-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
全球过敏性疾病和多重共病负担日益加重,迫使我们需要创新策略以增强免疫健康。过敏性疾病和多重疾病常常共存,降低各年龄段人群的生活质量。尽管它们表面上不同,但过敏和心血管疾病、肥胖症及神经退行性疾病等慢性疾病经常共享潜在的免疫和微生物紊乱。这些包括炎症性老化、免疫衰老和肠道菌群失调,即微生物多样性减少和微生物代谢改变。
随着饮食和肠道健康被确立为免疫功能的关键调节因素,突出了肠道-免疫-代谢轴在疾病发病机制和管理中的关键作用,它们为干预提供了新的靶点。
通过组分分辨诊断、肠道微生物检测、嗜碱性粒细胞活化试验和表观遗传生物标志物等诊断技术的进步,个体化营养成为可能,可以针对不同的过敏表型和多重共病特征进行精准的饮食干预,将为可持续的疾病预防和提升多样人群免疫力带来了巨大前景。
科技进步,深度测序数据以及人工智能驱动的饮食评估、可穿戴设备和移动应用程序,又进一步革新了个性化饮食管理,实现了实时、精准的营养监测和干预。
一个功能良好的免疫系统是生存的关键。它必须准确识别自身与非自身成分,并区分有害病原体和无害的膳食抗原等外来物质。这种精确识别能力对预防自身免疫疾病和过敏等不当免疫反应至关重要。
先天性免疫和适应性免疫:同一枚硬币的两面
免疫系统通过两种主要机制运作:先天性免疫提供即时但非特异性的防御,适应性免疫则提供高度针对性但需要时间发展的反应。
尽管传统上被视为独立分支,现在认识到这两个系统深度互联,通过众多共享组件实现协调的免疫活动。
先天免疫和适应性免疫之间的主要区别
Andreou E,et al.Nutrients.2025
▸ 先天免疫
先天免疫是机体第一道防线,能快速响应病原体而无需事先致敏。它具有非抗原特异性且缺乏免疫记忆的特点,每次接触均以相同方式响应。该防御系统依赖多重保护机制:
物理和化学屏障(皮肤、黏膜、胃酸、抗菌肽);细胞成分(中性粒细胞、单核细胞、巨噬细胞、树突状细胞和NK细胞);可溶性因子(补体蛋白、细胞因子、急性期蛋白)。
虽然先天免疫响应迅速且覆盖面广,但其非特异性可能造成组织损伤。然而,其在物种间的进化保守性表明了它在宿主生存中的关键作用。
▸ 适应性免疫
相比之下,适应性免疫以抗原特异性和免疫记忆为特征。它由抗原呈递细胞(APCs)—尤其是树突状细胞和巨噬细胞启动,这些细胞处理并向淋巴细胞呈递源自病原体的抗原。
适应性免疫由两个主要组成部分构成:B淋巴细胞产生抗原特异性抗体介导体液免疫,T淋巴细胞协调细胞免疫。
在T细胞中,CD4+辅助T细胞通过细胞因子信号协调免疫反应,CD8+细胞毒性T细胞直接清除受感染或异常细胞。初次接触后形成的记忆B和T细胞在循环中持续存在,使机体在再次遇到相同抗原时产生更快速、更强烈的反应。
尽管适应性免疫强大而精确,但需要严格调控以防止自身免疫或慢性炎症等病理后果。
尽管先天免疫和适应性免疫有着不同的功能角色,但它们是高度整合的。树突状细胞是关键连接点,作为抗原呈递细胞,基于先天免疫环境信号启动T细胞反应。自然杀伤T(NKT)细胞兼具NK细胞和T细胞特征,通过产生调节性细胞因子在两个系统间发挥桥梁作用。
传统上与先天免疫相关的补体系统,也通过促进抗原呈递和B细胞激活来增强适应性反应。这些要素共同体现了先天免疫与适应性免疫间的动态交互和协调,这对维持免疫平衡和宿主防御至关重要。
过敏症:免疫系统的平衡之战
在近几十年来,全球过敏性疾病的发病率急剧上升,构成了日益严峻的公共卫生挑战。目前约有10亿人受到过敏症的困扰,预测表明这一数字可能在未来30-40年内上升至40亿。
过敏是由对特定抗原(过敏原)的免疫反应引发的超敏反应。常见过敏原包括花粉、尘螨、动物皮屑和某些食物。
注:世界卫生组织(WHO)认可多种过敏性疾病。这些包括哮喘、鼻炎、结膜炎、过敏性休克、特应性湿疹、荨麻疹和血管性水肿,以及对食物、药物和昆虫叮咬的超敏反应。值得注意的是,肠道微生物群已被确认为影响过敏性疾病发展的关键因素,尽管具体机制仍在研究中。
免疫系统在区分有害和无害物质方面发挥关键作用。然而,在过敏性疾病中,这种平衡被打破,导致对通常无害的环境抗原(过敏原)产生过度免疫反应。
过敏的定义已从历史上的”身体对外来物质反应能力的改变”演变为更精确的概念——一种由对通常良性抗原的不适当免疫反应所特征的疾病。
▸ 过敏反应的基本机制
过敏性疾病的核心是涉及先天和适应性免疫的免疫失调。过敏反应主要由过度的Th2免疫反应驱动,特征为过量产生IgE抗体。当再次接触过敏原时,过敏原特异性IgE抗体结合并激活肥大细胞,触发组胺、白三烯和细胞因子等炎症介质的释放。这些介质产生典型过敏症状,包括打喷嚏、瘙痒、气道收缩和炎症,严重程度从轻微不适到哮喘恶化或致命的过敏性休克。
正常情况下,调节性T细胞(Tregs)维持免疫耐受并防止不必要的免疫激活。然而,过敏性疾病患者的Treg功能常受损,抗炎细胞因子如IL-10和TGF-β的产生减少。这种调节障碍使Th2驱动的反应占主导地位,加剧过敏性炎症。
而肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞等关键免疫效应细胞的持续激活及其释放的炎症介质维持并强化过敏性病理学。
过敏反应中的关键免疫学参与者
Andreou E,et al.Nutrients.2025
▸ 什么是多重共病?
随着全球过敏性疾病的增加,多重共病——定义为两种或多种慢性疾病的共存——已成为一个主要的公共卫生问题,特别是在老龄化人群中。多种慢性疾病的存在使临床管理变得复杂,并大大提高了残疾、住院和死亡的风险。
多重共病通常始于获得单一慢性疾病,随着时间的推移,可能会出现其他疾病。许多慢性疾病,包括肥胖、2型糖尿病、心血管疾病(CVD)、自身免疫疾病和神经退行性疾病,都有一个共同点:慢性低度炎症。这种持续的炎症状态通常由免疫失调、肠道微生物群的改变和代谢失衡驱动,突显了免疫健康与多重共病之间的紧密联系。
慢性炎症可能驱动多重共病
某些多病共存被视为独特的临床实体,如代谢综合征(MS)。当中心性肥胖伴随至少两个额外因素时可诊断MS:甘油三酯升高、HDL胆固醇降低、血压升高或空腹血糖升高。该综合征与心血管疾病密切相关,两者均通过氧化应激和慢性低度炎症(炎症老化)机制显著促进生物学老化。
▸ 较高的炎症标志物与多病共存相关
慢性炎症作为老化标志之一,与多病共存密切相关。多种慢性疾病患者常出现炎症标志物升高,如IL-6、TNF-α和CRP。较高的炎症标志物水平与残疾、住院和死亡风险增加相关。因此,炎症生物标志物已成为临床试验中老化生物标志物组的重要组成部分。
最近一项研究显示,多病共存百分位较高的个体中IL-6和TNF-α水平显著升高,尤其在女性和70岁以上成年人中。值得注意的是,抗炎细胞因子IL-10与多病共存无相关性,表明促炎途径而非代偿性抗炎反应主要驱动多病共存状态。
▸ 某些特异性蛋白可作为慢性疾病风险标志物
近期的研究进展扩大了对多重疾病的理解,超越了传统炎症标志物。一项涉及超过53000名成人的大规模蛋白质组学分析识别出972种在多种慢性疾病中共同存在的蛋白质和345种疾病特异性蛋白质。研究强调了炎症在多重疾病中的核心作用,并确定NFKB1、JUN和RELA等转录因子为上游调节因子。
此外,GDF15、PLAUR、WFDC2和AREG等蛋白质与多种慢性疾病风险相关,凸显其作为多重疾病进展生物标志物的潜力。这些发现强调了开发针对慢性疾病集群潜在炎症和分子机制靶向干预措施的必要性。
多重疾病并非单一疾病的简单累积,而是涉及共享生物学和免疫学途径的复杂相互作用。炎症性衰老概念提供了理解慢性低度炎症如何加速疾病进展、导致功能下降和寿命缩短的有价值框架。
如美国中年研究(MIDUS)和InCHIANTI等研究表明,循环中IL-6和CRP水平随着慢性疾病数量的增加而成比例上升,且基线IL-6水平较高的个体在一段时间内疾病累积轨迹更为陡峭。
多病共存和免疫老化:慢性循环
虽然炎症衰老被广泛认为是衰老标志和多重疾病驱动因素,但新兴研究强调免疫衰老不仅涉及细胞因子调节紊乱,而是代表多维度衰退,特征为几个相互关联的过程:
▸ 免疫衰老——免疫监视功能丧失
衰老伴随衰老免疫细胞积累,特别是CD8+T细胞和记忆T细胞。这些细胞增殖能力降低,并分泌衰老相关分泌表型(SASP)的促炎介质。细胞积累不仅加剧全身性炎症,还破坏组织修复,削弱耐受机制,增加自身免疫疾病易感性。
▸ 神经免疫交互和认知衰退
神经免疫互动对衰老相关疾病至关重要。活化的小胶质细胞和升高的炎症因子(如IL-1β和IL-6)损害突触可塑性,导致认知障碍及阿尔茨海默病、抑郁症等疾病。这些神经系统疾病常与心脏代谢疾病同时出现,凸显其在老年人群中的互联病理发生。
▸ 代谢性炎症和线粒体功能障碍
代谢性炎症——由代谢超负荷和过度营养引发的慢性低度炎症反应——根本不同于经典炎症。代谢应激导致线粒体功能障碍,增加活性氧产生和线粒体DNA释放,激活NLRP3等炎症体。此过程显著促进代谢综合征和胰岛素抵抗,是多重疾病的关键组成部分。
▸ 表观遗传学衰老和生物钟
通过DNA甲基化钟(如Horvath钟)测量的生物学衰老与多重疾病风险的相关性比单纯年龄更密切。在慢性炎症、生活方式因素和微生物群落变化条件下,表观遗传漂变加速,形成连接免疫衰老与代谢、心血管疾病的机械性桥梁。
人们逐渐意识到共生微生物在黏膜表面免疫调节中的不可或缺作用,影响免疫系统发育和稳态。它们在塑造各器官免疫反应、调节2型免疫、调控嗜碱性粒细胞造血及维护上皮屏障完整性方面发挥重要作用。
▸ 肠道微生物群对免疫及相关疾病有重要影响
肠道微生物群产生的细菌代谢物对免疫成熟和功能有显著影响。短链脂肪酸(SCFAs),如丁酸盐和丙酸盐,发挥免疫调节作用,特别是通过调控FOXP3+调节性T细胞(Tregs),对维持免疫耐受性和防止炎症损伤至关重要。因此,黏膜免疫细胞与定居微生物群间的有效交流对维持平衡免疫反应、优化保护而不引发过度炎症至关重要。
微生物失调越来越多地与免疫介导的疾病,包括过敏性疾病相关。改变的微生物组成可诱导免疫调节紊乱,增加炎症和超敏反应的易感性。
微生物组也影响认知功能,凸显其系统性影响超出了胃肠道免疫。微生物组促进免疫耐受或引发炎症的双重能力说明了其在维持免疫平衡和疾病发病机制中的复杂参与。
▸ 肠道微生物群与免疫系统的动态平衡
肠道微生物群与宿主的先天性和适应性免疫系统之间的动态相互作用对肠道稳态和预防炎症至关重要。肠道微生物群通过代谢膳食蛋白质和碳水化合物,合成必需维生素,以及产生介导肠上皮细胞与免疫细胞对话的生物活性化合物,积极参与免疫反应。饮食、抗生素、环境暴露和生活方式等外部因素显著影响微生物组成,凸显其适应性。
肠上皮屏障是肠道防御系统的组成部分,由粘液层、分泌型IgA和抗菌肽加强,作为选择性过滤器将微生物与宿主免疫细胞分离。肠道微生物群与粘膜免疫之间的调节失衡可破坏这一屏障,导致肠道通透性增加(”肠漏”),伴随病原性革兰氏阴性菌增加的微生物失调,代谢紊乱,以及感染和慢性炎症性疾病的易感性增加。
过敏与肠道健康:微生物组-免疫系统的连接
过敏性疾病,包括呼吸道、皮肤和食物过敏,通常涉及优势Th2免疫反应。这种反应触发IL-4、IL-5和IL-13的产生,促进IgE类转换、嗜酸性粒细胞炎症和肥大细胞激活,这是过敏反应的特征。此外,T细胞亚群如Th9细胞通过分泌IL-9和IL-10加剧过敏性炎症。
▸ 微生物组是免疫功能的中央调节器
微生物组可作为免疫功能的中央调节器,对免疫发育、抗原耐受和炎症调节至关重要。气道微生物组直接调节哮喘等疾病的局部炎症反应,而肠道微生物群产生影响过敏性疾病易感性的系统性效应。饮食和环境变化导致的肠道菌群失调显著影响微生物组成和代谢活动,影响全身免疫反应。
肠道微生物群在生命各阶段的免疫系统发育和成熟中起重要作用。肠道微生物多样性在婴儿期相对较低,通过童年和成年期因各种饮食、环境和免疫因素而增加。
▸ 微生物代谢产物影响免疫耐受和炎症程度
在微生物代谢产物中,短链脂肪酸、胆汁酸结合物和色氨酸代谢物对调节过敏反应特别重要。短链脂肪酸(如丁酸盐和丙酸盐)对调节免疫稳态至关重要,影响结肠FOXP3+调节性T细胞活性,维持免疫耐受和减轻过度炎症。
肠道微生物与过敏性炎症间的联系涉及可发酵膳食纤维在影响微生物代谢中的作用。高纤维饮食改变肠道和肺部微生物组成,特别是厚壁菌门/拟杆菌门比例。肠道微生物对膳食纤维的发酵增强短链脂肪酸产生,具有免疫调节作用。高纤维饮食小鼠显示循环中SCFAs水平升高,受过敏性气道炎症保护,而低纤维饮食小鼠SCFAs水平降低,疾病易感性增加。丙酸通过GPR41在调节免疫反应和过敏疾病进展中发挥关键作用。
▸ 肠道微生物影响过敏风险
肠道微生物在调节过敏风险中的复杂作用得到了众多流行病学和机制研究的支持。出生队列研究进一步揭示,双歧杆菌和乳酸菌的减少与特应性皮炎风险相关,而丁酸产生细菌的减少与哮喘发展相关,以及艰难梭菌的早期定植与过敏性敏感增加有关。
宿主-微生物群落交流主要通过模式识别受体(如Toll样受体)进行。TLR4激活支持树突状细胞成熟和调节性T细胞发育,该通路破坏会加剧过敏性炎症。共生菌通过产生短链脂肪酸、脆弱拟杆菌多糖A及梭状芽胞杆菌簇诱导的上皮源性TGF-β促进Treg分化。
除诱导Treg外,微生物信号还影响Th1/Th2平衡。特定微生物可增强Th1和Th17反应,抵消Th2优势。分节丝状菌促进Th17分化,双歧杆菌通过树突状细胞促进Th1极化。幽门螺杆菌早期定植与哮喘风险呈负相关,可能通过诱导Treg和免疫耐受实现。
▸ 有益菌有助于减少特异性敏感
肠道微生物群有助于维护上皮屏障完整性。阿克曼氏菌等共生菌增强粘蛋白生成和紧密连接装配,丁酸盐通过调节紧密连接蛋白支持屏障功能。相反,肠道通透性增加(食物过敏个体的特征)与菌群失调和SCFA水平降低相关。
《妊娠期益生菌研究》调查了母亲从妊娠早期到哺乳期补充鼠李糖乳杆菌HN001是否能减少婴儿一岁时的湿疹和特应性敏感。研究发现益生菌补充与湿疹发病率显著降低相关,支持早期微生物干预在过敏预防中的作用。
此外,母亲健康益处包括降低妊娠期糖尿病、细菌性阴道炎和分娩前B组链球菌阴道定植率,以及减少产后抑郁和焦虑。特定细菌菌株诱导Foxp3+ T调节细胞在保护小鼠免受过敏性炎症方面起关键作用。
研究表明,长双歧杆菌AH1206显著增加婴儿、成年和无菌小鼠体内Foxp3+ T调节细胞数量,同时改变派氏斑基因表达,减少抗原呈递、TLR信号传导和细胞因子产生,并增强视黄酸代谢。该菌株对气道炎症提供保护,在口服过敏模型中阻断IgE诱导,而短双歧杆菌AH1205效果有限,仅在婴儿小鼠中诱导调节性T细胞。
▸ 微生物有望成为过敏预防和治疗的新靶点
唾液乳杆菌AH102对T调节细胞数量或过敏反应无影响。研究表明特定益生菌可能通过调节免疫反应缓解呼吸道和食物过敏。益生元如半乳寡糖和果寡糖减少高风险婴儿的过敏结果,人乳寡糖促进有益细菌生长。
随机双盲研究表明,短双歧杆菌M-16V与短链半乳寡糖和长链果寡糖的合生元成功补偿剖腹产婴儿双歧杆菌定植延迟。该干预使婴儿从生命早期就拥有显著较高比例的双歧杆菌,同时降低肠杆菌科水平,促进肠道环境酸化(乙酸盐产生增加)。这些变化模拟阴道分娩婴儿通常观察到的微生物群落组成,突显合生元在支持早期肠道健康方面的潜力。事后分析表明合生元组湿疹和特应性皮炎发生率较低,尽管需进一步研究确立直接临床益处。
未来以微生物组为靶点的干预为过敏预防和治疗提供有前景的策略,包括补充益生菌和益生元恢复微生物平衡,调整饮食增加纤维摄入和多酚消费,以及探索粪菌移植和新一代后生元等基于微生物组的治疗。
免疫功能不仅由遗传倾向决定,还受饮食模式和肠道微生物群的动态影响。肠道-免疫-代谢轴越来越被认为是健康的关键调节因素,营养素和微生物代谢物可作为强大的免疫调节剂。
接下来谷禾小编将深入探讨可以通过饮食干预来优化的特定营养素、饮食策略和代谢途径,以增强免疫功能并促进长期健康。
营养、肠道微生物群和免疫系统之间的相互作用
Andreou E,et al.Nutrients.2025
营养、肠道菌群和免疫系统之间的动态相互作用——统称为“韧性三元组”——及其在调节过敏和多种共病中的作用。
饮食输入塑造肠道微生物组,而肠道微生物组则产生短链脂肪酸(SCFAs)等代谢产物,这些代谢产物调节免疫功能。这一相互连接系统的中断可能导致免疫失调,从而促进慢性炎症状况和过敏性疾病的发生。
管理过敏和多重疾病的营养与肠道健康小窍门
饮食成分在塑造免疫反应中扮演关键角色,免疫系统与营养和代谢密切相关。影响免疫系统的主要饮食成分总结在下表中。
Andreou E,et al.Nutrients.2025
▸ 营养物质可调节细胞因子或充当辅助因子
营养物质作为免疫细胞的构建基块,调节细胞因子产生,并通过直接代谢信号或与肠道微生物相互作用调节炎症通路。营养状态、微生物组成和免疫功能间的复杂相互作用被称为肠道-免疫-代谢轴,突显饮食如何增强对病原体的免疫抵抗力,或促进低度慢性炎症和免疫失调。
营养物质(包括宏量和微量营养素)通过调节能量可用性、细胞代谢和炎症反应影响免疫活动。必需微量营养素如维生素A、C、D、E、B6、B12和叶酸,以及锌、硒、铁、镁和铜等重要矿物质,在支持免疫防御和信号传导的关键酶促反应中充当辅助因子。
▸ 抗炎饮食与微生物代谢物有助于增强免疫能力
此外,来自饮食的微生物代谢产物(包括短链脂肪酸、多酚和胆汁酸)作为重要免疫调节剂,影响T细胞分化、细胞因子分泌和肠道屏障完整性。
饮食对免疫功能的影响显著,有证据将抗炎饮食模式与增强免疫能力和降低慢性疾病风险联系起来。相反,富含加工食品、精制糖和不健康脂肪的饮食与代谢功能障碍和系统性炎症相关。新兴证据还支持间歇性禁食和热量限制能进一步促进免疫系统更新和代谢灵活性,潜在减轻与年龄相关的免疫功能下降。
虽然避免过敏原接触是主要策略,但类固醇、抗组胺药等药物治疗方法常被使用缓解症状。然而,以饮食和微生物组为中心的策略正成为过敏管理和免疫调节中有前景的辅助方法。
通过营养丰富的饮食优化免疫功能
营养对调节免疫反应至关重要,确保免疫细胞获得充分营养以有效应对病原体并调节炎症。
▸ 营养素影响快速免疫防御和防止过度慢性炎症
多种微量营养素、矿物质、维生素和特定宏量营养素(包括特定氨基酸、胆固醇和脂肪酸)在调节免疫活动中起关键作用。这些营养素对启动快速免疫防御和防止过度慢性炎症(可导致免疫功能紊乱)至关重要。
锌(存在于牡蛎、南瓜籽和豆类中)对胸腺素产生至关重要,这对T细胞成熟关键。
硒(丰富存在于巴西坚果和海鲜中)增强中性粒细胞和NK细胞活动,有助于身体抗氧化防御。
维生素D(普遍存在于脂肪鱼和强化食品中)在调节先天性和适应性免疫反应中发挥关键作用,对控制炎症和调节整体免疫功能至关重要。
饮食摄入不足或营养吸收不良可能显著损害免疫系统功能,增加感染和慢性炎症性疾病的易感性。
▸ 肠道微生物与多样化营养共同促进免疫系统
免疫系统的发育和功能也受细菌刺激影响,肠道微生物组在免疫成熟中发挥不可或缺的作用。保持富含必需营养素的饮食对支持免疫系统至关重要。
食用多样化饮食,富含色彩鲜艳的水果和蔬菜,提供重要抗氧化剂如维生素C和β-胡萝卜素,保护免疫细胞免受氧化应激。十字花科蔬菜(如西兰花、羽衣甘蓝和卷心菜)富含萝卜硫素,该化合物通过Nrf2信号通路激活抗氧化途径。柑橘类水果、浆果和甜椒以高维生素C含量著称,增强中性粒细胞功能并加强上皮屏障完整性。
维生素对免疫功能的作用
维生素对免疫系统的发育、功能和平衡至关重要,每种维生素在增强免疫反应中都发挥特定作用。下表总结了参与免疫功能的主要维生素、具体作用以及需求和来源信息。
关键维生素的免疫功能、推荐摄入量和食物来源
Andreou E,et al.Nutrients.2025
▸ 维生素之间协同优化免疫功能
维生素间的相互作用和协同效应在优化免疫功能方面起关键作用,因为许多微量营养素并非孤立发挥作用,而是共同支持免疫反应的各个方面。
例如,维生素C和E展现经典协同关系——维生素C有助于再生氧化的维生素E,使其继续作为强效脂溶性抗氧化剂发挥作用。这种协作增强了身体中和氧化自由基的能力,保护免疫细胞免受氧化应激影响,而氧化应激在感染和炎症反应期间尤为突出。
除此之外,其他维生素也以重要方式相互支持。维生素D增强钙吸收,间接支持免疫相关信号通路。叶酸和维生素B12共同参与甲基化反应和核酸合成,这对快速分裂免疫细胞的复制和修复都必不可少。此外,锌和硒与抗氧化维生素的相互作用支持缓解氧化应激和炎症的酶系统,进一步增强免疫功能。
通过营养丰富饮食实现全系列维生素的均衡摄入,比高剂量补充单一维生素更有效,后者可能导致营养失衡或毒性。
地中海饮食对过敏是否具有保护作用?
地中海饮食(MD)是一种受环地中海盆地某些国家传统饮食模式启发的饮食模型。尽管存在差异,地中海饮食模式具有几个共同特点。
其特点是大量使用橄榄油,高摄入水果、蔬菜、全谷物、豆类、坚果和种子。还包括适量食用鱼类和贝类、白肉、鸡蛋和发酵乳制品(如奶酪和酸奶),而红肉、加工肉类和高糖食品摄入很少。此外,地中海饮食模式传统上鼓励在餐食期间定期但适量饮用葡萄酒,特别是红酒。
▸ 地中海饮食可能有助于减轻儿童过敏风险
一些研究强调了地中海饮食在降低过敏性疾病风险方面的潜力,尽管不同人群和研究设计中的发现仍不一致。
一项系统综述评估了地中海饮食成分对食物过敏的影响,发现孕期和哺乳期母亲坚持地中海饮食与婴儿食物过敏风险降低相关。然而,当饮食干预仅在孕期引入或仅限于婴儿早期几个月时,保护作用不太明显。这些发现表明,早期接触地中海饮食中的生物活性化合物,特别是通过母亲营养,可能有助于塑造免疫耐受性并减少过敏性致敏。
保护作用的主要贡献者包括多酚、omega-3脂肪酸、纤维和维生素,它们有助于调节炎症通路、肠道微生物组成和免疫系统功能。
另一项系统综述分析了儿童过敏风险数据,发现虽然坚持地中海饮食与哮喘发病率降低相关,但对过敏性鼻炎、湿疹和特应性疾病的影响结论不太明确。同样,在儿科人群中进行的研究将更高的地中海饮食依从性与哮喘发病率降低联系起来,但发现过敏性致敏没有显著减少。
地中海饮食成分及其免疫益处
Andreou E,et al.Nutrients.2025
▸ 可能的保护机制
抗炎特性:地中海饮食富含抗炎化合物,包括多酚、黄酮类和ω-3脂肪酸,有助于调节免疫反应并抑制慢性炎症。由于过敏性疾病的特点是Th2驱动的免疫激活和炎症过度,地中海饮食调节细胞因子产生和抑制氧化应激的能力可能有助于减轻过敏症状。
肠道菌群调节:平衡的肠道菌群对免疫稳态和过敏耐受至关重要。地中海饮食富含纤维、发酵食品和植物性益生元,促进肠道微生物多样性和短链脂肪酸产生。这些微生物代谢产物增强调节性T细胞活性,减少肠道通透性,并减轻全身炎症,从而降低过敏易感性。
抗氧化防御对抗过敏反应:许多地中海饮食成分(包括水果、蔬菜、橄榄油和坚果)富含抗氧化剂,如维生素C和E、类胡萝卜素和多酚。这些化合物有助于保护免疫细胞免受氧化应激损伤,这是过敏性炎症和气道高反应性的关键因素。通过中和活性氧,这些抗氧化剂可能减少肥大细胞脱颗粒和组胺释放,从而减轻过敏反应的严重程度。
多不饱和脂肪酸和免疫调节:地中海饮食富含来自鱼类、橄榄油和坚果的长链ω-3脂肪酸(EPA和DHA),这些脂肪酸具有免疫调节作用。多不饱和脂肪酸影响二十碳烯酸合成,导致产生有助于平衡Th1/Th2免疫反应的抗炎介质。多项研究表明,更高的ω-3摄入量与较低的哮喘患病率和改善的肺功能相关,支持地中海饮食可能对呼吸道过敏特别有益的假设。
孕期营养和早期免疫调节:母体饮食对胎儿免疫系统发育起关键作用。研究表明,孕期坚持地中海饮食可能降低后代过敏性致敏风险,可能通过表观遗传修饰、改变肠道菌群传递和早期接触免疫调节营养素实现。
多重疾病,即个体同时患有两种或多种慢性疾病,是重大的公共卫生挑战,尤其在老龄人口中。吸烟、长时间久坐和肥胖等关键生活方式因素已被确定为发展多重疾病的重要风险因素。
在这些因素中,饮食模式作为多重疾病风险的关键决定因素尤为突出,有证据表明营养干预可能在疾病预防和管理中发挥关键作用。
▸ 免疫失调与多重疾病之间存在联系
多重疾病与免疫失调之间的复杂联系通过几个关键机制介导,慢性炎症既是各种疾病过程的结果,也是其驱动因素。免疫失调通常表现为持续的低度炎症,导致广泛的组织损伤,并促进多种慢性疾病同时发展。
这种动态受老龄化的显著影响,老龄化与免疫衰老相关——免疫系统逐渐减弱,降低疫苗效力并提高感染易感性。同时老龄化过程也可能由于免疫调节减弱和耐受机制损害而增加自身免疫风险。这种免疫老化过程可能加速年龄相关疾病进展,从而加剧多重疾病与免疫功能障碍之间的联系。
免疫失调的主要驱动因素是细胞因子的异常产生,促炎症信号对多个器官系统产生不利影响。这种细胞因子平衡的破坏与一系列疾病有关,包括心血管疾病、糖尿病和神经退行性疾病。此外,肠道微生物群在整体免疫功能中发挥关键作用,菌群失调显著促进免疫功能障碍。当这种微生物失衡与肠道通透性增加(也称为”肠漏”)结合时,细菌成分可进入血流,触发全身性炎症并促进慢性疾病发生。
代谢失调是另一个影响免疫功能的关键因素。在肥胖和糖尿病等条件下,代谢活跃组织(如脂肪组织)释放炎症介质,加剧全身性免疫失调。此外,氧化应激(以过度产生活性氧物质为特征)导致细胞和组织损伤,进一步助长免疫失调。这种氧化负担是多重疾病进展的重要贡献者,突显了营养在调节炎症和减轻整体疾病负担中的关键作用。
饮食对多重疾病的影响
多项研究已经探讨了饮食对多重疾病(同时患有多种慢性疾病)的影响。以下是这些研究的主要发现:
▸ 英国女性队列研究
跟踪了25389名35-69岁女性,中位随访期为22年:
-发现每日能量和蛋白质摄入量增加分别使多重疾病风险增加8%和12%。
-维生素C和铁的摄入量增加略微降低风险,铁对60岁以下女性具有特别的保护作用。
-维生素B12和维生素D摄入量与风险增加的关联在敏感性分析中失去统计学意义。
-强调了营养摄入对多重疾病风险的复杂性和个体化影响。
▸ 中国纵向研究
调查了1020名中国参与者在五年内的多重疾病进展:
-多重疾病患病率从14%上升到34%。
-水果、蔬菜和非大米小麦的谷物产品摄入量增加与多重疾病进展的更健康轨迹相关。
-这些食物提供更多的膳食纤维、铁、镁和磷,与改善健康结果相关。
▸ 荷兰Lifelines队列横断面研究
分析了129369名荷兰成年人,确定了四种饮食模式:
-肉类、酒精和土豆
-零食
-面包和甜食
-蔬菜、鱼和水果
发现更多遵循肉类、酒精和土豆模式以及零食模式与多重疾病患病率增加相关,尤其是在男性中。
面包和甜食模式以及蔬菜、鱼和水果模式具有保护作用,但后者在调整体重指数(BMI)后减弱。
▸ 英国生物银行前瞻性队列研究
分析了348290名参与者,中位随访期为8年:
确定了三种饮食模式:西方式、白肉式和谨慎式
-西方式饮食模式增加多重疾病风险。
-中度遵循白肉式饮食和高度遵循谨慎式饮食与风险降低相关。
-经常食用加工肉类和家禽与更高的多重疾病风险相关,而增加鱼类、水果和谷物的摄入则显示保护作用。
不同营养素与多重慢病
值得注意的是,营养不良既可能是多种慢性病的驱动因素,也可能是其结果。
▸ 营养不良会加剧全身炎症嗯好免疫紊乱
营养缺乏——通常源于加工食品和营养贫乏的食物——直接参与了多种慢性疾病的发展,包括缺血性心脏病、脑血管疾病、各种癌症、糖尿病和阿尔茨海默病。以加工食品为主的饮食不仅增加全身炎症水平,还会通过必需微量营养素(如铁、维生素B12、叶酸和钙)的缺乏,加剧免疫调节紊乱。
多种慢性病患者常常营养状况不佳。这通常由慢性疾病负担、食欲减退、药物副作用和胃肠功能障碍等因素造成。这些因素形成恶性循环:慢性疾病损害营养吸收和利用,从而进一步削弱免疫功能和整体健康状况。
▸ 不同营养素调节免疫老化和多种慢性病
越来越多的证据强调营养在调节免疫老化和多种慢性病的分子机制中起关键作用。除了提供必需的维生素和矿物质外,营养素还影响细胞过程,如线粒体效率、氧化应激平衡和表观遗传调节。例如:
镁、B族维生素和辅酶Q10改善线粒体功能并减少活性氧,从而减轻与老化相关的炎症。
叶酸、维生素B12、胆碱和膳食多酚作为表观遗传调节因子影响DNA甲基化,可能减缓生物学老化。
抗炎营养素——如omega-3脂肪酸、白藜芦醇、姜黄素和来自膳食纤维的短链脂肪酸——可抑制炎症小体激活和细胞因子过度产生,从而促进免疫耐受和代谢平衡。
微量营养素如锌、硒、维生素D和维生素C对维持T细胞功能、免疫监视和预防慢性炎症至关重要。
衰老、肥胖和多重疾病:精准营养的作用
如前所述,多重疾病代表着重大的公共卫生挑战,影响高达95%的65岁及以上人群。
老龄化被广泛认为是主要风险因素,近期研究表明,它反映了生理储备和功能的逐渐下降,通常伴随着慢性低度炎症、激素调节失衡以及对慢性疾病的脆弱性增加。然而,仅靠老龄化并不能完全解释该病症的复杂病因。
此外,肥胖已成为多重疾病的主要促成因素。为应对这一公共健康挑战,国家卫健委联合多部门出台了《健康中国行动——控制肥胖行动方案》,提出了”三减三健”的核心理念,即减盐、减油、减糖,健康口腔、健康体重、健康骨骼。该政策鼓励公众养成健康饮食习惯,增加日常身体活动,同时加强肥胖防治的科普宣传工作。
各地方政府也积极响应,在学校推广”每天一小时体育活动”,在社区建设健身设施,在医疗机构开设减重门诊。企业界也参与其中,食品企业被鼓励开发低糖、低脂、低盐产品,餐饮业推出健康菜单。
▸ 综合防控策略与个性化营养干预
应对与肥胖相关的多重疾病需要综合策略,包括生活方式改变、有针对性的营养、早期检测和公共卫生倡议。
专注于减轻体重和代谢健康的饮食干预——特别是那些强调水果、蔬菜、全谷物和瘦肉蛋白的干预——可以减少炎症并抵消肥胖相关的代谢紊乱。
具有抗炎特性的营养素,如omega-3脂肪酸、纤维和抗氧化剂,也有助于调节免疫反应并减轻慢性炎症。
当与体育活动和戒烟相结合时,这些策略可以增强整体健康并降低多重疾病的风险。促进健康饮食和积极生活方式的公共卫生宣传活动进一步支持预防和长期行为改变。这些措施总体上不仅有助于管理现有疾病,还有助于预防新疾病,最终帮助打破多重疾病的循环并改善公共卫生结果。
随着全球多重疾病的增加,传统的饮食建议常常无法满足同时管理多种慢性疾病的个体的复杂需求。个性化营养在精准医学原则的指导下,提供了更有效的替代方案。通过整合个体特定因素——如遗传和表观遗传谱、微生物组组成和生活方式特征——个性化营养能够开发针对每个人独特健康背景的定制饮食策略。新兴证据支持这些个性化饮食干预在降低多重疾病风险和负担以及改善相关健康结果方面的潜力。
在多重疾病(多病共存)的情况下实施个性化营养需要超越一般膳食指导的范畴,它要求整合多种个体特定变量,以解决多种慢性疾病共存所带来的独特挑战。准确的营养评估是有效膳食管理的基础,尤其在个性化医疗框架内。
▸ 人工智能、肠道菌群等有助于改善营养评估
近期技术进步——包括人工智能、肠道微生物组以及代谢组学、可穿戴传感器——正在改变营养评估,提供前所未有的精确度、易用性和实时功能。这些创新促进了量身定制的饮食干预,解决传统方法的局限性并推动个性化健康策略。
传统的饮食评估方法,如饮食回忆、食物日记和频率问卷,在准确性、回忆偏差、参与者负担和可扩展性方面存在固有的局限性。
人工智能和机器学习通过提高数据收集准确性、简化分析和实现个性化反馈来解决这些局限性。人工智能驱动的饮食评估工具利用自动图像识别、综合食物数据库和高精度估算营养成分的算法。
如今,消费者利用应用程序购买检测盒,尤其粪便采样盒来掌握自己的健康情况。这些工具克服了医疗保健院内就医检查的障碍,直接向个体提供实时数据,而个体则利用这些信息来制定从健身计划到饮食策略的各种方案。
无论是个性化健康还是精准营养,这都是一种革命性的健康方式,并且已在消化系统领域得到了很好的应用。
目前市场上很多补充剂研发或配方设计师也在考虑结合营养和菌群检测来挖掘消费者数据,了解不同个体的肠道健康需求,并定制个性化解决方案来满足这些需求。好消息是,这些解决方案通常简单、经济实惠,而且相对无害。
虽然我们今天看到的“精准化”是营养行业的一个阶段性转变,但长期以来,消费者一直在他们的补充剂方案中应用各种个性化元素。未来谷禾包括精准的检测让猜测变少了,有科学依据的选择变多了。
▸ 推动个性化营养的三项关键技术
“如果没有数据,这一切都不可能实现”,谷禾健康创始人一直持续强调,数据科学和人工智能的应用对个性化营养干预补充体验至关重要。
事实上,谷禾负责人认为,至少有三项关键技术的融合将在理论和实践上推动个性化营养的发展,无论是现在还是可预见的未来。
首先是深度测量技术,它能让我们以较低的成本对血液或粪便等样本进行成千上万次的测量。
接下来,综合多维度的数据特征,包括年龄、地区、人种、饮食习惯、食物成分分析、健康状况等,结合计算机呈现个体独特的个性化特征,帮助配方设计师模拟干预组合的预期效益。
第三种是我们都耳熟能详的大型语言模型,比如ChatGPT和Deepseek。
关键在于将这三种技术与可信赖的信息源结合起来,以确保反馈信息的准确性,并为这些技术提供个人的测量数据,从而实现深度个性化。我们以前从未有过这样的东西,它带来了真正大规模知识的民主化,彻底改变了我们的生活。
肠道菌群检测逐步解开代谢之谜
我们对新陈代谢和肠道微生物之间联系的理解几乎每天都在增长,许多研究人员相信,了解代谢紊乱的答案可能会在我们的肠道微生物组中找到。
我们从谷禾用户那里得到了很多关于代谢变化的反馈。一些用户抱怨说,以前他们无法减掉多余的体重。尽管尝试了几乎所有的节食方法,他们最终还是屈服于对食物的渴望,或者只是在体重管理之旅上停滞不前。在获得个性化推荐后,以下是他们现在的反馈:
“我的体重稳定了,消化能力也改善了。”
“在我上次测试和改变食物之后,我的体重又开始下降。”
“我感觉好多了。体重又掉下来了。我的过敏症消失了。”
对于我们的许多用户来说,改用适合他们的饮食习惯已经为他们快速启动新陈代谢、恢复健康体重以及让体重维持之旅重回正轨带来了改变。
随着谷禾的数据推荐引擎处理的信息越来越多,将会变得越来越智能,从而可以根据您身体当前发送的信号更精确地制定理想的营养计划。建议最终根据您的生物需求精确个性化,并解决您所经历的症状或问题的根本原因。
未来谷禾会继续不断探索某些食物、补充剂和生物素如何在此过程中发挥关键作用。
肠道菌群检测机构
当用户选择肠道菌群检测机构时,有几个关键标准需要考虑
数据和数据库支持:一个优秀的肠道菌群检测机构应该有充足的样本数据和相关的研究数据库。这些数据可以包括来自不同人群、不同地区和不同健康状况的样本,以确保检测结果的准确性和可靠性。此外,一个强大的数据库可以提供参考范围和比较数据,帮助解读和分析检测结果。
AI团队的应用:人工智能在肠道菌群分析中发挥着重要作用。一个不错的机构应该拥有专业的AI团队,能够应用最新的机器学习和数据挖掘技术,帮助解读复杂的肠道菌群数据。AI可以帮助发现潜在的菌群模式、预测风险因素,并提供个性化的建议和干预措施。
与疾病队列的合作:与疾病队列的合作可以为机构提供更全面的数据和验证机会。通过与疾病队列合作,机构可以建立与疾病发展和治疗效果相关的数据库,从而提高检测结果的应用性和准确性。这种合作还可以帮助机构与临床实践和科学研究保持紧密联系,不断改进和优化检测方法。
科学公正和专业能力:优质机构应该遵循科学研究的原则和道德准则。他们的研究结果应该经过严格的验证和复现,确保其可靠性和可信度。此外,机构的团队成员应该具备相关的背景和经验,包括微生物学、生物信息学、统计学等领域的专业知识。他们应该能够提供专业的解读和建议,帮助个体理解检测结果并采取适当的措施。
综上所述,选择一个认为不错的肠道菌群检测机构需要综合考虑数据和数据库支持、AI团队的应用、与疾病队列的合作以及科学公正和专业能力等方面。这些条件能够确保机构能够提供准确、可靠的肠道菌群检测服务,并为个体的健康管理和疾病预防提供有价值的信息和建议。
主要参考文献
Andreou E, Papaneophytou C. Boosting Immunity Through Nutrition and Gut Health: A Narrative Review on Managing Allergies and Multimorbidity. Nutrients. 2025 May 15;17(10):1685.
Childs, C.E.; Calder, P.C.; Miles, E.A. Diet and immune function. Nutrients 2019, 11, 1933.
Shin, Y.H.; Hwang, J.; Kwon, R.; Lee, S.W.; Kim, M.S.; Shin, J.I.; Yon, D.K. Global, regional, and national burden of allergic disorders and their risk factors in 204 countries and territories, from 1990 to 2019: A systematic analysis for the Global Burden of Disease Study 2019. Allergy 2023, 78, 2232–2254.
Han, P.; Gu, J.Q.; Li, L.S.; Wang, X.Y.; Wang, H.T.; Wang, Y.; Chang, C.; Sun, J.L. The association between intestinal bacteria and allergic diseases-cause or consequence? Front. Cell Infect. Microbiol. 2021, 11, 650893.
Lewis, E.D.; Wu, D.; Meydani, S.N. Age-associated alterations in immune function and inflammation. Prog. Neuropsychopharmacol. Biol. Psychiatry 2022, 118, 110576.
Yu, X.; Pu, H.; Voss, M. Overview of anti-inflammatory diets and their promising effects on non-communicable diseases. Br. J. Nutr. 2024, 132, 898–918.
Chi, H.; Pepper, M.; Thomas, P.G. Principles and therapeutic applications of adaptive immunity. Cell 2024, 187, 2052–2078.

谷禾健康

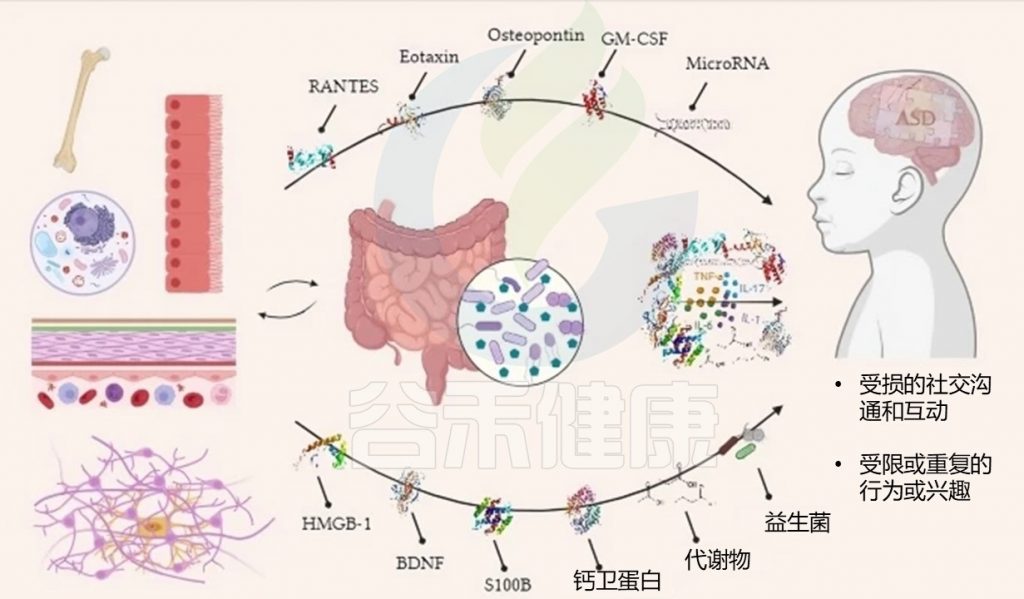
自闭症谱系障碍 (ASD) 是一种神经发育障碍,其特征是社交沟通和行为障碍,经常伴有兴趣或活动受限和重复的模式。遗传和环境都与自闭症有关。
近年来,多种类型的研究都将肠道菌群与自闭症的病因联系起来。前面我们的文章有提到,肠道微生物群影响宿主健康的许多方面,包括免疫系统控制、肠道激素调节和神经传递。它会改变摄入的药物及其代谢、毒素清除以及多种影响宿主的物质的产生。肠道菌群可以通过“肠-脑轴”的相互关系直接或间接地影响大脑。
近期研究表明,肠道微生物群可以通过中间细胞因子和代谢物诱发神经炎症。炎症偏差是肠道微生物群影响自闭症患者肠脑轴的潜在病因候选者。
神经炎症因素会导致肠道屏障完整性丧失、小胶质细胞激活和神经递质失调,从而导致自闭症。它强调了神经炎症中间体与自闭症患者肠道微生物群改变相关的潜在作用。具体而言,脑源性神经营养因子、钙卫蛋白、S100B、RANTES、嗜酸细胞趋化因子等细胞因子以及一些代谢物和微小RNA已被视为病因生物标志物。
了解肠道和大脑之间的相互作用,微生物群和神经炎症生物标志物的变化,是理解自闭症谱系障碍的病因、诊断、预后和治疗的基础背景。目前,自闭症谱系障碍的诊断是基于临床症状的,这可能会导致延误。基于与肠道微生物群相关的神经炎症过程的生物标志物可能是一种更客观精确可行的自闭症谱系障碍检测方法。
本文我们来详细了解一下神经炎症生物标志物在自闭症谱系障碍的发病机制和潜在诊断试验中的作用,还概述了益生菌及其他营养干预措施用作自闭症儿童的治疗策略及孕妇的饮食建议。
深入了解自闭症的复杂病理机制,结合生物标志物监测、肠道菌群管理和营养干预,或将为受影响的个体及其家庭提供更有针对性的支持和干预措施。
近 20 年前,有人提出了肠道菌群与自闭症之间的潜在关联。尽管自闭症的确切病因尚不完全清楚,但现有文献表明,自闭症患者存在肠道菌群失调和神经炎症。
自闭症的肠道菌群
总体而言,自闭症人群表现出菌群失调的迹象,与健康对照组相比,下列菌群和许多其他微生物的丰度有所不同:
拟杆菌门 / 厚壁菌门
普雷沃氏菌
梭菌属
乳杆菌属
双歧杆菌属
粪杆菌属
链球菌属
肠杆菌科
疣微菌属
梭杆菌门
大肠杆菌
肠球菌属
阿克曼菌属
考拉杆菌属
肠道菌群失调的识别与炎症途径
最近也有研究指出,自闭症儿童的肠道菌群失调和炎症可通过宿主粪便 DNA 特异性甲基化来识别。患有菌群失调的自闭症患者的炎症和免疫途径显著丰富,包括IL-2、IL-6 和 IL-12 的产生以及 Toll 样受体 (TLR3) 信号通路的激活。
多项研究一致证实了早期的发现,即菌群失调在各种神经退行性和神经精神疾病中会引起神经炎症。
自闭症儿童微生物组改变的潜在影响

doi.org/10.1016/j.bbr.2024.115177
菌群失调:免疫信号通路中断与自闭症严重程度
NLRP3炎症小体、1型干扰素和NF-κB信号通路等免疫信号通路的中断是菌群失调可能导致的后果之一。Th17/Tregs比例发生改变,巨噬细胞极化、TNF-α、IL-1β、IL-18、IL-6 失衡也是可能的。
另一方面,炎症和免疫失调已被证明与自闭症的发展和/或严重程度有关。先前对自闭症病例的研究表明,TNF-α、干扰素-γ、IL-2、IL-4、IL-5、IL-6、IL-8、IL-17、IL-10 等炎症标志物的水平升高。
神经炎症生物标志物与微生物交替和自闭症行为的关联研究


doi.org/10.1007/s10753-024-02061-y
关于自闭症患者肠道微生物组成和代谢物与炎症,这三个因素之间的确切关系需要进一步研究。总体而言,肠道菌群似乎通过炎症在自闭症中发挥关键作用。
一些研究已将蛋白质和肽类生物标志物作为自闭症早期诊断的研究对象。S100 钙结合蛋白 β 亚基 (S100B) 在星形胶质细胞和其他神经外细胞(包括EGC)中表达。
注:EGC,enteric glial cells,肠神经胶质细胞,EGC是肠神经系统的重要组成部分。它调节肠道稳态、参与维持肠黏膜屏障功能,调控炎症反应,在消化及非消化系统疾病中发挥着重要作用。
S100B对神经元的影响取决于浓度
浓度在几纳摩尔剂量下可产生营养作用,在微摩尔水平下可产生毒性。
S100B 促进神经炎症
细胞外蛋白 S100B 与促炎细胞因子协同作用,在较高浓度下可作为细胞因子,从而显著促进神经炎症。
自闭症 S100B 显著升高
尽管存在争议,但多项研究发现与健康人相比,自闭症患者的 S100B 显著升高,支持该因素在 ASD 的病因和发展中可能发挥的作用。
外周 S100B 浓度升高的来源可能是受损的神经元或 EGC。
在最近的一项研究中,血浆 S100B 水平与粪便钙卫蛋白浓度(胃肠道炎症状态的客观标志物)之间的相关性表明,不仅脑星形胶质细胞,还有 EGC 也可能参与自闭症的病理生理学。
肠道微生物群与S100B的相互作用
有一种假说认为,自闭症患者肠道胶质细胞衍生的 S100B 表达的改变可能是由微生物群改变、肠道屏障破坏甚至致病菌引起的,这些因素共同诱发肠道炎症并将 EGC 转化为反应性 EGC。
另一项小鼠体内研究表明,肠道微生物群的多样性随着 S100B 水平或口服给药而增加。
厚壁菌门(包括乳杆菌)和拟杆菌门(包括Barnesiella和丁酸杆菌属)均受 S100B 水平的影响。然而,在一组自闭症儿童中观察到拟杆菌门水平较高,而厚壁菌门水平较低。可以考虑研究 S100B 作为自闭症诊断和治疗中的潜在生物标志物。
BDNF(脑源性神经营养因子) 是神经生长因子家族(神经营养因子)的蛋白质成员。BDNF 在突触前位点(调节神经递质释放)和突触后位点(增强离子通道功能)中都发挥着关键作用,因此它通常会影响神经可塑性,从而影响行为相关疾病。
BDNF与自闭症病理生理学的关联
多种神经系统疾病都存在 BDNF 水平异常,包括精神分裂症、抑郁症甚至自闭症。最近的研究显示,与对照组相比,自闭症患者的 BDNF 水平发生了改变,这表明 BDNF 可能在自闭症病理生理学中发挥作用。
与重度自闭症相比,轻度表型患者的 BDNF 水平相对较高,强调了该因子可能具有保护作用。自闭症患者脑内抗凋亡信号通路中 BDNF 的下调是自闭症病理生理的可能机制之一。
作为神经保护剂的 BDNF 表达减少可能是由炎症因子(包括 IL-1β 和 TNF)升高引起的;因此,它可能在神经炎症中起负调节作用。
肠道菌群与BDNF的相互影响
自闭症患者肠道菌群失调可能通过免疫失调和释放穿过血脑屏障的炎症因子(如 IL-1β)导致这种炎症状态。
还需要进一步研究了解自闭症患者肠道微生物改变的诱导和改变,是否可以通过 BDNF 水平进行监测和控制。
受激活、正常 T 细胞表达和分泌的调节,RANTES(CCL5)和嗜酸细胞趋化因子(CCL11)是由多种细胞释放的促炎趋化因子,包括血细胞、成纤维细胞、内皮细胞、上皮细胞、神经元和神经胶质细胞。
详情展开如下:
RANTES
RANTES是一种重要的趋化因子,属于CC亚家族的β趋化因子。它由多种细胞类型表达和分泌,包括T细胞、单核细胞、NK细胞、上皮细胞和血小板等。
RANTES的主要功能是通过与其特异性受体结合来诱导白细胞向炎症部位迁移,从而在炎症反应中起关键作用。
这些受体包括CCR1、CCR3、CCR4和CCR5。RANTES不仅能够促进T细胞的活化和增殖,还能调节Th1/Th2细胞效应平衡。
嗜酸细胞趋化因子
嗜酸细胞趋化因子是一类属于CC趋化因子家族的小细胞因子,主要作用是选择性地募集嗜酸性粒细胞。
这些因子在多种组织中表达,并通过与特定受体结合来诱导嗜酸性粒细胞向特定位置迁移。主要包括CCL11、CCL24和CCL26。
不仅在过敏性疾病如哮喘和过敏性鼻炎中发挥重要作用,还参与了其他炎症反应和肿瘤的发展。
RANTES和嗜酸细胞趋化因子在自闭症中的神经炎症作用
自闭症儿童的血浆中 RANTES和嗜酸细胞趋化因子水平明显较高。由于RANTES和嗜酸细胞趋化因子充当促炎介质,它们的升高意味着两者都在 自闭症中发挥神经炎症作用。
尽管Shen等人报告 RANTES 或嗜酸细胞趋化因子与自闭症的行为模式之间没有显著相关性,但Han 等人和 Hu 等人分别发现 RANTES 和嗜酸细胞活化趋化因子与自闭症相关。此外,其他研究表明这两个因素的增加都与自闭症相关。
肠道菌群诱导RANTES介导的炎症
早期研究发现,NOD 样受体家族含有吡啶结构域的 6-肠道菌群轴以及随后的 IL-6 和 TNF 释放是肠道菌群失调与 RANTES 介导的免疫失调之间的可能联系。
关于基因编码的表达,已发现肠道菌群可以操纵嗜酸细胞活化趋化因子的表达水平。在这方面,接受抗生素治疗的小鼠的微生物组发生了改变,嗜酸细胞活化趋化因子升高,小胶质细胞结构不同。
小胶质细胞是中枢神经系统中的常驻免疫细胞,是抵御病原体和损伤的第一道防线。它们不断探测大脑环境,寻找感染、损伤或疾病的迹象。小胶质细胞对全身炎症信号特别敏感。TNF-α和IL-6等促炎细胞因子水平升高可激活小胶质细胞,使其从静息状态转变为活化状态。
激活的小胶质细胞可以吞噬细胞碎片、死细胞和病原体,并释放细胞因子和趋化因子来协调免疫反应。它们在中枢神经系统中发挥双重作用:促进炎症以抵御威胁,并在威胁过去后促进组织修复和炎症消退。慢性小胶质细胞活化与神经炎症有关。
粪菌移植与行为改善
此外,研究发现,小鼠的嗜酸细胞活化趋化因子水平在粪菌移植后发生了变化。关于肠道微生物群与自闭症的关系,在自闭症小鼠中,通过肠道微生物群移植,研究人员观察到焦虑样行为和重复性行为得到改善,而 RANTES 和嗜酸细胞活化趋化因子的水平得到改善。
这些结果表明,RANTES 和嗜酸细胞活化趋化因子在中枢神经系统突触传递和发育中起着重要作用,它们的水平与小鼠的微生物群结构有关。
特定菌群与趋化因子水平呈负相关
研究发现,梭菌科、丹毒丝菌科、普氏菌科、CandidatusArthromitus、变形杆菌属与 RANTES 和嗜酸细胞活化趋化因子的水平呈负相关。
通过益生菌改善
体内外用和口服益生菌治疗已报告与RANTES有关的菌株,包括副干酪乳杆菌SGL04、植物乳杆菌SGL07、发酵乳杆菌SGL10、短乳杆菌 SGL12裂解物以及鼠李糖乳杆菌GG有关。
同样,含有嗜酸乳杆菌、鼠李糖乳杆菌 GG和双歧杆菌的益生菌也改变了动物体内嗜酸细胞活化趋化因子基因的表达。
总的来说,这些研究的重要发现表明肠道菌群通过 RANTES和嗜酸细胞活化趋化因子的炎症因子在自闭症发病机制和严重程度中的潜在机制。
细胞因子粒细胞-巨噬细胞集落刺激因子 (GM-CSF) 驱动髓系造血细胞生物学的许多方面,包括存活、增殖、分化和功能活动。它还通过树突状细胞和 T 细胞功能影响免疫系统。GM-CSF 可引发中枢神经系统慢性炎症,并作为神经元生长因子刺激神经元和神经胶质细胞分化。
GM-CSF在自闭症中的复杂作用
一些早期研究认为自闭症患者的 GM-CSF 水平较低,但随后的研究在自闭症患者大脑中发现 GM-CSF 水平较高。
研究发现,在同时出现胃肠道症状的自闭症儿童中,GM-CSF-IL-1α、TNF-α 和干扰素-α 的水平较高。自闭症中 GM-CSF 水平的变化可能表明炎症过程可能与发育和神经免疫障碍有关。
Takada 等人的共培养实验结果首次表明,GM-CSF 诱导的巨噬细胞可抑制自闭症个体神经元的树突状生长。这种现象是通过促炎细胞因子IL-1α和TNF-α的分泌介导的,并可能导致更严重的行为影响。
肠道菌群与GM-CSF的关联
有趣的是,GM-CSF 水平随着肠道菌群的变化而变化,且主要与 IL-17a有关,IL-17a 是一种与 自闭症患者行为症状严重程度相关的细胞因子。
不同种类的肠道细菌与 GM-CSF 有关,包括副拟杆菌、普氏菌、链球菌、梭菌、罗伊氏乳杆菌、卷曲乳杆菌、粪肠球菌、布劳特氏菌、丁酸单胞菌、罗斯氏菌、Anaerotruncus、Blautia。一项重要发现表明,肠道菌群代谢物(如短链脂肪酸)可能会改变 GM-CSF 水平。
一项研究表明,使用含有长双歧杆菌、保加利亚乳杆菌和嗜热链球菌的益生菌可增加神经免疫因子 GM-CSF。
总之,肠道菌群改变导致 GM-CSF 神经炎症因子的变化,为了解自闭症患者发病机制提供了思路。
高迁移率族蛋白 1 (HMGB-1) 是 HMGB 蛋白家族中最丰富的成员之一,具有许多潜在作用。作为核蛋白,它在DNA调控活动中起关键作用。作为一种细胞外因子,它在免疫细胞对炎症作出反应时主动释放,也会被坏死或受损细胞被动释放。
HMGB-1的多功能性和在炎症中的作用
HMGB1 具有多种膜受体,称为病原体识别受体,其中 TLR4、TLR9 和晚期糖基化终产物受体 (RAGE) 是主要受体。通过与这些受体的相互作用,HMGB1可促进细胞炎症。HMGB1 可以穿过血脑屏障,促进神经突生长和细胞迁移,或介导损伤后的神经炎症。
HMGB-1与自闭症严重程度的相关性
已知自闭症患者血浆中的HMGB-1水平会升高,并且与自闭症的严重程度呈正相关。
另一种有效的炎症分子——表皮生长因子受体与自闭症儿童的症状严重程度有关,而 HMGB1 水平与之相关。
肠道功能障碍与HMGB-1水平的联系
研究发现,自闭症患者的 HMGB1 水平较高与胃肠道功能障碍较高有关,这可能意味着肠道是发病机制的一部分。
类似的研究表明,粪便中的HMGB1水平与自闭症儿童的胃肠道体征严重程度相关,这与自闭症相关的菌群失调有关。伴有肠道炎症的微生物群失调可导致单核细胞的激活,上调 HMGB1 的排泄,从而形成促炎反馈回路。
扩展阅读:炎症回路和肠道微生物
HMGB-1与自闭症行为表现的关联
较高水平的 HMGB1 和 TLR4 也与小鼠的自闭症样行为有关,可能是通过激活 HMGB1/TLR4 信号级联实现的。
自闭症儿童血清中 TLR4 水平升高,并且与他们的多动评分呈正相关。这进一步强调了炎症因子在自闭症行为表现中的作用。
HMGB-1在神经炎症中的作用机制
HMGB1/RAGE/TLR4 轴的激活会导致白细胞浸润到神经细胞中,从而引起持续的中枢神经系统炎症。有研究表明,神经炎症与自闭症的发生密切相关,其机制是激活炎症小体系统。此外,HMGB1 可以与内源性分泌性 RAGE 结合,导致血浆 RAGE 水平下降。这可能通过干扰神经肽催产素从外周到大脑的运输,导致自闭症的病理生理。
益生菌和肠道菌群改变对自闭症患者 HMGB1 水平的影响可以强化这一想法,并可以进一步研究。HMGB1 可能通过神经炎症在自闭症发病机制中发挥关键作用,并可以指导治疗策略。然而,它是自闭症病理生理学中一个非常潜在的因素,尚未明确阐明,需要更多研究。
骨桥蛋白 (OPN) 是一种可溶性促炎细胞因子,在自身免疫性神经炎性疾病中发挥着明确的作用,同时也是控制骨组织生物矿化的非胶原骨基质的组成部分。
OPN的功能多样,根据其位置和环境,OPN 参与局部炎症、细胞粘附、免疫反应、趋化性和防止细胞凋亡。
OPN在免疫调节中的作用
Heilmann 等人认为 OPN 可以在急性炎症期间激活免疫系统、减少组织损伤并刺激粘膜修复,同时在慢性情况下促进 Th1 反应并增强炎症。
OPN与神经系统疾病的关系
OPN 与多发性硬化症和阿尔茨海默病等神经心理疾病的发病机制有关。CD11c + 细胞表达分泌性磷蛋白1 及其编码蛋白 OPN 与阿尔茨海默病的认知障碍和常见神经病变有关。
注:CD11c+ 是一种在多种免疫细胞上表达的分子,主要与树突状细胞(DCs)相关。CD11c+ 标记物在免疫系统中具有重要的生物学功能。例如,在炎症性关节炎模型中,CD11c+ 树突状细胞的存在与疾病的严重程度呈负相关。
OPN在自闭症研究中的发现
有研究发现血清中 OPN 水平升高与病情严重程度有关,表明 OPN 在神经炎症和大脑特异性自身抗体的产生中的作用。他们的发现可以支持 OPN 是自闭症机制中重要神经炎症因子的观点。
在代谢紊乱中,人们讨论了 OPN 与肠道微生物群之间可能存在的相互作用。然而,OPN 与肠道微生物群在神经系统疾病(尤其是自闭症患者)中的作用尚未得到研究,这可能是未来研究的一个潜在目标。
钙卫蛋白是一种与钙结合的蛋白质,主要存在于中性粒细胞中,中性粒细胞是一种白细胞,在炎症和细胞损伤时会增加。
粪便中的钙卫蛋白可以指示肠道炎症,并可作为生物标志物。
钙卫蛋白与自闭症
考虑到肠道炎症在自闭症发展中可能发挥的作用,许多研究已经研究了自闭症患者中钙卫蛋白水平的关联,但结果并不一致。
一些报告显示,自闭症患者及其亲属的钙卫蛋白水平可能高于对照组。
钙卫蛋白与炎症及自闭症的关联
钙卫蛋白水平也与巨噬细胞炎症蛋白 1β 的较高表达呈中等相关性,而巨噬细胞炎症蛋白 1β 与自闭症诊断观察计划的沟通分量表和总分相关,表明它可能在微生物-神经元串扰中发挥作用。不太可能的是,一些研究发现自闭症患者和对照组之间的钙卫蛋白水平没有统计学上显著差异,因此,有和没有胃肠道症状的自闭症患者的钙卫蛋白水平没有明显变化。
钙卫蛋白水平与肠道菌群的关系
Laghi 等人的研究表明,钙卫蛋白水平较高与肠道中普雷沃氏菌较多和阿克曼氏菌减少有关,表明这些细菌可能分别具有炎症或保护作用。
益生菌疗法对自闭症患者的影响
Santocchi 等人发现益生菌疗法(包括 多种链球菌、双歧杆菌、乳杆菌)对自闭症患者的适应功能有有利影响,但对有或无胃肠道症状的钙卫蛋白水平没有明显影响。这表明益生菌对自闭症患者的影响比减少肠道炎症更为复杂,钙卫蛋白作为可能的神经炎症介质的作用应得到进一步研究。
总体而言,钙卫蛋白研究的异质性可能是由于试验个体的多样性、所用方法的准确性以及对微生物群改变和钙卫蛋白的同时研究不足造成的。但我们仍然可理解宿主微生物群失调和炎症诱导的钙卫蛋白会触发导致自闭症方面的神经炎症机制。
doi.org/10.1007/s10753-024-02061-y
在自闭症患者中,许多肠道微生物衍生的代谢物尤为突出,例如复合多糖或代谢氨基酸,它们可以作为神经递质。其中几种代谢物最近被讨论作为自闭症的早期诊断生物标志物。
特定菌群与短链脂肪酸的生产
肠道微生物通过一组重要的代谢物来调节宿主的生理机能,这些代谢物是短链脂肪酸,主要构成乙酸盐 (AA)、丁酸盐 (BTA) 、丙酸盐 (PPA)。
自闭症患者短链脂肪酸研究不一致
与某些研究不同,其他研究报告称自闭症患者的 乙酸盐、丙酸盐和丁酸盐水平高于对照组。这些肠道菌群相关的短链脂肪酸在宿主的炎症反应中表现出相互冲突的促炎和抗炎作用,可能是由于结合受体和局部浓度的差异。一些动物研究表明,补充微生物代谢物乙酸盐和丁酸盐可以逆转社会行为表型。
相反,在大鼠脑室内注射丙酸盐会诱发自闭症样症状,包括反应性神经胶质增生。丙酸盐可通过调节自闭症中的 PTEN/AKT 通路导致神经胶质增生、神经回路紊乱和神经炎症反应。
短链脂肪酸在自闭症和肠道微生物群中的意义

doi.org/10.1016/j.bbr.2024.115177
由于关于自闭症患者短链脂肪酸水平的发现数据不一致且尚待研究,因此需要进一步研究来验证短链脂肪酸在自闭症病理生理学中的潜在作用。它们可能被视为自闭症患者神经炎症生物标志物和肠道微生物群改变的指标。
COX1 和 COX2
脂质是大脑的主要成分,脂质代谢物是大脑发育和体内平衡的调节分子。作为脂质介质的主要脂质代谢物是前列腺素 (PG) 和白三烯 (LT),它们分别由花生四烯酸 (AA) 和其他不饱和脂肪酸在环氧合酶 (COX) 和脂氧合酶 (LOX) 的代谢下代谢。
已知 PGE2 信号在大脑形态形成中发挥作用,COX2/PEG2 信号受损与 MIA 模型中的自闭症发病机制有关。COX 通路涉及两种限速酶,COX-1 和 COX-2。
用于诱导 MIA 的内毒素和 MIA 模型中产生的炎症介质(IL-1β、IL-6、TNF-α、IFN、AA)均可诱导 COX-2。此外,有证据表明 COX-2 介导 N-甲基-D 天冬氨酸 (NMDA) 神经毒性。
COX2 和 自闭症
先前的研究使用自闭症患者的外周血单核细胞作为小胶质细胞的替代品,观察到在先天免疫刺激下上述细胞因子的产生增加。这种增加发生在有微生物感染后行为症状和认知功能波动史的自闭症患者中。有趣的是,自闭症患者血浆中的 COX-2 和 PGE2 升高,同时 α-突触核蛋白水平降低。因此,阻断 COX-2 可能有助于减轻自闭症患者的神经炎症和随后的神经元损伤。另一方面,脑中 COX-2 的上调可能具有神经保护作用,部分调节脑血流。
关于 COX-2 抑制剂在 ASD 患者中的临床试验数据很少。只有一项随机、双盲、安慰剂对照试验研究了 COX-2 抑制剂塞来昔布对 ASD 患者行为症状的疗效。
该试验将塞来昔布作为利培酮的辅助治疗,持续 10 周;使用异常行为检查表 (ABC) 评估行为症状。发现ABC分量表的易怒、嗜睡和刻板行为有显著改善。
当使用塞来昔布控制病毒性流感等综合征引起的 自闭症行为症状恶化时,也经常观察到 COX2 抑制剂塞来昔布减轻行为症状。吡格列酮具有多种抗炎作用,包括抑制小胶质细胞上 COX-2 的表达。吡格列酮对创伤性脑损伤有有益作用。
综上所述,COX-2抑制剂可能对有COX2激活迹象的自闭症患者有益,尤其是在急性和/或亚急性期。
自闭症患者中犬尿氨酸代谢产物的变化
例如,自闭症的患者尿液中神经毒性色氨酸代谢物的浓度增加。有报道称,自闭症患者中犬尿氨酸代谢物的靶分子 NMDAR 亚基的多态性 ,以及其他色氨酸代谢物的水平改变。
据报道,大约三分之一的自闭症患者具有高循环 5-HT 水平,这主要反映了肠道产生并储存在血小板中的 5-HT。5-HT 水平的变化可能与肠道 5-HT 代谢的变化和/或肝脏和肺部 5-HT 清除率的变化有关。然而,高血清素血症和特征性 ASD 行为症状之间的关联尚未得到一致证实。
同样,抑制 5-羟色胺再摄取转运蛋白 (SERT) 作用的选择性 5-羟色胺再摄取抑制剂 (SSRI) 对 自闭症患者并没有普遍有益的作用。这些发现表明,其中存在复杂的潜在机制。
有趣的是,对主要致病成分和生物内表型(包括血液中 5-羟色胺水平)的分析发现,与自闭症患者的免疫功能障碍有关。在同一研究人群中,免疫成分对表型变异的贡献最大;这些结果支持免疫激活对自闭症受试者血清素代谢的影响。
色氨酸影响大脑功能的 4 种不同途径
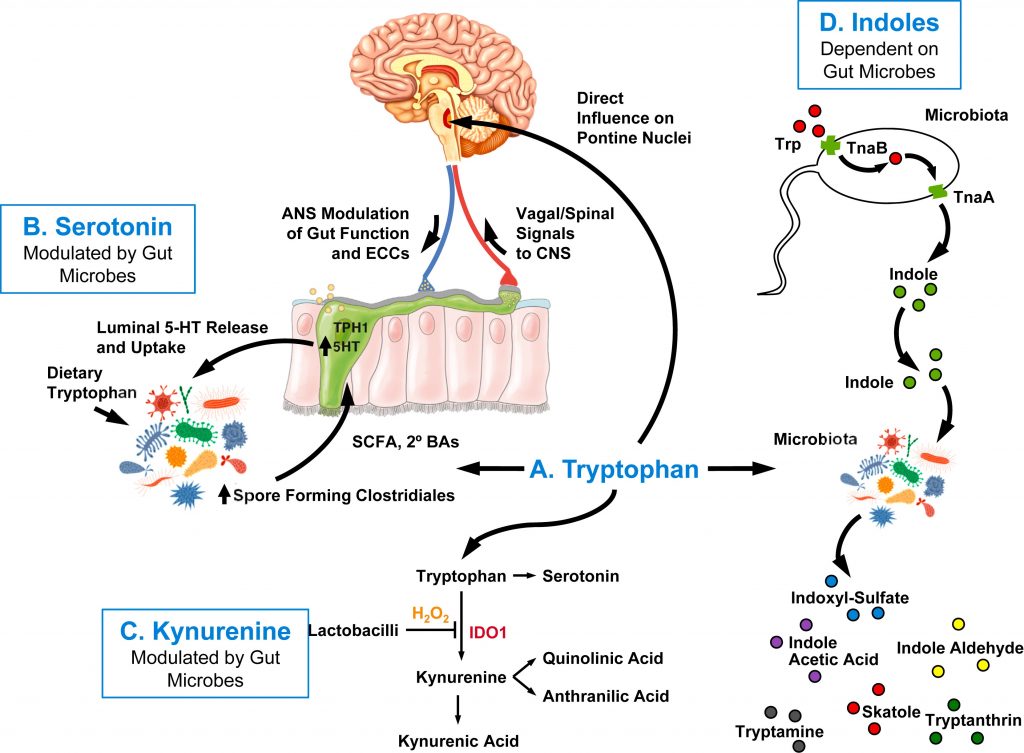
doi.org/10.1016/j.biopsych.2023.10.018
色氨酸[A]、血清素[B] 、犬尿氨酸[C]、吲哚[D]。其中三种途径依赖于肠道微生物代谢,而另一种途径中,色氨酸通过体循环到达缝核,无需微生物修饰。
自闭症与血清素代谢物研究的总结
SERT多态性与自闭症
米诺环素对色氨酸代谢的影响
当色氨酸代谢物的复杂稳态受损时,米诺环素可能对特定情况有效,从而导致犬尿氨酸代谢物的毒性作用恶化。将米诺环素用作自闭症患者的治疗选择需要谨慎选择自闭症患者。
miRNA 在神经系统中的作用
超过 60% 的人类基因受微小 RNA (miRNA) 控制,微小 RNA 是一种小型非编码 RNA,长度约为 18 到 24 个核苷酸,可作为表观遗传调控因子。miRNA 可改变大脑的可塑性和神经元的发育,其失调会导致多种神经系统疾病,包括自闭症。miRNA 已充分证实其可调控多种细胞和生理过程,包括造血、免疫反应、炎症。此外,miRNA 还受宿主-微生物群相互作用的影响,并在菌群失调和诱发炎症中发挥关键作用。
miR-146a 是自闭症中失调最严重的miRNA
一项深入研究发现,自闭症患者中存在过度表达的 miRNA,它们可能通过失调的炎症基因在神经发育受损中发挥作用。
此外,一些研究还发现,miRNA 通过与调节炎症小体表达的 3′-UTR 基因相互作用直接或间接激活炎症小体。具体而言,动物研究表明 miR-146a 的增加或减少可能是自闭症的潜在原因。
一项产后临床研究比较了自闭症和健康对照者的 miRNA,证实 miR-146a 是自闭症中失调最严重的 miRNA。
miR-146a 和 miR-155 在自闭症中的作用
另一项使用体外模型和死后人脑组织的研究也发现,早在儿童时期即可在自闭症患者脑中检测到 miR-146a 过表达。肠道菌群-宿主相互作用的变化可能诱导 miR-146a,从而促进神经炎症途径。值得注意的是,miR-146a 诱导的核因子 κB 增强了肠-脑轴的炎症信号通路。
研究表明,脆弱拟杆菌、鼠李糖乳杆菌 GG、嗜酸乳杆菌、保加利亚乳杆菌和大肠杆菌Nissle 1917与 miR-146a 表达相关。
另一项研究表明,miR-146a 对某些炎症细胞因子表达至关重要,其在大脑中的缺失会导致 miR-155整体补偿性上调。蛋白质羰基化增强和半胱氨酸硫醇水平降低是氧化应激介质激增导致神经炎症通量升高的额外指标。
miR-146a和miR-155如何与慢性炎症相关?
多项研究已将 miR-146a 和 miR-155 与慢性炎症所指的各种病理状况联系起来。一种可能的解释是,肠道毒素(如 LPS)能够穿过血脑屏障并进入体循环,可能激活 NF-kB-miRNA-146a-miRNA-155 信号通路。该通路会将来自微生物组的致病信号传递到大脑,这可能会扰乱先天免疫反应并导致神经炎症。
肠道菌群失调也可能改变 miR-155
一项研究增加了证据表明,自闭症儿童的杏仁核、额叶皮质和小脑中的 miR-155 表达增加。miRNA-155 参与细菌脂多糖对 TLR 的激活、肿瘤坏死因子-α 和 IL-6 的激活以及对树突状细胞上细胞因子信号传导抑制因子 1 的调节。这些活动,加上微生物群失调的变化,可以使 miRNA-155 成为肠脑轴和自闭症神经炎症机制中的候选角色。
早期研究发现,发酵乳杆菌、唾液乳杆菌、鼠李糖乳杆菌GG、嗜酸乳杆菌、德氏乳杆菌、双歧杆菌和大肠杆菌 Nissle 1917 等益生菌可以改变 miR-155的水平。
miR-181在自闭症中的潜在影响
研究发现自闭症患者的 miR-181 上调,预计会影响自闭症相关的神经连接蛋白 1基因。神经炎症和免疫失调是与 miR-181 家族相关的众多生理过程中的两种。
另一方面,一些研究表明肠道菌群可以调节小鼠的 miR-181。还有研究显示,鼠李糖乳杆菌和德氏乳杆菌益生菌会影响炎症疾病中 miR-181a 的表达。此外,来自肠道菌群的代谢物可能影响不同状态下的 miR-181表达。总之,这些证据强化了 miR 介导肠道微生物群可能通过自闭症中的神经炎症过程发挥作用的论点。
生酮饮食对miRNA及自闭症的影响
一项小型介入性随访研究,分析七名儿童包括在生酮饮食之前和生酮饮食 4 个月之后收集的血液和粪便样本。经过 4 个月的随访发现,生酮饮食 导致促炎细胞因子(IL-12p70 和 IL-1b)和脑源性神经营养因子 (BDNF) 的血浆水平下降。肠道微生物群的变化、肠道中丁酸激酶表达的增加以及血浆中 BDNF 相关 miRNA 水平的变化。这些队列研究结果表明,生酮饮食可能通过减少炎症、逆转肠道微生物群失调以及影响与大脑活动相关的 BDNF 通路对自闭症社交能力产生积极影响。
生酮饮食诱导的神经炎症变化的拟议间接途径
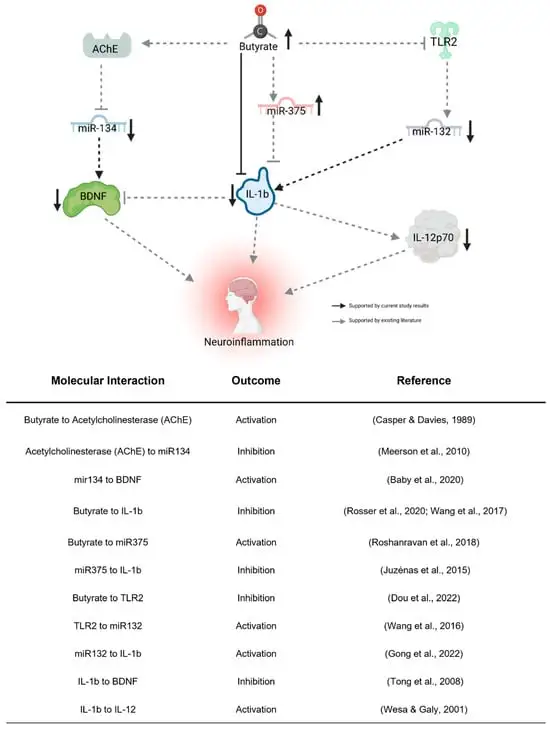
doi.org/10.3390/nu16101401
益生菌可以通过各种机制影响宿主的健康。据最近的研究,它们可以作为治疗工具,通过恢复肠道菌群的健康平衡、调节组织中的神经递质水平以及减少肠道炎症来治疗自闭症。
动物模型显示,益生菌显著改变了大鼠的社交和情感行为以及血液中 IL-6、IL-17a 和 IL-10 等细胞因子的水平。另一方面,只有少数试验从炎症调节和免疫系统调节方面评估了益生菌对自闭症的影响。
益生菌在炎症和自闭症管理中的作用试验

doi.org/10.1007/s10753-024-02061-y
有研究评估了婴儿双歧杆菌与牛初乳产品联合用于自闭症儿童的情况。一些患者出现胃肠道症状和异常行为的频率较低,可能是由于TNF-α和 IL-13 减少所致。
益生菌对自闭症儿童炎症标志物和症状的影响
有研究表明,粪便中TNF-α水平与自闭症严重程度之间存在很强的相关性,表明胃肠道炎症和通透性可能通过炎症途径参与自闭症。他们可以通过补充益生菌(包括乳酸杆菌、双歧杆菌和 链球菌)显著降低自闭症儿童粪便中的TNF-α水平。
在患有胃肠道问题的自闭症儿童亚组中,益生菌治疗组的一些胃肠道症状、适应性功能和感觉状况比安慰剂治疗组有较大改善。
益生菌混合物的应用
目前尚无针对自闭症核心缺陷的药物。因此,迫切需要为自闭症患者开发新的药理学方法。总体而言,这些发现表明益生菌可能是一种有前途的治疗方法,因为它们对自闭症症状有有益的影响。考虑到免疫系统功能障碍与行为异常之间存在关联,以及肠道微生物群可能通过炎症介质对 自闭症产生影响,建议在益生菌给药期间检查神经炎症变量,并确定改变这些变量的最有效配方。
无麸质和无酪蛋白饮食
研究发现,单纯的无麸质饮食对自闭症儿童的症状、行为或智力能力没有显著影响。
当无麸质饮食结合其他干预措施(如维生素、矿物质、必需脂肪酸、肉碱、硫酸镁浴、消化酶和无酪蛋白、无大豆饮食)时,观察到在非言语智力能力和自闭症症状方面有显著改善。
改良的生酮无麸质饮食
一项研究评估了补充MCT的改良生酮无麸质饮食对自闭症症状的影响,为期3个月的干预导致自闭症核心特征显著改善。
低FODMAP饮食
一项实施低FODMAP饮食的研究在自闭症儿童中未发现行为问题的显著差异。
适合自闭症谱系障碍儿童的饮食模式
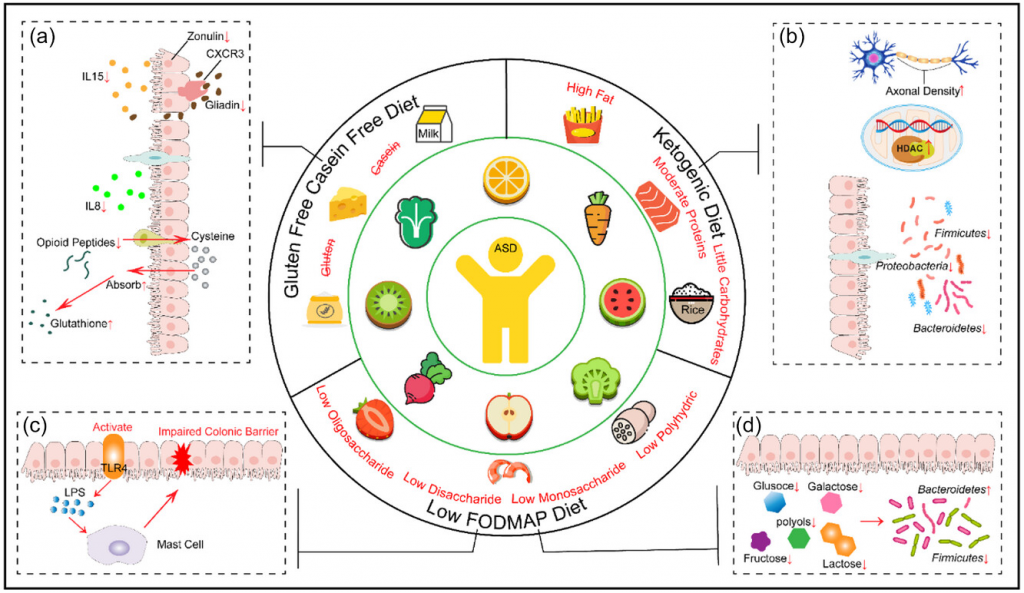
doi.org/10.1002/fft2.380
a)无麸质/无酪蛋白(GFCF)饮食可以使肠黏膜组织正常化,恢复肠上皮细胞对半胱氨酸的吸收,提高谷胱甘肽水平,增加甲基供体,防止甲基化抑制;
b)生酮饮食(KD)可以优化肠道菌群结构,降低厚壁菌门、拟杆菌门和变形菌的丰度,调节组蛋白去乙酰化酶活性,增加脑神经元轴突的密度;
c、d)低发酵寡糖-双糖-单糖-多元醇(FODMAP)饮食可以通过激活toll样受体修复受损的结肠屏障,同时调节肠道菌群以恢复肠道稳态。
必需脂肪酸补充
多项研究调查了ω-3脂肪酸补充对自闭症症状、发展年龄和营养状况的影响。综合分析显示,ω-3脂肪酸补充显著改善了干预组的刻板行为、多动、社交沟通、非言语智力能力、发展和营养状况。
肉碱
肉碱补充在自闭症患者的一年营养计划中显示出改善非言语智力能力和症状的效果。
萝卜硫素
萝卜硫素是一种存在于十字花科蔬菜中的膳食异硫氰酸酯,是一种营养保健食品。几项研究探索了萝卜硫素在自闭症治疗中的潜力,报告显示在行为和生化标志物方面有所改善。
多项研究调查了维生素补充对自闭症患者症状严重程度和生活质量的影响。
维生素A
维生素A补充对自闭症症状有显著缓解作用,特别是通过增加血清中的维生素A水平来改善社交响应性。
维生素D
维生素D补充在减少多动、减轻易怒方面有效,并可能与ω-3联合使用时进一步改善自闭症症状。
矿物质
锌的补充被认为可以增强自闭症患者的认知-运动功能。
肌肽
肌肽补充对自闭症儿童的睡眠障碍有积极作用,但对自闭症症状的严重程度影响不大。
益生元
一项针对 30 名自闭症儿童的为期 6 周的研究表明,益生元干预显著减轻了胃肠道不适并改善了排便,但对睡眠或胃肠道症状没有显著影响。研究发现,韦荣球菌科和双歧杆菌减少,拟杆菌属和普拉梭菌增加。
一项为期 12 周的小规模试点研究针对 8 名患有 自闭症和胃肠道合并症的儿童,发现益生元补充剂可显著减少异常行为(嗜睡、多动、刻板行为和易怒)并改善胃肠道症状,这可能是由于肿瘤坏死因子α 和IL-13 的产生减少所致。

doi.org/10.1016/j.rasd.2024.102352
近期研究表明,孕妇饮食中某些营养素含量高与患自闭症的风险增加有关。
在这些饮食因素中,孕妇饮食中水果和蔬菜上的农药残留可能是导致胎儿神经发育异常的重要暴露因素。
孕妇蛋白质营养不良和高咖啡因摄入量均与胎儿发育受限和后代患自闭症的风险增加有关。
每日盐的摄入量也可能是一个条件性危险因素。具体而言,盐摄入量增加对身体免疫系统和肠道微生物群有显著影响,导致肠道稳态失衡和炎症的发生,进一步通过菌-肠-脑轴导致神经发育异常。
母亲怀孕期间不良的饮食模式会增加后代患自闭症的风险。例如,高能量、高密度饮食和西式饮食均可导致自闭症发病率增加。
与这些不良饮食因素相反,怀孕期间摄入足够的维生素和 omega-3 多不饱和脂肪酸与后代自闭症发病率较低相关。
此外,增加孕妇膳食中的锌含量可以预防与自闭症相关的社交缺陷和焦虑症状。除了避免上述与孕期不良饮食有关的潜在风险因素外,患有糖尿病、肥胖或高血压等潜在风险的孕妇应特别注意每日膳食摄入量。
肥胖孕妇的饮食建议
基于人群的流行病学调查发现,母亲肥胖和怀孕期间体重大幅增加均与后代患自闭症的风险增加有关。
膳食纤维摄入不足会导致肠道中的短链脂肪酸水平异常。高膳食纤维干预和短链脂肪酸疗法可以缓解由此产生的后代的认知和社交功能障碍。高纤维饮食可能减少突触损伤和小胶质细胞缺陷,降低后代神经发育障碍风险。所有母亲无论胖瘦,都应在怀孕期间避免高脂肪饮食,以降低后代患精神疾病的风险。
动物研究表明,母鼠的高脂饮食选择性地促使雄性子代脑内免疫细胞过度消耗5-HT,从而导致神经系统异常。
孕期高脂、高糖饮食可能导致炎症介导的神经发育障碍,增加自闭症风险。肥胖女性在孕期应限制脂肪和糖摄入,增加膳食纤维摄入,以降低后代精神疾病风险。
糖尿病孕妇的饮食建议
众多研究发现母亲孕期患糖尿病与子代罹患自闭症风险增高显著相关。
短暂性高血糖可能引发持续性表观遗传改变和紧密连接蛋白表达抑制,伴随活性氧产生和超氧化物歧化酶(SOD)表达的抑制。动物研究显示,高血糖可诱导子代杏仁核中活性氧产生和SOD表达抑制,诱导自闭症样表型。
母亲糖尿病介导的氧化应激可能导致消化道功能障碍、肠道通透性增加、肠道微生物组成改变和神经元基因表达抑制,最终导致后代出现自闭症表型。母亲糖尿病可能抑制造血干细胞SOD表达、诱导炎性细胞因子,导致子代自闭症患者免疫功能紊乱。
妊娠期糖尿病女性应控制碳水化合物摄入,适量摄入具有抗糖尿病作用的食物,如洋葱和苦瓜。传统植物,如葱属、苦瓜属和荆芥属植物,含有抗糖尿病功效成分,可能有助于控制血糖。
维生素B6和维生素D的补充对降低后代罹患自闭症风险和改善糖尿病相关并发症有益。矿物质如锌和铬有助于保护糖尿病患者免于产生胰岛素抵抗。
妊娠高血压孕妇的饮食建议
妊娠期高血压与后代神经发育障碍和自闭症风险增加有关。
DASH饮食是一种有效的降低血压的饮食干预措施,通过增加粗粮、蔬菜、蛋白质、纤维素、钙和钾的摄入,并限制食盐摄入,可以显著降低血压。高质量的DASH饮食还与降低后代焦虑、行为缺陷和神经发育障碍的风险相关。
补钙和增加膳食钾的摄入也有助于预防妊娠高血压。此外,高血压的发病与肠道菌群有关,通过增加南美油藤的摄入量,可以缓解高血压。
类风湿性关节炎孕妇饮食建议
母亲类风湿性关节炎也与后代患自闭症的风险增加有关,可能通过炎症或免疫机制导致自闭症的发展。目前尚无特定的饮食模式来预防这种风险,但食用具有抗炎症或自身免疫反应的食物,如含有酚类和三萜类化合物的水果和蔬菜,可能是一种潜在的替代方案。
需要进一步研究来探索孕期饮食与菌群和炎症之间的联系,并开发有效的预防策略。
扩展阅读:深度解析 | 炎症,肠道菌群以及抗炎饮食
鉴于自闭症病理生理的复杂性和不明确性,近年来人们对炎症机制和免疫失调的作用进行了研究。自闭症中的失调途径在病因上也可以追溯到肠道微生物群失调。
这些变化可能通过释放的代谢物、BDNF的神经信号通路和神经炎症生物标志物(包括 S100B、HMGB-1、OPN、miRNA、RANTES、嗜酸细胞趋化因子和 GM-CSF)与自闭症症状和严重程度有关。
本文强调了介质作为触发机制和桥梁作用,一方面是肠道微生物群失调引起的炎症,另一方面是自闭症中枢神经系统神经炎症过程。益生菌作为恢复自闭症微生物群的适用治疗选择,表明肠道微生物群的相关性和潜在的有益影响。
然而,考虑到微生物群改变类型、神经炎症介质的巧合、干预时间长度以及自闭症年龄和症状等个体差异,评估个体肠道菌群状况以及不同益生菌及其他配方的功效对于自闭症的干预至关重要。
随着对微生物群与自闭症关系的深入理解,一个多维度的临床视角逐渐显现。我们可以通过分析微生物群的变化、相关的代谢产物、神经炎症介质以及它们与自闭症患者中枢神经系统的相互作用,在临床上描绘出自闭症的发展轨迹,这些研究的整合可能有助于我们构建一个综合的框架,用于自闭症的早期识别、干预和长期管理。
主要参考文献
Zarimeidani F, Rahmati R, Mostafavi M, Darvishi M, Khodadadi S, Mohammadi M, Shamlou F, Bakhtiyari S, Alipourfard I. Gut Microbiota and Autism Spectrum Disorder: A Neuroinflammatory Mediated Mechanism of Pathogenesis? Inflammation. 2024 Aug 2.
Yu R, Hafeez R, Ibrahim M, Alonazi WB, Li B. The complex interplay between autism spectrum disorder and gut microbiota in children: A comprehensive review. Behav Brain Res. 2024 Aug 2;473:115177.
Allan NP, Yamamoto BY, Kunihiro BP, Nunokawa CKL, Rubas NC, Wells RK, Umeda L, Phankitnirundorn K, Torres A, Peres R, Takahashi E, Maunakea AK. Ketogenic Diet Induced Shifts in the Gut Microbiome Associate with Changes to Inflammatory Cytokines and Brain-Related miRNAs in Children with Autism Spectrum Disorder. Nutrients. 2024 May 7;16(10):1401.
Li, Wentian, et al. “Dietary nutrients that potentially mitigate autism spectrum disorder and dietary recommendations for children and pregnant women.” Food Frontiers 5.3 (2024): 920-946.
Aldegheri, Luana, et al. “Impact of Human Milk Oligosaccharides and Probiotics on Gut Microbiome and Mood in Autism: A Case Report.” Microorganisms 12.8 (2024): 1625.
Ross FC, Mayer DE, Gupta A, Gill CIR, Del Rio D, Cryan JF, Lavelle A, Ross RP, Stanton C, Mayer EA. Existing and Future Strategies to Manipulate the Gut Microbiota With Diet as a Potential Adjuvant Treatment for Psychiatric Disorders. Biol Psychiatry. 2024 Feb 15;95(4):348-360.
Kim J. Autism Spectrum Disorder and Eating Problems: The Imbalance of Gut Microbiota and the Gut-Brain Axis Hypothesis. Soa Chongsonyon Chongsin Uihak. 2024 Jan 1;35(1):51-56.
Camberos-Barraza, J.; Guadrón-Llanos, A.M.; De la Herrán-Arita, A.K. The Gut Microbiome-Neuroglia Axis: Implications for Brain Health, Inflammation, and Disease. Neuroglia 2024, 5, 254-273.
Jyonouchi H. Autism spectrum disorder and a possible role of anti-inflammatory treatments: experience in the pediatric allergy/immunology clinic. Front Psychiatry. 2024 Jun 24;15:1333717.

谷禾健康

自闭症谱系障碍 (ASD) 是一组神经发育疾病,其特征是社交互动和沟通的质量障碍、兴趣受限以及重复和刻板行为。
环境因素在自闭症中发挥重要作用,多项研究以及谷禾队列研究文章表明肠道微生物对于自闭症的发生和发展以及存在明显的菌群和代谢物的生物标志物。
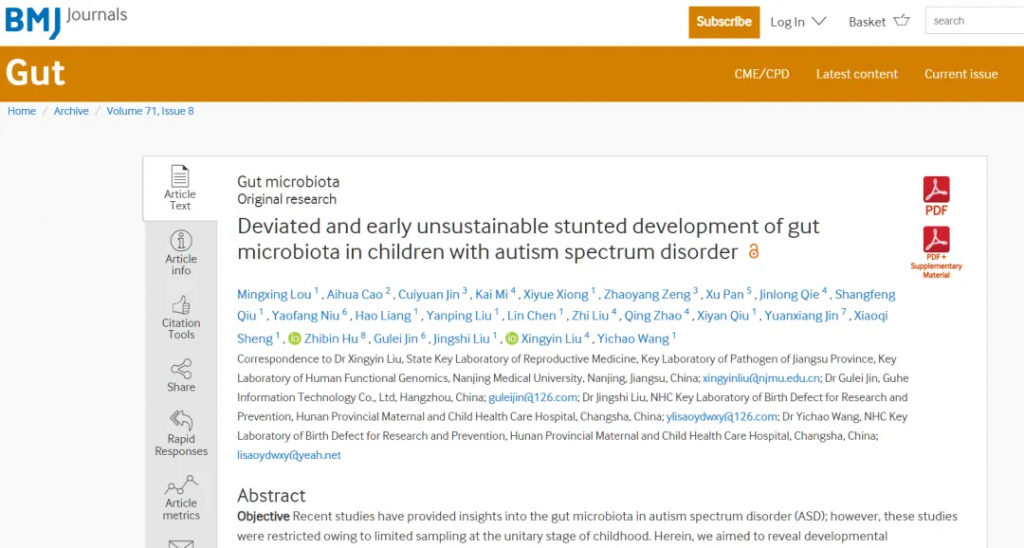
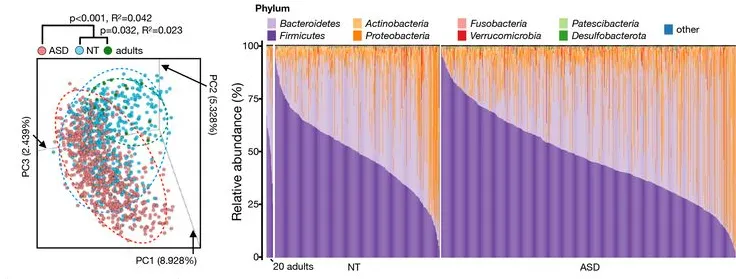
doi: 10.1136/gutjnl-2021-325115.
尽管环境因素在自闭症中发挥重要作用,但几乎没有确凿的证据将饮食与疾病的发生和进展联系起来。然而,最近关于饮食如何塑造肠道-大脑轴的研究可能会为环境对疾病机制的影响提供新的见解,并提出至少通过饮食改善某些自闭症谱系障碍症状的可能性。
此外,在谷禾检测实践过程中,也发现部分自闭症儿童的消化功能,以及饮食营养存在问题,主要集中表现为挑食,消化不良等。
doi: 10.1136/gutjnl-2021-325115.
本文参考以往相关研究性文章,详细讨论饮食和肠道微生物群-肠-脑轴如何影响自闭症,主要概述肠道微生物群对分子代谢(各类氨基酸、γ-氨基丁酸、不饱和脂肪酸、短链脂肪酸、胆固醇、丁酸盐、乙酸盐、N-乙酰天冬氨酸、多酚等)和与自闭症发病和进展相关的酶(二糖酶、己糖转运蛋白和单羧酸转运蛋白等)。还回顾了饮食模式、益生菌和肠道微生物群在大脑发育中的作用及与自闭症的关联,这些都为自闭症的干预策略提供了重要的理论支持。
自闭症谱系障碍 (ASD) 是一组神经发育疾病,一般在 3 岁之前发病,其特征是社交互动和沟通的质量障碍、兴趣受限以及重复和刻板行为。
直到几十年前,自闭症谱系障碍还被认为相当罕见,但自 20 世纪 80 年代以来,全世界自闭症谱系障碍快速增加,这给自闭症谱系障碍患者的家庭和整个社会带来了重大的后果。
目前在临床上自闭症谱系障碍的诊断仍然是根据行为来定义的,通过详细的发展史、父母对孩子日常行为的描述以及对孩子的社交互动方式以及沟通和智力功能的直接评估。
一个重要问题让人对自闭症表型发病机制的理解变得更加复杂,简而言之,自闭症谱系障碍的发病和表现远非同质:
此外,除了核心症状之外,这些儿童通常还表现出一系列其他相关特征,例如:
doi: 10.1136/gutjnl-2021-325115.
饮 食
人体必需氨基酸必须由食物供给,喂养可能代表环境因素和神经生物学因素之间的桥梁,因此可能在导致疾病表型的途径中发挥作用。从临床经验和文献中都知道,自闭症儿童往往与喂养和饮食态度有特殊的关系。
部分自闭症儿童可能有进食困难及胃肠道症状,对食物的味道和颜色非常挑剔。因此,自闭症儿童必需氨基酸 (赖氨酸、色氨酸、苯丙氨酸、组氨酸) 减少,可能部分是由于食物摄入不足或饮食习惯不良所致。
非常有限的饮食可能会使任何儿童面临营养缺乏和发育不良的风险,包括大脑发育。
遗 传
强有力的证据支持遗传因素对自闭症和相关疾病的疾病风险有影响。
然而,与自闭症风险有关的许多不同基因编码参与各种生理过程的各种不同蛋白质,包括大脑发育和功能、神经递质受体或转运蛋白、细胞粘附/屏障功能蛋白、免疫相关蛋白、参与胆固醇代谢或运输的蛋白质,以及影响线粒体功能的蛋白质。
近期,发表在《Cell》的一项研究对一个出生队列进行了 20多年的跟踪,详细的早期纵向问卷记录了感染和抗生素事件、压力、产前因素、家族史等饮食,在随访的 16,440 名瑞典儿童中,1,197 名患上神经发育障碍。下面一些有关自闭症风险的研究数据出自该文章:
家族病史
环 境
并非所有携带这些特定突变的个体都会患自闭症谱系障碍。最近的一项同卵双胞胎研究强调,环境因素可能解释了他们患自闭症谱系障碍相对风险的 55%,环境因素为自闭症谱系障碍型症状的出现提供了选择性压力,这些症状从各种不同的症状中出现。各种易诱发的遗传异常,结合起来会引起明显的疾病。
重大生活事件
化学物质暴露
早期感染和抗生素
儿童早期(出生至 5 岁)感染与自闭症风险增加显著相关,最显著的是第一年内中耳炎和反复湿疹。
微生物组
胃肠道症状长期以来表明,肠道和大脑之间存在着紧密联系,即”肠-脑轴”。
——胃肠道问题
在未来患有神经发育障碍的儿童中,早期胃肠道问题明显,情绪问题程度较轻。
——肠道菌群
肠道细菌可能在自闭症病理生理学中发挥一定作用。事实上,各种研究表明肠道微生物群在自闭症中发生了改变, 尽管文献中对于参与其中可能发挥作用的细菌几乎没有达成一致。
肠道细菌及其代谢产物不仅影响肠道功能和饱腹感,还可能与情绪、认知、行为、抑郁以及大脑发育等方面有关。
饮食在塑造哺乳动物代谢通量(包括神经化学物质的通量)以及塑造肠道微生物群及其活动方面具有重要作用。
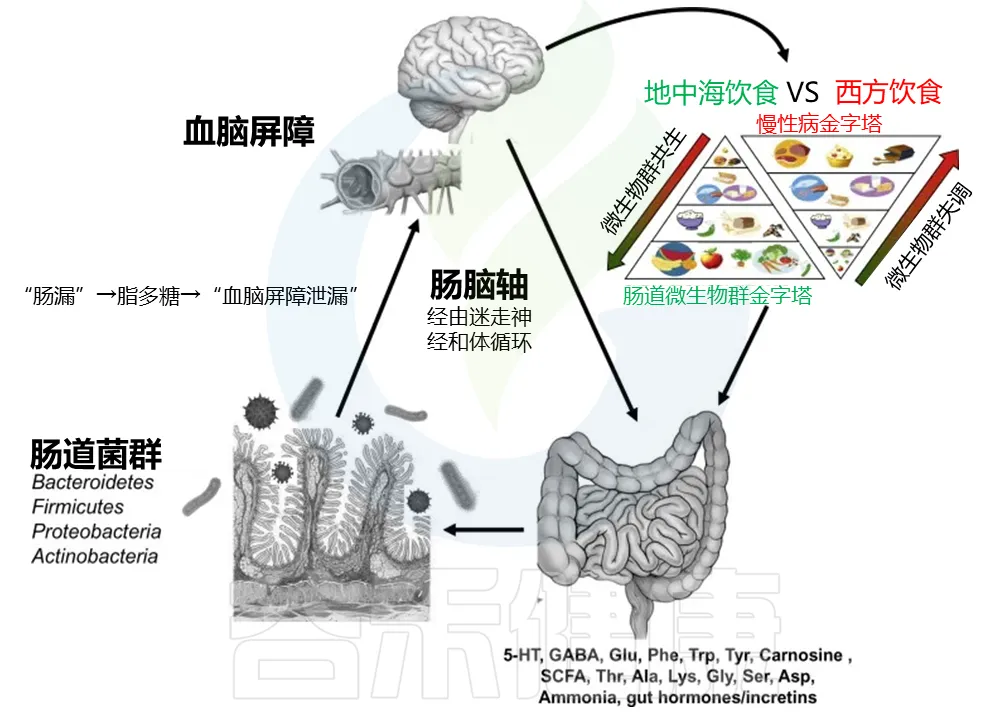
例如,纤维和益生元尤其支持有益的糖分解肠道微生物群,其特征是双歧杆菌和乳酸菌的相对丰度增加以及短链脂肪酸 (SCFA) 的产生。来自水果、谷物和蔬菜等全植物食品的多酚也会影响肠道微生物群组成、免疫功能,充当抗氧化剂,防止大脑炎症并改善血脑屏障 (BBB) 功能。
Kieran M. Tuohy, et al.,Diet and the Gut Microbiota,2015,225-245
接下来我们着重就微生物组这方面,详细探讨肠道微生物群如何在自闭症的发展中起作用,以及相关的最新研究进展。
肠-脑轴作为外部环境与人类大脑之间的沟通通路,在体内有重要的“内部”通道——人类肠道微生物群。许多营养物质和摄入的化学物质必须经过这些通道,转化为生物可利用和活跃的中间产物,然后通过肝门静脉被吸收并在全身分布。
许多对大脑重要的化学物质也由肠道微生物群在肠道中产生,包括色氨酸、多巴胺、血清素、GABA、β-羟基丁酸、胆碱、牛磺酸、乙酸盐、琥珀酸、乳酸、乙酰辅酶A、肌酐、甜菜碱、谷氨酸、谷氨酰胺、对甲酚、反式吲哚丙烯酸甘氨、脂肪酸和马尿酸。
一些其他化学物质可能由细菌(例如在消化和发酵过程中)调节,或者是细菌成分,如革兰氏阴性细菌细胞壁的组成部分脂多糖(LPS),它可剂量依赖性地减少人类肠道细胞对血清素的吸收,并在外周和大脑引发炎症,影响大脑功能。
神经递质:GABA、血清素
最近有研究表明,神经递质GABA在自闭症谱系障碍神经元发育中可能起作用,尤其是考虑到它在婴儿期从神经递质兴奋剂到抑制剂的转变。
另一种神经递质,血清素(5-羟色胺,5-HT),也被怀疑在自闭症中起作用。自闭症患者的血液中,血清素和 GABA 水平均发生了变化。有趣的是,这两种神经递质都是由氨基酸代谢产生的,分别是色氨酸和谷氨酸。
肠道代谢物是否直接影响大脑的神经发育?
取决于它们是否能够穿过血脑屏障(BBB)。
比如说,肠道细菌可以产生GABA,这个 GABA 可能会影响到肠道神经系统的工作,或者改变血液中 GABA 的含量。但是,在正常健康的情况下,肠道产生的 GABA 是不能直接穿过”血脑屏障”进入大脑的。
反之,乙酸盐作为肠道微生物群发酵碳水化合物的主要终产物和哺乳动物细胞胆固醇生物合成的底物,可以迅速通过血脑屏障。
然而,血脑屏障可能会因氧化或炎症压力等原因受到损伤,与胃肠道屏障类似出现“漏”,允许不需要的化学物质进入大脑。在自闭症患者中血脑屏障受到损伤。
为什么说肠道菌群可用于区分自闭症与非自闭症?
研究表明,肠道微生物群在影响自闭症谱系障碍(ASD)代谢产物谱和生理参数的过程中起着重要作用。
首先,自闭症患者的肠道微生物群与健康对照组或非自闭症的兄弟姐妹有显著差异,显示出异常的肠道微生物组成和活动是自闭症的一个特征。
研究报告显示,自闭症群体与非自闭症对照组之间在拟杆菌门、厚壁菌门、变形菌门和放线菌门的组成上存在差异。
前面提到的发表在《Cell》大队列的自闭症儿童研究,在 11.9 ± 2.9 个月时采集了 1,748 名婴儿的粪便样本,将所有可用的对照与未来的神经发育障碍进行比较,然后匹配风险因素和微生物组多样性混杂因素。
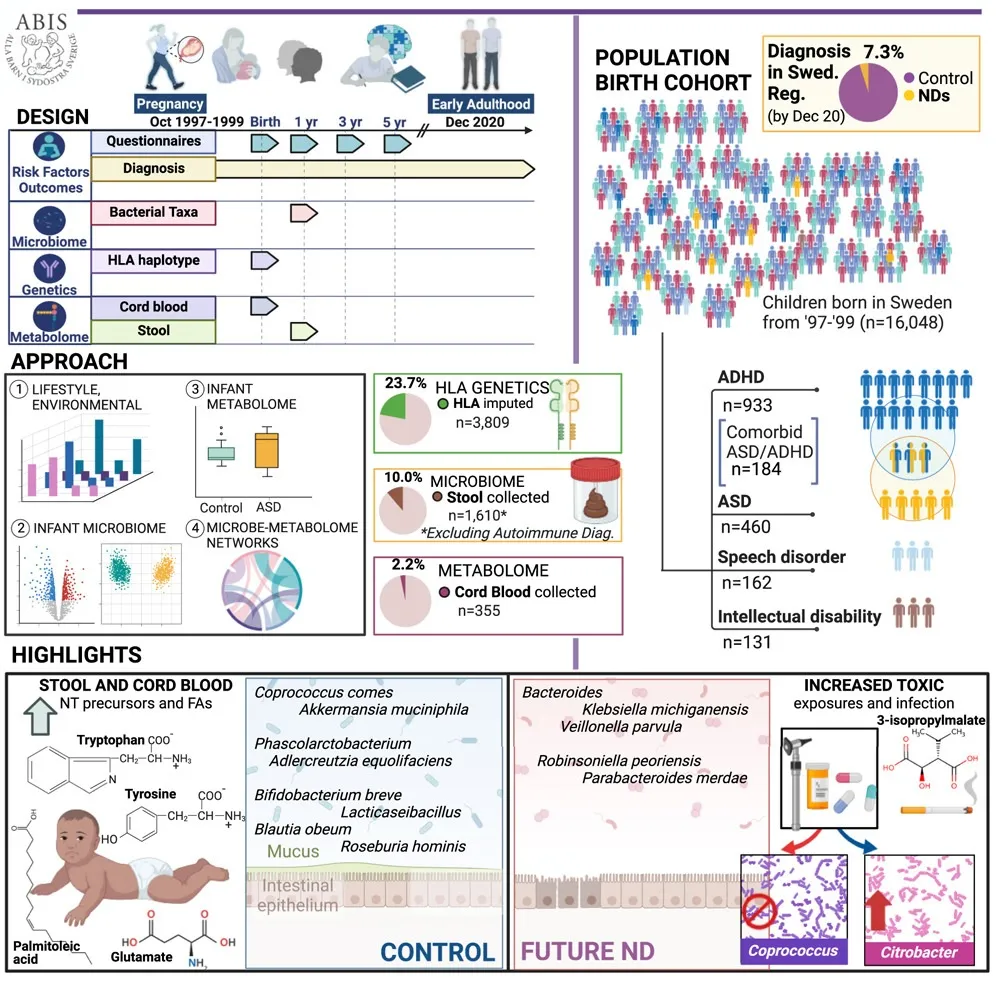
doi.org/10.1016/j.cell.2024.02.035
在未来的神经发育障碍中,下列菌群丰度较高:
在我们的GUT队列里,也发现自闭症儿童这个菌的Veillonella显著富集。
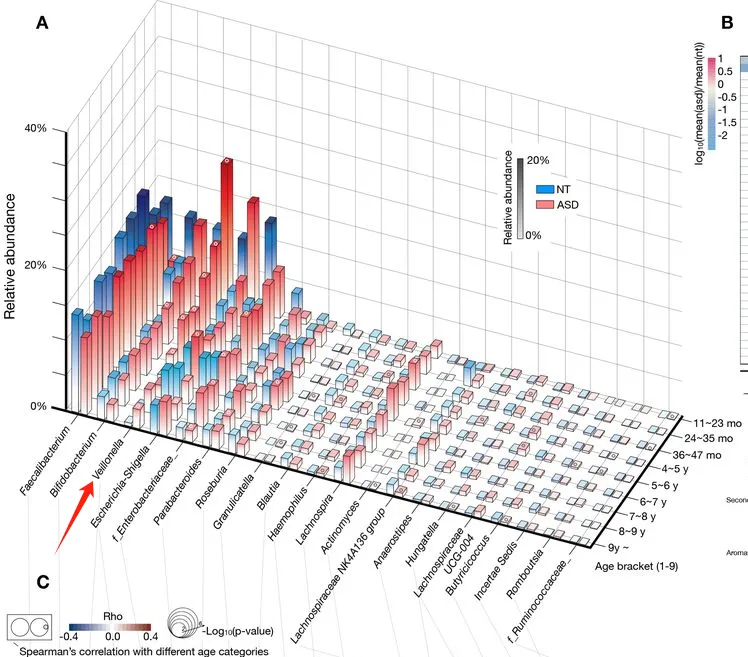
doi: 10.1136/gutjnl-2021-325115.
注:Veillonella是一种革兰氏阴性的厌氧球菌,正常情况下通常存在于人体口腔和胃肠道中。该菌以其乳酸发酵能力而闻名,能代谢乳酸产生丙酸、CO2和H2。
下列菌群始终较少富集:
这些菌属具有抗炎、维护肠道屏障、产生短链脂肪酸等有益作用,其减少可能导致肠道功能紊乱和免疫失调。
Akkermansia muciniphila在后来被诊断患有自闭症或自闭症-多动症合并的婴儿中不存在,并且与儿童早期的胃肠道和情绪症状呈负相关。
Akkermansia muciniphila促进粘蛋白并产生叶酸,丙酸和乙酸;以增强肠细胞单层完整性和强化受损的肠道屏障而闻名;并具有免疫调节特性。
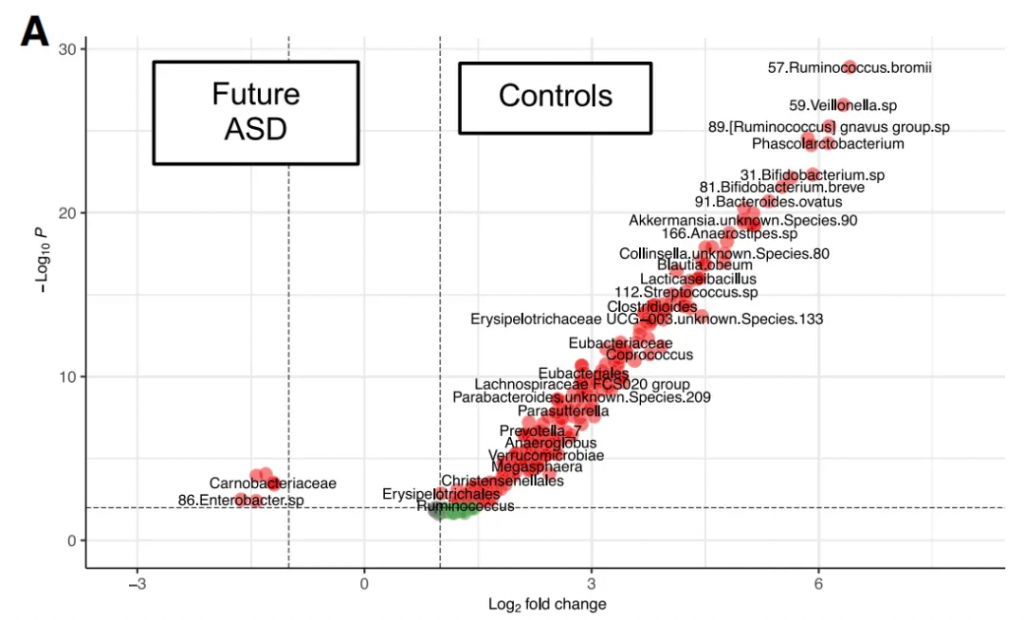
doi.org/10.1016/j.cell.2024.02.035
特定菌群:
与对照组(21.7%)相比,两种Klebsiella michiganensis菌株(HCXXMCOL0180 和 HCXXMCOL0513)在自闭症儿童中更普遍(43.6%),携带这两种菌株的婴儿日后患自闭症的风险更高。
携带这两种菌株的对照组婴儿抗生素使用频率更高(27.1%),提示抗生素暴露可能促进了这些菌株的定植。
性别和诊断年龄影响:
菌群自闭症男童的肠道菌群组成可能因诊断年龄不同而异,如晚期诊断与Akkermansia muciniphila丰度增加相关,而这种模式在女童中并不明显,女童中一些Bacteroides菌株丰度升高。
而早期诊断男童,Enterobacteriaceae科一些菌属如Enterobacter、 Klebsiella丰度升高。
这提示自闭症的肠道菌群变化可能具有性别特异性,且随年龄和病程进展而动态变化。
代谢物异常与菌群相关:
粪便代谢组学分析显示,自闭症儿童的某些代谢物如酪氨酸、色氨酸(儿茶酚胺、血清素前体)、精氨酸、赖氨酸等氨基酸,亚油酸等脂肪酸以及维生素B6等水平异常。
注:关于氨基酸,脂肪酸等详细介绍与自闭症的关联详见后面章节。
精氨酸水平与Roseburia、Coprococcus、Akkermansia丰度呈正相关,提示菌群失调可能影响宿主氨基酸代谢。
色氨酸代谢产物:吲哚-3-乙酸盐(AhR激动剂)在自闭症组中升高,且与Ruminococcaceae和Lachnospiraceae科菌属丰度正相关。
其他的一些与自闭症相关菌群的研究结果:
多样性降低
一些菌群减少,包括:
一些菌群增多,包括:
下列菌群可作为3-6岁有胃肠道症状儿童自闭症的可靠生物标志物:
菌群代谢产物LPS→慢性炎症→血脑屏障损伤
研究表明,细菌脂多糖(LPS)会引发慢性低度系统性炎症或“代谢性内毒素血症”,在动物模型中,这被证明会损害包括血脑屏障(BBB)在内的屏障功能。实际上,出生期暴露于LPS引发的系统性炎症的小鼠表现出永久性的血脑屏障损伤和渗透性增加,且在青少年和成年期表现出行为改变。对自闭症患者而言,血脑屏障功能的永久性损害将只会加剧肠道微生物及异常代谢产物输出所带来的病理后果。
母亲妊娠期:LPS诱导的系统性炎症如何影响孩子神经发育,增加自闭症风险?
妊娠期由LPS诱导的系统性炎症可以改变后代的神经发育和脑功能。自闭症中的这种先天性或细胞介导的炎症反应,可能会因获得性免疫系统中明显的自身免疫成分而加剧。由系统性炎症或母体自身免疫疾病触发的自身抗体在妊娠期间产生,现在被怀疑在胎儿异常神经发育和受损的血脑屏障发展中起作用,并影响婴儿期的大脑功能,包括增加自闭症的风险。
肠道菌群失调诱导产生自身抗体,影响神经系统发育
在自闭症患者中,对叶酸、血清素和GABA受体的自身抗体水平,以及一些重要的免疫相关酶如转谷氨酰胺酶2的抗体水平也有所升高。尽管自身抗体生成的分子触发机制尚不完全了解,但有一个可能性是,对关键代谢物如神经递质受体的自身抗体可能是在血液中异常代谢物浓度、早期生活中的不当免疫教育或由肠道细菌模拟引导下由免疫系统产生的。
这样的“代谢组-炎症组”调控网络也在其他自身免疫性疾病中出现,包括1型糖尿病和炎症性肠病(IBD),并且似乎与肠道微生物群密切相关。
氨基酸代谢在神经传递相关代谢物的生物合成中扮演着重要角色,长期以来被怀疑在自闭症谱系障碍中发挥作用。
血液分析氨基酸变化
Glu:Gln比率升高
有许多研究报告称,自闭症患者的血液中谷氨酸与谷氨酰胺(Glu:Gln)的比率升高。
将谷氨酸转化为谷氨酰胺是大脑中处理氨废物的主要方式,这对于避免氨中毒和在突触中谷氨酸的过度积累以减少兴奋性毒性非常关键。因此,血液中Glu:Gln比率的升高可能表明自闭症患者大脑中的氨解毒和谷氨酸循环发自闭症生了变化,这会影响行为。
注:低纤维高蛋白饮食可能会使这种氨中毒恶化,因为这样的饮食会导致肠道中的蛋白水解微生物群发酵氨基酸,从而增加系统性氨贡献。饮食中氨基酸的微生物分解会影响哺乳动物体内氨基酸的可用性和循环,也可能产生生物活性化合物,如短链脂肪酸、支链脂肪酸和生物胺。
蛋氨酸
一项包括87项研究的自闭症氧化应激生物标志物的汇总荟萃分析发现,参与甲基化循环和硫酸盐转移途径的几种代谢物异常。
蛋氨酸在硫酸盐转移途径中利用半胱氨酸合成,该途径连接蛋氨酸和谷胱甘肽的生物合成,蛋氨酸显著降低(p < 0.001),异常甲基化会增加自闭症谱系症状的风险 。
瓜氨酸
有研究发现,自闭症儿童的瓜氨酸水平与刻板行为(ADOS-2 上的 RRB 评分)之间存在正相关,且具有统计学意义。瓜氨酸和氨的累积暴露是经典瓜氨酸血症(精氨琥珀酸合成酶缺乏症)患者认知功能较差的最可靠标志。
尿液代谢物分析氨基酸变化
色氨酸
色氨酸因与自闭症症状相关而闻名,它是血清素 (5-HT) 的前体,血清素是一种抑制性单胺类神经递质,一些研究报告色氨酸水平升高,而另一些研究报告色氨酸水平降低 。
关于色氨酸,详见我们之前的文章:
苏氨酸
有研究发现,自闭症组男孩的苏氨酸含量明显高于对照组男孩。5 岁以下自闭症儿童的尿液苏氨酸含量高于 5 岁以上儿童。苏氨酸属于天冬氨酸家族,是一种蛋白质氨基酸,其分解产生乙酰胆碱酯酶 A 和甘氨酸,促进各种生理过程和整体身体稳态 ,它也可以通过影响色氨酸进入大脑,间接影响5-羟色胺的合成。
脯氨酸
有研究发现,5 岁以下自闭症儿童的脯氨酸含量明显低于 5 岁以上儿童。
与 22q11.2 染色体缺失的 CMPT158 基因型相关的脯氨酸水平异常升高,会影响自闭症谱系症状的严重程度,尤其是影响面部情绪识别、行为和认知。
β-丙氨酸
β-丙氨酸,在肉类中常见的氨基酸,会抑制肠道细胞(如Caco-2细胞)对GABA的吸收。β-丙氨酸也可以在肠道内由白色念珠菌产生的丙酸和氨反应形成,尽管这些化合物也由肠道内的许多其他微生物产生。
HPHPA
有研究报告了一种稀有代谢物3-(3-羟基苯基)-3-羟基丙酸(HPHPA)的出现。HPHPA是梭菌属细菌特有的代谢产物,会耗尽大脑中的儿茶酚胺,导致自闭症症状。
HPHPA在患有艰难梭菌感染的个体中也有发现,并且在急性精神病发作的精神分裂症患者中甚至达到非常高的水平。
以上这些研究是基于血浆、尿液氨基酸变化,血液和尿液中的氨基酸(AA)水平受许多因素影响,包括从食物中吸收的氨基酸、氨基酸和蛋白质的降解、宿主蛋白质的分泌和在粪便中的排泄。这些氨基酸相对比例的改变也可能对它们参与的代谢途径的产物产生连锁反应,包括不同神经递质的生产或相对比例。
肠道菌群代谢分析氨基酸变化
大多数氨基酸来自饮食或由体内合成,但肠道微生物群也会影响饮食氨基酸的回收以及氨基酸的生产或分解。
目前,我们对参与氨基酸生物利用度和肠道微生物群体生物转化的微生物种类或代谢过程知之甚少,对于其对神经功能的可能影响了解更少,也不清楚不同食物和食物成分如何相互作用以调节肠道微生物群对氨基酸的摄取或代谢。
有早期体外研究显示,人类肠道微生物群对氨基酸的发酵受到低pH值和可发酵纤维/碳水化合物(抗性淀粉)存在的抑制。然而,目前不知道这种过程在体内如何转化,或在自闭症等疾病状态或抗生素治疗下如何变化。
谷禾肠道菌群健康检测数据库中有这样的案例,一起来看一下:
一名5岁自闭症男孩,检测结果,自闭症为中等风险,符合实际情况。
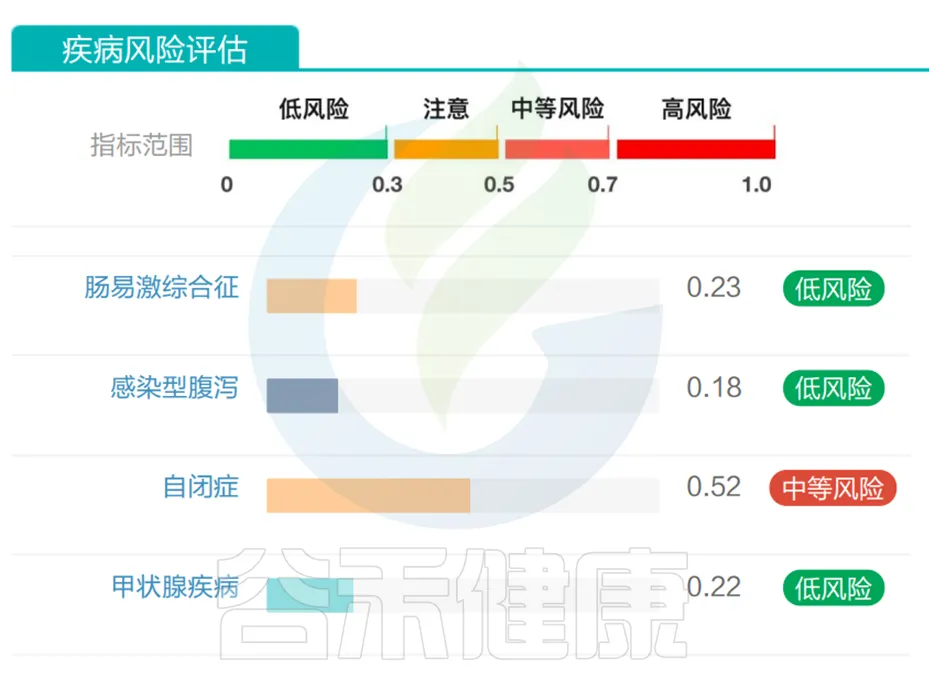
<来源:谷禾健康肠道菌群检测数据库>
这是谷禾利用几十万例的临床和人群样本数据(其中4895例自闭症患者),结合机器学习方法,使用肠道菌群数据进行疾病状态和风险的预测,并给出了的风险值。
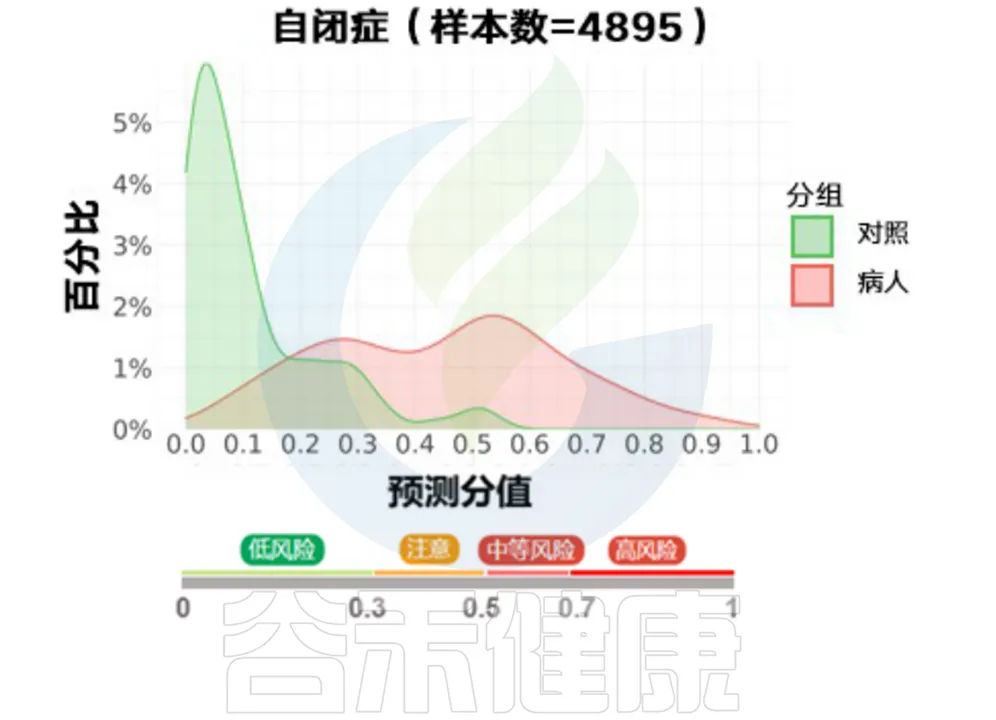
<来源:谷禾健康肠道菌群检测数据库>
从该患者肠道菌群检测报告可以看到,蛋白质,脂肪水平都相对偏低。
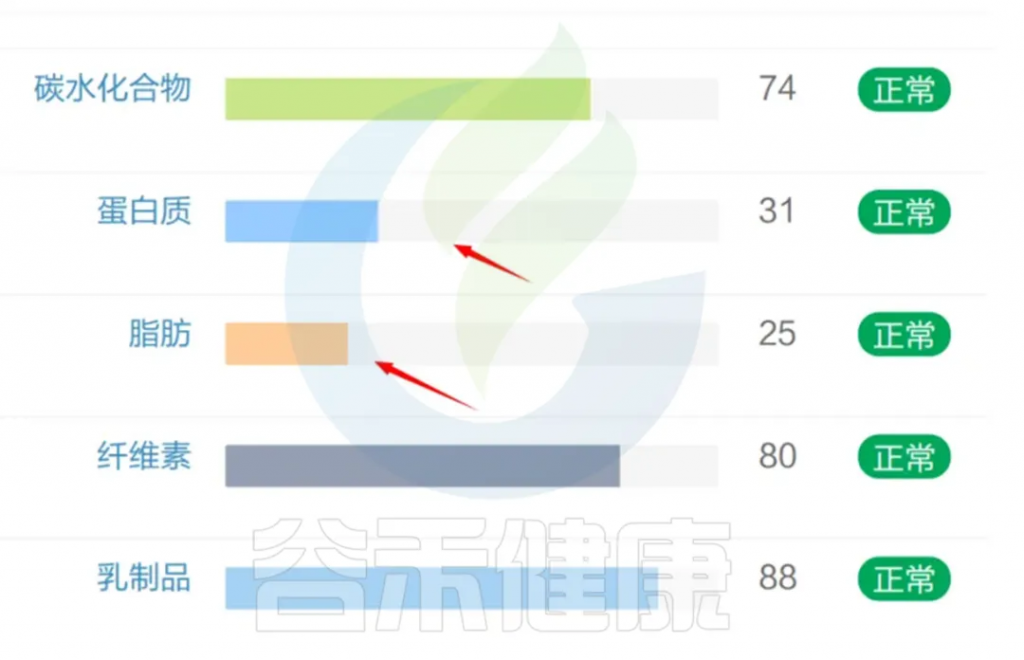
<来源:谷禾健康肠道菌群检测数据库>
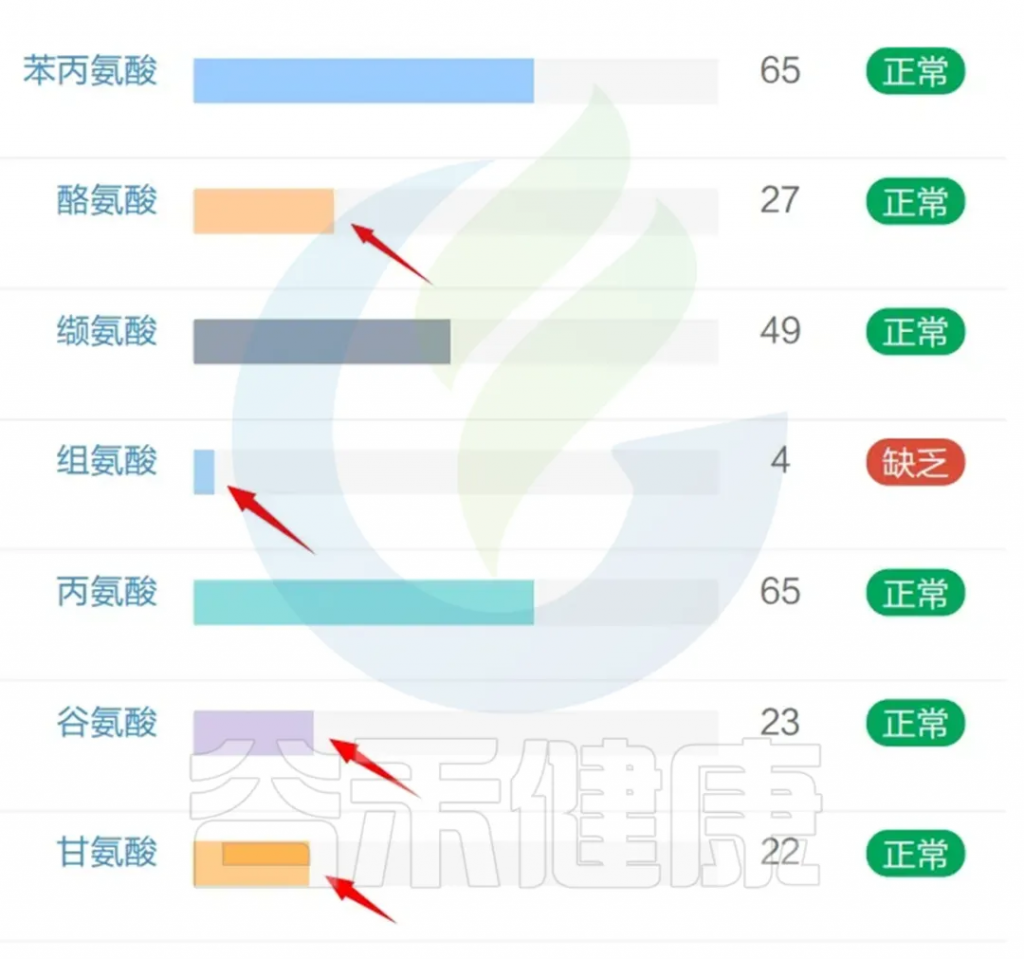
我们再来看肠道菌群检测报告中的氨基酸水平,部分氨基酸严重缺乏,例如组氨酸;
其他氨基酸如酪氨酸、谷氨酸、甘氨酸、亮氨酸、赖氨酸、蛋氨酸也都相对偏低。
酪氨酸是一种与认知功能相关的儿茶酚胺前体。
<来源:谷禾健康肠道菌群检测数据库>
组氨酸通过清除氧自由基发挥抗氧化作用,从而参与缓解氧化应激。组氨酸是肌肽的前体,肌肽是一种含有 β 丙氨酸和组氨酸的二肽,在人脑中起到缓冲剂和抗氧化剂的作用。肌肽可以调节与智力障碍相关的各种生物途径。
组氨酸是组胺的前体,而组胺是一种重要的神经递质和神经调节因子。关于组胺,详见之前的文章:
有小鼠研究显示,组氨酸缺乏的小鼠表现出一些类似自闭症的行为,如社交互动减少、刻板重复行为增多等。其他也有多项研究表明,组氨酸血症与自闭症和语言发育迟缓之间存在关联。
谷氨酸,可以调节记忆和学习等认知功能,而这些功能在自闭症患者中通常会受损,关于谷氨酸,详见谷禾之前的文章:
甘氨酸是一种具有抗炎、细胞保护和免疫调节特性的抑制性神经递质,甘氨酸以多种方式与线粒体代谢相关。
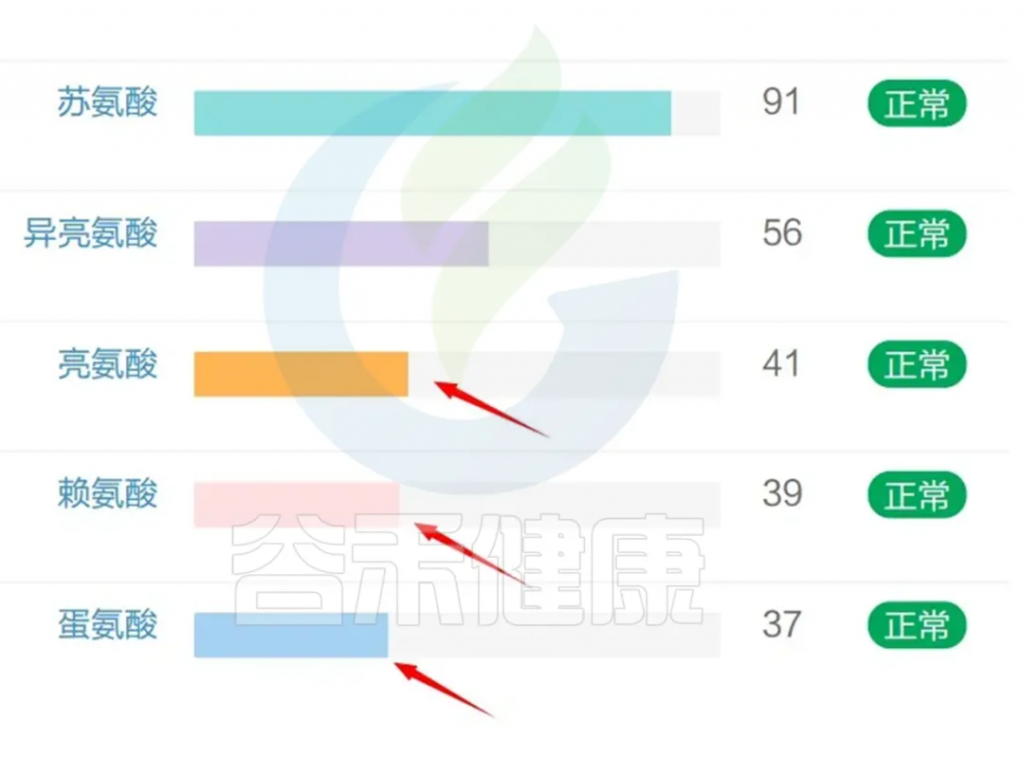
其他,赖氨酸,蛋氨酸,亮氨酸都属于人体必须氨基酸,是人体不能自行合成或以适合人体需要的速率合成的氨基酸,必须通过食物摄入来获取。
<来源:谷禾健康肠道菌群检测数据库>
亮氨酸,属于支链氨基酸,支链氨基酸生物合成与自闭症症状、甲基化潜力和细胞内 GSH 比率相关。支链氨基酸具有多种生理作用,包括调节葡萄糖和脂肪酸代谢以及调节重要的分子途径和促进蛋白质合成,它们通过琥珀酰辅酶 A 进入 CAC 与线粒体功能相连。大多数自闭症患者都会有线粒体功能障碍。
赖氨酸,是一种生酮氨基酸,通过合成谷氨酸作为其分解的副产物,参与肠道菌群-肠-脑轴。
经过几个月的干预,再次检测肠道菌群,该患者的自闭症风险有所下降,症状也有相应好转。

<来源:谷禾健康肠道菌群检测数据库>
未来患有自闭症的新生儿中关键脂质减少,如亚油酸、α-亚麻酸、胆汁酸、甘油三酯。
这些必需脂肪酸、它们的衍生物、相对比例和个体分子种类在许多哺乳动物的生理过程中起关键作用,包括磷脂生成、膜流动性和大脑发育。
亚油酸和α-亚麻酸
亚油酸和α-亚麻酸是哺乳动物不能自行合成的必需脂肪酸(EFA),必须通过饮食摄取。
注:亚油酸: LA,C18:2n-6,n-6脂肪酸的前体
α-亚麻酸: ALA,C18:3n-3,n-3脂肪酸的前体
它们对大脑具有抗炎作用,并调节自噬、神经传递和神经发生。它们通过抑制神经递质(例如GABA)的释放来调节内源性大麻素系统,从而影响突触功能和可塑性。
ARA、DHA、EPA
与其他身体组织相比,大脑中亚油酸和α-亚麻酸的浓度较低,而其衍生物,特别是ARA(花生四烯酸)和DHA(即二十二碳六烯酸)的浓度较高。
在妊娠晚期,胎儿大脑快速积累多不饱和脂肪酸,特别是DHA。
亚油酸和α-亚麻酸的衍生物可以进一步被宿主磷脂酶修饰,转化为主要来自ARA的二十碳烷类,如前列腺素、白三烯和血栓素。这些二十碳烷是促炎分子,作为局部激素来激活免疫细胞、启动血小板聚集和引发分娩。
相反,DHA和EPA可以进一步转化为抗炎的消退素(resolvins)和保护素(protectins)。
胆汁酸
关于胆汁酸,UDCA,熊去氧胆酸,一种天然存在的次级胆汁酸,在代谢性疾病、自身免疫性疾病、慢性炎症性疾病和神经病理学等疾病中显示出治疗前景。研究发现,UDCA在未来自闭症患者中较低。
ARA加DHA改善自闭症
一项双盲、安慰剂对照随机试验发现膳食补充ARA加DHA(ARA占优势)显著改善了自闭症患者(n=13)在异常行为检查表-社区量表测量的社交退缩和社交回应量表测量的沟通情况。虽然样本量较小,但这个研究证明了通过饮食调节大脑脂肪酸谱可能带来的好处,这种脂肪酸调节在动物研究中也可以通过益生菌达到。
n-3和n-6脂肪酸
一些小规模的n-3和n-6脂肪酸的膳食干预研究显示,自闭症患者的症状有所缓解,虽然并非所有研究都显示有改善。
自闭症患者可能与母乳喂养较少有关
自闭症和精神分裂症患者较少接受母乳喂养,而健康对照组则较多,这表明富含ARA、EPA和DHA的人类母乳对婴儿大脑发育的最佳饮食份额的重要性。相反,早期断奶与自闭症风险增加相关。这些观察结果不仅强调了早期产后饮食对大脑发育和自闭症风险的重要性,还暗示了肠脑轴和肠道微生物群在这一发育过程中的可能早期作用。
补充益生菌,改变脂肪酸
一些肠道微生物,最著名的是某些乳酸菌属和双歧杆菌属的菌种,具备进行脂肪酸生物氢化所需的酶,从而增加脂肪酸的不饱和度。
研究表明,饮食补充α-亚麻酸(ALA)会改变小鼠肝脏、脂肪组织和大脑中的脂肪酸谱,并且在联合补充α-亚麻酸与益生菌Bifidobacterium breve NCIMB 702258时,脂肪酸谱会进一步改变。
注:B. breve NCIMB 702258是高效生产共轭亚油酸(CLA)的菌。
相比于对照组喂养或单独补充α-亚麻酸的情况,食用n-3脂肪酸加益生菌的动物其大脑中的DHA水平升高,而ARA水平下降。
同一组作者随后表明,单独使用B. breve NCIMB 702258菌株,相比于另一种共轭亚油酸(CLA)产生的B. breve菌株和对照组,小鼠的大脑中DHA和ARA的水平也有所上升,证实了益生菌调节大脑脂肪酸谱的能力,并显示这种活动具有明显的菌株特异性。
LA和ALA不够,其他饱和脂肪酸来凑
尽管亚油酸(LA)和α-亚麻酸(ALA)是磷脂形成所必需的必需脂肪酸,但当饮食中这些脂肪酸含量偏低时,其他脂肪如饱和脂肪酸有时可作为替代品,从而对最终磷脂的结构和可能的功能产生影响。
磷脂代谢异常、脂肪酸缺乏或血脂异常已牵涉到多种神经和大脑发育或退行性疾病,包括精神分裂症、注意力缺陷多动障碍(ADHD)、抑郁症、广泛性发育障碍、发育性协调障碍、癫痫、双相情感障碍、阿尔茨海默病、帕金森病、尼曼-皮克病、亨廷顿舞蹈病、中风。
胆固醇代谢和磷脂代谢异常在自闭症中起作用
自闭症患者血液中磷脂酶A2水平较高,细胞膜中的ARA和DHA水平较低,并且可能具有更高的n-6脂肪酸与n-3脂肪酸的比例。
与健康对照组相比,自闭症儿童(n=16)的红细胞脂质谱被修改,表现为较低的胆固醇水平和细胞膜中单唾液四己糖神经节苷脂(GM1)的比例较高。研究人员认为这可能反映了更普遍的胆固醇合成缺陷,在大脑中,结合GM1表达的变化,可能会促成自闭症的病理生理机制。
BDNF对突触传递和神经元胆固醇合成的影响
自闭症与BDNF和益生菌的关联
然而,并非所有益生菌研究都显示BDNF与实验动物观察到的脑功能改善有关。
益生菌、益生元与改善脑功能
然而,需要在人类受试者和相关实验模型中进行基础研究,以验证这些假设的有效性并在机制上将肠道细菌与这些病情联系起来。
大脑占人体质量约2%,但却占胆固醇约20%。血脑屏障(BBB)对脂蛋白是不可通透的,这意味着大脑所需的胆固醇是内源性形成的。
其中星形胶质细胞和神经元分别是胆固醇的净生产者和使用者,体现了胆固醇生物合成机制的独特分区化。
神经元——胆固醇的使用者
神经元需要大量的胆固醇来维持其广泛的膜表面积并提供突触前囊泡的形成。它们还有稍微不同的酶途径,将鲨烯转化为胆固醇。出生后的胆固醇主要由星形胶质细胞提供,并优先来源于乙酸盐。
注:鲨烯(C30H50)是一种多不饱和烃类,也称为角鲨烯或三十碳六烯。 它是一种在人体胆固醇合成等代谢过程中产生的萜类化合物。鲨烯在自然界中广泛存在,尤其是在鲨鱼肝油中含量较高,同时也是橄榄油、米糠油等少数几种植物油中的成分。具有良好的生物活性,在食品、化妆品、保健品等领域广泛应用。
星形胶质细胞——胆固醇的净生产者
星形胶质细胞是包裹神经细胞的细胞,负责供应细胞外钾、谷氨酸、能量和抗氧化剂,并调节大脑中的活性依赖性血流,并可能影响突触活动。
星形胶质细胞在大脑胆固醇运输中的关键作用
ApoE缺乏的啮齿动物模型,表现出各种行为和神经系统症状,并在感觉系统中也有缺陷,这些缺陷与随年龄增长而丧失的突触和树突,突触膜胆固醇分布的改变有关。
CYP46,在维持大脑胆固醇稳态中的作用
短链脂肪酸——乙酸,对神经发育的作用
出生后乙酸在神经发育中重要,母乳喂养乙酸多
AceCS1的表达及其功能
乙酸是胆固醇的组成成分
乙酸的代谢去向
乙酸作为特殊代谢产物的重要性
NAA——乙酸的主要来源之一
N-乙酰天冬氨酸(NAA)在大脑中的作用
自闭症儿童大脑中NAA浓度降低
短链脂肪酸——丙酸,对大脑的负面影响
饮食如何影响大脑中短链脂肪酸的可用性?
自闭症中二糖酶和己糖转运蛋白减少
研究发现,在自闭症儿童中,二糖酶和己糖转运蛋白的表达显著减少,这些变化与肠道微生物群组成的变化相关。这些变化与厚壁菌门相对丰度较高,拟杆菌门较少,以及β-变形菌门升高有关。
注:至少是三种常见肠道二糖酶之一:蔗糖酶-异麦芽糖酶(SI)、麦芽糖酶-异麦芽糖酶(MGAM)、乳糖酶(LCT)
己糖转运蛋白:SGLT1、GLUT2
肠道二糖酶和糖转运蛋白的表达受到多种因素的调控,包括饮食、肠道微生物以及肠神经系统等。
丁酸:结肠健康的关键能量源与吸收机制
考虑到丁酸是结肠细胞的首选能量来源、黏膜更新和分化的介质,以及其生产率在早期肠道微生物群继发发育过程中发生变化,丁酸在肠黏膜成熟中的作用可能非常重要。
丁酸吸收机制:MCT1负责运输,GPR109A助攻
在了解了丁酸在肠黏膜中的重要性及其吸收机制之后,我们再探讨不同饮食和环境因素对MCT1表达的影响及其对丁酸和其他短链脂肪酸吸收的调节作用。
饮食影响短链脂肪酸(丁酸)吸收的机制
高纤维饮食和益生元→MCT1表达和短链脂肪酸吸收↑
高脂肪饮食→抑制短链脂肪酸在结肠中的吸收
肠道炎症和氧化应激→MCT1表达↓→丁酸吸收↓
以上我们知道,MCT1表达异常会影响丁酸吸收,不仅如此,MCT1表达异常还可能与肥胖相关的神经系统疾病有关。
在饮食诱导和遗传性肥胖动物中,MCT1-4 表达都增加,特别是在神经元和神经元胞体中,说明这种变化可能不全是饮食因素,也可能是由于肥胖引起的激素变化间接导致的。
前面我们知道,MCT与短链脂肪酸转运相关,那么MCT表达异常,短链脂肪酸也异常,可能会影响大脑的能量代谢,如果这些变化发生在生命早期,可能会影响神经系统的发育过程,并与个体成年后的肥胖易感性相关。
注:从母乳到固体食物的饮食结构转换可能会影响生理发育、代谢途径和营养转运蛋白(如MCT)的表达,从而对大脑功能产生重要影响。
谷禾发表在 GUT上的队列也表明,随着断奶或引入辅食,自闭症儿童的肠道菌群发育轨迹逐渐偏离健康儿童。如下:
doi: 10.1136/gutjnl-2021-325115.
不良饮食,尤其是在断奶后采用现代西式饮食,实际上可能通过将营养素转运蛋白关闭,重定向营养流向,从而下调了必需营养素(如氨基酸、脂肪和SCFA)的肠道流动。
对比现代西式饮食和古老传统的饮食,有助于重新定义营养不良的范式。营养不良不再仅限于某些必需营养素的缺乏,还包括营养过剩和异常的营养素比例和结构。

在人类“超级有机体”中,这种改变的营养环境的代谢后果,最明显地体现在肠道微生物群与宿主能量代谢和大脑功能的相互作用中。
生命早期:母乳喂养
前面我们了解到,早期断奶与自闭症风险增加相关。很多自闭症患者较少接受母乳喂养,这表明母乳中含有ARA、EPA和DHA,是婴儿大脑发育的最佳饮食。
随着年龄增长:其他饮食
多酚及其代谢物
现有的研究确认了流行病学数据,表明多酚及其代谢物可能有助于促进大脑健康。提出的作用机制包括抗氧化活动、改善血管功能和脑部血流、直接增强神经元信号传递、缓冲钙离子、增强神经保护性应激蛋白和减少应激信号。
线粒体功能障碍在自闭症谱系障碍、神经退行性疾病和一般脑老化的发病机制中得到了关注。线粒体常被认为是氧化应激的启动者和目标,植物多酚代谢物可能具有保护作用。
体外研究在生理相关剂量下测试了选定多酚代谢物对高级糖化终产物形成的抑制能力以及对人类神经元细胞中轻度氧化应激的对抗能力。例如:
药用植物的多酚提取物
少数研究探讨了来自药用植物的多酚提取物对自闭症动物模型的影响,发现:
注:尚需确定这些高剂量植物提取物的抗氧化活性仅与减轻丙戊酸引起的氧化损伤相关,还是在氧化损伤可能只是一个影响因素的神经病理情况下更具广泛相关性。
——黄酮类化合物
肠道菌群对黄酮类化合物的吸收转化
估计有95%的膳食植物多酚在上肠道内无法消化和吸收,并最终到达结肠中的肠道微生物群。一些黄酮类糖苷进入结肠,被肠道菌群分解为更简单的代谢物,比如:
黄酮类化合物对肠道菌群的调节
膳食类黄酮调节肠道菌群改善自闭症
doi.org/10.1016/j.foodres.2024.114404
黄酮类化合物抗自闭症作用的实验研究


doi.org/10.1016/j.foodres.2024.114404
肥胖和不良饮食与抑郁症和自闭症谱系障碍发病率增加有关。同样,母亲的不良饮食(特别是高脂肪饮食),健康状况(特别是肥胖/代谢综合症),会影响胎儿和新生儿的大脑发育过程,从而增加焦虑、抑郁、注意力缺陷多动障碍(ADHD)和自闭症等神经系统疾病的风险。
神经内分泌系统,特别是下丘脑-垂体-肾上腺(HPA)轴,代表了肠道环境和中枢神经系统(CNS)之间的主要通信通道。
在动物模型中,使用各种益生菌微生物干预,既包括乳酸杆菌也包括双歧杆菌,已显示能够减轻标准动物应激挑战下的类似焦虑行为。
婴儿双歧杆菌
L. helveticus R0052 和 B. longum R0175
L. rhamnosus JB-1
脆弱拟杆菌NCTC 9343
注:脆弱拟杆菌是一个比较复杂的菌种,里面既有潜在的益生菌株,也有致病的病原菌株,具体可以查看我们以前文章:
益生元
最近的研究表明,饮食中补充益生元发酵纤维,可以选择性地刺激对人体有益的肠道细菌,如双歧杆菌,从而对大脑产生重要变化。
实验动物在摄入果寡糖(FOS)或半乳寡糖(GOS)后,海马中的BDNF和N-甲基-d-天冬氨酸受体(NMDARs)亚基NR1的表达增加,并且GOS似乎通过诱导肠道激素PYY来介导这一过程。FOS和GOS都能够上调肠道微生物群中短链脂肪酸的产生,特别是乙酸和丁酸,同时增加肠道双歧杆菌的相对丰度。
L-肌肽
胆固醇或DHA
从模拟人类婴儿营养的猪仔研究中,发现婴儿配方奶粉中的胆固醇补充会改变大脑中的氨基酸谱,降低谷氨酸、丝氨酸、谷氨酰胺、苏氨酸、β-丙氨酸、丙氨酸、蛋氨酸、异亮氨酸、亮氨酸和γ-氨基丁酸的浓度,同时增加甘氨酸和赖氨酸的浓度。
二十二碳六烯酸(DHA)也有类似的效果,但会降低牛磺酸水平,对异亮氨酸和赖氨酸没有影响。胆固醇或DHA膳食补充剂也会影响猪仔肝脏、肌肉和血浆中的氨基酸水平。DHA还会减少肌肉和大脑中的肌肽和氨的含量。
这些观察结果确实对食物选择或家庭饮食对营养可用性和代谢的影响有重要启示,进而影响早期儿童的大脑发育和功能,当然还需在人类队列中进一步研究其潜在机制。
药物
对自闭症儿童每周使用万古霉素治疗,可显著改善神经行为和胃肠道症状。
粪菌移植
一项开放标签研究对18名自闭症儿童进行了粪菌移植(每日口服8周),结果表明移植后其胃肠道症状和自闭症核心症状评分均有所改善。
移植后8周,受试者的肠道菌群多样性增加,厚壁菌门丰度下降,拟杆菌门和变形菌门丰度上升。
随访2年后,受试者的部分症状改善仍然维持。这提示通过重建肠道菌群可能成为干预自闭症的新策略。
关于粪菌移植,仍需更多深入研究。
自闭症谱系障碍 (ASD) 是一组神经发育疾病,一般在 3 岁之前发病,目前的发病率在全世界逐渐升高,与多种因素有关,其中饮食会影响和塑造肠道微生物群,孕期和幼儿期似乎是一个关键时期,尤其从哺乳/配方奶→断奶→成人“家庭”饮食的过渡过程中饮食和环境暴露影响较大。
人类微生物组对宿主代谢过程和膳食化合物加工的核心贡献,许多营养物质和摄入的化学物质必须经过肠道及肠道微生物,转化为生物可利用和活跃的中间产物,然后通过肝门静脉被吸收并在全身分布。
研究表明,大部分自闭症患者的肠道菌群异常,这可能与饮食习惯、抗生素使用等因素有关。同时,自闭症患者某些氨基酸水平也存在异常。
饮食作为塑造肠道微生物群的重要因素,可能在自闭症的发病中扮演重要角色。优化孕期和幼儿期的饮食结构,如母乳喂养、合理添加辅食、避免过多加工食品和添加剂等,有助于维持肠道菌群平衡,从而有助于大脑健康。
针对自闭症患者的饮食干预,如补充益生元、益生菌,调整膳食纤维和蛋白质比例等,可能对改善部分症状有一定帮助。但由于自闭症的高度异质性,饮食干预的效果可能因人而异,还需要更多的结合个体化健康信息及相应症状进行个性化指导和干预。
此外,幼儿早期尤其6-12个月能够更早判别出自闭症风险,对于神经发育的改善和行为的扭转非常重要,希望临床上与相关机构能够合作共同推进自闭症的研究和个性化干预。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Lou M, Cao A, Jin C, Mi K, Xiong X, Zeng Z, Pan X, Qie J, Qiu S, Niu Y, Liang H, Liu Y, Chen L, Liu Z, Zhao Q, Qiu X, Jin Y, Sheng X, Hu Z, Jin G, Liu J, Liu X, Wang Y. Deviated and early unsustainable stunted development of gut microbiota in children with autism spectrum disorder. Gut. 2022 Aug;71(8):1588-1599.
Ahrens A P, Hyötyläinen T, Petrone J R, et al. Infant microbes and metabolites point to childhood neurodevelopmental disorders[J]. Cell, 2024, 187(8): 1853-1873. e15.
Chen, WX., Chen, YR., Peng, MZ. et al. Plasma Amino Acid Profile in Children with Autism Spectrum Disorder in Southern China: Analysis of 110 Cases. J Autism Dev Disord 54, 1567–1581 (2024).
Chang, X., Zhang, Y., Chen, X. et al. Gut microbiome and serum amino acid metabolome alterations in autism spectrum disorder. Sci Rep 14, 4037 (2024).
Kieran M. Tuohy, Paola Venuti, Simone Cuva, et al, Chapter 15 – Diet and the Gut Microbiota – How the Gut: Brain Axis Impacts on Autism, 2015, Pages 225-245, American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders (4th ed.), American Psychiatric Association, Washington DC (1994)
Anastasescu, C.M.; Gheorman, V.; Popescu, F.; Stoicănescu, E.-C.; Gheorman, V.; Riza, A.-L.; Badea, O.; Streață, I.; Militaru, F.; Udriștoiu, I. Serum Amino Acid Profiling in Children with Autistic Spectrum Disorder: Insights from a Single-Center Study in Southern Romania. Healthcare 2023, 11, 2487
V. Hughes. Epidemiology: complex, disorder, Nature, 491 (2012), pp. S2-S3
S. Baron-Cohen, F.J. Scott, C. Allison, et al., Prevalence of autism-spectrum conditions: UK school-based population study. Br J Psychiatry, 194 (2009), pp. 500-509
T.S. Brugha, S. McManus, J. Bankart, et al., Epidemiology of autism spectrum disorders in adults in the community in England Arch Gen Psychiatry, 68 (2011), pp. 459-466
B.S. Abrahams, D.H. Geschwind., Advances in autism genetics: On the threshold of a new neurobiology, Nat Rev Genet, 9 (2008), pp. 341-355
Brister, D.; Rose, S.; Delhey, L.; Tippett, M.; **, Y.; Gu, H.; Frye, R.E. Metabolomic Signatures of Autism Spectrum Disorder. J. Pers. Med. 2022, 12, 1727.
S. Ozonoff, B.J. Williams, R. Landa, Parental report of the early development of children with regressive autism: The delays-plus-regression phenotype, Autism, 9 (2005), pp. 461-486
S. Ozonoff, G.S. Young, M.B. Steinfeld, et al., How early do parent concerns predict later autism diagnosis?
J Dev Behav Pediatr, 30 (2009), pp. 367-375
G. Esposito, P. Venuti, Symmetry in infancy: Analysis of motor development in autism spectrum., disorders, Symmetry, 1 (2009), pp. 215-225
Zhao Y, Wang Y, Meng F, Chen X, Chang T, Huang H, He F, Zheng Y. Altered Gut Microbiota as Potential Biomarkers for Autism Spectrum Disorder in Early Childhood. Neuroscience. 2023 Jul 15;523:118-131.
G. Esposito, P. Venuti, F. Apicella, F. Muratori, Analysis of unsupported gait in toddlers with autism, Brain and Development, 33 (2011), pp. 367-373
F. Happé, A. Ronald, R. Plomin, Time to give up on a single explanation for autism, Nat Neurosci, 9 (2006), pp. 1218-1220
T. Charman, C.R.G. Jones, A. Pickles, E. Simonoff, G. Baird, F. Happé, Defining the cognitive phenotype of autism, Brain Res, 1380 (2011), pp. 10-21
P. Krakowiak, C.K. Walker, A.A. Bremer, et al.,Maternal metabolic conditions and risk for autism and other neurodevelopmental disorders,Pediatrics, 129 (2012), pp. e1121-e1128
J.A. Hollway, M.G. Aman Pharmacological treatment of sleep disturbance in developmental disabilities: a review of the literature,Res Dev Disabil, 32 (2011), pp. 939-962
Shen L, Liu X, Zhang H, Lin J, Feng C, Iqbal J. Biomarkers in autism spectrum disorders: Current progress. Clin Chim Acta. 2020 Mar;502:41-54.
C.A. Molloy, P. Manning-Courtney,Prevalence of chronic gastrointestinal symptoms in children with autism and autistic spectrum disorders, Autism, 7 (2003), pp. 165-171
D.V. Keen , Childhood autism, feeding problems and failure to thrive in early infancy: Seven case studies, Eur Child Adolesc Psychiatr, 17 (2008), pp. 209-216
L.G. Bandini, S.E. Anderson, C. Curtin, et al., Food selectivity in children with autism spectrum disorders and typically developing children, J Pediatr, 157 (2010), pp. 259-264
S.A. Cermak, C. Curtin, L.G. Bandini, Food selectivity and sensory sensitivity in children with autism spectrum disorders, J Am Diet Assoc, 110 (2010), pp. 238-246
Y. Martins, R.L. Young, D.C. Robson, Feeding and eating behaviors in children with autism and typically developing children, J Autism Dev Disord, 38 (2008), pp. 1878-1887, View at publisher
E. Cornish, A balanced approach towards healthy eating in autism, J Hum Nutr Diet, 11 (1998), pp. 501-509
P. Whiteley, J. Rodgers, D. Savery, P. Shattock, A gluten-free diet as an intervention for autism and associated spectrum disorders: Preliminary findings, Autism, 3 (1999), pp. 45-65
K. Fitzgerald, M. Hyman, K. Swift, Autism spectrum disorders, Glob Adv Health Med, 1 (2012), pp. 62-74
E. Courchesne, K. Campbell, S. Solso, Brain growth across the life span in autism: age-specific changes in anatomical pathology, Brain Res, 1380 (2011), pp. 138-145
M. Rutter, Aetiology of autism: findings and questions, J Intell Disabil Res, 49 (2005), pp. 231-238, View at publisher
J.J. Michaelson, Y. Shi, M. Gujral, et al.
Whole-genome sequencing in autism identifies hot spots for de novo germline mutation, Cell, 151 (2012), pp. 1431-1442
B.N. Vardarajan, A. Eran, J.Y. Jung, L.M. Kunkel, D.P. Wall, Haplotype structure enables prioritization of common markers and candidate genes in autism spectrum disorder
Transl Psychiatry, 3 (2013), p. e262
Yu X, Qian-Qian L, Cong Y, Xiao-Bing Z, Hong-Zhu D. Reduction of essential amino acid levels and sex-specific alterations in serum amino acid concentration profiles in children with autism spectrum disorder. Psychiatry Res. 2021 Mar;297:113675.
J. Veenstra-Vanderweele, R.D. Blakely
Networking in autism: Leveraging genetic, biomarker and model system findings in the search for new treatments, Neuropsychopharmacol, 37 (2012), pp. 196-212
K.T.E. Kleijer, M.J. Schmeisser, D.D. Krueger, et al. Neurobiology of autism gene products: towards pathogenesis and drug targets, Psychopharmacology (Berl), 231 (6) (2014), pp. 1037-1062
Li H, Dang Y, Yan Y. Serum interleukin-17 A and homocysteine levels in children with autism. BMC Neurosci. 2024 Mar 12;25(1):17.

谷禾健康

抗生素耐药性是当下和未来几十年人类健康将面临的重要挑战之一。从2000年到2015年,抗菌药物的普及导致人类抗生素消耗量增加了约65%,2015年后这个数据还在增加。最明显的后果是抗生素耐药性的增多,这使得近年来常见的感染难以治疗。
最近,由于担心出现更难治疗的肠道感染和其他感染,以及耐药病原体可能传播给更脆弱的人群(如小孩和老人),人们对使用抗生素进行严格管理和开展精准用药算是迈开了第一步。
抗生素的使用经常产生脱靶效应,这意味着抗生素的使用浓度所引发的抗菌作用超出了消除影响病原菌的作用。下一代靶向测序已证明抗生素会导致肠道细菌生物量、分类多样性和功能多样性减少。
除了耐药性之外,抗生素未能清除感染的原因还有多种。感染灶中药物的药代动力学较差或生物膜(下期专门讲)等受保护的生态位中细菌的持续存在会导致治疗失败。
此外,在感染过程中,一些细菌(持续存在)可能会由于进入抗生素持久性状态而在药物治疗后达到致命的浓度。然后会引起长期和反复感染,导致最终治疗失败。
感染期间抗生素的持久性涉及持久性在宿主免疫反应和药物的联合作用下生存的能力。病原体已经进化出多种方式来击败宿主的免疫反应,并且它们的毒力因子已经被仔细研究了几十年。然而,细菌通过持久性抵抗抗生素暴露的能力仍然更加难以捉摸。
虽然抗生素暴露对病原体清除的正向影响有利于宿主健康,但抗生素暴露对肠道微生物组组成和功能的脱靶影响可能会对宿主健康产生有害或有益的影响,具体取决于初始成分和原生微生物群落的功能。
预测抗生素耐药性进化轨迹以及耐药风险的能力对于调整抗生素的给药方案以最大限度地延长其使用寿命具有重要价值。
本文将讨论抗生素持久性以及微生物持久性形成在感染中的重要性,了解肠道微生物群如何对抗生素扰动做出反应以及对特别人群的影响、影响抗生素暴露对微生物群影响的因素、抗生素引起的微生物群改变的潜在健康结果以及有可能改善这些问题的策略。
抗生素持久性领域仍处于起步阶段;然而,关于定义的争议和讨论已经模糊了关键概念及其各自的重要性。在这里,采用的定义和说明与最近几十个研究小组的文章一致。
Gollan B,et al.Annu Rev Microbiol.2019
确定的定义主要集中在体外研究的细菌上,并以最小抑制浓度(MIC——明显抑制细菌生长的药物最低浓度)和杀死99%数量细菌所需的最少时间(MDK99)的测量为中心。
尽管这些测量对于区分允许细菌在实验室培养物中暴露于抗生素后存活的不同现象非常有价值,但它们在感染模型中的工作中难以进行。
因此,研究者们更多地关注不同概念的描述性定义。重要的是,一些导致抗生素暴露存活率增加的细菌行为(即抗生素持久性和表型耐药性)涉及复制群体内的表型异质性,因此最好通过群体和单细胞特征的组合来描述。
▼
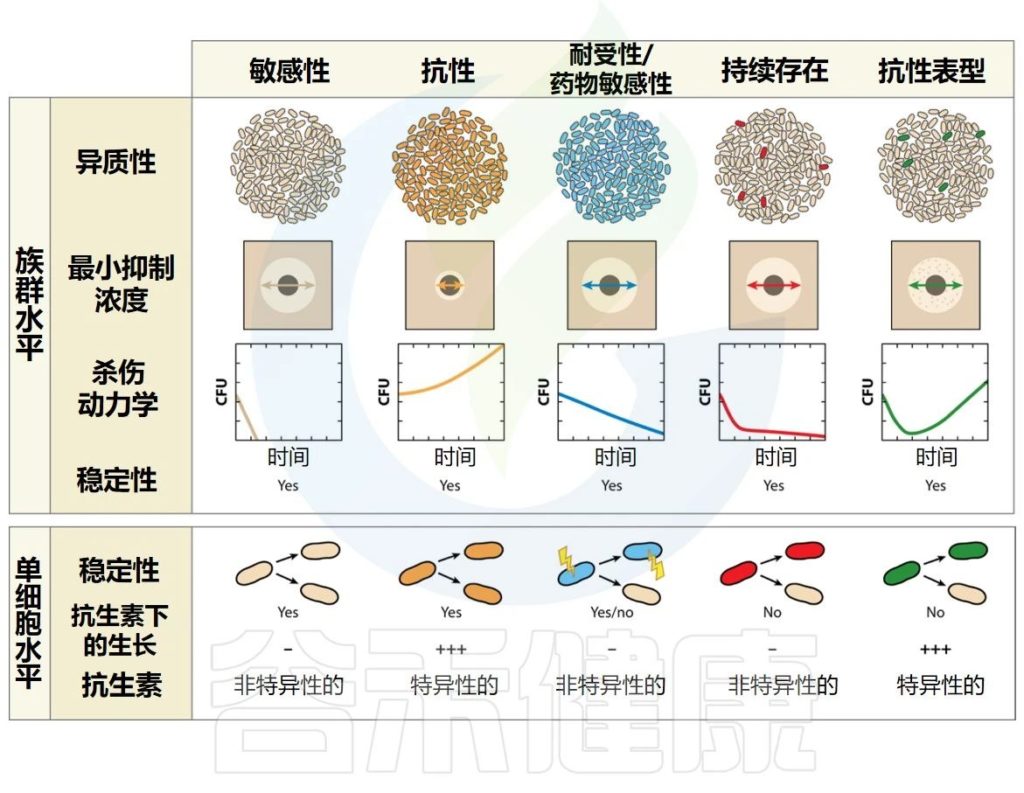
▸ 细菌的耐药性
当细菌能够在对同一物种的参考菌株致死的药物浓度下增殖时,细菌被认为对抗生素具有耐药性。
耐药性通常(但并非总是)特定于一种药物或一类药物,并且是由于非耐药亲本菌株的基因修饰(从头突变或通过水平基因转移获得)造成的。
遗传性状会代代相传
一旦获得,遗传性状就会代代相传。产生耐药性的主要原因是药物或药物靶点的输出或修改。在体外,可以通过测量增加的明显抑制细菌生长的药物的最低浓度。
▸ 群体的耐受性
当暴露于杀菌药物时,整个细菌群体可能表现出较低的杀灭率,因为群体的增长率因遗传或环境因素而降低。因此,与普通菌株相比,生长缓慢的细菌表现出相对的药物冷漠,这增加了种群在抗生素暴露下存活的时间。
从理论上讲,足够长的时间接触抗生素应该可以清除整个人群。营养缺陷型突变代表了这种耐受现象的一个极端例子。当环境条件发生变化允许恢复快速生长时,种群就会恢复到易感表型。在体外,可以通过测量杀死一定比例的群体的持续时间来量化耐受性。
▼
抗生素持久性和表型耐药性代表了抗生素存活方面的异质行为。“持久性”与“耐药性”一词指的是两个不同的概念,它们被认为是有联系的,但又是不同的。因此,它们不能互换使用。
▸ 感染持续存在
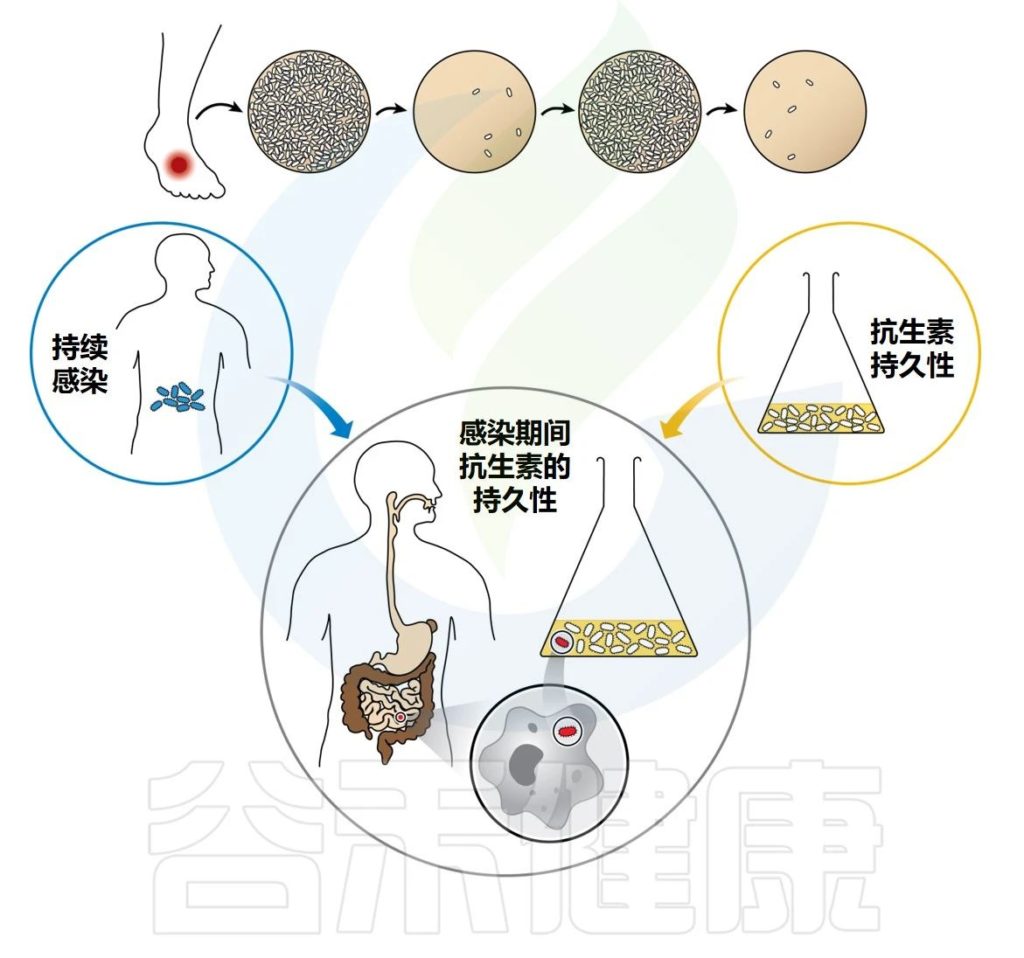
当病原体有能力在宿主体内停留较长时间时,无论宿主免疫反应如何或长期抗生素治疗如何,感染都会持续存在。
据信,持续感染至少部分依赖于感染人群的耐受性(或药物冷漠)以及抗生素的持久性,但这种联系仍然很脆弱。迄今为止,抗生素持久性领域主要忽视了持久性细菌在宿主体内生存的能力。
Gollan B,et al.Annu Rev Microbiol.2019
▸ 抗生素持久性
药物暴露后的这种异质群体行为是由于细菌亚群(持续存在)通过生长停滞、暴露于对其余群体致命的浓度的抗生素而得以生存的能力。
由于持续者是非定植者,因此他们的存在不会影响整个种群的MIC。在种群水平上,这种现象在几代群体中都是稳定的,这表明种群内的所有细菌都具有持续存在的遗传装备。
MIC——明显抑制细菌生长的药物最低浓度
抗生素持久性与压力有关
抗生素持久性很大程度上是由 “压力” 引发的,最好在压力缓解后进行评估,以免与耐受现象混淆。
事实上,与耐受人群相反,持久人群携带着压力暴露的记忆。由于现象的异质性,通常可能需要允许单细胞分析的工具来获取有意义的信息。
▸ 持续者
持续者是抗生素持久性种群中的个体,当暴露于对其他种群中的亲属致命的浓度的抗生素时,它们能够通过生长停滞而生存。
持久菌在药物中存活的能力是短暂的,并且持久菌后代是异质的,由易感细菌和持久菌组成。在体外,群体中存留菌的存在可以通过双相杀伤曲线来揭示,该曲线显示存活率与时间的关系,其中易感细菌被快速杀死,存留菌存活时间更长。
▼
表型耐药性是在药物暴露时可能发生的另一种异质行为,这是由于细菌亚群(耐药性)在抗生素浓度达到对其余菌群致命的情况下能够增殖的能力。
整个群体的最小抑制浓度与易感菌株相当
由于群体主要由易感细菌组成,因此整个群体的MIC(明显抑制细菌生长的药物最低浓度)与易感菌株的MIC相当。在种群水平上,这种现象在几代菌中都是稳定的,这表明种群中的所有细菌都具有抵抗力的遗传装备。
▸ 休眠
休眠是一个用于定义一系列特征的术语,从缺乏任何可测量的细胞活性到生长停滞。在这篇文章中,我们用它来表示缺乏活性。
从体内感染模型中积累的新证据强调了持续感染者在持续感染中的重要性。持续感染者在感染复发中的潜在作用是对其进行研究的重要原因。
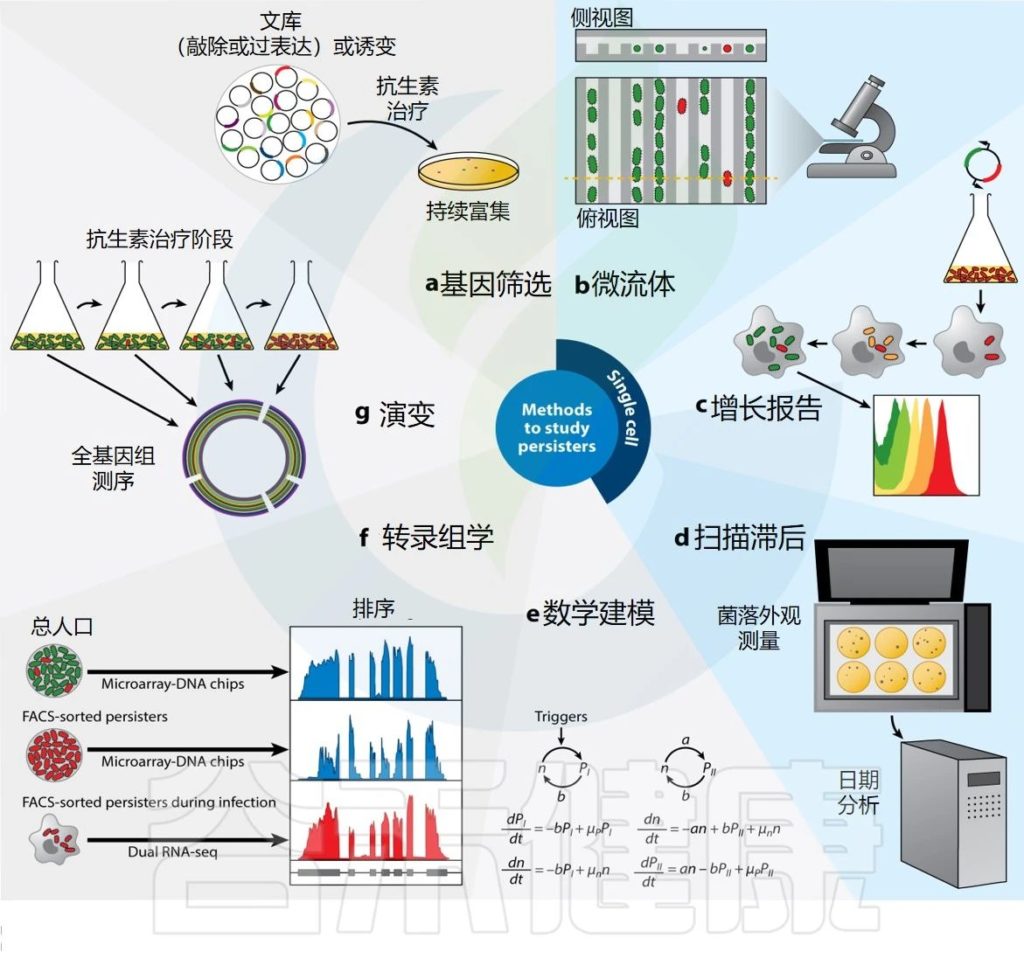
★ 开发研究持久性的技术
由于这种生理状态的短暂性和可逆性,以及相对稀有的残留物可以产生少量的生物材料,研究抗生素残留物具有挑战性。
长期以来,最常见的方法是从基因或环境角度操纵细菌种群,并测量其对持久性水平的影响。虽然这使得能够识别涉及调节群体中持续者水平的压力和途径,但近年来通过建立能够跟踪、收集和分析持续者的方法,取得了重要突破(下图)。
Gollan B,et al.Annu Rev Microbiol.2019
很快,人们就清楚地意识到重点应该放在单细胞研究上,因为持久性细菌只是细菌种群的一小部分。微流体装置与显微镜和流式细胞术相结合的使用成为一种选择技术。微流体背后的基本原理是分离单个细菌,以便使用延时显微镜来跟踪个体随时间的行为,以检查持久细胞的历史。
然而,微流体带来的对单个细菌的直接可视化和跟踪的能力受到可同时评估的细胞数量有限的阻碍。因此,流式细胞术提供了一种替代方法,允许以高通量方式进行单细胞分析,并通过荧光报告基因的发展,增强对感兴趣细胞进行分选的能力。
因此提出休眠(代谢活动的缺乏)对于进入持久性既不是必要的,也不是充分的。第一个开发荧光稀释技术来在单细胞水平上追踪细菌分裂的人。这种方法类似于免疫学家用来追踪T细胞增殖的羧基荧光素琥珀酰亚胺酯 (CFSE) 染色。
高通量下一代测序技术的兴起,随着生物信息学分析的改进和此类平台的可访问性的增加,也为持久化领域带来了视野。
最后,除了用于跟踪持久者的实验室技术之外,数学模型还允许对持久者行为进行计算机预测。例如,已经建立了一些模型来重点了解单细胞水平上持久物形成的分子机制。
▼
许多病原菌在宿主组织内建立持续感染,避免被免疫系统和抗生素清除。细菌感染通常会导致宿主产生先天免疫反应,然后产生适应性免疫反应,这通常足以清除感染。然而,许多病原体已经进化出复杂的生存机制来逃避免疫反应并建立持续感染。
// 急性结核感染
急性结核感染是细菌躲避免疫系统且相对难以治疗的典型例子,导致需要长时间的抗生素治疗才能治愈感染。
然而,分枝杆菌感染有时只能部分清除,并且10%的患者在其一生中会出现复发。复发不仅出现在结核病中。5%至10%的患者会出现伤寒复发。
// 其他感染
尿路致病性大肠杆菌引起的尿路感染(UTI)后,20%至30%的女性会再次出现症状;许多其他细菌感染在治疗后往往会复发。
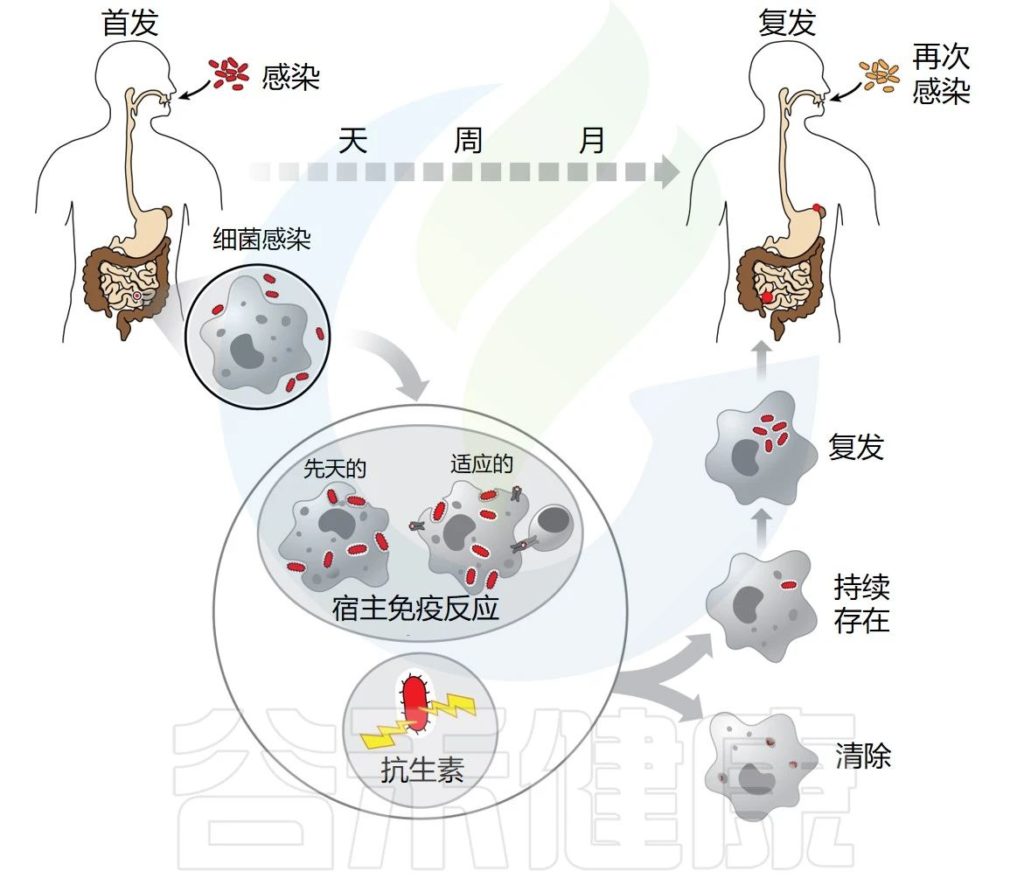
✦许多感染会反复发作
“复发”一词用于描述这样一种现象:最初感染的症状暂时消退,直到首次感染时未清除的细菌库重新激活。
有多种原因会导致感染反复发作,例如宿主易感性增加、其他慢性合并感染以及环境和生活方式因素。
较难确定是再次感染还是复发
长期以来,无法确定感染复发是再次感染还是复发。当初次感染完全清除后,个体出现新的感染时,就会发生再感染。
▼
抗生素残留物研究中投入的许多努力都围绕着调查残留物形成的触发因素和途径。
✦持久性的形成是一种细菌应激反应
但一个总体观察结果是,持久性的形成是一种普遍的细菌应激反应。多种环境因素充当压力信号,促进持久者的产生。
此外,大多数已被确定参与持久物形成的分子途径都是应激反应元件。我们首先回顾了持续细胞形成的触发因素,然后回顾了持续细胞形成所涉及的分子途径和效应器(下图)。
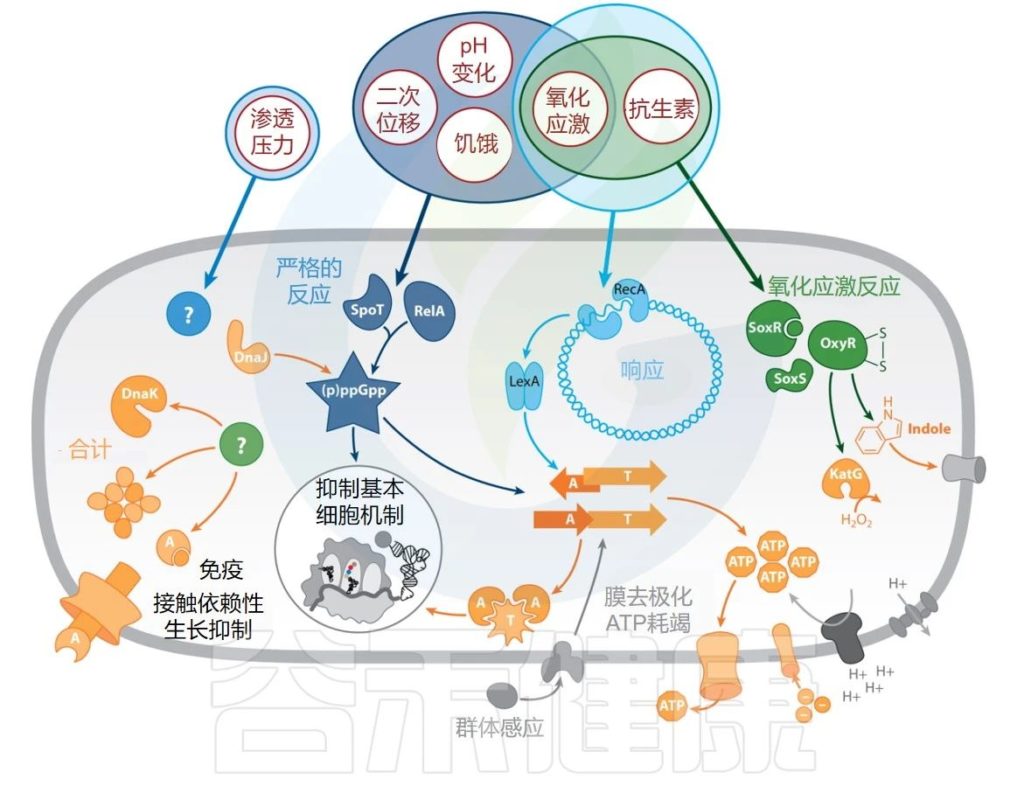
Gollan B,et al.Annu Rev Microbiol.2019
抗生素持久性的触发因素、途径和效应器。持久性的外部触发因素以红色圆圈显示。应激反应途径为蓝色或绿色(已识别的效应器为橙色,受效应器影响的细胞成分为灰色)。
缩写:A—抗毒素;T—毒素。
▼
选择压力可能是最难确定和纳入模型的因素。因此,在人类、动物和其他环境中,细菌病原体暴露于各种选择剂,这些选择剂通常存在于复杂的混合物中(例如抗生素、杀生物剂),并且其浓度可能随着时间的推移而发生很大变化。因此,在实验室环境之外通常很难确定选择的强度。
✦抗药性的选择具有较大差异
此外,抗药性的选择过程将有很大差异,具体取决于药物浓度是否足够高以(a)阻止病原体生长(如果> MIC则致命选择,如果< MIC则非致命选择)和(b)允许敏感和耐药菌同时生长。
在前一种情况下,在应用选择之前需要存在抗性突变体,富集率由群体中突变体的数量及其在特定抗生素浓度下的适应性决定。
然而,在最小抑制浓度选择过程中,可能会出现突变体,其富集率由群体中突变体的数量以及易感细胞和耐药细胞之间的适应度差异决定。因此,致死和非致死选择压力的出现率和选择的突变体类型有所不同。
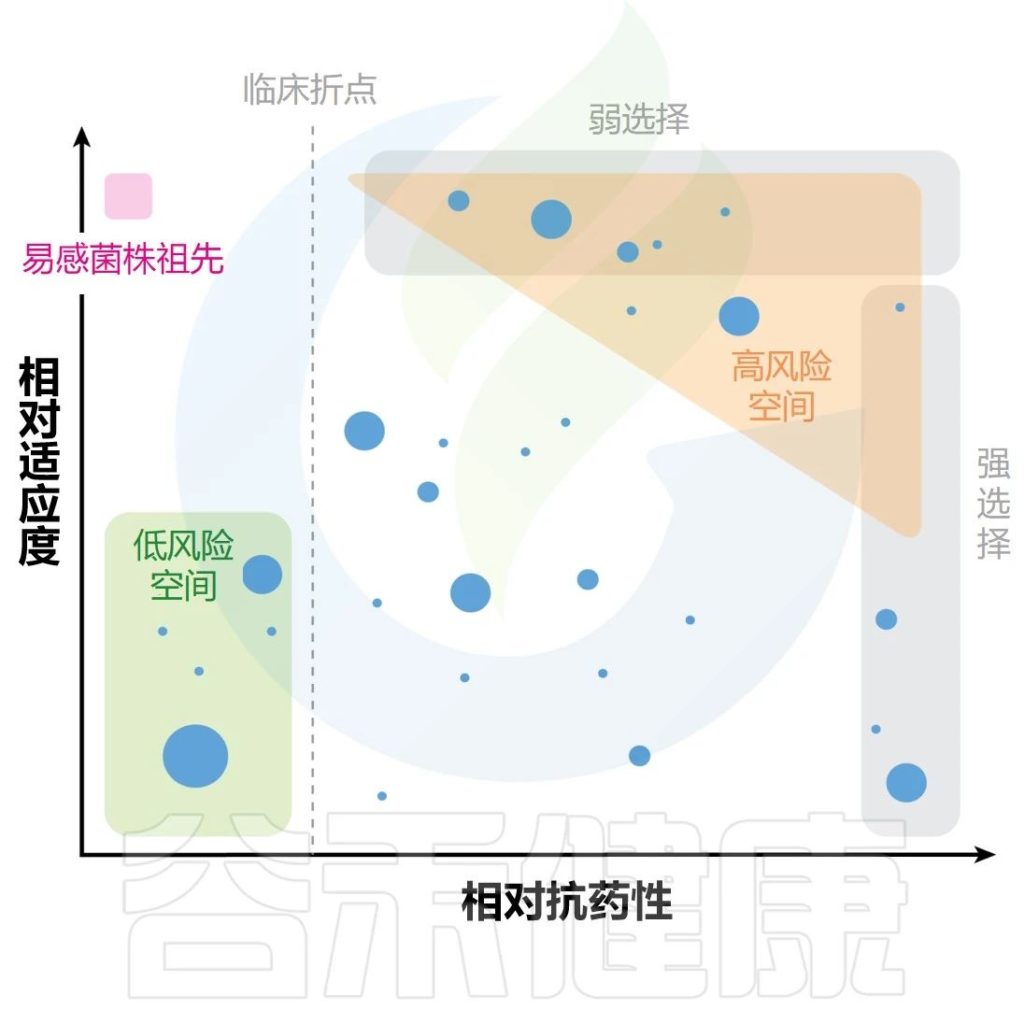
高致死抗生素浓度
在高致死抗生素浓度下,在一个遗传事件中提供高水平耐药性的罕见的预先存在的大效应突变往往会被选择性富集(下图)。
Gollan B,et al.Annu Rev Microbiol.2019
非致死性抗生素浓度
相反,在非致死性抗生素浓度下,富集的突变体通常是由许多对耐药性影响较小的突变引起的(但它们组合起来可能会产生高水平的耐药性)。
重要的是,选择越弱(即易感细菌和耐药细菌之间的适应度差异越小),对于低适应度成本的突变体(上半部分)的富集就越强。
此外,由于在弱非致死选择压力下逐步选择连续的小效应突变,通过突变或水平基因转移获得抗性的概率增加的突变菌株得到富集。
注:矛盾的是,较弱的非致死选择可能比致死选择更富集有问题的突变体(高适应度菌株和突变体)。
许多触发因素似乎都会刺激持久性的形成,从饥饿或氧化应激等营养应激再到细胞外代谢信号。
几十年来,人们都知道抗生素的杀灭率取决于细菌的生长速度,而细菌的生长速度又取决于碳源的可用性,因此控制整个细菌群体的抗生素耐受性。
✦营养缺乏是持久性形成的诱因
此外,营养缺乏似乎是持久性形成的主要诱因之一。例如,氨基酸或氮饥饿会增加铜绿假单胞菌(Pseudomonas aeruginosa)、变形链球菌(Streptococcus mutans)和大肠杆菌(Escherichia coli)等不同物种中经抗生素治疗后存活下来的细菌数量。
! 手术或抗生素治疗后患者的营养非常重要
这就涉及另外一个主题,就是手术或抗生素治疗后,患者的营养,尤其肠内营养的监测或补充非常重要。
还有充分的证据表明,细菌培养物在进入稳定期及以后往往会开始积累持续细胞,然后持续细胞的比例达到与生物膜中所见的水平一样高。事实上,研究表明,营养和氧气有限的生物膜中含有非常高比例的持久物。
除了饥饿造成的剧烈压力外,碳源的变化会破坏代谢通量(可被视为暂时饥饿),也会导致大肠杆菌的持续存在增加。
这种碳源转变伴随着严格反应关键介体四磷酸或五磷酸鸟苷 [ (p)ppGpp ] 水平的大幅增加,这可能是饮食模式改变或节食诱发的。
重要的是,通过营养转换形成的持续细胞似乎维持高 ATP 水平,从而允许非生长相关过程的继续,例如维持膜电位。
除了营养变化之外,氧化、酸性和渗透应激也被认为是持久物形成的触发因素。例如,用过氧化氢处理大肠杆菌培养物或通过向培养基中添加水杨酸盐产生活性氧会导致持久性细菌的增加。
✦吲哚促进持久细胞的形成
同样在大肠杆菌中,吲哚(一种色氨酸生物合成中间体,其产量因氧化应激而增加)被证明可以促进持久细胞的形成。
此外,无法合成海藻糖的大肠杆菌突变体产生的氧化应激与吲哚分泌增加和持久物形成同时发生。
暴露于吲哚的细菌上调了它们的oxyR调节子和噬菌体休克pspBC途径,并且这些途径的缺失降低了吲哚促进持久细胞形成的能力。
沙门氏菌也观察到对吲哚的类似反应,伴随着katG 过氧化氢酶表达的增加,有趣的是,沙门氏菌不产生吲哚。然而,这可能有利于肠道中的沙门氏菌,肠道中的沙门氏菌在感知来自其他微生物群的吲哚时升高的氧化防御反应可能会保护其免受伴随局部炎症的氧化应激。
✦pH值变化和高渗透压也促进持久性形成
pH值变化和高渗透压是促进持久物形成的其他压力。此外,抗生素本身也可能引发持久性细菌的形成,例如在大肠杆菌或金黄色葡萄球菌中,其中用亚抑制浓度的各种抗生素进行预处理显著增加了残留物水平。
✦氧化应激和抗生素诱导细菌群体的持续存在
重要的是,暴露于逐渐增加的抗生素浓度的肺炎克雷伯菌(Klebsiella Pneumoniae)临床菌株显示出持续增加的水平,以及随后出现的耐药变异体。
这一观察结果可能特别相关,因为在临床中抗生素输送和药代动力学通常会导致血液中抗生素浓度逐渐增加。这可能会增加持久菌群的规模,从而增加产生耐药性的细菌库。
同样,氧化应激和抗生素诱导的DNA损伤的结合已被证明可以诱导细菌群体的持久存在。总体而言,许多非生物胁迫导致持久细胞形成增加,大量研究充分支持了这一点,表明主要的细菌胁迫反应是这种表型的强有力的协调者。
当暴露于细菌分泌到周围环境中的细胞外代谢物时,也可以刺激持久细胞的形成。
✦细胞外代谢物也刺激持久细胞的形成
除了上面引用的吲哚的例子之外,能力刺激肽CSP(一种群体感应分子)被证明可以促进变形链球菌(Streptococcus mutans)持久细胞的形成。
这种群体感应分子似乎是一种中间体,向其他群体发出压力信号,以便其做出适当的压力反应,包括持久性形成。同样,一些假单胞菌群体感应分子不仅可以增加假单胞菌的存留细胞分数,还可以增加通常从囊性纤维化患者中分离出来的不动杆菌和伯克霍尔德氏菌的存留细胞分数。
因此,似乎不仅种内信号传导而且种间信号传导也可能促进持久物的形成。
在感染过程中,细菌会经历上述压力的组合,其强度和时间各异,可能有利于持久细胞的形成。
这提出了一种可能性,即在受感染宿主中形成的细菌持续存在可能独特地适应了它们最初形成的触发因素,并且与从生长的细菌中分离出的细菌不同,后者通常使用单一应激因子来诱导细菌持久化状态。
✦宿主巨噬细胞诱导持久化
就沙门氏菌而言,它在宿主免疫骨髓细胞中存活,其持续水平在被小鼠巨噬细胞内化后急剧增加。
结核分枝杆菌持续细胞的形成也是由与宿主巨噬细胞的相互作用触发的。
▼
鉴于刺激存留细胞形成的不同应激,看到相应的应激反应途径也在存留细胞形成中发挥作用也就不足为奇了,这可能会在细菌暴露于应激和最终导致长期生长停滞的分子效应物之间架起桥梁。
▸ 严格响应
由于饥饿是持久细胞形成的重要触发因素,因此对于严格反应和持久细胞之间的联系已经进行了大量的工作。
严格反应的关键介质是警报素 (p)ppGpp,在营养饥饿时被激活。(p)ppGpp 水平升高,与DksA协同作用,导致转录和翻译重排,使细菌能够适应稀缺资源。
当暴露于低pH值或氧化条件时,DksA会发生影响其调节功能的构象变化,因此,严格的反应不仅与饥饿有关,而且与氧化和pH应激因素有关。
影响 (p)ppGpp 合成或 DksA 的突变会显著降低革兰氏阴性和革兰氏阳性细菌中的存留细胞分数。
▸ SOS反应
SOS反应是一种DNA修复机制,在暴露于各种环境应激因素(氧化应激和抗生素暴露)时被激活,这些都是持久性的一般触发因素。
这些压力会造成损伤,产生单链DNA,而单链DNA 又会被RecA蛋白识别。RecA 随后激活LexA阻遏物的蛋白水解活性,最终导致细胞内的全局转录重排。去除这些主调节因子中的任何一个都会导致持续细胞的大量损失。
▸ ATP水平下降
在大肠杆菌和金黄色葡萄球菌中,持久性与细胞内ATP下降有关。
在这两种生物体中,处于指数期但表现出稳定期标记表达的细胞富含持久细胞。此外,用砷酸盐(一种已知能降低ATP浓度的化合物)处理呈指数增长的细菌,会导致持续细胞的大幅增加。
因此,ATP水平的降低可能是大多数细菌过程(例如翻译)关闭的普遍模式,从而导致抗生素在休眠期间持续存在。
一般来说,暴露于抗生素通常会导致微生物群落结构、物种组成和代谢能力发生重要变化。
▼
阿奇霉素是世界卫生组织消除沙眼和雅司病战略的重要组成部分。
雅司病是由雅司螺旋体引起的慢性接触性传染病,病原为雅司螺旋体,亦称纤细螺旋体。
五项随机对照试验研究了阿奇霉素预防性使用对普通人群肠道微生物群的影响。肠道微生物组的特征主要在于α多样性,它量化了单个微生物群中不同细菌类群的数量及其丰度的均匀性。
•阿奇霉素治疗后微生物群α多样性下降
据报道,12个月后微生物群α多样性下降了16%–22%。24个月的长期随访发现,阿奇霉素治疗后,乌普萨拉弯曲菌(Campylobacter upsaliensis)和人弯曲杆菌(campylobacter hominis)丰度降低,并且主要与微生物存活、生长和炎症相关的细菌代谢途径的丰度降低,这可能部分解释了所报道的对儿童死亡率的降低。
乌普萨拉弯曲菌(Campylobacter upsaliensis)在高收入环境中,特别是在农村儿童中,它是一种公认的食源性肠道病原体;而人弯曲杆菌(campylobacter hominis)与肠道炎症和菌血症有关。
三个国家的四项随机对照试验报告了短期使用的影响。与安慰剂相比,阿奇霉素治疗使微生物群α多样性降低高达32%。据报道,Akkermansia muciniphila和Proteobacteria也有所减少。
注:后一组细菌包括常见的病原体,例如大肠杆菌和弯曲杆菌属。
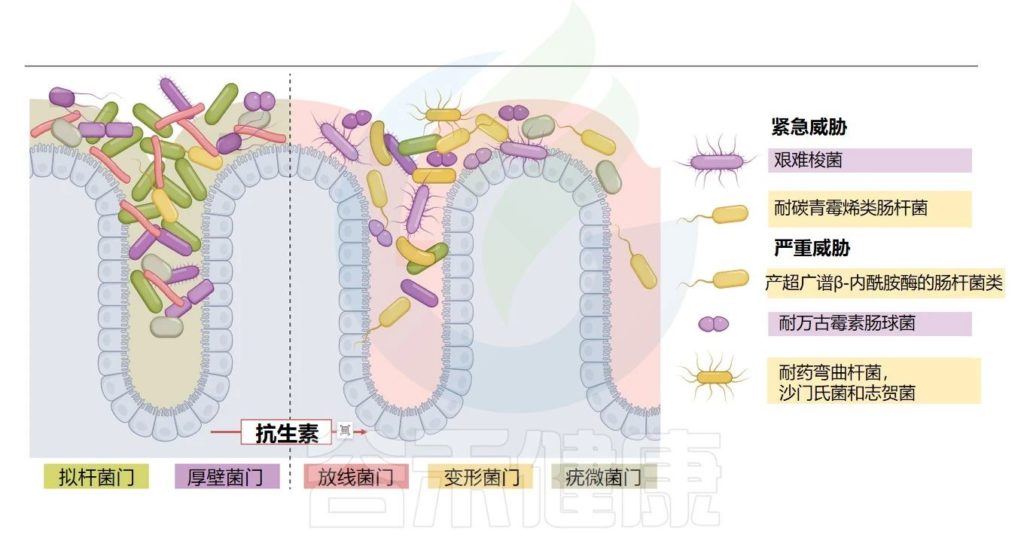
Fishbein SRS,et al.Nat Rev Microbiol.2023
总之,这些研究表明阿奇霉素引起的α多样性明显减少,同时肠杆菌科病原体也减少。
▼
抗生素与代谢或饮食元素之间的协同作用可以进一步塑造微生物组动力学并改变对抗生素的易感性,从而导致疾病的临床相关差异。
•高脂饮食下进行抗生素治疗会引起病理性炎症
对高脂肪饮食的小鼠进行抗生素治疗会引起肠道黏膜的病理性炎症,并增加肠杆菌(Enterobacteriaceae)的水平。这些小鼠表现出炎症性肠病的免疫症状。
Fishbein SRS,et al.Nat Rev Microbiol.2023
•饮食和抗生素结合改变了微生物和宿主的代谢
从其他几项使用饮食和化学干预来模拟西式饮食影响的小鼠研究来看,很明显,饮食和抗生素的结合改变了微生物和宿主的代谢。
具体来说,在一个模型中,这种协同干预通过改变脂肪酸代谢释放了单糖和乙醇胺,最终增加了肠道沙门氏菌感染的易感性。
另外,饮食中多糖或微生物可及的碳水化合物水平的调节对抗生素治疗结果有很大影响。在没有纤维的情况下,使用传统微生物组或人源化微生物组的小鼠在环丙沙星治疗后α多样性恢复延迟。
•含纤维饮食促进了丁酸水平的恢复
在人类实验中,在联合抗生素治疗期间,以杂食和纯素饮食喂养的志愿者,相对于那些不含纤维的液体饮食的志愿者,表现出了更快的微生物群恢复(通过α和β多样性来衡量)。
具体来说,含纤维饮食促进了粪便丁酸水平的快速恢复和具有独特氨基酸代谢的厚壁菌门的恢复。
▼
抵抗组(resistome)是指存在于肠道微生物群中的抗生素抵抗基因的集合。抗生素对肠道抵抗组具有显著但高度可变的影响。
•抗生素通常会增强肠道抵抗组
通过抗生素暴露对肠道抵抗组的改变可能引起微生物组中耐药病原体的病理性繁殖。值得注意的是,抗生素治疗最常见的结果是肠道微生物组中抵抗组负荷急剧增加(通过相对丰度的变化来衡量)。
这些研究揭示了抗生素诱导的抵抗组变化的一些一般模式。尽管增加了总抗性组负担,但抗生素可同时导致特异性的大量丧失和抗性组多样性的减少,这可能是由于分类损失。
•水平基因转移促进抗性组富集
抗生素诱导的肠道抵抗组扩张也可能由ARG编码的MGEs驱动。
在短期内,抗生素治疗后抵抗组负担的增加主要是由染色体编码ARGs的富集(即耐药细菌谱系的扩大)驱动的。
然而,此后不久(约1个月),染色体ARGs的微生物丰度急剧下降。相反,mge编码的ARGs在治疗停止后持续更长的时间,这可能是由于mge的寄生性质。(尽管缺乏抗生素介导的生长优势或细菌宿主存在适应性缺陷,它们仍在细菌群体中持续存在)
抗生素可以增加肠道中mge编码的ARGs的丰度,并导致ARGs和MGEs在患者中更频繁和更广泛(涉及更多样化的分类群)的传播。
总体而言,在临床使用和环境抗生素暴露较高的人群中,ARGs水平转移率较高。
▼
在全球范围内,使用产时抗生素预防(IAP)是预防围产期感染和相关不良妊娠结局的最常见策略。
产时抗生素预防涉及使用广谱抗生素,这些抗生素可有效对抗最有可能引起高危母亲感染的微生物,主要是B族链球菌。
建议在剖腹产手术切开前进行抗生素预防;分娩期间,母亲B族链球菌培养呈阳性或有侵袭性GBS感染风险;或出生后立即进行,以减少与手动去除胎盘、过度宫内操作或生殖道撕裂相关的感染风险。
•经过产时抗生素预防的婴儿微生物多样性降低
七项观察性研究和一项随机对照研究调查了抗生素预防与肠道微生物群之间的关联。经过产时抗生素预防治疗的母亲所生的婴儿在6-7天时的微生物群α多样性有所降低。
暴露于产时抗生素预防还与微生物群组成的更大相似性(即β多样性减少)相关,这表明母体抗生素暴露的选择性压力对婴儿的早期婴儿微生物群组成具有一致的影响。
•产时抗生素预防组以肠杆菌为主,双歧杆菌较少
一项前瞻性队列研究发现,产时抗生素预防组10日龄时放线菌门(包括双歧杆菌)的相对丰度显著减少,厚壁菌门(包括一些值得注意的致病菌群,如葡萄球菌、李斯特菌和链球菌)显著增加。
双歧杆菌是母乳喂养的婴儿肠道微生物群的重要成员,可以通过与其他重要肠道细菌(如乳杆菌)的共生交叉喂养相互作用来驱动微生物群的持续发育。
总体而言,这些研究表明,婴儿微生物群的α多样性降低与母亲产生接触抗生素相关,包括肠杆菌科相对丰度较高和拟杆菌和双歧杆菌丰度较低。
以下讨论抗生素类别、细菌进化枝、起始微生物群组成和长期微生物群组成。
▼
√不同抗生素会影响对应的菌属丰度
最近对55项人类研究的回顾总结了微生物群组成的变化,这些变化与分为22个抗生素类别的68种不同抗生素显著相关。研究表明,每种抗生素对属于一组有限属的细菌影响最强烈。
此外,受影响的细菌属的数量在抗生素类别之间和内部都存在差异。
阿奇霉素与3个属(拟杆菌、双歧杆菌、梭菌)的丰度变化相关,而其他大环内酯类药物则与2-6个属的丰度变化相关(包括前三个属,以及粪杆菌属、普雷沃菌属、瘤胃球菌、链球菌、肠球菌、嗜血杆菌或假单胞菌)。
β-内酰胺类药物,例如氨苄西林和头孢菌素,分别与8和12个属的丰度变化相关,这些属与其他β-内酰胺类药物不同,涵盖系统发育上不同的门(放线菌门、厚壁菌门、变形菌门、疣微菌门)。
√抗生素的不同分类群具有特异性作用
培养实验证实了不同抗生素的这些分类群特异性作用。例如,甲硝唑强烈抑制拟杆菌属和双歧杆菌属的生长。在厌氧培养中,而氨苄青霉素显著减少拟杆菌属和产气荚膜梭菌的生长,但其对双歧杆菌属的影响取决于细菌的生长速度。
此外,氨基糖苷类和磺胺类药物对测试的细菌几乎没有影响。大环内酯类药物对所有测试的细菌种类均具有抑菌作用(但不会杀死),但对艰难梭菌没有影响。
注意:β-内酰胺的作用具有菌株特异性,并且因所使用的特定抗生素而异。
因此,抗生素对微生物群的影响取决于所使用的抗生素,以及细菌分支的反应以及反应方式。
然而,抑制对抗生素敏感的微生物可能会破坏定植抵抗力,并为机会致病菌打开生态位,增加宿主对抗生素后感染的易感性。另外,抗生素的使用也可以增加耐抗生素的共生细菌,这对宿主有潜在的好处。
影响这些效应的因素包括不同抗生素的药代动力学、不同细菌对每种抗生素的降解和耐药机制,这些降解和耐药机制对不主动执行这些功能的其他细菌的间接影响,以及特定耐药决定因素的局部或区域流行率。
▼
考虑到抗生素作用因抗生素类别和细菌进化枝而异,微生物群的初始组成也可能决定抗生素的短期和长期作用。
√微生物群的初始组成会影响抗生素的作用
对五个队列的数据分析确定,具有增强的降解复杂碳水化合物(特别是宿主粘蛋白)的功能能力的特定物种的丰度,准确地预测了微生物群从抗生素相关的α多样性减少中恢复。
这些细菌的基线丰度可以识别使用抗生素后α多样性减少的参与者,准确度为70%。
√粘蛋白降解能力促进细菌在肠道繁殖
研究人员提出粘蛋白降解能力可能为这些细菌在肠道中重新繁殖提供了优势。此外,这些复杂碳水化合物的降解可能会产生次生代谢物,这些代谢物反过来又可以被其他细菌用作营养源以支持其再生。
注:与恢复相关的细菌包括拟杆菌属的几种。
无菌小鼠的证据支持了这一在人类身上的发现。两组均被富含普雷沃氏菌和粪杆菌或富含拟杆菌和副拟杆菌的人类粪便微生物群定植,并且两组均接受为期7天的阿莫西林克拉维酸治疗。
18天后,拟杆菌组的α-多样性对抗生素暴露更具弹性。然而,拟杆菌属的粘蛋白消化降解可以促进肠道感染,这已在艰难梭菌、啮齿类梭菌和鼠伤寒沙门氏菌中得到证实。
▼
两项分析均使用了10个月期间纵向收集的成人数据,其中包括两个为期5天的环丙沙星疗程。
√不同菌群达到新的平衡所需时间不等
一项分析确定,对于不同的细菌亚群,微生物群达到新的稳定配置所需的时间从2到42天不等。
拟杆菌属中的一个细菌亚群在两周内以相同或更高的相对丰度建立了新的平衡。然而,其他细菌如毛螺菌科(Lachnospiraceae)和一部分细菌在治疗期间有所增加,并需要42天才能恢复到使用抗生素前的水平。
相比之下,瘤胃球菌科的一组细菌在一次治疗后减少到检测不到的水平,十个月后仍未恢复。该综述发现细菌进化枝的特异性决定了抗生素对微生物群的影响。
√更短的恢复时间可能由于暴露于环境来源的细菌
对相同数据的第二次分析表明,更短的恢复时间可能是由于更多地暴露于环境来源的细菌,这些细菌可以重新定殖受干扰的微生物组。
尽管这些研究涉及的个体很少,并且最多只能代表个体间的异质性,但他们探索了微生物群丰度数据的采样时间序列,并且他们的发现得到了实验工作的支持。
√更复杂的微生物群可以减轻抗生素暴露的影响
在一项这样的实验中,两组小鼠被分配到无特定病原体的条件或暴露于土壤的一般动物条件下,并且均接受为期两周的万古霉素和链霉素治疗。
暴露于土壤的小鼠在治疗后表现出更大的α多样性和稳定性,并且在停用抗生素后更快地恢复治疗前的α多样性。这些研究表明,更受控制的外源细菌,例如复杂的益生菌混合物,可以减轻抗生素暴露对微生物组的影响。
√抗生素暴露使婴儿α多样性降低
抗生素暴露的长期影响也在婴儿中进行了研究。α-多样性降低与出生后立即治疗有关,但在产后第一年恢复。α-多样性的减少是由于毛螺菌科和肠杆菌科被抑制所致。
尽管微生物群α多样性在一岁时基本上恢复,但由于新生儿接触抗生素而导致这些早期定植菌减少对宿主健康的影响需要仔细调查。
在另一项研究中,与在那段时间没有接触过抗生素的婴儿相比,从出生到三岁接受抗生素治疗的婴儿的物种α多样性较低,但α多样性的减少幅度不大,仅在第一年明显。然而,在细菌菌株水平上,暴露于抗生素的婴儿和未暴露于抗生素的婴儿之间的差异更大。
此外,还发现部分细菌菌株只在肠道定殖一次。这些菌株通过接触抗生素而被消除,但在未经治疗的婴儿中仍然存在。相比之下,其他菌株在随访期间多次在肠道重新定殖。这些菌株更有可能在暴露和未暴露的婴儿中持续存在,这为以下观点提供了进一步的支持:再定殖是使用抗生素后微生物群恢复的驱动力。
★ 评估菌群经过抗生素治疗恢复原有结构的能力
根据菌群的基本构成,尤其是底层代谢黏蛋白以及短链脂肪酸的菌构成情况,可以评估菌群在经过抗生素治疗后恢复原有菌群结构的能力。
该恢复能力越强菌群结构较难通过抗生素改变,越弱则易受抗生素影响,导致后续菌群构成发生较大变化。该指标可以为菌群的抗生素干预选择和菌群重建提供参考。
抗生素耐药是指病原体(细菌、病毒、真菌等)不能被抗生素及其他抗感染药物有效杀死的抵御能力。由于存在抗生素滥用的情况,导致环境中许多细菌尤其是病原菌产生对特定抗生素类型的耐药性。通过对大量抗生素耐药菌基因组和耐药基因的分析,结合肠道菌群测序数据,报告中评估了肠道菌群对主要抗生素类型可能存在的耐药风险。
注意:仅作为风险提示和参考,并不直接对应抗生素耐药,具体用药和耐药检测请谨遵医嘱和进行耐药检测。

<来自:谷禾健康肠道菌群检测数据库>
总而言之,这些分析表明,微生物群从抗生素暴露中恢复可能取决于所使用的抗生素、初始微生物群组成以及受药物影响的特定细菌分类群。
此外,纵向观察研究提供了额外的证据,表明肠道的重新定植可能在抗生素暴露后微生物组的恢复中发挥关键作用。然而,还需要更多的研究来检验这几项研究提出的具体假设。
值得注意的是,仅恢复可能无法保护宿主免受抗生素扰动对微生物组的潜在长期影响。
流行病学研究已确定抗生素使用与肥胖、哮喘,过敏特应性和结直肠癌以及其他健康疾病之间存在关联。抗生素对肠道微生物组的破坏已被认为是这些关联背后的重要机制。
▼
50%或更多中低收入国家的婴儿在3个月大时携带至少一种肠道病原体,并在24个月大时经历至少一次腹泻发作。
中度至重度腹泻的最常见原因是病毒(轮状病毒、沙波病毒、诺如病毒)或细菌(大肠杆菌致病型、志贺氏菌、弯曲杆菌属)感染。
特定病原体的流行情况因国家而异。死亡率和严重腹泻发作也因国家和病原体而异。
▷抗生素降低了腹泻和痢疾导致的死亡率
抗生素的广泛目标是减轻病原菌对宿主健康的负担和影响。使用阿奇霉素进行的随机对照试验结果表明,对弯曲杆菌属具有抑制作用。促炎微生物组代谢途径可能部分解释了在这些环境中观察到的腹泻和痢疾导致的儿童死亡率持续下降。
在另一项研究中,长双歧杆菌(Bifidobacterium longum)抑制了儿科病例中分离的轮状病毒,并缩短了病毒性胃肠炎的持续时间。
▷抗生素也会扰乱肠道微生物群促进肠道感染
抗生素扰乱肠道微生物组后可促进肠道感染,这一点已在艰难梭菌、啮齿类梭菌和鼠伤寒沙门氏菌中得到证实。
或者,用抗生素扰乱肠道微生物群已被证明可以延迟轮状病毒感染并预防小鼠的诺如病毒感染。
相比之下,在艾滋病毒感染儿童中长期使用复方新诺明,4年后仍可抑制炎性草绿色链球菌以及相关的全身性炎症,从而增加该人群的防御风险。
▼
抗生素的使用与肥胖风险增加有关。接触时间越早(6个月之前)和接触频率越高,这种关联就越大。较低的肠道微生物群α多样性也与肥胖有关。
▷抗生素促进营养不良儿童的体重增加
相比之下,抗生素可以促进营养不良儿童的体重增加,尽管其影响是异质的,并且可能是由抗生素类别以及不同人群中生长限制性合并症(例如艾滋病毒和严重急性营养不良)的不同患病率驱动的。
微生物组组成对体重增加的因果影响也已在无菌小鼠中得到证实。
如果不清楚微生物群组成变化与健康结果之间的因果机制,微生物群组成通常被定义为“生态失调”,这是基于与疾病相对于健康对照的关联。
在高收入成年人群中,α多样性下降是“生态失调”的一个共同特征,“生态失调”是根据与疾病的关联来定义的。在这种情况下,α多样性减少表明肥胖和相关代谢紊乱(例如I型和II型糖尿病)的风险增加。
▷抗生素导致α多样性下降增加肥胖风险
相比之下,在纯母乳喂养的婴儿中,肠道微生物组以双歧杆菌为主。由于母乳中存在高浓度的寡糖,导致与混合或配方奶喂养的婴儿相比,α多样性较低。
更大的α多样性与较早引入补充食品和青春期超重风险增加有关。因此,婴儿早期微生物群α多样性的增加可能表明由于婴儿早期营养不足而导致“生态失调”,抗生素相关的α多样性减少对健康的影响也可能是因情况而异的。
▷新生儿抗生素暴露于儿童生长有关
抗生素暴露的时间可能有助于进一步了解具体情况的影响。在芬兰的一个由12422名足月新生儿组成的队列中,新生儿抗生素暴露(主要是静脉注射苄青霉素和庆大霉素)与男孩生命前6年生长受损有关。
一项由1707名德国新生儿组成的独立队列证实了与男孩生长的相关性。相反,新生儿期后接受抗生素疗程的次数与男女6岁时体重指数的增加有关 。
最近的一项针对小鼠的研究表明,出生时注射的低剂量青霉素会导致肥胖增加,并加剧高脂肪饮食对体重增加的影响。生长表型是在无菌接种抗生素处理小鼠的粪便微生物群时诱导的,表明改变的微生物群起着因果作用。
然而,还需要更多的研究来表征和确认促进从抗生素暴露中恢复的微生物组的成分,以及健康新陈代谢可能需要的成分,并将这些转化为人类健康。
▼
较早和更频繁的抗生素处方也与儿童哮喘风险增加有关。较低的肠道微生物群α多样性与婴儿期和儿童期的湿疹和过敏有关。
▷婴儿抗生素使用与儿童哮喘风险存在联系
最近证明婴儿抗生素使用引起的微生物群改变与5岁时哮喘风险之间存在直接联系。在出生第一年接触抗生素的婴儿到5岁时患哮喘的可能性是正常婴儿的两倍。估计这种关联的25%可归因于抗生素引起的α多样性减少或抗生素相关的特定细菌丰度变化。
▷母亲使用抗生素会影响婴儿微生物的早期定植
尽管整个婴儿期的肠道微生物组存在巨大的变异性,但婴儿期微生物组的有意义的一部分是在出生后立即从母体肠道获得的,并保留长达3年。因此,母亲接触抗生素也可能会改变分娩过程中微生物物种向婴儿的传播,并影响早期定植。
影响新生儿微生物组组成的抗生素暴露可能会对儿童发育产生长期影响。几项使用动物模型的研究表明,新生儿期对于免疫系统的成熟至关重要,这一过程依赖于新生儿肠道微生物组的定植,并且会受到抗生素消融的干扰。
小结
抗生素在治疗细菌感染和减少疾病传播方面起着积极的作用。然而,滥用和不适当使用抗生素可能导致细菌耐药性的增加,并对肠道微生物群产生负面影响。
因此,我们应该合理使用抗生素,遵循医生的建议,并在使用抗生素期间维护肠道健康。谨慎使用抗生素有助于最大限度地减少负面影响,确保抗生素继续为我们的健康服务。
人们提出了一些有前景的方法来减轻抗生素使用对微生物组的影响。
▼
共同施用益生元以促进共生细菌的生长就是这样的策略之一。在婴儿中,母乳富含复杂的低聚糖,可作为双歧杆菌生长的底物,并促进其他物种的交叉喂养。
在一个观察队列中,母乳喂养与产时抗生素预防暴露婴儿微生物组α多样性的更快恢复有关。母乳喂养的好处也可能超出其益生元含量。
•儿童益生元和抗生素联合给药使有益菌丰度升高
在儿童中,乳果糖与阿奇霉素的联合给药有助于恢复乳果糖的相对丰度。治疗后18天内,乳杆菌属(Lactobacillus)、肠球菌(Enterococcus)、Anaerostipes、经黏液真杆菌属(Blautia)和罗氏菌属(Roseburia)出现增加,而单独使用阿奇霉素可导致治疗后60天内促炎性链球菌的丰度增加。
•成人联合使用益生菌和抗生素可减轻耐药性
在成人中联合使用益生菌和抗生素也显示出一定的潜力,可以减轻耐药性遗传决定因素的抗生素选择。
然而,口服益生菌在肠道的成功定植表现出因人、肠道区域和益生菌菌株而异的相当大的变异性,这可以通过宿主和本土微生物组特征来解释。
此外,益生菌菌株中缺乏对所施用抗生素的耐药性可能会加剧微生物组中抗生素耐药性的选择,进一步限制了益生菌的潜在保护作用。
注:使用抗生素给药前收集的自备健康粪便样本进行粪便微生物群移植可能是恢复微生物组的更有效方法,尽管这对于中低收入国家来说可能不太实用。
▼
另一种策略涉及使用抗生素药物组合来实现比单一抗生素治疗更有针对性的物种特异性效果。
例如,一项调查筛选了超过1000种药物,以确定可降低抗生素广谱活性而不损害其对抗相关病原体活性的候选药物。
•红霉素对肠道共生细菌具有强抑制作用
抗凝药物双香豆素和两种非甾体类抗炎药物托芬那酸和二氟尼柳成为红霉素对肠道共生细菌(例如普通拟杆菌和均匀拟杆菌)作用的强抑制剂。
然而,红霉素对致病菌(例如金黄色葡萄球菌、肺炎链球菌和屎肠球菌)没有显著影响。
•药物组合具有物种特异性效应
另一项研究分析了近3000种抗生素、药物和食品添加剂的组合,以确定可以减轻对微生物群的附带影响而不减少对病原体影响的候选化合物。超过70%的药物组合具有狭窄的物种特异性效应,20%显示出菌株特异性效应。
▼
另一种方法是确定窄谱抗生素替代品,尽可能选择狭谱抗生素,这些抗生素只对特定类型的细菌有效,而不是广谱抗生素,后者会杀死更多的细菌,包括有益菌。
微生物组本身可能是此类窄谱化合物的来源。例如,对人类微生物组计划中的752个细菌基因组的研究发现了共生细菌携带的一组编码硫肽的基因。
•对病原菌有很强的抑制作用,对共生菌没有抑制
乳青霉素是一种由加氏乳杆菌编码的硫肽,对金黄色葡萄球菌和阴道加德纳菌等常见病原体具有很强的抑制活性,但对共生菌没有抑制作用。
苏云金素是另一种已被鉴定的抗菌素,由苏云金芽孢杆菌(Bacillus thuringiensis)产生。它已被证明可以有效对抗艰难梭菌,而不影响人类结肠的粪便培养系统中的微生物群组成。
开发此类干预措施需要更深入地了解与抗生素结合产生健康益处或不良副作用的机制,以便窄谱替代品能够实现预期结果,同时最大限度地减少不必要的风险。
最后,环境中可能还存在重要的微生物成分,有助于防止生态失调或在关键发育时期恢复肠道微生物组的生理重要子集。识别这些成分可以指导缓解干预措施的开发和测试。
有令人信服的证据表明,即使不存在抗生素耐药性,感染也很难治疗。几项依赖于对患者分离株进行深度基因组测序的纵向研究表明,这些持续性感染的复发与宿主体内细菌库的维持有关,这些细菌在免疫防御和抗生素的联合作用下幸存下来。
用于追踪动物和细胞感染模型中细菌的细菌生长停滞报告者已经证明,尽管接受抗生素治疗,但在持续感染部位仍存在不增殖或缓慢增殖的细菌。过去几年,追踪和分析稀有非生长细菌的尖端技术的发展极大地促进了抗生素持久性的研究。在这方面,这个领域正在不断发展。
总结如下:
1.与普通菌株相比,生长缓慢的细菌表现出相对的药物冷漠,这增加了种群在抗生素暴露下存活的时间。
2.药物暴露后的这种异质群体行为是由于细菌亚群(持续存在)通过生长停滞、暴露于对其余群体致命的浓度的抗生素而得以生存的能力。
3.许多病原菌在宿主组织内建立持续感染,避免被免疫系统和抗生素清除。细菌感染通常会导致宿主产生先天免疫反应,然后产生适应性免疫反应,这通常足以清除感染。然而,许多病原体已经进化出复杂的生存机制来逃避免疫反应并建立持续感染。
4.有多种原因会导致感染反复发作,例如宿主易感性增加、其他慢性合并感染以及环境和生活方式因素。长期以来,无法确定感染复发是再次感染还是复发。
5.持久性的形成是一种普遍的细菌应激反应。多种环境因素充当压力信号,促进持久者的产生。许多触发因素似乎都会刺激持久细胞的形成,从饥饿或氧化应激等营养应激到细胞外代谢信号。
6.婴儿微生物群的α多样性降低与母亲接触抗生素相关,包括肠杆菌科相对丰度较高和拟杆菌和双歧杆菌丰度较低。
7.不同的抗生素对不同细菌菌属影响不同,肠道内菌群结构的恢复与抗生素的使用和患者基线菌群有关。
8.超重,肥胖,哮喘,过敏等人群与早期和长时间抗生素的使用引起的菌群失调以及部分关键菌属的消失或下降有关。
9.未来可以发展更综合的预防措施,例如,乳青霉素是一种由加氏乳杆菌编码的硫肽,对金黄色葡萄球菌和阴道加德纳菌等常见病原体具有很强的抑制活性,但对共生菌没有抑制作用。
相关阅读:
主要参考文献
Gollan B, Grabe G, Michaux C, Helaine S. Bacterial Persisters and Infection: Past, Present, and Progressing. Annu Rev Microbiol. 2019 Sep 8;73:359-385.
Gough EK. The impact of mass drug administration of antibiotics on the gut microbiota of target populations. Infect Dis Poverty. 2022 Jun 30;11(1):76.
Shah T, Baloch Z, Shah Z, Cui X, Xia X. The Intestinal Microbiota: Impacts of Antibiotics Therapy, Colonization Resistance, and Diseases. Int J Mol Sci. 2021 Jun 20;22(12):6597.
Vuong HE, Pronovost GN, Williams DW, Coley EJL, Siegler EL, Qiu A, Kazantsev M, Wilson CJ, Rendon T, Hsiao EY. The maternal microbiome modulates fetal neurodevelopment in mice. Nature. 2020 Oct;586(7828):281-286.
Fishbein SRS, Mahmud B, Dantas G. Antibiotic perturbations to the gut microbiome. Nat Rev Microbiol. 2023 Jul 25.
Koh E, Hwang IY, Lee HL, De Sotto R, Lee JWJ, Lee YS, March JC, Chang MW. Engineering probiotics to inhibit Clostridioides difficile infection by dynamic regulation of intestinal metabolism. Nat Commun. 2022 Jul 4;13(1):3834.
Gomaa EZ. Human gut microbiota/microbiome in health and diseases: a review. Antonie Van Leeuwenhoek. 2020 Dec;113(12):2019-2040.