-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

一听到高脂饮食,很多人就会想到会增加患心脏病和其他慢性疾病的风险。然而,低碳水化合物、高脂肪的生酮饮食却在各个方面越来越受欢迎,从减肥到自身免疫疾病等。
生酮饮食的支持者认为,通过减少碳水化合物的摄入,可以帮助控制血糖和胰岛素水平,从而降低患糖尿病和肥胖的风险。甚至有人选择生酮饮食是为了提高生产力、精力和思维清晰度。
一些研究表明,生酮饮食可能会对肠道健康产生积极影响,如减少肠道炎症、改善肠道通透性和促进有益菌群的生长。然而,也有研究认为生酮饮食会减少肠道菌群多样性,可能引发代谢紊乱等情况,这是为什么呢?
这些研究之间是否相互矛盾?
许多人对这种饮食方法可能对肠道及肠道微生物组健康产生的影响有担忧。
有一种普遍的观念认为,唯一能为有益肠道微生物提供营养的物质是复合碳水化合物,如果我们没有膳食纤维,我们的肠道屏障也会受到影响。
但事实真的如此吗?
生酮饮食真的会给肠道带来很大危害吗?
生酮饮食对肠道菌群的影响是快速的吗?
生酮饮食中的高脂肪不会增加LPS吸收吗?
为什么说生酮饮食对一些疾病具有保护作用?
生酮饮食到底是促炎多还是抗炎多?
什么人群更适合生酮饮食呢?
……
在本文中,我们将深入探讨生酮饮食对肠道健康的影响,并对证据进行完整的讨论,包括目前知道什么和不知道什么,更全面地了解这种饮食方法,可以更好地选择适合自己的饮食方式。

我们与肠道微生物的关系是数千代共同进化的产物。数百万年来,进化不仅作用于我们 23,000 个人类基因,还作用于我们体内和体表的近 400 万个基因(包括人类和微生物)。之所以成为今天的我们,是因为我们是与微生物一起进化的。
什么是代谢灵活性?
我们进化的环境需要定期适应不断变化的条件。我们的祖先并不能总是稳定地获得食物,当食物匮乏时,他们会偶尔禁食。因此,当食物充足时,我们的身体有能力燃烧和使用碳水化合物,而当食物或碳水化合物稀缺时,我们的身体有能力将膳食脂肪或储存的身体脂肪转化为酮以获取能量。这种根据饮食摄入量变化而改变新陈代谢的能力称为代谢灵活性。
那么问题来了:为什么我们的身体具有代谢灵活性来应对食物供应的变化,而我们的肠道微生物群却没有同样的代谢灵活性?
当淀粉类碳水化合物变得稀缺时,我们的祖先真的会产生“患病”的微生物组吗?
不一定。
我们可以考虑一下因纽特人等传统文化。
因此,所谓“健康”微生物组,就是你个人健康时所拥有的微生物组,对你来说健康的东西可能对其他人来说并不健康。
打个比方,选择任意两个人,平均而言,他们只会分享大约三分之一的肠道微生物群。另外三分之二的肠道菌群将因遗传、地理位置、抗生素和药物使用史、出生方式、饮食以及其他未知的因素而存在显著差异。没有足够的信息来证明一个人的“三分之二”比另一个人的“三分之二”更好。
我们在肠道菌群检测的时候,并不能以单一的指标去武断地认为这个人就是不健康,而是要结合他自身其他指标来综合判断是否需要采取某些干预措施。
我们继续来看研究数据。
很多项研究表明,给动物喂养“高脂肪饮食”会导致严重的肠道菌群失调、肠道通透性增加和全身炎症,表明高脂肪饮食可能对人类肠道微生物群不利。
不过仔细观察会发现,大多数动物研究中使用的“高脂肪饮食”,更准确地说是富含精炼大豆油、猪油和精制糖且纤维含量极低的饮食。
加州大学戴维斯分校教授 Craig Warden 博士称其为“相当于小鼠吃猪皮、排骨、可乐”。换句话说,经典的动物“高脂肪饮食”比任何精心设计的生酮饮食更能反映标准美国饮食换句话说,典型的动物“高脂肪饮食”其实更多地反映了标准西方饮食,而不是精心设计的生酮饮食。
进化来说:人易适应高脂饮食,小鼠适应低脂
低碳饮食下,经过基因筛选的小鼠容易代谢紊乱
最常用于此类研究的小鼠品系 C57Bl/6 小鼠经过基因筛选,因其能够响应“高脂肪饮食”而增加体重和升高血糖。
Richard Feinman 等人写道:
“结果表明,肥胖的啮齿动物模型,在理解代谢机制如何以与人类效应不同的方式工作方面可能最有价值。”
因此,我们不能简单地将针对经过选择性育种、喂食高度精炼“高脂肪饮食”的小鼠的研究结果,直接应用到具有健康意识的人类身上,这是对基础科学的严重误解。
那么,我们来看看人类研究。
2014 年在《自然》杂志上发表了一项研究,研究人员让健康的人类志愿者短期接受植物性饮食或动物性饮食。他们发现独特的肠道微生物群在短短三天内就出现了。
这是微生物组研究领域的一项开创性研究,自 2014 年以来已被引用超过 2700 次。其实这篇文章里面说的动物性饮食是生酮饮食。
– 植物性饮食每天包含 300 克来自谷物、蔬菜、大米、扁豆和水果的碳水化合物;
– 动物性饮食每天包含的碳水化合物少于 3 克,其中 30% 的热量来自蛋白质,70% 的热量来自蛋白质来自鸡蛋、肉和奶酪的脂肪。这种常量营养素比例与生酮饮食一致。研究人员甚至通过尿酮测量证实受试者在动物性饮食的第二天就处于酮症状态。
那么他们发现了什么?
动物性生酮饮食的参与者微生物α多样性没有变化。他们发现耐胆汁微生物相对丰度有所增加,如Bilophila、Alistipes、Bacteroides。已知代谢复杂膳食植物纤维的微生物的相对丰度减少,如Roseburia、Eubacterium rectale、 Ruminococcus bromii。
该文作者写道:
研究结果表明,人类肠道微生物组可以在草食性和肉食性功能特征之间快速切换,这可能反映了人类进化过程中过去的选择压力。
我们的祖先吃动物食品可能是不稳定的,依赖于季节和随机的觅食成功;
而现成的植物性食物提供了热量和营养的后备来源。微生物群落能够迅速、适当地改变其功能,以应对饮食变化,从而增强人类的饮食灵活性。
换句话说,我们的肠道微生物群只是在适应当前不同食物来源的可用性,它不一定会因饮食中碳水化合物或脂肪的数量而变得或多或少具有致病性。
注意:生酮饮食可能会加剧一些菌过度生长——稍后会详细介绍。
那么,更长期的研究呢?
2017 年《微生物学前沿》杂志上发表的一项研究检查了生酮饮食对 25 名多发性硬化症患者粪便微生物群的长期影响。
多发性硬化症 (MS) 是一种影响神经系统的自身免疫性疾病,与肠道病变有关。事实上,一些研究人员怀疑肠道菌群失调和肠道通透性可能先于自身免疫的发展。因此,如果生酮饮食可以显著改善多发性硬化症的症状,它可能不太会损害肠道,甚至可能改善肠道健康。
与健康个体相比,多发性硬化症患者在基线时的Roseburia、拟杆菌属和普拉梭菌属数量往往减少。然后他们进行了六个月的生酮饮食。
作者写道:
生酮饮食的影响是双向的。短期内,细菌浓度和多样性进一步降低。他们在第 12 周开始恢复,并在生酮饮食 23-24 周后显著超过基线值。
这表明,虽然短期饮食变化可以迅速改变肠道微生物群的组成,但我们可能需要关注长期饮食变化,并在多个时间点收集样本,以确定生酮饮食干预的真正效果。
最近发表的一项研究证实,生酮饮食可以改变肠道微生物群的结构和功能。

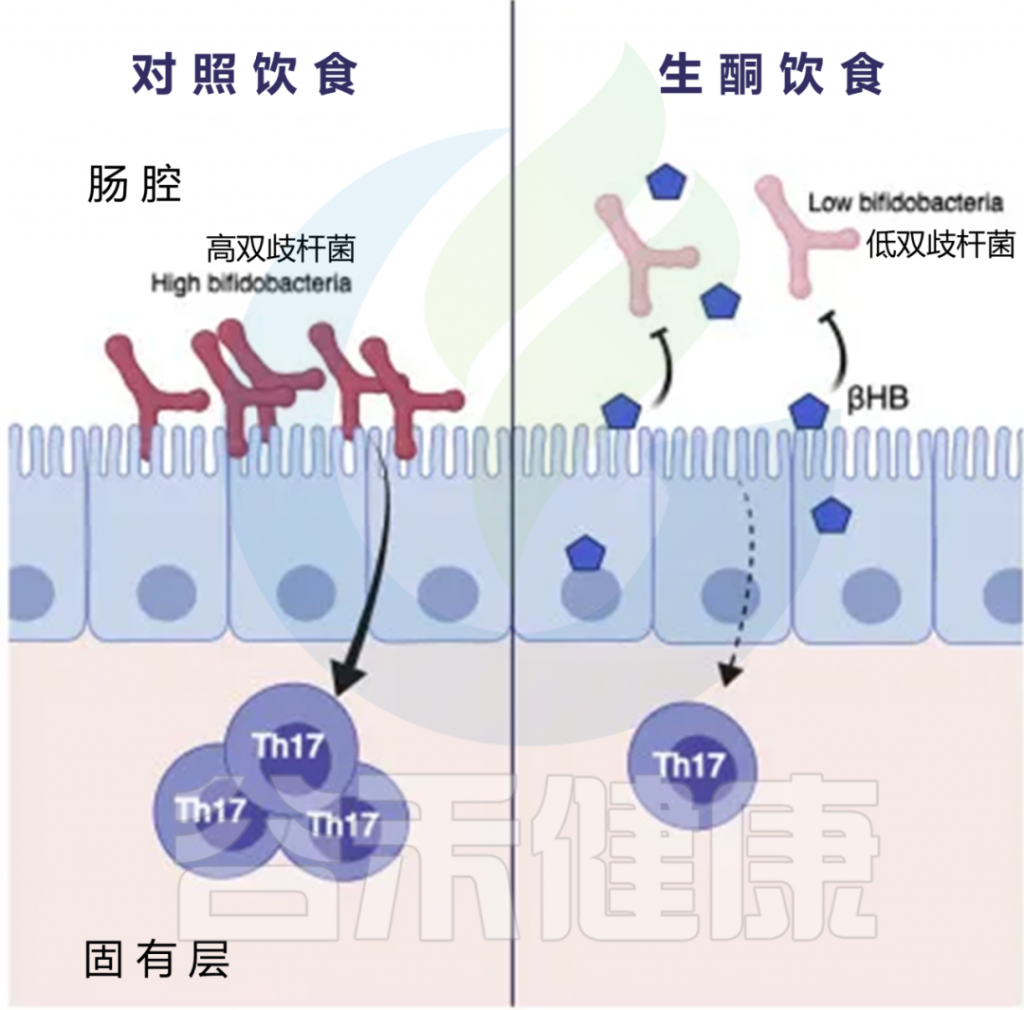
该小组招募了 17 名超重和肥胖男性参与研究的第一部分。让他们吃基线控制饮食四个星期,然后再吃四个星期规定的生酮饮食。生酮饮食最显着的变化是,几种双歧杆菌物种丰度的显著减少。
研究人员接下来对小鼠进行了控制喂养研究。相对于传统的高脂肪饮食,生酮小鼠饮食对肠道微生物组具有独特的影响,随着碳水化合物限制的增加,双歧杆菌的丰度减少。进一步的实验发现,生酮饮食或酮酯补充剂都会导致肠腔和结肠组织中β-羟基丁酸的增加。
酮体直接抑制双歧杆菌的生长
有趣的是,这与小肠 Th17 细胞的减少有关。Th17 细胞是T辅助细胞的一个亚群,可产生促炎细胞因子 IL-17,作为适应性免疫反应的一部分。这些细胞在维持肠粘膜屏障方面发挥着重要作用,并有助于清除粘膜表面的病原体。然而,Th17 细胞也与自身免疫和炎症性疾病有关,包括类风湿性关节炎、多发性硬化症和牛皮癣。
为了完善这个发现,他们将在基线饮食或生酮饮食期间收集的人类捐赠者的粪便,移植到无菌小鼠体内,以确定 Th17 细胞的变化是否依赖于酮诱导的微生物群变化。接受酮类微生物群的小鼠肠道 Th17 细胞显著降低。
doi.org/10.1016/j.cell.2020.04.027
有趣的是,与生酮饮食相比,基线饮食的总体胆汁酸池没有变化。
生酮饮食不会破坏肠道粘液层
之前的研究表明,喂食无纤维饮食的小鼠结肠粘液层有显著破坏。然而,在生酮饮食中却没有看到这一点。
作者写道:
尽管缺乏可发酵碳水化合物,生酮饮食仍能保持强健的粘液层。
这是一个关键发现。低碳水化合物者可以放心,如果处于酮症状态,肠道粘液层可能不会破坏。生酮饮食不仅维持了粘液宽度,还维持了肠道粘液主要成分 Muc2 的表达。
我们现在已经在人类身上看到了大量关于生酮饮食引起肠道微生物组变化的证据,并且看到了生酮饮食如何影响小鼠的肠道微生物群和粘液层。
让我们看看其他一些设计良好的动物研究。
生酮饮食经常用于治疗对药物治疗无反应的癫痫症。虽然生酮饮食非常有效,但几十年来,生酮饮食到底如何给大脑活动带来好处仍然难以捉摸。
然而,Elaine Hsiao 团队于 2018 年 5 月在《细胞》杂志上发表的一项研究表明,生酮饮食对癫痫的有益作用是通过肠道微生物组介导的。换句话说,如果生酮饮食不能改变微生物群,它就不能有效预防癫痫发作。
这项研究是在小鼠癫痫模型中进行的。与之前的研究一样,他们能够证明给小鼠喂食生酮饮食可以保护它们免受癫痫发作。
然而,他们进一步证明,用广谱抗生素治疗小鼠会消除对癫痫发作的保护作用。同样,在无菌培养箱中饲养且没有肠道微生物组的无菌小鼠,即使在食用生酮饮食时也无法预防癫痫发作。
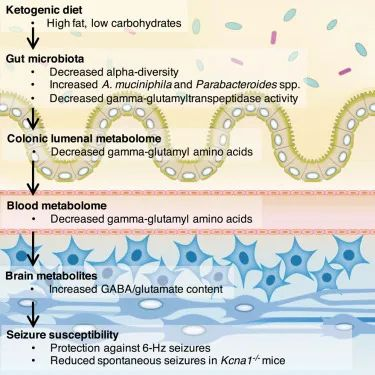
doi.org/10.1016/j.cell.2018.04.027
有趣的是,本研究中的生酮饮食降低了微生物多样性,但增加了Akkermansia muciniphila(简称AKK菌)和副拟杆菌(Parabacteroides)丰度。
扩展阅读:
研究人员想知道这两种微生物是否负责癫痫发作保护,并尝试用阿克曼氏菌和副杆菌来治疗喂食正常高碳水化合物食物的小鼠。令人惊讶的是,这可以防止癫痫发作。
进一步的机制实验发现了一条细菌途径,该途径提高了大脑中抑制性神经递质GABA与兴奋性神经递质谷氨酸的比例。GABA 可以镇静大脑的活动,因此这可以解释癫痫发作的减少,也可以解释为什么许多人发现生酮饮食有助于减少焦虑。
扩展阅读:
癫痫中的微生物群-肠-脑轴
Ding M,et al.Front Immunol.2021
基于相关的人类和动物实验数据,我们深入探讨生酮饮食引起的肠道生理学变化的一些机制。
你可能会问,如果没有任何可发酵碳水化合物,肠道如何生存?
我们知道肠道细菌代谢复杂的碳水化合物,产生短链脂肪酸(SCFA),如乙酸盐、丙酸盐和丁酸盐。丁酸盐在肠道中具有重要的信号传导功能,并且是肠上皮细胞的首选燃料来源。已发表的研究表明,丁酸盐提供了结肠上皮细胞约 70% 的能量需求。
丁酸盐对免疫功能的调节作用
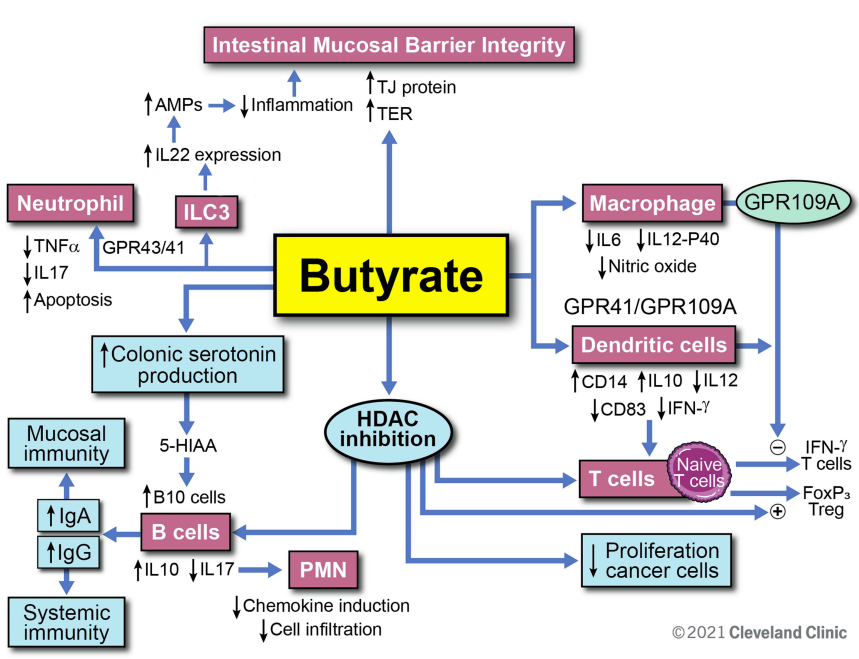
我们需要定期供应丁酸盐来维持肠道屏障功能吗?
不。事实证明,还有其他几种分子可以执行丁酸盐的许多信号传导功能,并作为肠上皮细胞的燃料来源。事实上,这种“首选”燃料来源的想法可能偏离了对食用大量碳水化合物的人(和啮齿动物)的研究。换句话说,生酮饮食中丁酸盐的产生可能会减少,但其他分子可以代替它来帮助维持肠道屏障功能。
扩展阅读:
有三种分子可以替代丁酸:异丁酸、乙酰乙酸、β-羟基丁酸。
异丁酸替代丁酸,刺激肠道受体
异丁酸是蛋白质发酵的代谢产物,其产生量通常低于丁酸。当丁酸较少时,异丁酸可以被肠上皮细胞从肠腔吸收并代谢为能量。前面提到的 2014 年研究发现,食用动物性生酮饮食的人类粪便异丁酸含量升高。
此外,异丁酸可以刺激肠道中与丁酸相同的受体(GPR41、GPR43和GPR109a),从而刺激粘液分泌、抗菌肽释放和免疫调节。
异丁酸浓度不足,效力来补
虽然中等高蛋白饮食中产生的异丁酸水平可能低于高碳水化合物饮食中产生的丁酸水平,但异丁酸已被证明是GPR41(FFAR3)的更强效刺激剂,这是丁酸的主要受体之一。换句话说,异丁酸在浓度上的不足,但在效力上可能弥补了这一不足。
乙酰乙酸 和 β-羟基丁酸 (βHB)
是肝脏产生的两种主要酮体。与丁酸盐一样,βHB 也可以刺激 GPR109a,减少肠道炎症。然而,最值得注意的是,βHB 和乙酰乙酸都是丁酸代谢途径中的中间体。
换句话说,当丁酸盐被肠道上皮细胞吸收时,它实际上首先转化为βHB,然后转化为乙酰乙酸,然后进一步分解为能量。参考下图:
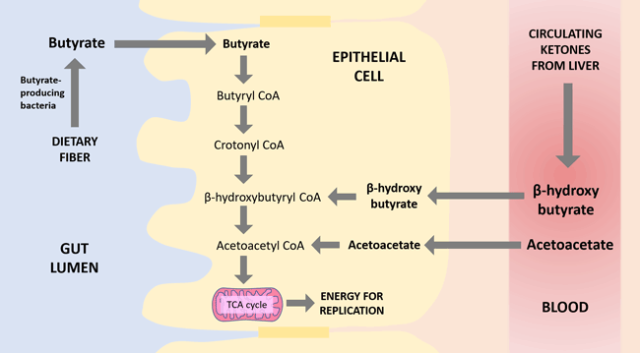
编辑
已知肠道上皮细胞在基底外侧表面(最靠近血流的细胞一侧)表达单羧酸转运蛋白 MCT1 。MCT1 可以转运酮,并且特别在使用酮体获取能量的细胞中表达。几篇论文表明,肠道上皮细胞确实能够利用血管床中的酮体。
酮体与丁酸盐在肠道健康中的角色
使用酮代替丁酸盐的能力可能看起来没有优势,但考虑到许多肠道发炎的人都存在粘膜损伤,丁酸盐的吸收受损。
那么这意味着什么呢?如果你有一个健康的微生物群和肠黏膜,丁酸可能足以应对你肠道的所有需求,不需要酮体。
但是,如果你:
尝试治疗性营养生酮来支持肠道上皮细胞代谢,至少在治疗潜在的肠道病理和治愈肠道粘膜之前是这样。
生酮饮食在治疗肠道疾病中的应用
可惜,很少有研究是针对克罗恩病、溃疡性结肠炎或肠易激综合症的生酮饮食。
一份病例报告发现,旧石器时代的生酮饮食使一名患有严重克罗恩病的小男孩完全缓解。
第二份病例报告发现,补充酮酯的低碳水化合物饮食可显著减少克罗恩病患者的炎症并提高生活质量。
另一项针对 13 名腹泻型肠易激综合征 (IBS-D) 患者的研究发现,10 名患者在 4 周生酮饮食期间症状得到缓解。

有趣的是,许多溃疡性结肠炎的患者发现生酮饮食可以缓解症状。
目前极少有研究评估酮或生酮饮食对肠道屏障功能的影响,在这方面可进一步研究。
鉴于生酮饮食相当严格,许多人开始使用酮酯或盐来实现酮症。其他人可能会在生酮饮食的基础上使用酮酯或盐来达到更深层次的酮症状态。
酮酯或酮盐对肠道微生物和丁酸盐水平的潜在影响
有趣的是,一些体外数据表明,至少在某些个体中,酮酯或酮盐可能会增加肠道丁酸盐水平。《科学报告》 2020 年发表的一项研究调查了体外发酵室中 12 种人类粪便微生物群样本的 β-羟基丁酸盐的动态。
编辑
在 7 个样本(βHB 利用者)中,超过 54% 的 βHB在发酵 30 小时后被代谢,这与已知的丁酸盐生产者粪球菌属丰度的增加有关,而粪球菌属又与丁酸盐产量的增加相关。
在其他五个粪便样本(βHB 非利用者)中,只有不到 19% 的 BHB 被代谢,并且粪便丁酸盐没有变化。
作者推测:
微生物正在将 βHB 转化为丁酸盐
这一观点得到了 2018 年发表在《细胞代谢》杂志上的一项研究的支持,该研究发现啮齿动物的间歇性禁食,导致与酮体合成和降解相关的微生物途径丰富。
另一种可能的机制是通过激活 PPAR-γ 并维持肠道低氧状态,这反过来又会支持肠道中的产丁酸菌。
一项由麻省理工学院的一组研究人员在2019年末发表在《细胞》杂志上的研究发现:
酮体信号调节了肠干细胞的正常功能及其对伤害的响应能力
肠道上皮广泛折叠,上皮表面有峰(绒毛)和谷(隐窝)。肠道干细胞(ISC)位于每个隐窝的底部,负责每隔几天更新整个肠道上皮或修复损伤。
肠道干细胞受到许多影响其发育的不同生长因子的严格控制。之前的研究表明,膳食营养素在决定肠道干细胞功能方面发挥着重要作用,但尚未有人研究酮体及其潜在作用。
Cheng C W et al., cell,2019
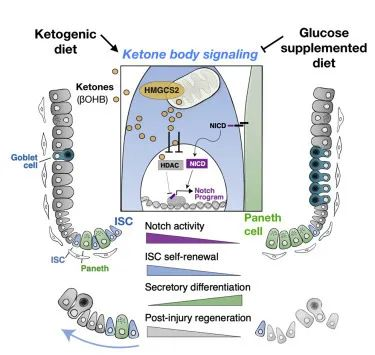
酮体生产酶HMGCS2对肠道健康的影响
研究小组首先发现,生成酮体的酶HMG-CoA合成酶2(HMGCS2)在小肠干细胞中富集。HMGCS2 存在于许多不同的组织中,已知可以限制酮的形成速率。
消除肠道中的Hmgcs2基因会降低隐窝中的 β-羟基丁酸水平,并损害干细胞功能以及后肠道上皮的再生。给予外源性(补充)βHB 可挽救干细胞功能并部分恢复肠道再生。
生酮饮食对肠道干细胞和上皮再生的影响
他们接下来研究了生酮饮食的影响,发现它增加了 HMGCS2 表达、ISC 数量、功能和损伤后再生。相比之下,补充葡萄糖的饮食抑制了肠道干细胞的生酮作用,并使干细胞向杯状细胞和潘氏细胞倾斜分化。
值得注意的是,一旦干细胞分化为成熟的上皮细胞并迁移出隐窝,它们就表达很少的 HMGCS2。这表明成熟的上皮细胞不具备通过经典生酮途径(通过两个乙酰辅酶A分子的缩合)产生大量酮的能力,尽管我们了解到它们确实有能力利用酮。
因此,如果我们在生酮饮食中看到成熟肠上皮细胞中存在高水平的酮,并且这些酮不是在成熟的上皮细胞中产生的,那么酮几乎肯定来自循环。
沿着这些思路,作者写道:
因为外源性酮在体外和体内都能纠正 Hmgcs2 的缺失,肝脏或其他非肠道来源的酮体可能会替代或补充肠道干细胞生成的酮体,在生酮饮食介导的再生过程中,其中循环酮水平高度升高。
避免高脂肪饮食的另一个常见论点是,它们会增加肠道对脂多糖 (LPS) 的吸收。LPS 是一种存在于革兰氏阴性细菌细胞壁中的分子。如果它进入循环,可能会引起低度的全身炎症。
要真正理解这一机制,我们需要了解一下:
脂肪是如何消化和吸收的?
当我们吃脂肪时,小肠中的特殊细胞会释放一种叫胆囊收缩素(CCK)的激素。胆囊收缩素刺激胆囊分泌胆汁进入小肠。在这里,胆汁酸包围脂肪分子,帮助它们变成水溶性的(就像洗洁精有助于乳化油一样)。
人体胆汁酸的肠肝循环
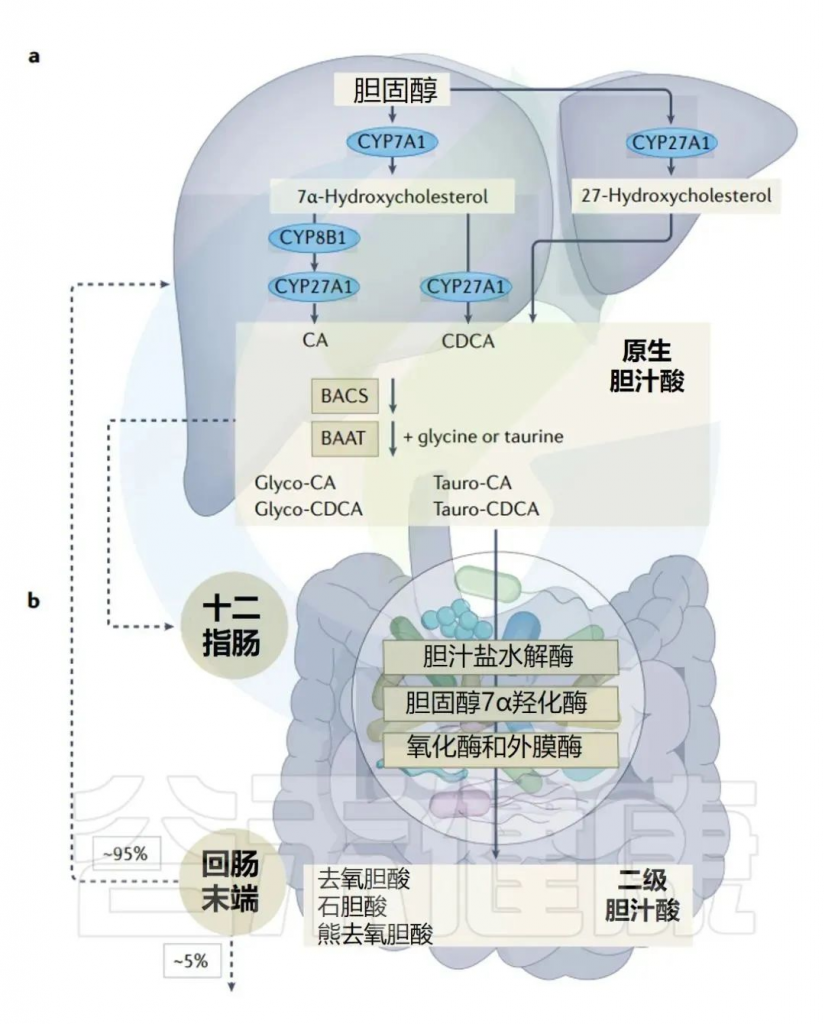
Collins SL,et al.Nat Rev Microbiol.2023
LPS的肠道吸收与运输
事实证明,LPS 对这些称为胶束的水溶性包裹具有很高的亲和力。胶束最终扩散到肠上皮,在那里它们的内容物(包括 LPS)被肠上皮细胞吸收。上皮细胞将脂质和脂多糖重新包装成乳糜微粒,然后乳糜微粒可以通过淋巴管(携带免疫系统淋巴的血管)输送到肝脏。
关于高脂饮食增加LPS吸收的思考
当我们摄入更多的长链脂肪酸时,我们的身体就会产生更多的乳糜微粒,因此更多的脂多糖可以以这种方式搭便车。事实上,富含脂肪的膳食已被证明可以适度增加小鼠和人类的血清 LPS 水平。
虽然这绝对是一个真实的现象并且值得考虑,但其实这个问题不大,原因如下:
LPS 吸收的增加可以减少肠道粘膜的炎症
首先,一些研究表明,乳糜微粒运输 LPS 可能具有优势,因为它有利于肝脏清除 LPS,从而降低 LPS 的毒性。此外,乳糜微粒还具有灭活 LPS 的先天能力。总而言之,LPS 吸收的增加可以减少肠道粘膜的炎症。
乳糜微粒诱导的 LPS 吸收与肠漏相比——小巫见大巫
这一点尤其重要,因为全身接触 LPS 的主要方式不是通过脂肪吸收,而是通过肠漏。当肠道具有渗透性时,大量脂多糖会渗漏到粘膜下层和血液中,引起局部肠道免疫反应和全身炎症。
换句话说,与完全的肠道通透性相比,乳糜微粒诱导的 LPS 吸收可能只是杯水车薪。事实上,对于那些患有严重肠道渗透性的人来说,乳糜微粒诱导的 LPS 解毒甚至可以减少炎症,足以促进肠道上皮的愈合。
生酮饮食的受试者全身炎症减轻
反过来说,如果脂肪诱导的 LPS 吸收是一个问题,那些食用高脂肪生酮饮食的人会出现全身炎症增加?
实际上相反,接受生酮饮食的受试者几乎普遍出现全身炎症减轻的情况。
不必担心高脂肪饮食缺乏丁酸盐或增加 LPS 的吸收。在下一节中,我们将了解胆汁酸如何促进肠道健康。
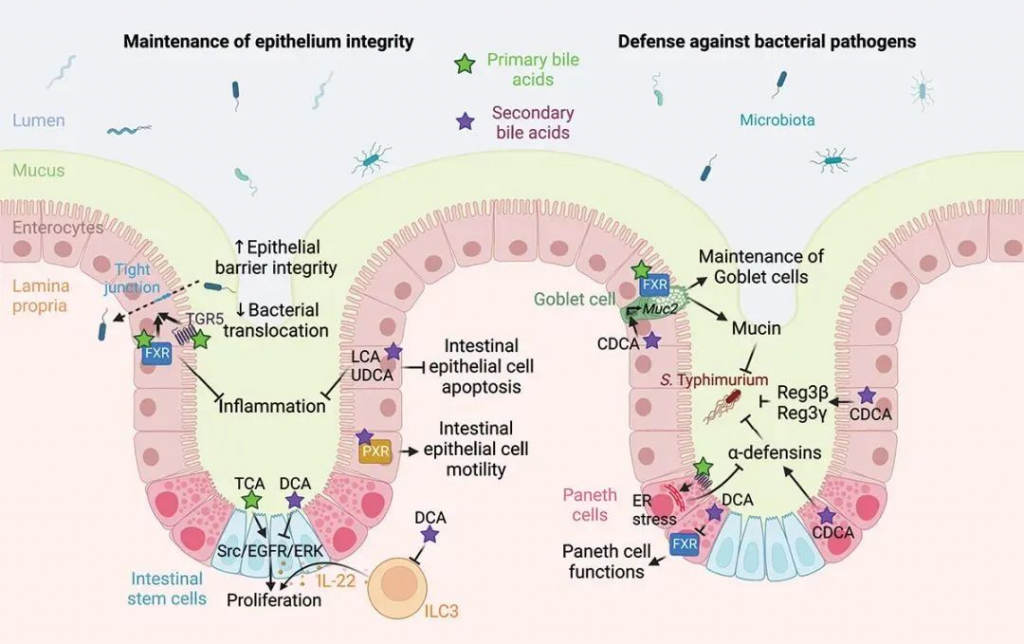
一些人还认为,高脂肪饮食可能对肠道微生物群和肠道屏障有害,因为它会刺激胆汁酸分泌增加。一般来说,吃的脂肪越多,释放到小肠的胆汁就越多。
事实上,一些研究表明,肠道屏障持续暴露于高浓度胆汁酸会导致肠道通透性增加。然而,生理剂量的胆汁酸已被证明可以支持屏障功能,诱导杯状细胞分泌粘液,促进上皮细胞迁移,并增强肠道先天免疫防御。
胆汁酸介导的肠道屏障功能调节
Larabi AB,et al.Gut Microbes.2023
胆汁酸还具有抗菌特性,有助于调节肠道微生物群,尤其可以防止小肠菌群失调。多项研究还表明,胆汁酸可激活肠内分泌细胞释放血清素,从而有助于促进肠道蠕动。
篇幅有限,每种类型的结合和解结合胆汁酸的来龙去脉就不详细阐述了,总的来说,没有足够的证据表明,生酮饮食中胆汁酸的生理增加对肠道微生物群或肠道屏障功能有害。
肉食动物饮食有时候被吹捧为治疗多种疾病的灵丹妙药。虽然全肉饮食作为短期治疗饮食可能是有益的,而且许多人的症状得到改善,但有关这种饮食方法的长期安全性的数据有限。
理论上,假设你从鼻子到尾巴吃遍动物的所有部分,从动物性饮食中获取所有营养素是可能的。有趣的是,上面提到的研究中的短期动物性饮食与维生素生物合成细菌基因表达的增加有关。作为低残渣饮食,肠道炎症的减少也可能在短期内改善营养状况。然而,我们对肉食动物饮食如何长期影响营养状况、激素、生育能力和甲状腺功能知之甚少。
此外,没有证据表明任何祖先只吃肉类或植物为生。即使是因纽特人和生活在极北纬度地区的其他人群,也会不遗余力地采集植物,或以其他方式提高他们的生育能力。
韦斯顿·普莱斯 (Weston A. Price) 在他的著作《营养与身体退化,原始与现代饮食及其影响的比较》中写道:
在北极圈附近驼鹿国家的印第安人中,六月份出生的孩子比例最高。
这是通过父母双方在雄性驼鹿从高山地区下来进入交配季节时,大量食用雄性驼鹿的甲状腺来实现的,此时喉咙下方携带甲状腺的大突起大大增大。
换句话说,这些文化有传统智慧,可以用其他动物的甲状腺进行自我用药,以弥补由于缺乏植物性食物而导致的生育能力下降。大多数现代“肉食动物”并没有这样做,许多人只吃肌肉。
话虽如此,相信在大多数情况下,治疗性生酮饮食可能同样有效,并且需要完全食肉来缓解症状,这是潜在肠道感染的一个迹象。一旦解决了这个问题,理想的饮食可能包括某种形式的植物性食物。
看到这里,希望你已经感觉到生酮饮食对于肠道健康来说一般没有什么可担心的。但这里确实有一个潜在的警告要聊,那就是硫化氢过度生长的个体。
硫化氢 (H2S) 是一种无色气体,通常在体内产生,在低浓度下可作为重要的信号分子。
哺乳动物细胞硫化氢的生物合成
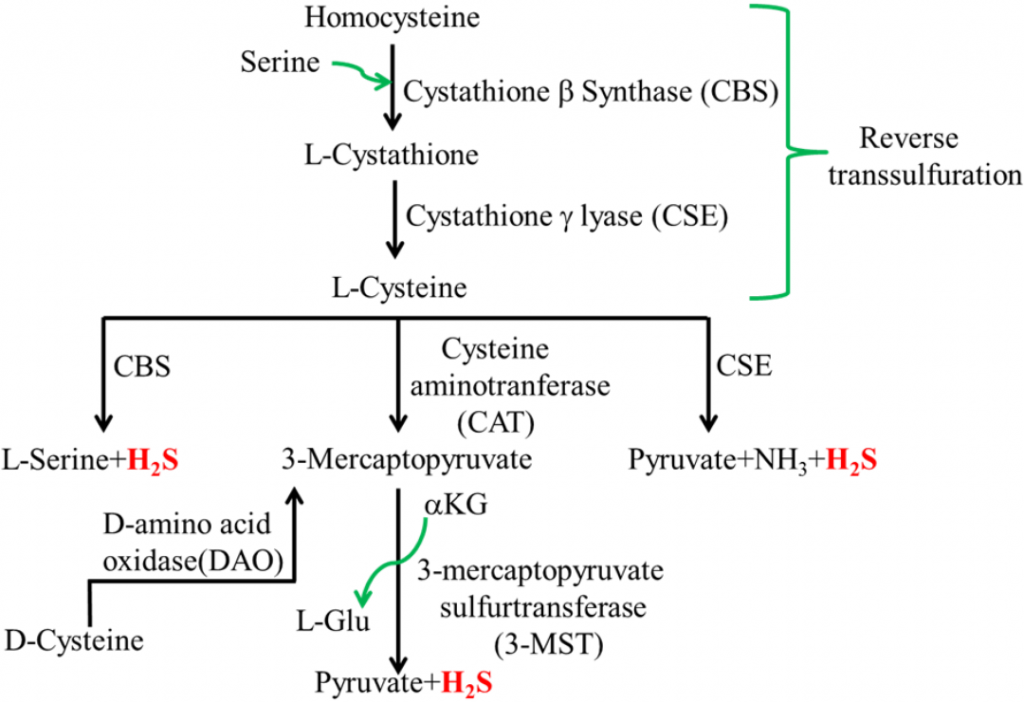
doi.org/10.3390/microorganisms3040866
然而,某些肠道细菌也会产生硫化氢,这些细菌的过度生长会导致硫化氢过量。H2S与腹泻、肠道过敏、IBS、IBD 和结直肠癌有关。
人类肠道中最常见的H2S产生者是Desulfovibrio、Bilophila wadsworthia和Fusobacter nucleatum。这些细菌往往在富含动物蛋白和脂肪的饮食中大量繁殖。
因此,如果有H2S过度生长,最好避免食用生酮饮食,解决了这个问题肠道重新平衡之后再尝试。
注:营养食品多酚(浆果提取物)可将H2S氧化为有效的抗氧化多硫化物,从而引发细胞保护作用。该机制表明,多酚会自动氧化为相应的半醌类物质,然后与H2S反应生成巯基,最终形成多硫化物和硫代硫酸盐。
那H2S过度生长的人适合什么饮食呢?一般来说,高纤维、以植物为主的地中海饮食实际上可能最适合。
扩展阅读:
总而言之, 没有明确的证据表明精心设计的高脂肪或生酮饮食对肠道微生物群或肠道屏障功能有害。事实上,生酮饮食带来的肠道微生物群和肠道屏障的变化甚至可能是我们从生酮饮食中看到如此多益处的原因。
此外,我们并不真正知道健康的肠道微生物群是由什么构成的,而酮和异丁酸酯可以取代丁酸。一些病例报告表明,生酮饮食可以减少 IBS 和 IBD 患者的炎症并改善生活质量。
这里强调的是,并不是说生酮饮食适合每个人。本文的目的并不是建议每个有肠道问题的人都去生酮饮食。只是对生酮饮食与肠道健康相关的证据进行更完整的讨论,让大家有个正确全面的认识。
就肠道健康而言,生酮饮食也有正确和错误的方法。下面两种饮食为肠道带来的治疗效果不同:
就此而言,以下是在食用高脂肪或生酮饮食时遵循肠道健康的一些建议:
1) 关注优质脂肪
如牛油果、牛油果油、橄榄油、多脂鱼、椰子油、放牧酥油、黄油、牛脂等。尽量摄入单不饱和脂肪、多不饱和脂肪和饱和脂肪的混合物。避免高度脂肪加工和精炼油,如菜籽油、玉米油和大豆油。

如果计划长期保持生酮饮食,建议在采用生酮饮食 1-2 个月后检查一下完整的心血管概况。一小部分人的低密度脂蛋白LDL数量会增加,可能需要调整脂肪摄入量或考虑改良生酮饮食,以确保他们不会增加心血管风险。
2)吃非淀粉类蔬菜
不一定需要丁酸盐并不意味着应该减少蔬菜的摄入量。尝试购买各种类型和颜色的生蔬菜和熟蔬菜。
3)多吃浆果
浆果是一种很好的低碳水化合物来源,提供益生元纤维,有助于促进有益细菌的生长。

4)喝咖啡,吃可可
多酚可促进有益细菌的生长,可以适量饮用咖啡和可可。具有严重肠漏或自身免疫性疾病的患者最初可能需要避免这些食物。
5)考虑营养密度,从头到尾吃
食用内脏、贝类、海鲜,并确保富含蛋氨酸的肌肉与富含甘氨酸的动物食品(如胶原蛋白和骨头汤)之间的平衡。
6)亲自实践找到最佳方案
了解生酮是否适合自己的最佳方法是尝试几周,看看感觉如何。特别注意自身能量、皮肤、情绪、生产力、消化、排便等方面。
7)灵活选择生酮饮食
没有必要无限期地处于生酮饮食状态。通过保持 20-120 克的碳水化合物摄入量(取决于自身活动水平),可以轻松地进入和退出生酮状态。实际上,这可能有助于肠道和微生物组保持最高的代谢灵活性。
全面的粪便测试是指除了标准粪便培养之外还可以提供有关肠道健康的更详细信息的任何测试。通常提供以下信息:
而肠道菌群检测使用更彻底的 DNA 测序来更细微地了解到菌属层面的肠道细菌的整体平衡。
谷禾肠道菌群检测还通过复杂的模型构建及大数据分析等方式解读人体健康状况,除了菌群详情之外,还包括疾病风险,营养构成,药物代谢等综合信息。
全面的粪便测试和肠道菌群检测都很有用,它们通常可以相互补充。
哪些人需要全面的粪便或肠道菌群检测?
如果感觉自己有以下症状或一些健康小问题,可能会需要肠道菌群检测:
消化问题、胃酸反流、胀气或腹胀、腹痛、便秘、腹泻、肠易激综合症、炎症性肠病、憩室炎、体重快速增加或减轻等。
患有肠道外其他症状的人也可以进行粪便和/或微生物组检测,例如:
食物不耐受、湿疹或荨麻疹、粉刺、情绪紊乱、抑郁或焦虑、疲劳、失眠、脑雾、关节疼痛、慢性鼻窦问题或过敏、哮喘、痛风等。
这些检测可以帮助自己了解肠道菌群的状况,为制定个性化的治疗方案提供重要参考。
主要参考文献
Singh SB, Lin HC. Hydrogen Sulfide in Physiology and Diseases of the Digestive Tract. Microorganisms. 2015 Nov 12;3(4):866-89.
Austin GL, Dalton CB, Hu Y, Morris CB, Hankins J, Weinland SR, Westman EC, Yancy WS Jr, Drossman DA. A very low-carbohydrate diet improves symptoms and quality of life in diarrhea-predominant irritable bowel syndrome. Clin Gastroenterol Hepatol. 2009 Jun;7(6):706-708.e1.
Cignarella F, Cantoni C, Ghezzi L, Salter A, Dorsett Y, Chen L, Phillips D, Weinstock GM, Fontana L, Cross AH, Zhou Y, Piccio L. Intermittent Fasting Confers Protection in CNS Autoimmunity by Altering the Gut Microbiota. Cell Metab. 2018 Jun 5;27(6):1222-1235.e6.
Zambrano-Zaragoza JF, Romo-Martínez EJ, Durán-Avelar Mde J, García-Magallanes N, Vibanco-Pérez N. Th17 cells in autoimmune and infectious diseases. Int J Inflam. 2014;2014:651503.
Olson CA, Vuong HE, Yano JM, Liang QY, Nusbaum DJ, Hsiao EY. The Gut Microbiota Mediates the Anti-Seizure Effects of the Ketogenic Diet. Cell. 2018 Jun 14;173(7):1728-1741.e13.
David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, Biddinger SB, Dutton RJ, Turnbaugh PJ. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014 Jan 23;505(7484):559-63.
Jiang W, Chen J, Gong L, Liu F, Zhao H, Yan Z, Li Y, Zhang J, Xiao M, Mu J. Microbiota-derived short-chain fatty acids may participate in post-stroke depression by regulating host’s lipid metabolism. J Psychiatr Res. 2023 May;161:426-434.
Clemens Z, Kelemen A, Fogarasi A, Tóth C. Childhood absence epilepsy successfully treated with the paleolithic ketogenic diet. Neurol Ther. 2013 Sep 21;2(1-2):71-6.
Sasaki K, Sasaki D, Hannya A, Tsubota J, Kondo A. In vitro human colonic microbiota utilises D-β-hydroxybutyrate to increase butyrogenesis. Sci Rep. 2020 May 22;10(1):8516.

谷禾健康
在过去几十年中,人类的饮食行为发生了巨大的变化。传统的早餐-午餐-晚餐模式已被频繁的小吃、夜间大餐和不吃早餐所取代。这种不规律的饮食模式可能对心血管代谢疾病风险产生不利影响,如肥胖、胰岛素抵抗、高血糖症、2型糖尿病等。
间歇性禁食已被越来越多的人认为是一种有前途的治疗心血管代谢疾病(CMD)的方法。一些神经科学家认为,我们的身体已经进化到能够不吃东西几个小时,甚至几天。
进食时机和频率可以一定程度上改善生活方式和心血管代谢,防止2型糖尿病和心血管疾病的发生。
间歇性禁食(IF),包括周期性禁食和限时饮食(TRF)等开始越来越流行。

本文讨论肠道微生物组的组成和功能改变,对代谢、高血压、2型糖尿病、肥胖症及其长期微血管和大血管并发症发展的风险之间潜在联系的新证据,同时也包括间歇性禁食的安全性,将间歇性禁食融入日常生活的建议等。
本文关键词

间歇性禁食在进食和禁食之间循环,通常是只能在特定时间进食,比如通过每周12小时至几天的限制进食。它关注的不是吃什么,而是在什么时间段内可以吃。
在食物缺乏的时间内,人体新陈代谢通过产生和利用脂肪酸衍生的酮,以及通过自噬增加细胞水平的营养循环,将脂肪从储存转换到动员。
注:脂肪动员是指储存在脂肪细胞中的脂肪,被脂肪酶逐步水解为游离脂酸(FFA)及甘油并释放入血液,被其他组织氧化利用的过程。
目前已有许多研究表明,间歇性禁食在减轻体重、改善葡萄糖稳态和血脂以及抗炎作用等方面都带来益处。
间歇性禁食包括以下几种常见的方式:
隔日禁食(ADF)
在某一天规律进食和第二天不进食之间进行交替。
周期性禁食(5:2天)
5:2天的进食也称为周期性禁食,其特征是一周两天极度限制或完全禁食,而一周其他五天可以不受限制地进食。
模拟禁食的饮食(FMD)
定期禁食的一种变体,特点是连续几天低热量摄入周期,然后每一到四个月或每隔一周进行一次正常的饮食循环。
限时饮食(TRF)
不那么极端的饮食,将每天的食物摄入量限制在4-12小时内,例如,分别在12:12小时或16:8小时(禁食:进食),包括斋月期间的禁食。
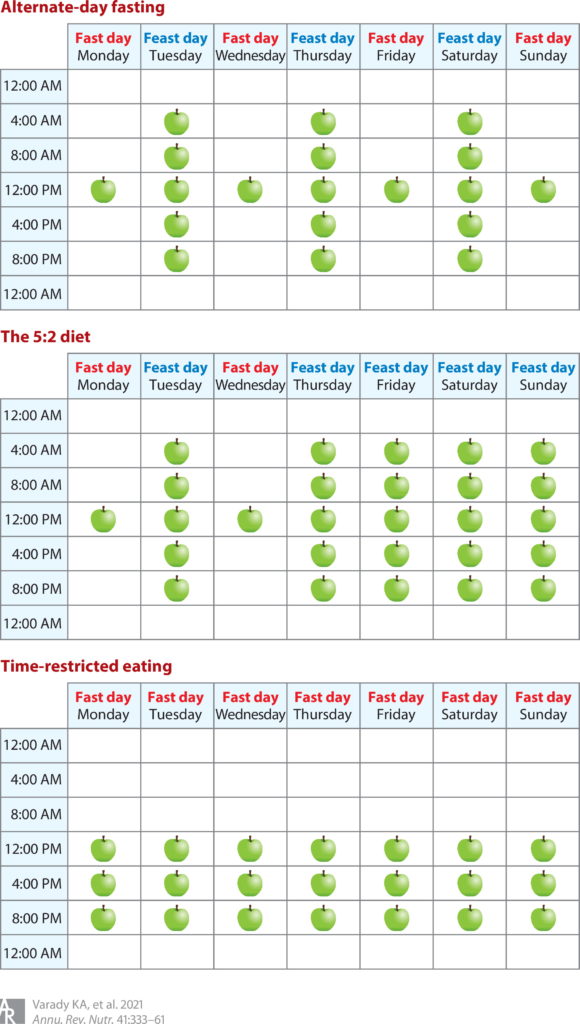
此图概述了一周中每一天的隔日禁食、5:2 饮食和限时进食 (TRE)(此处显示 8 小时 TRE)期间的食物摄入时间。食物摄入时间用苹果图标表示。
临床上对间歇性禁食的研究结果不一致:
几项临床研究表明,间歇性禁食可延长预期寿命并提供广泛的益处,包括减轻肥胖、高血压、2型糖尿病和心血管疾病。
然而,其他研究发现,特定时间的饮食在改善心血管和代谢结果方面并不优于控制能量的饮食。
因此,禁食和进食期间代谢转换的机制值得进一步研究。
最近,间歇性禁食已被证明会影响肠道菌群,几乎涉及宿主生理学的所有方面,这表明间歇性禁食生理影响的全新机制。
人类研究中,关于禁食对肠道菌群的影响

Angoorani P, et al.,Nutr Metab (Lond). 2021
本小节重点介绍一些关于肠道微生物组在间歇性禁食中作用的显著发现,肠道微生物组反过来影响心血管疾病相关的代谢表现,如肥胖、高血糖、高血压等。
我们知道,体重增加是由于过多的能量摄入加上较低的能量消耗,这通常是由体内脂肪的积累造成的。脂肪积累会对心血管系统造成严重的威胁。
关于肥胖与菌群的关系详见我们之前的文章:
体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
对人体随机对照试验的Meta分析表明,每周定期禁食2-3天的间歇性能量限制可改善超重和肥胖使体重减轻,降低体脂。这些改善的重要贡献可归因于肠道微生物群对脂质代谢和能量平衡的影响。
其中一种机制涉及脂肪组织,这是一种对营养刺激敏感并在间歇性禁食期间经历动态重塑的异质器官。
在哺乳动物中发现了两种不同形式的脂肪组织:
▸ 肠道菌群在隔日禁食介导的代谢改善中具有因果作用
喂食高脂肪食物并接受隔日禁食方案的肥胖小鼠在WAT中表现出白色脂肪积累增加,同时伴有体重减轻和肠道微生物组组成改变。
值得注意的是,向接受隔日禁食的肥胖小鼠补充抗生素消除了隔日禁食的有益代谢作用,并且将 隔日禁食小鼠的粪便移植到抗生素治疗的肥胖小鼠的粪便改善了代谢健康,表明肠道微生物组在隔日禁食介导的代谢改善中具有因果作用。
间歇性禁食介导的肠道微生物群调节宿主能量代谢的积极作用
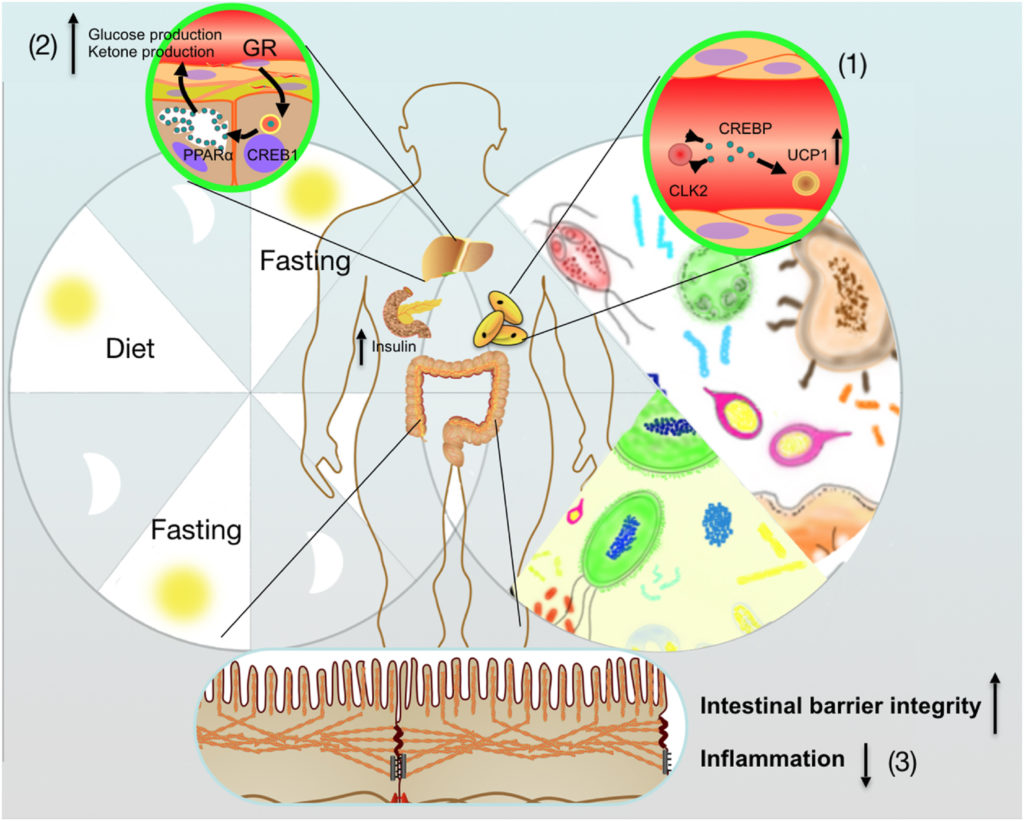
Rong B, et al.,Anim Nutr. 2021
(1) 间歇性禁食通过改善肠道菌群,促进WAT米色脂肪组织
(2) 在不摄入营养期间,肠道微生物群参与增加肝酮的产生
(3) 间歇性禁食优化的微生物群还负责保护宿主肠道屏障
▸ 隔日禁食诱导多种肠道细菌产生乙酸和乳酸
将盲肠代谢组学与Shotgun宏基因组学相结合,发现隔日禁食会导致肠道微生物群的组成发生变化,从而导致产生乳酸和乙酸的细菌(如罗伊氏乳杆菌)发生变化,进而导致血清乳酸和乙酸的积累。
关于罗伊氏乳杆菌详见:认识罗伊氏乳杆菌(Lactobacillus reuteri)
隔日禁食还通过促进米色脂肪生成来增加能量消耗,并改善体重增加和其他代谢紊乱。
在另一项研究中,仅在喂食正常饲料的小鼠中,乳酸杆菌水平在隔日禁食喂养的小鼠身上重复升高,而Allobaculum属则只在隔日禁食和高脂肪饲料的小鼠中富集。Allobaculum属是一种活性的葡萄糖代谢产物,能产生丁酸盐和乳酸盐。
这些结果表明,隔日禁食诱导多种肠道细菌产生乙酸和乳酸。然而,还需要更多的研究来确定乳酸和短链脂肪酸对WAT褐变以及对宿主产热和能量消耗的影响。
肠道微生物群的变化除了影响脂肪细胞产热之外,也可能影响适时进食过程中的脂质摄取。
控制宿主昼夜脂质吸收可能通过以下几种机制发生:
▸核因子白细胞介素-3 (NFIL3)的调节
核因子白细胞介素-3是一种受昼夜节律控制的转录因子,调节参与肠上皮细胞中脂质的摄取、加工和储存的基因的节律性表达。
NFIL3中的节律振荡由肠道微生物组通过激活先天免疫细胞反应驱动。
▸组蛋白脱乙酰酶3(HDAC3)的调节
刺激HDAC3的节律性表达和向染色质招募导致肠上皮组蛋白乙酰化的同步昼夜振荡,这反过来调节营养转运蛋白的基因表达,从而影响营养物质摄取和脂质吸收。
总的来说,肠道微生物群通过调节控制脂质和营养摄入的基因,以及通过产生影响脂肪组织的微生物代谢物来影响能量代谢。
间歇性禁食导致肠道微生物组分和功能的改变,这反过来可能影响心血管代谢健康
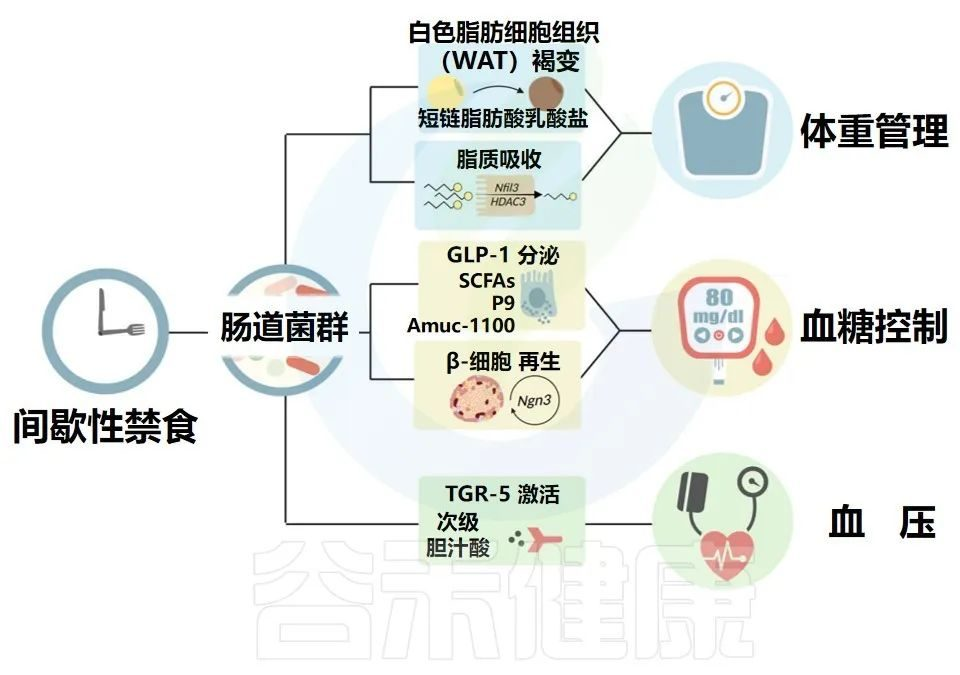
Karina R,et al.Rev Art Jou of Dia.2022
肠道微生物群驱动的WAT褐变和脂质吸收有助于体重管理。微生物通过GLP-1分泌和β细胞再生对血糖控制的影响。
微生物衍生的次级胆汁酸激活TGR-5以控制血压。
对啮齿动物和猴子的研究表明,间歇性禁食对血糖控制具有持续的有益作用。
肠道微生物组分与血糖水平相关,并适应日常生活中的禁食和再喂养期,包括昼夜饮食模式和限时饮食(例如,作为宗教禁食的一部分)。
在小鼠中,乳酸杆菌属在禁食期间高度富集,而Akkermansia muciniphila在喂养期间高度富集。除了昼夜变化外,A. muciniphila在接受限时饮食的人和小鼠体内都显著扩增。
▸A. muciniphila的增加如何在血糖控制中发挥作用?
这些成分的变化很有趣,因为A. muciniphila 与啮齿动物和人类的血糖水平呈负相关。
此外,A. muciniphila的增加与GLP-1的分泌增强有关,GLP-1是一种促胰岛素激素,由肠内分泌L细胞分泌,对膳食作出反应,并在全身血糖控制中发挥关键作用。
▸ 微生物群的昼夜变化 & GLP-1的昼夜分泌
GLP-1的分泌遵循昼夜节律,在活动期葡萄糖负荷后,餐后GLP-1水平较高,而在静息期,GLP-1水平较低,此外还受L细胞时钟机制的调节。
在喂食西方饮食的肥胖小鼠和缺乏微生物组的小鼠中,GLP-1的波动性分泌减弱。这项研究表明,通过将食用正常食物的常规小鼠的粪便微生物群转移到肥胖小鼠中,可以恢复无菌小鼠GLP-1的昼夜节律。
间歇性禁食、肠道微生物群和昼夜节律之间的多向关系
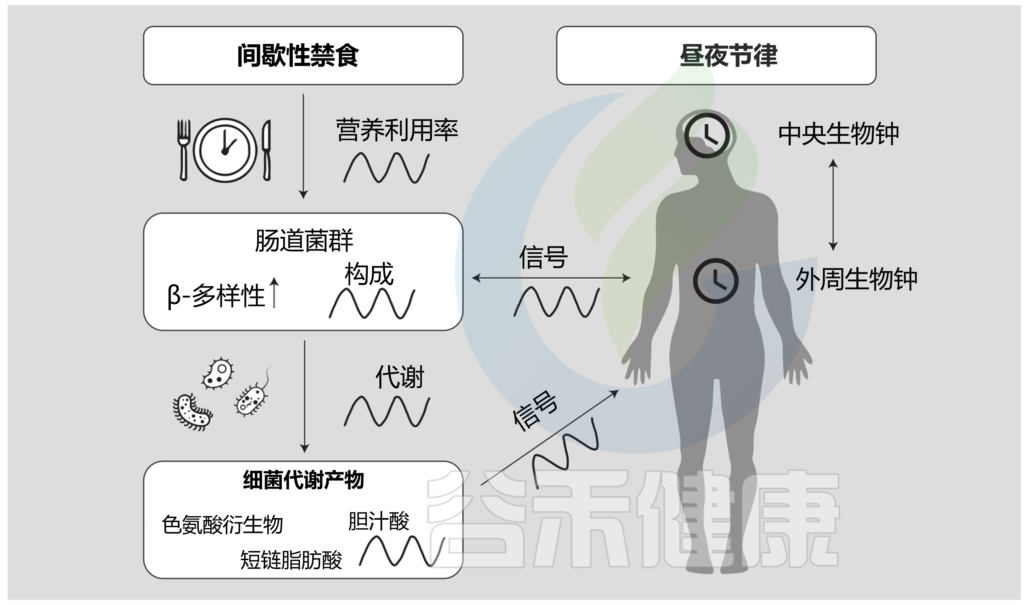
Daas MC, et al.,Benef Microbes. 2021
这些结果表明,微生物群的昼夜变化可能在GLP-1的昼夜分泌及其对葡萄糖稳态的后续影响中起着核心作用。至于机制,最近的研究已经确定了由A. muciniphila产生的几个假定的生物分子,它们可以触发肠L细胞分泌GLP-1。其中,丙酸盐和蛋白P9和Amuc-1100可刺激L细胞分泌GLP-1。
▸ 间歇性禁食改善血糖调节和2型糖尿病
给予肥胖和高血糖小鼠或缺乏瘦素受体的糖尿病db/db小鼠间歇性禁食或模拟禁食的饮食(FMD),可分别改善血糖控制和2型糖尿病。
模拟禁食的饮食有益于葡萄糖稳态的一个主要潜在机制包括神经生长素3(Ngn3)的激活,Ngn3是产生胰岛素的β细胞发育所必需的转录因子。β细胞的再生发生在暴露于间歇性模拟禁食的饮食后,并表明其遵循肠道微生物群的重组,这与db/db小鼠的血糖水平相关。
根据粪便微生物群的16S rRNA测序,
模拟禁食的饮食增加了下列菌的丰度:
模拟禁食的饮食降低了下列菌的丰度:
这与低血糖水平相关。
在此背景下,发现在模拟禁食饮食中具有较高丰度的Blautia,在糖尿病大鼠经2型糖尿病药物治疗后相对增加。
总之,营养时间对肠道微生物群、GLP-1分泌以及β细胞增殖的影响可能有助于改善血糖控制和胰岛素敏感性,从而为基于饮食和微生物群的2型糖尿病治疗潜力提供理论基础。与间歇性禁食对啮齿动物β细胞再生的影响一致,人类随机临床试验表明,与每日热量限制的匹配组相比,定期禁食(5:2饮食)对空腹胰岛素的影响更为显著。
有几个迹象表明,间歇性禁食和进餐时间可能有助于改善小鼠和人类的高血压。
不过间歇性禁食的有效性仍有争议,但DASH饮食(阻止高血压的饮食方法)提供了一种可以降低高血压的低钠饮食。
最近的一项研究表明,在高血压代谢综合征患者中,五天禁食后进行改良DASH饮食可以降低收缩压。
▸ 五天禁食通过改变肠道菌群影响血压
这种禁食还改变了肠道微生物群,包括一些与短链脂肪酸产生相关的菌群和基因。
使用对基线微生物组数据的机器学习分析来预测持续的收缩压反应,确定以下菌群为控制高血压的潜在贡献菌:
在大鼠中,五周的隔日禁食治疗可显著降低易患高血压卒中动物的血压。这种表型变化伴随着微生物组结构的改变,包括下列菌升高:
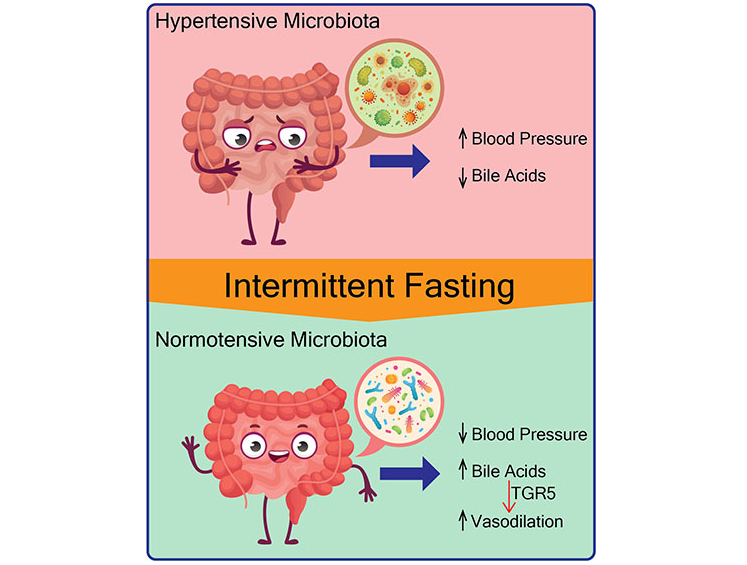
Shi H, et al.,Circ Res. 2021
▸ 隔日禁食饮食的调节血压机制
从机理上讲,隔日禁食饮食与微生物向产生次级胆汁酸的细菌转移有关,包括共轭和非共轭的二级胆汁酸(如牛磺胆酸、牛磺脱氧胆酸、牛磺脱氧胆酸[TUDCA]、LCA、甘鹅脱氧胆酸等),以及胆汁酸受体TGR5的激活。
此外,用胆酸或TGR5激动剂治疗这些高血压大鼠可降低血压,从而超过隔日禁食的需要。
从隔日禁食喂养的大鼠到无菌大鼠的粪菌移植可防止收缩压升高,表明肠道微生物群在降低血压方面的因果作用。
进一步的研究需要确定对次级胆汁酸产生反应的靶组织和细胞类型,以及这些胆汁酸诱导的导致血压下降的细胞途径。此外,还需要更多的试验来确定不同的间歇性禁食在降低各种心血管代谢紊乱患者血压方面的疗效和可持续性。
心血管代谢疾病是一种进行性疾病,具有长期和毁灭性的后果。
2型糖尿病患者的常见表现是微血管并发症,包括视网膜病和肾病以及心血管疾病。作为营养疗法的一部分,间歇性禁食已经成为治疗2型糖尿病几种长期并发症的潜在干预措施,包括视网膜病、认知能力下降、心力衰竭和肾病。
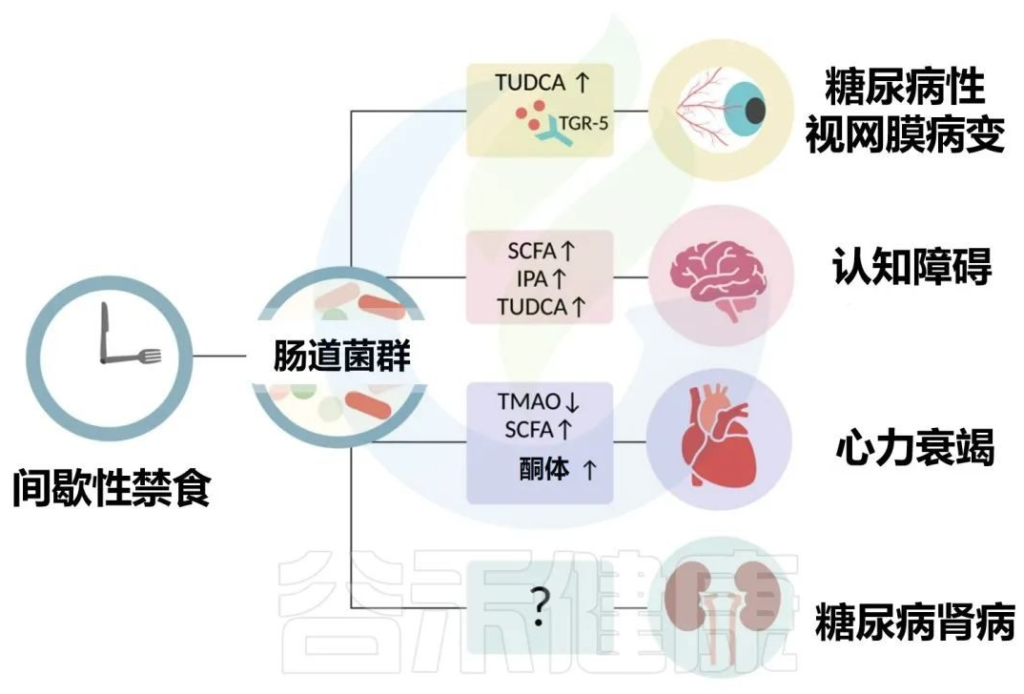
Karina R,et al.Rev Art Jou of Dia.2022
糖尿病性视网膜病变是2型糖尿病的一种并发症,它会影响视网膜的血管,并可能导致未经治疗的个体失明。
幸运的是,通过早期检测和及时治疗可以控制血糖水平和血压,可以降低糖尿病性视网膜病变导致的失明风险。
▸ 糖尿病性视网膜病变的菌群变化
以下三者之间的肠道微生物群存在显著差异:
比如说,研究人员Das等人发现,糖尿病视网膜病变患者中菌群变化:
在这项观察性研究之后,其他研究人员提出了肠道微生物组作为糖尿病视网膜病变鉴别生物标志物的潜在用途,并发现以下细菌是区分2型糖尿病患者和糖尿病视网膜病变患者的主要生物标志物:
这可能有助于视网膜病变的诊断。
其中,巴氏杆菌科在患有视网膜病的2型糖尿病患者中特别减少,这种细菌的减少可以作为该疾病的预测生物标志物。
▸ 隔日禁食干预后,糖尿病小鼠的菌群变化
研究人员使用糖尿病小鼠(db/db)比较了隔日禁食喂养的小鼠与随意喂养的小鼠糖尿病视网膜病变的经典标志物,发现隔日禁食方案阻止了无细胞视网膜毛细血管数量的增加,并减少了炎性细胞对视网膜的浸润。
隔日禁食的糖尿病小鼠具有厚壁菌门显著扩张的特征,更具体地说,在属的水平上,下列菌群丰度增加:
下列菌群减少:
随着肠道微生物组组成的变化, 作者观察到,与非糖尿病小鼠相比,糖尿病小鼠表现出昼夜微生物模式的差异,这种差异也在对隔日禁食的反应中发生了改变。
▸ 隔日禁食引起的代谢变化,有助于改善及诊断视网膜病变
值得注意的是,隔日禁食仅在糖尿病小鼠中增强了初级至次级胆汁酸的代谢,如TUDCA。
TUDCA的受体TGR5在视网膜神经节细胞中表达,这表明TUDCA的微生物生产可能会潜在地影响视网膜。
给糖尿病小鼠补充TGR5的强效激动剂导致糖尿病视网膜病变减少,其特征是视网膜炎症减少和无细胞毛细血管减少。
因此,隔日禁食可能导致次级胆汁酸的肠道细菌生产发生改变,激活视网膜TGR5,防止视网膜变性。
综上所述,这些结果表明,如果隔日禁食等干预措施可能导致肠道微生物群和代谢物的独特改变,这可能有助于视网膜病的诊断,并可能潜在地改善糖尿病视网膜病变。
▸ 2型糖尿病 → 认知障碍
2型糖尿病可引起明显的中枢神经系统并发症,包括结构改变或脑萎缩、脑微血管损伤、神经炎症以及最终导致认知缺陷的脑电生理特性改变。
随着时间的推移,这些认知和大脑结构的改变可能会导致认知能力的加速下降,并增加老年痴呆症等与年龄相关的神经退行性变的风险。
多项因素会导致糖尿病认知障碍,包括大脑胰岛素抵抗和葡萄糖摄取降低以及神经递质代谢紊乱。在动物模型中,各种类型的间歇性禁食有益于大脑健康,延缓神经退行性疾病的发展。
▸ 肠道菌群在调节隔日禁食诱导的认知功能中发挥作用
在隔日禁食治疗糖尿病db/db小鼠期间,肠道微生物组与认知功能之间存在联系。
糖尿病小鼠表现出认知能力下降,但28天的隔日禁食方案改善了焦虑行为、运动活动和突触结构,同时保护了海马中的胰岛素信号和线粒体生物生成。
隔日禁食干预小鼠组脑功能的改善伴随着下列菌群增加:
下列菌群减少:
抗生素治疗后,隔日禁食对糖尿病小鼠认知功能的保护作用被部分消除。学者发现隔日禁食组的初级和次级胆汁酸生物合成途径丰富。
▸ 菌群代谢物在调节隔日禁食诱导的认知功能中发挥作用
此外,db/db隔日禁食小鼠组的粪便和血浆中几种微生物相关代谢物的水平升高,其中包括短链脂肪酸、TUDCA(也可预防视网膜病变的次生胆汁酸)、吲哚-3-丙酸(IPA)和血清素。
补充这些代谢物可改善db/db小鼠的认知功能和胰岛素敏感性。
总的来说,隔日禁食诱导的肠道细菌种类和代谢物可能有助于减轻糖尿病诱导的认知障碍,并表明即使在没有隔日禁食的情况下,细菌代谢物也可能调节大脑功能的特征。
胰岛素抵抗的小鼠模型表明,如TRF和FMD等饮食方式可以改善高血压、血脂异常、高血糖和高胰岛素血症,所有这些都是心血管健康的一般指标。
▸心力衰竭与肠道菌群联系的证据
多项研究表明,心力衰竭患者肠道微生物群的组成发生了改变。对Dahl盐敏感大鼠进行的一项研究表明,补充益生菌植物乳杆菌可降低其对心力衰竭的易感性,并可在心肌梗死后更好地恢复。
已经提出了几种机制来解释肠道微生物组与心力衰竭之间的潜在联系,包括微生物组诱导的炎症调节、肠道通透性以及与细菌过度生长和细菌生物膜形成的关联。
▸肠道菌群影响心血管健康的机制:增加短链脂肪酸产生菌,为心脏提供能量
在几项研究中,在心力衰竭患者中也检测到几种病原菌的扩增。一项研究揭示了间歇性禁食对心脏的益处,提出肠道微生物群可以产生短链脂肪酸,在禁食期间为心脏提供充足的能量。
与常规小鼠相比,无菌小鼠的肝脏酮体生成量减少。根据这项研究,禁食与更高丰度的拟杆菌有关,这些拟杆菌可能负责产生短链脂肪酸,尤其是乙酸盐,可用于肝脏生酮,从而为心脏提供能量来源。
▸肠道菌群影响心血管健康的机制:TMAO降低
一项开创性研究表明,肠道微生物代谢膳食胆碱和左旋肉碱产生TMA,TMA被宿主肝脏转化为 TMAO.
研究发现,TMA-TMAO通路与动脉粥样硬化、血小板过度活跃和血栓形成有关,并用于预测心血管疾病风险的增加。
禁食影响肝脏代谢,与TMAO降低有关。此前有研究表明,维持低水平的TMAO可能对预防2型糖尿病相关的心肌病特别有帮助。
最近,在白天和夜间的db/db小鼠中发现TMAO水平升高,这与各种肠道细菌的昼夜振荡消失有关。作者建议,可以通过限制活跃期的摄食来恢复失去的细菌的昼夜振荡。
根据啮齿类动物的研究结果,间歇性禁食是否能够利用肠道微生物群,调节氧化三甲胺水平,并导致2型糖尿病患者心血管预后的有效改善,仍有待确定。
糖尿病可能导致肾功能障碍或肾病。在糖尿病患者中,血糖控制不良和高血压可导致肾小球滤过、蛋白尿、肾病性蛋白尿,并发展为终末期肾脏疾病。
多项研究表明,糖尿病肾病患者的肠道细菌丰度发生改变,总体上较低的细菌多样性与疾病进展相关。
在啮齿类动物中,糖尿病肾病与菌群及其代谢物(如苯基硫酸盐)的改变有关,并与肾素-血管紧张素系统的激活相关。
已有多项观察性研究测试了斋月禁食对糖尿病肾病严重程度的影响,但没有一项研究显示肾功能有显著变化。这些报告不是随机对照研究,样本量小,并且包含使用不同药物或透析治疗的患者。
目前,间歇性禁食对肾功能和糖尿病肾病的疗效以及肠道菌群在这一过程中的作用尚未阐明。
间歇性禁食除了前面章节提到的,通过脂质代谢来调节能量平衡从而减轻肥胖之外,还可以改善食欲调节,促进减肥。
▸ 三项短期研究评估:间歇性禁食增加饱腹感
在为期8周的ADF试验中,从基线检查到治疗后,主观饥饿感保持不变,饱腹感水平增加。这些饱腹感的增加与肽YY(PYY)的增加平行,肽YY是一种有效的饱腹激素。然而在任何时间点,饱腹感和PYY的变化与体重减轻或静息代谢率无关。
其他研究也有类似的发现。12周ADF后,肥胖受试者的饥饿感未受影响,饱腹感显著增加。饱腹感增加与体重减轻之间没有显著关系。
研究人员比较了ADF和每日卡路里限制对体重减轻后食欲的影响(比基线降低5%)。饥饿感在两组中都有类似的下降,但饱足指数保持不变。
▸ 一项长期研究评估:间歇性禁食对食欲调节没有长期有益影响
Kroeger等人进行的一项为期12个月的试验表明,ADF期间体重下降不理想和饮食依从性差与食欲没有任何有益变化有关。
总之,对ADF的短期研究表明,主观食欲有所改善(最常见的是饱腹感增加),而对ADF的长期研究表明,在食欲调节方面没有长期的益处。这方面还需要更多的研究。
目前似乎还没有任何人体试验检测ADF或5:2饮食对睡眠的影响,但有几项研究测试了限时进食对睡眠的影响。
▸三个限时进食试验:限时进食期间睡眠质量无变化
研究一:经过8周的4小时或6小时限时进食后,睡眠质量没有改变。
研究二:观察到8小时限时进食治疗12周后对睡眠质量没有影响。
研究三:10周10小时限时进食后,睡眠质量没有变化。
虽然这一初步证据表明,限时进食不会影响睡眠质量,但应该注意的是,这些研究的参与者基本上都是良好的睡眠者。因此,通过干预,他们的睡眠质量没有进一步改善,这并不奇怪。
▸限时进食不会影响睡眠时间
限时进食是否会改变睡眠时间也已得到评估。
前面的研究指出,4小时或6小时限时进食的睡眠时间没有变化。同样,8小时和9小时限时进食的睡眠时间保持不变。
然而,大多数参与者的平均睡眠时间为每晚约7小时,这符合国家睡眠基金会规定的最低7小时。这些受试者已经有足够的睡眠时间,这可以解释为什么限时进食不会影响睡眠时间。
▸限时进食可能改善睡眠
研究还评估了限时进食对失眠严重程度的影响。
研究人员推测,睡前禁食2-3小时可能会改善睡眠。更具体地说,睡前不吃脂肪和酸性食物可以减少胃酸反流和夜间胃灼热,这可能有助于降低失眠率。
在6小时限时进食研究中,受试者在基线检查时表现出阈下失眠症,到8周试验结束时,没有出现具有临床意义的失眠症。
相比之下,对于基线检查时无临床意义失眠的受试者,4小时和8小时限时进食对失眠严重程度没有影响。
综上所述,这些发现表明,对于已经显示出健康睡眠习惯的受试者来说,使用限时进食进行轻度减肥不会影响睡眠质量或睡眠时间。相比之下,限时进食可能有助于减轻受这种情况困扰的人的失眠严重程度。需要更多的研究来证实这些初步发现。
间歇性禁食虽然带来以上种种益处,但其安全性一直受到质疑。有些人对胃肠道问题、能量水平紊乱、饮食失调症状和激素紊乱的发生率增加表示担忧。这些饮食是否会对饮食质量产生负面影响也是一个问题。
人体试验的结果表明,禁食通常不会产生任何长期的胃肠道不良反应,例如便秘、腹泻、恶心、口干或口臭。不过早期的 6 小时限时进食导致了一些轻微的呕吐和腹泻病例。
最近的几项试验证明了,间歇性禁食也不会导致易怒、疲劳或头晕的程度增加。因此,迄今为止的研究结果表明,间歇性禁食几乎不会产生胃肠道问题或能量水平紊乱。
禁食因可能增加饮食失调风险而受到质疑。
来自 ADF 和限时进食研究的最新数据表明,这类饮食不会增加抑郁、暴饮暴食、通便行为或对肥胖的恐惧的发生率。
事实上,一项研究表明,ADF 可能对身体形象感知产生很小的有益影响。ADF 的这些发现与每日卡路里限制的发现相当。
在减少能量摄入的长期影响综合评估 (CALERIE) 试验中,将能量限制 25% 不会增加饮食失调症状,也没有其他有害的心理影响。
因此,间歇性禁食,也和卡路里限制一样,不会增加饮食失调症状,并且对身体形象感知具有良性或有益的影响。
然而,应该指出的是,这些研究排除了有饮食失调史的参与者。对于诊断为饮食失调的人来说,间歇性禁食是否安全仍然未知。
▸甲状腺激素
在健康人群和亚临床甲状腺功能减退人群中,研究了禁食期间甲状腺激素水平的变化。
招募年轻男性运动员参加8小时限时进食与阻力训练相结合的试验。8周后,血浆总三碘甲状腺原氨酸(T3)略有下降,但促甲状腺激素(TSH)无明显变化。在这些受试者中未观察到体重变化。游离甲状腺素(fT4)的变化没有报道,因此很难确定限时进食是否破坏这些甲状腺功能正常受试者的T3:fT4比率。
其他研究人员比较了ADF和每日卡路里限制对肥胖和亚临床甲状腺功能减退患者甲状腺水平的影响。24周后,ADF和卡路里限制(8%)同样降低体重,循环fT4、T3和TSH保持不变。这些试点数据表明,在间歇性禁食期间,瘦人的T3水平可能会略有降低,但这些影响不会发生在肥胖和亚临床甲状腺功能减退的人身上。
▸ 生殖激素
在 5:2 禁食 24 周后,绝经前妇女的睾酮、雄烯二酮、脱氢表雄酮硫酸盐、性激素结合球蛋白或催乳素没有变化。
相比之下,在 8 小时限时进食 8 周后,年轻男性的游离和总睾酮浓度降低。合成代谢激素睾酮的减少并没有导致身体成分的任何有害变化或肌肉力量的损害。
由于缺乏这方面的数据,因此很难就禁食对生殖健康的影响得出结论。此外,这些变化如何影响生育能力仍然未知,因为没有研究测试过这些饮食对男性和女性怀孕能力的影响。
据推测,在限时进食期间限制进食时间窗口期会导致高能量食物的消耗增加和补偿性地多喝(即,增加无糖苏打水和咖啡因的摄入)。
研究人员评估了4小时和6小时限时进食期间饮食质量的变化。
▸ 纤维摄入量偏少
8周后,4小时和6小时限时进食组的糖、饱和脂肪、胆固醇和钠摄入量与对照组相比没有显著差异。然而,限时进食受试者纤维摄入量远远低于(∼10-15克/天)在基线检查和治疗后的推荐量[25-38克/天]。ADF和5:2饮食试验中也经常报告纤维摄入不足。
▸ 饮料、酒等摄入量没有变化
至于饮料摄入,8周后,4小时限时进食、6小时限时进食和对照组的饮食苏打水、含咖啡因饮料(即咖啡、茶和能量饮料)和酒精的摄入没有差异。
作为这些发现的补充,一项为期一年的ADF试验报告称,饮料摄入量没有变化。
这些初步发现表明,间歇性禁食不会对饮食质量或饮料摄入产生不利影响。然而,应在间歇禁食期间向受试者提供膳食咨询以增加纤维摄入量,以确保肠道健康。
▸ 间歇性禁食并不代表胡吃海喝
重要的是,个人应注意间歇禁食期间的饮食质量。诚然,这些方案要求个人更多地关注用餐时间,而不是所摄入的营养素类型。虽然如此,临床医生应该向患者明确指出,进食窗口时间并不能让患者完全不考虑健康影响,彻底放纵自己乱吃。
为了使这些方案成为改善健康的可持续解决方案,应鼓励间歇性禁食的人食用水果、蔬菜和全谷物含量高、加工食品含量低的饮食。
本章节总结了一些关于如何开始禁食方案,以及如何将这些方法融入日常生活的实用建议。同时,就哪些人不应该使用间歇性禁食来控制体重提供建议。
对于大多数人来说,大约需要1-2周才能完全适应这种新的饮食模式。
据报道,在初期可能会出现头晕,头痛和便秘,但这些不良反应通常在禁食第二周后消退。
头痛通常是由于水分摄入不足导致脱水,当食物受到限制时可能会发生脱水。增加饮水量(每天增加1.5升)可能有助于个人在禁食期间缓解头痛。
与普遍的看法相反,禁食时锻炼确实是可能的。已经进行了几项将禁食与运动相结合的人体试验。
这些研究中的受试者可以在12-36小时的禁食期内进行中等强度到高强度的耐力或阻力训练。
有趣的是,在研究中,受试者在快节奏的日子里感觉到能量的增强,这对那些希望锻炼的人来说是有利的。
然而ADF期间,建议个人在运动后食用禁食日餐。一些人在运动后会出现能量摄入的代偿性增加。因此,把饭留到运动后吃,可能有助于个人保持在禁食日卡路里目标的范围内。
虽然对于间歇性禁食期间摄入的食物类型没有具体的建议,但始终建议强调多吃水果、蔬菜和全谷类食物。
这些食物可以帮助禁食参与者增加纤维摄入量,从而有助于缓解禁食期间偶尔出现的便秘。
避免超加工食品也很重要。与富含能量相匹配的未加工食品的饮食相比,富含加工食品的饮食会导致自由摄入的能量增加和体重增加。
间歇性禁食期间允许饮酒。然而不建议在ADF和5:2禁食模式中的禁食日饮酒。
禁食日的能量摄入非常有限(∼500千卡),因此建议将这些卡路里花在能提供营养的健康食品上,而不是酒精上,因为酒精会消耗营养。
无论是在禁食期间还是在进食窗口,都允许喝含咖啡因的饮料。越来越多的证据表明,与基线相比,个体在禁食期间的含咖啡因饮料消费模式没有显著改变。
不过,将咖啡因的摄入限制在上午和下午可能是值得的,这样它就不会干扰一个人晚上的入睡能力。
除以上人群之外,一般都可以安全地进行间歇性禁食,这可能是一种生活方式的改变。
如果尝试间歇性禁食后持续发现,异常焦虑、头痛、恶心或其他症状,不要勉强继续,说明暂时还不适合这种方式,可暂停。
间歇性禁食导致肠道菌群结构改变,以及细菌产生特定的代谢物发生变化,如次级胆汁酸和酮体,可能会潜在地影响正常宿主生理,及心血管代谢异常的临床结果。这些发现可以作为治疗干预的潜在基础。
当相同的膳食在不同的时间提供时,餐后对食物的反应因人而异。由于肠道微生物群参与了个人对食物的反应,因此有理由假设个人对间歇性禁食的反应也与肠道微生物群有关。这也是将间歇性禁食方案转化为临床实践的一个挑战。
需要更多控制良好的、前瞻性的、纵向的临床研究,来确定不同饮食带来的微生物变化,以便进一步转化为临床实践。同时包括肠道菌群健康检测在内的对个体肠道微生物组的进一步了解,或将为最终的临床实践带来益处。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Ratiner K, Shapiro H, Goldenberg K, Elinav E. Time-limited diets and the gut microbiota in cardiometabolic disease. J Diabetes. 2022 Jun;14(6):377-393. doi: 10.1111/1753-0407.13288. Epub 2022 Jun 13. PMID: 35698246.
Angoorani P, Ejtahed HS, Hasani-Ranjbar S, Siadat SD, Soroush AR, Larijani B. Gut microbiota modulation as a possible mediating mechanism for fasting-induced alleviation of metabolic complications: a systematic review. Nutr Metab (Lond). 2021 Dec 14;18(1):105. doi: 10.1186/s12986-021-00635-3. PMID: 34906176; PMCID: PMC8670288.
Varady KA, Cienfuegos S, Ezpeleta M, Gabel K. Cardiometabolic Benefits of Intermittent Fasting. Annu Rev Nutr. 2021 Oct 11;41:333-361. doi: 10.1146/annurev-nutr-052020-041327. PMID: 34633860.
Shi H, Zhang B, Abo-Hamzy T, Nelson JW, Ambati CSR, Petrosino JF, Bryan RM Jr, Durgan DJ. Restructuring the Gut Microbiota by Intermittent Fasting Lowers Blood Pressure. Circ Res. 2021 Apr 30;128(9):1240-1254. doi: 10.1161/CIRCRESAHA.120.318155. Epub 2021 Feb 18. Erratum in: Circ Res. 2022 Mar 4;130(5):e18. PMID: 33596669; PMCID: PMC8085162.
Aron-Wisnewsky J,Clément K.The gut microbiome, diet,and links to cardiometabolic and chronic disorders. Nat RevNephrol. 2016;12(3):169-181.
Di Francesco A, Di Germanio C, Bernier M, de Cabo R. A time to fast. Science. 2018;362(6416):770-775.
Daas MC, de Roos NM. Intermittent fasting contributes to aligned circadian rhythms through interactions with the gut microbiome. Benef Microbes. 2021 Apr 12;12(2):147-161. doi: 10.3920/BM2020.0149. Epub 2021 Feb 3. PMID: 33530881.
Rong B, Wu Q, Saeed M, Sun C. Gut microbiota-a positive contributor in the process of intermittent fasting-mediated obesity control. Anim Nutr. 2021 Dec;7(4):1283-1295. doi: 10.1016/j.aninu.2021.09.009. Epub 2021 Oct 9. PMID: 34786501; PMCID: PMC8567329.