-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

春节假期期间,亲朋好友欢聚一堂,美食佳肴各种狂炫,然而当传统节日遭遇现代饮食文化,频繁的高脂高蛋白摄入、不规律的进食节奏,正不断冲击着肠道屏障的免疫调控网络,部分人群可能正被食物过敏困扰。
食物过敏(FA)是一个当今面临公共卫生问题。一个人可以在任何时候对任何食物过敏,但有引起过敏反应最普遍的食物包括:牛奶、鸡蛋、花生、坚果、大豆、小麦、鱼类和贝类。这些过敏反应范围从肿胀和荨麻疹到危及生命的过敏性休克。
更不乐观的是,食物过敏在当今全球工业化社会中的流行率呈现显著代际增长(一代比一代增强)。与此同时食物过敏率的上升与很多疾病的增加相呼应,包括肥胖、糖尿病、哮喘、自闭症和炎症性肠病(以及其他疾病)。我们如何解释这种代际变化?
食物过敏是过敏性疾病的一部分,被称为I型超敏反应,是由食物蛋白(抗原)通过肥大细胞和/或嗜碱性细胞表面上的免疫球蛋白同种型E(IgE)交联引起的,这与由食物成分引起的食物敏感性不同(例如,乳糖不耐症)。
与此同时,我们的肠道相关淋巴组织(GALT)每天都面临着相当大的挑战。它遇到的抗原估计来自1014微生物和每年超过约30公斤的食物蛋白质。这要求它必须将这些无害的抗原与潜在的病原体区分开来,并能同时引起适当的宿主免疫应答。
目前越来越明确的是,与先天免疫细胞和常驻微生物群密切相互作用的功能性上皮屏障对于建立和食物过敏以及口服耐受性至关重要。而口服耐受性的形成取决于年龄、遗传学、粘膜屏障状态、抗原的物理性质、暴露剂量和频率以及肠道微生物群。
是什么驱动了对食物抗原的过敏反应,近年来有关微生物群在调节抗原摄取和抗原呈递中的作用开始被解开。在4至6个月大的婴儿中早期引入致敏性食物已被证明有希望降低部分但并非所有儿童的IgE-食物过敏(IgE-FA)发病率。
IgE-FA尚无明确的治愈方法,金标准治疗是在发生过敏反应时避免使用对症治疗。幸运的是,疾病修饰疗法,包括免疫疗法,生物制剂等有希望。
本文汇总和依托这些文献结果,讨论了IgE-食物过敏在其自然史的背景下,发展的风险因素,免疫生物学,诊断和治疗,包括新兴疗法。同时,我们也将探讨肠道微生物群在食物过敏中的作用,以及如何通过调节肠道微生物群来预防和管理食物过敏。
食物过敏是一种由免疫球蛋白E(简称IgE)引起的过敏反应。这种病近几十年来越来越常见,可能会威胁生命。特别是对于那些难以完全避开的食物(比如牛奶或鸡蛋)过敏的人来说,生活质量会受到很大影响。
对牛奶、鸡蛋、小麦和大豆的过敏,随着年龄增长可能会慢慢好转。
对花生、坚果和海鲜的过敏,通常会伴随终身。
食物过敏常常和其他过敏性疾病一起出现,比如:
虽然理论上任何食物蛋白质都可能引起过敏,但最常见的是:
小麦过敏和乳糜泻是两种不同的病:
小麦过敏是对小麦蛋白的过敏反应;
但在乳糜泻中,部分水解的麦醇溶蛋白被小肠粘膜中的组织转氨酶脱酰胺。这种特异性和有序的脱酰胺作用增强了小肠固有层中CD4+T细胞对麦胶蛋白的识别,导致免疫应答。细胞因子的后续释放导致肠粘膜的组织学变化。
◆ 过敏疾病是如何发展的?
医生们发现,很多孩子的过敏疾病会按照一定规律逐步发展,这个过程被称为“过敏进行曲”。大约有30-50%的过敏儿童会经历这个过程。不过每个孩子的发展过程可能不太一样。
◆ 过敏疾病通常会按这个顺序出现:
湿疹(特应性皮炎):通常在出生后6个月内最先出现
食物过敏:在1岁前就可能出现
过敏性鼻炎和哮喘:在有湿疹的孩子中,差不多三分之二会在3岁前出现这些症状。
特别提醒:如果湿疹控制得不好,更容易得其他过敏病。
◆ 为什么会得食物过敏?
食物过敏的形成和很多因素有关:
个人因素:
严重的早期湿疹
父母有过敏病史
环境因素:
接触过敏物的时间
肠道中的菌群平衡情况
环境因素如何影响过敏?
新出现的数据表明,在免疫系统发育过程中暴露于非微生物环境因素,包括空气过敏原、清洁剂、污染物和微塑料,可能会导致屏障功能障碍。霉菌、蟑螂和尘螨等空气过敏原含有促进上皮蛋白分解的蛋白酶,导致上皮渗透性增加,例如,清洁剂破坏角质层内的紧密连接和脂质依赖性相互作用,从而增加细胞旁渗透性。
◆ 食物过敏的风险因素:
对过敏原蛋白的反应会受到多种因素的影响,包括:
个人的敏感程度:有些人对过敏原特别敏感,而有些人反应较轻。
过敏原的特性:不同食物中的过敏原性质不同,反应也会有所差异。
食物加工方式:加工过程可能会改变过敏原的性质,比如加热可能降低或增强过敏性。
有的加工对某些过敏原有帮助,比如鸡蛋中的卵清蛋白和卵粘蛋白在加热后过敏原性下降。
但对某些过敏原(如花生蛋白)可能起反作用,加热会使其形成更稳定的抗性结构,增加过敏原性。
◆ 胃肠道屏障与过敏风险
婴幼儿风险更高: 由于他们的胃肠道屏障和免疫系统尚未成熟,食物过敏更容易发生。
胃酸不足: 服用抗酸剂可能降低胃酸浓度,使更多未被分解的蛋白质进入肠道,增加过敏风险。
肠道通透性增加: 肠道屏障功能受损可能导致更多过敏原进入免疫系统,增加致敏和过敏反应的可能性。
食物成分的相互作用:食物中的其他成分可能会影响过敏原的作用。
◆ 过敏反应的严重程度
敏感人群的过敏反应可能从轻微到严重不等,严重时甚至可能危及生命(如过敏性休克)。因此,避免接触过敏原是目前最有效的预防方法。
◆ 为什么食物过敏难以治疗?
目前还没有针对食物过敏的有效治疗方法,因为科学家对引发过敏的分子机制还没有完全弄清楚。因此,过敏患者最好的办法就是避免食用含有过敏原的食物。但问题是,只有在明确知道食物中含有过敏原时,才能做到有效避免。
◆ 食品标签的重要性
食品标签是帮助消费者了解食物中是否含有过敏原的重要手段。然而,确保全球食品标签的准确性并不容易,主要有以下几个挑战:
◆ 哪些食物最容易引发问题?
牛奶是最常见的未标注过敏原,其次是小麦和大豆。这些食物经常出现在食品召回事件中,很大程度因为它们被意外添加或未正确标注。
对于过敏患者来说,了解食品标签和避免过敏原是保护自己的关键。但由于标签错误、交叉污染等问题,完全避免过敏原仍然具有挑战性。
食物过敏原主要是一类特殊的蛋白质(糖蛋白),它们通常能溶于水,而且比较”顽固”-不容易被热、酸和消化酶破坏。
不过,不同的过敏原特性会有很大差异。有的需要糖分子的修饰才能发挥作用,有的则不需要。
过敏原的结构特点:
大小不一:从小分子到大分子都有。
结构多样:有的是单个分子,有的会几个分子组合在一起。
稳定性强:通常含有特殊的化学键(二硫键),使它们不容易被破坏。
结合能力:能与金属、脂肪等物质结合,这种结合会让过敏原更稳定。
不同食物的过敏原如果结构相似,可能会导致交叉过敏。
常见的交叉过敏组合:
过敏原的识别位点(表位):
直线型表位:像一串珠子一样排列的氨基酸片段
立体型表位:蛋白质折叠形成的特殊立体结构
一般认为直线型表位更重要,因为它们更稳定,不容易被破坏。
但在某些情况下,立体型表位也能在食物中保持稳定,发挥作用。
了解这些特性有助于预测哪些食物可能会引起交叉过敏;改进食物加工方法,降低过敏风险;开发更好的过敏预防和治疗方案。
致敏是指免疫系统首次接触到某种过敏原后,开始产生针对它的特异性抗体(IgE),但此时不会引发过敏症状。
致敏的主要途径:
小麦过敏是一种IgE介导的I型过敏反应,部分人群对小麦中的某些蛋白质成分较为敏感,即使在护肤品中接触也可能出现过敏症状。
如果你已知对小麦过敏,或者属于敏感肌肤,建议谨慎使用含有水解小麦蛋白的护肤品。
花生过敏者可能因皮肤接触花生而致敏,尤其是皮肤屏障受损的人。
胃肠道致敏(1类食物过敏): 最常见的方式,食物过敏原通过消化道进入身体,导致过敏反应,尤其常见于婴幼儿,因为他们的肠道屏障和免疫系统尚未完全发育。常见过敏原包括牛奶、鸡蛋和豆类。
吸入性致敏(2类食物过敏): 通过呼吸道接触到空气中的过敏原(如花粉、动物毛发等),随后对相关食物产生过敏。
皮肤接触致敏: 通过皮肤接触到过敏原而致敏。例如:
蜱叮咬致敏: 蜱叮咬可能导致对红肉的过敏反应,这是一种特殊的皮内致敏途径。
子宫内暴露: 胎儿可能通过胎盘接触到母体食物中的过敏原(如牛奶、鸡蛋和花生),但目前没有确凿证据表明母亲的饮食会直接影响婴儿的食物过敏风险。
B细胞的双重角色 | 引起过敏/预防过敏
什么是B细胞?
B细胞是我们身体里的一种免疫细胞,它最重要的工作就是产生抗体(免疫球蛋白)。在食物过敏中,B细胞主要产生一种叫IgE的抗体。
食物过敏发生的过程:
第一步: 识别“入侵者”
B细胞会产生IgE抗体,这些IgE能够识别食物中的特定蛋白质(过敏原)。
第二步: 设置“警报器”
IgE会附着在特殊的免疫细胞(肥大细胞和嗜碱性粒细胞)表面,这些细胞就像身体的“警报器”。
第三步: 过敏反应的触发
当吃到过敏食物时,IgE认出并抓住过敏原
“警报器”被触发,免疫细胞释放出化学物质,这些化学物质引起过敏症状(如皮疹、呼吸困难等)。
关于IgE的特点:
IgE在所有抗体中数量最少,但它在过敏反应中起着关键作用。
B细胞的变化过程:
B细胞可以通过特殊方式转变,开始产生IgE,这个转变需要其他免疫细胞(T细胞)的帮助,还需要特定的信号分子(IL-4和IL-13)的参与。
对花生过敏的研究发现,科学家从花生过敏患者的血液中找到了产生IgE的B细胞。这些B细胞寿命较短。
不同过敏患者的IgE抗体可能会以相似的方式识别花生中的过敏原,这些发现帮助我们更好地理解食物过敏的发生机制,为开发新的治疗方法提供线索,从而可能帮助预防或减轻过敏反应。
图 控制对过敏原反应的免疫过程
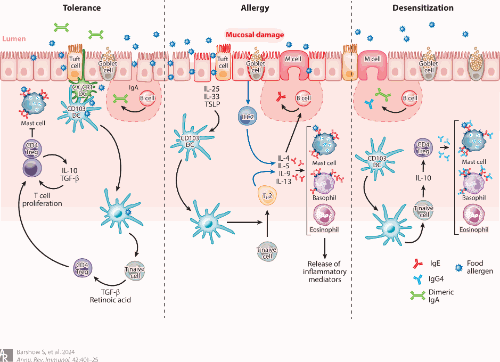
(左)耐受性:耐受性是一种主动免疫过程,在此过程中暴露于过敏原不会引发过敏性炎症。耐受性可涉及特异性抗原呈递细胞、TcB的诱导和活化以及B细胞同种型转换为伊加。
(中)过敏症:在过敏症中,上皮细胞功能障碍使抗原进入并触发alarmins IL-25、IL-33和TSLP的释放。幼稚T细胞分化成TH2细胞,其分泌促炎性TH2细胞因子IL-4、IL-5、IL-9和IL-13,其导致B细胞同种型类别转换为IgE。IgE通过高亲和力IgE受体(FcεR1)与肥大细胞和嗜碱性粒细胞结合,导致急性过敏性炎症。
(右)脱敏:过敏原免疫疗法的脱敏与IL-10的Treg产生相关。B细胞类别从IgE转变为IgG 4和伊加产生。IgG 4和伊加可通过分别与IgE竞争变应原结合位点和直接结合食物变应原而充当阻断抗体来抑制TH2适应性免疫应答。缩略语:DC,树突状细胞;TH2,2型辅助性T细胞; Treg,调节性T细胞; TSLP,胸腺基质淋巴细胞生成素。
不是所有抗体都会引起过敏;B细胞除了能产生引起过敏的IgE抗体,还能产生其他种类的保护性抗体,这些保护性抗体可以帮助预防食物过敏。
保护性抗体是如何工作的?
科学家通过小鼠实验发现粘膜中的IgA抗体能阻止过敏原被肠道吸收。
IgG抗体有两种保护作用:
直接捕获并中和过敏原;
通过FcγRIIb受体的作用抑制过敏反应。
此外,治疗食物过敏的新发现在口服免疫治疗(OIT)中观察到,保护性抗体IgG4会明显增加,IgG4与致敏抗体IgE的比值升高。这些变化与患者对食物的耐受性直接相关。
调节性B细胞的重要性
研究发现牛奶过敏患者与健康人对比,过敏患者的调节性B细胞明显减少,这些细胞产生的IL-10也较少。
IL-10的重要作用可以减少致敏抗体IgE的产生,促进保护性抗体IgG4的产生。
B细胞的信使功能:
B细胞也可通过IgE促进的抗原呈递作用作为T细胞的抗原呈递细胞(APC),其中IgE-过敏原复合物被低亲和力IgE受体CD 23(FcεRII)内化,后者在B细胞上表达。
值得注意的是,最近的一项研究表明,B细胞上CD 23的表面密度通过IgE促进的抗原呈递决定了过敏原特异性T细胞的活性,并与总血清IgE水平呈正相关。抗CD 23单克隆抗体鲁昔单抗通过靶向CD 23-IgE相互作用抑制IgE合成。
B细胞治疗方面潜力:
预防方面:
T细胞在食物过敏中的角色
1. TH2细胞:过敏反应的”指挥官”
研究发现,TH2细胞是引发食物过敏的核心细胞,它通过三种方式发挥作用:
2. 治疗的新发现
口服免疫治疗(OIT)的研究显示:能够抑制TH2细胞的活动,减少过敏相关物质的产生,帮助建立对食物的耐受性。
3. 新发现的重要T细胞类型
最新研究发现Tfh13细胞在食物过敏中的重要作用,动物实验证明,这种细胞对产生高效过敏抗体必不可少,能直接影响过敏反应的强度。
注:Tfh13(滤泡辅助性T细胞13)是一种特殊的免疫细胞亚型,属于CD4+ T细胞家族。它在免疫反应中起着重要作用,尤其是在过敏反应和IgE抗体的产生过程中。
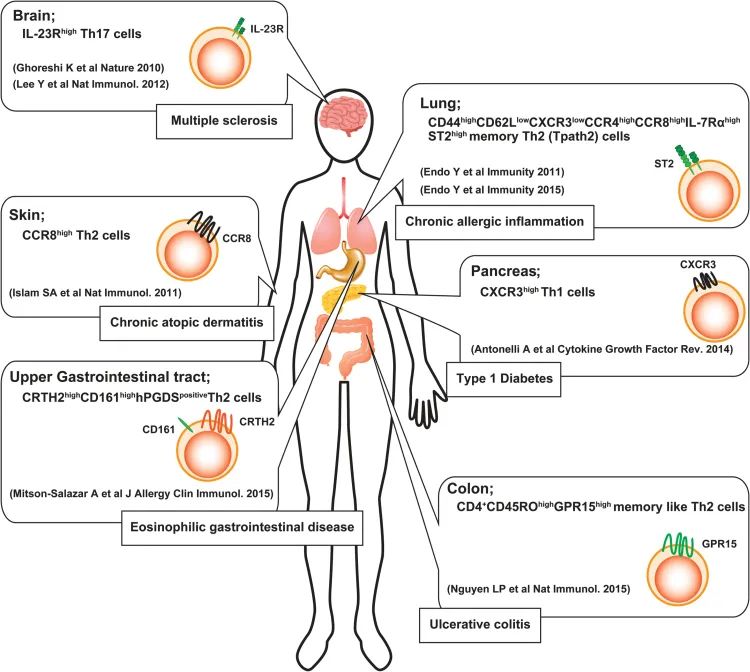
此外,还有TH2A细胞,这是一种特殊的记忆性T细胞,该细胞只在过敏人群中发现,其表面有特定标记物(CD161、CRTH2、CD49d)。发现该细胞不仅与食物过敏有关,还与其他过敏病相关,例如,湿疹、过敏性鼻炎、哮喘和食管炎。
4. T细胞的共同识别标记
研究人员通过CD154标记发现:花生过敏患者的T细胞有特殊特征,17%的特定序列在不同花生过敏患者中相同。这说明花生过敏可能有共同的免疫机制。
5. 调节性T细胞(Treg):过敏的“刹车系统”
Treg细胞是免疫系统的调节者,有两种来源:
动物实验显示,牛奶过敏小鼠经过治疗后:Treg细胞数量增加,产生更多保护性物质(IL-10和TGF-β)。
人类研究发现,鸡蛋过敏儿童成功治疗后:特定类型Treg细胞增加。与此同时,花生过敏治疗后:Treg相关基因活性增加。
T细胞在诊断和治疗方面应用潜力:
肥大细胞:驻扎在“人体边防”的过敏触发器
主要在身体的”边界”位置:皮肤、呼吸道、消化道。
研究发现:对胃肠道过敏患儿的活检发现,他们的胃部和结肠中,肥大细胞数量比健康孩子多(通过CD117和类胰蛋白酶标记检测)。
临床观察:在食物过敏患者的肠道检查中发现,过敏相关物质明显增加:
特定条件下可能缓解过敏
小鼠实验发现,肥大细胞表面有个“刹车开关”(FcγRIIb),能接收IgG抗体的“停战指令”,抑制过敏反应,这可能是未来治疗的关键靶点。
嗜碱性粒细胞:血液中的哨兵
基本特征:在血液中数量很少(仅占白细胞的0.5-1%),但在过敏反应中作用重要。
临床应用:可以通过流式细胞术(BAT)检测,使用CD63和CD203c作为标记,帮助诊断食物过敏,监测治疗效果。
治疗相关发现:口服免疫治疗(OIT)研究显示,成功治疗后:
小鼠实验发现:在 IgE-FA 的小鼠模型中,嗜碱性粒细胞耗竭减轻了腹泻的发生率,临床过敏反应减弱。同一项研究表明,嗜碱性粒细胞来源的 IL-4 对于肥大细胞募集和/或增殖至关重要。
临床意义:可以通过检测这两种细胞,判断过敏严重程度,评估治疗效果。
治疗方向:可以破坏 IgE-FA 中肥大细胞和嗜碱性粒细胞反应性的新型干预措施,可能代表未来研究的有吸引力的治疗靶点。
抗原呈递细胞(APCs):免疫系统的“情报分析员”
主要包括三类细胞:
抗原呈递细胞是如何工作的?
➤ 发现并捕获食物过敏原 → 分解成小片段(肽段) → 用MHC II分子“举牌”展示
➤ 指挥CD4+ T细胞分化成不同细胞(TH1/TH2/Treg等)
不同派系的树突状细胞:过敏派 vs 和平派
◈ 过敏派(CD209+树突状细胞)
锁定目标:锁定致敏蛋白,如花生、坚果等。
煽风点火:释放信号诱导T细胞变身TH2(分泌IL-4/IL-5/IL-13)
研究证据:
◈ 和平派(CD103+树突状细胞)
维稳专家:在小鼠肠道训练T细胞成为Foxp3+ Treg(分泌IL-10),有助于预防过敏。
制衡机制:表达诱导性T细胞共刺激配体(ICOS-L),促进“调解员细胞”生成。
树突状细胞功能的其他重要考虑因素包括共刺激分子如 CD80 和 CD86 等表达,它们是 CD28 的天然配体;这些分子与 T 细胞表达的 CD28 的相互作用受损可能导致激活减少或缺失,并最终导致 T 细胞无反应。
花生口服免疫治疗降低了APC上CD86的表达,尽管这些变化可能是暂时的。
诊断方面:通过分析树突状细胞的亚型特征和活化状态,可评估个体过敏风险等级,并预测潜在的过敏反应发生概率。
治疗突破:为过敏治疗开辟了新路径。
1)精准调控不同功能亚型DC的比例平衡;
2)靶向干预DC表面关键分子(如共刺激分子)的表达;
3)特异性增强具有免疫调节功能的DC活性。
总之,免疫系统的多个部分协同作用。
正常耐受状态是B细胞生产保护性抗体(IgA),调节性T细胞(Treg)担任”指挥”角色,共同抑制过度反应,防止肥大细胞引发过敏症状。
过敏状态TH2细胞过度活跃,产生大量致敏物质,指导B细胞产生过敏抗体(IgE)。多种免疫细胞被激活,包括肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞等。受损的肠道细胞会释放:IL-25、IL-33、TSLP,这些物质进一步加重过敏反应。
成功的脱敏治疗会带来以下变化:
T细胞方面,抑制致敏T细胞(TH2)、增加调节性T细胞;
B细胞方面,增加保护性抗体(IgA和IgG4)、减少致敏抗体(IgE)。
来自人类和动物研究的越来越多的证据支持肠道微生态失调在食物过敏发展中的关键作用。
基于16S rRNA测序的研究发现,与没有食物过敏的儿童相比,患有食物过敏的儿童具有独特的肠道微生物组结构。
表. 在有和没有FA的小儿患者之间主要的肠道微生物组差异(基于16S-rRNA测序的研究)
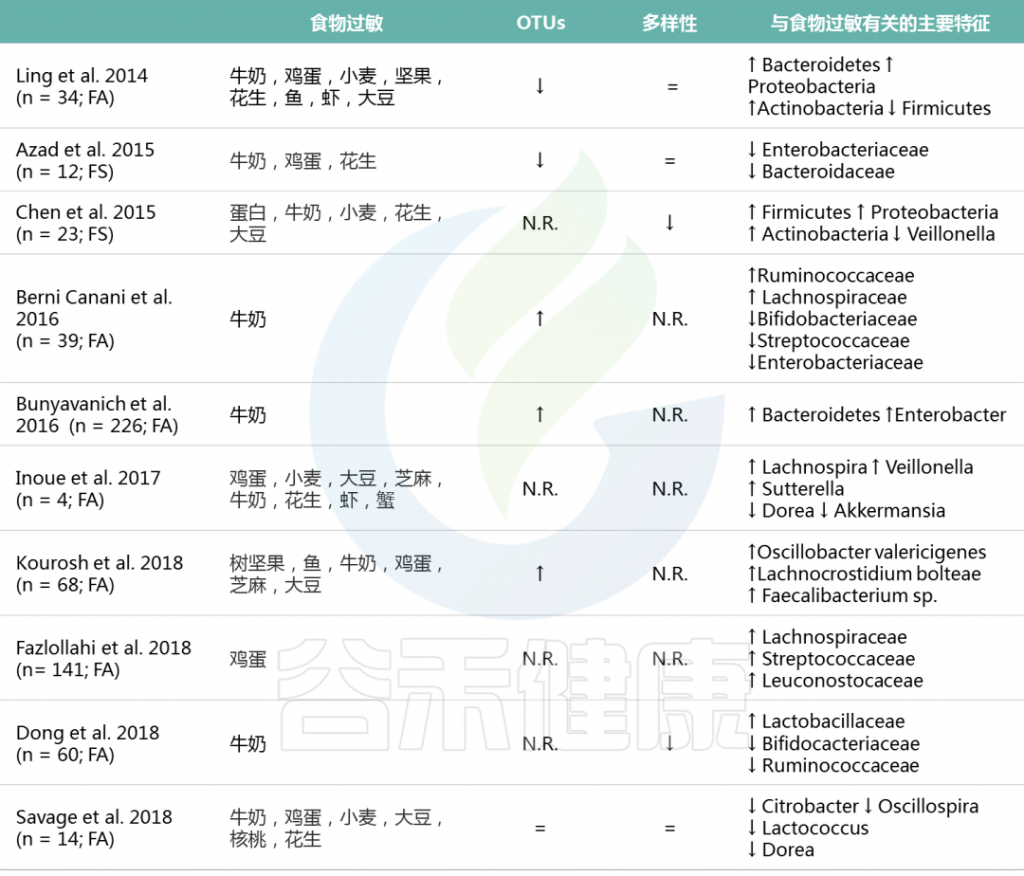
M.D.Costanzo et al, Int.J.Mol.Sci. 2020
FA:食物过敏; FS: 食物过敏; OTUs:操作分类单元; N.R.: 未报道过的; ↑ : 增加;↓: 减少; =: 不变.
表1中所有研究均调查了IgE介导的食物过敏。有趣的是,关于46例受非IgE介导的牛乳过敏(CMA)影响的患者的数据显示,与健康对照组相比,失调的菌群中拟杆菌Bacteroides (Bac 12) 和Alistipes丰富,IgE介导的CMA儿童的特征重叠,是从健康到IgE介导的CMA患者的拟杆菌逐渐增加。
在同一项研究中,患有非IgE介导的CMA的儿童的粪便中丁酸浓度明显低于健康人。
菌群失调先于食物过敏发作
来自人体研究的可用数据表明,菌群失调先于食物过敏发作。
Azad 等人研究发现,在婴儿早期肠道微生物组含量较低的情况下,肠杆菌科(Enterobacteriaceae) / 拟杆菌科(Bacteroidaceae)的比率增加和Ruminococcaceae的丰度较低与随后的食物敏感性相关,这表明早期肠道菌群失调对食物过敏的后续发展有促进作用。
此外,人类研究的可用数据表明,生命早期,尤其是生命的头6个月,微生物组构成与食物过敏的发展更为相关;
在出生后的前 6 个月内,在食物过敏儿童的肠道菌群中占比过高的菌如下:
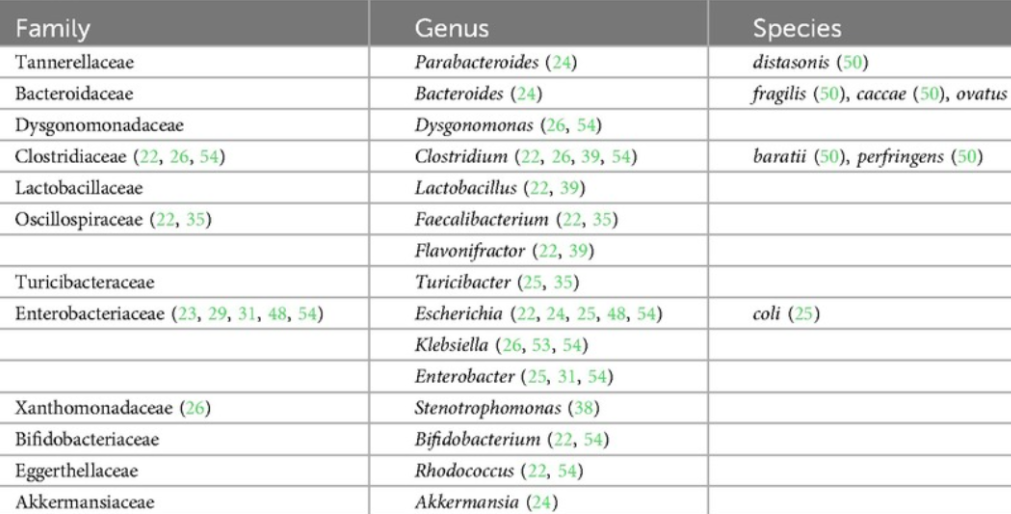
doi.org/10.3389/falgy.2024.1438252
在出生后的前 6 个月内,在食物过敏儿童的肠道菌群中缺乏的菌如下:
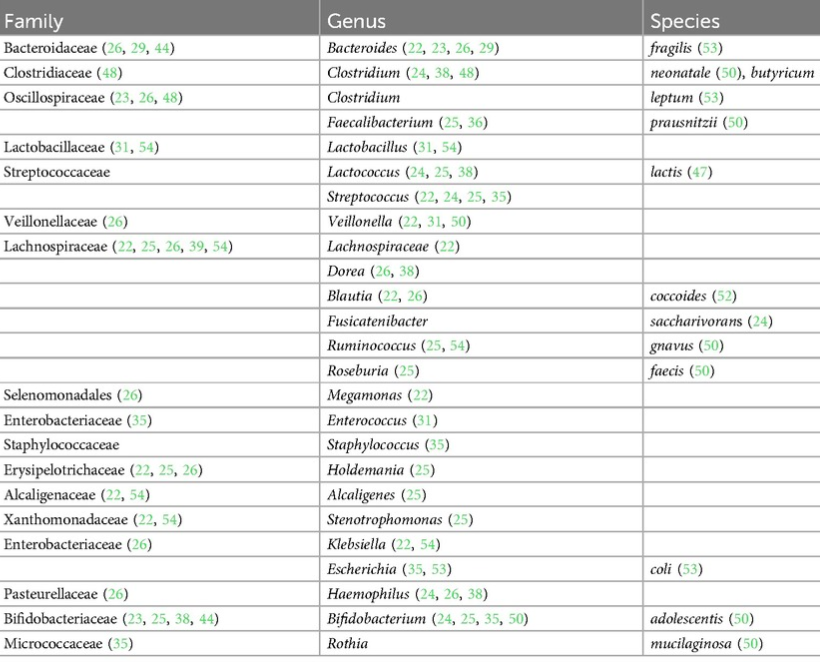
doi.org/10.3389/falgy.2024.1438252
▲ 有害菌增加:
肠杆菌等有害菌释放脂多糖(LPS)等毒素:
▼ 有益菌减少:
双歧杆菌、乳杆菌等能分解食物纤维,产生短链脂肪酸(如丁酸),这类物质:
调节免疫耐受
肠道菌群通过调节Tregs细胞的分化和功能,增强对食物抗原的耐受性。例如,梭菌和双歧杆菌能够通过其代谢产物(如SCFAs)和信号分子(如IL-10、TGF-β)促进Tregs的分化和增殖,从而抑制过敏反应。
肠道菌群还通过调节树突状细胞(DCs)的功能,影响免疫反应。例如,健康的肠道菌群能够使DCs产生TGF-β和视黄酸(RA),从而诱导Tregs的分化。
共生菌介导免疫耐受
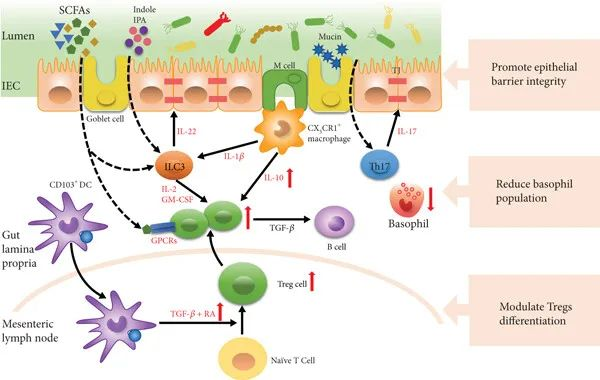
doi.org/10.1155/2023/9575410
增强肠道屏障功能
肠道菌群通过产生短链脂肪酸(如丁酸)和色氨酸代谢产物(如吲哚)来增强肠道上皮屏障的完整性。这些代谢产物能够促进黏液分泌和紧密连接蛋白的表达,从而防止食物抗原进入血液循环,减少过敏反应的发生。
例如,丁酸能够通过诱导IL-22的产生,增强肠道上皮细胞的屏障功能,减少过敏原的渗透。
调节过敏效应细胞
肠道菌群能够调节过敏效应细胞(如嗜碱性粒细胞)的数量和功能。例如,抗生素处理或无菌小鼠的嗜碱性粒细胞数量增加,而补充益生菌可以减少这些过敏效应细胞的数量,从而减轻过敏症状。
关于肠道菌群的干预措施,我们将在06章节详细阐述。
IgE-食物过敏的诊断依赖于临床病史和过敏试验的结合,如食物特异性IgE的存在。诊断指南和标准临床实践在国际上各不相同。这些差异主要是由于多种方法可用于评估IgE-FA;这些方法在灵敏度、特异性、成本、时间和可及性方面各不相同。准确的诊断对于防止不必要的食物避免和提供及时和适当的治疗建议至关重要。
金标准
双盲安慰剂对照食物激发试验(DBPCFC)是最可靠的确诊方法。由于12.9%的试验可能出现安慰剂反应,其准确性优于非盲法试验。
确定IgE对给定食物致敏的两种主要方法是:
体内皮肤点刺试验(SPT)
操作:将微量食物(新鲜的或更常见的作为提取物)刺入皮肤表层
判读标准:15-20分钟后,检查皮肤刺痛部位,若出现比阴性对照大3mm以上的红肿包块(因肥大细胞释放组胺所致)即为阳性。
编辑
血清特异性IgE(sIgE)
sIgE测定定量外周血中存在的过敏原特异性IgE的量。
传统标准:≥0.35 kU/L为阳性
新型检测:临界值可低至0.1 kU/L
注意:两项检测结果必须谨慎解释,均需结合症状分析,因可能出现”致敏但无过敏反应”的假阳性。
检测结果优化策略:
使用较大的SPT包块直径或较高的sIgE临界值可增加临床反应性的可能性,但这是以牺牲敏感性为代价的。
组合检测优势:
对1247例食物激发试验数据分析显示:
SPT+sIgE联合检测或sIgE/总IgE比值(sIgEr)
的阳性预测值显著优于单项检测。
应用价值:在临床试验等场景中可替代部分激发试验,但仍需更多验证。
现存挑战:许多具有临床相关IgE-FA的患者的SPT和/或sIgE值可能低于已发表的临界值,强调需要更稳健的诊断方法来取代口服食物激发试验。
食物过敏检测升级版:成分检测与表位检测有什么用?
除了常规的皮肤点刺、抽血验IgE,医生手里还有两把更精细的“放大镜”——成分检测和表位检测。它们能帮你区分“假警报”和“真危险”,甚至预测过敏反应有多严重。
成分检测:锁定过敏食物里的“关键蛋白质”
原理:
食物过敏其实是对其中某些蛋白质过敏。比如花生含有Ara h1、Ara h2等多种蛋白质,成分检测(CRD)可以单独测出你对哪一种蛋白质过敏。
实际用途:
区分“花粉过敏连带反应”和“真过敏”。
比如有人吃花生过敏,但检测发现只对Ara h8蛋白敏感,这通常是因为它和桦树花粉蛋白相似,属于“交叉反应”(可能症状轻微,比如口腔发痒)。
但如果对Ara h1/2/3敏感,则是真正的花生过敏,严重时可能引发全身反应。
预判过敏风险高低
研究证实:对花生中的Ara h2蛋白过敏的人,严重过敏风险更高;而另一种Ara h6蛋白(与Ara h2结构相似)阳性,也可能指向真实过敏。

表位检测: 看清IgE攻击的“精确靶点”
原理:如果把过敏蛋白比作一根长绳,表位就是绳子上被IgE抗体“咬住”的具体位置(分线性和构象两种结构)。表位检测能识别这些关键攻击点,帮助判断过敏是否会长期存在或容易引发严重反应。
在花生过敏的儿童和成人中,针对花生过敏的BBEA表位检测法(检测Ara h2蛋白的两个线性表位):灵敏度92%,特异性94%,准确度碾压常规检测:比皮肤点刺、普通IgE检测更准。
另一个相关的体液测试是 过敏原特异性IgG4
IgG4抗体通过充当阻断抗体而在IgE-FA中具有保护作用。一项研究发现,花生致敏但临床耐受或花生过敏并接受OIT治疗的儿童的血浆能够抑制花生诱导的肥大细胞活化。重要的是,当血浆中的IgG4耗尽时,肥大细胞的活化不能完全恢复。
但是目前需要进一步的研究来更全面地了解IgG4单独或与其他生物标志物结合在食物过敏诊断和/或预后中的作用。
编辑
诊断方法仍然主要限于研究环境,包括嗜碱性粒细胞活化试验(BAT)和肥大细胞活化试验(MAT)。
BAT与MAT的优劣对比:
BAT和MAT都是基于体外流式细胞术的实验室检测,用于测量过敏原刺激后活化标志物的表达。
BAT检测(嗜碱性粒细胞活化试验)
需要采集新鲜血液立即检测。
BAT在诊断IgE-食物过敏时的特异性高于SPT和sIgE水平,在花生过敏中的特异性为98%,灵敏度为75%。
但存在15%人群天生对检测无反应。
MAT检测(肥大细胞活化试验)
可用冷冻血清来激活培养的原代人血源性肥大细胞。
在花生过敏诊断中比BAT更准确。
重复检测结果高度一致(组内相关性:MAT 0.96 VS BAT0.43)。
新的诊断方法包括:
评估食物过敏原特异性B和T细胞
外周血中的过敏原特异性B和T细胞由于其稀缺性而历来难以分离。由于技术的进步,这些罕见的细胞现在可以通过几种方法来识别。
关于T细胞,这些方法包括:
a)用所选抗原或肽体外刺激PBMC,然后通过表达特异性活化标志物经由流式细胞术鉴定活化的T细胞;
b)用重组肽-MHC(pMHC)复合物离体染色T细胞。pMHC四聚体或多聚体技术也可用于鉴定变应原特异性B细胞。
多组学研究
包括基因组学、表观基因组学、转录组学、蛋白质组学、代谢组学、微生物组学和免疫组学在内的组学科学有望成为研究过敏性疾病(包括IgE-FA)的高通量方法。需要多组学方法来全面识别生物标志物,如基因,蛋白质和/或代谢产物,可以提高IgE-食物过敏诊断和预后的准确性。
此外,非常需要鉴定可预测IgE-食物过敏反应严重程度的生物标志物。特别令人感兴趣的是血小板活化因子乙酰水解酶(PAF-AH)。之前的研究已经证实,PAF-AH可以通过灭活PAF来预防过敏级联反应的进展。
肠道菌群检测
通过高通量测序技术获得菌群组成和功能数据,结合机器学习模型(如随机森林、神经网络)识别过敏相关特征。肠道菌群检测报告菌群失衡程度、关键菌群丰度及代谢物水平,提示过敏风险。
干预后复查菌群,观察过敏症状是否缓解,验证菌群与过敏的因果关系。
该方法是非侵入性的,且可以早期预警,因为很多时候菌群失衡可能早于过敏症状出现。通过个性化干预,指导益生菌、膳食调整等精准治疗。
肠道菌群检测可作为食物过敏的辅助诊断工具,为个性化治疗提供依据。可以结合临床传统方法(如食物激发试验)综合判断,通过连续检测评估过敏风险和干预效果,整合IgE检测、皮肤点刺试验和菌群数据,提高准确性。
1. 当前的食物过敏治疗方式
目前,食物过敏没有治愈方法,治疗的核心是避免接触过敏原。如果意外接触导致过敏反应,通常使用肾上腺素和抗组胺药进行处理。
由于食物过敏带来的严重健康和经济负担,科学界投入了大量资源研究新的治疗方法。
2. 预防的转变:从回避到早期接触
过去建议高过敏风险的婴儿(如父母有过敏史)避免接触过敏性食物,比如花生。
但后来研究发现,在婴儿早期引入过敏性食物(如花生)反而可以降低过敏风险。这项发现改变了过敏预防的建议,也激发了对免疫疗法的研究热情。
3. 免疫疗法的探索
免疫疗法的目标是通过逐步改变免疫系统的反应,让身体对过敏原“习惯”并耐受。方法包括:
其中,口服免疫疗法(OIT)效果最好,但也存在风险。比如,患者可能会出现轻微不适(如口痒、肚子痛),甚至更严重的过敏反应(如全身性过敏或嗜酸性食管炎)。
doi.org/10.1146/annurev-immunol-090122-043501
4. 辅助治疗:提高疗效,减少副作用
为了让免疫疗法更安全有效,科学家正在研究辅助治疗:
此外,新的治疗IgE-FA包括疫苗、纳米颗粒、Janus激酶(JAK)和布鲁顿的酪氨酸激酶抑制剂。
5. 基于微生物群的干预
研究发现,肠道中的某些细菌和它们的代谢产物(如丁酸盐)可以调节免疫系统,帮助身体更好地耐受过敏原。下列措施可以在调节肠道菌群的基础上干预食物过敏。
饮 食
增加膳食纤维
高纤维饮食(如全谷物、蔬菜、水果)可促进双歧杆菌、乳酸菌等有益菌增殖,增加短链脂肪酸的生成,抑制促过敏的Th2免疫反应。
举例:
菊粉(如洋葱、大蒜):增加双歧杆菌。
果胶(如苹果、柑橘):改变厚壁菌门与拟杆菌门的比例,增加血清和粪便中SCFA的含量,并通过损害树突状细胞功能来预防炎症的发展。
高纤维摄入通过重塑肠道微生物群和增加SCFA水平,特别是乙酸盐和丁酸盐水平,保护小鼠免受花生过敏。此外,这种保护作用取决于SCFA的受体GPR43和GRP109A,因为缺乏其中一种的小鼠表现出更严重的食物过敏。
减少高脂高蛋白饮食
过多动物蛋白和脂肪可能促进拟杆菌属等菌群占优,增加炎症风险,间接诱发过敏。建议适量摄入,平衡植物蛋白(如豆类)。
高脂饮食诱导的肠道菌群变化也被证实可以诱导食物过敏。
一项研究显示,高脂饮食通过增加Ruminococcaceae(梭菌目)、Desulfovibrionaceae(δ-变形菌纲)和Rikenellaceae(拟杆菌纲)的相对丰度,同时减少Muribaculaceae和Prevotellaceae的丰度来诱导食物过敏。
增加优质脂肪
ω-3脂肪酸,ω-3主要来自海洋来源(如鱼油、藻类)和某些植物(如亚麻籽):通过抑制树突状细胞(DCs)的激活、抑制CD4 T细胞的增殖和活化、减少促炎因子、降低IgE水平以及抑制肥大细胞脱颗粒,从而减轻食物过敏。
增加膳食多酚
多酚是次生植物代谢产物,富含水果、蔬菜、谷物、咖啡和茶。非结合多酚通过肠道菌群调节、紧密连接蛋白表达和 β-防御素分泌来缓解食物过敏。
可可多酚:
研究表明,富含可可多酚的饮食可以减少厚壁菌门和变形菌门,增加Tenericutes和蓝藻门(Cyanobacteria),从而抑制特定抗体和肠道IgA的合成,有助于减少过敏反应。
矢车菊素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside):
通过增加有益菌(如乳酸杆菌和Odoribacter)和减少有害菌(如幽门螺杆菌和Turicibacter)来上调紧密连接蛋白的表达,促进分泌型IgA和β-防御素的分泌,并平衡Th1/Th2水平,有助于增强肠道屏障功能,减少过敏原的渗透,从而减轻食物过敏症状。
槲皮素(Quercetin):
槲皮素具有抗氧化、抗炎和抗癌活性。它可以通过与卵清蛋白(OVA)结合,减少OVA的致敏性,并降低特异性免疫球蛋白水平,从而减轻过敏反应。
咖啡酸和表儿茶素没食子酸酯(Epigallocatechin-3-gallate, EGCG):
与乳清蛋白结合后,可以减轻乳清蛋白引起的口服致敏反应,降低小鼠血清中特异性抗体和mMCP-1水平,并减少体外CD4 T细胞的增殖,有助于减少乳清蛋白引起的过敏反应。
益生菌
双歧杆菌(Bifidobacterium)
乳杆菌(Lactobacillus)
丁酸梭菌(Clostridium butyricum)
混合益生菌
注意:
益生元
通过特定益生元干预食物过敏的机制主要是调节肠道菌群,促进短链脂肪酸生成,抑制过敏相关炎症反应。以下为具体益生元及研究证据:
临床试验显示,补充该组合可显著降低高风险婴儿食物过敏发生率,可能与促进双歧杆菌生长有关。
2’-岩藻糖基乳糖(2’-FL)和乳糖-N-新四糖(LNnT):添加到配方奶粉中可缓解牛奶蛋白过敏(CMA),降低IgE水平和炎症因子(如IL-4、IL-6)。
乳-N-岩藻五糖III(LNFP III):摄入量高的婴儿CMA风险更低。
动物实验表明,母体补充可诱导免疫耐受,降低后代小麦过敏风险。
多不饱和脂肪酸(PUFA)等可能减少儿童食物致敏风险。
合生元
合生元是一种包含活菌(益生菌)和宿主微生物选择性利用的底物(益生元)的混合物,能够为宿主带来健康益处。
在一项多中心随机对照试验(RCT)中,研究了含有短双歧杆菌M-16V和低聚果糖(scGOS/lcFOS)的氨基酸配方(AAF-S)对IgE介导的牛奶过敏(CMA)婴儿的安全性。
结果显示,与普通氨基酸配方(AAF)相比,AAF-S在控制过敏症状和促进正常生长方面同样有效,但在减少感染、用药次数和住院率方面效果更好。具体数据如下:AAF-S组婴儿的感染发生率显著降低、使用的药物更少、住院率显著降低(8.8% vs. 20.2%,p = 0.036)。
粪便微生物组分析显示,AAF-S组婴儿的双歧杆菌丰度显著增加,而Eubacterium rectale和C. coccoides的丰度显著降低。
代谢产物变化:AAF-S组婴儿的粪便中乙酸和L-乳酸水平显著升高,粪便pH值显著降低。
粪菌移植
最近,一项小鼠模型研究表明,FMT抑制了特应性皮炎小鼠中OVA诱导的过敏反应。
除了恢复肠道微生物群外,FMT还降低了IgE水平;受监管的Tregs;肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞减少;提高了SCFA的含量;恢复Th1/Th2平衡。
与其他方法相比,FMT是一种相对简单的治疗策略,可以改变人体肠道微生物群;然而,迄今为止,这项研究还不够充分,需要开展大量工作来提高我们对用FMT治疗食物过敏的理解。
中草药
中药因其低成本、高安全性以及高生物活性,近年来在食物过敏治疗中受到越来越多的关注。虽然传统中医中没有“食物过敏”的具体术语,但一些中药方剂在现代研究中显示出对食物过敏的潜在治疗效果。
食物过敏草药配方-2(FAHF-2):
来源:FAHF-2是从传统的“乌梅丸”(Wu Mei Wan)中开发而来的。
临床研究:在一项多中心、双盲、随机、二期临床试验中,68名12-45岁的食物过敏患者每天三次服用FAHF-2或安慰剂,持续六个月。结果显示,FAHF-2安全且耐受性良好。
免疫调节作用:FAHF-2能够显著抑制外周血单个核细胞(PBMCs)产生的IL-5,并增加IL-10和调节性T细胞(Tregs)的生成,显示出良好的免疫调节效果。
改进形式:由于FAHF-2的剂量较大,研究者开发了两种改进形式:丁醇纯化的FAHF-2(BF2)和乙酸乙酯及丁醇纯化的FAHF-2(EBF2)。在花生过敏的小鼠模型中,EBF2显示出很强的抑制IgE产生的能力,被认为是对花生过敏最有潜力的治疗药物。
尽管中药在治疗过敏性疾病中被广泛应用,但关于食物过敏的临床研究样本量小,且研究受限,需要进一步验证中药在食物过敏治疗中的效果。
从概念上讲,人类食物供应中的任何蛋白质都可能是潜在的过敏原,因此建立“无过敏原食品”体系不现实。由于不同个体的免疫系统对相同的过敏原可能会有不同的反应,因此很难对食物过敏做出普遍适用的定义。
现有诊断工具(如特异性IgE检测)可靠性有限,过敏原结构、加工方式及食物基质相互作用均影响致敏性。
引起个体过敏反应所需的最小量(阈值)也取决于个体的敏感性。大多数过敏性食物的阈值尚未确定,导致警示标签(如“可能含”)难以精准保护敏感人群。 需开发特异性强、灵敏度高的检测方法,并基于主要过敏食物(如牛奶)建立分级阈值标准——从鉴定关键过敏原及其表位入手,明确检测目标。
肠道菌群可能通过调节免疫耐受影响过敏风险。未来可探索菌群检测(如特定菌群丰度与过敏表型关联)作为辅助诊断工具,或通过益生菌等多种干预手段重塑菌群平衡,降低致敏性。
协同策略:
整合免疫学、微生物组学与食品加工技术,推动从“一刀切”警示转向动态风险评估,实现过敏防控的精准化与人性化。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Iweala OI, Nagler CR. The Microbiome and Food Allergy. Annu Rev Immunol. 2019 Apr 26;37:377-403.
Januszkiewicz, Emilia, et al. “The importance of the gut microbiome in the development of allergic diseases.” Alergologia Polska-Polish Journal of Allergology 10.3 (2023): 202-209.
Venter, Carina. “Immunonutrition: Diet diversity, gut microbiome and prevention of allergic diseases.” Allergy, Asthma & Immunology Research 15.5 (2023): 545.
Jiachen Liang, Baodong Zheng, Yi Zhang, Hongliang Zeng, Food allergy and gut microbiota, Trends in Food Science & Technology, Volume 140, 2023, 104141, ISSN 0924-2244
Farnetano M, Carucci L, Coppola S, Oglio F, Masino A, Cozzolino M, Nocerino R, Berni Canani R. Gut microbiome features in pediatric food allergy: a scoping review. Front Allergy. 2024 Sep 25;5:1438252.

谷禾健康
同样暴露在含有致病微生物的环境中,有的人很少生病,有的人却很容易感染并生病。这是因为每个人的机体对潜在的病原体产生的免疫应答不同。
★ 固有免疫和适应性免疫保护着人体
人体的免疫应答分为固有免疫(先天免疫)和适应性免疫(后天免疫)。
固有免疫是生物在长期进化中逐渐形成的,是机体抵御病原体入侵的第一道防线。
参与固有免疫的细胞包括白细胞、单核/巨噬细胞、树突状细胞、粒细胞、自然杀伤细胞等。
适应性免疫,是机体针对外来刺激而产生的免疫反应,包括细胞免疫和体液免疫。其中细胞免疫是指T细胞受到抗原刺激后,增殖、分化、转化为效应T细胞,当相同抗原再次进入机体的细胞中时,效应T细胞对抗原的直接杀伤作用及致敏T细胞所释放的细胞因子的协同杀伤作用,而体液免疫是指B细胞产生抗体来达到保护目的的免疫机制。
无论是先天免疫还是后天免疫,免疫细胞之间的平衡和协调互作对于每个个体应对感染和疾病的发展息息相关。
肠道微生物,病原体感染以及饮食成分在调节和诱导这些免疫细胞形成和平衡中发挥不可替代的作用。
肠道菌群主要分布在胃肠道,尤其结直肠部位,所以从上面说肠道对于免疫的作用不言而喻。而且肠道还有一个重要功能是感知外部信号并做出反应。
肠道具有大量的淋巴组织和大量分散的先天性和适应性免疫细胞。肠道及相关微生物的免疫过程也越来越多地涉及控制身体其他部位的疾病发展。这反应在肠道免疫相关的文章数量的激增。
注意,由于胃肠道沿其长度存在不同的功能和结构差异,每个部分都有不同的生理作用和免疫学成分。
小肠的免疫系统侧重于保护表面上皮细胞消化和吸收食物的能力,使其免受感染。
这些机制包括: 产生IL-17和IL-22的T细胞和先天性淋巴样细胞;抗菌肽的生产;和具有先天和细胞溶解效应功能的上皮内T细胞。调节性T细胞有助于防止对饮食抗原的超敏反应。
大肠(结肠)不参与消化,但它是大量对健康至关重要的共生微生物的储存库。结肠免疫系统将这些微生物识别为潜在的危害,并在不驱逐它们的情况下与它们“保持一定距离”。
这涉及上皮细胞更新,粘液层的产生、IgA 等抗体的产生以及大量调节性T和B细胞的存在。
免疫功能的这些不同方面由不同种类的次级淋巴器官或免疫细胞提供服务,并受到局部环境因素的影响,例如饮食成分和细菌代谢物。这其中肠上皮细胞、肠道黏膜、肠道微生物互作对于肠道免疫和全身健康的重要贡献是普遍得出的共识。
因此,进一步研究肠道微生物群与肠道免疫系统之间的相互作用机制,对于我们深入了解这种复杂关系的本质具有重要意义,并为免疫相关疾病的预防和治疗提供新的思路。
本文主要分享肠道的结构和不同部分的功能,肠道免疫涉及的主要免疫细胞及其来源和能量代谢,还有肠道微生物群在其中起到的重要作用,及其失调与免疫相关疾病的关联。
免疫中涉及的一些专业术语
Th1/Th2轴:Th1和Th2细胞是两种不同类型的辅助T细胞。Th1细胞主要分泌干扰素γ和IL-2等细胞因子,参与细胞免疫应答;而Th2细胞则主要分泌IL-4、IL-5、IL-10和IL-13等细胞因子,参与体液免疫应答。Th1/Th2轴的平衡与否,与多种疾病的发生和发展密切相关。Th2状态下容易诱发过敏性疾病;Th1状态下容易诱发自身免疫性疾病。
Th17/Treg轴:Th17和Treg细胞分别是促炎性和抗炎性的T细胞。Th17细胞主要分泌IL-17等细胞因子,参与炎症反应;而Treg细胞则主要分泌IL-10、TGF-β等细胞因子,参与免疫耐受。Th17/Treg轴的失衡,也与多种疾病的发生和发展密切相关。Th1/Th2和Th17/Treg细胞失衡与肿瘤大小、淋巴结转移和血管浸润有关。
NK/NKT轴和自然杀伤细胞:NK细胞和NKT细胞都是自然杀伤细胞,可以直接杀伤病原体和肿瘤细胞。NK细胞主要通过分泌细胞毒素杀伤靶细胞;而NKT细胞则通过分泌细胞因子和直接杀伤靶细胞等多种方式发挥作用。NK/NKT轴的失衡,也与多种肿瘤,炎症,感染等有关。
DC/T轴:DC细胞是树突状细胞,是免疫系统中最重要的抗原递呈细胞。T细胞则是免疫系统中最重要的效应细胞。DC/T轴指的是DC细胞和T细胞之间的相互作用和调节关系。DC细胞通过递呈抗原,激活和引导T细胞的免疫应答,从而对抗病原体和肿瘤细胞。
目录
第一部分:肠的解剖学和生理学
①肠道的结构
②小肠具体的结构和功能
③大肠具体的结构和功能
第二部分:肠道内丰富的免疫细胞
①肠上皮细胞——肠道免疫系统的协调员
②巨噬细胞——肠道免疫系统的关键哨兵
③先天淋巴细胞——肠道免疫的重要力量
④肠神经细胞——中心调节者
⑤肠潘氏细胞——肠道守护者,控制易感性
⑥肠杯状细胞——肠道中的前哨和护送者
⑦T细胞——免疫强弱,免疫监视
⑧B细胞——免疫耐受,产生抗体
第三部分:肠道微生物群与免疫反应
①肠是共生微生物的主要来源
②肠道微生物群——免疫系统的调控者
③肠道菌群失调与免疫相关疾病
▼
肠道是从口腔延伸至肛门的长管状结构,其主要功能是消化食物、吸收营养和水分以及排泄废物。肠道也是许多病原体的主要进入部位,并且是庞大而多样化的微生物群落家园。
小肠和大肠形成一个连续的管子。小肠始于幽门,止于回盲瓣,回盲瓣是大肠的入口。小肠分为三个主要部分,十二指肠最靠近胃,然后是空肠,最后是回肠。大肠始于盲肠,然后是升(近端)结肠、横结肠、降(远端)结肠和直肠,止于肛门。
小肠和大肠的大小明显不同,人类的小肠由多个长度为6-7米的线圈组成;结肠直径更宽且更短(大约1.5m)。
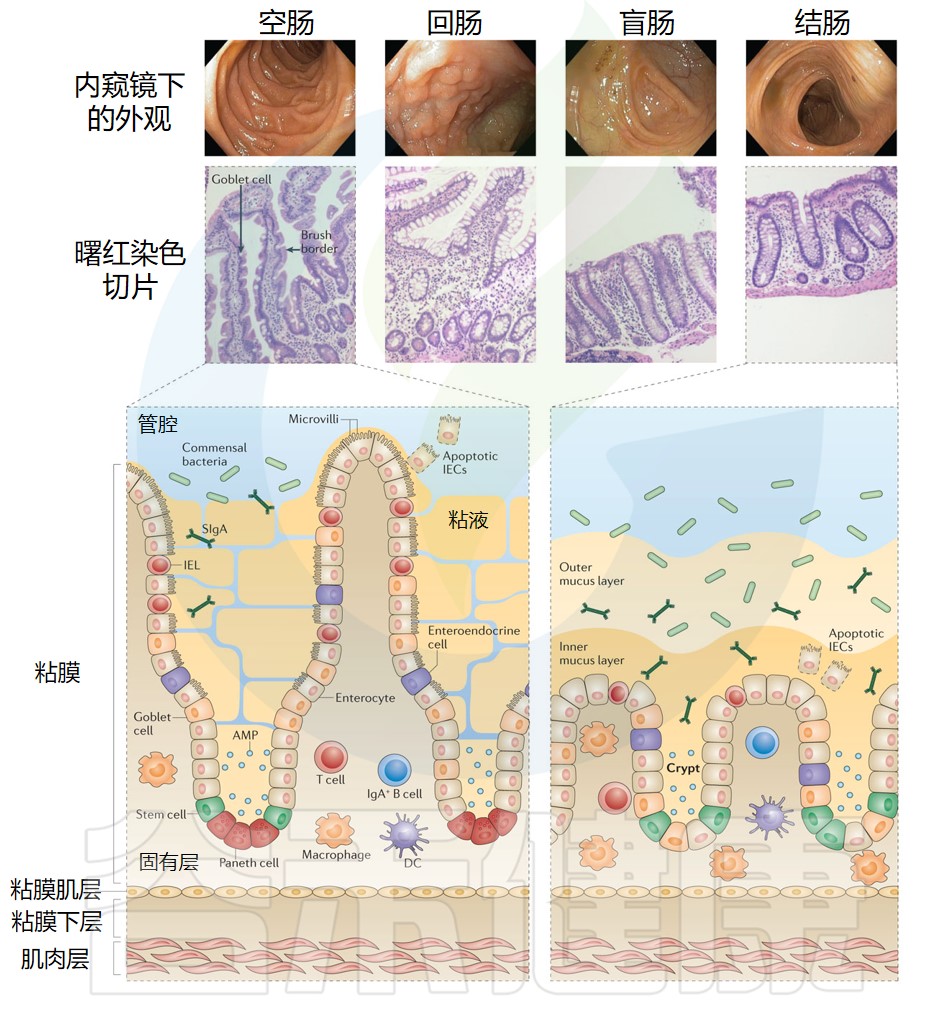
肠粘膜及其免疫装置的解剖结构
Mowat AM,et al.Nat Rev Immunol.2014
在解剖学上,肠组织通常可分为肠系膜、浆膜、肌层、粘膜下层、固有层、上皮和管腔。
▸ 固有层中有众多免疫细胞
在固有层中发现了许多适应性和先天免疫细胞,包括巨噬细胞、肥大细胞、嗜酸性粒细胞、树突状细胞、B细胞和T细胞。
此外,血管、神经、神经胶质突起延伸至整个固有层和粘膜,与这些结构相关的多种细胞和分子对于肠道功能很重要。
▸ 浆膜包裹并润滑胃肠道
肠系膜与浆膜相邻,浆膜是间皮的最外层,包裹并润滑胃肠道,使蠕动收缩不受抑制。
▸ 肌层是肠组织的最外层
肠组织的最外层统称为肌层。该区域由外部纵向肌肉层和内部圆形肌肉层组成,这些层彼此交织,拉伸。
下面详细描述的结构和细胞区室化将为胃肠道中可能发生的大量神经免疫相互作用提供解剖学参考。与这些结构相关的细胞和分子对于肠道功能非常重要。
▼
✦小肠的主要功能是消化和吸收
小肠的主要功能是营养物质的消化和吸收,起始于胃的幽门,终止于回盲瓣。在人类中,它的长度达到6-7m,按降序由十二指肠、空肠和回肠组成。
小肠的特征是绒毛的指状突起,它延伸到内腔并增加消化活性上皮的表面积,绒毛的丰富表面积,使得它们能够更充分地接触到食物中的营养分子,并将其迅速吸收进入血液循环。
相比之下,表面平坦的盲肠和结肠没有绒毛。
•十二指肠
十二指肠位于胃和空肠之间,是食物从胃进入小肠的第一段。主要功能包括:
•接受来自胃的部分消化食物,继续消化和吸收。
•分泌胰液和胆汁,帮助消化食物中的脂肪和蛋白质。
•吸收营养物质(如碳水化合物、脂肪和部分氨基酸)。
除了来自胃的管腔内容物外,十二指肠每天还通过胆总管接收0.6-1.0L胆汁。胆汁的主要成分包括胆固醇、卵磷脂、胆红素和胆汁盐,后者对食物中的脂肪颗粒具有关键的洗涤作用,并有助于吸附脂肪酸、单甘油酯、胆固醇和其他脂质。
•空肠
空肠位于十二指肠之后,是小肠的一段。主要功能包括:
•进一步消化和吸收食物中未消化的碳水化合物、脂肪和蛋白质。
•吸收维生素、矿物质和水分。
•回肠
回肠是消化系统的一部分,位于空肠之后,是小肠中最后一个部分。它具有以下主要功能:
•营养物质吸收:回肠是主要的吸收器官之一,通过其表面上的细胞吸收并转运剩余的营养物质。
•液体平衡维持:回肠通过吸收水分和电解质维持体内的液体平衡。
•消化废物储存:回肠也起到储存和排泄消化废物的作用。在回肠中,食物残渣逐渐形成粪便,然后被推进结肠,进行最终的排泄。
单糖、二糖和三糖、氨基酸、膳食脂肪、脂溶性维生素(维生素A、D、E和K)或水溶性维生素(维生素B和C)主要存在于十二指肠和空肠中,而回肠是吸收胆汁盐和维生素B12的主要场所。
小肠上段的损伤(如乳糜泻中所见)会导致严重的吸收不良、蛋白质渗漏和营养不良。
✦小肠中有众多的免疫细胞
大多数免疫过程发生在粘膜中,粘膜包括上皮细胞、下面的固有层和粘膜肌层。固有层由松散堆积的结缔组织组成,形成绒毛的支架,并包含粘膜的血液供应、淋巴引流和神经供应。它还包含许多先天性和适应性免疫系统的细胞。
淋巴细胞也存在于上皮细胞中,尽管仅被一层薄的基底膜隔开,固有层和上皮细胞形成非常不同的免疫隔室。它们的组成和功能在整个肠道中也有很大差异。
✦与小肠相关的疾病
乳糜泻
一种自身免疫性疾病,食用麸质会引发白细胞攻击小肠内壁。
克罗恩病
一种导致消化道疼痛性炎症的长期疾病。
肠易激综合症
一种与大脑和肠道之间的信号传导问题相关的常见病症,可导致胃肠道症状。
小肠细菌过度生长
小肠内菌群数量或菌群种类改变,达到一定程度并引起临床表现者。临床表现包括腹痛、腹胀、腹泻或是吸收不良。
消化性溃疡
是位于胃或十二指肠的开放性溃疡。
小肠憩室
肠腔内压力的影响或胚胎时期发育不良使小肠壁薄弱处向外膨出形成的盲囊。
▼
大肠是人体消化系统中的重要组成部分,主要分为盲肠、结肠和直肠。
•盲肠
盲肠是一个封闭的囊,是大肠的第一部分,长约6~8cm,位于腹腔右下部,与回肠交接处有回盲瓣,有孔与阑尾相连,向上续接升结肠。
它充当共生细菌的大储藏室,这些共生细菌参与无法被小肠酶处理的复杂碳水化合物,蛋白质等的发酵消化。
盲肠没有绒毛,粘膜主要由隐窝组成,只有短的平面上皮区域。杯状细胞数量众多,遍布整个隐窝。潘氏细胞很少见。盲肠是整个结肠中最宽的部分,大约20%的结肠癌发生在盲肠。
•结肠
结肠构成了大肠的大部分,包括以下四个部分:
升结肠(从盲肠向上,位于腹部右下角)
横结肠(穿过腹部)
降结肠(向下到最后的结肠部分)
乙状结肠(结肠的最后部分)
升结肠
升结肠长约10厘米,起始于盲肠的肝曲。它沿着腹部右侧延伸,连接横结肠。
横结肠
横结肠长约50厘米,靠近胃、肝脏和胆囊。它连接到降结肠,即所谓的大肠远端或左侧部分的起点。
降结肠
降结肠长约10厘米,结肠在腺曲转折向下固定在腹后壁左侧的一段为降结肠。降结肠下降至左髂嵴处与乙状结肠相连。
乙状结肠
结肠的一部分,在左髂嵴平面与降结肠相连,至第三骶椎平面续于直肠,位于左腹下部及小骨盆内,呈“乙”状或“S”形弯曲,长约40cm。
•直肠
直肠是人体消化系统中的最后一部分,位于盆腔,连接着乙状结肠和肛门。
直肠的壁内有众多的褶皱和粘膜绒毛,这增加了其表面积,有助于吸收水分和电解质。这些特点有助于保持粪便的适当湿润,以便于排泄。
!
注意
人类结肠比小肠短得多(约1.5m)且宽。尽管也被单层柱状上皮细胞覆盖,但其表面完全由散布在表面上皮平坦区域之间的隐窝组成。产生粘液的杯状细胞在小肠上皮细胞中所占比例相对较小(≤10%),但在大肠上皮细胞中所占比例≥25%。
小肠与结肠中的主要细胞与结构
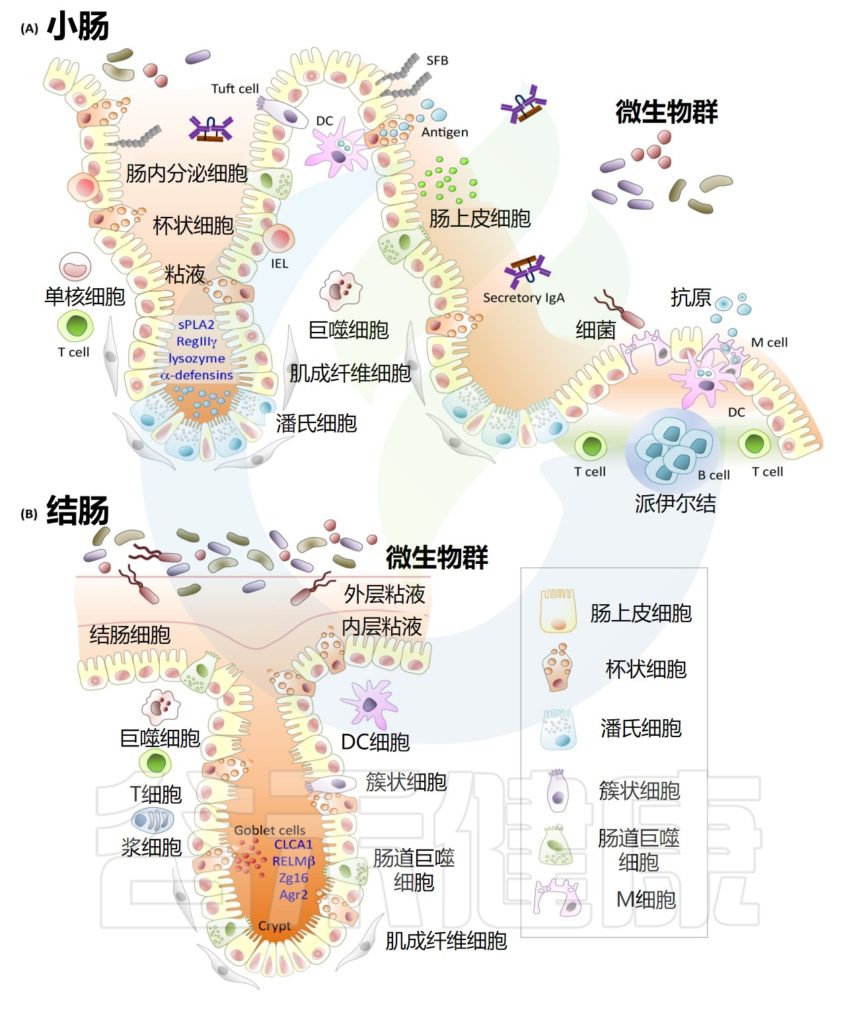
Allaire JM,et al.Trends Immunol.2018
尽管大部分膳食成分在小肠中被吸收,但每天仍有约1.5L的肠液通过回盲瓣。这种液体主要由水和电解质组成,以及半消化或未消化的食物,包括植物多糖和纤维。其中大部分被结肠上半部吸收,它们是常驻微生物群的重要营养来源。
所有结肠癌中约20%至25%起源于远端结肠,而25%至30%的癌症发生在长约15厘米的直肠。
✦与大肠相关的疾病
结肠癌
结肠癌可以始于升结肠。由于它并不总是会引起症状,因此通常直到癌症晚期才被发现。
注:当诊断出结肠癌时,病理学家将确定癌症已到达哪一层(例如最内层或最外层),以帮助确定癌症的分期。
结肠息肉
结肠息肉是发生在肠内壁上的茎状生长物。它们伸入结肠内部。如果它们变大,就会阻止废物通过。
注:息肉是癌症的先兆,在筛查结肠镜检查过程中,发现的任何息肉都将被切除,这样它们就不会继续生长并带来患癌症的风险。
憩室病
憩室病是一种在结肠内壁薄弱部分出现的向外囊状突起。它可能不会引起任何症状,除非被感染,这被称为憩室炎。憩室炎可能导致发烧、恶心、腹痛和腹泻。
注:对于40岁以上的人来说,结肠内壁出现这些小袋很常见,大多数50岁以上的人也有这种情况。
炎症性肠病
克罗恩病、溃疡性结肠炎和不确定性结肠炎是炎症性肠病的一种。炎症性肠病会引起消化道炎症和溃疡。这可能会导致消化道出血、腹痛和腹泻。
此外,炎症性肠病还可引起肠外并发症,包括疲劳、皮肤病、眼部问题和各种形式的关节炎。
▼
肠上皮细胞是位于肠道内壁的特殊细胞类型,它们构成了肠道黏膜的外层。肠上皮细胞具有多种重要功能,包括吸收营养物质、分泌消化酶、阻止有害物质进入身体内部以及促进肠道免疫响应等。
√大肠与小肠间肠上皮细胞差异较大
肠上皮是单层细胞,但是在小肠和大肠之间的结构和细胞组成上有很大差异。
在小肠中,上皮延伸到伸入管腔的结构,称为绒毛,从而增加粘膜表面积和营养吸收。结肠中没有绒毛,导致粘膜表面相对平坦,从而限制了半固体粪便通过大肠造成的潜在损害。
√肠上皮细胞内具有不同分化类型的细胞
上皮本身并不是一层直的细胞,而是由被称为“Lieberkühn 隐窝”的内陷组成。肠干细胞位于这些隐窝的底部,并产生短暂的增殖细胞,这些细胞在向上穿过过渡区时分化和成熟,肠上皮细胞最终脱落到隐窝顶端的管腔(或小肠中的绒毛)。
注:肠隐窝经历肠上皮细胞补充和更新的持续循环,在稳态条件下,估计整个隐窝每4-5天更换一次。
在肠道上皮细胞内发现了各种分化的细胞类型,每一种都执行独特和专门的功能。这些细胞类型包括:肠细胞,肠上皮细胞中负责营养和水分吸收的最主要细胞类型;各种分泌细胞,例如分泌粘蛋白的杯状细胞,分泌激素的肠内分泌细胞,以及释放抗菌因子以促进消化的潘氏细胞,保护小肠隐窝底部附近的干细胞。
还有在抵御蠕虫中起关键作用的化学感受簇细胞,以及对免疫系统摄取和最终呈递管腔抗原不可或缺的M细胞。
√肠上皮细胞在免疫中主要起屏障功能
肠上皮细胞对免疫的主要贡献是屏障功能,可防止肠腔物质与肠道内壁细胞之间的相互作用。除了不渗透性、快速更新和蠕动等因素外,上皮层首先受到杯状细胞产生的粘液的保护,其次受到无数抗菌分子的保护,例如隐菌素、溶菌酶、磷脂酶和趋化因子。
这些天然杀菌或抑菌化合物会损害多种微生物的增殖,从而阻止入侵粘膜之前大部分正在进行的定植。
尽管在大多数情况下先天免疫足以保护肠道,但适应性免疫系统效应淋巴细胞的记忆特性使病原体在再次遇到病原体时能够更特异、更有效地被消除。
因此,消化道是免疫记忆的主要部位,并且确实构成了人体B和T淋巴细胞的主要储存库。已有文献总结了在解剖学上不同的粘膜诱导位点和粘膜效应位点引发适应性免疫。抗原特异性反应的先决条件是通过粘膜上皮取样抗原并递送至下面的MALT或引流粘膜的淋巴结。
上皮细胞的能量代谢
上皮细胞的能量代谢,尤其是结肠中的能量代谢,在很大程度上取决于肠道微生物群。在生命早期,在适应性免疫系统成熟之前,未知的微生物衍生分子通过 STAT3 磷酸化以IL-23和IL-22依赖性方式激活上皮内淋巴细胞和先天淋巴细胞。
在缺乏适应性免疫的情况下,IL-23-IL-22可以控制肠道微生物群,但过度激活的IL-22产生会导致脂质代谢异常,并导致关键脂质转运蛋白的表达减少(例如, CD36、Fabp1/2),以及血清中甘油三酯和游离脂肪酸的减少。
自噬是由能量应激诱导的,以维持结肠细胞的稳态。结肠肠道微生物组产生的丁酸盐确实是结肠细胞的唯一碳源。转化为丁酰辅酶A后,它被动扩散到线粒体中,进行β-氧化,并供给三羧酸循环和氧化磷酸化以产生能量并抑制自噬激活。
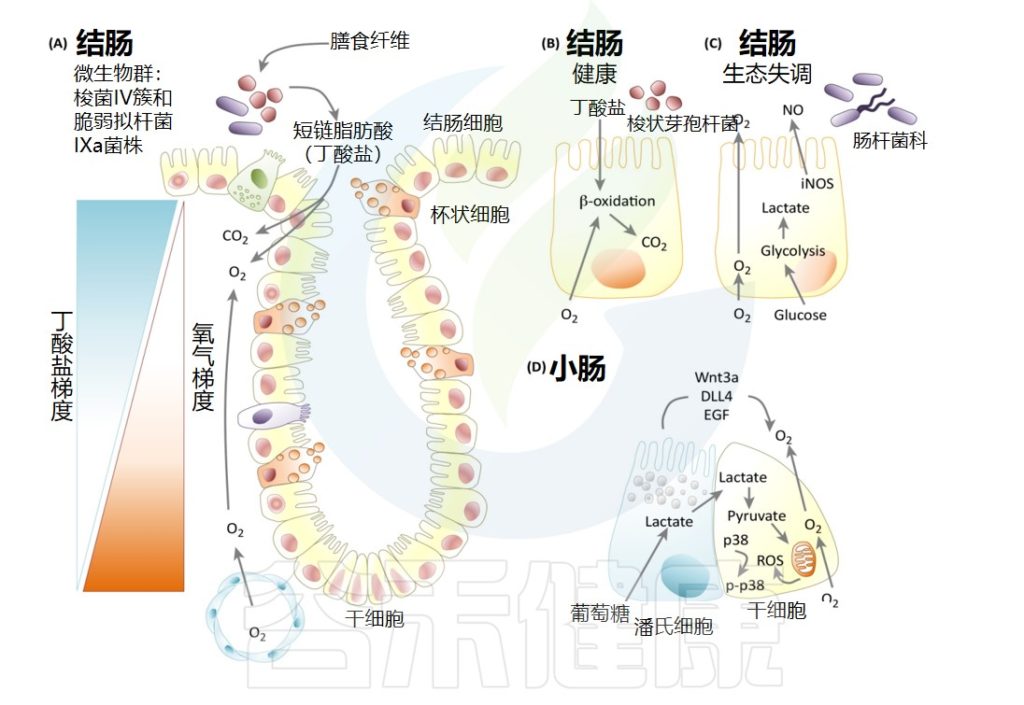
Allaire JM,et al.Trends Immunol.2018
肠上皮细胞大量暴露于肠道微生物,并产生粘液和抗菌肽以保持安全距离。丁酸盐还通过下调人类肠三批细胞中的IDO1表达和犬尿氨酸途径来促进肠道稳态。
IDO1在我们前面色氨酸代谢那篇文章中讲到过:
色氨酸通过犬尿氨酸通路的分解代谢,该通路占整体色氨酸降解的约95%,形成主要最终产物NAD+。
注:犬尿氨酸通路是炎症和免疫反应的重要参与者。
首先,色氨酸被转化为N-甲酰基-L-犬尿氨酸
该反应由三种限速酶之一催化:
TDO(色氨酸 2,3-双加氧酶) -肝内
IDO1(吲哚胺 2,3-双加氧酶 1) -肝外
IDO2(吲哚胺 2,3-双加氧酶 2) -肝外
注:这三种酶都是血红蛋白,并使用分子O2作为共底物,这也使它们能够利用活性氧 (ROS) 并调节细胞内的氧化还原平衡。
IDO和TDO酶在不同的组织中表达,暴露于不同的刺激物时被诱导,表明它们在健康和疾病中具有不同的功能。
TDO在基础条件下催化色氨酸分解,而在免疫调节中具有关键作用的IDO-1受到多种刺激物的诱导和调节,例如炎症信号 。
√肠道微生物群影响肠嗜铬细胞产生血清素
在不同的肠上皮细胞类型中,肠嗜铬细胞负责产生血清素,这对免疫细胞有重大影响。结肠中血清素的产生很大程度上受到肠道微生物群,特别是孢子形成细菌代谢物的调节。
其机制尚未完全阐明,但已表明,短链脂肪酸(丁酸和丙酸)和一些次级胆汁酸(例如通过微生物生物转化产生的脱氧胆酸)可以上调TpH1表达(血清素生产中的限速酶)。
即使需要进一步研究,这些数据表明,调节肠道微生物群组成或直接施用微生物代谢物可以从治疗角度控制血清素的产生。
▼
巨噬细胞是一种具有细胞吞噬能力的细胞,源自单核细胞,而单核细胞又来源于骨髓中的前体细胞。
√巨噬细胞在肠道稳态中发挥多种作用
巨噬细胞在维持肠道稳态方面发挥多种作用。与其他组织中的巨噬细胞一样,肠壁中的巨噬细胞也具有强烈的吞噬能力。然而,虽然具有高度杀菌作用,同时还不会导致明显的炎症反应 。
吞噬
肠固有层巨噬细胞具有高度吞噬能力,负责清除凋亡和衰老的上皮细胞。通过表达组织重塑金属蛋白酶和分泌刺激上皮干细胞更新的因子,例如前列腺素E2、肝细胞生长因子和Wnt配体,它们可促进上皮完整性。
转移
巨噬细胞可以将获得的抗原转移至迁移性树突状细胞,以呈递给引流肠系膜淋巴结中的T细胞。通过产生免疫调节细胞因子,例如IL10和TGFβ,它们维持并促进局部调节性T细胞的二次扩增。
以类似的方式,巨噬细胞通过产生IL1β来支持Th17细胞和ILC3,IL1β是通过暴露于微生物群或其衍生物而诱导的。巨噬细胞也存在于肠壁的更深层,包括粘膜下层和外肌层。
促炎或抗炎
巨噬细胞是免疫系统的关键介质,几乎遍布整个胃肠道。巨噬细胞对炎症状态具有重要影响,具有促炎和抗炎功能。它们的极化状态与许多代谢紊乱有关,例如炎症性肠病。
注:炎症M1细胞和抗炎M2细胞的表型和功能之间的平衡受细胞外和细胞内刺激的调节,从而决定疾病的进展情况。
√肠道微生物诱导巨噬细胞
现在有多种证据表明微生物群在影响粘膜巨噬细胞群动态方面发挥着关键作用。
首先,微生物定植后,结肠巨噬细胞区室发生了重大变化,特别是在断奶时,单核细胞通过单核细胞“瀑布”的分化已经建立。
其次,使用广谱抗生素可以减少巨噬细胞的周转,这进一步表明共生微生物群在控制巨噬细胞周转中的作用。
此外,与正常小鼠相比,无菌小鼠肠壁中发现的巨噬细胞较少。粘膜微环境实际上可能会对巨噬细胞进行招募。
如上所述,微生物群可能构成这种分化的一种刺激因素,其他可能性可能包括饮食代谢物或蠕动产生的持续机械应力。
注:有人建议机械应力可以解释心脏中胚胎来源的巨噬细胞的替换并且除了产生低度“炎症”外,它还可以简单地阻止巨噬细胞的长期停留。
巨噬细胞的能量代谢
巨噬细胞在免疫反应过程中处于第一线,但也感知微生物群并对其做出反应以控制微生物群,而不引发有害的炎症反应。
在致病反应期间,活化巨噬细胞的代谢特征根据情况而变化。在促炎性M1巨噬细胞中,三羧酸循环被破坏,导致衣康酸和琥珀酸的积累以及糖酵解的转变。
衣康酸是免疫代谢的主要参与者,具有免疫调节和抗菌作用。它还参与琥珀酸的积累,因为它通过阻断琥珀酸脱氢酶的活性来直接抑制其氧化。
琥珀酸通过氧化产生线粒体活性氧并导致IL-1β产生,从而表现出促炎作用。
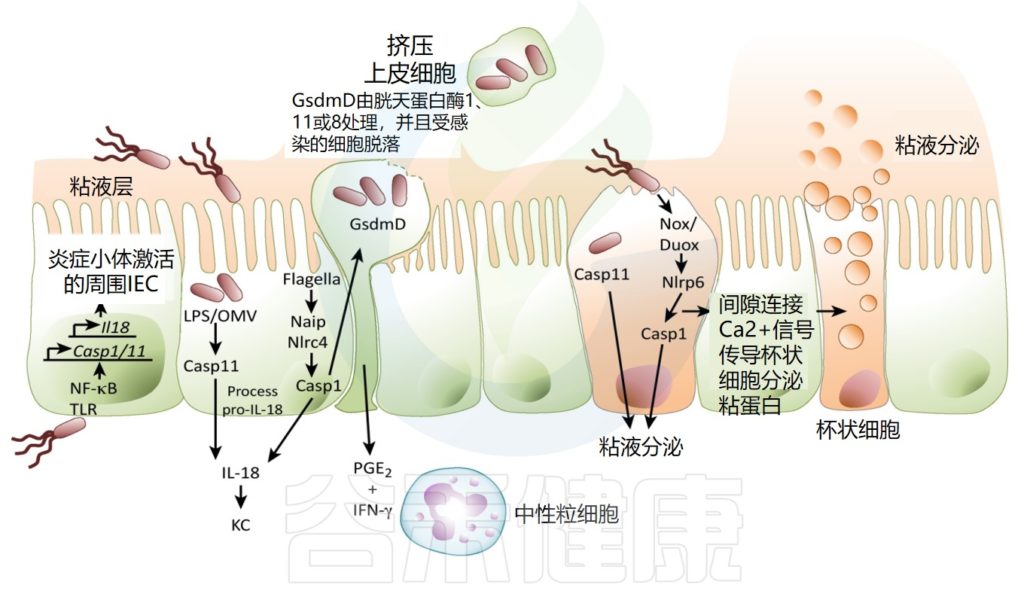
Allaire JM,et al.Trends Immunol.2018
相反,M2巨噬细胞具有完整的三羧酸循环,并且主要依赖氧化磷酸化。肠道微生物群是通过短链脂肪酸来调节这些过程。丁酸盐(但不是乙酸盐或丙酸盐)将巨噬细胞代谢重新编程为氧化磷酸化和脂质代谢,从而导致抗炎M2表型。
▼
先天性淋巴细胞家族由自然杀伤细胞、ILC1、ILC2和ILC3组成,它们参与对病毒、细菌、寄生生物和转化细胞的免疫反应。
√先天淋巴细胞对感染和损伤做出免疫反应
有不同类型的先天淋巴细胞,其特征是表达特定的膜标记、转录因子和细胞因子特征。在激活过程中,先天淋巴细胞会深刻改变其能量代谢以适应其新功能。
先天淋巴细胞,通过产生细胞因子和分泌蛋白对感染或损伤作出反应,这些细胞因子和分泌蛋白指导和增强攻击前线的免疫反应。
√肠道微生物群影响先天淋巴细胞功能
肠道微生物群影响先天淋巴细胞功能,抗生素对ILC1、ILC2和ILC3转录组程序的巨大影响证明了这一点。
ILC3是胃肠道中存在的先天淋巴细胞的主要类型。这些细胞表达RORγt,可以产生IL-17和IL-22,是炎症、感染、微生物群组成和代谢的重要调节因子。
ILC3功能例如肠上皮防御的维持,依赖于昼夜节律调节器ARNTL介导的昼夜节律信号。但众所周知,肠道微生物群是昼夜节律的影响因素。
肠道微生物群衍生的丁酸盐也可调节ILC2功能,抑制其不受控制的激活,从而抑制其在肺部炎症和哮喘中的负面作用。
▼
哺乳动物的神经系统分为中枢神经系统和周围神经系统。中枢神经系统包括大脑和脊髓,周围神经系统包括神经节,神经节是神经细胞体的聚集体,头部、颈部和内脏中的神经束从神经细胞体中产生。
注:消化道同时受自主神经和管道壁上的肠神经丛的神经支配。
√交感神经直接从大脑连接到胃肠道
从中枢神经系统到肠神经系统的外部连接由交感神经纤维和副交感神经纤维组成。离开脑后,副交感神经和交感神经可以直接突触到胃肠道。
例如,副交感迷走神经,离开后脑后,沿着食道穿过隔膜,最终突触到胃肠道。交感神经起源于脊柱,并突触到交感内脏神经节,例如腹腔神经节、肠系膜上神经节和肠系膜下神经节。副交感神经和交感神经均可直接突触至肌间神经节、平滑肌和粘膜。
√盆腔神经支配远端结肠和直肠
此外,起源于脊髓并通过骶脊神经离开的盆腔神经支配远端结肠和直肠。盆腔神经传统上被认为是副交感神经。副交感神经对交感神经节的神经支配使胃肠道的神经连接变得更加复杂。
最后,内在的肠神经系统是沿着胃肠道的神经元和神经胶质细胞的扩展网络;这些可以自主发挥作用,但也可以通过肠神经系统与外在交感神经和副交感神经的连接进行调节。因此,中枢神经系统和肠神经系统之间的通信是双向的。
√肠神经元上的受体介导重要的胃肠道功能
肠神经元上的受体介导重要的胃肠道功能。机械感受器对粘膜磨损敏感;张力感受器对拉伸敏感;化学感受器对管腔内的各种化学刺激做出反应,例如pH值、渗透压和营养物质。此外,各种受体负责调节肠道内的液体交换。
2021年美国一项研究发现肠道神经细胞可以通过分泌细胞因子IL6来调控调节性T细胞的水平。
此外,调节性细胞诱导菌很有可能是通过降低肠道神经系统密度和神经细胞IL6水平的双重作用,来诱导调节性T细胞的。
▼
潘氏细胞于19世纪末首次描述为柱状上皮细胞,胞浆内有明显的嗜酸性颗粒。它们在维持肠道稳态和调节小肠及其相关微生物菌群的生理方面发挥着不可或缺的作用。
√潘氏细胞可调节肠道稳态
潘氏细胞产生的致密颗粒含有丰富的抗菌肽和免疫调节蛋白,它们的功能是调节肠道菌群的组成。
肠道中的潘氏细胞在小肠中比较丰富,与吸收性肠细胞不同,潘氏细胞寿命长,在从干细胞分化后向下迁移到隐窝的最底部。
√潘氏细胞具有重要的抗菌作用
它们具有重要的抗菌作用,可产生溶菌酶、防御素等抗菌肽并再生胰岛衍生蛋白IIIγ,以响应白细胞介素22或刺激Toll样受体、核苷酸结合寡聚化结构域2或胆碱能神经。
潘氏细胞是专业的分泌细胞,通常通过将抗菌因子分泌到管腔中来控制肠道细菌,从而在先天免疫系统中发挥作用。潘氏细胞能够感知来自腔内细菌的信号,并通过改变这些因子的产生来做出反应,以保护上皮屏障。潘氏细胞依靠自噬来调节其分泌能力和能力。
潘氏细胞还通过产生促表皮生长因子 配体来帮助维持正常的隐窝干细胞活性,它们对于肠道稳态至关重要。
小结
总之,肠潘氏细胞在肠道内稳态的许多方面都起着关键作用,从调节与上皮密切相关的微生物区系,到维持干细胞生态位的健康,再到帮助调节炎症水平。不仅保护自己不受外来入侵,而且促进肠道的生长和发育。
这些功能在早产儿的未成熟肠道中尤其重要,早产儿的肠道发育中伴随着一个非生物菌群。因此,潘氏细胞破坏与新生儿肠道坏死的发生有机械联系是合理的。对潘氏细胞生物学的进一步了解可能会为理解新生儿肠道坏死的发展提供一条重要的途径。
▼
我们的肠道和呼吸道中布满了杯状细胞,这些细胞因其杯状外观而得名,它们能够分泌具有保护作用的凝胶状粘液,以防止肠道内细菌直接侵入肠壁组织而引发炎症反应。
这些黏液的主要成分为肠壁上杯状细胞分泌的黏蛋白。黏蛋白则肠道黏液层的重要组成部分,凝胶形成黏蛋白和跨膜黏蛋白是目前已知的两种黏蛋白。
√杯状细胞沿着胃肠道逐渐增加
与潘氏细胞相反,产生粘液的杯状细胞的频率沿着胃肠道逐渐增加。杯状细胞在远端结肠中至少占所有上皮细胞的25%,而在小肠上段则为10%或更少。
与此同时,覆盖在粘膜上的粘液层——被称为糖萼,在结肠中最厚,它由两个不同的层组成:一个附着在上皮表面的致密内层和一个外层,类似于小肠中发现的松散层。
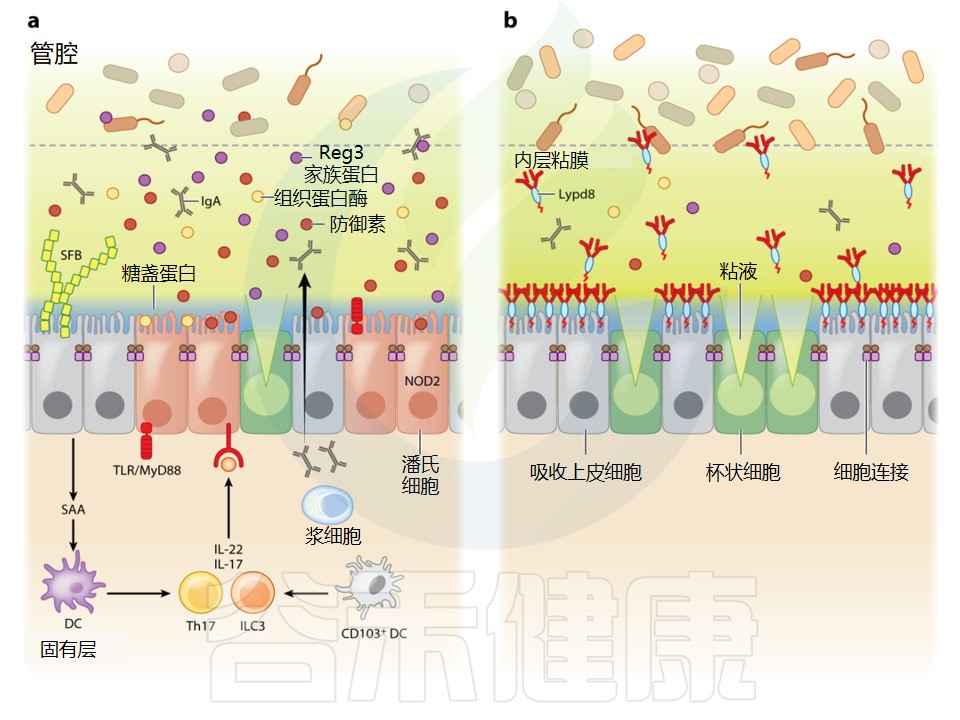
Kayama H,et al.Annu Rev Immunol.2020
√杯状细胞分泌的粘液具有抗菌作用
粘液具有抗菌作用,形成一种高度带电的凝胶,充当物理屏障,并且由对许多细菌有直接毒性的粘蛋白糖蛋白组成。
小肠较松散的糖萼也提供了抗体和抗菌肽可以粘附的基质。粘液合成的缺陷导致共生细菌更多地渗透到结肠的上皮表面,从而增加对结肠炎和结肠癌的易感性。
杯状细胞除了分泌肠道黏液层,形成肠道组织、免疫系统与肠腔微生物群、内容物分离的重要屏障,它其实还有其他意想不到的作用。
√避免一些蛋白引起免疫反应
杯状细胞还可以“护送”抗原到树突细胞。来自华盛顿大学圣路易斯医学院的研究人员在小鼠肠道中鉴定出一种“护送”食物中的抗原或蛋白到树突细胞的细胞,即杯状细胞,这样免疫系统就不会对它们发起免疫。这项发现给科学家提供一种潜在性靶标来治疗炎性肠道疾病、乳糜泻和食物过敏,这些疾病都是由于免疫系统过分活跃而导致的。
√杯状细胞与痛觉感受神经联系保护肠道
2022年,哈佛大学医学院的研究表明,肠道中的痛觉感受神经在正常情况下能够调节保护性粘液的存在,并在炎症状态下刺激肠道中的杯状细胞分泌更多粘液,从而直接发挥保护肠道的作用。
该研究详细描述了这种复杂信号级联的步骤,显示痛觉感受神经与肠道杯状细胞直接可以进行直接的串扰。
√杯状细胞增加粘液分泌阻止外来的细菌侵入
杯状细胞可以还“自杀”换取结肠的安全。
哥德堡大学的研究团队发现一类新的被称作杯状细胞的岗哨细胞能够冲洗走侵入到保护性的黏液屏障的细菌。一旦发现细菌存在于这种隐窝入口处的迹象,它们就启动一种级联反应,最终导致黏液增多,从而将细菌冲洗走。
这一发现可能为解释炎症性肠病(如溃疡性结肠炎)如何发生提供重要理论依据。
此前,该团队已证实黏液层作为第一道防线而存在。然后又证实在隐窝入口处存在一部分杯状细胞作为第二道防线阻止进入黏液层的细菌侵入结肠。
▼
T细胞在哺乳动物免疫反应中的核心作用是无可争议的。
根据所产生的细胞因子和效应细胞的生物功能特征,可将其分为辅助型T细胞1(Th1)、辅助型T细胞2(Th2)、调节性T细胞(Treg)和Th17等。
T细胞祖细胞源自骨髓中的造血干细胞。它们迁移到胸腺,在那里成熟为T细胞。随后,T细胞迁移通过次级淋巴器官,扫描呈递其同源抗原的抗原。
√肠道内含有大量的T细胞
肠道是体内最大的T细胞群之一的所在地。粘膜T细胞对于体内平衡和保护性免疫至关重要,但也在不受控制的(慢性)粘膜炎症中发挥作用,如乳糜泻或炎症性肠病,甚至可能在肿瘤的发展过程中。
胃肠道的上皮屏障是大量上皮内T细胞的家园。上皮内T细胞在功能上适应粘膜环境,是最早遇到微生物和饮食抗原的适应性免疫细胞之一。
√上皮内T细胞的免疫作用
上皮内T细胞在免疫监视中发挥重要作用,同时诱导对非病原性抗原的耐受性,从而保持单层上皮膜的完整性。
炎症性肠病和乳糜泻的特点是(复发性)胃肠道炎症占主导地位。上皮内T细胞在肠上皮屏障中的寿命长且大量存在,表明上皮内T细胞在这些疾病的复发和缓解过程以及持续的低度炎症中发挥作用。
作为组织特异性和潜在致病细胞,上皮内T细胞是治疗(非系统性)慢性组织特异性炎症性疾病(如 炎症性肠病)的理想靶点。
启动的T细胞会长期驻留在肠道中
在炎症或感染环境中,已启动的T细胞会暂时从循环中募集到肠道,但大量T细胞会永久驻留在肠道中,并且独立于淋巴和循环记忆群体而维持。
这些T细胞主要由T细胞受体αβ + CD8αβ +和TCRαβ + CD4组成+组织驻留记忆T细胞,但调节性T细胞 (TCRαβ + CD4 + FOXP3 + )、TCRγδ + T 细胞、自然杀伤T细胞和粘膜相关不变T细胞也建立长期驻留在肠道。
T细胞的能量代谢
T细胞代谢可塑性对于适应永久动态的免疫环境是必要的。肠道微生物群通过活性氧、短链脂肪酸和胆汁酸的产生以及氧化还原信号传导的修饰积极参与这一复杂过程。
效应T细胞和记忆T细胞具有不同的功能和需求,因此表现出不同的代谢。它在效应T细胞中由有氧糖酵解主导,在记忆T细胞中由脂肪酸氧化和氧化磷酸化 主导。记忆T细胞中存在融合的线粒体网络,效应T细胞中存在点状线粒体。
此外,线粒体是T细胞激活的关键组成部分,主要通过活性氧产生。通过CD3刺激T细胞会诱导钙内流,从而刺激丙酮酸脱氢酶和三羧酸循环酶的功能。
√短链脂肪酸可以增强T细胞功能
微生物群衍生的短链脂肪酸通过改变细胞代谢来增强CD8+ T细胞效应功能。肠道微生物群代谢膳食纤维产生的短链脂肪酸会刺激CD8+ T细胞中的氧化磷酸化和线粒体质量及其糖酵解能力。
此外,短链脂肪酸可以扩散到细胞质中并作为脂肪酸氧化的底物,导致乙酰辅酶A的产生,为三羧酸循环和氧化磷酸化提供燃料。
在活化的CD8+ T细胞中,短链脂肪酸,特别是丁酸,促进胆汁酸的摄取和氧化,导致三羧酸循环与糖酵解输入断开,并通过胆汁酸分解代谢和谷氨酰胺利用有利于氧化磷酸化。这种丁酸盐诱导的细胞代谢适应是分化为记忆T细胞所必需的。
短链脂肪酸对CD4+ T细胞也表现出显著影响,特别是在辅助性T(Th)17、Th1的生成方面和调节性T细胞。其机制涉及组蛋白去乙酰化酶的抑制和mTOR通路(细胞生长和代谢的主要调节因子)的调节。
最近发现了戊酸的这种联系,它可以通过为组蛋白乙酰转移酶提供额外的乙酰辅酶A并增强糖酵解和 mTOR 活性来刺激抗炎细胞因子IL-10的产生。
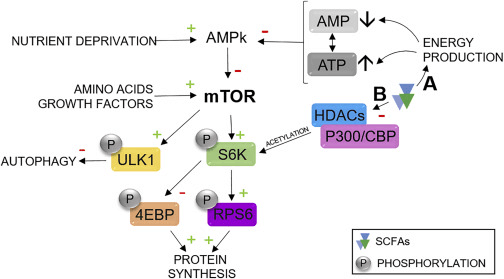
短链脂肪酸激活mTOR的机制
短链脂肪酸激活mTOR的机制有两种。短链脂肪酸通过对能量产生途径的作用,诱导ATP的产生和AMP的消耗,它们分别是AMP激活蛋白激酶 的抑制剂和激活剂。因此,AMPK对 mTOR的抑制剂活性被抑制,从而导致mTOR激活。
第二个潜在机制涉及短链脂肪酸的组蛋白去乙酰化酶抑制活性。短链脂肪酸与 P300/CBP(E1A 结合蛋白 p300/CREB 结合蛋白)结合,促进核糖体蛋白 S6 激酶 beta-1 (S6K1) 的乙酰化,这是mTOR 的下游靶标,从而更强有力地激活途径。
√胆汁酸对T细胞的影响
胆汁酸对T细胞也有重要影响。石胆酸的衍生物3-oxoLCA通过直接与转录因子RORγt相互作用来抑制Th17细胞的分化。
相反,石胆酸的另一种衍生物isoalloLCA促进调节性T细胞的分化。该机制涉及刺激OXPHOS和mROS的产生,从而通过增加Foxp3启动子中组蛋白 (H3K27) 乙酰化的水平来增加FOXP3的表达。
具体来说,在结肠中,胆汁酸通过胆汁酸受体 Breg 调节 RORγ+ Treg 细胞的功能,这些细胞在维持结肠稳态中发挥着重要作用。
▼
B细胞是一种在适应性免疫过程中发挥重要功能的淋巴细胞,B细胞及其所生产的抗体,对于免疫系统的正常运行是十分重要的。
√B细胞通过产生抗体阻止外来病原体
B细胞是可以产生抗体的白细胞。这些抗体或免疫球蛋白可以与有害的外来颗粒(如病毒或致病细菌)结合,阻止它们入侵和感染人体细胞。
每个B细胞携带一个单独的B细胞受体,该受体决定它可以结合哪些病原体,就像每个锁接受不同的钥匙一样。
人类肠道中B细胞谱系的两个主要区室是肠道相关淋巴组织和弥漫性淋巴组织中高度组织化的B细胞的聚集地,它们占据了大肠和小肠的广泛肠固有层 。
肠道相关淋巴组织可以以滤泡簇的形式出现,通常被称为派尔氏淋巴结或孤立的淋巴滤泡,分布在整个胃肠道中,是对从肠腔采样的抗原做出长期反应的免疫诱导位点。
研究人员使用专门设计的计算机程序来处理数百万个基因序列,这些序列会比较来自B细胞的抗体库,这取决于这些微生物是留在肠道里,还是进入血液。在这两种情况下,抗体库都改变了,但改变的方式不同,取决于暴露发生的方式。
√肠壁与血液中的抗体不同
与血液中的抗体(IgM和IgG)相比,肠壁(IgA)中存在不同种类的抗体。通过强大的基因分析,研究人员发现,肠道产生的不同抗体的范围远小于身体中央组织产生的抗体。
这意味着一旦微生物进入人体,免疫系统就有更多的可能去中和和消灭它们,而肠道中的抗体主要结合在任何时候都能看到的细菌分子。
B细胞有时会影响受损肠道的愈合
B细胞有时也会好心办坏事。来自瑞典研究组发表研究结果发现,B细胞的数量在肠道损伤后大幅增加,并且阻碍了损伤组织的愈合。这一研究结果对炎症性肠病的治疗具有重要意义。
√短链脂肪酸有助于B细胞的能量代谢
B细胞分化为浆细胞和产生抗体需要大量能量和涉及细胞代谢的整体变化。肠道微生物群衍生的短链脂肪酸有助于在不同水平上为这些过程的细胞能量引擎提供燃料,并促进抗体的产生。
短链脂肪酸转化为乙酰辅酶A,并整合到线粒体三羧酸循环循环中,从而产生ATP。短链脂肪酸还通过mTOR激活刺激B细胞中的糖酵解。短链脂肪酸衍生的乙酰辅酶A也是胆汁酸(特别是棕榈酸)合成的底物,这对于浆细胞分化并刺激抗体产生至关重要。
注:最近研究表明,异丁酸或异戊酸等分支短链脂肪酸也可以调节B细胞功能。受操纵的小鼠中缺乏分支短链脂肪酸产生导致小肠中 IgA+ 浆细胞的频率增加,以及与先天免疫细胞(如中性粒细胞、巨噬细胞和树突状细胞)表面结合的IgA水平增加。
此外,B细胞通过产生免疫球蛋白和产生IL-10的调节性B细胞的作用,在对肠道微生物群的耐受性中发挥关键作用。
肠道微生物群与免疫系统之间存在着紧密的相互作用,这种作用对于维持免疫系统的正常功能和免疫平衡至关重要。
肠道微生物群维持上皮屏障的完整性并塑造粘膜免疫系统,通过微生物代谢物、成分和对宿主细胞的附着来平衡宿主免疫防御和口服耐受性。
为了避免异常的免疫反应,上皮细胞通过构建化学和物理屏障将肠道微生物群与免疫细胞隔离开来,从而建立宿主共生互惠关系。
这是为什么人们努力表征肠道微生物群在健康和疾病中的功能。许多研究报告和我们检测实践报告了众多慢病的临床前和临床模型中微生物群的改变。尽管这些改变可能部分是由疾病状态驱动的,但最近的研究强调,改变的微生物群也可以在驱动疾病本身方面发挥核心作用。
▼
我们肠道内的良性微生物数量与我们体内的细胞数量大致相同。这些细菌大多停留在肠道内,而不是渗透到人体组织中。
不幸的是,有些渗透是不可避免的,因为肠道只有一层细胞,把我们吸收食物所需的血管和管子内部分开。
✦细菌的数量沿着胃肠道逐渐增加
细菌的数量通常会沿着胃肠道增加,从胃的高酸性环境中的每毫升100–1,000个到小肠上段的每毫升约105个,在结肠中高达每毫升1010-1011个。
然而,回肠末端可能含有比结肠中更多的细菌。这些细菌使用复杂的多糖和粘液的其他成分以及未消化的纤维作为能量来源,产生生物素、短链脂肪酸 和维生素等必需的代谢物。
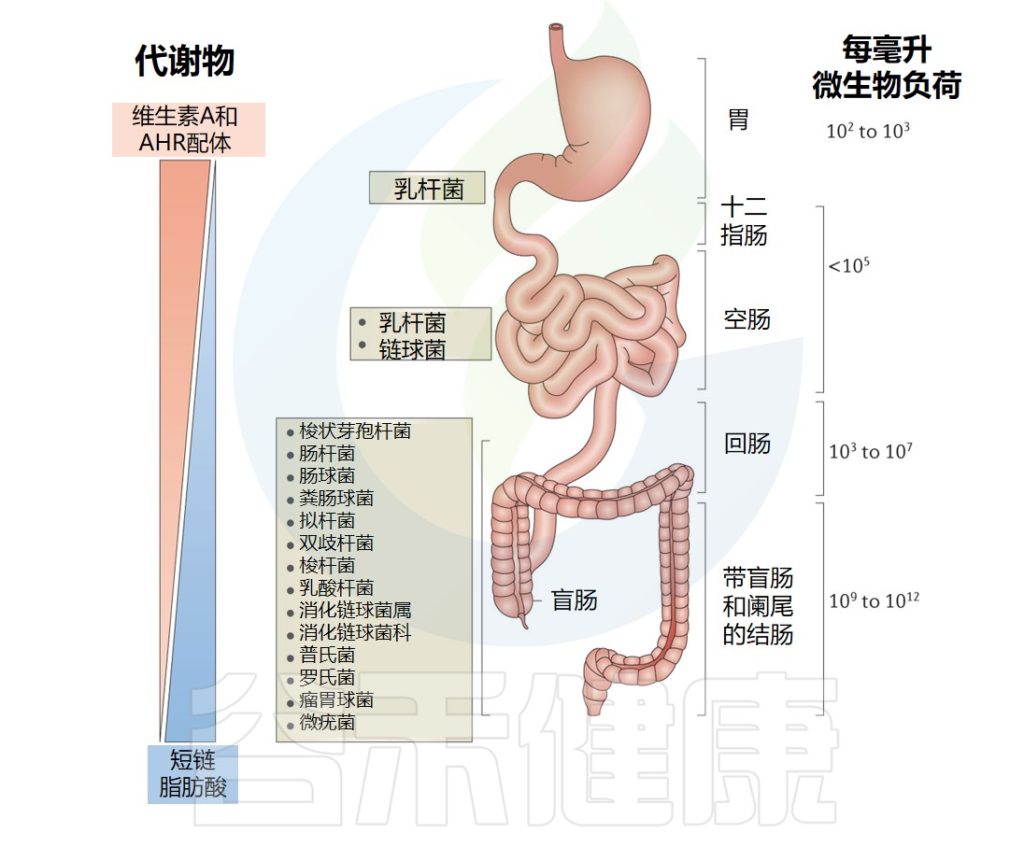
Mowat AM,et al.Nat Rev Immunol.2014
由于结肠大多数物种是专性厌氧菌,难以在体外培养,还有部分种群的组成和分布尚未最终确定。然而,分子技术揭示了几个主要门类中大约200-2000 个物种;它们的相对数量因人而异,但厚壁菌门、拟杆菌门、变形菌门和放线菌门最为普遍。
也包括少部分古细菌,真菌和病毒。好氧菌在小肠上段普遍存在,而厌氧菌在结肠中占主导地位。
✦不同的疾病会导致肠道菌群分布改变
构成肠道微生物群的物种分布的改变(生态失调)与许多不同的疾病有关,从精神疾病到代谢性疾病、过敏和自身免疫病。其中盲肠中细菌密度相较于小肠较高,该部位肿瘤发生率较高的原因。
肠道不同区域接触各种饮食成分可影响免疫功能的程度也存在显著差异。例如,维生素A只存在于饮食中,也可以通过胆汁输送到小肠,类黄酮和芳基烃受体的其他配体在小肠中的含量也较高。
▼
肠道微生物通过多种机制与肠外器官中的免疫细胞进行交流。
微生物能够通过直接与免疫细胞作用,如粘附到细胞表面或被吞噬细胞摄取,来调节免疫细胞的功能和活性。
其次,微生物通过与肠道黏膜上皮细胞和巨噬细胞表面的受体结合,激活免疫细胞,使它们产生免疫应答和促炎信号,并进一步调节免疫细胞的活性。
微生物还通过产生代谢产物,如短链脂肪酸和其他微生物分子,与免疫细胞进行信号传导。这些代谢产物可以直接调节免疫细胞的活性和功能,影响它们的增殖、分化和效应物质的产生。
✦肠道微生物群影响免疫系统的发育
首先,肠道微生物群对于免疫系统的发育起着重要的影响。在婴幼儿期,肠道微生物群通过与免疫系统的交互作用,促进免疫系统的成熟和功能发展。特别是在胎儿期和早期生活中,良好的肠道微生物组成对于建立免疫耐受、预防过敏反应和自身免疫性疾病的发生非常重要。
微生物群刺激对于产生免疫球蛋白 (IgA) 的B细胞的发育和成熟、通过促进IgA类别转换的记忆浆细胞以及生发中心的发育至关重要。
此外,通过介导浆细胞样树突状细胞产生I型干扰素,微生物群增强了抗原特异性T细胞反应。
✦肠道微生物可以直接抵抗病原体
肠道微生物群赋予宿主免疫保护的最直接例子是通过对粘膜病原体(如艰难梭菌)的定植抵抗。
多样化的肠道微生物群通过各种机制帮助宿主抵抗病原体定植,包括微生物间对营养的竞争、代谢竞争和直接拮抗以及粘膜屏障完整性的强化和局部粘膜免疫防御。
通过这种方式,肠道共生微生物保护宿主免受粘膜感染,以及由于肠道病原体过度生长和转移到循环系统和远端器官中而可能发生的继发性全身感染。
此外,之前也有报道称,病原体入侵是人类代谢失调的一个特征。这些研究进一步说明了在粘膜表面需要良好的宿主/微生物群相互作用。
// 双歧杆菌对免疫细胞的影响
本文以双歧杆菌(Bifidobacterium)为例:在小鼠肥胖模型中,给予假链状双歧杆菌通过恢复调节性T细胞和B淋巴细胞的平衡状态来减少全身炎症。
类似的免疫稳态特性已归因于双歧杆菌菌株,其通过体外刺激树突状细胞,诱导Th17谱并增强调节性T细胞从幼稚淋巴细胞的分化。
双歧双歧杆菌DSM 20082裂解物刺激外周T细胞可增加CD8+ T细胞的细胞毒活性,而对CD4+ T细胞活性没有任何影响。
✦肠道微生物通过其代谢物影响免疫细胞
肠道微生物产生的代谢产物能够刺激肠道上皮细胞和免疫细胞,如树突状细胞和巨噬细胞,促进免疫细胞的活化和增殖。
肠道微生物通过膳食分子的修饰(脂肪酸、色氨酸代谢物,氧化三甲胺)、宿主胆汁酸(次级胆汁酸)以及从头细菌代谢物(多胺、维生素、支链氨基酸),可以促进全身免疫反应的调节。
肠道微生物群的免疫调节
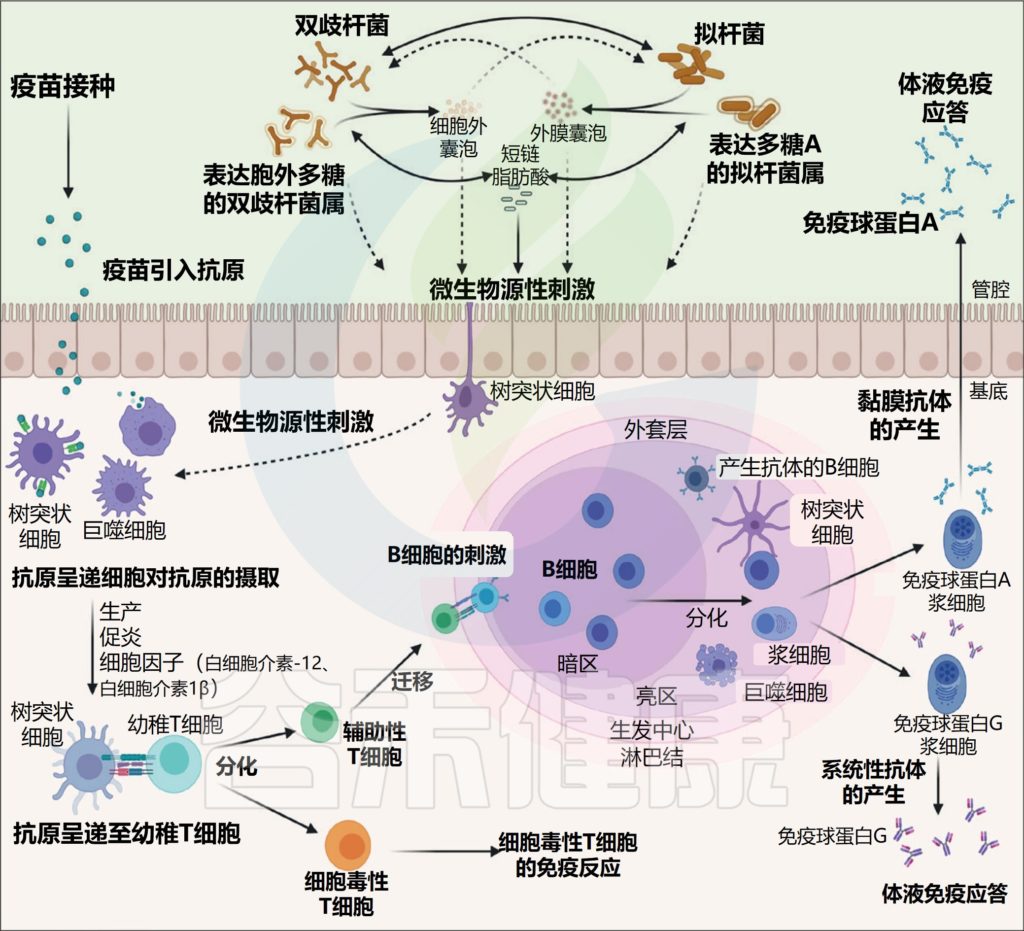
Jordan A,et al.Lancet Microbe.2022
// 乙酸盐可以激活免疫细胞
乙酸盐可以激活B细胞、T细胞亚群、中性粒细胞、巨噬细胞、树突细胞和肠上皮细胞上表达的G蛋白偶联受体43(GPR43),导致固有层调节性T细胞增殖,和调节自身抗体的产生和边缘区B细胞。
// 丙酸盐影响巨噬细胞浓度
丙酸盐诱导小鼠调节性T细胞的分化和增殖以及白细胞介素10的表达。丙酸盐激活GPR15和GPR43还通过降低组蛋白去乙酰化酶6和9的表达以及抑制 NF-κB信号传导来增加结肠调节性T细胞的浓度。
丙酸盐激活GPR41会改变骨髓造血功能,导致巨噬细胞和树突状细胞前体浓度升高,并扭曲Th2分化。
// 细菌胞外多糖影响免疫反应
脆弱拟杆菌的表面多糖A可激活巨噬细胞上的Toll样受体2,并诱导调节性T细胞的扩增和抗炎白细胞介素10的产生,从而在病毒感染期间促进强烈的抗炎反应。
来自长双歧杆菌BCRC14634的胞外多糖被证明可增强巨噬细胞产生白细胞介素,与同基因的胞外多糖阴性突变体相比,来自B.longum亚种longum 35624的胞外多糖显示通过抑制促炎细胞因子产生来抑制促炎性Th17细胞的扩增。
✦肠道微生物调节神经免疫信号
肠道和肠外器官之间的信号传导也可以通过肠道微生物调节的神经免疫机制来完成。肠道细菌可以合成γ-氨基丁酸等神经递质,并调节各种影响免疫细胞功能的神经递质。
此外,肠道细菌刺激肠内分泌细胞释放神经内分泌肽激素,这些细胞可以进入循环系统并作用于全身。
▼
肠道微生物群通过多种途径调节免疫系统的功能,包括维持免疫平衡、促进免疫耐受、保护黏膜屏障等。
➤ 自身免疫性疾病
肠道微生物群对免疫耐受的维持至关重要
自身免疫性疾病分为肠道相关疾病、非肠道相关疾病和免疫特异性疾病。
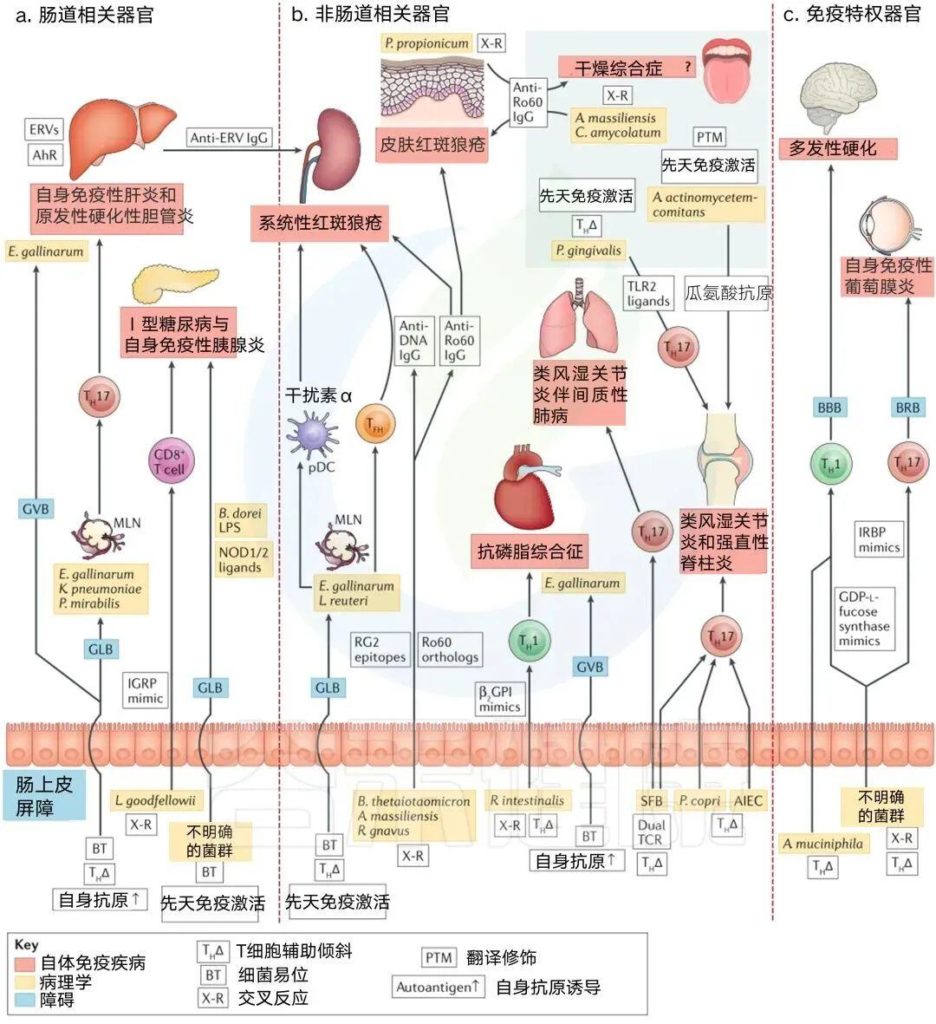
a | 肠相关器官。鸡肠球菌(Enterococcus gallinarum)向肝脏的转移促进了自身免疫性肝炎,并与肺炎克雷伯菌和奇异变形杆菌一起,通过包括TH17分化在内的多种机制导致原发性硬化性胆管炎。鸡肠球菌诱导的肝芳香烃受体(AhR)和内源性逆转录病毒(ERV)也参与了小鼠狼疮性肾炎(一种非肠道相关器官)的系统性抗ERV反应。
Leptotrichia goodfellowii 能与小鼠Ⅰ型糖尿病自身抗原胰岛特异性葡萄糖-6-磷酸酶催化亚单位相关蛋白(IGRP)发生交叉反应。在小鼠Ⅰ型糖尿病中,未定义的微生物群易位到胰腺淋巴结并激活NOD2,而来自微生物群的NOD1配体的易位驱动自身免疫性胰腺炎。
b | 非肠道相关器官。鸡肠球菌和乳杆菌在系统性红斑狼疮模型中向肠系膜淋巴结(MLNs)、肝脏和脾脏转移,从而激活先天性(浆细胞样树突状细胞(pDC))途径。
鸡肠球菌还刺激狼疮患者滤泡辅助因子(TFH)和自身抗体的产生。Ro60直系表达细菌在狼疮患者中引起Ro60自身免疫反应;肠道中的类泰奥托米克龙杆菌、口腔或肠道中的大量放线菌和阿米巴棒状杆菌,除了狼疮外,还可能导致Sjógren综合征,丙酸假丙酸杆菌与亚急性皮肤狼疮皮损通过交叉反应。
Ruminococcus gnavus在狼疮性肾炎时扩张,可与狼疮双链DNA发生交叉反应。抗磷脂综合征是一种凝血性自身免疫性疾病,鸡肠球菌传染性支气管炎也加重了这种疾病,它诱导肝脏中的自身抗原β2GPI。
口腔牙龈卟啉单胞菌、普雷沃氏菌和小肠节段丝状菌(SFB)的TH17偏斜均与类风湿关节炎的发病有关。同样,粘附性侵袭性大肠杆菌(AIEC)可导致克罗恩病相关性脊柱炎。在关节炎模型(未显示)中,SFB还使CD4+T细胞向TFH细胞倾斜,并通过携带双TCRs的TH17细胞在同一模型中引发间质性肺病。口腔中的放线菌群通过一种也能激活中性粒细胞的毒素,瓜氨酸化类风湿关节炎中的系统自身抗原。
c | 免疫特权器官。Akkermansia muciniphila在多发性硬化症中增强TH1反应,并且未定义的微生物群与GDP-l-岩藻糖合酶(一种神经炎症疾病的自身抗原)交叉反应。未定义的小鼠肠道微生物群与TH17细胞交叉反应,识别自身免疫性葡萄膜炎的自身抗原——视黄酸结合蛋白(IRBP)。
扩展阅读:
➤ 过敏性疾病
肠道微生物群可以影响免疫系统的平衡
肠道微生物群的失调可能导致免疫系统的异常激活,从而增加过敏性疾病的风险。肠道微生物群可以通过多种途径影响免疫系统,包括调节免疫应答的平衡、维持免疫耐受等。
以过敏性鼻炎为例,典型的过敏性鼻炎肠道菌群促进细胞因子的不利变化,从而促进过敏性鼻炎发展中涉及的 Th1/Th2 失衡。
过敏性鼻炎患者的肠道菌群失调及其对 Th1/Th2 平衡的影响
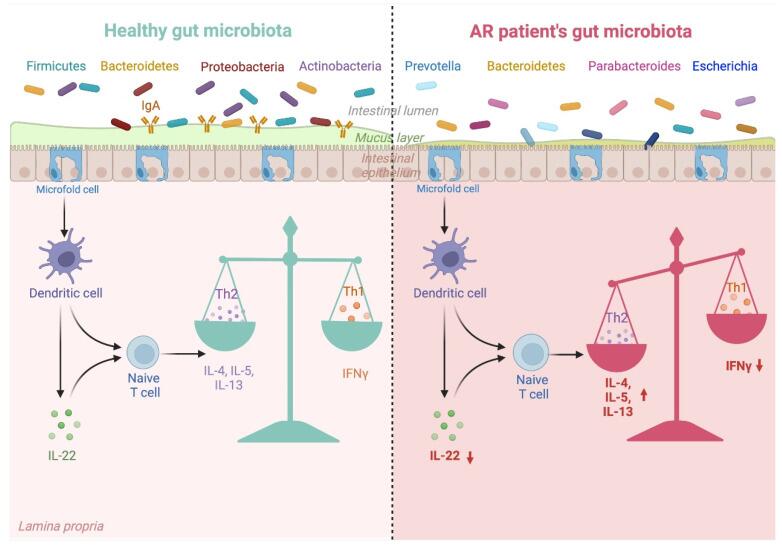
Kaczynska A, et al., Nutrients. 2022
肠道菌群的每一次紊乱都会对免疫系统产生负面影响,并破坏先天性和适应性反应。上图解释了改变的肠道微生物群组成与其对过敏性鼻炎患者免疫系统的影响之间的联系。
肠道微生物群失调影响过敏性鼻炎
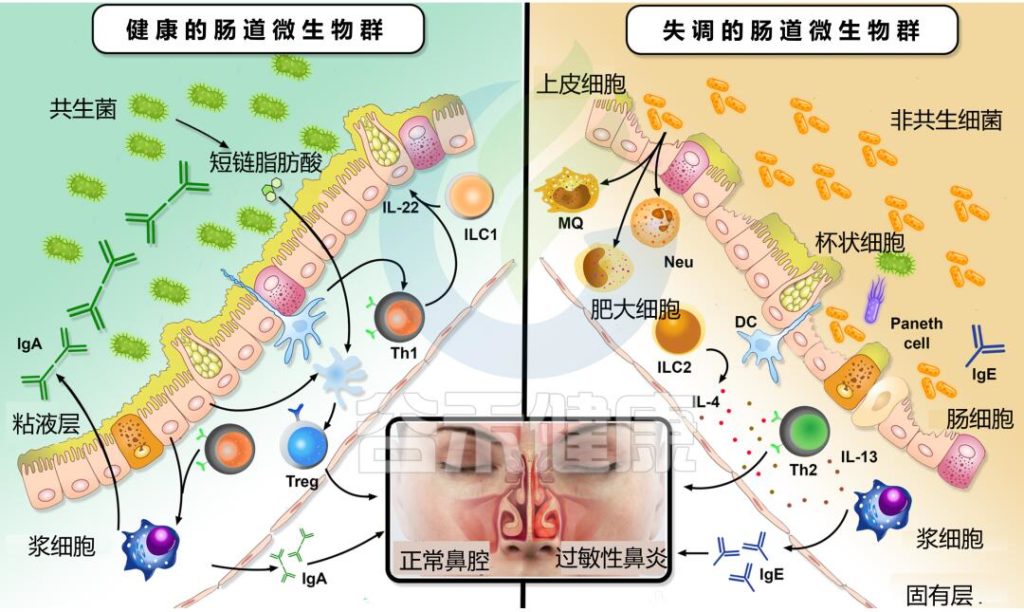
Li J, et al., Eur Arch Otorhinolaryngol. 2022
肠道微生物群影响ILC2通过肠-肺轴从肠道向肺的迁移。例如,变形菌门显著促进了上述迁移,并促进了IL-33的产生。此外,呼吸道过敏的发展与Ruminococcus gnavus的丰度增加有关联。
扩展阅读:
➤ 肠道炎症性疾病
肠道微生物群对保护黏膜屏障功能至关重要
与溃疡性结肠炎患者或健康受试者相比,克罗恩病患者的变形菌门显著增加。在炎症克罗恩病组织中,埃希氏菌(Escherichia)和志贺氏菌(Shigella)更为丰富,而在非炎症克罗恩病组织里,Pseudomonas更为广泛。
大肠杆菌和梭杆菌能够粘附粘膜,侵入肠上皮细胞,并可能加剧炎症。具核梭杆菌通过破坏上皮屏障和诱发异常炎症而加重结肠炎。
相对于炎症性溃疡性结肠炎,拟杆菌门在克罗恩病炎症粘膜中更常见。克罗恩病粘膜活检中最常见的是普通拟杆菌(Bacteroides vulgatus),克罗恩病患者中脆弱拟杆菌(Bacteroides fragilis)的数量明显高于溃疡性结肠炎患者或健康受试者。脆弱拟杆菌与产生IL-10的调节性T细胞的增加有关,这限制了促炎机制,从而有助于减少炎症。
肠道微生物群在调节宿主免疫以建立和维持肠道稳态方面起着至关重要的作用。
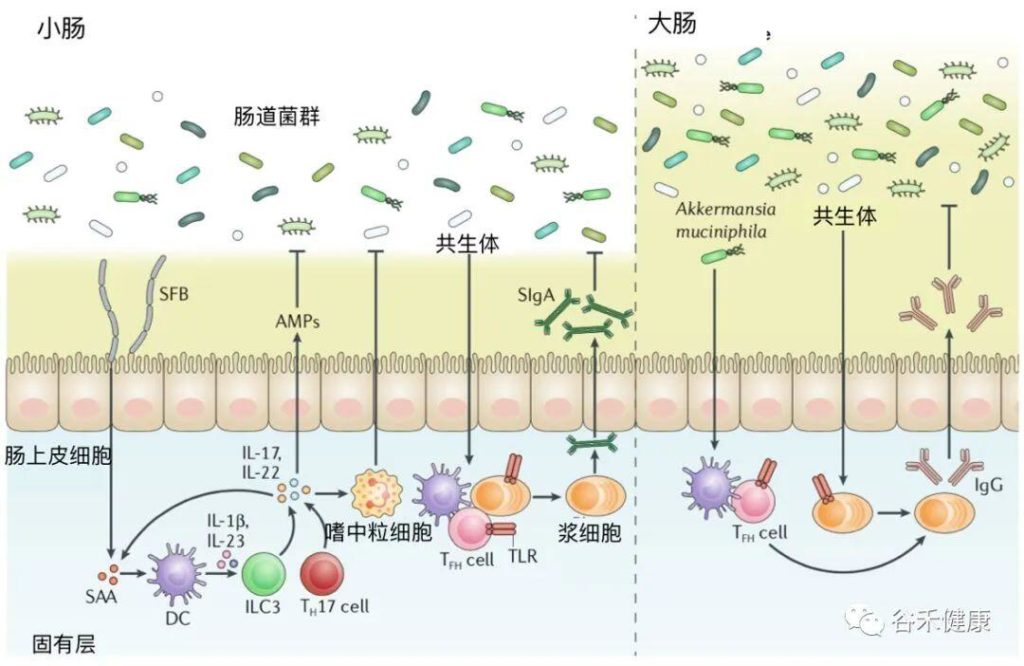
doi: 10.1038/s41577-019-0268-7
失调可能分为早期和晚期两个阶段进行。
在早期失调期间,IBD相关的遗传和环境因素可能导致致病菌的积累,这可能先于临床疾病的发展。
在晚期失调期间,肠道炎症推动了菌群的进一步变化,包括变形菌的增殖。鉴于肠道微生物群的不同菌群对宿主免疫系统和肠道屏障有有益的影响,某些菌群的缺失可能导致肠道炎症的加剧或消退。特定细菌的大量繁殖,如粘附性和侵袭性大肠杆菌,积聚在IBD患者的炎症粘膜中,可进一步促进炎症反应。
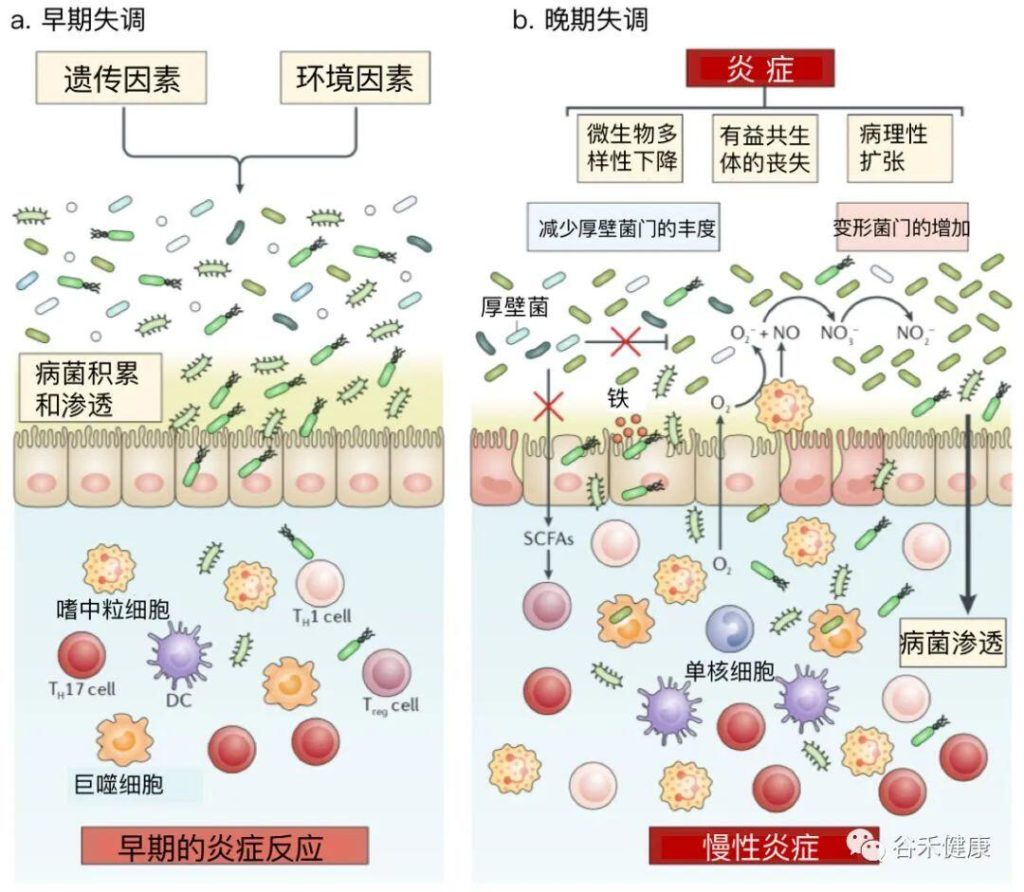
doi: 10.1038/s41577-019-0268-7
扩展阅读:
小结
综上所述,肠道微生物群与免疫系统之间的相互作用对于维持免疫系统的正常功能和免疫平衡至关重要。
良好的肠道微生物组成能够促进免疫系统的发育和成熟,调节免疫应答的程度和方向,预防免疫相关疾病的发生。
肠道内的免疫细胞在整个机体中扮演着至关重要的角色。它们作为守卫者,保护着我们免受外界病原体的入侵,并维持着肠道的免疫平衡。
肠道免疫细胞与肠道中的微生物密切合作,形成了一种复杂的共生关系。这些微生物通过调节免疫细胞的活性和功能,帮助我们抵御病原体,促进免疫平衡和整体健康。
此外,肠道免疫细胞还参与到免疫耐受的调节中,即对自身组织的免疫反应进行限制,避免自体免疫疾病的发生。肠道免疫细胞的失调可能会导致免疫炎症反应过度激活,引发炎症性肠病和其他免疫相关疾病。因此,保持肠道免疫系统的平衡和稳定对于整体健康至关重要。
了解和关注肠道免疫系统的功能及其与微生物群的相互作用对于维持整体健康具有重要意义。
主要参考文献
Mowat AM, Agace WW. Regional specialization within the intestinal immune system. Nat Rev Immunol. 2014 Oct;14(10):667-85.
Kayama H, Okumura R, Takeda K. Interaction Between the Microbiota, Epithelia, and Immune Cells in the Intestine. Annu Rev Immunol. 2020 Apr 26;38:23-48.
Allaire JM, Crowley SM, Law HT, Chang SY, Ko HJ, Vallance BA. The Intestinal Epithelium: Central Coordinator of Mucosal Immunity. Trends Immunol. 2018 Sep;39(9):677-696.
Yan Y, Ramanan D, Rozenberg M, McGovern K, Rastelli D, Vijaykumar B, Yaghi O, Voisin T, Mosaheb M, Chiu I, Itzkovitz S, Rao M, Mathis D, Benoist C. Interleukin-6 produced by enteric neurons regulates the number and phenotype of microbe-responsive regulatory T cells in the gut. Immunity. 2021 Mar 9;54(3):499-513.e5.
Cray P, Sheahan BJ, Dekaney CM. Secretory Sorcery: Paneth Cell Control of Intestinal Repair and Homeostasis. Cell Mol Gastroenterol Hepatol. 2021;12(4):1239-1250.
Yang D, Jacobson A, Meerschaert KA, Sifakis JJ, Wu M, Chen X, Yang T, Zhou Y, Anekal PV, Rucker RA, Sharma D, Sontheimer-Phelps A, Wu GS, Deng L, Anderson MD, Choi S, Neel D, Lee N, Kasper DL, Jabri B, Huh JR, Johansson M, Thiagarajah JR, Riesenfeld SJ, Chiu IM. Nociceptor neurons direct goblet cells via a CGRP-RAMP1 axis to drive mucus production and gut barrier protection. Cell. 2022 Oct 27;185(22):4190-4205.e25.