-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

“胖!可怎么办?”《柳叶刀》发布的一项报告称,截止2022年,全球超过10亿人患有肥胖症,超过20亿人存在超重。从1990年到2022年间,全球患肥胖症的成年人增加了一倍多,患肥胖症的儿童和青少年(5至19岁)更是增加了约3倍。超重和肥胖已成为全球日益严重的流行病。
超重和肥胖的不良影响可能不会马上体现,有时会延迟十年或更长时间。流行病学研究证实,超重和肥胖程度的增加是寿命缩短的重要预测因素。在一项心脏研究中,在30岁到42岁之间,体重每增加一磅(0.45公斤),26年内死亡的风险增加1%,在50岁到62岁之间,死亡风险增加2%。
肥胖还会引起或加剧许多健康问题,这些问题既有独立的,也有与其他疾病相关的。例如超重和肥胖增加了患高血压、冠心病和中风等心血管疾病的风险。肥胖还是2型糖尿病主要风险因素;此外,肥胖和超重人群更容易患上睡眠呼吸暂停、哮喘和其他呼吸系统问题。过重的身体还会给骨骼和关节造成巨大压力,增加骨质疏松症和关节炎的风险。
“那么我们应该如何改善或是预防肥胖呢?”除了常规的“管住嘴,迈开腿”,谷禾在最近与减肥前后相关的检测中发现,在不改变其他生活方式和饮食的情况下,额外补充一定量的膳食纤维对减肥的帮助效果显著。
肠道菌群已越来越多地被认为是宿主生理和病理的重要调节器。肠道菌群调节炎症、脂肪储存和葡萄糖代谢进而影响体重和代谢健康。
而对肠道微生物群影响最大的是饮食,人类从食物中提取和储存卡路里的能力至少部分受到肠道微生物的影响。这使得饮食成为驱动人类肠道微生物群组成的重要因素。
膳食纤维是一种来自植物的复合多糖,在消化过程中不被小肠吸收,并通过为微生物生长提供底物来改变肠道微生态环境。膳食纤维可能会改变微生物群的丰度、多样性和代谢,包括短链脂肪酸的产生。最近的研究表明,富含膳食纤维的饮食具有预防肥胖的潜力。
首先,膳食纤维的物理化学性质(粘性、可发酵性等)具有预防肥胖的作用,因为粘稠的纤维可以延长胃排空和小肠运输时间,从而增加饱腹感,减少进食频率,降低热量的摄入。
其次,膳食纤维可通过增加代谢相关有益肠道菌群的丰度和多样性来改善能量稳态并预防肥胖,降低门水平上厚壁菌门/拟杆菌门的比例(F/B比)并增加罗氏菌属(Roseburia)的相对丰度。
第三,膳食纤维可被肠道菌群发酵产生短链脂肪酸 (SCFA),通过降低肠道腔内pH值、抑制致病或有害肠道细菌、减少脂多糖(LPS)和代谢有害化合物,在能量代谢方面发挥重要作用。同时,研究还表明,在高脂膳食中添加纤维可降低外周血炎症水平,在本文一起了解下肥胖的原因,哪些肠道菌群参与肥胖及其作用机理,此外,我们还分享了几个根据检测报告针对性调整和补充膳食纤维合生元等干预措施减重改善健康的案例。
肥胖不仅仅是因为吃得多这一个原因造成的,而是由多种因素共同导致的慢性代谢性疾病。
肥胖受到遗传、环境、生活方式、社会心理因素、内分泌和健康状况、个体的微生物和营养差异等因素的影响,这些因素通过能量摄入和消耗的生理机制相互作用,最终导致了肥胖。
变胖最直接的原因就是能量摄入与能量消耗的不平衡。我们知道,要维持健康的体重,需要保持食物摄入和能量消耗的平衡。

★ 摄入大于消耗时,变成脂肪慢慢堆积
当一天中人体的能量摄入大于能量消耗时,多余的能量就会被储存为脂肪、糖原或蛋白质,而体重就会上涨;相反,当摄入量小于消耗量时,机体就会通过转化储存能量(大部分来源于脂肪)来弥补热量差,体重就会下降。
简单来说就是:当你吃的比消耗的多时,能量储存=能量摄入-能量消耗
尽管在过去的20年里,环境变化导致了肥胖率的上升,但家庭和双胞胎研究表明,遗传因素在肥胖的发展中也起着关键作用。
★ 瘦素等基因突变易导致肥胖
迄今为止,已确定十几个基因的变异是肥胖的单基因原因;包括瘦素、瘦素受体、黑皮质素3受体和黑皮质素4受体(MC4R)基因。
最著名的肥胖相关基因是瘦素(ob)及其受体(db)基因。洛克菲勒大学的研究首次发现ob基因突变和缺乏ob基因的小鼠导致严重肥胖,能量摄入增加(暴饮暴食),但能量消耗减少(代谢率、产热和身体活动减少)。
注:该基因产物后来被描述为循环因子,命名为瘦素。瘦素主要由脂肪细胞分泌,循环至全身并穿过血脑屏障屏障来传递饱腹信号,从而减少食物摄入。
★ 肥胖的遗传原因大致可分为:
1)单基因原因:由单个基因突变引起,主要位于瘦素-黑皮质素通路。许多基因,如PYY(食欲促进基因)或MC4R(黑皮质素4受体),被发现与单基因肥胖有关,这些基因会破坏食欲和体重的调节系统以及位于下丘脑弓状核的受体感知激素信号(胃促生长素、瘦素、胰岛素)。
罕见的单基因缺陷与高饥饿水平有关,并可能导致幼儿严重肥胖。
2)综合征性肥胖是由神经发育异常和其他器官/系统畸形引起的严重肥胖。这可能是由单个基因或包含多个基因的较大染色体区域的改变引起的。
3)多基因肥胖是由许多基因的累积作用引起的。这些类型的基因存在会导致热量摄入增加、饥饿感增加、饱腹感减少、储存身体脂肪的倾向增加以及久坐不动的倾向增加。
★ 有肥胖家族史的人患肥胖风险较高

一项研究发现,如果父母一方肥胖,孩子成年后患肥胖的风险会提高3倍;而如果父母双方都肥胖,那么孩子成年后患肥胖的风险会提高10倍。(当然这在一定程度上也可能与相同的生活方式有关)
一项针对260名儿童(139名女性、121名男性,年龄分别为2.4岁至17.2岁)的横断面观察研究表明,心脏代谢疾病家族史和肥胖是儿童期肥胖严重程度的关键危险因素。
生活方式等环境因素在肥胖发展中也发挥作用。肥胖患病率的显著增加与饮食和生活方式的改变密切相关。
在工业化国家,教育程度较低和收入较低的人超重和肥胖的发生率较高,尽管发展中国家的情况可能正好相反。
例如,生活在美国的皮马印第安人平均比生活在墨西哥的皮马印第安人重25公斤。生活在美国的非洲人也出现了类似的趋势。
在男性和女性中,超重和肥胖的患病率随着年龄的增长而增加,直到50至60岁;这在20岁到40岁之间尤为明显。结婚后,超重的趋势也会增加。
★ 高糖的零食和饮料加剧了肥胖
在众多导致肥胖的因素中,过量食用高热量食物是罪魁祸首之一。目前,无论是发达国家还是发展中国家,高热量食物在食品行业的大规模生产和营销方面都相当成功。这类食物在商店、餐馆、超市和家庭中随处可见。
两餐之间(尤其是晚餐后)吃零食,以及每天饮用果汁、碳酸饮料、糖果和高糖食物。这些不健康的饮食与肥胖风险增加密切相关。
★ 运动量的减少也导致肥胖率增加
体育锻炼应该是人们日常生活的一部分,但是随着青少年的学业负担增加、中年人的工作负担沉重,运动量大幅减少。如果平时不注意运动,长时间久坐,会导致脂肪堆积,从而出现肥胖的现象。
其他可能导致身体活动减少的因素包括花在电子游戏和移动设备上的时间增加,而花在户外活动上的时间减少。这些不良习惯都会损害人们的健康。
★ 睡眠不足导致皮质醇升高也不利于减肥
缺乏充足睡眠会引发皮质醇水平的升高,这对身体的减肥过程是不利的,因为高水平的皮质醇可能会干扰新陈代谢和影响体重管理的效果。
你也许见过,本来身材挺匀称的一个人,因为生病或是吃了一些药物而迅速变胖,这就是内分泌紊乱进而导致肥胖的结果。
许多外周激素参与中枢神经系统(CNS)对食欲和食物摄入、食物奖励或成瘾的控制。美味的食物和一些药物都能激活中脑边缘多巴胺(DA)奖励系统,而该系统对于调节人类和动物的成瘾至关重要。
★ 瘦素、胰岛素等激素会影响进食行为
来自脂肪组织的瘦素、胰腺的胰岛素和胃肠道的胆囊收缩素、胰高血糖素样肽-1(GLP-1)、肽YY3-36(PYY3-36)和生长素释放肽参与通过主要针对下丘脑和脑干的神经激素肠脑轴传递有关饥饿和饱腹信号,这些信号可能会直接或间接地调节食欲,影响个体的进食行为。
瘦素和瘦素受体的基因缺陷可导致儿童早发性严重肥胖。同时当内分泌系统出现紊乱时,可能会导致个体无法有效地控制食欲,进而对食物上瘾或是出现严重的暴饮暴食症。
肠道能量吸收、饱腹感调节和全身炎症
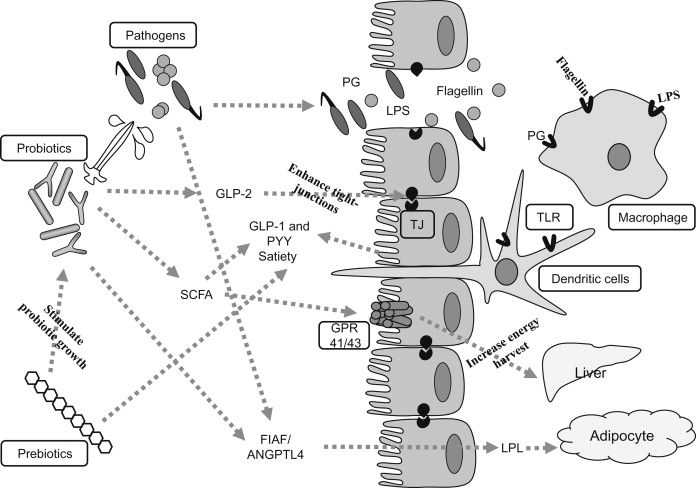
DOI:10.1016/B978-0-12-407825-3.00011-3.
★ 内分泌紊乱影响代谢更易导致肥胖
一些疾病如甲状腺功能减退会影响基础代谢率,导致能量代谢异常,进而影响体重控制,甚至引发肥胖。
胰岛素抵抗是指身体细胞对胰岛素的反应下降,导致血糖不能有效地被细胞吸收利用。这可能导致胰岛素分泌增加,促使脂肪细胞更多地吸收葡萄糖并转化为脂肪,从而引起肥胖。
多囊卵巢综合征(PCOS)一种影响女性生殖系统的疾病,患者常伴有胰岛素抵抗和雄激素水平异常。这些因素会导致体重增加和脂肪堆积,使得患者更容易发展为肥胖。
有证据表明,胎儿在宫内发育期间的营养不良可能决定了肥胖、高血压和2型糖尿病的后期发病,而这与基因遗传无关。这种现象表明,由于宫内生长的改变,可能存在基因表达的长期编程。
★ 胎儿时期的营养不良可能导致中老年时的肥胖
研究人员假设,子宫内不良的营养环境会导致身体器官发育缺陷,从而导致“程序化”的易感性,这种易感性与后来的饮食和环境压力相互作用,在几十年后导致明显的疾病。
这表明胎儿的生长和新陈代谢为了适应出生后营养不足的预期。这可能在子宫内具有生存优势,因为它将可用的营养物质定向到重要器官,并在以后的生活中,通过增加以脂肪形式储存能量的能力,为食物短缺时提供能量储备。
有报告显示腹部脂肪与出生体重呈负相关,一项研究提供了一些有说服力的证据,证明妊娠早期和晚期是随后肥胖发展的关键时期。与没有在怀孕期间接触过饥荒的对照组相比,那些胎儿在怀孕的前两个月接触过饥荒等到成年后的肥胖患病率明显更高。
肠道微生物群在肥胖中的作用是多方面的,并且与肥胖的发生和发展密切相关。肠道微生物群参与能量稳态的调节,并通过影响营养吸收、食欲和脂肪组织功能来影响肥胖的发生。
接下来我们详细了解下肠道微生物群在肥胖中的作用和角色。
越来越多的研究和谷禾实践检测数据表明肠道微生物群与肥胖之间存在着许多相互作用,虽然大人群水平来看,肠道菌群只能解释其中部分的肥胖原因,但是在个体水平上,肠道菌群的状况和构成对于肥胖以及肥胖相关的能量摄入,炎症反应,食物消化等都息息相关。
肠道菌群在肥胖中的作用简单分为两个层面,直接参与与间接影响。
一,菌群是直接影响致肥胖途径还是通过其成分/代谢产物影响致肥胖途径?
二,是否存在导致肥胖的特定宿主-微生物信号传导机制?
队列人群和小鼠研究试验均表明,肥胖个体的肠道微生物群种类和丰富度与正常体重个体存在明显差异。
★ 肥胖人群与健康个体之间占主导的肠道微生物不同
大量研究集中于拟杆菌门和厚壁菌门水平变化与肥胖和减肥之间的动态关系。通过比较瘦人和肥胖个体的肠道菌群,发现大人群水平上肥胖个体的拟杆菌门比例降低,而厚壁菌门水平升高。更有趣的是,经过饮食治疗后,拟杆菌门的相对丰度增加,而厚壁菌门的相对丰度降低。
在谷禾的检测案例里也发现,同一个人减肥前后的肠道菌群构成(如下桑基图展示)发生了较大的变化,有的肠型也会发生改变。
减肥前后的主要肠道菌群构成变化
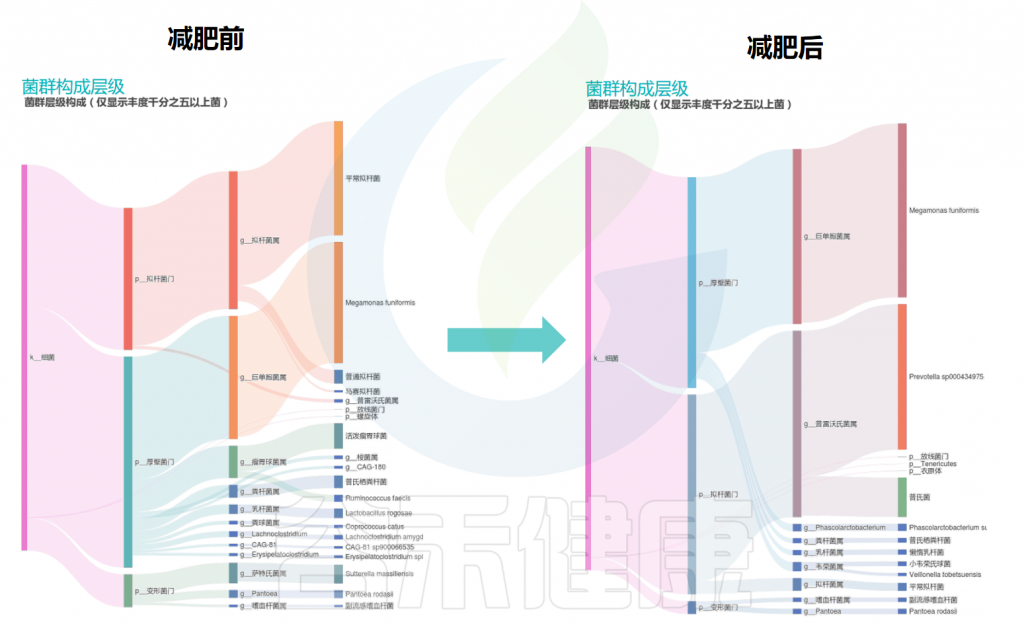
通过上图的变化可以看到:减肥之后拟杆菌门的比例增加,与此同时,普雷沃氏菌属的丰度也大大增加,其他菌属的构成也有一定程度的变化。
该案例通过饮食管理和膳食纤维补充,减肥后普雷沃氏菌占比为主可能是水果蔬菜、高纤维豆类的饮食摄入相关。
★ 减肥的效果与基线肠道菌群相关
2021年,发表在《Gut Microbes》和《Gastroenterology》两篇研究分别以饮食控制和维生素给予为变量,同时都研究了基线时和干预后肠道菌群的变化。研究结论表示作为节食前个人体重减轻轨迹的预测指标,基线肠道微生物的作用超过了其他因素。
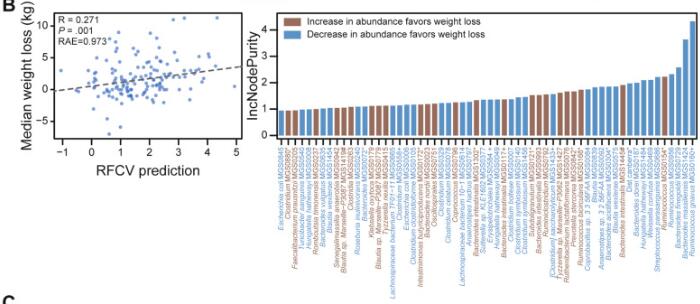
doi: 10.1053/j.gastro.2021.01.029.
同时使用随机森林算法,基于相对于基线的种水平物种变化来预测体重下降,预测精度R=0.271,发现R. gnavus (MGS0160), Bacteroides massiliensis (MGS1424)和Bacteroides finegoldii (MGS0729)这三个物种在模型中贡献度最大。
此外,基线菌属如普雷沃氏菌,罗氏菌属(Roseburia)的丰度也会影响饮食营养干预的减肥效果。
这些研究同时确定有哪些饮食因素与个体的体重下降相关。使用GLMMLASSO模型,结果如下图,当coef为非零时被认为是显著的。发现,在所有受试者中,体重下降与卡路里摄入量(系数=-0.153)、膳食中大量营养素组成(脂肪,系数=-0.161;碳水化合物,系数=-0.055;蛋白质,系数=0.084;纤维,系数=0.1)、膳食微量营养素含量和体力活动之间的具有弱相关。
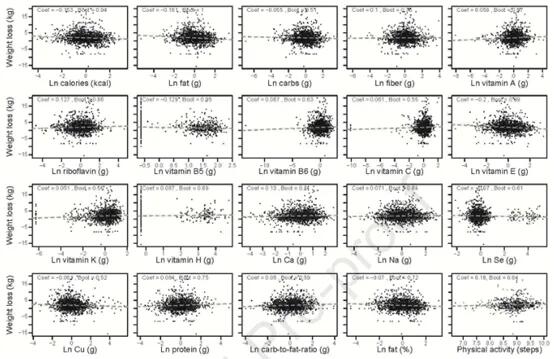
Jie Zhuye, et al., .Gastroenterology, 2021
但是在个体间有很大差异。例如在受试者F00161中,纤维摄入量的增加与减肥之间存在正相关关系,而在F00147中,受试者的脂肪摄入量增加与体重减轻之间存在负相关关系。相反,尽管纤维或脂肪摄入量发生变化,F00203人仍然对体重变化不敏感。所以,即使是相似的膳食大量营养素,体重反应也是高度个性化的。
饮食控制期间肠道菌群的组成变化是否会影响减肥轨迹?
研究发现许多参与者的肠道菌群组成发生了实质性的变化,0-3个月的微生物群的变化幅度与体重下降的程度呈正相关,有15个个体肠型被改变了,体重变化范围从20公斤到+7公斤。这两个时间段都是一致的。这一发现表明,在饮食控制计划中,饮食和肠道菌群之间存在着持续的相互作用。如下图:
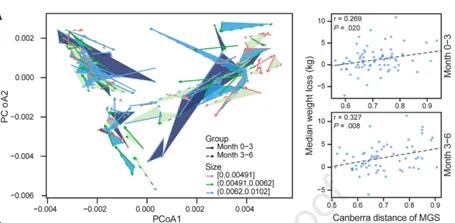
Jie Zhuye, et al., .Gastroenterology, 2021
这些结果表明可以基于基线肠道菌群组成和饮食数据建立个性化的体重预测模型。我们可以利用肠道菌群的分布做个性化的饮食推荐,以此调节体重,进而促进宿主健康。
此外,谷禾根据权威研究和检测大数据库,在菌群检测报告中给出了肥胖,便秘,失眠,过敏等症状相关菌(包括正相关,负相关菌,证据强度,菌的说明和异常菌的个性化干预调整措施)。
如下是谷禾菌群报告里肥胖相关菌的截图展示:
与肥胖症状相关的菌属
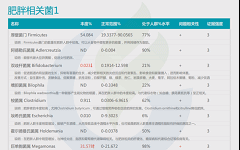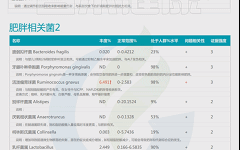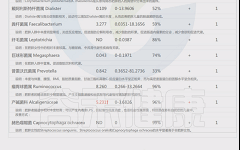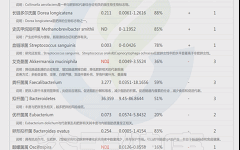
这些菌里,包括有益菌,核心菌,以及有害菌和致病菌等。部分菌在以往文章中详细介绍过:
★ 普雷沃氏菌——在摄入膳食纤维后对减脂更有利
普雷沃氏菌丰度高的健康超重成人在食用富含全谷类和纤维的随意饮食6周后,比普雷沃氏菌丰度低的受试者减脂更多。
普雷沃氏菌的高水平不仅与肥胖有关,且与非糖尿病患者的BMI指数、胰岛素抵抗、高血压和非酒精性脂肪性肝显著相关。
★ Blautia——治疗炎症肥胖相关的潜力菌
Blautia是肠道中常见的乙酸生产者,可通过激活G蛋白偶联受体 GPR41 和 GPR43 来抑制脂肪细胞中的胰岛素信号传导和脂肪积累,进而促进其他组织中未结合的脂质和葡萄糖的代谢,从而减轻肥胖相关疾病。
Blautia是有效减肥组女性肠道菌群中的优势菌属,但在减肥无效组中则不然。Blautia,特别是B. luti和B. wexlerae,可能有助于减少与肥胖相关的炎症。
肠道核心菌属——经黏液真杆菌属(Blautia),炎症肥胖相关的潜力菌
★ Bifidobacterium——减轻体重和减少体脂
双歧杆菌对糖尿病、肥胖症和高脂血症的有益作用也得到了研究,证据显示其对普通人群的血糖水平和胰岛素抵抗具有有益作用,同时还能降低孕妇妊娠糖尿病的发病率。
★ Phascolarctobacterium——帮助减肥
比较容易减肥的人体肠道内考拉杆菌属(Phascolarctobacterium)水平较高,因此该菌也被认为可以用来预测肥胖指标。在代谢综合征女性中观察到的Phascolarctobacterium属的丰度高于代谢综合征男性。
肠道核心菌属——考拉杆菌属(Phascolarctobacterium),与减肥相关?
★ Ruminococcus——含量过多与炎症和肥胖有关
瘤胃球菌(Ruminococcus)在新陈代谢中起着至关重要的作用。
一项研究包括肥胖组(BMI≥40kg/m2)和对照组(BMI18.5~ 24.9kg/m2之间)的粪便菌群,其中Ruminococcus bromii, Ruminococcus obeum 在肥胖患者中丰度较高。
瘤胃球菌喜欢植物中的多糖。如果肠道中有过多的瘤胃球菌,细胞可能会吸收更多的糖,导致体重增加。
★ Desulfovibrio——含量过高与肥胖相关
脱硫弧菌属(Desulfovibrio)里的一种能够引起炎症的细菌,当其含量过多时与肥胖相关。并在便秘型肠易激综合征患者,帕金森,系统性硬化症患者患者富集,可产生硫化氢对肠道上皮具有毒性,会导致人体腹泻。
★ 嗜胆菌属——喜欢脂肪、耐胆汁的促炎菌
嗜胆菌属(Bilophila)是变形菌门,脱硫弧菌科的一种厌氧、革兰氏阴性、耐胆汁,该菌是“喜欢动物脂肪喜欢胆汁”的微生物——在以动物为基础的饮食,尤其富含肉类和乳制品脂肪时,其肠道中Bilophila丰度会增加。
《Nature》杂志的一项研究发现,当人们从素食转变为以肉类和奶酪为主的饮食结构上时,他们肠道里的细菌Bilophila几乎立即增加,但植物性为主的饮食结构可以降低该菌群的数量。
Bilophila是机会致病菌,其丰度的增加与肠道炎症相关。其代表菌种Bilophila wadsworthia增加了高脂饮食诱导的代谢综合征,这是一种与低程度全身炎症相关的疾病,伴随着较高的体重指数。
肠道重要菌属——嗜胆菌属 (Bilophila)喜欢脂肪、耐胆汁的促炎菌
★ 脆弱拟杆菌——肥胖儿童中含量较高
宿主的生活方式和生理状态也会影响肠道脆弱拟杆菌的丰度。例如,缺乏运动可能会导致脆弱拟杆菌和其他拟杆菌属物种显著富集。
以往的研究表明,脆弱拟杆菌过多与肥胖呈正相关,肥胖儿童中脆弱拟杆菌的丰度高于瘦儿童。
扩展阅读:
★ 短链脂肪酸影响饱腹感、促进能量消耗
菌群关键代谢物短链脂肪酸(SCFA)可以说是研究最广泛的微生物代谢物,对人体代谢有许多影响。
短链脂肪酸(SCFA)在维持宿主健康和影响代谢方面发挥着广泛的作用。SCFA调控体内各种生理过程,包括维持结肠上皮和粘液水平的先天性肠道屏障的完整性、调节肠道蠕动以及控制重要肠道激素的分泌,如肽YY(PYY)、血清素、胃抑制肽和胰高血糖素样肽1(GLP-1) 。
短链脂肪酸参与L细胞产生的肽YY和胰高血糖素样肽1(GLP1)激素的调节。这两种激素都调节神经系统的饱腹感,GLP1在葡萄糖刺激的胰岛素敏感性和分泌中也起作用。
-乙酸盐
乙酸盐的健康影响还存在争议。一些研究将其与通过GPR41/43相互作用减少食欲、减轻体重以及增强胰岛素敏感性联系起来,而另一些研究则表明其作为肝脏和脂肪组织脂肪产生的底物,在促进肥胖方面发挥着作用。
-丙酸盐
丙酸可由拟杆菌属、考拉杆菌属(Phascolarctobacterium succinatutens)、戴阿利斯特杆菌属(Dialister)和韦荣氏球菌属通过琥珀酸途径产生;或是由埃氏巨球形菌属(Megasphaera elsdenii)、粪球菌属(Coprococcus catus)、沙门氏菌属(Salmonella spp.)、Roseburia inulinivorans和Ruminococcus obeum通过丙烯酸途径产生。
人体研究表明,丙酸具有整体抗肥胖作用,因为它可以增加餐后GLP-1和PYY水平,减少体重增加、腹部脂肪和肝细胞内脂质含量,并预防胰岛素敏感性问题。丙酸还通过减少中性粒细胞释放白细胞介素8(IL-8)和肿瘤坏死因子α(TNF-α)而表现出抗炎特性。
-丁酸盐
在胃肠道发酵产生的所有短链脂肪酸中,丁酸尤其值得注意。重要的产丁酸属和种有Coproccocus 属、Anaerostipes属、真杆菌属(Eubacterium)、普拉梭菌(Faecalibacterium prausnitzii)和罗氏菌属。
丁酸盐是成熟结肠细胞的主要能量来源,支持结肠健康,并且是一种具有强效抗炎特性的微生物代谢物,局部和系统性作用均有。此外,丁酸盐在调节局部和全身免疫、维持粘膜完整性和抑制细胞水平的肿瘤改变方面起着至关重要的作用。丁酸盐与丙酸盐类似,具有通过刺激食欲抑制激素的释放和促进瘦素的合成来减少肥胖的作用。
★ 胆汁酸影响脂肪代谢
许多研究报告了肠道微生物组、胆汁酸和肥胖或肥胖相关疾病之间存在联系。胆汁酸在肠道中与脂肪分子结合,形成复合物,促进脂肪的分解和吸收。适当的胆汁酸可以帮助提高脂肪代谢效率,减少脂肪在体内的堆积。
此外,胆汁酸在消化系统中可以影响胃液分泌,从而影响饱腹感和食欲调节。适当的胆汁酸水平可以帮助控制饥饿感,减少摄入的热量,有助于减轻体重。
★ 吲哚——抗肥胖特性
一项研究发现较高的血浆吲哚丙酸水平与降低患2型糖尿病的风险之间存在关联。
另一项研究发现,与瘦对照相比,患有2型糖尿病的肥胖受试者的吲哚丙酸水平降低。吲哚丙酸显示通过与孕烷X受体结合并随后下调肿瘤坏死因子α来调节炎症。
吲哚丙酸也被证明在小鼠中具有抗肥胖活性,微生物衍生的吲哚乙酸进一步限制了巨噬细胞中脂肪酸的积累和炎症标志物的产生。
★ 谷氨酸过量与肥胖潜在危害有关
谷氨酸是一种多功能氨基酸,谷氨酸在生物体内的蛋白质代谢过程中占重要地位。根据对肥胖和瘦受试者的队列进行的全基因组关联分析显示,谷氨酸盐具有潜在危害。
通过进行途径分析,谷氨酰胺/谷氨酸转运系统在肥胖个体中高度富集。这与拟杆菌属(包括B.thetaiotaomicron)的物种呈负相关。事实上,与瘦受试者相比,肥胖者体内这种细菌的数量减少。因此谷氨酸与人体肥胖之间也存在一定联系。
★ 肥胖人群的肠道微生物能够更多地获取能量
对肠道微生物群影响膳食能量收集和储存过程的探索揭示了两种关键机制:肥胖人群具有分解难以消化的膳食细菌多糖水解酶从而对多糖降解;以及抑制一种名为禁食诱导脂肪因子(FIAF)或血管生成素样4(ANGPTL4)的脂蛋白脂肪酶(LPL)抑制剂的肠道基因表达。
一项比较肥胖小鼠及瘦小同窝小鼠的功能性宏基因组的研究发现,肥胖微生物群富含八个能够水解膳食多糖的糖苷水解酶家族。第二种机制涉及微生物对FIAF的抑制,通过影响LPL活性导致脂肪堆积增加。
细菌多糖水解产生脂肪形成底物,即单糖和短链脂肪酸。肠道微生物群还通过增强钠/葡萄糖转运蛋白-1(SGLT1)的表达以及使小肠毛细血管密度加倍来促进有效的单糖吸收。这些脂肪形成底物到达肝脏后促进了肝脏甘油三酯的合成。
★ 肠道微生物群的组成影响从食物中获取的能量
“能量获取理论”最近也在人类受试者身上进行了测试。招募了12名瘦弱和9名肥胖的成年男性,在最初3天的体重维持饮食之后,以随机交叉的方式分配到2400或3400千卡/天的饮食,持续3天。
在初始体重维持饮食中,瘦人和肥胖个体的三大细菌门(厚壁菌门、拟杆菌门和放线菌门)存在显著差异。作为对改变的热量负荷的反应,肠道厚壁菌门增加、拟杆菌门减少与宿主能量吸收增加约150kcal有关。
瘦人似乎对增加热量摄入更为敏感,在2400vs. 3400 kcal/天饮食中,粪便能量损失和肠道微生物组成的变化均显著减少。而肥胖个体没有出现类似的变化。我们认为,与体重维持饮食相比,能量摄入的差异程度可能会通过肠道微生物群影响饮食中能量的吸收效率。
暴饮暴食是肥胖的主要诱因,是由调节食物摄入的过程失衡造成的,包括“饥饿”、“食欲”和“饱腹感”,以及环境因素。
★ 饱腹和饥饿信号影响人们的进食行为
正常的饮食行为在我们感到饱腹(饱腹感)时就会停止,并在感到饥饿一段时间后再次开始。两餐之间的时间是饱腹感的指标。有许多肠道激素会向大脑传递“饱腹”或“饥饿”的信号。肠内分泌L细胞分泌的胆囊收缩素(CCK)和胰高血糖素样肽1(GLP-1)是与饱腹感相关的肠道激素,可传递“饱腹”信号。
肠内分泌L细胞分泌的肽YY(PYY)和肠内分泌K细胞分泌的葡萄糖依赖性胰岛素促泌多肽(GIP)也传达“饱腹感”,而胃细胞分泌的生长素释放肽则传达决定开始进餐的“饥饿”信号。
★ 短链脂肪酸可以影响激素水平进而调节饱腹感
研究表明,肠道微生物群和其发酵产物短链脂肪酸可以影响肠道激素水平,进而调节饱腹感。肠内分泌L细胞分泌的GLP-1和PYY含有短链脂肪酸受体GPR41和GPR43,暗示结肠短链脂肪酸的生成与食欲或摄食量存在关联。
膳食纤维可选择性地支持肠道中有益细菌的生长和短链脂肪酸的产生。与饲喂对照饮食或高蛋白饮食的大鼠相比,饲喂高纤维饮食的大鼠血浆GLP-1和PYY水平较高,血浆GIP水平较低,结肠PYY mRNA水平增加5倍,胰高血糖素原mRNA水平增加11倍。
菊粉型果聚糖已被证明可以提高血浆GLP-1水平和结肠胰高血糖素原基因表达,保护免受高脂肪饮食引起的肥胖。一项人体研究表明,每天摄入21克低聚果糖(FOS)可降低超重成人的生长素释放肽并增加PYY,同时减少卡路里摄入量,有助于减肥。
★ 肠道微生物通过影响免疫也会导致贪食、肥胖
另一个影响食物摄入和肥胖的因素是肠道微生物群与先天免疫系统之间的相互作用。Toll样受体5(TLR5)是被广泛研究的受体之一。TLR5在小鼠肠粘膜中高表达,可以识别细菌鞭毛蛋白作为病原相关分子模式(PAMP),与肠道炎症和肠道微生物群的变化有关。
最新研究表明,TLR5基因敲除小鼠(T5KO)表现出贪食、肥胖、代谢综合征以及相关的高脂血症、高血压和胰岛素抵抗。T5KO小鼠的贪食/肥胖表型与肠道微生物群组成的细菌物种水平变化相关,T5KO小鼠有116种来自不同门类的细菌属丰富或减少。
将T5KO小鼠肠道微生物移植到健康小鼠中,导致健康小鼠发展代谢综合征,表明T5KO小鼠的肠道微生物影响代谢健康。
总的来说,肠道微生物群通过短链脂肪酸信号传导或与先天免疫系统相互作用,在调节食欲、肥胖和糖尿病方面发挥着重要作用。
因此,可发酵纤维和益生元等膳食成分以及肠道内生成的微生物代谢产物可以作为对抗这些疾病的简单而有效的手段。
肥胖与慢性、轻度全身性炎症相关。脂肪细胞和肥胖下的脂肪组织内的巨噬细胞都释放炎症细胞因子。这种轻度全身性炎症部分来源于细菌脂多糖(LPS)从肠道进入血液循环。
血浆中脂多糖浓度增加两到三倍,被称为“代谢性内毒血症”,与肥胖、胰岛素抵抗、糖尿病和动脉粥样硬化等多种慢性疾病相关。
★ 高脂饮食会加剧炎症状态
肠道脂多糖倾向于通过乳糜微粒携带,这些是脂蛋白颗粒,用于输送膳食脂质。因此,高脂饮食可能诱发或加剧代谢性内毒血症。
肠道通透性可能导致脂多糖位移,肠道微生态失调或引发肠道壁炎症可能增加通透性。双歧杆菌和乳酸杆菌的几种菌株及其代谢产物(如短链脂肪酸)已被证实能促进紧密连接蛋白的表达,这些蛋白维持有效的肠道屏障。而肠道中双歧杆菌相对缺乏与肠道通透性增加相关。
★ 肥胖状态下促炎巨噬细胞比例增加
引起脂肪组织炎症加剧的一个关键因素是巨噬细胞的渗入。产生促炎细胞因子的脂肪组织主要来自渗入的巨噬细胞。动物研究表明,巨噬细胞在肥胖中逐渐积累,瘦小鼠脂肪组织中不到10%的细胞是巨噬细胞,而肥胖小鼠中这一比例超过50%。
巨噬细胞本身表现出不同表型,可极化为促炎的“M1”或抗炎的“M2”表型。肥胖状态改变了M1和M2巨噬细胞的比例,导致M1巨噬细胞增加。
注:有趣的是,TLR4缺乏可减轻脂肪组织炎症,促进脂肪组织和腹膜巨噬细胞极化为M2型,但不会影响全身胰岛素敏感性。
另一项研究比较了无菌小鼠和大肠杆菌单个定植小鼠,结果显示单个定植小鼠脂肪组织中存在脂多糖依赖性巨噬细胞积累。大肠杆菌的定植还增加了巨噬细胞的极化,使其转变为促炎的M1型,并导致葡萄糖和胰岛素耐受性下降。
小结
肠道微生物组影响肥胖和相关代谢状态的三种机制,即通过能量获取、食欲调节和炎症状态,综合起来看,每条途径都是协同作用而非独立作用。这些调节过程的核心是宿主、微生物组和饮食之间复杂而动态的三向相互作用。
人体的消化过程和细菌作用在肠道中协同处理膳食成分。产生的代谢产物的特征取决于宿主遗传、宿主生理和肠道微生物的组成。微生物与营养消化产物结合,可以通过与宿主细胞受体的特定相互作用或以非特定方式进入一般血液循环,对宿主代谢产生不同的影响。
以下是来自君好美健康科技公司的3个案例,采取“膳食纤维+后生元”君好美膳食片作为主食,三餐吃饱——肉鱼蛋奶豆制品蔬菜充分吃,水果干果控制吃,在基本不改变在原有饮食情况下,一段时间后,个案的体重体脂明显下降、肠菌菌群得到有效改善。
案例一
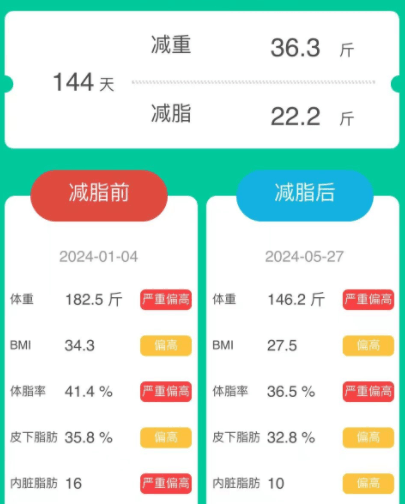
女,44岁,原本体重为182.5斤,属于严重偏胖。
经历144天的改善后,体重减轻了36.3斤,减脂了22.2斤,减肥效果非常明显。体脂率、皮下脂肪和内脏脂肪都有所减少。
身体数值的各项变化
编辑
改善前后的报告对比
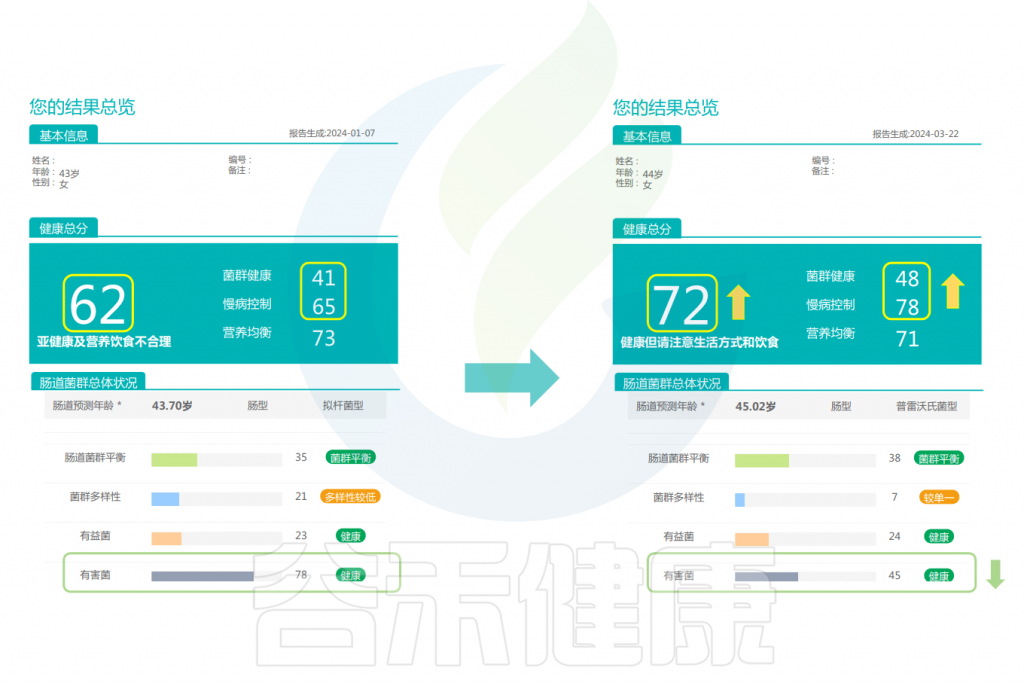
可以看到:在额外补充膳食纤维后,健康总分升高,肠道微生物的结构更健康,通过增加膳食纤维来增加微生物的数量和多样性是非常有效的。有益菌的分值提高,有害菌明显减少,肠型由原来拟杆菌型变成了普雷沃氏菌型,慢病风险总分下降。
▸ 具体到菌种

活泼瘤胃球菌与短链脂肪酸的产生有关。与非酒精性脂肪肝病和肥胖等疾病存在正相关。在改善后由原本的过高丰度,降低到了正常水平。
干预前:

干预后:

颤螺菌属也是与肥胖相关的菌群,过多或过少都可能影响肥胖。在改善后由原本的过低,丰度有所增加,恢复到了正常水平。
干预前:
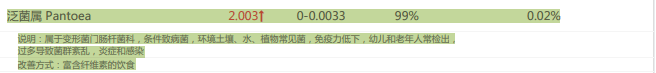
干预后:

泛菌属是一种条件致病菌,过多导致菌群紊乱,炎症和感染。而在补充膳食纤维后丰度有所降低(尽管还有一点偏高)。
干预前:
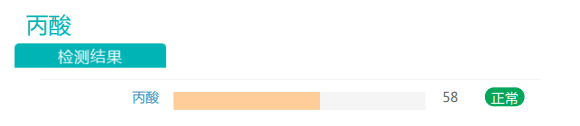
干预后:
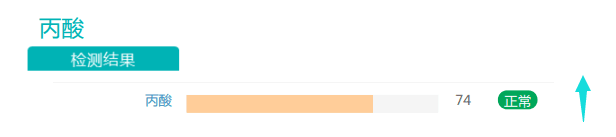
此外,丙酸盐的丰度也有一定程度的提高。有充分证据表明,随着膳食纤维摄入量的增加,产生的短链脂肪酸(SCFA)也增加。SCFA能够激活游离脂肪酸受体,从而促使厌食激素(如瘦素和肽YY)的分泌。在减肥中发挥益处。
根据以上这些变化,可以看出在额外补充膳食纤维后,可以在一定程度上改善人体的肥胖和代谢健康。
案例二
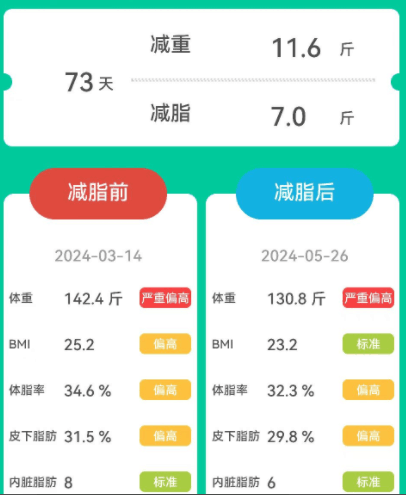
女,52岁,原本体重为142.4斤,属于严重偏胖。
经历73天的改善后,体重减轻了11.6斤,减脂了7斤,虽然没有上一个人减重多,但是BMI恢复到了正常水平。体脂率、皮下脂肪和内脏脂肪也均有所减少。
身体数值的各项变化
改善前后的报告对比
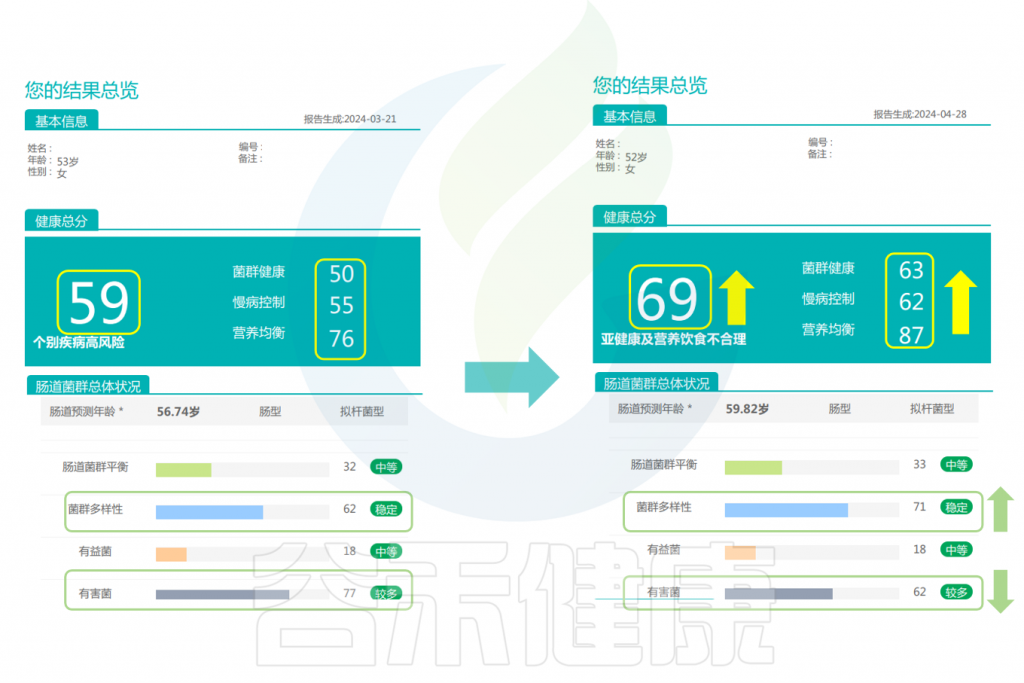
可以看到,该女性在经过干预后,健康总分也升高了。并且菌群变得更健康、对于慢病的控制评分更高,营养也更均衡了。肠道菌群多样性提高,有害菌明显减少。
与此同时,核心菌属也发生了一定程度的变化:
干预前:

干预后:
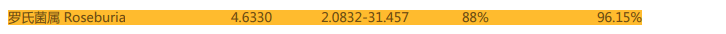
重要的肠道基石菌,产短链脂肪酸菌属罗氏菌在改善后由原来的丰度过低变成了正常丰度。罗氏菌具抗炎特性,有助于分解不可消化的碳水化合物如膳食纤维,对健康有利。
干预前:

干预后:

过多会导致菌群紊乱的副拟杆菌属由原本的过高丰度降低到了正常值。
肠道核心菌——副拟杆菌属(Parabacteroides),是否是改善代谢减轻炎症的黑马?
干预前:

干预后:

能够产生脂多糖,代谢生成苯酚,引发感染和并发症的梭杆菌属丰度由原来的过高水平恢复到了正常水平。
梭杆菌属Fusobacterium——共生菌、机会致病菌、致癌菌
干预前:

干预后:

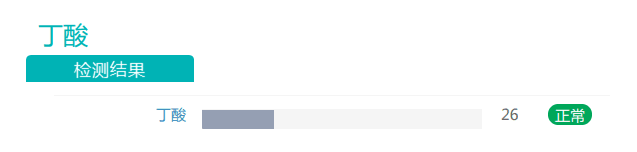
过高时会导致肥胖和2型糖尿病的副萨特氏菌属在额外补充膳食纤维后丰度也有所下降(尽管仍然高于正常值)。
干预前:
干预后:
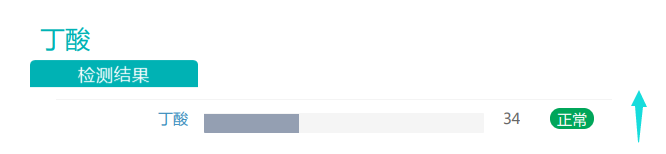
随着膳食纤维摄入量的增加,丁酸盐的丰度有所上升。丁酸对于维持肠道内环境温度预防结直肠癌发生具有重要作用,是肠上皮细胞最重要能量来源,对肠粘膜有营养作用,利于代谢健康的重要物质。
案例三
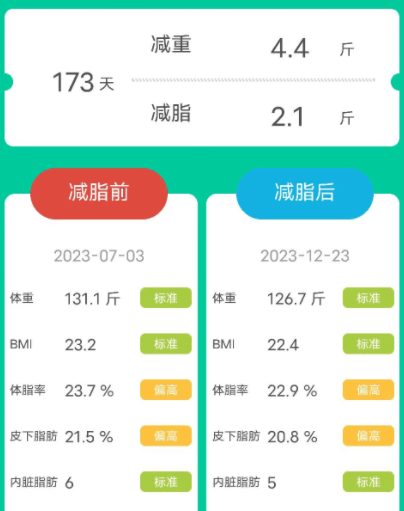
男,54岁,原本体重为131.1斤,属于标准体重,本来健康状态就比较好。因此在经历173天后,体重只下降了4.4斤,减脂2.1斤。体脂率、皮下脂肪、内脏脂肪也稍微有所下降,但都变得更健康了。
此外,三个案例可以看出膳食纤维对不同基础体重人群的作用效果不太一样,大体重人群在额外补充膳食纤维后减重更多。
身体数值的各项变化
改善前后的报告对比
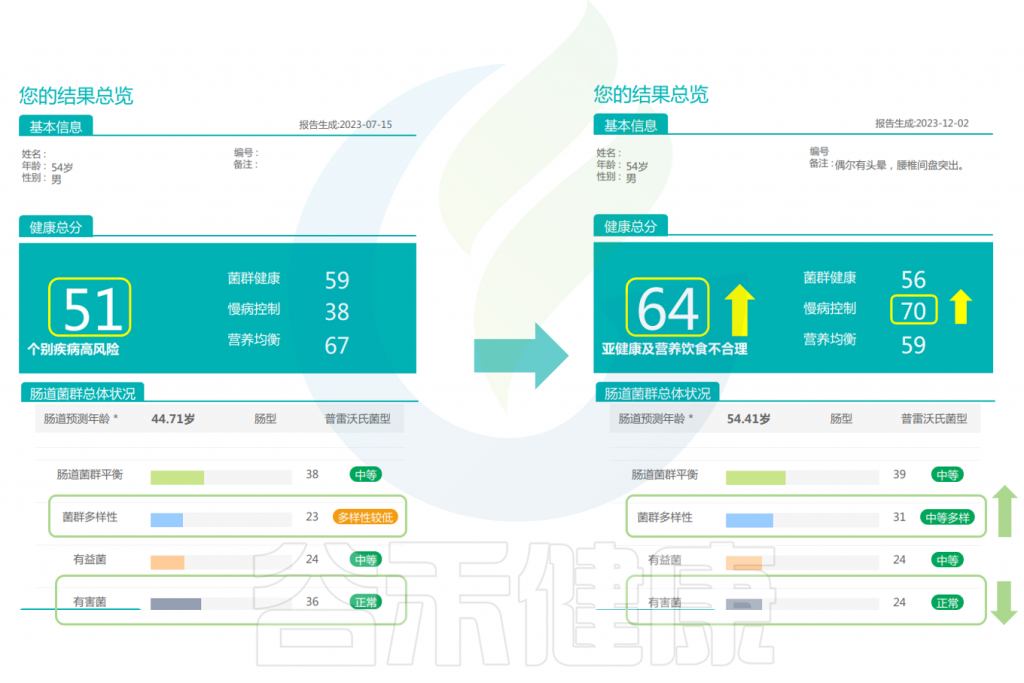
<来源:谷禾肠道菌群健康检测数据库,下同>
根据谷禾的健康报告前后对比可以看到,该男性在经过干预后,健康总分升高,对于慢病控制的评分显著升高。肠道微生物的多样性变得更丰富,有害菌减少明显。
干预前:

干预后:

过高时与肥胖相关,可能通过抑制乙酸水平来加速肥胖的脆弱拟杆菌在额外补充膳食纤维后丰度降低到了正常水平。
干预前:

干预后:
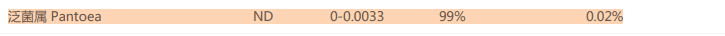
肠道的条件性致病菌泛菌属,过多导致菌群紊乱,炎症和感染。在补充额外的膳食纤维后水平也下降到正常值。
肠道微生物群多样性和高纤维摄入量与长期体重增加较低有关
此外一项对1632个人的研究也发现,微生物群多样性会影响膳食纤维与体重增加之间的关系。在微生物群多样性较高的人群中,纤维摄入量与体重增加风险降低有显著相关性。

膳食纤维对体重的有益作用可能在微生物组多样性较高的个体中更为明显。实验表明,纤维摄入会降低饮食的能量密度,由此产生的短链脂肪酸促进肠道糖异生、肠促胰岛素形成并随后产生饱腹感,同时短链脂肪酸也会向宿主输送能量并影响脂肪异生。
TIPs: 膳食纤维与益生元的区别
膳食纤维和益生元虽然都是植物性食物中的复杂碳水化合物,但它们之间存在一些区别:
1.膳食纤维的定义: 膳食纤维是指植物性食物中不被人体消化酶分解的碳水化合物,包括不溶性纤维和可溶性纤维。不溶性纤维,如纤维素,主要作用是增加大便体积,促进肠道蠕动,帮助消化系统健康。可溶性纤维,如果胶和树胶,可以溶解在水中,形成凝胶状物质,有助于降低血糖和胆固醇。
2.益生元的定义: 益生元是一种可溶于水的可溶性纤维,它作为益生菌的食物,可以被肠道中的有益细菌发酵,从而促进有益细菌的生长和活动。益生元主要包括低聚果糖(FOS)菊粉、低聚半乳糖(GOS)等。
3.作用机制: 膳食纤维的作用更广泛,包括促进肠道蠕动、帮助排便、降低血糖和胆固醇等。而益生元的主要作用是喂养和促进益生菌的生长,尤其是那些能够产生短链脂肪酸(如丁酸盐)的细菌,这些短链脂肪酸对肠道健康至关重要。
4.种类: 膳食纤维的种类很多,包括纤维素、半纤维素、果胶、树胶、抗性淀粉等。而益生元的种类相对较少,主要是一些特定的低聚糖和某些类型的多糖。
5.健康益处: 膳食纤维对整体消化系统健康有益,而益生元则更专注于通过促进益生菌的生长来改善肠道微生物群的平衡。
总的来说,膳食纤维是一个更广泛的概念,包括了益生元但它们的作用和重点略有不同。膳食纤维对消化系统的整体健康有益,而益生元则专门针对促进一些细菌的生长。
拓展:不同纤维对肠道菌群的影响

一项研究了不同谷物纤维(包括麦麸)对健康成人肠道菌群组成的影响。
-食用小麦纤维对肠道微生物的影响:
食用小麦纤维或麸皮纤维对肠道菌群有显著影响,以下门类的菌群均显著增加:
双歧杆菌(Bifidobacteria) ↑↑↑
乳酸杆菌(Lactobacillus) ↑↑↑
奇异菌属(Atopobium) ↑↑↑
肠球菌(Enterococci) ↑↑↑
梭状芽孢杆菌(Clostridia) ↑↑↑
毛螺菌科(Lachnospiraceae) ↑↑↑
埃格氏菌(Eggerthella) ↑↑↑
柯林斯菌(Collinsella) ↑↑↑
棒状杆菌(Corynebacterium) ↑↑↑
拟杆菌(Bacteroides) ↑↑↑
普氏菌属(Prevotella) ↑↑↑
-食用大麦纤维对肠道微生物的影响:
所有研究都表明大麦纤维对肠道菌群标志物有显著影响:要么改变微生物群落 ,要么改变发酵代谢物。发现厚壁菌门和放线菌(特别是罗氏菌属、Dialister、真杆菌和双歧杆菌)显著增加,拟杆菌减少。
其余3项研究测量了发酵标志物,结果显示,在食用大麦纤维后,总短链脂肪酸、丁酸盐和乙酸盐显著增加,呼气氢显著增加。由于发酵代谢物的积极作用,血糖反应同时改善。
-食用燕麦纤维对肠道微生物的影响:
燕麦粒的外层含有不溶性和可溶性(β-葡聚糖)纤维的混合物,这两种纤维都为肠道微生物群提供了食物来源。已证实可溶性燕麦β-葡聚糖有助于降低血液胆固醇水平。
对患有轻度高血糖症或高胆固醇血症的参与者研究了每天早餐食用全麦燕麦片与精制谷物片的影响。据报道,食用全麦燕麦片后,粪便总细菌、乳酸杆菌和双歧杆菌数量显著增加,而食用精制谷物片后,总细菌数量和双歧杆菌数量均下降。
-食用玉米纤维对肠道微生物的影响:
玉米的淀粉含量相对于其他谷物来说较高,麸皮含量较低。
一项急性干预研究比较了单次食用48克全麦玉米早餐麦片(14.2克纤维)对肠道菌群的影响,并与48克低纤维玉米早餐麦片(0.8克纤维)进行了比较。
3周后,高纤维组和低纤维组均报告粪便双歧杆菌增加,高纤维组的增幅更大,但未达到显著性,乳酸杆菌、肠球菌和奇异菌属物种的增加不显著。
-混合全谷物对肠道微生物的影响:
全麦谷物包括谷物的胚乳、胚芽和麸皮成分,因此其营养成分与谷物的麸皮纤维部分不同,这可能会影响肠道微生物群。
共计357人的研究发现,增加完整谷物纤维的摄入具有显著的益生元作用,细菌多样性、放线菌、双歧杆菌、梭菌、毛螺菌显著增加;但阿克曼氏菌、罗氏菌、乳酸杆菌和肠球菌的增加趋势不显著。促炎性肠杆菌科细菌的水平也显著下降。
作者认为,对高纤维干预的反应取决于基线肠道微生物丰富度——由于膳食纤维的增加,基线微生物丰富度有限的人会随着时间的推移表现出更大的微生物群变化。
如今全球肥胖症的流行,寻求新的有效解决方案已成为研究的重中之重。这主要是因为大多数人无法长期坚持既定的饮食和身体活动方案,从而无法达到并保持健康的体重。
肠道微生物群由于位于宿主营养/能量代谢的关键位置并能够影响它,因此已成为一种有希望的新治疗靶点。
饮食、肠道微生物群和肥胖之间的相互关系是高度互动和动态的。虽然饮食热量摄入是能量平衡方程的主要因素,研究估计现在知道某些肠道微生物可以从饮食中获取“额外”的能量,大约150千卡/天;相当于一年内可能增加6.8公斤的体重。
除了热量含量外,饮食成分也是与肥胖相关的饮食-微生物相互作用的重要因素,例如肠道微生物失调以及高脂饮食引起的全身炎症。
肠道微生物还通过调节食欲、食物摄入和饱腹感来影响肥胖:这是能量平衡的一部分。膳食纤维、合生元是调节肠道微生物组成的有效方法,这些干预措施不仅降低了体重,体脂,而且同时改善了与肥胖和相关代谢状况相关的生物标志物,例如血糖水平、胰岛素敏感性、血浆脂联素等。
总体而言,这些结果表明,通过膳食纤维,合生元以及饮食调节肠道微生物群可以作为人类减肥的独立方法,同时可以有助于减轻风险并控制肥胖相关疾病(如心血管疾病、胰岛素抵抗和2型糖尿病)的症状。
在当前肥胖流行和健康挑战的背景下,个体化肠道菌群干预显得尤为重要。每个人的肠道微生物群独一无二,受基因、生活方式和环境等多方面影响。因此,针对个体的肠道菌群进行精准干预,可以更有效地调节体重、改善健康状况。
主要参考文献
Li H, Zhang L, Li J, Wu Q, Qian L, He J, Ni Y, Kovatcheva-Datchary P, Yuan R, Liu S, Shen L, Zhang M, Sheng B, Li P, Kang K, Wu L, Fang Q, Long X, Wang X, Li Y, Ye Y, Ye J, Bao Y, Zhao Y, Xu G, Liu X, Panagiotou G, Xu A, Jia W. Resistant starch intake facilitates weight loss in humans by reshaping the gut microbiota. Nat Metab. 2024 Mar;6(3):578-597.
Jie Zhuye,Yu Xinlei,Liu Yinghua et al. The Baseline Gut Microbiota Directs Dieting-Induced Weight Loss Trajectories.[J] .Gastroenterology, 2021.
Pham Van T,Fehlbaum Sophie,Seifert Nicole et al. Effects of colon-targeted vitamins on the composition and metabolic activity of the human gut microbiome- a pilot study.[J] .Gut Microbes, 2021, 13: 1-20.
Corica D, Aversa T, Valenzise M, Messina MF, Alibrandi A, De Luca F, Wasniewska M. Does Family History of Obesity, Cardiovascular, and Metabolic Diseases Influence Onset and Severity of Childhood Obesity? Front Endocrinol (Lausanne). 2018 May 2;9:187.
Bartsch M, Hahn A, Berkemeyer S. Bridging the Gap from Enterotypes to Personalized Dietary Recommendations: A Metabolomics Perspective on Microbiome Research. Metabolites. 2023 Dec 2;13(12):1182.
Zhang M, Liu J, Li C, Gao J, Xu C, Wu X, Xu T, Cui C, Wei H, Peng J, Zheng R. Functional Fiber Reduces Mice Obesity by Regulating Intestinal Microbiota. Nutrients. 2022 Jun 28;14(13):2676.
Menni C, Jackson MA, Pallister T, Steves CJ, Spector TD, Valdes AM. Gut microbiome diversity and high-fibre intake are related to lower long-term weight gain. Int J Obes (Lond). 2017 Jul;41(7):1099-1105.
Mayengbam S, Lambert JE, Parnell JA, Tunnicliffe JM, Nicolucci AC, Han J, Sturzenegger T, Shearer J, Mickiewicz B, Vogel HJ, Madsen KL, Reimer RA. Impact of dietary fiber supplementation on modulating microbiota-host-metabolic axes in obesity. J Nutr Biochem. 2019 Feb;64:228-236.
Jefferson A, Adolphus K. The Effects of Intact Cereal Grain Fibers, Including Wheat Bran on the Gut Microbiota Composition of Healthy Adults: A Systematic Review. Front Nutr. 2019 Mar 29;6:33.
Zhang, Y.; Liu, J.; Yao, J.; Ji, G.; Qian, L.; Wang, J.; Zhang, G.; Tian, J.; Nie, Y.; Zhang, Y.E.; et al. Obesity: Pathophysiology and Intervention. Nutrients 2014, 6, 5153-5183.
Lin X, Li H. Obesity: Epidemiology, Pathophysiology, and Therapeutics. Front Endocrinol (Lausanne). 2021 Sep 6;12:706978.Lin X, Li H. Obesity: Epidemiology, Pathophysiology, and Therapeutics. Front Endocrinol (Lausanne). 2021 Sep 6;12:706978. Pathophysiology, and Therapeutics. Front Endocrinol (Lausanne). 2021 Sep 6;12:706978
谷禾健康
Blautia (经黏液真杆菌属)
Blautia 是一种最近发现的细菌属,是将几种丰富的胃肠道细菌归类,这些细菌以前属于 Ruminococcus 属。基于表型和系统发育分析,梭菌属和瘤胃球菌属中的一些物种也已被重新归类为Blautia.
Blautia 作为毛螺菌科的一个属,自成立以来,因其对缓解炎症性疾病和代谢疾病的贡献以及对特定微生物的抗菌活性而备受关注。最近的几份报告表明,肠道中Blautia菌的组成和变化与宿主年龄、地理、饮食、基因型、健康状况、疾病状态和其他生理状态等因素有关。
研究人员发现:该属中的物种水平在老年患者中经常减少,在结直肠癌患者的黏膜样本中水平降低,在肠易激综合征 (IBS) 患者中水平升高。
此外,Blautia与内脏脂肪面积负相关,内脏脂肪面积被认为是心血管和代谢疾病风险的肥胖生物标志物。研究还确定了Blautia luti 和Blautia wexlerae 的减少与肥胖个体的胰岛素抵抗有关。Blautia菌通过产生细菌素来防止病原体的定植,并通过上调调节性 T 细胞和 SCFA 的产生而表现出抗炎特性和维持葡萄糖稳态作用。
Blautia. 图片来源:microbiomology
Blautia 属严格厌氧,不能运动,是哺乳动物肠道内重要的核心菌属。Blautia 能够使用氢气和二氧化碳来制造乙酸盐。乙酸是肠上皮细胞的次要能力来源,也是肌肉和脑组织的能量来源,可以抑制病原菌,有抗炎作用。
Blautia菌通常为球形或椭圆形,成对或成股出现,大多数菌株无孢子。Blautia广泛分布于哺乳动物的粪便和肠道中。大多数Blautia菌株的最适温度和 pH 值分别为 37°C 和 7.0。DNA的GC含量约为 37-47 mol%。
培养实验表明,所有Blautia菌株都可以利用葡萄糖,但不同菌株对蔗糖、果糖、乳糖、麦芽糖、鼠李糖和棉子糖的利用能力不同。Blautia发酵葡萄糖的最终产物是乙酸、琥珀酸、乳酸和乙醇,主要生化试验显示卵磷脂、脂肪酶、过氧化氢酶和吲哚的阴性结果。
Blautia菌株的碳水化合物利用特性
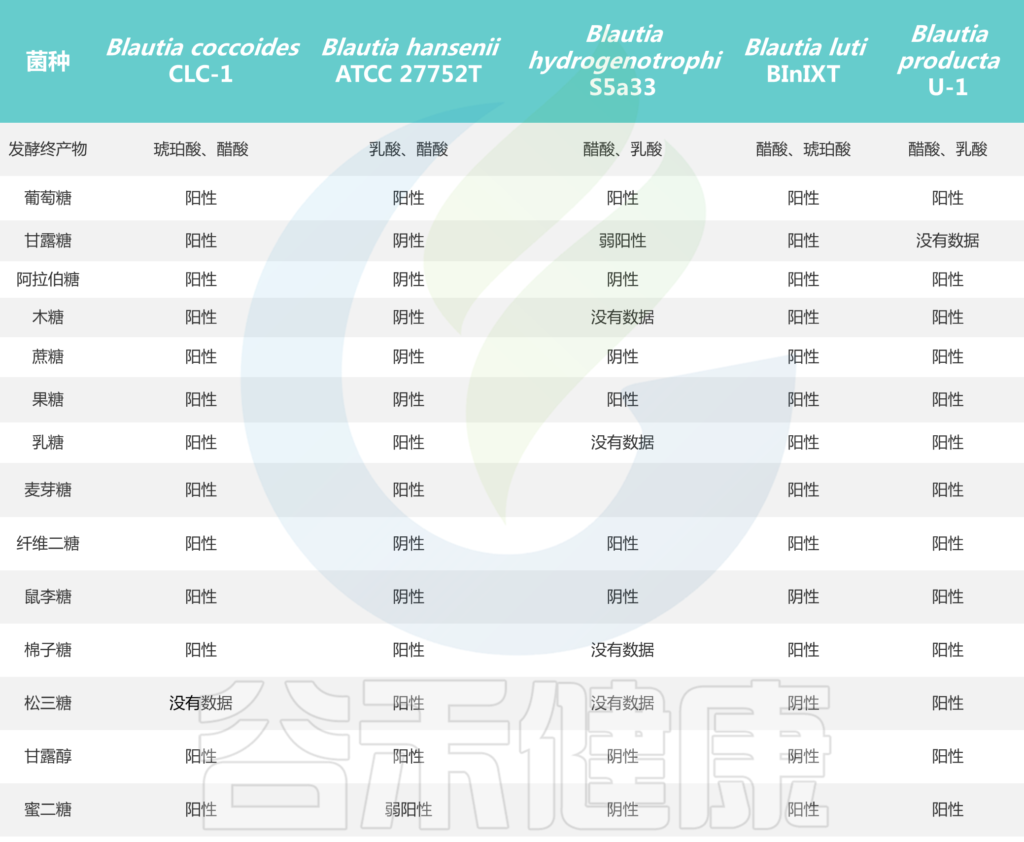

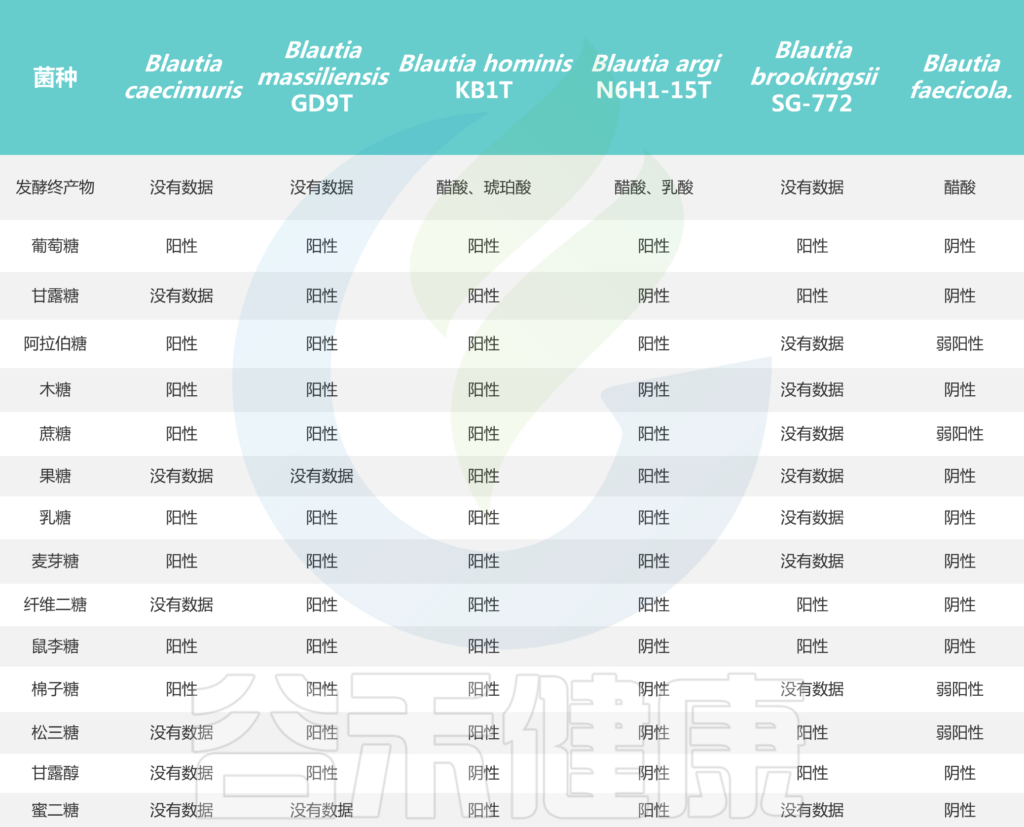
Liu X, et al., Gut Microbes. 2021
Blautia属目前根据公布的有效名称物种共计20个,包括:
它们最初被错误分类为Ruminococcus、梭菌属或瘤胃球菌属。
文献中报道的Blautia的所有种
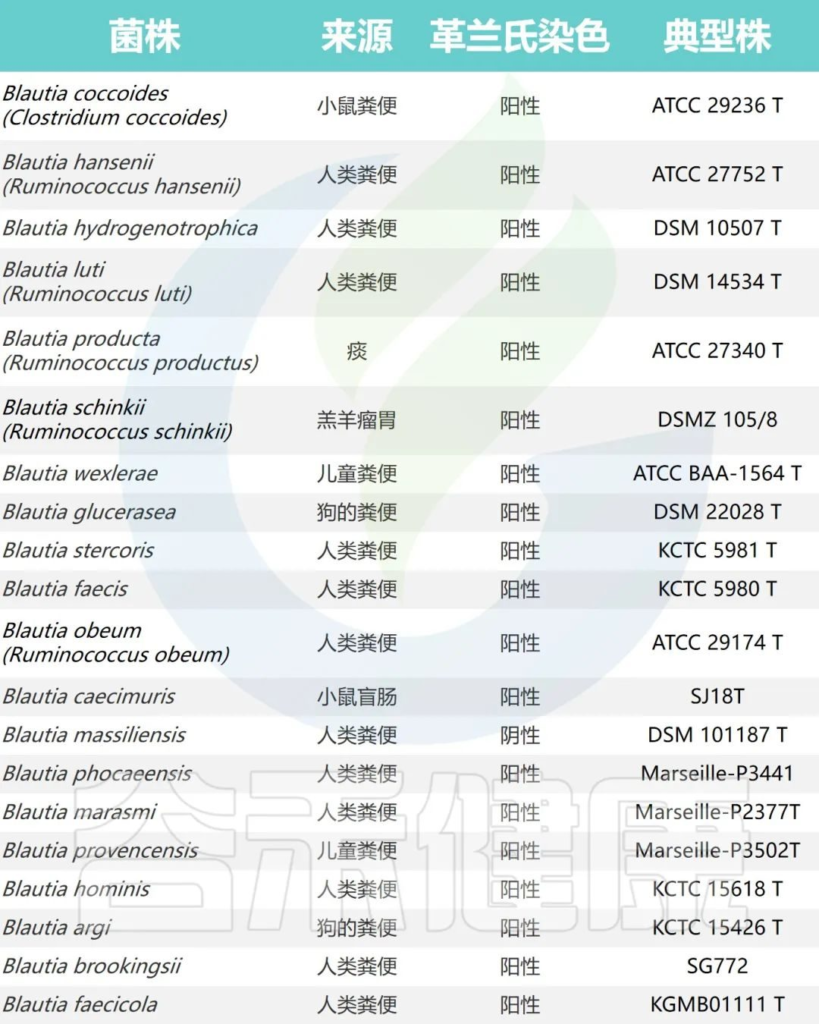
Liu X, et al., Gut Microbes. 2021
该属的组成通过增加新的种和品系而不断更新,但总的来说,Blautia中的种仍形成一个相对稳定和连贯的单系分支。
不同物种首次发现的来源不同,但是主要物种都是从人粪便分离出来的。
例如:Blautia hydrotrophica (B.hydrotrophica)和Blautia stercoris (B. stercoris) 首先是从人类粪便中分离出来的。
B.hydrotrophica 的代谢途径
Blautia hydrotrophica 是革兰氏阳性、无芽孢、球杆菌状细菌,平均大小为 0.7-0.6 毫米。Hydrogenotrophica,意为以氢为食,是指生物体利用 H2 和 CO2 作为生长能源的能力。它将 H2 和 CO2 代谢形成乙酸盐作为唯一代谢物自养生长。该生物体还能够使用几种不同的有机化合物作为底物异养生长。通过葡萄糖和果糖的发酵,乙酸是主要产物,但也可以形成乙醇、乳酸以及较小程度的异丁酸和异戊酸。
B.hydrotrophica的生存环境
B.hydrotrophica的最佳栖息地pH范围为6.0-7.0,温度为35-37˚C。B.hydrotrophica也可能是一种重要的微生物,可替代反刍家畜体内的产甲烷菌,以限制释放的甲烷量。
B.hydrotrophica栖息在哺乳动物的内脏中,有助于分解宿主饮食中原本难以消化的部分,主要是植物材料。膳食多糖和蛋白质的分解是通过微生物群在厌氧肠道环境中发酵完成的。这些微生物群是共生的,这意味着它们的相互作用创造了一个相互关联的食物网。这种代谢食物网的产物是短链脂肪酸,例如乙酸盐、其他有机酸以及 H2 和 CO2 气体。H2 气体的积累实际上可以抑制 NADH 的再氧化,从而减少 ATP 和短链脂肪酸的产生量。据估计,这些短链脂肪酸的代谢产生了人类所需能量的 5%-10% 。Blautia hydrotrophica在宿主新陈代谢中发挥重要作用,因此更好地了解这些微生物可能会导致能够操纵人体能量平衡。
B. wexlerae和B. luti 是Blautia中最丰富的物种,是人类肠道的主要物种之一。
B. wexlerae 治疗代谢疾病
Blautia wexlerae ( B. wexlerae ) 是主要的丁酸盐生产者。动物实验表明,丁酸盐可以改善胰岛素抵抗,减少脂肪堆积。因此,这可能是B. wexlerae抗肥胖的机制之一。B. wexlerae在治疗代谢疾病方面具有发展潜力。
B. faecis DSM33383 菌株预防管理呼吸道疾病
Blautia faecis也是从人粪便分离出来的,细胞染色呈革兰氏阳性、严格厌氧。研究人员已经确定了B. faecis DSM33383 菌株,该菌株降低了 TNF 诱导的肠上皮细胞系 HT-29 产生的 IL-8。在流感后的两个临床前模型中进一步研究了该菌株的作用表明该菌株胃内给药可保护感染了肺炎链球菌的小鼠,并在较小程度上保护鼠伤寒沙门氏菌继发感染。该研究表明,粪杆菌DSM33383 可能是预防和管理呼吸道传染病的有希望的候选者。
B. coccoides参与促炎途径
B. coccoides最初是从喂食高乳糖饮食的小鼠的粪便中分离出来的;Blautia coccoides已通过免疫调节和促炎途径参与多发性硬化,包括与抗原呈递、B 和 T 细胞活化以及补体活化相关的基因的上调。
B. hydrogenotrophica,以前称为 Ruminococcus hydrogenotrophicus,是一种在哺乳动物(人类和反刍动物)的肠道内发现的物种。
B. glucerasei从狗的粪便中分离出来。
另外的物种如B. producta和B. schinkii甚至从痰液、污水和瘤胃中分离出来。
这些发现表明Blautia在肠道和其他微环境中的生存和进化的重要性。
当细菌从膳食成分中产生的代谢物作为底物支持其他物种的生长时,称为交叉喂养。交叉喂养是肠道微生物群中厌氧菌之间的重要相互作用,可影响其代谢途径并有助于其稳定性和生产力。
作为厌氧菌的一个属,Blautia与其他细菌的交叉喂养也在一定程度上有助于代谢调节。
Blautia & R. bromii
一项研究发现,通过使用 0.2% 的抗性淀粉作为能量来源,布氏瘤胃球菌(R. bromii)在 RUM-RS 培养基上可以产生大致相等摩尔比的甲酸、乙醇和乙酸。
注:布氏瘤胃球菌(R. bromii)是存在于人类肠道中的降解抗性淀粉的细菌,富含抗性淀粉的饮食可以增加它的丰度。
然而,在淀粉上与产乙酸细菌B. hydrotrophica进行批量共培养导致甲酸消失,乙酸水平增加。产生甲酸的物种和产生乙酸的物种之间的交叉喂养可能在结肠中短链脂肪酸的形成中起重要作用,并有助于大量产生乙酸。
Blautia & Dorea
在肠易激综合征 (IBS) 患者中观察到 Blautia 菌种水平升高,研究人员推测可能由于由高丰度的Dorea菌产生的较高气体水平,Dorea 是一种可以被 Blautia 使用的细菌。
Blautia & B. bifidum
Blautia hydrotrophica消耗 H2和 CO2通过 Wood-Ljungdahl 途径产生乙酸——当与双歧双歧杆菌共存时,该途径显着激活。B. bifidum (双歧双歧杆菌)作为一种特殊的碳水化合物发酵物种并产生 CO2,它是 Wood-Ljungdahl 途径中的固定底物。因此,在 Blautia hydrotrophica 中观察到的 Wood-Ljungdahl 途径的变化可能是B. bifidum交叉喂养的结果。
备注:Wood-Ljungdahl 途径又称为厌氧乙酰辅酶 A 途径,存在于产甲烷菌、硫酸盐还原菌和产乙酸菌等化能自养的厌氧细菌和古生菌中。
饮食是驱动肠道菌群组成和代谢活动的主要因素,不同种类和数量的饮食以及主要营养素之间的平衡对肠道微生物有显着影响。
酒曲通过糖基神经酰胺作为 Blautia coccoides 的益生元
传统的日本烹饪方法和食,其中包含用非致病性真菌酒曲制备的发酵食品,与日本人的长寿密切相关。一项研究报道,酒曲中含有大量的糖基神经酰胺,并表明在小鼠饮食中添加 1% 纯化的糖基神经酰胺作为益生元1周可以提高小鼠肠道中球状芽孢杆菌的丰度,减少其血液糖水平,并上调其肾腺激素水平。同时发现Blautia coccoides可以将糖基神经酰胺降解为神经酰胺,然后将神经酰胺代谢为脂肪酸和鞘氨醇碱,它们被肠道吸收并产生有益作用。
玉米中提取的膳食纤维F-FOP增加Blautia
将从玉米中提取的膳食纤维 (F-FOP) 添加到喂食高脂肪 (HF) 饮食的小鼠的饮食中,显着增加了小鼠粪便中Blautia的丰度。与 HF 饮食的小鼠相比,F-FOPs + HF 饮食的小鼠表现出体重和组织重量的损失,结果显示Blautia的丰度与肥胖相关代谢紊乱的标志物呈负相关。
低聚果糖、冻干豆浆增加Blautia
在喂食高脂饮食的大鼠中添加 20% 的冻干豆浆会导致大鼠粪便中的Blautia含量增加。
在一项研究中,将 30 只雌性大鼠分为六组,分别喂食酪蛋白或大豆分离蛋白,每组都含有纤维素、棉子糖或低聚果糖 (FOS)。结果表明,两种来源的日粮蛋白质都可以改变大鼠粪便中乙酸浓度和乳酸杆菌的丰度,但无论膳食蛋白质来源如何, FOS都会增加Blautia的丰度。
研究还表明,大鼠肠道酸化可能会抑制次级胆汁酸的形成。
omega-3增加Blautia
在另一项研究中,一名 45 岁的男性志愿者每天摄入 600 毫克 omega-3,持续 14 天,该志愿者的整体肠道微生物多样性下降,尤其伴随着粪杆菌丰度的降低和Blautia丰度的显着增加。
交替饮食和自助饮食增加Blautia
除了食物,人们的饮食方式也会塑造肠道菌群。与普通饮食相比,交替饮食和自助饮食可以提高肠道菌群中Blautia菌属和瘤胃球菌的丰度,此外还会引起一些宿主代谢相关参数的变化。随着全基因组测序的发展,未来的研究可以检验各种饮食如何调节Blautia的代谢活动并改善宿主健康。
在生命的不同阶段(即从童年到成年再到老年)的过渡期间,肠道微生物群会发生显着变化。使用高通量测序对 367 名 0-104 岁健康日本受试者的粪便样本进行的横断面研究报告称,日本成年人(21-69 岁)的肠道微生物群含有高丰度的Blautia和Bifidobacterium和低丰度Bacteroides。此外,与成年人相比,老年人的微生物组多样性和个体微生物丰度降低,包括Blautia丰度降低。这种现象可能与年龄相关的免疫功能下降(称为免疫衰老)有关,并伴有许多与年龄相关的疾病,包括慢性低水平炎症。
Blautia wexlerae和Bifidobacterium pseudocatenulatum的丰度在成人型肠道微生物群中显着更高,而在老年型肠道微生物群中观察到兼性厌氧菌(如大肠杆菌)的丰度更高。这些发现表明,通过增加会随着年龄增长而减少的菌群,将肠道微生物群从老年人型转变为成人型,可以预防与年龄相关的疾病的风险。
最近的一项研究分析了来自亚洲温带和热带地区五个国家的城市或农村地区的 303 名学龄儿童粪便样本中的微生物群落特征。儿童肠道菌群分为普氏菌属(P型)和双歧杆菌/拟杆菌属(BB型)两组。中国(包括台湾地区)、日本等温带地区儿童肠道菌群多为BB型,泰国、印度尼西亚等热带地区儿童肠道菌群多为P型。值得注意的是,Blautia 在 BB 型肠道菌群中显着富集,占总 BB 型细菌组成的 10%,但仅占总P的 5%。
一项研究指出,日本人的主要肠道菌属是双歧杆菌和梭状芽孢杆菌。在美国人、中国人、法国人和西班牙人中存在拟杆菌属;在澳大利亚人中是Blautia。据报道,地理位置之间人类肠道微生物多样性的差异在很大程度上与遗传、生活方式和饮食有关。
有趣的是,据报道Blautia在双胞胎遗传中具有很强的分类关联。一项研究收集了七种宿主的粪便样本,包括人类、猪、牛、鹿、狗、猫和鸡,并对 16S rRNA 基因的 V6 区域进行了测序。发现Blautiaoligotypes可以准确识别不同的宿主来源,表明该属具有宿主特异性和宿主偏好。
近年来,Blautia对草本植物和功能性食品的生物转化和代谢的研究引起了研究关注。
多甲氧基黄酮 (PMF) 是从山奈和柑橘类水果中分离出来的黄酮类化合物,具有抗癌、抗炎、抗病毒和抗凝血等生物学功能。
研究表明,Blautia菌属通过将 5,7-二甲氧基黄酮 (5,7-DMF) 和 5,7,4-三甲氧基黄酮 (5,7,4-TMF)分别转化为具有生物活性的白杨素和芹菜素,对芳基甲基醚官能团具有水解作用。该菌还具有去糖基化能力,它可以将异黄酮、黄酮和类黄酮代谢成相应的苷元。
作为黄酮类化合物的另一个例子,姜黄素在治疗某些疾病,包括癌症、心血管疾病、糖尿病、肝病和神经退行性疾病方面表现出抗氧化、抗炎、抗病毒、抗菌的有益作用,受到了广泛的关注。
由于姜黄素结构中含有β-二酮,该化合物具有高的疏水性、低的溶解性和“生物利用度”,因此,每天大量摄入姜黄素,可以观察到对健康的促进作用。不幸的是,大量摄入姜黄素可能会产生有害影响并降低疗效,这会导致限制了姜黄素在疾病预防中的应用。
由肠道细菌产生的姜黄素代谢物具有生物效应,而不是姜黄素的原始形式。
据报道,姜黄素是由人肠道细菌Blautia 菌株MRG-PMF1通过甲基芳醚裂解,转化为去甲基姜黄素和双去甲基姜黄素的。有证据表明,未被吸收的姜黄素可以间接调节结肠微生物群,通过产生额外的生物可利用和生物活性分子(如二氧去甲基姜黄素和二甲氧基姜黄素)对多种疾病产生有益的影响。
此外,Blautia sp AUH-JLD56 菌株已被证明可特异性且有效地将牛蒡子苷或牛蒡子苷元生物转化为具有良好自由基清除活性的 (-)-3′-去甲基牛蒡子苷元。 B. glucerasei sp. 产生一种特定的细胞外葡萄糖神经酰胺酶,将葡萄糖神经酰胺水解成功能性物质,对结肠癌具有特定的预防作用。
但是值得提醒的是,Blautia的某些生物转化可能无益,甚至可能有害。某些Blautia物种可以对初级胆汁酸进行 7-α-脱羟基化,并将其转化为次级胆汁酸,如石胆酸和脱氧胆酸。这些物质是诱发结肠癌的致癌物,在溃疡性结肠炎、发育不良或癌症患者的粪便中发现这些物质浓度高。
一般来说,肠道中的细菌代谢不涉及氧气,而是还原和水解,导致形成非极性低分子量产物。在类黄酮转化过程中,Blautia菌种催化的反应包括去甲基化、脱羟基化、O-和 C-去糖基化和 C-环裂解,这可能是由于其相应的酶,如 β-葡萄糖苷酶和 O-糖苷酶。因此,深入开发Blautia对生物转化的探索对于开发用于食品补充剂的新酶和生物活性代谢物至关重要,并为人体肠道微生物组的代谢组学研究提供有价值的视角。
次级代谢产物是微生物在生长代谢过程中产生的具有生物活性的化合物,广泛用于抗菌抗癌药物、除草剂、杀虫剂等,也是微生物药物开发的重要来源。如双歧杆菌产生的细菌素对单核细胞增生李斯特菌、产气荚膜梭菌和大肠杆菌等病原微生物具有抗菌活性。
Blautia通常具有生产细菌素的能力。通过antiSMASH数据库对次生代谢物的注释,将74株Blautia菌株注释为7类共261个次生代谢生物合成基因簇(BGCs),包括NRPS、sactipeptide、lanthipeptide、bacteriocin、lassopeptide、betalactone、transat-pks。
NRP、sactipeptide、lanthipeptide 通常分布在所有菌株中。NRP 和 PK 是具有多种功能的最丰富的次级代谢产物家族之一,包括参与铁清除的铁载体、提供针对一系列压力因素的保护的色素,以及营养获取、化学通讯和防御反应。
备注:antiSMASH数据库可实现基因组与基因组之间的相关天然产物合成基因簇的查询和预测。临床上使用的大部分抗生素和药物均来自植物或微生物的天然产物。近二十年来,基因组数据的不断增加,使通过基因组挖掘来获取化合物的生物合成簇成为可能。antiSMASH是该领域最流行的工具之一。自2011年首次发布以来,antiSMASH已成为次级代谢产物基因组挖掘的标准工具,antiSMASH数据库为许多公开可用的微生物基因组提供预先计算的antiSMASH结果,并允许进行高级跨基因组搜索。
Blautia产生的细菌群具有抑制肠道内病原菌定植的潜力,并且它还可以影响肠道微生物群的组成。研究显示B. obeum和B. producta可以抑制产气荚膜梭菌和耐万古霉素肠球菌的增殖,使其成为潜在的益生菌,发挥益生菌功能。
肠道微生物群是一个复杂的生态系统,与宿主疾病的发展、药物代谢、免疫系统调节和其他过程有关。Blautia 作为肠道微生物群中的优势菌属,与宿主生理功能障碍具有显着相关性,例如肥胖、糖尿病、癌症和各种炎症性疾病。
一项研究观察到连续 3 周食用低热量和高蛋白饮食的超重/肥胖非酒精性脂肪肝患者的肠道微生物群组成发生变化和Blautia丰度增加。在另一项研究中,无论是否存在非酒精性脂肪性肝炎,肥胖儿童的肠道拟杆菌属丰度较高,同时Blautia和粪杆菌丰度较低。
在一项基于人群的横断面研究中,研究人员调查了 20-76 岁日本男性和女性的内脏脂肪积累和体重指数与按性别分层的肠道微生物群的关系。发现Blautia是唯一一个其丰度与日本人的内脏脂肪积累呈显着负相关的属,无论性别如何。
Blautia是肠道中常见的乙酸生产者,可通过激活 G 蛋白偶联受体 GPR41 和 GPR43 来抑制脂肪细胞中的胰岛素信号传导和脂肪积累,进而促进其他组织中未结合的脂质和葡萄糖的代谢,从而减轻肥胖相关疾病。
Blautia是有效减肥组女性肠道菌群中的优势菌属,但在减肥无效组中则不然。在另一项研究中,与健康儿童相比,糖尿病儿童的Blautia丰度显着下降。一项横断面研究表明,Blautia,特别是B. luti和B. wexlerae,可能有助于减少与肥胖相关并发症相关的炎症。
肥胖组的Prevotella、巨型单胞菌(Megamonas)、梭杆菌属和Blautia显著增加。
Blautia作为共生的专性厌氧菌属,通过上调肠道调节性T细胞和产生短链脂肪酸,在维持肠道生态平衡和预防炎症方面发挥着重要作用。
IBD患者和健康人的粪便和黏膜菌群分析表明,CD患者盲肠黏膜菌群中Blautia的丰度显着降低。在结直肠癌患者的黏膜粘连菌群中,同样报道了Blautia的丰度降低。
霍乱弧菌通常会导致人类腹泻,但人们对病原体的易感性不同,这可能是由人际微生物组变异驱动的。
发现霍乱患者的肠道菌群与健康个体存在显着差异,其中Blautia obeum与霍乱弧菌的定植呈显着负相关。进一步研究表明,B. obeum基因组中编码胆汁盐水解酶(BSH)的基因可以降低霍乱弧菌tcpA基因的表达,抑制其定植,缓解腹泻。
一项生物标志物分析研究表明,接受异体 BMT 的患者肠道微生物群多样性增加,特别是Blautia属共生细菌的丰度增加,与致死性移植抗宿主病的减少和总生存期的增加有关。
少数研究也报道了Blautia丰度降低与回肠袋-肛门吻合和肝硬化的关系。Blautia作为共生的专性厌氧菌属,通过上调肠道调节性 T 细胞和产生短链脂肪酸,在维持肠道环境平衡和预防炎症方面发挥重要作用。
上述研究表明,Blautia的丰度与某些疾病呈负相关。然而,与健康个体相比,在肠易激综合征和溃疡性结肠炎患者的粪便微生物群中发现了更高丰度的Blautia.
尽管Blautia在各种疾病中的潜在机制尚不明确,但 Blautia丰度仍可作为相关疾病早期诊断或治疗的潜在工具。
老年人特别容易出现食欲不振和营养不良。这可能部分是由于肠道微生物群老化。Blautia属的较低丰度可能与营养不良有关,而来自毛螺菌科、瘤胃球菌科 UCG-002、Parabacteroides merdae和Dorea formicigenerans 的分类群丰度较高与食欲不振相关。食欲不振或营养不良的参与者的粪便乙酸水平降低。
Blautia丰度减少可能会增加慢性低度炎症,并降低通过发酵从饮食中摄取的能量。该结论需要进一步的研究支持。
与对照组相比,来自虚弱组的粪便样本下列菌群具有较高的水平:
Akkermansia, Parabacteroides, Klebsiella
而共生属较低水平菌群如下:
Blautia, Megamonas, Faecalibacterium, Prevotella, Roseburia
在自闭症谱系障碍患有功能性肠胃疾病的儿童中观察到几种与粘膜相关的梭菌显着增加,而 Dorea 和Blautia以及 Sutterella的显着减少。
此外,帕金森病患者子中发现在属的分类水平上,来自 Blautia、Coprococcus 和 Roseburia 属的推定“抗炎” 丁酸盐产生菌在对照组的粪便中明显多于帕金森病患者。
肌肉减少症是一种症状性病症,其特征是由于骨骼肌质量随着年龄的增长而过度损失,导致肌肉力量和身体机能下降。
肌肉减少症伴随着身体平衡差、步态障碍、使用拐杖和跌倒。研究发现与附肢骨骼肌质量/体重 (ASM/BW)与 ASM/BW 呈正相关的Blautia、Bifidobacterium可能有助于增加骨骼肌质量。
Blautia coccoides可能会通过免疫调节和促炎途径参与多发性硬化,包括与抗原呈递、B 和 T 细胞活化以及补体活化相关的基因的上调。与其他疾病一样,在多发性硬化中,肠道菌群失调会增加肠道通透性,从而促进 LPS 的进入。
如何增加(来自文献,证据不是很充分)
食物:
富含 Omega-3 的食物
糙米
大麦
迷迭香
黄酮类
高谷物饮食
益生元或药物:
二甲双胍
黄连素
小檗碱
红花油
丁酸钠
抗性淀粉(II、IV型)
橙子(果胶/黄烷酮)
葡萄籽多酚/酒
亚麻籽
维生素 D3
益生菌:
枯草芽孢杆菌
布拉酵母菌
德氏乳杆菌
鼠李糖乳杆菌GG
长双歧杆菌 BB
例如:一项研究指出富含阿拉伯木聚糖的麦麸提取物会提高Blautia物种的比例 ,这表明有可能设计基于饮食的干预措施,以增加肥胖儿童体内耗尽的这些细菌物种的肠道生态系统。需要对B. luti和B. wexlerae菌株进行临床前和临床干预试验,以明确证明它们对肥胖和糖尿病前期状态的潜在保护作用。
减少Blautia
人类肠道微生物研究的不能忽略的关注之一是研究核心微生物群。拟杆菌、普雷沃氏菌、瘤胃球菌、经黏液真杆菌属(Blautia)、考拉杆菌、罗伊氏菌、吉米菌、粪杆菌、毛螺菌以及梭菌等是世界代表性人群的核心肠道菌群。在目前谷禾健康超过60万的肠道菌群数据库中,肠道微生物群的几个核心肠道细菌普遍存在于超过90%人群粪便中。
Blautia作为一个重要的核心菌属,在肠道中占比丰度,是短链脂肪酸尤其乙酸的主要生产者,对于减肥和抗炎均有重要的积极作用。此外,其属下某些菌株分泌的细菌素可以抑制特定病原菌,这对于当下耐药性问题无疑看到了新方向。
但是经黏液真杆菌属(Blautia)作为一种严格厌氧的细菌,需要苛刻的培养条件和严格的操作程序。因此,将属于该属的细菌用作商业益生菌并不容易。相反,Blautia的益生元底物可以用于健康维护。一些食物成分,例如低聚果糖、乳果糖和日本酒曲糖基神经酰胺,均表明可以增加小鼠体内的Blautia丰度。然而,需要注意的是粪便微生物群的益生元作用也会因人而异。
主要参考文献:
Liu X, Mao B, Gu J, Wu J, Cui S, Wang G, Zhao J, Zhang H, Chen W. Blautia-a new functional genus with potential probiotic properties? Gut Microbes. 2021 Jan-Dec;13(1):1-21.
Benítez-Páez A, Gómez Del Pugar EM, López-Almela I, Moya-Pérez Á, Codoñer-Franch P, Sanz Y. Depletion of Blautia Species in the Microbiota of Obese Children Relates to Intestinal Inflammation and Metabolic Phenotype Worsening. mSystems. 2020 Mar 24;5(2):e00857-19.
Stanley D, MS G, SE D, VR H, TM C, RJ H, RJ M. Identification of chicken intestinal microbiota correlated with the efficiency of energy extraction from feed. Vet Microbiol. 2013;164(1–2):85–21.
Biddle A, Stewart L, Blanchard J, Leschine S. Untangling the genetic basis of fibrolytic specialization by lachnospiraceae and ruminococcaceae in diverse gut communities. Diversity. 2013;5(3):627–640.
Chakravarthy SK, Jayasudha R, Prashanthi GS, Ali MH, Sharma S, Tyagi M, Shivaji S. Dysbiosis in the gut bacterial microbiome of patients with uveitis, an inflammatory disease of the eye. Indian J Microbiol. 2018;58(4):457–469.
Milani, C.; et al. The first microbial colonizers of the human gut: composition, activities, and health implications of the infant gut microbiota. Microbiology and molecular biology reviews. 2017, 81(4): e00036-17.
Luu TH, Michel C, Bard JM, Dravet F, Nazih H, Bobin-Dubigeon C. Intestinal Proportion of Blautia sp. is Associated with Clinical Stage and Histoprognostic Grade in Patients with Early-Stage Breast Cancer. Nutr Cancer. 2017 Feb-Mar;69(2):267-275
Chen, W., Liu, F., Ling, Z. et al. “Human Intestinal Lumen and Mucosa-Associated Microbiota in Patients with Colorectal Cancer.” PloS ONE. 7(6): e39743; doi: 10.1371/journal.pone.0039743
Grisham, J. “Bacteria May Hold the Key to Preventing Dangerous Side Effect of Transplants.” Memorial Sloan Kettering Cancer Center. (2014). Memorial Sloan Kettering Cancer Center
Jenq, R.R., Taur, T., Devlin, S.M. et al. “Intestinal Blautia is Associated with Reduced Death from Graft-versus-Host Disease.” Biology of Blood and Marrow Transplantation. (2015). 21(8) 1373-83; doi: http://dx.doi.org/10.1016/j.bbmt.2015.04.016,/p>
Murat Eren, A., Sogin, M.L., Morrison, H.G. et al. “A single genus in the gut microbiome reflects host preference and specificity.” The ISME Journal. (2015). 9: 90-100; doi: 10.1038/ismej.2014.97
Rajilić-Stojanović, M., de Vos W.M. “The first 1000 cultured species of the human gastrointestinal microbiota.” FEMS Microbiology Reviews. (2014). 38(5) 996-1047; doi: 10.1111/1574-6976.12075
Horigome A, Hashikura N, Yoshida K, Xiao JZ, Odamaki T. 2′-Fucosyllactose Increases the Abundance of Blautia in the Presence of Extracellular Fucosidase-Possessing Bacteria. Front Microbiol. 2022 Jun 2;13:913624.