-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

爱格氏菌属(Eggerthella),厌氧、不产生孢子、不活动的革兰氏阳性杆菌,是人类肠道微生物组的常见成员,人群检出率比较高,属于放线菌门。
大多数时候,Eggerthella与多种疾病相关
Eggerthella存在于人类结肠和粪便中,并被认为是溃疡性结肠炎、肝和肛门脓肿以及全身性菌血症的原因。
研究表明Eggerthella还与多种人类慢性疾病有关,包括哮喘、抑郁、肾病、多发性硬化症和类风湿性关节炎,尽管Eggerthella在这些疾病中的因果作用尚未确定。
哮喘
出生队列研究和大型国际研究发现哮喘与生命早期抗生素使用之间存在关联,特别是关于头孢菌素类和大环内酯类药物。研究发现,在大环内酯类暴露后观察到的Eggerthella水平增加了10倍。大多数Eggerthella是病原体并可能促进炎症反应。来自动物模型的实验证据表明,生命早期使用抗生素会破坏微生物群,从而破坏免疫系统的发育,导致易感个体的气道反应过度。
神经系统疾病
多项研究表明在抑郁,情感障碍以及精神分裂患者中Eggerthella丰度富集。
有16项观察到重度抑郁症患者和健康对照者之间的肠道微生物群组成存在显著差异。与健康对照相比,重度抑郁症患者的Eggerthella、Atopobium、Bifidobacterium的相对丰度增加,粪杆菌的相对丰度降低。
在患有认知障碍的老年人肠道中,Lachnospiraceae、Eggerthellaceae、Dorea、Blautia、Eggerthella的丰度减少,而Veillonellaceae增加。然而,在衰老过程中,这些变化并没有出现。表明衰老过程中和认知障碍特有的微生物群变化是独立于年龄的。
用于早期诊断肝细胞癌的微生物标志物
一项研究评估中国人群乙型肝炎病毒相关肝病(包括慢性乙型肝炎、肝硬化和肝细胞癌)肠道微生物组的改变,Eggerthella的相对丰度随着HC向慢性乙型肝炎和肝硬化的进展而逐渐降低,但在肝细胞癌中显著增加。
肌肉减少症合并肝硬化
肌肉减少症肝硬化患者的肠道微生物群缺乏与身体功能相关的细菌(甲烷杆菌、普雷沃氏菌和阿克曼菌),并且富含Eggerthella,这是一种虚弱的肠道微生物标志物。
肾病
在肾病中该菌的增加或减少有争议,在人类肾脏疾病的肠道微生物群数据库中发现 Eggerthella 属减少。然而,一项横断面研究,评估了中国原发性IgA肾病患者粪便菌群特征,与健康对照组相比,IgA肾病组中显著增加的属为Escherichia-Shigella、Hungatella、Eggerthella。
影响药物吸收和脂质水平
Eggerthella和相关的人类肠道Coriobacteriaceae 细菌还参与多种代谢转化,包括广泛使用的心脏药物地高辛的灭活、膳食植物化学物质的各种反应、儿茶酚的脱羟基以及胆汁的代谢酸。
一些Eggerthella菌株负责将地高辛转化为一种无活性的微生物代谢产物,限制了10%左右的患者吸收到系统血流中的活性药物的数量。 最近的研究证明,地高辛与抗生素或富含精氨酸的饮食共同给药,都会导致全身地高辛水平升高和药物水平的临床相关波动。
注:地高辛(Digoxin)是一种强心苷类药物,主要用于治疗心力衰竭和某些心律失常。
此外,Eggerthella与甘油三酯增加和高密度胆固醇减少存在相关性,它可通过将胆固醇转化为不可吸收的粪甾醇和粪甾酮,或将胆固醇转移至胆汁酸代谢过程中,直接限制体循环中的胆固醇水平,从而影响脑血管的发展。Eggerthella 也被证明参与生物活性次生植物化合物的代谢,例如葡萄中的白藜芦醇或大豆中的大豆苷元。
Eggerthella作为有潜在保护菌
谵妄被定义为一种突然、精神状态下降的临床综合征,其特征是意识模糊和认知状态波动,一项
大规模孟德尔随机化研究显示,Eggerthella属与谵妄的风险降低有关(P = 0.047)。
代表菌种:迟缓埃格特菌
该属的典型菌种是Eggerthella lenta(迟缓埃格特菌)。Eggerthella lenta 可引起血流感染,被认为是一种机会性人类病原体。
越来越多的研究表明,它也可能是人类的重要病原体,甚至在某些条件下引起危及生命的感染。Eggerthella lenta已从血液、脓肿、伤口、皮肤溃疡、产科和泌尿生殖道感染以及腹腔内感染中分离出来。
危险因素
危险因素包括免疫功能受损状态(类固醇使用、近期化疗、终末期肾病和糖尿病)、恶性肿瘤和胃肠道疾病,如溃疡性结肠炎和克罗恩病。
Eggerthella lenta菌血症最常见的潜在健康状况是实体癌或血液器官癌、糖尿病和心血管疾病。而所有这些患者的主要感染源是胃肠道、皮肤和软组织和脓肿。
在所有首发症状中,阑尾炎所占比例最高,远高于第二大的结肠炎。阑尾炎常伴有穿孔甚至腹膜炎。
Eggerthella lenta通常存在于消化道中,但可能会导致因胃肠道疾病导致粘膜内层破坏的患者或免疫系统受损的患者发生全身感染。然而,其他研究表明,患有癌症、褥疮、阑尾炎和糖尿病的患者更容易患迟缓埃格特菌菌血症。
Eggerthella lenta 非运动型革兰氏阳性杆状体和革兰氏染色形态
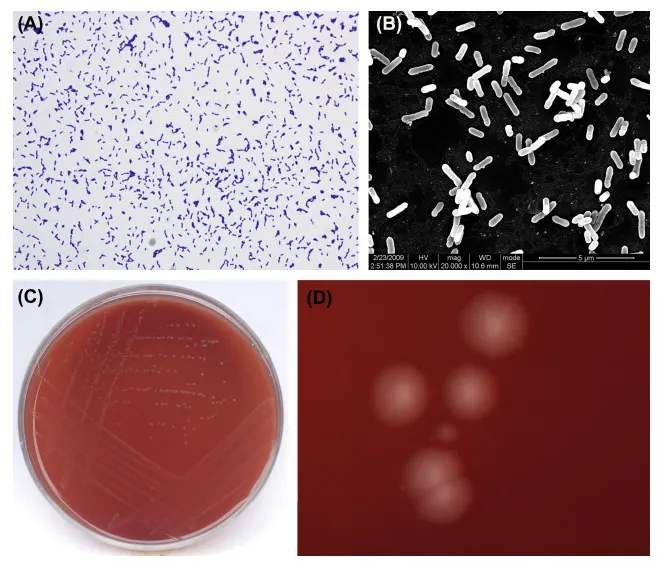
这些生物体能够扩展人类超级生物体的代谢潜力,在多糖的消化、维生素和氨基酸的合成以及内源性化合物的修饰中发挥重要作用。此外,它们在外源物质(包括药物、膳食化合物和环境毒素)的代谢中发挥着重要作用,影响这些化合物的生物利用度、活性和毒性。
例如,某些Eggerthella lenta菌株还可以使药物 L-多巴(一种用于治疗帕金森病的多巴胺的氨基酸前体)失活,因为该细菌能够将 L-多巴代谢物多巴胺脱羟基为间酪胺。
此外,Eggerthella lenta还会把白藜芦醇转化为二氢白藜芦醇。
有研究从人类肠道菌群中分离出一种能够有效代谢白藜芦醇的细菌Eggerthella lenta J01,通过诱导富集转录组学和生物信息学分析,研究人员进一步鉴定了来自 E. lenta J01 的白藜芦醇还原酶 (RER),该酶特异性催化白藜芦醇的 C9-C10 双键氢化并启动白藜芦醇的体内代谢。
注:RER及其同系物代表了一类新型的烯还原酶。健康个体肠道菌群中RER的丰度显著高于炎症性肠病患者,表明其至关重要的生理功能。
关于白藜芦醇和二氢白藜芦醇:
• 白藜芦醇
白藜芦醇是一种强抗氧化剂,可以中和自由基,减少氧化应激对细胞的损害。
潜在健康益处:
1.心血管健康:研究表明白藜芦醇有助于降低低密度脂蛋白胆固醇(LDL-C)水平,增强动脉弹性,减少心血管疾病的风险。
2.抗炎作用:白藜芦醇具有抗炎特性,可以减少炎症反应,对抗慢性炎症相关的疾病。
3.抗癌潜力:白藜芦醇的抗癌作用在实验室研究中得到了很大关注,它能抑制癌细胞的生长和扩散。
4.延缓衰老:白藜芦醇可能通过激活某些基因(如SIRT1)来延缓衰老过程。
• 二氢白藜芦醇
二氢白藜芦醇是白藜芦醇的代谢产物,通常通过肠道微生物的代谢活动生成。
潜在健康益处:
1.抗氧化作用:与白藜芦醇一样,二氢白藜芦醇也具有抗氧化特性,可以保护细胞免受氧化损伤。
2.抗炎作用:也具有抗炎特性,可能对抗慢性炎症。
3.肠道健康:作为肠道微生物代谢的产物,二氢白藜芦醇可能对肠道健康有益。
大多数研究集中在白藜芦醇上,而关于二氢白藜芦醇的研究相对较少。因此,更广泛且深入的研究可能仍需要对二氢白藜芦醇的确切健康益处进行验证。从现有研究来看,白藜芦醇因其广泛的健康效益被更多地关注和研究。
超过五十种不同的药物化合物已被确定对这种代谢改变敏感。参与这些生物转化过程的一种人类肠道共生细菌是迟缓埃格特菌(Eggerthella lenta) (以前称为迟缓真杆菌)。
该菌的名字来源于 Arnold Eggerth,他于 1935 年首次描述了这种细菌。从历史上看,由于该生物体生长缓慢且物种形成需要营养密集型,因此很难培养和鉴定。16S rRNA 基因测序的出现使得鉴定变得更加快速和准确。鉴于其高死亡率,由这种微生物引起的菌血症始终具有重要的临床意义,并需要立即寻找其来源。
干预
抗生素
尽管缺乏临床指南,但是治疗成功案例报告对抗迟缓肠球菌感染最有效的抗菌药物是甲硝唑、阿莫西林克拉维酸和碳青霉烯类;它对头孢曲松具有耐药性。
但之前的病例报告也报道使用广谱 β-内酰胺(例如碳青霉烯或哌拉西林-他唑巴坦)单一疗法或甲硝唑加 β-内酰胺联合疗法取得成功。
注:哌拉西林他唑巴坦 (TZP) 是一种覆盖厌氧菌的广谱联合抗菌剂,通常用于腹腔内感染的经验性治疗。
此外,头孢唑肟,也显示出良好的疗效。
中药
对抗生素诱导腹泻小鼠进行七味白术散灌胃3天后发现,可特异性地产生门乳糖酶的肠道菌群如放线菌门、厚壁菌门和变形菌门,具有明显的检测水平。与其他组相比,来自治疗组小鼠Acidovorax sp.KKs102、Stenotrophomonas sp. LMG11000、Pseudomonas oleovorans、 Eggerthella 、Burkholderia的乳糖酶基因表达更丰富。七味白术散治疗对腹泻的疗效可能与其促进新的或一些关键的乳糖酶产生菌株的生长有关。
一项随机对照研究显示,益肾化湿颗粒可降低慢性肾病患者蛋白尿,减轻肠道菌群失调,益肾化湿颗粒干预4个月后,Faecalibacterium、Lachnospiraceae、Lachnoclostridium、Sutterella等对机体有益的细菌相对丰度明显增加,而Eggerthella和Clostridium innocuum组等致病菌相对丰度降低。
益生菌
在12周植物乳杆菌Q180干预后,Eggerthella的丰度趋向于减少。Eggerthella所属的放线菌门在内源性脂质代谢中起作用,并且与血浆胆固醇呈正相关。此外,有研究通过年龄、性别和宿主基因分析了肠道微生物群与脂质水平的关系,发现Eggerthella属的丰度与其有显著正相关。在上述研究中,Eggerthella属被证明会增加血液甘油三酯水平并降低HDL胆固醇。因此,目前的结果表明,摄入植物乳杆菌Q180可能通过减少Eggerthella的水平来改善血脂。
长双歧杆菌(B.longum)可改善心血管疾病。研究人员通过体外厌氧发酵研究了从健康人粪便中分离的长双歧杆菌L556在冠心病患者中的作用。结果显示,在冠心病患者的肠道微生物群中,长双歧杆菌L556增加了乳酸杆菌、粪杆菌、普雷沃氏菌和Alistipes,同时减少厚壁菌/拟杆菌门、Eggertella、Veillonella、Holdemanella、Erysiperotrichacee_UCG-003。长双歧杆菌 L556还通过调节肠道微生物群和SCFAs等代谢产物来增强抗炎作用。此外,它还调节冠心病组发酵代谢产物中的脂质和氨基酸代谢。
饮食
调查研究发现健康饮食分数越高,该菌的丰度相对更低。■
•◆
Flavonifractor(解黄酮菌属)属于厚壁菌门,梭菌目,通常为革兰氏阳性,大多数物种形成椭圆形/球形内孢子,通常为过氧化氢酶阴性,大多数物种是专性厌氧的,尽管对氧气的耐受性差异很大。
肠道微生物群中 Flavonifractor 丰度升高与较高的情感障碍相关,吸烟和女性是造成这种关联的原因之一,可能导致氧化应激增强,以及儿茶酚途径和低度炎症有关。此外,肠癌或息肉病人该菌富集。
该菌的典型菌种是 Flavonifractor plautii ,是人类肠道微生物中一种常见的专性厌氧菌,通常黏附在肠壁上,在粪便中可提取得到。 Flavonifractor plautii可以通过裂解类黄酮分子的 C 环来降解类黄酮。黄酮类化合物是人类饮食的重要成分,主要由具有广谱药理活性的多酚类次级代谢产物组成。
几种常见的黄酮类食物,如茶、咖啡、苹果、番石榴、榄仁树皮、葫芦巴籽、芥菜籽、肉桂、红辣椒粉、丁香、姜黄和豆类,都含有大量的类黄酮。因此为了最大限度发挥类黄酮潜在有益作用和生物利用度,需要控制Flavonifractor plautii其丰度。
Flavonifractor 作为有益菌
肥胖
Flavonifractor 是肠道健康的重要菌群,其含量与肥胖呈负相关。
口服Flavonifractor plautii可减轻肥胖脂肪组织的炎症反应,F. plautii可能参与抑制炎症环境中的 TNF-α 表达。
前列腺癌
PRACTICAL 和 FinnGen 联盟汇总的数据结果表明,Eubacterium fissicatena和Odoribacter与前列腺癌风险增加有关。相反,Adlercreutzia、Roseburia、Holdemania、Flavonifractor、Allisonella属则是预防前列腺癌的潜在保护因素。
过敏(哮喘)
针对690名参与者生命第一年期间肠道微生物 (16S rRNA 测序)与随后的哮喘风险相关联研究显示,Veillonella与 5 年内较高的哮喘风险相关;而罗斯氏菌、Alistipes和Flavonifractor的相对丰度较高,与哮喘风险较低有关。
糖尿病
两项或以上研究中一致报告的变化,可以明显看出下列细菌在糖尿病前期和新发糖尿病中有所增加,包括乳杆菌、链球菌、埃希氏菌、Veillonella 、Collinsella等,而普拉梭菌、Roseburia、Dialister、Flavonifractor、 Alistipes、Haemophilus 、Akk菌则减少。这些菌作为健康生物标志物的作用已被广泛认可,其有益效果主要归因于其生产短链脂肪酸,尤其是丁酸盐的能力,这对于维持肠道屏障的完整性、能量稳态、减轻炎症和调节血糖反应起着重要作用。
其他
个别研究报道,口服 Flavonifractor plautii(一种在绿茶摄入量中增加的肠道细菌)可通过抑制 IL-17 信号传导促进小鼠急性结肠炎的恢复。
口服 Flavonifractor plautii 可有效抑制小鼠的 Th2 免疫反应,可能有助于减轻抗原诱导的 Th2 免疫反应。
与Flavonifractor 过高相关的疾病
神经系统疾病(抑郁、认知障碍)
肠道微生物群中Flavonifractor 丰度升高与较高的情感障碍相关,Flavonifractor属的种类增加和抑郁症相关。
注:一项研究显示,在重度抑郁症和所有个体中,Flavonifractor 与疲劳呈正相关。
Flavonifractor与新诊断的双相情感障碍有关。
NEAD 研究 (左) 和BIO研究 (右) 中情感障碍 (AD) 患者、其未受影响的亲属 (UR)和健康个体 (HC) 中Flavonifractor的流行率
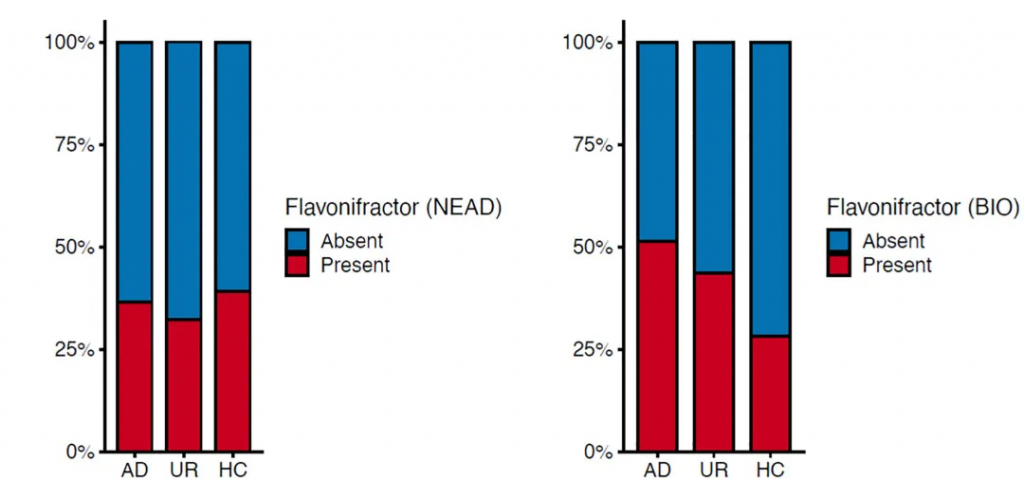
doi.org/10.1016/j.pnpbp.2021.110300
一项双样本孟德尔随机化研究显示,鞘磷脂水平与Flavonifractor呈负相关 (p = 0.026, beta 95%CI = -0.218 [-0.411, -0.026]) 。鞘磷脂代谢异常可能与阿尔茨海默病的发病机制有关。在患有认知障碍的老年个体中, Flavonifractor 属也被发现有所增加。
结直肠癌
肠癌或息肉病人该菌富集。
来自江南大学食品科学与技术国家重点实验室团队的对 85 名接受结肠镜检查的结直肠癌患者的样本进行了 16S rRNA 测序、代谢组学和蛋白质组学研究,结果发现Catabacter、Mogibacterium的相对丰度从粘膜内癌到晚期持续增加,而Clostridium、Anaerostipes、Vibrio、Flavonifractor、Holdemanella和Hungatella仅在中期病变中发生显著改变。
血清代谢组学发现,在中期病变阶段,胆素、甘油酯和核苷水平最高,而胆汁酸和氨基酸水平最低。
食管癌
食管癌是目前全球最常见的恶性肿瘤之一,发病率位居第九位。食管癌可分为两种主要病理亚型:食管鳞状细胞癌(ESCC)和食管腺癌(EAC)。
一项双样本孟德尔随机化研究显示,在食管腺癌 (EAC) 的情况下,Flavonifractor表现出正相关性。
慢性心力衰竭合并心房颤动
小型研究显示,慢性心力衰竭合并心房颤动患者肠道菌群显著富集在Flavonifractor属(p=0.003,FDR p adj =0.12)和 L-赖氨酸生物合成途径(p=0.04,FDR p adj =0.26),而Alistipes属(p=0.02,FDR p adj =0.29)和淀粉降解(p=0.02,FDR p adj =0.26)和糖酵解(p=0.03,FDR p adj =0.26)途径,相对缺乏。
慢性肾病
根特大学医院招募的 110 名非慢性肾病和慢性肾病患者,Flavonifractor属在慢性肾病个体中的水平高于非慢性肾病个体。
泌尿道结石
泌尿道结石可引起一系列并发症,如尿路阻塞、感染、不适以及对肾脏的潜在不可逆损害。
一项双向双样本孟德尔随机化研究显示,Flavonifractor 属丰度增加(IVW OR = 0.69,95%CI 0.53-0.91,P = 8.57 × 10-3)与尿路结石形成风险降低之间存在因果关系。
肌肉减少症
肌肉减少症是一种与年龄相关的全身性骨骼肌疾病,其特征是肌肉质量损失和肌肉功能下降,它会增加跌倒、骨折、残疾等有害后果的风险。与 正常骨骼肌质量组相比,低骨骼肌质量组中的Flavonifractor属大幅增加。
酒渣鼻(红斑痤疮)
一项横断面对照试点研究显示,与年龄和性别匹配的对照者相比,红斑痤疮中的Flavonifractor plautii显著增加(coef. 0.011,p = 0.037)。
注:被认定为诱发红斑痤疮的食物比有益食物多。主观上认为酒精是主要的饮食诱因,其次是香料、精制糖、油炸/油腻食物、热食、咖啡、乳制品、肉类和糖替代品。而蔬菜、水果、鱼、益生菌、茶、全麦和豆类被认为是最有利的。
典型菌种 Flavonifractor plautii
Flavonifractor plautii,是人类肠道微生物中一种常见的专性厌氧菌,通常黏附在肠壁上,在粪便中可提取得到。这个细菌还有一个超能力,它可以「吃掉」红细胞的 A 抗原。
Flavonifractor plautii可以通过裂解类黄酮分子的 C 环来降解类黄酮。黄酮类化合物是人类饮食的重要成分,主要由具有广谱药理活性的多酚类次级代谢产物组成。从流行病学、临床前和临床研究中积累的证据支持这些多酚在预防癌症、心血管疾病、2 型糖尿病和认知功能障碍方面的作用。
Flavonifractor plautii 改善动脉硬化程度
人类粪便宏基因组测序显示,在正常对照组中,F. plautii丰度显著较高,并在微生物群落中处于中心地位,而在动脉僵硬度升高的受试者中,F. plautii缺失。此外,血压只部分介导了F. plautii对降低动脉僵硬度的影响。
正常对照组的微生物组表现出增强的糖酵解和多糖降解能力,而动脉僵硬度增加的受试者的微生物组则以脂肪酸和芳香族氨基酸的生物合成增加为特征。
整合代谢组学分析进一步表明,顺式乌头酸的增加是F. plautii对动脉硬化保护作用的主要效应物,通过抑制基质金属蛋白酶-2的激活,维持弹性纤维网络,缓解动脉功能障碍。
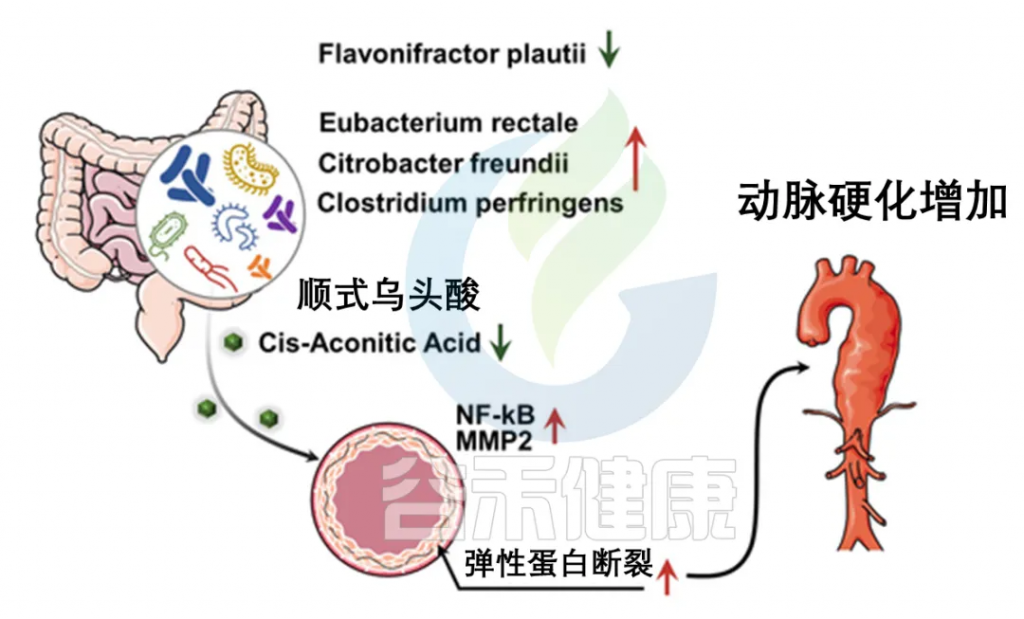
doi.org/10.1161/CIRCRESAHA.122.321975
如何调节
★ 增加
一项随机、单盲、平行组、安慰剂对照研究显示,红茶摄入增加了肠道中Flavonifractor plautii的数量,尤其是在基线水平较低的个体中。
一项交叉研究显示,乳制品摄入会改变高胰岛素血症个体的肠道微生物群组成,其中Faecalibacteria(p = 0.05)和Flavonifractor(p = 0.06)丰度增加,Flavonifractor的丰度变化与HOMA-IR的变化呈负相关。
注:HOMA-IR为胰岛素抵抗的稳态模型评估
在一项小鼠实验中,帕金森患者在7天的利福昔明治疗在治疗6个月后导致Flavonifractor的相对丰度增加,血浆促炎细胞因子水平的变化与基线血浆白细胞介素-1α水平呈负相关。
膳食纤维改善了结肠炎引起的肠道微生物种类减少问题。其中可溶性膳食纤维的效果更明显:大豆壳膳食纤维通过调节肠道菌群和抑制TLR-4/NF-κB信号通路来缓解BALB/C小鼠的炎症,在属水平上Barnesiella、乳杆菌、瘤胃球菌、Flavonifractor的相对丰度都比正常对照组更高。
在结肠癌模型中,小蘖碱治疗改善了隐窝的发育不良和粘膜中的腺瘤增生,并减少了结肠癌的发生。此外,小蘖碱治疗后放线菌门、疣微菌门、双歧杆菌、Barnesiella和Odoribacter的相对丰度减少,而Alloprevotella、Flavonifractor、 Oscillibacter和副拟杆菌的相对丰度增加。
★ 减少
一项研究显示,灰树花杂多糖在喂食高脂饮食的大鼠中改善非酒精性脂肪肝的能力。与高脂饮食组相比,补充灰树花杂多糖组的大鼠肠道菌群中Flavonifractor显著降低。
一项多中心、随机、双盲、安慰剂对照临床试验的结果显示,与安慰剂相比,乳香树提取物治疗后,非酒精性脂肪肝患者Flavonifractor相对丰度较低。
贝特类药物治疗后,非酒精性脂肪肝患者肠道菌群中的Flavonifractor下降。
注:关于非酒精性脂肪肝患者黄酮类化合物特征的数据是矛盾的,与健康人相比,其水平要么增加,要么减少。
一项针对复发性尿路感染女性的安慰剂对照研究,长期每日食用蔓越莓,研究组之间检测到的唯一显著差异是Flavonifractor属 OTU41,与安慰剂消费者相比,蔓越莓消费者的OTU41相对丰度显著降低。
注:有研究表明,24 周内每天饮用蔓越莓饮料的复发性复发性尿路感染患者中,复发性尿路感染症状减少了 39%。
一项随机对照实验显示,食用油炸肉的受试者的IGI值(胰岛素生成指数)低于对照组,但胰岛素和脂多糖、TNF-α、IL-10和IL-1β水平的MIRI(肌肉胰岛素抵抗指数 )和AUC值较高(P < 0.05)。油炸肉摄入降低了Lachnospiraceae、Flavonifractor,增加了Dialister、Dorea 、Veillonella丰度 (FDR <0.05)。油炸肉类的摄入会影响肠道菌群和微生物宿主共代谢物,从而损害血糖稳态并增加肠道内毒素和全身炎症水平。
注:该研究中共 117 名超重成年人被随机分为两组。59 名参与者每周提供四次煎炸肉类,58 名参与者被限制食用煎炸肉类。
一项随机临床试验比较低FODMAP黑麦面包与普通黑麦面包对肠易激综合征患者肠道菌群的影响,结果显示食用低FODMAP黑麦面包减少了拟杆菌、Flavonifractor、Holdemania、Parasutterella和克雷伯菌的丰度,并显示出双歧杆菌增加的趋势。Flavonifractor利用γ-氨基丁酸(GABA)作为生长基质,因此该菌过多的话可能减少肠道中的GABA含量。由于GABA在肠道中具有多种调节作用,包括减少通便时间和缓解疼痛,增加谷物纤维摄入会减少IBS患者体内“食GABA”菌Flavonifractor的数量。通过饮食调整减少Flavonifractor丰度并增加双歧杆菌丰度可能有助于缓解IBS患者的腹痛或加速通便时间。
注:在患有功能性胃肠道疾病的自闭症儿童的直肠黏膜中发现了较高水平的Flavonifractor,尤其是那些报告有腹痛的儿童。Flavonifractor的数量与组织活检样本中的5-羟色胺水平呈线性相关。在抑郁成年人的粪便中也检测到了较高水平的Flavonifractor。这些都加强了进一步研究的理由,以阐明Flavonifractor、肠道疼痛和情绪障碍之间的联系。
主要参考文献:
Wang J, Guo R, Ma W, Dong X, Yan S, Xie W. Eggerthella lenta Bacteremia in a Middle-Aged Healthy Man with Acute Hepatic Abscess: Case Report and Literature Review, 1970-2020. Infect Drug Resist. 2021 Aug 19;14:3307-3318.
Wong D, Aoki F, Rubinstein E. Bacteremia caused by Eggerthella lenta in an elderly man with a gastrointestinal malignancy: A case report. Can J Infect Dis Med Microbiol. 2014 Sep;25(5):e85-6.
James A S, Chaudhari D S, Jain S, et al. Specific Microbiome Signature Dynamics Could Predict Aging Continuum and Cognitive Impairment in Older Adults[J]. Physiology, 2024, 39(S1): 1991.
Hu, X., Du, J., Xie, Y. et al. Fecal microbiota characteristics of Chinese patients with primary IgA nephropathy: a cross-sectional study. BMC Nephrol 21, 97 (2020)
Vázquez-Martínez ER, García-Gómez E, Camacho-Arroyo I, González-Pedrajo B. Sexual dimorphism in bacterial infections. Biol Sex Differ. 2018;9(1):27.
Cho G.-S., Ritzmann F., Eckstein M., Huch M., Briviba K., Behsnilian D., Neve H., Franz C.M.A.P. Quantification of Slackia and Eggerthella spp. in human feces and adhesion of representatives strains to Caco-2 cells. Front. Microbiol. 2016;7:658.
Haiser H.J., Seim K.L., Balskus E.P., Turnbaugh P.J. Mechanistic insight into digoxin inactivation by Eggerthella lenta augments our understanding of its pharmacokinetics. Gut Microbes. 2014;5:233–238.
Yu H, Wan X, Yang M, Xie J, Xu K, Wang J, Wang G, Xu P. A large-scale causal analysis of gut microbiota and delirium: A Mendelian randomization study. J Affect Disord. 2023 May 15;329:64-71.
Gupta RS, Chen WJ, Adeolu M, Chai Y. Molecular signatures for the class Coriobacteriia and its different clades; proposal for division of the class Coriobacteriia into the emended order Coriobacteriales, containing the emended family Coriobacteriaceae and Atopobiaceae fam. nov., and Eggerthellales ord. nov., containing the family Eggerthellaceae fam. nov. Int J Syst Evol Microbiol. 2013 Sep;63(Pt 9):3379-3397.
Korpela, K., Salonen, A., Virta, L. et al. Intestinal microbiome is related to lifetime antibiotic use in Finnish pre-school children. Nat Commun 7, 10410 (2016).
Koppel N., Bisanz J.E., Pandelia M.-E., Turnbaugh P.J., Balskus E.P. Discovery and characterization of a prevalent human gut bacterial enzyme sufficient for the inactivation of a family of plant toxins. eLife. 2018;7:e33953.
Dong X, Zhang J, Li W, et al. Yi-Shen-Hua-Shi regulates intestinal microbiota dysbiosis and protects against proteinuria in patients with chronic kidney disease: a randomized controlled study[J]. Pharmaceutical Biology, 2024, 62(1): 356-366.
Ponziani FR, Picca A, et al., GuLiver study group. Characterization of the gut-liver-muscle axis in cirrhotic patients with sarcopenia. Liver Int. 2021 Jun;41(6):1320-1334.
Park, Y.E.; Kim, M.S.; Shim, K.W.; Kim, Y.-I.; Chu, J.; Kim, B.-K.; Choi, I.S.; Kim, J.Y. Effects of Lactobacillus plantarum Q180 on Postprandial Lipid Levels and Intestinal Environment: A Double-Blind, Randomized, Placebo-Controlled, Parallel Trial. Nutrients 2020, 12, 255
Yang, L., Wu, Y., Zhao, X. et al. An In Vitro Evaluation of the Effect of Bifidobacterium longum L556 on Microbiota Composition and Metabolic Properties in Patients with Coronary Heart Disease (CHD). Probiotics & Antimicro. Prot. (2024).
Claus S.P., Ellero S.L., Berger B., Krause L., Bruttin A., Molina J., Paris A., Want E.J., de Waziers I., Cloarec O., et al. Colonization-induced host-gut microbial metabolic interaction. mBio. 2011;2:e00271-10.
Bode L.M., Bunzel D., Huch M., Cho G.-S., Ruhland D., Bunzel M., Bub A., Franz C.M.A.P., Kulling S.E. In vivo and in vitro metabolism of trans-resveratrol by human gut microbiota. Am. J. Clin. Nutr. 2013;97:295–309.
Kawada Y., Goshima T., Sawamura R., Yokoyama S., Yanase E., Niwa T., Ebihara A., Inagaki M., Yamaguchi K., Kuwata K., et al. Daidzein reductase of Eggerthella sp. YY7918, its octameric subunit structure containing FMN/FAD/4Fe-4S, and its enantioselective production of R-dihydroisoflavones. J. Biosci. Bioeng. 2018;126:301–309.
Gardiner B.J., Tai A.Y., Kotsanas D., Francis M.J., Roberts S.A., Ballard S.A., Junckerstorff R.K., Korman T.M. Clinical and microbiological characteristics of Eggerthella lenta bacteremia. J. Clin. Microbiol. 2015;53:626–635.
Ugarte-Torres A., Gillrie M.R., Griener T.P., Church D.L. Eggerthella lenta bloodstream infections are associated with increased mortality following empiric piperacillin-tazobactam (TZP) Monotherapy: A Population-based Cohort Study. Clin. Infect. Dis. 2018;67:221–228.
Koh A., Molinaro A., Ståhlman M., Khan M.T., Schmidt C., Mannerås-Holm L., Wu H., Carreras A., Jeong H., Olofsson L.E., et al. Microbially produced imidazole propionate impairs insulin signaling through mTORC1. Cell. 2018;175:947.e17–961.e17.
Luo S, Zhao Y, Zhu S, Liu L, Cheng K, Ye B, Han Y, Fan J, Xia M. Flavonifractor plautii Protects Against Elevated Arterial Stiffness. Circ Res. 2023 Jan 20;132(2):167-181.
Karpat I, Karolyi M, Pawelka E, Seitz T, Thaller F, Wenisch C. Flavonifractor plautii bloodstream infection in an asplenic patient with infectious colitis. Wien Klin Wochenschr. 2021 Jul;133(13-14):724-726.
Pan Y, Su J, Liu S, Li Y, Xu G. Causal effects of gut microbiota on the risk of urinary tract stones: A bidirectional two-sample mendelian randomization study. Heliyon. 2024 Feb 14;10(4):e25704.
Amerikanou C, Kanoni S, Kaliora AC, Barone A, Bjelan M, D’Auria G, Gioxari A, Gosalbes MJ, Mouchti S, Stathopoulou MG, Soriano B, Stojanoski S, Banerjee R et al., Effect of Mastiha supplementation on NAFLD: The MAST4HEALTH Randomised, Controlled Trial. Mol Nutr Food Res. 2021 May;65(10):e2001178.
Coello K, Hansen TH, Sørensen N, Ottesen NM, Miskowiak KW, Pedersen O, Kessing LV, Vinberg M. Affective disorders impact prevalence of Flavonifractor and abundance of Christensenellaceae in gut microbiota. Prog Neuropsychopharmacol Biol Psychiatry. 2021 Aug 30;110:110300.
Mehrotra, I, Snyder, M, Mamic, P. CHARACTERIZING THE GUT MICROBIOTA AND THEIR INTERACTIONS WITH THE HOST IN THE CHRONIC HEART FAILURE-ASSOCIATED ATRIAL FIBRILLATION. J Am Coll Cardiol. 2024 Apr, 83 (13_Supplement) 1033.
Stokholm J, Blaser MJ, Thorsen J, Rasmussen MA, Waage J, Vinding RK, Schoos AM, Kunøe A, Fink NR, Chawes BL, Bønnelykke K, Brejnrod AD, Mortensen MS, Al-Soud WA, Sørensen SJ, Bisgaard H. Maturation of the gut microbiome and risk of asthma in childhood. Nat Commun. 2018 Jan 10;9(1):141.
Wang, L., Zheng, Yb., Yin, S. et al. Causal relationship between gut microbiota and prostate cancer contributes to the gut-prostate axis: insights from a Mendelian randomization study. Discov Onc 15, 58 (2024).
Jian Gao, Xiaoyu Guo, et al., The Association of Fried Meat Consumption With the Gut Microbiota and Fecal Metabolites and Its Impact on Glucose Homoeostasis, Intestinal Endotoxin Levels, and Systemic Inflammation: A Randomized Controlled-Feeding Trial. Diabetes Care 1 September 2021; 44 (9): 1970–1979.
Mavrogeorgis, E.; Valkenburg, S.; Siwy, J.; Latosinska, A.; Glorieux, G.; Mischak, H.; Jankowski, J. Integration of Urinary Peptidome and Fecal Microbiome to Explore Patient Clustering in Chronic Kidney Disease. Proteomes 2024, 12, 11.
Hong, C.-T.; Chan, L.; Chen, K.-Y.; Lee, H.-H.; Huang, L.-K.; Yang, Y.-C.S.H.; Liu, Y.-R.; Hu, C.-J. Rifaximin Modifies Gut Microbiota and Attenuates Inflammation in Parkinson’s Disease: Preclinical and Clinical Studies. Cells 2022, 11, 3468.
Yang L, Lin Q, Han L, et al. Soy hull dietary fiber alleviates inflammation in BALB/C mice by modulating the gut microbiota and suppressing the TLR-4/NF-κB signaling pathway[J]. Food & function, 2020, 11(7): 5965-5975.
Tomioka R, Tanaka Y, Suzuki M, et al. The Effects of Black Tea Consumption on Intestinal Microflora—A Randomized Single-Blind Parallel-Group, Placebo-Controlled Study[J]. Journal of Nutritional Science and Vitaminology, 2023, 69(5): 326-339.
Cheng H, Liu J, Tan Y, Feng W, Peng C. Interactions between gut microbiota and berberine, a necessary procedure to understand the mechanisms of berberine. J Pharm Anal. 2022 Aug;12(4):541-555.
He, L., Liu, Y., Guo, Y. et al. Diversity of intestinal bacterial lactase gene in antibiotics-induced diarrhea mice treated with Chinese herbs compound Qi Wei Bai Zhu San. 3 Biotech 8, 4 (2018)
Straub, T.J., Chou, WC., Manson, A.L. et al. Limited effects of long-term daily cranberry consumption on the gut microbiome in a placebo-controlled study of women with recurrent urinary tract infections. BMC Microbiol 21, 53 (2021).
Laatikainen, R., Jalanka, J., Loponen, J. et al. Randomised clinical trial: effect of low-FODMAP rye bread versus regular rye bread on the intestinal microbiota of irritable bowel syndrome patients: association with individual symptom variation. BMC Nutr 5, 12 (2019).
Xu YJ, He Y, Chen C, Shi J, He M, Liu Y, Zhang Y, Liu Y, Zhang Y. Multiomics Analysis Revealed Colorectal Cancer Pathogenesis. J Proteome Res. 2024 Apr 18.