-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

自闭症谱系障碍 (ASD) 是一组神经发育疾病,其特征是社交互动和沟通的质量障碍、兴趣受限以及重复和刻板行为。
环境因素在自闭症中发挥重要作用,多项研究以及谷禾队列研究文章表明肠道微生物对于自闭症的发生和发展以及存在明显的菌群和代谢物的生物标志物。
doi: 10.1136/gutjnl-2021-325115.
尽管环境因素在自闭症中发挥重要作用,但几乎没有确凿的证据将饮食与疾病的发生和进展联系起来。然而,最近关于饮食如何塑造肠道-大脑轴的研究可能会为环境对疾病机制的影响提供新的见解,并提出至少通过饮食改善某些自闭症谱系障碍症状的可能性。
此外,在谷禾检测实践过程中,也发现部分自闭症儿童的消化功能,以及饮食营养存在问题,主要集中表现为挑食,消化不良等。
doi: 10.1136/gutjnl-2021-325115.
本文参考以往相关研究性文章,详细讨论饮食和肠道微生物群-肠-脑轴如何影响自闭症,主要概述肠道微生物群对分子代谢(各类氨基酸、γ-氨基丁酸、不饱和脂肪酸、短链脂肪酸、胆固醇、丁酸盐、乙酸盐、N-乙酰天冬氨酸、多酚等)和与自闭症发病和进展相关的酶(二糖酶、己糖转运蛋白和单羧酸转运蛋白等)。还回顾了饮食模式、益生菌和肠道微生物群在大脑发育中的作用及与自闭症的关联,这些都为自闭症的干预策略提供了重要的理论支持。
自闭症谱系障碍 (ASD) 是一组神经发育疾病,一般在 3 岁之前发病,其特征是社交互动和沟通的质量障碍、兴趣受限以及重复和刻板行为。
直到几十年前,自闭症谱系障碍还被认为相当罕见,但自 20 世纪 80 年代以来,全世界自闭症谱系障碍快速增加,这给自闭症谱系障碍患者的家庭和整个社会带来了重大的后果。
目前在临床上自闭症谱系障碍的诊断仍然是根据行为来定义的,通过详细的发展史、父母对孩子日常行为的描述以及对孩子的社交互动方式以及沟通和智力功能的直接评估。
一个重要问题让人对自闭症表型发病机制的理解变得更加复杂,简而言之,自闭症谱系障碍的发病和表现远非同质:
此外,除了核心症状之外,这些儿童通常还表现出一系列其他相关特征,例如:
doi: 10.1136/gutjnl-2021-325115.
饮 食
人体必需氨基酸必须由食物供给,喂养可能代表环境因素和神经生物学因素之间的桥梁,因此可能在导致疾病表型的途径中发挥作用。从临床经验和文献中都知道,自闭症儿童往往与喂养和饮食态度有特殊的关系。
部分自闭症儿童可能有进食困难及胃肠道症状,对食物的味道和颜色非常挑剔。因此,自闭症儿童必需氨基酸 (赖氨酸、色氨酸、苯丙氨酸、组氨酸) 减少,可能部分是由于食物摄入不足或饮食习惯不良所致。
非常有限的饮食可能会使任何儿童面临营养缺乏和发育不良的风险,包括大脑发育。
遗 传
强有力的证据支持遗传因素对自闭症和相关疾病的疾病风险有影响。
然而,与自闭症风险有关的许多不同基因编码参与各种生理过程的各种不同蛋白质,包括大脑发育和功能、神经递质受体或转运蛋白、细胞粘附/屏障功能蛋白、免疫相关蛋白、参与胆固醇代谢或运输的蛋白质,以及影响线粒体功能的蛋白质。
近期,发表在《Cell》的一项研究对一个出生队列进行了 20多年的跟踪,详细的早期纵向问卷记录了感染和抗生素事件、压力、产前因素、家族史等饮食,在随访的 16,440 名瑞典儿童中,1,197 名患上神经发育障碍。下面一些有关自闭症风险的研究数据出自该文章:
家族病史
环 境
并非所有携带这些特定突变的个体都会患自闭症谱系障碍。最近的一项同卵双胞胎研究强调,环境因素可能解释了他们患自闭症谱系障碍相对风险的 55%,环境因素为自闭症谱系障碍型症状的出现提供了选择性压力,这些症状从各种不同的症状中出现。各种易诱发的遗传异常,结合起来会引起明显的疾病。
重大生活事件
化学物质暴露
早期感染和抗生素
儿童早期(出生至 5 岁)感染与自闭症风险增加显著相关,最显著的是第一年内中耳炎和反复湿疹。
微生物组
胃肠道症状长期以来表明,肠道和大脑之间存在着紧密联系,即”肠-脑轴”。
——胃肠道问题
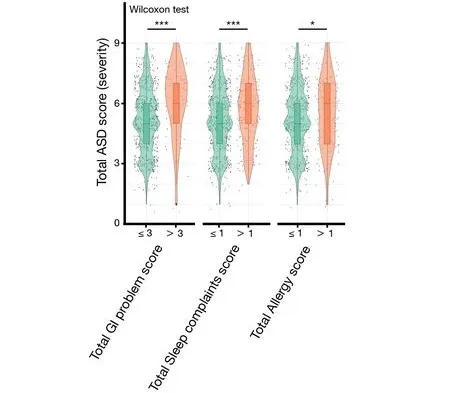
在未来患有神经发育障碍的儿童中,早期胃肠道问题明显,情绪问题程度较轻。
——肠道菌群
肠道细菌可能在自闭症病理生理学中发挥一定作用。事实上,各种研究表明肠道微生物群在自闭症中发生了改变, 尽管文献中对于参与其中可能发挥作用的细菌几乎没有达成一致。
肠道细菌及其代谢产物不仅影响肠道功能和饱腹感,还可能与情绪、认知、行为、抑郁以及大脑发育等方面有关。
饮食在塑造哺乳动物代谢通量(包括神经化学物质的通量)以及塑造肠道微生物群及其活动方面具有重要作用。
例如,纤维和益生元尤其支持有益的糖分解肠道微生物群,其特征是双歧杆菌和乳酸菌的相对丰度增加以及短链脂肪酸 (SCFA) 的产生。来自水果、谷物和蔬菜等全植物食品的多酚也会影响肠道微生物群组成、免疫功能,充当抗氧化剂,防止大脑炎症并改善血脑屏障 (BBB) 功能。
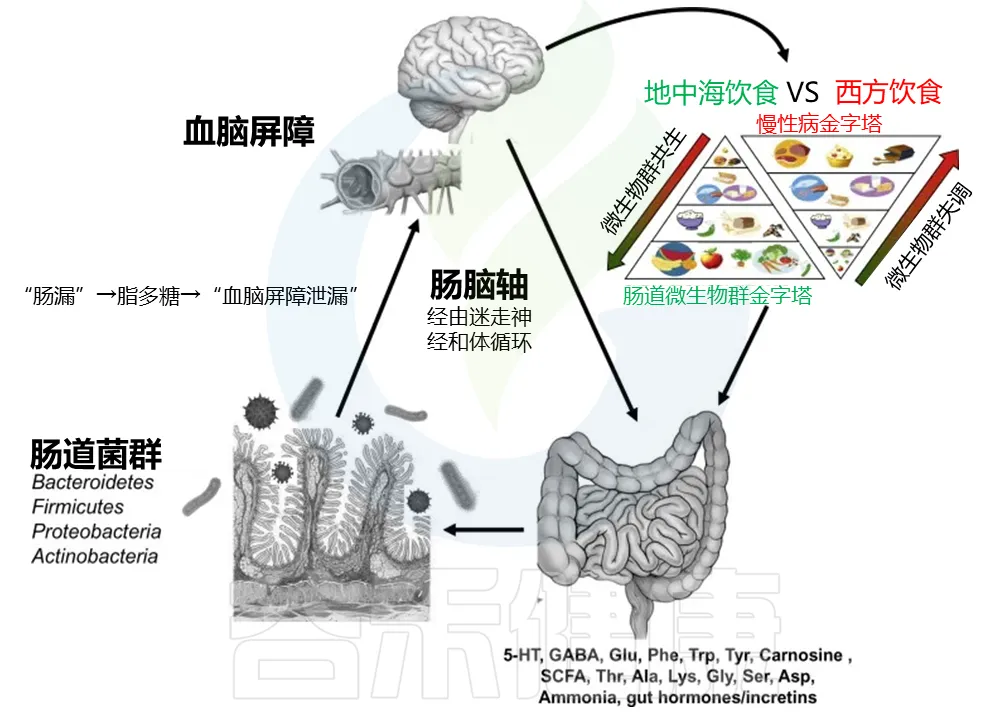
Kieran M. Tuohy, et al.,Diet and the Gut Microbiota,2015,225-245
接下来我们着重就微生物组这方面,详细探讨肠道微生物群如何在自闭症的发展中起作用,以及相关的最新研究进展。
肠-脑轴作为外部环境与人类大脑之间的沟通通路,在体内有重要的“内部”通道——人类肠道微生物群。许多营养物质和摄入的化学物质必须经过这些通道,转化为生物可利用和活跃的中间产物,然后通过肝门静脉被吸收并在全身分布。
许多对大脑重要的化学物质也由肠道微生物群在肠道中产生,包括色氨酸、多巴胺、血清素、GABA、β-羟基丁酸、胆碱、牛磺酸、乙酸盐、琥珀酸、乳酸、乙酰辅酶A、肌酐、甜菜碱、谷氨酸、谷氨酰胺、对甲酚、反式吲哚丙烯酸甘氨、脂肪酸和马尿酸。
一些其他化学物质可能由细菌(例如在消化和发酵过程中)调节,或者是细菌成分,如革兰氏阴性细菌细胞壁的组成部分脂多糖(LPS),它可剂量依赖性地减少人类肠道细胞对血清素的吸收,并在外周和大脑引发炎症,影响大脑功能。
神经递质:GABA、血清素
最近有研究表明,神经递质GABA在自闭症谱系障碍神经元发育中可能起作用,尤其是考虑到它在婴儿期从神经递质兴奋剂到抑制剂的转变。
另一种神经递质,血清素(5-羟色胺,5-HT),也被怀疑在自闭症中起作用。自闭症患者的血液中,血清素和 GABA 水平均发生了变化。有趣的是,这两种神经递质都是由氨基酸代谢产生的,分别是色氨酸和谷氨酸。
肠道代谢物是否直接影响大脑的神经发育?
取决于它们是否能够穿过血脑屏障(BBB)。
比如说,肠道细菌可以产生GABA,这个 GABA 可能会影响到肠道神经系统的工作,或者改变血液中 GABA 的含量。但是,在正常健康的情况下,肠道产生的 GABA 是不能直接穿过”血脑屏障”进入大脑的。
反之,乙酸盐作为肠道微生物群发酵碳水化合物的主要终产物和哺乳动物细胞胆固醇生物合成的底物,可以迅速通过血脑屏障。
然而,血脑屏障可能会因氧化或炎症压力等原因受到损伤,与胃肠道屏障类似出现“漏”,允许不需要的化学物质进入大脑。在自闭症患者中血脑屏障受到损伤。
为什么说肠道菌群可用于区分自闭症与非自闭症?
研究表明,肠道微生物群在影响自闭症谱系障碍(ASD)代谢产物谱和生理参数的过程中起着重要作用。
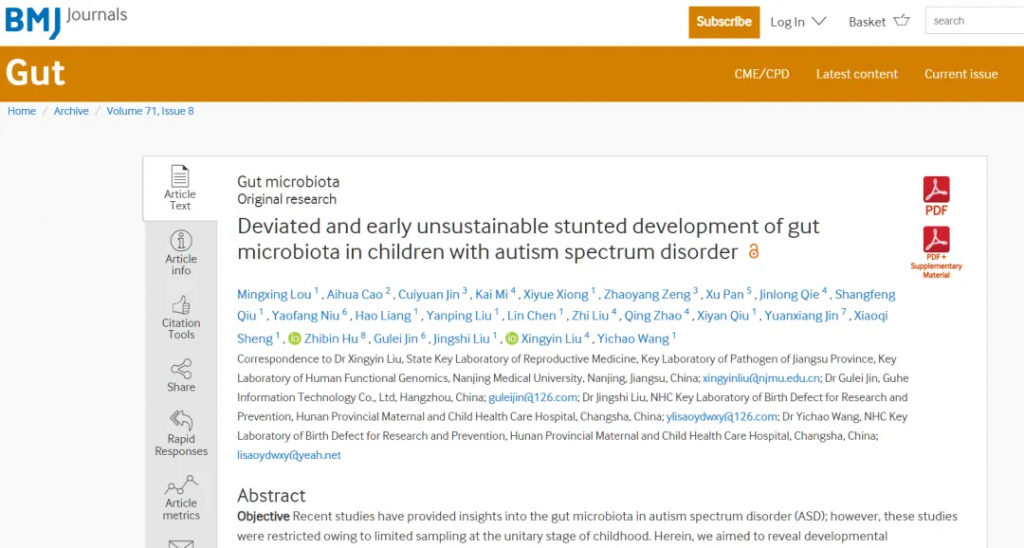
首先,自闭症患者的肠道微生物群与健康对照组或非自闭症的兄弟姐妹有显著差异,显示出异常的肠道微生物组成和活动是自闭症的一个特征。
研究报告显示,自闭症群体与非自闭症对照组之间在拟杆菌门、厚壁菌门、变形菌门和放线菌门的组成上存在差异。
前面提到的发表在《Cell》大队列的自闭症儿童研究,在 11.9 ± 2.9 个月时采集了 1,748 名婴儿的粪便样本,将所有可用的对照与未来的神经发育障碍进行比较,然后匹配风险因素和微生物组多样性混杂因素。
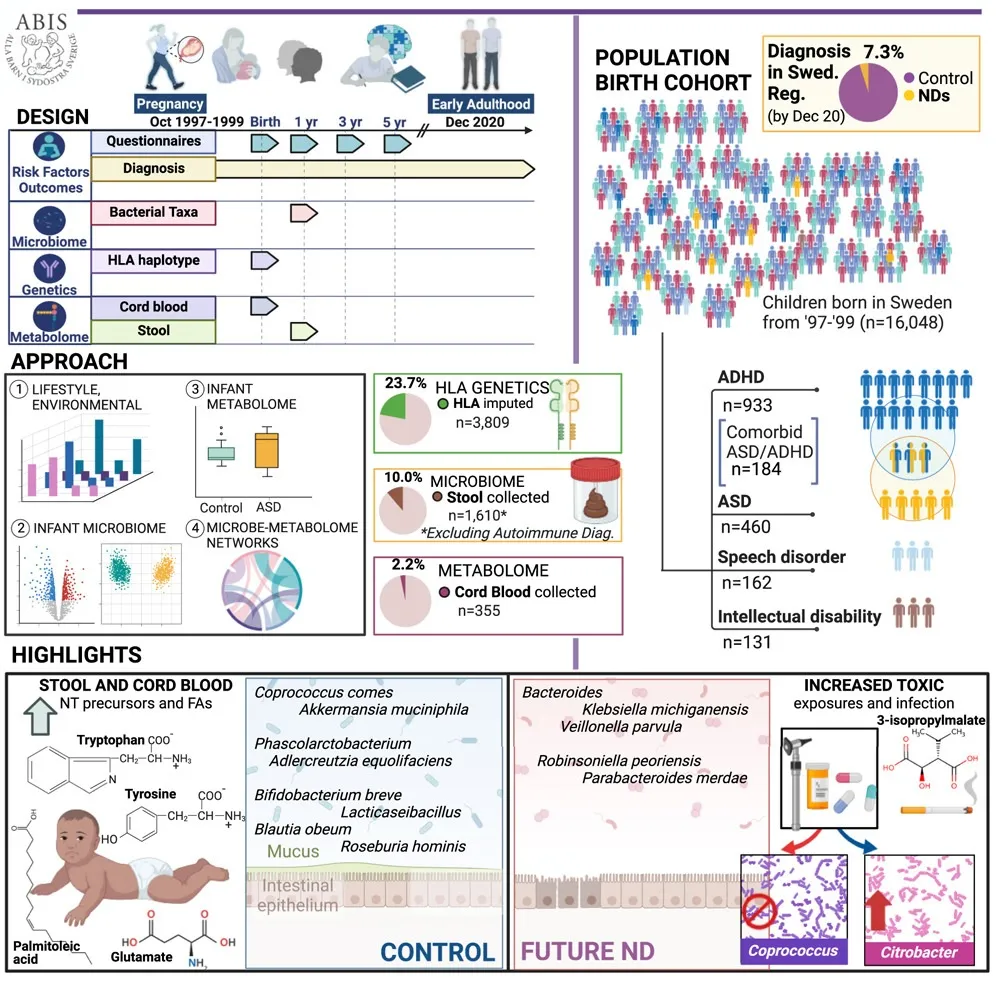
doi.org/10.1016/j.cell.2024.02.035
在未来的神经发育障碍中,下列菌群丰度较高:
在我们的GUT队列里,也发现自闭症儿童这个菌的Veillonella显著富集。
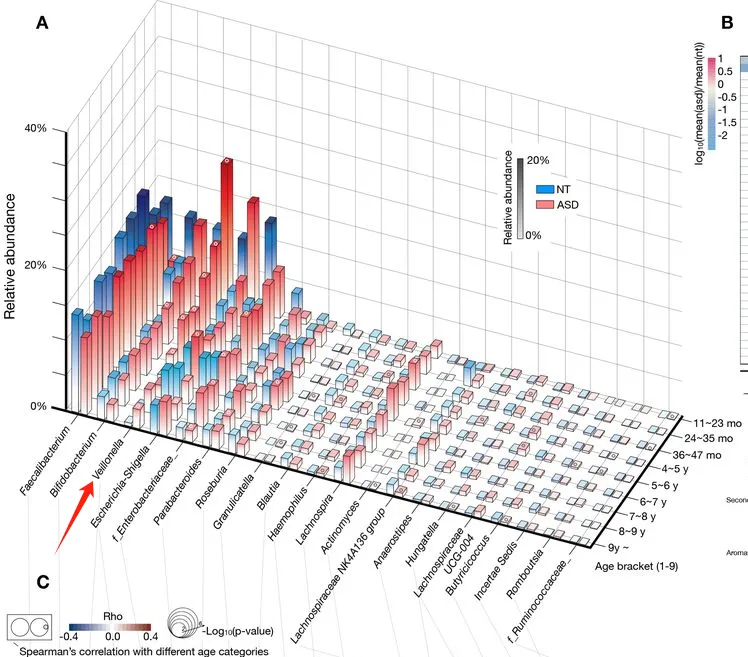
doi: 10.1136/gutjnl-2021-325115.
注:Veillonella是一种革兰氏阴性的厌氧球菌,正常情况下通常存在于人体口腔和胃肠道中。该菌以其乳酸发酵能力而闻名,能代谢乳酸产生丙酸、CO2和H2。
下列菌群始终较少富集:
这些菌属具有抗炎、维护肠道屏障、产生短链脂肪酸等有益作用,其减少可能导致肠道功能紊乱和免疫失调。
Akkermansia muciniphila在后来被诊断患有自闭症或自闭症-多动症合并的婴儿中不存在,并且与儿童早期的胃肠道和情绪症状呈负相关。
Akkermansia muciniphila促进粘蛋白并产生叶酸,丙酸和乙酸;以增强肠细胞单层完整性和强化受损的肠道屏障而闻名;并具有免疫调节特性。
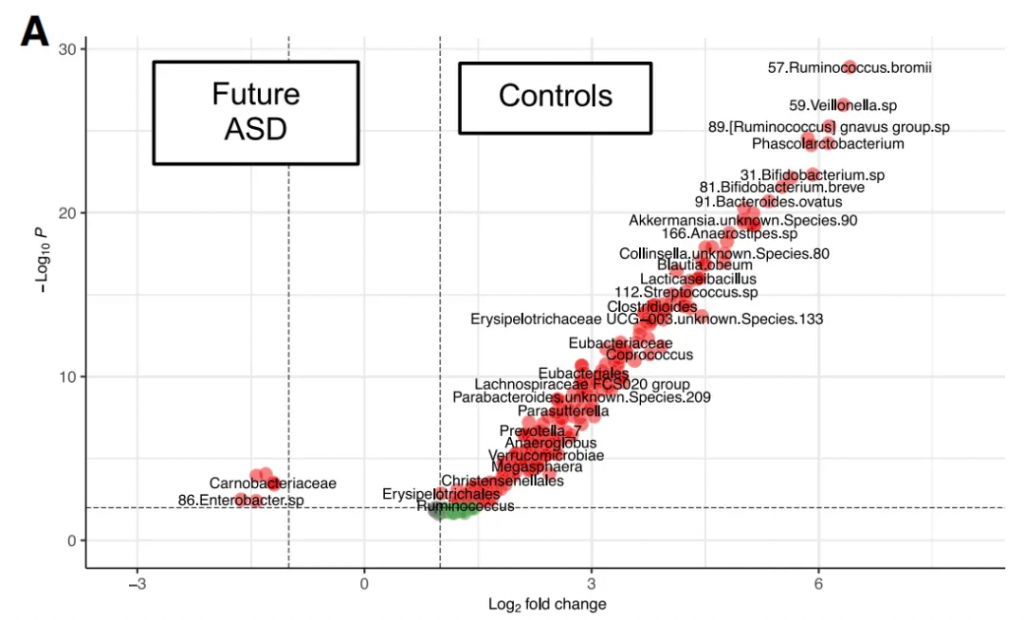
doi.org/10.1016/j.cell.2024.02.035
特定菌群:
与对照组(21.7%)相比,两种Klebsiella michiganensis菌株(HCXXMCOL0180 和 HCXXMCOL0513)在自闭症儿童中更普遍(43.6%),携带这两种菌株的婴儿日后患自闭症的风险更高。
携带这两种菌株的对照组婴儿抗生素使用频率更高(27.1%),提示抗生素暴露可能促进了这些菌株的定植。
性别和诊断年龄影响:
菌群自闭症男童的肠道菌群组成可能因诊断年龄不同而异,如晚期诊断与Akkermansia muciniphila丰度增加相关,而这种模式在女童中并不明显,女童中一些Bacteroides菌株丰度升高。
而早期诊断男童,Enterobacteriaceae科一些菌属如Enterobacter、 Klebsiella丰度升高。
这提示自闭症的肠道菌群变化可能具有性别特异性,且随年龄和病程进展而动态变化。
代谢物异常与菌群相关:
粪便代谢组学分析显示,自闭症儿童的某些代谢物如酪氨酸、色氨酸(儿茶酚胺、血清素前体)、精氨酸、赖氨酸等氨基酸,亚油酸等脂肪酸以及维生素B6等水平异常。
注:关于氨基酸,脂肪酸等详细介绍与自闭症的关联详见后面章节。
精氨酸水平与Roseburia、Coprococcus、Akkermansia丰度呈正相关,提示菌群失调可能影响宿主氨基酸代谢。
色氨酸代谢产物:吲哚-3-乙酸盐(AhR激动剂)在自闭症组中升高,且与Ruminococcaceae和Lachnospiraceae科菌属丰度正相关。
其他的一些与自闭症相关菌群的研究结果:
多样性降低
一些菌群减少,包括:
一些菌群增多,包括:
下列菌群可作为3-6岁有胃肠道症状儿童自闭症的可靠生物标志物:
菌群代谢产物LPS→慢性炎症→血脑屏障损伤
研究表明,细菌脂多糖(LPS)会引发慢性低度系统性炎症或“代谢性内毒素血症”,在动物模型中,这被证明会损害包括血脑屏障(BBB)在内的屏障功能。实际上,出生期暴露于LPS引发的系统性炎症的小鼠表现出永久性的血脑屏障损伤和渗透性增加,且在青少年和成年期表现出行为改变。对自闭症患者而言,血脑屏障功能的永久性损害将只会加剧肠道微生物及异常代谢产物输出所带来的病理后果。
母亲妊娠期:LPS诱导的系统性炎症如何影响孩子神经发育,增加自闭症风险?
妊娠期由LPS诱导的系统性炎症可以改变后代的神经发育和脑功能。自闭症中的这种先天性或细胞介导的炎症反应,可能会因获得性免疫系统中明显的自身免疫成分而加剧。由系统性炎症或母体自身免疫疾病触发的自身抗体在妊娠期间产生,现在被怀疑在胎儿异常神经发育和受损的血脑屏障发展中起作用,并影响婴儿期的大脑功能,包括增加自闭症的风险。
肠道菌群失调诱导产生自身抗体,影响神经系统发育
在自闭症患者中,对叶酸、血清素和GABA受体的自身抗体水平,以及一些重要的免疫相关酶如转谷氨酰胺酶2的抗体水平也有所升高。尽管自身抗体生成的分子触发机制尚不完全了解,但有一个可能性是,对关键代谢物如神经递质受体的自身抗体可能是在血液中异常代谢物浓度、早期生活中的不当免疫教育或由肠道细菌模拟引导下由免疫系统产生的。
这样的“代谢组-炎症组”调控网络也在其他自身免疫性疾病中出现,包括1型糖尿病和炎症性肠病(IBD),并且似乎与肠道微生物群密切相关。
氨基酸代谢在神经传递相关代谢物的生物合成中扮演着重要角色,长期以来被怀疑在自闭症谱系障碍中发挥作用。
血液分析氨基酸变化
Glu:Gln比率升高
有许多研究报告称,自闭症患者的血液中谷氨酸与谷氨酰胺(Glu:Gln)的比率升高。
将谷氨酸转化为谷氨酰胺是大脑中处理氨废物的主要方式,这对于避免氨中毒和在突触中谷氨酸的过度积累以减少兴奋性毒性非常关键。因此,血液中Glu:Gln比率的升高可能表明自闭症患者大脑中的氨解毒和谷氨酸循环发自闭症生了变化,这会影响行为。
注:低纤维高蛋白饮食可能会使这种氨中毒恶化,因为这样的饮食会导致肠道中的蛋白水解微生物群发酵氨基酸,从而增加系统性氨贡献。饮食中氨基酸的微生物分解会影响哺乳动物体内氨基酸的可用性和循环,也可能产生生物活性化合物,如短链脂肪酸、支链脂肪酸和生物胺。
蛋氨酸
一项包括87项研究的自闭症氧化应激生物标志物的汇总荟萃分析发现,参与甲基化循环和硫酸盐转移途径的几种代谢物异常。
蛋氨酸在硫酸盐转移途径中利用半胱氨酸合成,该途径连接蛋氨酸和谷胱甘肽的生物合成,蛋氨酸显著降低(p < 0.001),异常甲基化会增加自闭症谱系症状的风险 。
瓜氨酸
有研究发现,自闭症儿童的瓜氨酸水平与刻板行为(ADOS-2 上的 RRB 评分)之间存在正相关,且具有统计学意义。瓜氨酸和氨的累积暴露是经典瓜氨酸血症(精氨琥珀酸合成酶缺乏症)患者认知功能较差的最可靠标志。
尿液代谢物分析氨基酸变化
色氨酸
色氨酸因与自闭症症状相关而闻名,它是血清素 (5-HT) 的前体,血清素是一种抑制性单胺类神经递质,一些研究报告色氨酸水平升高,而另一些研究报告色氨酸水平降低 。
关于色氨酸,详见我们之前的文章:
苏氨酸
有研究发现,自闭症组男孩的苏氨酸含量明显高于对照组男孩。5 岁以下自闭症儿童的尿液苏氨酸含量高于 5 岁以上儿童。苏氨酸属于天冬氨酸家族,是一种蛋白质氨基酸,其分解产生乙酰胆碱酯酶 A 和甘氨酸,促进各种生理过程和整体身体稳态 ,它也可以通过影响色氨酸进入大脑,间接影响5-羟色胺的合成。
脯氨酸
有研究发现,5 岁以下自闭症儿童的脯氨酸含量明显低于 5 岁以上儿童。
与 22q11.2 染色体缺失的 CMPT158 基因型相关的脯氨酸水平异常升高,会影响自闭症谱系症状的严重程度,尤其是影响面部情绪识别、行为和认知。
β-丙氨酸
β-丙氨酸,在肉类中常见的氨基酸,会抑制肠道细胞(如Caco-2细胞)对GABA的吸收。β-丙氨酸也可以在肠道内由白色念珠菌产生的丙酸和氨反应形成,尽管这些化合物也由肠道内的许多其他微生物产生。
HPHPA
有研究报告了一种稀有代谢物3-(3-羟基苯基)-3-羟基丙酸(HPHPA)的出现。HPHPA是梭菌属细菌特有的代谢产物,会耗尽大脑中的儿茶酚胺,导致自闭症症状。
HPHPA在患有艰难梭菌感染的个体中也有发现,并且在急性精神病发作的精神分裂症患者中甚至达到非常高的水平。
以上这些研究是基于血浆、尿液氨基酸变化,血液和尿液中的氨基酸(AA)水平受许多因素影响,包括从食物中吸收的氨基酸、氨基酸和蛋白质的降解、宿主蛋白质的分泌和在粪便中的排泄。这些氨基酸相对比例的改变也可能对它们参与的代谢途径的产物产生连锁反应,包括不同神经递质的生产或相对比例。
肠道菌群代谢分析氨基酸变化
大多数氨基酸来自饮食或由体内合成,但肠道微生物群也会影响饮食氨基酸的回收以及氨基酸的生产或分解。
目前,我们对参与氨基酸生物利用度和肠道微生物群体生物转化的微生物种类或代谢过程知之甚少,对于其对神经功能的可能影响了解更少,也不清楚不同食物和食物成分如何相互作用以调节肠道微生物群对氨基酸的摄取或代谢。
有早期体外研究显示,人类肠道微生物群对氨基酸的发酵受到低pH值和可发酵纤维/碳水化合物(抗性淀粉)存在的抑制。然而,目前不知道这种过程在体内如何转化,或在自闭症等疾病状态或抗生素治疗下如何变化。
谷禾肠道菌群健康检测数据库中有这样的案例,一起来看一下:
一名5岁自闭症男孩,检测结果,自闭症为中等风险,符合实际情况。
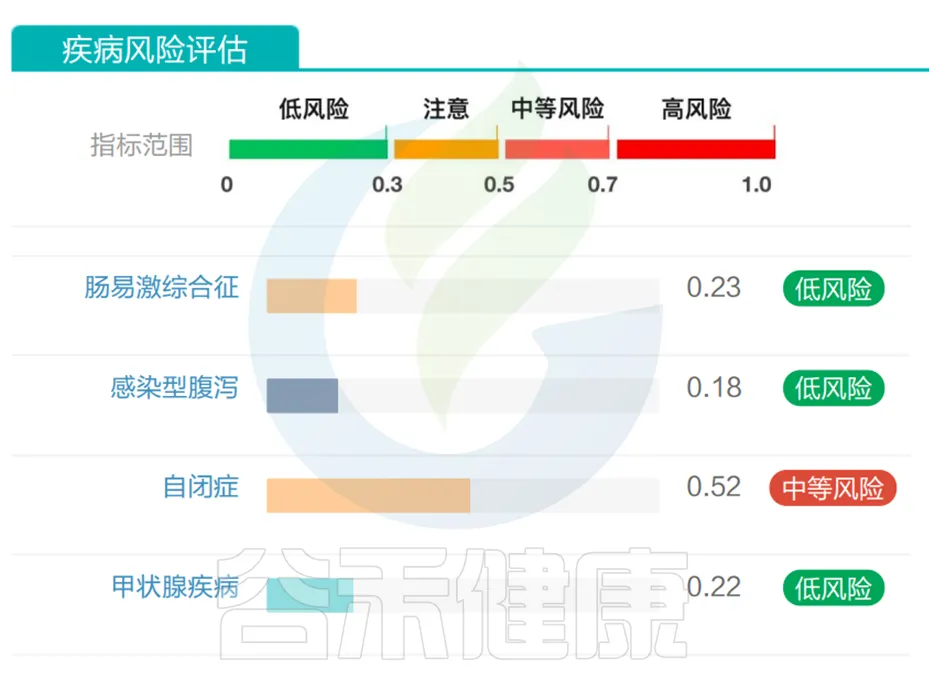
<来源:谷禾健康肠道菌群检测数据库>
这是谷禾利用几十万例的临床和人群样本数据(其中4895例自闭症患者),结合机器学习方法,使用肠道菌群数据进行疾病状态和风险的预测,并给出了的风险值。
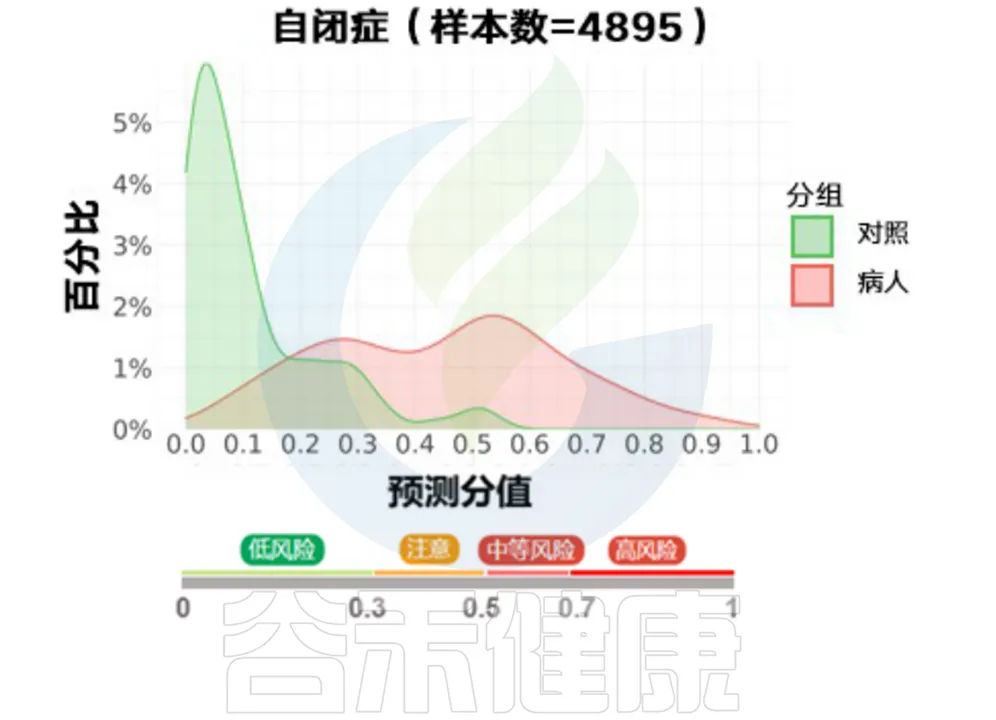
<来源:谷禾健康肠道菌群检测数据库>
从该患者肠道菌群检测报告可以看到,蛋白质,脂肪水平都相对偏低。
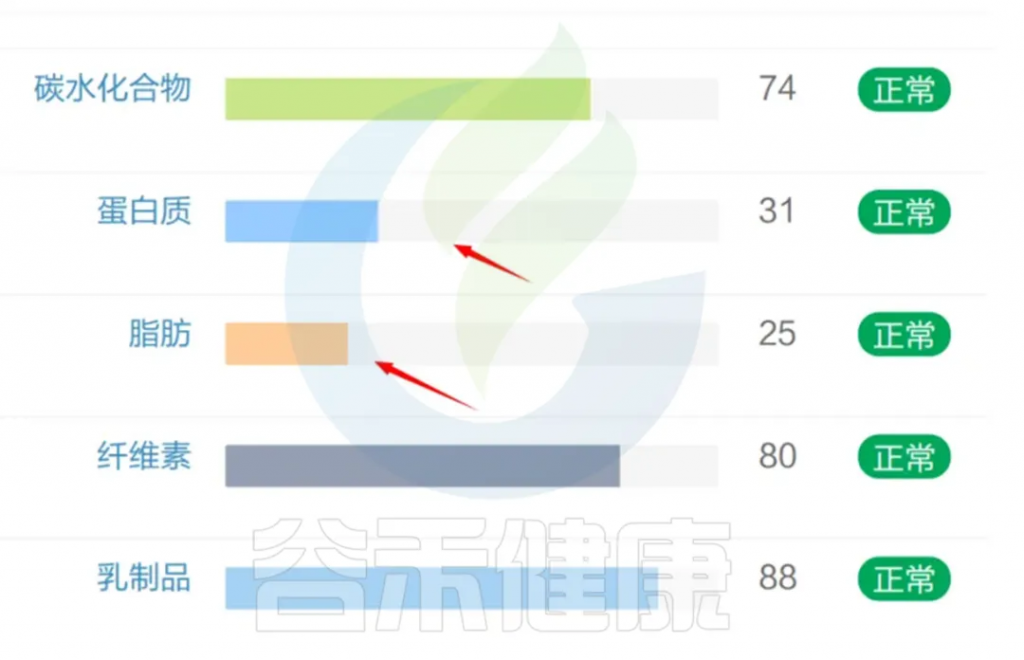
<来源:谷禾健康肠道菌群检测数据库>
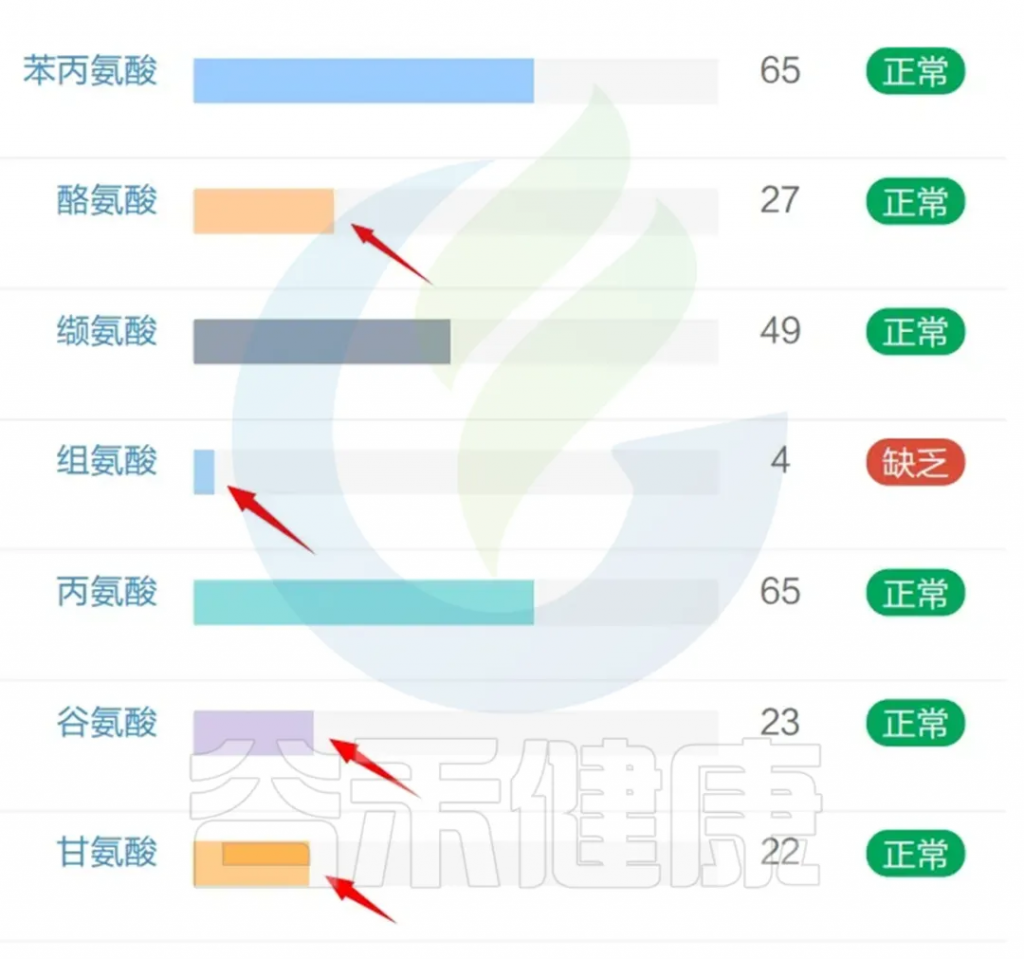
我们再来看肠道菌群检测报告中的氨基酸水平,部分氨基酸严重缺乏,例如组氨酸;
其他氨基酸如酪氨酸、谷氨酸、甘氨酸、亮氨酸、赖氨酸、蛋氨酸也都相对偏低。
酪氨酸是一种与认知功能相关的儿茶酚胺前体。
<来源:谷禾健康肠道菌群检测数据库>
组氨酸通过清除氧自由基发挥抗氧化作用,从而参与缓解氧化应激。组氨酸是肌肽的前体,肌肽是一种含有 β 丙氨酸和组氨酸的二肽,在人脑中起到缓冲剂和抗氧化剂的作用。肌肽可以调节与智力障碍相关的各种生物途径。
组氨酸是组胺的前体,而组胺是一种重要的神经递质和神经调节因子。关于组胺,详见之前的文章:
有小鼠研究显示,组氨酸缺乏的小鼠表现出一些类似自闭症的行为,如社交互动减少、刻板重复行为增多等。其他也有多项研究表明,组氨酸血症与自闭症和语言发育迟缓之间存在关联。
谷氨酸,可以调节记忆和学习等认知功能,而这些功能在自闭症患者中通常会受损,关于谷氨酸,详见谷禾之前的文章:
甘氨酸是一种具有抗炎、细胞保护和免疫调节特性的抑制性神经递质,甘氨酸以多种方式与线粒体代谢相关。
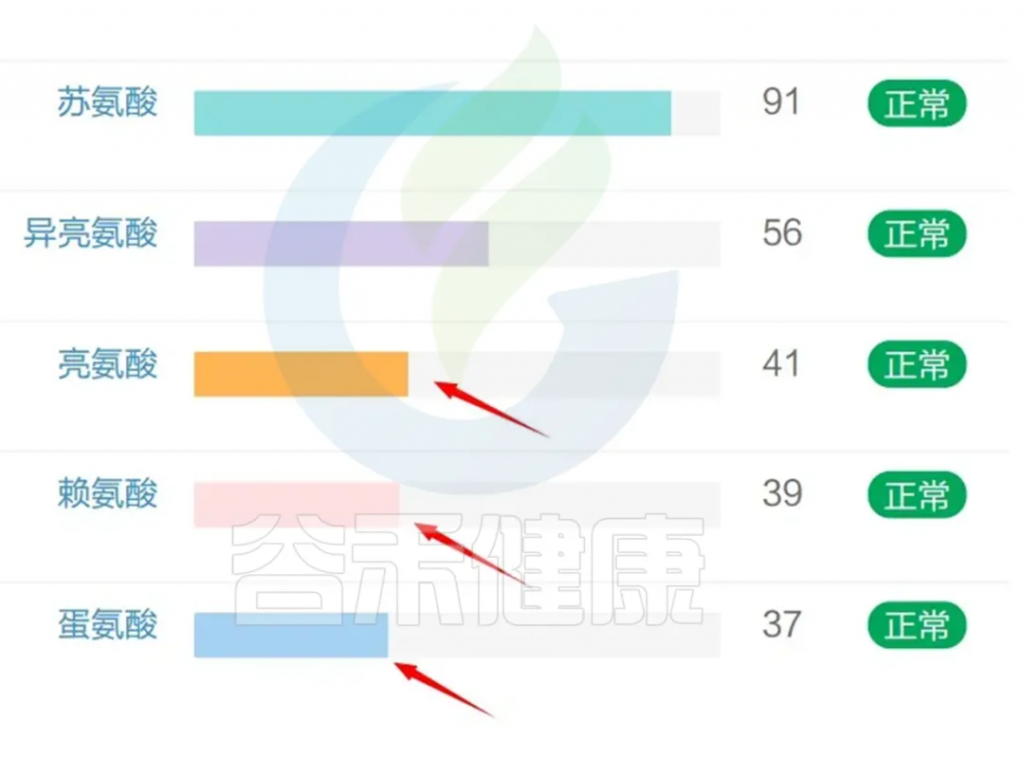
其他,赖氨酸,蛋氨酸,亮氨酸都属于人体必须氨基酸,是人体不能自行合成或以适合人体需要的速率合成的氨基酸,必须通过食物摄入来获取。
<来源:谷禾健康肠道菌群检测数据库>
亮氨酸,属于支链氨基酸,支链氨基酸生物合成与自闭症症状、甲基化潜力和细胞内 GSH 比率相关。支链氨基酸具有多种生理作用,包括调节葡萄糖和脂肪酸代谢以及调节重要的分子途径和促进蛋白质合成,它们通过琥珀酰辅酶 A 进入 CAC 与线粒体功能相连。大多数自闭症患者都会有线粒体功能障碍。
赖氨酸,是一种生酮氨基酸,通过合成谷氨酸作为其分解的副产物,参与肠道菌群-肠-脑轴。
经过几个月的干预,再次检测肠道菌群,该患者的自闭症风险有所下降,症状也有相应好转。

<来源:谷禾健康肠道菌群检测数据库>
未来患有自闭症的新生儿中关键脂质减少,如亚油酸、α-亚麻酸、胆汁酸、甘油三酯。
这些必需脂肪酸、它们的衍生物、相对比例和个体分子种类在许多哺乳动物的生理过程中起关键作用,包括磷脂生成、膜流动性和大脑发育。
亚油酸和α-亚麻酸
亚油酸和α-亚麻酸是哺乳动物不能自行合成的必需脂肪酸(EFA),必须通过饮食摄取。
注:亚油酸: LA,C18:2n-6,n-6脂肪酸的前体
α-亚麻酸: ALA,C18:3n-3,n-3脂肪酸的前体
它们对大脑具有抗炎作用,并调节自噬、神经传递和神经发生。它们通过抑制神经递质(例如GABA)的释放来调节内源性大麻素系统,从而影响突触功能和可塑性。
ARA、DHA、EPA
与其他身体组织相比,大脑中亚油酸和α-亚麻酸的浓度较低,而其衍生物,特别是ARA(花生四烯酸)和DHA(即二十二碳六烯酸)的浓度较高。
在妊娠晚期,胎儿大脑快速积累多不饱和脂肪酸,特别是DHA。
亚油酸和α-亚麻酸的衍生物可以进一步被宿主磷脂酶修饰,转化为主要来自ARA的二十碳烷类,如前列腺素、白三烯和血栓素。这些二十碳烷是促炎分子,作为局部激素来激活免疫细胞、启动血小板聚集和引发分娩。
相反,DHA和EPA可以进一步转化为抗炎的消退素(resolvins)和保护素(protectins)。
胆汁酸
关于胆汁酸,UDCA,熊去氧胆酸,一种天然存在的次级胆汁酸,在代谢性疾病、自身免疫性疾病、慢性炎症性疾病和神经病理学等疾病中显示出治疗前景。研究发现,UDCA在未来自闭症患者中较低。
ARA加DHA改善自闭症
一项双盲、安慰剂对照随机试验发现膳食补充ARA加DHA(ARA占优势)显著改善了自闭症患者(n=13)在异常行为检查表-社区量表测量的社交退缩和社交回应量表测量的沟通情况。虽然样本量较小,但这个研究证明了通过饮食调节大脑脂肪酸谱可能带来的好处,这种脂肪酸调节在动物研究中也可以通过益生菌达到。
n-3和n-6脂肪酸
一些小规模的n-3和n-6脂肪酸的膳食干预研究显示,自闭症患者的症状有所缓解,虽然并非所有研究都显示有改善。
自闭症患者可能与母乳喂养较少有关
自闭症和精神分裂症患者较少接受母乳喂养,而健康对照组则较多,这表明富含ARA、EPA和DHA的人类母乳对婴儿大脑发育的最佳饮食份额的重要性。相反,早期断奶与自闭症风险增加相关。这些观察结果不仅强调了早期产后饮食对大脑发育和自闭症风险的重要性,还暗示了肠脑轴和肠道微生物群在这一发育过程中的可能早期作用。
补充益生菌,改变脂肪酸
一些肠道微生物,最著名的是某些乳酸菌属和双歧杆菌属的菌种,具备进行脂肪酸生物氢化所需的酶,从而增加脂肪酸的不饱和度。
研究表明,饮食补充α-亚麻酸(ALA)会改变小鼠肝脏、脂肪组织和大脑中的脂肪酸谱,并且在联合补充α-亚麻酸与益生菌Bifidobacterium breve NCIMB 702258时,脂肪酸谱会进一步改变。
注:B. breve NCIMB 702258是高效生产共轭亚油酸(CLA)的菌。
相比于对照组喂养或单独补充α-亚麻酸的情况,食用n-3脂肪酸加益生菌的动物其大脑中的DHA水平升高,而ARA水平下降。
同一组作者随后表明,单独使用B. breve NCIMB 702258菌株,相比于另一种共轭亚油酸(CLA)产生的B. breve菌株和对照组,小鼠的大脑中DHA和ARA的水平也有所上升,证实了益生菌调节大脑脂肪酸谱的能力,并显示这种活动具有明显的菌株特异性。
LA和ALA不够,其他饱和脂肪酸来凑
尽管亚油酸(LA)和α-亚麻酸(ALA)是磷脂形成所必需的必需脂肪酸,但当饮食中这些脂肪酸含量偏低时,其他脂肪如饱和脂肪酸有时可作为替代品,从而对最终磷脂的结构和可能的功能产生影响。
磷脂代谢异常、脂肪酸缺乏或血脂异常已牵涉到多种神经和大脑发育或退行性疾病,包括精神分裂症、注意力缺陷多动障碍(ADHD)、抑郁症、广泛性发育障碍、发育性协调障碍、癫痫、双相情感障碍、阿尔茨海默病、帕金森病、尼曼-皮克病、亨廷顿舞蹈病、中风。
胆固醇代谢和磷脂代谢异常在自闭症中起作用
自闭症患者血液中磷脂酶A2水平较高,细胞膜中的ARA和DHA水平较低,并且可能具有更高的n-6脂肪酸与n-3脂肪酸的比例。
与健康对照组相比,自闭症儿童(n=16)的红细胞脂质谱被修改,表现为较低的胆固醇水平和细胞膜中单唾液四己糖神经节苷脂(GM1)的比例较高。研究人员认为这可能反映了更普遍的胆固醇合成缺陷,在大脑中,结合GM1表达的变化,可能会促成自闭症的病理生理机制。
BDNF对突触传递和神经元胆固醇合成的影响
自闭症与BDNF和益生菌的关联
然而,并非所有益生菌研究都显示BDNF与实验动物观察到的脑功能改善有关。
益生菌、益生元与改善脑功能
然而,需要在人类受试者和相关实验模型中进行基础研究,以验证这些假设的有效性并在机制上将肠道细菌与这些病情联系起来。
大脑占人体质量约2%,但却占胆固醇约20%。血脑屏障(BBB)对脂蛋白是不可通透的,这意味着大脑所需的胆固醇是内源性形成的。
其中星形胶质细胞和神经元分别是胆固醇的净生产者和使用者,体现了胆固醇生物合成机制的独特分区化。
神经元——胆固醇的使用者
神经元需要大量的胆固醇来维持其广泛的膜表面积并提供突触前囊泡的形成。它们还有稍微不同的酶途径,将鲨烯转化为胆固醇。出生后的胆固醇主要由星形胶质细胞提供,并优先来源于乙酸盐。
注:鲨烯(C30H50)是一种多不饱和烃类,也称为角鲨烯或三十碳六烯。 它是一种在人体胆固醇合成等代谢过程中产生的萜类化合物。鲨烯在自然界中广泛存在,尤其是在鲨鱼肝油中含量较高,同时也是橄榄油、米糠油等少数几种植物油中的成分。具有良好的生物活性,在食品、化妆品、保健品等领域广泛应用。
星形胶质细胞——胆固醇的净生产者
星形胶质细胞是包裹神经细胞的细胞,负责供应细胞外钾、谷氨酸、能量和抗氧化剂,并调节大脑中的活性依赖性血流,并可能影响突触活动。
星形胶质细胞在大脑胆固醇运输中的关键作用
ApoE缺乏的啮齿动物模型,表现出各种行为和神经系统症状,并在感觉系统中也有缺陷,这些缺陷与随年龄增长而丧失的突触和树突,突触膜胆固醇分布的改变有关。
CYP46,在维持大脑胆固醇稳态中的作用
短链脂肪酸——乙酸,对神经发育的作用
出生后乙酸在神经发育中重要,母乳喂养乙酸多
AceCS1的表达及其功能
乙酸是胆固醇的组成成分
乙酸的代谢去向
乙酸作为特殊代谢产物的重要性
NAA——乙酸的主要来源之一
N-乙酰天冬氨酸(NAA)在大脑中的作用
自闭症儿童大脑中NAA浓度降低
短链脂肪酸——丙酸,对大脑的负面影响
饮食如何影响大脑中短链脂肪酸的可用性?
自闭症中二糖酶和己糖转运蛋白减少
研究发现,在自闭症儿童中,二糖酶和己糖转运蛋白的表达显著减少,这些变化与肠道微生物群组成的变化相关。这些变化与厚壁菌门相对丰度较高,拟杆菌门较少,以及β-变形菌门升高有关。
注:至少是三种常见肠道二糖酶之一:蔗糖酶-异麦芽糖酶(SI)、麦芽糖酶-异麦芽糖酶(MGAM)、乳糖酶(LCT)
己糖转运蛋白:SGLT1、GLUT2
肠道二糖酶和糖转运蛋白的表达受到多种因素的调控,包括饮食、肠道微生物以及肠神经系统等。
丁酸:结肠健康的关键能量源与吸收机制
考虑到丁酸是结肠细胞的首选能量来源、黏膜更新和分化的介质,以及其生产率在早期肠道微生物群继发发育过程中发生变化,丁酸在肠黏膜成熟中的作用可能非常重要。
丁酸吸收机制:MCT1负责运输,GPR109A助攻
在了解了丁酸在肠黏膜中的重要性及其吸收机制之后,我们再探讨不同饮食和环境因素对MCT1表达的影响及其对丁酸和其他短链脂肪酸吸收的调节作用。
饮食影响短链脂肪酸(丁酸)吸收的机制
高纤维饮食和益生元→MCT1表达和短链脂肪酸吸收↑
高脂肪饮食→抑制短链脂肪酸在结肠中的吸收
肠道炎症和氧化应激→MCT1表达↓→丁酸吸收↓
以上我们知道,MCT1表达异常会影响丁酸吸收,不仅如此,MCT1表达异常还可能与肥胖相关的神经系统疾病有关。
在饮食诱导和遗传性肥胖动物中,MCT1-4 表达都增加,特别是在神经元和神经元胞体中,说明这种变化可能不全是饮食因素,也可能是由于肥胖引起的激素变化间接导致的。
前面我们知道,MCT与短链脂肪酸转运相关,那么MCT表达异常,短链脂肪酸也异常,可能会影响大脑的能量代谢,如果这些变化发生在生命早期,可能会影响神经系统的发育过程,并与个体成年后的肥胖易感性相关。
注:从母乳到固体食物的饮食结构转换可能会影响生理发育、代谢途径和营养转运蛋白(如MCT)的表达,从而对大脑功能产生重要影响。
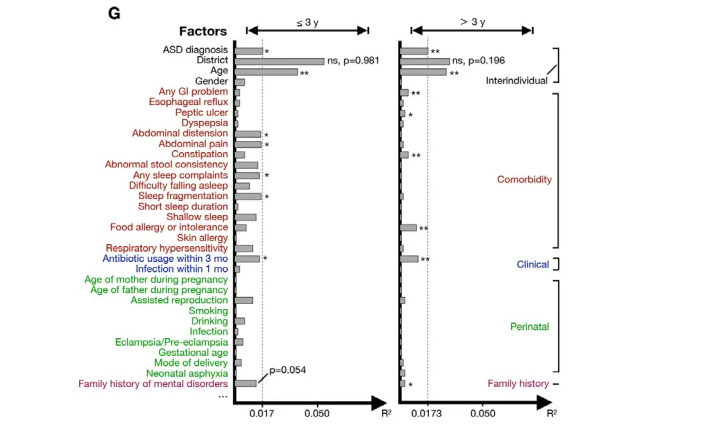
谷禾发表在 GUT上的队列也表明,随着断奶或引入辅食,自闭症儿童的肠道菌群发育轨迹逐渐偏离健康儿童。如下:
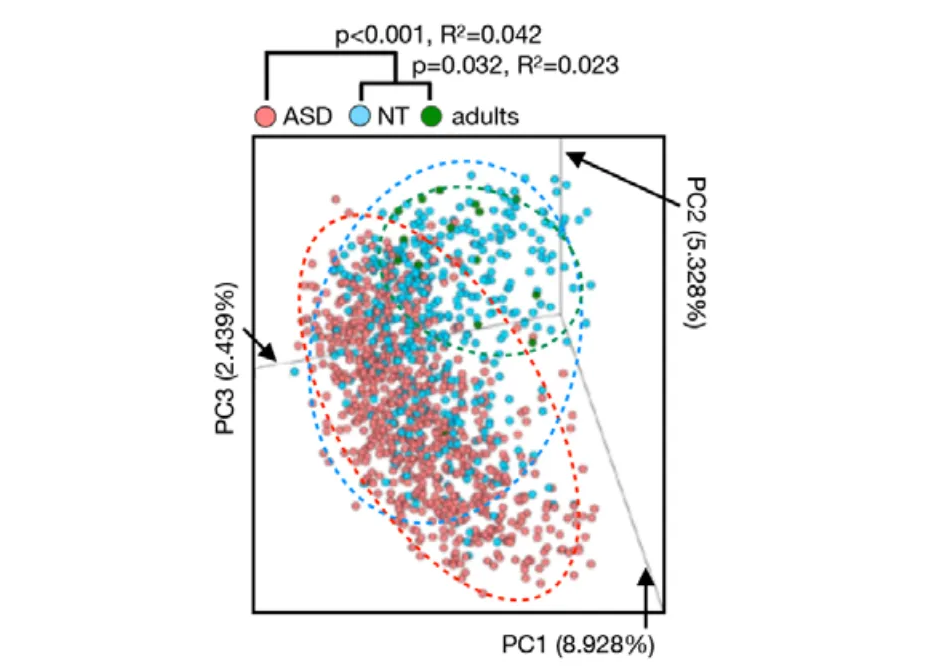
doi: 10.1136/gutjnl-2021-325115.
不良饮食,尤其是在断奶后采用现代西式饮食,实际上可能通过将营养素转运蛋白关闭,重定向营养流向,从而下调了必需营养素(如氨基酸、脂肪和SCFA)的肠道流动。
对比现代西式饮食和古老传统的饮食,有助于重新定义营养不良的范式。营养不良不再仅限于某些必需营养素的缺乏,还包括营养过剩和异常的营养素比例和结构。

在人类“超级有机体”中,这种改变的营养环境的代谢后果,最明显地体现在肠道微生物群与宿主能量代谢和大脑功能的相互作用中。
生命早期:母乳喂养
前面我们了解到,早期断奶与自闭症风险增加相关。很多自闭症患者较少接受母乳喂养,这表明母乳中含有ARA、EPA和DHA,是婴儿大脑发育的最佳饮食。
随着年龄增长:其他饮食
多酚及其代谢物
现有的研究确认了流行病学数据,表明多酚及其代谢物可能有助于促进大脑健康。提出的作用机制包括抗氧化活动、改善血管功能和脑部血流、直接增强神经元信号传递、缓冲钙离子、增强神经保护性应激蛋白和减少应激信号。
线粒体功能障碍在自闭症谱系障碍、神经退行性疾病和一般脑老化的发病机制中得到了关注。线粒体常被认为是氧化应激的启动者和目标,植物多酚代谢物可能具有保护作用。
体外研究在生理相关剂量下测试了选定多酚代谢物对高级糖化终产物形成的抑制能力以及对人类神经元细胞中轻度氧化应激的对抗能力。例如:
药用植物的多酚提取物
少数研究探讨了来自药用植物的多酚提取物对自闭症动物模型的影响,发现:
注:尚需确定这些高剂量植物提取物的抗氧化活性仅与减轻丙戊酸引起的氧化损伤相关,还是在氧化损伤可能只是一个影响因素的神经病理情况下更具广泛相关性。
——黄酮类化合物
肠道菌群对黄酮类化合物的吸收转化
估计有95%的膳食植物多酚在上肠道内无法消化和吸收,并最终到达结肠中的肠道微生物群。一些黄酮类糖苷进入结肠,被肠道菌群分解为更简单的代谢物,比如:
黄酮类化合物对肠道菌群的调节
膳食类黄酮调节肠道菌群改善自闭症
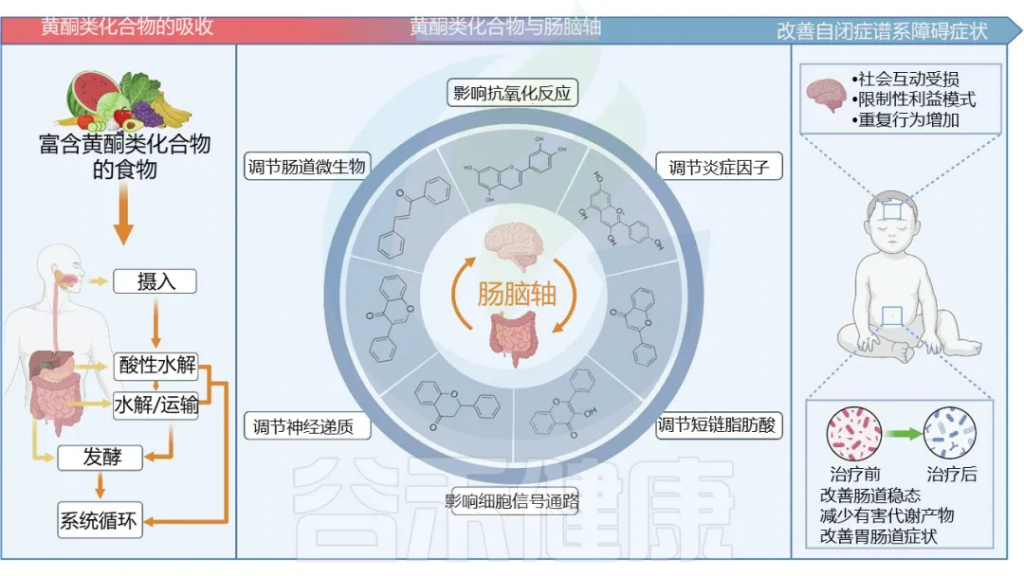
doi.org/10.1016/j.foodres.2024.114404
黄酮类化合物抗自闭症作用的实验研究


doi.org/10.1016/j.foodres.2024.114404
肥胖和不良饮食与抑郁症和自闭症谱系障碍发病率增加有关。同样,母亲的不良饮食(特别是高脂肪饮食),健康状况(特别是肥胖/代谢综合症),会影响胎儿和新生儿的大脑发育过程,从而增加焦虑、抑郁、注意力缺陷多动障碍(ADHD)和自闭症等神经系统疾病的风险。
神经内分泌系统,特别是下丘脑-垂体-肾上腺(HPA)轴,代表了肠道环境和中枢神经系统(CNS)之间的主要通信通道。
在动物模型中,使用各种益生菌微生物干预,既包括乳酸杆菌也包括双歧杆菌,已显示能够减轻标准动物应激挑战下的类似焦虑行为。
婴儿双歧杆菌
L. helveticus R0052 和 B. longum R0175
L. rhamnosus JB-1
脆弱拟杆菌NCTC 9343
注:脆弱拟杆菌是一个比较复杂的菌种,里面既有潜在的益生菌株,也有致病的病原菌株,具体可以查看我们以前文章:
益生元
最近的研究表明,饮食中补充益生元发酵纤维,可以选择性地刺激对人体有益的肠道细菌,如双歧杆菌,从而对大脑产生重要变化。
实验动物在摄入果寡糖(FOS)或半乳寡糖(GOS)后,海马中的BDNF和N-甲基-d-天冬氨酸受体(NMDARs)亚基NR1的表达增加,并且GOS似乎通过诱导肠道激素PYY来介导这一过程。FOS和GOS都能够上调肠道微生物群中短链脂肪酸的产生,特别是乙酸和丁酸,同时增加肠道双歧杆菌的相对丰度。
L-肌肽
胆固醇或DHA
从模拟人类婴儿营养的猪仔研究中,发现婴儿配方奶粉中的胆固醇补充会改变大脑中的氨基酸谱,降低谷氨酸、丝氨酸、谷氨酰胺、苏氨酸、β-丙氨酸、丙氨酸、蛋氨酸、异亮氨酸、亮氨酸和γ-氨基丁酸的浓度,同时增加甘氨酸和赖氨酸的浓度。
二十二碳六烯酸(DHA)也有类似的效果,但会降低牛磺酸水平,对异亮氨酸和赖氨酸没有影响。胆固醇或DHA膳食补充剂也会影响猪仔肝脏、肌肉和血浆中的氨基酸水平。DHA还会减少肌肉和大脑中的肌肽和氨的含量。
这些观察结果确实对食物选择或家庭饮食对营养可用性和代谢的影响有重要启示,进而影响早期儿童的大脑发育和功能,当然还需在人类队列中进一步研究其潜在机制。
药物
对自闭症儿童每周使用万古霉素治疗,可显著改善神经行为和胃肠道症状。
粪菌移植
一项开放标签研究对18名自闭症儿童进行了粪菌移植(每日口服8周),结果表明移植后其胃肠道症状和自闭症核心症状评分均有所改善。
移植后8周,受试者的肠道菌群多样性增加,厚壁菌门丰度下降,拟杆菌门和变形菌门丰度上升。
随访2年后,受试者的部分症状改善仍然维持。这提示通过重建肠道菌群可能成为干预自闭症的新策略。
关于粪菌移植,仍需更多深入研究。
自闭症谱系障碍 (ASD) 是一组神经发育疾病,一般在 3 岁之前发病,目前的发病率在全世界逐渐升高,与多种因素有关,其中饮食会影响和塑造肠道微生物群,孕期和幼儿期似乎是一个关键时期,尤其从哺乳/配方奶→断奶→成人“家庭”饮食的过渡过程中饮食和环境暴露影响较大。
人类微生物组对宿主代谢过程和膳食化合物加工的核心贡献,许多营养物质和摄入的化学物质必须经过肠道及肠道微生物,转化为生物可利用和活跃的中间产物,然后通过肝门静脉被吸收并在全身分布。
研究表明,大部分自闭症患者的肠道菌群异常,这可能与饮食习惯、抗生素使用等因素有关。同时,自闭症患者某些氨基酸水平也存在异常。
饮食作为塑造肠道微生物群的重要因素,可能在自闭症的发病中扮演重要角色。优化孕期和幼儿期的饮食结构,如母乳喂养、合理添加辅食、避免过多加工食品和添加剂等,有助于维持肠道菌群平衡,从而有助于大脑健康。
针对自闭症患者的饮食干预,如补充益生元、益生菌,调整膳食纤维和蛋白质比例等,可能对改善部分症状有一定帮助。但由于自闭症的高度异质性,饮食干预的效果可能因人而异,还需要更多的结合个体化健康信息及相应症状进行个性化指导和干预。
此外,幼儿早期尤其6-12个月能够更早判别出自闭症风险,对于神经发育的改善和行为的扭转非常重要,希望临床上与相关机构能够合作共同推进自闭症的研究和个性化干预。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Lou M, Cao A, Jin C, Mi K, Xiong X, Zeng Z, Pan X, Qie J, Qiu S, Niu Y, Liang H, Liu Y, Chen L, Liu Z, Zhao Q, Qiu X, Jin Y, Sheng X, Hu Z, Jin G, Liu J, Liu X, Wang Y. Deviated and early unsustainable stunted development of gut microbiota in children with autism spectrum disorder. Gut. 2022 Aug;71(8):1588-1599.
Ahrens A P, Hyötyläinen T, Petrone J R, et al. Infant microbes and metabolites point to childhood neurodevelopmental disorders[J]. Cell, 2024, 187(8): 1853-1873. e15.
Chen, WX., Chen, YR., Peng, MZ. et al. Plasma Amino Acid Profile in Children with Autism Spectrum Disorder in Southern China: Analysis of 110 Cases. J Autism Dev Disord 54, 1567–1581 (2024).
Chang, X., Zhang, Y., Chen, X. et al. Gut microbiome and serum amino acid metabolome alterations in autism spectrum disorder. Sci Rep 14, 4037 (2024).
Kieran M. Tuohy, Paola Venuti, Simone Cuva, et al, Chapter 15 – Diet and the Gut Microbiota – How the Gut: Brain Axis Impacts on Autism, 2015, Pages 225-245, American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders (4th ed.), American Psychiatric Association, Washington DC (1994)
Anastasescu, C.M.; Gheorman, V.; Popescu, F.; Stoicănescu, E.-C.; Gheorman, V.; Riza, A.-L.; Badea, O.; Streață, I.; Militaru, F.; Udriștoiu, I. Serum Amino Acid Profiling in Children with Autistic Spectrum Disorder: Insights from a Single-Center Study in Southern Romania. Healthcare 2023, 11, 2487
V. Hughes. Epidemiology: complex, disorder, Nature, 491 (2012), pp. S2-S3
S. Baron-Cohen, F.J. Scott, C. Allison, et al., Prevalence of autism-spectrum conditions: UK school-based population study. Br J Psychiatry, 194 (2009), pp. 500-509
T.S. Brugha, S. McManus, J. Bankart, et al., Epidemiology of autism spectrum disorders in adults in the community in England Arch Gen Psychiatry, 68 (2011), pp. 459-466
B.S. Abrahams, D.H. Geschwind., Advances in autism genetics: On the threshold of a new neurobiology, Nat Rev Genet, 9 (2008), pp. 341-355
Brister, D.; Rose, S.; Delhey, L.; Tippett, M.; **, Y.; Gu, H.; Frye, R.E. Metabolomic Signatures of Autism Spectrum Disorder. J. Pers. Med. 2022, 12, 1727.
S. Ozonoff, B.J. Williams, R. Landa, Parental report of the early development of children with regressive autism: The delays-plus-regression phenotype, Autism, 9 (2005), pp. 461-486
S. Ozonoff, G.S. Young, M.B. Steinfeld, et al., How early do parent concerns predict later autism diagnosis?
J Dev Behav Pediatr, 30 (2009), pp. 367-375
G. Esposito, P. Venuti, Symmetry in infancy: Analysis of motor development in autism spectrum., disorders, Symmetry, 1 (2009), pp. 215-225
Zhao Y, Wang Y, Meng F, Chen X, Chang T, Huang H, He F, Zheng Y. Altered Gut Microbiota as Potential Biomarkers for Autism Spectrum Disorder in Early Childhood. Neuroscience. 2023 Jul 15;523:118-131.
G. Esposito, P. Venuti, F. Apicella, F. Muratori, Analysis of unsupported gait in toddlers with autism, Brain and Development, 33 (2011), pp. 367-373
F. Happé, A. Ronald, R. Plomin, Time to give up on a single explanation for autism, Nat Neurosci, 9 (2006), pp. 1218-1220
T. Charman, C.R.G. Jones, A. Pickles, E. Simonoff, G. Baird, F. Happé, Defining the cognitive phenotype of autism, Brain Res, 1380 (2011), pp. 10-21
P. Krakowiak, C.K. Walker, A.A. Bremer, et al.,Maternal metabolic conditions and risk for autism and other neurodevelopmental disorders,Pediatrics, 129 (2012), pp. e1121-e1128
J.A. Hollway, M.G. Aman Pharmacological treatment of sleep disturbance in developmental disabilities: a review of the literature,Res Dev Disabil, 32 (2011), pp. 939-962
Shen L, Liu X, Zhang H, Lin J, Feng C, Iqbal J. Biomarkers in autism spectrum disorders: Current progress. Clin Chim Acta. 2020 Mar;502:41-54.
C.A. Molloy, P. Manning-Courtney,Prevalence of chronic gastrointestinal symptoms in children with autism and autistic spectrum disorders, Autism, 7 (2003), pp. 165-171
D.V. Keen , Childhood autism, feeding problems and failure to thrive in early infancy: Seven case studies, Eur Child Adolesc Psychiatr, 17 (2008), pp. 209-216
L.G. Bandini, S.E. Anderson, C. Curtin, et al., Food selectivity in children with autism spectrum disorders and typically developing children, J Pediatr, 157 (2010), pp. 259-264
S.A. Cermak, C. Curtin, L.G. Bandini, Food selectivity and sensory sensitivity in children with autism spectrum disorders, J Am Diet Assoc, 110 (2010), pp. 238-246
Y. Martins, R.L. Young, D.C. Robson, Feeding and eating behaviors in children with autism and typically developing children, J Autism Dev Disord, 38 (2008), pp. 1878-1887, View at publisher
E. Cornish, A balanced approach towards healthy eating in autism, J Hum Nutr Diet, 11 (1998), pp. 501-509
P. Whiteley, J. Rodgers, D. Savery, P. Shattock, A gluten-free diet as an intervention for autism and associated spectrum disorders: Preliminary findings, Autism, 3 (1999), pp. 45-65
K. Fitzgerald, M. Hyman, K. Swift, Autism spectrum disorders, Glob Adv Health Med, 1 (2012), pp. 62-74
E. Courchesne, K. Campbell, S. Solso, Brain growth across the life span in autism: age-specific changes in anatomical pathology, Brain Res, 1380 (2011), pp. 138-145
M. Rutter, Aetiology of autism: findings and questions, J Intell Disabil Res, 49 (2005), pp. 231-238, View at publisher
J.J. Michaelson, Y. Shi, M. Gujral, et al.
Whole-genome sequencing in autism identifies hot spots for de novo germline mutation, Cell, 151 (2012), pp. 1431-1442
B.N. Vardarajan, A. Eran, J.Y. Jung, L.M. Kunkel, D.P. Wall, Haplotype structure enables prioritization of common markers and candidate genes in autism spectrum disorder
Transl Psychiatry, 3 (2013), p. e262
Yu X, Qian-Qian L, Cong Y, Xiao-Bing Z, Hong-Zhu D. Reduction of essential amino acid levels and sex-specific alterations in serum amino acid concentration profiles in children with autism spectrum disorder. Psychiatry Res. 2021 Mar;297:113675.
J. Veenstra-Vanderweele, R.D. Blakely
Networking in autism: Leveraging genetic, biomarker and model system findings in the search for new treatments, Neuropsychopharmacol, 37 (2012), pp. 196-212
K.T.E. Kleijer, M.J. Schmeisser, D.D. Krueger, et al. Neurobiology of autism gene products: towards pathogenesis and drug targets, Psychopharmacology (Berl), 231 (6) (2014), pp. 1037-1062
Li H, Dang Y, Yan Y. Serum interleukin-17 A and homocysteine levels in children with autism. BMC Neurosci. 2024 Mar 12;25(1):17.