-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
2024年6月19日,广东省人民医院儿科杨敏团队取得了一项备受瞩目的成果。该团队关于“肠道菌群失调通过糖原贮积病中的 CCL4L2-VSIR 轴引发炎症性肠病”,在国际著名期刊《Advanced Science》(影响因子IF=15.1)发表,针对这一通路不仅可以为 GSD 患者提供有益的治疗,还可以为结肠炎和其他形式的 IBD 患者提供有益的治疗。
谷禾健康技术团队参与并支持本研究的菌群测序和分析部分。
这一突破性研究为糖原贮积病及其相关并发症的治疗提供了新的视角,这也是我国儿科在罕见病领域的研究中取得的重大突破。

糖原贮积病(GSD),是一类由于先天性酶缺陷所造成的糖原代谢障碍疾病,多数属常染色体隐性遗传,发病因种族而异。该病类型多样,其中GSD-Ib型患者常伴有炎症性肠病。
在GSD-Ib型患者中,肠道菌群失调通过CCL4L2-VSIR轴影响炎症性肠病(IBD)。研究发现,与典型IBD不同,GSD-Ib患者展现出独特的消化道症状和肠道菌群特征。
肠道菌群失调主要由特定病原菌引起,导致肠道巨噬细胞过度激活,CCL4L2-VSIR轴的过度激活促进上皮细胞特定基因的表达,从而推动IBD的进展。
研究结果表明,靶向肠道菌群失调或CCL4L2-VSIR轴可能成为治疗GSD相关IBD的潜在策略。
糖原是肝脏和骨骼肌中储存的葡萄糖形式,其分解提供稳定的葡萄糖供应。当特定酶的活性缺失时,会导致糖原积累,进而影响组织的功能,导致一系列健康问题,包括低血糖、肌肉痉挛、疲劳、肝脏肿大等。
糖原贮积病的类型多样,根据受影响的酶和组织不同,可以分为几种主要类型。例如:
糖原贮积病的治疗主要是通过调节血糖水平和预防低血糖来管理。对于GSD-Ia和GSD-Ib,过去十多年的治疗方法包括间歇性未煮玉米淀粉或通过胃管给予夜间葡萄糖输注。给GSD-III患者高蛋白饮食,以增加儿童的生长速率。
GSD不仅影响儿童,成人也可能受到影响。未经最佳终身饮食葡萄糖治疗的成人GSD患者的长期预后不佳,可能会出现多种并发症,成人GSD患者常见的并发症包括骨质疏松症和骨折、肾结石、肾盂肾炎等。
▼
正常情况下,人体摄入的碳水化合物会被转化为葡萄糖,一部分葡萄糖会被立即利用以提供能量,而多余的葡萄糖则会在肝脏和肌肉等组织中合成糖原储存起来。当身体需要能量时,糖原又会分解为葡萄糖以供使用。
然而,在糖原贮积病患者中,由于参与糖原合成或分解的某些酶存在缺陷,导致糖原的合成、分解或储存出现异常,从而引起一系列的健康问题,包括低血糖、肌肉痉挛、疲劳、肝脏肿大等。
这类疾病有一个共同的生化特征,即是糖原贮存异常,绝大多数是糖原在肝脏、肌肉、肾脏等组织中贮积量增加。
▼
糖原贮积病是一种罕见病,总体发病率相对较低,但具体的发病率因不同类型的糖原贮积病而有所差异。
《世界胃肠病学杂志》资料显示,发病率约为20000-43000名新生儿中的1人。
由于其症状的多样性和隐匿性,一些病例可能未被准确诊断,实际的发病率可能被低估。
为了调查中国大陆GSD的流行病学和临床特征,杨敏及其团队进行了两项大型多中心研究,并通过问卷调查报告了2020年10月至2021年6月的209例GSD病例(如图)。
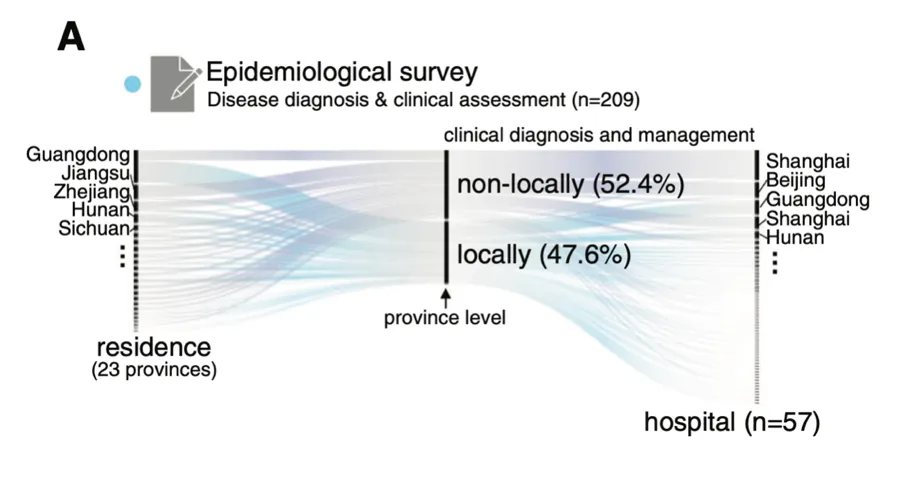
关于患者的就医情况,其中最显著的一个特点是超半数家庭(52.4%)为“省级”外来病例,就医的医院主要来自相对发达地区。且就诊地主要集中在上海、北京、广东等医疗资源相对发达的城市。
▼
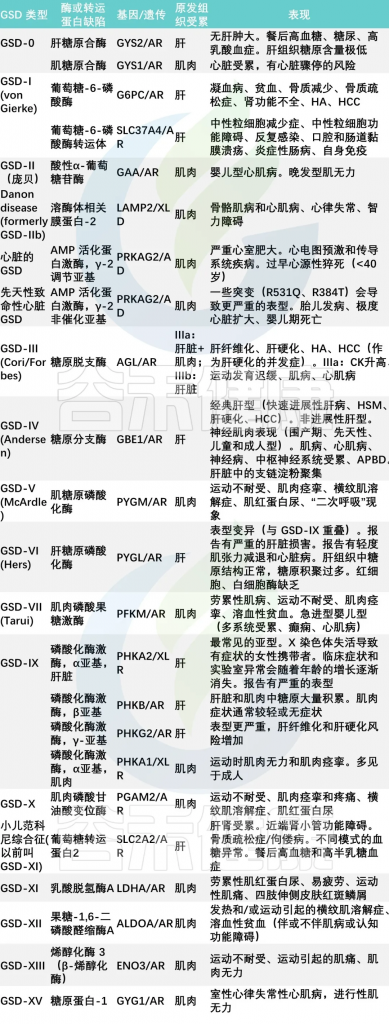
糖原合成和分解代谢中所必需的各种酶至少有8种,由于这些酶缺陷所造成的临床疾病有15型,其中:
doi: 10.3748/wjg.v29.i25.3932
杨敏团队的调查研究中,主要包括6种类型的GSD,即:
其中最常见的是I型(66.9%)。
▼
不同类型的糖原贮积病临床表现各异,但常见的症状包括:
低血糖、肝肿大、酸中毒(乳酸性酸中毒)、高脂血症、高尿酸血症、疲劳、肌肉无力等。
由于糖原无法正常分解为葡萄糖,患者在空腹或长时间运动后容易出现低血糖症状,如头晕、乏力、出汗、心慌等。
糖原在肝脏中过度积累,导致肝脏体积增大。
长期的低血糖和代谢紊乱可能影响儿童的生长发育,导致身高、体重增长缓慢。
某些类型的糖原贮积病会影响肌肉功能,表现为肌肉无力、疼痛、痉挛等。
如Ⅱ型糖原贮积病可能导致心脏肥大、呼吸肌无力等,严重影响心肺功能。
其中:
口疮性口炎、肛周病变、胃肠炎、呼吸道感染和皮肤感染等症状在I型GSD中更常见;
厌食、呕吐、腹泻、粘液/血便、腹痛和腹胀是 GSD 患者常见的胃肠道并发症,尤其是在 GSD-Ib 组(77.8%)。
造成患者家庭问诊困难的一个主要原因是该疾病表型的复杂,例如下图:
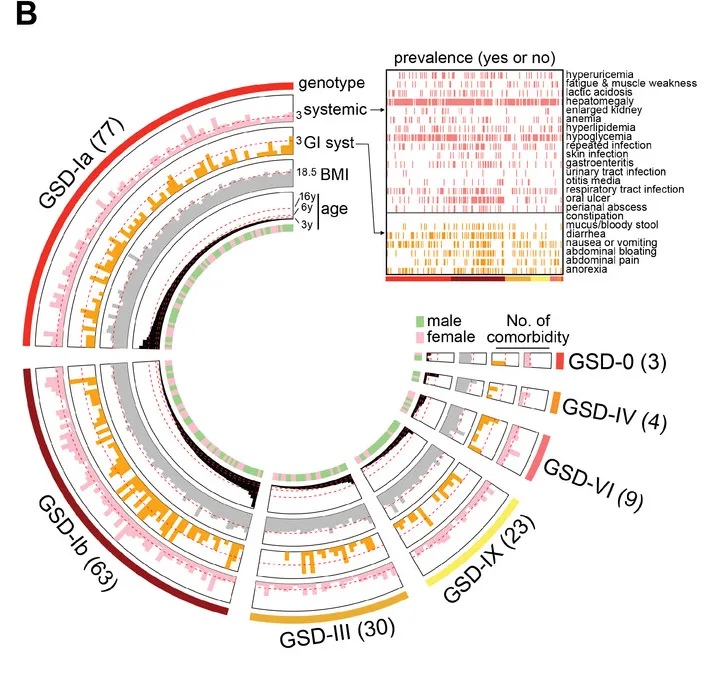
一种奇怪的糖原贮积病亚型:许多GSD-lb患者也患有慢性 IBD
杨敏教授表示,他们关注 GSD相关IBD 已有近10年了。多中心内镜监测研究中,他们招募了 32 名 GSD 患者。这些患者在内镜检查期间表现出活动性胃肠道症状。在这 32 名患者中,27 名患有 GSD-Ib,25 名最初诊断为 IBD。
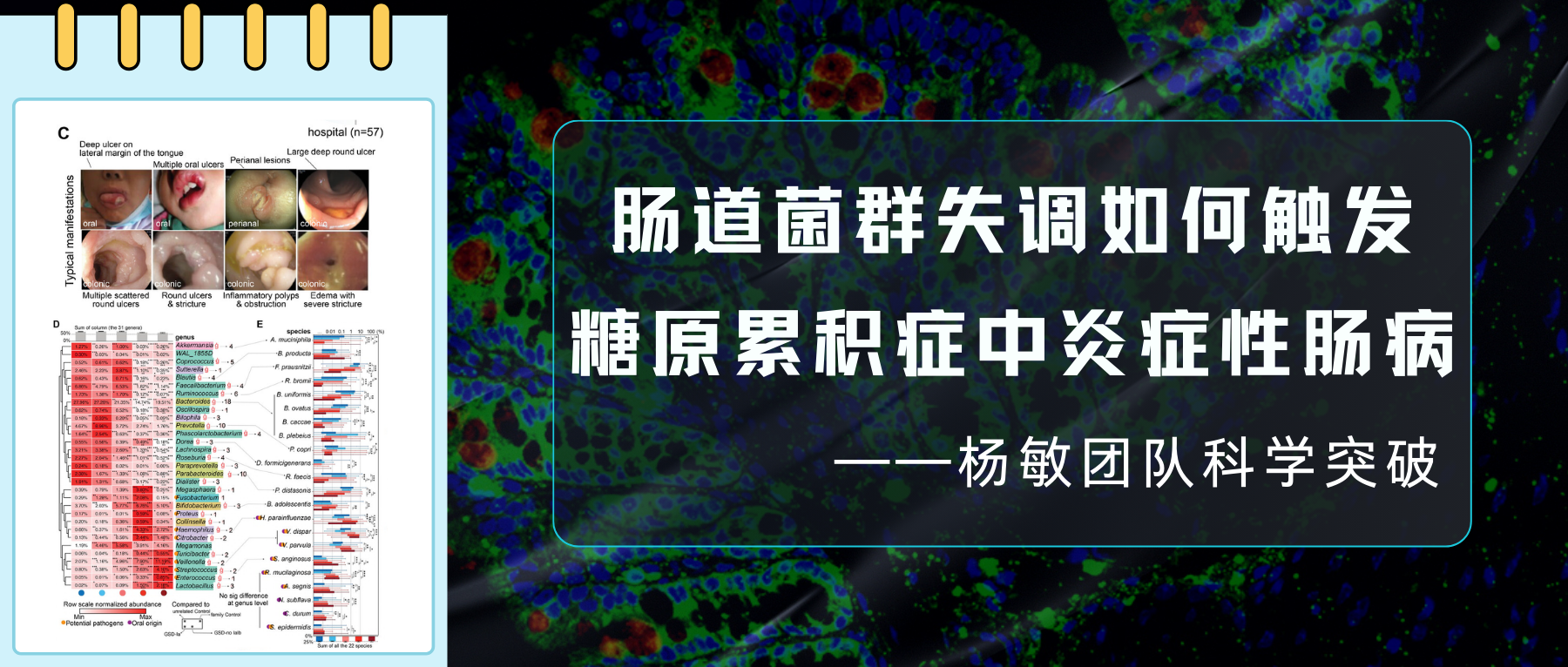
其中GSD-Ib型患儿消化道症状比例最高(77.8%)且最为特殊,表现为单个或多发散在深圆形溃疡、炎性假息肉、梗阻和狭窄(如下图)。
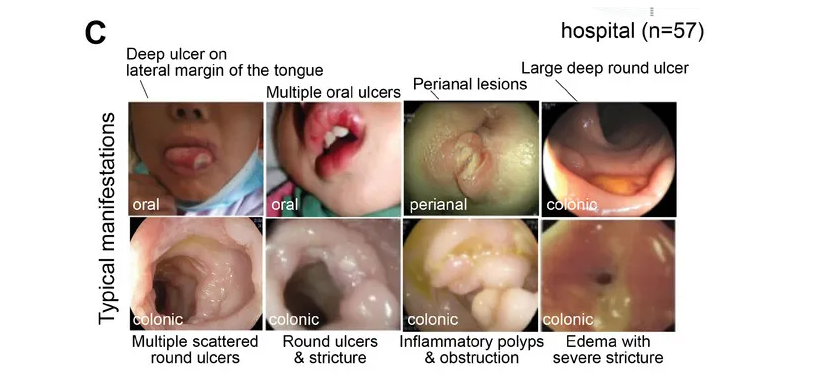
目前人们对 GSD-lb 中 IBD 的发病机制和发病原因知之甚少,超过 70% 的病例会出现严重的消化道症状,而这种症状在其他疾病亚型中偶尔才会出现。
如果不具体了解这些机制以及免疫系统与肠道微生物群之间的关系,科学家将无法开发出针对与 GSD 相关的 IBD 症状的有效治疗方法或干预措施。杨敏及其团队希望改变这一现状,开始了他们的实验探索过程。
▼
为了探究GSD群体消化系统异常,特别是IBD高发的原因,杨敏及其团队在全国23个省份招募了150名GSD患者(共涵盖Ia、Ib、III、IX、VI、IV及0型共7种类型)采集粪便样本, 327个健康对照者的粪便样本。
注:这327个对照样本包括:137 名家庭对照者和 190 名在山东、浙江、湖南等地收集的无关健康对照者。
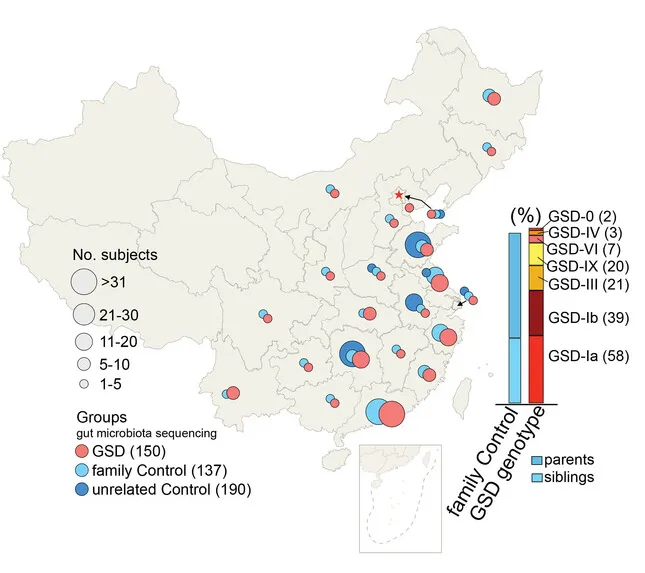
GSD基因型是肠道菌群的主要影响因素
肠道菌群受多种因素影响,包括饮食、地域和医疗条件等。
通过结合个人临床信息与肠道菌群数据的EnvFit分析发现(如下图),共有45个个人因素与肠道菌群的变异显著相关,如疾病情况(基因型)、家庭因素、年龄、身高体重、共患病等等。
值得注意的是,在这个队列中,GSD基因型主要影响肠道菌群组成。总体而言,家庭因素(家庭组配对比较)和居住地区是影响肠道菌群组成的第二和第三重要因素。
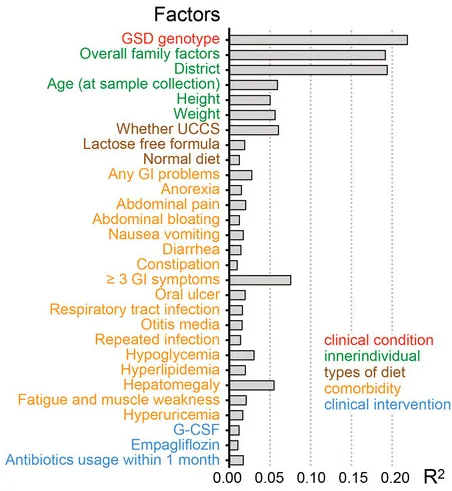
这在肠道菌群研究中颇为少见,因为多数研究认为地域因素极大且显著地影响个体菌群构成。这说明,特殊的基因型对于塑造个体肠道菌群构成起到决定性作用。
具体而言,研究人员将患者分为三组:
GSD-Ia、GSD-Ib、GSD-no IaIb
▼
GSD引起了个体肠道菌群多样性显著降低(下图H)及潜在致病菌显著升高(下图G),特别是GSD-Ia和GSD-Ib。这些肠道菌群的变化在校正性别、年龄、BMI和地域等因素后,仍然存在。
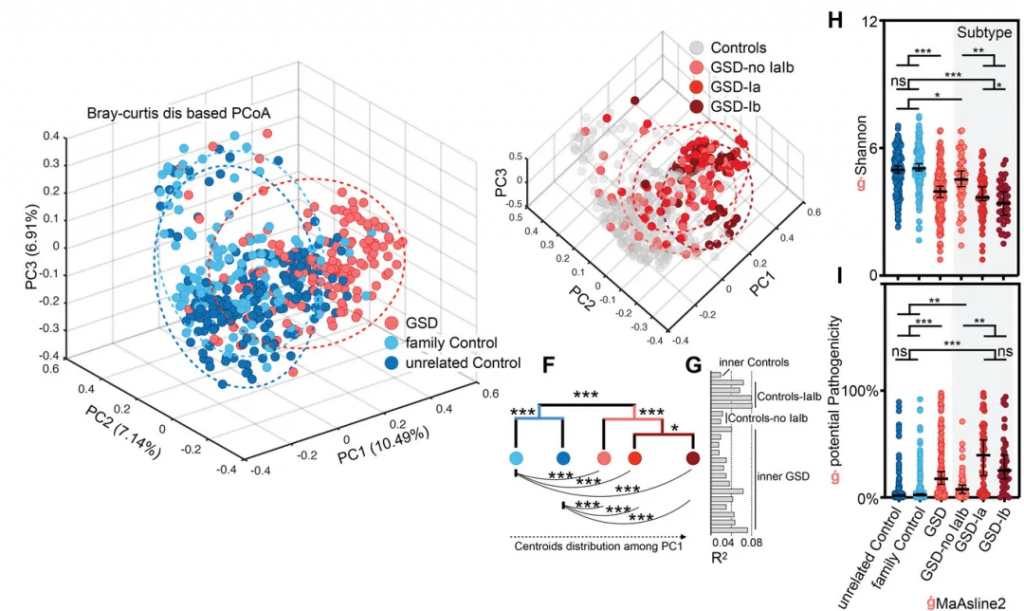
厚壁菌门和拟杆菌门仍是主要菌群;但变形菌门和放线菌门的比例显著增加。
GSD 患者共有31个属发生显著改变。其中18个属减少,而其余13个增加。这31个属中28个属在校正掉性别、年龄、BMI和地域等因素影响后,仍与GSD显著相关(下图D)。
有22物种的丰度和GSD显著关联(下图E),其中10 个增加和12个降低。
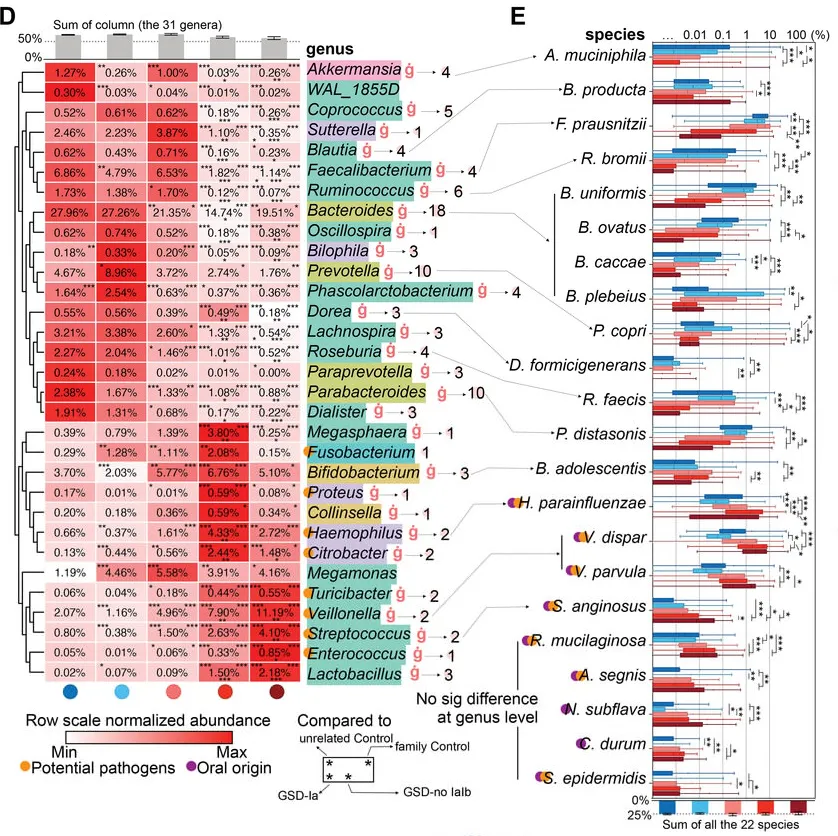
这31个显著改变的属的总丰度在不同分组人群中的总占比达到60-70%,种水平则为~25%,表明这些GSD相关的属种变化,是肠道菌群构成主体的紊乱。
▼
GSD-Ia和GSD-Ib患者表现出更严重的菌群紊乱,特别是那些最常见、功能性的微生物类群在其肠道内丢失,例如下列菌群在GSD-Ia和-Ib几乎完全耗尽:
丁酸可增强上皮氧合,有利于结肠中的低氧微环境并抑制病原体定植。然而,主要丁酸生产菌,如拟杆菌属、粪杆菌属和瘤胃球菌,以及相关代谢途径在GSD中显著降低,这可能导致兼性厌氧病原菌的延伸。
具体到每个菌来说:
AKK菌与肠道屏障的维持和抗炎作用有关,其减少可能会削弱肠道屏障,增加肠道炎症的风险,从而可能与IBD症状的出现有关。
粪杆菌参与肠道内的发酵过程,对维持肠道健康和免疫功能有重要作用。在糖原贮积病患者中,由于糖原代谢异常可能影响了肠道环境,进而影响了粪杆菌的定殖和功能,导致其数量减少。这可能会减少短链脂肪酸的产生,影响肠道健康。
拟杆菌在肠道内参与碳水化合物的分解,产生短链脂肪酸,糖原贮积病患者拟杆菌的减少可能导致肠道炎症反应加剧,与IBD症状的出现有关。
瘤胃球菌是产生短链脂肪酸的重要菌群,对肠道健康和宿主能量代谢有重要作用。瘤胃球菌的减少可能会导致短链脂肪酸的产生下降,影响肠道屏障功能和抗炎作用,从而可能与IBD症状的出现有关。以动物为基础的饮食会增加有害菌Ruminococcus gnavus。
GSD患者中存在口腔源的潜在病原体激增,例如:
口腔中的致病菌可以在肠道中定植和繁殖,说明肠道为这些菌群的生长繁殖提供了条件和环境。
链球菌,已被证明可通过GasderminA依赖性细胞焦亡诱导肠道损伤;可能通过产生超抗原等物质激活宿主T细胞免疫反应进而引发肠道炎症。
肠球菌的成员已显示出促炎作用;肠球菌可以通过分泌金属蛋白酶分解上皮钙黏蛋白破坏肠屏障。
韦荣氏球菌属在IBD中延伸,细小病毒通过产生硝酸盐诱导炎症。韦荣氏球菌属和链球菌的组合抑制了IL-12p70的生物合成,随后增强了IL-8、IL-6和TNFα的炎症反应。
菌群该定植时未定植,该退出时却长期占据
值得注意的是,双歧杆菌、韦荣球菌和乳杆菌这些本应该在健康儿童生命早期保持较高比例的细菌,在GSD患者的肠道中扩张,并且这些细菌在 GSD 患者的整个童年和成年期都会扩增,这可能抑制了其他正常菌群的定植。
▼
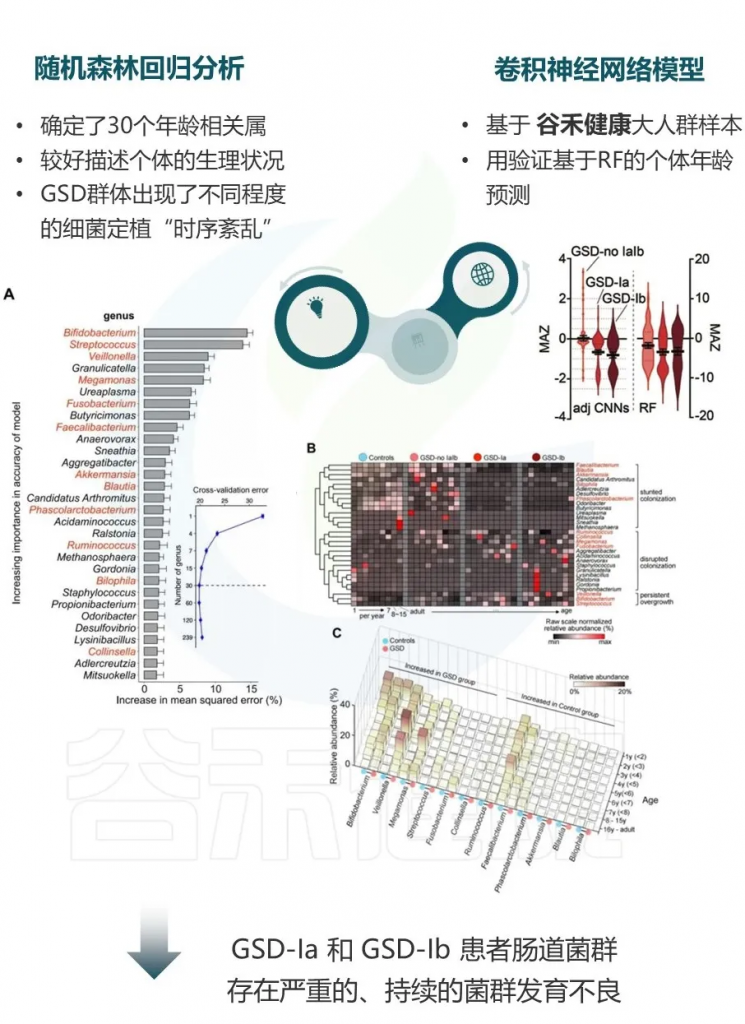
GSD患者肠道菌群发育落后于实际年龄
使用微生物组年龄Z分数(MAZ)评估菌群发育状态,随机森林回归和调整的深度神经网络分析均显示GSD患者的MAZ显著降低,特别是在GSD-Ia和Ib患者中。
这表明GSD患者的肠道菌群发育落后于实际年龄,呈现发育延迟状态。
▼
从数据分析的角度,研究团队进一步分析了GSD患病情况、共患病与肠道菌群紊乱的中介关系。
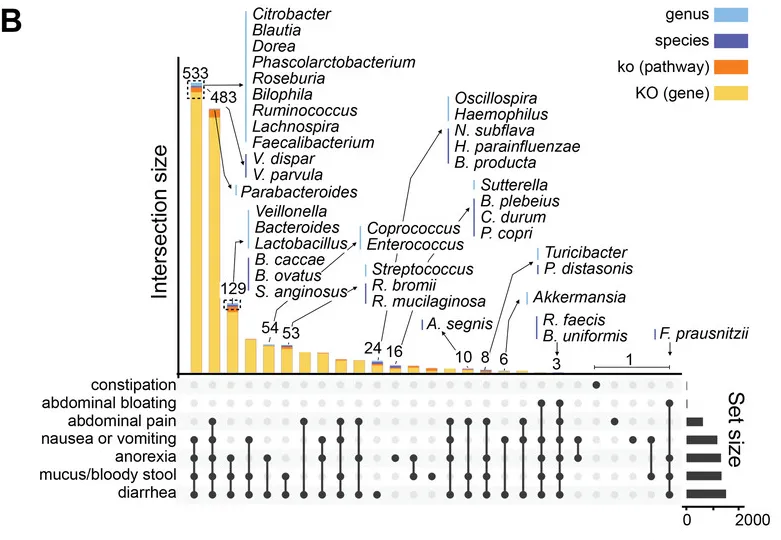
他们用最具代表性的肠道微生物特征和临床元数据构建了一个中介模型,在校正年龄、性别、BMI、地域及特殊治疗性饮食(生玉米淀粉)的影响后,肠道菌群仍然是GSD背景下,患者消化道异常的显著中介因子(下图)。说明GSD会通过影响肠道菌群构成最终造成消化道异常。
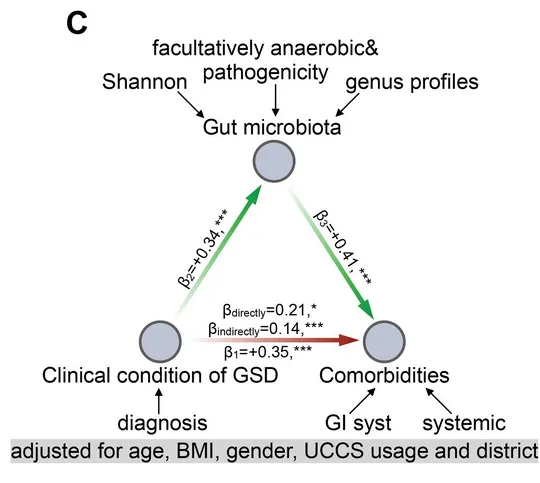
GSD 中这些细菌可能相互依赖资源和生存,形成一个复杂的相互支持网络,肠道菌群失调可能通过细菌的“群体犯罪”引起 GSD 患者的肠道上皮功能障碍。
下面我们来看一下该研究的另一个重要内容——肠道微生物群和免疫细胞之间的“串扰”。
▼
为了明确GSD相关的肠道菌群紊乱,如何引起个体IBD表性的产生。研究者们采集3名GSD-Ib患者的结肠粘膜组织(下图G),并使用单细胞测序技术分析患者结肠粘膜单细胞层面的转录水平变化。通过转录水平注释发现,相较于健康人、典型IBD和结肠炎的肠粘膜组织,GSD-Ib患者肠粘膜上有非常高的巨噬细胞聚集(下图H)。
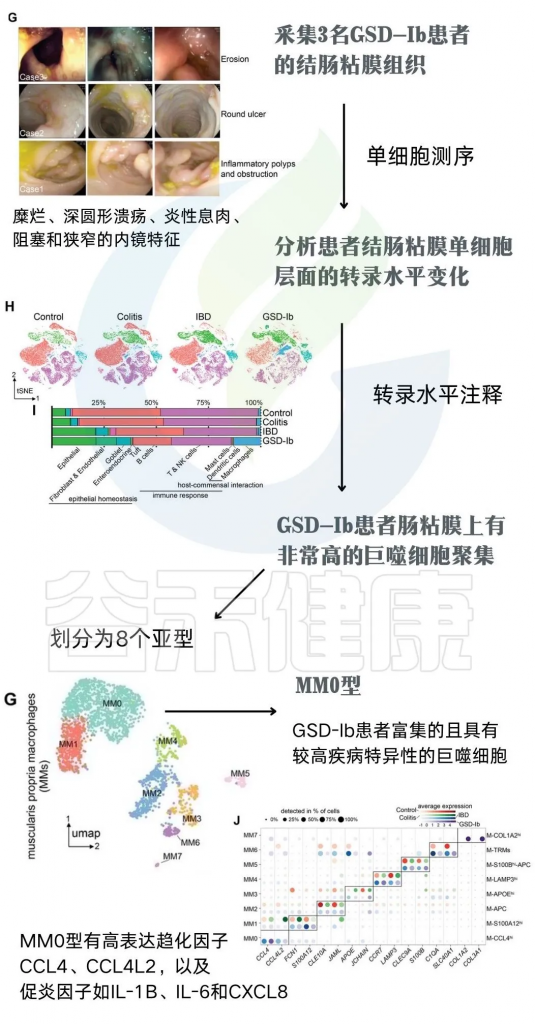
注:巨噬细胞中差异表达基因的KEGG通路注释显示,GSD-Ib中调节抗菌体液免疫反应和趋化因子介导的信号通路的基因集显著富集。GSD-Ib组中上调的基因主要参与环境信息处理和人类疾病。
“
更深入的分析确定了一种巨噬细胞亚型(MM0)的重要性,这种亚型产生一种名为CCL4L2的趋化因子,负责激活其他免疫细胞对抗有害细菌的生长。
虽然CCL4L2的自然功能通常是保护性的,但杨敏及团队怀疑,由于GSD-Ib患者相关肠道细菌的存在,CCL4L2的过度或失调刺激可能是他们出现IBD症状的可能原因。
这一点最初在实验室中得到了支持,其中用有害细菌感染的细胞获得的细胞培养基处理的巨噬细胞,比用对照培养基处理的巨噬细胞更加“激活”。
下面我们来看一下他们选用了哪些菌群进行相关实验,来刺激巨噬细胞:
▼
研究人员选择了三种GSD相关菌群来刺激巨噬细胞,即:
暴露于粪肠球菌、小弧菌和咽峡炎链球菌以及混合感染 (EVS) 的巨噬细胞中 CCL4L2 的表达在 mRNA 和蛋白质水平上显著增加,但不影响 IL-1 β和 IL-6 的表达。
来自EVS感染的条件培养基(CM)与对照组相比,诱导了显著的巨噬细胞迁移趋化性,而这种趋化性部分被CCL4L2中和所减弱。
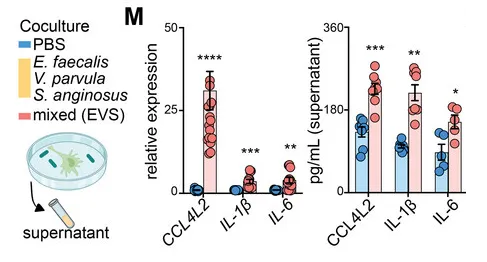
因此,是特定的肠道病原菌(如E. faecalis、V. parvula、S. anginosus)引发了CCL4L2的高表达,那么具体是如何影响炎症性肠病的进展?我们接着看。
“
然后,团队在从GSD-Ib患者取得的活检样本中寻找CCL4L2,并发现CCL4L2蛋白与一种叫做VSIR的受体结合,这种受体存在于肠道细胞壁中。
在IBD的小鼠模型中也发现了类似的结果,科学家们发现与健康对照组相比,巨噬细胞的水平更高,并且在用一种旨在抑制VSIR的抗体处理后,他们发现小鼠的症状加重了。
巨噬细胞通过CCL4L2-VSIR配体-受体信号与肠道上皮细胞相互作用,以促进损伤修复。
具体研究如下:
调节核糖体、氧化磷酸化途径和抗病原体反应的基因集在GSD-Ib上皮细胞中特异性富集。
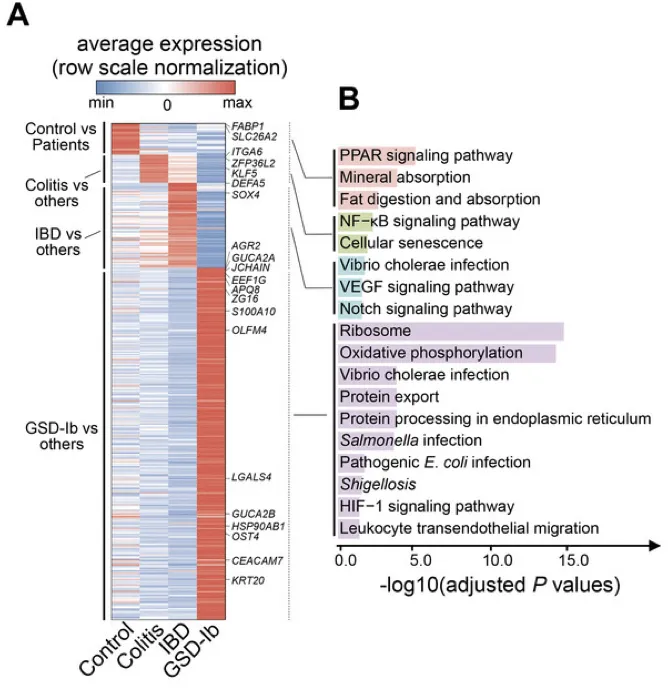
上皮细胞中典型的差异表达基因是AQP8、ZG16、GUCA2C、SLC26A3、AGR2,它们负责吸收、分泌、代谢、上皮屏障完整性、pH稳态、粘液屏障功能。
▼
免疫荧光染色显示GSD-Ib患者肠道组织中CCL4L2和VSIR的显著共定位,进一步验证了CCL4L2在巨噬细胞中的高表达及其与VSIR的相互作用。
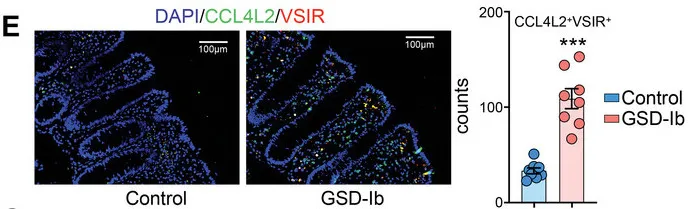
CCL4L2与其受体VSIR形成的CCL4L2-VSIR轴主导参与了MM0型巨噬细胞与其他类型细胞交互,特别是OLFM4+上皮细胞(这类细胞是GSD特异性增加的,同时也被报道在克罗恩病中较高)。
预测MM0巨噬细胞与其他细胞类型之间的相互作用
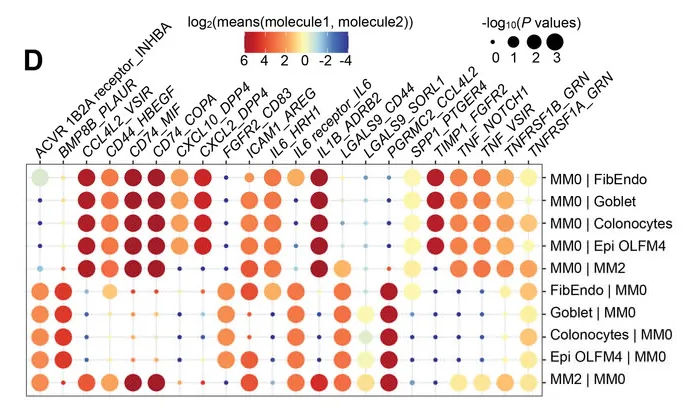
而这些受体细胞的基因表达情况,决定了患者肠道组织的疾病发展方向,如AGR2、ZG16、MUC2等。
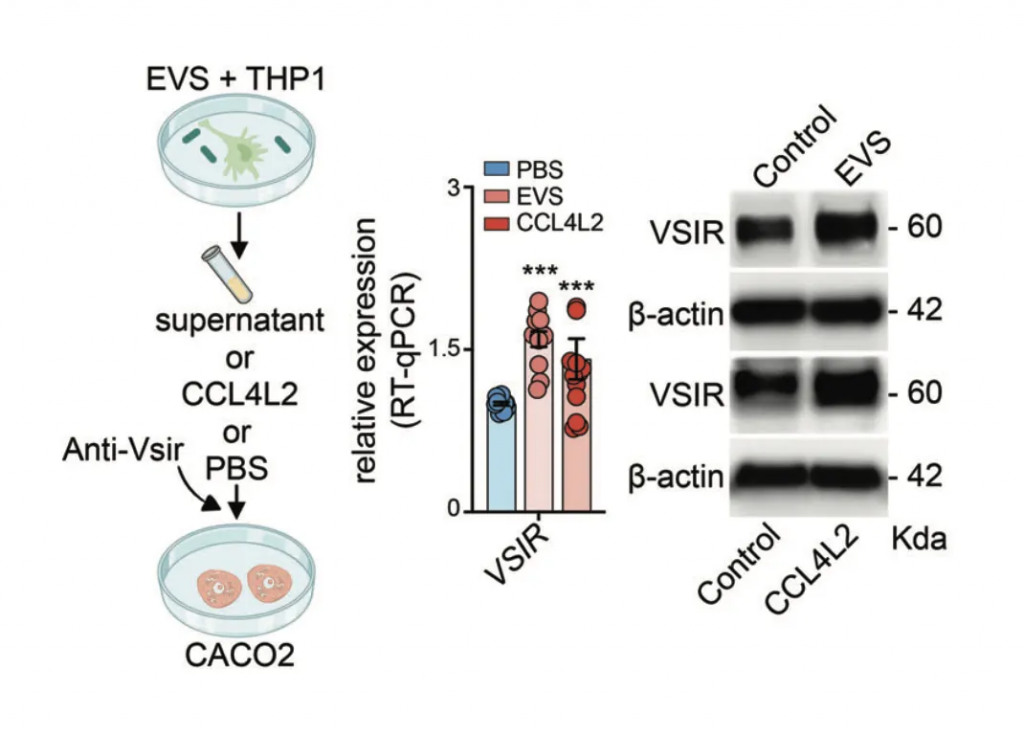
表明GSD相关的肠道菌群紊乱,通过引起肠上皮巨噬细胞高表达趋化因子CCL4L2,激活其他下游细胞膜蛋白VSIR表达,从而引起了GSD独有的消化系统IBD表型。这个现象进一步在C57BL/6小鼠中得到验证。
▼
研究人员在C57BL / 6小鼠中进行了选择性细菌移植,通过口服灌胃的方式将EVS移植到小鼠体内,并用DSS诱导结肠炎。研究发现,抗生素治疗显著降低了EVS灌胃诱导的小鼠血清CCL4L2水平,而抗VSIR则显示出完全相反的趋势。
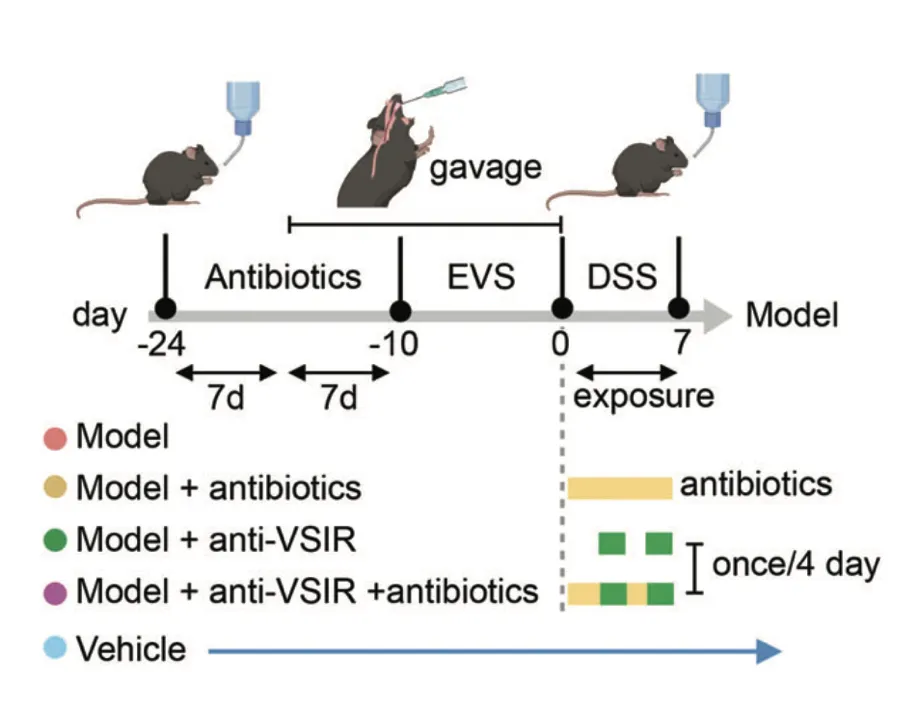
免疫荧光染色显示,模型组中MM0巨噬细胞增强,但在给予抗生素或抗VSIR注射后减少,这进一步导致模型组中肠上皮细胞的MUC2、AGR2和ZG16表达显著下调,引发粘膜损伤。
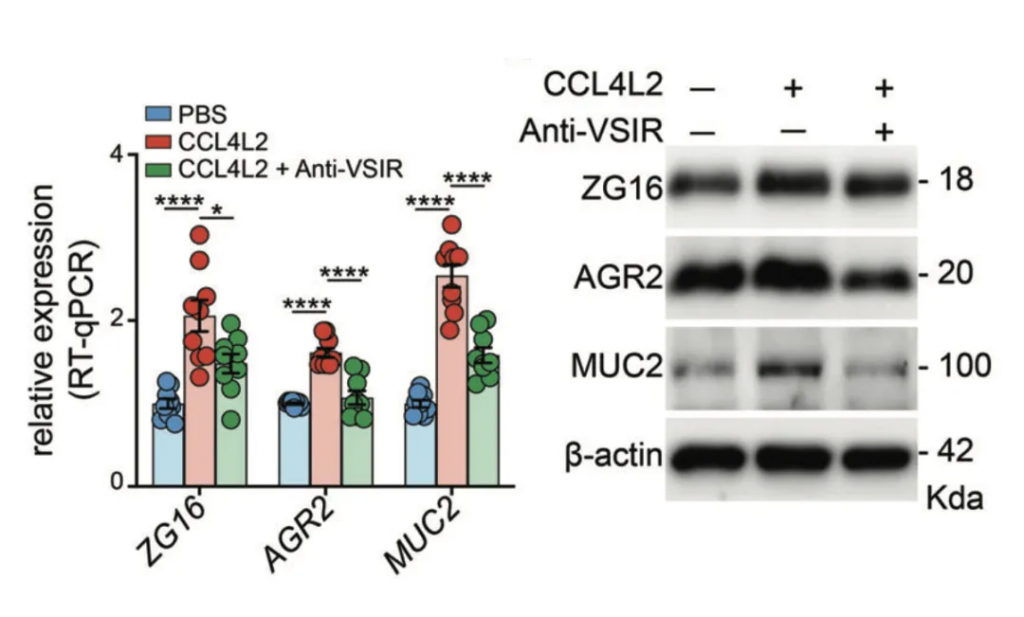
研究结果表明,EVS 增强的 MM0 巨噬细胞可以通过调节 CCL4L2-VSIR 轴来介导结肠肠上皮稳态。因此,靶向CCL4L2-VSIR通路可用于结肠炎和IBD的广泛应用。
肠道驻留免疫细胞和上皮之间的串扰,对于胃肠道稳态、抗原致敏调节、预防感染和 IBD 发展至关重要。在该研究中 GSD相关IBD 与典型的 IBD 相比具有不同的特征,特别是复杂的内镜表现及其特殊的解构:大量巨噬细胞积聚和上皮细胞增殖。
从病因上讲,肠道致病菌激活粘膜巨噬细胞导致胃肠道内形成炎症环境。在 GSD-Ib 中,一群独特的巨噬细胞由致病菌诱导,并表达高水平的趋化因子CCL4L2。
关于CCL4L2的有益方面:
潜在有害方面:
值得注意的是,CCL4L2-VIR通路的激活可能促进严重细胞因子风暴中的T细胞耗竭,这与新冠肺炎的不良预后有关。
靶向CCL4L2-VSIR可以抑制各种炎症性疾病、自身免疫性疾病和肿瘤转移。在这里,研究人员揭示了胃肠道中CCL4L2-VSIR轴的异常激活,最终驱动GSD-Ib中的非典型IBD。该发现为诊断和治疗GSD-Ib以及潜在的GSD相关IBD引入了一个新的靶点,并为VSIR相关研究提供了证据。
总的来说,这项研究证实了在糖原贮积病群体中独有的肠道菌群紊乱,即:
而这样的肠道菌群紊乱会引起个体结肠巨噬细胞高表达CCL4L2,并通过其受体蛋白VSIR介导上皮细胞的异常基因表达,最终造成GSD相关的IBD表型。
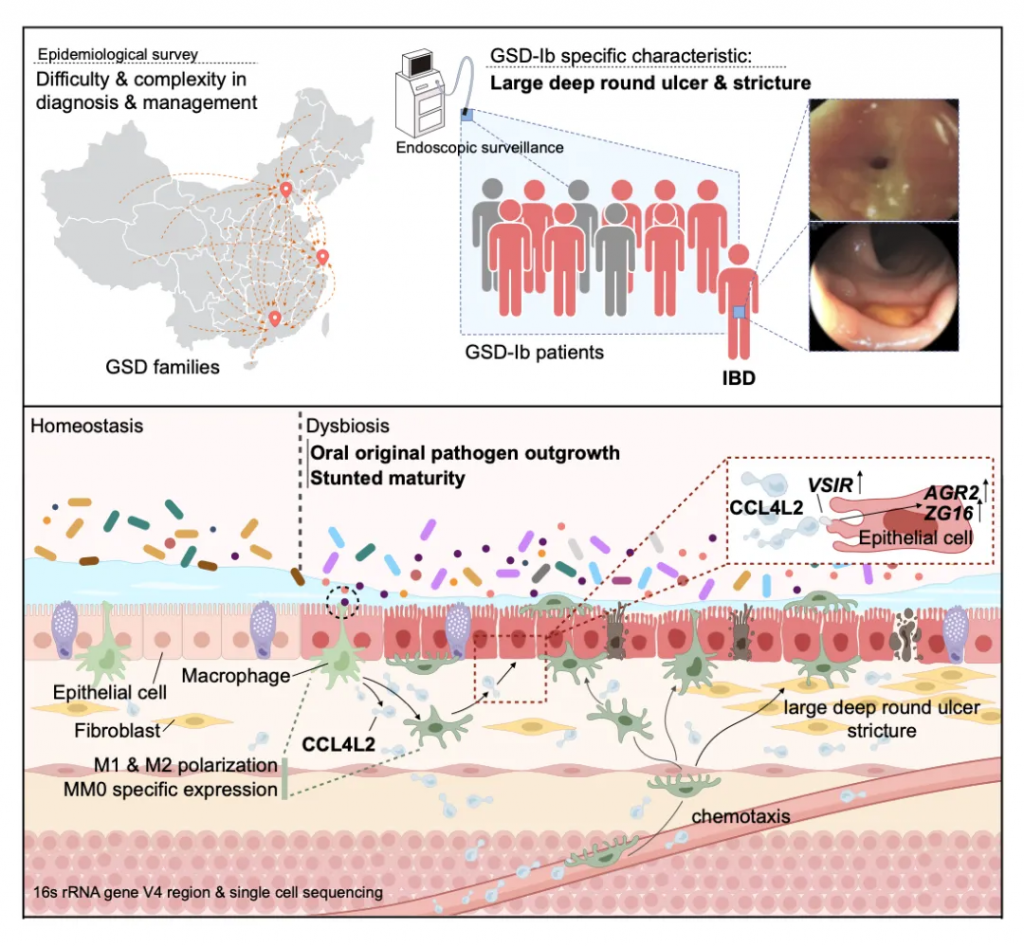
该研究的意义及未来方向:
该研究通过识别GSD-Ib与IBD之间的特定生物学联系,推动了精准医疗在代谢性疾病和消化系统疾病中的应用。
目前杨敏团队正在研究 CCL4L2-VSIR 通路的作用机制,并将探索其在患者治疗中的潜力。该团队预计,针对这一通路不仅可以为 GSD 患者提供有益的治疗,还可以为结肠炎和其他形式的 IBD 患者提供有益的治疗。
CCL4L2-VSIR轴的发现也可能促进新药开发,特别是针对GSD-Ib相关IBD的治疗。
这些研究结果也可应用于个性化治疗方案(基于肠道菌群特征),为患者提供更有效的治疗选择,有助于改善GSD-Ib患者及更广泛消化系统疾病患者的生活质量。
主要参考文献
Lan J, Zhang Y, Jin C, Yang M et al., Gut Dysbiosis Drives Inflammatory Bowel Disease Through the CCL4L2-VSIR Axis in Glycogen Storage Disease. Adv Sci (Weinh). 2024 Jun 18:e2309471.
Gümüş E, Özen H. Glycogen storage diseases: An update. World J Gastroenterol. 2023 Jul 7;29(25):3932-3963.
Hannah WB, Derks TGJ, Drumm ML, Grünert SC, Kishnani PS, Vissing J. Glycogen storage diseases. Nat Rev Dis Primers. 2023 Sep 7;9(1):46.
Zhong J, Gou Y, Zhao P, Dong X, Guo M, Li A, Hao A, Luu HH, He TC, Reid RR, Fan J. Glycogen storage disease type I: Genetic etiology, clinical manifestations, and conventional and gene therapies. Pediatr Discov. 2023;1(2):e3.
Wang Y, Liu H, Dong F, Xiao Y, Xiao F, Ge T, Li D, Yu G, Zhang T. Altered gut microbiota and microbial metabolism in children with hepatic glycogen storage disease: a case-control study. Transl Pediatr. 2023 Apr 29;12(4):572-586.