-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
冠心病患者的肠道微生物群存在差异,这已成为共识。 研究表明,肠道微生物群与肥胖、糖尿病、血脂异常和高血压有关,这些都是冠心病的危险因素。肠道微生物群通过其代谢产物参与介导胆固醇代谢、尿酸代谢、氧化应激和炎症反应等基本代谢过程,可诱导动脉粥样硬化和冠心病的发生。 干扰肠道微生物群的组成,补充益生菌和粪便捐赠是潜在预防和治疗冠心病的热门研究领域。
研究表明,肠道菌群与肥胖,糖尿病,血脂异常和高血压有关,它们是冠心病的危险因素。
肠道菌群与肥胖
2004年,Bäckhed等人首先报道了肠道微生物群与肥胖有关,因为他们发现肠道微生物群可以调节实验小鼠的脂肪储存。在人和小鼠中都发现了与肥胖相关的相似的肠道菌群。在肥胖的小鼠和肥胖的人类肠道微生物群中,厚壁菌/拟杆菌比例更高。 他们的结果表明,肥胖患者的微生物组从饮食中获取能量的能力更强。 这一发现进一步证实了肠道菌群与肥胖之间的关系。
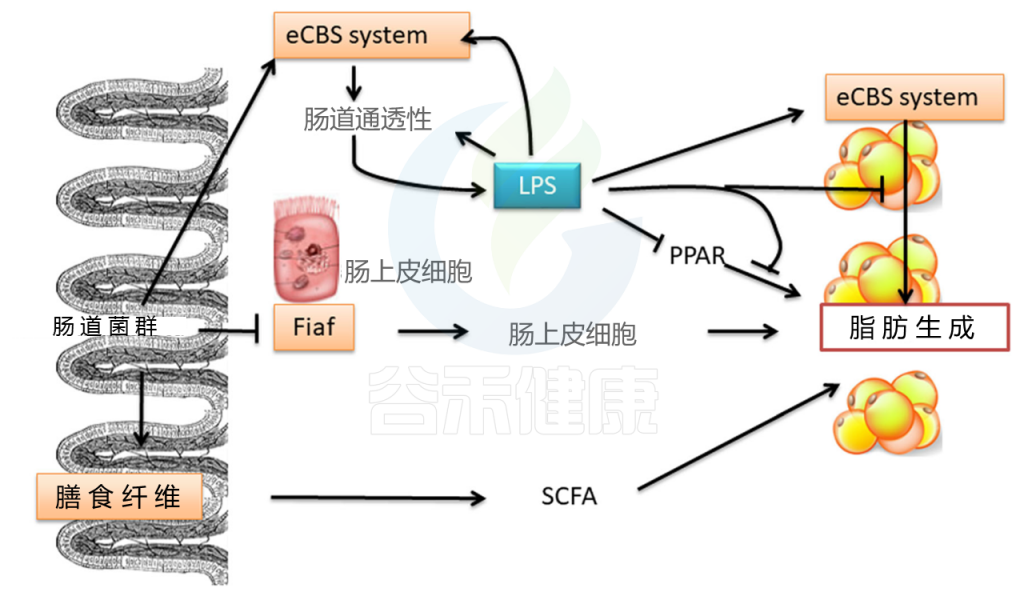
目前的研究表明,肠道菌群可能导致肥胖(图1)。 肠道微生物群会发酵宿主无法消化的物质,将其转化为小分子,例如短链脂肪酸(SCFA),并为宿主提供能量。 肠道菌群抑制禁食诱导的脂肪细胞因子(FIAF)的表达,增加脂蛋白脂肪酶的表达,并促进脂肪细胞中甘油三酸酯的储存(乙酰辅酶A羧化酶[ACC]和脂肪酸合成酶[FAS]是关键的调节剂),因此诱发肥胖。肠道菌群还调节内源性大麻素(CB)系统。
CB调节肠的通透性以及肠粘膜中紧密连接蛋白的定植和分布,从而导致肠通透性增强,脂多糖和炎症反应增加,从而导致肥胖。
图1 肠道微生物群对肥胖的影响

肠道菌群和糖尿病
糖尿病是冠心病的主要危险因素。糖尿病患者的冠心病发病率为55%,是非糖尿病患者的几倍。糖尿病的发病机制与环境因素和宿主遗传有关。 作为重要的环境因素,肠道菌群与糖尿病密切相关。 在人类粪便微生物群的研究中,这些有益细菌与改善胰岛素敏感性和改善糖尿病有关。增加糖尿病风险的细菌是有害的。
对我国345例糖尿病患者肠道微生物DNA的基因组学分析显示,中度菌群失调是2型糖尿病患者正常菌群平衡受到干扰的状态。 为了对2型糖尿病患者的肠道微生物含量进行分析,开展了一个全基因组关联研究(MGWAS),并根据shotgun法对来自345位中国人的肠道微生物DNA进行了两阶段的MGWAS分析。 此外,共生丁酸产生菌数量减少,而条件致病菌的数量增加。
对145名欧洲糖尿病女性的肠道菌群进行的研究也得出了相似的结果:产生丁酸的梭状芽孢杆菌数量减少,而乳酸杆菌属和链球菌属增加。
普氏菌(Prevotella copri)和普通拟杆菌(Bacteroides vulgatus)是支链氨基酸合成与胰岛素抵抗之间联系的驱动因素。 胰岛素抵抗者的血清代谢组的特征是支链氨基酸(BCAAs)含量升高,已证明Prevotella copri可以诱导胰岛素抵抗,加重葡萄糖耐量和增加小鼠BCAA的循环水平。普通拟杆菌可以引起胰岛素抵抗并增加循环支链氨基酸水平,从而介导糖尿病。 许多研究表明,肠道菌群通过影响胰岛素抵抗和胰岛素分泌失调来促进糖尿病(图2)。
图2 肠道微生物群对糖尿病的影响
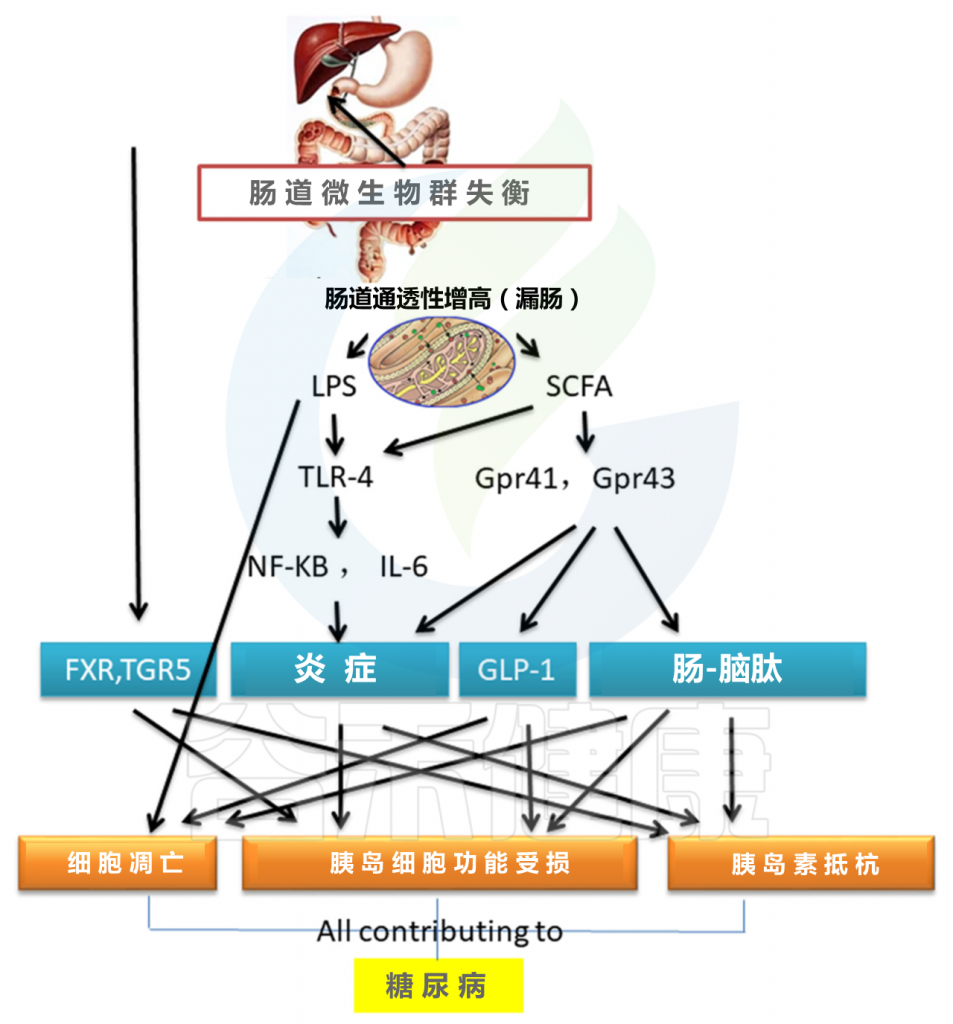

肠道菌群与2型糖尿病之间的重要联系是Toll样受体(TLR)。 肠道菌群的变化通过调节TLR4参与胰岛素抵抗诱导的肥胖。 来自肠道菌群的脂多糖(LPS)通过肠道吸收进入血液循环,这一过程称为代谢性内毒素血症。TLR4缺失对胰岛素抵抗的保护作用与其对代谢性内毒素血症信号转导的抑制有关 。LPS可以促进胰岛B细胞的凋亡并减少胰岛素分泌。
肠道菌群失衡会导致短链脂肪酸(SCFA)失调,这在调节肠道菌群,维持体液平衡,为肠上皮提供能量,抑制炎症因子形成以及促进肠黏膜修复方面起着重要的作用。增加的SCFA可以诱导TLR4信使RNA表达显着增加,并增强NF-κB与白介素(IL)-6结合。
SCFA与G蛋白偶联受体41/43结合也可影响抗炎和脑肠肽激素分泌功能,导致胰岛素抵抗和胰岛细胞功能障碍,并导致胰岛素样生长因子-1(GLP-1)分泌障碍(例如GLP-1可降低血糖和胰岛细胞凋亡)。
此外,肠道菌群的结构和体内稳态的变化会改变胆汁酸的转化,从而导致异常的TGR5和法尼醇X受体(FXR)信号通路。 这种变化会导致代谢紊乱,最终导致糖尿病。
肠道菌群和血脂异常
血脂异常与冠心病密切相关。饮食,肥胖,激素,基因和其他因素会导致血脂异常。
肠道菌群的生理和代谢活动对于调节和维持人类平衡的脂质代谢至关重要。厚壁菌和拟杆菌属是影响血脂改变的主要细菌菌群。 肠道菌群的脂质代谢产物(例如胆碱,三甲胺氧化物[TMAO]和甜菜碱)会促进动脉粥样硬化并增加患心血管疾病的风险。肠道菌群会影响血清甘油三酯和高密度脂蛋白胆固醇的转化。
三种机制很可能导致血脂异常。
首先,肠道菌群产生胆汁盐羟化酶,将结合的胆汁酸转化为二级游离胆汁酸。二级游离胆汁酸可通过G蛋白偶联受体调节肝脏和脂质的代谢,肠道菌群紊乱可导致胆汁酸分泌异常,从而引起血脂异常。
其次,肠道菌群将胆碱和肉碱从宿主转化为三甲胺(TMA),而TMA在肝脏中转化为TMAO。 TMAO可通过影响胆固醇的运输和代谢以及胆汁酸水平而引起血脂异常和动脉粥样硬化斑块。
第三,SCFAs可以抑制肝脏脂肪合成酶的活性,调节血液和肝脏中胆固醇的分布,从而在降低血清3-酰基甘油和胆固醇水平方面发挥作用。
细菌异常会导致SCFA分泌不足和血脂异常。 益生菌可以降低血清胆固醇并增加高密度脂蛋白含量,这表明正常的肠道菌群间接地参与了血脂水平的降低。
肠道菌群与高血压的关系
高血压是导致心血管疾病的关键因素。 本研究表明,除了公认的高血压病因(例如交感神经系统过度活跃,肾素-血管紧张素-醛固酮系统活化以及水和钠潴留),肠道菌群也与高血压密切相关(图3)。
图3 肠道微生物群对高血压的影响
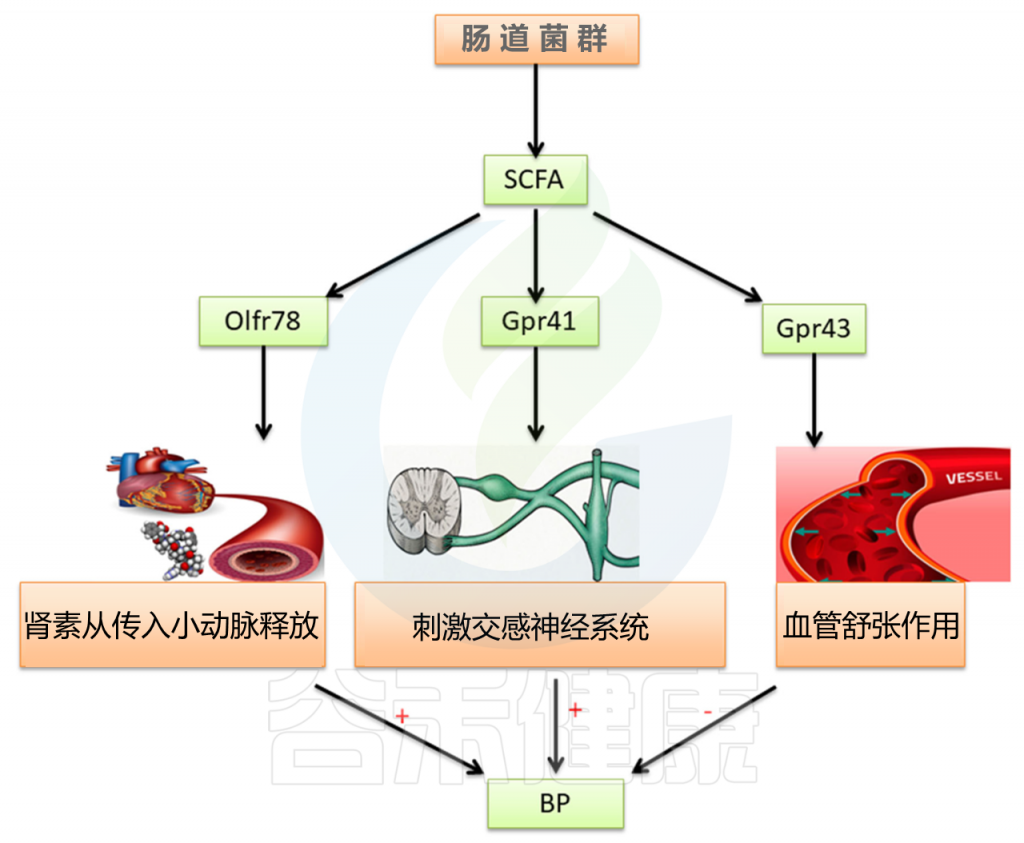

对原发性高血压大鼠粪便细菌的分析表明,细菌数量和多样性明显降低。厚壁菌和拟杆菌的比例增加,SCFA产量降低。
SCFA可通过与嗅觉受体78(OLFR78),G蛋白偶联受体41(GPR41)和G蛋白偶联受体43(GPR43)结合来调节血压。
SCFA在维持肠上皮屏障功能中发挥作用。它们可以减少炎症反应,直接影响免疫细胞,减少交感神经活动,从而改善高血压。 此外,一项研究还报道了肠道菌群可以影响血管活性激素(如5-羟色胺,多巴胺和去甲肾上腺素)的形成,从而在调节血压中发挥作用。
最近的一项临床研究对高血压患者的粪便菌群进行了分析,并发现了类似的结果。普雷沃氏菌和克雷伯氏菌的比例显著增加。将健康对照组和高血压组的肠道菌群移植到GF小鼠体内。用高血压患者粪便细菌移植治疗的小鼠血压显著升高。这表明肠道微生物群与宿主的血压有关,并进一步证实不平衡的肠道微生物群是高血压的重要致病因素。
肠道微生物群参与调节基本代谢过程,如胆固醇代谢、尿酸代谢、氧化应激和炎症反应,通过其代谢物,可导致动脉粥样硬化和冠心病的发展。
冠心病患者肠道菌群的变化
在2012年,Karlssion等人使用全基因组测序来确定肠道菌群变化与动脉粥样硬化性心脏病之间的可能联系。与健康人群相比,Collinsella菌的数量增加,而 Rothia 和 Eubacterium 菌数量减少。 使用宏基因组技术进行的进一步功能分析表明,冠心病患者肠道菌群中编码肽聚糖合成的基因增加,而编码八氢番茄红素去饱和酶的基因(与血清中β-胡萝卜素减少相关)减少。
2016年,Emoto等人使用末端限制性片段长度多态性(T-RFLP)和16S rRNA来研究冠心病患者和健康志愿者之间肠道菌群的差异。结果表明,在冠心病患者中,成熟的乳杆菌数量显着增加,而拟杆菌(双歧杆菌和普氏杆菌)显着下降。此外,厚壁菌/拟杆菌的比例明显增加。 该研究还发现,不使用抗生素的冠心病患者肠道菌群中乳酸菌的比例显着增加,而拟杆菌的比例显着下降。
2017年,这些作者在两项临床试验中再次验证了这些结果。首次将肠道菌群结构的变化直接鉴定为冠心病的诊断标记。
TMAO在冠心病中的作用
肠道菌群产生的代谢性TMAO是心血管疾病的关键机制(图4)。 食物中的胆碱(例如,磷脂酰胆碱,胆碱,L-肉碱和其他三甲胺[TMA])通过肠道微生物酶复合物来产生TMA。 然后TMA进入门静脉循环,并被宿主的肝酶进一步代谢,从而产生TMAO。
图4 TMAO对冠心病的影响
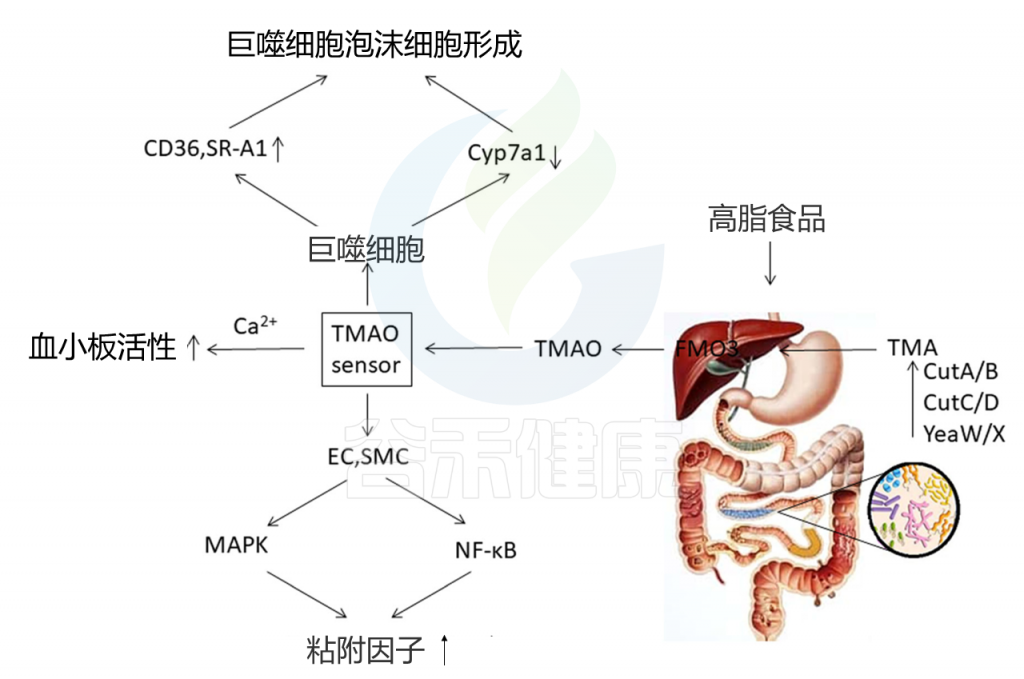

当前的研究表明,血浆TMAO水平与冠心病风险高度相关。临床研究还表明,TMAO增加了患心血管疾病的风险,并增加了急性心肌梗塞,心源性休克和死亡的发生率。
一项为期3年的研究(涉及4007名参与者)进行了选择性冠状动脉造影术。 结果表明,空腹血浆TMAO水平在独立于传统心血管危险因素的心脏事件预测中发挥作用。 这项研究表明,最高四分位数患者中,TMAO水平较高的患者恶性心脏事件的发生率比最低四分位数患者高2.5倍。 而且,TMAO的风险比显着高于低密度脂蛋白的风险比。校正传统的危险因素和肾功能后,TMAO水平仍是恶性心血管事件的独立预测因子。
Cyp7al是胆汁酸合成中的主要酶。Cyp7al的表达上调可以帮助扩大胆汁酸库,增加胆固醇的运输,并最终减少动脉粥样斑块的形成。TMAO可以降低Cyp7al的表达,抑制胆固醇的运输,引起胆固醇在细胞中的积累,并导致形成泡沫细胞。
TMAO还可以诱导血小板反应过度,因此成为动脉粥样硬化的危险因素。 TMAO与血小板之间的相互作用可能通过改变血小板依赖性钙信号传导而促进血小板高反应性并增强体内血栓形成。据报道血小板高反应性是心血管事件的危险因素。
最近的证据表明,TMAO可以在数分钟内迅速向细胞发送信号。 在内皮或平滑肌细胞中,TMAO可以迅速诱导丝裂原活化的蛋白激酶和NF-κB活化,并引起下游粘附分子的上调。 TMAO水平升高还与SMAD 3 蛋白的磷酸化增加有关。 SMAD 3是转化生长因子β(TGF-beta)途径中的关键信号。 在动物模型中,TMAO促进血管炎症并诱导主动脉内皮细胞活化和粘附蛋白上调。这些作用都是急性冠状动脉综合征的关键机制。
肠道菌群通过尿酸对冠心病的作用
血清尿酸水平可能是冠心病的独立危险因素。 尿酸在体内具有氧化特性。 血尿酸水平升高会导致血尿酸增加氧自由基,氧化应激,血管内皮功能障碍,炎症反应以及动脉粥样硬化的发展。
肠道菌群通过调节尿酸代谢来影响氧化应激过程。 大肠杆菌含量越高,尿酸分解越多。 冠心病患者血清尿酸水平升高与肠道菌群功能障碍有关。高尿酸血症也是动脉粥样硬化的危险因素。血清尿酸水平升高会增加氧自由基的产生,引起氧化应激,并引起内皮功能障碍。UA水平与循环类胡萝卜素成负相关。
与年龄,性别,总能量,蛋白质和维生素摄入量无关,循环尿酸水平与总类胡萝卜素(尤其是α-胡萝卜素,番茄红素,叶黄素,玉米黄质和硒)呈负相关。 类胡萝卜素作为抗氧化剂,具有抗心绞痛的作用。一项研究分析了动脉粥样硬化患者和正常对照组的肠道菌群结构,发现动脉粥样硬化患者的肠道菌群富含编码肽聚糖生物合成的基因,而正常对照组的肠道菌群富含类胡萝卜素编码基因。肠道微生物疾病会导致含有合成类胡萝卜素基因的细菌减少,从而降低血液中的类胡萝卜素水平并削弱抗氧化作用,从而促进动脉粥样硬化的发展。
肠道菌群失衡与冠心病的发病机制有关。 这是一种有效的靶向疗法,但缺乏与冠心病和心肌梗塞患者干预相关的数据。 Lam等人使用抗生素抑制肠道菌群,并观察这些变化对急性心肌梗死(AMI)小鼠预后的影响。 研究结果表明肠道菌群变化与心肌梗死之间存在联系,并证明益生菌补充剂可以减少心肌梗死率。 Gan等研究了给予益生菌以减轻心肌梗塞后心肌肥大的小鼠。作者确定,干扰肠道菌群结构并改善急性心肌梗死的预后可能成为AMI的新疗法。
在当前的临床实践中,益生元和益生菌是调节肠道菌群失衡的主要治疗工具。 为了确定益生菌是否可以改变心肌梗塞后患者的预后,研究人员建立了大鼠心肌梗死模型,并在大鼠饮用水中随机给予GR-1或安慰剂和益生菌。 16S rRNA用于对大鼠盲肠微生物组成进行测序,两组之间无明显差异。 但是,心钠素的基因表达有所不同。接受GR-1的动物的左心室肥厚较轻,血液动力学参数更好。 停止使用益生菌后的四个星期,两组仍然存在差异,这表明在治疗结束后GR-1的作用仍然存在。
益生菌可以用作预防冠心病和改善心肌梗死患者预后的潜在疗法。 益生元作为发酵底物,可以增强有益肠道菌群的活性,并有效改善血糖控制和血浆脂质分布。此外,益生元还可以改善肠道通透性,减少代谢性内毒素血症,减轻炎症,缓解糖尿病患者对葡萄糖不耐的症状。
研究人员认为,粪便捐赠是一种治疗由于微生物引起的肠外疾病的新疗法。研究表明,健康人向代谢综合征男性患者捐赠粪便样本后,在6周后就会增加胰岛素敏感性和丁酸水平。 但是,该研究并未证实改善肠道菌群结构是否可以预防冠状动脉粥样硬化或降低AMI发生率。 需要大样本的前瞻性队列研究来进一步探讨肠道菌群与冠心病之间是否存在因果关系。
最近,研究人员发现DMB可以抑制TMA的产生。 抑制TMA的产生可降低小鼠的TMAO水平和动脉粥样硬化斑块形成,且无不良反应。 此外,在一些天然安全食品中也富含DMB,例如醋,红酒,初榨橄榄油和葡萄籽。因此,可以通过食用DMB胆碱来调节潜在的动脉粥样硬化来防止TMA产生。
本文介绍了肠道菌群与冠心病之间的关系,以及目前对这种关系的研究。 已经达成共识,冠心病患者的肠道菌群存在差异。 无菌小鼠模型和菌群基因组学技术的出现可以帮助确定肠道菌群与冠心病之间的关系,并将肠道菌群研究的准确性提高到菌株水平。
展望未来,早期发现和抑制冠心病发展,并进行干预调节是预防冠心病发展的关键目标。
【参考文献】
Liu Huagang,Zhuang Junli,Tang Peng et al. The Role of the Gut Microbiota in Coronary Heart Disease.[J] .Curr Atheroscler Rep, 2020, 22: 77.
Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation. Cell. 2014;157(1):121-41.
CM O, K R. Heartbeat: the gut microbiota and heart failure. Heart. 2016;102(11):811 TMAO increases the risk of cardiovascular disease
Richards EM, et al. The gut, its microbiome, and hypertension. Curr Hypertens Rep. 2017;19(4):36
Pedersen HK, Gudmundsdottir V, Nielsen HB, Hyotylainen T, Nielsen T, Jensen BAH, et al. Human gut microbes impact host serum metabolome and insulin sensitivity. Nature. 2016;535(7612):376–81