-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
韦荣氏球菌属(Veillonella)是革兰氏阴性厌氧性微小球菌,直径0.3~0.5μm,初期培植为革兰氏阳性,过夜转为阴性。光学显微镜下为双球状、片状和短链状,无荚膜,无鞭毛,无芽孢。最适生长温度37℃,最适pH6.5~8.0。
Veillonella该属的成员是非发酵的,它们无法使用碳水化合物或氨基酸,不发酵无法葡萄糖或任何其他碳水化合物(除了有一个种发酵果糖外)或氨基酸,但它们会积极发酵发酵丙酮酸、乳酸、苹果酸、富马酸和草酰乙酸。胰蛋白酶-葡萄糖-酵母提取物肉汤中的主要代谢终产物是乙酸和丙酸。能代谢乳酸产生丙酸、CO2和H2。一些物种产生一种缺乏卟啉的非典型过氧化氢酶。大多数菌株产生气体,如H2S。
在动物和人的自然腔道中大量存在,是分布于口腔、咽部、呼吸道、消化道的常见菌群。其粘附于表面或与其他细菌并形成生物膜的能力对于肠道和口腔微生物群组成和功能至关重要,尤其是在口咽和肠道中。 在一些严重的感染过程中,如菌血症、骨髓炎和心内膜炎,在各种混合感染中起作用。常从软组织脓肿及血液中检出。青霉素已被建议作为韦韦氏菌属病原体感染的治疗选择 。
Veillonella属最早于1898年被Veillon和Zuber分离。Prevot在1933年进一步描述了这些细菌,并提出了目前的分类法。
大多数Veillonella菌是从脓肿,吸入性肺炎,烧伤,叮咬和鼻窦中回收的。在95%例患者中感染是多菌种,但在5%例患者中,纯培养物中回收Veillonella。与该菌检出相关的诱因条件是先前的手术,恶性肿瘤,类固醇治疗,异物和免疫缺陷。。
已知的Veillonella属中已描述了超过10种。
人类样品分离出(齿状Veillonella denticariosi,Veillonella dispar,Veillonella montpellierensis,Veillonella rogosae 和 Veillonella tobetsuensis)
非人类动物样品分离出(Veillonella caviae,Veillonella criceti,Veillonella magna,Veillonella ratti和Veillonella rodentium)
Veillonella atenty 从人和其他动物来源分离出。
它们的表型特征,包括形态,主要代谢终产物,产气,硝酸盐还原和琥珀酸脱羧,这些菌株被鉴定为Veillonella属的成员。 多基因座序列分析和相应的系统发育基于16S rRNA,dnaK和rpoB基因,以及新近提出的gltA基因。
其中一个重要的菌种,小韦荣球菌(Veillonella parvula)在120年前,当Veillon和Zuber将其从阑尾炎脓肿中分离出来时被发现并被描述。六十年后,同样的微生物被用于第一次观察外膜(OM),从而证明了革兰氏阴性和革兰氏阳性细胞包膜结构之间的关键区别。目前在包括口腔、肺、胃肠道和阴道内的人体多个生态位中发现了Veillonella parvula菌。Veillonella parvula可能在许多环境中发挥重要作用,但其主要生态位是作为口腔中的第二殖民者。
与口腔疾病
Veillonella是牙周炎的重要病原体,是舌苔中的本土口腔细菌,而且Veillonella附着在舌头上的能力很高,已被确定为硫化氢(H2S)的主要生产者,H2S是口腔恶臭的主要成分之一。并且在1份报告中,它是慢性上颌窦炎中最常见的厌氧性病原体。
口腔生物膜是一个多物种的社区,敌对双方共存,以保持社区成员的生态平衡。 在早期的口腔生物膜形成的各个阶段中,Veillonella作为早期定居物种可以与许多细菌形成聚集,包括最初的定居者戈登链球菌和牙周病原体Fusobacter nucleatum。 除了为许多微生物提供结合位点外,Veillonella还能为牙周病原体的生存和生长提供营养。 这些发现表明,Veillonella在口腔生物膜的发育和人类口腔生态学中起着重要的“架桥”作用。
Veillonella和链球菌在生态系统(如口腔和结肠)中发生代谢相互作用并经常共生,共存可能部分取决于它们在代谢中的相互作用的潜力。链球菌属参与糖的发酵,产生乳酸作为其主要发酵终产物。反过来,Veillonella也以利用乳酸作为碳和能源的能力而闻名。
全世界龋齿的患病率仍然很高。 当牙齿暴露于产酸微生物通过碳水化合物代谢产生的酸(如乳酸)环境下时,就会引发龋齿。 Veillonella是主要的口腔微生物之一,由于它们具有将乳酸转化为弱酸并从NO3产生NO2的能力,而NO2可以抑制链球菌的生长和代谢。因此,Veillonella被认为对预防龋齿有好处。但是Veillonella代谢乳酸的能力受口腔环境因素(即pH和乳酸)的调节。
与免疫相关
肠道是肠道菌群与粘膜免疫系统相互作用的关键部位。近年来,人们发现Veillonella对人类微生物组,感染和免疫发育的重要影响。研究发现Veillonella parvula是细胞因子和TLR2 / 6信号转导的有效诱导。链球菌与韦永氏菌的组合似乎可以抵消IL-12p70的产生,同时增强IL-8,IL-6,IL-10和TNF-α的反应。
Veillonella的存在与疾病缓解或疾病稳定相关。这些特定的细菌属可能是免疫检查点抑制剂的生物标志物。在单抗治疗的患者中,或许它们可能成为晚期胃癌的特异性生物标志物。
一项研究指出对免疫治疗有响应的患者体内,富含屎肠球菌(Enterococcus faecium),产气柯林斯菌(Collinsella aerofaciens),青春双岐杆菌(Bifidobacterium adolescentis),肺炎克雷伯菌(Klebsiella pneumonia),小韦荣球菌(Veillonella parvula), Parabacteroides merdae, 乳酸杆菌(Lactobacillus species)和长双歧杆菌(B longum)8个菌种。
最近的数据表明,Veillonella parvula可能在儿童早期免疫系统发育中起到保护作用和帮助作用。对婴儿的流行病学研究表明,Veillonella parvula的存在与哮喘、毛细支气管炎负相关,在有哮喘风险的儿童中,肠道中相对丰富的细菌属Veillonella的相对丰度显著降低。
Prevotella 作为革兰氏阴性菌,产生 LPS 进而诱发炎症反应。与此同时,该菌代谢产生的丙酸盐可以发挥抗炎症的作用。产生相互矛盾的结论背后或许是由于肠道微环境以及菌群构成的不同所导致的。当在肠道中 Veillonella 与唾液链球菌菌株 1 共培养时可降低炎性细胞因子的产生,而与菌株 2 共培养时炎性细胞因子的产生比各自单独培养时显著增加。
链球菌 和Veillonella在肠道微生物群的高丰度和种内遗传多样性,可能是这些菌对由于食物摄入量变化引起的营养物利用率变化而引起的高种群动态的主要驱动因素。这些动态的种群可能会深刻影响当地宿主与微生物之间的相互作用,从而调节肠道的生理和免疫系统功能。
与运动耐力相关
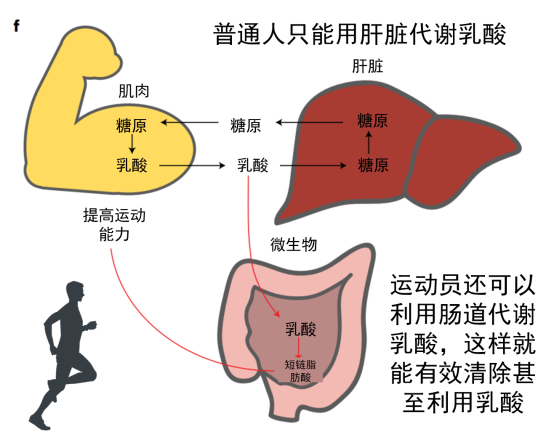
当我们跑步速度较慢时,糖和脂肪可以充分氧化分解成二氧化碳和水,并提供能量。但是,高强度运动后往往会出现肌肉酸痛现象,这是因为运动超过了有氧运动强度,导致葡萄糖通过无氧呼吸在体内代谢产生了乳酸,乳酸堆积会引起局部肌肉酸痛。
体内堆积的乳酸一部分继续分解成丙酮酸,再进一步被分解为二氧化碳和水,一部分则进入肝脏,乳酸可以再次合成糖原,这个过程称为糖异生。
Scheiman及其同事发表在《自然医学》(Nature Medicine)上文章研究了肠道微生物组对精英跑步者运动表现的影响,并确定了属于Veillonella属的一种能增强性能的微生物。比赛结束后,马拉松长跑运动员中富集了非典型的Veillonella atypica菌种。Veillonella 利用乳酸作为碳源, 分析发现乳酸到丙酸的代谢通路的运动后运动员中富集。
图片来源:慧跑
与其他厌氧菌不同,Veillonella atypica具有通过三羧酸循环的乳酸代谢的完整途径。Veillonella细菌可以将乳酸变成丙酮酸,而且体内产生的乳酸可以穿过上皮屏障进入肠腔,也就是说运动中体内积累的乳酸可以运输到肠道,肠道中的veillonella细菌就可以分解乳酸了。
在这个过程中,会产生丙酸,而丙酸可以提高小鼠心率和氧气利用率,丙酸还可以促进人体的新陈代谢。为了验证丙酸是否可以改善运动性能,研究人员给一些小鼠使用丙酸灌肠。与喂食Veillonella atypica 菌株的小鼠相同,这些使用丙酸灌肠的小鼠的运动时间也明显增加了。科学家们还给小鼠注射了可以追踪的乳酸,发现这些乳酸会进入到肠道。 而且乳酸有助于这种微生物的生长。
总的来说,葡萄糖因肌肉运动产生乳酸,一部分乳酸通过血液循环进入肝脏,在肝脏中通过糖异生作用重新合成葡萄糖;一部分乳酸通过血液循环进入肠道,肠道中的Veillonella属细菌迅速将乳酸分解成丙酸,从而降低乳酸浓度,改善运动表现。
哺乳动物肠道微生物组可能会通过肌肉衍生的乳酸代谢为丙酸酯来为其宿主提供额外的跑步耐力能力提升。 此外,由于在多个独立的人体研究中,相对于久坐的控制者,经常运动者中的Veillonella菌增加了,这增加了这些微生物通过利用独特的代谢环境(L-乳酸代谢)而在运动员的肠道中具有适应性优势的可能性。 这可能会导致积极的反馈循环,从而以较小的能力加强锻炼。 换句话说,由于预期重复运动会导致肠道L-乳酸浓度增加,L-乳酸代谢物的代谢位扩大,因此,这些L-乳酸代谢物反过来有望提高运动的耐力。
与其他疾病
自闭症
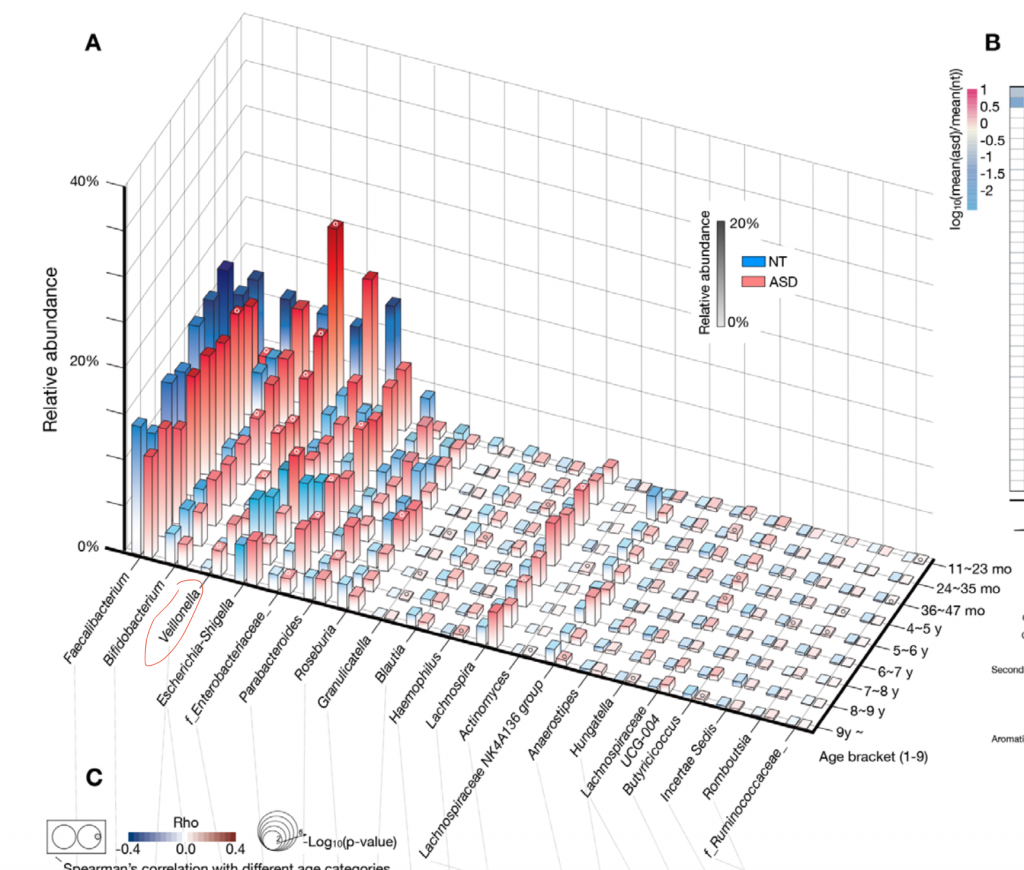
最新的发表在CELL和谷禾健康2019年发表在GUT上的队列都表明,未来发展为自闭症谱系障碍的儿童早期肠道内Veillonella菌富集,比对照儿童显著增加。
原发性硬化性胆管炎
原发性硬化性胆管炎(PSC)是一种罕见的、以肝内外胆管受损为主要特征的原发疾病,易导致胆管炎症和肝纤维化的发生而原发性硬化性胆管炎。
PSC患者肠道菌群某些菌群丰富度也会产生相应变化。特别是韦荣球菌(Veillonella)、肠球菌(Enterococcus)和链球菌(Streptococcus),其丰度显著升高。Veillonella可以通过肠道淋巴细胞进入肝脏。而肠球菌则是一种对万古霉素敏感的细菌,它可以通过分泌金属蛋白酶分解上皮钙黏蛋白破坏肠屏障。
肝病
在NAFLD和NASH中有几项研究确定,随着纤维化的进展,微生物群结构和功能恶化。晚期纤维化和NASH与碳水化合物和脂质代谢的变化有关,因为他们观察到相应功能的细菌含量增加。酒精性肝炎患者或肝脏疾病患者中Veillonella和Enterococcus丰度显著增加,而Veillonella parvula的丰度与白蛋白和血小板计数呈负相关。事实上,在所有3项肝硬化研究中,患者体内的几种Veillonella species的丰度都发生了改变。
肺癌
与对照组相比,肺癌患者的口腔菌群增加,特别是Streptococcus和Veillonella。口腔菌群的增加与PI3K和ERK上调有关。在体外实验中,气道上皮细胞暴露于Veillonella,Prevotella和Streptococcus也会导致ERK和PI3K通路上调(Tsay et al,2018)。PI3K通路被认为是肺癌发生的早期事件,因此共生微生物群失调会上调该通路促进肺癌发生。
胰腺癌
结果显示患有胰腺癌的病人组中三种口腔微生物Streptococcus,Treponema和Veillonella的组分显著低于其他组别。
其他
子痫前期患者会富集 Fusobacterium, Veillonella,Clostridum 等这些细菌。剖腹产的新生儿粪便微生物群富含Veillonella dispar/V这表明皮肤、口腔微生物以及出生过程中周围环境中的细菌是第一批在这些婴儿中定殖的细菌。
与对照组相比,后发展为T2D的研究对象Veillonella dispar的丰度较低,结果表明肠道菌群中的该物种可能与参与宿主血糖调节。
在肥胖的男性中观察到韦荣氏球菌属(Veillonella)和产甲烷短杆菌属(Methanobrevibacter)高于女性。 在吸烟人群中,Veillonella dispar的脂多糖生物合成通路相关的基因出现频率较高。
口腔,捏着呼吸道的脉搏,牙好胃口好,也不是句空话。Veillonella作为口腔和肠道的重要“居民”,它的定植,丰度以及与其他菌落共存的能力决定和影响着人体的口腔和消化道甚至肝肺胃疾病。
相关阅读:
主要参考文献:
Yu Sunakawa, et al. Genomic pathway of gut microbiome to predict efficacy of nivolumab in advanced gastric cancer: DELIVER trial (JACCRO GC-08). ASCO GI. Jan 15-17, 2021. ABSTRACT 161.
Jackson, M.A., Goodrich, J.K., Maxan, M.-E., Freedberg, D.E., Abrams, J.A., Poole, A.C., Sutter, J.L., Welter, D., Ley, R.E., Bell, J.T. et al. (2015) Proton pump inhibitors alter the composition of the gut microbiota. Gut, 65, 749-756.
Shi, Y.-C., Cai, S.-T., Tian, Y.-P., Zhao, H.-J., Zhang, Y.-B., Chen, J., Ren, R.-R., Luo, X., Peng, L.-H., Sun, G. et al. (2019) Effects of Proton Pump Inhibitors on the Gastrointestinal Microbiota in Gastroesophageal Reflux Disease. Genom Proteom Bioinform, 17, 52-63.
Bajaj, J.S., Acharya, C., Fagan, A., White, M.B., Gavis, E., Heuman, D.M., Hylemon, P.B., Fuchs, M., Puri, P., Schubert, M.L. et al. (2018) Proton Pump Inhibitor Initiation and Withdrawal affects Gut Microbiota and Readmission Risk in Cirrhosis. 113, 1177-1186.
Wang L, Yu X, Xu X, Ming J, Wang Z, Gao B, Xing Y, Zhou J, Fu J, Liu T, Liu X, Garstka MA, Wang X and Ji Q (2021) The Fecal Microbiota Is Already Altered in Normoglycemic Individuals Who Go on to Have Type 2 Diabetes. Front. Cell. Infect. Microbiol. 11:598672. doi: 10.3389/fcimb.2021.598672
Wong-Rolle A, Wei HK, Zhao C, Jin C. Unexpected guests in the tumor microenvironment: microbiome in cancer. Protein Cell. 2020 Dec 9. doi: 10.1007/s13238-020-00813-8. Epub ahead of print. PMID: 33296049.
Metagenomic analysis of bacterial species in tongue microbiome of current and never smokers 03-13, doi: 10.1038/s41522-020-0121-6
Scheiman J, Luber JM, Chavkin TA, MacDonald T, Tung A, Pham LD, Wibowo MC, Wurth RC, Punthambaker S, Tierney BT, Yang Z, Hattab MW, Avila-Pacheco J, Clish CB, Lessard S, Church GM, Kostic AD. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism. Nat Med. 2019 Jul;25(7):1104-1109. doi: 10.1038/s41591-019-0485-4. Epub 2019 Jun 24. PMID: 31235964; PMCID: PMC7368972.
Djais AA, Theodorea CF, Mashima I, Otomo M, Saitoh M, Nakazawa F. Identification and phylogenetic analysis of oral Veillonella species isolated from the saliva of Japanese children. F1000Res. 2019 May 3;8:616. doi: 10.12688/f1000research.18506.5. PMID: 31448103; PMCID: PMC6688723.
Mashima I, Theodorea CF, Djais AA, Kunihiro T, Kawamura Y, Otomo M, Saitoh M, Tamai R, Kiyoura Y. Veillonella nakazawae sp. nov., an anaerobic Gram-negative coccus isolated from the oral cavity of Japanese children. Int J Syst Evol Microbiol. 2021 Jan;71(1). doi: 10.1099/ijsem.0.004583. Epub 2020 Dec 2. PMID: 33263509.
Rovery C, Etienne A, Foucault C, Berger P, Brouqui P. Veillonella montpellierensis endocarditis. Emerg Infect Dis. 2005 Jul;11(7):1112-4. doi: 10.3201/eid1107.041361. PMID: 16022792; PMCID: PMC3371781.
Maqsood A. Bhatti, Michael O. Frank, Veillonella parvula Meningitis: Case Report and Review of Veillonella Infections, Clinical Infectious Diseases, Volume 31, Issue 3, September 2000, Pages 839–840, 0人