-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
双歧杆菌
双歧杆菌属(Bifidobacterium)是放线菌门严格厌氧的革兰氏阳性多形性杆状细菌。末端常常分叉,故名双歧杆菌。是人和动物肠道的重要核心菌群和有益生理菌群,也是母乳喂养婴儿中发现的第二大菌。
肥胖、糖尿病和过敏等各种疾病都与生命各个阶段的双歧杆菌数量减少有关。双歧杆菌有助于改善消化问题,抗菌和病毒、抗炎、改善血糖控制,降低血脂水平,提高免疫力,表现出抗氧化活性,有助于预防湿疹,缓解压力和过敏。
从代谢的角度来看,该属比较典型的特征是单糖的分解代谢(即所谓的果糖 6-磷酸途径),主要发酵葡萄糖产生乳酸和乙酸和少量乙醇。
重要的是,双歧杆菌产生硫胺素(维生素B1)、核黄素(维生素B2)、维生素 B6和维生素 K。可能还具有合成叶酸、烟酸(维生素B3)和吡哆醇(维生素B6)的能力。双歧杆菌代谢产物还包括γ-氨基丁酸 (GABA)和生物素。比如青春双歧杆菌是人体肠道微生物群中 GABA生产的关键成员。
by Kateryna Kon
食用双歧杆菌食品可以通过降低胃 pH 值(促进矿物质的电离,这是矿物质的吸收所必需的)来提高某些矿物质的生物利用度,包括钙、锌和铁。
多种因素会导致人体肠道内双歧杆菌变化
导致减少的因素包括:
增加双歧杆菌的因素包括:
补充益生菌:可以通过食物或药物的方式补充益生菌,可以增加肠道内双歧杆菌。
吃发酵食品:多吃发酵食品,如酸奶、奶酪、泡菜,适量葡萄酒等,可以增加肠道内双歧杆菌。
增加特定膳食补充剂,比如低聚果糖,抗性淀粉,白藜芦醇、镁、绿茶、水苏糖,杏仁/杏仁皮、岩藻多糖、大麦、菊芋、阿拉伯木聚糖、菊粉等
多样性饮食,摄入足够的蔬菜、水果、豆类和全谷物,定期摄入奶制品。
合理运动和良好睡眠,清洁的水源等。
存在于不同生态位的双歧杆菌物种与其宿主之间有不同的生态关系
抗生素敏感性
药敏实验显示双歧杆菌对多种抗生素敏感,如氯霉素、四环素、红霉素等,但对氨苄青霉素、庆大霉素、痢特灵、丁胺卡那霉素、新霉素、环丙沙星等抗生素耐受。
应用
目前双歧杆菌制剂已经广泛应用于保健食品、医药等领域。比如双歧杆菌药品、双歧杆菌与药成分搭配的保健药品、双歧杆菌与双歧因子搭配的保健食品以及双歧杆菌与寡糖、葡萄糖酸、精氨酸配合,对青春双歧杆菌有选择的增殖作用,发挥特有的免疫赋活功能等。
开发价值
未来还可能扩大双歧杆菌利用面,促进双歧杆菌向多元化方向发展。比如双歧杆菌富含B族维生素,该菌的代谢产物富含(L+)乳酸和一些酶类,可用来生产微生态护肤品或其他化妆品。除用于特定保健食品和医药外,在畜业、水产业和肉制品加工中也广泛应用,也大有开发价值。
通过补充益生菌或益生元调节双歧杆菌水平可以改变肠道微生物群的整体组成和代谢。但是双歧杆菌介导的健康益处是双歧杆菌、肠道微生物群的其他成员和人类宿主之间建立的复杂动态相互作用的结果。值得强调的是,某些双歧杆菌定植特征受肠道因素调节,包括其他微生物的存在。
这体现在具有不同肠道微生物群组成的个体似乎对双歧杆菌补充剂的反应不同,这一事实提供了双歧杆菌-肠道微生物群串扰存在的进一步证据。
本文主要讨论和介绍双歧杆菌的菌属特性,生态代谢特征,对人体的健康特性以及影响双歧杆菌在体内定植的主要因素。
—正文—
★
▼
双歧杆菌属于放线菌目,双歧杆菌在细胞壁类型上与其他放线菌(如链霉菌和诺卡氏菌)是分开的;双歧杆菌被指定为具有 VIII 型细胞壁(鸟氨酸浓度相对较高)。
属水平
双歧杆菌属(Bifidobacterium)于 1899 年首先由 Tissier 从母乳喂养婴儿的粪便中分离出来,并命名为Bacillus bifidus。
然而,由于它们与乳杆菌相似的形态和生理特征,在 20 世纪的大部分时间里它们被归类为乳杆菌属的成员,直到最近才被认为是和乳杆菌不同的属。
种水平
随着鉴定方案的技术改进和微生物系统学信息的扩展,该属中已定义物种的数量已经稳步增加。
Bergey 的系统细菌学手册(1986) 鉴定了 24 种不同的双歧杆菌。在这些物种中,被认为主要起源于人类的类型有以下种:
B.bifidum、B.longum、B.infantis、
B.breve、B.adolescentis、B.angulatum、B.catenulatum、B.pseudocatenulatum 、B.dentium 。
大多数这些物种在人类结肠中占主导地位,随后可以在粪便和污水中找到。
在2004共列出了 33 种双歧杆菌;大多数新添加的物种都是从动物来源中分离出来的。
截止2020年已在该菌属在分类学上已鉴定出 78 个种和 10 个亚种,而且这个数字每年都在上升。
▼
双歧杆菌是革兰氏阳性、不运动、过氧化氢酶阴性、不形成孢子和非还原细菌的多样化菌属。是厌氧菌和多形性细菌,具有单细胞、链、聚合物形、V 形或 Y 形或栅栏形等多种排列方式。
适宜生长条件
人源双歧杆菌的最适生长温度为 36 至 38 °C,而动物源双歧杆菌的最适生长温度为 41 至 43 °C。但蒙古双歧杆菌和嗜冷双歧杆菌除外,它们分别可以在 15°C 和 8°C 下生长;最高生长温度为 43–45°C,但嗜热双歧杆菌除外,其最高生长温度为 49.5°C。
双歧杆菌的最适生长 pH为 6.5–7.0。pH 值低于 4.5–5.0 或高于 8.0–8.5 时不会一般发生生长。嗜热双歧杆菌除外,它可以在 pH 4.5 下生长或 pH 8.0–8.5 下不生长。
双歧杆菌菌落与乳酸菌易混淆
在琼脂平板上,双歧杆菌的菌落与乳酸菌(尤其是乳酸杆菌)的菌落非常相似,容易混淆,经常被错误地称为乳酸菌的一员;然而,双歧杆菌与发酵食品生产中使用的传统乳酸菌都没有密切关系。
与乳酸菌相比,双歧杆菌的耐酸性较差,它们的生长不能称为“兼性厌氧”。双歧杆菌确实会通过碳水化合物的发酵产生乳酸,但通常产生的乙酸量高于乳酸,并且所使用的分解代谢途径不同于乳酸菌所采用的同源发酵和异源发酵途径。
乳杆菌的 DNA 的平均(G+C)mol%约为 37%,双歧杆菌的平均值约为 58%。
▼
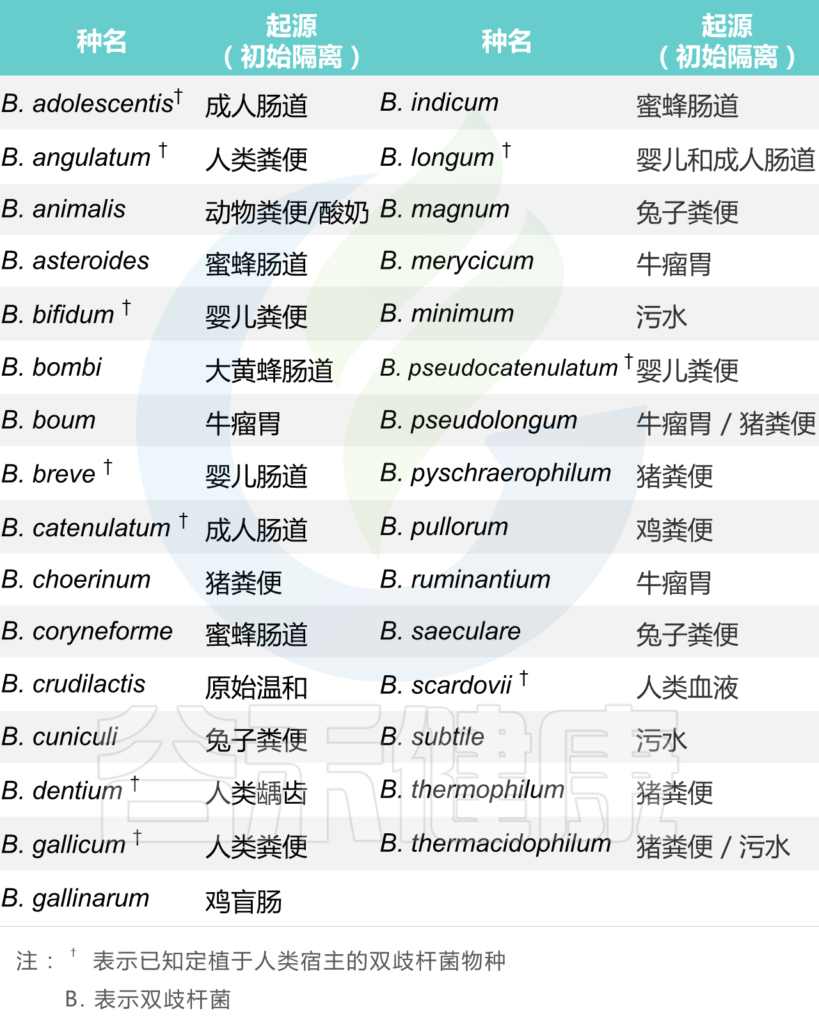
它们是正常人类和动物肠道菌群的天然居民,并且已经从六个不同的生态位中分离出来,双其中三个与人类和动物肠道环境直接相关:例如人类肠道、动物肠道(牛、兔、鼠、鸡和昆虫)和口腔,而其他(污水、血液和食物)可能是胃肠道污染的结果。
从不同生态位分离出来的双歧杆菌物种表
doi.org/10.2217/fon-2019-0374
▼
通常在我们的认知中,双歧杆菌是益生菌,但实际上,双歧杆菌与其宿主之间可以建立不同的生态关系,从机会性致病相互作用(例如齿双歧杆菌)到共生甚至促进健康的关系(例如双歧双歧杆菌和短双歧杆菌)。
在已知的促进健康的菌群中,双歧杆菌代表了最主要的群体之一,一些双歧杆菌物种通常被用作许多功能性食品中的益生菌成分。
动物双歧杆菌已被证明是在冷藏条件下保持活力的双歧杆菌物种中最顽强的物种之一,并且一些菌株已被证明可以为人类带来健康益处,但动物这个名称在暗示对人类有益方面并不易于使用,尤其是老鼠粪便作为原始来源。
在当前的文献中,人们越来越意识到双歧杆菌的潜在致病性。双歧杆菌的致病潜力尚不清楚;有报道称在免疫功能低下的宿主和肠道屏障受损的宿主中具有“败血症样图像”的侵袭性。
双歧杆菌的促炎作用

Lim HJ,et al., J Microbiol Biotechnol. 2020
先前的研究表明,最常见的引起双歧杆菌感染是长双歧杆菌和齿双歧杆菌。在儿科和成人菌血症病例中,无论是否使用过益生菌,公认的菌种是婴儿双歧杆菌、青春双歧杆菌、短双歧杆菌、长双歧杆菌和齿双歧杆菌(在较早的文献中称为埃里克森双歧杆菌)。
已经报道了由双歧杆菌引起的几种类型的感染。偶尔的感染发现还包括B. scardovii。
在一项研究中,从无菌场所分离出的 15 种推定的双歧杆菌分离株或大量存在的双歧杆菌被鉴定到物种水平,鉴定出四种:A. omnicolens、B. breve、B. longum、B. scardovii ,来自胃肠道或泌尿生殖道,B. breve来自血液。Scardovia wiggsiae 是一种新物种,与严重的幼儿龋齿有关。
在血培养分析中,双歧杆菌约占厌氧血培养分离株的 0.5-3%,截至 2015 年,文献中仅报道了 15 例成人双歧杆菌菌血症,因此,双歧杆菌还是相对安全的。
▼
双歧杆菌属属于放线菌门、放线菌纲(高 G+C 革兰氏阳性菌)、双歧杆菌目和双歧杆菌科。
产生B族维生素
双歧杆菌可产生硫胺素、核黄素、维生素 B6 和维生素 K。还有报道称它们具有合成叶酸、烟酸和吡哆醇的能力。这些维生素B复合物在人体中被慢慢吸收。
产生乳酸
关于含有双歧杆菌的发酵乳的营养特性的现有信息表明,与非发酵乳相比,它们的残留乳糖含量较低,游离氨基酸和维生素含量较高。它们优先含有(+)-乳酸[双歧杆菌除乙酸外还产生(+)-乳酸,而乳酸菌产生(−)-乳酸],更容易被人体代谢。这对于 1 岁以下的婴儿尤为重要,因为在这些婴儿中代谢性酸中毒可能是一个问题。
所有与人类有关的物种都可以发酵乳糖;在考虑将双歧杆菌应用于乳制品和作为益生菌培养物以缓解乳糖吸收不良不适的预期效果时,这是一个重要特征。
主要代谢途径:果糖 6-磷酸途径
双歧杆菌使用果糖 6-磷酸途径(双歧途径)作为碳水化合物代谢的主要途径,其中Xfp是该途径的主要酶,具有双底物特异性,最终代谢产物是乙酸盐、乳酸盐和乙醇。
注:Xfp——果糖 6-磷酸磷酸酮醇酶
其他代谢途径
人们认为,双歧杆菌能够与其他胃肠道细菌竞争并在胃肠道区域的细菌菌群中占据很大比例,部分原因可能是它能够利用多种分子提供能量。双歧杆菌可能还参与的其它代谢通路如下:
2-氧代羧酸代谢
ABC转运体
丙氨酸、天冬氨酸和谷氨酸代谢
氨基糖和核苷酸糖代谢
氨酰-tRNA生物合成
精氨酸和脯氨酸代谢
精氨酸生物合成
细菌分泌系统
碱基切除修复
氨基酸的生物合成
抗生素的生物合成
次级代谢物的生物合成
不饱和脂肪酸的生物合成
生物素代谢
丁酸代谢
C5-支链二元酸代谢
碳青霉烯生物合成
碳代谢
氯代烷烃和氯代烯烃降解
柠檬酸循环(TCA循环)
氰基氨基酸代谢
半胱氨酸和甲硫氨酸代谢
D-丙氨酸代谢
D-谷氨酰胺和D-谷氨酸代谢
DNA复制
芳香族化合物的降解
脂肪酸生物合成
脂肪酸降解
脂肪酸代谢
叶酸生物合成
果糖和甘露糖代谢
半乳糖代谢
谷胱甘肽代谢
甘油脂代谢
甘油磷脂代谢
甘氨酸、丝氨酸和苏氨酸代谢
糖酵解/糖异生
乙醛酸和二羧酸代谢
组氨酸代谢
同源重组
肌醇磷酸代谢
胰岛素抵抗
赖氨酸生物合成
代谢途径
甲烷代谢
不同环境中的微生物代谢
错配修复
内酰胺生物合成
萘降解
烟酸盐和烟酰胺代谢
氮代谢
非核糖体肽结构
核苷酸切除修复
一个由叶酸组成的碳库
其他聚糖降解
氧化磷酸化
泛酸和 CoA 生物合成
戊糖和葡萄糖醛酸相互转化
戊糖磷酸途径
肽聚糖生物合成
苯丙氨酸代谢
苯丙氨酸、酪氨酸和色氨酸的生物合成
磷酸转移酶系统 (PTS)
聚酮化合物糖单元生物合成
卟啉和叶绿素代谢
丙酸代谢
蛋白质输出
嘌呤代谢
嘧啶代谢
丙酮酸代谢
RNA降解
RNA聚合酶
核黄素代谢
核糖体
次级胆汁酸生物合成
硒化合物代谢
鞘脂代谢
淀粉和蔗糖代谢
链霉素生物合成
硫代谢
牛磺酸和亚牛磺酸代谢
萜类骨架生物合成
硫胺素代谢
双组分系统
酪氨酸代谢
泛醌和其他萜类醌生物合成
缬氨酸、亮氨酸和异亮氨酸的生物合成
缬氨酸、亮氨酸和异亮氨酸降解
万古霉素耐药
维生素B6代谢
β-内酰胺抗性
▼
Bifidus在拉丁语中的意思是裂开或分开(当营养受限时,细胞的特征性分叉很明显)。
双歧杆菌属的物种具有较高的 rRNA 16S 序列相似性,构成了一个连贯的系统发育单元。
2002年,来自长双歧杆菌的第一个基因组被发表,并且此后公开可用的双歧杆菌基因组数量稳步增加。截至2016年4月,共有254个公开的双歧杆菌基因组序列,其中61个代表完整的基因组序列。通过比较不同物种的基因组,揭示了该属的系统发育和进化适应性。
双歧杆菌基因组平均长度为2.2 Mb,通常编码52-58个tRNA基因和3-5个rRNA操纵子。
▼
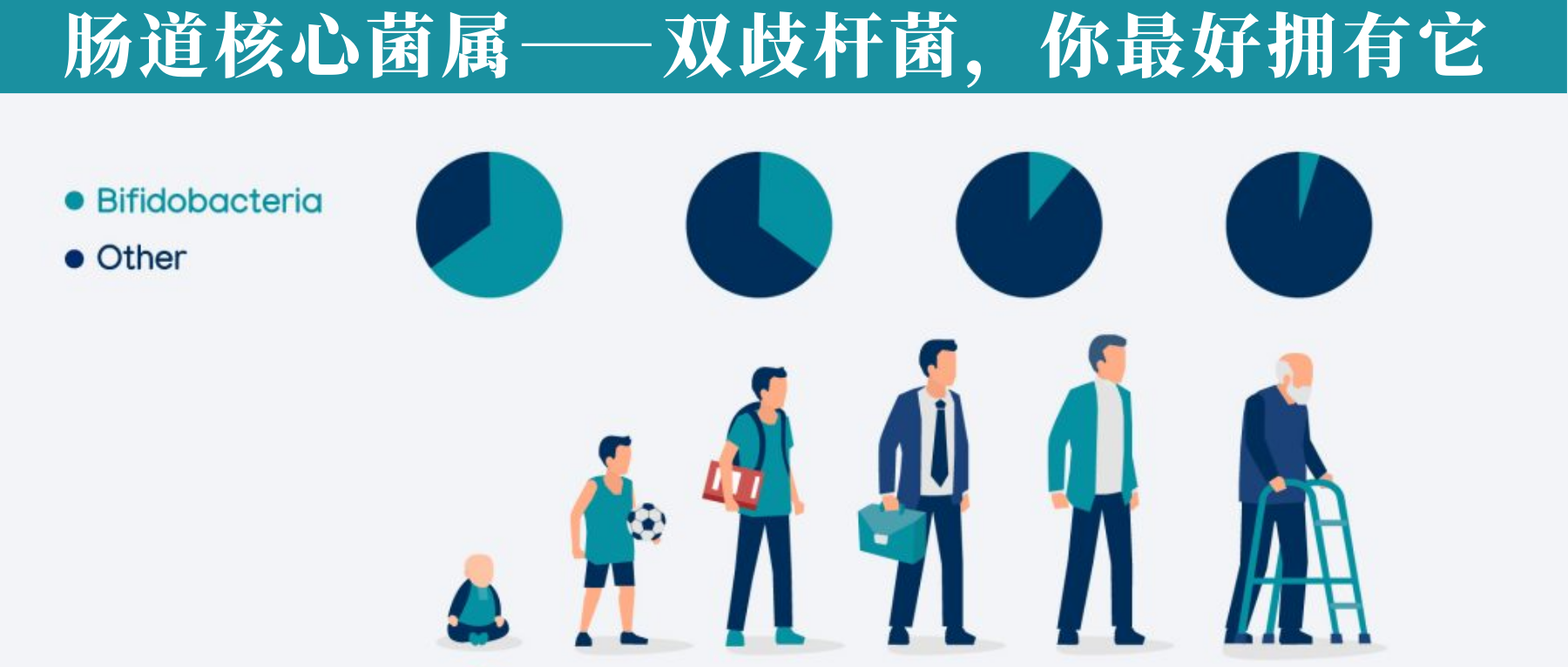
• 通常,在婴儿肠道内以婴儿双歧杆菌和短双歧杆菌为优势菌群;
• 而在成人肠道内则缺少这两种双歧杆菌,仅有少量双岐双歧杆菌、青春双歧杆菌和长双歧杆菌存在
通过使用不同的方法和技术,已经观察到双歧杆菌的数量和多样性会随着年龄的增长而减少(当然这个目前仍然不明确)。
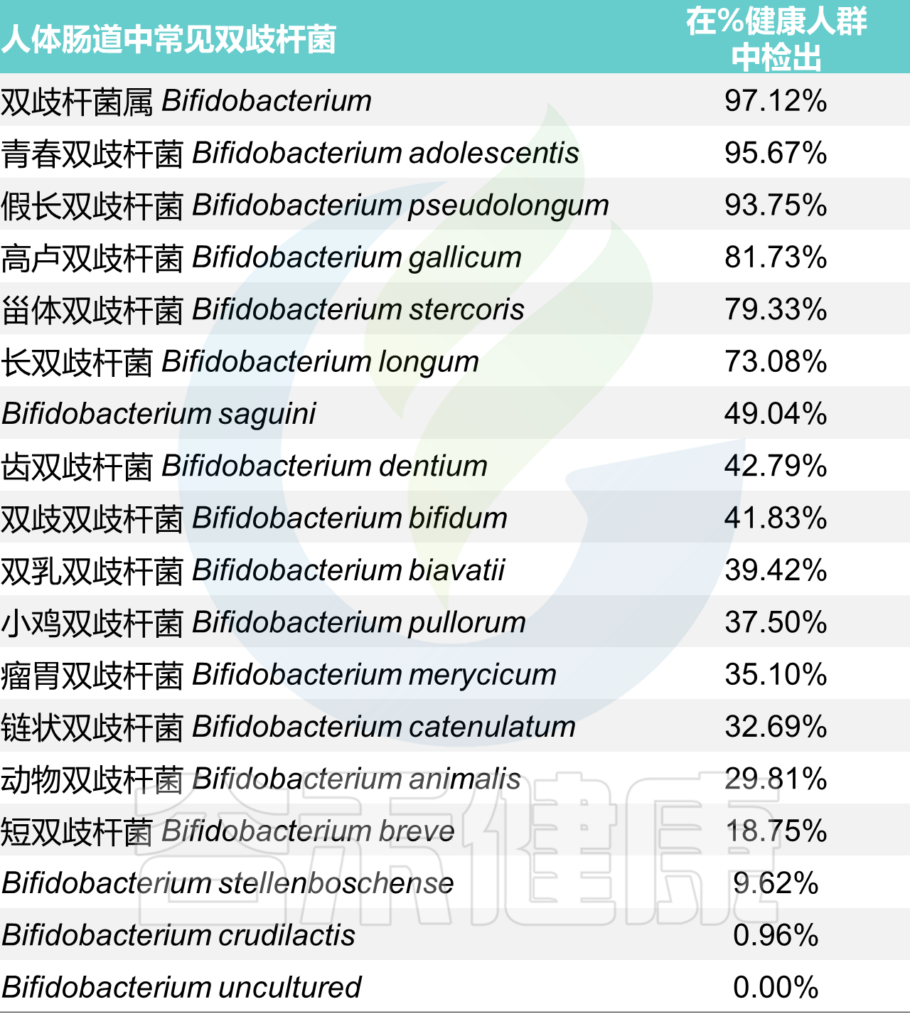
<来源:谷禾健康肠道菌群检测数据库>
其中能在人体肠道内定植并能用于制备保健食品的双歧杆菌主要有5种:
婴儿:双歧杆菌占90%,断奶后迅速下降
双歧杆菌通常是婴儿肠道微生物群中最丰富的分类群(高达 90%),其丰富性与对婴儿健康的各种有益影响有关,包括肠道中叶酸的产生、对疫苗接种的免疫反应增加和预防或减少过敏性疾病。
已知双歧杆菌产生的紧密粘附菌毛会刺激结肠上皮细胞增殖,从而可能影响新生儿肠道的成熟。富含双歧杆菌的健康肠道微生物群在母乳喂养期间继续存在,但相对丰度在断奶后迅速下降。
成人:双歧杆菌参与复杂碳水化合物的代谢
存在于成人肠道中的肠道双歧杆菌基因组,例如青春双歧杆菌,似乎并不包含与母乳成分利用相关的基因,相反,它们包含大量专门用于成人饮食中常见的复杂碳水化合物的代谢(例如,淀粉和淀粉衍生的碳水化合物)。
到目前为止,饮食类型(西方、亚洲、地中海)与特定双歧杆菌种类在肠道中的富集之间尚无明确关系,但据报道不同人群和国家之间存在差异。
老人:双歧杆菌物种水平变化
在老年人(百岁老人)中也提到了物种水平的变化。结果仍然有些争议。在某些地区,百岁老人的微生物群组成仍然与成年人相似,然而,也有些地方百岁老人的双歧杆菌比例高于年轻老人。
与衰老过程间接相关的其他外在因素也会影响双歧杆菌的组成。抗生素在老年人群中的长期使用无疑对肠道菌群组成产生巨大影响,从而减少双歧杆菌数量。
▼
双歧杆菌介导的健康益处是双歧杆菌、肠道微生物群的其他成员和人类宿主之间建立的复杂动态相互作用的结果。
这些错综复杂的相关模式尚未在分子水平上得到完全破译。因此,目前正在努力了解肠道生态系统内的代谢通量,以辨别健康和疾病中的微生物群-宿主串扰。这将为通过以微生物组为目标的方法以更精确、安全和可控的方式调节宿主健康奠定基础。
在双歧杆菌益处中,抑制肠病原体和减少轮状病毒感染是它们最确定的结果。许多体外研究表明,双歧杆菌可以通过产生有机酸、抗菌肽、群体感应抑制剂来抑制病原体, 或免疫刺激以及其他机制,为它们预防某些感染的能力提供分子线索。
双歧杆菌的抗菌作用
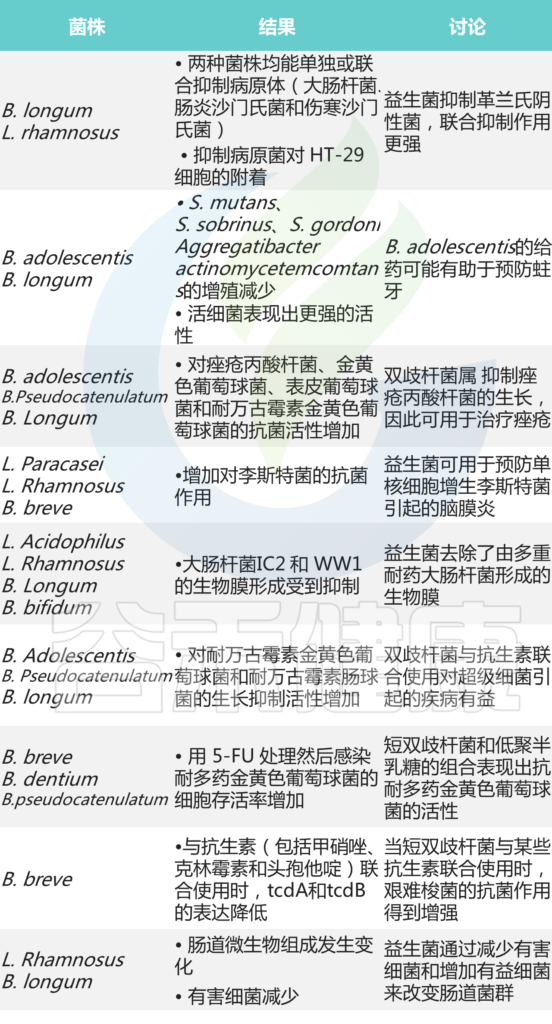
Lim HJ,et al., J Microbiol Biotechnol. 2020
另一个事实表明,存在一个关键的双歧杆菌-肠道微生物群-宿主串扰,即婴儿早期微生物群的建立似乎遵循一种精心策划和有组织的菌群演替模式。
与人类肠道菌群的串扰机制表现在:
第一批肠道定殖者,双歧杆菌占主导地位
有助于减少环境并产生代谢物,使其他细菌种群能够稳定地定植肠道。
和其他肠道细菌间存在显著的共生效应
多形拟杆菌能够在长双歧杆菌存在下,扩大其利用多糖的能力,这表明常驻肠道共生体能够调整其底物利用以响应对双歧杆菌。
通过补充益生菌调节双歧杆菌
通过补充益生菌调节双歧杆菌水平可以改变肠道微生物群的整体组成和代谢。
在源自人肠道的微生物群小鼠模型中补充长双歧杆菌菌株会增加丙酮酸、丁酸和生物素的产量。可能是由于长双歧杆菌和Bacteroides caccae的共存。
补充长双歧杆菌还与肠杆菌科的减少和直肠真杆菌的增加相关,支持双歧杆菌对其他肠道菌群的数量和功能的影响。
双歧杆菌分子调节肠道菌群
体外研究表明,在双歧杆菌胞外多糖存在的情况下,脆弱拟杆菌和Faecalibacterium prausnitzii(粪栖杆菌,又名普拉梭菌)会改变它们的代谢。
通过补充益生元调节双歧杆菌
通过益生元(包括菊粉、阿拉伯木聚糖、低聚半乳糖和低聚果糖)促进双歧杆菌生长,也与更高的乳杆菌-双歧杆菌与肠杆菌科比例相关,并调节短链脂肪酸,有机酸等的产生。
对益生元代谢分析,了解双歧杆菌与其他菌群的交叉喂养机制
B. longum NCC2705 和E. rectale ATCC 33656之间的交叉喂养机制,有利于双歧杆菌菌株和产丁酸菌在同一生态位中共存。为阿拉伯木聚糖寡糖的产双歧和产丁酸作用提供了新的见解。
理解双歧杆菌和拟杆菌属物种以及双歧杆菌和普拉梭菌之间的交叉喂养机制),这将有助于理解共培养发酵的产丁酸活性。这些结果也有助于阐明益生元发酵过程中肠道内的细菌相互作用。
双歧杆菌菌株间的潜在串扰
分析长双歧杆菌和短双歧杆菌菌株之间的相互作用,证明它们对碳水化合物利用酶的产生显著影响。
双歧双歧杆菌PRL2010和短双歧杆菌UCC2003之间存在交叉喂养机制:
短双歧杆菌UCC2003不能在体外利用唾液酸作为唯一的碳源,尽管它可以以消耗唾液酸的残留物为代价生长。
双歧双歧杆菌PRL2010 从粘蛋白上裂解。事实上,对双歧杆菌属糖苷利用能力的详细分析强调了特定物种专门针对特定碳水化合物的利用,因此表明双歧杆菌物种可能在肠道内合作利用碳水化合物。
也就是说益生菌菌株的混合物可能会产生协同效应,提高它们对肠道菌群以及宿主健康发挥作用的能力。
值得强调的是,某些双歧杆菌定植特征受肠道因素调节,包括其他微生物的存在。具有不同肠道微生物群组成的个体似乎对双歧杆菌补充剂的反应不同,这一事实提供了双歧杆菌-肠道微生物群串扰存在的进一步证据。
双歧杆菌与其他菌群可能的相互影响如下:
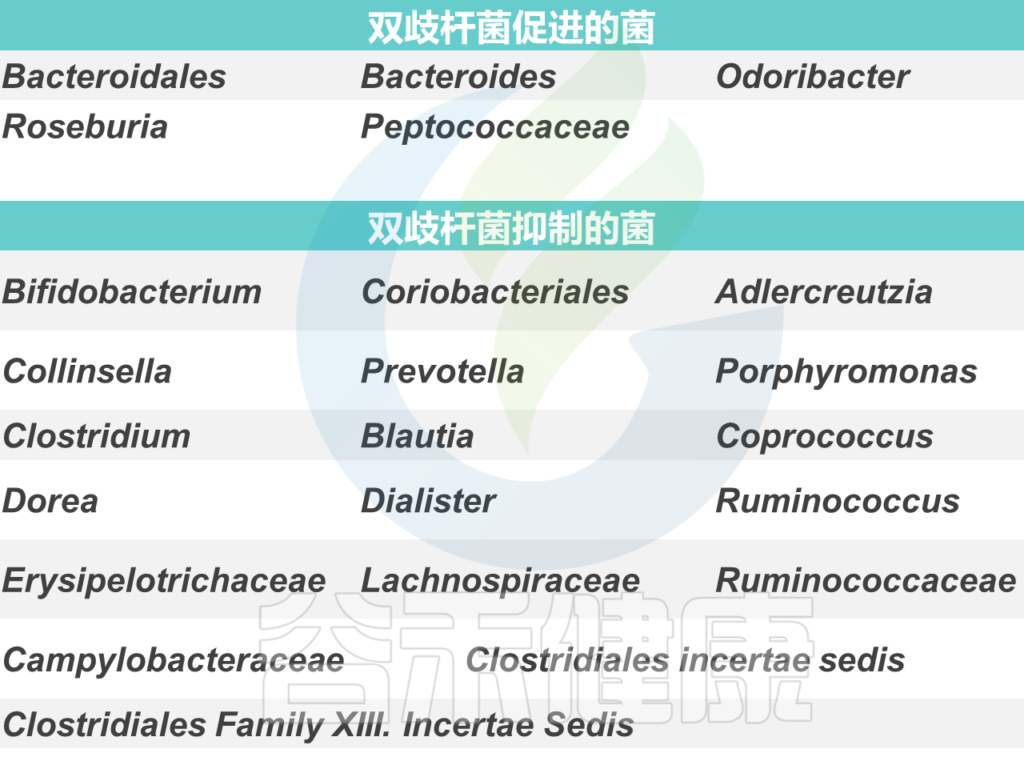
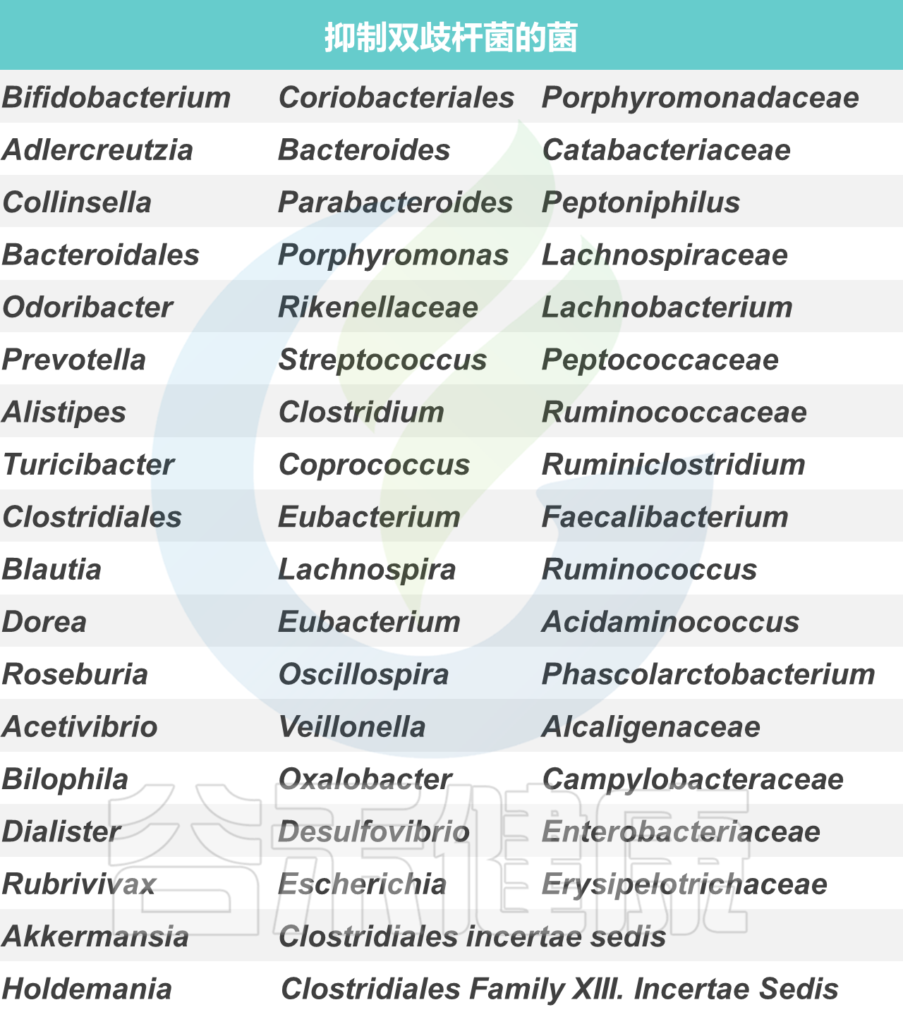
尽管这种不同行为背后的串扰的分子机制还远未被理解,但对它们的理解将极大地帮助设计基于益生菌的疗法,即使在目前在临床试验中被归类为“无反应者”的那些亚群中也能发挥作用。
★
双歧杆菌是革兰氏阳性菌,必须能够在胃肠道运输中存活下来,了解双歧杆菌对克服胃肠道应激因素的反应,对于合理选择益生菌菌株和开发分子工具箱以提高其性能至关重要。最近的发展,如表达载体和突变生成系统,以及功能基因组学和其他组学技术的巨大进步,揭示了双歧杆菌使用多种策略来适应人类肠道的特定环境条件。
▼
在通过胃肠道期间,口服益生菌会遇到各种恶劣的环境条件(下图)。这些条件危及这些有益微生物的生存,损害它们的生存能力和功能。这些包括消化酶、胃中的酸性 pH 值、防御素和肠道中高浓度的胆汁盐。
人类胃肠道的示意图和双歧杆菌对各种环境因素或生态位的反应
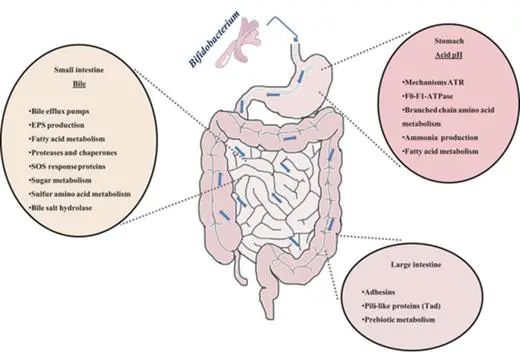
低 pH 值
胃液成分造成的强酸性条件是双歧杆菌在胃中应对的首要障碍之一。除动物双歧杆菌和嗜酸双歧杆菌外,双歧杆菌对酸的耐受性较低。因此,益生菌的使用需要分离具有良好耐酸性的菌株,这些菌株通常对其他技术和胃肠道应激因素表现出交叉抗性。
细菌可能通过一系列酸诱导机制对随后的酸胁迫产生耐受性。双歧杆菌中这种耐酸反应 (ATR) 的分子机制在部分研究中已经被报道。长双歧杆菌中的乳酸和酸适应与 F0-F1-ATP 酶亚基的过量产生有关,这通过增加的 H + 排出活性来抵消这种 H + 积累。
注:暴露于低pH值会影响质子动力,导致H+在细胞内积累。
在双歧杆菌中发现了环境条件(例如可发酵碳源的可用性或生长期)对酸耐受性的强烈影响。这突出了体外模型模拟双歧杆菌在肠道中面临的条件的局限性。
胆汁
胆汁的存在是双歧杆菌在肠道中必须面对的生理障碍之一。胆汁酸是这种生物体液的主要成分,它们具有类似洗涤剂的抗菌特性。这些酸在细胞质中的积累会影响细胞的稳态,导致离子泄漏。
双歧杆菌对这种肠道疾病的抵抗力取决于物种,尽管它们可以通过接触胆汁获得稳定的抵抗表型。这个过程经常涉及对其他压力因素的交叉抗性的出现、抗生素抗性模式的改变、碳水化合物代谢、细胞表面结构和组成,以及它们与肠道生态系统的相互作用等。
酶和抗菌肽
双歧杆菌在胃肠道中存活和功能受到多种因素的影响,其中包括消化酶(如胃蛋白酶和胰酶)、肠道抗菌肽(如防御素和导管素)以及某些益生菌的刺激。
研究表明,消化酶可能影响双歧杆菌的粘附,而肠道抗菌肽可能影响双歧杆菌的存活和功能,但其机制尚未完全了解。
某些益生菌会刺激肠道防御素的产生。B. animalis亚种lactis Bb12导致人体中 β-2-防御素的产生增加,这可能解释了双歧杆菌预防某些感染的能力。
▼
微生物对肠粘膜的粘附是定植过程中的一个重要特征,并且与菌株与宿主相互作用的能力有关。因此,对粘膜的粘附经常被用作选择益生菌菌株的标准。
菌株的粘附能力似乎对免疫调节和竞争性排斥病原体也很重要。肠粘膜的外部区域由覆盖上皮细胞的粘液层组成。这种粘液富含糖蛋白和糖脂,为细菌粘附提供了丰富的目标,包括碳水化合物部分。
竞争性排除肠道病原体
一些益生菌与肠道病原体共享碳水化合物结合特异性,这为使用益生菌对抗过度竞争的病原体以预防感染提供了明确的理由。因此,对人肠粘液和/或人肠上皮细胞系的粘附一直是评估细菌粘附的最常用模型。在这方面,某些双歧杆菌菌株具有从肠道细胞和人体肠道粘液中竞争性排除肠道病原体的能力。
细菌粘附到胃肠道粘膜的机制很复杂,涉及非特异性现象,细胞壁特性和组成以及粘附素的存在等因素,构成了菌株粘附粘膜能力的最重要决定因素。
★
双歧杆菌在预防疾病方面的作用仍在研究中,但它们的一些有益作用包括:
doi.org/10.3389/fbioe.2021.770248
补充双歧杆菌也被证明可以增强肠道新陈代谢,理论支持两者之间的协同相互作用双歧杆菌和其他有益的肠道菌种。
✔ 治疗消化系统疾病中发挥作用
在消化系统中可以看到双歧杆菌最流行的治疗效果之一:
在因使用抗生素而出现腹泻的婴儿中,含有双歧杆菌和嗜热链球菌的益生菌配方可显著降低腹泻的发生率。
施用婴儿双歧杆菌CECT 7210 和短双歧杆菌K-110 可成功抑制轮状病毒并治疗腹泻。
双歧杆菌的抗病毒作用

Lim HJ,et al., J Microbiol Biotechnol. 2020
动物双歧杆菌已发现发酵乳制品中的双歧杆菌可以改善结肠规律性,这引发了关于双歧杆菌是否可以帮助治疗便秘的问题。
✔ 治疗感染疾病中发挥作用
双歧杆菌已被证明对产气荚膜梭状芽孢杆菌、肠病原性大肠杆菌和轮状病毒具有作用。双歧杆菌的另一种普遍尝试的临床应用涉及粪便移植作为治疗复发性艰难梭菌结肠炎的方法。
研究进一步表明双歧杆菌在预防艰难梭菌相关性腹泻、改善幽门螺杆菌根除(与抗生素治疗相结合)以及降低结肠手术后术后感染率方面的功效。
虽然作用机制尚不清楚,但研究报告称,双歧杆菌可减轻炎症性肠病的症状,缓解溃疡性结肠炎,并降低早产儿坏死性小肠结肠炎的发生率。尽管溃疡性结肠炎症状有所改善,但益生菌在克罗恩病的治疗中没有显示出益处。
双歧杆菌属的抗炎作用

Lim HJ,et al., J Microbiol Biotechnol. 2020
✔ 治疗肝病中发挥作用
双歧双歧杆菌可能通过帮助重建肠道菌群在慢性肝病的管理中发挥作用,肠道菌群是肝硬化期间受到干扰的环境。在这些患者中,含双歧杆菌的益生菌补充剂可有效预防肝性脑病的发展,但无法确定对总体死亡率的影响。
✔ 免疫反应中发挥作用
双歧杆菌也可能在刺激宿主的免疫反应中发挥作用:给予长双歧杆菌的小鼠产生了 T 和 B 淋巴细胞的显著增加,以及巨噬细胞吞噬活性的增加。有趣的是,已发现乳糜泻患者肠道微生物组中的双歧杆菌水平较低,并且在一些研究中,益生菌给药可降低 TNF-α 水平并改善症状。
B. animalis、B. longum 和B. bifidum的某些菌株在体外和体内实验中展示的对免疫功能影响的示意图
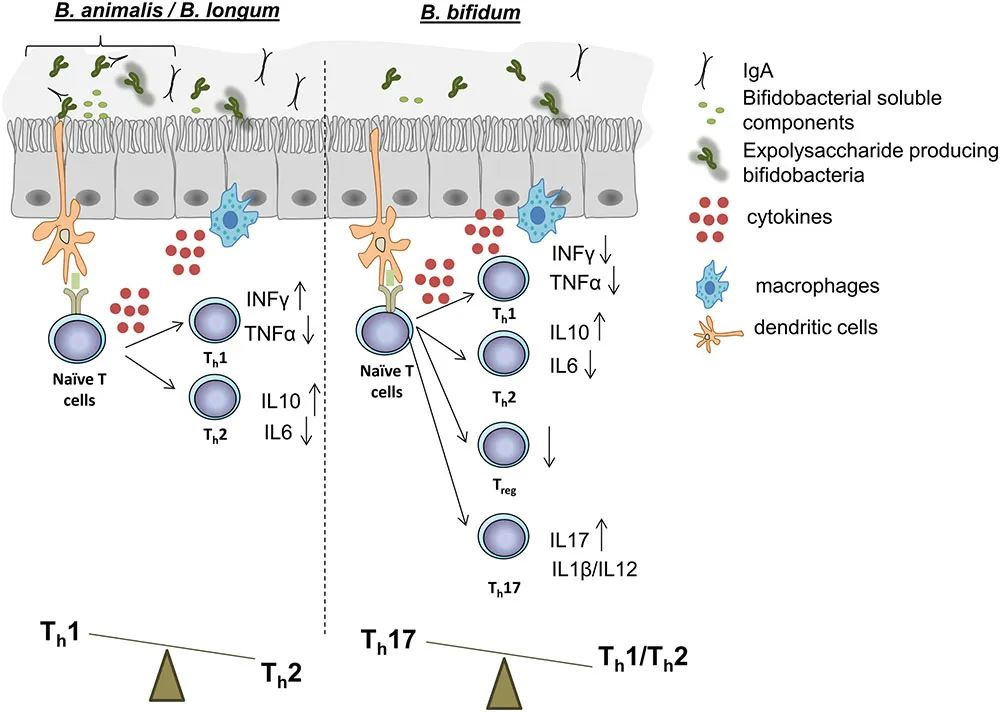
doi.org/10.3389/fmicb.2017.02345
✔ 治疗过敏性疾病中发挥作用
服用含双歧杆菌的益生菌后,患有特应性皮炎和过敏性鼻炎症状的儿童得到改善。还对高危婴儿的特应性皮炎的预防进行了研究,一些证据表明对产前或产后妇女给予益生菌有益。
✔ 治疗代谢性疾病中发挥作用
双歧杆菌对糖尿病、肥胖症和高脂血症的有益作用也得到了研究,证据显示其对普通人群的血糖水平和胰岛素抵抗具有有益作用,同时还能降低孕妇妊娠糖尿病的发病率。
一些数据也已发表,显示含有双歧杆菌的补充剂在降低胆固醇水平方面的功效,尽管更多的证据表明其他益生菌菌株的功效更大。双歧杆菌属,也显示出对减轻体重和减少体脂有益。
✔ 治疗精神类疾病中发挥作用
双歧杆菌益生菌干预在改善重度抑郁症患者的症状方面显示出显着疗效,一些数据表明,服用含双歧杆菌的益生菌补充剂的健康个体和精神分裂症患者的抑郁和焦虑水平发生率较低。
✔ 婴儿人群中发挥作用
在婴儿人群中,补充双歧杆菌可降低极低出生体重婴儿患坏死性小肠结肠炎的风险、降低全因死亡率以及迟发性败血症。
双歧杆菌菌株在人体试验中显示出有效性

编辑
doi.org/10.1128/microbiolspec.BAD-0010-2016
总之,大量证据支持双歧杆菌在治疗和预防多种人类疾病方面的安全、有益作用。
★
各种研究报道双歧杆菌通过不同的机制表现出抗肿瘤作用,包括发酵和生物转化。
不同种类的双歧杆菌通过下调和上调抗凋亡和促凋亡基因对结直肠癌细胞表现出抗癌活性。
此外,双歧杆菌可以与现有的癌症治疗手段发挥协同效应,通过调节免疫反应以帮助抗癌。越来越多的证据表明,双歧杆菌的某些物种和菌株可以改善免疫监视和抗肿瘤反应。
通过对非小细胞肺癌患者队列中癌症治疗有反应者和无反应者的肠道微生物群进行比较,作者发现,对治疗有反应的患者的粪便样本中富含双歧杆菌。
特定的双歧双歧杆菌菌株与癌症治疗协同作用
Hall, L.J, et al.,Nat Microbiol 2021
在癌症小鼠模型中测试了四种商业双歧杆菌菌株。只有那些在细胞壁中表达高水平肽聚糖的菌株在额外处理的同时,才会产生协同效应。产生协同作用的菌株诱导TLR2依赖性反应,导致IFN-γ和IL-2水平升高,并增加抗肿瘤白细胞。研究结果表明,用某些双歧杆菌菌株补充,可能会使无反应患者变得有反应。
体内和体外研究表明,长双歧杆菌和短双歧杆菌菌株能够保护 DNA 免受致癌物的侵害,并在大鼠模型中抑制两种不同致癌物的遗传毒性作用。
另一项研究表明,动物双歧杆菌对致癌物喹诺酮具有抗突变活性。在研究双歧杆菌的潜力在预防和/或治疗癌症方面,发现益生菌和细菌的组合可以减少小鼠结直肠癌模型中致癌物诱导的癌细胞。
双歧杆菌在免疫监视和刺激宿主免疫反应中的作用
一项早期研究表明,将短双歧杆菌添加到淋巴集结细胞的培养物中会导致免疫反应增强,如抗脂多糖抗体生产。
一项更近期的综合研究比较了口服或未口服双歧杆菌的小鼠黑色素瘤的生长情况。接受细菌制剂的小鼠表现出自发的抗肿瘤作用,这些作用在粪便转移后被逆转。
此外,肿瘤控制得到了与检查点封锁相同程度的改善,两者的结合几乎消除了肿瘤的生长。这些作用是通过增加树突状细胞功能、增强 CD8 + T 细胞启动和肿瘤微环境中的积累来介导的。
双歧杆菌可以作为一种运载工具,这种运载工具可以被设计用来表达感兴趣的基因/质粒。
双歧杆菌最有前途的作用,也是未来的药物输送载体。作为一种非致病性厌氧共生细菌,它成为了一种有吸引力的药物递送候选物,第一个肿瘤靶向研究表明该细菌在艾氏腹水小鼠肿瘤中高度定位。双歧杆菌对肿瘤组织的独特定位源于该细菌只能在缺氧条件下生存的厌氧特性:缺氧是恶性肿瘤的普遍现象,在肿瘤中心更为明显,从而选择性地吸引双歧杆菌生物体。
类似的后续工作证明了双歧杆菌不仅能够定位于肿瘤组织,而且能够表达lux报告基因的工程质粒。
几项研究证明了双歧杆菌作为疫苗递送载体、所需基因质粒的载体、可在无需质粒转染的情况下富集抗癌物质(如硒)的细菌的广泛用途。在不同的模式中,双歧杆菌证明有效地选择性靶向肿瘤细胞,同时表现出抗肿瘤作用。
当使用青春双歧杆菌菌株递送时,内皮抑素是一种广泛的血管生成抑制剂,可成功并选择性地抑制血管生成。
肝癌小鼠异种移植模型注射了经改造以表达内皮抑素基因的青春双歧杆菌。结果与细菌对肿瘤的选择性定位一致,因为在处死的正常组织中没有发现杆菌,并且与对照小鼠相比,血管生成受到强烈抑制,肿瘤生长减少。
考虑到双歧杆菌选择性定位于厌氧肿瘤环境的能力,及其携带转染质粒的能力,“货物”基因传递的可能性几乎是无限的。这种运载工具已被用于提供靶向分子通路调节剂。
双歧杆菌递送PTEN,抑制肿瘤生长
一个例子是使用长双歧杆菌穿梭载体递送PTEN,这是一种主要的肿瘤抑制基因,通常在癌发生的早期步骤中丢失,试图“挽救”其在小鼠实体瘤中的表达,并重建抑癌活性。 尽管结果尚未完全发表,但已描述了携带线性质粒的长双歧杆菌 L17菌株的成功改造,该质粒由pMB1和PTEN cDNA上游的HU基因启动子组成。当对小鼠实体瘤给药时,它会显着抑制肿瘤生长。
双歧杆菌递送中草药
如前所述,通过双歧杆菌载体递送药物/产品的可能性实际上是无限的,并且可能会扩展到包括递送正在临床评估的传统医学中使用的产品,比如,臭椿酮。
双歧杆菌递送生物转化剂
双歧杆菌也已被用于将生物转化剂递送至肿瘤部位。在该模型中,将无活性前药转化为其有效活性形式所需的酶通过双歧杆菌穿梭输送,确保在肿瘤内选择性地发生激活。
这种生物转化模型实现了两个目标:
此外,在有假体关节或心脏瓣膜等异物的患者中,细菌可能会脱靶到这些厌氧部位,需要高度警惕。
关于双歧杆菌属药物递送系统的可用临床前研究

doi.org/10.2217/fon-2019-0374
★
双歧杆菌是杂食“动物”,许多食物有利于促进其生长。
优质益生元:
低聚半乳糖GOS、低聚果糖FOS 和 母乳低聚糖HMO 已被用于婴儿配方奶粉,以增强婴儿肠道中的双歧杆菌。它们是经过临床验证的益生元,对促进肠道中的双歧杆菌非常有效。
含有多酚的食物:
苹果皮、红茶和绿茶、黑巧克力、咖啡、橄榄、橄榄油、姜黄和石榴、蔓越莓、蓝莓、黑莓和覆盆子等深色水果,适量葡萄酒等。
含有可溶性纤维的食物:
苹果、梨、燕麦、大麦、萝卜、西兰花、鳄梨和豆类。
含有抗性淀粉的食物:
绿色或半绿色香蕉、煮熟和冷却的土豆、煮熟和冷却的米饭、豆类和豆类。
某些发酵食品:
例如,酸奶,开菲尔,泡菜等。
其他食物:
例如:菊苣、洋葱、大蒜等。
如何知道这些吃进去的食品或补充剂对双歧杆菌产生影响?
肠道菌群检测是目前较为直观地反映补充剂和食物对肠道双歧杆菌影响的方法,使用 DNA 测序技术评估肠道中的菌群丰度。
如果通过检测发现双歧杆菌处于正常水平,则不需要额外补充,过高的双歧杆菌水平并不代表更健康;如果发现双歧杆菌缺乏,那么通过食物或益生菌补充剂等各种针对性补充方式是有利于健康的手段之一。
双歧杆菌是益生菌混合物的重要组成部分,当以适当的剂量给药时,它基本上具有各种有益健康的特性,包括抗感染、抗炎、抗癌、促进宿主心理和身体健康以及调节宿主免疫系统。
双歧杆菌通过抑制促炎细胞因子,诱导抗炎细胞因子来调节免疫系统,表明其作为感染性或炎症性疾病或癌症的潜在疗法的有效性。
当然,并非所有双歧杆菌都可以是益生菌菌株,需要正确识别益生菌干预的菌株、病理学和对应人群。深入理解双歧杆菌在宿主微生物组中的作用机制,从而了解更多未来使用这些微生物治疗疾病的影响和安全性。
此外,双歧杆菌工程可以促进增值化学品的生物产量的增加,同时消耗更少的资源。有必要进一步研究双歧杆菌作为工程宿主的可行性。
除了特定保健食品和医药行业外,双歧杆菌在微生态护肤、畜业、水产业和肉制品加工中也广泛应用,大有开发价值。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Turroni F, van Sinderen D, Ventura M. Genomics and ecological overview of the genus Bifidobacterium. Int J Food Microbiol. 2011 Sep 1;149(1):37-44. doi: 10.1016/j.ijfoodmicro.2010.12.010. Epub 2010 Dec 28. PMID: 21276626.
Lim HJ, Shin HS. Antimicrobial and Immunomodulatory Effects of Bifidobacterium Strains: A Review. J Microbiol Biotechnol. 2020 Dec 28;30(12):1793-1800. doi: 10.4014/jmb.2007.07046. PMID: 33144551; PMCID: PMC9728261.
Chen J, Chen X, Ho CL. Recent Development of Probiotic Bifidobacteria for Treating Human Diseases. Front Bioeng Biotechnol. 2021 Dec 22;9:770248. doi: 10.3389/fbioe.2021.770248. PMID: 35004640; PMCID: PMC8727868.
Sanchez B, Ruiz L, de los Reyes-Gavilan CG, Margolles A. Proteomics of stress response in Bifidobacterium. Front Biosci. 2008 May 1;13:6905-19. doi: 10.2741/3198. PMID: 18508704.
Sánchez B, Ruiz L, Gueimonde M, Ruas-Madiedo P, Margolles A. Adaptation of bifidobacteria to the gastrointestinal tract and functional consequences. Pharmacol Res. 2013 Mar;69(1):127-36. doi: 10.1016/j.phrs.2012.11.004. Epub 2012 Nov 22. PMID: 23178557.
Luo J, Li Y, Xie J, Gao L, Liu L, Ou S, Chen L, Peng X. The primary biological network of Bifidobacterium in the gut. FEMS Microbiol Lett. 2018 Apr 1;365(8). doi: 10.1093/femsle/fny057. PMID: 29546277.
González-Rodríguez I, Ruiz L, Gueimonde M, Margolles A, Sánchez B. Factors involved in the colonization and survival of bifidobacteria in the gastrointestinal tract. FEMS Microbiol Lett. 2013 Mar;340(1):1-10. doi: 10.1111/1574-6968.12056. Epub 2012 Dec 17. PMID: 23181549.
Andriantsoanirina V, Allano S, Butel MJ, Aires J. Tolerance of Bifidobacterium human isolates to bile, acid and oxygen. Anaerobe. 2013 Jun;21:39-42. doi: 10.1016/j.anaerobe.2013.04.005. Epub 2013 Apr 15. PMID: 23598280.
Gwiazdowska D, Juś K, Jasnowska-Małecka J, Kluczyńska K. The impact of polyphenols on Bifidobacterium growth. Acta Biochim Pol. 2015;62(4):895-901. doi: 10.18388/abp.2015_1154. Epub 2015 Nov 30. PMID: 26619254.
Jung DH, Seo DH, Kim YJ, Chung WH, Nam YD, Park CS. The presence of resistant starch-degrading amylases in Bifidobacterium adolescentis of the human gut. Int J Biol Macromol. 2020 Oct 15;161:389-397. doi: 10.1016/j.ijbiomac.2020.05.235. Epub 2020 May 30. PMID: 32479932.
Ferrario C, Milani C, Mancabelli L, Lugli GA, Turroni F, Duranti S, Mangifesta M, Viappiani A, Sinderen Dv, Ventura M. A genome-based identification approach for members of the genus Bifidobacterium. FEMS Microbiol Ecol. 2015 Mar;91(3):fiv009. doi: 10.1093/femsec/fiv009. Epub 2015 Jan 27. PMID: 25764568.
Lugli GA, Milani C, Turroni F, Tremblay D, Ferrario C, Mancabelli L, Duranti S, Ward DV, Ossiprandi MC, Moineau S, van Sinderen D, Ventura M. Prophages of the genus Bifidobacterium as modulating agents of the infant gut microbiota. Environ Microbiol. 2016 Jul;18(7):2196-213. doi: 10.1111/1462-2920.13154. Epub 2016 Jan 18. PMID: 26627180.
Lugli GA, Milani C, Turroni F, Duranti S, Ferrario C, Viappiani A, Mancabelli L, Mangifesta M, Taminiau B, Delcenserie V, van Sinderen D, Ventura M. Investigation of the evolutionary development of the genus Bifidobacterium by comparative genomics. Appl Environ Microbiol. 2014 Oct;80(20):6383-94. doi: 10.1128/AEM.02004-14. Epub 2014 Aug 8. PMID: 25107967; PMCID: PMC4178631.
Collado MC, Hernández M, Sanz Y. Production of bacteriocin-like inhibitory compounds by human fecal Bifidobacterium strains. J Food Prot. 2005 May;68(5):1034-40. doi: 10.4315/0362-028x-68.5.1034. PMID: 15895738.