-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康


最近关于“益生菌”的风很大,我们越来越容易从各种渠道听到关于补充益生菌的科普,但依然一知半解。
我们每个人都需要补充益生菌吗?
不同益生菌有什么不同,如何选择?
为什么有的人补充有效,有的人无效?
益生菌真的能定植吗?与什么因素有关?
…..

本文我们来逐一解答这些问题。
对于这个问题而言,我们要明确的是,补充益生菌的目的是为了通过改善菌群,从而达到更健康的状态。补充益生菌是改善菌群的一种方式。
并不是每个人都需要补充益生菌,也并不是每个人都适合补充益生菌,所以首先第一步是判断:
目前已有研究的,与菌群相关的疾病包括:
消化系统(腹泻、腹胀、便秘等);
神经系统(自闭症、精神障碍等);
免疫系统(哮喘等);
代谢系统(肥胖、糖尿病等);
心血管疾病(高血压、中风等);
癌症(胰腺癌、结肠癌等);
…
本号里有各类与菌群相关疾病的研究进展。
假如你本身非常健康,同时也一直遵循着健康的饮食和生活方式,那就不需要补充。
假如在你身上出现的症状和菌群完全没有关联,补充益生菌可能起不到太大的效果。
如果症状与菌群有关,或者正经历慢性压力、营养不良、药物、环境变动、衰老、疾病、旅行、肠道菌群紊乱等情况,可以通过补充益生菌的方式来改善菌群从而缓解症状。
然而,不同益生菌有不同的功效,并不是可以随意补充,究竟该如何选择?
下一章节我们来详细了解。
目前市面上的益生菌种类五花八门,要从这么多益生菌中选择适合自己的能发挥作用的,并不是一件容易的事儿,我们可以尝试从以下几个方面来了解益生菌。
最可靠的益生菌是那些经过双盲测试的益生菌。如果不进行双盲试验,益生菌测试可能会有偏差这些信息应该清楚地印在包装上。要检查包装确认益生菌厂家是否告知检测结果。
使用标准化流程的可追溯性确保了消费者安全和产品注册,尽可能选择严格规范的公司生产的益生菌。
对于无活菌标识、无菌株号、无任何文献数据支持的类型,则需谨慎。
益生菌每个属内都有很多种和菌株,益生菌的作用因这些种和菌株而不同。哪怕同属于乳酸杆菌,菌株不同效果也不同,比如:
嗜酸乳杆菌有助于血压、胆固醇、过敏和消化;鼠李糖乳杆菌可以帮助降低血糖、免疫功能和胆固醇;瑞士乳杆菌可以降低血压、改善睡眠质量和骨骼健康。
这里提供一些常见的益生菌及目前已知的功能作为参考。


-357x1024.png)
-1024x426.png)
-1024x615.png)
<来源:谷禾健康数据库>
研究表明最好空腹服用,通常是在早上。服用益生菌的是为了让它到达大肠,因为这是菌群存活率最高的地方。当有食物时,胃酸分泌较多,益生菌可能会被胃酸杀死,因此最好空腹服用。
一天中,最佳时间是早上空腹时,其余的话饭前或睡前也可以,饭后服用效果较差。
绝大多数人开始服用益生菌是安全的。在开始服用前几天,可能会出现胃部不适、胀气、腹泻或腹胀等症状。这些症状通常会在身体习惯后消失。
服用益生菌可能出现的副作用


如果是小肠细菌过度生长等疾病患者,则需要注意,可能会出现腹胀、便秘等消化疾病问题。
此外,它也可能会跟某些药物相互作用,如果长期服用药物,或有严重感染和近期做过手术的人群,使用益生菌前请遵医嘱。
如有牛奶过敏或乳糖不耐症、怀孕或哺乳等情况,请咨询医生是否适合服用。
在通过胃肠道的不利和波动条件的运输过程中,包埋可以为益生菌提供显著的保护。
微胶囊化对益生菌的贮藏稳定性和贮藏后性能有显著的影响。微胶囊化可以提高其在不利环境条件下的存活率,确保一定数量的益生菌进入人体并且在肠道中释放,提高益生菌的使用价值。
益生菌的种类不同,存储方式可能也有所不一,
益生菌产品的储藏方式一般可以分为常温,冷藏和冷冻三种,市场上的很多益生菌产品都需要冷藏。请检查包装去了解如何储存。对于干性益生菌补充剂,一般来说需要在干燥、黑暗的地方存储(潮湿条件会导致代谢发酵或降解)。
关于这部分详见《益生菌的靶向递送:研究和商业化前景》
跟其他食品一样,益生菌也要看生产日期或到期日期。随着时间的推移,CFU 的数量可能会下降。因此最好检查包装上的日期。
如果已经使用某种益生菌补充剂几周甚至几个月了,但没有发现消化系统健康状况有所改善,那么是时候尝试换一种新的益生菌了。
与药物不同,更换益生菌补充剂不会产生重大副作用。
此外,可以利用好肠道菌群检测这个工具。可以从两个方面入手:
益生菌抑制其他菌群生长
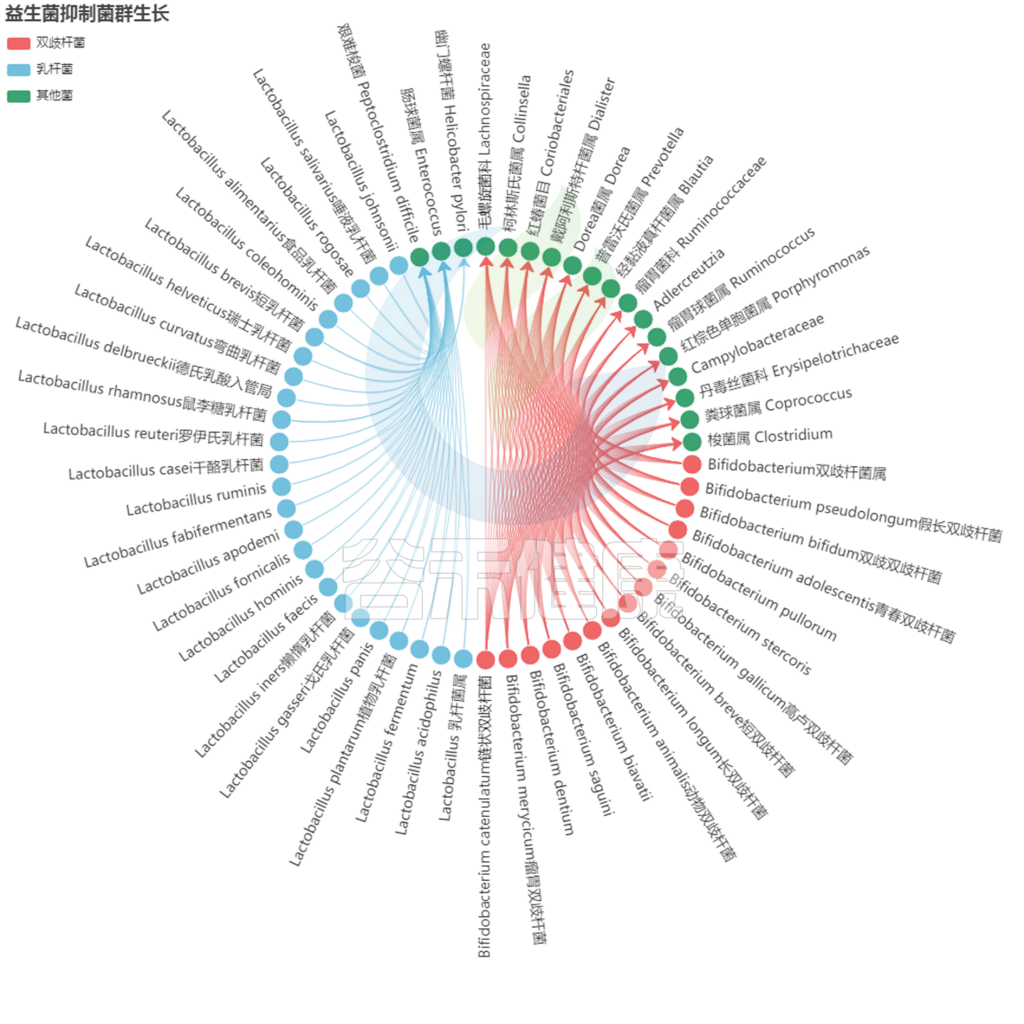

<来源:谷禾健康数据库>
注:以上红色代表双歧杆菌,蓝色代表乳杆菌,绿色则为其他菌群,箭头指向代表抑制的菌群。
我们知道,抗生素可以在杀死致病菌的同时,也会误伤体内的有益菌,破坏原有的菌群平衡状态。那能不能在抗生素使用的时候,补充一些益生菌使其恢复平衡?
目前针对益生菌和抗生素同时服用的研究,支持和不支持的都有。
√ 支持益生菌和抗生素同时服用的研究:效果显著
对给予益生菌的23项研究(3938名参与者)进行调查,22个试验报告了抗生素相关腹泻的发生率,结果显示,与活性、安慰剂或无治疗对照组相比,益生菌组显著受益(益生菌组8%,对照组19%)。
研究副作用的16项试验(n = 2455)中,没有一项记录了可归因于益生菌的任何严重副反应。作者认为益生菌对预防抗生素相关性腹泻具有保护作用。相对危险度为0.46 (95% CI为0.35 ~ 0.61),NNT为10。
作者认为鼠李糖乳杆菌或布氏酵母菌Saccharomyces boulardii 形成单位为每天50 – 400亿个是最合适的选择。
建议在进行进一步研究之前,应避免在有不良事件风险的儿童人群中使用益生菌。
× 反对益生菌和抗生素同时服用的研究:菌群恢复难
研究人员发现在服用抗生素4周后,接受11株益生菌治疗的人的肠道微生物群需要更长的时间才能恢复正常。这是在益生菌有效地在肠道定植的情况下。问题是新的细菌和酵母菌株的存在使肠道微生物群在整个6个月的研究期间无法恢复正常。
而那些没有服用益生菌的人的肠道菌群在停用抗生素三周后恢复正常。作者得出的结论是,这项研究只是检测了一种益生菌,不同的益生菌可能对服用不同抗生素的患者有帮助。不过他们也认为,在服用抗生素之后再服用益生菌可能是没有益处的。
还需要更多的研究来确定是否有其他方法来探索益生菌和抗生素的共存关系,如益生菌封装技术增强效果、自体粪菌移植等各种方式。
研究发现,封装的益生菌有一个由海藻酸钠或其他合适的生物相容性材料组成的保护壳,可以抵御抗生素;胶囊型益生菌对抗生素耐药病原体的治疗效果有所提高。这可能为益生菌和抗生素共同使用带来利好。
研究表明,自体粪便移植(在使用抗生素之前收集粪便样本并冷冻,在抗生素治疗后移植),8天内肠道菌群就恢复正常。未进行粪便移植的那一组的肠道菌群花了21天时间才恢复。
除了直接服用益生菌这种方式之外,有些食物中也富含益生菌,如:
还有其他方式也可以获取益生菌或者协助益生菌生长。
补充益生元,协助有益菌生长
益生元是一种可溶于水的可溶性纤维,可以作为益生菌的“食物”。
益生元可以通过小肠到达大肠和结肠,然后有益细菌会把它消化或发酵,形成乙酸盐、丙酸盐和丁酸盐等代谢物。
最广泛认可的益生元包括低聚果糖 (FOS)、菊粉和低聚半乳糖 (GOS) 等。
此外还包括抗性淀粉、果胶寡糖 (POS)、多酚等。
菊粉型果聚糖和阿拉伯木聚糖低聚糖等益生元表现出双歧化和产丁酸作用。产丁酸菌正需要这些益生元,例如直肠真杆菌、普拉氏粪杆菌和罗氏菌属。
有机酸的产生还可以形成对病原体的防御并增加矿物质的吸收。通过益生元和有益菌繁殖结合将导致较低的管腔 pH 值,阻止病原体在肠粘膜中的粘附和生长,并增加盲肠和结肠对矿物质,特别是钙和镁的吸收。
★ 哪些食物中含有益生元?
蒲公英嫩叶
蒲公英绿叶植物是菊粉和其他纤维的重要来源,每100克含有4克纤维。
蒲公英绿色植物也因其抗炎、抗氧化、降低胆固醇的功效而闻名,同时也有助于减轻便秘。
菊芋
每 100 克菊芋含有约 2 克膳食纤维,其中 3/4 由菊粉组成。它们还富含硫胺素和钾,可支持神经系统并促进适当的肌肉功能
青香蕉或青香蕉粉
未成熟的(绿色)香蕉富含抗性淀粉,绕过小肠的消化(可消化的淀粉转化为葡萄糖)并携带到结肠,被有益细菌发酵成代谢物。
香蕉中的纤维已被证明可以增加健康的肠道细菌并减少腹胀。
大麦和燕麦
大麦和燕麦由 3-8% 的 β-葡聚糖组成,这是一种益生元纤维,可促进肠道中有益细菌的生长。
还发现大麦和燕麦中的 β-葡聚糖可以降低 LDL 胆固醇(坏胆固醇)和血糖水平
大麦富含硒 – 支持甲状腺功能,抗氧化益处与预防多种癌症有关。
由于其酚酸含量,燕麦还提供抗氧化和抗炎保护。
魔芋根
魔芋根,也称为葡甘露聚糖,原产于亚洲部分地区,用于中药以及烹饪中作为增稠剂。它因其减肥益处和帮助降低低密度脂蛋白胆固醇而得到普遍认可。
除魔芋外,一项研究发现有助于减少粉刺并改善患者的整体皮肤健康。它还被发现有助于减少过敏。
菊苣根
菊苣根与蒲公英来自同一个家族,新鲜菊苣根由高达 70% 的菊粉组成,研究发现它有助于改善血糖控制,尤其是对糖尿病患者而言,并且还被发现有助于减轻体重。
菊苣根可以整个煮熟后与食物一起食用,也可以作为热饮冲泡,或者作为补充剂。
牛蒡根
通常作为茶饮用,具有广泛的益处,包括治疗癌症、糖尿病和炎症。其他好处包括帮助降低血糖水平和治疗糖尿病治疗和预防感染。
牛蒡可以作为茶服用,也可以作为补充剂的粉末服用。
亚麻籽
亚麻籽具有多种相关的健康益处。除了高纤维含量外,亚麻籽还富含蛋白质、omega-3 脂肪酸,以及一些维生素和矿物质的丰富来源。
一汤匙亚麻籽含有 3 克纤维,占每日推荐摄入量的 10%。亚麻籽有助于促进肠道中有益细菌菌株的生长,有助于降低血糖水平和治疗糖尿病、治疗和预防感染。
雪莲果根
雪莲果根的外观与甘薯相似,富含果糖(FOS),使其具有甜味。
豆薯根
豆薯根是一种可食用的根茎类蔬菜,原产于墨西哥,通常被称为墨西哥萝卜,由大约 5% 的膳食纤维组成。
海藻
海藻含有大量的生物活性化合物,如多糖和酚类物质,长期以来因其对健康的益处以及作为益生元的价值而得到认可。
海藻中发现的许多化合物对小肠的消化有抵抗力,但会刺激有益肠道细菌的生长及其发酵成短链脂肪酸。
土豆
土豆(以及土豆泥、薯条和炸薯条等土豆产品),一听就觉得是容易长胖的食物。确实,煮沸或油炸时,很容易在小肠中消化成葡萄糖。
然而,当土豆煮熟然后完全冷却至室温时,或者更好的是放在冰箱里,就会形成抗性淀粉。抗性淀粉属于膳食纤维的一种,抗性淀粉不被消化,进入结肠,作为菌群的营养源,菌群通过发酵,将碳水化合物代谢后生成丁酸等短链脂肪酸,促进肠道健康。
苹果
苹果含有丰富的纤维、维生素C、抗氧化剂和钾,具有显着的健康益处。它含有果胶,一种可溶性纤维,具有益生元作用并促进健康的肠道菌群。果胶会增加丁酸盐(短链脂肪酸),可以滋养有益的肠道细菌并减少有害细菌的数量。
其他协助益生菌的方式
▸ 适当锻炼
干预研究支持锻炼对肠道微生物群的有益影响。纵向研究表明,经常中等强度的耐力运动对肠道微生物产生最有益的影响,但是不同类型的运动训练方案(例如,阻力、间歇、伸展/柔韧性、耐力/有氧等)对肠道微生物群的影响存在差异。其他如训练状态,共享训练环境,自愿性,健康或疾病状况,年龄,性别等因素也是评估运动和肠道菌群的混杂因素。
关于运动锻炼对菌群的影响,详见:运动如何影响肠道微生物群,如何正确运动
▸ 足够睡眠
某些菌群会在睡觉时会大量繁殖,这些菌群在白天不会很好地繁殖。
如果你缩短睡眠时间,这些菌群可能会受到影响,没有机会增殖,从而影响肠道菌群的整体平衡。保持足够的睡眠对于健康的身体、肠道极为重要。
需要多少睡眠时间取决于年龄,并且因人而异。大多数成年人每晚至少需要七个或七个以上的睡眠时间。
新生儿(0到3个月):睡眠14到17个小时
婴儿(4至11个月):睡眠12至15小时
幼儿(1至2岁):睡眠11至14小时
学龄前儿童(3至5岁):睡眠10至13小时
学龄儿童(6至13岁):睡眠9至11小时
青少年(14至17岁):睡眠8至10小时
年轻人(18至25岁):睡眠7至9小时
成人(26至64岁):睡眠7至9小时
老年人(65岁或以上):睡眠7至8小时
当然以上只是参考,并不是所有人必须达到的标准,少数人的需要的睡眠时间本来就不多,且没有睡眠困扰或不适症状,则无需参考以上标准。
关于睡眠与肠道菌群详见:
肠道菌群与睡眠:双向调节
深度解析|睡眠健康与肠道健康之间的双向联系
有人说,益生菌在体内不能定植,很快就会被排出体外了…… 益生菌究竟能不能定植?


可以定植,但不容易。
首先,我们来看口服的益生菌在体内经历了什么?
▸口腔——唾液对益生菌的影响微乎其微
益生菌首先会接触到口腔中的唾液。唾液是一种透明且微酸性的黏液性外分泌物,由保护牙齿和黏膜表面的免疫和非免疫成分组成。
对多种乳酸杆菌、小球菌和双歧杆菌菌株进行的体外研究表明,与对照组相比,接触唾液时细胞计数没有显著损失。
▸胃——胃酸对大多数细菌都是极其致命的
通过食道后,益生菌到达胃部,转运需要5分钟到2小时,长时间暴露在酸性胃液中,对益生菌来说是一个巨大的挑战。
尤其是对不耐酸的细菌,会导致细菌细胞质pH降低。
氢离子(H+)的涌入导致糖酵解酶活性下降,进而影响F1F0 – ATP酶质子泵。低pH条件下F1F0 – ATP酶质子泵活性的降低,因此益生菌存活难。
胃中存在的其他不利条件:
包括离子强度、酶活性(胃蛋白酶)和机械搅拌对益生菌的生存能力有影响。例如,长双歧杆菌和短双歧杆菌的活细胞在模拟胃液中1小时内消失。


▸小肠——胆汁酸和消化酶影响益生菌生存
益生菌通过幽门到达小肠,那里有大量胰液和胆汁。在肠液的中和作用下,小肠内的pH约为6.0-7.0,比胃液温和得多。
然而,胆汁酸和消化酶(包括脂肪酶、蛋白酶和淀粉酶)也可以影响益生菌的生存能力,通过细胞膜破坏和DNA损伤等方式。
体外研究表明,在模拟肠液中唾液乳杆菌Lactobacillus salivarius Li01、Pediococcus pentosaceus Li05 的生存能力降低。
为了增强益生菌对胃液和胆汁的耐受性,可以将益生菌包裹在一层保护性外壳上,也就是前面说的微胶囊。近年来,微囊化技术在提高存活率和保证足够数量的活菌到达结肠方面取得了很大进展。
经历以上重重考验,益生菌的定植之路看起来并不容易。

而以上这些只是其中一部分原因。
等益生菌到了结肠之后,有更多的考验等着它。
共生菌的定植抗性,给益生菌的定植带来不利影响
doi.org/10.3389/fcimb.2021.609722
由于定植抗性,大多数益生菌在口服后和消耗停止后不久随粪便排出结肠。
那么,什么是定植抗性?
通俗地说,在人类的菌群中,一个新的物种想要入侵并定居下来,也就是定植。但是本身存在的菌群会用各种方式,拒绝新的物种一起生活,就是所谓的“定植抗性”。
对于病原体而言,常驻微生物群的这种定植抗性,可以使其更难生长和繁殖,从而预防疾病的发生。
举个例子:
鼻腔微生物群的存在,可以保护人体免受呼吸道金黄色葡萄球菌感染,金黄色葡萄球菌想要入侵得过鼻腔微生物群这一关…
换句话说,益生菌如果想要定植,必须与宿主菌群竞争养分和粘附部位,争到了资源,活下来,才能繁衍后代。
具体的争抢资源的方式是什么?
包括以下各种方式:改变资源可用性、占领生态位、捕食、竞争等。
我们大致分成两种机制:直接和间接。
指严格通过与肠道菌群相关的因素,来限制外源微生物定植,独立于与宿主的任何相互作用。
这就涉及到菌群之间的相互作用。
一般这样的相互作用分为两种情况:
互利共生和竞争关系。
以拟杆菌为例。
▸ 互利共生(定植成功):
不同的拟杆菌种之间存在广泛的互利共生作用,也就说,拟杆菌群在肠道中团结友爱,稳定存在。
比如说,一些拟杆菌能够分解某种多糖,并释放出小分子物质,从而促进不能利用该多糖的拟杆菌生长。更有甚者,这种交互共生关系有时是以过量消耗某一种拟杆菌能量的前提下实现的。
延伸到其他菌群,可能会出现的情况:
里应外合:
准备入侵的菌与本地菌群偶然相互作用,促进定植;
抱团取暖:
两个非本地菌群之间的良好相互作用,可以使定植更加成功。
▸ 竞争关系(一争高下):
非病原菌与细菌竞争肠道上皮细胞刷状缘的结合位点,阻止病原菌的黏附、侵袭;
细菌竞争性利用营养素,消耗掉维持各自种群的生长原料。
有些菌群不直接和新来的菌群产生竞争,而是可以通过改变环境(改变pH值,胆汁酸浓度等)或释放抑制因子(如,代谢产物、细菌素等),从而决定另一个物种是否能成功定植。
结合肽聚糖抑制其他菌生长:
例如,拟杆菌的结构分子及代谢产物,能通过激活一系列的免疫细胞而参与宿主肠道免疫。
拟杆菌还能够更大量地刺激肠上皮细胞分泌RegIIIγ,它能够强力结合大部分革兰氏阳性菌表面的肽聚糖,抑制脂磷壁酸的合成从而抑制细菌的生长。
环境的改变如何影响其他菌群?
更高的营养浓度会导致微生物之间更多的负面相互作用
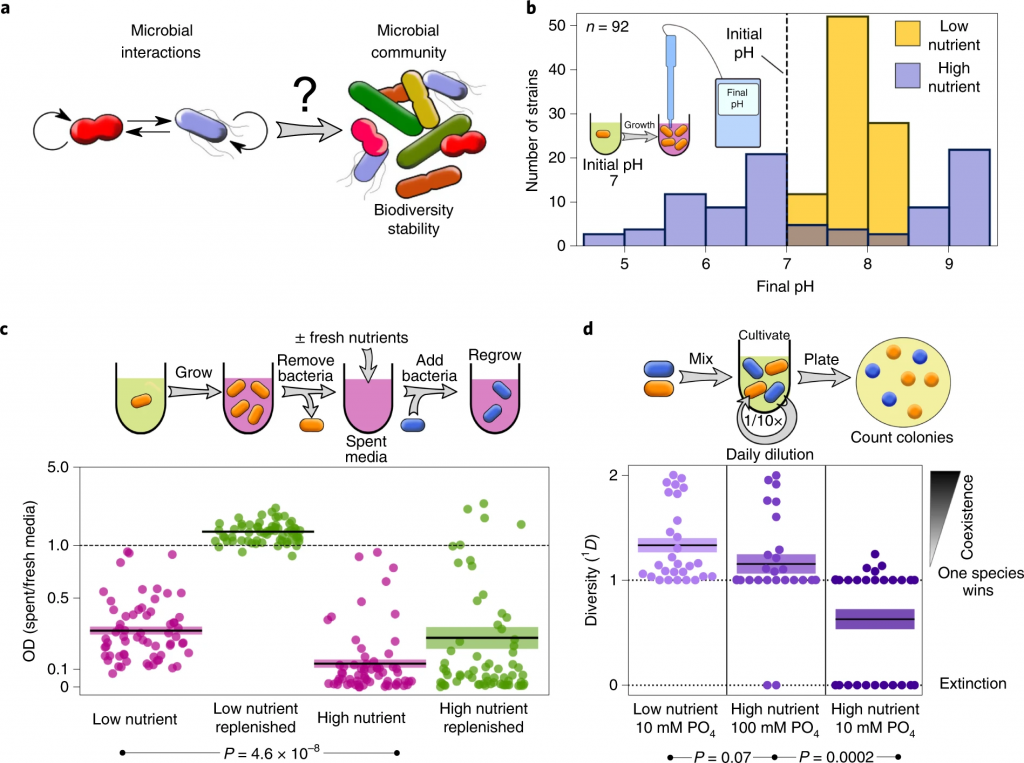

Ratzke C, et al., Nat Ecol Evol. 2020
在较高的营养浓度下,细菌会更强烈地改变环境pH值。
在较高的营养浓度下,细菌会产生更具生长抑制性的环境。
参考上图c,直接(紫色)或补充资源(绿色)后使用不同细菌的废培养基重新培养细菌。每个相互作用对的相对增长显示为散点图。
高营养浓度会减少相互作用对之间的共存。
低营养成分包括0.1%酵母抽提物和0.1%大豆酮。高营养的培养基与添加1%葡萄糖和0.8%尿素的培养基相同。所有28种共培养结果均显示为一个群体图。
微生物获得的营养浓度越高,它们生长的越多,它们代谢的底物就越多,因此它们可以改变环境的能力越强。
再看常见的益生菌,例如,乳酸杆菌和双歧杆菌:
乳酸杆菌和双歧杆菌在碳水化合物发酵过程中产生乙酸盐和乳酸,有机酸可以通过交叉喂养相互作用被其他细菌转化为丁酸盐。这些产生的有机酸降低了腔内的 pH 值,抑制了病原体的生长并增加了矿物质的吸收。
注:丁酸盐和其他短链脂肪酸对肠道健康至关重要,但也可能进入体循环并直接影响新陈代谢或外周组织的功能。短链脂肪酸在脂肪组织、骨骼肌中发挥重要作用和肝脏底物代谢和功能,有助于改善葡萄糖稳态和胰岛素敏感性。
以上,我们了解菌群之间相互作用机制。
可见菌群的定植并不容易,它们要面临的,可能是同伴的帮助,也可能是其他菌群的竞争或杀戮,又或者是受到环境的考验。
在经历此番折腾后,益生菌如果能顺利定植,它会在哪里,如何定植?
胃肠道的成功定植,是益生菌能够发挥足够的作用,是赋予健康益处的关键。粘膜粘附是益生菌定植的重要步骤。
在本小节中,我们将讨论肠道粘液层的组成和与益生菌粘附相关的特定蛋白质。
什么是肠粘膜和粘液层?
肠粘膜由上皮层、固有层和肌层组成。小肠绒毛由上皮细胞和伸入肠腔的固有层组成,覆盖在黏膜表面,负责肠内营养物质的吸收。
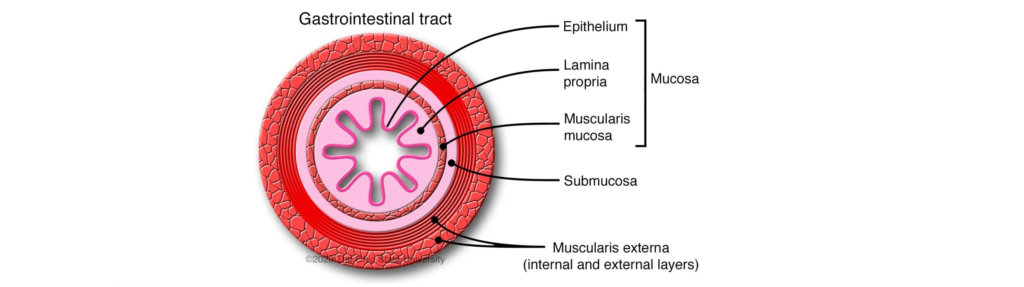
上皮细胞由吸收细胞、杯状细胞和内分泌细胞组成。杯状细胞分散在吸收细胞之间,分泌覆盖整个小肠腔的粘液,由碳水化合物、脂类、盐、蛋白质、细菌和细胞碎片组成。
粘液厚度约为 30 ~ 300 μm;从肠道到直肠的厚度都在增加。主要的蛋白质是粘蛋白,它聚合形成一个连续的凝胶基质,为粘膜层提供结构基础,保护肠道免受病原体、酶、毒素、脱水和磨损。
同时,肠道粘液中含有维生素、矿物质等外源性营养物质,为定植于肠道粘液中的细菌提供了巨大的生态生长优势。可以说,粘液是益生菌和病原体的绝佳生态位。
细菌粘附粘膜的过程包括可逆阶段和稳定阶段。
可逆阶段(初相识)
最初,益生菌通过非特异性的物理接触(包括空间和疏水识别)与粘膜结合,建立可逆的、弱的物理结合。
稳定阶段(如胶似漆)
随后,随着粘附素(通常是固定在细胞表面的蛋白)和互补受体之间的特异性相互作用,益生菌与粘液或肠上皮细胞(IECs)建立了稳定的结合,从而成功定植胃肠道。
益生菌可以编码大量的细胞表面因子,这些因子参与粘液蛋白或上皮细胞的粘附。
除蛋白质外,益生菌中还存在非蛋白分子,如磷壁酸和胞外多糖,它们可以与宿主细胞相互作用,影响粘附。
从目前的研究可以推断,没有固定的分子可以适用于所有菌株的益生菌。
许多粘附素似乎是种或株依赖性的。这些与粘附相关的益生菌表面分子和粘附相关的机制将在下面详细讨论(下表)。
表 益生菌中的粘附相关分子
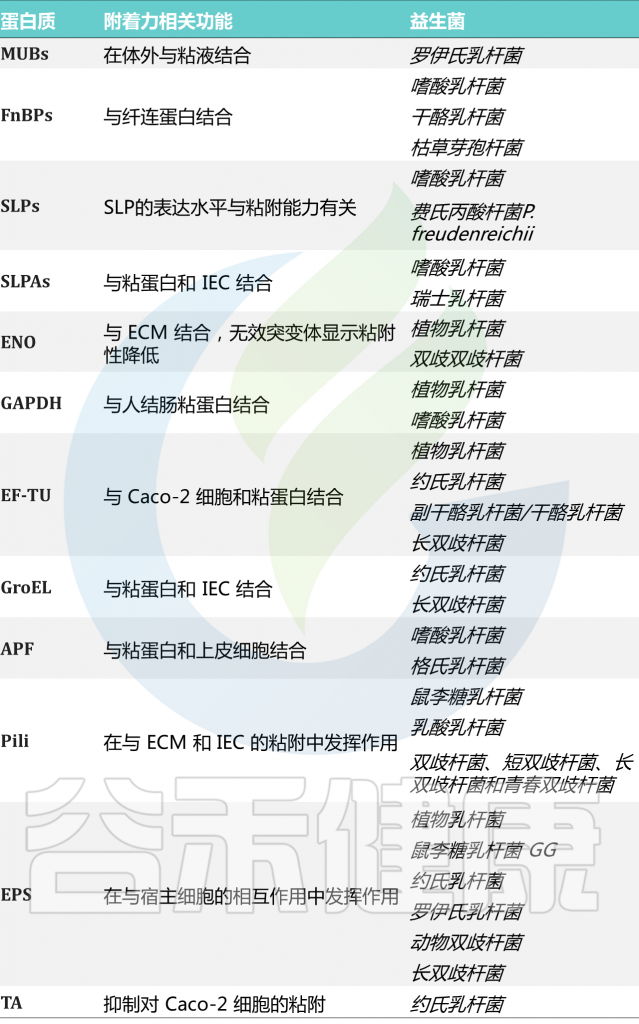

doi.org/10.3389/fcimb.2021.609722
粘液层的组成和与益生菌表面蛋白的结合
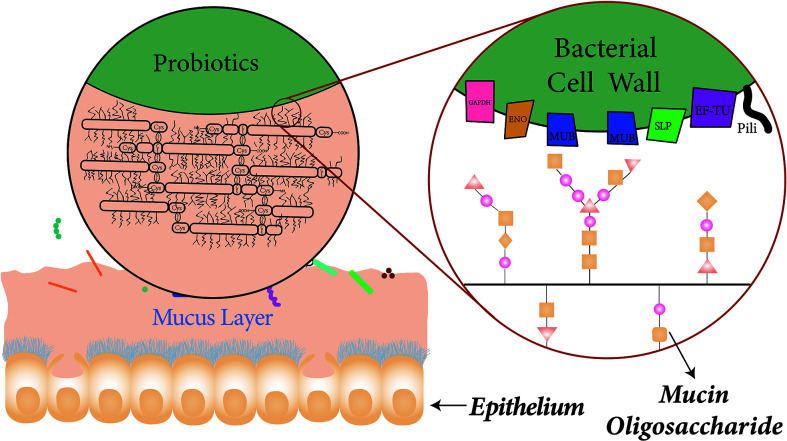
doi.org/10.3389/fcimb.2021.609722
杯状细胞分散在吸收细胞之间,吸收细胞可以分泌覆盖整个小肠的粘液。粘液主要由富含半胱氨酸的粘蛋白组成。粘液蛋白之间广泛的二硫键形成黏液特有的粘弹性。
益生菌表面的特异蛋白在益生菌粘附粘液中起着重要作用。例如,粘液结合蛋白可以通过与粘液蛋白的糖基修饰相互作用而与粘液层结合。
一旦粘附在肠道,益生菌通过将碳水化合物、蛋白质和其他次要化合物转化为能杀死病原菌的重要物质,如有机酸、酶、过氧化氢、细菌素和低分子量肽,可以产生细胞外抗菌成分。
以上是益生菌的定植给人体带来益处,当然这也不一定会发生在每个人身上。
益生菌定植的效果因人而异。
看一项有趣的研究,志愿者被分为两组,“允许型”和“抵抗型”。在允许组的人的肠道粘膜中益生菌菌株显著增加,而在抵抗组的人的肠道中没有检测到益生菌。
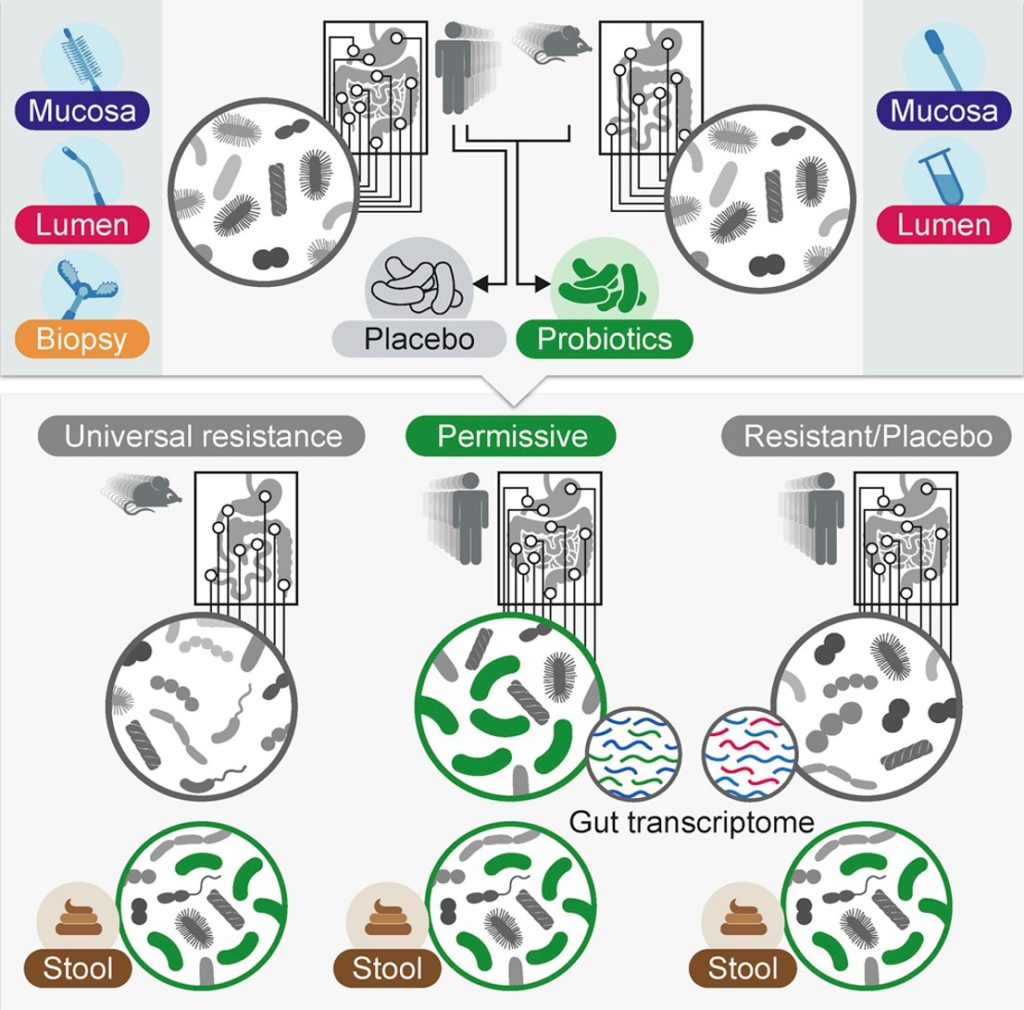
doi.org/10.1016/j.cell.2018.08.041
同样是补充益生菌,有些人身上可以看到非常明显的效果,而有些人的效果则不明显,这是为什么呢?
菌群都具有高度个体特异性,也就是人和人之间的菌群相差较大。
常驻微生物群对人类健康很重要,因为它们占据了可能被病原微生物占据的生态位。
就婴儿而言,影响初始菌群定植的因素包括:胎龄(足月or早产)、分娩方式(自然分娩or剖腹产)、喂养方式(母乳or配方奶)、药物使用(抗菌药物)、生长环境(城市or农村)等。
就成年人而言,年龄、饮食、生活方式、疾病状况、药物使用、环境等多因素都会影响肠道菌群多样性,这在前面的文章《菌群多样性是如何形成的,与健康的关系,如何改善?》已经详细阐述。
这些所有叠加后会形成一个具有高度特异性的个体菌群,构成的整体菌群环境会影响到其他新的菌群的定植。
那么,益生菌在什么样的菌群中更容易定植?
再来看一项研究,为了评估定植抗性,该研究建立了一种电子入侵分析方法,在该方法中,稳定的菌群受到不同种群规模的入侵者的挑战。
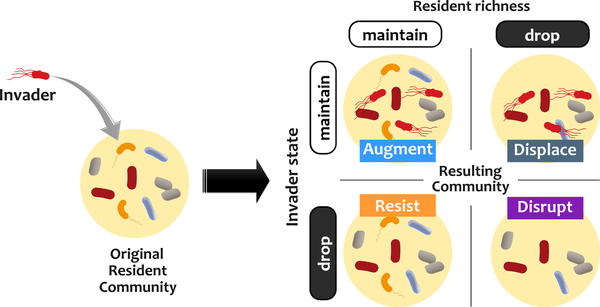
doi.org/10.1371/journal.pcbi.1008643(下同)
根据入侵者和常驻菌群的命运对结果进行分类。
有四种可能的结果:
增加入侵者的数量不会增加入侵者定植的概率。
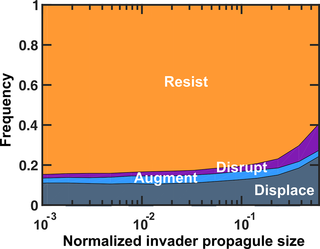
类比到益生菌,高剂量的益生菌可能并不会因此带来明显的定植效果。
基础增长率较高的入侵者更有可能取代常驻菌群,这可能是竞争潜力的主要指标。
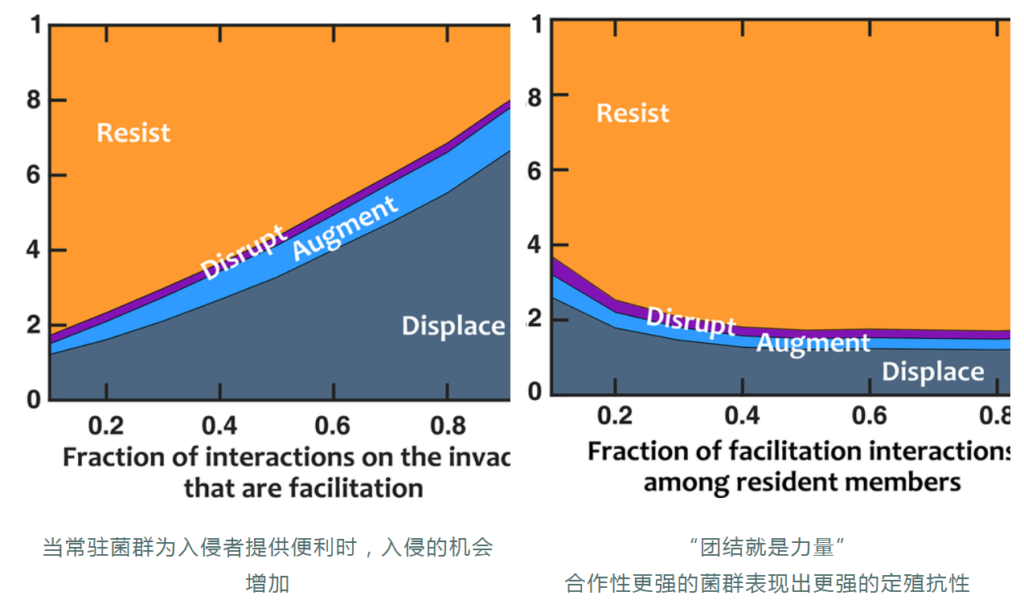

如果常驻菌群创造的化学环境有利于入侵者,入侵者会更成功。
这就说明,常驻菌群本身的结构特征也比较重要。益生菌带来的健康益处可能不仅是由单独补充的益生菌菌株引起的,而是与常驻肠道微生物群相互作用的结果。
研究人员在宏基因组和宏转录组学研究中表明,在 12 名健康老年人中食用鼠李糖乳杆菌GG益生菌菌株改变了常驻菌群的活性,而不会影响肠道微生物群组成本身。
益生菌虽然没有在菌群构成上带来改变,但是菌群的表达特征发生较大变化。尤其是益生菌服用后会大大促进双歧杆菌和主要丁酸产生菌:Roseburia和Eubacterium的鞭毛、运动,趋化性和粘附相关基因的表达。表明其能促进这些关键菌主动渗透进入肠粘膜的能力,提高宿主对于丁酸盐的利用度。
那么对于部分人群,益生菌不能有效定植,是否意味着益生菌无效?
有时候,益生菌并不是完全依靠在肠道的定植来产生影响。就算不能定植,它也有其他很多种方式来发挥优势。
益生菌:有助于维持宿主体内的动态平衡和防治疾病
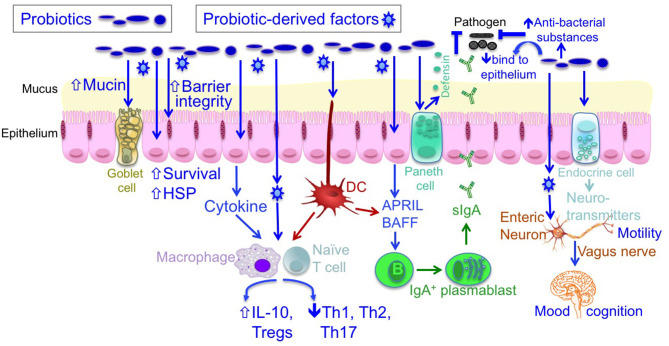
Yan F, Polk DB. Front Immunol. 2020
(1)通过产生抗菌物质和与病原体竞争结合上皮细胞来阻断致病细菌的作用
(2)通过增加屏障功能、粘液生成、存活和细胞保护反应来促进肠上皮细胞的稳态
(3)通过增加先天免疫,如IgA和防御素的产生,上调抗炎细胞因子的产生,抑制促炎细胞因子的产生,确定必要和过度防御免疫之间的平衡
(4)通过产生神经递质和迷走神经调节肠脑轴
益生菌衍生因子:有助于增强肠道屏障功能和刺激抗炎免疫反应
益生菌源因子对宿主反应的调控。一些益生菌衍生因子,包括产物和代谢物,对宿主发挥促进健康的作用。
益生菌的这些功能因子有助于增强肠道屏障功能,刺激抗炎免疫反应,从而改善肠道炎症紊乱。

Yan F, Polk DB. Front Immunol. 2020
益生菌混合物:减少成人肠道致病性或耐药性肠杆菌定植
益生菌补充剂可以减少肠道中潜在的耐药性或致病性肠杆菌,但有时候不能完全根除。
“如果益生菌单打独斗的力量不够,是不是可以寻求其他外援?”
比如多联益生菌,或者益生菌-益生元联合使用等方式。
多联益生菌减少肠杆菌:
为了根除潜在的肠杆菌,益生菌混合物(Bactiol duo ®:S. boulardii、L. acidophilus NCFM、L. paracasei Lpc-37、B. lactis Bl-04、B. lactis Bi-07 )的临床试验表明 ,在阿莫西林-克拉维酸治疗后,产 AmpC肠杆菌的定植会暂时增加,而在益生菌干预后会下降。
嗜酸乳杆菌CL1285、干酪乳杆菌LBC80R 和鼠李糖乳杆菌CLR2 (Bio-K+ ® )的混合物在预防成人抗生素相关性腹泻和初级预防艰难梭菌感染方面也表现出显着效果。
益生菌-益生元联合使用减少肠杆菌:
60名健康绝经前日本女性连续摄入发酵豆奶(含异黄酮)和干酪乳杆菌Shirota,能够降低肠道杆菌的粪便水平,并提高异黄酮的生物利用度。
当然以上只是小规模研究,还需进一步研究。
在人类中,一些临床干预可能会促进肠杆菌的肠道携带。益生菌可能有助于根除肠道携带的致病性或耐药性肠杆菌。
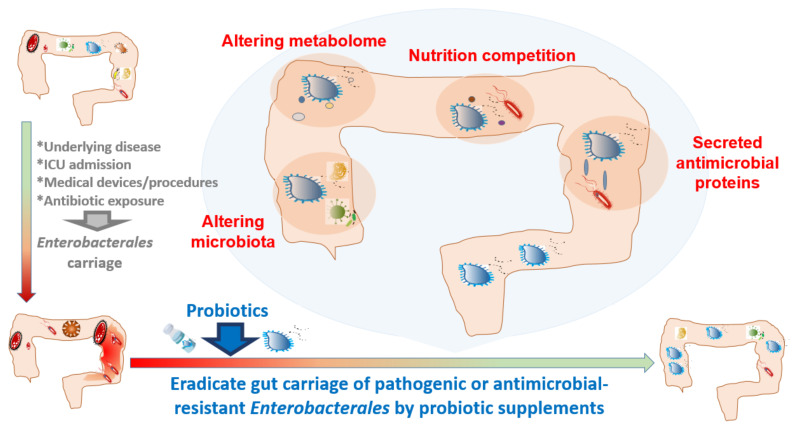
doi:10.3390/antibiotics10091086
综上,益生菌不能定植并不能说就是无效的,它有各种方式来影响人体健康。
“
广谱益生菌无论是否定植,在一定程度上都可以为我们的健康带来益处。当然每个人的菌群特征各不相同,结合肠道菌群检测结果,根据自身菌群特征,选择适合自己的益生菌,可以更加快速有效地帮助建立或恢复健康的菌群。
在服用益生菌的同时,如果能注意上述合理的饮食、健康的生活方式等,相当于开启了外挂,对于快速恢复菌群具有重要意义。主要参考文献:
Yan F, Polk DB. Probiotics and Probiotic-Derived Functional Factors-Mechanistic Insights Into Applications for Intestinal Homeostasis. Front Immunol. 2020;11:1428. Published 2020 Jul 3. doi:10.3389/fimmu.2020.01428
Hung, Yuan-Pin et al. “The Potential of Probiotics to Eradicate Gut Carriage of Pathogenic or Antimicrobial-Resistant Enterobacterales.” Antibiotics (Basel, Switzerland) vol. 10,9 1086. 8 Sep. 2021, doi:10.3390/antibiotics10091086
Wieërs G, Belkhir L, Enaud R, et al. How Probiotics Affect the Microbiota. Front Cell Infect Microbiol. 2020;9:454. Published 2020 Jan 15. doi:10.3389/fcimb.2019.00454
Pickard, Joseph M et al. “Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease.” Immunological reviews vol. 279,1 (2017): 70-89. doi:10.1111/imr.12567
Zmora N, Zilberman-Schapira G, Suez J, Mor U, Dori-Bachash M, Bashiardes S, Kotler E, Zur M, Regev-Lehavi D, Brik RB, Federici S, Cohen Y, Linevsky R, Rothschild D, Moor AE, Ben-Moshe S, Harmelin A, Itzkovitz S, Maharshak N, Shibolet O, Shapiro H, Pevsner-Fischer M, Sharon I, Halpern Z, Segal E, Elinav E. Personalized Gut Mucosal Colonization Resistance to Empiric Probiotics Is Associated with Unique Host and Microbiome Features. Cell. 2018 Sep 6;174(6):1388-1405.e21. doi: 10.1016/j.cell.2018.08.041. PMID: 30193112.
Han S, Lu Y, Xie J, Fei Y, Zheng G, Wang Z, Liu J, Lv L, Ling Z, Berglund B, Yao M, Li L. Probiotic Gastrointestinal Transit and Colonization After Oral Administration: A Long Journey. Front Cell Infect Microbiol. 2021 Mar 10;11:609722. doi: 10.3389/fcimb.2021.609722. PMID: 33791234; PMCID: PMC8006270.
de Melo Pereira GV, de Oliveira Coelho B, Magalhães Júnior AI, Thomaz-Soccol V, Soccol CR. How to select a probiotic? A review and update of methods and criteria. Biotechnol Adv. 2018 Dec;36(8):2060-2076. doi: 10.1016/j.biotechadv.2018.09.003. Epub 2018 Sep 26. PMID: 30266342.
Eloe-Fadrosh, Emiley A et al. “Functional dynamics of the gut microbiome in elderly people during probiotic consumption.” mBio vol. 6,2 e00231-15. 14 Apr. 2015, doi:10.1128/mBio.00231-15

谷禾健康
人类肠道菌群复杂多样,在与人类长期的共同进化过程中,具备了调节人体免疫应答、影响疾病发展等作用。这种作用与肠道菌群本身的多样性和关键核心菌种的是否存在等具有紧密联系。
在前面的文章我们已经了解到,肠道菌群失调与很多疾病相关,详见:
肠道菌群失衡的症状、原因和自然改善
造成菌群失调的原因有很多,比如抗生素的使用,膳食营养不均衡,感染,重金属污染,疾病发生以及过渡清洁肠道等。
一般肠道菌群失衡可以通过一些明显的迹象表明肠道菌群失衡,如腹胀气、腹泻、便秘、间歇性或慢性腹泻、肠易激综合征、溃疡性结肠炎和克罗恩病,频繁呼吸道感染、过敏、神经问题、免疫低下或代谢异常等来判别。
说到对改善修复肠道菌群,一般是针对菌群存在异常或者偏离健康状态的特定情况才进行针对性调节,这些调节思路主要包括 “清除”,“补充”,“置换”,“塑造”。常用的手段或措施如,使用抗生素或抗菌剂,益生菌,益生元,膳食纤维,粪菌移植,饮食或天然补充物等。
以上改善措施单一或者组合对改善和调节宿主微生态平衡发挥重要作用。不过个体的菌群构成和状态差异很大,由此带来的干预对不同个体和状态的干预效果同样有很大差异,这也反映在很多菌群干预临床研究上。
所以盲目的补充益生菌,益生元等单纯的从菌量或功效来评价益生菌产品的好坏,都可能不利于有效的改善健康状况和调整微生态平衡。除了对比如益生菌菌株,益生元结构区分等进行更加精细化的功能分析外,还需要结合肠道菌群检测,基于不同肠道菌群特点进行精准化的匹配干预和临床研究。
今天我们主要简单讲下不同的一些益生菌、益生元、天然调节剂等对肠道菌群的调节以及对宿主健康的影响及其差异化。
益生菌的现代定义为“活的微生物,当给予足够的剂量时,会赋予宿主健康”。益生菌主要存在于人体肠道内,通过维持肠道微生物平衡,在宿主体内发挥有益作用。在日常生活中,常见的益生菌,如乳酸杆菌或双歧杆菌,通常作为活性菌制剂食用。
近年来,益生菌的研究取得了重大进展。例如,益生菌益生菌可以改善肠道菌群的组成缓解便秘,IBS,IBD,改善腹泻,修复多种与肠道相关的损伤等,此外,益生菌可以在慢性炎症性疾病的治疗中发挥作用,具有抗癌、抗肥胖和抗糖尿病等作用。
本章节我们列举一些常见的益生菌及其功效。
双歧杆菌
人体内双歧杆菌的数量实际上随着年龄的增长而下降。双歧杆菌在提高整体免疫力、减少和治疗胃肠道感染以及改善腹泻、便秘和湿疹等方面发挥作用。
双歧杆菌中常见的种类有:双歧双歧杆菌、长双歧杆菌、婴儿双歧杆菌、乳酸双歧杆菌、短双歧杆菌等。
双歧双歧杆菌B.bifidum是一种通常用于改善消化问题的益生菌。B.bifidum与健康饮食相结合还可以改善血糖控制、减轻压力并帮助对抗感染,有助于增强免疫系统并减少过敏。
双歧双歧杆菌是在母乳喂养婴儿中发现的第二大菌种。在成年期,双歧杆菌的水平显著下降,但保持相对稳定 (2-14%),在老年时再次开始下降。
对其他肠道菌群的影响
在一项针对 27 名健康志愿者的临床试验中,双歧杆菌的摄入量减少了普氏菌科和普氏菌属,并增加了瘤胃球菌科和Rikenellaceae。
在一项针对 53 名慢性肝病患者的临床试验中,双歧双歧杆菌是成功防止小肠细菌过度生长的益生菌之一。同样,在一项针对 66 名酒精性肝损伤患者的试验中,它与植物乳杆菌(后面会讲到)的组合恢复了肠道菌群。
在对 30 人进行的另一项试验中,双歧双歧杆菌与嗜酸乳杆菌(后面会讲到)结合也在抗生素治疗后恢复了肠道菌群。
健康益处


双歧杆菌除在以上列举的疾病发挥作用之外,还在压力、过敏等方面发挥作用(小规模研究或临床试验单一)。
安全性
B. bifidum一般都是安全的,但应避免在免疫功能低下的个体、器官衰竭和“肠漏”的人群中使用。在这些情况下,益生菌可能会导致感染。在具有自身免疫性甲状腺疾病遗传易感性的人群中,双歧杆菌可能导致其发展和恶化。
短双歧杆菌是一种有益细菌,可以在人类母乳以及婴儿和成人的胃肠道中找到。随着个体年龄的增长,其肠道内的短双歧杆菌减少。
对肠道菌群的影响
在一项对 30 名没有其他畸形、染色体异常或宫内感染的低出生体重婴儿的研究中,早期给予短双歧杆菌促进了双歧杆菌的定植和正常肠道菌群的形成。
B. breve还显著减少了 10 名极低出生体重婴儿的吸入空气量并改善了体重增加。
健康益处


短双歧杆菌除在以上列举的疾病发挥作用之外,还在肥胖、坏死性小肠结肠炎、乳糜泻、感染等疾病中发挥作用(小规模研究或临床试验单一)。
目前已有文献中,部分关于短双歧杆菌菌株的研究:
短双歧杆菌M -16V (B. breveM-16V) 显着抑制 Th2 和 Th17 淋巴细胞亚群。
同时,B. breve M-16V 可能激活 MyD88 表达并促进 Th1 相关细胞因子 IL-12 的产生。此外,B. breve M-16V 可能部分恢复肠道菌群失调。
B. breve CCFM1025 是一种很有前途的候选精神生物菌株,可减轻抑郁症和相关的胃肠道疾病。
B. breve FHNFQ23M3可以缓解腹泻症状。
母乳分离的益生菌菌株B. breve CECT7263 是一种安全有效的婴儿绞痛治疗方法。
B. breve UCC2003 在生命早期驱动肠上皮稳态发育中发挥着核心作用。
安全性
B. breve被证明是适合早产儿常规使用的益生菌。
与使用短双歧杆菌相关的不良事件发生率极低,且严重程度较轻。
长双歧杆菌是一种革兰氏阳性、杆状细菌,天然存在于人体胃肠道中。它可以改善人体免疫反应并帮助预防肠道疾病。早期证据表明,它还可以抑制过敏、降低胆固醇和改善皮肤健康。
我们之前这篇文章有详细介绍,详见:双歧杆菌:长双歧杆菌
乳酸杆菌
鼠李糖乳杆菌是一种革兰氏阳性乳酸菌,是人类正常肠道菌群的一部分。通常都是安全的,并已广泛用于食品和保健品中。
健康益处


鼠李糖乳杆菌除在以上列举的疾病发挥作用之外,还在体重管理、肝功能、牙齿健康、免疫、怀孕与分娩等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
鼠李糖乳杆菌在健康成人中是安全的并且耐受性良好,并且似乎不会对年轻或老年受试者造成不良影响。
但是,免疫功能低下的人不应服用它,因为它可能导致菌血症。在器官衰竭、免疫功能低下状态和肠道屏障功能失调的患者中使用益生菌可能导致感染。
短乳杆菌L. brevis是一种植物来源的乳酸菌,L. brevis可以在酸菜和泡菜等发酵食品中找到。它也是人体肠道微生物群的正常组成部分。
健康益处


短乳杆菌除在以上列举的疾病发挥作用之外,还在睡眠、口腔黏膜炎等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
L. brevis被认为对人类食用是安全的。
L. brevis可以产生生物胺,如酪胺和腐胺。
对于器官衰竭、免疫功能低下和肠道屏障机制功能障碍的患者,应避免使用益生菌,因为可能会导致感染。为避免任何不利影响或意外相互作用,请在服用短乳杆菌之前咨询医生。
干酪乳杆菌是一种革兰氏阳性、非致病性乳酸菌。它存在于发酵乳制品(例如奶酪)、植物材料(例如葡萄酒、泡菜)以及人类和动物的生殖和胃肠道中。
作为一种营养补充剂,干酪乳杆菌已被证明可以改善肠道微生物平衡、关节炎、2 型糖尿病,并具有潜在的抗癌特性。
干酪乳杆菌在动物消化道中的运输过程中增强了免疫系统,可以刺激一氧化氮、细胞因子和前列腺素的产生。
干酪乳杆菌通过激活自然杀伤 (NK) 细胞、细胞毒性 T 细胞和巨噬细胞来促进小鼠化疗药物引起的免疫抑制的恢复。这些都是识别和消除肿瘤细胞和感染细胞的白细胞。
对其他肠道菌群的影响
干酪乳杆菌与普氏菌属、乳酸杆菌属、粪杆菌属、丙酸杆菌属、双歧杆菌属和一些拟杆菌科和毛螺菌属呈正相关,与梭菌属、芽孢杆菌属、沙雷氏菌属、肠球菌属、志贺氏菌属和希瓦氏菌属的存在呈负相关。
在志愿者实验中,L. casei 抑制了潜在有害的假单胞菌和不动杆菌。
含有干酪乳杆菌的发酵乳保留了肠道微生物群多样性,缓解了腹部功能障碍,在学业压力的健康医学生中,它并防止了皮质醇水平升高。
健康益处


干酪乳杆菌除在以上列举的方面发挥作用之外,还在压力、免疫力、呼吸道和胃肠道感染、病毒感染、炎症、关节炎、过敏、牙齿健康、心血管疾病、糖尿病、吸烟的并发症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
干酪乳杆菌通常具有良好的耐受性。应避免在器官衰竭、免疫功能低下和肠道屏障功能障碍的患者中使用益生菌。为避免不良反应,请在开始任何新的益生菌补充剂之前咨询医生。
格氏乳杆菌是一种乳酸菌,具有抗菌活性、产生细菌素以及调节先天和适应性免疫系统。
健康益处


格氏乳杆菌除在以上列举的疾病发挥作用之外,还在胆固醇、免疫力、肠道健康(腹泻、溃疡、幽门螺杆菌)、过敏、疲劳、子宫内膜异位症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
一般认为是安全的。然而,应避免在器官衰竭、免疫功能低下状态和肠道屏障功能障碍的患者中使用益生菌。为防止不良副作用,请在开始服用新的益生菌补充剂之前咨询医生。
嗜酸乳杆菌是一种革兰氏阳性乳酸菌,传统上广泛用于乳制品行业,最近还用作益生菌。
嗜酸乳杆菌因其风味和益生菌作用而被添加到商业酸奶和乳制品配方中,并且是最常选择的用于饮食的乳酸菌之一。
对其他肠道菌群的影响
接受嗜酸乳杆菌和纤维二糖的健康志愿者表现出乳酸杆菌、双歧杆菌、柯林氏菌和真杆菌的水平升高,而Dialister降低了。
酸奶中的嗜酸乳杆菌可正向改变肥胖小鼠的肠道微生物群并增加肠道双歧杆菌。
嗜酸乳杆菌增加了大鼠中乳酸杆菌和双歧杆菌的数量,增加了乙酸、丁酸和丙酸的水平,并降低了人体微生物群模拟器中的铵盐。


嗜酸乳杆菌除在以上列举的疾病发挥作用之外,还在改善儿童叶酸和 B12 状态、糖尿病、轻微肝性脑病、老化、疲劳等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
嗜酸乳杆菌通常耐受性良好。然而,应避免在器官衰竭、免疫功能低下状态和肠道屏障功能障碍的患者中使用益生菌,因为它可能导致感染。
肠道微生物植物乳杆菌是一种很有前途的,用于治疗腹泻、高胆固醇和特应性皮炎的益生菌。植物乳杆菌是一种广泛分布的乳酸菌。它常见于许多发酵的植物产品中,例如酸菜、泡菜、卤橄榄和韩国泡菜。
植物乳杆菌是一种具有抗癌、抗炎、抗肥胖和抗糖尿病特性的抗氧化剂。植物乳杆菌可以减少促炎细胞因子(IL-6、IL-8和MCP-1)的产生,增加抗炎细胞因子 ( IL-10 ) 的产生,降低 ALT 和 AST,减少NF-κB.
营养益处
从生牛奶中分离出的植物乳杆菌能够产生 B 族维生素核黄素(B2) 和叶酸(B9)。
植物乳杆菌可使健康女性从果汁饮料中吸收的铁增加约 50%。
植物乳杆菌可以将女性从燕麦基质中的铁吸收提高 100% 以上。
含有植物乳杆菌的发酵乳表现出更高的钙保留摄取。


植物乳杆菌除在以上列举的疾病发挥作用之外,还在改善肥胖、血糖、伤口愈合、牙齿健康、免疫、过敏、念珠菌病等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
在大鼠中未观察到任何类型的不良反应,即使在大量食用后也是如此。然而,与其他益生菌一样,用于器官衰竭、免疫功能低下状态和功能失调的肠道屏障机制的患者可能会导致感染。为了避免不良事件,请在使用益生菌之前咨询医生。
菊粉(不要与胰岛素混淆,胰岛素是一种控制血糖水平的激素)是一种存在于多种植物中的可溶性纤维。纤维是不被人体肠道消化或吸收的化合物。可溶性纤维吸水并在消化过程中变成凝胶。
来源及用处
菊粉存在于 36,000 种植物中,包括我们日常饮食中食用的植物,如小麦、洋葱、香蕉、大蒜和芦笋。它们也存在于不太常见的食物中,例如菊芋,尤其是菊苣,菊粉是商业提取菊粉的主要来源。
菊粉的其他天然来源有:菊苣根、龙舌兰、雪莲果根、新鲜香草等。不太常见的菊粉来源是蒲公英根、松果菊、牛蒡根等。
含有菊粉的植物用它来储存能量和抵御低温。当暴露于低温时,菊粉起到防冻剂的作用。
菊粉的溶解度使其能够吸收大量水分。当它膨胀时,它会形成一种凝胶,沿途聚集脂肪颗粒并将它们排出体外。
此外,它通过充当有益菌的食物,来增加肠道中有益细菌的数量。
对其他肠道菌群的影响
前面我们知道,双歧杆菌是肠道中的有益菌。菊粉基本上是双歧杆菌的食物并刺激它们的生长和活动。
多项研究表明,菊粉可刺激双歧杆菌的生长。例如:
8 名健康受试者被给予低聚果糖 15 天,并监测他们的粪便。虽然粪便中的细菌总数没有变化,但双歧杆菌成为主要类型。
在另一项研究中,10 名便秘的老年患者服用菊粉 19 天,并监测他们的大便情况。这些患者还表现出双歧杆菌数量增加,同时有害细菌减少。
此外,其他菌群似乎也受到菊粉的影响。
在一项针对 165 人的临床试验中,这种纤维还增加了厌氧菌的丰度(可以通过产生丁酸改善消化,甚至预防结肠癌),并减少嗜胆菌(与大便和便秘有关)。
不一样的研究结果
对实验室培养的细菌进行的一些研究表明,菊粉还会增加沙门氏菌等有害细菌,以及那些不会在正常人中引起疾病但可能导致免疫系统较弱的人感染的细菌,例如克雷伯氏菌和大肠杆菌。然而,其他实验室研究表明,菊粉通过增加双歧杆菌的生长来抑制艰难梭菌等有害细菌的生长。


菊粉除在以上列举的疾病发挥作用之外,还在增加钙和镁的摄取、骨骼健康、炎症性肠病、预防结肠癌的发展等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
菊粉可能对敏感个体产生某些副作用,或者如果使用的剂量太大产生不良反应。这些包括:
肠道不适,包括胀气、腹胀、胃部噪音、嗳气和痉挛、结肠肿胀、腹泻等。
此外可能会发生严重的过敏反应,但很罕见。在一些孤立的案例中,它会导致过敏反应,可能与食物过敏反应有关。
此外,对于在怀孕和哺乳期间补充菊粉的效果知之甚少。因此,孕妇应避免服用菊粉补充剂。
对于肠易激综合征 (IBS) 患者,低剂量可能会调节肠道细菌并减轻症状,但大剂量可能会产生中性甚至负面影响。
果胶是一种复杂的碳水化合物(多糖),存在于植物细胞壁中,有助于维持其结构。它是一种粘性可溶性纤维,具有形成凝胶的能力。果胶由主要在大肠(结肠)中的有益菌群发酵,产生短链脂肪酸。
由于其凝胶状稠度,果胶是一种流行的食品添加剂,作为增稠剂和纤维的重要来源,具有许多潜在的健康益处。研究表明,它可能有助于治疗高胆固醇、反酸、减肥和糖尿病。
果胶含量高的水果和食物
果胶存在于水果、蔬菜、豆类和坚果中。柑橘皮中的果胶含量最高,如橙皮、柠檬皮和葡萄柚皮(30% 至 35%)和苹果果肉(15% 至 20%)。其他主要来源包括木瓜、李子、醋栗、樱桃、杏子、胡萝卜等 。


在食品工业中用作胶凝剂(用于果酱和果冻)或用作稳定剂(用于糖果、果汁和奶饮料)的果胶主要从苹果果肉或柑橘类水果的果皮中提取。


果胶除在以上列举的疾病发挥作用之外,还在改善糖尿病、减肥、辐射损伤、便秘、呕吐、降血压、溃疡性结肠炎、铅毒性等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
对肠道菌群的影响
果胶在结肠中由不同的细菌属发酵,如双歧杆菌、乳酸杆菌、肠球菌、直肠真杆菌、普氏粪杆菌、梭菌、厌氧菌、Roseburia属,以促进其生长。
果胶的降解由不同的细菌衍生酶(如果胶酶、甲基酯酶、乙酰酯酶和裂解酶)促进,产生不同的POS,其取决于微生物群组成和果胶结构。
体外发酵系统报告的果胶效应


Blanco-Pérez F, et al., Curr Allergy Asthma Rep. 2021
果胶通过增加拟杆菌的丰度来改变肠道菌群的组成,并改善酒精诱导的肝损伤(在非酒精性脂肪肝中,拟杆菌的丰度降低)。
膳食纤维果胶可以改变肠道和肺微生物群中厚壁菌门与拟杆菌门的比例,增加粪便和血清中短链脂肪酸的浓度。
通过果胶产生的短链脂肪酸进行免疫调节
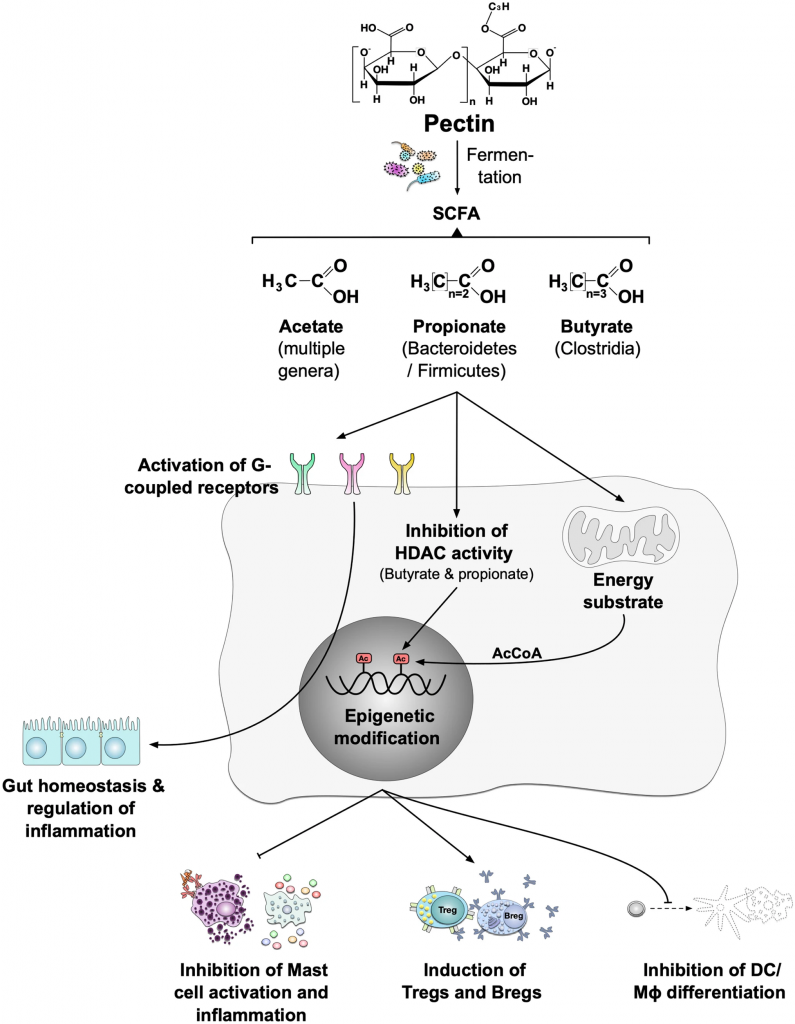

Blanco-Pérez F, et al., Curr Allergy Asthma Rep. 2021
果胶经肠道菌群发酵可产生短链脂肪酸。不同的属可以产生不同的短链脂肪酸。例如,乙酸盐可以由许多不同的属生产;丙酸主要由拟杆菌门和厚壁菌门产生,丁酸主要由梭状芽胞杆菌产生。短链脂肪酸结合“代谢感知”G蛋白偶联受体,如GPR41、GPR43、GPR109A和嗅觉受体(Olfr)-78。这些受体促进肠道内稳态和炎症反应的调节。GPRs及其代谢产物影响Treg活化、上皮完整性、肠道稳态、DC生物学和IgA抗体反应。通过抑制HDAC的表达或功能,短链脂肪酸还影响许多细胞和组织中的基因转录。
过敏:果胶在过敏反应中的作用存在争议
一些临床报告表明,食用果胶后出现过敏反应,这可能归因于果胶和过敏原之间的交叉反应。此外,果胶还被描述为防止胃中过敏原的消化,促进完整的过敏原分子到达肠道并诱发过敏反应。
然而,其他人则认为果胶有直接和间接免疫调节作用。已经提供了一系列广泛的证据,描述了应用果胶诱导有益微生物群的转变和SCFA水平的增加,这两者都与减少体内外的炎症和过敏反应有关。由于不同的果胶增加或减少了与人类健康相关的细菌数量,因此,施用果胶可能会对肠道中的菌群进行特异性调节。
果胶能够通过与TLR2的静电相互作用直接与免疫细胞(如DC和巨噬细胞)相互作用,从而抑制促炎症TLR2-TLR1途径,同时不影响TLR2-TLR6耐受途径。
此外,它能够结合LPS,影响其与TLR4的结合。其他类型的细胞,如T细胞、B细胞和NK细胞也被果胶激活,而腹腔巨噬细胞中的iNOS和COX-2表达则被IKK活性、MAPK磷酸化和NF-κB激活抑制,表明其具有抗炎特性。
炎症性肠病:果胶调节IBD相关菌群
在短链脂肪酸中,丁酸能滋养结肠细胞并抑制结肠肿瘤,因此在大肠中表现出促进局部健康的特性。
产丁酸菌(主要属于厚壁菌门)的流失被认为是IBD期间微生物失调的一个特征。果胶可以促进厚壁菌门中许多丁酸生产者的生长。
果胶物质在调节 IBD 相关肠道微生物群中的综合概况
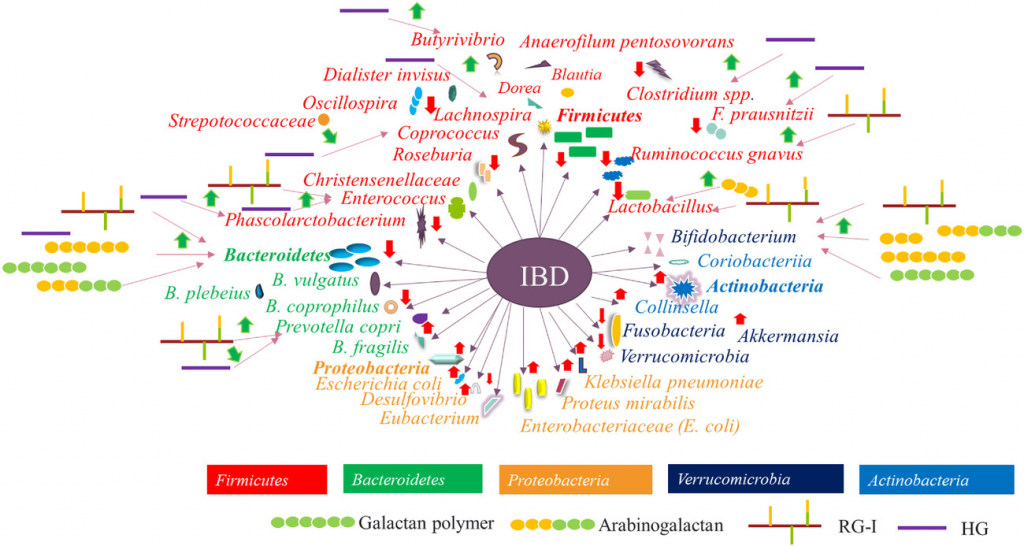

Wu D, et al., Compr Rev Food Sci Food Saf. 2021
注:不同颜色表示不同的细菌门。绿色箭头表示果胶物质对细菌的调节作用,红色箭头表示 IBD 与特定微生物群之间的正相关或负相关。
注意事项
果胶通常对人类食用是安全的。然而,在临床试验中,纤维与果胶的混合物(每天 20 克,持续 15 周)会引起一些与肠道相关的副作用,例如腹泻、肠胃胀气和稀便。
与药物相互作用:
在 3 名高胆固醇患者中,每天服用 15 克果胶和 80 毫克降胆固醇药物(洛伐他汀)会增加 LDL 水平。
建议把果胶和地高辛分开至少 2 小时。
在一项对 7 名健康受试者进行的研究中,他们服用 12 克柑橘果胶和 25 毫克 β-胡萝卜素,果胶将 β-胡萝卜素(维生素 A的前体)血液水平降低了 50% 以上。
姜黄是一种来自植物的香料,通常用于调味或着色咖喱粉、芥末和其他食物。姜黄根也用于制造替代药物。
姜黄已被用于替代医学中,作为降低血液胆固醇、减轻骨关节炎疼痛或缓解慢性肾病引起的瘙痒的一种可能有效的帮助。
姜黄含有几种被称为类姜黄素的主要成分,姜黄素是姜黄中最活跃的植物化学物质。它占类姜黄素的 77%.
姜黄素的健康益处
姜黄素和整个姜黄根茎在治疗慢性疾病如胃肠道、心血管和神经系统疾病、糖尿病和几种癌症方面具有一些有益作用。


姜黄素除在以上列举的疾病发挥作用之外,还在关节痛和关节炎、克罗恩病(肠蠕动、腹泻和胃痛)、狼疮、糖尿病、经前综合症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。

姜黄素目前已被认为可以治疗许多疾病,肠道微生物群在姜黄素生物活性机制中可能产生的作用,是一个有趣且有吸引力的研究领域。下面我们来看它们之间有怎样的互作关系。
姜黄素与肠道菌群的相互作用
★ 姜黄素直接调节肠道菌群
食用姜黄素与梭状芽孢杆菌、拟杆菌属物种的增加以及Blautia、Ruminococcus的减少有关。
研究证实,口服姜黄素能够显著改变肠道微生物群落中有益细菌和有害细菌的比例,有利于有益细菌菌株的生长,如双歧杆菌、乳酸杆菌和产丁酸菌,并减少致病菌的丰度,如普雷沃氏菌科、Coriobacteries、肠杆菌、Rikenellaceae.
姜黄素治疗会物种的微生物丰度,例如发现结直肠癌患者粪便中的普雷沃氏菌多。患有结肠癌的小鼠被喂食不同的颗粒饲料,姜黄素的计算人体等效剂量为8/mg/kg/天-162 mg/kg/天。最高剂量的姜黄素给药可减少或消除结肠肿瘤负担,增加乳酸杆菌,减少Coriobacteries。
还清楚地证明,姜黄素治疗可减少几种瘤胃球菌;这是一个有趣的发现,因为瘤胃球菌种类的增加与大肠癌的发生有关。此外,在使用致突变化合物治疗的小鼠中,膳食姜黄素能够将乳酸杆菌的数量恢复到控制水平,这已被证明具有抗肿瘤功能。
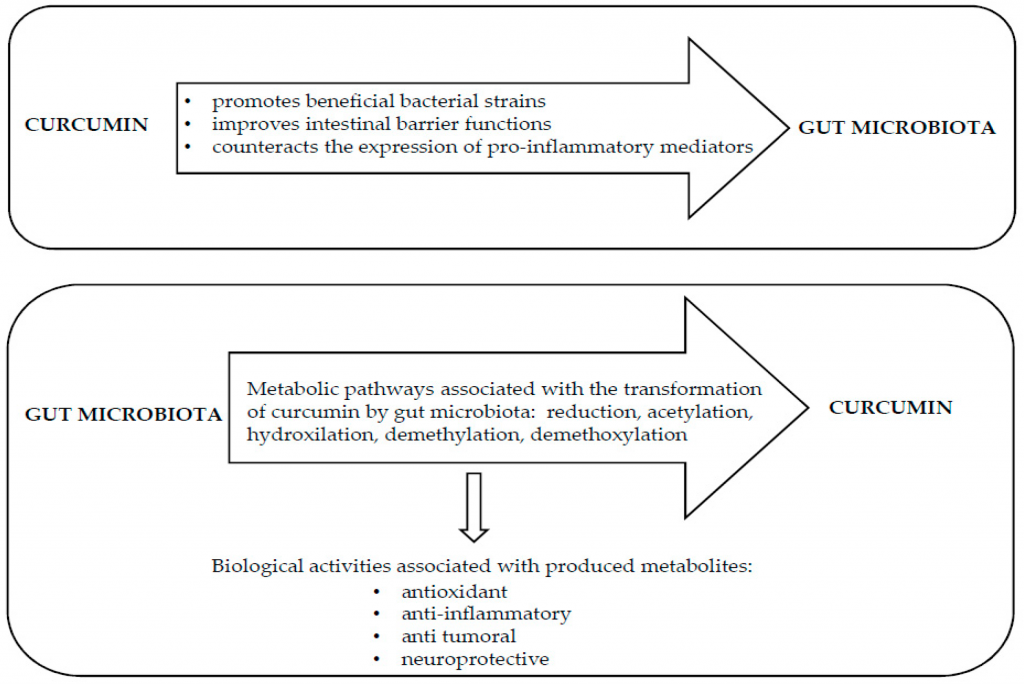

Scazzocchio B, et al., Nutrients. 2020
★ 肠道菌群对姜黄素进行生物转化,产生活性代谢物
姜黄素的代谢转化不仅发生在肠细胞和肝细胞中,还通过肠道微生物群产生的酶进行,这些酶产生许多活性代谢物。姜黄素代谢产物的生物活性可能不同于天然姜黄素,姜黄素的特定生物学特性实际上取决于肠道微生物群消化产生的生物活性代谢产物。
已经鉴定出几种能够修饰姜黄素的肠道细菌:对从人类粪便中分离的微生物的分析表明,大肠杆菌代表了姜黄素代谢活性最高的细菌,通过NADPH依赖的姜黄素/二氢姜黄素还原酶。这种酶能够将姜黄素转化为二氢姜黄素,然后转化为四氢姜黄素。
其他菌群,如长双歧杆菌、假链状双歧杆菌、粪肠球菌、嗜酸乳杆菌和干酪乳杆菌,代表了能够代谢姜黄素的相关菌株,母体化合物的还原率高于50%.
姜黄素代谢物具有与姜黄素相似的特性和效力:四氢姜黄素表现出与母体化合物相同的生理和药理特性,可能是通过β-二酮部分以及酚羟基。此外,四氢姜黄素能够预防氧化应激和神经炎症,还表现出抗癌作用,这可能是由于抑制了显着的细胞因子释放,例如 IL-6 和 TNFα。因此,在对姜黄素的进一步研究中应考虑细菌分解产物,因为它们可能具有有益作用。
对肠道屏障的影响
体外研究表明,姜黄素是一种潜在的化合物,可以恢复被破坏的肠道通透性。在 CaCo2 细胞中,姜黄素能够减轻肠上皮屏障功能的破坏,抵消 LPS 诱导的 IL-1β 分泌并防止紧密连接蛋白破坏。此外,姜黄素还能够减少由 IL-1β 诱导的 p38 MAPK 活化,以及随后紧密连接蛋白磷酸化的升高。
对肠道炎症的影响
代谢组学分析显示姜黄素对氧化应激和炎症的生物标志物具有有益作用,作者认为,姜黄素治疗抵消了非酒精性脂肪肝进展过程中一些细菌菌株的增加。
一项活体动物研究报告,新开发的纳米姜黄素通过抑制促炎介质的表达和诱导Treg扩张(同时伴随粪便丁酸水平的增加)积极改善DSS-结肠炎小鼠的炎症。将姜黄素与正常啮齿类动物饮食的粉末形式(含有0.2%(w/w)纳米姜黄素)混合:该化合物能够抑制NF-κB的激活和治疗小鼠结肠上皮细胞中促炎症介质的表达。
或者,姜黄素可以通过抑制TLR4/MyD88/NF-κB信号通路的激活来减轻LPS诱导的炎症。此外,姜黄素能抑制NF-κB核转位,并减轻其他在癌症中过度激活的促炎症基因的表达。
在喂食添加姜黄素(300 mg/kg姜黄素,与正常饲料混合)28天的断奶仔猪中,Gan等人证明,这种多酚能够通过抑制大肠杆菌增殖来减轻炎症,下调TLR4的表达。
虽然姜黄素迄今为止在体内研究中描述了所有有益的作用,但这些结果必须通过更大的人体临床试验得到一致的支持。
潜在风险和副作用
姜黄素通常耐受性良好。
常见的副作用包括便秘、消化不良(消化不良)、腹泻、腹胀、胃食管反流(胃酸反流)、恶心、呕吐和其他肠道问题。
极少的情况下,姜黄素会引起瘙痒或凹陷性水肿。
姜黄涂在皮肤上可能会引起过敏性接触性皮炎。
在高剂量体外模型中,姜黄素可引起细胞毒性和 DNA 损伤。
协同效应
添加胡椒碱(来自黑胡椒)可能会增加姜黄素在血液中的吸收。研究人员估计它可能会将姜黄素的生物利用度提高多达 2000%.
白藜芦醇是一种多酚,主要存在于葡萄皮和红酒中。
白藜芦醇是一种小多酚,在 1990 年代引起了科学界的关注。这种化合物被戏称为“瓶中的法国悖论”,因为在红酒中发现了白藜芦醇,法国人喜欢在高饱和脂肪饮食的同时食用不太适量的白藜芦醇。然而,法国人的心脏病发病率非常低。
虽然红酒中的白藜芦醇不太可能完全解释这一悖论,但一些科学家表示它可能是一个促成因素。
葡萄皮中的白藜芦醇含量很高,因为葡萄会产生白藜芦醇来防御毒素和寄生虫。它也存在于各种浆果、花生、大豆中。
有限的研究探索了它的抗氧化、抗炎、抗衰老和植物雌激素活性。白藜芦醇确实具有改善慢性疾病的一些潜力。
白藜芦醇有一个主要缺陷:生物利用度差。
白藜芦醇比其他多酚(如槲皮素)更容易从肠道吸收到血液中。但它会很快分解,在血液中留下很少的游离白藜芦醇。
与肠道菌群之间的关系
白藜芦醇和肠道菌群之间的双向相互作用:肠道菌群进行白藜芦醇生物转化,白藜芦醇对肠道菌群进行相互靶向,从而维持肠道稳态。
白藜芦醇的长期摄入改变了DSS诱导小鼠的肠道菌群,厚壁菌门/拟杆菌门的比例显著提高,这反过来又改变了白藜芦醇的代谢。
白藜芦醇补充对肠道生态系统的作用
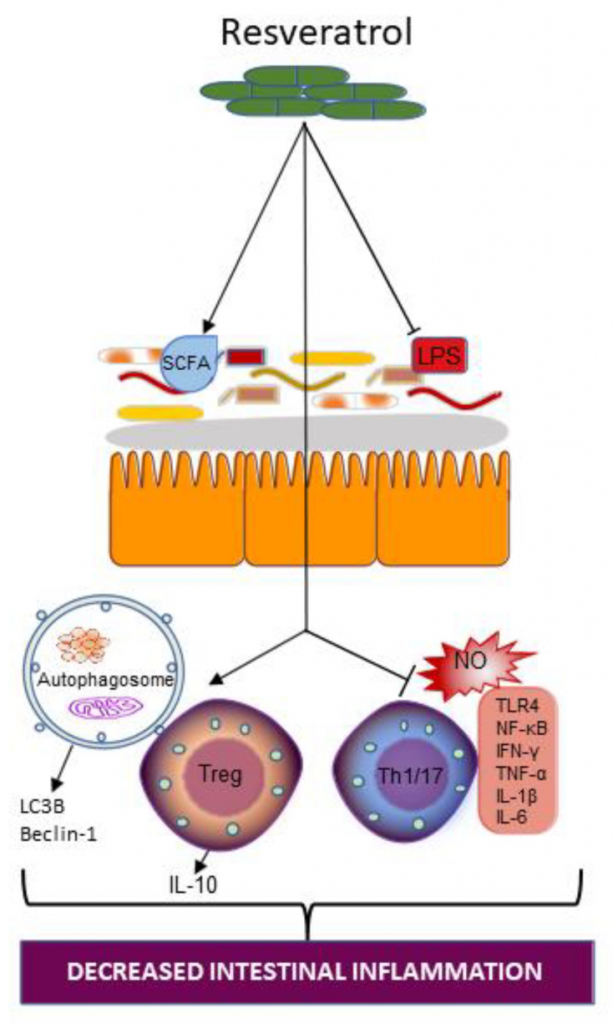

Wellington VNA, et al., Int J Mol Sci. 2021
白藜芦醇添加增加了产短链脂肪酸菌,同时减少了产生LPS的肠道细菌。
补充白藜芦醇也可以通过增加自噬小体的数量和诱导微管相关蛋白1A/1B-light chain 3和Beclin-1的表达来恢复自噬,这两种蛋白在自噬中都是重要的蛋白。白藜芦醇补充也可能会中断Th1/17和细胞因子依赖的促炎通路,一氧化氮依赖的促氧化通路,并干扰toll样受体(TLR) 4信号转导。
白藜芦醇能减轻LPS对小鼠肠道和肝脏的炎症损伤。白藜芦醇减少了拟杆菌和Alistipes的相对丰度,增加了乳酸杆菌的相对丰度。白藜芦醇治疗降低了肝脏中TNF-α、IL-6、IFN-γ、髓过氧化物酶和丙氨酸转氨酶的水平。
此外,益生菌Ligilactobacillus salivarious Li01促进白藜芦醇大量代谢为二氢藜芦醇、硫酸白藜芦醇和白藜芦醇葡萄糖苷酸。在代谢产物中,二氢藜芦醇水平升高最为显著。
肠道菌群的存在促进了二氢藜芦醇的产生,同时促进了硫酸白藜芦醇和白藜芦醇葡萄糖苷酸的消除。

补充剂量
大多数补充剂含有 50 – 500 毫克白藜芦醇。有些含有更高的剂量,高达 1,200 毫克。
临床数据仍然有限。可用的临床研究使用典型的白藜芦醇剂量:
口服纯白藜芦醇的剂量在 150 – 500 毫克/天之间变化。每天喝 1 – 2 杯葡萄酒(100 – 300 毫升)可降低患心脏病的风险并改善血管健康。不含酒精的葡萄酒可能更有益,尤其是对于已经有患心脏病风险的人。
注意:对于有自身免疫和组胺问题的人来说,葡萄酒可能不合适。某些慢病患者如果不确定每天喝一杯葡萄酒是不是安全,请咨询医生。
在接受高剂量(每天 2.5 克或 5 克)白藜芦醇 29 天的人中观察到频繁的胃肠道不适/腹泻。根据 NOAEL 研究,使用 10 倍的安全系数,对于体重 60 公斤的个体,每日 450 毫克白藜芦醇的剂量被认为是安全的。
补充形式
白藜芦醇有多种形式作为口服补充剂:
大多数研究得出结论,反式白藜芦醇是更活跃的白藜芦醇形式。
增加生物利用度的方法
一些可能增加白藜芦醇生物利用度的方法包括:
协同效应
在研究中探索了以下白藜芦醇协同作用:


与药物相互作用
白藜芦醇可能与肠道或肝脏中的药物相互作用,尤其是那些被相同肝酶 (CYP450) 分解的药物。
白藜芦醇还可以减少血液凝固,增强抗凝血药物(抗凝血剂或抗血小板药物,如阿司匹林、氯吡格雷、达肝素、肝素和华法林)的活性。
一起来看下白藜芦醇可能与之相互作用的药物:
“
他汀类药物(Mevacor)
降低高血压的药物(如硝苯地平)
用于减少心律失常的药物(胺碘酮)
抗真菌剂(Sporanox)
抗组胺药(Allegra)
镇静剂/抗焦虑药(安定等苯二氮卓类药物)
抗抑郁药(Halcion)
抗病毒药物和 HIV 药物(蛋白酶抑制剂)
降低免疫反应的药物(免疫抑制剂)
勃起功能障碍(ED)药物
抗凝血药物
NSAID 止痛药/抗炎药,如双氯芬酸 (Voltaren)、布洛芬 (Advil, Motrin)、萘普生 (Anaprox)
……
来源
你知道葡萄酒中含有多少白藜芦醇吗?
通常,白藜芦醇的总浓度为:
红葡萄酒中 0.2 – 5.8 mg/L(平均约为 2 mg/L)
白葡萄酒中仅约 0.68 mg/L
红葡萄酒的反式白藜芦醇含量是白葡萄酒的六倍;白葡萄酒含有高水平的顺式白藜芦醇。红葡萄酒是在不去除葡萄皮的情况下提取的。
白藜芦醇的其他食物来源包括:
黑巧克力、各种浆果、大豆和生或煮花生。
1 杯煮花生含有 1.28 毫克白藜芦醇,大多数食物中的白藜芦醇含量可能太低,无法指望太多特定的健康益处。
副作用
在对健康人进行的临床研究中,每天服用 500 毫克的白藜芦醇具有良好的耐受性。
给予癌症患者高剂量的高生物利用度白藜芦醇(每天 5 克)不会引起任何严重的副作用,但一些患者会出现恶心和胃部不适。
由于缺乏适当的安全数据,儿童应避免使用白藜芦醇。
有人提出,补充白藜芦醇在怀孕期间有益于平衡新陈代谢和产前健康。不过,没有充分的临床研究调查孕妇中的白藜芦醇。
注意事项
白藜芦醇可减少铁吸收和/或血液水平,这可能会恶化贫血。
白藜芦醇转向代表涉及铁代谢(肝素)的重要蛋白质的基因,这可能降低铁吸收。另一方面,白藜芦醇对铁代谢的影响可能是有益的铁过载。
“
肠道菌群的维护和有益菌等的获得以及核心菌群的定植等,与每个人自身的饮食,遗传,生活环境等息息相关,尽量保持饮食多样化,每天食物应该包括蛋白,肉,全谷物,蔬菜,水果,坚果,鱼油/亚麻籽,发酵和多酚食物,食材选择新鲜,无过渡添加/烹饪同时清洁干净的食物,此外,不滥用抗生素或过渡清洁肠道,合理睡眠,适量运动,保持乐观,将有利于肠道和菌群健康。
主要参考文献:
Kato-Kataoka A, Nishida K, Takada M, et al., Fermented Milk Containing Lactobacillus casei Strain Shirota Preserves the Diversity of the Gut Microbiota and Relieves Abdominal Dysfunction in Healthy Medical Students Exposed to Academic Stress. Appl Environ Microbiol. 2016 May 31;82(12):3649-58. doi: 10.1128/AEM.04134-15. PMID: 27208120; PMCID: PMC4959178.
Segers ME, Lebeer S. Towards a better understanding of Lactobacillus rhamnosus GG–host interactions. Microb Cell Fact. 2014;13 Suppl 1(Suppl 1):S7. doi:10.1186/1475-2859-13-S1-S7
Ren JJ, Yu Z, Yang FL, et al. Effects of Bifidobacterium Breve Feeding Strategy and Delivery Modes on Experimental Allergic Rhinitis Mice. PLoS One. 2015;10(10):e0140018. Published 2015 Oct 7. doi:10.1371/journal.pone.0140018
Diaz Ferrer J, Parra V, Bendaño T, Montes P, Solorzano P. Utilidad del suplemento de probioticos (Lactobacillus acidophilus y bulgaricus) en el tratamiento del sindrome de intestino irritable [Probiotic supplement (Lactobacillus acidophilus and bulgaricus) utility in the treatment of irritable bowel syndrome]. Rev Gastroenterol Peru. 2012 Oct-Dec;32(4):387-93. Spanish. PMID: 23307089.
Jeun J, Kim S, Cho SY, Jun HJ, Park HJ, Seo JG, Chung MJ, Lee SJ. Hypocholesterolemic effects of Lactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice. Nutrition. 2010 Mar;26(3):321-30. doi: 10.1016/j.nut.2009.04.011. Epub 2009 Aug 19. PMID: 19695834.
Yoo JY, Kim SS. Probiotics and Prebiotics: Present Status and Future Perspectives on Metabolic Disorders. Nutrients. 2016;8(3):173. Published 2016 Mar 18. doi:10.3390/nu8030173
Tursi A, Brandimarte G, Giorgetti GM, Forti G, Modeo ME, Gigliobianco A. Low-dose balsalazide plus a high-potency probiotic preparation is more effective than balsalazide alone or mesalazine in the treatment of acute mild-to-moderate ulcerative colitis. Med Sci Monit. 2004 Nov;10(11):PI126-31. Epub 2004 Oct 26. PMID: 15507864.
van Zanten GC, Krych L, Röytiö H, Forssten S, Lahtinen SJ, Abu Al-Soud W, Sørensen S, Svensson B, Jespersen L, Jakobsen M. Synbiotic Lactobacillus acidophilus NCFM and cellobiose does not affect human gut bacterial diversity but increases abundance of lactobacilli, bifidobacteria and branched-chain fatty acids: a randomized, double-blinded cross-over trial. FEMS Microbiol Ecol. 2014 Oct;90(1):225-36. doi: 10.1111/1574-6941.12397. Epub 2014 Sep 5. PMID: 25098489.
Kadooka Y, Sato M, Ogawa A, Miyoshi M, Uenishi H, Ogawa H, Ikuyama K, Kagoshima M, Tsuchida T. Effect of Lactobacillus gasseri SBT2055 in fermented milk on abdominal adiposity in adults in a randomised controlled trial. Br J Nutr. 2013 Nov 14;110(9):1696-703. doi: 10.1017/S0007114513001037. Epub 2013 Apr 25. PMID: 23614897.
Fujii T, Ohtsuka Y, Lee T, Kudo T, Shoji H, Sato H, Nagata S, Shimizu T, Yamashiro Y. Bifidobacterium breve enhances transforming growth factor beta1 signaling by regulating Smad7 expression in preterm infants. J Pediatr Gastroenterol Nutr. 2006 Jul;43(1):83-8. doi: 10.1097/01.mpg.0000228100.04702.f8. PMID: 16819382.
Kanjan P, Hongpattarakere T. Prebiotic efficacy and mechanism of inulin combined with inulin-degrading Lactobacillus paracasei I321 in competition with Salmonella. Carbohydr Polym. 2017 Aug 1;169:236-244. doi: 10.1016/j.carbpol.2017.03.072. Epub 2017 Apr 1. PMID: 28504142.
Micka A, Siepelmeyer A, Holz A, Theis S, Schön C. Effect of consumption of chicory inulin on bowel function in healthy subjects with constipation: a randomized, double-blind, placebo-controlled trial. Int J Food Sci Nutr. 2017 Feb;68(1):82-89. doi: 10.1080/09637486.2016.1212819. Epub 2016 Aug 5. PMID: 27492975.
Blanco-Pérez F, Steigerwald H, Schülke S, Vieths S, Toda M, Scheurer S. The Dietary Fiber Pectin: Health Benefits and Potential for the Treatment of Allergies by Modulation of Gut Microbiota. Curr Allergy Asthma Rep. 2021 Sep 10;21(10):43. doi: 10.1007/s11882-021-01020-z. PMID: 34505973; PMCID: PMC8433104.
Wu D, Ye X, Linhardt RJ, Liu X, Zhu K, Yu C, Ding T, Liu D, He Q, Chen S. Dietary pectic substances enhance gut health by its polycomponent: A review. Compr Rev Food Sci Food Saf. 2021 Mar;20(2):2015-2039. doi: 10.1111/1541-4337.12723. Epub 2021 Feb 16. PMID: 33594822.
Scazzocchio B, Minghetti L, D’Archivio M. Interaction between Gut Microbiota and Curcumin: A New Key of Understanding for the Health Effects of Curcumin. Nutrients. 2020;12(9):2499. Published 2020 Aug 19. doi:10.3390/nu12092499
Ding S, Jiang H, Fang J, Liu G. Regulatory Effect of Resveratrol on Inflammation Induced by Lipopolysaccharides via Reprograming Intestinal Microbes and Ameliorating Serum Metabolism Profiles. Front Immunol. 2021 Nov 15;12:777159. doi: 10.3389/fimmu.2021.777159. PMID: 34868045; PMCID: PMC8634337.
Wellington VNA, Sundaram VL, Singh S, Sundaram U. Dietary Supplementation with Vitamin D, Fish Oil or Resveratrol Modulates the Gut Microbiome in Inflammatory Bowel Disease. Int J Mol Sci. 2021;23(1):206. Published 2021 Dec 24. doi:10.3390/ijms23010206
Yao M, Fei Y, Zhang S, et al. Gut Microbiota Composition in Relation to the Metabolism of Oral Administrated Resveratrol. Nutrients. 2022;14(5):1013. Published 2022 Feb 28. doi:10.3390/nu14051013
Del Follo-Martinez A, Banerjee N, Li X, Safe S, Mertens-Talcott S. Resveratrol and quercetin in combination have anticancer activity in colon cancer cells and repress oncogenic microRNA-27a. Nutr Cancer. 2013;65(3):494-504. doi: 10.1080/01635581.2012.725194. PMID: 23530649.
Malhotra A, Nair P, Dhawan DK. Curcumin and resveratrol synergistically stimulate p21 and regulate cox-2 by maintaining adequate zinc levels during lung carcinogenesis. Eur J Cancer Prev. 2011 Sep;20(5):411-6. doi: 10.1097/CEJ.0b013e3283481d71. PMID: 21633290.

谷禾健康

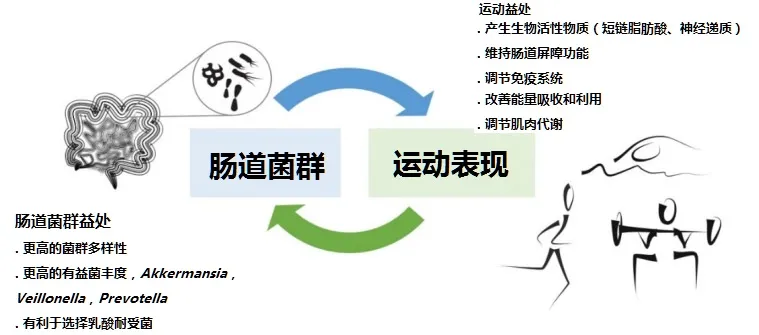
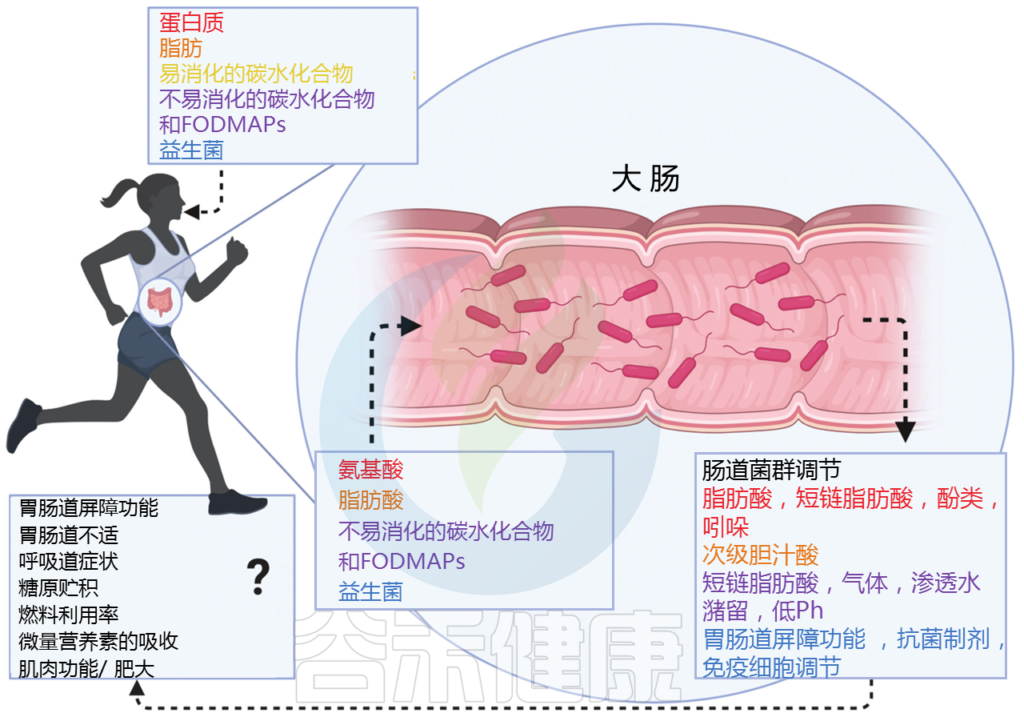
运动对心肺健康、肌肉力量、葡萄糖代谢、免疫系统和心理健康有影响。新的横断面研究证据表明,运动锻炼与肠道微生物群组成之间可能存在密切关联。

干预研究支持锻炼对肠道微生物群的有益影响。纵向研究表明,经常中等强度的耐力运动对肠道微生物产生最有益的影响,但是不同类型的运动训练方案(例如,阻力、间歇、伸展/柔韧性、耐力/有氧等)对肠道微生物群的影响存在差异。其他如饮食摄入,结肠运送时间,训练状态,共享训练环境,自愿性,健康或疾病状况,年龄,性别等因素也是评估运动和肠道菌群的混杂因素。

反过来,肠道微生物群对运动表现、恢复和疾病模式的各种指标都有间接影响,例如通过肌细胞因子,激素,神经肽和其他代谢物发出信号,调节下丘脑-垂体-肾上腺轴的激活,以及影响与表现相关的代谢途径。
了解肠道微生物群在运动表现中的各种作用,对于寻求改善锻炼结果以及减少训练恢复时间的普通人和运动员来说都非常重要。
本文就以下方面进行详细阐述:

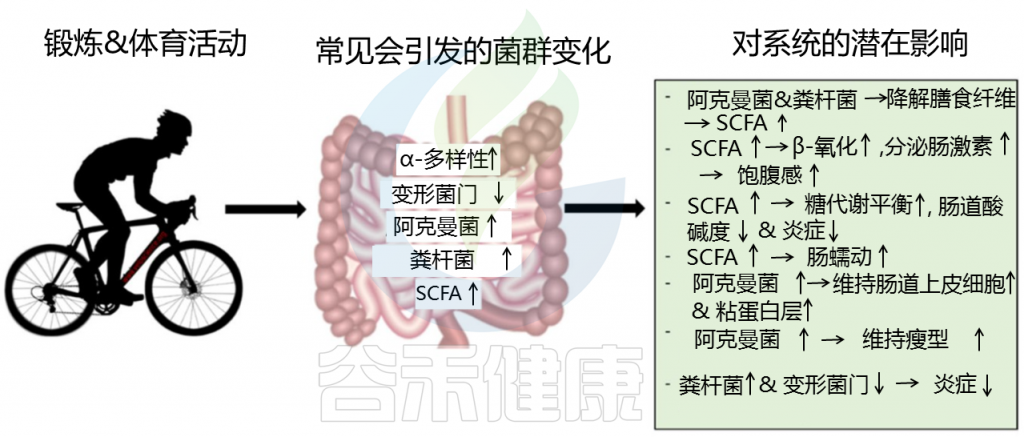
最近的研究表明,运动对肠道微生物群有很多好处。它与有益微生物物种数量的增加和微生物多样性的丰富以及短链脂肪酸合成和碳水化合物代谢的增强有关。
适度运动的频率会导致厚壁菌门的多样性更大。包括Faecalibacterium prausnitzii(产生丁酸,抗炎共生菌),颤螺菌属(Oscillospira) ,有助于更健康肠道环境的Lachnospira和Coprococcus属的成员。
体脂百分比、肌肉质量和身体活动与几种细菌种群显著相关
研究发现,锻炼与女性中具有促进健康功能的细菌的比例更高有关。包括以产生丁酸盐的能力而闻名的F. prausnitzii(普拉梭菌)和Roseburia hominis,以及运动员体内丰富的Akkermansia muciniphila,低水平与肥胖和糖尿病等代谢状况有关。
一项研究调查了 40 名国际职业橄榄球联盟球员的微生物组,并将其与 BMI 高或低的相似年龄的对照组进行比较。结果表明,运动员肠道微生物多样性显著著增加。
与对照组相比,许多其他参数也显示出显著改善的结果。其中包括短链脂肪酸 (SCFA),该研究发现与对照组相比,运动员体内的乙酸盐、丙酸盐、丁酸盐和戊酸盐水平明显更高。”
简而言之,运动已被证明可以显著改善与身体表现和健康相关的几个指标,特别是在有益细菌类型及其功能方面。
然而,这些观察性研究的结果只能确认训练状态和微生物群之间的关联,而不能确定因果关系。
运动与肠道微生物群组成之间的关联似乎是双向的。来自动物研究的越来越多的证据也表明肠道微生物群在宿主的身体机能中起着重要作用。肠道微生物群的组成和代谢活动可能有助于消化膳食化合物并改善运动期间的能量收集,这可以为运动员在高强度运动和恢复期间提供代谢益处。
观察性研究表明,与久坐的受试者相比,运动员微生物组中与氨基酸和碳水化合物代谢相关的代谢活动和途径增加。
在肠道中,细菌将不易消化的碳水化合物发酵成短链脂肪酸乙酸盐、丙酸盐和丁酸盐。训练和定期锻炼与人类粪便短链脂肪酸含量增加有关,并且在动物研究中,特定短链脂肪酸与改善身体机能有关。
大多数短链脂肪酸从肠道吸收并有助于宿主的能量代谢。
丁酸盐主要被结肠中的上皮细胞用作能量来源。
乙酸盐在肌肉组织中代谢,但也可以穿过血脑屏障。
丙酸盐可用作肝脏中葡萄糖合成的前体。
此外,短链脂肪酸可改善肠道屏障完整性,降低局部和全身炎症风险。临床前研究强烈表明短链脂肪酸可能是身体机能的关键调节剂。
值得注意的是,宿主可能不是唯一受益于运动期间与微生物群的共生关系的一方。
目前关于肠道微生物群与身体机能之间相互作用如下:
Maija Marttinen et al., Nutrients.2020

你可能想知道运动是否会改变微生物群,或者拥有健康的微生物群是否会让你更加活跃想运动。其实这用一句俗话讲就是“先有鸡还是先有蛋”的情景。
例如,肠道菌群失调会引起炎症,从而导致负面情绪,抑郁等症状,而抑郁不利于外出和积极运动锻炼。
多项研究表明,运动实际上可以改变你的肠道微生物群。
女性:运动与久坐女性菌群有差异
2017 年一项针对女性的研究表明,积极活动方式的女性和久坐女性之间肠道微生物群特征的差异。
积极参与者被选为在试验期间在 7 天内进行至少 10 小时运动的组。久坐组参加安静的活动,并从日常生活中不是经常运动的女性中挑选出来,每周进行 3 次不超过 30 分钟的适度运动。
11 个属(细菌的分类等级)在运动女性和久坐女性之间存在显著差异。重要的是,运动的女性群体拥有更丰富的促进健康的细菌,包括Faecalibacterium prausnitzii、Roseburia hominis和Akkermansia muciniphila.
他们还发现“体脂百分比、肌肉质量和身体活动与几种细菌种群显著相关。”
换句话说就是,过着积极的生活方式更能取悦某些细菌,这是一种正向反馈。
橄榄球运动员比久坐者具有更高的α多样性
一项对爱尔兰男性职业橄榄球运动员的研究表明,与久坐的对照组相比,运动员肠道微生物群的 α 多样性(细菌丰富度,例如在粪便样本中鉴定了多少细菌种类)更高。
肠道微生物群多样性与蛋白质消耗和血浆肌酸激酶水平呈正相关,血浆肌酸激酶水平是运动引起的肌肉损伤的生物标志物。
与高 BMI 对照组的比例相比,在橄榄球运动员和低体重指数 (BMI) 对照组中检测到的Akkermansia细菌比例更高。与低 BMI 的对照组相比,运动员中拟杆菌属的含量显著减少。
从大人群水平上看,Akkermansia和拟杆菌属与肥胖呈负相关。
在微生物代谢水平上也检测到橄榄球运动员和久坐对照组之间的差异,在运动员中检测到的氨基酸和碳水化合物代谢途径活性增加。此外,与久坐的对照组相比,橄榄球运动员的粪便 SCFA(乙酸盐、丙酸盐和丁酸盐)水平更高。
竞技自行车运动员中:经常训练者普氏菌高
在竞技自行车运动员中,每周训练超过 11 小时的自行车手比那些不经常训练的人的普氏菌相对丰度更高。
此外,元转录组学分析表明,普氏菌的转录与微生物组中的支链氨基酸 (BCAA) 代谢途径呈正相关。支链氨基酸,尤其是亮氨酸,是促进肌肉蛋白质合成的必需氨基酸,可以促进运动后的恢复。(详见本文09章节——蛋白质小节)
与业余自行车手相比,在职业自行车手中发现了更多的粪便Methanobrevibacter smithii。该菌与上调的甲烷代谢相关,这与肠道微生物组中短链脂肪酸代谢途径的上调呈正相关。
遗憾的是,该研究没有饮食控制和非运动员对照组。与在骑自行车的人中观察到的结果一致,在一小群精英竞走者中,粪便微生物群被分为普氏菌或拟杆菌为主的肠型。
马拉松运动员:韦荣球菌增加
马拉松运动员中的韦荣球菌丰度在马拉松后显著增加。此外,同一研究小组使用来自超级马拉松运动员和奥运会级别赛艇运动员的粪便样本进行宏基因组分析,结果显示与运动前样本相比,运动后与乳酸和丙酸代谢相关的基因富集。
在小鼠中进行的一项后续研究表明,研究人员从跑步者的粪便中分离培养出Veillonella atypica菌株,给小鼠灌注,结果发现,小鼠开始跑得更多,在跑步机上的跑步时间增加了 13% 。
中强度锻炼的人:促进健康和抗炎细菌增加
除了由专业或竞技运动员进行的高强度训练外,根据世界卫生组织 (WHO) 每周进行 150 分钟中等强度运动的指导方针,以推荐的最低水平进行运动 ,似乎足以改变肠道微生物群的组成。
与久坐不动的女性相比,以低强度进行连续运动的绝经前女性的嗜粘蛋白阿克曼菌、普拉梭菌等的丰度增加。这些都是与促进健康和抗炎作用相关的细菌种类。
此外,运动组和久坐组之间不同的饮食模式可能影响了肠道微生物群的组成,与久坐的女性相比,运动女性的膳食纤维摄入量明显更高,久坐组加工肉类的摄入量比例明显更高。
长期运动的人:菌群多样性更高
在迄今为止最长的运动干预中,研究了在 6 个月内,具有相似运动能耗的不同强度和方式的定期有氧训练对肠道微生物群的影响。
总共 88 名久坐的超重/肥胖受试者被随机分为四个组,包括习惯性生活(对照组)、非机动自行车积极通勤、休闲时间中等强度的运动或剧烈运动。
与对照组相比,所有运动组的 β多样性(样本间差异)都发生了变化,剧烈运动组的参与者组内菌群差异度变小,换句话说就是构成趋向一致。
此外,与对照组相比,剧烈运动组在3个月时的 α多样性增加更多。这表明可能需要更剧烈的运动来诱导久坐、超重/肥胖受试者的肠道微生物群发生变化。
在一项关于剧烈运动的研究中,拟杆菌门增加,厚壁菌门/拟杆菌门比率下降。这一结果与运动员有关,因为拟杆菌的增加在复杂糖聚合物的代谢转化和蛋白质降解中起着至关重要的作用。
梭菌属和Blautia属也减少了。梭菌在全身免疫反应中起着重要作用,而Blautia会增加促炎细胞因子的释放。有趣的是,结肠葡萄糖浓度与拟杆菌呈正相关,并与厚壁菌门、厚壁菌门/拟杆菌门比率和Blautia属相反。此外,Blautia属的丰度较低与更好的全身胰岛素敏感性相关。
这些结果强调了肠道底物摄取对全身的重要性,尤其是葡萄糖和蛋白质摄取,可能对肠道微生物群产生积极影响。

Lensu, S. et al., Metabolites, 2021
在儿童和老年人中也证明了身体活动水平与肠道微生物群组成之间的关联。
儿童:运动者菌群中梭菌目、毛螺菌科增加
来自美国肠道项目的 7-18 岁儿童研究队列中,在控制协变量(年龄、性别和使用抗生素和益生菌)。运动频率与富含厚壁菌门的肠道微生物群有关。此外,每天锻炼的儿童在梭菌目、毛螺菌科中的属增加了。
老年男性:与粪杆菌和Lachnospira菌有关
在老年男性中,根据步数和自我报告的活动测量的体力活动与微生物 α 多样性无关,但体力活动水平与粪杆菌属和Lachnospira属之间存在适度关联。
这些研究表明,运动员或经常运动人群与久坐人群之间的肠道微生物群组成存在差异。
运动者菌群特征可能与饮食有关
然而,运动员和身体活跃的人体内微生物群组成的一些特征可能是通过饮食来解释的,而不是运动的影响。
运动员经常遵循支持训练和表现的严格饮食,而极端运动通常与极端饮食有关。与正常人群相比,运动员的蛋白质摄入量可能要高得多。蛋白质补充剂通常用于满足训练者对蛋白质的更高需求,尽管蛋白质补充剂的流行也可能受到有关增加肌肉质量和改善性能和恢复的说法的影响。
摄入大量蛋白质后,未被吸收的蛋白质会进入结肠并促进特定细菌的生长和选择。
持续 10 周的蛋白质补充剂(乳清分离物和牛肉水解物)增加了跑步者拟杆菌的丰度,并减少了与健康相关的分类群,包括Roseburia spp、Blautia spp 和长双歧杆菌。然而,肠道微生物群组成的这种改变对宿主健康的长期影响仍不清楚。
动物研究:运动产生的变化与年龄、饮食、是否自愿、个体生理状态等因素都有关
很少有研究关注自愿运动对肠道微生物群的影响,迄今为止,除了七项实验研究外,所有研究都使用了小鼠模型。这些初步研究表明,运动会影响肠道微生物群的组成。
大鼠定期跑步运动与产丁酸菌的增加以及丁酸盐浓度的增加有关。其他动物研究表明,通过影响小鼠肠道微生物组成,每日轮式跑步运动可能会改善不健康状态的某些方面,例如饮食引起的肥胖、糖尿病和毒性。这些影响包括改变优势门厚壁菌门和拟杆菌门之间的比例。然而,这在研究之间并不总是相同。
在对动物进行的运动研究中,对于哪些种群受慢性运动的影响几乎没有达成一致。除了运动和乳酸杆菌之间的正相关关系之外,没有其他分类群在经常锻炼的小鼠或大鼠中相对丰度持续增加。
运动所产生的变化似乎取决于个人的生理状态。例如,无论是肥胖-高血压大鼠还是正常大鼠,有规律的强迫运动对微生物群的丰度都有不同的影响。高脂饮食的大鼠运动对微生物群的改变与正常饮食的大鼠不同,并且糖尿病小鼠产生的改变与其对照小鼠不同。
总的来说,这些发现表明,长期运动对微生物群的调节不仅取决于个体的生理状态,还取决于饮食。此外,动物强制运动与自愿运动之间的另一个显著差异是运动量。这在人类骑自行车的数据中得到了概括,需要在动物模型中进一步研究。
此外,年龄,性别也会呈现不同效果。据观察,与成年大鼠相比,运动对幼年大鼠的微生物群产生更有效的改变。在这些检查运动训练对肠道微生物群的影响的小鼠研究中,一个共同的发现是增加了α多样性。

在研究人类肠道微生物群时,很难分别研究运动和饮食。这种关系因饮食摄入变化而变得更加复杂(例如,抗阻力训练运动员的蛋白质摄入量增加或耐力运动员的碳水化合物摄入量增加,以及总体能量和营养摄入量的增加)。
为什么部分运动人群和久坐人群的菌群无显著差异?
高蛋白 + 膳食纤维少 = 运动改变菌群无效
韩国的一项研究表明,高蛋白/限制性膳食纤维与健康久坐人群之间的肠道微生物多样性或有益细菌没有显著差异。然而,当蛋白质或膳食纤维摄入量符合 KRDA(韩国推荐膳食允许量)时,肠道微生物多样性和有益细菌的相对丰度与健康久坐的受试者相比有显著差异。这些结果表明,运动对肠道微生物群的积极影响取决于蛋白质和膳食纤维的摄入量。结果还表明,在补充益生菌之前,应解决营养充足的问题。
研究人群之间膳食摄入量的差异,可能解释了不同研究结果之间观察到的一些不一致之处。
在韩国的一项临床研究中,总蛋白质摄入量与微生物多样性呈负相关 ,而爱尔兰职业橄榄球运动员的高蛋白质摄入量与微生物多样性增加有关。韩国运动员不符合膳食纤维摄入量的膳食建议(建议≥ 25 g/天;健美运动员的中位摄入量 19 g/天,耐力运动员 17 g/天),而爱尔兰橄榄球运动员的纤维摄入量处于推荐水平(中位摄入量 39 克/天)。
未消化的膳食纤维是肠道微生物群的重要能量和碳源,是短链脂肪酸合成的底物,是微生物多样性的关键贡献者。高蛋白饮食与低膳食纤维饮食相结合,可能对肠道微生物群组成有害,而不是单独摄入高蛋白。
营养补充剂介入运动和微生物关联
此外,主要来自动物研究的有限数据表明,流行的运动营养补充剂,如咖啡因、支链氨基酸、碳酸氢钠和肉碱,可以改变肠道微生物群的组成。大型研究队列的结果表明,运动与梭菌和毛螺菌科中的属增加有关。
其他小样本人群研究
尽管有几项研究调查了可能缺乏足够统计功效的小样本群,但有趣的是,通常诸如Akkermansia 和Prevotella等属在运动员和身体活跃的受试者中含量更高。然而,由于临床研究的数量仍然有限,参与者的人口统计学和膳食摄入量(特别是膳食纤维摄入量)差异很大,因此应谨慎得出结论。
运动前后营养变化不大,但是菌群有变化
运动对肠道菌群的影响需要考虑运动期间的饮食因素,那么运动前后对营养元素是否会显著变化?
一个研究小组表明,运动训练干预改变了久坐、未受过训练的芬兰女性的肠道微生物群组成,而饮食习惯、体重或身体成分没有改变。
作者证明,耐力运动改变了超重、久坐女性的肠道微生物群,这些女性参加了一项运动干预,包括每周 3 次、持续六周的自行车训练。研究表明,在训练干预后,总摄入量或常量营养素或膳食纤维的摄入量没有差异。
然而,耐力运动增加了Verrucomicrobia和Akkermansia相对丰度并减少肠道中与炎症相关的变形菌数量。此外,变形菌门和疣微菌门属对运动有反应,并且与年龄、体重、体脂百分比和食物摄入量无关。另一项研究为期 12 周的有氧运动训练计划显著增加了拟杆菌属的相对丰度,但是在年长、久坐的女性中,营养摄入没有变化。
下表总结了关于运动和/或运动饮食对肠道微生物群影响的研究



Mohr AE, et al., J Int Soc Sports Nutr. 2020

除了影响肠道微生物群,运动还会影响胃肠道生理机能。尽管运动通常是一种有益的或“刺激性”压力,但如果持续时间和强度的增加得不到足够的训练、休息、营养和抗氧化状态的支持,它就会变得有害。
运动后的生理效应
运动会激活自主神经系统,增加外周组织和胃肠道中皮质醇和儿茶酚胺、肾上腺素和去甲肾上腺素的循环浓度。这会导致流向胃肠道的血流量减少,导致缺氧、ATP 耗竭和氧化应激。这些作用会破坏肠道屏障,增加肠道通透性、内毒素血症、营养消耗和炎症。胃肠道通过释放与胃肠道紊乱相关的神经递质,如 γ-氨基丁酸 (GABA)、神经肽 Y 和多巴胺来应对压力激活。这些生理效应与运动的强度、持续时间和频率成正比。
长时间运动可能造成胃肠道紊乱
虽然低至中等强度的运动促进胃肠蠕动和转运时间,但剧烈的 [ >60%最大摄氧量(VO2max) ] 或长时间 (≥2 小时) 运动可能会产生相反的效果,并会造成急性胃肠道紊乱。定期运动可促进适应以维持肠道血流并减少炎症,当然恢复也必须足够。
为什么耐力运动员中常出现胃肠道问题?
胃肠道问题很常见,特别是在耐力运动员中,30-50% 的运动员出现胃肠道不适症状。这些症状可以通过生理,机械,心理,营养因子,包括血流量减少,增加的肠通透性引起的,产量增加应激激素和炎症细胞因子,胃排空不足。
然而,在耐力跑之外,很少评估胃肠道症状。例如,一项对参加 4 天严格越野滑雪行军的士兵的研究显示肠道通透性增加,但没有报告胃肠道症状,这使得对主观体验的影响和对运动表现的影响尚不清楚。
肠道上皮具有高周转率(3-5 天),需要大量的能量和营养。在没有足够燃料的情况下长时间高强度训练的运动员有可能出现肠道完整性和功能紊乱以及胃肠道症状。特别是,习惯性碳水化合物摄入量不足会增加对长时间、持续剧烈运动的促炎应激反应。

★
根据运动类型、强度、年龄和其他因素,20-50% 的运动员会出现胃肠道症状,并且随着运动强度的增加而增加。
高强度运动带来的负面影响
在对 29 名训练有素的男性铁人三项运动员的研究中,在比赛中,93% 的人报告消化功能紊乱,两名参与者因严重呕吐和腹泻而不得不放弃比赛。这些在运动员中很常见,因为在剧烈运动期间体温升高,血液从胃肠道流向周边肌肉和器官,如心脏和肺。远离肠道的血流重新分布以及对肠黏膜的热损伤可导致肠道屏障破坏,继而引发炎症反应。
在每周进行 4-10 小时耐力运动的健康年轻成年男性骑自行车者中,仅以 70% 的最大工作负荷进行 1 小时的运动就会产生内脏灌注不足,这会导致胃肠道循环减少、肠道通透性增加和小器官受损。
另一项研究表明,在 70% VO2max 下运动的人会导致内脏血流量减少 60-70%,当血流量减少 50% 时,运动引起的缺血会导致肠道通透性增加 。
加一句题外话,例如明星,网红为了美,限制碳水摄入,同时大量高强度锻炼来达到快速瘦身的效果,其实损害了肠道健康,可能会引起全身炎症反应,不要盲目效仿。
然而,研究主要集中在运动期间急性摄入(之前和期间)对胃肠道症状的影响,而不是习惯性饮食,尽管越来越多的运动员和研究人员关注避免食物的策略,例如低发酵低聚糖,二糖、单糖 、FODMAP 饮食或无麸质饮食。
剧烈运动 -> 胃肠道紊乱 -> 影响肠道微生物群
导致胃肠道症状的氧化应激增加和肠道屏障功能紊乱也会影响肠道微生物群。LPS(由肠道通透性增加引起的革兰氏阴性菌的成分)的易位会导致内毒素血症并触发促炎细胞因子分泌到胃肠道中,这可能会影响肠道微生物群并进一步加剧病情。
反过来:肠道微生物群失调 -> 胃肠道紊乱
相反,微生物代谢物丁酸盐和丙酸盐可作为结肠细胞的能量来源,减少粘膜降解、胃肠道通透性和炎性细胞因子。
肠道微生物群可作为生物标志物
由于微生物组成和多样性的改变与运动员胃肠道不适的流行有关,因此肠道微生物群组成可用作运动后代谢和全身压力的生物标志物。
例如,一项研究运动对血清和粪便代谢组以及肠道微生物群的急性影响的研究表明,一次运动上调骨骼肌底物利用和血清中碳水化合物代谢物的代谢途径,增加粪便氨和氨基酸代谢物,并增加梭菌的丰度。因此,微生物和代谢物谱的急剧变化可以提供有关运动对胃肠道和代谢影响的信息。
此外,考虑到运动对肠道微生物群的影响以及对以肠道为中心的饮食策略的需求,胃肠道症状评估可以补充有关肠道微生物群组成的信息。

一般运动员在运动训练中摄入大量单糖,以最大限度地储存糖原和维持血糖,同时尽量减少膳食纤维和抗性淀粉的摄入,以防止胃肠道紊乱。膳食纤维和抗性淀粉摄入不足可能会导致排便减少,从而导致肠道功能下降,也会降低肠道微生物群的多样性。
此外,运动员比非运动员消耗更多的动物蛋白来满足肌肉增生的需要。蛋白质摄入过多会导致肠道微生物中氮底物过量,产生腐败的发酵产物,如氨、硫化氢、胺、酚、硫醇和吲哚。随着食糜通过肠道,碳水化合物含量减少,腐烂的发酵变得更加有害。
实际上,蛋白质摄入过量,同时结肠中可发酵的膳食底物较低,会导致结肠黏膜DNA损伤。
高强度运动通过血液影响肠道微生物群
此外,高强度运动刺激血液从肠道器官重新分配到肌肉,同时它们积极进行细胞呼吸。血液的频繁重新分布可能会通过内脏低灌注和缺血以及随后的再灌注来扰乱肠道微生物群。因此,需要研究特定运动类型和运动员饮食对肠道微生物群的长期影响。
肠道微生物群在胃肠道功能、肠道免疫、内分泌以及调节氧化应激和水合水平等方面扮演多种角色,对肠道微生物群改善运动员肠道屏障功能的机制的研究也就越来越多。
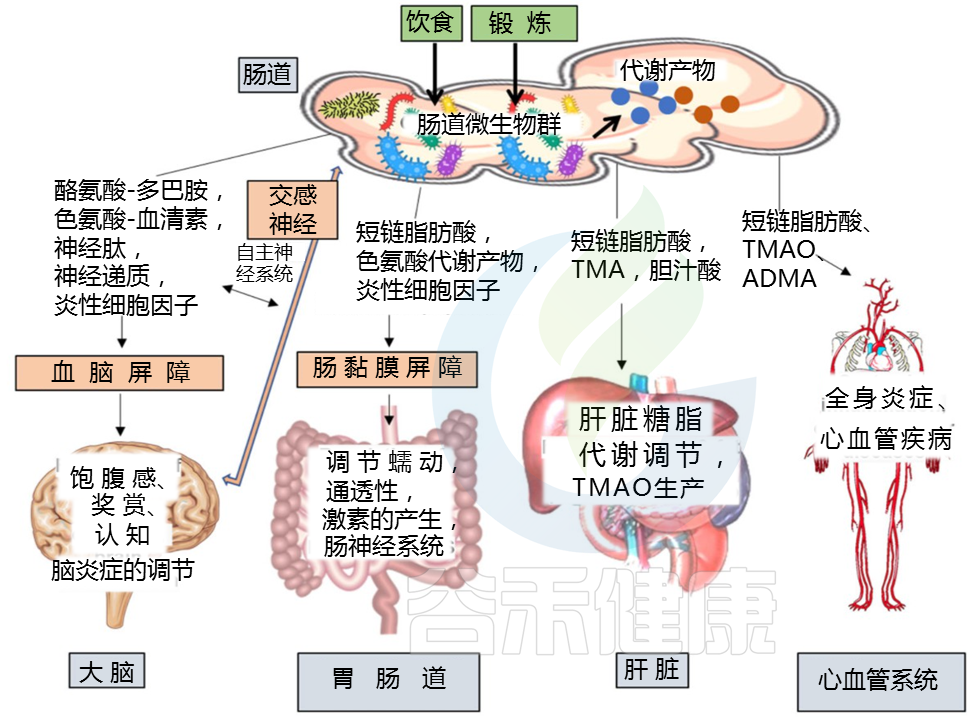
微生物群产生的 SCFA 影响一系列宿主过程
在结肠和盲肠中,复杂的植物来源的多糖被消化,随后被肠道微生物(如乳杆菌、双歧杆菌、梭状芽孢杆菌、拟杆菌)发酵成短链脂肪酸和气体,这些气体也被专门的细菌(如还原性产乙酸菌)用作碳和能源、硫酸盐还原菌和产甲烷菌。肠道中乙酸盐、丙酸盐和丁酸盐在结肠和粪便中的摩尔比约为 60:20:20。肠道微生物群的组成,微生物群之间的代谢相互作用,及主要膳食宏量和微量营养素的数量和类型,决定了肠道微生物群产生的短链脂肪酸的类型和数量。
一个人吃的植物来源的多糖、寡糖、抗性淀粉和膳食纤维越多,这些细菌就越能将这些难以消化的食物来源发酵成有益的短链脂肪酸。微生物群产生的短链脂肪酸影响一系列宿主过程,包括控制结肠 pH 值,进而影响微生物群组成、肠道运动、肠道通透性和上皮细胞增殖。
Lensu, S. et al., Metabolites, 2021

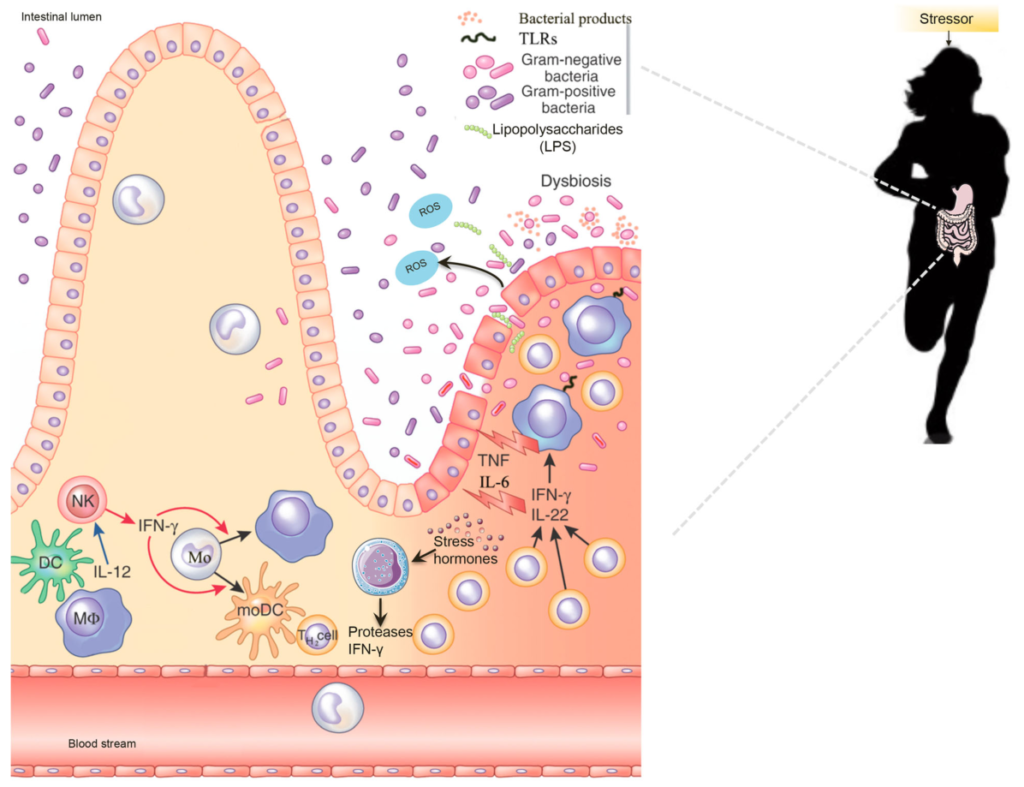
运动引起的压力会改变分解代谢激素、细胞因子和肠道微生物群,这可能会导致胃肠道紊乱、焦虑、抑郁和表现不佳。肠道微生物群在人类生物学的许多方面都具有基础性作用,包括新陈代谢、内分泌、神经元和免疫功能。
Allison Clark & Núria Mach,J Int Soc Sports Nutr. 2016
适当的肠道屏障功能对于维持健康和免疫力至关重要。但是训练和比赛数小时的精英运动员会经历身体和情绪压力,导致生理稳态发生变化,刺激SAM(交感神经-肾上腺髓质轴)和 HPA轴(下丘脑-垂体-肾上腺轴)高强度运动期间的胃肠道紊乱。
在剧烈运动期间,运动员的体温会升高,血液会在剧烈运动时从胃肠道流向周围肌肉和器官,例如心脏和肺。远离肠道的血流重新分布以及对肠黏膜的热损伤可导致肠道屏障破坏,继而引发炎症反应。长时间的剧烈运动会增加胃肠道中的应激激素和脂多糖 (LPS) 易位,从而引发免疫反应,这通常会导致促炎细胞因子和肠道通透性增加。
由于活性氧 (ROS) 的产生增加以及肠道微生物群组成和活性的改变(所谓的生态失调),肠道通透性可能会变得更糟。
胃肠道通过释放 GABA、神经肽 Y (NPY) 和多巴胺等激素来应对压力,这些激素会导致胃肠道紊乱、焦虑、抑郁、食物摄入减少和压力应对能力降低。相反,微生物群产生的丁酸盐和丙酸盐可以增加跨上皮抵抗,从而改善肠道屏障功能并减少炎症。
胃肠道通过释放 GABA、NPY和多巴胺等激素来应对压力
GABA,这是身体的主要抑制中枢神经系统的神经递质,调节血压和心率和在各种胃肠道功能中起着重要作用,如运动性,胃排空和瞬态下食道括约肌放松,以及焦虑、抑郁,疼痛感和免疫反应。
适度运动可以增加下丘脑中的 GABA 水平,从而降低静息血压、心率和交感神经张力。在 25 °C 水中强迫游泳时,发现大鼠海马 GABA 水平下降(基线的 70%)。
神经肽 Y(NPY)也会在胃肠道中响应各种压力刺激(例如剧烈运动)而释放,并在减弱 HPA 轴方面发挥作用。
注:神经肽Y是一种36个氨基酸的肽,位于整个肠脑轴,是大脑中最普遍的神经肽,在压力恢复和炎症过程中发挥作用。
检测了 12 名训练有素的赛艇运动员的神经肽 Y血清水平,发现运动后神经肽Y的浓度显著增加。虽然很少有研究研究了血清和海马 NPY 水平对运动的反应,但这些结果表明它在减少剧烈运动时的压力反应方面发挥作用。
多巴胺(去甲肾上腺素和肾上腺素的前体)也可以在胃肠道压力期间合成。
多巴胺的产生取决于几个因素:
整个肠道中有多种多巴胺受体,表明它在肠-脑轴中发挥作用。胃肠道、脾脏和胰腺会产生大量的多巴胺。在人胃上皮细胞中发现了多巴胺合成的限速酶酪氨酸羟化酶,表明其功能存在于大脑中的神经传递之外。每天大约 1-2 小时的习惯性运动已被证明会增加大脑中的多巴胺水平。
肠道微生物群如何与周围组织(如胃肠道粘膜层)的应激激素直接相互作用?
去甲肾上腺素(NE)已显示对肠道嗜水气单胞菌(Aeromonas hydrophila)、博德特氏菌属(Bordetella)、空肠弯曲杆菌(Campylobacter jejuni)、幽门螺杆菌(Helicobacter pylori)、李斯特菌(Listeria)和沙门氏菌(Salmonella enterica)有直接影响。
其中去甲肾上腺素促进致病细菌生长的一些方法是,通过增加其毒力因子 K99 菌毛粘附素的表达以及激活鼠伤寒沙门氏菌中毒力相关因子的表达来促进大肠杆菌粘附在肠壁上,然后使这些细菌更容易感染。
此外,去甲肾上腺素还会增加非致病性大肠杆菌和其他革兰氏阴性菌的水平。
微生物组如何调节运动引起的压力反应?
最近发表了一项研究,揭示了对胃肠道和全身健康很重要的,独特微生物群—宿主相互作用。
在结肠炎小鼠模型中,自愿跑步 6 周会减轻症状,而强制跑步机跑步会加剧肠道炎症和临床结果。粪便和盲肠水平与 6 周强制跑步机跑步组相比,与免疫功能和肠道疾病密切相关的在自愿跑步者中显著降低。
此外,与久坐组相比,强制组中的瘤胃球菌(Ruminococcus gnavus)在肠道粘液降解中具有明确的作用,以及增加了丁弧菌属、Oscillospira属和粪球菌属。
这项针对运动和压力动物的初步研究表明,运动可以改变微生物群的组成以及代谢功能,这可能根据运动强度和自愿性等对菌群产生积极或消极的影响。

由于营养、遗传和环境因素,在人类临床研究中剖析肠道微生物群对运动表现的确切作用可能很困难。无菌动物模型克服了其中的许多挑战,并已被用于证明肠道微生物群对身体表现结果所起的作用。
失去肠道微生物群的小鼠,运动表现下降
研究了无特定病原体 (SPF)、无菌 (GF) 和脆弱拟杆菌(Bacteroides fragilis)无菌小鼠的游泳能力。GF 小鼠从游泳到精疲力竭的时间最短,SPF小鼠最长,表明在没有肠道微生物群的情况下表现会下降。观察到与SPF小鼠相比,GF 小鼠表现降低的类似发现。
其他研究:失去肠道微生物群的小鼠运动表现无影响,但肌肉功能下降
与上述相反,另外的研究,GF 小鼠和 SPF 小鼠在运动至精疲力竭时的身体表现没有差异。然而,与 SPF 小鼠相比,GF 小鼠表现出肌肉质量减少、肌纤维减少和肌肉力量降低。GF 小鼠的肌肉萎缩与线粒体生物合成失调和氧化能力降低有关。SPF 小鼠肠道微生物群的移植恢复了 GF 小鼠的肌肉质量,与未治疗的 GF 小鼠相比,用短链脂肪酸混合治疗增加了 GF 小鼠的骨骼肌质量和肌肉力量。
抗生素治疗极大地改变了肠道微生物群的组成
研究证明肠道微生物群在光谱抗生素治疗后耗竭,同时减少了小鼠的耐力运行时间,通过重新接种微生物群恢复后,耐力能力恢复正常。耐力能力的变化与肌肉质量、肌纤维类型或线粒体功能的变化无关,但与肌糖原水平的变化有关,在重新接种后恢复。
多项研究报告了类似的发现,其中与未治疗的对照组相比,使用多种抗生素治疗的小鼠的跑步机运行时间更短。
SCFA 产生的影响及其对运动表现的作用
通过用具有不同底物可用性的纤维喂养小鼠,以在肠道中产生微生物 SCFA。与喂食高度可发酵纤维的小鼠相比,喂食可发酵纤维减少的小鼠的跑步时间显著缩短,这表明微生物群及其底物都与身体机能有关。
为了进一步探索 SCFAs 在表现能力中的假定作用,对抗生素治疗的小鼠进行皮下注射乙酸盐或丁酸盐。乙酸盐而非丁酸盐的输注改善了抗生素引起的剧烈运动带来的不良反应。
无菌动物当然是一种极端模型,可能无法解释在人类微生物群中观察到的更细微的差异。不过,无菌动物模型的研究已经建立了肠道微生物群与身体机能之间的因果关系。
总体而言,恢复肠道微生物群失调似乎可以有效恢复啮齿动物的运动能力和骨骼肌参数。
此外,肠道微生物群组成的差异或肠道微生物群的缺乏可以调节与肌肉结构、肌肉力量和/或能量利用相关的运动能力。
身体活动分为力量和耐力两大类,这取决于你的身体如何产生能量来维持你的运动表现。
无氧运动
力量运动通常高强度,如举重、短跑和拳击。这些运动通过锻炼细胞的无氧途径来增强肌肉质量。这就是说你的肌肉利用其有限的糖原储备来制造 ATP(肌肉的燃料),而无需使用氧气。
最近的一项研究表明,宿主骨骼肌在无氧运动期间产生的乳酸通过循环进入肠腔,为结肠中利用乳酸的物种提供了选择性优势。这项开创性工作的结果表明,在高强度运动期间,宿主以乳酸的形式为特定细菌提供燃料,这些细菌又会产生代谢物,例如丙酸盐,对运动宿主有益。
有氧运动
这与耐力运动不同,有氧运动允许身体以较低的强度进行运动,但运动时间要长得多,例如长跑、骑自行车和滑雪,此类运动肌肉使用氧气将脂肪和糖类转化为 ATP 作为燃料。
测量心血管健康最流行的方法是 V02最大值,它可以查看你的身体在剧烈运动期间可以使用的最大氧气量。用于评估耐力表现,并且可以通过高强度运动得到显著改善。
几项研究表明,微生物群组成与心肺健康之间的关系可以解释“分类丰富度”(微生物组中鉴定的细菌多样性)的 20% 以上的变化。注意到这些变化与其他因素无关,包括年龄、脂肪摄入量和碳水化合物摄入量。
有氧运动对微生物群及身体的益处
研究表明,有氧运动对你的微生物群有好处,包括有益菌和整体多样性丰度增加。
重复进行有氧运动可以增加健康个体和患有慢性便秘的中年患者的胃肠道转运时间。
有氧运动还会增加粪便 SCFA 浓度,从而降低结肠腔的 pH 值。
此外,作为运动副产物并在全身循环的代谢物(例如乳酸),可能会通过肠道过滤并作为某些细菌分类群(例如韦永氏菌)的能量来源。
有氧运动类型及建议
有氧运动是长期而稳定的,确保为你的肌肉提供氧气,以便它们可以产生燃料 (ATP)。这包括任何可以提高心率并长时间保持心率的运动。
比如:步行、慢跑、跳舞、慢骑自行车、椭圆机和健身房的划船机、登山、游泳等都是有氧运动。但是,锻炼的强度和持续时间还是根据身体的总体健康水平而异。
有氧运动是长期的。放轻松,坚持下去,你的身体会适应的。
NHS 已经发布了成人的运动建议:
至少150分钟中等的有氧运动,如骑自行车或快走
每周进行 2 天或更多天的力量锻炼,可以锻炼所有主要肌肉(腿部、臀部、背部、腹部、胸部、肩部和手臂)
或者
每周进行中等强度和剧烈有氧运动的组合——例如,两次 30 分钟的跑步加上 30 分钟的快走相当于 150 分钟的中等有氧运动
每周进行 2 天或更多天的力量锻炼,可以锻炼所有主要肌肉(腿部、臀部、背部、腹部、胸部、肩部和手臂)
适当的训练计划旨在平衡精英运动员所经历的全身压力因素以及个性化的饮食计划,以提高表现并减少运动引起的压力症状。
某种营养素对应激反应的调节程度取决于其持续时间、运动员的整体营养状况、运动的类型和强度、生理状况以及肠道微生物群的组成和功能。由于精英运动员的压力反应相当复杂(从肠漏到分解代谢和抑郁症),定义标准的饮食计划很困难。
一般来说,许多精英运动员被鼓励摄入大量的简单碳水化合物和蛋白质以及少量的脂肪和纤维,以提供快速的能量来源,同时避免潜在的消化问题,例如高纤维饮食有时会出现的胀气和腹胀。精英运动员的饮食计划也基于某些微量营养素的消耗,如铁、钙、氨基酸、必需脂肪酸和抗氧化剂。
饮食设计应考虑肠道微生物群
由于饮食强烈影响微生物群的组成和功能,通过营养治疗调节肠道微生物群可以改善运动员的压力反应并提高表现。可以假设,每个饮食计划可能都伴随着微生物群的同步调整。为运动员设计个性化饮食时的另一个重要考虑因素是了解微生物组如何随时间变化。
目前和未来运动员或经常的锻炼计划应根据其对肠道微生物群的潜在影响来考虑饮食策略,包括以运动为中心的饮食策略(例如,蛋白质补充剂、碳水化合物负荷)对肠道微生物群的影响以及以肠道为中心的饮食策略的影响。

对性能的饮食策略,除了摄入益生元、益生菌和合生元外,摄入足够的膳食纤维、多种蛋白质来源,并强调不饱和脂肪,尤其是 omega-3脂肪酸,在优化运动员的健康和表现。
蛋白质
蛋白质是骨骼肌的主要成分。然而,特定氨基酸在肝脏和骨骼肌的吸收和分解代谢以及它们调节肌肉蛋白质合成反应的能力方面有所不同。
必需氨基酸,尤其是支链氨基酸 (BCAA),对于肌肉蛋白质合成至关重要,并且比非必需氨基酸产生更大的肌肉蛋白质合成反应。因此,膳食蛋白质会影响蛋白质利用和骨骼肌对运动的合成代谢反应。
补充亮氨酸导致血浆亮氨酸和总支链氨基酸浓度显著增加,并改善耐力表现和上肢力量,影响血浆色氨酸:支链氨基酸比率。BCAA 的补充也被用于通过改变大脑神经递质的产生(如 5-HTP、多巴胺和去甲肾上腺素)来调节运动期间疲劳的影响。由于缺乏证据,无法对运动员应服用的 BCAA 类型或数量提出建议。
运动员可能需要的蛋白质是一般人群的两倍
用以维持蛋白质合成、能量产生、免疫功能和肠道完整性和运动引起的压力的结果。
这对于耐力和阻力训练的运动员来说比较重要。耐力运动员可能需要在运动后恢复期摄入更多的蛋白质,尤其是在禁食状态下进行耐力运动时,因为这可能会增加肌丝蛋白水解。
虽然根据饮食和生理因素而变化,例如消化率、氨基酸的数量和组成、食物基质以及其他营养素的存在,但约 10% 的蛋白质未被消化,可能会到达结肠被肠道细菌分泌的蛋白酶进行蛋白水解。
Hughes RL, et al., Adv Nutr. 2021
关于肠道微生物群代谢,氨基酸可以根据其发酵代谢产物进行分类:含硫氨基酸、芳香族氨基酸和色氨酸。
过量蛋白质摄入的不利影响
这些代谢物包括支链脂肪酸和短链脂肪酸、氨、硫化物、吲哚和酚类化合物。虽然其中一些代谢物(例如 SCFA 和吲哚)可能具有改善肠道完整性等有益效果,但其他代谢物(例如氨和对甲酚)会降低肠道上皮完整性。过量的蛋白质摄入可能会导致蛋白水解代谢物的产生水平超过宿主吸收、转化或解毒有害代谢物的能力,导致对肠道屏障功能、炎症和结肠健康的不利影响。
非蛋白质成分有助于运动后的蛋白质合成反应
另一个领域是全食物蛋白质与蛋白质补充剂的影响,因为全食物具有相同或更好的增效作用。例如,摄入全鸡蛋与蛋清相比,摄入全脂牛奶与脱脂牛奶相比,会导致更多的氨基酸摄入和运动后肌原蛋白合成,表明非蛋白质成分(例如,脂质、碳水化合物、微量营养素和其他生物活性化合物)有助于运动后的蛋白质合成反应。
过量蛋白质补充剂增加结直肠癌风险
蛋白质补充剂,包括添加到能量饮料中的支链氨基酸和牛磺酸,通常被运动员用来增强运动对骨骼肌的合成代谢和适应性作用,并促进恢复。过量的牛磺酸会导致牛磺胆酸(TCA)、脱氧胆酸(DCA) 和硫化氢 (H2S) 浓度升高,这与结直肠癌风险增加有关;然而,这些补充剂对运动肠道微生物群的影响尚不清楚。
谷氨酰胺
运动前几天食用高蛋白、低碳水化合物的饮食会导致运动后血浆谷氨酰胺浓度降低。然而,谷氨酰胺补充剂几乎没有得到对健康、营养良好的运动员的严格控制的科学研究的支持。此外,研究者指出谷氨酰胺补充剂应取决于症状(即血浆谷氨酰胺水平低、肠漏)。
酪氨酸
新的中央疲劳假说指出,当血清素水平升高而多巴胺水平降低时,疲劳就会开始,这可能是许多运动员服用酪氨酸补充剂以防止其消耗的原因,尽管尚未确定推荐的补充剂量。酪氨酸或 4-羟基苯丙氨酸可在体内由苯丙氨酸合成,存在于许多高蛋白食物中,如豆制品、鸡肉、火鸡、鱼、花生、杏仁、鳄梨、牛奶、奶酪、酸奶和芝麻。
肠道微生物群通过增加膳食蛋白质的生物利用度和吸收以及增加肌肉蛋白质合成影响肌肉功能
有证据表明,肠道微生物有助于蛋白质的吸收和利用。例如,益生菌补充剂(副干酪乳杆菌)增强了植物蛋白的生物利用度,将必需氨基酸和支链氨基酸的浓度提高到与动物蛋白相当的浓度。此外,当与蛋白质共同给药时,益生菌凝结芽孢杆菌(GBI-30,6086) 减少了上皮细胞炎症,改善了营养吸收,并产生了增加人类氨基酸吸收的蛋白酶。这些作用可以减少肌肉损伤并促进肌肉恢复,从而提高适应能力和表现。
需要注意的是,细菌虽发酵氨基酸,但它们代谢动物和植物蛋白的方式不同。每个饮食计划都伴随着微生物群组成和功能的同步调整。因此,纯素食者、素食者、杂食者和红肉摄入量高的饮食的微生物群组成差异很大。
多项研究表明在高蛋白饮食中添加抗性淀粉可以抵消高蛋白摄入的负面影响,进一步说明摄入足够的膳食纤维对肠道和整体健康的重要性。
碳水化合物
毫无疑问,充足的碳水化合物消耗对于繁重的训练计划和成功的运动表现至关重要。
碳水化合物怎么补充?
对于每天训练超过 2 小时的运动员,膳食碳水化合物的摄入量为每天 7 至 12 克/千克,脂肪摄入量通常小于每天体重的 1 克/千克(消耗总卡路里的 20%)。

碳水化合物在长时间的剧烈运动中恢复肌肉和肝脏糖原储存,减轻压力激素水平升高,如皮质醇,并可以限制与高强度运动相关的免疫抑制。高碳水化合物饮食(8.5 g/Kg/d;总能量摄入的 65%)和随意食用碳水化合物在高强度训练期间可以减少疲劳并改善身体机能和情绪。
运动前和运动中摄入大量简单碳水化合物
针对运动员的饮食建议在运动前摄入大量简单碳水化合物以维持葡萄糖稳态,并在运动前摄入低纤维以减少胃肠道不适,同时补充说,以植物为基础的高纤维饮食可能会降低能量供应。在运动前和运动期间摄入简单碳水化合物(例如,葡萄糖、果糖、蔗糖、右旋糖)可以减轻疲劳、提高运动表现、促进水重吸收和维持水分充足。
摄入等量的果糖和葡萄糖,优化果糖吸收减轻不适
然而,葡萄糖和果糖负荷以及果糖与葡萄糖的比例会影响肠道微生物发酵和胃肠道应激。葡萄糖和果糖的组合导致比摄入单一碳水化合物更高的碳水化合物氧化率,减少运动期间内源性能量储存的消耗。摄入等量的果糖和葡萄糖可优化果糖吸收,减少微生物发酵,从而减轻胃肠道不适症状。
乳糖提高运动表现和恢复能力
乳糖还可以作为运动前、运动中和运动后的良好燃料来源,以提高运动表现和恢复能力,同时还可能促进对肠道微生物群的有益影响,例如双歧杆菌和乳酸杆菌的增加。
注意:
高碳水化合物饮食不会改善免疫功能,也不会防止经过大量训练后血浆谷氨酰胺浓度降低。
富含简单和精制碳水化合物的饮食不会促进健康的肠道微生物群组成,也不会产生有益的短链脂肪酸。
需要更多的研究来了解微生物群从饮食中提取营养的能力,并包括宿主的代谢变化。
膳食纤维
一般每 1,000 卡路里摄入足够的纤维总量为 14 克,即成年女性为 25 克,成年男性为 38 克。
低膳食纤维供应与较低的微生物群多样性、较少的短链脂肪酸产生和较少的抗病原菌相关,所有这些都可能对宿主产生有害的长期后果。
运动员或运动锻炼期间可以通过增加植物性食物的摄入量(例如全谷类、豆类、蔬菜、水果和坚果),同时在恢复期和训练期减少来自高添加糖、精制碳水化合物和脂肪的加工食品的能量,从而获得足够的膳食纤维摄入量,因为在激烈的训练或比赛之前吃高纤维饮食可能会导致胃肠道不适,如腹胀、胀气。
腹胀详见:“肚子像气球?”“好像怀孕?”——可能是腹胀惹的祸
此外,膳食纤维和大量食用植物性食物似乎会抑制细菌从蛋白质中产生有害代谢物,这强调了摄入足够的复合碳水化合物以维持肠道微生物组碳水化合物发酵的重要性。
脂肪和多不饱和脂肪酸
运动员的脂肪消耗量往往很低,占膳食能量的 15-30% 。长时间运动期间脂肪代谢的增加(30-50% 的膳食能量)可能具有糖原节约作用,并可能改善耐力表现和健康。
高脂肠内营养可以减轻肠道灌注不足导致消化功能紊乱后的肠道炎症、细菌易位和肠道损伤。
高脂饮食的危害
另一方面,高脂饮食会导致类似焦虑的行为增加,选择性破坏探索性、认知性和刻板行为,神经炎症破坏肠道屏障功能的标志物,以及与高脂肪饮食的小鼠相比增加循环内毒素和淋巴细胞表达。
在人类中,与高碳水化合物饮食(65% 的饮食能量)相比,富含脂肪的饮食(62% 的饮食能量)可能对免疫功能有害。
这些作者比较了 10 名未经训练的年轻男性在每周 3-4 次持续 7 周的耐力训练期间食用富含碳水化合物的饮食,和10 名高脂饮食的受试者。高脂饮食的运动员的 NK 细胞活性较低。
注:NK 细胞溶解一定数量肿瘤靶细胞的能力
Omega-6 多不饱和脂肪酸
它可以改变细胞膜流动性并间接影响免疫功能,包括减少 IL-2 的产生和抑制有丝分裂原诱导的淋巴细胞增殖,从而在运动期间和运动后产生潜在的不良免疫功能。
omega-3 多不饱和脂肪酸
它的最佳剂量约为 1–2 g/d,二十碳五烯酸与二十二碳六烯酸的比例为 2:1,可能会减少运动过程中 ROS 的产生。

高脂饮食对运动的影响不明确
到目前为止,由于结果相互矛盾,很难就补充 omega-3 的数量和持续时间向运动员提出任何明确的建议。目前,高脂肪饮食对后续运动表现的影响是模棱两可的,并且缺乏关于压力个体的信息。
最重要的是,摄入高脂肪和卡路里的饮食与慢性“低度”全身炎症、肠道通透性和血浆LPS增加以及总细菌多样性降低以及拟杆菌和梭菌的相对比例增加有关。因此,似乎食用高脂肪饮食也可能导致肠道微生物群发生不利变化。
维生素和抗氧化剂
运动员通常不会补充维生素和其他抗氧化剂,但建议运动员应考虑增加抗氧化剂的摄入量,如维生素 C、E、β-胡萝卜素和多酚,以减少 ROS 的形成和脂质过氧化。

用蓝莓和绿茶提取物(作为布洛芬替代品)补充多酚并没有改变既定的炎症和氧化应激,但增加了肠道细菌多酚代谢特征的代谢物(例如马尿酸盐、4-羟基马尿酸、4-甲基儿茶酚硫酸盐)和跑步者在3天剧烈运动后恢复期间的生酮。
不推荐补充个别微量营养素或食用大剂量的简单抗氧化剂混合物
尽管没有任何负面影响的报道,但富含多酚提取物(蓝莓和绿茶)的运动员饮食并没有减轻剧烈运动带来的生理压力,也没有提高恢复速度。
摄入大剂量的个别维生素(在运动员中并不少见)可能弊大于利,因为大多数维生素在体内主要作为辅酶发挥作用。一旦这些酶系统饱和,游离形式的维生素就会产生毒性作用。因此,运动锻炼期间应该通过增加水果和蔬菜的摄入量来获得复杂的抗氧化化合物混合物。
益生菌
常规益生菌包括双歧杆菌属和乳酸杆菌,尽管在运动员中研究的其他细菌包括芽孢杆菌属、肠球菌属、链球菌属、韦永氏菌或酵母布拉氏酵母菌。
益生菌带来的健康益处及对运动效果的影响
益生菌可减少感染、炎症、肌肉酸痛和胃肠道通透性或不适。迄今为止,益生菌益处的最实质性证据是改善上呼吸道感染的发生率、持续时间和严重程度,这可能会间接提高运动成绩。
呼吸道症状改善的研究包括来自乳酸杆菌家族的有机体。L.salivarius也可能通过增加产生丁酸盐的类群Roseburia和Lachnospiraceae 来降低胃肠道通透性,并减少疣微菌。虽然有证据表明益生菌功能的共享机制,但益生菌的益处通常取决于益生菌的菌株和剂量。
益生菌可以通过改善肠道通透性和抗氧化状态以及减少炎症来减轻剧烈运动对运动员胃肠道不适和肌肉酸痛的影响。布拉氏酵母菌和嗜酸乳杆菌和双歧双歧杆菌的组合有助于预防旅行者腹泻。
益生菌还可以通过生物活性代谢物的产生(例如短链脂肪酸、神经递质)、肠道 pH 的调节和肠道的改变等机制改善营养吸收和利用、糖原储存、身体成分、能量收集、激素产生以及认知和情绪微生物群的活动。例如,植物乳杆菌增加了铁人三项运动员的耐力表现,同时增加了粪便短链脂肪酸。
一项对小鼠的研究表明,从一名奥林匹克举重运动员身上分离出的细菌菌株 [ L. salivarius亚种 salicinius (SA-03)] 通过增加肝脏和肌肉糖原并降低乳酸、血尿素氮、氨和肌酸激酶在运动后提高耐力表现和肌肉力量。
然而,更多的研究表明,多菌株益生菌比单菌株益生菌具有更强的增效作用,这表明多种菌株可能以互补的方式发挥作用以提供性能优势。
益生菌可能因此有利于通过直接和间接的机制,提高运动成绩,虽然增补效应的证据仍然稀少。
益生菌如何补充?
益生菌菌株和剂量的差异以及个人的基线饮食、免疫状态和微生物群组成可能会导致研究之间的结果存在差异,从而使比较和得出结论变得困难。
大多数针对运动员的益生菌补充研究并未评估肠道微生物群,因此很难确定疗效是否取决于基线或参与者肠道微生物群组成的变化。同时饮食摄入,尤其是纤维和益生元底物的摄入,也可能影响益生菌的作用,因此应在分析中加以考虑。因为消费者应该意识到,如果没有足够营养的饮食支持,单独补充益生菌可能不会产生预期的效果。
此外,针对运动的益生菌补充研究通常样本量较小(即 10 至 30 名参与者),并且通常仅包括或主要包括男性参与者,这是有问题的,因为存在可能是性别特定的影响。
发酵食品对运动的影响
人们越来越关注发酵食品中活培养物的影响 ,以及它们的影响或与肠道微生物群的关联。然而,很少有研究调查发酵食品(包括酸奶、开菲尔、酸菜)对运动的影响。
三项使用开菲尔或发酵乳的研究报告称,运动诱发的 CRP 或肌酸磷酸激酶和肌肉酸痛降低,表明这些发酵食品对减少炎症有积极作用。一项小鼠研究报告了开菲尔对力量和耐力的增效作用。因此,含有活微生物的发酵食品可能对炎症和运动表现有益。
合生元
合生元是“包含活微生物和宿主微生物选择性利用的底物的混合物,它赋予宿主健康益处”。合生元可能是益生菌和益生元的组合(互补合生元),尽管单个成分不一定需要满足益生菌和益生元的标准,只要它们在共同给药时协同作用(协同合生元)。因此,益生元成分可以增强益生菌(协同合生元)的功能,或者这两种成分在引入肠道及其常驻微生物(互补合生元)后可以提供独立的有益功能。
这种微生物和选择性利用底物的组合可能比单独补充益生元或益生菌具有不同的效果。然而,只有 1 项研究调查了这些成分对身体活跃的人类的协同和独立影响。合生元补充剂(副干酪乳杆菌431、动物双歧杆菌乳酸亚种BB-12、嗜酸乳杆菌LA-5、鼠李糖乳杆菌)与单独补充益生元(阿拉伯胶)相比,LGG、raftiline、raftilose、乳铁蛋白、免疫球蛋白、阿拉伯胶)与血清 IL-16 浓度的增加较小相关,但合生元补充剂和阿拉伯胶单独都不影响 SCFA 浓度、免疫或胃肠通透性。因此,与单独补充益生元或益生菌相比,合生元可能对运动员的健康和表现产生不同或额外的影响。
微量营养素
微量营养素有助于免疫功能、炎症、能量代谢和骨骼健康,影响运动表现。充足的铁、锌和维生素 A、E、C、B-6 和 B-12 的摄入量对于适当的免疫功能至关重要,在运动员的高强度训练和比赛条件下可能会受到影响。
此外,由于汗液和尿液的流失以及氧化应激的增加,运动员对某些微量营养素的饮食需求可能会增加。此外,女运动员或女性增加锻炼缺铁的风险更高,影响健康和表现。
微量营养素与肠道微生物群
缺乏抗氧化微量营养素(例如,维生素 C 和 E 以及硒)会减少共生肠道细菌的数量,同时促进大肠杆菌的增加。
在压力增加的动物中,维生素 C、维生素 E、多酚、硫辛酸和微生物抗氧化剂的抗氧化剂混合物可恢复肠道氧化还原状态,这与双歧杆菌和乳杆菌增加以及大肠杆菌减少有关。然而,过量摄入某些微量营养素也可能增加感染易感性。例如,婴儿过量补铁会增加病原微生物,包括大肠杆菌,并导致肠道炎症。
因此,在压力增加或微量营养素缺乏的情况下补充微量营养素可能对免疫和炎症具有微生物群介导的益处。
钙和维生素D
钙和维生素D支持骨骼健康。此外,维生素 D 可能通过调节钙依赖性收缩、蛋白质依赖性骨骼肌合成代谢、线粒体功能和胰岛素敏感性来影响骨骼肌质量和强度。纤维摄入后双歧杆菌、毛螺菌科和拟杆菌的增加与钙吸收的增加呈正相关。这可能是由于短链脂肪酸的产生,它通过降低结肠 pH 值或调节信号通路或基因表达来增加钙吸收。维生素 D 的摄入也会影响肠道微生物群,尽管结果的可变性排除了确定补充剂对特定分类群的影响的能力。摄入钙和维生素 D 与肠道微生物群之间的双向关系对所有年龄段运动员的骨骼健康都有重要意义,无论是生长还是维持骨密度,以降低骨折风险。
需避免的食物
胃肠道问题在运动员和长期运动锻炼人群中比较常见。为了缓解症状,运动员可能会避免或限制某些会引发症状的食物。运动员还可以采用营养策略来增加胃排空并改善水和营养物质的吸收,包括避免高 FODMAP食物和含麸质食物。
FODMAP 是不易消化的短链碳水化合物,可增加胃肠道内的渗透负荷。肠道微生物可以将这些膳食成分发酵形成气体,从而导致有些人出现腹胀和胃肠道不适。

最近一项调查耐力运动员 FODMAP 摄入量的研究报告称,高摄入量都会导致胃肠道症状。初步结果表明,低FODMAP饮食减轻了运动员胃肠道症状。然而,FODMAP也充当肠道微生物群的燃料,它们的限制可能会影响群落的组成和功能。
有一种推测,无麸质饮食之所以能改善胃肠道症状,并不是其本身,而是其中 FODMAP 食物的减少。
只有一项研究调查了无麸质饮食对非腹腔耐力运动员的影响,其中报告无麸质饮食对表现、胃肠道症状、健康、肠道损伤或炎症没有影响。

运动可能是改变肠道菌群组成和恢复肠道共生的重要干预措施
目前的研究支持运动作为一种重要的行为因素的作用,它可以影响肠道微生物组成和功能的定性和定量变化,并对宿主有益。运动可以丰富微生物群的多样性,刺激可以调节粘膜免疫、改善屏障功能的细菌的增殖,并刺激能够产生防止胃肠道疾病和提高性能的物质的细菌和功能通路。
尽管这些变化可能不会以类似的方式在个体间发生,也可能取决于微生物群和宿主的基线特征。
值得注意的是,某些菌群可能在运动员中富集,例如与瘦表型相关的A. muciniphila和产生丙酸盐的Veillonella(通过乳酸代谢)。精英运动员身上丰富多样的、有利于代谢的肠道微生物群,很可能是在整个青春期和成年期参加高水平运动期间,多年高营养摄入和高强度运动和训练的累积表现。
运动带来的益处涉及内在和外在因素的结合
常运动的人更有可能接触到他们的环境生物圈,并遵循整体健康的生活方式,因此拥有更健康的微生物群。
同时,耐力训练的内在适应性,例如血流量减少、组织缺氧以及转运和吸收能力增加,可导致胃肠道发生变化。胃肠道转运时间的变化又会影响结肠腔内的 pH 值,这可能导致肠道微生物群的组成发生变化。而较长的结肠转运时间与肠道微生物群多样性的减少有关,同时伴随着从近端结肠到远端结肠的转运过程中 pH 值的增加。
长时间过度运动对肠道功能产生不利影响
尽管运动通常有益健康,但如果持续时间和强度的增加,且得不到足够的休息、营养的支持,它就会变得有害。
剧烈运动将血液从内脏循环重新分配到活跃的呼吸组织。长时间的肠道低灌注会损害黏膜稳态并导致肠细胞损伤,可能会导致肠道缺血,特别是在脱水的情况下,表现为腹部绞痛、腹泻或偶尔血性腹泻,也会使肠道通透性增加,产生炎症。这种不利影响在耐力运动中尤其如此。
目前对人体肠道微生物群与运动之间相互作用的研究仍然缺乏
尤其是与控制饮食相结合的研究,这是一个重要的混杂因素。准确测量营养成分和饮食质量,将有助于把运动对肠道微生物群的影响与其他混杂因素区分开来。
研究还应记录液体摄入量或测量水合生物标志物(如和肽素),以确定水合状态是否影响肠道微生物群,反之亦然。
此外,饮食和运动对肠道微生物群的影响通常是短暂的,并且在干预完成后不会持续。这表明长期的生活习惯对于诱导肠道微生物群的稳定变化是必要的。在关键发育窗口期间的干预措施可能对肠道微生物群产生更持久的影响,当然这需要进一步研究。
未来与运动相关的肠道微生物群的研究领域

Mohr AE, et al., J Int Soc Sports Nutr. 2020
未来的研究应侧重于使用分层方法,使用人体临床试验来识别可能有益于运动表现的目标细菌,并使用动物和体外研究来确定因果关系和机制。
然后可以再次使用人体试验来确定是否补充已鉴定的细菌或实施饮食习惯(例如,益生元/不易消化的碳水化合物、ɷ-3 脂肪酸补充剂、蛋白质摄入量的类型/数量),以提高细菌丰度和/或功能有利于运动表现。
需要在控制饮食的情况下调查高蛋白饮食、全食物蛋白质来源和蛋白质补充剂的影响的临床研究,以确定这些饮食模式和成分对运动员肠道微生物群的影响。
此外,需要更多的研究来阐明膳食脂肪的数量和类型对肠道微生物群的影响以及随后微生物群介导的(例如,通过胆汁酸)对运动表现的影响。
总之,人们越来越意识到,微生物群的个体差异会导致运动反应和健康结果的差异性。
未来的研究还应该整合其他“组学”数据
整合其他“组学”数据,以确定可能导致、促成、介导或调节饮食和运动对肠道微生物群的影响的潜在代谢物、基因和表观遗传修饰。
“组学”数据的使用与机器学习方法相结合,有可能揭示肠道微生物群与其代谢物、饮食和运动表现之间的新关联,并预测对饮食策略的个性化反应。这些发现的影响包括提高运动员成绩和改善健康,尤其是胃肠道和呼吸系统健康的潜力。
此外,研究应对肠道微生物群、饮食和人类健康之间的相互作用有更深入的了解,这些相互作用可能具有超越运动人群的影响和应用,以造福所有人的健康。
声明:本账号发表的内容仅是用于信息的分享,仅供学习参考使用。在采取任何预防、治疗或治愈的措施之前,请先咨询临床医生。
主要参考文献:
Clark A, Mach N. Exercise-induced stress behavior, gut-microbiota-brain axis and diet: a systematic review for athletes. J Int Soc Sports Nutr. 2016;13:43. Published 2016 Nov 24. doi:10.1186/s12970-016-0155-6
Lensu, S.; Pekkala, S. Gut Microbiota, Microbial Metabolites and Human Physical Performance. Metabolites 2021, 11, 716.
Mohr AE, Jäger R, Carpenter KC, et al. The athletic gut microbiota. J Int Soc Sports Nutr. 2020;17(1):24. Published 2020 May 12. doi:10.1186/s12970-020-00353-w
Jang LG, Choi G, Kim SW, Kim BY, Lee S, Park H. The combination of sport and sport-specific diet is associated with characteristics of gut microbiota: an observational study. J Int Soc Sports Nutr. 2019;16(1):21. Published 2019 May 3. doi:10.1186/s12970-019-0290-yHughes RL,
Holscher HD. Fueling Gut Microbes: A Review of the Interaction between Diet, Exercise, and the Gut Microbiota in Athletes. Adv Nutr. 2021;12(6):2190-2215. doi:10.1093/advances/nmab077
Jollet M, Nay K, Chopard A, et al. Does Physical Inactivity Induce Significant Changes in Human Gut Microbiota? New Answers Using the Dry Immersion Hypoactivity Model. Nutrients. 2021;13(11):3865. Published 2021 Oct 29. doi:10.3390/nu13113865
Marttinen M, Ala-Jaakkola R, Laitila A, Lehtinen MJ. Gut Microbiota, Probiotics and Physical Performance in Athletes and Physically Active Individuals. Nutrients. 2020;12(10):2936. Published 2020 Sep 25. doi:10.3390/nu12102936
Sohail MU, Yassine HM, Sohail A, Thani AAA. Impact of Physical Exercise on Gut Microbiome, Inflammation, and the Pathobiology of Metabolic Disorders. Rev Diabet Stud. 2019;15:35-48. doi:10.1900/RDS.2019.15.35
Monda V, Villano I, Messina A, et al. Exercise Modifies the Gut Microbiota with Positive Health Effects. Oxid Med Cell Longev. 2017;2017:3831972. doi:10.1155/2017/3831972
Clauss M, Gérard P, Mosca A, Leclerc M. Interplay Between Exercise and Gut Microbiome in the Context of Human Health and Performance. Front Nutr. 2021;8:637010. Published 2021 Jun 10. doi:10.3389/fnut.2021.637010
Okamoto T, Morino K, Ugi S, Nakagawa F, Lemecha M, Ida S, Ohashi N, Sato D, Fujita Y, Maegawa H. Microbiome potentiates endurance exercise through intestinal acetate production. Am J Physiol Endocrinol Metab. 2019 May 1;316(5):E956-E966. doi: 10.1152/ajpendo.00510.2018. Epub 2019 Mar 12. PMID: 30860879.
Ticinesi A, Nouvenne A, Cerundolo N, et al. Gut Microbiota, Muscle Mass and Function in Aging: A Focus on Physical Frailty and Sarcopenia. Nutrients. 2019;11(7):1633. Published 2019 Jul 17. doi:10.3390/nu11071633
Hughes RL, Holscher HD. Fueling Gut Microbes: A Review of the Interaction between Diet, Exercise, and the Gut Microbiota in Athletes. Adv Nutr. 2021 Dec 1;12(6):2190-2215. doi: 10.1093/advances/nmab077. PMID: 34229348; PMCID: PMC8634498.
Zhao J, Zhang X, Liu H, Brown MA, Qiao S. Dietary Protein and Gut Microbiota Composition and Function. Curr Protein Pept Sci. 2019;20(2):145-154. doi: 10.2174/1389203719666180514145437. PMID: 29756574.
谷禾健康
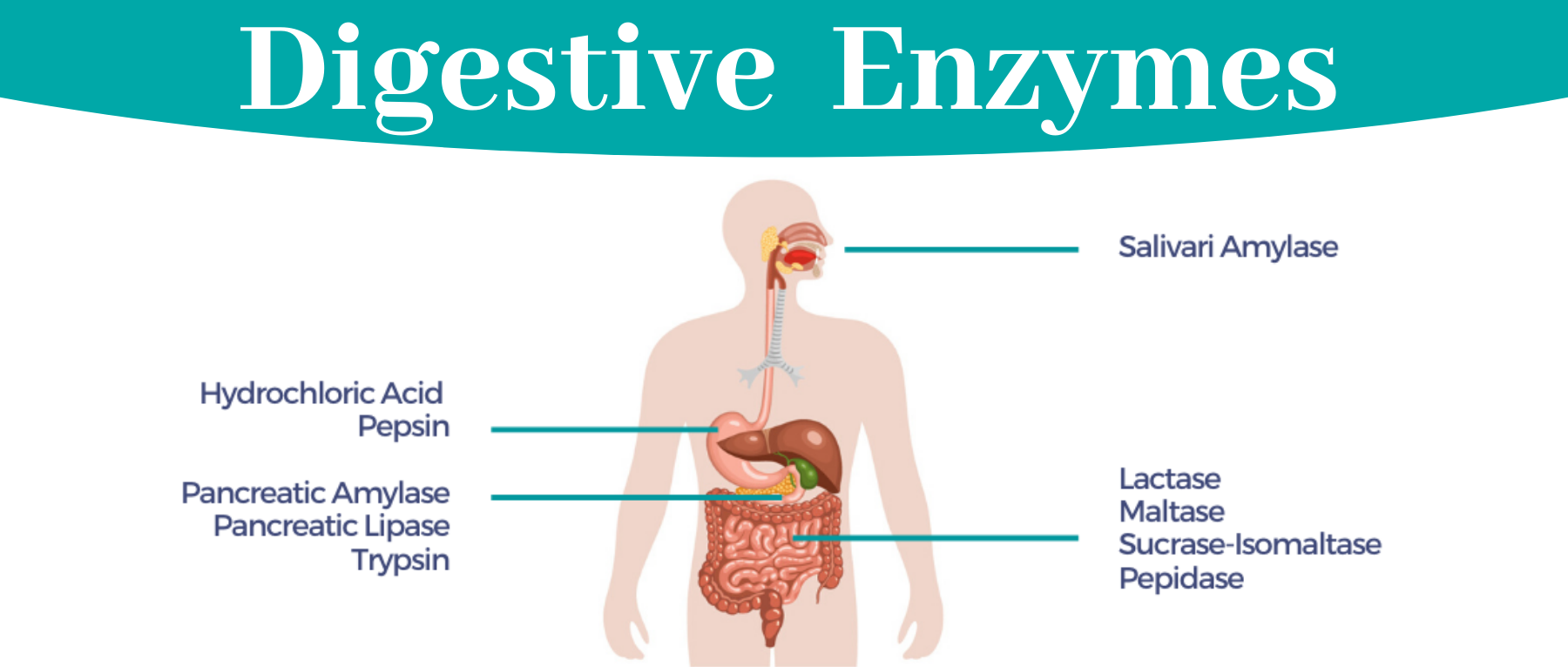
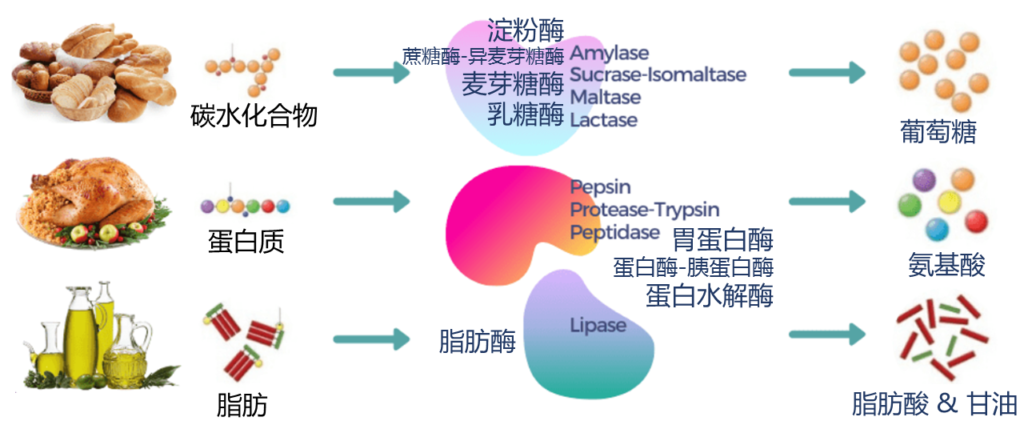
消化酶分解脂肪、蛋白质和碳水化合物,便于身体吸收营养。大部分消化酶由胰腺产生,其次是小肠、胃和口腔。
本文主要介绍不同酶的工作原理、酶水平背后的遗传因素和消化系统疾病以及自然促进消化的方法。
消化酶是一组广泛的酶,可将脂肪、蛋白质和碳水化合物等大营养素分解成更容易被身体吸收的较小营养素。人体在胰腺中自然产生大部分酶,而胃、小肠和口腔中产生少量酶。
以下酶可以帮助人体从特定的食物中吸收营养:
▪ 蛋白酶把蛋白质分解成氨基酸
▪ 脂肪酶把脂肪分解成脂肪酸
▪ 淀粉酶将碳水化合物分解成单糖,如葡萄糖
它们的主要作用是帮助消化,这些酶在你体内的数量和活性取决于一系列复杂的因素。初步研究表明,消化酶可能有助于缓解各种消化疾病、减轻炎症、肠道感染等。
消化酶水平低表明胰腺不能正常工作,难以产生重要的消化化合物。
在严重的时候,这种情况被称为外分泌胰腺功能不全(EPI)。这时,胰腺中产生消化酶的细胞会随着时间的推移而被破坏。
当然,EPI不是唯一的原因,各种因素都会导致消化酶水平降低:
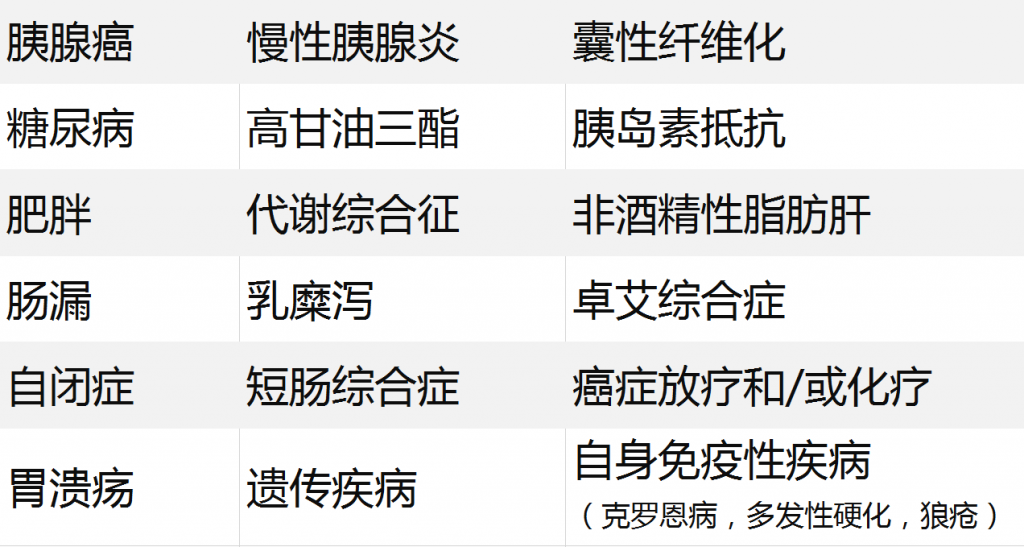

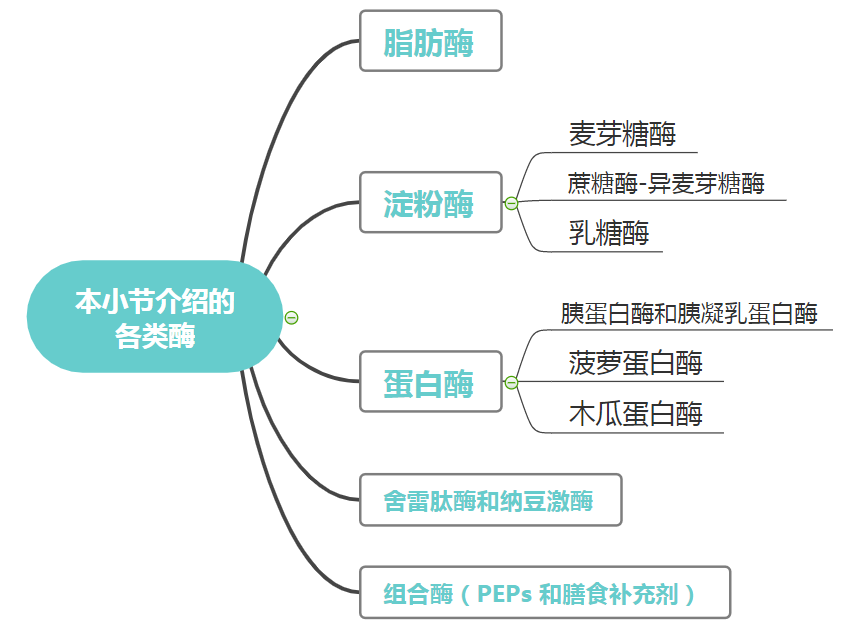
消化酶主要分三大类:脂肪酶、淀粉酶、蛋白酶
脂肪酶
脂肪酶是分解脂肪的酶,帮助维持胆囊功能正常。它们在胰腺中产生,但也可以从植物、动物和真菌中提取,并且足够稳定。
各种类型的脂肪酶参与不同的过程,例如脂肪代谢、运输、细胞信号传导、炎症等。

✓ 用于肠易激综合征(IBS)患者
含有脂肪酶和其他胰酶的补充剂可以帮助减少餐后的腹胀、胀气和饱腹感,尤其是脂肪含量高的食物。这些症状通常与消化问题有关,如肠易激综合征(IBS)。研究还表明,一些肠易激综合征患者可能存在胰腺外分泌功能不全,即由于胰腺产生的消化酶缺乏而无法正确消化食物。

谷禾健康
乳酸菌属益生菌是使用最广泛的益生菌之一。罗伊氏乳杆菌( L. reuteri ) 是一种经过充分研究的益生菌,可以在大量哺乳动物中定殖。
罗伊氏乳杆菌是一种革兰氏阳性杆状细菌,已在各种食物中发现,尤其是肉类和奶制品。在人类中,罗伊氏乳杆菌存在于不同的身体部位,包括胃肠道、泌尿道、皮肤和母乳。罗伊氏乳杆菌的丰度因个体而异。
可能的优势
● 可能促进皮肤光泽和头发浓密
● 可能有助于对抗感染
● 可能减少炎症并加强免疫
● 可能会改善肠道健康(减少 IBS 和 IBD 症状)
● 可能降低胆固醇
可能的副作用
● 可能对组胺不耐受的人不利
● 可能导致某些人体重增加
● 缺乏大规模临床研究
● 长期补充的安全性未知
罗伊氏乳杆菌(Lactobacillus reuteri)名字来自德国微生物学家 Gerhard Reuter,他在1960 年代在人类肠道和粪便样本中发现了它。1960 年代被发现时,罗伊氏乳杆菌自然存在于 30-40% 的人体内,现在大约降至10-20%。科学研究者将这种下降与生活方式的改变联系起来。我们不像以前那样吃发酵食品,如酸菜,而是使用防腐剂,这会杀死食物和体内的细菌。
罗伊氏乳杆菌在发酵过程中能够产生葡聚糖和果聚糖。其中一种葡聚糖,α-1,4/1,6 葡聚糖,分子量为 40 MDa,支化度约为 16%,似乎是一种饱腹感诱导剂,对胰岛素和血糖水平有良好的影响在人类。葡聚糖不会在胃和空肠中降解,而是在结肠中完全降解。由于其慢淀粉特性,这种葡聚糖可能是烘焙应用中一种促进健康的成分。
不同菌株的Lactobacillus reuteri已被证明具有不同的生理作用。例如,Lactobacillus reuteri DSMZ 17648用于治疗幽门螺杆菌(H. pylori),而Lactobacillus reuteriNCIMB 30242 用于治疗高胆固醇。
但是,罗伊氏乳杆菌补充剂尚未获得批准用于医疗用途,而且有的益处和副作用缺乏可靠的临床研究。法规制定了补充剂的制造标准,但不保证它们是安全或有效的。
大多数关于Lactobacillus reuteri的研究是在动物或细胞中进行的。临床研究很少,而且大多数是低质量的、小规模的或可能存在偏见的。此外,使用的确切菌株因不同研究而异。
尽管罗伊氏乳杆菌在人类中是正常的,但并不是每个人的胃肠道中都有它。口服补充剂可以增加和补充胃肠道罗伊氏乳杆菌,然而它不一定会长期留在那里。
同样,罗伊氏乳杆菌的良好来源是乳制品和肉类,素食者和大多数素食者都避免食用这些食品,因此补充剂很重要。在母乳喂养时服用罗伊氏乳杆菌补充剂的女性更有可能将这些有益细菌转移给婴儿。
为消化和吸收而建,胃肠系统的某些部位已发展为对微生物定植不利。这方面的例子可以在由小肠上部胃酸和胆汁盐引起的低 pH 条件下看到。因此,在胃肠道定植的第一步就是在这样的环境中生存。幸运的是,罗伊氏乳杆菌对低 pH 值和胆汁盐具有抵抗力。这种抗性被认为至少部分取决于其形成生物膜的能力。
谷禾健康
自身免疫性疾病,包括炎症性肠病、多发性硬化和类风湿性关节炎,具有不同的临床表现,但肠道微生物群紊乱和肠道屏障功能障碍的潜在模式相同。但宿主因素的个体差异使得统一的方法不太可能。
我们往往会有这样的错觉:“自然”的东西一定是对健康有益的。我们是不是只要吃最原始的食物就能恢复健康?
事实上,优化人类健康的途径并不像照搬我们祖先的饮食或增加我们对微生物的接触那样简单。归根结底,过去和现在的环境是根本不同的,也许是不可逆转的。
因此,针对微生物群的饮食干预的目标不应是回到祖先的状态,而是操纵微生物群,优化宿主健康,直接适应日益工业化的世界。
本文介绍了关于饮食-局部炎症中的微生物群相互作用、肠道微生物群失衡和宿主免疫失调的知识。通过了解并结合个别饮食成分对微生物代谢输出和宿主生理的影响,研究了基于饮食的自身免疫性疾病预防和治疗的潜力。讨论了针对肠道微生物群的工具,如粪便微生物群移植、益生菌和正交小生境工程等。这些方法强调了在自身免疫性疾病不断增加的情况下,利用饮食精确操纵肠道微生物组的途径。
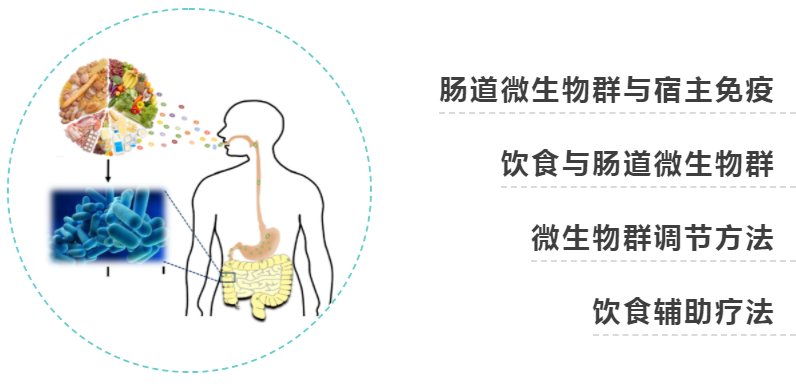
在肠道中,对微生物威胁作出适当反应的免疫平衡行为,对共生微生物和自身抗原的耐受,在生命早期尤其重要,这是定植微生物群和宿主免疫系统相互作用的窗口,引发促炎或抗炎倾向,可能对终身健康产生影响。
★ 婴儿期影响菌群的因素
看过我们文章的都知道,早期生活因素,如剖腹产、配方奶粉喂养和抗生素的使用,可能会干扰微生物群生长过程。
婴儿期母乳中的人乳低聚糖有助于双歧杆菌的定植,双歧杆菌在早期肠道微生物群中占主导地位,产生岩藻糖、乙酸盐、丙酮酸盐和1,2-丙二醇,通过交叉喂养支持微生物群的扩增,有助于对共生细菌的免疫耐受。
人类通常在6个月大时开始转变为固体食物饮食,自此菌群显著扩大,产生更多数量和种类的代谢物(例如,丁酸盐,它促进结肠粘液屏障的成熟,并阻止具有高致病潜力的细菌的生长)。
★ 抗性淀粉缓解系统性红斑狼疮
在一项涉及149名健康志愿者的研究中,脂多糖通过诱导TLR4耐受来抑制先天免疫过程。微生物抗原对TLR的不当刺激也可能影响自身免疫疾病的进展,并为其修复提供线索,如系统性红斑狼疮过度表达TLR7的小鼠模型中,通过添加抗性淀粉来改变微生物代谢产物和分类组成,狼疮进展得到缓解。
★ 微生物变化引起的免疫反应
在自身免疫性疾病患者中也发现了由微生物引起的适应性免疫反应失调。哺乳动物肠道中的共生微生物群,尤其是梭菌群IV和XIVa,它们将膳食纤维代谢成丁酸盐以诱导Treg细胞发育,与小鼠模型中的结肠炎严重程度呈负相关。
通常,自身免疫性疾病患者表现出产生耐受性IL-10的CD25 FOXP3 T细胞的丰度降低,自身反应性效应性T细胞亚群(如TH1细胞和TH17细胞)的丰度增加,从而使Treg细胞与效应性T细胞的比率偏离稳态水平。这些改变可能通过过度产生促炎细胞因子(如TNF和IL-17)进一步促进肠道通透性的增加,这些促炎细胞因子可调节紧密连接蛋白的表达。
自身免疫疾病共同的潜在驱动因素鼓励通过饮食干预或微生物群调节策略(下文讨论)来进行肠道微生物群工程,以将肠道微生物群转变为功能多样的“健康”状态。
饮食可直接影响肠道微生物群,调节其组成或代谢输出,从而可能促进疾病或形成稳态。

谷禾健康
2型糖尿病是一种血糖水平升高(高血糖)的慢性代谢疾病,主要由胰岛素抵抗和胰岛素分泌不足引起。2型糖尿病全球患病率在不断上升。
截止到2020年,根据美国糖尿病学会评估标准,糖尿病患病率已达到12.8%。其实在我国成年人中,已经有将近一半的人存在血糖异常,未来极有可能发展为2型糖尿病。如果不加干预治疗,会引发许多不良后果。
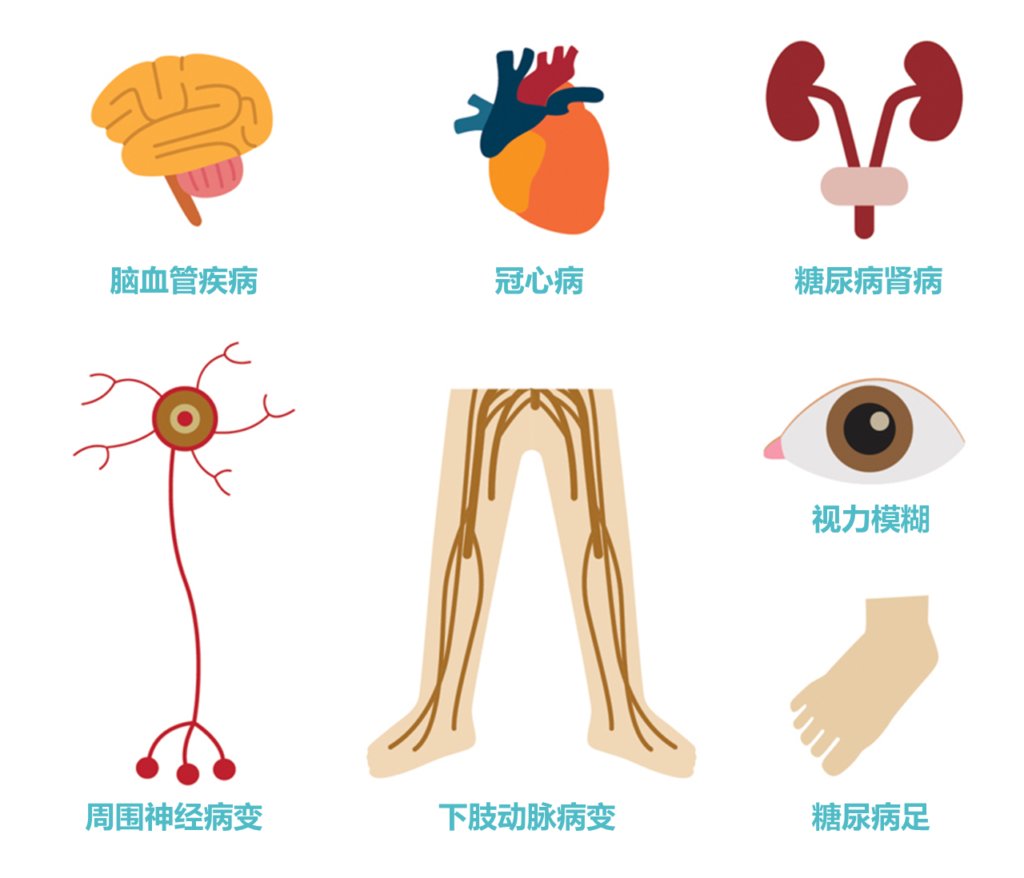
很多研究表明,肠道菌群在宿主的代谢和疾病状态中起着重要的作用。特别是2型糖尿病,其病因复杂,包括肥胖、慢性低度炎症,受肠道微生物群和微生物代谢产物的调节。
本文将从肠道菌群的角度了解其与2型糖尿病的关系;肠道菌群及其代谢物对葡萄糖代谢、免疫系统的影响;
从影响肠道菌群变化的因素来了解各种干预措施,包括药物,饮食,益生菌/益生元,粪菌移植,间接性禁食等方式。
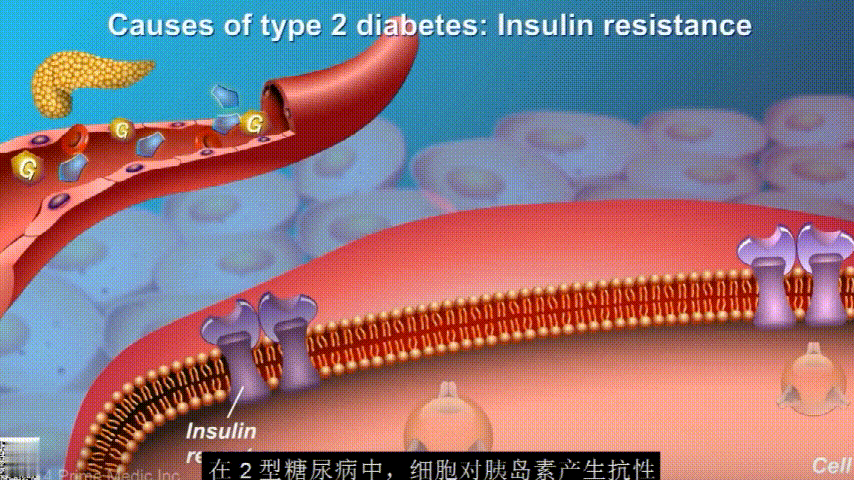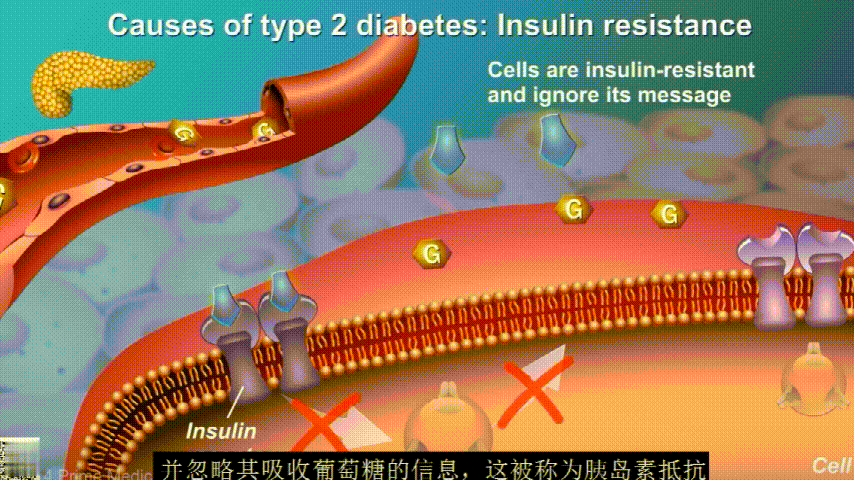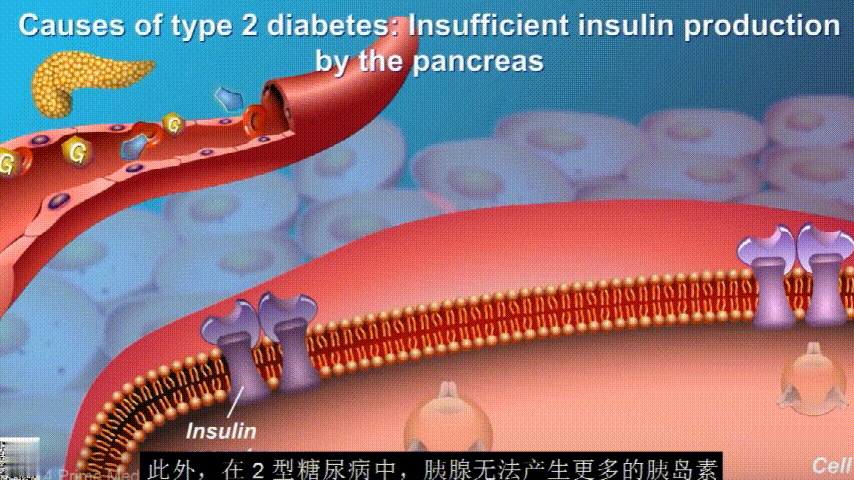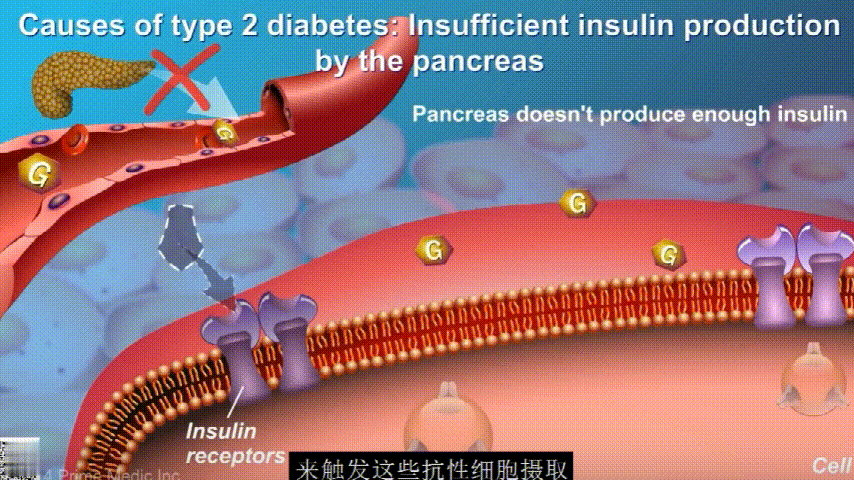
葡萄糖主要通过食用的食物和饮料进入人体。胰腺会产生一种叫做胰岛素的激素,以帮助血液中的葡萄糖进入肌肉、脂肪和肝脏,用作能量。
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像钥匙打开锁一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
刚开始的时候,胰腺会觉得自己使不上力,于是不甘心开始拼命工作,产生更多的胰岛素来克服这种抵抗。
随着时间的推移,胰腺开始累了,力不从心,不能产生更多的胰岛素,这时候就是2型糖尿病开始了。
肠道微生物群可以直接或间接地影响人类健康,肠道微生物群失调可能会增加促炎疾病的患病率,如肥胖、炎症性肠病、2 型糖尿病、关节炎和癌症。
2型糖尿病人群中个体微生物群的差异
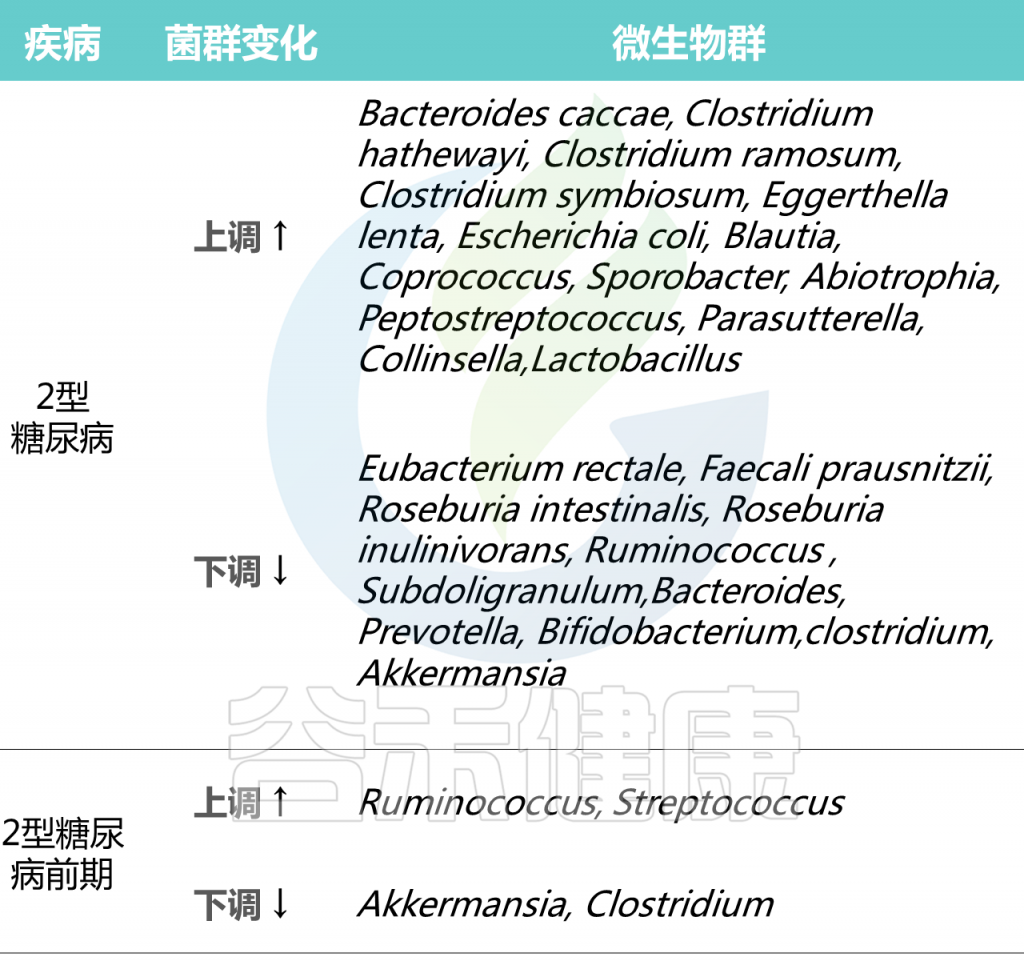

Cunningham A L et al., Gut Pathog, 2021
在2型糖尿病患者普遍具有相对高丰度的特定属:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
2型糖尿病患者中,产生丁酸菌特别缺乏,特别是梭菌目,包括:
Ruminococcus、Subdoligranulum,Eubacterium rectale、Faecali prausnitzii、Roseburia intestinalis 、
Roseburia inulinivorans
2型糖尿病患者中,其他明显较少的菌属有:
拟杆菌属、普雷沃氏菌属、双歧杆菌属

谷禾健康
你知道吗?有一种菌群可改善人体免疫反应并有助于预防肠道疾病。还具有抑制过敏,降低胆固醇并改善皮肤健康的作用。它就是——长双歧杆菌Bifidobacterium longum。
接下来带你探索它的秘密……
定义发现
双歧杆菌是从六个不同的生态位中分离出来的,其中三个与人类和动物的肠道环境直接相关。例如:人、动物的肠道(牛,兔,鼠,鸡和昆虫)和口腔,而其他的则是污水,血液和食物,也可能是胃肠道污染的结果。
双歧杆菌广泛分布在为它们的后代提供有父母进行照料的活生物体中,例如:哺乳动物,鸟类和社交昆虫。到目前为止,尚未从其他动物(如爬行动物和鱼类)中分离出双歧杆菌。因此,它们的生态分布的重要原因可能是由亲代/照护者直接将双歧杆菌细胞传给后代。
长双歧杆菌是自然存在于人类胃肠道中的革兰氏阳性棒状细菌,是最早在婴儿通过产道时在肠道内定殖的细菌之一。这些细菌也被称为益生菌。婴儿双歧杆菌Bifidobacterium infantis和猪双歧杆菌Bifidobacterium suis 是长双歧杆菌的亚种。
结构代谢
双歧杆菌是革兰氏阳性,厌氧性和分支杆状细菌。它们也是非运动的和非孢子形成的。
双歧杆菌通过磷酸酮醇酶途径产生己糖代谢。果糖-6-磷酸磷酸酮醇酶(F6PPK)是其重要组成部分。
长双歧杆菌将糖发酵成乳酸,这有助于降低肠道的pH值。“它具有修复氧化损伤的酶的同系物,例如NADH氧化酶和NADH过氧化物酶。它还含有逆转氧化损伤的蛋白质和脂质,如:硫醇过氧化物酶,烷基过氧化氢还原酶(ahp C),肽甲硫氨酸亚砜还原酶。”
长双歧杆菌基因组存在编码各种专门用于分解寡糖的蛋白质。该菌在结肠中长期存在,是因为它能代谢宿主或其他肠道菌群吸收不良的底物。
1 增强免疫力
一项针对婴儿双歧杆菌的小型研究表明,婴儿双歧杆菌可起到预防脊髓灰质炎病毒的作用。婴儿双歧杆菌改善了实验志愿者的免疫反应。
我们知道从婴儿期开始肠道健康就关系到未来生活中与健康相关的状况和疾病危险因素。研究已将肠道菌群的改变与多种疾病联系起来,包括自身免疫性疾病,如腹腔疾病和1型糖尿病,代谢综合征,过敏,哮喘和炎症性肠病等。
多种因素可以促进肠道健康。健康的肠道菌群是支持肠道健康,改善免疫功能并可能降低某些疾病风险的因素之一。
研究人员认为,双歧杆菌对早期生命疾病的保护能力是通过产生短链脂肪酸(SCFA)和乳酸,通过特定的免疫刺激和肠道环境酸化来发挥作用。
长双歧杆菌还激发了45名接受过流感疫苗的住院的年迈患者的免疫功能。与其他知名的菌株相比,婴儿双歧杆菌在老年患者的血液中具有较强的免疫调节作用。
2 降低传染病
实验表明,长双歧杆菌通过微调炎症反应和加快肺恢复来保护小鼠免受肺炎诱发的死亡。婴儿双歧杆菌可以抑制小鼠轮状病毒感染,口服长双歧杆菌可以保护小鼠免受铜绿假单胞菌引起的肠道败血症的侵害,且大大提高了伤寒沙门氏菌感染小鼠的存活率。
用长双歧杆菌喂养的婴儿显示出呼吸道感染的比率较少。在27名接受流感疫苗的老年受试者中,长双歧杆菌补充剂减少了流感和发烧率。
3 减轻和治疗胃肠道感染
益生菌通常与抗生素结合使用,以降低胃肠道感染的风险并防止有益菌的死亡。此外,一些研究表明,用含有双歧杆菌的益生菌进行治疗可以通过减少腹泻来帮助治疗类似艰难梭菌的感染。
4 改善腹泻和便秘
肠易激综合征(IBS)通常以腹痛或不适为特征,并伴有大便次数和/或稠度变化,可能导致腹泻和/或便秘。
关于IBS的临床实践指南得出结论,根据一些随机临床对照试验,长双歧杆菌可以改善IBS患者的总体症状。
婴儿长双歧杆菌可以改善腹部疼痛/不适,腹胀,排便困难。
长双歧杆菌还降低了IBS小鼠的内脏超敏性,显著降低大鼠第一疼痛行为和总疼痛行为的内脏痛阈压。
美国家庭医师学会指出,“益生菌可减少抗生素相关性腹泻的发病率,减少所有因感染性腹泻的持续时间和疼痛的严重程度和患者腹胀。” 作用的有益程度取决于所使用的类型,配方和给定的量。
5 预防湿疹
许多研究表明,使用含有双歧杆菌菌株的益生菌在妊娠和哺乳期给予母亲以及婴儿,可以预防婴儿和儿童的湿疹。但当涉及湿疹治疗时,益生菌的有益用途是多样的,所以需要更多的研究来确定其益处。当给孩子进行任何补充之前,请应该先进行肠道菌群检测或咨询医生的建议。
6 减轻过敏
在柳杉花粉过敏患者中,摄入添加长双歧杆菌的酸奶或粉末可减轻主观症状并影响过敏的血液标志物。鼻症状,如瘙痒,鼻漏,堵塞以及喉咙症状往往可以得到缓解。

实验表明,双歧杆菌菌株减轻了小鼠的过敏性气道炎症和食物过敏症状。口服长双歧杆菌可抑制IgE水平并改善IgG2a / IgG1比例。它也增加了小鼠的Th1细胞因子并降低了Th2细胞因子的产生。长双歧杆菌平衡了Th1 / Th2反应并减轻了小鼠的β-乳球蛋白过敏性炎症。
7 减少胆固醇
长双歧杆菌降低了总胆固醇,特别是在中度高胆固醇血症患者中。长双歧杆菌补充剂可明显降低高胆固醇血症大鼠的总胆固醇,肝脂质沉积和脂肪细胞大小,并积极影响肝肾功能。
给大鼠喂食富含胆固醇的食物,并补充长双歧杆菌,结果发现,甘油三酯、低密度脂蛋白胆固醇(LDL-C)、超低密度脂蛋白(VLDL)胆固醇和丙二醛显著降低。
8 减轻精神分裂症
每天服用长双歧杆菌可减轻小鼠的精神分裂症饲养行为,降低静息时的血浆皮质酮水平以及犬尿氨酸与色氨酸的比率。
9 治疗焦虑和抑郁症
长双歧杆菌可以使感染性结肠炎小鼠焦虑样行为和海马脑源性神经营养因子(BDNF)正常化。
服用婴儿双歧杆菌可逆转抑郁症。长期服用婴儿双歧杆菌可保护大鼠免于因母体分离引起的压力而导致的抑郁症状。

目前已经有研究了长双歧杆菌对细胞水平的影响。这些可能反映长双歧杆菌在人体中的作用机制。
以下列举的均有研究文献支持。
炎性条件
● 降低的Th1相关的细胞因子(T-bet的,IL-2 ,和IFN-γ)和Th17相关的细胞因子(IL-12p40的,RORγt,IL-17A,IL-21,和IL-23),并增加了调节性T细胞-相关分子(Foxp3的,IL-10 ,和TGF-β)。
● 降低IL-1α,IL-1β,IL-6,IL-18,TNF-α的表达。
● IL-27升高。
● 降低CD80,CD40,CXCL1 ,CRP,iNOS的和抗微生物肽Reg3b和Reg3g 。
传染性条件
● 增加天然杀伤(NK)细胞活性。
● 血清IgA增加和IgG2a产生减少。
● IL-2,IL-1 2和IL-18升高。
● 降低IL-6和IL-8。
● TNF-α降低。
● 既增加了和减少IL-10,并降低和增加的IFN-γ
变态反应
● 减少IgE和改进了的IgG2a / IgG1的比。
● IgA增加。
● Th1细胞因子增加而Th2细胞因子产生减少。
● 降低IL-4和IL-5。
● 增加IL-10,IL-12和TGF-β。
● 增加或降低的IFN-γ。
● 抑制了MDC和TARC。
● CD4 + CD25 + Foxp3 + Treg细胞增加。
乳糜泻
● 降低TNF-α。
● NFκB增加。
● IL-10升高。
● 减少的CD3+ T,CD4+和CD4+ / Foxp3+细胞和增加的CD8+ T。
● MIP-1β升高。
下面具体以长双歧杆菌BB536为例,对长双歧杆菌的缓解过敏感染,调节代谢,调节免疫等作用进行详细阐述。
长双歧杆菌BB536与肠道微生物群协同作用,改善胃肠健康,调节宿主免疫稳态,缓解过敏性疾病和感染状况。
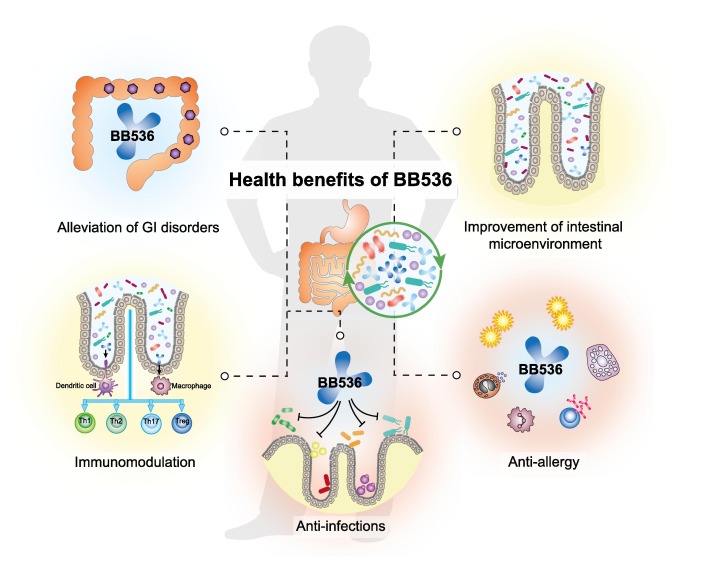
Wong C B, et al., Journal of Functional Foods, 2019
长双歧杆菌BB536通过与人体肠道微生物群串扰调节肠道代谢。
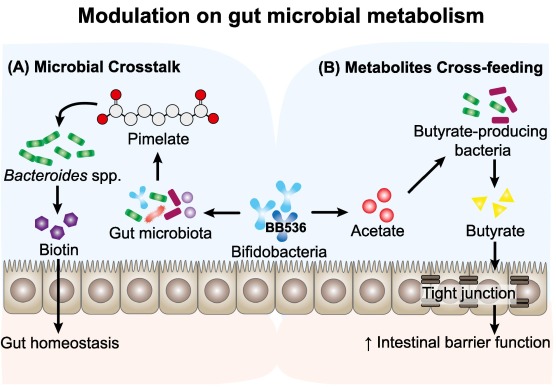
Wong C B, et al., Journal of Functional Foods, 2019
(A) BB536通过促进前体庚二酸的产生调节生物素的生物合成,并使Bacteroides caccae将其进一步代谢为生物素,从而促进宿主肠道内稳态。
(B) BB536通过交叉喂养机制影响共生丁酸生产菌(如直肠真杆菌)的代谢活性。BB536在碳水化合物发酵过程中产生的乙酸盐作为底物,维持Eu. rectale的生长,刺激丁酸盐的产生。
长双歧杆菌BB536的免疫调节作用
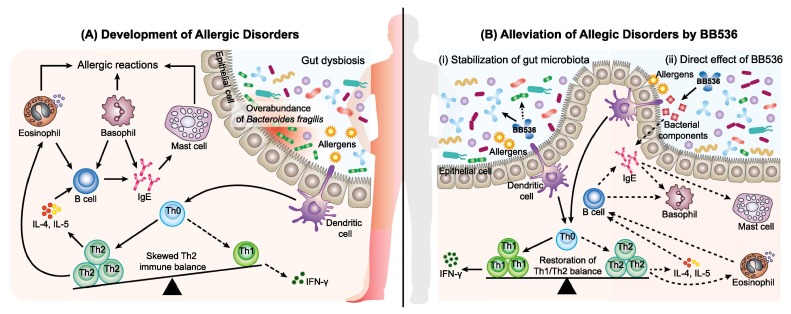
Wong C B, et al., Journal of Functional Foods, 2019
(A) 肠道微生物群的波动,特别是脆弱拟杆菌的过量,有助于干扰宿主免疫和发展过敏性疾病。在过敏反应中,一种过敏原被树突状细胞吸收,呈现给初始型T细胞(Th0),然后转化为辅助性T细胞2型(Th2)。Th2细胞分泌白细胞介素-4和白细胞介素-5,随后刺激记忆B细胞转换为过敏原特异性体液反应,主要由产生免疫球蛋白E(IgE)抗体。这些IgE抗体附着于肥大细胞和嗜碱性粒细胞,从而使它们对随后的暴露和过敏症状的发展敏感。
(B) BB536通过间接和直接机制调节宿主-微生物相互作用中的免疫稳态并减轻过敏性疾病。
(i) BB536通过纠正脆弱拟杆菌的流行,从而恢复Th1/Th2平衡,减轻过敏症状,促进肠道微生物群的稳定。
(ii)BB536通过其细菌成分直接影响抗原诱导的IgE介导的Th2倾斜免疫平衡。
1 剂量与特征
在使用双歧杆菌之前,请咨询医生。如果有某些慢病,可能无法使用双歧杆菌。
双歧杆菌有胶囊,片剂,散剂和咀嚼片形式。在没有医疗建议的情况下,请勿同时使用不同的配方。
以下情况需咨询是否可以安全使用该产品:
● 牛奶过敏或乳糖不耐症
● 正在服用抗生素药物期间
●孕妇或母乳喂养期间
应该如何判断益生菌的质量?
益生菌根据菌落形成单位(CFU)进行标记。这表明活细菌的密度或强度。益生菌中CFU的数量越高,就意味着它对肠道菌群中有益细菌的生长产生更大的影响。现在市面上很多产品把CFU的数量作为一种活菌标识。
有研究人员认为,关于CFU的特定剂量研究较少,可能不太重要。更重要的是找到一种经过适当加工和存储的高质量产品,这样就可以得到一种含有大量活细菌的产品。
未正确准备和存储的产品可能会导致细菌死亡,从而导致没有效果或者浪费。为了防止这种情况的发生,一些公司封装了他们的产品。
有效益生菌满足什么样的条件?
1. 它一定不能有毒或致病的。
2. 它必须保留已被证明对宿主(使用它的人)有益的特征。
3. 每单位必须包含足够数量的活微生物。
4. 它必须能够生长并在制造过程中存活,并能够通过胃和小肠运输。
5. 在存储和使用期间,它要保持活的状态。
如果需要开始补充,请尽量缓慢并逐渐增加。剂量范围很广,太高的剂量可能会引起胃部不适。
2 获取方法
每天食用富含有益菌的食物。发酵的食品和饮料,如酸菜,泡菜,开菲尔,康普茶,酸奶和人工培养的蔬菜,都是活益生菌和活性益生菌的绝佳来源。
* 开菲尔是一种发酵的乳制品,可以在酸奶和牛奶之间混合使用,可以作为早餐的不错选择。
如果想服用补充剂,请记住,益生菌菌株有很多不同的类型,每种类型的作用都略有不同。当寻找双歧杆菌时,请寻找完整的名称,包括属,种和菌株。
例如,在“Bifidobacterium adolescentis. 22L”中,“Bifidobacterium” 代表双歧杆菌属,种类是adolescentis,菌株为22L。
以正确的比例选择正确的活细菌类型非常重要。
冻干益生菌补充剂要特别小心。可以选择,但是,“它们暴露在湿气中会迅速降解,因此可能无法长期保持稳定” 。
3 如何储存
益生菌对光,热和水分敏感。优质的益生菌应保存在黑暗的玻璃瓶中,以防止细菌死亡。大多数类型的益生菌都需要冷藏。尽可能遵循厂商的说明进行最佳存储。
1 服用双歧杆菌时应避免什么?
请勿将口服粉与热液体或食物混合。
2 错过服用怎么办?
跳过错过的时间,并在常规时间使用下一个剂量。不要一下子服用两次的剂量。
3 服用过量怎么办?
咨询医生,寻求紧急医疗救护。
4 有可能出现的副作用?
如果你有过敏反应的迹象需就医:
荨麻疹; 呼吸困难;脸,嘴唇,舌头或喉咙肿胀。
常见的副作用可能包括:胃腹胀或不适。也可能会发生其他副作用。
5 是否一定要服用?
不一定。首先确定体内是否缺少益生菌,尤其是双歧杆菌。结合长双歧杆菌的健康益处和每个人的健康状况,可以在进行肠道菌群检测后,发现双歧杆菌(尤其长双歧杆菌)缺少的情况下进行服用,或遵医嘱。这样可以更加有针对性地改善某些症状,从而达到更好的效果。
附录:双歧杆菌的历史演变
自1900年,亨利·蒂西埃从新生婴儿的粪便中发现了双歧杆菌,蒂西埃便称他为革兰氏阳性弯曲和分叉(裂开,X形或Y形)杆状细胞双歧杆菌。现如今,蒂西埃的原始分离株被称为双歧双歧杆菌。
不久之后,作为诺贝尔奖获得者,蒂西埃研究所的同事——梅契尼科夫(Elie Metchnikoff)将蒂西埃的杆菌加入了他所研究的一份关于活力和长寿理论中。虽然早期有关于发酵乳的报道已经隐含说出关于发酵乳对于健康的益处,但梅契尼科夫是率先将其作为科学依据的。
梅契尼科夫的理论,从摄入的乳酸杆菌含量对健康和长寿的影响进行分析,目前酸奶是最有益的食品,其他如酸牛奶,纯牛奶等也含有。梅契尼科夫这一言论导致了20年以来公众对酸牛奶产品的需求逐增。梅契尼科夫不仅提出并延续了该理论——即肠道微生物群不仅可以控制肠道病原体感染的结果,还可以调节自然的慢性毒血症,这在降低衰老和死亡率中起着重要作用。
虽然由于第一次世界大战的爆发以及梅契尼科夫在71岁的时候去世,导致了人们对细菌疗法的兴趣大幅度降低。但是,关于在饮食中使用乳酸菌的研究一直持续了一个世纪,并在现今依然流行着。在健康的母乳所喂养的婴儿中发现了大量的双歧杆菌以及双歧杆菌的发酵/酸化性质,以此来暗示着双歧杆菌对人类营养方面和胃肠道健康有很大的益处。
如今,随着研究逐步扩大,双歧杆菌不仅通过食用益生菌培养物对人类进行了有益效果评估,还对家畜和其他动物进行了评估。
参考文献:
Wong C B, Odamaki T, Xiao J. Beneficial effects of Bifidobacterium longum subsp. longum BB536 on human health: Modulation of gut microbiome as the principal action[J]. Journal of Functional Foods, 2019, 54: 506-519.
Smecuol E, Hwang HJ, et al., Exploratory, randomized, double-blind, placebo-controlled study on the effects of Bifidobacterium infantis natren life start strain super strain in active celiac disease. J Clin Gastroenterol. 2013 Feb;47(2):139-47.
Smecuol E, Hwang HJ, et al., Exploratory, randomized, double-blind, placebo-controlled study on the effects of Bifidobacterium infantis natren life start strain super strain in active celiac disease. J Clin Gastroenterol. 2013 Feb;47(2):139-47.
Takahashi N, Kitazawa H, et al., Oral administration of an immunostimulatory DNA sequence from Bifidobacterium longum improves Th1/Th2 balance in a murine model. Biosci Biotechnol Biochem. 2006 Aug;70(8):2013-7.
Xiao JZ, Kondo S, et al., Effect of probiotic Bifidobacterium longum BB536 [corrected] in relieving clinical symptoms and modulating plasma cytokine levels of Japanese cedar pollinosis during the pollen season. A randomized double-blind, placebo-controlled trial. J Investig Allergol Clin Immunol. 2006;16(2):86-93.
Desbonnet L, Garrett L, et al., Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience. 2010 Nov 10;170(4):1179-88.
Takahashi N, Kitazawa H, et al., An immunostimulatory DNA sequence from a probiotic strain of Bifidobacterium longum inhibits IgE production in vitro. FEMS Immunol Med Microbiol. 2006 Apr;46(3):461-9.
Namba K, Hatano M, et al., Effects of Bifidobacterium longum BB536 administration on influenza infection, influenza vaccine antibody titer, and cell-mediated immunity in the elderly. Biosci Biotechnol Biochem. 2010;74(5):939-45.
Jonathan Ritter, Puya Yazdi, Scientific Health Benefits of Bifidobacterium longum, 2020
Silva AM, Barbosa FH, et al., Effect of Bifidobacterium longum ingestion on experimental salmonellosis in mice. J Appl Microbiol. 2004;97(1):29-37.
Akatsu H, Iwabuchi N,et al.,Clinical effects of probiotic Bifidobacterium longum BB536 on immune function and intestinal microbiota in elderly patients receiving enteral tube feeding. JPEN J Parenter Enteral Nutr. 2013 Sep;37(5):631-40.

谷禾健康
在20世纪初,Elie Metchnikoff(著名生物学家,酸奶之父)发现了有益的肠道微生物,该微生物可使肠道健康正常化并延长寿命,后来被称为“益生菌”。益生菌是指“以适当的剂量给予宿主健康有益的活生物体” 。

益生菌是促进健康的微生物,在肠道微生物组学领域也被认为是下一代生物疗法。乳酸菌(Lactobacillus),乳球菌(Lactococcus),芽孢杆菌(Bacillus),链球菌(Streptococcus),双歧杆菌(Bifidobacterium),小球菌(Pediococcus)和丙酸杆菌属(Propionibacterium)是众所周知的益生菌。
酵母(如啤酒酵母,卡里斯伯格葡萄球菌和布拉氏酵母)和真菌(如黑曲霉和米曲霉)也被视为益生菌。
然而,最常见的益生菌属是乳杆菌和双歧杆菌。到2020年3月,乳杆菌属包含261个遗传多样性物种。最近,一群科学家根据全基因组测序将其重新分类为25属。当前分类学分类的更新可能有助于理解益生菌有益健康的机制。
除调节肠道功能外,益生菌还通过其在人体内的生物学机制与多种其他健康益处相关联,例如大脑功能,增强免疫力,降低胆固醇和促进代谢稳态。益生菌可以产生短链脂肪酸,维生素,酶,有机酸和抗菌肽。这些化合物参与人体的生理功能。
《益生菌补充剂市场-2020-2025年全球展望与预测》报告说,人们对免疫健康的关注增加导致COVID-19大流行期间益生菌补充剂的市场增长。
最近关于“益生菌市场-增长,趋势和预测”的报告预测,到2024年,全球益生菌市场将达到768.5亿美元,在2020年至2025年的预测期内复合年增长率为8.15%。
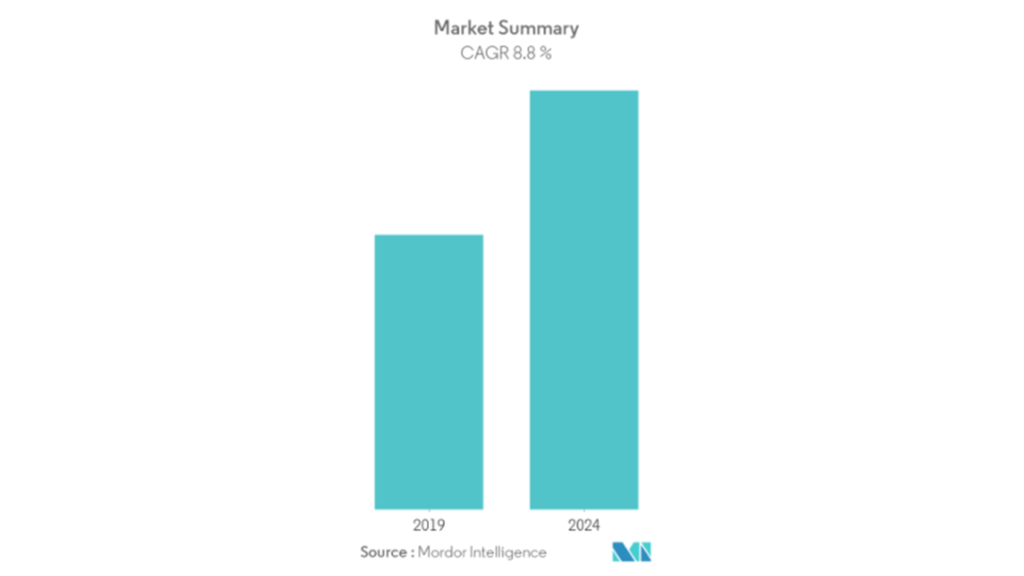
该报告还指出,由于在益生菌强化食品中对显着应用的需求不断增长,细菌市场将以最快的复合年增长率增长。
益生菌通过它们在体内的生物学机制提供各种健康益处。“人类微生物组计划”报告说,人体中其他细菌细胞的数量约为人体细胞数量的10倍。这些细菌还包括有益微生物,它们在维持人类健康方面也起着至关重要的作用。益生菌会产生短链脂肪酸,酶,乳酸,还会分泌杀死致病细菌菌株的抗菌肽。这些细菌素被认为是“天然防腐剂” 。
益生菌也与营养物与病原体竞争,从而抑制在结肠腔框致病细菌粘附,从而改善粘液产生,这反过来又增强了免疫系统刺激肠上皮屏障。
益生菌减少通过胆盐水解酶[毒素],并通过其它的酶活性提高体内的养分生物利用度。一些益生菌甚至有可能分泌有助于疾病治疗的特定抗癌和抗氧化代谢产物。
内源性补充益生菌可以帮助抗生素治疗后肠道微生物组的补充。与抗生素一起使用或在抗生素治疗后食用益生菌可以预防与抗生素有关的腹泻。
除了增强消化健康,益生菌还与大脑功能有关,有助于治疗肠易激综合征,降低血液中的低密度脂蛋白水平,预防女性的阴道和尿道感染(酵母/细菌),预防胰腺炎和改善胰腺健康,促进呼吸道健康,抑制肿瘤发生,调节免疫反应,促进代谢稳态。
此外,益生菌有助于治疗代谢紊乱,如糖尿病、非酒精性脂肪肝和心血管疾病、癌症、口腔念珠菌感染和牙周炎。
因此需要知道自己缺乏哪些益生菌,以及整齐肠道菌群状况来选择合适的菌株和益生菌属是不同应用的关键。
益生菌的生物学作用可以基于它们的代谢过程进行解释,描述益生菌在人体中的重要性,即益生菌的生理作用。此类影响分为以下几类:
调制
益生菌通过直接或间接影响抑制或激活信号通路调节的信号通路,参与代谢调节。益生菌粘附于肠粘膜进行定植的能力及其与先天免疫反应的相互作用可以调节肠上皮细胞的屏障功能,从而为宿主带来健康益处。这些调节机制有助于对抗病原体,从而提高免疫力(免疫调节),增加抗氧化能力,改善肠道转运,增强神经反射(神经调节),调节血管内皮功能和血压,降低胆固醇水平,保持健康细胞和受损细胞的动态平衡。
合成
益生菌活性的关键方面是合成活性代谢物。如:通过多种机制合成短链脂肪酸(乙酸、丁酸、丙酸),维生素(枯草芽孢杆菌合成B2、K2,B.megaterium 合成B12),菌株特有机制产生的信号分子(唾液乳杆菌LDR0723, BNL1059, RGS1746和CRL1528菌株相关的细胞因子)。
吸收
益生菌可以提高微量营养素的生物利用度及其代谢。铁以Fe2+形式吸收显著;然而,在肠粘膜中,铁与脱铁蛋白结合,脱铁蛋白将Fe2+转化为Fe3+(铁蛋白)。肠道微生物群中的益生菌有助于将Fe3+还原为Fe2+,促进十二指肠对铁的吸收。
摄入乳酸菌可通过胞外酶提高铁的吸收率和相对铁的生物利用度。益生菌在增强钙吸收以及通过结肠发酵改善钙吸收方面起着重要作用。益生菌参与维生素D的合成和吸收。这些例子解释了益生菌在提高人体维生素和矿物质的生物利用度方面的作用。
预防
益生菌的预防机制有助于预防疾病,降低感染、1型过敏、病毒感染和癌症的风险。此外,还有益生菌预防在细菌性阴道病治疗中的作用。重要的是,一些介入性临床试验正在进行,以了解益生菌预防的有效性。一些正在进行的临床试验是益生菌预防微生物组调节和预防严重感染。
益生菌科学涵盖了从微生物学到食品加工的各个方面,并且已在营养保健品和功能食品,牙科保健疗法,皮肤护理,肿瘤学,肠胃病学,免疫学和神经内分泌学等各个领域得到了应用。
通常,益生菌是口服给药的,并且可以以功能性食品,膳食补充剂和药物(药用益生菌)的形式在市场上买到。但人们更喜欢食物而不是补充剂/药物。
粮农组织/世卫组织2002年报告指出,食品中益生菌的生存能力必须足以赋予健康。另外,据报道,益生菌食品应至少含有106CFU / g的活的微生物的生存力。然而,益生菌的稳定性是口服摄入靶向结肠时最需要考虑的问题。有必要在胃肠道(GI)转运过程中维持其生存能力,以提高其功效。
此外,益生菌需要在加工,储存和消化过程中防止各种压力因素的影响。益生菌的不同菌株显示出其能力的变化,例如功能特性,稳定性和功效。益生菌的稳定性可以通过各种策略来改善,例如通过预处理,诱变,选择性压力处理以及通过组学技术进行基因改造等来适应环境和选择。
然而,一些这些方法中的可能改变的益生菌的潜力,并且还遗传修饰的菌株不能很好转化到食品应用。事实证明,封装是保护益生菌以确保其稳定性而不改变天然菌株特性的最佳方法。
益生菌的包封提供了保护作用,这些包封材料通过增强抗逆性来稳定益生菌在加工,储存和作用部位时的稳定性。因此,封装过程也赋予了靶向递送。配方是针对目标给药系统的关键考虑因素之一,可以通过适当设计工艺来开发。
有许多方法可将益生菌输送到结肠的降结肠。例如聚合物/脂质涂覆的,pH控制的,磁性/酶触发的和基于配体受体的递送系统。牛奶,酸奶,奶酪,冰淇淋,蜂蜜,巧克力和发酵食品(大米/水果/蔬菜)是益生菌的天然递送系统。

此外,益生元是支持益生菌递送至结肠(如包封剂),并在所有情况下,不易消化的食物成分,滋养微生物的益生菌。天然的益生元包括生香蕉,洋葱,大蒜,甘蔗,朝鲜蓟,和菊苣和雪莲果[根部],并且是市售的如抗性淀粉,菊粉,乳果糖,乳糖醇,乳果糖,低聚果糖(FOS),低聚木糖,低聚半乳糖。

通常,微生物的生存能力高度取决于多种因素,如基质,贮存温度,湿度,pH值,和氧水平。包封基质提高了益生菌的抗逆性。因此,当两种益生菌以基质形式组合时,协同合生作用方法可确保共同施用的益生菌的稳定性。同样,这有助于在整个保质期内保持益生菌的潜力。
通过口服途径摄入的益生菌在消化道中会遇到多种压力环境。例如,人类消化系统的pH值是可变的。大约,口腔的pH值为6–7,胃的pH值较低,为1–3,小肠和大肠的pH值在6到7之间。由于胃的低pH条件和小肠的高胆盐含量,维持到达大肠(结肠作用靶点)的益生菌的活性是一个挑战。
因此,在任何功能性益生菌食品的开发过程中,益生菌的适当保护是至关重要的。除人体条件外,其他因素,如:加工温度、封装/基质材料的pH值、产品中的氧气水平、其他竞争细菌的存在以及代谢物的毒性等,都会影响益生菌的生存能力。在这种情况下,在储存期间,产品的温度和水分含量是需要考虑的主要因素。此外,干燥的益生菌的再水化和溶解度行为与它们的生存和复苏有关。
已经开发了各种技术来提高益生菌对外界胁迫的耐受性,从而通过食物基质修饰和采用过程工程方法来增强肠道微生物群的定植。在这方面,食品基质的选择和配方是技术性能和益生菌稳定性的关键考虑因素。
将益生菌封装为粉末制剂可以保护这些活的微生物,提高其稳定性,并在靶向给药方面提供益处。
重要的是,在优化益生菌封装方法的过程中,必须在封装过程前后建立微生物稳定性、功能性、安全性、有效性和靶向能力。
Yohaet al., Probiotics & Antimicro. Prot. 2021
上图解释了根据FAO/WHO指南评估食品用益生菌所涉及的各种筛选部分。为了保持益生菌的特性,封装方法应该考虑以下几个方面。
益生菌的稳定性
提高胶囊化益生菌活力保留率的保证
益生菌的功能性
功能性方面,如抗胃酸、胆盐和消化酶、对潜在病原体的抗菌活性、粘液粘附性、聚集性和其他潜在特性应在封装后保留
安全性和有效性
益生菌菌株应安全、无污染、无毒、包封后保留治疗效果
靶向能力
提高对环境压力的耐受性和靶向结肠的能力,以增强肠道微生物群和有益健康的影响
已经探索了各种技术来封装益生菌(下图)。尽管所有这些方法的重点是保护益生菌的生存能力/稳定性,但每种技术的概念都是独特的,并对产品质量有直接影响。
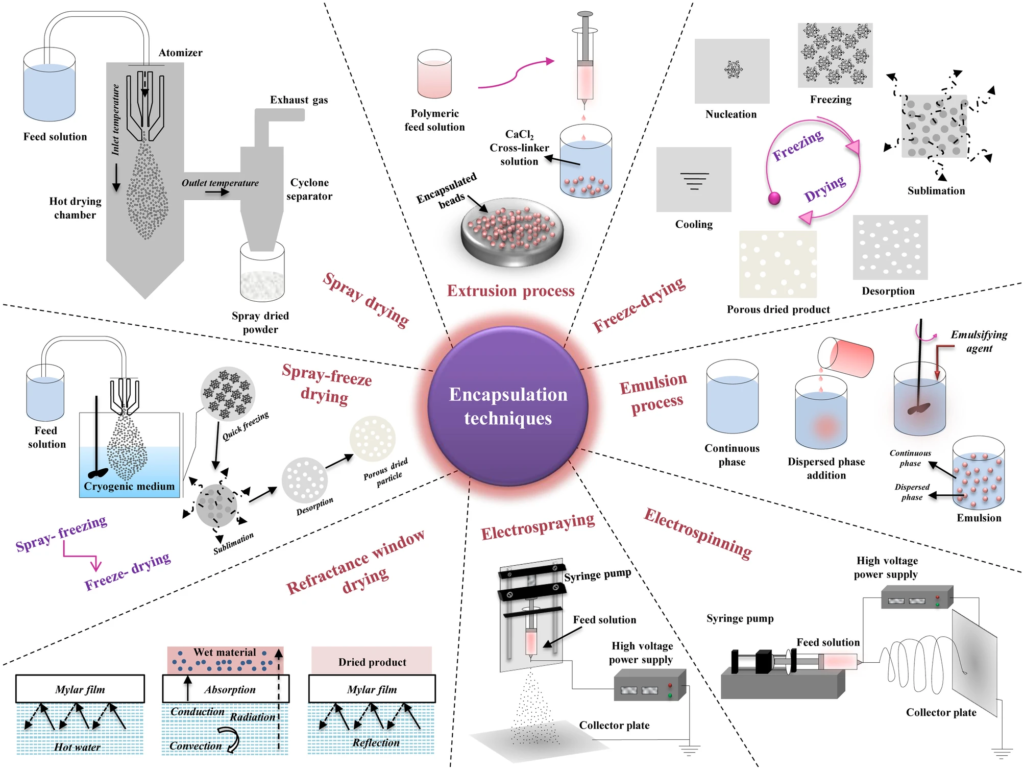
Yohaet al., Probiotics & Antimicro. Prot. 2021
加工条件被认为是主要因素,是负责保留质量和活力的胶囊益生菌。此外,不同的壁材料已被探索作为保护/涂层剂用于封装益生菌。
它们来源于膳食纤维、多糖、蛋白质和合成聚合物。
通常,选择取决于它们的功能性、成膜能力、稳定性、溶解性、消化率和释放特性。为了获得所需的性能,还可以使用壁材的组合或乳化剂/填充剂的添加。
然而,大多数已建立的益生菌封装方法只考虑了益生菌的生存能力,而没有考虑益生菌的功能或特性。在益生菌的封装/干燥过程中,细胞的表面性质及其功能性会受到影响。这可能会影响益生菌的特性,如聚集(自聚集和共聚集)特性、肠粘液粘附能力、拮抗活性和胆盐水解酶活性。
因此,未来的研究除了探讨微囊化益生菌的生存能力外,还需要探索微囊化益生菌的功能特性,从而更好地关注微囊化益生菌的健康益处。
未封装的益生菌(游离细胞)在高温、高操作压力、剪切应力和低胃pH下失去活力,进而导致益生菌细胞计数和性能的耗尽。
封装过程可以通过将益生菌包埋在保护壁材料/基质中来保护益生菌。益生元材料,如FOS、菊糖和填充材料,如麦芽糊精(MD)、乳清蛋白(WP)、乳清分离蛋白(WPI)、乳清浓缩蛋白(WPC)、海藻酸钠、明胶,并在改善益生菌在不同外部环境中的稳定性方面发挥了重要作用。
下图详述了据报道用于封装益生菌的不同壁材料。
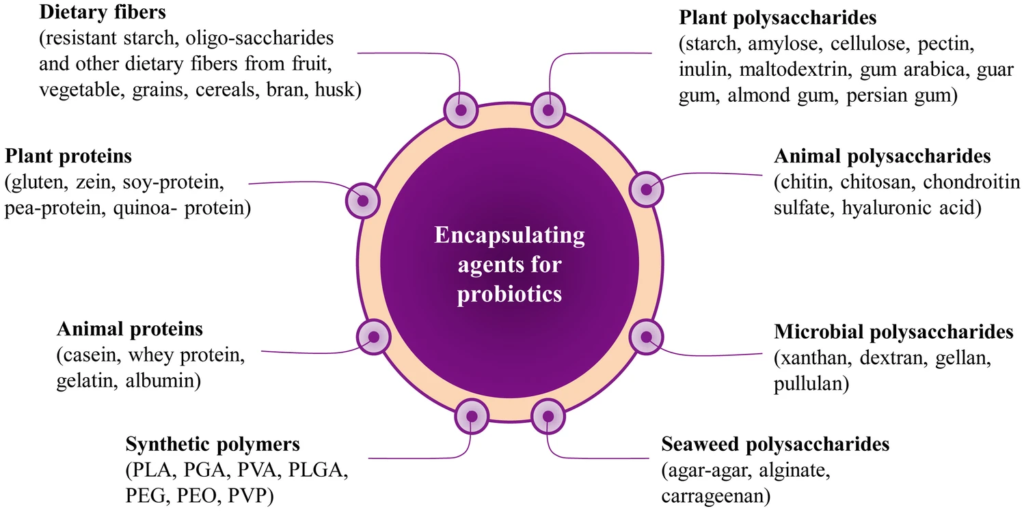
Yohaet al., Probiotics & Antimicro. Prot. 2021
在通过胃肠道的不利和波动条件的运输过程中,包埋可以为益生菌提供显著的保护。
例如微胶囊化对益生菌的贮藏稳定性和贮藏后性能有显著的影响。且胶囊化益生菌的后酸化过程比非胶囊化益生菌慢。
一项关于抗生素与胶囊型益生菌(抗生素敏感型益生菌)合用效果的研究显示,胶囊型益生菌对抗生素耐药病原体的治疗效果有所提高。此外,抗生素治疗可以杀死目标病原体以外的有益细菌;因此,为了滋养肠道微生物,益生菌的补充是必要的。
封装的益生菌有一个由海藻酸钠或其他合适的生物相容性材料组成的保护壳,可以抵御抗生素。生物相容性脂质涂层提供肠道微生物的生物界面超分子自组装,用于增强口服给药和治疗。
研究人员和工业界已经探索了不同的封装方法来封装感兴趣的不同成分。作为公认的优点,胶囊益生菌可以提供更好的范围,有针对性的 “交付”。本节解释了每种技术的概念以及最近在益生菌的封装效率、生存能力和稳定性方面的应用。
下表总结了不同的封装技术。
传统方法

新型方法
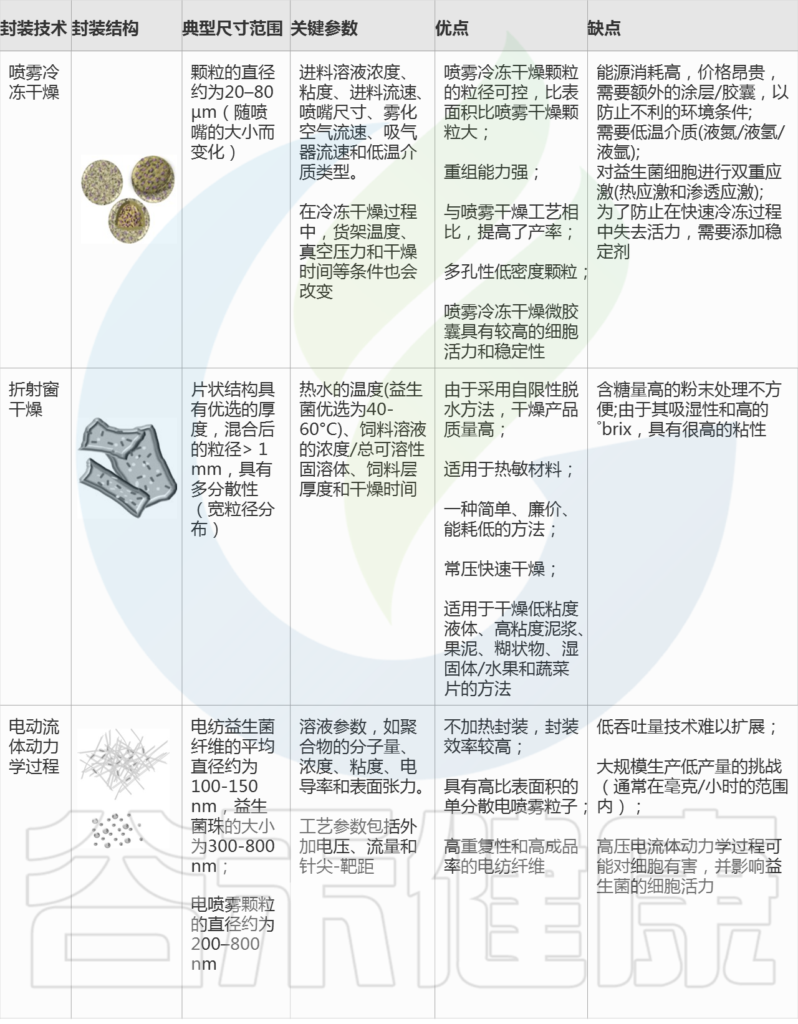
Yohaet al., Probiotics & Antimicro. Prot. 2021
益生菌的封装可以保护细胞直至到达结肠的生存能力,从而提高了到达肠道远端(胃肠道下部)后益生菌功能的有效性。益生菌递送的确认可以首先通过体外研究使用模拟的静态体外消化或动态体外消化系统(模拟器)来完成。这些可以为目标交付提供概念证明。此外,需要对益生菌的体内研究来获得对这种益生菌的现实看法以及对健康影响,功效和安全性进行深入研究的需要。
静态体外消化研究
可以在控制温度,pH和连续摇动条件下,使用模拟消化液(例如模拟唾液(SSF),模拟胃液(SGF)和模拟肠液(SIF))进行体外消化研究。尽管如此,这些还是很少地模仿消化过程(下图)。
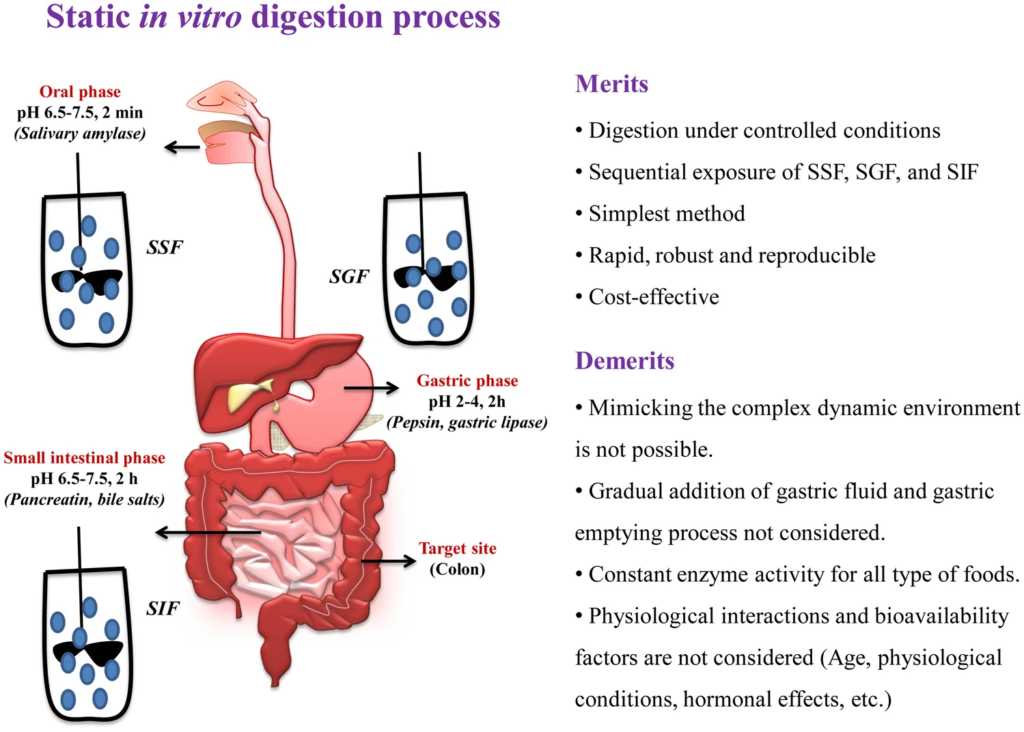
Yohaet al., Probiotics & Antimicro. Prot. 2021
de Almeida Paula等人评估了在模拟的GI条件下植物乳杆菌的双过程微囊化对益生菌存活的效率。报告说,与游离细胞(25%)相比,微囊化植物乳杆菌中的细胞活力更高(80.4 %)。
动态体外消化研究
静态模型只能代表胃肠道中的生化过程,但不能提供动态环境,例如对胃的恒定物理力(轴向和剪切力),胃排空,用于肠蠕动的非自愿肌肉的同步收缩,反馈机制,以及餐食和常驻微生物区系的影响。为了解决这些挑战,已经开发了动态体外消化模型。
——Mainville模型(IViDiS)
人类上消化道的动力学模型模拟了上消化道运输的事件。该模型由胃(胃)和十二指肠反应器组成,可用于验证从人,动物和发酵乳制品中分离出的益生菌的存活率。该模型考虑了进餐时胃中存在pH值以及小肠中的胆汁盐的pH值变化。特别是,它证明了膳食以及包封基质对益生菌生存力的影响。
——SHIME®
模拟人肠道微生物生态系统(SHIME®)是计算机控制的模拟人胃肠道模型。该模型由五个反应器组成,这些反应器模拟从胃到大肠的降结肠。胃反应器通过胃蛋白酶消化模拟酸性环境,小肠反应器为消化过程提供胆汁条件,大肠的三个反应器模拟结肠的不同区域(上升,横向和下降),有助于研究结肠的差异。微生物过程。
研究使用SHIME®评估了藻酸盐-壳聚糖微囊化嗜酸乳杆菌的靶向递送,确认了益生菌在目标部位的成功递送。
——SIMGI®
胃肠道模拟器(SIMGI®)是一种多隔室的GI模型,旨在模拟胃,小肠和大肠(具有上升,横向和下降结肠隔室)的消化过程。SIMGI®系统可以处理结肠菌群的增殖。
一项研究补充植物乳杆菌CLC17对多酚代谢的影响。他们将SIMGI®模型用于模拟的GI消化,并通过qPCR(定量聚合酶链反应)和16S rRNA基因序列分析对微生物群组成进行了定量。结果推断该菌株可以成功地在结肠区域的区室中递送。
另一项使用SIMGI®模型研究了纳米银颗粒对人体肠道菌群的影响,并报道纳米颗粒不影响人体肠道菌群的代谢活性。
——ARCOL
人工结肠(ARCOL)是模拟结肠(大肠)消化的单室模型。它可以与任何其他动态上层GI系统一起使用。肠道菌群的组成及其活性可以使用ARCOL模型进行研究。此外,该模型中存在的透析纤维模仿了微生物代谢产物的被动吸收。
——TIM
TNO胃肠模型(TNO)系统具有TIM-1(由胃,十二指肠,空肠和回肠组成)和TIM-2(大肠)两种模型。Marteau等首先研究了使用TIM-1的乳酸菌的存活率,并报道了它可用于验证胃肠道转运过程中益生菌的生存能力。
Cordonnier等使用TIM -1和ARCOL动态仿真器研究酿酒酵母的存活动力学以及CNCM I-3856及其对肠道菌群的影响。结果表明,益生菌菌株在上消化道中具有较高的存活率,而该菌株对结肠条件更敏感。
Venema等使用TNO GI模型(TIM-1系统)研究了多层包被的益生菌菌株(加氏乳杆菌PA 16/8,长双歧杆菌SP 07/3和双歧双歧杆菌MF 20/5)的存活率-胃和小肠的体外模型。他们报告说,胃存活率双歧杆菌和乳杆菌分别以72%和53%的比例被递送到小肠。因此,与未包衣的益生菌菌株相比,益生菌菌株的肠溶衣提供的活细胞递送增加了20–40倍。
——GITS
胃肠道模拟器(GITS)是模拟人类胃肠道状况的单个生物反应器。
Sumeri等使用GITS研究了不同的益生菌(嗜酸乳杆菌La-5,约翰逊乳杆菌NCC533,干酪乳杆菌Shirota和鼠李糖乳杆菌GG)的存活率,并报道了嗜酸乳杆菌La-5和约翰逊乳杆菌NCC533对胆汁盐表现出更高的抗性,而干酪乳杆菌菌株Shirota和鼠李糖乳杆菌GG的生存能力降低。
——GIDS
胃肠道消化模拟器(GIDS)-一种半动态体外胃肠道模型,其模拟“禁食模式”,即空腹消化-添加样品前不含消化液。唾液在喂入胃反应器之前被人工添加到外面,以模拟口腔消化。
Adouard等人专门为益生菌开发了这个模型,并建立了它来评估整个人类胃肠道的益生菌生存能力。GIDS系统为识别到达结肠的目标菌株提供了有效的见解。
定制动态体外消化系统
Moumita等人使用定制的体外GI模型研究了胶囊化乳酸菌的GI耐受性。对游离型和包封型乳酸菌进行了消化,观察到包封型乳酸菌在消化过程中的变化。
嗜酸菌NCIM-2660与游离菌相比表现出更高的抗性。除了封装外,抗应力/耐应力条件与应变有关。设计体外胃肠道模型,观察益生菌菌株在10.25小时(包括2小时胃、0.25小时十二指肠、3小时空肠、4小时回肠和1小时盲肠5个隔室)的释放和活力,并观察益生菌菌株的释放。在SGIF(模拟胃肠液)中,在pH值(6.0–6.5)范围内释放益生菌菌株,因此,在小肠的空肠腔中发现了活性益生菌。
其他动态体外消化系统
Parthasarathi等人开发了一种工程化的小肠系统,以研究肠吸收和灌注过程以及粘膜层的干扰。它由一个与蠕动泵、pH计、供体、受体和缓冲循环室相连的灌注室组成。小动物(大鼠/鸡)的小肠可与该模型相吻合,该模型模拟了精确的体内模型。
Parthasarathi等人在这种工程化小肠系统中使用大鼠小肠来研究生物活性化合物的肠道通透性,并报告所开发的系统非常适合肠道通透性的被动扩散。
利用这种方法研究了纳米胶囊化玉米醇溶蛋白-白藜芦醇的生物利用度,改进后的方法可以推广到益生菌。
其他一些系统,如M.I.D.A.(婴儿消化器官模型)、动态胃模型(DGM)、人类胃模拟器(HGS)、DIDGI® 系统和工程化胃和小肠(ESIN)已被用于评估食物的消化率、溶解特性、营养素的吸收和生物可利用性,包括药物应用。
在BALB/c小鼠中评估了逐层包裹的凝结芽孢杆菌的靶向递送,并报告了逐层涂层可提高益生菌的存活率。此外,他们还利用猪小肠进行了粘液粘附和肠道定植研究,并通过使用活体成像系统(IVIS)软件进行生物发光成像,观察到益生菌在短时间内与肠组织良好粘附。
Coelho Rocha等人通过口服给药研究了C57BL/6小鼠体内微囊化和非微囊化乳酸菌的存活情况,并通过共聚焦显微镜和qRT PCR(定量逆转录-聚合酶链反应)分析了小鼠的肠道切片。结果确保在肠的不同部分存在活的乳酸菌。研究人员观察到,包封乳酸菌和非包封乳酸菌在十二指肠和空肠切片中均有较高的相对表达,而回肠和结肠切片中仅在包封乳酸菌中观察到相对表达。
上述体内研究实例可证实益生菌在作用靶点的递送;尽管如此,还需要证据证明它们的健康主张/功效/健康用途路径。
包囊技术的范围提供了货架稳定的益生菌。然而,监管问题存储期间与在环境条件下益生菌的贮存稳定性产生。市场上的大多数益生菌产品都需要冷藏。但事实上,即使是胶囊形式,也应至少在打开包装后进行冷藏以保持益生菌的效力,因为大气中的潮湿条件会导致代谢发酵或降解。
尤其是在益生菌果汁中,由于高有机酸含量需要冷藏,因此酸性胁迫是一个挑战。
通过选择特定的弹性基因型益生菌(如形成孢子的益生菌)可以克服这一挑战。包封方法与益生菌的选择性菌株一起,即使在非冷藏条件下也将提高货架期。
在应用的基础上,益生菌在各种疾病的治疗中起着至关重要的作用,如本文前面的部分所述。有趣的是,益生菌在病毒感染中的作用-“抗病毒益生菌”是医学界的一个新概念。最近许多研究都集中在使用益生菌的急性呼吸道感染的治疗,考虑到涉及通过肠道-肺轴肠肺串扰科学。
益生菌的免疫调节和预防机制可用于治疗/预防病毒感染。众所周知,肠道益生菌介导的免疫调节通过细胞因子的分泌来上调呼吸道粘膜免疫,从而预防呼吸道病毒感染。
有几个关于益生菌防治呼吸道感染的干预临床试验报道(NCT01782755,NCT03449459,NCT03636191和NCT03683927)。
最近,国家卫生委员会建议益生菌用于COVID-19感染的患者,以维持肠道菌群的平衡并预防继发性细菌感染。此外,已经在我国临床试验注册中心(ChiCTR2000029974)下注册了临床试验,以评估丁酸梭状芽孢杆菌胶囊和凝结芽孢杆菌的有效性和安全性片治疗新型冠状病毒性肺炎患者并研究其作用机制。对益生菌及其新发现的认识不断提高,可能为改善人类健康的解决方案铺平道路,并且封装作用仍然至关重要。
这篇文章阐述了益生菌在人类健康中的作用以及为实现所需益处而对益生菌进行封装的必要性。
通过提供对人类口腔胃肠道的复杂途径和一系列应激环境的理解,来解释对封装的需求。益生菌的封装已被证明具有保护益生菌和促进其靶标递送的潜力。
益生菌的包封,靶向递送以及菌群检测方法以及包封对益生菌的作用等面临的挑战,是益生菌从研究进入商业化所必须解决的。
相关阅读:
参考文献
Yoha, K.S., Nida, S., Dutta, S. et al. Targeted Delivery of Probiotics: Perspectives on Research and Commercialization. Probiotics & Antimicro. Prot. (2021).
van de Wijgert JHHM, Verwijs MC (2019) Lactobacilli-containing vaginal probiotics to cure or prevent bacterial or fungal vaginal dysbiosis : a systematic review and recommendations for future trial designs. BJOG An Int J Obstet Gynaecol 127:287–299.
Raghavi LM, Moses JA, Anandharamakrishnan C (2018) Refractance window drying of foods: a review. J Food Eng 222:267–275.
Patarroyo JL, Florez-Rojas JS, Pradilla D et al (2020) Formulation and characterization of gelatin-based hydrogels for the encapsulation of Kluyveromyces lactis – applications in packed-bed reactors and probiotics delivery in humans. Polymers (Basel) 12:1287
Yoha KS, Moses JA, Anandharamakrishnan C (2020) Effect of encapsulation methods on the physicochemical properties and the stability of Lactobacillus plantarum (NCIM 2083) in synbiotic powders and in-vitro digestion conditions. J Food Eng 283:110033.

谷禾健康
功能性腹痛性疾病(FAPD)是儿童期最常见的疾病,全世界25%的儿童和婴儿受其影响。
功能性腹痛性疾病
小儿功能性腹痛性疾病,目前称为肠脑相互作用障碍,包括肠易激综合症,功能性消化不良,腹型偏头痛和功能性腹痛。
<罗马IV诊断标准见附录>
近日,英国和美国的研究科学家联合发表在《NATURE REVIEWS | DISEASE PRIMERS》上的一篇综述文章题为:“Paediatric functional abdominal pain disorders”(小儿功能性腹痛症)。


该文总结了FAPD患病率和致病性的最新进展,并特别关注了早期生命的影响和构建。对食源性发病机理和病理生理学有了更深入的了解,包括肠道器官(炎症,运动和微生物群),核心因素(心理方面,某些大脑区域的敏感性和/或连通性或活动性差异)以及外在因素(感染)。
此外,讨论了当前的诊断方法并着重介绍了这些疾病的治疗选择,特别是IBS和FAP-NOS。强调可用的药理干预措施仅限于儿童,因此,干预管理重点落在综合方法上,包括针对精神的干预措施(催眠疗法和认知行为疗法),饮食(益生菌)和经皮神经电刺激。这些方向将有助于理解病理生理学并更好地治疗这些疾病。
FAPDs的特征通常内脏痛觉过于敏感以及内脏刺激中枢感知增加而导致残疾,是遗传易感性和早期生活事件背景上叠加的社会心理因素和医学因素的最终结果。
功能性消化不良的症状特征主要来自胃肠道近端,涉及上腹部腹痛和/或餐后饱胀和/或早期饱腹感。
腹型偏头痛的特点是发作性长时间发作,剧烈,急性脐周,中线或弥漫性腹痛。这些痛苦的发作通常无能为力并干扰正常生活。
这些发作通常但不总是与其他症状(例如厌食,恶心,呕吐,头痛,畏光等)相关,这些症状可能在疼痛持续时间之前或与疼痛持续时间同时发生,并且这种症状性发作可能相隔数周至数月不等。
风险因素如下:


FAPDs是一种复杂的疾病,似乎是由于一个或多个元素的功能和/或更微妙的结构完整性的破坏造成的菌群-肠-脑轴。这些条件下相互作用的复杂性和多面性被整合到一个生物心理社会模型中。
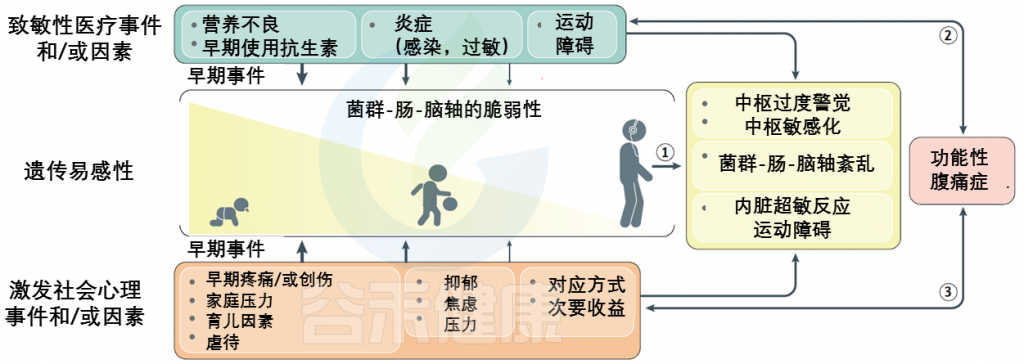

该模型的关键组成部分是内脏超敏反应和中枢敏感化。
内 脏 超 敏 反 应
内脏超敏反应描述了对周围信号的知觉反应(即痛觉过敏),并且可能是内脏传入信号处理变化的结果或疼痛下调变化的结果(例如,中枢敏感化)。
表现:疼痛的感觉阈值降低,也就是稍微一点点刺激就会感到疼痛。
可能原因:在肠扩张期间或由于暴露于食糜的化学成分改变引起,部分解释了对诸如饮食调整和抑酸等治疗的反应。
潜在诱因:炎症,感染和压力
从本质上讲,这些触发因素可引起粘膜通透性变化并导致炎症,释放促生因子,包括5-羟色胺,组胺,NGF,蛋白酶和前列腺素,它们能够激活传入伤害感受器(痛觉神经)上的受体,引起急性疼痛以及持久的功能和结构改变,这是维持慢性疼痛的关键。
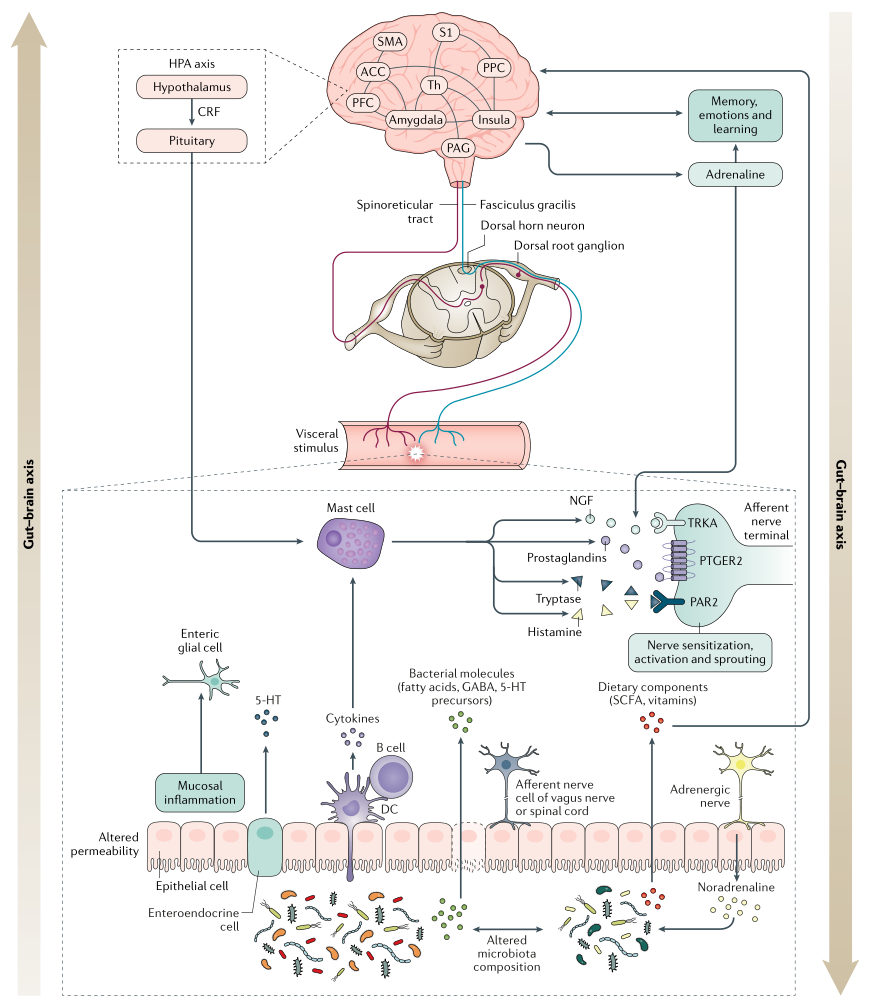

中 枢 敏 感 化
中枢敏化是指通过增强中枢神经系统内的神经元功能和神经信号来放大疼痛敏感性的现象,会引起疼痛超敏反应,并且是一种发展和维持慢性疼痛的机制。
除了疼痛超敏反应外,中枢敏化还会导致脑部活动的继发性变化,可以通过电生理或成像技术进行检测。患有FAPD的个体可能更倾向于发展来源不明的中央致敏。
2018年进行的一项系统性回顾涉及12项病例对照研究,发现功能性腹痛儿童的继发性痛觉过敏和皮质伤害感受改变。
生 命 早 期 事 件
在小儿FAPD中,损伤时机比导致微生物群-肠-脑轴成分破坏的多种因素或该轴本身的破坏更为关键。在生命的头二十年中,尤其是从围产期到儿童时期直至青春期,支撑其功能的肠脑轴所有元素的发育和成熟的关键过程至关重要。
包括手术(例如脐疝和幽门狭窄),细菌性胃肠道感染,炎性或免疫介导的疾病(例如乳糜泻,炎性肠病),以及在生命的最初几个月中发生无害的侮辱,例如婴儿期对牛奶过敏和早期使用抗生素等。
神 经 免 疫 相 互 作 用
在一些患有FAPD的儿童中,证据表明存在低度的肠道炎症,并在发病机理中发挥了神经免疫相互作用的作用。
一项研究发现,IBS患儿回结肠结肠粘膜中靠近神经的肥大细胞数量增加。神经纤维相关的肥大细胞计数与腹痛的强度和疼痛发作的频率相关。
胃 肠 蠕 动
胃肠动力异常促进FAPD的病理生理。具有上消化道症状的患者可能有胃排空延迟和/或胃适应性降低或两者都不存在。功能性下消化道症状的患者可能延迟,加速或正常结肠转移,和/或骨盆底运动障碍(肌肉协调障碍导致试图放松骨盆底肌肉时收缩)。
—功能性消化不良
—肠易激综合征
微 生 物 群
FAPD与肠道微生物群的多样性和菌群组成有关,尤其是IBS。2019年,一项系统评价86评估了健康个体和IBS患者(成人和儿童)的肠道菌群组成。发现双歧杆菌属的丰度下降。IBS患者中的抗炎作用与Faecalibacterium spp,尤其是Faecalibacterium prausnitzii一样,具有抗炎作用。
IBS患者的粪便微生物群的多样性降低或保持不变。粪便微生物群组成或代谢组组成可以预测患者可能从饮食中获益。
除细菌外,真菌或病毒也可能在FAPD病理生理中起作用。但是,有关真菌菌群失调或病毒菌群失调的可用数据有限,目前的研究主要集中于炎症性肠病,而不是IBS。
营 养
在患有FAPD的儿童中起着至关重要的作用。
饮食失调(例如神经性贪食症)可能导致IBS患儿肥胖的发生率增加。
碳水化合物的吸收不良可引起胃肠道症状。吸收不良可能与特定的酶缺乏症有关(例如乳糖酶缺乏症中的乳糖;蔗糖和异麦芽糖酶缺乏症中的蔗糖和淀粉)或与碳水化合物(如果糖,山梨糖醇或甘露醇)的吸收能力有限有关。
在糖较小的情况下,所引起的渗透负荷可导致肠腔膨胀小和快速转运。对于诸如果聚糖等较大的糖,人不具有消化的酶促能力,因此,吸收不良的糖会被结肠菌群发酵,从而导致气体形成和潜在的结肠扩张。
心 理 因 素
肠脑轴的生理很复杂,包括传入和传出成分。
下丘脑-垂体-肾上腺轴通过皮质醇和促肾上腺皮质激素释放因子的释放(在压力条件下均会增加),以及通过刺激肥大细胞和诱导脯氨酸释放的反馈回路,促进肠-脑相互作用。
研究表明,在成年人和有FAPDs的儿科患者中,压力都会增加肠道炎症标志物,如粪便钙卫蛋白和CRP。
肠道与大脑的相互作用涉及自上而下和自下而上的过程,因此,肠道菌群也可以影响脑功能。在压力条件下,肠道菌群可以增加上皮屏障的通透性,使抗原和/或病原体能够通过并引起炎症反应。由此产生的循环性促炎细胞因子可能会与中枢神经系统通讯,刺激大脑的免疫反应,从而可能导致或加重心理症状(例如焦虑和抑郁)。
几项研究表明,与健康儿童相比,患有家族性帕金森病的儿童的心理压力和行为问题有所增加。心理因素可能既是FAPD的起因,也是后果。

无论采用哪种治疗方法,患者与临床医生之间有效的沟通和病人教育,是成功进行FAPD管理的核心。必须花足够的时间向每位患者的照护者解释诊断,并讨论生物心理社会模型。
FAPD的管理受到几个因素的限制
1. 由于FAPD生物心理社会特性,每个孩子都有一套独特的病理生理因素,并且对疗法的反应也不同。
2. FAPD患儿的证据基础很小,许多治疗建议都是基于对成年人的研究。 儿童通常不会像成年人那样做出反应。
3. 一些有效的治疗方法是行为疗法(饮食疗法和心理疗法),由于缺乏专职医疗保健专业人员以及缺乏保险,这些方法并不容易。
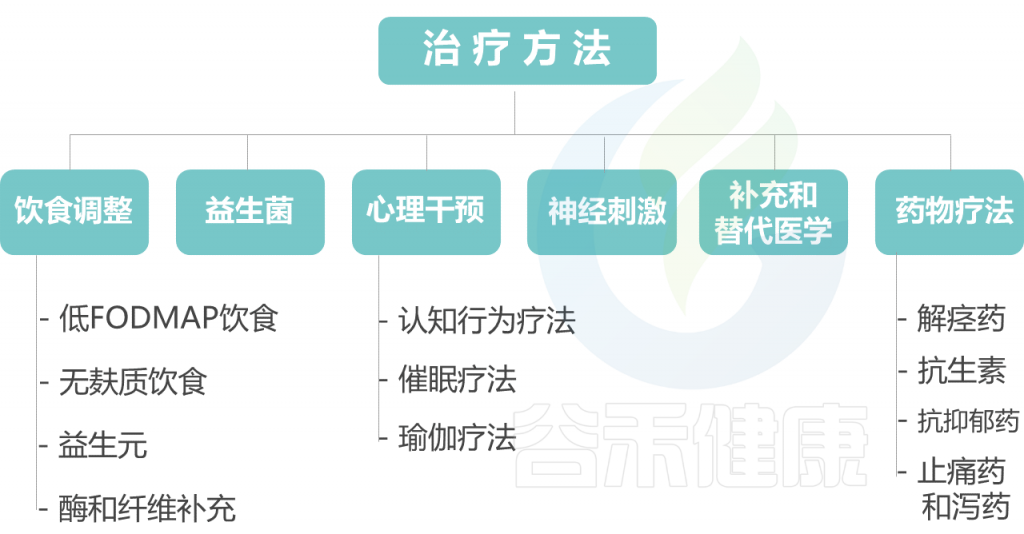

以下对每种治疗方法展开讨论。
饮 食 调 整


益 生 菌
多项研究检查了益生菌治疗FAPD的功效(大多成年IBS患者)。这些研究表明,益生菌或特定菌特定组合可能是有效的,但研究有局限性,如样品量,致盲性,所用益生菌的差异以及不同的剂量,其作用仍不清楚。
在患有IBS的儿童中,两项研究发现鼠李糖乳杆菌GG可有效减轻腹痛症状,而一项研究则报告腹痛没有改善,但感觉到的腹胀有所改善。在不同的研究中,疼痛程度再次有所不同。
在一个多中心,IBS儿童中进行的交叉RCT研究中,VSL#3(八种益生菌菌株的混合物)在改善症状和改善生活质量方面比安慰剂更安全,更有效。
心 理 干 预
心理干预迄今为止,诸如CBT和催眠治疗等心理干预已被证明是管理FAPD的最成功干预措施,并主张将其普遍纳入管理策略。
认知行为疗法(CBT)
CBT是治疗IBS的研究最多的心理疗法,其目的是改变认知,情绪和行为,这些不良情绪行为等都可能加剧或维持IBS症状。
在成人和儿童中的研究表明,与教育和其他控制干预措施相比,CBT在改善疼痛和参与社交生活的能力以及减轻焦虑或抑郁症状方面是有效的。
十二项随机对照试验涉及990名IBS儿童(7-18岁),显示出CBT对生活质量,学校表现和社会参与产生了长期的,持久的有益影响。CBT可以作为面对面的治疗提供,也可以通过互联网面向儿童或通过电话面向父母。
已报道,CBT在改善肠易激综合征儿童的疼痛和残疾方面具有有效性。患有家族性帕金森病的儿童的社区康复治疗主要集中在学习应对症状和减少残疾上,这些治疗应该是综合护理方法的理想组成部分。
催 眠 疗 法
在治疗师的指导下,患者会进入催眠状态,以响应改变主观体验,感知,情感,思想或行为的建议。
在成年人中,催眠疗法已被证明可导致结肠运动改变,改善内脏超敏性并减少长期持续存在的心理因素,例如躯体化和心理压力。
然而,在IBS患儿中,尽管接受了标准疗法的儿童的疼痛评分和躯体化评分均较低,但在催眠治疗后并未发现超敏反应降低(通过实验测试)。
IBS或FAP-NOS(n = 412;6-18岁)儿童的5个随机对照试验,无论是单独治疗还是在家中通过CD进行催眠治疗,均产生了长期有益影响。
在1年和5年的随访中,接受催眠治疗的患者中分别有85%和68%已没有症状,而对照组中分别只有25%和20%的患者缓解
瑜 珈 疗 法
瑜伽练习已被证明可以改善应激诱导的副交感神经系统活性不足。三个随机对照试验,包括127名IBS儿童(7-18岁),瑜伽疗法在减少腹痛方面具有积极作用。
但是,一项荷兰研究表明,在1年的随访中,瑜伽干预并没有比不包括CBT的标准治疗更有效。由于学习方法的重大缺陷,尚不能提出将瑜伽作为FAPD儿童的常规干预措施的建议。
神 经 刺 激
多项研究表明,脊髓和大脑的电刺激在调节疼痛途径中的功效,能够减少脊髓和中央杏仁核中50%以上的神经元放电,从而减轻内脏疼痛。
一项研究表明,经皮神经电刺激(PENFS)可以调节杏仁核和脊髓神经元的反应特性,并显着降低大鼠内脏超敏反应的发展。
随后,同一组受试者在115名FAPD的青少年(11至18岁)的随机对照试验中显示,具有主动装置的PENFS可以改善健康状况,并显着减轻疼痛和残疾 与假刺激组。
此外,PENFS的有益作用在2个月的随访期间得以维持。尽管有些耳部不适,但未报告严重的不良反应。
补 充 和 替 代 医 学
补充和替代医学包括不同的方法,从针灸和阿育吠陀医学到脊椎指压疗法、整骨疗法、顺势疗法、精神治疗、按摩和冥想等身心技术。大约40%的澳大利亚和荷兰诊断为糖尿病肾病的儿童使用其中某些替代疗法,其中草药治疗是最常见的(46%)。
许多补充疗法被公众认为是“自然的”,比现代医学的医疗设备更安全、更温和。FAPDs儿童对对抗疗法药物相关可能产生不良反应的恐惧,常规治疗没太大效果,让父母希望寻求补充和替代治疗。
然而,到目前为止,评估草药疗法、针灸、顺势疗法、身心疗法或肌肉骨骼操作(如整骨疗法和脊椎指压疗法)对患有家族性帕金森病的儿童的效果的随机对照试验尚不可用。
由于糖尿病周围神经病变的自发缓解率很高(30-70%),采取逐步的管理方法是明智的;必要时,教育、识别和改变压力因素和饮食干预可能是第一步。当症状持续或再次出现时,下一步可能是开始一种心理治疗,如认知行为疗法和催眠疗法,或PENFS。
药 物 疗 法




胃肠症状的严重程度和发生频率对不同患者的功能状态有不同的影响。患者报告的健康相关生活质量(HRQOL)测量应该有助于深入了解FAPDs对儿童和青少年功能状态的不同影响,包括身体、情感、行为、社会和认知方面。
评估症状和HRQOL影响的患者报告结果已成为成人临床状态和治疗结果的公认指标。但在儿童环境中,自我报告的HRQOL措施在仪器开发和临床应用中遇到了挑战,部分原因是担心儿童能否可靠地自我报告与健康相关的信息。
量化个体胃肠道症状对于开发以患者为中心和针对症状的干预措施很重要,这可以改善整体HRQOL。例如,一项针对259名患有功能性便秘,功能性腹痛或IBS的儿科患者的多中心研究发现,胃肠道症状最能预测整体受损。
FAPD在儿童时期很常见,FAPD患病率和/或复杂性可能会增加。因此,需要有来自所有地理区域以及世界各地精心设计的流行病学研究,才能真正了解问题的性质和规模。
特别重要的是,我们目前对导致儿童FAPD发病机理的潜在因素的了解,需要使用来自FAPD患儿的组织样本来解决免疫功能障碍和神经功能障碍的基础和转化科学研究。如上所述,早期的影响,即在复杂的肠脑轴各要素发展的关键阶段发生的事件,通常是辱骂或创伤(心理或医学方面的事件),使易感人群容易患上FAPD。
异常改变肠道菌群的因素可能会改变肠神经系统的结构或功能完整性,进而改变其与中枢神经系统的复杂且平衡的相互作用。结果可能是胃肠道重新调整为过敏状态,而大脑则重新编程为过度警觉状态。
当然,其他遗传因素,社会因素和生理变化,例如在青春期或青春期发生的那些,也可能促进症状发展。
现代工具越来越多地与焦虑和压力相关联,也可能会对FAPD产生重大影响。
总体而言,在过去十年中,儿童家庭保护方案取得了相当大的进展。对所有影响因素,及其与触发FAPD最终发展有关时机的更深入了解,可能带来更合适的预防或治疗策略。
【附录】
功能性腹痛疾病的罗马IV诊断标准
肠易激综合征
该标准必须满足至少2个月,并包括以下所有:
• 每月至少有4天腹痛伴有排便和/或排便次数的改变和/或大便外观的改变
• 腹痛不能随着便秘的解决而消失(疼痛消除的儿童患有功能性便秘,非肠易激综合征)
• 经过适当评估,症状不能完全由另一种疾病解释
功能性消化不良
诊断前必须至少满足2个月的标准,并且必须包括以下一种或多种症状,每月至少4天:
• 餐后饱腹感
• 早期饱腹感
• 与排便无关的上腹部疼痛或灼热感
• 经过适当评估,这种症状不能完全由另一种医学状况来解释
腹型偏头痛
必须在诊断前至少6个月内达到标准,并包括以下所有至少发生两次的情况:
• 持续1小时或更长时间的剧烈、急性脐周、中线或弥漫性腹痛的阵发性发作(应为最严重和最痛苦的症状)
• 发作间隔数周至数月;疼痛使人丧失能力并干扰正常活动;个体患者的定型模式和症状
• 疼痛与以下两种或两种以上症状相关:厌食、恶心、呕吐、头痛、畏光或苍白
• 经适当评估,症状不能完全由另一种医学状况解释,
功能性腹痛
未另行规定标准必须在诊断前至少2个月完成,每月至少四次,包括以下所有内容:
• 并非仅在生理事件(例如,饮食和月经)期间发生的偶发性或持续性腹痛;肠易激综合征、功能性消化不良或腹部偏头痛的标准不足
• 经过适当评估,腹痛不能由其他医疗状况完全解释
相关阅读:
主要参考文献:
Sjölund, J. et al. Prevalence and progression of recurrent abdominal pain, from early childhood to adolescence. Clin. Gastroenterol. Hepatol. 2020
Paediatric functional abdominal pain disorders.[J] .Nat Rev Dis Primers, 2020, 6: 88.
Rutten, J. M. T . M., Korterink, J. J., Venmans, L. M. A. J., Benninga, M. A. & T abbers, M. M. Nonpharmacologic treatment of functional abdominal pain disorders: a systematic review. Pediatrics 135, 522–535
Masuy, I., Van Oudenhove, L. & T ack, J. Review article: treatment options for functional dyspepsia. Aliment. Pharmacol. Ther. 49, 1 134–1 172 (2019)
Russell, A. C., Stone, A. L. & Walker, L. S. Nausea in children with functional abdominal pain predicts poor health outcomes in young adulthood. Clin. Gastroenterol. Hepatol. 15, 706–71 1 (2017)
Maragkoudaki, M. et al. Lactobacillus reuteri DSM 17938 and a placebo both significantly reduced symptoms in children with functional abdominal pain. Acta Paediatr. 106, 1857–1862 (2017).