-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
韦荣氏球菌属(Veillonella)是革兰氏阴性厌氧性微小球菌,直径0.3~0.5μm,初期培植为革兰氏阳性,过夜转为阴性。光学显微镜下为双球状、片状和短链状,无荚膜,无鞭毛,无芽孢。最适生长温度37℃,最适pH6.5~8.0。
Veillonella该属的成员是非发酵的,它们无法使用碳水化合物或氨基酸,不发酵无法葡萄糖或任何其他碳水化合物(除了有一个种发酵果糖外)或氨基酸,但它们会积极发酵发酵丙酮酸、乳酸、苹果酸、富马酸和草酰乙酸。胰蛋白酶-葡萄糖-酵母提取物肉汤中的主要代谢终产物是乙酸和丙酸。能代谢乳酸产生丙酸、CO2和H2。一些物种产生一种缺乏卟啉的非典型过氧化氢酶。大多数菌株产生气体,如H2S。
在动物和人的自然腔道中大量存在,是分布于口腔、咽部、呼吸道、消化道的常见菌群。其粘附于表面或与其他细菌并形成生物膜的能力对于肠道和口腔微生物群组成和功能至关重要,尤其是在口咽和肠道中。 在一些严重的感染过程中,如菌血症、骨髓炎和心内膜炎,在各种混合感染中起作用。常从软组织脓肿及血液中检出。青霉素已被建议作为韦韦氏菌属病原体感染的治疗选择 。
Veillonella属最早于1898年被Veillon和Zuber分离。Prevot在1933年进一步描述了这些细菌,并提出了目前的分类法。
大多数Veillonella菌是从脓肿,吸入性肺炎,烧伤,叮咬和鼻窦中回收的。在95%例患者中感染是多菌种,但在5%例患者中,纯培养物中回收Veillonella。与该菌检出相关的诱因条件是先前的手术,恶性肿瘤,类固醇治疗,异物和免疫缺陷。。
已知的Veillonella属中已描述了超过10种。
人类样品分离出(齿状Veillonella denticariosi,Veillonella dispar,Veillonella montpellierensis,Veillonella rogosae 和 Veillonella tobetsuensis)
非人类动物样品分离出(Veillonella caviae,Veillonella criceti,Veillonella magna,Veillonella ratti和Veillonella rodentium)
Veillonella atenty 从人和其他动物来源分离出。
它们的表型特征,包括形态,主要代谢终产物,产气,硝酸盐还原和琥珀酸脱羧,这些菌株被鉴定为Veillonella属的成员。 多基因座序列分析和相应的系统发育基于16S rRNA,dnaK和rpoB基因,以及新近提出的gltA基因。
其中一个重要的菌种,小韦荣球菌(Veillonella parvula)在120年前,当Veillon和Zuber将其从阑尾炎脓肿中分离出来时被发现并被描述。六十年后,同样的微生物被用于第一次观察外膜(OM),从而证明了革兰氏阴性和革兰氏阳性细胞包膜结构之间的关键区别。目前在包括口腔、肺、胃肠道和阴道内的人体多个生态位中发现了Veillonella parvula菌。Veillonella parvula可能在许多环境中发挥重要作用,但其主要生态位是作为口腔中的第二殖民者。
与口腔疾病
Veillonella是牙周炎的重要病原体,是舌苔中的本土口腔细菌,而且Veillonella附着在舌头上的能力很高,已被确定为硫化氢(H2S)的主要生产者,H2S是口腔恶臭的主要成分之一。并且在1份报告中,它是慢性上颌窦炎中最常见的厌氧性病原体。
口腔生物膜是一个多物种的社区,敌对双方共存,以保持社区成员的生态平衡。 在早期的口腔生物膜形成的各个阶段中,Veillonella作为早期定居物种可以与许多细菌形成聚集,包括最初的定居者戈登链球菌和牙周病原体Fusobacter nucleatum。 除了为许多微生物提供结合位点外,Veillonella还能为牙周病原体的生存和生长提供营养。 这些发现表明,Veillonella在口腔生物膜的发育和人类口腔生态学中起着重要的“架桥”作用。
Veillonella和链球菌在生态系统(如口腔和结肠)中发生代谢相互作用并经常共生,共存可能部分取决于它们在代谢中的相互作用的潜力。链球菌属参与糖的发酵,产生乳酸作为其主要发酵终产物。反过来,Veillonella也以利用乳酸作为碳和能源的能力而闻名。
全世界龋齿的患病率仍然很高。 当牙齿暴露于产酸微生物通过碳水化合物代谢产生的酸(如乳酸)环境下时,就会引发龋齿。 Veillonella是主要的口腔微生物之一,由于它们具有将乳酸转化为弱酸并从NO3产生NO2的能力,而NO2可以抑制链球菌的生长和代谢。因此,Veillonella被认为对预防龋齿有好处。但是Veillonella代谢乳酸的能力受口腔环境因素(即pH和乳酸)的调节。
与免疫相关
肠道是肠道菌群与粘膜免疫系统相互作用的关键部位。近年来,人们发现Veillonella对人类微生物组,感染和免疫发育的重要影响。研究发现Veillonella parvula是细胞因子和TLR2 / 6信号转导的有效诱导。链球菌与韦永氏菌的组合似乎可以抵消IL-12p70的产生,同时增强IL-8,IL-6,IL-10和TNF-α的反应。
Veillonella的存在与疾病缓解或疾病稳定相关。这些特定的细菌属可能是免疫检查点抑制剂的生物标志物。在单抗治疗的患者中,或许它们可能成为晚期胃癌的特异性生物标志物。
一项研究指出对免疫治疗有响应的患者体内,富含屎肠球菌(Enterococcus faecium),产气柯林斯菌(Collinsella aerofaciens),青春双岐杆菌(Bifidobacterium adolescentis),肺炎克雷伯菌(Klebsiella pneumonia),小韦荣球菌(Veillonella parvula), Parabacteroides merdae, 乳酸杆菌(Lactobacillus species)和长双歧杆菌(B longum)8个菌种。
最近的数据表明,Veillonella parvula可能在儿童早期免疫系统发育中起到保护作用和帮助作用。对婴儿的流行病学研究表明,Veillonella parvula的存在与哮喘、毛细支气管炎负相关,在有哮喘风险的儿童中,肠道中相对丰富的细菌属Veillonella的相对丰度显著降低。
Prevotella 作为革兰氏阴性菌,产生 LPS 进而诱发炎症反应。与此同时,该菌代谢产生的丙酸盐可以发挥抗炎症的作用。产生相互矛盾的结论背后或许是由于肠道微环境以及菌群构成的不同所导致的。当在肠道中 Veillonella 与唾液链球菌菌株 1 共培养时可降低炎性细胞因子的产生,而与菌株 2 共培养时炎性细胞因子的产生比各自单独培养时显著增加。
链球菌 和Veillonella在肠道微生物群的高丰度和种内遗传多样性,可能是这些菌对由于食物摄入量变化引起的营养物利用率变化而引起的高种群动态的主要驱动因素。这些动态的种群可能会深刻影响当地宿主与微生物之间的相互作用,从而调节肠道的生理和免疫系统功能。
与运动耐力相关
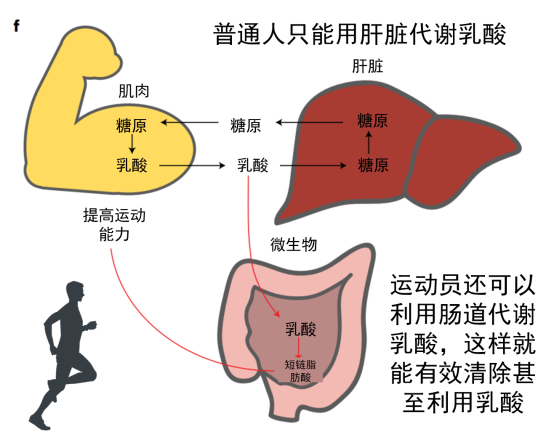
当我们跑步速度较慢时,糖和脂肪可以充分氧化分解成二氧化碳和水,并提供能量。但是,高强度运动后往往会出现肌肉酸痛现象,这是因为运动超过了有氧运动强度,导致葡萄糖通过无氧呼吸在体内代谢产生了乳酸,乳酸堆积会引起局部肌肉酸痛。
体内堆积的乳酸一部分继续分解成丙酮酸,再进一步被分解为二氧化碳和水,一部分则进入肝脏,乳酸可以再次合成糖原,这个过程称为糖异生。
Scheiman及其同事发表在《自然医学》(Nature Medicine)上文章研究了肠道微生物组对精英跑步者运动表现的影响,并确定了属于Veillonella属的一种能增强性能的微生物。比赛结束后,马拉松长跑运动员中富集了非典型的Veillonella atypica菌种。Veillonella 利用乳酸作为碳源, 分析发现乳酸到丙酸的代谢通路的运动后运动员中富集。
图片来源:慧跑
与其他厌氧菌不同,Veillonella atypica具有通过三羧酸循环的乳酸代谢的完整途径。Veillonella细菌可以将乳酸变成丙酮酸,而且体内产生的乳酸可以穿过上皮屏障进入肠腔,也就是说运动中体内积累的乳酸可以运输到肠道,肠道中的veillonella细菌就可以分解乳酸了。
在这个过程中,会产生丙酸,而丙酸可以提高小鼠心率和氧气利用率,丙酸还可以促进人体的新陈代谢。为了验证丙酸是否可以改善运动性能,研究人员给一些小鼠使用丙酸灌肠。与喂食Veillonella atypica 菌株的小鼠相同,这些使用丙酸灌肠的小鼠的运动时间也明显增加了。科学家们还给小鼠注射了可以追踪的乳酸,发现这些乳酸会进入到肠道。 而且乳酸有助于这种微生物的生长。
总的来说,葡萄糖因肌肉运动产生乳酸,一部分乳酸通过血液循环进入肝脏,在肝脏中通过糖异生作用重新合成葡萄糖;一部分乳酸通过血液循环进入肠道,肠道中的Veillonella属细菌迅速将乳酸分解成丙酸,从而降低乳酸浓度,改善运动表现。
哺乳动物肠道微生物组可能会通过肌肉衍生的乳酸代谢为丙酸酯来为其宿主提供额外的跑步耐力能力提升。 此外,由于在多个独立的人体研究中,相对于久坐的控制者,经常运动者中的Veillonella菌增加了,这增加了这些微生物通过利用独特的代谢环境(L-乳酸代谢)而在运动员的肠道中具有适应性优势的可能性。 这可能会导致积极的反馈循环,从而以较小的能力加强锻炼。 换句话说,由于预期重复运动会导致肠道L-乳酸浓度增加,L-乳酸代谢物的代谢位扩大,因此,这些L-乳酸代谢物反过来有望提高运动的耐力。
与其他疾病
自闭症
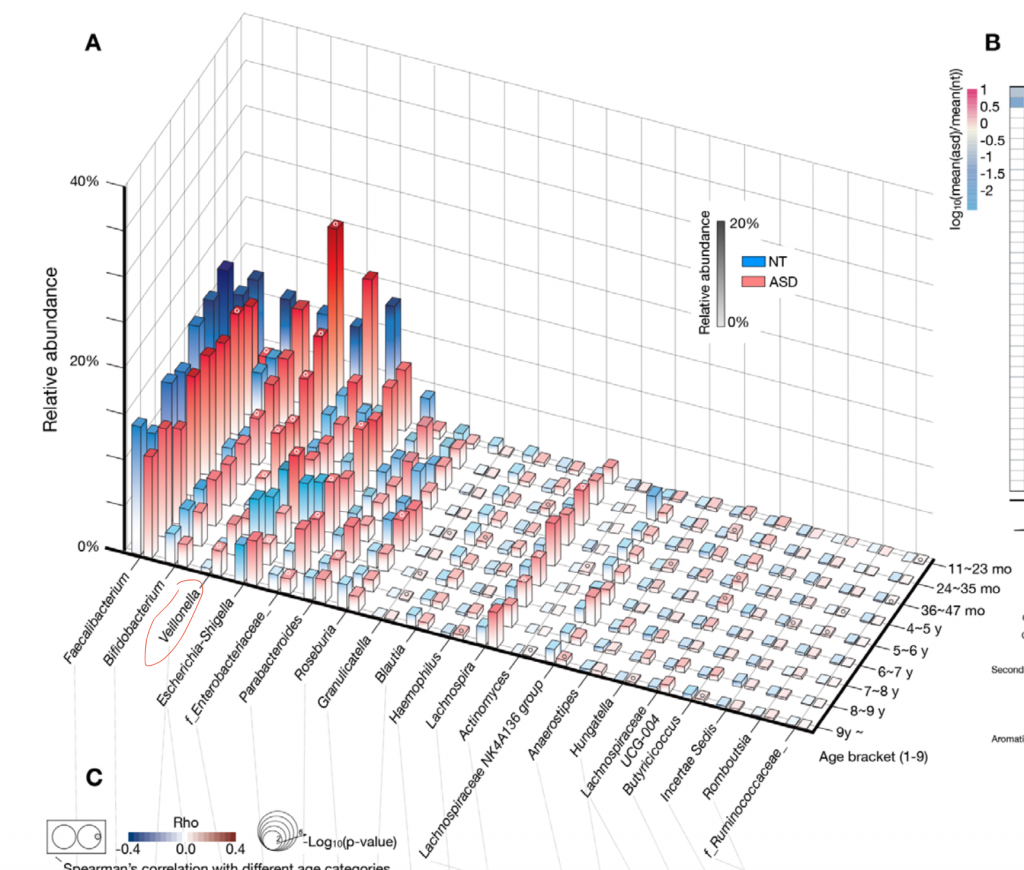
最新的发表在CELL和谷禾健康2019年发表在GUT上的队列都表明,未来发展为自闭症谱系障碍的儿童早期肠道内Veillonella菌富集,比对照儿童显著增加。
原发性硬化性胆管炎
原发性硬化性胆管炎(PSC)是一种罕见的、以肝内外胆管受损为主要特征的原发疾病,易导致胆管炎症和肝纤维化的发生而原发性硬化性胆管炎。
PSC患者肠道菌群某些菌群丰富度也会产生相应变化。特别是韦荣球菌(Veillonella)、肠球菌(Enterococcus)和链球菌(Streptococcus),其丰度显著升高。Veillonella可以通过肠道淋巴细胞进入肝脏。而肠球菌则是一种对万古霉素敏感的细菌,它可以通过分泌金属蛋白酶分解上皮钙黏蛋白破坏肠屏障。
肝病
在NAFLD和NASH中有几项研究确定,随着纤维化的进展,微生物群结构和功能恶化。晚期纤维化和NASH与碳水化合物和脂质代谢的变化有关,因为他们观察到相应功能的细菌含量增加。酒精性肝炎患者或肝脏疾病患者中Veillonella和Enterococcus丰度显著增加,而Veillonella parvula的丰度与白蛋白和血小板计数呈负相关。事实上,在所有3项肝硬化研究中,患者体内的几种Veillonella species的丰度都发生了改变。
肺癌
与对照组相比,肺癌患者的口腔菌群增加,特别是Streptococcus和Veillonella。口腔菌群的增加与PI3K和ERK上调有关。在体外实验中,气道上皮细胞暴露于Veillonella,Prevotella和Streptococcus也会导致ERK和PI3K通路上调(Tsay et al,2018)。PI3K通路被认为是肺癌发生的早期事件,因此共生微生物群失调会上调该通路促进肺癌发生。
胰腺癌
结果显示患有胰腺癌的病人组中三种口腔微生物Streptococcus,Treponema和Veillonella的组分显著低于其他组别。
其他
子痫前期患者会富集 Fusobacterium, Veillonella,Clostridum 等这些细菌。剖腹产的新生儿粪便微生物群富含Veillonella dispar/V这表明皮肤、口腔微生物以及出生过程中周围环境中的细菌是第一批在这些婴儿中定殖的细菌。
与对照组相比,后发展为T2D的研究对象Veillonella dispar的丰度较低,结果表明肠道菌群中的该物种可能与参与宿主血糖调节。
在肥胖的男性中观察到韦荣氏球菌属(Veillonella)和产甲烷短杆菌属(Methanobrevibacter)高于女性。 在吸烟人群中,Veillonella dispar的脂多糖生物合成通路相关的基因出现频率较高。
口腔,捏着呼吸道的脉搏,牙好胃口好,也不是句空话。Veillonella作为口腔和肠道的重要“居民”,它的定植,丰度以及与其他菌落共存的能力决定和影响着人体的口腔和消化道甚至肝肺胃疾病。
相关阅读:
主要参考文献:
Yu Sunakawa, et al. Genomic pathway of gut microbiome to predict efficacy of nivolumab in advanced gastric cancer: DELIVER trial (JACCRO GC-08). ASCO GI. Jan 15-17, 2021. ABSTRACT 161.
Jackson, M.A., Goodrich, J.K., Maxan, M.-E., Freedberg, D.E., Abrams, J.A., Poole, A.C., Sutter, J.L., Welter, D., Ley, R.E., Bell, J.T. et al. (2015) Proton pump inhibitors alter the composition of the gut microbiota. Gut, 65, 749-756.
Shi, Y.-C., Cai, S.-T., Tian, Y.-P., Zhao, H.-J., Zhang, Y.-B., Chen, J., Ren, R.-R., Luo, X., Peng, L.-H., Sun, G. et al. (2019) Effects of Proton Pump Inhibitors on the Gastrointestinal Microbiota in Gastroesophageal Reflux Disease. Genom Proteom Bioinform, 17, 52-63.
Bajaj, J.S., Acharya, C., Fagan, A., White, M.B., Gavis, E., Heuman, D.M., Hylemon, P.B., Fuchs, M., Puri, P., Schubert, M.L. et al. (2018) Proton Pump Inhibitor Initiation and Withdrawal affects Gut Microbiota and Readmission Risk in Cirrhosis. 113, 1177-1186.
Wang L, Yu X, Xu X, Ming J, Wang Z, Gao B, Xing Y, Zhou J, Fu J, Liu T, Liu X, Garstka MA, Wang X and Ji Q (2021) The Fecal Microbiota Is Already Altered in Normoglycemic Individuals Who Go on to Have Type 2 Diabetes. Front. Cell. Infect. Microbiol. 11:598672. doi: 10.3389/fcimb.2021.598672
Wong-Rolle A, Wei HK, Zhao C, Jin C. Unexpected guests in the tumor microenvironment: microbiome in cancer. Protein Cell. 2020 Dec 9. doi: 10.1007/s13238-020-00813-8. Epub ahead of print. PMID: 33296049.
Metagenomic analysis of bacterial species in tongue microbiome of current and never smokers 03-13, doi: 10.1038/s41522-020-0121-6
Scheiman J, Luber JM, Chavkin TA, MacDonald T, Tung A, Pham LD, Wibowo MC, Wurth RC, Punthambaker S, Tierney BT, Yang Z, Hattab MW, Avila-Pacheco J, Clish CB, Lessard S, Church GM, Kostic AD. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism. Nat Med. 2019 Jul;25(7):1104-1109. doi: 10.1038/s41591-019-0485-4. Epub 2019 Jun 24. PMID: 31235964; PMCID: PMC7368972.
Djais AA, Theodorea CF, Mashima I, Otomo M, Saitoh M, Nakazawa F. Identification and phylogenetic analysis of oral Veillonella species isolated from the saliva of Japanese children. F1000Res. 2019 May 3;8:616. doi: 10.12688/f1000research.18506.5. PMID: 31448103; PMCID: PMC6688723.
Mashima I, Theodorea CF, Djais AA, Kunihiro T, Kawamura Y, Otomo M, Saitoh M, Tamai R, Kiyoura Y. Veillonella nakazawae sp. nov., an anaerobic Gram-negative coccus isolated from the oral cavity of Japanese children. Int J Syst Evol Microbiol. 2021 Jan;71(1). doi: 10.1099/ijsem.0.004583. Epub 2020 Dec 2. PMID: 33263509.
Rovery C, Etienne A, Foucault C, Berger P, Brouqui P. Veillonella montpellierensis endocarditis. Emerg Infect Dis. 2005 Jul;11(7):1112-4. doi: 10.3201/eid1107.041361. PMID: 16022792; PMCID: PMC3371781.
Maqsood A. Bhatti, Michael O. Frank, Veillonella parvula Meningitis: Case Report and Review of Veillonella Infections, Clinical Infectious Diseases, Volume 31, Issue 3, September 2000, Pages 839–840, 0人

谷禾健康
一个多世纪前,埃利·梅奇尼科夫提出了人类健康和预期寿命可以通过操纵肠道菌群来改善的概念。
现在,科学家们已经将目光投向了如何利用微生物来促进人类健康。
来自美国国立卫生研究院国家过敏症和传染病研究所的Stacy及其同事的最新研究表明,有感染史的肠道菌群能够为宿主提供更强的抗感染力。也就是说急性感染后,共生微生物群也可以被“训练”以增强对异源感染的定植抗性。
定植抗性:微生物群阻碍病原体入侵肠道生态系统,这种现象称为定植抗性。定植抗性是肠道微生物群的原始功能之一,为宿主提供了明显的益处。
训练免疫:感染或免疫可以重新编程先天免疫细胞,产生对后续感染具有广泛保护作用的记忆反应,这一过程被称为“训练免疫”。
肠道微生物群是宿主防御网络的基础。除了塑造免疫系统的发展和维护,共生微生物通过战胜病原体获得必需的营养物质和分泌抗生素来确保宿主(和它们自己)的生存,这些因素共同使肠道成为入侵的病原菌不可生存的环境。
肠道微生物群的训练总览
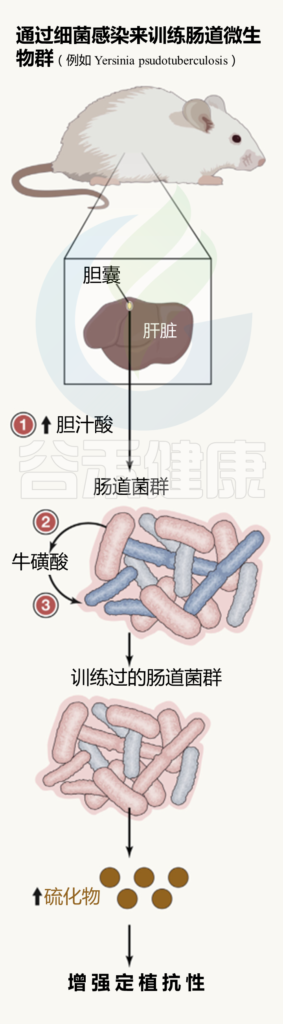
最初的肠道感染后:
( 如Y. pseudotuberculosis )
(1) 肝脏中与牛磺酸结合的胆汁酸产生增加,储存在胆囊,并释放到肠道;
(2) 在肠道中,胆汁酸被特定的微生物群化学解共轭;
(3)牛磺酸变得可利用,导致产生硫化氢的细菌大量繁殖,从而阻止肠道病原体的有氧生长。
下面我们来看Stacy等人是如何一步步进行的实验探究过程。
Stacy等人在研究中发现,与实验室特有的无病原体(SPF)微生物群的小鼠相比,拥有野生小鼠(即WildR)微生物群的自交系小鼠表现出对致命病毒感染的增强保护。
在这里,作者还发现野生小鼠比SPF小鼠对肠道肺炎克雷伯菌感染更具抵抗力。考虑到WildR小鼠的未知感染史,作者用肺炎克雷伯菌对以前感染过急性Yersinia pseudotuberculosis ( post-△yopM) 的SPF小鼠进行了挑战。
值得注意的是,post-△yopM 的小鼠在初次感染后的至少15周内对肺炎克雷伯菌感染的抵抗力也更强。与SPF重建的对照组相比,用post-△yopM小鼠的粪便重建无菌小鼠也增强了对肺炎克雷伯菌感染的保护,这证实了微生物群在抗性中的作用。
这些结果表明,感染史可以改变肠道微生物群,从而诱导定植抗性,因此称为“微生物群训练”。
Stacy等人使用代谢组学方法记录了清除了假结核杆菌Y. pseudotuberculosis△yopM的小鼠肠道中胆汁酸水平的升高。微生物群对初级胆汁酸的解偶联释放了偶联组分,如牛磺酸。
注:牛磺酸在胰腺中合成,对肌肉和大脑发育至关重要,是哺乳动物中最丰富的游离氨基酸。最近发现牛磺酸可以激活杯状细胞中的NLRP6炎症小体,并通过肠道上皮细胞调节稳定状态的抗微生物肽的产生。
在短暂的假结核杆菌感染后牛磺酸水平升高。之前的研究表明,牛磺酸支持解决肠道炎症和清除肠道病原体的柠檬酸杆菌感染。
他们发现,补充牛磺酸会损害柠檬酸杆菌C. rodentium和肺炎克雷伯菌的肠道定植。而当补充给无菌小鼠时,牛磺酸对肠道感染没有影响,这表明它通过调节共栖群落而不是直接影响病原体。
从机制上讲,牛磺酸可增强微生物群中硫化物的产生,硫化物是细胞呼吸的抑制剂,这是宿主被多种病原体入侵的关键。
Stacy等人用16S rDNA和宏基因组测序来解决这个问题。肠道炎症通常与肠杆菌科(Enterobacteriaceae)的大量繁殖有关。
参与对抗感染菌– δ 变形菌 Deltaproteobacteria
他们发现,与对照组小鼠相比,清除假结核杆菌△yopM感染的小鼠微生物群中变形菌门增加,特别是δ 变形菌纲(Deltaproteobacteria)。
宏基因组学揭示,δ 变形菌纲的这种繁殖导致感染小鼠的硫代谢途径增加。虽然在感染后的微生物群中没有发现代谢硫的菌(δ 变形菌纲Bilophila wadsworthia),但当补充到无菌小鼠中时,足以提高对肺炎克雷伯菌的定殖抗性。
牛磺酸的施用同样影响了微生物群;然而,这些变化与post-Yersinia状态相当不一致,包括梭状芽孢杆菌而不是δ变形菌的增殖。这些不一致的分类变化表明,仅补充牛磺酸并不能完全重现共生微生物群的感染后状态,多种因素和微生物群可能能够增强对继发感染的定殖抗性。
Stacy等人通过宏基因组学检测牛磺酸处理过的小鼠微生物组,发现与post-Yersinia菌感染后的微生物组相似,编码异化亚硫酸盐还原酶(dsr)的基因得到了富集。这种蛋白质参与牛磺酸酶转化为硫化物的最后一步。
当牛磺酸调节的微生物群在体外培养中暴露于牛磺酸时,会产生更多的硫化氢,这与肠道中牛磺酸水平较高支持能将这种代谢物转化为硫化物的物种生长的观点一致。
重要的是,硫化氢通过抑制细胞色素氧化酶来限制有氧呼吸,而细胞色素氧化酶是病原体在不可发酵的底物上进行有氧呼吸和生长的常用物质。因此,牛磺酸依赖的硫化氢的产生可能通过阻断有氧呼吸来提高定植抗性。
原发感染后牛磺酸代谢菌群的扩张增强了对继发感染的定植抗性
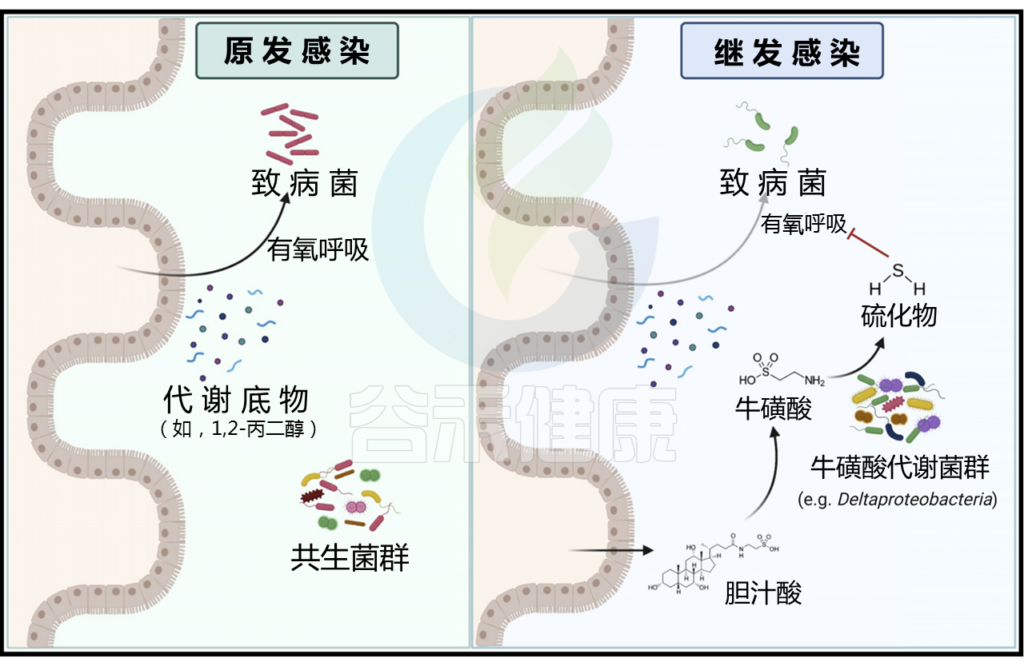
在原发感染(左)期间,病原体通过有氧发酵利用代谢底物,如1,2-丙二醇。清除感染后,宿主产生的胆汁酸水平增加,可以通过共生微生物群与牛磺酸解偶联。牛磺酸反过来被代谢成硫化物,抑制有氧呼吸,从而增强对继发感染的定植抗性(右)。
Stacy等人用两种方法验证:
(1) 使病原体不能在不可发酵的物质上生长
Stacy等人对肺炎克雷伯菌进行了高通量转座子测序。他们让12000个转座子突变体通过小鼠,然后测序,以确定与输入库相比丢失的突变体。
在未感染的小鼠中,导致细菌适应的因素包括与1,2-丙二醇利用有关的基因以及与细胞色素氧化酶bd-II同源的假定氧化酶。因此,肺炎克雷伯菌在低氧环境下对1,2丙二醇作用最为有利,低氧环境受硫化物抑制。
此外,缺乏在1,2-丙二醇或细胞色素氧化酶II上生长能力的肺炎克雷伯菌突变体在体内被它们的野生型对应物所取代,但当牛磺酸被补充到肠道生态系统中时却没有这种情况,表明牛磺酸破坏了病原体在1,2-丙二醇上的呼吸和生长能力。
(2) 隔离硫化氢
Stacy等人使用铋来隔离硫化物。铋对小鼠的处理阻止了微生物群产生硫化氢,导致了具有有氧呼吸功能的细菌数量的增加。
重要的是,铋处理还增加了对肺炎克雷伯菌感染的易感性,突出了硫化物隔离对定植抗性的影响。
这种对继发感染的增强抗性似乎是高度非特异性的,因为弱毒假结核分枝杆菌的初次感染可以防止肺炎克雷伯氏菌或柠檬酸杆菌的继发感染。
事实上,Stacy等人使用“wildR”小鼠的微生物群发现了相同的效果,这些小鼠是无菌小鼠,与野生小鼠的微生物群一起定居,野生小鼠可能有许多肠道感染的历史。
野生小鼠的肠道也显示出δ变形菌纲的扩张,但牛磺酸的水平降低而不是升高,这表明感染后牛磺酸可能会随着时间的推移而消耗,或者是不同的机制导致了这些小鼠中δ变形菌纲的大量繁殖。
Stacy等人没有用相同的病原体进行原发性和继发性感染,因此尚不清楚保护机制是否也适用于这种情况,以及增强定殖抗性的进化目的论是否是为了避免用相同的病原体进行二次感染。同样,确定感染后微生物群是否对不依赖硫化物敏感有氧呼吸的病原体无效也很重要。
Stacy等人的发现也存在一些问题。
首先,为什么在成功清除感染后胆汁酸分泌持续升高?
作者在post–Yersinia感染后的小鼠中发现了增大的胆囊,但这可能不是主要原因。
二、这种增强的殖民抵抗的状态持续多久?
Stacy等人在post-Yersinia感染后15天观察到,接受来自小鼠体内微生物群的无菌小鼠的定殖减少,但尚不清楚肠道牛磺酸水平是否表现相似,以及保护作用是否在超过15天的时间内减弱。
同样,确定多轮感染是否会进一步增强最终的定植抗性能力也很有意思。
Stacy等人的工作使用了生物化学、微生物学和生物信息学方法等,不仅形成了一个关于感染史如何导致肠道-肝脏保护轴的新概念框架,使“微生物群记忆”的概念得到推广,还提供了对宿主及其微生物群之间存在的互利途径的新见解。
这可能是通过精确调节微生物群来提高抗病原体入侵能力的重要一步。
相关阅读:
主要参考文献:
Stacy, A., Andrade-Oliveira, V., McCulloch, J.A.,Hild, B., Oh, J.H., Perez-Chaparro, P.J., Sim, C.K., Lim, A.I., Link, V.M., Enamorado, M., et al. (2021). Infection trains the host for microbiota-enhanced resistance to pathogens. Cell 184, this issue, 615–627.e18
Wong Andrea C, Levy Maayan,Microbial memories.[J] .Immunity, 2021, 54: 201-204.
King Irah L,Divangahi Maziar,Training the metaorganism: the microbial counterpart.[J] .Cell, 2021, 184: 574-576.
Rosshart, S.P., Vassallo, B.G., Angeletti, D.,Hutchinson, D.S., Morgan, A.P., Takeda, K., Hickman, H.D., McCulloch, J.A., Badger, J.H., Ajami, N.J., et al. (2017). Wild Mouse Gut Microbiota Promotes Host Fitness and Improves Disease Resistance. Cell 171, 1015–1028.

谷禾健康
当生命逐渐衰老时,肠道微生物群的脆弱性和随之而来的疾病易感性显得更加突出。
老年人肠道菌群中双歧杆菌、普氏栖粪杆菌(Faecalibacterium prausnitzii)和XIVa梭菌的丰度减少,而产气荚膜梭菌(Clostridium perfringens)、大肠杆菌、肠球菌、链球菌、葡萄球菌、肠杆菌的丰度增加。
因此,衰老的人类肠道微生物群显示出与短链脂肪酸(SCFAs)生产相关的基因缺失和糖分解能力下降,淀粉、蔗糖、半乳糖、糖酵解和糖异生代谢途径的表达降低;伴随着纤维分解微生物的损失;以及蛋白水解功能的全面增强。
益生元低聚半乳糖(GOS)对肠道健康有广泛的有益影响。近日,来自美国北卡罗莱纳大学医学院的研究人员在《Microbiome》上发表文章,题为《益生元低聚半乳糖对衰老肠道的多效性作用》。

在这项研究中,研究人员确定了GOS饮食对肠道老化特征的影响。
在艰难梭状芽胞杆菌感染的小鼠模型中,研究人员还评估了短期喂养低聚半乳糖是否会影响衰老的肠道对抗生素挑战的反应。最后,评估结肠类器官是否能复制体内观察到的低聚半乳糖应答-非应答表型。
老年动物有一个独特的微生物组,其特征是非糖化细菌与糖化细菌的比例增加,相应地,β-半乳糖苷酶的丰度较低。
低聚半乳糖降低了总体多样性,增加了特定的糖化细菌(拟杆菌和乳酸杆菌的种类)的丰度。
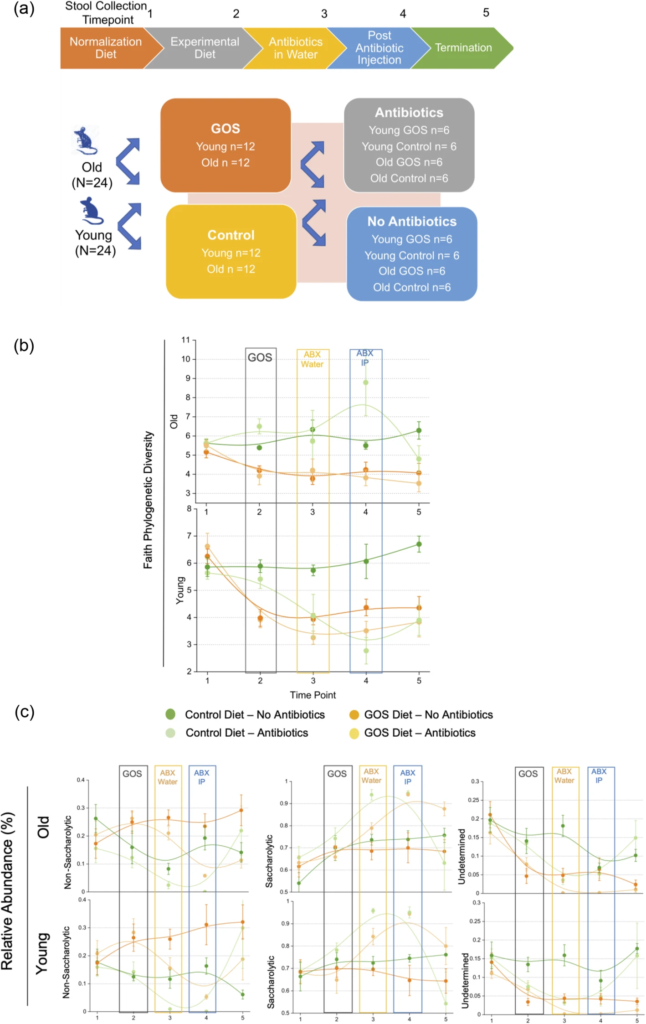
增加了幼年和老年动物中β-半乳糖苷酶的丰度,并增加了非糖化生物;但是,没有观察到强有力的、均匀的双歧作用。
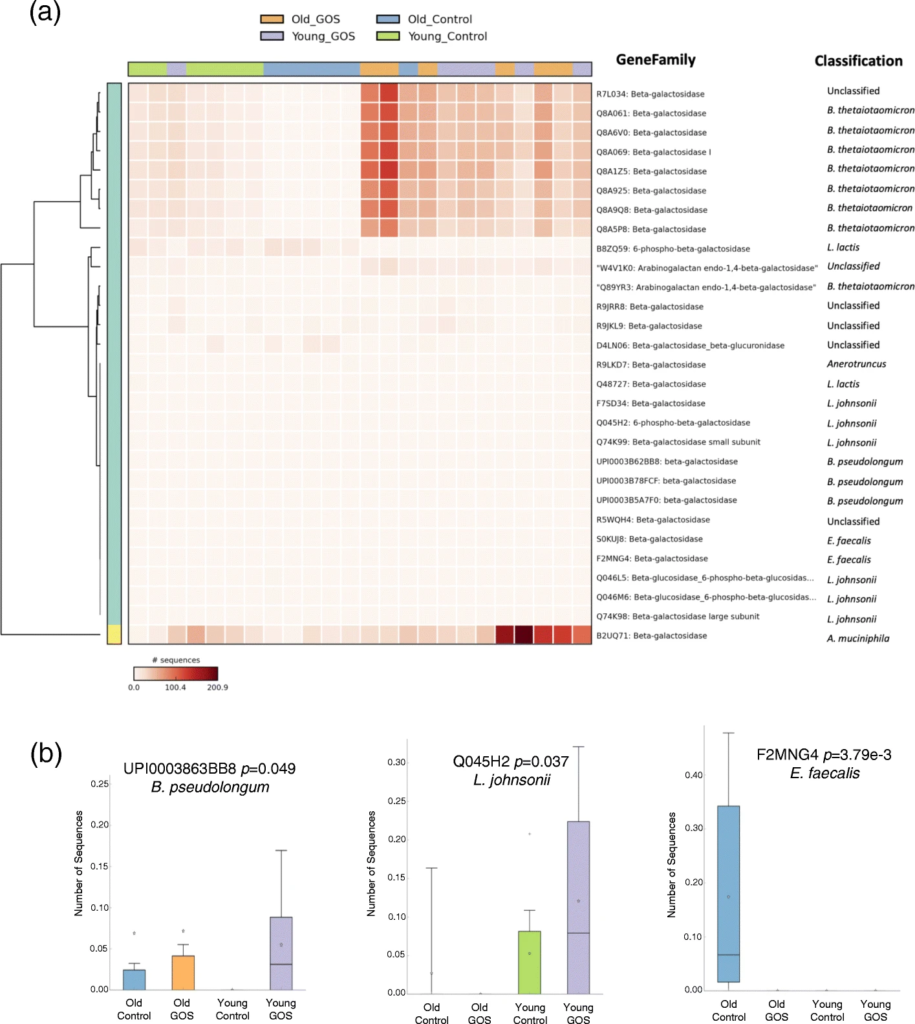
低聚半乳糖降低了老年小鼠与年龄相关的肠通透性增加,增加了MUC2 的表达和黏液厚度。
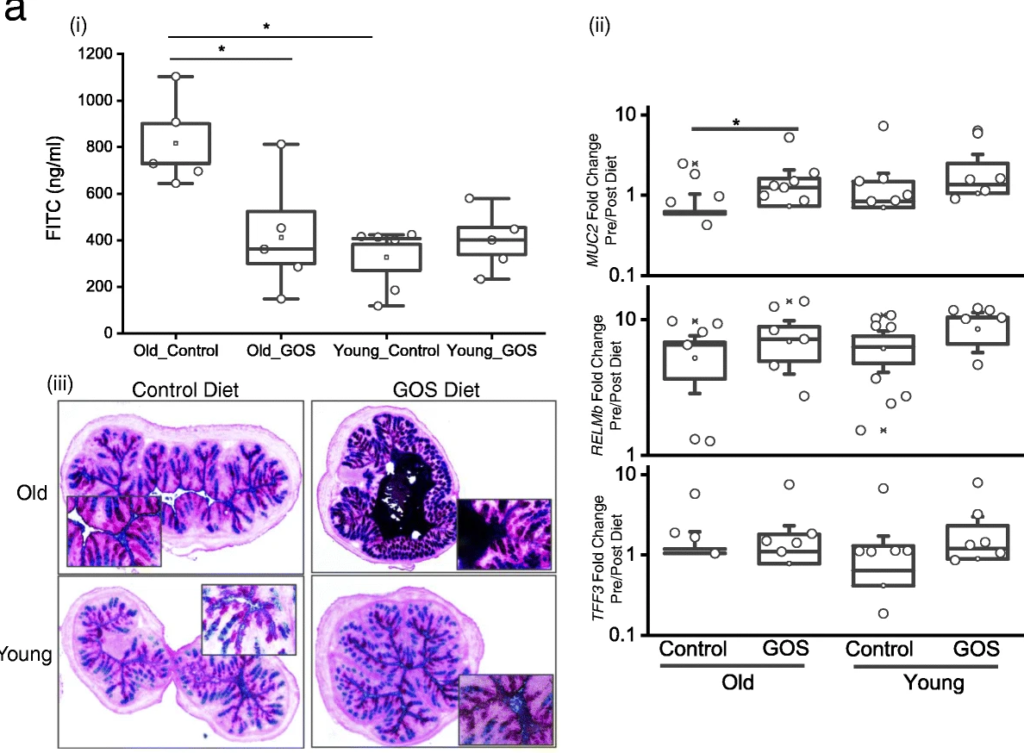
抗生素降低了老年小鼠双歧杆菌的丰度,同时增加了阿克曼菌、梭状芽孢杆菌、粪球菌、芽孢杆菌、拟杆菌和瘤胃球菌。
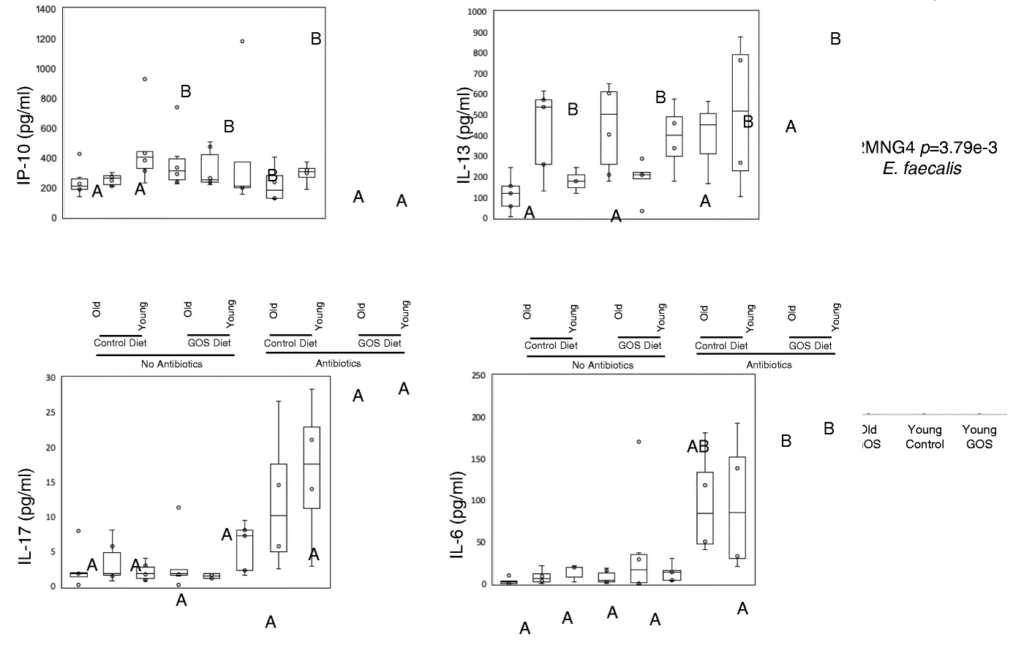
抗生素在调节血清炎症标志物方面比低聚半乳糖更有效。在抗生素组的对照组和低聚半乳糖饮食中观察到较高的血清IL-17和IL-6水平,并且在这些组中,无论年龄大小,低聚半乳糖组的IL-6水平较高,并且与对照饮食组的幼年动物相比,老年动物的IL-6水平较高。
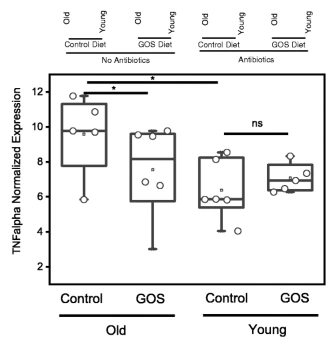
RTqPCR显示老年小鼠远端结肠组织中TNFα的基因表达显著增加,低聚半乳糖饮食降低了这种表达。
结肠转录组学分析显示,在年老的动物中,小分子代谢过程,特别是呼吸体相关基因的表达增加,这可能表明氧化代谢和能量效率增加。
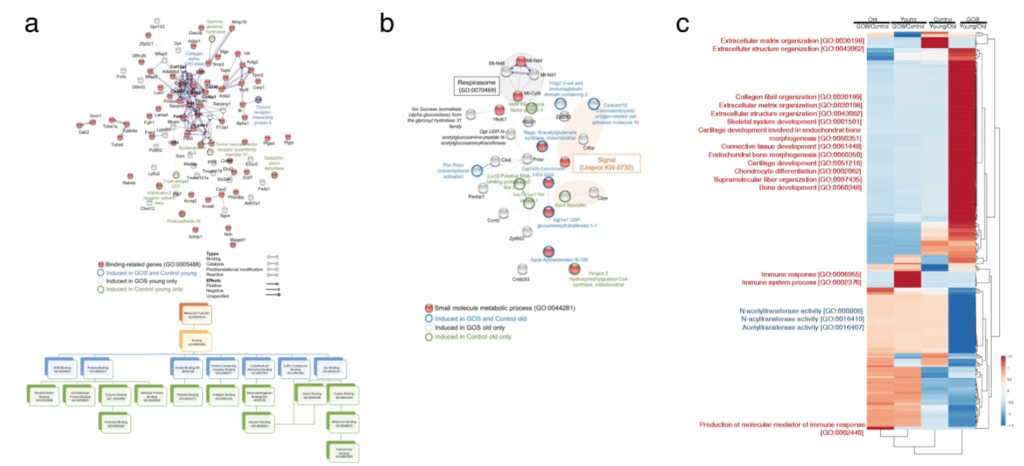
在幼龄小鼠中,低聚半乳糖诱导了结合相关基因的表达。半乳糖凝集素基因Lgals1是一种β-半乳糖结合凝集素,通过其糖基连接分子,是免疫应答的重要调节剂,PI3K-Akt和ecm受体相互作用通路也在年轻小鼠中被诱导。
在益生元存在的情况下,将GOS注射到结肠类有机物中,小鼠粪便显示出不同的双歧作用,重现了体内观察到的应答和非应答表型,这表明微生物群的组成和功能是表型的主要贡献者。
膳食GOS通过促进微生物组分和宿主基因表达的变化来调节老化肠道的内稳态,这种变化转化为降低肠道通透性和增加粘液生成。
年龄是益生元如何影响肠道上皮细胞的微生物组和表达的决定因素,尤其是在年轻而非老年小鼠中诱导半乳糖凝集素-1时更为明显。
相关阅读:
参考文献:
Arnold Jason W,Roach Jeffery,Fabela Salvador et al. The pleiotropic effects of prebiotic galacto-oligosaccharides on the aging gut.[J] .Microbiome, 2021, 9: 31.0人点赞日记本

谷禾健康
大部分人都遭受过头皮屑的困扰。头皮屑虽然看起来不是严重的疾病,但有时候足以令人头疼和尴尬,影响整体生活质量。

头皮屑是一种非常常见的皮肤病,无论年龄,性别等,任何人都可能会有。
头皮屑通常看起来像油腻的皮肤片,如果飘落在深色衣服上更加明显。在头皮上,它也可能表现为皮肤的鳞片状斑点,有时伴有发红、发痒或发炎。
头皮表面为微生物提供了独特的微环境,主要来自宿主的生理条件,包括皮脂含量,水分,pH值等。
头皮屑与多种可能的原因有关,包括卫生差,压力大和饮食不当,当然头皮屑的产生也离不开微生物群。
微生物包括真菌和细菌。
真菌
少量脱落实际上是正常的,因为皮肤细胞会死亡,以便形成新的皮肤。然而,在某些情况下,由于一种或多种潜在的问题可能会使头皮真菌的过量生长,导致剥落异常大量。
头皮表面发现的最多的真菌是马拉色菌(malassezia)。这种真菌生活在头皮上,以皮肤油脂为食。
马拉色菌里有限制性马拉色菌、球形马拉色菌等,不同种类的马拉色菌的致病性不同,并适应人体皮肤的不同部位,这主要归因于宿主的生理条件(皮脂,免疫反应,汗液等),环境(温度,湿度,紫外线暴露)以及其他微生物的存在。
其中限制性马拉色菌与球形马拉色菌的比例较低与健康的头皮有关。
当球形马拉色菌利用脂肪酶代谢其消耗的油脂时,会产生一种副产物——油酸,该副产物渗透到头皮并引起头皮屑。
功能分析表明,真菌菌群主要通过与头皮屑头皮细胞-宿主粘附有关的途径富集。马拉色菌的粘附与头皮角质层屏障功能受损有关,可能进一步有助于头皮屑区马拉色菌的发育。
与健康头皮相比,头皮屑头皮中还发现了大量与一般功能和遗传信息处理相关的通路(硫中继系统、蛋白酶体通路、酵母细胞周期和减数分裂等),且与限制性马拉色菌呈显著正相关。
“酵母细胞周期”和“减数分裂”是参与真菌细胞周期和增殖的重要通路,这两通路在头皮屑头皮上的较高数量表明,它们在头皮屑头皮上的马拉色菌的增殖中起作用。
“蛋白酶体通路”与包膜的形成有关,包膜是真菌的主要致病决定因素。

细菌
头皮表面发现的最丰富的两个细菌属是Cutibacterium菌(健康头皮)和葡萄球菌(头皮屑头皮)。
研究表明,与健康人群相比,头皮屑患者的限制性马拉色菌和葡萄球菌的丰度较高(p <0.05)。
不同的葡萄球菌丰度变化也不同。
与健康人群相比,头皮屑患者头皮上表皮葡萄球菌的丰度减少,而同时头状葡萄球菌的丰度显著增加。头状葡萄球菌丰度的增加足以驱动头皮屑损伤部位葡萄球菌绝对物种丰度的总体增加。
细菌菌群的功能分析显示出,健康头皮与以下代谢相关通路明显高于头皮屑头皮:
氨基酸:丙氨酸、天冬氨酸、谷氨酸、精氨酸、脯氨酸、赖氨酸、组氨酸、半胱氨酸、蛋氨酸代谢;
维生素:维生素B6,B7
其他辅助因子:卟啉,叶绿素,烟酸和烟酰胺代谢,泛醌和其他萜醌的生物合成。
这些头皮微生物群合成的维生素、生物素、氨基酸等被头皮角质形成细胞吸收,为头皮提供营养,在保持头发和头皮健康以及控制头皮屑方面起着有益的作用。
可能引起头皮屑的一些潜在潜在问题包括:
•皮肤状况-例如脂溢性皮炎,湿疹和牛皮癣,会增加头皮屑的风险。
•神经系统疾病-发现患有帕金森氏症等神经系统疾病的人更容易患头皮屑。
•洗护用品的刺激-购买的洗护品含有许多化学物质,可能会刺激头皮并导致发炎,发痒和脱落。
•不良的饮食习惯-摄入含锌和B族维生素的食物不足,可能会导致头皮屑。
•年龄-虽然说任何年龄的任何人都可能患有头皮屑,但往往在年轻人和中年人中更为普遍。
•气候-冬季的寒冷天气可能促进头皮中酵母样真菌的生长。
•激素-体内激素的变化可能会影响头皮的天然皮脂分泌。激素失调的人更容易有头皮屑。

为了想要尽快清除头皮屑,有人会选择含药的洗发水。但是,药用洗发水真的可以治愈头皮问题吗?
首先,含药的洗发香波只有在您持续使用时才有效-它们不能彻底治愈头皮屑。这就意味着,必须要每周使用几次这种洗发水才能看到效果,一旦停止使用,头皮屑很可能卷土重来。

这些洗发剂大多数都含有抗真菌成分,例如酮康唑。虽然可以有效控制头皮屑,但连续使用会刺激头皮,并使头发变得蓬松干燥。
其他药用去屑洗发水也可能含有煤焦油,煤焦油是通过延迟皮肤细胞再生的过程来控制头皮屑。但是,煤焦油是已知的致癌物质,因此最好避免含有这种成分的洗发水。
皮肤会吸收施加的任何物质,自然疗法是最佳选择。
盐
快速去除头皮屑且不使用任何有害化学物质的最安全方法之一是:用盐来去除片状头皮屑。
在洗澡之前,将盐轻轻按摩到干头皮上,使头发在漂洗时更容易去除。
椰子油
椰子油可以帮助改善水合作用,减少刺激感,并防止真菌在头皮上生长。恢复头皮的水分有助于止痒。

根据一项临床试验的结果,在117名1-13岁的儿童中,将纯净的椰子油涂在皮肤上可使特应性皮炎症状减少68.23%。当然也需要进行更多研究,以评估椰子油在治疗头皮屑中的作用。
椰子油的保湿和抗菌特性,使其成为抵抗干燥的绝佳自然选择。
茶树油
使用茶树油治疗头皮屑也是比较快速简便的。有研究人员认为茶树油中的化合物可以有效控制表皮葡萄球菌。

只需在头皮上按摩几滴茶树油,可减少瘙痒和多余油脂的产生。也可以在洗发水中混合几滴茶树油。
芦荟凝胶
芦荟是一种多汁植物,以其愈合特性而闻名。叶片中的凝胶含有几种生物活性化合物,例如氨基酸和抗氧化剂,可减少头皮屑。
2019年一项研究检查了23项涉及芦荟的临床试验。这些研究的结果表明,芦荟凝胶可以改善皮肤中的水分保留并促进伤口愈合。芦荟还可以减轻炎症,这可以帮助有头皮屑症状的人减轻症状,例如发痒。
2015年的研究表明,芦荟的抗菌性能可预防头皮屑。

饮 食
头皮屑通常与不良饮食有关,首先请开始调整饮食习惯。
Omega-3脂肪酸
Omega-3脂肪酸可以降低血压,增加“良好的” HDL胆固醇水平,并支持心脏和大脑健康。这种脂肪酸的缺乏会导致不良症状,例如头皮屑,指甲变脆和皮肤干燥。
锌
锌是支持人体免疫系统并促进细胞生长的矿物质。可以从动物蛋白,坚果等获取锌。

根据NIH研究表明,严重的锌缺乏与脱发、腹泻、皮肤损伤等有关。
2016年的一研究将缺锌列为脂溢性皮炎和头皮屑的潜在诱因。
减少糖和谷物
应该减少糖和谷物的摄入,因为已知这些会促进酵母或真菌的过度生长。
水果
水果和蔬菜含有许多必需的维生素,矿物质和抗氧化剂,可以帮助减轻炎症。

一项涉及4379人的观察性研究称,多吃水果的人患脂溢性皮炎的可能性较小。
研究结果还表明,典型的西方饮食可能会增加女性脂溢性皮炎的风险。
生物素
2018年的一项审查显示,生物素缺乏症可能导致几种皮肤疾病,包括脂溢性皮炎。生物素,也称为维生素B7,在支持健康的头发,指甲和皮肤方面发挥作用。富含生物素的食物包括:肝、蛋黄、坚果、三文鱼等。

晒太阳
还有一种非常简单的方法是:经常晒晒太阳。阳光可以防止真菌在头皮上繁衍。同时可以增加维生素D的含量,从而有助于改善皮肤状况。

解 压
此外,压力是头皮屑的最常见诱因之一。学习如何正确处理压力也很重要。适当培养一些兴趣爱好,定期放松解压,尽可能远离压力源。

其 他
最后,要保持良好的个人卫生习惯,避免过多抓挠,发痒最初是由头皮屑引起的刺激引起的,抓挠会增加刺激性并导致恶性循环。
避免使用过多的护发产品,防止头皮发炎。
摆脱头皮屑需要时间,精力和耐心,才能获得持久的效果。
Q & A
如何区分头皮屑和虱子?
如果白色颗粒在吹动或梳理头发时掉落,痒的程度相对较轻,则很可能是头皮屑。头虱在头皮部叮咬吸血,主要症状头皮部剧烈瘙痒,斑点粘在发干上,则可能是虱子或虱子空卵。
头皮屑可以治愈吗?
没有永久治愈的方法,但合理的方式可以控制住头皮屑。一些自然疗法包括茶树油、椰子油等。
头皮屑会导致脱发吗?
头皮屑本身不会直接导致脱发。然而,因为头皮屑抓挠发痒的头皮,久而久之可能会导致发丝脱落。
相关阅读:
主要参考文献:
Grimshaw SG, Smith AM, Arnold DS, Xu E, Hoptroff M, Murphy B. The diversity and abundance of fungi and bacteria on the healthy and dandruff affected human scalp. PLoS One. 2019;14(12):e0225796. Published 2019 Dec 18.
Saxena R, Mittal P, Clavaud C, et al. Comparison of Healthy and Dandruff Scalp Microbiome Reveals the Role of Commensals in Scalp Health. Front Cell Infect Microbiol. 2018;8:346. Published 2018 Oct 4.
National Health Service, Dandruff
Lorch JMP J.M.; Vanderwolf K.J.; Schmidt K.Z.; Verant M.L.; Weller T.J.; Blehert D.S. Malassezia vespertilionis sp. nov.: a new cold-tolerant species of yeast isolated from bats. Persoonia. 2018; 41:56–70. 10.3767/persoonia.2018.41.04
Symptom Find, Dandruff
Lin Qingbin,Panchamukhi Ananth,Li Pan et al. Malassezia and Staphylococcus dominate scalp microbiome for seborrheic dermatitis.[J] .Bioprocess Biosyst Eng, 2020
Zinc, Fact Sheet for Health Professionals
Borda, L. J., & Wikramanayake, T. C. (2016). Seborrheic dermatitis and dandruff: A comprehensive review.
Hekmatpou, D., et al. (2019). The effect of aloe vera clinical trials on prevention and healing of skin wound: A systematic review.
Kim, S., et al. (2017). Enhanced barrier functions and anti-inflammatory effect of cultured coconut extract on human skin.
Omega-3 fatty acids fact sheet for consumers. (2018).
Sanders, M. G. H., et al. (2019). Association between diet and seborrheic dermatitis: A cross-sectional study.
Varma, S. R., et al. (2019). In vitro anti-inflammatory and skin protective properties of virgin coconut oil.

谷禾健康
功能性腹痛性疾病(FAPD)是儿童期最常见的疾病,全世界25%的儿童和婴儿受其影响。
功能性腹痛性疾病
小儿功能性腹痛性疾病,目前称为肠脑相互作用障碍,包括肠易激综合症,功能性消化不良,腹型偏头痛和功能性腹痛。
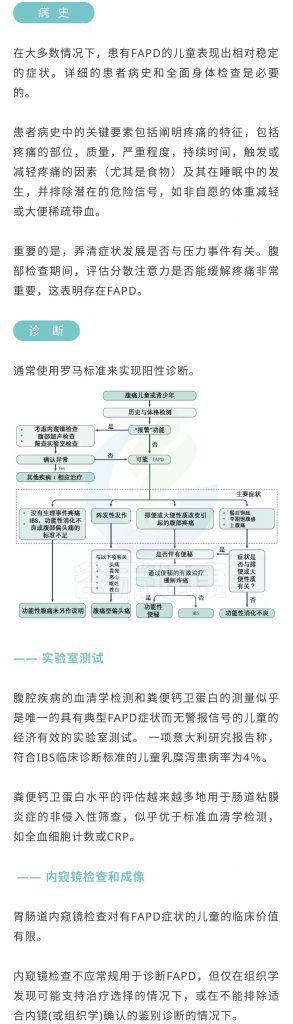
<罗马IV诊断标准见附录>
近日,英国和美国的研究科学家联合发表在《NATURE REVIEWS | DISEASE PRIMERS》上的一篇综述文章题为:“Paediatric functional abdominal pain disorders”(小儿功能性腹痛症)。


该文总结了FAPD患病率和致病性的最新进展,并特别关注了早期生命的影响和构建。对食源性发病机理和病理生理学有了更深入的了解,包括肠道器官(炎症,运动和微生物群),核心因素(心理方面,某些大脑区域的敏感性和/或连通性或活动性差异)以及外在因素(感染)。
此外,讨论了当前的诊断方法并着重介绍了这些疾病的治疗选择,特别是IBS和FAP-NOS。强调可用的药理干预措施仅限于儿童,因此,干预管理重点落在综合方法上,包括针对精神的干预措施(催眠疗法和认知行为疗法),饮食(益生菌)和经皮神经电刺激。这些方向将有助于理解病理生理学并更好地治疗这些疾病。
FAPDs的特征通常内脏痛觉过于敏感以及内脏刺激中枢感知增加而导致残疾,是遗传易感性和早期生活事件背景上叠加的社会心理因素和医学因素的最终结果。
功能性消化不良的症状特征主要来自胃肠道近端,涉及上腹部腹痛和/或餐后饱胀和/或早期饱腹感。
腹型偏头痛的特点是发作性长时间发作,剧烈,急性脐周,中线或弥漫性腹痛。这些痛苦的发作通常无能为力并干扰正常生活。
这些发作通常但不总是与其他症状(例如厌食,恶心,呕吐,头痛,畏光等)相关,这些症状可能在疼痛持续时间之前或与疼痛持续时间同时发生,并且这种症状性发作可能相隔数周至数月不等。
风险因素如下:


FAPDs是一种复杂的疾病,似乎是由于一个或多个元素的功能和/或更微妙的结构完整性的破坏造成的菌群-肠-脑轴。这些条件下相互作用的复杂性和多面性被整合到一个生物心理社会模型中。
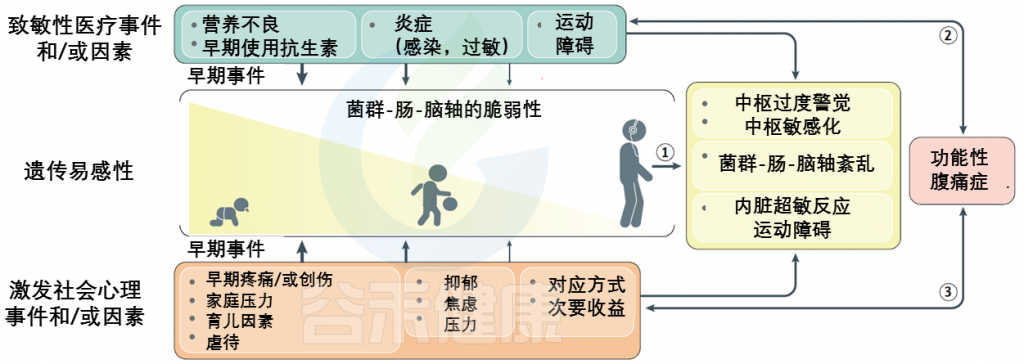

该模型的关键组成部分是内脏超敏反应和中枢敏感化。
内 脏 超 敏 反 应
内脏超敏反应描述了对周围信号的知觉反应(即痛觉过敏),并且可能是内脏传入信号处理变化的结果或疼痛下调变化的结果(例如,中枢敏感化)。
表现:疼痛的感觉阈值降低,也就是稍微一点点刺激就会感到疼痛。
可能原因:在肠扩张期间或由于暴露于食糜的化学成分改变引起,部分解释了对诸如饮食调整和抑酸等治疗的反应。
潜在诱因:炎症,感染和压力
从本质上讲,这些触发因素可引起粘膜通透性变化并导致炎症,释放促生因子,包括5-羟色胺,组胺,NGF,蛋白酶和前列腺素,它们能够激活传入伤害感受器(痛觉神经)上的受体,引起急性疼痛以及持久的功能和结构改变,这是维持慢性疼痛的关键。
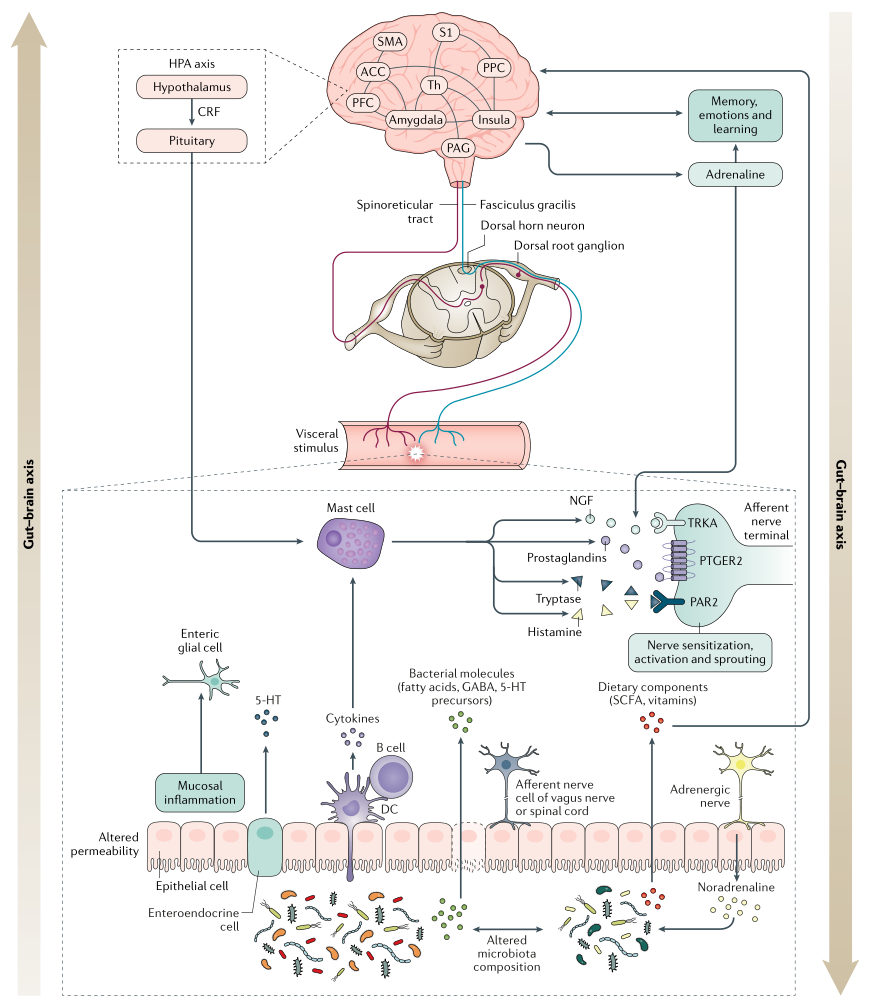

中 枢 敏 感 化
中枢敏化是指通过增强中枢神经系统内的神经元功能和神经信号来放大疼痛敏感性的现象,会引起疼痛超敏反应,并且是一种发展和维持慢性疼痛的机制。
除了疼痛超敏反应外,中枢敏化还会导致脑部活动的继发性变化,可以通过电生理或成像技术进行检测。患有FAPD的个体可能更倾向于发展来源不明的中央致敏。
2018年进行的一项系统性回顾涉及12项病例对照研究,发现功能性腹痛儿童的继发性痛觉过敏和皮质伤害感受改变。
生 命 早 期 事 件
在小儿FAPD中,损伤时机比导致微生物群-肠-脑轴成分破坏的多种因素或该轴本身的破坏更为关键。在生命的头二十年中,尤其是从围产期到儿童时期直至青春期,支撑其功能的肠脑轴所有元素的发育和成熟的关键过程至关重要。
包括手术(例如脐疝和幽门狭窄),细菌性胃肠道感染,炎性或免疫介导的疾病(例如乳糜泻,炎性肠病),以及在生命的最初几个月中发生无害的侮辱,例如婴儿期对牛奶过敏和早期使用抗生素等。
神 经 免 疫 相 互 作 用
在一些患有FAPD的儿童中,证据表明存在低度的肠道炎症,并在发病机理中发挥了神经免疫相互作用的作用。
一项研究发现,IBS患儿回结肠结肠粘膜中靠近神经的肥大细胞数量增加。神经纤维相关的肥大细胞计数与腹痛的强度和疼痛发作的频率相关。
胃 肠 蠕 动
胃肠动力异常促进FAPD的病理生理。具有上消化道症状的患者可能有胃排空延迟和/或胃适应性降低或两者都不存在。功能性下消化道症状的患者可能延迟,加速或正常结肠转移,和/或骨盆底运动障碍(肌肉协调障碍导致试图放松骨盆底肌肉时收缩)。
—功能性消化不良
—肠易激综合征
微 生 物 群
FAPD与肠道微生物群的多样性和菌群组成有关,尤其是IBS。2019年,一项系统评价86评估了健康个体和IBS患者(成人和儿童)的肠道菌群组成。发现双歧杆菌属的丰度下降。IBS患者中的抗炎作用与Faecalibacterium spp,尤其是Faecalibacterium prausnitzii一样,具有抗炎作用。
IBS患者的粪便微生物群的多样性降低或保持不变。粪便微生物群组成或代谢组组成可以预测患者可能从饮食中获益。
除细菌外,真菌或病毒也可能在FAPD病理生理中起作用。但是,有关真菌菌群失调或病毒菌群失调的可用数据有限,目前的研究主要集中于炎症性肠病,而不是IBS。
营 养
在患有FAPD的儿童中起着至关重要的作用。
饮食失调(例如神经性贪食症)可能导致IBS患儿肥胖的发生率增加。
碳水化合物的吸收不良可引起胃肠道症状。吸收不良可能与特定的酶缺乏症有关(例如乳糖酶缺乏症中的乳糖;蔗糖和异麦芽糖酶缺乏症中的蔗糖和淀粉)或与碳水化合物(如果糖,山梨糖醇或甘露醇)的吸收能力有限有关。
在糖较小的情况下,所引起的渗透负荷可导致肠腔膨胀小和快速转运。对于诸如果聚糖等较大的糖,人不具有消化的酶促能力,因此,吸收不良的糖会被结肠菌群发酵,从而导致气体形成和潜在的结肠扩张。
心 理 因 素
肠脑轴的生理很复杂,包括传入和传出成分。
下丘脑-垂体-肾上腺轴通过皮质醇和促肾上腺皮质激素释放因子的释放(在压力条件下均会增加),以及通过刺激肥大细胞和诱导脯氨酸释放的反馈回路,促进肠-脑相互作用。
研究表明,在成年人和有FAPDs的儿科患者中,压力都会增加肠道炎症标志物,如粪便钙卫蛋白和CRP。
肠道与大脑的相互作用涉及自上而下和自下而上的过程,因此,肠道菌群也可以影响脑功能。在压力条件下,肠道菌群可以增加上皮屏障的通透性,使抗原和/或病原体能够通过并引起炎症反应。由此产生的循环性促炎细胞因子可能会与中枢神经系统通讯,刺激大脑的免疫反应,从而可能导致或加重心理症状(例如焦虑和抑郁)。
几项研究表明,与健康儿童相比,患有家族性帕金森病的儿童的心理压力和行为问题有所增加。心理因素可能既是FAPD的起因,也是后果。

无论采用哪种治疗方法,患者与临床医生之间有效的沟通和病人教育,是成功进行FAPD管理的核心。必须花足够的时间向每位患者的照护者解释诊断,并讨论生物心理社会模型。
FAPD的管理受到几个因素的限制
1. 由于FAPD生物心理社会特性,每个孩子都有一套独特的病理生理因素,并且对疗法的反应也不同。
2. FAPD患儿的证据基础很小,许多治疗建议都是基于对成年人的研究。 儿童通常不会像成年人那样做出反应。
3. 一些有效的治疗方法是行为疗法(饮食疗法和心理疗法),由于缺乏专职医疗保健专业人员以及缺乏保险,这些方法并不容易。
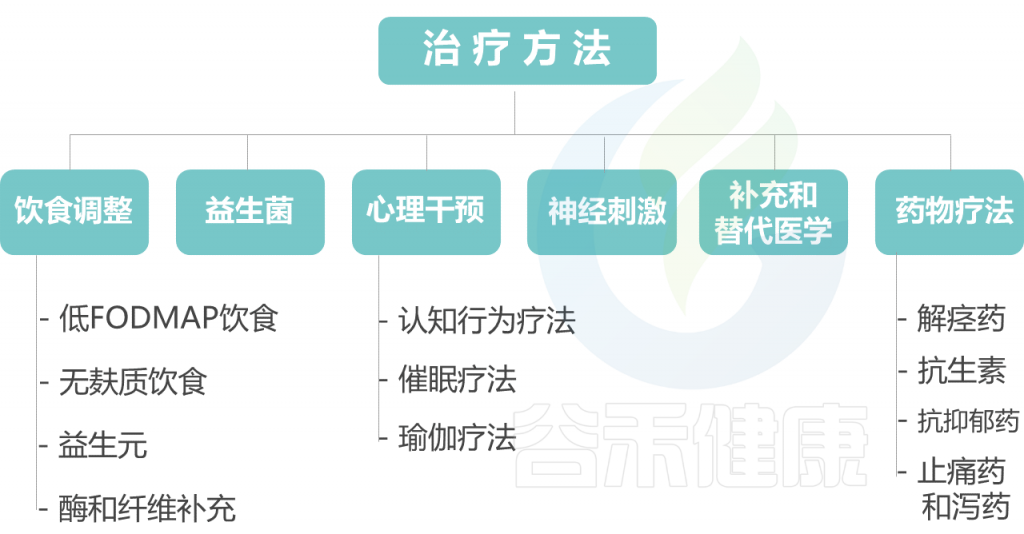

以下对每种治疗方法展开讨论。
饮 食 调 整


益 生 菌
多项研究检查了益生菌治疗FAPD的功效(大多成年IBS患者)。这些研究表明,益生菌或特定菌特定组合可能是有效的,但研究有局限性,如样品量,致盲性,所用益生菌的差异以及不同的剂量,其作用仍不清楚。
在患有IBS的儿童中,两项研究发现鼠李糖乳杆菌GG可有效减轻腹痛症状,而一项研究则报告腹痛没有改善,但感觉到的腹胀有所改善。在不同的研究中,疼痛程度再次有所不同。
在一个多中心,IBS儿童中进行的交叉RCT研究中,VSL#3(八种益生菌菌株的混合物)在改善症状和改善生活质量方面比安慰剂更安全,更有效。
心 理 干 预
心理干预迄今为止,诸如CBT和催眠治疗等心理干预已被证明是管理FAPD的最成功干预措施,并主张将其普遍纳入管理策略。
认知行为疗法(CBT)
CBT是治疗IBS的研究最多的心理疗法,其目的是改变认知,情绪和行为,这些不良情绪行为等都可能加剧或维持IBS症状。
在成人和儿童中的研究表明,与教育和其他控制干预措施相比,CBT在改善疼痛和参与社交生活的能力以及减轻焦虑或抑郁症状方面是有效的。
十二项随机对照试验涉及990名IBS儿童(7-18岁),显示出CBT对生活质量,学校表现和社会参与产生了长期的,持久的有益影响。CBT可以作为面对面的治疗提供,也可以通过互联网面向儿童或通过电话面向父母。
已报道,CBT在改善肠易激综合征儿童的疼痛和残疾方面具有有效性。患有家族性帕金森病的儿童的社区康复治疗主要集中在学习应对症状和减少残疾上,这些治疗应该是综合护理方法的理想组成部分。
催 眠 疗 法
在治疗师的指导下,患者会进入催眠状态,以响应改变主观体验,感知,情感,思想或行为的建议。
在成年人中,催眠疗法已被证明可导致结肠运动改变,改善内脏超敏性并减少长期持续存在的心理因素,例如躯体化和心理压力。
然而,在IBS患儿中,尽管接受了标准疗法的儿童的疼痛评分和躯体化评分均较低,但在催眠治疗后并未发现超敏反应降低(通过实验测试)。
IBS或FAP-NOS(n = 412;6-18岁)儿童的5个随机对照试验,无论是单独治疗还是在家中通过CD进行催眠治疗,均产生了长期有益影响。
在1年和5年的随访中,接受催眠治疗的患者中分别有85%和68%已没有症状,而对照组中分别只有25%和20%的患者缓解
瑜 珈 疗 法
瑜伽练习已被证明可以改善应激诱导的副交感神经系统活性不足。三个随机对照试验,包括127名IBS儿童(7-18岁),瑜伽疗法在减少腹痛方面具有积极作用。
但是,一项荷兰研究表明,在1年的随访中,瑜伽干预并没有比不包括CBT的标准治疗更有效。由于学习方法的重大缺陷,尚不能提出将瑜伽作为FAPD儿童的常规干预措施的建议。
神 经 刺 激
多项研究表明,脊髓和大脑的电刺激在调节疼痛途径中的功效,能够减少脊髓和中央杏仁核中50%以上的神经元放电,从而减轻内脏疼痛。
一项研究表明,经皮神经电刺激(PENFS)可以调节杏仁核和脊髓神经元的反应特性,并显着降低大鼠内脏超敏反应的发展。
随后,同一组受试者在115名FAPD的青少年(11至18岁)的随机对照试验中显示,具有主动装置的PENFS可以改善健康状况,并显着减轻疼痛和残疾 与假刺激组。
此外,PENFS的有益作用在2个月的随访期间得以维持。尽管有些耳部不适,但未报告严重的不良反应。
补 充 和 替 代 医 学
补充和替代医学包括不同的方法,从针灸和阿育吠陀医学到脊椎指压疗法、整骨疗法、顺势疗法、精神治疗、按摩和冥想等身心技术。大约40%的澳大利亚和荷兰诊断为糖尿病肾病的儿童使用其中某些替代疗法,其中草药治疗是最常见的(46%)。
许多补充疗法被公众认为是“自然的”,比现代医学的医疗设备更安全、更温和。FAPDs儿童对对抗疗法药物相关可能产生不良反应的恐惧,常规治疗没太大效果,让父母希望寻求补充和替代治疗。
然而,到目前为止,评估草药疗法、针灸、顺势疗法、身心疗法或肌肉骨骼操作(如整骨疗法和脊椎指压疗法)对患有家族性帕金森病的儿童的效果的随机对照试验尚不可用。
由于糖尿病周围神经病变的自发缓解率很高(30-70%),采取逐步的管理方法是明智的;必要时,教育、识别和改变压力因素和饮食干预可能是第一步。当症状持续或再次出现时,下一步可能是开始一种心理治疗,如认知行为疗法和催眠疗法,或PENFS。
药 物 疗 法




胃肠症状的严重程度和发生频率对不同患者的功能状态有不同的影响。患者报告的健康相关生活质量(HRQOL)测量应该有助于深入了解FAPDs对儿童和青少年功能状态的不同影响,包括身体、情感、行为、社会和认知方面。
评估症状和HRQOL影响的患者报告结果已成为成人临床状态和治疗结果的公认指标。但在儿童环境中,自我报告的HRQOL措施在仪器开发和临床应用中遇到了挑战,部分原因是担心儿童能否可靠地自我报告与健康相关的信息。
量化个体胃肠道症状对于开发以患者为中心和针对症状的干预措施很重要,这可以改善整体HRQOL。例如,一项针对259名患有功能性便秘,功能性腹痛或IBS的儿科患者的多中心研究发现,胃肠道症状最能预测整体受损。
FAPD在儿童时期很常见,FAPD患病率和/或复杂性可能会增加。因此,需要有来自所有地理区域以及世界各地精心设计的流行病学研究,才能真正了解问题的性质和规模。
特别重要的是,我们目前对导致儿童FAPD发病机理的潜在因素的了解,需要使用来自FAPD患儿的组织样本来解决免疫功能障碍和神经功能障碍的基础和转化科学研究。如上所述,早期的影响,即在复杂的肠脑轴各要素发展的关键阶段发生的事件,通常是辱骂或创伤(心理或医学方面的事件),使易感人群容易患上FAPD。
异常改变肠道菌群的因素可能会改变肠神经系统的结构或功能完整性,进而改变其与中枢神经系统的复杂且平衡的相互作用。结果可能是胃肠道重新调整为过敏状态,而大脑则重新编程为过度警觉状态。
当然,其他遗传因素,社会因素和生理变化,例如在青春期或青春期发生的那些,也可能促进症状发展。
现代工具越来越多地与焦虑和压力相关联,也可能会对FAPD产生重大影响。
总体而言,在过去十年中,儿童家庭保护方案取得了相当大的进展。对所有影响因素,及其与触发FAPD最终发展有关时机的更深入了解,可能带来更合适的预防或治疗策略。
【附录】
功能性腹痛疾病的罗马IV诊断标准
肠易激综合征
该标准必须满足至少2个月,并包括以下所有:
• 每月至少有4天腹痛伴有排便和/或排便次数的改变和/或大便外观的改变
• 腹痛不能随着便秘的解决而消失(疼痛消除的儿童患有功能性便秘,非肠易激综合征)
• 经过适当评估,症状不能完全由另一种疾病解释
功能性消化不良
诊断前必须至少满足2个月的标准,并且必须包括以下一种或多种症状,每月至少4天:
• 餐后饱腹感
• 早期饱腹感
• 与排便无关的上腹部疼痛或灼热感
• 经过适当评估,这种症状不能完全由另一种医学状况来解释
腹型偏头痛
必须在诊断前至少6个月内达到标准,并包括以下所有至少发生两次的情况:
• 持续1小时或更长时间的剧烈、急性脐周、中线或弥漫性腹痛的阵发性发作(应为最严重和最痛苦的症状)
• 发作间隔数周至数月;疼痛使人丧失能力并干扰正常活动;个体患者的定型模式和症状
• 疼痛与以下两种或两种以上症状相关:厌食、恶心、呕吐、头痛、畏光或苍白
• 经适当评估,症状不能完全由另一种医学状况解释,
功能性腹痛
未另行规定标准必须在诊断前至少2个月完成,每月至少四次,包括以下所有内容:
• 并非仅在生理事件(例如,饮食和月经)期间发生的偶发性或持续性腹痛;肠易激综合征、功能性消化不良或腹部偏头痛的标准不足
• 经过适当评估,腹痛不能由其他医疗状况完全解释
相关阅读:
主要参考文献:
Sjölund, J. et al. Prevalence and progression of recurrent abdominal pain, from early childhood to adolescence. Clin. Gastroenterol. Hepatol. 2020
Paediatric functional abdominal pain disorders.[J] .Nat Rev Dis Primers, 2020, 6: 88.
Rutten, J. M. T . M., Korterink, J. J., Venmans, L. M. A. J., Benninga, M. A. & T abbers, M. M. Nonpharmacologic treatment of functional abdominal pain disorders: a systematic review. Pediatrics 135, 522–535
Masuy, I., Van Oudenhove, L. & T ack, J. Review article: treatment options for functional dyspepsia. Aliment. Pharmacol. Ther. 49, 1 134–1 172 (2019)
Russell, A. C., Stone, A. L. & Walker, L. S. Nausea in children with functional abdominal pain predicts poor health outcomes in young adulthood. Clin. Gastroenterol. Hepatol. 15, 706–71 1 (2017)
Maragkoudaki, M. et al. Lactobacillus reuteri DSM 17938 and a placebo both significantly reduced symptoms in children with functional abdominal pain. Acta Paediatr. 106, 1857–1862 (2017).