-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

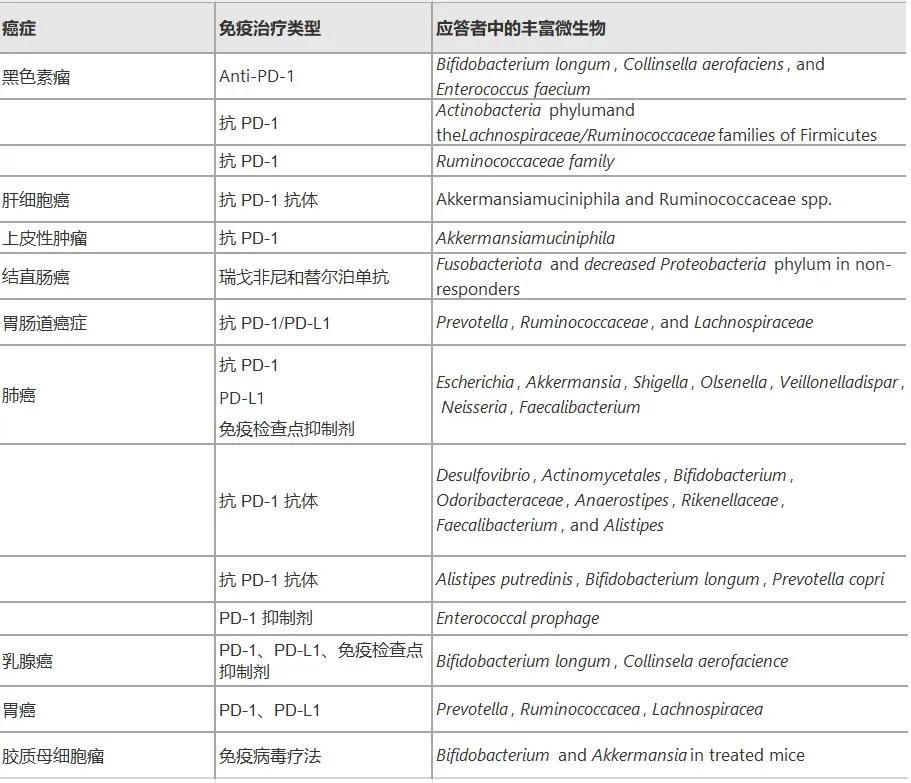
癌症——这个困扰人类几个世纪的疾病,至今仍是全球死亡率最高的疾病之一。
国际癌症研究机构调查显示,2022年,全球有超过 1900 万新诊断的癌症病例和近1000 万癌症死亡病例,无数家庭因此经历痛苦。
癌症是一种复杂的多步骤慢性疾病,由活跃分裂细胞在 DNA 复制过程中获得的自发突变积累而成,环境也对癌症风险产生了相当大的影响。
传统的癌症治疗方法——手术切除、放射治疗和化学疗法,虽然在过去几十年中挽救了无数患者的生命,但它们的局限性也日益明显:手术无法完全清除微小转移灶;放疗和化疗的副作用严重,往往让患者雪上加霜;而且,即便是相同类型、相同分期的癌症患者,对同一治疗方案的反应也可能截然不同。
传统的癌症生物学理论难以完全解释这些差异。
这些问题引发了研究人员的深思:也许我们需要超越单纯关注癌细胞本身,将目光投向更广阔的“宿主环境”——患者的整体生理状态、免疫系统功能,以及体内的微生态系统。
从结直肠癌到肝癌,从乳腺癌到胰腺癌,微生物的”指纹”无处不在,它们通过复杂的代谢网络和免疫调节机制,参与肿瘤的发生、发展、转移和治疗反应全过程。
例如,肠道微生物群与宿主黏膜表面之间存在相互作用,后者在肿瘤发生中起着主要作用。微生物可能通过在胃黏膜中诱导氧化应激来损伤 DNA,增强上皮炎症并破坏黏膜屏障,从而增加肿瘤发生风险。
本文我们主要来了解微生物与癌症之间错综复杂的关系,探讨微生物如何成为癌症研究的新焦点,以及这一领域如何有可能彻底改变我们对癌症的认知和治疗方法。
随着年龄增长,我们的身体就像一台逐渐磨损的精密机器,各个部件的功能开始下滑。这种时间依赖性的细胞和生理功能退化过程,被称为”衰老“,它是多种重大疾病的主要风险因素之一,也包括癌症。
衰老的基本特征
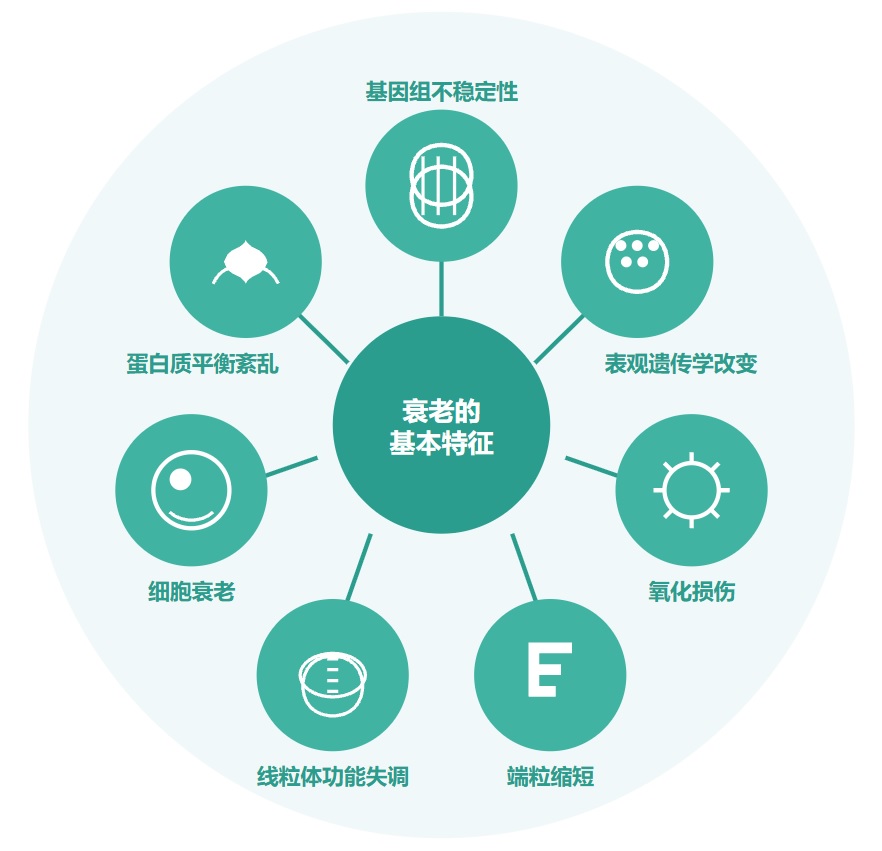
有人提出,尽管存在显著的个体间异质性和生活方式、饮食和治疗等外部因素的影响,但人类的肠道微生物组成在衰老过程中会逐渐变化。
多项报告表明,与有益菌相比,微生态失调在衰老过程中会增加,并导致促炎共生菌的大量存在,这些菌的富集,可以滋养生理性炎症。
对人类老龄化队列的研究表明,包括 Akkermansia、Anaerotruncus、Eggerthella、Bilophila 在内的一组属的丰度随着年龄的增长而显著增加,而 Faecalibacterium、Prevotella、Bacteroides 的丰度在老年人中相对较低。
衰老可能导致癌症,癌症治疗可能导致过早衰老

doi.org/10.1186/s12935-025-03787-x
微生物代谢物如何影响细胞衰老和健康?
短链脂肪酸,包括丁酸,可以帮助减缓细胞衰老。它们通过抑制组蛋白脱乙酰化酶来实现这一点,这调节代谢过程,增加胰岛素分泌,并调节免疫反应。
相比之下,致病菌的代谢产物,如脂多糖(LPS),通过加速炎症和增加氧化应激来增强细胞衰老,这是衰老的一个标志。
此外,铜绿假单胞菌和幽门螺杆菌产生的毒素会导致宿主 DNA 损伤并增加氧化应激。
因此,这加剧了 DNA 损伤反应、基因组不稳定性和细胞衰老。
菌群失调和细菌毒素促进衰老人群中衰老细胞的积累、DNA 损伤和促炎微环境的形成。这导致代谢紊乱,并创造一个促进肿瘤细胞生存和增殖的 肿瘤微环境,最终导致癌症。
癌症如何开始?
癌症起源于普通细胞中的遗传变化。当细胞DNA受到致癌物损伤时,会触发一系列变化。这些变化可能不会立即表现出来,但会逐渐积累。关键的基因突变会赋予细胞生长优势和抵抗死亡的能力,导致异常增殖,最终形成肿瘤。

癌细胞有什么特别之处?
癌细胞最显著的特征之一是它们的代谢方式发生了改变,也就是“代谢重编程”。正常细胞和癌细胞使用能量的方式完全不同。癌细胞即使在氧气充足的环境中也会进行糖酵解,这种现象称为”有氧糖酵解“。
此外,它们还进行大分子合成、维持氧化还原平衡,谷氨酰胺分解代谢,所有这些都有助于细胞快速增殖和生长。所有这些都有助于癌细胞快速分裂、扩散并侵入身体不同部位。
一个具体例子是D-2-羟基戊二酸的累积,这个代谢物抑制细胞分化,加速癌症发展。这是由于异柠檬酸脱氢酶-1/2 的连续突变。这表明通过抑制分化直接促进癌症的发生和进一步发展。
一个肿瘤内部并非完全一致,不同区域的细胞可能有不同的代谢特性,这种现象称为肿瘤异质性,这使得癌症治疗更加复杂。

肿瘤微环境:癌症的”生态系统”
肿瘤微环境(TME)是另一个在癌症发生和进展中发挥关键作用的组成部分。
肿瘤微环境是围绕癌细胞形成的高度组织化区域,就像一个小型社会,其中癌细胞只是众居民之一。其他成员如下图:

这个微环境如何影响癌症发展?
癌细胞能够改造邻居,使整个环境有利于肿瘤生长。
比如,癌细胞怎样获得养分和氧气?它们促使血管内皮细胞形成新血管。肿瘤相关巨噬细胞(TAMs)被招募后,会分泌生长因子和细胞因子,刺激血管生成和肿瘤侵袭。
癌细胞甚至能重新编程癌细胞相关成纤维细胞(CAFs),使它们分泌ECM蛋白和血管生成因子(如VEGF-A)。ECM则作为信号分子的储存库,增强细胞间通讯、粘附和迁移。
因此,TME 的不同组成部分通过影响各种细胞过程,有助于癌症的发生、进展和迁移。更深入地了解调节癌症进展和可塑性的分子机制,有助于开发精确和针对性的癌症治疗疗法,并预防复发。
微生物如何影响癌症发展?
最直接的联系是某些微生物直接致癌的能力:
动物研究显示,微生物可促进多种癌症的发展,包括:

doi.org/10.1186/s12935-025-03787-x
微生物群如何变化?
高通量DNA测序揭示了癌症相关的微生物群落变化:
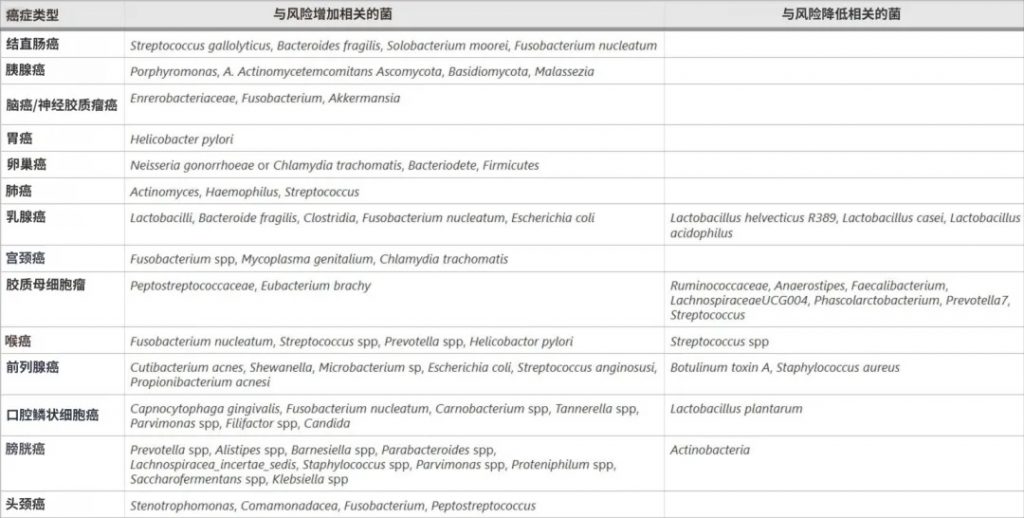
doi.org/10.1186/s12935-025-03787-x
微生物如何促进癌症?
微生物可能通过多种机制促进肿瘤发生:
了解微生物与癌症的关系,可能帮助我们开发新的癌症预防策略、提高治疗效果,甚至预测哪些患者可能对特定治疗产生耐药性。
实际上,微生物群可以同时扮演促进肿瘤发展和抑制肿瘤生长的双重角色,这取决于肿瘤进展的阶段以及微生物群的功能和分布位置,那么,哪些微生物会致癌?又是如何作用的?
微生物的促癌作用
结直肠癌
脆弱拟杆菌、大肠杆菌、Streptococcus gallolyticus、Enterococcus faecalis、Fusobacterium nucleatum、Parvimonas micra等在结直肠癌患者肠道中大量存在,通过分泌短链脂肪酸等代谢物、DNA甲基化、组蛋白修饰等表观遗传机制影响肿瘤形成。
胰腺癌
牙龈卟啉单胞菌、奈瑟菌、放线菌、链球菌、双歧杆菌、拟杆菌、梭杆菌等与胰腺癌的发生有关,它们通过引起炎症和免疫抑制影响肿瘤生长。
口腔微生物群和幽门螺杆菌通过诱导炎症而成为胰腺癌症的危险因素。
乳腺癌
对人类乳腺癌症组织16S rRNA基因序列的分析显示,与早期乳腺肿瘤相比,晚期乳腺肿瘤中卟啉单胞菌、Lacibacter、Ezakiella、Fusobacterium的丰度更高。
具核梭杆菌(Fusobacterium nucleanum)和脆弱拟杆菌通过定植于乳腺肿瘤和促进癌症细胞的自我更新来加重乳腺癌症的生长和转移。
脑癌
Enterobacteriaceae、Fusobacterium、 Akkermansia是脑癌患者肠道中的主要菌群,它们可能通过免疫抑制、激活炎症、限制细胞死亡以及促进血管生成和侵袭性来影响胶质瘤。
微生物虽然不能穿过血脑屏障,但能释放具有穿透能力的细胞外囊泡,这些囊泡有能力穿过屏障进入大脑。
其他
其他癌症相关的微生物还包括:
这些菌在相应的癌症中大量存在,并通过改变代谢和免疫反应、增强炎症和毒性以及改变信号通路来提高肿瘤易感性。
微生物的抗癌作用
一些微生物如乳杆菌、双歧杆菌、Faecalibaculum rodentium、Streptococcus thermophiles等具有抗肿瘤特性,它们主要通过以下机制抑制肿瘤生长:
调节免疫系统
一组共生肠道细菌,如Paraprevotella xylaniphila、Bacteroides dorei、 Parabacteroides distasonis,可以诱导 CD8 T 细胞产生 IFNγ,抵抗单核细胞增生李斯特菌感染,并增强免疫检查点抑制剂在小鼠体内的疗效。
产生抑制性毒素
其他细菌,如铜绿假单胞菌、鼠伤寒沙门氏菌、艰难梭菌,分别在黑色素瘤、胰腺癌和乳腺癌癌症中表现出抗肿瘤特性。它们通过产生抑制增殖、使细胞停滞在G1-S期并诱导细胞凋亡的毒素来实现这一点,从而促进抗癌活性。
嗜热链球菌还抑制细胞增殖,引发细胞周期阻滞,增强体外结直肠细胞的凋亡,并减少结直肠癌异种移植物的生长。此外,肠道微生物群通过抑制结肠lncRNA Snhg9和上调p53表达来限制小鼠结直肠癌癌症的进展。
产生有益代谢物
– 微生物本身及其毒素能抗癌
科利毒素:赋予宿主抗肿瘤免疫力。
产气荚膜梭菌毒素(CPE)能识别乳腺癌、前列腺癌等细胞表面高表达的claudin-3/4蛋白,与这些蛋白结合后直接引发癌细胞死亡。
Akkermansia muciniphila在肝癌小鼠模型中减少免疫抑制细胞(单核MDSC、M2巨噬细胞),同时增强PD-1免疫治疗的疗效。
– 微生物代谢产物:短链脂肪酸抗癌
丁酸钠,在非小细胞肺癌中消除肿瘤细胞生长,诱导细胞周期阻滞,促进细胞凋亡,并改变免疫反应。
异丁酸,通过减少肿瘤体积来提高癌症结肠癌小鼠模型中抗PD-1免疫疗法的效率。
色氨酸,是人体必需氨基酸,其代谢途径包括:
拟杆菌、Clostridium sporogenes、 Eubacterium、Ruminococcus gnavus等菌群通过吲哚途径产生吲哚-3-乳酸、吲哚-3-丙酸、吲哚-3-乙酸等代谢物,这些物质既能抑制肿瘤免疫逃逸,也可能促进癌细胞生长,具体作用取决于代谢物种类和浓度。
吲哚代谢物可改善化疗和免疫治疗效果,但菌群失衡可能导致色氨酸代谢紊乱,反而加速癌症进展。
微生物与肿瘤微环境的相互作用
具核梭杆菌的Fap2蛋白可与抑制性受体TIGIT结合,抑制NK细胞和T细胞清除肿瘤的能力。
幽门螺杆菌与微环境中的巨噬细胞互动,诱导其极化为M2样巨噬细胞,促进胃癌进展。
肿瘤内微生物也参与肿瘤生成和进展,例如:
也有报道称,一些瘤内微生物可以增强抗肿瘤免疫反应,从而抑制肿瘤进展。
了解微生物在癌症中的双重作用,可能为开发新型抗癌疗法提供思路,包括调节微生物群落和利用微生物产物来增强现有治疗方法的效果。
转移是癌症细胞的一个关键标志,大多数癌症类型的晚期通常以转移开始为特征。
转移,是指癌症细胞通过血液循环从原发肿瘤转移到其他器官的继发部位。它涉及上皮间质转化(EMT)、迁移、侵袭、外渗和继发部位的定植。
转移过程包括哪些步骤,癌细胞面临哪些挑战?
这个过程对癌细胞来说充满了物理和化学挑战,包括需要穿越坚硬的细胞外基质、承受液体剪切应力、逃避免疫监视,并最终在可能与原发部位环境截然不同的部位建立殖民地。
微生物如何协助癌细胞转移?
– 乳腺癌:细菌随转移扩散
– 具核梭杆菌的多重促转移机制
有核梭杆菌可诱导乳腺癌、结直肠癌、喉癌的转移。它是口腔中常见的革兰氏阴性菌,通常与牙周病、口臭有关。
结直肠癌

doi.org/10.1186/s12935-025-03787-x
喉癌
– 抗生素治疗的启示
当然,微生物并不总是促进转移,已知许多微生物群也能抑制转移,从而为防止癌症进展提供了一种自然的方法。
微生物如何阻止转移?
– 抑制转移的菌群代谢物
– 调节肿瘤微环境
膀胱癌中的菌群关联:
– 抗癌微生物的鉴定
前列腺癌数据分析:
肿瘤内微生物种类在转移中的重要性在其他癌症中也得到了证实(下表)。

doi.org/10.1186/s12935-025-03787-x
这些研究表明,癌症中微生物的特异性靶向可以抑制肿瘤的转移,从而成为抗癌联合治疗的重要组成部分。未来需揭示菌群与宿主互作的具体机制,探索“以菌治癌”的精准策略,为癌症治疗提供新突破口。
微生物不仅参与癌症的发生和发展,还可能影响癌症治疗的效果。为什么有些患者对治疗产生耐药性?微生物可能是其中一个关键因素。
微生物如何影响抗癌疗效?
微生物群主要通过两种方式来影响抗癌疗效:
这样一来,药物的疗效和对癌细胞的毒性都会发生变化。
以环磷酰胺(CTX)为例,它是一种常用的抗癌药,用于治疗各种血液系统恶性肿瘤和实体瘤。
环磷酰胺不仅能杀伤癌细胞,还能调节肠道微生物的组成。它会促使一些特定的革兰氏阳性细菌从肠道转移到次级淋巴器官,而这些细菌到达那里后,会激活致病性 T 辅助细胞,从而增强环磷酰胺的抗癌活性。
但如果通过某种方式消除肠道微生物,比如用无菌小鼠或给小鼠喂食抗生素,特别是针对Barnesiella intestinihominis、Enterococcus hirae等特定菌群时,就会发现一个很棘手的问题:环磷酰胺的抗癌效果会变差,耐药性出现了。这说明肠道微生物群在化疗耐药性中扮演着重要的角色。
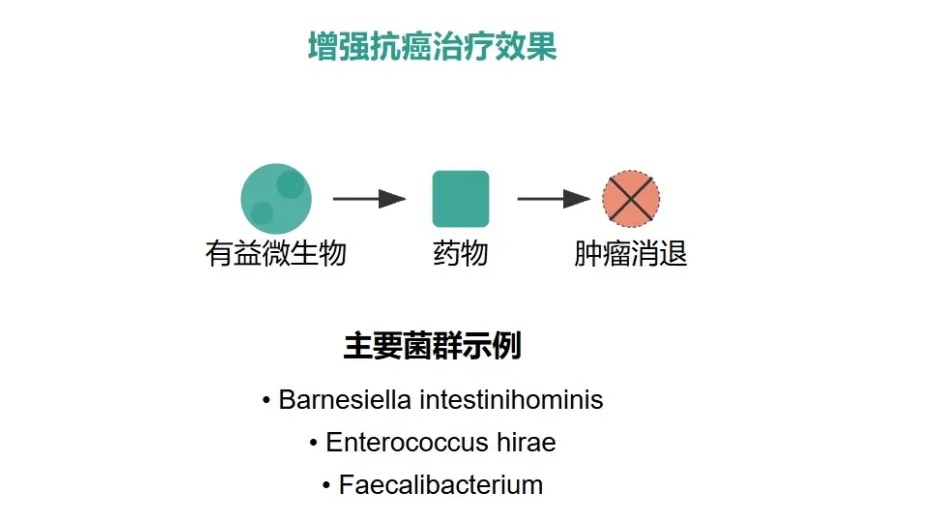
不过,这里又出现了一个违反我们直觉的情况。抗生素虽然可以杀菌,但用多了反而会导致细菌耐药性增加。
研究还在不断深入,科学家们发现:
微生物群调节有助于提高癌症治疗的效率,并通过改变代谢和免疫反应促进更好的预后。
比如,García-González 等人做了一项很有意思的研究,大肠杆菌可改变线虫体内代谢通路,增强5-氟尿嘧啶(FUDR)的疗效。
同样,在黑色素瘤患者的治疗中,研究发现粪杆菌Faecalibacterium能帮助增加免疫细胞和抗原呈递,从而让细胞毒性 CD8 + T 细胞在肿瘤床的浸润程度更高,引发大规模的免疫反应,这对抗 PD-1治疗很有帮助。
基于这些发现,有人提出一个大胆的想法:
肠道微生物群也可以用作生物标志物,来预测患者化疗和免疫治疗的治疗反应和疗效。
肝癌患者的肠道菌群失衡指数(Ddys) 反映了HCC患者粪便样本中的微生物干扰,可用于预测治疗效果。
失衡指数是根据HCC患者粪便样本中有益菌与有害菌的相对丰度计算的。
工程菌成为抗癌新武器
直接杀伤癌细胞:
靶向递送药物:
激活免疫:
现有研究揭示了微生物群在癌症治疗中的多重价值:增强药效、预测疗效、直接作为治疗载体。需深入解析不同癌症特异的菌群特征,明确特定菌种的作用机制,同时解决工程菌的生物安全性问题。
化疗不仅直接作用于肿瘤,同时也会对人体内的微生物群落产生显著影响。肠道微生物在应对化疗时,会通过代谢和免疫调节来影响化疗的疗效和毒性。
化疗如何破坏肠道菌群平衡?
化疗不仅攻击癌细胞,还会显著扰乱肠道微生物的组成。例如,在肠道中,化疗可能会破坏黏液层,使部分肠道微生物能够穿透黏膜层,引发免疫反应。
在结直肠癌患者中,化疗会降低肠道菌群的多样性,这种变化可能反向影响治疗效果——菌群结构越失衡,化疗耐药风险可能越高。
菌群网络的重构:竞争还是合作?
梭杆菌、拟杆菌、粪杆菌分别与肿瘤标志物CEA、CA724、CA242相关,但它们的丰度不受不同化疗阶段的影响。这提示特定菌群可能成为化疗反应的独立预测指标。
注:CEA是一种糖蛋白,最初在胚胎组织和结肠癌组织中发现。作为最早被应用于临床的肿瘤标志物之一,CEA主要用于消化系统肿瘤的辅助诊断和监测。
CA724是一种高分子量糖蛋白,是胃癌较为特异的肿瘤标志物。
CA242是一种新型的消化系统肿瘤标志物,主要用于胰腺癌和胆道系统肿瘤的辅助诊断。
菌群如何“对抗”化疗药物?
某些细菌通过代谢转化直接削弱药物活性:
菌群失衡是否会加剧化疗副作用?
5-氟尿嘧啶(5-FU)为例
5-氟尿嘧啶用于治疗乳腺癌、结直肠癌、胃癌、胰腺癌、胃癌等。其作用方式涉及DNA损伤,导致细胞凋亡或RNA合成抑制。
菌群也能增强化疗效果吗?
奥沙利铂和丁酸盐为例
奥沙利铂是晚期结直肠癌患者的一线化疗药物。
研究表明,肠道微生物产生的代谢物丁酸盐能增强奥沙利铂的抗癌效果。
丁酸盐通过依赖ID2的方式激活CD8 + T细胞。在结直肠癌患者中,对奥沙利铂有反应的患者血清丁酸盐水平高于无反应患者。这表明,肠道微生物产生的丁酸盐可能是决定患者对奥沙利铂反应的关键因素。
临床转化方向
预测性生物标志物
精准调控策略
化疗与肠道菌群存在双向影响:药物破坏菌群平衡,菌群则通过代谢和免疫调控反作用于药物疗效。未来研究需结合菌群检测,在分子机制与临床干预之间架起桥梁,最终实现精准治疗策略。
多项研究表明,放射治疗和微生物群之间存在相互交织的关系。虽然放射治疗可以杀死有益的微生物群,但某些微生物群也可以通过影响患者的免疫系统来提高放射治疗的敏感性。
例如,口腔中的具核梭杆菌会被转移到结直肠肿瘤部位,从而降低放疗的治疗效果。
而甲硝唑是一种针对具核梭杆菌的抗生素,研究发现,在结直肠癌小鼠模型中,甲硝唑可以作为一种放疗增敏剂,提高放疗的效果。
微生物群导致放疗抵抗
丁酸盐在肠道健康中通常被认为有益,为何在放疗中反而有害?
由Lachnospiraceae合成的丁酸盐与放疗抵抗有关
细菌和真菌对放疗的影响相反
小鼠模型(黑色素瘤、乳腺癌)研究发现:
关键分子:免疫受体Dectin-1(感知真菌感染)高表达的乳腺癌患者生存率较差。抑制Dectin-1可提升放疗疗效。
临床转化方向
精准菌群干预:
免疫微环境重塑:
传统癌症治疗方法存在很多局限性,例如对正常细胞的附带损伤、产生治疗耐药性的可能性以及无法完全穿透肿瘤等。因此,迫切需要开发新的、更好的癌症治疗方法。有文献表明,对癌症患者的肠道微生物群进行干预可以增强当前抗癌药物的疗效,如化疗和免疫疗法。
微生物群提高各种肿瘤免疫疗法的效率
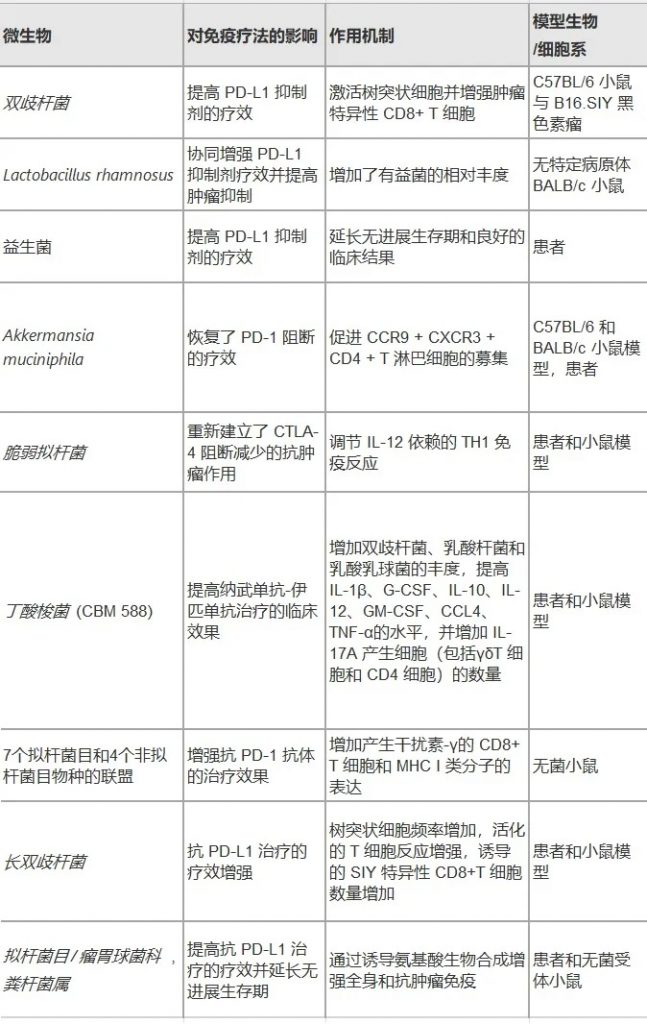
doi.org/10.1186/s12935-025-03787-x
细菌疗法
早在1868年,William Coley发现细菌感染可导致肿瘤消退,开创了细菌疗法的先河。现代研究揭示了细菌靶向肿瘤的独特机制:
研究人员改造了专性厌氧鼠伤寒沙门氏菌菌株YB1,并通过在神经母细胞瘤小鼠模型的肿瘤核心注射这种修饰的细菌观察到对肿瘤生长的抑制。
重组减毒沙门氏菌菌株SL7207被用作在黑色素瘤小鼠模型中递送工程肿瘤疫苗的载体。活细菌也可以与纳米粒子结合,形成有效的药物递送系统。
挑战:
细菌介导的抗癌疗法带来了一些挑战,包括半衰期短、DNA不稳定性和微生物的内在致病潜力。
基因工程有助于删除致病菌株的一些毒力基因,从而可以控制其抗肿瘤活性、特异性和定植。
目前,一些临床试验正在确定功能化鼠伤寒沙门氏菌菌株的效果。这些菌株要么通过各种遗传技术进行工程改造,要么通过纳米粒子或其他试剂进行表面修饰,以显示出所需的肿瘤靶向和定植。
粪菌移植 (FMT)
最近的研究表明,使用FMT重塑微生物群失调可以潜在地抑制癌症进展,特别是结直肠癌。
结直肠癌(CRC)
移植健康小鼠粪便至CRC模型,逆转菌群失衡,增加CD8+ T细胞浸润,减少促炎因子(IL-6、IL-17),抗炎细胞因子IL-10增加,抑制肿瘤进展。
临床试验进展

注:部分试验中FMT导致腹泻等副作用,提示需优化供体筛选。
宏基因组分析显示,在反应者中,FMT后Prevotella copri、Ruminoccocaceae、Eubacterium丰富。此外,与非反应者相比,反应者在FMT后一个月的粪便样本在小鼠模型中抑制肿瘤生长的能力更强。
涉及粪便微生物移植的临床试验

doi.org/10.1186/s12935-025-03787-x
关于 FMT的研究我们之前也写过,详见:
益生菌
益生菌如何帮助对抗癌症?
最近的一项队列研究中,发现益生菌的低等和中等摄入量与癌症死亡率的降低显著相关。
益生菌通过以下机制发挥作用:
鼠李糖乳杆菌(LGG)通过释放脂磷壁酸(LTA)激活TLR2信号,保护肠道干细胞免受放疗损伤。
另一种益生菌Prohep由鼠李糖乳杆菌GG(LGG)、具有活性的大肠杆菌Nissle 1917(EcN)和热灭活VSL3组成,用于在HCC小鼠模型中通过减少Th17细胞和IL-17细胞因子来减少肿瘤生长。
工程化益生菌有何突破?
益生菌要适量
益处:适量补充益生菌可降低癌症死亡率。
风险:过量可能干扰免疫治疗,如黑色素瘤模型中PD-1抑制剂疗效下降。
益生元
益生元——激活菌群抗癌潜能的“燃料”
益生元选择性地促进有益菌(如产丁酸菌)增殖,协同抗癌治疗。
益生元如何优化药物递送?
临床启示与风险管控
个体化菌群干预:
动态监测必要性:
风险提示:
免疫缺陷患者慎用活菌制剂,优先选择灭活益生菌或纯化代谢产物。
总的来说,益生菌双刃剑效应显著,需严格把控种类和剂量;而益生元通过调节菌群代谢,相对安全增强化疗/免疫疗效。
益生菌+益生元+传统疗法可能成为癌症治疗新方向,但需更多临床验证。
抗癌药物
为什么同种药物在不同患者中效果差异显著?
肠道微生物群还参与抗癌药物的生物转化和代谢,导致这些药物的差异吸收和生物利用度。在药物的生物转化过程中,微生物群采用各种机制,如脱氨基、水解、去甲基化、葡萄糖醛酸化和其他反应。
伊立替康(CPT11):
5-氟尿嘧啶(5-FU):
如何减轻菌群介导的副作用或耐药?
抑制特定酶活性:
调控菌群组成:
壳寡糖通过降低肠球菌、大肠杆菌-志贺氏菌、Turicibacter的密度以及促进丁酸产生菌的生长,对结直肠癌具有保护潜力。

临床潜在方向
未来,建立“菌群-药物代谢”数据库,结合人工智能预测个体化用药方案。例如,对高β-葡萄糖醛酸酶活性的患者,优先选择不受该酶影响的化疗药物(如奥沙利铂)。
关于常用药物和肠道菌群之间复杂的双向相互作用,我们之前的文章也写过,详见:
为什么药物对人效果不一?探索药物-微生物群相互作用对效果的影响
全球癌症治愈率依然不高,肠道微生物群在癌症发生、发展、转移和药物反应中的关键作用正逐渐成为研究热点,为精准抗癌策略提供了全新思路。
菌群在癌症治疗中的关键作用
微生物通过多种机制影响癌症治疗效果:
doi.org/10.1186/s12935-025-03787-x
当前挑战:从实验室到临床的鸿沟
– 研究方法的“碎片化”
样本收集(粪便 vs 肿瘤组织)、测序技术(16S rRNA vs 宏基因组)的差异导致结果难以比较;
解决方案:建立全球统一的微生物组分析标准。
– 个体化差异
年龄、饮食、地理因素使菌群组成差异巨大——同一疗法在不同人群中的响应率波动;
突破口:开发基于AI的个体化菌群图谱,预测治疗敏感性与毒性风险。
– 治疗复杂性的叠加
在现有化疗/免疫治疗基础上引入菌群调控,可能引发不可预见的药物-微生物相互作用;
未来方向:迈向精准菌群医学
– 精准菌群分层
通过多组学技术(宏基因组+代谢组)构建个体化菌群图谱,识别“促癌菌”与“抑癌菌”。
针对不同化疗方案调整菌群结构,丁酸水平低者优先使用奥沙利铂联合益生元。
– 联合干预策略
饮食-菌群协同:高纤维饮食联合特定益生元(如菊粉),可使MEK抑制剂疗效提升。
个性化膳食(如高纤维饮食)联合益生菌,改善肠道健康并增强治疗响应。
结合基因、饮食等多维度数据定制治疗方案。
工程菌开发:设计靶向降解耐药相关酶(如β-葡萄糖醛酸酶)的工程菌。
– 临床转化路径
推动大规模临床试验,验证菌群移植(FMT)、益生元/菌在特定癌种中的疗效。
探索菌群标志物(如丁酸盐水平)作为治疗响应预测指标。
开发微生物群-人工智能联合预测模型,优化治疗决策。
将菌群检测纳入癌症辅助诊疗,实现早筛与疗效监控。
总的来说,微生物组研究不仅扩展了我们对癌症发生发展的认知,更为癌症治疗提供了新的可能性。通过系统化的菌群检测与精准干预,跨学科协作与技术创新,未来有望实现真正的个体化治疗方案,提高抗癌疗效并改善患者生活质量。这一领域的进步,代表着癌症治疗从单一靶向向生态系统整体调控的深刻范式转变。
主要参考文献
Adlakha YK, Chhabra R. The human microbiome: redefining cancer pathogenesis and therapy. Cancer Cell Int. 2025 Apr 28;25(1):165.
Shi Z, Li Z, Zhang M. Emerging roles of intratumor microbiota in cancer: tumorigenesis and management strategies. J Transl Med. 2024 Sep 11;22(1):837.
Murayama M, Hosonuma M, Kuramasu A,et al., Isobutyric acid enhances the anti-tumour effect of anti-PD-1 antibody. Sci Rep. 2024 May 17;14(1):11325.
Jia D, Kuang Z, Wang L. The role of microbial indole metabolites in tumor. Gut Microbes. 2024 Jan-Dec;16(1):2409209.
Sun X, Shan X, Zhu B, Cai Y, et al., 5-Fluorouracil Loaded Prebiotic-Probiotic Liposomes Modulating Gut Microbiota for Improving Colorectal Cancer Chemotherapy. Adv Healthc Mater. 2025 Feb;14(4):e2403587.
Zhang H, Xu Z. Gut-lung axis: role of the gut microbiota in non-small cell lung cancer immunotherapy. Front Oncol. 2023 Nov 22;13:1257515.
Wang S, Yin F, Guo Z, Li R, Sun W, Wang Y, Geng Y, Sun C, Sun D. Association between gut microbiota and glioblastoma: a Mendelian randomization study. Front Genet. 2024 Jan 4;14:1308263.

谷禾健康
肠道微生物群通过代谢发酵膳食纤维等不被人体直接吸收的物质,产生了一类重要的代谢产物——短链脂肪酸。
短链脂肪酸主要包括乙酸盐、丙酸盐、丁酸盐,它们不仅仅是肠道上皮细胞的重要能量来源,更是联结肠道-免疫-代谢-大脑轴的信号分子。通过与特定受体(如GPR41/GPR43)结合,它们能调节肠道蠕动、维护肠屏障完整性、调节免疫反应、影响食欲和能量代谢,甚至可能影响神经系统功能。
随着微生物组研究的深入,我们逐渐认识到肠道微生物与人体健康之间存在着错综复杂的关系网络,而短链脂肪酸恰是这一网络中的核心。短链脂肪酸并非独立存在的简单分子,而是复杂生态系统平衡的产物和指标。它们反映了微生物群落的结构与功能,同时也塑造着宿主的生理状态。正是这种动态平衡的特性,使得短链脂肪酸在不同条件下表现出迥异的生物学效应。
因此,短链脂肪酸的健康效应高度依赖于机体状态、剂量水平以及具体应用场景,这远比简单的”好”与”坏”复杂得多。以丁酸盐为例,在健康状态下,它是肠道健康的守护者;但在肠道屏障受损或炎症状态下,同样的丁酸盐可能延迟伤口修复,甚至加重炎症反应。丙酸盐也展现类似特性:低浓度时可能有益肠道健康,但高浓度时可能产生毒性效应,甚至与自闭症等神经发育障碍存在争议性关联。
本文将全面梳理短链脂肪酸的生物学特性及健康影响,探讨短链脂肪酸异常的相关干预措施。更全面地理解短链脂肪酸,不仅有助于我们认识肠道微生物组与人体健康的深层联系,也为未来的个性化营养干预、精准医疗和健康管理提供了理论基础。
* 本研究参考并整合了微生物学领域知名专家Lucy博士和MacFabe博士的部分研究总结与学术观点。作为肠道微生物与人体健康研究方向的权威学者,他们长期致力于探索肠道菌群、营养代谢与疾病发生机制之间的科学关联。
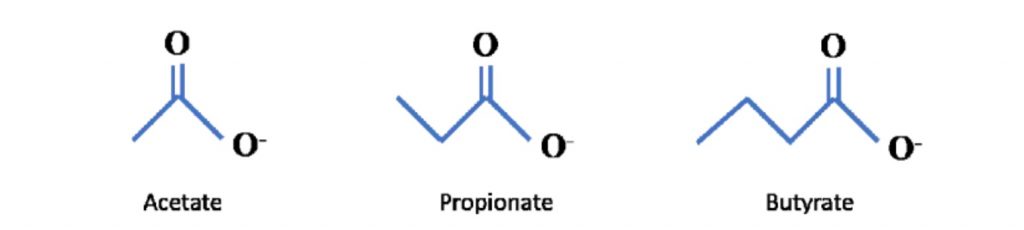
短链脂肪酸是包含 6 个或更少碳分子的脂肪酸的一个子集。它们包括乙酸盐(C2)、丙酸盐 (C3)、丁酸盐(C4)、戊酸(C5)、己酸(C6)。最近的科学进展主要集中在乙酸盐、丙酸盐、丁酸盐上,因此这三个将是本系列文章的主要关注点。
可以在下面看到它们的化学结构:
哺乳动物消化道不擅长代谢某些纤维。相反,菊粉、低聚果糖和抗性淀粉等膳食纤维很容易被肠道中的微生物发酵,短链脂肪酸是这种发酵的主要产物。
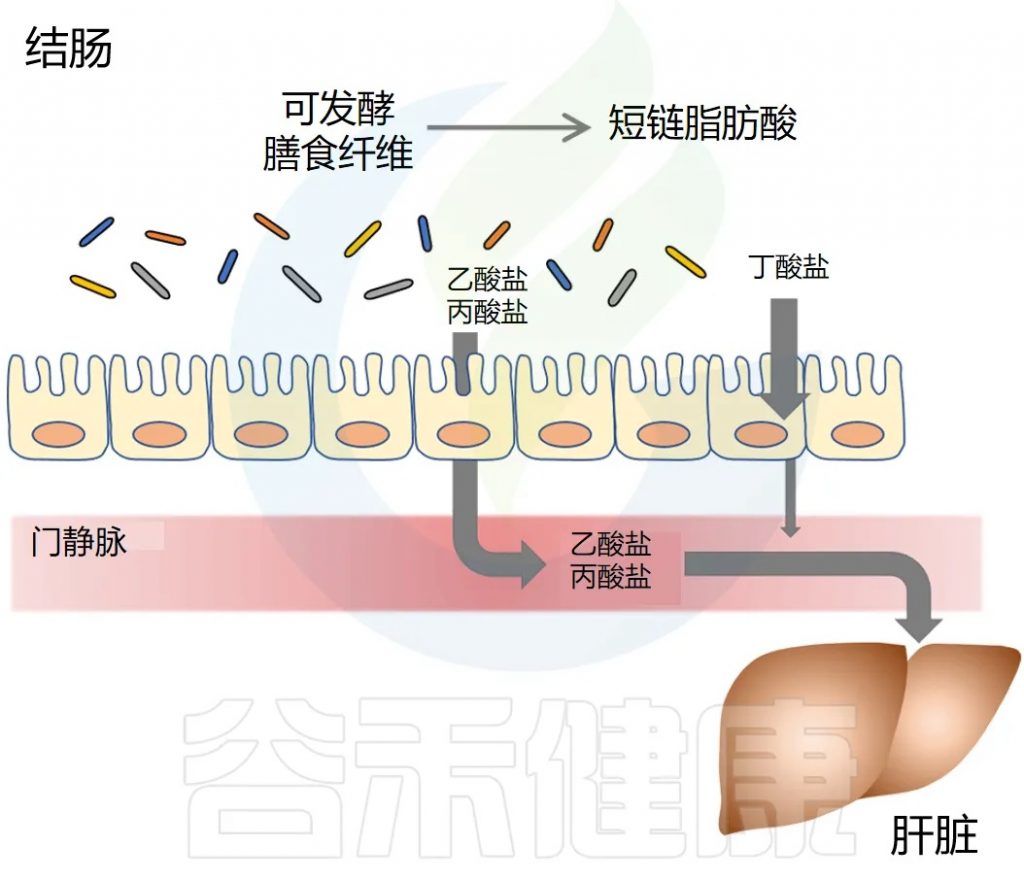
短链脂肪酸去哪里?
短链脂肪酸要么被肠道上皮细胞局部使用,要么通过肠道上皮运输到门静脉。
丁酸盐主要被结肠上皮细胞用作能量来源,而丙酸盐和乙酸盐主要通过门静脉运输到肝脏。
丙酸盐被肝细胞迅速代谢。乙酸盐可以留在肝脏中或释放到外周循环中。
信号分子和 HDAC 抑制剂
短链脂肪酸是有效的信号分子,与专门的 G 蛋白偶联受体(GPCR)结合,并最终改变细胞和组织的生物化学性质。这些受体可以在免疫细胞、神经细胞、甲状腺、肾脏、胰腺、脾脏、肝脏、其他组织上找到。
注:G蛋白偶联受体(G Protein-Coupled Receptors, GPCR)是一类重要的膜蛋白,在细胞信号转导中扮演关键角色。作为人体内最大的膜蛋白受体家族,GPCR参与调控众多生理过程。
它们也是基因表达的有效修饰因子,影响各种细胞类型的表观遗传学。特别是丁酸盐,它是组蛋白脱乙酰酶的有效抑制剂,组蛋白脱乙酰酶是负责确定 DNA 卷曲的紧密程度以及因此转录成 RNA 的程度的酶。
注:组蛋白脱乙酰是由组蛋白去乙酰化酶(HDACs)催化的过程,该过程通过调节染色质结构和基因表达参与几乎所有关键生物过程,包括基因表达,细胞分化,DNA修复和生长发育方面,是表观遗传调控的核心机制,也是重要的疾病治疗靶点。
SCFA 具有广泛的影响
通过这些机制,SCFA 能够对宿主生理产生广泛的影响。SCFA 决定结肠运动、血流和胃肠道 pH 值,这会极大地影响电解质和其他营养物质的摄取和吸收。它们也是结肠健康和肠道屏障完整性的重要促进剂,并在维持正常的肠道和免疫功能方面发挥着重要作用。
SCFA 也被证明会影响神经系统和大脑。丁酸盐已被证明可以调节小胶质细胞(大脑的免疫细胞) 的活性,而丙酸盐则被认为与自闭症谱系障碍的发展和进展有关,这个将在本系列的下面 部分中详细介绍这个主题。
SCFA 的产生也可能在塑造肠道微生物生态学中发挥重要作用。SCFA 在低浓度下表现出广谱抗菌活性。有趣的是,SCFA 对产生它们的细菌种类是相对惰性的抗菌剂,但对其他微生物具有相当强的抗菌活性。
注意,SCFA 总是好的吗?不一定。
SFCA 对宿主健康的总体影响存在广泛争议。例如,尽管刺激饱腹感信号,但 SCFA 也与增加从饮食中收集的能量有关。短链脂肪酸在高浓度或特定疾病条件下也可能具有毒性,将在下面详细讨论。
改变的SCFA水平会是疾病的原因吗?
SCFA 可能影响多种疾病的发病机制,包括过敏、哮喘、癌症、肥胖、代谢性疾病、自身免疫性疾病和神经系统疾病。但是请考虑以下事项:
一些研究仍在试图确定这些关联背后的机制。粪便 SCFA 测量有一些主要局限性,并且 SCFA 水平改变是这些疾病的原因还是结果仍然未知。更好地了解 SCFA 对于描述肠道和肠道微生物群在慢性疾病中的作用至关重要。
丁酸盐是肠道中产生的一种代谢物,对大脑、皮肤、免疫系统等都有好处,其分子结构如下:
编辑
丁酸盐保护肠道
丁酸盐是结肠细胞的首选底物,可提供结肠上皮细胞 60-70% 的能量需求。
丁酸盐抑制炎症、调节免疫、促进紧密连接蛋白组装,增强肠道屏障功能。
丁酸盐还影响粘液层,健康的结肠上皮覆盖着双层粘液。厚厚的内层致密无菌,保护上皮细胞免受微生物侵袭;外层松散,容纳以粘液层糖蛋白为食的细菌。
两个粘液层均由杯状细胞分泌的MUC2粘蛋白构成。研究表明,补充生理浓度的丁酸盐可增加人杯状细胞系中MUC2基因的表达和MUC2的分泌。
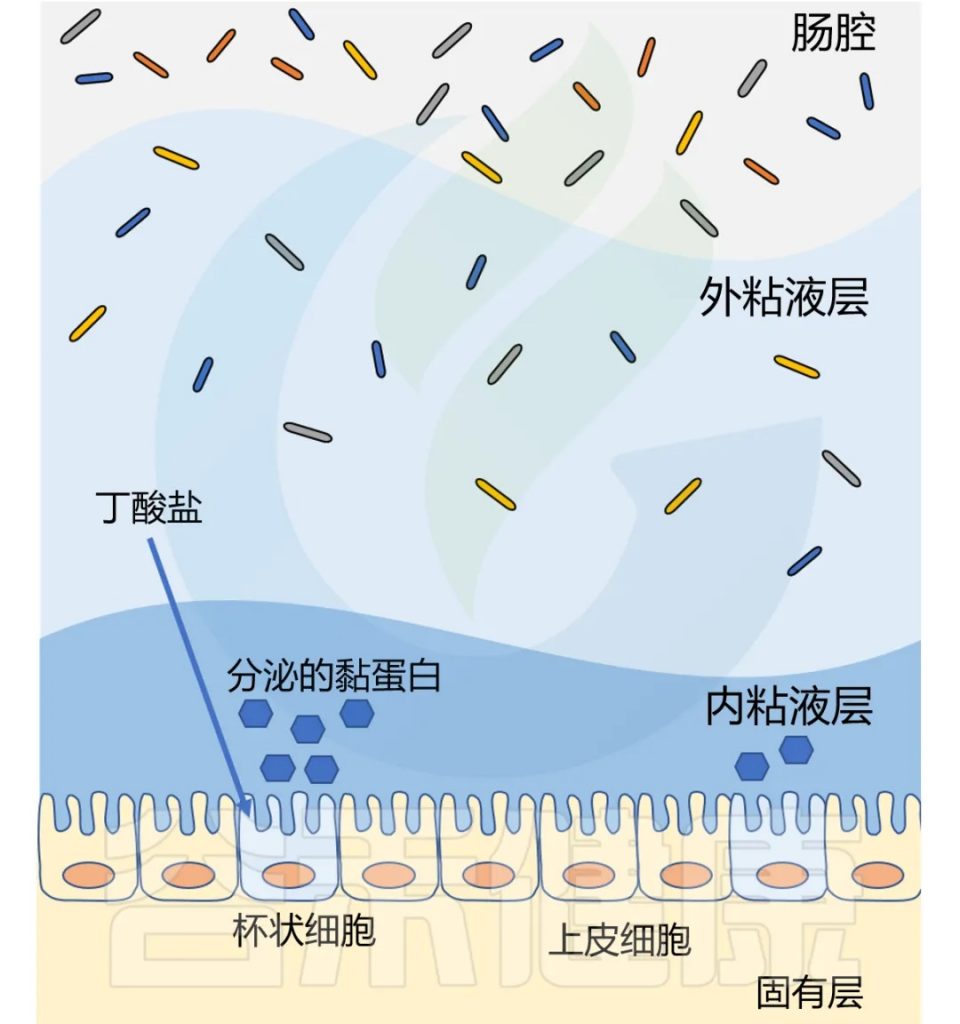
丁酸盐改善代谢功能
丁酸盐还影响新陈代谢。在肥胖小鼠模型中,补充丁酸盐被证明可以提高胰岛素敏感性、增加能量消耗和减少肥胖。它还增加了线粒体的数量及其在骨骼肌和棕色脂肪组织中的活性。一系列研究证实丁酸盐反应受体在脂肪组织中高度表达。
但是这种表达随着年龄的增长而下降,这可能解释了与年龄相关的胰岛素敏感性下降。丁酸盐还诱导饱腹感激素的产生,从而减少食物摄入量。
丁酸盐也可能对其他代谢疾病有益。研究表明,生命早期口服丁酸盐可延缓大鼠糖尿病的发展。丁酸盐补充剂还可以通过改善肠道屏障功能和纠正微生物失调来减轻饮食诱导的小鼠脂肪肝疾病。
丁酸盐改变基因表达
虽然我们的基因构成基本上是不可改变的,但基因的表达方式却具有高度可塑性。
在我们身体每个细胞的细胞核中,DNA 缠绕在组蛋白周围。
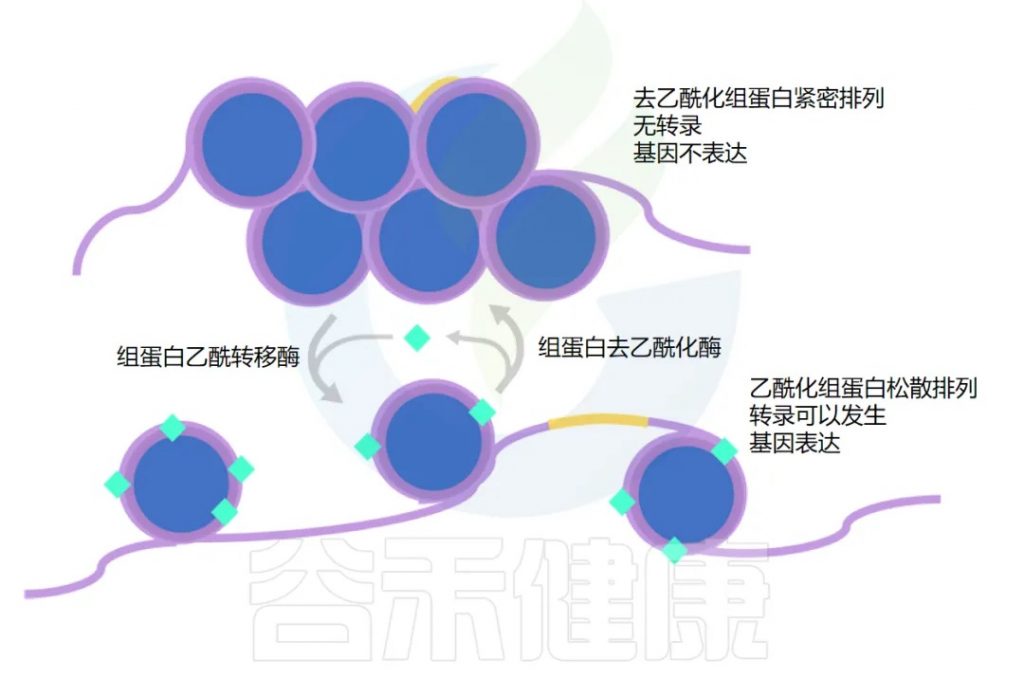
那么什么决定了基因是乙酰化还是去乙酰化呢?
组蛋白乙酰转移酶(HAT)负责添加乙酰基,而组蛋白去乙酰化酶(HDAC)负责去除。细胞内的许多信号分子可以影响这些酶的活性,丁酸盐就是其中之一。
丁酸盐通过两种不同的方式增加乙酰化,用于不同的基因集。
这两种机制都有助于增加乙酰化并保持基因“开启”。下一节将探讨其如何在癌细胞中发挥作用。
丁酸盐有抗癌作用
长期以来,人们一直知道丁酸盐可以刺激上皮细胞增殖,但同时对结肠癌具有保护作用。换句话说,丁酸盐可以在健康和癌变的结肠细胞中发挥不同的作用。
研究揭示了丁酸盐悖论背后的机制,实验表明 Warburg 效应是其解释的关键。Warburg效应描述了快速分裂的癌细胞的代谢特点。
注:Warburg效应是由德国生物化学家Otto Warburg于20世纪20年代发现的一种代谢现象,描述了肿瘤细胞的特殊能量代谢方式:即使在氧气充足的环境中,癌细胞也主要通过糖酵解而非有氧呼吸产生能量。
◆ 丁酸盐促进增殖
正常上皮细胞主要通过线粒体三羧酸循环(TCA循环)代谢丁酸盐等脂肪酸,产生能量。TCA循环通量增加,导致胞质溶胶中柠檬酸盐积累,柠檬酸盐可在细胞核中转化为乙酰辅酶A。该乙酰辅酶A为组蛋白乙酰转移酶(HAT)提供乙酰基,乙酰化调控上皮细胞增殖的基因。

◆ 丁酸盐的抑制作用
另一方面,癌细胞往往具有功能失调的线粒体,这意味着它们无法代谢脂肪酸(如丁酸盐)以获取能量。正因为如此,它们在很大程度上依靠葡萄糖代谢来产生能量,而丁酸盐等脂肪酸往往会在细胞中积累。这种细胞丁酸盐浓度的增加导致 HDAC 抑制增加,以及阻止癌细胞复制的基因表达。
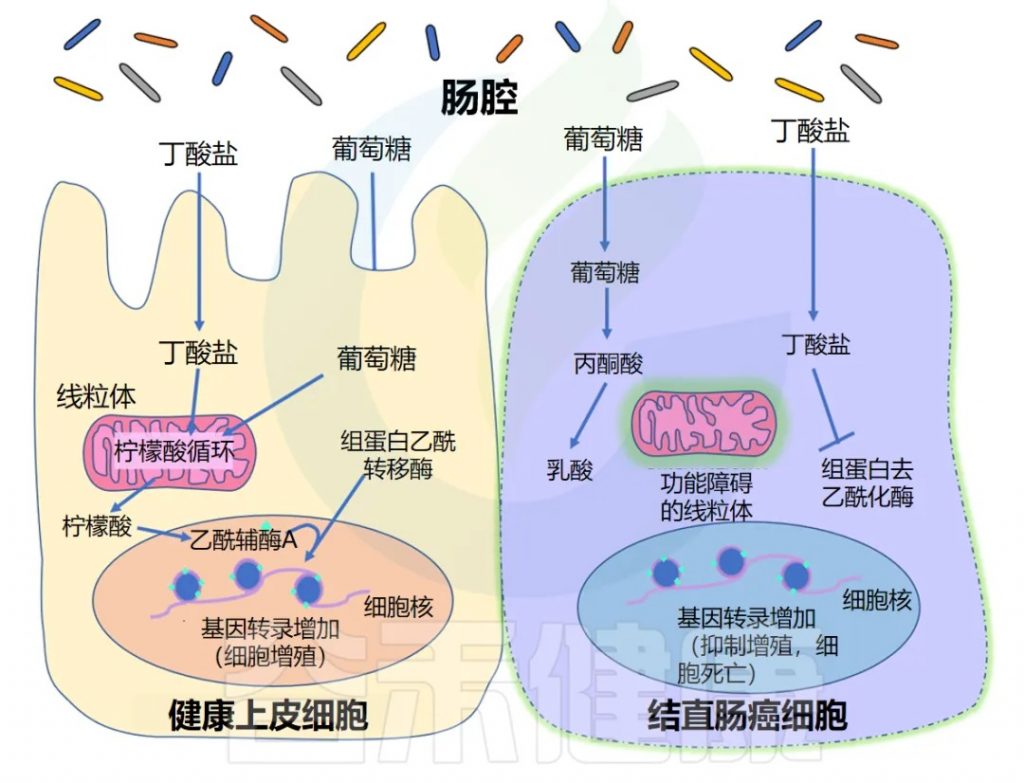
这种现象并非结肠癌所独有。丁酸盐已被确定在多种人类癌细胞系中具有抗癌活性,包括舌癌、前列腺癌、 肝癌、乳腺癌、肺癌、神经母细胞瘤等。
丁酸盐可能有益于大脑
丁酸盐对大脑健康的影响已在动物模型中得到广泛证实。
◆ 脑损伤保护
研究表明,给予丁酸钠或产丁酸梭菌的小鼠,在缺血性脑损伤后表现出神经发生增加、氧化应激减少和恢复改善。丁酸钠还能恢复血脑屏障的完整性,并减轻创伤性脑损伤后的神经功能缺损,同时可预防脊髓性肌萎缩症中的神经变性。
◆ 抗抑郁效应
在抗抑郁方面,丁酸盐可改变小鼠海马体和额叶皮层中脑源性神经营养因子(BDNF)等基因的表达,并增加血清素水平,同时减少药物诱导的双相情感障碍模型中的躁狂样行为,增加神经营养因子表达,并在慢性轻度应激和母体分离模型中减轻了认知障碍。
◆ 记忆增强作用
丁酸盐对记忆形成和保留也具有潜在作用。研究表明,丁酸盐通过抑制 HDAC 可以减轻海马胃泌素释放肽受体(GRPR)信号阻断导致的认知障碍,并使大脑处于“可塑性准备状态”,类似于运动的效果。
注:海马胃泌素释放肽受体 (GRPR) 的紊乱可能会抑制适当的记忆形成和消退,并导致与神经发育障碍相关的认知障碍。
最后,丁酸盐可能对自闭症谱系障碍有益,相关讨论将在SCFA不平衡和丙酸盐-自闭症连接部分展开。
丁酸盐调节免疫系统
丁酸盐在调节免疫系统方面也起着重要作用,几乎在所有类型的免疫细胞上都发现了丁酸盐反应受体。
丁酸盐信号传导产生抗炎效应,抑制促炎细胞因子的产生并上调抗炎细胞因子的产生,即使在脂多糖(LPS)等炎症刺激下也能发挥作用。这可能是通过 HDAC 抑制 NF-kB 通路来实现的,
注:NF-kB 通路是参与炎性细胞因子释放的主要通路。已在许多不同的免疫细胞类型中观察到丁酸盐介导的 HDAC 抑制。
丁酸盐还促进结肠和外周调节性T 细胞 (Treg) 的产生,这有助于抑制免疫反应,影响 Treg 和效应 T 细胞功能,并诱导抗菌肽素(Cathelicidin)的活性,从而增强对细菌感染的先天防御能力。
注:cathelicidin 是一种有效的抗菌剂,已知在结肠和肺上皮细胞中对细菌感染的先天防御中起重要作用。
丁酸盐和皮肤
由于很多朋友的小孩湿疹病史和对肠道皮肤轴的实验研究,小编感兴趣的是丁酸盐对皮肤健康的影响。
丁酸盐充当皮肤免疫系统的调节剂。皮下或局部应用丁酸盐被证明可以减少接触超敏反应,这可能是通过观察到调节性 T 细胞的增加和炎症效应 T 细胞的减少来解释的。丁酸盐还诱导胶原蛋白的合成,胶原蛋白是皮肤的重要结构成分。
丁酸盐改善骨骼健康
骨骼在成骨细胞(骨骼构建)细胞活性和破骨细胞(骨分解)细胞活性之间的微妙平衡中不断重塑。存在于骨髓中的间充质干细胞(MSC)可以分化成骨细胞(造骨细胞)或脂肪细胞(脂肪细胞)。
﹝仅供参考﹞
增加丁酸盐的方法
我们已经了解到丁酸盐是基因表达的有效修饰剂,对宿主健康有广泛的益处。想要增加丁酸盐,有几种方法可以做到这一点:
增加产生丁酸盐的细菌的丰度。具有特别高丁酸盐生产能力的细菌种类属于厚壁菌门和拟杆菌门,包括梭菌门、真杆菌属(Eubacterium)、罗氏菌属(Roseburia)、粪球菌属(Coprococcus)和普拉梭菌(Faecalibacterium prausnitzii)等。
双歧杆菌(Bifidobacteria)和乳酸杆菌(Lactobaccilus)等属也可能通过产生乙酸盐和乳酸盐来促进丁酸盐的产生,然后其他细菌可以将其转化为丁酸盐。
增加产生丁酸盐的细菌可用的底物。这意味着吃含有可发酵纤维的益生元食品,这些纤维会刺激丁酸盐的产生。一些最有效的产丁纤维包括抗性淀粉和低聚果糖。
补充剂。这应该非常谨慎,使用正确的补充剂形式。下面将对此进行说明。
过量的丁酸盐有毒吗?
目前各种形式的口服丁酸盐补充剂。但我们真的应该服用丁酸盐吗?丁酸盐过多是一件坏事吗?
查阅很多文献,发现一些研究表明,低浓度的丁酸盐是有益的,但高浓度可能是有害的,尤其是对于那些肠道受损的人。
在本文中,我们将分析几项阐明丁酸盐悖论的研究。首先,我们先来了解肠道解剖结构,这对于了解丁酸盐对肠道的影响至关重要。
肠道结构与丁酸盐的关联
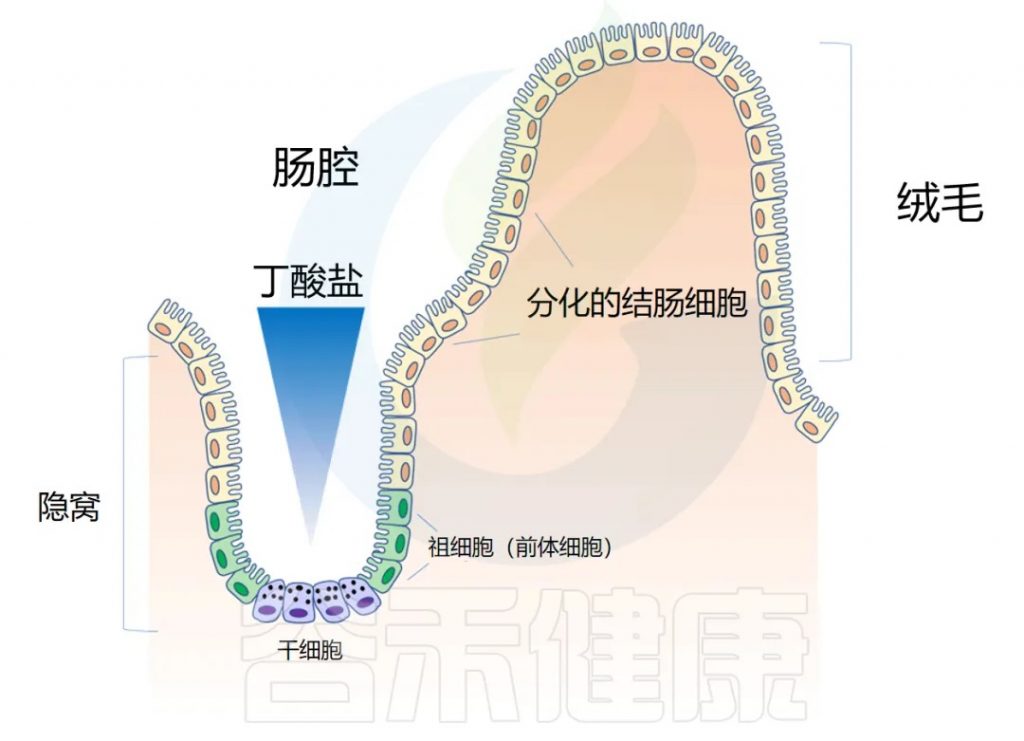
◆ 肠道解剖学:隐窝和绒毛
肠道上皮在人的一生中不断更新。肠壁内陷形成隐窝,而向外突出形成绒毛(villi)。隐窝有点像一个 “山谷”,把绒毛想象成 “山”。
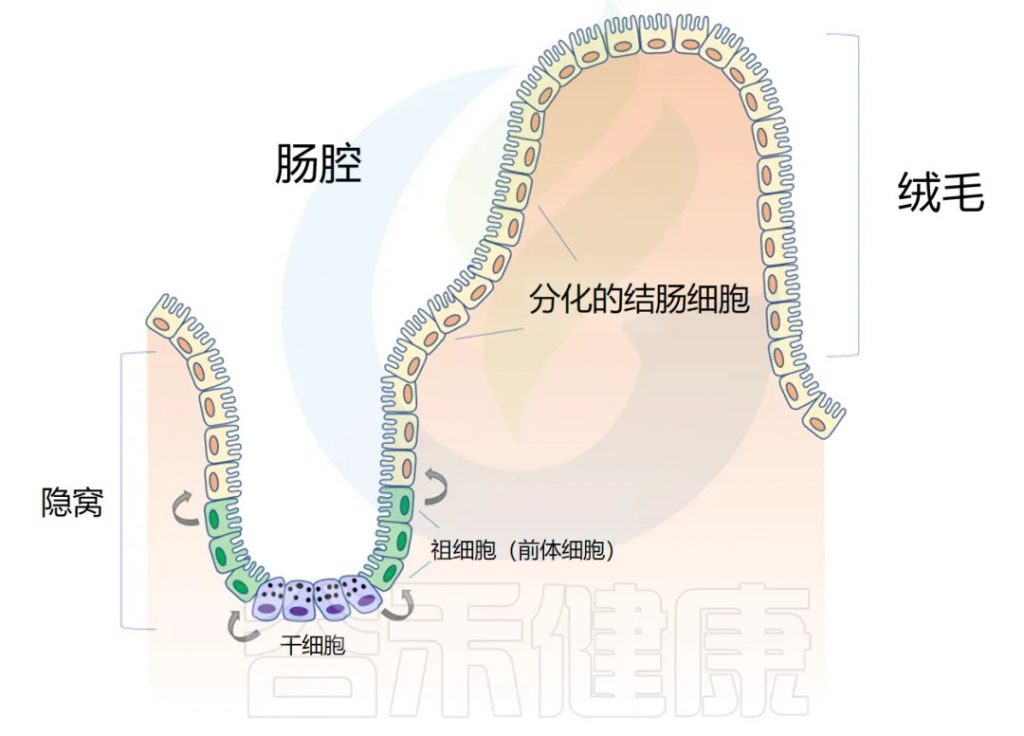
干细胞位于隐窝底部,周期性产生祖细胞,这些祖细胞在绒毛中向上移动时反过来分化为成熟的结肠细胞(colonocytes)。这补充了在顶部脱落的旧细胞。通过这个过程,整个肠道上皮大约每 4-5 天翻新一次。
注:肠道内壁覆盖着一层称为上皮的细胞组织,这些细胞负责吸收营养物质并形成保护屏障。这些上皮细胞不会长期存在,而是会定期死亡并被新细胞替代。这个更新过程非常快速 – 大约每4-5天,肠道内所有的上皮细胞都会被完全更换一遍。这种快速更新有几个重要作用:
这是人体中细胞更新最快的系统之一,反映了肠道作为消化和吸收器官以及防御屏障的重要性。
◆ 隐窝结构对干细胞的保护功能
人们已知隐窝已有数个世纪,但其结构功能直到近些年才被阐明。1974年,Cheng和Leblond提出隐窝可能保护快速分裂的干细胞和祖细胞,使其免受肠腔内的病原体和毒素侵害。

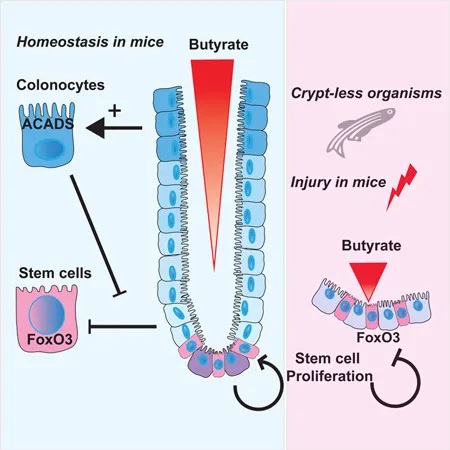
2016年,华盛顿大学的研究小组于《CELL》上发表的研究进一步佐证了该假设。他们利用高通量筛选方法研究微生物代谢物对干细胞增殖的抑制作用,结果他们发现在所有代谢物中,发现丁酸盐是抑制干细胞和祖细胞增殖最有效的抑制剂。
doi:10.1016/j.cell.2016.05.018
隐窝底部干细胞缺乏丁酸盐代谢酶 → 避免暴露于高浓度丁酸盐
然而,在活体生物中,丁酸盐并未导致这种抑制。他们想知道是否隐窝底部的干细胞没有代谢丁酸盐。为了找出答案,他们使用含有放射性标记13C的丁酸盐来评估不同位置丁酸盐代谢的速率。
他们发现,与隐窝底部的干细胞和祖细胞相比,隐窝顶部细胞中13C标记的乙酰辅酶A(丁酸盐氧化的最终产物)水平高出3倍。

作者总结了这些发现:
位于隐窝顶部的分化结肠细胞可以将丁酸盐作为能量来源代谢,从而可能防止干细胞生态位暴露于高水平的管腔丁酸盐。
炎症性肠病中的丁酸盐
◆ 丁酸盐延迟炎症模型中的伤口修复
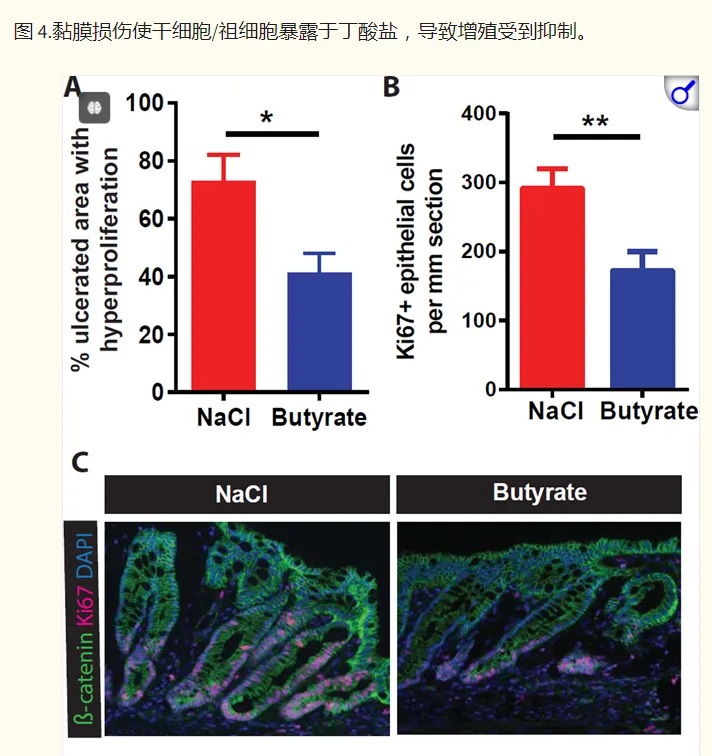
然后,研究人员转向结肠炎的小鼠模型,以了解在丁酸盐存在下隐窝结构的破坏如何影响干细胞增殖。抑制干细胞增殖将阻止愈合粘膜损伤所需的上皮细胞更新。
他们发现,给予丁酸盐可减少与结肠溃疡直接相邻的隐窝中的上皮增殖,并延迟伤口修复。
◆ 产丁酸菌与可发酵纤维在IBD中的双重效应
在另一项实验中,他们发现使用抗生素敲除产生丁酸盐的微生物可以减少结肠炎损伤后的溃疡大小。重新引入丁酸盐或产生丁酸盐的微生物导致大溃疡复发。
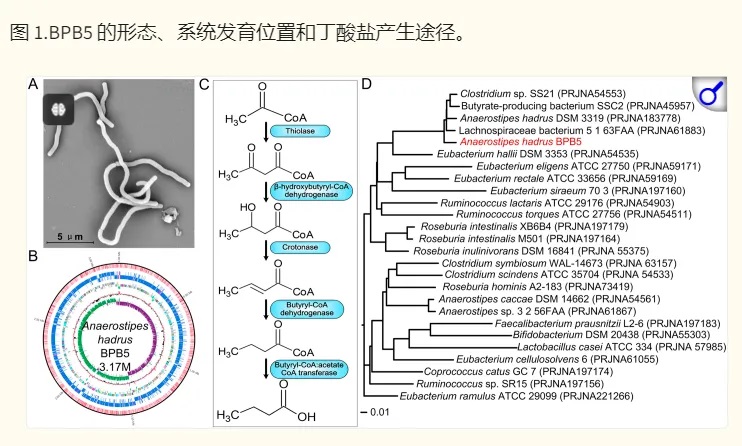
上海交大一项类似的研究(如下),将一种源自人类的产丁酸盐细菌株Anaerostipes hadrus BPB5 引入患有和不患有结肠炎的小鼠中。

另一项研究发现,补充已知可刺激丁酸盐产生的可溶性纤维菊粉导致 IBD 易感(IL-10 敲除)小鼠结肠中的促炎基因表达增加。这在对照野生型小鼠中没有发生。
总之,这些研究表明,丁酸盐、丁酸盐生产菌,甚至潜在的可发酵纤维的好处,都取决于肠道的状况。这些数据也可能部分解释为什么一些炎症性肠病患者在减少 FODMAP 摄入量后似乎有所改善。
同理,上海交大研究团队还指出:对健康个体可能有益的细菌也可能会成为入侵物种,从而对肠道微生物群被疾病破坏的宿主造成致命后果。这样的案例在免疫功能低下个体中引起感染甚至败血症、溃疡性结肠炎、短肠综合征、癌症等的报道均时有发生。
◆ IBD中,产丁酸菌丰度低:原因还是后果?
IBD 患者产丁酸菌水平降低,长期以来被认为是疾病的诱因。然而,一项研究引发了疑问:
缺乏丁酸盐生产者是否仅仅是疾病的结果?
炎症肠道有没有可能为了保护干细胞,抵抗丁酸盐生产菌,从而促进干细胞增殖和粘膜修复?
作者对自身研究的解读:
短期内,丁酸盐可能不利于伤口修复,但长期来看,它可能使宿主受益。通过抑制上皮损伤后干细胞的快速扩增,防止干细胞在接触遗传毒性管腔内容物时分裂。
尽管这个解释有其道理,但更严谨的科学需要不断验证。长期以来,丁酸盐都被认为是有益的,因此理解丁酸盐在肠道完整性受损时可能有害这一新范式颇具挑战。当然如果更多研究就更好了。
◆ 溃疡性结肠炎患者的丁酸盐氧化受损
体外和体内研究的证据表明,溃疡性结肠炎 (UC)患者丁酸盐的氧化受损。De Preter 等人发现,UC 活检中的平均丁酸盐氧化率降低到几乎是对照活检的一半。

根据疾病严重程度分层,非活动性和轻度疾病的丁酸盐氧化率与对照组无异,但中度和重度疾病的丁酸盐氧化率显著降低。值得注意的是,对照组之间的丁酸盐氧化也存在显著差异。
进一步研究丁酸盐动力学表明,丁酸盐浓度并非限制因素。对照组和UC活检的管腔丁酸盐浓度增加至1 mM以上并未提高丁酸盐氧化,表明超过1 mM的饱和点后,丁酸盐浓度不再是限制因素。
作者写道:
“…局部应用较高浓度的丁酸盐并不能克服UC中的粘膜能量不足,并且通过不可消化的碳水化合物或丁酸盐灌肠剂刺激丁酸盐的产生可能对治疗这种疾病无效。”
一项后续的研究表明,丁酸盐氧化减少是由于发炎粘膜对丁酸盐的吸收减少,这与促炎细胞因子下调 MCT1 的表达有关。MCT1 是一种转运蛋白,负责包括丁酸盐在内的多种分子的转运。此外,丁酸盐对 IBD 患者的抗炎作用也降低。
临床试验、动物研究和细胞培养实验显示结果喜忧参半
事实上,当在溃疡性结肠炎中测试丁酸盐灌肠剂或丁酸盐治疗时,动物研究和人体临床试验得出了相互矛盾的结果。
人类研究:丁酸盐灌肠剂研究的矛盾结果
在两项小型非安慰剂对照研究以及两项对照交叉研究中发现了丁酸盐灌肠剂的有益作用。
一项针对轻度至中度结肠炎患者的小型随机安慰剂对照研究发现,含有乙酸盐、丙酸盐和丁酸盐的 SCFA 灌肠剂具有有益作用

目前为止,大型的随机安慰剂对照试验(91名患者)表明,SCFA灌肠对结肠炎没有治疗价值,即使是病情较轻、发作短暂的患者也未能显著获益。
另一项大型随机安慰剂对照试验(38名患者)也未发现生理盐水安慰剂与丁酸盐灌肠之间存在显著差异,接受盐水灌肠的患者甚至比接受丁酸盐灌肠的患者临床改善比例更高(9/19 vs 7/19)。这些研究都没有显示丁酸盐的明确有害影响,但也没有评估其潜在粘膜毒性。

动物研究中的剂量依赖性效应
一项研究发现,口服丁酸钠可减轻小鼠的结肠炎。
但高浓度丁酸盐灌肠可诱导小鼠细胞凋亡和 UC 样病变。
在结直肠癌的小鼠模型中,菊粉和直肠内丁酸盐都已被证明可以改变结肠上皮并增加肿瘤的形成。
在小鼠中,慢性口服 SCFA 诱导 T 细胞介导的输尿管组织炎症,导致肾积水,即肾脏中的积液。
摘要如下:
“当 SCFA 以高于生理水平的水平全身给药时,会导致肾脏系统中的 T 细胞反应失调和组织炎症。”

细胞培养:浓度与环境决定效果
值得注意的是,现在有几项研究表明,SCFA 可以促进免疫调节或免疫激活,具体取决于炎症环境。换句话说,在正常状态下,SCFA 促进免疫调节;在炎症状态下,它们会促进免疫反应的放大。
此外,以低浓度(2mM)施用丁酸盐到上皮培养模型通过加速紧密连接蛋白的组装来改善肠道屏障完整性。然而,在高浓度(8mM)下,丁酸盐会增加屏障通透性。
丁酸盐还促进致病性大肠杆菌中毒力因子的表达。因此,这些大肠杆菌倾向于在丁酸盐水平最高的结肠中定植。
我们应该考虑补充丁酸盐吗?
有很多人发现了丁酸盐补充剂的好处,就如前面提到的。大部分试验中的一些患者确实看到了丁酸盐灌肠的临床改善,丁酸盐当然有很多好处。然而,目前还没有在人类中进行口服丁酸盐补充剂的双盲、安慰剂对照试验,所以需要谨慎的更细致入微的方法。
严重粘膜损伤时应避免直接补充
如果您有严重的粘膜损伤,例如高度活动性溃疡性结肠炎,倾向于建议不要使用丁酸盐灌肠剂或补充剂。
那些较轻的病例、缓解期或难治性结肠炎患者,或没有胃肠道疾病的人可以考虑丁酸盐。尽管如此,避免超生理水平还是很重要的。
直到最近,最广泛可用的丁酸盐形式是丁酸盐,例如丁酸钠或丁酸钙/镁。然而,丁酸盐可能会部分溶解在口中。高浓度口服丁酸盐与牙周炎有关,并可能抑制牙龈上皮细胞的增殖。
益生元:更自然的丁酸盐来源
由于肠道发酵的性质,益生元纤维也可能在结肠中提供更缓慢、更分散的丁酸盐释放。从肠道解剖结构和肠道生态学是在富含可发酵纤维的饮食中进化而来的,这是我们肠道最习惯的丁酸盐前体。
除了产生丁酸盐之外,益生元还有许多好处,包括对肠道上皮的抗炎作用和有益微生物的增殖。要注意的是,在严重的肠道炎症和粘膜损伤的情况下,即使是大量的益生元也可能不利于愈合。
健康状态下,丁酸盐通过多种机制促进肠道健康,包括增强肠屏障功能、促进黏蛋白MUC2的产生、调节免疫反应、抑制炎症,有抗癌潜力。它也是肠道上皮细胞提供主要能量来源。
然而,在肠道损伤或炎症状态下,丁酸盐的作用可能完全相反。研究表明,当肠隐窝结构受损,高浓度丁酸盐直接接触干细胞时,会抑制细胞增殖,延迟伤口修复。在炎症性肠病患者中,丁酸盐的代谢和转运机制受损,使得补充更多丁酸盐可能无法发挥预期效果,甚至可能加重病情。
这种复杂性表明,丁酸盐补充不应一刀切,而需根据个体健康状况、肠道完整性以及具体需求进行个性化评估和应用。肠道菌群检测成为个体化营养干预的重要工具。
对于产丁酸菌缺乏但肠道功能正常的个体,可适度补充丁酸盐;对于肠道屏障功能受损者,则应谨慎使用丁酸盐,可能需先修复屏障再考虑补充。
未来研究应关注丁酸盐作用的剂量-反应关系,明确不同肠道状态下的最佳干预策略,并将肠道菌群分析结果整合到个体化方案中,以实现丁酸盐益处的最大化和风险的最小化,从而更精准地应对不同人群的健康需求。
丙酸盐(Propionate)含有三个碳原子,羟基(-OH)位于第二个碳原子上。
而前面讲的丁酸盐(Butyrate)含有四个碳原子,羟基(-OH)位于第四个碳原子上。
丙酸盐通常由肠道细菌通过发酵L-鼠李糖、聚葡萄糖、阿拉伯木聚糖、D-塔格糖、甘露寡糖、昆布多糖等糖类物质产生。
丁酸盐可以通过肠道微生物群发酵富含抗性淀粉和果聚糖的食物来增加,如菊粉、马铃薯、洋葱等。
丙酸盐的生理作用
肠道健康与代谢调节
丙酸盐刺激肠道平滑肌收缩,增加黏液分泌,促进抗菌肽表达,扩张结肠动脉,并通过释放血清素调节肠道内分泌功能。它还能通过调节胆囊簇细胞促进胆汁释放,防御肠道细菌入侵。
糖代谢:丙酸盐是肝脏糖异生的主要能量来源,可激活三羧酸循环,影响下丘脑食欲调节神经肽,增加瘦素释放,抑制食欲。
脂代谢:抑制胆固醇合成,拮抗乙酸盐的促胆固醇作用,并降低脂肪细胞抵抗素表达,可能对肥胖有保护作用。但在某些研究中,丙酸盐可能通过升高胰高血糖素、去甲肾上腺素等激素增加糖尿病和肥胖风险,提示作用存在个体差异。
免疫调节与抗炎作用
丙酸盐通过激活GPR43/GPR41受体,促进调节性T细胞分化,抑制辅助T细胞活性,减少全身炎症反应。
心血管保护
丙酸盐减少促炎细胞因子(如TNF-α、IL-6),改善心脏纤维化和心功能。
血脑屏障保护
丙酸盐通过Nrf2信号通路减少氧化应激,增强紧密连接蛋白表达,保护血脑屏障完整性。
在前文中,我们看到了四碳丁酸盐,一种有效的抗炎和维持肠道屏障功能的关键分子,在高浓度下可能是有害的,特别是在粘膜炎症的情况下。有趣的是,类似的悖论可能适用于三碳丙酸盐,低浓度有益,但高浓度有毒。
生理双重性
在小鼠中,丙酸盐已被证明可以诱导肠道中产生饱腹感激素,以减少食物摄入并防止饮食诱导的肥胖。 最近的一项研究发现,短链脂肪酸丙酸的管理显著减弱脊柱关节炎。
然而,过量的丙酸盐可能是有问题的。在丙酸血症(代谢的遗传错误)中,丙酸盐的积累与酸中毒、发育迟缓、癫痫发作、氧化应激增加、线粒体功能障碍和胃肠道症状发作有关。肠易激综合征中也有过量丙酸的报道,当然还有自闭症。
丙酸盐与自闭症
近几十年来,自闭症和其他神经精神疾病的患病率急剧上升。环境因素肯定会发挥作用,包括肠道微生物群及其非常重要的代谢产物短链脂肪酸(SCFA)。
自闭症是一种复杂的神经生物学状况,影响多个身体系统,包括免疫和神经系统,表现为沟通和感官理解能力受损,通常在孩子很小的时候被诊断出来,且对男孩的影响更大。
近年来,自闭症的发病率呈上升趋势,在谷禾数据库,自闭症样本量也积累了超过5000例的样本。其特征包括社交和沟通障碍、感觉异常和重复行为等。越来越多的证据表明,自闭症不仅是一种大脑疾病,更是一种“全身”疾病,涉及代谢和免疫功能异常、胃肠道症状等。
多因素病因学挑战传统认知
遗传因素仅解释10%-20%病例,参与线粒体功能,免疫调节和神经回路形成的基因与自闭症有关。
环境因素在自闭症的发病中起着重要作用,肠道菌群失调、抗生素使用、饮食西化等环境因素显著增加ASD风险其中肠道微生物群及其代谢产物短链脂肪酸受到关注。
注:饮食西化这一点在从不发达国家向发达国家移徙的人口中尤其明显。每一个移民到西方国家的索马里人都注意到他们社区的ASD患病率增加。他们称之为“西方病”,因为他们在东非的家乡没有获得这种疾病。
关于自闭症我们以前的文章也有写过相关:
儿童神经发育异常的脑肠轴视角 – 自闭症早期风险判别和干预新路径

这意味着环境因素起着主要作用,自闭症是由基因与环境的复杂相互作用引起的。最近的证据表明,肠道微生物代谢物,特别是SCFA丙酸盐,可能发挥作用。
在动物模型中丙酸盐诱导自闭症样行为
在一项研究中,他们将丙酸盐直接注射到老鼠大脑的脑脊液中。与接受安慰剂输注的大鼠相比,在短短2-30分钟内,丙酸盐治疗的大鼠表现出重复行为,多动增加,社会行为受损和癫痫发作活动的证据。虽然丁酸盐和乙酸盐处理的大鼠确实显示出一些异常,但丙酸盐引起了最强烈的ASD样行为。

在另一项研究中,他们通过外周注射怀孕大鼠及其后代来观察系统性丙酸盐的影响。丙酸盐增加焦虑样行为和重复行为,特别是在出生前和出生后暴露的大鼠中。
丙酸盐与人类自闭症相关的证据
动物模型结果的外推需谨慎,需通过纵向人类研究逐步验证这些生物标志物与自闭症消退或临床改善的关联。
肠道微生物群改变是ASD相关症状的原因还是结果,尚不明确。
然而,普遍认为剖腹产、早期感染和抗生素暴露可能改变肠道微生物群,并增加ASD风险。
研究表明,ASD患儿粪便中丙酸盐水平升高,且ASD相关细菌包括多种丙酸盐产生菌,如梭菌、拟杆菌、脱硫弧菌等。
近期临床研究发现,ASD患者胃肠道活检中梭菌代谢物尿液标志物升高,碳水化合物代谢也发生改变。另有研究报告,使用抗生素治疗后暂时的行为改善,这些抗生素可降低产丙酸菌的水平。
机制:丙酸盐如何导致自闭症
✦【 间隙连接功能 】
MacFabe博士推测,丙酸盐的许多效应可能源于其关闭间隙连接的能力。间隙连接连接着相邻细胞的细胞质,允许小分子和离子在它们之间通过。这对于同步神经电活动至关重要,并在早期大脑发育中扮演着关键角色。间隙连接耦合的减少也可能抑制皮质修剪,这与 ASD 患者中发现的神经元密度增加的现象一致。
关于 Dr. MacFabe 与自闭症研究
Dr. MacFabe是Kilee Patchell-Evans自闭症研究小组的主任。他是温哥华不列颠哥伦比亚大学 iTARGET 自闭症倡议的核心成员。
该小组的核心重点是肠道微生物组的代谢产物如何控制自闭症患者的大脑功能和行为,以及相关的神经精神疾病,如强迫症、焦虑症、运动、饮食和学习障碍。尤其对肠道细菌短脂肪酸代谢物的作用及其在自闭症中的作用以及开发新的临床生物标志物和疗法以预防、识别、筛选和治疗该疾病特别感兴趣 。
此外,间隙连接“基因敲除”小鼠(即经过基因工程改造,不表达任何间隙连接蛋白的小鼠)表现出异常的大脑发育和行为、癫痫性疾病,以及对神经毒性损伤的过度反应。
✦【 线粒体功能障碍 】
ASD 通常伴有与线粒体功能障碍一致的遗传和生化变化。有证据表明,丙酸盐可能通过干扰线粒体 TCA 周期来引起这些变化。

线粒体三羧酸(TCA)循环是细胞能量产生的关键步骤。TCA循环的产物是 NADH 和 FADH2,它们将高能电子带到电子传递链(ETC),在那里它们的还原能力用于产生 ATP(细胞能量)。
从下图中可以看出,一轮TCA循环产生3个NADH分子和1个FADH2分子。丙酸盐通过转化为琥珀酰辅酶A进入TCA循环。少量有助于维持TCA循环中间体,并有利于细胞能量的产生。

然而,进入TCA循环的大量丙酸绕过前四种TCA酶,并可能导致循环的转变。在循环的后半部分通量增加,产生柠檬酸盐积聚,而由于琥珀酰辅酶 A 的反馈抑制,前半部分则因“拥堵”而减缓。
这有几个后果:
首先,这改变了NADH : FADH2的比例,导致产量为1:1而不是3:1。当这些能量载体到达电子传递链时,NADH进入ETC复合物I,FADH2进入复合物II。
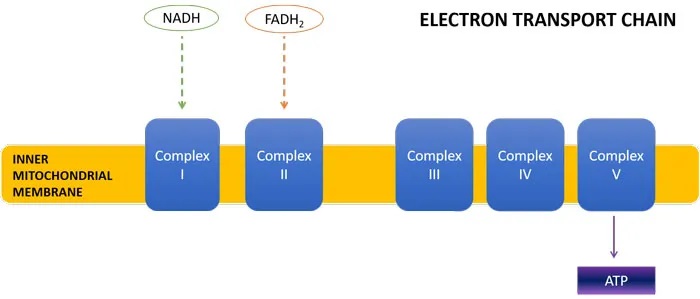
每个NADH分子导致产生3个ATP分子,而每个FADH2分子导致产生2个ATP分子。因此,丙酸盐诱导的TCA循环通量的转变将导致较少的NADH产生,以及复合物I处能量载体的缺乏,导致较少的总体ATP形成。事实上,ASD儿童已被证明缺乏ETC复合物。
其次,线粒体柠檬酸盐的积累将导致柠檬酸盐被转运到细胞胞质溶胶中。柠檬酸盐抑制磷酸果糖激酶,糖酵解的关键调节步骤。柠檬酸盐还增加了丙二酰辅酶A的形成,丙二酰辅酶A抑制CPT-1,CPT-1是将脂肪酸运送到线粒体中的转运蛋白。这有效地阻止脂肪酸氧化。
丙酸盐与线粒体功能:浓度与环境依赖性效应
为了更多地了解丙酸盐在线粒体功能障碍中的作用,McFabe博士实验室的学生培养了ASD和对照患者的免疫细胞,这些患者具有不同浓度的丙酸盐,有和没有活性氧(ROS)。
奇怪的是,他们发现如果ROS不存在,丙酸盐会改善线粒体功能;然而,在ROS存在的情况下,它会对线粒体功能产生负面影响。
换句话说:丙酸盐可以对线粒体功能产生有益和毒性作用,这取决于浓度,暴露时间和微环境。
作为一种弱酸,丙酸盐的摄取在细胞内酸化的条件下增加,并且可以在细胞内变得更加浓缩。像脱硫弧菌这样的菌群,它们产生丙酸和硫化氢。硫化氢的存在可能会增加丙酸盐损害线粒体功能的能力,可能是通过酸化细胞。
✦【 肉碱代谢障碍 】
肉碱代谢障碍也可能在神经发育障碍如ASD中发挥作用。肉碱是最有名的参与脂肪酸β-氧化。脂肪酸不能自由地穿过线粒体膜被代谢,而是必须与肉毒碱分子结合以穿过线粒体膜运输。
然而,肉碱也在脂质合成、胆碱能神经传递、膜稳定性和抗氧化活性中发挥作用。因此,肉碱对细胞能量,大脑发育和大脑功能很重要。

许多ASD患者有相对的肉碱缺乏症,这可能是由于遗传和后天因素。例如,已知某些抗生素可降低肉碱水平。口服肉碱及其衍生物乙酰-L-肉毒碱已被证明具有神经保护作用,并有望作为ASD和其他神经发育障碍的治疗剂。
如果肉碱缺乏,柠檬酸盐的积累阻止脂肪酸被运送到细胞中,不仅脑细胞会受到影响,肠道上皮细胞也会受到影响,后者依赖脂肪酸氧化(特别是丁酸代谢)来获得70%的能量,以维持肠道完整性。缺乏脂肪酸氧化会导致肠道通透性增加。研究表明,36%的ASD患者肠道通透性明显增加,近一半患者存在某种胃肠道症状。
进一步的研究可以探索肉碱补充在改善ASD患者的神经行为和胃肠道症状方面的具体益处,并确定最佳的剂量和给药方案。此外,还需要考虑个体化治疗方法。
关于丙酸盐调节的干预措施
有几种方法可以潜在地减少胃肠道丙酸盐的产生和丙酸盐的细胞水平。
抗生素
甲硝唑和万古霉素已用于ASD患者,取得了一定的成功。这些抗生素对革兰氏阳性菌具有广谱活性,包括产丙酸盐的梭菌属成员。在这两种药物中,万古霉素是更安全的,因为在正常情况下,口服万古霉素不会被显著吸收到循环中,而甲硝唑被全身吸收,可能具有不良的全身副作用。
然而,任何一种抗生素对丙酸盐产生的影响可能是短暂的。
一项为期8周的小型部分盲法临床试验发现,万古霉素对11名儿童中的8名ASD暂时有效,但这种益处并不持久。停止抗生素治疗后,梭菌很快又重新出现,可能是由于它们的孢子形成特性。因此,从长远来看,单独使用抗生素不足以降低丙酸盐的产量。
恢复胃肠道pH值和SCFA比值
改变肠道的pH值对肠道微生物群组成有重大影响。对人类粪便微生物群落的研究发现,在pH 5.5时,有益的丁酸盐产生菌占总菌群的20%。当pH值上升到6.5时,这些细菌几乎完全消失,产生乙酸盐和丙酸盐的细菌占主导地位。当然,恢复ASD患者的结肠pH值并非易事,目前也不是一种可行的治疗选择。

另一方面,丁酸盐已显示出治疗ASD和其他神经系统疾病的一些前景。当然,丁酸盐可以改善屏障功能,调节免疫系统,并可能有助于降低肠道的pH值,选择丙酸盐生产者。丁酸盐对转运蛋白的竞争也可能减少从肠道吸收到循环中的丙酸盐的量。需要更多的研究来确定SCFA比率如何影响ASD。
纠正营养缺乏症
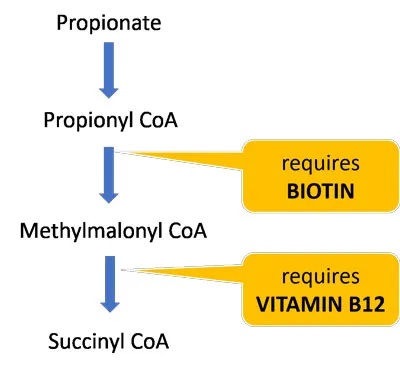
生物素和维生素B12是分解丙酸盐并使其进入TCA循环的酶的重要辅助因子。这些维生素的饮食缺乏可能进一步损害丙酸盐和肉毒碱代谢,并导致线粒体功能障碍(参考自lucy 博士博客内容)。
注:Dr lucy 以优异的成绩获得Kalamazoo College生物学学士学位和伊利诺伊大学厄巴纳-香槟分校营养科学博士学位,她花大量的时间研究饮食和运动对健康和疾病肠道微生物群的影响。
编辑
大约一半的生物素是由肠道微生物群产生的,因此那些肠道生态失调的人特别容易缺乏。
一项研究发现,与对照组相比,ASD儿童的生物素水平显着降低。一项后续研究发现,补充生物素水平与ASD症状改善高度相关,表明许多ASD患者可能受益于生物素补充剂。

无麸质、无酪蛋白饮食
在过去的十年中,无麸质,无酪蛋白(GFCF)饮食已成为ASD患者越来越受欢迎的治疗方法。虽然从饮食中去除这些免疫原性蛋白质可能具有独立的益处,但GFCF饮食也可能对丙酸盐产生影响。
值得注意的是,丙酸盐是小麦和乳制品中主要的动物青贮饲料和食品防腐剂,如丙酸钠或丙酸钙盐,并天然存在于一些乳制品中,如奶酪。

丙酸盐也由许多ASD相关细菌直接或间接产生,如梭菌属和脱硫弧菌属,来自精制糖和小麦糖的发酵。换句话说,当你喂这些细菌某些谷物和精制碳水化合物,他们开始制造更多的丙酸盐。
去除这些食物可能对丙酸代谢和肠道屏障功能有好处。上面提到的同一项研究发现,自闭症儿童的肠道通透性增加,发现那些GFCF饮食的肠道通透性评分低于对照组。
丙酸盐的其他饮食来源
除了小麦和乳制品,丙酸盐也被添加到许多精制食品中作为防腐剂。食品工业和农业越来越多地使用丙酸盐和相关的化学衍生物。硝基丙酸盐是许多植物和真菌产生的丙酸盐的衍生物。它是甘蔗、酱料和加工大米的潜在污染物,也是一种强效的线粒体和神经毒素。
其他食物刺激丙酸盐的产生。例如,人工甜味剂如糖精和糖精已被证明会显著增加啮齿动物肠道丙酸盐水平。
我们之前有写过关于食品添加剂相关的文章:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
2005年的一项研究发现,配方奶粉喂养的婴儿的丙酸盐水平比母乳喂养的婴儿高2.5倍。在配方中添加低聚糖仅部分改善了过量丙酸盐的产生。

GAPS饮食和碳水化合物
Natasha Campbell-McBride博士因其著作《肠道与心理综合征》而在自闭症社区中广为人知。麦克布赖德博士认为,包括自闭症在内的神经精神疾病是在肠道中产生的。她帮助许多儿童和成人扭转自闭症行为,并使用特定碳水化合物饮食(SCD)的修改版本(称为GAPS饮食)恢复正常的日常功能。
GAPS饮食在一段时间内从饮食中去除所有可发酵的碳水化合物,使炎症消退,肠道屏障愈合和密封。有趣的是,GAPS饮食排除了几乎所有的饮食丙酸盐来源和产丙酸菌的底物,这至少可以部分解释饮食对治疗神经系统疾病的成功。
在最初的消除阶段之后,重新引入富含菊粉的蔬菜,如西兰花和花椰菜,可能会优先喂养丁酸盐生产者。
GAPS饮食也是生酮的,特别是在早期阶段。生酮饮食对丙酸代谢的影响尚不清楚,尽管由于碳水化合物限制,丙酸产量可能要低得多。生酮饮食似乎还增加了整体NADH的产生和通过TCA循环右侧的通量,可能改善了由过量丙酸引起的左侧性。最后,酮与丙酸盐和其他SCFA使用相同的转运蛋白,因此可能通过竞争转运减少细胞中丙酸盐的积累。

回顾一下本章节主要的要点:
自闭症和其他神经系统疾病越来越普遍,这不能用遗传影响来解释。
丙酸盐在自闭症中的研究最多,但它也可能对其他神经系统和神经系统相关疾病有影响。即使是患有脑雾或疲劳的人也可能会有过量丙酸盐的影响。
丙酸盐在动物模型中可诱导ASD样行为。人类ASD患者的产丙酸盐菌丰度增加,粪便丙酸盐水平升高。
丙酸盐不是自闭症的唯一原因,但它可能在ASD患者的一个子集中起着重要作用。丙酸盐诱导间隙连接功能障碍、线粒体功能障碍、肉毒碱功能障碍,特别是在炎症和酸中毒的情况下。
抗生素可以暂时击倒丙酸盐生产者,但不是长期解决方案。
补充乙酰-L-肉毒碱、生物素、甲基维生素B12和/或丁酸盐可能有帮助。
丙酸盐在食品中的广泛使用需要注意。去除小麦、乳制品和其他丙酸盐的饮食来源可能会改善症状。
婴儿配方奶粉、精制碳水化合物和人造甜味剂会刺激产丙酸菌的生长。
GAPS饮食可以通过在一段时间内去除所有可发酵的碳水化合物来帮助调节丙酸盐的产生。之后,战略性地重新引入合适的纤维可能能够刺激有益的产丁酸菌的增长,并使丙酸盐生产者处于困境。
乙酸盐是含两个碳原子的短链脂肪酸,由肠道菌群发酵膳食纤维产生,也可通过外源性摄入。
乙酸盐的生理功能
能量代谢:作为细胞燃料参与三羧酸循环(TCA)。
抑制炎症反应:乙酸盐通过激活G蛋白偶联受体(GPR43),抑制促炎因子(如IL-6、TNF-α)表达。
调节肠道免疫:通过GPR43激活,促进肠黏膜屏障修复,减少细菌易位,并通过调节IgA与菌群结合维持肠道稳态。
神经调节:作为星形胶质细胞的主要能量源,参与神经递质合成(如GABA)。
维持肠道屏障:乙酸盐促进肠道上皮细胞增殖,改善血供,增强黏液分泌,保护黏膜完整性。
乙酸盐会让你发胖?
研究已经知道,微生物群的改变与代谢综合征和体重增加有关。
2006年,研究人员发现,遗传肥胖小鼠的微生物组具有更强的从饮食中收集能量的能力。此外,将肥胖小鼠的粪菌移植到无菌小鼠体内,会使无菌小鼠体重和脂肪增加。
在人类中,粪便乙酸盐水平升高与肥胖相关,但相关性不等于因果关系。
耶鲁大学研究人员开展了一项题为 “乙酸盐介导微生物组 – 脑 – β – 细胞轴以促进代谢综合征” 的研究,发表在《自然》杂志上,主要发现如下:
◆ 肥胖大鼠代谢更多乙酸盐,分泌更多胰岛素
在导致肥胖的饮食 3 天或 4 周后,大鼠的全身乙酸盐周转、血液乙酸盐和粪便乙酸盐浓度显著增加,肠道微生物群是乙酸盐升高的来源。喂食正常饮食并将乙酸盐输注到胃中的大鼠复制了肥胖大鼠中 GSIS 的增加。
◆ 乙酸盐激活迷走神经以驱动胰岛素分泌
作者接下来研究了乙酸盐是否可以通过直接影响 β 细胞(负责胰岛素分泌的胰腺细胞)来刺激 GSIS。他们发现乙酸盐不会刺激离体胰岛中的 GSIS,但通过影响副交感神经系统,特别是激活迷走神经,增加了 GSIS。
注:副交感神经系统调节β细胞胰岛素分泌。这通常被称为“休息和消化”神经系统,因为它会减慢心率并增加肠道活动。
研究人员发现,输注乙酸盐 60 分钟后,副交感神经活动增加了三倍。脑乙酸盐浓度也增加,证实了乙酸盐穿过血脑屏障的能力。
刺激迷走神经也被证明可以驱动胰岛素分泌。迷走神经从脑干开始,几乎支配每个腹部器官,包括肠道和胰腺。
乙酸盐是否激活了迷走神经?为了找出答案,他们比较了乙酸盐对迷走神经完整的大鼠和手术切除迷走神经的大鼠的影响。
研究发现,输注乙酸盐后,副交感神经活动和脑乙酸盐浓度增加,将乙酸盐直接输注到大脑也导致 GSIS 大幅增加。切断迷走神经的大鼠对乙酸盐的反应中血浆胰岛素浓度显著降低。
下图总结了他们的发现,显示了肠-脑-β细胞轴:
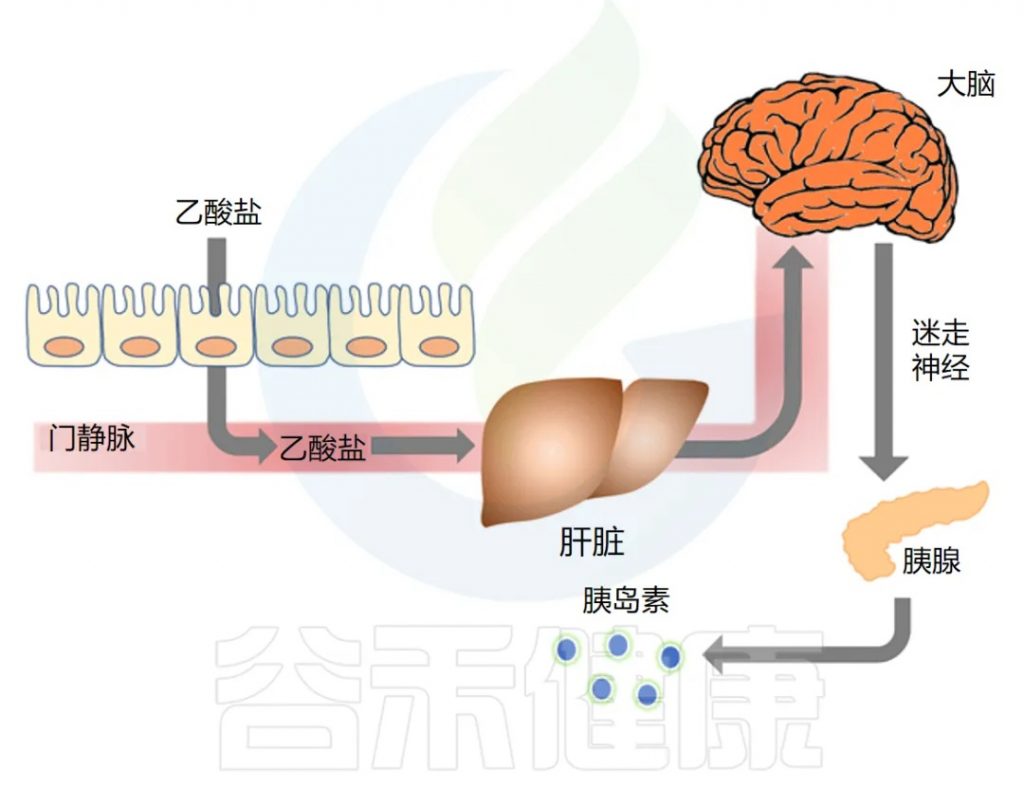
◆ 长期乙酸盐输注会导致肥胖和代谢综合征
最后,研究人员想确定乙酸盐本身会导致肥胖。他们给瘦大鼠连续输注乙酸盐到胃中10天,结果发现,接受乙酸盐输注的大鼠胰岛素分泌和胰岛素抵抗增加,副交感神经系统活动增加,血浆 grehlin (一种调节食物摄入的激素)激素增加了3倍,每日热量摄入量增加,体重显著增加,血浆、肝脏和骨骼肌甘油三酯含量增加。而迷走神经切断术的大鼠未出现这些作用。再次证明乙酸盐的作用是通过迷走神经介导的。
所以肠道来源的乙酸盐会导致肥胖,对吧?
还没那么快下定论。
这项研究的结果与体外研究和多项动物研究形成鲜明对比,那些研究认为乙酸盐对新陈代谢有益。
体外研究
乙酸盐与受体 GPR43 结合,在培养的肠道上皮细胞中,导致分泌一种调节能量代谢的肠道来源的激素;在脂肪组织中,激活 GPR43 抑制胰岛素信号传导并抑制脂肪堆积,从而提高胰岛素敏感性。
动物研究
缺乏乙酸受体 GPR43 的小鼠在喂食正常饮食时变得肥胖,而过表达 GPR43 的小鼠即使在喂食致肥胖饮食时也保持苗条。
给饮食诱导的肥胖小鼠纳米颗粒递送的乙酸盐。在肝脏中,乙酸盐减少了脂质积累,改善了肝功能,并提高了线粒体效率。在白色脂肪组织中,乙酸盐抑制脂肪分解,但会诱导“褐变”,增加代谢能力并导致体内脂肪减少。
菊粉、低聚果糖等益生元增加了乙酸盐的产生,并导致 Grehlin 的产生减少,从而导致食物摄入量、体重和脂肪量减少。
在饮食诱导的肥胖小鼠中,每隔一天禁食 (EODF)升高血清乙酸盐和乳酸水平,这与白色脂肪组织的褐变和代谢改善有关。
乙酸盐已被证明还有其他好处:
耶鲁大学的研究为理解乙酸盐在肥胖中的作用提供了一个新视角,但同时也引发了更多的疑问,为什么在不同研究条件下,乙酸盐对肥胖和代谢综合征的影响会出现如此大的差异呢?这促使我们进一步探讨可能影响乙酸盐作用的各种因素。
不同模型和条件下乙酸盐的差异
模型差异
Perry 等人使用大鼠进行研究,而其他关于乙酸盐和肥胖或代谢综合征的研究大多使用小鼠品系,不过大鼠和小鼠的生理机能相似,这一因素不太可能解释所有差异。
方式差异
胃内(进入胃)和口服或结肠乙酸盐之间可能存在差异。正如 Canfora 等人指出的那样,“连续胃内供应的乙酸盐可能会影响胃的 pH 值,从而可能影响胃排空和食物释放、消化和吸收以及激素调节。”
此外,乙酸盐受体的表达在整个胃肠道中并不均匀,不同位置的乙酸盐可能产生不同影响。稍后将讨论一些人体研究,这些研究发现根据乙酸盐的位置存在不同的影响。
剂量差异
正如我们在丁酸盐中看到的那样,SCFA 的剂量非常重要。Perry 等人使用的大剂量乙酸盐可能与肠道微生物群正常产生或在饮食中消耗的乙酸盐水平不符,剂量不同可能导致不同结果。
SCFA 比率差异
在大多数健康人中,SCFA 以 3:1:1 的比例存在,仅通过提供乙酸盐可能扭曲这个比率,导致不同的代谢效应。
那么,超生理剂量的胃内乙酸盐会引起代谢综合征吗?是的。Perry 等人证明了这一点。
但是肠道菌群产生的乙酸是否会导致代谢综合征?可能不是。
我们可以从 Perry 等人的研究中学到什么?
首先,乙酸盐周转受肠道影响,在肥胖时升高。其次,乙酸盐可能确实会激活迷走神经以引起胰岛素分泌,因为将乙酸盐注射到大脑中证实了胃内输注的结果。至少在动物中是这样的。
人类和动物受体对乙酸盐的反应不同?
无论如何,至少有三项研究表明,GPR43 是乙酸盐的主要受体,对小鼠和人类的刺激反应不同:
这只是动物模型无法准确模拟人类生理的常见案例之一,所幸已有相当数量的人体研究关注了乙酸盐。
需要进一步的研究来明确阐明乙酸盐在人类中的作用。
关于乙酸盐和代谢综合征的动物研究结果喜忧参半,这可能是由于给药方式、剂量和 SCFA 比率的差异。
乙酸对大脑和免疫系统有益。
人类和动物对乙酸的响应不同 ,因此我们不能依赖动物研究来了解乙酸在人类中的作用。
有限的临床试验似乎表明乙酸对新陈代谢有有益作用。
乙酸盐的位置似乎很重要。在结肠更远端产生的乙酸盐似乎具有最有益的效果。
短链脂肪酸这些看似简单的分子,无疑是解读“微生物-宿主”对话的重要密码。短链脂肪酸研究引领我们重新思考健康的本质——健康并非某种单一指标的最优化,而是复杂生态系统的动态平衡。
正如肠道微生物群的多样性对健康至关重要,短链脂肪酸的种类、比例和浓度的平衡同样重要。未来的健康管理将从单一指标的”正常化”,转向生态系统的”平衡化“。
肠道菌群检测与短链脂肪酸代谢评估将成为个体健康”生态地图”的重要组成部分,谷禾肠道菌群检测报告中也有关于菌群代谢的短链脂肪酸相关指标。
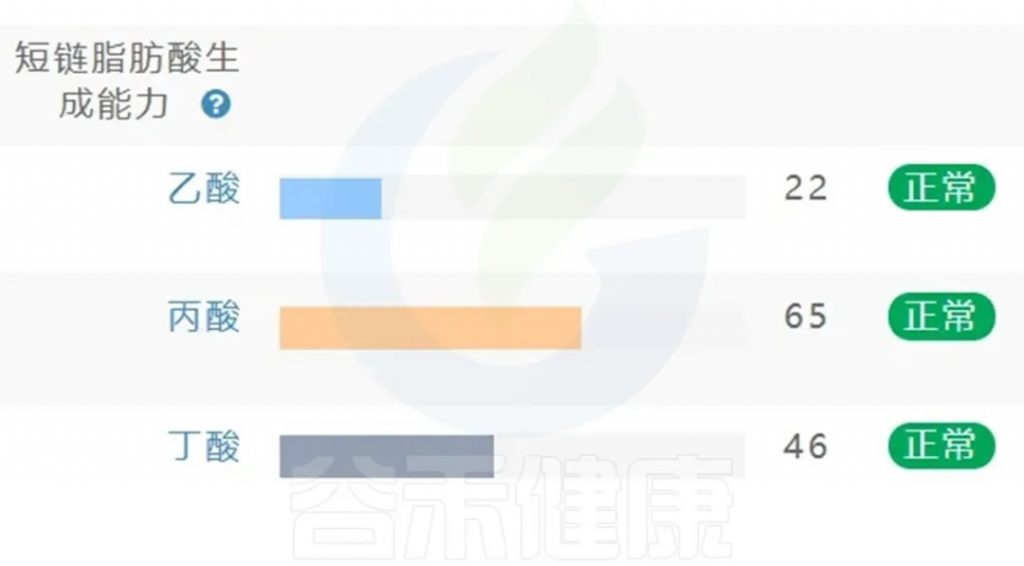
<来源:谷禾肠道菌群检测数据库>
随着对短链脂肪酸双面性理解的加深,未来的干预策略将更加精准和个性化。
针对短链脂肪酸不足的个体,可能会有靶向益生菌组合或特定结构的益生元配方,从小剂量开始逐步增加,避免肠道不适,有利短链脂肪酸的产生。但同时也需要结合其他指标,比如说肠道屏障功能是否正常,这在谷禾肠道菌群检测报告中也有相关指标。在肠道屏障薄弱的情况下,可以考虑优先修复肠道屏障,再补充短链脂肪酸。
而对于那些特定短链脂肪酸过高或对其敏感性增加的人群,可能需要定制化的饮食方案或特异性的益生菌干预,鉴别过度生长菌群比如说梭菌,可能需要优先考虑维持菌群平衡的相关干预策略,例如考虑低FODMAP饮食、减少添加剂摄入等方式,同时补充关键辅助因子如B族维生素、辅酶Q10等支持线粒体能量产生。
通过精准检测和个性化管理,我们可以逐步优化肠道微生态平衡,使短链脂肪酸保持在有利于健康的水平。
在药物开发方面,短链脂肪酸受体调节剂、缓释型短链脂肪酸制剂以及能够在特定肠道环境中释放活性成分的”智能”递送系统,都可能成为下一代肠道健康干预工具。
在日益关注肠道健康的今天,短链脂肪酸研究无疑将成为连接微生物学、营养学、临床医学的重要桥梁。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Singh, N. et al. Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis. Immunity 40, 128–139 (2014).
Chang, P. V., Hao, L., Offermanns, S. & Medzhitov, R. The microbial metabolite butyrate regulates intestinal macrophage function via histone deacetylase inhibition. Proc. Natl. Acad. Sci. U. S. A. 111, 2247–2252 (2014).
Zhou, D. et al. Sodium butyrate attenuates high-fat diet-induced steatohepatitis in mice by improving gut microbiota and gastrointestinal barrier. World J. Gastroenterol. 23, 60–75 (2017).
Donohoe, D. R. et al. The Warburg effect dictates the mechanism of butyrate-mediated histone acetylation and cell proliferation. Mol. Cell 48, 612–626 (2012).
Lucy Mailing, PhD., A brief introduction to short-chain fatty acids
Decrypting the butyrate paradox: can excess butyrate be toxic?
Does acetate make you fat? The skinny on acetate and metabolic syndrome
The propionate-autism connection
Sun, J. et al. Clostridium butyricum pretreatment attenuates cerebral ischemia/reperfusion injury in mice via anti-oxidation and anti-apoptosis. Neurosci. Lett. 613, 30–35 (2016).
Li, H. et al. Sodium butyrate exerts neuroprotective effects by restoring the blood-brain barrier in traumatic brain injury mice. Brain Res. 1642, 70–78 (2016).
Sun, J. et al. Antidepressant-like effects of sodium butyrate and its possible mechanisms of action in mice exposed to chronic unpredictable mild stress. Neurosci. Lett. 618, 159–166 (2016).
Kaiko, G. E. et al. The Colonic Crypt Protects Stem Cells from Microbiota-Derived Metabolites. Cell 165, 1708–1720 (2016).
Zhang, Q. et al. Accelerated dysbiosis of gut microbiota during aggravation of DSS-induced colitis by a butyrate-producing bacterium. Sci. Rep. 6, (2016).
Kuo, S.-M., Chan, W.-C. & Hu, Z. Wild-type and IL10-null mice have differential colonic epithelial gene expression responses to dietary supplementation with synbiotic Bifidobacterium animalis subspecies lactis and inulin. J. Nutr. 144, 245–251 (2014).
Machiels, K. et al. A decrease of the butyrate-producing species Roseburia hominis and Faecalibacterium prausnitzii defines dysbiosis in patients with ulcerative colitis. Gut 63, 1275–1283 (2014).
Belcheva, A. et al. Gut microbial metabolism drives transformation of MSH2-deficient colon epithelial cells. Cell 158, 288–299 (2014).
Park, J., Goergen, C. J., HogenEsch, H. & Kim, C. H. Chronically Elevated Levels of Short-Chain Fatty Acids Induce T Cell-Mediated Ureteritis and Hydronephrosis. J. Immunol. Baltim. Md 1950 196, 2388–2400 (2016).
Park, J. et al. Short-chain fatty acids induce both effector and regulatory T cells by suppression of histone deacetylases and regulation of the mTOR-S6K pathway. Mucosal Immunol. 8, 80–93 (2015).
Chambers, E. S. et al. Effects of targeted delivery of propionate to the human colon on appetite regulation, body weight maintenance and adiposity in overweight adults. Gut 64, 1744–1754 (2015).
Asquith, M. et al. Intestinal Metabolites Are Profoundly Altered in the Context of HLA-B27 Expression and Functionally Modulate Disease in a Rat Model of Spondyloarthritis. Arthritis Rheumatol. Hoboken NJ 69, 1984–1995 (2017).
MacFabe, D. F. Enteric short-chain fatty acids: microbial messengers of metabolism, mitochondria, and mind: implications in autism spectrum disorders. Microb. Ecol. Health Dis. 26, 28177 (2015).
Foley, K. A., Ossenkopp, K.-P., Kavaliers, M. & MacFabe, D. F. Pre- and Neonatal Exposure to Lipopolysaccharide or the Enteric Metabolite, Propionic Acid, Alters Development and Behavior in Adolescent Rats in a Sexually Dimorphic Manner. PLOS ONE 9, e87072 (2014).
Finegold, S. M. State of the art; microbiology in health and disease. Intestinal bacterial flora in autism. Anaerobe 17, 367–368 (2011).
Rossignol, D. A. & Frye, R. E. Mitochondrial dysfunction in autism spectrum disorders: a systematic review and meta-analysis. Mol. Psychiatry 17, 290–314 (2012).
Frye, R. E. et al. Modulation of mitochondrial function by the microbiome metabolite propionic acid in autism and control cell lines. Transl. Psychiatry 6, e927 (2016).
Reichardt, N. et al. Phylogenetic distribution of three pathways for propionate production within the human gut microbiota. ISME J. 8, ismej201414 (2014).
Suez, J. et al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature 514, 181–186 (2014).
Napoli, E., Dueñas, N. & Giulivi, C. Potential Therapeutic Use of the Ketogenic Diet in Autism Spectrum Disorders. Front. Pediatr. 2, (2014).
Fernandes, J., Su, W., Rahat-Rozenbloom, S., Wolever, T. M. S. & Comelli, E. M. Adiposity, gut microbiota and faecal short chain fatty acids are linked in adult humans. Nutr. Diabetes 4, e121 (2014).
Kimura, I. et al. The gut microbiota suppresses insulin-mediated fat accumulation via the short-chain fatty acid receptor GPR43. Nat. Commun. 4, 1829 (2013).
Sahuri-Arisoylu, M. et al. Reprogramming of hepatic fat accumulation and ‘browning’ of adipose tissue by the short-chain fatty acid acetate. Int. J. Obes. 2005 40, 955–963 (2016).
Frost, G. et al. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nat. Commun. 5, (2014).
Everard, A. et al. Microbiome of prebiotic-treated mice reveals novel targets involved in host response during obesity. ISME J. 8, 2116–2130 (2014).
Li, G. et al. Intermittent Fasting Promotes White Adipose Browning and Decreases Obesity by Shaping the Gut Microbiota. Cell Metab. 26, 672–685.e4 (2017).
Wu, W. et al. Microbiota metabolite short chain fatty acid acetate promotes intestinal IgA response to microbiota which is mediated by GPR43. Mucosal Immunol. 10, 946–956 (2017).
Long, P. M. et al. Acetate supplementation as a means of inducing glioblastoma stem-like cell growth arrest. J. Cell. Physiol. 230, 1929–1943 (2015).
Trent, C. M. & Blaser, M. J. Microbially Produced Acetate: A ‘Missing Link’ in Understanding Obesity? Cell Metab. 24, 9–10 (2016).
Canfora, E. E. & Blaak, E. E. Acetate: a diet-derived key metabolite in energy metabolism: good or bad in context of obesity and glucose homeostasis? Curr. Opin. Clin. Nutr. Metab. Care 20, 477–483 (2017).
Ang, Z. et al. Human and mouse monocytes display distinct signalling and cytokine profiles upon stimulation with FFAR2/FFAR3 short-chain fatty acid receptor agonists. Sci. Rep. 6, srep34145 (2016).
Canfora, E. E. et al. Colonic infusions of short-chain fatty acid mixtures promote energy metabolism in overweight/obese men: a randomized crossover trial. Sci. Rep. 7, 2360 (2017).