-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

如果近期出现鼻子、喉咙、肺部相关症状,如咽喉痛、发烧(体温迅速升高通常超过38.5℃)、咳嗽、流鼻涕、鼻塞、乏力、发冷、浑身疼痛等情况,很有可能是甲流。
根据中国疾病预防控制中心2025年第1周流感监测周报显示(截至2025年1月5日),本周南、北方省份流感病毒检测阳性率继续上升,甲型H1N1流感占比99.4%。
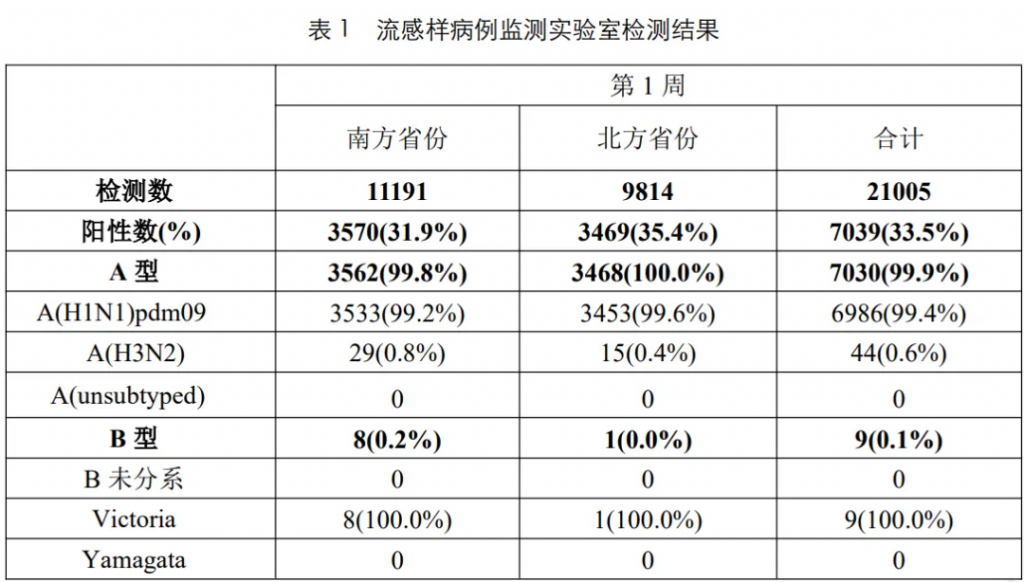
来源:Chinacdc
甲型流感是一种高度传染性的呼吸道感染疾病,其传播速度快、感染范围广,给公共卫生带来了巨大挑战,甲流每年导致300万-500万例严重感染和25万-50万例死亡。甲型流感主要通过咳嗽、打喷嚏或说话时的飞沫传播,症状可持续几天到几周。
近年来的研究发现,甲流感染可能会破坏肠道微生物群的平衡,而肠道生态失调可能会影响甲流患者的疾病进展。
调节肠道菌群可以通过肠-肺轴促进抗甲流病毒的免疫效应。这包括在感染的早期阶段促进甲流病毒清除,并在后期阶段减少炎症损伤。此外,肠道菌群还可以通过维持肠道屏障功能、产生具有保护作用的代谢产物(如短链脂肪酸、氨基酸、胆汁酸)等,促进宿主的免疫反应。
本文我们主要来详细了解一下甲流的症状、原因、潜伏期、危险因素、感染过程,包括肠道菌群及其代谢产物与甲流的关系,以及通过调节肠道菌群及其代谢产物来防治流感的潜在策略,包括益生菌、植物化学物质、中药等干预措施,这为甲流的预防和治疗提供了新的策略。
流感病毒有四种类型:甲(A)、乙(B)、丙(C)、丁(D)。甲型和乙型流感病毒几乎每个冬天都可能会引起季节性疾病流行。
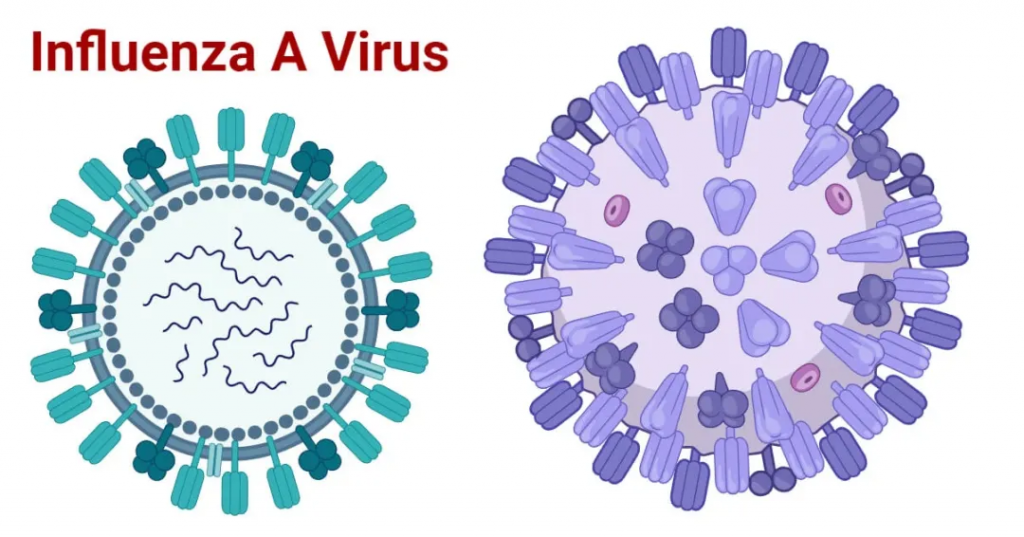
甲流病毒是一种包膜病毒,包膜含有两种糖蛋白,一种叫血细胞凝集素(HA),另一种叫神经氨酸酶(NA)。
注:有18种不同的血凝素亚型和11种不同的神经氨酸酶亚型(分别为H1至H18和N1至N11)。
这两个可以排列组合形成不同的流感亚种,比如说H1N1,就是血细胞凝集素的1型和神经氨酸酶的1型组合。目前经常在人群中传播的甲型流感病毒亚型包括H1N1和H3N2。
甲型流感主要影响呼吸系统,包括鼻子、喉咙、肺。症状可能会突然出现,可能包括:
严重的症状
在严重病例中,甲流引起一系列症状,可能较少见:
图源:mypositiveparenting
并非所有流感都出现呼吸道症状
医生提醒,呼吸道症状是流感的典型症状,但以恶心、呕吐为主的消化道症状患者也大有人在。此外,还有部分患者会出现反应迟钝、嗜睡、躁动等精神系统症状。以上这些症状可能合并出现,也可单独出现,容易给人误导,导致没有及时就诊,延误流感的治疗。
当病毒感染上呼吸道(鼻窦,口腔和喉咙)或下呼吸道(肺部)的组织时,可能会发生甲型流感。病毒可以在这些组织内复制,从而引起症状。
这种流感具有高度传染性。你可以通过咳嗽、打喷嚏或在他人附近说话将病毒传染给他人。
甲流病毒通常在每个流感季节迅速变异。免疫系统可能无法立即抵抗新形式的病毒,即使以前得过流感,你也可能会有几天的症状。
如果被感染,通常会在接触后一到四天(潜伏期)出现流感症状,平均 2 天。
流感可以持续几天到两周。
发烧和身体疼痛等症状可能会突然出现,但通常比其他症状消失得更快。咳嗽或流鼻涕会持续更长时间。
普通感冒由鼻病毒等多种病原体导致,传染性弱,发病没有明显的季节特征,症状表现为鼻塞、流涕、喷嚏、咳嗽等,一般不发热或仅有低热,没有全身性症状,5-7天即可自愈,很少有并发症出现。
甲流传染性强,容易大范围流行,发病季节特征明显。患者表现为高烧、头痛、乏力,并伴有全身肌肉酸痛等。甲流有一定自限性,但容易引起其他并发症,包括肺炎、中耳炎、心肌炎、脑膜炎等严重并发症。
甲流和乙流之间有几个区别:
其他两种流感:
任何人都可能患上甲型流感。某些人出现严重症状和并发症的风险更大,例如:
大多数甲流病例在几周内消退,甲流可能更严重,并导致一些人的并发症,并发症可能包括:
耳部感染:对甲型流感的免疫反应会引起炎症,这会影响并导致咽鼓管中的液体积聚。这根管子把喉咙后部和中耳连接起来。这种液体会吸引可能导致耳部感染的细菌。尤其在儿童中较为常见。
鼻窦感染:甲型流感可能会导致鼻窦充血和炎症,从而吸引可能导致感染的细菌。
脑炎:免疫反应可能导致这种大脑炎症。甲流病毒可以通过血液或神经系统进入脑部,引起脑组织的炎症和损伤。
脑膜炎:表现为头痛、呕吐、意识障碍等症状。
心肌炎: 流感病毒可以直接攻击心肌细胞,引起心肌受损,表现为心悸、胸闷、胸痛、乏力等症状。
肌肉炎症:对流感过度活跃的免疫反应可导致肌肉炎症。症状包括疼痛、触痛和肌肉无力。
肺炎:甲型流感会削弱免疫系统,使其更容易受到细菌的感染,导致肺部感染。表现为高热、咳嗽加剧、呼吸困难等,严重时可导致呼吸衰竭。
继发性细菌性肺炎:它通常发生在病程的后期,在急性疾病观察到一段时间的改善之后,症状和体征是典型的细菌性肺炎。继发性细菌性肺炎比原发性病毒性肺炎更常见。
脓毒症:这是一种严重的、危及生命的感染反应。如果细菌进入血液就会发生。如果不治疗,败血症会导致器官损伤和死亡。
急性呼吸窘迫综合征(ARDS):在重症病例中可能出现,导致严重的呼吸困难。
这些并发症在免疫力低下的人群中更为常见和严重,如老年人、儿童、孕妇以及患有慢性疾病的人。因此,及时就医和治疗对于预防并发症的发生至关重要。
病毒入侵
首先,甲流病毒主要通过呼吸道进入人体。
甲流病毒通过其表面的血凝素(HA)蛋白与呼吸道上皮细胞表面的唾液酸受体结合,从而进入宿主细胞。
病毒复制
病毒进入细胞后,其基因组RNA在细胞核内进行复制,并指导宿主细胞合成病毒蛋白。新合成的病毒颗粒在细胞内组装后,通过细胞膜释放到外界,感染其他细胞。
免疫反应
当甲型流感病毒入侵人体后,免疫系统会迅速识别病毒的病原相关分子模式(PAMPs),激活先天性免疫应答。
巨噬细胞、树突状细胞等免疫细胞被激活,开始分泌多种细胞因子,包括IL-1、IL-6、TNF-α和干扰素等。这些细胞因子一方面协调免疫细胞的募集和活化,增强机体的抗病毒能力;另一方面作用于下丘脑体温调节中枢,导致体温升高,同时还可引起全身性炎症反应,造成肌肉关节疼痛、乏力等症状。
症状形成机制
发热:发热是由于病毒感染触发免疫系统释放的细胞因子(如IL-1、IL-6等)作用于下丘脑温度调节中枢,使体温设定点上调所致,这种发热反应实际上有利于抑制病毒复制并增强免疫功能。
咳嗽:病毒直接感染呼吸道上皮细胞,导致细胞损伤、炎症反应和气道分泌物增多的结果,刺激气道感受器引起咳嗽反射。
全身症状:如肌肉酸痛、乏力、头痛等,主要是由细胞因子介导的系统性炎症反应引起,这些炎症介质可以作用于全身多个器官系统,影响神经-内分泌网络,导致患者出现全身不适。症状的严重程度往往与机体免疫反应的强度直接相关。
病毒变异特点
抗原漂移:点突变导致的小幅变异
抗原转变:基因重配导致的大幅变异
变异使病毒逃避免疫系统识别,是季节性流感和流感大流行的重要原因。
在传统认知中,我们往往将甲流视为一种单纯的呼吸道感染,但随着研究的深入,研究人员发现这种认识可能过于简单化。近年来,越来越多的研究表明,人体的免疫系统是一个高度统一的网络,其中肠道菌群作为人体最大的微生态系统,在调节全身免疫反应中扮演着关键角色。
肠道菌群可以通过调节免疫细胞的分布和功能,影响宿主对流感病毒的免疫反应,显著影响呼吸道感染的疾病进程和预后。此外,肠道菌群的代谢产物,如短链脂肪酸,也被发现能够调节免疫系统,从而可能对甲流的发病机制产生间接影响。接下来,我们进一步探讨肠道菌群是如何参与和调节甲流感染的过程。
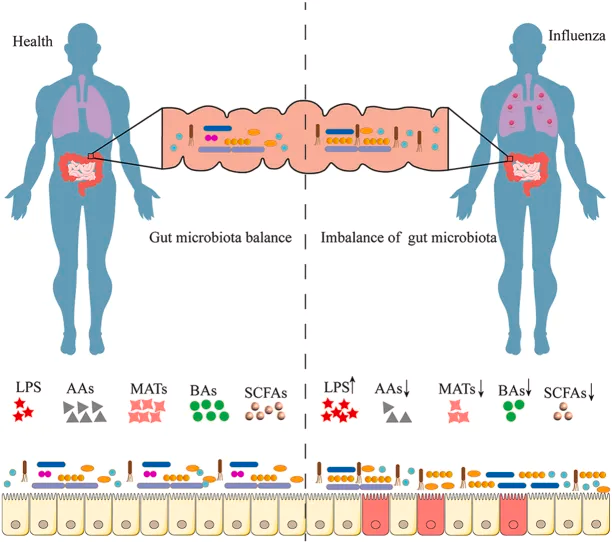
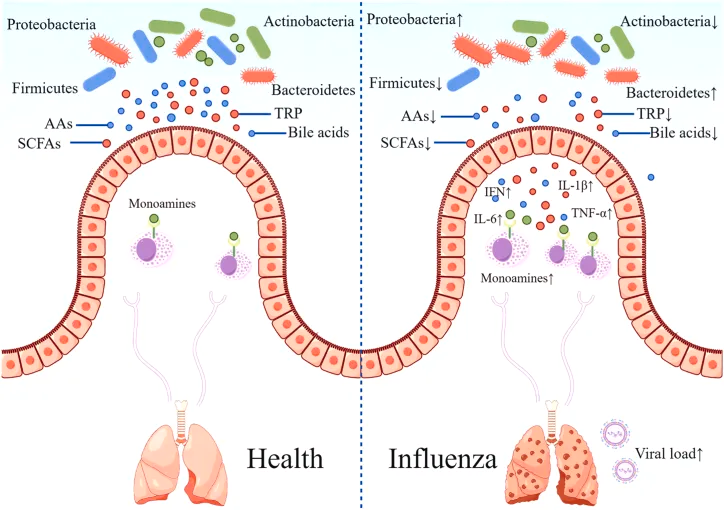
研究表明,肠道微生物群的丰富性和多样性响应于甲流感染发生了显著变化,包括拟杆菌门中细菌数量的增加和厚壁菌门中细菌数量的减少。同样,另一项研究表明,流感感染改变了肠道微生物群,促进肠道特异性厌氧菌的消耗和变形菌门的富集,导致肠道生态失调。
doi: 10.1016/j.heliyon.2024.e37661
▸甲流病毒感染
肠道菌群多样性增加,同时下列菌群增殖较为明显:
而一些有益菌的丰度则降低:
在健康个体中,肠道微生物群以平衡、稳定的方式在肠道中定植,与肠道粘膜屏障和抑菌物质一起维持肠道微生态。 一个平衡良好的肠道菌群能够增强机体的免疫功能,从而降低感染甲型流感的可能性。以下是几个关键机制:
调节免疫系统
在流感病毒感染后,CCR9 + CD4 + T细胞(其是源自肺的效应细胞)被募集到小肠,在小肠中它们分泌干扰素-γ(IFN-γ)。这导致肠道微生物群的不平衡,促进了小肠中的Th17细胞极化。最终导致IL-17 A分泌,其介导免疫损伤。接下来,我们从先天免疫和适应性免疫两方面详细了解肠道菌群对甲流的影响。
先天免疫
肠道微生物主要通过两种方式影响流感病毒感染的先天免疫:
首先,肠道菌群能够影响一种叫做天然淋巴细胞(ILCs)的免疫细胞。这些ILCs细胞在我们的肺部可以对抗病毒,而肠道菌群就像是一个“信号员”,通过释放一些信号物质,告诉肺部的ILCs该怎么做。比如,肠道菌群产生的短链脂肪酸(SCFAs)可以调节肺部ILCs的数量和功能,帮助我们更好地对抗流感病毒。
此外,肠道菌群还能够影响我们的身体识别病毒的能力。它们通过激活一些特殊的受体(比如Toll样受体和RIG-I样受体),帮助我们的身体更快地发现病毒并启动免疫反应。一旦有病毒入侵,就能迅速发出警报,让免疫细胞及时赶到“战场”去消灭病毒。
适应性免疫
肠道微生物群对甲型流感的适应性免疫影响主要体现在三个方面:
1- CD4+T细胞的调节
肠道微生物及其代谢产物可调节CD4+T细胞的分化。
在感染早期,主要促进Th1和Th17细胞分化,有助于病毒清除,乳酸杆菌通过参与色氨酸代谢和产生芳烃受体配体,促进IL-22表达,影响Th17分化;梭菌属通过诱导TGF-β释放,促进结肠Treg细胞分化。
短链脂肪酸(SCFA)通过多种机制促进Treg细胞分化,帮助控制炎症。
抗生素破坏菌群会显著降低CD4+T细胞数量,影响病毒清除。
2- 细胞毒性T淋巴细胞(CTL)的影响
CTL是消灭病毒感染的关键角色,而肠道微生物群能够通过调节树突状细胞(DCs)的活动来增强CTL的细胞毒性作用。
抗生素导致的菌群破坏会降低CTL的免疫应答。
3- 参与调节流感疫苗的免疫效果,促进流感特异性抗体的产生
预防流感的最佳方法是在流行期前接种流感疫苗,以产生特异性抗体。近期的临床试验表明,益生菌制剂可以有效增强流感疫苗的保护效力及提高个体抗体滴度。
然而,动物实验显示,接种前使用抗生素会降低疫苗诱导的抗体滴度及其中和能力,而在无菌小鼠中,恢复肠道植物群能恢复疫苗保护效力。此外,短链脂肪酸(SCFA)的不足会影响B细胞向特异性抗体产生浆细胞的分化。
维护肠道屏障功能
感染甲型流感病毒后,肠黏膜屏障功能障碍与感染的严重程度密切相关。
肠黏膜屏障由肠上皮细胞构成,分泌多种免疫因子并传递细菌抗原,在维持肠道菌群与宿主的共生关系中发挥着重要作用,并作为维持肠道菌群稳定性和生态平衡的控制开关。
流感病毒感染通过破坏肠上皮细胞中紧密连接蛋白和粘附蛋白的功能来影响肠道屏障,这些蛋白调节肠道屏障功能,阻止肠腔内大分子(如细菌和毒素)进入血液。
这些蛋白表达的降低可导致屏障功能受损,从而增加甲型流感病毒的疾病进展和危重症的发生。研究发现,小鼠感染H1N1导致肺和结肠中紧密连接蛋白的表达显著降低。这种减少导致这些器官的屏障结构受损,从而允许肠道细菌易位。随后,通过体液循环发生继发性细菌感染。
产生有益代谢产物
短链脂肪酸
短链脂肪酸包括乙酸盐、丙酸盐和丁酸盐,SCFAs可以通过调整流感病毒感染宿主的肠道菌群结构,如增加双歧杆菌等有益菌的数量,增强免疫适应性等来抵抗流感病毒。
短链脂肪酸能够增强肠道上皮细胞的免疫功能,促进免疫细胞的增殖和分化,同时具有抗炎作用,能够减轻流感病毒感染引起的炎症反应。
在流感期间补充短链脂肪酸,可以减轻肠道病原体如鼠伤寒沙门氏菌的移位,并提高合并感染的存活率。
肠道菌群及其代谢产物对正常人和流感患者的影响
doi: 10.1016/j.heliyon.2024.e37661
氨基酸
支链氨基酸被认为是身体健康的“潜在生物标志物”,在蛋白质合成、分泌和激素(如胰岛素和生长激素)释放中发挥重要作用。 研究表明,庆大霉素治疗后,肠道微生物群紊乱诱导流感小鼠体内支链氨基酸水平升高,从而抑制CD11b + Ly6G +细胞的发育,增加CD8+T细胞水平,导致流感病毒感染程度增加。
色氨酸是必需氨基酸,其缺乏会损害肠道免疫力,通过改善宿主先天免疫应答,降低流感期间的发病率和死亡率,补充色氨酸可能是预防流感的有效策略。
脱氨基酪氨酸(DAT),一种Clostridium orbiscindens菌产生的代谢物,可以通过提高I型干扰素(IFN)的水平,来增强身体对流感病毒的抵抗力,从而减少流感感染小鼠的体重减轻和死亡率。
胆汁酸
初级胆汁酸在肝脏产生,分泌到肠道中,约95%通过肠-肝循环被重吸收。
肠道菌群衍生的代谢产物脱氧胆酸(DCA)通过TGR5受体信号通路,抑制病毒复制,抑制嗜中性粒细胞依赖性组织损伤,增加宿主对流感病毒的抵抗力。
牛磺胆酸是一种胆汁酸。牛磺胆酸钠水合物(STH)抑制流感病毒复制,降低流感病毒RNA、互补RNA和mRNA水平,并对多种流感病毒株(H5N6、H5N1、H1N1、H3N2)表现出广谱抗病毒活性。 此外,STH降低流感病毒感染小鼠中炎症因子(TNF-α、IL-1β、IL-6)的表达,减轻其临床症状,抑制体重减轻,并降低其死亡率,这归因于STH通过抑制NF-B途径的激活而在流感抗性中的作用。
鹅去氧胆酸对甲型流感病毒(H5N1、H9N2和H1N1)具有抑制作用,它能够通过阻断病毒RNA复合物的核输出来抑制甲型流感病毒的复制。
以上我们了解到健康的肠道菌群通过多重免疫调控机制能够增强机体对甲型流感病毒的抵抗力,包括增强免疫系统的警戒能力、提升适应性免疫防护、调节炎症反应等,但在实际临床工作中,准确及时的诊断仍然是控制流感传播和开展针对性治疗的关键。接下来我们来看在临床中,医生可能借助的实验室检测手段。
甲型流感与其他病毒感染(如COVID-19)的症状类似。诊断测试包括:
★ 病毒分离和鉴定
从患者的呼吸道标本中分离出甲型流感病毒,并通过电镜或免疫荧光等方法进行鉴定。
优点:是诊断甲流的金标准。
缺点:操作复杂且耗时较长,一般不作为常规诊断方法
★ 甲型流感病毒核酸检测
通过聚合酶链式反应(PCR)等技术检测病毒的核酸。采集患者的呼吸道标本(如鼻咽拭子、口咽拭子等),进行核酸提取和扩增。
优点:准确率高,是确诊甲流的常用方法。
缺点:需要专业的实验室设备和技术
★ 快速抗原检测
通常使用检测试剂条,从鼻子或喉咙采集组织样本后检测病毒的存在,最快可在15分钟内显示结果,类似于新冠抗原检测。
优点:速度快;
缺点:敏感性和特异性相对较低。
★ 血常规检查
通过检测血液中的白细胞水平等指标,辅助诊断甲流。
优点:可以提供一些间接的诊断信息。
缺点:不能直接确诊甲流
★ 胸部X光
拍摄肺部图像以排除细菌感染或肺炎。
优点:可以排除其他肺部疾病。
缺点:影像学表现无特异性,不能单独用于确诊甲流。
利福昔明通过调节肠道菌群改善甲流病毒感染引起的肺屏障损伤
IAV引起了显着的体重减轻,并破坏了肺和肠的结构。16 S rRNA和代谢组学分析结果表明,感染甲流的小鼠粪便样品中益生菌Lachnoclosdium、Ruminococcocceae_UCG-013和色氨酸代谢产物的水平显著降低。
相比之下,补充50mg/kg利福昔明可以逆转这些变化,包括促进肺屏障的修复,增加粪便中Muribaculum、Papillibacter和色氨酸相关代谢物的含量。此外,利福昔明治疗增加了ILC3细胞数量、IL-22水平以及肺中RORγ和STAT-3蛋白的表达,减轻对肠屏障的损伤,同时增强小肠中AHR、IDO-1和紧密连接蛋白的表达。
在病原体清除方面,用冻干鼠李糖乳杆菌GG和加氏乳杆菌TMC0356进行口服预处理显著降低了PR8感染后6天小鼠肺部的病毒载量。
此外,单独口服煮沸的植物乳杆菌06CC2、植物乳杆菌DK119、热灭活b240和副干酪乳杆菌也降低了甲流病毒感染后BALF中的病毒载量。
口服加氏乳杆菌SBT2055可在感染后5天降低PR8感染小鼠肺部的病毒载量,并上调抗病毒基因Mx1和Oas1a的表达。益生菌治疗降低肺部病毒载量可能与促进对甲流病毒的先天免疫和适应性免疫有关。
煮沸的植物乳杆菌06CC2在感染早期(第二天)增加了抗病毒效应分子IFN-a、IFN-γ、IL-12的水平和NK细胞的活性。
口服植物乳杆菌DK119可增加BALF中IL-12和IFN-γ水平。
副干酪乳杆菌增加了甲流感染后肺组织中树突状细胞的募集。
植物乳杆菌0111口服预处理在H9N2感染后7天上调ISG转录,同时提高脾脏中CD3+CD4+TNF-α+T淋巴细胞百分比和CD3+CD8+TNF-β+T淋巴细胞百分比,增强对病毒的适应性免疫。
在感染的晚期,一些益生菌还可以抑制炎症损伤,促进组织修复。鼠李糖乳杆菌M21可减少甲流感染小鼠肺部的炎症损伤,并增加肺部裂解物中的IFN-γ和IL-2水平。
A. muciniphila可降低H7N9感染小鼠中促炎因子IL-1β和IL-6的水平,并增加炎症调节因子IL-10、IFN-β和IFN-γ的水平。
与益生菌粘膜乳杆菌L. mucosae1025和短双歧杆菌CCFM1026联合治疗可提高甲流感染小鼠盲肠粪便中的丁酸水平,并减轻肺组织中的炎症浸润。
一些口服益生菌可以双向作用,在甲流感染的早期阶段创造一个有利于病毒清除的炎症环境,并在后期抑制过度的炎症激活。
口服Bacteroides dorei在感染早期(第3天)更快地增加了1型干扰素的表达,降低了肺部的病毒载量,而在感染后期(第7天),它降低了1型IFN和其他促炎因子的水平,这有利于组织修复。与此同时,Bacteroides dorei治疗也改变了肠道菌群组成,增加了拟杆菌、普氏菌和乳杆菌,减少了大肠杆菌、志贺氏菌和副拟杆菌。
除此之外,益生菌制剂还可以通过促进甲流特异性抗体的产生来提高流感疫苗的有效性。
植物乳杆菌16和鼠李糖乳杆菌P118共同口服,改善了宿主对甲型流感病毒感染的防御。
研究人员利用C57BL/6和BALB/c小鼠模型的研究结果表明,单独施用植物乳杆菌16(L.plantarum 16)或鼠李糖乳杆菌P118(L.rhamnosus P118)并不能提供足够的流感防护。然而,植物乳杆菌16和鼠李糖乳杆菌P118的联合给药显著降低了呼吸道和肺部的病毒滴度,从而显著缓解了临床症状,改善了预后,降低了死亡率。
这种作用的机制涉及通过共同施用植物乳杆菌16和鼠李糖乳杆菌P118来调节宿主肠道微生物群和代谢,导致厚壁菌门富集和苯丙氨酸相关代谢增强,最终导致抗病毒免疫反应增强。值得注意的是,研究人员发现循环代谢分子2-羟基肉桂酸在抗击流感中起着重要作用。数据表明,植物乳杆菌16和鼠李糖乳杆菌P118这两种细菌或2-羟基肉桂酸在预防流感方面具有潜在的效用。
膳食中添加益生元短链低聚半乳糖和长链低聚果糖会增加小鼠流感疫苗特异性T辅助细胞1反应和mLN中特异性B细胞活化,导致IgG1和IgG2A水平升高。
β-葡聚糖重编程中性粒细胞以促进对甲型流感病毒的疾病耐受
最新研究表明,β-葡聚糖通过重编程造血干细胞来产生具有”调节”功能的中性粒细胞,这些特殊的中性粒细胞具有线粒体氧化代谢特征并能产生IL-10。这种机制通过RoRγt+ T细胞促进中性粒细胞向肺部组织募集,提高了机体对甲流病毒感染的疾病耐受能力,有助于维持肺部组织的完整性,从而降低发病率和死亡率,而这种保护作用并不依赖于抑制病毒载量。
益生元改善肠道菌群,延长流感疫苗抗体效果
接受肠内营养治疗的60岁以上老年人在标准肠内营养配方治疗的基础上,接受了双歧杆菌生长刺激素和半乳糖低聚糖治疗14周,并在治疗后第4周接种了三价季节性流感疫苗(A/H1N1、A/H3N2和B)。在第0、4、6、8和12周测量抗体滴度。结果显示,两组疫苗免疫应答率无差异,但实验组肠道内双歧杆菌数量明显高于对照组,实验组A/H1N1抗体滴度维持时间长于对照组。这表明益生元可能会增加肠道中益生菌的数量,从而维持抗体滴度。
中药在临床应用已有一千多年的历史,最近研究表明,中药在减轻甲流患者肺部炎症、改善临床症状、缩短治疗时间、促进康复等方面具有功效。
感染肺部后,甲流病毒可以改变肠道微生物群的组成和代谢,导致肠粘膜屏障受损、免疫功能受损和炎症因子水平升高。尽管如此,中药干预具有调节肠道微生物群、恢复体内平衡、保持肠粘膜屏障完整性、增强免疫功能和调节炎症反应的潜力。
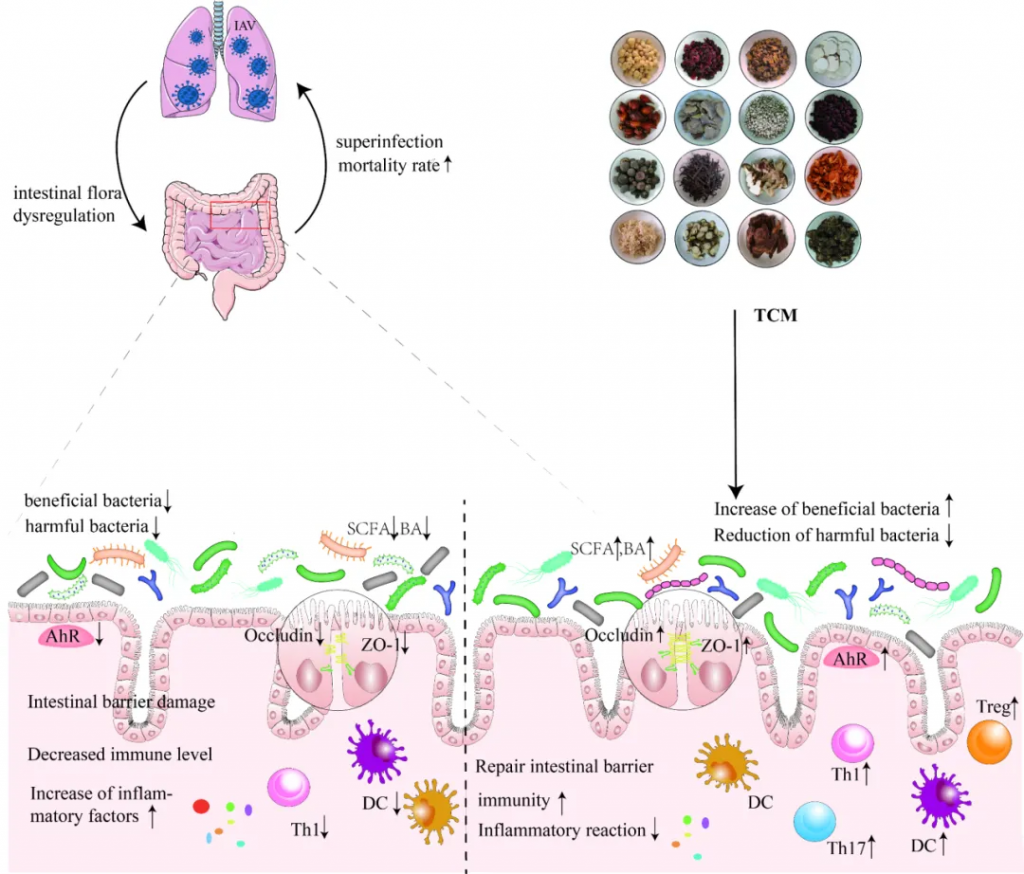
doi: 10.1186/s12985-023-02228-3.
宣肺败毒汤调节肠道微生物群多样性,并与拟杆菌、志贺氏菌、Eubacterium nodatum、Turicibacter、Clostridium sensu stricto 1 的变化呈正相关,而这些变化与 TNF-α 水平相关。
升麻素苷(Prim-O-glucosylcimifugin,POG)是中药防风的提取物,可以通过上调紧密连接蛋白Occludin、Claudin-3和ZO-1的表达水平来调节肠道菌群结构并修复肠道免疫屏障。
999 小儿感冒颗粒可以缓解H1N1感染小鼠的体重减轻,降低IL-6和IL-1β等炎性细胞因子的水平。 降低肺指数和病理损伤,通过维持结肠杯状细胞的数量来保护肠道屏障,降低结肠组织中IL-17 A的表达。
大黄中蒽醌类成分不仅增加了大鼠肠道中一些益生菌和产短链脂肪酸菌的丰度,而且通过上调ZO-1和闭塞素的表达水平来增强肠道屏障功能,从而抑制炎症。
其他中药对菌群及免疫的影响
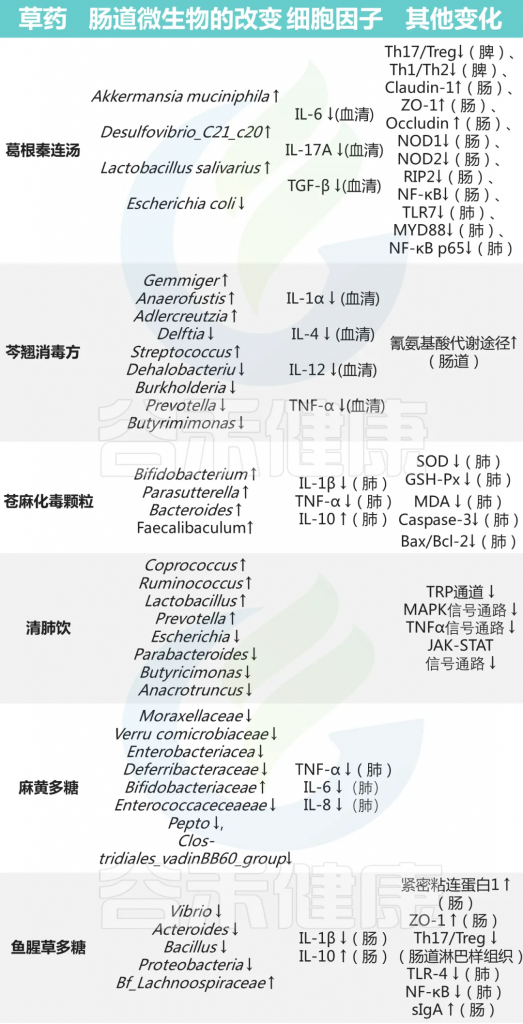
编辑
doi: 10.3389/fimmu.2023.1147724
黄芪多糖具有免疫增强作用,有望成为甲流疫苗的新型佐剂
黄芪多糖组表现出更高的免疫球蛋白G(IgG)、IgG 1和IgG 3水平,以及中和抗体水平。此外,它增加了CD 8+细胞的频率,以增强对致死性感染的抵抗力。
感染后第14天,高剂量黄芪多糖组的存活率(71.40%)高于血凝素组(14.28%),体重恢复更快。
黄芪多糖还能改善肺泡损伤和肠道结构紊乱。上调肠组织紧密连接蛋白Occludin和Claudin-1的表达水平,降低血清TNF-α的表达水平。此外,Colidextribacter、消化球菌科和瘤胃球菌科的群体是病毒感染后黄芪多糖组中的优势肠道微生物群。
doi: 10.1002/ptr.8334

doi: 10.2147/IJGM.S361001
维生素C
维生素 C 具有重要的抗炎、免疫调节、抗氧化、抗血栓和抗病毒特性。诺贝尔奖获得者莱纳斯·鲍林从随机对照试验中得出结论,维生素 C 可以预防和缓解感冒。
一项针对儿童上呼吸道感染的荟萃分析发现,维生素C的补充能够减少感染持续时间约1.6天。
口服维生素 C(2-8 克/天)可以减少呼吸道感染的发生率和持续时间。
英国安慰剂对照试验由 168 名志愿者组成,他们在 60 天的冬季期间随机接受安慰剂或维生素 C(每天 2 × 500 毫克)。
维生素 C 组的感冒次数较少(37次 vs.50次,p=0.05)
病毒感染的“感冒”天数更少(85次 vs.178次,p=0.03)
严重症状持续时间较短(1.8天 vs.3.1天,p=0.03)。
试验期间患过两次感冒的参与者人数显着减少(维生素 C 组为 2/84,安慰剂组为 16/84;p=0.04)
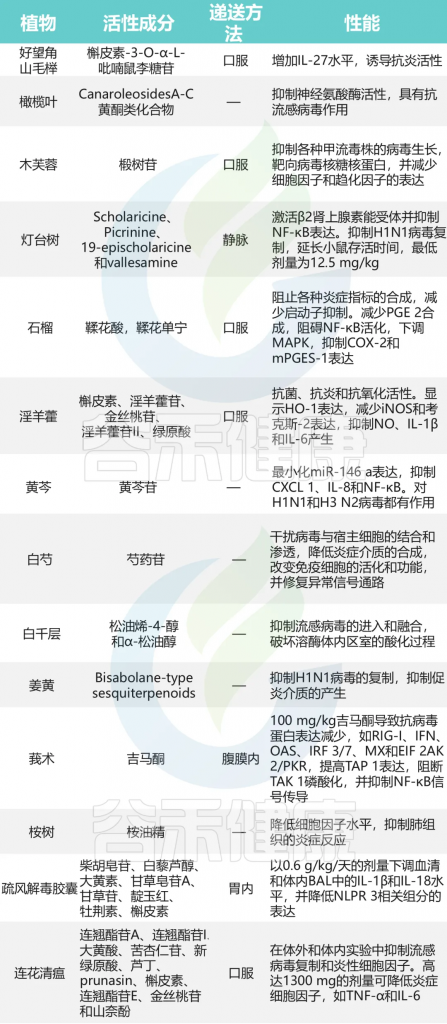
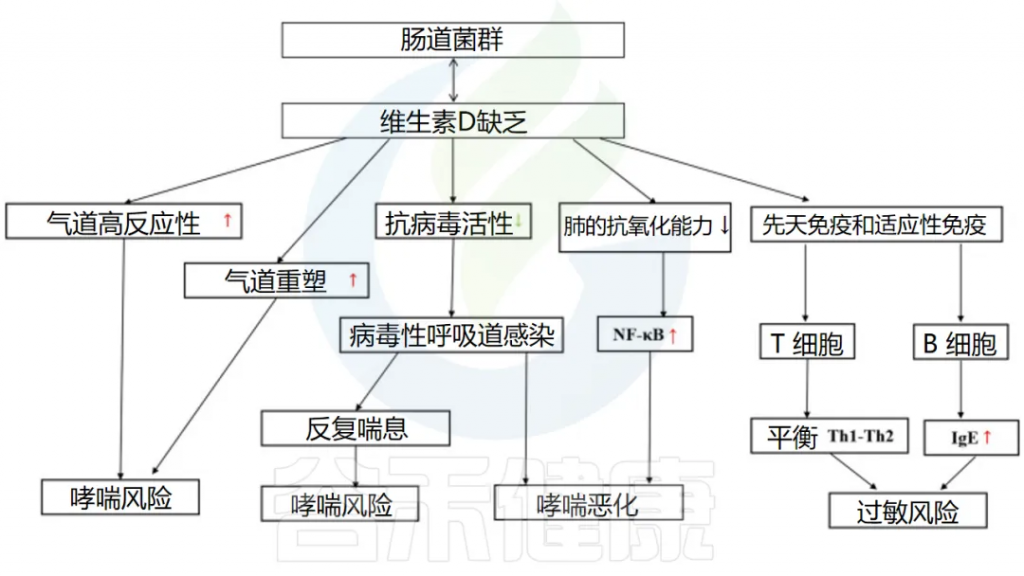
维生素D
维生素D缺乏会影响呼吸道感染的发生和哮喘的恶化。
维生素D和肠道微生物组以多种类似的方式影响呼吸道疾病中的免疫系统。它们之间可能存在一些相互作用和/或协同作用。
肠道微生物组可以改变肠道维生素D代谢,1,25(OH)2D (维生素D的活性形式)水平较高的人更有可能拥有有利的肠道微生物群,尤其是更多的产丁酸菌。
维生素D->抗病毒感染->降低哮喘发生和恶化的风险
一项涉及不同国家儿童的队列研究发现,补充维生素D 与 RV感染呈负相关。此外,患有下呼吸道感染的儿童的平均维生素 D 水平明显低于对照组。下呼吸道感染的发生率和严重程度也与维生素 D 水平相关。
维生素D可以双向调节肠道微生物群
doi: 10.3389/fmicb.2023.1219942
维生素D通过多种途径影响哮喘的发生
因此,保持足够的维生素D水平对于预防和管理哮喘以及呼吸道感染至关重要。
研究表明,甲流病毒主要破坏气道上皮紧密连接,导致急性呼吸窘迫综合征,且胃肠道症状常与甲流病毒感染同时发生,提示肠-肺轴参与了宿主对甲流病毒的反应。在感染甲流病毒的患者和小鼠中发现SCFA(尤其是乙酸盐)显著减少。
在FMT后的小鼠中,这些条件被逆转,减少了肺部炎症损伤,并证实乙酸盐可能是肠-肺轴的重要介质。进一步的实验表明,乙酸盐激活了GPR 43,恢复了一些甲流病毒诱导的气道上皮屏障功能,并降低了TNF-α、IL-6、IL-1β水平。FMT能够有效调节流感感染小鼠肠道菌群结构紊乱。
粪菌移植通过增强I型干扰素通路改善甲流防御
在病毒感染中,I型干扰素(IFNs)非常重要,它们是病原体和宿主之间的重要调节因子。I型干扰素是抵御病毒感染的第一道防线。通过使用感染了甲流病毒的小鼠模型,研究人员发现IFN-κb是最早对H9N2感染做出反应的I型干扰素之一,并且IFN-κb能够有效地抑制多种流感病毒在培养的人类肺细胞中的复制。因此,阻断IFN-κ特异性途径可以作为预防和治疗甲流的依据。
I型干扰素途径对身体很重要。适当调节它既能抵御病毒感染,又能避免免疫或病理对身体造成过度损伤。比如降低IFNAR1水平可抑制流感病毒早期繁殖。
I型干扰素主要会激活一些干扰素刺激基因(ISGs)的表达。ISGs编码的蛋白质具有多种抗病毒功能。抗生素的使用会导致肺间质细胞中ISGs的减少,从而使身体更容易感染流感病毒。
然而,粪菌移植(FMT)可以逆转这一情况,增加肺间质中的I型干扰素信号通路和I型干扰素驱动的抗病毒状态,从而增强对流感病毒感染的防护。
在流感季节很容易感染甲型流感,因为它传染性很强。预防策略可以保护你免受流感或减少并发症的风险。一些常见的预防方法包括:
肠道微生物群是一个复杂而广泛的群落,显著影响各种生物系统,包括免疫系统和代谢功能。最近的研究越来越多地强调肠道微生物群与流感之间的潜在联系,表明肠道微生物群可能影响流感病毒的致病性,从而提供了一种新的治疗靶点。
总之,肠道微生物群表现出对流感的治疗潜力,这可以通过调节肠道微生态来解决。未来的研究应侧重于确定肠道微生物群中的关键菌株、特定代谢物和免疫调节机制,以精确靶向微生物群干预,预防和治疗流感和其他呼吸道病毒感染。
在此基础上,菌群组合的优化研究显得尤为重要。比如说通过研究植物乳杆菌16和鼠李糖乳杆菌P118等益生菌的协同作用,探索不同菌群配比对免疫调节的影响,从而制定个体化的菌群干预方案。
可以进行新型保护性代谢物的筛选与鉴定,深入研究短链脂肪酸、胆汁酸等代谢产物的作用机制,并结合代谢组学分析推进临床应用。
开展一系列临床转化研究,包括建立菌群检测作为辅助诊断的标准化体系,开展益生菌制剂的临床试验,并根据不同患者特点制定个性化预防和治疗方案。同时,预防策略的优化也需要重点关注,特别是探索疫苗免疫效果与肠道菌群的关系,建立预防性菌群调节方案,并为高危人群制定个性化预防策略。
这些研究方向相互关联、相互促进。分子机制的研究为菌群组合优化提供理论指导,代谢产物研究则为临床应用提供新靶点,而临床转化研究的结果又能反馈指导基础研究的方向。通过多维度、多层次的研究,将更全面地理解肠道菌群与甲型流感的关系,为开发新型防治策略提供坚实的科学依据。
主要参考文献
Khan N, Tran KA, Chevre R, Locher V, Richter M, Sun S, Sadeghi M, Pernet E, Herrero-Cervera A, Grant A, Saif A, Downey J, Kaufmann E, Khader SA, Joubert P, Barreiro LB, Yipp BG, Soehnlein O, Divangahi M. β-Glucan reprograms neutrophils to promote disease tolerance against influenza A virus. Nat Immunol. 2025 Jan 8.
Luo C, Yang Y, Jiang C, Lv A, Zuo W, Ye Y, Ke J. Influenza and the gut microbiota: A hidden therapeutic link. Heliyon. 2024 Sep 10;10(18):e37661.
Ma L, Ji L, Wang T, Zhai Z, Su P, Zhang Y, Wang Y, Zhao W, Wu Z, Yu H, Zhao H. Research progress on the mechanism of traditional Chinese medicine regulating intestinal microbiota to combat influenza a virus infection. Virol J. 2023 Nov 13;20(1):260.
Liu X, Wang Q. Effect of natural products on host cell autophagy induced by Influenza A virus infection. Front Cell Infect Microbiol. 2024 Sep 30;14:1460604.
Ho JSS, Ping TL, Paudel KR, El Sherkawi T, De Rubis G, Yeung S, Hansbro PM, Oliver BGG, Chellappan DK, Sin KP, Dua K. Exploring Bioactive Phytomedicines for Advancing Pulmonary Infection Management: Insights and Future Prospects. Phytother Res. 2024 Dec;38(12):5840-5872.
Ou G, Xu H, Wu J, Wang S, Chen Y, Deng L, Chen X. The gut-lung axis in influenza A: the role of gut microbiota in immune balance. Front Immunol. 2023 Oct 20;14:1147724.
Gounder AP, Boon ACM. Influenza Pathogenesis: The Effect of Host Factors on Severity of Disease. J Immunol. 2019 Jan 15;202(2):341-350.
Zhang Y, Chen Y, Xia J, Li L, Chang L, Luo H, Ping J, Qiao W, Su J. Rifaximin ameliorates influenza A virus infection-induced lung barrier damage by regulating gut microbiota. Appl Microbiol Biotechnol. 2024 Sep 19;108(1):469.
Wan C, Yan S, Lu R, Zhu C, Yang Y, Wu X, Yu Z, Jiang M, Peng W, Song W, Wu H, Fang B, He Y. Astragalus Polysaccharide improves immunogenicity of influenza vaccine as well as modulate gut microbiota in BALB/c mice. Microb Pathog. 2024 Oct;195:106893.

谷禾健康

葡萄球菌(Staphylococcus)属于厚壁菌门,是一类革兰氏阳性球菌,因常呈葡萄串状聚集而得名。已经鉴定出大约89种葡萄球菌及亚种。金黄色葡萄球菌(Staphylococcus aureus)为该菌属的模式菌种。
葡萄球菌是兼性厌氧菌,但在有氧条件下生长更快、更丰富,金黄色葡萄球菌亚种和解糖葡萄球菌厌氧除外。
它们可在18°C至40°C、pH4.5~9.8范围内生长,最适温度37°C,最适pH7.4。葡萄球菌可以在高盐(15%氯化钠)和高胆汁浓度(40%胆汁)的环境中生存,展现出强大的适应性。
葡萄球菌分布非常广泛,普遍存在于人类和其他温血动物皮肤、皮肤腺体和粘膜上。但也能在肠道和会阴区域定植。根据谷禾数据库和相关文献统计,葡萄球菌肠道定植的发生率约为20%。过量的葡萄球菌定植于肠道会导致肠道菌群平衡受到破坏,另外由于其具有产毒素的能力,还可能引发肠道炎症、并影响肠道屏障功能。
葡萄球菌以呼吸作用或发酵为主,利用碳水化合物或氨基酸作为碳源和能量来源。大多数菌种发酵葡萄糖的主要产物是乳酸,而在有氧条件下则产生乙酸和CO2。
大多数葡萄球菌为非致病菌,少数可导致疾病,一般为凝固酶阳性葡萄球菌,例如金黄色葡萄球菌,是最常见的化脓性球菌,是医院交叉感染的重要来源。因为它能够产生一种称为凝固酶的物质;当分泌时,凝固酶会导致血液凝结,从而使细菌能够在组织中持续存在并导致脓肿的发展。是导致一系列感染的原因,从轻微的皮肤刺激到肺炎和败血症等危及生命的疾病。
但有一些葡萄球菌也可作为共生菌生活在人体体表或是肠道,了解葡萄球菌的独特结构特征、分布、致病机制及耐药性等对其在人类健康与疾病中的作用至关重要。让我们一起深入认识它。
▸ 发现历史
葡萄球菌(Staphylococcus)是柯赫(1878年)、巴斯德(1880年)和奥格斯顿(1881年)从脓液中发现的,由F. J. Rosenbach于1884年首次纯培养并详细研究。
从金黄色葡萄球菌的细胞壁分离出的蛋白质A可与免疫球蛋白(主要为IgG)进行特异性结合,这是于1959年发现的,现已被应用于各种免疫反应。
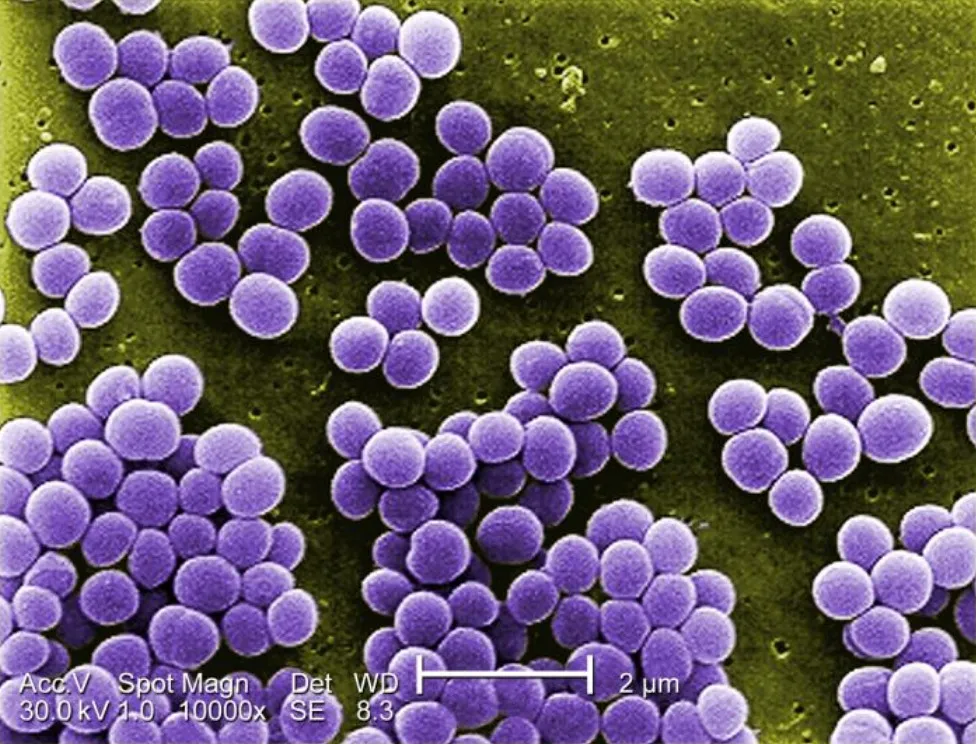
▸ 细胞形态
葡萄球菌(Staphylococcus)属于厚壁菌门下的芽孢杆菌目-葡萄球菌科,是一类革兰氏阳性球菌,因常呈葡萄串状聚集而得名。
葡萄球菌细胞呈球形,直径为0.5-1.5μm,单独出现、成对出现、以四分体形式出现或以短链形式出现(3-4个细胞),其特征是在多个平面分裂形成不规则的葡萄状簇。
注:这种簇状结构将葡萄球菌与链球菌区分开来,链球菌通常呈链状生长。
金黄色葡萄球菌10000倍放大倍率下的图像
来源:https://www.lecturio.com/concepts/staphylococcus/
葡萄球菌不具备鞭毛或纤毛,因此通常是不运动的,也不形成内生孢子。但葡萄球菌具有厚的、富含肽聚糖的细胞壁,肽聚糖层为细胞提供结构支持,并在维持细胞形状和完整性方面起着重要作用。
固体琼脂上的葡萄球菌菌落通常是圆形、光滑且略微凸起的。颜色可以从白色或奶油色到金黄色不等,具体取决于菌株。
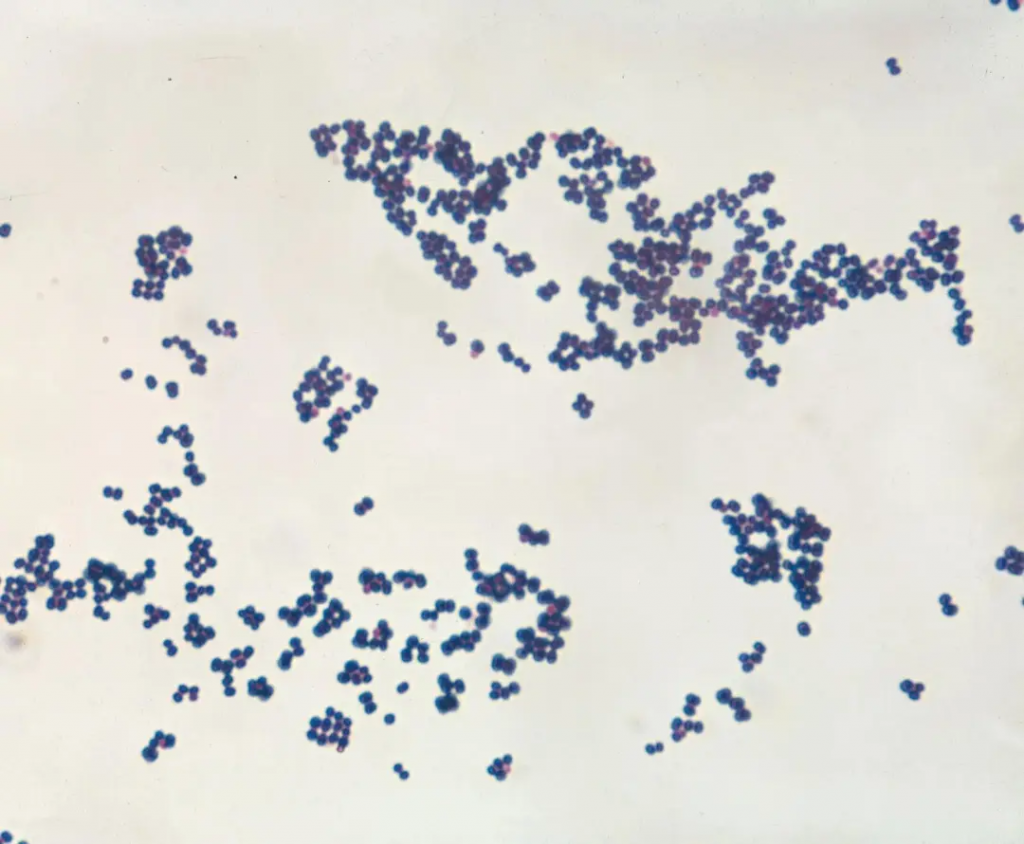
来源:britannica
特别注意,一些葡萄球菌可能会产生围绕细胞壁的多糖保护层,这种细胞外涂层可以保护细菌免受宿主免疫防御,并与毒力增加有关。
▸ 生长代谢
葡萄球菌是兼性厌氧菌,但在有氧条件下生长更快、更丰富,金黄色葡萄球菌亚种和解糖葡萄球菌厌氧除外。
它们可在18°C至40°C、pH4.5~9.8范围内生长,最适温度37°C,最适pH7.4。因此人体的环境非常适宜其定植。此外,葡萄球菌可以在高盐(15%氯化钠)和高胆汁浓度(40%胆汁)的环境中生存,展现出强大的适应性。
一些种类以呼吸作用或发酵为主,利用碳水化合物或氨基酸作为碳源和能量来源。大多数菌种发酵葡萄糖的主要产物是乳酸,而在有氧条件下则产生乙酸和CO2。过氧化氢酶也呈阳性。
营养需求是可变的。大多数物种需要有机氮源,即某些氨基酸和B族维生素。其他的可以在(NH4)2SO4作为底物氮的唯一来源条件下生长。某些物种可能需要尿嘧啶或可发酵的碳源进行厌氧生长。
注:金黄色葡萄球菌能够产生类胡萝卜素,使得菌落呈现从深橙色到浅黄色的特征。此外,它们产生接触酶,并且能够分解各种蛋白质和脂质,如血红蛋白、纤维蛋白、卵白、酪朊、明胶以及脂类,释放出脂肪酸。
▸ 分类
据报道,已经鉴定出大约89种葡萄球菌和亚种。金黄色葡萄球菌(Staphylococcus aureus)为该菌属的模式菌种。
▸ 凝固酶阳性葡萄球菌
根据其血浆凝固酶活性一般可分为两类:凝固酶阳性葡萄球菌和皮肤上常见的凝固酶阴性葡萄球菌。例如金黄色葡萄球菌是一种致病性的物种,属于凝固酶阳性组。此外,凝固酶检测呈阳性的葡萄球菌属物种还包括中间葡萄球菌(S.intermedius)、S.delphini、S.schleiferi subsp和S.hyicus。
注:血浆凝固酶是能使含有枸椽酸钠或肝素抗凝剂的人或兔血浆发生凝固的酶类物质,致病菌株多能产生,常作为鉴别葡萄球菌有无致病性的重要标志。
对人类具有重要意义的金黄色葡萄球菌是伤口感染、疖子和其他人类皮肤感染的主要病原体,是食物中毒的最常见原因之一。金黄色葡萄球菌还会导致脑膜炎、肺炎、尿路感染和乳腺炎。此外,局部葡萄球菌感染可导致中毒性休克综合征,这是一种与毒素从感染部位释放到血液中有关的疾病。
中间葡萄球菌(S.intermedius)是一种狗的机会性病原体,可引起外耳道炎、脓皮病、脓肿、生殖道感染、乳腺炎和化脓性伤口。
S.hyicus被认为是猪感染性渗出性表皮炎和感染性多关节炎、牛和马皮肤病变、家禽和牛骨髓炎的病原体,偶尔与牛的乳腺炎有关。
▸ 凝固酶阴性葡萄球菌
其他葡萄球菌基本都是凝固酶阴性,凝固酶阴性葡萄球菌是人体菌群的重要组成部分。
在凝固酶阴性葡萄球菌中,表皮葡萄球菌(S.epidermidis)是与院内疾病最相关的物种,表皮葡萄球菌是一种轻微的病原体,在抵抗力较低的人群中具有致病性。近年来发现表皮葡萄球菌与菌血症、自体和人工瓣膜心内膜炎、骨髓炎、脓性关节炎、纵隔炎、永久性起搏器感染、血管移植物、脑脊液分流、假体、骨科和泌尿关节以及泌尿道感染(包括尿道炎和肾盂肾炎)有关。
其他凝固酶阴性物种可能也与人类和动物的感染有关。溶血葡萄球菌(S.haemolyticus)与自体瓣膜心内膜炎、脓毒症、腹膜炎和尿路感染有关,有时与伤口、骨骼和关节感染有关。
S.caprae已经发现了感染性心内膜炎、菌血症和尿路感染的病例。
除此之外,其他葡萄球菌见附录。
葡萄球菌种型菌株关系树
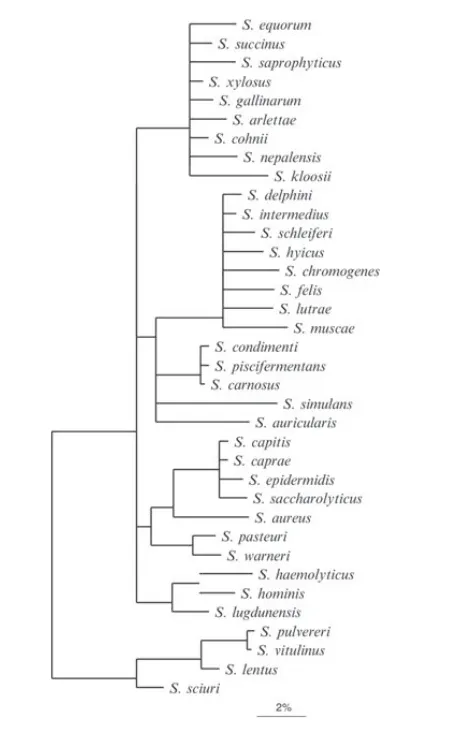
DOI: 10.1002/9781118960608.gbm00569.
▸ 葡萄球菌的分布
▸ 人和动物来源
葡萄球菌物种普遍存在于人类和其他温血动物皮肤、皮肤腺体和粘膜上。它们可能在皮肤上作为常驻细菌或瞬态细菌被发现。
注:常驻细菌是宿主固有的,并主要通过已有细菌的繁殖来增加数量。瞬态细菌来源于外源,主要存在于暴露的皮肤上,很容易被洗掉。
金黄色葡萄球菌可以在许多灵长类动物中发现,尽管偶尔也可以在不同的家畜或鸟类身上发现。在人类中,金黄色葡萄球菌偏爱于鼻腔前部,尤其是在成人中,约30%的人类鼻子和其他粘膜中存在金黄色葡萄球菌。
表皮葡萄球菌是人类皮肤上最常见和持久存在的葡萄球菌。它广泛分布于体表,在前鼻孔、腋窝、腹股沟、会阴区和趾蹼等湿润且营养丰富部位数量最多。偶尔也可在家畜等其他宿主上发现,可能源自人类传播。
人葡萄球菌(Staphylococcus hominis)也普遍存在于人体皮肤上。在大汗腺较多的皮肤部位(如腋窝、腹股沟和会阴区),其种群大小通常次于表皮葡萄球菌。它比其他物种更能成功定居于四肢等干燥皮肤区域。
溶血葡萄球菌与人葡萄球菌有许多共同的栖息地,但通常发现的较少,有些个体可能携带大量溶血葡萄球菌。
头葡萄球菌(Staphylococcus capitis)在青春期后大量繁殖于人类头皮,并存在于成人前额、面部、眉毛和外耳道等部位。耳葡萄球菌(Staphylococcus auricularis)是成人外耳道的主要菌种之一,对该生态位有强烈偏好。
从家禽和山羊中分离出了Staphylococcus arlettae,从马中分离出了Staphylococcus equorum,从家禽中分离出了Staphylococcus gallinarum。
中间葡萄球菌(Staphylococcus intermedius)是家养狗中存在的主要种类;猫葡萄球菌(Staphylococcus felis)是家猫的主要种类之一;
猪葡萄球菌(Staphylococcus hyicus)和产色葡萄球菌(Staphylococcus chromogenes)主要存在于猪、牛和马等家养有蹄类动物身上。Staphylococcus lentus已从家养绵羊和山羊中大量分离出来,偶尔来自其他家畜,是兔唾液中存在的细菌。
▸ 环境和食物来源
葡萄球菌零星地从各种环境来源中分离出来,如土壤、沙滩、海水、淡水、植物表面和饲料、肉类、乳制品,以及炊具、器具、家具、衣服、地毯、纸币的表面,以及各种居住地区的灰尘和空气。
金黄色葡萄球菌已被证实是食物中毒的主要病原体。其他葡萄球菌可能参与某些发酵食品的生产。
发酵肉中的葡萄球菌主要是肉葡萄球菌(Staphylococcus carnosus),50多年来,肉葡萄球菌一直被单独使用或与乳酸菌联合使用,作为生产发酵香肠的发酵剂。在干香肠的成熟过程中,肉葡萄球菌发挥了几种理想的功能。
从酱油醪中分离到调料葡萄球菌(Staphylococcus condimenti);以及从表面成熟的奶酪中提取到Staphylococcus fleurettii,从发酵虾和鱼中提取到的Staphylococcus piscifermentans。
金黄色葡萄球菌和木糖葡萄球菌(Staphylococcus xylosus)可以在仅含无机氮源的环境中生长,因此可能比其他葡萄球菌分布更广泛。这些物种已从沙滩、天然水域、沼泽草和植物产品中分离出来。
▸ 基因组信息
葡萄球菌基因组大小约为2-3 Mbp。目前已完全测序八种菌株(七种金黄色葡萄球菌和一种表皮葡萄球菌),其基因组大小分别为2.82-2.9Mbp和2.5Mbp。
两种菌株均含有1个质粒和3个致病岛。将引起急性感染的金黄色葡萄球菌N315的基因组与引起慢性感染的表皮葡萄球菌RP62A的基因组进行比较。
与金黄色葡萄球菌相比,表皮葡萄球菌毒力基因较少
在金黄色葡萄球菌N315的125个毒力基因中,仅22个(18%)在表皮葡萄球菌RP62A中有同源基因,反映了两者致病潜力的差异。这解释了为何金黄色葡萄球菌是侵袭性病原体,而表皮葡萄球菌则相对无害。
在金黄色葡萄球菌的40个毒素基因中,表皮葡萄球菌仅有3个同源基因。这与表皮葡萄球菌毒素产生减少的观察结果一致,也与其感染严重程度较低相符。此外,与金黄色葡萄球菌相比,表皮葡萄球菌的外泌酶和粘附素等毒力因子数量也明显减少。
▸ 危害与致病性
虽然大部分葡萄球菌可以在人体共存,但一些葡萄球菌物种对人体具有危害,其中最具代表性的是金黄色葡萄球菌(Staphylococcus aureus)。
• 葡萄球菌可能产生毒素
葡萄球菌,尤其是金黄色葡萄球菌,会产生多种毒素,导致其致病性。这些毒素会在感染宿主时引起一系列症状和疾病。葡萄球菌毒素包括:
α-毒素:这种溶细胞毒素会损害细胞膜,并可能导致各种宿主细胞(如红细胞和白细胞)以及感染部位的其他细胞裂解(破裂)。它还可能导致组织破坏。
β-毒素:β-毒素是一种影响细胞膜的鞘磷脂酶。它在红细胞的破坏中发挥作用,并可能导致脓肿的形成。
δ-毒素:δ-毒素是一种小的疏水性肽,可在宿主细胞膜上形成孔。它会损害红细胞并导致细胞裂解。
γ-毒素:γ毒素是一种溶血素,可损害红细胞并促进感染扩散。
去角质毒素:金黄色葡萄球菌会产生剥落毒素,在葡萄球菌烫伤皮肤综合征等情况下会导致水泡和皮肤脱皮。这些毒素会破坏表皮的完整性。
肠毒素:葡萄球菌肠毒素(SEs)`是导致食物中毒的原因。当它们在受污染的食物中产生并摄入时,它们会导致恶心、呕吐、腹泻和腹部绞痛等症状。
中毒性休克综合征毒素(TSST-1):这种毒素与中毒性休克综合征(TSS)有关,可导致快速而严重的疾病,并伴有高烧、皮疹、低血压和器官衰竭等症状。
杀白细胞素(PVL):PVL是一种针对白细胞的毒素,可导致金黄色葡萄球菌引起的皮肤和软组织感染的严重程度。
葡萄球菌超抗原:这些毒素通过激活大量T细胞来刺激夸张的免疫反应。它们是葡萄球菌感染中一些强烈炎症的原因。
• 葡萄球菌的致病种及其危害
金黄色葡萄球菌是多种感染的罪魁祸首。在20世纪50年代末和60年代初,金黄色葡萄球菌作为住院患者的一种医院病原菌,引起了相当大的发病率和死亡率。
该物种引起的主要人类感染包括局部皮肤感染(疖、痈、脓疱疮)、中毒性表皮坏死松解(烫伤皮肤综合征)、肺炎、骨髓炎、急性心内膜炎、心肌炎、心包炎、小肠结肠炎、乳腺炎、膀胱炎、前列腺炎、宫颈炎、脑炎、脑膜炎、菌血症、败血症、中毒性休克综合征,以及肌肉、皮肤、泌尿生殖道、中枢神经系统和各种腹内器官的脓肿。此外,葡萄球菌肠毒素与食物中毒有关。
注:金黄色葡萄球菌也能在多种其他哺乳动物和鸟类中产生感染。我们会在后文详细介绍金黄色葡萄球菌的致病过程和机制。
中间葡萄球菌是犬的一种严重机会致病菌,可引起外耳炎、脓肿、生殖道感染、乳腺炎和脓性伤口感染。Staphylococcus hyicus被认为是猪的感染性渗出性表皮炎(油猪病)和脓毒性多发性关节炎、牛和马的皮肤病变、家禽和牛骨髓炎的病原体,偶尔与牛的乳腺炎有关。Staphylococcus delphini与海豚的化脓性皮肤病变有关。
尽管凝固酶阴性葡萄球菌是人体正常菌群的组成部分,但过去二十年来,其在医院感染中越来越多的被发现。这类感染的增加与假体和留置装置的广泛使用以及免疫功能低下患者数量的增长密切相关。
在凝固酶阴性葡萄球菌中,表皮葡萄球菌是最常与疾病相关的物种。它似乎具有最大的致病潜力和适应多样性。该物种涉及菌血症、原生和人工瓣膜心内膜炎、骨髓炎、化脓性关节炎、持续动态透析期间的腹膜炎、永久性起搏器感染、血管移植、脑脊液分流、假关节和各种骨科装置,以及包括尿道炎和肾盂肾炎在内的尿路感染。
最近发表了关于表皮葡萄球菌和其他凝固酶阴性物种引起的人类感染综述。医院内的耐甲氧西林表皮葡萄球菌(MRSE)菌株在20世纪80年代成为一个严重的临床问题,特别是在植入人工心脏瓣膜或接受其他形式心脏手术的患者中。表皮葡萄球菌有时也与牛的乳腺炎有关。
一些其他凝血酶阴性的葡萄球菌也可能与人类或动物的感染有关。溶血葡萄球菌是人类临床感染中常见的,它与先天性瓣膜心内膜炎、败血症、腹膜炎和尿路感染有关,偶尔与伤口、骨和关节感染有关。
Staphylococcus caprae与感染性心内膜炎、菌血症和尿路感染病例有关。Staphylococcus lugdunensis与天然和人工瓣膜心内膜炎、败血症、脑脓肿、慢性骨关节炎以及软组织、骨、腹膜液和导管感染有关,尤其是在患有基础疾病的患者中。
Staphylococcus schleiferi与人骨膜炎、菌血症、伤口感染以及与颅骨引流管和颈静脉导管相关的感染有关。腐生葡萄球菌(Staphylococcus saprophyticus)是人类尿路感染中一种重要的机会性病原体,尤其是在年轻、性活跃的女性中。它被认为是这些患者中第二常见的尿路感染原因,如急性膀胱炎或肾盂肾炎。该物种偶尔也会从伤口感染和败血症中分离出来。
▸ 耐药性
葡萄球菌对各种抗生素的敏感性或耐药性,可能因菌株而异,并且由于耐药菌株的出现,可能会随着时间的推移而变化。以下是金黄色葡萄球菌抗生素敏感性的概述:
• 一部分菌株耐甲氧西林
一些金黄色葡萄球菌菌株对甲氧西林和其他β-内酰胺类抗生素敏感,包括青霉素和头孢菌素。它们通常可以用一系列抗生素治疗,例如萘夫西林、苯唑西林和万古霉素。
但耐甲氧西林金黄色葡萄球菌(MRSA)菌株已对甲氧西林和许多其他β-内酰胺类抗生素产生耐药性。它们通常对多种抗生素具有耐药性,因此难以治疗。MRSA菌株通常对万古霉素、利奈唑胺、达托霉素等抗生素和头孢洛林等较新药物敏感。
耐甲氧西林金黄色葡萄球菌(MRSA)菌株出现于20世纪80年代,是医院的一个主要临床和流行病学问题。
• 一部分菌株耐万古霉素
金黄色葡萄球菌已显示出对多种抗生素产生耐药性的显著能力,部分原因是获得耐药基因和存在可移动遗传元件,例如质粒。
一些金黄色葡萄球菌菌株对万古霉素的敏感性降低,万古霉素是治疗耐甲氧西林金黄色葡萄球菌(MRSA)的关键抗生素。在极少数情况下,报道了万古霉素-中间金黄色葡萄球菌(VISA)和耐万古霉素金黄色葡萄球菌(VRSA)菌株,使治疗更具挑战性。
除了β-内酰胺类和万古霉素耐药外,一些金黄色葡萄球菌菌株还对其他类别的抗生素产生了耐药性,例如大环内酯类、四环素类和氨基糖苷类抗生素。这导致了多重耐药金黄色葡萄球菌菌株的出现。
下面通过葡萄球菌属中的典型和最引人重视的金黄色葡萄球菌和表皮葡萄球菌,来说明葡萄球菌对人体存在的危害和可能的益处,有助于更深刻地认识葡萄球菌。
金黄色葡萄球菌(Staphylococcus aureus)是最臭名昭著、分布最广的细菌性病原体之一,每年在全球范围内造成难以估计的皮肤感染,以及可能数十万至数百万例更严重的侵袭性感染。
它还是肺炎和其他呼吸道感染、手术部位、假体关节、心血管感染以及院内菌血症的主要病原体。
其他金黄色葡萄球菌感染,如中重度皮肤感染,包括疖、脓肿和伤口感染,通常不会危及生命,但可能伴有明显的发病率和疼痛。由于发病频率高,它们构成了相当大的公共卫生负担。最后,金黄色葡萄球菌也与特应性皮炎的发展有关。
注:2012年的一项综述估计,金黄色葡萄球菌菌血症的发病率为每年20至50例/10万人,其中10%至30%的患者将死于感染。在2017年的一项最新研究中,据报道,美国每年因金黄色葡萄球菌菌血症死亡的人数为2万人。金黄色葡萄球菌菌血症导致的死亡人数比获得性免疫缺陷综合征(艾滋病)、结核病和病毒性肝炎加起来造成的死亡人数还要多。
▸ 感染的来源
金黄色葡萄球菌感染通常源于无症状定植,或更罕见地通过污染物或他人传播,尤其在医院中。鼻孔是其主要定植部位,除肠道外,金黄色葡萄球菌也可定植于多种皮肤部位。
• 通过破损皮肤感染
金黄色葡萄球菌感染依赖于细菌突破上皮屏障。例如,皮肤感染可由轻微划伤发展并可能变为侵袭性。此外,金黄色葡萄球菌可通过α毒素激活含金属蛋白酶结构域的蛋白10(ADAM10),裂解E-钙粘蛋白,破坏粘附连接并损害肌动蛋白细胞骨架。
α毒素在金黄色葡萄球菌感染中的作用
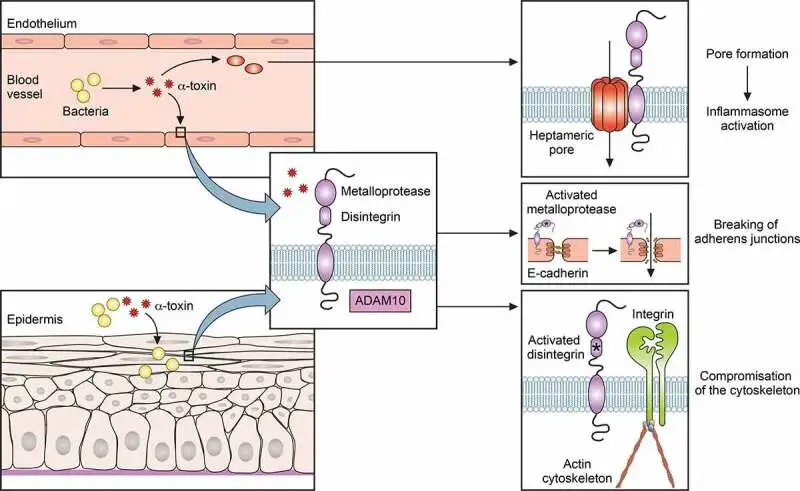
doi: 10.1080/21505594.2021.1878688.
• 通过医疗器械感染
留置医疗器械的污染是医院中常见的感染途径。其主要机制是金黄色葡萄球菌可在器械插入后迅速粘附于塑料材料及其基质分子上,并形成生物膜。
• 通过食物摄入
食物中毒是急性金黄色葡萄球菌感染的一种特殊情况,由摄入含葡萄球菌肠毒素(SE)的受污染食物引起。SE属于超抗原毒素,可非特异性激活T细胞,导致多克隆T细胞活化和大量细胞因子释放,引发过度免疫反应。肠道金黄色葡萄球菌定植可能是其扩散至其他上皮部位的储存库,与其他感染形式存在一定关联。
最后,金黄色葡萄球菌还可作为机会性病原体,利用其他病原体或易感因素引发感染。例如,在流感等病毒感染导致的肺部感染中,继发性金黄色葡萄球菌感染常成为最终致死原因。
▸ 感染的过程
金黄色葡萄球菌全身感染通常始于细菌突破皮肤屏障或从留置医疗器械上的生物膜传播。在血液中,细菌可通过溶细胞毒素攻击并消除中性粒细胞,或在其中存活以实现全身分布。
经过肝脏时,细菌需面对库普弗细胞(Kupffer cell)的吞噬作用,这一阶段是全身感染的关键阶段。一旦存活,细菌可通过血流进一步扩散,依靠MSCRAMM表面蛋白附着并侵入组织细胞。
脓肿的形成受多种细菌因子影响,包括特定表面蛋白、毒素和外酶。
金黄色葡萄球菌的全身感染

doi: 10.1080/21505594.2021.1878688.
• 避免吞噬细胞的杀伤
金黄色葡萄球菌会通过许多机制避免被中性粒细胞消除,包括:
1)抑制中性粒细胞从血流外渗到组织中、中性粒细胞活化和趋化性;
2)通过聚集、保护性表面结构和生物膜形成抑制吞噬作用;
3)抑制调理素作用;
4)抑制中性粒细胞杀伤机制;
5)通过溶细胞毒素直接消除中性粒细胞或触发细胞凋亡。
• 感染的恶化
一旦形成脓肿,除了大量白细胞浸润外,细菌增殖也随之而来。此外,高细菌密度意味着营养物质变得稀缺。金黄色葡萄球菌会产生一系列溶细胞素,可以裂解细胞和酶以消化释放的营养大分子。
除了杀白细胞素对白细胞的溶细胞特性外,一些金黄色葡萄球菌溶细胞素协同作用,实现极强的溶血。
表皮葡萄球菌(S.epidermidis)是迄今为止研究最多的凝固酶阴性葡萄球菌(CoNS)成员。表皮葡萄球菌可从所有皮肤微环境中分离,包括干燥、湿润、皮脂腺和足部。
一项宏基因组学研究显示,不同皮肤微环境和个体间的健康皮肤表皮葡萄球菌分离株具有高度的时空多样性。这些群落在高选择压力下,通过质粒和噬菌体多次水平基因转移,适应并维持其特定的皮肤生态位。
★ 表皮葡萄球菌的多样性非常重要
表皮葡萄球菌菌株水平多样性及其对整体皮肤健康影响的一个机制例子是辅助基因调节(agr)群体感应系统。
表皮葡萄球菌的agr调控着一小部分潜在毒力因子的产生,如蛋白酶、脂肪酶和免疫调节酚溶性调节素(psm),而agr系统的保留对于皮肤定植是必要的。重要的是,每个表皮葡萄球菌菌株都是单一的agr型。虽然大多数个体主要由单一表皮葡萄球菌agr型定殖,但在特定皮肤部位的非显性agr型的小亚群也很常见。
某些表皮葡萄球菌agr类型以及其他凝固酶阴性葡萄球菌物种可以产生抑制非同源的表皮葡萄球菌agr信号传导的小肽。这一观察结果表明,agr异质性与总凝固酶阴性葡萄球菌多样性可能是促进稳态的重要因素。
由于agr活性受细菌密度控制,皮肤上表皮葡萄球菌的绝对数量低也可能导致稳态条件下agr活性低。
▸ 表皮葡萄球菌皮肤定植的益处
表皮葡萄球菌及其作为有益皮肤共生菌的作用受到了广泛关注。
• 激活先天免疫通路,增强抗菌作用
一些表皮葡萄球菌激活了人类角质形成细胞中不同的先天免疫信号通路,以增强抗菌肽(AMP)介导的对金黄色葡萄球菌的杀伤作用,尽管这种增强所必需的分泌因子尚未阐明。
表皮葡萄球菌酚溶性调节蛋白(PSM)是一种小的、两性的α-螺旋肽,在正常表皮和毛囊中大量产生。PSM与宿主AMPs协同作用,增强病原菌化脓性链球菌的杀伤作用。
• 减轻炎症反应
一些表皮葡萄球菌菌株还可以抑制金黄色葡萄球菌诱导的中性粒细胞募集和促炎细胞因子的产生,这可能对更严重的皮肤感染有潜在的保护作用。
在小鼠皮肤损伤模型中,表皮葡萄球菌脂质胆酸和脂肽LP78都通过toll样受体(TLR)-3依赖机制减轻炎症反应,加速伤口愈合。
• 有助于适应性免疫的发育和启动
除了调节对皮肤感染或损伤的先天免疫反应外,表皮葡萄球菌的定植还有助于适应性免疫系统的发育和启动。对共生小鼠的研究表明,表皮葡萄球菌的皮肤定植对于效应T细胞的发育和功能,以及粘膜相关不变T细胞(MAIT细胞)的早期定位和启动是必要的。
注:MAIT细胞是介导宿主-共生串扰不同模式的非经典皮肤免疫信号传导的重要组成部分。
皮肤也是最大的效应T细胞亚群库之一,人们越来越认识到这些组织识别淋巴细胞和表皮葡萄球菌等定植体之间串扰的深度和复杂性。
综上所述,表皮葡萄球菌在启动先天和适应性防御病原体和促进体内平衡方面无疑是重要的。未来可能会揭示其他凝固酶阴性葡萄球菌,与表皮葡萄球菌一起,对皮肤发育和健康的共同作用。
▸ 表皮葡萄球菌的潜在危害
虽然被广泛认为是一种丰富的皮肤共生体,但新出现的证据表明,表皮葡萄球菌特定菌株在皮肤上的定植实际上可能在某些条件下对宿主有害。完整的皮肤对病原体和共生生物都是一个强大的屏障,但是通过基因突变或物理破坏这种屏障,可以极大地改变表皮葡萄球菌的行为,从良性到致病性。
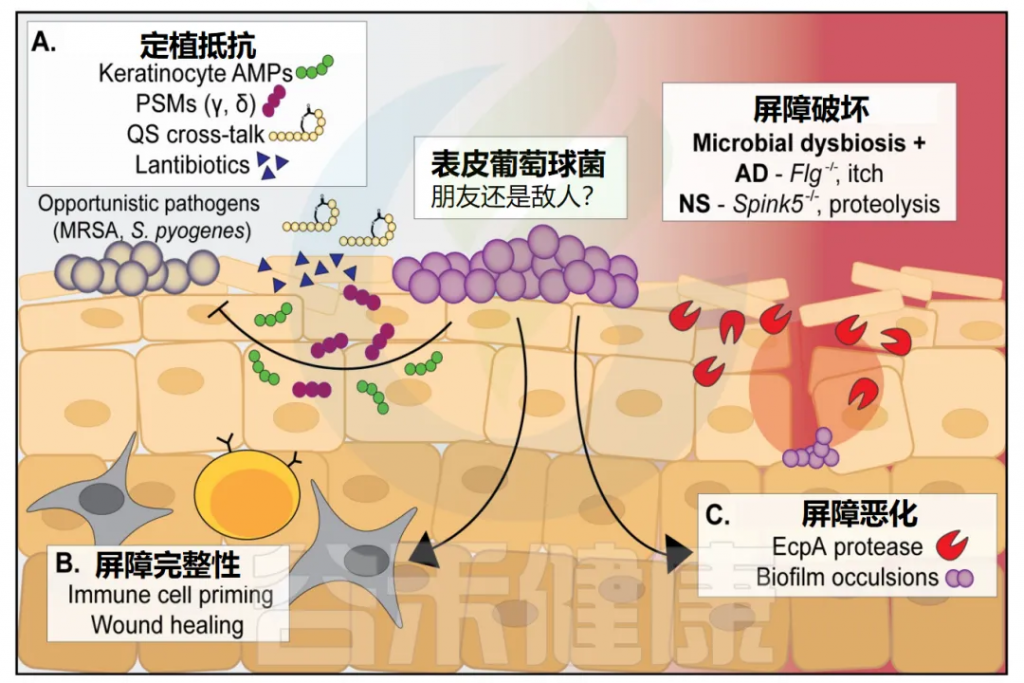
• 表皮葡萄球菌只有在皮肤完整时具有抗菌能力
表皮葡萄球菌预处理的小鼠皮肤只有在屏障完好无损时才对金黄色葡萄球菌的攻击有抵抗力,而在细菌接种前被物理破坏时则没有。
• 可能加剧特应性皮炎
在特应性皮炎(AD)中,患者通常在病灶部位高度定植金黄色葡萄球菌,这种细菌“繁殖”与疾病严重程度呈正相关。纵向宏基因组学研究表明,一些AD患者在病变部位可以被表皮葡萄球菌而不是金黄色葡萄球菌高度定植。据推测,这种生长可能同样与疾病严重程度相关;然而,关于表皮葡萄球菌介导的AD屏障恶化的机制基础的研究很少。
最近,半胱氨酸蛋白酶EcpA被确定为表皮葡萄球菌诱导的特应性皮炎屏障降解的关键介质。EcpA存在于所有表皮葡萄球菌菌株中,但似乎仅由一个亚群表达。EcpA降解多种皮肤屏障成分,包括LL-37和粘粒素-1,并在AD小鼠模型中显著增加炎症和屏障功能障碍。
最后,表皮葡萄球菌形成生物膜的倾向也可能加剧特应性皮炎(AD),因为在AD病变部位的一些汗腺中已经发现了金黄色葡萄球菌和表皮葡萄球菌的炎症生物膜群落。
• 恶化内瑟顿综合征
除了特应性皮炎,表皮葡萄球菌的过度扩张和EcpA的产生也与内瑟顿综合征(NS)的恶化有关,内瑟顿综合征是一种皮肤疾病,以丝氨酸蛋白酶活性高水平为特征,由spink5基因突变引起。
重要的是,EcpA的产生受表皮葡萄球菌agr群体感应系统的调节。这表明表皮葡萄球菌可能通过生态失调和agr信号去抑制加重特应性皮炎和内瑟顿综合征,其中抑制型表皮葡萄球菌或共生菌的减少是关键因素。
在这两种皮肤病中,EcpA和其他毒力因子的表达增强,再加上遗传或环境屏障的破坏,将为表皮葡萄球菌的扩张和恶化提供理想的环境。
除了金黄色葡萄球菌和表皮葡萄球菌外,还存在一些可能致病的葡萄球菌物种或是一些可以在人体共生的葡萄球菌。
1
溶血葡萄球菌
溶血葡萄球菌(Staphylococcus haemolyticus)是人类皮肤微生物群的组成部分。它已成为医院感染的一个重要原因,在医院和医务人员中普遍存在。
与其他凝固酶阴性葡萄球菌相比,溶血葡萄球菌分离株,特别是那些导致医院获得性感染的葡萄球菌,表现出更高水平的抗生素耐药性。大量证据表明,溶血葡萄球菌具有将耐药基因传播给其他葡萄球菌的能力。
它在免疫功能低下的人群中尤其普遍,并与严重感染有关,包括脑膜炎、心内膜炎、假体关节感染、菌血症、败血症、腹膜炎和中耳炎。
建立生物膜的能力是致病性溶血葡萄球菌分离株的一个显著特征,溶血葡萄球菌分泌多种促进细菌粘附和侵袭的因子,以及生物膜的形成,如肠毒素、溶血素和纤维连接蛋白结合蛋白。
2
沃氏葡萄球菌
沃氏葡萄球菌(Staphylococcus warneri)是一种凝固酶阴性的机会致病菌,已知可引起多种感染,特别是在留置医疗器械的患者中。
沃氏葡萄球菌是皮肤菌群的成分,特别集中在头部,颈部,手臂和大腿。作为一种机会致病菌,沃氏葡萄球菌的重要性正在上升。
从这些感染中分离的大多数沃氏葡萄球菌菌株对β-内酰胺类抗菌药物耐药。其毒力与粘附素、酶、细胞外毒素、荚膜、铁摄取系统、毒力调节因子、生物膜形成及侵入和损伤上皮细胞的能力有关。目前尚无法完全解析其致病机制,包括逃避宿主免疫系统并持续存在的策略。
3
头葡萄球菌
头葡萄球菌(Staphylococcus capitis)于1975年首次从人体皮肤中分离出来。在特定菌株中发现的蛋白质对生物膜的形成、粘附性和毒力至关重要。
一项研究发现,头葡萄球菌TE8菌株含有14种促进粘附的粘附素,从而促进其在人体皮肤上的定植。根据另一项研究,在从患者胃中分离出的所有凝固酶阴性葡萄球菌中,S.capitis分离株表现出最强的尿素酶活性。它们建立生物膜的能力是S.capitis物种的主要致病因素。
4
人葡萄球菌
人葡萄球菌(Staphylococcus hominis)是凝固酶阴性葡萄球菌中第三大常见病原体,可在新生儿和免疫抑制的成人血液中引起机会性感染。近年来,由人葡萄球菌引起的菌血症、败血症、眼内炎和心内膜炎的报告病例数量显著增加。
人葡萄球菌对多种抗菌剂具有耐药性,给治疗带来挑战。其耐药性源于获得mecA基因,该基因通过改变青霉素结合蛋白,降低了对青霉素等β-内酰胺类抗生素的亲和力。此外还发现了耐甲氧西林人型葡萄球菌(MRSHo)的出现。
尽管对几种抗生素具有耐药性,人葡萄球菌仍然对包括头孢他林、四环素、氨基糖苷类、头孢菌素、糖肽类和脂糖肽类(如万古霉素),以及其他抗菌剂如达托霉素的治疗敏感。
葡萄球菌属还有几十种,在此就不一一列举了。
附录:其他葡萄球菌
Staphylococcus agnetis
Staphylococcus argensis
Staphylococcus argenteus
Staphylococcus arlettae
Staphylococcus aureus
Staphylococcus auricularis
Staphylococcus capitis
Staphylococcus caprae
Staphylococcus carnosus
Staphylococcus chromogenes
Staphylococcus cohnii
Staphylococcus condimenti
Staphylococcus delphini
Staphylococcus devriesei
Staphylococcus epidermidis
Staphylococcus equorum
Staphylococcus faecalis
Staphylococcus felis
Staphylococcus fleurettii
Staphylococcus gallinarum
Staphylococcus haemolyticus
Staphylococcus hominis
Staphylococcus hyicus
Staphylococcus intermedius
Staphylococcus kloosii
Staphylococcus leei
Staphylococcus lentus
Staphylococcus lugdunensis
Staphylococcus lutrae
Staphylococcus lyticans
Staphylococcus massiliensis
Staphylococcus microti
Staphylococcus muscae
Staphylococcus nepalensis
Staphylococcus pasteuri
Staphylococcus petrasii
Staphylococcus pettenkoferi
Staphylococcus piscifermentans
Staphylococcus pseudintermedius
Staphylococcus pseudolugdunensis
Staphylococcus rostri
Staphylococcus saccharolyticus
Staphylococcus saprophyticus
Staphylococcus schleiferi
Staphylococcus schweitzeri
Staphylococcus sciuri
Staphylococcus simiae
Staphylococcus simulans
Staphylococcus sp.
Staphylococcus sp. 3348O2
Staphylococcus sp. C9I2
Staphylococcus sp. WB18-16
Staphylococcus sp.C10c
Staphylococcus sp.FZ-6
Staphylococcus stepanovicii
Staphylococcus succinus
Staphylococcus vitulinus
Staphylococcus warneri
Staphylococcus xylosus
environmental samples
unclassified Staphylococcus
主要参考文献
Britannica, T. Editors of Encyclopaedia (2024, May 3). staphylococcus. Encyclopedia Britannica.
Ahmad-Mansour, N., Loubet, P., Pouget, C., Dunyach-Remy, C., Sotto, A., Lavigne, J. P., & Molle, V. (2021). Staphylococcus aureus Toxins: An Update on Their Pathogenic Properties and Potential Treatments. Toxins, 13(10), 677.
Karl-Heinz Schleifer, Technische Universität München, Lehrstuhl für Mikrobiologie, Am Hochanger 4, Freising D-85350,Germany Julia A. Bell, Michigan State University, Food Safety and Toxicology Center, East Lansing, MI 48824, USA
Paharik AE, Horswill AR. The Staphylococcal Biofilm: Adhesins, Regulation, and Host Response. Microbiol Spectr. 2016 Apr;4(2):10.1128/microbiolspec.VMBF-0022-2015.
Brown MM, Horswill AR (2020) Staphylococcus epidermidis—Skin friend or foe? PLoS Pathog 16(11): e1009026.
Cheung GYC, Bae JS, Otto M. Pathogenicity and virulence of Staphylococcus aureus. Virulence. 2021 Dec;12(1):547-569.
Heath, V., Cloutman-Green, E., Watkin, S., Karlikowska, M., Ready, D., Hatcher, J., Pearce-Smith, N., Brown, C., & Demirjian, A. (2023). Staphylococcus capitis: Review of Its Role in Infections and Outbreaks. Antibiotics (Basel, Switzerland), 12(4), 669.
Becker, K., Heilmann, C., & Peters, G. (2014). Coagulase-negative staphylococci. Clinical microbiology reviews, 27(4), 870–926.
medicallabscientist.org/staphylococcus/
biologyinsights.com/understanding-staphylococcus-types-diagnosis-and-resistance/
lifeder.com/staphylococcus

谷禾健康

抑郁症仍然是最普遍的精神疾病之一,许多患者对可用的治疗方法反应不足。慢性或早期生活压力是抑郁症的主要风险因素之一。
研究发现清楚地表明,抑郁症是一种复杂的精神疾病,与压力适应不良有着内在的联系,这会导致下丘脑-垂体-肾上腺轴(HPA轴)和免疫系统失调。在过去的几年里,很明显,这种改变的压力和炎症反应会聚集在大脑功能上,从而破坏正常的神经免疫稳态。
与此同时,人们发现肠道微生物群是压力和炎症的关键调节因子,因此它在抑郁症中的作用机理和干预调节机制也越来越清晰。
这三位一体的风险因素如何相互作用以维持大脑和身体的生理稳态尚不完全清楚。

在本文,我们整合了动物和人类研究中关于抑郁症病因和进展中的这三个因素的现有数据。还关注这种微生物群免疫应激基质可能影响集中介导事件的过程,以及可能的治疗干预措施以纠正这三位一体的失衡。
关键词
重度抑郁症(MDD)是一种复杂的使人衰弱的精神疾病,估计约占全球残疾的10%;根据世界卫生组织的数据,它是目前全球残疾的主要原因。
典型症状包括情绪低落、焦虑、快感缺乏和认知障碍,这些症状会严重影响患者的生活质量。尽管在过去几十年中对了解这种疾病的病因、进展和生物学进行了大量投资,但其分子和细胞基础仍然不明确。
目前,人们越来越认准这样一个事实,即抑郁症并不完全影响大脑功能,而是表现为影响几乎所有主要身体系统的全身疾病。
抗抑郁药治疗通常涉及操纵5-羟色胺能和去甲肾上腺素能系统。然而,这些抗抑郁药是次优的,因为它们起效缓慢且有不良副作用,有时会降低患者的依从性,从而限制其疗效。
此外,据估计,大约1/3的MDD患者在一线抗抑郁治疗后进入缓解期。对一种或多种适当的抗抑郁药治疗没有反应,以及适当的治疗持续时间和剂量,被定义为难治性抑郁症,这大大增加了MDD的负担。
认知行为疗法是一种越来越突出的干预措施,它基于这样一个断言,即适应不良的信息处理和不准确的信念为重复的消极思考奠定了基础,在抑郁症中起着至关重要的作用,当受到挑战时,可以导致急性痛苦的减少或防止未来的症状复发。这种策略在临床上被广泛使用,并且已被证明可以在焦虑和精神病中产生神经可塑性和大脑连接的调节。
小编也不太懂认知行为疗法,去专门了解查阅了,以下是对认知行为疗法的具体解释:
认知行为疗法
CBT, Cognitive Behavioral Therapy
基本概念:
认知行为疗法是一种心理治疗方法,它强调我们的想法(认知)如何影响我们的感受和行为。简单来说,就像是帮助人们“重新编程”自己的思维方式。
工作原理:
识别问题:帮助人们发现自己的消极想法模式
挑战想法:学会质疑这些消极想法是否合理
改变行为:通过改变思维方式来改变行为反应
具体举例:
假设遇到这样一个场景:
事件:在公众场合演讲
消极想法:”我一定会搞砸的,大家都会笑话我”
情绪反应:焦虑、恐惧
认知行为疗法介入:帮助分析这种想法是否合理,提供更平衡的思考方式
应用领域:
抑郁症
焦虑障碍
恐慌障碍
社交恐惧
强迫症
创伤后应激障碍
治疗过程:
识别触发因素:找出引起负面情绪的情境
记录想法:记录当时的想法和感受
分析证据:检验这些想法的真实性
寻找替代:学习更健康的思维方式
实践新技能:在日常生活中应用新的认知模式
优势:
实用性强:提供具体的问题解决工具
时间较短:通常12-20次治疗即可见效
效果持久:学到的技能可以终身使用
科学依据:有大量研究支持其有效性
神经可塑性影响:
这种疗法能够:
改变大脑结构
增强神经元之间的连接
促进大脑的适应性变化
帮助形成新的神经通路
通俗来说,认知行为疗法就像是给我们的思维方式做一次“软件更新”,帮助我们用更健康、更理性的方式来看待问题和应对压力。它不仅能帮助我们度过当前的困境,还能预防未来可能出现的问题。
这种疗法特别适合那些经常陷入负面思维循环的人、容易焦虑或抑郁的人、面对压力时感到无助的人、希望提高情绪管理能力的人。需要注意的是,虽然认知行为疗法效果显著,但最好在专业心理治疗师的指导下进行,这样能够获得更好的治疗效果。
人们正在努力了解导致抑郁症的病因因素,希望它们可以被利用以获得治疗益处。
值得注意的三个因素是压力和下丘脑-垂体-肾上腺(HPA)轴、炎症和异常的免疫系统激活,以及最近的肠道微生物组。
抑郁症通常被称为压力相关疾病,而当前的教条是,由负面生活事件引起的压力,包括在早期生活中,会导致这种使人衰弱的疾病的发展、表现和神经发展。
◮ 负面事件引起的压力会促使疾病的发展
这种不利的生活事件被身体视为对其体内平衡的威胁,导致促进适应这些挑战的生理反应——即失落。然而,由于系统(包括HPA轴)的反复过度活动或不活动,这种调整可能对生物体造成巨大的生理成本,导致异体负荷增加,这已被概念化为代表反复压力暴露后身体磨损的生物学影响。
▸ HPA轴和压力
总的来说,压力可以被视为对刺激的必要进化反应,该刺激导致体内战斗或逃跑机制的激活,这对任何生物体的生存都是必不可少的。在哺乳动物中,这种反应是由HPA轴介导的,HPA轴是一种调节对压力的生理反应的负反馈系统。
◮ HPA轴调节对压力的生理反应
在几秒钟到几分钟内,HPA轴的激活使生物体能够通过优先考虑防御行为所必需的功能(如认知和能量供应)而不是与食物相关的生理功能(如消化)来应对威胁。
HPA 轴激活下丘脑室旁核(PVN)中的神经元分泌精氨酸加压素(AVP)和促肾上皮质激素释放因子(CRF),这反过来又促进垂体前叶促肾上腺皮质激素(ACTH)的产生和分泌。因此,ACTH诱导盐皮质激素和糖皮质激素(啮齿动物的皮质酮,人类的皮质醇)从肾上腺皮质产生和分泌到血液中。因此,高水平的皮质醇通过负反馈机制抑制ACTH和CRF的进一步释放,该机制通过皮质醇与垂体、PVN 和海马中的糖皮质激素受体(GR)结合来发挥作用。这导致系统急性激活后恢复到生理状态。
肾上腺皮质释放的糖皮质激素与GR相互作用,GRs不仅在HPA轴内表达,而且在整个身体中表达,包括肠道、免疫细胞和边缘大脑区域,如海马体。在这里,它们充当转录因子并塑造控制对压力的行为反应的神经回路的功能和结构组织。
◮ 抑郁症HPA轴负反馈回路受损
在抑郁症的情况下,HPA轴负反馈回路受损,导致糖皮质激素水平升高时间延长。有趣的是,抑郁症的一些症状,如绝望、睡眠中断以及食欲和体重的变化,都与HPA轴损伤有关,这部分解释了库欣病患者经常观察到的抑郁症状(一种以皮质醇分泌过多为特征的疾病)。
此外,慢性皮质酮治疗或慢性应激会诱导神经元海马萎缩。还值得注意的是,抑郁症会诱导HPA对急性压力的反应发生变化,这是通过特里尔社会压力测试测量的。
此外,临床神经影像学研究显示抑郁症中海马体的体积减少。因此,反复和严重的压力暴露,特别是在神经发育的敏感时期,会促进海马体的重新编程,诱导长期的改变,这些改变可能会决定,通常以性别特异性的方式对未来压力源的反应,可能有助于一些与压力相关的抑郁样表型。
大约一个世纪前,诺贝尔奖获得者 Julius Wagner-Jauregg 观察到,免疫系统的激活(由于接种疟疾)会影响精神功能。然而,心理神经免疫学领域花了几十年的时间才在抑郁症和心身医学的背景下出现。
研究指出,伴随人类感染发作和持续时间的各种心理参数的变化与抑郁症相似,这加强了该领域在抑郁症背景下的重要性。此外,人们越来越意识到患有自身免疫性疾病的个体表现出抑郁症的高发病率。
到1990年初期,很明显,免疫调节信号分子的过度分泌,特别是促炎细胞因子,可能在抑郁症的发生和维持中发挥作用。
▸ 促炎细胞因子与抑郁症
最初报道了白细胞介素6 (IL-6)、干扰素-γ(IFN-γ)和急性期蛋白的血浆浓度增加,现在已确定这些细胞因子和其他细胞因子,特别是肿瘤坏死因子(TNF),在抑郁症患者中升高。这种炎症表型也被认为是抑郁症治疗耐药的重要因素。
该理论促使研究人员研究抗炎化合物的抗抑郁作用,结果表明,TNF拮抗作用尤其能改善具有高基线炎症生物标志物的患者的抑郁症状。
此外,使用干扰素-α(IFN-α)等促炎剂治疗丙型肝炎病毒导致四分之一的患者出现抑郁症状。鉴于许多抗抑郁药物的抗炎作用,神经免疫机制现在被视为抑郁症状发展的核心。
具体的炎症因子在精神疾病中的详细特征可以参考文章:从肠道菌群到炎症因子:读懂疾病的预警信号
近年来,在整体大脑健康的背景下,人们对免疫运输到大脑的细胞机制越来越感兴趣。最初认为中枢神经系统(CNS)在某种程度上与外周免疫系统隔离。
然而,随着证据表明循环细胞因子确实可以影响大脑和行为,研究表明,尽管血脑屏障(BBB)严格调节免疫细胞迁移到中枢神经系统,但外周白细胞可以浸润脑脊髓液(CSF)、脑膜、脉络丛、血管周围间隙,并最终浸润脑实质。
随后,专门的先天免疫哨兵细胞——脉络丛巨噬细胞、血管周围巨噬细胞、肥大细胞、脑膜巨噬细胞和小胶质细胞(CNS常驻巨噬细胞)——在稳态条件下监视CNS,是潜在危险的第一反应者,检测病原体或组织损伤,并触发免疫反应。
此外,最近研究表明,CNS实际上通过淋巴引流系统直接连接到次级颈部淋巴结,该系统可以引起外周免疫反应。
▸ 在压力和抑郁中激活免疫系统
先天免疫系统是抵御感染和压力源的第一道防线,它从出生起就是固有的。就抑郁症的病理生理学而言,首要重要的是先天免疫系统通过产生细胞因子、激活补体级联反应以及随后通过抗原呈递激活适应性免疫系统来募集免疫细胞中的作用。
◮ 抑郁症患者中免疫相关分子浓度增加
研究人员报告称,MDD患者的循环免疫细胞(如单核细胞和粒细胞)水平升高。许多研究还表明,抑郁症患者血清中免疫信号分子(趋化因子和粘附分子,如人巨噬细胞趋化蛋白-1、可溶性细胞内粘附分子-1和E-选择素)以及急性期蛋白和促炎细胞因子,如 IL-6 或促炎因子(如前列腺素)的浓度增加,表明外周免疫系统与抑郁症有关。
同样,在暴露于社交失败压力的动物中,中性粒细胞和巨噬细胞的增加。此外,促炎细胞因子如IL-6 和TNF-α的缺失导致小鼠抑郁样行为的减少。
肥大细胞是参与免疫反应调节和体内平衡支持的先天免疫细胞,它们在过敏和癌症、HIV和结肠炎中起关键作用。此外,在大脑中发现了肥大细胞,它们已被证明在神经炎症、焦虑和塑造与性行为相关的神经发育通路中发挥作用。
它们还被证明通过依赖于色氨酸代谢的过程参与抑郁症。然而,需要进一步的研究来揭示外周先天免疫活性与抑郁症发展之间关系的潜在机制。
扩展阅读:
适应性免疫涉及免疫记忆现象,其中特定的淋巴细胞(T细胞或B细胞)特异性识别独特的决定因素(抗原),以便在第二次和随后与病原体相遇时产生更有效的反应。因此,它是身体对特定病原体做出反应的一种高度特异性的防御机制。
当研究显示抑郁症患者的循环辅助性T细胞(Th) (CD4+)、细胞毒性T细胞(CD8+)和B细胞数量增加时,最初提出了适应性免疫系统在抑郁症病因中的作用。
◮ 抑郁症个体中Th2和Th17等免疫细胞受损
最近报道了抑郁症个体中Th2和Th17细胞成熟受损、多种CD4+ T细胞库减少和B调节细胞减少。同样,动物模型的研究也表明,糖皮质激素和应激暴露会调节T细胞和B细胞反应。
鉴于这些过程中涉及的一些细胞因子与疾病行为的发展有关,在感染的情况下,这代表了一种重要的应对机制——这些分子的长期失衡可以解释恶心、食欲不振、睡眠障碍、疲劳和快感缺乏等症状的发展。
◮ CD8+细胞调节皮质甾酮和行为来响应压力
最近的一项研究报告称,尽管CD4+ T细胞似乎不直接参与对压力的反应,但 CD8+ 细胞毒性T细胞不仅通过调节皮质甾酮和行为反应来响应压力,而且还通过诱导促炎细胞因子的产生,可能通过诱导单核细胞和巨噬细胞来响应应激。
此外,有人提出,在依赖于记忆T细胞的过程中,对自身抗原的免疫记忆可能有助于压力应对机制的发展。
根据应激性损伤的性质和强度,循环中免疫调节剂的增加可能通过从BBB的外周毛细血管内皮细胞释放细胞因子,或通过迷走神经刺激响应外周炎症介质,间接触发神经炎症。
事实上,认知行为疗法已被证明可以有效调节促炎细胞因子(如IL-6和TNF-α)的水平,同时减轻抑郁症状,因此表明不平衡的促炎信号的减少与更好的临床结果有关。
▸ 炎症小体和抑郁症
人们对炎症小体在压力敏感和抑郁中的作用越来越感兴趣。
炎性小体是在骨髓谱系的细胞中产生的蛋白质复合物,作为对病原微生物或所谓的无菌压力源(如心理压力)的反应,产生的蛋白质复合物。
扩展阅读:
◮ 炎症小体会导致促炎细胞因子的激活
炎性小体的组装导致caspase-1的激活,而caspase-1又会裂解 IL-1β 和 IL-18 的前体形式,从而导致这些促炎细胞因子的激活并导致焦亡,这是一种不同于细胞凋亡的程序性细胞死亡形式。
在感染过程中,由特定先天免疫细胞强制执行的首要防御形式之一是在种系中编码的一组模式识别受体(PRR)的呈递,以识别入侵病原体表达的分子模式。这些可能在膜表面,例如Toll样受体(TLR),也可能在细胞质内部,例如Nod样受体(NLR)。
NLR 是胞质受体,能够识别非自身分子和相关细胞损伤,并由病原体相关分子模式(PAMP)和损伤相关分子模式(DAMP)触发。
◮ 抗抑郁治疗可以逆转炎症小体的过表达
NLRP3是NLR的一个亚群,是研究最多的参与 caspase-1 激活的炎性小体;它在小胶质细胞和未分化神经元的 CNS 中表达。啮齿动物研究表明,慢性应激导致 NLRP3 在小胶质细胞中过表达,这可以通过选择性血清素再摄取抑制剂(SSRI)抗抑郁药逆转。
在人类中,在未经治疗的 MDD 患者的外周血细胞中观察到 NLRP3 的过表达,同时血清 IL-1β 和 IL-18 水平升高,这被抗抑郁治疗逆转。因此,炎性小体有望成为炎症反应的关键调节剂,尽管这种复杂反应背后的机制仍相对未被探索。
▸ 神经免疫、压力和抑郁
◮ 小胶质细胞——脑部前哨免疫细胞
越来越多的证据表明,抑郁症有神经免疫基础。如前所述,小胶质细胞是关键的先天前哨免疫细胞,仅限于CNS,并通过运动突起监测环境以确定生理环境的变化。
除了作为对感染和损伤的反应者的关键作用外,小胶质细胞还参与神经发育和成年期不同阶段的神经元事件,包括突触重塑以塑造神经元网络信号。这些细胞参与一个动态系统——神经血管单位,其中包括围绕BBB并传递CNS细胞与外周之间相互作用的细胞。
最近的研究确定,小胶质细胞通过自我更新维持在大脑中,并维持与神经元的长期互动。此外,小胶质细胞可以释放炎性细胞因子来影响神经元活动和神经递质受体的运输以及基因表达。
小胶质细胞和神经元之间的相互交流可能在整个生命周期中促进神经可塑性、神经发生、增殖、修剪和神经退化,并且可能在压力和神经炎症反应中起关键作用。
作为对压力的反应,小胶质细胞在与抑郁样症状有关的皮质边缘区域内发生形态和功能的动态变化。在压力条件下,神经内分泌通路微调中枢和外周免疫反应,导致单核细胞运输和启动,随后小胶质细胞表型发生变化,并最终导致神经炎症,这反过来又会导致多种压力相关疾病的发展,包括抑郁症。
◮ 星形胶质细胞——大脑功能的关键参与者
应该注意的是,中枢神经系统(CNS)中最常见的神经胶质细胞类型是星形胶质细胞,它们是维持大脑功能、调节神经传递、新陈代谢和能量供应的关键参与者。
据报道,在抑郁症中,星形胶质细胞的密度和数量有所减少。最近使用易位蛋白18 kDa(TSPO)作为反应性星形胶质细胞和小胶质细胞标志物的人脑成像研究表明,MDD患者的神经炎症增加,抗抑郁治疗减少了神经炎症。
综上所述,这些发现清楚地表明,抑郁症是一种复杂的精神疾病,与压力适应不良有着内在的联系,这会导致HPA轴和免疫系统失调。在过去的几年里,很明显,这种改变的压力和炎症反应会聚集在大脑功能上,从而破坏正常的神经免疫稳态。
因此,在免疫精神病学领域,人们的热情伴随着这样一个想法,即针对这种改变的压力免疫轴可能会产生治疗抑郁症的新方法。然而,最近出现了一个新的参与者——肠道微生物群——它也是压力和炎症的关键调节因子,因此它在抑郁症中的作用也正在研究中。
哺乳动物肠道是无数微生物的生活环境,这些微生物统称为肠道微生物群。新出现的证据支持胃肠道微生物群与内分泌和免疫系统的双向通信在介导关键的大脑过程,包括神经炎症、压力轴激活、神经传递和神经发生)。此外,在心理学中,人们越来越认识到微生物群-肠-脑轴在精神病理学中的作用。
肠道微生物群影响免疫细胞各种亚群的相对种群、迁移和表型,不同的研究说明了肠道微生物种群如何在炎症、感染和自身免疫时影响粘膜表面的先天性和适应性免疫反应。
事实上,已经表明肠道免疫系统是一个复杂的结构,它已经发展出特定的机制来确保共生细菌负荷得到维持,如果细菌穿过肠道屏障,这些将被免疫系统靶向并消除,防止它们可能侵入外围。另一方面,共生菌还通过直接识别T细胞、树突状细胞或直接识别微生物代谢物或产物(如短链脂肪酸)来触发调节性 T 细胞的激活,从而塑造免疫反应。
▸ 微生物组与免疫脑信号传导
微生物群有助于免疫反应的启动、教育和激活;反过来,免疫系统在维持和调节肠道细菌的数量和多样性方面发挥作用。目前的证据表明,在稳态条件下,保持健康和动态的低度炎症基调,以在肠道免疫和肠道神经系统与大脑之间持续交流。
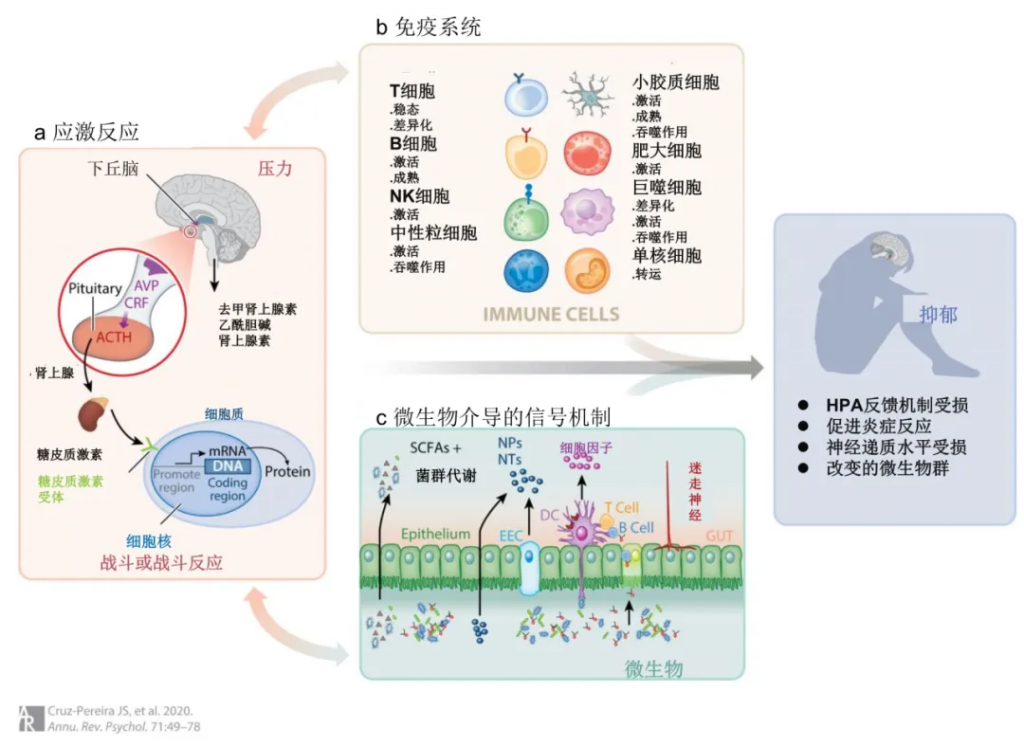
◮ 微生物群与神经炎症密切相关
除了在肠道水平影响免疫系统外,微生物群还与小胶质细胞的严格调节有关。事实上,微生物组与通过调节短链脂肪酸(SCFA)调节神经炎症过程有关,短链脂肪酸是纤维代谢的微生物衍生副产品,特别是在帕金森病的动物模型中。值得一提的是,单核细胞显示游离脂肪酸受体(FFAR),这是SCFA的内源性分子靶标之一。
越来越多的证据表明,肠道微生物组在介导神经炎症过程中发挥着令人信服的作用。在一项引人入胜的研究中,发现脑海绵状血管畸形——增加癫痫发作和出血性中风风险的血管缺陷——受到革兰氏阴性菌和脂多糖激活内皮Toll样受体4(TLR4)的刺激,TLR4参与先天免疫的激活。相反,TLR4信号传导的药物阻断阻止了牵涉畸形的发展。
更重要的是,这些畸形未能在无菌小鼠中发展,抗生素暴露显著降低了对牵涉畸形的易感性。综上所述,这些结果表明,肠道微生物组无疑参与了影响大脑形态和功能的先天免疫信号通路。
◮ 肠道微生物群影响大脑的免疫结果
调节和炎症适应性免疫反应的损害也与缺血性中风的发展有关。已发现抗生素暴露会改变免疫肠道功能,同时减少小鼠的缺血性脑损伤。在这个模型中,肠道T细胞在中风后迁移到脑膜,这被特定肠道细菌群的消耗所逆转。通过观察到无菌小鼠以淋巴细胞依赖性方式免受缺血病变的发展,进一步加强了细菌定植与中风结果的相关性,进一步加强了肠道微生物组在影响大脑的免疫结果中的作用。
关于炎性小体与微生物群-肠道-大脑轴的相互作用,NLPR6 已被证明对肠道微生物代谢物信号做出反应,导致宿主免疫反应的激活。caspase-1 的基因缺失是该信号级联反应的关键组成部分,可减少小鼠的抑郁样行为,同时导致肠道微生物组改变。
应激小鼠的抗生素治疗以类似于caspase-1敲除小鼠的方式促进肠道微生物组的再平衡,进一步暗示肠道微生物组在调节影响大脑功能的炎性小体途径中的作用。
综上所述,这些结果挑战了肠道微生物群、免疫系统和神经发育之间的关系在成年后是不变的既定概念。事实上,健康多样的胃肠道微生物群被认为对于维持平衡的免疫系统和适当的大脑功能至关重要。
◮ 微生物群还可通过迷走神经影响肠脑信号
微生物群和免疫系统可能与肠脑信号相互作用的另一种机制是通过迷走神经。迷走神经的末梢对来自肠道神经系统的神经通讯和肠道释放的炎症因子很敏感,它们通过脑干将这些感觉信息传递到大脑的更高中枢。
最近使用迷走神经切断术的研究报告称,肠道微生物群在调节神经发生中起关键作用,可能是通过涉及脑源性神经营养因子(BDNF)的机制。
脑源性神经营养因子可以参考我们以前的文章:探索大脑健康的宝藏:神经营养素、肠道菌群与我们的思维宇宙
这些发现支持早期的工作,其中益生菌鼠李糖乳杆菌JB-1对压力诱导的抑郁和焦虑样行为的积极影响通过迷走神经切断术消融。迷走神经刺激在某些抑郁症病例中作为治疗方法的作用。
除了在对神经发生的积极影响中发挥作用外,来自大脑中高级中心的传递通过传出的迷走神经冲动抑制了外周炎性细胞因子,如TNF-α和脾脏中的IL-1β,从而影响肾上腺的局部事件;因此,这种交流在调节压力反应中发挥作用。
尽管研究尚未明确确定肠道微生物群与通过迷走神经调节免疫和压力相关事件的直接联系,但现有数据表明,迷走神经可能在某种程度上导致了肠道微生物群对抑郁症的一些影响。
缺乏调查肠道微生物组在宿主心理健康中的作用的机制、纵向临床研究。有证据表明抑郁症个体的微生物群组成发生了变化,粪杆菌属(Faecalibacterium)的丰度与症状严重程度呈负相关。
一项观察性研究报告称,用单一和复发性抗生素治疗攻击微生物群会增加患抑郁症和焦虑症的风险。最近,一项大型人群研究表明,Coprococcus和Dialister菌株不仅是生活质量提高的预测因子,而且在未经治疗的抑郁症患者中也持续耗尽,而 Butyricicoccus与抗抑郁治疗有关。
有趣的是,最近的研究表明,MDD 患者的粪便移植会影响受体动物的抑郁样行为,从而表明肠道微生物组进一步参与抑郁症。
▸ 压力和抑郁患者的微生物组
许多不同的压力范式——包括慢性社交失败、克制压力、母体分离、拥挤、热应激和声学压力——会影响肠道中微生物的组成,如临床前模型所确定的那样。
多项研究侧重于了解肠道微生物群在通过抗生素给药、益生元和益生菌干预以及粪便移植对肠道微生物群进行积极或消极操作后暴露于压力中的作用,以及对特定无病原体和无菌动物的压力的反应。
与微生物群免疫应激反应相关的微生物群调控的临床前研究,如下图所示:
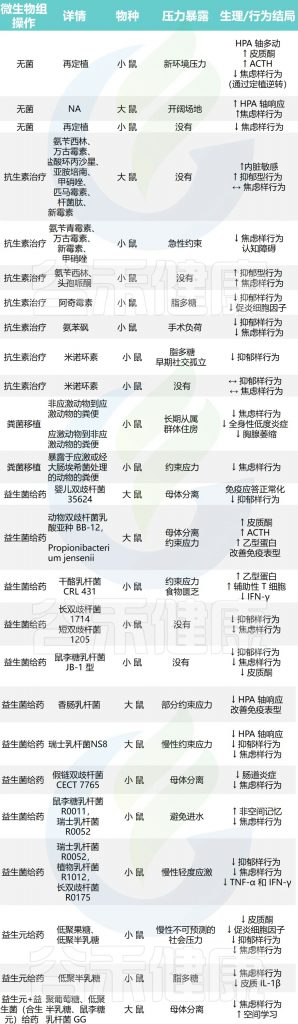
◮ 肠道微生物群可以对神经行为产生不同影响
临床前研究表明,无菌动物——从出生起就在无菌环境中饲养,因此缺乏胃肠道细菌——表现出的行为和表型结果,可以通过细菌定植来逆转,并且对急性应激的敏感性增加。
剖析肠道微生物群对压力生理学影响的另一种方法是通过暴露于抗生素来消融稳定的核心细菌种群。越来越多的研究表明抗生素治疗后的行为受到调节,这表明特定的肠道细菌种群可能会对神经行为结果产生积极或消极的影响。
然而,仍然缺乏进一步的临床前研究来检查抗生素给药对响应应激暴露的神经内分泌水平变化的影响。鉴于肠道细菌可能会影响压力反应和情绪行为,多项研究也探讨了益生元和益生菌给药在压力模型中的效果。事实上,益生元和益生菌干预都已被证明可以防止压力的有害影响,可能是通过调节免疫系统,同时改善行为(见上表)。
此外,从应激小鼠到幼稚受体的粪菌移植导致焦虑样行为以及单核细胞和活化小胶质细胞在海马体中的积累,而用来自未应激动物的有益微生物治疗通过改善肠道炎症来改善焦虑样行为。
综上所述,越来越多的证据表明,肠道微生物组无疑参与了应激反应的潜在机制,塑造肠道微生物群落可能会为更有针对性的应激信号传导操作的发展提供一些启示。
▸ 迈向精神益生菌
最近创造了精神益生菌的概念,以表示赋予心理健康益处的活细菌。它的定义已扩大到指任何促进大脑健康的微生物组有针对性的干预。
◮ 精神益生菌改善了情绪反应
尽管研究仍处于早期阶段,但越来越多的数据,尤其是健康志愿者的数据,支持这一概念。例如,用益生菌瑞士乳杆菌R0052和长双歧杆菌R0175和低聚半乳糖治疗导致皮质醇减少,从而促进受试者对压力的适应力并改善健康受试者的情绪反应。
此外,在功能性磁共振成像研究中,摄入益生菌鸡尾酒导致大脑活动和情绪信息处理发生变化和与消极情绪相关的消极想法的减弱,支持肠道微生物群在压力和情绪反应中的重要性。
食用长双歧杆菌1714与健康受试者的压力减轻和认知改善有关。尽管有这些发现,但构成微生物群和压力反应之间通信的确切机制仍有待阐明。最近,益生菌治疗被证明可以改善压力反应以及重度抑郁症(MDD)和肠易激综合征患者和产后抑郁症的抑郁评分。
然而,关于益生菌作为MDD预防措施的整体疗效尚未达成明确的共识。在过去的十年中,科学界,特别是在社会心理学领域,开始了一场关于科学可重复性和复制性的重要讨论。尽管精神益生菌具有巨大的潜力并且广受欢迎,但不仅在科学界,而且在公众中,在从仍然有限的证据中得出结论时需要谨慎。因此,很明显,需要进行菌株选择和更多的纵向大规模研究来证明任何潜在的心理益生菌干预的特定作用。
鉴于压力、炎症和微生物组都是抑郁症的危险因素,人们对了解神经生物学回路和细胞机制越来越感兴趣,它们各自可以影响重度抑郁症(MDD)症状。
成人海马神经发生正在成为这样一种过程。1960年代的开创性研究首次提供了证据,证明成年大鼠和豚鼠海马体中产生了新的神经元,结束了神经元出生后在中枢神经系统中不再产生的长期教条。现在人们普遍认为,成体神经发生主要局限于侧脑室内衬的脑室下区和包括大鼠、小鼠和人类在内的几个物种海马齿状回(DG)的颗粒下区(SGZ)。
在海马体DG的SGZ中,神经祖细胞(NPC)增殖并分化为星形胶质细胞、少突胶质细胞或神经元,然后迁移到星形胶质细胞层(GCL)中,并最终投射到海马体的CA3区域,在那里它们成为功能齐全的神经元,集成到大脑回路中。虽然最近对人类一生中海马神经发生的维持存在一些争议,但人们普遍认为神经发生发生在海马中并具有功能相关性。然而,在临床神经影像技术取得进步之前,很难完全确定神经发生在这些临床情况下的确切作用。
▸ 神经发生,压力和抑郁
质疑成人海马神经发生在抑郁症中潜在作用的主要驱动因素之一是,慢性压力是抑郁症的一种风险和诱发因素,一直被报道会减少成人海马神经发生,而抗抑郁治疗会逆转这种情况。
由于海马体参与 HPA 轴负反馈的调节,因此推测成人海马神经发生的损伤可能与 HPA 轴反馈回路的破坏有关,从而加剧其失调,正如在很大一部分 MDD 患者中观察到的那样。
事实上,有一些临床前证据表明,成人海马神经发生可以缓冲皮质酮和对压力的行为反应。然而,在没有压力的情况下,神经发生消融似乎不会诱导抑郁表型。另一方面,使用不同类型的抗抑郁药和其他诱导抗抑郁样作用的手法进行长期治疗,例如电休克疗法和锻炼,已被证明会增加啮齿动物的成年海马神经发生。来自人类死后脑组织的一些证据表明,抗抑郁药物在抑郁症中会增加海马祖细胞增殖。
临床前模型还提供了证据表明,某些抗抑郁药的至少部分行为影响需要完整的成人海马神经发生。有趣的是,与抑郁症中观察到的 HPA 轴多动症非常相关,已经证明成人海马神经发生是通过抗抑郁治疗使 HPA 轴功能正常化所必需的。
抗抑郁药发挥其治疗效果所需的时间与新生成的海马细胞成熟并整合到神经元网络中所需的时间相匹配,这符合抗抑郁活性需要成人海马神经发生的观察结果。
此外,压力通过诱导抑郁样行为对成人神经发生产生有害影响,而这种影响可以通过抗抑郁药治疗来逆转。
▸ 神经炎症和海马神经发生
炎症对成年海马神经发生影响的第一个证据是,当外周或中枢注射 LPS 到啮齿动物减少神经发生,同时增加海马体 DG 中小胶质细胞的数量时。从那时起,很明显,经典的促炎细胞因子 IL-1β、IL-6 和 TNF-α 是海马神经发生的主要负炎调节剂。
由于海马 IL-1β 水平的长期升高对记忆和认知有不利影响,并且在动物研究中也会促进行为抑郁,海马体中同源 IL-1 I 型受体(IL-1R1)的受体表达升高,并且抗抑郁治疗降低海马体中的 IL-1β 水平,这种促炎细胞因子现在被确定为抑郁症海马功能障碍的重要因素也就不足为奇了。
除了影响成熟神经元的功能外,IL-1β还可以直接与新生的神经元相互作用,这是由于IL-1R1在海马体的神经祖细胞上的表达。几个小组现在已经发表了关键研究,证明 IL-1β 对海马神经发生产生负面影响,并且存在相关的行为后果。
事实上,IL-1β 被认为对慢性压力诱发的抑郁症很重要,因为它对海马神经发生有负面影响。此外,研究报告说,IL-1β诱导的海马神经发生的减少被体外和体内的抗抑郁治疗逆转。
IL-1β 主要由海马体中的小胶质细胞产生,因此这种在塑造神经元发育中起重要作用的动态细胞因其通过海马神经发生的变化对压力诱导的抑郁样行为的贡献而被研究。有趣的是,阻断压力诱导的小胶质细胞活化和抗抑郁药丙咪嗪独立地挽救了压力诱导的抑郁样行为并抑制了神经发生。除了促炎细胞因子和小胶质细胞外,有证据表明T细胞也是维持海马神经发生所必需的。
▸ 微生物组和海马神经发生
越来越多的证据表明,在成人海马神经发生的背景下,肠道微生物组也是免疫系统的关键调节剂。
事实上,无菌小鼠的成年海马细胞增殖和神经发生水平增加,而从三周龄开始的微生物再定植并不能阻止这些。有趣的是,这些影响主要在背侧海马体而不是腹侧海马体中观察到,这可能对主要参与背侧海马体的认知功能(如空间学习和记忆)产生有趣的影响。
另一方面,最近的一项研究表明,抗生素治疗减少了成人海马神经发生,这被益生菌治疗和自愿运动逆转,不是通过粪便移植,而是通过调节 Ly6Chi 单核细胞运输。因此,肠道微生物组似乎参与了成人海马神经发生的调节,可能是通过与免疫系统的相互作用。
关于益生菌是否会影响成人海马神经发生的数据有限,但一项研究报告称,用益生菌制剂(瑞士乳杆菌 R0052 和长双歧杆菌 R0175 组合)治疗可以防止应激诱导的表达双皮质素(神经发生的标志物)的细胞数量减少。
下图展示了成人海马神经发生是参与抑郁症的精心编排的通路中的重要调节剂。这个过程受到饮食和运动以及健康的免疫系统和肠道微生物组的积极影响,同时受到压力和异常免疫系统和肠道微生物组等因素的负面影响。成人海马神经发生似乎很可能处于这个邪恶的三位一体的核心,因为这个关键过程是由这个三位一体调节的。
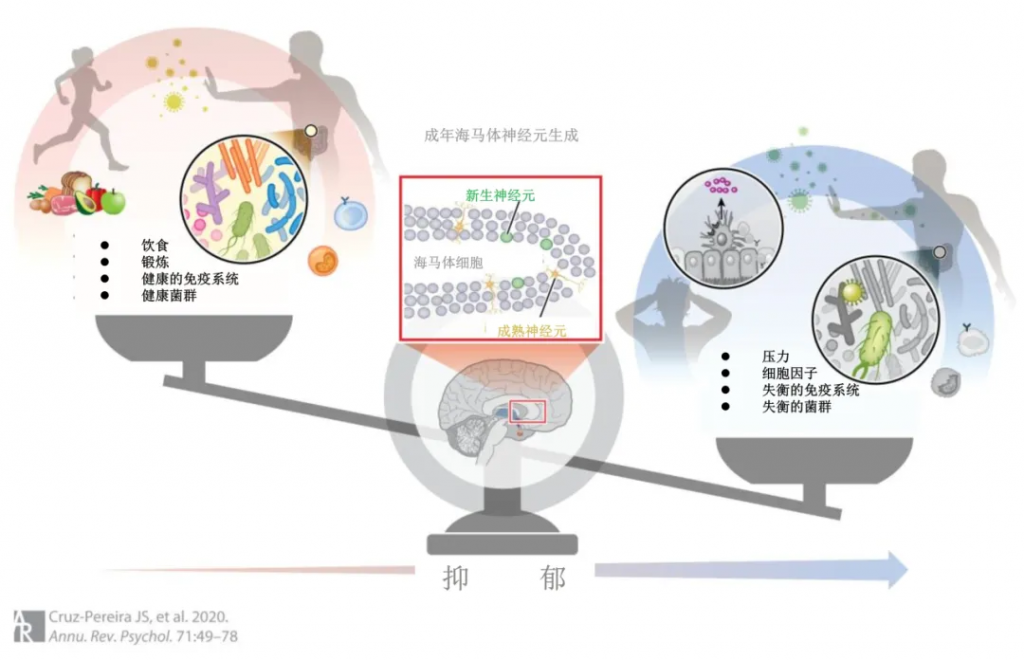
从动物研究中可以清楚地看出,成人海马神经发生是抗抑郁作用的关键,并且一直被证明会受到压力的抑制。最近重新认识到成人神经发生在人类海马体中的重要性进一步推动了发现针对它的策略,以维持正常的海马功能。
鉴于肠道微生物组对这一中心过程的潜在调节,未来的研究应该解决可能将肠道微生物组与大脑联系起来的潜在机制途径以及成体神经发生的正确整合,特别是在压力、炎症和随后的抑郁的情况下。
近几十年来,生活方式,尤其是饮食发生了巨大的转变。从本质上讲,很大一部分人类采用西式饮食,这些饮食富含加工食品、糖和脂肪,这与肥胖、糖尿病和心血管疾病的患病率不断上升有关。
◮ 更健康的饮食可能带来更好的认知功能
另一方面,地中海饮食等健康饮食提供必需的常量营养素,如类黄酮、omega-3脂肪酸和omega-6多不饱和脂肪酸,这些营养素与更好的预期寿命和健康状况有关。然而,报告也将西方饮食的消费与认知和情绪障碍联系起来,而地中海饮食则与更好的认知功能有关。
此外,最近的一项系统评价得出结论,在观察性研究中,坚持健康饮食,尤其是传统的地中海饮食,或避免促炎饮食,似乎可以提供一些预防抑郁症的保护。这些研究为预防抑郁症的营养方法提供了明确的证据。了解支撑这些影响的机制将很重要,尤其是在微生物群免疫应激水平上。
事实上,最近的研究表明,不健康食物摄入量较高和营养丰富的食物摄入量较低与海马体积减少有关,相反,更健康的饮食与人类海马体积较大有关。
事实上,在临床前模型中,不同的饮食干预与海马体的神经元可塑性有关,这进一步强调了健康饮食在促进大脑体内平衡和功能方面的重要性。此外,最近表明,在正常的抗抑郁药或心理治疗中加入改良的地中海饮食可以对抑郁症产生显著的积极影响。鉴于地中海饮食显著影响微生物群组成,很容易推测微生物群可能在此类饮食干预的有益效果中发挥作用。
因此,饮食改变似乎是一种促进整体健康的有趣干预措施。事实上,人们对生活方式的改变越来越感兴趣,特别是采用独特的饮食方式——如旧石器时代、生酮饮食和植物性饮食等——被认为可以促进健康益处,而这可能反过来与炎症和/或肠道微生物组的调节有关。
此外,鉴于早期生活环境深刻塑造了神经发育,并且饮食与神经可塑性有关,因此评估饮食在早期生活中的相关性将极为重要。进一步的研究应该解决这些饮食的潜在大脑健康益处及其潜在机制。
肠道微生物组、免疫力和压力反应之间的微妙平衡对神经系统健康至关重要。最终,该矩阵中一个或多个因素的破坏(例如,由消极的生活事件)会导致大脑生理和行为失调,从而导致重度抑郁等情绪障碍的发展。
尽管在抑郁症的背景下单独研究了这个邪恶的三位一体的组成部分,但在临床前和人类研究中,需要在机械层面上做很多工作,以梳理它们各自的相对贡献以及它们如何相互作用。
如本文开始所述,有大量患者对抑郁症的常规治疗没有反应,了解这三位一体如何在难治性抑郁症中发挥作用是进一步研究的重要途径。
我们现在认识到,不平衡的压力和炎症反应无疑与抑郁症的发展和维持有关,但最近的证据表明,肠道微生物组也在这些途径的不平衡和神经心理学中发挥作用,这表明针对这些因素的治疗可能更有效。
微生物群在疾病中的作用现在才刚刚显现出来,尤其是在神经心理学领域。研究表明,肠道微生物改变在抑郁症患者和抗抑郁药物后的作用;然而,进一步的研究应该检查心理疗法(如认知行为疗法)后微生物组的变化。
因此,心理益生菌干预可能会增强现有疗法的有益效果,从而可能产生更好的结果。然而,确实需要对特定菌株或其组合进行大规模、双盲、安慰剂对照试验来验证这些方法。此外,包括营养、均衡饮食和定期锻炼在内的健康生活方式可能有助于肠道微生物组的平衡和成体神经发生,这反过来又促进了与免疫系统的相互交换和压力反应,从而可能预防抑郁症等疾病。
总之,抑郁症的理想治疗方法可能是重置免疫力、压力生理学和微生物群的不平衡。我们等待这最后一块拼图,但目前的研究表明,这是一个可行的阐明策略。
主要参考文献
Cruz-Pereira JS, Rea K, Nolan YM, O’Leary OF, Dinan TG, Cryan JF. Depression’s Unholy Trinity: Dysregulated Stress, Immunity, and the Microbiome. Annu Rev Psychol. 2020 Jan 4;71:49-78.
Cussotto S, Clarke G, Dinan TG, Cryan JF 2019. Psychotropics and the microbiome: a chamber of secrets. Psychopharmacology 236:1411–32
Dantzer R. 2018. Neuroimmune interactions: from the brain to the immune system and vice versa. Physiol. Rev. 98:477–504.
de Kloet ER, Joels M, Holsboer F 2005. Stress and the brain: from adaptation to disease. Nat. Rev. Neurosci. 6:463–75
DePalma G, Blennerhassett P, Lu J, Deng Y, Park AJ et al. 2015. Microbiota and host determinants of behavioural phenotype in maternally separated mice. Nat. Commun. 6:7735
DePalma G, Collins SM, Bercik P, Verdu EF 2014. The microbiota-gut-brain axis in gastrointestinal disorders: stressed bugs, stressed brain or both?. J. Physiol. 592:2989–97
Del Grande da Silva G, Wiener CD, Barbosa LP, Goncalves Araujo JM, Molina ML et al. 2016. Pro-inflammatory cytokines and psychotherapy in depression: results from a randomized clinical trial. J. Psychiatr. Res. 75:57–64
Derecki NC, Cardani AN, Yang CH, Quinnies KM, Crihfield A et al. 2010. Regulation of learning and memory by meningeal immunity: a key role for IL-4. J. Exp. Med. 207:1067
Desbonnet L, Clarke G, Traplin A, O’Sullivan O, Crispie F et al. 2015. Gut microbiota depletion from early adolescence in mice: implications for brain and behaviour. Brain Behav. Immun. 48:165–73
Desbonnet L, Garrett L, Clarke G, Kiely B, Cryan JF, Dinan TG 2010. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience 170:1179–88

谷禾健康

▶ 某天,10岁的豆豆开始感到奇怪,左半身隐约有些麻木,使不上劲儿,还有些“抽搐”的感觉。她的病是逐渐发作的,直到有一天在上学路上摔倒了。这时候家长意识到不对劲,豆豆说她不能运动,不能跳舞…
儿科医生怀疑她有神经系统问题,经过核磁共振扫描等系列检测,豆豆最后被确诊为“烟雾病”。
▶ 一名37岁男性,因突发性右臂无力和持续30分钟的言语停止而就诊,医生对他进行了头部CT、脑血管造影、脑数字减影血管造影检查,结果显示双侧颅内血管病变累及前循环左侧大于右侧,与烟雾病的发展最为一致…
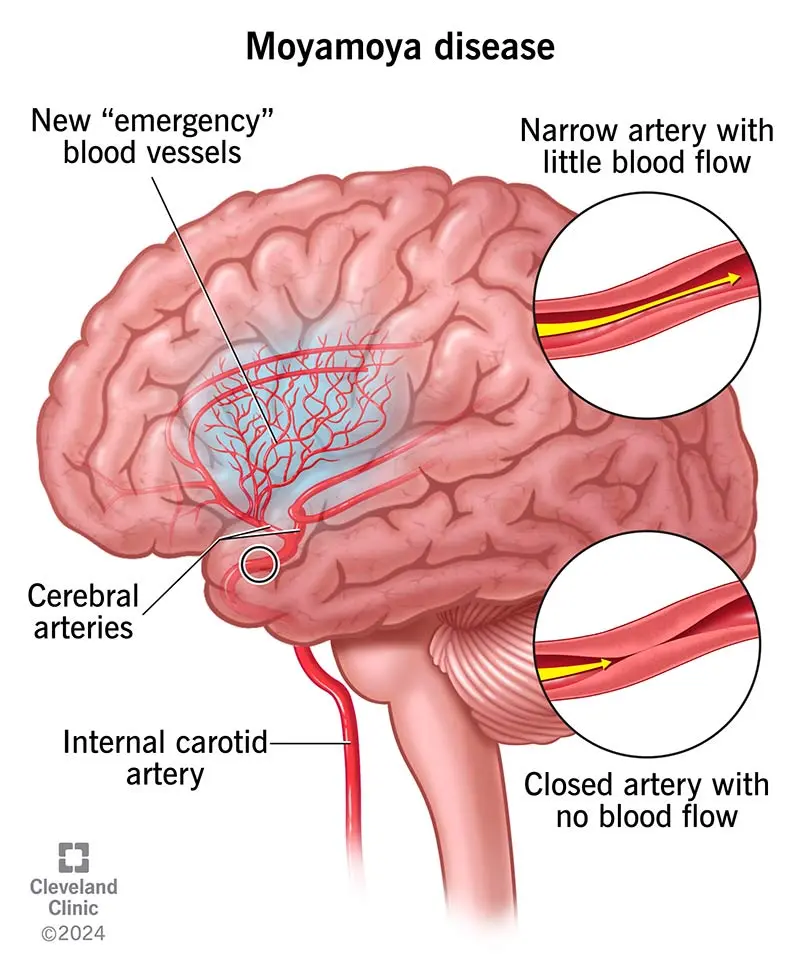
烟雾病是一种慢性脑血管病,临床表现包括缺血性和/或出血性卒中和认知障碍,儿童和成人均可发生,因此导致残疾和死亡的发生率较高。
烟雾病的主要特征是供应大脑前部的主要动脉发生进行性狭窄,包括颈内动脉及其分支。这种狭窄导致大脑的血液供应逐渐减少,进而促使大脑发展出代偿机制以防止缺血。
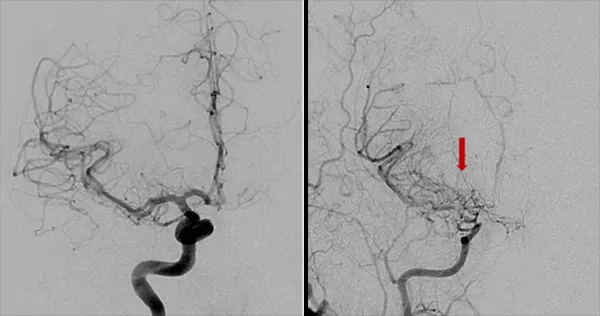
这些代偿机制之一是侧支循环的形成,即附近的血管生成小分支来供应血液不足的区域。在脑血管造影中,这些侧支血管形成的异常血管网状结构呈现出一种模糊的特征,类似于烟雾,因此这种疾病被形象地命名为“烟雾病”,在日语中的意思为“一股烟”。
尽管侧支循环能在短期内增加血液供应,但它们也容易破裂,限制血液流向大脑,从而增加患者中风的风险。
大约10-15%的病例是家族性的,表明有很强的遗传成分。有几个基因与此有关,包括RNF 213,这在东亚人群中特别常见。
环境因素也可能与烟雾病的发展有关,感染,自身免疫性疾病和辐射暴露可能会引发易感个体的疾病。
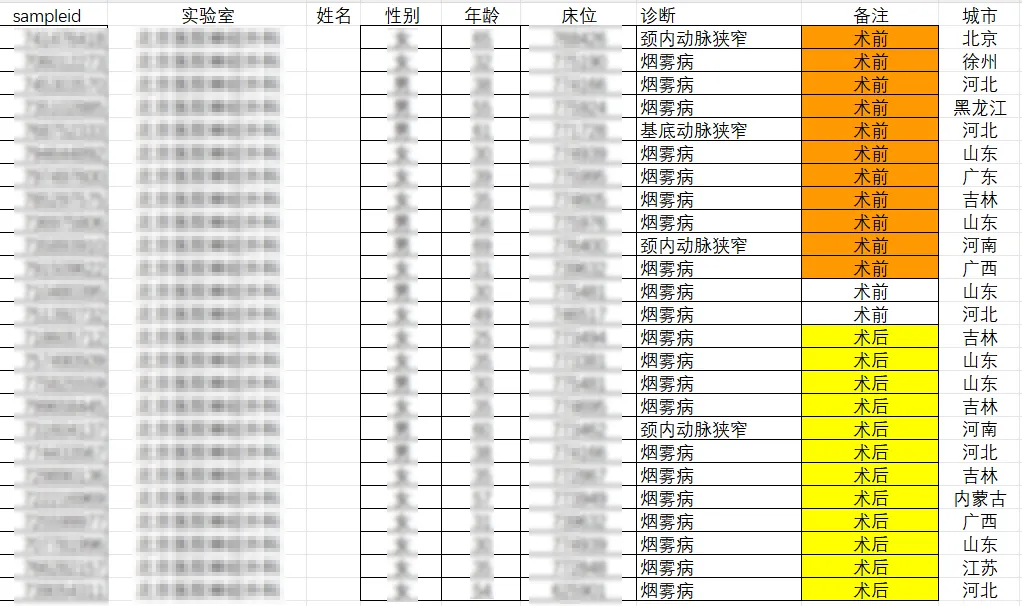
免疫炎症方面,全身免疫炎症指数(SII)、转化生长因子-β(TGF-β)等多个炎症标志物在烟雾病患者中显著升高。微生物组研究显示,活泼瘤胃球菌(Ruminococcus gnavus)丰度升高与烟雾病风险增加约10倍相关,而双歧杆菌等有益菌群显著减少。此外,血浆代谢物分析发现鸟氨酸水平升高与成人烟雾病风险显著相关。
本文我们来详细了解一下烟雾病的基本特征、临床表现和人群分布特点,包括该病的危险因素识别和发病机制研究进展,以及与肠道菌群的关联,同时也涵盖了一些常见的诊疗策略。
烟雾病(Moyamoya Disease,简称MMD)是一种罕见的慢性脑血管疾病。当医生们在进行脑血管造影检查时,发现患者脑底部形成的异常血管网在影像上呈现出袅袅升起的烟雾状,因此得名。
烟雾病症状通常出现在儿童或中年,包括中风,头痛和癫痫发作。这种情况及其症状在儿童中的进展速度比成人快。
突发症状
症状之一是典型的中风,它会引起广泛的神经系统症状,包括:
渐进性症状
一些患有烟雾病的儿童和成人的症状是逐渐出现的,然后随着时间的推移而变得更糟。这些症状包括:
烟雾病症状按照引起的原因可分为:
缺血症状
症状通常取决于哪一个大脑区域缺血(例如,额叶、顶叶、颞叶)。常见症状包括轻偏瘫、失语、认知障碍、癫痫发作、晕厥、视力缺陷等。缺血性症状可能是短暂的(TIA)或永久性的(中风),并且通常在儿童中由过度换气(例如,哭泣,运动),脱水或劳累引起。
颅内出血
临床症状根据出血部位而不同,出血部位可以是脑室内、脑实质内或蛛网膜下腔。出血可归因于脆弱的侧支血管破裂,在某些情况下也可能由烟雾病相关的微动脉瘤引起。
在所有年龄组中,缺血(TIA或中风)是烟雾病最常见的表现,但成人出现颅内出血的可能性是儿童的7倍,这可能是由于成人血压较高时微小烟雾病血管破裂所致。
烟雾病症状最常见于5~10岁的儿童和30~50岁的成年人。
烟雾病在全球范围内呈现出显著的地域性分布特征,其中亚洲地区,特别是东亚国家的发病率最高。
在美国,缺血性症状是成人和儿童的主要表现,尽管成人发生颅内出血的可能性仍然是儿童的7倍(20% vs 2.8%)。相比之下,亚洲人群中出现出血的成年人比例(42%)远高于居住在美国的亚裔人群。
在日本的流行病学研究中显示:
在韩国也观察到上升趋势,年发病率从2007年的每10万居民1.7例增加到2013年的每10万居民4.3例。
在美国2002年至2008年全国住院患者样本的一项研究表明:
在中国烟雾病的流行病学研究,纳入了2016年~2018年期间来自 1312 家医院的 47443例新发患者,共 69680例住院记录。
在亚洲国家,大约10-30%的烟雾病病例有遗传原因。
家族史:
基因突变:
RNF 213是一种与颅内大动脉狭窄/闭塞相关的锌环指蛋白,RNF 213的突变可能会影响与血管生成和免疫活性相关的信号传导过程相关的一些微RNA和蛋白质的表达,这些信号传导过程是烟雾病病理和进展的基础。
性别:女性发病率显著高于男性
年龄:呈双峰分布;
第一个高峰在5-10岁;第二个高峰在30-50岁
种族:
放射治疗
在因脑瘤而暴露于颅辐射的患者中,烟雾病血管病变的发生率报告为2%-4.3%;
在接受视神经胶质瘤放射治疗的神经纤维瘤病1型患者中,发病率可高达60%。
感染相关
烟雾病血管病变的另一个非遗传性触发因素是感染,如钩端螺旋体病和HIV感染。
水痘带状疱疹病毒感染引起了人们的注意,因为它常发生可逆性动脉病,称为短暂性脑动脉病(TCA)或局灶性脑动脉病(FCA),有时会发展为烟雾病。
一名20岁女性在成功治疗肺炎链球菌脑膜炎后出现进行性血管病变。在她感染后的八个月内,血管造影显示出烟雾综合征的外观。
社会经济因素
低收入人群风险较高,这可能与医疗资源获取、生活方式等多个因素有关。
城市生活环境,这可能与城市环境中的压力因素、环境污染等因素有关。
多种基础疾病可能增加烟雾病的发病风险:
理解这些危险因素对于疾病的预防、早期诊断和治疗具有重要意义。特别是对于具有多个危险因素的人群,应当进行更密切的监测和随访。同时,某些危险因素(如环境因素)是可以调控的,这为疾病的预防提供了可能的干预靶点。
目前已经研究了烟雾病的流行病学、临床特征等,但对其病因和进展知之甚少。研究表明,烟雾病可能与免疫、炎症、微生物组等有关。
1993年,6例烟雾病患者的研究显示,在主要由平滑肌细胞组成的Willis环中,增厚的动脉内膜中有巨噬细胞和T细胞浸润。这为免疫系统和炎症参与烟雾病的病理生理学提供了见解。
慢性炎症可损伤血管壁并引起微血栓,导致缺血性卒中。此外,由细胞因子的异常分泌形成的促炎环境也可能刺激内皮细胞和巨噬细胞的活化、平滑肌细胞的增殖和新血管形成。
一项前瞻性研究表明,与健康对照(HC)相比,烟雾病患者的循环Treg和Th17细胞显著升高。
巨噬细胞
烟雾病患者中M2型巨噬细胞标记物sCD163的高表达,表明巨噬细胞可能在烟雾病的进展中发挥作用。
烟雾病患者中哪些细胞因子水平发生变化?
转化生长因子-β(TGF-β)是促炎细胞因子之一,能够调节多种细胞功能,如增殖、分化和迁移。研究发现,烟雾病患者的外周TGF-β水平增加,并与铃木分期烟雾病呈正相关。TGF-β的增加表达可能诱导大量细胞外基质产生,并伴有正常猪动脉的内膜和中膜增生。
同样,烟雾病患者的血清IL-1β、TNF-α、IL-12水平也高于年龄和性别匹配的健康个体,血清中VIP、CCK、SST水平显著降低;这些水平也与这些受试者的脑脊液(CSF)中检测到的水平相关。
烟雾病患者免疫炎症标志物的比较与评估
一项对154例烟雾病患者(MMD组)和321例年龄、性别匹配的健康体检者(对照组)进行的回顾性病例对照研究,烟雾病组的全身免疫炎症指数(SII)、中性粒细胞与淋巴细胞比率(NLR)和血小板与淋巴细胞比率(PLR)值均显著高于对照组[分别为754 ± 499 vs.411 ± 205(P< 0.001),2.83 ± 1.98 vs.1.81 ± 0.72(P< 0.001)和152 ± 64 vs.120 ± 42(P< 0.001)]。
SII是一种新型、经济的生物标志物,能够反映炎症和免疫反应之间的平衡状态,ROC曲线分析显示SII的AUC为0.76,优于NLR(0.69)和PLR(0.66),可能是烟雾病患者炎症状态的可靠指标,特别是在评估疾病活动性和预测并发症风险方面具有潜在应用价值。
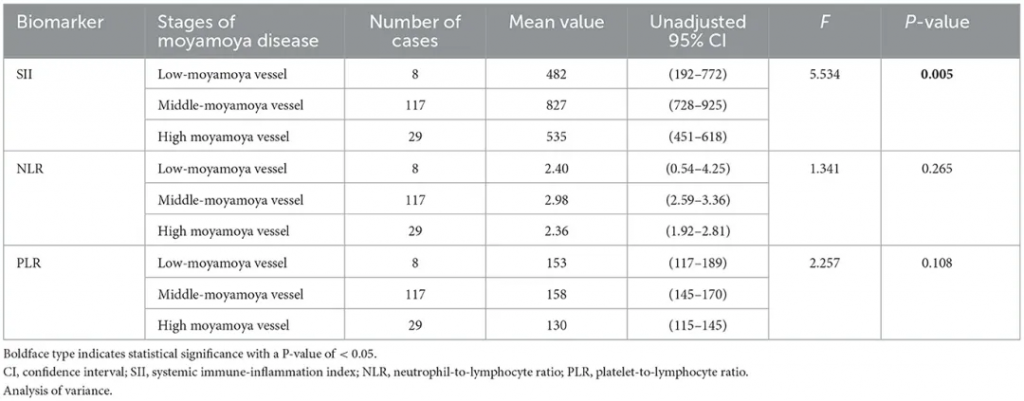
从免疫炎症的角度,中间阶段烟雾血管群的免疫炎症状态可能变得更加活跃,这一发现似乎意味着铃木阶段的III期和IV期烟雾病患者更容易患中风。 这可为外科手术时机的选择提供参考。
烟雾病与自身免疫疾病有何关联?
烟雾病与某些自身免疫性疾病的共存,促使研究者探索免疫调节紊乱和免疫蛋白异常表达在烟雾病进展中的机制。
Yanagawa等人报告了一例烟雾病患者,其类风湿因子和髓过氧化物酶-抗中性粒细胞胞质抗体的检测结果为阳性。蛋白质阵列数据分析和生物信息学分析帮助鉴定了165种在烟雾病患者血清中显著过表达的自身抗体,这些抗体与翻译后修饰、炎症反应和DNA损伤修复及维护相关。
免疫复合物沉积导致的血管损伤
在烟雾病患者中发现的IgG和IgM沉积可能导致主要脑血管及其分支的内弹性层退化、迂曲和破裂。
在15例烟雾病病例的尸检中发现,内弹性板下以及颈内动脉和大脑前动脉及中动脉中发现了IgG和IgM的沉积。免疫复合物的沉积可能导致中膜平滑肌细胞大量迁移到内皮下,导致内膜增厚和血管腔狭窄。
内皮祖细胞(EPCs)在肿瘤血管生成、缺血组织的血管生成、维持血管稳态以及胚胎期血管发育中发挥作用。
烟雾病患者中EPCs水平的变化
研究发现,烟雾病患者的循环EPCs水平高于动脉粥样硬化性脑血管疾病患者和健康对照组。特别是在有造影显示的烟雾血管的患者中观察到这一现象。
EPCs与烟雾病术后恢复的相关性
一项前瞻性临床试验还发现,在116例烟雾病患者中,EPC计数与术后侧支循环良好之间存在显著相关性。然而,看似矛盾的报告发现,一组未接受手术的高加索成年烟雾病患者和一组患有烟雾病的儿童的血液EPCs水平降低。
EPCs功能异常与烟雾病进展
早期EPC具有3种特异性表面标志物:CD34、CD133和血管内皮生长因子受体2(VEGFR-2),而晚期EPC仅表达2种标志物:CD34和VEGFR-2。不同时期的EPCs在烟雾病病理生理过程中可能发挥不同的作用。
一氧化氮(NO)在烟雾病中的作用
一氧化氮(NO)通过与其受体鸟苷酸环化酶(sGC)结合,在烟雾病的血管重塑和血管收缩调节中发挥重要作用。
NO通过NO-sGC-cGMP途径参与多种生理和病理生理活动,包括血管平滑肌重塑和血管收缩调节。L-精氨酸(NO的前体)对小鼠脑小动脉的扩张作用和NO合成抑制剂L-NMMA的收缩作用证实了这一点。
此外,23名烟雾病患者的脑脊液中NO水平显著高于16名非烟雾病患者的对照样本。sGC突变导致的NO信号传导障碍可能导致烟雾病。可以推测,NO水平的变化可能通过扩大侧支循环中的小血管,影响血管平滑肌,促进异常血管网络的形成,但具体机制尚待阐明。
烟雾病患者中Cav-1的作用
在烟雾病患者中,抑制性调节器Cav-1的减少可能对动脉重塑产生负面影响。
Cav-1是NO的抑制性调节因子,在烟雾病患者中被发现减少,体外研究表明Cav-1的下调抑制了内皮细胞的血管生成并诱导平滑肌细胞凋亡,表明其在烟雾病的动脉重塑中起负面作用。
烟雾病患者中细胞因子的变化
烟雾病患者的血浆中细胞因子,包括生长因子和与血管生成相关的细胞因子,显著改变。
烟雾病患者的血浆中细胞因子,包括生长因子如VEGF和PDGF-BB,以及与血管生成相关的细胞因子显著改变。VEGF的表达可由缺氧诱导,被认为是最有效的促血管生成生长因子。研究发现烟雾病患者的血浆中VEGF浓度显著更高。
VEGF在烟雾病进展中的作用
局部脑缺氧可能通过改变VEGF的表达,促进烟雾血管的形成。
在烟雾病的进展中,局部脑缺氧可能引起VEGF表达的变化,这可能有助于烟雾血管的形成。此外,VEGF的受体sVEGFR-1和sVEGFR-2在烟雾病患者中减少,接受间接搭桥手术的烟雾病患者往往有更好的侧支形成,sVEGFR-1和sVEGFR-2水平更低。
MMP-9及其他细胞因子在烟雾病中的作用
作为与血管生成相关的细胞因子,MMP-9靶向胶原IV,通过降解细胞-细胞和细胞-基质接触,破坏内皮基底膜的稳定性,并可能参与破坏血脑屏障。
一些零星的研究报告了烟雾病患者血清或脑脊液中其他细胞因子如bFGF、HGF、PDGF-BB、MCP-1的表达增加。这些细胞因子主要引起内皮细胞的增殖和平滑肌细胞的迁移,导致内膜增生和病理性侧支血管形成。然而,这些细胞因子是否在烟雾病的进展中起启动作用,或者仅仅是中间产物,尚不清楚,需要进一步研究。
血脂异常与烟雾病
肠道菌群
越来越多的证据表明,肠道微生物群是影响宿主代谢和免疫稳态的关键环境成分。肠道微生物组在心脑血管疾病如高血压、动脉粥样硬化和中风中的重要性得到了很多关注。
在这些病症中,由肠道微生物组产生的许多代谢物被吸收到循环系统中,在循环系统中它们被宿主酶进一步加工,导致对靶器官的损伤。
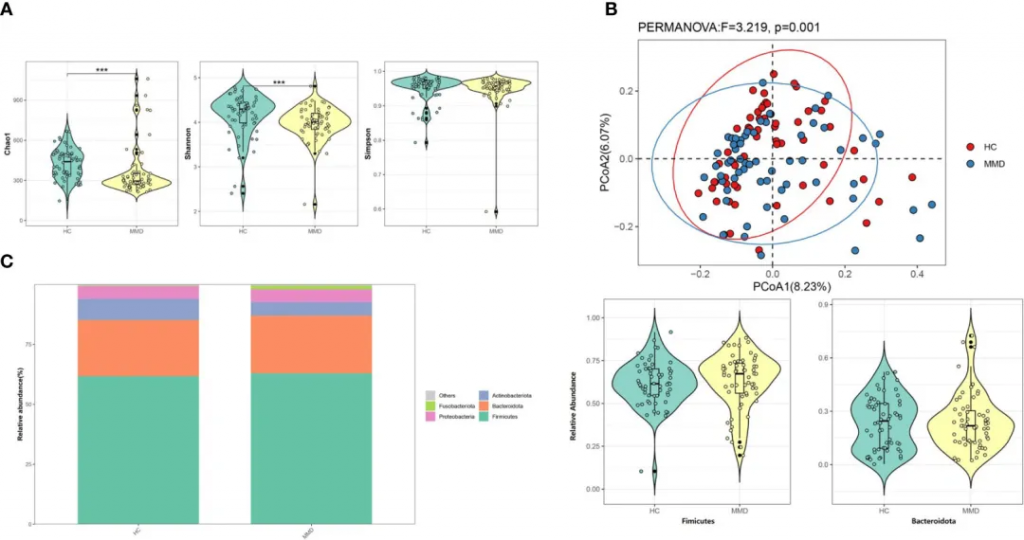
2021-2022年进行的一项前瞻性病例对照研究,纳入2021年6月至2022年5月期间在首都医科大学附属北京天坛医院神经外科就诊的72例烟雾病型脑血管疾病成人患者(年龄≥ 18岁),排除了10名烟雾综合征患者和2名粪便样本不足的患者,也就是60例烟雾病患者vs 60例健康对照,采用16S rRNA测序技术,对烟雾病患者的肠道菌群进行了系统分析。
多样性
研究发现烟雾病组患者的α多样性指数显著降低,具体表现为Shannon指数和Chao 1指数的明显下降。这种多样性的降低,提示烟雾病患者肠道微生态系统的稳定性可能受到影响。同时,通过加权UniFrac距离分析的β多样性也显示出显著差异,表明烟雾病患者的菌群群落结构发生了明显改变。
烟雾病和对照组之间微生物多样性和微生物组组成的比较
doi.org/10.3389/fcimb.2023.1252681
菌群组成
研究发现了以下特征性改变:
门水平的变化
属水平的特征性改变
增加的菌属:
梭杆菌属(Fusobacterium)
梭杆菌属(Fusobacterium)是口腔或结肠中的一种机会性肠道厌氧菌。近年来,许多研究表明梭杆菌通过调节免疫炎症因子参与结直肠癌的生长和进展。此外,梭杆菌可以促进促炎因子和活性氧物质的产生,这可能在慢性炎症中起关键作用。
在该研究中,烟雾病组中梭杆菌的丰度高于HC组。因此,推测梭杆菌介导的慢性炎症可能与烟雾病的发生发展有潜在的关系是合理的。
Lachnoclostridium
与正常人群相比,结直肠癌患者的该菌相对丰度更高。
心脏病患者血浆中的三甲胺-N-氧化物(TMAO)水平越高,其心血管疾病风险就越大,呈现明显的剂量依赖关系。后续研究进一步证实,血液中TMAO水平升高与高血压和高同型半胱氨酸血症的发生率密切相关。
TMAO的形成过程涉及肠道菌群代谢:首先,肠道微生物产生三甲胺(TMA)这一代谢产物,随后TMA在肝脏中经过含黄素的单加氧酶3的作用,转化为TMAO。近期研究发现,Lachnoclostridium能够促进TMA的产生,进而加速动脉粥样硬化的发展。
这一发现与烟雾病的研究产生了联系。既往研究已经表明,血液中同型半胱氨酸水平升高会增加患烟雾病的风险。在本研究中,研究人员观察到烟雾病患者体内Lachnoclostridium的含量明显高于健康对照组。基于这些发现,研究团队提出一个新的假说:Lachnoclostridium可能通过影响同型半胱氨酸的水平,并促进TMAO的产生,参与烟雾病的发病过程。
更值得注意的是,研究还发现在烟雾病患者中,Lachnolostridium属的含量与收缩压(SBP)呈现正相关。这一现象可能也与乳杆菌影响TMAO合成有关,提示乳杆菌的含量可能可以作为预测烟雾病患者血压变化的一个指标。
减少的菌属:
双歧杆菌属(Bifidobacterium)
双歧杆菌是重要的肠道有益微生物。先前的研究已经表明双歧杆菌与血浆TMAO和TMA呈负相关。在该实验中,烟雾病组群具有比HC组群更少的双歧杆菌丰度。如前所述,这种趋势的出现是合乎逻辑的。
肠杆菌属(Enterobacter)
肠杆菌可在人类胃肠道中发挥益生菌作用。在这项研究中,烟雾病患者中肠杆菌属的相对丰度也降低了。
双歧杆菌和肠杆菌对烟雾病的发生、发展可能有拮抗作用。
在临床应用方面,研究者基于4个特征性属建立了预测模型,该模型的ROC曲线下面积达到0.921,显示出良好的诊断价值。这些发现为烟雾病的早期筛查提供新的指标。

一项研究通过分析27例烟雾病患者、7例ICAD患者和15例对照者的粪便样本16S rRNA测序数据,发现烟雾病患者中活泼瘤胃球菌(Ruminococcus gavus)丰度显著升高,而Roseburia inulinivorans丰度显著降低,这两种菌群的变化与疾病风险增加约10倍相关。
活泼瘤胃球菌在烟雾病患者中丰度显著升高,是区分烟雾病和对照的有效生物标志物(AUC=0.81)。
活泼瘤胃球菌 (Ruminococcus gavus)
Ruminococcus gnavus是一种常见的肠道微生物,属于厚壁菌门,R. gnavus在肠道粘膜的粘液层中具有优势,能够降解粘液作为能量来源,并通过产生细菌素来保护和定植。
同时R. gnavus与多种炎症性疾病有关,包括炎症性肠病(IBD)、肠易激综合征(IBS)、湿疹、代谢紊乱和风湿性疾病。
R. gnavus已知能够产生一种炎症性多糖,这种多糖能够激活树突状细胞分泌肿瘤坏死因子-α(TNF-α),并以TLR4依赖的方式增加RNF213的表达。RNF213是一种可能的细菌感染感应器,其功能障碍可能导致病原体清除不足,从而引发持续的炎症,这可能与烟雾病的病理过程有关。
口腔菌群
日本烟雾病患者口腔菌群中弯曲杆菌丰度较高

研究通过对比日本烟雾病患者(未经手术治疗的)(n=16) 与健康人群(n=15)的口腔和肠道微生物组成发现,烟雾病患者口腔中弯曲杆菌的丰度显著高于健康人群。
烟雾病患者的口腔微生物多样性(Chao1指数和观察到的物种)高于健康对照组;两种分析方法(LEfSe和ANCOM-BC)均证实弯曲杆菌在烟雾病患者口腔中显著富集。
弯曲杆菌 (Campylobacter)
弯曲杆菌是一类革兰氏阴性、微需氧的细菌,广泛存在于鸟类、哺乳动物和人类的消化道,要通过粪口途径传播,是全球常见的细菌性腹泻病原体之一。
弯曲杆菌感染主要引起急性胃肠炎,症状包括腹泻(常带血)、腹痛、呕吐、发热和恶心等,大多数感染是自限性的,但免疫力低下的人群(如儿童、老年人和免疫抑制者)可能发展为严重并发症。
感染途径主要包括食用受污染的肉类、乳制品、蔬菜和水果,以及饮用未经处理的水或牛奶。
弯曲杆菌是如何参与烟雾病发病机制的?
在日常口腔卫生实践中,口腔细菌可以短暂地进入血液循环,弯曲杆菌可能通过这种短暂性血源感染到达血管组织,通过血液传播可能激活颅内动脉的免疫反应。
分子机制相互作用:
弯曲杆菌含有脂多糖(LPS),RNF213基因(烟雾病的易感基因)参与细胞内细菌脂多糖的泛素化过程,这种相互作用提示弯曲杆菌可能通过影响RNF213基因功能参与烟雾病发病。
免疫调节作用:
弯曲杆菌能够上调HT-29细胞中的TLR4和MD-2表达,虽然不是血管细胞系,但可通过这一机制调节免疫应答,这种免疫调节作用可能与烟雾病患者颅内动脉病变相关。
炎症反应激活:
这些发现表明弯曲杆菌可能是烟雾病发病机制中的重要环境因素,通过血源性感染、免疫调节、与RNF213基因的相互作用等多重途径参与疾病的发生发展。
一项研究探讨了血浆尿素循环代谢物与成人烟雾病(MMD)风险之间的关系。研究发现,血浆鸟氨酸水平升高与成人烟雾病风险增加显著相关,而精氨酸、尿素和全球精氨酸生物利用度比(GABR)水平升高则与烟雾病风险降低相关。
鸟氨酸是产生脯氨酸、多胺和瓜氨酸的必需结构单元,并且对于控制许多代谢活性至关重要。鸟氨酸与线粒体功能异常有关,可能受到炎症因子的影响。
精氨酸是一种与许多生物过程相关的氨基酸,包括蛋白质合成、免疫反应和一氧化氮的产生,精氨酸可能是缺血性脑血管疾病中的保护因子。具有抗炎效果;产生一氧化氮,帮助血管舒张;有助于预防血小板和白细胞粘附。
这些发现表明,血浆尿素循环代谢物可能是烟雾病风险的潜在生物标志物,有助于疾病的早期诊断,为治疗提供新的思路。当然,未来还需要更多的研究来验证这些发现。
烟雾病的诊断是一个复杂的过程,涉及多种影像学检查方法,以观察脑部血管的异常变化。以下是烟雾病主要的诊断方法:
影像学检查
影像学检查是诊断烟雾病的关键步骤,可以帮助医生观察到脑部血管的异常变化,如颈内动脉狭窄或闭塞,以及异常血管网的形成。
-计算机断层扫描 (CT) 和 CT血管造影 (CTA)
CT可以显示脑部的结构,而CTA可以提供血管的详细图像,帮助识别颈内动脉的狭窄或闭塞。
-磁共振成像(MRI)
MRI能够提供脑部的详细图像,有助于识别烟雾病相关的脑组织变化,如脑缺血或出血。
-磁共振血管造影(MRA)
MRA是一种无创的血管成像技术,可以显示脑部血管的结构和血流情况,对于发现烟雾病的血管异常非常有用。
-数字减影血管造影(DSA)
DSA被认为是诊断烟雾病的“金标准”。通过将造影剂注入血管,并进行X射线成像,DSA可以清晰地显示血管的狭窄、闭塞和异常血管网。
烟雾病有哪些分期?不同分期有什么特点?
铃木分期法是一种根据血管造影结果对烟雾病进行分期的方法,它有助于评估疾病的严重程度和进展。
铃木分期法的六个阶段:
第一阶段(初期):
第二阶段(早期):
第三阶段(中期):
第四阶段(晚期):
第五阶段(末期):
第六阶段(终末期):
以上是铃木分期法,不同分期的烟雾病患者可能需要不同的治疗方法。例如,早期患者可能只需要密切监测,而晚期患者可能需要手术治疗。
3、肠道菌群检测
随着医学研究的深入,肠道菌群检测作为一种新兴的辅助诊断手段,显示出其在烟雾病诊断中的潜力。
肠道菌群检测的优势在于其非侵入性和易操作性。通过分析粪便样本中的微生物组成,可以为烟雾病的诊断提供重要的生物标志物。
烟雾病患者的肠道菌群与健康对照组存在显著差异。通过前瞻性病例对照调查,研究人员发现,烟雾病患者的肠道菌群中,Lachnoclostridium和梭杆菌属(Fusobacterium)的相对丰度增加,而双歧杆菌属和肠杆菌属的相对丰度减少。这一发现揭示了肠道菌群与烟雾病之间的关联,并为无创辅助诊断提供了新的思路。通过识别特定的肠道微生物标志物,医生可以更早地发现烟雾病,从而及时干预,改善患者的预后。
此外,肠道菌群检测的结果还可以与影像学检查相结合,提高诊断的准确性。例如,通过比较肠道菌群检测结果与铃木分期法的分期,临床医生可以更全面地评估患者的病情,制定个性化的治疗方案。
一、传统治疗方案选择
烟雾病的传统治疗主要集中在改善脑部血流,以减少缺血性和出血性卒中的风险。治疗方法包括药物治疗和手术治疗。
药物治疗
抗血小板药物:用于减少血栓形成,如阿司匹林。抗血小板药物治疗的获益和风险需要权衡。
根据2021年美国心脏协会/美国卒中协会(AHA/ASA)指南建议:
2021年日本烟雾病管理指南同样提出:
例如,西洛他唑是一种多效抗血小板药物,它是一种选择性磷酸二酯酶III抑制剂,具有抗血小板、抗血栓形成和血管扩张作用。在一项大型人群研究中,西洛他唑与其他抗血小板药物相比,在新诊断的烟雾病患者中,死亡率下降幅度最大。已成为烟雾病管理的潜在治疗方法。
抗癫痫药物:控制癫痫发作,尤其是在有癫痫症状的患者中。
神经保护剂应用:主要用于改善神经功能,但缺乏大规模随机对照研究证据,临床应用需要个体化考虑。
钙通道阻滞剂:用于缓解由烟雾病引起的头痛,也有研究认为要谨慎使用。
烟雾病血管病变中的头痛治疗
典型地具有偏头痛(>50%伴先兆)或紧张型头痛的特征。烟雾病血管病变中头痛的病理生理机制和最佳治疗尚不确定,但应避免限制血管舒张(降钙素基因相关肽靶向治疗)、增强血管收缩(曲坦类、麦角类)或降低血压(β受体阻滞剂、钙通道阻滞剂)的药物。
一项前瞻性非随机研究中,手术血运重建后使用阿托伐他汀可改善术后数字减影血管造影的侧支循环。
在无烟雾病血管病变的患者中,阿托伐他汀已被证明可降低偏头痛的频率,但这尚未在烟雾病血管病变患者中进行专门评估。
手术治疗
直接血管搭桥手术:将颅外血管直接连接到颅内血管,以改善血流。
间接血管搭桥手术:通过各种方法(如贴敷术)促进新血管形成,增加血流。
二、手术治疗的具体方法
烟雾病的手术治疗旨在通过重建血流来改善脑的血供,减少卒中风险。
直接血运重建
颞浅动脉-大脑中动脉搭桥:将头皮的颞浅动脉直接连接到大脑中动脉,以改善血流,就像新建一条高速公路来绕过交通堵塞。
间接血运重建
在大脑表面铺设血管组织(如肌肉或硬脑膜),随着时间的推移,鼓励新血管生长。这是一个缓慢的过程,但可能是有效的,特别是对儿童。
脑肌血管粘连术:将带血管的肌肉贴附到大脑表面,促进新血管生成。
脑硬脑膜动脉血管粘连术:将硬脑膜及其血管贴附到大脑表面。
这些技术之间的选择取决于各种因素,包括患者的年龄、疾病阶段和整体健康状况。通常,这两种方法的组合用来最大限度地提高成功的机率。
三、微生物组干预策略
近年来,微生物组干预作为一种新兴的治疗策略,开始在烟雾病治疗中受到关注。研究发现,烟雾病患者的肠道菌群与健康人存在显著差异,这可能与炎症和免疫反应有关。
通过调节肠道菌群平衡,可能有助于减轻炎症,改善血管健康。
通过补充双歧杆菌等显著减少的有益菌,改善烟雾病患者的肠道菌群平衡。
通过调整饮食结构,环境因素控制,粪菌移植等方式,促进有益菌群生长,减少可能影响肠道菌群的不利因素。
定期检测关键菌群的相对丰度变化,评估多样性指数及相关菌群变化情况,结合临床症状改善情况进行综合评估。
在这个过程中注意,选择安全性已验证的益生菌,避免过度干预。菌群干预作为综合治疗的组成部分,也可以与其他治疗方案协调,同时指导自我监测要点,制定长期维持计划,保持治疗方案的灵活性,根据患者反应及时调整。
四、危险因素控制
一些因素与预后相关,例如:
其他关于烟雾症的相关问题
应该什么时候看医生?
一些相关的自我判断如下:
如果出现上述任何症状,尤其是当它们突然出现或迅速恶化时,应立即寻求医疗帮助。烟雾病是一种进展性的血管疾病,及时的诊断和治疗对于预防严重并发症至关重要。
需要终身服药吗?
烟雾病是否需要终身服药取决于患者的具体情况。烟雾病的治疗主要以手术为主,药物治疗仅作为辅助手段,并不能从根本上解决问题。
对于无症状或病情较轻的患者,国内和日本的指南通常建议以随访和观察为主,不建议长期用药。
然而,对于有症状或病情较重的患者,可能需要短期或长期使用药物来控制症状,如抗血小板药物、血管扩张剂等,但这些药物并不能完全治愈烟雾病。
请根据病情变化调整用药方案。不建议擅自停药。因为每个病人情况不同,需要个性化的治疗方案,具体用药方案需要遵医嘱。
术后护理和康复是治疗过程的关键组成部分
患者可能需要物理治疗,职业治疗或语言治疗来恢复受疾病或手术干预影响的功能。这是一个需要耐心、毅力和支持性护理的过程。
定期复查的频率是多少?
初诊后未手术患者:
手术后患者:
复查内容可能包括:
以上这些建议仅供参考,具体复查频率和内容需要根据个人情况由专科医生制定,并根据病情变化适时调整。
烟雾病患者在保守治疗与手术治疗之间的选择标准是什么?
手术治疗可以显著改善脑血流,减少症状发作频率和严重程度,防止脑卒中等并发症。然而,手术风险较高,需要医疗团队进行操作。
保守治疗可以有效控制症状,延缓疾病进展,提高患者生活质量,但需要长期坚持,且疗效因人而异。
烟雾病患者在选择保守治疗与手术治疗之间的标准主要取决于病情的严重程度、患者的年龄和健康状况、手术的风险与效果、个人意愿等。
病情严重程度:
轻微或初期烟雾病:对于症状较轻或病变较轻的患者,保守治疗是首选。保守治疗包括药物治疗(如抗血小板药物、血管扩张剂、神经营养药物等)、康复训练、生活方式管理等。
进展性或重度烟雾病:对于病情进展较快或症状较重的患者,手术治疗可能是更好的选择。手术治疗可以改善脑血流,减少症状发作频率和严重程度,防止脑卒中等并发症。
患者年龄和健康状况:
年轻患者:年轻患者身体恢复能力较强,手术治疗可能是更好的选择。
老年患者:老年患者身体承受能力较弱,药物治疗或保守治疗可能更为合适。
有其他严重基础疾病或并发症的患者:可能需要谨慎选择手术治疗,以免加重病情。
长期监测对于烟雾病患者至关重要。定期随访影像学和神经系统评估有助于跟踪疾病进展和干预措施的有效性。
如何预防烟雾病?
保持情绪稳定,避免血压忽高忽低,对脑血管产生不利影响。
避免在生气、哭泣或吹气球时突然过度换气,以防短暂性脑缺血发作。
对于长期伴有睡眠障碍的患者,需要去心理科专科就诊,调节失眠。
控制高血压、糖尿病等慢性疾病,减少对血管的损害。
多吃富含维生素C、E等抗氧化成分的食物,如新鲜蔬果、坚果等,以增强免疫力。
保持适量的体育活动,有助于身体健康和血液循环。
烟雾病作为一种罕见而复杂的脑血管疾病,其发病机制和治疗策略一直是医学界关注的焦点。近年来的研究揭示了肠道菌群与烟雾病之间存在着密切联系,为疾病的诊断和治疗开辟了新的思路。
肠道菌群检测中,基于大数据建立的预测模型显示出良好的辅助诊断价值,这为无创性诊断方法的发展带来了新的希望。微生物组干预作为一种新兴的治疗策略,可能为传统的药物和手术治疗提供有益补充。
然而,我们也应该认识到,目前的研究仍处于探索阶段,需要更多的临床验证来确认这些发现的可靠性和实用性。同时需要多学科的协作努力,将基础研究与临床实践紧密结合,不断推进烟雾病诊疗水平的提升。
谷禾致力于推动肠道菌群与各类疾病之间的机制理解和临床应用,目前正与首都医科大学开展烟雾病患者队列的肠道菌群研究,并在多家医院进行多点临床验证。借助谷禾肠道菌群数据模型促进烟雾病的机理研究以及愈后和药物干预策略的改善。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
He, S., Duan, R., Liu, Z. et al. Characteristics of cognitive impairment in adult asymptomatic moyamoya disease. BMC Neurol 20, 322 (2020).
Hirano, Y.; Miyawaki, S.; Imai, H.; Hongo, H.; Teranishi, Y.; Dofuku, S.; Ishigami, D.; Ohara, K.; Koizumi, S.; Ono, H.; et al. Differences in Clinical Features among Different Onset Patterns in Moyamoya Disease. J. Clin. Med. 2021, 10, 2815.
Bax BE and Pacitti D (2023) Editorial: Biomarkers to evaluate rare diseases. Front. Mol. Med. 3:1237089.
Nguyen VN, Parikh KA, Motiwala M, Erin Miller L, Barats M, Milton C and Khan NR (2022) Surgical techniques and indications for treatment of adult moyamoya disease. Front. Surg. 9:966430.
Takayanagi, K., Kanamori, F., Ishii, K. et al. Higher abundance of Campylobacter in the oral microbiome of Japanese patients with moyamoya disease. Sci Rep 13, 18545 (2023).
Yu X, Ge P, Zhai Y, Liu W, Zhang Q, Ye X, Liu X, Wang R, Zhang Y, Zhao J and Zhang D (2023) Gut microbiota in adults with moyamoya disease: characteristics and biomarker identification. Front. Cell. Infect. Microbiol. 13:1252681.
Liu E, Liu C, Jin L, Zhou H, Tan X, Zhang G, Tao W, Gao X, Zhao H, Luo C, Li X and Yang S (2023) Clinical value of the systemic immune-inflammation index in moyamoya disease. Front. Neurol. 14:1123951.
Mineharu, Y., Nakamura, Y., Sato, N. et al. Increased abundance of Ruminococcus gnavus in gut microbiota is associated with moyamoya disease and non-moyamoya intracranial large artery disease. Sci Rep 12, 20244 (2022).
Zhang X, Xiao W, Zhang Q, Xia D, Gao P, Su J, Yang H, Gao X, Ni W, Lei Y, Gu Y. Progression in Moyamoya Disease: Clinical Features, Neuroimaging Evaluation, and Treatment. Curr Neuropharmacol. 2022;20(2):292-308.
Mineharu Y and Miyamoto S (2021) RNF213 and GUCY1A3 in Moyamoya Disease: Key Regulators of Metabolism, Inflammation, and Vascular Stability. Front. Neurol. 12:687088.
Gonzalez NR, Amin-Hanjani S, Bang OY, Coffey C, Du R, Fierstra J, Fraser JF, Kuroda S, Tietjen GE, Yaghi S; American Heart Association Stroke Council; Council on Cardiovascular and Stroke Nursing; and Council on Clinical Cardiology. Adult Moyamoya Disease and Syndrome: Current Perspectives and Future Directions: A Scientific Statement From the American Heart Association/American Stroke Association. Stroke. 2023 Oct;54(10):e465-e479.
Zhang D, Huang L, Huang Z, Zhou Q, Yang X, Gu H, Li Z, Shi Y, Gan L, Wang H, Ma X, Wang Y, Zhao J. Epidemiology of Moyamoya disease in China: A nationwide hospital-based study. Lancet Reg Health West Pac. 2021 Dec 11;18:100331.
Zhang H, Zheng L, Feng L. Epidemiology, diagnosis and treatment of moyamoya disease. Exp Ther Med. 2019 Mar;17(3):1977-1984.
Ge, P., Yin, Z., Tao, C. et al. Multiomics and blood-based biomarkers of moyamoya disease: protocol of Moyamoya Omics Atlas (MOYAOMICS). Chin Neurosurg Jl 10, 5 (2024).
Han W, Jin F, Zhang H, Yang M, Cui C, Wang C, Jiang P. Association of Brain-Gut Peptides with Inflammatory Cytokines in Moyamoya Disease. Mediators Inflamm. 2020 Apr 28;2020:5847478.

谷禾健康

随着人们健康意识的提高,”益生菌”早已不是什么陌生的名词。目前人们比较关心的问题是:
实际上,自从2002年联合国粮农组织和世界卫生组织——益生菌是当足量补充时,对宿主健康有益的,活的微生物。其中强调了3点,只有对宿主能发挥显著有效作用,能够确保安全性,存活在食品中能保持有效的菌数。
虽然我国益生菌行业起步较晚,但发展较为迅速, 尤其是近年来一些益生菌已被卫生部批准作为新资源食品。广泛应用于乳制品行业,同时也逐步被应用于其他功能性食品,如固体饮料,果汁、冰淇淋、糖果、巧克力、 泡菜等。常见益生菌主要指两大类乳酸菌群:一类为双歧杆菌;常见的有婴儿双歧杆菌、长双歧杆菌、短双歧杆菌和动物双歧杆菌。另一类为乳酸杆菌,常见的有罗伊氏乳杆菌,植物乳杆菌,鼠李糖乳杆菌和嗜酸乳杆菌。
但是菌种具有特异性,不同的菌种具有特定的健康益处,没有一种菌种是万能的。由于主要的益生菌是通过补充或膳食进入肠道,属于肠道菌群的一员。而肠道菌群被认为是影响人体健康的重要因素之一,其与代谢、免疫、神经系统等多方面的健康密切相关。
因此,益生菌作为调节肠道菌群的重要工具,已被广泛应用于功能性食品和临床干预。然而,由于个体间肠道菌群的组成和功能存在显著差异,传统的“一刀切”益生菌干预模式在某些情况下可能效果有限,甚至可能引发不良反应。
本文将探讨个性化益生菌选择的必要性、益生菌定植影响的内外部因素,以及益生菌补充不适当或者过量的案例。
人体内外栖息着大量微生物,这些微生物与健康存在密切的关系。有的能够促进健康,有的则会引起疾病;有的能促进消化、有的则会造成感染;有的能增强免疫系统,有的则会产生毒素破坏器官和组织。同样是细菌,可以被分为“有益的”细菌和“有害的”细菌。
联合国粮食及农业组织和世界卫生组织将益生菌定义为“活的微生物,当摄入足够量时,会给宿主带来健康益处”(又名友好细菌)。通俗地讲,益生菌就是“对人体有益的细菌”。
近几十年来,益生菌因其对人类健康的有利影响而逐渐被纳入我们的饮食中,成为越来越多人的健康选择。益生菌可能对身体产生多种积极影响,而不同种类的益生菌可能在作用机制和效果上有所不同。这些影响包括:
No.1
维持肠道微生态平衡
◆ 抑制有害菌定植
益生菌可以通过竞争肠道黏膜表面的结合位点,阻止有害菌的黏附与定植。例如,双歧杆菌和嗜酸乳杆菌等益生菌能够分泌抗菌物质,如乳酸、乙酸和细菌素等,抑制病原菌的生长。
益生菌还可以调节肠道的pH值,创造不利于有害菌生长的环境。
◆ 促进有益菌生长
益生菌可以为其他有益菌提供营养支持,促进其生长繁殖。例如,某些益生菌可以分解膳食纤维产生短链脂肪酸,为双歧杆菌等有益菌提供能量来源,从而促进它们的生长。
益生菌还可以通过信号传导等方式,调节肠道菌群的组成和结构,促进有益菌的生长和优势地位的确立。
No.2
改善消化系统功能
◆ 缓解便秘
益生菌可以增加肠道内的水分含量,使粪便变得柔软,易于排出。益生菌还可以促进肠道蠕动,加快粪便在肠道内的传输速度。例如,乳酸菌可以通过刺激肠道神经系统,促进肠道平滑肌的收缩,从而增强肠道蠕动。
◆ 减轻腹泻
对于感染性腹泻,益生菌可以通过调节肠道菌群,增强肠道免疫力,抑制病原菌的生长,从而减轻腹泻症状。例如,布拉氏酵母菌可以在肠道内定植,分泌抗菌物质,抑制致病性大肠杆菌等病原菌的生长,减轻腹泻症状。
对于抗生素相关性腹泻,益生菌可以预防和治疗由于抗生素使用导致的肠道菌群失调引起的腹泻。
◆ 促进营养物质的吸收
益生菌可以产生多种消化酶,帮助人体消化和吸收食物中的营养物质。例如,乳酸菌可以产生乳糖酶,帮助人体消化乳糖;双歧杆菌可以产生多种维生素,如维生素B1、B2、B6、B12等,以及短链脂肪酸等有益物质,促进肠道对这些营养物质的吸收。
◆ 改善肠道屏障
益生菌通过促进肠道上皮细胞修复,减少肠漏综合征的发生。益生菌还可以调节肠道黏膜的通透性,改善肠道屏障功能,减少营养物质的流失。
doi.org/10.1016/j.tifs.2023.06.013.
No.3
增强免疫功能
◆ 调节肠道免疫
益生菌可以刺激肠道黏膜免疫系统,增强肠道局部免疫力。例如,双歧杆菌和嗜酸乳杆菌等益生菌可以激活肠道黏膜中的免疫细胞,如巨噬细胞、T细胞等,促进免疫细胞的增殖和分化。
益生菌还可以调节肠道免疫细胞分泌的细胞因子,维持肠道免疫平衡。例如,某些益生菌可以促进抗炎细胞因子的分泌,抑制促炎细胞因子的产生,从而减轻肠道炎症反应。
◆ 全身免疫调节
益生菌可以通过肠道黏膜免疫系统与全身免疫系统的相互作用,调节全身免疫功能。例如,可以刺激肠道黏膜中的免疫细胞产生免疫调节因子,如白细胞介素-10(IL-10)等,这些因子可以进入血液循环,调节全身免疫系统的功能。
益生菌还可以增强机体的非特异性免疫,如提高吞噬细胞的活性、增强自然杀伤细胞的活性等,从而提高机体的抵抗力。
◆ 抗过敏作用
益生菌抗过敏作用的机制是通过抑制Th2免疫反应和有利于Th1细胞反应来增强辅助性T细胞(Th1/Th2)免疫平衡。益生菌调节树突状细胞的功能,而树突状细胞又具有外周Tregs的能力。Tregs控制过量的免疫反应并维持Th1和Th2细胞之间的平衡。
例如乳杆菌刺激调节性T细胞,调节性T细胞通过产生免疫抑制细胞因子和调节IgE、IgA和IgG的产生在平衡免疫反应中起着至关重要的作用。
口服罗伊氏乳杆菌有助于恢复结肠菌群的恶化特征并减轻过敏性腹泻。研究结果证实了罗伊氏乳杆菌的抗过敏活性是通过调节肠道菌群和增强耐受性免疫反应来促进的。它还增加了肥大细胞的活化,增强了血清免疫球蛋白E(IgE)的产生,抑制了辅助性 T 细胞因子1和2的产生,下调了GATA3的表达,并增加了TGF-b 、 IL-10和Foxp3的表达。
益生菌的抗过敏作用
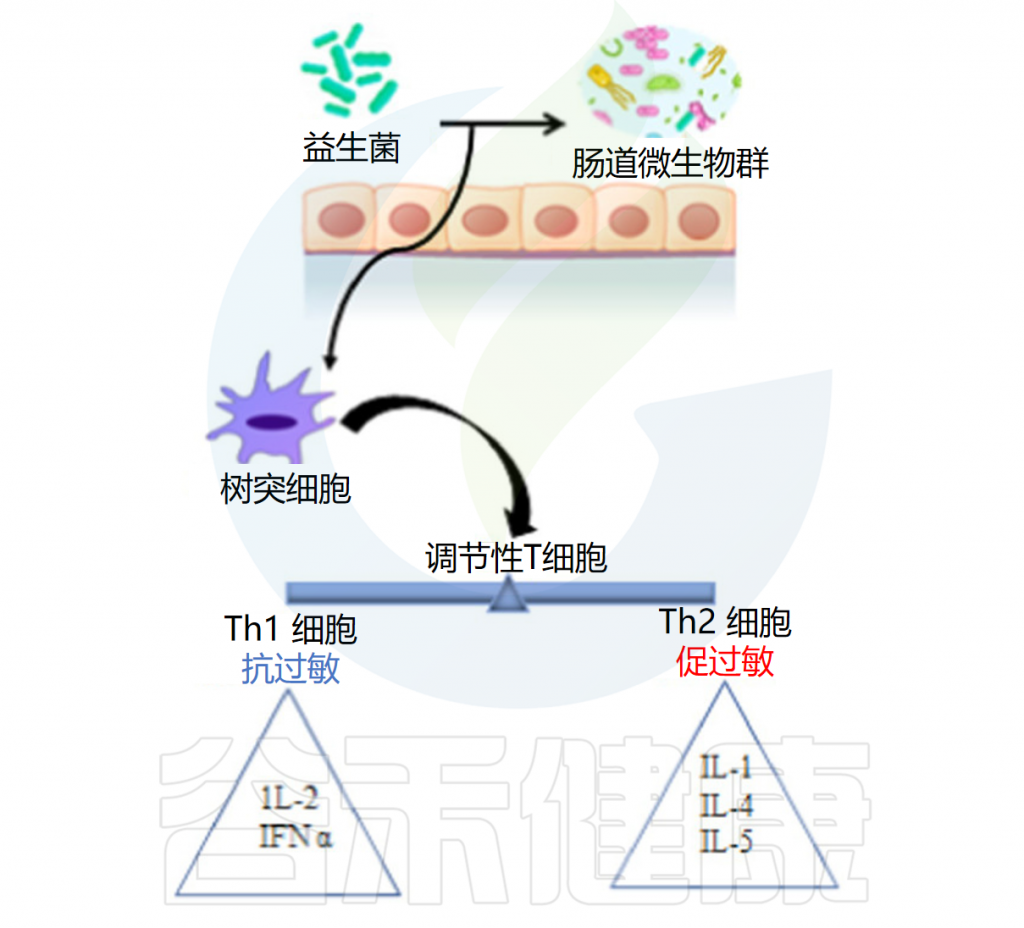
Latif A,et al.Front Microbiol.2023
No.4
益生菌与病毒感染
益生菌在几种关键病毒感染中也发挥作用,包括 SARS-CoV-2感染、流感感染、病毒性肝炎、人类免疫缺陷病毒(HIV)、人瘤病毒(HPV)。
◆ 减轻新冠病毒感染患者症状
先前的研究表明,益生菌治疗呼吸道感染的给药具有有益效果,这可能是由于它们的免疫调节和抗炎作用。
在新型冠状病毒大流行期间还研究了益生菌菌株与 新型冠状病毒(SARS-CoV-2)相关潜在治疗作用的临床试验,在大多数研究中,使用的益生菌由乳酸杆菌和双歧杆菌菌株组成,因为这些细菌已被推广为潜在的免疫调节剂。
一项研究报告称,接受益生菌和酶补充剂的患者身体和精神疲劳减轻。在另一项随机安慰对照试验中,接受测试的SARS-CoV-2 患者的胃肠道症状似乎有所改善,并且与接受安慰剂的患者相比,接受益生菌的患者发生医院获得性腹泻的频率较低。
◆ 降低流感的易感性
人类流感病毒主要附着在上下呼吸道的上皮细胞内并复制。在流感感染的啮齿动物模型中使用了益生菌菌株副干酪乳杆菌CNCM I-1518,并报道摄入该菌株降低了对流感感染的易感性,减少了炎症细胞浸润到肺部,并增加了病毒清除率。
对啮齿类动物的其他研究表明,微生物组通过诱导流感病毒复制的早期难治性环境,从而减少流感病毒的早期感染,在介导肺组织中的IFN特征中发挥重要作用。抗生素诱导的啮齿动物生态失调可降低受体7(TLR7)和NF-kB mRNA的表达,导致抗病毒免疫力受损,而使用双歧杆菌和乳酸菌的益生菌菌株可逆转。
◆ 对肝炎具有一定的治疗作用
乙型肝炎(HBV)和丙型肝炎(HCV)感染是全球性的健康问题,病毒与宿主免疫系统之间的致病性相互作用可导致肝损伤,并可能导致肝硬化和肝细胞癌。
据报道,在体外细胞模型中,青春双歧杆菌SPM0212的细胞提取物抑制乙型肝炎(HBV),其抗病毒机制与Mx-GTP酶途径有关。Mx GTP酶通路是干扰素介导的抗病毒反应中的四种主要效应通路之一。
No.5
改善某些疾病
◆ 辅助癌症治疗
益生菌可用作癌症治疗的佐剂,因为它们具有调节肠道菌群和增强局部和系统免疫力的潜力。它们可以防止可移植或化学诱导的肿瘤的发生、进展和转移。在抑制肠癌和肠外癌方面都可以观察到益生菌的作用。
益生菌使用不同的途径来对抗癌症。益生菌抑制β葡萄糖醛酸酶活性,产生叶酸,最终调节DNA甲基化模式,保护基因组的完整性,产生短链脂肪酸,增强癌细胞的细胞分化和凋亡,排除可能导致癌症发展的慢性炎症病原体。
此外,益生菌通过竞争性排斥抑制病原体、减少致癌胆盐的产生、结合致癌物和诱变剂、下调细胞增殖的NF-kappa B依赖性基因产物和细胞存活率。益生菌还上调TNF相关的凋亡诱导配体。
益生菌的癌症抑制活性
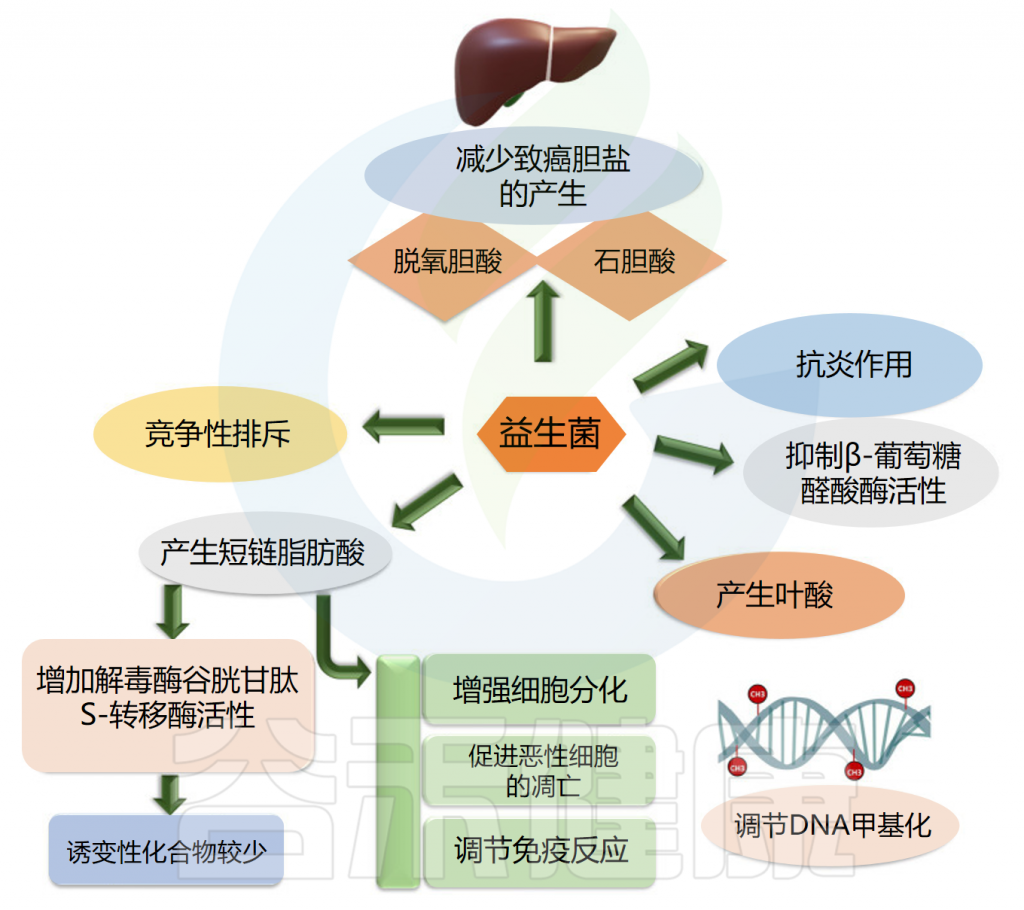
Latif A,et al.Front Microbiol.2023
◆ 减轻炎症性肠病、肠易激综合征
益生菌在调节导致肠道相关疾病的微生物失调方面起着至关重要的作用。肠易激综合征(IBS)、乳糜泻和其他肠道疾病与肠道有益细菌的缺乏有关。通过荟萃分析评估益生菌对肠道炎症的治疗效果,得出结论:益生菌治疗可防止溃疡性结肠炎复发,其疗效与常用药物美沙拉嗪相当。然而,它们对溃疡性结肠炎的影响是特定于菌株的。
这些益生菌菌株的作用机制可能不同,但一般限于三种主要机制:抑制肠道细胞上的病原菌,通过诱导屏障细胞产生粘液或抗菌肽来增强肠道细胞的物理屏障,或通过改变自然杀伤活性来改变粘膜免疫系统, 核因子 kappa-B(NFkB)途径,并诱导T细胞凋亡,导致肠道抗炎细胞因子(IL-10、TFG-B)的产生增加以及促炎细胞因子(TNF-a、IFN-y、IL-8)的产生减少。
研究表明,益生菌可能对治疗与肠易激综合征(IBS)相关的症状有效,从而改善胀气、腹胀、食欲、排便频率和营养。一项研究表明,益生菌治疗IBS的可能机制是通过上调粘蛋白2(MUC2)基因表达来诱导人肠道细胞分泌粘蛋白,并在相同的粘附部位竞争、排除和置换病原体,防止病原菌的入侵。嗜酸乳杆菌CL1285、干酪乳杆菌LBC80R和鼠李糖乳杆菌CLR2已被确定为缓解IBS症状的潜在治疗方法。
◆ 降胆固醇,减少心血管疾病
益生菌可以用作降低血液胆固醇水平的有效工具,它们可以直接或间接地降低体内的胆固醇水平。直接机制包括尿酸、乳糖、乳清酸和乳清蛋白等低胆固醇血症因子抑制胆固醇的从头合成,以及以三种方式减少肠道对膳食胆固醇的吸收——同化、结合和降解。
益生菌降低胆固醇的间接机制是通过胆盐水解酶生产使胆盐(共轭糖脱氧胆酸和牛磺脱氧胆酸)解离胆盐。解离的胆盐通过肠道的重吸收较少,从而抑制胆汁的肠肝循环和粪便中的排泄增加。
益生菌对一些疾病的影响和相关机制

DOI:10.1002/fbe2.12078.
No.6
改善心理健康
◆ 通过肠脑轴联系
益生菌通过肠道与大脑之间的联系,可能对情绪和心理健康产生积极影响。益生菌可以通过调节肠道菌群,影响肠道神经系统和内分泌系统,进而影响大脑的功能和情绪。例如,某些益生菌可以产生神经递质如γ- 氨基丁酸(GABA)等,这些神经递质可以通过肠-脑轴传递到大脑,调节情绪和行为。
◆ 缓解焦虑和抑郁
一些研究表明,益生菌可以缓解焦虑和抑郁症状。例如,在动物实验中,补充益生菌可以改善焦虑和抑郁样行为;在临床研究中,益生菌也被发现可以改善焦虑和抑郁患者的症状。
No.7
促进女性健康
◆ 维持阴道健康
益生菌可以帮助维持阴道内的微生物平衡,通过竞争作用,阻止有害菌在阴道黏膜表面的黏附、定植与生长,预防阴道感染和尿路感染。
◆ 提高HPV清除率
在人乳头瘤病毒(HPV)感染的背景下对益生菌进行了研究。一项前瞻性研究纳入了54例 HPV 感染者,这些女性被诊断为低级别鳞状上皮内病变,研究发现,每天饮用益生菌饮料后,使用益生菌的患者中有29%清除了HPV,而对照组这一比例为19%
与短期服用益生菌相比,长期添加阴道益生菌在减少细胞学异常和提高HPV清除率方面具有更强的能力。然而,无论治疗方法或持续时间如何,益生菌的功能支持和保护性阴道微生物群的最终恢复似乎都是成功对抗 HPV 感染的关键要素。
◆ 改善妊娠健康
一些研究表明,益生菌可能对孕妇和胎儿的健康有益。健康的阴道微生物群与妊娠结果密切相关。益生菌的使用可能有助于降低早产、妊娠高血压等并发症的风险。
No.8
改善皮肤健康
◆ 促进皮肤修复、预防感染
益生菌可以帮助维持皮肤表面的微生物平衡,抑制有害细菌的生长,同时有助于加速皮肤伤口的愈合过程,减少痤疮和其他皮肤感染的风险。
体外研究表明,某些菌株,如唾液乳杆菌LS03、乳球菌和唾液链球菌,会产生抑制痤疮杆菌生长的细菌素。此外,由于抗菌活性,青春芽孢杆菌SPM0308被证明可有效控制痤疮丙酸杆菌和金黄色葡萄球菌的生长。
◆ 改善皮肤屏障功能
益生菌有助于增强皮肤的屏障功能,防止水分流失和外部刺激物的侵入,保持皮肤的水分和健康;减少皮肤敏感性和炎症反应。
◆ 抗氧化和抗衰老
益生菌可能通过减少自由基对皮肤的损伤;促进胶原蛋白生成,改善皮肤弹性,帮助减缓皮肤衰老过程。
除此之外,益生菌可能还存在着许多潜在的健康益处,这些益处尚未被人们完全认知和发现,可能在不同的生理和病理状态下发挥着重要的作用,影响着我们的整体健康和疾病预防。深入研究益生菌的多种功能将有助于揭示它们在健康管理中的潜力。
!
益生菌补充越多越好吗?
既然益生菌有如此多的健康益处,是否所有人都可以补充益生菌,且补充越多越好呢?
对于这个问题而言,我们要明确的是,补充益生菌的目的是为了通过改善菌群,从而达到更健康的状态。
◆ 并非每个人都需要补充益生菌
并不是每个人都需要补充益生菌,也并不是每个人都适合补充益生菌,所以首先第一步是判断:
是否真的需要补充益生菌?
目前已有研究的,与菌群相关的疾病包括:
-消化系统(腹泻、腹胀、便秘等);
-神经系统(自闭症、精神障碍等);
-免疫系统(哮喘等);
-代谢系统(肥胖、糖尿病等);
-心血管疾病(高血压、中风等);
-癌症(胰腺癌、结肠癌等);
假如你本身非常健康,同时也一直遵循着健康的饮食和生活方式,那就不需要补充。此外如果在你身上出现的症状和菌群完全没有关联,补充益生菌可能起不到太大的效果。
◆ 益生菌也不是补充越多越好
那有些人会觉得,我出现了与菌群相关的症状,那我就大量补充益生菌,把有益菌的丰度变得非常高。
这种做法也是不正确的
益生菌会与宿主常驻菌群相互作用,有些益生菌可以与宿主菌群形成共生关系,促进彼此的生长和代谢;而有些则可能导致竞争或拮抗作用。
过量补充益生菌可能破坏原有的菌群结构,导致生态失调或菌群结构过于单一,从而引起不健康症状。此外,对于免疫功能低下的人群,过量或不当的益生菌补充可能引发感染或其他健康问题。
谷禾的检测中就曾遇到过量补充益生菌的案例,下面让我们一起来看下:
①双歧杆菌和乳杆菌过高,菌群多样性非常低
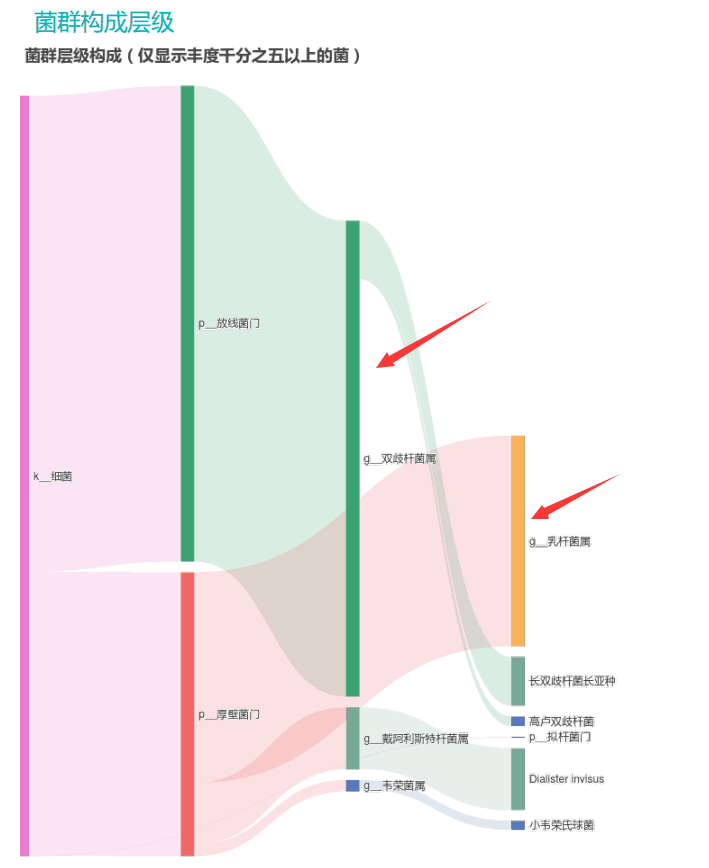
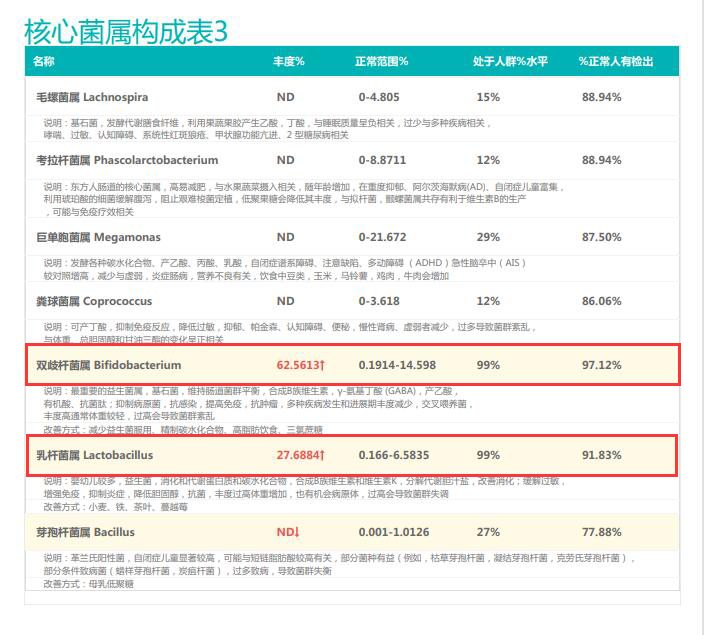
从菌群构成层级和核心菌属构成表中可以看到,该患者的双歧杆菌属和乳杆菌属严重超标。
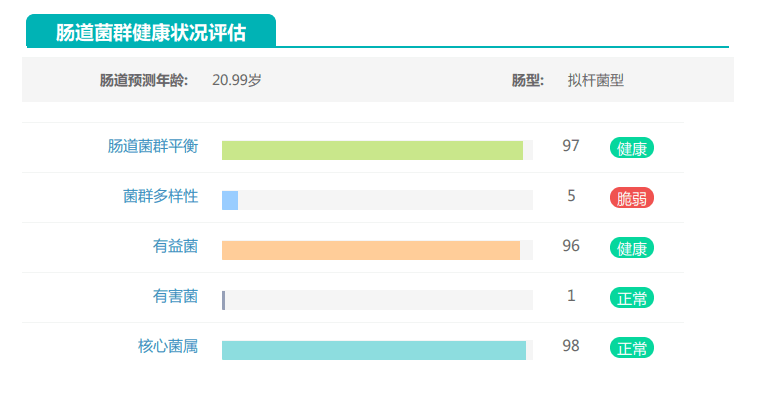
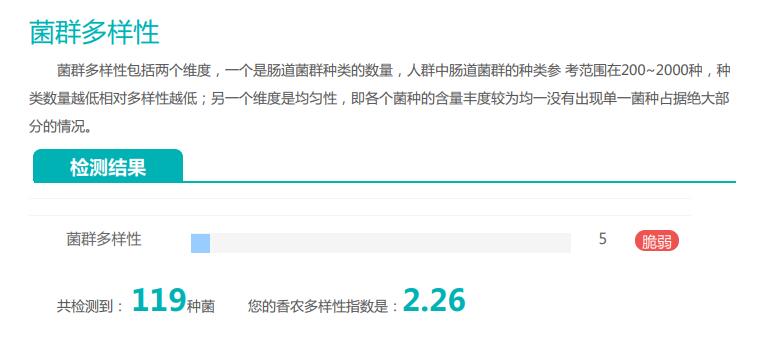
其的有益菌水平非常高,但是反观菌群多样性却很低,菌群数量明显低于正常人群。并且由于其菌群构成不平衡,导致肠道产气过多,而次级胆汁酸、短链脂肪酸、吲哚等需要由其他菌株产生的代谢物严重缺乏,最终导致了身体的不健康状态。
②双歧杆菌过高,核心菌属缺乏
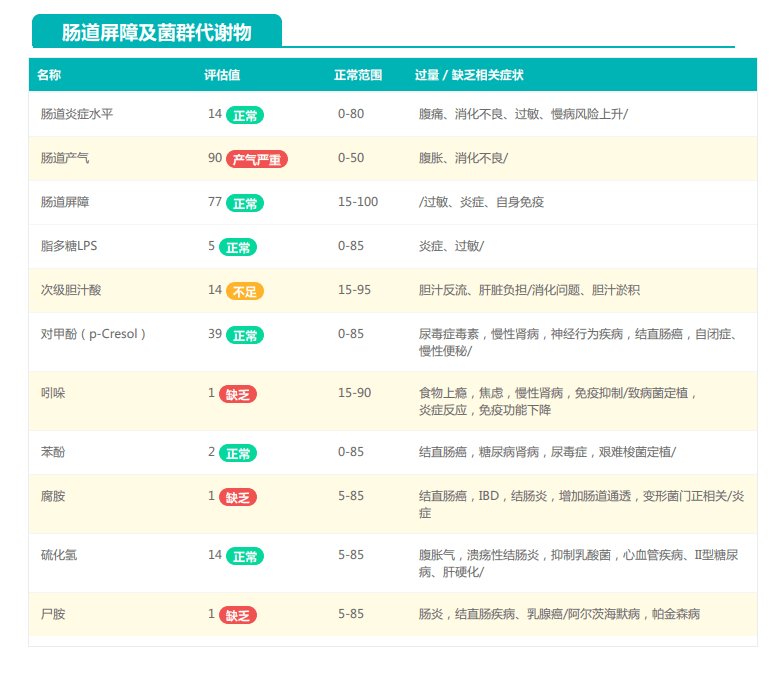
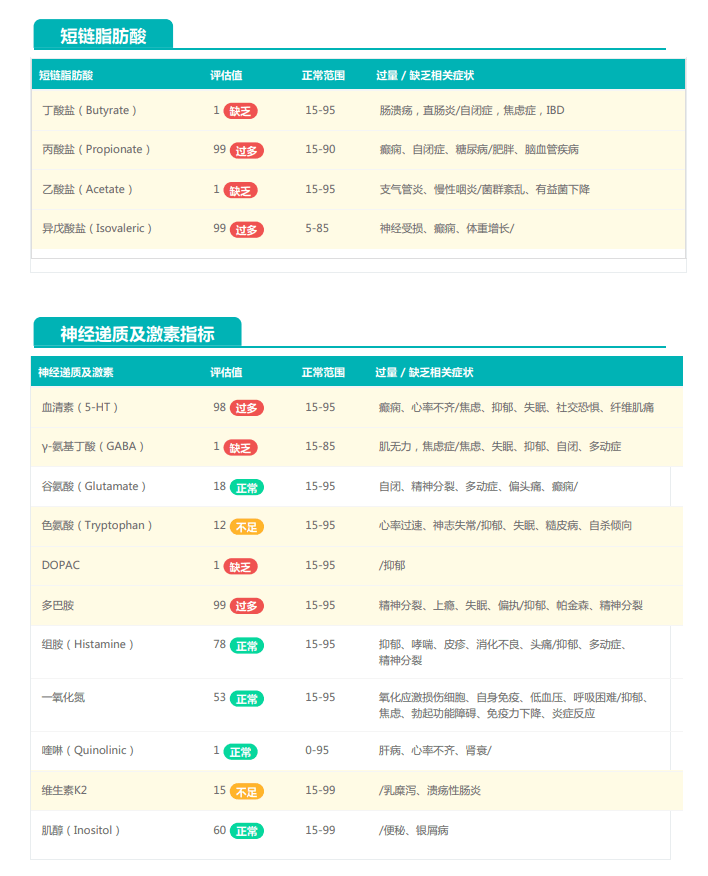
观察另一个案例报告发现,尽管双歧杆菌含量较高,但许多核心菌属缺乏,且菌群多样性较低。因此导致了肠道产气和炎症水平较高,一些菌群代谢产物如脂多糖过量,而短链脂肪酸则存在缺乏。
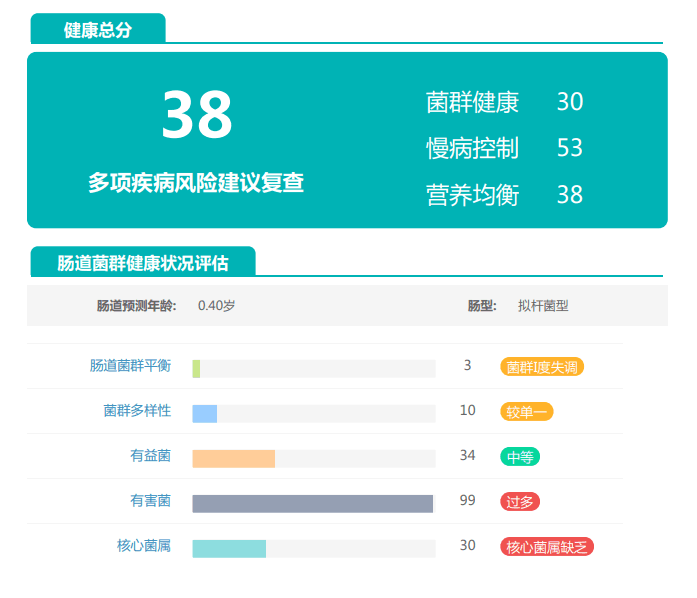
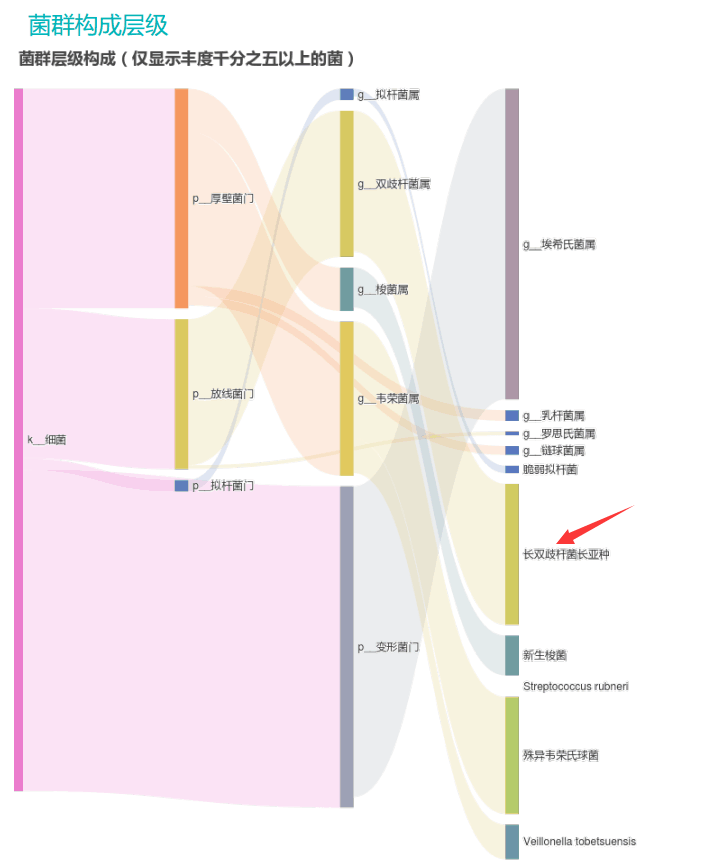
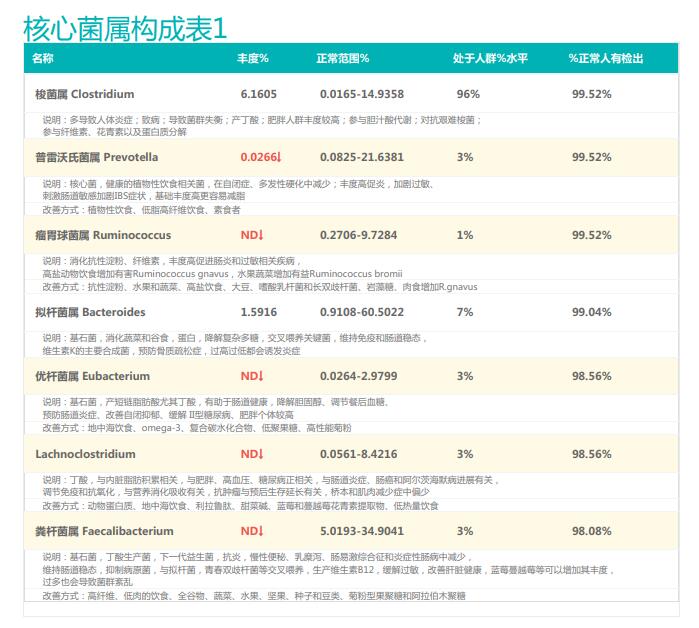
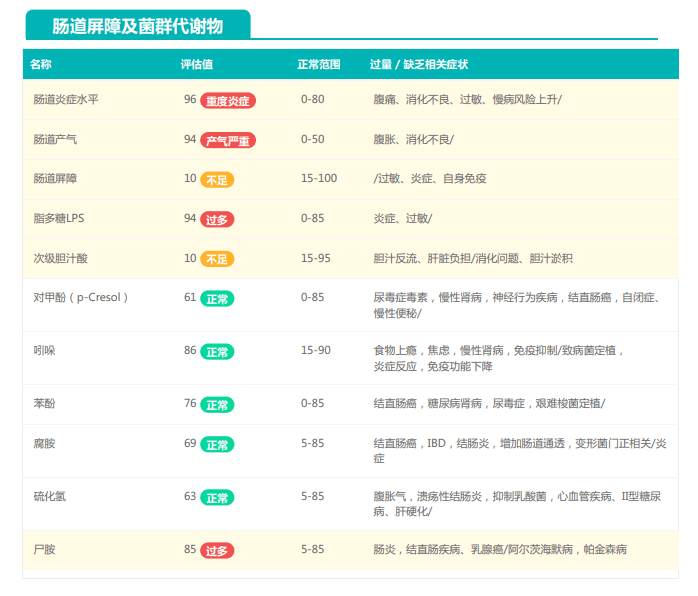

由此可见,单一有益菌的过高可能导致菌群多样性较差和菌群失衡,这并不健康。因此,在补充益生菌的同时整体菌群多样性和核心菌属水平同样不容忽视。
★ 肠道菌群检测有助于益生菌的辅助判别和干预
利用好肠道菌群检测这个工具,有助于益生菌干预的辅助判别:
辅助干预:可以进行肠道菌群检测查看体内菌群比例,如发现某些菌群过高,可选择相应的益生菌来抑制致病菌的大量增殖,有针对性地施用益生菌;
辅助判别:在服用益生菌前后均进行肠道菌群检测,通过菌群变化情况判断益生菌服用效果。
益生菌虽然被认为是有益的,但并不一定在所有情况下都能产生良好的效果。实际上,有许多因素会影响益生菌的功效,这些因素可以分为外部因素和内部因素。这一节我们主要讲影响益生菌功效的外部因素。
doi: 10.1016/j.copbio.2012.10.002.
益生菌在生产加工和储存过程中的存活率受多种因素影响,包括温度、pH值、氧气含量、水分、盐浓度、糖等营养资源和其他化合物(包括过氧化氢、细菌素、人工香料和色素)的存在。
这些因素可以显著改变益生菌在体外的生存和活性,影响其的生长速率和总细胞量,也会对益生菌在消费品和消化道中的存活产生下游影响。
此外,发酵条件、包装材料、食物基质、给药方式、干预持续时间、菌株特异性等参数也起着影响。
1
益生菌的生长条件
◆ 生长条件会影响效应分子的表达
益生菌的生长条件会影响宿主-益生菌和病原体-益生菌相互作用的效应分子的表达。例如,小鼠脾细胞对嗜酸乳杆菌L-92的反应产生的IL-12、IFN-γ、IL-4和IL-10的量因细菌是在培养基中生长还是在没有pH控制的情况下生长而不同。
◆ 生长条件会影响抵抗病原体的能力
生长条件也会影响益生菌细胞预防人类病原体感染的能力。这表现为在补充不饱和脂肪酸中生长后,约氏乳杆菌NCC533对沙门氏菌粘附和感染的抑制作用增强。
益生菌的免疫调节也是生长阶段依赖性的,这可以通过人外周血单核细胞对指数期和稳定期野生型和突变型植物乳杆菌WCFS1的IL-10和IL-12的差异表达来说明。
这些生长期效应得到了以下发现的支持:摄入指数期植物乳杆菌WCFS1激活了人十二指肠的细胞分裂和生长,而静止期和热杀伤细胞诱导了NF-κB免疫反应途径。
◆ 加工和保存影响益生菌的耐受水平
大量研究表明,加工和保存会显著影响益生菌的应激耐受水平,益生菌功能也会随培养加工步骤的不同而变化。
在益生菌制造和储存过程中以及胃肠道中更好的生长和存活能力,对酸、胆汁和胃肠道酶的保护,与肠上皮的粘附,抗菌特性和抗生素耐药性可以被认为是维持益生菌功效的重要因素。
2
益生菌的选择和特异性
◆ 多样化的益生菌一般效果更好
多菌株益生菌比单菌株益生菌在降低空腹血糖和胰岛素抵抗指数方面效果更好。益生菌产品中包含的菌株种类越多,其在体外条件下抑制病原菌的能力越强。多样化的菌株组合可以提供更好的抗菌效果。
◆ 不同的菌株效果各异
不同的益生菌菌株具有不同的功能特性。益生菌的功效是高度针对菌株的。同一物种的不同菌株对健康的影响不同。例如,嗜酸乳杆菌CL1285、干酪乳杆菌LBC80R和鼠李糖乳杆菌 CLR2,已显示出预防抗生素相关腹泻的功效,而其他菌株则没有显示出相同的益处。
◆ 活菌数量和施用速度
益生菌产品中的活菌数量是影响效果的重要因素。一般来说,活菌数量越高,可能发挥的作用越大。但这也不是绝对的,还需要考虑菌株的活性和生存能力。
产品在储存和使用过程中,活菌数量可能会逐渐减少。因此,选择具有较高初始活菌数量且能够在储存和消化过程中保持一定活性的产品更为重要。
◆ 疾病特异性
益生菌也是疾病特异性的。相同的益生菌菌株或菌株混合物可能对一种疾病有效,但对其他疾病类型无效。
益生菌使用的适应症多种多样,从预防疾病(例如阴道炎、旅行者腹泻、败血症、特应性皮炎)或预防疾病标准疗法的副作用(如幽门螺杆菌的治疗或化疗),到急性疾病的治疗(如艰难梭菌感染、急性儿童或成人腹泻、便秘)或慢性疾病的治疗(如炎症性肠病、肠易激综合征或肥胖)。
益生菌菌株的有效性可能因其用于治疗的疾病而异。例如,鼠李糖乳杆菌GG和布拉酵母菌CNCM I-745 在治疗特定胃肠道疾病方面显示出显著的疗效,而对其他疾病可能没有效果。
◆ 孢子益生菌具有更好的生存能力和稳定性
孢子益生菌指的是能使用蛋白质、矿物质和其他可用的化合物形成保护性内生孢子,使它们免受恶劣环境影响的一部分益生菌。
孢子益生菌通常属于芽孢杆菌属,以下是一些在临床环境中的常见孢子益生菌物种:
•印度芽孢杆菌(Bacillus indicus) HU36
•凝结芽孢杆菌(Bacillus coagulans) SC-208
•克劳氏芽孢杆菌(Bacillus clausii) SC-109
•枯草芽孢杆菌(Bacillus subtilis) HU58
•地衣样芽孢杆菌(Bacillus lichenformis) SL-307
•巨型芽孢杆菌(acillus megaterium) EM144
孢子益生菌相比于普通益生菌,具有更好的生存能力: 孢子益生菌能够通过胃酸和消化液而不会被破坏。其他益生菌,如乳酸菌和双歧杆菌则没有。并且孢子益生菌通常不需要冷藏,保质期更长。
临床试验和研究中报告了孢子益生菌的一些健康益处,包括:
•减少血液中的毒素
•降低胆固醇
•降低炎症
•改善免疫反应
•新陈代谢增加
•维生素合成
•抗氧化剂生产
3
益生菌依附的食物基质(载体)
益生菌依附的食物基质会显著影响其功效。不同的食物基质可以提供不同的营养成分和环境条件,从而影响益生菌的生长、存活和定植能力。
食品,特别是乳制品被认为是将益生菌输送到人体胃肠道的理想载体。目前,益生菌主要掺入乳制品中,如奶酪、酸奶、冰淇淋和其他乳制品甜点。尽管其他基质(例如果汁)的使用也越来越多。
◆ 食物基质会影响益生菌的粘附、细胞大小等
食物配方可能对益生菌产生直接影响,例如提供针对胃酸的特定营养物质的理化屏障。这些基质效应因细菌种类而异。
食物基质还会影响肠道递送部位的功能性状表达。尽管相关研究有限,但鼠李糖乳杆菌GG在酸奶中孵育后对Caco-2细胞的粘附性较在冰淇淋中增强,且其结合能力与产品储存时间相关。在食物输送基质中孵育可能还会导致其他生理差异。例如,与实验室培养基相比,干酪乳杆菌在牛奶中冷藏孵育后,细胞大小显著减少(约0.1μm),并诱导肠道中与功能相关的特定细胞表面和代谢蛋白的表达。
干酪乳杆菌BL23在不同培养基中的细胞形态

doi: 10.1016/j.copbio.2012.10.002.
(a)含有2%乳糖;(b)UHT牛奶。平均而言,在牛奶中培养的干酪乳杆菌BL23明显短于在MRS中培养的细胞
◆ 不同的食物基质益生菌活力水平存在差异
不同的酸奶在保质期内表现出不同的益生菌活力水平。观察到,在60天的保质期内,全套酸奶中的链球菌水平在6°C下下降了约1个对数周期。虽然它们在相同条件下在脱脂酸奶中仍然存活甚至繁殖。当全套酸奶与加热牛奶和糖的浓缩产品一起生产时,它们的存活率下降了1.5个对数周期。
与含有混合浆果或百香果的酸奶相比,普通酸奶在保质期内保持更高水平的嗜酸乳杆菌的能力显著。有趣的是,含有芒果或草莓的酸奶比普通酸奶含有更高水平的嗜酸乳杆菌,这表明了各种水果混合物的不同性质(如pH值)对酸奶中益生菌活力的影响。
不同的营养成分,如果汁中的维生素水平,也可能对生存能力产生影响。据报道,抗坏血酸强化可以提高酸奶中嗜酸乳杆菌的存活率,尽管这对双歧杆菌没有任何影响。抗坏血酸的氧清除作用是可能有助于提高益生菌存活率的原因之一。
◆ 蔬菜、谷物的微结构保护益生菌或促进其生长
尽管目前大多数益生菌食品主要以乳制品为基础,但由于许多人的乳糖不耐症和发酵乳制品中不利的胆固醇含量等问题,此外,对素食益生菌产品的需求不断增加。这导致了从各种食物中开发出新的益生菌产品,包括水果、蔬菜、豆类和谷物产品。
麦芽、小麦和大麦提取物对提高嗜酸乳杆菌、罗伊氏乳杆菌和植物乳杆菌的胆汁耐受性有积极影响。然而,麦芽培养基已经显示出比小麦或大麦培养基更好的支持嗜酸乳杆菌、发酵乳杆菌、罗伊氏乳杆菌和植物乳杆菌的生长。将植物乳杆菌(L.plantarum)固定在麦芽和大麦纤维中似乎对胃肠道耐受性起主要作用。
此外据报道,在储存期间以及体外和体内胃肠道条件下,副干酪乳杆菌、植物乳杆菌和一些其他益生菌在食用橄榄和朝鲜蓟中的存活率较高。这种高活力是由这些蔬菜的微结构引起的,粗糙可能会在酸性环境中保护益生菌,或存在益生元物质,并由于蔬菜中营养物质的释放而对生存产生积极影响。因此,不仅食品的化学成分,而且它们的物理结构对它们所具有的益生菌功效也很重要。
因此,可以通过调整和优化携带益生菌的食物产品的配方,以提高其疗效和功能。这种操纵不仅可以增强益生菌的存活率,还能改善其在肠道内的定植能力,从而更有效地发挥其健康益处。
◆ 微胶囊化或益生元封装提高了存活率
研究发现,用人工酶包裹的长双歧杆菌可以增加益生菌在肠道中的定植时间,增强其抗炎作用。另一项研究报告称,益生元封装的益生菌在小鼠结肠癌病变周围特异性富集,有效抑制结肠癌。
微胶囊化的乳双歧杆菌在胃液中表现出更高的存活率,其保质期内的存活率显著高于游离细胞。此外,微胶囊化还提高了冻干酸奶在4°C和21°C下储存6个月后的益生菌活力。这是因为微胶囊化通过在封装材料中保护细胞,减少了细胞损伤和损失。
4
干预持续时间

一项研究通过系统综述和荟萃分析的方法,评估了益生菌补充对2型糖尿病患者的血糖、血脂、血压和炎症控制的影响。研究发现干预持续时间的不同会影响益生菌补充的效果。
◆ 长期的干预可能具有更好的定植和改善效果
干预时间超过8周的益生菌补充在改善血糖控制、胰岛素抵抗、血脂水平、血压和炎症因子方面表现出更显著的效果。这表明较长的干预时间可能更有助于益生菌发挥其潜在的健康益处。
空腹血糖(FBS):干预时间超过8周的研究显示,FBS显著降低。
糖化血红蛋白(HbA1c):干预时间超过8周的研究在整体分析中显示出更显著的改善。
胰岛素抵抗:干预时间超过8周的研究显示,胰岛素抵抗指数(HOMA-IR)显著降低。
总胆固醇和甘油三酯:干预时间超过8周的研究显示,总胆固醇(TC)和甘油三酯(TG)显著降低。
血压:收缩压和舒张压都显著降低。
炎症因子:干预时间超过8周的研究显示,肿瘤坏死因子(TNF-α)显著降低。
上一节讨论了影响益生菌效果的环境因素,本节将重点介绍宿主因素。益生菌的效果受到多种宿主因素的影响,这些因素决定了益生菌在肠道内的生存、定植和功能。

DOI:10.1002/fbe2.12078.
个体的营养饮食习惯、肠道微生物组成、免疫系统状态、年龄、健康状况和药物使用等均可能显著影响益生菌的活性和功效。
1
宿主营养、饮食习惯
宿主的饮食习惯和营养成分可能对益生菌在体内获得生长和生存所需的营养能力产生重大影响。

Rytter H,et al.Gut Microbes.2023
◆ 不同饮食习惯下的益生菌活性和效果存在差异
对于单个菌株,无菌小鼠盲肠中植物乳杆菌(L.plantarum)WCFS1的整体转录组和定植水平在喂食标准食物或西式饮食(41%的卡路里来自脂肪)的小鼠之间有所不同,并且在活性水平和与宿主相互作用的代谢和细胞表面修饰途径方面存在差异。L. plantarum 299v 在人结肠和回肠中表达的适应与 L. plantarum WCFS1 在喂食西方饮食的小鼠中表达的性状最相似。
饮食也有助于植物乳杆菌WCFS1的持续存在和与免疫调节作用相关的细胞产物的差异表达。对饮食条件的反应能力可能会调节益生菌对人类病原体的保护作用。例如双歧杆菌菌株具有将糖发酵成醋酸盐的能力增强,醋酸盐是一种保护无菌小鼠免受大肠杆菌侵害的产品。
◆ 特殊饮食成分可以影响益生菌的免疫反应
饮食对益生菌性能的影响也可能与个别饮食成分有关。饮用水中的乳糖补充剂促进了嗜热链球菌LMD9在无菌大鼠体内的肠道定植,嗜热链球菌的乳酸产生与上皮细胞中单羧酸转运蛋白和细胞周期停滞蛋白的诱导有关。
罗伊氏乳杆菌从组氨酸中产生的组胺也被证明可以诱导上皮细胞对抑制促炎细胞因子 TNF 产生的反应。益生菌在消化道中将膳食成分转化为对免疫反应途径至关重要的生物活性形式。
2
宿主生理特征
益生菌临床试验中反应者与无反应者的一致发现表明,宿主的生理特征会影响益生菌的效果。年龄、遗传学、种族、性别差异和健康状况都可能单独或共同影响益生菌对健康的作用。
◆ 年龄<55岁的人群可能更利于益生菌定植
上述研究益生菌补充对2型糖尿病患者的影响,表明年龄≤55岁的人在血糖(FBS)和胰岛素抵抗(HOMA-IR)方面对益生菌补充剂的反应更强。
◆ 益生菌效果存在性别差异
一项研究调查了益生菌对肠道微生物群的性别依赖性影响,发现补充益生菌后,与男性相比,女性的促炎肠道微生物显著减少。此外,外周免疫细胞分析显示,益生菌降低了男性树突状细胞和CD14单核细胞的比例,但女性没有。这表明益生菌对肠道微生物群的调节存在性别特异性反应。
另一项研究表明,补充益生菌后,与男性运动员相比,女性运动员的厚壁菌门比例很高 。哥德堡大学进行的一项有趣的研究报告了补充植物乳杆菌后男性和女性患者沙门氏菌感染临床症状的差异。
◆ 体重指数影响益生菌效果
不同体重指数(BMI)人群的肠道环境存在差异,例如肠道pH值、胆汁酸浓度和肠道通透性等。肥胖者的肠道菌群多样性通常较低,且一些特定的细菌种类相对丰度发生改变。益生菌需要在适宜的肠道环境中生存和发挥功能,这些因素可能会影响益生菌的定植和生存。
然而有研究发现,当BMI≥30时,益生菌补充对改善血糖控制、胰岛素抵抗、血脂水平、血压和炎症因子的效果更显著,而当BMI<30时,效果则不明显。但这可能是由于基数较高,使得改善的变化更加明显。
◆ 地理区域或种族
来自东亚国家的受试者在血糖控制和胰岛素抵抗(HOMA-IR)方面的改善效果显著优于来自西方国家的受试者。
3
消化道的生理结构
胃肠道的成功定植是益生菌能够发挥足够的宿主相互作用以赋予健康益处的关键因素。口服后,益生菌经过口腔,通过胃,到达小肠和结肠。在这一过程中,消化系统的结构与蠕动及消化酶、氧气水平、pH变化、胆汁等都会影响益生菌的定植和效果。
影响益生菌在胃肠道运输过程中活力的因素
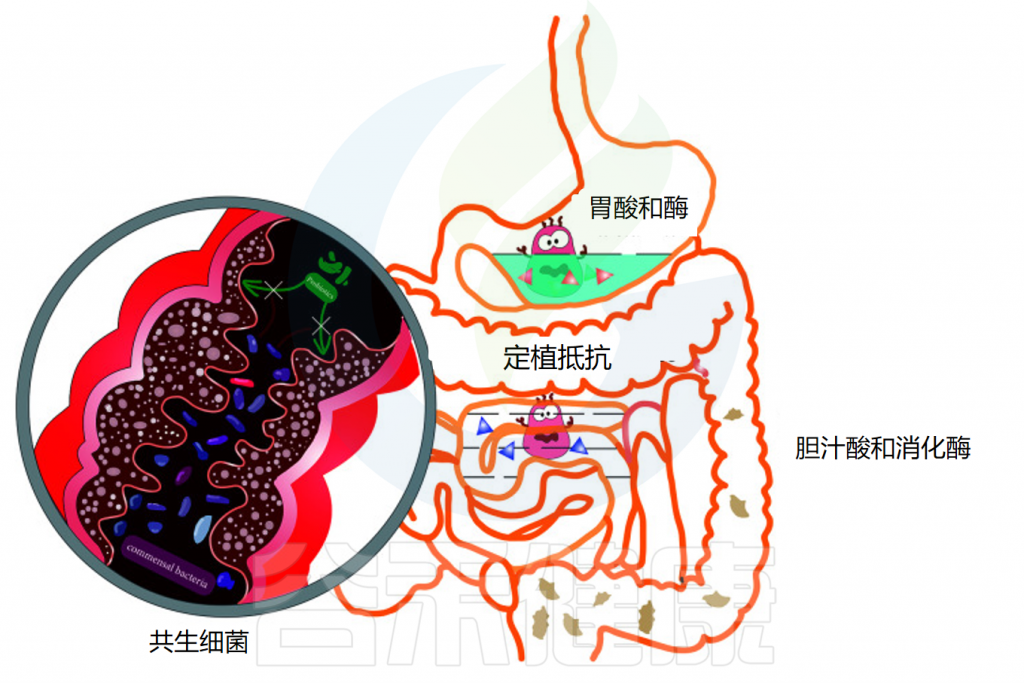
doi: 10.3389/fcimb.2021.609722.
◆ 唾液对益生菌的影响微乎其微
当摄入益生菌时,它们首先会接触到口腔中的唾液。对多种乳酸杆菌、片球菌和双歧杆菌菌株的体外研究表明,与对照组相比,当暴露于唾液时,细胞计数没有显著损失。虽然益生菌在口服后通过口腔的运输和它们与唾液的接触是短暂的,但唾液对益生菌存活率的影响似乎很小。
◆ 胃酸对大多数细菌都是极其致命的
通过食道后,益生菌到达胃部,在那里它们暴露在酸性胃液中。酸性环境对大多数细菌极为致命,尤其是对不耐酸的细菌,这会导致细菌细胞质pH值降低。通过胃的运输需要5分钟到2小时,长时间暴露在酸性环境中对益生菌来说是一个巨大的挑战。
此外,胃中存在的其他不良条件,包括离子强度、酶活性(胃蛋白酶)和机械搅动,已被证明对益生菌的生存能力有影响。例如,长双歧杆菌和短双歧杆菌的活细胞在一小时内在模拟胃液中变得检测不到。因此,在经过胃的时候可能有一部分的益生菌已经失活或失去作用。
◆ 小肠中的胆汁酸和消化酶影响益生菌生存
益生菌通过幽门后,会到达小肠,那里有丰富的胰液和胆汁。在肠液的中和作用下,小肠中的pH值约为 6.0-7.0,比胃液温和得多。然而,胆汁酸和消化酶(包括脂肪酶、蛋白酶和淀粉酶)也可以通过细胞膜破坏和DNA损伤来影响益生菌的活力。
体外研究表明,唾液乳杆菌Li01和戊糖片球菌Li05在模拟肠液中的活力降低。
◆ 增强在胃肠道中存活率的技术
为了增强益生菌对胃肠道中胃液和胆汁的耐受性,益生菌可以涂上保护壳,这种技术称为微胶囊化。近年来,在提高存活率和保证通过基于微胶囊的方法到达结肠的足够数量的活益生菌方面取得了重大进展。
◆ 结肠中的共生细菌可能产生定植抵抗
结肠具有最大的细菌密度,益生菌在这可能会遇到共生细菌的定植抗性。益生菌必须与宿主常驻微生物群竞争营养物质和粘附位点,才能在结肠粘膜定植和增殖。
并且由于定植抗性,大多数益生菌在口服给药后和停止食用后不久随粪便从结肠排出,因此无法检测到益生菌。产生定植抵抗的机制在下面的部分中详细说明。
拓展:益生菌的结构与定植
益生菌可以编码许多细胞表面因子,这些因子与粘附粘蛋白或肠上皮细胞有关。
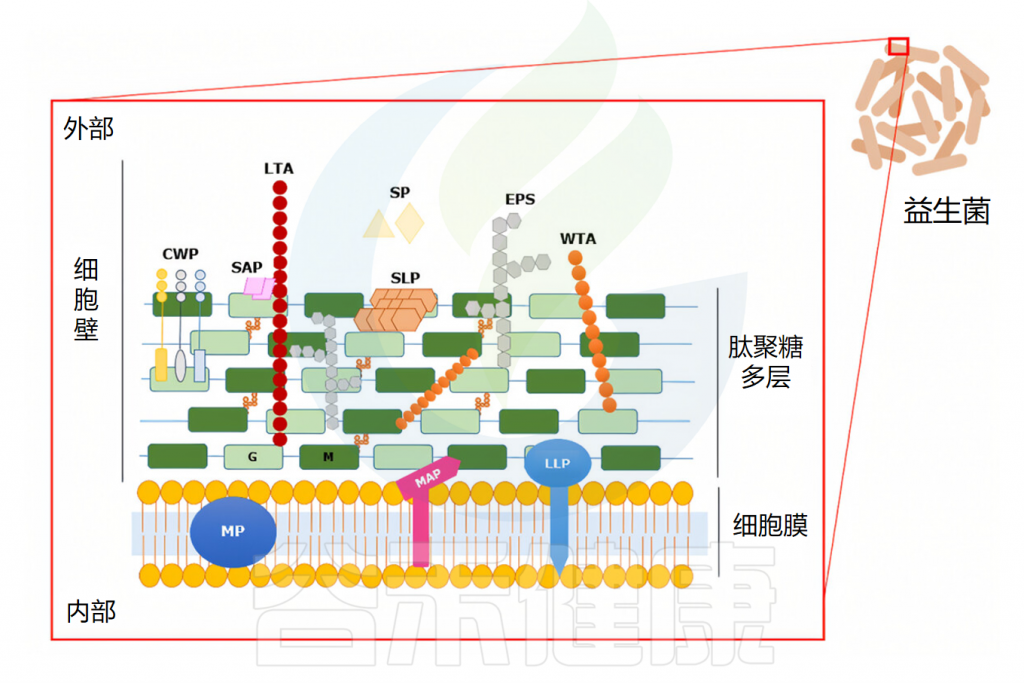
DOI:10.1002/fbe2.12078.
胞外多糖
胞外多糖可能促进细菌和肠道细胞之间的相互作用,从初始粘附机制到永久粘附机制。例如,长双歧杆菌NB667 含有与人肠道粘液的粘附直接相关的胞外多糖。益生菌产生的胞外多糖可能因物种而异,这些变化可能会影响相应细菌的粘附能力,因为它们可能需要不同的结合机制。
菌毛或鞭毛
菌毛或鞭毛是存在于特定革兰氏阳性菌和革兰氏阴性菌上的细胞表面的细长蛋白质突起。已经证明鼠李糖乳杆菌GG 中的菌毛在确保有效粘附人肠上皮细胞系方面起着至关重要的作用。
蛋白质成分
蛋白质成分已被证实在乳酸杆菌菌株的粘附促进因子中起关键作用。存在于乳酸杆菌CNCM-I-3698和法氏乳杆菌CNCM-I-3699表面的蛋白质成分对于它们与人肠道上皮细胞的粘附至关重要。
在乳酸杆菌的粘附过程中,表层蛋白和表面相关蛋白,包括粘液结合蛋白、胶原蛋白和纤连蛋白以及月光蛋白,通过与宿主受体相互作用而发挥关键作用,宿主受体在肠上皮定植中表现出不同的功能作用。
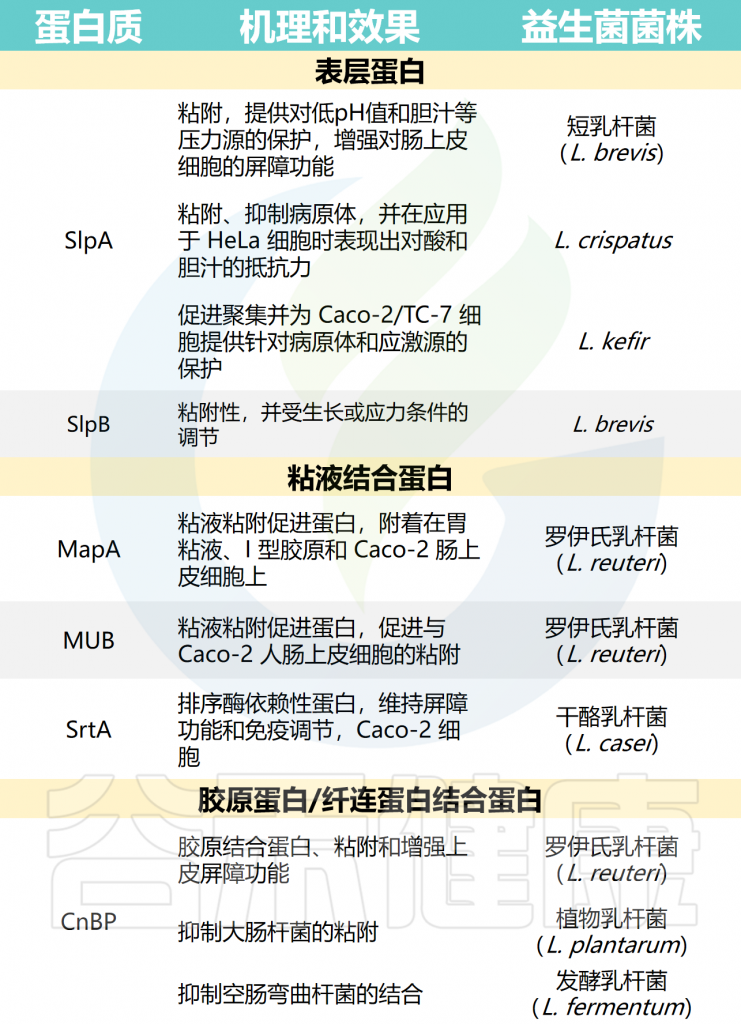

DOI:10.1002/fbe2.12078.
附着力
细菌粘附到粘膜的过程包括可逆和稳定的阶段。最初,益生菌通过非特异性物理接触与粘膜结合,建立可逆和弱的物理结合。随后,随着粘附素(通常是锚定在细胞表面的蛋白质)和互补受体之间的特异性相互作用,益生菌与粘液或肠上皮细胞(IEC)建立了稳定的结合,从而成功地定植了胃肠道。
4
肠道微生物群
常驻肠道微生物群对消化道益生菌功能的影响也不应被低估。肠道微生物群落的结构可能影响了对益生菌的反应,可能是通过改变益生菌在肠道中的生理状态和活性。
◆ 不同的菌群可能对益生菌“允许”定植或“抵抗”
同样是补充益生菌,有些人身上可以看到非常明显的效果,而有些人的效果则不明显,这是为什么呢?
一项有趣的研究,志愿者被分为两组,“允许型”和“抵抗型”。在允许组的人的肠道粘膜中益生菌菌株显著增加,而在抵抗组的人的肠道中没有检测到益生菌。
不同的肠道菌群对益生菌的定植反应复杂,有些适宜定植,而另一些则强烈抵抗。这些机制对益生菌的合理选择和干预效果至关重要。
◆ 定植抗性会严重影响补充益生菌的效果
人体自身正常的肠道微生物群形成稳定的细菌群落,抵抗外来细菌的入侵和病原体的扩张。这种现象被称为“定殖抵抗”。定植抗性机制可分为两大类:直接机制和间接机制。
直接定植抗性是指严格通过与肠道微生物群相关的因素限制外源性微生物定植,独立于与宿主的任何相互作用。间接定植抗性取决于宿主衍生因子,包括抗菌肽的产生、上皮屏障的维持以及通过与宿主相互作用调节胆汁酸浓度。
例如,细菌素是在革兰氏阳性菌或革兰氏阴性菌的核糖体中合成的蛋白质化合物,并且能够抑制密切相关的物种或利用相似营养物质或生态位的物种。
益生菌受到共生肠道微生物群施加的定植抗性的不利影响。一些研究表明,人类摄入的益生菌在局限于给药期间和之后不久在通过粪便排出。定植抵抗可能是限制益生菌长期影响的重要原因之一。
将由11种益生菌菌株组成的组合施用到成年、雄性无特异性病原体小鼠和无菌小鼠中。在指定的时间点分析粪便样本,然后在补充后第28天解剖胃肠道。发现在无菌小鼠中观察到的细菌活菌计数显着更高。对结果的一种解释可能是,与无菌小鼠相比,益生菌在常规小鼠中遇到更高程度的粘膜定植抵抗。
5
抗生素或药物的使用
我们知道,抗生素可以在杀死致病菌的同时,也会误伤体内的有益菌,破坏原有的菌群平衡状态。因此,其使用也可能会影响益生菌的效果。
◆ 抗生素和抗炎药会改变肠道环境,影响益生菌定植
抗生素的使用可能改变肠道环境,使得益生菌难以在肠道内定植。肠道黏膜屏障可能受损,影响益生菌的黏附和生存。
例如,抗生素可能导致肠道黏液层变薄,减少益生菌与肠道黏膜的接触机会。此外,抗生素还可能改变肠道pH值、胆汁酸浓度等,这些因素都可能影响益生菌的生长和定植。
例如非甾体类抗炎药(如布洛芬、阿司匹林等)可能引起胃肠道黏膜损伤,破坏肠道屏障功能。质子泵抑制剂(如奥美拉唑、兰索拉唑等)通过抑制胃酸分泌来治疗胃酸相关疾病。然而,胃酸减少可能会改变肠道菌群的组成,影响益生菌的生长和定植。
研究人员发现在服用抗生素4周后,接受11株益生菌治疗的人的肠道微生物群需要更长的时间才能恢复正常。
胃肠道成功定植是益生菌发挥功效并带来健康益处的关键。考虑到影响益生菌定植的众多外部和宿主因素,那么,究竟什么样的肠道更适合益生菌定植呢?
1
平衡和健康的菌群组成
菌群都具有高度个体特异性,也就是人和人之间的菌群相差较大。益生菌更有可能定植于具有平衡和健康微生物群的肠道。特定有益菌的存在和肠道环境的整体健康状况在益生菌的成功定植中起着至关重要的作用。
就婴儿而言,影响初始菌群定植的因素包括:胎龄(足月or早产)、分娩方式(自然分娩or剖腹产)、喂养方式(母乳or配方奶)、药物使用(抗菌药物)、生长环境(城市or农村)等。
就成年人而言,年龄、饮食、生活方式、疾病状况、药物使用、环境等多因素都会影响肠道菌群多样性,这在前已经详细阐述。这些所有叠加后会形成一个具有高度特异性的个体菌群,构成的整体菌群环境会影响到其他新的菌群的定植。
根据外来菌群和常驻菌群的反应结果进行分类。有四种可能:
“抵抗”(外来益生菌消失,所有常驻物种保持)
“增强”(外来益生菌维持,所有常驻物种保持)
“破坏”(外来益生菌消失,一些常驻物种也消失)
“位移”(外来益生菌维持,一些常驻物种消失)
当常驻菌群创造的环境有利于外来菌群,施用益生菌就会更成功。常驻菌群本身的结构特征也比较重要。益生菌带来的健康益处可能不仅是由单独补充的益生菌菌株引起的,而是与常驻肠道微生物群相互作用的结果。
2
健康的肠道
益生菌更有可能在粘膜完整且炎症水平低的肠道中定植。益生菌有助于维持粘膜完整性和调节免疫反应,这也可以进一步支持它们的定植。
◆ 正常的肠道pH值
不同的益生菌对pH值有不同的适应范围,但一般来说,偏酸性的肠道环境(pH值约为5.5-7.0)更有利于益生菌的生长和定植。
例如,乳酸菌等益生菌在酸性环境下活性较高,而过高或过低的pH值会影响益生菌的存活。
◆ 完整的肠道黏膜屏障
健康的肠道黏膜可以为益生菌提供附着位点,同时阻挡有害菌和毒素的入侵。如果肠道黏膜受损,益生菌的定植可能会受到影响。例如,炎症性肠病患者的肠道黏膜屏障功能受损,益生菌的定植难度可能会增加。
◆ 正常的肠道蠕动
适度的肠道蠕动有助于益生菌在肠道内的分布和定植。过慢的肠道蠕动可能导致益生菌在局部堆积,而过快的肠道蠕动则可能使益生菌来不及定植就被排出体外。
3
适宜的饮食和生活方式
◆ 富含膳食纤维等益生元的饮食
膳食纤维可以被肠道中的有益菌发酵,产生短链脂肪酸等物质,为益生菌的生长提供营养支持。例如,摄入足够的蔬菜、水果、全谷物等富含膳食纤维的食物,可以促进益生菌的定植。
益生元是一种可溶于水的可溶性纤维,可以作为益生菌的“食物”。
益生元可以通过小肠到达结肠,然后有益细菌会把它消化或发酵,形成乙酸盐、丙酸盐和丁酸盐等代谢物。最广泛认可的益生元包括低聚果糖 (FOS)、菊粉和低聚半乳糖(GOS)等。
◆ 规律的生活习惯
良好的睡眠、适度的运动和减少压力等生活方式因素有助于维持肠道的正常功能,从而为益生菌的定植创造有利条件。例如,长期熬夜、过度劳累和精神压力过大可能会影响肠道菌群的平衡,降低益生菌的定植能力。
4
根据症状选择适合自身的益生菌
益生菌每个属内都有很多种和菌株,益生菌的作用因这些种和菌株而不同。哪怕同属于乳酸杆菌,菌株不同效果也不同,比如:嗜酸乳杆菌有助于血压、胆固醇、过敏和消化;鼠李糖乳杆菌可以帮助降低血糖、免疫功能和胆固醇;瑞士乳杆菌可以降低血压、改善睡眠质量和骨骼健康。
这里提供一些常见的益生菌及目前已知的功能作为参考。


<来源:谷禾健康数据库>
不同益生菌菌株在不同疾病中的疗效存在显著差异,最终,在充分考虑益生菌菌株的特异性以及与特定疾病相关的特异性因素的情况下,挑选出一个最适合的益生菌进行补充,以便有效改善健康状况和促进身体的整体功能。
不能有效定植,是否意味着益生菌无效?
有时候,益生菌并不是完全依靠在肠道的定植来产生影响。就算不能定植,它也有其他很多种方式来发挥优势。包括以下几种方式:
(1)通过产生抗菌物质和与病原体竞争结合上皮细胞来阻断致病细菌的作用;
(2)通过增加屏障功能、粘液生成、存活和细胞保护反应来促进肠上皮细胞的稳态;
(3)通过增加先天免疫,如IgA和防御素的产生,上调抗炎细胞因子的产生,抑制促炎细胞因子的产生,确定必要和过度防御免疫之间的平衡;
(4)通过产生神经递质和迷走神经调节肠脑轴。
根据市场分析,益生菌产业呈现高态势增长,这背后离不开消费者需求的多元化发展以及企业的积极布局。一方面,人们对健康生活方式的追求,推动了益生菌产品从单一功能向个性化、多样化方向发展。针对不同人群和特定健康需求,企业纷纷推出定制化的益生菌组合,全方位满足消费者的健康诉求。另一方面,国内外研究机构对益生菌的探索不断深入,为企业的产品创新提供了扎实的科学基础。
目前谷禾与众多益生菌品牌以及科研院校合作,通过益生菌与其他健康元素(如益生元,维生素、矿物质、膳食纤维等)或干预手段(饮食生活方式,粪菌移植)的联合使用,有望产生”1+1>2″的协同效应,为消费者提供更加全面、更加个性化的健康解决方案。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Lau L Y J , Quek S Y .Probiotics: Health benefits, food application, and colonization in the human gastrointestinal tract[J].Food Bioengineering, 2024, 3(1).DOI:10.1002/fbe2.12078.
Latif A, Shehzad A, Niazi S, Zahid A, Ashraf W, Iqbal MW, Rehman A, Riaz T, Aadil RM, Khan IM, Özogul F, Rocha JM, Esatbeyoglu T, Korma SA. Probiotics: mechanism of action, health benefits and their application in food industries. Front Microbiol. 2023 Aug 17;14:1216674.
Maftei NM, Raileanu CR, Balta AA, Ambrose L, Boev M, Marin DB, Lisa EL. The Potential Impact of Probiotics on Human Health: An Update on Their Health-Promoting Properties. Microorganisms. 2024 Jan 23;12(2):234.
Rytter H, Combet E, Chassaing B. Probiotic: is diet part of the efficacy equation? Gut Microbes. 2023 Jan-Dec;15(1):2222438.
Marco ML, Tachon S. Environmental factors influencing the efficacy of probiotic bacteria. Curr Opin Biotechnol. 2013 Apr;24(2):207-13.
R.D.C.S. Ranadheera, S.K. Baines, M.C. Adams,
Importance of food in probiotic efficacy,Food Research International,Volume 43, Issue 1,
2010,Pages 1-7,ISSN 0963-9969,https://doi.org/10.1016/j.foodres.2009.09.009.
McFarland LV, Evans CT, Goldstein EJC. Strain-Specificity and Disease-Specificity of Probiotic Efficacy: A Systematic Review and Meta-Analysis. Front Med (Lausanne). 2018 May 7;5:124.
de Melo Pereira GV, de Oliveira Coelho B, Magalhães Júnior AI, Thomaz-Soccol V, Soccol CR. How to select a probiotic? A review and update of methods and criteria. Biotechnol Adv. 2018 Dec;36(8):2060-2076.
Ferreiro A, Dantas G, Ciorba MA. Insights into How Probiotics Colonize the Healthy Human Gut. Gastroenterology. 2019 Feb;156(3):820-822.
Han S, Lu Y, Xie J, Fei Y, Zheng G, Wang Z, Liu J, Lv L, Ling Z, Berglund B, Yao M, Li L. Probiotic Gastrointestinal Transit and Colonization After Oral Administration: A Long Journey. Front Cell Infect Microbiol. 2021 Mar 10;11:609722.
Teng Ma, Xin Shen, Xuan Shi, Hafiz Arbab Sakandar, Keyu Quan, Yalin Li, Hao Jin, Lai-Yu Kwok, Heping Zhang, Zhihong Sun,Targeting gut microbiota and metabolism as the major probiotic mechanism – An evidence-based review,Trends in Food Science & Technology,Volume 138,2023,Pages 178-198,ISSN 0924-2244,https://doi.org/10.1016/j.tifs.2023.06.013.
Zmora N, Zilberman-Schapira G, Suez J, Mor U, Dori-Bachash M, Bashiardes S, Kotler E, Zur M, Regev-Lehavi D, Brik RB, Federici S, Cohen Y, Linevsky R, Rothschild D, Moor AE, Ben-Moshe S, Harmelin A, Itzkovitz S, Maharshak N, Shibolet O, Shapiro H, Pevsner-Fischer M, Sharon I, Halpern Z, Segal E, Elinav E. Personalized Gut Mucosal Colonization Resistance to Empiric Probiotics Is Associated with Unique Host and Microbiome Features. Cell. 2018 Sep 6;174(6):1388-1405.e21.
Liang T, Xie X, Wu L, Li L, Yang L, Gao H, Deng Z, Zhang X, Chen X, Zhang J, Ding Y, Wu Q. Comparative analysis of the efficacies of probiotic supplementation and glucose-lowering drugs for the treatment of type 2 diabetes: A systematic review and meta-analysis. Front Nutr. 2022 Jul 18;9:825897.
Chandrasekaran P, Weiskirchen S, Weiskirchen R. Effects of Probiotics on Gut Microbiota: An Overview. Int J Mol Sci. 2024 May 30;25(11):6022.
Kothari D, Patel S, Kim SK. Probiotic supplements might not be universally-effective and safe: A review. Biomed Pharmacother. 2019 Mar;111:537-547
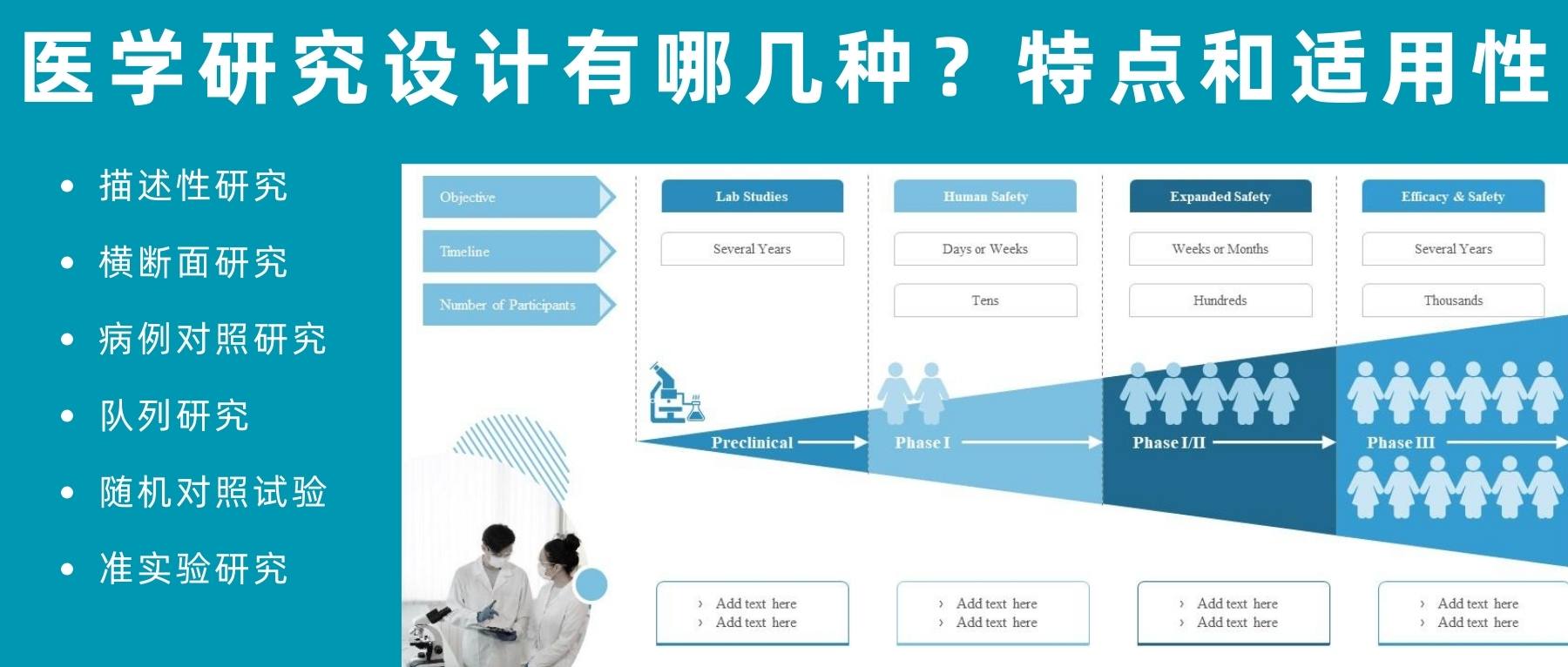
谷禾健康
在医学研究中,研究者如要想要弄清楚一个核心问题:某些因素(比如生活习惯、环境污染或药物治疗等)是否会影响人们的健康状况,通常要采用两种研究方法:实验研究和观察研究。
实验研究可以看作是一场精心设计的”科学实验”。研究人员会将参与者分成不同的组别,比如一组使用新药,另一组使用安慰剂(空白对照),通过严格控制各种条件,来准确判断新药的效果。这种方法的优点是可以直接证明“因果关系”,比如某种新药是否真的能治愈特定疾病。
然而,并非所有研究都适合用实验方法。比如,我们想研究吸烟对健康的影响,显然不能要求一组人去吸烟来做实验。这时候,观察研究就派上用场了,顾名思义,观察研究就是科学家们通过观察、记录和分析自然发生的现象来得出结论。
根据观察时间的不同,可以是:

观察性和实验性研究设计具体可分为如下:
观察性研究设计(像一个细心的观察者)
实验/干预性研究设计(像一个主动的实验者)
本文我们详细分享下每种研究方法的特点和适用性,并探讨了它们在不同情境下的应用和局限性。
——研究有害 · 不干预
它主要用于研究已知有害的原因,暴露和影响之间的关联。比如说,研究吸烟者的肺癌模式,研究人员无法进行干预并要求一组吸烟者停止吸烟,另一组未接触吸烟者开始吸烟。
观察性研究不影响人类受试者的暴露选择,并评价暴露或未暴露于感兴趣因素的受试者的结局。
然而,观察性研究的局限性之一是研究组中可能发生的特征差异。不同职业的人群可能会接触到不同的职业危害,同样,他们可能会在生活方式,健康状况等方面存在差异。由于这些不可测量的因素,确定正在研究的特定暴露的影响更具挑战性。

1
描述性研究
在描述性研究中,描述了健康问题的特征及其在特定时间在人群中的发生情况。由于同时记录暴露和结果,但没有进行随访跟踪,因此研究者无法确定因果关系。
然而,确保从所获得的结果得出的结论是有效的。在流行病学,公共卫生和社会科学中,这些研究通常用于提出假设。
根据研究对象的不同,这些研究可以分为个体层面的研究(比如流行病学调查和案例研究)和群体层面的研究(生态学研究)。
○ 特点:最基础的研究方法,像绘制“健康地图”
○ 目的:描述疾病在人群中的分布特征
○ 关注要素:时间、地点、人群特征
○ 实例:统计某个城市不同年龄段人群的糖尿病患病率
○ 优点:简单直观,成本较低
○ 局限:无法确定因果关系
2
生态学研究
在公共卫生研究中,如果研究对象是一个群体,而且只有群体的数据,则使用生态研究。在这种情况下,暴露和健康结果在所研究的群体中应该是清晰的,从而可以观察到暴露和疾病率之间的相关性。
它也用于研究暴露对疾病状况的影响需要在人口层面进行大规模比较的情况。生态谬误指的是一种混淆,当在群体水平上确定的关系被假设为对个人是正确的,就会发生这种混淆。简单来说,就是把群体的统计结果误认为是个体的实际情况。
在进行地理比较、研究社会阶层、移民群体和有关疾病的时间趋势时,通常会观察到生态研究设计的应用。
○ 特点:研究整体而非个人,像是”鸟瞰”健康问题
○ 目的:寻找群体层面的关联
○ 研究对象:不同地区、不同时期的群体数据
○ 实例:比较不同国家的饮食习惯与心脏病发病率的关系
○ 优点:可以发现大尺度的关联
○ 局限:可能出现”生态学谬误”(群体现象不一定适用于个人)
3
横断面研究
由于其相对简单的方法,这是最常用的研究设计。本研究设计的基本基础是研究和调查总人群的一部分,考虑到人群中的特征相似。
作为一种观察性研究,它详细描述了单一时间点(横断面)的暴露和健康结果。
在本研究中,暴露量和结局状态在一个时间点确定,因此未确立因果关系,被视为一种局限性。
横断面研究最流行的例子是同时收集多个特征的数据以探索相关性的调查,并通过合理的假设进行评估。它有助于描述结果在人群中的流行程度。这些研究被广泛用于遗传流行病学。
○ 特点:某一时间点的”快照”研究
○ 目的:了解某一时刻健康状况和相关因素
○ 研究方法:同时收集暴露因素和健康结果的信息
○ 实例:调查某高校学生的睡眠质量与学习成绩的关系
○ 优点:效率高,成本相对较低
○ 局限:难以确定因果时序
4
病例对照研究
这是一个对比研究,比较患病人群(病例组)和未患病人群(对照组)。为了通过回顾性方法研究和调查暴露情况并进行随访,横断面研究被用来研究具有较长潜伏期的疾病。
在回顾评估时,病例组有时可能会夸大其暴露程度,相比对照组而言,这被称为回忆偏倚。这也是该研究设计的一个局限性。
此外,识别和选择合适的对照组很重要,因为它们可能会因选择偏倚而影响研究结果。由于研究是回顾性的,病例对照研究设计广泛用于评估患病率而非发病率。
○ 特点:从结果往回追溯原因
○ 设计:将患病组(病例组)与未患病组(对照组)进行比较
○ 研究方向:回溯性研究过去的暴露情况
○ 实例:比较肺癌患者和健康人群的吸烟史
○ 优点:适合研究罕见疾病,成本较低
○ 局限:可能存在回忆偏倚
简单理解,假如做两种不同的调查:
-1 病例对照研究像“倒推式调查”
比如先找到100个胃病患者和100个没得胃病的人,然后回过头去问他们以前的饮食习惯,这样算出来的是”患病率”(有多少人得病)。
-2 队列研究像“跟踪式调查”
比如选择1000个健康人分两组:经常吃辣的和不吃辣的,然后跟踪观察5年,看谁得胃病,这样算出来的是”发病率”(新发生了多少病例)。
5
队列研究
队列或纵向研究设计是一种观察性流行病学研究,监测接触和未接触人群中疾病随时间的发展,参与者根据暴露及暴露水平进行分类。
与评估疾病患病率的病例对照研究不同,这种研究直接计算疾病的发病率。由于同时记录多个结局,队列研究中回忆偏倚的可能性很低,但选择偏倚的可能性很高。(关于回忆偏倚和选择偏倚在本章节后面详细介绍)
但是使用这种研究设计研究罕见疾病可能耗时且昂贵,这被认为是缺点之一。相关性的一种测量方法,即相对风险仅在队列研究中提供,因为它计算了暴露组和未暴露组的风险差异。
队列研究涉及对两个或两个以上的群体进行跟踪,从接触到结果,反之亦然。基于跟踪的时间点,队列研究可以分为前瞻性研究和回顾性研究。
5-1 前瞻性队列研究
在一项前瞻性队列研究中,没有疾病的人群根据他们是否有特定的风险因素进行分类,然后由研究人员进行一段时间的随访,看看是否会发展出研究中关注的疾病或健康结果。
○ 特点:从现在追踪到未来
○ 研究流程:选择健康人群,记录暴露因素,随访观察健康结果
○ 实例:追踪观察运动习惯对心血管疾病的影响
○ 优点:因果关系证据最强
○ 局限:耗时长,成本高
5-2 回顾性队列研究
在回顾性队列研究中,根据受试者暴露于特定风险因素的情况对受试者进行分类。与前瞻性研究不同,暴露和结局在研究期间已经发生。

○ 特点:利用历史资料进行研究
○ 研究流程:收集历史数据,分析暴露与结果关系
○ 实例:分析医院过去十年的病历资料
○ 优点:节省时间和资源
○ 局限:数据质量可能不够完整
▼ 回忆偏倚(Recall Bias)
简单来说:人们在回忆过去事情时可能出现的记忆偏差。
生活中的例子:
比如问你:“上个月吃了几次快餐?”
结果:病人可能报告得更准确,而健康人的记忆可能不够准确。
医学研究中的情况:
这种差异会影响研究结果的准确性。

▼ 选择偏倚(Selection Bias)
简单来说:研究对象的选择不具有代表性,导致研究结果产生偏差。
生活中的例子:
假设要调查”年轻人的运动习惯“,你如果只在健身房门口发问卷,结果当然显示大家都经常运动。这就是典型的选择偏倚,因为你只选择了去健身房的人。
医学研究中的情况:
长期研究中,可能会有人中途退出,留下来的往往是:更关心健康的人、有时间参与研究的人、生活较稳定的人,这样的样本就不能代表整体人群。

为什么队列研究中,回忆偏倚低,选择偏倚高?
—回忆偏倚低:
队列研究通常是前瞻性的,研究者可以在结果发生之前收集信息,是实时记录,不需要回忆,而且数据通常是通过标准化的问卷、访谈或医疗记录直接收集的,而不是依赖于参与者的回忆。
—选择偏倚高:
因为要长期跟踪,有些人可能中途退出(搬家、失联等),能坚持参与的人可能特点相似,也就是说愿意参与研究的人群可能在某些特征上与不愿意参与的人群不同,还有在招募阶段,那些拒绝参与研究的人可能与参与者在某些关键特征上不同,这都可能导致研究出现选择偏倚。
如何减少回忆偏倚?
如何减少选择偏倚?
——随机 · 减少偏见
在进行干预性研究时,研究者会采用随机化的方法来安排不同的实验条件给参与者。这样做的目的是为了通过随机分配,最大程度地减少主观偏见,并确保所比较的组在研究开始时相似。这样的设计有助于提升研究结果的有效性,因为它减少了组间差异可能由非干预因素引起的可能性。
随机化是实验设计中的基本原则,对于确保研究结论的准确性至关重要。
1
随机对照试验
随机临床试验,也称为随机对照试验(RCT),被认为是流行病学研究设计中的基准。这种研究设计的原理是将受试者随机分配到已定义的人群组别中。
研究者将受试者随机分配到对照组。由于随机化可以防止混杂因素并减少选择偏倚,因此相比观察性流行病学研究具有优势。
由于实验组和对照组相似,实验组接受暴露和治疗,而对照组根据研究目的不接受任何治疗或接受无效治疗。这也意味着干预措施是组间唯一的区别,从而可以将结果效应归因于干预措施的差异。
尽管在评估因果关系的有效性和可信度方面被认为是研究设计的黄金标准,但由于伦理原因、样本量小以及随机化受试者和地点的困难,许多研究者不倾向于采用这种方法。
RCT的核心特征
随机分配:这是RCT最重要的特征,确保研究对象被随机分到不同组别。
对照设计:包括实验组和对照组的对比。
干预措施:实验组接受特定干预,对照组可能不接受干预或接受安慰剂。
RCT的优势
减少偏倚:通过随机化减少选择偏倚
控制混杂因素:随机分配可以平衡已知和未知的混杂因素
因果推断:能够较好地评估干预措施与结果之间的因果关系
RCT的局限性
伦理考虑:某些研究可能涉及伦理问题,无法进行随机分配
样本量限制:往往需要较大样本量,但实际操作中可能难以实现
实施困难:在某些情况下难以进行随机化或控制研究条件
外推性问题:研究结果可能难以推广到更广泛的人群
RCT的应用场景
研究设计要点:
随机对照试验(RCT)的质量控制措施
这种研究设计虽然被认为是医学研究的”黄金标准”,但在实际应用中需要权衡其可行性、伦理性和资源投入等多个方面。研究者需要根据具体研究目的和条件,选择最适合的研究设计方法。
2
准实验研究
在医学信息学文献中,准实验研究也被称为非随机或干预前后研究,介于个体随机临床试验(变量受控)和观察性研究(变量无控制)之间。
这种研究设计用于回答研究问题、检验假设,并调查研究中干预措施与结果之间的因果关系。它是一种在没有随机化的情况下评估干预措施的实验研究设计。
与随机对照试验不同,准实验性研究旨在提高有效性并产生显著的结论,同时认识到实践的局限性和伦理问题。
准实验研究的两种主要类型是有对照组的准实验设计和无对照组的准实验设计,其中指标在干预前后都被观察。
准实验研究的定位
主要特征
研究目的
两种主要类型
a) 有对照组的准实验设计:
b) 无对照组的准实验设计:
优势
局限性
适用场景
质量控制要点
研究设计注意事项
准实验研究在实际研究中具有重要价值,特别是在无法进行RCT的情况下。研究者需要充分认识其优势和局限性,合理设计研究方案,确保研究质量和结果的可靠性。同时,在结果解释时也要注意其证据级别的限制,避免过度推论。
➦ 研究中的结果解释与影响因素控制
在流行病学研究中,调查得出的结果反映了暴露与结果发展之间的真实关联。然而,重要的是要考虑到这些发现也可能是由于随机误差、偏倚或混杂而可能出现的不同解释的结果。这可能会导致研究人员得出错误的结果和结论,例如存在统计关联,而它不存在,反之亦然。值得注意的是,这些偶然性、偏倚和混杂效应在观察性研究设计中普遍存在。因此,需要在设计和分析阶段考虑这些因素,从而减少其在流行病学研究中的影响。
➦ 偏倚对研究有效性的影响
由于偏倚而导致的测量误差可能发生在流行病学调查的多个时间点,并影响结果的内部和外部有效性。研究偏倚、混杂变量和变量的交互作用也会影响研究中关联和因果关系程度的建立和确定。在这种情况下,应提醒研究人员、流行病学家和公共卫生人员减少或避免偏倚,以确保研究结果的可靠性和有效性。
此外,还要注意混杂因素的出现可能会导致严重的失真,从而可能改变效果的方向。它有两种类型:当观察到的关联向远离null时为正混杂,当关联向null倾斜时为负混杂。
➦ 关于混杂变量
与因变量或疾病以及自变量或正在研究的因素相关的因子称为混杂变量。它影响疾病的风险,扭曲其他变量对所研究疾病的影响。当存在这种不需要的变量可以预测效果时,该研究无法提供暴露与结果之间的真实关联,夸大或稀释了所研究变量之间存在的实际关系。与健康结果有直接因果关系的各种因素,如个人年龄、性别、生活方式、社会经济地位、种族群体等,都是潜在的混杂因素。
举个例子,一项假设喝咖啡的人比不喝咖啡的人更容易患心脏病的研究,可能受到吸烟的第三个因素的影响。喝咖啡的人可能比不喝咖啡的人更习惯吸烟,在这里,吸烟是影响疾病与喝咖啡习惯之间关联的混杂因素。因此,心脏病可能是吸烟而不是咖啡的结果。
在研究的设计阶段和数据分析阶段,有几种方法可以减少混杂。
➯ 设计阶段使用的方法简要说明如下:
随机化:随机化是临床试验中使用的理想方法,涉及将参与者随机分配到变量分布相等的组中,限制潜在的混杂因素。
限制:参与研究的人数减少到在混杂因素方面相似的个体。
匹配:选择控件的方式应使潜在混杂因素的存在与案例中的存在相似。它可以通过 对匹配 或 频率匹配来完成。
➯ 分析阶段使用的方法简要说明如下:
分层:涉及评估不同水平(如年龄或性别)的混杂因素中暴露与结果之间的关联。
多变量分析:涉及统计建模,以同时限制多个混杂变量,然后评估每个混杂变量及其影响。
标准化:涉及使用标准参考人群来中和研究组之间的混杂因素的影响。
无论是被誉为”金标准”的随机对照试验,还是灵活实用的观察性研究,都在推动医学科学发展中发挥着不可替代的作用。
实验性研究,以其能够直接证明因果关系的能力,被视为评估新药物和治疗方法的“金标准”。然而,由于伦理和实践的限制,并非所有情况下都适用。
观察性研究,作为一种更为灵活的方法,通过自然观察来揭示现象之间的关联,尽管它们在确定因果关系方面存在局限。
我们可以看到,实际上没有一种研究设计是万能的。每种方法都有其优势和局限,研究人员在设计和实施研究时,需要权衡研究目的和实际情况,严格控制可能的偏倚,在保证科学严谨性的同时也要考虑现实可行性和伦理要求。
在探索未知领域的征途上,每一步都充满了挑战与机遇。随着研究方法的不断发展和创新,我们期待未来能够有更多的工具和策略来应对医学研究中的挑战。
主要参考文献
Munnangi, S. & Boktor, S.W. (2023) Epidemiology Of Study Design. StatPearls Publishing.
Belbasis, L., & Bellou, V. (2018). Introduction to Epidemiological Studies. Genetic Epidemiology, 1–6. doi:10.1007/978-1-4939-7868-7_1
Rivas-Ruiz, F., Expósito-Ruiz, M., & Domínguez-Almendros, S. (2012). Research designs in clinical epidemiology. Allergologia Et Immunopathologia, 40(2), 117–124.
Wang, J. & Attia, J. (2010). Study Designs in Epidemiology and Levels of Evidence. American Journal Of Opthalmology. 367-370. DOI.1016/j.ajo.2009.08.001
Dipika Shrestha. 2024. Study Designs in Epidemiology. Microbe Notes.
Harris, A.D., McGregor, J.C., Perencevich, E.N., Furuno, J.P., Zhu, J., Peterson, D.E. & Finkelstein, J. (2006). The use and interpretation of quasi-experimental studies in medical informatics. J Am Med Inform Assoc. 13(1):16-23.
Maciejewski, M. L. (2018). Quasi-experimental design. Biostatistics & Epidemiology. 1–10.

谷禾健康

有些人吃了豆类、坚果、谷物等,会出现消化问题,腹胀不适,头痛,餐后疲劳,关节不适…其实这可能与食物中的凝集素有着密切的关系。
凝集素(Lectin),一种与碳水化合物结合的蛋白质,存在于很多植物性食物中,就像是植物的”天然防御武器”,帮助植物抵御外敌的侵害。然而,临床研究和部分营养实践表面,它们可能会导致“肠漏”,即肠道内壁受损,使毒素和其他有害物质进入血液。
此外,凝集素是一种“抗营养物质”,一些研究发现凝集素可能与肥胖、慢性炎症和自身免疫性疾病等健康问题有关,因此引发了广泛关注和讨论。
植物中都含有凝集素,但生豆类(包括豆类、扁豆、豌豆、大豆、花生)以及小麦等全谷物中的凝集素含量尤为突出。这些说法背后有道理吗?
本文将全面探讨凝集素这一复杂的话题,主要内容包括:凝集素的基本介绍、不同凝集素对人体的益处、相关风险因素、凝集素敏感性的表现、如何预防凝集素带来的危害,以及高凝集素食物的识别等。
重点解答以下几个关键问题:
—— 碳水化合物结合蛋白
不要将凝集素与瘦素、乳糖或果胶混淆。
凝集素是与碳水化合物或糖蛋白(碳水化合物-蛋白质混合物)结合的蛋白质。
它们或多或少存在于每个生物体中,包括病毒、细菌和大多数食物,但其中大多数是无害的。自 1884 年以来,科学家们一直在研究凝集素。一些科学家认为,凝集素是植物保护机制的一部分。植物还使用凝集素与环境交流,用于细胞组织,并作为储备蛋白等功能。
而动物凝集素则可以在免疫反应中起到聚集细菌或病毒的作用。
最著名的例子是流感病毒表面的血凝素,它是病毒表面的糖蛋白,帮助病毒识别和附着在宿主细胞表面,是病毒入侵细胞的关键蛋白质。
总的来说,凝集素不是单一的物质,而是一类具有相似功能的蛋白质的统称。它们在生物体内和医学研究中都扮演着重要角色。
不同类型的植物凝集素
在植物中,凝集素集中在种子、早期叶子、根中。叶子通常含有较少的凝集素,尽管这可能因植物而异。叶子的一个很好的例子是长叶生菜。

可引起敏感的食物凝集素类型包括:
在大豆和小麦胚芽中发现的凝集素或血凝素 ,可导致血液凝集(凝块)。
植物凝集素具有聚集某些血型血细胞的能力,这表明某些血型的人可能比其他人更容易因凝集素而出现健康问题。

一些植物凝集素,如蓖麻子蓖麻毒素和白芸豆凝集素,对人类和大鼠具有很强的毒性。蓖麻毒素可引起血液凝集,并可能用于化学战和基因工程除草剂。
白芸豆血凝素可引起急性恶心,继而出现呕吐和腹泻。
存在于豆类等多种植物中也称为植物凝集素或植物血凝素能与特定的糖类分子结合。它们的结合特性引起了人们对其对人类健康影响的担忧,尤其是对肠道内壁的影响。
其他植物凝集素的毒性较小,但它们会以其他方式造成损害。
☑ 小结
凝集素集中在植物的种子和根中。芸豆、黄瓜、甜瓜、南瓜、谷物和大豆中的凝集素会引发食物过敏。一些植物凝集素具有剧毒,而另一些则危害较轻。
—— 消化,肠漏,免疫,肠道菌群
1
抗消化
✉ 凝集素不会被热消化或降解。它们可以进入血液,过度激活免疫系统,破坏激素。
凝集素可以承受大鼠和人类的高温和消化。它们很容易通过肠壁运输到血液中。

在血液中,凝集素可能会刺激免疫系统并改变激素功能,或沉积在血液和淋巴管壁中。

2
损伤肠道内壁,导致肠漏
✉ 凝集素会结合并损害肠道内壁,导致肠漏并干扰营养吸收。
凝集素与肠道内壁细胞结合,引起细胞损伤,并增加肠道内容物的摄取。
一些凝集素的饮食来源,如小麦,可以直接打破肠道细胞中的紧密连接。

凝集素可导致肠漏,从而增加饮食和细菌抗原(炎症剂)对免疫系统的暴露。
它们还会干扰营养物质的吸收。

典型例子:小麦胚芽凝集素
这是一种存在于小麦中的凝集素,也是最有害的凝集素之一。
小麦凝集素的自然作用
小麦凝集素是自然界中小麦植物的一种防御机制,用来保护自己不受天敌的侵害。这种凝集素能够识别并结合到N-乙酰氨基葡萄糖(GlcNAc)上,这是一种在真菌、细菌以及昆虫和甲壳类动物的外壳中都存在的物质。在人体中,N-乙酰氨基葡萄糖也是构成软骨、肌腱、关节等组织的重要成分。
糖萼与小麦凝集素
我们的粘膜表面覆盖着一层由N-乙酰葡糖胺和N-乙酰神经氨酸(唾液酸)组成的保护性糖蛋白,称为糖萼。小麦胚芽凝集素对这些糖蛋白有独特的结合特异性,这意味着它能够附着、破坏并进入这些粘膜表面。
小麦凝集素对人体的影响
研究表明,小麦凝集素能够抑制细胞积累维生素D受体,这可能影响维生素D的功能。此外,小麦凝集素与胰岛素受体位点有直接关系,它能够提高葡萄糖转运速率,增加葡萄糖向脂肪和肝细胞的运输,同时阻止储存的脂肪释放,这可能导致减肥困难和血液中甘油三酯含量增加。
小麦凝集素与肠道健康
小麦凝集素和麸质一样,能够增加肠道通透性并损害肠道内壁,这可能会引发免疫系统的反应,导致自身免疫性疾病的发生。小麦凝集素还能通过内吞过程增加肠道的大小,干扰新陈代谢,并在血液中沉积在各种细胞和血管壁中,导致胰腺和胸腺的大小变化。

小麦凝集素与神经系统
小麦凝集素和豆类中的凝集素ConA能够与动物血管素神经元结合,这些神经元与人类的加压素和催产素非常相似,影响认知和行为。下丘脑分泌的GnRH,负责性行为和睾丸激素的产生,也是凝集素的靶标。此外,下丘脑的内侧基底神经元涉及睡眠调节,这可能解释了为什么一些对凝集素敏感的人会出现睡眠问题。需要注意的是,下丘脑内侧基底不受血脑屏障保护,因此通过肠道屏障的凝集素可以到达这些区域。
虽然每个人都可能受到凝集素的影响,但并非每个人都会受到凝集素的伤害。以后的文章将讨论为什么会有这种差异。尽管不是每个炎症患者对相同的凝集素都同样敏感,但小麦胚芽凝集素确实给很多人带来了麻烦,这也是为什么患有自身免疫性疾病的人常常避免小麦的原因。
肠道通常含有大量糖蛋白,同样是许多凝集素的目标。
一些食物凝集素(如花生)会穿过肠壁,并沉积在远端器官中,可能会引发一系列健康问题。

常见的豆类凝集素如刀豆球蛋白A(Concanavalin A)和植物血凝素(Phytohemagglutinin),可以激活免疫系统 。
像小麦凝集素一样进入血液的凝集素特别擅长激活免疫系统。
大多数凝集素在胃肠道消化后存活。凝集素可以影响肠道上皮细胞的更新和丢失,破坏上皮的管腔膜,干扰营养物质的消化和吸收,刺激细菌菌群的变化,调节消化道的免疫状态。
在系统性方面,它们可以破坏脂质、碳水化合物和蛋白质代谢,促进关键内部器官和组织的增大和/或萎缩,并改变激素和免疫状态。

凝集素可引起瘦素抵抗,这解释了为什么有些人在低凝集素饮食中体重减轻。瘦素是饱腹感激素。当瘦素水平很高,但我们仍然没有满足时,这就是瘦素抵抗。
血清素转运蛋白是“糖蛋白”,这意味着它们是某些凝集素的靶标。小麦、谷物、豆类和坚果中的凝集素可以与这些转运蛋白结合,破坏它们的功能。
不仅转运蛋白受到影响,更重要的是受体由糖蛋白(唾液酸)组成,这意味着它们是来自谷物、豆类、坚果的常见植物性凝集素 。
肠道产生我们体内高达 90% 的血清素,而肠道直接与凝集素相互作用。可以想象,这可能导致血清素缺乏,血清素缺乏可能带来情绪、睡眠等问题,比如说情绪低落,焦虑,入睡困难,注意力难以集中,食欲异常等。
3
刺激免疫系统
✉ 凝集素吸收到血液中,过度刺激免疫反应,增加对其他食物的敏感性,加剧过敏和组胺不耐受。
当凝集素到达血液时,大多数人会产生针对膳食凝集素的抗体。

这些抗体不一定能保护您免受有害凝集素的侵害。这是否会导致疾病取决于个体易感性。

在小鼠中,通过鼻子或喂养凝集素会刺激 IgG 和 IgA 的产生,类似于霍乱毒素的产生。
凝集素可以增强对抗原的免疫反应,而这些抗原本身不会引起炎症。例如,与单独喂食蛋清蛋白相比,喂食小麦胚芽凝集素和蛋清蛋白的小鼠对蛋清蛋白的抗体反应要强得多。
因此,将含凝集素的食物与其他产品一起食用会增加对其他食物敏感的风险。
由于凝集素可以增强对其他抗原的免疫反应,因此它们可以与口服疫苗一起使用。
凝集素可以诱导肥大细胞反应,表明它们可以加重过敏和组胺不耐受。
4
引起自身免疫
✉ 凝集素与健康细胞和组织结合,这可能会触发自身免疫并增加炎症。
由于凝集素可以作为免疫系统的触发因素,因此它们可以在易感人群中引起自身免疫。
凝集素通过与细胞表面的糖蛋白和糖脂(附着在蛋白质和脂肪上的糖分子)结合(如唾液酸)来触发自身免疫。有趣的是,大脑和肠道富含唾液酸。
在人类中,唾液酸几乎存在于所有体液和组织中。在血液中,它存在于纤维蛋白原、结合珠蛋白、铜蓝蛋白、α1-抗胰蛋白酶、补体蛋白和转铁蛋白中。

凝集素还通过刺激 IFN-γ、IL-1 和 TNF-α 的产生来增加炎症。
5
影响肠道微生物群
✉ 凝集素可以干扰肠道微生物组,并喂养与自身免疫性疾病相关的有害细菌。
凝集素会影响肠道细菌的组成,并可能导致肠道微生物失调,让人容易患上自身免疫性疾病。然而,凝集素影响肠道细菌的机制尚不完全清楚。
凝集素可降低肠道热休克蛋白(iHSP)的水平,iHSP 是一种抗炎蛋白,对与肠道细菌的健康互动和抵御氧化应激很重要 。

在大鼠中,饮食中的凝集素会增加肠道中大肠杆菌和乳酸乳杆菌的水平,这两种疾病都与类风湿性关节炎等自身免疫性疾病有关。
芸豆凝集素可导致肠道中的大肠杆菌过度生长,而雪莲花凝集素和甘露糖特异性凝集素可阻断这种作用 。
6
导致细胞异常生长
✉ 某些类型的凝集素可能导致胰岛素抵抗、肥胖和神经递质失衡。
凝集素可导致许多组织中的细胞增大和过度生长,包括肠道、胰腺和肝脏。
在基于细胞的研究中,凝集素触发了淋巴细胞的生长和激活。
在低剂量下,小麦胚芽凝集素可以模拟脂肪细胞中的胰岛素功能。
然而,在较高剂量下,小麦胚芽凝集素可引起胰岛素抵抗(在一项基于细胞的研究中)。
由于饮食凝集素引起的胰腺肿大可能会降低大鼠的胰岛素水平。
在一项基于细胞的研究中,小麦胚芽凝集素和蓖麻油中的蓖麻毒素可以增加脂肪细胞中的脂肪合成。
在蛔虫中,凝集素可以从肠道转运到多巴胺神经元,并干扰神经元和多巴胺功能,这表明它可能导致帕金森病。
——抵抗肺炎,免疫刺激,抑制癌症
虽然凝集素常常被认为是有害物质,但实际上其中有些凝集素对人体是有益的。
在植物中,凝集素似乎是植物自然防御机制的一部分,对种子的存活很重要。
凝集素在体内有许多重要作用。首先,它们激活补体免疫系统(先天免疫系统的一部分),这有助于对抗病原体。例如,凝集素途径帮助我们抵抗肺炎。
凝集素通常具有抗菌作用
例如,香蕉中的凝集素抑制了试管中的 HIV-1。
一些草药通过凝集素发挥其魔力。苦瓜和大蒜是含有凝集素的草药的例子,可能是有益的。
一些草药来自豆科,因此可能含有高水平的凝集素。这些例如黄芪、甘草、角豆、葛根。

凝集素通常是免疫刺激剂,含有凝集素的草药通常也会刺激免疫系统。来自苦瓜的凝集素就是这样做的。
许多植物凝集素都是抗癌的
人们正在探索来自谷物和豆类的各种植物性凝集素来治疗癌症。凝集素有时直接抑制癌细胞,例如食用山药抑制乳腺癌。这也是为什么对于那些患有癌症,但没有肠道问题或自身免疫疾病(或其他凝集素敏感症状)的患者,医生会推荐含适量动物产品的植物性饮食。植物还含有植酸盐和植物化学物质,它们也有抗癌作用。

不过需要注意的是,凝集素敏感性的问题比潜在的癌症预防作用更需要重视,因为对凝集素敏感的个体会患有慢性炎症,从长远来看,这可能导致癌症和其他所有慢性疾病,下一章节开始,我们来详细了解凝集素敏感性。
—— 腹胀,脑雾,疲劳,皮肤体重问题
预计多达 40% 的人口对凝集素有一定程度的敏感性,但可能只有 25% 的人达到了引起严重不适的水平。凝集素敏感性处于一个范围内,人们在不同程度上敏感。
如果你有自身免疫问题或其他炎症,那么可能因食物而发炎。以下是凝集素敏感人群的常见症状列表。此列表并不全面。
症状越多,出现凝集素敏感的可能性就越高。
一些人会出现以下症状:
—— 心理压力,睡眠不足,饮食,抗生素
下面是产生凝集素敏感性的主要风险因素

—— 神经系统,氧化应激,炎症
任何激活免疫系统和神经系统的东西都会增加凝集素的敏感性。
慢性感染会同时引起免疫激活和神经系统激活。然而,在这些人中,避免凝集素并不能治愈他们的问题,因为凝集素敏感只是伴随而来的一种副作用,不是原因。
免疫激活会增加细胞因子,刺激神经系统,激活 Toll 样受体(TLR) ——免疫系统的警钟,降低 Tregs ,并刺激 MHC/共刺激分子。
各种植物凝集素也会激活 TLR,尤其是小麦凝集素。一种可能性是,当达到 TLR 或免疫激活的阈值时,凝集素会开始出现更多问题。免疫激活也会激活神经系统,而神经系统本身对肠道有很多负面影响。
★ 激活的神经系统
神经系统的过度激活是凝集素敏感的最大风险因素之一。
1)神经系统的过度激活会通过 CRH 激素的各种作用导致“肠漏”。
CRH 影响包括肠道蠕动缓慢、大麻素激活减少(在杏仁核中,怀疑在肠道中也是如此)和肠道中的局部炎症。此外,CRH 会直接导致荷尔蒙失调。结果是 GnRH、LH、FSH、孕烯醇酮、DHEA、睾酮、生长激素、甲状腺激素(T3、T4、TSH)、催乳素、雌激素升高。
2)神经系统的过度激活会导致肠道中的氧气降低或缺氧,从而干扰肠道免疫系统。
这是因为当神经系统增加时,流向肠道的血流量会减少。血流量减少也会导致营养输送减少。血液被分流到心脏和肌肉,而胃和肝脏则无法获得需求。
3)扰乱睡眠 / 昼夜节律
这会导致一系列下游问题,因为 sleep 对许多其他功能至关重要。
4)导致谷氨酸和组胺过多,血清素减少。
这将减慢肠道流动并导致 SIBO(通过犬尿氨酸Kynurenine 途径)。
5)导致 HCL 的产生减少。
结果是食物敏感,甚至更多的炎症。
6)降低好激素的水平,增加一些坏激素的水平
因为它们被分流到皮质醇,间接地由于昼夜节律和睡眠中断。
▼ 机 制
一般来说,氧化应激和炎症会导致肠道中出现凝集素敏感。
一些机制包括:
—— 症状 + 生物标志物
凝集素敏感性处于一个光谱上,人们对它的敏感程度不同,有些人非常敏感,而另一些人则不是特别敏感。那么如何知道你是否对凝集素敏感?
以下是一些常见的凝集素敏感症状,此列表并不全面(前面章节有详细列举过症状):
如果你怀疑自己可能对凝集素敏感,可以通过对比上述症状来初步判断(症状可参考前面章节)。
同时,可以通过症状、血液检查和基因的组合来确定凝集素敏感性。如果这些检测显示的症状越多,就越能确定对凝集素敏感,而且受凝集素的影响就越大。
三类对凝集素敏感的人
大多数时候,人们会同时具有这些因素的混合。比如说,一个人可能同时有一些遗传因素,加上一段压力时期,以及在生活中不知不觉积累的潜在感染。
在心理压力或慢性免疫激活之后开始的健康问题,是预测凝集素敏感性的最好指标之一。
如果有人出现间歇性脑雾,这是凝集素敏感性更重要原因的症状。这是因为凝集素对下丘脑造成了严重破坏。
慢性脑雾是一个感染或生物毒素存在的症状。但大多数时候,有慢性感染或生物毒素的人会自动增加对凝集素的敏感性,这既是直接的(通过免疫激活),也是间接的(由炎症引起的慢性交感神经或战斗或逃跑反应激活)。
——相关食物列表
1)✔ 最佳食物:

2)✔ 不那么完美,但也足够好的食物:

3) 对凝集素敏感的人要避免下列食物:
糙米、鹰嘴豆、扁豆、蒸谷米、浸泡扁豆、冬瓜、胡萝卜、南瓜、开心果、去皮杏仁、橄榄、核桃、杏仁、巴西坚果、野生蓝莓、西红柿等。
4) 食物敏感的人需避免下列食物:
鲱鱼(胺类)、酸面包、发霉的奶酪、无花果、成熟的香蕉、葡萄干、发芽荞麦/麦片、葡萄、乳清(不同类型可能或多或少)、咖啡因、无添加剂鹰嘴豆泥、未改性马铃薯淀粉、巧克力/可可(包括生可可)、大多数豆类、β-乳球蛋白(在所有乳制品中)、燕麦、金枪鱼、荞麦(未浸泡)等。
5) 不建议的食物:
酵母(存在于无麸质面包中)、卡拉胶、杏仁奶、果奶、谷物(尤其是含麸质的谷物)、腰果、花生、斑豆、芸豆等。
6) 最具炎症性的食物:
麸质。含麸质的食物也含有小麦凝集素,它也具有很强的炎症性,很难与麸质的影响区分开来。
酪蛋白(在所有乳制品中)。
▼ 如何降低食物中的凝集素水平?
浸泡2小时以上和烹饪破坏豆凝集素。在普通豆类中,凝集素含量从820下降到3.2,而在蚕豆中,它从51.3下降到6.4。
比如说,干豆,浸泡几个小时,煮几个小时,软化豆,这使凝集素的作用失效。
高压烹饪会破坏一些食物中的凝集素,如豆类、甘薯和一些南瓜。
我们可以看到,凝集素这种普遍存在于植物中的物质具有复杂的生物学特性。凝集素对人体的影响存在显著的个体差异性,这种差异可能与个人的肠道健康状况、免疫系统功能以及整体健康状态密切相关。
对于普通人而言,没有必要对含凝集素的食物产生过度恐慌。但对于已经出现自身免疫疾病、肠道问题或对某些食物特别敏感的人群,可能需要更加谨慎地选择和处理食物。
对于关注凝集素敏感性的人群,建议通过专业的肠道菌群检测和相关生物标志物检测,了解自身肠道健康状况,包括是否有“肠漏”这些指标来辅助判断。
凝集素敏感性人群在医生或营养师的指导下,根据自身情况调整饮食结构,通过调节肠道菌群、改善肠道屏障功能,可能帮助缓解凝集素敏感性。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Pusztai A, Ewen SW, Grant G, Brown DS, Stewart JC, Peumans WJ, Van Damme EJ, Bardocz S. Antinutritive effects of wheat-germ agglutinin and other N-acetylglucosamine-specific lectins. Br J Nutr. 1993 Jul;70(1):313-21.
Brady PG, Vannier AM, Banwell JG. Identification of the dietary lectin, wheat germ agglutinin, in human intestinal contents. Gastroenterology. 1978 Aug;75(2):236-9. PMID: 669209.
Cordain L, Toohey L, Smith MJ, Hickey MS. Modulation of immune function by dietary lectins in rheumatoid arthritis. Br J Nutr. 2000 Mar;83(3):207-17.
Drago S, El Asmar R, Di Pierro M, Grazia Clemente M, Tripathi A, Sapone A, Thakar M, Iacono G, Carroccio A, D’Agate C, Not T, Zampini L, Catassi C, Fasano A. Gliadin, zonulin and gut permeability: Effects on celiac and non-celiac intestinal mucosa and intestinal cell lines. Scand J Gastroenterol. 2006 Apr;41(4):408-19.
Joe Cohen, BS. Genes, Symptoms & Blood Tests to Detect Lectin Sensitivity. Selfhacked. 2023. October 24.
Sjölander A, Magnusson KE, Latkovic S. The effect of concanavalin A and wheat germ agglutinin on the ultrastructure and permeability of rat intestine. A possible model for an intestinal allergic reaction. Int Arch Allergy Appl Immunol. 1984;75(3):230-6.
Tchernychev B, Wilchek M. Natural human antibodies to dietary lectins. FEBS Lett. 1996 Nov 18;397(2-3):139-42.
de Punder K, Pruimboom L. The dietary intake of wheat and other cereal grains and their role in inflammation. Nutrients. 2013 Mar 12;5(3):771-87.
Coelho LC, Silva PM, Lima VL, Pontual EV, Paiva PM, Napoleão TH, Correia MT. Lectins, Interconnecting Proteins with Biotechnological/Pharmacological and Therapeutic Applications. Evid Based Complement Alternat Med. 2017;2017:1594074.
Kolberg J, Sollid L. Lectin activity of gluten identified as wheat germ agglutinin. Biochem Biophys Res Commun. 1985 Jul 31;130(2):867-72.
Wang Q, Yu LG, Campbell BJ, Milton JD, Rhodes JM. Identification of intact peanut lectin in peripheral venous blood. Lancet. 1998 Dec 5;352(9143):1831-2.
Vasconcelos IM, Oliveira JT. Antinutritional properties of plant lectins. Toxicon. 2004 Sep 15;44(4):385-403.
Nigam PK, Narain VS, Kumar A. Sialic acid in cardiovascular diseases. Indian J Clin Biochem. 2006 Mar;21(1):54-61.

谷禾健康

在地球生态系统中,细菌、真菌、古菌、病毒以及真核生物共同构成了生命的基础,并在多个层面上发挥着重要的作用。人类和其他大型生物的反应往往可以直接观察到,但看不见的微生物的作用和影响也同样重要。
在微生物研究中,一直面临着一个棘手的难题:想要准确识别环境样本中的微生物,却常常遇到技术和成本障碍。传统上,研究人员需要分别测序16S和18S两种核糖体RNA,这不仅增加了研究成本,还可能因为使用”通用”引物导致鉴定结果产生偏差。
为解决这一问题,加州理工学院的研究团队在2024年10月创建了一个数据库——CABO-16S。这个数据库的独特之处在于将两个知名数据库(SILVA和PR2)中的微生物序列巧妙整合,让研究人员可以用更简单、更经济的方式获取微生物分类信息。
具体来说,CABO-16S将细菌、古细菌的序列与细胞器(如叶绿体)的16S rRNA序列结合,大大提高了微生物鉴定的准确性。特别是在海洋、湖泊和海草环境中,这个数据库在识别光合真核生物方面表现出色。
此外,CABO-16S还提供了一个灵活的框架,研究者可以添加专业的、尚未被其他数据库收录的微生物序列。本文以甲烷渗漏沉积物中的特定微生物为例,展示了如何通过添加精选序列来揭示微生物群落的细微差别。
这项创新不仅降低了研究成本,还为探索极端或独特环境中的微生物提供了新的可能性。
传统方法的不足
在过去20年中,小亚基(SSU)核糖体RNA(rRNA)的高通量测序用于研究陆地和海洋环境中的微生物生态学,并加深了对植物和动物微生物组的理解。通常16S rRNA基因用于原核生物鉴定,而优化的18S rRNA基因用于真核生物鉴定,ITS区域则被证明最适合真菌。
用单个PCR反应扩增原核和真核微生物是更为理想的,与使用单独引物进行16S和18S rRNA基因测序相比,可以将扩增子文库制备成本降低两到三倍。尽管一些“通用”引物 (515f/926r)可以扩增真核生物 18S rRNA 和 16S rRNA ,但同时准确分析来自 16S 和 18S rRNA 的真核生物和原核生物具有一定的难度。
◮ 真核生物被低估
首先,当试图扩增更广泛的目标群体时,引物与其模板之间的不匹配可能更常见,事实上,在模拟群落中,仅与反向引物的单个不匹配就会导致真核生物被低估3-8倍。
其次,18S序列通常比16S序列长160- 180bp,并且 PCR 和测序都偏向于较长的扩增子。天然样品可能含有较长的18S序列或较高比例的甲藻,这些甲藻往往存在错配,这表明在一些天然样品中,515f/926r引物扩增真核生物可能被严重低估。
◮ 不能完全可靠地表示相对分类丰度
最后,在大多数细菌中,16S rRNA基因拷贝数在1-15之间,在大多数古细菌门中平均只有1个拷贝,而在浮游植物中,18S基因拷贝数可以在1-12,000之间变化。尽管18S基因计数可能与生物量显著相关,但它们不能可靠地用于表示相对分类丰度。
CABO-16S的优势
◮ 同时分析原核和真核生物更全面、更精准
CABO-16S作为一个整合16S rRNA序列的创新数据库,为微生物生态学研究提供了更全面和精确的分类工具。CABO-16S将细菌、古细菌的序列与细胞器(如叶绿体)的16S rRNA序列结合,特别适合需要同时分析原核生物和真核生物(尤其是光合真核生物)的环境样本研究,尤其是海洋、湖泊和沿海生态系统。
◮ 可根据研究需求添加自定义序列
研究者可以根据自身研究需求,向数据库添加自定义序列,但需谨慎操作,避免引入分类学不一致性。对于特定环境或复杂微生物群落的研究,建议结合基因组系统发育信息来验证16S rRNA分类结果。
在具体使用时由于数据库仍在持续更新,研究者应关注SILVA和PR2数据库的最新版本,并及时更新CABO-16S数据库,以获得更准确的微生物分类信息。
◮ 获取SILVA数据
为构建 CABO-16S 数据库,下载最新版本的 Silva(138.2)序列 (SILVA_138.2_SSURef_NR99_tax_silva.fasta.gz) 以及映射的分类法(taxmap_slv_ssu_ref_nr_138.2.txt.gz)和质量值 (SILVA_138.2_SSURef_Nr99.quality.gz)。
去除了针尾值 < 50 或比对质量值 < 75 的所有序列。去掉鉴定为叶绿体、线粒体和真核生物的序列,随机选择100个真核生物作为外群重新添加。真核生物外群的分类学仅保留门水平。
对原核生物分类学进行清理,特别是在物种水平,以删除基于生物宿主、样本收集、不明确的细菌分组或属重复(即“Genus sp.”)的命名方案。为了便于直接比较,使用相同的方法构建了一个简化的 SILVA 数据库,但保留了鉴定为叶绿体的序列。
◮ PR2数据库获取叶绿体、染色质等序列
将质体、顶质体、叶绿体和染色质序列从PR 2数据库(v 5.0.0)添加到CABO-16S数据库中,用R包“pr 2database”(https://pr2database.github.io/pr2database/articles/pr2database.html)获取。
为了与SILVA分类中的7个分类等级相匹配,从PR2序列中删除了超群和亚群的等级。
◮ 将SILVA数据与PR2数据相结合
最后,将从甲烷渗漏 Sanger 测序(https://doi.org/10.6084/m9.figshare.27288090)中获得的定制的16S rRNA序列与来自 SILVA 和 PR2 的数据相结合,形成 CABO-16S 数据集的基础。
CABO-16S和简化的SILVA 138.2训练集是根据DECIPHER的建议和IDTAXA算法制作的。简而言之,在使用LearnTasa函数进行三次迭代训练之前,将过采样组被随机子集化为100个序列。
Kmer长度设置为8nt,以匹配RDP和QIIME2默认值。注意,使用全长16S rRNA参考序列用于训练;截断扩增子窗口的可能会略微提高准确性,但代价是可能产生模糊性。因此,我们呈现全长序列并从全长序列进行比较,并将是否截断的选择留给用户。
利用CABO-16S和SILVA-132.1对已发表的广泛来源16S rRNA序列进行分类比较,包括已知细菌分离株的模拟群落和环境样品。
对于所有比较的样品,使用古细菌/细菌引物(515 f/926 r)扩增16S rRNA基因的V4-V5区域,并在Illumina MiSeq平台上测序。在5个以上样本的环境数据集中,选择任意一组子样本进行分类比较。
对所有下载的原始序列进行了相同的处理,除了Needham和Fuhrman(2016)的数据,这些数据直接下载并使用了已经分析的OTU序列和观测矩阵。可重现的工作流程(https://github.com/emelissa3/CABO-16S commit 472d7fc)报告了用于从NCBI SRA上可用的原始FASTQ文件生成扩增子序列变体(ASVs)的全部细节和参数。
简言之,使用Cutadapt去除引物,然后修剪序列(240 f/200 r),合并12 bp重叠,去噪,并使用DADA2 进行比对。删除嵌合体,并通过IDTAXA的IdTaxa函数进行分类。
CABO-16S将常用的16S rRNA数据库统一整合,提供了一个用户可以轻松扩展的单一数据库,包含了数据库更新或未发表的序列。来自SILVA 138.2的389144个细菌和19213个古细菌16S rRNA序列用作CABO-16S数据库的初始框架,同时保留了来自SILVA的随机100个真核生物序列作为外群。
这些序列与来自PR 2数据库的细胞器16S rRNA基因的8540个16S rRNA序列相结合。最后,可以组合自定义序列,以最大限度地提高目标群落的分辨率;这里还添加了一组未发表的全长16S rRNA序列,这些序列是从甲烷渗漏沉积物的Sanger测序中获得的,以及一份精选的代表性seep-SRB1序列列表。
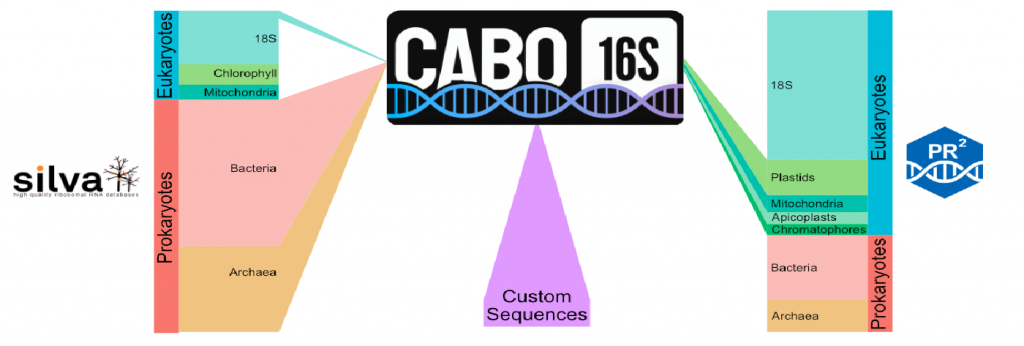
doi: https://doi.org/10.1101/2024.10.23.619938
以相当的准确度注释先前未分类的ASV
CABO-16S与SILVA 138.2比较了先前发表的代表不同系统的数据集,包括模拟群落和环境样本。该数据集包含基于模拟群落、哺乳动物肠道和住宅土壤、北方森林土壤、叶和周围沉积物、来自冷甲烷渗漏的深海沉积物、热液喷口沉积物、具有丰富浮游植物群落的海水以及最后来自以微藻Picocystis为主的封闭盆地湖泊的水的特征良好的基准集。合并数据集由64402个扩增子序列变体(ASVs)组成,单个数据集范围在45-32090个ASV之间。
CABO-16S的分类能力显著提高
在所有分类水平上接受分类分配的ASVs总数方面,CABO-16S数据库的表现优于未经修改的SILVA 138.2数据库。最大的差异是具有最多光合真核生物的数据集,如浅海草环境、海水和湖水。
例如,在海水数据集中,CABO-16S在门水平上比SILVA 138.2多分类了约10%的ASV。其他数据集差异不大,表明纳入PR2数据库的细胞器16S序列并没有对分类器继续准确预测细菌和古菌分类的能力产生有意义的影响。
唯一值得注意的例外是,SILVA 138.2中的海水数据集的分类率略高于CABO-16S,我们将其归因于PR2中的浮游植物目数比SILVA中的单一“叶绿体”标签增加。在这两个数据集中,绝大多数ASV都无法在物种水平上进行分类,尽管这可能部分是由于标记到物种水平的参考序列相对较少,特别是对于非人类环境特有的微生物。
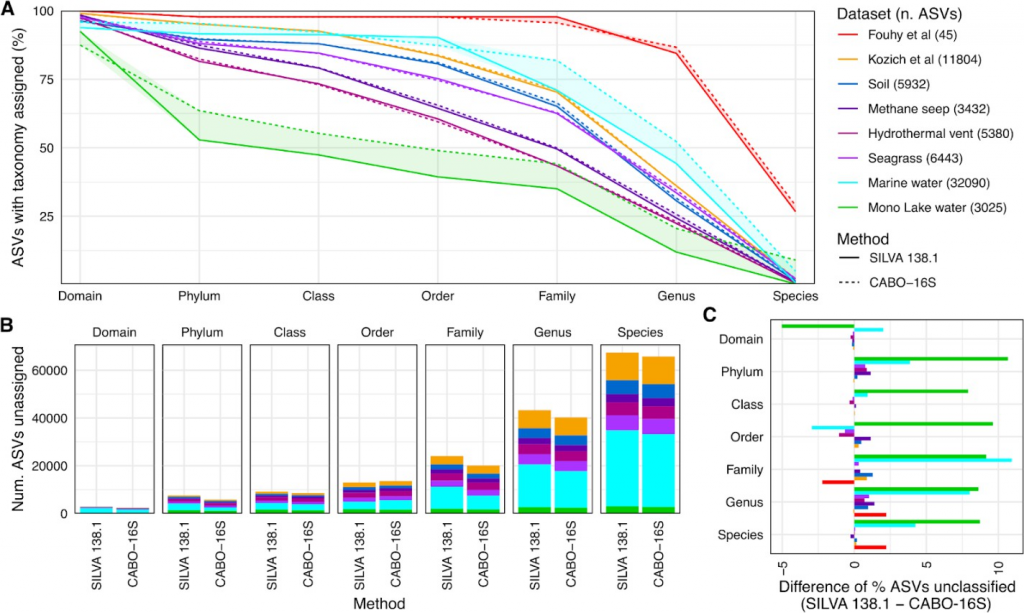
doi: https://doi.org/10.1101/2024.10.23.619938
A)SILVA 138.2(虚线)和CABO-16S(实线)在给定分类水平(x轴)上按数据集(彩色线)分类的ASV百分比。随着ASV在较高级别(如域)缺乏注释,这些线也在不断减少,根据定义,ASV在较低级别(如物种)也缺乏注释。
B)A.缺乏分类的ASV的绝对数量。
C)两个数据库之间未分类的百分比差异。阳性百分比反映CABO-16S注释的ASVs比SILVA 138.2更多,反之亦然。
CABO-16S和SILVA都揭示了分类模糊性的两种类型之间的区别,这是妨碍分类注释的主要原因。模糊性是最常考虑的精度形式,其中一个序列位于两个或多个参考分类群之间,因此不能在选定的置信阈值(本研究中为40%)下分配给单个分类群。
IDTAXA和其他类似的分类器通过将序列分类到竞争参考分类群的最低共同水平来处理此类事件,有时会在冲突的分类等级中添加‘unclassified’未分类前缀。相反,一个序列可以被确信地分配给一个单一的分类单元,但是如果参考序列在给定的等级上缺乏注释,那么在该等级上仍然可能缺乏分类学。
这种情况会影响许多未培养的谱系,例如,候选门级辐射类群candidate phyla radiation(Patescibacter门)中的SR1 科在SILVA 138.2中没有属或种分类,所有121个序列仅在科水平上进行注释。
因此,缺乏属分类的SR1 ASV不是由于分类器的不确定性,而是由于分类学的不确定性。此外,一些谱系可能同时包含这两种不确定性来源,例如,在SILVA 138.2中,Desulfosarcinacae脱硫杆菌科下有53个序列标记为种水平、676个序列标记为属水平和345个序列标记为科水平。而脱硫杆菌科的ASV缺乏属水平注释可能是由于与仅标记到科级的一组序列有密切相似性(taxonomic ambiguity 分类学模糊性)或与不同属无法区分(classifier ambiguity 分类器模糊性)。
因此,我们依照IDTAXA惯例在分类器模糊的情况下加上“unclassified_”,以及在参考序列模糊的情况下在最低分类层级上添加“unspecied_”来区分两者。
CABO-16S能够分类出几乎占一半读数的真核叶绿体
在分类序列中,CABO-16S和SILVA在大部分数据集中都产生了相似的群落组成。事实上,由于CABO-16S古菌和细菌序列的非蓝藻部分与SILVA 138.2完全相同,因此预期会有这种一致性。然而,在含有光养真核生物的数据集中(例如海草、海洋和湖泊水柱数据集),CABO-16S数据库允许对真核叶绿体进行分类,这些叶绿体占某些样本读取量的近50%(Mono Lake数据集)。
迄今为止,海水数据集的浮游植物多样性是所有数据集中最大的;这种多样性中的大部分都可以用CABO-16S进行分类标记。在Mono Lake数据集中,通过与NCBI人工对比,剩余的未分类多样性可归因于浮游植物线粒体序列。虽然目前的PR2数据库包括大约1842个线粒体序列,但绝大多数(1782个 96.7%)属于Opisthokonta,只有22个序列属于泛植物界Archaeplastida(植物和许多藻类)。
虽然并非在所有真核细胞中都发现线粒体,但我们预计未来PR2的扩展将包括更多来自植物和藻类谱系的线粒体16S,这将改善这一问题。
CABO-16S与原始SILVA 138.2的每个数据集的组成
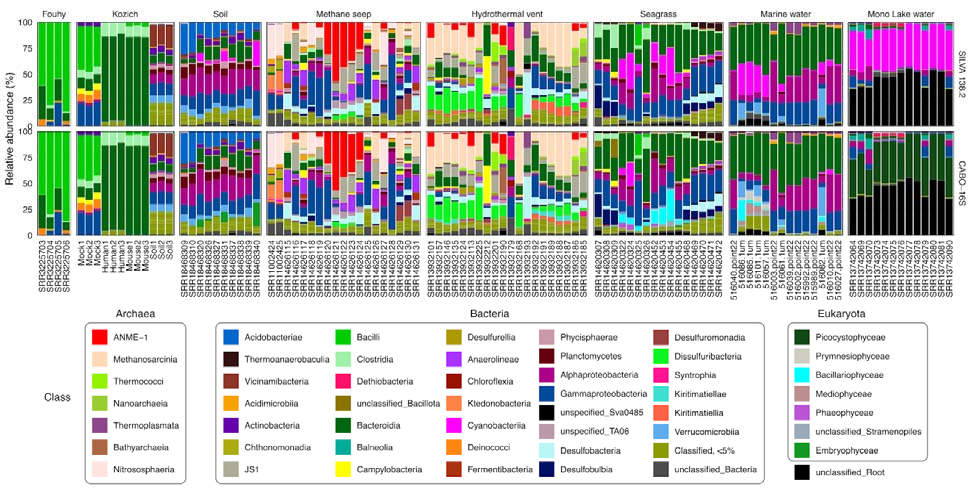
ASV被聚合到类级别(用不同颜色表示)。在样本中含量在5%以上的类别在图中展示。无法分配特定类别的ASV同样被汇总在最低注释级别。相对丰度<5%的剩余ASV被归为一类。
鉴定光合真核生物的精度更高
通过每个光养真核生物数据集对比不同ASV分类,以阐明数据库之间的差异点。对于富含真核浮游植物的沿海海水数据集,SILVA 138.2能够准确地对细菌群落进行分类,但是大部分reads(推测为真核生物)没有被分类到域水平或简单地注释为科水平的叶绿体。
扩增子序列变体序列得到进一步分类
而在CABO-16S数据集中,这些相同的质体ASV序列得到了进一步的分类。值得注意的是,序列的多样性并不总能对较低水平进行明确的分类注释,图中的分类注释显示在类或目水平上出现了许多歧义。
一些分类单元等级包括‘ _X ’后缀,这是PR2使用的中间占位符,类似于其他分类中使用的‘ Incertae Sedis ’。然而,通过质体分类获得的分类注释是有用的,因为主要的浮游植物类群(如硅藻、鞭毛藻、隐生植物等)是有区别的。
CABO-16S解析海洋数据集中的真核和细菌浮游植物
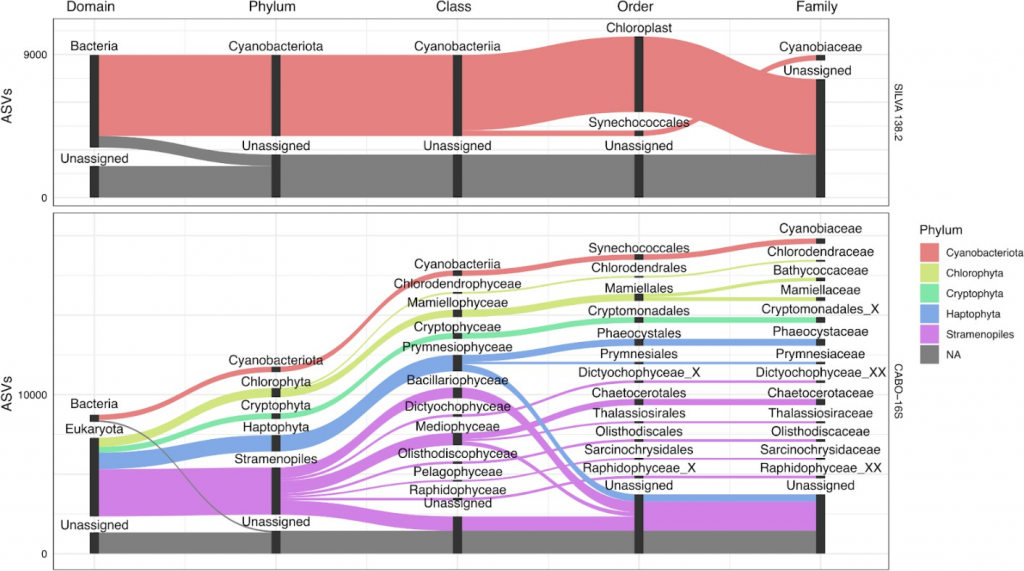
SILVA 138.2和CABO-16S的冲积图追踪了至少有100个ASV从域(最左侧)到科(最右侧)的ASV分类。对于每个层级,柱状图代表不同的分类群,每个柱状图的大小按比例反映了ASV的数量。条形图之间的空白是为了便于可视化。连接层级的流根据这些ASV的门级分类进行着色。仅显示了基于任一数据库的与蓝藻或质体序列相关的ASV。
自定义序列增加了多系进化枝的鉴定
向CABO-16S中添加自定义序列可以增加目前未纳入SILVA或PR2数据库中的物种的分类。增加了Sanger测序获得的甲烷渗漏沉积物序列和代表性SEEP-SRB1序列的精选列表。
SEEP-SRB 1是硫酸盐还原菌的多系分支,包括已知的ANME在甲烷厌氧氧化(AOM)过程中的共生性成员,如SEEP-SRB1a和SEEP-SRB1g,以及其他非共生性成员(SEEP-SRB1b、SEEP-SRB1c、SEEP-SRB1d、SEEP-SRB1e和SEEP-SRB1f)。
虽然目前在SILVA 138.2中被确定为属级进化枝,但这是这些生物的一个过于简化的分组。事实上,虽然一些成员,如SEEP-SRB1g和SEEP-SRB1c,被描述为物种水平的分支,但其他成员,如SEEP-SRB1a,更准确地描述为属水平的分支。
分辨率的提高揭示了不同SEEP-SRB 1亚组的不同分布
进一步使SEEP-SRB分类学复杂化的是SEEP-SRB1亚群之间不对称的系统发育距离——例如,基于基因组树,SEEP-SRB1g和SEEP-SRB1a可能位于不同的序列中。虽然用分类学分类纠正系统发育距离超出了本工作的范围,但这种历史命名惯例之间的冲突在环境微生物学中很常见并且难以解决。
然而,使用精确命名的组扩展数据库提供了一种避免这些差异的方法。因此,我们将SEEP-SRB亚群的代表性序列添加为SEEP-SRB1的“种”,但将SRB1g添加为“种”,这是SILVA 138.2中与SRB1g最相似的序列的分类名称。
将这些额外的SEEP-SRB序列纳入CABO-16S数据库,将部分环境SRB1组ASVs分解为各自的亚组。在甲烷渗漏和热液喷口数据集中,分辨率的提高揭示了不同SEEP-SRB 1亚组的不同分布。在喷口数据集中,只有一部分样本含有同营养型Seep-SRB1a和非同营养型Seep-SRB1d,这一区别无法用默认的SILVA 138.2数据库解决。与SILVA 138.2相比,CABO-16S如何将SILVA中注释为SEEP-SRB1、未分类的脱硫藻科或脱硫藻的ASVs分类时,分类分配的进一步差异变得清晰。
虽然CABO-16S对整个数据集中相对较小比例的ASV进行了不同的分类,但在特定环境中,如本研究中包括的沉积热液喷口,分类差异是显著的。有趣的是,一些SILVA 138.2分类为脱硫菌科的ASV在CABO-16S的较高级别上未分类(例如,unclassified_Desulfobacterales)或不同的分类。我们将这种差异归因于IDTAXA算法中的运行间差异,因为它对每次运行随机进行kmer的子采样,因此分类置信阈值边缘的一小部分ASV在运行之间会收到不同的分类。为了支持这一观察结果,将分析纳入归类为SEEP-SRB1、、Desulfosarcinaceae或LCP-80的ASVs,结果与一些归类为CABO-16S的asv在SILVA 138.2中未分类的结果大体一致。
CABO-16S通过添加特定序列,以更高的分辨率对SEEP-SRB1进行分类。

A) SEEP-SRB1及其相关分类群在最低分类水平的相对丰度。对于甲烷渗漏和热液喷口数据集,左侧子面板显示SILVA 138.2分类,右侧子面板显示CABO-16S分类。y轴表示每个样本总读取次数的百分比。
B)冲积图显示了数据库中相同ASV序列的分类。每一列都是一个不同的等级(从科到种),用CABO-16S标记的物种等级为不同的颜色。流量高度反映asv的数量。
缩写:unc,未分类;unsp不明;sed,沉积物。请注意,我们区分了由于分类冲突(未分类)而缺乏注释与由于参考分类群的注释不完整(未指定)而缺乏注释,如上图所述。
添加自定义序列相关的挑战
虽然Seep-SRB1亚型的注释可以通过添加具有特定注释的已知序列来实现,但这些分支的分类学、层级命名系统和系统发育,进化史之间仍然存在差异。
其他小组可能需要比我们用于SEEP-SRB1的方法更复杂的方法。志贺氏菌属和埃希氏菌属是这种矛盾的象征,因为两者在进化上都有很深的重叠,但分类学继续使参考数据库层次结构复杂化。
几十年来,聚球藻等其他环境群体同样对纠正分类学和系统发育提出了挑战。对于此类群体,添加具有特定、系统发育正确层次结构的序列不太可能改善分类,因为解决歧义的LCA方法假设所有序列共享相同的层次结构。
因此,所有现有序列都需要按照所需的系统发育框架进行类似的重新分类,并需要额外的管理,以确保新的分类层次与序列相似性的兼容性。最终,纠正系统发育和分类学的可行性受到16S rRNA基因中嵌入的信号的限制,虽然基于基因组的系统发育和16S rRNA系统发育在很大程度上是一致的,但它们并不完全相同。
◮ 分类分配的错误或不一致
提高分辨率的另一个障碍是分类分配中的错误或不一致,即相似的序列具有冲突的名称;据估计,这类错误占SILVA序列的1.5-17%。
基于大多数序列被正确且一致地标记的假设,IDTAXA等方法结合了工具来识别和删除在训练期间与大多数相似命名的序列冲突的单个序列,并且也存在独立的工具。
然而,这种方法对于由许多序列代表的分类群效果最好,对于需要提高分辨率的环境谱系并不总是如此。分类器的分辨率和准确性也可以通过限制数据库只包括特定于采样栖息地的微生物来提高,正如许多动物微生物组已经成功做到的那样。
这种特定栖息地的训练集无疑是对特定系统进行集中研究的最佳方法。但是,要了解具有广泛分布的特定分类群(如SEEP-SRB)的环境背景,就需要使用诸如SILVA之类的通用数据库最大化分辨率的方法。
CABO-16S成功地将来自SILVA 138.2的细菌和原始16S rRNA序列以及来自PR2数据库的细胞器16S rRNA序列与自定义选择的序列结合起来。与SILVA 138.2相比,增加了扩增子序列变体(ASVs)的分类定位。
具体来说,通过添加PR2的质体序列,CABO-16S无需额外测序16S和18S引物,就能在海洋和湖泊水体中出色地鉴定光养真核生物。尽管一些16S序列,如来自植物和藻类的线粒体仍然很少,可能会影响特定环境的分类,但CABO-16S减少了未分配的光养生物的数量从而可以快速提取剩余的丰富序列。
CABO-16S也被构建为可以添加自定义序列。随着SEEP-SRB1多系分支序列的加入,我们看到热液喷口沉积物样本的分类分化增加。这有助于确定特定环境中综合征的可能性,并加深对AOM的社区的理解。尽管添加自定义序列必须谨慎进行,但考虑到SILVA中未指定序列的数量以及将多系分支限制在当前分类结构的难度,CABO-16S的这一功能使用户可以自由定制16S分类,并可能增加对特定环境的理解。
最后,CABO-16S提供了一个框架,可以随着SILVA和PR2数据库未来版本的发布而轻松更新。R脚本和工作区可在https://github.com/emelissa3/CABO-16S上获得。自定义序列和其他东西永久托管在Figshare (https://doi.org/10.6084/m9.figshare.27288090)。
参考文献:
CABO-16S – A Combined Archaea, Bacteria, Organelle 16S database for amplicon analysis of prokaryotes and eukaryotes in environmental samples.
Eryn M.Eitel, Daniel Utter, Stephanie Connon, Victoria J. Orphan, Ranjani MuralibioRxiv 2024.10.23.619938; doi: https://doi.org/10.1101/2024.10.23.619938

谷禾健康
随着冬季到来,天气逐渐转冷,大部分呼吸道病原体在外界存活时间延长,同时人体的免疫力下降,呼吸道感染性疾病进入高发季节。
2024年第48周(11月25日—12月1日),对全国哨点医院(不含港澳台)采集的门急诊流感样病例和住院严重急性呼吸道感染病例的呼吸道样本,开展了多种呼吸道病原体检测,检测结果如下表所示:
呼吸道病原体检测阳性率(%)
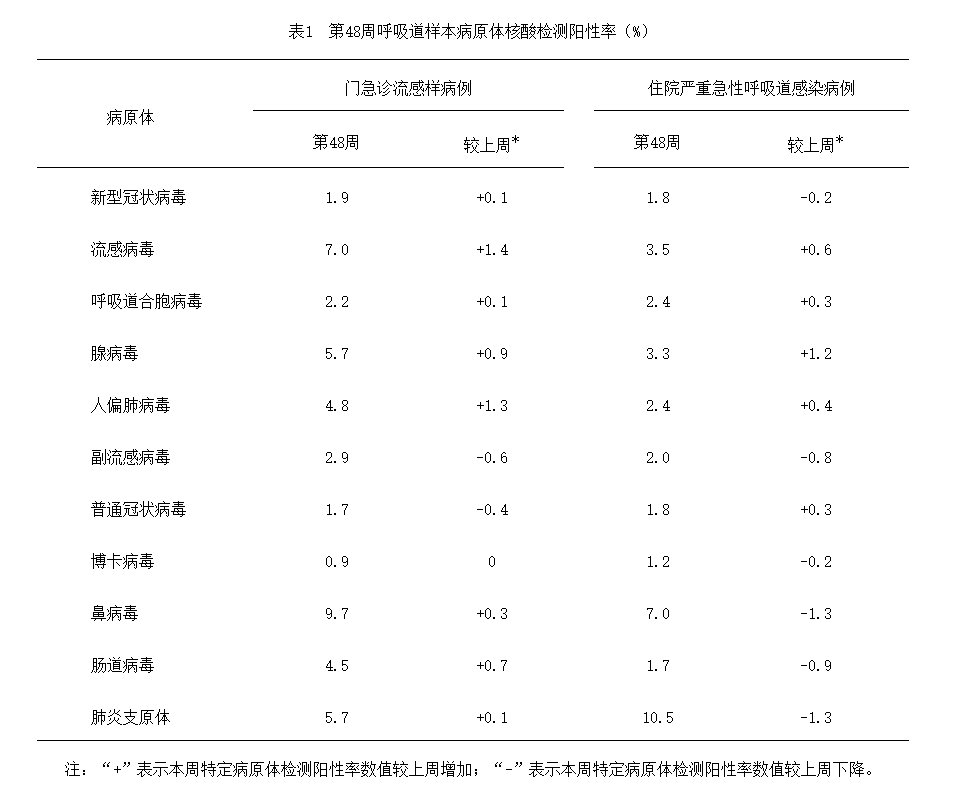
来源:中国疾病预防控制中心
呼吸道主要病原体检测阳性率区域差异

来源:中国疾病预防控制中心
呼吸道感染是最常见的传染病类别,也是全球发病率和死亡率的主要原因之一。2019年冬天爆发新型冠状病毒(SARS-CoV-2)就对人类产生了深远且持续的影响,影响了健康、日常生活、经济和心理等多个方面。
呼吸道是一个复杂的器官系统,分为不同的区域;上呼吸道包括鼻腔、咽和喉,而下呼吸道则由传导气道(气管和支气管)、小气道(细支气管)和呼吸区(肺泡)组成。曾经被认为是无菌器官的健康肺现在被描述为拥有自己的特定微生物种群——肺微生物群。
肺微生物群被认为是不断吸入和消除的细菌的短暂定居点。这些共生细菌作用于免疫系统,诱导保护性反应并防止病原体入侵和定植。同时,它们通过生产抗菌物质直接抑制病原体的生长。共生菌与常驻上皮细胞和免疫细胞之间的持续互作支持肺稳态。
肺部微生物群被视为“肺部健康状况的镜子”:多项研究表明,在肺部疾病发生期间,肺部细菌组成和肺部环境会发生巨大变化。另一方面,肺与肠道进行连续的双向串扰,并且任一部位微生物群组成的改变都会导致远端疾病的发展和进展。
在本文中,我们将重点关注宿主-微生物群相互作用在健康和最常见的呼吸道细菌(结核分枝杆菌、肺炎链球菌、肺炎克雷伯菌和流感嗜血杆菌)和病毒(流感病毒、呼吸道合胞病毒和严重急性呼吸系统综合症冠状病毒)感染中的作用,描述肺微生物群在生理防御以及疾病环境中的变化。
最后,本文总结了基于微生物群的治疗方法在呼吸道感染中的作用,包括新型微生物基础疗法(益生菌和膳食补充剂)以及微生物靶向疗法(抗菌单克隆抗体和噬菌体),有助于重塑常驻微生物群落并恢复呼吸道健康。
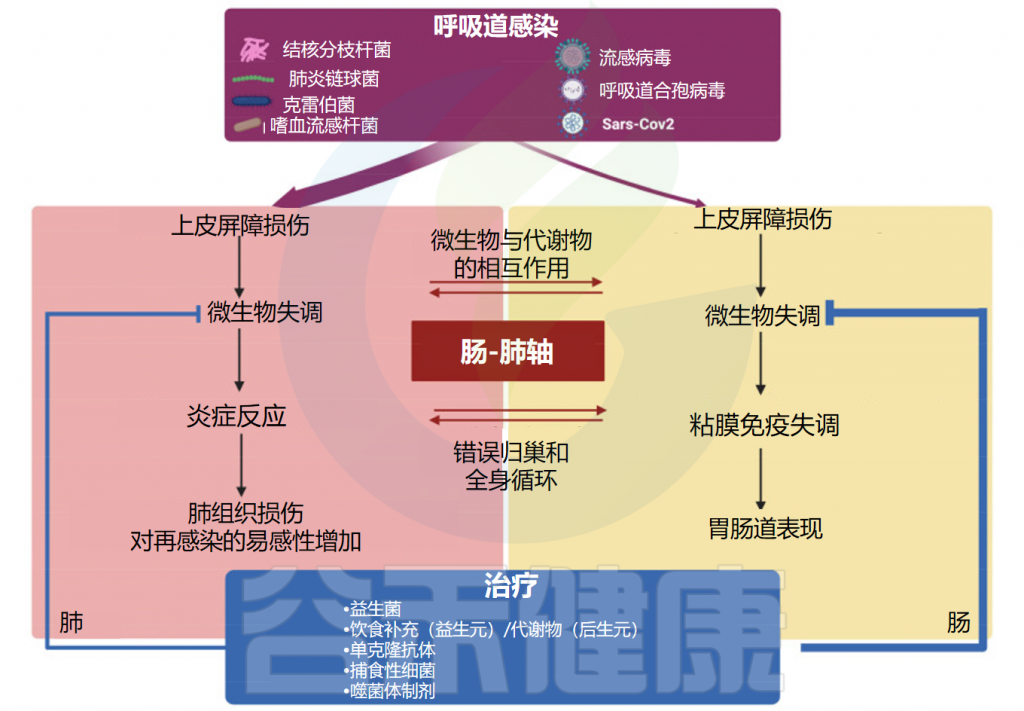
doi: 10.3390/ijms25074051.
肺部微生物群是指存在于肺部的微生物群落,包括细菌、病毒、真菌和其他微生物。尽管肺部长期被认为是无菌的,但近年来的研究表明,健康的肺部也存在复杂的微生物群,其组成和功能对维持肺部健康和免疫平衡至关重要。
★ 肺部相比肠道微生物较少,但也存在
肺部环境通常不适合细菌群落的发育,导致与肠道环境相比,细菌复制率相对较低,生物量也较低(103-105VS1011-1012个细菌/克组织)。
健康个体的上呼吸道(URT)微生物群更复杂一些,其中口腔共生菌普遍存在。相比之下,下呼吸道(LRT)的微生物群生物量较低,其组成受上呼吸道微吸入的影响,同时因粘膜纤毛活动和先天免疫功能的作用,局部微生物复制受到限制。
大量研究表明,健康的肺部含有拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的微生物群,其中普雷沃氏菌(Prevotella)、链球菌(Streptococcus)、奈瑟菌(Neisseria)、嗜血杆菌属(Haemophilus)、梭杆菌属(Fusobacterium)和Veilonella是最丰富的属。
16S rRNA 分析确定了健康URT和LRT之间微生物群的空间差异。从口腔到下肺不断发现与链球菌属的细菌重叠。然而,葡萄球菌通常栖息在上呼吸道,而普雷沃氏菌属和韦荣氏菌主要栖息在下呼吸道。
★ 呼吸道微生物定植在出生后就开始
呼吸道定植在出生后24小时内立即开始。在健康状态下,来自链球菌属(Streptococcus)、葡萄球菌属(Staphylococcus)、普雷沃氏菌属(Prevotella)、莫拉氏菌属(Moraxella)、嗜血杆菌属(Haemophilus)、乳杆菌属(Lactobacillus)、棒状杆菌属(Corynebacterium)和Dolosigranulum的物种代表了生命早期呼吸道的初始定植者,有助于平衡和动态的微生物群落。
从新生儿到成熟期,呼吸道中的细菌数量逐渐增加,多样性和功能能力受到分娩方式、母乳喂养、抗生素使用和烟雾暴露等因素的影响。动物模型研究显示,出生后前两周内细菌量明显增加,菌群从γ‐变形菌纲和厚壁菌门逐步转向拟杆菌门。
★ 微生物可以通过空气吸入和扩散进肺部
微生物迁移是通过吸入空气中的细菌、沿粘膜表面直接扩散发生的,后者被认为是健康受试者中占主导地位和普遍存在的途径。事实上,下呼吸道的细菌群落在很大程度上类似于口腔微生物群的组成。
与微生物群落具有高度抗性的高生物量粘膜(即口腔、肠道)的微生物相比,肺微生物组的动态性质可能是一个重要的独特特性。
★ 影响肺部微生物群的因素
影响肺微生物组成的因素主要有以下几个方面:
1.宿主因素
-年龄
-性别
-体重
-遗传因素
-健康状况(基础疾病)
2.环境因素
-空气质量
-吸烟
-职业暴露
-居住环境
3.生活方式因素
-饮食
-口腔卫生
-运动
-抗生素使用
4.其他因素
-季节变化
-医院环境暴露
-抗生素的使用
-疫苗接种
此外还有局部微生物竞争、宿主上皮细胞相互作用和免疫细胞活化等。术语“菌群失调”表示健康肺微生物组的三个决定因素(微生物迁移、微生物消除和繁殖率)平衡的变化,肺部菌群失调与许多不良生物学事件有关,并参与呼吸系统疾病的发生和发展。
★ 肺部微生物群的变化与疾病存在相关性
比较患病肺和健康肺发现,肺部微生物组成存在显著差异,疾病状况与细菌多样性的丧失有关,或者与一小群分类群的优势有关。微生物菌群失调是各种肺部疾病的特征,其中微生物多样性减少可能与疾病进展有关。
肺微生物组的生长条件在病理过程中发生了显著变化,导致适合受伤气道的疾病和患者的微生物群落。例如肺部富集的口腔厌氧菌群(如Prevotella和Veillonella)与炎症增强和免疫反应改变导致的感染易感性增加有关。
此外,肺微生物群成分的改变对某些个体造成更大的感染风险。肺微生物群的改变与多种肺部疾病的恶化有关,不同的细胞免疫反应与暴露于各种肺部微生物有关。例如在慢性肺部炎症中,来自病理性人支气管肺泡系统的假单胞菌(Pseudomonas)和乳杆菌(Lactobacillus)的富集与Th17型反应的增强相关。一些致病体还会诱导严重的不依赖性Toll样受体2的气道炎症和肺部免疫病理学。
呼吸道微生物组成影响人类和小鼠的炎症反应,调控肺γδ T细胞产生IL-17及肺泡巨噬细胞的分化,并影响抵抗呼吸道感染的能力。副流感嗜血杆菌通过TLR4激活促炎反应,阻碍皮质类固醇通路,诱导炎症性Th2途径,最终导致支气管反应。
健康和呼吸道感染期间的肺微生物群和免疫
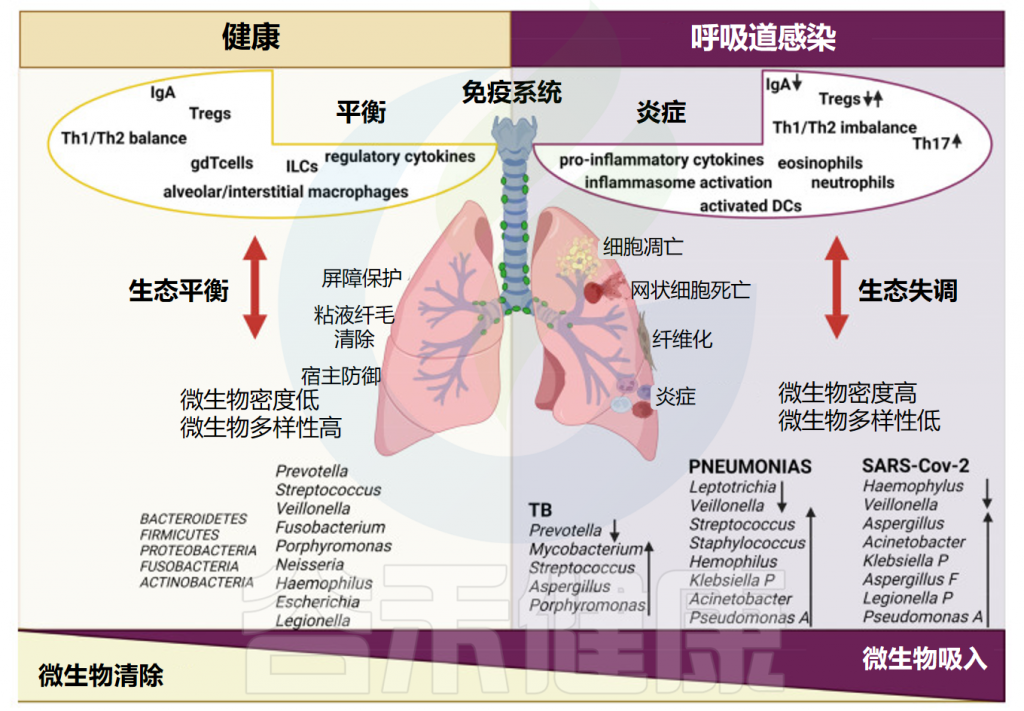
doi: 10.3390/ijms25074051.
肺部感染包括病原体的获得、传播和侵入下呼吸道。
肺炎是肺实质的炎症。在病因学上,它被归类为社区获得性肺炎(先前健康的个体的感染)或医院获得性肺炎(住院个体在入院后48小时内的感染)。革兰氏阳性肺炎链球菌(Streptococcus pneumoniae)是大多数社区获得性肺炎病例的原因,也是2岁以下儿童、老年人和免疫功能低下个体患病的主要原因。
★ 不同人群易感的病原体有所差异
由流感嗜血杆菌和肺炎克雷伯菌引起的肺炎易在50岁以上的慢性阻塞性肺病或酗酒患者中传播,而由肺炎支原体和肺炎衣原体引起的肺炎则在儿童中更为广泛。由呼吸道合胞病毒(RSV)和腺病毒引起的病毒性肺炎在健康人群中很少见,而由流感病毒引起的肺炎仍然是老年人和基础疾病患者高死亡率的原因。
在成人中,肺炎链球菌(S.Pneumonia)、乳杆菌(Lactobacilli)和罗斯氏菌属(Rothia)的优势与肺炎有关。新生儿中肺炎链球菌、流感嗜血杆菌或莫拉菌的定植与患支气管炎的风险较高有关。在流感患者中还发现假单胞菌增多。
主要病原体检测阳性率年龄组差异

来源:中国疾病预防控制中心
★ 呼吸道病原体感染导致肺部疾病的发展
人体研究表明,不同菌株的早期定植与发生呼吸道感染的风险增加有关。因此,病原体感染和微生物相互作用都可能影响疾病的进程。从生态学上讲,感染的特点是微生物负荷增加和群落多样性减少,以及宿主炎症和组织损伤增加。上呼吸道微生物组的改变是导致肺炎的细菌感染发生的原因。
最近的一项研究描述了严重肺部感染中病毒复制的显著增加,以及轻度和重度疾病患者之间微生物相互作用的差异,尤其是与常见病原菌之间的关联。流感导致的高死亡风险主要归因于继发性细菌感染。病毒通过多种机制增加了宿主对细菌定植的脆弱性。
注:鼻内接种H1N1病毒以模拟人类流感的小鼠微生物组、肺转录组和代谢组显示出显著变化,这些变化在恢复期持续存在。这表明感染对微环境的稳态产生了长期影响,有利于潜在病原体。
结核病
结核分枝杆菌(Mtb)是导致肺结核(TB)疾病中肺部肺炎的原因。在小鼠和人类身上进行的研究表明,肺部微生物组在抵抗结核分枝杆菌感染方面发挥作用。
结核病患者肺部存在特殊的菌群富集
一些细菌菌株可能与结核病的发病、复发和治疗失败有关。例如假单胞菌的丰度与治疗失败的风险增加有关。与健康对照组相比,感染结核分枝杆菌的个体的微生物群多样性降低,并且经常表现出链球菌和假单胞菌的富集。
在结核病中,肺部和整个下呼吸道具有特殊的微生物特征:结核分枝杆菌、金黄色葡萄球菌和乳酸克鲁维酵母(Kluyveromyces lactis)在123名结核病患者的支气管肺泡灌洗液 (BALF)中高度富集,而副流感嗜血杆菌在未感染的肺部富集。
使用鼻咽拭子样本的研究表明,结核分枝杆菌感染显著改变了微生物群组成:与健康对照组相比,结核病患者的变形杆菌、γ-变形杆菌、假单胞菌和莫拉菌科增加,而芽孢杆菌和毛螺菌属减少。
肺泡微生物多样性降低可能由炎症环境引起
与健康对照组相比,结核病患者的肺泡微生物群多样性降低(链球菌和梭杆菌减少,结核分枝杆菌丰度增加)。这些变化可能是由炎症环境决定的,因为结核分枝杆菌可以释放毒力因子,从而抑制巨噬细胞的反应。
在另一项研究中,链球菌在结核病中显著增加,而结核病中的Th1反应可能是由奈瑟菌(Neisseria)和嗜血杆菌(Haemophilus)引发的。
新冠肺炎
2019年,一种新型冠状病毒严重急性呼吸系统综合症2(SARS-CoV-2)引起了新型冠状病毒病(COVID-19)大流行。疾病严重程度和死亡率因年龄及合并症而异,其中许多与肠道和肺部微生物改变有关。这表明菌群失调可以在一定程度上预测COVID-19的严重程度。
新冠病毒感染者肺部微生物群失调
一般来说,与健康或病情较轻的COVID-19个体相比,危重症COVID-19患者的肺部物种多样性降低,细菌负荷增加。不良的临床结果与支原体的下呼吸道富集有关。
一项研究描述了来自重症COVID-19患者的支气管肺泡灌洗液(BALF)样本,假单胞菌丰度显著更高,而来自COVID-19肺炎阴性患者的 BALF 的特征是流感嗜血杆菌和韦荣氏球菌等的富集。
据报道,20名已故 COVID-19 患者的肺组织微生物组以不动杆菌(Acinetobacter)为主,不动杆菌通常与引起肺炎的肺部感染有关。
在上呼吸道和下呼吸道中,宿主免疫系统对潜在的有害物质做出反应,并将它们与自身成分、外来非危险物质和有益共生微生物群区分开来。
◆ 气道上皮产生粘蛋白形成抵御病原体的屏障
气道上皮是与当地微生物群相互作用的场所,也是生物物理保护屏障。产生粘液的气道上皮分泌细胞是肺先天免疫系统的关键要素。一些数据表明,呼吸道微生物群调节塑造粘液产生的上皮屏障。具体来说,在小鼠模型中,证明了粘蛋白与肺部感染反应之间存在联系。
◆ 产生lgA阻止病原体的吸附
除粘蛋白外,气道上皮细胞还提供抗原特异性分泌型IgA屏障,能够保护气道表面。分泌型IgA的作用是阻止病原体的吸附,中和它们在粘膜上皮的毒性产物,介导感染上皮细胞中病毒的消除,并促进对病原体的杀伤。
多项研究证明,IgA在防御呼吸道感染中发挥重要作用:IgA缺陷小鼠对牛分枝杆菌卡介苗(BCG)鼻内感染的易感性增加。鼻内给药中和IgA后,接种流感病毒(IV)或呼肠孤病毒导致小鼠模型中肺部病毒滴度显著降低,肺炎严重程度减轻。值得注意的是,静脉注射抗原特异性聚合物IgA可通过血清中的IgA分泌保护小鼠免受流感感染。
◆ 分泌抗菌肽来对抗病原体
局部呼吸道还分泌称为抗菌肽(AMP)的保护性介质,包括溶菌酶、乳铁蛋白、脂质运载蛋白、过氧化物酶、氨肽酶、集合蛋白(表面活性剂蛋白A和表面活性剂蛋白D)、甘露聚糖结合凝集素(MBL)、cathelicidins和β-防御素。
值得注意的是,β-防御素和cathelicidins具有抗菌和免疫调节作用,并参与塑造微生物群组成。事实上,炎症反应的直接抗菌活性和免疫调节是由微生物群的成员触发的。
免疫细胞在呼吸道病原体感染中至关重要,是机体防御系统的核心。接下来,我们一起来了解一下不同免疫细胞与病原微生物感染之间的相互作用。
▸ 巨噬细胞
肺中存在不同类型的先天免疫细胞:肺泡巨噬细胞(AMs)是最具代表性的细胞,似乎是几种呼吸道感染发病机制的核心,包括结核分枝杆菌(MTB)、肺炎链球菌、鼻病毒、流感病毒(IV)和呼吸道合胞病毒(RSV)。
◆ 肺巨噬细胞失调影响呼吸道感染的死亡率和并发症
AMs启动白细胞募集,并使用几种病原体特异性机制直接消除病原体,例如分泌促炎细胞因子/趋化因子(IL-6、IL-8或CXCL10),启动I型IFN信号传导,增强模式识别受体的表达,以及抑制病毒基因组的核输出。
并发症发生率和死亡率的增加与肺泡巨噬细胞耗竭有关,无论是在实验过程中还是在自然过程中,呼吸道病毒感染都是相关的。此外还发现,重症COVID-19的一个一致特征是肺巨噬细胞失调。
▸ 树突状细胞
肺部的树突状细胞(DC)在防止呼吸道感染方面发挥作用,对病原体产生强大的适应性免疫反应。树突状细胞可以启动抗病毒CD8细胞毒性T细胞反应,导致病毒清除,还可以控制炎症反应的水平。
◆ 树突状细胞可作为继发性肺炎的生物标志物
炎症期间和之后的树突状细胞(DC)改变可用作继发性肺炎易感性的生物标志物,以及有希望的治疗靶点,以改善患者的预后。在结核分枝杆菌(MTB)感染中,DC在将先天免疫反应转变为适应性免疫方面发挥着多因素作用。值得注意的是,树突状细胞在防御SARS-CoV-2感染方面也发挥着关键作用。
▸ 黏膜相关不变T细胞
黏膜相关不变T(MAIT)细胞是非常规T细胞的一个亚群,对微生物感染进行免疫监视和免疫反应。
◆ 进行免疫监视和免疫反应
不同的研究表明,MAIT 细胞通过识别和杀死细菌感染的细胞(包括树突状细胞和肺上皮细胞)在结核分枝杆菌感染的免疫控制中发挥作用。
此外,MAIT细胞在人和小鼠中都需要细胞因子来响应结核分枝杆菌抗原,这可能是由于它们在感染部位募集。一项新的研究证实,急性SARS-CoV-2感染患者循环中的MAIT被激活,但频率降低,而它们在致命性COVID-19患者的肺部蓄积。
▸ 自然杀伤T细胞
不变自然杀伤T(iNKT)细胞在控制共生菌(包括机会性病原微生物群)中发挥作用,反过来,微生物群调节iNKT细胞。
在原发性呼吸道合胞病毒(RSV)感染期间,肺iNKT细胞的激活除了导致肺嗜酸性粒细胞增多和纤维化外,还导致抗病毒CD8 T淋巴细胞反应和病毒清除。
◆ 活动性结核病患者存在iNKT细胞缺乏
人类iNKT细胞缺乏可能是活动性/急性结核病发展的基础:与潜伏性结核病患者相比,活动性结核病患者的外周iNKT细胞较少,并且通过活动性结核病的治疗可以重建正常的iNKT细胞频率。据报道,重症 COVID-19 肺炎患者 iNKT 细胞减少,表明该亚群可能作为疾病严重程度的生物标志物发挥作用。
▸ γδT细胞
肺驻留γδT细胞是粘膜上皮屏障的主要T细胞成分,对维持肺稳态和影响多种肺部疾病的进展至关重要。γδT细胞是肺炎克雷伯菌感染中 IL-17A 的主要来源,也是宿主对急性铜绿假单胞菌肺部感染的早期免疫防御。
◆ γδT细胞对肺部感染进行早期免疫防御
在肺炎链球菌肺部感染期间,观察到活化的γδ T细胞数量显著增加。γδ T 细胞对冠状病毒感染的反应仍在研究中,之前关于SARS-CoV-2感染的报道显示对感染的靶标单核细胞系具有很强的溶细胞活性。
▸ 调节性T细胞
调节性T(Treg)细胞对于肺对空气传播的过敏原的免疫耐受以及减少对自身和非自身抗原的危险免疫反应至关重要。Treg耗竭通过抗原致敏在衣原体肺炎感染的发病机制中发挥作用。
◆ 调节性T细胞对肺炎链球菌肺炎具有保护作用
此外,Tregs通过与TGF-β通路相关的机制对肺炎链球菌引起的肺炎具有保护作用。其他研究使用呼吸道合胞病毒和甲型流感病毒的小鼠模型表明,Treg细胞的耗竭可能导致CD8+ T细胞亚群的迁移延迟。
最近的研究显示,COVID-19患者的Tregs数量显著减少,导致Treg/Th17比值失衡,这与呼吸衰竭风险相关。
此外,呼吸道微生物群的成员通过TLR反复暴露于病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs),诱导树突状细胞和肺泡巨噬细胞的模式识别受体(PRR)耐受性。总之,呼吸道微生物群与气道上皮细胞和吞噬细胞形成正反馈回路,以实现免疫耐受并避免失控的炎症反应。
呼吸道中的宿主-微生物相互作用主要发生在粘膜部位。常驻微生物可以局部或全身引发免疫细胞(如上皮细胞、树突状细胞和中性粒细胞)的反应。这些物质能够进入循环并到达其他器官。
◆ 呼吸道微生物群与免疫和呼吸健康密切相关
呼吸道微生物组为宿主免疫系统提供重要信号,这些信号对免疫训练、器官发生和免疫耐受的维持至关重要。观察结果表明,在生命早期存在一个关键时期,正确的微生物群感知对免疫成熟和呼吸健康至关重要。
动物模型研究了微生物组在影响和管理宿主免疫系统中的作用,以及免疫系统在塑造微生物组中的作用。
例如,在小鼠模型中,拟杆菌门的成员相比流感嗜血杆菌减少了炎症、中性粒细胞募集和TLR2介导的细胞因子产生。
鼻内接种金黄色葡萄球菌导致单核细胞募集到肺部,并分化为抑制肺泡巨噬细胞的IV诱导炎症反应。
尽管肺炎链球菌被视为病原体,但它也是上呼吸道的一种共生菌。在小鼠鼻腔中同时定植肺炎链球菌和流感嗜血杆菌创造了炎症环境,导致C-X-C基序趋化因子配体2和中性粒细胞的高水平募集。协同反应依赖于肺炎链球菌产生的溶细胞毒素,表明其存在调节了对流感嗜血杆菌的免疫反应。遭受流感嗜血杆菌攻击的小鼠表现出严重的肺部疾病,显示出明显的中性粒细胞通路和高浓度的促炎细胞因子。
然而,如果小鼠在吸入共生普雷沃氏菌后进行预处理,炎症会显著减少,且不存在组织病理。腺病毒诱导的记忆肺泡巨噬细胞在小鼠急性鼻内感染中表现出主要组织相容性复合体II类(MHCII)表达增加,以及与宿主防御、趋化性、抗原呈递和糖酵解代谢相关的基因转录上调。
在呼吸道病原体引起的菌群失调期间,共生细菌受到干扰,致病菌可同时出现在肺和肠道中,因此可能导致两个部位的组织损伤。
肠道和肺之间的密切生理和病理联系主要依赖于宿主-微生物的串扰。事实上,肺和肠道细菌的成员可以通过血流成分和代谢物直接交换,从而促进这两个部位的健康或疾病。
肠-肺轴主要相互作用的示意图
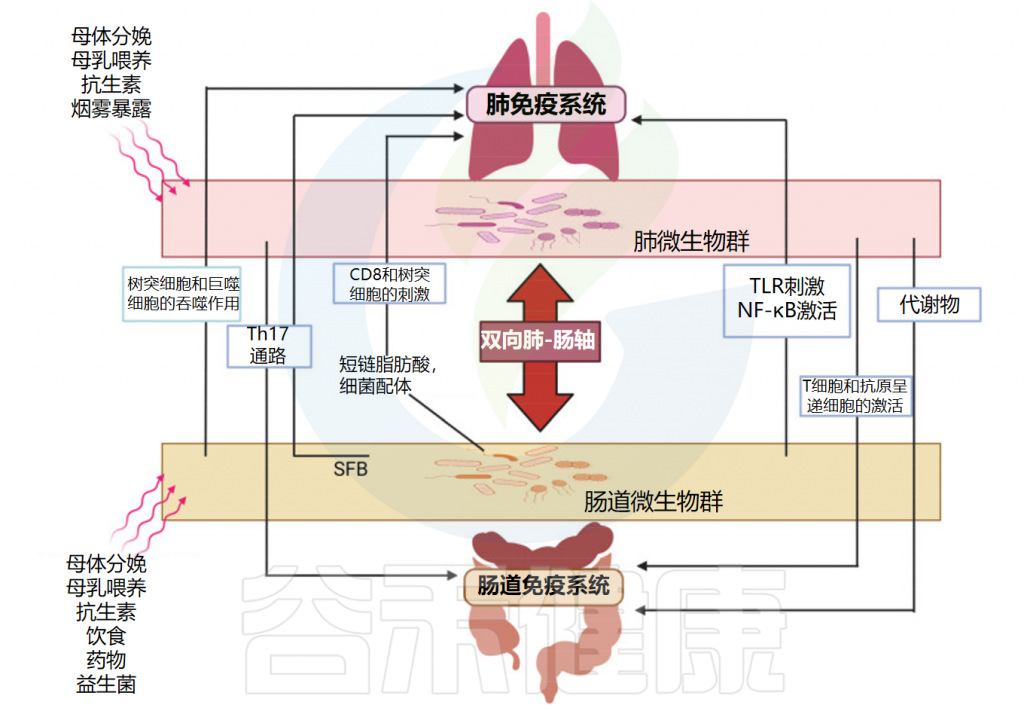
doi: 10.3390/ijms25074051.
呼吸道感染对肠道菌群的影响
研究发现,肺微生物群的改变调节肠道微生物群落,从而影响肠道信号传导。已知结核分枝杆菌感染会导致免疫系统失调,从而使肠道微生物组改变。
◆ 结核病患者肠道微生物群发生显著改变

在一项研究中,比较了成年结核病患者与健康对照的肠道微生物组,发现厚壁菌门、变形菌门和疣微菌门减少,而放线菌门、拟杆菌门和梭杆菌门增加。
另一项研究分析了新发和复发性结核病患者,报道了拟杆菌门、普雷沃氏菌属和毛螺菌属的减少,而放线菌门和变形菌门的富集。
最后,在一组受影响的儿童中,观察到放线菌门和厚壁菌门的减少,而包括拟杆菌属、双歧杆菌属、Dorea属、粪杆菌属、瘤胃球菌属和普氏粪杆菌(F.prausnitzii)属、肠球菌属和普氏菌属的数量增加。
◆ 结核病患者的微生物代谢也变得不平衡
结核病患者可能导致微生物代谢物的产生不平衡,例如短链脂肪酸(SCFA),这可能会重置肺微生物组和通过“肠-肺轴”的免疫反应。这些发现也可能解释了结核分枝杆菌在胃肠道中的定植和肺结核患者发生肠结核的原因。普氏粪杆菌(F.prausnitzii)还被描述具有抗炎作用,可抵御胃肠道疾病。
很少有研究分析人类呼吸道病毒感染期间发生的肠道微生物群改变的性质。在流感期间,尽管肠道中明显不存在病毒,但一些患者仍会出现类似胃肠炎的症状。
◆ 流感病毒感染患者的肠道菌群也存在失衡
一项针对H7N9病毒感染患者的研究显示,拟杆菌门(包括经黏液真杆菌属(Blautia)、罗氏菌属(Roseburia)和瘤胃球菌(Ruminococcus))减少,但厚壁菌门和变形菌门以及属(包括埃希氏菌(Escherichia)、梭菌属(Clostridium))增加。
另一项在流感亚型H1N1患者中进行的研究报告了放线菌门和厚壁菌门的减少,以及包括Dorea、粪杆菌、瘤胃球菌、链球菌在内的属,放线菌科和微球菌科的富集。
在最近的一篇综述中,11项不同的研究报告了与健康对照相比,确诊或疑似呼吸道感染(RTI)患者的肠道微生物组改变。总之,患者的肠道微生物组改变始终是多样化的,包括一些菌的枯竭和富集。
◆ 新冠病毒感染可在肠道中检测到病毒RNA
与甲型流感病毒(IAV)和呼吸道合胞病毒(RSV)的情况相反,在SARS-CoV-2(新型冠状病毒)感染期间,即使病毒RNA不再存在于呼吸道中,也可以在肠道中检测到病毒RNA,从而指出消化道是病毒复制和活性的潜在部位。
◆ 产丁酸抗炎菌减少,机会性病原体增多
SARS-CoV-2感染患者的肠道菌群失调与COVID-19疾病进展和严重程度以及COVID-19后综合征相关。它的特点是双歧杆菌和粪杆菌等抗炎菌减少,丁酸盐生产者丰度降低,例如瘤胃球菌科和毛螺菌科的几个属。
相反,还存在炎症相关微生物群(包括链球菌和放线菌)的富集,以及机会性细菌病原体的过度生长。
最近的一篇论文也表明,SARS-CoV-2感染会导致小鼠肠道微生物组失调,以及潘氏细胞和杯状细胞以及屏障通透性标志物的改变。同样,从96名 COVID-19患者收集的微生物组样本显示,抗菌素耐药物种在内的机会性病原菌属大量繁殖,这种肠道菌群失调与肠道细菌的继发性血流感染有关。
◆ 通过促炎因子和食物摄入减少影响肠道菌群
肺部感染的细胞免疫反应会导致食欲不振,从而改变肠道微生物组和代谢。研究发现,消除CD8+细胞可以阻止食物摄入量的减少并逆转肠道微生物群的变化,这可能是通过分泌TNF-α实现的。实际上,在呼吸道合胞病毒感染期间,中和这种细胞因子可以减少体重减轻并缓解肠道微生物群的扰动。
总的来说,炎性细胞因子的释放和食物摄入量减少是急性病毒性呼吸道感染影响肠道微生物群的可能机制。另一种机制涉及浸润的CD4+ T细胞或全身 IFN释放,它改变了上皮细胞的代谢,导致营养物质的积累,肠腔的微生物为此竞争。这些发现可能在呼吸道病毒感染期间的肠道菌群失调和胃肠道疾病中发挥作用。
肠道微生物群对呼吸道感染的影响
◆ 炎症性肠病患者通常存在肺部受损
肠道和肺之间的重要联系主要体现在炎症性肠病(IBD)患者的肺部受累范围广泛且严重,从亚临床改变到明显的慢性炎症性肺病。气道受累的症状最常见于有长期IBD病史的患者,这与肠道发育不良或全身性不当免疫反应有关。
◆ 肠道菌群失调与呼吸道感染易感性增加相关
除了慢性疾病,肠道菌群失调还与呼吸道感染的易感性增加有关。临床观察强调了健康肠道微生物群在预防病毒呼吸道感染方面的重要性。在肾移植受者和同种异体造血干细胞移植(HSCT)患者中,产丁酸盐的肠道细菌减少与病毒呼吸道感染的风险和发生率增加相关。
在COVID-19(新冠病毒感染)患者中也发现了肠道菌群失调和肠道代谢产物的变化,这与炎症反应和疾病并发症相关。值得注意的是,将COVID-19患者的粪便移植到无菌小鼠体内会导致肺部炎症,并在多重耐药肺炎克雷伯菌感染期间导致更糟糕的结果,这表明微生物群可能直接导致疾病后遗症。
此外,肠道菌群还可以调节血管紧张素转换酶2(ACE2)受体的结肠表达。这些证据可能有助于解释肠道菌群失调患者(如老年人、免疫功能低下患者和有其他合并症的患者)疾病易感性和胃肠道症状的增加。
◆ 肠道微生物及其代谢物可以调节肺部免疫反应
在几种细菌和病毒呼吸道感染的实验模型中,肠道共生菌的缺失或通过抗生素耗竭导致微生物传播、炎症、器官损伤和死亡率增加。这些影响大多与肠道微生物群塑造全身免疫的能力有关。由肠道微生物及其代谢物(如SCFAs)触发的免疫细胞和细胞因子可以到达体循环,并调节肺部、健康和疾病中的免疫和炎症反应。
此外,据报道,炎症性肠病患者的肠道淋巴细胞缺乏组织特异性;这可以解释IBD患者肠外器官存在炎症的原因。菌群失调介导的炎症也会导致粪便钙卫蛋白、血浆C反应蛋白、IL-6和IL-8的循环水平升高,这可能导致肺部感染期间的并发症发生。
肠道菌群失调也可能通过减少营养吸收和能量可用性来影响肺部感染的结果,这反过来会干扰患者产生有效免疫反应的能力。
关于肠道微生物群如何影响呼吸道感染的机制,动物研究提供了更多见解。
在抗生素处理的小鼠中,腹膜巨噬细胞中IFN-γRI、MHC-I、CD86和CD40分子的表达在对病毒感染的早期反应中减弱,这表明肠道微生物群在病毒在宿主体内复制之前就向先天免疫反应发出信号。
Th1、IgA和巨噬细胞对呼吸道病毒感染的反应建立取决于肠道微生物。直肠TLR刺激为IL-1β和IL-18分泌提供信号,恢复了抗生素处理小鼠的肺CD4+和CD8+ T细胞对感染的反应。
最近报道了一种常见细菌种类,即分段丝状细菌(SFB)在肠道中的定植,重新编程了肺泡巨噬细胞,使其增殖、补体产生和吞噬作用增强,从而增强了对流感病毒、呼吸道合胞病毒和SARS-CoV-2的保护。
总体而言,这些发现证实了肠道微生物刺激在先天抗病毒免疫反应激活中的重要性。在感染模型中,抗生素消耗肠道微生物群增加了结核分枝杆菌的负担和传播。菌群失调特别降低了肺树突状细胞中先天受体和巨噬细胞诱导的C型凝集素的表达,导致对幼稚T细胞的刺激功能受损,从而减少了感染小鼠的效应细胞和记忆T细胞数量。
◆ 肺部重叠感染可能受肠道微生物群的影响
肺部重叠感染可能是肺部原发感染诱导的肠道微生物组成改变的进一步后果。对继发性细菌感染的易感性增加,特别是由肺炎链球菌和金黄色葡萄球菌诱导的细菌感染,经常发生在患有呼吸道病毒感染的儿童和老年人中,导致并发症和死亡。
流感期间的肠道菌群失调通过改变短链脂肪酸的产生导致肺炎链球菌重叠感染。在接受甲型流感病毒条件微生物群的小鼠中,乙酸盐的产生减少,改变了肺泡巨噬细胞的杀菌活性,降低了肺对继发性肺炎链球菌感染的防御能力,并促进了重叠感染小鼠的死亡。肠道疾病也可能导致重症 COVID-19 患者伴随或继发性细菌感染。
因此,局部肺部或肠道菌群失调,改变了微生物间相互作用的动力学以及微生物代谢,可能会增强潜在致病细菌物种的增殖。
揭示肺和肠道之间的复杂相互作用有助于更好地了解共生微生物群作为各种呼吸道传染病的治疗靶点。
使用益生菌(微生物)、有利于其生长的产品(如益生元)或微生物代谢物(如后生元)的给药可以通过与病原微生物的直接竞争、改善上皮屏障功能或免疫调节,在呼吸系统疾病期间提供宿主保护。
病毒感染下的治疗
◆ 使用益生菌能够减少流感风险和发生率
在一项系统评价中,评估了益生菌在大规模健康受试者中预防病毒性呼吸道感染(RTI)的疗效。乳杆菌(Lactobacillus)是最常用的益生菌,其次是双歧杆菌(Bifidobacterium)和乳球菌(Lactococcus)。
大多数研究表明,益生菌的使用与病毒RTI的风险和发生率降低相关。然而,在临床表现、病毒载量和免疫学结局的改善方面尚无共识。益生菌鼠李糖乳杆菌和短乳杆菌也与流感感染发生率的减少有关。
在新型冠状病毒(COVID-19)背景下,一项针对SARS-CoV-2诱发肺炎的ICU患者的回顾性研究显示,与单独使用标准治疗相比,使用乳杆菌、双歧杆菌和链球菌属的益生菌混合物治疗与死亡率降低相关。
◆ 益生菌增强了免疫反应,有助于提高生存率
几份报告描述了口服益生菌对病毒性呼吸道感染结果的影响,也提供了机制见解。在感染流感病毒或呼吸道合胞病毒之前服用益生菌,如乳杆菌、双歧杆菌、肠球菌或乳球菌,可缓解症状并提高生存率。肺部和鼻腔冲洗液中的病毒载量也有一定程度的降低。
从机制上讲,益生菌可以通过参与免疫细胞并诱导特定的细胞因子/趋化因子产生来引发针对病毒呼吸道感染的保护性反应,尽管其作用似乎是高度菌株特异性的。
研究表明,益生菌给药后,自然杀伤细胞活性增加,浸润性巨噬细胞和中性粒细胞减少,支气管肺泡灌洗液中的病毒特异性IgA/G滴度增加。粘膜乳杆菌抑制呼吸道合胞病毒复制并降低血炎细胞(如粒细胞和单核细胞)的比例。
用副流感病毒对用益生菌治疗的小鼠肺淋巴细胞进行离体刺激,导致IFN-α和IFN-β的高度表达。病毒感染期间IL-10的上调和IL-6的相应减少也由益生菌给药引发。除了这些保护作用外,经鼻给药鼠李糖乳杆菌GG和嗜酸乳杆菌L-92还增加了IL-1β和单核细胞趋化蛋白1细胞因子以及趋化因子eotaxin和M-CSF的水平。
注意:尽管益生菌具有令人满意的安全性,但它们的使用可能与体弱人群感染或发病率的较高风险有关。因此,人们对使用非活微生物越来越感兴趣。动物研究证明了热灭活益生菌在呼吸道感染中的有益作用,尽管它们的全球影响似乎仅次于活益生菌。
◆ 通过饮食补充益生元提高了抗病毒感染的能力
肠道微生物群可以通过产生短链脂肪酸来调节免疫反应。摄入微生物可利用的膳食纤维(益生元),促进特定共生微生物的多样性和活性的增加,导致对微生物代谢物产生不同影响,进而对宿主对感染的反应产生不同影响。
高纤维(可发酵菊粉)饮食通过两种互补机制传达对流感的保护。小鼠表现出增强的选择性激活巨噬细胞的骨髓生成,这些巨噬细胞促进CXCL1介导的中性粒细胞募集到气道的能力有限,从而导致感染期间组织免疫病理学受限。
同时,饮食衍生的短链脂肪酸刺激CD8+ T细胞抗病毒活性。这种作用是由丁酸盐通过游离脂肪酸受体(FFAR)介导的。同样,高纤维(可发酵果胶)饮食通过刺激肺上皮细胞中的I型IFN 反应来防止呼吸道感染,这种保护是由乙酸盐通过GPR43介导的。
此外,有研究报道,流感感染期间口服醋酸盐补充剂以FFAR2依赖性方式加强了肺部对继发性肺炎球菌感染的防御能力,并降低了重叠感染小鼠的致死结局。同样,鼻内醋酸盐增加了鼻病毒感染期间的干扰素依赖性反应,降低了肺病毒载量。
有趣的是,一项评估益生元(低聚半乳糖和聚葡萄糖)预防新生儿病毒性呼吸道感染功效的试验表明,与益生菌相比,益生元显示出更好的有益效果,这可能与对预先存在的有益细菌生长的直接刺激作用有关。
细菌感染下的治疗
通过调节微生物群对肺部细菌感染又有怎样的效果,让我们接着往下看。大多数研究分析了益生菌在预防和治疗ICU患者肺部感染中的疗效。
◆ 口服益生菌降低了细菌性肺部感染的概率
口服或口咽给予干酪乳杆菌和鼠李糖乳杆菌,可以减少铜绿假单胞菌或相关病原体对下呼吸道的定植和感染。一项研究观察到,在脓毒症患者中,使用短双歧杆菌、副干酪乳杆菌和低聚半乳糖的混合物后,呼吸机相关性肺炎(VAP)的发生率降低。
对感染肺炎链球菌的小鼠研究表明,口服不同的益生菌,如乳杆菌属和链球菌属的菌株,可增加对感染的抵抗力,降低肺细菌负荷,提高存活率。
◆ 鼠李糖乳杆菌等益生菌增强了肺部的免疫反应
鼠李糖乳杆菌的使用通过增加 Foxp3 + Treg 和减少促炎IL-6来增强抗炎反应。在气管内给予其他乳杆菌菌株后,在感染的小鼠中也观察到这种抗炎特征。
活的或灭活的益生菌长双歧杆菌 51A的给药通过增强肺泡巨噬细胞中活性氧的产生和减少促炎性TNF-α和IL-6来刺激肺炎克雷伯菌的肺清除。然而,只有活的益生菌诱导了IL-10水平的同时升高,主要是由醋酸盐介导的。
经鼻或口服接种能有效激活Nod2受体的细菌菌株(分别为脆弱乳杆菌、金黄色葡萄球菌和表皮葡萄球菌,或罗伊氏乳杆菌、粪肠球菌和解黄酮梭菌)可保护小鼠免受肺炎链球菌或肺炎克雷伯菌感染。
补充乳杆菌还可以恢复肺部树突状细胞介导的抗结核分枝杆菌免疫。在感染结核分枝杆菌的小鼠中,口服A.muciniphila或A.mucinihila介导的棕榈烯酸通过表观遗传抑制肿瘤坏死因子,强烈抑制了结核病感染。
呼吸道益生菌
虽然大多数用作益生菌的共生菌起源于肠道,但已经尝试使用呼吸道共生菌。特别是,在婴儿小鼠中鼻内施用Corynebacterium pseudodiphteriticum能够改善呼吸道合胞病毒原发感染和继发性肺炎链球菌重叠感染的特征,降低病原体负荷和肺损伤。据我们所知,迄今为止还没有人类研究评估过呼吸益生菌(即滴注或雾化到下呼吸道的活菌群)的潜力。
在动物模型中,细菌B.bacteriovorus和M.aeruginosavorus的鼻内给药大大降低了呼吸道肺炎克雷伯菌的负担。它们随后被宿主先天免疫机制消除,没有产生不良影响,这预示了它们可能用于治疗人类细菌性肺炎。
◆ 单克隆抗体特异性对抗细菌病原体
使用单克隆抗体(mAb)选择性消耗机会性细菌病原体,通过靶向和灭活细菌及其毒力因子或毒素,成为对抗传染病的一种有前景的方法。
这些抗体因其靶标特异性,不会对本身微生物群产生不良影响,且不太可能导致广泛耐药性。此外,多价mAb经过工程改造,能够发挥多种抗菌作用,包括灭活毒力因子、促进补体沉积和激活先天免疫。
Gremubamab(MEDI3902;AstraZeneca)是一种双特异性人IgG1 mAb,能选择性结合铜绿假单胞菌毒力因子,用于预防高危患者的医院肺炎。该单克隆抗体促进中性粒细胞清除细菌,并防止其附着在气道上皮细胞。Gremubamab的预防性和治疗性给药在急性铜绿假单胞菌肺炎中表现出高度保护作用。
单克隆IgM抗体帕诺巴单抗(AR-101,Aerumab;Aridis Pharmaceuticals)正在临床开发中,用于治疗医院获得性肺炎中的铜绿假单胞菌。帕诺巴单抗的给药减少了急性铜绿假单胞菌感染小鼠模型中的细菌负荷,并减轻了肺部炎症。
另外两种抗体已被检测用于预防和治疗金黄色葡萄球菌肺炎。舒拉妥珠单抗(MEDI4893;Aridis Pharmaceuticals)特异性结合并灭活金黄色葡萄球菌的成孔α-毒素,这是一种关键的毒力因子。在针对金黄色葡萄球菌定植的机械通气ICU患者的临床试验中,单克隆抗体显著缩短了部分患者的肺炎、住院时间和ICU住院时间。
◆ 噬菌体及其内溶素有助于治疗细菌感染
噬菌体疗法在治疗细菌病原体的呼吸道感染方面受到了临床关注,因为它能够在不影响宿主微生物群的情况下选择性地消除目标细菌,与抗生素相容性好,免疫原性低。
噬菌体制剂在治疗铜绿假单胞菌、肺炎克雷伯菌、鲍曼不动杆菌或大肠杆菌方面显示出很强的临床疗效,目前正在临床上评估用于治疗人类呼吸道感染。四种针对铜绿假单胞菌呼吸道感染的专性裂解噬菌体混合物被用于成功治疗肺炎和肺气肿患者。
噬菌体衍生的内溶素或溶酶在对抗细菌感染方面可能优于全噬菌体制剂,因为其细胞壁靶标的保守性使得耐药性难以产生。在鼻咽定植小鼠模型中,噬菌体内溶素的给药降低了肺炎链球菌的滴度,并有效保护小鼠免受致命性肺炎球菌肺炎或铜绿假单胞菌感染,显示出其在预防和治疗呼吸道细菌感染中的潜力。
呼吸道感染是最常见的病毒或细菌来源的传染病之一,造成严重社会和经济负担。研究发现呼吸道感染会导致肺部微生物群的多样性和组成发生变化,进而影响宿主与病原体的相互作用、炎症信号和免疫细胞因子的产生,最终影响疾病的进展和结果。
肺和肠道之间的重要性和复杂的串扰以及肠-肺轴与呼吸健康的紧密联系越来越受到认可,特别强调了肺-肠轴在调节炎症和免疫反应中的双向通信作用。然而,对涉及肠-肺轴的机制的理解,特别是在呼吸道感染的情况下才刚刚开始。需要更好地了解微生物组、呼吸道粘膜和潜在免疫途径之间的相互作用。
迄今为止,大多数用作益生菌的共生菌都来自胃肠道。由于肠道微生物群在影响免疫系统方面起关键作用,它会影响局部和全身(肺部)对病原体的反应。因此,改变肠道微生物组的微生物群靶向疗法(如益生菌、益生元和噬菌体疗法)已被证明对急性和慢性呼吸系统疾病都有益处。
然而,最近的研究表明,与肠道微生物群落相比,肺微生物群与肺免疫变化的相关性始终更密切。此外,肺共生菌的实验性调节直接和持续地改变了肺免疫反应,表明它们可能具有作为局部应用益生菌预防和管理呼吸道感染的潜力。
值得注意的是,致病细菌的抗生素耐药问题。下呼吸道感染是多重耐药感染导致死亡的主要原因,通常与金黄色葡萄球菌、肺炎克雷伯菌、肺炎链球菌、鲍曼不动杆菌和铜绿假单胞菌等重点病原体相关。同时,新变种的出现使呼吸道病毒感染愈加难以控制。
未来的研究应进一步揭示肺和肠道微生物群在健康和疾病状态下的具体机制,特别是它们如何通过代谢产物和免疫细胞影响呼吸道的免疫稳态。此外,需要更多的临床数据来验证这些微生物组干预措施在改善呼吸道感染预后方面的有效性。通过深入理解肺-肠轴的复杂相互作用,有望开发出新的预防和治疗策略,以减轻呼吸道感染的负担并改善患者的整体健康状况。
主要参考文献
Marrella V, Nicchiotti F, Cassani B. Microbiota and Immunity during Respiratory Infections: Lung and Gut Affair. Int J Mol Sci. 2024 Apr 5;25(7):4051. doi: 10.3390/ijms25074051.
Wypych T.P., Wickramasinghe L.C., Marsland B.J. The influence of the microbiome on respiratory health. Nat. Immunol. 2019;20:1279–1290.
Mathieu E., Escribano-Vazquez U., Descamps D., Cherbuy C., Langella P., Riffault S., Remot A., Thomas M. Paradigms of Lung Microbiota Functions in Health and Disease, Particularly, in Asthma. Front. Physiol. 2018;9:1168.
Sommariva M., Le Noci V., Bianchi F., Camelliti S., Balsari A., Tagliabue E., Sfondrini L. The lung microbiota: Role in maintaining pulmonary immune homeostasis and its implications in cancer development and therapy. Cell. Mol. Life Sci. 2020;77:2739–2749.
Natalini J.G., Singh S., Segal L.N. The dynamic lung microbiome in health and disease. Nat. Rev. Microbiol. 2023;21:222–235.
Wu B.G., Segal L.N. The Lung Microbiome and Its Role in Pneumonia. Clin. Chest Med. 2018;39:677–689.
Yagi K., Huffnagle G.B., Lukacs N.W., Asai N. The Lung Microbiome during Health and Disease. Int. J. Mol. Sci. 2021;22:10872.
Belizário J., Garay-Malpartida M., Faintuch J. Lung microbiome and origins of the respiratory diseases. Curr. Res. Immunol. 2023;4:100065.
谷禾健康
当我们的皮肤被轻微割伤或烧伤时,伤口周围区域可能会变得红肿、发热,甚至伴有疼痛;感冒时,喉咙痛、肿胀;不小心扭伤后,可能会肿胀、疼痛和僵硬…这些都与炎症相关。
炎症,作为身体对损伤或感染的自然防御机制,是一种复杂的生物学过程,涉及到免疫细胞和多种分子介质的相互作用。它可以帮助身体对抗病原体、清除死亡细胞和促进组织修复。然而,当炎症反应过度或持续时间过长时,它也可能成为许多疾病的驱动因素,包括心脏病、糖尿病、某些类型的癌症,自身免疫疾病等。因此,了解炎症及其相关症状对于早期识别和治疗炎症相关疾病至关重要。
你是否想过,在身体出现炎症之前,其实已经有一些潜在的信号出现?炎症这个过程看似简单,但背后却涉及复杂的免疫系统调控,以及多种炎症因子的参与。值得注意的是,在这些可见的炎症症状出现之前,我们体内的炎症因子可能已经悄然发生了改变。
研究表明,肠道菌群的失调往往是最早的预警信号之一。当肠道微生物群的平衡被打破时,会引发一系列连锁反应:有益菌群(如双歧杆菌、乳酸杆菌)数量减少,条件致病菌和致病菌的比例升高。这种失衡会导致肠道屏障功能受损,使得细菌产物(如脂多糖LPS)更容易进入血液循环。
早期的肠道菌群改变会引起炎症因子水平的显著变化。比如说:血清中促炎因子如TNF-α、IL-1β和IL-6的水平开始升高,而抗炎因子如IL-10的水平则呈现下降趋势。同时,由于有益菌群减少,短链脂肪酸等具有抗炎作用的代谢产物的产生也会减少。这些变化都可能发生在明显的炎症症状出现之前。
这种早期的炎症因子改变往往具有预警作用。例如,在动脉粥样硬化的发展过程中,即使尚未出现明显的斑块形成,血液中的炎症因子水平就已经开始发生变化。
本文将带大家了解炎症因子,具体怎么看,它的高低代表着什么,发挥什么作用,探讨炎症因子作为早期诊断生物标志物的价值,以及肠道菌群与炎症因子之间的复杂联系。通过监测肠道菌群的变化和炎症因子水平的波动,我们可以更早地发现潜在的健康问题,为疾病的预防和早期干预提供重要的时间窗口。

◑ 炎症
炎症是身体对外界损伤、感染或内部损伤的一种自然防御反应,旨在清除有害刺激因子、清除死亡细胞和组织碎片,并启动修复过程。它是免疫系统的一部分,涉及多种细胞类型和分子介质,包括白细胞、血管系统、补体系统和各种炎症因子。
日常可见的炎症反应可分为两类:
不健康的生活方式,如吸烟、不良饮食、过量饮酒、久坐不动、压力、体重增加等,都可能导致慢性炎症。
慢性低度炎症——疾病之源
慢性低度炎症是在没有明显感染的情况下,体内炎症介质水平持续升高。这种炎症状态往往不会引起明显的临床症状,但会长期影响人体健康。
慢性炎症可以攻击全身,并在此过程中增加特定区域某些类型疾病和紊乱的风险,如心脏、大脑、关节、胃肠道等。
炎症是如何被触发的?
炎症的触发是一个复杂的过程,感染、损伤、应激、自身免疫反应、坏死细胞、代谢紊乱…这些都可能是炎症触发的途径。
随着损伤信号的识别,免疫细胞如巨噬细胞和树突状细胞迅速响应,受体的激活促使免疫细胞分泌炎症因子,这些炎症因子是炎症反应中的关键分子。
炎症因子的释放不仅放大了炎症信号,还促进了血管的扩张和通透性增加,使得免疫细胞和分子能够更有效地到达受损部位。这些炎症因子的相互作用和级联反应构成了炎症反应的基础,它们共同协调了机体对损伤和感染的防御机制。
接下来我们来深入认识炎症过程中的核心”信使”——炎症因子。
◑ 炎症因子
炎症因子在疾病发展过程中扮演着关键角色,其水平变化不仅反映了疾病的发展态势,更为疾病的早期诊断和预后评估提供了重要依据。研究表明,炎症因子的变化往往早于临床症状的出现,这种特性使其成为疾病发展的重要生物标志物。
我们先看一下,炎症因子是什么?
炎症因子是一类由免疫细胞和其他细胞产生的特殊蛋白质分子,它们在体内发挥着”信使“的作用。也就是说,炎症因子就像是我们身体内的一支特殊”信号部队“,它们负责在炎症发生时传递各种指令,协调免疫系统的行动。
无论是急性炎症还是慢性炎症,炎症因子都扮演着不可或缺的角色,它们决定着炎症反应的强度、持续时间和最终结果。
炎症因子与细胞因子有什么区别?
炎症因子主要是指那些能够引起或加剧炎症反应的分子,而细胞因子则是一类更广泛的信号分子,包括炎症因子在内的多种类型,比如生长因子、趋化因子等,它们参与调节免疫细胞的功能和相互作用。
炎症因子可以被视为细胞因子的一个子集,也就是那些具有促进炎症反应功能的细胞因子。
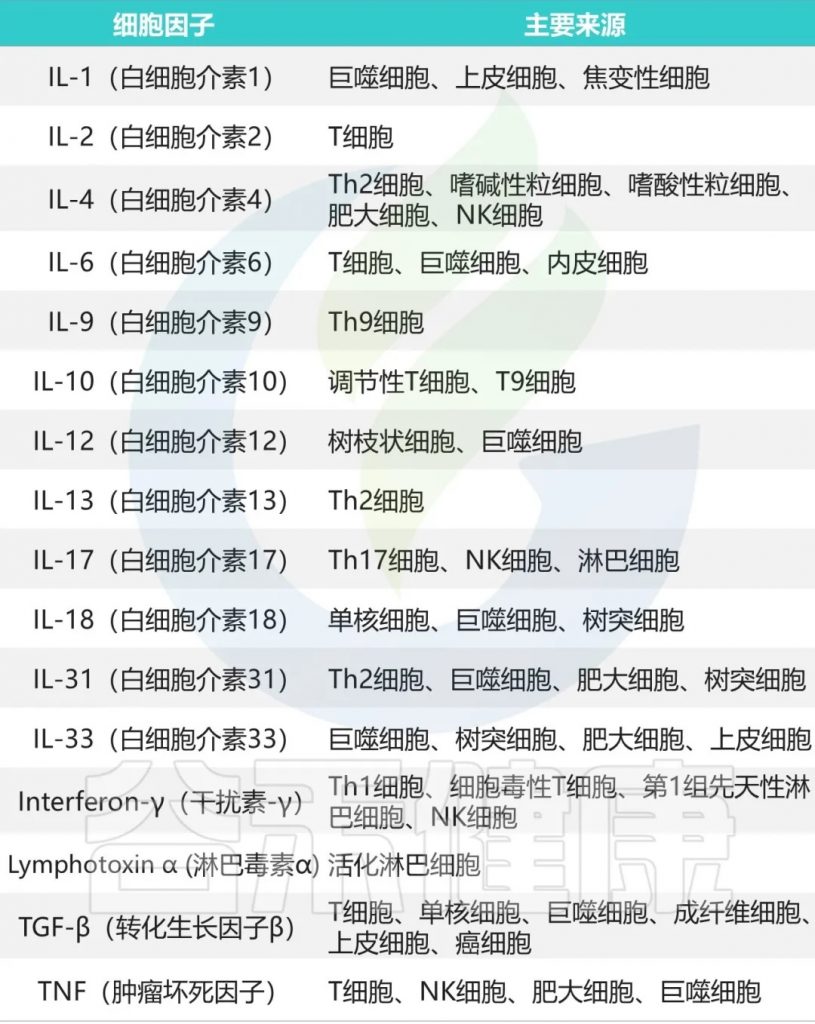
在疾病发展的早期阶段,即使尚未出现明显的临床表现,体内的炎症因子已经开始发生显著变化。
例如,促炎因子TNF-α和IL-6的水平会逐渐升高,而抗炎因子IL-10的水平则呈现下降趋势。这种变化具有明显的时序性和渐进性特征,为疾病的早期预警提供了可能。同时,C反应蛋白(CRP)等急性期蛋白的轻微升高,也常常预示着潜在的健康问题。
主要的促炎因子和抗炎因子有哪些?
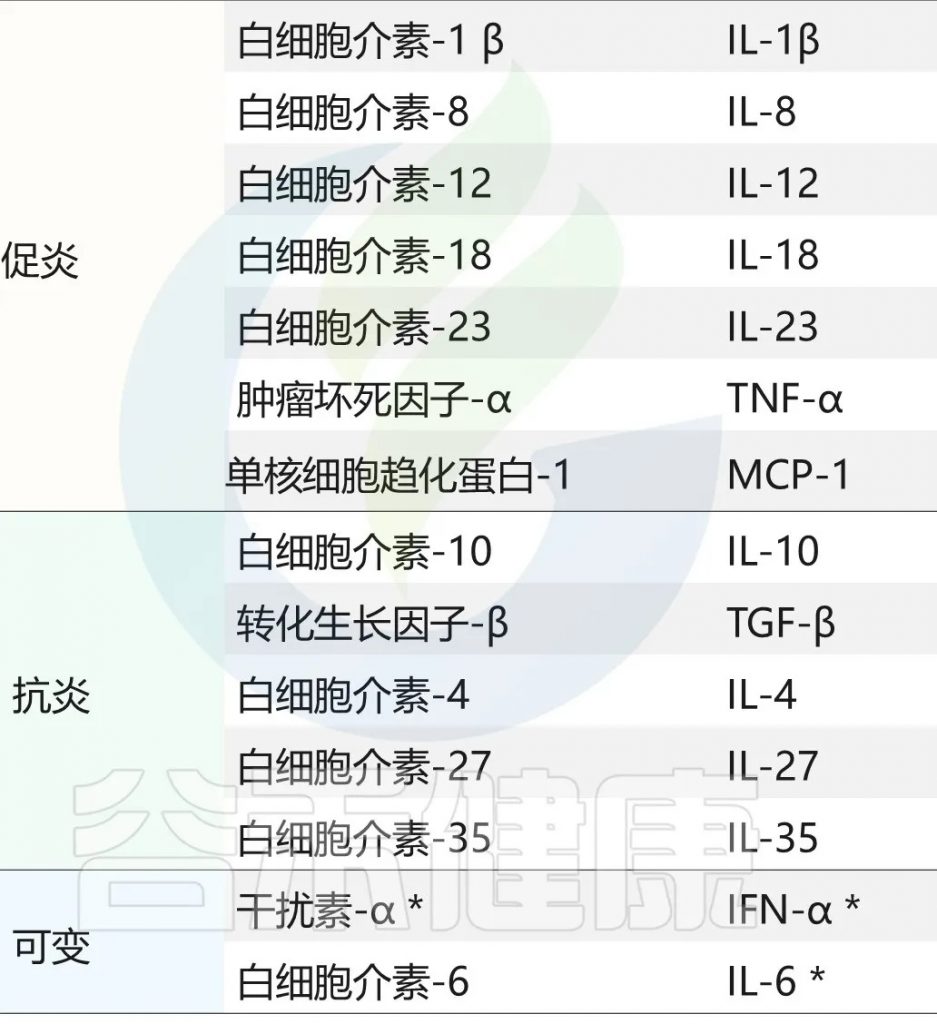
doi:10.3390/ijeph17207618
随着疾病的进展,炎症因子会呈现出不同的变化模式。在急性疾病中,IL-1β和TNF-α等促炎因子会快速升高,同时伴随着中性粒细胞趋化因子的显著增加。而在慢性疾病中,则常常表现为持续的低度炎症状态,多种炎症因子维持在较高水平,形成促炎和抗炎因子的失衡状态。
不同类型的疾病中,炎症因子往往表现出特征性的变化。以心血管疾病为例,患者体内的CRP和IL-6水平通常持续升高,同时伴有粘附分子表达的增加。在自身免疫性疾病中,TNF-α和IL-17的显著升高,以及特异性自身抗体的出现,往往是重要的诊断依据。而在代谢性疾病中,脂联素水平的改变和瘦素抵抗的出现,则与胰岛素抵抗密切相关。
炎症因子作为生物标志物在临床实践中有多重价值
在诊断方面,它可以用于疾病的早期筛查、鉴别诊断和病情评估;
在预后评估方面,能够预测疾病的进展趋势,评估并发症风险,并监测治疗效果;
在治疗指导方面,帮助医生选择合适的治疗方案,调整用药剂量,评价治疗效果。
了解炎症因子的作用机制不仅有助于我们更好地理解炎症过程,也为开发新的治疗策略提供了靶点,通过调节炎症因子的活性来治疗炎症性疾病,那么,如何有效地调节这些炎症因子的活性呢?近年来,越来越多的研究开始关注肠道菌群在调节炎症因子和免疫反应中的作用。
在疾病发展的早期阶段,即使在临床症状尚未显现时,身体内部可能已经发生了微妙的改变。肠道菌群作为人体最大的微生态系统,常常能够最早感知这些变化,并通过多种途径向身体发出预警信号。
我们以前的文章也有很多提及,肠道菌群不仅能影响局部的免疫反应,还能通过多种机制影响全身性的炎症状态,比如说:
代谢产物:
肠道菌群通过发酵膳食纤维产生短链脂肪酸(SCFAs),如乙酸、丙酸和丁酸,这些代谢产物能够调节免疫细胞的功能,特别是对调节性T细胞(Treg)的分化和功能具有重要作用,进而影响炎症因子的产生。
免疫细胞调节:
肠道菌群能够影响树突状细胞(DCs)和巨噬细胞的成熟和功能,这些免疫细胞在调节炎症因子的表达和释放中起着关键作用。
肠道屏障功能:
维持健康的肠道菌群有助于维持肠道屏障的完整性,防止病原体和有害物质的入侵,从而减少炎症因子的激活。
抗炎和促炎平衡:
某些肠道菌群成员能够促进抗炎细胞因子如IL-10的产生,而抑制促炎细胞因子如TNF-α和IFNγ的表达。
肠道菌群发出的预警信号,主要通过代谢产物、免疫细胞调节、肠道屏障功能维持以及抗炎促炎平衡等途径实现,而炎症因子则是传递这些预警信号的关键分子。
通过监测这些早期的分子标志物,我们可以在疾病发展的早期阶段进行干预,从而更有效地预防和控制炎症反应的发生发展。
接下来,我们将深入探讨常见的炎症因子(炎症标志物),包括C反应蛋白、粪便钙卫蛋白、TNF-α、IL-1、IL-6、IL-10、IL-17、IL-22等,这些炎症因子的具体功能,肠道菌群与这些炎症因子的关联等。
C反应蛋白(CRP)是一种重要的由肝脏产生的急性期反应蛋白,是临床上最常用的炎症标志物之一。比如,广泛使用于IBD筛查和评估疾病活动性、临床复发和治疗反应。
什么时候需要做CRP测试?
——急性
CRP水平在体内发生炎症或组织损伤时会急剧上升。比如说,感冒时身体的免疫系统会被激活,C反应蛋白的产生显著增加,反映了身体正在经历一种急性炎症反应,通常伴随着其他症状,如发热、 寒战、喉咙痛、全身乏力、呼吸急促、恶心呕吐等。一般出现这种情况的时候医生会要求抽血,看看CRP指标。
——慢性
除了感染性疾病的早期诊断外,CRP水平的升高还可用于判断疾病的严重程度和监测治疗效果。例如,在风湿性关节炎、狼疮、炎症性肠病、血管炎、哮喘等慢性疾病中,CRP常常作为一种重要的生物标志物,帮助医生评估病情进展及治疗反应。也可用于术后并发症监测。
例如,血液中高水平的hs-CRP与心脏病发作的风险增加有关。如果hs-CRP水平较高,心脏病发作的人更有可能再次心脏病发作。
CRP水平的高低意味着什么?
一般来说,健康人的血液中CRP含量很低。

CRP与肠道菌群有什么关联?
一项研究中,在CRP血浆水平升高的肥胖小鼠中,Akkermansia muciniphila的比例下降。
Phascolarctobacterium属成员的丰度与较低水平的CRP有关。这种关系可能会解释为什么该菌属比例的下降与结肠炎症有关:Phascolarctobacterium是丙酸的生产者,丙酸是一种短链脂肪酸,通过抑制促炎调节因子NFκB的活性来抑制促炎级联反应。同样,粪杆菌的丰度与CRP水平呈负相关。
因此,CRP是一种下游炎症标志物,可以通过特定肠道微生物的抗炎代谢产物的作用下调。
对BMI超过25的健康受试者的基线血清和微生物群数据的评估表明,CRP水平较高的受试者乳杆菌属和双歧杆菌属的细菌丰度明显较低,但大肠杆菌属和拟杆菌属的丰度较高。
钙卫蛋白是一种胞浆蛋白复合物,在中性粒细胞中组成性表达,并在肠道炎症期间迁移至肠粘膜时释放。
在健康状况下,钙卫蛋白具有免疫调节功能,对免疫防御至关重要;在慢性炎症性疾病中,钙卫蛋白可通过细胞因子受体结合和活性氧的产生来促进疾病进程。
钙卫蛋白——非侵入性生物标志物
自20世纪80年代钙卫蛋白的鉴定和表征以来,粪便钙卫蛋白成为一种经过显著验证的非侵入性生物标志物,可用于评估肠道炎症,是短期复发和IBD炎症活动的可靠预测指标。
举个例子:一个人去医院看病,主诉反复腹泻、腹痛、体重下降,有慢性腹泻的病史,过去几个月中症状有所加重,医生考虑他可能与肠道疾病相关,为了确诊,医生可能会开具粪便钙卫蛋白检测进行辅助诊断,帮助区分炎症性肠病和肠易激综合征。
钙卫蛋白水平高低意味着什么?
粪便钙卫蛋白与肠道菌群有什么关联?

一项来自TREND队列的大样本老年人研究发现,在高钙卫蛋白组与低钙卫蛋白组中,几种促炎肠道微生物属显著增加,而产短链脂肪酸菌减少。
在粪便钙卫蛋白升高的组中,几种产短链脂肪酸菌属(如梭菌属、Blautia、Turicibacter)的丰度降低与IBD、帕金森和心血管疾病中的许多发现一致。这些产生SCFA菌减少可能是几种疾病机制的关键,因为SCFA可以防止病原体,调节代谢,内分泌和免疫功能,并影响药物代谢和吸收。
发炎的肠道中较高水平的氧气可以允许肠杆菌科的有氧呼吸,同时抑制专性厌氧菌、拟杆菌和产生SCFA的梭菌的生长。此外,通过与富含脂肪的西方饮食的相互作用,含有促炎脂多糖作为膜成分的革兰氏阴性菌可能会引发炎症和粪便钙卫蛋白水平升高。
血清中,高粪便钙卫蛋白组IL-17 C、CCL 19和毒性代谢产物硫酸吲哚酚升高。这些变化部分由肠道微生物群介导。此外,高粪便钙卫蛋白组显示BMI增加,心脏病发作和肥胖的患病率较高。
在免疫疗法治疗肝细胞癌患者期间,粪便钙卫蛋白显示出与阿克曼氏菌与肠杆菌科比例和肠道微生物群α多样性相反的时间演变,但与zonulin-1和LBP相似。
肿瘤坏死因子-α(TNF-α)是驱动炎症的关键细胞因子。TNF-α在炎症级联反应的上游启动阶段,是Th1信号通路关键的细胞因子,在人体免疫系统中扮演着“紧急呼叫器”的角色。
该分子水平升高与胰岛素抵抗和葡萄糖耐受不良相关,因为TNF-α能够激活各种信号传导途径,包括mTOR途径,使其成为代谢疾病发展中的关键分子。
TNF的“好”
TNF诱导睡眠,并增加非快速眼动睡眠。因此,当我们晚上想入睡时,它提高一些是很好的。TNF在健康人中在夜间自然升高。
TNF是一种直接的脂肪克星,它导致脂肪细胞中的胰岛素抵抗,但也导致肌肉细胞中的胰岛素抵抗。这意味着葡萄糖不能进入这些细胞。
TNF通过抑制食欲素来抑制食欲。因此,高水平的TNF会使你吃得更少,并抑制葡萄糖进入脂肪细胞,从而使你变瘦。如果你减少TNF,会变得更饿,储存更多的脂肪。因此,抗TNF治疗导致体重增加并不奇怪。
TNF的“坏”
TNF通过抑制食欲素让人感到疲劳,降低情绪并降低认知和身体表现。
注:食欲素是一种非常重要的神经递质,对许多身体功能。食欲素在记忆获得和巩固以及长期记忆强化中起着许多关键作用。因此,如果你有炎症升高,它会损害你的认知能力。
TNF可以通过破坏线粒体造成持久的伤害。
TNF还可以降低甲状腺激素,导致“低T3综合征”。它也可以降低睾酮(趋势,但不显著)。
TNF会减缓伤口愈合,这意味着需要更多的时间从运动/受伤中恢复。
TNF可诱导“肠漏”。
长期升高的TNF-α也会扰乱昼夜节律并导致白天疲劳。
与TNF-α相关的疾病:炎症性肠病(IBD)、类风湿性关节炎(RA)、2型糖尿病、肥胖、系统性红斑狼疮、神经退行性疾病、精神分裂症等。
哪些肠道菌群与TNF-α呈负相关?
哪些肠道菌群与TNF-α呈正相关?
TNF-α在不同类型的感染中表现出不同的作用,例如在真菌感染中,TNF-α通过调节Th17/Th2和中性粒细胞/嗜酸性粒细胞的平衡来影响炎症反应。而在克罗恩病患者中,TNF-α的诱导活性与某些革兰阴性菌有关。
肠道菌群通过其代谢产物,如短链脂肪酸,可以影响TNF-α的水平。短链脂肪酸能激活AMPK,减少FIAF(诱导型脂肪因子)的产生,从而抑制脂多糖的活性,进而影响TNF-α的产生。
★ 如何减少TNF-α?
生活方式:运动(骑车)、瑜伽、太极拳、睡眠不足后的小睡、谈恋爱等。
饮食:沙丁鱼、蘑菇、大蒜、蜂蜜、大豆、苦瓜、十字花科蔬菜(西兰花、花菜)、水果(红树莓、蓝莓、黑醋栗果、李子、桃、荔枝、巴西莓)等。
其他补充剂:姜黄素、鱼油、肉桂、精氨酸、甘氨酸、组氨酸、铬、植物淄醇、黄芪、青蒿素、柠檬苷、辅酶Q10、紫锥菊、葡萄糖胺、小檗碱、黄芩、银杏、南非醉茄、槲皮素等。
IL-1是一种重要的促炎细胞因子。促进炎症细胞的招募和活化,增加血管通透性,吸引免疫细胞到达炎症部位。参与调节T细胞和B细胞的活化、增殖和分化,促进发热反应、疼痛、肿胀。同时也可以诱导某些细胞类型的凋亡,参与组织修复和再生。
与IL-1相关的疾病:自身免疫性疾病、感染性疾病、心血管疾病、代谢性疾病、神经退行性疾病等。
哪些肠道菌群与IL-1呈负相关?
哪些肠道菌群与IL-1呈正相关?
肠道菌群代谢产物,短链脂肪酸,通过激活AMPK和抑制PGC-1α,进而影响IL-1的产生。
◆ IL-1β
IL-1β是IL-1家族的重要成员之一,同属于促炎性细胞因子,IL-1β常作为特异性炎症标志物。
IL-1β的“好”
IL-1β是诱导睡眠机制的一部分,并增加非快速眼动睡眠,IL-1β具有昼夜节律,在睡觉前升高,但如果你是夜班工人,它会转移到白天。
IL-1在记忆功能中发挥作用,所以人需要一定水平的IL-1,但要“尽可能低”。
在啮齿动物中,IL-1β增加了催产素和加压素的释放。
IL-1β增加NGF。
NGF和NT-3在刺激神经突起生长方面有些独特,这是NGF、BDNF或NT-4无法单独完成的。IL-1β还会增加GDNF,这再次刺激神经突起的生长。
此外,它可以通过增加bFGF来增加多巴胺促进神经元。
IL-1β的“坏”
如果你的IL-1水平升高,那么这将影响你的情绪、认知功能、清醒程度和动力,需要关注降低慢性炎症。
IL-1与抑郁症有关,可能通过减少雌激素合成、增加黄体酮分解影响情绪,同时降低雄性激素水平。压力可通过IL-1b介导的途径导致抑郁,同时损害认知能力,影响学习和记忆,这可能与脑源性神经营养因子(BDNF)的减少有关。
IL-1通过抑制食欲素引起疲劳,并与焦虑、HPA轴激活、IBS、认知缺陷和多种慢性疾病相关。
IL-1β与低睾酮水平相关,可能通过影响甲状腺激素和皮质醇水平降低性能。它还抑制胰岛素释放,影响血糖水平,降低乙酰胆碱水平,并在肠道中抑制胃酸,可能导致幽门螺杆菌感染失控。
IL-1β与肠道菌群的关联
★ 如何减少IL-1β?
饮食:蔬菜和水果(花青素)、芹菜、生姜、十字花科蔬菜(西兰花、花菜)、燕麦鱼(虾青素)等。
益生菌:植物乳杆菌等
其他补充剂:维生素A、VB2、穿心莲、β-葡聚糖、葡萄籽提取物、水飞蓟素、红景天、黄连素、小檗碱、葡萄籽提取物、鱼油、茶多酚、蜂蜜、黄芩苷、迷迭香酸、丹参、锌(如果缺乏)、苜蓿、白术、紫苏等。
IL-6是与系统性炎症相关的炎症因子,调节免疫反应,参与激活和分化T细胞,促进B细胞分化和抗体产生,促进急性期蛋白的合成,促进中性粒细胞的募集,参与炎症性疾病的发生发展。
IL-6在中枢神经系统中也发挥作用,参与调节神经炎症和情绪反应。
IL-6可以通过两种方式激活细胞:
IL-6在你生病和运动后升高,特别是有氧运动。如果运动增加炎症标志物,那么怎么理解运动是健康的?
当你运动时,肌肉会释放IL-6,这是抗炎的。然而,当免疫细胞(巨噬细胞)释放它时,它是促炎性的。
IL-6还抑制Th1细胞,同时诱导Th2细胞,因此对Th2占主导地位的人来说情况更糟。它还增加了B细胞,这是产生抗体并导致过敏和自身免疫的原因。
不易患自身免疫性疾病的人也可能患有IL-6升高。这是与现代文明病有关的细胞因子。最常见的原因可能是肥胖。
IL-6升高的其他常见原因可能是慢性压力、睡眠太少、吃得太多(特别是吃太多糖或精制食品)、吸烟、过量酒精、运动过多。
IL-6的“坏”
IL-6水平在几乎所有疾病状态中都升高。
它减少了Treg细胞,这反过来又阻碍了我们对摄入的蛋白质产生耐受性的能力-引起过敏。它还增加了中性粒细胞的产生,这是炎症。
IL-6是中年后期认知能力下降的一个很好的预测因子。
IL-6可能会导致情绪恶化,绝望的感觉。IL-6还与暴力自杀、冲动和避免单调乏味相关。
IL-6导致血糖水平升高,增强了应激激素(CRH)对肠道粘膜的影响,导致IBS。IL-6可导致肠漏。
IL-6通过抑制(或超甲基化)对GABA正常工作重要的基因(GAD 67)而导致精神分裂症。
IL-6是CRP最有效的诱导剂,CRP就是我们前面讲的炎症标志物。
它可以通过增加IgG和IgM抗体产生和恶化食物敏感性和自身免疫问题。
IL-6也会导致皮肤问题。IL-6在患有皮肤真菌变色菌的人中升高。IL-6还增加了Th 22细胞,这破坏了皮肤微生物平衡。
IL-6的“好”
IL-6如果升高大多是不好的,但短暂的峰值可能是有益的。
TNF和IL-1β增加IL-6,但IL-6反过来抑制这两种细胞因子,其比IL-6本身更有害。在这种方式下,它是一种抗炎。抑制TNF,分解脂肪细胞并降低胰岛素抵抗。
IL-6在一些细菌、病毒和真菌感染中起保护作用。
IL-6的正常水平是什么?
在健康受试者中,IL-6血液水平几乎检测不到,范围在2-6 pg/ml之间。另一项研究提到,健康人的平均水平为0.5 pg/ml 。
抑郁症患者的IL-6水平比健康人高约1.78 pg/ml。
在患有风湿性关节炎的人中,水平可以增加到1000倍(不常见)。在败血症中,这是非常危险的,它可以增加到一百万倍。
IL-6与肠道菌群有什么关联?
高脂饮食会削弱粘液层的完整性,增加血液中LPS的水平,通过TLR-4传递,导致血液中TNF-α、IL-1、IL-6和PAI-1(纤溶酶原激活抑制剂-1)的水平升高,引起系统性炎症。
坏死的肠道粘膜细胞会刺激巨噬细胞产生IL-6。
★ 如何减少IL-6?
生活方式:情绪积极、睡眠不足后的小睡、听音乐等。
饮食:地中海饮食、燕麦、多酚、坚果(腰果)、豆类、橄榄油、蔬菜、蓝莓、红树莓、蜂蜜等。
其他补充剂:鱼油、植物甾醇、螺旋藻、维生素B2、VB12、VE、镁、铬、锌、精氨酸、组氨酸、甘氨酸、银杏、维生素E、黄芩苷、乳铁蛋白、葡萄籽提取物、黄芪、丹参、紫锥菊、迷迭香酸、牛至、鼠尾草等。
IL-10是一种重要的抗炎因子。
它能抑制促炎细胞因子的产生(如TNF-α、IL-1β、IL-6),降低抗原呈递细胞的活性,减少炎症细胞的募集,有助于炎症反应的消退。抑制Th1细胞的活化,从而调节Th1/Th2平衡。
IL-10的“好”
在自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮等)和移植免疫中,IL-10有助于防止自身反应性T细胞的活化,减少对移植器官的排斥反应。
IL-10抑制COX-2,这是参与偏头痛,疼痛和炎症。COX-2通常被非甾体抗炎药如阿司匹林和布洛芬阻断。
通过抑制肥大细胞,它抵消了这些细胞在过敏反应部位的炎症作用。
IL-10通过减少暴饮暴食并降低下丘脑(控制食欲的腺体)中的胰岛素和瘦素抵抗(通过抑制细胞因子、Nf-kB和ER应激)来减少肥胖。
IL-10的“坏”
IL-10可以阻断对病毒感染的反应,甚至直接增加病毒蛋白的产生,比如说,在慢性疲劳综合征中,IL-10增加;慢性感染的丙型肝炎患者在遗传上倾向于高IL-10产生,对治疗的积极反应较低。
平衡 IL-10 的“好”与“坏”
Th 1免疫系统,特别是CD 8 + T细胞和IFN γ,是人体对抗癌症的机制的一部分。阻断IL-10显示出作为癌症治疗的前景。然而,IL-10在某些情况下也通过促进细胞毒性T细胞活性和IFN-γ产生而发挥保护性抗癌作用。
重要的是认识到全身和癌组织中的IL-10水平之间存在差异。如果IL-10在正常组织中处于健康水平,在癌组织中处于低水平,那么这是比较理想健康的。
血液中IL-10的水平并不一定代表肠道或其他组织中的水平,但通常存在相关性。
在现代环境中,高IL-10水平可能比低IL-10水平更好,因为可以对抗细菌感染。
IL-10与肠道菌群有什么关联?
乳杆菌、双歧杆菌、普氏粪杆菌、某些产丁酸菌:能促进IL-10的产生,从而改善肠道炎症。
益生菌通过促进调节性T细胞(Treg)的分化来增加IL-10的产生。
★ 如何增加IL-10?
生活方式:运动、晒太阳、冥想等。
饮食:芝麻油、肉桂、大蒜、辣椒素、甘草、芥末等。
益生菌:植物乳杆菌、布拉氏酵母菌、干酪乳杆菌、枯草芽孢杆菌等。
益生元:阿拉伯半乳聚糖
其他补充剂:姜黄素、表儿茶素EGCG、Boswellia、橄榄苦苷、褪黑素、白藜芦醇、维生素D3、辅酶Q10、植物甾醇等。
IL-17(白细胞介素-17)是一种重要的促炎细胞因子,在自身免疫和炎症反应中发挥关键作用。IL-17能够促进多种细胞产生炎症因子,如IL-1β、TNF-α和IL-6,促进中性粒细胞募集,加剧炎症反应。
在肿瘤微环境中具有双重作用,既可以促进抗肿瘤免疫反应,也可能促进肿瘤的侵袭和转移。
与自身免疫性疾病、肿瘤、感染性疾病等相关。
IL-17水平的变化可以作为某些疾病预后的生物标志物。
IL-17 C属于IL-17细胞因子家族,由上皮细胞而不是免疫细胞产生。它作为对上皮损伤的快速局部自分泌反应,促进抗微生物保护反应和肠屏障维持。
分节丝状菌(SFB):通过其鞭毛蛋白促进其产生。
青春双歧杆菌(Bifidobacterium adolescentis):能够诱导肠道Th17细胞积累,从而促进IL-17的产生。
IL-22(白细胞介素-22)是IL-10家族的重要成员,主要参与组织修复和黏膜免疫。
具体来说,IL-22在组织损伤后的修复和再生过程中起着重要作用,特别是在肝脏和肠道等上皮组织中。
它是一种促炎细胞因子,但它也能发挥抗炎作用,特别是在抑制过度的炎症反应和促进组织稳态方面。
IL-22能够增强上皮细胞的抗菌肽表达,从而增强机体对细菌和病毒感染的防御能力。
在急性结肠炎中具有保护作用,但在慢性结肠炎中,IL-22与IL-17A协同介导致病性。
分节丝状菌(SFB):通过鞭毛蛋白参与调节其产生,诱导SAA产生来促进IL-22的分泌,刺激树突状细胞促进IL-22的产生。
IFNγ(干扰素-γ)是一种重要的细胞因子,它在免疫反应、抗感染、抗肿瘤和调节免疫应答中扮演着重要角色。
IFNγ是Th1细胞介导免疫反应的关键因子,它能够促进Th1细胞的分化,并抑制Th2细胞的分化,从而调节Th1/Th2平衡。
在某些自身免疫性疾病中,如多发性硬化症和类风湿性关节炎,IFNγ的过度产生与疾病的发生和发展有关。
肿瘤:IFNγ在肿瘤免疫监视中起关键作用,但其在肿瘤微环境中的作用可能更为复杂,包括促进肿瘤免疫逃逸。
TGF-β(转化生长因子-β)是一种多功能细胞因子,在调节免疫反应和促进Tregs细胞的增殖中起作用。
肠道菌群的变化可以影响TGF-β的产生,进而影响Tregs和Th17细胞的平衡。
丁酸梭菌,诱导树突状细胞中TGF-β信号传导,进而诱导调节性T细胞(Treg)的产生。
以上我们了解一些常见的炎症因子的功能,与肠道菌群的关联,基于这一认识,我们将进一步探讨这种异常变化如何表征不同疾病的风险,以及如何通过早期干预来预防和治疗相关疾病。
在探讨肠道菌群与炎症因子异常之间的关系时,我们不得不关注它们在多种慢性疾病中的作用,尤其是那些与炎症密切相关的疾病。
这里我们通过举例分析几种典型疾病(抑郁症、心血管疾病、炎症性皮肤病)中肠道菌群与炎症因子的动态变化特征,更深入地理解肠道菌群如何作为炎症反应的早期指标,为疾病的早期预防和个体化治疗提供科学依据。
抑郁症是一种常见的精神障碍,其特征为情绪低落、食欲不振和高自杀率。研究表明,炎症反应在抑郁症的发病中起着关键作用,炎症水平的紊乱可增加抑郁症的发病率。
调节炎症水平可能是肠道菌群影响宿主健康的途径之一。通过调节特异性肠道菌群和炎症反应,可以实现抑郁症的早期预测、预防和个性化治疗。
➤ 抑郁症
一项研究通过孟德尔随机化分析方法确定了15个与抑郁症相关的肠道菌群分类群和4种细胞因子,并证实了某些细胞因子在肠道菌群对抑郁症影响中的介导作用。
研究发现,Romboutsia、Intestinimonas、瘤胃球菌UCG 011等对抑郁症具有保护作用。
Romboutsia,Ruminococcaceae UCG 011,Intestinimonas都是产丁酸菌,临床研究发现,Romboutsia的丰度与帕金森病患者的抑郁状态呈负相关。同样,应激耐受性较差的小鼠含有较少的Romboutsia,导致对抑郁症的易感性更高。
Intestinimonas与IL-10水平呈正相关,与能够修复肠道损伤的促炎细胞因子DAO、D-LA呈负相关。
瘤胃球菌科UCG 011能够影响促炎细胞Th17的分化,减少促炎细胞因子IL-17的分泌,改善慢性炎症,缓解疼痛和焦虑抑郁症状。
毛螺菌FCS 020、链球菌、Marvinbryantia等被确定为抑郁症的危险因素。
毛螺菌科FCS 020能够诱导炎症反应,与血清脂多糖和细胞因子产生正相关,并且在自闭症儿童中丰度增加。
链球菌是一种与LPS密切相关的促炎性肠道菌群。
Marvinbryantia在慢性轻度应激大鼠中数量增加。
ADA 和 IL-18 R1是抗抑郁的保护性细胞因子。
VEGF_A和TNFSF 14是促进抑郁的危险因子。
抑郁症的严重程度与VEGF_A呈正相关。这可能与VEGF介导的血脑屏障功能障碍有关。许多抗抑郁药物通过调节VEGF_A发挥抗抑郁作用,因此VEGF_A对抑郁症的治疗效果具有预测作用。
TNFSF 14是TNF受体超家族的成员,其通过激活NF-κB信号通路促进促炎细胞因子的产生。TNF损害神经递质的合成并降低5-羟色胺的可用性,导致神经毒性代谢物的积累,这反过来会导致神经系统损伤并导致抑郁症。
循环细胞因子介导的肠道菌群对抑郁症的影响
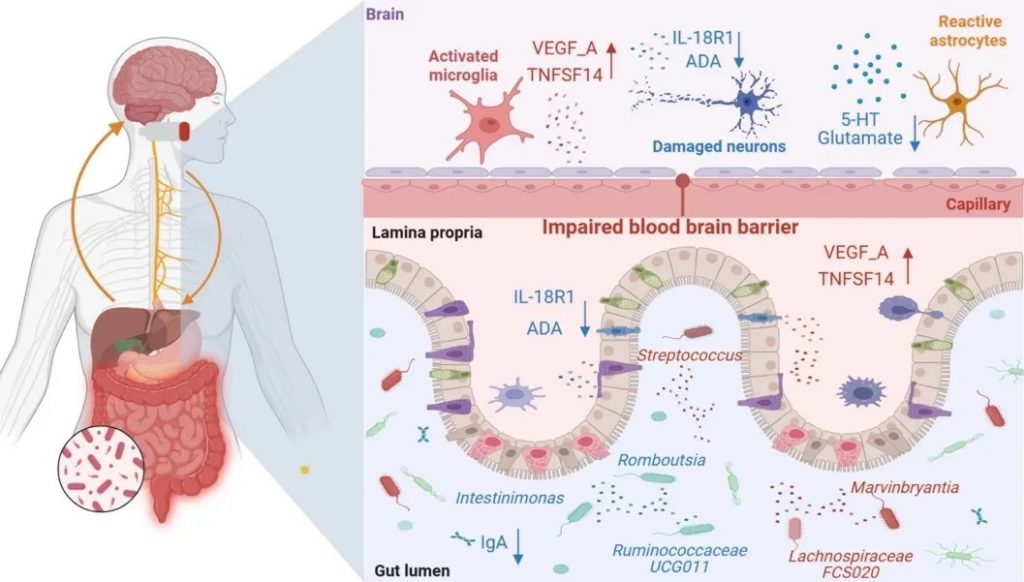
doi.org/10.1007/s13167-024-00379-z
➤ 重度抑郁症(MDD)
一项研究探讨了首发未经治疗的重度抑郁症(MDD)患者的肠道菌群组成与炎症因子和认知功能之间的关系。
研究发现MDD患者的肠道菌群多样性显著降低,某些菌群如拟杆菌属、Alistipes增加;一些菌群如梭菌科、Turicibacter减少。这些肠道菌群的改变与炎症因子(如IL-6、CRP)水平升高以及认知功能障碍(如执行功能、记忆力下降)显著相关。
在MDD患者中,拟杆菌科和拟杆菌属均与hsCRP、CCT1、CCT2呈正相关。
拟杆菌属是嗜酸性和革兰氏阴性的,是存在于人类胃肠道系统中非常丰富的细菌。拟杆菌属的某些菌株由于其许多能力对人类健康有利。然而,当人们经历压力,如休克,虐待,失去家庭成员等。拟杆菌属物种的某些菌株如脆弱拟杆菌可分泌脂多糖(LPS)、细菌淀粉样蛋白、内毒素(如脆弱溶素)和外毒素。这些神经毒素刺激各种细胞类型中TNF-α、IL-1β、IL-8、IFN-γ、CXCL 8和其他炎性细胞因子和趋化因子的释放,导致对这些细菌分子病原体的炎症反应。
活化的炎症反应可以破坏肠粘膜屏障以及血脑屏障,并且进一步地,它们可以活化CNS的小胶质细胞。发现活化的小胶质细胞参与促炎细胞因子的分泌,包括IL-1β、IL-6、TNF-α和TGF-β,从而有助于患有神经障碍的个体中认知障碍的发展。
Alistipes与IL-6呈正相关,与延迟记忆、总分和标准化评分呈负相关。
Alistipes也是促炎细菌,有研究表明,Alistipes属以IL-6依赖性方式参与促进炎症和肿瘤发生。本研究中Alistipes与IL-1、IL-6无显著相关性,与TNF-α呈负相关。因此,Alistipes可以通过炎症反应以外的其他方式加重认知障碍。
扩展阅读:
肠道重要菌属——另枝菌属(Alistipes),调节炎症情绪等的潜力菌
Clostridiaceae、Turicibacterae、Turicibacter与IL-1β和IL-6均呈负相关。
➤ 伴有厌食症的重度抑郁症
与健康个体相比,患有厌食症重度抑郁症患者具有不同的肠道微生物群,具有更高的CRP水平。伴厌食症的抑郁症患者中Blautia含量更丰富,并与CRP、HAMD评分和厌食症呈正相关。肠道菌群可能通过炎症因子CRP影响MDD和厌食症。
粪杆菌、拟杆菌、Roseburia和副拟杆菌与厌食、HAMD评分和CRP水平呈负相关。
短链脂肪酸通过干扰NF-κB通路发挥抗炎作用,补充短链脂肪酸可以减少炎症并缓解抑郁症状。
因此,MDD患者中产短链脂肪酸菌的减少可能会通过炎症反应引起抑郁症。这些炎症分子干扰食欲并促进厌食。下丘脑的炎症通过上调5-羟色胺的可用性,并刺激其在下丘脑中的信号传导途径而引起厌食症。
总的来说,由于肠道生态失调引起的免疫失衡是抑郁症发病的早期风险指标。这为利用无创肠道菌群检测对抑郁症进行早期筛查、及时预防和个性化治疗提供了依据。通过将非侵入性肠道菌群检测与现有方法(如心理问卷)相结合,可以共同预测和评估患抑郁症的风险。
心血管疾病(CVD)对人类健康构成了巨大的威胁。炎症是心血管疾病病理过程的普遍原因,包括免疫细胞的激活、积聚和炎症因子的释放。
➤ 动脉粥样硬化(AS)
动脉粥样硬化是CVD的病因之一。脂质沉积和持续性血管炎症被认为是动脉粥样硬化斑块进展的两个核心因素。
一项基于粪便宏基因组学、临床测量和流行病学的研究表明,日常饮食通过影响肠道微生物群促进动脉粥样硬化的形成,而抗炎反应功能障碍可能是核心过程。
脆弱拟杆菌的增加减少了乳酸杆菌的丰度,增加了脱硫弧菌科的丰度,导致葡萄糖或脂质代谢功能障碍,加重炎症反应。
循环中低密度脂蛋白含量显著增加,斑块中CD 36、F4/80增加,促进主动脉斑块的形成和动脉粥样硬化的进展。
衰老是动脉粥样硬化发展的另一个关键危险因素。
在炎症反应加重的衰老个体中,参与花生四烯酸(AA)代谢途径的组分(如20-HETE、PGF 2 α、花生四烯酸和LTB 4)显著增加。因此,建议肠道微生物群与动脉粥样硬化可能通过“肠道微生物群-代谢物-局部炎症-动脉粥样硬化”轴联系起来。
花生皮提取物(PSE)可降低动脉粥样硬化小鼠的血清TC和LDL-C含量,增加HDL-C含量,从而减缓动脉粥样硬化斑块的形成。
天麻素可以调节肠道微生物种类和丰度,降低促炎细胞因子TNF-α和IL-6的水平,增加抗炎因子IL-10的水平。
通心络干预是一种传统中药,通过增加肠道中益生菌的水平来改变斑块稳定性,从而增加有益代谢产物的含量,如反式阿魏酸,这可以抑制斑块中NLRP 3相关的炎症通路并稳定斑块。
乳酸杆菌的管理减少了来自受干扰的肠道微生物群的毒素,并增加了SCFA的水平,抑制了动脉粥样硬化的进展。
黄酮类化合物通过抑制TMA裂解酶而具有治疗冠心病的作用。
燕麦纤维可以防止动脉粥样硬化的恶化,阻断了TLR 4信号通路,降低了NF-κB p65的表达,并通过影响肠道微生物源性异丁酰-L-肉碱、戊酰肉碱、1-甲基鸟苷和2-甲基鸟苷来维持肠粘膜屏障的完整性。
鱼油衍生的长链单不饱和脂肪酸(LCMUFA),通过降低厚壁菌门和拟杆菌门的比例,增加肠道中阿克曼氏菌的丰度,上调SCFA以及SCFA诱导的一些胰高血糖素样物质来维持肠道微环境的平衡,降低了血清中炎性细胞因子的水平,抑制了动脉粥样硬化病变的进展。
支链氨基酸(BCAA)补充剂可以通过调节炎症来减轻动脉粥样硬化,包括减少巨噬细胞浸润、降低炎症因子的血清水平和抑制炎症相关信号通路。
➤ 慢性心力衰竭(CHF)
对53名慢性心力衰竭患者和41名对照成员的粪便宏基因组分析显示,慢性心力衰竭患者的肠道微生物群组成和代谢特征与对照组有显著差异,提示肠道微生物群功能障碍与慢性心力衰竭密切相关。
当肠道微生物群被破坏时分泌的LPS,以TLR4依赖性方式减少ZO-1紧密连接(TJ),并诱导肠上皮TJ的明显变形,导致肠屏障完整性的破坏。
心力衰竭患者会发生慢性全身炎症反应,血浆中几种促炎细胞因子的水平与疾病的严重程度和预后相关。肠道微生物群破坏和细菌产物(如LPS)易位到血液中是炎症过度状态的主要因素。
LPS是最强的促炎介质之一,可诱导心力衰竭患者血清中TNF-α、IL-1和IL 6的释放。另一方面,LPS通过TLR 4直接诱导心肌细胞损伤。
研究表明,晚期心力衰竭患者心脏中TLR 4的表达增加,与心脏炎性损伤高度相关,而抑制TLR 4可缓解心力衰竭的进展。
然而,一些研究表明,通过适当调节肠道微生物群,从而减轻或逆转心室重塑,可以减轻炎症。
目前有报道称,一些中药,如芪荔强心(QL),可稳定心力衰竭后的肠道菌群,通过减少炎症因子(如NLRP 3、IL-1β和TNF-α)的产生来抑制心肌纤维化和心脏重塑。
严重的心力衰竭总是伴随着肠道功能障碍。因此,重视肠功能的维持,可能会改善心力衰竭患者的预后。
肠道微生物群失衡会加重心血管疾病
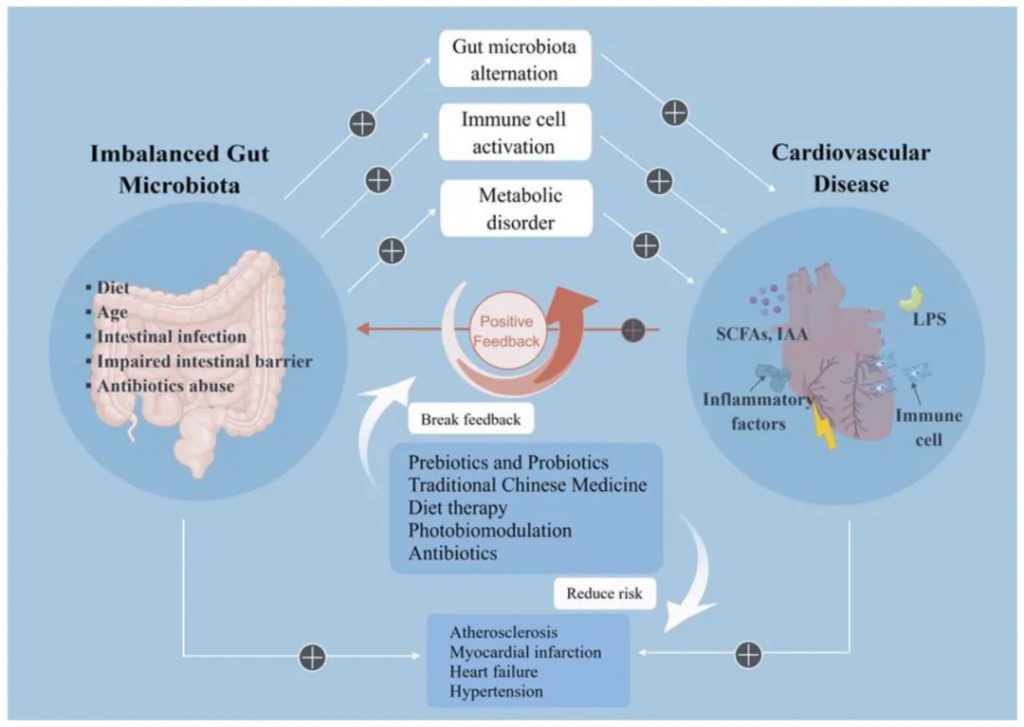
doi.org/10.3390/nu15030607
➤ 高血压
• 高盐饮食与肠道菌群失衡:
高盐饮食导致乳杆菌属减少,这些菌株能够产生肠道吲哚-3-乳酸,进而影响Th17细胞的活化。
• Th17细胞与炎症因子IL-17A:
Th17细胞的活化与IL-17A的产生增加有关,IL-17A通过上调肾脏中的钠转运蛋白(如钠氢交换蛋白3和氯化钠共转运蛋白)促进肾钠再吸收,这可能导致盐敏感性高血压。
• 益生菌治疗与血压调节:
用鼠乳杆菌(Lactobacillus murinus)进行的益生菌治疗可以预防小鼠的盐敏感性高血压,这表明通过调节肠道菌群可以影响血压。
• 高盐饮食与肠道菌群代谢物:
高盐饮食降低了肠道中脆弱拟杆菌和花生四烯酸的水平,这可能增加肠源性皮质酮的产生,进而提高血清和肠道中的皮质酮水平,促进血压升高。
• 饮食中钠的减少与SCFA:
减少饮食中的钠可以增加循环中的短链脂肪酸(SCFA),降低血压,这表明菌群代谢物SCFA可能在血压调节中发挥作用。
• 神经炎症与高血压:
肠道微生物群的紊乱及其代谢产物失调,会刺激巨噬细胞释放过量的炎症因子,加剧高血压的进展。
• 交感神经系统的激活与肠道菌群:
交感神经系统的激活增加了肠粘膜的渗透性,破坏了肠道微生物群的平衡,导致炎症细胞的动员和分化,这些炎性细胞返回大脑后加重神经炎症。
双歧杆菌能够增加eNOS的活性,降低血清过氧化氢酶的活性,这可能有助于维持血管的舒张和降低血压。
高纤维饮食增加了共生细菌的丰度,抑制了机会致病菌的繁殖,例如,产乙酸菌比例的增加有效降低了血压,减轻了心脏肥大和纤维化。
总的来说,维持肠道微生物群的稳定性对CVD的进展具有抑制作用。合适的饮食疗法,如益生菌和益生元补充剂,可以维持肠道微生物群的平衡,这已被证明可以有效降低血液中炎症因子的水平,改善心血管疾病的预后。
炎症性皮肤病代表了一组具有多种病因的疾病,包括遗传因素、感染和免疫失调,涉及先天性和适应性免疫系统中各种免疫细胞和炎症介质的激活。
一项研究首次使用双样本MR分析评估肠道微生物群与炎症性皮肤病之间的双向因果关系。
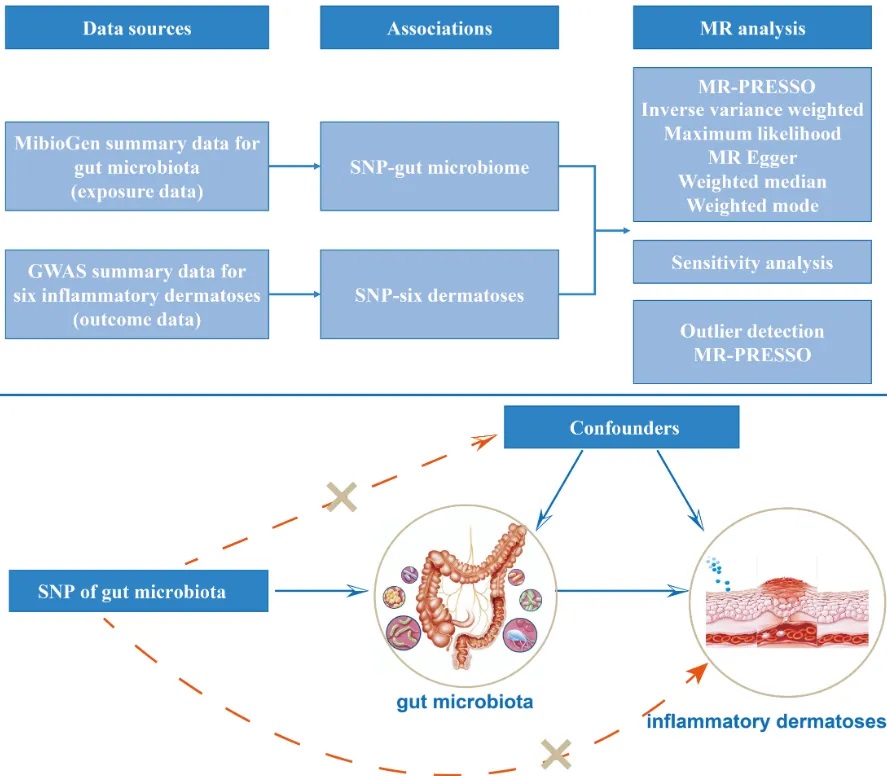
doi.org/10.3389/fimmu.2023.1231848
▸阿克曼氏菌属、瘤胃球菌属、双歧杆菌属、真杆菌属、粪球菌属等:
产生乙酸盐、丙酸盐和丁酸盐,通过GPCR和PPARγ受体调节免疫细胞,减少炎症因子释放,抑制组蛋白脱乙酰酶(HDAC),促进线粒体脂肪酸β-氧化。
▸乳酸杆菌和双歧杆菌:
增加色氨酸(Trp)和Trp代谢物,维持肠道屏障功能,减少痤疮炎症。
▸长双歧杆菌特殊作用:
将Trp代谢为吲哚-3-甲醛(I3C),通过AHR途径抑制Th2细胞,缓解特应性皮炎(AD)。
▸双歧杆菌、乳杆菌、Roseburia:
将多不饱和脂肪酸代谢为共轭亚油酸(CLA),抑制COX-2/5-LOX途径,抑制TLR4/NF-κB信号通路,减轻特应性皮炎皮肤病变。
▸硫酸盐还原菌(SRB):
如Desulfovibrionaceae,产生硫化氢(H2S),干扰丁酸盐氧化,损害肠道屏障,增加炎症因子释放。
以银屑病(牛皮癣)为例
银屑病是一种慢性复发性炎症性皮肤病,其特征是促炎细胞因子的释放增加。
Th-1、Th-17、Th-22细胞的扩增和活化, 一旦活化,这些细胞促进大量促炎介质的产生,包括但不限于来自角质形成细胞、淋巴细胞和其它免疫细胞的TNF-α、IL-6、IL-1、IL-17、IL-22、IL-23、VEGF、IFN-γ。此外,这些细胞促进皮肤病变的免疫发病机制,并在银屑病过程中驱动全身参与。
通过健康的饮食和运动获得的体重减轻能够改善银屑病的临床病程和治疗反应,甚至防止其发生,这种平衡的一个关键因素是肠道微生物群。(这在我们之前的文章中也详细阐述过)
肠道菌群在代谢综合征和银屑病中的多效性作用
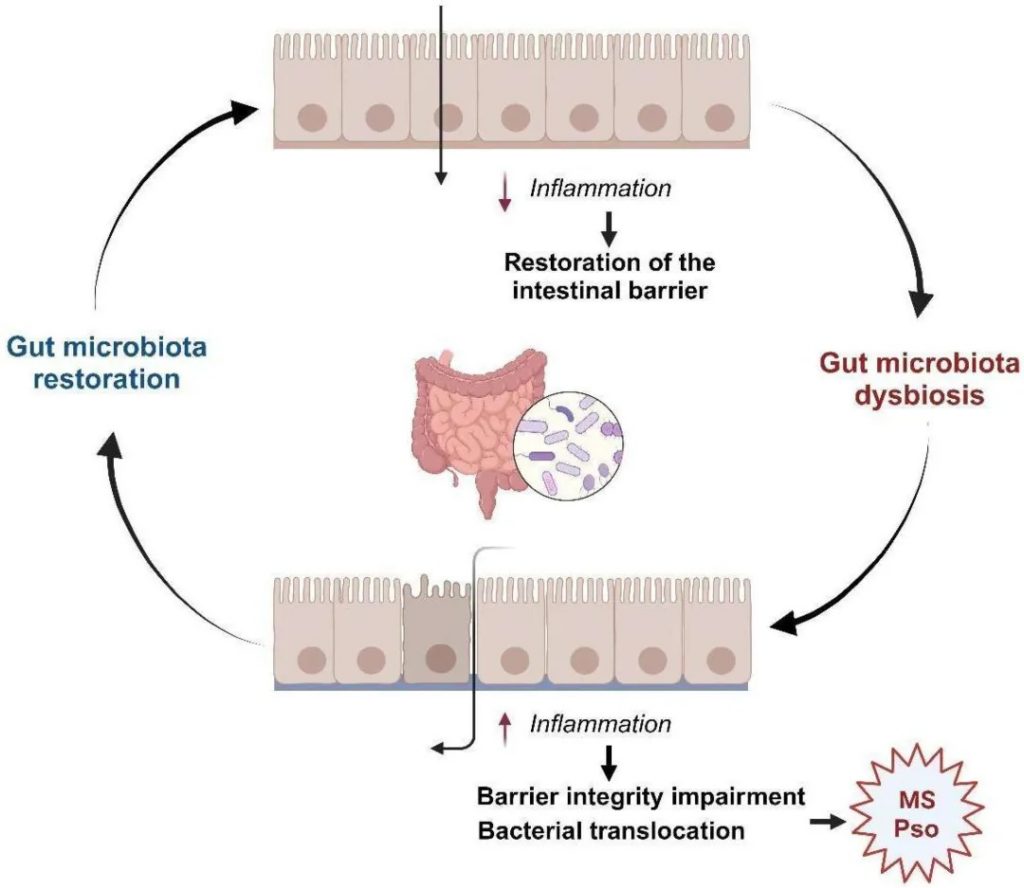
doi.org/10.3390/ijms25158098
哪些菌群产生炎症因子,影响银屑病发生发展?
厚壁菌门中,金黄色葡萄球菌(Staphylococcus aureus)产生超抗原如TSST-1,其刺激角质形成细胞和DC分别产生促炎细胞因子和IL-23。这导致Th17细胞活化和IL-17产生,促进银屑病特征。
放线菌门中,纹状体棒状杆菌(Corynebacterium striatum)直接刺激角质形成细胞和DC产生IL-1β、IL-6和IL-23,增强Th17细胞分化。
在变形菌门中,大肠杆菌和粘膜奈瑟氏菌(Neisseria mucosa)通过LPS激活巨噬细胞和DC,触发IL-23、IL-6和IL-1β的产生,从而稳定Th17细胞并促进IL-17的产生。
孢子形成细菌如梭菌和脆弱拟杆菌通过诱导结肠T淋巴细胞和平衡Th1/Th2/Th17细胞来调节免疫应答.
分节丝状细菌(SFB)诱导Th17细胞分化。
在标准治疗的协同作用下,可以建议采用适当的饮食或其他干预措施来调节肠道菌群,从而改善银屑病的临床表现,并降低合并症的发生率。
婴儿双歧杆菌35624和1:1:1的益生菌混合物(即长双歧杆菌CECT 7347、乳双歧杆菌CECT8145、鼠李糖乳杆菌CECT 8361)在8至12周的治疗过程后,要么降低促炎TNF-α和血浆C-反应蛋白,要么降低患者的银屑病面积和严重程度指数。
在用咪喹莫特治疗的BALB/c小鼠中,戊糖乳杆菌GMNL-77显著降低了红斑鳞屑病变和促炎细胞因子如IL-23和IL-27的mRNA水平。
有趣的是,补充短双歧杆菌CCFM683有效地下调了角蛋白16/17、IL-17和TNF-α的表达,通过调节FXR/NF-κB通路和角质形成细胞增殖来改善银屑病。
以上我们了解了炎症因子在多种疾病中的作用机制,以及肠道菌群如何通过影响这些因子的水平和功能来调节炎症反应。炎症因子不仅反映了炎症的状态,还可以作为疾病进展和治疗效果的生物标志物。
为了有效地评估炎症因子的变化,临床上采用了多种检测方法。这些方法能够提供准确的炎症因子水平信息,辅助医生做出及时的诊断和治疗决策。接下来,我们将详细介绍几种常用的检测技术。
检测体内炎症通常需要特定的血液检查,以测量指示炎症反应的各种标志物。
◉ ELISA(酶联免疫吸附测定)
原理:抗原-抗体特异性结合,通过酶标记检测
优点:
灵敏度高、特异性强、可批量检测
缺点:
检测时间较长、操作步骤多、成本较高
适用:
IL-1β、IL-6、TNF-α等细胞因子的定量检测
◉ 化学发光免疫分析
原理:利用化学发光物质标记抗体或抗原
优点:
检测速度快、灵敏度高、自动化程度高
缺点:
仪器要求高、试剂成本高
适用:CRP、PCT等急性期蛋白的快速检测
◉ 免疫比浊法
原理:
抗原抗体形成免疫复合物产生浊度
优点:
操作简单、成本低、检测快速
缺点:
灵敏度较低、易受干扰
适用:CRP、血清淀粉样蛋白等的常规检测
◉ 流式细胞术
原理:通过荧光标记检测细胞因子
优点:
可同时检测多个指标、特异性强、定量准确
缺点:
设备昂贵、要求技术人员专业水平高
适用:细胞内细胞因子和膜表面标志物检测
◉ PCR技术
原理:检测炎症因子的基因表达水平
优点:
灵敏度极高、特异性强、可检测微量样本
缺点:
操作复杂、成本高、易污染
适用:炎症因子基因表达研究
◉ 蛋白质芯片
原理:多种抗原抗体反应的微阵列分析
优点:
可同时检测多个指标、样本用量少、高通量
缺点:
成本高、技术要求高、标准化难度大
适用:多种炎症因子的同时检测
◉ 肠道菌群健康检测
原理:通过分析肠道菌群及其代谢产物的变化情况,间接反映人体的炎症状态
优点:
非侵入性、可重复采样、早期预警、利于干预、反映整体状态、长期监测
缺点:
成本高、技术要求高、数据分析复杂
适用:多种炎症因子的同时检测
通过肠道菌群监测炎症因子的方法虽然存在一些局限性,但其独特的预警价值和非侵入性特点使其成为传统炎症监测方法的重要补充。
随着技术的进步和研究的深入,这种检测方法的局限性正通过多种创新手段得到克服:
这些技术创新显著提升了肠道菌群检测在临床应用中的价值,特别是在精准医疗和预防医学领域,使其成为疾病预警和健康管理的重要工具。
饮食方式
地中海饮食(MD)包括水果、蔬菜、全谷物、橄榄油、红酒等,可能对IBD有益。有证据表明,地中海饮食后可降低IBD和炎症的发生率。地中海饮食有助于抗炎菌群的存活,并防止肠道微生物群的失调发展。
通过调节肠道微生物群,改变肠道微生物组成,增加SCFA水平,降低尿TMAO水平,地中海饮食可以成为阿尔茨海默的潜在治疗干预措施。此外,更严格地遵守地中海饮食会延缓阿尔茨海默的进展,并提供1.5-3.5年的阿尔茨海默防护。
更多抗炎饮食,详见我们之前的文章:
益生菌
益生菌引入人体后,不仅会产生抗炎代谢产物,下调IL-6、IL-12、TNF-α等炎症因子和NF-κB通路等相关信号通路,还有助于抑制病原体的生长,修复肠道屏障,调节初始淋巴细胞的分化和增殖。
在BALB/c小鼠中,引入干酪乳杆菌可以预防肠道和关节炎症,不仅在膝盖,还在肠系膜和腘淋巴结中下调IL-1β、IL-6、IL-17、IL-23、TNF-α。
在一项涉及18名活动性强直性脊柱炎患者的试点研究中,补充嗜酸乳杆菌和唾液酸乳杆菌4周后,巴斯强直性脊柱炎疾病活动指数和视觉模拟量表有所改善。
此外,干酪乳杆菌、嗜酸乳杆菌、罗伊氏乳杆菌、双歧杆菌和嗜热链球菌的组合成功降低了用光受体间类维生素A结合蛋白免疫的C57BL/6小鼠的视网膜组织学评分,这是一种自身免疫性葡萄膜炎的动物模型。
在牙周炎的背景下,引入乳双歧杆菌HN019或罗伊氏乳杆菌显著改善了牙周炎的临床指标,包括减少探诊深度、减少探诊出血和降低手术风险。上述临床试验或动物实验中没有报告严重不良事件。
下一代益生菌,如F.prausnitzii、A.muciniphila,它们对IBD的治疗效果已经得到证实。这些益生菌可以减少浸润的巨噬细胞,抑制NF-κB信号通路,减少IL-8的产生,最终降低结肠炎的严重程度。
考虑到IBD和常见肠易激综合征之间肠道生态失调的相似模式,下一代益生菌在肠易激综合症管理中的应用也可能很有前景。
益生元
益生元是指微生物选择性利用以带来健康益处的底物。菊粉和低聚果糖等益生元的微生物发酵会产生代谢物(如SCFA),进一步调节肠道微生态系统和免疫反应。
在SpA的背景下,据报道,口服长链菊粉和低聚果糖可显著降低HLA-B27转基因大鼠结肠炎和关节炎的发病率。
对于牙周炎的动物模型,口服甘露寡糖成功地防止了牙槽骨丢失,降低了IL-10和IFN-γ的表达,下调了TNF-α和IL-1β的水平,并显著恢复了肠绒毛和隐窝深度。
值得注意的是,益生元具有广泛可接受的安全性,报告的严重不良事件很少。
后生元
在国际益生菌和益生元科学协会的指导下,益生元是指死亡的微生物或其对宿主有益的成分,包括SCFA、SBA等。
在SpA的背景下,直接外源性补充短链脂肪酸可以减轻各种动物模型中的关节炎严重程度。此外,口服短链脂肪酸还可以防止效应T细胞的激活和免疫细胞向脾脏和颈部淋巴结的运输,最终降低C57BL/6J和Kaede转基因小鼠模型中葡萄膜炎的严重程度。
该领域对原发性硬化性胆管炎的研究相对丰富。已经启动了几项为期12-24周的II期临床试验,报告称,无论是去甲熊去氧胆酸(SBA的衍生物)、奥贝胆酸(FXR配体)还是西洛菲索(FXR激动剂),都能显著降低原发性硬化性胆管炎患者(有或没有IBD)血清中的碱性磷酸酶。
此外,在患有IBD相关肝损伤的C57BL/6J小鼠中,添加乳脂球膜(Milk Fat Globule Membrane)与促炎细胞因子减少、Faccalibacumum和Roseburia恢复、结肠炎和肝损伤减轻以及谷胱甘肽转移酶途径的重新激活有关。
对于牙周炎患者,口服热灭活植物乳杆菌L-137有效地减少了同时接受支持性牙周治疗且基线深度不小于4mm的患者的探诊深度。
此外,小檗碱促进丁酸盐的产生,改善肠道屏障,降低循环LPS和促炎细胞因子水平,下调牙槽骨中的促炎细胞,最终改善牙周炎动物模型中的牙槽骨损失。同样,在后生元中也没有报告严重的不良事件。
抗生素
临床上,抗生素用于杀死致病菌或抑制其增殖。
在SpA的背景下,口服美罗培南和万古霉素有效地抑制了BALB/c和SKG小鼠脾脏中Th1和Th17细胞减少的外周附着点炎的发展。
对于葡萄膜炎,甲硝唑或万古霉素已被证明可以缓解葡萄膜炎,并增加用光受体间维甲酸结合蛋白预处理的B10.RII小鼠肠外淋巴组织中Tregs的丰度。
对于原发性硬化性胆管炎患者,应用万古霉素、甲硝唑和米诺环素可改善肝酶和梅奥风险评分。
此外,阿莫西林联合甲硝唑、单独甲硝唑和阿奇霉素可有效改善牙周炎患者的临床结果,其中阿莫西林联合甲硝唑在减少探诊袋深度、探诊出血和提高临床附着水平方面表现最佳。
粪菌移植 (FMT)
FMT是指将健康人类粪便中的微生物群移植到患者消化道中,使肠道微生态系统快速恢复的疗法。FMT的效果受到各种因素的干扰,包括供体的粪便质量、粪便的制备程序、给药方法和频率、FMT前的个体化肠道微生物组成(包括细菌、真菌和病毒)以及操作员技术。
一项试点随机对照研究表明,FMT组的内镜严重程度指数降低,C反应蛋白水平降低,这证明了FMT在维持克罗恩病缓解方面的疗效。
FMT还可以通过改善肠道微生物群的失调来减少肝脏脂肪积聚,从而减少NAFLD。
对FMT在阿尔茨海默病治疗中的作用的系统综述表明,FMT可以恢复SCFA和健康的微生物组,从而破坏阿尔茨海默患者的Aβ寡聚体,从而减少阿尔茨海默的发病机制。进一步机制研究表明,FMT降低了结肠、血清和SN中的LPS水平,抑制了TLR4/MyD88/NF-κB信号通路,使肠道微生物群和SCFA正常化,增加了突触素I的表达,并改善了阿尔茨海默模型小鼠的认知缺陷和Aβ沉积。
在许多慢性疾病中,例如肥胖症、动脉粥样硬化、2型糖尿病、炎性肠病、多发性硬化、类风湿性关节炎等,炎症是主要原因。肠道菌群的结构成分可能引发炎症,这可能引发一系列涉及白细胞介素和其他细胞因子的炎症反应。同样,某些短链脂肪酸和细菌代谢的其他代谢副产物可能有助于抑制炎症反应。因此,肠道菌群改变往往可能是炎症的预警信号,更早于临床症状的出现,其在疾病防治中的价值正逐渐被认识和挖掘。
特别是在当今精准医疗时代,结合人工智能深度学习算法、多组学整合分析等创新技术,肠道菌群检测的准确性和临床应用价值将得到进一步提升。随着检测技术的不断优化、数据分析方法的持续改进,以及临床验证研究的深入开展,肠道菌群检测将在疾病预警、健康管理、个体化治疗,响应监测以及预后评估中发挥越来越重要的作用。
未来,深入了解肠道微生物诱导的炎症因子的信号机制,有助于为肠道微生物诱导的炎症性疾病开发更精确、更有效的治疗方案。
本文内容仅供学习和交流目的,不构成任何形式的医疗建议。
主要参考文献
Chaudhary S, Kaur P, Singh TA, Bano KS, Vyas A, Mishra AK, Singh P, Mehdi MM. The dynamic crosslinking between gut microbiota and inflammation during aging: reviewing the nutritional and hormetic approaches against dysbiosis and inflammaging. Biogerontology. 2024 Oct 23;26(1):1.
Bai S, Bai H, Li D, Zhong Q, Xie J, Chen JJ. Gut Microbiota-Related Inflammation Factors as a Potential Biomarker for Diagnosing Major Depressive Disorder. Front Cell Infect Microbiol. 2022 Mar 15;12:831186.
Wu, J., Ou, G., Wang, S. et al. The predictive, preventive, and personalized medicine of depression: gut microbiota and inflammation. EPMA Journal (2024).
Liu P, Gao M, Liu Z, Zhang Y, Tu H, Lei L, Wu P, Zhang A, Yang C, Li G, Sun N, Zhang K. Gut Microbiome Composition Linked to Inflammatory Factors and Cognitive Functions in First-Episode, Drug-Naive Major Depressive Disorder Patients. Front Neurosci. 2022 Jan 28;15:800764.
Secchiero, P.; Rimondi, E.; Marcuzzi, A.; Longo, G.; Papi, C.; Manfredini, M.; Fields, M.; Caruso, L.; Di Caprio, R.; Balato, A. Metabolic Syndrome and Psoriasis: Pivotal Roles of Chronic Inflammation and Gut Microbiota. Int. J. Mol. Sci. 2024, 25, 8098.
Wang, W.; Zhu, L.-J.; Leng, Y.-Q.; Wang, Y.-W.; Shi, T.; Wang, W.-Z.; Sun, J.-C. Inflammatory Response: A Crucial Way for Gut Microbes to Regulate Cardiovascular Diseases. Nutrients 2023, 15, 607.
Mao R, Yu Q, Li J. The causal relationship between gut microbiota and inflammatory dermatoses: a Mendelian randomization study. Front Immunol. 2023 Sep 27;14:1231848.
Heinzel, S., Jureczek, J., Kainulainen, V. et al. Elevated fecal calprotectin is associated with gut microbial dysbiosis, altered serum markers and clinical outcomes in older individuals. Sci Rep 14, 13513 (2024)
Saedi, S., Derakhshan, S., Hasani, A. et al. Recent Advances in Gut Microbiome Modulation: Effect of Probiotics, Prebiotics, Synbiotics, and Postbiotics in Inflammatory Bowel Disease Prevention and Treatment. Curr Microbiol 82, 12 (2025).
Jukic A, Bakiri L, Wagner EF, Tilg H, Adolph TE. Calprotectin: from biomarker to biological function. Gut. 2021 Oct;70(10):1978-1988.
Zhao M, Chu J, Feng S, Guo C, Xue B, He K, Li L. Immunological mechanisms of inflammatory diseases caused by gut microbiota dysbiosis: A review. Biomed Pharmacother. 2023 Aug;164:114985.
Tie Y, Huang Y, Chen R, Li L, Chen M, Zhang S. Current insights on the roles of gut microbiota in inflammatory bowel disease-associated extra-intestinal manifestations: pathophysiology and therapeutic targets. Gut Microbes. 2023 Dec;15(2):2265028.
Nigam M, Devi K, Coutinho HDM, Mishra AP. Exploration of gut microbiome and inflammation: A review on key signalling pathways. Cell Signal. 2024 Jun;118:111140.
Soares CLR, Wilairatana P, Silva LR, Moreira PS, Vilar Barbosa NMM, da Silva PR, Coutinho HDM, de Menezes IRA, Felipe CFB. Biochemical aspects of the inflammatory process: A narrative review. Biomed Pharmacother. 2023 Dec;168:115764.