-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

慢性子宫内膜炎(Chronic endometritis, CE)是一种慢性非特异性的子宫内膜炎症性疾病,常表现为无症状或非特异性临床症状,慢性子宫内膜炎经常被患者和妇科医生忽略。因此,寻找新的诊断标记对于改善慢性子宫内膜炎的预后至关重要。
针对上述问题,来自武汉大学人民医院生殖医学中心杨静团队的科研人员在《OBSTETRICS AND GYNECOLOGY》上发表了研究论文。
该研究针对慢性子宫内膜炎女性的阴道微生物特征进行深入研究,比较了98名接受子宫内膜活检进行不孕症常规临床检查的女性(49名诊断为CE的女性和49名非CE的女性)的阴道微生物组特征,并采用杭州谷禾核酸提取试剂盒及测序平台,使用16S rRNA基因扩增子测序分析阴道微生物组,对微生物标记物进行了鉴定。
该项研究确定了四个慢性子宫内膜炎的微生物标记物(肠杆菌,普雷沃氏菌,粪杆菌,Phascolarctobacterium),开发了针对慢性子宫内膜炎预测诊断分类器,并进一步探讨了阴道微生物组特征作为慢性子宫内膜炎诊断新工具的潜力。

英文题目:Vaginal microbiome dysbiosis as a novel noninvasive biomarker for detection of chronic endometritis in infertile women
中文题目:阴道微生物群失调作为检测不孕女性慢性子宫内膜炎的新型非侵入性生物标志物
期刊名:OBSTETRICS AND GYNECOLOGY
发表时间:2024年7月10日
▼ 什么是慢性子宫内膜炎?
慢性子宫内膜炎是发生在子宫内膜间质区的持续性细微炎症性疾病,其特征为子宫内膜间质区的浆细胞浸润,通常无症状或仅出现轻微的症状,如异常子宫出血、盆腔疼痛、白带增多等。
▼ 慢性子宫内膜炎有哪些不良后果?
大量研究表明,慢性子宫内膜炎与女性不孕症、反复流产、反复着床失败、子宫内粘连和辅助生殖技术的不良后果密切相关,此外慢性子宫内膜炎还是影响活产和足月分娩的客观因素之一。
▼ 慢性子宫内膜炎的发病率
慢性子宫内膜炎的发病率在不同人群中不尽相同:
其病理改变与内膜中微生物群的定性、定量改变有关。
近年来,人类微生物组学的研究表明,人体不同系统内微生物群与人类健康和疾病发病机制存在密切关系,刺激炎症并增加癌症等疾病发生的风险。作为人体主要的微生物组,阴道菌群对于女性生理和生殖健康起着重要作用。
◆阴道病原体感染是慢性子宫内膜炎的病因之一
Moreno等人通过微生物培养在慢性子宫内膜炎女性子宫内膜中发现了包括无乳链球菌和淋病奈瑟菌在内的细菌,并开发了一种诊断慢性子宫内膜炎的分子方法——逆转录聚合酶链反应试验,从这些病原体中识别DNA,用于慢性子宫内膜炎的诊断。
◆慢性子宫内膜炎:宫腔内致病菌增加
随着微生物组学技术的发展,传统观点认为宫腔内是无菌环境的观念也逐渐被推翻。16S和宏基因组测序等技术均证实宫腔内存在微生物的定植,健康女性以乳杆菌属占绝对优势,且宫腔内微生物与慢性子宫内膜炎的发病存在关联,慢性子宫内膜炎患者宫腔非乳酸杆菌为优势菌群且致病菌如加德纳菌、葡萄球菌、链球菌检出率增加。
在研究中也指出,诊断患有慢性子宫内膜炎的女性阴道微生物群生态失调。与子宫内膜冲洗样品相比,阴道分泌物可以作为诊断慢性子宫内膜炎的更无创和更经济有效的生物标志物。阴道宫颈黏液的免疫学指标已被认为是子宫内膜炎的潜在诊断生物标志物。然而,需要进一步评估阴道微生物组在慢性子宫内膜炎中的诊断潜力。
本研究于2023年6月至2023年11月在武汉大学人民医院生殖医学中心完成。研究集中于常规不孕症检查中接受子宫内膜活检的患者。最终共纳入49名患有慢性子宫内膜炎的女性,并与49名非慢性子宫内膜炎对照组相匹配。
慢性子宫内膜炎患者的选择标准如下:
排除标准为:
注:所有受试者均获得书面同意,并经武汉大学人民医院伦理委员会批准(批准通知号:WDRY2023- K090)。
该研究的设计和流程图如图所示:
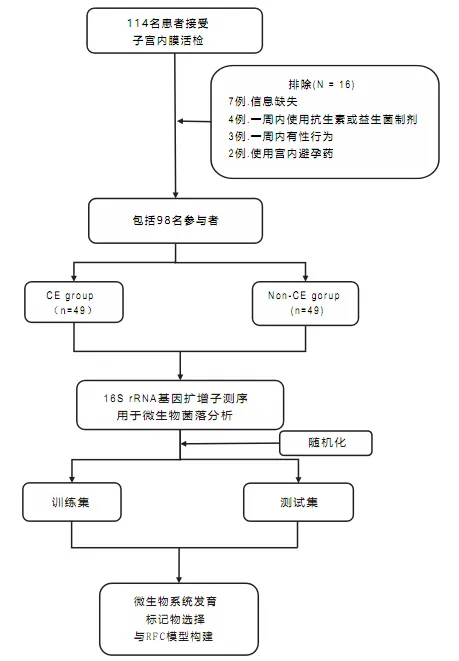
编辑
在本研究中,所有样本均在子宫内膜活检前采集。用无菌生理盐水擦拭外阴。随后,使用无润滑剂的一次性无菌阴道窥镜完全暴露宫颈。使用两个无菌拭子从后穹窿收集阴道分泌物:一个使用Nugent评分法进行评估,另一个储存在−80°C下用于后续16S rRNA基因测序分析。
项目采用杭州谷禾核酸提取试剂盒(GHFDE100)提取阴道冲洗液样本的基因组DNA。用引物515F(5′- GTGCCAGCMGCCGCGGTAA- 3′)和806R(5′- GGACTACHVGGGTWTCTAAT- 3′)扩增16S rRNA的V4区。为了实现多重测序,将样品特异性对端6bp条形码集成到TrueSeq适配器中。纯化和定量后,整个DNA池在Illumina NovaSeq6000平台(Illumina)上按照协议进行测序。
使用Vsearch v2.22.1组装拼接双端序列,并以100%的相似性阈值将序列聚类为相同的扩增子序列变体(amplicon sequence variant, ASV)。利用QIIME2加权分类器获得ASV的分类信息。基于R包“VennDiagram”生成维恩图来说明分组间共有的和独有的ASV。
α-多样性是指群落内的物种多样性,以物种丰富度和归一化香农熵(均匀度)为其显著组成部分。物种丰富度采用Chao1指数进行量化,而Shannon多样性指数同时评估丰富度和均匀度。通过主坐标分析(PCoA)可视化两个组之间样本的微生物菌落结构。使用R的vegan包进行相似性分析(ANOSIM)评估微生物群落的差异。
此外,为了预测微生物的代谢功能,使用京都基因与基因组百科全书(KEGG)数据库与PICRUSt2 (Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)进行代谢途径富集分析。组间的统计差异使用Kruskal-Wallis检验和Wilcoxon秩和检验进行评估,显著性水平定义为P < 0.05。
为了评估阴道微生物群组成对慢性子宫内膜炎(CE)的诊断潜力,应用随机森林算法,这是一种稳健的监督学习算法。使用R的pROC软件包生成的受试者工作特征(ROC)曲线评估模型的整体性能。曲线下的面积(AUC)量化了ROC曲线的判别能力。此外,还计算模型的特异性、敏感性和准确性。
连续变量的临床特征差异使用Student’s t检验进行评估,而分类变量则需要使用χ²检验或Fisher精确检验进行评估。统计分析使用SPSS版本27(IBM)进行,P < 0.05被认为具有统计学意义。
在98名参与者中,49名被诊断为CE,其标准是在30个随机选择的高倍视野中至少有一个视野中观察到超过5个MUM-1+/CD138+细胞。基线特征包括年龄、体重指数、抗穆勒激素水平和流产史,在两组之间显示了可比性(见表1)。
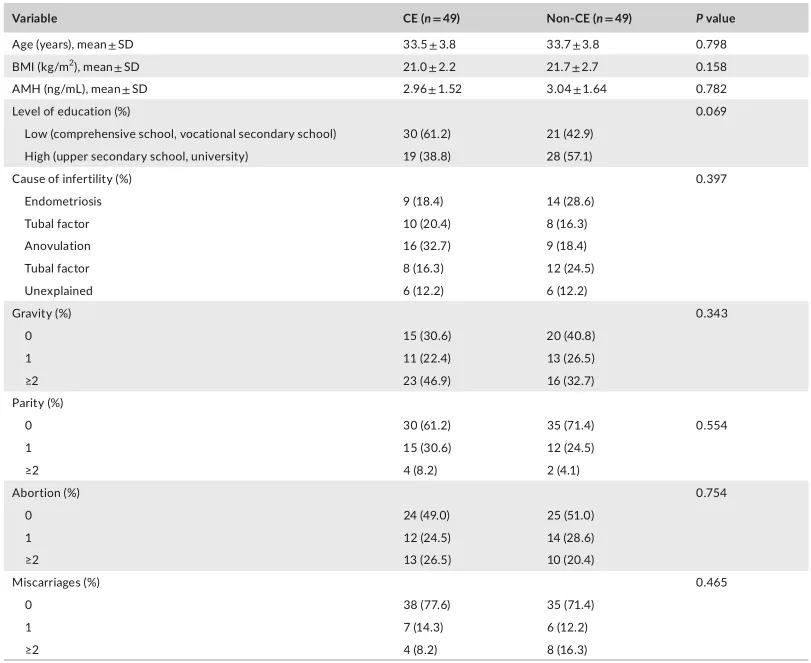
等级丰度曲线体现了物种丰富度和均匀度
等级丰度曲线描述了两组微生物群落的物种丰富度和均匀度。曲线范围越宽表明物种丰度越高,曲线越光滑表明物种分布越均匀。
从曲线上看,CE组的物种丰富度和均匀度高于非CE组(图2a)。维恩图显示,两组共有1180个ASV中的664个,其中CE组特有的ASV为354个(图2b)。利用Chao1丰富度估计器和Shannon多样性指数量化的α-多样性结果显示,两组间差异不显著(Chao1的P = 0.1733, Shannon的P = 0.9043,图2c,d)。
为了说明样品之间的微生物组分布空间,进行了PCoA,如图2e所示。结果显示,两组样本的分布是对称的。
值得注意的是,ANOSIM结果显示组间差异大于组内差异,尽管没有达到统计学意义(R = 0.022, P = 0.085)(图2f)。
阴道微生物群的细菌多样性
(a)用秩丰度曲线评价细菌的相对均匀度;
(b)显示组间重叠的维恩图;
(c)采用Chao1指数;
(d)Simpson指数估算口腔微生物多样性;
(e)使用Bray-Curtis通过主坐标分析计算β多样性;
(f)通过相似性分析计算了组间微生物群落的差异。
阴道微生物群的组成
文中分析了与CE相关的阴道微生物组的分类组成和变化。门、科和属水平的平均细菌群落组成如图3a-c所示。值得注意的是,与非CE组相比,CE组有10个属的细菌显著富集,包括双歧杆菌、普雷沃氏菌和加德纳菌(均P < 0.05)(图3d)。
慢性子宫内膜炎患者阴道微生物群落的系统发育概况
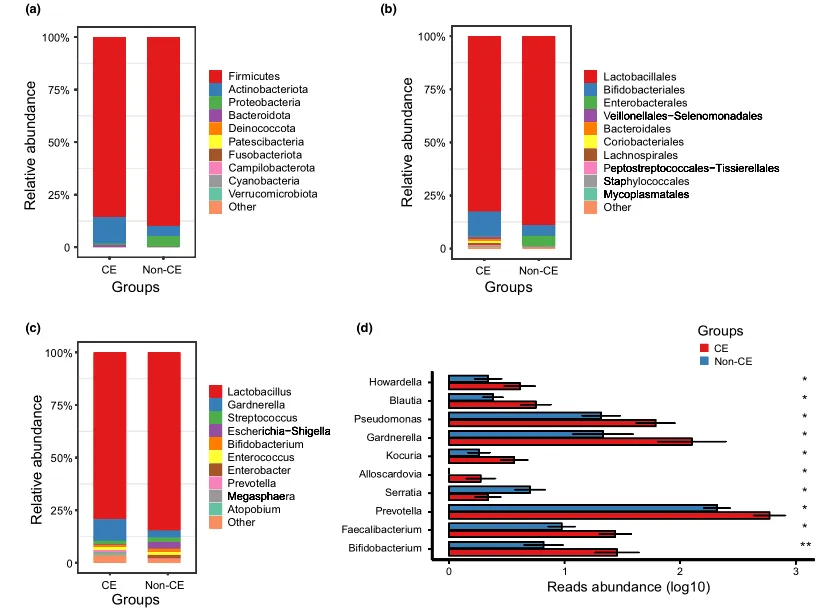
门(a)、科(b)、属(c)水平上细菌群落的平均组成。CE组与非CE组间差异有统计学意义(均 P < 0.05)。0.01 <矫正 P ≤ 0.05 ,标记为*。
代谢途径
通过KEGG途径富集的功能分析揭示了CE组中几种上调的途径,如图4所示。具体而言,参与多糖生物合成和代谢的途径(包括鞘糖脂生物合成、糖胺聚糖降解和其他多糖降解过程)上调。
此外,萜类和聚酮类代谢、II型聚酮类生物合成、鞘脂质代谢、次生代谢物生物合成、链霉素生物合成、外源生物降解、氯烷烃和氯烯烃降解以及凋亡相关途径也上调。总共有8个KEGG模块在CE组显著富集,重点是代谢相关途径(均P < 0.05)。
KEGG代谢通路的丰度差异
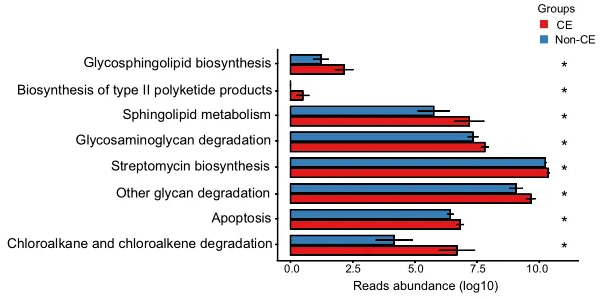
0.01< 校正P≤0.05,标记为*;0.001 <校正P≤0.01,标记为**。CE,慢性子宫内膜炎。
为测试阴道微生物组对慢性子宫内膜炎(CE)的诊断潜力,这里构建了一个随机森林分类器模型,用以区分CE样本和非CE样本。训练集用于模型训练,测试集用于评估模型性能。通过在发现阶段重复五次的10倍交叉验证,我们识别出四个最优标记 ASV 作为CE的标记集(图5a)。
这些选定ASV的对应细菌属包括:
随机森林模型在训练集队列上的AUC值为85.68%(95%置信区间[CI], 75.62%-95.73%),在测试集队列上的AUC值为83.26% (95% CI, 68.67%-97.85%)(图5b)。模型的特异性为82.76%,灵敏度为79.49%,准确率为80.88%。
这些发现表明,基于阴道微生物ASV标记的随机森林模型在区分CE和非CE队列方面表现出强大的诊断潜力。
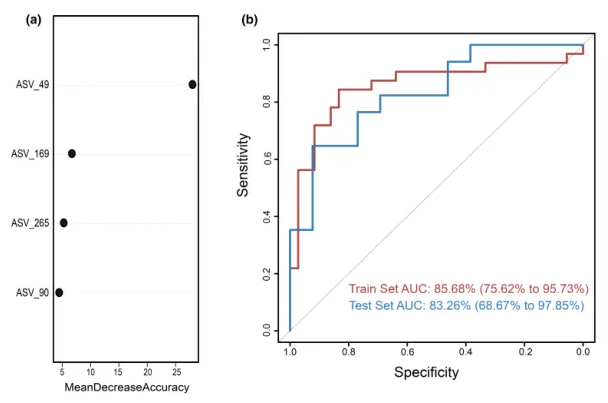
图5.通过随机森林模型鉴定用于临床诊断的微生物标志物。
(a)使用阴道样品中四种选定生物标志物的概况,来自随机森林模型的变量的平均降低准确度。
(b)接收器工作特征曲线基于组织样本的训练集和测试集。ASV,扩增子序列变体; AUC,曲线下面积。
◆阴道菌群的变化可引起宫腔的菌群失调
女性阴道中的微生物组是一个完整的连续体观点已被广泛接受。阴道细菌可以异位定植并改变上生殖道中的微生物组。局部微生物组的生态失调会导致微环境发生复杂的病理生理变化,最终扰乱与免疫反应、炎症和凋亡相关的各种过程,从而促进病理状况。
阴道和宫腔内的菌群变化有一定的同步性,阴道菌群的变化可引起宫腔内的菌群失调,从而影响女性生殖健康。
本研究旨在对有或没有慢性子宫内膜炎(CE)的女性阴道微生物组的群落结构和功能进行初步探索。此外,文章中还提出了基于阴道微生物ASV的新型非侵入性CE诊断标志物。
◆特定的菌群可作为新型非侵入性CE诊断标志物
与先前的研究结果一致,该研究中没有发现慢性子宫内膜炎组和非慢性子宫内膜炎组阴道微生物组之间的α-多样性或β-多样性有显著差异。
值得注意的是,微生物组的低组内变异情况表明其作为潜在诊断标记具有一定的稳健性。与非CE组相比,慢性子宫内膜炎组中几个低丰度属的富集程度不同,包括双歧杆菌,普雷沃氏菌和加德纳菌。
双歧杆菌
双歧杆菌以其保护作用而闻名,其高丰度在CE组中令人惊讶。双歧杆菌菌株作为益生菌用于肠道炎症、严重疾病和抑郁症患者的肠道微生物组调节已有很长的历史。然而,其他研究报告称,在一些不健康的情况下,包括子宫内膜异位症、高危人乳头瘤病毒和不孕症,阴道中双歧杆菌含量很高。这种不一致的潜在机制尚不清楚,需要进一步研究。
加德纳菌和普氏菌
加德纳菌和普氏菌是公认的阴道生态失调的指标。这些属的定植改变了免疫系统,并诱导了促炎反应。在宿主-微生物共培养模型中,加德纳菌与宫颈阴道屏障的破坏有关,同时促进小鼠中普雷沃菌属对上生殖道的侵入性感染。
总的来说,该研究结果表明,两组之间的阴道微生物组发生了实质性变化,突显了阴道冲洗液样本作为检测慢性子宫内膜炎的诊断工具的潜力。
◆阴道菌群的变化可引起宫腔的菌群失调
KEGG途径富集分析强调了关键代谢过程的上调,特别是CE组的聚糖生物合成和代谢。覆盖阴道上皮细胞的聚糖涂层是保护屏障的重要组成部分。乳杆菌与阴道上皮的粘附被认为是具有竞争性地抑制病原体,而上皮的糖胺聚糖在这些过程中起着至关重要的作用。
值得注意的是,糖胺聚糖的消耗与宫颈上皮细胞屏障功能的破坏有关,这可能会增加对局部细菌和上升感染的易感性。这表明CE患者的微生物组失调可能会对微生物侵入阴道的主要门户产生负面影响,并引发宫内炎症。
关于慢性子宫内膜炎(CE)的标准化定义和诊断指南仍存在争议,最被接受的诊断依赖于子宫内膜活检。基于选定的阴道微生物群构建了CE诊断模型。本文研究中,引入了一种新的随机森林模型,该模型可以根据ASV以更高的灵敏度和准确性将CE患者与使用阴道分泌物的健康个体区分开来。该研究结果表明,阴道微生物组的变化可以作为诊断CE的指标,为慢性子宫内膜炎提供了一种更容易获得和更方便患者的诊断选择。
然而,该研究也存在一定的局限性。首先,它主要侧重于检查有慢性子宫内膜炎和没有慢性子宫内膜炎的女性之间的成分差异,而不是研究与慢性炎症相关的免疫失调的潜在机制。其次,阴道微生物样本是在分泌中期收集的,这可能无法解释整个月经周期中微生物群组成的变化。第三,作为一项单中心调查,发现的普遍性可能有限。考虑到饮食和运动等因素,多中心方法可以提供更全面的解读。
最后,多种组学方法的整合(包括培养组学、元转录组学和代谢组学),可以提供对微生物群落功能的全面了解。这种更广泛的视角对于阐明阴道微生态系统内复杂的网络和阴道微环境的潜在变化至关重要。
阴道微生物生态失调是慢性子宫内膜炎的重要指标。该研究确定了与慢性子宫内膜炎发展相关的潜在候选细菌,并提出了潜在的机制。基于阴道微生物群的生物标志物有望成为检测慢性子宫内膜炎的非侵入性工具。需要进一步的研究来发现特定阴道微生物组在慢性子宫内膜炎中的功能,并确定具有诊断能力的强大阴道微生物标记物,以区分患有慢性子宫内膜炎的个体。
谷禾健康

有这样一些病人:经常性的腹痛、拉肚子、甚至便血、人也日渐消瘦,这很有可能是患有炎症性肠病。
炎症性肠病是一种慢性、非特异性的肠道炎症性疾病,因其顽固无法治愈且需要终身治疗的特点,又称为“绿色癌症”。目前全世界有超过1000万人患炎症性肠病。
在我国炎症性肠病的发病率也呈上升趋势,已经成为常见的肠道疾病,预计2025年患病人数将达到150万,且发病人群偏年轻化。如何预防和治疗炎症性肠病,成为了许多病友和大众关注的重点。
肠道微生物群是一个复杂而独特的实体,在宿主免疫、获取营养物质和强化肠道上皮方面发挥着重要的生理作用。与常见胃肠道疾病的预防、发病机制和进展有关。
虽然肠道微生物群主要由细菌主导,但先进的测序技术已经确定了共生真菌群落,统称为真菌群。大量研究和谷禾的检测数据发现,肠道炎症与微生物组成改变有关,称为肠道菌群失调。微生物群落改变与各种病理疾病有关,例如炎症性肠病(IBD),但它们作为炎症的原因或后果的作用仍是正在进行的研究主题。
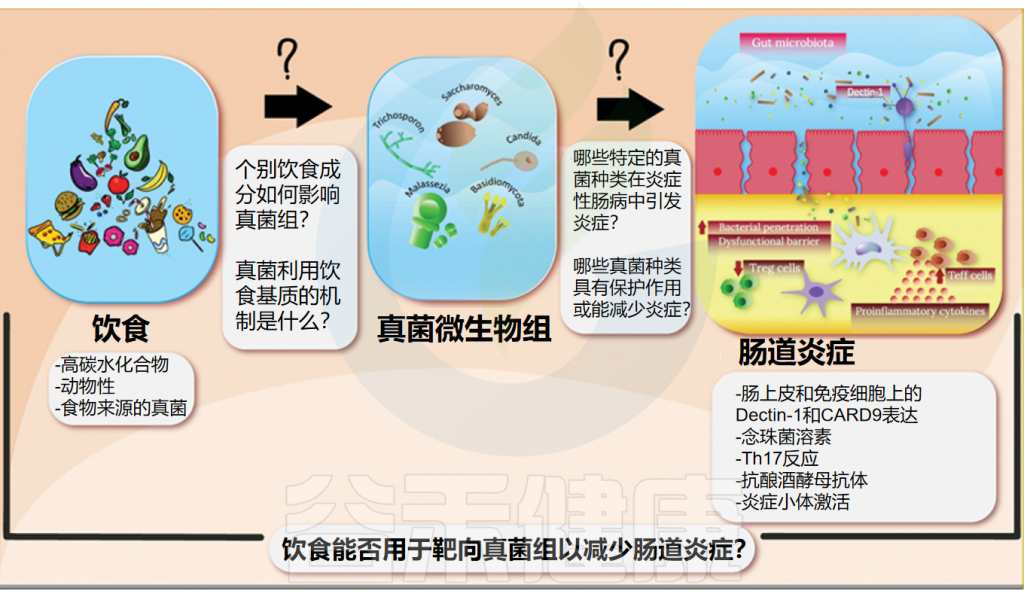
而饮食在预防和管理各种疾病方面起着至关重要的作用,被认为是全身炎症的重要调节剂。近年来,随着饮食与肠道微生物关系的深入研究,我们逐渐认识到饮食不仅塑造了肠道细菌的组成,同样也在悄然影响着肠道真菌群落的结构和功能,包括真菌发酵中涉及的代谢途径和酶。
本文将探讨饮食如何调节肠道真菌群,并分析这一过程与炎症性肠病(IBD)之间的潜在联系,为未来饮食疗法在IBD治疗中的应用提供新的视角和研究方向。
☆ 什么是炎症性肠病?
炎症性肠病(IBD)是一种慢性、非特异性的肠道炎症性疾病。包括溃疡性结肠炎(UC)和克罗恩病(CD)。克罗恩病涉及所有粘膜层,可在胃肠道的任何区域发现,并被细分为穿透性或狭窄性表型。溃疡性结肠炎累及直肠并向近端延伸,涉及粘膜和粘膜下层。
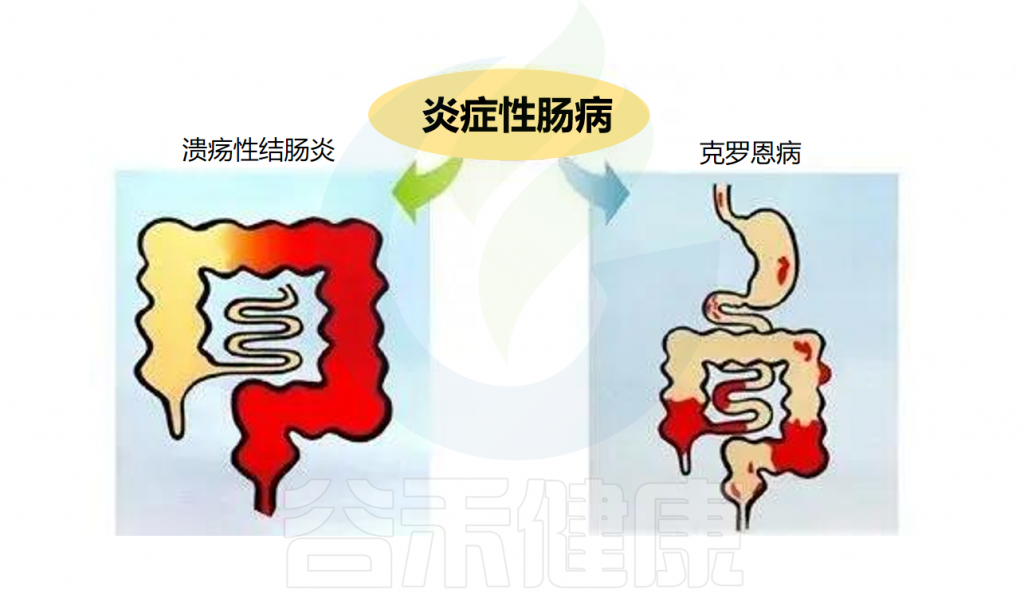
克罗恩病
-主要表现:腹泻、腹痛、大便带血、消瘦、乏力。
-可能还会出现:发烧 、关节痛、关节僵硬、眼睛红肿及疼痛、儿童生长或性发育延迟、皮肤红肿及发痛、口腔溃疡。
–并发症包括:瘘管、狭窄、脓肿、肠穿孔。
溃疡性结肠炎
主要表现:腹泻,多见黏液血便,常常伴发下腹部疼痛尤其以左下腹部疼痛多见。
可能还会出现:腹痛、腹胀、食欲不振、恶心、呕吐、发热、营养不良、关节炎、口腔溃疡。
并发症包括:下消化道大出血,肠穿孔、中毒性巨结肠及癌变。
☆ 炎症性肠病患病率有多高?
近几十年来,炎症性肠病(IBD)发病率逐年上升,目前已成为全球性疾病,具有显著的患者发病率和卫生保健负担。
在全球范围内,IBD的患病人数从1990年的332万例增加到2010年的490万例,增加了47%。据相关数据推测,预计到2025年,全球超过1000万人受到炎症性肠病的影响,我国炎症性肠病患者将达到150万,且以青壮年居多,发病高峰年龄为15至40岁。
注:在欧洲和北美,IBD已经逐步发展为常见疾病。比如在患病率最高的国家,UC和CD的患病率都已高达823/10万。在美国,目前大约有160万UC或CD患者,每年约7万人确诊为IBD。目前中国地区IBD发病率为1.96/10万-3.14/10万左右。
☆ 为什么会得炎症性肠病?
目前暂未明确炎症性肠病的发病机制,可能与多种因素有关:包括遗传因素、感染因素、过度反应的T细胞介导的免疫因素、环境触发因素、生活饮食因素和肠内微生物群因素。
炎症性肠病的日益流行引发了基础科学和临床研究的广泛关注,促使研究者们致力于开发有效的短期和长期治疗方案。这些研究的统一目标是显著减少患者的住院率,并同时提高患者的生活质量,以应对这一日益严重的健康问题。通过不断探索和创新,找到了一些有效的治疗方法,以改善患者的整体健康状况和生活体验。
▸ 药物治疗
抗炎药物短期效果好
炎症性肠病(IBD)的药物治疗是双管齐下的,旨在诱导或维持缓解。包括皮质类固醇和5-氨基水杨酸在内的抗炎药物可以通过多种方式给药,并且在及时诱导活动期病情缓解方面最为有效。
生物制剂可改善长期预后并提高疗效
相比之下,免疫调节剂和生物制剂起效较慢,但可以通过实现长期缓解维持来改变疾病轨迹。生物制剂是基于蛋白质的分子,可以阻断促炎细胞因子。
近年来,生物制剂已成为IBD治疗的基石,有证据表明,在IBD病程早期应用生物制剂可改善长期预后并提高疗效。此外,鉴于生物源化合物耗尽其开放性,生物疗法变得更具成本效益。
注:目前批准了四种不同类别的生物制剂:抗TNF制剂、抗整合素制剂、抗白介素12/23 IgG 1κ制剂和鞘氨醇-1-磷酸(S1P)抑制剂。
生物疗法的出现减少了炎症性肠病(IBD)相关的住院和腹部手术,然而,与IBD相关的总体发病率仍然很高。
▸ 饮食疗法
炎症性肠病(IBD)患者经常询问饮食策略来控制他们的胃肠道症状。饮食调节作为一种非药物疗法,具有显著的益处,其可以调节炎症和促进粘膜愈合并且基本没有副作用。
肠内营养
纯肠内营养(EEN)是一种通过消化道提供全面营养的方法,包括营养全面的流质饮食。在儿科克罗恩病患者中使用纯肠内营养(EEN)显示出与类固醇相似的功效,促进黏膜生长而无相关副作用。
部分肠内营养(PEN),允许一些食物摄入,比EEN耐受性更好,以克罗恩病排除饮食(CDED)为例。避免或减少动物/乳制品脂肪/蛋白质、小麦和食品添加剂的饮食相结合,允许逐渐重新引入水果、蔬菜和豆类以提高食物的灵活性。
特定碳水化合物饮食
一些针对成年IBD患者的饮食,如特定碳水化合物饮食(SCD),已经显示出减轻胃肠道症状的前景。SCD限制IBD患者难以吸收的复合碳水化合物,避免食用谷物、淀粉类蔬菜、乳制品、糖和甜味剂以及某些食品添加剂。
地中海饮食
地中海式饮食最近受到了关注,因为它限制较少,但却和SCD一样有效。这种饮食强调水果、蔬菜、坚果、鱼、全谷物、油性鱼和橄榄油,可以减少炎症,同时限制具有促炎症特性的动物脂肪/蛋白质和食品添加剂。
高膳食纤维并不总是有益
虽然膳食纤维通常被认为对健康有益,但一些炎症性肠病患者,尤其是在疾病活动期,对高纤维食物的耐受性降低。
在活动期疾病患者中证明,某些纤维,特别是低聚果糖(FOS),触发了促炎细胞因子IL-1β。而用来自非IBD或轻度感染患者的微生物群发酵FOS减少了IL-1β的分泌。但这种减少在大多数患有中度或重度IBD患者的微生物群中并不存在,这表明共生微生物群对FOS的发酵不足可能导致异常的免疫反应。
尽管饮食在炎症性肠病(IBD)发病机制中的作用已被认可,但我们对其对IBD进展的影响仍不够深入。目前尚未定义一种能够促进活动性疾病成年患者病情缓解的“IBD饮食”。需要加强对饮食对人类肠道影响的理解,特别是饮食与肠道微生物之间的关系及其在炎症中的作用。
最近的研究表明,肠道微生物群对不同纤维的反应存在相当大的个体间差异。菊粉和欧车前纤维的微生物群组成和功能差异很大,一些个体具有纤维抗性微生物群,而另一些个体具有纤维敏感性微生物群。这强调了个性化饮食建议的必要性,特别是在管理肠道健康和炎症方面。
人类肠道内居住着超过100万亿个微生物,包括细菌、古菌、病毒和真菌。这些微生物统称为肠道微生物群。肠道微生物群是一个复杂而独特的实体,与常见胃肠道疾病的预防、发病机制和进展有重要联系。
☆ 真菌虽然只占肠道微生物群的一小部分,但与多种疾病相关
然而,肠道中超过99%的微生物基因属于细菌,真菌只构成了常驻微生物群的一小部分,在不同的身体部位,包括皮肤、泌尿生殖系统、呼吸道和胃肠道,已经鉴定出390多种真菌。
尽管与细菌相比,真菌的多样性和丰度较低,但真菌的组成和功能与多种疾病有关,包括炎症性肠病、结直肠癌和代谢综合征。
☆ 肠道核心真菌群
然而,微生物组的研究主要集中在细菌上,而对真菌等其他重要的微生物组关注不够。真菌是单细胞或多细胞的异养真核生物,具有惊人的分解和获取营养物质的能力。
早期的研究集中在真菌对肠道健康的潜在危害上,随着人类微生物组项目的出现,真菌物种作为具有共生和互利关系的微生物组的必要组成部分获得了证明。
人体肠道内真菌的多样性和丰度较低,但个体之间存在相当大的可变性,然而,一些真菌物种在个体之间是共享的,这表明可能存在肠道核心真菌群落。
为了描述哪些真菌物种是本地的并有助于肠道健康,真菌群落被分为常驻和非常驻物种。常驻物种具有在缺氧的肠道环境中生长的内在能力,包括子囊菌门、担子菌门和接合菌门中的属,例如假丝酵母菌属(Candida)、马拉色菌属(Malassezia)和枝孢菌属(Cladosporium)。
相比之下,非常驻物种是通过非培养技术在肠道中分离出来的,常见的非常驻物种包括酵母属(Saccharomyces),曲霉属(Aspergillus),以及青霉菌属(Penicillium)等。非常驻物种通常是外部影响的产物,如短期饮食暴露或环境触发因素。这个亚群占分离真菌种类的三分之二。
念珠菌
常驻真菌中最常报道的是假丝酵母菌(Candida),假丝酵母菌又称念珠菌。包括白色念珠菌(C.albicans)、热带念珠菌(C.tropicalis)、近平滑念珠菌(C.parapsilosis),以及光滑念珠菌(C.glabrata)。
具有共生和致病双重特性
白色念珠菌是一种具有共生和致病双重特性,最广为人知的是作为肠道、口腔粘膜、阴道和血液的条件致病菌。它是每年数百万阴道和口腔感染病例的原因,当感染免疫低下的宿主时,导致显著的死亡率。
经历肠道诱导的转变更适合营养吸收
白色念珠菌当暴露于哺乳动物肠道时,会经历“胃肠诱导的转变”,这被认为部分是由于WOR1转录因子,导致更适合短链脂肪酸(SCFA)和N-乙酰氨基葡萄糖营养吸收的表型变化。
白色念珠菌的形态转变机制尚未完全了解,初步研究认为宿主上皮细胞在其中起调节作用。
马拉色菌
马拉色菌属主要以皮肤的定植者和病原体而闻名,也是肠道内第二普遍的真菌种类。其中,M.globosa、M.restricta、M.sympodalis和M.pachydermatis是肠道中最普遍的物种。
马拉色菌经常定植于富含皮脂的区域
几乎所有种类的马拉色菌属不合成脂肪酸,而是依赖外部来源的脂质,这解释了它们在人类皮肤富含皮脂的区域增殖。
在肠道内,脂质可从胆汁盐中获得,胆汁盐由胆汁酸通过肝细胞合成。人们对马拉色菌如何在人类肠道中定植仍然知之甚少,相互竞争的假设包括从人体皮肤间接暴露或由于婴儿期摄入母乳。
在炎症性肠病患者中更多,并可能导致黏膜炎
无论机制如何,马拉色菌都是真菌定植的主要参与者,最近的研究表明它与肠道共生有关。然而,在某些情况下,马拉色菌具有致病潜力,会诱发有害的、异常的免疫反应。
在皮肤上,它与脂溢性皮炎和花斑癣的发病机理有关。与肠道相比,马拉色菌在胰腺导管腺癌组织中的相对丰度更高,通过刺激模式识别受体甘露糖结合凝集素(MBL)与肿瘤发生有关。与健康对照者相比,在炎症性肠病患者中发现的马拉色菌相对比例更高,并且被认为会导致粘膜炎。
酵母菌
酵母菌被认为是人类肠道的非常驻真菌,通常是短暂的定植者和饮食习惯的结果。其中最主要的物种是酿酒酵母。它有助于面包发酵、啤酒酿造,可用作食品添加剂。它在肠道微生物组稳态中的作用经常被忽视。
有助于减轻胃肠道疾病引起的腹泻
最近的研究表明,酵母菌确实可以在肠道中茁壮成长,代谢被称为粘蛋白的高度糖基化蛋白质。布拉氏酵母菌(S.cerevisiae var. boulardii),为酿酒酵母变种,是一种众所周知的益生菌酵母物种,已知有助于解决各种胃肠道疾病,包括旅行者腹泻和抗生素相关性腹泻。研究表明克罗恩病(CD)患者的结肠通透性降低之后,使用布拉氏酵母菌有助于治疗CD。
胃肠道承载着一系列微生物,它们共同形成复杂而动态的生态系统。最近,人们开始关注细菌-真菌的相互作用,因为它们与疾病有关。
细菌-真菌存在互惠共生和竞争
细菌-真菌相互作用可能是互利的,然而,建立特定生态位或营养的竞争可能导致细菌和真菌的失衡。有各种各样的机制参与细菌-真菌的相互作用和拮抗作用。
一项研究表明,纤维发酵过程中细菌产生的短链脂肪酸本身具有抗真菌的特性。另一项研究发现细菌细胞壁合成过程中分泌的肽聚糖片段直接结合并灭活白色念珠菌,阻止其从出芽酵母转变为细长的菌丝。
稳定的肠道细菌群有助于抵抗病原真菌
一个稳定多样的肠道细菌群落调节其真菌对应物。在肠道炎症或长期使用抗生素期间,肠道中的细菌数量减少,使其容易受到侵袭性真菌物种的影响。这在一项涉及用万古霉素治疗的小鼠研究中得到强调,该研究显示在没有细菌种类的情况下存在播散性白色念珠菌感染。因此,病原真菌不仅受宿主免疫的调节,还受各种共生细菌的调节。
真菌和细菌相互作用以优化它们的微环境。肠道微生物产生一种称为生物膜的细胞外基质,以防止抗菌因子。体外研究表明,热带念珠菌(C.tropicalis)、大肠杆菌(E.coli)和粘质沙雷氏菌(Serratia marcescens)共生作用,形成比它们单独产生的能力要厚得多的生物膜。
扫描电子显微镜揭示了这三种生物体之间的密切相互作用,粘质沙雷氏菌使用菌毛将大肠杆菌和热带念珠菌连接在一起。
众所周知,炎症性肠病(IBD)患者体内的微生物群发生了改变,以往的研究主要集中在细菌的相对失衡上。IBD患者的细菌生物多样性降低,来自厚壁菌门的细菌相对减少,来自变形杆菌门的细菌相对增加。
炎症性肠病患者的真菌群落主要由子囊菌门和担子菌门的真菌组成,最常见的属包括酵母属、德巴利酵母(Debaryomyces)、青霉属、曲霉属,以及念珠菌属。
☆ 不同IBD表型真菌群落存在差异
炎症性肠病涉及疾病表型的异质性集合。疾病的表型和炎症的程度与独特的菌群特征有关。在克罗恩病(CD)中,与仅发生在结肠的疾病相比,霉菌种群因累及回肠的疾病而异。特别是,保留回肠的CD显示出较高的念珠菌和德巴利酵母菌,而曲霉菌属(Aspergillus)和毕赤酵母菌(Pichia)在回肠受累的CD中的丰度较高。
在疾病发作期间,与对照组相比,担子菌门与子囊菌门的比率增加。在物种水平上,处于活动发作期的克罗恩病患者显示出念珠菌属、Gibberella moniliformis、Alternaria brassicicola和新型隐球菌(Cryptococcus neoformans)的相对丰度更高。
当根据疾病程度分类时,菌群组成的变化在溃疡性结肠炎(UC)中最为突出。直肠炎患者的青霉菌相对丰度最高,随着疾病程度向近端进展呈负相关。与直肠炎患者相比,毕赤酵母菌(Pichia)在左侧结肠炎患者中的比例过高。
☆ 白色念珠菌增加,导致促炎细胞因子释放
随着与炎症性肠病发作相关的独特微生物组特征得到进一步验证,真菌致病因子在促炎状态中的作用逐渐被认可。
与健康对照相比,炎症性肠病(IBD)患者肠道中白色念珠菌的丰度增加。在菌丝形式中,白色念珠菌上调内皮转化酶1(ECE1)基因,导致ECE1蛋白的丰度更高。这种蛋白质经过蛋白水解加工以释放其活性形式,称为念珠菌溶血素。
念珠菌溶血素是一种31个氨基酸的溶细胞肽,以破坏上皮细胞质膜和刺激编码促炎细胞因子的转录因子而闻名。念珠菌溶血素还损害巨噬细胞的功能,对其抗真菌能力产生负面影响。与健康对照相比,一组克罗恩病患者表现出对念珠菌溶血素特异性的IgA介导的反应水平较低。这表明炎症性肠病患者的高免疫原性真菌病原体没有得到充分控制,并可能导致其促炎状态。
☆ 可作为炎症的替代标志物
作为炎症性肠病中真菌分析的副产品,某些物种已被确定为炎症的替代标志物。与同一克罗恩病(CD)患者体内的发炎组织相比,发现酿酒酵母在非发炎组织中的相对丰度更高。活跃发作的克罗恩病患者表现出更高水平的抗酿酒酵母抗体(ASCA)。
抗酿酒酵母抗体(ASCA)也被用于疾病预测,与对照组相比,在后来诊断为CD的患者中发现的ASCA 水平更高。此外,ASCA已被推断为疾病严重程度的预测指标,与ASCA IgG阴性的CD患者相比,ASCA IgG阳性患者的手术干预率更高。
对患有克罗恩病患者进行定期筛查抗酿酒酵母抗体(ASCA)尚未渗透到临床医学的常规实践中,但它作为一种辅助的、无创的疾病活动和严重程度的衡量方法继续显示出前景。
肠道真菌通过先天和适应性免疫系统影响宿主免疫,这是由真菌细胞壁成分和肠道免疫细胞的模式识别受体(PRR)之间的相互作用引发的。
真菌激活先天免疫和适应性免疫
真菌的吞噬作用导致各种免疫反应的激活,以努力控制真菌的定居。当这些调节机制功能障碍或缺失时,真菌定植不受抑制,导致肠道微生物结构紊乱和肠道炎症。
通过几个检查点,先天和适应性免疫系统可以区分共生真菌或致病真菌。鉴于白色念珠菌可作为共生因子或致病因子,通常用于免疫学分析,以帮助区分这些不同的免疫反应。蛋白质相关分子模式(PAMPs)白色念珠菌和其他真菌与肠道单核吞噬细胞(MNPs)上的toll样受体(TLRs)、C型凝集素受体(CLRs)和NOD样受体(NLRs)相互作用。
例如,巨噬细胞甘露糖受体1(MMR)、树突细胞特异性ICAM3抓取非整合素(DC-SIGN)和巨噬细胞诱导型C-型凝集素(MINCLE)识别某些真菌细胞壁上富含甘露糖的结构。常见的MNPs C型凝集素受体包括dectin-1和dectin-2。dectin-1与真菌β-葡聚糖结合后刺激构象变化,暴露其尾部的免疫受体基于酪氨酸的激活基序(ITAM),随后被SRC家族激酶磷酸化。这一过程使得磷酸化的ITAMs能够与脾酪氨酸激酶(Syk)的SH2结构域结合,激活含有胱天蛋白酶募集结构域的CARD9,并引导Th-17细胞的诱导,动员中性粒细胞进入肠道。
共生和致病形态分别通过不同的免疫途径影响肠道炎症
dectin-1与白色念珠菌或曲霉菌上的β-葡聚糖结合,促进生物活性IL-1β从非活性形式pro-IL-1β通过非经典caspase-8炎性小体激活。重要的是,caspase-8炎性小体的激活不依赖于真菌物质的内化。因此,dectin-1能够在识别外部真菌细胞壁成分后,通过激活IL-1β产生快速有效的反应。IL-1β是IL-1家族的一员,以诱导全身炎症而闻名,同时也能防御外来抗原。作为对真菌识别的反应,IL-1β刺激辅助性T细胞,动员中性粒细胞,并增强吞噬作用,以改善肠道中真菌病原体的清除。
当白色念珠菌处于共生酵母形态时,其负责炎症小体和IL-17通路的PAMPs被隐藏。当它转变为致病菌丝形式时,炎症小体通路和IL-17信号通路被激活。特别是,TLR会分泌细胞因子,如IL-1β、IL-23和IL-6,促进CD4+ T细胞激活进入Th17谱系。Th17细胞则分泌IL-17,招募巨噬细胞、中性粒细胞和抗菌肽,产生有效的抗真菌反应。因此,致病真菌上的PAMPs与宿主树突状细胞上的PRR之间的独特相互作用决定了炎症反应。
共生真菌通过训练免疫系统增加对病原体的抵抗
真菌群在宿主免疫中发挥重要作用。参与真菌识别的巨噬细胞和单核细胞在接触共生真菌(如酿酒酵母)后会获得训练,进一步接触细菌或真菌时,TNF-α和IL-6的产生会增加。
真菌共生菌直接参与稳定肠道稳态,白色念珠菌能够在宿主应激时脱落其致病菌株,保护宿主免受细菌和真菌病原体的侵害。
此外,真菌共生对结肠炎相关的致癌作用也有保护作用。与野生型小鼠相比,真菌耗尽的小鼠在施用氧化偶氮甲烷-葡聚糖硫酸钠(AOM/DSS)后结肠肿瘤发生率更高,而补充外源性IL-18则显著降低肿瘤发生率。因此,真菌共生通过炎症小体途径在预防结肠炎及其相关癌症中发挥重要作用。
鉴于肠道微生物组的广泛多样性及其对人类健康的独特、多模式影响,优化肠道微生物组以改善健康的机制已成为许多新兴研究的焦点。饮食不仅是胃肠道内许多微生物成分的载体,也是其主要营养来源。因此,饮食调节可以通过微生物群组成和功能的变化间接传播起到促炎或抗炎作用。
例如,以植物为基础的饮食与肠道细菌向更具抗炎性的转变有关,其特征是更高的普拉梭菌(Faecalibacterium prausnitzii),直肠真杆菌(E.rectale)和两形真杆菌(Eubacterium biforme),均为丁酸盐生产者。
注:丁酸盐对人体健康的重要性已经在谷禾之前的多篇文章中有过具体讲述。
相反,以肉类为基础的饮食与更易引发炎症的特征相关,这些特征包括活泼瘤胃球菌属(Ruminococcus gnavus)和柯林斯氏菌物种(Collinsella species)的增加。
然而迄今为止,大多数饮食微生物组研究关注点主要集中在细菌种群的组成和功能变化上。鉴于真菌群落在肠道健康中的重要性,有必要进一步研究饮食调节对这一重要群落的影响。这一更广阔的视角会增强我们对饮食如何针对微生物群的所有关键成员的理解,为它们对肠道健康和疾病的影响提供更全面的见解。
可消化的碳水化合物,如单糖、二糖和淀粉多糖,在被身体消化分解为能量并吸收。相比之下,大多数不易消化的碳水化合物或纤维与胃肠道微生物群相互作用,主要在结肠中进行发酵。这个发酵过程产生气体、短链脂肪酸和其他代谢物。
• 念珠菌与近期摄入的碳水化合物呈正相关
研究表明念珠菌与最近的碳水化合物摄入呈正相关。此外,发现高果糖、葡萄糖、麦芽糖和蔗糖的摄入增加了内皮细胞的粘附假丝酵母物种(白色念珠菌,热带念珠菌,以及克柔念珠菌)到上皮细胞。此外,减少饮食中的单糖和淀粉已被证明可以减少肠道中念珠菌的慢性过度生长。
• 高碳水化合物饮食的真菌变化
观察到,与健康的日本人相比,健康的印度成年人的粪便微生物群中含有更高比例的念珠菌和普雷沃氏菌,这可能是由于印度成年人对膳食植物多糖的摄入量较高。
高碳水化合物饮食增加了五个真菌属:
Pleurotus ↑↑↑
Kazachstania ↑↑↑
Auricularia ↑↑↑
Paraphaeosphaeria ↑↑↑
Ustilaginaceae ↑↑↑
并降低了布氏白粉菌属(Blumeria)。
相反,低碳水化合物饮食导致了肠道真菌群落的显著变化,减少了:
Blumeria ↓↓↓
Agaricomycetes ↓↓↓
Malassezia ↓↓↓
Rhizopus ↓↓↓
Penicillium ↓↓↓
增加了Ustilaginaceae。
一些真菌群也可以产生短链脂肪酸,并呈正相关
多项研究表明念珠菌有助于将复杂的碳水化合物发酵成单糖,单糖是其他微生物的能量来源。对猪的研究发现,饮食中碳水化合物含量的差异与不同的真菌种群和短链脂肪酸(SCFA)产量有关。具体来说,低碳水化合物饮食的猪具有较低水平的乙酸盐、丁酸盐和总短链脂肪酸,一些真菌属与这些短链脂肪酸正相关,包括Tomentella,Metschnikowia和Loreleia。
人类研究中膳食碳水化合物调节对肠道真菌的影响


Buttar J,et al.Gut Microbes.2024
因此,膳食碳水化合物的摄入可能会影响肠道真菌种群及其代谢活动,未来的研究应侧重于阐明不同碳水化合物影响真菌群落的确切机制。
肠道微生物群高度参与蛋白水解发酵,产生短链脂肪酸、支链脂肪酸(BCFA)、气体和有害的腐败代谢物,如氨、胺和硫化氢。
• 真菌对氨基酸的高利用率提高其在肠道中的存活率
一项体外研究发现,氨基酸利用率与真菌生长呈正相关。氨基酸可以作为白色念珠菌的碳源,因为这种真菌物种产生蛋白酶并具有寡肽转运蛋白,使白色念珠菌能够通过代谢途径调节适应不同的环境。
在另一项研究中,发现酿酒酵母(S.cerevisiae)和无冠构巢曲霉(Aspergillus nidulans)使用转运蛋白,如氨基酸-多胺-有机阳离子(APC)超家族和主要促进剂超家族(MFS)来利用氨基酸,这可以提高真菌在肠道中的存活率。
• 高蛋白饮食与念珠菌丰度呈负相关,与酵母菌呈正相关
很少有研究评估富含蛋白质的饮食对人类的影响。研究了影响肠道真菌群落稳态的因素,发现乳制品消费是一种高蛋白食物来源,与念珠菌呈负相关,与酵母菌呈正相关。
膳食脂肪主要在小肠中被消化和吸收,并在小肠中代谢,为身体提供能量和各种脂肪酸。一项人类研究表明,脂肪会影响肠道真菌群落。具体来说,证明了念珠菌与总饱和脂肪消耗量呈负相关。
• 脂肪酸可能抑制真菌的生长
体外研究表明,不同真菌物种将脂肪酸和脂肪醇代谢为碳源和能源的效率差异很大。脂肪酸可以抑制真菌的生长。在专注于食品防腐的研究中,发现饱和脂肪酸、不饱和脂肪酸和氧化脂质具有抗真菌特性。
由于缺乏研究调查脂肪对人类肠道真菌群落的影响,这些饮食成分对肠道真菌群落的影响仍然不清楚。然而,在一项小鼠研究中,与喂食标准食物的小鼠相比,喂食高脂肪饮食的小鼠几种真菌类群有所增加,包括Alternaria, Saccharomyces, Septoriella和Tilletiopsis。
动物模型中饮食调节对肠道菌群的影响

Buttar J,et al.Gut Microbes.2024
虽然膳食脂肪对能量代谢至关重要,但它们对肠道真菌群落的影响还不太清楚。未来的研究还需要深入研究膳食脂肪在塑造肠道真菌群落中的作用。
已经发现某些饮食习惯和模式显著影响肠道真菌群落的组成。城市化和饮食习惯的变化会导致中国不同地区人群真菌组成的差异。

这项研究确定了食用酪乳和蓝莓茶与Tetrapissipora blattae、Sugiyamaella lignohabitans、Kazachstania naganishii等的存在之间的相关性。
此外,红茶和猪肉的消费与镰刀真菌属(Fusarium spp.)的四个物种的组成有关。
在另一项研究中,发现杏仁和开心果的摄入与念珠菌和青霉菌属呈负相关。此外,对动物性饮食和植物性饮食进行了比较分析,结果显示动物性饮食组中Neosartorya fischeri(一种源自青霉属的真菌)的丰度更高。
• 素食者体内易出现食源性真菌
研究表明,超过60%的素食者粪便样本中存在食源性真菌,如青霉菌和曲霉菌,以及潜在的致病真菌,如镰刀菌和马拉色菌,但这些真菌类群在食用西方饮食的个体中很少发现。小鼠研究进一步支持饮食调节对真菌群落特征的影响。与标准食物相比,喂食加工饮食的小鼠的总体真菌多样性降低。
• 酵母菌可能随饮食来源进入体内
另一个值得注意的方面是我们的食品中普遍存在常见的肠道真菌,例如酿酒酵母(S.cerevisiae)和汉斯德巴氏酵母菌(Debaryomyces Hansenii)。这些真菌常见于乳制品、面包、果皮(包括葡萄)、普洱茶和奶酪中,因此很难确定这些真菌物种是真的存在于肠道中,还是在自然界中更短暂。
研究发现,食用不含酿酒酵母的饮食导致酿酒酵母水平从基线时的86%大幅降低到无酿酒酵母饮食2天后ITS读数的 0.1%。这表明酿酒酵母的丰度高度依赖于这种真菌物种的饮食来源。
因此,探索特定真菌物种对疾病潜在影响的研究应考虑食物来源的真菌分类群的潜在短暂性。这种考虑很重要,因为它可能会影响这些物种在健康和疾病中的重要性。
• 利于真菌群落稳态和健康的饮食
最近的营养学研究利用Mycobiome 饮食来选择性地改变肠道中真菌的组成。Mycobiome 饮食的特点是消耗瘦肉或植物蛋白、单不饱和脂肪或多不饱和脂肪、富含纤维和抗性淀粉的食物,同时避免加工的高糖食物。
遵循Mycobiome饮食28天导致念珠菌的丰度下降了72.4%,尤其是白色念珠菌和热带念珠菌。此外,Mycobiome饮食增加了一些有益真菌物种的浓度,包括Pichia kluyveri和Galactomyces geotrichum。
这种饮食除了对肠道菌群的有益影响外,还使小肠细菌过度生长患者的细菌过度生长减少,并改善了所有参与者的疲劳、睡眠、腹胀、便秘和腹泻。
尽管研究表明,真菌群落随着饮食而变化,但我们对饮食对这些微生物功能潜在影响的了解仍然有限。据了解,细菌和真菌群落都产生代谢物,这些代谢物不仅形成它们自己的群体,而且对其他群落成员和各种宿主细胞群体施加影响。
作为对高纤维饮食的响应,肠道细菌上调功能途径和酶,使纤维发酵产生短链脂肪酸,特别是丁酸。
真菌作为真核生物,表现出与细菌等原核生物不同的代谢特征。真菌具有发酵植物细胞壁的代谢途径和酶,一些真菌种类在食品工业中用于乙醇生产,并通过发酵果胶、纤维素和木质素等纤维产生乳酸和气体。
真菌在降解纤维素纤维方面优于细菌。真菌产生更多的甲烷、乙酸盐和甲酸盐,而细菌产生更多的丁酸盐和丙酸盐。
重要的是要考虑代谢物在调节肠道细菌和真菌之间的作用。代谢物,如胆汁酸,可以影响微生物的相互作用,因为真菌有能力通过胆汁酸的转化对细菌的生存力产生不利影响。
!
小贴士
饮食对改变真菌群落组成的影响可能不直接归因于饮食成分对肠道真菌的影响。相反,这些影响可能是间接的,源于肠道细菌的调节,进而影响真菌的组成。
由于阐明饮食如何调节肠道真菌群落背后的机制的证据有限,有必要进行进一步的研究来辨别饮食对肠道真菌群落的直接和间接影响。
肠道微生物组是一个复杂而独特的实体,能对环境、饮食和疾病的变化做出反应。它充满了来自各个种群的微生物,通过复杂而动态的关系相互作用。虽然细菌是微生物组稳态中最重要的部分,但真菌在其中也起着不容忽视的作用,参与机会性病原体的调节和原本无法获得的营养物质的发酵。
菌群结构的改变与菌群失调有关,菌群失调是一种与包括炎症性肠病(IBD)在内的各种慢性疾病有关的发炎免疫状态。菌群概况因IBD表型和严重程度而异,菌群标志物有望作为疾病进展的指标。
还需研究饮食对非细菌微生物群的调节作用,以及参与真菌发酵和膳食成分利用的代谢途径和酶的机制。深入了解饮食如何影响肠道菌群的组成和功能至关重要。这些知识将帮助确定饮食疗法是否应该专门针对肠道真菌,从而可能减轻炎症并改善炎症性肠病患者的预后。
主要参考文献
Buttar J, Kon E, Lee A, Kaur G, Lunken G. Effect of diet on the gut mycobiome and potential implications in inflammatory bowel disease. Gut Microbes. 2024 Jan-Dec;16(1):2399360.
Rinninella E, Raoul P, Cintoni M, Franceschi F, Miggiano GAD, Gasbarrini A, Mele MC. What is the healthy gut microbiota composition? A changing ecosystem across age, environment, diet, and diseases. Microorganisms. 2019. Jan 10;7(1):14.
Liang G, Cobián-Güemes AG, Albenberg L, Bushman F. The gut virome in inflammatory bowel diseases. Curr Opin Virol. 2021. Dec;51:190–198.
Nacer S, Haddad F, Tahiri M, Hliwa W, Badre W, Choukri EM, Jai SR, Erguibi D, Boufettal R, Chehab F. P51 predictive factors of surgery in crohn’s disease. Gut. 2022.
Wang R, Li Z, Liu S, Zhang D. Global, regional and national burden of inflammatory bowel disease in 204 countries and territories from 1990 to 2019: a systematic analysis based on the global burden of disease study 2019. BMJ Open. 2023. Mar. 13(3):e065186.
Sigall-Boneh R, Levine A, Lomer M, Wierdsma N, Allan P, Fiorino G, Gatti S, Jonkers D, Kierkuś J, Katsanos KH, et al. Research gaps in diet and nutrition in inflammatory bowel disease. A topical review by D-ECCO working group [dietitians of ECCO]. J Crohns Colitis. 2017.
Raimondi S, Amaretti A, Gozzoli C, Simone M, Righini L, Candeliere F, Brun P, Ardizzoni A, Colombari B, Paulone S, et al. Longitudinal survey of fungi in the human gut: ITS profiling, phenotyping, and colonization. Front Microbiol. 2019. Jul 10;10:1575.
Dalle F, Wächtler B, L’Ollivier C, Holland G, Bannert N, Wilson D, Labruère C, Bonnin A, Hube B. Cellular interactions of Candida albicans with human oral epithelial cells and enterocytes. Cell Microbiol;2010;12(2):248–271. doi: 10.1111/j.1462-5822.2009.01394.x.

谷禾健康

你可知道,为什么明明摄入了很多的蛋白质,仍然可能出现氨基酸缺乏的情况吗?谷禾今天就带你深入了解这一现象背后的各种奥秘和原因,帮助你更好地理解蛋白质的摄入与氨基酸利用关系。
造成这种情况的原因可以主要分为几个方面,我们将逐一详细讲述:
一、内源性氨基酸的产生不足。这些氨基酸是在体内合成的,主要通过蛋白质的分解与转化而来。然而,内源性氨基酸的生成受到多种因素的影响,比如身体的整体代谢状态、营养状况、肝脏的功能等。如果这些影响因素出现问题,就会导致体内内源性氨基酸的产生不足,从而影响整体的氨基酸平衡。特别值得注意的是,肠道菌群在这个过程中扮演着关键角色,它们不仅参与氨基酸的合成,还能影响宿主的代谢状态。如果肠道菌群失衡,可能会影响内源性氨基酸的产生效率。
二、外源性蛋白质的消化和吸收率不高。外源性蛋白质来自我们摄入的食物,经过消化过程转化为氨基酸。但这个过程的效率不总是很高,因素如食物的种类、加工方式、个人的消化功能等都会影响外源性蛋白质的消化和氨基酸的吸收。健康的肠道菌群能够提高蛋白质的消化效率,产生有益的代谢物,并维持肠道屏障功能,从而促进氨基酸的吸收,如果肠道菌群失衡,消化吸收不良,即使摄入了足够的蛋白质,身体也无法有效利用其中的氨基酸。
三、氨基酸的消耗过大,导致消耗量超过了摄入量。这就像一个游泳池,放水速度比注水速度快,那么即使持续地注入水,也很难增加池内的水量。而肠道菌群的代谢活动也会影响氨基酸的消耗速率,某些菌群可能会竞争利用宿主的氨基酸资源。
每个人对氨基酸的需求和消耗情况是不同的,这和个体的活动水平、身体状况以及生理需求都有很大关系,同时,每个人的肠道菌群组成都是独特的,这种个体差异会影响到氨基酸的代谢和利用效率。有些人可能会在日常生活中消耗掉大量氨基酸,导致最终的总量不足。因此,在摄入氨基酸时,需要综合考虑个体需求的差异,关注肠道健康状况,以确保氨基酸的充分吸收和利用,满足身体所需。
本文我们一起来了解一下,蛋白质在胃肠道内的消化过程,详细讨论影响氨基酸消化和吸收的关键因素,肠道菌群如何影响氨基酸的吸收,探讨根据不同人群的特点(如素食者、运动人群、孕妇等)来优化蛋白质的摄入策略,以及如何通过调节肠道菌群来提高氨基酸的利用效率,从而更好地把握蛋白质摄入与氨基酸利用的关系,制定有效的营养策略。
▸ 氨基酸的定义
氨基酸(amino acid)是含有氨基和羧基的一类有机化合物,是促进人体生长,维持身体正常代谢,影响生命活动的重要物质,也是合成机体所需抗体、激素、酶类的原料。
如果氨基酸代谢异常,可能导致生长发育、全身稳态受损,甚至死亡。总的来说,氨基酸作为生命体的最基本组成单位,在人体扮演着重要角色。
▸ 氨基酸与蛋白质的关系
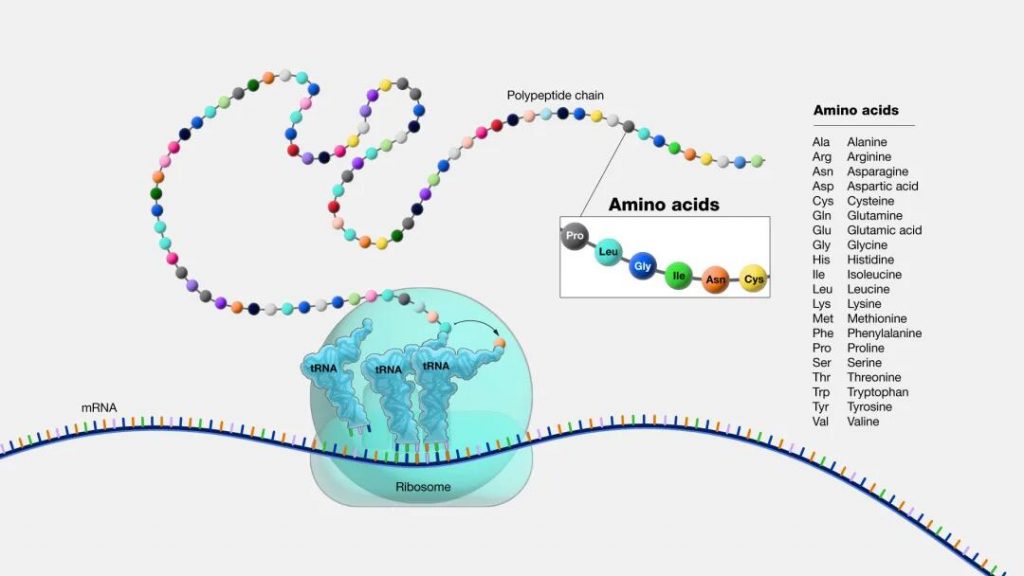
蛋白质我们都知道,人体必需的营养素之一。它是有机大分子,是构成细胞的基本有机物,是生命活动的主要承担者。可以这么说,没有蛋白质就没有生命。
而氨基酸是蛋白质的基本组成单位。蛋白质和氨基酸之间的关系是:氨基酸通过脱水缩合形成肽键,进而连接形成肽链,肽链折叠盘旋形成具有空间结构的蛋白质。
图源:National Human Genome Research Institute
氨基酸的种类、数目、排列方式、多肽链的盘曲、折叠方式及其空间结构的不同导致了蛋白质结构的多样性,其结构的多样性导致了功能的多样性。
通俗地讲:氨基酸是构成蛋白质的小分子“积木”。想象一下,蛋白质就像一串珠子项链,而每颗珠子就是一个氨基酸。它们通过不同的组合和排列形成各种蛋白质。
通常,我们体内的氨基酸以游离氨基酸总量计算,包括两部分,一是内源氨基酸,即体内组织蛋白降解产生或自身合成的非必需氨基酸;二是外源氨基酸,即食物蛋白质经消化吸收而来。两者共同分布于身体各处,参与代谢,总称为氨基酸代谢库。
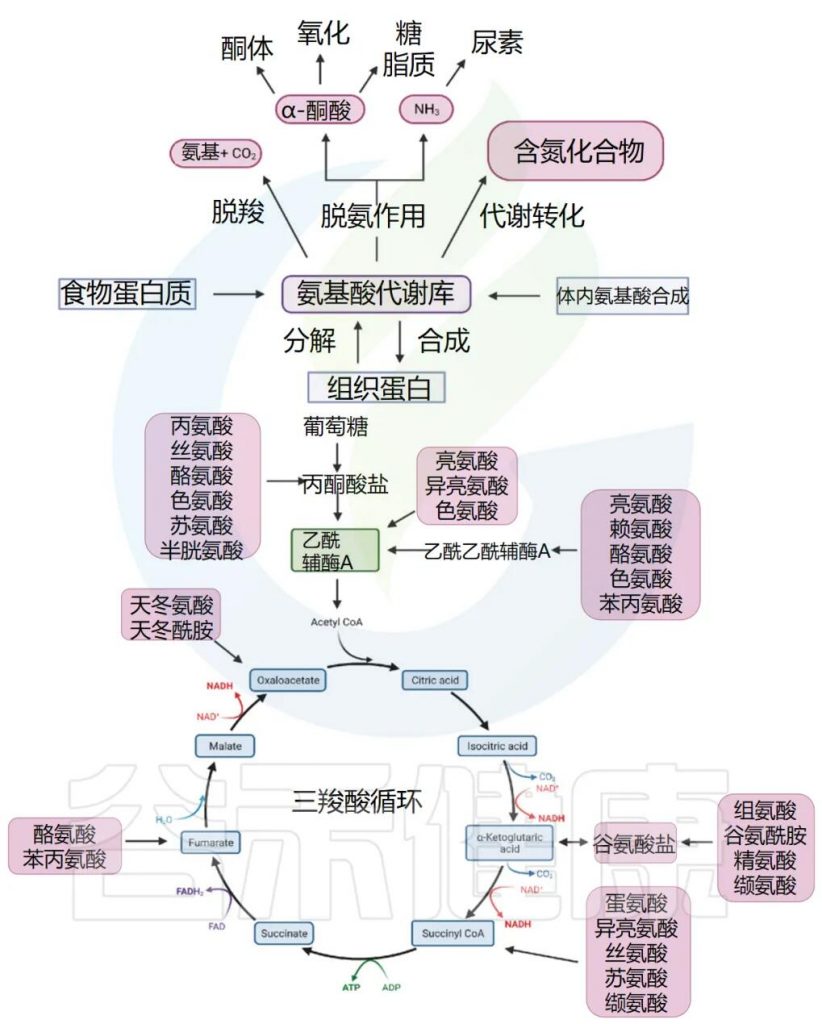
1
内源性氨基酸的合成
◆ 大多数非必需氨基酸可通过转氨基作用合成
转氨基作用指的是一种α-氨基酸的α-氨基转移到一种α-酮酸上的过程,可以看成是氨基酸的氨基与α-酮酸的酮基进行了交换。生成相应的α-氨基酸;而原来的α-氨基酸则转变为相应的α-酮酸。
例如,天冬氨酸是三羧酸循环中间产物草酰乙酸经转氨作用得到,谷氨酸是三羧酸循环中间产物α-酮戊二酸经转氨作用得到,丙氨酸是糖酵解生成的丙酮酸经转氨作用得到。
一般有以下几类:
1) 谷氨酸族:以a-酮戊二酸为起始物,可合成Glu,GIn,Pro,Arg(称为谷氨酸族);
2) 天冬氨酸族:以草酰乙酸为起始物,可合成Asp,Asn,Met,Thr,Lys,le(称为天冬氨酸族);
3)丙氨酸族:以丙酮酸为起始物,可合成Ala,Val,Leu(称为丙氨酸族);
4)丝氨酸族:以甘油酸-3-磷酸为起始物,可合成Ser,Gly,Cys(丝氨酸族);
5)芳香族氨基酸:以赤藓糖-4-磷酸、磷酸烯醇式丙酮酸为起始物,可合成芳香族氨基酸(Phe,Tyr,Trp);
6)组氨酸(His):由核糖-5-磷酸衍生,核糖-5-磷酸通过磷酸戊糖途径产生。
◆ 通过必需氨基酸转化
从上述合成的过程可以发现,氨基酸的种类发生了改变,数量并没有发生改变。那么,有没有不是通过转氨基途径合成氨基酸呢?答案肯定是有的,如下所示是半胱氨酸的合成示意图:
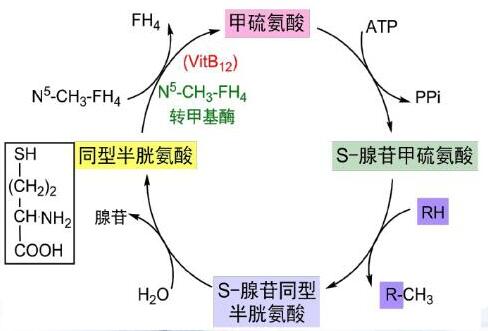
半胱氨酸在体内可以由甲硫氨酸转化而成,而这一过程必须有维生素B6参与。
必需氨基酸还可以通过苯丙氨酸羟化酶催化合成非必需氨基酸酪氨酸,如果缺少这种酶,转化过程很难进行,苯丙氨酸就会转化为苯丙酮酸,这就是苯丙酮尿症的原因。
2
影响内源性氨基酸合成的因素
▸ 营养因素
•必需氨基酸的充足供应
虽然非必需氨基酸可以在体内合成,但合成过程中往往需要以必需氨基酸为前体或底物。如果必需氨基酸缺乏,可能会影响非必需氨基酸的合成途径,导致非必需氨基酸合成减少。
例如,当饮食中缺乏蛋氨酸时,可能会影响半胱氨酸的合成,因为半胱氨酸可以由蛋氨酸转化而来。
•能量供应
非必需氨基酸的合成需要消耗能量,因此充足的能量供应对于非必需氨基酸的合成至关重要。如果能量摄入不足,身体会优先利用能量来维持生命活动的基本需求,从而可能减少非必需氨基酸的合成。
在饥饿或能量摄入不足的情况下,身体会分解蛋白质来提供能量,这会导致非必需氨基酸的合成减少。
•维生素和矿物质的供应
某些维生素和矿物质是参与非必需氨基酸合成的酶的辅助因子或激活剂。例如,维生素B6是参与氨基酸代谢的多种酶的辅酶,缺乏维生素B6可能会导致谷氨酸合成谷氨酰胺的过程受阻。锌、镁等矿物质也可能参与某些氨基酸合成酶的活性调节。
▸ 生理因素
•年龄和生长发育阶段
不同年龄和生长发育阶段的人对非必需氨基酸的合成能力可能不同。婴幼儿和青少年时期,身体生长发育迅速,对蛋白质和氨基酸的需求较大,非必需氨基酸的合成能力也相对较强。
随着年龄的增长,身体的代谢功能逐渐下降,非必需氨基酸的合成能力可能会减弱。因此老年人可能需要更多的优质蛋白质补充来满足身体对氨基酸的需求。
•健康状况和疾病状态
某些疾病可能会影响非必需氨基酸的合成。例如,肝脏疾病可能会影响氨基酸的代谢和转化,导致非必需氨基酸的合成减少。肾脏疾病可能会影响氨基酸的排泄和重吸收,从而影响体内氨基酸的平衡。
此外,一些慢性疾病如糖尿病、癌症等也可能影响非必需氨基酸的合成,因为这些疾病会导致身体的代谢紊乱和营养消耗增加。
•激素水平
激素可以调节身体的代谢过程,包括氨基酸的合成和分解。例如,生长激素可以促进蛋白质的合成和细胞的生长,从而可能增加非必需氨基酸的合成。胰岛素可以促进葡萄糖的摄取和利用,同时也可以促进氨基酸的摄取和蛋白质的合成,可能对非必需氨基酸的合成有一定的促进作用。
相反,一些应激激素如皮质醇可能会促进蛋白质的分解,从而可能减少非必需氨基酸的合成。
▸ 环境因素
•饮食结构和饮食习惯
长期的不良饮食结构和饮食习惯可能会影响非必需氨基酸的合成。例如,高糖、高脂肪、低蛋白的饮食可能会导致蛋白质摄入不足,从而影响非必需氨基酸的合成。过度饮酒、吸烟等不良习惯也可能对身体的代谢功能产生不良影响,从而影响非必需氨基酸的合成。
此外,一些特殊的饮食限制,如素食主义、低蛋白饮食等,需要更加关注非必需氨基酸的合成问题,以确保身体的正常代谢需求。
•运动和体力活动
适度的运动和体力活动可以促进身体的代谢功能,运动可以增加肌肉的蛋白质合成,从而可能增加对非必需氨基酸的需求和合成。
然而,过度的运动和体力活动可能会导致蛋白质分解增加,从而影响非必需氨基酸的合成。此外,运动过程中如果没有及时补充足够的营养物质,也会影响非必需氨基酸的合成。
•环境压力和应激
长期处于高压力、高应激的环境中,会影响身体的代谢功能,从而影响非必需氨基酸的合成。在应对环境压力和应激时,身体会优先利用能量和营养物质来维持生命活动的基本需求,从而可能减少非必需氨基酸的合成。
当这些因素受到影响时,会导致内源性氨基酸的产生不足。这种不足会进一步影响人体内氨基酸的整体水平,使得总氨基酸的水平较低。
还有一些氨基酸人体不能合成或合成速度远不能适应人体需要,必须通过食物中的蛋白质补充,也称为必需氨基酸。
1
蛋白质和多肽在肠道内的消化
以前,蛋白质消化和氨基酸吸收被认为是截然不同的独立过程;现在人们认识到,蛋白质分解成更小的单位,随后被肠细胞吸收,并将氨基酸释放到门静脉血液中,这是一个高度组织和紧密结合的过程。
消化涉及食物基质、自身物理过程和哺乳动物及细菌酶的化学过程之间的多种相互作用,所有这些都发生在胃肠道的复杂环境中。
•大分子蛋白质先被胃蛋白酶水解成多肽
摄入的食物在口腔中经过咀嚼发生物理分解,食物与唾液等液体混合,产生可被吞咽进入胃部的食物丸。胃蛋白酶在不同的裂解点水解蛋白质,形成更小的多肽,胃酸使蛋白质变性并部分展开,帮助胃蛋白酶更好地进入它们的键。
随后,剩余的蛋白胨和多肽被转移到小肠中,在小肠中胰腺产生和分泌多种蛋白酶和肽酶,如肠黏膜的胰蛋白酶、羧肽酶。上皮细胞的刷状缘膜结合酶包括许多氨基肽酶和一种羧肽酶,并作用于胰腺消化后留下的任何寡肽。
•多肽再被切割成各个氨基酸
胰腺蛋白酶将多肽切割成寡肽和氨基酸。胃蛋白酶、胰蛋白酶、凝乳胰蛋白酶和弹性酶都属于内肽酶,它们攻击某些内部键,产生大的多肽。
注:胃蛋白酶在芳香氨基酸如苯丙氨酸、色氨酸和酪氨酸旁切割消化键,而胰蛋白酶在碱性氨基酸精氨酸和赖氨酸旁切割键。
在这些内肽酶作用后剩余的寡肽受到外肽酶的攻击,如羧基肽酶A和B,它们每次从多肽或蛋白质的羧基或氨基端切割一个氨基酸。
羧基肽酶从肽链的羧基端切除氨基酸,羧基肽酶A优先释放缬氨酸、亮氨酸、异亮氨酸和丙氨酸,羧基肽酶B优先释放碱性氨基酸如精氨酸和赖氨酸。
2
氨基酸的吸收
蛋白质消化的产物,主要是游离氨基酸、二肽和三肽,通过几种运输机制从小肠腔吸收。
肽和氨基酸通过不同的转运体被小肠肠细胞吸收。空肠近端是肽和氨基酸吸收的主要部位,但小肠的其他部位也具有显著的运输能力。
短肽(二肽和三肽)通过肠细胞顶膜中的H+依赖性肽转运体(如PepT1)转运进入肠细胞,并在上皮细胞中进一步水解为氨基酸。
•不同的氨基酸有特定的转运系统
游离氨基酸(FAAs)被碱性、阳离子、中性氨基酸以及亮氨酸和甘氨酸转运体以梯度依赖的方式通过肠上皮细胞的刷状边界膜吸收。有许多刷状边缘(顶端膜)和基底侧膜转运系统,特定于特定的氨基酸或氨基酸群。
例如,浓缩氨基酸转运蛋白在顶膜上表达,用于吸收中性氨基酸(B0AT1,广义中性氨基酸转运蛋白 1,SLC6A19)、阳离子氨基酸(囊胚中性和阳离子氨基酸转运蛋白,SLC7A9)、甘氨酸和脯氨酸 (PAT1,质子氨基酸转运蛋白1,SLC36A1;SIT,系统亚氨基转运蛋白,SLC6A20) ,阴离子氨基酸(兴奋性氨基酸转运蛋白3(EAAT3),SLC1A1)和β-氨基酸(PAT1,SLC36A1,TauT,牛磺酸转运蛋白,SLC6A6)。
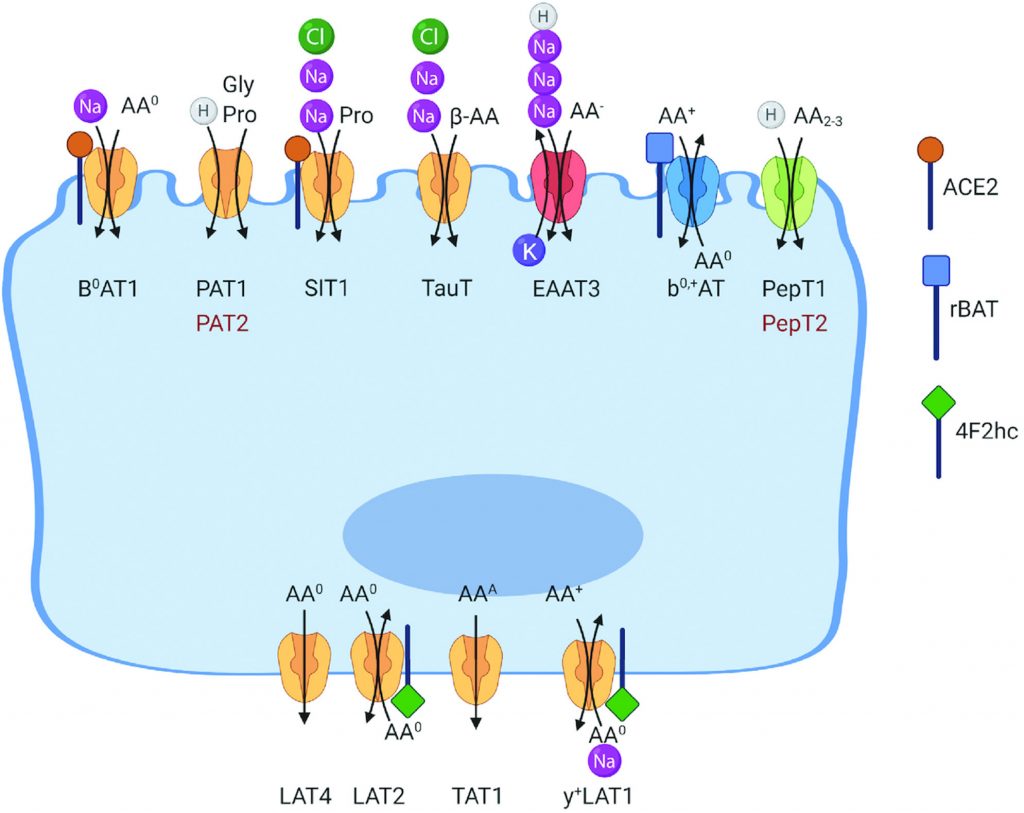
doi: 10.1093/jn/nxab342.
•小肠可以适应性地上调氨基酸吸收能力
人体从膳食蛋白质中获得氨基酸的净正流量是至关重要的,因此小肠具有适应性地上调其氨基酸吸收的能力。个体的膳食蛋白质摄入量和生理状态(影响氨基酸需求)都可能随着时间的推移而改变,氨基酸吸收机制可以在组织和细胞水平上进行相应的调整。例如转运蛋白上调和粘膜增生的共同作用可导致氨基酸吸收能力比禁食状态增加数倍。
继基底外侧膜转运到间质液后,氨基酸通过绒毛毛细血管进入门静脉。门静脉直接供应肝脏,在那里氨基酸可以进一步代谢或运输到其他器官和组织。
3
影响膳食氨基酸消化和吸收的因素
虽然膳食蛋白质通常在胃肠道内被消化,但它们并不一定被完全消化和吸收。此外,不同的氨基酸从蛋白质中释放出来,并在不同程度上被肠道吸收。因此,有必要了解膳食蛋白质和氨基酸的消化和吸收率。影响膳食氨基酸消化和吸收的因素主要有以下几个方面:
▸ 食物因素
•蛋白质的来源和性质
不同来源的蛋白质其氨基酸组成和结构不同,消化和吸收的难易程度也有所差异。例如,动物蛋白(如肉类、蛋类、奶类)通常含有较高比例的优质蛋白质,其氨基酸组成与人体需求较为接近,且消化率较高。
蛋白质的消化是一个有效的过程,从鸡蛋中粗蛋白的97%消化率到谷物中的≥70%不等。
蛋白质的结构也会影响消化。例如,胶原蛋白等结构紧密的蛋白质较难被消化酶分解,而球状蛋白等结构较为松散的蛋白质则相对容易消化。研究表明,与酪蛋白相比,乳清蛋白的消化和吸收速度更快。
•食物的加工和烹饪方式
适当的加工和烹饪可以提高蛋白质的消化率。例如,加热可以使蛋白质变性,使其结构变得松散,更容易被消化酶作用。此外,研磨、破碎等加工方式可以增加蛋白质与消化酶的接触面积,促进消化。
然而,过度加工和烹饪可能会破坏蛋白质的结构和营养成分,降低其消化率。例如,高温油炸、长时间炖煮等可能会导致蛋白质发生美拉德反应,产生难以消化的化合物,同时也会破坏一些必需氨基酸。当被吸收时,通常不被利用,而是被分解并随尿液排出。
•抗营养因子
抗营养因子是一类能够干扰人体对营养素的吸收和利用的物质。食品中的胰蛋白酶抑制剂、单宁和植酸盐等化合物会显著降低蛋白质和氨基酸的消化率。此外,还可能会与蛋白质结合,形成难以消化的复合物,影响蛋白质的消化和吸收。
▸ 消化系统因素
•消化酶的分泌和活性
胃液中的胃蛋白酶、胰液中的胰蛋白酶、糜蛋白酶等消化酶在蛋白质的消化过程中起着关键作用。消化酶的分泌量和活性受到多种因素的影响,如年龄、健康状况、饮食等。老年人的消化酶分泌量可能会减少,导致蛋白质消化能力下降。某些疾病(如胰腺疾病、胃肠道疾病)也会影响消化酶的分泌和活性。
此外,消化酶的活性还受到pH值、温度等环境因素的影响。例如,胃蛋白酶在酸性环境下活性较高,而胰蛋白酶等则在碱性环境下活性较高。
•胃肠道的生理状态
胃肠道的蠕动、分泌、吸收等生理功能对氨基酸的消化和吸收至关重要。胃肠道蠕动过慢会导致食物在胃肠道内停留时间过长,影响消化和吸收;而蠕动过快则可能使食物来不及充分消化就被排出体外。
胃肠道的分泌功能也会影响消化。例如,胃液、胰液、胆汁等消化液的分泌不足会影响蛋白质的消化。此外,胃肠道的吸收面积和功能也会影响氨基酸的吸收。例如,小肠黏膜的损伤会导致吸收面积减少或吸收功能障碍。
▸ 个体因素
•年龄
婴幼儿的消化系统尚未发育完全,消化酶的分泌和活性较低,胃肠道的吸收能力也较弱。随着年龄的增长,消化系统的功能逐渐成熟,但老年人的消化和吸收功能又会逐渐下降。
不同年龄段的人对蛋白质的需求和消化吸收能力不同,因此在饮食中应根据年龄特点选择合适的蛋白质来源和摄入量。
•健康状况
一些疾病会影响蛋白质的消化和吸收。例如,胃肠道疾病(如胃炎、胃溃疡、肠炎等)、肝脏疾病、肾脏疾病等都可能会影响消化酶的分泌、胃肠道的蠕动和吸收功能。此外,一些慢性疾病(如糖尿病、心血管疾病等)也可能通过影响代谢和营养状态间接影响蛋白质的消化和吸收。
营养不良、消瘦、肥胖等也可能影响蛋白质的消化和吸收。营养不良可能导致消化酶的合成减少、胃肠道黏膜萎缩等,从而影响消化和吸收功能;而肥胖可能会引起胃肠道激素分泌异常、肠道菌群失调,也会影响蛋白质的消化和吸收。
•遗传因素
个体的遗传差异可能会影响蛋白质的消化和吸收。例如,某些人可能存在特定的基因突变,导致消化酶的活性或结构异常,从而影响蛋白质的消化。此外,遗传因素还可能影响胃肠道的生理功能、肠道菌群的组成等,进而影响蛋白质的消化和吸收。
▸ 其他因素
•饮食中的其他成分
饮食中过多的膳食纤维、脂肪等成分可能会影响蛋白质的消化和吸收。膳食纤维可以促进肠道蠕动,但过多的膳食纤维可能会吸附蛋白质和消化酶,影响蛋白质的消化。脂肪可以延缓胃排空,使蛋白质在胃中停留时间延长,有利于胃蛋白酶的作用,但过多的脂肪可能会引起消化不良。
•药物和补充剂
某些药物会影响蛋白质的消化和吸收。例如,抗生素可能会破坏肠道菌群,影响消化酶的合成和活性;抗酸药会改变胃肠道的pH值,影响消化酶的活性。一些补充剂,如蛋白粉、氨基酸补充剂等,如果使用不当也可能会影响蛋白质的消化和吸收。
在使用药物和补充剂时,应注意其对蛋白质消化和吸收的影响,并在医生或营养师的指导下合理使用。
•肠道菌群
肠道微生物群在氨基酸的调节、消化和吸收过程中发挥着至关重要的作用,它们通过多种方式来影响氨基酸的利用效率。在下一章节中,我们将详细探讨肠道微生物群如何在氨基酸的消化、吸收及利用中发挥作用,并分析其对整体健康的影响。
氨基酸对各种生物活性化合物的合成至关重要,这些化合物在信号通路和代谢中发挥关键的调节作用。肠道微生物群在促进氨基酸调节以及氨基酸消化和吸收过程中起着不可缺少的作用。
doi: 10.2174/1389203719666180514145437.
1
参与氨基酸代谢和吸收
过去对肠道微生物群和氨基酸相互作用的研究表明,许多肠道细菌参与了胃肠道中蛋白质的消化和氨基酸的吸收。
•一些肠道细菌能够产生肽酶,用于降解蛋白质
蛋白质的转换主要发生在肠道中,结肠细菌降解内源性或外源性蛋白质的效率较高。拟杆菌属(Bacteroides)、梭状芽胞杆菌属(Clostridium)、丙酸杆菌属(Propionibacterium)、梭杆菌属(Fusobacterium)、乳酸杆菌属(Lactobacillus)和链球菌属(Streptococcus)在蛋白质水解过程中发挥着重要作用。
其中一些细菌可以直接代谢氨基酸,并具有分泌各种蛋白酶和肽酶的能力。发酵过程中,复杂蛋白质首先被各种细菌肽酶、蛋白酶和内肽酶切割,释放出游离氨基酸和短肽。然后对氨基酸和短肽进行发酵。产生支链脂肪酸(2-甲基丁酸酯、异丁酸酯、异戊酸酯)、有机酸、气体(H2和CO2)以及微量酚、胺、吲哚和氨。
肠道内的梭菌属细菌(赖氨酸或脯氨酸利用的基础细菌)是氨基酸发酵的关键驱动因素,而消化链球菌属细菌是谷氨酸或色氨酸利用的关键驱动因素。

Yadav M,et al.Arch Microbiol.2018
其他例如瘤胃细菌,Selenomonas ruminantium, Megasphaera elsdenii, Prevotella ruminicola, Misuokella multiacidas, Butyrivibrio fibrisolvens, Streptococcus bovis等含有极为活跃的二肽基肽酶和二肽酶。
•代谢氨基酸的基因广泛分布于人类肠道细菌

研究了来自不同系统发育群体的肠道细菌中相关代谢酶及其同源物的分布情况。对代表10个门的380种肠道细菌的基因组做了blast比对。
结果表明,大多数这些酶广泛分布在肠道细菌中,但有些酶表现出不同的分布模式。例如,L-天冬酰胺酶在拟杆菌门(Bacteroidetes)和假单胞菌门(Proteobacteria)中普遍存在,而芳香族氨基酸转氨酶和精氨酸脱亚胺酶主要存在于厚壁菌门(Firmicutes)和放线菌门(Actinomycetota)中。
支链氨基酸转氨酶仅在拟杆菌门和厚壁菌门中观察到,而前消旋酶主要在厚壁菌门中普遍存在。此外,大多数拟杆菌表现出快速消耗天冬酰胺(Asn)的能力,而L-脯氨酸降解菌仅在属于厚壁菌门的毛螺菌科和梭菌科中发现。
这些结果表明,氨基酸代谢基因广泛分布在人类肠道微生物中,并编码消化代谢蛋白质氨基酸的关键酶。
2
从头合成氨基酸
肠道菌群除了参与蛋白质的降解外,还可以合成氨基酸,包括从头合成。
体外研究表明,瘤胃中的细菌种类可以在不同的肽浓度下合成氨基酸。包括Streptococcus bovis,Selenomonas ruminantium, Prevotella bryantii。
doi: 10.2174/1389203721666200212095503.
此外,体内研究还表明,微生物衍生的赖氨酸(一种必需氨基酸)被吸收并并入宿主蛋白质。在无菌和常规化大鼠体内,将15NH4CL中的15N并入赖氨酸的比较表明,检测到的所有15N赖氨酸均来自微生物来源。在后续研究中,这些研究人员确定约75%的微生物15N标记的赖氨酸被小肠吸收。
对18岁以上的人样本进行了检查,这些人被提供了氮充足的饮食,并发现微生物衍生的赖氨酸和苏氨酸对游离血浆赖氨酸和苏氨酸库有显著贡献。此外,有报告说,大肠中微生物群的富集是通过与必需氨基酸(EAA)生物合成相关的基因进行的,该生物合成基于人血浆池产生的前体。
3
对氨基酸吸收的影响
肠道微生物群还可以通过以下几种方式影响氨基酸的吸收。
▸ 调节肠道环境影响氨基酸吸收
•改变肠道pH值
肠道菌群的代谢活动可以改变肠道的pH值。不同的氨基酸在不同的pH值下具有不同的离子化状态,从而影响其吸收。例如,在酸性环境下,一些氨基酸更容易以阳离子形式存在,而在碱性环境下则更容易以阴离子形式存在。
某些肠道菌群如乳酸菌可以产生乳酸,降低肠道pH值,使一些氨基酸更容易被吸收。而另一些细菌如大肠杆菌等则可以产生碱性物质,升高肠道pH值,可能会影响某些氨基酸的吸收。
•影响肠道通透性
肠道菌群可以通过调节肠道上皮细胞之间的紧密连接来影响肠道通透性。正常情况下,肠道上皮细胞之间的紧密连接可以阻止大分子物质和有害物质进入体内,但也会限制一些氨基酸的吸收。
一些有益的肠道菌群如双歧杆菌可以增强肠道上皮细胞之间的紧密连接,维持肠道屏障功能,防止有害物质进入体内,同时也可以促进一些氨基酸的选择性吸收。而一些有害的致病菌则可能破坏肠道上皮细胞之间的紧密连接,增加肠道通透性,导致氨基酸吸收紊乱和肠道炎症。
▸ 与宿主相互作用影响氨基酸吸收
•竞争吸收位点
肠道菌群和宿主细胞可能会竞争氨基酸的吸收位点。一些肠道细菌可以表达与宿主细胞相似的氨基酸转运蛋白,从而与宿主竞争氨基酸的吸收。
例如,某些大肠杆菌可以表达与人体小肠上皮细胞相似的赖氨酸转运蛋白,从而竞争赖氨酸的吸收。这种竞争会导致宿主明明摄入了较多的蛋白质,但实际对氨基酸的吸收量却不多。
•调节宿主基因表达
肠道菌群可以通过产生代谢产物、分泌信号分子等方式调节宿主基因的表达,从而影响氨基酸的吸收。
例如,一些短链脂肪酸如丁酸可以作为信号分子,调节肠道上皮细胞中氨基酸转运蛋白的表达。此外,肠道菌群还可以通过调节肠道免疫系统、内分泌系统等间接影响氨基酸的吸收。
4
补充益生菌增加了植物蛋白的吸收

该实验研究了益生菌补充剂对植物蛋白(如豌豆蛋白)中氨基酸吸收的影响。
研究发现,副干酪乳杆菌LP-DG®(每天50亿 CFU)给药显著增加了摄入豌豆蛋白后蛋氨酸(+20.0%)、组氨酸(+40.4%)、缬氨酸(+21.5%)、亮氨酸(+23.3%)、异亮氨酸(+26.0%)、酪氨酸(+16.0%)、总支链氨基酸(+22.8%)和总必需氨基酸(+16.0%)的含量。
而副干酪乳杆菌 LPC-S01(每天50亿 CFU)给药显著增加了蛋氨酸(+16.3%)、组氨酸(+49.2%)、缬氨酸(+24.7%)、亮氨酸(+25.2%)、异亮氨酸(+26.1%)、酪氨酸(+11.6%)、总支链氨基酸(+26.8%)和总必需氨基酸(+15.6%)最大浓度。
这项研究表明,通过补充益生菌可能是一种重要的营养策略,可以改善餐后血液氨基酸的变化,并克服植物蛋白的组成缺陷。益生菌可以通过优化肠道菌群结构,提高植物蛋白的消化吸收率。
氨基酸在人体营养和生理活动中至关重要,人们对蛋白质的需求实际上是对氨基酸的需求。我们每天从食物中摄取蛋白质,正是为了满足这些生理活动所必需的氨基酸。那么氨基酸被人体吸收后主要有哪些去处呢?让我们继续来看。
1
氨基酸吸收后的利用
人体的游离氨基酸主要有三条去路:
一是合成人体所需的多肽和蛋白质,多肽和蛋白质是机体生命活动的执行者。蛋白质合成过程较复杂,需根据特定基因上携带的遗传信息,经复制、转录、翻译等一系列过程,以各种氨基酸为原料装配成人体蛋白质。
二是经脱氨、脱羧等分解代谢途经生成氨、α-酮酸和胺类、CO2。其中,生成的α-酮酸可进一步代谢,经氨基化作用生成非必需氨基酸供机体利用。或氧化供能(当非蛋白质能量来源不足时,氨基酸可能被用于能量代谢,以满足能量需求)。氨基酸脱氨作用产生的游离氨,在正常情况下,主要在肝脏中合成尿素,随尿排出体外,少部分氨在肾脏中以铵盐形式由尿排出。
三是转变成其它含氮化合物,比如经一系列酶催化转变成嘌呤、嘧啶、肌酸等(赖氨酸合成肉碱,精氨酸合成肌酐,蛋氨酸作为甲基供体)。
!
注意
一些氨基酸代谢产生出具有特殊重要生理功能的小分子化合物,比如:谷氨酸脱氨分解生成γ-氨基丁酸(GABA),GABA是抑制性神经递质,可抑制中枢神经;组氨酸脱羧分解产生组胺,组胺是一种强烈的血管扩张剂,引起平滑肌收缩,并增加毛细血管通透性;色氨酸脱羧分解产生5-羟色胺(又叫血清素),也是一种抑制性神经递质,直接影响神经传导。
•不是所有氨基酸都能被吸收利用
人体内的氨基酸除了被利用外,也会有部分无意流失。每天摄入大量的蛋白质进入胃肠道;虽然其中一些物质被消化和吸收,但相当数量的氨基酸在胃肠道中分解代谢或被纳入微生物蛋白质,这些蛋白质与一些未消化的蛋白质一起在粪便中从体内流失。
2
氨基酸的重吸收
生物体氨基酸稳态的一个重要因素是发生在肾皮层的肾小球滤过/肾小管重吸收机制。
每天都会不可避免地流失一些氨基酸,如尿素、肌酐和氨。当蛋白质成分增加超过必需替代或氨基酸用于糖异生时,尿素的量会增加。
•肾小管重吸收受损会导致氨基酸的流失增加
肾小管重吸收是氨基酸循环的一部分。它由于肠道中发现的几乎相同的一组转运蛋白介导,当肾小管重吸收受损时,可能导致氨基酸流失增加,即使摄入了较多的蛋白质,氨基酸的总含量仍缺乏。
3
不同人群氨基酸需求不同
多年来,人们进行了大量的工作来确定人类对膳食氨基酸的需求。粮农组织、世卫组织和联合国建议,每公斤体重0.83克优质蛋白质是每日膳食蛋白质的“安全”摄入量,即体重70公斤的参考男性每天摄入58克蛋白质,体重57公斤的参考女性每天摄入47克蛋白质。
但越来越多的研究和谷禾数据表明,由于个体消化吸收差异以及不同食物和饮食习惯的代谢影响,每个人对蛋白质的需求量各不相同。
•不同人群对氨基酸的需求和利用都不同
每个人的不同状态对蛋白质的需求量也都不同:在成长中的儿童中,需要氨基酸来维持体内蛋白质和生成新的组织,而在成人中,需要氨基酸来补充体内丢失的氨基酸。对于孕妇和哺乳期妇女来说,还需要额外的氨基酸来促进胎儿的生长和产奶量。健身人群则需要大量的蛋白质来合成肌肉。
因此,成人所需的膳食氨基酸不是固定值,每日最佳摄入量取决于你的身高体重、健康状况、目标、身体活动水平。
•消化率较低的人群需要摄入更多的蛋白质
素食主义者对蛋白质的需求较高,因为植物蛋白在生物利用度上通常不如动物蛋白。植物蛋白消化率为60-80%,而动物蛋白消化率超过90%。
此外一些植物含有抑制蛋白质消化和吸收的抗营养因子,如胰蛋白酶抑制剂、凝集素、植酸盐和单宁、硫苷,会导致素食主义者的蛋白质消化和吸收率偏低。而消化率较低的人群需要摄入更多的蛋白质,以确保满足身体的营养需求。
•注意摄入蛋白的氨基酸构成
另外,一些蛋白质也含有限制性氨基酸,限制性氨基酸是指食物所含必需氨基酸的量与人体所需的蛋白质必需氨基酸的量相比,比值偏低的氨基酸。
一种食物里特别缺少某一种氨基酸,即使其它的氨基酸含量很高,因为这个氨基酸导致它的各个氨基酸比例不平衡。人体对这种食物的吸收依然不理想。多样性饮食结合不同的膳食蛋白可以帮助弥补它们各自的不足。
比如说,赖氨酸是最常见的限制性氨基酸,特别是在谷类中,如小麦和水稻。坚果往往也含有赖氨酸作为限制性氨基酸。另一方面,豆类含有足够的赖氨酸,可以弥补,但缺乏硫氨基酸,如蛋氨酸和半胱氨酸。
通过整合微生物组学、宏基因组学、代谢组学和蛋白质组学数据,我们可以构建更完整的个体营养代谢图谱,有望建立更精确的营养-微生物-代谢互作网络模型,为精准营养干预提供依据。
益生菌在提高氨基酸吸收率方面的应用潜力。新型益生菌的筛选和开发将更加注重其对氨基酸代谢的调节作用,有望开发出更有针对性地提高氨基酸的生物利用度的微生态制剂。
随着精准医疗的发展,个性化的氨基酸需求评估和补充策略将成为研究热点,这需要我们更深入地了解个体差异对氨基酸代谢的影响。基于机器学习的预测模型将帮助我们更准确地评估个体的氨基酸需求,这需要综合考虑肠道菌群特征、代谢指标和临床表型等多维度数据。通过这些数据的综合分析,我们可以构建出更加个性化的营养干预方案,优化个体健康和疾病预防。
主要参考文献
Li TT, Chen X, Huo D, Arifuzzaman M, Qiao S, Jin WB, Shi H, Li XV; JRI Live Cell Bank Consortium; Iliev ID, Artis D, Guo CJ. Microbiota metabolism of intestinal amino acids impacts host nutrient homeostasis and physiology. Cell Host Microbe. 2024 May 8;32(5):661-675.e10.
Jäger R, Zaragoza J, Purpura M, Iametti S, Marengo M, Tinsley GM, Anzalone AJ, Oliver JM, Fiore W, Biffi A, Urbina S, Taylor L. Probiotic Administration Increases Amino Acid Absorption from Plant Protein: a Placebo-Controlled, Randomized, Double-Blind, Multicenter, Crossover Study. Probiotics Antimicrob Proteins. 2020 Dec;12(4):1330-1339.
Neis EP, Dejong CH, Rensen SS. The role of microbial amino acid metabolism in host metabolism. Nutrients. 2015 Apr 16;7(4):2930-46.
Hou Y, Yao K, Yin Y, Wu G. Endogenous Synthesis of Amino Acids Limits Growth, Lactation, and Reproduction in Animals. Adv Nutr. 2016 Mar 15;7(2):331-42.
Gorissen SHM, Trommelen J, Kouw IWK, Holwerda AM, Pennings B, Groen BBL, Wall BT, Churchward-Venne TA, Horstman AMH, Koopman R, Burd NA, Fuchs CJ, Dirks ML, Res PT, Senden JMG, Steijns JMJM, de Groot LCPGM, Verdijk LB, van Loon LJC. Protein Type, Protein Dose, and Age Modulate Dietary Protein Digestion and Phenylalanine Absorption Kinetics and Plasma Phenylalanine Availability in Humans. J Nutr. 2020 Aug 1;150(8):2041-2050.
Bröer S, Gauthier-Coles G. Amino Acid Homeostasis in Mammalian Cells with a Focus on Amino Acid Transport. J Nutr. 2022 Jan 11;152(1):16-28.
Mariotti F, Gardner CD. Dietary Protein and Amino Acids in Vegetarian Diets-A Review. Nutrients. 2019 Nov 4;11(11):2661.
Abdallah A, Elemba E, Zhong Q, Sun Z. Gastrointestinal Interaction between Dietary Amino Acids and Gut Microbiota: With Special Emphasis on Host Nutrition. Curr Protein Pept Sci. 2020;21(8):785-798.
Fan P, Li L, Rezaei A, Eslamfam S, Che D, Ma X. Metabolites of Dietary Protein and Peptides by Intestinal Microbes and their Impacts on Gut. Curr Protein Pept Sci. 2015;16(7):646-54.

谷禾健康

目前可获得的有关人类不同人群微生物组成的大量数据显示,总体而言,人类肠道中最丰富的细菌属于两个门,即厚壁菌门和拟杆菌门。而在拟杆菌门的成员中,有两个属占主导地位——拟杆菌属(Bacteroides)和普雷沃氏菌属(Prevotella)。
在任何生态系统中,某些生物体往往扮演着更为重要的角色。类似于在人类社会中,科学家和发明家对人类发展做出了重大贡献,肠道菌群社区中也存在一些关键物种,它们在菌群的定植、聚集、生存和保护方面发挥着重要作用。这些关键物种包括拟杆菌属的某些物种、普雷沃氏菌属的某些物种,以及其他一些共生菌。它们在维持肠道生态平衡和促进健康方面具有重要贡献。
普雷沃氏菌和拟杆菌是两类重要的肠道细菌,它们来自同一个祖先,但在进化过程中选择了不同的生存环境:
◆ 拟杆菌
拟杆菌是肠道中的“先驱开拓者”,从婴儿时期就开始在肠道定居。它们能够很好地适应肠道环境,主要有两个原因:
一是因为婴儿的饮食相对简单,主要是一些简单的糖类,而拟杆菌恰好擅长分解这些糖类,把它们转化为更简单的糖分,不仅自己获得营养,还能为其他细菌提供食物来源。
二是它们能够很好地利用肠道粘液层中的粘蛋白。这些粘蛋白就像”停靠站”,帮助细菌在肠道中定居。
此外,细菌居民获取营养物质可能需要:
1)细胞外多糖水解酶
2)细菌细胞表面的受体蛋白
3)适当的糖转运系统
4)细胞质碳水化合物降解酶
拟杆菌属成员的多糖利用位点(PUL)刚好包括:
分泌的糖苷酶
细胞表面聚糖结合蛋白的补体
TonB依赖性外膜寡糖受体/转运蛋白
细胞质膜中的摄取转运蛋白
细胞质碳水化合物代谢酶
然后它们通过多糖利用位点来获取和利用营养,这使其能在竞争激烈的肠道环境中占据优势的同时,还能影响其他菌的生存。
例如Bacteroides thetaiotaomicron VPI-5482菌株具有88个多糖利用位点,可用于降解各种聚糖,包括饮食衍生和宿主聚糖。还具有灵活的聚糖捕食能力,当膳食多糖变得稀缺时,它可以轻松切换到宿主多糖。在营养缺乏期间,这为肠道细菌组的生态系统提供了整体稳定性。
◆ 普雷沃氏菌
普雷沃氏菌属以微生物学家AR Prevot的先驱之名命名。普氏菌属包含50多个已鉴定的物种,除了存在于肠道,在人体的口腔和阴道丰度也较高。
虽然都是拟杆菌门下的革兰氏阴性厌氧菌,但普雷沃氏菌属的糖利用和分解能力弱于拟杆菌,并且缺乏参与戊糖磷酸途径的酶,如葡萄糖6磷酸脱氢酶、6磷酸葡萄糖酸脱氢酶,这使它们与拟杆菌属不同。
普雷沃氏菌属是肠道中的膳食纤维发酵剂,与地中海饮食呈正相关,特别是与高碳水化合物以及水果和蔬菜摄入量有关。
一项研究利用小鼠研究了拟杆菌和普雷沃氏菌在无菌小鼠体内的相互作用。实验结果显示,当两种细菌同时定植时,拟杆菌的数量超过普雷沃氏菌,但两者的数量都低于它们单独定植时的水平。这表明两种细菌之间可能存在拮抗作用。
通过进行 PubMed、Web of Science 核心合集和 Google Scholar 电子搜索确定了研究。我们发现85篇出版物报告了饮食模式对肠道微生物群落的影响,特别是普雷沃氏菌与拟杆菌(P/B)比率。但单一饮食成分对普雷沃氏菌的影响并不容易预测。
在一项随机对照试验,80名超重参与者被随机分配到不同的干预组或对照组,以比较不同干预措施的效果。发现在普雷沃氏菌与拟杆菌比率(P/B)高的个体比P/B比率低的个体多减重和减脂3.8kg。
高纤维摄入(>30g/10MJ)时:
P/B比率高组减重8.3kg
P/B比率低组减重3.2kg
两组差异达5.1kg
相关性分析:
P/B比率高组:纤维摄入与体重变化强相关(r=0.90)
P/B比率低组:相关性较弱(r=0.25)
这项研究表明,肠道菌群中P/B比率可能是预测减重效果的重要指标,特别是在高纤维饮食干预中。
图片来源:Laura Marshall/NPG
2011年,科学家首次提出了“肠型”的概念,试图将人类肠道中的微生物群落分类。这就像是给我们的肠道细菌”划分阵营”,帮助我们更好地理解肠道微生物的分布特点。
最初科学家认为有三种主要的肠型,但随着研究深入,实际上主要确定了两种显著的类型:
以拟杆菌属(Bacteroides)为主导的类型
以普雷沃氏菌属(Prevotella)为主导的类型
第三个与瘤胃球菌有关,但不够明显,因为瘤胃球菌分布在其他两类中。
■ 饮食习惯与肠型的关系
研究发现,不同地区、不同饮食习惯的人群往往具有不同的肠型特征:
西方饮食人群(如欧美人群)
特点:高蛋白、高脂肪、低纤维
主导菌:拟杆菌较多
传统饮食人群(如非洲农村):
特点:高纤维、低蛋白、多植物性食物
主导菌:普雷沃氏菌较多
■ 有趣的研究发现
儿童研究
意大利儿童(西式饮食,低纤维,更多的动物蛋白、脂肪和糖,母乳喂养1年):拟杆菌占优势
非洲儿童(传统饮食,富含蔬菜和纤维,母乳喂养到两岁):普雷沃氏菌占优势
母乳喂养的婴儿:双歧杆菌较多
跨文化比较
美国人vs非洲人:饮食习惯不同导致肠道菌群差异明显
城市vs农村:生活方式的差异也会影响肠道菌群构成
总体而言,采用西方饮食的美国人和欧洲人的肠道微生物群往往以拟杆菌属和梭菌目为主,而高纤维、低蛋白饮食的农村人口往往以普雷沃氏菌为主。
■ “肠型”概念的局限性
想象一下,我们在试图给不同人的肠道细菌”画像”。科学家们发现,虽然”肠型”这个词很常用,但可能过于简化了实际情况。这就像把人分类成”高个子”和”矮个子”,忽略了身高其实是连续的,中等身高的人可能更多。
两种主要细菌的重要性
拟杆菌和普雷沃氏菌是最常见的两种主要细菌
它们通常占据肠道细菌总量的40%以上
有趣的是,当一种细菌数量多时,另一种就会很少
常规研究方法的特点
科学家们通常用特殊的方法(PCoA和NMDS)来分析样本。这些方法就像在地图上标注位置:相似的样本会被画在一起,不同的样本会被画得远一些。因为这两种主要细菌的变化最大,所以它们在分析中的影响最明显。
研究的挑战
当研究的细菌种类太多,而样本数量较少时,可能会得出不准确的结论。目前的证据表明,把人的肠道细菌简单地分成几种固定的”肠型”可能不够准确。
从谷禾的角度以及部分科学家的建议还是不要简单地用”肠型”来给人分类,改用”具体的菌群结构以及指标或生物标注物”这个概念。这些标志物可以更好地反映一个人的生活环境和健康状况。
因为肠道菌群比我们想象的要复杂得多,不同的生活方式和饮食习惯会影响肠道菌群,需要更细致的方法来研究和理解肠道健康。
这就像是从”给人贴标签”转变为”理解每个人的独特性”,这种方式更科学,也更有助于我们理解如何维护肠道健康。
① 拟杆菌:肠道中的”适应高手”
拟杆菌就像是肠道中的“生存专家”,它们有着令人惊叹的适应能力。让我们来看看它们是如何在肠道中生存和繁荣的:
•超强的环境适应能力:氧气适应
虽然拟杆菌通常不喜欢氧气,但它们能在极少量氧气存在的环境中生存,这种能力帮助它们在人体组织中更好地定居。例如,脆弱拟杆菌可以在低O2条件下生长,这可能有利于它在含氧宿主组织中建立初始感染。
•灵活的饮食习惯
婴儿时期:能利用母乳中的营养物质
断奶后:可以转而消化植物纤维
它就像一个”美食家”,几乎能消化各种碳水化合物,例如B.thetaiotaomicron会根据宿主的情况调整其食物来源,在哺乳期优先使用宿主衍生的多糖以及来自母乳的单糖和寡糖,然后在断奶后扩大其新陈代谢以使用植物多糖。
•竞争策略
拥有类似”微型武器系统”的机制,能够抑制其他细菌的生长,确保自己的生存空间。拟杆菌进一步在胃肠道中立足,利用类似于 VI 型分泌系统的系统将物质转移到胃肠道中的受体微生物,输出抗菌效应物并拮抗其他胃肠道细菌。
•基因的”魔法”
拟杆菌最神奇的地方在于它的基因特性:
基因的灵活性
能够根据需要“开启”或”关闭”特定基因
就像随身携带的”百宝箱”,需要什么就拿出什么
在对174个脆弱拟杆菌组临床分离株的研究中,至少有10个编码孔蛋白的不同基因序列和8个青霉素结合蛋白的不同序列,这可能影响生物体的抗菌敏感性。
•基因的学习能力
能从其他细菌那里”学习”新的基因(称为水平基因转移),这种能力让它们能获得新的特性,比如抗药性。
多样的基因版本:同一个功能的基因可能有多个不同版本,能根据环境选择最合适的版本使用。
肠道微生物群中拟杆菌门的数量较多,水平基因转移率较高,这对拟杆菌门与其他细菌之间的微生物组基因转移产生了重大影响,导致整个细菌群落发生重要的遗传变化。
由于拟杆菌的这些特性,它们可能帮助传播抗生素耐药性,这提醒我们要谨慎使用抗生素。
② 拟杆菌:肠道中的多面手
拟杆菌是肠道中最稳定和重要的细菌之一,它们具有非常丰富的代谢能力,能够影响人体的多个生理功能。
•智能适应系统
拟杆菌有一个特殊的”感应系统”,能够检测环境中的营养物质,根据需要,它可以快速开启或关闭相应的基因,产生不同的消化酶。这种能力让它能够适应各种不同的食物来源。
拟杆菌属凭借其多功能的多糖利用机制可以降解复杂的植物多糖,如淀粉、纤维素、木聚糖和果胶,使它们成为微生物群中最稳定的成员,并能够作为关键物种影响微生物组。
•强大的消化能力
能分解复杂的植物纤维,如淀粉、纤维素等,当简单糖类已经被人体吸收后,它仍能利用其他复杂的营养物质,这种能力使它成为肠道中的“常驻居民”。
•产生多种有益代谢物
能产生有益物质,如短链脂肪酸(SCFA),包括:琥珀酸、乙酸、丙酸、丁酸。
丁酸盐被用作结肠上皮细胞的主要能量来源,而丙酸盐和乙酸盐是肝脏中脂肪生成和糖异生所必需的。
除此之外,拟杆菌属还能产生神经递质类化合物,如GABA。在一项对人类肠道拟杆菌分离株的研究中,几乎所有分离株都产生 GABA,浓度范围很宽(取决于前体可用性和浓度)。有强有力的临床前和临床证据表明微生物群影响神经系统的发育和功能,并可能影响大脑功能和心理健康。
③ 拟杆菌:肠道的守护者
拟杆菌不仅参与消化,还能保护我们的肠道健康,特别是在抵抗有害细菌入侵方面发挥重要作用。
•对抗感染
几种拟杆菌属会产生胆汁盐水解酶,这些酶可解离逃逸肠肝再循环的胆汁酸,这是将初级胆汁酸转变为次级胆汁酸的两步过程的第一步。这种转化过程能够抑制艰难梭菌(一种导致严重腹泻的细菌)的生长。在粪便菌群移植治疗中,这种机制帮助患者预防艰难梭菌感染的复发。研究发现拟杆菌含量越高,艰难梭菌感染的风险越低。
•维持肠道屏障,调节微生物平衡
拟杆菌帮助维持肠道壁的完整性,减少炎症反应,保护肠道健康。同时促进有益菌群的生长,增加肠道微生物的多样性。
•其他健康影响
拟杆菌还可以帮助调节血糖水平,参与脂肪代谢可能与预防肥胖和糖尿病有关。研究表明拟杆菌数量减少可能与肥胖有关;一些研究发现它与2型糖尿病呈负相关;某些拟杆菌种类可能有助于改善胰岛素敏感性。
④ 拟杆菌:平衡中的潜在病原体
虽然大多数研究表明拟杆菌对健康有益,但也存在一些复杂性。它们通常是共生生物,但一些拟杆菌属。可能是机会致病菌。
一些情况,包括胃肠道疾病、创伤、癌症和胃肠道手术,可能会使拟杆菌逃离胃肠道中的生态位,侵入其他解剖位置并引起感染。
促进这种入侵的脆弱拟杆菌的毒力因素包括其产生的脆弱拟杆菌毒素(增加通透性并诱导活性氧形成)、裂解粘蛋白多糖的神经氨酸酶和促进脓肿形成的荚膜多糖。
拟杆菌最常与腹内感染相关,通常是因为肠壁完整性受到损害而发生。如果不及时治疗,这些感染可能会发展为菌血症。
触发条件:
-肠道疾病
-外伤
-癌症
-手术创伤
这些情况可能导致拟杆菌”越界”,从肠道进入身体其他部位。
致病机制:
-产生特殊毒素(BFT),可能损害组织
-分泌能分解粘液的酶
-形成保护性外壳,有助于细菌存活
-可能引发的健康问题
常见感染:
-腹腔感染(最常见)
-血液感染
-皮肤和软组织感染
-肺部感染
-脑部感染
危险信号:
-当肠道屏障受损时,感染风险最高
-如果不及时治疗,可能会扩散到血液中
治疗方法:
甲硝唑是首选药物,其次还有一些抗生素包括:哌拉西林-他唑巴坦、亚胺培南、美罗培南。
治疗注意事项:
-通常需要联合用药,因为感染往往涉及多种细菌
-医院感染可能需要额外的抗生素覆盖
未来随着拟杆菌对抗生素的耐药性增加,需要开发新的治疗策略,预防感染变得越来越重要。
因此,保持肠道健康,避免不必要的抗生素使用,手术时注意预防感染,及时治疗肠道疾病。
⑤ 拟杆菌:在抗癌中的双重角色
拟杆菌是一类在肠道中常见的细菌,它在癌症发展和抑制中的作用是一个颇具研究价值的话题。
•保护与免疫调节
拟杆菌产生代谢副产物,如丁酸盐,对肠道健康具有保护作用。
在一项动物研究中,使用携带肠癌的小鼠模型,发现移植脆弱拟杆菌有助于减少体重减轻并抑制肿瘤生长。
•与免疫疗法的协同作用
在接受抗癌药物ipilimumab治疗的小鼠中,脆弱拟杆菌似乎增强了药物效果,并减轻了药物引发的肠道不良反应。
•拟杆菌的促癌潜力
携带特定毒素的脆弱拟杆菌可能在特定情况下增加结肠癌风险。有研究指出,结肠癌患者肠道中脆弱拟杆菌毒素基因的数量较多。
一些动物研究也表明,当拟杆菌定殖在肠道时,可以促进肿瘤发生。
未来识别哪些具体的拟杆菌种类最有利于预防癌症,了解哪些种类可能促进癌症发展是重要的研究方向。
⑥ 拟杆菌:抗炎作用
普通拟杆菌(FTJS7K1)在脂多糖诱导的急性肠道损伤小鼠模型中显示出对急性炎症的显著保护作用,包括恢复因急性损伤而受到干扰的肠道微生物群。
移植物抗宿主病(GVHD)是一种促炎性疾病,由同种异体造血细胞移植后供体T细胞发展而来。在一项临床前小鼠GVHD模型研究中,给予脆弱拟杆菌增强了小鼠肠道的多样性,减少了急性GVHD的发生,并预防了慢性GVHD。
金氏副拟杆菌(P. goldsteinii)已被证明有助于免疫系统的成熟和发展。具体而言,P.goldsteinii促进了 CD4+效应T细胞亚型的发育,调节肠粘膜的适应性免疫,从而在肠粘膜的稳态和炎症中发挥重要作用。
β-己糖胺酶是拟杆菌门中的一种保守酶,有助于预防小鼠结肠炎模型中的炎症。
普雷沃氏菌属(Prevotella)是人类体内、特别是在肠道和口腔中常见的细菌群之一,具有多种重要的菌群特性。
① 生态位与环境适应
普雷沃氏菌主要存在于人类的口腔和肠道中。在健康的口腔微生物群中,普雷沃氏菌是一种普遍存在的菌种,且在肠道微生物群中占据重要位置。它们通常作为共生菌存在,但在特定条件下可能转变为机会性病原体。
•主要栖息地
口腔环境:在牙菌斑、牙周袋等部位常见
消化道:主要分布在结肠和直肠
女性生殖道:在阴道微生物群中也有发现
•环境适应特征
普雷沃氏菌是一类严格厌氧的细菌,能够在缺氧环境中生存,这是它们适应宿主微环境的关键特性。它们对宿主的免疫环境具有一定的适应能力,能够调节宿主免疫反应,促进其自身的生存和繁殖。
氧气耐受性:严格厌氧,需要低氧或无氧环境生存
pH适应性:最适pH在6.5-7.0之间
温度要求:37℃为最适生长温度
营养需求:需要特定生长因子,如维生素K和血红素
② 代谢特征与营养方式
普雷沃氏菌在代谢方面表现出高度的灵活性,能够利用各种碳源,包括植物性纤维和淀粉。它们能够生成短链脂肪酸,如丙酸和丁酸,这些代谢产物对于宿主的肠道健康具有重要意义。
此外,普雷沃氏菌还与宿主的营养状态和代谢健康密切相关,可能在一些代谢疾病中扮演角色。
•碳水化合物代谢
主要底物:
-复杂多糖(如木聚糖、果胶)
-植物性纤维
-粘蛋白
代谢产物:
-短链脂肪酸(如丙酸、丁酸)
-琥珀酸
-乳酸
•特殊代谢能力
多糖降解酶系统:
-β-木糖苷酶
-α-葡萄糖苷酶
-纤维素酶
蛋白质降解能力:
-产生蛋白酶
-肽酶系统完整
③ 基因组特征
普雷沃氏菌拥有丰富的基因组多样性,其中某些种类如P.copri表现出显著的遗传多样性。研究表明,这些细菌的不同亚种可能对维持宿主健康或诱发疾病具有不同的功能特性。
它们的基因组常包含与代谢能力、毒力因子及抵抗药物相关的基因,这使得普雷沃氏菌在健康与疾病之间的界限变得模糊。
•基因组结构
基因组大小:2.5-3.5 Mb
GC含量:约40-48%
基因密度:每kb约0.9个基因
•功能基因特征
碳水化合物代谢相关基因:
-多糖降解酶基因簇
-糖转运体基因
耐药基因:
-β-内酰胺酶基因
-外排泵基因
毒力因子基因:
-粘附素
-溶血素
④ 肠道分布特点与生态学意义
•群落分布特征
-某些人群中可达20%以上
地理分布差异:
-东亚人群中部分人含量较高
-非洲农村人群中含量较高
-西方发达国家人群中含量较低
•菌株代谢能力差异
研究表明,西方人群中的普雷沃氏菌(特别是P.copri)往往缺乏有效代谢碳水化合物的能力。这一现象与西方饮食结构有关,通常富含高脂肪和低纤维,这使得某些普雷沃氏菌在这样的环境中生存和增殖的能力受到限制。
而东亚人群的普雷沃氏菌则表现出较强的代谢碳水化合物的能力,尤其在以碳水化合物为主的饮食中,普雷沃氏菌能显著占据主要菌群的组成。
•生态适应性
东亚地区人群中的普雷沃氏菌群体在饮食多样性与微生物生态位的适应性上表现出更高的灵活性,这可能与他们的饮食模式(例如更多的全谷物和蔬菜)密切相关。相对地,西方人群由于饮食结构的变化,导致普雷沃氏菌的生态位和多样性出现了很大的变化,从而影响了肠道微生物组的平衡。
⑤ 健康相关性
•有益作用
-维持肠道屏障功能
-产生有益代谢物:短链脂肪酸、维生素B族
-调节免疫系统:促进Th17细胞分化、调节炎症反应
•潜在风险
-与某些疾病相关:牙周炎、类风湿性关节炎、炎症性肠病
-机会性感染:在免疫力低下时可能致病、可能参与混合感染
⑥ 致病机制和触发因素
1.环境因素
普雷沃氏菌的致病性与特定的环境因素密切相关,包括:
-pH值改变:口腔或肠道的pH值显著变化,会促进普雷沃氏菌的生长,特别是在细菌性阴道病或口腔感染中。
-氧化还原电位改变:微环境中的氧气水平异常,过度的厌氧环境可能会促使厌氧细菌大量繁殖。
-营养物质改变:特定营养物质的过度丰富(例如糖类)可能会导致普雷沃氏菌的快速增殖。
2.宿主因素
宿主的状态也是普雷沃氏菌引发感染的重要因素,包括:
-免疫功能低下:免疫抑制治疗、HIV感染或器官移植后的免疫抑制可能使宿主更易受到普雷沃氏菌的感染。
-局部屏障受损:例如粘膜损伤、手术创伤或放化疗后的局部损伤,会使普雷沃氏菌更容易入侵。
3.微生态失衡
-优势菌群改变:抗生素的使用可能导致菌群失调,抑制保护性菌群的生长,使得普雷沃氏菌过度增殖。
-菌群多样性下降:多样性的减少往往会导致生物膜的形成和感染风险的增加。
普雷沃氏菌的致病机制包括以下几种:
1.直接致病作用
普雷沃氏菌通过产生毒素直接致病:包括内毒素和外毒素,这些毒素能够导致组织损伤和炎症。
普雷沃氏菌产生的毒力因子

组织侵袭:普雷沃氏菌还可能释放组织降解酶,破坏周围组织和细胞间连接。
2.免疫介导损伤
-炎症反应激活:普雷沃氏菌的感染可刺激宿主免疫系统,促进炎症因子的释放和趋化因子的产生,导致局部或全身的免疫反应。
免疫失调:T细胞应答的异常可能导致自身免疫反应,使得宿主的免疫反应对自身组织造成损伤。
3.代谢紊乱
普雷沃氏菌在代谢方面的失调可能导致:
-营养物质竞争:普雷沃氏菌可能与宿主或其他细菌竞争营养物质,从而影响宿主的营养吸收。
-有害代谢产物积累:某些代谢产物可能对宿主造成毒性,进一步加重疾病。
⑦ 感染的信号和治疗
•临床表现
普雷沃氏菌感染的临床表现通常包括:
-口腔症状:如牙龈出血、口臭加重和牙周疼痛。
-消化道症状:如腹痛、腹泻和消化不良。
-全身症状:可表现为发热、乏力和体重下降。
•实验室指标
-炎症标志物的升高:例如C反应蛋白(CRP)和红细胞沉降率(ESR)。
-微生物学检查:可以通过检测普雷沃氏菌的丰度来判断感染情况。
•治疗方案
1.抗生素治疗
对于普雷沃氏菌感染,通常采用以下抗生素:
首选药物:包括β-内酰胺类、克林霉素和甲硝唑。
用药原则:根据药敏结果选择合适药物,确保足量和足疗程,多考虑联合用药。
2.微生态调节
益生菌补充:可以使用乳酸杆菌和双歧杆菌,有助于帮助恢复健康的肠道微生物群。
益生元应用:如低聚糖和膳食纤维可促进益生菌的生长。
3.免疫调节
免疫功能评估和支持:可使用免疫调节剂和提供必要的营养支持。
•治疗注意事项
1.用药监测
定期评估疗效和不良反应,关注药物耐药性的发展。
2.预防措施
维持良好的口腔卫生和调整饮食结构以避免菌群失调。
3.长期管理
定期复查和生活方式指导用以防止复发。
⑧ 肠道普雷沃氏菌—饮食与健康
普雷沃氏菌属,尤其是P.copri复合群,通常与非西方饮食模式以及富含碳水化合物、抗性淀粉和纤维的饮食习惯相关。
在西方饮食中,梭状芽孢杆菌属(包括瘤胃球菌科和毛螺菌科)通常负责降解膳食纤维。尽管如此,通过增加富含纤维的食物来进行营养干预时,往往会导致普雷沃氏菌数量的增加。
•膳食纤维与普雷沃氏菌和拟杆菌丰度密切相关
膳食纤维不仅能改善糖代谢,还与普雷沃氏菌和拟杆菌的相对比例关联密切。研究显示,普雷沃氏菌对葡萄糖稳态和整体代谢有潜在的益处。然而,也有研究指出,P. copri与胰岛素抵抗相关,而其在基线时的较低水平则与超重个体在地中海饮食干预后改善胰岛素抵抗的效果相关。
普雷沃氏菌能有效分解膳食中的复杂多糖。这一点与人类的代谢密切相关,因为人类基因组中编码的酶只能降解有限类型的碳水化合物,比如蔗糖、乳糖和淀粉。因此,肠道微生物能够发酵多糖,促进人类营养吸收是至关重要的。
此外,普雷沃氏菌能够分解植物来源的多糖和某些宿主来源的粘蛋白,但不具备分解动物来源多糖的能力。这就解释了为何工业化西方人群的普雷沃氏菌多样性下降,因为他们很少摄入多种类的植物性食物。
研究也表明,普雷沃氏菌的多样性越高,其在消化多糖和维持肠道稳态方面的能力就越强。在这些发现基础上,研究人员正在努力揭示普雷沃氏菌对于饮食变化和健康状况的具体影响机制,尽管目前对其角色的理解仍存在一定的争议。
共存关系的形成
1.进化适应
普雷沃氏菌和拟杆菌都经过长期进化,形成了与人类肠道共生的关系。它们在进化过程中获得了特殊的代谢能力:
-可以分解复杂的膳食纤维
-与人体免疫系统相适应的表面分子结构
-能够在肠道厌氧环境中生存的代谢系统
2.生态位分配
这两类菌群在肠道中形成了独特的生态位分配:
拟杆菌主要分布在结肠前端,更适应中性偏酸性环境;
而普雷沃氏菌则在结肠后段较为丰富,能够适应更广范围的pH值。
3.不用降解能力
此外它们对不同类型的膳食纤维具有互补性的降解能力。
拟杆菌主导型:
-适应高蛋白、高脂肪的西式饮食
-产生更多支链氨基酸和饱和脂肪酸
-倾向于形成较高的胆汁酸代谢活性
普雷沃氏菌主导型:
-适应高纤维、植物性为主的饮食
-产生更多短链脂肪酸
-有利于维持肠道屏障功能
拟杆菌代谢特点:
-善于降解动物性蛋白质
-产生较多的乙酸盐和丙酸盐
-影响胆固醇代谢
普雷沃氏菌代谢特点:
-擅长发酵复杂碳水化合物
-产生琥珀酸等代谢物
-影响葡萄糖代谢
相互制约机制
1.营养物质竞争
两类菌群之间存在竞争关系
对碳源的竞争:不同种类的膳食纤维
对氮源的竞争:蛋白质和氨基酸
对微量元素的竞争:铁、锌等
2.代谢产物影响
拟杆菌主要通过产生短链脂肪酸(SCFAs)来抑制普雷沃氏菌的生长。乙酸盐是拟杆菌产生的主要SCFAs之一,在酸性环境下可抑制普雷沃氏菌的生长,研究表明高浓度乙酸盐会降低普雷沃氏菌的增殖速率。
拟杆菌还通过琥珀酸途径产生丙酸盐,可降低环境pH值,不利于普雷沃氏菌生长,对普雷沃氏菌的生物膜形成有抑制作用。
普雷沃氏菌发酵碳水化合物产生琥珀酸,高浓度琥珀酸可抑制拟杆菌的生长,影响拟杆菌的代谢通路。
占比此消彼长的原因
1.饮食因素
拟杆菌属通常被认为是能够有效降解多种膳食纤维的细菌,尤其是在高纤维饮食环境中表现良好。这种菌群能够利用复杂的碳水化合物(如植物多糖)作为其主要能量来源,同时能促进短链脂肪酸的生成。
而普雷沃氏菌特别是P. copri复合群,通常与丰富的碳水化合物、抗性淀粉和膳食纤维的饮食模式相关。这类菌群能较好地利用膳食纤维,尤其是对于那些以植物性为主的饮食表现出强大的代谢能力。特定的普雷沃氏菌在研究中显示出较强的能力来降解阿拉伯木聚糖和低聚果糖,这些物质常见于富含纤维的饮食中。
2.环境因素
pH值变化会影响两种菌群的相对丰度
肠道氧化还原电位的改变会影响菌群平衡
肠道蠕动速度会影响营养物质的可及性
普雷沃氏菌的健康影响机制
普雷沃氏菌(Prevotella)在不同健康状况下的影响机制涉及多个领域,特别是在与炎症、代谢和免疫反应相关的疾病中。
炎症反应
普雷沃氏菌与类风湿性关节炎(RA)等免疫介导疾病的发病机制相关。
一些研究指出,普雷沃氏菌可引发促炎性T细胞(如Th17细胞)的反应。这些细胞分泌多种细胞因子(如IL-17),加剧局部和全身性炎症,从而可能导致关节和组织的损伤。
研究发现,普雷沃氏菌的数量增加与粪便样本中的炎症因子水平升高相关。此外,普雷沃氏菌在类风湿性关节炎患者的滑液中也存在,表明其可能通过免疫激活机制参与疾病的发生。
代谢影响
普雷沃氏菌与葡萄糖代谢的关系相对复杂。
一些研究显示,P. copri 可能与胰岛素抵抗相关,但其作用依赖于饮食和个体差异。在高纤维饮食下,普雷沃氏菌的富集通常有助于改善葡萄糖稳态。
其主要机制可能与普雷沃氏菌对抗性淀粉和其他膳食纤维的高效发酵能力相关,这使得它们能够生成短链脂肪酸,为宿主提供代谢能量,有助于改善代谢综合症。
微生物群失调
普雷沃氏菌的丰度在不同人的微生物组中表现出差异。在细菌性阴道病(BV)或HIV感染相关的肠道菌群失调情况下,普雷沃氏菌的增加与炎症因子的释放、局部免疫反应的增强有关,可能导致更易患其他感染。
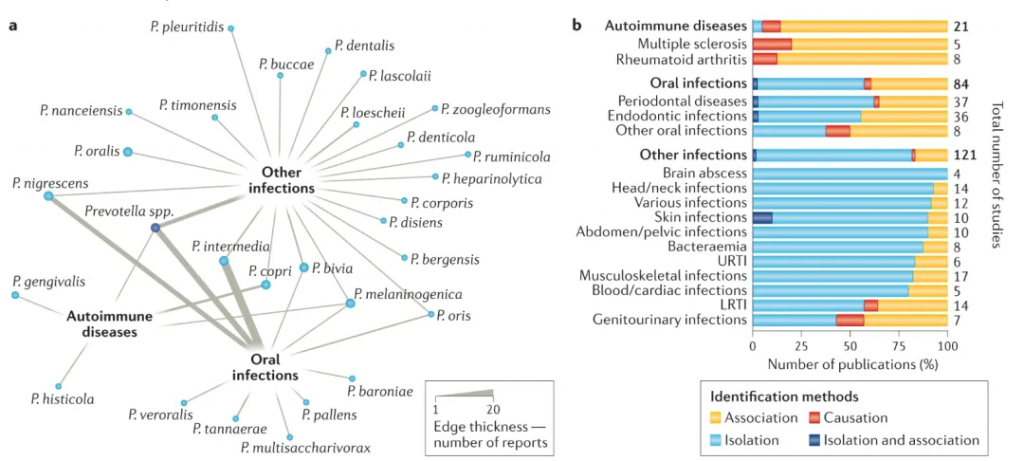
doi.org/10.1038/s41579-021-00559-y
网络分析显示每种普雷沃氏菌与一种或多种疾病(分为三大类:自身免疫性疾病、口腔感染或其他感染)的关联,基于总共226项研究。边的厚度与报告普雷沃氏菌与疾病关系的文章数量成正比。
❤ 编者总结
这两个菌属是中国人群肠道菌群最主要的两个属,两个菌属代表了不同的饮食习惯,展现了肠道菌群令人惊叹的适应能力和复杂的相互作用。它们不仅在进化过程中形成了独特的生态位分配,还通过各自的代谢特长参与营养物质的消化和吸收,还能通过产生多种代谢物来调节人体免疫系统,影响我们的整体健康状况。
主要参考文献
Hjorth MF, Blædel T, Bendtsen LQ, Lorenzen JK, Holm JB, Kiilerich P, Roager HM, Kristiansen K, Larsen LH, Astrup A. Prevotella-to-Bacteroides ratio predicts body weight and fat loss success on 24-week diets varying in macronutrient composition and dietary fiber: results from a post-hoc analysis. Int J Obes (Lond). 2019 Jan;43(1):149-157.
Rinninella E, Raoul P, Cintoni M, Franceschi F, Miggiano GAD, Gasbarrini A, Mele MC. What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases. Microorganisms. 2019 Jan 10;7(1):14.
Hitch TCA, Bisdorf K, Afrizal A, Riedel T, Overmann J, Strowig T, Clavel T. A taxonomic note on the genus Prevotella: Description of four novel genera and emended description of the genera Hallella and Xylanibacter. Syst Appl Microbiol. 2022 Nov;45(6):126354.
Shah HN, Collins DM. Prevotella, a new genus to include Bacteroides melaninogenicus and related species formerly classified in the genus Bacteroides. Int J Syst Bacteriol. 1990 Apr;40(2):205-8.
De Filippis F, Pasolli E, Tett A, Tarallo S, Naccarati A, De Angelis M, Neviani E, Cocolin L, Gobbetti M, Segata N, Ercolini D. Distinct Genetic and Functional Traits of Human Intestinal Prevotella copri Strains Are Associated with Different Habitual Diets. Cell Host Microbe. 2019 Mar 13;25(3):444-453.e3.
De Filippis F, Pellegrini N, Laghi L, Gobbetti M, Ercolini D. Unusual sub-genus associations of faecal Prevotella and Bacteroides with specific dietary patterns. Microbiome. 2016 Oct 21;4(1):57.
Larsen JM. The immune response to Prevotella bacteria in chronic inflammatory disease. Immunology. 2017 Aug;151(4):363-374.
Tett A, Huang KD, Asnicar F, Fehlner-Peach H, Pasolli E, Karcher N, Armanini F, Manghi P, Bonham K, Zolfo M, De Filippis F, Magnabosco C, Bonneau R, Lusingu J, Amuasi J, Reinhard K, Rattei T, Boulund F, Engstrand L, Zink A, Collado MC, Littman DR, Eibach D, Ercolini D, Rota-Stabelli O, Huttenhower C, Maixner F, Segata N. The Prevotella copri Complex Comprises Four Distinct Clades Underrepresented in Westernized Populations. Cell Host Microbe. 2019 Nov 13;26(5):666-679.e7.
Hjorth MF, Blædel T, Bendtsen LQ, Lorenzen JK, Holm JB, Kiilerich P, Roager HM, Kristiansen K, Larsen LH, Astrup A. Prevotella-to-Bacteroides ratio predicts body weight and fat loss success on 24-week diets varying in macronutrient composition and dietary fiber: results from a post-hoc analysis. Int J Obes (Lond). 2019 Jan;43(1):149-157.
Gellman RH, Olm MR, Terrapon N, Enam F, Higginbottom SK, Sonnenburg JL, Sonnenburg ED. Hadza Prevotella Require Diet-derived Microbiota Accessible Carbohydrates to Persist in Mice. bioRxiv [Preprint]. 2023 Mar 9:2023.03.08.531063.
Yeoh YK, Sun Y, Ip LYT, Wang L, Chan FKL, Miao Y, Ng SC. Prevotella species in the human gut is primarily comprised of Prevotella copri, Prevotella stercorea and related lineages. Sci Rep. 2022 May 31;12(1):9055.
Iljazovic A, Roy U, Gálvez EJC, Lesker TR, Zhao B, Gronow A, Amend L, Will SE, Hofmann JD, Pils MC, Schmidt-Hohagen K, Neumann-Schaal M, Strowig T. Perturbation of the gut microbiome by Prevotella spp. enhances host susceptibility to mucosal inflammation. Mucosal Immunol. 2021 Jan;14(1):113-124.
Tett, A., Pasolli, E., Masetti, G. et al. Prevotella diversity, niches and interactions with the human host. Nat Rev Microbiol 19, 585–599 (2021).

谷禾健康

在这个快节奏的现代社会中,”疲劳”似乎已经成为了我们生活中挥之不去的常客,尤其是在后疫情时代,它更是频繁地困扰着我们的日常生活。
你是否有过这样的经历:
疲劳是一种正常的生理反应,就像手机电量不足需要充电一样。一般疲劳的发生,主要有两方面:
身体方面:就比如说跑步后肌肉酸痛,主要是因为能量消耗过多,乳酸等代谢物累积,以及肌肉微损伤等原因造成的。
大脑方面:就像电脑运行太多程序会变卡一样,主要是因为大脑神经递质失衡,比如5-羟色胺增多,多巴胺减少等。
但是,当疲劳持续很长时间,并且休息后也无法缓解时,这可能预示着更深层次的健康问题。
慢性疲劳综合征很复杂,就像一台精密仪器出了故障,涉及多个系统:免疫系统失调、神经系统异常、能量代谢紊乱、内分泌系统紊乱、肠道微生物失衡等。疲劳也是癌症、甲状腺功能减退等疾病的常见症状,此外,疲劳还会导致焦虑和抑郁,神经系统疾病的发作。
最新研究发现,肠道微生物群在疲劳和慢性疲劳综合征中扮演着重要角色,肠道微生物群可以帮助产生重要的神经递质,维持肠道屏障完整性,防止炎症物质进入血液。在慢性疲劳综合征患者中,研究发现产丁酸盐菌明显减少,这可能与症状严重程度相关。
本文我们主要探讨各种常见疾病相关疲劳的症状、发病机制及干预措施,包括营养干预、心理支持、饮食及生活方式调整等。长新冠和慢性疲劳综合征的疲劳症状管理是一个复杂的过程,需要多方面的干预策略。虽然目前尚无特效治疗,但综合管理策略可以显著改善患者的症状和生活质量。对症下药的同时,重视整体健康的提升,才能在这复杂的症状中找到一丝突破。
目录
01 关于疲劳
02 慢性疲劳的发病机制
03 各种不同的疲劳
04 针对疲劳的菌群干预措施
疲劳是一种压倒性的疲倦感和精力耗尽感,在各种生理、病理和心理失衡的情况下出现。这种感觉通常无法通过休息或睡眠得到充分缓解,会严重影响个人的日常活动和生活质量。
意大利生理学家安杰洛·莫索(Angelo Mosso) 在一个多世纪前表示,“疲劳”一词至少指的是两种现象,“首先是肌肉力量的减少。第二个是疲劳作为一种感觉”。换句话说,有一个是可以测量的物理事实,而一个是心理事实。
注:肌肉力量的减少通常可以通过一系列客观测试来量化,例如运动后肌肉的力量测试和乳酸水平的检测。
“感觉衰减假说”认为疲劳发生在个体感知到完成任务所需的努力超过预期时。这种感觉输入主要来自收缩肌肉的本体感觉信号,正常情况下这些信号会被减弱,使得日常活动感觉轻松。然而,在疲劳状态下,这种减弱失效,导致日常活动感觉费力。这种假说解释了为什么疲劳患者在进行相同强度的活动时,会感到比正常人更费力。
在现代生理学中,疲劳的定义已经趋于复杂化,涵盖了生理、心理及情绪多个层面。
简单可以分以下几大类:
生理性疲劳 (如运动疲劳)
生理性疲劳是由正常的生理活动引起的,如运动后的肌肉疲劳。这种疲劳通常是可预期的,并且可以通过适当的休息和恢复来缓解。例如,运动疲劳是一种典型的生理性疲劳,表现为运动后肌肉力量或功率输出的暂时性下降。
病理性疲劳 (如癌症相关疲劳、慢性疲劳综合征)
病理性疲劳与各种疾病或病理状态有关,如癌症相关疲劳、慢性疲劳综合征(ME/CFS)等。这种疲劳通常更为严重和持久,可能需要医疗干预。
心理性疲劳
心理性疲劳主要与心理因素有关,如长期压力、焦虑或抑郁等。这种疲劳可能表现为情绪低落、注意力不集中等症状,需要通过心理干预来缓解。
疲劳的症状表现可以涉及身体、认知和情绪等多个方面:
身体症状:
认知症状:
情绪症状:
睡眠障碍:
睡眠障碍是疲劳的一个重要症状,同时也可能是疲劳的原因之一。主要表现包括:
虽然疲劳是一种常见的症状,但当疲劳变得持续且严重,并伴随着其他症状时,可能就不仅仅是简单的疲劳了,可能是一种复杂的长期疾病,与正常疲劳在定义、持续时间、症状和机制上有显著差异。
正常疲劳:
病理性疲劳:
在讨论了正常疲劳和病理性疲劳的区别之后,我们需要特别关注一种具代表性的病理性疲劳类型——慢性疲劳综合征(ME/CFS)。这种疾病不仅完整体现了病理性疲劳的各项特征,更因其独特的临床表现和严重的致残性,成为近年来医学界研究的重点。
慢性疲劳综合症
慢性疲劳综合征,也叫肌痛性脑脊髓炎,是一种严重的、多系统失能性疾病。它会导致至少持续六个月的极度疲劳。症状在身体或精神活动时加重,但休息后不会完全改善。
注:慢性疲劳综合征(CFS)和肌痛性脑脊髓炎(ME)是同种疾病,慢性疲劳综合征(CFS)强调了最主要的症状特征;肌痛性脑脊髓炎(ME)则更多地体现了疾病的神经系统病理特征,医学界现在倾向于使用合并的说法(ME/CFS),这样可以更全面地描述这种疾病的特点。
慢性疲劳综合征发病前,大多数患者都是能正常工作和成功的。许多患者初发为类似病毒感染性疾病,伴淋巴结肿大、极度疲劳、发热和上呼吸道症状。最初的综合征会消退,但似乎会引发长期的严重疲劳,这会干扰日常活动。
症状因人而异,症状的严重程度每天都会波动。除了疲劳,症状可能包括:
体格检查是正常的,没有肌无力、关节炎、神经系统受累或者脏器肿大等表现。但是一些患者存在低度发热、非渗出性咽炎和/或可触及而柔软的(非肿大)淋巴结。
慢性疲劳综合征并发症
慢性疲劳综合征的复杂和非特异性症状可能导致许多误诊,并伴有其他严重疾病,包括纤维肌痛、原发性睡眠障碍(睡眠呼吸暂停)、营养障碍(缺铁、肥胖)、肌肉骨骼疾病、焦虑/抑郁和胃肠道疾病(乳糜泻、肠易激综合征、炎症性肠病)。
在新冠开始后不久的研究表明,慢性疲劳综合征的症状与约87%的急性SARS-CoV-2感染恢复患者报告的症状相似,具体来说,长新冠患者出现了慢性疲劳综合征已知的29种症状中的25种。
其中最主要的症状包括:

doi.org/10.3390/nu16111545
慢性疲劳综合征发病率
美国疾病预防控制中心(CDC)的流行病学数据估计,美国有 0.84-250 万慢性疲劳综合征患者,其中约 25% 无法出门或卧床不起。慢性疲劳综合征的全球患病率在 0.4%~2.5% 之间。
慢性疲劳综合征的发病通常在20~40岁之间的成年人中。
女性患者比男性更为常见,比例大约为 3:1。有些研究显示比例可高达 6:1。
大多数慢性疲劳综合征病例被归类为长期病程,表现超过 3 年。
■ 生理因素
内分泌系统问题
营养代谢问题
免疫系统问题
■ 生活方式因素
睡眠问题
运动相关
饮食习惯
■ 心理因素
压力相关
情绪问题
■ 环境因素
工作环境
生活环境
■ 病理因素
常见疾病
感染
其他疾病
疲劳往往是多种因素共同作用的结果,这些因素往往相互关联、相互影响,无论是生理、心理还是环境因素,都可能通过不同的途径和机制影响我们的身体,最终导致疲劳的产生。
要深入理解慢性、持久的疲劳这个复杂的生理现象,我们需要进一步探讨疲劳产生的具体机制,了解它是如何在分子、细胞和器官系统层面上发展的。
以上我们已经知道疲劳有很多不同种类型,如运动性疲劳、慢性疲劳综合征、癌症相关性疲劳、肾上腺疲劳、长新冠疲劳、更年期疲劳、骨质疏松疲劳、周一疲劳综合征等,虽然各个类型有特异性表现,它们往往共享一些基础的发病机制。
疲劳是一种复杂的生理病理现象,涉及多个系统的功能紊乱,以下我们从能量代谢、神经内分泌系统、免疫系统、氧化应激反应、炎症因子变化、肠道菌群失调等角度来探讨疲劳的机制,为防治疲劳提供新的思路和方法。
能量代谢失衡是疲劳发生的重要基础。
ATP产生和利用的功能障碍
研究表明,疲劳状态下存在ATP产生和利用的功能障碍。在剧烈运动过程中,ATP-酶泵功能受损会导致能量产生效率下降,能量产生效率降低进一步加重疲劳感。
当ATP水平降低时,疲劳程度会增加,例如,枸杞多糖 (LBP) 和 滑子菇多糖 (PNP) 可以通过增加ATP水平来缓解疲劳。
山药多糖可通过调节炎症途径和氧化应激来对抗疲劳,从而降低 IL-lβ、MDA、BUN 和 LDH 的水平,并增加 ATP 和 SOD 的活性。
代谢产物的积累效应
在强度运动期间产生的过量代谢物,会在骨骼肌和血液中积累,打破体内稳态,影响血乳酸(BLA)、丙二醛(MDA)、乳酸脱氢酶(LDH)等指标水平。这种能量代谢紊乱不仅影响肌肉收缩能力,还会引发一系列级联反应,导致疲劳症状加重,形成恶性循环。
富含多糖的芦苇根茎(PEP)提取物可显著延长小鼠的游泳耐力,提高血糖水平,降低 LDH 和 CK 活性。
玉米丝、翘鳞肉齿菌、党参和山药还通过调节相关代谢物的积累而具有抗疲劳作用。
线粒体功能的影响
线粒体是细胞能量产生的主要场所,慢性疲劳综合征患者存在外周线粒体功能异常,正常化静息代谢率(nRMR)发生改变,这些改变会影响细胞能量的正常供应,加重疲劳症状。
印加萝卜水提取物可以通过防止线粒体介导的肌肉损伤和氧化应激来发挥抗疲劳功能。
红参提取物可以通过挽救骨骼肌线粒体的密度和形态以及增加线粒体生物发生来改善线粒体功能障碍,从而发挥抗疲劳作用。
神经内分泌系统的改变在疲劳发生中起着核心作用。
神经递质系统改变
5-羟色胺(5-HT)水平升高:高浓度5-HT会影响运动神经元和肌肉收缩,通过影响运动神经元输出导致疲劳。
螺旋藻多糖可以抑制运动诱导的 5-HT 和色氨酸羟化酶-2(TPH2)的增加,并上调 5-羟色胺能 1B 型(5-HT1B)的表达以增强运动能力。
多巴胺(DA)系统功能异常:多巴胺合成和转化率下降会加重疲劳,多巴胺参与大脑网络的连接和结构整合,影响疲劳的发展和体温调节。
牛樟芝多糖干预可以抑制6-羟基多巴胺(6-OHDA)诱导的ROS-NLRP3的表达,保护多巴胺能神经元,提高小鼠的运动能力。
去甲肾上腺素(NA)系统改变:NA系统加速中枢疲劳的发生,影响认知和情绪调节。
淫羊藿多糖通过增加去甲肾上腺素和肌酸激酶水平来治疗疲劳,从而对代谢紊乱产生改善作用。
γ-氨基丁酸(GABA)和乙酰胆碱的代谢改变:参与中枢/精神疲劳的调节,影响认知和情绪功能。
下丘脑-垂体-肾上腺轴(HPA轴)功能紊乱
研究发现,疲劳患者普遍存在下丘脑-垂体-肾上腺轴(HPA轴)功能紊乱,尤其是肾上腺疲劳患者,HPA轴过度激活,影响皮质醇和应激激素的分泌,这种紊乱会通过多种信号通路放大疲劳和应激反应。例如:
芦根多糖提取物通过抑制 HPA 轴的过度激活以及降低 TC 和皮质醇的含量来发挥抗应激和抗疲劳作用。
在慢性疲劳综合征、癌症相关疲劳、长新冠疲劳中都会存在免疫系统异常的情况。
免疫系统改变是疲劳发生的重要机制之一。研究表明,疲劳初期是机体的一种适应性免疫介导反应,目的是提高抗炎细胞因子的产生,增强抗病能力。然而,持续的疲劳状态会导致免疫功能受损,表现为:
铁皮石斛多糖提取物,可以调节其潜在的免疫功能改善疲劳,大大增加 T 和 B 淋巴细胞的细胞变异性,并缓解由负重游泳引起的疲劳综合征。
人参多糖可以提高运动耐力,延长疲惫的游泳时间;它还可以通过改善受训练小鼠的生化指标和增强脾细胞增殖(T 或 B 淋巴细胞)来延缓运动引起的疲劳和运动相关损伤。
壳寡糖(COS)与跑步相结合,促进脾肺发育、淋巴细胞水平、T 细胞/CD8+ T 细胞比例,并通过 TNF、IL-2、IL-10等细胞因子改善大鼠免疫状态,从而减轻疲劳。
黄精多糖不仅显著降低了 IL-1β、IL-6 和 TNF-α 的上调,而且还通过调节 miR-340-3p/IRAK3 和 GLUT-4 改善了 L6 肌管中的炎症和葡萄糖摄取。
黄芪多糖通过激活 AMPK 通路、限制 ROS 的产生以及降低 IL-1β、TNF-α 和 NF-κB 的水平,对SD大鼠过度运动诱导的心肌损伤具有保护作用。
氧化应激在疲劳发生中扮演着重要角色。虽然低水平的活性氧(ROS)对于产生正常的肌肉力量是必要的,但高浓度的ROS会导致肌肉收缩能力受损。
研究表明,持续的耐力运动会产生大量ROS,影响肌肉的运动能力,慢性疲劳综合征ROS水平也是异常,过量的ROS会导致机体氧化还原系统失衡,ROS可能触发线粒体膜的脂质过氧化,破坏线粒体功能,影响能量供应。
高水平的氧化应激可能导致炎症标志物恶化,过量的ROS与癌症相关疲劳的发生发展密切相关。
远志多糖可以降低疲惫运动小鼠的 BLA 和 BUN 浓度,并增加 LG 、肌糖原(MG)、LDH 的水平;它在体外对羟基自由基和 DPPH 自由基表现出高清除率,并表现出良好的抗氧化特性。
人参多糖可以减少BLA、LDH、BUN、MDA的积累,增加 SOD、CAT 和 CK 的活性,从而延长小鼠的疲劳耐受性。
枸杞多糖能够通过提高抗氧化酶水平和调节代谢机制来缓解疲劳。
冬虫夏草酸性多糖可以通过刺激海马中磷脂酰肌醇 3-激酶(PI3K)、蛋白激酶 B(AKT)、Nrf2 和 HO-1 蛋白的表达水平来缓解小鼠的运动疲劳并改善小鼠的学习和记忆。
近年来的研究发现,肠道菌群失调与疲劳的发生密切相关。在慢性疲劳综合征(ME/CFS)患者中观察到:
具体的每种疲劳相关的肠道菌群变化在下一章节详细阐述。
以上这些机制之间并非独立存在,而是相互影响、相互作用。例如,肠道菌群失调可通过肠-脑轴影响神经内分泌功能,同时也会引起免疫失调和炎症反应;氧化应激则可能加重炎症反应,影响能量代谢。因此,在研究和治疗疲劳时,需要采取整体观念,综合考虑这些机制的相互作用。
理解这些基础机制对于解释不同类型疲劳的发生发展具有重要意义。例如,慢性疲劳综合征可能同时存在能量代谢紊乱、神经内分泌功能失调和免疫系统异常;而癌症相关性疲劳则可能主要通过炎症反应和氧化应激来影响机体功能。
接下来,我们将具体分析几种常见类型疲劳的特点及其与这些基础机制的关系。
慢性疲劳综合征(简称ME/CFS)是一种无法解释的衰弱性慢性疾病,核心症状在于:

慢性疲劳综合征患者可能看起来没有生病,但无法进行正常活动,前面我们也已经知道了慢性疲劳综合征最常见于中年人群,但也影响儿童、青少年和老年人。在成人中,女性比男性更容易受到影响。在儿童中,青少年比年幼的孩子更容易受到影响。
慢性疲劳综合征的病因尚不清楚,可能涉及多种因素的组合,包括:
除了上述原因及上一章节提到的发病机制之外,慢性疲劳综合征还与肠道菌群的变化密切相关。
慢性疲劳综合征的肠道菌群组成
长期COVID 和慢性疲劳综合征患者肠道菌群组成的改变,以及报告的恶心、腹泻和腹痛等胃肠道症状可能表明肠道菌群失调在这两种疾病的发展中可能起作用。
多项研究表明,疲劳患者的肠道菌群组成与健康人群存在显著差异。主要特点包括:
多样性减少
慢性疲劳综合征患者肠道细菌的多样性明显下降,比健康人少了大约34%(P < 0.00001)。
ME/CFS 患者肠道微生物组 α 和 β 多样性的变化
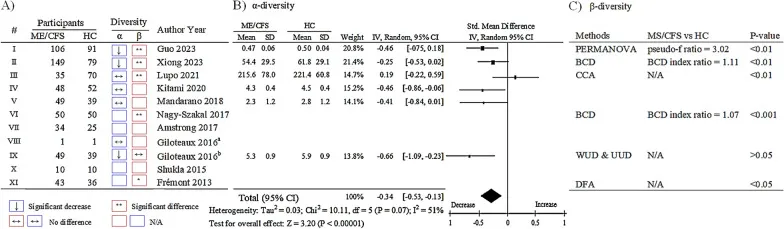
A、从 11 项选定研究中概述的肠道微生物组 α 和 β 多样性变化,用罗马数字 I 至 XI 表示。
B、使用随机效应荟萃分析模型总结肠道微生物组的 α 多样性的森林图。
C、ME/CFS 患者与健康对照组肠道微生物组的肠道微生物组 β 多样性列表。
促炎菌增多
与健康对照组相比,慢性疲劳综合征患者体内促炎性革兰氏阴性细菌(如 Alistipes、拟杆菌、肠杆菌科)的水平更高,这可能会加重病程,导致疲劳、疼痛和精神错乱的严重程度增加。
产丁酸菌减少
慢性疲劳综合征与厚壁菌门某些菌群的减少有关,包括粪杆菌属、罗斯氏菌属、梭菌属,其中产丁酸菌粪杆菌的减少被认为是对慢性疲劳综合征有诊断价值的潜在生物标志物。
注:在 IBD、癌症和自身免疫患者(如多发性硬化和1型糖尿病)中发现粪杆菌丰度减少与疲劳感增加之间存在关联,从而表明全身性炎症和肠道菌群失调可能会影响与其他重要器官的双向联系,并导致神经精神和胃肠道症状的发展。
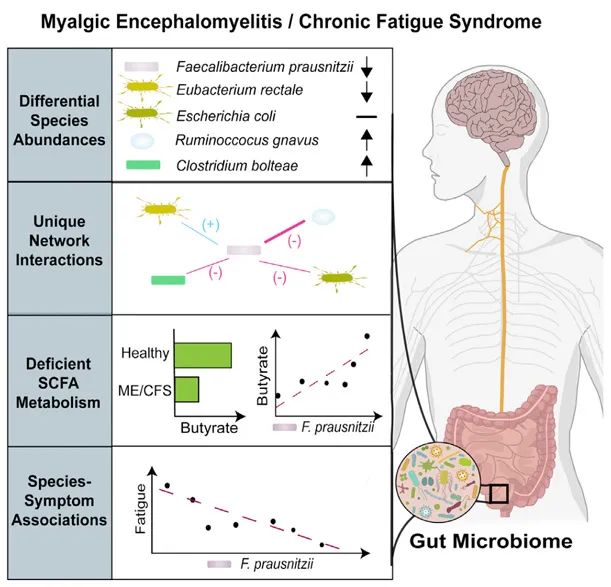
doi:10.1016/j.chom.2023.01.004
条件致病菌增加
4 项研究表明,慢性疲劳综合征患者中一些机会性致病细菌物种显著增加,包括Erysipelatoclostridium ramosum、Enterocloster citroniae、Hungatella hathewayi、Eggerthella lenta等。
慢性疲劳综合征患者的一些乳酸菌和其他有益物种明显减少,如Faecalibacterium prausnitzii、Bifidobacterium angulatum、Lactobacillus ruminis、Roseburia intestinalis等。
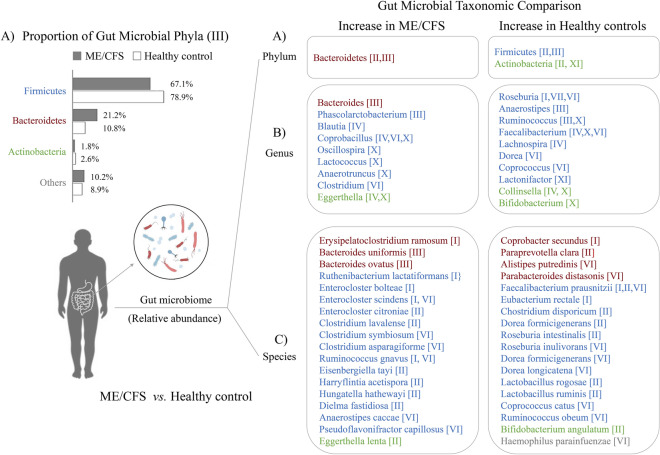
编辑
doi: 10.1186/s40001-024-01747-1
肠道菌群如何通过代谢产物影响疲劳?
短链脂肪酸
有 5 项研究报告了慢性疲劳综合征患者和健康对照者之间代谢物的潜在差异,特别是,慢性疲劳综合征患者的粪便、血液或尿液中的短链脂肪酸 (SCFA,如丁酸盐、乙酸盐) 和支链SCFA(如异丁酸盐)均显著减少。
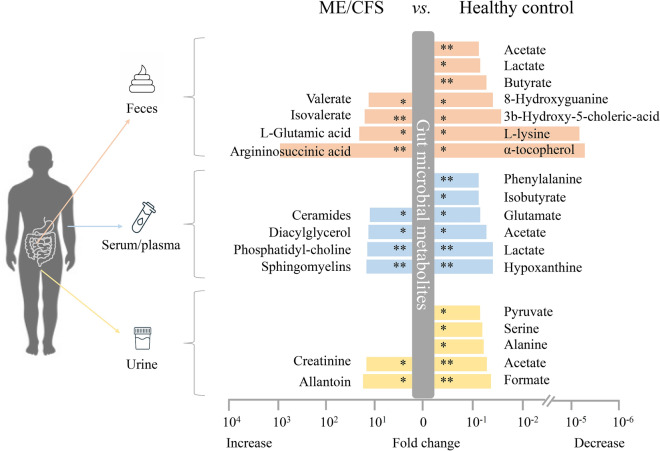
doi: 10.1186/s40001-024-01747-1
在慢性疲劳综合征患者中也有其他细菌产生的代谢物(如乙酸盐和异戊酸盐)的显著减少,这些代谢物作为能量来源,并表现出抗菌特性(如乳酸盐和苯甲酸盐)。这些变化与 Clostridium 呈正相关,与 Bacteroides 呈负相关。
维生素E
维生素E(α-生育酚)作为一种重要的抗氧化维生素,在维持认知功能和心理健康方面发挥着关键作用。然而,在慢性疲劳综合征患者中观察到一个显著现象:
与健康对照组相比,慢性疲劳综合征患者血清 α-生育酚 (维生素 E)大幅降低(P<0.05)。这种降低可能与肠道菌群的改变密切相关。具体来说:
因此,慢性疲劳综合征患者出现的认知障碍很可能是由这种肠道微生物组的特定改变引起的维生素E水平显著降低所致。
鞘脂
肠道微生物组衍生的鞘脂可以改变宿主脂质代谢。具体来说,具有丝氨酸棕榈酰转移酶 (SPT)基因的拟杆菌属具有产生鞘脂的能力。因此,这可以部分阐明长期慢性疲劳综合征患者血清脂质水平升高和高拟杆菌素同时出现。
色氨酸
色氨酸是一种必需氨基酸,也是神经递质5-羟色胺(血清素)的关键前体物质。在正常生理状态下,色氨酸的代谢主要有两条重要通路:
血清素合成通路:
色氨酸 → 5-羟色胺(5-HT,血清素) → 褪黑素
这条通路对维持情绪、睡眠-觉醒周期和能量代谢至关重要。
犬尿氨酸通路:
色氨酸 → 犬尿氨酸 → 其他代谢物
这条通路与免疫调节和神经炎症有关。
在这个过程中,如果某些肠道细菌通过各种途径将色氨酸分解,那么用于制造血清素的“原料”就减少了。血清素不足会引起一系列问题:如睡眠质量下降、情绪容易低落、疲劳感增加、精力不足等,这些睡眠、情绪问题都会带来更加疲惫的恶性循环。
肠道菌群如何通过“肠漏”影响疲劳?
前面我们知道,在慢性疲劳综合征中,肠道菌群中产丁酸菌明显减少,丁酸盐是肠道上皮细胞的主要能量来源,丁酸盐产生菌减少导致丁酸盐不足,影响肠道屏障完整性维持。
促炎细菌增加导致炎症因子升高,炎症也同时损害肠道屏障功能,肠道通透性增加,细菌及其代谢物进入血液,激活系统性免疫反应,通过迷走神经影响大脑功能,导致神经炎症和认知功能障碍,血清素和GABA等神经递质产生受影响,影响情绪和睡眠调节,加重疲劳感知。
疲劳导致活动减少,活动减少进一步降低丁酸盐产生,丁酸盐减少加重肠漏,肠漏加重全身炎症和疲劳,循环往复,症状持续…
具体针对菌群的对慢性疲劳综合征的干预措施我们将在下一章节详细展开。
长新冠的首个大规模研究,调查来自56个国家的近3800人,该研究显示,最常见的症状为疲劳、劳累后不适。近86%的受访者表示劳累会引起症状复发 ;87%的受访者表示疲劳是主要症状。
不同人群的发病率差异:
COVID 引起的疲劳通常会感觉如下:
克利夫兰诊所的一项新研究可能有助于解释原因。它发现 67% 的长期 COVID 参与者经历了中度至重度睡眠障碍。
COVID可以杀死大脑中的神经细胞,影响睡眠
COVID进入大脑的一种方式是通过鼻子中的神经纤维进入下丘脑和额叶皮层,这可能是COVID攻击的两个“初始站点”,然后传播到大脑的其他部分。下丘脑负责调节呼吸、我们如何应对压力、体温、新陈代谢、心血管功能,也包括睡眠。
科罗拉多大学丹佛-安舒茨医学校区神经外科教授Granholm-Bentley在2023 年 7 月的《临床医学杂志》上对 SARS-CoV-2 对大脑影响的研究进行了进一步的评论,引用了检查重症COVID患者大脑的研究,这些研究显示 COVID 病毒颗粒在大脑中徘徊。她说,这很重要,因为“下丘脑中有含有食欲素的神经细胞,这些神经肽特别参与睡眠/觉醒周期。这些神经细胞在下丘脑对感染很敏感,因此它们在像 COVID 这样的病毒攻击中很容易死亡,永远不会再生。
当这种情况发生时,你可能会发现自己在夜间经常醒来,难以定期入睡,或两者兼而有之,所有这些都会让人长期疲惫不堪,甚至可能在未来患上其他神经退行性疾病。
斯坦福大学发作性睡病中心发表的一篇论文,有朝一日可能会通过增加大脑中的食欲素水平来治疗慢性睡眠障碍,该中心正在研究下丘脑周围睡眠障碍的潜在疗法。
病毒攻击“细胞的发电厂”——线粒体
长新冠持续攻击线粒体,线粒体是我们体内每个细胞的能量来源,你也可以理解为细胞的发电厂。病毒实际上能够改变线粒体功能,因此它能够复制,同时还可以减少进入细胞的能量,通常,线粒体只会关闭能量产生几天或几周,直到病毒颗粒消失。但对于某些感染,线粒体很难自行恢复。线粒体功能障碍造成的能量下降也是触发下丘脑睡眠中心离线的原因。
来自长期 COVID 患者的组织样本还显示严重的肌肉损伤、免疫反应紊乱和微凝块积聚。
微凝块积聚
对肌肉组织的深入研究还发现了长新冠病理学中另一个越来越熟悉的特征——微凝块。
南非的研究人员已经将注意力集中在这些携带“被困炎症分子”的微凝块上,这些微凝块表明患者的脉管系统受损。这意味着微凝块实际上可能已经通过受损的脉管系统进入肌肉,这也可能发生在其他组织中。
在这种情况下,微凝块可能反映了血管内壁的损伤程度,这也会损害氧气向肌肉组织的输送。有研究人员在肌肉组织中发现了来自 SARS-CoV-2 的病毒蛋白的证据。但这也可能是病毒残留物,是否直接导致劳累后不适仍存在争议。
免疫系统异常
与肠道微生物有关
一些研究表明,长期 COVID 患者可能会获得新的食物过敏和敏感性(尤其是对小麦和麸质),胃肠道症状的发生率为 3% ~ 79% 。同样,高达 92% 的合并诊断为肠易激综合征(IBS)的慢性疲劳综合征患者也认为胃肠道症状是常见的合并症。
而胃肠道不适,包括腹痛和腹胀,以及疲劳、头痛和认知障碍等肠外症状,可能是由于慢性肠道炎症和肠道上皮屏障受损而出现的,其次是粘膜相关不变T(MAIT)细胞的比例显著增加,这与 MHC I 类相关分子中微生物抗原的识别和微生物感染期间对细胞因子诱导刺激的反应有关。
持续感染或无活力的病原体残留会刺激慢性炎症,因为肠道病毒和细菌感染都会影响微生物组。
肠道菌群具体如何影响长新冠疲劳?
目前越来越多的研究报告了从急性感染中恢复的长新冠患者的肠道成分和多样性的变化。这些个体的肠道组成已发生显著变化,其特征是共生菌种类减少长达 30 天,包括直肠真杆菌、普拉梭菌、双歧杆菌属,而即使在恢复期 6 个月后,微生物群落的丰富度似乎也没有恢复。
抗炎微生物群Alistipes onderdonkii 、Faecalibacterium prausnitzii的减少,表现为促炎细胞因子(包括 IL-2、IL-7、IL-10 和 TNF-α)水平升高,这与疾病严重程度和症状严重程度增加密切相关,包括呼吸、神经精神、胃肠道和疲劳问题。
对初次诊断后 6 个月出现长期 COVID 症状的患者(占 106 名患者初始样本的 76%)进行的一项观察性研究显示,瘤胃球菌和普通拟杆菌(Bacteroides vulgatus)水平明显较高,而普拉梭菌水平较低,这与持续的呼吸道症状和神经精神疾病和疲劳相关,包括Clostridium innocuum、Actinomyces naeslundii.
有趣的是,产丁酸菌,包括假小链双歧杆菌(Bifidobacterium pseudocatenulatum)和普拉梭菌(Faecalibacterium prausnitzii),在 6 个月时与长期 COVID 症状呈最大的负相关 。
一项针对新冠肺炎康复的有症状患者的前瞻性随访研究报告称,出院一年后,存在某些肠道微生物群失调,包括细菌多样性显著降低和产短链脂肪酸菌的相对丰度较低,如Eubacterium hallii, Subdoligranulum、Ruminococcus、Dorea、Coprococcus、Eubacterium ventriosum。
有趣的是,在肠道微生物群改变的个体中,持续12个月出现身体功能受损、精神疾病(主要是焦虑或抑郁)、肺功能下降和影像学异常等长期症状的个体与恢复阶段的临床指标显著相关,从而表明肠道微生物群可能在长新冠中发挥重要作用。
总的来说,肠道菌群失调与通过微生物群-肠道-免疫-大脑轴调节慢性疲劳综合征和长新冠的大脑活动和认知功能有关。然而,迄今为止尚不清楚肠道微生物组和神经胶质细胞如何相互作用,以及这些相互作用如何触发慢性疲劳综合征和长新冠的神经认知症状(也称为“脑雾”)和劳累后疲劳的发作。研究人员认为可能的触发因素之一可能是神经递质及其特异性受体的产生、运输和功能失调(初级M1运动皮层内GABA能和谷氨酸能活性的兴奋性降低)。
目前尚无治愈或批准的慢性疲劳综合征及长新冠疲劳的治疗方法,但有些措施及注意事项可以缓解。
营养补充
补充B族维生素、C、D、E,微量元素如锌、硒等。
改变生活方式以提高能量水平
日常生活习惯、饮食和锻炼习惯的简单改变会显着影响整体活力。避免过量饮酒。避免久坐不动。
采取健康的适合自己的饮食方式
在日常饮食中,尽量选择新鲜、天然的食材。水果、蔬菜、全谷物和优质蛋白质应成为饮食的主角。每个人的身体都是独特的,饮食方式的选择应当结合个人的生活方式和文化习惯。合理规划饮食时间与频率也是必要的,必要时可以采取间歇性禁食,它的战略性进食暂停旨在让你的身体有时间专注于修复而不是消化。
探索重金属排毒
有些人认为重金属积累可能会导致持续疲劳,探索重金属排毒成为一种潜在的缓解途径。需在医疗专业人员指导下进行重金属排毒,确保针对慢性疲劳综合症患者的独特需求量身定制安全和个性化的策略。
调整生活节奏
由于慢性疲劳综合征可能会波动,你可能会一次感到几天甚至几周的疲惫,然后有一天醒来感觉好多了。发生这种情况时,不要做太多事情来弥补其他日子,换句话说,你感觉更好的日子里不要把自己逼得太紧,结果让自己再次变得更糟。享受这一天,不要强迫完成所有堆积如山的事情,慢慢来,调整自己的节奏。
认知行为疗法(CBT)
在慢性疲劳综合征的治疗中具有一定的应用和效果。一项长期跟踪研究显示,接受CBT的患者中有68%在5年后自我评价为“显著改善”或“非常显著改善”,接受CBT的患者在治疗结束后仍能维持较高的工作时间。CBT不仅改善了患者的疲劳症状,还对积极心理维度如希望和乐观产生了积极影响。
分级运动疗法(GET)
对慢性疲劳综合征患者的长期影响有多个研究支持,2021年的研究调查了分级运动疗法在常规专科诊所中的有效性,结果显示疲劳评分在第4次会话时显著降低,并在随访时保持显著改善。
注:分级运动疗法与认知行为疗法(CBT)一样,是慢性疲劳综合征的有效治疗方法。两者在总体效应大小上相当,但在初级保健设置中和接触时间较少的治疗中,CBT的效果较小。
具体针对菌群的对长新冠疲劳的干预措施我们将在下一章节详细展开。
癌症相关疲劳是癌症常见症状,也是癌症治疗最常见的副作用。
癌症相关疲劳(CRF)被定义为“与癌症或癌症治疗相关的令人痛苦的、持续的、主观的身体、情感和/或认知疲倦或疲惫感,与最近的活动不成比例,并干扰正常功能。与健康个体所经历的疲劳相比,癌症相关疲劳更严重、更痛苦,并且不太可能通过休息来缓解”。
它主要表现为持续疲劳和情绪和认知功能下降,无法通过休息和睡眠缓解,导致身体功能和生活质量下降。
一项荟萃分析指出,近一半的癌症患者都会感到疲劳。也有研究发现,在接受治疗后5-10年内,大约有20~30%的癌症患者报告持续的疲劳。
横断面和纵向研究证明,功能状态下降和合并症水平较高的年轻女性肿瘤患者报告的癌症疲劳水平较高。癌症疲劳程度较高的肿瘤患者报告更高水平的整体、疾病特异性和累积生活压力,以及睡眠障碍、抑郁、认知功能障碍和疼痛的并发情况。
研究表明,炎症生物标志物,如C反应蛋白和促炎细胞因子与各种癌症人群中的疲劳有关;下丘脑-垂体-肾上腺轴的失调也与疲劳有关。但人们对疲劳原因了解的不够深入,科学现状仍存在局限性。
在理解肠道-大脑轴及其与疲劳关系的研究进展,促使许多研究者关注肠道微生物变化对癌症患者疲劳潜在影响。
一些研究发现了特定肠道微生物属的相对丰度与癌症患者的疲劳水平有关,具体而言,高疲劳水平与促炎菌群相关,而低疲劳水平与抗炎菌群或产短链脂肪酸菌相关。例如,瘤胃球菌的相对丰度与低疲劳水平相关,而大肠埃希氏菌Escherichia和肠杆菌科Enterobacteriaceae的相对丰度与高疲劳水平相关。
瘤胃球菌科属于产丁酸菌,由于丁酸盐是一种具有抗炎特性的短链脂肪酸,因此疲劳与产生丁酸盐的瘤胃球菌科之间的关系是合乎逻辑的。在慢性疲劳综合征里面也有类似研究结果。
Enterobacteriaceae是变形菌门下的一个革兰氏阴性菌,这些微生物表面的分子成分,称为微生物相关分子模式,通过与免疫细胞受体的相互作用直接增加炎症。由于炎症水平升高与疲劳增加有关,因此与高相对丰度Enterobacteriaceae相关的更高疲劳是合理的。
晚期癌症
一项横断面观察研究,识别晚期癌症患者中微生物组组成与疲劳之间的关联。具体来说,
患者选择:患者来自MD安德森癌症中心的调查癌症治疗部门,共88名晚期、转移性、不可切除的癌症患者。最常见的诊断包括结肠癌、卵巢癌、宫颈癌和非小细胞肺癌。
注:纳入标准为至少18岁,能够说英语,病理诊断为晚期、转移性、不可切除的癌症,且在入组前至少30天未使用抗生素。
疲劳测量:使用MD安德森症状清单(MDASI)免疫疗法模块(MDASI-Immunotherapy)评估疲劳。
注:该模块已验证用于评估20种症状,包括7种免疫疗法特定项目和6种干扰项目。
疲劳评分:
88名患者中,58名(66%)归为低疲劳,30名(34%)归为高疲劳。
肠道菌群:
Eubacterium hallii与疲劳严重程度评分呈负相关(r=-0.31, p=0.0026),而Cosenzaea与疲劳严重程度评分呈正相关(r=0.26, p=0.014)。
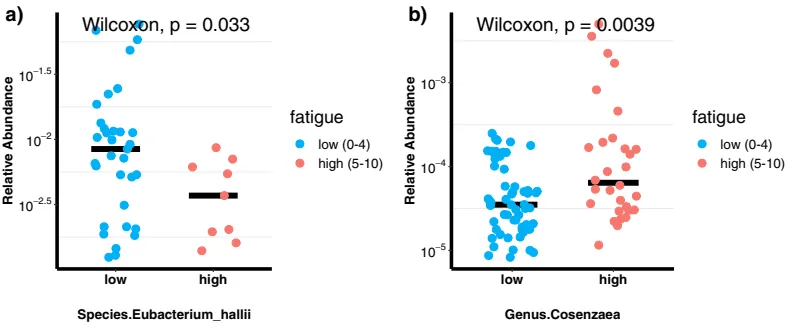
doi.org/10.1038/s41598-021-84783-9
作为营养相互作用中的关键物种,Eubacterium hallii可以高度影响代谢平衡,最终影响肠道微生物群落、宿主稳态以及宿主健康。此外,Eubacterium hallii已被用于治疗与胰岛素抵抗相关的疾病,包括血脂异常、1型糖尿病和库欣综合征以及其他内分泌疾病。综合这些数据表明,Eubacterium hallii在肠道代谢和免疫稳态中扮演着可能影响肠道-脑轴和疲劳的角色。
Cosenzaea(以前称为Proteus myxofaciens),有利条件下,生活在环境中的细菌,存在于人类的肠道中,可引起尿路感染、伤口感染和脑膜炎(新生儿和婴儿)。高疲劳癌症患者中Cosenzaea的丰度增加表明细菌在诱导炎症中的潜在作用。
癌症治疗
局部晚期直肠癌(RC)的治疗通常采用放化疗(CRT),尽管CRT提高了局部控制和生存率,但它常常导致如疲劳等严重的副作用,影响患者的生活质量。癌症治疗引起的肠道微生物组扰动/失调可能与炎症有关,进而导致系统性炎症反应和行为症状如疲劳。
在接受放化疗的直肠癌患者中,约67%会出现严重疲劳,85%的患者在放化疗后仍会持续出现疲劳症状,疲劳程度与肿瘤分期呈正相关。
一个概念验证研究,用于解决CRT引起的肠道微生物群扰动与疲劳之间的关系问题。在CRT开始前、中期(12-16次治疗后)和末期(24-28次治疗后)收集粪便样本和疲劳评分。
疲劳程度的变化
CRT结束时,疲劳评分显著高于CRT前(中位数从17.0提高到23.0,p≤0.05)。
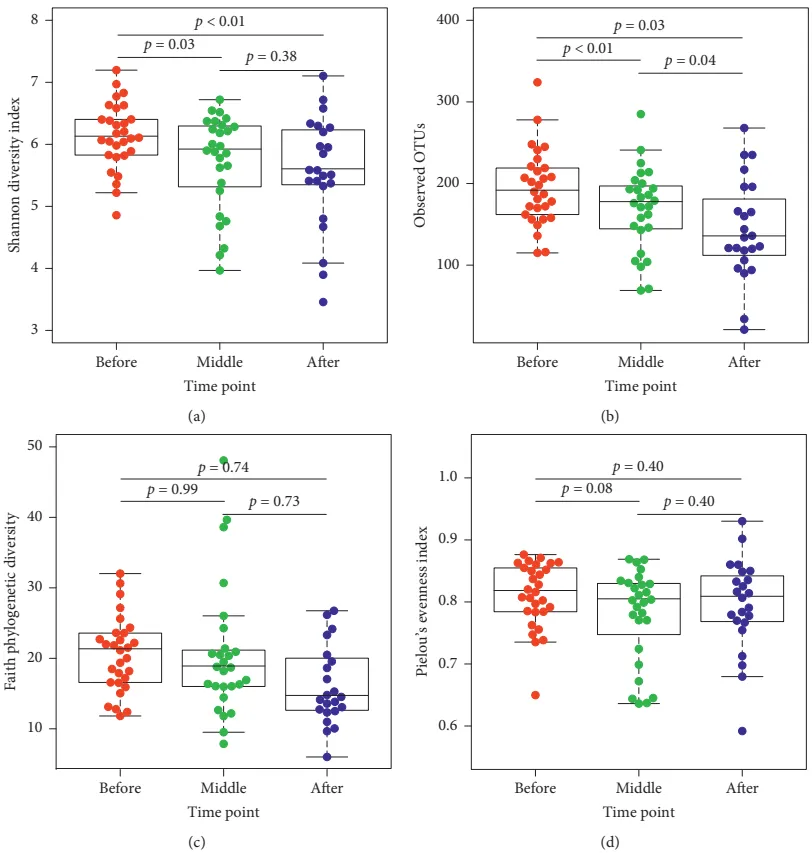
doi: 10.1155/2020/6375876
肠道微生物群多样性变化
在整个CRT过程中,Shannon多样性指数、观察到的操作分类单元(OTUs)数量和Pielou均匀度指数均显著降低。
多样性变化与肠道微生物群失衡有关,可能影响营养物质的吸收和利用,导致患者营养不良,进一步加重疲劳症状。同时也可能引发免疫系统的异常反应,导致炎症反应加剧。
疲劳与非疲劳患者的差异
在CRT中期,疲劳患者的OTUs数量显著低于非疲劳患者(149.30±53.1 vs. 189.15±44.18,t(23)=2.08,p≤0.05)。
主要菌群的相对丰度
在CRT中期,疲劳患者的拟杆菌门相对丰度显著低于非疲劳患者(U=124,p≤0.04)。
在CRT末期,疲劳患者的拟杆菌门相对丰度显著高于非疲劳患者(U=16,p≤0.01)。
在门水平上,据报道,肠易激综合征和非酒精性脂肪肝等肠道炎症疾病中拟杆菌门增加。有趣的是,拟杆菌属可能包括一种潜在的病原体,例如脆弱拟杆菌B. fragilis。
最近的一篇文献表明,脆弱拟杆菌的产肠毒素菌株不仅与结直肠癌有关,还与菌血症、结肠炎、腹泻、脓毒症、全身感染、全身炎症和神经系统疾病(如阿尔茨海默病)有关。后一篇综述还强调,脆弱拟杆菌与全身炎症和神经退行性变相关的机制之一可能与脆弱拟杆菌分泌促炎脂多糖 BF-LPS 等神经毒素的能力有关。
主要菌属的差异
在CRT中期,疲劳患者的Escherichia属显著增加(p≤0.05)。
在CRT末期,疲劳患者的Bacteroides、Faecalibacterium、Oscillospira属显著增加(p≤0.05)。
一些大肠埃希菌菌株,特别是在免疫功能低下的癌症患者中,与可能严重和危及生命的感染有关,如UTI、急性和慢性腹泻(如肠致病性和肠出血性大肠埃希菌腹泻,或血流感染)。此外,一些大肠杆菌菌株与结直肠癌肿瘤大小呈正相关。这也支持疲劳组促炎环境的假设,与 CRT 结束时非疲劳参与者相比,拟杆菌门和拟杆菌属的相对丰度显著更高证明了这一点。
鉴于肿瘤分期与疲劳的高关联,临床医生需要意识到那些表现出更高肿瘤分期的患者疲劳可能恶化的风险。因此,建议在癌症治疗过程中定期评估患者的疲劳状况,特别是对晚期患者进行更频繁的随访和监测。同时,应当重视肠道微生物组在癌症相关疲劳中的潜在作用,考虑将微生物组分析纳入疲劳评估体系。
这可能是肾上腺疲劳或甲状腺功能低下或……两者都有。这两种情况都主要影响女性,女性患甲状腺功能减退的可能性是男性的 5~8 倍。
肾上腺疲劳与甲状腺功能低下如何区分?
它们在某些关键方面有所不同。简单说,肾上腺疲劳主要是压力大,而甲状腺功能低下主要是因为自身免疫的问题。
肾上腺疲劳是当产生皮质醇等压力荷尔蒙的肾上腺收到停止产生尽可能多的皮质醇的信号或身体产生蛋白质来结合皮质醇时发生的一种情况(稍后会详细介绍)。
而甲状腺功能低下是指甲状腺不产生甲状腺激素,和肾上腺疲劳原因不同。
下面我们分别看一下肾上腺疲劳和甲状腺疲劳的发病机制。
肾上腺疲劳又名 HPA 轴失调
肾上腺疲劳不是一个实际的诊断,但它是人们通常对下丘脑-垂体-肾上腺轴(HPA 轴)失调出现的一系列症状的命名。
注:HPA 轴是下丘脑、垂体、肾上腺和肾上腺激素之间的复杂通讯系统。它控制我们体内的压力反应。
当我们感到压力时,下丘脑会向垂体发出信号,以释放促肾上腺皮质激素(ACTH)。然后 ACTH 向肾上腺发出信号以释放皮质醇。皮质醇有时被称为“压力荷尔蒙”,因为它可以帮助我们应对身体、情绪或精神压力。皮质醇通过调节血糖和新陈代谢在体内发挥作用,它激活中枢神经系统,维持血压,并具有抗炎作用。
在身体或情绪压力期间,皮质醇水平会上升。它加速了新陈代谢,因此我们能够度过那段紧张的时期。
皮质醇在短期内是有帮助的,但当我们经历慢性压力时,肾上腺分泌压力荷尔蒙的时间会比它们的设计时间更长。HPA 失调时,大脑和肾上腺通讯就会被甩开,这可能导致感觉“疲惫不堪”或精疲力尽。
起初,皮质醇升高的人会感到颤抖,心跳加速,并且可能有失眠问题。最终,肾上腺将无法产生足够的皮质醇来满足需求,并且水平会下降并保持在较低水平。这称为肾上腺疲劳。
即使是皮质醇水平的微小变化也会导致明显的症状,尤其是疲劳和脑雾。
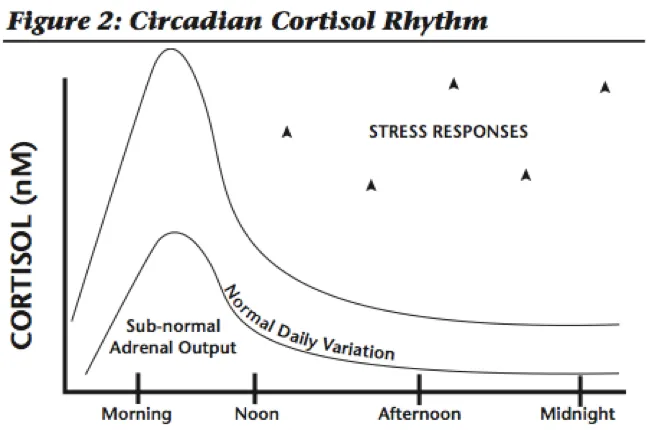
编辑
此外,为了保护身体免受皮质醇的促衰老作用,身体会产生一种称为皮质醇结合球蛋白(CBG) 的结合蛋白。CBG 抓住皮质醇,使其无法刺激体内细胞。
肾上腺疲劳主要还是因为压力大,因此,压力管理对于正常的肾上腺功能至关重要。
这可以包括瑜伽、冥想、定期锻炼以及为爱好腾出时间。

按摩能增加人体内催产素水平,减少让人紧张、亢奋的肾上腺皮质激素。还能降低肌肉组织内炎症因子水平,促进肌纤维再生,修复肌肉损伤。按摩还能调动副交感神经,使大脑平静放松,改善睡眠。
避免咖啡因等兴奋剂甚至 ADHD 药物也很重要。咖啡因通过对肾上腺施加压力以产生更多的皮质醇并增加肾上腺素的产生来帮助产生能量。当肾上腺系统已经虚弱时,这不是一件好事。因此,如果有咖啡因依赖,请尝试戒掉咖啡因依赖。
甲状腺功能低下又名甲状腺功能减退
甲状腺功能低下或甲状腺功能减退也表现为疲劳,但这是因为甲状腺功能没有发挥最佳功能。你的甲状腺就像身体的代谢恒温器,它控制着新陈代谢、体重、体温和心率。它还在生育能力和月经周期中起着重要作用。
甲状腺疲劳什么感觉?
会一直感到疲劳、即使在睡了一夜好觉之后也是如此。它还可能包括脑雾、注意力不集中、一直感到寒冷、月经不调、体重增加等。
甲状腺疲劳是怎么发生的?
患有甲状腺功能减退症时,要么无法产生足够的甲状腺激素来满足身体的需要(原发性甲状腺功能减退症),要么无法将可用的甲状腺激素转化为活性形式。
甲状腺功能减退症也可能让人更容易患上肾上腺疲劳,因为根本原因是自身免疫。
自身免疫引起的炎症
大多数女性甲状腺功能减退症的主要原因是桥本氏症。高达 90% 的甲状腺功能减退症是由桥本氏甲状腺炎引起的。人群中多达 10% 患有桥本氏病。
桥本氏病是一种自身免疫性疾病。这意味着某些事情导致免疫系统失控并攻击自己的一部分,攻击导致身体该部位的炎症细胞增加。炎症会让人感到“疲惫不堪”,类似于感染病毒时的感觉。
吃有机、天然的食物并避免加工食品和糖也很重要。关于桥本甲状腺炎及相关干预措施我们也有写过相关文章,详见:
除了桥本氏病之外,甲状腺功能减退的原因包括:甲状腺切除术、放射暴露治疗甲状腺功能亢进、暴露于环境中的辐射、某些药物、环境毒素、感染、碘过多或过少、先天性疾病等。
食物敏感
甲状腺疾病通常与食物敏感性有关。其中最常见的是麸质。麸质是一种存在于谷物产品中的蛋白质,尤其是小麦。据估计,多达 1/3 的人对麸质有一定程度的敏感性。这些食物敏感性会导致消化道发炎,从而损害其吸收营养的能力。当缺乏营养时,疲劳通常是一个主要症状。
关于麸质不耐受可以详见我们之前的文章:
低铁蛋白/铁
铁蛋白是铁的储存形式。体内有适量的铁水平对于正常的能量产生至关重要。它也是正常甲状腺激素产生所必需的。缺铁会导致疲劳和其他症状,例如脱发、运动耐力下降、频繁感染以及胃肠道问题,例如胀气和腹胀。甲状腺功能减退症也会影响正常吸收铁的能力。这会产生一个恶性循环,导致严重的疲劳。
即使没有贫血的证据(低血红蛋白),补充铁也被证明可以提高能量和减轻疲劳。
维生素B12 缺乏
甲状腺疾病通常与胃酸水平低有关。如果没有足够的胃酸,就无法完全消化食物并从中提取营养。自身免疫(如桥本甲状腺炎)引起的炎症只会使营养物质的吸收变得更糟。甲状腺激素缺乏会导致某些维生素(如 B12)的营养缺乏。事实上,高达 40% 的甲状腺功能减退患者的维生素 B12 水平不佳。由于 B12 对细胞中线粒体的影响,它直接参与能量产生。缺乏 B12 会降低线粒体能量产生的效率,从而导致疲劳。如果缺乏严重,还会导致恶性贫血。
MTHFR(甲基四氢叶酸诱导酶)是一种向某些营养物质中添加甲基的酶,使我们的身体能够代谢它们。当这种酶缺乏时,我们就无法有效地代谢营养物质,从而导致该营养物质的缺乏。B12 和叶酸等 B 族维生素以这种方式代谢。在 MTHFR 突变的患者中,它们的水平可能不理想。它还可能导致同型半胱氨酸水平升高,从而增加患心血管疾病的风险。
因此可以考虑补充维生素 B12。注射剂优于口服剂型,因为它们直接进入组织并绕过胃肠道吸收。许多甲状腺患者存在便秘、SIBO 和其他胃肠道相关问题,这些问题会损害营养物质的吸收。绕过胃肠道有助于确保 B12 被尽可能多地吸收。
血糖失衡
糖和简单碳水化合物可以快速提升能量,因为它们被迅速吸收和代谢,但从长远来看它们是有害的。当你吃糖或简单的碳水化合物时,血糖水平会飙升。这会触发胰腺释放胰岛素,胰岛素将葡萄糖输送到细胞中。然后胰岛素会降低糖分。有时身体会过度纠正,血糖水平就会下降得太低。从而导致疲劳、颤抖、脑雾以及想吃更多甜食或碳水化合物等症状。
这个循环又重新开始。
较高水平的胰岛素也会导致长期体重增加和/或难以减肥。如果你发现自己在上午晚些时候和下午中午感到疲倦,那么血糖可能在过山车上。
尽可能从饮食中减少糖和简单的碳水化合物。需要 “训练”身体优先使用脂肪而不是糖。最初几天不适应可能会感到有点昏昏沉沉和疲倦,但这些症状会逐渐消失。然后你会注意到精力增加和食欲下降。一些饮食模式例如:原始人饮食法,生酮饮食可参考。
睡眠不良,睡不醒
低(或高)甲状腺激素可能会直接降低睡眠质量。已经表明,甲状腺激素参与 REM 和非 REM 睡眠。如果睡眠质量差,无论睡多久多会觉得累。
如果是因为甲状腺功能减退症导致睡眠质量下降,那么需要甲状腺激素替代疗法来解决这个问题。
另一个重要因素是考虑何时入睡。人们在晚上睡觉时往往有更好的昼夜节律功能,而不是白天。
床是用来睡觉的。避免在床上看电视、阅读、工作电脑或玩智能手机。
尽量每晚在同一时间上床睡觉,每天早上在同一时间起床。身体会对一致的例程做出更好的反应。
晚上避免服用任何兴奋剂,睡前避免剧烈运动,这些会影响睡眠模式。
更多关于睡眠的内容详见我们之前的文章:
疲劳是甲状腺疾病非常常见的症状,可能表明存在更深层次的问题,从荷尔蒙失衡到营养缺乏。仅仅替代甲状腺激素可能不足以让身体完全充满活力并减轻疲劳。重要的是要采取全面的方法来解决问题并调查所有潜在的促成因素。

如果你患有疲劳和骨质疏松症,疲劳可能与药物的副作用、潜在的健康状况或缺乏维生素D有关,而不是骨骼疾病本身。
睡眠不足
目前尚不清楚为什么骨质疏松症患者经常感到疲劳,但根据最近的研究,睡眠不足可能会增加骨折的风险,反之亦然。
2019 年发表在《骨与矿物质研究杂志》上的一项研究得出结论,睡眠不足与绝经后女性的骨密度(BMD)较低和骨质疏松症风险较高有关。
2018 年对女性健康倡议中 157,000 名女性的分析进一步表明,每晚睡眠少于 5 小时的人复发跌倒的几率增加了 27%。
药物副作用
当身体失去过多的骨量,或没有足够快地构建新骨时,就会发生骨质疏松症,从而增加骨折的风险。一些为促进骨骼健康和骨密度而开具的药物可能会引起副作用,这些副作用可能会干扰睡眠并促进疲劳。
其他慢病
类风湿性关节炎、多发性硬化症、糖尿病、多发性骨髓瘤和白血病是导致骨密度低和疲劳的继发性疾病。2018 年的一项研究发现,长期承受精神、情绪或身体压力会给肾上腺带来负担,对骨量有直接的不利影响。
营养失衡
例如维生素 B12 缺乏症,会进一步导致与骨质疏松症作斗争的人感到疲惫。维生素 D 缺乏症在骨质疏松症患者中普遍存在,可导致疲劳、肌肉无力和骨痛。
因此,解决骨骼健康问题、确保摄入维生素 D 等必需营养素以及监测药物副作用是管理与骨质疏松症相关的疲劳的关键步骤。
保证充足的睡眠时间,避免过度劳累。学会压力管理,保持积极心态。
避免久坐不动,选择低冲击性运动,循序渐进避免过度。根据身体状况调整活动强度。
遵医嘱用药,定期进行骨密度检查。
更多关于骨质疏松的改善详见我们之前的文章:
酮症疲劳是过渡到生酮饮食的常见症状,通常在进行生酮饮食后的最初几周内会减轻。在开始低碳水化合物、高脂肪饮食后出现酮症疲劳是对新陈代谢强大变化的正常反应。
在酮症的早期阶段,你的身体会转向燃烧脂肪而不是糖来获取能量。大脑、肌肉和器官必须适应利用脂肪,而疲劳、缺乏精力和疲倦是这种转变的标志。其他症状可能包括头晕、恶心、心律不齐等。
生酮饮食可能会导致矿物质和电解质的损失,如钠、钾和镁,这些电解质对于肌肉功能和能量代谢至关重要。它还会增加对 B 族维生素的需求,这些都可能会导致肌肉疲劳和无力。
由于生酮饮食中碳水化合物的减少,身体可能会失去水分,导致脱水,这也可能是导致疲劳的一个因素。
确保摄入足够的钠、钾和镁,可以帮助缓解由于电解质失衡引起的疲劳。
即使不感到口渴,也要确保充足的水分摄入,以防止脱水。
适量的体育活动可以帮助身体适应酮症状态,并可能提高能量水平。
如果疲劳持续存在,可能需要调整生酮饮食的比例,或者咨询医生或营养师的建议。
每个人对生酮饮食的反应都是不同的,有些人会经历酮症疲劳,而有些人可能就没有这个问题。通常,随着时间的推移,身体会逐渐适应这种新的代谢状态,疲劳感也会减轻。一旦你的身体适应了,酮症疲劳通常会在一两周后消失。
更年期生殖激素水平的变化与身体和精神疲劳有关。它们会对其他激素产生连锁反应,并可能导致睡眠质量变差、血糖控制下降以及维生素或矿物质缺乏,所有这些都会让人感到疲倦。女性的更年期疲劳经历差异很大,从一般的精力不足到突然的“崩溃疲劳”或脑雾。崩溃性疲劳是指突然的剧烈疲惫,可能包括肌肉无力。
一项研究发现,虽然近 20% 的绝经前妇女报告了身心疲惫,但在围绝经期上升到 46%以上,绝经后上升到 85%以上。
荷尔蒙失衡
在围绝经期和更年期,身体的天然激素平衡,尤其是雌激素、黄体酮和睾丸激素开始减弱。由此产生的不平衡会引发不舒服的症状,如潮热、极度疲劳、情绪波动、体重增加、低下、脑雾等。
压力增加
更年期荷尔蒙失衡通常与其他中年压力源达到顶峰同时出现——工作压力、照顾孩子和年迈的父母以及睡眠不足。当我们经历慢性压力时,每个腺体和器官都会专门用于泵出称为肾上腺素和皮质醇的压力荷尔蒙。在“皮质醇窃取”中,这种对皮质醇的需求为其他激素提供了基础。这意味着身体剩下最少的资源来滋养甲状腺和性激素,尤其是雌激素、黄体酮和 DHEA。长期升高的压力和高皮质醇会对荷尔蒙平衡和能量水平产生毁灭性影响。
血糖控制不佳
雌激素还可以帮助身体对胰岛素做出反应,胰岛素是保持血糖水平稳定的激素。随着雌激素水平下降,血糖控制会恶化,从而增加吃某些类型食物后“崩溃”的风险。
失眠
在潮热、盗汗、思绪奔腾和体重增加之间,更年期症状会使安宁的睡眠几乎是不可能的。荷尔蒙波动还会触发皮质醇的释放,从而进一步破坏正常昼夜节律睡眠周期。
低雌激素和黄体酮水平的变化与失眠风险增加有关。其他更年期症状,如盗汗、焦虑和肌肉疼痛或关节痛,也会打断您的睡眠。
脑雾
如果你的疲劳感觉更多的是精神上的而不是身体上的,那么雌激素也可能与这里有关。它对健康的大脑功能和认知能力很重要,这就是为什么许多女性经历更年期“脑雾”的原因,在思考、记忆和注意力方面苦苦挣扎。
如果在围绝经期感到疲劳,当荷尔蒙波动时,症状可能会随着接近更年期并且情况开始稳定而改善。围绝经期通常持续约 4~8 年。
如果雌激素水平降低是主要问题,那疲劳可能会持续到更年期,此时荷尔蒙会永久处于低位。
激素替代疗法(HRT)
可替代更年期过渡期间流失的生殖激素,如雌激素和黄体酮,可以帮助缓解一系列围绝经期和更年期症状。可以以药丸和片剂的形式服用,也可以通过凝胶和贴剂通过皮肤服用。
改变饮食改善
精制碳水化合物或糖含量高的食物会迅速将葡萄糖释放到血液中。这可能导致血糖飙升,随后能量消耗崩溃。雌激素水平低降低了对胰岛素的敏感性,使控制这些波动变得更加困难。
早餐:将加工过的早餐麦片或白吐司换成蛋白质、健康脂肪和纤维含量更高的选择,如鸡蛋和牛油果,或带有坚果和浆果的酸奶。
午餐和晚餐:将面包、米饭或意大利面换成高纤维全麦、蔬菜和豆类,以及一些健康蛋白质,如豆腐、鱼或鸡肉。
小吃和饮料:吃水果、坚果,而不是蛋糕和饼干。尽量避免含糖饮料和果汁。
维生素B12
随着年龄的增长,维生素 B12 缺乏症更为常见,可导致贫血、精力下降、疲劳和呼吸急促,使身体活动更加困难。研究表明,服用 B12 补充剂可以显著改善这些症状。也可以吃一些鱼类,肉类,鸡蛋等食物。
南非醉茄
南非醉茄根是一种传统的草药,最近许多科学研究都以此为基础,包括一些研究表明它可以提高围绝经期的雌激素水平。
镁
矿物质镁对广泛的生理过程至关重要,包括调节生物钟。摄入更多镁的人往往睡得更久、更好,这可能有助于减轻白天的疲劳。
铁
如果在围绝经期月经过多,可能会导致缺铁,从而导致疲倦、精力不足和呼吸急促。一项涉及缺铁绝经前妇女的研究回顾发现,服用铁补充剂使她们的疲劳感减少了 60% 以上。
铁的食物来源包括:红肉和内脏、鱼、家禽、豆类、坚果和种子、深绿色蔬菜,如菠菜、羽衣甘蓝、西兰花等。
多喝水
雌激素有助于调节液体水平,保持细胞水分。随着更年期雌激素的下降,身体会发现更难保持液体,可能会脱水。这会导致疲劳,头晕,潮热或盗汗导致的出汗过多会使情况变得更糟。
随着年龄的增长,对身体的口渴信号变得不那么敏感,因此有意识地努力摄入足够的液体很重要。
定期锻炼
一项大型观察性研究发现,只进行少量体育活动的女性明显更容易出现一系列更年期症状,包括疲劳。
定期锻炼有助于提高能量水平和情绪,并改善睡眠。
如果目前不怎么运动,可以慢慢开始并逐渐增加。目标是每周至少进行 150 分钟的适度身体活动或 75 分钟的剧烈运动,分几天进行。
尝试进行一系列不同的运动,包括有氧运动(如快走、游泳或有氧运动)、力量训练(重量训练、自重锻炼或使用阻力带)以及涉及伸展和平衡的活动,如瑜伽和普拉提。
许多患者认为,因为他们已经在麻醉下睡着了,相当于休息了,所以在手术结束后应该有更多的精力。然而,手术后的疲劳感是大多数患者的常见情况。有以下一些原因:
· 抑郁或焦虑
手术前的焦虑导致睡眠不足,加重疲劳感,需要术后弥补
· 贫血
手术过程中的失血可能导致贫血,引起疲劳、虚弱和头晕
· 禁食
手术前的禁食会导致电解质和矿物质流失,影响身体机能
· 恢复
年龄增长和整体健康状况会影响术后恢复能力和疲劳程度;手术创伤使身体进入修复模式,需要更多能量进行愈合。
· 药物
麻醉药物和术后用药可能加重疲劳感。
美托洛尔或利尿剂(例如氢氯噻嗪)等降压药来降低血压,这些药物的副作用包括疲劳;
手术后,苯二氮卓类药物(例如劳拉西泮)等药物可用于镇静和/或肌肉痉挛。苯二氮卓类药物也用于治疗失眠,并可能导致嗜睡;
抗生素是在手术期间或手术后立即开始的。一些抗生素,如头孢氨苄、甲氧苄啶和磺胺甲噁唑,会引起疲劳。
1、保证充足的睡眠时间,避免过多访客打扰,循序渐进地恢复活动。
2、监测血红蛋白水平,补充铁剂等营养素。
3、维持电解质平衡,补充必要的矿物质,注意营养均衡。
4、缓解手术相关焦虑,保持积极心态,必要时寻求心理支持。
5、合理用药,遵医嘱服用药物,注意药物相互作用,尽可能避免使用导致疲劳的药物,必要时调整用药方案。
更多关于术后康复内容详见:
“周末赛神仙,周一丧整天”。
对很多人来说,周一早上可能真的很艰难,周一早上醒来时出现疲劳、焦虑、头晕、胸闷、注意力不集中、感觉压力大、沮丧、烦躁、喜怒无常、渴望撤退、食欲不振等症状。

周一具有挑战性,这通常涉及调整睡眠时间表、从休闲活动切换到工作任务以及为一周的责任做好心理准备。
为什么有人会出现这样的症状?
好消息是这通常是暂时的,可以通过特定的策略来解决,让周一更愉快。星期一也可以代表一个新的开始,这一天带来了设定新目标和做出积极改变的机会。与其将星期一视为周末的结束,不如尝试将它们视为一个新的开始。每个星期一都是重新开始、应对新挑战并为成功和令人满意的一周定下基调的机会。
如何调整?
1、“圆桌派”有这样一个观点:焦虑的反面是“具体”。可以妥善安排工作或项目并制定工作时间表。严格执行,不要将周五的工作留到下周一。
2、锻炼是一种很好的方式,你会专注于身体和感觉,这可以让你在周一工作时暂时把所有的烦恼放在一边。冥想可以帮助您平静心情,减轻压力。快走、瑜伽课并将其作为你周一早上仪式的一部分。
3、自我反思,重新评估您的工作目标和满意度。经常与朋友和同事沟通,以提高工作效率,改善工作态度。
4、星期天的时候可以出去散步,尤其是大自然,在清新安静的环境中度过周末。接触自然环境可以帮助我们减轻心理压力,观察大自然的过程能唤起我们内心的敬畏感,我们会感知到更小的自我,自我的需求和欲望不那么重要,进而产生深深的被治愈的感觉。
5、和宠物互动可以增强人们的心理健康和幸福感,甚至与植物交谈也有改善情绪、减轻压力的作用。动物和植物都是优秀的倾听者,它们允许一个人充分表达自己的感受和情绪,不会打断和评判。

6、周日晚上好好洗个热水澡,睡觉时听一些轻柔的音乐,轻松阅读,让身体真正放松。尽可能地在周日晚上11点之前睡觉。
7、周一早上建立积极的星期一仪式,例如特别的早餐、最喜欢的播客等,周一早上早点到公司,提前安排一周的工作。尽量保持周一的议程轻松且易于管理。
8、列出一些会让自己期待的一周中的好事情或者计划。比如,下班后晚上和朋友吃饭、喝咖啡、约会、看电影、健身或者其他你喜欢的活动。
9、选择热量较少的食物,有助于减轻身体新陈代谢的负担。不要试图通过喝大量的咖啡和牛磺酸饮料来抵抗星期一综合症。
10、完美的妆容和清新的衣服可以帮你在五分钟内振作起来。
以上只是建议,或许可以帮到你,当然你也可以有适合自己的调整方式。
在慢性疲劳综合征和长新冠患者中,益生菌可能通过以下机制发挥作用:
慢性疲劳综合征
对慢性疲劳综合征患者进行的干预主要集中在使用双歧杆菌和乳酸菌菌株上,这些菌株在减少炎症和氧化应激方面始终表现出良好的效果,并且伴随着疲劳感的降低。例如,在8周内使用干酪乳杆菌菌株Shirota的益生菌治疗可显著降低慢性疲劳综合征(ME/CFS)患者的炎症标志物。
使用多菌株益生菌制剂,这些制剂可以对抗抗生素耐药性病原体,增强粘膜屏障并调节免疫反应,包括制剂鼠李糖乳杆菌联合干酪乳杆菌(Ramnoselle) 和干酪乳杆菌联合乳酸双歧杆菌(Cytogenex) 在 8 周后有效改善疲劳(Chadler 评分),这归因于炎症减少,与基线相比,CRP 水平降低了近 30%,免疫力增强,其特征是 IgM 显着增加(是基线值的三倍)和 CD4/CD8 比率降低。
注:CRP一般是指C-反应蛋白的缩写,是血检中常见的炎症指标,当发生细菌感染或组织损伤时,其浓度显著升高。
IgM(免疫球蛋白M)是一种重要抗体,IgM在急性感染早期出现,是感染初期的重要标志物,在人体免疫系统中发挥重要作用。
长新冠
用嗜热链球菌 BT01、短链球菌 BB02、动物芽孢杆菌乳酸亚种 BL03、动物芽孢杆菌亚种 BI04、嗜酸乳杆菌 BA05、植物乳杆菌 BP06、副干酪乳杆菌 BP07 和瑞士乳杆菌 BD08 的八种活菌株和冻干菌株组成的益生菌联盟进行处理 (VSL#3®),与安慰剂相比,4 周后长期COVID患者的Chalder疲劳量表 (CFS)疲劳评分显著降低,安慰剂在干预后维持 4 周。
使用合生元将植物乳杆菌、鼠李糖乳杆菌、保加利亚乳杆菌、乳球菌和副干酪乳杆菌的益生菌菌株与益生元菊粉纤维相结合,以及柑橘果实、洋甘菊、姜黄、石榴以及从虎杖根中提取的白藜芦醇,与安慰剂相比,4 周后,平均疲劳评分降低了近 2 倍,主观幸福感评分的整体幸福感评分提高了一倍。
这些植物作为天然衍生的益生元纤维、抗氧化剂和微量营养素的来源,可能提供促进肠道健康和微生物活性的协同效益,与微生物代谢物的产生有关,其系统作用可以改善整体健康状况并促进疲劳恢复。
多组分制剂的对疲劳的改善
一项初步研究调查了多组分制剂“OMNi-BiOTiC®STRESS Repair 9”的有效性,该制剂由益生菌,例如干酪乳杆菌 W56、嗜酸乳杆菌 W22、副干酪乳杆菌 W20、乳双歧杆菌 W51、唾液乳杆菌 W24、乳酸乳球菌 W19、乳双歧杆菌 W52、 植物乳杆菌 W62 和双歧双歧杆菌 W23;益生元低聚果糖(FOS),如菊粉、酶(淀粉酶)和选定的微量营养素,包括氯化钾、维生素 B2(核黄素 5′-磷酸钠)、维生素 B6(盐酸吡哆醇)、硫酸锰和维生素 B12(氰钴胺素)组成,已被证明可有效改善益生菌和安慰剂组的疲劳、情绪和生活质量,但益生菌组在治疗 6 个月后有更大的改善。
由发酵乳杆菌LF16、鼠李糖乳杆菌LR06、植物乳杆菌LP01和长双歧杆菌BL04;嗜酸乳杆菌、干酪乳杆菌和双歧杆菌;瑞士乳杆菌R0052、长双歧杆菌R0175和植物乳杆菌299组成的精神生物制剂已被证明可以通过减少抑郁和愤怒情绪来显著改善情绪,并减少对HPA轴压力的反应,唾液皮质醇水平降低,所有这些都能改善睡眠。特别是,与基线相比,12周后在疲劳的参与者中补充副干酪乳杆菌HII01已被证明可以显著降低唾液皮质醇水平,这表明对病毒感染后综合征患者的疲劳减轻也有潜在益处。


doi.org/10.3390/nu16111545
总之,迄今为止的研究表明,益生菌,尤其是乳酸菌,可能有助于减轻慢性疲劳综合征和长期 COVID 患者的胃肠道症状。益生菌的免疫调节特性可能有助于恢复肠道微生物群的受干扰组成和菌群失调,从而减轻症状的严重程度(与丁酸菌丰度减少有关)。
因此,通过提高短链脂肪酸(如丁酸盐)水平(由于其强大的免疫调节和抗炎特性),使用活的F.prausnitzii和B.pullicaecorum菌株作为强效的丁酸盐生产者,可能必须在过度炎症后恢复肠道稳态,并且通过加强肠道屏障,可以预防与IBS样症状相关的肠漏综合征。此外,某些精神益生菌菌株和抗炎特性可能有助于减轻由压力诱导的肠道生态失调和HPA轴激活引起的心理困扰引起的胃肠道症状。
补充丁酸盐可能比较有利,因为它具有经过验证的免疫调节作用,例如,通过诱导干扰素-γ 和颗粒酶 B 的表达来增加粘蛋白和防御素的分泌并促进抗病毒防御,并减少全身炎症,从而可能减轻精神和疲劳症状。
后生元作为不可存活或无活性的益生菌及其代谢副产物,可能提供提供所有益处的显著优势,从而为患有慢性炎症和/或免疫力低下的个体提供一种可能更安全、更合适的方法。
此外,探索益生菌/合生元与其他具有免疫调节和抗氧化特性的生物活性物质(如辅酶 Q10 和硒或辅酶 Q10 和类脂酸)联合使用的潜在协同作用,值得进一步研究。
一项研究验证了针灸在乳腺癌化疗相关疲劳中的抗疲劳效果,其机制可能通过调节肠道菌群-肠-脑轴来实现。
根据针灸理论,选择足三里(ST36)、三阴角(SP6)、关元(CV4)、气海(CV6)、百会 (GV20)的穴位进行针灸治疗。
针灸治疗可有效缓解CRF小鼠的疲劳样行为,包括减少强迫游泳不动时间和增加总活动距离。针灸治疗可以显著提高肠道菌群的多样性和丰度,增加有益菌如乳杆菌,Candidatus arthromitus、Clostridia_UCG-014_unclassified,减少有害菌如大肠杆菌-志贺氏菌、链球菌的含量。
针灸治疗可以显著提高肠道紧密连接蛋白(ZO-1、occludin、claudin-5)的表达水平,减少肠道和海马体中的炎症因子(IL-1b、IL-6和TNF-a)的表达水平。
针灸治疗可以显著提高血清中CRH和CORT的水平,降低ACTH的水平,改善HPA轴功能。
针灸治疗可以调节血清中的代谢物,如N-甲基烟酰胺、β-甘油磷酸、香叶基乙酰乙酸、血清素和色氨酸等,影响相关的代谢途径。
总的来说,针灸能够改善肠道屏障功能、减少肠道和神经炎症反应、改善HPA轴功能,并调节血清代谢物,从而缓解疲劳症状。
疲劳可能发生在我们任何人身上,但通常不是一个长期的问题。如果它变成长期的,则表明可能存在更严重的健康问题,需要引起重视。
近年来的研究表明,肠道菌群方面的研究为慢性疲劳的诊断和治疗提供了新的视角。通过检测肠道菌群的组成变化,如产丁酸菌的减少、促炎菌的增加以及菌群多样性的降低,评估肠道屏障完整性等,可以帮助我们更好地理解个人疲劳情况是否与其肠道菌群有关,如果相关,则可以根据菌群失调的具体情况制定治疗方案。
例如,针对检测发现的具体菌群失调,可以采用相应的益生菌、后生元补充,或调整饮食结构来改善肠道微生态环境。同时,通过定期检测还能监测治疗效果,及时调整干预策略。
免责声明:本文所含信息仅供参考,不应视为医疗建议。如有任何健康问题,以及在进行任何医疗或生活方式改变之前,请咨询您的医生。
主要参考文献
Lv Z, Liu R, Su K, Gu Y, Fang L, Fan Y, Gao J, Ruan X, Feng X. Acupuncture ameliorates breast cancer-related fatigue by regulating the gut microbiota-gut-brain axis. Front Endocrinol (Lausanne). 2022 Aug 24;13:921119.
Wang, JH., Choi, Y., Lee, JS. et al. Clinical evidence of the link between gut microbiome and myalgic encephalomyelitis/chronic fatigue syndrome: a retrospective review. Eur J Med Res 29, 148 (2024).
Jurek JM, Castro-Marrero J. A Narrative Review on Gut Microbiome Disturbances and Microbial Preparations in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome: Implications for Long COVID. Nutrients. 2024 May 21;16(11):1545.
Zhou Y, Chu Z, Luo Y, Yang F, Cao F, Luo F, Lin Q. Dietary Polysaccharides Exert Anti-Fatigue Functions via the Gut-Muscle Axis: Advances and Prospectives. Foods. 2023 Aug 17;12(16):3083.
Tornero-Aguilera JF, Jimenez-Morcillo J, Rubio-Zarapuz A, Clemente-Suárez VJ. Central and Peripheral Fatigue in Physical Exercise Explained: A Narrative Review. Int J Environ Res Public Health. 2022 Mar 25;19(7):3909.
Guo C, Che X, Briese T, Ranjan A, Allicock O, Yates RA, Cheng A, March D, Hornig M, Komaroff AL, Levine S, Bateman L, Vernon SD, Klimas NG, Montoya JG, Peterson DL, Lipkin WI, Williams BL. Deficient butyrate-producing capacity in the gut microbiome is associated with bacterial network disturbances and fatigue symptoms in ME/CFS. Cell Host Microbe. 2023 Feb 8;31(2):288-304.e8.
Raizen DM, Mullington J, Anaclet C, Clarke G, Critchley H, Dantzer R, Davis R, Drew KL, Fessel J, Fuller PM, et al., Beyond the symptom: the biology of fatigue. Sleep. 2023 Sep 8;46(9):zsad069.
Du Preez S, Corbitt M, Cabanas H, Eaton N, Staines D, Marshall-Gradisnik S. A systematic review of enteric dysbiosis in chronic fatigue syndrome/myalgic encephalomyelitis. Syst Rev. 2018 Dec 20;7(1):241.
Boolani A, Gallivan KM, Ondrak KS, Christopher CJ, Castro HF, Campagna SR, Taylor CM, Luo M, Dowd SE, Smith ML, Byerley LO. Trait Energy and Fatigue May Be Connected to Gut Bacteria among Young Physically Active Adults: An Exploratory Study. Nutrients. 2022 Jan 21;14(3):466.
González-Mercado VJ, Pérez-Santiago J, Lyon D, Dilán-Pantojas I, Henderson W, McMillan S, Groer M, Kane B, Marrero S, Pedro E, Saligan LN. The Role of Gut Microbiome Perturbation in Fatigue Induced by Repeated Stress from Chemoradiotherapy: A Proof of Concept Study. Adv Med. 2020 Feb 7;2020:6375876.
Bourgonje, A.R., Hörstke, N.V., Fehringer, M. et al. Systemic antibody responses against gut microbiota flagellins implicate shared and divergent immune reactivity in Crohn’s disease and chronic fatigue syndrome. Microbiome 12, 141 (2024).
Ceban F, Ling S, Lui LMW, Lee Y, Gill H, Teopiz KM, Rodrigues NB, Subramaniapillai M, Di Vincenzo JD, Cao B, Lin K, Mansur RB, Ho RC, Rosenblat JD, Miskowiak KW, Vinberg M, Maletic V, McIntyre RS. Fatigue and cognitive impairment in Post-COVID-19 Syndrome: A systematic review and meta-analysis. Brain Behav Immun. 2022 Mar;101:93-135.
Hajjar J, Mendoza T, Zhang L, Fu S, Piha-Paul SA, Hong DS, Janku F, Karp DD, Ballhausen A, Gong J, Zarifa A, Peterson CB, Meric-Bernstam F, Jenq R, Naing A. Associations between the gut microbiome and fatigue in cancer patients. Sci Rep. 2021 Mar 12;11(1):5847.

谷禾健康

人们逐渐发现数以万亿计的共生微生物不仅占据人体各处,而且往往是人体健康生理不可或缺的参与者。这是自 19 世纪细菌理论首次彻底改变生物医学领域以来,生物医学领域最重大的进步之一。事实上,早在人类出现之前,我们可能就一直在与微生物一起进化和共同进化,我们必须将人类(以及大多数多细胞生命)重新设想为“全生物”,即超有机体,其进化轨迹只能根据宿主和微生物基因组赋予的复合表型来考虑。
人体是多种多样且功能重要的共生微生物群落的家园,这些微生物群落在不同的空间尺度上变化可预测,无论是在身体部位内还是跨身体部位。这些空间上不同的微生物群落的组成可能受到各种随机性和确定性因素的影响,包括来自不同来源群落的扩散,以及区域特定宿主过程对生理重要类群富集的选择。
尤其在过去十年中,科学家已经积累了大量证据,健康身体功能的许多方面都与我们携带的特定微生物组合及其各自的基因组或我们的“微生物组”密切相关。因此,了解哪些微生物出现在身体的哪个部位以及它们在做什么具有极其重要的临床意义。这一直是微生物组领域许多基础探索性工作的重点,特别是随着不依赖培养的细菌定量方法的出现,我们极大地扩展了我们对各种身体部位的微生物组组成、功能、稳定性和健康和疾病恢复力的认识。
本文我们将初步了解和认识有关健康人类胃肠道、皮肤、阴道和呼吸道微生物组的组成和功能的当前知识状态,特别是胃肠道内微生物的区域特异性,以及可能有助于每个栖息地群落聚集的生态过程。
微生物组研究已经从单纯的相关性调查发展到探讨微生物群落组装的机制,以期能够操纵这些过程,实现治疗目的。
微生物群落组装受宿主基因型、微生物间相互作用和环境因素(如饮食)的复杂动态影响。这些过程可以概括为四个基本过程:传播、选择、多样化和漂移。了解这些基本过程有助于更好地理解和操纵微生物群落的组装。(下图)
影响群落聚集的生态过程总结
★ 扩散
扩散是指微生物从一个局部栖息地迁入和移出到另一个局部栖息地(上图1A)。
想象一下,我们每个人的身体就像一个小岛。这个小岛上住着很多微生物。这些微生物可能来自周围的环境,比如其他人或者我们周围的空气、物品等。
我们体内能有哪些微生物,取决于两点:
举个例子,刚出生的婴儿体内最初的微生物,主要是从母亲身上或医院环境中”搬家”过来的。如果是顺产,婴儿会接触到母亲阴道里的微生物;如果是剖腹产,婴儿接触到的可能更多是手术室里的微生物。这就决定了婴儿一开始能获得哪些微生物。
★ 选择
适者生存,不适者淘汰
选择是一种确定性的进化力量,那些更适应环境的生物,能够很好地利用这里的资源(比如食物)的微生物,能活得更好,生更多的后代。而那些不太适应环境的生物,可能就会慢慢消失(上图1B)。
这些选择压力通常以“栖息地过滤器”或环境条件的形式出现(例如代谢资源的可用性、pH 值或粘附位点),限制哪些分类群能够在特定地点生存和生长。比如说,在一个特别酸的地方,只有能耐酸的微生物才能活下来。
有时候,微生物还要和其他微生物、我们身体的细胞,甚至是一些病毒竞争。
在微生物群落中,选择压力也可以通过与群落中的其他微生物、宿主细胞和噬菌体的相互作用来施加,从而改变可用的生态位空间。
即使一种细菌菌株理论上可以利用给定环境中的可用资源生存,但为了在该群落中生存,它必须能够胜过同样争夺这些有限资源的其他微生物。宿主细胞和噬菌体也可以对特定微生物的存在作出反应,并直接或通过改变环境来抑制或促进某些群体的发展。
★ 漂移
生态系统像一个随机彩票抽奖,持有彩票少的生物(丰度低的物种) 更容易在这个抽奖中“输光”
生态漂变是指由于出生率和死亡率的随机变化而导致物种丰富度的随机波动(上图1C)。从实际角度来说,这意味着低丰度物种更有可能从群落中灭绝,尤其是在受到干扰之后,即使它们可能比其他丰度较高的类群更适应该群落。在受到强烈干扰(如抗生素疗程)后,漂变在群落重组中可以发挥特别突出的作用。
★ 多样化
多样化是微生物不断地改写自己的
“生存说明书”,以适应不断变化的环境。
多样化描述了特定种群中新遗传变异的产生(上图 1D)可能通过突变、重组或细菌中常见的水平基因转移发生。
如果想象成一本书的话,“多样化” 就是不断地给这本书添加或修改内容:
值得注意的是,与较大规模的生物体相比,微生物的多样化发生的速度要快得多,因为微生物种群规模庞大、繁殖率高、突变率高。
最近的数据显示,常见的与人类相关的细菌,例如,脆弱拟杆菌,它能在一个人的一生中不断”改写”自己,更好地适应这个人的身体环境。
药物失效?可能和水平基因转移有关
当我们使用抗生素时,一些细菌可能会很快”学会”如何抵抗这种抗生素,这就是通过”复制”其他细菌的”抗生素抵抗“内容实现的。这就是为什么有时候药物会失效,因为细菌已经”学会”了如何对抗它们。
因此,多样化为群落中已经存在的细菌提供了一种适应不断变化的选择压力的方法。
在人体中,许多这些力量可能都在发挥作用。毕竟,不同的身体部位构成了截然不同的生态位。例如:
在每个部位,微生物还面临着来自宿主免疫系统的不同压力、暴露于外来微生物的程度以及资源可用性模式。
我的肠道微生物群与你的肠道的相似性,
比我的肠道与我的肘部的相似性更高
鉴于不同身体部位的环境差异,栖息地过滤和确定性选择过程在群落形成中发挥重要作用是合乎情理的,而且这在很大程度上得到了数据的支持。
人类微生物组计划的证据表明,人类微生物群在个体之间的相似性比在身体部位之间的相似性更高。也就是说,我的肠道微生物群与你的肠道的相似性比我的肠道与我的肘部的相似性更高,这表明肠道(或肘部)独有的选择过程以可预测的方式塑造了这些群落。
驱动因素是什么, 确定性力量 or 随机?
尤其是从生物医学和转化的角度来看,人们很容易认为选择等确定性力量是微生物组组成的主要驱动因素。
然而,微生物生态学家越来越多地致力于量化和解释更随机的过程(如扩散和漂移)在群落组装中的作用程度。
例如,寻求了解群落构成的微生物组研究人员必须考虑优先效应和历史偶然性,在这种情况下,群落可以通过在生命早期偶然接触有限的微生物子集而转向另一种稳定状态,然后占据和/或修改可用的生态位空间,影响后来到达的微生物的定殖能力。类似于“先到先得”,先到的微生物可能会占据最好的位置。
这凸显了这样一种可能性,即随机过程和确定性过程之间的反馈可能会放大群落构成的差异,从而使处于类似选择压力下的群落经历不同的组成轨迹。
这可能解释了健康个体体内微生物组成的一些显著差异。即使是健康的双胞胎,他们体内的微生物组成也可能很不一样。
就像是在玩桌游,游戏规则是固定的(环境的选择压力),但骰子的点数是随机的(微生物随机到达)。两个人玩相同的游戏,但因为骰子点数不同,最终结果可能大不相同。理解这一点对于研究人体微生物以及它们如何影响我们的健康非常重要。
胃肠道 (GIT) 非常与众不同,因为它要面对来自外界的大量挑战,还要在消化食物的同时做好防御。
每次我们吃东西,它都得识别并处理潜在的危险物质,同时把食物变成营养,便于吸收,还得向身体其他部位传递信息。
胃肠道不仅是消化的大本营,还有感觉、神经、内分泌和免疫系统,是丰富微生物群的家园。
整个胃肠道的生态相关空间梯度
编辑
沿着这个轴线,有几个关键的梯度:
微生物负荷和多样性从喙端到尾端增加,氧气水平降低,粘液厚度发生变化,pH 值在胃中下降,并从那里向远端增加(上图)。
胃肠道的每个部分(我们将其分为口腔、食道、胃、小肠和结肠),都有自己的消化、代谢、免疫和内分泌功能,导致营养吸收和微生物环境有区域性差异。
这些区别以显著且通常可预测的方式影响局部微生物组成,而这些局部不同的微生物群落所执行的功能随后可以反馈到局部宿主过程中,形成互惠互利的共生关系,或者在疾病状态下,“菌群失调”的微生物群可能导致宿主功能受损。
尽管人们付出了大量努力来描述健康个体的微生物组,但对“健康”肠道微生物组的具体定义却一直难以确定。部分原因是,即使是在健康个体的同一身体部位,也存在相当大的微生物多样性,特别是在更高的分类分辨率下(即属、种或菌株水平)。
其中一些变化可能归因于起作用的随机和确定性构成力的特殊组合。在这里,我们描述了“健康”区域胃肠道微生物群的一些组成和功能特征。
口腔:防御与消化的前线
口腔是胃肠道和呼吸道的入口,承担着多种功能性作用,是重要的呼吸管道,也是许多消化过程的起始点。这些作用包括咀嚼、润湿、酶分解的初始阶段,以及味觉和其他感官接收,这些作用在防御有毒或致病因子方面发挥着重要作用。
作为入侵病原体与胃肠道首次接触的机会,口腔还发挥着关键的免疫学作用。口腔反映了这种功能作用的多样性,拥有一系列解剖和功能适应性,这些适应性创造了丰富多样的空间独特栖息地,这些栖息地的相对可达性为高分辨率的口腔微生物群空间采样铺平了道路。
口腔微生物群
最近的研究估计,大约有 200-500 种独特的细菌栖息在口腔中,数量达到约 2000 万个单细胞。
从解剖学角度来看,口腔包含各种不同的栖息地和拓扑特征,包括嘴唇、牙齿、牙龈、舌头、脸颊、硬腭和软腭以及扁桃体。这些特征之间的第一个关键区别是它们是否有脱落或不脱落的表面:口腔中唯一不脱落的表面是牙釉质,而口腔黏膜的其余部分则被定期更新和脱落的复层鳞状上皮细胞覆盖。
不脱落的牙釉质是口腔中更持久的结构,可导致牙菌斑或细菌生物膜的积聚。这些多种类结构是微生物合作和连续群落组装的迷人例子:丝状的棒状杆菌(Corynebacterium)触须提供了一个支架,组织良好的分类群(如链球菌、嗜血杆菌/聚集杆菌、卟啉单胞菌、口腔拟杆菌和梭状芽胞杆菌)根据微米级生化梯度附着在“刺猬”结构上。牙龈上方和下方的菌斑——即分别称为龈上菌斑和龈下菌斑——也包含不同的微生物群落,部分原因是营养物质和免疫分子在牙龈和牙齿之间的缝隙中被捕获和积累。
牙龈线上方和下方的牙菌斑(即龈上牙菌斑和龈下牙菌斑)也含有不同的微生物群,部分原因是牙龈和牙齿之间的缝隙中捕获和积累了营养物质和免疫分子。
尽管龈上菌斑的主要成员在整个口腔中仍然很丰富,但这些群落中较少丰富的成员因牙齿类别(门牙与臼齿)和牙齿方面(颊侧或舌侧)而异。
唾液流动是口腔中的主要选择力量
当唾液从各种主要和次要唾液腺从口腔后部流向前部时,它会产生水分和 pH 值的生物物理梯度,同时也起到物理运送细菌、释放或清除部分消化食物中的代谢物并刺激粘蛋白分泌的作用。
这些梯度选择富集臼齿上的韦荣球菌等分类单元,以及门牙上的链球菌和放线菌。牙周炎和龋齿等微生物介导的疾病通常与唾液分泌不足有关,这表明在缺乏唾液流动和口腔内相关微环境梯度的情况下,菌群失调群落可能会聚集在一起。
与不脱落的牙釉质相比,口腔黏膜的软组织具有脱落的上皮细胞,这些细胞大约每两到三周更新一次。据推测,角化(硬腭、舌背、角化牙龈)和非角化(颊唇黏膜、舌腹、软腭)组织上的微生物群落会根据粘附机制和与唾液腺的接近程度的差异而变化。
口腔微生物与免疫系统相互作用
作为摄入食物的初始部位,口腔也会接触到许多病原体,而这个群落聚集的主要选择力量是免疫系统的持续基础激活。因此,鉴于可分散到口腔中的微生物种类繁多,定期监测和基础免疫活动(例如通过 IL-17 途径)负责过滤掉潜在的致病因子。
口腔微生物群的共生菌,如链球菌(Streptococcus)、韦荣球菌(Veillonella)、Granulicatella,已被证明有助于这些防御过程,刺激免疫效应物(如抗菌肽 (AMP) 和促炎细胞因子)的产生增加,并增加上皮屏障功能和粘膜厚度。
与口腔相比,食管的解剖结构和功能相对统一。食管两侧为上、下食管括约肌,主要负责将食物从口腔运送到胃中。食管表面覆盖着非角化的复层鳞状上皮细胞,表面覆盖着粘膜下腺分泌的粘液。
尽管大量微生物会随摄入的食物经过食管进入胃部,但这些微生物被认为大多是短暂的。食管中更稳定的常驻菌群附着在粘膜表面,只能通过侵入性上消化道内镜检查(刷检或活检)进行取样,这严重限制了对该身体部位的特征描述。尽管如此,少数研究发现,食管粘膜主要被从口腔摄入的微生物定植,表现出高度的组成重叠,且均来自相同的主要类群,包括链球菌、普氏菌和韦荣球菌。
与口腔不同,食管中明显缺乏螺旋体。这些模式与分散受限的群落装配相一致,其中定植在食管的微生物是口腔中存在的元群落的一个子集。
胃在胃肠道中发挥着重要的消化、防御和内分泌作用。到达胃中的摄入物质通过蠕动搅拌进行机械分解,通过盐酸进行化学降解,并通过胃蛋白酶原等酶原蛋白酶进行酶促分解,胃蛋白酶原在酸性胃环境中被激活。胃还通过各种机制感知和调节食物摄入、运动和食欲,包括拉伸机械感受器和产生胃泌素和生长素释放肽等激素。这些功能既影响胃微生物群,又受其影响。
胃微生物:极端环境中的生存挑战
这些条件对微生物来说非常恶劣。胃部的低 pH 值(~1.5 – 2.5)构成了一个相当极端的栖息地过滤器,除了作为抵御摄入病原体的防御机制外,还显著限制了能够在那里生存的共生微生物的多样性。
从历史上看,这让科学家认为胃是完全无菌的,直到发现幽门螺杆菌在患病个体的胃粘膜中旺盛生长,这种传染性嗜酸细菌会导致消化性溃疡。然而,最近,不依赖培养的技术表明,虽然胃中的总体细菌负荷相对较低(~10 1 – 10 3 CFU/ml),但有多种门类的代表,包括链球菌、普氏菌、韦荣球菌和罗氏菌。
胃微生物群落:口腔与肠道的交汇点
在胃中发现的菌群中,超过 65% 属于口腔菌群,不过其中许多是在胃液中发现的,被认为主要是暂时性的。
胃中的群落聚集可以理解为口腔和十二指肠的扩散与主要受 pH 值(主要栖息地过滤器)驱动的选择之间的平衡。有证据表明,胃中 pH 值较高与可能来自口腔和肠道来源群落的分类单元的过度生长相对应。
幽门螺杆菌:敌人 or 朋友
酸度水平会受到质子泵抑制剂等药物或甚至常驻微生物的影响:幽门螺杆菌,据记录在美国无症状成人中的患病率约为 50%,它可以降低胃酸度。通过将尿素分解为氨(一种中和胃酸的基本物质),幽门螺杆菌可以潜入胃粘膜,在那里刺激免疫反应,导致胃壁细胞萎缩,进一步减少酸的分泌。
随着胃酸减少,它变得更适合从口腔或十二指肠扩散的微生物,最终导致“菌群失调”疾病状态。
尽管幽门螺杆菌在现代社会中被普遍视为一种地方性病原体,但有人推测,在工业化之前,这种普遍存在的微生物所引发的促炎性 IL-17 反应对其他传染性病原体具有保护作用。此后,细菌理论诞生,卫生习惯不断发展,抗生素也得到了开发,导致此类传染性病原体的流行率下降,并使幽门螺杆菌的促炎作用与我们“干净”的环境格格不入。因此,幽门螺杆菌现在最常与消化性溃疡病和胃癌有关。
小肠是胃肠道中营养吸收的主要部位
它具有单层吸收性柱状肠上皮细胞 (IEC),其间散布着各种特殊细胞,包括杯状细胞、潘氏细胞、微皱襞细胞和肠内分泌细胞,有助于消化、防御和分泌。这些 IEC 的顶端表面最大化了吸收表面积,具有隐窝、绒毛和微绒毛,并被一层松散附着的粘液包裹,其中基本没有微生物。
与大肠相比,小肠的需氧量更高、酸性更强、分泌的抗菌分子水平更高,并且运输时间更短。
小肠微生物:快速生长,抵抗抗生素
在这些区域定殖的微生物不仅必须通过这些栖息地过滤器,还必须与其他细菌和宿主细胞竞争营养。
因此,一般来说,小肠中含有大量快速生长的兼性厌氧细菌,这些细菌可以利用碳水化合物作为能量来源,具有强大的 AMP 耐受机制,并且尽管胃肠道运动迅速,但仍可以粘附在粘液、饮食底物或上皮组织上。
小肠的防御系统
为了促进营养物质进入肠内消化道,小肠的黏液层比胃肠道其他区域的黏液层薄得多。因此,小肠面临着在厚的次级黏液层可以提供的防御屏障功能与有效消化和吸收肠腔中营养物质的能力之间的权衡。为了对抗这种情况,小肠具有特殊的免疫适应性,例如隐窝底部的潘氏细胞,它们会将大量的 AMP(如溶菌酶和 α-防御素)分泌到黏液层中,以及丰富的浆细胞,它们会将分泌性 IgA 释放到黏液中,从而抑制微生物定植。
小肠上皮覆盖在黏膜和黏膜下层中特殊的肠道相关淋巴组织 (GALT) 和派尔集合淋巴结上,这些组织在抗原呈递和适应性免疫系统的激活中发挥作用。由于这种广泛的免疫活动,一些肠道共生微生物已被证明拥有独特的抗原修饰,以逃避先天免疫机制。
小肠微生物的重要性
小肠微生物群在健康宿主生理学中的独特功能作用的研究是医学微生物组研究中一个经常被忽视但新兴的子领域。虽然这主要是因为与粪便取样相比,小肠部位相对难以接近,但最近在动物模型中的研究已开始确定小肠微生物群在宿主代谢和营养吸收中的重要作用。例如,与已充分表征的结肠微生物群一样,小鼠的小肠微生物群受到西式高脂肪 (HF) 饮食的显著影响,事实上在甘油三酯的消化和吸收中起着不可或缺的作用。
这项研究表明,小肠微生物对于胰腺脂肪酶在饮食脂质反应中的释放是必不可少的,从而间接帮助宿主脂质消化。此外,作者还表明,在西式高脂肪条件下大量繁殖的梭菌科等菌类释放的代谢物会与十二指肠和空肠的吸收性肠细胞相互作用,从而增强游离脂肪酸的吸收。
因此,随着宿主消耗更多的脂肪,微生物群会发生变化,使宿主能够吸收这些脂肪。这是宿主和微生物之间双向串扰的一个显著例子,这对于维持健康的宿主生理至关重要,尤其是在饮食变化等快速变化的条件下。
从胃部向外,小肠可分为三段,每段都具有不同的功能作用、解剖特征和微生物栖息环境:十二指肠、空肠和回肠。
十二指肠——食物加工的第一站
十二指肠是小肠的前 10-15 英寸,就像是一个工厂的第一个车间。它是分泌和消化活动的重要部位,杯状细胞的粘液保护肠上皮免受酸性胃食糜的侵蚀,胰腺的碳酸氢盐将 pH 值恢复到中性区,胆汁和胰酶流入以帮助分解和吸收碳水化合物、脂肪和蛋白质。
十二指肠的特殊设计
从解剖学上讲,十二指肠上皮具有隐窝和长绒毛,微绒毛“刷状缘”充满了用于分泌的消化酶和用于吸收的营养转运蛋白。从免疫学上讲,十二指肠具有粘膜下 GALT,尽管派尔集合淋巴结比空肠和回肠少。
十二指肠的“工作环境”:氧气足,食物通过快
这些特征以特定的方式影响十二指肠微生物群。
因此,细菌负荷相当低,在 101 -103 CFU/ml 范围内,并且往往以厚壁菌门、放线菌门和变形菌门的细菌为主,这些细菌含有许多兼性厌氧菌。
胆汁酸:分解脂肪,耐受性强的细菌才能生存
初级胆汁酸 (BA) 由肝脏中的胆固醇合成,通过胆管直接沉积到十二指肠中。这些两亲性分子充当清洁剂,通过乳化脂肪球帮助脂质吸收。然而,初级胆汁酸已被证明具有很强的杀菌活性,因此可作为整个小肠中胆汁耐受性更强的微生物的选择压力。
胆汁盐水解酶 (BSH) 是一种分解初级 BA 的酶,它们广泛存在于肠道微生物中。有人推测这些 BSH 酶可增强对初级 BA 的耐受性,这可能在初级 BA 最丰富的近端小肠中尤为重要。
细菌版的”无线充电”
关于细胞外电子转移 (EET) 的令人兴奋的新研究还表明,十二指肠和空肠中特别丰富的铁可能是肠道细菌的重要代谢资源,肠道细菌可以利用 EET 产生能量。与哺乳动物细胞内的氧化磷酸化类似,这些细菌可以利用铁等细胞外矿物质作为电子受体,产生电能和 ATP,并支持细菌在不可发酵碳源上的生长。最近,在多种致病和共生厚壁菌种的基因组中发现了 EET 通路直系同源物,这表明 EET 可能是近端小肠资源有限环境中的重要竞争性适应。
总的来说,十二指肠就像一个高效、复杂的工厂车间,它不仅要处理食物,还要平衡各种化学物质,同时为特殊的微生物提供生存环境。这个”车间”的独特设计和工作方式,使它成为消化系统中非常重要的一部分。
空肠:吸收营养,高效的分拣中心
空肠具有与十二指肠相同的许多功能和解剖学特征,但含氧量较低、pH 值为中性、绒毛较长、派尔集合淋巴结数量增加、运输时间较慢,营养成分也发生了改变,这取决于十二指肠中已经消化或吸收的物质。与十二指肠相比,空肠的消化功能较少,更擅长吸收,是碳水化合物、小肽、维生素和矿物质(如叶酸、钙、镁和其他微量元素)的主要吸收部位。
微生物数量比十二指肠多
由于人类空肠只能通过内窥镜检查,因此研究健康个体空肠微生物组成的研究很少。早期与小肠细菌过度生长综合征相关的研究表明,健康个体空肠的典型细菌负荷约为 10 3 – 10 5 CFU/ml。
随后的独立培养分析证实了这一估计,并表明空肠在组成上主要由多种兼性厌氧菌属组成,包括链球菌、普氏菌、韦荣球菌、罗氏菌和梭杆菌,以及大肠杆菌和克雷伯菌。
虽然尚未从同一个体同时采集粘膜和腔内空肠样本进行直接比较,但对粘膜和腔内空肠微生物群的独立研究已确定了相似的分类群和丰度。
总的来说,空肠就像一个专门负责吸收的高效车间。它的环境比十二指肠更适合微生物生存,但仍然保持着良好的秩序。同时也为特定类型的微生物提供了生存环境。
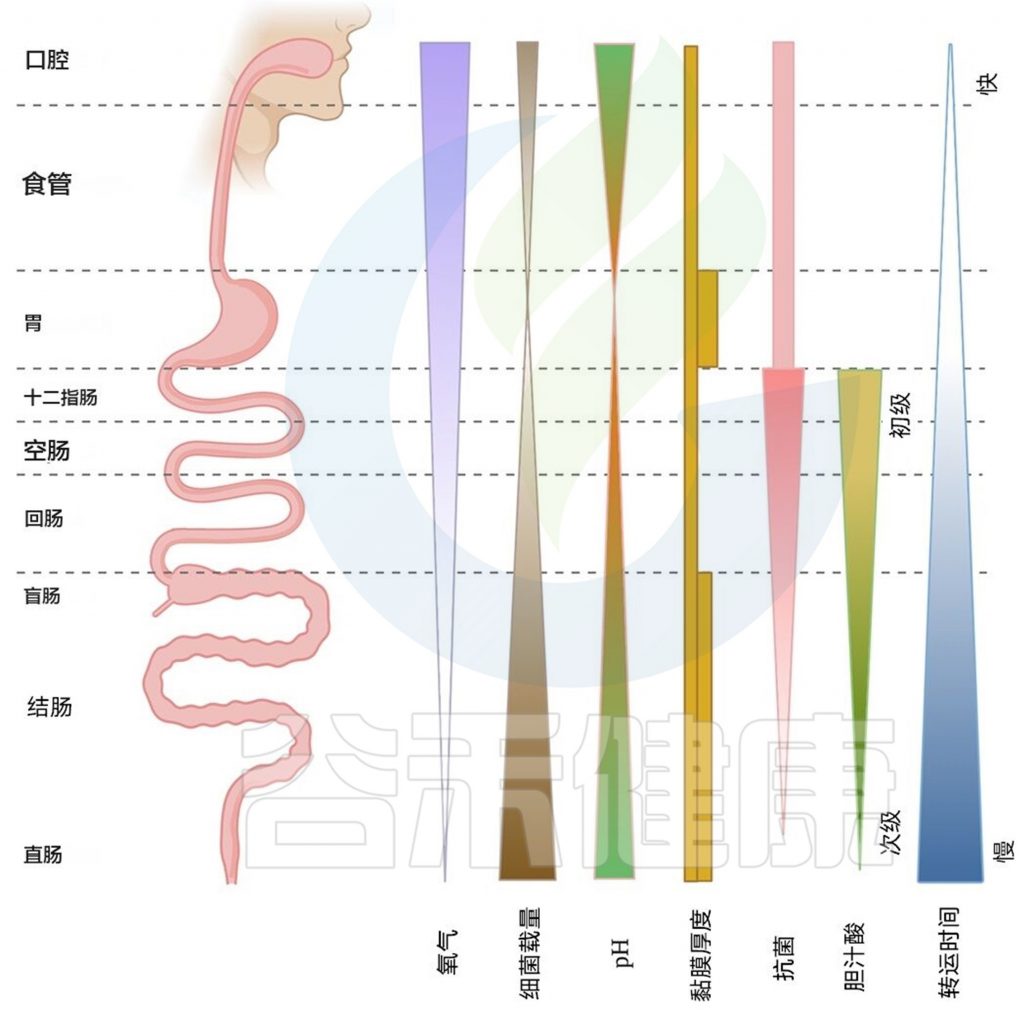
回肠:最后的营养吸收,食物通过慢,粘液保护层加强防护
回肠继续沿着同样更广阔的环境梯度:氧气水平较低、运输时间较慢、绒毛较短、较宽且消化酶较少。到达回肠的食糜已基本耗尽宿主可利用的营养物质,其主要吸收作用是吸收维生素 B12和再吸收胆汁酸。
虽然回肠中的派尔集合淋巴结稀疏,但其隐窝中有大量分泌 AMP 的潘氏细胞,以及数量相对较高的分泌粘液的杯状细胞,这些细胞会形成厚度不一的斑块状粘液层。
在这里,向远端移动,肠道环境开始接近结肠中微生物生长的最佳条件:由于宿主已经吸收了其能够利用的大部分营养物质,因此栖息在远端回肠中的微生物不再与宿主细胞竞争剩余的资源。此外,吸收能力和防御之间的权衡已大大缓解,因为营养吸收在回肠中不那么重要,因此被认为可以降低近端小肠微生物密度的免疫机制也放松了。
回肠微生物:数量大幅增加,厌氧菌
与空肠相比,微生物负荷增加了几个数量级,估计范围为 103 – 10 8 CFU/ml。
由于如果不进行侵入性操作就很难对回肠进行取样,因此对其组成的了解大多来自接受回肠造口术或根治性膀胱切除术的患者群体。需要注意的是,这类患者群体通常具有潜在的健康状况,可能会或可能不会影响回肠微生物群的组成,这些研究表明,回肠是兼性和专性厌氧菌的家园,包括链球菌属、颗粒菌属、放线菌属、索洛杆菌属、罗氏菌属、孪生菌属和TM7(G-1)属的分类单元。
这与结肠微生物群有显著不同,严格厌氧菌科如梭菌科、消化链球菌科或真细菌科的丰度较低,而兼性厌氧菌科如链球菌科和乳酸杆菌科的丰度较高,尽管这可能部分归因于回肠造口患者的氧张力差异。
尽管免疫释放被认为是回肠中细菌负荷高于小肠其他部分的原因之一,但粘膜免疫在塑造回肠微生物组成方面仍然发挥着关键作用,反之亦然。
回肠微生物的重要性:帮助刺激免疫系统
潘氏细胞大量产生抗菌肽,如抗菌肽、C 型凝集素和防御素,在上皮细胞和微生物栖息者之间形成防御边界。然而,这些免疫效应分子的产生和分泌依赖于共生微生物的刺激:无菌小鼠的抗菌肽水平降低,如革兰氏阳性靶向 REGIII-γ,在与特定病原体无小鼠的盲肠内容物常规化后恢复。
共生微生物的免疫刺激也可以在抵抗某些病原生物的定植中发挥重要作用。例如,缺乏节段丝状细菌(一种回肠末端特有的微生物)的小鼠无法发育出Th17 细胞,因此极易受到柠檬酸杆菌和鼠伤寒沙门氏菌等病原体的感染。
回肠与生物钟:自动化系统,影响睡眠、进食和新陈代谢
回肠和结肠微生物在维持宿主昼夜节律方面也发挥着重要作用。昼夜节律是指全身组织基因表达的周期性 24 小时振荡,其作用是协调稳态功能,包括睡眠-觉醒周期、摄食行为以及葡萄糖和脂质代谢。
通过对各种分解代谢和合成代谢过程进行时间划分,昼夜节律能够减少身体资源利用效率低下,而这些节律的失调与糖尿病和肥胖症等慢性代谢疾病有关。
虽然中央昼夜节律时钟位于大脑的视交叉上核,主要受光刺激的影响,但肠道等外周组织中的振荡动力学也可以受摄食行为和微生物刺激的影响。
研究表明,在小肠中,Nfil3的节律性、昼夜节律性表达受肠道微生物群的调节,而抗生素引起的Nfil3节律性丧失与体重增加和脂肪储存有关。
总的来说,回肠就像一个复杂的、多功能的收尾车间。它不仅负责最后的营养吸收,还为大肠做准备,同时还是大量微生物的家园。这些微生物不仅帮助消化,还参与调节免疫系统和身体的生物钟。
结肠:巨大的发酵罐,数以万亿计的微生物
结肠是人体中微生物种类最丰富的场所,其微生物数量比身体其他部位加起来要多几个数量级,细菌密度为 1010 – 1012 CFU/ml。这是由该区域独有的解剖和功能特点所促成的。
厚厚的粘液层,高度厌氧,分解无法消化的纤维
与小肠一样,结肠具有单层极化的柱状肠上皮细胞,具有类似凹陷的隐窝,但与小肠不同的是,结肠上皮缺乏绒毛和微绒毛。结肠上皮中的杯状细胞分泌出厚厚的双层粘液层,内层致密且基本无菌,外层疏松且含有大量特殊微生物。
结肠是高度厌氧的,通过的消化物主要由宿主过程无法消化的复杂多糖和纤维以及微量营养素和回肠中未吸收的任何剩余胆汁酸组成。结肠中的运动要慢得多,通常运输时间长达 30 小时。
为什么微生物能在结肠大量繁衍?
首先,发酵代谢在细菌中广泛存在,大肠中的厌氧环境和丰富的纤维基质为这一过程创造了最佳条件。
其次,通过结肠的缓慢运输时间使微生物有足够的时间在物理空间中粘附、消耗、繁殖和扩张。因此,由于它们没有定期通过系统,结肠中的微生物可以积累到更高的水平。
第三,结肠提供了许多空间上不同的生态位,可以支持不同的微生物群落,从结肠隐窝到外粘液层,再到管腔和中央管腔的褶皱间区域。这种空间异质性允许对有限资源进行生态位划分,从而增加了可以支持的总体多样性水平。
最后,作为长期共同进化的共生体,结肠中的微生物已经发展出独特的免疫逃避和调节适应机制,以避免被宿主防御机制主动从肠道中清除。
微生物代谢产物——短链脂肪酸
微生物通过复杂多糖的发酵代谢合成短链脂肪酸 (SCFA) 是肠道微生物群的典型互利功能:这也许是第一个被发现完全依赖于肠道微生物“器官”的主要生理功能。在这个分解代谢过程中,纤维素、果胶、菊粉、高直链淀粉等纤维底物或宿主衍生的粘膜聚糖,被厚壁菌门和拟杆菌门的微生物共生菌厌氧发酵,释放出乙酸盐、丙酸盐和丁酸盐等 SCFA。
这些 SCFA 被宿主组织回收,估计占人类总热量需求的 5-15%。虽然所有这些 SCFA 都可以进入各种宿主和微生物代谢途径。
丁酸盐尤其是结肠细胞的首选能量来源
这些细胞将丁酸氧化成二氧化碳,从而消耗结肠中的氧气供应,并促进厌氧状态,这对于抗病原体、免疫稳态,当然还有产生丁酸的厌氧微生物种群的生长都很重要,这是一个典型的正反馈回路。
饮食对微生物的影响
宿主所摄入的饮食成分会显著影响结肠中的微生物组成,进而影响发酵和代谢。一项早期研究调查了在指定时间内从动物饮食转换为植物饮食的人类受试者,结果表明,微生物组成会随着饮食成分的变化而迅速且可逆地发生变化。
其他研究广泛记录了高脂和低脂饮食对粪便微生物群落的深远影响,高脂饮食使群落向厚壁菌门与拟杆菌门的比例转变。在稍高的营养分辨率下,最近的研究表明,施用特定的复合多糖可以促进特定拟杆菌种群的生长。
虽然结肠腔内的资源可用性因饮食摄入量而异,但许多结肠微生物都寄居在粘膜中并以宿主衍生的成分为食,而这些成分在不同的饮食行为模式下可能保持得更稳定。
结肠不同的”社区”:腔内生态位
构成结肠粘液大部分的糖蛋白粘蛋白 2 (MUC2) 被各种各样的 O-连接聚糖、寡糖所包裹,这些寡糖可以从 MUC2 上裂解并代谢以支持各种特殊微生物类群(如 Akkermansia muciniphila)的生长。
不同微生物在穿透和粘附粘液层的能力上有所不同,以及它们对从下层上皮细胞通过粘液向外扩散的 AMP 和氧气的耐受性方面也有所不同。
结肠不同的”社区”:粘膜生态位
与结肠中的腔内生态位相比,粘膜生态位经历了独特的选择压力,它支持来自放线菌门和变形菌门的耐氧、不进行糖分解的蛋白质代谢物种的富集。
在粘膜内,研究人员也记录了进一步的空间生态位划分。例如,不动杆菌属(Acinetobacter)物种特别擅长穿过粘液层及其相关的生化梯度,直接与结肠隐窝的 IEC 结合。
结肠不同的”社区”:褶间区域
与粘膜一样,管腔本身也具有显著的空间异质性,在大多数结肠微生物组研究中,由于使用粪便取样,因此忽略了这一点。小鼠的证据表明,结肠壁的特征性粘膜褶皱在肠腔内形成了不同的“褶间”区域,这些区域富含毛螺菌科和瘤胃球菌科的分类群。这些分类群被认为既受益于上皮粘液的局部积累,也受益于相对不受其他管腔内容物流动影响的环境。
结肠不同的”社区”:中央管腔
相比之下,中央管腔的消化物主要由来自拟杆菌科、肠球菌科(Enterococcaceae)、普氏菌科(Prevotellaceae) 、文肯菌科(Rikenellaceae)
从近端到远端,结肠中的微生物表现出局部特化功能,似乎广泛反映了资源的可用性。由于进入结肠的食糜具有较高浓度的复合多糖和胆汁酸,因此发酵和胆汁酸代谢主要位于盲肠和近端结肠。
胆汁酸代谢广泛影响结肠中的微生物组成
未被回肠吸收的初级胆汁酸进入盲肠和结肠,在那里,它们可以通过共生微生物中广泛存在的 BSH 酶进行去结合,和/或通过具有 7-α-脱羟酶的梭菌类(Clostridia)中的特定细菌物种转化为次级胆汁酸。
胆汁酸杀菌
胆汁酸对许多分类群具有杀菌作用,因此去结合和转化过程可以作为微生物群落成员的防御措施。次级胆汁酸通常对合成它们的细菌无害,但仍会对其他微生物分类群产生毒性作用。
一些细菌能把胆汁酸转化为对自己有利的形式
因此,在初级胆汁酸浓度较高的条件下,如在近端结肠中,我们预计将初级胆汁酸转化为次级胆汁酸的能力将带来物种特异性的生长优势。这一预测得到了文献的支持。一项针对大鼠的研究表明,胆汁酸库的大小可以对结肠微生物群落施加极强的选择压力:接受膳食胆汁酸补充剂的啮齿动物表现出微生物组成显著的门级变化,尤其有利于能够将初级胆汁酸转化为次级胆汁酸的梭菌种。
由于高脂饮食会诱导产生更多的胆汁盐以促进脂质吸收,这些胆汁盐反过来又会影响结肠微生物群。
胆汁酸与微生物的双向作用
胆汁酸池的组成和大小既影响整个结肠的微生物代谢,又受其影响,同样对宿主的健康和代谢有重大影响。例如,微生物 BSH 酶作用产生的去结合胆汁酸会破坏胶束形成,抑制胆固醇和其他脂质通过肠膜的吸收,这对心血管疾病有影响。
共生微生物产生的次级胆汁酸可以激活核受体,如法呢醇 X 受体 (FXR) 和 G 蛋白偶联受体,如 TGR5,在宿主组织之间进行通讯,调节初级胆汁酸的合成和降解、葡萄糖和脂质代谢以及能量稳态。最后,微生物合成的胆汁酸作为炎症疾病介质的作用正受到越来越多的研究。
炎症与微生物
宿主的炎症状态本身在结肠微生物群的组成和功能中起着重要作用,反映了免疫系统和胃肠道这个密集区域中的微生物群之间微妙的稳态平衡。在健康肠道中定植的微生物已经进化出多种机制来避免引发免疫反应。例如,许多共生菌株,特别是拟杆菌属的菌株,已经进化出一种对其外膜脂多糖 (LPS) 的修饰,使其对宿主衍生的 AMP 不可见。
其他共生类群已经进化出更明确的免疫调节策略。例如,脆弱拟杆菌多糖荚膜的一种成分可刺激调节性T细胞产生免疫抑制性白细胞介素10,从而使脆弱拟杆菌能够定植于粘膜微环境。虽然尚不清楚菌群失调是否会引发病理性免疫反应或反之亦然,但许多研究已证实,在炎症条件下,微生物组组成截然不同,其主要特征是厚壁菌门和拟杆菌门的含量减少,放线菌门和变形菌门的丰度增加。
皮肤是一个完全外在的巨大器官,其相关微生物群可能会暴露于任何身体部位最易变的条件。微生物可以从宿主遇到的任何源群落到达皮肤,扩散限制非常低,尽管皮肤在区域和局部尺度上表现出不同的生物地理学,但这些部位的条件往往因环境条件和宿主行为而异。
一般来说,皮肤是干燥、凉爽、有氧和酸性的
尽管在区域结构和褶皱中,这些物理化学参数以及微尺度拓扑结构的密度存在差异。某些区域,例如腋窝,往往更温暖、更潮湿,汗腺和毛囊密集。然而,即使是这个口袋也会受到时间和行为变化的影响——在炎热天气锻炼的人的腋窝环境与在寒冷天气坐着的人不同。
虽然毛囊或汗腺等微尺度拓扑特征往往可以充当更一致的栖息地过滤器,但即使是这些地点也会由于宿主不同的美容和卫生行为而频繁受到干扰。
因此,皮肤成为具有以下特征的场所:
这些标准是生态学文献中被最广泛引用的维持多样性的机制。这些特征为扩散和漂移等随机过程与皮肤的不同选择压力相互作用铺平了道路,从而在个体之间产生了各种可能的群落结果。
事实上,人类微生物组计划的数据表明,尽管胃肠道表现出可比的 alpha 多样性或站点内多样性,但皮肤在所有身体部位中具有最高的 beta 多样性,这意味着它在人与人之间变化最大。
此外,对皮肤微生物组的纵向跟踪表明,它也是时间上最不稳定的身体部位,随着时间的推移,个体内差异很大。
从结构上看,皮肤由脱落的层状角质化鳞状上皮细胞组成,其间散布着毛囊、毛孔和皮脂腺等结构。估计有 1011 个微生物细胞覆盖表皮表面,深入毛孔、腺体和毛囊。
这些结构不仅是物理空间异质性的重要来源,而且它们的生理功能会导致皮肤局部水分、酸度和盐度不均匀,从而形成独特的、通常具有选择性的生态位(下图) 。
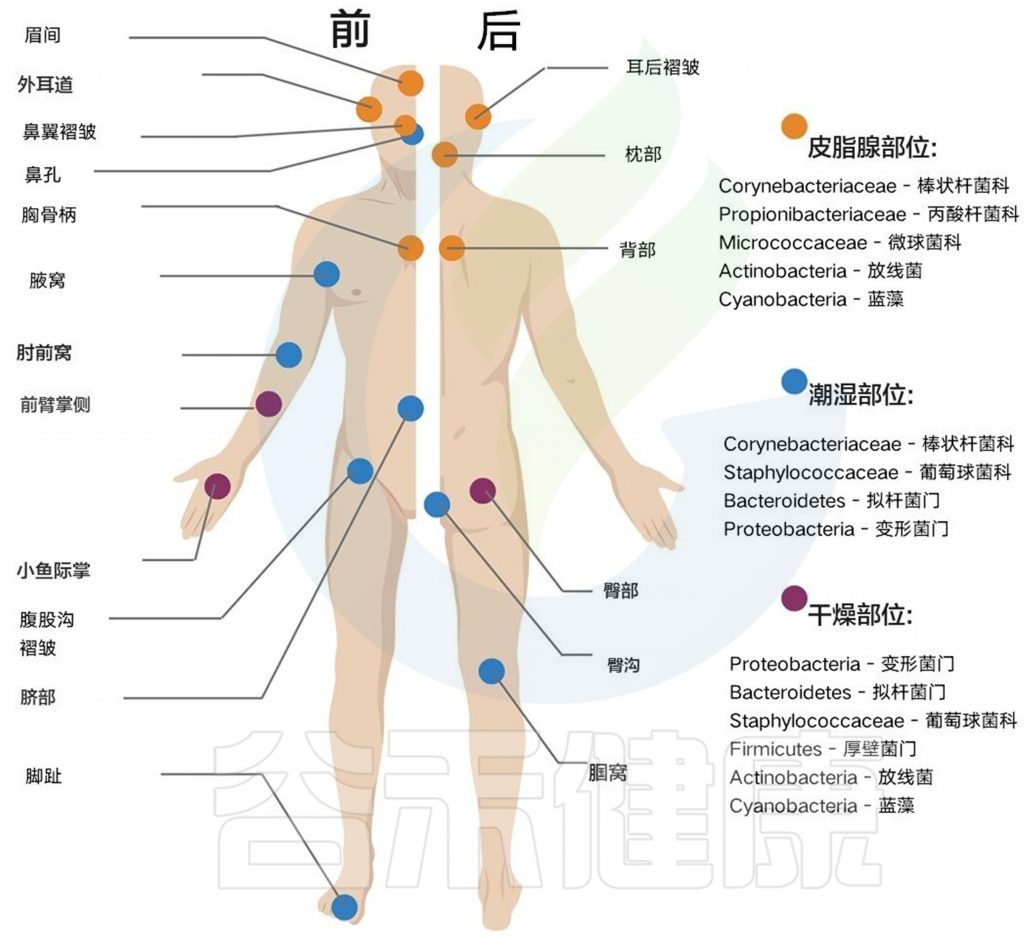
例如,顶泌汗腺会吸引棒状杆菌属(Corynebacteria)。在肾上腺素的作用下,这些腺体释放无味的类固醇、酸和其他挥发性分泌物,这些物质被棒状杆菌消耗并代谢成汗液特有的恶臭化合物。
皮脂腺与毛囊相连,会分泌一种富含脂质的物质——皮脂,以保护和润滑皮肤,皮脂腺对特定细菌也具有高度选择性。
皮脂腺密集区:吸引喜欢油脂的微生物
面部、胸部和背部等皮脂腺密集的皮肤区域与其他皮肤部位相比,其 β 多样性最低,并且不同个体的细菌类群始终相同。
这些腺体会招募亲脂性物种,如痤疮丙酸杆菌(Propionibacterium acnes),它会消耗和降解构成皮脂的脂质。这会释放出游离脂肪酸作为副产品,促进皮肤基线酸化,而皮肤是抵御病原体的主要屏障。皮脂腺部位也是真菌共生菌的家园,例如另一种亲脂性微生物马拉色菌(Malassezia)。

皮肤折叠区域:吸引大量喜湿细菌
此类拓扑结构的密度以及不同皮肤区域的更广泛解剖结构会影响这些位置的生理和环境。例如,温度和湿度在不同的解剖结构中存在巨大差异。较少暴露的皮肤折叠区域(如腋窝、腹股沟皱褶、臀皱或脐)往往比其他暴露的皮肤区域更温暖、更潮湿,因此会招募大量喜湿细菌,如棒状杆菌(Corynebacteria)和葡萄球菌。
较干燥、较暴露的部位(如四肢)会比身体其他部位经历更大的温度波动和更频繁的扰动,这可能是导致这些区域的细菌生物量相对较低的原因。尽管如此,这些暴露区域是人体中最具多样性的部位之一,代表了放线菌门、变形菌门、厚壁菌门和拟杆菌门。
从功能上看,皮肤微生物群对健康生理的完整性似乎不如其他身体部位的微生物群。大多数皮肤共生菌被认为是共生的,只有相对较少的专性互利共生的例子,即宿主依赖其微生物来实现特定功能。这在像皮肤这样多变的环境中可能并不奇怪——选择压力不一致,因此选择不能以定向的方式起作用。
尽管如此,有新证据表明皮肤微生物群在刺激和教育宿主免疫系统方面发挥着作用:分泌 AMP,如抗菌肽和 β-防御素,以及产生补体,都是由共生菌刺激宿主先天免疫受体引起的。
此外,在小鼠中,最近的证据表明皮肤共生菌可以通过改变 IL-1 产生的能力来调整和调节适应性免疫反应。最后,表皮葡萄球菌(S.epidermidis)等共生微生物已证实能够直接抑制金黄色葡萄球菌和 A 组链球菌(A Streptococcus)等致病菌的生长。
阴道微生物群是人体中多样性最低的部位之一,并且与宿主呈现出最紧密、最一致的互利共生关系。虽然阴道微生物物种会消耗宿主脱落的细胞和分泌物中的物质,但宿主被认为受益于阴道微生物可能发挥的保护作用,防止各种病原体的定植,包括那些可能导致酵母菌感染、性传播感染和尿路感染的病原体。
宿主与特定微生物类群之间的紧密联系以及机制上易于理解的互利共生表明,阴道微生物群可能是宿主-微生物共同进化的一个特殊例子。
阴道上皮由分层的、充满糖原的、非角化的鳞状细胞组成,这些细胞会迅速脱落,最上层大约每四小时更新一次。
厌氧、酸性、乳杆菌为主
它在育龄女性中主要是厌氧的,而且酸性相当强(pH 值 3.5 – 4.5)。虽然阴道上皮细胞可以产生乳酸,但大量证据表明,互利共生细菌(主要是乳酸杆菌)是这种酸性的主要来源,它们通过厌氧发酵过程将脱落上皮细胞中的糖原储存转化为乳酸。
在大多数健康育龄妇女中,该生态系统以乳酸杆菌为主导。从历史上看,大量乳酸杆菌和随之而来的酸性 pH 值被认为是“健康”阴道微生物群的标志,而 pH 值较高且更加多样化的微生物群与早产、细菌性阴道病 (BV) 等“菌群失调”情况以及加德纳菌或滴虫等阴道病原体的存在有关。
然而,在不同人口群体中进行的更广泛的不依赖培养的抽样显示,大约 20%-30% 的健康女性拥有更加多样化、非乳酸杆菌主导的微生物群,这再次混淆了我们对该生态系统中“健康”的确切定义的理解。
健康女性的五种阴道菌群状态类型(CST)
这项研究在健康女性中发现了五种不同的“群落状态类型”(CST),其中四种类型分别由不同种类的乳酸杆菌(L.crispatus、L.gasseri、L.jensenii、L.iners)主导,第五种(CST – IV)由多种兼性和严格厌氧菌群主导,包括来自Atopobium、棒状杆菌、厌氧球菌、Peptoniphilus、普氏菌和加德纳菌属的微生物。

从人口统计学上看,黑人和西班牙裔女性更有可能患上 CST-IV 群落,而白人和亚洲女性更有可能患上其他任何类型的群落。
阴道菌群五种分类详见我们之前的文章:
人们认为,阴道天然微生物群通过多种机制对阴道抵抗病原体具有重大贡献。
乳酸产生,降低pH值,增强保护
首先,常驻乳酸杆菌会产生大量乳酸,而宿主细胞和其他微生物栖息者会产生较少的乳酸,这种乳酸对许多入侵病原体来说是不适宜的,或者直接具有抑制作用,包括性传播病原体,如沙眼衣原体、淋病奈瑟菌(Neisseria gonorrhoeae)和 HIV。
不同乳酸杆菌种会产生不同数量和异构体的乳酸,从而不同程度地降低阴道 PH 值,从而降低其保护能力。
免疫调节
其次,乳酸已被证明具有保护性的免疫调节特性。尽管促炎环境与 BV 和 STI 的获得有关,但 Hearps等人的研究发现。
已经证明乳酸可以诱导抗炎细胞因子 IL-1RA 的产生,并抑制促炎细胞因子 IL-6 和 IL-8 的产生。
抗菌物质
第三,阴道乳酸杆菌可以产生抗菌细菌素,专门针对克雷伯氏菌、加德纳氏菌、大肠杆菌和粪肠球菌等病原体。
竞争排斥
最后,有人假设天然阴道微生物有助于通过竞争性排斥部分防止病原体定植:天然阴道微生物群更适应阴道环境,可以更有效地提取那里的有限资源,防止潜在入侵者生长和建立。
为什么某些健康女性的阴道菌群以乳酸杆菌为主导,而其他女性却没有,以及在有乳酸杆菌的女性中,为什么不同的乳酸杆菌种类会占主导地位,这是一个悬而未决的问题。
在胃肠道中,我们很容易推测选择压力和栖息地过滤器会影响群落的形成,但在阴道中尚未发现明确的栖息地过滤器。
许多人假设乳酸杆菌是因为它们具有代谢糖原衍生资源的能力而被选择,但这仍然无法解释为什么其他糖原代谢细菌在这些群落中并不更突出,或者为什么在已知的 130 多种乳酸杆菌中,只有 4 种在 70-80% 健康女性的阴道菌群中占主导地位。
旨在识别这四种乳酸杆菌特有的栖息地相关性状的功能基因组学研究未能成功。
关于单菌株优势的一种推测性解释可能是,优先效应使得单一、早期到达的乳酸杆菌种群得以建立,从而赋予其空间和数量的生长优势,限制了后来到达的种群的竞争能力,但这种可能性需要实验研究。
慢性干扰
鉴于生殖生理的周期性,阴道的生理学与其他身体部位相比具有独特的时间依赖性:激素水平随规律的月经周期而波动,怀孕会导致一系列剧烈的解剖和功能变化,这些变化随着时间的推移有序地展开。
急性干扰
除了这些对阴道微生物群的长期慢性干扰外,阴道还经常因性行为、使用避孕药、润滑剂和月经产品以及其他行为习惯而受到更剧烈的干扰。鉴于该群落慢性和急性干扰的规律性,阴道微生物群是否稳定或有多稳定一直是一个至关重要的问题。
集“稳定”与“弹性”于一身
有趣的是,健康的阴道既非常稳定,又具有很强的弹性。阴道群落的急性行为干扰以及每月规律的月经周期似乎只会引起微生物群落成员的轻微变化,大多数群落最终会恢复到其基线组成状态。
类似地,对整个妊娠期阴道微生物群的纵向研究表明,尽管 CST-IV 在孕妇中的代表性降低,表明妊娠导致乳酸杆菌占主导地位,但在整个妊娠过程中,阴道微生物群落与非孕妇相比保持异常稳定。
根据 Dickson等人提出的模型,上呼吸道 (URT),尤其是口腔,构成微生物源群落,微生物从该群落扩散到下呼吸道 (LRT)。因此,LRT 每个局部栖息地中存在的微生物是 URT 源群落中存在的微生物的一个子集。LRT 内较深的地点面临的扩散限制更大,因为它们在物理上距离源群落较远,因此多样性随着与 URT 距离的增加而减少。
适应健康肺微生物组组装的岛屿理论
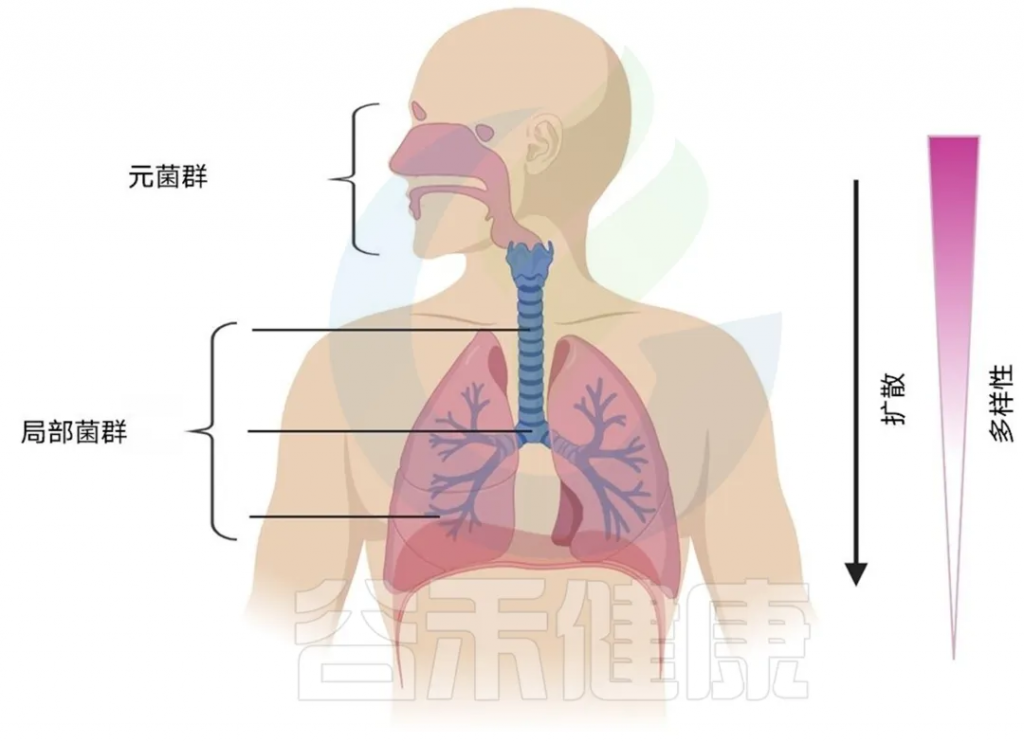
疾病状态的肺部
有趣的是,随着患者从健康转变为疾病,中性和选择性过程的相对重要性似乎发生了变化:患有晚期肺病(如囊性纤维化或慢性阻塞性肺病)的患者的肺部表现出微生物群落结构明显的空间异质性,而健康人则没有这种现象。
这可能是由于在局部加剧的疾病条件下茁壮成长的本地或入侵微生物的增殖,或者由于现有微生物对这种局部条件的敏感性增加,并因此而灭绝。
为什么某些微生物在疾病状态下会突然增多?
通常,呼吸道损伤和炎症会导致温度升高和粘液产生增加,进而形成厌氧袋,可支持特定群落成员或病原体的生长。
局部严重的疾病可能会在不同地区造成这样的条件,从而使这些新的栖息地过滤器塑造那里的群落组成。
从历史上看,尽管众所周知上呼吸道(URT)藏有大量细菌,但人们认为下呼吸道(LRT)是无菌的,除非处于活动性疾病状态。
随着不依赖培养的测序技术的出现,这种误解已被纠正,我们现在知道实际上存在一个生物量低但相当健康的 LRT 微生物组。呼吸道微生物组的特征及其随时间和疾病状态的动态是一个新兴领域,这可能带来未来肺部疾病治疗方法的重大变革,比如开发针对特定微生物群落的靶向治疗,或者使用益生菌来恢复健康的微生物平衡。
上鼻腔由鼻孔、鼻腔和口腔、咽部和上喉部组成。有关口腔微生物群的描述,请参阅上文的胃肠道部分。
虽然咽喉的微生物群通常反映了口腔的微生物群,但鼻孔和鼻腔却拥有一组独特的微生物。
鼻孔(鼻前庭):类似皮肤、较凉爽、干燥、
棒状杆菌、葡萄球菌、丙酸杆菌
从解剖学上讲,鼻孔比鼻粘膜的其他部分具有更多类似皮肤的特征,包括角化、分层鳞状上皮细胞、汗腺和皮脂腺,以及毛囊,粗糙的特殊毛发(称为触须)从毛囊中长出。虽然空气在通过鼻腔时会变湿变暖,但进入鼻前庭的空气处于环境温度,因此这个栖息地比鼻腔的其他部分更凉爽、更干燥。栖息在鼻前庭的微生物群落高度反映了皮肤群落,以丰富的棒状杆菌(Corynebacteria)、葡萄球菌(Staphylococcus)和丙酸杆菌(Propionibacteria) 为特征。
鼻粘膜:鼻腔深处、更温暖湿润、清除颗粒物
放线菌、变形菌比例较高(与鼻孔的主要区别)
鼻粘膜位于鼻腔深处,具有几个重要的解剖学和生理学特征,使其与鼻前庭和口腔区分开来。与鼻前庭相比,鼻粘膜更温暖、更湿润。上皮从角化的复层鳞状细胞转变为假复层纤毛柱状细胞,并被一层流动的粘液覆盖。纤毛与粘液一起在整个呼吸道中进行上下向外的清扫运动,以清除颗粒物。这个区域主要由放线菌组成,包括棒状杆菌和丙酸杆菌,就像在前鼻孔中一样,但变形菌种类的代表性更高。这表明,鼻腔可能由从鼻前庭分散出来的微生物播种,但具有独特的栖息地过滤器,可以选择这些微生物的独特子集。
下呼吸道的结构与功能
下呼吸道 (LRT) 由气管、支气管、细支气管、肺泡组成。这些环境通常营养不良且需氧,尽管从近端到远端会发生许多重要的解剖和生理转变。
从鼻腔到细支气管,这些组织中的大多数构成呼吸道的“传导”部分,负责将空气带入肺部并清除所有其他颗粒物,而肺泡构成“呼吸”部分,负责气体交换。这些区域的上皮在很大程度上反映了这些不同的生理作用。
气管和支气管与鼻腔一样,具有纤毛假复层柱状上皮。在细支气管处,这种上皮转变为单层柱状细胞,然后扁平化为立方形上皮,最终发展为肺泡中薄薄的鳞状细胞内层。各种分泌细胞散布在整个下呼吸道中,释放粘液,粘液覆盖上皮表面并捕获分泌的抗菌肽和免疫调节分子。
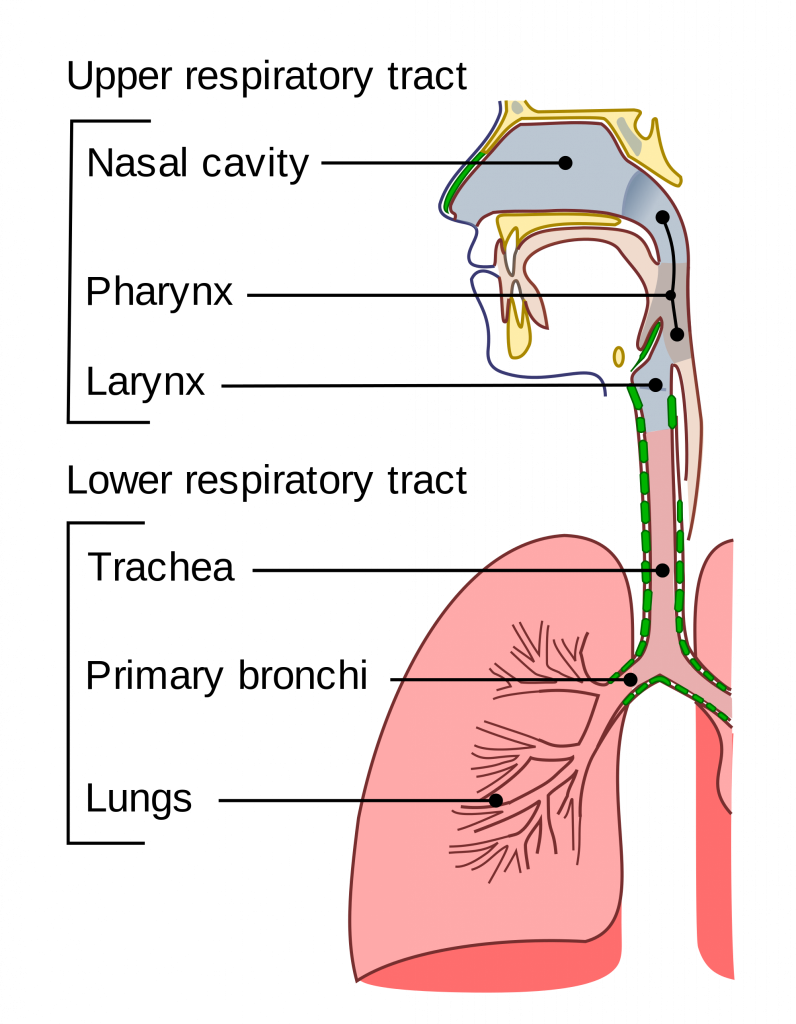
气道粘液在下呼吸道的近端区域最厚,向远端细支气管变薄,最终被肺泡中的表面活性剂取代。从近端到远端,下呼吸道还具有氧气张力、pH、温度和吸入颗粒密度的梯度。
采样技术与局限性
虽然这种空间异质性很可能导致整个下呼吸道中微生物组成的局部差异,但在人类中,目前的采样技术不具备研究这种可能性的空间分辨率。
下呼吸道微生物组的样本通常通过称为支气管肺泡灌洗(BAL)的过程收集,在此过程中,将支气管镜插入细支气管,并引入无菌盐水,然后重新收集被冲洗到其中的任何微生物群落成员。
上皮粘液不同层中的微生物,或可能出现在肺泡而不是细支气管中的微生物,都混合成单一的均质溶液,阻碍了跨微生境检测不同群落。
不同肺叶微生物群落有相似性,个体差异大于位置差异
然而,在更广阔的空间尺度上,从不同肺叶收集的 BAL 数据似乎表明,尽管在同一区域范围内观察到环境梯度,但微生物群落几乎难以区分。
对来自舌叶、右中叶、左上叶和右上叶以及气管上腔的样本进行测序分析,发现均存在大量耐氧普雷沃氏菌、韦荣球菌、链球菌。
每个个体的下呼吸道位置的样本与同一个体的 URT 源群落的相似性高于其他个体的同一下呼吸道位置的样本,这可能反映了下呼吸道群落组装的独特、基于个体的元群落。这些结果表明,栖息地过滤器在肺群落组装中发挥的作用可能不如中性的、基于分散的过程那么重要。
鉴于这些发现,有人提出了一种肺内微生物群落获得模型,该模型改编自岛屿生物地理学理论,这是一种经典的生态模型(上图)。
在这个模型中,肺的多样性是来自元群落物种库 (URT) 的随机移民与灭绝事件之间的平衡。一个地点离源群落越近,移民率就越高,该地点维持的多样性就越高。
微生物从元群落到达肺部的迁移过程
在这个模型下,当来自 URT 的微生物物理迁移到口咽部、被吸入气溶胶颗粒物或在睡眠期间被微吸入时,就会发生向 LRT 的移民。
灭绝事件如何影响肺部微生物的多样性
灭绝事件是由于咳嗽、粘液纤毛清扫和免疫清除等各种力量而发生的。由于不同地点的群落来自同一个元群落池,因此地点之间会存在显著的重叠——每个本地群落理论上都应该是同一源群落的一个子集——但预计物种丰富度会随着与源群落的距离而降低。
注:灭绝可能因为资源不足、环境变化,或者被岛上的”本地居民”(免疫系统)驱逐。
虽然 LRT 微生物组的高分辨率空间数据对于测试和改进这一假设非常有价值,但物种丰富度会随着与源群落的距离而降低。发现物种丰富度确实随着每个采样点与 URT 之间的距离而降低,支持了这一预期。
人体拥有如此多的特殊功能,因此在不同的解剖和功能部位拥有多样化、特殊的微生物群落是再合适不过的了。人类相关的微生物群落可以通过多种不同的过程形成,如扩散、选择和漂移,这些过程可以以不同的程度影响不同身体部位的组装和组成。
近年来,微生物组研究领域取得了显著进展。在菌群检测方面,无创采样技术的进步大大降低了研究的难度和患者的不适。高通量测序技术的不断进步,结合人工智能辅助的数据分析方法,使我们能够更快速、更准确地分析复杂的微生物组数据。
希望有一天,对这些更深入理解将使我们能够更有策略地操纵这些群落,以实现健康。
随着我们对微生物组的定义、框架和机制理解的不断发展和完善,我们在促进健康方面工程化这一复杂生态网络的能力也将不断扩大。不远的未来,个性化的微生物组干预策略可能成为常规医疗实践的一部分,为慢性疾病、自身免疫疾病,甚至是某些精神疾病提供新的治疗方案。
主要参考文献:
Kennedy MS, Chang EB. The microbiome: Composition and locations. Prog Mol Biol Transl Sci. 2020;176:1-42.
Vellend M Conceptual synthesis in community ecology. Q Rev Biol. 2010;85(2):183–206.
Costello EK, Stagaman K, Dethlefsen L, Bohannan BJM, Relman DA. The application of ecological theory toward an understanding of the human microbiome. Science. 2012;336(6086):1255–1262.
Dominguez-Bello MG, Costello EK, Contreras M, et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc Natl Acad Sci U S A. 2010;107(26):11971–11975.
Chibani-Chennoufi S, Bruttin A, Dillmann ML, Brüssow H. Phage-host interaction: An ecological perspective. J Bacteriol. 2004;186(12):3677–3686.
Sun CL, Relman DA. Microbiota’s “little helpers”: Bacteriophages and antibiotic-associated responses in the gut microbiome. Genome Biol. 2013;14(7):127.
Gilbert B, Levine JM. Ecological drift and the distribution of species diversity. Proc R Soc B Biol Sci. 2017;284(1855).
Zaura E, Brandt BW, de Mattos MJT, et al. Same Exposure but two radically different responses to antibiotics: Resilience of the salivary microbiome versus long-term microbial shifts in feces. MBio. 2015;6(6).
Dethlefsen L, Relman DA. Incomplete recovery and individualized responses of the human distal gut microbiota to repeated antibiotic perturbation. Proc Natl Acad Sci U S A. 2011;108(SUPPL. 1):4554–4561.
Marais GAB, Calteau A, Tenaillon O. Mutation rate and genome reduction in endosymbiotic and free-living bacteria. Genetica. 2008;134(2):205–210.
Zhao S, Lieberman TD, Poyet M, et al. Adaptive Evolution within Gut Microbiomes of Healthy People. Cell Host Microbe. 2019;25(5):656–667.e8.
Huddleston JR. Horizontal gene transfer in the human gastrointestinal tract: Potential spread of antibiotic resistance genes. Infect Drug Resist. 2014;7:167–176.
Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome. Nature. 2012;486(7402):207–214.
Sprockett D, Fukami T, Relman DA. Role of priority effects in the early-life assembly of the gut microbiota. Nat Rev Gastroenterol Hepatol. 2018;15(4):197–205.
Friedman ES, Bittinger K, Esipova TV., et al. Microbes vs. chemistry in the origin of the anaerobic gut lumen. Proc Natl Acad Sci U S A. 2018;115(16):4170–4175.
Donaldson GP, Lee SM, Mazmanian SK. Gut biogeography of the bacterial microbiota. Nat Rev Microbiol. 2016;14(1):20–32.
Johansson ME V, Sjövall H, Hansson GC. The gastrointestinal mucus system in health and disease. Nat Rev Gastroenterol Hepatol. 2013;10(6):352–361.
Tropini C, Earle KA, Huang KC, Sonnenburg JL. The Gut Microbiome: Connecting Spatial Organization to Function. Cell Host Microbe. 2017;21(4):433–442.

谷禾健康
随着中央国务院关于《健康中国2030指导意见》、《 “十四五”国民健康规划的通知》、《国民营养计划(2017—2030年)》等重要文件的发布,人们对日常膳食营养的关注度和认知也越来越高。自己吃的是否健康?怎么样吃的更健康?已经成为国民关注的重中之重。
在现代社会,随着物质生活的极大改善,传统意义上由饥饿导致的营养不良问题已大幅减少。然而,新的营养挑战正在浮现:即便在食物丰富的情况下,人们仍可能面临营养不良的风险。这种现象的根源在于人们往往忽视了营养均衡的重要性,特别是微量营养素的摄入。
近日,哈佛大学研究团队在世界著名期刊《柳叶刀·全球健康》上发表一项重磅研究成果。
该研究团队分析了185个国家超70亿人的15种微量营养素的摄入量。调查数据得出:
在同一国家和同一年龄人群组中不足量的有:
碘、维生素 B12、铁和硒:女性高于男性
镁、维生素B6、锌、维生素C、维生素A、维生素B1和维生素B3:男性高于女性。
因此,本文基于柳叶刀调查的结果,我们按照微量元素缺乏率由高代顺序,依次与大家介绍这些大人群容易缺乏的微量元素是什么?参与哪些生理生化活动?缺乏或过量对人体有哪些影响?风险因素是什么?有哪些检测方法?如果通过饮食改善或预防缺乏?
最重要的,我们需要清楚地了解自身是否缺乏这些微量营养素,以及缺乏了该如何补充改善,怎样才能更好地吸收利用?希望本文的内容对你们未来的合理膳食和健康有帮助。
碘是世界上最常见的营养素缺乏之一,超过50亿人存在碘缺乏。
碘是正常甲状腺功能的必要矿物质,是甲状腺素(T4)和三碘甲状腺原氨酸(T3)的重要组成部分。这两种激素对肝脏、肾脏、肌肉、大脑和中枢神经系统的功能至关重要。
碘对胎儿和儿童的神经发育、器官功能至关重要,并调节新陈代谢率,对心血管、免疫和生殖健康也有重要作用。
我国目前一般人群整体处于碘营养适宜的状态,但也存在碘缺乏和碘过量的问题。
特定人群如儿童、孕妇等可能存在碘营养缺乏的风险。
我国曾是世界上碘缺乏病流行严重的国家之一,自1995年实施普遍食盐加碘以来,碘缺乏病得到了有效控制,在2015年底实现了94.2%的县消除碘缺乏病的目标。
随着缺乏问题的缓解,碘过量的问题又凸显出来。
有研究指出,中国居民膳食碘摄入量较高的地区在内陆。
在水源性高碘地区,居民可能会受到高碘的危害,如甲状腺肿、亚临床甲状腺功能减退等。
根据《中国居民膳食营养素参考摄入量(2023版)》的建议:
0-0.5岁婴儿的适宜摄入量(AI)约为85微克/天。
0.5-1岁婴儿的AI约为115微克/天。
1-11岁儿童的推荐摄入量(RNI)为90微克/天。
12-14岁的RNI为110微克/天。
15岁(含)以上及成人的RNI为120微克/天。
孕妇的RNI为230微克/天。
乳母的RNI为240微克/天。
① 地理因素
某些地区的土壤和水中天然碘含量低,尤其是远离海洋的内陆地区和高山地区,这些地方的食物中碘含量普遍较低。
② 饮食因素
不食用或少食用富含碘的食物,如海产品(海鱼、海藻)和加碘盐。
素食者如果不注意摄入富含碘的植物性食物,可能会导致碘摄入不足。
③ 怀孕和哺乳期碘需求量增加
孕妇和哺乳期妇女对碘的需求增加,如果饮食中碘摄入不足,容易导致缺乏。
④ 环境污染
工业化进程中,大量的汞、氯和硫等元素的排放和使用,会干扰体内碘的吸收与代谢,使碘在体内的利用率降低。
⑤ 自身健康状况
某些健康状况或疾病(如甲状腺疾病)可能影响碘的吸收和代谢。
⑥ 药物因素
硫脲类抗甲状腺药物、四环素、磺胺类、咪唑类等药物会干扰碘的吸收和利用
碘缺乏症是最常见的营养素缺乏症之一,影响到世界上近三分之一的人口,而下列这些人群缺碘的风险更高。
高危人群:孕妇、胎儿、新生儿最容易出现碘缺乏症,因为碘在怀孕和生命早期的大脑发育和甲状腺功能中起着关键作用。
儿童也面临很高的风险,碘缺乏会损害生长、认知和运动功能。
生活在缺碘山区的人:一些内陆地区或高山地区的土壤和水中碘含量较低,导致当地居民容易缺碘。
素食者:如果饮食中缺乏富含碘的食物(如海产品),素食者可能面临缺碘的风险。
不使用碘盐的人群:如果饮食中不使用碘盐,可能会增加缺碘的风险。
有甲状腺疾病的人:某些甲状腺疾病可能影响碘的吸收和利用。
碘缺乏会出现下面的一些症状,快来自查一下你是否存在碘缺乏。
碘缺乏的最常见症状是甲状腺肿大,也称为甲状腺肿。它还可能导致心率加快、呼吸短促和体重增加。
生长和神经发育受损
严重的碘缺乏可能导致智力迟钝和发育异常。怀孕期间和婴儿期缺碘可能会损害生长和神经发育,导致儿童认知和运动功能障碍。
妊娠期间严重缺碘可导致呆小症,这是一种以严重智力和身体发育迟缓为特征的疾病。
甲状腺功能障碍
碘缺乏可导致甲状腺功能障碍,包括甲状腺肿大和甲状腺功能减退(甲状腺功能低下)。
慢性碘缺乏可导致毒性结节性甲状腺肿和甲状腺功能亢进,因为甲状腺受到长期刺激。
围产期和婴儿死亡率增加
怀孕期间碘缺乏可能导致流产、早产、死产和先天性畸形。并且可能生下甲状腺功能减退的新生儿,影响婴儿的生长和神经系统发育。
免疫功能下降
碘缺乏可能削弱免疫系统,使机体更易感染疾病。
心血管问题
长期碘缺乏可能影响心血管健康,导致心率减慢和血压异常。
◮ 大部分碘会进入甲状腺
膳食中的碘在小肠中被吸收,以碘化物(I−)的形式进入血液循环,然后通过Na+/I−同向转运体(NIS)清除,进入甲状腺,在甲状腺中,碘在滤泡细胞中浓缩为I2,用于甲状腺激素的生物合成。
它还被转运到乳腺等其他组织,为新生儿提供I−或由肾脏清除。在甲状腺功能正常的成年人中,甲状腺含有约70%–80%的身体I2 ,而I2的吸收量因营养状况的不同而有很大差异。
注:除了钠/碘同向转运体(NIS)之外,在肠道中,碘还可以通过钠多维生素转运体(SMVT)和囊性纤维化转运体(CFTR)吸收,不过,吸收程度很小。
◮ 垂体促甲状腺激素刺激碘代谢
垂体促甲状腺激素(促甲状腺激素(TSH))刺激甲状腺碘代谢的各个阶段,包括NIS介导的碘转运到甲状腺,以及甲状腺素(T4)和三碘甲状腺原氨酸(T3)的合成和分泌。大约90%的不必要的I−通过尿液排出,其余10%通过粪便和汗液排出。
◮ 影响碘吸收的因素
其他微量元素:日粮中的钙会妨碍碘的吸收,抑制甲状腺素的合成,加速碘的排出;磷与碘具有协同作用,但钙和镁会阻碍碘的吸收,当饮食中钙、氟、镁离子较多时,会妨碍碘的吸收。
硫氰酸盐:食物中的硫氰酸盐(如木薯、玉米等)在胃肠道逆转化为硫氰酸根,竞争性地抑制碘离子向甲状腺输送,使碘排出增多。
低蛋白、低能量:低蛋白、低能量可使血清中T3、T4、血浆蛋白结合碘(PBI)降低,血清促甲状腺素(TSH)升高,促使酷氨酸分泌减少,降低碘的有机化。
◮ 健康的肠道菌群支持正常的甲状腺功能
健康的肠道菌群可支持免疫系统并确保碘等必需微量营养素的供应,从而对甲状腺功能产生积极影响。
◮ 菌群失调会导致碘代谢异常
肠道菌群失调或不平衡常见于桥本甲状腺炎和格雷夫斯病等自身免疫性甲状腺疾病(AITD),并且可以通过改变营养吸收来影响碘代谢。
在炎症性肠病(IBD)中,已经观察到肠道菌群多样性降低,厚壁菌门和拟杆菌门丰度降低。碘吸收不良是IBD的常见后果,反之亦然,表明二者之间存在相互关系。
一篇论文展示了肠道菌群在调节大鼠碘吸收中的作用:与传统饲养的大鼠相比,用卡那霉素(一种可降低大鼠体内细菌总数的抗生素)治疗的动物在治疗3小时以及治疗42和72天后碘吸收量降低。
谷禾健康经过多年检测实践和与临床的合作,已经积累了超过2000例的甲状腺患者肠道菌群样本,从初步的研究结果看,甲状腺功能减退症和碘吸收异常患者有明显的肠道菌群特征。
碘缺乏症的全球性要求维持和加强碘营养监测计划。那么目前有哪些方法可以评估人体的碘含量呢?
① 测定尿液中的碘水平
世界卫生组织将碘缺乏症的指标从甲状腺肿患病率改为尿液中位碘排泄水平,即近期碘摄入量的主要指标,这一关键决定大大提高了患病率数据的准确性。然而,由于个人每天的碘摄入量都不同,对尿液碘值的解释需要谨慎。
② 尿碘/肌酐比
另一种方法是根据年龄和性别调整碘/肌酐比,这比基于每升浓度的随意报告更为准确,但可能导致在蛋白质摄入量低(尿肌酐低)的情况下估计过高,在肌酐排泄量高的情况下估计过低。
③ 血清TSH和血清甲状腺球蛋白
血清促甲状腺激素(TSH)和血清甲状腺球蛋白(Tg) 是碘状态的互补“功能性”生化指标,反映了对营养状态的中期反应。
然而,虽然TSH是新生儿碘状态的敏感指标,但它对年龄较大的儿童和成人相对不敏感,特别是在存在边缘碘缺乏的情况下。
•海产品,包括海带、海藻、深海鱼类(如三文鱼、金枪鱼、鳕鱼)、海虾、海蟹、蛤干、干贝、海参等,这些食物不仅含碘量高,而且易于吸收,是补充碘的良好选择。
•肉类:牛肉、猪肉、鸡肉等肉类食物,通常也含有一定的碘元素,适量食用可为身体补充一定的碘。
•乳制品和蛋类,牛奶、奶酪和酸奶等乳制品通常含有一定量的碘。鸡蛋,尤其是蛋黄,含有碘。
•碘盐,使用碘化食盐是许多国家预防碘缺乏的有效措施。
•水果和蔬菜,如柑橘类水果(橙子、柠檬)、葡萄、草莓、苹果、梨、香蕉以及菠菜、花椰菜、胡萝卜、芹菜、茄子、土豆、洋葱等,虽然碘含量相对较低,但适量食用仍能为身体补充一定的碘元素。
缺铁也是世界上常见的微量营养素缺乏症,超过40亿人的铁摄入不足,尤其是在婴儿、儿童、青少年和妇女中。
全球缺铁情况估计值
.png)
doi.org/10.1016/B978-0-12-802861-2.00002-X
(A)15-49岁孕妇;(B)6-59个月婴儿和儿童
铁是一种人体必需的矿物质。它是红细胞的一个重要组成部分,它与血红蛋白结合,将氧气输送到你的细胞。铁在新陈代谢和免疫防御中都起着重要作用。
缺铁会导致贫血、疲劳、免疫系统减弱和大脑功能受损、宿主发育迟缓等。
一般我们常见的缺铁,主要是以下几个原因:
① 铁摄入不足
这很好理解。我们的身体不能制造铁,需要从食物中获取。如果你每天摄入的铁量没有达到身体需要的量,就会出现缺铁。
② 铁需求增加
快速生长会增加铁需求,因此儿童、孕妇和哺乳期女性更可能缺铁。此外,进行耐力锻炼的人更容易患低铁症。
③ 铁流失过多
出血和失血会增加铁的流失,包括:月经出血、分娩、溃疡、痔疮、因受伤或手术而出血、献血等。长期使用消炎药(布洛芬、萘普生、双氯芬酸)会增加肠道出血的可能性。
需要注意的是,缺铁性贫血的一个常见且常被忽视的原因是月经过多。随着时间的推移,这种缓慢的血液流失通常会导致铁流失过多。
④ 铁隔离
在慢性炎症性疾病中也会出现缺铁,例如自身免疫性疾病、慢性感染、慢性肾病或癌症。因为铁对病原体和癌细胞的生长很重要,所以当发生感染或炎症时,身体会试图通过锁定铁来抑制病原体或恶性细胞的生长。
受感染或炎症影响的组织会释放降低铁血水平的细胞因子,从而导致贫血的发展。
⑤ 铁吸收不足
消化系统的疾病会降低铁的吸收,包括:乳糜泻、炎症性肠病、胃炎、幽门螺杆菌感染、小肠细菌生长过度等,此外,减肥手术也会减少营养吸收,包括铁。
铁吸收不足的其他原因包括大量摄入抑制铁吸收的食物或药物,包括:植酸盐(全谷物、豆类)、多酚(茶、咖啡、葡萄酒)、抗酸药、H2受体阻滞剂、四环素或消胆胺等药物等。
⑥ 肠道菌群紊乱,病原菌定植
还有一个很重要的我们可能会忽略的因素,就是菌群。大肠杆菌、铜绿假单胞菌、肺炎克雷伯菌、金黄色葡萄球菌和结核分枝杆菌。这些病原菌的定植会与宿主进行铁的竞争吸收,同时诱发肠道炎症,改变肠腔环境,影响菌群构成,进一步导致缺铁加剧。
学龄前儿童:这个数字在学龄前儿童中上升到47%。除非给他们提供富含铁或强化铁的食物,否则他们非常可能缺乏铁。
月经期妇女:大约30%的月经期妇女由于每月失血过多也可能缺乏,高达42%的年轻孕妇也可能缺乏。
素食主义者:此外,素食者铁缺乏的风险增加,因为他们只摄入非血红素铁,而非血红素铁的吸收率不高。
贫血是缺铁最常见的危害
缺铁最常见的后果是贫血,据估计,女性贫血平均有50%是由于缺铁引起的,孕妇这一比例上升至60%,儿童约为42%。
由于贫血氧气输送能力下降,会出现呼吸困难(气短)和静息时心输出量增加、心血管压力增大等症状。
疲劳和身体虚弱
缺铁通常与疲劳、身体耐力下降和嗜睡有关,即使没有贫血。
认知和心理影响
注意力、专注力和记忆力下降等认知障碍与缺铁有关。此外,情绪低落、焦虑和烦躁等症状也很普遍。
异食癖
缺铁会导致异食癖,尤其是食冰癖(渴望和咀嚼冰块或其他冰冻食物),这与铁含量低密切相关。
不安腿综合症(RLS)
研究发现缺铁与不安腿综合征之间存在密切联系,补铁可改善症状。
免疫功能和感染风险
缺铁会损害免疫功能,特别是T细胞免疫,使人更容易受到感染。
头发和指甲的变化
缺铁患者还报告了脱发和指甲纹理变化等身体症状。
◮ 血红素铁吸收率更高
•血红素铁:这种铁的吸收率非常高。它只存在于动物性食物中,在红肉中含量特别高。
•非血红素铁:这种类型的铁在动物和植物食物中都有,比较常见。它不像血红素铁那样容易被吸收。
血红素铁和非血红素铁通过两种不同的途径吸收,血红素铁被十二指肠刷膜边缘的血红素载体蛋白1(HCP1) 吸收。
非血红素铁通常呈三价铁形式,不具有生物利用度,必须通过十二指肠细胞色素b(DCYTB)将其还原为二价铁形式,然后再由二价金属转运蛋白(DMT1)转运到十二指肠刷膜上。
肠上皮细胞对非血红素铁的吸收
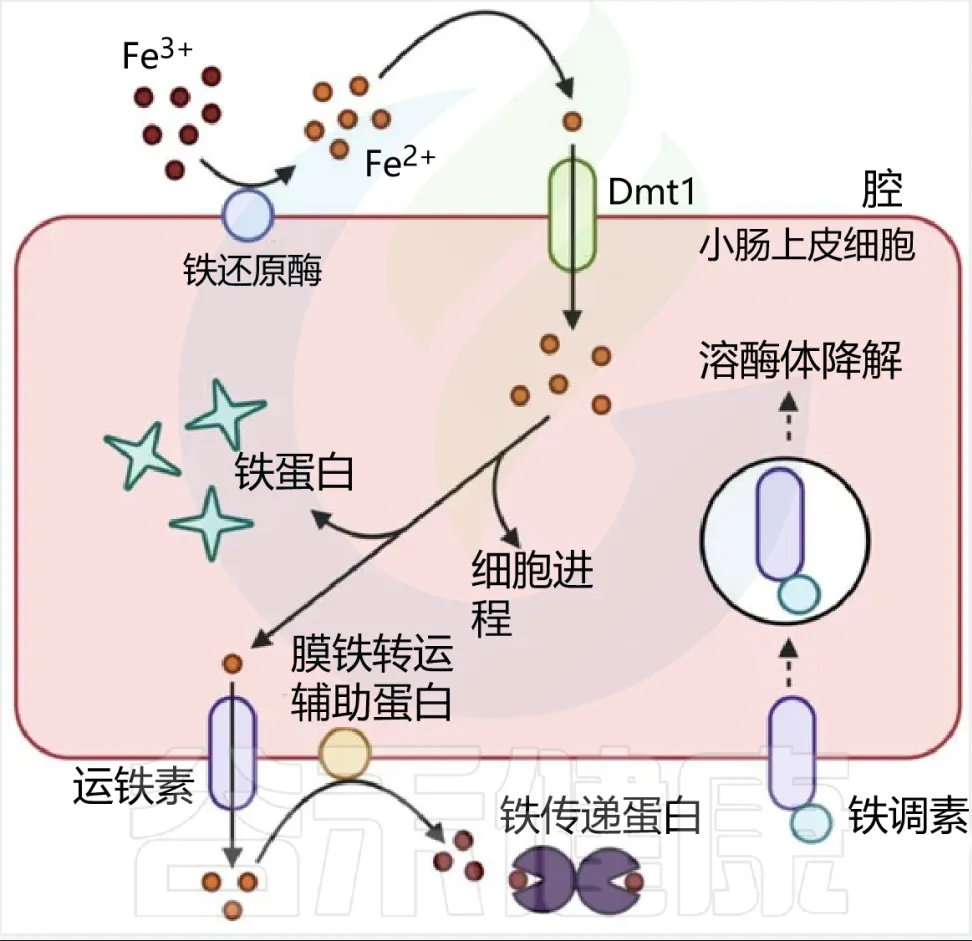
肠道内的微生物群可能与宿主竞争可用铁,也可能通过其他方式促进或抑制铁的吸收。
◮ 一些细菌可以直接利用铁
细菌可以通过分泌铁载体摄取Fe3+。铁载体是一种Fe3+特异性的螯合剂,对Fe3+具有超强的络合力。而大多数革兰氏阳性菌存在直接吸收血红素而获得铁元素的转运系统。
除此之外,细菌也可以产生分泌的或位于膜上的铁还原酶,将Fe3+还原成更容易溶解的Fe2+形式,并通过Feo、Yfe、Efe等转运系统来摄取Fe2+。
◮ 部分菌群调节肠道环境有助于更好地吸收铁
许多食物基质中的非血红素铁与抑制剂(例如多酚、纤维或植酸盐)相连,这些抑制剂可以被专用细菌酶降解,从而更好地吸收铁。
细菌还可以通过发酵饮食中的不可消化碳水化合物来产生短链脂肪酸,这会降低管腔pH值,从而将三价铁还原为二价铁,从而提高其被细菌和宿主的吸收。
其他一些有机酸(例如乳酸)是由许多细菌产生的,存在于整个消化道中。酸化的肠道环境还可以降解螯合微量营养素的复合物并促进铁的吸收。
特定的微生物代谢物,如羧酸,还可以通过防止肠道中的铁沉淀来增强铁的吸收。
◮ 一些肠道菌群代谢物会抑制铁的吸收

但是需要注意的是,还有研究发现肠道微生物群产生的代谢物会抑制缺氧诱导因子(HIF-2α)(肠道铁吸收的主要转录因子)并增加铁储存蛋白铁蛋白,从而导致宿主肠道铁吸收减少。
这可能是肠道微生物群通过抑制肠道HIF-2α活性和上调铁转运蛋白(FPN)表达来调节宿主全身铁稳态,有效防止全身铁过载。
评估缺铁的生化测试包括血清总铁、总铁结合能力(TIBC)、转铁蛋白、可溶性转铁蛋白受体(sTfR)、血清铁蛋白和红细胞锌原卟啉。
① 测定血红蛋白
血红蛋白是评估铁状态最常用的参数,因为它简单易用。然而,当单独使用时,它缺乏特异性,因为它受维生素B12和叶酸状态以及感染和血红蛋白病的影响。
② 测定血清铁蛋白
血清铁蛋白被认为是检测早期缺铁的较好生物标志物。然而,作为一种急性期反应物,其血清浓度受炎症状态影响,并可能因长期饮酒而升高,从而限制了其在缺铁性贫血(IDA)诊断中的实用性。
③ 测定血浆铁(PI)/总铁结合能力
血浆铁(PI)/总铁结合能力(TIBC)比值反映转铁蛋白饱和度,可通过在自动化平台上常规分光光度法分析的PI和TIBC轻松获得。
直接测量转铁蛋白已被提议作为一种更好的生物标志物,并且已经开发出自动化免疫化学方法,但在临床实验室中应用并不广泛。最近描述了一种使用合成转铁蛋白肽的LC-MS/MS方法用于测量血清转铁蛋白。它可以成为参考方法的基础,从而提高免疫学方法的准确性。
④ 测定可溶性转铁蛋白受体(sTfR)
可溶性转铁蛋白受体(sTfR)测量是最近描述的一种铁状态评估方法,通常可以区分缺铁性贫血(IDA)和慢性病性贫血(ACD) ,尤其适用于识别同时患有炎症性疾病(其中铁蛋白(一种急性期蛋白)增加)的患者的IDA。
⑤ 红细胞锌原卟啉
红细胞锌原卟啉是血红素合成异常的产物,在无并发症的铁缺乏症(缺铁性红细胞生成)的初步筛查中特别有价值,并且与sTfR一起用于在排除铅中毒(如今很少见)时监测补铁疗法。
低成本和能够用即时血荧光计直接测量一滴血中的红细胞锌原卟啉/血红素比率是该检测的主要优点。然而,自动化检测的困难限制了它在中心临床实验室中的使用。
⑥ 含铁血黄素
最后,可以检查骨髓以评估网状细胞中的含铁血黄素含量。然而,这种技术是侵入性的、半定量的、依赖观察者的,不能在临床病理实验室中常规使用。
考虑到缺铁对人体健康影响重大,因此实施适当的策略来解决这一问题至关重要。
最常见的策略是食物中的铁补充、益生菌、益生元、铁药物补充剂等方法。
◮ 富含铁的食物
前面我们知道,膳食铁有两种形式:血红素和非血红素。血红素铁具有较高的生物利用度,而非血红素铁的吸收要低得多。
血红素铁主要存在于以下食物中:
•红肉,尤其是牛肉,是血红素铁的重要来源,每 100克牛里脊肉含有约3毫克血红素铁;
•血液制品,例如猪血和鸭血,含有极其丰富的血红素铁,每100克含9.2至15.4毫克;
•内脏,尤其是肝脏,是血红素铁的极佳来源。例如,每100克猪肝含有约2.3毫克血红素铁;
•某些贝类,如青口贝、蛤蜊和牡蛎,也富含血红素铁,每100克含4.0至9.1毫克。
非血红素铁:
•豆类,如大豆、蚕豆。食用豆类是非血红素铁的重要来源;
•种子和坚果,芝麻和南瓜子是非血红素铁的良好来源;
•深色多叶蔬菜,西兰花、甘蓝和菠菜含有丰富的铁,此外韭菜、芹菜、黑木耳、豆芽等也含有一定的铁含量;
•全谷物,如燕麦、藜麦、糙米;
•鱼类,鳕鱼、鲤鱼、鲑鱼等鱼类中也有一定的非血红素铁。
◮ 维生素C:促进铁的吸收
特别注意的是,维生素C可以促进铁的吸收。与富含铁的食物一起吃富含维生素C的食物,像冬枣、柑橘、猕猴桃、草莓、西红柿等都含有丰富的维生素C,可以帮助你最大限度地吸收铁。
◮ 铁补充剂
不同形式的铁补充剂补充铁以亚铁和铁的形式存在。由于铁形态必须在体内转化为亚铁形态以供吸收,因此亚铁形态更具生物利用度。
常用的口服亚铁补充剂包括:
•柠檬酸亚铁
•硫酸亚铁
•葡萄糖酸亚铁
•铁琥珀酸亚铁
•氨基酸螯合物(如双甘氨酸铁、天冬氨酸铁)
•血红素铁
◮ 益生菌
一些益生菌可以产生乳酸,这可能会降低pH值,从而增加铁的溶解度,帮助其吸收。
例如,植物乳杆菌 299v 有助于预防缺铁性贫血。这种益生菌可以改善活跃的高加索欧洲人的膳食非血红素铁吸收。
发酵乳杆菌是人类微生物群中的一种主要益生菌,具有显著的铁还原活性。对羟基苯乳酸是该菌株产生的代谢物,通过DMT1转运体将Fe3+还原为Fe2+来增加肠细胞对铁的吸收。
◮ 益生元
益生元是功能性食品成分,可刺激肠道中有益细菌的生长和定植,最终改善身体健康。
几项研究将益生元或合生元的摄入与铁可用性的增加联系起来,主要是通过将Fe3+转化为Fe2+(由于它们的铁还原活性),并促进肠细胞对铁的吸收。
!
特别提醒
除非你真正需要,否则绝不应该补充铁,因为过多的铁可能非常有害。
钙对你身体的每个细胞都是必不可少的。它能使骨骼和牙齿矿化,特别是在快速生长的时期。除其结构功能外,钙还参与多种生命功能,包括受精、血液凝固、肌肉收缩、神经冲动传递、分泌活动、细胞死亡、免疫反应、细胞分化和酶活化。
获得和保持所需的钙量对于儿童骨骼的发育、强度和密度以及预防老年人的骨质流失和骨质疏松性骨折至关重要。充足的钙摄入量还有助于降低患高血压、高胆固醇血症、结肠癌、肾结石和腹部肥胖等各种慢性疾病的风险。
世界卫生组织(WHO)建议,年轻人的每日推荐钙摄入量(RDI)为1000毫克/天,65岁以上男性、绝经后女性和9至18岁的儿童的每日推荐钙摄入量为1300毫克/天。
然而之前的一项调查发现,只有不到15%的少女、不到10%的50岁以上的妇女、不到22%的少年和50岁以上的男子符合建议的钙摄入量。虽然目前这些数字略有增加,但大多数人仍然没有获得足够的钙。最新的研究表明,全球人口有超50亿存在钙不足(占66%)。
钙缺乏症是影响各类人群的全球健康问题,对骨骼健康和其他生理功能有重大影响。了解钙缺乏的原因对于制定有效的干预措施和政策以减轻其影响至关重要。
① 饮食摄入不足
世界上大约一半的人口无法获得足够的膳食钙,其中低收入和中等收入国家面临的风险最大,尽管高收入国家中的许多人也没有达到推荐摄入量。
对于儿童来说,钙摄入不足是缺钙的主要原因,而生长和骨骼发育对钙的需求较高,则加剧了缺钙现象。
② 生理和代谢因素
成人缺钙通常是由于钙通过肠道、肾脏和皮肤流失,而无法通过饮食摄入得到补偿。
在绝经后妇女中,尿钙流失增加和钙吸收不良导致钙缺乏和骨质疏松症。
③ 维生素D缺乏症
维生素D缺乏会导致钙吸收受损,从而导致钙缺乏症和佝偻病和骨软化症等相关疾病。
④ 荷尔蒙影响
激素变化,如绝经后女性的雌激素水平下降,会增加骨质吸收和钙质流失,加剧钙缺乏症。
此外,甲状旁腺激素(PTH)和骨化三醇水平因缺钙而升高,导致骨吸收以维持血钙水平。
⑤ 遗传和健康状况
影响矿物质代谢的遗传、先天或后天性疾病可能导致儿童继发性钙缺乏症。
⑥ 环境和生活方式因素
缺乏日光照射导致维生素D不足,以及含有钙结合剂(例如磷酸盐、草酸盐)的饮食习惯会损害钙的吸收。
老年人:老年人由于钙和维生素D摄入量低、日照时间短、肠道吸收能力下降、肾功能下降等因素,特别容易出现钙缺乏症。
绝经后的女性:由于雌激素水平下降,骨质流失加快,容易导致钙缺乏。
孕妇和哺乳期妇女:由于胎儿和婴儿对钙的需求增加,母体可能会出现钙不足。
素食者:如果饮食中缺乏富含钙的植物性食物,可能会导致钙摄入不足。
乳糖不耐受者:由于无法摄入乳制品,可能会导致钙摄入不足。
青春期青少年:由于快速生长发育,对钙的需求增加,如果饮食中钙摄入不足,容易缺钙。
长期服用某些药物的人:如长期服用类固醇药物,可能会影响钙的吸收和代谢。
患有某些疾病的人:如甲状旁腺功能亢进、肾病或胃肠道疾病,可能会影响钙的吸收和利用。
钙缺乏症的症状和健康危害主要包括以下几个方面:
骨折、骨质疏松症
当钙摄入量低或钙吸收不良时,就会发生骨吸收,骨骼中储存的钙用于维持正常的生物功能。长期钙缺乏会导致成年人骨质疏松,增加骨折的风险,尤其是绝经后女性和老年人。
佝偻病
更为严重的饮食性缺钙的症状包括儿童的软骨(佝偻病),钙缺乏会影响儿童骨骼生长和发育,表现为骨骼畸形、生长迟缓等。
某些疾病和特定饮食,如素食,可能会导致钙缺乏。炎症性肠病患者也需要补钙,尤其是使用皮质类固醇/糖皮质激素的患者。
妊娠期并发症
除了骨骼健康之外,孕妇钙缺乏可能增加患妊娠期高血压疾病、早产、低出生体重等妊娠并发症的风险。补钙最有据可查的好处之一是显著降低孕妇先兆子痫和产妇发病率以及早产的风险。
其他健康影响
钙缺乏还可能与其他健康问题有关,如牙齿问题、肌肉痉挛、心血管疾病、情绪不稳定等。
对于非妊娠成人,补钙可能对降低血压有轻微作用,尤其对于年轻人。补钙还与胆固醇代谢的有利变化有关,包括低密度脂蛋白的减少和高密度脂蛋白的增加。
钙以离子形式(即Ca2+)在胃肠道中吸收。肠道钙吸收是维持Ca2+稳态的重要过程,并通过两种不同的运输机制进行:跨细胞主动饱和转运和旁细胞被动不饱和转运。
◮ 钙的跨细胞主动转运
跨细胞运输发生在十二指肠和空肠上段,受维生素D刺激,包括三个基本步骤:
(1)钙进入细胞(通过正电化学梯度);
(2)扩散;
(3)从细胞中排泄。
一旦进入细胞,钙就会被转运到基底侧膜,与缓冲蛋白钙结合蛋白-D9K(CaBP-9K)结合,该蛋白对 Ca2+有很高的亲和力。另一种钙结合蛋白钙调蛋白可能有助于钙在细胞内的易位,但其作用程度不如钙结合蛋白-D9K。
钙通过位于基底侧膜的钙泵ATPase(PMCA1)和钠钙交换器(NCX1)的作用从上皮细胞挤出到间质空间。PMCA1对钙的吸收至关重要,在人体中,它存在于十二指肠、回肠和结肠中。PMCA1活性受钙调蛋白(CaM)、钙结合蛋白-D28K(CaBP-28K)和钙调节。
◮ 钙的旁细胞被动扩散
钙的旁细胞被动扩散主要发生在小肠中,该扩散不可饱和且不依赖于维生素D;随着钙摄入量的增加,通过旁细胞扩散的吸收增加,当钙摄入量高时,旁细胞吸收占主导地位。
旁细胞吸收通过整个小肠的紧密连接发生,紧密连接是存在于肠细胞顶端区域的细胞间结构,可调节离子和分子的旁细胞运输,而肠道微生物群对于紧密连接的构成至关重要。
◮ 当钙摄入不足时,骨骼会释放出钙进而引起骨质疏松
血液中的钙浓度受到严格的调节,任何多余的钙都会储存在骨骼中。如果你的摄入量不足,你的骨骼就会释放出钙。
这就是为什么缺钙最常见的症状是骨质疏松症,其特点是骨骼更软、更脆弱。
健康人的血钙维持在一个相对稳定的水平,主要依靠血液与细胞外液之间钙代谢的快速交换与平衡,而调控骨骼、肠道、肾脏等重要器官和核心环节的大型钙库则受钙调节因子的控制。例如经典的钙调节因子1,25-二羟基维生素D3。
维生素D3首先在肝脏中羟基化生成25-羟基维生素D3,然后在肾脏中经1α-羟化酶作用生成活性最强的1,25-二羟基维生素D3。活性维生素d3通过增加肠道钙吸收、减少肾脏钙排泄、调节骨代谢等作用而升高血钙。
◮ 肠道微生物可以影响钙调节因子水平
已有多项研究调查了不育小鼠血浆中25-羟基维生素d3和1,25-二羟基维生素d3水平非常低,而不育小鼠在植入肠道微生物群 2周后血清钙水平恢复至正常水平。

在一项临床试验中,参与者被给予NCIMB 30242罗伊氏乳杆菌胶囊后,服用益生菌胶囊的患者25-羟基维生素d3水平较服用安慰剂胶囊的对照组显著升高。
◮ 短链脂肪酸有助于增强钙的吸收
肠道微生物群还能产生短链脂肪酸(SCFAs)。实验证明,SCFAs的存在可以增加小鼠结肠腔内钙的转运,而单独用盐酸处理并不能增加钙的转运,SCFAs可能通过其他机制促进钙的吸收。
SCFAs是肠黏膜细胞的重要能量供应者,尤其是丁酸,是结肠和盲肠黏膜细胞所青睐的。所以SCFAs能促进肠道细胞生长,增加肠道吸收面积,从而增强钙的吸收。
此外,丁酸可以诱导骨调节T细胞的形成,进而达到甲状腺激素诱导的骨代谢,降低血钙的目的。
◮ 维生素D与肠道微生物群共同作用调节钙吸收
维生素D是人体唯一能合成的维生素,其来源主要是皮肤在太阳紫外线照射下合成的维生素D,其次是天然食物。维生素D与肠道微生物群相互作用,共同作用于机体对钙的吸收。
肠道菌群的组成可因维生素D状态或暴露而变化,维生素D摄入量与普氏菌的丰度相关,与拟杆菌呈正相关。另一方面,有数据支持菌群也影响维生素D代谢,一些细菌表达参与类固醇羟基化的酶,因此它们可以加工和激活维生素D。细菌CYP105a1(苍白链霉菌)可以通过两个独立的羟基化反应将维生素D3转化为1,25(OH) 2 D3,这表明细菌功能相当于维生素D代谢酶。
维生素D对机体钙平衡的调节作用是通过调节肠道、肾脏对钙的吸收,以及骨的成骨、破骨细胞生成过程来实现的,能促进小肠黏膜对钙的吸收。有研究表明,当维生素D由不足转为正常时,肠道对钙的主动吸收增加45~65%,而血清25-羟基维生素D低于30ng/ml时,肠道对钙的吸收明显降低。
① 饮食评估
膳食钙摄入量是广泛使用的钙状态测量指标,可用于得出人口状态指标(例如,摄入量充足或不足的个体比例;平均摄入量)。膳食评估方法可分为间接方法(如食物平衡表),利用二手数据估计国家和家庭层面可供消费的食物,以及直接方法(如24小时回忆),从个人收集原始膳食数据。
② 离子钙测量
直接测量离子钙(Ca2+)被认为是评估真实钙状态的黄金标准,因为它不受白蛋白等血清蛋白的影响。重症监护室通常使用血气分析仪进行离子钙测量,但其成本较高,且需要及时处理样品,因此受到限制。
③ 测量血清中的总钙
总钙通常用作一线检测,使用原子吸收光谱法的标准化参考方法可以准确测量血清中的总钙,但它们没有考虑离子钙。通常需要根据白蛋白或总蛋白进行调整才能估算离子钙。然而,这些调整通常与直接离子钙测量值不一致,可能无法准确反映真实的钙状态。
④ 骨量测量
虽然骨量测量结果与近期膳食钙摄入量没有很好的相关性,但它们反映了长期钙的充足性,并受整体钙状态的影响。
⑤ 空腹尿钙:肌酐比率
这种方法有望成为一种简单且廉价的指示近期钙状态的方法,尽管目前尚未广泛使用。
◮ 摄入高钙食物
摄入富含钙的食物是满足每日钙需求的最佳方式。
-高钙食物包括乳制品(牛奶、酸奶、奶酪);
-深海鱼类,深海鱼的含钙量比普通的鱼肉要高,虾皮含钙量高达991毫克/百克;
-蛋类,鸡蛋、鹌鹑蛋、甲鱼蛋等蛋类也含有丰富的钙元素;
-坚果,例如榛仁含钙达815毫克/百克;
-一些蔬菜,例如紫衣甘蓝、西兰花、香菇、木耳等食物也含有较多的钙。
◮ 使用钙补充剂
对于无法从饮食中摄取足够钙质的人,可能需要补充钙质。常见的钙质包括碳酸钙和柠檬酸钙,后者更容易被吸收。补充剂应根据个人需求量身定制,通常每天约500毫克,以补充饮食摄入量并达到推荐的每日摄入量。
钙与维生素D结合补充可增强钙的吸收,并具有其他健康益处,例如改善血脂状况并降低老年人的骨折风险。
注:建议每日摄入1000-1200毫克钙和800国际单位(IU)维生素D,尤其是对于老年人。
◮ 适当运动、晒晒太阳
运动不仅可以增强自身体质,还可以在户外增加晒太阳的时间,适当的阳光照射是皮肤合成维生素D的重要来源,对钙的吸收都有益处。
◮ 不吸烟、少喝酒
吸烟会增加肺癌的患病率,还有可能成为缺钙的重点人群。少喝酒,少摄入咖啡因。酒精和咖啡因会影响钙的吸收,也是造成骨质疏松的不可忽视的因素。
镁是人体内含量第四多的元素(Ca²+>K+>Na+>Mg²+),也是人体内细胞中含量第二多的阳离子,仅次于钾。
★ 镁在许多生理功能中发挥着重要作用
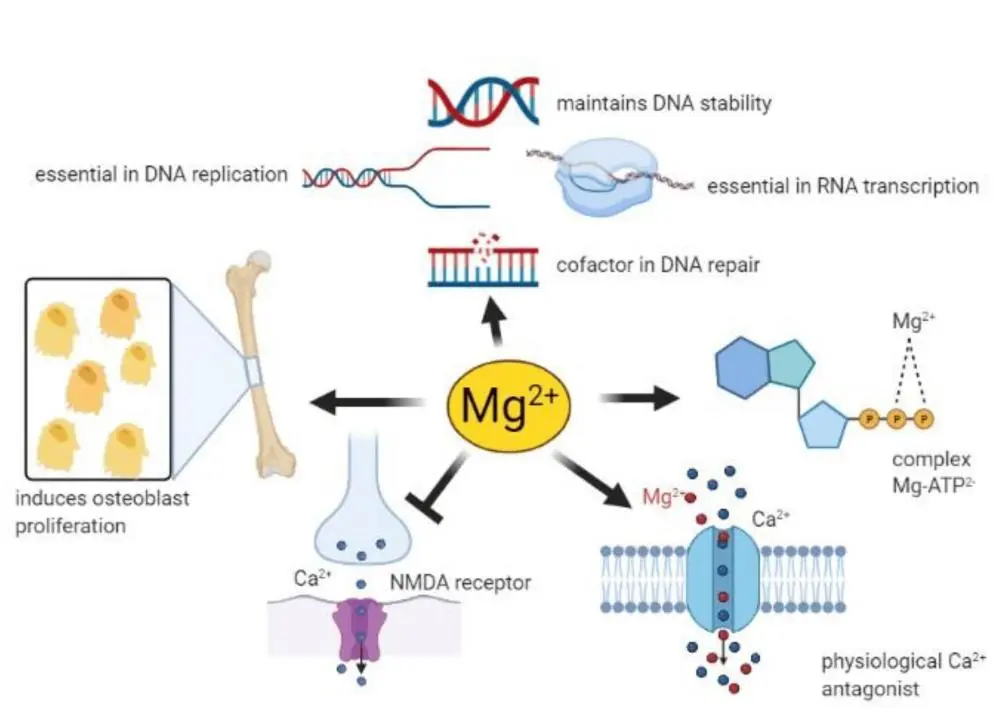
doi: 10.3390/nu13041136.
–MgATP复合物是许多酶活性所必需的。一般来说,Mg2+在所有涉及ATP利用和转移的反应中都起辅助因子的作用,包括细胞对生长因子的反应和细胞增殖,因此几乎参与了细胞中的每个过程。
–Mg2+是DNA和RNA聚合酶保持正确结构和活性所必需的,在DNA复制、RNA转录和蛋白质形成过程中必不可少,从而参与控制细胞增殖。此外,Mg2+对维持基因组和遗传稳定性至关重要,鉴于这些影响,Mg2+可用性低可能与癌症的发展有关。
-血清Mg2+浓度与骨代谢密切相关,骨表面Mg2+不断与血液中的Mg2+进行交换。此外,Mg2+会诱导成骨细胞增殖。
-Mg2+参与控制许多组织中某些离子通道的活性。这些能力与镁对心血管系统、肌肉和大脑的影响有关。
-神经元镁离子浓度会下调N-甲基-D-天冬氨酸(NMDA)受体的兴奋性,而这种受体对于学习和记忆中的兴奋性突触传递和神经元可塑性至关重要。出于这些原因,人们推测许多神经系统疾病都与Mg2+缺乏有关,例如偏头痛、癫痫、阿尔茨海默病、帕金森病和中风,以及焦虑和抑郁。
在普通人群中,镁缺乏症并不少见,并且男性的镁缺乏量要大于女性,因为雌激素会增强镁的利用率,有利于组织对镁的吸收。但由于不同原因和情况,习惯性摄入镁不足或过度流失会导致镁缺乏。
① 膳食摄入和不健康饮食
相当一部分人的镁摄入量未达到平均水平,这主要是由于现代西方饮食中镁含量低。此外,过去一个世纪里,蔬菜中的矿物质含量大幅下降,人们的蔬菜摄入量也减少,导致膳食中镁的摄入量降低。同时研究表明加工食品会阻碍镁的吸收。
② 胃肠道的pH值影响吸收
镁形式(无机盐、有机盐、螯合物等)的溶解度是一个重要因素,溶解度增加与吸收增加相关。胃肠道的pH值会影响镁形式的溶解度,pH值较低时镁的溶解度增加。而pH升高时,镁的吸收变得越来越困难。胃肠道中产生短链脂肪酸的细菌减少,可能会导致镁的吸收减少。
③ 药物的使用
某些药物,如利尿剂和质子泵抑制剂,可能导致镁缺乏。常用的质子泵抑制剂奥美拉唑影响体外被动运输。奥美拉唑通过使管腔酸度升高,抑制了镁的被动吸收。
④ 雌激素的水平
性别也会影响镁的状态,因为雌激素会增强镁的利用率,有利于软组织和硬组织对镁的吸收。年轻女性的镁保留能力比年轻男性更好,尤其是在排卵期或服用口服避孕药期间,此时雌激素水平最高。
⑤ 胃肠道和肾脏疾病
由于各种潜在的健康状况和治疗,住院患者,尤其是重症监护病房的患者,经常会缺乏镁。胃肠道和肾脏的流失是导致镁缺乏的重要因素。影响这些系统的疾病会导致镁排泄增加。
老年人:老年人从肠道吸收的镁较少,而由于肾脏排泄增加,镁流失较多,慢性镁缺乏症在老年人中确实很常见,通常是由于饮食摄入和肠道吸收减少所致,并且可能因雌激素缺乏而加剧,雌激素缺乏发生在老年女性和男性身上并导致高镁尿症。
患有胃肠道疾病的人:如克罗恩病、炎症性肠病和乳糜泻。特别是,除了乳糜泻导致的吸收效率低下之外,无麸质饮食还发现缺乏纤维和微量营养素,如镁。因此,患有乳糜泻的人是特别容易受到镁缺乏症的影响。
酗酒的人:酒精会影响肠道,并导致肠道吸收不良。乙醇还会导致近端肾小管功能障碍,增加尿镁流失。
使用一些药物的人:正在接受药物治疗(如利尿剂、质子泵抑制剂、他克莫司、免疫抑制剂、化疗药物和一些磷酸盐类药物)的人。
过去30年来,多项实验、临床和流行病学研究表明,慢性镁缺乏与多种疾病有关,或会加重这些疾病。
急性低镁血症
急性低镁血症具有明显的临床特征(严重痉挛、眼球震颤、心律失常等),并且易于检测。相反,亚临床或慢性镁缺乏症经常被低估,因为它反映的是细胞和骨骼内镁含量的降低,而不是细胞外镁含量的降低。
糖尿病
镁能诱导胰岛素受体的自身磷酸化,并调节这些受体上的酪氨酸激酶活性,从而起到胰岛素增敏剂的作用。多项研究报告称,细胞内镁水平降低会导致胰岛素抵抗增加。
骨质疏松症
镁缺乏可能是骨质疏松症的一个危险因素。研究发现,膳食镁、骨矿物质密度(BMD)和降低骨质疏松症风险之间存在正相关。

心血管疾病
越来越多的流行病学研究、随机对照试验和荟萃分析证据表明,镁摄入量与心血管疾病(CVD)呈反比关系。事实上,高镁摄入量与主要心血管风险因素(如高血压和糖尿病)、中风和总CVD的发生概率降低相关。此外,缺血性和冠心病风险降低与循环中镁含量较高有关。
癌症
多项流行病学研究表明,缺乏镁的饮食会增加患癌症的风险。镁是参与DNA修复机制的酶辅因子,在维持基因组稳定性和保真度、调节细胞周期进程、细胞增殖、分化和凋亡方面发挥着重要作用。镁缺乏会导致DNA突变,从而导致肿瘤发生以及癌症的风险和预后。此外,最近有报道称镁对化学致癌作用具有保护作用。
神经系统疾病
一篇文献非常详尽的总结了关于镁在预防和辅助治疗最常见的神经系统疾病方面所起的作用,镁缺乏可能导致偏头痛、中风、癫痫、阿尔茨海默病和帕金森病,以及常见的焦虑和抑郁并发疾病。
Mg2+主要通过小肠吸收,尽管有些也通过大肠吸收。Mg2+转运系统有两种,一种是被动的旁细胞机制,另一种是通过专门的Mg2+通道和转运蛋白进行的跨细胞转运。
Mg2+稳态由肠道、骨骼和肾脏在激素控制下维持。镁跨细胞膜的转运表现出组织差异,在人体组织中,心脏、肝脏、肾脏、骨骼肌、红细胞和脑的转运较高。
因此,镁的转运、镁稳态的生理学和细胞的代谢活动是紧密相关的。以下一些因素会影响膳食镁的吸收和利用:
◮ 饮食因素
膳食中钾含量过高会显著降低镁的吸收;钙和磷酸盐摄入量增加会损害镁的吸收。
某些膳食纤维(如半纤维素、纤维素、木质素)、植酸和草酸会抑制镁的吸收,而蛋白质和某些碳水化合物(如抗性淀粉、菊粉)则会促进镁的吸收。
◮ 维生素D
药理剂量的维生素D可增加镁的吸收,但相当一部分镁的吸收与维生素D无关。
◮ 激素水平
激素也会调节跨细胞Mg2+的吸收。最近的一项研究报告称,甲状旁腺激素(PTH)和成纤维细胞生长因子23(FGF-23)系统性地直接抑制十二指肠、空肠和回肠的跨细胞而非旁细胞Mg2+吸收。
◮ 肠道pH值
肠道内pH浓度会影响Mg2+溶解度和肠道Mg2+吸收,管腔pH升高导致可溶性Mg2+降低,从pH5.15时占管腔总Mg含量的79.61%下降到pH7.8时占管腔总Mg含量的8.71%。因此,腔内酸性可增强人体小肠和上皮样 Caco-2 单层细胞对Mg2+的吸收。
◮ 质子泵抑制剂的使用
自2006年以来,已有报道称质子泵抑制剂(PPI)诱发人类低镁血症(PPIH)和低镁尿。静脉补充Mg2+或停用PPI可使PPIH患者的血浆和尿液Mg2+水平迅速恢复正常,但口服补充Mg2+则不能。这些发现表明PPI可以抑制肠道Mg2+的吸收。
肠道菌群在结肠Mg2+吸收中可能发挥的作用已有人提出。
◮ 肠道菌群失调导致毒性物质产生增加
长期质子泵抑制剂(PPI)治疗可导致肠道菌群失调,例如负责维持粘膜屏障功能的放线菌和双歧杆菌属的减少。此外,长期使用PPIs治疗会导致小肠细菌过度生长,毒性物质的产生增加,如血清内毒素和刺激促炎细胞因子分泌的细菌化合物,这些有毒物质会干扰镁的吸收。
◮ 肠道微生物群会影响肠道吸收表面的变化
除了这些发现之外,我们之前的研究还显示低镁血症(PPIH)大鼠小肠存在潘氏细胞功能障碍和慢性炎症。肠道微生物代谢物的合成也可能导致肠道吸收表面的变化或刺激基因表达。
◮ 产短链脂肪酸的细菌有利于镁的吸收
在结肠中,双歧杆菌等细菌发酵会产生短链脂肪酸导致结肠酸化,有利于Mg2+的吸收。在人体小肠中,占主导地位的细菌门是链球菌属,它是一种厌氧菌,能够以较高的速率发酵相对简单的碳水化合物,而腔内酸性会显著诱导小肠对Mg2+的吸收。
自从认识到镁对人类健康的重要性以来,人们就提出了一个问题:如何才能清楚了解自身镁的状态?
① 原子吸收光谱法
原子吸收光谱法(AAS)可能是最古老、应用最广泛的评估生物样品中镁含量的技术。它的重要优点是可以应用于所有类型的生物样品,但其主要缺点是样品制备、仪器校准和分析耗时。
② 离子选择电极
Mg2+可用离子选择性电极进行电位测定,离子化的 Mg2+可以在全血、血清或血浆,或在红细胞等细胞中测量。该技术的主要缺点是电极缺乏特异性和反应时间较长。
③ 光学化学传感器
用于测定镁的光学化学传感器由于其良好的选择性、灵敏度和制备简单而成为重要且日益增长的应用领域。提出了几种荧光和比色测定方法,包括比色法和酶法测定和荧光化学传感器,前者的选择性和灵敏度更高。
④ 元素生物成像
化学成像是一个相当新的研究领域,它能够以高灵敏度和空间分辨率检测元素,另一个优势是它可以同时评估多种元素或分子。
镁是生物体必需的营养物质,因此必须定期从饮食中补充,以达到推荐摄入量,防止缺镁。当食物中的镁摄入不足时,可能就需要使用镁补充剂。
◮ 饮食补充
镁广泛分布于食物中,尽管食物中的镁含量受多种因素影响,包括灌溉的土壤和水、肥料、保护以及精炼、加工和烹饪方法。一般来说,种子、豆类、坚果(杏仁、腰果、巴西坚果和花生)、全麦面包和谷物(糙米、小米)、一些水果(杏和香蕉)和可可被认为是镁的良好来源。
◮ 镁补充剂
镁补充剂有多种配方,包括无机盐(例如氧化镁、氯化镁、硫酸镁)和有机化合物(例如柠檬酸盐、苹果酸盐、吡多酸盐、牛磺酸盐)。
不同种类补充剂对镁的吸收并不相同。此外,吸收取决于受试者的镁状态。Mg2+的吸收量取决于摄入剂量。例如,当膳食中Mg2+摄入量较低时,相对吸收率可达80%,而在Mg2+丰度状态下,相对吸收率降至20%。通常,Mg2+以离子形式被吸收。可溶性镁比溶解性较低形式的镁更容易被肠道吸收。
◮ 菊粉、寡糖、抗性淀粉等有助于增强镁吸收
含有膳食非发酵纤维的食物确实含有高含量的镁,但其生物利用度较低,与铁类似。相比之下,可发酵的碳水化合物(如菊粉、寡糖、抗性淀粉、甘露醇和乳果糖)可增强 Mg2+的吸收。
◮ 生活方式调整
减少摄入过多的酒精和咖啡因,因为它们可能影响镁的吸收。
通过适当的运动和减压活动来改善整体健康,从而促进镁的吸收和利用。
下图展示了镁的主要来源、镁补充剂以及增加或减少镁生物利用度的因素:
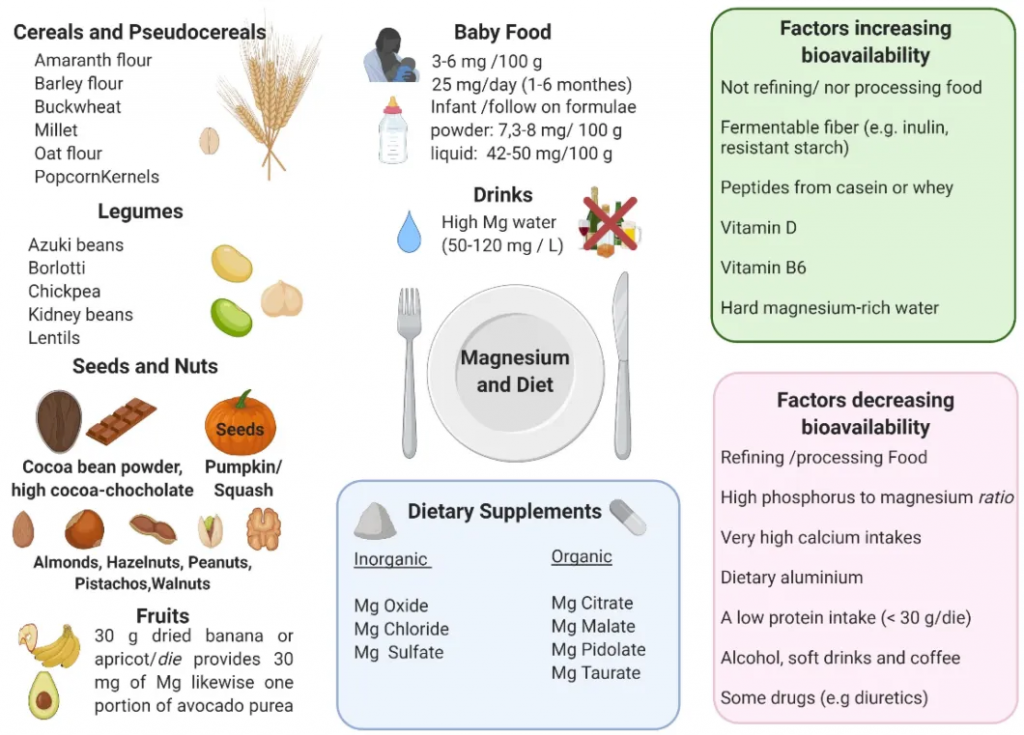
doi: 10.3390/nu13041136.
硒是一种重要的微量营养素,主要通过硒蛋白(可作为结构蛋白或酶)来支持多种生理功能。它在抗氧化防御、甲状腺激素代谢、免疫功能、生殖健康以及潜在的癌症预防和慢性疾病管理中发挥着重要作用。
硒缺乏在人体中也不罕见,并且女性中硒缺乏量高于男性。硒缺乏的原因可以归结为多种因素,以下是详细的说明:
① 生活在低硒地区、饮食中缺硒
某些地区的土壤中硒含量低,如中国的克山病和大骨节病的重病区,这些地方的植物和动物产品中硒含量较低。
海产品和动物内脏是硒的良好食物来源,如鱼子酱,海参,牡蛎蛤蜊和猪肾等。饮食中缺乏硒的来源,导致营养性缺硒。
② 农药、化工产品阻碍硒的吸收
环境污染,农药、化肥、化工原料的残留物可拮抗硒元素的吸收,造成农作物缺硒,进而导致人体缺硒。
③ 体质和疾病状况
进入中老年后,人体的消化、吸收能力也会逐渐降低,影响硒元素的吸收。
疾病加剧缺硒、缺硒加剧疾病,例如,肿瘤、心血管病、克罗恩病、溃疡性结肠炎、糖尿病、肝病患者体内往往处于缺硒状态。
④ 特殊人群的硒需求量增加
长期酗酒、吸烟、情绪紧张的人体内的硒流失量远高于健康人,此外,包括孕妇和哺乳期妇女、儿童和青少年、老年人、癌症患者、运动员和体力劳动者的硒需求量增加。
人体缺硒的表现主要为脱发、脱甲;部分患者会出现皮肤症状;少数患者可出现神经症状及牙齿损害等问题;严重缺硒可导致溶血性贫血、克山病和大骨节病。
硒缺乏还被认为是几种慢性疾病的风险因素,这些疾病涉及胃肠道、肌肉和神经系统的氧化应激和炎症有关。
克山病
克山病亦称地方性心肌病,这种病是由硒缺乏和柯萨奇病毒突变株的存在相互作用而引起的,患者主要表现为急性和慢性心功能不全,心脏扩大,心律失常以及脑、肺和肾等脏器的栓塞。
大骨节病
缺硒还与大骨节病(一种地方性骨软骨病)有关,大骨节病被认为是硒缺乏和谷物中霉菌毒素以及饮用水中腐殖酸含量高共同引起的。
◮ 硒主要在十二指肠、盲肠、结肠中被吸收
膳食中摄入的有机或无机硒均在胃肠道中吸收,研究表明,有机硒的吸收率高于无机硒。硒的主要吸收部位是十二指肠、盲肠和结肠。
硒氨基酸通过各种膜转运机制在十二指肠、盲肠和结肠中主动转运,而硒酸盐则通过 SLC26 基因家族的阴离子交换剂转运。
从十二指肠吸收的硒首先进入血液,与血浆中的红细胞、白蛋白或α球蛋白结合,也可结合β球蛋白、血浆高密度脂蛋白或低密度脂蛋白,随后转运至肝脏,在肝脏中代谢并用于生成硒蛋白,然后分布至身体的其他组织。
硒的主要排泄形式是通过尿液,然而,在过量摄入的情况下,可能会发生呼吸道排泄。在适量摄入硒的情况下,通过肾脏排出的主要单甲基化合物是硒糖,即1β-甲基硒N-乙酰-D-半乳糖胺。食物中未被吸收的硒被吸收到胆汁、胰腺和肠道分泌物中,并在粪便中排出。
硒的吸收、代谢和分布
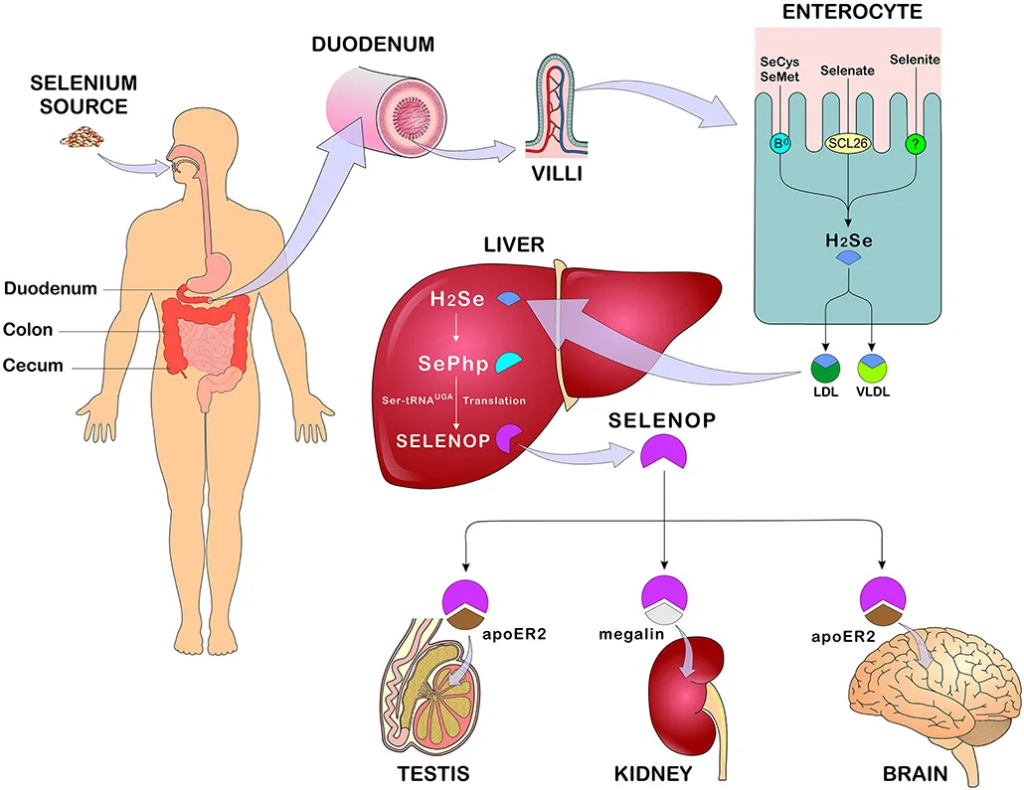
doi: 10.3389/fnut.2021.685317.
肠道微生物群的调节取决于硒的状态和硒衍生物的生物转化。
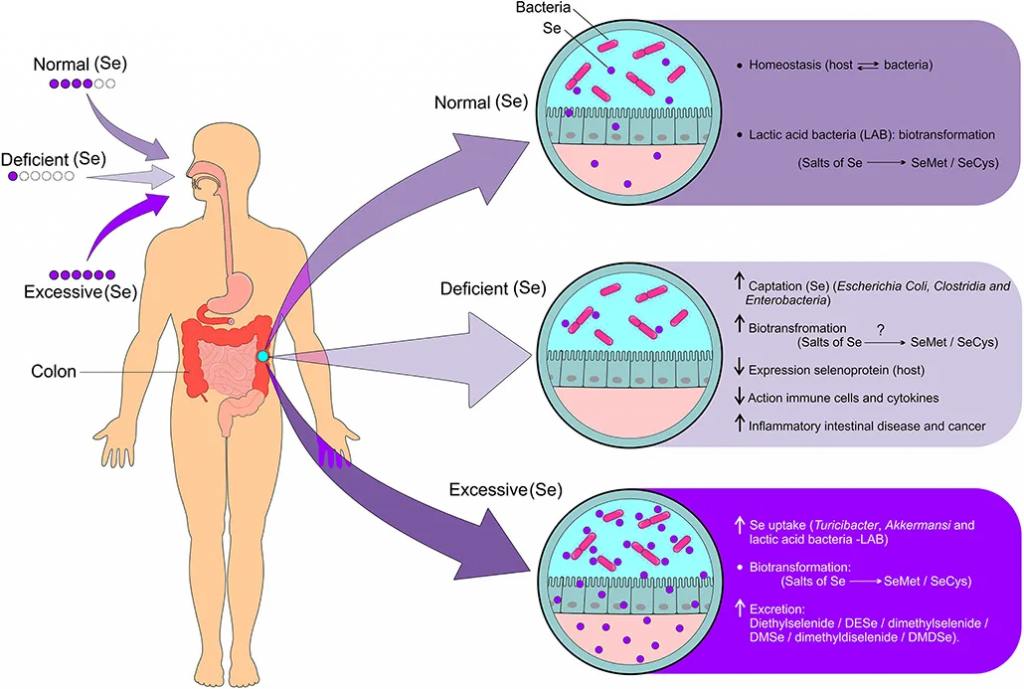
doi: 10.3389/fnut.2021.685317.
◮ 硒摄入充足时,肠道菌群有助于更好地转化和利用硒
如果硒摄入量充足,由于肠道和宿主细菌之间的有益关系,会导致硒化合物的生物转化(硒盐代谢为硒蛋氨酸和硒半胱氨酸),从而形成体内平衡。
一项研究表明,大鼠肠道菌群将几种无机和有机硒化合物代谢为硒蛋氨酸,并且硒蛋氨酸被整合到细菌蛋白质中。含有硒蛋氨酸的蛋白质可作为宿主动物的硒库,在肠道菌群中积累。尿液中的主要硒代谢物 SeSug1 被肠道菌群转化为营养上可利用的硒化合物。最后,在肠道菌群中观察到一些生物硒化合物(如SeCN、MeSeCys和SeSug1)对生物利用度有积极影响。
◮ 硒含量较低时,菌群会与宿主竞争导致更缺乏
尽管宿主和肠道菌群互利共生,但当微量营养素供应有限时,这两个环境就会变成竞争对手。肠道细菌对硒的吸收会对宿主体内硒蛋白的表达产生负面影响,导致硒蛋白在硒限制条件下的含量降低2到3倍。
硒缺乏会导致细菌(大肠杆菌、梭菌和肠杆菌)对硒的吸收增加,硒化合物的生物转化(硒盐代谢为硒蛋氨酸和硒半胱氨酸),宿主硒蛋白的表达减少,硒免疫细胞的活性降低,促炎细胞因子增加,炎症性肠病和癌症的风险增加。
◮ 一些菌群可以通过硒来增强毒力和致病性
一些细菌物种能够从硒中获益,从而触发致病机制。具有硒依赖性酶的细菌可以在哺乳动物肠道的厌氧条件下存活。因此,这些细菌通过使用硒来增加其毒力和致病性,从而对宿主产生一定危害。
硒状态可从三个层面进行评估,即摄入量、保留量/排泄量和组织浓度的生物标志物以及功能性生物标志物。
① 摄入量的评估
硒摄入量的评估可以使用评估食物消费的方法来执行,例如食物频率问卷。使用食物成分表可以估算食物中的硒含量。由于食物成分表中营养成分缺乏精确度,因此根据食物消费预测硒状态仍然是一个挑战,因为食物中硒浓度的变化与土壤中硒含量有关。
② 尿液硒浓度可以反应食物中的硒含量
测量尿液中的硒浓度被认为是硒状态的潜在可行生物标志物。此外,尿液中的硒浓度可用于识别硒状态的区域差异,并可能反映食物中硒含量随土壤类型的差异。
③ 指甲硒浓度可以反应硒的长期暴露情况
指甲中的硒浓度被认为是硒状态的优质生物标志物,因为它可以提供长期暴露(长达1年)的综合测量数据,而血液生物标志物则可指示短期暴露情况。注:脚趾甲被认为是非侵入性基质,并用于大型流行病学研究,因为它们生长缓慢、易于采集、受外部污染的影响较小。
④ 血浆硒浓度可以有效反应硒的摄入量情况
考虑到硒在血浆中的稳定性,血浆硒浓度是评估人体硒状态更有用的生物标志物。血浆中硒的测量已被证明可有效反映基线时硒浓度中等或较高的个体的摄入量 (补充) 变化。此外,强调了红细胞和全血中硒作为状态标志物的实用性,这两者都被报告为长期状态的标志物。
⑤ 硒功能的生物标志物
硒功能性的生物标志物包括SELENOP(占血浆硒的20-70%)、GPX3(占血浆硒的10-25%)和GPX1(可在红细胞、淋巴细胞、口腔细胞和组织活检标本中检测)。
血浆SELENOP被认为是硒摄入量相对较低的人群中硒状态的有用生物标志物,但不适用于硒摄入量高、在开始补充前硒水平就已经很高的人群。
GPX是细胞抗氧化防御系统的主要硒蛋白之一。由于硒蛋白的层次结构,推荐的硒摄入量是根据最佳血浆 GPX3 活性计算得出的。它还考虑了其他生物硒化合物正常浓度所需的硒量。
◮ 食物补充
巴西坚果、谷物、肉类、鱼类、海鲜、牛奶和坚果是硒的最佳来源。但鱼类和海鲜与汞相互作用会产生不溶性硒衍生物,从而降低硒的生物利用度。此外,饮食中的蛋白质、脂肪和重金属含量也会影响硒的生物利用度。
硒的生物利用度主要取决于其化学形态。一般而言,有机形态吸收更快。
◮ 药物补充
硒酵母胶囊:是一种常见的补硒药,主要成分为硒酵母,临床多用于治疗低硒的肿瘤、肝病、心脑血管疾病等。
亚硒酸钠片:属于一种常见的微量元素补充药,临床主要用于防治缺硒引起的疾病,如克山病、大骨节病等。
与矿物质相比,维生素在过去几年已经引起了广泛关注,市场上也涌现出众多维生素补充产品。因此,我们将维生素的讨论放在后面,但这并不意味着维生素的重要性被低估。顾名思义,维生素是“维持生命的重要元素”,它们在身体的正常运作、代谢过程以及免疫系统的健康中都扮演着不可或缺的角色。
维生素E又称生育酚,是一种脂溶性的维生素,是人体最主要的抗氧化剂之一。其对人体健康有多方面的作用,简单概况如下:
•抗氧化、抗自由基作用
•维持生育功能
•维持免疫功能
•减少细胞耗氧量
•改善脂质代谢
•抑制癌细胞分化
•促进红细胞膜稳定及红细胞的合成
•重要的血管扩张剂和抗凝血剂
•保护皮肤免受紫外线和污染的伤害
•对晶状体有一定保护作用
•促进蛋白质的更新合成
•治疗口腔溃疡
•治疗痔疮
最新的研究报告显示超过50亿人的维生素E摄入不足(占67%),这值得引起我们的重视。
根据最新的研究结果,探讨了维生素E缺乏的主要原因和促成因素。
① 营养缺乏
饮食中维生素E摄入不足,长期摄入低脂饮食或极低脂肪饮食可能导致维生素E摄入不足,因为维生素E是一种脂溶性维生素,主要存在于植物油、坚果和种子中。
缺乏富含维生素E的食物,如坚果、种子、植物油、绿叶蔬菜等。
② 吸收不良症
维生素E缺乏症通常是由脂肪吸收不良引起的,这种疾病会阻碍这种脂溶性维生素的正常吸收。脂蛋白代谢异常和α-生育酚转移蛋白缺陷等情况都可能导致维生素E缺乏。
③ 氧化应激和感染
发展中国家的人更容易出现维生素E缺乏症,因为他们更容易受到疟疾和艾滋病毒感染或其他氧化应激源的影响,而这些因素会增加人体对维生素E等抗氧化剂的需求。
④ 年龄和性别脆弱性
儿童和老年人更容易缺乏维生素E。此外,男性的风险可能高于女性,尽管这种性别差异的原因尚不完全清楚。
⑤ 减肥手术
接受减肥手术的患者,尤其是涉及吸收不良手术的患者,由于术后脂肪吸收受损,更容易出现维生素 E 缺乏症。
⑥ 遗传因素
家族性维生素E缺乏症是一种罕见的遗传综合症,会导致严重缺乏,并与氧化应激引起的多器官并发症有关。
⑦ 特殊人群需求量增加
饮用氯消毒自来水的人需要多摄入维生素E,心血管病患者、帕金森病患者、孕妇、中老年人和摄入酒精和激素的人维生素E的需求量也增大。
大多数人缺乏维生素E时,可能会导致贫血、免疫力下降、人体代谢紊乱、早衰、肌肉无力等症状。
•儿童
小儿缺乏维生素E时,可引发脊髓小脑病和轻度溶血性贫血。最为常见的是溶血性贫血,此外还可发生黄疸、全身性水肿、以及神经系统的症状,主要表现为小脑共济失调、色素性视网膜病、眼肌麻痹、眼球震颤和肌无力,反射减弱等。
•男性
男性严重缺乏维生素E会引起男性激素分泌不足、睾丸萎缩、精子生成障碍、精子减少或不成熟、精子活力不足等,甚至会导致不育。
•女性
女性缺乏维生素E容易导致黄体激素不足,易造成流产、不孕症、早产等,还容易造成皮肤干燥、易衰老。中年女性缺乏维生素E,很容易诱发更年期综合征、卵巢早衰。
•孕妇
孕妇若缺乏维生素E,所生婴儿会比较瘦小,发育较慢;孕妇严重缺乏维生素E会造成胚胎和胎盘萎缩,从而引起流产。
通过日常饮食调节维生素E是最便捷的方法,那么哪些食物中含有较高的维生素E呢?
种子植物的油,特别是小麦、黄豆、豌豆、棉籽和玉米胚芽油是含维生素E最丰富的来源(0.5-3mg/g)。
人造黄油也含有丰富的维生素E,而奶制品则含量较少,人和牛的初乳所含维生素E约比成熟乳含量高10倍。
其他植物如生菜,芹菜和甜薯也含有维生素E,但含量不高。蛋类、鸡(鸭)胗、绿叶蔬菜中也含有一定量的维生素E;肉,鱼类动物性食品,水果及其他蔬菜的维生素E含量较少。
维生素C,也称为抗坏血酸,是一种水溶性维生素,对人体健康非常重要。它在许多身体功能中起着关键作用,简单概况如下:
•抗氧化
•促进氨基酸中酪氨酸和色氨酸的代谢
•改善贫血
•增强免疫力
•促进胶原蛋白的形成
•防癌抗癌
•解毒排毒
•参与蛋白质合成
•改善脂肪和类脂特别是胆固醇的代谢
•提高钙的利用
① 饮食摄入不足
人体不能合成维生素C,必须从外界摄入。如果摄入不足,就有可能导致维生素C缺乏。
缺乏富含维生素C的食物:长期不摄入新鲜水果和蔬菜,如柑橘类水果、草莓、番茄、绿叶蔬菜等。
不均衡饮食:偏食或饮食单一,导致维生素C摄入不足。
② 吸收障碍
消化系统疾病:如克罗恩病、溃疡性结肠炎等,可能影响维生素C的吸收。
胃肠道手术:如胃切除术后,可能影响维生素C的吸收。
此外,维生素C遇热、碱或金属也极易被破坏,从而影响维生素C的利用。
③ 需求增加
生长发育期:儿童和青少年在快速生长阶段对维生素C的需求增加。
妊娠和哺乳期:孕妇和哺乳期妇女对维生素C的需求增加。
感染或疾病:在感染、手术或创伤后,身体对维生素C的需求可能增加。
④ 生活方式因素
吸烟:吸烟者体内维生素C的代谢加快,需求量增加。
酗酒:长期酗酒可能导致营养不良,包括维生素C缺乏。
维生素C缺乏症也称为坏血病,刚缺乏维生素C的时候症状不明显,大约一个月的时间才会出现症状。体内维生素C总含量低于300-400mg会出现明显症状。
•初期症状
缺乏维生素C初期常有一些非特异性表现,如易激、性情暴躁、倦怠、食欲减退、体重减轻和面色苍白等,也可出现易感染、伤口不易愈合或低热、呕吐、腹泻等消化功能紊乱症状。
•出血症状
随着病情的发展,可出现大小不等、程度不等的出血。常见长骨骨膜下出血;皮肤及黏膜出血多见于骨骼病变附近,膝部、踝部多见。
牙龈黏膜常肿胀、出血;也可出现鼻出血,眼结膜出血,眼眶骨膜下出血可引起眼球突出;偶见消化道出血、尿血甚至颅内出血。
•骨骼症状
维生素C缺乏症的较晚阶段患者下肢会由于骨膜下出血较多而肿胀、疼痛;部分患者肋骨与肋软骨的交接处会因骨干骺半脱位而隆起,形成坏血病串珠,内侧可扪及凹陷。
•长期症状
维生素C不足可影响铁的吸收和利用,加上长期出血会导致缺铁性贫血。当叶酸代谢障碍时,患者可能同时缺乏叶酸,从而出现巨幼红细胞贫血。
◮ 含维生素C的食物
维生素C广泛存在于新鲜蔬菜和水果中。番茄、花菜、柿子椒、深色叶菜、苦瓜、柑橘、柚子、苹果、葡萄、猕猴桃、冬枣中均富含维生素C。
一些维生素C含量较高的食物
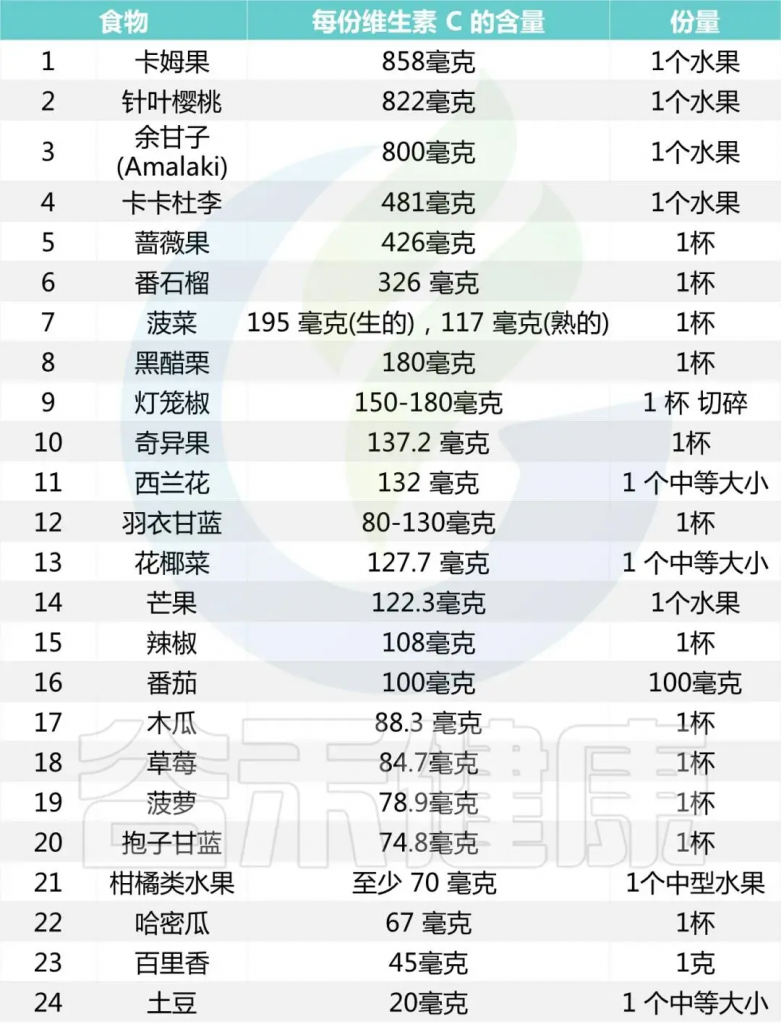
◮ 维生素C补充剂
可以补充维生素C的药品多种多样,包括:
(1)维生素C片;
(2)维生素C泡腾片;
(3)抗坏血酸钙;
维生素A是一种重要的脂溶性维生素,又称抗眼干燥症因子。需要注意的是,维生素A并不是单一的化合物,而是一系列包括视黄醇、视黄醛、视黄酸、视黄醇乙酸酯和视黄醇棕榈酸酯等的视黄醇衍生物。
维生素A是最受关注的营养素之一,它对于维持正常的视力、基因表达、生殖、胚胎发育、生长和免疫功能都是极为重要的。维生素A在人体具有广泛而重要的功能:
•参与暗光视觉的物质循环,使机体可适应暗光环境
•保持皮肤和黏膜的完整
•细胞核激素样作用
•维持和促进免疫功能
•促进生长发育和维持生殖功能
•对骨骼代谢有影响
•抗氧化、防癌
•促进血红蛋白生成
自然界的维生素A包括维生素A1、维生素A2两种。维生素A1即视黄醇,多存在于哺乳动物及咸水鱼的肝脏中;维生素A2即3-脱氢视黄醇,常存在于淡水鱼的肝脏中,其生理活性为维生素A1的40%。
75%以上吃西方饮食的人获得的维生素A是足够的,不需要担心缺乏的问题。然而,在许多发展中国家,维生素A的缺乏是非常普遍的。在某些地区,大约44-50%的学龄前儿童有维生素A缺乏症。并且柳叶刀最新研究公布的数据显示,男性摄入的维生素 A不足量估计高于女性。
维生素A缺乏症的公共卫生数据
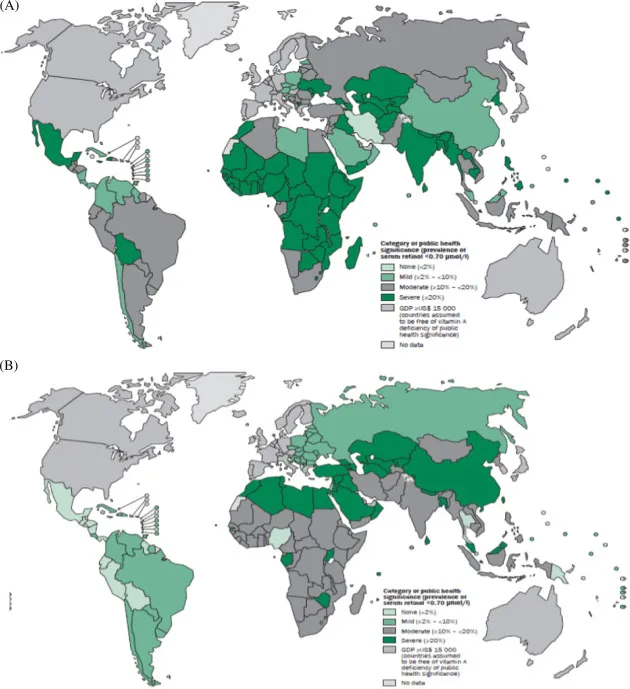
doi.org/10.1016/B978-0-12-802861-2.00002-X
上图反应了截止2018年的全球维生素A缺乏症情况:
(A)学龄前儿童;(B)孕妇
那么为什么一部分人会存在维生素A缺乏?主要是以下几点原因:
① 摄取不足
长期不摄入富含维生素A的食物,如动物肝脏、鱼肝油、乳制品、蛋黄,以及富含β-胡萝卜素的蔬菜和水果(如胡萝卜、甘薯、菠菜等)。
注:β-胡萝卜素,是一种原维生素A,你的身体能将其转化为维生素A。
② 排泄增加
肿瘤、泌尿系统疾病、急慢性感染性疾病等,可能会导致维生素A的消耗和流失增加,使得更易缺乏维生素A。
③ 吸收障碍
维生素A是脂溶性维生素,任何导致脂肪吸收不良的情况都会影响维生素A的吸收。这包括慢性胰腺炎、胆汁淤积、囊性纤维化等。
一些肠道疾病,如乳糜泻、克罗恩病等,这些疾病会影响肠道对维生素A的吸收。
④ 代谢异常
患有合成蛋白质和锌减少的疾病,如肝病、甲状腺功能低下、糖尿病等,导致胡萝卜素无法转变成维生素A。
维生素A的储存和代谢主要在肝脏进行,肝功能不全可能影响维生素A的代谢。
⑤ 需求增加
生长发育期:儿童和青少年在快速生长阶段对维生素A的需求增加。
妊娠和哺乳期:孕妇和哺乳期妇女对维生素A的需求增加。
无法通过正常饮食摄入足够的维生素A就可能导致这些人群缺乏。
•眼睛症状
维生素A的缺乏初期表现为眼睛干涩,随后可能出现夜盲;进一步发展会导致暂时和永久的眼睛损伤,甚至可能导致失明。这种缺乏是世界上主要的失明原因。
•皮肤症状
初期表现为皮肤干燥、脱屑;进一步发展可在大腿和手臂出现大量的丘疹,后期可蔓延至颈、腹、背等部位。
•生长发育障碍
长期缺乏维生素A,患儿可表现为骨骼粗短,牙齿发育不良、生长缓慢、智力轻度落后等。
•贫血
维生素A可以促进铁的吸收,当维生素A缺乏时,铁不能正常地被红细胞吸收,会造成贫血。
•免疫力下降
由于维生素A直接影响上皮细胞的体液免疫和细胞免疫,对机体的特异性免疫和非特异性免疫都具有一定作用,如果缺乏维生素A会导致机体的免疫力下降,容易继发感染性疾病。
•其他影响
缺乏维生素A还可能影响味觉、嗅觉的功能,导致食欲下降。
维生素A存在于动物体内,在鱼类特别是鱼肝油中含量很多。维生素A主要来源于各种动物肝脏和其他脏器类肉品,蛋黄、鱼油、奶油和奶制品。
植物中并不含有维生素A,但许多蔬菜和水果却含有维生素A原,维生素A原是指在人体内能转变为视黄醇,发挥维生素A生理功能的类胡萝卜素。富含维生素A原的食物包括各种红、黄、绿色蔬菜和水果,如胡萝卜、红心甜薯、菠菜、水芹、羽衣甘蓝、芥菜、南瓜、莴苣、西兰花等。
维生素B12,又称钴胺素,是一种水溶性维生素。维生素B12家族有四个成员,即氰钴胺、羟钴胺、腺苷钴胺和甲钴胺。
维生素B12对多种基本代谢功能至关重要,包括:
•促进红细胞发育
•促进人体神经细胞发育
•促进甲基转移
•提高叶酸利用率
•还参与脱氧核糖核酸(DNA)的合成,以及脂肪、糖类、蛋白质的代谢
•促进维生素A在肝脏的储存
维生素B12缺乏症非常常见,尤其是在素食者、孕妇和老年人中。同时数据表明女性摄入的维生素 B12不足量估计高于男性。
而导致维生素B12缺乏的原因可能是以下几种:
① 先天储备不足
孕妇多因长期素食、恶性贫血、胃肠道手术等引起体内维生素B12缺乏,从而导致新生儿维生素B12先天储备减少。
② 饮食结构不合理
长期素食或苯丙酮尿症患者长期拒绝动物蛋白摄入可引起体内维生素B12缺乏。
③ 吸收异常
包括以下几种情况:内因子的异常或缺失、维生素B12释放缓慢、回肠吸收面积减小、回肠维生素B12结合受体异常。
④ 先天性维生素B12代谢障碍
钴胺转运蛋白II是维生素B12的主要转运蛋白,先天性钴胺转运蛋白II缺乏可导致维生素B12转运障碍,从而出现维生素B12缺乏。
⑤ 其他因素
麻醉剂氧化亚氮可导致维生素B12失去生物活性,引起脊髓变性;大剂量维生素C可导致食物中维生素B12的利用率下降;不适当补给叶酸可诱导或加重维生素B12缺乏。
缺乏维生素B12导致的疾病有巨幼红细胞性贫血、神经系统损害、高同型半胱氨酸血症。
•血液系统
缺乏维生素B12可表现为贫血,乏力、肝脾大,重症患者可有皮肤瘀点、瘀斑等。严重者有发热,皮肤、巩膜轻度黄染。
•神经系统
症状出现较迟,有神经障碍、脊髓变性,脱髓鞘和严重的精神症状,患者有手指和脚对称性麻木及感觉异常、出汗障碍,指端和关节突处溃疡、行动困难、共济失调、健忘、易激、甚至痴呆。年幼患者有精神抑郁、智力减退,头、四肢和躯干震颤,亦可因昏迷而死亡。
•消化系统
消化道症状有呕吐,腹泻和舌炎,舌乳头萎缩,舌面有炎性小疱或浅溃疡,自觉疼痛。
•心脑血管
维生素B12缺乏会引起同型半胱氨酸过高,导致动脉粥样硬化、心脑血管疾病。
•小儿缺乏维生素B12
早期表现为精神情绪异常、表情呆滞。少哭少闹、反应迟钝、睡眠多等症状,最后可能出现贫血。
肠道菌群可以是维生素B12的消费者或生产者。
◮ 肠道细菌过度生长会导致维生素B12缺乏
胃肠道中大约80%的微生物群被认为是维生素B12的消费者。因此,细菌过度生长可能会与宿主竞争外源性维生素B12,从而降低生物利用度。在小肠细菌过度生长中,厌氧菌增加对维生素B12的消耗被认为是维生素B12缺乏症状的主要原因。
减少维生素B12消耗细菌的数量对维生素B12缺乏症有益。例如,每日使用益生菌治疗乳酸杆菌对细菌过度生长和维生素B12吸收均有益,这表明益生菌治疗可以改善维生素B12缺乏症。
◮ 一些肠道菌群可以产生维生素B12
据报道,有几种细菌是维生素B12的生产者,如罗伊氏乳杆菌和屎肠球菌。从发酵食品中分离出的植物乳杆菌和棒状乳杆菌产生维生素B12,而动物双歧杆菌在牛奶发酵过程中合成维生素B12。
此外,可能参与维生素B12合成和代谢的菌还有:
大约三分之一的嗜黏蛋白阿克曼菌(A.muciniphila)分离株能产生类似于A.glycaniphila的维生素B12。多种结肠微生物可以产生可供A.muciniphila利用的维生素B12。
据推测,补充产生维生素B12的细菌可以改善胃肠道对维生素B12的利用率。这种假设已在喂食缺乏维生素B12饮食的小鼠身上得到证实。补充产生维生素B12的菌株罗伊氏乳杆菌CRL1098可预防维生素B12缺乏的症状,表明肠道细菌对维生素B12缺乏症具有治疗作用。
◮ 肠道菌群改善了维生素B12的吸收利用
肠道菌群除了生产或消耗维生素B12外,还可能通过影响吸收相关的生理因素间接改变维生素B12的生物利用度。
与酸分泌或酶含量减少有关的胃肠道疾病可能会干扰食物中维生素B12的释放或维生素B12转化为内在因子。在以肠道通透性异常为特征的炎症性肠病中也观察到维生素B12吸收减少。
作为益生菌,Lacidofil治疗显著改善了H.pylori感染的胃酸分泌,从而有助于食物中维生素B12的释放。一些肠道细菌也表现出对炎症性肠病的缓解作用,这可能通过使肠道通透性正常化来改善维生素B12的吸收。
然而,肠道菌群与宿主之间的过度竞争可能会干扰维生素B12的生物利用度。例如,多形拟杆菌 (Bacteroides thetaiotaomicron)表达一种对维生素B12运输至关重要的表面暴露脂蛋白,名为BtuG。BtuG的结合亲和力较高,可能会将维生素B12从内在因子中移除,从而降低维生素B12的吸收。
饮食和微生物群的在维生素B吸收中的作用
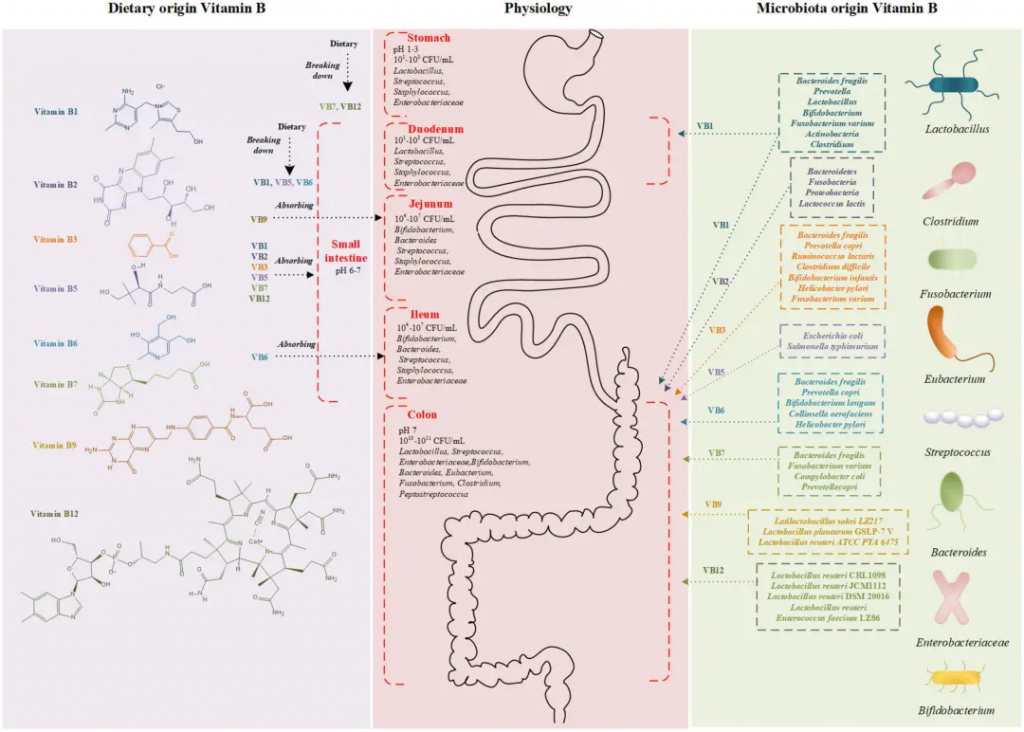
Wan Z,et al.Front Nutr.2022
维生素B12的膳食来源主要为动物性食品,含维生素B12较丰富的食物为动物内脏(肝、肾、心)、双壳贝(蛤、蚶和牡蛎)、脱脂奶粉、蟹、石鱼、鲑鱼、沙丁鱼和蛋黄,其他还有龙虾、鳕鱼、比目鱼、金枪鱼、发酵奶酪、鲜奶制品。
豆制品经发酵也会产生一部分维生素B12。
!
小贴士
有的人可能会担心维生素B12补充过量是否会存在一定风险,大量的维生素B12并不有害,因为它通常吸收不好,容易排出体外。
目前对体内维生素水平是否缺乏有以下几种方法:
1
临床症状观察
观察身体是否出现特定维生素缺乏的症状。例如,维生素C缺乏可能导致牙龈出血,维生素D缺乏可能导致骨骼疼痛或软化。
2
血液检测
血清维生素水平:通过血液检测直接测量特定维生素的浓度,如维生素D、B12、A等。
代谢产物检测:测量血液或尿液中某些代谢产物的水平,间接反映维生素状态。
3
饮食评估
饮食记录分析:记录几天的饮食,分析是否摄入足够的维生素。
食物频率问卷:通过问卷了解饮食习惯,评估维生素摄入情况。
4
肠道菌群健康检测
通过肠道菌群健康检测,也可以查看近期体内维生素状况。
与通过血液进行维生素检测不同,肠道菌群的评估更加反映一段时间(一般2周左右)的长期状态。
注意,菌群会受检测前一天饮食的影响,造成15~30%的菌群改变,同样也会反映在营养状况的评估上,因此建议检测前一天尽量保持近期正常饮食 ,这样能更好的反映真实的营养饮食状态。
5
功能性测试
红细胞溶血试验:用于评估维生素E的抗氧化能力。
骨密度测试:用于评估维生素D缺乏对骨骼的影响。
在了解维生素的重要性和缺乏带来的危害后,我们还需要了解一下影响维生素合成吸收的因素。
1
年龄变化
维生素缺乏是一个严重的问题,尤其是在老年人中。随着年龄的增长,营养需求会随之变化。
例如食物中的维生素B12需要胃酸及胃蛋白酶的作用才能释放出来被吸收,而老年人胃酸及胃蛋白酶分泌减少,就会影响维生素B12的吸收。
2
饮食摄入
不同的食物含有不同种类和数量的维生素。新鲜水果、蔬菜、全谷物、坚果、种子、肉类和乳制品是维生素的主要来源。饮食中缺乏这些食物会导致维生素摄入不足。
维生素主要在小肠中吸收,其生物利用度取决于食物成分,相关相互作用等。饮食和膳食的组成会通过影响肠道转运时间或混合胶束的肠道形成来影响某些维生素的吸收。
饮食中足量的水和膳食脂肪对于分别吸收水溶性和脂溶性维生素至关重要。
由于脂溶性维生素可以溶解在脂肪中,因此与膳食脂肪一起食用时最容易被吸收。例如,一种富含维生素A的小胡萝卜,如果单独食用,将在食物中获取维生素A,但如果它是在含有一些膳食脂肪的食物成分中(比如说,橄榄油),将增加体内维生素A的吸收。
doi: 10.7717/peerj.11940
食物的性质(物理状态)也会影响维生素的吸收效率。例如,存在于可消化性较差的纤维植物材料中的类胡萝卜素已被证明相对于维生素A表现出较低的生物利用度。
3
药物的使用
一些药物会改变营养物质的吸收或代谢方式。例如,抗惊厥药会减少叶酸的吸收。
抗生素的使用会影响众多维生素特别是B族维生素的吸收。例如,在饮食中添加青霉素和金霉素会增加雄性大鼠的肝脏维生素B2浓度,以及B2和B3在尿液中的排泄。然而,链霉素和放线菌酮的施用降低了肝脏中维生素B9和B12的浓度。
4
遗传因素
人类基因的变异与肠道结构和微生物组组成有关。人类肠道微生物群中存在不同的维生素B生物合成途径支持人类遗传变异影响维生素B合成的观点。
维生素的合成吸收不仅需要靠饮食补充,还与吸收相关。而维生素的吸收涉及到相关基因,例如:
MTHFR 基因的突变会影响我们产生加工维生素B9的酶——亚甲基四氢叶酸还原酶。
亚甲基四氢叶酸还原酶是叶酸代谢通路中的一种重要的辅酶,亚甲基四氢叶酸还原酶基因缺陷,容易造成叶酸在体内的代谢障碍,MTHFR基因最主要的两种突变为C677T、A1298C基因多态性。该两种位点同时突变可显著降低MTHFR活性进而降低叶酸水平。
VDR基因(维生素D受体):维生素D(来自阳光、食物或补充剂)经过转化步骤后,活性形式骨化三醇 (1,25(OH)2D3 ) 可以通过VDR在细胞内发挥作用,是打开或关闭基因的转录因子。该基因突变可能导致维生素D缺乏引起的佝偻病。
5
菌群影响维生素的合成吸收
肠道菌群通过各种代谢途径影响维生素的合成,例如拟杆菌属、肠球菌属和双歧杆菌属等人类肠道共生菌可以从头合成维生素K和大多数水溶性B族维生素。
6
暴露于自由基
自由基是含有不成对电子的化学物质,可以诱导氧化应激。一个这样的例子是一氧化氮,它与金属离子形成复合物,包括钴,维生素B12的一种结构成分,因此使其无法用于细菌维生素B12的生物合成。此外,维生素生产者(如脆弱拟杆菌)暴露于过氧化氢等自由基会抑制其生长 ,从而降低维生素的生物合成能力。
1
通过饮食直接补充
当我们知晓维生素缺乏的时候,可能希望通过饮食来补充相应缺乏的维生素,下表列出了常见的维生素的食物来源,可供参考。

此外,宿主饮食作为肠道中细菌的底物,含有益生元和其他膳食营养素(如微量营养素和多酚)的饮食可以显著影响有益细菌的生长,包括维生素生产菌,从而有利于产生更多的维生素。
一些维生素,如核黄素(维生素B2),可作为氧化还原介质并刺激营养缺陷菌(如Faecaibacterium prauznitsii)的生长。
2
通过产维生素的益生菌调节
除了通过饮食直接补充之外,我们还可以通过补充产维生素的益生菌来调节,从而改善疾病。
双歧杆菌—叶酸
在健康成人中补充益生菌菌株青春双歧杆菌DSM 18350、青春双歧杆菌DSM 18352和假链双歧杆菌DSM 18353,导致粪便中叶酸浓度显著增加。
乳酸菌—核黄素
乳酸菌通过产生核黄素(维生素B2)和叶酸发挥抗炎和抗氧化作用。乳酸菌通过不同的机制抑制炎症过程,包括调节炎症性肠病患者肠道菌群紊乱、保护肠道屏障和黏膜的正常功能、调节人体免疫反应等。
AKK菌—维生素B12
Akkermansia muciniphila是肠道中的一种常见细菌,可保护肠道免受炎症和肿瘤侵袭;它还产生维生素B12以缓解炎症性肠病患者的维生素缺乏症。
产维生素的益生菌及其作用

doi.org/10.3390/nu14163383
3
使用补充剂
在饮食无法满足需求时,可以考虑使用维生素补充剂,特别是对于特定人群(如孕妇、老年人、素食者等)。
个性化营养方案:在使用补充剂前,最好咨询医生或营养师,以制定个性化的饮食和补充方案,以满足特定的维生素需求。
4
调整生活方式
避免过度烹饪:过度烹饪会导致食物中的维生素流失,因此在烹饪食物时应尽量减少烹饪时间和温度。
避免吸烟和饮酒:吸烟和饮酒会影响身体对维生素的吸收和利用,因此应尽量避免吸烟和饮酒。
适量运动:适量运动有助于改善整体健康,促进营养吸收。
晒太阳:阳光中的紫外线可以促进合成维生素D,因此适当晒太阳可以帮助维持体内维生素D的水平。
5
定期健康检查
通过血液检测等方式监测维生素水平,及时发现缺乏或过量。在谷禾肠道菌群健康检测中,我们也能看到结果报告中关于维生素的评估。
治疗基础疾病,保持健康状态:某些疾病(如消化系统疾病)可能影响维生素的吸收,治疗这些疾病有助于改善维生素水平。
微量营养素(矿物质和维生素)缺乏是全球最常见的营养不良形式之一,尤其在中低收入国家的妇女、幼儿和青少年、老年人中更为严重。这种缺乏及其负面后果是许多地区的重要公共卫生问题,影响国民健康和经济。
世界卫生组织(WHO)和联合国粮食及农业组织(FAO)确定了改善微量营养素缺乏症的四大策略:营养教育,提高饮食多样性和质量;食品强化;补充;以及疾病控制措施。
当微量营养素缺乏较严重时,应采用补充剂。补充剂可以每日服用,也可以间歇性服用。补充剂作为一种策略,要求补充剂的提供切实可行,并有足够的计划来确保依从性。但补充剂并不能解决缺乏的根本原因,只是提供了一种相对经济有效的短期解决方案。人们越来越担心补充营养素可能表现出与食物中的营养素不同的生理反应和吸收:叶酸、锌和铁就是一个例子。
与补充剂相比,饮食改善是一种更长期的对抗微量营养素缺乏的策略。改善饮食与补充剂的不同之处在于,改善饮食意味着摄入丰富多样的食物,这些食物中含有多种微量营养素以及其他对健康有益的成分,同时食物中的微量营养素通常以天然的形式存在,与其他成分相互配合,使得它们更容易被人体吸收和利用。并且食物中的微量营养素其含量和比例相对较为安全,不至于补充过量。
一种新兴方法是生物方法,即可以通过改善肠道菌群来调节微量营养素水平,从而改善疾病。肠道菌群可以改善微量营养素的吸收利用,而肠道细菌过度生长会导致与宿主竞争,进而微量营养素缺乏。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
特别说明:本文中营养缺乏状况是基于柳叶刀-全球健康研究的185个国家的调查情况,中国居民的膳食营养缺乏可能与其存在一定差异,比如我国由于长期使用添加碘盐,碘缺乏的人群比例要远低于该研究。
主要参考文献
Singer P, Robinson E, Raphaeli O. The future of artificial intelligence in clinical nutrition. Curr Opin Clin Nutr Metab Care. 2024 Mar 1;27(2):200-206.
Barone M, D’Amico F, Brigidi P, Turroni S. Gut microbiome-micronutrient interaction: The key to controlling the bioavailability of minerals and vitamins? Biofactors. 2022 Mar;48(2):307-314.
Das NK, Schwartz AJ, Barthel G, Inohara N, Liu Q, Sankar A, Hill DR, Ma X, Lamberg O, Schnizlein MK, Arqués JL, Spence JR, Nunez G, Patterson AD, Sun D, Young VB, Shah YM. Microbial Metabolite Signaling Is Required for Systemic Iron Homeostasis. Cell Metab. 2020 Jan 7;31(1):115-130.e6.
Knezevic J, Starchl C, Tmava Berisha A, Amrein K. Thyroid-Gut-Axis: How Does the Microbiota Influence Thyroid Function? Nutrients. 2020 Jun 12;12(6):1769.
Wang J, Wu S, Zhang Y, Yang J, Hu Z. Gut microbiota and calcium balance. Front Microbiol. 2022 Dec 20;13:1033933.
Shkembi B, Huppertz T. Calcium Absorption from Food Products: Food Matrix Effects. Nutrients. 2021 Dec 30;14(1):180.
Shlisky J, Mandlik R, Askari S, Abrams S, Belizan JM, Bourassa MW, Cormick G, Driller-Colangelo A, Gomes F, Khadilkar A, Owino V, Pettifor JM, Rana ZH, Roth DE, Weaver C. Calcium deficiency worldwide: prevalence of inadequate intakes and associated health outcomes. Ann N Y Acad Sci. 2022 Jun;1512(1):10-28.
Fiorentini D, Cappadone C, Farruggia G, Prata C. Magnesium: Biochemistry, Nutrition, Detection, and Social Impact of Diseases Linked to Its Deficiency. Nutrients. 2021 Mar 30;13(4):1136.
Farsinejad-Marj M, Saneei P, Esmaillzadeh A. Dietary magnesium intake, bone mineral density and risk of fracture: a systematic review and meta-analysis. Osteoporos Int. 2016 Apr;27(4):1389-1399.
World J Gastroenterol. Jan 14, 2023; 29(2): 332-342Published online Jan 14, 2023.
Ferreira RLU, Sena-Evangelista KCM, de Azevedo EP, Pinheiro FI, Cobucci RN, Pedrosa LFC. Selenium in Human Health and Gut Microflora: Bioavailability of Selenocompounds and Relationship With Diseases. Front Nutr. 2021 Jun 4;8:685317.
Valdes AM, Louca P, Visconti A, Asnicar F, Bermingham K, Nogal A, Wong K, Michelotti GA, Wolf J, Segata N, Spector TD, Berry SE, Falchi M, Menni C. Vitamin A carotenoids, but not retinoids, mediate the impact of a healthy diet on gut microbial diversity. BMC Med. 2024 Aug 7;22(1):321.
Singer P, Robinson E, Raphaeli O. The future of artificial intelligence in clinical nutrition. Curr Opin Clin Nutr Metab Care. 2024 Mar 1;27(2):200-206.
Ian Darnton-Hill,Chapter 2 – Prevalence, Causes, and Consequences of Micronutrient Deficiencies. The Gap Between Need and Action,Editor(s): M.G. Venkatesh Mannar, Richard F. Hurrell,Food Fortification in a Globalized World,Academic Press,2018,Pages 13-28,
ISBN 9780128028612.
Wan Z, Zheng J, Zhu Z, Sang L, Zhu J, Luo S, Zhao Y, Wang R, Zhang Y, Hao K, Chen L, Du J, Kan J, He H. Intermediate role of gut microbiota in vitamin B nutrition and its influences on human health. Front Nutr. 2022 Dec 13;9:1031502.

谷禾健康

每个清晨,无数人依赖咖啡来开启新的一天。咖啡作为全球最受欢迎的饮料之一,不仅因其独特的味道和香气备受青睐,还因其对健康和多种生物过程的有益影响而广受关注。历史上,人们曾普遍认为饮用咖啡会对健康产生显著的负面影响,但现今越来越多的证据表明,咖啡对多个健康方面都具有重要的积极作用。
咖啡的生理影响源于其复杂的成分构成,包括超过1000种不同的生物活性化合物,如咖啡因、咖啡豆醇、绿原酸、咖啡醇,以及多种微量营养素,如镁、钾、维生素E。尽管咖啡对健康有诸多益处,但过量饮用可能导致一些心血管和胃肠道不良反应及功能障碍。
越来越多的人体和动物研究证据表明,咖啡对肠道微生物群和胃肠功能具有调节作用,包括运动、分泌、吸收和免疫反应等方面。咖啡对胃肠功能的影响可能部分是通过对微生物群的调节来实现的。适量饮用咖啡(每天<4杯)可增加肠道菌群多样性,提高厚壁菌门和放线菌门的相对丰度,降低拟杆菌门的丰度。
咖啡的摄入还可能影响肠道菌群的代谢产物,如短链脂肪酸,这些物质在调节能量代谢、炎症反应和维持肠道健康方面起着关键作用。短链脂肪酸,如丁酸,是肠道上皮细胞的主要能量来源,并且具有抗炎和抗癌的特性。
然而,咖啡对肠道菌群的影响可能因个体差异而异,这可能与个人的饮食习惯、生活方式、遗传等因素有关。例如,一些研究指出,经常食用高脂肪、高糖食物的人可能会有不同反应,因为这种饮食可能会破坏肠道菌群的平衡,从而影响咖啡代谢产物的生成。
本文我们从咖啡的起源,到探讨咖啡对肠道微生物群组成、多样性的具体影响,包括咖啡对健康和疾病状态下某些胃肠道功能的影响,并讨论肠道微生物群在这些与咖啡相关的胃肠道功能变化中可能扮演的角色,以及我们如何在享受咖啡的同时保护肠道健康的一些建议。
在非洲埃塞俄比亚高原的Kefa森林中,生长着一种奇特的野生植物——咖啡树。传说公元850年,牧羊人卡尔迪发现吃了红色浆果的山羊异常兴奋,他尝试后也感到兴奋和愉悦,于是向村民宣布了这一发现。
冲泡的咖啡豆实际上是一种经过加工和烘烤的水果种子,这种水果被称为咖啡浆果。

成熟的(红色)和未成熟的(绿色)咖啡浆果。 图源:Britannica
几个世纪后,咖啡树传到阿拉伯半岛,苏菲派僧侣可能是最早制成咖啡饮料的人,用以提神。尽管有伊斯兰教权威视咖啡为违禁饮料,但许多穆斯林将其作为酒精替代品。咖啡因其提神效果在阿拉伯世界流行,15世纪麦加和16世纪君士坦丁堡的咖啡馆成为社交热点,被称为“智慧学校”。
随着奥斯曼帝国扩张,咖啡文化传入欧洲,16世纪末教皇克莱门特八世品尝后给予祝福。
17世纪末,咖啡在英国、美洲殖民地和欧洲大陆蓬勃发展,种植也从也门扩散到爪哇岛等地,18世纪传到美洲。

咖啡馆,17世纪英国,1668年的画作。图源:Britannica
1825年,夏威夷群岛开始种植咖啡。到了 20 世纪,咖啡产量最大的地区集中在西半球,尤其是巴西。
1950 年后,速溶咖啡的生产日益完善。速溶咖啡的流行导致非洲更便宜的罗布斯塔咖啡豆产量增加。到了2020年,全球咖啡产量最大的国家是巴西、越南、哥伦比亚、印度尼西亚、埃塞俄比亚。
从埃塞俄比亚高原的小发现到全球产业,咖啡不仅成为了一种广受欢迎的饮品,也成为了科学研究的热点。正如古代的苏菲派僧侣发现咖啡可以帮助他们保持清醒一样,现代科学家们也对咖啡可能带来的健康影响产生了浓厚的兴趣。让我们来看看,这种起源于非洲的神奇饮料,是如何影响我们的健康的。
咖啡是由一千多种化学物质组成的复杂混合物。你在咖啡店点的那杯咖啡可能与你在家里煮的咖啡不同。一杯咖啡的定义在于所用的咖啡豆、烘焙方式、研磨量以及冲泡方式。
人们对咖啡或咖啡因的反应也可能有很大差异。
过去的研究表明咖啡可能有副作用,但最新的研究表明,它实际上可能对健康有益。
以下是喝咖啡的一些最显著的健康益处:
癌症预防
咖啡可能有助于降低多种癌症的风险。研究发现,经常喝咖啡的人患前列腺癌的可能性较小。此外,咖啡中的咖啡因可能有助于预防从非黑色素瘤皮肤癌到子宫内膜癌等各种癌症。
降低患糖尿病的风险
一些研究表明,经常饮用含咖啡因或不含咖啡因的咖啡可能会降低患 2 型糖尿病的风险。另外,咖啡中的咖啡因对血糖没有明显影响。
预防阿尔茨海默病和帕金森病
饮用咖啡与降低罹患阿尔茨海默病和帕金森病等疾病的风险有关。对于目前被诊断患有帕金森病的人来说,喝咖啡可能有助于减少震颤的频率。
为什么研究会逆转?如果仅关注饮食的一个方面,很难将其与健康状况联系起来,因为还有很多其他因素可能起作用。
例如,对咖啡的早期研究并没有考虑到大量饮用咖啡的人也习惯于使用烟草和久坐不动。同样,这些早期研究也忽视了咖啡对肠道菌群的潜在影响。
这些新的发现帮助我们更全面地理解咖啡对健康的影响。下面,我们具体来看一下,咖啡到底是如何通过对人体肠道菌群,以及涉及的多种生物活性化合物和肠道微生物的相互作用,对人体健康产生影响的。
肠道菌群与其微环境密切协调。饮食、生活方式和健康状况的任何变化都会引起菌群结构和组成的显著变化。多项动物和人类样本研究调查了咖啡摄入后肠道菌群的变化。
▼ 咖啡对微生物群多样性的影响
一项大型人群宏基因组学研究发现,饮用咖啡、茶和红酒(这些物质的多酚含量较高)与粪便样本中肠道菌群的 α 多样性增加有关。
最近的一项横断面研究表明,基于成年人每日咖啡因和咖啡摄入量,结肠黏膜相关细菌的群落组成和结构存在显著差异。
通过人体活检评估了低和高咖啡摄入量对结肠黏膜相关微生物组成的影响,发现较高的咖啡摄入量与较高的α多样性和较高的Faecalibacterium和Alistipes相对丰度有关,与较低的Erysipetoclostridium相对丰度有关。
▼ 咖啡对微生物群组成的影响
下表总结了人类和动物在饮用咖啡或使用咖啡成分治疗后肠道菌群的具体变化。
咖啡对人体和动物研究中微生物群组成的影响
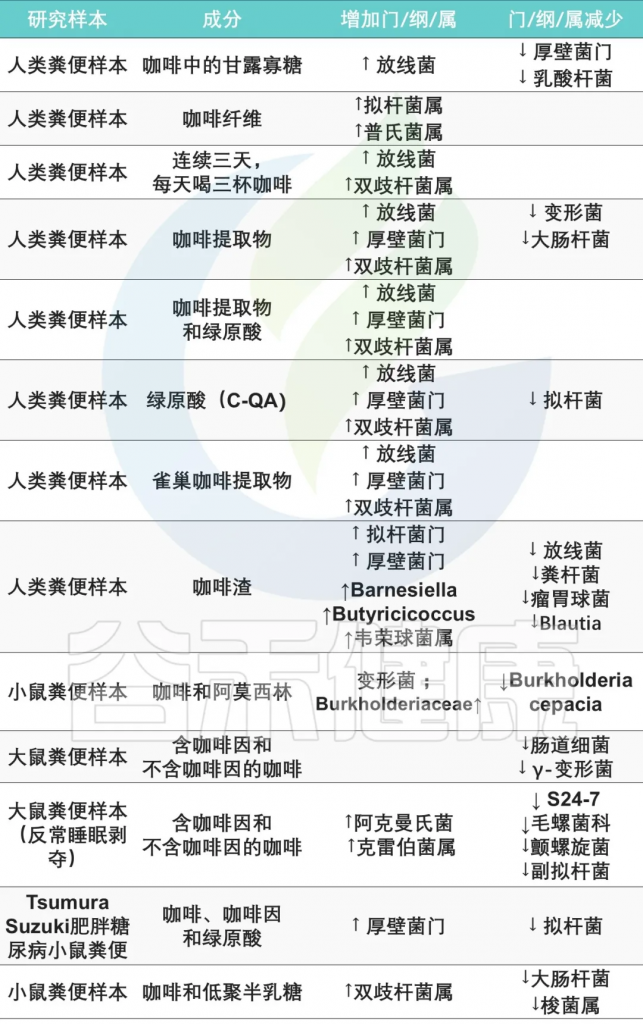
doi.org/10.3390/nu16183155
咖啡对不同菌群的影响可能存在差异
大多数研究人类粪便样本的研究报告,咖啡增加了厚壁菌门和放线菌门的相对丰度。
一些研究报告咖啡降低了肠道中拟杆菌门的相对丰度,而另一项研究报告可溶性咖啡纤维增加了属于拟杆菌门的拟杆菌-普雷沃菌属的相对丰度60%。
咖啡可能增加有益菌群的丰度
一项人体志愿者研究显示,连续3周每天饮用3杯咖啡可以显著改变微生物群组成,增加肠道中有益的放线菌门和双歧杆菌属的丰度。
咖啡可能影响短链脂肪酸的产生
一项啮齿动物模型研究发现,长期咖啡消费导致产生短链脂肪酸的细菌(如粪杆菌和长双歧杆菌)增加,同时普雷沃菌属减少,结果导致短链脂肪酸水平随后增加。
咖啡对肠道微生物生长的影响存在争议
Jaquet等人报告咖啡促进某些特定细菌种类的生长。
然而,Nakayama等人发现咖啡可能对大肠杆菌有抗菌作用。
还有报告称粪便细菌不受咖啡消费的影响。
一项对大鼠的研究中,发现咖啡提取物显著抑制了肠道菌群的生长。
与普通LB琼脂相比,含1.5%咖啡的LB琼脂上结肠内容物中细菌的生长显著受到抑制(9.31×109 CFU/克 vs 9.65×109 CFU/克)。含3%咖啡时,细菌群的生长进一步被抑制到5.02×105 CFU/克。
咖啡因可能不是抑制细菌生长的主要成分
脱咖啡因咖啡提取物在体外显示了类似的抑制细菌生长的效果。体内研究也发现,脱咖啡因咖啡与普通咖啡显示了类似的效果。
普通咖啡和脱咖啡因咖啡在喂食咖啡3天的大鼠的肠道细菌和γ-变形菌种类都减少了,这表明咖啡因以外的成分或代谢物是造成观察到的抗菌作用的原因。
咖啡的不同活性成分对微生物生长有不同的影响
从咖啡渣中提取的甘露寡糖 (MOS) 能够通过刺激一些有益菌属的生长,如Barnesiella 、Odoribacter、Coprococcus 、Butyricicoccus、Intestinimonas、Pseudoflavonifractor、Veillonella等,对肠道菌群发挥益生作用。
而咖啡渣基质在水解过程中产生的糠醛和多酚,可能对其他有益菌属产生抑制作用,如Faecalibacterium、Blautia、Dialister、Collinsella、Butyricimonas、Ruminococcus、Anaerostipes。
咖啡对微生物的影响可能因微环境而异
体外粪便M-batch培养研究也报告,咖啡有利于双歧杆菌、乳杆菌、普拉梭菌在肠腔中的生长,而XIVa组、粪球菌属和普拉梭菌在粘膜环境中增加,表明咖啡对微生物群体的影响取决于微环境因素。
总的来说,这些研究结果表明咖啡可能抑制某些细菌的生长,同时促进其他细菌的生长。这种影响可能不仅仅依赖于咖啡因,咖啡中的其他成分也可能发挥重要作用。此外,咖啡的加工方法和肠道的微环境因素也可能影响咖啡对肠道微生物的作用。
肠道菌群在竞争性抑制肠道病原体中起着至关重要的作用,有助于维持肠道稳态和改善免疫系统。
咖啡中的多种成分具有抗菌作用
有研究表明,饮用咖啡可显著减少小鼠小肠和结肠中的大肠杆菌和梭菌属细菌数量。
那么,咖啡中的哪些成分具有抗菌作用呢?
咖啡提取物中含有高含量的绿原酸,而绿原酸与咖啡的抗菌、抗真菌和抗病毒功效有关。
注:绿原酸(Chlorogenic Acid,CGA) 是一种重要的生物活性物质,广泛存在于植物性食品中,如咖啡豆、苹果、蓝莓、向日葵仁等。它是由咖啡酸和奎尼酸通过缩合反应形成的天然产物。绿原酸具有多种药理作用,包括抗氧化、抗炎、抗菌、抗病毒、抗肿瘤、降血糖、降血脂等。
咖啡中存在的两种重要代谢物酚酸和类黑精(Melanoidins)也对革兰氏阳性菌(金黄色葡萄球菌、单核细胞增生李斯特菌)和酵母菌(白色念珠菌)具有抗菌活性。
注:
酚酸(Phenolic acids) 是一类含有酚环的有机酸,广泛存在于植物中,具有广泛的用途和生物活性,如抗炎、抗菌、抗氧化等,比如醒脑提神、美白肌肤、清热解火、滋阴养颜等功效。
类黑精(Melanoidins) 是一类高分子量、含氮的棕色化合物,主要通过美拉德反应(Maillard reaction)形成,广泛存在于经过热处理的食品中,如面包、可可、咖啡、烤肉、啤酒、蜂蜜等。它具有多种生物活性,包括抗氧化、抗菌、抗肿瘤和降血糖作用。例如,从黑蒜中提取的Melanoidins具有免疫调节效果。
咖啡成分影响肠道免疫反应
咖啡中的多酚等成分可以影响肠道的先天性和适应性免疫反应。
咖啡因抑制促炎细胞因子的释放,从而降低自然杀伤(NK)细胞、巨噬细胞以及T细胞和B细胞增殖的活性。
咖啡中的另一种生物活性化合物咖啡醇通过调节巨噬细胞环氧化酶-2、一氧化氮合酶和NF-κB的表达来介导抗炎作用。
咖啡对炎症性肠病(IBD)的影响存在争议
一些研究报告,在克罗恩病和溃疡性结肠炎患者中,咖啡消费加重了症状并与IBD复发有关。相反,其他研究报告IBD与咖啡无关,实际上咖啡消费对溃疡性结肠炎有保护作用。
咖啡可能降低肠易激综合征(IBS)的风险
一项最近的元分析显示,与对照组相比,咖啡饮用者患IBS的可能性降低。然而,一项全面的IBS患者调查显示,咖啡因消费与腹泻等肠道症状增加有关。
总的来说,咖啡对肠道微生物群和免疫系统有多方面的影响,这些影响可能与其对某些肠道疾病的作用有关。然而,目前的研究结果仍存在一些矛盾,需要进一步的研究来澄清咖啡的确切作用。
咖啡刺激胃酸和胰液分泌
研究发现,即使是脱咖啡因咖啡也能刺激胃酸分泌,其效果达到五肽胃泌素峰值酸输出反应的70%。
注:五肽胃泌素是一种人工合成的多肽类药物,其化学结构与天然胃泌素一致,主要用于促进胃酸分泌和增强消化功能。
咖啡还能增加血清胃泌素水平。相当于2杯自制咖啡的咖啡溶液,能显著将血液中的胃泌素水平提高2.3倍,而脱咖啡因咖啡也有类似效果,能使血液中的胃泌素提高1.7倍。
进一步的研究表明,咖啡因和其他咖啡成分可能直接作用于G细胞,刺激胃泌素释放并增强胃分泌。
注:G细胞是一种重要的胃肠内分泌细胞,主要分布在胃窦部,数量最多,其次在十二指肠、胃底和空肠等处也有分布。它们属于开放型细胞,含有较粗大的圆形颗粒,因其分泌胃泌素(gastrin)而得名。G细胞还参与铁稳态的调节,并且在胃黏膜屏障的破坏和胃肠激素的神经内分泌调节机制中起重要作用。
咖啡刺激胰腺外分泌
Coffey等人确认了咖啡对胃泌素释放的影响,并发现咖啡和脱咖啡因咖啡不仅刺激胃分泌,还刺激胰腺外分泌胰蛋白酶的分泌。
咖啡降低下食管括约肌压力
Thomas等人在1980年发现,咖啡显著降低正常受试者和反流性食管炎患者的下食管括约肌压力。脱咖啡因咖啡也有类似效果。
体外研究发现,咖啡刺激胃肌收缩,随后放松。然而,人体体内研究发现,咖啡并不显著改变胃排空。
咖啡刺激结肠运动
一项对99名健康志愿者的研究报告,29%的人描述在饮用一杯咖啡后有强烈的排便需求,表明咖啡刺激结肠活动。另一项研究显示,在饮用咖啡后几分钟内,远端结肠运动迅速增加。脱咖啡因咖啡也有类似效果。
咖啡可能有助于预防便秘
一些基于人群的研究发现,咖啡的消费与便秘的发生率呈负相关。
咖啡可能通过改变肠道微生物群影响肠道运动
肠道微生物群可能通过短链脂肪酸(SCFAs)和色氨酸代谢物等微生物代谢产物调节肠道运动。咖啡引起的肠道微生物群改变可能解释其对肠道运动的影响。
咖啡直接作用于神经肌肉系统影响肠道运动
体外研究发现,普通咖啡和脱咖啡因咖啡都能剂量依赖性地(0.1至10 mg/mL)刺激大鼠结肠平滑肌条收缩。这种收缩不受神经活动阻断剂河豚毒素或烟碱受体拮抗剂六甲铵的影响,但被毒蕈碱受体拮抗剂阿托品完全阻断。
咖啡影响小肠运动,改善术后肠梗阻
多项研究报告了咖啡消费对术后肠梗阻(POI)的益处。不同的研究表明,咖啡是一种低成本的解决方案,可以加速结肠直肠和妇科手术后肠道功能和运动的恢复。
注:术后肠梗阻 (POI) 是一种在剖腹手术后发生的具有严重炎症变化的运动障碍疾病。运动功能障碍和运输缓慢主要发生在 POI 中的小肠。
在临床前模型中的研究发现,咖啡不影响POI小鼠的炎症反应,但显著改善肠道通过时间,并以依赖毒蕈碱受体的方式刺激回肠平滑肌收缩。
总的来说,这些研究结果表明咖啡对肠道功能有多方面的积极影响,包括刺激结肠运动,可能有助于预防便秘,以及改善术后肠道功能恢复。这些效果可能部分通过改变肠道微生物群实现,也可能是咖啡直接作用于肠道平滑肌的结果。
“肠道菌群-脑轴”指的是肠道菌群和大脑之间进行双向通讯的连接网络,对维持胃肠道、中枢神经和微生物系统的稳态至关重要。
咖啡可能具有抗压力作用
一项随机、双盲、交叉临床试验发现,在非压力条件下,急性咖啡消费与任何胃肠道症状无关,但激活了交感神经系统,导致唾液α-淀粉酶增加,但唾液皮质醇不变。这被解释为咖啡中除咖啡因外的其他代谢物可能具有抗压力作用,而这种作用是由咖啡中除咖啡因以外的代谢物介导的。
咖啡可能具有抗氧化作用,保护肠道
一项研究表明,严重的睡眠不足导致活性氧(ROS)在肠道中积累,但不会在大脑中积累,这种影响可以通过抗氧化剂(如咖啡中的类黑精Melanoidins)来预防。
咖啡可能改善睡眠剥夺引起的抑郁样行为
咖啡因引起的小鼠睡眠限制与肠道菌群多样性和组成的改变有关,例如,变形菌和放线菌丰度降低,并改变肠道菌群的代谢特征。
最近一项针对慢性反常睡眠剥夺 (PSD) 大鼠的研究表明,咖啡和脱咖啡因咖啡均显著改善了抑郁样行为,血清中超氧化物歧化酶和谷胱甘肽过氧化物酶水平升高,IL-6 和 TNF-α 水平降低。
平行的肠道菌群分析表明,咖啡摄入逆转了肠道菌群失调,并使S24-7、毛螺菌科、颤螺菌属、副拟杆菌、阿克曼菌和克雷伯菌的丰度恢复到健康水平,表明咖啡、肠道菌群和中枢神经系统之间存在密切的关系。
咖啡可能影响疼痛感知
一项针对 62 名健康人的研究表明,日常饮食中摄入咖啡因可通过涉及外周腺苷受体和环氧合酶途径的机制提高痛阈值、热痛耐受性和压力痛阈值。肠道微生物群参与改变这两种途径,表明微生物群、咖啡因和痛觉之间存在密切的相互作用。然而,还需要进一步研究来了解肠道微生物群、肠神经系统和中枢神经系统之间的分子串扰。
总的来说,这些研究结果表明咖啡可能通过影响肠道微生物群来影响神经系统功能,包括压力反应、睡眠、情绪和疼痛感知等。然而,肠道微生物群、肠神经系统和中枢神经系统之间的分子对话机制还需要进一步研究。
肠道微生物群在不同矿物质和微量营养素的代谢和吸收中起着关键作用。
咖啡消费导致的肠道微生物群变化可能间接影响营养吸收。然而,关于咖啡在营养吸收中的作用的研究结果分歧很大。一般认为适量咖啡给肠道菌群及健康带来有利影响。
在一种以高脂饮食喂养大鼠的肥胖病理模型中,连续 10 周适量饮用咖啡可降低体重、肥胖、肝脏甘油三酯和能量摄入。它还逆转了与高脂肪相关的Clostridium Cluster XI 的增加。
咖啡因干预还改善了代谢综合征小鼠模型中的血清脂质紊乱和胰岛素抵抗。这些变化归因于Dubosiella、双歧杆菌和脱硫弧菌相对丰度的变化,拟杆菌、乳酸杆菌、乳球菌的减少。
与咖啡相关的代谢成分变化和通过微生物群变化的吸收变化

doi.org/10.3390/nu16183155
咖啡对某些营养物质的吸收有积极影响
在健康青少年中,咖啡消费可以增加HDL胆固醇和维生素D水平。
适度的咖啡消费可能有助于改善代谢综合征。在一项小鼠研究中,咖啡处理组的普雷沃菌属减少【普雷沃氏菌的减少导致糖尿病小鼠的内毒血症和全身炎症改善】。
粪球菌属Coprococcus和经黏液真杆菌属Blautia增加。
【粪球菌与肥胖女性的空腹胃肠道多肽水平相似,已知这些肽能刺激胰岛素分泌,这可能有助于预防代谢综合征】。
【然而,在喂食高脂肪饮食的大鼠中观察到Blautia的含量较高,并且肥胖个体中 Blautia 的含量较高。
Blautia研究还发现,全谷物摄入量增加,有助于产生抗炎作用,还参与了乙酸盐的产生。咖啡介导的肠道菌群变化也与肥胖减少和葡萄糖耐受性改善有关】
肠道核心菌属——经黏液真杆菌属(Blautia),炎症肥胖相关的潜力菌
适量饮用咖啡对营养吸收有益。然而,研究发现,饮用大量咖啡(每天 >4 杯)会干扰营养和矿物质的吸收。这个干扰对健康人来说,不利于营养吸收,但对于特殊病人而言,可能也是另一种益处。
咖啡可能影响锌、钙、铁、维生素B的吸收
动物研究表明,咖啡摄入降低了锌和钙的水平。
研究发现,在富含铁的餐食中饮用一杯咖啡或其他含咖啡因的饮料可能会使铁的吸收降低39-90%。也有一些研究表明,饭前一小时喝咖啡不会减少铁的消耗。未来的研究应该调查咖啡消费时间对这些营养素摄入量的影响。
咖啡摄入似乎也与健康个体维生素B浓度的降低有关。
咖啡影响葡萄糖的吸收,可能有益糖尿病人
研究表明,咖啡可能会降低肠道对葡萄糖的吸收。对于普通人群来说,适度饮用咖啡可能影响不大。
然而,对于正在进行糖尿病管理或有胰岛素敏感性的个体来说,这种葡萄糖吸收的降低可能有助于调节血糖水平。
咖啡对肠道营养吸收的影响

doi.org/10.3390/nu16183155
咖啡可能影响某些药物的吸收
一项针对小鼠的研究发现,咖啡摄入可以增加阿司匹林的吸收。这种作用与咖啡改变肠道微生物群的α和β多样性有关。
具体来说,咖啡摄入降低了粪便微生物中变形菌门、螺杆菌科、拟杆菌科的丰度,同时增加了乳杆菌科的丰度。
咖啡可能降低血浆中的药物浓度
咖啡中的咖啡因可以诱导肝脏细胞色素P450酶系统的活性,这些酶负责代谢多种药物。
一项对健康男性志愿者的研究表明,咖啡摄入导致对乙酰氨基酚主要通过肝脏细胞色素P-450和P-448从血液中清除。
由于其酶诱导能力,咖啡因可以在某些情况下降低血浆中的药物浓度。负责代谢咖啡因的最丰富的酶是 CYP450 肝酶,这种酶也在许多药物的清除中起主要作用。
咖啡也可能增加药物的血药浓度
然而,如果同时服用大量咖啡,会使这些酶饱和,并增加药物的血清浓度。
一项针对健康志愿者的药代动力学研究发现,同时饮用2-3杯咖啡可使氯氮平(一种抗精神病药物)的血浆浓度增加97%。
锂、茶碱、华法林以及几种抗抑郁药和抗精神病药的血液浓度也有所增加,可能导致肝脏毒性等不良后果。
咖啡中的某些成分可能具有协同治疗作用
咖啡中的葫芦巴碱可以抑制细菌Citrobacter freundii的生长,防止胆碱分解,从而防止产生一种会导致心血管风险的促动脉粥样硬化代谢物。
另一项研究发现,咖啡中的绿原酸与中药栀子苷联用可通过保护肠道屏障功能等机制治疗小鼠的非酒精性脂肪肝。
咖啡和药物相互作用的总结

doi.org/10.3390/nu16183155
咖啡可能通过影响短链脂肪酸间接影响药物代谢
肠道微生物发酵膳食纤维产生的短链脂肪酸(如乙酸、丙酸和丁酸),可以通过诱导其他酶产生直接作用,或改变肝脏和肠道中药物转运蛋白的表达,影响某些药物的吸收和代谢。
更高丰度的细菌,如产生高水平丁酸的Clostridium butyricum,可能会增强CYP3A活性。由于CYP3A代谢了50%以上的上市药物,如果咖啡摄入会产生额外的丁酸盐或其他短链脂肪酸,它可能会对针对肠道微生物组的干预措施产生敏感反应。这可能会影响炎症性肠病患者,因为IBD患者的结肠细胞对丁酸的摄取和利用受损。
短链脂肪酸还可以直接诱导治疗效果,将肠神经系统的作用与身体的其他部位联系起来。乙酸盐通过平行机制影响血压和心脏功能,并确立了短链脂肪酸在调节交感神经功能和心脏收缩性中的作用。
总的来说,咖啡与药物之间存在复杂的相互作用,这些作用部分是通过咖啡对肠道微生物的影响来实现的。因此,正在服用药物的人群应该谨慎对待咖啡的摄入,最好咨询医生的建议。同时,这一领域还需要更多的研究来阐明咖啡、肠道微生物和药物代谢之间的具体关系。
咖啡显著影响口腔微生物群的组成
体外培养研究表明,咖啡抑制了唾液细菌的整体生长,减少了Streptococcus salivarius,增加了Streptococcus mitis、Streptococcus infantis的比例。
一项大规模人体志愿者研究发现,高咖啡摄入与口腔中Granulicatella、Synergistetes丰度增加有关。
研究发现,咖啡饮用者唾液样本中放线菌门、厚壁菌门、变形菌门、Saccharibacteria的丰度显著高于非咖啡饮用者。
咖啡增加口腔微生物群的多样性
咖啡饮用者的唾液微生物群表现出显著更高的α多样性。
另一项针对43名韩国受试者的小型人群研究也发现,咖啡饮用显著提高了口腔微生物群的α多样性,并显著改变了β多样性。
该研究还发现,咖啡消费者的口腔微生物群中含有丰富的Oribacterium、Campylobacter、Megasphaera.
适量饮用咖啡可能有益于牙周炎患者
有研究报告称,低至中度的咖啡消费可能对牙周炎患者有益。牙周炎是由口腔微生物群和免疫系统之间的失衡引起的,而咖啡可以增加口腔微生物群的丰富度,有助于恢复微生物群和免疫系统之间的平衡。
过量饮用咖啡可能对口腔健康产生负面影响
大量饮用咖啡与牙周病的病因/进展呈正相关。此外,有观察发现,每天大量饮用咖啡(>5杯)的个体口腔微生物群的丰富度显著降低。
需要进一步研究来评估喝咖啡以及咖啡中特定成分对不同口腔疾病和感染的益处和风险。
胃食管反流病(GERD)是一种常见的消化系统疾病,其特征是胃酸反流到食管,导致不适和炎症。咖啡是GERD的潜在诱因之一。然而,研究结果并不一致,有研究表明咖啡可能加重GERD症状,也有研究未发现明显关联。
咖啡可能加重GERD症状的机制
多项研究表明,咖啡可能通过以下机制加重GERD症状:
研究结果矛盾:咖啡与GERD风险无显著关联
尽管有上述机制支持咖啡可能加重GERD症状,但研究结果并不一致。一项大规模前瞻性研究发现,咖啡摄入与GERD风险之间没有显著关联。
这种矛盾可能源于个体差异、咖啡摄入量、研究方法等因素。鉴于研究结果的不一致性,建议GERD患者在医生指导下,根据自身症状调整咖啡摄入量。
炎症性肠病,包括溃疡性结肠炎和克罗恩病,是一组慢性复发性肠道炎症疾病。咖啡对IBD的影响一直是研究的热点,但结果仍存在争议。
潜在的有益影响
一项针对溃疡性结肠炎患者的研究发现,适量饮用咖啡(每天2-3杯)与疾病活动性降低相关。
潜在的不利影响
也有研究指出咖啡可能对IBD患者产生不利影响,一项研究报告称,高剂量咖啡摄入(每天超过5杯)可能增加克罗恩病进展的风险。
这些矛盾的结果强调了咖啡对IBD影响的复杂性,以及个体化建议的重要性。
肠易激综合征是一种常见的功能性胃肠道疾病,其症状包括腹痛、腹胀和排便习惯改变。
不过,咖啡对IBS患者的影响可能因个体和IBS亚型而异。
最近对 IBS 患者现有数据集进行的荟萃分析显示,与对照组相比,喝咖啡的人患 IBS 的可能性较低。
相反的是,一项全面的 IBS 患者调查显示,腹泻等肠道症状的增加与咖啡因摄入有关。
需要进一步进行对照和重点研究,以严格评估咖啡在IBS的发生发展中的作用。
咖啡对IBS症状的潜在影响
IBS亚型的差异反应
研究表明,不同IBS亚型对咖啡的反应可能不同:
患者可以在医生指导下,通过食物日记记录咖啡摄入与症状之间的关系,从而确定最适合自己的咖啡摄入量。
咖啡的保护作用
多项大规模流行病学研究和荟萃分析支持咖啡对结直肠癌的保护作用:
剂量-反应关系
一项大规模荟萃分析发现,咖啡摄入量与结直肠癌风险之间存在剂量-反应关系。每天增加一杯咖啡的摄入量与结直肠癌风险降低3%相关。
研究局限性
多项研究表明,咖啡摄入与NAFLD风险降低相关:
剂量-反应关系
一项荟萃分析发现,咖啡摄入量与NAFLD风险之间存在剂量-反应关系。每天增加一杯咖啡的摄入量与NAFLD风险降低约23%相关。
研究局限性
大多数研究是观察性的,无法确定咖啡摄入与肝脏健康改善之间的因果关系。具体的分子机制仍需进一步研究。咖啡对肝脏健康的影响可能因个体基因、生活方式等因素而异。
未来的研究应关注咖啡对肠道微生物群的长期影响,以及这种影响如何通过肝肠轴影响肝脏健康。此外,还需要更多的干预性研究来确定咖啡对NAFLD患者的治疗潜力。
一项新研究分析了约 172,000 名健康成年人的数据,表明与很少喝咖啡或不喝咖啡的人相比,每天喝三杯咖啡的人患心脏病、中风和 2 型糖尿病等疾病的可能性降低了近 50%。
喝咖啡或茶可能有助于减少慢性低度炎症,这是心脏代谢疾病发展的关键因素。咖啡因还可以提高人体将食物中的糖分转化为能量的能力。
《临床内分泌与代谢杂志》发表的研究结果表明,与很少喝咖啡或不喝咖啡的人相比,每天喝三杯咖啡的人罹患多种心脏代谢疾病的可能性降低了 48%。
此外,每天摄入约 200~300 毫克咖啡因(大约两至三杯咖啡或五至六杯红茶)的参与者比每天摄入 100 毫克或更少咖啡因的参与者患多种心脏代谢疾病的可能性降低 41%。
纽约大学格罗斯曼医学院流行病学教授、公共卫生陈博士表示:“适量饮用咖啡可能有助于减少慢性低度炎症,这是导致心脏代谢疾病的一个关键因素。”
陈博士说,咖啡因还可以改善人体利用激素胰岛素将食物中的糖分转化为人体所需的能量。她还指出,咖啡和茶都含有酚酸和多酚,这些物质具有抗氧化作用。
当人们患有慢性炎症或难以使用胰岛素时,更容易患上所谓的心脏代谢疾病,如 2 型糖尿病、冠心病和中风。“研究发现,适量饮用咖啡可以预防所有这些疾病的发生、发展以及从一种疾病发展到两种疾病”。
但以上前提是适量,过量仍然会产生危害。
一项新研究发现,每周大多数日子里,每天摄入超过 400 毫克咖啡因的健康成年人更容易患上心脏病。该量的咖啡因大约相当于四杯咖啡、十罐可乐或四罐红牛。
这项研究的首席作者、印度达霍德 Zydus 医学院和医院内科系研究员 Nency Kagathara 医学学士表示,经常摄入大量咖啡因会刺激心脏,导致心率加快和血压升高,随着年龄的增长,这可能会引发许多其他心脏问题。
一项研究对大约 6,000 名认知健康的成年人进行了为期约七年的跟踪调查,从他们平均 68 岁开始。在过去五年左右的跟踪调查中,约有 230 人患上了痴呆症。
但每天至少喝两杯咖啡的人患痴呆症的可能性比从不喝咖啡的人低 38%,喝茶的人患痴呆症的风险也比从不喝茶的人低 36%。这可能是因为这些饮料中含有大量的多酚,多酚具有抗炎和抗氧化作用,对大脑健康有益。
另一项研究对 8,451 名认知健康的成年人进行了约九年的跟踪调查,从他们至少 60 岁开始。该分析侧重于所谓的流体智力,即抽象思维和解决问题的能力——这些能力会随着年龄的增长而自然下降。
研究人员发现,每天喝 0~3 杯咖啡与流体智力下降的关系,明显小于每天喝 4 杯或以上咖啡与流体智力下降的关系。
注:这些初步研究结果中未提及的因素,例如饮食、锻炼量以及潜在的医疗问题,可能对结果产生影响。
★ 每天应该喝多少咖啡最合适?
根据文献表明,尽量不超过4杯。可根据自身健康状况酌情调整。
★ 食用建议
行业通用标准是,在咖啡冲泡后尽快饮用,此时咖啡新鲜热腾腾,然后等待咖啡冷却至理想的饮用温度。咖啡通常在饮用后会迅速冷却,具体取决于盛放咖啡的杯子或容器。
在《食品科学杂志》发表的一项实验中,300 名咖啡消费者测试了不同范围的咖啡温度。研究得出结论,饮用咖啡的平均首选温度约为 140°F +/- 15°F,也就是60℃左右。
不过,以上仅供参考,任何咖啡饮用者所偏好的咖啡温度都是个人喜好。
★ 有哪些人群应该限制咖啡摄入?
某些特殊人群应该限制咖啡摄入:
★ 如何在享受咖啡的同时保护肠道健康?
a) 控制摄入量:将每日咖啡摄入量控制在3-4杯以内。
b) 选择高质量咖啡:优质咖啡通常含有更多有益的多酚和抗氧化物质。选择新鲜研磨的咖啡豆可能比速溶咖啡更有益于肠道健康。
c) 添加益生元:考虑在咖啡中添加益生元,如菊粉或抗性淀粉。
d) 平衡饮食:确保整体饮食均衡,富含膳食纤维的水果和蔬菜。这有助于维持健康的肠道微生物群,抵消咖啡可能带来的任何潜在负面影响。喝咖啡时多喝水,因为咖啡具有利尿作用,会增加脱水的风险。
e) 注意饮用时间:避免空腹饮用咖啡,可以减少对胃肠道的刺激。喝完最后一口咖啡后,咖啡因仍会留在体内几个小时。所以,下午晚些时候喝或晚餐后喝一杯咖啡可能会让你晚上辗转反侧。为了安全起见,晚上还是尽量少喝。
f) 监测个人反应:每个人对咖啡的耐受性不同。密切关注自身对咖啡的反应,如出现不适症状,及时调整摄入量或方式。
g) 考虑替代品:对于需要限制咖啡摄入的人群,可以考虑一些替代品,如低咖啡因咖啡、脱咖啡因咖啡或草本茶。
由于有些人在饮用含咖啡因的咖啡时可能会出现负面副作用,如果您还没有开始喝咖啡,则没必要必须开始喝,也没有必要增加目前的饮用量,因为其实还有许多其他饮食策略可以改善健康。如果对咖啡因敏感,脱咖啡因咖啡是一个不错的选择。

随着对咖啡与健康的深入探索,我们逐渐认识到它对肠道菌群的潜在影响:适量饮用咖啡可能对维护肠道健康产生积极作用。咖啡中的生物活性化合物不仅能够为肠道中的有益菌群提供营养,还可能通过调节肠道环境来促进整体健康。
然而,这并不意味着咖啡适合每个人。每个人的肠道菌群都是独一无二的,对咖啡的反应也各不相同。因此,关键在于找到适合自己的平衡点,个性化地调整咖啡的摄入量。在这个过程中,了解自己的身体反应和生活习惯至关重要。通过倾听身体的信号,我们可以更好地调整饮食,使之与个人的肠道菌群平衡相协调。
主要参考文献
Saygili, S.; Hegde, S.; Shi, X.-Z. Effects of Coffee on Gut Microbiota and Bowel Functions in Health and Diseases: A Literature Review. Nutrients 2024, 16, 3155.
Rosa, F.; Marigliano, B.; Mannucci, S.; Candelli, M.; Savioli, G.; Merra, G.; Gabrielli, M.; Gasbarrini, A.; Franceschi, F.; Piccioni, A. Coffee and Microbiota: A Narrative Review. Curr. Issues Mol. Biol. 2024, 46, 896-908.
Safe, S.; Kothari, J.; Hailemariam, A.; Upadhyay, S.; Davidson, L.A.; Chapkin, R.S. Health Benefits of Coffee Consumption for Cancer and Other Diseases and Mechanisms of Action. Int. J. Mol. Sci. 2023, 24, 2706.
Rai SP, Ansari AH, Singh D, Singh S. Coffee, antioxidants, and brain inflammation. Prog Brain Res. 2024;289:123-150.
Tripathi S, Murthy PS. Coffee oligosaccharides and their role in health and wellness. Food Res Int. 2023 Nov;173(Pt 1):113288.

饮用水(DW)中含有多种微生物物种和化学特性。水构成了我们日常饮食的最大部分,既可单独饮用,也用于食物制备。
饮用水是我们主要的液体来源,对维持体内平衡至关重要,还可以提供必需矿物质。
有限的证据表明,饮用水在塑造肠道微生物群方面发挥作用,这意味着它可能影响人类健康。尽管饮用水对饮食有重要贡献,但在研究饮食对肠道微生物群的影响时,饮用水常被忽视。
本文探讨饮用水与肠道微生物群之间联系的理解——这是人类微生物组科学中研究不足的领域。
对饮用水与肠道微生物群关系的深入理解将有助于理解肠道微生物群结构及其与人类健康的关系。这可能导致针对失调状态的具体建议,优化饮用水处理过程,并为研究人员制定具有定制益生菌或化学特征的饮用水铺平道路。
干预措施可能包含或排除特定化学物质甚至益生菌,到优化例如氯离子含量,调节pH值,来促进健康的肠道微生物群。
人们普遍认为人类肠道微生物群对人类健康具有重要影响。饮食因素在决定肠道微生物组成中的作用已明确,各个因素都会影响原核生物的相对丰度和绝对丰度,以及它们的生长动态。
在对肠道微生物群的影响方面,一个被人们忽视的关键饮食因素是饮用水 (DW)。饮用水主要来自地下水和地表水,每种水源都有不同的物理和化学属性及相关微生物群。根据水质,源水通常会经过各种处理和消毒过程,以去除有害化学物质和微生物,生产出可饮用水。许多源水中的微生物能够耐受处理过程,处理后的饮用水中存在多样化的微生物群,细菌浓度约为106–108个细胞/升。
不同源水的化学和微生物学特性因源环境的生物地球化学而显著不同,这些因素与所应用的处理过程相结合,影响了最终的饮用水微生物群。
饮用水是我们饮食的核心组成部分。鉴于饮食模式和因素在塑造肠道微生物群结构中起关键作用。饮用水可以通过直接(即通过驻留的饮用水微生物群)或间接(即由于其化学成分)方式与肠道微生物群相互作用。然而,在研究饮食因素对肠道微生物群影响的队列研究中,饮用水很少被考虑。在少数考虑的几项研究中,发现其具有显著影响。
研究发现,饮用水的化学、物理和生物特性在塑造肠道微生物群结构和功能中起着关键作用,并对人类健康产生连锁效应。
在此,我们总结了从各个领域和不同设计的研究中获得的关于饮用水对肠道微生物群直接和间接影响的有限知识。
个体之间以及饮用水之间的高度变异性将使未来的研究工作复杂化,但这些挑战已经在肠道微生物群研究领域得到解决。
肠道对水的吸收发生在小肠和大肠中。渗透梯度驱动水的吸收,这通常与离子和营养物质的运输有关。在小肠中,葡萄糖和半乳糖转运蛋白 SGLT1 以及 Na+/H +反向转运蛋白负责从肠腔中运输大部分水。
水分吸收和体内平衡是大肠的主要功能之一,而大肠也是肠道微生物的主要聚集地。水分与离子(主要是钠)一起穿过肠上皮,钠离子的运输产生渗透梯度,推动水分吸收。
早在1998年,有一项研究就证实大肠中存在的水量通过改变肠道中的 pH 值和运输时间来影响肠道微生物组的组成。
饮用水中其他成分的吸收通过多种机制并在肠道的特定位置发生。复杂的有机化学物质可能被肠道微生物群发酵并转化为脂肪酸,或者在没有吸收或转化的情况下被排除。肠道中微生物细胞的最高丰度是在大肠中,近端大肠被认为是最高微生物增殖的地方,因为发酵底物的可用性很高。
我们预计饮用水中的化学物质和生物与肠道的相互作用方式与其他摄入的化学物质和生物类似。由于益生元和益生菌在这方面的研究相对较多,我们使用来自该领域的数据来描述潜在的相互作用。
然而值得注意的是,饮用水中的化学物质和生物可能并非都具有有益影响,区分对宿主产生有益和有害影响的相互作用是制定优化饮用水成分以支持公共健康的策略的关键。
A) 饮用水微生物群和肠道微生物群之间的潜在相互作用
B) 识别饮用水和肠道微生物群之间联系的建议方法
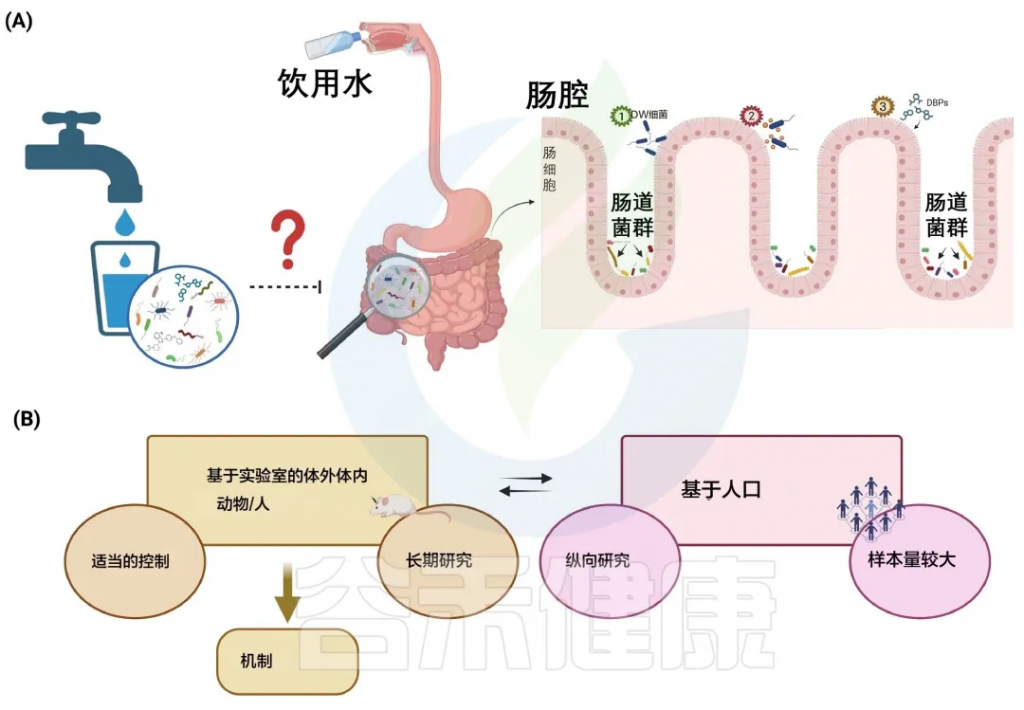
Moghaddam HS et al., Water Res. 2024
饮用水对肠道微生物群的影响途径:
饮食是塑造肠道微生物群落的主要驱动因素之一。成人每日建议饮水量约为2.0-3.7升。
两项研究使用不同的方法检查了肠道微生物群和饮用水微生物群之间的重叠。使用 16S rRNA 基因扩增子数据鉴定出 35 个属,它们属于 5 个门(假单胞菌门、放线菌门、芽孢杆菌门、拟杆菌门和蓝藻门),存在于经过处理的饮用水和肠道微生物群中。
来自 131 个饮用水样本宏基因组的组装重叠群,并将它们与来自同一国家的 196 个粪便样本的宏基因组进行了比较。通过关注饮用水中大量存在的属,他们确定了与肠道微生物群共享的 6 个关键属:
肠道菌群和肠道菌群重叠程度最大的是假单胞菌门(Pseudomonadota),两项研究都在肠道和饮用水群落中发现了鞘氨醇单胞菌属(Sphingomonas)、假单胞菌属(Pseudomonas)和伯克霍尔德菌属(Burkholderia)。
然而,当应用类似的宏基因组学方法来评估一个人的粪便菌群和饮用水菌群之间的直接联系时,他们只发现了一种常见的生物,即Curvibacter(弯钩菌),这表明,如果饮用水微生物能够在人体肠道中定植,那么存在一些重要的决定因素,这些因素是生物体固有的,也是肠道中生物和非生物条件的共同决定因素。
显然,饮用水和肠道之间存在共同的属并不意味着饮用水是这些微生物的来源。假单胞菌属、鞘氨醇单胞菌属等属广泛存在于各种自由生活和宿主相关环境中。
饮用水质量与肠道微生物群的长期影响
在考虑饮用水对肠道微生物群的长期影响时,也值得考虑劣质饮用水的影响,因为全球超过27%的人口无法获得安全管理的水源。

为了研究水资源不安全和肠道病原体暴露如何影响肠道微生物群的发展,Piperata等人2020年的研究分析了尼加拉瓜儿童的家庭饮用水和粪便样本。在水和粪便样本中观察到了高浓度的沙门氏菌(Salmonella)、弯曲杆菌属(Campylobacter)和大肠菌群(coliforms)。
沙门氏菌(Salmonella)是世界范围内肠道感染(食物中毒)的最常见原因之一。尤其在卫生条件差的地方。沙门氏菌是能动的生物,它们利用鞭毛将自身导向肠细胞,有时候也依赖入侵基因来穿透宿主肠细胞。入侵基因在宿主细胞中介导广泛的动作重排,导致细胞膜变形并使生物体能够入侵。
研究根据饮用水中的大肠菌群含量将家庭分为高含量和低含量两类(高含量为每毫升≥29个菌落形成单位)。虽然这项研究没有直接比较饮用水和粪便样本的微生物组成,但他们发现,饮用高大肠菌群饮用水家庭的儿童,其肠道微生物群的多样性低于饮用低大肠菌群家庭的儿童。
简单来说,肠道微生物群的多样性可能与抵抗肠道病原体的能力有关。也就是说,肠道内的微生物种类越丰富,可能越能抵抗有害细菌的侵袭。不过,某些特定微生物的存在似乎比整体的多样性更为重要。
这强调了确保全球安全和良好管理的饮用水供应的重要性。
除了建立饮用水和肠道微生物群之间的机制联系的重要性之外,抗菌素耐药性基因 (ARG) 从饮用水到肠道的传播也同样重要。饮用水中存在各种携带 ARG 的微生物和可能含有 ARG 的 eDNA。
Tips:这里的eDNA也可能是提取了环境中的微生物内的DNA,很难直接判断:即使没有活的微生物,ARG也可能通过环境DNA的形式存在于水中。
各种水处理工艺都可用于改变耐药基因的丰度。耐药基因从饮用水传播到肠道微生物群的速度尚未得到很好的研究。

2020的如上项目研究了上海和北京饮用水中耐药基因 blaNDM and mcr-1的丰度。他们随后证实,免疫缺陷 (BALB/c) 小鼠能够从饮用水中分离出的微生物中获得这些耐药基因,而这些微生物的浓度与饮用水中相当。这就引发了一个问题:免疫功能低下和/或健康的人是否也可能从饮用水中获得抗菌素耐药性微生物或基因。
饮水来源与肠道微生物群多样性
虽然饮用水和肠道中同一属的成员之间的重叠并不意味着存在直接联系,但两项人群水平的研究已将饮用水来源确定为解释肠道微生物组多样性变化的最重要因素之一。这两项研究都调查了分布在全球不同地区的多个人群,并使用了粪便微生物的16S rRNA基因测序数据。

2022年,Vanhaecke 等人调查了来自美国和英国 3413 个体肠道菌群组成的主要影响因素。微生物群、生活方式和饮食数据来自美国肠道微生物组计划。使用线性和逻辑模型分析了肠道菌群与不同饮用水来源 (瓶装、过滤、自来水和井水) 之间的关联。
饮用水来源是肠道菌群 α 和 β 多样性的关键因素,其效应大小与酒精摄入量和饮食类型相似。
参与者的地理位置多样,这可能导致饮用水的物理化学和生物参数存在较大差异。然而,研究发现市政自来水饮用者与其他类型饮用者之间,以及私人井水饮用者与瓶装水饮用者之间的肠道微生物群存在显著差异。
不同组之间观察到几种物种的丰度差异,包括瓶装水和市政自来水饮用者中链球菌属(Streptococcus)、拟杆菌、Odoribacter的丰度较高,而井水饮用者中Dorea属的丰度较高。
每日饮水量也影响了β多样性(组间差异性),每日饮水量少于1升的人群中弯曲杆菌属(Campylobacter)的丰度较高。
Dorea菌属于厚壁菌门毛螺菌科,广泛存在于人体肠道内,谷禾数据显示该菌在人群的检出率超89%。该菌最早也是从人体粪便中分离出来。
该菌是一类革兰氏阳性厌氧菌,主要存在于人类和动物的肠道中,可以利用多种底物进行发酵代谢,包括葡萄糖、果糖、乳糖和芳香族化合物等。它可能通过诱导Treg并抑制Th17细胞的分化和功能,从而调节肠道免疫反应,维持肠道黏膜屏障的完整性和稳定性。
在多发性硬化症、炎症性肠病患者,甚至结直肠癌、自闭症谱系障碍以及肥胖人群中的Dorea菌高丰度富集,被认为具有促炎作用。多数研究证实Dorea与体重指数 (BMI)、腰围和舒张压呈正相关。基线肠道内富含高丰度的Dorea菌的人群,在减重方面更困难。
然而Dorea菌在抑郁患者和患有食物过敏人群中减少,研究还表明Dorea菌可以预防或治疗过敏性鼻炎。

美国加利福尼亚州斯坦福市斯坦福大学人类微生物组研究中心团队2018年通过研究喜马拉雅山脉 4 个具有不同觅食程度和采用农耕方式时间的人群,研究了区分农耕和觅食生活方式的肠道微生物群的因素。这些人群分为觅食者、过渡到自给性农业的觅食社区和过去两个世纪完全过渡到农耕的人群。
从 56 个人采集了粪便样本。对应分析 (CA) 和微生物多样性分析表明,饮用水是与肠道微生物组成显着相关的两个因素之一。
各组之间没有观察到 α 多样性的显著差异,但几个β多样性指标表明与饮用水来源相关的组成变化。
在将这项研究扩展到坦桑尼亚的猎人采集者人群——哈扎人(Hadza)的季节性肠道微生物群数据时,研究发现饮用水对肠道微生物群组成也有类似的显著影响。这表明饮用水来源在不同生活方式的人群中对肠道微生物群有重要作用。

饮水中的化学成分与口腔及肠道微生物群
随后,英国研究团队于2020年开展的一项研究,他们调查了自来水中溶质浓度(钠、氯和硫酸盐)与肠道微生物群之间的关联。研究对象为英国的36对单卵双胞胎。结果表明,自来水中钠的日均摄入量(ADD)增加显著降低了肠道微生物群的丰富度,而微生物群的组成在硫酸盐和氯的日均摄入量的影响下有所不同。然而,这些关联较弱,并且研究中没有量化一些可能影响肠道微生物群的其他变量。
与饮用水和肠道微生物群之间的相互作用类似,关于饮用水对口腔微生物群影响的研究也很少。一项研究发现,在西班牙青少年的口腔微生物群中,自来水是所有调查因素中影响最大的。
饮用水的几个特征,包括碱度、硬度,以及氟化物和几种离子的存在,对特定菌属的丰度有显著影响。另一项研究也证实了饮用水中的氟化物对口腔微生物群的影响,该研究在小鼠中得出了类似的结果。除了饮用水对口腔微生物群的影响可能间接影响肠道微生物群外,饮水还可能将口腔中的微生物引入肠道。
总之,这些研究表明,饮用水属性对肠道菌群的组成有重要影响。有必要进一步研究这种关系是如何介导的,以及它如何影响人类健康。
关于饮用水(DW)与肠道微生物群关系的研究大多集中在饮用水的物理化学特性上,通常是在动物模型中进行,少数情况下涉及人类。需要注意的是,饮用水的物理化学性质,包括化学成分和处理过程,直接影响其微生物群,这反过来可能直接或间接影响肠道微生物群。一项荟萃分析表明,饮用水的化学性质在动物模型的微生物群研究中起到混杂作用,因此研究时需要注意。特别是,饮用水的 pH 值似乎会改变实验动物的肠道菌群。
■ 灭菌与否

2018年,一项实验动物研究了四种水源对小鼠肠道微生物群的影响:
他们观察到高压灭菌水和非高压灭菌水的肠道菌群存在差异,喂食高压灭菌水的小鼠中,属于芽孢杆菌属(Bacillota)和不动杆菌属(Acinetobacter)的操作分类单元 (OTU) 的丰度降低。
在喂食未高压灭菌水的小鼠中,没有观察到显着差异。这些差异的原因尚不清楚,并且该研究没有评估饮用水微生物群。
■ PH值
实验室研究中使用的动物通常被喂食酸化水,以防止动物护理设施中的微生物污染。酸化水导致 1 型糖尿病发病率增加,并导致小鼠肠道微生物群发生变化。
研究饮用水的pH值对健康成年男性血糖调节和肠道微生物群的影响,参与者在两个为期两周的周期内分别饮用中性(pH7)或碱性(pH9)水。研究未发现血糖调节或肠道微生物群的显著变化,尽管这种差异可能是由于所饮用水的pH值不同所致。
先前的人体研究表明,饮用酸性水与1型糖尿病之间存在关联,但尚未研究其对肠道微生物群的影响。
此外,已知肠道微生物群会影响葡萄糖稳态,而酸性pH值会不同程度地影响肠道常驻微生物的生长速率,这提示了可能的关联。从实际角度来看,市政供水中暴露于酸性饮用水是不常见的,因为饮用水通常以中性到微碱性的条件分配,以防止管道腐蚀。
■ 富含碳酸氢盐/硅酸盐
饮用富含碳酸氢盐的矿泉水或偏硅酸盐碱性矿泉水可能会通过改变肠道微生物群来影响宿主的生理机能(下表)。
饮用水微生物群和化学物质对肠道微生物群的影响

Moghaddam HS et al., Water Res. 2024

上面两篇研究分别在人类和猪仔和发现,饮用富含重碳酸盐的矿泉水或以偏硅酸为基础的碱性矿泉水可能通过改变肠道微生物群影响宿主生理。其中一些观察到的益处包括减少仔猪腹泻发生率,降低与胰岛素抵抗相关的某些标志物。
因此,值得进行样本量更大且具有适当对照组的综合研究将为矿泉水对肠道微生物群和宿主生理的影响提供更有力的证据。
■ 氯化物
自 20 世纪 50 年代以来,氟化物就被引入到饮用水和牙科用品中,如今大多数牙科产品和许多市政水源都已含氟。尽管氟化物使用范围很广,但很少有研究调查其对宿主相关微生物群落的影响。
最近一项关于水氟化对小鼠微生物组影响的研究表明,氟化水对口腔有选择性影响,但对肠道微生物组没有影响(上表)。
流行病学研究已将饮用水氯化和/或接触消毒副产物 与结直肠癌和膀胱癌联系起来。在小鼠结肠直肠癌模型中,高浓度的水氯化(10 mg/L)增加了肿瘤发生。
肠道微生物群中产气荚膜梭菌(C.perfringens)和肠杆菌科(Enterobacteriaceae)等专性厌氧菌同时减少。同样,由于未评估饮用水微生物群,因此无法建立饮用水与肠道微生物群之间的直接联系。
此外,这些发现与实际饮用水系统的相关性尚不清楚,因为这远远超过了正常的氯浓度。美国可接受的最大氯浓度为 4 mg/L。
根据世界卫生组织(WHO)的有关数据,人体对氯的耐受量为每天每公斤体重0.15毫克,假设这些氯全部来自于饮用水,得到自来水氯的允许含量为每升5毫克。根据我国的相关规定,出厂水的余氯含量最低不能低于0.05毫克/升,最高上限为4毫克/升。

在如上一项关于水氯化对 6-61 个月儿童肠道微生物群影响的研究中,未发现氯化对肠道菌群有显著的长期影响,但氯化处理组的腹泻发作和抗生素使用次数较少。氯化水处理组中某些微生物物种的丰度略有增加,抗生素耐药基因 (ARG) 的丰度也有所增加。
耐药基因丰度的增加归因于肠杆菌科细菌相对丰度的增加,这些细菌含有可移动的耐药基因,但被认为最终是有益的肠道居民。
由于本研究再次未测量水中的微生物群,因此这些耐药基因的来源尚不清楚。先前的研究表明,饮用水中存在的大多数耐药基因表现出垂直传播模式,而不是水平传播模式。这些耐药基因可能来自饮用水,或者可能有其他来源,但氯的存在会在肠道中创造一种环境,从而有利于这些肠杆菌科细菌的繁殖。
迄今为止,已有少数研究考察了水氯化对模型生物肠道菌群的影响。几种水氯化会导致肠道菌群发生变化,但这些变化仅在高于饮用水中通常测量的浓度时才会观察到。这些研究中的暴露时间通常也很短。对水中氯离子相关浓度的慢性暴露进行进一步研究将有助于得出与现实世界相关的结论。
众所周知,自来水会影响人体健康,但其影响机制尚不明确。
随着技术的发展,我们现在有很多工具可以帮助研究饮用水对人类肠道微生物群的影响。现代的DNA测序技术已经变得更加经济实惠,使我们能够分析饮用水中的微生物群落。这些技术的应用可以显著提升我们对这一领域的理解。
此外,各种可用的组学技术,包括代谢组学、蛋白质组学和转录组学,以及成像技术,提供了可用于动物模型和人类的工具,以研究饮用水微生物组与水特性和肠道微生物组之间的关系。
综合饮用水对肠道菌群及进一步身体健康的影响,还需要以下研究:
1) 长期研究
大多数现有研究侧重于持续 1 至 3 个月的短期治疗。纵向方法将考虑肠道微生物群和水质与微生物群的时间变化,并有助于了解微生物群和化学性质之间的长期关系。增强我们当前知识的一个简单方法是将饮用水属性(如水源、化学性质和消费模式)纳入肠道微生物群的纵向队列研究中。这还将改善样本量限制,因为许多队列包括数百名参与者。
2) 饮用水微生物群的影响
以前的研究主要集中在水的特性上,例如 pH 值、温度、消毒剂和溶质。然而,了解饮用水微生物群与肠道微生物群之间的直接关系对于理解其对人类健康的潜在影响至关重要。因此,未来的研究工作应该同时考虑饮用水微生物群及其化学属性。这项工作还应考虑耐药基因从饮用水到肠道微生物群的潜在传播。
3) 以人为本的研究
使用动物模型进行的研究有助于在严格控制的环境中检验假设和开发机械联系。需要进行更多研究来直接检查人类和类似人类的状况,因为这些状况可能与动物模型中的状况不同。
最近的创新如可复制的肠道微观生态系统,可能在可控环境中进行类似人类的研究。这些系统减少了对活体动物研究的需求,可用于调查多种因素、肠道发育的不同阶段及其他条件。
在体外系统中获得的重要发现可以通过人类试验并结合运用基因组学、转录组学/蛋白质组学和代谢组学来验证。这种以人为重点的研究将显著有助于理解饮用水微生物群与人类肠道微生物群之间的联系,以及在现实环境中如何体现,为公共卫生考量提供相关见解。
主要参考文献:
Moghaddam HS, Abkar L, Fowler SJ. Making waves: From tap to gut- exploring the impact of drinking water on gut microbiota. Water Res. 2024 Sep 21;267:122503.
Piperata BA, Lee S, Mayta Apaza AC, Cary A, Vilchez S, Oruganti P, Garabed R, Wilson W, Lee J. Characterization of the gut microbiota of Nicaraguan children in a water insecure context. Am J Hum Biol. 2020 Jan;32(1):e23371.
Vanhaecke T, Bretin O, Poirel M, Tap J. Drinking Water Source and Intake Are Associated with Distinct Gut Microbiota Signatures in US and UK Populations. J Nutr. 2022 Jan 11;152(1):171-182.
Khan H, Miao X, Liu M, Ahmad S, Bai X. Behavior of last resort antibiotic resistance genes (mcr-1 and blaNDM-1) in a drinking water supply system and their possible acquisition by the mouse gut flora. Environ Pollut. 2020 Apr;259:113818.
Jha AR, Davenport ER, Gautam Y, Bhandari D, Tandukar S, Ng KM, Fragiadakis GK, Holmes S, Gautam GP, Leach J, Sherchand JB, Bustamante CD, Sonnenburg JL. Gut microbiome transition across a lifestyle gradient in Himalaya. PLoS Biol. 2018 Nov 15;16(11):e2005396.
Bowyer RCE, Schillereff DN, Jackson MA, Le Roy C, Wells PM, Spector TD, Steves CJ. Associations between UK tap water and gut microbiota composition suggest the gut microbiome as a potential mediator of health differences linked to water quality. Sci Total Environ. 2020 Oct 15;739:139697.
Murakami S, Goto Y, Ito K, Hayasaka S, Kurihara S, Soga T, Tomita M, Fukuda S. The Consumption of Bicarbonate-Rich Mineral Water Improves Glycemic Control. Evid Based Complement Alternat Med. 2015;2015:824395.
Chen J, Xu XW, Kang JX, Zhao BC, Xu YR, Li JL. Metasilicate-based alkaline mineral water confers diarrhea resistance in maternally separated piglets via the microbiota-gut interaction. Pharmacol Res. 2023 Jan;187:106580.
Murakami S, Goto Y, Ito K, Hayasaka S, Kurihara S, Soga T, Tomita M, Fukuda S. The Consumption of Bicarbonate-Rich Mineral Water Improves Glycemic Control. Evid Based Complement Alternat Med. 2015;2015:824395.

谷禾健康

慢性子宫内膜炎(Chronic endometritis, CE)是一种慢性非特异性的子宫内膜炎症性疾病,常表现为无症状或非特异性临床症状,慢性子宫内膜炎经常被患者和妇科医生忽略。因此,寻找新的诊断标记对于改善慢性子宫内膜炎的预后至关重要。
针对上述问题,来自武汉大学人民医院生殖医学中心杨静团队的科研人员在《OBSTETRICS AND GYNECOLOGY》上发表了研究论文。
该研究针对慢性子宫内膜炎女性的阴道微生物特征进行深入研究,比较了98名接受子宫内膜活检进行不孕症常规临床检查的女性(49名诊断为CE的女性和49名非CE的女性)的阴道微生物组特征,并采用杭州谷禾核酸提取试剂盒及测序平台,使用16S rRNA基因扩增子测序分析阴道微生物组,对微生物标记物进行了鉴定。
该项研究确定了四个慢性子宫内膜炎的微生物标记物(肠杆菌,普雷沃氏菌,粪杆菌,Phascolarctobacterium),开发了针对慢性子宫内膜炎预测诊断分类器,并进一步探讨了阴道微生物组特征作为慢性子宫内膜炎诊断新工具的潜力。

英文题目:Vaginal microbiome dysbiosis as a novel noninvasive biomarker for detection of chronic endometritis in infertile women
中文题目:阴道微生物群失调作为检测不孕女性慢性子宫内膜炎的新型非侵入性生物标志物
期刊名:OBSTETRICS AND GYNECOLOGY
发表时间:2024年7月10日
▼ 什么是慢性子宫内膜炎?
慢性子宫内膜炎是发生在子宫内膜间质区的持续性细微炎症性疾病,其特征为子宫内膜间质区的浆细胞浸润,通常无症状或仅出现轻微的症状,如异常子宫出血、盆腔疼痛、白带增多等。
▼ 慢性子宫内膜炎有哪些不良后果?
大量研究表明,慢性子宫内膜炎与女性不孕症、反复流产、反复着床失败、子宫内粘连和辅助生殖技术的不良后果密切相关,此外慢性子宫内膜炎还是影响活产和足月分娩的客观因素之一。
▼ 慢性子宫内膜炎的发病率
慢性子宫内膜炎的发病率在不同人群中不尽相同:
其病理改变与内膜中微生物群的定性、定量改变有关。
近年来,人类微生物组学的研究表明,人体不同系统内微生物群与人类健康和疾病发病机制存在密切关系,刺激炎症并增加癌症等疾病发生的风险。作为人体主要的微生物组,阴道菌群对于女性生理和生殖健康起着重要作用。
◆阴道病原体感染是慢性子宫内膜炎的病因之一
Moreno等人通过微生物培养在慢性子宫内膜炎女性子宫内膜中发现了包括无乳链球菌和淋病奈瑟菌在内的细菌,并开发了一种诊断慢性子宫内膜炎的分子方法——逆转录聚合酶链反应试验,从这些病原体中识别DNA,用于慢性子宫内膜炎的诊断。
◆慢性子宫内膜炎:宫腔内致病菌增加
随着微生物组学技术的发展,传统观点认为宫腔内是无菌环境的观念也逐渐被推翻。16S和宏基因组测序等技术均证实宫腔内存在微生物的定植,健康女性以乳杆菌属占绝对优势,且宫腔内微生物与慢性子宫内膜炎的发病存在关联,慢性子宫内膜炎患者宫腔非乳酸杆菌为优势菌群且致病菌如加德纳菌、葡萄球菌、链球菌检出率增加。
在研究中也指出,诊断患有慢性子宫内膜炎的女性阴道微生物群生态失调。与子宫内膜冲洗样品相比,阴道分泌物可以作为诊断慢性子宫内膜炎的更无创和更经济有效的生物标志物。阴道宫颈黏液的免疫学指标已被认为是子宫内膜炎的潜在诊断生物标志物。然而,需要进一步评估阴道微生物组在慢性子宫内膜炎中的诊断潜力。
本研究于2023年6月至2023年11月在武汉大学人民医院生殖医学中心完成。研究集中于常规不孕症检查中接受子宫内膜活检的患者。最终共纳入49名患有慢性子宫内膜炎的女性,并与49名非慢性子宫内膜炎对照组相匹配。
慢性子宫内膜炎患者的选择标准如下:
排除标准为:
注:所有受试者均获得书面同意,并经武汉大学人民医院伦理委员会批准(批准通知号:WDRY2023- K090)。
该研究的设计和流程图如图所示:
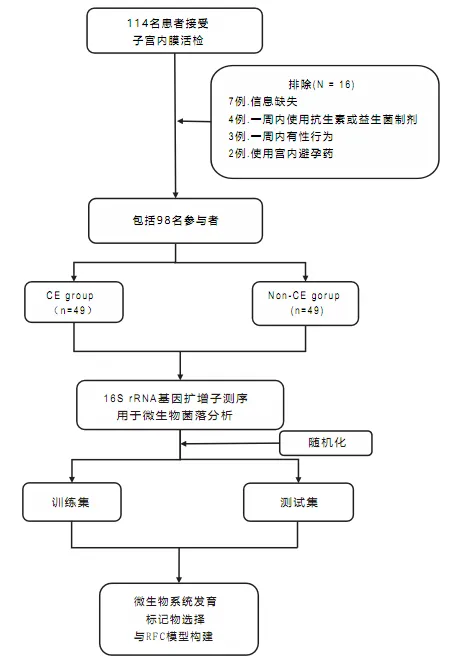
编辑
在本研究中,所有样本均在子宫内膜活检前采集。用无菌生理盐水擦拭外阴。随后,使用无润滑剂的一次性无菌阴道窥镜完全暴露宫颈。使用两个无菌拭子从后穹窿收集阴道分泌物:一个使用Nugent评分法进行评估,另一个储存在−80°C下用于后续16S rRNA基因测序分析。
项目采用杭州谷禾核酸提取试剂盒(GHFDE100)提取阴道冲洗液样本的基因组DNA。用引物515F(5′- GTGCCAGCMGCCGCGGTAA- 3′)和806R(5′- GGACTACHVGGGTWTCTAAT- 3′)扩增16S rRNA的V4区。为了实现多重测序,将样品特异性对端6bp条形码集成到TrueSeq适配器中。纯化和定量后,整个DNA池在Illumina NovaSeq6000平台(Illumina)上按照协议进行测序。
使用Vsearch v2.22.1组装拼接双端序列,并以100%的相似性阈值将序列聚类为相同的扩增子序列变体(amplicon sequence variant, ASV)。利用QIIME2加权分类器获得ASV的分类信息。基于R包“VennDiagram”生成维恩图来说明分组间共有的和独有的ASV。
α-多样性是指群落内的物种多样性,以物种丰富度和归一化香农熵(均匀度)为其显著组成部分。物种丰富度采用Chao1指数进行量化,而Shannon多样性指数同时评估丰富度和均匀度。通过主坐标分析(PCoA)可视化两个组之间样本的微生物菌落结构。使用R的vegan包进行相似性分析(ANOSIM)评估微生物群落的差异。
此外,为了预测微生物的代谢功能,使用京都基因与基因组百科全书(KEGG)数据库与PICRUSt2 (Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)进行代谢途径富集分析。组间的统计差异使用Kruskal-Wallis检验和Wilcoxon秩和检验进行评估,显著性水平定义为P < 0.05。
为了评估阴道微生物群组成对慢性子宫内膜炎(CE)的诊断潜力,应用随机森林算法,这是一种稳健的监督学习算法。使用R的pROC软件包生成的受试者工作特征(ROC)曲线评估模型的整体性能。曲线下的面积(AUC)量化了ROC曲线的判别能力。此外,还计算模型的特异性、敏感性和准确性。
连续变量的临床特征差异使用Student’s t检验进行评估,而分类变量则需要使用χ²检验或Fisher精确检验进行评估。统计分析使用SPSS版本27(IBM)进行,P < 0.05被认为具有统计学意义。
在98名参与者中,49名被诊断为CE,其标准是在30个随机选择的高倍视野中至少有一个视野中观察到超过5个MUM-1+/CD138+细胞。基线特征包括年龄、体重指数、抗穆勒激素水平和流产史,在两组之间显示了可比性(见表1)。
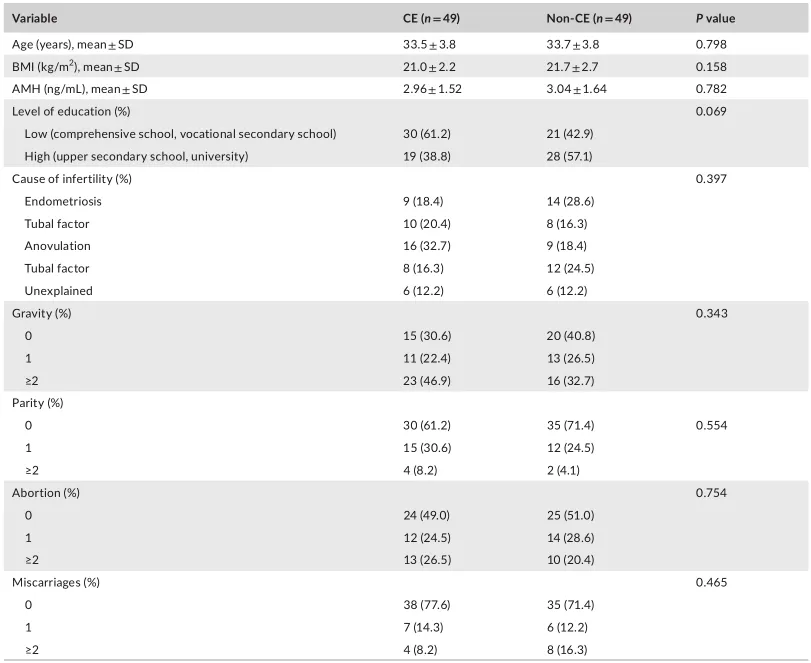
等级丰度曲线体现了物种丰富度和均匀度
等级丰度曲线描述了两组微生物群落的物种丰富度和均匀度。曲线范围越宽表明物种丰度越高,曲线越光滑表明物种分布越均匀。
从曲线上看,CE组的物种丰富度和均匀度高于非CE组(图2a)。维恩图显示,两组共有1180个ASV中的664个,其中CE组特有的ASV为354个(图2b)。利用Chao1丰富度估计器和Shannon多样性指数量化的α-多样性结果显示,两组间差异不显著(Chao1的P = 0.1733, Shannon的P = 0.9043,图2c,d)。
为了说明样品之间的微生物组分布空间,进行了PCoA,如图2e所示。结果显示,两组样本的分布是对称的。
值得注意的是,ANOSIM结果显示组间差异大于组内差异,尽管没有达到统计学意义(R = 0.022, P = 0.085)(图2f)。
阴道微生物群的细菌多样性
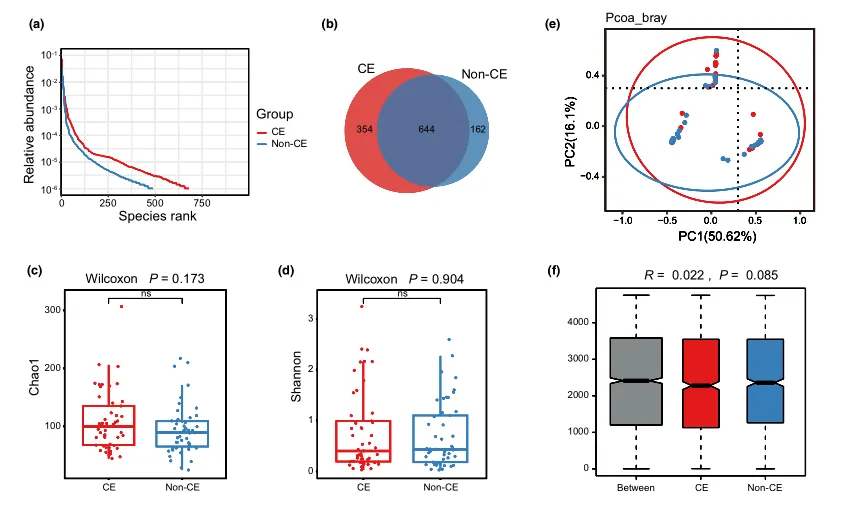
(a)用秩丰度曲线评价细菌的相对均匀度;
(b)显示组间重叠的维恩图;
(c)采用Chao1指数;
(d)Simpson指数估算口腔微生物多样性;
(e)使用Bray-Curtis通过主坐标分析计算β多样性;
(f)通过相似性分析计算了组间微生物群落的差异。
阴道微生物群的组成
文中分析了与CE相关的阴道微生物组的分类组成和变化。门、科和属水平的平均细菌群落组成如图3a-c所示。值得注意的是,与非CE组相比,CE组有10个属的细菌显著富集,包括双歧杆菌、普雷沃氏菌和加德纳菌(均P < 0.05)(图3d)。
慢性子宫内膜炎患者阴道微生物群落的系统发育概况
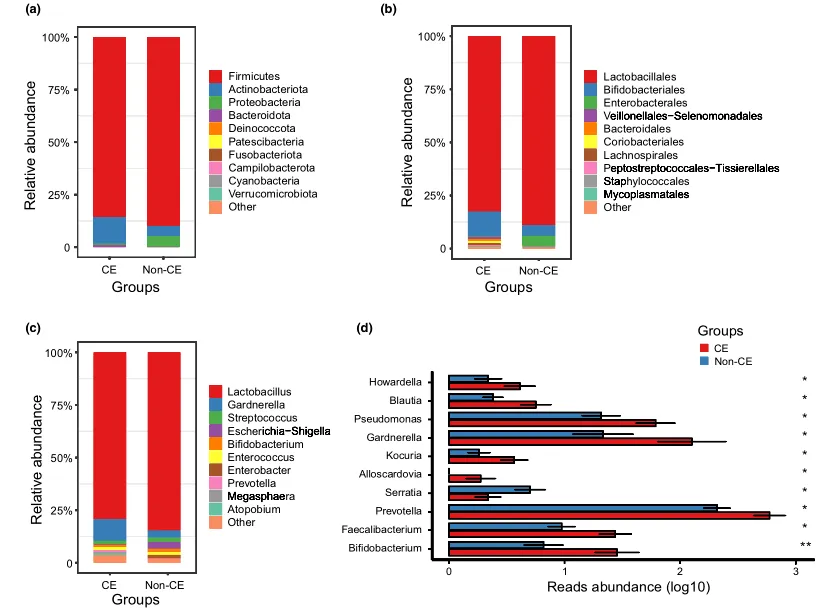
门(a)、科(b)、属(c)水平上细菌群落的平均组成。CE组与非CE组间差异有统计学意义(均 P < 0.05)。0.01 <矫正 P ≤ 0.05 ,标记为*。
代谢途径
通过KEGG途径富集的功能分析揭示了CE组中几种上调的途径,如图4所示。具体而言,参与多糖生物合成和代谢的途径(包括鞘糖脂生物合成、糖胺聚糖降解和其他多糖降解过程)上调。
此外,萜类和聚酮类代谢、II型聚酮类生物合成、鞘脂质代谢、次生代谢物生物合成、链霉素生物合成、外源生物降解、氯烷烃和氯烯烃降解以及凋亡相关途径也上调。总共有8个KEGG模块在CE组显著富集,重点是代谢相关途径(均P < 0.05)。
KEGG代谢通路的丰度差异
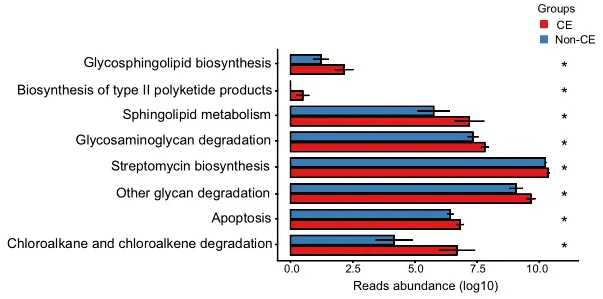
0.01< 校正P≤0.05,标记为*;0.001 <校正P≤0.01,标记为**。CE,慢性子宫内膜炎。
为测试阴道微生物组对慢性子宫内膜炎(CE)的诊断潜力,这里构建了一个随机森林分类器模型,用以区分CE样本和非CE样本。训练集用于模型训练,测试集用于评估模型性能。通过在发现阶段重复五次的10倍交叉验证,我们识别出四个最优标记 ASV 作为CE的标记集(图5a)。
这些选定ASV的对应细菌属包括:
随机森林模型在训练集队列上的AUC值为85.68%(95%置信区间[CI], 75.62%-95.73%),在测试集队列上的AUC值为83.26% (95% CI, 68.67%-97.85%)(图5b)。模型的特异性为82.76%,灵敏度为79.49%,准确率为80.88%。
这些发现表明,基于阴道微生物ASV标记的随机森林模型在区分CE和非CE队列方面表现出强大的诊断潜力。
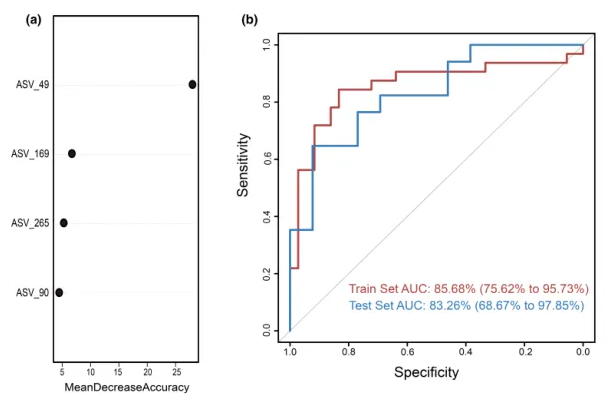
图5.通过随机森林模型鉴定用于临床诊断的微生物标志物。
(a)使用阴道样品中四种选定生物标志物的概况,来自随机森林模型的变量的平均降低准确度。
(b)接收器工作特征曲线基于组织样本的训练集和测试集。ASV,扩增子序列变体; AUC,曲线下面积。
◆阴道菌群的变化可引起宫腔的菌群失调
女性阴道中的微生物组是一个完整的连续体观点已被广泛接受。阴道细菌可以异位定植并改变上生殖道中的微生物组。局部微生物组的生态失调会导致微环境发生复杂的病理生理变化,最终扰乱与免疫反应、炎症和凋亡相关的各种过程,从而促进病理状况。
阴道和宫腔内的菌群变化有一定的同步性,阴道菌群的变化可引起宫腔内的菌群失调,从而影响女性生殖健康。
本研究旨在对有或没有慢性子宫内膜炎(CE)的女性阴道微生物组的群落结构和功能进行初步探索。此外,文章中还提出了基于阴道微生物ASV的新型非侵入性CE诊断标志物。
◆特定的菌群可作为新型非侵入性CE诊断标志物
与先前的研究结果一致,该研究中没有发现慢性子宫内膜炎组和非慢性子宫内膜炎组阴道微生物组之间的α-多样性或β-多样性有显著差异。
值得注意的是,微生物组的低组内变异情况表明其作为潜在诊断标记具有一定的稳健性。与非CE组相比,慢性子宫内膜炎组中几个低丰度属的富集程度不同,包括双歧杆菌,普雷沃氏菌和加德纳菌。
双歧杆菌
双歧杆菌以其保护作用而闻名,其高丰度在CE组中令人惊讶。双歧杆菌菌株作为益生菌用于肠道炎症、严重疾病和抑郁症患者的肠道微生物组调节已有很长的历史。然而,其他研究报告称,在一些不健康的情况下,包括子宫内膜异位症、高危人乳头瘤病毒和不孕症,阴道中双歧杆菌含量很高。这种不一致的潜在机制尚不清楚,需要进一步研究。
加德纳菌和普氏菌
加德纳菌和普氏菌是公认的阴道生态失调的指标。这些属的定植改变了免疫系统,并诱导了促炎反应。在宿主-微生物共培养模型中,加德纳菌与宫颈阴道屏障的破坏有关,同时促进小鼠中普雷沃菌属对上生殖道的侵入性感染。
总的来说,该研究结果表明,两组之间的阴道微生物组发生了实质性变化,突显了阴道冲洗液样本作为检测慢性子宫内膜炎的诊断工具的潜力。
◆阴道菌群的变化可引起宫腔的菌群失调
KEGG途径富集分析强调了关键代谢过程的上调,特别是CE组的聚糖生物合成和代谢。覆盖阴道上皮细胞的聚糖涂层是保护屏障的重要组成部分。乳杆菌与阴道上皮的粘附被认为是具有竞争性地抑制病原体,而上皮的糖胺聚糖在这些过程中起着至关重要的作用。
值得注意的是,糖胺聚糖的消耗与宫颈上皮细胞屏障功能的破坏有关,这可能会增加对局部细菌和上升感染的易感性。这表明CE患者的微生物组失调可能会对微生物侵入阴道的主要门户产生负面影响,并引发宫内炎症。
关于慢性子宫内膜炎(CE)的标准化定义和诊断指南仍存在争议,最被接受的诊断依赖于子宫内膜活检。基于选定的阴道微生物群构建了CE诊断模型。本文研究中,引入了一种新的随机森林模型,该模型可以根据ASV以更高的灵敏度和准确性将CE患者与使用阴道分泌物的健康个体区分开来。该研究结果表明,阴道微生物组的变化可以作为诊断CE的指标,为慢性子宫内膜炎提供了一种更容易获得和更方便患者的诊断选择。
然而,该研究也存在一定的局限性。首先,它主要侧重于检查有慢性子宫内膜炎和没有慢性子宫内膜炎的女性之间的成分差异,而不是研究与慢性炎症相关的免疫失调的潜在机制。其次,阴道微生物样本是在分泌中期收集的,这可能无法解释整个月经周期中微生物群组成的变化。第三,作为一项单中心调查,发现的普遍性可能有限。考虑到饮食和运动等因素,多中心方法可以提供更全面的解读。
最后,多种组学方法的整合(包括培养组学、元转录组学和代谢组学),可以提供对微生物群落功能的全面了解。这种更广泛的视角对于阐明阴道微生态系统内复杂的网络和阴道微环境的潜在变化至关重要。
阴道微生物生态失调是慢性子宫内膜炎的重要指标。该研究确定了与慢性子宫内膜炎发展相关的潜在候选细菌,并提出了潜在的机制。基于阴道微生物群的生物标志物有望成为检测慢性子宫内膜炎的非侵入性工具。需要进一步的研究来发现特定阴道微生物组在慢性子宫内膜炎中的功能,并确定具有诊断能力的强大阴道微生物标记物,以区分患有慢性子宫内膜炎的个体。