-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

拟杆菌是革兰氏阴性、专性厌氧菌,在人类肠道微生物群中含量丰富,构成了肠道菌群中大部分比例。
Bacteroides uniformis (一般简称为 B.uniformis),翻译为单形拟杆菌或普通拟杆菌,是拟杆菌属的主要成员,在肠道中起着重要的作用。也被鉴定为阴道微生物组的组成部分。
Bacteroides uniformis是与人类粪便中异黄酮染料木黄酮降解相关的特定细菌物种,可以产生纤维素酶和淀粉酶,降解复杂多糖。
Bacteroides uniformis与肠炎、厌食、肥胖、糖尿病、腹胀、认知发育与情绪运动、多动症、慢性肾病、骨质疏松等相关,是可引起人类或动物疾病的物种,不太可能在人群中传播,并且存在足够的预防或治疗方法。
对单形拟杆菌进行深入研究,有助于我们更好地理解其在人体肠道中的功能,并为相关疾病的预防和治疗提供新的思路。
Bacteroides uniformis是一种革兰阴性细菌,呈杆状。它们通常具有弯曲或弯钩形态,并且没有芽胞。

图源:Microbe Canvas
生理特性
Bacteroides uniformis是一种厌氧菌,不能在氧气存在的环境中生长。它们通常能够利用多糖类物质作为碳源,如淀粉、纤维素和其他复杂碳水化合物。还可以产生一些酶,如纤维素酶和淀粉酶,用于降解消化这些复杂碳水化合物。
分布和生存环境
Bacteroides uniformis是人体肠道,阴道中常见的细菌之一,也可以在其他动物的肠道中找到。它们在肠道中扮演重要的生态角色,参与食物消化、营养吸收和免疫调节等过程。Bacteroides uniformis能够适应肠道的微生态环境,与其他肠道细菌相互作用。
功能和代谢
Bacteroides uniformis在肠道中具有多种功能和代谢活性。它们参与葡萄糖和其他碳水化合物的代谢,并产生短链脂肪酸(如丙酸和乙酸),这些酸有益于肠道健康。此外,Bacteroides uniformis还参与胆固醇代谢、氨基酸代谢和维生素合成等生物化学过程。
肥胖和肥胖相关疾病构成了世界范围内的重大公共卫生问题。除了传统的减肥药物外,下一代益生菌(NGP)似乎非常有希望作为潜在的肥胖预防和治疗药物。
主要的候选NGP已在肥胖和肥胖相关疾病的临床前模型中显示出前景,例如:
B.uniformis已被证明具有对抗肥胖和代谢紊乱的有益特性。在动物模型中, B. uniformis与减肥、降低血清胆固醇和甘油三酯水平以及改善肝脂肪变性有关。此外,它还与血清瘦素水平降低、空腹血糖浓度降低和糖耐量改善有关。
推测的机制包括调节肠道菌群和改善肠道菌群失调、改善肠道屏障功能、减少慢性低度炎症和调节肠道肽分泌。
一项对41名体重指数(BMI)正常的个体肠道菌群和内脏脂肪面积 (VFA)的研究显示,内脏脂肪面积高/低(VFA)两组的肠道菌群存在显著差异,在 L-VFA 组中,B. plebeius 和B.uniformis含量很高。此外,B.uniformis与血清 LDL-胆固醇水平呈负相关。
另一项对32名肥胖成年人(14 名接受了腹腔镜袖状胃切除术 (LSG))和30名基线健康对照者的肠道菌群以及身体指标的研究,并在术后 6 个月进行了随访。通过磁共振成像测量腹部内脏脂肪面积(VFA)和皮下脂肪面积(SFA)。腰围、臀围、腰臀比(WHR)和体重指数(BMI)被列为简单的肥胖参数。通过宏基因组测序分析肠道微生物组。在与腹部内脏脂肪面积(VFA)负相关的物种中,Eubacteria eligens相关性最强,其次是Clostridium citroniae、C. symbiosum、Bacteroides Uniformis、E. ventriosum、C. hathewayi等。
一项涉及 45 名儿童(6 至 12 岁)的横断面研究调查了肠道微生物群与儿童肥胖之间的关系。发现两个BMI组之间的多样性存在差异。这种差异包括真杆菌属(Eubacterium)、普拉梭菌(Faecalibacterium prausnitzii)、Dialister、Monoglobus pectinilyticus、Bifidobacterium pseudocatenulatum、Intestinibacter bartlettii、 Bacteroides intestinalis、Bacteroides uniformis (单形拟杆菌)和 史密斯甲烷杆菌(Methanobrevibacter smithii)。
一项针对减肥手术是否显著改善体重的研究显示单形拟杆菌的丰度可能影响手术后的效果。
术前属于拟杆菌门和厚壁菌门的成员丰度存在差异无应答组:
富含拟杆菌科、拟杆菌属、单形拟杆菌、Alistipes Finegoldii、Alistipes alistipes、Dorea formicigenerans 、瘤胃球菌。
应答组:
富含消化链球菌科、 Gemmiger、Gemiger formicilis、Barnesiella、Prevotellaceae 、 Prevotella。
线性判别分析 >2;p < 0.05。与有反应组相比,无反应组中普氏菌与拟杆菌的比率显着较低 (p = 0.048)。
神经性厌食症(Anorexia nervosa, AN)的特点是一种神秘的食物回避模式,导致严重的营养不良,这种疾病在青春期早期发展。近期,在《Nature Microbiology》上发表的文章研究了77名患有神经性厌食症的成年女性和70名被认为是健康体重的对照组。
利用宏基因组学,作者对微生物组的细菌和病毒成分进行了深入分析。细菌基因组中的结构变异,特别是Bacteroides uniformis(单形拟杆菌)中的结构变异,可能造成了硫胺素生产的破坏。
硫胺素(或称维生素B1)缺乏会影响人体健康,包括记忆丧失、焦虑、抑郁、易怒、失眠、食欲减退和胃肠道不适。这也可以解释在神经性厌食症患者中普遍观察到的硫胺素缺乏的现象。
认知发展
一项针对健康以色列阿拉伯儿童的横断面研究显示一些菌群分类学差异与儿童智商测试FSIQ评分显着正相关,包括Prevotella(普雷沃氏菌属)、Dialister属、Sutterella(萨特氏菌属)、Ruminococcus callidus和Bacteroides uniformis(单形拟杆菌)。
情绪相关
一项针对长期封闭环境中心理变化和肠道菌群的研究,鉴定出四种潜在的“精神抗生素”(单形拟杆菌Bacteroides Uniformis、Roseburia inulinivorans、Faecalibacter prausnitzii、Eubacterectale )。
根据宏基因组、宏蛋白质组和代谢组学分析,四种潜在的精神抗生素主要通过与神经系统功能相关的三种途径改善情绪:
首先,通过发酵膳食纤维,它们可能产生短链脂肪酸,例如丁酸和丙酸;
其次,它们可能调节天冬氨酸、谷氨酸、色氨酸等氨基酸代谢途径(例如,将谷氨酸转化为γ-氨基丁酸;将色氨酸转化为血清素、犬尿酸或色胺);
第三,它们可能调节其他途径,例如牛磺酸和皮质醇代谢。此外,动物实验的结果证实了这些潜在的精神抗生素对情绪的积极调节作用和机制。
运动相关
肠道微生物群可能有助于改善运动表现。日本庆应义塾大学先进生命科学研究所通过分析25名男性长跑运动员的比赛成绩后发现,运动员粪便中单形拟杆菌(Bacteroides uniformis)的丰度与其3000米比赛成绩间存在相关性。
在随后的一项随机、双盲、安慰剂对照研究中,研究人员让健康男性志愿者服用α-环糊精,以增加肠道中的单形拟杆菌总量。结果表明,补充α-环糊精可以提高人体的耐力运动能力。
此外,在小鼠实验中,食用单形拟杆菌显著延长了动物游泳的持续时间;动物盲肠短链脂肪酸浓度以及肝脏中与糖异生相关酶的基因表达均上升,肝糖原含量降低。该研究表明,单形拟杆菌可能通过促进肝脏内源性葡萄糖生成,增强个体的耐力运动能力。
妊娠糖尿病
妊娠合并糖尿病包括孕前糖尿病(PGDM)和妊娠期糖尿病(GDM)。 一项针对234份孕妇粪便样本的16S rRNA测序数据显示,随着妊娠的进展,妊娠糖尿病PGDM 组的肠道细菌种类数量有所减少。巨单胞菌、拟杆菌和 Roseburia Enteris 在 PGDM 组中富集,而 Bacteroides vulgatus、Faecalibacter prausnitzii、Eubacterectale、Bacteroides uniformis(单形拟杆菌)、Eubacteria eligens、Subdolilegum在对照组中比例更高,这些菌血糖与血糖特征呈负相关。
二型糖尿病
一项针对亚洲人的包括36个不同二型糖尿病T2DM研究(健康,n = 3378;T2DM,n = 551)的meta分析显示,T2DM 组中普通杆菌菌、单形拟杆菌和普氏粪杆菌较低。
另一项包括29名T2DM患者和28名健康对照者研究显示,Megamonas funiformis 和 Escherichia 的丰度在T2DM患者的肠道中显着增加。相反,Bacteroides stercoris、单形拟杆菌和Phascolarctobacterium faecium的丰度降低。
单形拟杆菌 (Bacteroides uniformis) 还可能调节动物肠道稳态,减轻小鼠结肠炎。一项研究使用B.uninis JCM5828 及其代谢物对患有葡聚糖硫酸钠盐 (DSS) 诱导的结肠炎的雌性 C57BL/6J小鼠进行治疗。
Bacteroides uniformis治疗显著减轻了结肠炎的进展并恢复了机械和免疫屏障蛋白的表达。此外,Bacteroides uniformis还增加了共生菌双歧杆菌和阴道乳杆菌的丰度,同时减少了致病性埃希氏菌、志贺氏菌的丰度,并调节了肠道胆汁酸代谢。
Bacteroides uniformis在很大程度上调节结肠组织中NF-κB和丝裂原激活蛋白激酶(MAPK)信号通路关键调节蛋白的表达以及TH17细胞的分化。然而,Bacteroides uniformis在体外不能直接抑制TH17细胞分化;它应该是通过参与胆汁酸代谢和调节关键代谢物(α-鼠胆酸、猪去氧胆酸和异石胆酸)来调节固有层的过程,从而调节肠道免疫反应。
此外在一项溃疡性结肠炎(UC)患者的菌群研究中,六种拟杆菌属表现出显着较低的相对丰度,十二种拟杆菌属被发现与至少一项疾病活动指标显着相关。五个物种( Alistipes putredinis、Bacteroides stercoris、Bacteroides Uniformis、Bacteroides rodentium、Parabacteroides merdae )的相对丰度与溃疡性结肠炎活性的四个指标中的三个相关。
12 个关键物种表达了与 UC 发病机制相关的5 个基因(TARP、C10ORF54、ITGAE、TNFSF9和LCN2 )。作为潜在生物标志物的关键物种的丧失可能会加剧 UC 活动。
比较功能性腹胀和膨胀(FABD)患者和12健康个体粪便微生物群的多样性和组成,并评估小肠细菌过度生长 (SIBO) 。结果显示FABD 组的微生物多样性显着低于对照组。与健康对照相比,FABD 患者中变形菌的比例显着升高,放线菌的比例显着降低。与健康对照相比,FABD患者中粪杆菌的比例显着升高,而SIBO(+)FABD患者中普氏菌和粪杆菌的比例也显着升高。与健康对照相比,FABD 患者的普氏粪杆菌 (Faecalibacter prausnitzii) 的丰度显着增加,但单形拟杆菌 (Bacteroides uniformis)和青春双歧杆菌数量明显减少。
乳糜泻患者肠道中的 Bacteroides distasonis、Bacteroides fragilis / Bacteroides thetaiotaomicron、Bacteroides Uniformis、Bacteroides ovatus比对照组更少(p<0.05)。
骨质疏松
一项研究中,与对照组相比,几个物种的丰度发生了变化,在骨质疏松组中发现了特定的功能途径,骨质疏松组中下列菌群的水平下降:
类风湿性关节炎
一项研究包括 76 名类风湿关节炎患者的粪便宏基因组和血浆代谢组的分期概况。
骨关节炎
骨关节炎是一种病因不明的慢性退行性疾病。一项研究针对骨关节炎患者(n = 32)和正常对照组(n = 57)肠道菌群检测,宏基因组测序显示,骨关节炎患者中Bacteroides stercoris、Bacteroides vulgatus、Bacteroides uniformis在物种水平上的丰度显著降低,大肠杆菌、肺炎克雷伯菌、Shigella flexneri、唾液链球菌在骨关节炎中显著增加。
特应性皮炎AD
使用 16S rRNA 测序分析了 93 名志愿者的粪便样本,其中包括 44 名 AD 患者和 49 名健康对照受试者,年龄为 6-22 岁。
卟啉单胞菌科、Blautia、Parabacteroides、Bacteroides ovatus、Bacteroides uniformis 和 Prevotella stercorea 的相对丰度显著较高(P < 0. 05) AD 患者高于健康对照者。与 AD 患者相比,健康对照受试者中梭状芽胞杆菌和粪疟原虫含量较高 (P < 0.05)。
儿童多动症
对11项儿童多动症研究的meta分析显示,拟杆菌属与多动和冲动水平相关。在物种水平上,多动症儿童Faecalibacterium丰度较低,但Bacteroides uniformis、肠球菌、双歧杆菌和Odoribacter增加,可能导致中枢神经系统多巴胺相关功能受损。
此外,多动症儿童肠道中Faecalibacterium丰度的降低可能导致炎症细胞因子的渗透性和交叉性更高。
一项调查多动症儿童及其饮食模式和肠道菌群的研究显示,在注意缺多动障碍(ADHD)组中,粪肠拟杆菌(B. coprocola)的相对丰度降低,而单形拟杆菌(B.uniformis)、卵形拟杆菌(B.ovatus)和粪类杆菌(S. stercoricanis)的相对丰度升高。
结直肠癌转移组
转移性结直肠癌组和非转移性结直肠癌组患者的肠道菌群存在差异。在属水平上,拟杆菌属菌种脆弱拟杆菌和单形拟杆菌组成在转移组中显着高于非转移组。
PD-1免疫疗法反应
肠道微生物群被认为是调节免疫检查点抑制剂治疗功效的关键因素。一项波兰黑色素瘤患者队列中PD-1疗法反应与基线肠道微生物组的研究显示,普氏菌和单形拟杆菌的丰度与反应有关,而无反应者的肠道微生物群富含普氏粪杆菌和脱硫弧菌以及一些未分类的厚壁菌门。
慢性肾病
一项台湾地区人群肠道菌群研究显示,在慢性肾病 (CKD)患者中发现的最丰富的属是拟杆菌属,在物种水平上,血液透析患者中的B. ovatus、B. caccae 、 B.uniformis表现出显著丰度,而腹膜透析患者中的Blautia表现出较高的丰度。
白塞病
在活动性白塞病BD患者其单形拟杆菌丰度显著高于其匹配的健康对照和处于非活动状态的疾病患者 ( p = 0.038)。
单形拟杆菌可以消化多种膳食纤维,作为一种代谢膳食纤维产生乙酸的肠道菌已有大量研究表明日常膳食纤维摄入会影响单形拟杆菌的丰度。
一项横断面研究中检查了全谷物和精制谷物、纤维和麸质的习惯摄入是否与肠道微生物群相关。对779 名参与者137 项食物频率的调查问卷和肠道菌群的分析显示。最高全谷物摄入量四分位与较高丰度的普通拟杆菌、普氏粪杆菌、Blautiaproducta和Rikenellaceae以及较低丰度的单形拟杆菌有关。
一项对不同特异性(低-低聚果糖、低至中-2 型抗性淀粉、中-果胶和高-不溶性 β-1,3-葡聚糖特异性)纤维的微生物发酵研究显示,高特异性不溶性β-葡聚糖促进目标细菌大量增加,Anaerostipes sp. 平均从0.3%增加到16.5%,单形拟杆菌平均为 2.5% 至 17.9%,这与这些细菌所在的每个微生物群落中相关代谢物(分别为丁酸盐和丙酸盐)比例的增加有关。
水溶性醋酸纤维素 (WSCA) 是一种合成纤维来源,可以导致拟杆菌属成员的丰度增加,尤其是单形拟杆菌。在四种具有代表性的人类肠道拟杆菌属中,只有单形拟杆菌在WSCA上的纯培养物中生长并活跃地产生乙酸。
一项对健康志愿者进行了为期 4周的营养干预分析天然单宁提取物混合物对肠道微生物变化的研究显示。从前两周起就可以观察到微生物群的组成和功能的变化,测序显示以下菌相对丰度增加,例如:
利用同位素标记发,发现食用菊粉富集的前三种细菌为单形拟杆菌(Bacteroides uniformis)、产酸拟杆菌(Bacteroides acidifaciens)和狄氏副拟杆菌(Parabacteroides distasonis)。
一项研究评估富含黄酮类化合物的蔓越莓多酚(CP)和龙舌兰(AG)(一种高支链龙舌兰衍生的新果聚糖)对C57BL6雄性小鼠的心脏代谢反应、肠道微生物群组成、代谢内毒素血症和粘膜免疫调节的影响,该雄性小鼠喂食致肥胖高脂肪高糖(HFHS)饮食9周。AG,单独或与CP(CP+AG)联合,主要刺激聚糖降解细菌:
与未经治疗的小鼠相比,接受AG的肥胖小鼠中聚糖降解细菌的增加与丁酸水平的显著增加一致。
总的来说,研究发现高特异性不溶性β-葡聚糖、天然单宁提取物混合物、菊粉、蔓越莓多酚和龙舌兰能增加Bacteroides uniformis的丰度。
主要参考文献:
Vallianou NG, Kounatidis D, Tsilingiris D, Panagopoulos F, Christodoulatos GS, Evangelopoulos A, Karampela I, Dalamaga M. The Role of Next-Generation Probiotics in Obesity and Obesity-Associated Disorders: Current Knowledge and Future Perspectives. Int J Mol Sci. 2023 Apr 4;24(7):6755.
Nie X, Chen J, Ma X, Ni Y, Shen Y, Yu H, Panagiotou G, Bao Y. A metagenome-wide association study of gut microbiome and visceral fat accumulation. Comput Struct Biotechnol J. 2020 Sep 20;18:2596-2609.
Murga-Garrido SM, Ulloa-Pérez EJ, Díaz-Benítez CE, Orbe-Orihuela YC, Cornejo-Granados F, Ochoa-Leyva A, Sanchez-Flores A, Cruz M, Castañeda-Márquez AC, Plett-Torres T, Burguete García AI, Lagunas-Martínez A. Virulence Factors of the Gut Microbiome Are Associated with BMI and Metabolic Blood Parameters in Children with Obesity. Microbiol Spectr. 2023 Feb 14;11(2):e0338222.
Lapidot Y, Maya M, Reshef L, Cohen D, Ornoy A, Gophna U, Muhsen K. Relationships of the gut microbiome with cognitive development among healthy school-age children. Front Pediatr. 2023 May 19;11:1198792.
Cheng M, Zhao Y, Cui Y, Zhong C, Zha Y, Li S, Cao G, Li M, Zhang L, Ning K, Han J. Stage-specific roles of microbial dysbiosis and metabolic disorders in rheumatoid arthritis. Ann Rheum Dis. 2022 Aug 19;81(12):1669–77.
Shirvani-Rad S, Ejtahed HS, Ettehad Marvasti F, Taghavi M, Sharifi F, Arzaghi SM, Larijani B. The Role of Gut Microbiota-Brain Axis in Pathophysiology of ADHD: A Systematic Review. J Atten Disord. 2022 Nov;26(13):1698-1710.
Wang LJ, Yang CY, Chou WJ, Lee MJ, Chou MC, Kuo HC, Yeh YM, Lee SY, Huang LH, Li SC. Gut microbiota and dietary patterns in children with attention-deficit/hyperactivity disorder. Eur Child Adolesc Psychiatry. 2020 Mar;29(3):287-297.
Hao Z, Meng C, Li L, Feng S, Zhu Y, Yang J, Han L, Sun L, Lv W, Figeys D, Liu H. Positive mood-related gut microbiota in a long-term closed environment: a multiomics study based on the “Lunar Palace 365” experiment. Microbiome. 2023 Apr 24;11(1):88.
Ren Y, Hao L, Liu J, Wang P, Ding Q, Chen C, Song Y. Alterations in the Gut Microbiota in Pregnant Women with Pregestational Type 2 Diabetes Mellitus. mSystems. 2023 Apr 27;8(2):e0114622.
Wu X, Park S. Fecal Bacterial Community and Metagenome Function in Asians with Type 2 Diabetes, According to Enterotypes. Biomedicines. 2022 Nov 21;10(11):2998.
Lv M, Li L, Li W, Yang F, Hu Q, Xiong D. Mechanism research on the interaction regulation of Escherichia and IFN-γ for the occurrence of T2DM. Ann Palliat Med. 2021 Oct;10(10):10391-10400.
Yan Y, Lei Y, Qu Y, Fan Z, Zhang T, Xu Y, Du Q, Brugger D, Chen Y, Zhang K, Zhang E. Bacteroides uniformis-induced perturbations in colonic microbiota and bile acid levels inhibit TH17 differentiation and ameliorate colitis developments. NPJ Biofilms Microbiomes. 2023 Aug 14;9(1):56.
Nomura K, Ishikawa D, Okahara K, Ito S, Haga K, Takahashi M, Arakawa A, Shibuya T, Osada T, Kuwahara-Arai K, Kirikae T, Nagahara A. Bacteroidetes Species Are Correlated with Disease Activity in Ulcerative Colitis. J Clin Med. 2021 Apr 17;10(8):1749.
Noh CK, Lee KJ. Fecal Microbiota Alterations and Small Intestinal Bacterial Overgrowth in Functional Abdominal Bloating/Distention. J Neurogastroenterol Motil. 2020 Sep 30;26(4):539-549.
Wang H, Zhang K, Wu L, Qin Q, He Y. Prediction of Pathogenic Factors in Dysbiotic Gut Microbiomes of Colorectal Cancer Patients Using Reverse Microbiomics. Front Oncol. 2022 Apr 27;12:882874.
Ye S, Yan F, Wang H, Mo X, Liu J, Zhang Y, Li H, Chen D. Diversity analysis of gut microbiota between healthy controls and those with atopic dermatitis in a Chinese population. J Dermatol. 2021 Feb;48(2):158-167.
Zhou P, Dai Z, Xie Y, Li T, Xu Z, Huang Y, Sun D, Zhou Y. Differences in tissue-associated bacteria between metastatic and non-metastatic colorectal cancer. Front Microbiol. 2023 Jun 9;14:1133607.
Shivani S, Kao CY, Chattopadhyay A, Chen JW, Lai LC, Lin WH, Lu TP, Huang IH, Tsai MH, Teng CH, Wu JJ, Hsieh YH, Wang MC, Chuang EY. Uremic Toxin-Producing Bacteroides Species Prevail in the Gut Microbiota of Taiwanese CKD Patients: An Analysis Using the New Taiwan Microbiome Baseline. Front Cell Infect Microbiol. 2022 Apr 26;12:726256.
Kim JC, Park MJ, Park S, Lee ES. Alteration of the Fecal but Not Salivary Microbiome in Patients with Behçet’s Disease According to Disease Activity Shift. Microorganisms. 2021 Jul 6;9(7):1449.
Um CY, Peters BA, Choi HS, Oberstein P, Beggs DB, Usyk M, Wu F, Hayes RB, Gapstur SM, McCullough ML, Ahn J. Grain, Gluten, and Dietary Fiber Intake Influence Gut Microbial Diversity: Data from the Food and Microbiome Longitudinal Investigation. Cancer Res Commun. 2023 Jan 11;3(1):43-53.
Cantu-Jungles TM, Bulut N, Chambry E, Ruthes A, Iacomini M, Keshavarzian A, Johnson TA, Hamaker BR. Dietary Fiber Hierarchical Specificity: the Missing Link for Predictable and Strong Shifts in Gut Bacterial Communities. mBio. 2021 Jun 29;12(3):e0102821.
Molino S, Lerma-Aguilera A, Jiménez-Hernández N, Rufián Henares JÁ, Francino MP. Evaluation of the Effects of a Short Supplementation With Tannins on the Gut Microbiota of Healthy Subjects. Front Microbiol. 2022 Apr 27;13:848611.

谷禾健康

手术,俗称开刀,是医生通过医疗器械对病人身体局部进行去除病变组织、修复损伤等治疗,来维持患者的健康,在治愈疾病方面具有明确的作用。
围手术期是指从手术决策到手术结束及术后恢复期的整个时间段。围手术期管理的目标是确保手术的成功和患者的安全。然而,每个患者的情况都是独特的,因此个性化的管理计划是非常重要的。
医疗团队会根据患者的具体情况和手术类型制定适合的围手术期管理方案,以最大程度地减少手术风险和并发症,并促进患者的康复。
总结下围手术期主要流程和事项(仅供参考):
手术前
术前评估:医疗团队会对患者进行全面的评估,包括身体状况、病史、过敏史等。这有助于确定手术的风险和制定个性化的手术计划。
术前准备:患者需要按照医疗团队的指示进行术前准备,如禁食、停止某些药物的使用等。这有助于减少手术风险和并发症的发生。
心理准备:围手术期对患者来说可能是一个焦虑和紧张的时期。医疗团队会提供支持和心理辅导,帮助患者应对手术前的情绪和压力。
手术期
在围手术期中,医疗团队会密切监测患者的生命体征和手术进展,并根据需要进行干预。
麻醉和镇痛管理:麻醉师会根据手术类型和患者的情况选择合适的麻醉方法,并确保患者在手术过程中没有疼痛。
液体和营养管理:患者在手术期间可能需要静脉输液或营养支持,以维持体液平衡和营养状态。
预防感染:医疗团队会采取措施来预防手术相关感染,如使用无菌技术、给予抗生素预防等。
术后 (围手术期后,患者需要进行恢复和康复)。
术后护理:医疗团队会提供术后护理指导,包括伤口护理、药物使用、饮食和活动限制等。
康复计划:根据手术类型和患者的情况,医疗团队会制定个性化的康复计划,包括物理治疗、康复训练等。
术后随访:医疗团队会安排术后随访,以监测患者的康复进程,并及时处理并发症或其他问题。
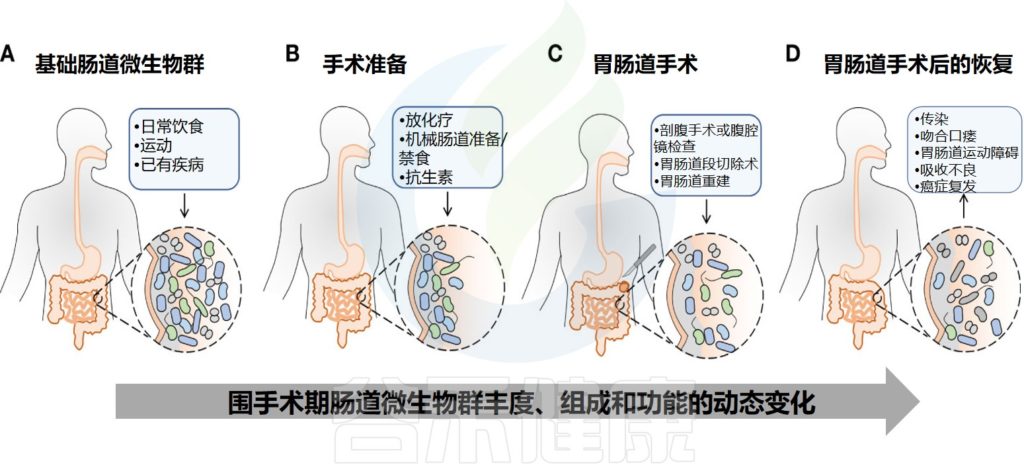
每个人有独特的遗传背景和生活方式,其中人体肠道微生物在人群之间差异较大,不同的年龄,不同的饮食,用药和感染等都会塑造不同的肠道共生菌群,而这些菌群又共同参与人体的健康维护和影响疾病的发生。
目前越来越多的研究和临床实践逐渐发现围手术期间,不管是术前禁食,消毒以及心里压力的增加,还是术中麻醉的使用和手术本身,亦或是手术后的服用药物,伤口护理,肠内营养或术后“特殊”饮食等,都会对胃肠道和胃肠道菌群造成严重的影响,甚至是破坏。
胃肠道,尤其肠道菌群作为免疫消化,炎症反应的主要介质,也与神经大脑和远端很多器官的形成轴,互作影响。其中术后的大脑和胃肠功能障碍是常见的麻醉手术相关并发症。例如术后谵妄(postoperative delirium, POD)、吸收不良到术后肠梗阻以及术后感染等。
研究显示,手术所导致的肠道菌群失调可持续长达1个月,随着术后感染的出现与抗菌药物的使用,典型的共生细菌会迅速流失并导致微生物群平衡的破坏。值得注意的是,即使在心肌梗死、外伤或脑血管意外等急性应激的数小时内,微生物组也会发生剧烈变化。
这些变化为病原体的繁殖与侵袭提供了机会。常用的吸入麻醉药和阿片类药物均会影响肠道微生物群的组成。暴露于1.5%异氟烷4h可使小鼠肠道微生物群丰富度显著降低,主要表现为厚壁菌门的梭状芽孢杆菌数量减少,而这种变化与免疫功能受损和机会性致病菌感染相关,特别是在免疫功能低下的患者中。
另一项研究显示,禁食和异氟醚暴露显著改变了马粪便的微生物的组成,主要表现为梭菌和立克次体的丰度较低。动物研究显示,阿片类药物可改变微生物群组成并破坏肠道屏障功能。
因此,在围手术期中,健康状态下微生物组平衡被抗菌药物、阿片类药物、手术损伤和营养不良所打破,除病原微生物迅速繁殖所导致的感染外,仍可能以多种方式影响患者的转归与预后。
本文主要分享和讨论围手术期肠道微生物群的变化及其对术后并发症的影响。从微生物组的整体角度认识围手术期中微生物群的变化及其作用,可以为优化围手术期管理策略提供了一个全新视角。
目录
一.什么是围手术期?
-术前期
-手术期
-术后期
二.围手术期的肠道微生物变化
-基础肠道微生物
-术前期的肠道微生物
-手术期的肠道微生物
-术后期的肠道微生物
-重症患者的肠道微生物
三.不同手术对肠道微生物的影响
-袖状胃切除术和胃旁路手术
-胃肠道癌症部位切除
-肝移植手术
-老年患者手术
四.术后并发症与肠道菌群的关联
-术后疼痛
-术后感染
-胃肠动力障碍
-吸收不良
-吻合口瘘
-癌症风险及癌症复发
五.结语
围手术期是围绕手术的一个全过程,从病人决定接受手术治疗开始,到手术治疗直至基本康复 ,包含手术前、手术中及手术后的一段时间,时间约在术前5-7天至术后7-12天。
这段时间内,医疗团队会采取一系列措施来确保手术的成功和患者的安全。这个阶段的目标是减少手术相关的并发症,促进患者的康复。
即从病人决定接受手术到将病人送至手术台。
①心理准备
术前病人常见的心理问题:夸大手术的危险性;不理解麻醉的过程;不知道疼痛的程度;对预后悲观。
心理护理的最基本措施:正视病人的情绪反应,鼓励病人表达自己的焦虑、感受,给予支持和疏导,安排病人参加适当娱乐活动等都可以达到较好效果。此外,要充分尊重病人自主的选择,应在病人“知情同意”的前提下采取诊断治疗措施,
术前心理准备可以减轻焦虑;促进术后脉搏和血压的稳定;减少术中麻醉剂的用量,减少病人术后对止痛剂的需求;增加病人术后活动的主动性。此外还可以降低术后感染的发生率;缩短住院时间。
②身体准备
身体准备能够帮助病人维持良好的生理状态,以安全度过手术和手术后的过程。
皮肤准备
清除皮肤上的微生物,减少感染导致伤口不愈合的概率。充分清洁手术部位皮肤和剃除毛发,范围大于约定切口的范围。
皮肤准备一般在术前一天进行。
呼吸道准备
目的是改善通气功能,预防术后并发症。主要措施是戒烟和深呼吸、咳痰训练。如病人患有呼吸系统疾病,术前应行体位引流,雾化吸入,必要时使用抗生素。
胃肠道准备
目的是减少麻醉引起的呕吐及误吸,也可以预防消化道手术中的污染。术前12小时禁食,术前6小时开始禁止饮水,以防因麻醉或手术引起呕吐而致窒息或吸入性肺炎。
肠道手术前3天起少渣饮食,并口服肠道不吸收抗生素,以减少术后感染的机会。术前1天改流食;放置胃管或肠管,一般在术日晨放置;排便练习。
腹部手术病人除急诊手术禁止灌肠外,于术前一日晚用肥皂水灌肠或使用开塞露,排空肠腔内粪便。
其他准备
术前一天或术日早晨检查病人,如有发热(超过38.5℃)或女病人月经,则延迟手术;术前夜给镇静剂,保证病人的充分睡眠;进手术室前排空尿液,必要时留置尿管;手术前取下活动牙齿。
即从送病人到手术室实施麻醉,到病人接受预定手术程序。术中包括术中麻醉,手术过程,术中管理,术中护理。
•麻醉管理
麻醉师会根据手术类型和患者的情况选择适当的麻醉方法,并监测患者的生命体征,包括心率、血压、呼吸等。他们会确保患者在手术过程中处于无痛和稳定的状态。
•感染控制
医疗团队会采取严格的感染控制措施,包括消毒手术场所、佩戴无菌手套和口罩、使用无菌器械等,以减少手术部位感染的风险。
•手术操作
医生会根据手术计划进行手术操作,包括切口、组织修复、器官重建等。他们会遵循严格的操作规范和技术,以确保手术的准确性和安全性。
•输血和输液
根据患者的需要,医疗团队可能会进行输血或输液来维持患者的血容量和电解质平衡。
术中意外低体温会导致严重后果!
术中一般需要对患者的生命体征进行监测,包括心率、血氧、体温等,同时对患者的营养状态、术前血糖的控制、术中血压的控制等进行全面的监测。
围手术期低体温可能对肠道微生物群产生一定的影响。低体温可能导致肠道微生物群的失衡,影响其组成和功能,还会使手术部位感染的概率上升。
低体温可能引起肠道血液循环减慢,导致肠道缺血和缺氧,从而影响肠道微生物的生存和代谢活动。此外,低体温还可能影响肠道黏膜屏障的完整性,增加肠道通透性,使有害微生物更容易进入肠道。
此外患者常反映术后初期的寒冷不适是住院期间最为痛苦的体验之一,有时甚至超过疼痛。
肠道微生物群的失衡可能导致肠道炎症的增加,免疫功能下降以及消化不良等问题。这些问题可能进一步影响术后恢复和患者的整体健康。
开始于病人进入恢复室或病房,终止于病人从手术相关的各种应激中恢复。
•疼痛护理
术后会因手术切口疼痛导致焦虑不安、恐惧等情绪,医护会在术后完善患者疼痛的自我评估,并在术后视情况联合使用止痛药物,同时对患者进行适当心理疏导,从而能够有效降低不良心理情况的发生,提高手术治疗的效果。
•活动指导
翻身或下床活动时引流管是否固定妥善,引流管是否保持畅通,避免扭曲折叠。在病床上可适度活动下肢,预防长期卧床导致的深静脉血栓出现。
•呼吸道护理
术后每隔2h督促或协助患者翻身、变化体位,指导患者正确咳嗽咳痰、深呼吸,定期拍背,促进排痰,对于痰液黏稠者,可雾化吸入,稀释痰液,便于痰液排出,术后按需给予持续低流量吸氧,氧流量控制在3L/分。
•饮食护理
鼓励患者进食优质蛋白,促进伤口愈合,告知患者少食用高糖、刺激性食物,严格控制胆固醇、脂肪摄入,叮嘱戒烟戒酒,观察患者饮食后肠蠕动、排气等情况。
小结
围手术期是住院患者死亡率较高的环节,因而国内外都将围术期死亡率作为评价手术、麻醉质量与安全以及患者康复的重要和关键指标。
2014年,世界卫生组织已将其列入《全球100项核心健康指标》。
围手术期医学终极目标是促进患者术后高质量恢复。围手术期应利用各种临床风险评分或生物标志物来识别那些可能发生严重不良事件的高危患者,对这些高危患者采用诸如:器官保护、严密监视、特异性的早期干预等具有特异性的临床管理措施来提高患者预后,以及健康生存质量。
肠道微生物在维持肠道健康、免疫功能和营养吸收等方面发挥着重要作用。因此肠道微生物的平衡会影响围手术期患者的健康状况以及术后的恢复。
而在围手术期中,术前的焦虑、睡眠不足与禁食,术中的麻醉药物与抗菌药物使用,以及术后手术部位感染、阿片类镇痛药、质子泵抑制剂等均可改变患者微生物群的组成,减少微生物多样性。
Zheng Z,et al.Front Cell Infect Microbiol.2023
肠道微生物群的基础状态取决于日常饮食、运动和慢性疾病等。
▸ 饮食
肠道微生物、饮食和宿主健康之间的关系很复杂。饮食通过影响肠道微生物群组成及其代谢物的产生来间接影响宿主健康。术前饮食调节一直是医生预防术后并发症的补充考虑因素。
先前一项使用动物模型的研究表明,短期的低脂高纤维饮食可以通过以下方式逆转高脂西式饮食对伤口愈合的不利影响:改善整体肠道微生物群多样性并减少术后肠球菌。
▸ 运动
运动作为一种环境因素会影响肠道微生物群的组成,这可能有益于健康和疾病预防。最近的研究表明,运动可以改善共生细菌的发育,丰富微生物区系多样性,并增加有益微生物的数量。
▸ 疾病
疾病极大地改变了术前肠道微生物群的组成及其对手术的术后反应。越来越多的证据表明,恶性肿瘤部位的肠道微生物群发生了变化,肠道微生物群的不平衡会引发癌症发生。
此外,多种代谢性疾病(营养不良、肥胖、2型糖尿病、心血管疾病、非酒精性脂肪肝等)、自身免疫性疾病(类风湿性关节炎、鼻炎、系统性红斑狼疮)、生活环境和行为因素(熬夜和饮酒等)吸烟)与肠道微生物群的改变有关并受其影响,这已在谷禾其他文章中详细综述。
扩展阅读:
围手术期通常包括住院、麻醉、手术和康复相关的时期。需要手术的人数量增加,这给围手术期的各个组成带来了巨大的挑战。
术前治疗期间肠道微生物群的变化包括长期化疗或放疗(并非所有接受手术的患者都适用)和术前短期治疗,例如禁食、肠道准备和抗生素预防。
▷禁食和限制饮水改变了肠道微生物群
围手术期术前禁食和限制液体是常规做法。然而,饮食是肠道微生物群落结构和功能的关键决定因素,因此禁食可能会引发肠道微生物群变化,进而影响宿主健康和免疫力。
进食/禁食节律会导致肠道微生物群的每日周期性成分波动,在动物模型中,肠道微生物群在禁食后1-3天内迅速变化。随着禁食时间的增加,空肠微生物群的结构发生显著变化,β-bacilli和拟杆菌(Bacteroides)减少。
基于健康犬的研究发现,空腹8 h后犬空肠菌群α多样性降低,同时β‑变形菌纲和类杆菌目丰度显著降低。基于健康人群的临床研究则发现,术前灌肠可对肠道菌群造成明显影响,并且这种影响会持续至灌肠后2~4周。此外,抗生素的使用对于预防术后感染起着重要的作用,但其同时也是造成术后肠道菌群失调的重要因素。
▷心理和生理压力影响肠道易感性
手术患者经常面临术前心理压力(如焦虑和恐惧)或生理压力(如失眠和营养不良)。这些应激刺激可以激活交感神经系统和HPA轴(下丘脑-垂体-肾上腺轴),从而增加肠道通透性和炎症,最终影响肠道微生物群。
据报道,心理压力会改变粘膜表面的微生物定植和宿主对感染的易感性。
▷放疗和化疗导致肠道微生物群失调
癌症的辅助放化疗可能会导致肠道微生物群的组成发生变化。
化疗导致非霍奇金淋巴瘤患者肠道菌群严重失调,厚壁菌(Firmicutes)和放线菌(Actinobacteria)的相对丰度显著下降,变形菌门(Proteobacteria)的相对丰度增加。
在动物研究中,5-氟尿嘧啶 (属于抗代谢药的一种,主要用于治疗肿瘤) 会降低肠道微生物群落的丰富度和多样性,导致厚壁菌门、变形菌门、软壁菌门(Tenericutes) 、蓝藻门(Cyanobacteria)的相对丰度降低,而疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria)的相对丰度增加。
注:益生菌混合物可以改善这种情况。
此外,放射治疗降低了放射性肠病患者肠道微生物的多样性,这与梭状芽胞杆菌(Clostridium IV)、罗氏菌属(Roseburia)和考拉杆菌属(Phascolarctobacterium)相对丰度的增加相关。
化疗和放疗不仅可以改变肠道微生物群,肠道微生物群还可以直接或间接调节癌症对化疗、放疗和免疫治疗的反应。
▷机械肠道准备会破坏肠道微生物群
机械性肠道准备是通过物理或化学方法减少肠内容物的过程,包含机械灌肠与口服泻药(渗透性泻剂、刺激性泻剂、组合型泻剂)。
肠道准备会破坏肠道微生物群,并可能导致长期的有害后果。灌洗会导致肠道微生物群的细菌水平和组成发生即时和实质性的变化,特别是双歧杆菌(Bifidobacterium)和乳酸菌(Lactobacillus)减少,大肠杆菌(E. coli)和葡萄球菌(Staphylococcus)增加。
注:机械肠道准备对肠道代谢组有深远的影响,口服益生菌有助于快速恢复到基线水平。
▷麻醉会降低肠道微生物多样性
许多研究发现吸入麻醉药具有明显的“类抗生素”作用,可有效抑制多种革兰阳性和革兰阴性细菌的增殖,并且对一些多重耐药菌也有明显的抗菌作用。近年来多项研究开始关注并发现吸入麻醉药对肠道菌群会产生显著的影响。
吸入异氟醚可引起健康成年马肠道菌群多样性及结构显著改变。在小鼠中发现了相似的现象,该研究让成年小鼠暴露于1.5%异氟醚4 h,结果发现麻醉后出现了明显的小鼠肠道菌群失调并且持续到了麻醉后1周,麻醉后小鼠菌群α多样性较麻醉前明显降低。
另外的研究表明小鼠暴露于挥发性麻醉剂(异氟烷)4小时显著降低了微生物多样性和包括梭状芽胞杆菌(Clostridiales)在内的几种共生细菌的水平。因此,麻醉剂是术后患者肠道菌群失调的潜在因素。
阿片类药物是临床麻醉常用镇痛药物。阿片类药物对肠道功能、免疫微环境及通透性有着明显影响。通过小鼠观察发现,吗啡持续5~6 d慢性给药能够通过肠道μ阿片受体影响肠道菌群结构,造成肠道菌群失调,同时肠道乳酸杆菌表达丰度明显降低。
通过给予阿片受体拮抗剂,能够逆转这一影响。此外,一项临床研究也发现,长期使用阿片类药物治疗会对肝硬化患者肠道菌群造成影响,主要表现为其可引起肠道拟杆菌、Clostridiales ⅩⅣ及瘤胃球菌科的相对丰度下降。
常用的局部麻醉药(利多卡因、布比卡因及罗哌卡因)也具有抗菌作用,体内及体外实验均证实其可对多种革兰阳性和阴性细菌产生明显的抗菌作用。然而,局部麻醉药物的抗菌作用不仅受到药物浓度、使用时间的影响,还与合并用药密切相关。诸如抗生素、防腐剂、阿片类药物、肾上腺素、异丙酚等药物可与局部麻醉药物结合,通过协同或拮抗作用影响其抗菌作用。此外,目前尚缺乏相关研究观察局部麻醉药物对肠道菌群是否存在影响。
▷止痛药会影响肠道屏障功能
阿片类止痛药是治疗疼痛最常用的药物,但它们会增加对艰难梭菌、霍乱弧菌、肠道沙门氏菌和铜绿假单胞菌肠道感染的易感性。
另一项研究表明,吗啡会损害小鼠肠上皮屏障功能并增加肠道微生物群的易位。
▷手术干预影响肠道微生物群的平衡
手术干预,特别是胃肠手术,威胁患者肠道微生物群的平衡。胃肠手术常会直接改变肠道微生物群的栖息地。研究发现接受手术治疗的胃癌患者肠道微生物的多样性和丰度有所增加。
此外,胃切除术增加了需氧菌、兼性厌氧菌和口腔微生物的丰度,这可能与消化道重建或术后并发症有关。
对肠道微生物群与术后并发症之间关系的荟萃分析表明,手术常常会增加假单胞菌(Pseudomonas)、葡萄球菌(Staphylococcus)和肠球菌(Enterococcus)等潜在病原体,并减少乳杆菌(Lactobacillus)和双歧杆菌(Bifidobacterium)。
将在后续章节中具体讲述不同手术对肠道微生物群的影响
外科手术创伤刺激对患者全身内环境造成重大影响,其中也包括消化系统。对于心脏手术,近年临床研究观察到,行择期心脏手术重症患者术后恢复期其肠道菌群多样性明显降低,且菌群结构改变,多种潜在致病菌表达丰度增加。
在动物研究中,手术大鼠与非手术大鼠相比,在多个水平出现表达丰度不同的差异菌。
对于非心脏手术,尤其是胃肠道手术,对肠道菌群稳态会产生巨大影响。肠道手术会使肠腔暴露在氧气中,导致肠道正常厌氧环境改变,进而导致肠道菌群紊乱。同时,手术过程中血管结扎等造成的局部缺血也会导致肠道菌群失调。肠道手术对肠道菌群的影响具有一定的持续性。
在小肠切除手术小鼠模型中,手术引起的回肠菌群改变在手术后90 d仍可以被观察到。除肠道手术外,其他非心脏手术后也可发生肠道菌群紊乱。如在腹部探查手术和骨折手术动物模型中,研究者都观察到了术后肠道菌群发生多样性和结构的显著改变。
▷抗生素会扰乱肠道微生物群
为了预防术后感染,抗生素的使用是关键。然而,许多研究表明,抗生素会对人和动物的肠道微生物群造成短期或长期影响,例如肠道微生物群组成的变化、多样性的变化以及定植时间的延迟。
特别是广谱抗生素会严重损害肠道微生物群并导致腹泻,这可能与艰难梭菌过度生长或短链脂肪酸产量减少有关。此外,抗生素通过干扰肠道菌群,会影响药物代谢,降低机体对外界病原体的抵抗力,从而增加感染风险。
▷术后并发症与肠道菌群密切相关
术后并发症与肠道菌群密切相关,肠道菌群在阻止病原体穿过肠道屏障方面发挥着重要作用。此外,肠道微生物群的组成可以反映免疫系统对入侵病原体的反应效率。
在一项涉及26名接受肾移植的患者的试点研究中,肾移植手术后3个月收集的粪便样本中的肠道微生物群出现了显著变化,这与腹泻、急性排斥反应和尿路感染等并发症有关。
▷术后肠道菌群紊乱参与术后神经认知损伤
越来越多的研究开始关注术后肠道菌群紊乱与术后神经认知损伤之间的潜在联系。对成年小鼠实施异氟醚全身麻醉下腹部探查手术,手术6 h后进行认知功能行为学测试,结果发现,全身麻醉手术后,发生POD的小鼠与未发生POD的小鼠相比,肠道菌群α多样性显著降低,同时β多样性也存在着显著的差异。对于菌群表达丰度方面,在门水平,POD小鼠软壁菌门相对丰度显著降低;在纲水平,γ‑变形菌丰度在POD小鼠显著降低;而在目水平,POD小鼠厌氧原体目和双歧杆菌目表达也出现了显著降低。
另外,该研究还进一步通过粪菌移植方法,证实存在认知功能异常的伪无菌(pseudo germ‑free, PGF)小鼠分别接受POD和非POD小鼠的粪菌移植后,接受非POD小鼠粪便细菌移植的PGF小鼠表现出认知功能的改善,而接受POD小鼠粪便细菌移植的PGF小鼠其认知功能则未见改善。这一结果证明了肠道菌群失调引起的肠‑脑轴功能紊乱是术后认知损伤的内在病因,而非疾病发展中的并存现象。
另外一个老年POCD动物模型的肠道菌群变化,结果也显示在全身麻醉腹部手术后1周,发生认知损伤的老年雄性小鼠与未发生认知损伤小鼠相比,其肠道菌群α多样性显著降低,同时β多样性出现显著改变。另外,在多个水平出现了表达丰度具有显著差异的菌种。POCD大鼠软壁菌门和部分厚壁菌门丰度明显减少。该研究还发现大肠埃希菌相对表达丰度与空间学习记忆能力损伤呈显著正相关。而Dehalobacterium属表达丰度对预测小鼠POCD的发生具有较高的敏感性和特异性。
几项研究探讨了ICU患者肠道微生物组组成的变化及其对疾病结果的预后意义。
▷重症存活患者的双歧杆菌丰度更高
在61名入住ICU患者的前瞻性队列中,研究了肠道微生物的组成,并将其与临床指标和结果相关联。发现与住院期间死亡的患者相比,存活患者的双歧杆菌属丰度显著更高。
此外,与单独的急性生理学和慢性健康评估(APACHE)II或序贯器官衰竭评估(SOFA)相比,将微生物组的组成添加到临床评分中可以改善院内死亡的预测。
▷重症患者肠道微生物多样性下降
脓毒症是危重患者死亡的主要原因,多项研究表明脓毒症与肠道微生物组密切相关。
在最近一项针对10名入住ICU的脓毒症患者、10名入住ICU的无脓毒症患者和10名健康对照的前瞻性研究中,与健康对照相比,两组ICU患者的肠道微生物组组成均发生显著改变。
ICU患者表现出α多样性降低(表明微生物组物种丰富度降低),厚壁菌门丰度增加,拟杆菌门、普雷沃氏菌(Prevotella)和毛螺菌属(Lachnospira)比例下降。
拓展:肠道微生物群对危重脓毒症患者的影响
此外,脓毒症和非脓毒症ICU患者之间观察到显著差异,肠球菌丰度增加。
在一项探索64名入住ICU脓毒症患者肠道微生物组的前瞻性研究中,检测到两个不同的簇。这些簇的特征是拟杆菌属和未分类的肠杆菌科细菌丰度增加,与血清乳酸脱氢酶水平升高和发生感染性休克的风险增加有关。
根据这些观察结果,一些研究人员提出肠道微生物组在危重脓毒症患者多器官衰竭的发展中发挥着关键作用。
▷肠道微生物群可能还与肺部炎症有关
使用动物模型,发现实验证据支持肠道细菌群落因高氧而改变并与肺部炎症相关。
检查人类肺组织,发现短链脂肪酸存在个体差异。由于短链脂肪酸依赖于肠道微生物组,这些发现表明肠道微生物组、肺微生物组和宿主健康之间存在机制联系。
总之,入住ICU的危重患者表现出明显的肠道和肺部生态失调,这与各种临床结果指标相关。然而,潜在的微生物组靶向治疗措施在这种情况下的作用尚未确定。
手术本身是影响肠道菌群组成和功能的重要因素。谷禾在这里主要讲述胃肠道手术对肠道微生物的影响。
胃肠道手术会影响腔内环境、肠道通透性、转运时间、食物消化和营养吸收。同时,胃肠道的手术重建可以改变肠道微生物群,影响新陈代谢和免疫功能。
袖状胃切除术(SG)和Roux-en-Y胃旁路术(RYGB)是治疗病态肥胖最常见的手术方法。
注:减肥手术的有益效果不仅是由于手术本身引起的胃袋限制和吸收不良结构所致,肠道微生物群的变化也可能是其机制的一部分。
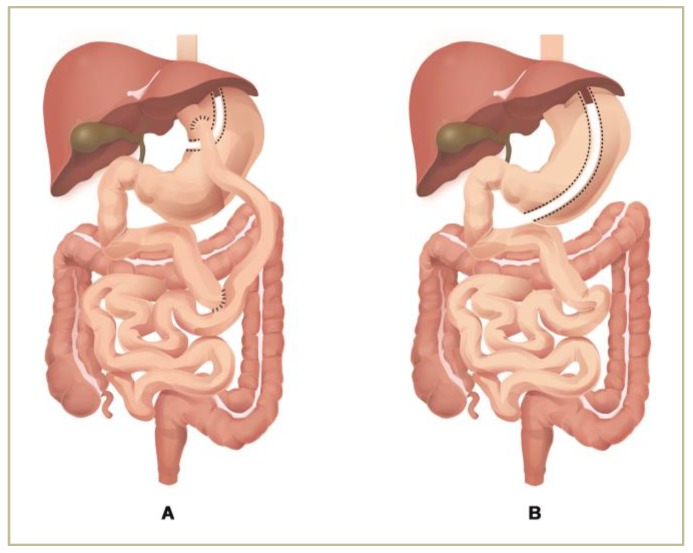
Ciobârcă D,et al.Nutrients.2020
注:(A)Roux-en-Y胃旁路手术(B)垂直袖状胃切除术。
手术改变了肠道微生物群,并且在随访的第一年,这种深刻的改变持续存在,在大多数研究中,拟杆菌和变形菌增加,厚壁菌减少。肠道微生物群的变化在不同的手术过程中存在显著差异。
✦胃旁路手术后耐氧细菌的相对丰度更高
Roux-en-Y胃旁路手术(RYGB)对肠道微生物群的组成和功能的影响比袖状胃切除术更深。
腹腔镜RYGB导致耐氧细菌(大肠杆菌和链球菌)相对丰度更高,而厌氧菌(梭状芽胞杆菌)在袖状胃切除术后相对丰度更高。此外,两次手术后6个月观察到嗜黏蛋白阿克曼菌(Akkermansia muciniphila)富集。
✦其他肠道微生物的变化
另一项短期研究中,在袖状胃切除术后3个月,下列菌群的相对丰度更高:
阿克曼菌(Akkermansia) ↑↑↑
真杆菌属(Eubacterium) ↑↑↑
嗜血杆菌(Haemophilus) ↑↑↑
经黏液真杆菌属(Blautia) ↑↑↑
而在胃旁路手术后,以下菌群的相对丰度也更高:
韦荣氏球菌属(Veillonella) ↑↑↑
史雷克氏菌(Slackia) ↑↑↑
氨基酸球菌(Acidaminococcus) ↑↑↑
Granucatiella ↑↑↑
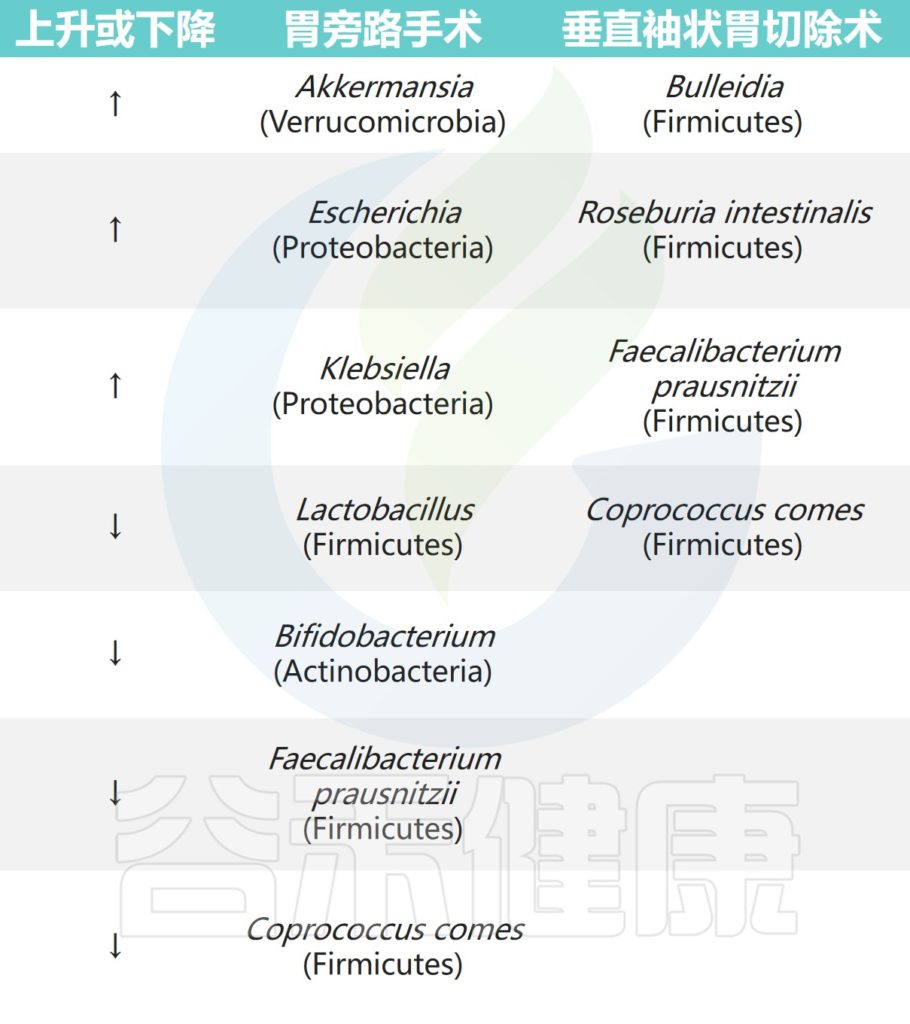
Ciobârcă D,et al.Nutrients.2020
✦肠道微生物与宿主相互作用影响手术预后
此外,与接受假手术小鼠粪便微生物群移植的小鼠相比,从胃旁路手术处理的小鼠向未接受肠道重建的无菌小鼠移植粪便微生物群会导致受体小鼠的体重减轻和脂肪量减少。这表明胃旁路手术后的肠道微生物群有助于对体重和代谢的影响。
这些研究表明,肠道手术引起肠道微生物群与宿主相互作用的改变,进而影响手术的预后。
✦胃癌患者胃切除后表现出更大的物种多样性
在胃癌患者中观察到胃切除术后肠道微生物群的变化,与对照组相比,显示出更大的物种多样性和丰富度。
口腔微生物、需氧菌(链球菌和肠球菌)和兼性厌氧菌(大肠杆菌、肠杆菌和链球菌)的丰度也更高。
✦结直肠癌患者术后肠道微生物发生显著变化
此外,肠道菌群在结直肠癌(CRC)的发生和发展中发挥着重要作用。值得注意的是,几种与结直肠癌相关的细菌(具核梭杆菌和Atopobium parvulum)和次生胆汁酸(例如脱氧胆酸)在接受全胃切除术的患者中显著富集。
相比之下,手术大大降低了结直肠癌患者肠道微生物群的多样性。术后患者和结直肠癌患者的肠道微生物群存在显著差异。与术前结直肠癌患者和健康人相比,术后结直肠癌患者中变形杆菌的相对丰度增加,并且克雷伯氏菌(Klebsiella)在术后结直肠癌病人中的比例高于术前病人,这也与传染病和淋巴细胞浸润显著相关。
长期肠道微生物群改变与术后并发症之间的关联表明,肠道微生物群调节可能有助于优化结直肠癌患者术后的预后。
随着医疗技术的不断创新与发展,我国肝移植的数量逐年增加,但术后并发症仍难以控制,导致不良预后,因此肝移植术也逐渐成为关注的焦点。
与肝脏相关的手术是诱发肠道菌群失调和细菌移位的主要因素之一。众多的研究发现,在经历肝移植手术后,模型动物和临床患者不仅在肠道微生物构成上有显著差异,而且在数量上也有显著变化。
✦肝移植后肠道菌群的变化与急性细胞排斥和感染有关
进行了一项前瞻性研究,分析了38例肝移植患者在肝移植术前和肝移植术后肠道微生物群多样性的变化。
研究发现,在肝移植后21天内,患者肠道内微生物群的多样性显著降低,但是在肝移植术2个月后微生物多样性逐渐升高,并且肠道菌群多样性的变化与急性细胞排斥和感染的发生显著相关。
急性排斥反应是器官移植受者排斥反应中最常见的一种类型。因为其发生早期是由于细胞免疫机制所致,故亦称之为急性细胞性排斥反应。
拟杆菌、肠杆菌、链球菌和双歧杆菌在急性细胞排斥患者中增加;而肠球菌、乳杆菌、梭菌科、瘤胃菌科和消化链球菌科在非急性细胞排斥患者中增加。此外,在感染患者中,金黄色葡萄球菌、粪肠球菌、大肠杆菌和铜绿假单胞菌的水平增加。
另一项研究也得到了相同的结果,研究分析了肝移植术前和肝移植术后患者肠道微生物的差异,发现肝移植术后放线菌、埃希菌和志贺菌的数量显著减少,而小单胞菌科、脱硫菌科、优杆菌科和阿克曼菌的数量显著增加。
✦肝移植后产丁酸细菌显著减少
此外发现在肝移植手术后产丁酸细菌(如普氏栖粪杆菌)显著减少,而机会致病菌(如肠球菌属)增加,这与糖尿病患者的特征相似,这可能是肝移植后新发糖尿病的原因之一。
值得注意的是,在属水平上,经黏液真杆菌属(Blautia)在肝移植后几乎消失了。Blautia因其对减轻炎症性疾病和代谢性疾病的贡献以及对特定微生物的抗菌活性而受到特别关注。
Blautia是肠道菌群中的优势菌属,与肥胖、糖尿病、癌症和各种炎症性疾病等宿主生理功能障碍存在显著相关性。产生细菌素的能力为Blautia提供了抑制肠道病原菌定植的潜力,同时它还可以影响肠道微生物群的组成,使其成为潜在的益生菌。
这些结果表明,肠道菌群的多样性与肝移植的预后相关。
每年有很大一部分老年人接受手术。在这类人群中,手术创伤和压力可能会增加认知能力下降的风险,特别是对于那些患有前驱期阿尔茨海默病或患有遗忘性轻度认知障碍的患者。
术后全身炎症与血浆细菌内毒素增加一起,已被证明可协同引起神经炎症,从而引发认知功能障碍。此外,术后血浆细菌内毒素水平较高与胃肠道微生物群失调有关,包括肠道微生物群多样性减少和组成改变以及肠道屏障损伤。
✦手术后肠道微生物的变化导致神经炎症
手术/麻醉后,肠道微生物群的丰度发生显著变化,革兰氏阴性菌的比例增加。脂多糖是革兰氏阴性菌细胞壁的关键成分,是肠上皮细胞表面TLR4的强激动剂,增加肠道通透性。
此外,手术创伤和麻醉引起的氧化应激可诱导促炎因子的释放,如IL-1β、IL-6和TNF-α。促炎细胞因子可以破坏血脑屏障的完整性,并通过血脑屏障内皮细胞上的特定表面受体和转运蛋白穿过,最终导致大脑中的小胶质细胞激活和神经炎症。
✦大肠杆菌分泌的Aβ蛋白可能会导致认知障碍
此外,麻醉/手术后,肠道中大肠杆菌的比例增加。肠道中的大肠杆菌(E.coli)、枯草芽孢杆菌(Bacillus subtilis)和沙门氏菌(Salmonella)可以合成Aβ蛋白。
Aβ(β-淀粉样蛋白)是大脑皮质老年斑的主要成分。可溶性二聚体可以有效削弱突触结构和功能。这种二聚体是最小的突触毒性物质,是引起阿尔茨海默病的重要物质。
肠道Aβ可以通过受损的肠道屏障进入循环,从而引发交叉反应性免疫反应。这会过度激活炎症信号,并导致Aβ在大脑中沉积。Aβ沉积会干扰海马神经元中N-甲基-D-天冬氨酸(NMDA)受体mRNA的表达,降低突触可塑性,最终导致认知障碍。
手术影响下肠道菌群变化与认知功能


Wang XQ,et al.Front Aging Neurosci.2021
综上所述,手术期肠道生态失调会损害神经递质和神经调节剂的合成和分泌,通过肠脑轴引起认知功能障碍。
许多术后并发症,如感染、术后疼痛、胃肠道运动障碍、吸收不良和癌症复发,会阻碍手术的重建过程和恢复。
研究发现一些术后并发症与肠道微生物之间存在联系,对宿主和肠道微生物群在围手术期相互作用的更好的理解将使手术更安全并进一步预防并发症。
全世界每年进行超过3亿例外科手术。据估计,住院和门诊手术后分别有71%和51%的患者经历中度至重度疼痛。
√肠道微生物的产物影响疼痛感受器
细菌的产物,包括神经递质、代谢物以及肠道微生物的组成元素,能够激活伤害感受器。
疼痛有不同的表现形式,其中一种是炎症性疼痛,例如关节炎疼痛,它影响着全世界很大一部分人。免疫细胞释放介质如腺苷三磷酸(ATP)、前列腺素E2、肿瘤坏死因子α、白细胞介素1β、C–C基序趋化因子配体2(CCL2)和趋化因子(C-X-C基序)配体1(CXCL1),可观察到炎症条件下疼痛阈值降低,疼痛反应增加。
关于炎症性疼痛和微生物组的临床研究表明两者之间存在关联。使用磁共振成像评估,骨关节炎、膝盖疼痛和炎症患者的粪便样本中链球菌属(Streptococcus)丰度之间存在显著关联。
√内脏疼痛与微生物的变化有关
慢性盆腔疼痛是功能性内脏疼痛的另一种常见综合征,也与微生物组的改变有关。多项研究表明,慢性盆腔疼痛、慢性前列腺炎和间质性膀胱炎患者的肠道和泌尿微生物组发生了变化。
肠道内的益生菌,包括乳酸菌和双歧杆菌,能够产生神经递质,如5-羟色胺、去甲肾上腺素、γ-氨基丁酸和组胺等。
5-羟色胺在疼痛中的作用已有充分记录,它不仅由肠道细菌产生,而且由肠嗜铬细胞产生。5-羟色胺激活 TRPV4 与内脏疼痛有关。
肠道微生物群影响术后疼痛
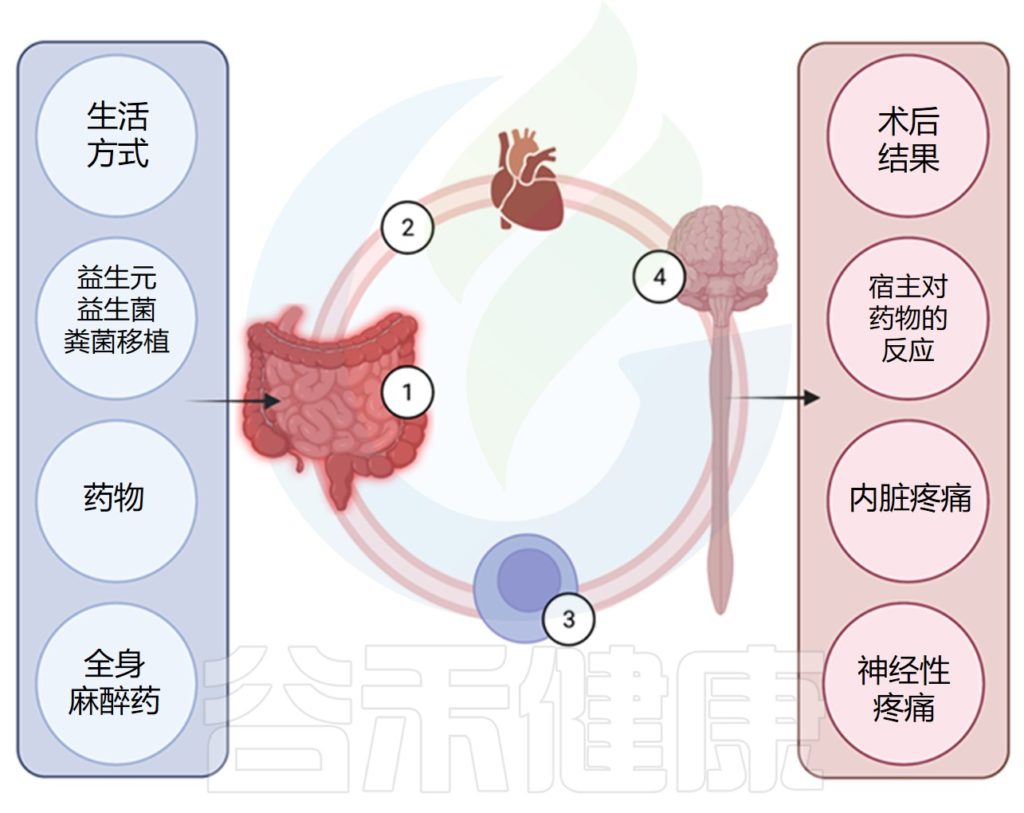
Minerbi A,et al.Anesthesiology.2022
关联研究表明肠道微生物组的改变与人类的慢性疼痛和一些术后疼痛相关。动物模型提供的证据表明肠道微生物组可能在发病机制中发挥作用。
需要更全面地了解肠道微生物组和感觉神经元之间直接和间接相互作用的机制,以发现新的治疗靶点,从而为术后疼痛的治疗策略提供信息。
术后感染,特别是手术部位感染,是再入院的常见原因,这导致医疗费用增加。一般来说,与其他外科手术相比,胃肠道手术术后感染的风险更大,因为胃肠道栖息着大量微生物。
传统上,术后感染往往是由于术前局部或肠道消毒不充分引起的,即使没有机械肠道准备,也可以在手术前一天通过抗生素作为预防措施来预防。然而,肠道和皮肤微生物群的完全耗尽是不可能的,并且具有潜在的负面影响。
√原有肠道微生物群失调易导致术后感染
许多术后感染是由患者的肠道微生物群引起的,通常是在无意中抑制有益细菌和抗生素耐药病原菌易位之后发生的。
相反,多样化和保护性的肠道微生物群为抵抗感染并发症提供了重要的生物层,因为共生细菌通过竞争性抑制、抗菌肽的产生和宿主免疫系统的激活,有助于抵抗内源性和外源性病原体的定植抵抗。
√术前肠道菌群失调与术后感染率较高有关
生活方式因素、基础疾病、药物、抗生素和外科手术都可能会扰乱肠道微生物群,导致定植抵抗力丧失并增加对病原菌入侵的易感性。
此外,当有益菌群受到抑制时,许多院内感染源自患者的肠道微生物群。结直肠癌患者术前肠道菌群失调与术后感染并发症发生率较高相关,包括腹部/盆腔感染和肺部感染。
结直肠癌术后患者中克雷伯氏菌(Klebsiella)相对丰度的增加与感染性疾病显著正相关,如细菌侵袭上皮细胞和金黄色葡萄球菌感染,差异代谢途径和属之间的相关性分析揭示了这一点。
手术部位感染的致病菌被确定为铜绿假单胞菌(P.aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus)和肠球菌(Enterococcus spp.),这些细菌在结直肠癌术后患者的粪便微生物群中也较丰富。
√围手术期补充益生菌可以降低术后感染几率
临床试验评估了围术期益生菌或合生元调节肠道微生物群对术后感染并发症的影响。荟萃分析显示,围手术期补充益生菌或益生元可降低胃肠道手术患者感染并发症的总体发生率,包括伤口感染、呼吸道感染和尿路感染。
注:最常用的菌株是乳酸菌和双歧杆菌。
益生菌在术后感染中的作用可能是由于围手术期肠道微生物群的稳定和全身炎症反应的减轻。在整个住院过程中使用益生菌或益生元作为维持肠道菌群有益结构的潜在替代方案可能是降低术后感染风险的一种有前途的策略。
注:但现有的临床研究结果并不一致,可能是由于益生菌/益生元的种类、剂量和给药策略(时机和持续时间)存在差异,因此需要大规模随机临床试验来证实其有效性和安全性手术患者中的益生菌/益生元。
胃肠道运动障碍在胃肠道手术后很常见。这种动力障碍的范围可以从与动力增加相关的吸收不良到术后肠梗阻。
√肠道微生物在胃肠道运动中发挥重要作用
肠道微生物群在胃肠道生理调节中发挥着重要作用,特别是胃肠道运动。胃肠道手术后肠道微生物群的改变很大程度上导致了胃肠道运动的变化。
术后肠梗阻是胃肠道手术后最常见的并发症之一。口服抗生素治疗的小鼠小肠术后肠梗阻适度减轻,而结肠抗生素治疗则改善术后肠梗阻。
在临床环境中,与无肠梗阻的结直肠癌患者相比,伴有肠梗阻的结直肠癌患者肠道菌群的α多样性较低,厚壁菌门与拟杆菌门的比例较高。
伴有肠梗阻的结直肠癌患者中变形菌门的相对丰度较高,而无肠梗阻的结直肠癌患者中拟杆菌门、厚壁菌门和梭杆菌的相对丰度较高。在属水平上,肠梗阻组中的大肠杆菌-志贺菌属(Escherichia-Shigella)、Ralstonia和韦荣球菌属(Veillonella)显著高于无肠梗阻组。
注:对于术后肠梗阻,Faecalibacterium丰度低的结直肠癌患者具有较高的风险。
√补充益生菌或益生元可以改善胃肠道动力
术前益生菌治疗可改善术后肠梗阻豚鼠的排便,可能是通过恢复有益细菌种类如双歧双歧杆菌(Bifidobacterium bifidum)和长双歧杆菌(Bifidobacterium longum)以及增加丁酸产量来实现的。
此外,对21项随机对照试验的荟萃分析表明,预防性补充益生菌或合生元可以有效缩短接受胃肠道癌症手术的患者首次排气、首次排便和首次饮食的时间,降低术后肠梗阻的发生率。
尽管如此,通过补充益生菌或合生元来调节围手术期肠道菌群可用于改善胃肠道手术后胃肠道动力的恢复,但肠道准备和手术引起的肠道菌群变化的潜在机制以及肠道菌群的变化会导致胃肠道动力障碍仍有待阐明。
复杂的胃肠道手术,如胃切除术、胃旁路手术和胰十二指肠切除术,可能导致脂肪吸收不良、倾倒综合征和维生素缺乏。
倾倒综合征是失去幽门或胃的正常生理功能后,胃内容物迅速进入十二指肠或空肠所引起的一系列全身或胃肠道症状的综合征。
√肠道微生物是影响吸收的重要媒介
肠道微生物群似乎是这一过程中的一个重要媒介,因为与接受假手术对照组粪菌移植的小鼠相比,从胃旁路手术处理的小鼠到没有胃旁路手术的无菌小鼠的粪菌移植可能通过调节短链脂肪酸的产生而导致体重减轻和脂肪量减少。
腹腔镜袖状胃切除术后,肠道微生物群的能量再吸收潜力降低,肠道微生物组也可以在胃旁路手术对能量稳态的影响中发挥重要作用。γ-变形杆菌相对丰度的增加与胃旁路手术后的吸收不良密切相关。
尽管在许多情况下吸收不良可以通过补充维生素和调整饮食适应代谢变化来治疗,肠道菌群对胃肠道手术后消化吸收的影响需要进一步了解,这将为开发加速术后恢复的疗法提供线索。
吻合口瘘是消化道手术重建后最具潜在破坏性的并发症之一,几十年来一直困扰着外科医生。尽管手术技术和术后护理在过去几十年中得到了改善,但吻合口瘘仍然发生,并可能导致腹膜炎、败血症,甚至死亡。
√肠道微生物群有助于吻合口愈合
吻合后,胃肠道的修复过程立即启动,分为三个阶段,包括滞后期、纤维增生期和成熟期。最终,愈合过程导致肠上皮屏障的修复,涉及宿主细胞、管腔增殖成分和肠道微生物群的复杂分子和细胞相互作用。在这些有助于吻合口愈合的因素中,肠道微生物群在很大程度上仍然被忽视,应该予以关注。
与无菌动物和嗜酸乳杆菌或大肠杆菌定植的大鼠相比,常规无菌大鼠显示出明显更好的肠道吻合伤口愈合,这表明肠道微生物群对肠道吻合愈合的影响取决于细菌类型的差异。
肠道微生物在吻合口瘘发病机制中的作用
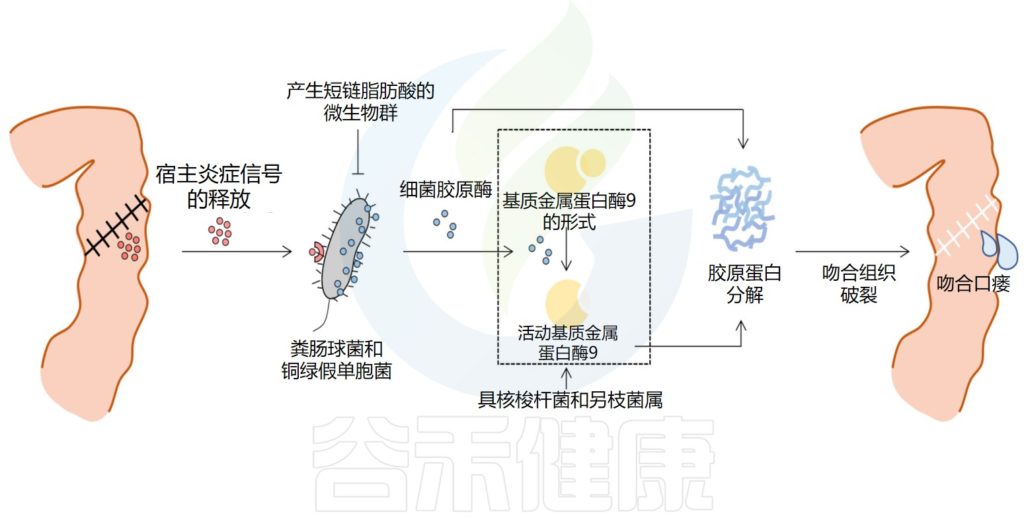
Zheng Z,et al.Front Cell Infect Microbiol.2023
肠道菌群影响伤口愈合的机制
肠道菌群通过多种分子机制参与肠道伤口愈合和上皮修复的生理过程。肠道微生物群的成员可以通过先天免疫受体(例如Toll样受体(TLR)4和2)与不同的肠上皮谱系相互作用,识别肠道微生物成分(例如脂多糖和鞭毛蛋白),从而调节肠道内的稳态并在损伤后上皮修复中发挥重要作用。
肠道微生物群产生的代谢物也参与肠上皮修复。丁酸盐是源自膳食纤维细菌发酵的短链脂肪酸之一,可调节结肠细胞增殖、增强肠道屏障、限制病原体生长并抑制炎症反应。
多项动物研究表明,外源性丁酸盐给药可改善大鼠结肠吻合的愈合并增强结肠吻合强度。此外,围手术期补充菊粉和低聚半乳糖可调节肠道微生物群,通过增强丁酸产生细菌来增加丁酸的产生,改善小鼠的吻合口愈合并增强肠道屏障。
此外,肠道微生物群产生的短链脂肪酸可能是肠道抵抗铜绿假单胞菌定植的机制,铜绿假单胞菌已被确定为吻合口瘘相关病原体。这些数据表明功能性肠道微生物群对于确保充分愈合的重要性,但围手术期事件和手术本身的压力可能会诱导肠道微生物群转变为病理表型,从而导致吻合口瘘。
因此,肠道微生物群可以通过不同微生物物种之间的合作或竞争来帮助或阻碍肠道伤口愈合。针对肠道微生物群的进一步研究可能是揭示吻合口瘘发病机制的途径之一。
√胃肠道手术会影响一些癌症的发病风险
随着时间的推移,胃肠道手术后结直肠癌的风险可能会增加,而激素相关癌症(包括乳腺癌、子宫内膜癌和前列腺癌)的风险与减肥手术相关。
此外,结直肠癌风险还受到性别和手术类型的影响。与女性相比,男性患结直肠癌的风险增加,特别是在减肥手术后3年或更长时间,而女性在胃旁路手术后结直肠癌风险降低,但袖状胃切除术后则没有降低。
√肠道微生物群的改变会影响癌症风险和复发
肠道重建后吸收性胃肠道粘膜的减少和肠道微生物群的变化都会导致胆汁酸处理的破坏,这可能会使结肠细胞暴露于更多的次级胆汁酸,特别是脱氧胆酸,激活肠细胞中的多种信号通路,包括EGFR和Wnt,这可能会增加结直肠癌的风险。
肠道细菌与癌症复发的可能机制
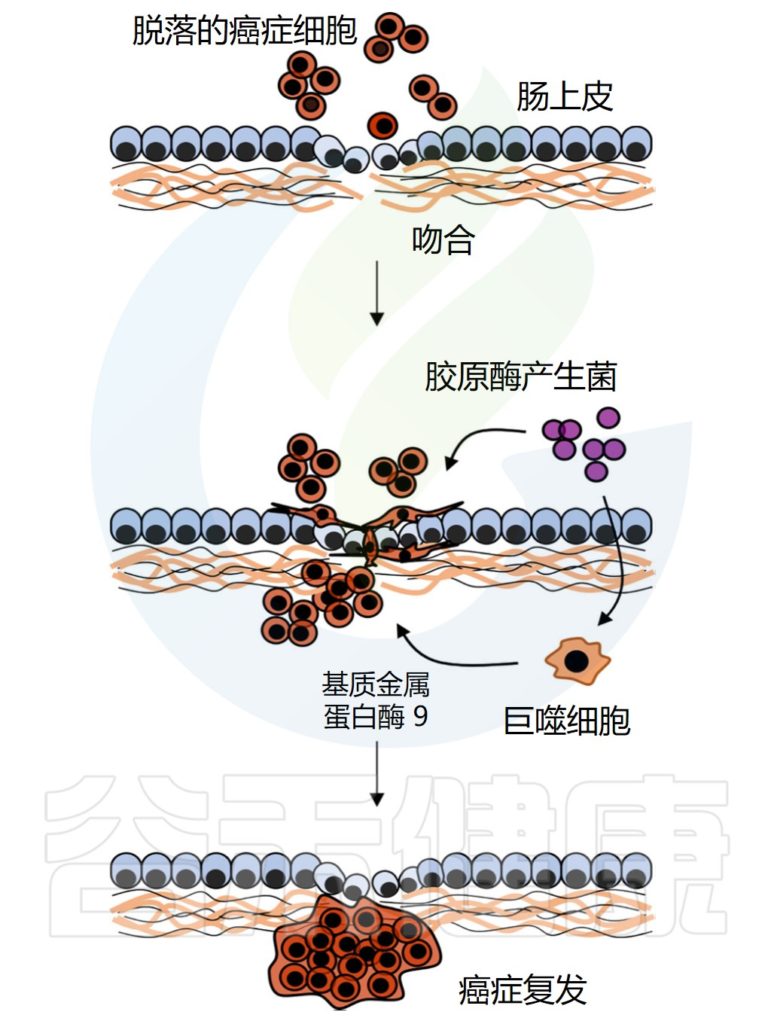
Zheng Z,et al.Front Cell Infect Microbiol.2023
Huang F,et al.Nutrients.2023
√围手术期针对肠道微生物群的干预可以改善认知障碍
近期发表了一项临床随机对照研究,观察了围手术期益生菌喂养对围手术期认知功能的影响。该研究共纳入120例行髋或膝关节置换术以及结直肠癌手术,年龄60~90岁的老年患者,随机分为益生菌喂养组和安慰剂对照组。益生菌喂养组患者在入院后开始服用混合益生菌胶囊(长双歧杆菌、嗜酸乳杆菌和粪肠球菌活菌)至出院。
该研究主要终点为POCD(术后认知功能障碍)发生率,患者的认知功能通过使用简易精神状态检查(Mini‑Mental State Examination, MMSE)量表分别在入院和术后8 d进行评估。
研究结果显示,益生菌喂养组患者POCD发生率明显低于安慰剂对照组(5.1%比16.4%,P=0.046)。此外,该研究还发现益生菌喂养组患者术后5~7 d血浆炎症因子IL‑6和皮质醇下降水平显著高于安慰剂对照组。
这些结果提示,围手术期混合益生菌喂养能够通过调节肠道菌群,进而改善术后炎症和应激反应,从而对POCD的发生起到预防作用。但是,该研究对于POCD的诊断仅使用了MMSE量表,这一工具虽然常用于认知异常的筛查,但其过于简单并且敏感性较差,并非诊断POCD的最佳工具,因此未来仍需要开展更多的临床研究,更加系统地对调节肠道菌群对POCD的预防作用进行评价。
认识围手术期中微生物群的变化及其对健康的作用,为优化围手术期管理策略提供了一个全新视角。
在围手术期中,健康状态下微生物平衡被抗菌药物、镇痛药物、手术损伤和营养不良所打破,除病原微生物迅速繁殖所导致的感染外,仍可能以多种方式影响患者的预后。
需要注意的是,目前开展的相关研究多为描述性研究,对于围手术期这一应激状态下的微生物群的改变与患者预后之间是否存在因果关系,有待于进一步探究补充。
目前尚无数据可推荐由微生物组介导的疗法。但基于上面讨论,潜在的策略包括:
避免不必要的抗菌药物滥用或针对性的杀菌策略、改善睡眠质量、减轻对即将进行手术和麻醉的焦虑、戒烟戒酒、缩短禁食水时间;术中管理包括维持足够的灌注,正常体温以及尽量减少输血;术后免疫提升,早起肠内营养和后期个性化的精准营养补充,针对肠道菌群的恢复与维护,以及合理应对感染和选用抗菌物等,以上一系列组合可以有助于身体快速康复和最大化减少手术带来的负面影响。
目前正在进行有关益生菌、益生元和合生元在围手术期作用的研究,这些研究可能会丰富基于菌群的干预手段。随着该领域的发展,人们将更好地了解宿主与微生物群的关系,以及它与外科手术和麻醉间的相互影响。
了解围手术期肠道微生物的变化对于医生和患者来说都非常重要,因为这有助于提高手术的效果和维持期,促进患者更好地康复。
主要参考文献
Zheng Z, Hu Y, Tang J, Xu W, Zhu W, Zhang W. The implication of gut microbiota in recovery from gastrointestinal surgery. Front Cell Infect Microbiol. 2023 Feb 28;13:1110787.
Liu F, Duan M, Fu H, Zhao G, Han Y, Lan F, Ahmed Z, Cao G, Li Z, Ma D, Wang T. Orthopedic Surgery Causes Gut Microbiome Dysbiosis and Intestinal Barrier Dysfunction in Prodromal Alzheimer Disease Patients: A Prospective Observational Cohort Study. Ann Surg. 2022 Aug 1;276(2):270-280.
Ciobârcă D, Cătoi AF, Copăescu C, Miere D, Crișan G. Bariatric Surgery in Obesity: Effects on Gut Microbiota and Micronutrient Status. Nutrients. 2020 Jan 16;12(1):235.
Sun Y, Wang K, Zhao W. Gut microbiota in perioperative neurocognitive disorders: current evidence and future directions. Front Immunol. 2023 May 4;14:1178691.
Wang XQ, Li H, Li XN, Yuan CH, Zhao H. Gut-Brain Axis: Possible Role of Gut Microbiota in Perioperative Neurocognitive Disorders. Front Aging Neurosci. 2021 Dec 22;13:745774.
Lai Z, Chen Z, Zhang A, Niu Z, Cheng M, Huo C, Xu J. The Gut Microbiota in Liver Transplantation Recipients During the Perioperative Period. Front Physiol. 2022 Apr 1;13:854017.
Minerbi A, Shen S. Gut Microbiome in Anesthesiology and Pain Medicine. Anesthesiology. 2022 Jul 1;137(1):93-108.
Huang F, Li S, Chen W, Han Y, Yao Y, Yang L, Li Q, Xiao Q, Wei J, Liu Z, Chen T, Deng X. Postoperative Probiotics Administration Attenuates Gastrointestinal Complications and Gut Microbiota Dysbiosis Caused by Chemotherapy in Colorectal Cancer Patients. Nutrients. 2023 Jan 11;15(2):356.

谷禾健康

辐射对人体的影响是一个长期以来备受关注的问题。长时间暴露在辐射环境下可能会导致细胞损伤、突变和癌症等健康问题。
辐射包括电离辐射(X光机、CT、伽马刀、钴60治疗机、碘-131)和非电离辐射(手机辐射、微波炉、电热毯、高压电塔、基地转播台等)。
电离辐射在核能发电、核医学诊疗、食品辐照灭菌、高分子材料改性以及环境治理等多个方面具有重要的应用。随着电离辐射在研究和技术中的广泛应用增加,其导致的代谢性疾病、急性造血综合征、胃肠综合征和免疫系统疾病也越来越多。
当核辐射暴露超过安全限度时,可能导致癌症、遗传损伤等健康问题。
其他电离辐射的主要来源包括医疗诊断、放射治疗等,长期暴露于电离辐射可能导致DNA损伤、细胞突变、组织损伤、患癌症、遗传疾病等健康问题的风险增加。
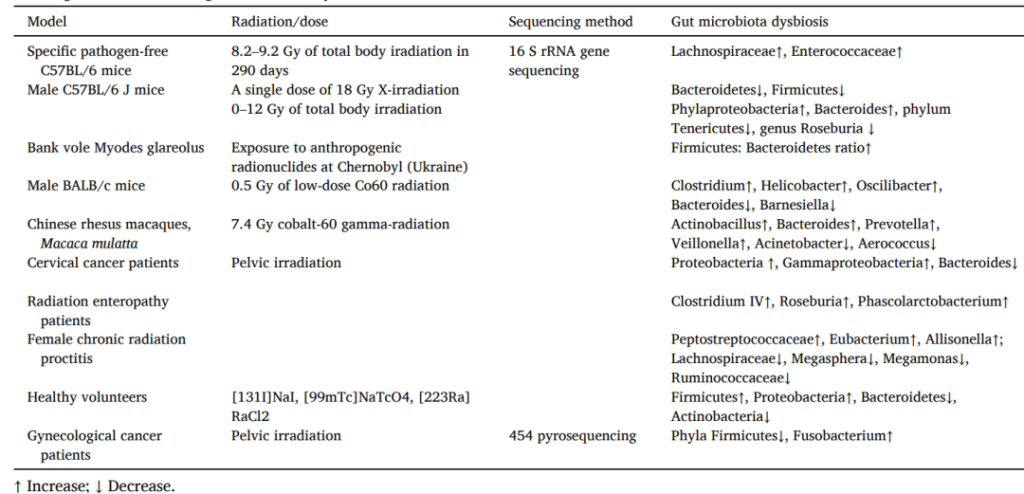
来自医疗暴露、放射性药物应用、切尔诺贝利灾难、环境辐射污染的研究证据表明,肠道菌群与电离辐射引起的损害之间存在着密切的关联。
电离辐射不仅仅对肠道产生直接影响,还对肠道菌群的组成和功能产生影响,如肠道菌群多样性下降、有益菌减少、有害菌如变形菌、梭菌属等富集。
临床上较常见的,放射性肠炎就是电离辐射对健康的不良影响之一,普雷沃氏菌属、巨单胞菌属等在放射性肠炎中显著富集,或成为放射性肠炎的特征菌属。某些重要菌属的缺失可能与较差的预后相关。
特别值得注意的是,《SCIENCE》研究发现,一些肠道菌群有辐射防护的潜力,如Lachnospiraceae和Enterococcaceae,这为临床上放射治疗或其他防辐射领域带来新的希望。
鉴于近期日本核污水的排放,及人们对辐射毒性威胁的关注不断增加,迫切需要了解关于核污水排放的一些小知识,基于此本文向大家介绍一些辐射对人体健康的影响,肠道菌群在其中发挥的防辐射作用,以及基于肠道菌群调节的辐射防护及其机制。充分了解这些信息,应用于临床辅助诊断中,可以帮助确定疾病的类型,指导相关治疗策略。
本文主要内容
01 核污水及辐射相关的小知识
什么是核污水?
核废水和核污水有什么区别?
核污水的主要成分及特点
核污水进入人体的主要途径
辐射有哪几种类型?
辐射对人体健康的影响
02 核辐射对人体健康的影响
03 电离辐射对肠道菌群的影响
电离辐射
电离辐射影响小鼠肠道菌群组成
放射性肠炎
“精英菌群”——电离辐射中保命?
电离辐射和肠道菌群有怎样的机制关联
(短链脂肪酸、芳香氨基酸、吲哚衍生物、胆汁酸等)
04 非电离辐射
紫外线辐射、红外线辐射、激光辐射、
微波辐射、极低频辐射等
05 基于肠道菌群调节的辐射防护及其机制
益生菌、益生元
粪菌移植
生活中抗辐射的食物
其他
(饮食模式、膳食成分、避免食物、运动、生活方式等)
从2011年3月11日海啸引发地震,日本福岛第一核电站发生爆炸。由于爆炸,核电站各种结构破损,辐射过于强大,人不能靠近,也无法清理,所以核电站爆炸至今,一直处理不了。
核燃料一直没有妥善处理,而其又必须不断地进行冷却,事发之后,福岛第一核电站的运营方东京电力公司需要持续注水为反应堆降温,所以,冷却水灌进去后,每天就会产生大概140吨的核污染水,现在装污水的罐子已经快容不下了…
这些冷却过核燃料的水就是我们说的核污水。
核废水只是核电站的冷却水,通过换热系统进行交叉循环,不会与发过电的铀燃料进行直接接触。核废水里的放射性物质,通常只有氢的同位素氚,而氚的半衰期是只有12.43年。
核污水因为经过融化堆芯,含有大量放射性核素,比如碳-14、碘-129、铯-137、锶-90、碘-131、钴-60、铀-238等。这些放射性核素会通过摄入或吸入进入人体,对人体组织产生辐射,增加患癌症和其他放射性疾病的风险。
碳-14的半衰期超过5000年,有些核素目前没有公认有效的净化技术,在国际上没有排放先例。

注:也有人认为,假如日方公布的数据属实,福岛的核污水虽然穿过了堆芯,但是会经过一系列的后续处理,过滤掉绝大多数放射性同位素,只有一种放射性同位素氚没法过滤,把“核污水”中的氚浓度降低至日本国内标准的四十分之一、世界卫生组织规定的饮用水标准七分之一后,才开始正式排放的,才能获得国际原子能机构的背书。基于此那么两者区别不大【这个结论有待商榷,此处不作详细探讨,本文所指的核污水只讨论含有大量放射性核素的核污水】。
放射性成分
核污水中含有放射性物质,包括碳14、碘131、铯137、锶90、钴60、氢3(也称为氚)等。这些放射性成分具有辐射活性,对环境和人体健康产生潜在的危害。
污染范围广泛
核污水的污染范围不仅局限于水体,还可能对大气、土壤和生物体产生影响。
核污水排放到海洋中会对环境产生广泛的影响。首先,核污水中的放射性物质会对海洋生态系统造成严重的影响。这些放射性物质会被水中生物摄取,并逐渐富集在食物链的不同层次中,进而传递给更高级的海洋生物,最终对整个生态系统产生影响。这不仅会破坏海洋生物多样性,还会导致生物畸形、生殖问题以及其他健康问题的出现。
其次,核污水排放到海洋中会对人类健康构成威胁。人类可通过食用海洋生物摄入核污水中的放射性物质,进而受到辐射的影响。这可能导致健康问题,如癌症、先天性缺陷等。此外,核污水中的放射性物质还会通过海洋风、波浪和潮汐等因素,扩散到沿海地区,进一步影响附近居民的健康和安全。
持久性
核污水中的放射性物质往往具有持久性,可能在环境中长时间存在。这意味着核污水的影响也是持久的,对周围环境和生物体造成的潜在危害可能长期存在,即使核污水排放停止,其带来的影响仍会持续存在。
饮用水
如果核污水进入水源并未经适当处理,人们可能通过饮用受污染的水源而摄入放射性物质。
食物链
食物链始于海洋浮游植物,与陆地植物一样进行光合作用的微型植物。这些生物体从周围的海水中吸收放射性污染物。由于浮游植物被食物链上较大的浮游动物、小鱼和较大的动物吃掉,一些污染物最终以粪便颗粒或其他碎屑颗粒的形式沉降到海底。这些颗粒积聚在沉积物中,其中包含的一些放射性同位素可能通过微生物和化学过程重新回到上覆水域。
呼吸道
如果核污水中的放射性物质以气溶胶的形式释放到空气中,人们可能通过呼吸受到污染。这种情况通常发生在核事故或核电站泄漏的情况下。
皮肤接触
如果人们接触到受核污水污染的土壤、水体或其他表面,放射性物质可能通过皮肤进入人体。
当谈到排放核污水时,不可避免地会涉及到辐射对人体的影响。我们先来了解一下辐射。
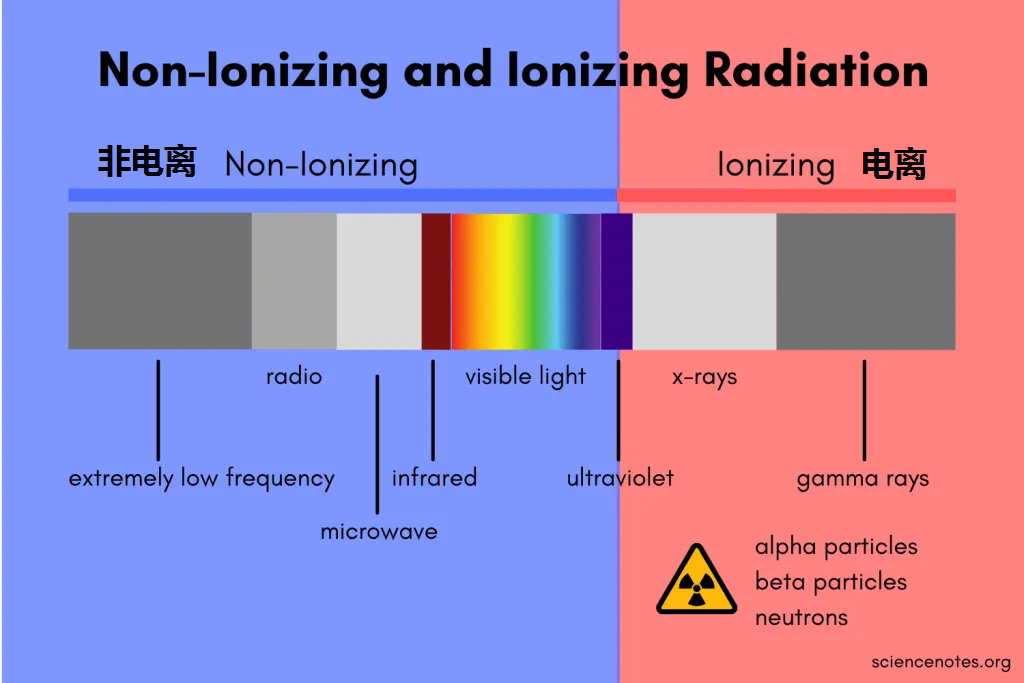
辐 射
辐射是指能量以电磁波或粒子的形式传播,它可以对人体产生不同程度的影响。
一般情况下,辐射分为电离辐射、非电离辐射。它们有什么区别呢?
电离辐射
波长短,频率高、能量强。使物质发生电离,对健康危害大,有致癌作用。
▸ 生活中可能接触到的比如:
X光机、CT、伽马刀、钴60治疗机、碘-131等。
非电离辐射
波长长,频率低,能量小。它对生物体和物质的穿透能力较弱,这些辐射不具备足够的能量来从原子或分子中剥离电子,因此不会引起电离作用。以热效应为主,没有明确致癌作用。
▸ 生活中比较常见的如:
手机辐射、微波炉、电热毯、高压电塔、基地转播台、近紫外光、可见光、热灯中使用的红外辐射等。
非电离辐射和电离辐射之间的分界线位于电磁波谱的紫外线部分
总的来说:
➩ 高剂量
在非常高的剂量下(超过一定阈值),辐射会损害组织和器官的功能,并产生急性影响,如恶心和呕吐、皮肤发红、脱发、急性辐射综合症、局部辐射损伤(也称为辐射烧伤),甚至死亡。

protein. cell., pwad044, doi.org/10.1093/procel/pwad044
▸ 头发
当暴露于高于 200 雷姆的辐射时,就会出现脱发。
▸ 心脏和大脑
强烈暴露于 1000 至 5000 雷姆的辐射下会影响心脏功能。辐射会杀死神经细胞和心脏小血管,可能导致立即死亡。如果辐射暴露超过 5000 雷姆,脑细胞就会受到影响。
▸ 甲状腺
当暴露于不同类型的辐射源时,某些身体部位会受到特别影响。暴露于放射性碘时,甲状腺可能会受到影响。如果暴露于大量放射性碘,整个或部分甲状腺可能会受到影响。
▸ 血液系统
如果一个人暴露于 100 雷姆,血液中存在的淋巴细胞数量将会减少。这可能会导致一些免疫问题。这被称为轻度放射病。根据长崎和广岛的报告,症状可能会在接触后十多年内出现。
▸ 生殖道
由于生殖道细胞分裂速度很快,即使暴露量不超过 200 雷姆,这些细胞也容易受到影响。
➩ 低剂量长期接触
低剂量电离辐射致癌相关的流行病学研究主要集中在辐射敏感部位发生的癌症,如白血病、甲状腺癌、乳腺癌、肺癌等。
致癌效应
非致癌效应
这里我们先了解一下电离辐射中的核辐射对人体健康的影响。
核辐射对人体健康的影响
美国心脏协会的《高血压》杂志上发表的一项针对俄罗斯核电站工人的研究表明,长期暴露在低剂量的电离辐射下会增加患高血压的风险。
对《英国医学杂志》发表的研究发现,接触低剂量电离辐射与心脏病风险适度增加有关。
……
我们来看一些案例。
在广岛和长崎爆炸事件后的两三年内:
白血病是首个与辐射暴露相关的癌症,从儿童到成年人都有。除了白血病外,乳腺癌、结肠癌和肺癌是报告中人数最多的其他癌症类型,但这些疾病在儿童中暴露的人数更多。
切尔诺贝利事件的长期后果:
研究人员普遍得出结论,由于儿童和青少年时期的辐射暴露而导致患甲状腺癌的风险增加,这是切尔诺贝利事故对健康的主要影响。
研究还证实,在暴露程度最高的人群中,存在以下情况的长期较高风险:
那些在 5 岁以下时暴露于高辐射水平的人最有可能遭受健康后果,包括生长发育不良、牙齿健康状况不佳、免疫紊乱、患甲状腺癌的风险等。
据切尔诺贝利儿童国际组织称,截至 2015 年,1986 年的事件继续影响着今天生活在辐射区的数百万人。超过一百万儿童生活在仍然受到污染的地区。该组织引用的健康风险和影响包括:
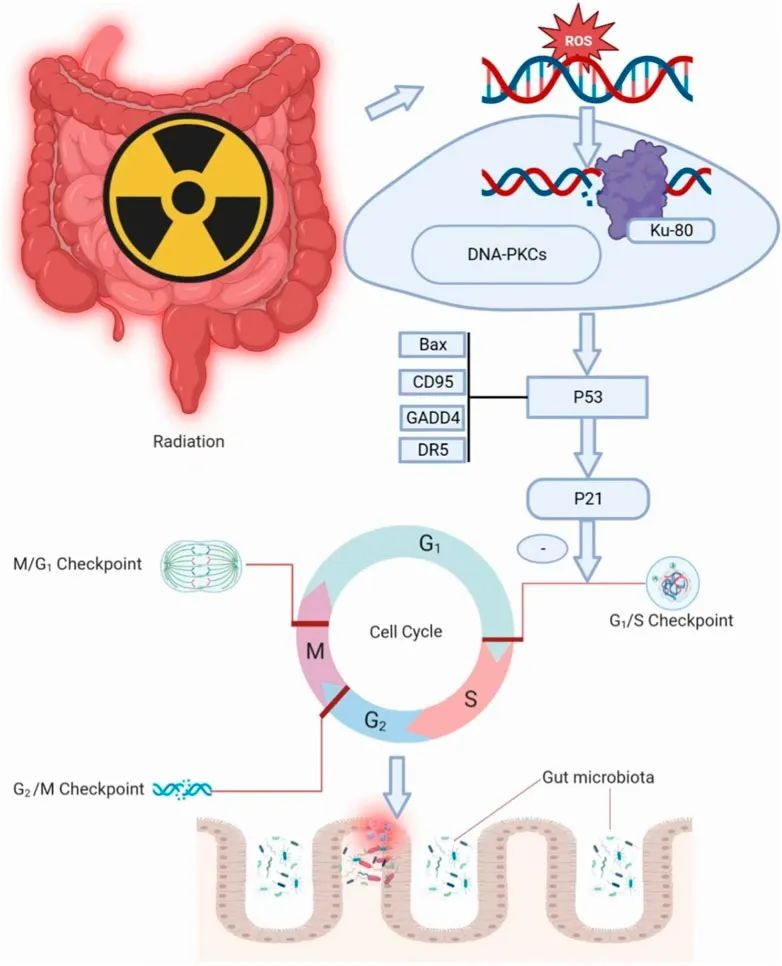
电离辐射可以引起造血系统,肠道系统,心脑血管神经系统的多器官损伤,这也意味着癌症放射治疗和意外暴露期间发生的大量未满足的医疗需求。研究人员已经做出大量努力来开发用于常规临床使用的治疗性放射防护剂,但辐射损伤仍然是一个长期存在且未解决的问题。
急性放射综合症或疾病(ARS)发生在部分或全身暴露于电离辐射后,死亡通常归因于造血恢复不良和/或胃肠道(GI)上皮细胞死亡。
胃肠道是更新最快的成人组织,因此对辐射高度敏感。
它还拥有由 10 至 100 万亿个微生物组成的多样化微生物群落,增加了肠道微生物群参与对辐射引起的损伤的反应的可能性。一些研究表明肠道微生物群与辐射引起的损伤之间存在关联。
电离辐射可以产生离子化的分子和自由基,对细胞和遗传物质造成损害,进而导致潜在的健康风险。
电离辐射可以是核辐射(如α、β、γ射线)或非核辐射(如X射线、紫外线)。当电离辐射与物质相互作用时,它可以剥离或激发原子或分子中的电子,导致化学和生物效应。不同射线穿透力不一样。
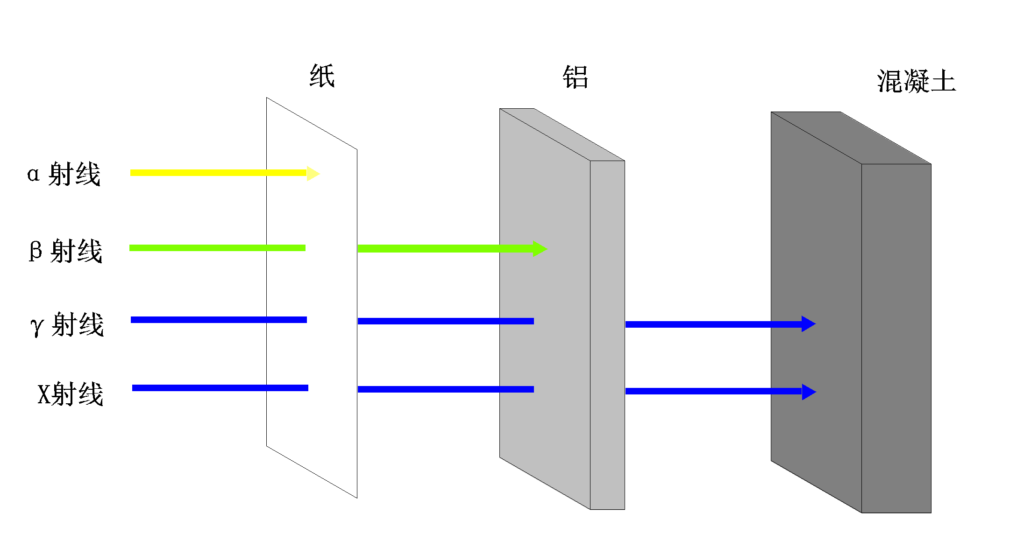
哪些情况可能暴露于电离辐射?
人们可能在不同的情况下暴露于电离辐射,在家里或在公共场所(公共暴露)、在工作场所(职业暴露)或在医疗环境(医疗暴露)。暴露于辐射可能通过内部或外部途径发生。
当放射性核素被吸入、摄入或以其他方式进入血流(例如,通过注射或通过伤口)时,就会发生电离辐射的内部暴露。当放射性核素自发地(例如通过排泄物)或由于治疗而从体内消除时,内照射就会停止。
当空气中的放射性物质(例如灰尘、液体或气溶胶)沉积在皮肤或衣服上时,可能会发生外部暴露。这种类型的放射性物质通常可以通过清洗从体内去除。电离辐射的暴露也可能是由外部来源的辐射引起的,例如 X 射线的医疗辐射暴露。当辐射源被屏蔽或人移出辐射场时,外部照射就会停止。
医学上辐射的应用占人类由人为源头产生的辐射总剂量的98%,也占总人口辐射暴露的20%。全球每年进行超过42亿次诊断放射学检查,进行4000万次核医学检查,进行850万次放射治疗。
电离辐射对身体的损害有哪些?
电离辐射对机体的损伤程度受辐射源、剂量率、暴露时间及机体敏感性等因素影响。
胃肠道系统对电离辐射具有高度的敏感性,辐射影响胃肠道的运动、吸收和分泌功能,常见的胃肠道反应为恶心呕吐、腹泻,病理检测可见小肠绒毛断裂、隐窝塌陷、黏膜上皮受损等。
长期低剂量辐射的影响较难衡量。电离辐射引起的DNA损伤可导致突变,导致癌症,尤其是在细胞分裂率高的组织中,如胃肠道、生殖细胞和骨髓。在生殖细胞中,电离辐射会损害遗传物质并导致代代相传的突变。
电离辐射可以破坏细胞内稳态,通过传输能量和引起细胞内水辐解和线粒体电子泄漏来激活促炎信号通路,释放自由基损伤DNA、蛋白质和脂质,从而导致机体组织损伤。
肠道菌群的特征与电离辐射引起的损伤严重程度有关。电离辐射对大脑、食管、心脏和肺部的损伤也与肠道菌群有关。
电离辐射对肠道菌群的影响
测量切尔诺贝利核灾所产生的人为放射性核素显示,暴露于环境放射性核素会显著影响脊椎动物的肠道菌群。
研究表明,电离辐射会降低小鼠肠道菌群的α和β多样性。
电离辐射会降低优势菌群的丰度,如:
增加某些菌群的丰度,如:
对于非人类灵长类动物,研究发现,电离辐射会使Actinobacillus、Bacteroides、Prevotella、Veillonella等属的丰度增加两倍以上,而Acinetobacter和Aerococcus等属的丰度减少十倍以上。
电离辐射诱导肠道微生物群失调
doi.org/10.1016/j.envres.2023.115947
电离辐射对人类肠道菌群也有着类似的影响,其中,放射性肠炎就是其中的影响之一。接下来,我们来了解一下放射性肠炎是如何发生的,肠道菌群在其中发挥怎样的作用。
放射治疗在临床上被广泛用于治疗多种肿瘤。放射治疗可诱导双链 DNA 断裂,导致肿瘤细胞凋亡。肿瘤细胞增殖迅速,对放射线敏感,修复速度比正常细胞慢,因此对多种类型的肿瘤有良好的治疗效果。
放射治疗的副作用
但是由于放射射线不仅可以杀死癌细胞,还会对周围的正常细胞和组织造成损伤。因此放疗经常会引起各种副作用,比如疲劳,恶心和腹泻等。由于放疗照射位置的不同,许多副作用也不同。胃肠细胞对电离辐射敏感,这限制了腹部和盆腔恶性肿瘤的放射治疗。
放射后的肠道损伤很常见
放射治疗造成的肠道损伤会在第一周或第二周导致胃肠道反应,少数发生在放射后几个小时。低剂量辐射引起的肠道损伤通常是可逆的。40%的患者在10~30 Gy的辐射剂量下可出现明显病变,而当剂量超过30 Gy时,这一数字将急剧增加至90%。
放射性肠炎的症状
急性放射性肠炎的临床表现为恶心、呕吐、腹痛、腹泻,大便次数增多,粪便呈粘液、脓血,严重者甚至死亡。
慢性放射性肠炎的临床表现包括慢性肠梗阻、肠穿孔、瘘管和脓肿等。
放射治疗对菌群的影响
辐射会导致肠道菌群失衡,包括有益菌的丰度降低和病原菌的丰度增加。当益生菌数量减少时,条件性致病菌会繁殖并占据生态位,从而抑制益生菌的生长并促进内毒素的释放。
在接受电离辐射和放射性药物治疗后,人类肠道菌群的组成发生改变。
下列菌群丰度减少:
健康肠道中优势菌群如厚壁菌门和拟杆菌门的丰度降低已被证明会削弱肠道对有害细菌的抵抗力,进而加重放射性肠炎的症状,激活促炎信号通路。
下列菌群丰度增加:
梭菌属(Clostridium IV)、Roseburia属和Phascolarctobacterium属的水平升高与放射性肠病相关。
2019 年发表的一项关于微生物群与急性/晚期放射性肠病相关性的临床研究,收集了134名受试者的粪便样本,基于16S rRNA 测序对放疗过程中肠道菌群的总体情况进行了分析。
结果表明,随着放疗进行,患者的肠道菌群多样性逐渐降低,并且表现出与晚期放射性肠病程度成正相关的特征。
放射性肠病患者的下列菌群相对丰度明显增加:
与微生物群调节和肠壁维持相关的稳态肠黏膜细胞因子(IL-7,IL-12/IL-23p40,IL-16,IL-15)明显减少,其中IL-15与罗氏菌属和丙酸杆菌属(Propionibacterium)的丰度呈负相关,表明肠道微生物可能与腹部或盆腔照射引发的急性和晚期放射性肠病有关。
反映放射性肠炎的特征菌属
另一项研究报道了盆腔放疗患者粪便中几种菌属的变化与放射性肠炎的发生密切相关,并可根据几种特定肠道菌属对患者放疗后可能发生肠炎的风险进行预测。
在该研究中,放射治疗导致粪便中菌群α多样性降低,β多样性增加。门水平上,放射性肠炎患者变形菌门相对丰度显著增加;属水平上,拟杆菌属相对丰度明显降低。
下列3种菌属在肠炎患者中显著富集,或可作为反映放射性肠炎的特征性菌属:
在放射性肠炎引起的腹泻中检测到革兰氏阴性杆菌的过度生长。
放疗前、放疗后立即和放疗后两周的微生物群比较表明,腹泻患者的放线菌门增加,梭状芽胞杆菌减少。放射后肠道蠕动受损是革兰氏阴性杆菌在胃肠道定植的主要致病因素。在细菌过度生长期间,肠道迁移运动复合体(MMC)的缺失与革兰氏阴性杆菌大规模定植的存在相关。因此,异常的肠道蠕动和革兰氏阴性杆菌的大量定植是严重晚期放射性肠病发生的重要因素。此外,放疗后对腹泻和其他细菌变化的易感性和保护作用也可能与不同的初始微生物群定植有关。
辐射诱导的肠道菌群失调助推放射性肠炎的发展
在放疗后发展为放射性肠炎的患者其照射前粪便样品中的粪球菌属(Copro⁃coccus)和脱硫弧菌属(Desulfovibrio)明显富集,这2种菌属或可作为特征性菌属对患者进行放射性肠炎发生风险的预测。
辐射导致部分菌属的丰度变化与促炎因子的表达量密切相关,可作为反映放射性肠炎发生发展的特征性菌属。
放射性肠炎患者粪菌液与上皮细胞共培养,诱导了上皮细胞的炎症和屏障功能障碍,使TNF-α和 IL-1β表达增加,进一步说明辐射诱导的肠道菌群失调可能助推放射性肠炎的发展进程。
辐射损害肠道完整性
辐射效应可以直接或间接影响细胞 DNA。DNA损伤导致细胞周期阻滞和细胞凋亡,同时激活炎症信号通路和释放促炎因子。绒毛细胞耗竭导致细胞死亡和肠道感染风险增加。此外,辐射还引发非靶向效应,导致染色体不稳定性。这些过程共同导致肠道屏障的破坏和菌群迁移。
doi.org/10.3389/fphar.2023.1116558
文献中采用的辐射源、辐射方式和辐射剂量各不相同,辐射后菌群的变化特点也存在不一致的情况,一些显著变化的菌的功能及在机体损伤中发挥作用的机制阐述不够。相信这些复杂问题会在未来研究中逐渐解决。
以上是临床上放射性肠炎面临的一些困境以及关于肠道菌群中与放射性肠炎的相关特征菌属。
与此同时,研究人员也发现了一些好消息,肠道菌群并不是总是受害者,其中一些特殊的“精英肠道菌群”,似乎可以帮助我们抵抗辐射的伤害。
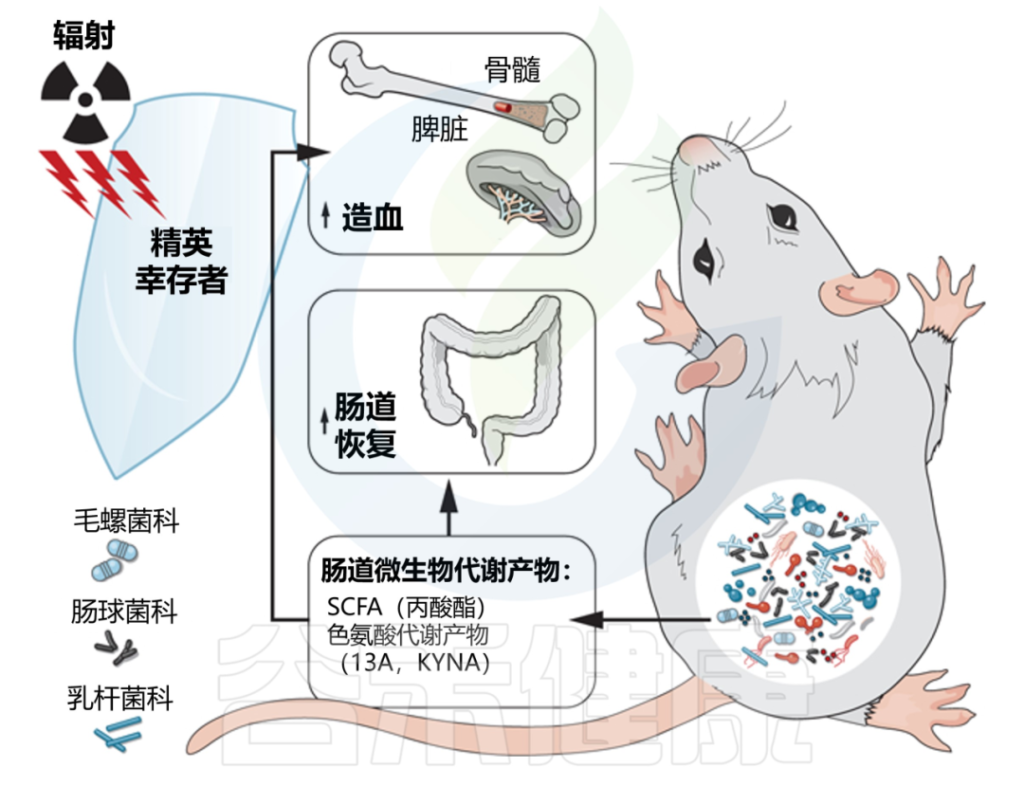
2020年,来自美国北卡罗拉纳大学教堂山分校的研究人员在《SCIENCE》上发表的一篇文章,揭示了肠道微生物群及其代谢产物在电离辐射中的保护作用。
该研究一群从高剂量辐射中恢复并过着正常寿命的小鼠。这些“精英幸存者”拥有独特的肠道微生物群,这些微生物群是在辐射后形成的,可以保护无菌和传统饲养的小鼠免受辐射引起的损伤和死亡。

在该研究中发现,毛螺菌科Lachnospiraceae和Enterococcaceae可以保护小鼠抵抗辐射引起的造血系统和肠道系统的损伤,从而在致死剂量的辐射后存活下来。
注:毛螺菌科一般参与多种碳水化合物的代谢,尤其水果蔬菜中的果胶(一种复杂的膳食纤维和益生元)的能力很强。
Lachnospiraceae 详见:肠道核心菌属——毛螺菌属(Lachnospira)
这些“有益菌”通过产生大量的短链脂肪酸和色氨酸代谢通路的代谢产物来促进造血发生以及肠道损伤修复,从而帮组机体抵抗辐射引起的损伤和死亡。
丙酸以及两种色氨酸途径代谢物 I3A 和 KYNA 在精英幸存者中升高,并提供长期的辐射保护。
DOI: 10.1126/science.aay9097
这项研究还在白血病患者中进行了临床研究,在轻度腹泻病人中,Lachnospiraceae,Enterococcaceae以及Lactobacillaceae这三种在小鼠中可能的“有益菌”数量明显高于重度腹泻的病人。Lachnospiraceae的数量与病人腹泻时间存在显著地负相关性。
因此,作者推断在人体中,这些可能的“有益菌”也可以帮助病人降低放疗引起的副作用。这些发现为开发针对放射性肠炎的治疗策略提供了新的思路。
DNA双链断裂与NF-κB通路活性
辐射会破坏细胞的DNA结构,导致DNA链断裂,并触发多个蛋白激酶和信号通路的激活。这些激活过程会引发炎症反应。然而,肠道菌群和短链脂肪酸可以通过调节p53和NK-κB通路来减轻辐射损伤。
例如,丁酸可以抑制炎症反应的NF-κB通路。
异鼠李素是一种黄酮类物质,可以促进DNA修复并提高存活率。
肠道菌群代谢产物尿石素A(UroA)也可以抑制炎症反应并保护DNA免受损伤。
氧化应激和炎症效应
水是细胞的主要组成部分,也是高能光子辐射的主要目标。辐射会导致水的辐解,产生有害的ROS和RNS。内源性抗氧化途径可以减轻ROS的过度积累,但Nrf-2缺乏会加重辐射引起的病理变化和炎症反应。肠道菌群产生的代谢物可以缓解辐射的毒性作用。在接受放疗或化疗的患者中,缺乏抗炎菌群可能促进炎症事件的发生。
脂质损伤和铁死亡
辐射损伤DNA和其他细胞分子,引发铁死亡。辐射诱导肠损伤与铁死亡、NF-κB途径有关。激活Nrf-2途径可减轻铁死亡。辣椒素可保护免受铁死亡相关损伤。
辐射引起的旁观者效应
当细胞受到辐射和其他有害物质的影响时,它们会释放一种信号,影响到周围的细胞。周围的细胞可能会受到DNA损伤,增加患癌的风险。这种现象被称为辐射诱导的旁观者效应。
这个效应导致细胞的基因表达改变、DNA修复的激活以及细胞的增殖、凋亡和死亡。这种效应可能是通过氧化应激的影响来实现的。
肠道菌群代谢物功能及对电离辐射的影响
肠道菌群的改变往往伴随多种代谢产物的变化,大量的代谢物驱动着宿主和菌群之间的交流,从代谢层面更好地理解宿主与肠道菌群的相互作用可为基于肠道菌群的治疗干预提供启发。
目前,短链脂肪酸、芳香氨基酸、胆汁酸等已被发现作为菌群和宿主对话的信号分子,参与辐射条件下宿主生理功能的调节过程。
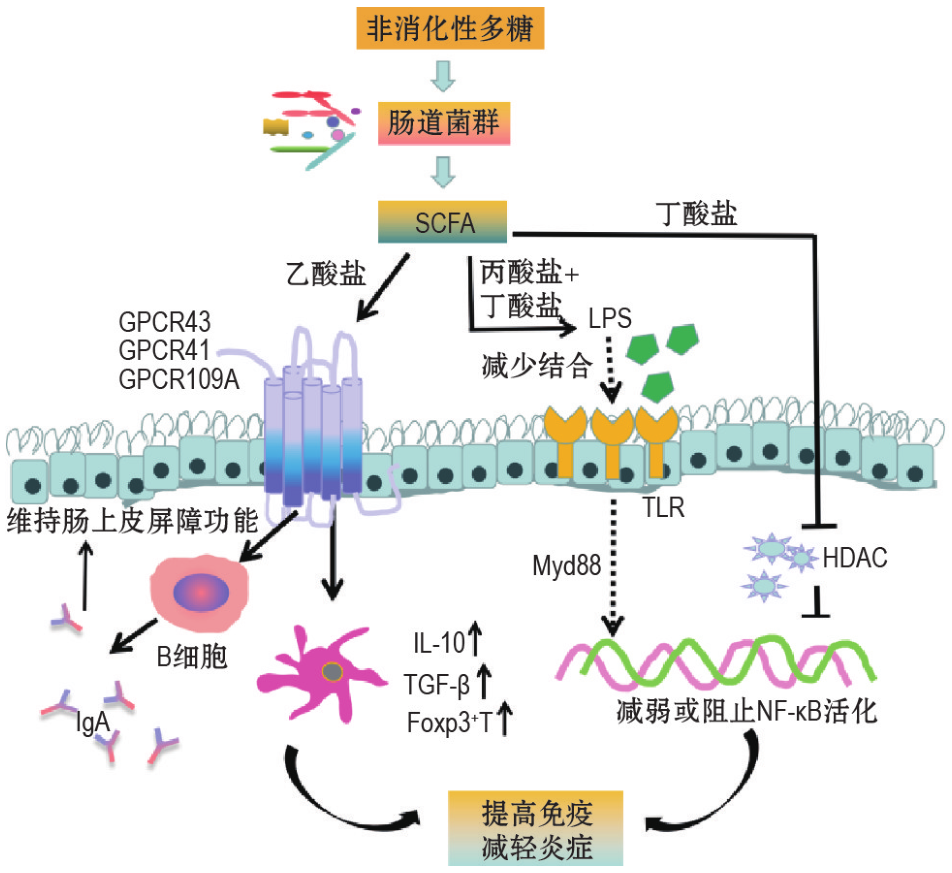
➢ 短链脂肪酸
短链脂肪酸通过与 G 蛋白偶联受体(GPCR)结 合 或 抑 制 组 蛋 白 去 乙 酰 酶(HDAC)调节下游信号通路发挥抗炎、免疫调节等作用。
DOI:10.3867/j.issn.1000-3002.2020.07.009
最新研究表明,由肠道菌群代谢产生的戊酸灌胃后提高了辐照小鼠的生存率,保护造血器官损伤和胃肠道功能;高通量测序、同位素相对标记和绝对定量(iTRAQ)结果显示,戊酸可恢复小鼠肠道菌群的分类比例,重建小肠组织的蛋白表达谱。
➢ 芳香氨基酸
芳香氨基酸可由宿主本身和肠道菌群代谢产生。其中肠道菌群分解代谢产生的大量芳香氨基酸代谢物,可能作为宿主生理信号分子,在局部和远处调节宿主的免疫、代谢和神经元反应。大量文献报道了色氨酸吲哚类代谢物对肠道功能和远处器官的调节作用。
色氨酸在胃肠道中有3条主要的代谢途径:
① 饮食色氨酸可被肠道微生物群直接转化为芳香烃受体(AhR)的配体;
② 免疫细胞和上皮细胞中吲哚胺 2,3-双加氧酶(IDO)的犬尿酸通路;
③ 肠嗜铬细胞5-羟色胺(5-HT)合成途径。
AhR信号被认为是肠道屏障免疫反应的关键组成部分,对肠道内稳态至关重要。肠道菌群色氨酸代谢产生的吲哚类化合物可激活AhR,生成 IL-22,维持黏膜表面宿主微生物的稳态。在肠道中,一些吲哚类衍生物可通过AhR/IL-22轴调节上皮完整性和黏膜免疫应答。吲哚也可通过芳基烃受体激活上调固有层淋巴细胞的IL-22 分泌,加速肠干细胞(ISC)上皮细胞的增殖,从而保证组织的稳态。
电离辐射干扰小鼠肠道的微生物代谢。由于与色氨酸相关的吲哚化合物起源于肠道菌群,随后进入肝,因此吲哚化合物浓度的改变可作为辐射损伤的血浆标记。
分析不同辐射剂量的血浆差异性代谢物,证明了电离辐射对肠道微生物色氨酸代谢的抑制作用,表明或可根据辐照后特定时间内给定血液样本中吲哚类化合物浓度来推断可能的全身辐射剂量,这对于核事件后快速评估个人辐射剂量具有重要意义。
辐射对肠道菌群代谢产物的毒性调节
doi.org/10.1016/j.envres.2023.115947
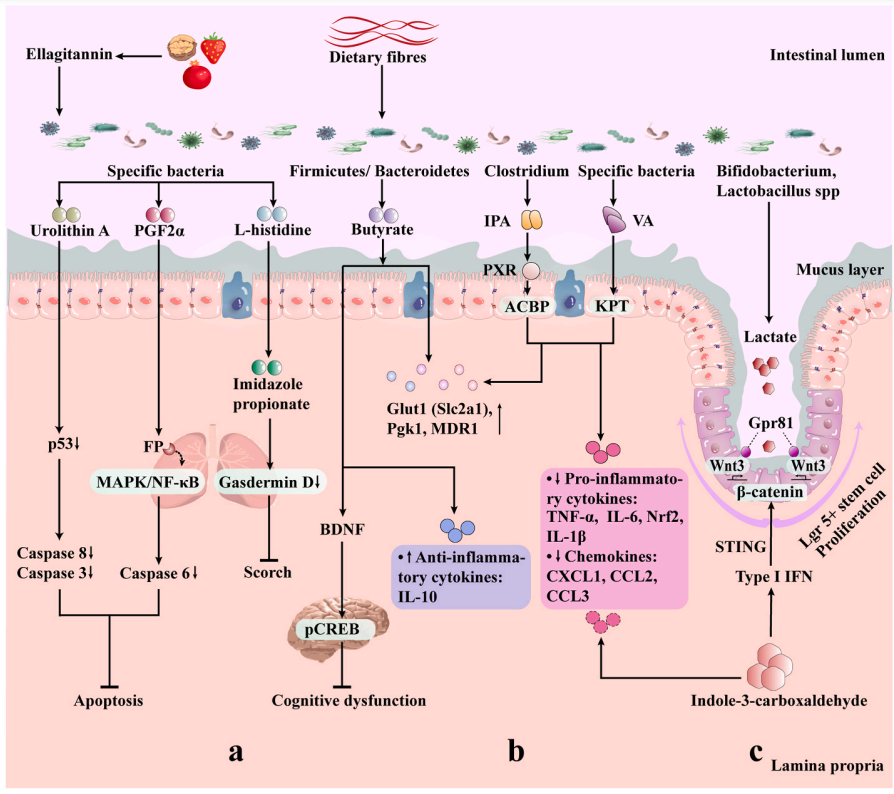
➢ 吲哚衍生物
肠道菌群中色氨酸代谢产生的吲哚或吲哚衍生物可以限制辐射诱导的肠道炎症。
吲哚-3-羧醛(ICA)治疗可以通过1型干扰素(IFN)限制肠道上皮损伤,并且依赖刺激相关的1型IFN响应促进Lgr5+干细胞再生,减少肠上皮细胞间细菌转位和炎症因子的产生。
ICA治疗21天后,辐射小鼠的结肠中显示出减少的隐窝丧失和炎性细胞因子(TNF-α、IFN-γ和IL-6)以及趋化因子(CXCL1、CCL2和CCL3)的表达,从而降低了辐射引起的肠道炎症。
吲哚-3-丙酸(IPA)是Clostridium sporogenes的一个功能代谢产物,在全腹部照射(TAI)辐射小鼠中增加了肠道屏障功能和上皮完整性,提高了Glut1(Slc2a1)、Pgk1和MDR1的表达,同时降低了IL-6和TNF-α的表达。此外,IPA改变了辐射肠道菌群的结构。研究还发现,PXR/酰基辅酶A结合蛋白(ACBP)信号通路支持IPA对抗辐射的作用。
➢ 胆汁酸
辐射影响肠道内胆汁酸水平。大鼠盆腔照射可诱发胆汁酸吸收不良引发腹泻,主要原因是放射治疗影响大鼠胆汁酸稳态和顶膜钠依赖性胆汁酸转运体(Asbt),回肠 Asbt表达下调或Asbt功能降低导致胆汁酸吸收不良,肠道胆汁酸积累导致腹泻。
在溃疡性结肠炎患者体内,肠道菌群失调引发肠道次级胆汁酸水平降低,加重肠道炎症,而放射性肠炎及肠道菌群失调是腹盆腔肿瘤放射治疗的常见不良反应,通过调节菌群带来胆汁酸水平的变化或直接阻断胆汁酸受体可能对减轻辐射损伤有作用。
我们每天都会受到低水平的非电离辐射。
紫外线(UV)辐射是太阳辐射的自然组成部分,同时也会由黑光、日光浴床和电弧照明释放。正常的日常紫外线辐射水平对人体有益,并能产生维生素D。
过多的紫外线辐射可能导致皮肤灼伤、皮肤过早老化、眼睛损伤和皮肤癌。大多数皮肤癌都是由紫外线辐射引起的。
UVR 可通过光化学和热反应造成生物损伤。它具有高光子能谱,并且特别有害,因为通常不会立即出现过度暴露的迹象。 UV-A 和 UV-B 可能对皮肤和眼睛产生有害影响。90% 的早期皮肤老化症状是由紫外线接触造成的。
同样,眼睛的辐射暴露可能是由任何简单的原因引起的,例如水面反射阳光,甚至是相机的闪光灯。过度暴露于紫外线可能会导致严重的风险,包括白内障和黄斑变性。
红外线位于微波和可见光之间。它有一定的波长范围,最接近可见光的波长是近红外线,而“远红外线”则更接近微波区域。近红外波较短、不热且无法检测到,这使得它们对皮肤和眼睛等敏感组织特别有害。
皮肤对红外线照射的反应是以疼痛的形式发出警告信号。
生产环境中,加热金属、熔融玻璃及强发光体等可以成为红外线辐射源。炼钢工、轧钢工、铸造工、锻钢工、烧瓷工、焊接工等可受到红外线辐射。
激光不是天然存在的,是用人工激活某些活性物质,在特定条件下受激发光,在农业中可用于育种、杀虫,也可以用于焊接、打孔、切割等。
长期接触过量会导致白内障并损害视网膜。激光损伤的一个例子是导致中央凹盲点的视网膜损伤。
当存在大量光辐射时,皮肤可能会发生烧伤。
微波辐射(MW)属于波长在1毫米和1米之间(或等效频率范围从300千兆赫到300兆赫)的电磁频谱。它们被用于各种领域,从通信到广播,再到厨房食物的加热或除霜。频率范围从80到800用于电视和调频无线电广播天线。
微波通常由移动电话及其基站和微波链路产生。此外,它还来自无绳电话、蓝牙设备、无线局域网和许多其他应用。
中枢神经系统是一个脆弱的区域,当身体暴露在微波辐射下时,它会发生显著的变化。它会导致睡眠障碍和记忆障碍,一些研究表明,长时间接触移动电话设备(会发射微波)会增加患脑肿瘤风险。
通过无线电发射器和手机接触微波意味着它可以通过皮肤被人体吸收,从而损害组织。
微波可以通过足够高强度的加热来损伤组织。微波的传播深度取决于微波的频率以及受影响的组织的类型。这些影响不会立即显现,因为较低的频率会深入组织,并且身体较深处区域的神经末梢较少。
睾丸特别容易受到温度升高的影响,从而更容易受到微波辐射的影响。将怀孕大鼠暴露于 9.417 GHz 微波会导致其后代(雄性和雌性)表现出与焦虑相关的行为增加,更令人惊讶的是,雄性表现出记忆和学习受损。
流行病学研究表明,暴露于极低频率的电磁场会损害人类健康。这会导致在暴露于此类磁场的环境中生活或工作的人们患上某些形式的癌症、抑郁症和流产。多项研究报告称,身体多个组织暴露于极低频辐射会导致氧化应激。
身体免受极低频辐射暴露的保护措施包括服用维生素 E、MEL、FA等抗氧化剂,以避免暴露于极低频辐射可能产生的不利影响。
乳杆菌属
主要通过胃肠道与远离器官之间的免疫信号交流来调节免疫反应。
嗜酸乳杆菌Lactobacillus acidophilus(L. acidophilus)对受到有限辐射(≤15 Gy)损伤的小肠黏膜有缩短恢复时间的作用,但对超过20 Gy的辐射无效。Lactobacillus acidophilus通过改善肠道干细胞功能和细胞分化来增强肠道上皮功能,从而减轻辐射引起的肠道损伤。
植物乳杆菌Lactobacillus plantarum(L. plantarum)可以通过激活肠上皮细胞中的FXR-FGF15信号来缓解辐射引起的肠道损伤,从而防止小鼠死于辐射。
罗伊氏乳杆菌Lactobacillus reuteri 作为第二代益生菌,通过产生代谢物和释放IL-22来稳定Lgr+5肠道隐窝干细胞的数量和功能,并保护肠道微血管内皮细胞免受死亡的影响,从而直接抑制肠道病原菌的生长。
鼠李糖乳杆菌LGG提高小肠隐窝存活数量,减少上皮细胞凋亡。LGG能释放放射保护性的LTA(TLR2激动剂),通过触发涉及巨噬细胞和分泌PGE2的MSCs的多细胞适应性免疫信号级联来保护上皮干细胞。
Lactobacillus royale通过释放IL-22来预防和减轻辐射毒性。
Akkermansia muciniphila
作为被广泛认可的下一代益生菌,在代谢性疾病和肿瘤免疫治疗中发挥作用。它可以通过上调RORγt+ Treg细胞介导的免疫反应改善结肠炎,并通过减少CD8+细胞毒性T淋巴细胞、TNF-α和PD-1来减轻结肠炎相关结直肠癌。
给辐射小鼠投予Akkermansia muciniphila可以显著缓解肠道毒性,并在肠道毒性更严重的小鼠消化道中稳定定居。然而,在某些特定情况下,A. muciniphila及其相关成分可能加剧病原体感染和肠道炎症,尽管在正常情况下有益于宿主肠道稳态的维持。
普拉梭菌
Faecalibacterium prausnitzii (F. prausnitzii)具有抗炎作用,在治疗炎症性肠病(IBD)和结肠炎方面发挥重要作用。研究发现,与健康人相比,患有IBD的患者中F. prausnitzii的丰度减少。
在局部照射29 Gy后的3天内,在大鼠体内口服F. prausnitzii A2-165菌株可以减轻隐窝形态学变化的严重程度,保护干/祖细胞和增殖上皮隐窝细胞的数量,并增加结肠隐窝上皮细胞产生的IL-18的产量。
益生菌组合
VSL#3的益生菌组合是由八种益生菌混合而成的,广泛安全地用于治疗胃肠疾病。一项双盲安慰剂对照试验证实,与安慰剂组相比,补充VSL#3的患者较少出现放射性肠炎引起的腹泻(77/243,31.6% vs. 124/239,51.8%;P < 0.001),且较少出现3级或4级腹泻(1.4% vs. 55.4%;P < 0.001)。
Dixentil是一种益生元和益生菌的混合物(低聚半乳糖、乳酸杆菌和酸酸乳杆菌),在保护放射性肠炎患者方面显示出积极效果。
宫颈癌患者盆腔放疗前7 d和放疗期间每天口服活的嗜酸乳杆菌和双歧双歧杆菌降低了辐射引起的腹泻的发生率,可减少抗腹泻药物的使用,并能改善患者的大便状态。
复合益生菌,包括嗜酸乳杆菌、鼠李糖乳杆菌、植物乳杆菌、长双歧杆菌和乳双歧杆菌,在小鼠模型的急性放射性肠道损伤中发挥积极作用。嗜酸乳杆菌加长双歧杆菌可以减少RE引起的2-3级腹泻,改善粪便稠度,尤其是在外束盆腔放疗后的盆腔癌患者中。此外,益生菌组的抗腹泻药物使用显著减少(P < 0.05)。
魔芋葡甘聚糖是一种天然大分子和可溶性膳食纤维,用于对抗电离辐射诱导的损伤。口服魔芋葡甘聚糖通过调节肠道微生物群和增加短链脂肪酸来预防电离辐射引起的损伤。魔芋葡甘聚糖作为一种益生元,可以增强肠道微生物群中益生菌数量和短链脂肪酸的产生,维持肠道稳态。魔芋葡甘聚糖还能抑制辐照后人肠上皮细胞的凋亡。
粪菌移植
粪菌移植(FMT)已被应用于难治性艰难梭菌感染的治疗,并在辐射损伤动物和放射性肠炎患者中显示出良好的效果。
研究表明,粪菌移植可以显著提高辐射小鼠的存活率,减轻体质量下降、脾脏萎缩和胃肠道功能异常等辐射损伤症状。粪菌移植还可以维持小鼠肠道菌群的组成,并对小肠中的基因表达谱产生性别特异性的影响。此外,粪菌移植对辐射引起的造血系统损伤也有一定的促进恢复作用。
在临床研究中,FMT被用于治疗常规治疗无效的慢性放射性肠炎患者。研究发现,在接受粪菌移植治疗的患者中,有部分患者的肠道不良反应减轻,卡氏评分降低,并且没有粪菌移植相关的死亡和感染并发症。这为粪菌移植作为治疗慢性放射性肠炎的可行性提供了证据。
此外,研究发现,FMT可以通过逆转肠道细菌分类比例和清除氧化应激来减少胸部局部辐射引起的肺损伤。因此,与抗生素相比,FMT更有效地增强胃肠功能和肠道上皮完整性。
由于缺乏长期随访证据,FMT的长期疗效尚不确定。对FMT前特定供体菌群特征的评估可能使其在治疗由辐射相关肠道菌群失衡引起的疾病时更安全、更有效。
★ 番茄红素
番茄红素在很多红色水果中都有,以番茄中的含量最高,番茄红素是迄今为止所发现的抗氧化能力最强的类胡萝卜素,它的抗氧化能力是维生素E的100倍,具有极强的清除自由基的能力,有抗辐射、预防心脑血管疾病、提高免疫力、延缓衰老等功效,有植物黄金之称。
代表:
番茄、西瓜等红色水果
★ 维生素E、维生素C
各种豆类、橄榄油、葵花籽油和十字花科蔬菜富含维生素E,而鲜枣、橘子、猕猴桃等水果富含维生素C,维生素E和维生素C都属于抗氧化维生素,具有抗氧化活性,可以减轻电脑辐射导致的过氧化反应,就像给我们的皮肤穿上了一层“防辐射衣”,从而减轻皮肤损害。
此外,新鲜的蔬果具有抗辐射作用,还在于它们可使血液呈碱性,溶解沉淀于细胞内的霉素,使之随尿液排泄掉。
代表:
各种豆类、橄榄油、葵花籽油、芥菜、卷心菜、萝卜等十字花科蔬菜;
鲜枣、橘子、猕猴桃等新鲜水果。
★ 维生素A、β胡萝卜素
此类食品富含维生素A和β胡萝卜素,能很好的保护眼睛。天然胡萝卜素是一种强有力的抗氧化剂,能有效保护人体细胞免受损害,从而避免细胞发生癌变。长期食用胡萝卜素,能使人体少受辐射和超量紫外线照射的损害,目前国外还将天然胡萝卜素用于化妆品中,发挥其防辐射,保护、滋润皮肤和抗衰老作用。
代表:
鱼肝油、动物肝脏、鸡肉、蛋黄、西兰花、胡萝卜、菠菜等。
★ 硒
微量元素硒具有抗氧化的作用,它是通过阻断身体过氧化反应而起到抗辐射、延缓衰老的作用,含硒丰富的食物首选芝麻、麦芽和黄芪。
代表:
芝麻、麦芽和黄芪;
酵母、蛋黄、啤酒、龙虾、金枪鱼等海产品;
大蒜、蘑菇等。
★ 脂多糖、维生素A原
如果不习惯喝绿茶,菊花茶也同样有效。现代医学研究证实,绿豆、绿茶中含脂多糖、维生素A原,能帮助排泄体内毒物、加速新陈代谢,可有效抵抗各种形式污染。
此外,茶叶中的茶多酚类化合物具有抗辐射作用,可以吸收90%的放射性同位素,并且加速代谢,减轻对人体的伤害。
代表:
绿茶、绿豆。
★ 胶原弹性物质
海带是放射性物质的克星,可减轻放射性核素、各种射线对机体免疫功能的损害,并抑制免疫细胞的凋亡而具有抗辐射作用。此外,海带还是人体内“清洁剂”,他是一种碱性食物,有利于保持身体处于弱碱性的环境。海带中含有的胶质、动物皮肤、脊髓中的胶原物质都有一种黏附作用,它可以把体内的腐蚀性物质黏附出来排出体外,而且其中动物皮肤所蕴含的弹性物质还具有修复受损肌肤的功能。
代表:
海带、紫菜;动物皮、骨髓。
选择可靠的食品来源
购买来自可靠供应商的食品,特别是海产品。选择经过严格检测和认证的产品,以确保其安全性。
查看食品标签上的信息,特别是有关产地和检测的信息。优先选择标明非受污染区域产地的食品。
饮食方式
保持饮食多样化,不要过度依赖某一种食品。通过摄入多种食物,可以减少单一食品对辐射的潜在影响。
含有ω-3多不饱和脂肪酸(n-3PUFAs)的饮食可以通过增加有益细菌(如乳酸菌、双歧杆菌和产丁酸细菌)来逆转肠道菌群失调。n-3PUFAs通过减少LPS合成和胃中粘液溶解菌的数量来减少炎症和氧化应激,预防和减轻辐射引起的损伤。
以下是一些可能含有较高辐射的食物:
海产品:如海藻、贝类和鱼类,可能吸收海水中的放射性物质,尤其是碘和铯。
野生蘑菇:野生蘑菇可能吸收土壤中的放射性物质,如铀和钍。
某些土壤栽培的农作物:某些农作物,特别是种植在放射性土壤中的农作物,可能含有较高的放射性物质。
食品添加剂中的聚山梨酸酯80和富含蛋氨酸的高蛋白饮食可以破坏肠道菌群的生态平衡,降低微生物多样性,并增加致炎细菌的丰度,这可能会加剧辐射引起的肠道损伤。
藻青蛋白(phyco⁃cyanin)可调节小鼠肠道微生物群组成,增加有益菌,减少有害细菌,进而降低 LPS 水平和抑制TLR4/Myd88/NF-κB通路的激活,下调炎性细胞因子的表达,使小鼠免受高剂量辐射损伤。
DIM是一种天然的小分子化合物,可减轻全腹部辐照引起的小鼠死亡或体质量减轻状况,提高辐照小鼠 Lgr5 +小肠干细胞的存活率及抗氧化酶 Nrf2 的表达,清除 ROS,缓解小肠内DNA损伤和细胞凋亡;DIM也可恢复辐射引起的肠道菌群失调现象,并表现出了通过调节菌群减轻辐射损伤的作用。
戊酸补充显著提高了辐照小鼠的存活率,保护了造血器官,改善了辐照小鼠的胃肠道功能和肠上皮完整性;戊酸对于肠炎的保护作用也不局限于放射性肠炎,还可用于DSS等化学物诱导的其他类型肠炎的保护。
中药复方凉血固元汤能有效调节 11 Gy 60Co-γ 全身照射引起的大鼠肠道菌群结构失调,改善大鼠生存质量。
黄芩素通过重新平衡肠道微生物群和抑制细胞凋亡来改善电离辐射引起的损伤。黄芩素改善了小鼠暴露于红外线后的肠道结构以及增殖和再生的能力,其中肠道微生物组成的重新平衡发挥了重要作用。黄芩素抑制p53的激活以及p53介导的肠道线粒体凋亡和死亡受体凋亡。黄芩素还改善电离辐射引起的造血系统损伤。
当归多糖对SD大鼠电离辐射诱发肠道屏障损伤具有一定的预防作用。当归多糖各组大鼠骨髓有核细胞计数,白细胞计数,Occludin蛋白高于模型组(P<0.05),Nrf2蛋白低于模型组(P<0.05),HE染色可见肠绒毛损伤轻于模型组(P<0.05),肠道菌群失调轻于模型组。
枸杞果实提取物(LBE)重建了辐射小鼠的肠道菌群,提高了潜在有益属的相对丰度,如Turicibacter和Akkermansia,并降低了潜在有害属的相对丰度,如Rikenellaceae。
槲皮素可以通过调节肠道菌群和降低炎症细胞因子水平来减少辐射性肠道疾病。
小球藻是一种单细胞绿藻,叶绿素含量非常高,已被证明可以中和体内的毒素,通常在汞中毒时使用。暴露于辐射时服用推荐剂量的小球藻是加速排毒的好方法。
水果中各种植物化学物质的辐射防护作用研究

编辑
Raghu SV, et al., Food Funct. 2023
低强度运动
与跑步相比,步行是一种更舒适、更可行的运动方式,对于接受放疗的虚弱患者来说可以接受。步行可减轻小鼠辐射引起的胃肠道损伤,受短期步行治疗的小鼠在属水平上表现出Dubosiella、拟杆菌属、A. muciniphila和乳杆菌属的优势,A. muciniphila可能是步行辐射防护的关键,增强步行治疗的辐射防护作用。
减少直接接触时长
避免在受污染区域长时间游泳、潜水、捕鱼等活动。如果必须在这些区域活动,应尽量缩短接触时间,减少潜水深度。
避免直接沾染雨水
放射性的粉尘和水蒸气在大气中随着气流传播,可传播到很远的地方,尤其是进入平流层,通过雨水落到地面。因此,在下雨天,尽量避免直接沾染雨水。
关注官方信息
密切关注官方相关机构发布的关于核污水排放的最新信息和指导方针。这些机构会提供有关食品安全和辐射风险的相关信息。
注意,以上信息是基于引用的研究论文,仅供参考。具体的治疗方案和应用建议应由专业医生或研究人员进行评估和制定。同时,日常生活中尽可能避免食用受污染区域产地的食品。
关于核污水排放:
核污水排放可能对环境和人类健康造成潜在风险。然而我们在担忧的同时,也不必为此陷入过度焦虑。听从中国海洋监测和质检部门的意见,相信他们会严密跟踪中国沿海水质的变化,一旦放射性物质超标,影响海产品的安全,他们会发出警告并采取相应的更为专业的措施。
相信国家监测部门的实时通报,关注相关的科学研究和专业意见,支持环境保护措施的加强。通过健康的饮食、良好的生活习惯和积极的心态来保护自己和家人。重要的是保持平衡,不让担忧阻碍我们享受生活的美好和追求自己的梦想。
关于辐射:
动物模型和临床试验已经用于探索辐射对肠道菌群的影响。辐射引起的菌群失调可以进一步促进宿主的辐射损伤和炎症。因此,肠道菌群的组成、多样性和丰度、有害菌富集等可以作为测量辐射暴露的生物剂量的新潜在生物标志物反应,并为后续辐射环境下的人体健康提供辅助评估和干预指导。
随着肠道菌群研究的深入,未来益生菌/益生元、菌群药物以及粪菌移植等产品及治疗方法,不仅能助健康人(或患者)建立良好的肠道微生态,也有可能达到减轻辐射损伤的目的。这些提示了未来以肠道菌群为基础的精准医疗的必要性。
相关阅读:
分享 | 肠道菌群和粪便菌群移植治疗炎症性肠病 – 罗马共识
主要参考文献
Azizova T, Briks K, Bannikova M, Grigoryeva E. Hypertension Incidence Risk in a Cohort of Russian Workers Exposed to Radiation at the Mayak Production Association Over Prolonged Periods. Hypertension. 2019 Jun;73(6):1174-1184.
Guo H, Chou WC, Lai Y, Liang K, Tam JW, Brickey WJ, Chen L, Montgomery ND, Li X, Bohannon LM, Sung AD, Chao NJ, Peled JU, Gomes ALC, van den Brink MRM, French MJ, Macintyre AN, Sempowski GD, Tan X, Sartor RB, Lu K, Ting JPY. Multi-omics analyses of radiation survivors identify radioprotective microbes and metabolites. Science. 2020 Oct 30;370(6516):eaay9097.
Yu Y, Lin X, Feng F, Wei Y, Wei S, Gong Y, Guo C, Wang Q, Shuai P, Wang T, Qin H, Li G, Yi L. Gut microbiota and ionizing radiation-induced damage: Is there a link? Environ Res. 2023 Jul 15;229:115947.
Fernandes A, Oliveira A, Soares R, Barata P. The Effects of Ionizing Radiation on Gut Microbiota: What Can Animal Models Tell Us?-A Systematic Review. Curr Issues Mol Biol. 2023 May 2;45(5):3877-3910.
Liu D, Zhuang B, Wei M, Yuan T, Li J, Deng P, Du L, Yuan B, Jin Y. Oral konjac glucomannan for prevention of ionizing radiation-induced injury by regulating gut microbiota and increasing short chain fatty acids. Int J Biol Macromol. 2023 Jun 15;240:124402.
郑颖,殷祥昶,赵阳,等.电离辐射对肠道菌群的影响及基于菌群调节的辐射防护研究进展[J].中国药理学与毒理学杂志, 2020, 34(7):10.
Kamiya K, Ozasa K, Akiba S, Niwa O, Kodama K, Takamura N, Zaharieva EK, Kimura Y, Wakeford R. Long-term effects of radiation exposure on health. Lancet. 2015 Aug 1;386(9992):469-78.
Tonneau M, Elkrief A, Pasquier D, Paz Del Socorro T, Chamaillard M, Bahig H, Routy B. The role of the gut microbiome on radiation therapy efficacy and gastrointestinal complications: A systematic review. Radiother Oncol. 2021 Mar;156:1-9.
Raghu SV, Rao S, Kini V, Kudva AK, George T, Baliga MS. Fruits and their phytochemicals in mitigating the ill effects of ionizing radiation: review on the existing scientific evidence and way forward. Food Funct. 2023 Feb 6;14(3):1290-1319.


小编最近仔细阅读了一本书,书名是《战斗细胞:人体免疫系统奇妙之旅》(海南出版社2022年10月出版的),该书是德国科学家菲利普·德特玛(Philipp Dettmer)撰写的一本书,作者是一名信息设计师。在32岁被确诊癌症并接受了一系列手术和化疗后,他逐渐痴迷于研究免疫学,目前已成为一名科学传播者和免疫研究爱好者。
译者李超群,英国利兹大学应用翻译专业硕士,译有《饮食的迷思》《显微镜下的室友》等。
在书中,作者以亲切易懂的语言、切入场景确切的比喻,生活化的语言描绘出免疫细胞世界的模样、运行的方式、如何使我们生病或保护健康,帮助读者轻松理解复杂的免疫相关知识。
免疫系统本来是对普通人比较陌生的领域,专业名词也多,但是作者通过生动的比喻帮我们克服了概念上的障碍,例如,他将普通体细胞比作“平民”,免疫细胞则是“各种专门士兵”——肠道有益菌是可爱小兔子、抗体是小龙虾等。看书的过程就好像在看影视剧一样。就算你从未接触过医学知识,也丝毫不影响阅读和理解。
回顾我们以往的科普文章,虽然前期选定主题,查阅大量研究文献和资料,再整理撰写花费时间很多,但是没有将科普文章写得如《战斗细胞》一书一样让不同知识面的客户都可以轻而易举读懂和受益。
在此有机会阅读此书并分享书中部分关于免疫系统和肠道黏膜和肠道菌群的内容,帮助读者增进对人体免疫系统的了解,从而更好地守护自身健康。
前序:在我们生活的环境中有着不计其数的病原体,不仅有病毒,还有细菌、寄生虫等等。人类几乎每时每刻都在和环境中的危险因素接触、斗争,只不过,我们常常感知不到这个“斗争”的过程。
免疫系统的构成:一支精密完备的“老牌”军队
用作者的话说,要回答什么是人类的免疫系统,还真有点不容易,但既然叫做“系统”,也就表明它不是一个单独的东西,而是一整套完整的体系。
作者把人类免疫系统比作是“一套军队系统”,说它“是由成百上千的营地和征兵处组成的遍布全身的复杂网络”,这说的就是免疫网络,是免疫系统的“基础设施”。
而所谓的“营地”,其实就是指免疫系统中专门的免疫器官,比如骨髓、胸腺、盲肠、扁桃体等等,这些免疫器官有些也是免疫细胞的诞生地;此外还有淋巴结。另外,免疫细胞内部还会释放出各种免疫活性物质,或者称为“细胞因子”,例如常见的有抗体、补体、免疫球蛋白等等,它们也是整个免疫系统重要的组成部分。
按照不同的免疫功能,免疫系统由两大王国组成,即先天性免疫(或说非特异性免疫),以及后天的适应性免疫(或说特异性免疫)。从名称就可以看出,两者的区别在于,先天性免疫是我们一出生就具有的,或者说不是针对特定的、单一的病原体的。
➤ 初代生命的进化与互相攻击:35亿年前,泥坑中的奇迹诞生
要是你因为每天早起上学,工作,路上堵车就觉得生活不顺,那原始的单细胞生命可以给你好好上一课。
35亿年前,地球还是一片蛮荒之地,在某个神奇的泥坑里,生命诞生了,而免疫系统要也随之出现了。我们不知道这些初代生命做过什么,又怎么活下来,但知道它们很快就开始了互相攻击。
➤ 生命的合作进化:从单细胞到多细胞
它们必须想办法把周围的化学物质转化为能为己用的东西,同时获取生成必需的能量,而其中几种细胞就盯上了“捷径”。
能偷别人干的,干嘛要自己干呢?
有几种办法实现了这一目标,比如:
可以整个同事其他细胞,或是在别的细胞上打洞并从其内部吸食营养……不过这样做颇有风险,成功了能饱餐一顿,失败了则会惨遭反噬,特别是在对手更大,更强的情况下。
风险更小的办法是潜入对手细胞内部并在此安家:分享宿主的粮食,享受它的呵护。这个办法相当成功,当然对宿主来说就很可怕了。
既然擅长“吸血”成了有效的生存技能,那么保护自己不被“吸”就成了演化上的必需。接下来的29亿年里,微生物凭借相似的招数,互相竞争厮杀。
假如有个时光机,能回到过去的微观世界一睹此类战争的宏大场面,你多半会失望,除了潮湿的石头上有一些纤薄的细胞膜之外,什么都没有。
在最初的几十亿年里,地球是个相当乏味的地方,直到生命形式的出现和飞越。
我们现在并不特别清楚,到底是什么让单打独斗的细胞开始向着密切合作并有专门分工的庞大细胞群发展的。
➤ 多细胞生物的兴起与免疫系统的重要性
大约在5亿4100万年前,多细胞动物出现了爆发性增长,体型变得肉眼可见,多样性也以极快的速度大大增加。
这当然就给刚演化出来的古代微生物们提出了一个问题:几十亿年来,生活在微型世界中的它们,无论进入任何生态系统,都要为其中的空间和资源争斗,而对这些细菌及其他微小生物来说,还有比多细胞动物更好的生态系统吗?这个系统里,从头到脚都是免费的营养!所以从一开始,多细胞生命就面临着细胞入侵者和机体寄生者的威胁。
只有能应付这种威胁的多细胞生物才能存活下来并有机会演化得越来越复杂。可惜,经过数亿年的时间,细胞和组织都没有得到好好的保存,我们看不到免疫系统的化石遗迹。但通过科技的魔法,我们可以看到生命树的各个分叉,并观察现存动物,研究它们的免疫系统。如果有些免疫特征,为生命树上差距越大的物种共同拥有,那么一般而言,这些特征也就越久远。
那么重要的问题就变成了:
➤ 免疫系统会在哪里产生区别,不同动物的免疫系统有哪些共性?
几乎所有当今的生物都有某种形式的内部防御机制,而生物越复杂,免疫系统也越复杂。选取相差悬殊的动物,比较它们的防御机制,我们就可以了解很多免疫系统的历史。
从最微小的层面来说,细菌也有抵御病毒的方法,它们不可能乖乖就范。而在动物世界中,海绵这种已经存在了5亿多年的最古老、最简单的动物,就拥有可能是最原始的动物免疫反应:“体液免疫”(“体液/humor”一词来自古希腊语,这里可不是“幽默”)。
体液免疫主要通过游离在细胞外体液中的微小蛋白来实现功能,杀伤、歼灭不该出现的外来微生物。这类防御非常有用,也非常成功,几乎所有现存的动物,包括我们人类,都有体液免疫。它没有被演化淘汰,而是变得举足轻重。原则上说,体液免疫在5亿年里都没怎么变。
但体液免疫只是个开端。多细胞动物的优势之一是就发展出了专业的防御细胞,相应的免疫就叫“细胞[介导]免疫”。
这种新型的免疫一开始就大获成功。连在蠕虫和昆虫的小小身体里,我们都发现了专门的免疫细胞卫士,它们能在小虫体内自由巡行,与入侵者正面交锋。
沿着演化之树,越是向枝头探寻,免疫系统就变得越是精妙。而在最早的脊椎动物身上,我们就已经看到了重大的创新:出现了专门的免疫器官暨细胞的“训练场”,以及最为强大的免疫原理之一——能够识别特定的敌人,并快速制造大量的针对性武器实现精准打击,还要牢牢记住它们!
即使是最原始的脊椎动物,比如样子诡异的无颌鱼,体内也有同样的免疫机制。

图源:dashangu
在数亿年的岁月里,这些防御机制变得越发复杂和精密。不过,简而言之,上面都是基本的免疫原理,它们有着出色的防御效果,所以或许在5亿年前的某些生物体内就已经存在了。因此,虽然你我的免疫系统很复杂、很强大,但其底层机制在动物界却很普遍,它擅长调动多种多样的特化细胞。
因此,从演化上来看,动物很可能没用多久其起源可以追溯回几亿年前。演化之手无须一次次地重新发明免疫系统——它发现了一套了不起的系统,并将其不断完善。
好,话题终于要回到人类,回到你我身上了。我们都在享受着数亿年来免疫系统不断演进的丰硕果实。不过,免疫系统并不只是存在于你的体内,它就是你本身。“免疫”只是对守护自身并维系生命的所有生物机制的一种表达方式。所以讨论免疫系统就是在讨论人本身。
免疫系统也不是一个单独的东西。它像一套军队系统,是由成百上千的营地和征兵处组成的遍布全身的复杂网络。它们和心血管系统一样,分布广泛,无处不在,由像高速路网一样的管道网连接起来。另外,人体还有专门的免疫器官,位于胸腔内,大小和鸡翅差不多,会随着人的衰老而逐渐退化。
基于免疫器官和免疫“基础设施”,有几百亿免疫细胞在免疫路网和血流中巡逻,可以随时应召和敌人作战。此外,人体外部组织表面也有几十上百亿的免疫细胞形成的屏障,准备抵挡入侵。

这还只是积极防御,还有1018数量级的蛋白质武器组成的防御系统,它们就像能自动组装、四处散布的地雷。免疫系统中还有专门的“大学”,供细胞学习如何识别敌人及怎样作战。这所大学有着世界上最大的生物学图书馆,可以教你识别一生中可能碰到的所有敌人并记住它们。
在最核心的意义上,免疫系统就是区分自身和异物的工具
无论对方是否恶意,并不重要,只要不是被授予自由通行证的贵宾,免疫系统都会发动攻击与歼灭,因为这些被视为潜在的威胁。对免疫系统来说,为任何“他者”冒险都不值得。没有它们的此种忠诚,我们可能活不了几天。可惜,免疫系统如果忠诚不足或忠诚过头,也会造成困扰甚至引发严重后果致人死亡,后面我们会谈到这些情况。
免疫系统的首要目标——维持稳态
虽然说区分自身和异物是免疫功能的核心,但并不是它的目标。免疫系统的首要目标是维持“稳态”,即维持体内全部细胞及物质的平衡。免疫系统真是投入了最大的努力保持平衡,也在尽心安抚自己免于反应过激,这一点我们怎么强调也不为过。
你也可以理解成,它在追求和平,追求让生存变得愉悦和轻松的稳定秩序,也就是我们所说的“健康”。健康是轻松自由地生活的基础,拥有健康,我们才能从心所欲,不受病痛的阻挡。
只有当我们失去健康时,才会真正意识到它的宝贵。健康其实是一个抽象的概念,因为它描述的并不是一种实质的存在,而是没有病痛、不受限制的状态,不是“有”而是“无”。拥有健康的时候,你觉得一切正常,感觉良好。而一旦健康离你而去,哪怕只有几天,都很难忽视人的脆弱和生命的稍纵即逝。疾病是生命中不可避免的事情。对于美好生活而言,没有什么比健康的身体更重要。
对免疫系统来说,健康就是稳态
尽管这场守护健康的战争终会不可避免地输掉,变成徒劳,但我们仍在努力夺取多一些时间,哪怕只是几个小时。总体而言,生而为人是幸福的,我们都希望自己可以活得久一点。
但维持健康殊非易事,因为我们每天都会遇到上亿的细菌和病毒,它们巴不得占领你的身体,就像几十亿年前那些单细胞生物之间发生的战争那样。
对微生物来说,你就是一套有待征服的生态系统。这片广袤无垠的土地资源丰富,适合繁殖,充满了机遇,是理想的栖居之地。当然,等我们最终离开这个世界时,它们还是会胜利的;没有了免疫系统的保护,大量疯狂的微生物组成的军团会大大加速尸体的分解过程。
预防癌症是免疫系统的头等大事之一
要担心的还不止这一大堆想要入侵的微生物,还包括可能误入歧途的身体本身,就是癌症。事实上,在你读这几页书的时候,身体里可能就有早期癌细胞正在被免疫系统悄无声息地清除掉。
免疫系统也可能出错——自身免疫性疾病、过敏
旨在保护你的免疫系统也可能出错,可能堕落。免疫系统一旦受了蒙骗,可能就会助长疾病的蔓延,或是保护癌细胞不被发现。免疫系统也可能失衡或受损,从而糊涂地攻击自身。它会把“我”误判为“他”,实实在在地攻击起它本该保护的那些身体细胞,导致一系列自身免疫性疾病,而病人不得不长期服用可能伴有严重副作用的免疫抑制药物。
过敏反应是指免疫系统对无害的物质产生了过激反应。“过敏性休克”就是一种严重的过敏反应,它凸显了免疫系统有多强大,一旦出错又多么可怕:疾病未必会马上置人于死地,而免疫系统带来的过敏性休克却能在几分钟内夺人性命。

免疫系统在帮助你的同时也会带给你痛苦
生病时的很多糟糕症状都是被激活的免疫系统引发的后果——对某些疾病来说,最严重的损伤甚至死亡都是免疫系统对入侵事件的失控反应造成的。比如,COVID-19导致的许多死亡病例都是免疫过激的结果。
伤害的累积是严重疾病的基础
免疫系统发挥防御功能的同时造成的损害会不断累积,于是今天有人认为,免疫系统的正常运转正是一些致命疾病的发展基础。因此,尽管拥有能对外界威胁做出快速有力反应的免疫系统对健康很是关键。
但同时保证它不会失控和搞破坏也很重要。就和人类社会一样,如果你的身体不得不打仗,那它至少想要快速地结束战争,赢得干净利落,而不想经历长期的被占领或冲突,那只会耗尽资源,毁坏基础设施。
人不管怎样生存和行动,都离不开世界本身及世上的一切。温馨私密的城堡,偏僻的森林木屋,遥远的社交距离,都无法让你免于和世界打交道,哪怕你是最叛逆的网瘾少年-最起码你需要稳定的食物来源,因此总要和外界有最基本的互动。

人体面临着同样的问题,因为细胞需要氧气和营养来维持生存和运转,并排出代谢产生的有害废物。就是说,资源要从外面进来,废物要从里面出去。因此,人体不可能是封闭的系统,内部总要有和外界直接接触的地方。
绝大部分病原体入侵都发生在这些内外交界之处
而这样的地方也就是人体的薄弱环节,从这里,不速之客能偷偷入侵血肉大陆。事实上,绝大部分的病原体入侵都发生在这些内外交界之处,包括从口腔一直到肛门的消化道,还有通向和外界进行交换的“洞穴系统”的多分支管道。
开头我们就说过,人体的肺和呼吸道、口腔和肠道,以及生殖道,其实是身体的外部,只是被卷到了里面。按理说,这些“管道”里铺的东西应该叫“内皮”,可惜,正确的名字是黏膜。为了听起来更酷一些,我们就叫它“沼泽之国”。
沼泽之国要解决的一大难题,方便营养进来、废物出去,同时又要让病原体难以逾越
这意味着,沼泽之国的免疫系统要和身体其他地方的不一样。肠道黏膜人体大部分都是无菌的,没有微生物,没有异物,而沼泽之国却在持续接触着各种“异物”:有待吸收的食物碎块,由此通过的可消化物质,可以自由进入并在肠道安居的有益菌,还有从空气中吸入的各种颗粒物,如污染物、灰尘等等。
这样一来,当然会有数不清的不速之客想要偷偷潜入,越过防线。其中一些是不小心闯入的无辜过客,另一些则是专门攻击人体的危险病原体。

这使得这些部位的免疫系统有着格外艰巨的职责,要维持平衡更是难上加难——因为沼泽之国的免疫系统要有一定的宽容度。
与此相反,身体多数部位的免疫系统对异物是毫不留情的。划伤之后,细菌侵入软组织,免疫系统就会发动猛烈的还击。皮下或者肌肉组织是容不得细菌的,会不惜一切代价把它们消灭掉。而这在黏膜附近就不可能了。

黏膜处的免疫系统小心处事
黏膜处的免疫系统不能像其他部位一样有攻击性,否则这些负责气体和营养交换的部位会遭到严重破坏,从而影响正常生活甚至造成死亡(许多患有自身免疫性疾病或过敏的人,就会遇到这种情况,不过我们后面再详细讲)。黏膜的免疫系统必须小心行事,被激活后要尽量把免疫反应限制在最必要的范围内。但同时,黏膜又是身体最薄弱的地方,免疫系统必须要能发挥保护作用,不能太过散漫,非常棘手。
针对入侵的第一项反制措施,就是把黏膜变成不适合危险微生物生存的死亡之地。为此,黏膜动用了一系列不同的防御系统。
如果说皮肤像广袤的荒漠,又像一道无法逾越的边境长城,黏膜就像一大片沼泽地,遍布着陷阱和巡逻的卫兵队伍。黏膜比皮肤容易入侵,但这也并不轻松。那么黏膜究竟是什么,又是怎样保护你的呢?
沼泽之国动用的第一道防线就是它本身的黏液层。黏液是细胞分泌的黏滑的物质,有点像水凝胶。你可能知道鼻涕,鼻子里面黏糊糊的东西,感冒时会流很多,看起来有点恶心。实际上黏液遍布身体里的各个地方:口腔、肠道、呼吸系统(包括肺部)、眼睑内侧等等。
与外界进行物质交换的通道表面上都有黏液。持续生产黏液的是杯状细胞,它们的样子很好玩,但我们主要讲免疫系统,就不过多介绍它们了。你可以把它们想象成被踩扁的怪虫子,不停地吐出黏液,形成了黏液层。
湿滑的黏液发挥着几方面的作用
它是一道阻止外敌入侵的物理屏障
假设你在满是污泥的泳池里游泳,还要潜到池底,而污泥有近百米深。黏液不仅是一层黏糊糊的屏障,还和皮肤荒漠一样充满了陷阱:有盐,有可以溶解微生物外部结构的酶,还有一些特殊的物质能耗尽细菌赖以为生的关键营养,从而饿死细菌。
大多数部位的黏液富含杀伤力强大的IgA抗体
所以黏液层本身就不是宜居之地。而且,黏液层不仅能为你抵御外敌,还能让你免受自身的伤害。你是否想过,胃里有那么多胃酸,你为什么没事?因为胃黏膜就是一层屏障,能保护胃壁细胞,令其不与胃酸接触。
黏液可以移动
黏膜表面是一层名为“上皮细胞”的特殊细胞,你可以把它们看成“内皮的皮肤细胞”。它的细胞膜上覆盖着形如发丝的纤毛,这种微小的细胞器聚在一起,连成大片的网。上皮细胞位于黏膜的最外层,就像“身体里的皮肤”,表面只有一层黏液。
有些地方黏液和身体内部之间只隔着薄薄的一层,一个上皮细胞的厚度。上皮可没有皮肤那么奢侈,能让好几百个细胞一层层摞在一起。也正因为这样,上皮细胞可不好对付。它们尽管不是真正的免疫细胞,但也发挥着重要的防御作用:它们特别擅长激活免疫系统,以及释放特殊的细胞因子以请求支援。它们就像民兵组织,虽不能与敌军旗鼓相当,但在身体遭遇入侵时,是非常有用的补充性防御力量。
上皮细胞的任务之一,就是借助细胞膜上的纤毛让黏液流动
有些微生物会借助纤毛移动,而上皮细胞则是摆动纤毛让表面的黏液一起有节律地流动。摆动的方向取决于上皮细胞的位置。呼吸道、鼻腔、肺里的黏液,要么从口鼻排出体外,要么绕个弯被吞进胃里。
我们在一生中会吞下相当多的黏液,虽然听起来可能有点恶心,但这种机制很是有用。毕竟,胃里充满了强酸性的胃液,绝大部分病原体都无法幸存。而肠道上皮细胞纤毛运动的方向也很清楚:从胃向肛门——吃进来的东西都从这里要排出去。
沼泽之国——合作联盟
不过黏膜形成的沼泽之国不是单一国家,而更像彼此迥然不同的多个国家,为了共同目标而结成的合作联盟。
比如在荒漠之国皮肤的情况中,脚底和腰部的皮肤厚度就有很大差异。相应的,肺部黏膜和肠道黏膜有着完全不同的功能,而女性生殖道黏膜的功能又大不一样。根据不同部位黏膜特化情况的不同,相应的免疫系统也各有特点。
在讲病毒之前,我们先看看肠道这个神奇的国度,看看它是怎么和足足几十万亿细对免疫系统来说,肠道是个非常特别的地方,因为在这里,免疫系统要应对许多复杂的挑战,才能保持身体健康和正常运转。
我们还是来把肠道想象成贯穿人体的长管道,它把一点“体外”裹进了“体内”。在这些“外”表面,即肠道黏膜上,生活着1000多种细菌,数量多达三四十万亿,还有几千种病毒,它们共同组成了“肠道微生物群”(绝大多数肠道病毒攻击的是肠道细菌而非人体)。
关于免疫系统和肠道微生物组各自的功能及其相互作用,我们还很缺乏了解。许多疾病和失调都跟两者间的失衡有关,不过要完全理解两者间的各种关系,还需要大量的研究。未来几年,我们很可能会有重大突破。
在本章中,我们会探讨免疫系统是怎样和如此众多的微生物和平共存的。
首先,肠道免疫系统是一个半封闭系统,它会试图和身体其他部位免疫系统保持一定的界线。
肠道黏膜遇到的最大挑战,就是它的防线一直在被攻破。对肠道来说,外界的侵扰永不停歇,肠道免疫系统要持续响应,分辨敌友,这和身体其他任何地方都不一样。肠道是个繁忙的地方,除了生活着组成肠道微生物组的几十万亿有机体之外,还有吃进来的所有东西。
食物消化
食物的旅程始于口腔。食物要被消化吸收,变成身体和细胞养分,第一步就是被牙齿磨碎,并被唾液浸润、炮制。唾液中含有一些可以分解食物的化学物质,从你吃第一口开始,整个消化过程就拉开了序幕。
从进食到把废物排出体外,吸收营养的时间是有限的,所以越早开始越好。嚼碎的食物接着会被吞下去,在胃酸之海里停留片刻。胃酸不仅可以帮助消化,分解结实的肉类和植物纤维,它还能淹没并杀死大量微生物,从而大大减轻免疫系统的负担。
经过胃部后,食物就到了肠道。肠道长约3—7米,是最长的一段消化道。90%以上人体所需的营养都是在肠道吸收的。这里生活着大量人体必需的细菌伙伴,它们进一步分解食物,便于身体吸收营养。但这些可不是随便什么细菌。
几百万年以前,人类祖先和某些微生物群做了个小约定:
肠道细菌——租客;生成的营养物质——租金
人允许它们住在温暖的肠道里,并提供源源不断的食物;作为交换,这些微生物负责分解人类自己无法分解的碳水化合物,并生成人体自身不能合成的维生素。
肠道细菌:亦友亦敌
这些细菌就叫“[偏利]共生细菌”,“共生”(commensal)一词来自拉丁文,意为“同在一张桌前”。就和生活在皮肤表面的那些细菌“部落”一样,肠道的共生细菌也是我们的朋友。这些细菌只要不危害人体健康,免疫系统就不会攻击它们,这就是双方守约定的最理想情况。
为了维持秩序与和平,肠道细菌也像皮肤表面的细菌那样,生活在肠道黏膜的表面之上。只要肠道细菌不越线,不侵入上皮层,双方就相安无事。当然,事情不会这么简单。
细菌可不是人类真正的朋友,它们不知道什么约定,也不会去遵守任何东西。而肠道面积辽阔,细菌多得惊人,时刻都有一些共生细菌侵入肠道内壁。这就不太妙了。要是这些细菌进入血流,即进入真正的“体内”,会带来可怕的后果,甚至危及生命。而黏膜的一大目标就是防止这种情况。
肠道黏膜有三层
1
先是黏液层,内含大量抗体、防御素(前面讲皮肤时提过,它们就像微型针头,能杀死微生物)和其他一些能杀伤或杀灭细菌的蛋白质。肠道的黏液层很薄,且要有一定的通透性,好让食物中的营养物质通过,要是第一层保护太厚,你可能就要饿死了。
2
黏液层之下是肠道上皮细胞,它们是人体内外之间的真正屏障。和肺部相似,肠道的上皮层也只有一个细胞那么厚。为了更好地起保护人体内部的作用,肠道上皮细胞彼此连接得非常紧密,被特殊的蛋白紧紧粘在一起,就像真正的墙一样牢固。免疫系统严密监控着这里的情况,对于一切企图黏附到上皮细胞上的微生物,它都会毫不客气。
3
共生细菌突破防护墙的情况每时每刻都在发生,所以上皮细胞下面还有第三层,“固有层”,这里是肠道免疫系统的大本营。

在紧贴着黏膜表面的固有层之内,有特殊的巨噬细胞、B细胞和树突状细胞随时待命,等着收拾那些不速之客。
免疫系统会极力避免引发炎症
因为炎症会让肠道产生大量多余的液体,造成腹泻。腹泻不仅会使大便呈水样,还会损伤负责从食物中吸收营养的、敏感纤薄的上皮层,并迅速导致重度脱水。
很多人不知道,腹泻现在仍是重要的死因,每年约有50万儿童因此死去。所以,从几百万年前,人类这一物种登上演化的舞台开始,人体和人体免疫系统就明白要谨慎对待肠道炎症。
守卫肠道的巨噬细胞有两个特点:
一、很擅长吞噬细菌;
二、不会释放召集中性粒细胞进而引发炎症的细胞因子。
这里的巨噬细胞更像是无声的杀手,不慌不忙地吃掉越界的细菌,不会大呼小叫。

编辑
肠道的树突状细胞也很特别
大量树突状细胞直接待在上皮细胞下面,将长触手从上皮细胞之间挤过去,直接伸入肠道黏液。这样,它们就能对不安分的调皮鬼,即想侵入体内的细菌,不断进行采样。
这里就埋藏着免疫学中的一大未解之谜,将来解开谜题的人定能获得诺贝尔奖:
树突状细胞怎么知道它采样的细菌是危险的病原体,还是无害的共生细菌?
目前我们还不知道答案;我们知道的是,采样是共生细菌时,树突状细胞会让肠道免疫系统保持冷静,不要为这些细菌携带的抗原而烦恼。
肠道还有特殊的B细胞,只生成大量的IgA
这些抗体特别适合在黏液中工作,简直就是为肠道的环境而设的:
这两点对肠道来说都很重要。
IgA还有别的长处:
它们有四只钳子,伸向两个相反的方向,这让它很擅长抓住两种不同的细菌,并把它们粘在一起。于是,大量IgA可以把无法反抗的细菌黏成大团,这些菌团会成为粪便的一部分,被排出体外。毕竟,粪便有三成多都是细菌,其中相当多的细菌是被IgA粘在一起的(让人担心的是,其中约一半的细菌在被排出时仍然是活菌)。
探索肠道免疫系统的守护之路
肠道免疫系统默默地守护着你,确保内部和外界的细菌不会作乱。有了这些机制和特殊细胞,免疫系统就保证了肠道黏液不会被野心太大的共生细菌所侵扰,同时自己也不会因过激而损伤身体,如此看来,肠道免疫系统可真是一支维和部队。
但要是有真正的敌人入侵,比如有致病菌经受住了胃酸的洗礼,存活到了肠道,这些机制就成了可怕的漏洞。此时,为了尽快捕获敌人,肠道有一种名为“派尔集合淋巴结”的特殊淋巴结,它们直接长在肠道上。

会有“微皱褶细胞”直接伸入肠壁,对免疫系统可能感兴趣的对象进行采样,某种意义上它们有点像电梯,装上乘客后会直接把它们送进派尔集合淋巴结,让适应性免疫细胞能检查肠道的各种情况。这样一来,肠道就相当于拥有了超快速的免疫筛查,可以持续地密切监测肠道的细菌组成。
本文选取了《战斗细胞:人体免疫系统奇妙之旅》该书中,与肠道免疫相关的几个章节作为分享,希望大家能更轻松地了解关于肠道免疫相关的知识,进一步引发对肠道免疫的思考和探索。让我们共同努力,推动肠道免疫健康知识的普及与实践,走向更健康美好的生活。
本文用于分享和交流,部分图片如有侵权请联系我们删除。

谷禾健康

抗生素耐药性是当下和未来几十年人类健康将面临的重要挑战之一。从2000年到2015年,抗菌药物的普及导致人类抗生素消耗量增加了约65%,2015年后这个数据还在增加。最明显的后果是抗生素耐药性的增多,这使得近年来常见的感染难以治疗。
最近,由于担心出现更难治疗的肠道感染和其他感染,以及耐药病原体可能传播给更脆弱的人群(如小孩和老人),人们对使用抗生素进行严格管理和开展精准用药算是迈开了第一步。
抗生素的使用经常产生脱靶效应,这意味着抗生素的使用浓度所引发的抗菌作用超出了消除影响病原菌的作用。下一代靶向测序已证明抗生素会导致肠道细菌生物量、分类多样性和功能多样性减少。
除了耐药性之外,抗生素未能清除感染的原因还有多种。感染灶中药物的药代动力学较差或生物膜(下期专门讲)等受保护的生态位中细菌的持续存在会导致治疗失败。
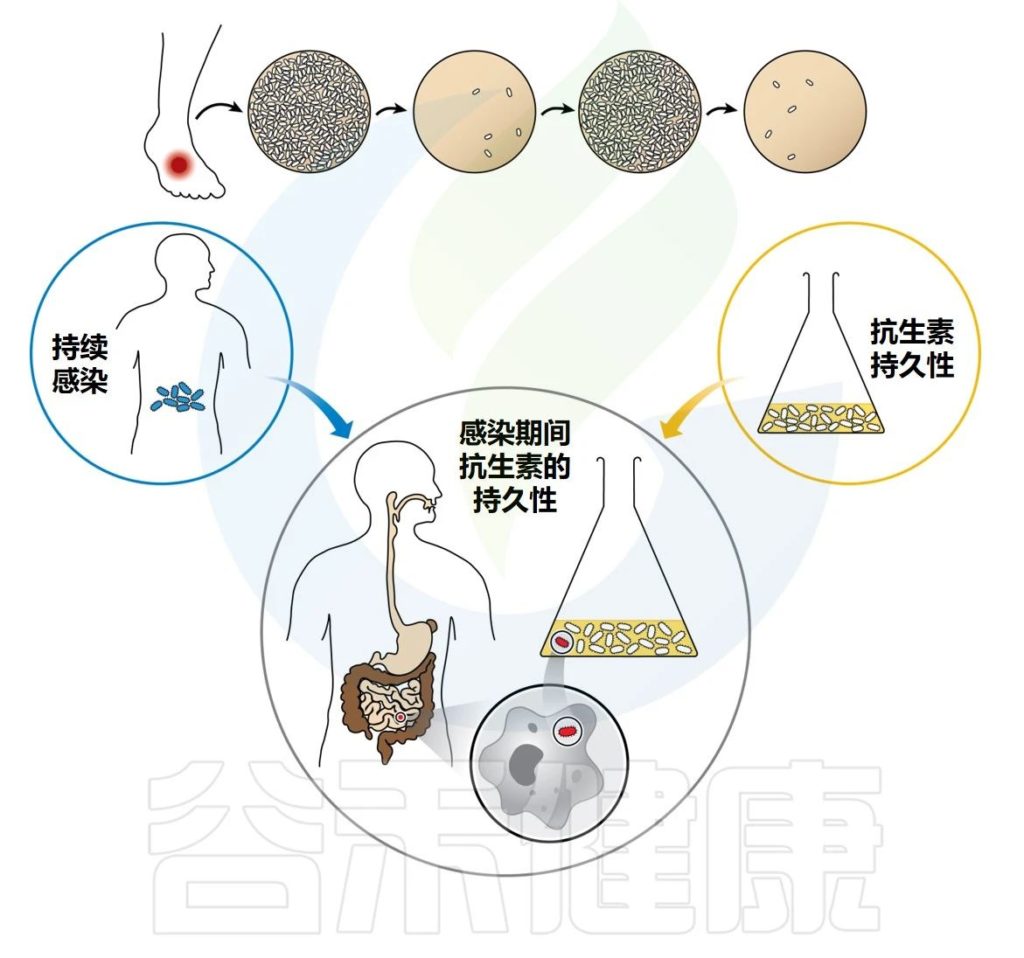
此外,在感染过程中,一些细菌(持续存在)可能会由于进入抗生素持久性状态而在药物治疗后达到致命的浓度。然后会引起长期和反复感染,导致最终治疗失败。
感染期间抗生素的持久性涉及持久性在宿主免疫反应和药物的联合作用下生存的能力。病原体已经进化出多种方式来击败宿主的免疫反应,并且它们的毒力因子已经被仔细研究了几十年。然而,细菌通过持久性抵抗抗生素暴露的能力仍然更加难以捉摸。
虽然抗生素暴露对病原体清除的正向影响有利于宿主健康,但抗生素暴露对肠道微生物组组成和功能的脱靶影响可能会对宿主健康产生有害或有益的影响,具体取决于初始成分和原生微生物群落的功能。
预测抗生素耐药性进化轨迹以及耐药风险的能力对于调整抗生素的给药方案以最大限度地延长其使用寿命具有重要价值。
本文将讨论抗生素持久性以及微生物持久性形成在感染中的重要性,了解肠道微生物群如何对抗生素扰动做出反应以及对特别人群的影响、影响抗生素暴露对微生物群影响的因素、抗生素引起的微生物群改变的潜在健康结果以及有可能改善这些问题的策略。
抗生素持久性领域仍处于起步阶段;然而,关于定义的争议和讨论已经模糊了关键概念及其各自的重要性。在这里,采用的定义和说明与最近几十个研究小组的文章一致。
Gollan B,et al.Annu Rev Microbiol.2019
确定的定义主要集中在体外研究的细菌上,并以最小抑制浓度(MIC——明显抑制细菌生长的药物最低浓度)和杀死99%数量细菌所需的最少时间(MDK99)的测量为中心。
尽管这些测量对于区分允许细菌在实验室培养物中暴露于抗生素后存活的不同现象非常有价值,但它们在感染模型中的工作中难以进行。
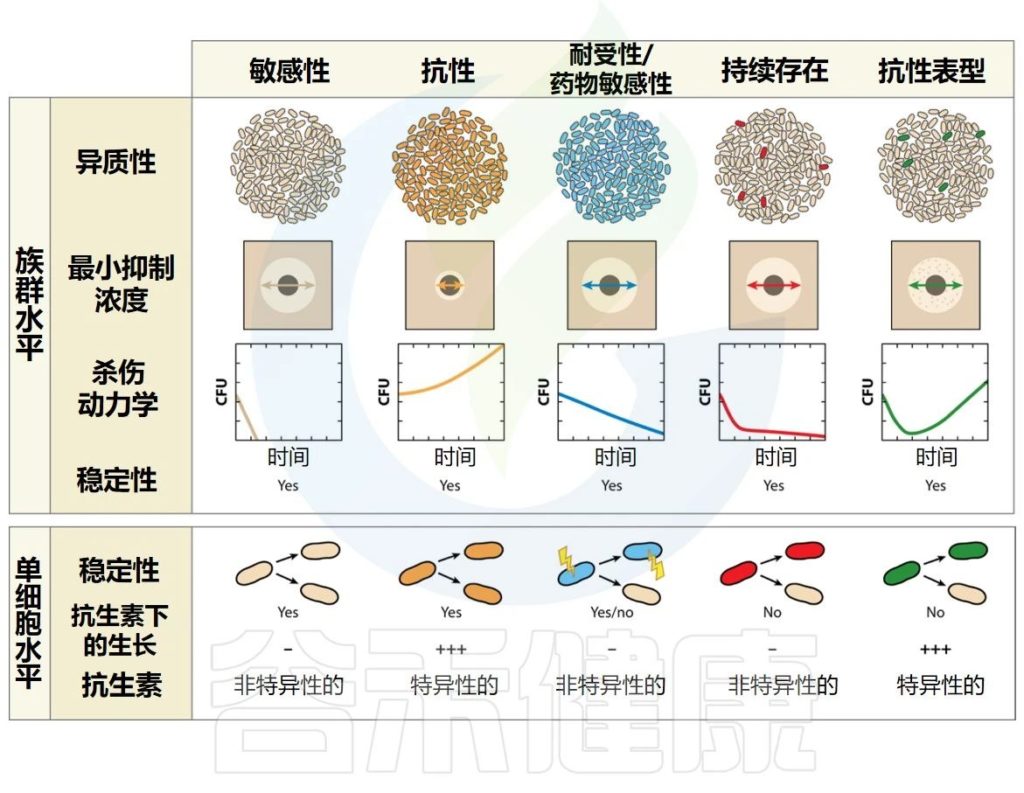
因此,研究者们更多地关注不同概念的描述性定义。重要的是,一些导致抗生素暴露存活率增加的细菌行为(即抗生素持久性和表型耐药性)涉及复制群体内的表型异质性,因此最好通过群体和单细胞特征的组合来描述。
▼
▸ 细菌的耐药性
当细菌能够在对同一物种的参考菌株致死的药物浓度下增殖时,细菌被认为对抗生素具有耐药性。
耐药性通常(但并非总是)特定于一种药物或一类药物,并且是由于非耐药亲本菌株的基因修饰(从头突变或通过水平基因转移获得)造成的。
遗传性状会代代相传
一旦获得,遗传性状就会代代相传。产生耐药性的主要原因是药物或药物靶点的输出或修改。在体外,可以通过测量增加的明显抑制细菌生长的药物的最低浓度。
▸ 群体的耐受性
当暴露于杀菌药物时,整个细菌群体可能表现出较低的杀灭率,因为群体的增长率因遗传或环境因素而降低。因此,与普通菌株相比,生长缓慢的细菌表现出相对的药物冷漠,这增加了种群在抗生素暴露下存活的时间。
从理论上讲,足够长的时间接触抗生素应该可以清除整个人群。营养缺陷型突变代表了这种耐受现象的一个极端例子。当环境条件发生变化允许恢复快速生长时,种群就会恢复到易感表型。在体外,可以通过测量杀死一定比例的群体的持续时间来量化耐受性。
▼
抗生素持久性和表型耐药性代表了抗生素存活方面的异质行为。“持久性”与“耐药性”一词指的是两个不同的概念,它们被认为是有联系的,但又是不同的。因此,它们不能互换使用。
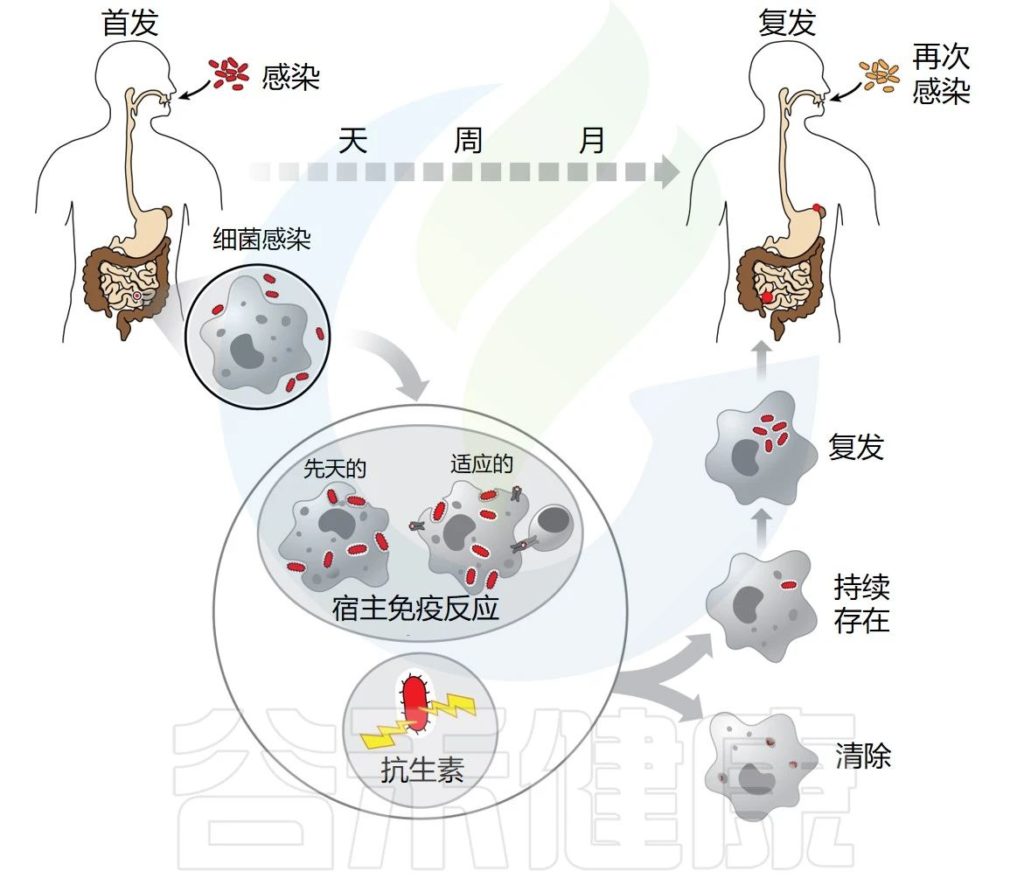
▸ 感染持续存在
当病原体有能力在宿主体内停留较长时间时,无论宿主免疫反应如何或长期抗生素治疗如何,感染都会持续存在。
据信,持续感染至少部分依赖于感染人群的耐受性(或药物冷漠)以及抗生素的持久性,但这种联系仍然很脆弱。迄今为止,抗生素持久性领域主要忽视了持久性细菌在宿主体内生存的能力。
Gollan B,et al.Annu Rev Microbiol.2019
▸ 抗生素持久性
药物暴露后的这种异质群体行为是由于细菌亚群(持续存在)通过生长停滞、暴露于对其余群体致命的浓度的抗生素而得以生存的能力。
由于持续者是非定植者,因此他们的存在不会影响整个种群的MIC。在种群水平上,这种现象在几代群体中都是稳定的,这表明种群内的所有细菌都具有持续存在的遗传装备。
MIC——明显抑制细菌生长的药物最低浓度
抗生素持久性与压力有关
抗生素持久性很大程度上是由 “压力” 引发的,最好在压力缓解后进行评估,以免与耐受现象混淆。
事实上,与耐受人群相反,持久人群携带着压力暴露的记忆。由于现象的异质性,通常可能需要允许单细胞分析的工具来获取有意义的信息。
▸ 持续者
持续者是抗生素持久性种群中的个体,当暴露于对其他种群中的亲属致命的浓度的抗生素时,它们能够通过生长停滞而生存。
持久菌在药物中存活的能力是短暂的,并且持久菌后代是异质的,由易感细菌和持久菌组成。在体外,群体中存留菌的存在可以通过双相杀伤曲线来揭示,该曲线显示存活率与时间的关系,其中易感细菌被快速杀死,存留菌存活时间更长。
▼
表型耐药性是在药物暴露时可能发生的另一种异质行为,这是由于细菌亚群(耐药性)在抗生素浓度达到对其余菌群致命的情况下能够增殖的能力。
整个群体的最小抑制浓度与易感菌株相当
由于群体主要由易感细菌组成,因此整个群体的MIC(明显抑制细菌生长的药物最低浓度)与易感菌株的MIC相当。在种群水平上,这种现象在几代菌中都是稳定的,这表明种群中的所有细菌都具有抵抗力的遗传装备。
▸ 休眠
休眠是一个用于定义一系列特征的术语,从缺乏任何可测量的细胞活性到生长停滞。在这篇文章中,我们用它来表示缺乏活性。
从体内感染模型中积累的新证据强调了持续感染者在持续感染中的重要性。持续感染者在感染复发中的潜在作用是对其进行研究的重要原因。
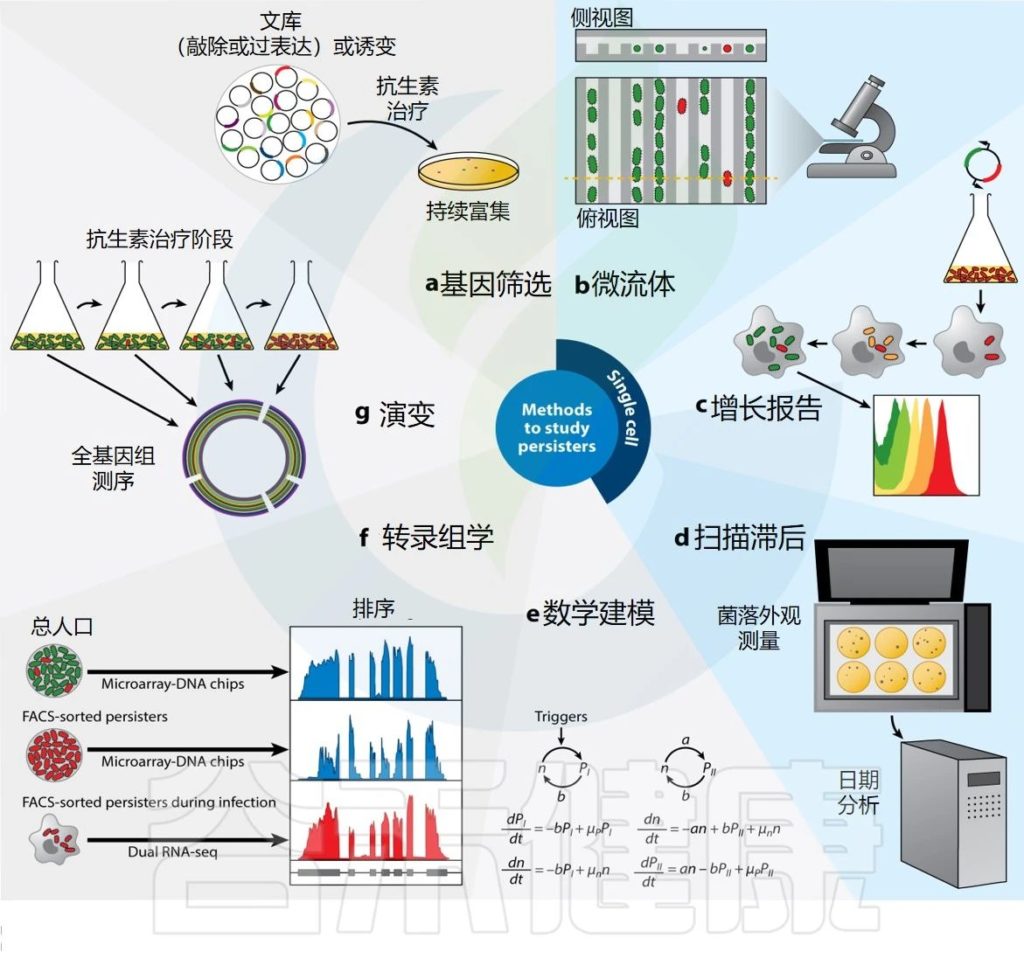
★ 开发研究持久性的技术
由于这种生理状态的短暂性和可逆性,以及相对稀有的残留物可以产生少量的生物材料,研究抗生素残留物具有挑战性。
长期以来,最常见的方法是从基因或环境角度操纵细菌种群,并测量其对持久性水平的影响。虽然这使得能够识别涉及调节群体中持续者水平的压力和途径,但近年来通过建立能够跟踪、收集和分析持续者的方法,取得了重要突破(下图)。
Gollan B,et al.Annu Rev Microbiol.2019
很快,人们就清楚地意识到重点应该放在单细胞研究上,因为持久性细菌只是细菌种群的一小部分。微流体装置与显微镜和流式细胞术相结合的使用成为一种选择技术。微流体背后的基本原理是分离单个细菌,以便使用延时显微镜来跟踪个体随时间的行为,以检查持久细胞的历史。
然而,微流体带来的对单个细菌的直接可视化和跟踪的能力受到可同时评估的细胞数量有限的阻碍。因此,流式细胞术提供了一种替代方法,允许以高通量方式进行单细胞分析,并通过荧光报告基因的发展,增强对感兴趣细胞进行分选的能力。
因此提出休眠(代谢活动的缺乏)对于进入持久性既不是必要的,也不是充分的。第一个开发荧光稀释技术来在单细胞水平上追踪细菌分裂的人。这种方法类似于免疫学家用来追踪T细胞增殖的羧基荧光素琥珀酰亚胺酯 (CFSE) 染色。
高通量下一代测序技术的兴起,随着生物信息学分析的改进和此类平台的可访问性的增加,也为持久化领域带来了视野。
最后,除了用于跟踪持久者的实验室技术之外,数学模型还允许对持久者行为进行计算机预测。例如,已经建立了一些模型来重点了解单细胞水平上持久物形成的分子机制。
▼
许多病原菌在宿主组织内建立持续感染,避免被免疫系统和抗生素清除。细菌感染通常会导致宿主产生先天免疫反应,然后产生适应性免疫反应,这通常足以清除感染。然而,许多病原体已经进化出复杂的生存机制来逃避免疫反应并建立持续感染。
// 急性结核感染
急性结核感染是细菌躲避免疫系统且相对难以治疗的典型例子,导致需要长时间的抗生素治疗才能治愈感染。
然而,分枝杆菌感染有时只能部分清除,并且10%的患者在其一生中会出现复发。复发不仅出现在结核病中。5%至10%的患者会出现伤寒复发。
// 其他感染
尿路致病性大肠杆菌引起的尿路感染(UTI)后,20%至30%的女性会再次出现症状;许多其他细菌感染在治疗后往往会复发。
✦许多感染会反复发作
“复发”一词用于描述这样一种现象:最初感染的症状暂时消退,直到首次感染时未清除的细菌库重新激活。
有多种原因会导致感染反复发作,例如宿主易感性增加、其他慢性合并感染以及环境和生活方式因素。
较难确定是再次感染还是复发
长期以来,无法确定感染复发是再次感染还是复发。当初次感染完全清除后,个体出现新的感染时,就会发生再感染。
▼
抗生素残留物研究中投入的许多努力都围绕着调查残留物形成的触发因素和途径。
✦持久性的形成是一种细菌应激反应
但一个总体观察结果是,持久性的形成是一种普遍的细菌应激反应。多种环境因素充当压力信号,促进持久者的产生。
此外,大多数已被确定参与持久物形成的分子途径都是应激反应元件。我们首先回顾了持续细胞形成的触发因素,然后回顾了持续细胞形成所涉及的分子途径和效应器(下图)。
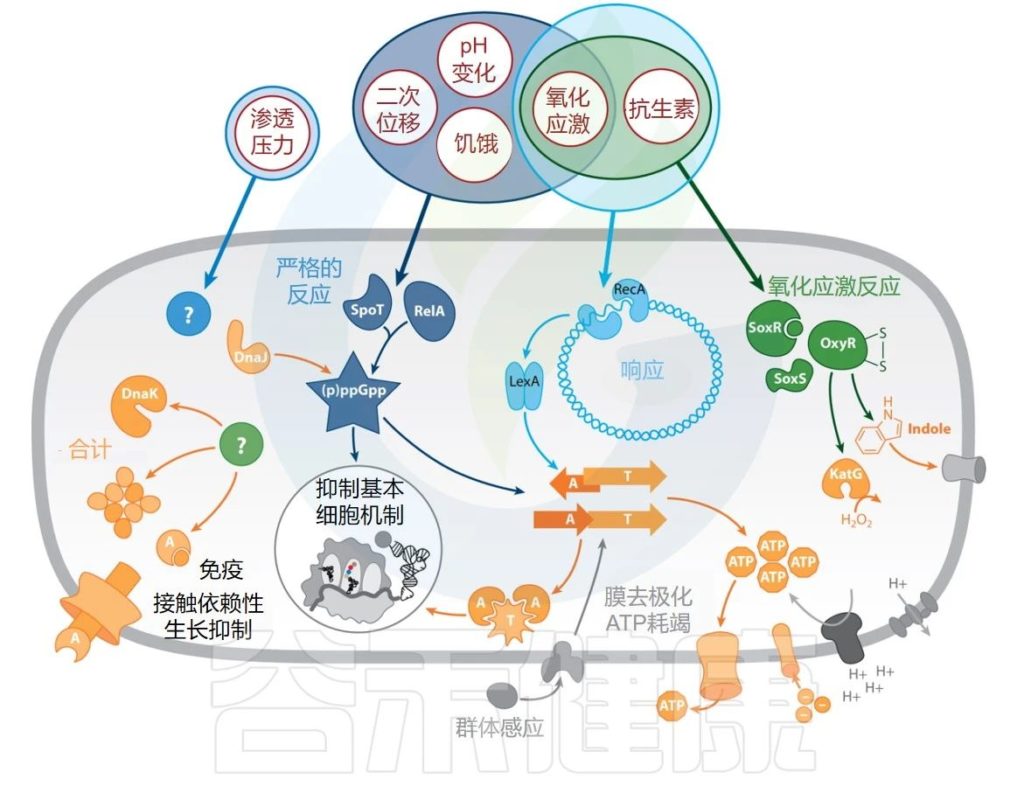
Gollan B,et al.Annu Rev Microbiol.2019
抗生素持久性的触发因素、途径和效应器。持久性的外部触发因素以红色圆圈显示。应激反应途径为蓝色或绿色(已识别的效应器为橙色,受效应器影响的细胞成分为灰色)。
缩写:A—抗毒素;T—毒素。
▼
选择压力可能是最难确定和纳入模型的因素。因此,在人类、动物和其他环境中,细菌病原体暴露于各种选择剂,这些选择剂通常存在于复杂的混合物中(例如抗生素、杀生物剂),并且其浓度可能随着时间的推移而发生很大变化。因此,在实验室环境之外通常很难确定选择的强度。
✦抗药性的选择具有较大差异
此外,抗药性的选择过程将有很大差异,具体取决于药物浓度是否足够高以(a)阻止病原体生长(如果> MIC则致命选择,如果< MIC则非致命选择)和(b)允许敏感和耐药菌同时生长。
在前一种情况下,在应用选择之前需要存在抗性突变体,富集率由群体中突变体的数量及其在特定抗生素浓度下的适应性决定。
然而,在最小抑制浓度选择过程中,可能会出现突变体,其富集率由群体中突变体的数量以及易感细胞和耐药细胞之间的适应度差异决定。因此,致死和非致死选择压力的出现率和选择的突变体类型有所不同。
高致死抗生素浓度
在高致死抗生素浓度下,在一个遗传事件中提供高水平耐药性的罕见的预先存在的大效应突变往往会被选择性富集(下图)。
Gollan B,et al.Annu Rev Microbiol.2019
非致死性抗生素浓度
相反,在非致死性抗生素浓度下,富集的突变体通常是由许多对耐药性影响较小的突变引起的(但它们组合起来可能会产生高水平的耐药性)。
重要的是,选择越弱(即易感细菌和耐药细菌之间的适应度差异越小),对于低适应度成本的突变体(上半部分)的富集就越强。
此外,由于在弱非致死选择压力下逐步选择连续的小效应突变,通过突变或水平基因转移获得抗性的概率增加的突变菌株得到富集。
注:矛盾的是,较弱的非致死选择可能比致死选择更富集有问题的突变体(高适应度菌株和突变体)。
许多触发因素似乎都会刺激持久性的形成,从饥饿或氧化应激等营养应激再到细胞外代谢信号。
几十年来,人们都知道抗生素的杀灭率取决于细菌的生长速度,而细菌的生长速度又取决于碳源的可用性,因此控制整个细菌群体的抗生素耐受性。
✦营养缺乏是持久性形成的诱因
此外,营养缺乏似乎是持久性形成的主要诱因之一。例如,氨基酸或氮饥饿会增加铜绿假单胞菌(Pseudomonas aeruginosa)、变形链球菌(Streptococcus mutans)和大肠杆菌(Escherichia coli)等不同物种中经抗生素治疗后存活下来的细菌数量。
! 手术或抗生素治疗后患者的营养非常重要
这就涉及另外一个主题,就是手术或抗生素治疗后,患者的营养,尤其肠内营养的监测或补充非常重要。
还有充分的证据表明,细菌培养物在进入稳定期及以后往往会开始积累持续细胞,然后持续细胞的比例达到与生物膜中所见的水平一样高。事实上,研究表明,营养和氧气有限的生物膜中含有非常高比例的持久物。
除了饥饿造成的剧烈压力外,碳源的变化会破坏代谢通量(可被视为暂时饥饿),也会导致大肠杆菌的持续存在增加。
这种碳源转变伴随着严格反应关键介体四磷酸或五磷酸鸟苷 [ (p)ppGpp ] 水平的大幅增加,这可能是饮食模式改变或节食诱发的。
重要的是,通过营养转换形成的持续细胞似乎维持高 ATP 水平,从而允许非生长相关过程的继续,例如维持膜电位。
除了营养变化之外,氧化、酸性和渗透应激也被认为是持久物形成的触发因素。例如,用过氧化氢处理大肠杆菌培养物或通过向培养基中添加水杨酸盐产生活性氧会导致持久性细菌的增加。
✦吲哚促进持久细胞的形成
同样在大肠杆菌中,吲哚(一种色氨酸生物合成中间体,其产量因氧化应激而增加)被证明可以促进持久细胞的形成。
此外,无法合成海藻糖的大肠杆菌突变体产生的氧化应激与吲哚分泌增加和持久物形成同时发生。
暴露于吲哚的细菌上调了它们的oxyR调节子和噬菌体休克pspBC途径,并且这些途径的缺失降低了吲哚促进持久细胞形成的能力。
沙门氏菌也观察到对吲哚的类似反应,伴随着katG 过氧化氢酶表达的增加,有趣的是,沙门氏菌不产生吲哚。然而,这可能有利于肠道中的沙门氏菌,肠道中的沙门氏菌在感知来自其他微生物群的吲哚时升高的氧化防御反应可能会保护其免受伴随局部炎症的氧化应激。
✦pH值变化和高渗透压也促进持久性形成
pH值变化和高渗透压是促进持久物形成的其他压力。此外,抗生素本身也可能引发持久性细菌的形成,例如在大肠杆菌或金黄色葡萄球菌中,其中用亚抑制浓度的各种抗生素进行预处理显著增加了残留物水平。
✦氧化应激和抗生素诱导细菌群体的持续存在
重要的是,暴露于逐渐增加的抗生素浓度的肺炎克雷伯菌(Klebsiella Pneumoniae)临床菌株显示出持续增加的水平,以及随后出现的耐药变异体。
这一观察结果可能特别相关,因为在临床中抗生素输送和药代动力学通常会导致血液中抗生素浓度逐渐增加。这可能会增加持久菌群的规模,从而增加产生耐药性的细菌库。
同样,氧化应激和抗生素诱导的DNA损伤的结合已被证明可以诱导细菌群体的持久存在。总体而言,许多非生物胁迫导致持久细胞形成增加,大量研究充分支持了这一点,表明主要的细菌胁迫反应是这种表型的强有力的协调者。
当暴露于细菌分泌到周围环境中的细胞外代谢物时,也可以刺激持久细胞的形成。
✦细胞外代谢物也刺激持久细胞的形成
除了上面引用的吲哚的例子之外,能力刺激肽CSP(一种群体感应分子)被证明可以促进变形链球菌(Streptococcus mutans)持久细胞的形成。
这种群体感应分子似乎是一种中间体,向其他群体发出压力信号,以便其做出适当的压力反应,包括持久性形成。同样,一些假单胞菌群体感应分子不仅可以增加假单胞菌的存留细胞分数,还可以增加通常从囊性纤维化患者中分离出来的不动杆菌和伯克霍尔德氏菌的存留细胞分数。
因此,似乎不仅种内信号传导而且种间信号传导也可能促进持久物的形成。
在感染过程中,细菌会经历上述压力的组合,其强度和时间各异,可能有利于持久细胞的形成。
这提出了一种可能性,即在受感染宿主中形成的细菌持续存在可能独特地适应了它们最初形成的触发因素,并且与从生长的细菌中分离出的细菌不同,后者通常使用单一应激因子来诱导细菌持久化状态。
✦宿主巨噬细胞诱导持久化
就沙门氏菌而言,它在宿主免疫骨髓细胞中存活,其持续水平在被小鼠巨噬细胞内化后急剧增加。
结核分枝杆菌持续细胞的形成也是由与宿主巨噬细胞的相互作用触发的。
▼
鉴于刺激存留细胞形成的不同应激,看到相应的应激反应途径也在存留细胞形成中发挥作用也就不足为奇了,这可能会在细菌暴露于应激和最终导致长期生长停滞的分子效应物之间架起桥梁。
▸ 严格响应
由于饥饿是持久细胞形成的重要触发因素,因此对于严格反应和持久细胞之间的联系已经进行了大量的工作。
严格反应的关键介质是警报素 (p)ppGpp,在营养饥饿时被激活。(p)ppGpp 水平升高,与DksA协同作用,导致转录和翻译重排,使细菌能够适应稀缺资源。
当暴露于低pH值或氧化条件时,DksA会发生影响其调节功能的构象变化,因此,严格的反应不仅与饥饿有关,而且与氧化和pH应激因素有关。
影响 (p)ppGpp 合成或 DksA 的突变会显著降低革兰氏阴性和革兰氏阳性细菌中的存留细胞分数。
▸ SOS反应
SOS反应是一种DNA修复机制,在暴露于各种环境应激因素(氧化应激和抗生素暴露)时被激活,这些都是持久性的一般触发因素。
这些压力会造成损伤,产生单链DNA,而单链DNA 又会被RecA蛋白识别。RecA 随后激活LexA阻遏物的蛋白水解活性,最终导致细胞内的全局转录重排。去除这些主调节因子中的任何一个都会导致持续细胞的大量损失。
▸ ATP水平下降
在大肠杆菌和金黄色葡萄球菌中,持久性与细胞内ATP下降有关。
在这两种生物体中,处于指数期但表现出稳定期标记表达的细胞富含持久细胞。此外,用砷酸盐(一种已知能降低ATP浓度的化合物)处理呈指数增长的细菌,会导致持续细胞的大幅增加。
因此,ATP水平的降低可能是大多数细菌过程(例如翻译)关闭的普遍模式,从而导致抗生素在休眠期间持续存在。
一般来说,暴露于抗生素通常会导致微生物群落结构、物种组成和代谢能力发生重要变化。
▼
阿奇霉素是世界卫生组织消除沙眼和雅司病战略的重要组成部分。
雅司病是由雅司螺旋体引起的慢性接触性传染病,病原为雅司螺旋体,亦称纤细螺旋体。
五项随机对照试验研究了阿奇霉素预防性使用对普通人群肠道微生物群的影响。肠道微生物组的特征主要在于α多样性,它量化了单个微生物群中不同细菌类群的数量及其丰度的均匀性。
•阿奇霉素治疗后微生物群α多样性下降
据报道,12个月后微生物群α多样性下降了16%–22%。24个月的长期随访发现,阿奇霉素治疗后,乌普萨拉弯曲菌(Campylobacter upsaliensis)和人弯曲杆菌(campylobacter hominis)丰度降低,并且主要与微生物存活、生长和炎症相关的细菌代谢途径的丰度降低,这可能部分解释了所报道的对儿童死亡率的降低。
乌普萨拉弯曲菌(Campylobacter upsaliensis)在高收入环境中,特别是在农村儿童中,它是一种公认的食源性肠道病原体;而人弯曲杆菌(campylobacter hominis)与肠道炎症和菌血症有关。
三个国家的四项随机对照试验报告了短期使用的影响。与安慰剂相比,阿奇霉素治疗使微生物群α多样性降低高达32%。据报道,Akkermansia muciniphila和Proteobacteria也有所减少。
注:后一组细菌包括常见的病原体,例如大肠杆菌和弯曲杆菌属。
Fishbein SRS,et al.Nat Rev Microbiol.2023
总之,这些研究表明阿奇霉素引起的α多样性明显减少,同时肠杆菌科病原体也减少。
▼
抗生素与代谢或饮食元素之间的协同作用可以进一步塑造微生物组动力学并改变对抗生素的易感性,从而导致疾病的临床相关差异。
•高脂饮食下进行抗生素治疗会引起病理性炎症
对高脂肪饮食的小鼠进行抗生素治疗会引起肠道黏膜的病理性炎症,并增加肠杆菌(Enterobacteriaceae)的水平。这些小鼠表现出炎症性肠病的免疫症状。
Fishbein SRS,et al.Nat Rev Microbiol.2023
•饮食和抗生素结合改变了微生物和宿主的代谢
从其他几项使用饮食和化学干预来模拟西式饮食影响的小鼠研究来看,很明显,饮食和抗生素的结合改变了微生物和宿主的代谢。
具体来说,在一个模型中,这种协同干预通过改变脂肪酸代谢释放了单糖和乙醇胺,最终增加了肠道沙门氏菌感染的易感性。
另外,饮食中多糖或微生物可及的碳水化合物水平的调节对抗生素治疗结果有很大影响。在没有纤维的情况下,使用传统微生物组或人源化微生物组的小鼠在环丙沙星治疗后α多样性恢复延迟。
•含纤维饮食促进了丁酸水平的恢复
在人类实验中,在联合抗生素治疗期间,以杂食和纯素饮食喂养的志愿者,相对于那些不含纤维的液体饮食的志愿者,表现出了更快的微生物群恢复(通过α和β多样性来衡量)。
具体来说,含纤维饮食促进了粪便丁酸水平的快速恢复和具有独特氨基酸代谢的厚壁菌门的恢复。
▼
抵抗组(resistome)是指存在于肠道微生物群中的抗生素抵抗基因的集合。抗生素对肠道抵抗组具有显著但高度可变的影响。
•抗生素通常会增强肠道抵抗组
通过抗生素暴露对肠道抵抗组的改变可能引起微生物组中耐药病原体的病理性繁殖。值得注意的是,抗生素治疗最常见的结果是肠道微生物组中抵抗组负荷急剧增加(通过相对丰度的变化来衡量)。
这些研究揭示了抗生素诱导的抵抗组变化的一些一般模式。尽管增加了总抗性组负担,但抗生素可同时导致特异性的大量丧失和抗性组多样性的减少,这可能是由于分类损失。
•水平基因转移促进抗性组富集
抗生素诱导的肠道抵抗组扩张也可能由ARG编码的MGEs驱动。
在短期内,抗生素治疗后抵抗组负担的增加主要是由染色体编码ARGs的富集(即耐药细菌谱系的扩大)驱动的。
然而,此后不久(约1个月),染色体ARGs的微生物丰度急剧下降。相反,mge编码的ARGs在治疗停止后持续更长的时间,这可能是由于mge的寄生性质。(尽管缺乏抗生素介导的生长优势或细菌宿主存在适应性缺陷,它们仍在细菌群体中持续存在)
抗生素可以增加肠道中mge编码的ARGs的丰度,并导致ARGs和MGEs在患者中更频繁和更广泛(涉及更多样化的分类群)的传播。
总体而言,在临床使用和环境抗生素暴露较高的人群中,ARGs水平转移率较高。
▼
在全球范围内,使用产时抗生素预防(IAP)是预防围产期感染和相关不良妊娠结局的最常见策略。
产时抗生素预防涉及使用广谱抗生素,这些抗生素可有效对抗最有可能引起高危母亲感染的微生物,主要是B族链球菌。
建议在剖腹产手术切开前进行抗生素预防;分娩期间,母亲B族链球菌培养呈阳性或有侵袭性GBS感染风险;或出生后立即进行,以减少与手动去除胎盘、过度宫内操作或生殖道撕裂相关的感染风险。
•经过产时抗生素预防的婴儿微生物多样性降低
七项观察性研究和一项随机对照研究调查了抗生素预防与肠道微生物群之间的关联。经过产时抗生素预防治疗的母亲所生的婴儿在6-7天时的微生物群α多样性有所降低。
暴露于产时抗生素预防还与微生物群组成的更大相似性(即β多样性减少)相关,这表明母体抗生素暴露的选择性压力对婴儿的早期婴儿微生物群组成具有一致的影响。
•产时抗生素预防组以肠杆菌为主,双歧杆菌较少
一项前瞻性队列研究发现,产时抗生素预防组10日龄时放线菌门(包括双歧杆菌)的相对丰度显著减少,厚壁菌门(包括一些值得注意的致病菌群,如葡萄球菌、李斯特菌和链球菌)显著增加。
双歧杆菌是母乳喂养的婴儿肠道微生物群的重要成员,可以通过与其他重要肠道细菌(如乳杆菌)的共生交叉喂养相互作用来驱动微生物群的持续发育。
总体而言,这些研究表明,婴儿微生物群的α多样性降低与母亲产生接触抗生素相关,包括肠杆菌科相对丰度较高和拟杆菌和双歧杆菌丰度较低。
以下讨论抗生素类别、细菌进化枝、起始微生物群组成和长期微生物群组成。
▼
√不同抗生素会影响对应的菌属丰度
最近对55项人类研究的回顾总结了微生物群组成的变化,这些变化与分为22个抗生素类别的68种不同抗生素显著相关。研究表明,每种抗生素对属于一组有限属的细菌影响最强烈。
此外,受影响的细菌属的数量在抗生素类别之间和内部都存在差异。
阿奇霉素与3个属(拟杆菌、双歧杆菌、梭菌)的丰度变化相关,而其他大环内酯类药物则与2-6个属的丰度变化相关(包括前三个属,以及粪杆菌属、普雷沃菌属、瘤胃球菌、链球菌、肠球菌、嗜血杆菌或假单胞菌)。
β-内酰胺类药物,例如氨苄西林和头孢菌素,分别与8和12个属的丰度变化相关,这些属与其他β-内酰胺类药物不同,涵盖系统发育上不同的门(放线菌门、厚壁菌门、变形菌门、疣微菌门)。
√抗生素的不同分类群具有特异性作用
培养实验证实了不同抗生素的这些分类群特异性作用。例如,甲硝唑强烈抑制拟杆菌属和双歧杆菌属的生长。在厌氧培养中,而氨苄青霉素显著减少拟杆菌属和产气荚膜梭菌的生长,但其对双歧杆菌属的影响取决于细菌的生长速度。
此外,氨基糖苷类和磺胺类药物对测试的细菌几乎没有影响。大环内酯类药物对所有测试的细菌种类均具有抑菌作用(但不会杀死),但对艰难梭菌没有影响。
注意:β-内酰胺的作用具有菌株特异性,并且因所使用的特定抗生素而异。
因此,抗生素对微生物群的影响取决于所使用的抗生素,以及细菌分支的反应以及反应方式。
然而,抑制对抗生素敏感的微生物可能会破坏定植抵抗力,并为机会致病菌打开生态位,增加宿主对抗生素后感染的易感性。另外,抗生素的使用也可以增加耐抗生素的共生细菌,这对宿主有潜在的好处。
影响这些效应的因素包括不同抗生素的药代动力学、不同细菌对每种抗生素的降解和耐药机制,这些降解和耐药机制对不主动执行这些功能的其他细菌的间接影响,以及特定耐药决定因素的局部或区域流行率。
▼
考虑到抗生素作用因抗生素类别和细菌进化枝而异,微生物群的初始组成也可能决定抗生素的短期和长期作用。
√微生物群的初始组成会影响抗生素的作用
对五个队列的数据分析确定,具有增强的降解复杂碳水化合物(特别是宿主粘蛋白)的功能能力的特定物种的丰度,准确地预测了微生物群从抗生素相关的α多样性减少中恢复。
这些细菌的基线丰度可以识别使用抗生素后α多样性减少的参与者,准确度为70%。
√粘蛋白降解能力促进细菌在肠道繁殖
研究人员提出粘蛋白降解能力可能为这些细菌在肠道中重新繁殖提供了优势。此外,这些复杂碳水化合物的降解可能会产生次生代谢物,这些代谢物反过来又可以被其他细菌用作营养源以支持其再生。
注:与恢复相关的细菌包括拟杆菌属的几种。
无菌小鼠的证据支持了这一在人类身上的发现。两组均被富含普雷沃氏菌和粪杆菌或富含拟杆菌和副拟杆菌的人类粪便微生物群定植,并且两组均接受为期7天的阿莫西林克拉维酸治疗。
18天后,拟杆菌组的α-多样性对抗生素暴露更具弹性。然而,拟杆菌属的粘蛋白消化降解可以促进肠道感染,这已在艰难梭菌、啮齿类梭菌和鼠伤寒沙门氏菌中得到证实。
▼
两项分析均使用了10个月期间纵向收集的成人数据,其中包括两个为期5天的环丙沙星疗程。
√不同菌群达到新的平衡所需时间不等
一项分析确定,对于不同的细菌亚群,微生物群达到新的稳定配置所需的时间从2到42天不等。
拟杆菌属中的一个细菌亚群在两周内以相同或更高的相对丰度建立了新的平衡。然而,其他细菌如毛螺菌科(Lachnospiraceae)和一部分细菌在治疗期间有所增加,并需要42天才能恢复到使用抗生素前的水平。
相比之下,瘤胃球菌科的一组细菌在一次治疗后减少到检测不到的水平,十个月后仍未恢复。该综述发现细菌进化枝的特异性决定了抗生素对微生物群的影响。
√更短的恢复时间可能由于暴露于环境来源的细菌
对相同数据的第二次分析表明,更短的恢复时间可能是由于更多地暴露于环境来源的细菌,这些细菌可以重新定殖受干扰的微生物组。
尽管这些研究涉及的个体很少,并且最多只能代表个体间的异质性,但他们探索了微生物群丰度数据的采样时间序列,并且他们的发现得到了实验工作的支持。
√更复杂的微生物群可以减轻抗生素暴露的影响
在一项这样的实验中,两组小鼠被分配到无特定病原体的条件或暴露于土壤的一般动物条件下,并且均接受为期两周的万古霉素和链霉素治疗。
暴露于土壤的小鼠在治疗后表现出更大的α多样性和稳定性,并且在停用抗生素后更快地恢复治疗前的α多样性。这些研究表明,更受控制的外源细菌,例如复杂的益生菌混合物,可以减轻抗生素暴露对微生物组的影响。
√抗生素暴露使婴儿α多样性降低
抗生素暴露的长期影响也在婴儿中进行了研究。α-多样性降低与出生后立即治疗有关,但在产后第一年恢复。α-多样性的减少是由于毛螺菌科和肠杆菌科被抑制所致。
尽管微生物群α多样性在一岁时基本上恢复,但由于新生儿接触抗生素而导致这些早期定植菌减少对宿主健康的影响需要仔细调查。
在另一项研究中,与在那段时间没有接触过抗生素的婴儿相比,从出生到三岁接受抗生素治疗的婴儿的物种α多样性较低,但α多样性的减少幅度不大,仅在第一年明显。然而,在细菌菌株水平上,暴露于抗生素的婴儿和未暴露于抗生素的婴儿之间的差异更大。
此外,还发现部分细菌菌株只在肠道定殖一次。这些菌株通过接触抗生素而被消除,但在未经治疗的婴儿中仍然存在。相比之下,其他菌株在随访期间多次在肠道重新定殖。这些菌株更有可能在暴露和未暴露的婴儿中持续存在,这为以下观点提供了进一步的支持:再定殖是使用抗生素后微生物群恢复的驱动力。
★ 评估菌群经过抗生素治疗恢复原有结构的能力
根据菌群的基本构成,尤其是底层代谢黏蛋白以及短链脂肪酸的菌构成情况,可以评估菌群在经过抗生素治疗后恢复原有菌群结构的能力。
该恢复能力越强菌群结构较难通过抗生素改变,越弱则易受抗生素影响,导致后续菌群构成发生较大变化。该指标可以为菌群的抗生素干预选择和菌群重建提供参考。
抗生素耐药是指病原体(细菌、病毒、真菌等)不能被抗生素及其他抗感染药物有效杀死的抵御能力。由于存在抗生素滥用的情况,导致环境中许多细菌尤其是病原菌产生对特定抗生素类型的耐药性。通过对大量抗生素耐药菌基因组和耐药基因的分析,结合肠道菌群测序数据,报告中评估了肠道菌群对主要抗生素类型可能存在的耐药风险。
注意:仅作为风险提示和参考,并不直接对应抗生素耐药,具体用药和耐药检测请谨遵医嘱和进行耐药检测。

<来自:谷禾健康肠道菌群检测数据库>
总而言之,这些分析表明,微生物群从抗生素暴露中恢复可能取决于所使用的抗生素、初始微生物群组成以及受药物影响的特定细菌分类群。
此外,纵向观察研究提供了额外的证据,表明肠道的重新定植可能在抗生素暴露后微生物组的恢复中发挥关键作用。然而,还需要更多的研究来检验这几项研究提出的具体假设。
值得注意的是,仅恢复可能无法保护宿主免受抗生素扰动对微生物组的潜在长期影响。
流行病学研究已确定抗生素使用与肥胖、哮喘,过敏特应性和结直肠癌以及其他健康疾病之间存在关联。抗生素对肠道微生物组的破坏已被认为是这些关联背后的重要机制。
▼
50%或更多中低收入国家的婴儿在3个月大时携带至少一种肠道病原体,并在24个月大时经历至少一次腹泻发作。
中度至重度腹泻的最常见原因是病毒(轮状病毒、沙波病毒、诺如病毒)或细菌(大肠杆菌致病型、志贺氏菌、弯曲杆菌属)感染。
特定病原体的流行情况因国家而异。死亡率和严重腹泻发作也因国家和病原体而异。
▷抗生素降低了腹泻和痢疾导致的死亡率
抗生素的广泛目标是减轻病原菌对宿主健康的负担和影响。使用阿奇霉素进行的随机对照试验结果表明,对弯曲杆菌属具有抑制作用。促炎微生物组代谢途径可能部分解释了在这些环境中观察到的腹泻和痢疾导致的儿童死亡率持续下降。
在另一项研究中,长双歧杆菌(Bifidobacterium longum)抑制了儿科病例中分离的轮状病毒,并缩短了病毒性胃肠炎的持续时间。
▷抗生素也会扰乱肠道微生物群促进肠道感染
抗生素扰乱肠道微生物组后可促进肠道感染,这一点已在艰难梭菌、啮齿类梭菌和鼠伤寒沙门氏菌中得到证实。
或者,用抗生素扰乱肠道微生物群已被证明可以延迟轮状病毒感染并预防小鼠的诺如病毒感染。
相比之下,在艾滋病毒感染儿童中长期使用复方新诺明,4年后仍可抑制炎性草绿色链球菌以及相关的全身性炎症,从而增加该人群的防御风险。
▼
抗生素的使用与肥胖风险增加有关。接触时间越早(6个月之前)和接触频率越高,这种关联就越大。较低的肠道微生物群α多样性也与肥胖有关。
▷抗生素促进营养不良儿童的体重增加
相比之下,抗生素可以促进营养不良儿童的体重增加,尽管其影响是异质的,并且可能是由抗生素类别以及不同人群中生长限制性合并症(例如艾滋病毒和严重急性营养不良)的不同患病率驱动的。
微生物组组成对体重增加的因果影响也已在无菌小鼠中得到证实。
如果不清楚微生物群组成变化与健康结果之间的因果机制,微生物群组成通常被定义为“生态失调”,这是基于与疾病相对于健康对照的关联。
在高收入成年人群中,α多样性下降是“生态失调”的一个共同特征,“生态失调”是根据与疾病的关联来定义的。在这种情况下,α多样性减少表明肥胖和相关代谢紊乱(例如I型和II型糖尿病)的风险增加。
▷抗生素导致α多样性下降增加肥胖风险
相比之下,在纯母乳喂养的婴儿中,肠道微生物组以双歧杆菌为主。由于母乳中存在高浓度的寡糖,导致与混合或配方奶喂养的婴儿相比,α多样性较低。
更大的α多样性与较早引入补充食品和青春期超重风险增加有关。因此,婴儿早期微生物群α多样性的增加可能表明由于婴儿早期营养不足而导致“生态失调”,抗生素相关的α多样性减少对健康的影响也可能是因情况而异的。
▷新生儿抗生素暴露于儿童生长有关
抗生素暴露的时间可能有助于进一步了解具体情况的影响。在芬兰的一个由12422名足月新生儿组成的队列中,新生儿抗生素暴露(主要是静脉注射苄青霉素和庆大霉素)与男孩生命前6年生长受损有关。
一项由1707名德国新生儿组成的独立队列证实了与男孩生长的相关性。相反,新生儿期后接受抗生素疗程的次数与男女6岁时体重指数的增加有关 。
最近的一项针对小鼠的研究表明,出生时注射的低剂量青霉素会导致肥胖增加,并加剧高脂肪饮食对体重增加的影响。生长表型是在无菌接种抗生素处理小鼠的粪便微生物群时诱导的,表明改变的微生物群起着因果作用。
然而,还需要更多的研究来表征和确认促进从抗生素暴露中恢复的微生物组的成分,以及健康新陈代谢可能需要的成分,并将这些转化为人类健康。
▼
较早和更频繁的抗生素处方也与儿童哮喘风险增加有关。较低的肠道微生物群α多样性与婴儿期和儿童期的湿疹和过敏有关。
▷婴儿抗生素使用与儿童哮喘风险存在联系
最近证明婴儿抗生素使用引起的微生物群改变与5岁时哮喘风险之间存在直接联系。在出生第一年接触抗生素的婴儿到5岁时患哮喘的可能性是正常婴儿的两倍。估计这种关联的25%可归因于抗生素引起的α多样性减少或抗生素相关的特定细菌丰度变化。
▷母亲使用抗生素会影响婴儿微生物的早期定植
尽管整个婴儿期的肠道微生物组存在巨大的变异性,但婴儿期微生物组的有意义的一部分是在出生后立即从母体肠道获得的,并保留长达3年。因此,母亲接触抗生素也可能会改变分娩过程中微生物物种向婴儿的传播,并影响早期定植。
影响新生儿微生物组组成的抗生素暴露可能会对儿童发育产生长期影响。几项使用动物模型的研究表明,新生儿期对于免疫系统的成熟至关重要,这一过程依赖于新生儿肠道微生物组的定植,并且会受到抗生素消融的干扰。
小结
抗生素在治疗细菌感染和减少疾病传播方面起着积极的作用。然而,滥用和不适当使用抗生素可能导致细菌耐药性的增加,并对肠道微生物群产生负面影响。
因此,我们应该合理使用抗生素,遵循医生的建议,并在使用抗生素期间维护肠道健康。谨慎使用抗生素有助于最大限度地减少负面影响,确保抗生素继续为我们的健康服务。
人们提出了一些有前景的方法来减轻抗生素使用对微生物组的影响。
▼
共同施用益生元以促进共生细菌的生长就是这样的策略之一。在婴儿中,母乳富含复杂的低聚糖,可作为双歧杆菌生长的底物,并促进其他物种的交叉喂养。
在一个观察队列中,母乳喂养与产时抗生素预防暴露婴儿微生物组α多样性的更快恢复有关。母乳喂养的好处也可能超出其益生元含量。
•儿童益生元和抗生素联合给药使有益菌丰度升高
在儿童中,乳果糖与阿奇霉素的联合给药有助于恢复乳果糖的相对丰度。治疗后18天内,乳杆菌属(Lactobacillus)、肠球菌(Enterococcus)、Anaerostipes、经黏液真杆菌属(Blautia)和罗氏菌属(Roseburia)出现增加,而单独使用阿奇霉素可导致治疗后60天内促炎性链球菌的丰度增加。
•成人联合使用益生菌和抗生素可减轻耐药性
在成人中联合使用益生菌和抗生素也显示出一定的潜力,可以减轻耐药性遗传决定因素的抗生素选择。
然而,口服益生菌在肠道的成功定植表现出因人、肠道区域和益生菌菌株而异的相当大的变异性,这可以通过宿主和本土微生物组特征来解释。
此外,益生菌菌株中缺乏对所施用抗生素的耐药性可能会加剧微生物组中抗生素耐药性的选择,进一步限制了益生菌的潜在保护作用。
注:使用抗生素给药前收集的自备健康粪便样本进行粪便微生物群移植可能是恢复微生物组的更有效方法,尽管这对于中低收入国家来说可能不太实用。
▼
另一种策略涉及使用抗生素药物组合来实现比单一抗生素治疗更有针对性的物种特异性效果。
例如,一项调查筛选了超过1000种药物,以确定可降低抗生素广谱活性而不损害其对抗相关病原体活性的候选药物。
•红霉素对肠道共生细菌具有强抑制作用
抗凝药物双香豆素和两种非甾体类抗炎药物托芬那酸和二氟尼柳成为红霉素对肠道共生细菌(例如普通拟杆菌和均匀拟杆菌)作用的强抑制剂。
然而,红霉素对致病菌(例如金黄色葡萄球菌、肺炎链球菌和屎肠球菌)没有显著影响。
•药物组合具有物种特异性效应
另一项研究分析了近3000种抗生素、药物和食品添加剂的组合,以确定可以减轻对微生物群的附带影响而不减少对病原体影响的候选化合物。超过70%的药物组合具有狭窄的物种特异性效应,20%显示出菌株特异性效应。
▼
另一种方法是确定窄谱抗生素替代品,尽可能选择狭谱抗生素,这些抗生素只对特定类型的细菌有效,而不是广谱抗生素,后者会杀死更多的细菌,包括有益菌。
微生物组本身可能是此类窄谱化合物的来源。例如,对人类微生物组计划中的752个细菌基因组的研究发现了共生细菌携带的一组编码硫肽的基因。
•对病原菌有很强的抑制作用,对共生菌没有抑制
乳青霉素是一种由加氏乳杆菌编码的硫肽,对金黄色葡萄球菌和阴道加德纳菌等常见病原体具有很强的抑制活性,但对共生菌没有抑制作用。
苏云金素是另一种已被鉴定的抗菌素,由苏云金芽孢杆菌(Bacillus thuringiensis)产生。它已被证明可以有效对抗艰难梭菌,而不影响人类结肠的粪便培养系统中的微生物群组成。
开发此类干预措施需要更深入地了解与抗生素结合产生健康益处或不良副作用的机制,以便窄谱替代品能够实现预期结果,同时最大限度地减少不必要的风险。
最后,环境中可能还存在重要的微生物成分,有助于防止生态失调或在关键发育时期恢复肠道微生物组的生理重要子集。识别这些成分可以指导缓解干预措施的开发和测试。
有令人信服的证据表明,即使不存在抗生素耐药性,感染也很难治疗。几项依赖于对患者分离株进行深度基因组测序的纵向研究表明,这些持续性感染的复发与宿主体内细菌库的维持有关,这些细菌在免疫防御和抗生素的联合作用下幸存下来。
用于追踪动物和细胞感染模型中细菌的细菌生长停滞报告者已经证明,尽管接受抗生素治疗,但在持续感染部位仍存在不增殖或缓慢增殖的细菌。过去几年,追踪和分析稀有非生长细菌的尖端技术的发展极大地促进了抗生素持久性的研究。在这方面,这个领域正在不断发展。
总结如下:
1.与普通菌株相比,生长缓慢的细菌表现出相对的药物冷漠,这增加了种群在抗生素暴露下存活的时间。
2.药物暴露后的这种异质群体行为是由于细菌亚群(持续存在)通过生长停滞、暴露于对其余群体致命的浓度的抗生素而得以生存的能力。
3.许多病原菌在宿主组织内建立持续感染,避免被免疫系统和抗生素清除。细菌感染通常会导致宿主产生先天免疫反应,然后产生适应性免疫反应,这通常足以清除感染。然而,许多病原体已经进化出复杂的生存机制来逃避免疫反应并建立持续感染。
4.有多种原因会导致感染反复发作,例如宿主易感性增加、其他慢性合并感染以及环境和生活方式因素。长期以来,无法确定感染复发是再次感染还是复发。
5.持久性的形成是一种普遍的细菌应激反应。多种环境因素充当压力信号,促进持久者的产生。许多触发因素似乎都会刺激持久细胞的形成,从饥饿或氧化应激等营养应激到细胞外代谢信号。
6.婴儿微生物群的α多样性降低与母亲接触抗生素相关,包括肠杆菌科相对丰度较高和拟杆菌和双歧杆菌丰度较低。
7.不同的抗生素对不同细菌菌属影响不同,肠道内菌群结构的恢复与抗生素的使用和患者基线菌群有关。
8.超重,肥胖,哮喘,过敏等人群与早期和长时间抗生素的使用引起的菌群失调以及部分关键菌属的消失或下降有关。
9.未来可以发展更综合的预防措施,例如,乳青霉素是一种由加氏乳杆菌编码的硫肽,对金黄色葡萄球菌和阴道加德纳菌等常见病原体具有很强的抑制活性,但对共生菌没有抑制作用。
相关阅读:
主要参考文献
Gollan B, Grabe G, Michaux C, Helaine S. Bacterial Persisters and Infection: Past, Present, and Progressing. Annu Rev Microbiol. 2019 Sep 8;73:359-385.
Gough EK. The impact of mass drug administration of antibiotics on the gut microbiota of target populations. Infect Dis Poverty. 2022 Jun 30;11(1):76.
Shah T, Baloch Z, Shah Z, Cui X, Xia X. The Intestinal Microbiota: Impacts of Antibiotics Therapy, Colonization Resistance, and Diseases. Int J Mol Sci. 2021 Jun 20;22(12):6597.
Vuong HE, Pronovost GN, Williams DW, Coley EJL, Siegler EL, Qiu A, Kazantsev M, Wilson CJ, Rendon T, Hsiao EY. The maternal microbiome modulates fetal neurodevelopment in mice. Nature. 2020 Oct;586(7828):281-286.
Fishbein SRS, Mahmud B, Dantas G. Antibiotic perturbations to the gut microbiome. Nat Rev Microbiol. 2023 Jul 25.
Koh E, Hwang IY, Lee HL, De Sotto R, Lee JWJ, Lee YS, March JC, Chang MW. Engineering probiotics to inhibit Clostridioides difficile infection by dynamic regulation of intestinal metabolism. Nat Commun. 2022 Jul 4;13(1):3834.
Gomaa EZ. Human gut microbiota/microbiome in health and diseases: a review. Antonie Van Leeuwenhoek. 2020 Dec;113(12):2019-2040.
谷禾健康

肠道微生物群与人类宿主共同进化,对于我们的消化、代谢、神经、免疫等系统具有重要贡献,影响着人类身体和心理健康。
肠道微生物群从出生时就开始形成。生命早期的多种因素,如分娩方式、婴儿喂养方式以及母体微生物群等,都会影响肠道微生物群的初期定植。早期微生物群的组成和功能可能对宿主长期健康产生影响。
人类肠道微生物群的变化与人类生存策略的演变密切相关,随着人类从狩猎采集社群向农耕与城市生活方式的转变,肠道微生物群的多样性经历了一系列的变化。而种族、地理、文化和行为特征等宿主因素,也会对全球范围内人类肠道微生物群的多样性和组成产生影响。
近日,来自《Trends in Molecular Medicine》杂志发表的文章,从生态学的角度探讨影响不同人类种群肠道微生物群的基本驱动因素,并考察生活方式、社会经济地位和人类迁移等因素,如何通过影响肠道微生物群而对不同人群的健康产生差异。

人类肠道中有高度多样的微生物群落,最显著的变化与工业化水平有关。
城市化、西方化的生活方式与细菌多样性减少、本地菌群(如普雷沃氏菌)和纤维降解功能丧失有关。这些差异可能导致非传染性免疫、代谢和神经系统疾病的发病率增加。
在所研究的许多生活方式和遗传因素(地理位置、遗传相关性、饮食、种族、内在环境、家庭组成等)中,饮食和生活方式实践对肠道微生物群落的形成最具影响力。
人类迁移可以揭示肠道微生物群在不同生活方式下对健康的影响。
这些信息的重要性在于,健康的或不健康的肠道微生物群不能简单适用于所有人,而应当根据特定的微生物组特征来设计适应各种人类群体的菌群失调策略。进一步了解和应对微生物组变化的探索,将成为未来疾病预防和治疗的重要方向。
通过研究微生物群落的组成,我们可以更好地了解微生物组的形成过程。这里面我们来了解几个概念:
微生物传播、环境选择、生态漂移
微生物物种在不同地点之间的传播能力,解释了微生物在人类和身体部位之间的垂直和水平传播。
另一种机制被称为环境选择,解释了微生物群落之间的适应度差异或基于生态位的相互作用,这有利于某些物种在特定环境中生存。例如,双歧杆菌属(Bifidobacterium)具有代谢母乳的能力,因此在婴儿的肠道中非常常见。
生态漂移是指人类微生物组中微生物物种丰度的随机变化。生态漂移可以减少群落内殖民化和竞争互动的作用,增加群落之间的差异。
注:扩散和环境选择在生态选择和形成微生物相互作用中发挥着更强的作用,克服了人类肠道微生物组中生态漂移的影响。
微生物之间的相互作用影响肠道微生物组的组成
有些微生物物种依赖于与其他物种的共生或互利关系。例如:
这表明在肠道微生物组中存在着合作和竞争的相互作用。
在炎症性肠病和肥胖等疾病中,已经确定了一些关键细菌物种的共存或其作用途径,这表明它们在调节疾病相关的微生物组中发挥着重要作用。
真菌在微生物组成和共生中起着重要作用
例如,肠道-真菌-细菌的相互作用有助于在生命早期形成微生物组组成,细菌和真菌α多样性之间的负相关性表明,抑制机制限制了许多真菌物种在人类肠道中的生长。
肠道中的原生动物捕食细菌
肠道中的原生动物与细菌多样性和群落组成变化有关,这表明原生动物可能通过捕食细菌产生自上而下的影响,从而增加细菌多样性。
来自不同国家的肠道微生物群研究也表明,人芽囊原虫(Blastcystis)是一种在人体肠道中常见的原生动物,与史密斯甲烷杆菌(Methanobrevibacter smithii)以及肠道优势细菌普雷沃菌(Prevotella copri)和瘤胃球菌(Ruminococcus gnavus)的丰度有关。史密斯甲烷杆菌的丰度与产短链脂肪酸菌(如Collinsella aeroffaciens、P.copri、Roseburia fadis)呈正相关。
扩展阅读:
这些研究结果强调了理解控制肠道微生物组成的生态过程和相互作用的重要性,因为我们的饮食习惯、生活方式、社会地理和其他环境因素会影响人体肠道微生物组。
人类肠道微生物组已经通过遗传相关性和同居关系的梯度进行了研究,揭示了宿主遗传和肠道微生物组成之间有趣的联系。
宿主遗传学影响特定肠道微生物类群的丰度
家庭成员拥有相似的肠道微生物组,特别是,基因相同的双胞胎表现出最高水平的相似性。为了研究宿主遗传学对肠道微生物群落的影响,研究人员分析了来自以下群体的单卵和双卵双胞胎的几个粪便样本数据集:
i)TwinsUK群体,由977个个体组成的数据集,包括1081个单卵和二卵双胞胎、具有未知结合度的双胞胎和无关个体的粪便样本
ii)Yatsunenko数据集,包括来自委内瑞拉亚马逊地区的531名美洲印第安人、马拉维农村社区居民和美国大都市地区居民的粪便样本
iii)密苏里双胞胎数据集,包括54对双胞胎
这些研究表明:宿主遗传学影响特定肠道微生物类群的丰度。
宿主遗传学的影响因类群和种群而异,例如,Christensenellaceae是TwinsUK和Yatsunenko种群中最具遗传性的细菌科,瘤胃球菌科和毛螺菌科是TwinsUK和密苏里种群中最具有遗传性的操作分类学单元。
宿主环境超过了宿主基因对肠道微生物组成的影响
相比之下,这项研究以及芬兰的一项单卵双胞胎研究都表明,拟杆菌属是一个包括主要肠道微生物物种的分类单元,是不可遗传的,其存在主要由饮食来解释。因此,虽然某些分类群受到宿主遗传学的影响,但同卵双胞胎的高度同质环境可能比遗传学更能推动其肠道微生物组成之间的相似性。这得到了几项研究的支持,这些研究表明,与非共享家庭双胞胎相比,共享家庭和饮食的非遗传相关个体之间的微生物组具有显著的相似性,这表明宿主环境超过了宿主基因对肠道微生物组成的影响。
尽管如此,人类的遗传多样性导致了与常驻微生物物种直接相关的人类种群之间的生理差异。
基因 & 肠道菌群 & 症状或饮食方式
全基因组关联研究报告了:某些宿主数量性状基因座与一些可遗传细菌类群的相对丰度和功能之间的显著联系。LCT基因座与双歧杆菌属之间的相关性在这些研究中最强,其随乳制品摄入量的变化而变化。
其他发现包括:
i)与缺血性中风相关的人类甲酸盐氧化基因乙醛脱氢酶1家族成员A1(ALDH1L1)与细菌SHA-98之间的相关性;
ii)PLD1基因和Akkermansia,其与降低肥胖风险有关;
iii)ABO血型基因和乳杆菌。
基因拷贝数的变化也与人类微生物组成有关。已知在富含淀粉的饮食人群中,负责消化过程中可消化淀粉水解的淀粉酶基因AMY1的拷贝数更高。AMY1拷贝数还与普雷沃氏菌、卟啉单胞菌、瘤胃球菌科分类群的增加有关,所有这些都可以降解耐膳食淀粉,AMY1的低拷贝数可能导致未消化的淀粉到达大肠,增加下肠道的简单淀粉发酵,并调节肠道微生物群落。
分析和制定标准化方法的重要性,尤其是在处理地理或种族分布的乳糖不耐受等特征时。值得注意的是,组成肠道微生物组的大多数微生物物种似乎不受宿主基因的影响,这表明它们大多是环境获得的。
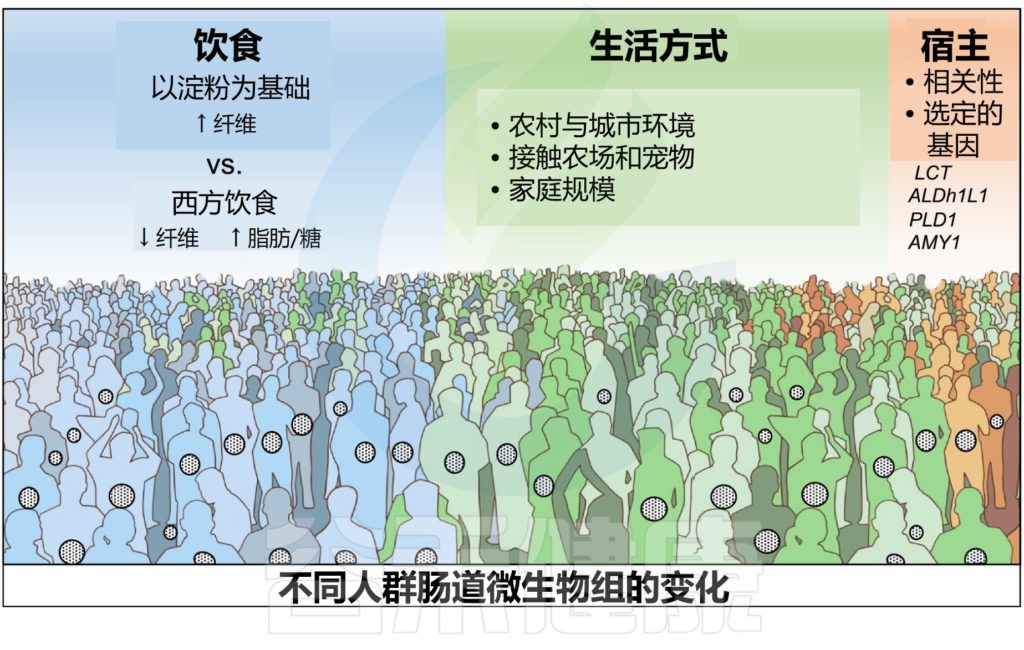
doi.org/10.1016/j.molmed.2023.07.002
人类历史上的生活方式转变伴随着饮食、社会人口特征以及其他环境和文化因素的变化,这些因素反映在人类群体中肠道微生物多样性和组成的显著变化中。
城市环境的饮食、生活方式
如今,世界上一半以上的人口生活在城市环境中,据估计,到2050年,这一比例将增至约70%。向城市生活方式的转变带来了膳食蛋白质和脂肪摄入的增加,以及卫生条件的变化和药物负担的增加。相比之下,目前的现代狩猎采集人群以淀粉为基础,纤维摄入量要高得多,并且经常被真正的胃肠道病原体或寄生虫定植。
人类肠道微生物群随着对这些饮食变化的反应和对宿主代谢需求的适应而发生了变化。
▼
狩猎采集者的肠道菌群
例如,一组与西方生活方式接触有限的南美洲亚诺马米狩猎采集者的肠道微生物组在其他研究人群中显示出组成和功能多样性较高。
哈扎狩猎采集者的微生物多样性也高于西方城市人口。它们独特的肠道微生物组成,包括参与支链氨基酸和广谱碳水化合物代谢的基因,表明它们适应了饮食习惯和传统的觅食生活方式。狩猎采集群体表现出更高丰度的梭状芽孢杆菌、变形杆菌、螺旋体和其他与纤维降解有关的分类群,如丁酸弧菌、乳杆菌、普雷沃氏菌、瘤胃杆菌、琥珀酸弧菌和密螺旋体,以及氨基酸、毒力和维生素代谢功能。
扩展阅读:
工业化城市人群的肠道菌群
工业化城市人群的特点是以拟杆菌属、双歧杆菌属、厚壁菌门成员和将纤维发酵成短链脂肪酸的细菌为主,包括Blautia和Faecalibacterium。工业化还与更高的水平基因转移率和抗生素抗性基因的增加以及碳水化合物和外源代谢的预测代谢途径有关,这表明城市化导致了许多微生物功能和性状的消失和替代。
偏远、非工业化地区介于狩猎采集和西方生活方式之间
从生态学的角度来看,狩猎采集者的生活习惯以及这些种群与环境的接触有利于更高的微生物传播率,这是一种受西方生活方式限制的机制。微生物之间对生态位空间的竞争性相互作用也通过选择使宿主能够降解新底物的特殊类群来塑造肠道微生物多样性。其他在偏远、非工业化地区从事自给农业的非游牧传统社会,如非洲的农业学家班图人,表现出与坦桑尼亚的哈扎人相似的饮食习惯,在狩猎采集和西方生活方式之间,微生物α多样性和丰富性处于中间状态。
▼
社会经济地位显著影响健康差异,包括肠道菌群
除了与偏远或农村地区传统生活方式的差距拉开之外,人口的社会经济地位(SES)也会显著影响健康差异和不平等,推动各种因素当然也会影响微生物组的组成。其中包括食物供应和营养状况、体育活动、饮用水、空气污染、卫生和药物、寄生虫、分娩和婴儿喂养法。
影响婴儿肠道微生物组的因素
通过影响拓荒者和早期殖民者,对该生态系统产生了重要的生态影响。与母乳喂养的婴儿相比,配方奶粉喂养加速了婴儿肠道微生物组的成熟,剖腹产分娩和围产期抗生素暴露是关键因素,它们会在出生时中断初级微生物的继承和定植。
由于社会经济和文化因素,全球剖腹产出生率估计将从2018年的21.1%增加到2030年的28.5%,其中近80%的病例发生在中低收入国家。
围产期和婴儿微生物组的改变导致双歧杆菌减少、病原体增加和微生物组成熟加速,这可能导致肠道微生物失衡(微生态失调),从而导致随后的疾病,如哮喘、过敏和1型糖尿病。
扩展阅读:
社会经济地位通过饮食影响菌群
社会经济地位的影响不能与饮食实践的影响脱节,因为不良的社会经济条件与低多样性饮食有关,这可能导致肠道微生物多样性低。社会经济地位、妇女教育和产假时间也与母乳喂养的开始率和持续时间有关。有趣的是,较低社会经济地位对微生物多样性的影响在普雷沃氏菌丰度较高的个体中更为明显。普雷沃氏菌是一种工业化程度较低的细菌群。
这些发现将饮食视为人类社会中人类肠道微生物组差异的决定性媒介,与社会经济地位等社会人口学特征和健康差异密切相关。
扩展阅读:
▼
肠道真菌群的差异也与生活方式、社会人口和环境因素有关
这些差异从早期就可以识别,例如真菌属曲霉属和毕赤酵母属与念珠菌属和马拉色菌属在非工业化和工业化城市人群中的优势。先前的研究也表明,原生芽囊虫在非工业化城市人群的微生物群中更为丰富。
此外,城市生活方式与个体间和个体内古菌多样性以及古菌与细菌比率的降低有关。农村的饮食习惯与史密斯分枝杆菌数量的增加有关,史密斯分枝杆菌是一种在农村人群中更常见的古菌。
肠道病毒群之间的个体差异增加
某些肠道病毒物种与地理位置、生活方式、种族特定饮食和其他环境因素、一些药物以及传染病和慢性病有关。研究表明,随着城市化的发展,肠道病毒群之间的个体差异增加,长期城市生活与几种噬菌体(如乳酸杆菌和乳球菌噬菌体)以及一些细菌病原体相关噬菌体(包括沙门氏菌和志贺氏菌噬菌体)之间存在明显关联。
在其中一项研究中,从中国两个地区(香港和云南)的城市和农村地区收集了来自六个不同种族(白人、傣族、汉族、哈尼族、苗族和藏族)的930名健康成年人的粪便DNA病毒群。他们的研究结果表明,肠道病毒组α的多样性在不同种族之间存在显著差异。与云南居民相比,香港居民的肠道病毒组含有更多的微小病毒科噬菌体,而较少的Myoviridae、Podoviridae和Siphoviridae噬菌体。在所有城市居民中富集的病毒在汉族、苗族和藏族城市居民中也比农村居民更丰富,而在傣族和哈尼族城市居民中比农村居民不那么丰富。
对非细菌微生物在人类肠道微生物组生态学中的作用的探索才刚刚开始,但新出现的证据表明,它可以极大地塑造细菌群落。因此,非细菌微生物很可能有助于解释人类种群之间的组成和功能微生物组差异。最近的报告也将真菌在疾病发病机制中与已知的微生物组贡献联系起来,包括癌症和IBD,这表明人类社会中非细菌微生物的差异应纳入微生物组和宿主疾病范式。
人种是指定义人类群体的社会学和文化因素。微生物组成变化的种族相关模式可以用许多与宿主祖先、种族、生活方式、饮食习惯、医疗保健以及社会文化和社会经济因素相关的协变量来解释,这些协变量很难相互脱节。
种族与微生物组成的相关性
人类对几个分类群的丰度和存在与否进行了显著的选择。一项针对新加坡106名婴儿在出生前两年的多民族人群的纵向队列研究报告称,从三个月大开始,在给婴儿介绍固体食物之前,种族对个体间微生物组差异的显著影响。
在本研究的三个种族(中国人、印度人和马来人)中,印度婴儿的双歧杆菌属和乳酸杆菌属丰度较高。相比之下,中国婴儿的阿克曼菌属和拟杆菌属的丰度更高。这些发现受到母亲饮食摄入缺乏和母乳成分信息的限制,这些信息可以解释研究人群之间的种族差异。
扩展阅读:
另一项比较阿姆斯特丹六个不同种族2084人微生物组成的研究表明,某些肠道微生物类群在不同种族之间存在差异。例如,拟杆菌在苏里南更为丰富,在荷兰的梭状芽孢杆菌和在加纳人、摩洛哥人和土耳其人的普雷沃特拉属更为丰富。荷兰和南亚苏里南的参与者分别表现出最高和最低的微生物α多样性。
移民对肠道微生物组的影响与种族相关的饮食和生活方式等多因素都有关
研究的一个重要因素是移民的影响。在这项研究中,94%的非荷兰人在成年后移民到荷兰。迁移时的年龄和停留时间与它们的肠道微生物群没有显著相关性。相反,种族与所有这些因素相结合,对肠道微生物多样性和组成的影响比单独或结合但不包括种族的这些因素更强。尽管长期生活在同一环境中,但与种族相关的协变量反映了这些参与者肠道微生物组的组成,这表明移民后保持与种族有关的饮食和生活方式因素,有助于保持与荷兰居民群体的肠道微生物组差异。
种族与相似起源的人群的基因模式之间的联系
有趣的是,一些与种族密切相关的分类群也属于可遗传和/或遗传相关的微生物分类群,如Christensenellaceae、Odoribacteriaceae、Rikenellaceae,强调了种族与具有相同或类似地理和祖先起源的人群的基因模式之间的联系。微生物类群共现的模式也与人类宿主种族有关。TwinsUK群体显示,Christensenellaceae与其他可遗传细菌(Dehalobacteriaceae,RF39和SHA-98)和古菌(甲烷杆菌科)共存。
共现模式也与宿主功能调节相关
另一项针对美国1673人的多民族群体的研究也显示,Christensenellaceae12个属在不同种族(非裔美国人、亚洲或太平洋岛民、高加索人和西班牙裔)中的共现模式与人类ALDH1L1基因的遗传变异有关。Christensenellaceae相关微生物中心的共有性和可遗传性,以及它们与ALDH1L1基因(叶酸代谢和细胞增殖)表达调节的重要宿主功能的关联,可能构成了宏生物(metaorganism)水平上的共同进化策略。然而,也有可能某些分类群与宿主遗传学有关,只是因为它们与其他可遗传分类群共存,如Christensenellaceae。目前,这些有趣的发现仍然只是联系在一起,需要检验因果关系。
种族是人类社会健康差异的一个重要决定因素,可能会导致种族对肠道菌群多样性和组成的影响
例如,在一项针对80名生活在英国的黑人和白人女性的研究中,双歧杆菌在白人女性中更为丰富,这一发现与压力增加有关。相比之下,尽管饮食习惯没有显著差异,但黑人女性的微生物β多样性和拟杆菌属丰度更高。
微生物组与种族相关的结直肠癌风险
这些模式可能具有临床相关性,因为此前已经发现低丰度的双歧杆菌属以及高丰度的拟杆菌属和瘤胃球菌属与结直肠癌(CRC)有关。
在一项将该人群与美国非裔美国人进行比较的研究中,在非洲农村地区也发现了较低丰度的拟杆菌属。然而,在引入西方饮食后,该人群的结直肠癌风险才有所增加。即使将压力作为一个风险因素加以控制,非洲裔美国女性的低拟杆菌属与结直肠癌之间的关联仍然显著,这表明微生物组在种族相关因素与结直肠癌风险之间的既定联系中发挥了作用。
在非裔美国人人群中,微生物组是否可能起到中介、调节或仅仅与结直肠癌风险增加相关的作用,在人类研究中仍未得到解决。然而,脆弱拟杆菌在结肠炎相关结直肠癌小鼠模型中具有抑制肿瘤形成的作用,这表明该分类单元可能按种族依赖的方式对结直肠癌风险有因果性贡献。
扩展阅读:
从出生到成年,地理位置一直被认为是与微生物组成变化有关的因素。然而,很难将其影响与宿主的特定特征和当地环境因素脱钩。
▼
地理位置与生活方式、饮食等变量相关
一项研究比较了20个不同变量(包括人口统计、生活方式和饮食)对中国63个城市8个民族2678人肠道微生物组成的影响。这一比较表明,生活在同一地理位置的汉族和其他不同少数民族(白族、回族、苗族、蒙古族、纳西族、藏族和维吾尔族)具有相似的肠道微生物组成,这与其他城市的群体不同。虽然地理位置是个体间微生物组成变化的最强驱动因素,但作者将这一发现与生活方式和饮食等其他变量联系起来。
环境可以影响与遗传和种族有关的人类微生物群落的形成
在更精细的范围内,一项针对居住在同一省份14个区的7000多名来自同一种族(中国少数民族,包括99%的汉族)的中国人的肠道微生物组研究也显示,在共享相同地理位置的个体中,微生物组相似,这表明环境也可以塑造共享遗传和种族相关因素的人类微生物群落。需要在这些因素不同的地方进行额外的微生物组研究,以进一步了解地理位置本身的影响。
▼
地理位置对肠道微生物组组成的作用也可以从人类迁移的角度进行研究
人们永久或半永久地迁移到一个新的地方,可能会在一代或几代人的时间内对人类的生物学和健康产生深远影响。
根据《世界移民报告》,自1970年以来,移民人数增加了三倍多。2020年,全球约有2.81亿国际移民,这意味着每30人中就有一人生活在出生国以外的国家。近几十年来,由于冲突、战争和侵犯人权而被迫流离失所的人数也有所增加。截至2022年5月,联合国难民事务高级专员报告称,全球有1亿被迫旅行者和难民。
旅行和移民会改变食物供应、饮食习惯、生活方式、抗生素和抗寄生虫药物的使用、饮用水、文化和社会经济条件、心理创伤和压力、获得医疗服务的机会、气候、空气污染、环境过敏原等。
移民对藏族肠道菌群影响:微生物群的恢复力
一项研究评估了移民对30名移民咸阳的藏族妇女的影响。西藏人的微生物群与汉族人不同,这可能是由于两个群体在环境、文化、饮食和基因构成方面存在巨大差异。这项研究调查了从迁移到10个月后的微生物组,发现尽管他们的饮食发生了变化,但迁移对肠道微生物多样性、组成和基因途径没有显著影响,这表明微生物组对这些变化有较高的恢复能力。
爱尔兰旅行者饮食接近西方化,肠道菌群仍然保持着类似非工业化群体的特征
第二项研究评估了爱尔兰旅行者的微生物组,爱尔兰流浪者是爱尔兰本土的少数民族。虽然与其他欧洲游牧民族相比,他们在基因上更像爱尔兰人,但他们作为一个独特的民族生活,拥有自己的游牧文化和语言。然而,爱尔兰政府的持续压力导致2022年立法限制他们获得土地临时生活,并强制停止他们的游牧生活。
这项研究比较了118名爱尔兰旅行者的肠道微生物组,他们在游牧生活中长大,但现在永久居住在科克附近,而非爱尔兰旅行者则生活在同一地理位置。两组之间存在重要的微生物组差异,爱尔兰游民的微生物组类似于非工业化的微生物组,但主要是那些留在原地的游民(与居住在社会住房中的游民相比),有更多的兄弟姐妹,并且与动物生活在一起。
虽然是横断面的,但这项研究揭示了从小生活方式的改变,特别是与家庭条件有关的生活方式的变化,对肠道微生物组的影响。重要的是,爱尔兰旅行者的饮食转变为类似西方的饮食,但他们的微生物组仍然更接近非工业化成分。
来自爱尔兰旅行者和西藏妇女的研究表明,工业化程度较低的微生物组的保留与人口采用新生活方式的程度呈负相关,这种影响可能比饮食的变化更强烈。从生态学的角度来看,大家庭和靠近动物有助于微生物的水平扩散和增加微生物多样性。
移民的生活方式对微生物组有何影响?
专注于人类迁移模式的微生物组研究也表明,更高程度地采用新的生活方式和随后的微生物组变化可能会导致适应不良的健康后果。
例如,过渡到社会住房而不是停留在原地的爱尔兰游民群体显示出与工业化国家更常见的慢性病相关的功能性微生物组变化,尽管目前尚不清楚这些变化是否导致了爱尔兰游民与非游民爱尔兰人之间的健康差异。
移民定居后微生物多样性和功能丧失,肥胖风险增加
另一项研究检查了514名苗族和克伦族个体(包括来自泰国的第一代和第二代移民)以及19名移居美国前后的克伦族个体的肠道微生物组。移民在美国定居后,经历了微生物多样性和功能的丧失,以及微生物组成的变化。
在移民前,个体原生的普雷沃氏菌菌株以及与植物纤维降解相关的细菌酶迅速消失,与之交替出现的是拟杆菌属。同时,该研究报告称,患肥胖症的风险增加。移民时的年龄,尤其是儿童早期的年龄,以及作为第二代移民等因素增加了肥胖风险,这表明移民后代谢程序的跨代失调可能至少部分由微生物组的变化介导。
移民带来的肥胖危机:可能与饮食相关
西班牙裔/拉丁裔也描述了美国移民肥胖风险增加之间的关系,这一群体的肥胖率非常高,而且随着移民或儿童早期移民的持续时间而增加。一项针对美国西班牙裔/拉丁裔人群的肠道微生物组研究表明,与肥胖风险显著相关的细菌属也与美国接触有关,并可能与西方饮食有关。
研究还表明,一些微生物类群的共存可能解释了个体肠道微生物分类组成与环境因素的关系,如暴露于美国、饮食和肥胖。这些研究提供了证据,证明新移民获得的生活方式后肠道微生物的变化可能会加剧已知风险因素(即西方饮食)对肥胖的有害影响。
从生态学的角度来看,普雷沃氏菌等主要本土物种的丧失可能会导致人类肠道微生物群的广泛组成和功能差异,从而降低生态系统对干扰的抵御能力。当这种情况发生在生命早期,宿主发育途径更容易接受微生物组信号时,这种微生态失调可能会对宿主发育稳态造成更严重的损害,从而增加免疫和代谢性慢性疾病的风险。
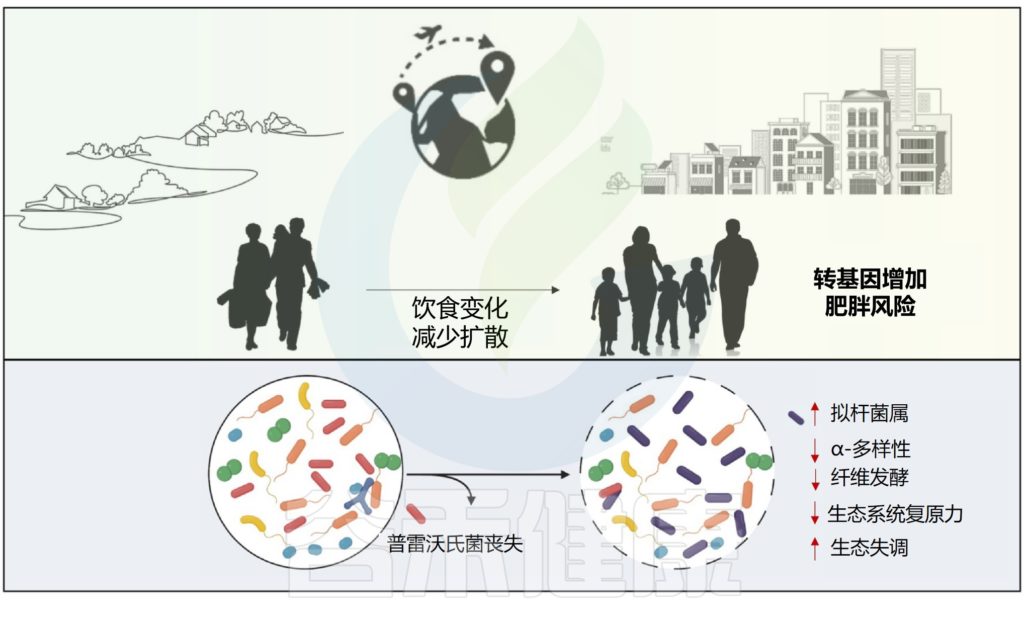
doi.org/10.1016/j.molmed.2023.07.002
基于人群的微生物组研究为微生物群落如何适应人类生活方式和遗传因素的梯度提供了一个窗口。从这些研究中,生活方式和饮食因素成为塑造肠道微生物群落的最具影响力的变量,尽管宿主基因和地理位置也发挥着重要作用。这些发现有力地证明了健康或失调肠道微生物群的普遍规模。
需要进行更多的微生物组研究,以特定人群的方式进一步调查人类微生物组组成的变化,特别是关于疾病的微生物组特征和研究不足人群中基于微生物组的治疗。这对于设计临床策略,预防或治疗世界不同地区的传染病和非传染病至关重要。
到目前为止,研究工作主要局限于更富裕的国家,忽略了社会不平等在人类微生物组中的大部分作用。将这项研究扩大到更大规模的人群的初步努力表明,工业化的城市生活方式和西方饮食与个体间细菌多样性的增加和个体内细菌多样性下降有关。换句话说,城市肠道微生物群更加个体化,每个宿主的物种数量减少。了解和解释这些差异对于定义每个群体的微生态失调和基于微生物组的诊断以及群体内的个性化药物至关重要。
将生态学理论与人类微生物组研究相结合,可以帮助人们了解更多关于早期微生物建立、对扰动的恢复力和功能多样性的生态驱动因素。通过观察早期生态系统建立过程中的微生物-微生物相互作用、人类迁徙研究中观察到的物种的损失和入侵,以及人们对非细菌微生物(古细菌组、病毒组和真菌生物组)的作用,可以更好地了解微生态失调的发展和解决。了解微生物变异的驱动因素对微生物共存的影响,可以为未来的微生物研究和治疗提供深刻的见解。
最后,对迁徙前后个体微生物组成的差异进行更多的研究,可以更深入地了解种群和人类各代肠道微生物组的稳定性或变化。移民往往发生在工业化、城市化地区,以寻求更好的生活条件。比较大型多民族和多文化社会中肠道微生物在迁移时间梯度上的变化,将有助于了解种群之间的微生物交换及其对健康或疾病轨迹的影响。
主要参考文献:
Parizadeh M, Arrieta MC. The global human gut microbiome: genes, lifestyles, and diet. Trends Mol Med. 2023 Jul 27:S1471-4914(23)00152-1. doi: 10.1016/j.molmed.2023.07.002. Epub ahead of print. PMID: 37516570.

谷禾健康

最近有客户在拿到科研报告分析结果的时候问:
“在同样的数据分析流程情况下,为什么我拿到的分析结果提取不出什么有价值的结果,而别人有着类似的项目课题,样本类型也相似,却可以拿到全面的差异分析结果,想要提取的信息一目了然?”
★项目设计和入组标准以及采样至关重要
微生物组研究涉及到生活的方方面面,从环境微生物检测,到人体疾病与微生物群的关系,再到药物与食品营养干预等,以及菌群的发酵产物等。一项好的研究一定离不开前期的项目主题优化以及合理的采样方案。
项目分析主要是依托高通量测序获取的数据和特定数据库对样本数据进行归类,识别,统计检验分析,以及差异化寻找和可视化展示,来获取全面的数据信息。
最终拿到科研分析报告结果,PDF结果报告也好,在线或平台呈现展示也好,是对结果的排列,展示和解读说明等。
个别研究者拿到结果报告后,发现结果不理想,分组没有代表性,组内差异较大,当这个时候发现前期研究不明确,或者取样不具有代表性等问题,想通过后期科研分析的手段进行补救,根据我们多年的分析经验来看,在这种情况下只能进行一定范围内的微调,差异结果大局已定。
如果想得到优质的差异分析结果靠后期数据分析筛选修改很难达到要求。这个时候如果想再次优化课题,重新取样,项目周期会延长,因此,本文就前期实验方案设计和取样环节进行详细描述和讨论,便于科研工作者获得更优质的实验结果。
一套完整的扩增子和宏基因组测序流程包括:
1. 确定实验设计与研究目的、样本规模和时间
2. 样本的采集,归纳,保存和运输
3. 预期实验结果计划,分析统计方法选择
4. 样本提取,实验,上机测序的选择
5. 数据下机,分析,与结果的呈现
一般测序公司拿到样本以后先进行样本状态查验以及样本信息核对,核对没问题后会尽快开展实验环节,包括提取,建库,上机,可以通过标准化流程减少实验误差,统一规范操作步骤;而数据分析也是通过标准的SOP分析流程拿到完整的数据分析结果,分析中分析人员可能会根据数据尝试寻找最适配的分析方法,或者增加图表展示的内容和呈现形式,以辅助客户拿到最能反映研究结果的图表。
唯有前两项主题设计与采样环节的不确定性因素较大,需要客户提前设计准备充分,同时也决定了未来数据分析结果的好坏。
实验设计就是为整个课题设定一个总的大纲,确立总的研究方向和目的;取样环节是未来能否将实验方案具体实现的关键。客户提前做好科研课题开题前这两项工作,更有利于后续测序分析的开展。
微生物组最常见的研究方法之一是高通量测序,其原理是基于微生物基因组的特异性序列(细菌16S rDNA,真菌的ITS或宏基因组DNA),进行测序和分类,分析在特定的环境下微生物群落的物种组成和功能,微生物的多样性与丰度。
根据主题的不同可以将微生物组研究主要应用到以下几个方面:
1. 将肠道微生物与疾病进行关联以探讨疾病与健康的个体之间微生物的差异性;
2. 在特定环境下找出特异性微生物,发现耐受菌群及与特定环境具有关联性的代谢通路,通过不同样本之间的比较,研究微生物群内部、微生物与环境、微生物与宿主之间的关系;
3. 通过单一因素直接作用于特定环境或宿主(例如补充维生素、给土壤施加不同的类型的肥料)研究对应的微生物群在不同时间段的变化规律。
依照不同的课题类型提前规划好实验设计方案。
▼
例如可以研究不同用药组菌群构成差异;在不同的地理环境下土壤菌群构成的变化;还可以研究不同疾病类型的病人与健康对照组的菌群做两两分组之间的差异分析。
•保证组内样本的均匀性和一致性
为了尽可能多的从不同分组当中找出差异结果,需要保证组内样本的均匀性和一致性,排除组内样本差异性过大等干扰因素。
例如研究某一种疾病的肠道菌群构成时,需要排除多种因素对菌群构成的影响:
所以在前期实验设计的时候这些细节都需要考虑到位,避免个别的干扰因素影响整体的实验效果。
不同分组直接菌属差异比较
上图表明:尽管是用药组,但是不同的细分用药对菌群的差异影响不同,甚至差异还比较大。
下图可以看下每两组之间是有显著性差异的。
两两分组之间菌属差异比较
这刚好反馈在分组的时候,一定要按照研究方案不同或处理效应尽可能细分分组,或严格入组样本标准,或设置细分的干预浓度等。
合理细分分组,确保实验结果的科学性和有效性,从而推出更可靠的结论。
▼
相关性分析用于研究微生物群落内部,微生物与环境之间,微生物与宿主之间的关系。例如最常见的就是临床病人拿到的各项生理生化指标与微生物群之间做关联分析;或是环境、土壤、发酵样本的各项理化指标与微生物之间做相关性分析等。
该项目是比较自闭症儿童与正常儿童的菌群差异的项目。客户在样本信息单里详细描述了孕期各种理化指标,根据这些理化指标与菌群数据做envfit相关性分析。
从结果可以看出,自闭症谱系障碍与正常儿童之间的分组与菌群之间相关性极显著**,其次是否有先兆流产的分组与菌群之间有显著相关性*,其他的包括是否喝牛奶、孕期是否感染、妊娠高血压都与菌群有相关性。
下列CCA图、RDA图可以做环境因子与菌属、样本之间的关联分析。
图中使用点代表不同的样本,从原点发出的箭头代表不同的环境因子。箭头的长度越长,表示环境因子的影响越大。夹角越小,代表相关性越高。样本点与箭头距离越近,该环境因子对样本的作用越强。
微生物相关性网络分析,可发现物种间的相互关系。图中每个节点代表属水平的物种,节点的颜色代表对应的门水平,节点越大,与之相关的属就越多,物种间的相关性用线条连接,相关性越强,线条越粗。线条红色正相关,绿色负相关。
微生物与理化指标的相关性网络图
上调代谢物、下调代谢物与菌群和基因的互作关系
理化指标与菌群的相关性热图分析
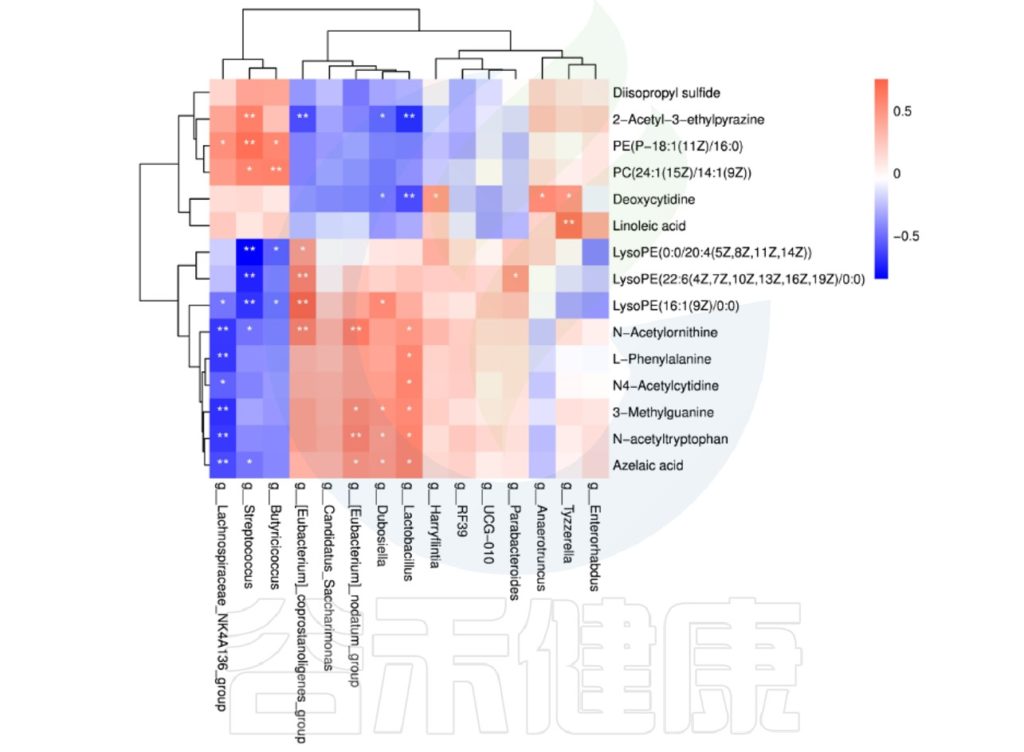
理化指标与物种的线性回归分析
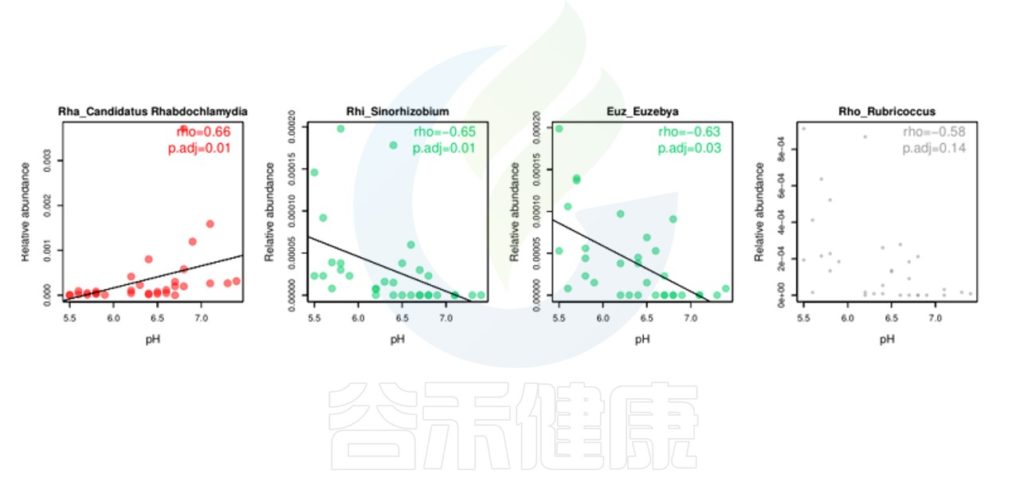
•实验设计时规划好哪些指标与菌群数据之间做关联分析
在实验方案设计阶段先规划好哪些生理生化、临床指标可以跟菌群数据之间做关联分析,在取样的同时搜集好样本相关的理化指标质量和范围,有利于后期相关性分析,增强分析结果的说服力。
将详细数据填写在样本信息单里,例如:
▼
微生物群是一个相对较为稳定的组合状态,在受到外部环境变化的影响下,菌群构成也会随之发生改变。在一定的时间范围内,菌群构成呈现出一定的变化规律。
•外界因素影响下肠道菌群在一定时间内变化
例如研究在抗生素药物治疗的情况下,一定时间内病人的肠道菌群变化情况。抗生素会直接影响肠道菌群的丰富度和多样性。
营养饮食的影响相对缓慢
对于益生菌,或者营养饮食等方面的摄入对肠道菌群的干预是缓慢的,被动的,需要长时间的补充摄入才能对整体的菌落构成起到影响作用,直到菌群构成趋于稳定。所以这里时间上要从几周到几个月的时间段内进行选取和采样,形成一个完整的采样周期。
婴儿的肠道菌群变化较为显著,取样间隔更短
又比如婴儿的肠道菌群在头几年变化较为显著,前期取样的时候就需要间隔更短一点,例如几天到几周采一次样,才能更细致的捕捉到婴儿肠道菌群的变化规律。
时间间隔的长短会影响微生物的时间序列分析,依据不同的样本类型,选取恰当的时间间隔周期,能观察短期或长期的菌群变化趋势,可以做个体之间的线性分析,配对T检验。
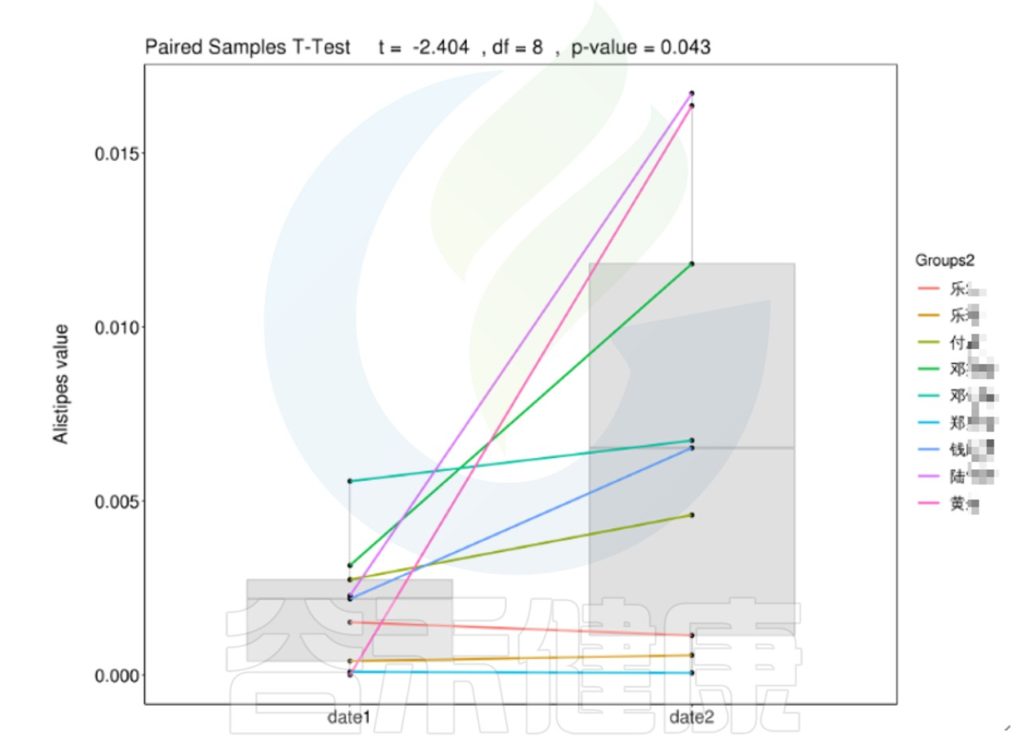
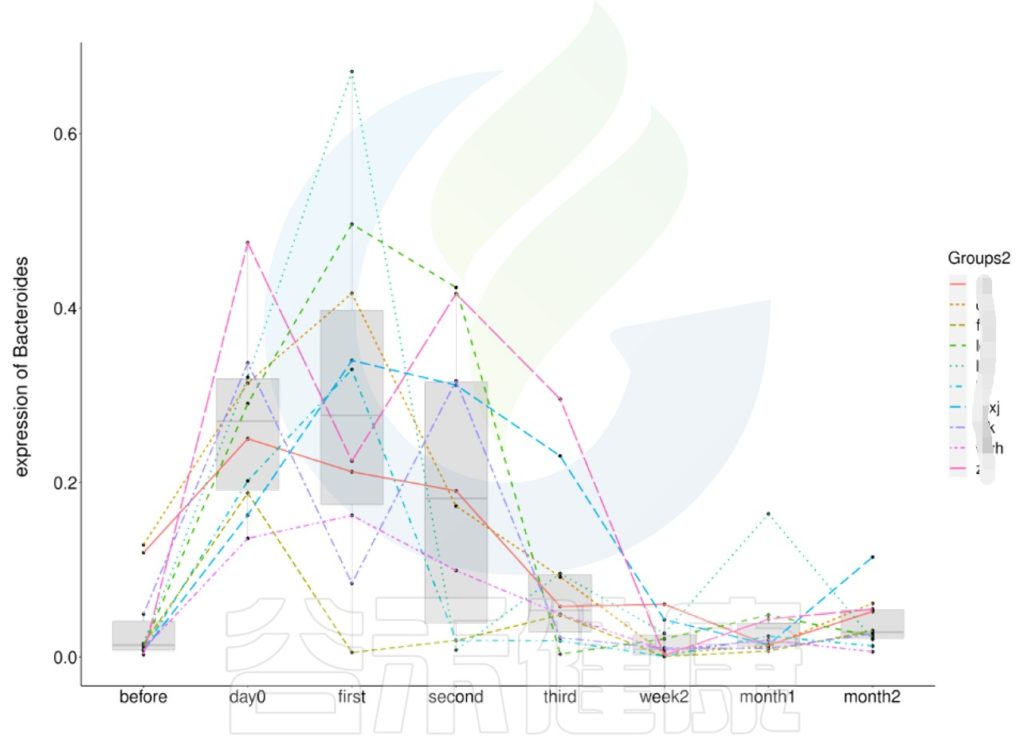
编辑
恰当的取样方法对于微生物组组学研究尤为重要,样本的收集和处理决定了后续微生物组鉴定的准确性。
前期的实验方案设计规划好以后,下一步就是落实,基于实验设计选取符合实验方案要求的高质量样本。在取样时需要注意以下几个点:
重复取样时,确定地理位置,或取样部位、取样深度、体积等都能实现标准化,以保证各个环节的一致性和可重复性。
影响肠道菌群样本的干扰因素有:年龄、地域、感染、疾病,药物治疗如抗生素、化疗、营养饮食干预等。
•收集样本时其他条件尽量保持一致
收集疾病组样本或者健康对照组样本时,尽量选择具有相同地理环境,饮食习惯,年龄段,药物治疗相关的病例作为重复样本。
采集过程的污染物也会被检测到变成样本组成的一部分,所以采样的过程中重复使用的工具,也要进行适当的消毒处理。取样的标准化和可重复性也可以避免由于不同的批次处理带来的样本菌群构成的差异性。
为了能合理的评估不同分组菌群之间的差异性或相似程度,必须要有一定的数据量来评估差异或者效应的大小。
一般来说,数据量规模越小,一组样本内的变异性越大。因此需要有更多的样本量来获得足够的统计能力。
每组至少3个重复,才能满足最低的组间差异统计检验条件,一般实验我们建议每组至少6个样本重复,临床样我们建议每组至少30个样重复。
不同的样本类型,如环境、植物、动物到人类,微生物组的来源差别较大,取样方法也有所差异。
•不同取样部位具有各自的生理特征
关于肠道菌群取样部位问题,该取粪便样本还是取肠道内容物?
根据研究发现不同的取样部位(如:粪便、粘膜活检,肠液等样本)具有各自的生理特征,肠道菌群的研究结果也有所差异。
•肠道内容物具有侵入性,用于某些特定疾病
肠道内容物由于采样方法较为复杂且具有一定的侵入性,所以在日常的应用相对较少。但是如对于一些特定的疾病或者研究问题,需要区分肠道不同部位微生物的组成或特性时,肠道组织样本或肠道内容物样本可能更加适合。
•一般情况下选择粪便样本
从实用的角度考虑,粪便样本可以自然采集、无创,且可以重复采样成为最常用的检测工具,是肠道菌群检测的最优选择。
注意
传统的粪便样本取样方法繁琐,对样本量和保存运输方式条件较为苛刻,例如单次的取样量要达到200mg以上,保存和运输过程中必须冷冻保存。一般临床上病例和健康人收集样本的配合度和接受度也不高,这也大大增加了收集样本的难度和成本。
★谷禾取样管便于采样以及储存运输
为了解决临床和实验过程中对粪便样本的取样遇到的这些实际问题和痛点,谷禾经过多年的肠道菌群检测实践,进一步对粪便样本的取样流程进行优化,开发出了专门用于肠道菌群取样的谷禾肠道菌群取样储存盒,实现了粪便样本的日常常规取样和常温储存运输。
该取样盒操作简单,取样方便,常温可以有效保存7天,日常在家就能实现常规粪便样本取样,缩短了实验人员收集样本的效率,节省了人力成本,所以该取样盒在市面上一经推出,就受到各大院校和临床机构的欢迎。同时也为谷禾做大健康方向前期收集样本阶段,提供了有力的前期技术支持。
谷禾取样管具有以下特征:
1、在家中就可轻松自行采集高质量样品
2、起始样品需要量低至0.01g左右,快速且稳定
3、样本取样7天内常温下储存和运输可保障稳定的群落结构
4、标准样品适合高通量标准化处理
5、能有效获得适用于16S 、宏基因组和qPCR等的高质量DNA
6、条形码化全样本可追溯性

取样方法也比较简单,仅需使用棉签从厕纸上沾取粪便,然后洗脱到取样管的保存液中即可,使保存液可见粪便颜色即表示取样量足够。
谷禾取样管不仅可用于人体粪便样本的采集,动物的粪便也同样适用,例如:大鼠样本用无菌棉签沾取少量粪便样洗脱到样本管的裂解液中;小鼠样本只需要放入1~2粒的粪便粒到裂解液即可。
1.如3天内使用过抗生素类,质子泵类胃药,阿片类精神药物请停药3天后进行检测;
2.感冒、腹泻或其他症状期间不影响取样,拉稀或稀便可以用棉签反复沾取粪便至取样管;
3.如长期便秘无排便可使用开塞露等辅助手段获取粪便样本;
4.取样无时间和饮食限制,取样前按照日常的用餐习惯进食即可;
5.完成取样后样本可常温有效存储一周,为保证检测时效请完成取样后尽快送检。如需长期储存,可将样本冷藏保存,-20℃冷藏最多可保存半年,-80℃可保存一年;
6.样本保存于取样管后需要拧紧瓶盖,防止取样管漏液,或者受到环境污染。

其他样本类型则需要用到传统常规的取样方法严格按照标准取样,之前我们的文章有对不同样本类型的常见取样方法作详细介绍:
微生物取样方法大全 (点击查看)
注:以上是16s测序项目送样需求,如果是宏基因组测序,需要达到常规标准,而且高宿主样本例如灌洗液,尿液,组织等样本,需要提前处理。
送样前要做好以下这些准备:
•样本信息单
样本信息单里填写好相关资料,包括谷禾编号,对应的科研分析名称,分组情况,有多少种分组情况就填几列,样本名称和分组名称由英文字母、数字、”.”组成,并以字母开头,不能以数字开头,不支持字符“- ”“_ ”、运算符、中文、空格等特殊字符。
注:名称长度最好不要超过8个字符。
如果要做相关性分析需要提前准备好样本的临床指标、生理生化指标,并将每个样本的具体测得的指标数值填写到样本信息单里。
如果对科研分析不太熟悉,不知道还能提取出哪些有用的分组信息,可以将具体的研究目的、实验方案详细写在备注里,分析人员会根据您的信息给出相应的指导意见和分析方案建议。可以提供一个纸质和电子版的样本信息单。
•样本检查
样本送样前要对样本和运输条件做检查,取样管是否拧紧,是否有漏液情况,样本不受环境污染和干扰,检查样本个数是否能核对的上,在寄样前要在快递箱上附带一张送样信息的纸条,包含以下内容:
寄样单位或联系人:xxx
寄样日期:xxx
样本个数:xxx
实验室接收到样本后会跟送样信息单进行核对,如果样本个数和信息能核对上,则继续对样本进行实验上机,如果样本个数或信息核对不上,会跟客户沟通,核对信息。
小 结
客户在做好实验方案设计和样本收集的前期准备工作以后,后续的实验和测序分析工作就交给我们来完成吧,从收到样本到科研分析报告的出具,周期一般在6~10天左右(16S v4); 15-20天(16S V3V4);15-20天(宏基因组)。
实验室在收到样本以后会先核对信息,然后进行样本DNA提取,质检,建库,测序上机。等测序数据下机以后,对原始数据拆分,质控,然后就进行科研数据分析阶段。
分析思路:
1.先了解不同分组样本都由哪些微生物构成,并计算丰富度,做α多样性分析;
2.比较不同分组微生物群落整体是否有差异,做β多样性分析;
3.进一步找出不同分组之间微生物群落的差异菌属,关键菌属;
4.根据关键菌属可以作为biomarker用于疾病诊断模型构建;
5.找出菌属与临床理化指标的相关性;
6.根据物种构成预测菌属代谢途径,基因功能预测,找出组间差异功能预测,查看菌属是怎么运行宿主的
7.将数据结果整合起来,找出不同疾病环境分组条件下,菌属的差异是否跟疾病相关,并影响宿主。
最终根据科研分析报告的研究方向和侧重科研选择不同的分析方法,并做图像化展示。
差异分析方法:
•Tukey检验
•非参数检验
•基于矩阵的Anosim检验、Adonis检验
•LEfSe分析
•随机森林和ROC曲线
相关性分析方法:
pearson相关系数
spearman相关系数
相关性网络图、相关性热图、线性回归图
功能分析:
PICRUSt2、FAPROTAX、BugBase
PCA、PCoA、NMDS
ROC、RDA
Venn图、花瓣图、Upset图
物种构成柱状图、热图、差异箱型图
GraPhlan物种进化树
metagenomeSeq
Random Forest随机森林
ROC曲线图
graphlan图
Gephi复杂网络图
三元相图
谷禾近期合作发表示例文章:
Hu Y, Li J, Ni F, et al. CAR-T cell therapy-related cytokine release syndrome and therapeutic response is modulated by the gut microbiome in hematologic malignancies[J]. Nature communications, 2022, 13(1): 1-14.
Lou M, Cao A, Jin C, et al. Deviated and early unsustainable stunted development of gut microbiota in children with autism spectrum disorder [J]. Gut, 2021 Dec 20:gutjnl-2021-325115.
Li R, Liu R, Chen L, et al. Microbiota from Exercise Mice Counteracts High-Fat High-Cholesterol Diet-Induced Cognitive Impairment in C57BL/6 Mice[J]. Oxid Med Cell Longev. 2023, 20:2766250.
Xiao W, Zhang Q, Zhao S, et al. Citric acid secretion from rice roots contributes to reduction and immobilization of Cr(VI) by driving microbial sulfur and iron cycle in paddy soil [J]. Sci Total Environ. 2023, 16:158832.
Wang X, Weng Y, Geng S, et al. Maternal procymidone exposure has lasting effects on murine gut-liver axis and glucolipid metabolism in offspring [J]. Food Chem Toxicol. 2023, 174:113657.
Liao J, Dou Y, Yang X, et al. Soil microbial community and their functional genes during grassland restoration [J]. J Environ Manage. 2023, Jan 1;325(Pt A):116488.

谷禾健康

成瘾是一种大脑疾病,受害者无法控制地对某种物质或行为产生强烈的依赖和渴求,尽管这种行为会产生有害的后果。成瘾包括一系列物质滥用障碍,例如药物、酒精、香烟,过度饮食。近年来,吸毒成瘾急剧上升,特别是阿片类药物,全世界每年有数十万人死于吸毒过量。

成瘾的特征是负面和正面情感状态的交替,这些状态可以归因于不同阶段神经递质活动的改变:
而微生物组已被证明能以多种方式影响宿主大脑,例如通过调节神经递质、通过肠脑轴与中枢神经系统相互作用,使得微生物群可以通过产生负反馈环和正反馈环来影响或参与大脑奖赏和戒断回路的神经活动,从而促进成瘾行为。
在这些回路中具有重要功能的神经递质,如多巴胺、GABA和5-羟色胺,都可以由肠道微生物群产生或调节。一些研究表明,肠道微生物可以合成苯丙氨酸和代谢左旋多巴,这两种都是多巴胺的前体,因此它们可以调节多巴胺的水平。这些过程促进了微生物影响大脑奖赏回路的途径,例如通过介导强化和奖赏的D1R和与厌恶和回避相关的D2R。
还有微生物组衍生的短链脂肪酸和色氨酸代谢,特别是它在5-羟色胺合成中的作用。总之,这些证据表明,微生物组有可能通过诱导强化积极和消极的对宿主的影响,从而影响宿主的状态和行为。
为了深入研究宿主-微生物组生态系统的生态学和进化学在成瘾机制中的影响作用,研究人员开发了一个数学框架,通过建立数学模型来模拟宿主-微生物生态系统对变化的反应动力学。利用这个模型,研究人员分析了成瘾行为的几个方面,重点关注微生物组对成瘾的起始和戒断的潜在影响。
研究人员假设,作为宿主微生物群一部分的微生物菌株已经进化出一种模式,影响宿主,从而改善了这些菌株在微生物群落中的地位。这可能会导致微生物群落在不同方向上影响宿主。比如宿主的成瘾行为改变了寄生微生物的生存环境,即使毒瘾对微生物很大程度上是有害的(例如毒素),但对一些微生物来说,它可能比对其他微生物的危害要小。这导致了微生物选择制度的转变,并扰乱了微生物组的组成。在新条件下繁殖的菌株可能会受益于宿主继续其新的行为。因此,微生物群可能在增强和维持成瘾行为方面发挥作用。
Methods
研究人员开发了一个三组分的框架来模拟宿主-微生物组相互作用及其对宿主行为的影响。
➦ 1 将宿主行为建模为空间中的连续特征。
➦ 2 宿主体内含有N个微生物菌株,随着宿主行为的改变,不同微生物菌株的丰度也会发生变化。
➦ 3 考虑微生物组对宿主行为的影响,模拟了微生物菌株分泌化合物,影响宿主奖励和戒断回路的功能,产生正向或负向的反馈(例如奖励或厌恶),从而调节宿主行为。
在模拟宿主-微生物组相互作用的模型中,其中宿主行为影响微生物组成,而微生物组则影响宿主行为。在这个模型中,研究人员使用相同的框架建立了两个模型:
具体的模型描述如下:
1 宿主的行为基线的建模描述
宿主的基线行为被表征为二维单位球体中的坐标

➨ 成瘾阶段:
即行为基线的改变,宿主的行为基线的改变表现为沿着X轴正方向的一系列移动。
在每个时间点t,步长σA(t)从均值为σ的指数分布中随机抽取。宿主行为的改变受到距离原点R的限制,代表了最大的成瘾程度。因此,宿主行为的坐标逐渐从(0, 0)移动到(R, 0),并在该阶段结束之前保持在(R, 0)位置,即从开始计算的τ个时间步长之后。
➨ 戒断阶段:
宿主通过在X轴上进行大小为 (−σA(t))的移动来逆转其行为模式,其中σA(t)从均值为σ的指数分布中随机抽取。
行为的改变下限为0。该阶段在微生物组成和宿主行为稳定之后结束,或者在该阶段开始后经过100000个时间步长之后。
2 微生物群组成的建模描述
一个由N个微生物菌株组成的群体寄居在宿主体内。每个菌株都有其独特的特征,可以用微生物组-行为空间中的坐标来建模。

考虑到微生物群中不同微生物菌株之间的资源竞争,在每次迭代中通过其总和对 xi(t+1) 的值进行归一化。由此获得微生物菌株的相对丰度,同时假设微生物群落的总丰度保持不变,类似于对整个微生物组群体设置一个承载能力。
接着,在每个菌株上设定一个恒定的低流入速率 μ / N,以避免菌株从系统中灭绝和永久消失(μ在整个过程中设置为10^(-8))。在每个时间步长中,使用上面的公式计算菌株的比例,然后计算流速和第二次归一化。
对于两菌株竞争模型(N=2),每个菌株的特征是手动定义并在结果中进行说明的。其中一种菌株会影响宿主行为,并承担反馈产生的成本,而另一种菌株不会影响宿主行为且不需要支付成本。
对于成瘾模型,在每次模拟开始时,在微生物组-行为空间内随机抽取菌株。还分析了不包括归一化的广义Lotka-Volterra模型(同样使用前向欧拉法,时间步长为1):
这个方程系统与上述过程类似,但有两个主要修改。
3 微生物群影响宿主行为的建模描述
假设所有或部分微生物菌株可以影响宿主的行为,且菌株可以感知它们种群中有益和有害的变化,这些变化表现为种群大小在一段时间里的增加或下降。
这些反馈将会影响宿主未来的行为轨迹。

因此,宿主轨迹远离中心、朝向中心或中性取决于过去 wh 个时间点的线性轨迹的斜率。默认设置 wh= wm -10
结合微生物代谢产物及其行为轨迹,微生物菌株 i 对宿主行为在时间 t 上的影响方向可以通过Imi(t)⋅Ib(t) 的结果来描述。
在时间t时,每个菌株的总效应强度是该菌株在微生物群落中的比例乘以( |σA(t)|⋅di)。
其中 di 表示菌株i对宿主的影响大小,|σA(t)| 是时间t的行为基线步长。微生物效应的大小 (di,i∈{1,…,N}) 是从指数分布中随机选择的,每次模拟开始时其均值为E[d],在每个时间步长中计算σA(t)。

在上述的模型中,微生物群落对宿主行为的影响是间接的,需要通过宿主的奖励回路。
为了观察微生物群落对宿主行为的直接影响,研究人员另外又建了一个模型,这个模型假设在成瘾和戒断过程中每个微生物菌株都会将宿主拉向其在微生物组-行为空间中的坐标。
首先,将宿主行为坐标减去菌株特征坐标,并对结果向量进行归一化,来确定每个微生物菌株相对于宿主行为的方向。
然后,将所有得到的向量求平均,得到整体微生物群落的影响方向。这个平均值根据每个微生物菌株的比例(xi )加权,同时每个分量也乘以菌株的影响强度(di)。
现在宿主行为的变化由宿主行为基线步长和微生物影响的总和决定,定义如下:
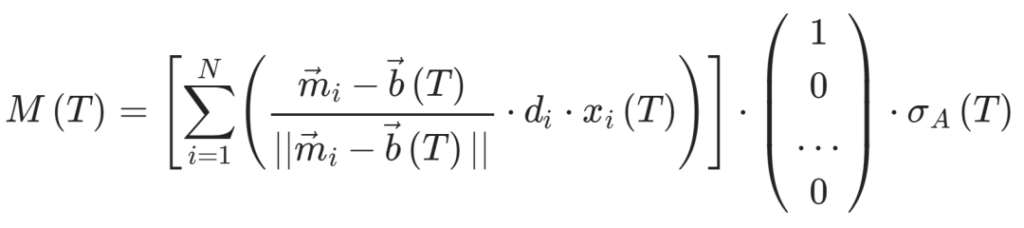
Results
基于方法中描述的模型,研究人员给出了从模型结果中观察到的宿主与微生物群的现象,如下:
1 微生物能够反应宿主行为的变化
在微生物菌株之间的竞争行为中,当其中一个菌株通过改变宿主行为而获得额外资源时,这种微生物效应就会被显现出来,反映为它在群落中的比例会增加,从而增强其继续影响宿主的能力,进一步诱使宿主继续新的行为。
如下图,模拟了两个微生物菌株之间对宿主资源的竞争,这些竞争源于宿主行为。
当微生物提供的优势超过产生这种影响的成本时,它对宿主状态的影响可能是有益的
a| 模型插图。蓝色和黄色分别代表两个不同的菌株,其中蓝色的菌株可能在影响宿主的行为:它在增殖时提供正反馈,诱导宿主继续其行为趋势,在下降时提供负反馈,诱导宿主逆转其行为趋势。
b| 绘制了经过100000个时间步长后影响宿主的菌株比例的热图。宿主的行为在x轴上沿着0到1之间随机游走,代表资源的消耗。
c| 绘制了在模拟的100000个时间步长里,微生物效应的大小与宿主行为轨迹的关系。
2 宿主-微生物群的相互作用可能会加剧成瘾行为
建立了一个简单的宿主行为模式,包括三个阶段:
当宿主开始改变其行为时,有相当数量的微生物菌株支持或反对这种行为改变,如图a,这是一个微生物组-行为空间,将N个菌株随机分布在空间内,星形的移动演示了宿主行为的改变。
图b和c分别展示了在不同平均微生物效应量(E[d])作用下随着时间的持续,宿主行为的变化和菌株丰度及其适应度的变化。
图b中的黑色虚线代表平均微生物效应量为零时的宿主行为基线。从E[d]=1到E[d]=10的宿主行为变化,可以发现微生物群的行为效应可以导致成瘾行为的加速和减速,但在大多数情况下,微生物群的行为效应减缓了戒断过程。
研究人员认为原因是在成瘾期间,微生物群转向了一个低多样性的群落,这个群落由在新的宿主行为下增殖的菌株组成。因此,在宿主开始戒断行为时,相当大一部分微生物群抵制行为变化。
3 微生物群落丰富度影响宿主成瘾行为
通过监测成瘾期(ϕ(Addiction))和戒断期(ϕ(Withdrawal))的微生物群落丰富度变化,发现加速成瘾或减缓戒断不仅取决于微生物效应大小,还与微生物群落丰富度有关。
如图a和b,在微生物组丰度非常高且微生物组效应强烈的情况下,微生物组实际上可能会加速成瘾和戒断过程(E[d]=10,N=300)。
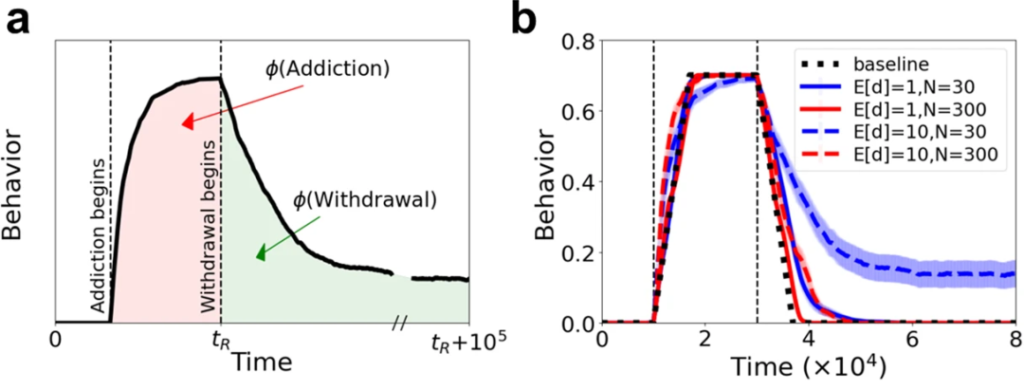
在恒定微生物效应的平均大小后,然后减少影响菌株(即能够影响宿主行为的菌株)的比例,结果是总微生物组效应量的下降,并加速戒断过程。这表示即使只有少数菌株影响宿主行为,对成瘾和戒断的影响也可能是显著的。
如下图,每个像素的颜色表示相对于没有微生物组效应的基线情况下的成瘾期和戒断期的倍增或减少的情况,E[d]=5。
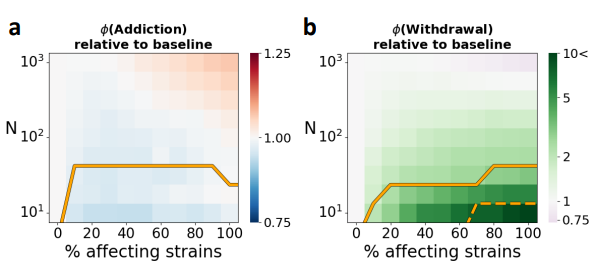
既然微生物群落丰富度会显著影响宿主成瘾或戒断行为,研究人员便做了一个模拟实验,在戒断期引入新的微生物菌株来增加微生物群落的丰富度和多样性,结果如下图。
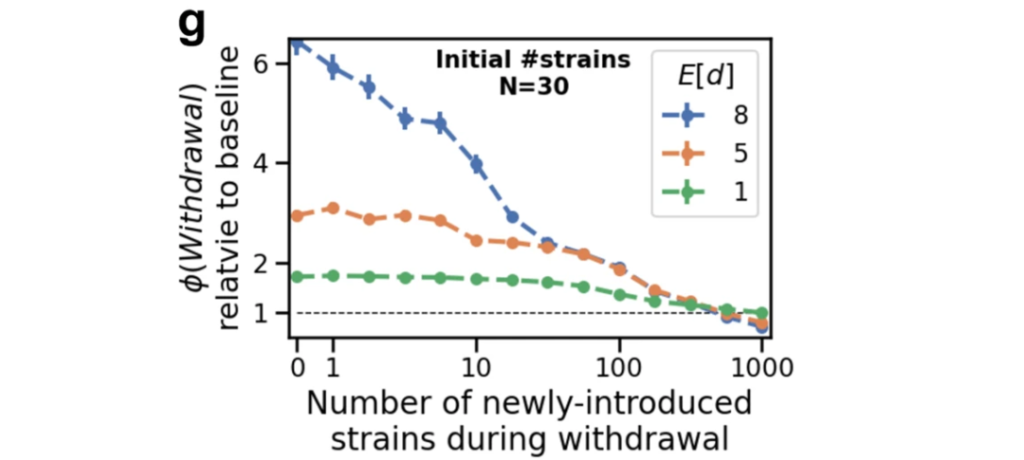
这种干预逐渐增加了微生物组内菌株之间的竞争,降低了为成瘾行为提供反馈的菌株的影响,从而促进了宿主-微生物组生态系统向其原始平衡状态的转变。
4 成瘾程度加重,微生物群越发抵制宿主戒断行为
通过研究微生物组与成瘾的最大严重程度(R)之间的相互作用,发现随着成瘾程度的加重(R值增加),宿主行为会产生一种生态制度,将微生物组引向更狭窄、多样性较低的生态位。
在新的生态建立之后,新的微生物组成可能会强烈抵制任何改变的尝试,从而减缓戒断过程。
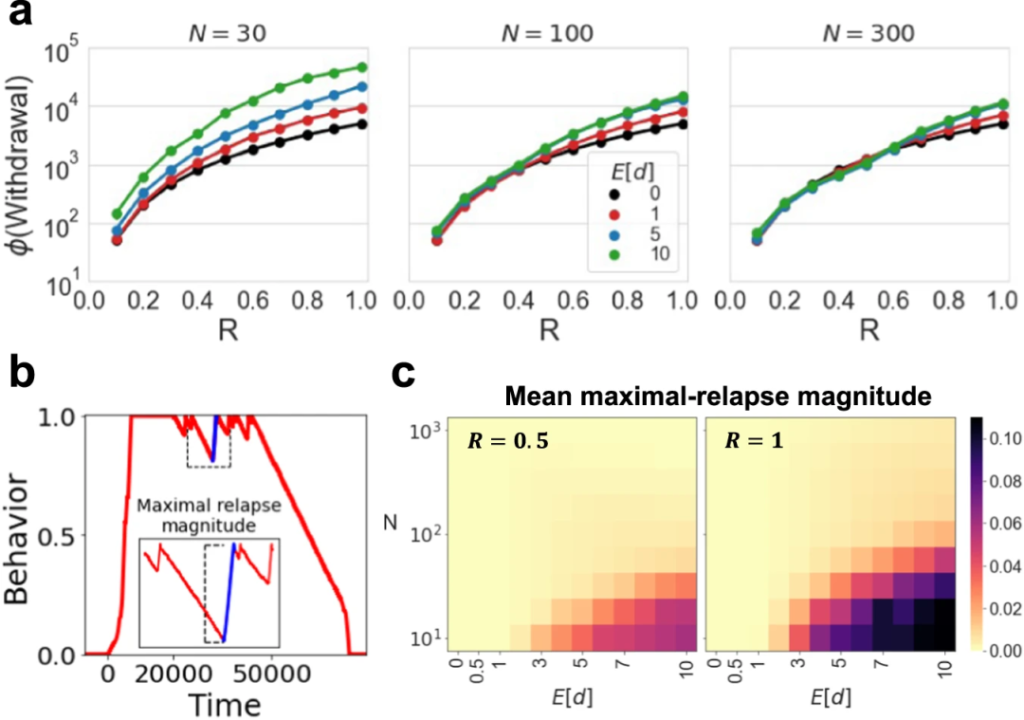
如图a,这种动态效应与微生物组对宿主行为的影响程度成正比,与微生物组的丰度成反比。当微生物组更为丰富和或其对宿主的影响相对较弱时,只有在微生物组成分发生实质性改变时,才会发生成瘾程度的加重。这意味着即使微生物组中只有少数菌株影响宿主行为,只要这些菌株发生了显著改变,成瘾问题就会加剧。
其次,还有复发的问题,即在戒断阶段发生的成瘾行为加剧。
如图b,c所示,更强的微生物效应、较低的微生物组丰富度和更剧烈的成瘾严重程度,都会导致更强烈和更频繁的复发现象。
Conclusion
模型结果表明,微生物组对宿主行为的反馈可以加重成瘾行为,使戒断更加困难,并增加复发的风险。而微生物组的丰度是这个过程的关键参数,低丰度会导致长期成瘾。
这种反馈有正向和负向,微生物组产生的代谢产物可以通过调节奖励回路对宿主行为提供正向或负向的反馈。由此,宿主-微生物群落相互作用产生了一个正反馈循环,改变了生态系统。
基于对成瘾机制的微生物组研究,也揭示了可能的成瘾治疗途径,增加微生物组的丰富度和功能多样性可能有助于成瘾的缓解和预防。而宿主的状态(包括生理和心理)与微生物群落多样性是息息相关的,比如压力和焦虑也会出现低多样性的微生物群落。
这些结论也反向验证了这个模型框架的优势:
参考文献:
Lewin-Epstein O, Jaques Y, Feldman MW, Kaufer D, Hadany L. Evolutionary modeling suggests that addictions may be driven by competition-induced microbiome dysbiosis. Commun Biol. 2023 Jul 26;6(1):782. doi: 10.1038/s42003-023-05099-0. PMID: 37495841; PMCID: PMC10372008.

谷禾健康

你是否有时会感到心悸、心慌、胸闷、气短、头晕、乏力?你是否有时感觉自己的心跳过快或过慢?
如果有上述情况,就要引起重视了,你可能存在心律失常。心律失常是最常见的心脏疾病之一,涉及到心脏的电活动节奏异常。根据发病机制和心电图特征被可以为不同类型,包括窦性心律失常、房性心律失常和室性心律失常。
长期熬夜,不健康的饮食,吸烟酗酒,压力大,过度劳累等各种因素都导致心律失常发病率越来越高和越来越年轻化。
与此同时,新冠肺炎的爆发也引起了人们对心律失常的关注。心律失常的治疗和预防,对于维持心脏健康和预防并发症的发生具有重要意义。
已有大量证据表明肠道微生物群及其代谢物对心血管健康具有重大影响,这为心律失常的治疗和预防带来了新的思路。

本文我们讨论了肠道微生物及其代谢物如何通过多种机制影响心律失常。目前公认的心律失常机制,包括结构重塑、电生理重塑、神经系统调节异常以及其他与心律失常相关的疾病。
最后介绍了与肠道微生物群相关的潜在的治疗策略,包括使用益生菌和益生元、粪便微生物移植和免疫调节剂等。
目录
1.了解心律失常
-心律失常的症状
-心律失常的分类
-发病率及高发人群
-心律失常的风险因素
2.心律失常患者的肠道微生物特征
-房性心律失常患者的肠道微生物
-室性心律失常患者的肠道微生物
-肠道菌群代谢物对心律不齐的影响
3.肠道微生物失调和心律失常的发生
-结构改造
-电生理重塑
-神经系统调节
4.其他疾病与心律失常的关系
-胃肠道疾病易诱发心律失常
-房颤患者易得胃肠道疾病
-与心律失常相关的其他疾病
5.心律失常的治疗
-饮食调整:多吃有益的脂质和膳食纤维
-补充益生菌、益生元
-药物与肠道微生物的相互作用
-粪菌移植
-免疫调节剂
-病因治疗和药物治疗
6.总结
以下是谷禾写过关于心血管疾病系列的文章,点击可查看:
-正文-
心律失常(cardiac arrhythmia)是指心脏电传导系统异常所引起的心跳不规则、过快或过慢等症状的总称。
正常心律起源于窦房结,频率60次~100次/分(成人),比较规律。窦房结冲动经正常房室传导系统顺序激动心房和心室,传导时间恒定(成人0.12~1.21秒)。
然而随着我国人口老龄化的进展和生活方式的改变,心律失常发病率快速上升,且呈年轻化和不断增长的趋势。
▼
心律失常的症状轻重不一,取决于发病的类型以及持续的时间,以及原发病的严重程度。
随着疾病的发生发展,患者发病早期可有心悸、出汗、乏力、透不过气等症状,此时,若心律恢复正常则无严重不适,若进一步发展可导致头晕、黑朦、晕厥,甚至猝死等。
▸ 心律失常可能伴随的症状
心律失常伴有明显的外周血流动力障碍时,还会出现相应器官受损的症状:
•脑:视力模糊、头晕、黑朦、晕厥等;
•胃肠道:腹胀、腹痛、腹泻等;
•肾:尿频、尿急、多尿等;
•肺:胸闷、气促、呼吸困难等。
▼
临床上根据心律失常的发生部位、机制及频率不同,可细分为许多种。
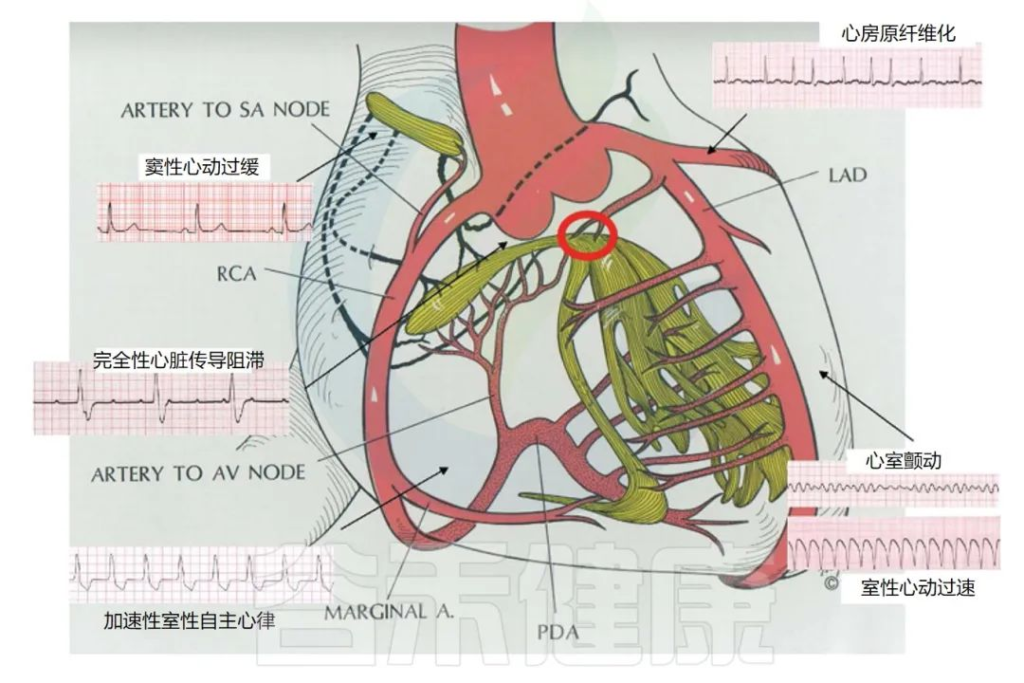
Frampton J,et al.Yale J Biol Med.2023
▸ 根据发病部位区分
按照心律失常发病部位可以分为窦性心律失常、房性心律失常、交界性心律失常、室性心律失常和束支心律失常。具体如下:
•窦性心律失常:包括窦性心动过速、窦性心动过缓、窦性停博、窦房传导阻滞、病态窦房结综合征;
•房性心律失常:包括房性早搏、房性心动过速、房室折返性心动过速、房室结折返性心动过速、房扑、房颤等;
•交界性心律失常:包括交界性早搏、交界性心动过速、房室传导阻滞等;
•室性心律失常:包括室性早搏、室性心动过速、室扑、室颤、室内传导阻滞等;
•束支心律失常:包括左束支传导阻滞、右束支传导阻滞、左前分支阻滞、左后分支阻滞等。
注:心房颤动(AF)是较为常见的心律失常。
▸ 根据发病机制区分
按发生机制可以分为冲动形成异常和冲动传导异常两大类:
•冲动形成异常:包括窦性心律失常,比如窦性心动过速、窦性心动过缓、窦性心律不齐、窦性停搏,还有异位心律失常,比如房性逸搏和逸搏心律,交界性逸搏和逸搏心律、室性逸搏和逸搏心律。
•冲动传导的异常:这种情况其实主要是包括传导阻滞,比如窦房传导阻滞、房室传导阻滞,另外还有完全性左束支传导阻滞、完全性右束支传导阻滞。
▸ 根据心律快慢区分
临床上常以心率快慢进行分类,分为快速型与缓慢型失常两大类。
•常见的缓慢型心律失常(心率<60次/分)包括:窦性心动过缓、窦性停搏、病态窭房结综合征、窦房传导阻滞。
•常见的快速型心律失常(心率>100次/分)包括:早搏、窦性心动过速、房性心动过速(心房扑动、心房颤动)、室上性心动过速、室性心动过速(心室扑动、心室颤动)等。▼
心律失常的确切发病率较难统计,根据研究数据显示,全球范围内心律失常的发病率大约在2%至4%之间,其中老年人中的患病率可能高达10%左右。
其中窦性心律不齐发病率最高,约占25%-27;窦性心动过速次之,约为20%-22%;窦性心动过缓,约13%-15%;室性早搏,约14%-16%;房颤,约11%-15%;房室传导阻滞,约5%-7%,其他各种心律失常约为5%-8%。
▸ 老年人和心血管疾病患者易发生心律失常
老年人和心血管疾病患者是心律失常的高发人群。
随着年龄的增长,心脏功能开始下降,心律失常的患病率也逐渐增加。
同时,存在高血压、冠心病、心力衰竭等心血管疾病的人群也更容易患上心律失常。
其他一些潜在因素,如家族史和遗传因素,也可能增加个体患上心律失常的风险。
▼
•年龄
随着年龄增长,心脏的功能会逐渐下降,从而增加心律不齐的风险。
•遗传
某些心律不齐类型可能与家族遗传有关,如果家族中有人患有心律不齐,那么你也可能面临较高的风险。
•心脏疾病
一些心脏疾病,如冠心病、心肌病、心脏瓣膜病等,可以增加心律不齐的风险。
•高血压
长期存在的高血压会对心脏造成损害,增加心律不齐的发生率。
•代谢紊乱
糖尿病、甲状腺功能异常等代谢紊乱疾病会对心脏功能产生影响,增加心律不齐的风险。
•药物滥用
某些药物(如某些心脏药物、精神类药物)滥用会干扰心脏的正常搏动。
•胸部手术
尤其是心脏手术、麻醉过程、心导管检查、各种心脏介入性治疗等可诱发心律失常。
此外,日常生活中也存在着很多诱发心律失常的因素,例如大量饮酒或咖啡、饮浓茶、情绪激动、剧烈运动等均可导致正常人发生快速性心律失常。
健康成年人体内存在数万亿微生物。值得注意的是,肠道微生物被称为与人类细胞基因组并列的“第二大基因组”。
几十年来,研究人员一直致力于探索心律失常的病因、机制和治疗方法。同时,不断更新的证据表明,肠道菌群不仅与人体健康和体内平衡维持密切相关,而且与包括心律失常在内的多种疾病的发生和发展密切相关。
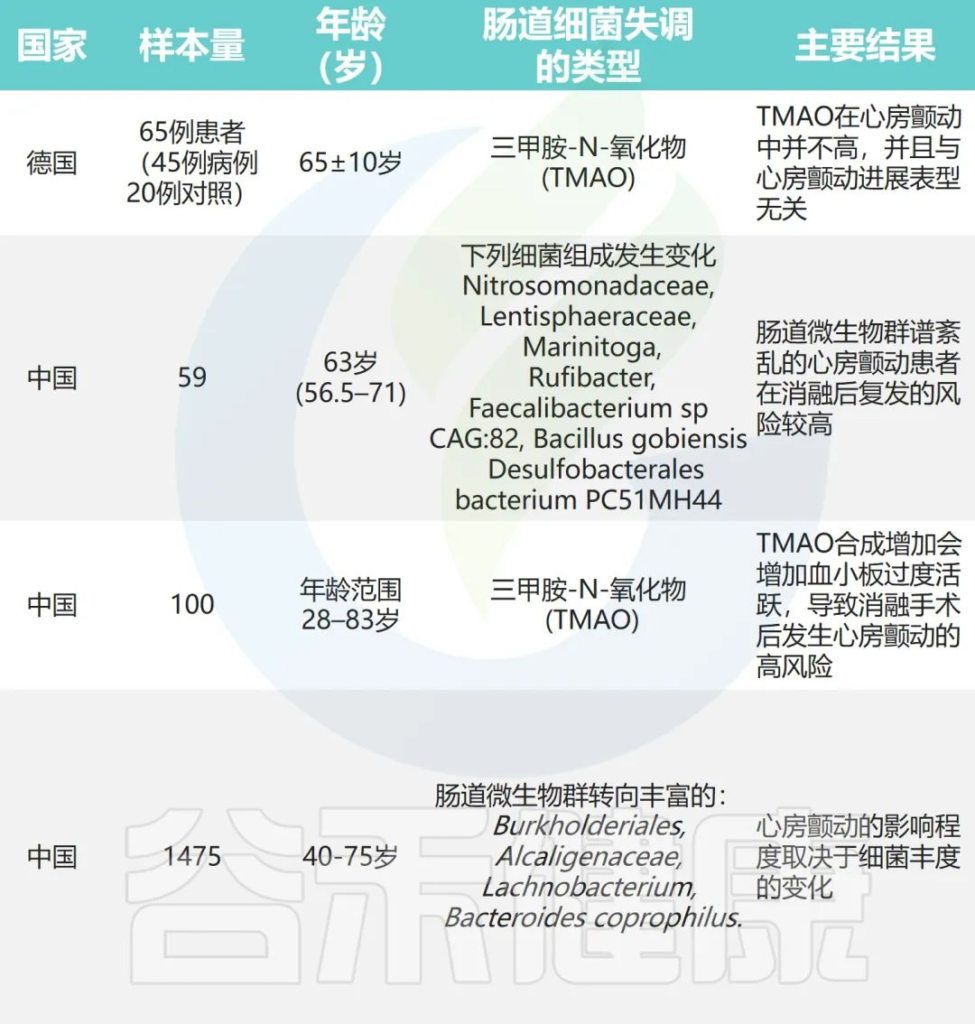


Rashid S,et al.Ann Noninvasive Electrocardiol.2023
▼
房颤,作为心律失常的一种重要类型。肠道微生物组与房颤的关系已得到初步认识,肠道微生物组及其代谢产物在心房结构重塑和电重塑方面与房颤的发生密切相关。
宏观基因组学和代谢组学分别作为研究肠道微生物组组成及其代谢物变化的重要研究工具,在探索肠道微生物组与心律失常的关系中发挥着重要作用。
最近,一些研究报告了与健康对照组相比,房颤患者中肠道微生物群变化的特征。
▷房颤患者体内有害细菌过度生长
使用宏观基因组学和代谢组学技术分析了50名健康对照者与50名房颤患者的肠道微生物群及其代谢物的组成。
研究发现,房颤患者的肠道微生物群中基因数量显著增加,样本内多样性(香农指数)也增加,这表明他们的肠道菌群具有更高的丰度和多样性。
较多的基因和属种表明房颤患者体内可能存在多种有害细菌过度生长。瘤胃球菌(Ruminococcus)、链球菌(Streptococcus)、韦荣氏球菌(Veillonella)和肠球菌(Enterococcus)等属在房颤患者中更为富集。
瘤胃球菌具有与炎症性肠病发展相关的促炎特性;链球菌在患有高血压、慢性心力衰竭和急性心血管事件的人群中也被证明是升高的。
来自日本的一项研究表明,与对照组相比,房颤患者的肠杆菌(Enterobacter)减少,而副拟杆菌(Parabacteroides)、Lachnoclostridium、链球菌(Streptococcus)和另枝菌属(Alistipes)增加。
▷胆汁酸、油酸含量显著下降
对健康受试者和房颤患者的粪便和血清样本进行代谢组学分析,其中胆汁酸、油酸、亚油酸和α-亚麻酸的含量显著降低。
研究表明,油酸、亚油酸和α-亚麻酸具有心脏保护作用,亚油酸和α-亚麻酸可以预防和终止由溶血磷脂酰胆碱或酰基肉碱引起的心律失常。
▷丁酸弧菌等有益菌的减少
心房颤动是一种进行性疾病。根据发作持续时间可分为阵发性房颤和持续性房颤。
采用宏基因组学和代谢组学相结合的分析方法来研究房颤持续时间与肠道微生物群之间的关系。
该研究包括20名健康个体、20名持续性房颤患者、12名房颤持续时间小于12个月和8名房颤持续时间大于12个月的患者。
与对照组相比,阵发性房颤组和持续性房颤组瘤胃球菌和链球菌等的丰度增加。丁酸弧菌属随病程呈下降趋势,丁酸弧菌属可产生短链脂肪酸并对宿主有有益作用。
粪弧菌属(Vibrio faecalis spp.)随时间呈上升趋势,粪弧菌可以极大地促进慢性精神分裂症患者发生冠心病。
心律失常组和对照组之间肠道微生物群的变化
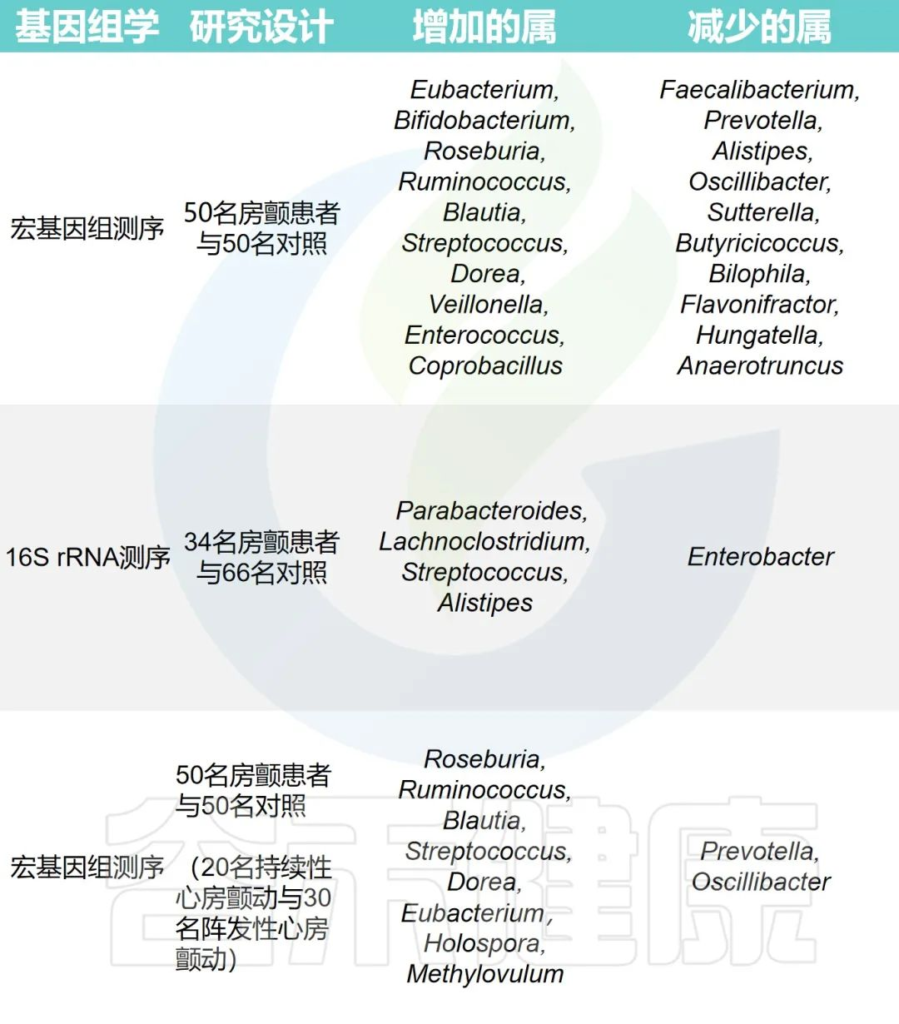

Fan H,et al.Front Cell Infect Microbiol.2023
这些证据表明,有益菌的减少或致病菌的增加以及代谢物的改变可能与心房颤动密切相关,甚至可能在心脏结构重塑中发挥关键作用。
▼
室性心律失常是临床最常见的心律失常之一。之前的一项研究发现左心室间隔或后壁厚度是室性心律失常发病率和复杂性增加的重要因素。而胎儿左心室生长可能是室性心律失常的原因之一。
▷新生儿肠道微生物多样性较低影响左心室后壁厚度
研究发现胎儿左心室生长与出生时肠道微生物群的组成有关,其中新生儿左心室后壁的厚度与肠道微生物群多样性较低有关,以及抗重塑作用相关的细菌(乳杆菌等)的耗竭和与炎症功能相关的细菌的富集(肠杆菌类等)。
肠道微生物群诱导的促炎特征在胎儿发育过程中促进心室生长,孕妇早期基于微生物群的调节可能会降低室性心律失常的发生率和不良结局。
肠道可以通过促进全身炎症和感染来影响危重患者。宿主防御机制在应激和粘膜缺氧的情况下分解,导致细菌和毒素的转移,从而通过内源性和外源性炎症反应引起心肌损伤。
▷婴儿早期室性心律失常与肠道微生物相关
根据研究,室性快速心律失常与50%至75%的心源性猝死直接相关。最近发现,与健康对照婴儿相比,在婴儿猝死综合症婴儿的肠道中发现了更高比例的艰难梭菌、Cl. innocuum和多形拟杆菌(B.thetaiotaomicron)。
多形拟杆菌(B.thetaiotaomicron)似乎介导粘膜-肠道屏障的形成,并通过其对物种特异性蛋白质抗生素表达的影响来帮助抵御病原体入侵。
致病性梭菌会破坏EC紧密连接或引发炎症反应,这两者都会损害肠壁的完整性。因此,婴儿早期室性心律失常可能与异常肠道微生物的建立有关。对于婴儿的健康和早期发育,创造健康的肠道微生物被认为是至关重要的。
▼
肠道微生物代谢就会产生生物活性代谢物,这些代谢物可以直接或间接影响宿主的生理过程。
肠道微生物群衍生的代谢物可以被宿主肠道吸收,影响肠道免疫细胞,并在宿主循环中检测到。它们充当信号分子影响重要的代谢途径。一些代谢物已被证明可以调节心律不齐的促进机制。
肠道微生物群衍生代谢物对心律失常的影响
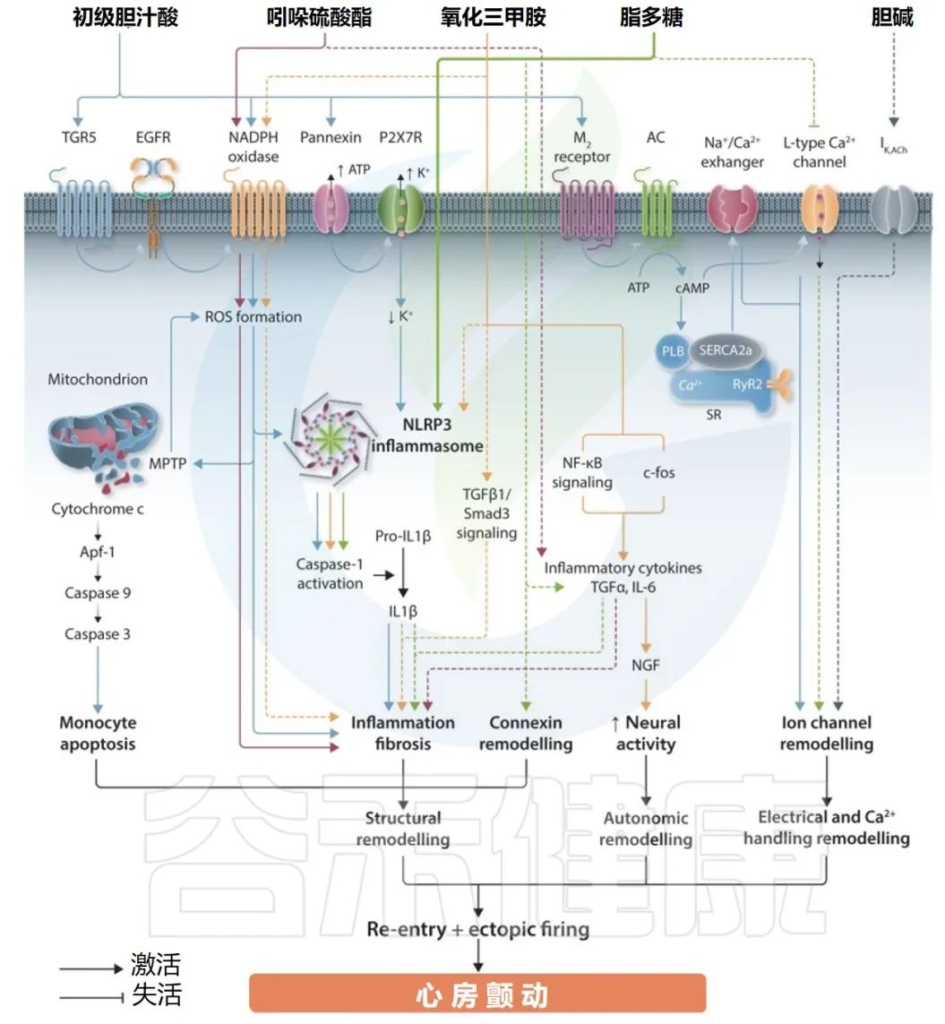
Gawałko M,et al.Cardiovasc Res.2022
1
氧化三甲胺
氧化三甲胺(TMAO)是含有肝黄素的单加氧酶氧化三甲胺的产物,也是参与房颤发病机制研究最广泛的微生物代谢产物。
氧化三甲胺过高影响房颤的发生
在犬模型中,局部注射氧化三甲胺激活心房自主神经节丛并促进心律失常,可能通过激活核因子-κB p65信号传导和增加炎症细胞因子的表达。
此外,在房颤患者的肠道中观察到三甲胺形成的微生物基因和三甲胺微生物生产者的显著增加。
尽管小型研究表明,血清氧化三甲胺水平升高可预测房颤患者的血栓栓塞事件,但这种关联的有效性和重要性需要在更多的房颤人群中进一步评估。
氧化三甲胺促进心律不齐的危险因素
此外,氧化三甲胺可能通过促进各种心律不齐危险因素(例如通过促动脉粥样硬化作用产生的代谢综合征和高血压、肾素-血管紧张素系统调节和主动脉硬化)来增强对房颤的易感性。
在蛋白质组学分析中,与非房颤受试者相比,房颤患者的心耳和血浆样本中的胆碱(TMAO前体)含量更高。
在对三个前瞻性队列进行的汇总分析中,血浆和膳食中胆碱的摄入量与后期房颤风险呈正相关。
2
硫酸吲哚酚
硫酸吲哚酚会引起氧化应激导致心律失常
在实验研究中,硫酸吲哚酚通过引起氧化应激和心肌细胞钙处理失调,增加肺静脉和左房心律失常的发生,并减少窦房结起搏器的活性。
在临床环境中,高浓度硫酸吲哚酚(≥0.65 μg/mL)可预测房颤复发风险3.7倍。相反,房颤的导管消融与硫酸吲哚酚血清浓度降低相关,这表明房颤本身可能会增加硫酸吲哚酚的产生。
在动物研究中,硫酸吲哚酚会增加促炎和促纤维化信号分子的表达,并引起氧化应激,从而可能导致房颤。
注:在这些实验研究中,所使用的硫酸吲哚酚浓度大大超出了其在血浆中的生理范围,使其在促进房颤中的潜在作用还不确定。
3
脂多糖
脂多糖是一种存在于革兰氏阴性菌(特别是埃希氏菌属)外层的内毒素。
脂多糖增加了心房促炎因子浓度
在犬模型中,给予脂多糖会增加心房促炎细胞因子的浓度,从而增加连接蛋白43的表达并导致连接蛋白偏侧化。
脂多糖会下调L型钙通道(α1C和β2亚基)的表达并缩短有效不应期。异常的钙处理和连接蛋白调节是诱导房颤的潜在机制。
L-型钙通道是一种电压依赖性钙通道。
脂多糖水平过高增加心血管疾病风险
尽管脂多糖对房颤发病机制的直接影响尚未研究,但脂多糖水平升高的房颤患者似乎有较高的不良心血管事件风险。
脂多糖可能通过加速动脉粥样硬化间接导致心律不齐,并可能诱发左心室功能障碍和心力衰竭,这两者都会增加心律不齐的风险。
4
胆汁酸
初级胆汁酸,例如鹅去氧胆酸,通过与氨基酸(牛磺酸或甘氨酸)结合形成胆汁盐,并进一步分泌到小肠中。
牛磺酸结合的胆汁酸可以通过心脏钠钙交换体刺激诱导膜电位变化并激活心肌细胞中毒蕈碱M2受体/乙酰胆碱调节的钾电流,这可能促进心房颤动。
鹅去氧胆酸等胆汁酸的水平影响心脏
鹅去氧胆酸已被证明可引起心房心肌细胞凋亡,这可能导致房颤的演变,促进结构重塑,通过法尼素X受体促进心脏损伤和纤维化,并通过NLRP3炎症小体激活加重炎症过程。
另一方面,熊去氧胆酸通过稳定细胞膜电位在预防心律失常中发挥作用。胆汁酸还可能通过参与葡萄糖和脂质代谢间接诱导房颤,并通过调节皮质醇和醛固酮水平的11β-羟基类固醇脱氢酶将血压维持在正常范围内。
5
短链脂肪酸
结肠微生物群发酵葡萄糖和膳食纤维会产生短链脂肪酸,主要是乙酸盐、丁酸盐和丙酸盐。
短链脂肪酸是房颤发病的潜在促成因素。短链脂肪酸负责促进粘液产生,从而改善肠道屏障功能,并且对于其中一些来说,还可以通过抑制组蛋白脱乙酰酶影响免疫调节。
短链脂肪酸水平过低会导致心律不齐风险升高
短链脂肪酸水平低会导致代谢物感应G蛋白偶联受体结合不良,从而损害肠道完整性并促进脂多糖等物质进入血液和组织。
丙酸盐刺激胰高血糖素样肽-1和肽YY的释放,降低肥胖风险并增加肾素释放,从而改变两个重要的心律不齐风险因素。
另外,乙酸盐会导致血脂异常,并通过大脑中副交感神经系统的激活增强胰岛素(由胰腺)和生长素释放肽(由胃粘膜)的分泌,从而促进肥胖。
心律不齐组和对照组之间的肠道微生物代谢
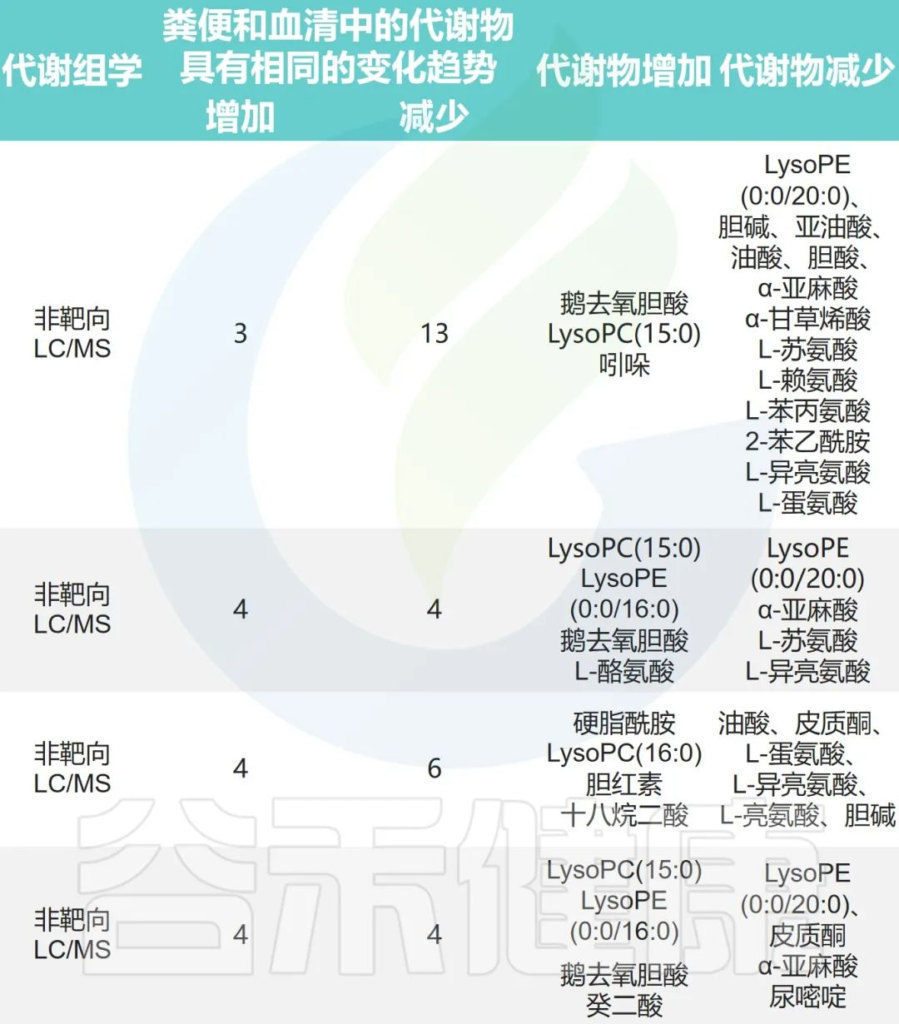
Fan H,et al.Front Cell Infect Microbiol.2023
小结
总之,这些研究表明:与健康人群相比,心律不齐人群经常伴随着肠道有益细菌的减少、心血管保护性代谢物的减少以及对健康有害的代谢物的增加。
近年来,越来越多的相关研究证明,肠道微生物紊乱与缺血性心肌病、心力衰竭、甚至心律失常有关。
下面将讲述肠道微生物如何利用代谢物、炎症因子、免疫细胞作为介质,通过神经、血液、直接作用于心肌组织,最终导致心律失常的发生。
肠道微生物群和代谢物引起心律失常的机制
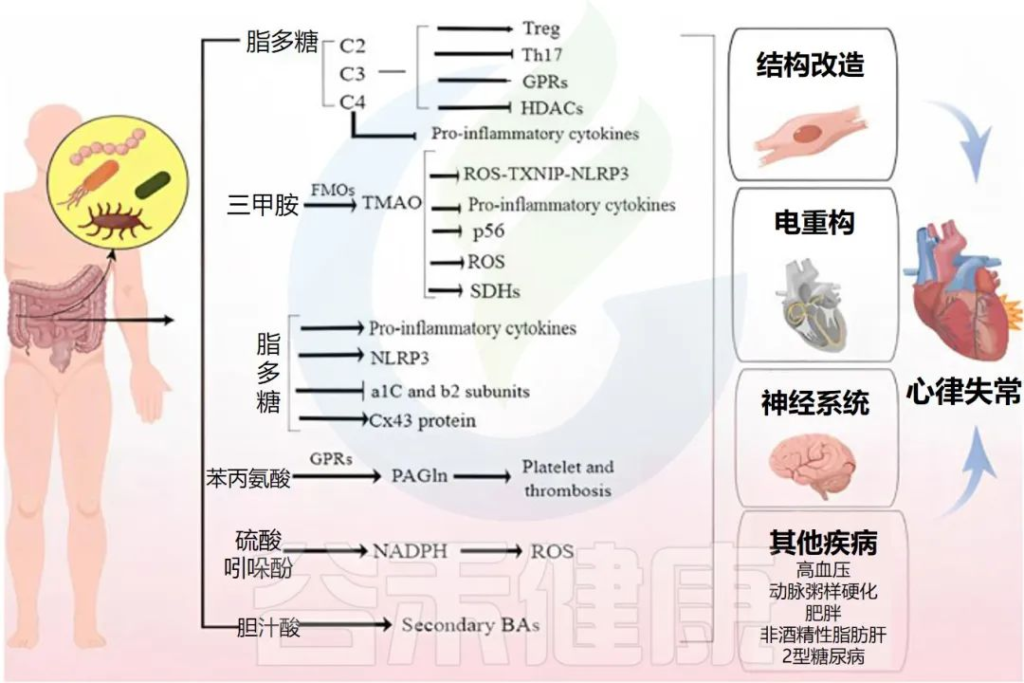
Fan H,et al.Front Cell Infect Microbiol.2023
▼
心肌重塑是指在快速心律失常的进展过程中,心肌原有的电生理和组织学特征发生了一定的变化。心肌重塑的主要表现之一是结构重塑,包括心肌细胞凋亡、心房基质纤维化等。
这主要是由于高血压、冠心病、糖尿病、肥胖等多种原因,导致心肌细胞内质网、线粒体等细胞器的结构、形态和数量发生变化,导致心肌细胞肥大、凋亡、坏死和心肌间质纤维化。
最后,肌壁不断增厚,心腔容积不断扩大,最终促进快速心律失常的发生。
短链脂肪酸通过减少炎症反应保护心血管
免疫炎症的减少可以通过肠道细菌产生的短链脂肪酸减轻心脏肥大、纤维化、血管功能障碍和高血压。
对免疫细胞的抗炎作用是通过短链脂肪酸实现的,例如丙酸可以诱导CD25+Foxp3+ Treg的分化和抑制功能。丙酸还通过抑制组蛋白脱乙酰酶或通过GPRs和嗅觉受体发挥心脏保护作用。
丙酸对心脏的保护主要取决于调节性T细胞的作用。
短链脂肪酸可以通过减少炎症反应对心血管的不利影响来预防或延缓心律失常的发生。
其他肠道代谢物通过炎症途径对心律失常的影响
肠道微生物产生的其他代谢物也可能通过炎症途径引起心律失常。
氧化三甲胺
氧化三甲胺激活NLRP3炎症小体导致人脐静脉炎症和内皮功能障碍。随着炎症标志物显著增加,活化的白细胞被招募来诱导血管炎症,这表明氧化三甲胺增强动脉粥样硬化和心血管风险的可能机制。
硫酸吲哚酚
硫酸吲哚酚可以通过氧化应激诱导肺静脉和房性心律失常。在窦性心律的患者中发现,射频电流导管消融后,患有高硫酸吲哚酚的房颤患者血清硫酸吲哚酚水平降低,这表明血清硫酸吲哚酚不仅可能诱发房颤,而且可能受到房颤的影响。
心肌肥厚和心肌纤维化影响心律失常
心肌肥厚和心肌纤维化是心律失常的重要原因。肠道微生物可以产生琥珀酸、乳酸、乙酰辅酶A,并进一步代谢成短链脂肪酸。其中一些与心肌肥大和心肌纤维化密切相关。
研究表明,丙酸可以在T细胞的帮助下减轻炎症反应,减轻小鼠心肌肥厚、纤维化、血管功能障碍和高血压。
亚油酸和α-亚麻酸抑制活性氧的产生并下调p38 MAPK途径β生长因子的激活和转化、发挥保护作用。它在心房纤维化中发挥调节作用,影响房颤的进展。
总之,有充分的证据表明,肠道微生物及其代谢物可以通过多种方式影响心肌肥大和纤维化,这很可能是心律失常发生的基础。
心肌细胞凋亡
鹅去氧胆酸已被证明可引起心房心肌细胞凋亡,这可能有助于结构重塑。鹅去氧胆酸与左心房低电压区呈正相关,可能促进心房肌细胞凋亡。
此外,丁酸通过抑制增殖和凋亡来促进血管平滑肌细胞的生长。氧化三甲胺通过琥珀酸脱氢酶复合物B亚基上调诱导活性氧促进血管内皮细胞凋亡,这可能有助于动脉粥样硬化病变的进展。
▼
心脏的功能就像机械泵一样,确保向全身和肺部持续供应血液。因此,人类心脏每天会进行100,000 次成功且协调的收缩。
由于心脏收缩受到严格的电调节,失衡会导致心律失常。这些收缩是由称为动作电位的电信号控制的。肠道微生物失衡引起的心肌重塑还反映在电生理重塑(心肌细胞膜表面离子通道的改变)。
通过钠离子通道影响心肌电活动
众所周知,钠通道是产生动作电位的关键通道,由此产生的细胞内和细胞外钠离子浓度的变化对心脏动作电位的产生很重要。
肠道微生物参与胆汁酸的代谢,胆汁酸诱导的心律失常发生的可能机制是与细胞膜和细胞膜离子通道或转运蛋白的相互作用。
研究发现牛磺胆酸通过刺激心肌中的钠钙交换诱导膜电位变化,导致内向电流密度增加和静息膜电位去极化,进而影响心肌电活动。
然而,也发现熊去氧胆酸在诱导心律失常方面无效,熊去氧胆酸偶联保护富含胆固醇的质膜免受疏水性胆汁酸的毒性作用,从而保护细胞免受心律失常的影响。
注:房颤患者的血清熊去氧胆酸偶联物水平明显较低,非熊去氧胆酸水平较高。
这表明,较高水平的毒性(致心律失常)和较低水平的保护性胆汁酸创造了一个心律失常阈值较低的环境,因此可能导致心律失常。
钾离子通道与持续性房颤相关
钾离子通道代表心脏中最多样化的离子通道,其中心脏乙酰胆碱激活的内向整流钾电流(IKACh)通道的激活是副交感神经系统对心脏功能的生理控制的重要组成部分。
目前,越来越多的研究证实,激活的内向整流钾电流被认为是持续性房颤中的背景内向整流器,因此有助于缩短动作电位持续时间并稳定高频电转子的形成,从而导致持续性房颤。
钙离子通过多种机制影响心律失常
Ca2+是一种普遍存在的第二信使,调节多种生物过程,包括激素产生、肌肉收缩、突触传递、增殖和死亡。越来越多的证据表明房颤和其他心脏疾病,与Ca2+相关。
因此,对心脏钙通道的任何影响都可能导致心律失常。在一项实验研究中,硫酸吲哚酚通过引起心肌细胞的氧化应激和钙处理失调,增加了肺静脉性心律失常和左心房心律失常的发生,并降低了窦房结起搏器的活性。
脂多糖还可以上调NLRP3系统,这除了引起结构重塑外,还可以导致心房动作电位的重新进入,促进收缩和舒张期间自发肌浆网Ca2+释放频率的增加,这可能导致去极化后延迟并触发异位活动,从而影响心肌电活动。
这些机制为钙调节促进心律失常提供了证据。
▼
人们对肠脑轴自下而上的信号传导知之甚少。然而,心脑轴的自上而下信号传导已被广泛研究。通过自主神经系统和迷走神经系统,神经系统可以控制心率。
心律失常可能是由于中枢神经系统限制副交感神经张力同时提高交感神经张力的能力而引起的。
注:神经系统调节心脏的机制非常复杂。植入的神经节丛中可能有数百到数千个自主神经元。
自主神经系统
心律失常的形成和维持在很大程度上取决于自主神经系统。
大脑和脊髓中的神经元以及连接心脏的神经组成了外源性心脏自主神经系统。在心脏本身以及沿着胸腔的大静脉中,自主神经元和神经构成了内在心脏自主神经系统的大部分。
•通过心脏自主神经系统调节房颤和室性心律失常
在犬模型中,局部注射氧化三甲胺可能通过激活 p65 核因子-κB 信号传导和增加炎症细胞因子的表达来激活心房自主神经丛并促进心律失常。
已经证明,房颤或室性心律失常的病理生理学是由心脏自主神经系统调节的。有证据表明,在发生室性心律失常之前,左心交感神经就已过度活跃,而左星状神经节的激活可大大增加室性心律失常发生的可能性。
研究结果表明,与对照组相比,静脉注射和局部氧化三甲胺治疗显著增强了左星状神经节功能和活性,从而提高了心脏交感神经张力,并恶化了缺血引起的室性心律失常。
同时,氧化三甲胺可显著促进促炎标志物的表达,如IL-1、IL-6、TNF-α,这可能进一步导致交感神经过度活跃并影响室性心律失常的发展。
迷走神经系统
调节心律受到迷走神经的负面影响。迷走神经放电增强钾通道电流,减少动作电位持续时间并稳定折叠转子。
•肠道微生物及其代谢物通过迷走神经影响心律
微生物群可以通过肠道内分泌细胞直接或间接触发迷走神经传入纤维。迷走神经传入纤维通过中枢自主神经网络刺激中枢神经系统。迷走神经传入纤维可以通过炎症反射触发传出纤维。
根据物质的不同,微生物群产生的不同代谢物可能以不同的方式激活迷走神经传入纤维。例如,油酸,一种长脂肪酸,通过胆囊收缩素介导的机制作用于迷走神经传入纤维;而丁酸,一种短脂肪酸,直接影响传入末梢。
Part 1
胃肠道疾病易诱发房颤
√较高的C反应蛋白增加心房颤动风险
炎症似乎在心律失常的发病机制中发挥着重要作用。C反应蛋白 (CRP) 升高与心房颤动相关,持续性心房颤动的平均C反应蛋白水平高于阵发性心房颤动中观察到的水平,表明炎症状态可能会促进心房颤动的持续存在。
C反应蛋白是一种非特异性炎性标志物,由肝脏合成的用于保护身体的急性时相反应蛋白。
在纵向研究中,较高的C反应蛋白会相应增加心房颤动风险。最后,在没有心血管合并症的情况下,严重败血症和急性全身炎症反应与新发心房颤动相关。
√炎症性肠病患者心房传导发生了改变
在一项研究中,观察到炎症性肠病患者的心房传导发生了改变,这是通过心电图上P波离散度的增加来衡量的。
在两项针对炎症性肠病患者的小型研究中,与参考对象相比,经胸超声心动图测量的心房机电传导时间延长。
丹麦的一项病例对照研究涉及24499例炎症性肠病病例和236275名年龄和性别匹配的对照,观察到在活动性炎症性肠病发作期间,房颤风险增加两倍,中风风险增加1.5倍。在炎症性肠病缓解期间,未观察到与房颤或中风的关联。
▼
在一些病例对照研究中,胃肠道恶性肿瘤,包括结直肠癌和食道癌,与房颤风险增加有关。
√结直肠癌患者发生房颤的风险更高
在一项研究中,与非癌症队列参与者相比,结直肠癌患者发生房颤的风险增加了一倍。
丹麦一项基于人群的病例对照研究观察到,结直肠癌患者的房颤患病率较高 [比值比为11.8],但患病率的增加仅限于癌症诊断后的前90天,这表明手术治疗癌症可能在很大程度上推动了这种关联。
√胃肠道手术后房颤风险增加
胃肠癌手术治疗后房颤的发生率很高,并且与手术结果不佳相关,包括肺部并发症、败血症、住院时间延长。
此外,在回顾性分析中,胃肠道癌症手术后发生房颤的患者在1年内发生心血管事件和60天内死亡的风险增加。
据报道,经胸食管切除术后房颤的发生率为10%至46% 。
Part 2
房颤患者易得胃肠道疾病
▼
在房颤患者中,缺血主要继发于心脏栓塞事件,而不是原位血栓栓塞。房颤患者心脏栓塞事件的主要风险因素包括既往卒中或短暂性脑缺血发作史,年龄大于75岁、高血压和结构性心脏病。
√房颤患者易发生肠系膜缺血
特别是,患有房颤的女性发生血栓栓塞的风险增加,包括肠系膜缺血。内脏-肠系膜血管系统栓塞是外周血栓栓塞疾病的第二常见部位,仅次于上肢和下肢的血管。
在一项基于房颤患者研究中,随着房颤评分的增加,发生肠系膜缺血的风险更高,评分为⩾2的患者与评分为0的患者相比,风险增加了三倍。
Part 3
与心律失常相关的其他疾病
▼
肠道微生物可以影响血压,而高血压患者通过多种作用方式参与心律失常。
√房颤、室性心律失常的发生率与高血压呈正相关
房颤、室性心律失常和猝死的发生率与以心脏重构为表现的高血压病程呈正相关。高血压患者心律失常发生的机制和表现通过心脏环境的宏观和微观变化影响心律失常的发展,导致电学和结构的改变。
高血压进一步促进左心室肥厚,这是心律失常的危险因素。长期升高的后负荷和心内压会导致心肌细胞肥大并激活心肌成纤维细胞。心肌细胞肥大和心肌成纤维细胞胶原沉积增加导致心肌质量增加,导致左心室肥厚。
已经确定,左心室肥厚可能通过诱发心肌缺血、心肌需氧量增加以及左心室舒张功能障碍而增加发生心律失常的风险。
肠道微生物群也会影响血压
据了解,缺乏肠道微生物的无菌小鼠的血压比传统小鼠的血压要低。与此同时,将人类高血压捐献者的粪便移植到无菌小鼠体内会导致这些小鼠血压升高。高血压中具有产生舒张代谢产物特性的细菌种类数量的减少也表明肠道微生物群会影响血压。
▼
动脉粥样硬化也是诱发心律失常的危险因素之一。当动脉粥样硬化影响传导系统,阻碍冲动传导时,就会引起各种心律失常。
√动脉粥样硬化会导致急性心肌梗塞与心律失常
急性心肌梗死是动脉粥样硬化的严重后果,经常与 心律失常一起发生,这会增加患者在医院接受治疗时突然死亡的风险和预后不良。
肠道微生物通过其代谢物参与动脉粥样硬化。具体而言,动脉粥样硬化患者的大肠杆菌(Escherichia coli)、克雷伯氏菌属(Klebsiella spp.)和产气肠杆菌(Enterobacter aerogenes)的丰度显著增加,而两种产生丁酸的细菌——Roseburia gutis和粪杆菌的丰度则下降。
肠道微生物的代谢产物可通过增加内皮活性氧的产生和损害内皮介导的血管舒张而参与动脉粥样硬化。
▼
肠道微生物研究表明,正常微生物群的失衡可能导致多种炎症性疾病,其中肥胖和胰岛素抵抗是肠道微生物失衡和能量失衡引起的主要疾病。
√糖耐量异常和肥胖是心律失常的重要原因
同时,糖耐量异常和肥胖也是心律失常的重要原因之一。糖尿病患者动脉粥样硬化和血栓形成的概率会增加,从而导致急性冠状动脉缺血性心脏病或心律失常。
细菌多样性的整体减少和细菌基因表达的改变被认为是影响代谢途径的主要原因,这可能与肥胖有关。
心律失常是一个缓慢发生且具有复杂机制的过程。从肠道菌群及其代谢物的角度出发,临床医生可以获得预防和治疗糖尿病/肥胖合并心律失常的新视角。尽管如此,还需要大量实验来证实。
▼
非酒精性脂肪性肝病是一种以肝脏细胞内脂肪过度沉积为主要特征的临床病理综合征,是最常见的肝脏疾病。
√非酒精性脂肪肝病提高了心律失常的易感性
非酒精性脂肪性肝病是一种多系统疾病,可能导致脂质和葡萄糖等代谢不良、炎症和氧化应激以及其他全身性有害后果。这些改变可能协同作用,增强心脏的结构、电和自主神经重塑,从而提高心律失常的易感性。
此外,心包脂肪体积或厚度与房颤的患病率和严重程度相关,大多数报告显示非酒精性脂肪肝病与心外膜脂肪体积或厚度呈正相关。
√肠道微生物通过肠-肝轴影响心律失常
肠-肝轴是肠道微生物群与肝脏之间的联系。肠道菌群功能障碍可能导致病原体相关分子模式的产生、粘膜屏障通透性增加导致肝脏炎症以及肝病的发生和进展,并且发现与健康人相比,肝病患者的微生物群多样性较低。
肠道及肝脏问题以多种方式显著影响心律失常。总之,非酒精性脂肪肝与心律失常密切相关,但现有证据并不完善,需要我们继续研究。
▼
阻塞性睡眠呼吸暂停综合征是一种在睡眠时导致呼吸暂停和通气不足的疾病,其特征是打鼾、睡眠模式紊乱、血氧饱和度频繁下降以及白天疲劳。
√睡眠呼吸暂停综合征通过多种途径诱发心律失常
阻塞性睡眠呼吸暂停综合征患者通过多种病理生理途径与心律失常的发生有关,包括呼吸暂停引起的缺氧、胸内压力变化、交感神经失衡、心房重塑、氧化应激、炎症和神经体液激活。
睡眠期间的缺氧会促进交感神经活动,这是诱发心房颤动的关键机制。因此,阻塞性睡眠呼吸暂停综合征本身可能促进心房颤动的发展。
现有的研究表明,患有心房颤动的人肠道中Ruminococcus gnavus为主的类型有所增加。因此,我们推测阻塞性睡眠呼吸暂停综合征和心房颤动病理生理过程的共同原因可能是由于肠道微生物群的改变,尤其是瘤胃球菌的增加。
▼
前不久的新冠肺炎对人类的影响是巨大的。SARS-CoV-2病毒主要影响上呼吸道,但也可能导致危及生命的肺部问题。在一些患有轻度至重度 COVID-19的人中,肠道微生物受到广泛干扰,这种干扰可能会持续长达一个月甚至更久。
√新冠肺炎是心律失常的危险因素
研究表明,新冠肺炎患者中存在心律失常的情况。这可能是由于病毒直接感染心肌细胞,或是由于免疫系统的异常反应所引起的。心律失常在新冠肺炎患者中可能表现为心率不齐、心动过速或心动过缓等症状,严重情况下甚至可能导致心脏骤停。
与其他呼吸道病毒感染一样,COVID-19可能与恶心、呕吐、腹痛和腹泻等胃肠道症状有关。由于影响肠道的途径是通过免疫和神经系统存在的,它们不仅对肠道微生物做出反应,而且还调节其组成。
循环淋巴细胞是两个器官之间的直接免疫接触,因为这些细胞不会停留在一个地方,它们在肠道和气道粘膜上巡逻。“肠肺轴”是这些器官“交流”的串扰。
综上所述,肠道微生物会通过各种分泌物引发心律失常,而SARS-CoV-2病毒由于“肠肺轴”的存在,可能是心律失常的危险因素。
心律失常作为一种心脏疾病,会给患者的健康和生活质量带来严重负面影响。因此,需要不断努力追求治疗心律失常的方法和策略。
在治疗心律失常方面,致力于整合多种治疗方法,包括药物治疗、手术治疗和其他创新疗法(例如肠道微生物干预)。需要根据患者的具体情况和心脏功能,制定最适合其需求的个性化治疗。
1
饮食调整: 多吃有益的脂质和膳食纤维
一些研究调查了不同食物成分和饮食模式对肠道菌群的影响,这可能是未来通过肠道微生物群治疗心律失常的重要目标。
•脂肪摄入过多会导致心律失常
最近的一项研究表明,房颤患者倾向于从动物脂肪中获取更多能量。至于肠道微生物群与脂肪摄入量之间的相关性,拟杆菌门与房颤患者的脂肪摄入量(特别是动物脂肪)呈弱负相关,而厚壁菌门则呈现相反的相关性。
•地中海饮食有助于降低心律不齐风险
代谢性内毒素血症和慢性炎症可能是脂肪摄入诱发房颤的机制。摄入油酸可以显著降低心血管疾病的风险,因为它可以抑制氧化应激,从而减轻心肌细胞损伤。
地中海饮食可以有益地影响肠道微生物群和相关代谢。以蔬菜为主的饮食人群具有更好的微生物代谢组。一项针对房颤患者的研究表明,地中海饮食可以降低氧化应激,从而降低房颤风险。
2
补充益生菌、益生元
研究表明,肠道微生物的失衡与心律失常的发生有关。肠道微生物在治疗心律失常方面具有潜力。因此,调整肠道微生物的组成可能成为未来心律失常治疗的一种新方法。
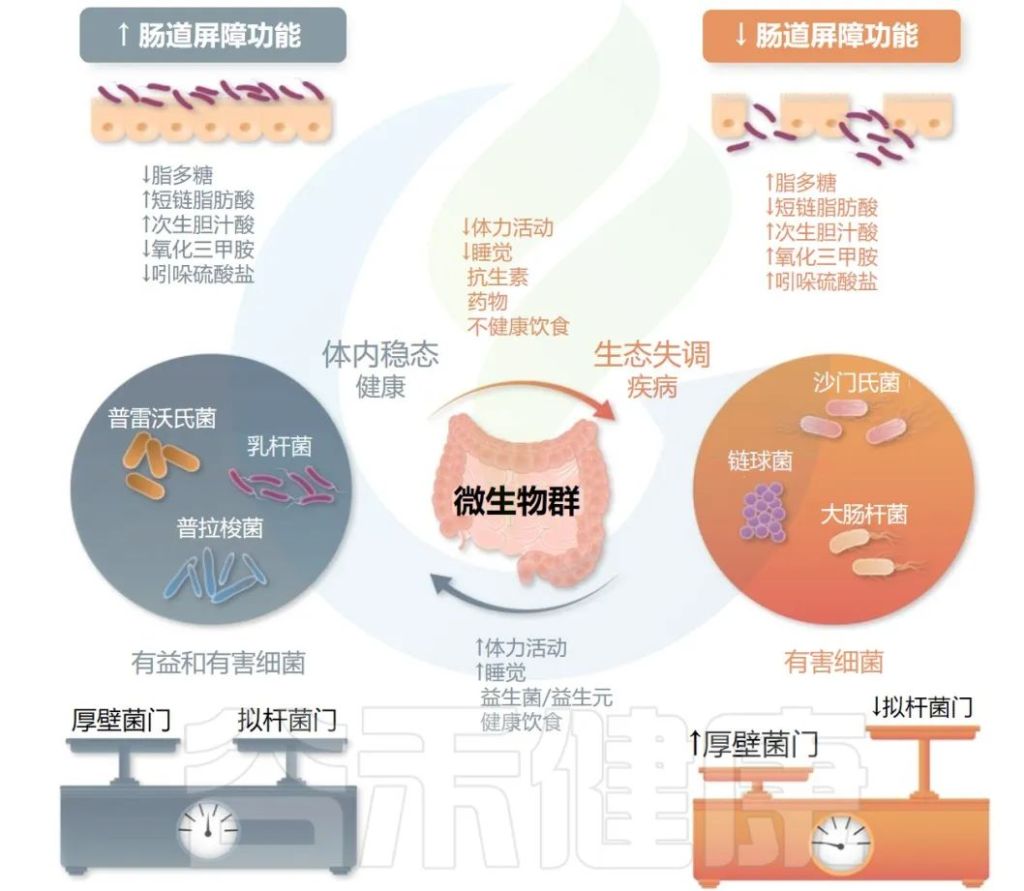
编辑
Gawałko M,et al.Cardiovasc Res.2022
•服用益生菌缓解了动脉粥样硬化
几项临床研究发现,口服嗜酸乳杆菌(L.acidophilus ATCC 4356)可以通过调节小鼠的氧化应激和炎症过程来缓解动脉粥样硬化的进展。
•益生菌促进了残留药物的降解
益生菌还可以影响药物的代谢。胺碘酮是市场上主要的抗心律失常药物,具有心外毒性,因此研究人员重点寻找改善体内残留胺碘酮代谢的方法。
研究发现酿酒酵母菌株OBS2是一种具有治疗潜力的益生菌,可以在体外和体内促进残留胺碘酮的降解。
•益生元可以减少心肌损伤
益生元是一类可促进肠道益生菌生长和活性的物质,其健康益处取决于微生物的新陈代谢。目前果聚糖(低聚果糖和菊粉)和半乳聚糖(低聚半乳糖)在益生元类别中的主导地位已被数十项研究证实。
一项在大鼠缺血再灌注模型中进行的研究得出结论,阿拉伯半乳聚糖可以抑制细胞凋亡,从而减少心肌损伤。
此外,源自红酒的多酚白藜芦醇通过抑制细胞内钙的释放而具有抗心律失常特性。在小鼠模型中,白藜芦醇通过肠道微生物群重塑降低氧化三甲胺水平并增加肝脏胆汁酸合成,从而减轻动脉粥样硬化。
3
药物与肠道微生物的相互作用
大量研究表明药物和肠道微生物群之间存在双向作用,这也可能调节药物代谢。例如,迟缓埃格特菌(Eggerthella lenta)通过还原内酯环产生无活性产物来灭活地高辛。
•肠道微生物增强了心血管药物的利用度
此外,肠道微生物酶活性参与了一些心血管药物的首次通过清除,包括钙通道阻滞剂和非甾体抗炎药,当患者接受抗生素预处理时,增加了这些药物的生物利用度。
•心血管药物对肠道微生物存在显著影响
同时,许多临床使用的药物可以增强或降低肠道微生物群或肠道微生物群衍生代谢物的生长速度。对荷兰一项队列研究的1135名参与者的粪便样本进行宏基因组测序显示,使用多种心血管药物,包括他汀类药物、抗血栓药物、 受体阻滞剂和血管紧张素转换酶抑制剂,对肠道微生物组有显著影响。
4
粪菌移植
粪便微生物移植作为一种安全的治疗方法被广泛应用于胃肠道疾病及胃肠外疾病的治疗。
•粪菌移植可以有效减轻甚至治愈疾病
从健康受试者到患有菌群失调相关疾病的受试者的菌群移植可以减轻甚至治愈这种疾病。在一项研究中,将血压正常大鼠的盲肠内容物移植到自发性高血压大鼠体内可降低血压,而对自发性高血压大鼠进行粪菌移植后,血压正常的大鼠会出现高血压。
最近,将来自高脂肪饮食喂养的小鼠的粪便微生物移植到正常饮食喂养的小鼠中,他们发现对房颤的易感性显著增加。
接受高脂饮食小鼠粪菌移植的小鼠遭受由脱硫弧菌(Desulfovibrionaceae)引起的代谢内毒素血症,该血症循环脂多糖升高,破坏肠道组织结构,并增加左心房促炎因子。
5
免疫调节剂
组蛋白脱乙酰酶在钙稳态、房颤发生和心力衰竭中起着至关重要的作用,因此组蛋白脱乙酰酶抑制剂可能是潜在的治疗方法。
•组蛋白去乙酰酶抑制剂降低了心律失常的发生
组蛋白去乙酰化酶抑制剂通过拯救线粒体生物能量学来治疗心脏功能障碍,即TNF-α诱导的线粒体功能障碍,降低能量利用率。
另一项在房颤兔身上进行的研究表明,组蛋白去乙酰化酶抑制剂可以降低钙稳态诱导的房颤和肺静脉心律失常的发生,房颤持续时间缩短。
注:MPT0E014处理的心肌细胞钙瞬态振幅、钠钙交换电流和ryanodine受体表达的降低可能是组蛋白去乙酰化酶抑制剂治疗心律不齐的潜在机制。
6
病因治疗和药物治疗
•病因治疗
病因治疗包括纠正心脏病理改变、调整异常病理生理功能(如冠脉动态狭窄、泵功能不全、自主神经张力改变等),以及去除导致心律失常发作的其它诱因(如电解质失调、药物不良副作用等)。
•药物治疗
药物治疗缓慢心律失常一般选用增强心肌自律性或加速传导的药物,如拟交感神经药(异丙肾上腺素等)、迷走神经抑制药物(阿托品)或碱化剂(克分子乳酸钠或碳酸氢钠)。
治疗快速心律失常则选用减慢传导和延长不应期的药物,如迷走神经兴奋剂(新斯的明、洋地黄制剂)、拟交感神经药间接兴奋迷走神经(甲氧明、苯福林)或抗心律失常药物。
多项证据表明肠道微生物群的变化可能是心律失常的重要诱发因素。肠道微生物可以通过短链脂肪酸、胆汁酸等代谢物,改变心肌细胞的电活动,从而调节心律。
其次,肠道微生物的失衡可能导致免疫系统的异常活化,诱发心律失常的发生。某些肠道菌群的代谢产物,如脂多糖、细菌毒素等,可能引发炎症反应,损伤心肌细胞,进而导致心律失常。
然而,肠道微生物与心律失常的具体关联和机制仍需进一步的研究和探索。目前,通过调整饮食结构、补充益生菌和使用粪菌移植等策略,可以尝试改善肠道微生物组成,从而对心律失常的治疗产生积极的影响。
但需要强调的是,个体差异和复杂性限制了一刀切的推广,治疗方案应当根据具体情况进行调整和制定。
主要参考文献
Fan H, Liu X, Ren Z, Fei X, Luo J, Yang X, Xue Y, Zhang F, Liang B. Gut microbiota and cardiac arrhythmia. Front Cell Infect Microbiol. 2023 Apr 25;13:1147687.
Gawałko M, Agbaedeng TA, Saljic A, Müller DN, Wilck N, Schnabel R, Penders J, Rienstra M, van Gelder I, Jespersen T, Schotten U, Crijns HJGM, Kalman JM, Sanders P, Nattel S, Dobrev D, Linz D. Gut microbiota, dysbiosis and atrial fibrillation. Arrhythmogenic mechanisms and potential clinical implications. Cardiovasc Res. 2022 Aug 24;118(11):2415-2427.
Frampton J, Ortengren AR, Zeitler EP. Arrhythmias After Acute Myocardial Infarction. Yale J Biol Med. 2023 Mar 31;96(1):83-94.
Li W, Li C, Ren C, Zhou S, Cheng H, Chen Y, Han X, Zhong Y, Zhou L, Xie D, Liu H, Xie J. Bidirectional effects of oral anticoagulants on gut microbiota in patients with atrial fibrillation. Front Cell Infect Microbiol. 2023 Mar 24;13:1038472.
Zuo K, Yin X, Li K, Zhang J, Wang P, Jiao J, Liu Z, Liu X, Liu J, Li J, Yang X. Different Types of Atrial Fibrillation Share Patterns of Gut Microbiota Dysbiosis. mSphere. 2020 Mar 18;5(2):e00071-20.
Li N, Durgan DJ, Wehrens XHT. Gut microbiota: a key regulator of ageing-associated atrial fibrillation? Cardiovasc Res. 2022 Feb 21;118(3):657-659.
Long MT, Ko D, Arnold LM, Trinquart L, Sherer JA, Keppel SS, Benjamin EJ, Helm RH. Gastrointestinal and liver diseases and atrial fibrillation: a review of the literature. Therap Adv Gastroenterol. 2019 Apr 2;12:1756284819832237.

谷禾健康

嗜血杆菌属(Haemophilus spp) 是变形菌门,小的、多形性、不活动、无孢子的革兰氏阴性杆菌或球杆菌。它们是需氧的和兼性厌氧的。主要寄居于人和动物的咽喉和口腔黏膜,少数见于生殖道,不过很多时候在粪便中也能检出。该病原菌能引起原发性化脓性感染及严重的继发感染。
嗜血杆菌属(Haemophilus)是一组细菌的名称。它们会引起不同类型的疾病,涉及呼吸、骨骼和关节以及神经系统。嗜血杆菌属的丰度与多种疾病和健康状态有关。例如,嗜血杆菌属在多发性硬化症、结直肠癌等患者中的丰度增加。
Photograph by David M. Phillips
嗜血杆菌属的过度生长与一些炎症性肠道疾病、肠道肿瘤和代谢性疾病的发生有关。嗜血杆菌属的存在可以引起肠道炎症反应,导致肠道黏膜的损伤和疾病的发展。
其次,嗜血杆菌属与一些疾病相关的菌群存在相互作用。例如,在某些研究中发现,嗜血杆菌属与肠道菌群中的某些菌属(如Prevotella、Roseburia、Subdoligranulum和Dorea)呈负相关。此外,嗜血杆菌属可能通过影响肠道菌群的代谢产物来调节疾病的发生和发展。例如,嗜血杆菌属与肠道代谢物(如丙酸和戊酸)的浓度呈负相关。
嗜血杆菌属包括许多可引起多种感染的菌种,但它们具有共同的形态,并且在生长过程中需要血源性因子,因此该属得名。
此外,嗜血杆菌属里比较受关注的是流感嗜血杆菌(Haemophilus influenzae)。
已知荚膜类的乙型流感嗜血杆菌(或是b型流感嗜血杆菌,简称HiB)是毒性的主因之一,通常会导致 2 岁以下儿童的血流侵入和脑膜炎,偶而地它会引致蜂窝组织炎、骨髓炎及关节感染。Hib 结合疫苗是减少嗜血杆菌相关疾病发病率的重要措施。对于住院患者,联合使用氨苄西林和氯霉素或单一头孢菌素如头孢呋辛、头孢噻肟或头孢曲松是有效的治疗方法。
本文一起来了解一下嗜血杆菌属的生物学特性,代谢途径,和其他菌群相互作用,与疾病之间的关联,耐药性和抗生素治疗等,嗜血杆菌属的研究对于理解呼吸道感染的发病机制、疫苗研发和公共卫生具有重要意义。
✓
嗜血杆菌属(Haemophilus)是一种人体常见的细菌属,它可以在人体的口腔、呼吸道和消化道中寄生。属于变形菌门,巴斯德氏菌科,该科还包含另外两个属:放线杆菌属和巴斯德氏菌属。
属于该科的细菌是小型(1 × 0.3 μm)、不形成孢子的球杆菌,具有苛刻的生长要求,通常需要补充培养基才能进行体外分离。
大多数嗜血杆菌属需要两种补充剂——因子 X(血红素)和 V(烟酰胺腺嘌呤二核苷酸,NAD)——才能在人工培养基上有氧生长。
巧克力琼脂平板上生长的流感嗜血杆菌菌落
doi:10.1186/2001-1326-1-10
但是注意,当细菌在实验室培养基上生长时,流感嗜血杆菌(Haemophilus influenzae)的生存力会迅速下降,通过未知的机制在 48 至 72 小时内变得不可培养。因此,如果需要,应在嗜血杆菌菌株在固体培养基上以离散菌落形式出现后立即对其进行永久储存。
▼
– 荚膜抗原(在胶囊化菌株中):抗吞噬细胞
– 粘附素蛋白(例如HMW1、HMW2)介导与气道中的人上皮细胞的附着。
– 菌毛和主要外膜蛋白 P2:将含有唾液酸的部分结合到上皮细胞表面。
不可分型流感嗜血杆菌是定植于人类呼吸道的主要病原体。细菌在哺乳动物组织上的粘附是由菌毛介导的,被认为是定植的重要前体,而上呼吸道感染与菌毛的存在有关。这些微生物引起的呼吸道感染包括鼻窦炎、中耳炎、急性气管支气管炎和肺炎。
– IgA1 蛋白酶:在铰链区裂解免疫球蛋白 A,防止凝集并机械消除病原体
– 相变:外表面蛋白质被修饰以适应宿主环境的变化。
– 体内生物膜的产生:在急性中耳炎的发病机制中尤其重要。
急性中耳炎是最常见的儿科细菌感染,在 5 岁之前的某个时期影响多达 75% 的儿童。肺炎链球菌和流感嗜血杆菌(主要是 NTHi)造成了高达 80% 的细菌急性中耳炎。
从儿童或成人急性感染的鼻窦或婴儿和幼儿受感染的鼓膜后面吸出的化脓性物质通常含有无法分型的流感嗜血杆菌。
外膜蛋白谱研究表明,中耳和鼻咽分离株是相同的,这支持了咽鼓管定植以及随后的阻塞和感染可能是其原因的观点。中耳炎的反复发作是由不同的菌株引起的。每次感染可能与针对独特表面蛋白的抗体的出现有关。随着年龄的增长,中耳炎的发病率逐渐降低,部分原因是解剖结构的变化,部分原因是对流感嗜血杆菌的免疫力。
▼
巴斯德氏菌科的几个 16S rRNA 序列特征已得到证实,但这些特征都不是目前定义的嗜血杆菌属所特有的。DNA 的 mol% G + C 为:37–44。
模式种:
其他研究的菌种包括:
其中以下菌种有致病性,但是致病机理和其他菌种的致病性还需要更多研究确定。
其中Haemophilus ducreyi和Haemophilus aegyptius容易形成生物膜。
注:许多细菌可以形成称为生物膜的聚集结构。生物膜中的生物通常表现出与处于个体状态或浮游状态的同一生物基本不同的特性。 聚集到生物膜中的细菌可以传达有关种群大小和代谢状态的信息。 这种类型的通信称为群体感应,通过产生称为自动诱导剂或信息素的小分子来进行操作。
群体感应分子【最常见的是肽或酰化高丝氨酸内酯(AHL;特殊的信号化学物质)】的浓度与生物膜中相同或不同物种的细菌数量有关,有助于协调生物膜的行为。
扩展阅读:
▼
Haemophilus生长最佳温度为 35–37°C。氧化酶和过氧化氢酶反应因菌株而异。化学有机营养型。所有物种都可以发酵碳水化合物,葡萄糖代谢产生乙酸、乳酸和琥珀酸作为最终产物。作为专性寄生存在于人类和多种动物的粘膜上。
KEGG 途径还包括:
▼
与肺炎链球菌的相互关系
嗜血杆菌与肺炎链球菌都能在人类的上呼吸系统中发现。一项有关它们之间的竞争研究指出,在培养基内,肺炎链球菌能以过氧化氢攻击流感嗜血杆菌,及能排除在表面流感嗜血杆菌生存所需的分子。
当两种细菌一同在鼻腔内时,两星期之内,只有流感嗜血杆菌能够生存。当两种细菌分别地放在鼻腔内时,两者皆能生存。使实验鼠的上呼吸组织暴露于两种细菌时,发现有格外大量的中性粒细胞。当实验鼠只是暴露于其中一种细菌时,则不会出现这些细胞。
实验显示,接触过嗜血杆菌死菌的中性粒细胞对肺炎链球菌会强烈攻击,而未接触过流感嗜血杆菌死菌的中性粒细胞的这种攻击则较不会这么强烈。
接触流感嗜血杆菌死菌,却不会对流感嗜血杆菌活菌有所影响。这种现象有两种可能性:
(1)当嗜血杆菌被肺炎链球菌攻击时,引发了免疫系统攻击肺炎链球菌。
(2)两种细菌的结合引发了只有其中一种细菌存在所不会引发的免疫系统警报。
至于为何流感嗜血杆菌会不受免疫系统的影响则不得而知。
与其他菌的互作
在一些研究中发现,普雷沃氏菌属(Prevotella)的相对丰度与Haemophilus的相对丰度呈负相关,这种互作可能对疾病的发展和治疗产生影响。
Haemophilus与厚壁菌门中的Roseburia、Subdoligranulum和Dorea之间存在负相关关系。这意味着Haemophilus的增加可能会导致这些厚壁菌门的特定菌属减少。
而比较惊讶的是在一些研究中发现,Haemophilus的相对丰度与Akkermansia的相对丰度呈正相关,这种互作可能对肥胖和代谢性疾病的发展产生影响,但是该结论还需要在更多的研究中验证。
在一些疾病中Haemophilus和拟杆菌属的相对丰度在一些疾病中呈现出相互竞争的趋势,这种互作可能对肠道微生物群的稳态和健康产生影响。
✓
Haemophilus influenzae
听名字可能会认为该菌是引起流感的元凶,但并不是,是因为流感嗜血杆菌是1892年被德国的一位细菌学家理查德.法伊弗医生在一位流感病人身上分离得到的,因此,此后一段时间流感嗜血杆菌也被认为是引起流行性感冒的病原体,直到1933年流感病毒被分离出来。1995年,第一个活体物种嗜血流感菌(Haemophilus influenzae,1.8Mb)的基因组测序完成。
分 类
流感嗜血杆菌是嗜血杆菌属主要病原体,它可分为有荚膜或可分型菌株,根据荚膜多糖的抗原结构,有七种类型(a至f,包括e’)和无荚膜或不可分型菌株。没有荚膜的菌株则较少侵略性,但它们能诱发炎症而产生其他病症,如会厌炎(主要症状有剧烈的喉痛、吞咽困难和呼吸困难等)。
注:荚膜是细菌比较常见的结构,是位于细胞壁表面的一种粘液型物质,也是重要的致病因子。荚膜可以帮助细菌抵抗人体免疫系统的吞噬和补体介导的溶菌作用,就如细菌的“防弹衣”或“盔甲”,人体的免疫系统原本可以很轻松的击毙细菌,而一旦细菌有了“防弹装备“”,它们就更容易存活下来。
荚膜多糖进化的一个可能的原因是,与缺乏荚膜的多糖相比,它们赋予细胞了一定的抗干燥性。这可能在宿主到宿主的传播过程中提供健康益处,这是细菌生命周期的关键部分。
流感嗜血杆菌可正常寄居于我们的上呼吸道,当抵抗力下降、免疫功能较差时,才会引起呼吸道感染。因此,婴幼儿、学龄期儿童、孕妇、老人等就成为了流感嗜血杆菌的主要攻击目标。作为儿童临床中常见的条件致病菌之一,是引起儿童社区获得性肺炎仅次于肺炎链球菌的致病菌。
人体内的常居部位及携带率
Haemophilus influenzae通常可以寄居在我们的呼吸道、眼结膜和阴道黏膜上。湿润的鼻咽黏膜就是它比较喜欢的栖息场所。
人群鼻咽部的Haemophilus influenzae的携带率受到了年龄、生理因素、人群密集程度、社会经济因素以及疫苗接种率等因素的影响。在未开展Haemophilus influenzae疫苗接种之前,发达国家约有3%~5%的健康学龄儿童是无症状Haemophilus influenzae的携带者。
它也是主要在上呼吸道发现的专性人类共生菌。最近临床从血液、痰液、肺泡灌洗液及阴道分泌物等各类临床标本中均有分离到Haemophilus influenzae,而且我们在粪便高通量测序检测实践中也检出Haemophilus influenzae,表明感染明显增多。
该菌作为一种苛养菌,其生长需要V和X因子,在培养中稍不留神容易漏检。临床标本中分离出的流感嗜血杆菌形态多种多样,从球杆菌到长丝状杆菌。这种不一致的形态和经常变化的染色(尤其是革兰氏染色中的沙弗宁)可能会导致临床微生物实验室的诊断混乱。
临床感染
流感嗜血杆菌(Haemophilus influenzae)可以导致多种类型的临床感染。
该菌可在局部蔓延引起非侵袭性疾病,如无菌血症的肺炎、中耳炎、鼻窦炎和结膜炎;
还可导致更为严重的侵袭性疾病,如脑膜炎、败血症、有菌血症的肺炎、会厌炎、脓性关节炎、心包炎、骨髓炎、软组织化脓及蜂窝组织炎等。
感染率
来自我国的研究发现,1990-1992 年中国合肥地区 Hib 脑膜炎占小儿细菌性脑膜炎的 51.7%。
复旦大学附属儿科医院对上海市 2000-2005 年 266 例临床诊断为细菌性脑膜炎的患儿进行致病菌抗原检测,Haemophilus influenzae阳性率为 15.4% 。5岁以下Haemophilus influenzae脑膜炎患儿的病死率为9.7%,存活患儿中21.4%的有精神和神经系统后遗症,主要包括硬膜下积液、听力和/或智力障碍、轻度瘫痪等。
感染宿主
流感嗜血杆菌非常适合人类宿主,并且没有其他已知的自然感染宿主。
据推测,大约一万年前,人类从“狩猎采集者”的生活过渡到以农业为基础的社区生活之后,就一直接触到一系列新型细菌。那时,人类开始与牲畜近距离生活,然后可能获得了嗜血杆菌的共同祖先,它也是其他几种嗜血杆菌的祖先。宿主特异性细菌,如放线杆菌和巴斯德氏菌,现在发现于牛和猪等家畜中。
代 谢
流感嗜血杆菌Rd菌株的全基因组序列极大地增加了我们对该细菌生物学的了解。嗜血杆菌似乎在代谢上适应了富氮、微厌氧的环境。编码三羧酸 (TCA) 循环中的三种酶(乌头酸酶、柠檬酸合成酶和异柠檬酸脱氢酶)的基因缺失。这解释了在特定的实验室培养基中生长期间需要通过 α-酮戊二酸进入 TCA 循环的谷氨酸。与大肠杆菌相比,嗜血杆菌中的双组分系统较少(总共六个)(>40);双组分系统将特定的环境信号(例如 pH 值、渗透压和阳离子浓度的变化)转换为细菌细胞内程序化的协调反应。显然,嗜血杆菌适应环境变化的机制与肠杆菌科等细菌的机制不同。
判别:流感嗜血杆菌
涂片镜检:采集肺炎患者的痰,脑膜炎患者的脑脊液或者患者感染部位的分泌物等,经革兰染色后显微镜下观察,如查见上述形态图中的红色细小杆菌将有助于诊断。
细菌培养:是诊断流感嗜血杆菌感染的金标准,但对于呼吸道标本,需要医生结合临床症状、标本质量等因素综合考虑是否为感染。
还可以通过检测血清中流感嗜血杆菌抗原或抗体,咽拭子、脑脊液,粪便等标本中流感嗜血杆菌基因测序来进行快速诊断。
传染源
虽然只有少部分携带者会发展为临床病例,但携带者是流感嗜血杆菌的主要传染源。
传播途径
主要经呼吸道飞沫传播,接触患者的呼吸道分泌物也可感染。新生儿可因吸入羊水或出生时接触产道分泌物而感染。
易感人群
该细菌的目标人群是免疫抑制/免疫抑制患者、脾切除患者和未接种疫苗的患者。此外,Haemophilus influenzae引起的疾病与年龄密切相关, 在未引入疫苗的地区,有超过60%的侵袭性疾病发生在1岁之前,主要集中在6-11月月龄的婴儿。而5岁及以上的儿童就很少发生由Haemophilus influenzae引起的侵袭性疾病了(少于10%)。由此婴幼儿是我们要重点关注的人群。
没有特定症状可以将流感嗜血杆菌肺炎与其他细菌区分开来。
可以怀疑 3 个月至 3 岁的儿童患有流感嗜血杆菌肺炎;而且疫苗接种状态不存在或不完整,最近使用抗生素或使抗生素后 48-72 小时内发烧未消退。
它不仅是肺炎的常见原因,而且会引起急性中耳炎,我们还应该怀疑上述相同经历的患者,特别是那些患有中耳炎并可能影响多个家庭成员的结膜炎的患者。
治 疗
流感嗜血杆菌感染需用抗生素治疗。使用哪种抗生素取决于感染的严重程度、感染部位以及药敏结果。
如果儿童出现严重感染,应将他们收入医院并予以隔离,以防止其他人接触到他们排放至空气中的飞沫(称作呼吸道隔离),隔离应持续至开始抗生素治疗后24小时。
脑膜炎必须尽早治疗。可静脉输注头孢曲松或头孢噻肟治疗流感嗜血杆菌脑膜炎。服用皮质激素有助于预防脑部损害。
会厌炎也必须尽早治疗。患者可能需要辅助呼吸。可能需要建立人工气道,如呼吸管插管,罕见情况下可能需要开放气道(称为气管切开术)。应给予一种抗生素,如头孢曲松、头孢噻肟或头孢呋辛。
由流感嗜血杆菌引起的其它感染可使用各种口服抗生素治疗。它们包括阿莫西林/克拉维酸钾、阿奇霉素、头孢菌素类、氟喹诺酮类等。
▼
Haemophilus aegyptius
埃及嗜血杆菌(Haemophilus aegyptius)值得特别提及,因为它可以引起类似脑膜炎球菌的疾病。在南美洲,这种微生物是导致巴西紫癜的原因。这种灾难性疾病在 10 岁以下儿童中尤为突出,通常以超急性结膜炎开始,随后在 3 至 5 天内出现发烧。48 小时内会出现播散性紫癜、低血压休克和死亡。
分子研究表明,引起巴西紫癜热的所有分离株都具有遗传相关性。最初,所有报告的病例都来自巴西圣保罗和邻近的巴拉那州,但其他地区出现了新菌株,引发了人们对该疾病可能在全球范围内传播的担忧。
致病性埃及嗜血杆菌的基因组大于非致病性菌株的基因组。细菌物种之间频繁的基因交换已被证明是这种遗传添加的基础。埃及嗜血杆菌个别菌株还可引起急性结膜炎,俗称“红眼病”,有高度传染性。
▼
Haemophilus ducreyi
杜克雷嗜血杆菌(Haemophilus ducreyi)是一种高度传染性的革兰氏阴性细菌,可通过性传播。它是性病感染的原因:软下疳。杜克雷嗜血杆菌在女性中仅引起轻微症状,而在男性中,下疳却极其疼痛。它会导致快速发展的病变,以与生殖器区域剧烈瘙痒相关的深度溃疡的形式出现。显微镜检查发现杜克雷嗜血杆菌。
▼
Haemophilus parainfluenzae
副流感嗜血杆菌是一种粘膜寄生菌,特别存在于口咽、泌尿生殖系统和直肠中。这是人类最常见的嗜血杆菌属,因为它占咽部菌群的 10%,有时在唾液中大量存在。这种病原体可引起呼吸道和耳鼻喉感染,特别是在免疫功能低下的人群中。副流感嗜血杆菌还可引起突发性心内膜炎。
✓
肠道微生物群中大量存在的嗜血杆菌是否会对健康产生积极或消极影响仍然未知。据报道,多发性硬化症、结直肠癌患者的嗜血杆菌丰度增加,并且也与腺瘤患者的结直肠癌发展相关。相反,嗜血杆菌属减少与 II 型糖尿病的发展有关,并且个别 II 型糖尿病的嗜血杆菌属的完全耗尽。
▼
研究发现,类风湿性关节炎(RA)患者口腔和肠道中的Haemophilus属菌群相对丰度较低。在类风湿性关节炎患者中,Haemophilus的相对丰度降低与类风湿性关节炎特异性自身抗体(抗环瓜氨酸肽)和类风湿因子的水平降低相关。这表明Haemophilus可能在类风湿性关节炎的发病和病理过程中发挥一定的作用。
注:抗环瓜氨酸肽抗体是以合成的环化瓜氨酸多肽(CCP)为抗原的自身抗体,对类风湿关节炎(RA)具有较高的敏感性和特异性,是RA早期诊断的一个高度特异指标。
类风湿性关节炎患者的唾液、牙菌斑和粪便样本中嗜血杆菌种类减少,类风湿性关节炎治疗后部分正常化。
肠道和口腔环境极其复杂,这些环境中的微生物群起着至关重要的作用。在维持体内平衡中发挥重要作用。据报道,随着肠道微生物群与免疫系统的接触减少,过敏性以及自身免疫性和炎症性疾病的发病率和患病率显著增加。
Haemophilus与炎症反应的调节
Haemophilus可能通过调节免疫反应参与类风湿性关节炎的发展。研究发现,Haemophilus属菌群的降低与炎症标志物的水平降低相关。例如,嗜血杆菌属与 C 反应蛋白(急性炎症标志物)呈负相关。
Haemophilus与肠道菌群失调的关联
类风湿性关节炎患者肠道菌群失调可能与Haemophilus的降低有关。肠道菌群失调已被认为是类风湿性关节炎发展的一个重要因素。Haemophilus与自身抗体的水平相关:Haemophilus的降低与类风湿性关节炎患者自身抗体水平的降低相关。自身抗体在类风湿性关节炎的发病和病情进展中起着重要作用。
▼
Haemophilus是一种与结直肠癌发病和发展相关的细菌。以下是Haemophilus参与结直肠癌的发病和发展的机制和关联线索:
肠道菌群失调
Haemophilus的丰度在结直肠癌患者中较高,与肠道菌群的失调有关。肠道菌群的失调可能导致炎症反应和免疫系统的异常,从而促进结直肠癌的发展。
炎症反应
Haemophilus可能通过引起炎症反应来促进结直肠癌的发展。炎症反应可以导致细胞损伤和DNA损伤,进而增加癌症的发生风险。
免疫调节
Haemophilus可能通过影响免疫系统的功能来参与结直肠癌的发展。它可能影响肠道免疫细胞的活性和功能,从而干扰对癌细胞的清除和抑制。
其他细菌的相互作用
Haemophilus可能与其他细菌相互作用,共同参与结直肠癌的发展。例如,与口腔菌群中的Fusobacterium相互作用可能导致肠道炎症和癌症的发展。
▼
多项研究报道了肠道内Haemophilus参与了多发性硬化(MS)的发病和发展。Haemophilus可能通过分子模仿来激活自身免疫T细胞,从而导致多发性硬化的发展。研究发现,Haemophilus的蛋白质结构与多发性硬化相关的蛋白质结构相似,可能引发自身免疫反应。此外,Haemophilus的丰度变化与肠道菌群失调有关。肠道菌群失调已被证明与多发性硬化的发展和进展有关。
多发性硬化症 (MS) 是一种中枢神经系统 (CNS) 脱髓鞘疾病。遗传和环境因素,如细菌或病毒感染,涉及其多因素病因。在推定与该疾病相关的病毒因子中,EB 病毒 (EBV) 已被多次报道,流感嗜血杆菌被描述为多发性硬化症可能的细菌触发剂。尽管多发性硬化症的病因和发病机制尚未完全阐明,但人们普遍认为,针对髓磷脂和其他相关蛋白的 T 细胞介导的炎症过程起着至关重要的作用,同时 B 细胞也可能发挥作用。
在多发性硬化症中,肠道内的甲烷短杆菌属、假单胞菌属、支原菌属、嗜血杆菌属、Blautia属和 Dorea属 增加。关于肠道微生物群对炎症性中枢神经系统病理学影响的更多数据已从多发性硬化症动物模型研究中获得。这些数据支持这样的观点,即肠道微生物群失调正在积极促进多发性硬化症的发生和进展。
▼
研究发现,Haemophilus的丰度在糖尿病患者粪便中发生了改变。另人意外的是,研究显示Haemophilus的减少与2型糖尿病的发展相关。Haemophilus可能通过与免疫系统的相互作用影响糖尿病的发展。一些研究发现,Haemophilus的存在与自身抗体水平的负相关性,这可能意味着Haemophilus的减少可能导致免疫系统的异常反应,从而增加糖尿病的风险。
另一项研究发现,布劳特氏菌属(Blautia)、嗜血杆菌属(Haemophilus)丰度与TIDM(I型糖尿病)自身抗体个数相关。Haemophilus可能与肠道菌群的变化相关,从而影响糖尿病的发展。
▼
慢性心力衰竭(CHF)是指一种持续性心力衰竭状态,可以稳定、恶化或失代偿。
个别研究显示嗜血杆菌和克雷伯氏菌在CHF患者的粪便中显着富集,可能意味它们可能是CHF的粪便生物标志物。作者进一步分析了肠道微生物群与血清代谢组之间的相关性。发现志贺氏菌与生物胞素和核黄素呈负相关。而嗜血杆菌与α-乳糖、纤维二糖、异麦芽糖、乳糖、蜜二糖、蔗糖、海藻糖呈负相关。
缺血性心脏病(IHD)是全球范围内人类死亡的首要原因。近年来研究表明,人体肠道菌群通过影响氧化三甲胺(TMAO)、苯乙酰谷氨酰胺(PAGln)、三甲基-5-氨基戊酸等相关代谢产物来促进IHD的发生和发展。宁波大学附属第一医院发现IHD患者毛螺菌科(Lachnospiraceae)和瘤胃球菌科(Ruminococcaceae)显著减少。且对疾病亚组分析提示,IHD患者的肠道链球菌属(Streptococcus)、嗜血杆菌属(Haemophilus)丰度显著富集。
前面讲过链球菌属和嗜血杆菌属的互作,它们都能在人类的上呼吸系统中发现。但是这两种菌呈现竞争趋势,而在肠道中这两种菌同时富集,可能是与上呼吸道不一样的生态模式,他们致病的机理还需要进一步探究。
▼
Haemophilus参与免疫系统的互作有以下几个方面的机制和关联线索:
SLPI调节
SLPI是一种抗菌肽,它在呼吸道中的丰度受到感染的调节。研究发现,Haemophilus的存在与SLPI的丰度增加相关。SLPI的表达调节是呼吸道微生物群和呼吸道黏膜免疫系统之间维持稳态的关键机制之一。
Haemophilus与哮喘
研究发现,Haemophilus在上呼吸道中的存在与成年人免疫控制不佳相关。这表明Haemophilus诱发的免疫可能在哮喘的发病机制中起到一定的作用。
锌补充与Haemophilus
锌是胎儿免疫系统发育的重要因素。研究发现,锌补充在孕期对贫困孟加拉婴儿对结核病卡介苗和流感嗜血杆菌b型疫苗的免疫反应有影响。
Haemophilus与免疫系统防御
Haemophilus居住在上呼吸道和口腔的黏膜上。多种Haemophilus菌株,如流感嗜血杆菌和溶血性流感嗜血杆菌,可以对抗宿主免疫系统并引起人类疾病。研究发现,IgAN患者对Haemophilus parainfluenzae的IgA抗体明显增多。IgA是黏膜免疫稳态的重要介质。
▼
一项研究(n=126)显示,与健康受试者相比,处于疾病不同阶段(急性与缓解期)的参与者的肠道细菌不平衡。嗜血杆菌丰度与精神分裂症阴性症状呈正相关(r = 0.303, P = 0.021),而粪球菌丰度与精神分裂症阴性症状呈负相关(r = – 0.285, P = 0.025)。这可以作为精神分裂症不同阶段的指标,也为精神分裂症的研究提供新的视角。
▼
一项研究基于 VFDB 数据库分析了食管鳞状细胞癌患者和肺癌患者中细菌的丰度和分布,嗜血杆菌的绝对丰度可以将肺癌与健康对照区分开来(P≤0.05),该研究为食管鳞癌和肺癌的鉴别提供了可能的方法,并为后续研究物种水平上潜在的人类病原体在癌症发生中的作用提供了数据支持。
▼
癫痫
少量研究显示特发性局灶性癫痫患者肠道菌群中的弯曲菌属、代尔夫特菌属、嗜血杆菌属、奈瑟菌属丰度显著增加,并且在10.6%的癫痫患者肠道中检测出梭杆菌门,而在对照组中未检出。
强直性脊柱炎
一项来自调查强直性脊柱炎患者(包括5名同时患有IBD的AS-IBD)、59名IBD患者和105名健康对照者中获取粪便和肠道活检样本。发现强直性脊柱炎疾病活动度指数(BASDAI评分)增加的强直性脊柱炎患者和粪便钙卫蛋白>100 μg/mg的IBD患者中观察到潜在致病性嗜血杆菌属的富集。
原发性胆管炎
肠道微生物群的变化会影响肠道和肝脏,它们通过所谓的“肠-肝轴”严格连接。原发性胆汁性胆管炎,也称为“原发性胆汁性肝硬化”。该病发病机制与肠道菌群失调有关,通过引起细菌性胆管炎,进而刺激促炎症机制,促进胆管细胞的纤维化和炎症。
一些研究报告显示,原发性胆管炎患者胆汁和粪便微生物组的改变以乳酸杆菌、梭杆菌和肠球菌的高丰度和低多样性为特征。原发性胆管炎患者还表现肠道内肠球菌属,罗氏菌属,梭菌属,链球菌属,嗜血杆菌属的过度生长。
桥本甲状腺炎
福建中医药大学附属人民医院89名参与的一项研究显示,游离三碘甲状腺原氨酸(FT3)调节的Romboutsia和Haemophilus可能促进桥本甲状腺炎的发展,而游离甲状腺素(FT4)调节的Faecalibacterium和Lachnospiraceae可能保护宿主。
检出案例
以下是疾病人群粪便样本中检出的嗜血杆菌,尤其流感嗜血杆菌,该菌是病原菌,过多可导致菌群紊乱,可引发呼吸道感染,肠道检出也常见于呼吸道感染或其他感染。
<来源:谷禾健康肠道菌群检测数据库>
(参考自:梅斯医学)
✓
氨苄西林曾经是治疗流感嗜血杆菌感染的经典药物之一,但是据2017年CHINET细菌耐药监测结果显示,流感嗜血杆菌对氨苄西林的耐药率均近45%或以上。其原因与不合理使用了3、4代头孢菌素、碳青霉烯类等广谱抗菌药物存在较大的关联。
贵州省一项研究,共收集住院患者临床分离株196株。所有研究的分离株均为不可分型流感嗜血杆菌(NTHi)。
氨苄西林、头孢克洛、阿奇霉素的耐药率分别为71.4%(140/196)、36.7%(72/196)、34.2%(67/196)。40.3% (79/196) 的菌株为 β-内酰胺酶阳性、氨苄西林耐药 (BLPAR)。β-内酰胺酶产生和 PBP3 突变的普遍存在可能导致局部氨苄青霉素耐药率较高。
临床上经验性选择氨苄西林用于临床治疗存在一定的风险;监测结果还显示,流感嗜血杆菌对除甲氧苄啶-磺胺甲唑外的其他抗菌药物敏感率均近70%或以上。因此,在未获得准确的药敏试验结果前,要根据患者病情及本地区的流调数据进行选药。比如可以考虑大环内酯类抗生素(阿奇霉素)和第1、2代菌素类抗生素为经验性治疗药物。
我们查阅其他研究资料显示,对于感染住院患者,联合使用氨苄西林和氯霉素或单一头孢菌素如头孢呋辛、头孢噻肟或头孢曲松可能是有效治疗嗜血杆菌的方法。
此外,针对儿童的b型流感嗜血杆菌(Hib),疫苗接种是预防2月龄-5周岁儿童由b型流感嗜血杆菌引起的侵袭性感染(包括脑膜炎、肺炎、败血症、蜂窝组织炎、关节炎、会厌炎等)主要的措施。
注意:以上仅供交流,不做医学建议。
主要参考文献
Chatziparasidis G, Kantar A, Grimwood K. Pathogenesis of nontypeable Haemophilus influenzae infections in chronic suppurative lung disease. Pediatr Pulmonol. 2023 Jul;58(7):1849-1860. doi: 10.1002/ppul.26446. Epub 2023 May 3. PMID: 37133207.
Shaikh N, Hoberman A, Paradise JL, Rockette HE, Kurs-Lasky M, Martin JM. Association Between Nasopharyngeal Colonization and Clinical Outcome in Children With Acute Otitis Media. Pediatr Infect Dis J. 2023 Aug 1;42(8):e274-e277. doi: 10.1097/INF.0000000000003956. Epub 2023 Apr 26. PMID: 37171965.
Zhou Y, Wang Y, Cheng J, Zhao X, Liang Y, Wu J. Molecular epidemiology and antimicrobial resistance of Haemophilus influenzae in Guiyang, Guizhou, China. Front Public Health. 2022 Dec 1;10:947051. doi: 10.3389/fpubh.2022.947051. PMID: 36530676; PMCID: PMC9751421.
Zhu C, Zheng M, Ali U, Xia Q, Wang Z, Chenlong, Yao L, Chen Y, Yan J, Wang K, Chen J, Zhang X. Association Between Abundance of Haemophilus in the Gut Microbiota and Negative Symptoms of Schizophrenia. Front Psychiatry. 2021 Jul 30;12:685910. doi: 10.3389/fpsyt.2021.685910. PMID: 34393849; PMCID: PMC8362742.
Du X, Liu J, Xue Y, Kong X, Lv C, Li Z, Huang Y, Wang B. Alteration of gut microbial profile in patients with diabetic nephropathy. Endocrine. 2021 Jul;73(1):71-84. doi: 10.1007/s12020-021-02721-1. Epub 2021 Apr 27. PMID: 33905112.
Kasai C, Sugimoto K, Moritani I, Tanaka J, Oya Y, Inoue H, Tameda M, Shiraki K, Ito M, Takei Y, Takase K. Comparison of human gut microbiota in control subjects and patients with colorectal carcinoma in adenoma: Terminal restriction fragment length polymorphism and next-generation sequencing analyses. Oncol Rep. 2016 Jan;35(1):325-33. doi: 10.3892/or.2015.4398. Epub 2015 Nov 4. PMID: 26549775.
Nocera A, Nasrallah HA. The Association of the Gut Microbiota with Clinical Features in Schizophrenia. Behav Sci (Basel). 2022 Mar 25;12(4):89. doi: 10.3390/bs12040089. PMID: 35447661; PMCID: PMC9025473.