-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
一个基因可以有多大?
十年前,在基因组测序的早期,研究人员在 580 种细菌和古菌物种的基因组中搜寻大基因。 他们发现,所有鉴定出的基因中有0.2% 的长度超过5,000 个碱基,其中 80 个是“巨型基因”,即大于 15,000 个碱基的基因。 从这个角度来看,原核基因的平均长度在 900 到 1,200 个碱基之间。
有一种细菌,绿硫细菌Chlorobium chlorochromatiii CaD3菌株中发现了两个最长的基因。这些基因编码36806和20647个氨基酸,相应的基因长度分别为110418和61941个碱基。
在进行这项研究时,这些巨型基因的长度仅超过38,138 个氨基酸的人类肌联蛋白编码序列。现在,科学家们已经确定了一系列长度超过 100 万个碱基的基因。
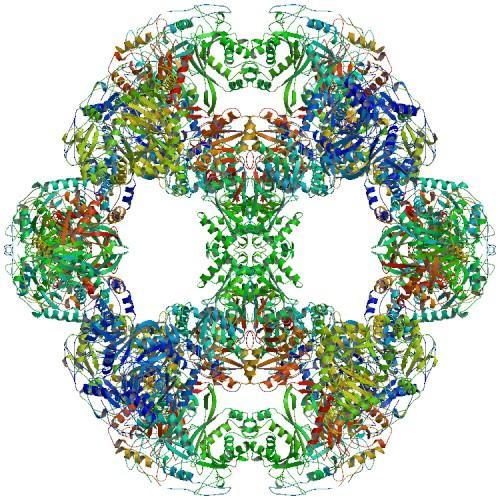
多酶复合物的结构
图片来源:microbialmenagerie
绿硫细菌会主动利用量子效应来调节光合作用进程。
绿硫细菌是世界上最古老的光合细菌之一,早在遥远的三十多亿年前,它就诞生了。
早期的地球极端缺氧,绿硫细菌是一类厌氧型光合细菌。
虽然细菌世界的生物体倾向于简化、高效的基因组,但这些巨型生物却被忽视了,从他们编码的蛋白质类型可以解释。
超过 90% 的巨基因编码表面蛋白,例如转运蛋白或粘附,或多酶复合物,它们按顺序工作,将底物转化为所需的产物,通常是抗真菌或抗菌化合物。
在与其他微生物竞争营养或领土时,这些微生物武器可以为携带这些巨大基因的生物带来优势。 多酶复合物通常由基因组中并排排列的基因编码,这使得基因很容易同时关闭和开启。或许,将这些单独的基因融合成一个巨大的基因只是方便而已。
但是制造如此巨大的蛋白质是一个相当大的负担,需要花费大量的时间、精力和‘材料’。
一般在最佳条件下,一个细胞可以在一秒钟内将40个氨基酸拼合在一起。一种“正常”的蛋白质可以在几秒钟内制造出来。
研究中发现的最大的Chlorobium chlorochromatiii蛋白质需要至少15分钟才能形成。对我们人类来说,这似乎仍然很快,但细菌的生命周期大约持续20分钟到几个星期。
如果细菌生长得很快,为什么还要费心从巨大的基因中制造蛋白质呢?目前猜测巨型基因可能只在生长缓慢的时期或在生长缓慢的生物体中有用。
毫无疑问,这些基因中的大多数是在环境细菌中发现的,这些细菌往往复制较慢,生活在盛宴和饥荒的循环中。
前面所说的研究得到的80个巨型基因,其中47种来自植物。当这项研究进行时,大多数被测序的细菌都是人类病原体。
即使基因组数据偏向于病原体,巨型基因也优先出现在非致病性环境细菌中,这一发现进一步支持了巨型基因在病原体中罕见,在环境细菌中更常见的说法。
近20年来,研究者们发现了量子力学在某些生物过程中的重要作用,尤其是解决了生物学的一个大难题——光合作用的效率。
在绿硫细菌体内, 一种叫做FMO的复合物,用于捕获光能; 而菌绿素,就像植物叶绿素一样, 是光合作用发生的场所。
在无氧状态下,FMO的两个电子态的能级之差和菌绿素分子的振动能量一致。
于是,通过电子振动耦合, 开启了一条能量转移的“高速公路”, 能量畅行无阻地直通光合作用的“反应中心”, 那里充满了菌绿素分子。
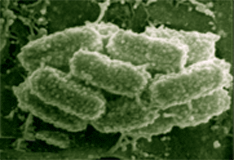
人们普遍认为细菌是微小的,隐蔽的,肉眼看不见。但是这种细菌,epulopisciumfishelsoni,是一种微生物庞然大物,你单凭人眼就能看到。
谷禾健康

现如今,有过敏症状的宝宝越来越多,如何防治孩子过敏成了颇受关注的公共健康问题之一。
过敏的原因除了遗传因素外,还与宝宝肠道菌群失调,自身的免疫系统发育不成熟,环境因素等息息相关。
本文列举的最新研究进展,从过敏早期识别干预,耐药基因,食物过敏及其因果关联等方面,展示了微生物群如何在其中发挥作用,为儿童过敏的防治提供新思路。
新生儿的第一次大便可能揭示发生过敏的风险
微生物群的成熟与免疫系统的发育同时发生,两者都与一系列疾病有关,包括过敏、花粉热、哮喘和湿疹。
发表在Cell Reports Medicine 通过分析 100 名新生儿的粪便,研究人员发现婴儿第一次粪便的成分可以决定儿童在以后的生活中是否有可能患上过敏症和其他疾病。研究小组发现,缺乏特定分子与一年后过敏的风险增加有关。这些化学物质的减少与在微生物群成熟中起关键作用的细菌的变化有关。
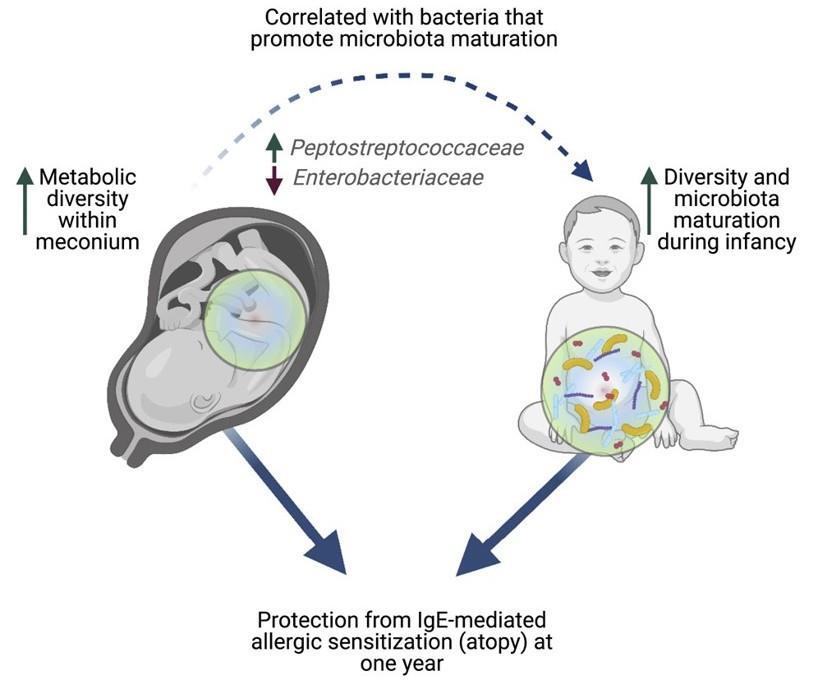
Petersen Cet al., Cell Rep Med. 2021
新生儿的第一次粪便,称为胎粪。胎粪是一种粘稠的深绿色物质,在怀孕 16 周左右开始在胎儿肠道中形成,含有羊水、皮肤细胞以及婴儿摄入的其他物质和分子。
胎粪也是出生后在肠道中定殖的第一批微生物的最初“食物来源”。胎粪就像一个时间胶囊,揭示了婴儿在出生前接触过的东西。
过 敏
为了评估胎粪成分是否会影响以后发生过敏的风险,研究人员研究了新生儿第一次粪便中存在的代谢物。然后,当孩子们满一岁时,该团队进行了一项皮肤测试,以测量免疫系统的反应性。
分析表明,婴儿胎粪中不同类型的分子越少,孩子在出生后第一年内发生过敏的风险就越高。
一些代谢途径,包括那些涉及氨基酸代谢的途径,在后来出现过敏性疾病的婴儿的胎粪中最少。
与没有发生过敏反应的新生儿相比,在一岁时发生过敏反应的新生儿在出生时的胎粪代谢多样性降低。
早 期 干 预
接下来,研究人员分析了胎粪成分是否会影响肠道微生物群的成熟。胎粪“代谢组”较少的婴儿的细菌丰度平较水平低,如肠杆菌科,这在微生物群的成熟中起着关键作用。
最后,研究人员将有关胎粪和微生物群组成的信息与新生儿及其母亲的临床数据相结合,以准确预测婴儿是否会在 1 岁时出现过敏反应。
这项工作表明,健康的免疫系统和微生物群的发展实际上可能在孩子出生之前就开始了——这表明婴儿在子宫内接触的微小分子对未来的健康起着至关重要的作用。
研究人员说,调节子宫内关键代谢物的早期干预措施有助于促进微生物群和免疫系统的健康发育,从而预防过敏性疾病的症状。
这些发现可能有助于识别有患过敏症或哮喘风险的婴儿,并制定有助于预防这些疾病的早期干预措施。
参考文献:
Petersen C, Dai DLY, Boutin RCT, Sbihi H, Sears MR, Moraes TJ, Becker AB, Azad MB, Mandhane PJ, Subbarao P, Turvey SE, Finlay BB. A rich meconium metabolome in human infants is associated with early-life gut microbiota composition and reduced allergic sensitization. Cell Rep Med. 2021 Apr 29;2(5):100260.
婴儿的肠道微生物群包含数百个抗生素抗性基因
人类肠道微生物群已成为细菌的储存库,这些细菌含有帮助它们抵抗抗生素的基因。
发表在Cell Host & Microbe的一项研究通过分析丹麦 650 多名一岁儿童的粪便样本,发现婴儿的肠道细菌有数百个抗生素抗性基因。
谷禾健康
胰腺癌是致命的癌症之一,其特点是:
难发现(发现多为晚期),病程短,发展恶化速度快,中位生存期为3-6个月,正所谓 “无声杀手”。
胰腺癌为什么难发现?这要从胰腺癌的位置说起。
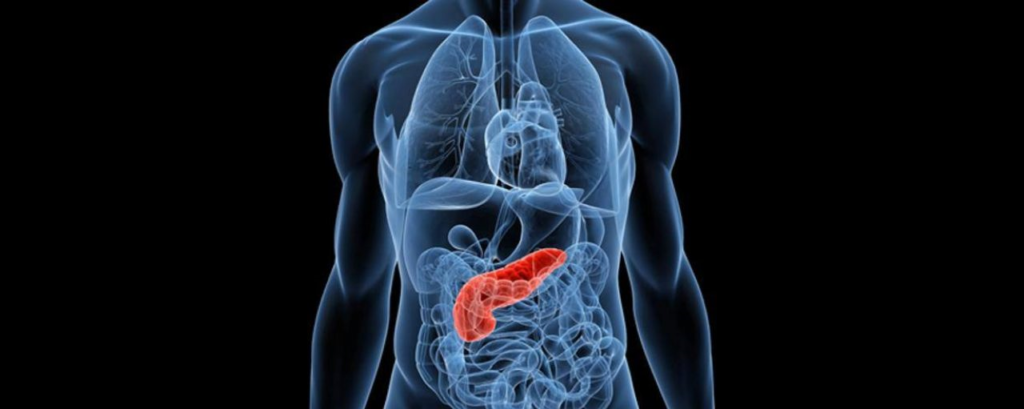
胰腺位于人体后腹部深处,被胃、肝等层层围绕,且体积小,胰腺癌早期几乎没有不适。普通检查手段较难发现。
随着胰腺肿瘤的生长,出现的许多症状看起来与其他疾病的症状很像,比如:发冷和出汗、发热、腹胀、腹泻、恶心、疲劳、食欲不振、不明原因体重减轻、上背部或上腹部疼痛、手臂或腿部肿胀、黄疸迹象等。这就容易导致误诊。


胰腺癌的发病率近年来呈快速上升的趋势,死亡率排在首位,因此也被称为“癌中之王”。
胰腺癌的诊断难,治愈也难,应对胰腺癌治疗这样的难题,科学界在不断努力中。
胰腺癌独特的免疫抑制微环境是免疫治疗面临的最大障碍,而微生物群的改变也被认为是塑造肿瘤局部微环境并影响免疫治疗的重要因素。
科学家发现微生物群在调节代谢和免疫反应中起着关键作用。通过维持相对健康的微生物群类型,提高胰腺癌化疗药物和免疫治疗的有效性,为胰腺癌患者带来新的希望。
接下来,本文详细列举口腔、肠道和胰腺微生物群在胰腺癌发展中的作用的关键信息,讨论不同类型的微生物群,它们在调节药物代谢、耐药性、免疫反应和胰腺癌治疗潜力中的潜在作用,以及相关预防措施。
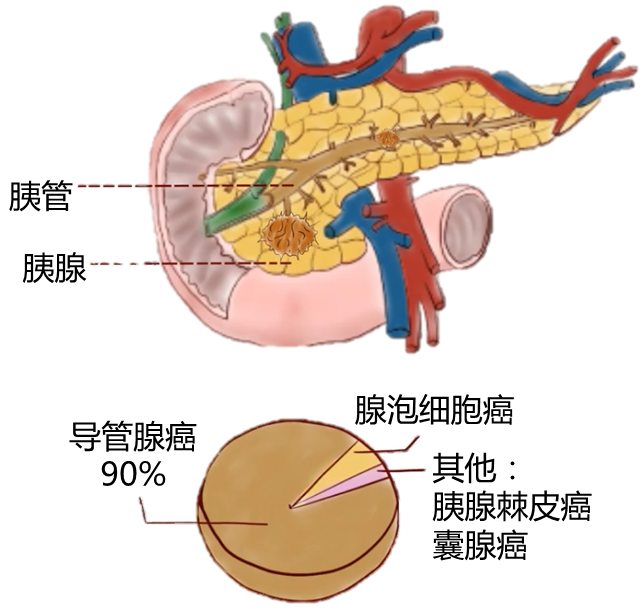
图源:知易社
一般说的胰腺癌主要是指胰腺导管腺癌,简称PDAC,下同:
从临床和解剖学的角度来看,胰腺与肠道微生物群没有直接的物理联系,因此胰腺被认为是无菌组织。但微生物可以通过消化道中的胆管迁移到胰腺。
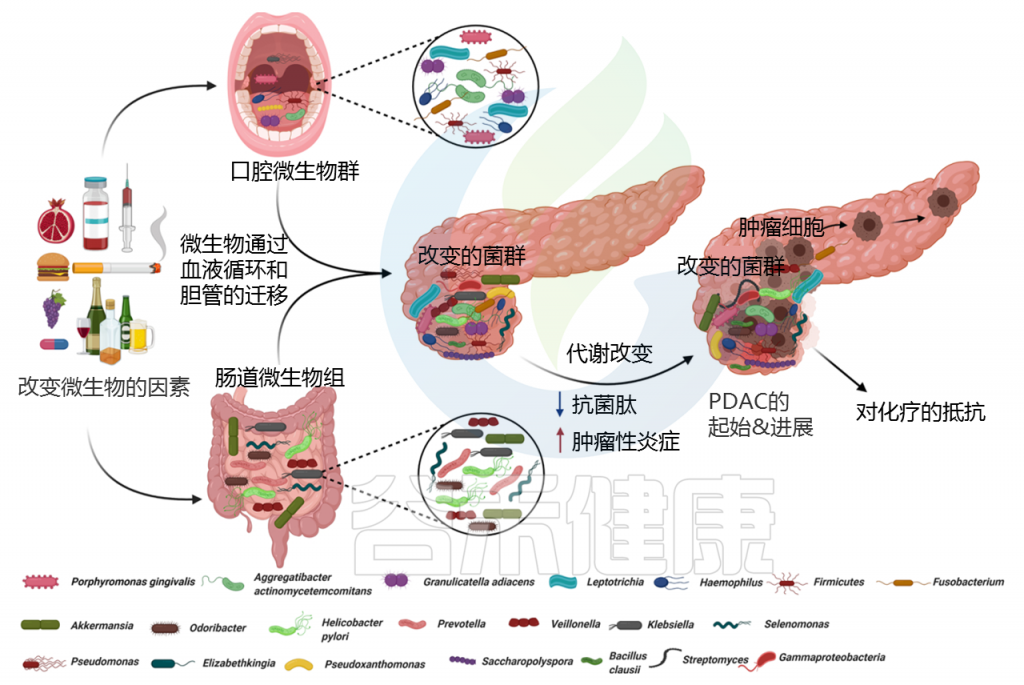

Pandya Gouri,et al., Semin Cancer Biol, 2021
许多研究表明,口腔、胃肠道、粪便和器官特异性(胰腺)微生物群的组成与PDAC高度相关。

PDAC的口腔、唾液、舌苔微生物群
口腔和唾液微生物群组成的改变与PDAC的风险相关。最近的研究表明,口腔中参与PDAC肿瘤发生的主要致病菌有:
牙龈卟啉单胞菌(Porphyromonas gingivalis)、梭杆菌(Fusobacterium)、缓症链球菌(Streptococcus mitis )、长奈瑟氏球菌(Neisseria elongata ).
牙龈卟啉单胞菌和Aggregatibacter actinomycetemcomitans 与胰腺癌高风险之间的相关性,表明口腔微生物群可能是导致PDAC肿瘤发生的危险因素。据推测,牙龈卟啉单胞菌可能分泌肽基精氨酸脱亚胺酶,通过引起KRAS和TP53基因突变来降解精氨酸代谢。
唾液微生物群
在胰腺癌患者的唾液样本中,与健康对照组相比,PDAC患者的长奈瑟氏球菌和缓症链球菌的水平明显降低,而Granulicatella adiacens的水平明显升高。
——作为预测胰腺癌的非侵入性生物标志物
在区分PDAC病患者和健康个体时,长奈瑟氏球菌和缓症链球菌的组合显示出96.4%的敏感性和82.1%的特异性。这项研究的结果表明,唾液微生物群可以作为预测胰腺癌的非侵入性生物标志物。
有研究对胰腺癌患者的唾液样本进行了微生物鉴定,发现纤毛菌Leptotrichia的丰度较高,而卟啉单胞菌和奈瑟氏球菌的比例相对较低。因此,唾液中纤毛菌Leptotrichia与卟啉单胞菌的显著高比率(L/P比率)可用作PDAC的预测标记。
口腔微生物组
PDAC和对照组在相关类群的平均相对比例上观察到差异。
PDAC患者 :高水平的厚壁菌门和相关类群,包括:乳杆菌科(Lactobacillales)、嗜热链球菌(Bacillli Streptococcus thermophilus)、链球菌科(Streptococcaceae)
对照组:具有相对较高水平的变形菌和相关分类群,包括:γ变形菌(Gammaproteobacteria)、巴氏杆菌科(Pasteurellaceae)、副流感嗜血杆菌(Haemophilus parainfluenzae);β变形菌(Betaproteobacteria),奈瑟氏球菌(Neisseria),黄奈瑟氏球菌(Neisseria flaviscen)
舌苔微生物群
胰头癌患者优势菌群如下:梭杆菌属Fusobacterium, 纤毛菌属Leptotrichia, 放线菌属Actinomyces, 罗氏杆菌属Rothia, 奇异菌属Atopobium, 棒状杆菌Corynebacterium, 莫拉氏菌属Moraxella, 消化链球菌属Peptostreptococcus, 产线菌属Filifactor, Oribacterium,坦纳菌属Tannerella
对照组优势菌群如下:嗜血杆菌Haemophilus, 卟啉单胞菌属Porphyromonas,Paraprevotella
在健康对照组和胰头癌患者中分别观察到嗜血杆菌、卟啉单胞菌和纤毛杆菌、梭杆菌的富集量有显著差异。
类似地,在胰头癌患者中观察到链球菌和罗氏菌属相对较高的富集,而在肝癌患者中SR1的相对丰度较高。因此,SR1和链球菌可用于区分肝癌和胰头癌。
*SR1:SR1 genera incertae sedis
对PDAC与微生物群的变化在多样性和组成方面的关联研究非常有限。需要在一个大队列中进一步的调查证实这些发现,从而得出确切的结论。

PDAC的胃肠道微生物群
——肠道微生物群可以直接影响胰腺微环境
给WT小鼠口服荧光标记的粪肠球菌Enterococcus faecalis,有趣的是,在这些小鼠的胰腺中观察到荧光,这表明细菌从肠道向胰腺迁移。
在另一项研究中,将抗生素混合物口服给药于PDAC、结肠癌和黑色素瘤的小鼠模型,观察到在所有受试模型中肠道微生物群的减少显著减弱了肿瘤的生长。
几个小组观察到,吸烟是胰腺癌的一个关键风险因素,可导致微生物群的显著变化,特别是在人类的肠道中。吸烟者肠道中厚壁菌门和放线菌门的减少,梭菌门、拟杆菌门、变形菌门的数量显著增加。
——胰腺癌患者和健康对照者粪便样本显著差异
微生物谱分析 (胰腺癌患者粪便样本,基于属水平的线性鉴别分析)
显著富集普雷沃菌属(Prevotella)、韦荣球菌属(Veillonella)、肠杆菌属(Enterobacter)、克雷伯氏菌属(Klebsiella)、哈氏菌属(Hallella)、月形单胞菌属(Selenomonas)、Cronobacter spp.
显著减少双歧杆菌属(Bifidobacterium)、芽孢杆菌属(Gemmiger)、梭状芽孢杆菌属(Clostridium IV)、Coprococcus、经黏液真杆菌属(Blautia)、Flavonifractor、丁酸球菌属(Butyricicoccus)、厌氧菌属(Anaerostipes)、Dorea spp.
这种粪便微生物群组成的显著差异表明,胰腺癌的胃肠道微生物是独一无二的。此外,本研究的数据表明,与脂多糖(LPS)生产、类异戊二烯和亮氨酸的生物合成相关的微生物有显著的富集/定殖,而已观察到产丁酸菌和益生菌的减少。
16S rRNA测序分析
分析PDAC患者和对照的粪便标本微生物群,观察到不同的优势菌:
PDAC患者:变形菌门(Proteobacteria),互养菌门(Synergistetes),广古菌门(Euryarchaeota),Akkermansia,韦荣氏菌科Veillonellaceae,Odoribacter
健康肠道:Clostridiacea,瘤胃球菌科,Ruminococcaceae,毛螺科Lachnospiraceae
除此之外,幽门螺杆菌感染和胰腺癌之间也呈正相关。在胃癌(69%)和胰腺癌(65%)患者的血液样本中,幽门螺杆菌感染率异常高。Meta分析和前瞻性队列研究表明,幽门螺杆菌感染的患者患胰腺癌的风险明显较高。然而,为了明确解决幽门螺杆菌在PDAC的影响,需要进行更多的人群和动物研究。
PDAC的胰腺微生物群
过去几十年科学家一直认为,在胰腺中存在蛋白酶,且胰腺环境是高碱性的,那么微生物无法生存。
胰腺中存在细菌,PDAC患者细菌更多
用16S rRNA基因特异性PCR对胰腺囊肿液体标本进行分析,发现优势菌:氨基酸球菌属Acidaminococcus, 埃希氏杆菌属Escherichia, 拟杆菌属Bacteroides, 志贺氏杆菌Shigella。这表明胰腺囊液可能是微生物群分析的良好来源。
最近,对PDAC样本进行的16S rRNA荧光探针和qPCR实验都证实,与正常人相比,PDAC患者的胰腺组织中存在细菌(约为正常人的1000倍)。
PDAC的标本中的主要菌
对人类PDAC肿瘤标本进行16S rRNA测序,发现了13个不同的门。
PDAC患者:变形菌门 (45 %);拟杆菌门(31 %);厚壁菌门 (22 %);放线菌门 (1%);假长双歧杆菌Bifidobacterium;
·pseudolongum【Kras(G12D)介导的胰腺癌小鼠模型】;假单胞菌属 Pseudomonas;Elizabethkingia;梭杆菌 Fusobacterium
对照组:乳酸菌 Lactobacillus
梭杆菌——预后生物标志物
PDAC肿瘤内梭杆菌Fusobacterium的定殖与PDAC患者的预后更差相关。这项研究的结果表明,梭杆菌属可以作为PDAC的预后生物标志物。
耐药患者的组织标本中 γ -变形菌定植
从耐受”吉西他滨”的PDAC中获得的组织标本中,γ-变形菌门Gammaproteobacteria定植,表明γ -变形菌可能干扰吉西他滨的代谢,并产生耐药性。
男女患者菌群差异
男性和女性患者之间微生物群组成的差异,各自的主导菌群如下:
男性患者:A. ebreus,Acinetobacter baumannii
女性患者:Geobacillus kaustophilus HTA426 ,Escherichia coli 55989
吸烟与非吸烟差距
此外,吸烟PDAC患者与非吸烟PDAC患者的对比,鲍曼不动杆菌A. baumannii 和M. hyopneumoniae高度富集,且与不良临床结果相关。这些微生物显示出富集的致癌信号和抑制肿瘤和免疫信号。
胰腺癌转移相关菌群
胰腺组织中微生物群的丰度与患者的转移和总生存率相关。M. hyopneumoniae、Sitophilus zeamais、宋内志贺菌Shigella sonnei、肠道沙门氏菌Salmonella enteric的高丰度与转移呈正相关。
更具体地说,Acidovorax ebreus与PDAC患者的转移和高肿瘤分级相关。
长期、短期生存的菌群不同
对长期和短期生存的PDAC患者的肿瘤标本进行了16S rRNA测序,肿瘤内微生物群:
PDAC长期生存者:多样性高;以下菌丰富:Pseudoxanthomonas, Saccharopolyspora, Bacillus clausii, Streptomyces
PDAC短期生存者:拟杆菌,梭状芽孢杆菌
上述数据表明,确定微生物群进入胰腺的机制以及这些微生物与胰腺癌的进展和转移之间的关系还有很大的研究空间。
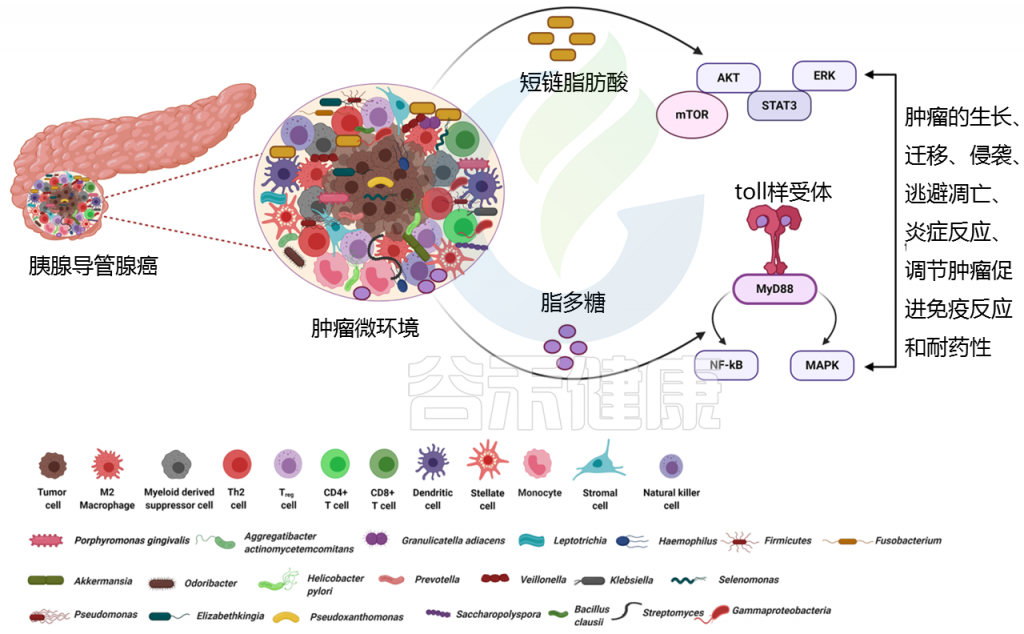
宿主和微生物群形成共生关系。宿主可以通过其遗传、饮食摄入和生活方式影响微生物群的组成和生物量,而微生物群可以通过分泌微生物代谢物、代谢营养物、合成维生素和消化酶来影响宿主。
细菌成分及其代谢物可以渗透到宿主的体循环中,并被运输到发挥激素样作用的部位。这些生物活性代谢物调节宿主中的信号转导,以调节基因表达调节中涉及的各种途径。
代谢物对肿瘤的发生有促进和抑制作用
丁酸盐、乙酸盐和丙酸盐是主要的短链脂肪酸(SCFAs),由结肠中的粪肠球菌、双歧杆菌和梭状芽孢杆菌 等细菌产生,可发挥抗癌作用。
短链脂肪酸通过与游离脂肪酸受体(FFAR2/FFAR3)结合发挥作用,游离脂肪酸受体通常在癌细胞、基质细胞和肠细胞上表达,刺激G蛋白偶联受体,通过激活致癌途径(包括PDAC的AKT、ERK、mTOR和STAT3)促进肿瘤生长和转移。
对微生物代谢物在PDAC和胰腺中刺激FFAR2/3的作用的理解需要进一步详细研究。
改变的微生物群在PDAC免疫反应调节中的作用

Pandya Gouri,et al., Semin Cancer Biol, 2021
体外研究表明,丁酸盐可以减少PDAC细胞的增殖,同时诱导它们向分泌表型分化。
此外,透明质酸与丁酸盐的共轭物显示出在PDAC细胞中诱导细胞抑制作用。据报道,丙戊酸(一种合成SCFA)结合5-FU对PDAC细胞有抑制细胞生长的作用。
PDAC患者多胺代谢失调
在PDAC患者中,益生菌和产丁酸的细菌被大量抑制。细菌可以合成多种多胺,如腐胺、精胺、亚精胺和尸胺。据报道,在PDAC患者中,多胺代谢严重失调。在小鼠模型和患者血清样本中,多胺均上调,并随着肿瘤的进展而进一步增多。
微生物代谢物可作为非侵入性生物标志物
罗伊乳酸杆菌Lactobacillus reuteri 在4个月大的KPC(K-rasLSL.G12D; p53R172 H/+; Pdx1-Cre)小鼠肿瘤标本(K-rasLSL)中定殖。罗伊乳酸杆菌参与多胺代谢。与2个月大的KPC鼠血清标本相比,4个月大的KPC鼠血清标本中多胺的浓度显著高。这些结果表明,微生物代谢物可被开发并用作潜在的非侵入性生物标志物,用于PDAC病的诊断,尤其是在肿瘤变得可见和明显之前的早期阶段。
脂多糖是与炎症、代谢性疾病和胰腺癌相关的关键因素
在PDAC患者中,脂多糖存在于高度富集的革兰氏阴性菌的细胞壁上。
脂多糖与线粒体的代谢重编程有关,从而有助于糖酵解、活性氧和炎症导致肿瘤发生。
脂多糖如何导致免疫抑制?
脂多糖可以有效地与免疫细胞上的toll样受体相互作用,并募集MyD88/TRIF分子来刺激NF-κB和MAPK信号产生炎性细胞因子,从而导致免疫抑制。
代谢产物——脱氧胆酸(DCA)
一些肠道相关细菌代谢原始胆汁并形成脱氧胆酸(DCA)。DCA通过与TGR5 (G蛋白偶联的细胞表面BA受体)结合发挥作用,TGR5反过来刺激PDAC细胞中的EGFR、MAPK和STAT3信号,并进一步导致细胞周期的进展。
代谢产物——熊去氧胆酸
与此相反,熊去氧胆酸通过抑制PDAC细胞系上皮细胞向间充质细胞的转化而显示出抗癌作用。
γ -变形菌科合成酶将化疗药代谢成不活跃形式
肿瘤内细菌属γ -变形菌科,能够合成胞苷脱氨酶(CDD),该酶能有效地将化疗药物吉西他滨代谢成2′,2′-difluorodeoxyuridine(不活跃的形式)。
说到化疗药物,为什么同样的药物治疗,有些人有效,有些人无效?这与微生物会有什么样的联系?
我们将在接下来的章节详细阐述。
肠道微生物群在改变癌症治疗中药物治疗的疗效方面发挥着既定的关键作用。当然,化疗药物也会使肠道微生物群失调。
二十多年来,吉西他滨单独和/或与化疗剂/药物联合用于治疗PDAC病患者。
引起化疗耐药性——猪支原体
人皮肤成纤维细胞中猪支原体(Mycoplasma hyorhinis)的存在,在体外和小鼠模型中导致了对吉西他滨的抗性,其中它被代谢为其非活性和脱氨代谢物,名为2’,2’-二氟脱氧尿苷。
引起化疗耐药性——γ – 变形菌
除此之外,γ – 变形菌能够通过表达胞苷脱氨酶(CDD)的长形式灭活吉西他滨。分析113个PDAC患者组织样本时,86个样本(76%)显示了γ – 变形菌的存在。
在结肠癌小鼠模型中,γ – 变形菌诱导的吉西他滨耐药可通过联合应用环丙沙星抗生素逆转。表明这种耐药是可逆的。
引起化疗耐药性——大肠杆菌
大肠杆菌可导致几种药物如克拉屈滨、吉西他滨、CB1954、氟达拉滨的原始化学结构发生改变。
在体外和体内小鼠模型中,非致病性大肠杆菌菌株引起了对吉西他滨治疗的化学抗性。
改变微生物群——更好的抗癌效果
最近,FOLFRNOX已被用于针对PDAC患者的多中心试验。结果报告了比吉西他滨更好的长期生存率。在这些试验中,患者腹泻和恶心的发生率很高。表明药物可以改变微生物群以产生更好的抗癌效果。
其他代谢疾病与胰腺癌的相关性
另一方面,肥胖、2型糖尿病和胰腺癌病例增加之间有很强的联系。
在KC小鼠中,高脂肪热量饮食(HFCD)显示完整腺泡的丧失和胰腺上皮内瘤形成的发展。此外,在小鼠模型中,高脂肪热量饮食显示出明显的微生物群组成变化,特别是梭状芽胞杆菌。
二甲双胍对这些小鼠的治疗与KC小鼠中PDAC的抑制相关,Akkermansia的定植显著增加,梭状芽胞杆菌的丰度显著减少。二甲双胍通过降低循环中脂多糖的水平来促使HFCD-KC小鼠模型的肠道菌群失调。这可以进一步抑制胰腺中M1巨噬细胞的脂多糖依赖性极化,从而抑制上皮内瘤的形成。
药物联合益生菌抗癌
吉西他滨与益生菌联合给药后,随着波形蛋白和Ki-67表达的抑制,上皮内瘤PanIN的形成明显减少。
鼠伤寒沙门氏菌与吉西他滨和贝伐单抗的组合在PDAC异种移植模型中产生了协同抗肿瘤作用。
肠道微生物群在调节化疗反应、将药物代谢成非活性形式,甚至对某些药物产生化学抗性方面起着不可避免的作用,越来越多的临床研究证明了微生物群对化疗的影响。这为癌症患者的治疗目的操控肠道菌群提供了基础。
免疫系统和微生物群之间的健康互动对于健康的生活方式和身体稳态至关重要。微生物群的失调会导致全身炎症和细菌代谢物介导的免疫反应,这可能进一步促进免疫调节,从而促使癌症发生和发展。
在胰腺癌的发展过程中,已经观察到胰腺组织内的微生物群和免疫细胞之间存在复杂的关系。癌症免疫可以通过微生物群的存在来改变。
菌群与胰腺癌发生的关系
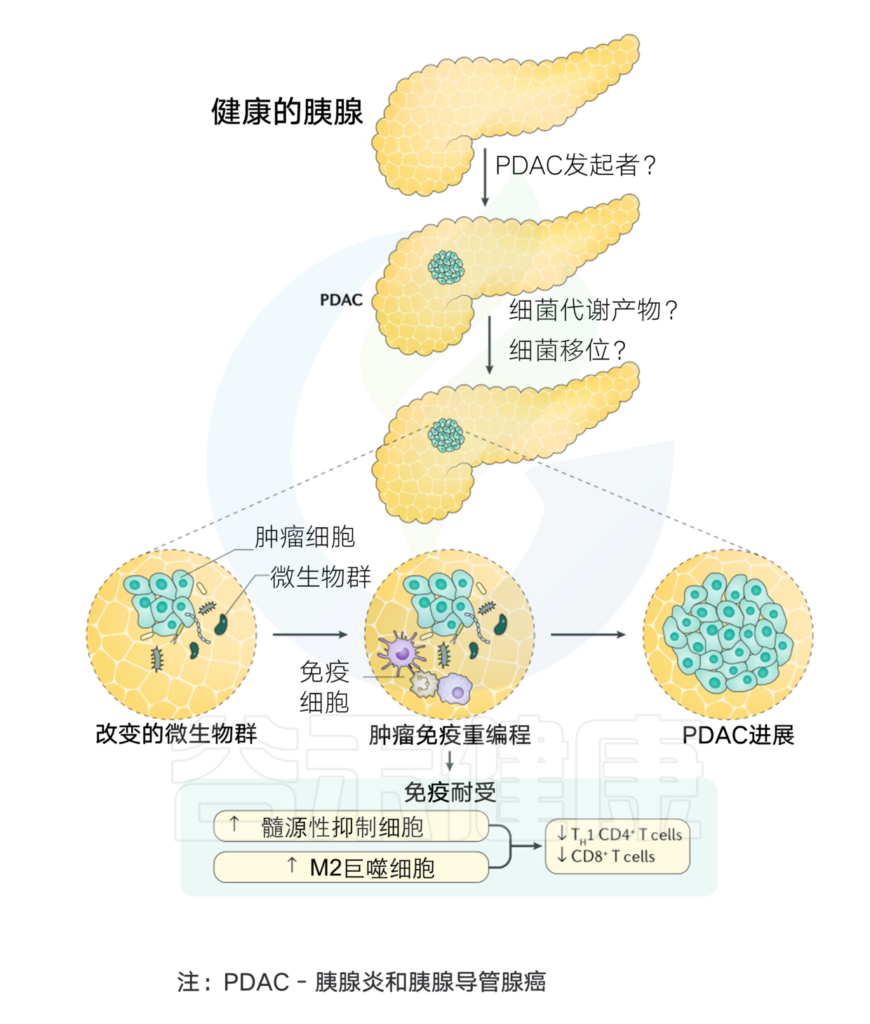
Thomas R M, et al.,Nature Reviews Gastroenterology & Hepatology, 2019
详见: 微生物,或许是下一个癌中之王(胰腺癌)诊断和干预治疗的新出路
微生物群对免疫系统的影响
当粘膜内层受到任何损伤时,微生物往往会进入肠道固有层,然后迁移到远处的淋巴器官,激活宿主免疫系统。PDAC肿瘤微环境基本上与免疫细胞交织在一起,其中免疫细胞与某些炎症因子一起负责促进肿瘤发生、免疫细胞浸润和疾病进展。
微生物衍生产物或代谢物,如脂蛋白、脂多糖、脂肽、单链或双链DNA,甚至CpG DNA可以有效地结合PPRs以激活TLRs,TLRs通过抑制胰腺癌的免疫反应在炎症和肿瘤发生过程中起关键作用。这与NF-κB和MAPK信号通路的激活有关,导致产生促进肿瘤的细胞因子和其他促炎分子,从而导致癌症的发展。
假长双歧杆菌促进肿瘤发生(TLRs)
假长双歧杆菌Bifidobacterium pseudolongum在肠道和肿瘤区域高度占优势,通过TLR介导的信号传导促进侵袭性肿瘤发生,TLR4和TLR7在PDAC的肿瘤微环境中特别强有力地表达。有研究显示,刺激TLRs会导致胰腺炎,并与K-ras协同促进胰腺癌在动物模型中的发展。
TLR7在人和鼠胰腺癌标本中有强有力的表达,并显示出刺激MAPK、NF-κB、STAT3和Notch信号以增强致癌作用。TLR7阻断可以通过阻止以上通路刺激,从而抑制胰腺癌。
肠道微生物群影响抗癌免疫治疗反应
肠道微生物群(脆弱双歧杆菌、双歧杆菌)的组成通过阻断CTLA-4和PD-1影响抗癌免疫治疗反应。
PDAC肿瘤微环境的产生在小鼠模型中具有免疫抑制作用,这归因于特定的肠道和胰腺内微生物。这也证明了随着免疫治疗抗性的增强,癌症进展的增强。
此外,微小核糖核酸与PDAC患者的生长、血管生成、化疗耐药性和转移增加有关。已知某些微生物如幽门螺杆菌和鼠伤寒沙门氏菌也能调节上述微小核糖核酸的表达,而这些微小核糖核酸又能调节宿主的免疫反应。
这表明肠道微生物群控制宿主免疫反应,从而提高免疫疗法的有效性,并在与PDAC相关的癌症领域具有巨大的意义。
微生物具有巨大的潜力,可用于设计不同的治疗方法,以对抗疾病的发展和进展。更具体地说,新出现的证据表明,微生物可能导致人类对恶性肿瘤的易感性,也可能影响对治疗的反应,还可能影响治疗相关的毒性。
用有益菌如拟杆菌和伯克霍尔德氏菌Burkholderiales恢复肠道提高了CTLA-4封闭的治疗效果。
双歧杆菌的存在增强了PDL-1阻断的抗癌潜力。
因此,微生物群的保护和恢复对改善治疗效果至关重要。
粪便微生物群移植(FMT)是一种直接有效的方法。肿瘤小鼠接受了来自短期生存期PDAC患者、长期生存期无疾病证据(LTS-NED)和健康对照组的粪便微生物群,发现肿瘤生长明显减少。这表明,在PDAC鼠模型中,来自长期存活者的FMT比来自短期存活者或没有PDAC的那些接受FMT的人对肿瘤有更好的保护作用。
此外,FMT在应对化疗的副作用方面显示出潜力,化疗会导致其他恶性肿瘤如转移性肾细胞癌的腹泻。这表明,用益生菌恢复肠道是一种可行的方法,可以与其他治疗方案一起使用,并且在治疗癌症方面可能非常有效。
目前这些研究探索了微生物群的多样性和组成,以及患者的菌群失调,与健康人的差异等,尽管还需要做深入研究,但这个方向的探索对于癌症治疗无疑是很有希望的。
虽然说没有完全避免胰腺癌的特定方法,但以下方法可以降低风险:
■ 戒烟
可避免的最重要的风险因素,戒烟有助于降低患胰腺癌风险
■ 维持正常体重
如果你现在正处于超重或肥胖阶段,减肥有助于降低胰腺癌风险;适当进行锻炼
■ 健康饮食
加工过的红肉和含糖饮料也可能增加患胰腺癌的风险。美国癌症协会建议遵循包括大量水果、蔬菜和全谷物在内的健康饮食模式,并限制或避免红肉和加工肉类、含糖饮料和高度加工食品
■ 不酗酒
大量饮酒与胰腺癌有关,也可能患上慢性胰腺炎,后期有发展成为胰腺癌的风险
■ 避免使用工作场所化学品
工作场所中的某些化学品会增加患胰腺癌和其他癌症的风险
■ 进行肠道菌群检测
维持一个相对健康的肠道菌群,监测健康状态,降低胰腺癌的风险
微生物组是一个新兴的前沿领域,它为胰腺癌的诊断、预后和转移的新生物标志物等提供了新的方向。
微生物治疗的个性化在于每个个体微生物群具有独特性,微生物群又与日常饮食,生活习惯,慢性病等息息相关,通过这些方式的改变使菌群维持或恢复到相对健康的状态,这对于胰腺癌及其他癌症的预防、治疗具有重大意义。
主要参考文献:
G.A. Vitiello, D.J. Cohen, G. Miller, Harnessing the microbiome for pancreatic cancer immunotherapy, Trends Cancer 5 (11) (2019) 670–676.
R. Mendez, K. Kesh, N. Arora, L. Di Martino, F. McAllister, N. Merchant, S. Banerjee, S. Banerjee, Microbial dysbiosis and polyamine metabolism as predictive markers for early detection of pancreatic cancer, Carcinogenesis 41 (5) (2020) 561–570.
R.M. Thomas, R.Z. Gharaibeh, J. Gauthier, M. Beveridge, J.L. Pope, M.V. Guijarro, Q. Yu, Z. He, C. Ohland, R. Newsome, J. Trevino, S.J. Hughes, M. Reinhard, K. Winglee, A.A. Fodor, M. Zajac-Kaye, C. Jobin, Intestinal microbiota enhances pancreatic carcinogenesis in preclinical models, Carcinogenesis 39 (8) (2018) 1068–1078.
Pandya Gouri,Kirtonia Anuradha,Singh Aishwarya et al. A comprehensive review of the multifaceted role of the microbiota in human pancreatic carcinoma.[J] .Semin Cancer Biol, 2021
B. Gupta, D. Sadaria, V.U. Warrier, A. Kirtonia, R. Kant, A. Awasthi, P. Baligar, J.K. Pal, E. Yuba, G.Sethi, M. Garg, R.K. Gupta, Plant lectins and their usage in preparing targeted nanovaccines for cancer immunotherapy, Semin. Cancer Biol.(2020).
J. Chakladar, S.Z. Kuo, G. Castaneda, W.T. Li, A. Gnanasekar, M.A. Yu, E.Y. Chang, X.Q. Wang, W.M. Ongkeko, The pancreatic microbiome is associated with carcinogenesis and worse prognosis in males and smokers, Cancers 12 (9) (2020).
J.S. Chang, C.R. Tsai, L.T. Chen, Y.S. Shan, Investigating the association between periodontal disease and risk of pancreatic Cancer, Pancreas 45 (1) (2016) 134–141.
H. Tilg, T.E. Adolph, Beyond digestion: the pancreas shapes intestinal microbiota and immunity, Cell Metab. 25 (3) (2017) 495–496.
Can Pancreatic Cancer Be Prevented? American Cancer Society. May 31, 2016.
谷禾健康
随着基因组测序的发展,大量的数据为分类学提供了更全面的框架。基因组序列的空前可用性意味着分类学可以建立在一个全面的进化框架上,这是分类学家的长期目标。
然而,采用单一的框架来保持分类自由存在阻碍,而且从未培养的原核生物衍生的基因组数量不断增加,威胁着目前基于特征分离物的命名实践。
接下来的挑战是就分类学框架达成共识,并对现有的命名密码进行调整和扩展,或者创建一个新的密码,以系统地将未培养的分类单元纳入所选择的框架。

近日,一篇发表在The ISME Journal(10.1038/s41396-021-00941-x)题为“Prokaryotic taxonomy and nomenclature in the age of big sequence data” 的文章,针对微生物分类学和命名法进行完整概述,主要侧重于细菌和古菌,从过去到现代研究其发展脉络,并探讨了如何利用基因组测序技术来让微生物分类学更加全面和完善。
将生命形式分类为一个等级系统(taxonomy 分类学),并将名称应用于这个等级系统(nomenclature 命名法)是微生物学领域的一个重要转折点。
最早在1700年代,Linnaeus在工作中就引入了现代生物分类学 taxonomy(将动植物分类为等级类别)和命名法 nomenclature(命名动植物分类组的规则)的原理,这些原则如今已成为生物分类的基础。
最初的分类法是基于共同的特性,发育过程和行为,后来统称为表型,这些特征用于区分遗传信息(基因型)。
Taxonomy 分类学在生物学中最常被定义为科学的一个分支,它根据共同的特性对生物体进行命名和分类。
生物学家认同分类学应该建立在进化关系的基础上,因为进化关系是排列生物的最自然的方式。由于微生物的表型特征大部分都没有揭示其共同祖先,所以微生物仍是系统发育框架中最有争议的分类单元 。
第一次尝试根据表型特性对细菌进行分类,始于1923年Bergey 写的第一版确定性细菌学手册,细菌分类为嵌套的层次分类,以指示不同的相关度。最初,排名从最高(最远亲)到最低(最紧密相关)排名。关键主要依赖于形态、培养条件和致病特征,其主要目标是在物种水平上进行分离菌株的实际鉴定,而不是构建一个进化框架。
数值分类法,由Sokal和Sneath于1962年提出,用于定量比较包含几十种特征的细菌的表型特性。虽然在原则上,数字分类法可以纳入系统发育信息,但在实践中,它主要用于鉴定,缺乏一个严格的进化框架。
Zuckerkandl 和 Pauling 通过使用信息大分子来推断进化关系,打破了表型预测的局限性。Woese 发现核糖体可以用来构成所有生命进化框架的基础。最著名的是小亚基核糖体RNA(16S / 18S rRNA),基于其高度的序列保守性,并且和可变区域穿插在一起。而对小亚基rRNA的比较分析能够为整个生命树提供客观的进化框架。 Woese和他的同事的分析的亮点是发现古细菌。

图源:scienceterms.net
传统培养方法遗漏的大量微生物可以通过16S rRNA基因获取。Pace和同事首次通过使用高度保守的“通用”引物,直接从环境中获得的16S rRNA序列表征微生物。这些引物随后用于从提取的基因组环境DNA中PCR扩增16S rRNA基因。 然后将混合的扩增子克隆并测序,来获得微生物群落。随着测序技术的改进,大量的样本从各种环境被提取出来,从而开发出各种数据库和工具,用于分析和分类16S rRNA基因序列(表1)。
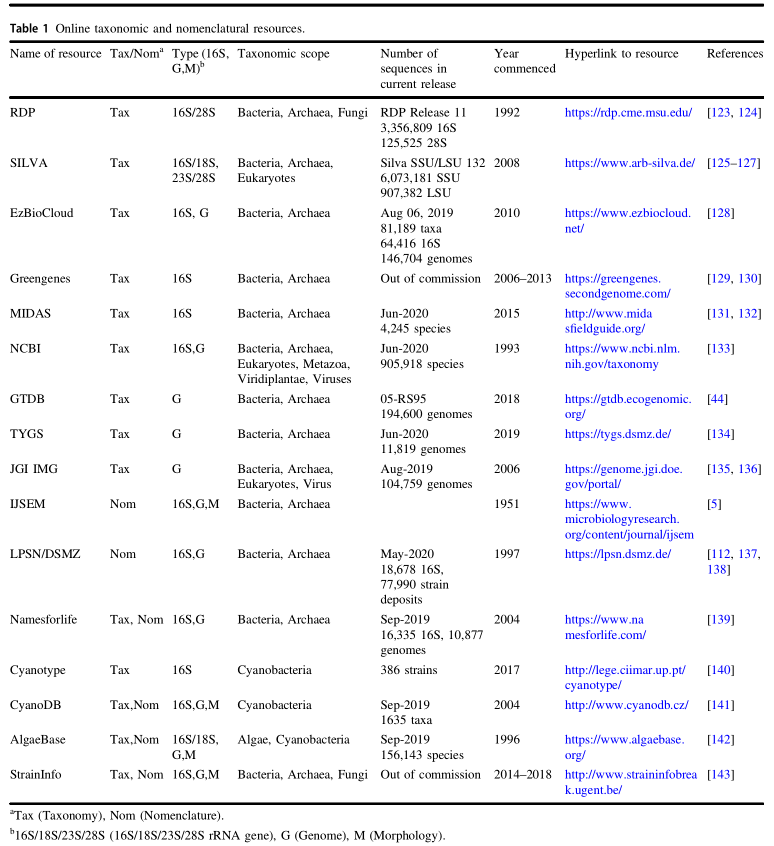
Hugenholtz P ,et al. ISME J,2021
多相分类法整合了表型和基因型的一种共识分类法,该分类法最能反映生物体的多种属性。
随着16S rRNA分析的出现,系统发育分类得到发展,由于16S rRNA基因的高序列保守性,对多相分类进行了分层,以使16S rRNA树可为属及以上分类水平属提供分类信息。
而化学分类学方法(如多基因座酶电泳和全细胞蛋白质分析)可以更好地划分物种和亚种水平。
全基因组测序的出现以及近年来技术的进步,加速了细菌和古细菌分类学上的发展,从基于16S rRNA的分类向基于基因组分类过渡。
与16S rRNA基因一样,基因组序列也可用于构建系统发育框架,并以此为基础进行系统分类。
基于基因组的分类比16S rRNA基因(仅占平均3-Mbp原核基因组的0.05%)对最古老和最近的关系提供了更高的分辨率,这是因为在比较中使用了更大比例的基因组,从而提供了更好的系统发育信号。
基于基因组序列构建进化树的方法有两种:超级树 supertrees 和 超级矩阵 supermatrices。
超级树:创建独立的基因树,然后将其组合以产生生物之间的系统发育关系。
超级矩阵:将基因连接到比对序列的系统发育矩阵中,然后从该矩阵中推断出树。
两种方法尽管基于不同的标记基因集,它们在分类学上的一致性为98.2%。
基于基因组序列的其他方法包括:成对的基因组之间进行相似性测量,或在编码蛋白质水平,或在核酸水平和DNA-DNA杂交,这些方法主要用于定义和识别物种。


基因组测序也可以对未培养的物种进行分析。随着测序技术和计算方法的改进,如今可以从环境DNA中获得天然微生物种群近乎完整的基因组序列,即所谓的宏基因组组装的基因组(MAG)。由于相对容易从单个基因组中获得多个MAG,因此可用MAG的数量迅速超过了分离基因组的数量。
未培养的分类单元的基因组数据的快速积累给分类学带来巨大挑战,根据系统发育树的指标,估计未培养的分类单元占微生物多样性的85%以上,意味着过去几十年建立的分类框架在其中存在重大差距。这个问题在病毒世界中更加明显。
众所众知,原核微生物分类学在系统发育上存在不一致的情况(多系统分类学)由以下原因导致:沿用历史上的表型数据、基于16S rRNA基因序列嵌合来自环境的PCR产物、基于早期的系统发育结论缺乏合适群体。来自未培养分类群的基因组使得问题更加复杂。
因此,已经开发了一些数据库和工具,试图通过建立可靠的微生物分类系统发育框架来解决这些缺点,首先使用16srRNA基因序列,最近使用宏基因组序列。但这必须建立在数十万个序列提供的微生物多样性全局视图上,对于单个基因来说已经很困难了,对于宏基因组来说更为困难。随着信息的不断增长,这些数据库能否继续扩张还有待观察。
从历史上看,基于表型数据的等级定义非常主观,特别是对于物种以上等级。基于基因组的分类能实现量化操作更加客观,并且可实现定义属和更高等级的机会。
2014年,Yarza及其同事提出了基于16S rRNA基因序列同一性的标准化阈值,用于定义从属到门的原核世系。尽管可以肯定地消除了分类学分类中的许多不一致之处,并且可以容纳未培养的分类单元,但这种方法并未考虑谱系之间的系统发育关系和可变的进化速率。
命名法的发展
图1:过去100年中原核生物分类学和命名法中的关键事件
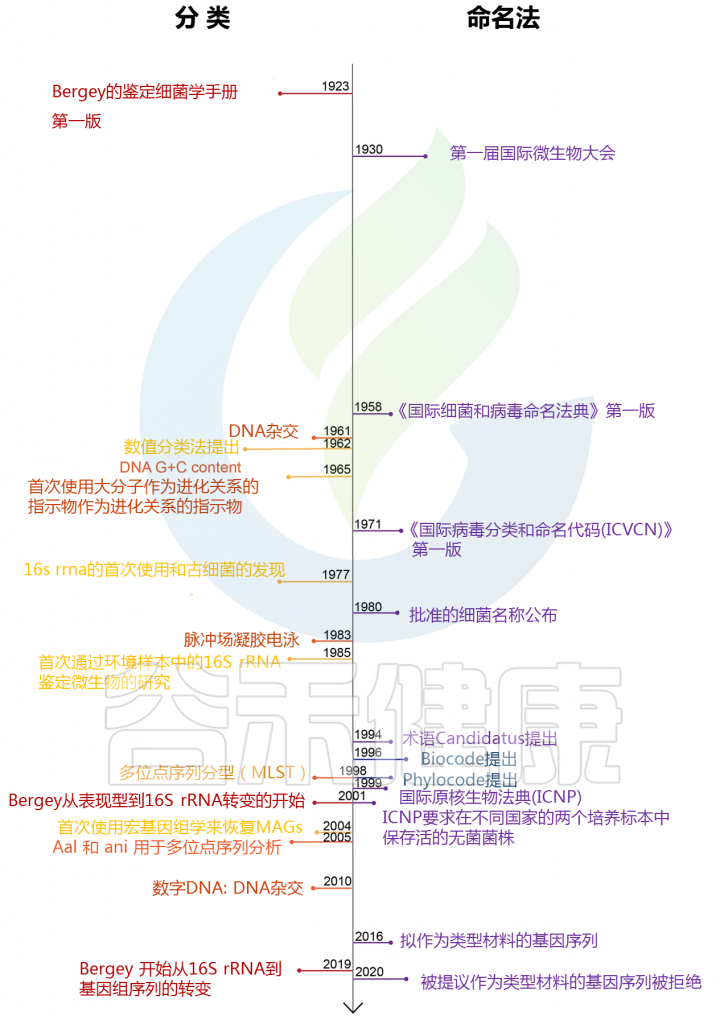

Hugenholtz P ,et al. ISME J,2021
缺乏未培养的多样性的命名法
由于技术的进步,未培养微生物的详细分子表征是一项相对较新的创新(请参见16S rRNA和基于基因组的分类)。这类生物对原核生物的编码构成了挑战,因为它们的名称不能被有效命名,这是由于物种描述必须建立在纯培养型菌株的基础上。
1994年,通过引入Candidatus的临时状态介绍,提出了一种未培养类群的早期命名规则。Candidatus一词作为任何等级的共同名称的前缀,以表示该分类单元的临时性质。
Candidatus最初是在16S rRNA环境调研时提出的。与分离株相比,它们的描述范围是受限的。然而随着MAGs和SAGs的出现,微生物不需要分离就能描述其功能。在2016年,有人提出,基因序列作为类型材料,因为它们能够用于命名法提供明确的参考点,特别是全基因组序列。鉴于掺入未培养的微生物进原核代码的命名法的困难,建议创建一个独立的编码命名这些类群。
命名定标问题
最近的一项估计显示,全球原核生物的数量在220万—430万之间,低于之前估计的数万亿。即使是这个向下修正的估计,在数百万种物种和目前有效公布的物种数量(~21K)和基因组描述的物种数量(~25K)之间仍存在巨大差距。
在未来的几十年里,作者很可能在基因组表达方面弥补这一差距,但通过原核密码验证如此大量的新物种的名称目前还不可能用于未培养的类群。并不是所有被识别的物种都需要用拉丁名称,前提是建立和维持一个系统的分类框架,该框架具有基因组限定物种的唯一和永久对象标识符。只有对科学界有足够兴趣的物种才会被更深入地描述和命名。
原核命名和微生物生态学间争论
微生物生态学家一直认为有必要为他们研究的微生物命名,然而,大多数生态学家并不太熟悉命名规则。这导致了两个学科之间的一些争论点,一旦在原核代码或新代码下更正式地考虑到未培养的分类群,这些争论点可能会扩大。
首先,代码要求严格遵守正确的拉丁语语法,在作为原始文章或验证列表发表在《国际系统与进化微生物学杂志》(IJSEM)上之前,由一小群专家定期检查名称的词源正确性。
第二,自1975年《原核生物密码法》修订以来,有一项要求,即从属名的词干和标准化后缀组成更高级别的属名。
此外,要求在从属属茎上形成更高等级的名称,导致有人提议完全改变一些更高分类单元的名称,尽管法典中有保留这一要求之前的较早名称的余地。
原核生物的分类和命名处在一个有趣的十字路口。从积极的方面来看,从来没有像现在这样,利用新兴的微生物基因组测序资源,以客观的进化关系为基础来发展一种分类方法。随着时间的推移,微生物分类法随着方法的改进而不断演变,有人认为,出于这个原因,应该避免正式的分类法,以防止它在方法上过时。然而,基因组是生命最基本的蓝图,因此不太可能出现一种被广泛接受的替代方法,从而产生一种完全不同的、改进的分类方法。尽管开发一个全面的基于基因组的分类法在生物信息学上面临挑战,但使用不同标记基因组合的独立项目之间的高度一致性预示着一个稳健的进化框架,可以形成一个稳定的分类法的基础。
虽然分类学的多相方法的想法是可以理解的,特别是使用多种特征来定义生态一致单位的目标,但作者认为,单独的基因组序列,特别是保守的垂直遗传核心操作基因的子集,应该构成分类学框架的基础。所有其他表型、基因型和生态数据都可以有效地叠加到这个框架上,以便了解它们相对于树种的个体分布和进化轨迹。
科学界普遍接受的单一一致分类法的好处是多方面的,包括改进互操作性和通信。这是发展GTDB的动力,GTDB非常强调包含性(即,使用尽可能多的来自培养和未培养分类群的高质量序列数据)和系统化(例如,定义物种代表性和等级的统一和可复制的方法,提供从领域到物种的完整分类学分配)。
一个标准化的分类学框架需要一个相似的、可复制的、客观的、能随手头的任务而扩展的命名法。官方的原核命名法是在大规模基因组测序和未培养分类群特征化出现之前制定的,因此不包括未培养微生物的大多数。
要克服这一点,要么开发一种以基因组序列为类型材料的单独命名法,要么对原核代码中分类群的管理规则进行重大修改。如果有必要开发一个单独的命名法,它可以提供一个机会,利用原核生物代码的最佳元素,简化陷入历史遗留问题的其他部分,这些部分对用户不友好,不能很好地适应大序列数据的挑战。一个例子是简化或自动形成拉丁语或希腊语的名称,并具有正确的词源,否则全世界只有少数实践者能够确保这一点。

消极的一面是,采用统一的标准化分类法将不可避免地伴随着越来越多的漏洞。一些行业已经开始制定特定的分类法和相关的命名法,它们不一定遵循进化框架。开发一个新的命名法,它确实带有与现有原核代码互操作性挑战的潜在负面影响。然而,这并不是史无前例的,例如蓝细菌的案例,因此应该通过命名委员会之间的公开对话来管理。
通过精心管理和充足的资源,对于新一代使用现代方法研究微生物世界的研究人员而言,基于基因组的分类和简化的命名将会受到欢迎。

谷禾健康

抗生素自问世以来挽救了无数生命
曾被誉为治病的“神药”,风靡全球。
然而,由于抗生素药物的滥用
它开始变得越来越无效
更可怕的是
一些药物抗生素还伴有有害的副作用,如呕吐、腹泻、过敏反应、皮疹,
甚至还会导致人的微生物群失调,并伴有免疫系统减弱及慢性炎症发展…
现如今,在“不要滥用抗生素”的呼吁下
很多人都知道吃抗生素对身体不好
明知不好却依然摆脱不了啊…
有没有别的方式可以帮助预防改善?
天然抗生素或许可以帮到你
其实在日常生活中常见的食物,一些植物或者提取物也能达到同样的效果,它们的杀菌特性展现其作为天然抗生素治疗的潜力,本期我们为大家介绍15种天然抗生素。
01 大 蒜
大蒜在历史上一直被广泛用于治疗和预防疾病。最近的研究评估了大蒜的潜在益处,包括其抗菌、抗真菌和抗病毒活性。
作用机理
大蒜素是大蒜中的主要活性化合物,负责其大部分抗菌活性。它对多种细菌菌株有效,包括多药耐药菌株。
大蒜素通过阻断对能源生产至关重要的酶(乙醇脱氢酶、乙酰辅酶 A 合成酶和乙酸激酶)维持细胞结构来杀死细菌。
此外,大蒜素可以通过阻断生物膜的形成来阻止细菌和真菌的生长,人体内大多数持续性感染源于生物膜,能阻断生物膜的形成意义重大。
有关生物膜感染,详见:
抗 细 菌 性
在接受14天治疗的60名患者中,大蒜素单独或与标准抗生素联合帮助34名患者根除幽门螺杆菌感染。然而,在对17人进行的2次试验中,大蒜对这种感染无效。
此外,在对75名健康人群进行的临床试验中,一种大蒜提取物漱口水降低了口腔变异链球菌的水平。
* 变异链球菌具有分泌酸性物质腐蚀牙釉质的特点,为人类主要致龋齿菌之一。
大蒜提取物可能有助于治疗牙龈肿胀和预防蛀牙,因为它们可以杀死试管中的口腔致病菌,
例如:牙龈卟啉单胞菌 Porphyromonas gingivalis、
中间普氏菌 Prevotella intermedia、
Aggregatibacter actinomycetemcomitans。
它还提高了其他抗生素在试管中对铜绿假单胞菌的有效性。然而,在34人的临床试验中,它未能阻止铜绿假单胞菌在肺组织瘢痕中形成生物膜。
大蒜提取物除了杀死金黄色葡萄球菌和化脓性链球菌,还能通过减少细菌毒素(如α-毒素和链球菌溶血素O)的产生来保护身体免受伤害。
抗 真 菌 性
大蒜素可以抑制试管中孢子的萌发和真菌的生长(白色念珠菌、隐球菌、曲霉和酿酒酵母)。
念珠菌可感染口腔粘膜,引起炎症性疾病,称为假牙炎或口腔念珠菌病。在对96名患有这种疾病的人进行的2项临床试验中,大蒜提取物(作为漱口水或牙膏使用)显示出与抗真菌药物制霉菌素和克霉唑相似的效果。
在110名妇女的临床试验中,大蒜提取物片(Garcin)改善阴道念珠菌病的症状与氟康唑一样有效。然而,另一种配方(大蒜素)在63名感染但无症状妇女的试验中无效。
在两项对81人进行的临床试验中,大蒜中的另一种成分,大蒜烯Ajoene(0.4-1%乳膏)杀死了导致足癣的真菌。
抗 病 毒 性
大蒜提取物对流感病毒和疱疹病毒(单纯型1、2和3)也有效。
在对146名健康成年人和172名儿童进行的2项临床试验中,用一种含有大蒜素的大蒜补充剂(每天1粒胶囊,持续12周)可以预防普通感冒,并缩短症状持续时间。
副 作 用
大蒜可能会引起恶心、胃灼烧和口臭。
★ 小 结 ★
大蒜对蛀牙/牙龈疾病、口腔念珠菌病、脚气和普通感冒有效。
02 茶树油
茶树油是从茶树植物(互叶白千层)中提取的,是一种用于皮肤的广谱抗生素。它是许多用于治疗皮肤感染的制剂中的活性成分。
作用机理
茶树油中的一些化合物,称为单萜(萜品烯-4-醇,芳樟醇,α-蒎烯和α-萜品醇)负责抗菌。
单萜阻断能量产生(细胞呼吸),破坏细菌和真菌细胞的外层(膜)。
抗 细 菌 性
茶树油对导致皮肤感染、痤疮、肺炎、食物中毒等细菌有效。
部分菌株包括葡萄球菌(金黄色葡萄球菌和表皮葡萄球菌),疮疱丙酸杆菌,绿脓杆菌,金黄色葡萄球菌,沙门氏菌,和大肠埃希氏菌。
在一项对 236 名住院患者进行的临床试验中,含有茶树油(分别为 10% 和 5% 茶树油)的乳霜和沐浴露使用 5 天,有助于清除耐抗生素金黄色葡萄球菌皮肤感染。
在30名受试者的唾液中,0.2%茶树油溶液减少了变异链球菌和其他微生物。
抗 真 菌 性
茶树油对以下真菌有效:白色念珠菌、曲霉菌、小孢子菌、表皮癣菌等。这些真菌会导致皮肤病(例如脚气和癣)以及其他问题。
在一项对 117 名患者的研究中(25% 和 50% 茶树油),每天两次使用茶树油治疗脚趾甲感染(甲真菌病)6 个月。
在一项137名患者的研究中(100%茶树油),每天使用两次,连续4周,也有治疗足癣的作用。
在大鼠研究中,外用茶树油治愈了阴道念珠菌感染。
抗 病 毒 性
茶树油抑制疱疹病毒的生长(单面型1和2)
副 作 用
注意,食用茶树油是有毒的。
另外,在皮肤上使用时,茶树油也有可能会导致干燥、灼热、瘙痒、炎症和过敏反应。
★ 小 结 ★
茶树油有助于治疗细菌和真菌性皮肤感染(包括痤疮、肺炎、脚趾甲感染、脚气等),预防蛀牙或牙龈疾病。
接下来介绍的也是天然抗生素,相对来说,证据不够充分,可以作为参考。
03 牛至油
牛至油(从牛至中提取)一直被用作食品添加剂。它以其抗菌、抗真菌和抗氧化特性而闻名。
作用机理
牛至油的抗生素和抗真菌活性来自两种化合物,香芹酚和百里酚。百里酚和香芹酚破坏细胞外细菌(膜),杀死细胞。
抗 细 菌 性
在一项对40名外科手术伤口康复患者的临床试验中,牛至油软膏减少了金黄色葡萄球菌对伤口的污染,从而有助于愈合过程。
百里酚和香芹酚可以阻止导致蛀牙的细菌(变异链球菌Streptococcus mutans)的生长,在大鼠试验中,可以保护大鼠免受牙龈疾病的侵袭。
在试管中,牛至抑制并杀死以下细菌:导致食物中毒、尿路感染、腹泻、肺炎、葡萄球菌感染等的细菌。
这些细菌包括:大肠杆菌Escherichia coli、沙门氏菌Salmonella、肺炎克雷伯菌 Klebsiella pneumoniae、枯草芽孢杆菌Bacillus subtilis、金黄色葡萄球菌Staphylococcus aureus、铜绿假单胞菌Pseudomonas aeruginosa、荧光假单胞菌Pseudomonas fluorescens、液化沙雷菌Serratia liquefaciens、变异链球菌 Streptococcus mutans、粪肠球菌Enterococcus faecalis、梭菌Clostridium、鸟分枝杆菌Mycobacterium avium和腐败希瓦氏菌 Shewanella putrefaciens。
在试管中,墨西哥牛至油与百里香和芥子油一起对三种细菌(单核增生李斯特菌,金黄色葡萄球菌和肠炎沙门氏菌)有效。
牛至油与丁香和肉桂油一起抑制了鲍氏不动杆菌Acinetobacter baumannii、鲍氏不动杆菌 RCH、肺炎克雷伯菌、大肠杆菌和铜绿假单胞菌的生长。
抗 真 菌 性
百里酚和香芹酚可有效阻止试管中三种不同的引起感染的真菌(酵母、曲霉和皮肤癣菌)的生长。
抗 病 毒 性
在基于细胞的研究中,香芹酚和百里酚对以下病毒具有抗病毒活性:
疱疹病毒(单纯型1)、人呼吸道合胞病毒、人轮状病毒、小鼠诺如病毒
抗 寄 生 虫
在一项小型试验中,14人感染了三种导致消化问题的寄生虫(人芽囊原虫blastocystis hominis、哈氏阿米巴原虫Entamoeba hartmanni和微小内蜒阿米巴Endolimax nana),在大多数情况下,补充牛至油可使寄生虫完全消失,并改善症状。
副 作 用
虽然很少见,但牛至油会引起过敏反应,尤其是对唇形科(如百里香)过敏的人。
药物间相互作用
牛至可以阻断肝酶(细胞色素p450)清除血液中的有毒物质。这可能会增加某些药物的效果。
★ 小 结 ★
只有几个小型临床试验表明牛至可能有助于治疗细菌和寄生虫感染。需要对更大人群进行更多的临床试验,以确定其对抗传染病的潜力。
04 紫锥菊
紫锥菊一直被用作草药。紫锥菊提取物以其潜在的抗菌和免疫保护特性而闻名。
作用机理
虽然紫锥菊的确切成分因物种而异,但主要成分是碳水化合物、咖啡酸和蛋白质(糖蛋白)。
紫锥菊通过阻断细胞因子等炎症标志物的释放来减轻细菌感染的症状。其抑菌作用机制尚未明确。
抗 细 菌 性
紫锥菊可有效减少多种细菌菌株的生长,例如化脓性链球菌、流感嗜血杆菌、嗜肺军团菌、艰难梭菌和痤疮丙酸杆菌。
抗 真 菌 性
紫锥菊阻止多种真菌菌株的生长,并保护小鼠细胞免受致命感染(白色念珠菌和单核细胞增生李斯特菌)。它还对酿酒酵母有效。
抗 病 毒 性
在对 282 人进行的临床试验中,在出现感冒症状时服用紫锥菊补充剂 (Echinilin),可减轻症状的严重程度。
然而,在一项对 100 多人的临床试验和一项对 700 多人的试验中,含有紫锥菊提取物的药片无法预防。一项荟萃分析得出结论,紫锥菊产品对治疗普通感冒无效,但可能有助于预防。
在对 95 名有早期感冒或流感症状的人进行的临床试验中,紫锥菊有助于缓解症状。
在154人的临床试验中,一种结合了紫锥菊和鼠尾草的喷雾剂与一种含有氯己定和利多卡因的喷雾剂对治疗喉咙痛同样有效。
然而,在一项针对400多名儿童的试验中,紫锥菊未能治疗上呼吸道感染;在两项针对近400名成人的试验中,紫锥菊未能预防上呼吸道感染。
基于细胞的研究表明紫锥菊对这些病毒有抗病毒活性:
鼻病毒、疱疹病毒(单纯型1和2)、甲型和乙型流感、呼吸道合胞体病毒
副 作 用
食用紫锥菊的副作用包括皮疹和恶心、胃痛等轻微胃部问题,但很罕见。
过敏反应可能发生,特别是对菊科其他植物(如甘菊)过敏的人。
★ 小 结 ★
尽管在患有普通感冒和其他上呼吸道感染的人群中进行了广泛调查,但结果有效和无效都存在,因此紫锥菊的有效性尚无定论。需要更多的临床试验来阐明其治疗潜力。
05
麦卢卡 蜂蜜
麦卢卡蜂蜜是由以麦卢卡树(Leptospermum scoparium)的花为食的蜜蜂生产的,被认为是最具药用价值的蜂蜜,但需要更多数据。
作用机理
麦卢卡蜂蜜的主要活性抗生素成分是一种叫丙酮醛的化合物。
蜂蜜的另一种成分是蜂胶,它含有黄酮类化合物(如高良姜精和匹诺塞林pinocembrin)、酚酸和酯类物质,可能有助于增强免疫系统。
麦卢卡蜂蜜还富含葡萄糖氧化酶,这种酶可以将葡萄糖转化为具有抗菌特性的过氧化氢。
另一种化合物葡萄糖内酯可以降低蜂蜜的pH值,并具有天然的抗菌特性。水无法在蜂蜜中流动,使得细菌难以在蜂蜜中生存。
抗 细 菌 性
麦卢卡蜂蜜是一种广谱抗菌剂,可以杀死以下细菌:大肠杆菌、金黄色葡萄球菌、几种肠球菌、铜绿假单胞菌、化脓性链球菌Streptococcus pyogenes、奇异变形杆菌Proteus mirabilis、鼠伤寒沙门氏菌Salmonella typhimurium等。
在 150 名有消化问题的患者中,每周食用蜂蜜与降低感染幽门螺杆菌的风险有关。
在42名慢性鼻窦炎患者的临床试验中,术前用麦卢卡蜂蜜冲洗改善了结果,包括细菌计数。
在一项针对 30 名健康志愿者的试点试验中,咀嚼麦卢卡蜂蜜口香糖可减少牙菌斑积聚和牙龈出血。
将麦卢卡蜂蜜外用于感染了耐抗生素金黄色葡萄球菌的腿部溃疡,促进了使用免疫抑制剂药物患者的伤口愈合。
抗 病 毒 性
麦卢卡蜂蜜可抑制水痘-带状疱疹病毒在人类皮肤细胞中的生长。
它还能抑制甲型流感病毒在狗肾细胞中的生长。
副 作 用
麦卢卡蜂蜜在 20 名健康成人中服用 4 周后没有产生副作用。虽然没有观察到过敏反应,但建议对蜜蜂过敏的个体应谨慎。
★ 小 结 ★
很少有小型临床试验支持在细菌感染患者中使用麦卢卡蜂蜜,虽然结果很有希望。需要更大规模、更稳健的临床试验来验证这些初步结果。
06 肉 桂
肉桂(Cinnamomum zeylanicum和Cinnamomum cassia) 是一种广泛使用的草药,以其抗氧化、抗炎、抗病毒、抗菌和抗真菌特性而闻名。
作用机理
肉桂醛和丁香酚这两种化合物负责肉桂的抗菌和抗病毒特性。
抗 细 菌 性
在试管中,丁香酚和肉桂醛阻止了幽门螺杆菌的生长。然而,4周治疗肉桂(80毫克/天)对15例幽门螺杆菌没有改善。
肉桂提取物还阻止了痤疮丙酸杆菌和表皮葡萄球菌的生长,这两种细菌会导致痤疮。
肉桂油和丁香油可阻止大肠杆菌、小肠结肠炎耶尔森氏菌Yersinia enterocolitica、铜绿假单胞菌Pseudomonas aeruginosa、猪霍乱沙门氏菌Salmonella choleraesuis、金黄色葡萄球菌Staphylococcus aureus、单核细胞增生李斯特菌Listeria monocytogenes、蜡样芽孢杆菌Bacillus cereus和粪肠球菌Enterococcus faecalis 在试管中的生长。
抗 真 菌 性
肉桂提取物对抗真菌的许多菌株,如念珠菌,曲霉Aspergillus,青霉菌等都有效。
在一项为期 7 天的试点研究中,每天服用 8 片肉桂含片可改善5 名 HIV 患者中 3 名的口腔念珠菌感染症状。
在一项针对60名肠道念珠菌感染患者的临床试验中,肉桂和藿香油胶囊解决了72%的感染,改善了28%.
肉桂油、迷迭香油和百里香油的组合减少了Penicillium expansum和Botrytis cinerea真菌的生长。
抗 病 毒 性
肉桂醛可阻止流感病毒(流感 (A/PR/8))的生长并提高大鼠的存活率。
在一项细胞研究中,源自肉桂的 IND02(一种原花青素 A 型分子)可阻止丙型肝炎病毒细胞进入,因此可能是治疗丙型肝炎和肝病的有效疗法。
在另一项细胞研究中,肉桂提取物阻止了另一种类型的流感病毒 (H7N3) 进入细胞。
副 作 用
肉桂提取物可能引起恶心,胃疼痛,和便秘。
★ 小 结 ★
肉桂只在临床试验中对念珠菌病进行了测试,其中一个非常小。需要在更大的人群中进行更多的临床试验,才能确定肉桂是否对治疗念珠菌感染有任何作用。
07 姜 黄
姜黄( Curcuma longa )常用于印度美食,它不仅以其风味而闻名,而且还以其众多的健康益处而闻名。
作用机理
姜黄素是姜黄中活性最强的化合物。在试管中,它阻断了引起尿路感染的细菌生物膜,如大肠杆菌、铜绿假单胞菌、奇异变形杆菌Proteus mirabilis和粘质沙雷氏菌Proteus mirabilis。
姜黄素还会干扰细菌细胞间通讯(群体感应)并阻止重要化合物(pyocyanin和酰基高丝氨酸内酯)的产生。
姜黄素还会破坏真菌中参与存活的蛋白质(ATP 酶活性、麦角甾醇和蛋白酶)的活性。
姜黄素抑制丙型肝炎病毒的复制(通过PI3K /Ak 途径)。
抗 细 菌 性
经过 7 周的治疗,姜黄素摄入量(30 毫克,2 次/天)仅治愈了 25 名幽门螺杆菌患者中的 3 名。但 2 个月后,其余患者的症状有所改善(临床试验)。
在大鼠和小鼠中,姜黄素的摄入减少了由幽门螺杆菌引起的胃部炎症。
姜黄素可预防小鼠创伤弧菌引起的血液中毒。
当与抗生素联合使用时,姜黄素可减轻小鼠肺炎(肺炎克雷伯菌感染)。
抗 真 菌 性
姜黄素通过破坏存活蛋白来杀死念珠菌。
抗 病 毒 性
姜黄素抑制HIV病毒,丙型肝炎病毒,流感病毒A和流感肺炎。
★ 小 结 ★
一项小型临床试验的适度结果显然不足以支持使用姜黄治疗幽门螺杆菌感染。需要进一步的临床研究。
接下来介绍的也是天然抗生素,但没有临床证据支持其对抗感染,是对现有动物和细胞研究的总结,对进一步的研究工作具有指导意义。
08 辣 椒
辣椒的多种变型椒(Capsicum annuum),如红椒,辣椒粉,墨西哥辣椒等,具有抗菌性能的影响。
作用机理
辣椒素是辣椒中的主要活性化合物,使辣椒具有辣味,可通过降低胃部 pH 值来防止细菌感染。
此外,咖啡酸、槲皮素和山奈酚使细菌细胞的外层(膜)变硬,从而杀死它们。
辣椒中的一种化合物 ( CAY-1 ) 通过破坏细胞外层(增加细胞膜渗透性)来杀死真菌。
抗 细 菌 性
辣椒素限制了金黄色葡萄球菌α-毒素的产生并预防了小鼠的肺炎。
辣椒素可阻止细菌(霍乱弧菌)毒素的产生,并防止细菌(化脓性链球菌和金黄色葡萄球菌)在试管中侵入细胞。
抗 真 菌 性
CAY-1在试管中对许多真菌有效,如白色念珠菌、曲霉、小孢子菌等。其中一些真菌会引起皮肤病,例如脚气和癣。
副 作 用
适量的辣椒素被认为是安全的,但可能会引起胃部刺激。
药物相互作用
使用辣椒素可能会增加服用治疗高血压药物(ACE抑制剂)的患者出现咳嗽的风险。
★ 小 结 ★
辣椒限制限制了金黄色葡萄球菌α-毒素,霍乱弧菌毒素的产生,对引起脚气和癣的许多真菌有效,需要更多的临床研究。
09 姜
生姜是一种源自植物生姜根的香料。它常用于烹饪许多亚洲、阿育吠陀和中东美食。它以其许多治疗特性而闻名。
作用机理
生姜含有姜辣素、姜酚、姜油酮、萜类化合物、黄酮类化合物和其他具有抗菌和抗生物膜特性的化合物。姜酚和姜二醇是主要的抗真菌成分。
抗 细 菌 性
生姜在试管中对许多细菌菌株有效,其中一些是葡萄球菌、芽孢杆菌、沙门氏菌、大肠杆菌、铜绿假单胞菌、肺炎克雷伯菌、幽门螺杆菌等。
生姜提取物减少了胃中压力引起的损伤并抑制了胃酸的产生,从而限制了小鼠体内幽门螺杆菌的生长。
在一项细胞研究中,姜化合物杀死了这三种导致牙龈疾病的菌,分别是:牙龈卟啉单胞菌、牙髓卟啉单胞菌和中间普氏菌。
抗 真 菌 性
生姜对试管中的几种真菌菌株有效,包括导致皮肤病(如足癣)和食物腐败的真菌菌株:镰刀菌、曲霉属、白色念珠菌、酿酒酵母、石膏小孢子菌等。
抗 病 毒 性
新鲜生姜可防止人类呼吸道合胞病毒 (HRSV) 附着在人体细胞上,并阻止气道中斑块的形成。
此外,姜提取物抑制疱疹病毒(单纯型1和2)。
副 作 用
姜看起来几乎没有副作用。
药物相互作用
生姜中的一种活性成分(姜酚)会阻断一种分解药物的酶(细胞色素 p450)的活性,这可能会增加药物的作用。
★ 小 结 ★
姜对导致肠胃疾病,口腔疾病的细菌菌株有效,对导致皮肤病(如足癣)和食物腐败的真菌菌株有效,防止人类呼吸道合胞病毒附着,抑制孢疹病毒。也需要更多临床研究。
10 丁 香
丁香(Eugenia caryophyllata)以其抗氧化、抗菌、抗真菌和抗病毒特性而闻名。
作用机理
丁香会破坏细菌细胞的细胞和外层(膜),限制其生长以及 DNA 和关键蛋白质的产生。
抗 细 菌 性
丁香酚是丁香中最重要和最有效的成分,对试管中的空肠弯曲杆菌、大肠杆菌、单核细胞增生李斯特菌和肠沙门氏菌有效。
丁香阻止了许多细菌菌株的生长,包括金黄色葡萄球菌和大肠杆菌。它还可以杀死牙龈疾病患者唾液样本中的细菌。
此外,丁香油和肉桂油可抑制大肠杆菌、小肠结肠炎耶尔森氏菌、铜绿假单胞菌、猪霍乱沙门氏菌、金黄色葡萄球菌、单核细胞增生李斯特菌、蜡样芽孢杆菌和粪肠球菌的生长。
丁香、牛至和肉桂油的组合抑制鲍氏不动杆菌、鲍曼不动杆菌 RCH、肺炎克雷伯菌、大肠杆菌和铜绿假单胞菌的生长。
抗 真 菌 性
口服丁香提取物可防止口腔白色念珠菌的生长并减轻大鼠的感染症状。
丁香的主要成分丁香酚可对抗多种念珠菌属,可用于治疗口腔念珠菌感染(口腔念珠菌病)以及假牙使用引起的炎症和酸痛(假牙口炎)。
抗 病 毒 性
研究表明,丁香油可能有效对抗:
单纯疱疹病毒、丙型肝炎。
★ 小 结 ★
丁香对口腔疾病患者的许多菌株有效,需要更多的临床研究。
11 百里香
百里香(Thymus vulgaris)是地中海美食中使用的一种香料,也因其药用特性而闻名。
作用机理
百里香提取物和精油可阻断细菌的群体感应,如大肠杆菌和铜绿假单胞菌。
抗 细 菌 性
百里香提取物和精油的抑制细菌的许多菌株,包括大肠杆菌,沙门氏菌属,假单胞菌属(荧光假单胞菌和铜绿假单胞菌),粪肠球菌等。
抗 真 菌 性
百里香油与迷迭香和肉桂油一起减少了Penicillium expansum和Botrytis cinerea真菌的生长。
百里香、墨西哥牛至和芥子油可抑制单核细胞增生李斯特菌、金黄色葡萄球菌和肠炎沙门氏菌的生长。
抗 病 毒 性
百里香抑制以下病毒:
疱疹病毒(单纯型 1, 2)
12 迷迭香
迷迭香( Rosmarinus officinalis L. )是一种广泛使用的草药,以其抗氧化、抗炎、抗菌、抗真菌和抗病毒特性而闻名。
作用机理
迷迭香包含化合物(酚衍生物和二萜烯)等1,8-桉树脑,α蒎烯,莰烯,α萜品醇,和冰片,即具有抗氧化,抗微生物剂,抗癌作用。
迷迭香提取物和精油阻断细菌的群体感应,如大肠杆菌和铜绿假单胞菌。
抗 细 菌 性
迷迭香提取物有效地降低许多细菌菌株等的生长,如沙门氏菌,金黄色葡萄球菌,肺炎克雷伯氏菌,大肠杆菌,铜绿假单胞菌等。
抗 真 菌 性
迷迭香油与肉桂油和百里香油一起阻止了Penicillium expansum和Botrytis cinerea真菌的生长。
抗 病 毒 性
迷迭香提取物鼠尾草酚(一种酚类二萜)具有抗 HIV 的抗病毒特性。
13 柠檬草
柠檬草(Cymbopogon citratus)以其抗炎、抗氧化、抗菌和抗真菌特性而闻名。它被广泛用于治疗和芳香目的。
作用机理
柠檬醛α和柠檬醛 β是柠檬草油的主要成分,可阻止不同种类细菌(革兰氏阳性和革兰氏阴性菌)的生长。
抗 细 菌 性
在试管中,柠檬草提取物可以有效减少金黄色葡萄球菌、沙门氏菌、大肠杆菌、铜绿假单胞菌和许多其他细菌的生长。
抗 真 菌 性
柠檬草提取物减少了白色念珠菌、曲霉、石膏小孢子菌和多种青霉菌的生长。
抗 病 毒 性
柠檬草精油降低了一种蛋白质(HIV-1 Tat蛋白)的功能,从而减少了HIV病毒的复制。
14 没 药
没药(Commiphora molmol)在古埃及被用于制作木乃伊。现在,没药被用于治疗伤病和感染,因为它具有抗细菌和抗真菌特性。
作用机理
樟脑、冰片、芳樟醇和α-萜品醇是没药精油的主要成分,具有抗菌特性。
没药可防止生物膜的形成。
抗 细 菌 性
在试管,没药抑制细菌的生长,如金黄色葡萄球菌,大肠杆菌,沙门菌,铜绿假单胞菌,肺炎克雷伯氏菌。
抗 真 菌 性
没药提取物对白色念珠菌、黑曲霉和青霉菌有效。
副 作 用
据报道,没药引起皮肤过敏反应。此外,还报告了腹泻、鼻子刺激和心率变化等可能的副作用。
15 橄榄叶提取物
橄榄叶提取物仅攻击病原体而对人体共生的肠道细菌无害,这是其超越人造抗生素的一大优点,且广泛用于保健品和化妆品。
作用机理
橄榄叶提取物的抗菌活性是由于其多酚。
抗 细 菌 性
橄榄叶提取物抑制了三种食源性病原体(单核细胞增生李斯特菌、大肠杆菌和肠炎沙门氏菌)的生长。抑制了单核增生乳杆菌和肠炎链球菌的生物膜,抑制了单核增生乳杆菌的运动(细胞研究)。
抗 真 菌 性
叶子的甲醇提取物抑制酵母菌株(白色念珠菌和酿酒酵母)。
副 作 用
橄榄叶提取物传统上已在多种培养物中以多种不同方式制备和使用。
在大鼠身上评估了橄榄叶提取物的毒性,并认为是安全的。需要进行人体研究来验证这一点。
■ 目前还缺乏支持这些天然抗生素益处的人体试验,支持它们安全性的研究也有限。在某些情况下,临床试验的结果好坏参半。还需要进一步的临床试验来证实其对人类的益处。
■ 如有慢性病,应该遵循原有的治疗计划,而不是直接用来代替药物。或者与医生讨论这些是否可以作为补充方法。
附录:如何使用天然抗生素?
* 以下不作为临床验方使用,仅供参考
足部或指甲真菌感染
将几茶匙牛至油放入一桶水中,然后把脚浸泡。也可以将一滴牛至油与一茶匙椰子油或冷榨橄榄油混合来稀释油,涂抹在指甲或皮肤上。
鼻窦感染
在一大锅热气腾腾的水中滴几滴牛至油,吸入蒸汽(注意不要太热)。或者使用洗鼻壶(仅使用一小滴),感到有点闷之后结束,效果很好。
口腔感染(如鹅口疮)
用一茶匙冷压椰子油稀释一滴牛至油。漱口几分钟,然后冲洗干净。每天重复3-4次。
皮肤感染
用麦卡卢蜂蜜轻拍患处,并在患处涂抹泡沫,用纱布包上,或者用创可贴贴上。
也可以将1汤匙冷榨橄榄油和1瓣捣碎的大蒜混合。将大蒜放入油中,静置30分钟,然后过滤。如果你想加热的话,可以把它放在温水里(不是热水)。然后滴在感染的地方。
也可以用几滴高品质锡兰肉桂油。把它和麦卢卡蜂蜜混合在一起,然后把它涂抹在感染部位。这种方法非常有效,因为它是两种不同的天然抗生素的组合。
耳部感染
根据 Natasha Campbell-McBride MD 博士的说法,可以用上述注入大蒜油来治疗耳部感染。取油,稍微加热,每小时滴几滴在受影响的耳朵中。这也将有助于松动耳垢堆积。
感冒——增强免疫力
如果你或者周围人最近感冒了,可以每天服用1-2杯麦卡卢蜂蜜茶。可以帮助你预防或缩短病情持续时间。麦卡卢蜂蜜有点贵,不建议长时间每天都吃它,免疫力差时吃点。
压碎 1 瓣生大蒜,压碎比咀嚼要好(减少口臭),吞下大蒜,每天服用一次。
还可以将高质量的有机锡兰肉桂粉与麦卢卡蜂蜜或普通的有机生蜂蜜混合,每天两次。预防感冒,或显著缩短感冒的时间。
生姜可以缓解流感带来的恶心。比较糙吃不下的话,可以和别的(如蜂蜜,肉桂等)结合泡一泡。
主要参考文献:
Leng BF, Qiu JZ, Dai XH, Dong J, Wang JF, Luo MJ, Li HE, Niu XD, Zhang Y, Ai YX, Deng XM. Allicin reduces the production of α-toxin by Staphylococcus aureus. Molecules. 2011 Sep 15;16(9):7958-68.
Lu X, Rasco BA, Jabal JM, Aston DE, Lin M, Konkel ME. Investigating antibacterial effects of garlic (Allium sativum) concentrate and garlic-derived organosulfur compounds on Campylobacter jejuni by using Fourier transform infrared spectroscopy, Raman spectroscopy, and electron microscopy. Appl Environ Microbiol. 2011 Aug;77(15):5257-69.
Watson CJ, Grando D, Fairley CK, Chondros P, Garland SM, Myers SP, Pirotta M. The effects of oral garlic on vaginal candida colony counts: a randomised placebo controlled double-blind trial. BJOG. 2014 Mar;121(4):498-506
Salgueiro LR, Cavaleiro C, Pinto E, Pina-Vaz C, Rodrigues AG, Palmeira A, Tavares C, Costa-de-Oliveira S, Gonçalves MJ, Martinez-de-Oliveira J. Chemical composition and antifungal activity of the essential oil of Origanum virens on Candida species. Planta Med. 2003 Sep;69(9):871-4.
Valcourt C, Saulnier P, Umerska A, Zanelli MP, Montagu A, Rossines E, Joly-Guillou ML. Synergistic interactions between doxycycline and terpenic components of essential oils encapsulated within lipid nanocapsules against gram negative bacteria. Int J Pharm. 2016 Feb 10;498(1-2):23-31.
Foster BC, Vandenhoek S, Hana J, Krantis A, Akhtar MH, Bryan M, Budzinski JW, Ramputh A, Arnason JT. In vitro inhibition of human cytochrome P450-mediated metabolism of marker substrates by natural products. Phytomedicine. 2003 May;10(4):334-42.
Manayi A, Vazirian M, Saeidnia S. Echinacea purpurea: Pharmacology, phytochemistry and analysis methods. Pharmacogn Rev. 2015;9(17):63-72. doi:10.4103/0973-7847.156353
Carlos Tello, Jonathan Ritter, Puya Yazdi, 15 Natural Antibiotics and Side Effects, 2020
Mavric E, Wittmann S, Barth G, Henle T. Identification and quantification of methylglyoxal as the dominant antibacterial constituent of Manuka (Leptospermum scoparium) honeys from New Zealand. Mol Nutr Food Res. 2008 Apr;52(4):483-9.
Prabuseenivasan S, Jayakumar M, Ignacimuthu S. In vitro antibacterial activity of some plant essential oils. BMC Complement Altern Med. 2006 Nov 30;6:39. doi: 10.1186/1472-6882-6-39. PMID: 17134518; PMCID: PMC1693916.
Packiavathy IA, Priya S, Pandian SK, Ravi AV. Inhibition of biofilm development of uropathogens by curcumin – an anti-quorum sensing agent from Curcuma longa. Food Chem. 2014 Apr 1;148:453-60. doi: 10.1016/j.foodchem.2012.08.002. Epub 2012 Aug 10. PMID: 24262582.
Renault S, De Lucca AJ, Boue S, Bland JM, Vigo CB, Selitrennikoff CP. CAY-1, a novel antifungal compound from cayenne pepper. Med Mycol. 2003 Feb;41(1):75-81. doi: 10.1080/mmy.41.1.75.82. PMID: 12627807.
Aghazadeh M, Zahedi Bialvaei A, Aghazadeh M, et al. Survey of the Antibiofilm and Antimicrobial Effects of Zingiber officinale (in Vitro Study). Jundishapur J Microbiol. 2016;9(2):e30167.
Cameron Hooper, The Top 7 Most Effective Natural Antibiotics and How to Use Them, 2017,5
Chaieb K, Hajlaoui H, Zmantar T, Kahla-Nakbi AB, Rouabhia M, Mahdouani K, Bakhrouf A. The chemical composition and biological activity of clove essential oil, Eugenia caryophyllata (Syzigium aromaticum L. Myrtaceae): a short review. Phytother Res. 2007 Jun;21(6):501-6.
Vattem DA, Mihalik K, Crixell SH, McLean RJ. Dietary phytochemicals as quorum sensing inhibitors. Fitoterapia. 2007 Jun;78(4):302-10. doi: 10.1016/j.fitote.2007.03.009. Epub 2007 Apr 11. PMID: 17499938.
Nikkhah M, Hashemi M, Habibi Najafi MB, Farhoosh R. Synergistic effects of some essential oils against fungal spoilage on pear fruit. Int J Food Microbiol. 2017 Sep 18;257:285-294. doi: 10.1016/j.ijfoodmicro.2017.06.021. Epub 2017 Jun 24. PMID: 28763743.
Mothana RA, Al-Rehaily AJ, Schultze W. Chemical analysis and biological activity of the essential oils of two endemic Soqotri Commiphora species. Molecules. 2010 Feb 1;15(2):689-98. doi: 10.3390/molecules15020689. PMID: 20335939; PMCID: PMC6263184.
Liu Y, McKeever LC, Malik NS. Assessment of the Antimicrobial Activity of Olive Leaf Extract Against Foodborne Bacterial Pathogens. Front Microbiol. 2017;8:113. Published 2017 Feb 2. doi:10.3389/fmicb.2017.00113

谷禾健康
想起写作和整理这篇文章的契机,除了夏季即将来临,还要从我们的一位消费者来咨询的内容说起。他的肠道菌群检测报告里有一个病原菌检出超标,这个病原菌就是赫赫有名的Borrelia burgdorferi (伯氏疏螺旋体,也称莱姆病螺旋体)。

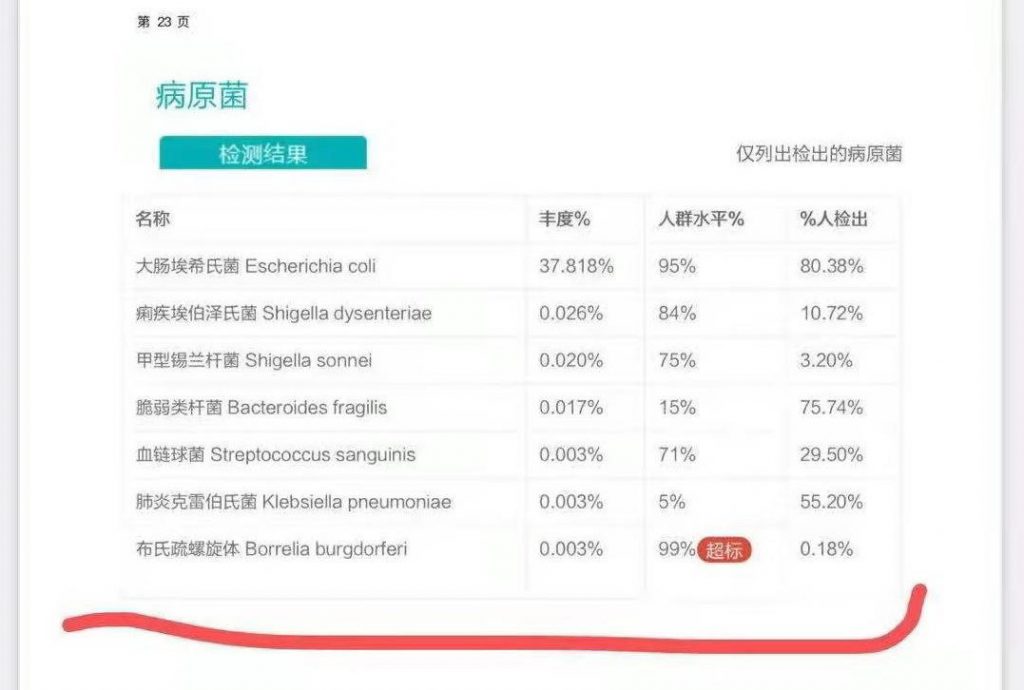
谷禾肠道菌群检测报告
说到这个菌,大家可能不熟悉,但应该听过或者患过“莱姆病”,或者听过有关莱姆病的新闻。

著名加拿大歌手贾斯汀·比伯和摇滚小天后艾薇儿都曾因为莱姆病不得不暂别歌坛数年,2018年,艾薇儿用一首《Head Above Water》诠释了与莱姆病战斗的过程。病情最严重的时候,她感觉:
“自己的身体停止运转,
像在慢慢沉入水底,
需要浮上来呼吸一口气”
莱姆病是全球性的疾病,但大家可能还不够重视。
地区分布
这种疾病于上世纪70年代在美国康涅狄格州的莱姆镇被发现,四十多年来,莱姆病在亚洲、欧洲、非洲都有病例报道,以北半球较为多见。
我国于1985年,在黑龙江省林区,发现了国内首个莱姆病病例,目前,东北林区仍是我国莱姆病最常见的地区。
发病率
2015 年 9 月发表在《新发传染病》上的一份报告估计,该国每年发生329,000 例莱姆病病例——是通常向 CDC(Centers for Disease Control and Prevention ) 报告的 30,000 例确诊和可能病例的10 倍以上。欧洲每年报告大约 85,000 例莱姆病病例。
莱姆病只发生在某些生态条件适宜的地区。在美国的高度流行地区,如康涅狄格州和纽约南部,每年的发病率约为每1000人0.5例,但在局部地区可能要高得多。报告的发病率在5至10岁儿童中最高,几乎是成人发病率的两倍。
莱姆病的“罪魁祸首”,是一种叫做“伯氏疏螺旋体(Borrelia burgdorferi)”的病原体,也就是我们前面报告中检出的病原菌。
下面我们就从“伯氏疏螺旋体”开始说起,详细了解一下究竟什么是莱姆病,感染之后为什么会这么严重,需要注意事项等。
伯氏疏螺旋体(Borrelia burgdorferi)是真细菌门螺旋体的一员。这类菌具有独特的形态,包括螺旋状或波浪状的身体和鞭毛(运动器官),鞭毛被包裹在外膜和内膜之间。
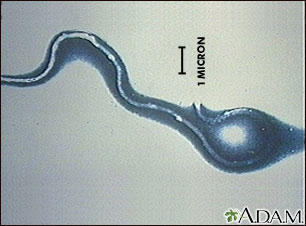
图源:医学百科全书
螺旋体包括几种人类病原体,例如:
梅毒螺旋体(梅毒病原体)、钩端螺旋体、脊螺旋体属和几种引起复发性发热的螺旋体。虽然医学界早就知道这些其他螺旋体,但莱姆病的病原菌是70年代才被发现的。
伯氏疏螺旋体的发现
1977年,Alan Steere博士及其同事在临床上将莱姆病描述为一种传染病。Steere等人认为,由于农村地区患者的地理聚集和症状的季节性发生,莱姆病的流行病学表明是通过节肢动物媒介传播的。随后,Willy Burgdorfer博士及其同事在莱姆病流行区采集的蜱中肠组织中观察到螺旋体。
当这些螺旋体注射到兔子体内时,会产生类似于红斑移行症的皮疹,莱姆病患者的血清在间接免疫荧光分析中与细菌发生反应。为了确认这一发现,这种细菌被命名为伯氏疏螺旋体。
美国,伯氏疏螺旋体是唯一导致莱姆病的病原体。 然而,在欧洲和亚洲,除伯氏疏螺旋体外,B. burgdorferi sensu strictu (s.s.),B. garinii 和B. afzelii也会引起莱姆病。
但是欧洲和北美莱姆病的临床表现具有一些共同特征,例如红斑游走性皮疹和流感样疾病。 随后,可能会出现与感染物种大致相关的其他症状。 关节炎经常伴随 B. burgdorferi s.s. 感染,而神经系统症状与 B. garinii 相关,皮肤病与 B. afzelii 相关,尽管这些临床关联不是绝对的。
尽管尚未确定导致疾病差异的潜在遗传特征,但释放的三个疏螺旋体基因组序列应该有助于了解更多。这些基因组具有几个共同的特点,包括线性染色体和大量的较小的DNA分子(质粒),其中一些是线性和其他环状。
染色体和许多质粒的线性结构在细菌世界中是不寻常的,虽然这种形式的 DNA 的进化优势尚不清楚。然而,它可能会给疏螺旋体属带来一些好处,因为所有特征成员都保留线性 DNA 分子。
传播这种病原菌的节肢动物主要为蜱虫(如下图)。

莱姆病最常见于6 月、7 月和 8 月,在这季节蜱很活跃,人们在户外的时间也较长。这些蜱虫会在春季和夏季觅食。
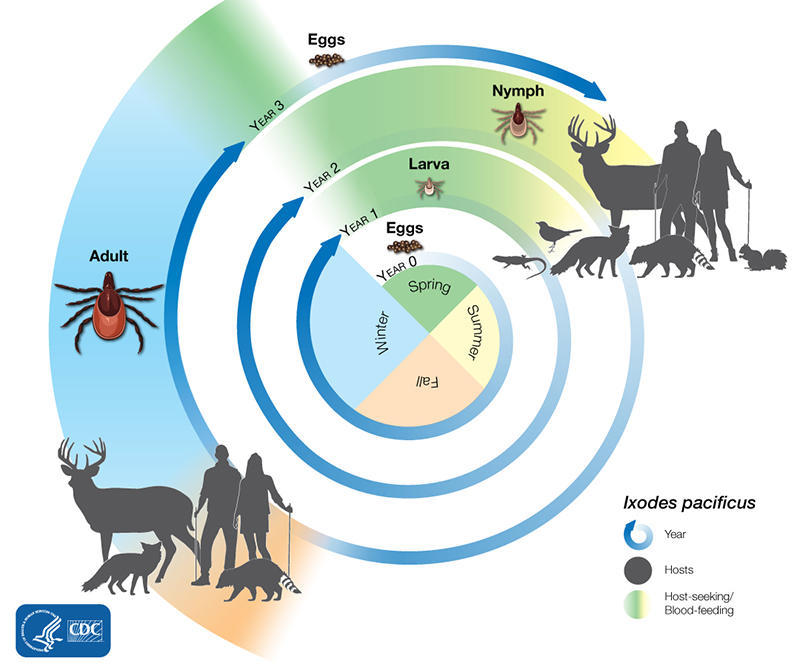
大多数蜱经历四个生命阶段:卵、六足幼虫、八足若虫和成虫。从卵孵化后,蜱必须在每个阶段吃血才能生存。需要这么多宿主的蜱虫可能需要长达 3 年的时间才能完成它们的整个生命周期,而且大多数会因为找不到宿主进行下一次喂养而死亡。
不同生命阶段几个蜱的相对大小

图源:CDC
像肩胛硬蜱的生命周期通常持续两年。在此期间,它们经历四个生命阶段:卵、幼虫、若虫和成虫。卵孵化后,蜱虫必须在每个阶段吃血才能生存。
图源:CDC
蜱可以以哺乳动物、鸟类、爬行动物和两栖动物为食。大多数蜱虫喜欢在其生命的每个阶段拥有不同的宿主动物,如下所示:
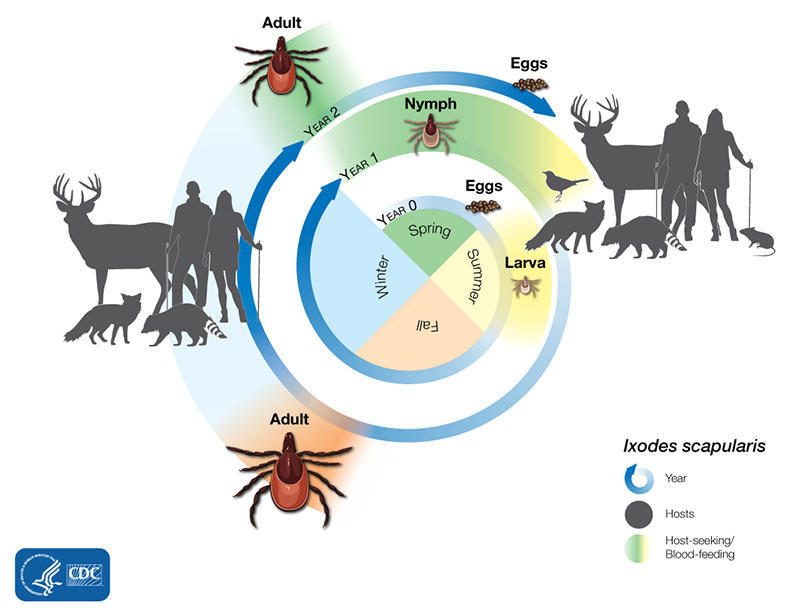
蜱虫可能会在其生命周期的任何阶段被感染,因为它是伯氏疏螺旋体的天然宿主。幼虫在地上过冬,次年春天以若虫的形式出现。 若虫蜱最有可能传播感染,因为它们很小,很难看到,而且在人类经常感染蜱虫的地区数量众多。 若虫在秋天蜕皮成为成虫。 成年雌性通常在冬天依附于鹿等大型动物(因此俗称鹿蜱),在第二年春天死亡前产卵,2年的生命周期再次开始。
注:不完全变态昆虫的幼虫被称为若虫(nymph)。故若虫不是某一种昆虫,而是一类昆虫发育至某一段时期的称谓,即营陆生生活的不完全变态昆虫的幼体。
当然,必须感染蜱才能传播伯氏疏螺旋体。
蜱虫如何找到宿主
蜱通过探测动物,或通过感觉身体热量,水分和振动,找到宿主的呼吸和身体气味。有些物种甚至能认出影子。此外,蜱虫通过识别使用良好的路径来选择一个等待的地方。然后,它们在草和灌木的顶端等待宿主。蜱不能飞也不能跳,但许多蜱类在一个做“任务”的位置等待。
在执行任务时,蜱通过它们的第三和第四对腿抓住树叶和草。他们伸出第一双腿,等待着爬到主人的身上。当寄主经过一个蜱虫等待的地方,它很快爬上。有些蜱虫会很快附着,有些则会四处游荡,寻找耳朵等皮肤较薄的地方。

蜱如何传播疾病
根据蜱类及其生活阶段的不同,准备可能需要10分钟到2小时。当蜱虫找到一个觅食点时,它会抓住皮肤并切入表面。
然后,蜱虫插入它的喂食管。许多物种还会分泌一种类似水泥的物质,使它们在进餐时牢牢地附着在一起。喂食管可以有倒钩,这有助于保持蜱虫在适当的位置。

SCIENCE PHOTO LIBRARY
蜱还能分泌少量具有麻醉性质的唾液,使动物或人感觉不到蜱附着在自己身上。如果蜱虫在一个隐蔽的地方,它可能会被忽视。
螺旋体生活在蜱的中肠中,然后细菌迁移到唾液腺和唾液,通过唾液将螺旋体注入宿主。
伯氏疏螺旋外表面蛋白的OspA显示出是细菌驻留在蜱表面,但在蜱喂养和传播给哺乳动物的过程中下调。随后的研究表明,OspA 是一种粘附素,对于将螺旋体保留在蜱中肠直到进食很重要。
OspB,另一种潜在的中肠粘附素,BptA,一种功能未知的脂蛋白,以及 BB0690 基因的产物,可能与抗氧化应激有关 ,似乎也有助于蜱中的细菌存活。
一只蜱会慢慢地吸血好几天。如果宿主动物有血源性感染,蜱虫会将病原体与血液一起摄入体内。
蜱虫的少量唾液也可能进入宿主动物的皮肤。如果蜱虫含有病原体,那么可能通过这种方式传染给宿主动物。
这一过程结束后,大多数蜱虫会脱落,为下一个生命阶段做准备。在下一次进食时,它可以将获得性疾病传染给新的宿主。
莱姆病典型症状包括发烧、头痛、疲劳以及称为游走性红斑的特征性皮疹。如果不及时治疗,感染会扩散到关节、心脏和神经系统。症状可能因疏螺旋体的具体类型而异。
在北美的主要种类是B.burgdorferi sensu strictu,它特别容易引起关节炎。相比之下,欧洲物种B. garinii和B. afzelii分别与神经和慢性皮肤病表现更相关。
莱姆病的进展通常分为三个阶段:
第一阶段
局部莱姆病,感染集中在身体一个区域
第二阶段
早期播散性莱姆病,其中细菌已开始传播
第三阶段
晚期播散性莱姆病,其中细菌已扩散到全身
莱姆病的早期症状
莱姆病通常以明显的皮疹开始,但也可能导致流感样症状。
莱姆病的早期体征和症状可能非常轻微,可能会被遗漏。这种疾病在发病时可能类似于流感。其最明显的症状是牛眼状皮疹。但美国国家过敏和传染病研究所 (NIAID) 指出,至少有四分之一的莱姆病患者没有出现明显的皮疹。
局限性莱姆病最常见的特征是缓慢扩大的皮肤病变或皮疹,称为游走性红斑 (EM)。这种皮疹通常在传播疾病的蜱叮咬后 3 到 30 天(平均 7 天)出现。
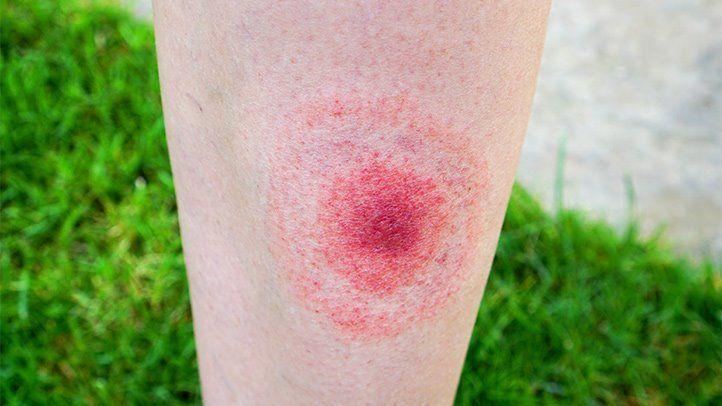
Anastasia Kopa/Shutterstock
在向疾控中心报告的莱姆病病例中,约有 70% 的莱姆病病例,游走性红斑是该病的最早征兆。
某些特征可以帮助识别游走性红斑: 它从蜱虫叮咬处的扁平或略微凸起的红点开始,然后扩展为直径达73 厘米(28.7 英寸)的圆形皮疹(如上图)。
它可以出现在身体的任何部位(咬伤部位),但最常见于成人的下肢、臀部和腹股沟,以及儿童的头部和颈部。
皮疹中心周围可能会出现一个清晰的环,使其看起来像牛眼(中心圆圈周围有一个清晰的环,周围环绕着一个更大的皮疹)。
它摸起来可能是发热的,但很少疼痛或发痒。
虽然典型的莱姆病皮疹呈牛眼状,但并非所有的游走性红斑病例看起来都一样。患者可能会出现红色、扩大的病灶,中央有皮肤结痂;多处红色病变;红色椭圆形斑块;根据疾病预防控制中心的说法,或出现蓝色皮疹。
除了游走性红斑外,局部莱姆病患者可能会出现类似流感的症状,包括发烧和发冷、头痛、疲劳、肌肉和关节疼痛、全身不适(不适)和淋巴腺肿胀。
莱姆病会导致关节疼痛急剧增加和大量肿胀,所以有些人觉得特别累。但是也有大约 20% 的莱姆病患者除了游走性红斑症外没有任何症状。
如果莱姆病得不到治疗,皮疹通常自行消退,但是细菌会进入血小管,并传播到身体其他部位。
神经系统并发症可在早期播散性(第二阶段)莱姆病中开始发展。
莱姆病并发症可能包括:
——视力障碍
——注意力不集中
——易怒
——睡眠和记忆障碍
——腿部和手臂的神经损伤(神经病)
也可能出现其他非神经系统并发症,例如严重的关节炎、持续性疲劳、情绪障碍以及危及生命的心脏、肺和神经系统疾病。
莱姆病的后期症状
在早期播散性(第二阶段)莱姆病中,在蜱叮咬后数周至数月发生,可能会出现其他症状,包括:
额外的红斑移行病变神经疼痛;
面部麻痹或贝尔麻痹,面部一侧肌肉麻痹或无力;
莱姆心脏炎:莱姆病细菌进入心脏组织并干扰协调心脏跳动的正常过程,症状包括心悸、胸痛或气短。

晚期播散性(第三阶段)莱姆病在感染开始后数月至数年发生,可能导致:
伴有严重关节疼痛和肿胀的关节炎,尤其是膝盖等大关节
肌腱、肌肉、关节和骨骼疼痛
肌肉运动异常
手或脚麻木和刺痛
认知问题,包括言语和短期记忆问题
脑膜炎 引起的严重头痛和颈部僵硬 (覆盖脊髓和大脑的膜发炎)
什么情况下,从蜱到人类传播风险较大?
受感染蜱的比例因地理区域和蜱在其生命周期中的阶段而异。 在新英格兰南部的高度流行地区,若虫感染的几率约为20%-30%,成年蜱的感染率为30% -50%。
根据动物的实验研究,要传播伯氏疏螺旋体,受感染的若虫蜱通常必须至少进食 36 至 48 小时,受感染的成年蜱必须至少进食 72 小时,然后传播风险才会变得很大。 这些实验结果在一项人类研究中得到证实,在该研究中,对于已进食至少 72 小时的若虫蜱,从蜱(可以评估其进食持续时间)到人类的传播风险为 25%。
研究表明,在大多数被蜱虫叮咬的情况下,蜱虫进食的时间不到 48 小时,这在一定程度上解释了在流行地区被蜱虫叮咬后患莱姆病的风险低(1%–3%)。未被识别的叮咬可能会导致莱姆病的风险更高,因为蜱虫可能会吃饱并更有可能传播感染。
什么情况下容易被蜱叮咬?
一个人被蜱虫咬伤和患莱姆病的几率取决于他们居住、旅行或谋生的地方。
感染莱姆病的常见风险因素包括:

长时间在树木繁茂的地方或草地,田地,庭院,特别是在美国东北部和中西部
裸露的皮肤,会让蜱虫更容易附着或叮咬
不正确地去除蜱虫或在它们附着在皮肤上 48 小时或更长时间后才去除,这会使叮咬处的细菌进入皮肤
在评估莱姆病患者时,首先应考虑:
莱姆病的体征和症状 ,患者接触感染蜱的可能性,其他疾病可能引起类似症状的可能性。
然后进行CDC建议的对莱姆病的两步检测。
这两个步骤都是必需的,并且可以使用相同的血液样本完成。如果第一步是阴性的,则不建议进行下一步测试。
如果第一步是阳性的或不确定的(“模棱两可”),则应执行第二步。仅当第一次测试为阳性(或模棱两可)而第二次测试为阳性(或某些测试模棱两可)时,总体结果才是阳性。
抗体产生
要记住,大多数莱姆病测试旨在检测身体对感染产生的抗体。
抗体可能需要数周时间才能产生,因此如果最近才感染,患者可能会检测为阴性。
感染消失后,抗体通常会在血液中持续存在数月甚至数年;因此,该测试不能用于确定治愈。
检测的准确性
感染其他疾病,包括一些蜱传疾病,或一些病毒、细菌或自身免疫性疾病,可能导致假阳性检测结果。
不过莱姆病的血液检测只有 65% 或更少是正确的。与其他传染病的血清学检测一样,检测的准确性取决于被感染的时间。在感染的最初几周内,例如当患者出现游走性红斑皮疹时,预计检测结果为阴性。
一些测试会给出两种抗体的结果,IgM 和 IgG。如果患者患病超过 30 天,则不应考虑阳性 IgM 结果。
感染几周后,FDA 批准的测试具有非常好的敏感性。
感染初期,在被蜱虫叮咬后的最初几周内接受抗生素的人可能没有完全发展的抗体反应,或者可能因产生抗体反应的水平太低而无法检测到。
针对莱姆病细菌的抗体通常需要几周的时间才能产生,因此即使被感染,在此之前进行的检测也可能呈阴性。在 4-6 周后,测试才可能呈阳性。
PCR,测序和培养
PCR或测序可以提供各种样本中伯氏疏螺旋体核酸的高度特异性证据,包括滑液、皮肤活检组织、血液和脑脊液 。然而,其临床效用受到低灵敏度(尤其是血液和脑脊液样本)及其潜在污染的限制。
滑液PCR 对莱姆关节炎的敏感性 > 75%,可能与其他滑液分析结合使用,以区分莱姆关节炎和其他关节炎 。
对血液 PCR 的研究发现,它的高特异性被其缺乏临床敏感性和污染的可能性所抵消。因此,PCR 尚未被普遍标准化或优化用于诊断莱姆病。然而,一些临床实验室提供了疏螺旋体属的 PCR 检测,血液 PCR 已显示出检测新基因种B. miyamotoi 和B. mayonii 的效用。
由于伯氏疏螺旋体是一种生长缓慢的菌,目前的培养方法敏感性较差。通常不建议将培养用于研究以外的目的,或用于证实在以前未被识别有感染风险地区感染的疾病。
根据我们的检测,可以看出粪便菌群检测结果也可以辅助判别是否感染了伯氏疏螺旋体,而且粪便里检测到有一定概率表明血液里也存在了。这种情况可以根据自身症状和是否接触过蜱虫活动区进一步判别,不过目前类似PCR和粪便菌群测序等测试目前都只能作为辅助判别。
如果你被蜱虫咬过并且它嵌入你的皮肤,最好的去除方法是使用细尖镊子。

图源:CDC
将镊子尽可能靠近皮肤,将蜱虫稳步向上拉以取出它的身体(包括它的嘴部),并彻底清洗咬伤处和手。即使没有看到蜱虫,如果在去过可能有蜱虫的区域后出现皮疹、发烧、发冷或头痛,也要特别留意和检查身体。
Thinkstock; Getty Images
抗生素治疗
抗生素是目前唯一已知的有效治疗莱姆病的方法。
在大多数情况下,莱姆病可以通过两到三周的抗生素疗程来解决,通常是强力霉素(也具有抗炎特性)或阿莫西林。
通常,治疗开始(和完成)越早,恢复就越快。
成人和儿童早期莱姆病的标准治疗方法是口服抗生素。 不过不同的人群使用抗生素不同,要遵循医生的建议。
如果莱姆病进展到更晚期并累及神经系统,则可能需要静脉注射抗生素。这些通常开处方 14 到 28 天,可以消除感染,但它们可能会引起副作用,包括白细胞计数降低、轻度至重度腹泻,或其他与莱姆病无关的抗生素耐药生物定植或感染。
替代和补充疗法
除抗生素外, 科学家们还在探索莱姆病的补充和替代医学。有针对莱姆病患者销售的替代或补充疗法,但没有科学证据证明它们有效,甚至可以安全使用。
发表在 2020 年 2 月出版的《医学前沿》杂志上的一项研究发现,相对低浓度 (1%) 的七种天然草药提取物可能对伯氏疏螺旋体有效,但是临床使用还需要进一步证明。
【1】避开木质、灌木丛和草地,尤其是在 5 月、6 月和 7 月。
【2】穿浅色衣服,如果蜱爬到身上时你可以及时发现它。
【3】穿长裤、长袖衬衫和覆盖整个脚的鞋子(不要穿凉鞋),把裤腿塞进袜子或鞋子里,把衬衫塞进裤子里。戴帽子保护头部。
【4】在衣服和裸露的皮肤区域喷洒含有避蚊胺的驱虫剂。
【5】如果在林荫小道上,请走在中间,尽量避开灌木和草地。
【6】从户外进来时,请立即脱掉衣服,并在高温下洗涤并晾干。
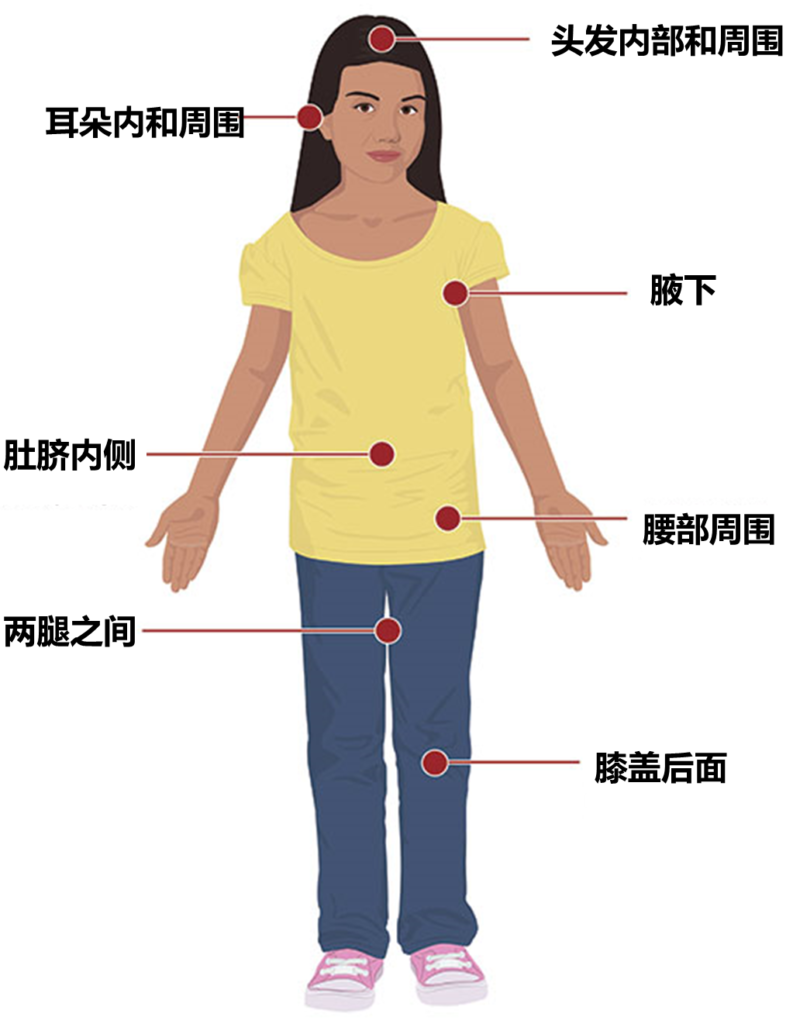
【7】户外活动后仔细检查身体和头部是否有蜱虫。尤其是身体的这些部位:
腋下、耳朵内和耳朵周围、肚脐内侧、膝盖后面、在头发内部和周围、两腿之间、腰部周围。
附录:关于莱姆病的常见问题
被蜱虫叮咬了,患莱姆病了吗?
被蜱虫叮咬后感染莱姆病的几率取决于蜱虫的类型、感染地点以及它附着在身上的时间。
在美国,许多类型的蜱虫会咬人,但只有黑腿蜱虫会传播导致莱姆病的细菌。此外,只有美国东北部和中北部高度流行地区的黑腿蜱通常被感染。最后,黑腿蜱需要附着至少 24 小时才能传播莱姆病。
对于被蜱虫叮咬,要引起重视,除了莱姆病之外,也有传染其他疾病的可能性。
莱姆病会通过性传播吗?
没有可靠的科学证据表明莱姆病是通过性接触传播的。已发表的动物研究不支持性传播(Moody 1991;Woodrum 1999),并且莱姆病螺旋体与这种暴露途径不兼容(Porcella 2001)。传播莱姆病的蜱虫非常小,很容易被忽视。因此,即使其中一方或双方不记得被蜱虫叮咬,生活在同一家庭的性伴侣也有可能因蜱虫叮咬而被感染。
莱姆病会通过母乳传播吗?
没有关于莱姆病通过母乳传播给婴儿的报告。如果在被诊断出患有莱姆病的时候还在母乳喂养,请告知医生,尽可能开出在母乳喂养时可以安全使用的抗生素。
莱姆病会通过输血途径传播吗?
尽管没有莱姆病病例与输血有关,但科学家们发现莱姆病细菌可以生活在一个活跃的感染者的血液中。接受抗生素治疗的莱姆病患者不应献血。
怀孕了,怀疑有患莱姆病,该怎么办?
怀孕期间未经治疗的莱姆病可导致胎盘感染。从母亲传播到胎儿是可能的,但很少见。幸运的是,通过适当的抗生素治疗,不良分娩结果的风险不会增加。
* 没有已发表的研究评估母亲在怀孕期间患上莱姆病的儿童的发育结果。
如何知道是否已经彻底治愈?
没有任何测试可以“证明”治愈。
莱姆病测试检测人体免疫系统产生的抗体,这些抗体可以在感染消失后持续很长时间。这意味着,如果血液测试呈阳性,那么即使细菌不存在,它也可能会持续数月甚至数年呈阳性。
如果说PCR研究工具可以检测某些患者的细菌 DNA。但研究表明,死细菌的 DNA 片段在治疗后数月内仍可检测到。剩余的 DNA 片段没有传染性。仅仅因为感染的 DNA 片段还存在, 并不意味着细菌是活的或有活力的。
一旦得了莱姆病,就会一直持续下去吗?
不会。在感染早期接受抗生素治疗的患者通常会迅速完全康复。大多数在疾病晚期接受治疗的患者也对抗生素反应良好,尽管有些患者可能对神经系统或关节造成长期损害。
但也有可能存在,接受推荐的 2 至 4 周抗生素疗程的莱姆病患者在完成治疗时出现疲劳、疼痛或关节和肌肉酸痛等症状。
在少数情况下,这些症状可持续 6 个月以上。这些症状无法通过更长疗程的抗生素治愈,但随着时间的推移,它们通常会自行改善。
主要参考文献
Shapiro ED. Borrelia burgdorferi (Lyme disease). Pediatr Rev. 2014;35(12):500-509. doi:10.1542/pir.35-12-500
Tilly K, Rosa PA, Stewart PE. Biology of infection with Borrelia burgdorferi. Infect Dis Clin North Am. 2008;22(2):217
Imaging in Lyme neuroborreliosis.Insights into Imaging(2018)9:833–844.
Lyme borreliosis:diagnosis and management.BMJ 2020;369:m1041.
Brainstem encephalitis in neuroborreliosis:typical clinical course and distinct MRI findings.J.Neurol.2020 Aug 28.
Centers for Disease Control website. Lyme disease. www.cdc.gov/lyme. Updated December 16, 2019. Accessed April 7, 2020.
Steere AC. Lyme disease (Lyme borreliosis) due to Borrelia burgdorferi. In: Bennett JE, Dolin R, Blaser MJ, eds. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 9th ed. Philadelphia, PA: Elsevier; 2020:chap 241.
Wormser GP. Lyme disease. In: Goldman L, Schafer AI, eds. Goldman Cecil Medicine. 26th ed. Philadelphia, PA: Elsevier; 2020.
What Is Lyme Disease? Symptoms, Causes, Diagnosis, Treatment, and Prevention. Joseph Bennington, Sanjai Sinha, 2020, 11
Lyme Disease Treatment. Joseph Bennington, Joseph Bennington, Castro Medically, 2018, February 23
How ticks spread disease, Content source: Centers for Disease Control and Prevention, National Center for Emerging and Zoonotic Infectious Diseases (NCEZID), Division of Vector-Borne Diseases (DVBD)
Shapiro ED. Borrelia burgdorferi (Lyme disease). Pediatr Rev. 2014;35(12):500-509
谷禾健康
肺炎克雷伯菌(Klebsiella pneumoniae),也称弗里德兰氏杆菌,最早是由德国微生物学家和病理学家Edwin Klebs卡尔·弗里德兰德于1882年描述的。
肺炎克雷伯菌是一种革兰氏阴性,不运动的,包囊的杆状芽孢杆菌,存在于人类和非人类灵长类动物的鼻咽和胃肠道中。属于克雷伯氏菌属和肠杆菌科。是兼性厌氧的,氧化酶为阴性,并从乳糖产生酸和气体。它是一种肠内细菌,在5%的健康人的肠道中可见。也可以驻留在皮肤和口腔中。
肺炎克雷伯菌可以自然存在于健康个体的肠道和呼吸道中,具有健康免疫系统的人很少发生感染疾病。
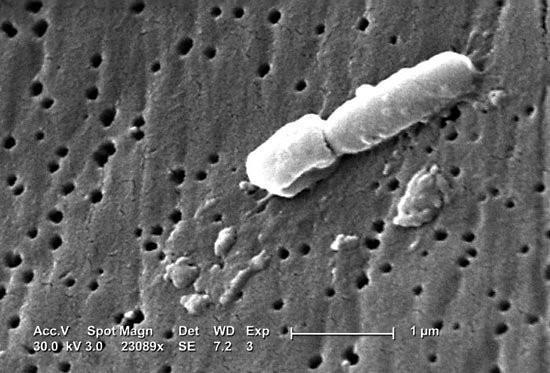
肺炎克雷伯菌的扫描电镜观察
图源:Janice Carr/Centers for Disease Control and Prevention (CDC)
肺炎克雷伯氏菌在人宿主中有两个主要的定植渠道:上呼吸道和肠道。肺炎克雷伯菌建立定植必须与这两个位置的微生物群和免疫系统建立的防御系统抗衡。
表达多种致病性因子,包括多种粘附素,荚膜多糖,铁载体和脂多糖,可逃避宿主防御。例如,荚膜多糖(K抗原)可防止吞噬作用;染色体上携带的多种抗生素抗性基因等。
科学分类
Trevisan 1885 emend. Drancourt et al. 2001
首先我们先来看看,肺炎克雷伯菌这种菌在人群中的分布情况究竟是怎样的?
我们从谷禾健康2019年近期检测人群肠道菌群样本抽取1.3万例样本,人群共计13358人,涵盖0~103岁人群。
其中肺炎克雷伯氏菌丰度占比超过1%的人群有3765例,占比28.2%。
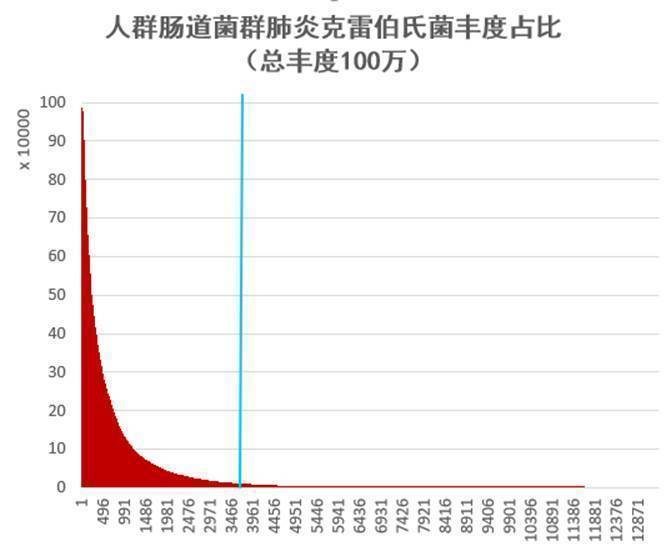
谷禾健康肠道菌群数据库
肺炎克雷伯菌可以逃避人体的正常保护机制。除了攻击肺和膀胱等器官外,它还引发炎症反应,从而加剧发烧和发冷等症状。
接下来我们详细了解一下,克雷伯菌感染后会有哪些症状。
在新的和旧的灵长类动物中,这种细菌都与脑膜炎,腹膜炎,败血病和肺炎有关。肺炎克雷伯菌是引起肺炎的人类呼吸系统的主要病原体之一。
当细菌直接进入人体内时,通常会发生克雷伯菌感染。一旦它们进入体内并在免疫系统的防御中幸存下来,它们就会影响各种器官。疾病的症状通常取决于感染开始的位置。
感染包括泌尿道、血液、脑部等。克雷伯菌的感染迹象和症状会随感染部位的不同而不同。
肺部感染
这类肺炎的主要症状是发烧和发冷,由于咳嗽,可能还会感到胸部不适,呼吸急促,疲倦。如果疾病已经蔓延很多,那么可能还会遇到一些其他症状,例如咳嗽时痰液浓稠,带血,通常被称为“黑加仑果冻痰”。
像肺炎球菌一样,克雷伯菌属感染肺部一般会产生大叶性肺炎,有黏液状的“粘液样”外观,并且上叶的原因不明。感染会导致出血性坏死,微脓肿和空腔形成。部分克雷伯菌属还会产生慢性坏死性肺炎,并伴有疤痕和肺部解剖结构扭曲。
鼻部感染
感染克雷伯氏菌会导致鼻粘膜的恶臭消散(萎缩)。
克雷伯氏菌鼻硬膜炎可引起鼻硬化症,是鼻子和喉咙的破坏性结节性炎症。
眼部感染
如果肺炎克雷伯菌(K. Pneumonia)感染了血液,那么它有可能会传播到眼睛并引起严重的感染,称为眼内炎。它主要引起眼睛的白色部分发炎。
在较早阶段,这种感染会导致眼睛发红和轻度至重度疼痛。除了不适,还可能会从眼睛排出白色或黄色粘液。
当感染处于晚期时,会导致视力模糊和畏光。如果不加以治疗,细菌还会扩散到大脑中,并引起其他健康并发症。
血液感染
当肺炎克雷伯菌进入血液并对其进行感染时,通常会发生细菌血症。症状可能包括发冷,发烧,发抖,肌肉酸痛,疲劳和嗜睡。可能还会出现意识变化。败血症可作为反应发生。
脑膜炎
在某些由肺炎克雷伯菌引起的眼内炎中,微生物从患者的眼睛传播到大脑,并引起细菌性脑膜炎。但是,已知这种肺炎克雷伯菌很罕见,通常发生在老年人中。
当一个人患有这种类型的感染时,他们会突然发高烧,脑膜(大脑周围的保护层)感染可引起头痛,脖子僵硬,背部疼痛,疲劳。由于急性疼痛,许多人也会感到恶心和畏光的感觉。在极少数情况下,脑膜炎会引起癫痫发作。
如果不及时治疗,在某些情况下也可能导致患者死亡。
尿路感染
当肺炎克雷伯氏菌细菌进入人的尿道(包括肾脏,尿道和膀胱)时,会引起严重的尿路感染(UTI)。
起初由克雷伯菌引起的泌尿道感染通常不显示任何明显的体征。但是,随着感染的增加,开始出现许多严重的症状。
这可能会导致尿频,排尿灼热感,膀胱急迫和尿失禁。其中,尿频是最常见的一种。它还可能引起发烧、小腹和骨盆区域的疼痛或不适。
这种感染通常发生在使用导尿管一段时间的患者中。通常,它在老年妇女中更为常见。
伤口感染
如果肺炎克雷伯菌通过瘀伤进入,可导致伤口愈合延迟,发红,脓液和疼痛,发烧,疲劳。
那么它也可以感染身体或皮肤的软组织。这种类型的感染发生在那些因手术和受伤导致开放性伤口的人中。
可能会感到非常恶心,但是医生不一定能马上知道感染这种菌,肺炎克雷伯菌的感染通常以与其他感染相似的症状为特征。要经过诊断测试才能确认。
化脓性肝脓肿
肺炎克雷伯菌还可以感染肝脏,并在其中引起脓性病变,它被称为化脓性肝脓肿。这种类型的感染更常见于患有糖尿病一段时间或已经服用抗生素多年的人。
患有化脓性肝脓肿的人可能出现:
轻度至重度发烧、呕吐(有血或无血)、急性腹泻、经常感到恶心、右上腹部轻度疼痛。
克雷伯菌的其他种类包括产酸克雷伯氏菌和植物肺炎克雷伯菌与肺炎克雷伯菌一起可引起人尿道和伤口感染。肺炎克雷伯菌的罕见亚种会引起特别严重的疾病。
K. ozaenae
是一种罕见的人类病原体,很少引起严重感染,被认为是萎缩性鼻炎的病因(萎缩性鼻炎:以粘液脓性分泌物、粘膜结痂和恶臭为特征)。K. ozaenae菌血症是一种罕见的临床问题。在文献中,只有十二病例报告。
K. rhinoscleromatis
可导致缓慢进展的疾病,称为鼻硬化症。在首次临床表现时,患者最初可能处于疾病的第一阶段(鼻炎),伴有鼻塞、结痂和恶臭。随着疾病进展到肉芽肿阶段,患者开始出现更明显的鼻塞、畸形、鼻衄、嗅觉障碍。
K.oxytoca
与新生儿菌血症有关,尤其是在早产儿和新生儿重症监护病房中。从新生儿菌血症患者中分离出来。
K. planticola
已从诸如小麦,水稻和玉米(玉米)等植物的根中分离出了K. planticola和某些肺炎克雷伯氏菌菌株,它们在其中起着固氮细菌的作用。
K. variicola
变栖克雷伯菌K. variicola于2004年被发现,它也存在于多种植物中,包括水稻,香蕉和甘蔗。这种细菌还已经从医院环境中分离出来,在医院中它可能像其他克雷伯菌一样,是一种条件致病菌。
Alfred Pasieka/science Photo Library
肺炎克雷伯菌通常通过触摸,唾液交换和其他接触方式从一个人传给另一个人。没有被这种细菌感染的人也可以将其传播给另一个人。
它们还可以通过其他一些医疗设备传播,例如输尿管和静脉导管,呼吸机等。但是,肺炎克雷伯菌不能通过空气传播。
克雷伯菌肺炎通常发生在由于年龄,酒精滥用或糖尿病等导致免疫功能低下人群。常出现在酒精中毒或慢性肺部疾病等患者中,并且通常以医院感染的形式出现。
此外,易感因素包括营养不良,接触程度,不卫生的环境和遗传易感性等。
具体易感因素如下:
1.开放性伤口
克雷伯氏菌微生物可以通过开放性伤口从一个人传播到另一个人。因此,如果有开放性伤口,那么受到这些感染的风险增加近35%。
2.酒精
酒精除了会使人醉,还会影响人的免疫系统并降低其整体能力。如果一周中的每一天几乎都喝酒,那么免疫系统可能会弱,从而增加感染肺炎克雷伯菌的风险。
3.癌症药物
通常用来治疗癌症的药物会降低人体免疫力。因此,细菌更容易在体内生长并引起感染。
4.服用抗生素
抗生素药物会降低免疫力。如果长期服用抗生素,那么感染克雷伯菌的风险就会大大增加。
5.肾衰竭
如果患有肾脏方面的疾病,那么患克雷伯氏菌感染的风险也较高。肾脏衰竭是又一个可能增加感染克雷伯菌感染的机会的原因。
6.年龄
已知衰老是最主要的因素之一,它会降低我们的免疫系统的能力。因此,肺炎克雷伯菌引起的感染通常在65岁以上的人群中更为普遍。
7.慢性肝病
肝脏有助于清洁血液中的废物成分,从而使免疫系统保持健康有活力。但是,如果一个人患有慢性肝病,肝脏就不能很好地清除血液中的废物。会降低免疫力,更容易感染细菌。
以上原因是较为常见的,当然还有一些其他原因,比如:
长时间使用皮质类固醇; 器官移植; 慢性阻塞性肺疾病;糖尿病;
使用受感染的输尿管导管; 进行重大的手术; 使用被感染的呼吸机。
医生可能进行病史检查,也会使用影像学检查来诊断感染(例如肺炎等),但肺炎克雷伯菌的诊断主要基于实验室检查。
通常,由该菌引起的肺炎,脑膜炎,伤口感染和任何其他部位感染会感到恶心。医学评估通常着重于确定感染的原因并寻找并发症的征兆,例如脓肿。
病 史
医生会问是否发烧,恶心,咳嗽,呼吸困难,疼痛不适以及睡眠情况。可能还会问与患有类似疾病的人的接触情况。
体 检
检查将包括对体温,嗓子,呼吸音的评估,以及对腹部压痛的评估。将检查任何伤口或疼痛的皮肤区域是否发红,肿胀或发热。
影像学检查
这是最常见的检查之一,医生通常会要求患者进行这些检查以定位疾病的位置和传播。假如医生怀疑肝脏有病变,那么他会要求检查。
肺炎克雷伯菌通常会影响右上肺叶,并导致形成空腔以及引起脓液的组织死亡。这些会在胸部X射线上比较明显,这就是成像检查的原因。
根据症状可能还需要对腹部,膀胱,大脑或骨骼进行影像学检查。
诊断测试
医生可能还需要取样,包括血液,粪便,尿液并进行微生物检测,具体取决于怀疑的感染。
甲痰样品可以检测细菌性肺炎。
检测是否有败血症可能需要血液样本。
如果怀疑细菌性脑膜炎可能需要腰椎穿刺。
如果伤口被感染,需要对感染区域的一小部分样本进行检测。
如果是腹泻,可能会送检粪便样本。
以上样本会被送至实验室进行培养或测序,以便识别传染性细菌(及其对抗生素的敏感性)。
抗生素治疗
如果患者感染了非耐药性肺炎克雷伯菌,通常会用抗生素治疗。可以口服或静脉注射。
医生可能会考虑的抗生素包括:
阿扎坦(aztreonam);
喹诺酮类;
第三或第四代头孢菌素,例如罗芬(头孢曲松);
碳青霉烯类,例如Primaxin(亚胺培南/西司他丁);
青霉素,例如佐辛(哌拉西林-他唑巴坦)
治疗持续时间因抗生素而异,但大致范围可能是2-14天。
此外,一定要告诉医生是否对青霉素过敏,青霉素过敏者无法服用某些抗生素。
# 抗生素耐药性 #
肺炎克雷伯氏菌是革兰氏阴性杆菌,包裹在厚多糖胶囊中。
某些肺炎克雷伯菌已经进化,尽管可以通过单药治疗(包括青霉素或类似抗生素)有效地治疗某些克雷伯菌感染,但是对这些药物产生抗药性的生物的出现仍需要开发新的治疗方法。例如,肺炎克雷伯菌对β-内酰胺抗生素有抗性,β-内酰胺类抗生素包括碳青霉烯,青霉素和头孢菌素。
耐药性是由生物体合成称为碳青霉烯酶的酶的能力引起的,该酶会水解构成这些药物抗菌活性基础的β-内酰胺环。结果,耐药的肺炎克雷伯菌感染通常需要与结构多样的药物(例如β-内酰胺抗生素和氨基糖苷)联合治疗。
手 术
如果有脓肿,可能需要通过外科手术将其引流。根据脓肿的位置,这可能需要在诊所进行小手术,或者可能需要在医院进行外科手术。
通常,排脓后至少还需要几天的抗生素治疗。
其他治疗新方向——微生物群
肺炎克雷伯菌感染治疗有难度,因为大多数临床分离株均表现出对几种抗生素的抗性,从而导致治疗失败和全身性传播的可能性。
好消息是,国际顶级微生物学期刊《Nature microbiology》研究发现,成熟的微生物群推动了不同免疫防御程序的发展,从而在上呼吸道和肠道限制肺炎克雷伯氏菌在这些生态位内的定植。
肠道免疫保护取决于拟杆菌、白细胞介素IL-36信号和巨噬细胞的发育。拟杆菌的这种作用需要其保守的共生定植因子的多糖利用位点。相反,在上呼吸道,变形菌门通过IL-17A增强免疫力,但是肺炎克雷伯氏菌通过包囊IL-17A来克服这些防御进而有效定植。
最终发现肺炎克雷伯氏菌的宿主间传播主要发生在其肠道贮存器中,而产生共生定植因子的拟杆菌足以通过IL-36阻止宿主之间的传播。
点此了解更多:
附录:预防感染肺炎克雷伯菌
有必要遵循所有预防措施,尤其是手部卫生。克雷伯氏菌主要通过人与人之间的接触传播,保持手部清洁是防止细菌传播的最佳方法。
身体健康的人感染的几率较低,但是住院病人或免疫力低下者需要非常注意,勤洗手:
在准备食物或食用食物之前洗手;
使用浴室后洗手;
咳嗽、打喷嚏或擤鼻涕后洗手;
更换伤口敷料和绷带前后洗手;
在医院接触床头柜、床栏、门把手、遥控器和电话等表面后洗手。
早期诊断/治疗有助于降低发病率。
主要参考文献:
Sequeira, R.P., McDonald, J.A.K., Marchesi, J.R. et al. Commensal Bacteroidetes protect against Klebsiella pneumoniae colonization and transmission through IL-36 signalling. Nat Microbiol (2020)
Bryan Corrin MD FRCPath, Andrew G. Nicholson DM FRCPath, Klebsiella Pneumoniae Infection: Symptoms and Diagnostic Procedures. Pathology of the Lungs (Third Edition), 2011
Thea Brabb, Martha Hanes, in The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents, 2012
Hanifa J. Abu Toamih Atamni, Fuad A. Iraqi, in Molecular-Genetic and Statistical Techniques for Behavioral and Neural Research, 2018
Nervous System Disorders of Nonhuman Primates and Research Models
MicheleA. Fahey, SusanV. Westmoreland, in Nonhuman Primates in Biomedical Research (Second Edition), Volume 2, 2012
Quereshi, Shahab. Klebsiella Infections. Medscape. December, 2018
Bush, Larry and Perez, Maria. Klebsiella, Enterobacter, and Serratia Infections. Merck Manual Professional Version. April, 2018
Clegg S, Murphy CN. Epidemiology and Virulence of Klebsiella pneumoniae. Microbiol Spectr. 2016 Feb;4(1). doi: 10.1128/microbiolspec.UTI-0005-2012. PMID: 26999397.

谷禾健康
饮食失调即使在古罗马时期也是一个社会性问题。但直到如今,我们仍然对它知之甚少。
当前,这种疾病有多流行?现代有“瘦之审美”,畸形观念之泛滥,催生出大批饮食失调人群。
著名演员加布里·西迪贝患有饮食失调(因《 珍爱》 与 《美国恐怖故事:启示录》获得奥斯卡提名),在其回忆录《这就是我的脸:试着不凝视》中生动地描述了她如何用贪食症来应对抑郁。


她写道:
“我的情绪失控了,我只能哭好几个小时。”
“有一天,我哭了很久很辛苦,以至于我开始呕吐。吐完后,我不再哭了。我甚至都没有想过让我哭泣的原因。我感到空虚,这是一件很了不起的事–在此之前,我感觉太过情绪激动了。”
…
《柳叶刀·精神病学》发表的最新研究显示,2019年,全球范围内饮食失调患者总人数已达5550万左右。相比男性,女性患者的占比明显更高。正因如此,饮食失调的临床科研多以女性为主,对男性患病情况缺乏了解。我国饮食失调的发生率与西方国家相当,却未引起足够重视。
虽然有很多关于饮食失调的信息,但是大部分人把这些症状误认为是一种生活方式的选择。
饮食失调,学名“进食障碍”,是以不健康,不正常,强迫性的饮食习惯或异常紊乱的进食行为为主的精神心理障碍,属于轻性精神病。饮食失调通常伴随着情绪和身体症状。
如果你过多地关注饮食,时间和饮食量,以至于对生活造成负面影响,影响工作能力、社交等,则可能意味着你患有进食障碍。
节食、暴饮暴食等现代生活中很常见,媒体也常报道有明星为控制体重连续3天只喝水不吃饭,还有人几十年没碰过米。其实不吃、贪吃、猛吃都可能是饮食失调。
普通人只是偶尔节食,还算不上疾病。
临床上关于此诊断通常有三个维度:
1 频度,异常饮食行为是否持续3个月以上,或每周至少一次。
2 进食习惯表现,比如,是否过度限制饮食等;
3 影响,是否对生活、工作、学业等造成不良影响。
如果三项全部为“是”,且排除垂体肿瘤等神经系统器质性病变,即可认定为饮食失调。
其实饮食失调是导致不健康饮食习惯养成的一系列心理状况,更偏向轻性心理疾病,可能是从对食物、体重或体型的某类思想执迷开始的,比如说“非瘦不可”,“体重超过3位数没有未来”等言论,疯狂追求“A4腰”,“巴掌脸”……
然而,在严重的情况下,饮食失调对身体的破坏力超出你想象。如果不及时治疗,甚至可能导致死亡。
饮食失调包括以下六种:
神经性厌食症
神经性贪食症
暴饮暴食症
异食癖
反刍障碍
回避/限制性食物摄入障碍
神经性厌食症和贪食症是最常见的饮食失调,但暴饮暴食症有时也包括在内。尽管它们三个有相似的根本原因,但受害者行为却是不同的。
厌食症
厌食症:这种疾病的特征是对卡路里摄入量的极端控制,对体重增加的强烈恐惧以及对身体胖瘦和形态的不切实际的看法。
其实部分厌食症患者仍保持有正常的食欲,只是她们为了保持徧低的体重而过分地节制饮食。或因本身身体因素,对食物有排斥心理,导致身体对饮食搭配的失衡。
厌食症的特点是不断自我饥饿造成体重急剧减轻,而且大多数情况下还伴随剧烈运动。
神经性厌食症的常见症状包括:
与年龄和身高相近的人相比,体重明显偏低;
饮食习惯很受限制;
即使体重偏低,仍然强烈担心体重增加或持续某些行为以避免体重增加;
不懈追求瘦和不愿意保持健康体重;
自尊受到体重或感知的身体形态的严重影响;
扭曲身体形象,包括否认体重严重不足。
神经性厌食症主要出现在成年初期,追求苗条身材的心理达到了极致的状态,有一种心理障碍,总觉得自己臃肿,想要把自己饿到很瘦为止。这种病的症状就是把不合适的身材印象强加在自己身上,看周围肥胖的朋友不觉得他们胖,却对自己极为严格,总觉得自己很胖。

这类人群情绪不稳定,带有攻击性,又时常忧郁,试图把自己隔离在家人和朋友之外,最后会出现体重剧减、体温和脉搏下降、缺铁性贫血、白血球数减少、毛发损伤、便秘,以及月经中断等症状。
在模特和演员中也时常出现这种病症。如果无条件地认为瘦就是美,是一件很危险的事情。之所以要减肥,是因为我们需要更健康更有活力的生活,而不是放弃生活。
贪食症
贪食症: 贪食症的特征是频繁进食,暴饮暴食,随后进行清除以免体重增加。清除可能包括催吐,强迫运动以及滥用泻药和利尿剂。
这种疾病的特征是在短时间内频繁失控的进食,直到人们感到不适为止。暴食症通常是由于自我厌恶和尴尬而悄悄发生的。
这样的患者为了减肥只吃热量很低的食物(单一食谱法、丹麦式减肥法、800卡以内减肥法等),但实际上从早到晚都有想吃东西的欲望,结果名义上虽吃低热量食品,实际上却能一次吃光15000卡的食物,相当于正常人一周的食量。意识到之后又觉得很惭愧,身体也感到不适,于是又常常进行人为催吐或服用泻药等不健康手段。


这种节食又暴饮暴食的反复过程,彻底破坏了人体的平衡。反复的呕吐使食道和胃都受到损伤,牙齿表面也被破坏,心理上的负担不断加重,甚至由于极度绝望而导致自杀。
暴饮暴食症
暴饮暴食症:可定义为强迫进食至不适感。重要的是,与同类情况相比,它需要吃的食物要多得多,同时还伴有明显的困扰,缺乏补偿行为以及无法控制吃多少或什么东西。
暴饮暴食症有时被称为强迫进食障碍,与贪食症有很相似的症状,但一般没有催吐之类的行为。这些患者往往超重,因此会造成一些严重的健康问题。


普通人偶尔多吃点没有什么后果。但是暴饮暴食症有所不同,因为暴饮暴食发作变得频繁并开始干扰一个人的幸福感,人际关系和自我价值感。
有意思的是,贪食症患者的体重从低于标准体重,到正常或超重各种各样都有。
如果你发现自己或朋友或家人中有以下危险信号,则可能需要引起注意:
被食物,体重,脂肪或卡路里的思想所控制
避免吃自己喜欢的食物,不愿意享受食物
宁愿一个人吃饭,也不要和别人一起吃饭
过度运动,例如,计划锻炼的一天 ,设定不切实际的目标,或忽略受伤、疲劳等现象
更加关注别人的身体
定期催吐,或者使用食欲抑制剂,泻药,利尿剂,灌肠剂等。
异食癖
异食癖是指一个人总是吃不属于食物的东西。这些食物可能包括纸、肥皂、布、颜料片、蜡笔、灰尘或冰块,这些食物没有营养价值,可能不利于消化。
异食癖通常在两岁后才被诊断出来。
听起来有些不可思议。为什么有人会吃非食物?
一些异食癖者说他们喜欢异食癖的味道、质地或气味。其他人说,吃某些非食物可以缓解压力和焦虑。
医生并不总是能识别出病人在吃非食物,人们通常也不会告诉他们的医生,因为他们感到羞耻。然而异食癖会有可怕的后果,比如窒息、中毒和营养不良,所以寻求治疗是至关重要的。
反刍障碍
反刍症是一种进食障碍,其特征是食物吃进去以后又反流出来。反流可能是自发的。若患者报告称反复反流食物一个月或以上,医生将诊断为反刍症。
有些反刍症患者知道该行为是社会不可接受的,并试图掩盖或隐藏。
如果患者限制了他们的食物摄入量(避免其他人看到反流),他们可能会体重减轻或出现营养缺乏。
反刍经常发生在婴儿期和儿童期,但它也会影响到成年人。压力和焦虑是婴儿和儿童的风险因素,而焦虑和抑郁是成年人的风险因素。
这种情况是习惯性的或无法控制的,治疗的重点可能是打断和逆转这些习惯。
回避/限制性食物摄入障碍
回避/限制性食物摄入障碍(ARFID)发生在人们没有吃足够的食物来获得适当的能量或营养的时候。患有ARFID的人可能会因为食物的口感或气味等感官特征而避免进食,害怕进食的后果,或者根本对进食不感兴趣。结果可能导致体重减轻、营养不良和发育问题。
这种疾病通常出现在婴儿期和儿童期。当这种回避不能用食物匮乏或文化习俗来解释时,就会被诊断为这种行为。医疗问题、饮食失调和心理健康问题也必须排除。ARFID的危险因素包括焦虑、强迫症、自闭症以及胃肠道问题。


人们经常被挑食和ARFID之间的界限所混淆。当一个人不能满足他们的热量或营养需求时,挑食就会变成一种紊乱。他们可能无法增加体重,体重与身高不相称,或者依赖补充剂。如果它开始干扰他们的日常功能,他们可能患有疾病。
ARFID也不同于厌食症;ARFID的食物厌恶并不像厌食症那样,是由对身体形象或体重增加的恐惧驱动的。
虽然一些患有饮食失调症的人看起来很正常,但实际上他们的身体正处于危险之中。
饮食失调症状的一些常见后果,包括干扰发育,并可能导致健康问题如心率过低、月经周期缩短、脱发、菌群失调进而引发一系列疾病。
你可能不知道,饮食失调还会干扰人际关系,妨碍处理潜在的痛苦情绪,很难过上幸福的生活。

患有饮食失调的人经过干预治疗有些最终完全恢复,而有些则在恢复和复发期中循环,有的甚至会长期患病或死亡。
根据统计,饮食失调是所有精神疾病中死亡率最高的。估计有20%的饮食失调者最终会死于以下疾病:例如,不规则或非常低的心跳(心律不齐),突然的心脏骤停,严重的肝脏疾病或自杀等并发症。
即使是幸存者,也可能面临严重的健康问题,包括但不限于:
不可逆转的骨质流失、肌肉丢失和无力;
贫血、严重脱水;
可导致肾功能衰竭;
皮肤干燥、脱发;
消化慢(胃轻瘫),晕厥;
疲劳和整体虚弱;
月经不调或性欲减退,沮丧等。
饮食失调的原因很少人知道。
饮食失调可能源于遗传、人格特征和环境影响(例如童年经历、社会比较、压力或创伤事件以及文化、审美标准)之间的复杂关系。
抑郁,双相情感障碍和焦虑症的较早出现强烈地预示了青少年的饮食失调。饮食失调似乎是遗传的,可能与5-羟色胺受体的遗传差异有关。
当感到烦恼或烦闷时,进食能带来舒服的感觉,因此,很多暴食症患者在感到沮丧时,试图用进食带来舒服的感觉。但是,因吃得过多而感到腹胀和臃肿,患者又感到十分难受,于是借呕吐等方式来控制体重上升,紧接着,内疚、悲伤和可怜的感受亦随之产生。


此外,还有以下三个重要原因:
——个体因素
个体因素:包括生物学因素和个性因素。
生物学因素是指在进食障碍患者中存在一定的遗传倾向(家族中罹患进食障碍和其他精神类障碍的人多于正常人群)和部分脑区的功能异常。
对双胞胎、亲生家庭和收养家庭的研究表明,遗传会使人们患上疾病的风险更大。家庭成员患有饮食失调症的人,患饮食失调症的风险要大得多。
个性因素是指进食障碍患者中常见典型的人格特点——追求自我控制、追求完美和独特;爱幻想,不愿长大等。在青春期即容易表现出自主性和依赖性的强烈冲突,引发进食问题。
有时候我们会建立目标,然而目标越重要,朝着这个目标前进的动力与实现它所需的生活限制之间的等式就越不平衡,以食物作为达到目的的手段危险就越大。
——家庭因素
家庭因素:家庭因素在进食障碍的发生、发展、维持和康复中都可能起到重要作用。
常见的“进食障碍家庭”模式有:
(1)家庭成员的情感紧紧纠缠,无法分清彼此,没有空间;
(2)父母对孩子过度保护;
(3)父母冲突,孩子卷入其中,背负过重的负担;
(4)家庭模式僵化,无法适应孩子的发展——永远用对待婴儿的方式对待长大的孩子。
有学者提出患者以进食行为代表了对父母过度控制、过度保护的反抗;或以节食为手段达到对父母的反控制,以此作为解决家庭内冲突的一种方法。也有学者认为病人的依赖性强,多与母亲的关系过于密切、依赖,而以自我控制进食作为自己独立的象征。
——社会文化因素
社会文化因素:现代社会文化观念中,把女性的身材苗条作为自信、自律、成功的代表。所以青春期发育的女性在追求心理上的强大和独立时很容易将目标锁定在减肥上。而媒体大力宣传减肥的功效,鼓吹极致身材人人皆可拥有,也让追求完美、幻想极致的女孩更容易陷进去。
此外,看多了各式各样滤镜下的照片会导致自我比较——这个过程有时是无意识的。不断的比较会对自尊和身体满意度造成严重影响。
在过去一年的疫情中,日常生活变得不确定,特别是对于许多年轻人而言。因此,控制食物就像是在压力大,不确定的环境中进行控制的一种可行的选择。
然而,这并不能完全解释为什么只有某些人会患上饮食失调。
科学研究者在进行多学科饮食失调研究时遇到了一些挑战:
一个问题是,神经科学家和临床医生的处理方法不同
在临床研究中,重点是综合征(构成一种紊乱的症状的集合),而在神经科学中,重点是大脑与认知和行为之间的联系。
因此,临床医生可能会研究被诊断为饮食失调的人的焦虑,而神经科学家则会研究导致焦虑的大脑机制。
由于进食障碍分类是基于症状群的,因此每种分类内有很多差异。因此很难将临床研究与神经科学研究结合起来,过多的参与者差异阻碍了关于脑与行为关系的结论。
简而言之:两个具有相同饮食失调诊断的人可能出现不同的诊断或神经特征。


另一个问题是饮食失调类别之间以及饮食失调类别与其他心理疾病之间的重叠
为了缓解这种情况,美国国家心理健康研究所创建了一个面向神经科学的框架,用于研究心理障碍(RDoC)。
该框架使用不同层次的分析(即细胞;神经回路)来探索与行为相关的不同领域(即负面评价;奖励)。但很少有饮食失调研究人员使用过它。
研究饮食失调的神经科学的研究人员还遇到了大脑分析的局限性。由于大多数饮食失调并不是致命的,而且经历饮食失调的人群还相对年轻,因此缺乏用于饮食失调研究的人脑样本。这意味着神经科学家很少分析患有进食障碍的人的大脑。相反,他们依靠血液和其他体液来推断脑功能和饮食失调行为。

除生物样本外,还可以使用诸如fMRI(用于测量大脑区域中的氧化血流)和EEG(脑电图)(用于测量大脑中的电活动)之类的技术来“观察活着的人的黑匣子”。 然而,这些技术的准确性有限,它们只能告诉我们很多有关饮食失调行为的信息。
研究人员用于研究饮食失调的神经科学的另一种选择是使用动物模型。使用动物模型有点好处,它可以减少参与者的变异性,因为神经科学家可以控制动物的遗传学,早期生活经历,父母关怀和饮食。这放在人类是不可能的(也是不道德的)。
通过操纵某些条件,神经科学家可以研究特定因素(例如生命早期创伤)如何随着时间的推移影响动物的健康。这提供了关于大脑与饮食失调行为之间因果关系的更具结论性的论据。
哪些性格特征和态度与饮食失调相关?
饮食失调与完美主义、强迫倾向和对负面情绪的敏感性有关。低自尊和对身体的不满是风险因素,以及焦虑和抑郁等心理健康挑战。
研究表明,女孩饮食失调的最强预测指标之一是同龄人对体重和饮食的重视。这种趋势在大学中更加突出,大学是一个由同龄人组成的社小社会,很少有年长的人提供更广阔的视角。同伴感知的影响可能导致大学校园饮食失调的扩散。
许多年轻人在成年后仍会继续患有饮食失调症。他们将面临大量健康问题的高风险,例如蛀牙和频繁呕吐造成的染色、胆囊疾病、消化疾病等。
当我们研究饮食失调时,重要的是要区分可能导致问题开始的过程(饮食失调的原因)与导致问题持续的过程(饮食失调的维持因素)。
这需要区分所谓的发展阶段(即进食障碍发作之前)和维持阶段(即进食障碍发作之后)。
这种区别有两个重要的含义:
1)识别影响进食障碍发展的过程可能有助于设计有效的预防这些进食障碍的干预措施;
2)确定维持饮食失调的过程可能有助于制定成功的治疗干预措施。
饮食失调维持过程的关键角色
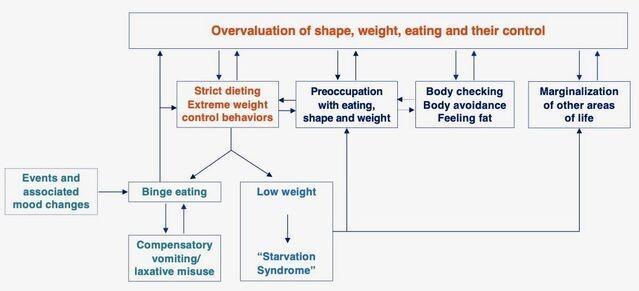
据认知行为理论,一种独特的自我评估方案(下图),即对身材,体重,饮食和饮食控制的过高评价(换句话说,就形态, 体重及其控制能力)在饮食失调中起重要作用。
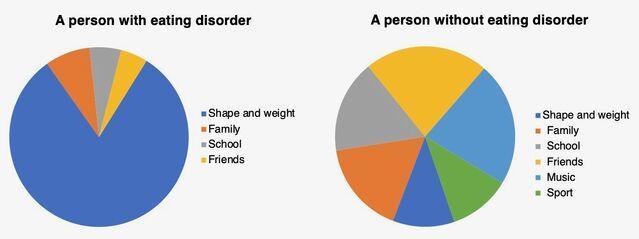

暴饮暴食是不是高估形态,体重,饮食及其控制的一种行为 。这种行为存在于一大群饮食失调的人群中,它是通过以下机制从这种高估间接产生的:
1.严重饮食不足
太在乎或高估身材,体重,饮食及其控制能力可能导致个人饮食不足。这样做会产生神经内分泌信号的几种变化,这些变化控制着食物的摄入,传达了饱腹感/饥饿感。
2.极端和严格的饮食规则
饮食失调的人对这些极端和僵化的饮食规则会做出消极和极端的反应(通常是全有或全无),甚至小小的违规行为也往往被解释为自我控制力差的证据。对这种缺乏自我控制感的反应是暂时放弃限制饮食的努力,这导致暴饮暴食。 反过来,这加剧了人们对他们的身材,体重和饮食缺乏控制的担忧和信念,并鼓励进一步的饮食限制,从而增加了随后暴饮暴食的风险。
3.事件和相关的情绪变化
人们倾向于通过三种主要机制维持暴饮暴食的发作。
体重过轻,饮食不足,暴饮暴食和饮食失调的其他特征(即饮食限制和节制,自发性呕吐,泻药和利尿剂滥用,过度运动,身体检查和避免,发胖)通过多种机制得以维持在持续激活的状态下,人们对形态,体重和饮食控制的过度关注和过度重视,其结果是饮食失调的心态被锁定在患者的核心(下图)。

2012 年发表在《营养与饮食学会杂志》上的一项研究发现,患有饮食失调症的女性成为素食者的可能性是没有饮食失调症的女性的四倍。超过一半 (52%) 有饮食失调病史的女性曾在一生中的某个阶段吃过素。其他研究也发现了类似的关联。
那是否说明素食和饮食失调有直接关联?
不一定。同样是素食主义,有些是健康的,有些与饮食失调相关联。
这里需要明确一点:真正的素食主义不会导致饮食失调。它可以成为人生任何阶段的健康选择,前提是成为健康的素食者。
怎么样算健康的素食者?
健康的素食者会寻找替代品来补充他们所缺少的营养素,例如钙、蛋白质、omega-3脂肪酸、维生素 B12 和铁。当他们的饮食包含多种营养食品时,与非素食饮食相比,水果、蔬菜、纤维和复合碳水化合物的含量往往更高,饱和脂肪和胆固醇的含量更低。
但是如果是用加工过的垃圾食品代替肉类,那不仅不会促进身体健康,反而会更加疲劳和营养不良。
素食者需要注意的饮食失调风险
素食主义看起来是选择了一种积极的生活方式,但对某些人来说要警惕其潜在机制,如痴迷、控制和自卑,可能是精神疾病的征兆。怎么理解痴迷,控制等状态?
打个比方,如果是为了减肥而采取的一种过于自我苛刻的措施,那么有可能就走偏了。尤其是如果变得痴迷于把某些食物标签为“好”和“坏”,减少麻烦类别的饮食。这样下去,饮食方式逐渐变得极端,那么就有可能与饮食失调相关联。
总而言之,看起来同样是素食,但是驱动因素各不相同,有些人的素食与饮食失调挂钩,而有些人的素食是自然而然的健康选择。这是两种不一样的境界。
神经性厌食症在20世纪下半叶之前就已存在。西方世界对神经性厌食症的最早描述可以追溯到12世纪和13世纪,最著名的是锡耶纳的圣凯瑟琳,她拒绝进食是精神上对自我的拒绝。
1973年,希尔德·布鲁赫出版了一本书,书中有许多案例研究,名为《饮食失调:肥胖、神经性厌食症和内向的人》。这种混乱在20世纪70年代蔓延成为公众意识,病例增加。


贪食症(暴饮暴食,然后通过运动、呕吐或泻药进行清除)最早存在于中世纪的一些富人中,他们会在吃饭时催吐,这样就能吃得更多。
关于贪食症的第一篇临床论文发表于1979年。
厌食症和贪食症的病例在1970年代和1980年代呈上升趋势,有人会说他们在那个时期达到顶峰,但全国调查数据表明,贪食症仍在继续上升。
1970年代和80年代是美国肥胖率上升的时期。开始以空前的速度增长,低脂饮食开始流行。
存在第三种饮食失调,暴饮暴食失调,其中周期性的食物刺激不能通过限制或清除行为来补偿。 虽然许多肥胖的人正常饮食,但是暴饮暴食的人每天要消耗多达几万卡路里的热量,一整袋糖果或5-6份快餐的晚餐量。
再有,这种疾病已经虽然已经有几个世纪了,但似乎只是最近才升级了。暴食者约占寻求肥胖治疗的人的1/3。
随着肥胖患病率,遗传易感性的增长以及工业化食品消费的增加,人们不禁会怀疑饮食失调是否又是西方文明中的另一种疾病,最重要的原因是以不良的饮食习惯为依据。厌食症的大部分自然进程可以通过对身体形象的无序思考以及饥饿过程本身来解释。
随着时间的推移,饮食失调发病率依然在不断上升。一项大型审查研究发现,在2000-2006年间,有3.5% 的人患有饮食失调症,而在2013-2018 年间,有近8% 的人患有饮食失调症。
现在,加工,含糖和富含谷物的饮食会导致炎症,瘦素和胰岛素抵抗,肥胖,思维紊乱等,节食或催吐、催泻等行为可能是在标准饮食上保持“瘦”的唯一方法。这些方法代价很大,并且主要由年轻女性承担。
对饮食失调的关键维持过程的理解有助于开发有效的心理治疗方法。最重要的例子是增强的认知行为疗法(CBT-E):旨在针对上述主要维持过程而不是进食障碍诊断(即神经性厌食症,神经性贪食症,其他进食障碍)设计的一种灵活而个性化的心理治疗方法。
CBT-E的功效已在多项临床研究中进行了评估,目前被认为是饮食失调的成人和青少年最有效的治疗方法之一。
病情轻微者可在门诊部接受个人认知心理治疗、行为治疗和家庭治疗而改善其饮食及生活习惯,以帮助患者回复可接受的体重。
其实,对大部分患者来说,和她们讨论烦恼非常重要,例如:学业压力、校园霸凌现象、过分自觉、家庭问题、青春期恋爱问题等等,以更正不正确的观念和行为。

只有当这些基本的治疗步骤无效,或患者体重剧降至威胁生命时,才需入院接受治疗。住院治疗的方法和非住院治疗差不多,都是用饮食控制和心理治疗,所不同的是在一个更有规律的环境下进行。其中大多数可以得到令人鼓舞的康复效果。
治疗饮食失调有时候涉及团队合作,其中包括初级保健医生,心理健康医生和营养师等。
一个人需要的具体疗法将取决于疾病的类型和严重性。
心理治疗
心理疗法,也称为“谈话疗法”,可以帮助进食障碍的人学会用健康的思想或习惯代替有害的思想或习惯。
营养咨询
医学专家可以帮助您制定健康的饮食计划,以满足您的个人需求。
药物治疗
有时,药物可以帮助控制焦虑,敦促或不健康的想法。抗抑郁药和抗焦虑药可给予患有饮食失调症的人。
住院治疗
由于饮食失调而导致严重健康问题的人们可能需要住院治疗。此外,一些诊所还提供密集的住院治疗方案。
替代和补充疗法
某些替代药物可以帮助进食障碍的人放松身心并减轻压力。瑜伽,按摩,冥想和针灸是常见的疗法。
调节肠道菌群
肠道菌群和饮食互相调节互相反馈,饮食塑造影响肠道菌群构成和发育,肠道菌群参与食物消化,调节免疫炎症,影响神经和情绪进而影响进食
预防饮食失调
没有预防饮食失调的最优方法,但是根据研究,一个人可以通过以下方法降低其患病风险:了解体征,症状和风险;避免节食和不健康的减肥行为;避免负面的自我交谈并学会欣赏身体,行为出现问题及时寻求帮助。
如果是家人或亲近的人患上饮食失调,该如何帮助他们?
首先要做好心理准备,帮助患有饮食失调症的人做出治疗的决定可能是一个漫长的过程。你要做的可能是:
询问患者的想法和感受,帮助他们承认自己有问题(他们可能不相信自己有病)。
鼓励患者接受心理帮助和体检,帮助他们排解疾病带来的心理压力。
帮助他们确立未来的目标,这些目标会让他们觉得治疗是必要的、是非常重要的。
主要参考文献
Mason, T. B., & Lewis, R. J. (2015). Assessing the Roles of Impulsivity, Food-Related Cognitions, BMI, and Demographics in the Dual Pathway Model of Binge Eating Among Men and Women. Eating Behaviors 18: 151–55.
Miranda, J., Woo, S., Lagomasino, I., Hepner, K. A., Wiseman, S., & Munoz, R. (2006). Group Cognitive Behavioral Therapy for Depression: Thoughts and Your Mood. Cognitive Behavioral Depression Clinic, Division of Psychosocial Medicine San Francisco General Hospital, University of California, San Francisco.
Olsen, E. M., Koch, S. V., Skovgaard, A. M., & Strandberg‐Larsen, K. (2021). Self‐reported symptoms of binge‐eating disorder among adolescents in a community‐based Danish cohort—A study of prevalence, correlates, and impact. International Journal of Eating Disorders 54: 492– 505.
Schaeffer, J. (2016). Binge Eating Disorder Statistics: Know the Facts
Vocks, S., Tuschen-Caffier, B., Pietrowsky, R., Rustenbach, S. J., Kersting, A., & Herpertz, S. (2010). Meta-Analysis of the Effectiveness of Psychological and Pharmacological Treatments for Binge Eating Disorder. International Journal of Eating Disorders 43: 205–217.
Dalle Grave, R., & Calugi, S. (2020). Cognitive behavior therapy for adolescents with eating disorders. New York: Guilford Press.
Fairburn, C. G. (2008). Cognitive behavior therapy and eating disorders. New York: Guilford Press.
Fairburn, C. G. (2013). Overcoming binge eating, Second Edition. New York: Guilford Press.
National Guideline Alliance. (2017). Eating disorders: Recognition and treatment. London: National Institute for Health and Care Excellence (UK); 2017 May. (NICE Guideline, No. 69.) London.
1)Wildes, J., & Marcus, M. (2015). Application of the Research Domain Criteria (RDoC) framework to eating disorders: Emerging concepts and research. Current Psychiatry Reports, 17.
Wildes, J., & Marcus, M. (2013). Incorporating dimensions into the classificati
What Is Anorexia Nervosa? Symptoms, Causes, Diagnosis, Treatment, and Prevention By Julie MarksMedically Reviewed by Allison Young, MD Last Updated: March 18, 2021
What Is Bulimia? Symptoms, Causes, Diagnosis, Treatment, and Prevention. By Julie Marks Medically Reviewed by Allison Young, MD Last Updated: October 13, 2020
What Are Eating Disorders? Symptoms, Causes, Diagnosis, Treatment, and Prevention.By Nuna Alberts, LCSW Medically Reviewed by Allison Young, MD Last Updated: April 20, 2021

谷禾健康
宝宝如果出现以下症状,家长要注意了,有可能是发育迟缓!

发育迟缓并不仅仅指身高体重不达标,还包括许多方面,比如说,智力发育迟缓,语言障碍,运动发育迟缓,心理发育迟缓等。
儿童发育迟缓会带来许多不良后果,然而很容易在早期被忽视。说话比同龄孩子明显晚几个月,一直不怎么会走路的情况出现,一部分家长还认为,等孩子长大慢慢就好了,这有可能会错过孩子的最佳干预期而遗憾终生。
《中国0-6岁儿童营养发展报告》指出:儿童早期特别是从胎儿期到出生后2岁(生命早期1000天),是决定其一生营养与健康状况最关键时期。
因此在发育迟缓的信号出现时,最好能抓住这段时间及时进行合理干预。
那么问题来了,如何进行干预?
不会走路就强加训练?
不会说话就多沟通练习?
……
很多类似的干预手段花费很多时间精力,可能会有一些效果,但也可能效果并不理想。
我们之前有讲到过发育迟缓的原因有很多,可能是神经内分泌和激素因素、儿童早期腹泻和其他感染频繁、环境肠道功能障碍、环境毒素和遗传因素等。
可以发现这些原因更多的是生理性病因,比如说肠道感染,而在这种情况下,干预如果只是从行为上施加外力进行纠正,可想而知,收效甚微。
临床上,很多寻求治疗的发育迟缓患儿同时伴有类似腹泻,便秘等肠道问题,这其中有着许多关联。

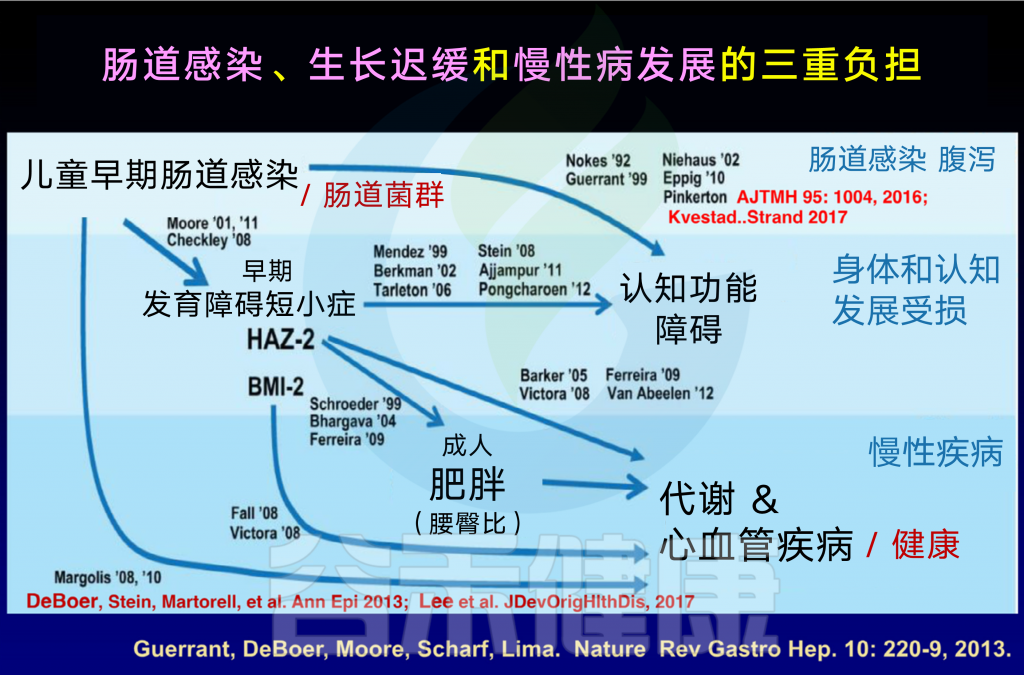
多项研究表明,一个不成熟的肠道菌群可能导致生长迟缓。尤其是,肠杆菌科的异常高患病率持续超过6个月的似乎与生长迟缓有关。肠杆菌科以外的细菌,如链球菌,也可能直接造成有害影响。
也就是说,发育迟缓和肠道菌群的变化有关联。
通过肠道菌群健康检测,可以去寻找可能与发育迟缓相关的因素,从而从根本上去解决问题。
来看两个关于利用谷禾肠道菌群健康检测进行发育迟缓干预的案例。

年龄:9月龄 性别:女
临床主诉
2020年10月起,间断睡眠不安,入睡后上半夜哭闹;
2021年3月初,下半夜也偶尔哭闹。白天睡眠质量一般,有时容易醒,抱睡。
2020年11月底添加辅食,大便两天一次,一个月后,因辅食渐变粘稠,大便3~4天一次(临床判断为便秘),现在,4天一次,有过2次5天一次,辅助开塞露。
Gesell评估表明存在应物能、言语能存在明显落后。
*格塞尔婴幼儿发展量表(Gesell Developmental Schedules)由美国耶鲁大学的A.格塞尔及其同事制定的婴幼儿发展测量工具,是心理学界、医学界、教育界公认的经典量表。主要诊断4个方面的能力:动作能、应物能、言语能、应人能。
临床上考虑到可能肠道菌群存在问题,进行肠道菌群检测,结果如下:
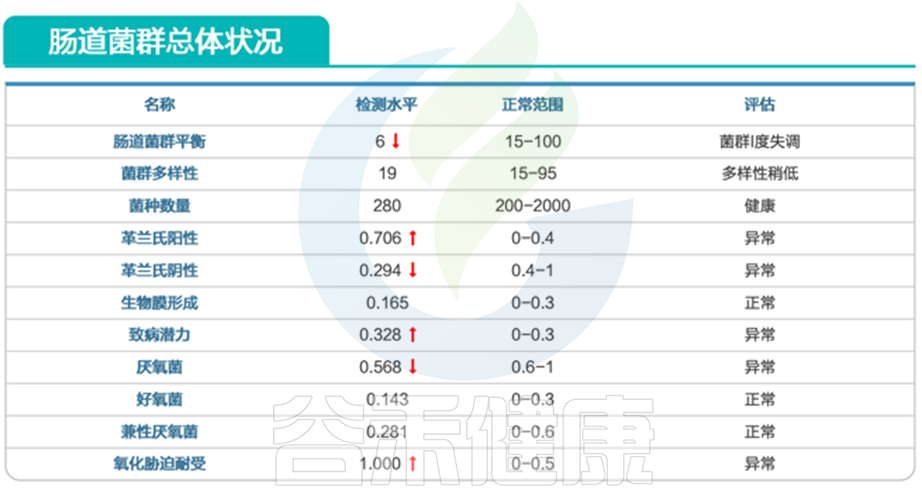

患儿肠道菌群存在明显失衡,以革兰氏阳性细菌比例过高、潜在致病性高为主要特征。
进一步分析发现,该患儿存在大肠埃希氏菌感染、酵母菌感染、宋内氏志贺菌超标及产气荚膜芽孢杆菌为主的菌群感染问题。
关于真菌感染可以详见这篇文章:最新研究速递 | 肠道真菌与健康和疾病有关
大肠埃希氏菌(Escherichia coli)

大肠杆菌是短杆菌,两端呈钝圆形,属革兰氏阴性菌。
大肠杆菌的生化代谢非常活跃。大肠杆菌可以发酵葡萄糖产酸、产气,个别菌株不产气,大肠杆菌还能发酵多种碳水化合物,也可以利用多种有机酸盐。
大肠杆菌具有三种硝酸盐还原酶和三种一氧化氮还原酶。因此,大肠杆菌菌株能够将不可发酵的营养物/硝酸盐转化为可发酵的硝酸盐。
更多关于大肠埃希氏菌的介绍详见:细菌大盘点 | 大肠埃希氏菌、血链球菌、李斯特菌
宋内氏志贺菌(Shigella sonnei)


宋内氏志贺菌是兼性厌氧革兰氏阴性细菌,是一种乳糖发酵细菌,可引起痢疾。
可以逃避人类免疫系统中的TLR-5(toll样受体).
相关疾病症状:痢疾,包括直肠出血,腹泻,发烧等。
除了引起志贺氏菌病外,它还可以引起菌血症,尿路感染,外阴阴道炎,直肠脱垂,反应性关节炎和其他各种并发症。
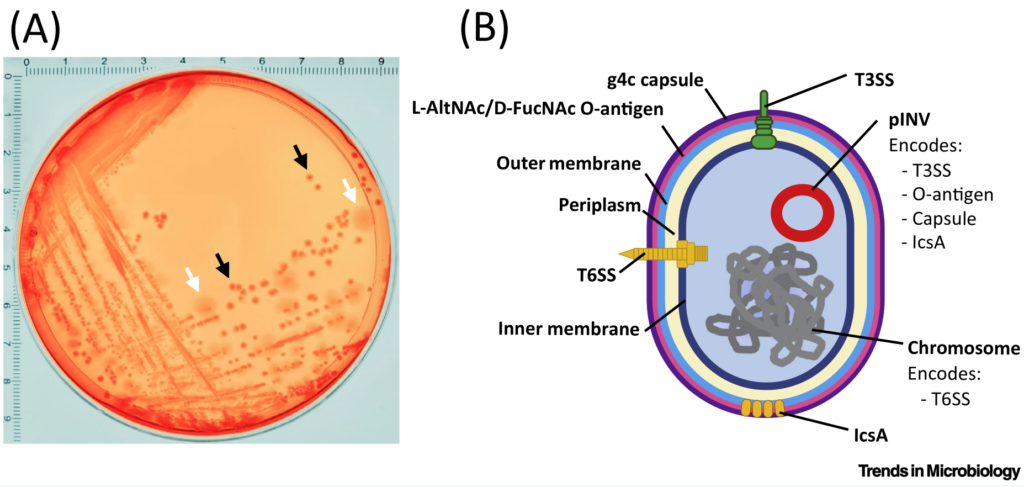
Shigella sonnei 毒力决定因子
产气荚膜梭状芽胞杆菌(Clostridium perfringens)
革兰氏阳性细菌,是嗜温菌,最适生长温度为37℃,产生内生孢子的非运动性菌。通过无氧呼吸产生能量,使用硝酸盐作为其电子受体。是人类正常肠道菌群中的一种,条件致病菌,导致许多胃肠道疾病,严重程度从轻微的肠毒血症到致命的气性坏疽。
还具有进行糖酵解和糖原代谢所需的所有酶,利用各种糖酵解酶将糖化合物分解为更简单的形式。
相关疾病症状:
食源性疾病(食物中毒)的最常见原因之一。
大多数感染了产气荚膜梭菌的人在食用受污染的食物后6至24小时内会出现腹泻和胃痉挛。这种疾病通常突然发作,持续不到24小时。
这种感染通常不会引起发烧或呕吐。
再来看谷禾检测报告中关于疾病风险评估这块:
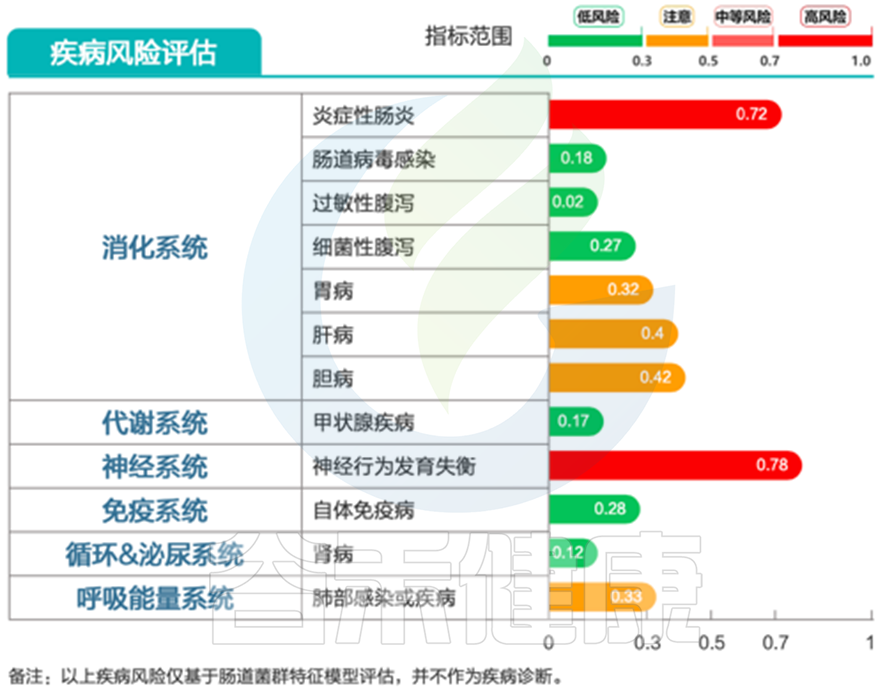

疾病风险分析也提示存在神经行为发育异常、炎症性肠病风险;
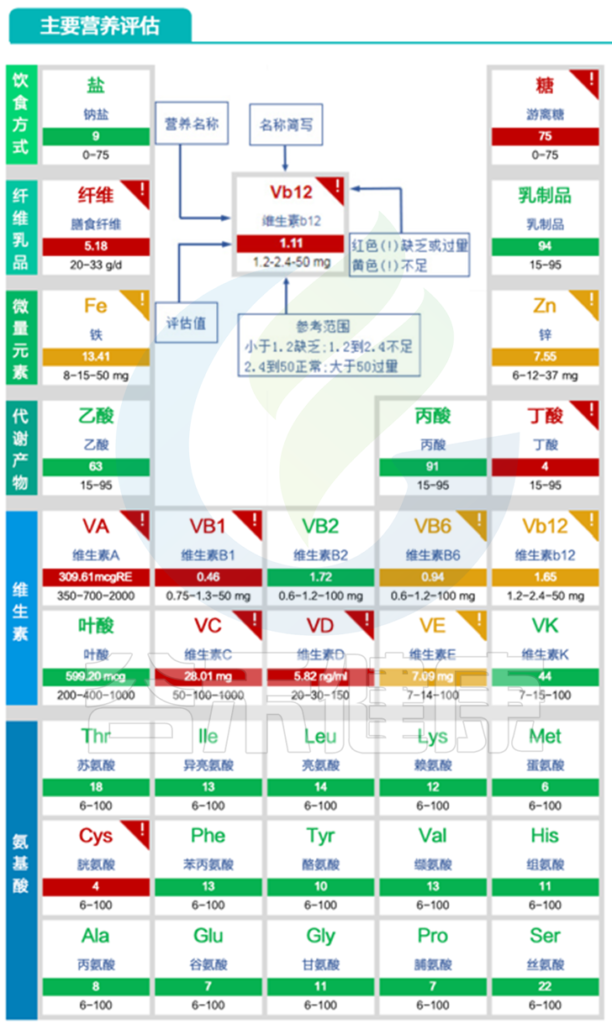
同时存在B1、B12为主的B族维生素缺乏问题;膳食纤维、锌、其他多维生素缺乏等问题。
读完以上肠道菌群检测报告内容之后,医生给出临床治疗方案。
临床治疗
抗肠道感染治疗;
抗真菌感染治疗(备选方案);
补充维生素B治疗;
益生菌补充;
治疗初步完成后:
临 床 反 馈
Gesell评估该患儿神经系统发育进步明显;
对人反应好,现有较好追视;
社交行为明显增多且改善;
大运动改善;
共患睡眠问题、便秘问题明显解决。
目前还在治疗期,等待复查中。

年 龄: 1岁6月龄 性 别: 男
临床主诉
临床诊断体格发育迟缓:LAZ= -2.87;
HAZ= -1.93;WAZ= -0.91;
骨密度对年龄Z分数= -0.47;
Gesell评估精神发育正常;
共患病:便秘腹泻交替;
存在严重食物不耐受情况。
* HAZ(LAZ)——身高 / 年龄 Z评分
WAZ——体重 / 年龄 Z评分
发育迟缓的儿童LAZ值从出生到18至24个月之间通常会下降到最低点。
临床上考虑到可能肠道菌群存在问题,进行肠道菌群检测,结果如下:
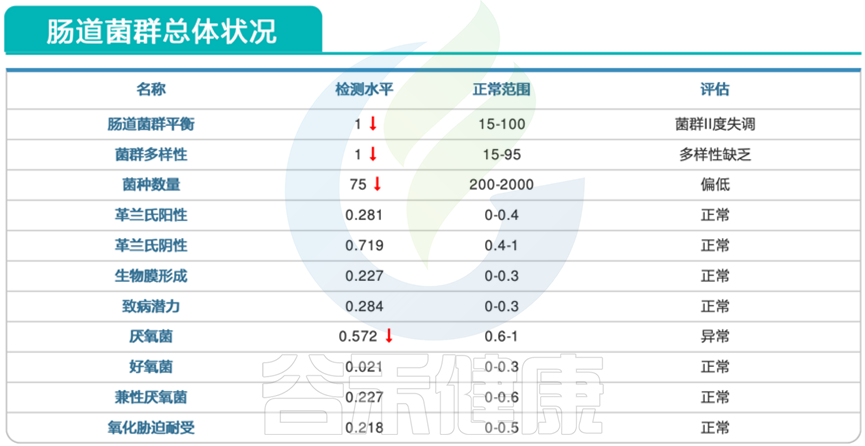
患儿肠道菌群存在明显失衡,以多样性极低为主要特征。
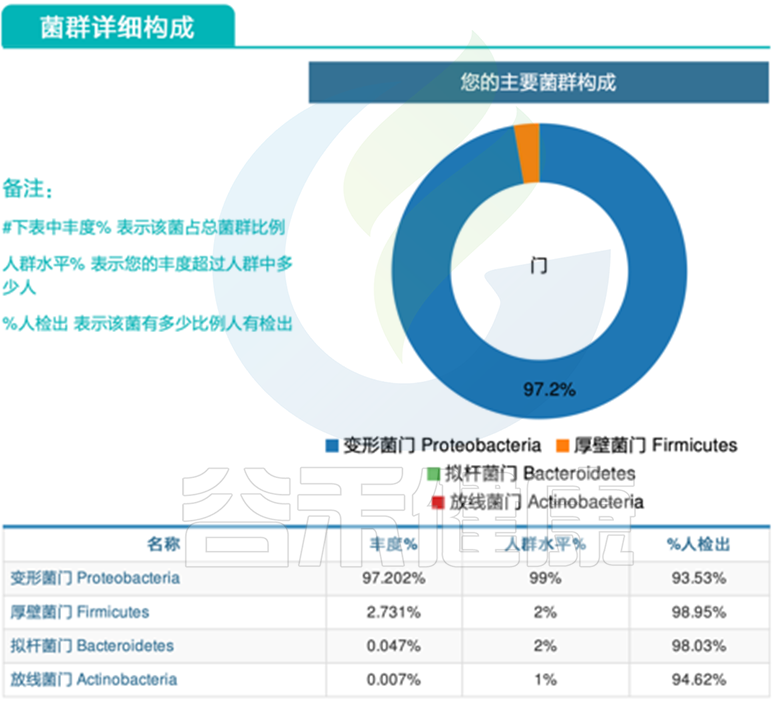
变形菌门扩张。
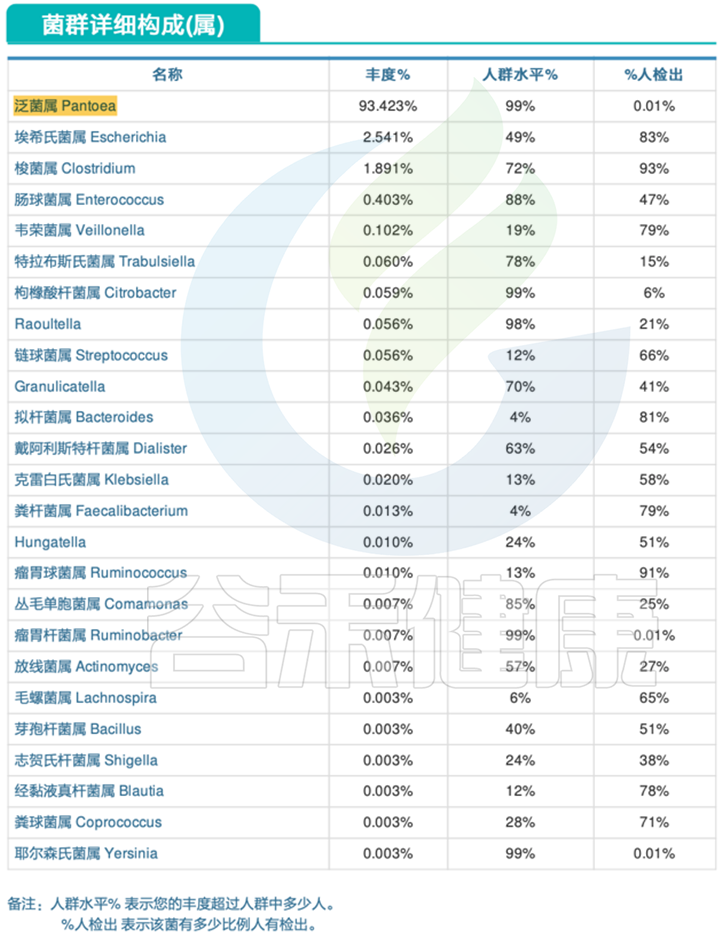
泛菌属病理性滋生。
泛菌属 pantoea
泛菌属 pantoea 是肠杆菌科中一种黄色杆状革兰氏阴性菌。从多种环境中分离出来,与植物、昆虫、人类和动物有关。泛菌通常被认为是一种植物致病菌,但最近的证据表明,泛菌经常从医院环境中分离出来,目前关于泛菌在人类疾病中的作用存在相当大的争议。
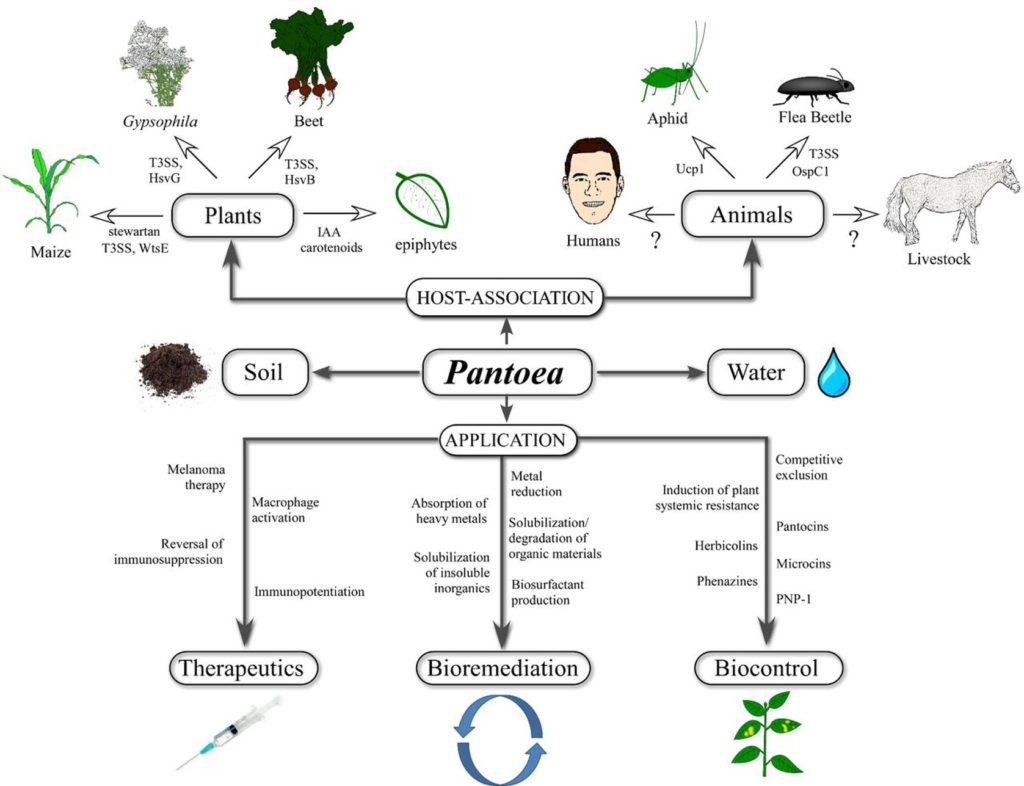
Alyssa M. Wet al,EMS Microbiology Reviews,2015
有研究认为,通过污染医疗器械和肠外(静脉)营养、吸入有机粉尘、接触有机物质的伤口或自然围产期,将细菌引入患者体内。泛菌被认为与一些疾病包括脓毒性关节炎、骨髓炎、菌血症和败血症,以及腹膜炎等有关。
然而,一些研究认为,这些和许多其他被标记为Pantoea菌株的临床分离株实际上被错误识别了,一项研究表明,临床和动物分离的Pantoea菌(最常见的是P. agglomerans)实际上属于其他Pantoea种,甚至其他属,如肠杆菌。
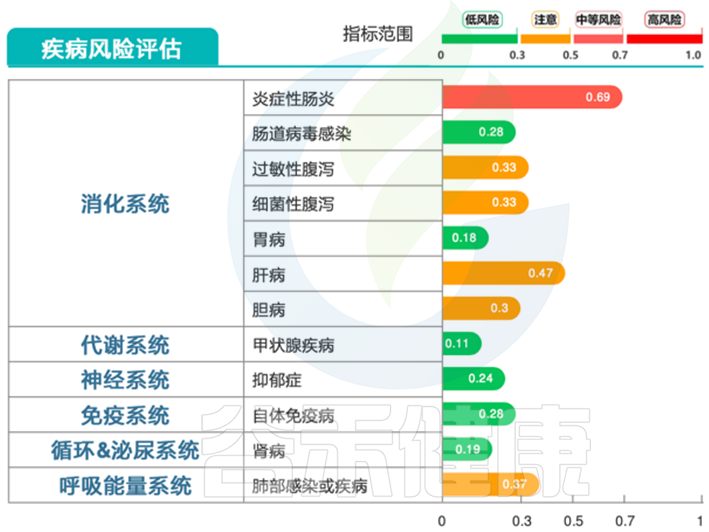
存在炎症性肠病为主的疾病风险,以及严重的肠道营养不良问题。
营养指标的评估是基于菌群构成特征和菌群代谢以及大队列人群膳食营养调查来评估的,严重的菌群失调构成异常会影响营养指标预测模型,比如大量氨基酸都评估缺乏的情况,这种情况建议优先调整好菌群再检测。
临床治疗
抗菌重建肠道菌群;
氨基酸奶粉;
益生菌补充;
特殊食疗(参考了2019年Jeffrey I Gordon课题组针对SAM问题的菌群靶向饮食,具体操作中选择了孩子不过敏但是营养价值较高的合适食物)
治疗初步完成后,复查结果如下:

患儿菌群构成、感染状态、营养状态均得到明显改善。
临 床 反 馈
临床诊断体格发育迟缓:
LAZ=-0.81;HAZ= -0.22;WAZ= 0.14;
骨密度对年龄Z分数= 0.07;
体格发育改善明显;
Gesell评估精神发育正常;
共患病:抗生素治疗后再未见腹泻,但偶见便秘。大便由绿转黄色条状,气味可。
仍然存在食物不耐受情况。
随着肠道健康产业的不断发展,市面上的益生菌种类越来越多,然而我们依然可以看到,很多人只是盲目补充,并不知道什么才是适合自己的益生菌,也不知道是否应该补充。简单粗暴的方式带来更多的是不确定性。
有大量文献研究数据支撑,我们将肠道菌群健康检测与临床案例相结合,将肠道菌群健康检测应用于发育迟缓儿童的干预,在上述案例中显现其应用价值。
在上述案例中我们可以看到,基于肠道菌群健康检测,其干预手段并不仅仅是益生菌的补充,也包括其他多种方式的配合,如维生素的补充,食疗等,因此肠道菌群健康检测并不局限于某种菌是否超标。通过多维数据模型分析,可以为临床干预带来更多角度的思考。
当然,在现有的基础上,也需要更大样本量和更多的临床积累。未来我们会加大投入力度,充分发挥其应用价值,同时也会为大家带来更多的案例参考。
温馨提醒
如果发现有发育迟缓的征兆,请及时就医并进行干预,等超过3岁之后,效果就可能不太理想哦~
最后,愿所有宝宝都能健康成长。

相关阅读:
谷禾健康
微生物群失调与人体中的多种疾病有关。在个体中,每个微生物栖息地都表现出不同的微生物种群模式。迄今为止,关于微生物组相关疾病的研究集中在器官特异性微生物组上。然而,器官间微生物网络正在成为生理功能和病理过程中的重要调节剂。
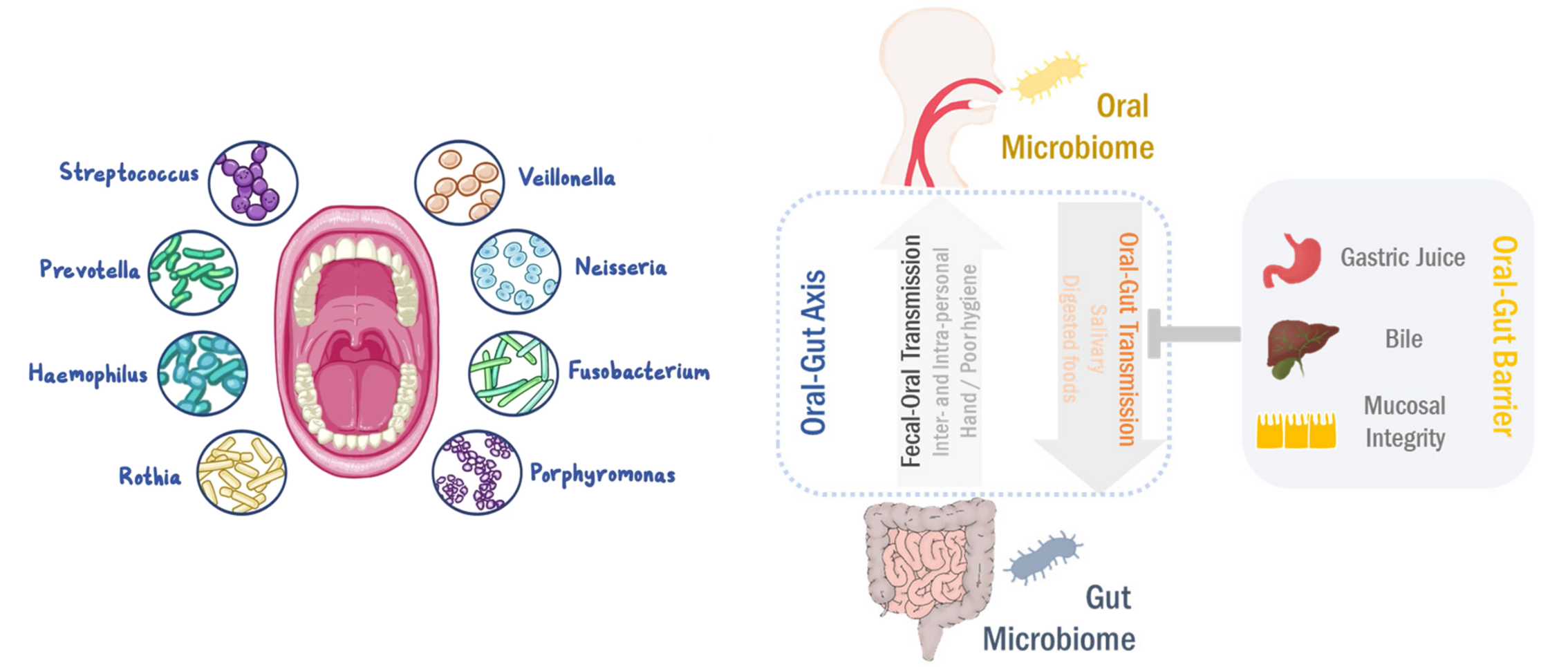
口-肠
口腔和肠道是两个最大的微生物栖息地,在微生物组相关疾病中起主要作用。即使口腔和肠道是通过胃肠道相连的连续区域,由于口腔-肠屏障的原因,口腔和肠道的微生物群分布很好的分离。
然而,在口腔-肠道屏障功能障碍的情况下,口腔微生物群可以转移到肠粘膜。相反,肠道至口腔的微生物传播也以人际和社区传播发生。
最近,有报道说口腔和肠道微生物组相互依赖地调节生理功能和病理过程。口腔到肠道和肠道到口腔的微生物传播可以塑造和/或重塑两个生境中的微生物生态系统,最终调节疾病的发病机理。
在这里,我们将讨论总结口腔-肠道微生物组轴在胃肠道疾病和癌症中的作用, 更好地了解肠道-肠道微生物组轴在发病机理中的作用将有利于精确的诊断/预后和有效的治疗。

人体消化系统由胃肠道和包括肝和胰腺在内的辅助消化器官组成。 胃肠道的粘膜排列整齐,从口腔开始,直到肠道(更准确地说是肛门)结束。 因此,口腔和肠道是通过胃肠道连接的解剖学连续区域。
此外,由于唾液和消化后的食物都通过胃肠道,因此这两个位置也是化学相连的。
通常,由于中空的运河结构,胃肠道被认为在人体外部。 口腔是消化道的通道,直接暴露于外部环境,例如微生物,营养物和其他外源性物质。 在这方面,口腔和肠道都为不同的微生物繁衍提供了适当的环境。
HMP(第一阶段人类微生物组计划)揭示了人体中一半以上的细菌位于胃肠道(29%)和口腔(26%)中。 除了这些丰富的生物外,口腔和肠道微生物群也高度多样化,并同时显示出与每个生境区分开的独特特征。
根据人类口腔微生物组数据库(HOMD),口腔中大约有700种微生物。口腔中的共生菌包括厚壁菌门、变形杆菌门、拟杆菌门、放线杆菌门、梭杆菌门、奈瑟菌门和TM7。口腔有几种不同的微生物环境,包括:颊粘膜、龈下菌斑、龈上菌斑、角化牙龈、硬腭、唾液、扁桃体、舌头和喉咙。口腔和腭粘膜的多样性低于其他口腔栖息地。
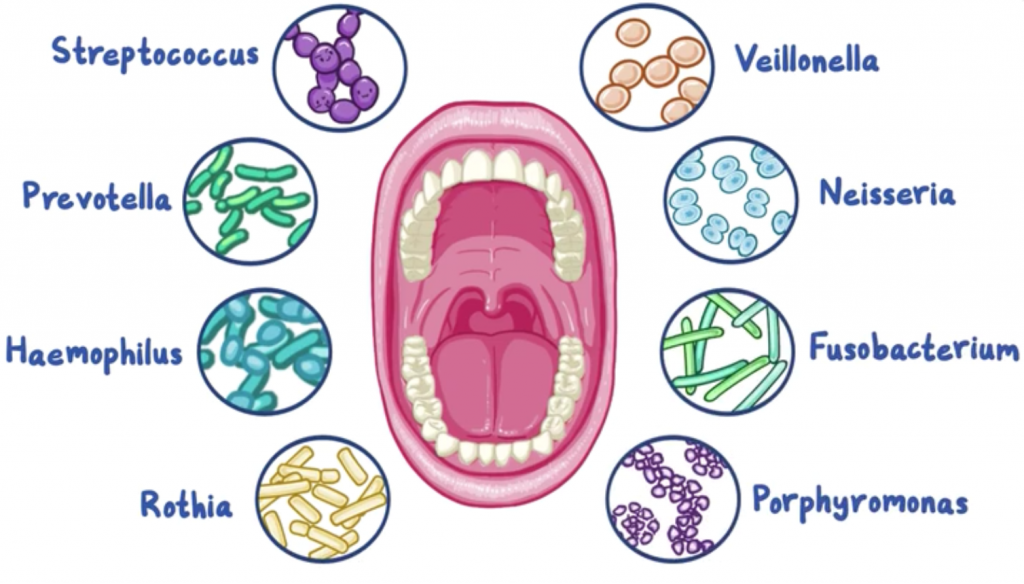

无论小生境的位置如何,健康受试者的所有口腔部位在属水平上的菌如下:
双歧杆菌 Gemella链球菌 Streptococcus
韦荣氏菌 Veillonella嗜血杆菌 Haemophilus
奈瑟菌 Neisseria卟啉单胞菌 Porphyromonas
放线菌 Actinomyces梭菌 Fusobacterium
普雷沃氏菌 Prevotella
除了这些常见的细菌进化枝外,每个小生境还具有分化良好的细菌组成。
根据微生物群落结构,口腔生态位可分为三组:
第一组:颊粘膜、角化牙龈和硬腭
第二组:唾液、舌头、扁桃体和喉咙
第三组:龈下和龈上菌斑
生态位对口腔微生物组的隔离可能归因于多种因素,例如pH,盐度,氧化还原电位,氧气和营养。 此外,牙齿卫生是影响口腔微生物组的另一个重要因素,因为口腔是直接向外界开放的。
肠道是人体内最大、最具特征的微生物生态系统,在50多个不同的门中有大约500到1000个物种。
由五个主要的拟杆菌门、厚壁菌门、放线菌门、变形菌门和疣状菌门组成,但以两个拟杆菌和厚壁菌门为主,占90%以上。
在属的水平上,拟杆菌是最丰富的。已知人类肠道微生物群在生命早期就已建立,然后可以随着年龄和环境(如饮食和营养)而改变,类似于人类口腔微生物群。因此,口腔和肠道微生物组直接反映了宿主的健康状况。
尽管肠道与口腔相连,但肠道微生物群的组成可与口腔微生物群的组成区分开来。在门的水平上,口腔主要由厚壁菌门控制,而粪便微生物群主要富含拟杆菌。这种分离可归因于胃中的胃酸和十二指肠中的胆汁酸。
据报道,长期使用质子泵抑制剂(PPI)会增加肠道感染的风险。值得注意的是,PPIs降低胃酸可以减少肠道微生物生态系统的多样性,改变肠道微生物组的组成。
此外,胆汁酸可引起肠细菌膜和/或DNA完整性的破坏,在口腔和肠道之间起有效的抗菌屏障作用。 因此,胃酸度和胆汁酸池负责肠道和口腔微生物组的独特模式。
人类肠道微生物组的概况可以根据健康状况,环境因素,遗传学甚至生活方式而改变。
宏基因组学分析表明,人类肠道菌群调节代谢途径,例如碳代谢和氨基酸合成。微生物显示出保守的分子基序,称为微生物相关的分子模式和病原体相关的分子模式(PAMP),宿主可通过模式识别受体(PRRs)识别这些基序,如toll样受体。
这种微生物与宿主的相互作用可以刺激人体的免疫系统和炎症反应。 这意味着肠道菌群可以调节人体的主要生物学功能,新陈代谢和免疫力,因此肠道菌群失调与多种人类疾病有关,从传染病到阿尔茨海默氏病。然而,要证明肠道微生物群是人类健康状况的原因还是后果是一个挑战。
另外,无菌(GF)动物为肠道微生物组的生理功能提供了深刻的线索。与无特定病原体(SPF)的小鼠相比,GF小鼠的肠重量减少,绒毛更短,小肠的总表面积减少,表明胃肠道发育存在缺陷。
与此相一致,GF小鼠显示出代谢异常,例如胆固醇代谢改变和肠道内短链脂肪酸的减少,短链脂肪酸是重要的能量来源之一。
因此,与SPF小鼠相比,GF小鼠显示出较低的体内脂肪含量和对高脂饮食诱导的体重增加的抵抗力。 但是,通过应用SPF小鼠的盲肠含量,通过GF小鼠的常规化可以恢复体内脂肪含量。
在免疫方面,GF小鼠在Peyer斑块和肠系膜淋巴结发育方面存在缺陷,CD4,CD8和Foxp3 T细胞数量减少,B细胞分泌的免疫球蛋白A产生减少。
通过与SPF小鼠共栖或口服SPF小鼠粪便中的成分,可以通过微生物群重建来恢复这些疾病。 两者合计,很明显,肠道菌群在维持生理稳态方面起着至关重要的作用,主要是代谢和免疫。
尽管口腔是人体第二大的微生物栖息地,但是累积的知识不足以完全了解口腔微生物组对人类健康的影响。 毫无疑问,口腔微生物组与牙齿健康直接相关。
口腔疾病中有许多已被确认的关键病原体,如龋齿的变形链球菌(Streptococcus mutans )和牙周炎的牙龈卟啉单胞菌(Porphyromonas gingivalis)。此外,与健康受试者相比,口腔鳞状细胞癌患者的口腔微生物组发生了改变。根据口腔微生物群分析,口腔鳞状细胞癌(OSCC)患者中的梭杆菌属(Fusobacterium)水平较高。
口腔微生物组会影响全身健康状况,而不仅限于牙齿健康(下图)。
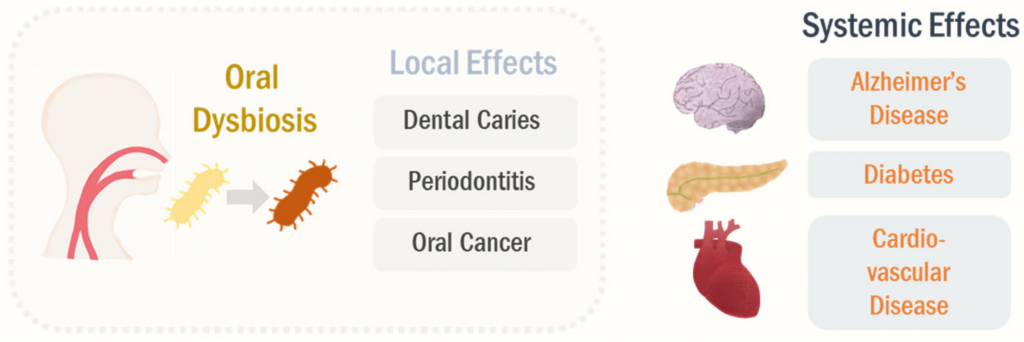

Park Se-Young, et al., Cancers (Basel),2021
流行病学和实验证据支持口腔菌群失调与全身性疾病密切相关,包括阿尔茨海默氏病,糖尿病和心血管疾病。 与此相符,阿尔茨海默氏病的口腔微生物群特征发生了显着变化,例如莫拉氏菌属(Moraxella),纤毛菌属(Leptotrichia)和鳞球菌属(Sphaerochaeta)的患病率。口腔不良反应的改变与阿尔茨海默氏病的进展有关。
I型糖尿病患者的放线菌门和厚壁菌门的丰度更高。此外,据报道,在有症状的动脉粥样硬化患者的口腔微生态环境中,厌氧菌属的富集已被报道。
在牙周炎(一种口腔失调疾病)的情况下,其标志性病原体牙龈卟啉单胞菌(P. gingivalis)感染可引起局部以及全身慢性炎症。
此外,口腔异位症可以诱导PAMP信号的产生,例如脂多糖(LPS),导致系统性刺激先天免疫应答和炎症转录因子,包括核因子κB。 这些全身性炎症和免疫反应被认为是主要机制之一,强调口腔微生物组调节远端器官的发病机理。
值得注意的是,口腔微生物群可以转移到其他器官,这被认为是口腔生物失调引起的全身性疾病的另一种机制。
在短期死后阿尔茨海默氏病患者的脑组织中已检测到口腔致病菌牙龈卟啉单胞菌(P. gingivalis)。 口腔病原体直接转移到大脑可以通过诱导神经炎症和神经变性而加剧阿尔茨海默氏病。
此外,在冠心病患者的动脉粥样硬化斑块中检测到许多口腔共生细菌,这进一步表明口腔细菌可能转移到远端器官。 由于物理和化学联系,口腔微生物向胃肠道系统的迁移可能更频繁。
在某些致病条件下,一些口腔细菌类群定居并富含胰腺和肠道,表明口腔和肠道菌群之间存在直接的串扰。
由于存在肠-肠屏障,物理距离以及化学障碍(例如胃酸和胆汁),因此口腔和肠道微生物组被很好地隔离了。 然而,口腔-肠道屏障的损伤会导致器官间的易位和交流。
一般来说,新生儿和老年人体内存在不成熟或功能性障碍较少。双歧杆菌是新生儿肠道中最丰富的细菌属。有趣的是,在新生儿的口液中发现了肠道内的双歧杆菌。
同样,与健康成年人相比,老年人肠道内口腔细菌的检出率也较高,如:
卟啉单胞菌(Porphyromonas)、梭杆菌(Fusobacterium) 和假分枝杆菌 (Pseudoramibacter)。
此外,低胃酸使肠道微生物群的组成向口腔微生物群转移。已在体外证明,通过分别引入人类粪便和唾液微生物群的GF小鼠组,口腔微生物群可以侵入肠道并重塑肠道微生物群。
综上所述,这些数据表明口腔微生物可以在某些情况下克服口腔与肠道之间的物理和/或化学障碍,并有可能转移到肠道中。
值得注意的是,在胃肠道的病理条件下已检测到典型的口腔驻留物种。 例如,炎症性肠病(IBD)患者的肠道粘膜中有大量嗜血杆菌和Veillonella富集,已知它们是口腔共生微生物。
在结肠癌患者中,他们的肠道微生物群包含几种口腔类群,包括梭菌。这意味着正常的人口腔微生物群可以在肠粘膜稳态中破坏并在肠道粘膜中定植,并成为条件致病菌。
而且,这种经口-粪便传播也可以在生理条件下发生,而不仅仅是在病理或屏障破坏的情况下。HMP联盟的数据被划分为每个身体部位的群落类型时,口腔和肠道微生物群类型显示出强烈的关联,尽管它们在分类上不同。
在唾液细菌中,普雷沃氏菌(Prevotella)大量存在于粪便样本中。与此相一致,从同一健康受试者的口腔和粪便样本中同时检测到几个属。通过分析470名个体口腔和粪便微生物群中的310种,唾液和粪便样本中普遍存在125种,包括链球菌(Streptococcus)、韦荣氏球菌属(Veillonella)、放线菌(Actinomyces)和嗜血杆菌(Haemophilus)菌株。
综上所述,很明显口腔微生物群可以比预期更广泛地进入肠道,即使在健康状态下,而不仅仅是在病理情况下。
肠道微生物可通过粪-口途径通过直接接触或通过受污染的液体和食物间接接触传播。人的手部微生物群与口腔和肠道微生物群模式高度重叠,表明人的手是粪便到口腔微生物传播的载体。因此,在发展中国家,由于卫生状况不佳,如缺乏清洁供水和公共卫生系统,微生物的粪-口途径经常被报道。
此外,免疫功能低下的个体也容易通过粪-口传播。在头颈部癌症患者中,放射治疗与革兰氏阴性杆菌的口腔定植高度相关,不良的口腔卫生状况会进一步加剧这种情况。因此,不良的卫生和/或免疫损害条件可能会促进同一个体的粪-口途径。
除了体内传播外,粪-口途径也被认为是病原体在人与人之间传播的重要机制。众所周知,甲型肝炎病毒(HAV)和戊型肝炎病毒(HEV)等肠道病毒通过粪-口途径传播,因此很容易通过人与人之间的接触传播,特别是在不卫生的条件下。
肠道病毒可以直接和间接地与肠道微生物群相互作用,对肠道微生物生态系统造成破坏性影响。据报道,戊型肝炎病毒感染会增加急性肝衰竭患者粪便样本中乳酸杆菌科(Lactobacillaceae)和伽马蛋白杆菌( Gammaproteobacteria)的丰度。
添加益生菌粪肠球菌NCIMB 10415(Enterococcus faecium NCIMB 10415) 可有效促进感染猪的HEV清除。
除了肠道病毒外,幽门螺杆菌(Helicobacter pylori)是严重胃十二指肠疾病的主要致病菌,也可以通过粪-口途径传播,显示出与甲型肝炎感染的相关性。
虽然需要进一步的研究来了解粪-口传播在口腔和肠道微生物群中的作用,但令人信服的是,口腔和肠道微生物群通过口-肠和粪-口途径紧密相连(下图)。
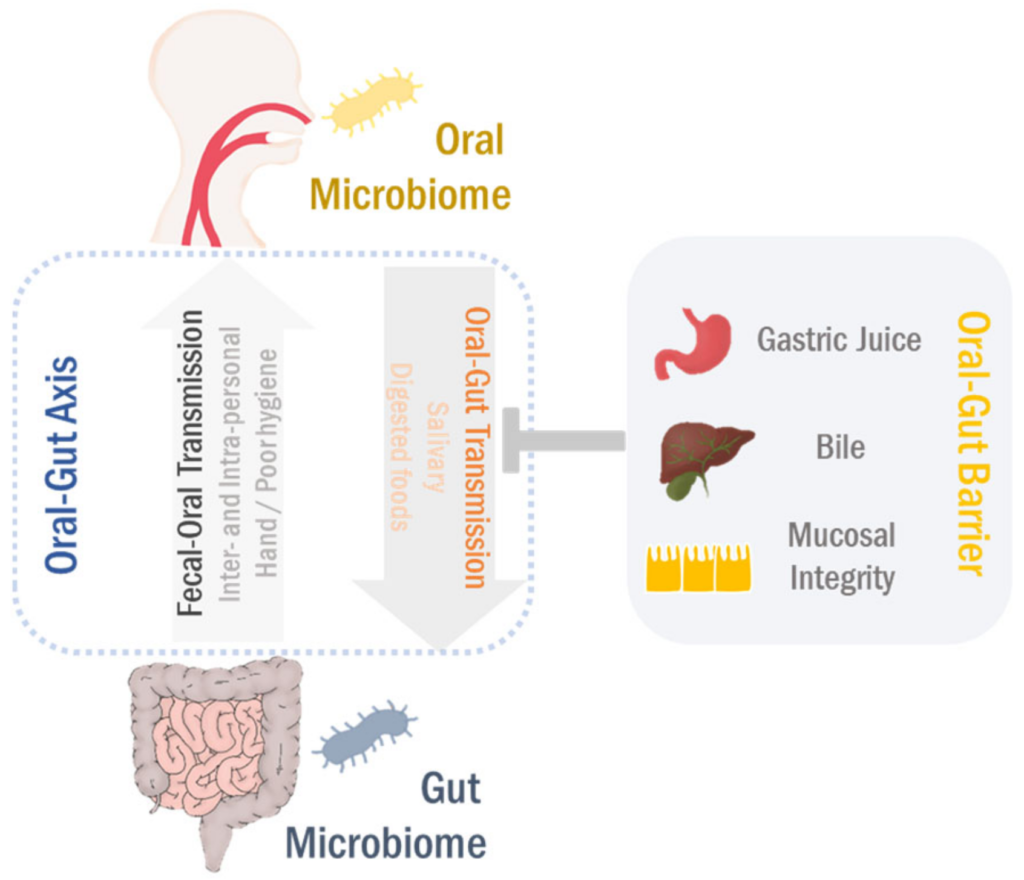
Park Se-Young, et al., Cancers (Basel),2021
这种双向相互作用可以相互塑造和/或重塑两个栖息地的微生物生态系统,最终调节胃肠系统的生理和病理过程。因此,口腔-肠道和粪便-口腔方向在以下中统称为“口腔-肠道微生物群轴”。

IBD代表结肠和小肠的慢性炎症性疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC)。因此,IBD与肠道微生物群失调密切相关。IBD患者的肠道微生物组显示出细菌组成的多样性降低和变化,包括厚壁菌门的丧失和变形菌门和拟杆菌门的丰度增加。在肠道粘膜组织活检中而不是在粪便中更深刻地观察到了这些不良生物事件。与健康受试者相比,在肠黏膜表面,IBD患者经常检测到细菌入侵和生物膜形成,表明肠屏障功能障碍与IBD发病有关。
在健康状态下,由于完整的粘膜屏障,肠道微生物群很少受到来自其他栖息地的微生物的入侵和定植。然而,IBD患者由于粘膜屏障受损而表现出肠上皮通透性增加。
值得注意的是,口腔内细菌菌株是从IBD患者的肠道微生物组中分离出来的,这可能是由于肠道渗漏造成的。具核梭杆菌( Fusobacterium nucleatum )通常存在于口腔中,但很少存在于健康人的肠道中。
有趣的是,IBD患者在肠道中出现了F. nucleatum,比其他F. nucleatum菌株更具侵袭性,表明IBD患者存在肠道-肠道微生物组轴。这一点已在体外通过将口腔微生物群移植到动物模型中得到证实。
在大鼠中,F.nucleatum的侵袭导致肠道微生物组发生转移并加重内脏超敏性。 此外,CD患者的唾液微生物群成功地定居在GF小鼠的肠道中。
克雷伯菌(Klebsiell)是最流行的定植菌,可促进肠道Th1细胞的诱导和炎症,这是IBD发病机理中的关键事件。 这些结果进一步支持了口腔微生物群,无论是共生的还是病原菌,都可以传播到肠道,通过肠道失调促进IBD的发病。
因此,口腔失调可以通过募集口腔-肠轴来直接调节IBD的发病机制。牙周炎是一种慢性炎性口腔疾病,与口腔微生物群的改变密切相关,特别是与其关键性病原体牙龈卟啉单胞菌的过度生长有关。
在C56BL/6小鼠中,口服牙龈卟啉单胞菌通过下调紧密连接蛋白来减弱肠道屏障功能,从而导致肠道微生物组发生重大变化,包括梭菌科的丰富。
此外,接种牙龈卟啉单胞菌的小鼠表现出肠道以及全身性炎症,这可以由牙龈卟啉单胞菌衍生的内毒素例如LPS介导。 与动物实验一致,荟萃分析表明牙周炎分别与IBD,CD和UC的两种主要形式密切相关。
两者合计,口腔病原体可以干扰肠屏障功能并侵入肠粘膜,从而引起肠道失调和慢性炎症,从而导致IBD发病。 值得注意的是,IBD患者以及结肠炎引起的小鼠唾液微生物群组成发生变化,这与炎症反应有关,表明口腔-肠道微生物相互作用可能是双向的。
大肠癌(CRC)是世界上最常见的癌症类型之一,也是导致癌症死亡的第二大原因。IBD是CRC发生和发展的最公认的危险因素。因此,IBD和CRC在发病机理中共享病因,包括肠道微生物组的明显变化。 与IBD相似,CRC与肠道失调密切相关。与健康个体相比,CRC患者在粪便和肠粘膜样品中均显示出不同的微生物组成模式。
一直以来,在结肠炎相关和化学诱导的大肠癌小鼠模型中都发现了肠道微生物群的深刻变化,支持肠道失调和大肠癌之间的关系。使用GF小鼠的研究进一步证明,肠道微生物群的改变可以直接促进炎症相关的结直肠癌的发展。
有趣的是,在大肠癌患者的肠道中发现了几种口腔分类群,包括细小单胞菌(Parvimonas)、消化链球菌(Peptostreptococcus)和梭形杆菌(Fusobacterium),表明大肠癌中存在口腔-肠道微生物群轴。
在这些口腔常驻细菌中,具核梭杆菌 (F.nucleatum)与健康人相比,结直肠癌患者的肿瘤组织和粪便中普遍存在细胞核,这与IBD一致。
在小鼠结肠炎模型中,口服具核梭杆菌(F.nucleatum) 细胞核引起的炎症以及小肠和大肠的肿瘤发生。具核梭杆菌 (F.nucleatum)细胞核似乎很容易附着在表达内皮钙粘蛋白的宿主CRC细胞上,然后刺激促炎症反应和细胞增殖。与IBD相似,结直肠肿瘤显示肠道屏障功能受损,这可能解释了口腔微生物群的肠道定植。
此外,据报道,具核梭杆菌 (F.nucleatum) 与口腔病原体牙龈卟啉单胞菌共聚并共感染。尽管体外方法存在局限性,但牙龈卟啉单胞菌仍侵袭CRC细胞并促进癌细胞增殖,这表明牙周病原体参与了结直肠肿瘤的发生。 与此相一致,牙龈卟啉单胞菌血清抗体水平与CRC患者的死亡率呈正相关。
此外,一项荟萃分析表明,牙周炎与CRC风险增加有关。 综上所述,这些研究可以证明口腔失调,口腔-肠道微生物组轴与CRC发病机理之间存在关联。
肝硬化是由慢性肝脏疾病引起的晚期肝病,例如非酒精性脂肪肝疾病(NAFLD)和非酒精性脂肪性肝炎(NASH)。 健康对照组相比,NAFLD、NASH或肝硬化患者粪便样本中的变形杆菌门显著增加,表明肠道微生物组与肝脏发病机制相关。在这方面,与SPF小鼠相比,GF小鼠免受高脂饮食诱导的脂质在肝脏中的蓄积。此外,定居于NAFLD易感肠道微生物的GF小鼠发生了严重的肝脂肪变性,进一步支持了肠道失调可能是慢性肝病的直接病因。
由于肠道和肝脏通过胆道和门静脉进行物理连接,如果粘膜屏障受损,肠道微生物可以转移到肝脏。胆汁酸具有抗菌活性,在肠道和肝脏之间循环循环,具有屏障和桥梁的双重功能。
慢性肝病通常与胆汁酸形成和/或分泌不良有关,会增加肠道通透性。 因此,胆道梗阻促进了细菌从肠道到肝脏的移位。 在胆结石患者中,与正常对照组(例如富集变形杆菌)相比,胆道和肠道中的微生物组成均发生了变化,这支持了慢性肝病中肠道-肝脏微生物组轴的存在。
通过与肠-肝微生物串扰的融合,口腔-肠道微生物组轴正在成为慢性肝病的重要调节剂。
值得注意的是,宏基因组学分析已证明肝硬化患者肠道内的口腔粘膜有侵袭和定植。另一项研究还显示,酒精依赖型肝硬化患者的肠道中口腔微生物的富集。 这些数据支持口腔微生物的肠道迁移与肝硬化有关。 但是,其潜在机制尚不清楚。如前所述,由于胃酸度低,PPI促进了从口腔到肠道的微生物转化。 同样,PPI治疗改变了肝硬化患者的肠道菌群组成,特别是肠道内口腔细菌的过度生长。 相同的研究小组已经证明了肝硬化患者唾液和粪便微生物组的伴随变化,进一步表明口腔-肠道微生物组轴调控肝脏的发病机制。
因此,口腔失调可能会通过改变肠道微生物组而加重慢性肝病。 确实,牙周炎与NASH,NAFLD和肝硬化显着相关。 在来自NAFLD和与病毒感染相关的肝硬化患者的口腔样本中已经检测到牙龈卟啉单胞菌,一种牙周基石病原体。
在高脂饮食喂养的小鼠中,牙龈卟啉单胞菌的牙源性感染通过脂质积累,纤维化和肝脏炎症促进了NAFLD和NASH的进展。 总体而言,口腔失调可能会通过调节肠道生态系统而加剧慢性肝病。 同时,口腔失调可能反映了由肝病驱动的肠道失调生态系统。
肝细胞癌(HCC)的发展经历了一个逐步的过程,从NAFLD/NASH到肝硬化,最后发展为HCC。在小鼠肝癌发生模型中,SPF小鼠比GF小鼠更易发生肝癌,类似于慢性肝病。
在生态型小鼠模型中,某些类型的肠道细菌,如大肠杆菌和粪链球菌,可显著增加肝肿瘤的发生,表明肠道微生物群直接参与了肝癌的发病机制。与这一观点一致,与健康对照组相比,HCC患者的丁酸产生菌属减少,如反刍球菌(Ruminococcus)、大肠杆菌(Oscillibacter)、粪杆菌(Faecalibacterium)、梭状芽孢杆菌IV(Clostridium IV)和粪球菌(Coprococcus),而LPS产生菌属增加,包括粪便样本中的克雷伯菌(Klebsiella)和嗜血杆菌(Haemophilus )。
此外,随着HCC的发展,肠道失调的水平趋于增加。 在患有肝硬化的HCC患者中,粪便微生物群的成分与没有HCC的肝硬化患者的粪便微生物群成分有所不同,例如大肠杆菌和Fusobacteriia的大量富集。 在化学诱导的HCC小鼠模型中,已在肿瘤内发现了一种肠道细菌肝幽门螺杆菌(Helicobacter hepaticus),它直接引起HCC的发展和进程,进一步支持肠道失调可以诱导HCC的发病机理。 然而,在人类HCC样品中未检测到肝炎性肝炎,而确诊存在其他幽门螺杆菌,例如幽门螺杆菌。因此,肝癌的发展与肠道失调密切相关。
有趣的是,据报道,与健康受试者相比,肝癌患者的口腔微生物群发生了变化。肝癌患者唾液微生物群中嗜血杆菌属、卟啉单胞菌属和Filifactor的丰度较高。在肝硬化的HCC患者中,根据舌苔的微生物组学特征,颤杆菌克属(Oribacterium)和梭形杆菌属(Fusobacterium)普遍存在。
此外,慢性牙周炎与晚期HCC相关,提示口腔失调与HCC相关。值得注意的是,肝硬化HCC患者的口腔和肠道微生物群中都富含梭杆菌,这表明口腔微生物可能通过口腔-肠道微生物群轴调节HCC发病机制,但需要进一步研究。
胰腺是消化系统的一部分,分泌分解脂类、蛋白质和碳水化合物的酶。主胰管与胆总管相结合,两者都与十二指肠相连。在正常健康条件下,胰腺被认为是一个无菌器官。
然而,胰腺导管腺癌(PDAC)患者的细菌数量增加,如肿瘤内的γ-变形菌纲(Gammaproteobacteria)和胰液和胰腺组织中的粪肠球菌(Enterococcus faecalis)。
此外,肿瘤内微生物组多样性与PDAC的预后相关。从更全面的角度来看,PDAC患者在胰腺组织、肿瘤以及粪便样本中表现出不同的微生物群模式,表明肠-胰腺微生物串扰参与了PDAC发病机制。特别是,PDAC患者的肠道和胰腺中同时富集了变形菌(Proteobacteria)。
在实验小鼠中,肠道通透性增加与肠道到胰腺的微生物易位有关,这可能加速PDAC的进展。在肠道菌群清除的小鼠中,用PDAC荷瘤小鼠的粪便菌群重新填充可显著促进胰腺肿瘤的发生,表明肠道菌群对PDAC进展的直接贡献。因此,肠道微生物组似乎与胰腺微生物生态系统密切相关,而胰腺生态系统在PDAC发病机理中起着至关重要的作用。
惊讶的是,口腔微生物组也与PDAC的发病机理有关。 根据元流行病学研究,牙周炎是一种主要的口腔菌群失调疾病,可以显着增加PDAC的风险和死亡率。
携带其关键病原体牙龈卟啉单胞菌与PDAC患者的较高风险和死亡率正相关。 在小鼠PDAC模型中,口服牙龈卟啉单胞菌可加速细胞增殖和上皮-间质转化,最终促进PDAC进程。
有趣的是,细胞内牙龈卟啉单胞菌直接促进人胰腺癌细胞系中肿瘤细胞的生长。 这些表明口腔菌群失调可能是直接的病因,也是诊断和预后PDAC发病机理的有用标志。
与健康受试者相比,PDAC患者的口腔微生物组有明显变化。 值得注意的是,尽管在人类PDAC组织中已发现了一种广为人知的口腔细菌群Fusobacterium,但其与PDAC预后的关系仍存在争议。
此外,PDAC患者的胰腺微生物组与肠道微生物组高度重叠。胰腺和肠道菌群均表现出口腔类群富集细菌和卟啉单胞菌的相对丰度。因此,某些类型的口腔微生物可能迁移到肠道,甚至进一步迁移到胰腺,这可能通过肠道和胰腺微生物群的协调调节促进PDAC的发病。
为了支持这一观点,在PDAC患者的口腔,肠道和胰腺微生物群之间发现了相关性,尤其是口腔起源的F. nucleatum subsp. vincentii亚种的丰度。
这些数据表明,口腔-肠道微生物组轴可以调节PDAC的发病机制,甚至进一步创造口腔-肠道-胰腺的微生物途径。

口腔和肠道是人体内最大的两个微生物栖息地。累积证据表明,口腔微生物群可以通过口腔细菌分泌体的直接易位和/或间接地改变整个肠道微生物生态系统。
肠道到口腔的微生物传播也可能发生,特别是在某些情况下,如卫生条件差和免疫功能低下。总之,口腔和肠道微生物群之间的双向串扰可以形成口腔-肠道微生物群轴,它在调节各种人类疾病的发病机制中起着关键作用,主要是在胃肠道系统(见下表)。
结肠疾病中的口腔-肠道微生物群轴

Park Se-Young, et al., Cancers (Basel),2021
肝脏疾病中的口腔-肠道微生物轴

Park Se-Young, et al., Cancers (Basel),2021
胰腺疾病的口腔-肠道微生物组轴
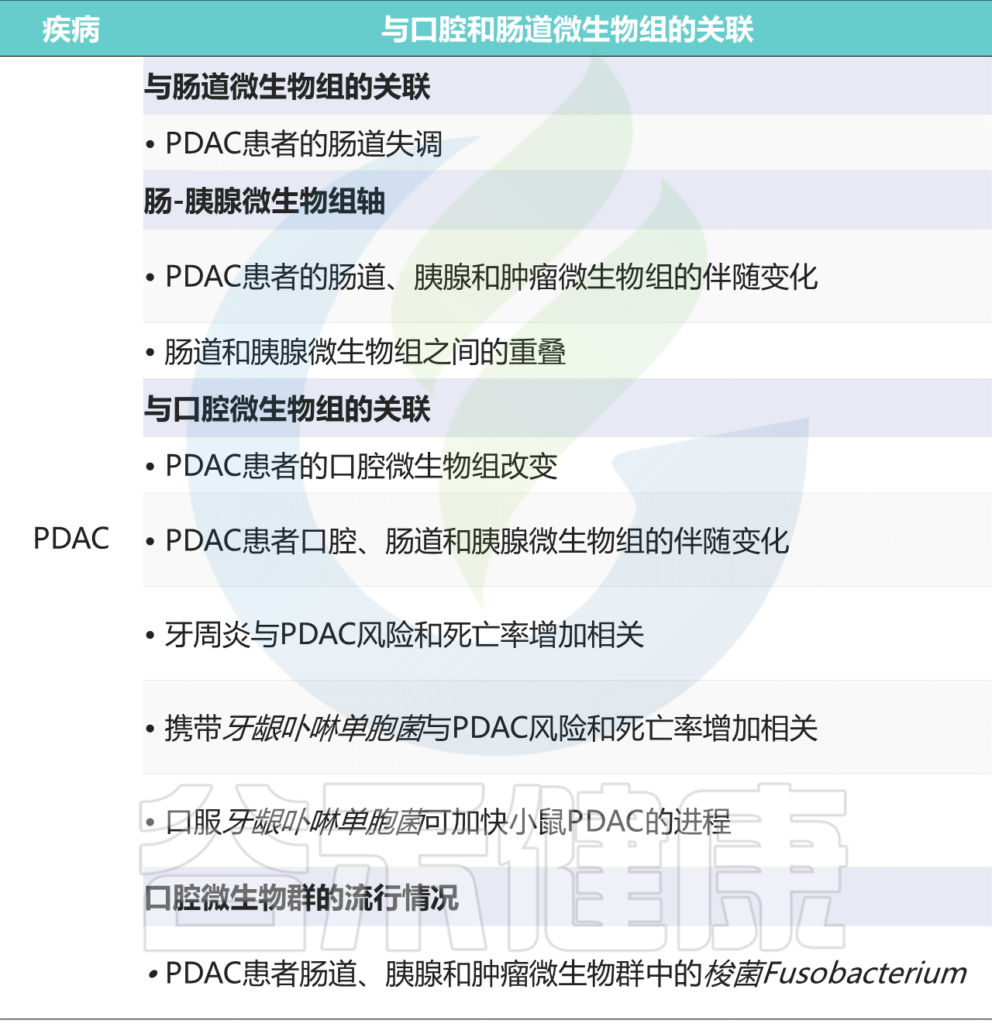
Park Se-Young, et al., Cancers (Basel),2021
值得注意的是,口腔-肠道微生物组轴改善了胃肠道系统的发病机理和预后的预测。荟萃分析表明,口腔微生物组的变化与胃肠道癌的风险有关,包括CRC,PDAC和HCC,这可能是早期发现的潜在指标。已经验证了PDAC特定的口腔微生物模式作为PDAC生物标志物。两种口腔细菌物种长奈瑟菌Neisseria elongata 和 轻型链球菌Streptococcus mitis
同时富集可以将PDAC患者与健康受试者区分开来。
口腔微生物分析的情况下,所述样品可从棉拭取,唾液和口腔冲洗获得。与肠道菌群的采样方法相比,无论健康状况如何,口腔菌群的收集实际上更为方便和可用,没有任何侵袭或卫生问题。因此,结合肠道微生物组,口腔微生物组还提供了作为诊断/预后工具以及治疗靶标的可行优点。
未来我们谷禾也将考虑口腔和肠道微生物组的相结合,结合口腔和肠道微生物组数据可以显着提高预测和检测息肉和/或肿瘤的敏感性。尽管揭示微生物组与疾病之间的因果关系具有挑战性。
参考文献:
Zhang, Z.; Yang, J.; Feng, Q.; Chen, B.; Li, M.; Liang, C.; Li, M.; Li, Z.; Xu, Q.; Zhang, L.; et al. Compositional and Functional Analysis of the Microbiome in Tissue and Saliva of Oral Squamous Cell Carcinoma. Front. Microbiol. 2019, 10, 1439
Wypych, T.P.; Wickramasinghe, L.C.; Marsland, B.J. The influence of the microbiome on respiratory health. Nat. Immunol. 2019, 20, 1279–1290
Park Se-Young,Hwang Byeong-Oh,Lim Mihwa et al. Oral-Gut Microbiome Axis in Gastrointestinal Disease and Cancer.[J] .Cancers (Basel), 2021, 13
Bathini, P.; Foucras, S.; Dupanloup, I.; Imeri, H.; Perna, A.; Berruex, J.L.; Doucey, M.A.; Annoni, J.M.; Auber Alberi, L. Classifying dementia progression using microbial profiling of saliva. Alzheimers Dement. 2020, 12, e12000.
Seedorf, H.; Griffin, N.W.; Ridaura, V.K.; Reyes, A.; Cheng, J.; Rey, F.E.; Smith, M.I.; Simon, G.M.; Scheffrahn, R.H.; Woebken, D.; et al. Bacteria from diverse habitats colonize and compete in the mouse gut. Cell 2014, 159, 253–266.