-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

2021年6月份,我们分享过一篇“全面认识——肺炎克雷伯菌(Klebsiella pneumoniae) ”的文章,当时也是发现该菌在肠道的人群检出率较高,基于想全面了解该菌,我们查阅整理了很多资料,包括统计了谷禾健康数据库中肺炎克雷伯菌的检出率等,向大家介绍了关于该菌的基本知识,人群分布,感染的症状,分类及来源,传播和易感因素,诊断方法以及治疗及预防。
本文我们要介绍的产气克雷伯菌(Klebsiella aerogenes),是肺炎克雷伯菌(Klebsiella pneumoniae) 的近源菌种,该菌是最近更名的,原来是叫产气肠杆菌。
革兰氏阴性菌的肠杆菌科(Enterobacterales)最初分为三个属:埃希氏菌属(Escherichia)、气杆菌属(Aerobacter)、克雷伯氏菌属(Klebsiella);其中气杆菌属包括A. aerogenes 和阴沟肠杆菌(A. cloacae)。
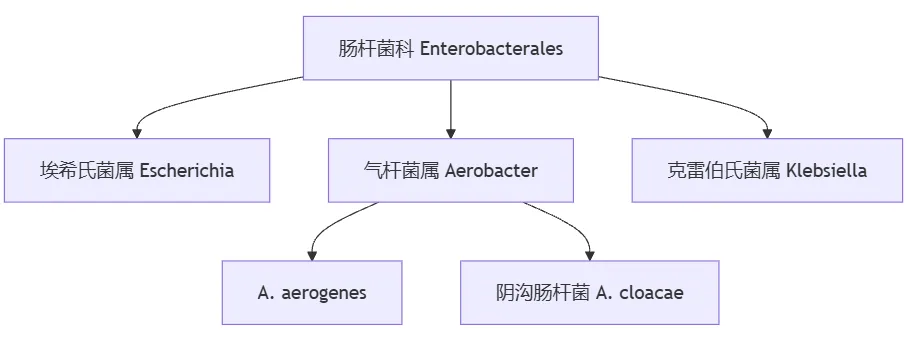
到 1960 年,Aerobacter 已被重新命名为肠杆菌属(Enterobacter)。最近,基于全基因组序列的比较细菌系统发育学表明,产气肠杆菌(E.aerogenes)与肺炎克雷伯菌(K.pneumoniae)的亲缘关系比与肠杆菌属的关系更密切。因此,以前称为产气肠杆菌的细菌更名为产气克雷伯菌(K.aerogenes)。
使用平均核苷酸同一性(ANI)将肠杆菌属的其余成员分为 22 个不同的系统发育组。这 22 个系统发育组统称为阴沟肠杆菌复合体(Ecc)。尽管细菌比较基因组学已经证明产气克雷伯菌和 Ecc 属于不同的系统发育组,但这些遗传差异的临床影响尚不清楚。
本文简单介绍和认识下产气克雷伯菌(K. aerogens) 的作为机会病原体的一些发现,其他着重分享一个有意思的研究结果,即肠道产气克雷伯菌产生高组胺,诱发IBS患者腹痛的证据,原因和干预建议。
K. aerogens
基本特征与临床意义
产气克雷伯菌(K.aerogens),属于肠杆菌科,是一种兼性革兰阴性厌氧菌。它广泛分布于环境中,存在于人体胃肠道中,也是医院常见的机会性病原体。当宿主免疫系统受损或肠粘膜受损时,可能导致呼吸系统、循环系统或泌尿生殖系统感染。
近年来,尽管关于大肠埃希菌和肺炎克雷伯菌的致病性和耐药性的报道越来越多,但关于产气克雷伯菌的报道很少。 既往关于该细菌的临床报告主要为呼吸道、胃肠道、泌尿道和血液感染。与其他肠杆菌科物种相比,产气克雷伯菌更容易导致患者感染性休克甚至死亡。
致病机制与毒力因子
与其他肠杆菌科病原体一样,克雷伯菌的毒力和耐药性很复杂,并受多种因素影响。产生的毒力因子和耐药基因可能因感染部位而异。
克雷伯菌产生的粘附素有助于其进入宿主细胞,细胞表面的荚膜多糖和脂多糖帮助细菌从吞噬作用中逃脱,而毒素或其他细胞外成分则引起粘膜损伤并通过循环传播。
耐药性与治疗策略
近年来,由于抗生素的过度使用,越来越多的克雷伯菌种出现了多药耐药性。不断有报道称,这种新兴病原体的爆发频率很高,其中一些与高死亡率有关,在世界各地的不同临床环境中,例如新生儿、老年和重症监护病房。
根据药敏试验结果表明,产气克雷伯菌分离株是对碳青霉烯类的非耐药细菌,对作为抗感染治疗的美罗培南特别敏感。此外,分离的产气克雷伯菌在亚胺培南中处于中间位置。然而,他们被发现对青霉素耐药,例如氨苄西林和阿莫西林。
一般克雷伯菌相关感染发展迅速,导致多器官衰竭甚至死亡,容易出现耐药菌株。因此,应尽早选择有效的抗生素,并确定剂量和疗程,以尽量减少副作用的发生。
本文主要的分享是基于基于目前发表于科学转化医学《Science Translational Medicine》上的一项有趣的研究,结合谷禾肠道菌群的检测实践检验综合分享。
先说该研究的主要结论:
1. 发现肠道细菌生产的组胺,可以诱发一部分 IBS 患者的腹痛
2. 确定了产气克雷伯氏菌是肠道组胺的主要产生者
组胺可以由许多细菌分泌,但到现在,导致肠道中组胺过量产生的特定微生物一直是个谜。
组胺是免疫细胞释放并参与局部免疫反应的化合物。它也是已知的疼痛介质。近年来,组胺与肠易激综合征(IBS)的关系越来越密切。人们还认为,“组胺不耐受”的各种症状特征可能是由于肠道中组胺分泌过多,压倒了身体分解和代谢组胺的能力。
在本文中,谷禾将带大家了解这些新发现并讨论其影响。首先,简单介绍一下背景知识,解释一下这项最新研究的动机。
一般低 FODMAP 饮食可减少 IBS 患者的尿液组胺。
低 FODMAP 饮食长期以来一直被认为能够帮助缓解 IBS 患者的症状。然而,这些碳水化合物加重肠道症状的确切机制尚不清楚。
2017 年,加拿大麦克马斯特大学的一组研究人员随机分配 IBS 患者食用低或高 FODMAP 饮食。饮食干预后,测量了尿液中的各种代谢物,发现,大约 1/3 的 IBS 患者在基线时尿组胺水平较高,而在低 FODMAP 饮食后,尿组胺水平降低了 8 倍。
饮食–微生物群相互作用导致肠道敏感性增加
基于他们最新研究的这些发现,研究人员将一名尿组胺含量高的 IBS 患者,一名尿组胺含量低的 IBS 患者,一名健康的对照受试者的肠道微生物群移植到三组独立的无菌小鼠中。
经过一段时间的定植期后,让微生物群在小鼠中扎根,它们进一步将每组小鼠一分为二,以接受低或高可发酵碳水化合物饮食。
结果发现只有用高尿组胺的 IBS 患者的微生物群定植并喂食高可发酵碳水化合物饮食的小鼠组增加了肠道敏感性。
产气克雷伯菌是IBS患者的主要组胺产生者
然后,研究人员回去更仔细地分析供体的粪便。尿组胺含量高的 IBS 患者的肠道微生物组产生组胺明显更多。他们着手确定哪些微生物可能是罪魁祸首。
研究人员总共分离了 164 种不同的肠道微生物,并测试了它们产生组胺的能力。
作者报告说:
在尿组胺水平高的 IBS 患者中,产气克雷伯菌是主要的组胺产生者。事实上, 产气菌产生的组胺比任何其他细菌分离物多 100 倍。
在 IBS 患者和低尿组胺患者中,屎肠球菌(Enterococcus faecium)和粪肠球菌(Enterococcus faecalis)是组胺的主要产生者。
但该论文没有包括测试的细菌及其产生组胺的能力的完整列表。例如,以前的研究强调Morganellamorganii、Raoultella planticola、 Raoultella ornithinolytica是肠道组胺的潜在生产者,但在结果或讨论中没有提到这种微生物。
在选择测试的微生物时,其他组胺生产者(也许是那些不太容易培养的)也完全有可能被遗漏。尽管如此,产气克雷伯菌(K.aerogenes) 在 IBS 患者的三个不同队列中含量很高,并且在低 FODMAP 饮食中减少。此外,用产气克雷伯菌定植的无菌小鼠产生的组胺是用另一种克雷伯氏菌定植的小鼠的 77 倍。
pH值很重要:为什么结肠酸度必不可少?
产气克雷伯菌是如何产生组胺的呢?查阅发现该菌使用一种称为组胺脱羧酶(HDC)的酶。HDC酶将组氨酸(饮食中的一种必需氨基酸)转化为组胺。(谷禾以前文章可以关注看下)
由于以前的研究发现这种酶的活性受 pH 值的影响,研究人员决定测试产气克雷伯菌产生的组胺是否取决于环境的酸度。
产气克雷伯菌在pH值为7.0时产生最多的组胺,而在pH值低于6.0或高于8.0时几乎没有组胺。
应该这是关键,因为结肠的 pH 值在 5.5 到 7.5 之间,具体取决于发酵水平。pH 值处于此范围的下限通常与更好的预防症状有关。换句话说,降低结肠的 pH 值(增加其酸度)可能是减少产气克雷伯菌产生肠道组胺的一种方法。
乳酸杆菌:一种防止克雷伯氏菌的方法
结肠 pH 值的主要决定因素之一是乳酸水平。当研究人员查看“人源化”小鼠的肠道样本时,他们发现从尿组胺含量高的 IBS 患者那里获得微生物群的小鼠的乳酸水平要低得多。与此同时,乳酸杆菌等产乳酸菌的水平较低。
为了进一步检查这种关系,研究人员培养了有或没有乳酸杆菌混合物的产气克雷伯菌。正如预期的那样,乳酸杆菌减少了组胺的产生,该实验室还在小鼠模型中证实了这些结果。
但本研究中使用的两种乳酸杆菌没有得到很好的表征。第一种是动物乳杆菌(L.animalis) 或鼠乳杆菌(L.murinus)的菌株,而第二种与嗜酸乳杆菌 (L.acidophilus) 和乳酸乳杆菌(L.lactis) 的关系更密切。
尽管如此,这表明一些乳酸杆菌可以调节产气克雷伯菌产生组胺,很可能是通过产生乳酸,从而降低pH值和组胺脱羧酶的活性。
但是要注意,许多乳酸杆菌对于有组胺不耐受或肥大细胞活化症状的人来说可能也是有问题的。稍后会详细介绍。
到目前为止,我们一直在谈论结肠中的克雷伯氏菌活动。但是小肠中的克雷伯氏菌呢?
小肠中的克雷伯氏菌
虽然一般小肠通常不会含有太多克雷伯氏菌,但至少有一项研究表明,克雷伯氏菌在有胃肠道症状的个体的十二指肠(小肠的上三分之一)中更为普遍,且它们可以破坏整体小肠微生物群结构。
初步证据表明,其中一些克雷伯氏菌可能起源于口腔。换句话说,唾液可能成为克雷伯氏菌持续传播到肠道的储存库,如果肠道环境允许,它们有机会将在那里蓬勃发展。
小肠部分的酸性也比结肠低得多。回肠(小肠最远端的部分)的 pH 值高达 7.4-7.8,这个水平可以支持产气克雷伯菌产生组胺。
也许小肠中产气克雷伯菌的机会性过度生长可能导致总体高水平的组胺。
细菌组胺将肥大细胞吸引到肠道
研究人员再次转向小鼠,以确定细菌组胺如何引起内脏疼痛。
他们发现细菌组胺通过组胺H4 受体发出信号,激活肥大细胞并将其吸引到结肠。这些肥大细胞贡献了更多的组胺和其他疼痛信号分子,触发肠道中的神经细胞并引起腹痛(详细可以看谷禾以前关于组胺的文章)。
因此,阻断 H4 受体可能代表了一种减轻高组胺患者症状的策略。这将防止肥大细胞募集到结肠和宿主产生额外的组胺。
如何检测细菌性组胺相关 IBS?
说到这,大家最感兴趣的应该如何知道你是否属于 IBS 患者的特定亚群呢?虽然需要更多的研究来准确定义此类 IBS 的特征,但指标可能包括:
有哪些干预措施?
以下我们整理了一些可能对患有这一特定 IBS 的人有帮助的潜在干预措施建议。(注意:此信息不应被视为医疗建议)。
低 FODMAP 饮食:低可发酵低聚糖、双糖、单糖和多元醇(FODMAP) 的饮食可以迅速降低肠道组胺水平,减少产气克雷伯菌的丰度,并暂时缓解腹痛。
恢复肠道酸度:较低的 pH 值被证明可以显著减少产气克雷伯菌产生的组胺。
以下可能对增加肠道酸度最有效,但组胺敏感个体可能无法耐受;仅在耐受性良好的情况下使用:
组胺敏感个体可能耐受性更好的其他干预措施:
1)肠道微生物群是组胺的重要来源:虽然传统上肥大细胞被认为是组胺的主要来源,但研究结果表明肠道微生物群是一个重要的来源。
2)产气克雷伯菌(Klebsiella aerogenes, K. aerogenes) 是 IBS 患者组胺升高的主要生产菌。产气克雷伯菌可以在肠道中募集和激活肥大细胞,导致腹痛,也可能参与以高组胺水平为特征的其他疾病,但需要更多的研究。
3)对于一部分组胺水平较高的肠易激综合征(IBS)患者来说,通过靶向治疗降低体内产气克雷伯菌的水平,可能会带来临床症状的改善。 产气菌或抑制组胺信号传导:将产气克雷伯菌或具有类似 HDC 活性的细菌鉴定为肠道中组胺的来源,可以指导饮食推荐、微生物群定向疗法或在患有慢性腹痛的 IBS 患者中使用H4 受体拮抗剂。
本文内容仅供学习和交流目的,不构成任何形式的医疗建议。
主要参考文献
De Palma, G. et al. Histamine production by the gut microbiota induces visceral hyperalgesia through histamine 4 receptor signaling in mice. Science Translational Medicine 14, eabj1895 (2022).
McIntosh, K. et al. FODMAPs alter symptoms and the metabolome of patients with IBS: a randomised controlled trial. Gut 66, 1241–1251 (2017).
Barcik, W. et al. Bacterial secretion of histamine within the gut influences immune responses within the lung. Allergy 74, 899–909 (2019).
Barcik, W. et al. Histamine-secreting microbes are increased in the gut of adult asthma patients. Journal of Allergy and Clinical Immunology 138, 1491-1494.e7 (2016).
Lucy et al. The gut bacteria that produce histamine in IBS – revealed. Lucymailing. 2022.
Barlow, J. T. et al. Quantitative sequencing clarifies the role of disruptor taxa, oral microbiota, and strict anaerobes in the human small-intestine microbiome. Microbiome 9, 214 (2021).
Atarashi, K. et al. Ectopic colonization of oral bacteria in the intestine drives TH1 cell induction and inflammation. Science 358, 359–365 (2017).
Koziolek, M. et al. Investigation of pH and Temperature Profiles in the GI Tract of Fasted Human Subjects Using the Intellicap(®) System. J Pharm Sci 104, 2855–2863 (2015).
Wesevich A, Sutton G, Ruffin F, Park LP, Fouts DE, Fowler VG Jr, Thaden JT. Newly Named Klebsiella aerogenes (formerly Enterobacter aerogenes) Is Associated with Poor Clinical Outcomes Relative to Other Enterobacter Species in Patients with Bloodstream Infection. J Clin Microbiol. 2020 Aug 24;58(9):e00582-20.
Gu, H., Cai, Q., Dai, X. et al. A case report of Klebsiella aerogenes-caused lumbar spine infection identified by metagenome next-generation sequencing. BMC Infect Dis 22, 616 (2022).
Morgado, S., Fonseca, É., Freitas, F. et al. In-depth analysis of Klebsiella aerogenes resistome, virulome and plasmidome worldwide. Sci Rep 14, 6538 (2024).
Niedzielin, K., Kordecki, H. & Birkenfeld, B. A controlled, double-blind, randomized study on the efficacy of Lactobacillus plantarum 299V in patients with irritable bowel syndrome. Eur J Gastroenterol Hepatol 13, 1143–1147 (2001).
Arellano, K. et al. Safety Evaluation and Whole-Genome Annotation of Lactobacillus plantarum Strains from Different Sources with Special Focus on Isolates from Green Tea. Probiotics Antimicrob Proteins 12, 1057–1070 (2020).
Shen, F. et al. Vinegar Treatment Prevents the Development of Murine Experimental Colitis via Inhibition of Inflammation and Apoptosis. J. Agric. Food Chem. 64, 1111–1121 (2016).
Wang, C. C. et al. Sodium butyrate enhances intestinal integrity, inhibits mast cell activation, inflammatory mediator production and JNK signaling pathway in weaned pigs. Innate Immun 24, 40–46 (2018).
Diakos, C. et al. n-Butyrate inhibits Jun NH(2)-terminal kinase activation and cytokine transcription in mast cells. Biochem Biophys Res Commun 349, 863–868 (2006).
Lewis, S. J. & Heaton, K. W. Increasing butyrate concentration in the distal colon by accelerating intestinal transit. Gut 41, 245–251 (1997).
Paulose, J. K., Wright, J. M., Patel, A. G. & Cassone, V. M. Human Gut Bacteria Are Sensitive to Melatonin and Express Endogenous Circadian Rhythmicity. PLOS ONE 11, e0146643 (2016).
Yang, C.-C. et al. Quercetin inhibits histamine-induced calcium influx in human keratinocyte via histamine H4 receptors. International Immunopharmacology 96, 107620 (2021).