-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

▶ 某天,10岁的豆豆开始感到奇怪,左半身隐约有些麻木,使不上劲儿,还有些“抽搐”的感觉。她的病是逐渐发作的,直到有一天在上学路上摔倒了。这时候家长意识到不对劲,豆豆说她不能运动,不能跳舞…
儿科医生怀疑她有神经系统问题,经过核磁共振扫描等系列检测,豆豆最后被确诊为“烟雾病”。
▶ 一名37岁男性,因突发性右臂无力和持续30分钟的言语停止而就诊,医生对他进行了头部CT、脑血管造影、脑数字减影血管造影检查,结果显示双侧颅内血管病变累及前循环左侧大于右侧,与烟雾病的发展最为一致…
烟雾病是一种慢性脑血管病,临床表现包括缺血性和/或出血性卒中和认知障碍,儿童和成人均可发生,因此导致残疾和死亡的发生率较高。
烟雾病的主要特征是供应大脑前部的主要动脉发生进行性狭窄,包括颈内动脉及其分支。这种狭窄导致大脑的血液供应逐渐减少,进而促使大脑发展出代偿机制以防止缺血。
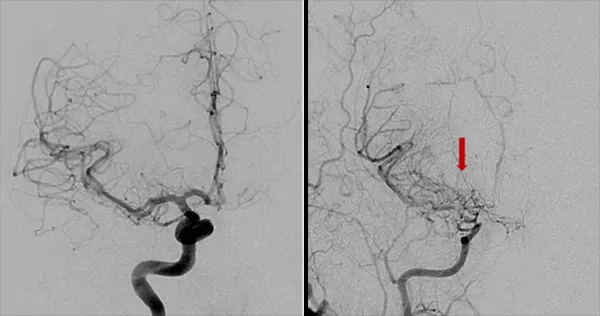
这些代偿机制之一是侧支循环的形成,即附近的血管生成小分支来供应血液不足的区域。在脑血管造影中,这些侧支血管形成的异常血管网状结构呈现出一种模糊的特征,类似于烟雾,因此这种疾病被形象地命名为“烟雾病”,在日语中的意思为“一股烟”。
尽管侧支循环能在短期内增加血液供应,但它们也容易破裂,限制血液流向大脑,从而增加患者中风的风险。
大约10-15%的病例是家族性的,表明有很强的遗传成分。有几个基因与此有关,包括RNF 213,这在东亚人群中特别常见。
环境因素也可能与烟雾病的发展有关,感染,自身免疫性疾病和辐射暴露可能会引发易感个体的疾病。
免疫炎症方面,全身免疫炎症指数(SII)、转化生长因子-β(TGF-β)等多个炎症标志物在烟雾病患者中显著升高。微生物组研究显示,活泼瘤胃球菌(Ruminococcus gnavus)丰度升高与烟雾病风险增加约10倍相关,而双歧杆菌等有益菌群显著减少。此外,血浆代谢物分析发现鸟氨酸水平升高与成人烟雾病风险显著相关。
本文我们来详细了解一下烟雾病的基本特征、临床表现和人群分布特点,包括该病的危险因素识别和发病机制研究进展,以及与肠道菌群的关联,同时也涵盖了一些常见的诊疗策略。
烟雾病(Moyamoya Disease,简称MMD)是一种罕见的慢性脑血管疾病。当医生们在进行脑血管造影检查时,发现患者脑底部形成的异常血管网在影像上呈现出袅袅升起的烟雾状,因此得名。
烟雾病症状通常出现在儿童或中年,包括中风,头痛和癫痫发作。这种情况及其症状在儿童中的进展速度比成人快。
突发症状
症状之一是典型的中风,它会引起广泛的神经系统症状,包括:
渐进性症状
一些患有烟雾病的儿童和成人的症状是逐渐出现的,然后随着时间的推移而变得更糟。这些症状包括:
烟雾病症状按照引起的原因可分为:
缺血症状
症状通常取决于哪一个大脑区域缺血(例如,额叶、顶叶、颞叶)。常见症状包括轻偏瘫、失语、认知障碍、癫痫发作、晕厥、视力缺陷等。缺血性症状可能是短暂的(TIA)或永久性的(中风),并且通常在儿童中由过度换气(例如,哭泣,运动),脱水或劳累引起。
颅内出血
临床症状根据出血部位而不同,出血部位可以是脑室内、脑实质内或蛛网膜下腔。出血可归因于脆弱的侧支血管破裂,在某些情况下也可能由烟雾病相关的微动脉瘤引起。
在所有年龄组中,缺血(TIA或中风)是烟雾病最常见的表现,但成人出现颅内出血的可能性是儿童的7倍,这可能是由于成人血压较高时微小烟雾病血管破裂所致。
烟雾病症状最常见于5~10岁的儿童和30~50岁的成年人。
烟雾病在全球范围内呈现出显著的地域性分布特征,其中亚洲地区,特别是东亚国家的发病率最高。
在美国,缺血性症状是成人和儿童的主要表现,尽管成人发生颅内出血的可能性仍然是儿童的7倍(20% vs 2.8%)。相比之下,亚洲人群中出现出血的成年人比例(42%)远高于居住在美国的亚裔人群。
在日本的流行病学研究中显示:
在韩国也观察到上升趋势,年发病率从2007年的每10万居民1.7例增加到2013年的每10万居民4.3例。
在美国2002年至2008年全国住院患者样本的一项研究表明:
在中国烟雾病的流行病学研究,纳入了2016年~2018年期间来自 1312 家医院的 47443例新发患者,共 69680例住院记录。
在亚洲国家,大约10-30%的烟雾病病例有遗传原因。
家族史:
基因突变:
RNF 213是一种与颅内大动脉狭窄/闭塞相关的锌环指蛋白,RNF 213的突变可能会影响与血管生成和免疫活性相关的信号传导过程相关的一些微RNA和蛋白质的表达,这些信号传导过程是烟雾病病理和进展的基础。
性别:女性发病率显著高于男性
年龄:呈双峰分布;
第一个高峰在5-10岁;第二个高峰在30-50岁
种族:
放射治疗
在因脑瘤而暴露于颅辐射的患者中,烟雾病血管病变的发生率报告为2%-4.3%;
在接受视神经胶质瘤放射治疗的神经纤维瘤病1型患者中,发病率可高达60%。
感染相关
烟雾病血管病变的另一个非遗传性触发因素是感染,如钩端螺旋体病和HIV感染。
水痘带状疱疹病毒感染引起了人们的注意,因为它常发生可逆性动脉病,称为短暂性脑动脉病(TCA)或局灶性脑动脉病(FCA),有时会发展为烟雾病。
一名20岁女性在成功治疗肺炎链球菌脑膜炎后出现进行性血管病变。在她感染后的八个月内,血管造影显示出烟雾综合征的外观。
社会经济因素
低收入人群风险较高,这可能与医疗资源获取、生活方式等多个因素有关。
城市生活环境,这可能与城市环境中的压力因素、环境污染等因素有关。
多种基础疾病可能增加烟雾病的发病风险:
理解这些危险因素对于疾病的预防、早期诊断和治疗具有重要意义。特别是对于具有多个危险因素的人群,应当进行更密切的监测和随访。同时,某些危险因素(如环境因素)是可以调控的,这为疾病的预防提供了可能的干预靶点。
目前已经研究了烟雾病的流行病学、临床特征等,但对其病因和进展知之甚少。研究表明,烟雾病可能与免疫、炎症、微生物组等有关。
1993年,6例烟雾病患者的研究显示,在主要由平滑肌细胞组成的Willis环中,增厚的动脉内膜中有巨噬细胞和T细胞浸润。这为免疫系统和炎症参与烟雾病的病理生理学提供了见解。
慢性炎症可损伤血管壁并引起微血栓,导致缺血性卒中。此外,由细胞因子的异常分泌形成的促炎环境也可能刺激内皮细胞和巨噬细胞的活化、平滑肌细胞的增殖和新血管形成。
一项前瞻性研究表明,与健康对照(HC)相比,烟雾病患者的循环Treg和Th17细胞显著升高。
巨噬细胞
烟雾病患者中M2型巨噬细胞标记物sCD163的高表达,表明巨噬细胞可能在烟雾病的进展中发挥作用。
烟雾病患者中哪些细胞因子水平发生变化?
转化生长因子-β(TGF-β)是促炎细胞因子之一,能够调节多种细胞功能,如增殖、分化和迁移。研究发现,烟雾病患者的外周TGF-β水平增加,并与铃木分期烟雾病呈正相关。TGF-β的增加表达可能诱导大量细胞外基质产生,并伴有正常猪动脉的内膜和中膜增生。
同样,烟雾病患者的血清IL-1β、TNF-α、IL-12水平也高于年龄和性别匹配的健康个体,血清中VIP、CCK、SST水平显著降低;这些水平也与这些受试者的脑脊液(CSF)中检测到的水平相关。
烟雾病患者免疫炎症标志物的比较与评估
一项对154例烟雾病患者(MMD组)和321例年龄、性别匹配的健康体检者(对照组)进行的回顾性病例对照研究,烟雾病组的全身免疫炎症指数(SII)、中性粒细胞与淋巴细胞比率(NLR)和血小板与淋巴细胞比率(PLR)值均显著高于对照组[分别为754 ± 499 vs.411 ± 205(P< 0.001),2.83 ± 1.98 vs.1.81 ± 0.72(P< 0.001)和152 ± 64 vs.120 ± 42(P< 0.001)]。
SII是一种新型、经济的生物标志物,能够反映炎症和免疫反应之间的平衡状态,ROC曲线分析显示SII的AUC为0.76,优于NLR(0.69)和PLR(0.66),可能是烟雾病患者炎症状态的可靠指标,特别是在评估疾病活动性和预测并发症风险方面具有潜在应用价值。
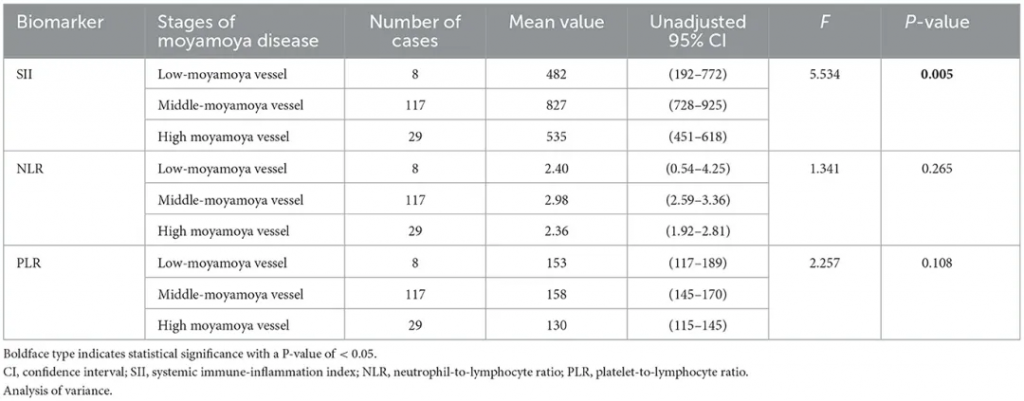
从免疫炎症的角度,中间阶段烟雾血管群的免疫炎症状态可能变得更加活跃,这一发现似乎意味着铃木阶段的III期和IV期烟雾病患者更容易患中风。 这可为外科手术时机的选择提供参考。
烟雾病与自身免疫疾病有何关联?
烟雾病与某些自身免疫性疾病的共存,促使研究者探索免疫调节紊乱和免疫蛋白异常表达在烟雾病进展中的机制。
Yanagawa等人报告了一例烟雾病患者,其类风湿因子和髓过氧化物酶-抗中性粒细胞胞质抗体的检测结果为阳性。蛋白质阵列数据分析和生物信息学分析帮助鉴定了165种在烟雾病患者血清中显著过表达的自身抗体,这些抗体与翻译后修饰、炎症反应和DNA损伤修复及维护相关。
免疫复合物沉积导致的血管损伤
在烟雾病患者中发现的IgG和IgM沉积可能导致主要脑血管及其分支的内弹性层退化、迂曲和破裂。
在15例烟雾病病例的尸检中发现,内弹性板下以及颈内动脉和大脑前动脉及中动脉中发现了IgG和IgM的沉积。免疫复合物的沉积可能导致中膜平滑肌细胞大量迁移到内皮下,导致内膜增厚和血管腔狭窄。
内皮祖细胞(EPCs)在肿瘤血管生成、缺血组织的血管生成、维持血管稳态以及胚胎期血管发育中发挥作用。
烟雾病患者中EPCs水平的变化
研究发现,烟雾病患者的循环EPCs水平高于动脉粥样硬化性脑血管疾病患者和健康对照组。特别是在有造影显示的烟雾血管的患者中观察到这一现象。
EPCs与烟雾病术后恢复的相关性
一项前瞻性临床试验还发现,在116例烟雾病患者中,EPC计数与术后侧支循环良好之间存在显著相关性。然而,看似矛盾的报告发现,一组未接受手术的高加索成年烟雾病患者和一组患有烟雾病的儿童的血液EPCs水平降低。
EPCs功能异常与烟雾病进展
早期EPC具有3种特异性表面标志物:CD34、CD133和血管内皮生长因子受体2(VEGFR-2),而晚期EPC仅表达2种标志物:CD34和VEGFR-2。不同时期的EPCs在烟雾病病理生理过程中可能发挥不同的作用。
一氧化氮(NO)在烟雾病中的作用
一氧化氮(NO)通过与其受体鸟苷酸环化酶(sGC)结合,在烟雾病的血管重塑和血管收缩调节中发挥重要作用。
NO通过NO-sGC-cGMP途径参与多种生理和病理生理活动,包括血管平滑肌重塑和血管收缩调节。L-精氨酸(NO的前体)对小鼠脑小动脉的扩张作用和NO合成抑制剂L-NMMA的收缩作用证实了这一点。
此外,23名烟雾病患者的脑脊液中NO水平显著高于16名非烟雾病患者的对照样本。sGC突变导致的NO信号传导障碍可能导致烟雾病。可以推测,NO水平的变化可能通过扩大侧支循环中的小血管,影响血管平滑肌,促进异常血管网络的形成,但具体机制尚待阐明。
烟雾病患者中Cav-1的作用
在烟雾病患者中,抑制性调节器Cav-1的减少可能对动脉重塑产生负面影响。
Cav-1是NO的抑制性调节因子,在烟雾病患者中被发现减少,体外研究表明Cav-1的下调抑制了内皮细胞的血管生成并诱导平滑肌细胞凋亡,表明其在烟雾病的动脉重塑中起负面作用。
烟雾病患者中细胞因子的变化
烟雾病患者的血浆中细胞因子,包括生长因子和与血管生成相关的细胞因子,显著改变。
烟雾病患者的血浆中细胞因子,包括生长因子如VEGF和PDGF-BB,以及与血管生成相关的细胞因子显著改变。VEGF的表达可由缺氧诱导,被认为是最有效的促血管生成生长因子。研究发现烟雾病患者的血浆中VEGF浓度显著更高。
VEGF在烟雾病进展中的作用
局部脑缺氧可能通过改变VEGF的表达,促进烟雾血管的形成。
在烟雾病的进展中,局部脑缺氧可能引起VEGF表达的变化,这可能有助于烟雾血管的形成。此外,VEGF的受体sVEGFR-1和sVEGFR-2在烟雾病患者中减少,接受间接搭桥手术的烟雾病患者往往有更好的侧支形成,sVEGFR-1和sVEGFR-2水平更低。
MMP-9及其他细胞因子在烟雾病中的作用
作为与血管生成相关的细胞因子,MMP-9靶向胶原IV,通过降解细胞-细胞和细胞-基质接触,破坏内皮基底膜的稳定性,并可能参与破坏血脑屏障。
一些零星的研究报告了烟雾病患者血清或脑脊液中其他细胞因子如bFGF、HGF、PDGF-BB、MCP-1的表达增加。这些细胞因子主要引起内皮细胞的增殖和平滑肌细胞的迁移,导致内膜增生和病理性侧支血管形成。然而,这些细胞因子是否在烟雾病的进展中起启动作用,或者仅仅是中间产物,尚不清楚,需要进一步研究。
血脂异常与烟雾病
肠道菌群
越来越多的证据表明,肠道微生物群是影响宿主代谢和免疫稳态的关键环境成分。肠道微生物组在心脑血管疾病如高血压、动脉粥样硬化和中风中的重要性得到了很多关注。
在这些病症中,由肠道微生物组产生的许多代谢物被吸收到循环系统中,在循环系统中它们被宿主酶进一步加工,导致对靶器官的损伤。
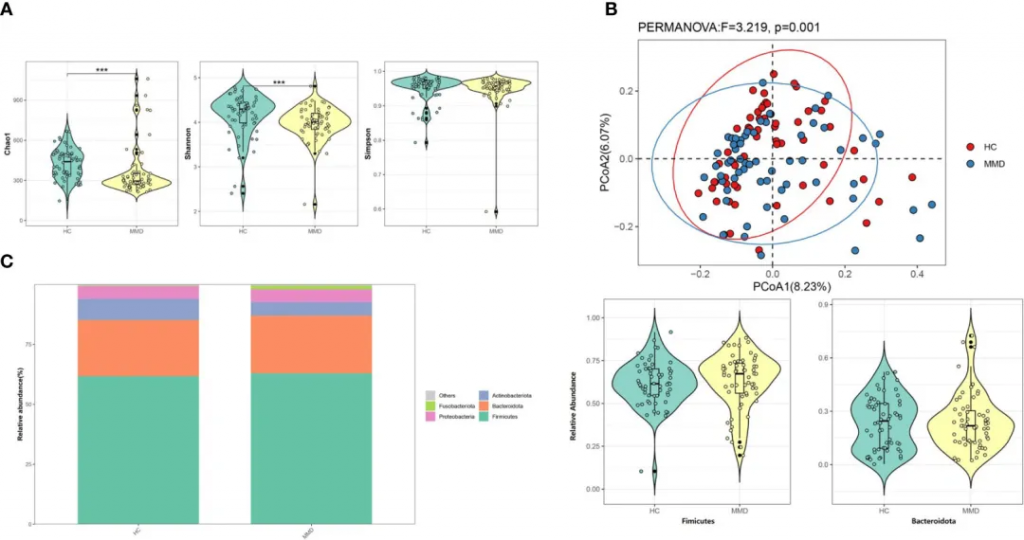
2021-2022年进行的一项前瞻性病例对照研究,纳入2021年6月至2022年5月期间在首都医科大学附属北京天坛医院神经外科就诊的72例烟雾病型脑血管疾病成人患者(年龄≥ 18岁),排除了10名烟雾综合征患者和2名粪便样本不足的患者,也就是60例烟雾病患者vs 60例健康对照,采用16S rRNA测序技术,对烟雾病患者的肠道菌群进行了系统分析。
多样性
研究发现烟雾病组患者的α多样性指数显著降低,具体表现为Shannon指数和Chao 1指数的明显下降。这种多样性的降低,提示烟雾病患者肠道微生态系统的稳定性可能受到影响。同时,通过加权UniFrac距离分析的β多样性也显示出显著差异,表明烟雾病患者的菌群群落结构发生了明显改变。
烟雾病和对照组之间微生物多样性和微生物组组成的比较
doi.org/10.3389/fcimb.2023.1252681
菌群组成
研究发现了以下特征性改变:
门水平的变化
属水平的特征性改变
增加的菌属:
梭杆菌属(Fusobacterium)
梭杆菌属(Fusobacterium)是口腔或结肠中的一种机会性肠道厌氧菌。近年来,许多研究表明梭杆菌通过调节免疫炎症因子参与结直肠癌的生长和进展。此外,梭杆菌可以促进促炎因子和活性氧物质的产生,这可能在慢性炎症中起关键作用。
在该研究中,烟雾病组中梭杆菌的丰度高于HC组。因此,推测梭杆菌介导的慢性炎症可能与烟雾病的发生发展有潜在的关系是合理的。
Lachnoclostridium
与正常人群相比,结直肠癌患者的该菌相对丰度更高。
心脏病患者血浆中的三甲胺-N-氧化物(TMAO)水平越高,其心血管疾病风险就越大,呈现明显的剂量依赖关系。后续研究进一步证实,血液中TMAO水平升高与高血压和高同型半胱氨酸血症的发生率密切相关。
TMAO的形成过程涉及肠道菌群代谢:首先,肠道微生物产生三甲胺(TMA)这一代谢产物,随后TMA在肝脏中经过含黄素的单加氧酶3的作用,转化为TMAO。近期研究发现,Lachnoclostridium能够促进TMA的产生,进而加速动脉粥样硬化的发展。
这一发现与烟雾病的研究产生了联系。既往研究已经表明,血液中同型半胱氨酸水平升高会增加患烟雾病的风险。在本研究中,研究人员观察到烟雾病患者体内Lachnoclostridium的含量明显高于健康对照组。基于这些发现,研究团队提出一个新的假说:Lachnoclostridium可能通过影响同型半胱氨酸的水平,并促进TMAO的产生,参与烟雾病的发病过程。
更值得注意的是,研究还发现在烟雾病患者中,Lachnolostridium属的含量与收缩压(SBP)呈现正相关。这一现象可能也与乳杆菌影响TMAO合成有关,提示乳杆菌的含量可能可以作为预测烟雾病患者血压变化的一个指标。
减少的菌属:
双歧杆菌属(Bifidobacterium)
双歧杆菌是重要的肠道有益微生物。先前的研究已经表明双歧杆菌与血浆TMAO和TMA呈负相关。在该实验中,烟雾病组群具有比HC组群更少的双歧杆菌丰度。如前所述,这种趋势的出现是合乎逻辑的。
肠杆菌属(Enterobacter)
肠杆菌可在人类胃肠道中发挥益生菌作用。在这项研究中,烟雾病患者中肠杆菌属的相对丰度也降低了。
双歧杆菌和肠杆菌对烟雾病的发生、发展可能有拮抗作用。
在临床应用方面,研究者基于4个特征性属建立了预测模型,该模型的ROC曲线下面积达到0.921,显示出良好的诊断价值。这些发现为烟雾病的早期筛查提供新的指标。

一项研究通过分析27例烟雾病患者、7例ICAD患者和15例对照者的粪便样本16S rRNA测序数据,发现烟雾病患者中活泼瘤胃球菌(Ruminococcus gavus)丰度显著升高,而Roseburia inulinivorans丰度显著降低,这两种菌群的变化与疾病风险增加约10倍相关。
活泼瘤胃球菌在烟雾病患者中丰度显著升高,是区分烟雾病和对照的有效生物标志物(AUC=0.81)。
活泼瘤胃球菌 (Ruminococcus gavus)
Ruminococcus gnavus是一种常见的肠道微生物,属于厚壁菌门,R. gnavus在肠道粘膜的粘液层中具有优势,能够降解粘液作为能量来源,并通过产生细菌素来保护和定植。
同时R. gnavus与多种炎症性疾病有关,包括炎症性肠病(IBD)、肠易激综合征(IBS)、湿疹、代谢紊乱和风湿性疾病。
R. gnavus已知能够产生一种炎症性多糖,这种多糖能够激活树突状细胞分泌肿瘤坏死因子-α(TNF-α),并以TLR4依赖的方式增加RNF213的表达。RNF213是一种可能的细菌感染感应器,其功能障碍可能导致病原体清除不足,从而引发持续的炎症,这可能与烟雾病的病理过程有关。
口腔菌群
日本烟雾病患者口腔菌群中弯曲杆菌丰度较高

研究通过对比日本烟雾病患者(未经手术治疗的)(n=16) 与健康人群(n=15)的口腔和肠道微生物组成发现,烟雾病患者口腔中弯曲杆菌的丰度显著高于健康人群。
烟雾病患者的口腔微生物多样性(Chao1指数和观察到的物种)高于健康对照组;两种分析方法(LEfSe和ANCOM-BC)均证实弯曲杆菌在烟雾病患者口腔中显著富集。
弯曲杆菌 (Campylobacter)
弯曲杆菌是一类革兰氏阴性、微需氧的细菌,广泛存在于鸟类、哺乳动物和人类的消化道,要通过粪口途径传播,是全球常见的细菌性腹泻病原体之一。
弯曲杆菌感染主要引起急性胃肠炎,症状包括腹泻(常带血)、腹痛、呕吐、发热和恶心等,大多数感染是自限性的,但免疫力低下的人群(如儿童、老年人和免疫抑制者)可能发展为严重并发症。
感染途径主要包括食用受污染的肉类、乳制品、蔬菜和水果,以及饮用未经处理的水或牛奶。
弯曲杆菌是如何参与烟雾病发病机制的?
在日常口腔卫生实践中,口腔细菌可以短暂地进入血液循环,弯曲杆菌可能通过这种短暂性血源感染到达血管组织,通过血液传播可能激活颅内动脉的免疫反应。
分子机制相互作用:
弯曲杆菌含有脂多糖(LPS),RNF213基因(烟雾病的易感基因)参与细胞内细菌脂多糖的泛素化过程,这种相互作用提示弯曲杆菌可能通过影响RNF213基因功能参与烟雾病发病。
免疫调节作用:
弯曲杆菌能够上调HT-29细胞中的TLR4和MD-2表达,虽然不是血管细胞系,但可通过这一机制调节免疫应答,这种免疫调节作用可能与烟雾病患者颅内动脉病变相关。
炎症反应激活:
这些发现表明弯曲杆菌可能是烟雾病发病机制中的重要环境因素,通过血源性感染、免疫调节、与RNF213基因的相互作用等多重途径参与疾病的发生发展。
一项研究探讨了血浆尿素循环代谢物与成人烟雾病(MMD)风险之间的关系。研究发现,血浆鸟氨酸水平升高与成人烟雾病风险增加显著相关,而精氨酸、尿素和全球精氨酸生物利用度比(GABR)水平升高则与烟雾病风险降低相关。
鸟氨酸是产生脯氨酸、多胺和瓜氨酸的必需结构单元,并且对于控制许多代谢活性至关重要。鸟氨酸与线粒体功能异常有关,可能受到炎症因子的影响。
精氨酸是一种与许多生物过程相关的氨基酸,包括蛋白质合成、免疫反应和一氧化氮的产生,精氨酸可能是缺血性脑血管疾病中的保护因子。具有抗炎效果;产生一氧化氮,帮助血管舒张;有助于预防血小板和白细胞粘附。
这些发现表明,血浆尿素循环代谢物可能是烟雾病风险的潜在生物标志物,有助于疾病的早期诊断,为治疗提供新的思路。当然,未来还需要更多的研究来验证这些发现。
烟雾病的诊断是一个复杂的过程,涉及多种影像学检查方法,以观察脑部血管的异常变化。以下是烟雾病主要的诊断方法:
影像学检查
影像学检查是诊断烟雾病的关键步骤,可以帮助医生观察到脑部血管的异常变化,如颈内动脉狭窄或闭塞,以及异常血管网的形成。
-计算机断层扫描 (CT) 和 CT血管造影 (CTA)
CT可以显示脑部的结构,而CTA可以提供血管的详细图像,帮助识别颈内动脉的狭窄或闭塞。
-磁共振成像(MRI)
MRI能够提供脑部的详细图像,有助于识别烟雾病相关的脑组织变化,如脑缺血或出血。
-磁共振血管造影(MRA)
MRA是一种无创的血管成像技术,可以显示脑部血管的结构和血流情况,对于发现烟雾病的血管异常非常有用。
-数字减影血管造影(DSA)
DSA被认为是诊断烟雾病的“金标准”。通过将造影剂注入血管,并进行X射线成像,DSA可以清晰地显示血管的狭窄、闭塞和异常血管网。
烟雾病有哪些分期?不同分期有什么特点?
铃木分期法是一种根据血管造影结果对烟雾病进行分期的方法,它有助于评估疾病的严重程度和进展。
铃木分期法的六个阶段:
第一阶段(初期):
第二阶段(早期):
第三阶段(中期):
第四阶段(晚期):
第五阶段(末期):
第六阶段(终末期):
以上是铃木分期法,不同分期的烟雾病患者可能需要不同的治疗方法。例如,早期患者可能只需要密切监测,而晚期患者可能需要手术治疗。
3、肠道菌群检测
随着医学研究的深入,肠道菌群检测作为一种新兴的辅助诊断手段,显示出其在烟雾病诊断中的潜力。
肠道菌群检测的优势在于其非侵入性和易操作性。通过分析粪便样本中的微生物组成,可以为烟雾病的诊断提供重要的生物标志物。
烟雾病患者的肠道菌群与健康对照组存在显著差异。通过前瞻性病例对照调查,研究人员发现,烟雾病患者的肠道菌群中,Lachnoclostridium和梭杆菌属(Fusobacterium)的相对丰度增加,而双歧杆菌属和肠杆菌属的相对丰度减少。这一发现揭示了肠道菌群与烟雾病之间的关联,并为无创辅助诊断提供了新的思路。通过识别特定的肠道微生物标志物,医生可以更早地发现烟雾病,从而及时干预,改善患者的预后。
此外,肠道菌群检测的结果还可以与影像学检查相结合,提高诊断的准确性。例如,通过比较肠道菌群检测结果与铃木分期法的分期,临床医生可以更全面地评估患者的病情,制定个性化的治疗方案。
一、传统治疗方案选择
烟雾病的传统治疗主要集中在改善脑部血流,以减少缺血性和出血性卒中的风险。治疗方法包括药物治疗和手术治疗。
药物治疗
抗血小板药物:用于减少血栓形成,如阿司匹林。抗血小板药物治疗的获益和风险需要权衡。
根据2021年美国心脏协会/美国卒中协会(AHA/ASA)指南建议:
2021年日本烟雾病管理指南同样提出:
例如,西洛他唑是一种多效抗血小板药物,它是一种选择性磷酸二酯酶III抑制剂,具有抗血小板、抗血栓形成和血管扩张作用。在一项大型人群研究中,西洛他唑与其他抗血小板药物相比,在新诊断的烟雾病患者中,死亡率下降幅度最大。已成为烟雾病管理的潜在治疗方法。
抗癫痫药物:控制癫痫发作,尤其是在有癫痫症状的患者中。
神经保护剂应用:主要用于改善神经功能,但缺乏大规模随机对照研究证据,临床应用需要个体化考虑。
钙通道阻滞剂:用于缓解由烟雾病引起的头痛,也有研究认为要谨慎使用。
烟雾病血管病变中的头痛治疗
典型地具有偏头痛(>50%伴先兆)或紧张型头痛的特征。烟雾病血管病变中头痛的病理生理机制和最佳治疗尚不确定,但应避免限制血管舒张(降钙素基因相关肽靶向治疗)、增强血管收缩(曲坦类、麦角类)或降低血压(β受体阻滞剂、钙通道阻滞剂)的药物。
一项前瞻性非随机研究中,手术血运重建后使用阿托伐他汀可改善术后数字减影血管造影的侧支循环。
在无烟雾病血管病变的患者中,阿托伐他汀已被证明可降低偏头痛的频率,但这尚未在烟雾病血管病变患者中进行专门评估。
手术治疗
直接血管搭桥手术:将颅外血管直接连接到颅内血管,以改善血流。
间接血管搭桥手术:通过各种方法(如贴敷术)促进新血管形成,增加血流。
二、手术治疗的具体方法
烟雾病的手术治疗旨在通过重建血流来改善脑的血供,减少卒中风险。
直接血运重建
颞浅动脉-大脑中动脉搭桥:将头皮的颞浅动脉直接连接到大脑中动脉,以改善血流,就像新建一条高速公路来绕过交通堵塞。
间接血运重建
在大脑表面铺设血管组织(如肌肉或硬脑膜),随着时间的推移,鼓励新血管生长。这是一个缓慢的过程,但可能是有效的,特别是对儿童。
脑肌血管粘连术:将带血管的肌肉贴附到大脑表面,促进新血管生成。
脑硬脑膜动脉血管粘连术:将硬脑膜及其血管贴附到大脑表面。
这些技术之间的选择取决于各种因素,包括患者的年龄、疾病阶段和整体健康状况。通常,这两种方法的组合用来最大限度地提高成功的机率。
三、微生物组干预策略
近年来,微生物组干预作为一种新兴的治疗策略,开始在烟雾病治疗中受到关注。研究发现,烟雾病患者的肠道菌群与健康人存在显著差异,这可能与炎症和免疫反应有关。
通过调节肠道菌群平衡,可能有助于减轻炎症,改善血管健康。
通过补充双歧杆菌等显著减少的有益菌,改善烟雾病患者的肠道菌群平衡。
通过调整饮食结构,环境因素控制,粪菌移植等方式,促进有益菌群生长,减少可能影响肠道菌群的不利因素。
定期检测关键菌群的相对丰度变化,评估多样性指数及相关菌群变化情况,结合临床症状改善情况进行综合评估。
在这个过程中注意,选择安全性已验证的益生菌,避免过度干预。菌群干预作为综合治疗的组成部分,也可以与其他治疗方案协调,同时指导自我监测要点,制定长期维持计划,保持治疗方案的灵活性,根据患者反应及时调整。
四、危险因素控制
一些因素与预后相关,例如:
其他关于烟雾症的相关问题
应该什么时候看医生?
一些相关的自我判断如下:
如果出现上述任何症状,尤其是当它们突然出现或迅速恶化时,应立即寻求医疗帮助。烟雾病是一种进展性的血管疾病,及时的诊断和治疗对于预防严重并发症至关重要。
需要终身服药吗?
烟雾病是否需要终身服药取决于患者的具体情况。烟雾病的治疗主要以手术为主,药物治疗仅作为辅助手段,并不能从根本上解决问题。
对于无症状或病情较轻的患者,国内和日本的指南通常建议以随访和观察为主,不建议长期用药。
然而,对于有症状或病情较重的患者,可能需要短期或长期使用药物来控制症状,如抗血小板药物、血管扩张剂等,但这些药物并不能完全治愈烟雾病。
请根据病情变化调整用药方案。不建议擅自停药。因为每个病人情况不同,需要个性化的治疗方案,具体用药方案需要遵医嘱。
术后护理和康复是治疗过程的关键组成部分
患者可能需要物理治疗,职业治疗或语言治疗来恢复受疾病或手术干预影响的功能。这是一个需要耐心、毅力和支持性护理的过程。
定期复查的频率是多少?
初诊后未手术患者:
手术后患者:
复查内容可能包括:
以上这些建议仅供参考,具体复查频率和内容需要根据个人情况由专科医生制定,并根据病情变化适时调整。
烟雾病患者在保守治疗与手术治疗之间的选择标准是什么?
手术治疗可以显著改善脑血流,减少症状发作频率和严重程度,防止脑卒中等并发症。然而,手术风险较高,需要医疗团队进行操作。
保守治疗可以有效控制症状,延缓疾病进展,提高患者生活质量,但需要长期坚持,且疗效因人而异。
烟雾病患者在选择保守治疗与手术治疗之间的标准主要取决于病情的严重程度、患者的年龄和健康状况、手术的风险与效果、个人意愿等。
病情严重程度:
轻微或初期烟雾病:对于症状较轻或病变较轻的患者,保守治疗是首选。保守治疗包括药物治疗(如抗血小板药物、血管扩张剂、神经营养药物等)、康复训练、生活方式管理等。
进展性或重度烟雾病:对于病情进展较快或症状较重的患者,手术治疗可能是更好的选择。手术治疗可以改善脑血流,减少症状发作频率和严重程度,防止脑卒中等并发症。
患者年龄和健康状况:
年轻患者:年轻患者身体恢复能力较强,手术治疗可能是更好的选择。
老年患者:老年患者身体承受能力较弱,药物治疗或保守治疗可能更为合适。
有其他严重基础疾病或并发症的患者:可能需要谨慎选择手术治疗,以免加重病情。
长期监测对于烟雾病患者至关重要。定期随访影像学和神经系统评估有助于跟踪疾病进展和干预措施的有效性。
如何预防烟雾病?
保持情绪稳定,避免血压忽高忽低,对脑血管产生不利影响。
避免在生气、哭泣或吹气球时突然过度换气,以防短暂性脑缺血发作。
对于长期伴有睡眠障碍的患者,需要去心理科专科就诊,调节失眠。
控制高血压、糖尿病等慢性疾病,减少对血管的损害。
多吃富含维生素C、E等抗氧化成分的食物,如新鲜蔬果、坚果等,以增强免疫力。
保持适量的体育活动,有助于身体健康和血液循环。
烟雾病作为一种罕见而复杂的脑血管疾病,其发病机制和治疗策略一直是医学界关注的焦点。近年来的研究揭示了肠道菌群与烟雾病之间存在着密切联系,为疾病的诊断和治疗开辟了新的思路。
肠道菌群检测中,基于大数据建立的预测模型显示出良好的辅助诊断价值,这为无创性诊断方法的发展带来了新的希望。微生物组干预作为一种新兴的治疗策略,可能为传统的药物和手术治疗提供有益补充。
然而,我们也应该认识到,目前的研究仍处于探索阶段,需要更多的临床验证来确认这些发现的可靠性和实用性。同时需要多学科的协作努力,将基础研究与临床实践紧密结合,不断推进烟雾病诊疗水平的提升。
谷禾致力于推动肠道菌群与各类疾病之间的机制理解和临床应用,目前正与首都医科大学开展烟雾病患者队列的肠道菌群研究,并在多家医院进行多点临床验证。借助谷禾肠道菌群数据模型促进烟雾病的机理研究以及愈后和药物干预策略的改善。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
He, S., Duan, R., Liu, Z. et al. Characteristics of cognitive impairment in adult asymptomatic moyamoya disease. BMC Neurol 20, 322 (2020).
Hirano, Y.; Miyawaki, S.; Imai, H.; Hongo, H.; Teranishi, Y.; Dofuku, S.; Ishigami, D.; Ohara, K.; Koizumi, S.; Ono, H.; et al. Differences in Clinical Features among Different Onset Patterns in Moyamoya Disease. J. Clin. Med. 2021, 10, 2815.
Bax BE and Pacitti D (2023) Editorial: Biomarkers to evaluate rare diseases. Front. Mol. Med. 3:1237089.
Nguyen VN, Parikh KA, Motiwala M, Erin Miller L, Barats M, Milton C and Khan NR (2022) Surgical techniques and indications for treatment of adult moyamoya disease. Front. Surg. 9:966430.
Takayanagi, K., Kanamori, F., Ishii, K. et al. Higher abundance of Campylobacter in the oral microbiome of Japanese patients with moyamoya disease. Sci Rep 13, 18545 (2023).
Yu X, Ge P, Zhai Y, Liu W, Zhang Q, Ye X, Liu X, Wang R, Zhang Y, Zhao J and Zhang D (2023) Gut microbiota in adults with moyamoya disease: characteristics and biomarker identification. Front. Cell. Infect. Microbiol. 13:1252681.
Liu E, Liu C, Jin L, Zhou H, Tan X, Zhang G, Tao W, Gao X, Zhao H, Luo C, Li X and Yang S (2023) Clinical value of the systemic immune-inflammation index in moyamoya disease. Front. Neurol. 14:1123951.
Mineharu, Y., Nakamura, Y., Sato, N. et al. Increased abundance of Ruminococcus gnavus in gut microbiota is associated with moyamoya disease and non-moyamoya intracranial large artery disease. Sci Rep 12, 20244 (2022).
Zhang X, Xiao W, Zhang Q, Xia D, Gao P, Su J, Yang H, Gao X, Ni W, Lei Y, Gu Y. Progression in Moyamoya Disease: Clinical Features, Neuroimaging Evaluation, and Treatment. Curr Neuropharmacol. 2022;20(2):292-308.
Mineharu Y and Miyamoto S (2021) RNF213 and GUCY1A3 in Moyamoya Disease: Key Regulators of Metabolism, Inflammation, and Vascular Stability. Front. Neurol. 12:687088.
Gonzalez NR, Amin-Hanjani S, Bang OY, Coffey C, Du R, Fierstra J, Fraser JF, Kuroda S, Tietjen GE, Yaghi S; American Heart Association Stroke Council; Council on Cardiovascular and Stroke Nursing; and Council on Clinical Cardiology. Adult Moyamoya Disease and Syndrome: Current Perspectives and Future Directions: A Scientific Statement From the American Heart Association/American Stroke Association. Stroke. 2023 Oct;54(10):e465-e479.
Zhang D, Huang L, Huang Z, Zhou Q, Yang X, Gu H, Li Z, Shi Y, Gan L, Wang H, Ma X, Wang Y, Zhao J. Epidemiology of Moyamoya disease in China: A nationwide hospital-based study. Lancet Reg Health West Pac. 2021 Dec 11;18:100331.
Zhang H, Zheng L, Feng L. Epidemiology, diagnosis and treatment of moyamoya disease. Exp Ther Med. 2019 Mar;17(3):1977-1984.
Ge, P., Yin, Z., Tao, C. et al. Multiomics and blood-based biomarkers of moyamoya disease: protocol of Moyamoya Omics Atlas (MOYAOMICS). Chin Neurosurg Jl 10, 5 (2024).
Han W, Jin F, Zhang H, Yang M, Cui C, Wang C, Jiang P. Association of Brain-Gut Peptides with Inflammatory Cytokines in Moyamoya Disease. Mediators Inflamm. 2020 Apr 28;2020:5847478.