-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

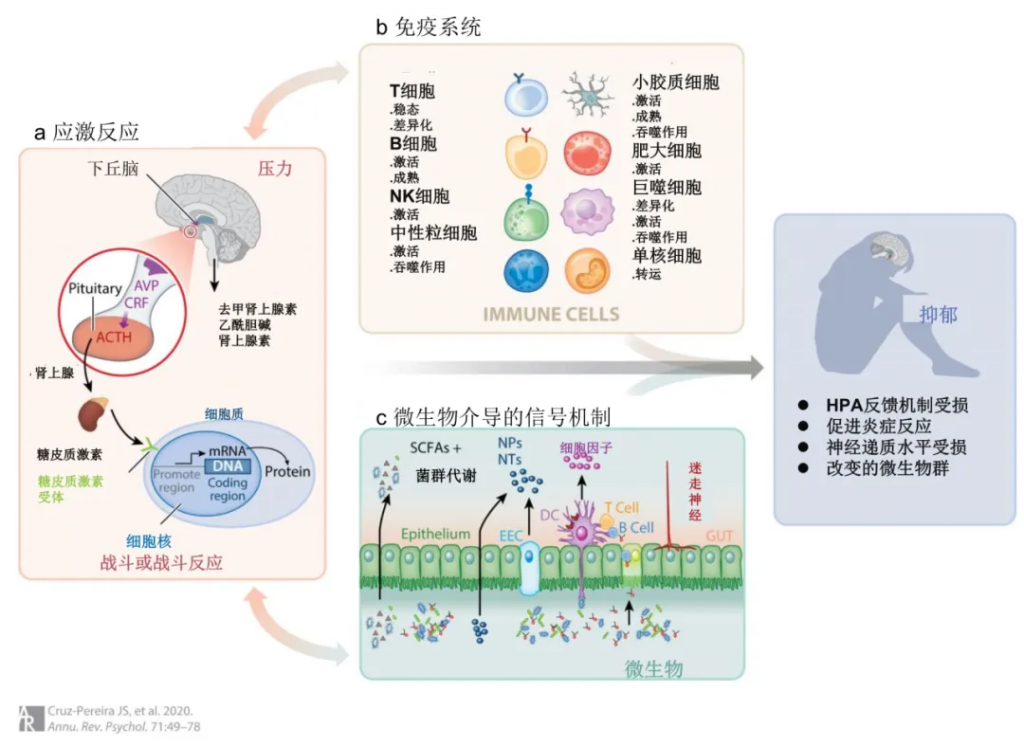
抑郁症仍然是最普遍的精神疾病之一,许多患者对可用的治疗方法反应不足。慢性或早期生活压力是抑郁症的主要风险因素之一。
研究发现清楚地表明,抑郁症是一种复杂的精神疾病,与压力适应不良有着内在的联系,这会导致下丘脑-垂体-肾上腺轴(HPA轴)和免疫系统失调。在过去的几年里,很明显,这种改变的压力和炎症反应会聚集在大脑功能上,从而破坏正常的神经免疫稳态。
与此同时,人们发现肠道微生物群是压力和炎症的关键调节因子,因此它在抑郁症中的作用机理和干预调节机制也越来越清晰。
这三位一体的风险因素如何相互作用以维持大脑和身体的生理稳态尚不完全清楚。

在本文,我们整合了动物和人类研究中关于抑郁症病因和进展中的这三个因素的现有数据。还关注这种微生物群免疫应激基质可能影响集中介导事件的过程,以及可能的治疗干预措施以纠正这三位一体的失衡。
关键词
重度抑郁症(MDD)是一种复杂的使人衰弱的精神疾病,估计约占全球残疾的10%;根据世界卫生组织的数据,它是目前全球残疾的主要原因。
典型症状包括情绪低落、焦虑、快感缺乏和认知障碍,这些症状会严重影响患者的生活质量。尽管在过去几十年中对了解这种疾病的病因、进展和生物学进行了大量投资,但其分子和细胞基础仍然不明确。
目前,人们越来越认准这样一个事实,即抑郁症并不完全影响大脑功能,而是表现为影响几乎所有主要身体系统的全身疾病。
抗抑郁药治疗通常涉及操纵5-羟色胺能和去甲肾上腺素能系统。然而,这些抗抑郁药是次优的,因为它们起效缓慢且有不良副作用,有时会降低患者的依从性,从而限制其疗效。
此外,据估计,大约1/3的MDD患者在一线抗抑郁治疗后进入缓解期。对一种或多种适当的抗抑郁药治疗没有反应,以及适当的治疗持续时间和剂量,被定义为难治性抑郁症,这大大增加了MDD的负担。
认知行为疗法是一种越来越突出的干预措施,它基于这样一个断言,即适应不良的信息处理和不准确的信念为重复的消极思考奠定了基础,在抑郁症中起着至关重要的作用,当受到挑战时,可以导致急性痛苦的减少或防止未来的症状复发。这种策略在临床上被广泛使用,并且已被证明可以在焦虑和精神病中产生神经可塑性和大脑连接的调节。
小编也不太懂认知行为疗法,去专门了解查阅了,以下是对认知行为疗法的具体解释:
认知行为疗法
CBT, Cognitive Behavioral Therapy
基本概念:
认知行为疗法是一种心理治疗方法,它强调我们的想法(认知)如何影响我们的感受和行为。简单来说,就像是帮助人们“重新编程”自己的思维方式。
工作原理:
识别问题:帮助人们发现自己的消极想法模式
挑战想法:学会质疑这些消极想法是否合理
改变行为:通过改变思维方式来改变行为反应
具体举例:
假设遇到这样一个场景:
事件:在公众场合演讲
消极想法:”我一定会搞砸的,大家都会笑话我”
情绪反应:焦虑、恐惧
认知行为疗法介入:帮助分析这种想法是否合理,提供更平衡的思考方式
应用领域:
抑郁症
焦虑障碍
恐慌障碍
社交恐惧
强迫症
创伤后应激障碍
治疗过程:
识别触发因素:找出引起负面情绪的情境
记录想法:记录当时的想法和感受
分析证据:检验这些想法的真实性
寻找替代:学习更健康的思维方式
实践新技能:在日常生活中应用新的认知模式
优势:
实用性强:提供具体的问题解决工具
时间较短:通常12-20次治疗即可见效
效果持久:学到的技能可以终身使用
科学依据:有大量研究支持其有效性
神经可塑性影响:
这种疗法能够:
改变大脑结构
增强神经元之间的连接
促进大脑的适应性变化
帮助形成新的神经通路
通俗来说,认知行为疗法就像是给我们的思维方式做一次“软件更新”,帮助我们用更健康、更理性的方式来看待问题和应对压力。它不仅能帮助我们度过当前的困境,还能预防未来可能出现的问题。
这种疗法特别适合那些经常陷入负面思维循环的人、容易焦虑或抑郁的人、面对压力时感到无助的人、希望提高情绪管理能力的人。需要注意的是,虽然认知行为疗法效果显著,但最好在专业心理治疗师的指导下进行,这样能够获得更好的治疗效果。
人们正在努力了解导致抑郁症的病因因素,希望它们可以被利用以获得治疗益处。
值得注意的三个因素是压力和下丘脑-垂体-肾上腺(HPA)轴、炎症和异常的免疫系统激活,以及最近的肠道微生物组。
抑郁症通常被称为压力相关疾病,而当前的教条是,由负面生活事件引起的压力,包括在早期生活中,会导致这种使人衰弱的疾病的发展、表现和神经发展。
◮ 负面事件引起的压力会促使疾病的发展
这种不利的生活事件被身体视为对其体内平衡的威胁,导致促进适应这些挑战的生理反应——即失落。然而,由于系统(包括HPA轴)的反复过度活动或不活动,这种调整可能对生物体造成巨大的生理成本,导致异体负荷增加,这已被概念化为代表反复压力暴露后身体磨损的生物学影响。
▸ HPA轴和压力
总的来说,压力可以被视为对刺激的必要进化反应,该刺激导致体内战斗或逃跑机制的激活,这对任何生物体的生存都是必不可少的。在哺乳动物中,这种反应是由HPA轴介导的,HPA轴是一种调节对压力的生理反应的负反馈系统。
◮ HPA轴调节对压力的生理反应
在几秒钟到几分钟内,HPA轴的激活使生物体能够通过优先考虑防御行为所必需的功能(如认知和能量供应)而不是与食物相关的生理功能(如消化)来应对威胁。
HPA 轴激活下丘脑室旁核(PVN)中的神经元分泌精氨酸加压素(AVP)和促肾上皮质激素释放因子(CRF),这反过来又促进垂体前叶促肾上腺皮质激素(ACTH)的产生和分泌。因此,ACTH诱导盐皮质激素和糖皮质激素(啮齿动物的皮质酮,人类的皮质醇)从肾上腺皮质产生和分泌到血液中。因此,高水平的皮质醇通过负反馈机制抑制ACTH和CRF的进一步释放,该机制通过皮质醇与垂体、PVN 和海马中的糖皮质激素受体(GR)结合来发挥作用。这导致系统急性激活后恢复到生理状态。
肾上腺皮质释放的糖皮质激素与GR相互作用,GRs不仅在HPA轴内表达,而且在整个身体中表达,包括肠道、免疫细胞和边缘大脑区域,如海马体。在这里,它们充当转录因子并塑造控制对压力的行为反应的神经回路的功能和结构组织。
◮ 抑郁症HPA轴负反馈回路受损
在抑郁症的情况下,HPA轴负反馈回路受损,导致糖皮质激素水平升高时间延长。有趣的是,抑郁症的一些症状,如绝望、睡眠中断以及食欲和体重的变化,都与HPA轴损伤有关,这部分解释了库欣病患者经常观察到的抑郁症状(一种以皮质醇分泌过多为特征的疾病)。
此外,慢性皮质酮治疗或慢性应激会诱导神经元海马萎缩。还值得注意的是,抑郁症会诱导HPA对急性压力的反应发生变化,这是通过特里尔社会压力测试测量的。
此外,临床神经影像学研究显示抑郁症中海马体的体积减少。因此,反复和严重的压力暴露,特别是在神经发育的敏感时期,会促进海马体的重新编程,诱导长期的改变,这些改变可能会决定,通常以性别特异性的方式对未来压力源的反应,可能有助于一些与压力相关的抑郁样表型。
大约一个世纪前,诺贝尔奖获得者 Julius Wagner-Jauregg 观察到,免疫系统的激活(由于接种疟疾)会影响精神功能。然而,心理神经免疫学领域花了几十年的时间才在抑郁症和心身医学的背景下出现。
研究指出,伴随人类感染发作和持续时间的各种心理参数的变化与抑郁症相似,这加强了该领域在抑郁症背景下的重要性。此外,人们越来越意识到患有自身免疫性疾病的个体表现出抑郁症的高发病率。
到1990年初期,很明显,免疫调节信号分子的过度分泌,特别是促炎细胞因子,可能在抑郁症的发生和维持中发挥作用。
▸ 促炎细胞因子与抑郁症
最初报道了白细胞介素6 (IL-6)、干扰素-γ(IFN-γ)和急性期蛋白的血浆浓度增加,现在已确定这些细胞因子和其他细胞因子,特别是肿瘤坏死因子(TNF),在抑郁症患者中升高。这种炎症表型也被认为是抑郁症治疗耐药的重要因素。
该理论促使研究人员研究抗炎化合物的抗抑郁作用,结果表明,TNF拮抗作用尤其能改善具有高基线炎症生物标志物的患者的抑郁症状。
此外,使用干扰素-α(IFN-α)等促炎剂治疗丙型肝炎病毒导致四分之一的患者出现抑郁症状。鉴于许多抗抑郁药物的抗炎作用,神经免疫机制现在被视为抑郁症状发展的核心。
具体的炎症因子在精神疾病中的详细特征可以参考文章:从肠道菌群到炎症因子:读懂疾病的预警信号
近年来,在整体大脑健康的背景下,人们对免疫运输到大脑的细胞机制越来越感兴趣。最初认为中枢神经系统(CNS)在某种程度上与外周免疫系统隔离。
然而,随着证据表明循环细胞因子确实可以影响大脑和行为,研究表明,尽管血脑屏障(BBB)严格调节免疫细胞迁移到中枢神经系统,但外周白细胞可以浸润脑脊髓液(CSF)、脑膜、脉络丛、血管周围间隙,并最终浸润脑实质。
随后,专门的先天免疫哨兵细胞——脉络丛巨噬细胞、血管周围巨噬细胞、肥大细胞、脑膜巨噬细胞和小胶质细胞(CNS常驻巨噬细胞)——在稳态条件下监视CNS,是潜在危险的第一反应者,检测病原体或组织损伤,并触发免疫反应。
此外,最近研究表明,CNS实际上通过淋巴引流系统直接连接到次级颈部淋巴结,该系统可以引起外周免疫反应。
▸ 在压力和抑郁中激活免疫系统
先天免疫系统是抵御感染和压力源的第一道防线,它从出生起就是固有的。就抑郁症的病理生理学而言,首要重要的是先天免疫系统通过产生细胞因子、激活补体级联反应以及随后通过抗原呈递激活适应性免疫系统来募集免疫细胞中的作用。
◮ 抑郁症患者中免疫相关分子浓度增加
研究人员报告称,MDD患者的循环免疫细胞(如单核细胞和粒细胞)水平升高。许多研究还表明,抑郁症患者血清中免疫信号分子(趋化因子和粘附分子,如人巨噬细胞趋化蛋白-1、可溶性细胞内粘附分子-1和E-选择素)以及急性期蛋白和促炎细胞因子,如 IL-6 或促炎因子(如前列腺素)的浓度增加,表明外周免疫系统与抑郁症有关。
同样,在暴露于社交失败压力的动物中,中性粒细胞和巨噬细胞的增加。此外,促炎细胞因子如IL-6 和TNF-α的缺失导致小鼠抑郁样行为的减少。
肥大细胞是参与免疫反应调节和体内平衡支持的先天免疫细胞,它们在过敏和癌症、HIV和结肠炎中起关键作用。此外,在大脑中发现了肥大细胞,它们已被证明在神经炎症、焦虑和塑造与性行为相关的神经发育通路中发挥作用。
它们还被证明通过依赖于色氨酸代谢的过程参与抑郁症。然而,需要进一步的研究来揭示外周先天免疫活性与抑郁症发展之间关系的潜在机制。
扩展阅读:
适应性免疫涉及免疫记忆现象,其中特定的淋巴细胞(T细胞或B细胞)特异性识别独特的决定因素(抗原),以便在第二次和随后与病原体相遇时产生更有效的反应。因此,它是身体对特定病原体做出反应的一种高度特异性的防御机制。
当研究显示抑郁症患者的循环辅助性T细胞(Th) (CD4+)、细胞毒性T细胞(CD8+)和B细胞数量增加时,最初提出了适应性免疫系统在抑郁症病因中的作用。
◮ 抑郁症个体中Th2和Th17等免疫细胞受损
最近报道了抑郁症个体中Th2和Th17细胞成熟受损、多种CD4+ T细胞库减少和B调节细胞减少。同样,动物模型的研究也表明,糖皮质激素和应激暴露会调节T细胞和B细胞反应。
鉴于这些过程中涉及的一些细胞因子与疾病行为的发展有关,在感染的情况下,这代表了一种重要的应对机制——这些分子的长期失衡可以解释恶心、食欲不振、睡眠障碍、疲劳和快感缺乏等症状的发展。
◮ CD8+细胞调节皮质甾酮和行为来响应压力
最近的一项研究报告称,尽管CD4+ T细胞似乎不直接参与对压力的反应,但 CD8+ 细胞毒性T细胞不仅通过调节皮质甾酮和行为反应来响应压力,而且还通过诱导促炎细胞因子的产生,可能通过诱导单核细胞和巨噬细胞来响应应激。
此外,有人提出,在依赖于记忆T细胞的过程中,对自身抗原的免疫记忆可能有助于压力应对机制的发展。
根据应激性损伤的性质和强度,循环中免疫调节剂的增加可能通过从BBB的外周毛细血管内皮细胞释放细胞因子,或通过迷走神经刺激响应外周炎症介质,间接触发神经炎症。
事实上,认知行为疗法已被证明可以有效调节促炎细胞因子(如IL-6和TNF-α)的水平,同时减轻抑郁症状,因此表明不平衡的促炎信号的减少与更好的临床结果有关。
▸ 炎症小体和抑郁症
人们对炎症小体在压力敏感和抑郁中的作用越来越感兴趣。
炎性小体是在骨髓谱系的细胞中产生的蛋白质复合物,作为对病原微生物或所谓的无菌压力源(如心理压力)的反应,产生的蛋白质复合物。
扩展阅读:
◮ 炎症小体会导致促炎细胞因子的激活
炎性小体的组装导致caspase-1的激活,而caspase-1又会裂解 IL-1β 和 IL-18 的前体形式,从而导致这些促炎细胞因子的激活并导致焦亡,这是一种不同于细胞凋亡的程序性细胞死亡形式。
在感染过程中,由特定先天免疫细胞强制执行的首要防御形式之一是在种系中编码的一组模式识别受体(PRR)的呈递,以识别入侵病原体表达的分子模式。这些可能在膜表面,例如Toll样受体(TLR),也可能在细胞质内部,例如Nod样受体(NLR)。
NLR 是胞质受体,能够识别非自身分子和相关细胞损伤,并由病原体相关分子模式(PAMP)和损伤相关分子模式(DAMP)触发。
◮ 抗抑郁治疗可以逆转炎症小体的过表达
NLRP3是NLR的一个亚群,是研究最多的参与 caspase-1 激活的炎性小体;它在小胶质细胞和未分化神经元的 CNS 中表达。啮齿动物研究表明,慢性应激导致 NLRP3 在小胶质细胞中过表达,这可以通过选择性血清素再摄取抑制剂(SSRI)抗抑郁药逆转。
在人类中,在未经治疗的 MDD 患者的外周血细胞中观察到 NLRP3 的过表达,同时血清 IL-1β 和 IL-18 水平升高,这被抗抑郁治疗逆转。因此,炎性小体有望成为炎症反应的关键调节剂,尽管这种复杂反应背后的机制仍相对未被探索。
▸ 神经免疫、压力和抑郁
◮ 小胶质细胞——脑部前哨免疫细胞
越来越多的证据表明,抑郁症有神经免疫基础。如前所述,小胶质细胞是关键的先天前哨免疫细胞,仅限于CNS,并通过运动突起监测环境以确定生理环境的变化。
除了作为对感染和损伤的反应者的关键作用外,小胶质细胞还参与神经发育和成年期不同阶段的神经元事件,包括突触重塑以塑造神经元网络信号。这些细胞参与一个动态系统——神经血管单位,其中包括围绕BBB并传递CNS细胞与外周之间相互作用的细胞。
最近的研究确定,小胶质细胞通过自我更新维持在大脑中,并维持与神经元的长期互动。此外,小胶质细胞可以释放炎性细胞因子来影响神经元活动和神经递质受体的运输以及基因表达。
小胶质细胞和神经元之间的相互交流可能在整个生命周期中促进神经可塑性、神经发生、增殖、修剪和神经退化,并且可能在压力和神经炎症反应中起关键作用。
作为对压力的反应,小胶质细胞在与抑郁样症状有关的皮质边缘区域内发生形态和功能的动态变化。在压力条件下,神经内分泌通路微调中枢和外周免疫反应,导致单核细胞运输和启动,随后小胶质细胞表型发生变化,并最终导致神经炎症,这反过来又会导致多种压力相关疾病的发展,包括抑郁症。
◮ 星形胶质细胞——大脑功能的关键参与者
应该注意的是,中枢神经系统(CNS)中最常见的神经胶质细胞类型是星形胶质细胞,它们是维持大脑功能、调节神经传递、新陈代谢和能量供应的关键参与者。
据报道,在抑郁症中,星形胶质细胞的密度和数量有所减少。最近使用易位蛋白18 kDa(TSPO)作为反应性星形胶质细胞和小胶质细胞标志物的人脑成像研究表明,MDD患者的神经炎症增加,抗抑郁治疗减少了神经炎症。
综上所述,这些发现清楚地表明,抑郁症是一种复杂的精神疾病,与压力适应不良有着内在的联系,这会导致HPA轴和免疫系统失调。在过去的几年里,很明显,这种改变的压力和炎症反应会聚集在大脑功能上,从而破坏正常的神经免疫稳态。
因此,在免疫精神病学领域,人们的热情伴随着这样一个想法,即针对这种改变的压力免疫轴可能会产生治疗抑郁症的新方法。然而,最近出现了一个新的参与者——肠道微生物群——它也是压力和炎症的关键调节因子,因此它在抑郁症中的作用也正在研究中。
哺乳动物肠道是无数微生物的生活环境,这些微生物统称为肠道微生物群。新出现的证据支持胃肠道微生物群与内分泌和免疫系统的双向通信在介导关键的大脑过程,包括神经炎症、压力轴激活、神经传递和神经发生)。此外,在心理学中,人们越来越认识到微生物群-肠-脑轴在精神病理学中的作用。
肠道微生物群影响免疫细胞各种亚群的相对种群、迁移和表型,不同的研究说明了肠道微生物种群如何在炎症、感染和自身免疫时影响粘膜表面的先天性和适应性免疫反应。
事实上,已经表明肠道免疫系统是一个复杂的结构,它已经发展出特定的机制来确保共生细菌负荷得到维持,如果细菌穿过肠道屏障,这些将被免疫系统靶向并消除,防止它们可能侵入外围。另一方面,共生菌还通过直接识别T细胞、树突状细胞或直接识别微生物代谢物或产物(如短链脂肪酸)来触发调节性 T 细胞的激活,从而塑造免疫反应。
▸ 微生物组与免疫脑信号传导
微生物群有助于免疫反应的启动、教育和激活;反过来,免疫系统在维持和调节肠道细菌的数量和多样性方面发挥作用。目前的证据表明,在稳态条件下,保持健康和动态的低度炎症基调,以在肠道免疫和肠道神经系统与大脑之间持续交流。
◮ 微生物群与神经炎症密切相关
除了在肠道水平影响免疫系统外,微生物群还与小胶质细胞的严格调节有关。事实上,微生物组与通过调节短链脂肪酸(SCFA)调节神经炎症过程有关,短链脂肪酸是纤维代谢的微生物衍生副产品,特别是在帕金森病的动物模型中。值得一提的是,单核细胞显示游离脂肪酸受体(FFAR),这是SCFA的内源性分子靶标之一。
越来越多的证据表明,肠道微生物组在介导神经炎症过程中发挥着令人信服的作用。在一项引人入胜的研究中,发现脑海绵状血管畸形——增加癫痫发作和出血性中风风险的血管缺陷——受到革兰氏阴性菌和脂多糖激活内皮Toll样受体4(TLR4)的刺激,TLR4参与先天免疫的激活。相反,TLR4信号传导的药物阻断阻止了牵涉畸形的发展。
更重要的是,这些畸形未能在无菌小鼠中发展,抗生素暴露显著降低了对牵涉畸形的易感性。综上所述,这些结果表明,肠道微生物组无疑参与了影响大脑形态和功能的先天免疫信号通路。
◮ 肠道微生物群影响大脑的免疫结果
调节和炎症适应性免疫反应的损害也与缺血性中风的发展有关。已发现抗生素暴露会改变免疫肠道功能,同时减少小鼠的缺血性脑损伤。在这个模型中,肠道T细胞在中风后迁移到脑膜,这被特定肠道细菌群的消耗所逆转。通过观察到无菌小鼠以淋巴细胞依赖性方式免受缺血病变的发展,进一步加强了细菌定植与中风结果的相关性,进一步加强了肠道微生物组在影响大脑的免疫结果中的作用。
关于炎性小体与微生物群-肠道-大脑轴的相互作用,NLPR6 已被证明对肠道微生物代谢物信号做出反应,导致宿主免疫反应的激活。caspase-1 的基因缺失是该信号级联反应的关键组成部分,可减少小鼠的抑郁样行为,同时导致肠道微生物组改变。
应激小鼠的抗生素治疗以类似于caspase-1敲除小鼠的方式促进肠道微生物组的再平衡,进一步暗示肠道微生物组在调节影响大脑功能的炎性小体途径中的作用。
综上所述,这些结果挑战了肠道微生物群、免疫系统和神经发育之间的关系在成年后是不变的既定概念。事实上,健康多样的胃肠道微生物群被认为对于维持平衡的免疫系统和适当的大脑功能至关重要。
◮ 微生物群还可通过迷走神经影响肠脑信号
微生物群和免疫系统可能与肠脑信号相互作用的另一种机制是通过迷走神经。迷走神经的末梢对来自肠道神经系统的神经通讯和肠道释放的炎症因子很敏感,它们通过脑干将这些感觉信息传递到大脑的更高中枢。
最近使用迷走神经切断术的研究报告称,肠道微生物群在调节神经发生中起关键作用,可能是通过涉及脑源性神经营养因子(BDNF)的机制。
脑源性神经营养因子可以参考我们以前的文章:探索大脑健康的宝藏:神经营养素、肠道菌群与我们的思维宇宙
这些发现支持早期的工作,其中益生菌鼠李糖乳杆菌JB-1对压力诱导的抑郁和焦虑样行为的积极影响通过迷走神经切断术消融。迷走神经刺激在某些抑郁症病例中作为治疗方法的作用。
除了在对神经发生的积极影响中发挥作用外,来自大脑中高级中心的传递通过传出的迷走神经冲动抑制了外周炎性细胞因子,如TNF-α和脾脏中的IL-1β,从而影响肾上腺的局部事件;因此,这种交流在调节压力反应中发挥作用。
尽管研究尚未明确确定肠道微生物群与通过迷走神经调节免疫和压力相关事件的直接联系,但现有数据表明,迷走神经可能在某种程度上导致了肠道微生物群对抑郁症的一些影响。
缺乏调查肠道微生物组在宿主心理健康中的作用的机制、纵向临床研究。有证据表明抑郁症个体的微生物群组成发生了变化,粪杆菌属(Faecalibacterium)的丰度与症状严重程度呈负相关。
一项观察性研究报告称,用单一和复发性抗生素治疗攻击微生物群会增加患抑郁症和焦虑症的风险。最近,一项大型人群研究表明,Coprococcus和Dialister菌株不仅是生活质量提高的预测因子,而且在未经治疗的抑郁症患者中也持续耗尽,而 Butyricicoccus与抗抑郁治疗有关。
有趣的是,最近的研究表明,MDD 患者的粪便移植会影响受体动物的抑郁样行为,从而表明肠道微生物组进一步参与抑郁症。
▸ 压力和抑郁患者的微生物组
许多不同的压力范式——包括慢性社交失败、克制压力、母体分离、拥挤、热应激和声学压力——会影响肠道中微生物的组成,如临床前模型所确定的那样。
多项研究侧重于了解肠道微生物群在通过抗生素给药、益生元和益生菌干预以及粪便移植对肠道微生物群进行积极或消极操作后暴露于压力中的作用,以及对特定无病原体和无菌动物的压力的反应。
与微生物群免疫应激反应相关的微生物群调控的临床前研究,如下图所示:
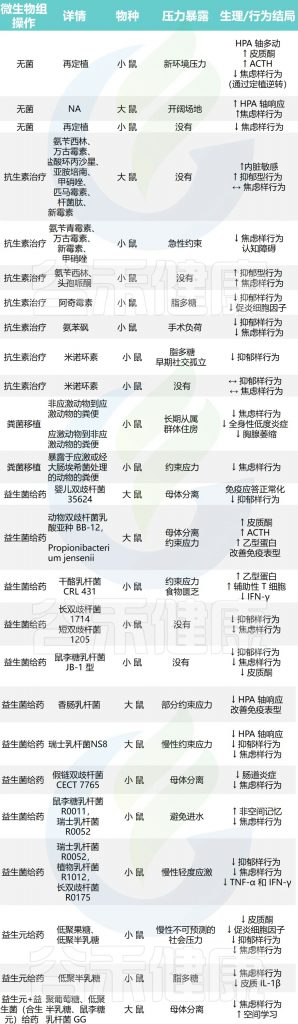
◮ 肠道微生物群可以对神经行为产生不同影响
临床前研究表明,无菌动物——从出生起就在无菌环境中饲养,因此缺乏胃肠道细菌——表现出的行为和表型结果,可以通过细菌定植来逆转,并且对急性应激的敏感性增加。
剖析肠道微生物群对压力生理学影响的另一种方法是通过暴露于抗生素来消融稳定的核心细菌种群。越来越多的研究表明抗生素治疗后的行为受到调节,这表明特定的肠道细菌种群可能会对神经行为结果产生积极或消极的影响。
然而,仍然缺乏进一步的临床前研究来检查抗生素给药对响应应激暴露的神经内分泌水平变化的影响。鉴于肠道细菌可能会影响压力反应和情绪行为,多项研究也探讨了益生元和益生菌给药在压力模型中的效果。事实上,益生元和益生菌干预都已被证明可以防止压力的有害影响,可能是通过调节免疫系统,同时改善行为(见上表)。
此外,从应激小鼠到幼稚受体的粪菌移植导致焦虑样行为以及单核细胞和活化小胶质细胞在海马体中的积累,而用来自未应激动物的有益微生物治疗通过改善肠道炎症来改善焦虑样行为。
综上所述,越来越多的证据表明,肠道微生物组无疑参与了应激反应的潜在机制,塑造肠道微生物群落可能会为更有针对性的应激信号传导操作的发展提供一些启示。
▸ 迈向精神益生菌
最近创造了精神益生菌的概念,以表示赋予心理健康益处的活细菌。它的定义已扩大到指任何促进大脑健康的微生物组有针对性的干预。
◮ 精神益生菌改善了情绪反应
尽管研究仍处于早期阶段,但越来越多的数据,尤其是健康志愿者的数据,支持这一概念。例如,用益生菌瑞士乳杆菌R0052和长双歧杆菌R0175和低聚半乳糖治疗导致皮质醇减少,从而促进受试者对压力的适应力并改善健康受试者的情绪反应。
此外,在功能性磁共振成像研究中,摄入益生菌鸡尾酒导致大脑活动和情绪信息处理发生变化和与消极情绪相关的消极想法的减弱,支持肠道微生物群在压力和情绪反应中的重要性。
食用长双歧杆菌1714与健康受试者的压力减轻和认知改善有关。尽管有这些发现,但构成微生物群和压力反应之间通信的确切机制仍有待阐明。最近,益生菌治疗被证明可以改善压力反应以及重度抑郁症(MDD)和肠易激综合征患者和产后抑郁症的抑郁评分。
然而,关于益生菌作为MDD预防措施的整体疗效尚未达成明确的共识。在过去的十年中,科学界,特别是在社会心理学领域,开始了一场关于科学可重复性和复制性的重要讨论。尽管精神益生菌具有巨大的潜力并且广受欢迎,但不仅在科学界,而且在公众中,在从仍然有限的证据中得出结论时需要谨慎。因此,很明显,需要进行菌株选择和更多的纵向大规模研究来证明任何潜在的心理益生菌干预的特定作用。
鉴于压力、炎症和微生物组都是抑郁症的危险因素,人们对了解神经生物学回路和细胞机制越来越感兴趣,它们各自可以影响重度抑郁症(MDD)症状。
成人海马神经发生正在成为这样一种过程。1960年代的开创性研究首次提供了证据,证明成年大鼠和豚鼠海马体中产生了新的神经元,结束了神经元出生后在中枢神经系统中不再产生的长期教条。现在人们普遍认为,成体神经发生主要局限于侧脑室内衬的脑室下区和包括大鼠、小鼠和人类在内的几个物种海马齿状回(DG)的颗粒下区(SGZ)。
在海马体DG的SGZ中,神经祖细胞(NPC)增殖并分化为星形胶质细胞、少突胶质细胞或神经元,然后迁移到星形胶质细胞层(GCL)中,并最终投射到海马体的CA3区域,在那里它们成为功能齐全的神经元,集成到大脑回路中。虽然最近对人类一生中海马神经发生的维持存在一些争议,但人们普遍认为神经发生发生在海马中并具有功能相关性。然而,在临床神经影像技术取得进步之前,很难完全确定神经发生在这些临床情况下的确切作用。
▸ 神经发生,压力和抑郁
质疑成人海马神经发生在抑郁症中潜在作用的主要驱动因素之一是,慢性压力是抑郁症的一种风险和诱发因素,一直被报道会减少成人海马神经发生,而抗抑郁治疗会逆转这种情况。
由于海马体参与 HPA 轴负反馈的调节,因此推测成人海马神经发生的损伤可能与 HPA 轴反馈回路的破坏有关,从而加剧其失调,正如在很大一部分 MDD 患者中观察到的那样。
事实上,有一些临床前证据表明,成人海马神经发生可以缓冲皮质酮和对压力的行为反应。然而,在没有压力的情况下,神经发生消融似乎不会诱导抑郁表型。另一方面,使用不同类型的抗抑郁药和其他诱导抗抑郁样作用的手法进行长期治疗,例如电休克疗法和锻炼,已被证明会增加啮齿动物的成年海马神经发生。来自人类死后脑组织的一些证据表明,抗抑郁药物在抑郁症中会增加海马祖细胞增殖。
临床前模型还提供了证据表明,某些抗抑郁药的至少部分行为影响需要完整的成人海马神经发生。有趣的是,与抑郁症中观察到的 HPA 轴多动症非常相关,已经证明成人海马神经发生是通过抗抑郁治疗使 HPA 轴功能正常化所必需的。
抗抑郁药发挥其治疗效果所需的时间与新生成的海马细胞成熟并整合到神经元网络中所需的时间相匹配,这符合抗抑郁活性需要成人海马神经发生的观察结果。
此外,压力通过诱导抑郁样行为对成人神经发生产生有害影响,而这种影响可以通过抗抑郁药治疗来逆转。
▸ 神经炎症和海马神经发生
炎症对成年海马神经发生影响的第一个证据是,当外周或中枢注射 LPS 到啮齿动物减少神经发生,同时增加海马体 DG 中小胶质细胞的数量时。从那时起,很明显,经典的促炎细胞因子 IL-1β、IL-6 和 TNF-α 是海马神经发生的主要负炎调节剂。
由于海马 IL-1β 水平的长期升高对记忆和认知有不利影响,并且在动物研究中也会促进行为抑郁,海马体中同源 IL-1 I 型受体(IL-1R1)的受体表达升高,并且抗抑郁治疗降低海马体中的 IL-1β 水平,这种促炎细胞因子现在被确定为抑郁症海马功能障碍的重要因素也就不足为奇了。
除了影响成熟神经元的功能外,IL-1β还可以直接与新生的神经元相互作用,这是由于IL-1R1在海马体的神经祖细胞上的表达。几个小组现在已经发表了关键研究,证明 IL-1β 对海马神经发生产生负面影响,并且存在相关的行为后果。
事实上,IL-1β 被认为对慢性压力诱发的抑郁症很重要,因为它对海马神经发生有负面影响。此外,研究报告说,IL-1β诱导的海马神经发生的减少被体外和体内的抗抑郁治疗逆转。
IL-1β 主要由海马体中的小胶质细胞产生,因此这种在塑造神经元发育中起重要作用的动态细胞因其通过海马神经发生的变化对压力诱导的抑郁样行为的贡献而被研究。有趣的是,阻断压力诱导的小胶质细胞活化和抗抑郁药丙咪嗪独立地挽救了压力诱导的抑郁样行为并抑制了神经发生。除了促炎细胞因子和小胶质细胞外,有证据表明T细胞也是维持海马神经发生所必需的。
▸ 微生物组和海马神经发生
越来越多的证据表明,在成人海马神经发生的背景下,肠道微生物组也是免疫系统的关键调节剂。
事实上,无菌小鼠的成年海马细胞增殖和神经发生水平增加,而从三周龄开始的微生物再定植并不能阻止这些。有趣的是,这些影响主要在背侧海马体而不是腹侧海马体中观察到,这可能对主要参与背侧海马体的认知功能(如空间学习和记忆)产生有趣的影响。
另一方面,最近的一项研究表明,抗生素治疗减少了成人海马神经发生,这被益生菌治疗和自愿运动逆转,不是通过粪便移植,而是通过调节 Ly6Chi 单核细胞运输。因此,肠道微生物组似乎参与了成人海马神经发生的调节,可能是通过与免疫系统的相互作用。
关于益生菌是否会影响成人海马神经发生的数据有限,但一项研究报告称,用益生菌制剂(瑞士乳杆菌 R0052 和长双歧杆菌 R0175 组合)治疗可以防止应激诱导的表达双皮质素(神经发生的标志物)的细胞数量减少。
下图展示了成人海马神经发生是参与抑郁症的精心编排的通路中的重要调节剂。这个过程受到饮食和运动以及健康的免疫系统和肠道微生物组的积极影响,同时受到压力和异常免疫系统和肠道微生物组等因素的负面影响。成人海马神经发生似乎很可能处于这个邪恶的三位一体的核心,因为这个关键过程是由这个三位一体调节的。
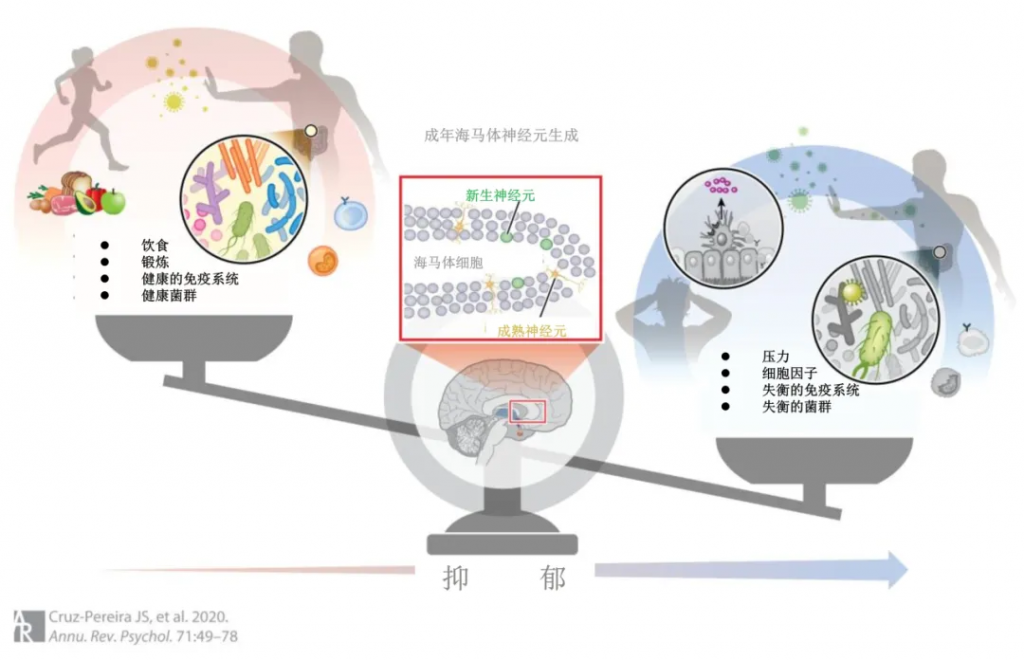
从动物研究中可以清楚地看出,成人海马神经发生是抗抑郁作用的关键,并且一直被证明会受到压力的抑制。最近重新认识到成人神经发生在人类海马体中的重要性进一步推动了发现针对它的策略,以维持正常的海马功能。
鉴于肠道微生物组对这一中心过程的潜在调节,未来的研究应该解决可能将肠道微生物组与大脑联系起来的潜在机制途径以及成体神经发生的正确整合,特别是在压力、炎症和随后的抑郁的情况下。
近几十年来,生活方式,尤其是饮食发生了巨大的转变。从本质上讲,很大一部分人类采用西式饮食,这些饮食富含加工食品、糖和脂肪,这与肥胖、糖尿病和心血管疾病的患病率不断上升有关。
◮ 更健康的饮食可能带来更好的认知功能
另一方面,地中海饮食等健康饮食提供必需的常量营养素,如类黄酮、omega-3脂肪酸和omega-6多不饱和脂肪酸,这些营养素与更好的预期寿命和健康状况有关。然而,报告也将西方饮食的消费与认知和情绪障碍联系起来,而地中海饮食则与更好的认知功能有关。
此外,最近的一项系统评价得出结论,在观察性研究中,坚持健康饮食,尤其是传统的地中海饮食,或避免促炎饮食,似乎可以提供一些预防抑郁症的保护。这些研究为预防抑郁症的营养方法提供了明确的证据。了解支撑这些影响的机制将很重要,尤其是在微生物群免疫应激水平上。
事实上,最近的研究表明,不健康食物摄入量较高和营养丰富的食物摄入量较低与海马体积减少有关,相反,更健康的饮食与人类海马体积较大有关。
事实上,在临床前模型中,不同的饮食干预与海马体的神经元可塑性有关,这进一步强调了健康饮食在促进大脑体内平衡和功能方面的重要性。此外,最近表明,在正常的抗抑郁药或心理治疗中加入改良的地中海饮食可以对抑郁症产生显著的积极影响。鉴于地中海饮食显著影响微生物群组成,很容易推测微生物群可能在此类饮食干预的有益效果中发挥作用。
因此,饮食改变似乎是一种促进整体健康的有趣干预措施。事实上,人们对生活方式的改变越来越感兴趣,特别是采用独特的饮食方式——如旧石器时代、生酮饮食和植物性饮食等——被认为可以促进健康益处,而这可能反过来与炎症和/或肠道微生物组的调节有关。
此外,鉴于早期生活环境深刻塑造了神经发育,并且饮食与神经可塑性有关,因此评估饮食在早期生活中的相关性将极为重要。进一步的研究应该解决这些饮食的潜在大脑健康益处及其潜在机制。
肠道微生物组、免疫力和压力反应之间的微妙平衡对神经系统健康至关重要。最终,该矩阵中一个或多个因素的破坏(例如,由消极的生活事件)会导致大脑生理和行为失调,从而导致重度抑郁等情绪障碍的发展。
尽管在抑郁症的背景下单独研究了这个邪恶的三位一体的组成部分,但在临床前和人类研究中,需要在机械层面上做很多工作,以梳理它们各自的相对贡献以及它们如何相互作用。
如本文开始所述,有大量患者对抑郁症的常规治疗没有反应,了解这三位一体如何在难治性抑郁症中发挥作用是进一步研究的重要途径。
我们现在认识到,不平衡的压力和炎症反应无疑与抑郁症的发展和维持有关,但最近的证据表明,肠道微生物组也在这些途径的不平衡和神经心理学中发挥作用,这表明针对这些因素的治疗可能更有效。
微生物群在疾病中的作用现在才刚刚显现出来,尤其是在神经心理学领域。研究表明,肠道微生物改变在抑郁症患者和抗抑郁药物后的作用;然而,进一步的研究应该检查心理疗法(如认知行为疗法)后微生物组的变化。
因此,心理益生菌干预可能会增强现有疗法的有益效果,从而可能产生更好的结果。然而,确实需要对特定菌株或其组合进行大规模、双盲、安慰剂对照试验来验证这些方法。此外,包括营养、均衡饮食和定期锻炼在内的健康生活方式可能有助于肠道微生物组的平衡和成体神经发生,这反过来又促进了与免疫系统的相互交换和压力反应,从而可能预防抑郁症等疾病。
总之,抑郁症的理想治疗方法可能是重置免疫力、压力生理学和微生物群的不平衡。我们等待这最后一块拼图,但目前的研究表明,这是一个可行的阐明策略。
主要参考文献
Cruz-Pereira JS, Rea K, Nolan YM, O’Leary OF, Dinan TG, Cryan JF. Depression’s Unholy Trinity: Dysregulated Stress, Immunity, and the Microbiome. Annu Rev Psychol. 2020 Jan 4;71:49-78.
Cussotto S, Clarke G, Dinan TG, Cryan JF 2019. Psychotropics and the microbiome: a chamber of secrets. Psychopharmacology 236:1411–32
Dantzer R. 2018. Neuroimmune interactions: from the brain to the immune system and vice versa. Physiol. Rev. 98:477–504.
de Kloet ER, Joels M, Holsboer F 2005. Stress and the brain: from adaptation to disease. Nat. Rev. Neurosci. 6:463–75
DePalma G, Blennerhassett P, Lu J, Deng Y, Park AJ et al. 2015. Microbiota and host determinants of behavioural phenotype in maternally separated mice. Nat. Commun. 6:7735
DePalma G, Collins SM, Bercik P, Verdu EF 2014. The microbiota-gut-brain axis in gastrointestinal disorders: stressed bugs, stressed brain or both?. J. Physiol. 592:2989–97
Del Grande da Silva G, Wiener CD, Barbosa LP, Goncalves Araujo JM, Molina ML et al. 2016. Pro-inflammatory cytokines and psychotherapy in depression: results from a randomized clinical trial. J. Psychiatr. Res. 75:57–64
Derecki NC, Cardani AN, Yang CH, Quinnies KM, Crihfield A et al. 2010. Regulation of learning and memory by meningeal immunity: a key role for IL-4. J. Exp. Med. 207:1067
Desbonnet L, Clarke G, Traplin A, O’Sullivan O, Crispie F et al. 2015. Gut microbiota depletion from early adolescence in mice: implications for brain and behaviour. Brain Behav. Immun. 48:165–73
Desbonnet L, Garrett L, Clarke G, Kiely B, Cryan JF, Dinan TG 2010. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience 170:1179–88