-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

药物是我们许多疾病的第一道,有时是最后一道防线,但尽管进行了数十年的研究,我们仍然不完全理解为什么某种药物对一名患者有效,而对另一名患者无效。
而人类肠道微生物组是这个环节里缺失的拼图之一,因为它能够平行和扩展药物代谢的宿主途径,以及更复杂的宿主-微生物组相互作用。
众所周知,微生物组可以调节宿主健康和疾病的许多方面,并且越来越被认为是药物作用的关键介质。然而,研究药物、微生物群和宿主之间复杂的多向关系是一项具有挑战性的工作,并且支持这些相互作用的生物学机制通常不是很清楚。
在本文中,我们概述了目前的证据,这些证据支持微生物群作为药物治疗益处和副作用的贡献者,特别关注用于治疗精神障碍、2型糖尿病和癌症的微生物群。
关键词
• 微生物组
• 药物
• 新陈代谢
• 抗精神病药
• 二甲双胍
• 癌症
药物微生物组学是一门新学科,旨在了解肠道微生物生态学、药理学、环境线索和宿主基因型之间的相互作用。
在这里,宿主和微生物细胞的这种超实体作为一个基因组和代谢单元发挥作用,其中两个生理实体都受到直接的选择压力,并且可以平等或独特地调节其周围环境的影响。这种复杂的相互作用产生了独特的功能和表型输出。
重要的是,这种对人体的整体看法也首先需要重新定义什么是药物治疗。Lipinski五法则,即根据药理化合物的分子特性(例如,吸收、分布、代谢和排泄或ADME)创建了一套指南,以评估药物相似性并预测人类口服活性的可能性,可能不再完全适合目的。
Lipinski 五法则
Lipinski 五法则是药物化学中一个重要的经验法则,用于预测药物分子是否具有良好的口服吸收性。
五法则具体规定:
较大的分子难以穿过细胞膜;
分子量越大,通常意味着药物的吸收性越差
反映药物的脂溶性
过高的logP值表示药物过于脂溶,可能在脂肪组织中蓄积;
过低则难以穿过细胞膜
主要指分子中-OH和-NH基团的数
过多的氢键供体会降低药物穿过细胞膜的能力
主要指分子中N和O原子的数量
过多的氢键受体同样会影响药物的膜渗透性
反映分子的柔性
过多的可旋转键会增加分子的熵,不利于与靶点结合
这些规则都与数字5或其倍数有关,因此称为”五法则”。
应用原则:
如果一个化合物违反上述规则中的2条或更多,可能在口服吸收方面存在问题。这些规则主要适用于通过被动扩散方式吸收的药物
不适用于天然产物和抗生素等特殊类别的化合物。
现代观点:
随着对人体微生物组认识的深入,这些规则可能需要扩展,以考虑:
药物与肠道微生物的相互作用
对整个宿主-微生物共同体的影响
营养因素对药物作用的调节
这些规则在药物研发早期阶段特别有用,可以帮助筛选具有潜在口服活性的候选药物分子。
鉴于微生物群在调节宿主功能中的作用和许多药物的作用 ,应扩大 Lipinski 五法则的范围,不仅包括靶向宿主细胞的化合物,还包括可以改变肠道微生物功能的化合物。此外,人们可能要考虑特定营养在调节药物对全身影响中的作用。
例如,强心苷地高辛(一种用于治疗心力衰竭的药物)作用方式的研究表明,存在于地高辛代谢Eggerthella lenta中的黄素和[4Fe-4S]簇依赖性还原酶 Cgr2 使地高辛失活,并受到精氨酸的抑制。这样的结果强调了从全息的角度考虑药理学的重要性,以增加最初针对宿主细胞的药物完全有效的可能性。
微生物群在调节全息菌体的健康和福祉方面的广泛作用为治疗提供了新途径,但我们目前对宿主、微生物群和环境之间复杂相互作用的理解仍处于起步阶段。
治疗药物↔微生物群相互作用
几项研究表明,环境(例如营养和药物)而不是宿主遗传学是调节微生物动力学的最重要因素 。特别是,最近的临床和人群研究表明,治疗药物可以改变微生物群组成,但微生物群同样会影响药物的可用性。
由微生物生物转化(活化、再活化、失活)引起的药代动力学改变已得到认可80年,已知有60多种药物被修饰。被微生物群激活的前药示例包括:
•protonsil,最早的非抗生素抗菌药物之一 ;
•柳氮磺吡啶,用于治疗类风湿性关节炎;
•洛伐他汀,用于降低胆固醇。
被微生物群重新激活的药物包括抗癌药物伊立替康,它在胆汁分泌到肠道后被细菌β-葡萄糖醛酸酶修饰 ,而心脏药物地高辛则是微生物群灭活药物的一个例子。
通过菌群代谢物间接改变药代动力学
微生物群还可以通过产生代谢物来间接改变药物药代动力学,这些代谢物竞争负责药物修饰的宿主酶的活性位点(例如、细菌对甲酚与镇痛对乙酰氨基酚之间的竞争)或通过改变负责药物作用的肝细胞色素P450酶的表达水平。
抗糖尿病药物二甲双胍等治疗药物也可以直接影响肠道微生物群落和新陈代谢,导致宿主代谢发生变化。
总体而言,药物-微生物群相互作用涵盖广泛的药物化学、治疗适应症和副作用,正如 Typas 实验室最近的一项综合研究所证明的那样。他们测试了超过1000种宿主靶向药物,发现24%的药物在体外抑制了代表性肠道细菌菌株的生长。
发现对细菌生长有显著影响的药物包括用于治疗心理健康障碍、2型糖尿病(T2D)和癌症的药物。
肠道和大脑之间的联系已经建立起来,肠道甚至被称为我们的第二大脑 。然而,对微生物组的研究显示,这两个器官比此前认为的联系更紧密。众所周知,肠道微生物群可以调节大脑发育,其成分的改变与焦虑、精神分裂症、双相情感障碍和抑郁症等精神障碍有关。
▷治疗精神疾病的药物与微生物群存在相互作用
此外,已发现用于治疗这些疾病的药物与微生物群相互作用。特别是,当筛选宿主靶向药物抑制肠道细菌生长的能力时,抗精神病化合物被确定为明显高占比。
进一步的研究支持这一发现,这些研究表明非典型抗精神病药(AAP)的给药会诱导肠道微生物群组成的抗生素异常改变。有趣的是,还有证据表明存在反比关系,因为抗生素诱导的生态失调与焦虑和抑郁等精神障碍有关。
下图展示了肠道微生物群作为脑-肠轴中央调节因子和潜在药物的相互作用。抗精神病药和精神药物直接影响肠道菌群组成,导致菌群失调和宿主代谢紊乱。此外,益生菌、益生元和抗生素等调节肠道微生物的手段也会影响宿主心理状态。
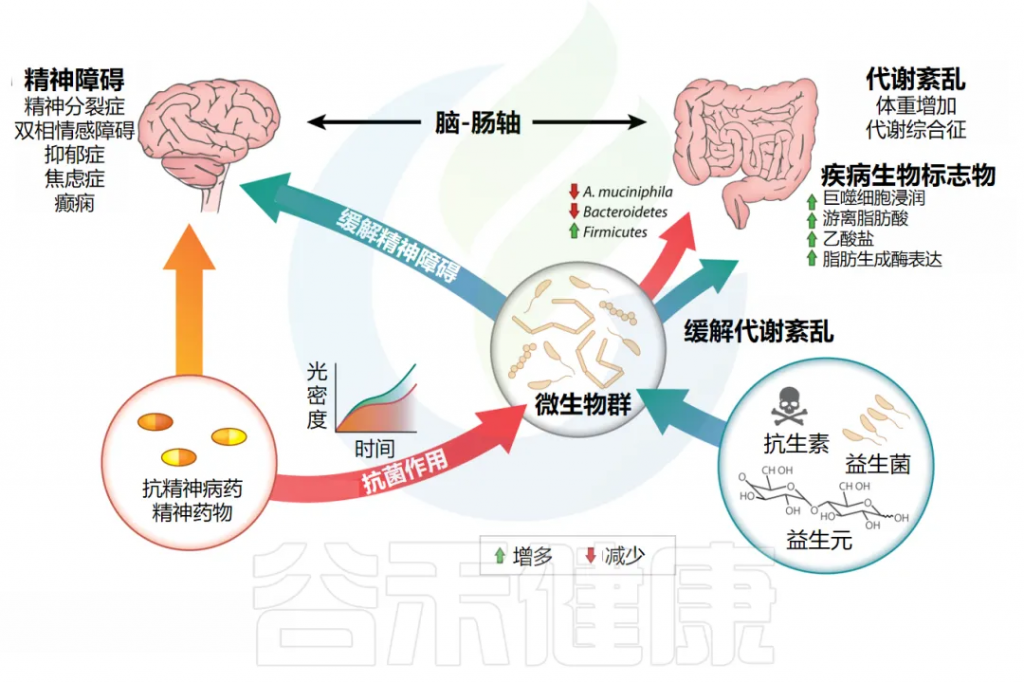
doi: 10.1146/annurev-pharmtox-010919-023612.
▷抗精神病药的副作用可能是药物对微生物的影响引起
有人提出,与抗精神病药(AAP)使用相关的几种代谢副作用,包括体重增加、心脏代谢紊乱和代谢综合征的发展,可能是由药物对微生物群的作用引起的。
例如,已发现儿童和小鼠长期暴露于利培酮会增加厚壁菌门/拟杆菌门比率。此外,在AAP处理组中观察到嗜粘蛋白阿克曼菌的减少,已知该物种具有有益的抗炎特性,可以防止肠道屏障功能障碍和脂肪量发育。
此外,一项涉及无菌(GF)小鼠的研究显示,肠道微生物群是导致奥氮平治疗后观察到的体重增加的原因 。同样,当与抗生素联合给药时,奥氮平的代谢副作用在雌性大鼠中被部分消除。
注释:奥氮平适用于有严重阳性症状或阴性症状的精神分裂症和其他精神病的急性期及维持期。可用于治疗中、重度躁狂发作。
同一项研究还报告说,奥氮平治疗增加了代谢功能障碍的几个标志物,包括脂肪组织中巨噬细胞浸润、血浆中游离脂肪酸丰度的增加以及脂肪生成酶表达的改变。
最近有研究表明,低聚半乳糖益生元的给药可缓解奥氮平诱导的体重增加。总而言之,这些发现表明抗精神病药可以通过对肠道微生物群的影响对宿主代谢产生深远影响。
▷精神药物会引发多种微生物反应
已知与微生物群相互作用的精神药物不仅限于抗精神病药(AAP)类的药物,还可以引发多种微生物反应。一项研究证明了这一点,该研究发现抗抑郁药氟西汀诱导微生物群组成的微小改变,而其他精神药物如锂、阿立哌唑和丙戊酸(VPA)则具有更强的效果。
有趣的是,短链脂肪酸(SCFA)水平因药物治疗而异,这些变化可以映射到已知的SCFA生产者细菌类群(例如拟杆菌门或梭菌属)。目前,解释这些药物对微生物群影响的机制在很大程度上是未知的。
有人提出,选择性5-羟色胺再摄取抑制剂抗抑郁药,如氟西汀和艾司西酞普兰,由于其外排泵抑制剂作用,可以起到抗菌剂的作用。相反,某些微生物群落能够降解氟西汀。
阿立哌唑和丙戊酸(VPA)提供了药物-微生物群相互作用的另一个例子。这种用于治疗癫痫发作、癫痫和情绪波动的药物已被证明在怀孕期间由母亲服用会增加儿童患自闭症的风险。这一发现导致了临床相关动物VPA诱导的自闭症大鼠模型的开发,其中对怀孕大鼠施用 VPA 会产生具有自闭症样表型的后代。重要的是,后代也表现出生态失调,肠道微生物群落的变化与在自闭症患者中观察到的变化相似。然而,这种微生物改变是否会导致这种疾病仍有待证明。
对微生物群在调节宿主行为中的作用的更深入理解使对其进行干预的新方法成为可能,例如使用精神益生菌,已发现益生元和益生菌都可以减轻人类的抑郁和焦虑。
T2D(II型糖尿病)的一线治疗是二甲双胍,属于双胍类药物。直到最近,关于二甲双胍作用机制的研究主要集中在其在肝脏中的抗糖异生作用上。
▷肠道微生物群是二甲双胍治疗的关键介质
现在有越来越多的证据表明肠道微生物群是二甲双胍治疗效果的关键介质。与口服或十二指肠内给药方法相比,静脉内给药在降低血糖水平方面效果较差。
此外,尽管全身暴露大大减少,但仅限于肠道的二甲双胍缓释制剂表现出与标准制剂相当的降糖特性。
下图显示了二甲双胍通过改变肠道微生物群组成调节葡萄糖稳态,其机制可能包括增加有益短链脂肪酸的产生和通过激活G蛋白偶联受体增强肠道激素GLP-1和PYY的分泌。
GLP-1的分泌也可能通过增加SGLT1表达恢复葡萄糖感应或通过调节 TGR5/FXR 胆汁酸受体活性来增强,这是由胆汁池改变(甘氨酸-熊去氧胆酸水平升高)引起的。此外,细菌肽Amuc_1100可能与 Toll 样受体2相互作用,以改善屏障功能并减少代谢性内毒素血症。
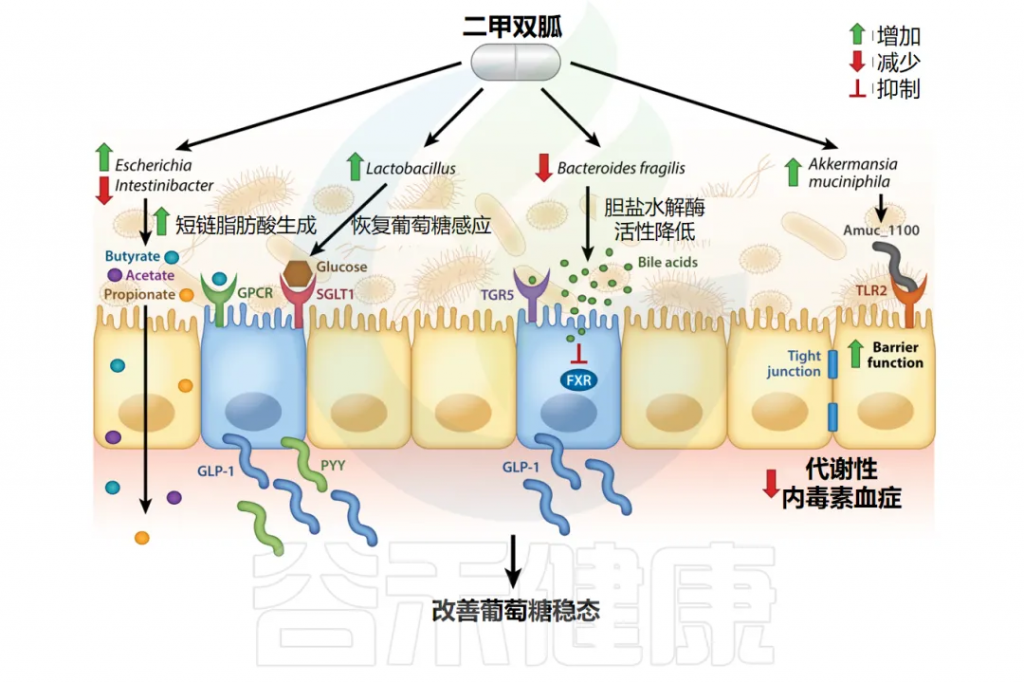
doi: 10.1146/annurev-pharmtox-010919-023612.
目前尚不完全了解肠道微生物群如何促进二甲双胍调节葡萄糖稳态的能力。一种可能性是二甲双胍诱导微生物结构和功能的改变,从而改善与T2D相关的生态失调。
▷使用二甲双胍调节了肠道微生物群组成
几项宏基因组学研究报告称,与非糖尿病个体相比,糖尿病个体的肠道微生物群组成发生了变化。根据二甲双胍治疗状态的进一步分层显示,未经治疗的个体的肠道菌群的特征是产生丁酸盐的分类群枯竭,包括罗氏菌属(Roseburia)、罕见小球菌属(Subdoligranulum)和梭菌目(Clostridiales)。
相比之下,二甲双胍治疗与大肠杆菌属的增加和肠杆菌属的减少有关。值得注意的是,同一项研究还表明,将二甲双胍治疗个体的微生物群移植到饲喂高脂肪饮食的无菌小鼠中足以增强葡萄糖耐量。
▷可能通过短链脂肪酸、肠道屏障或肠道激素来起到治疗作用
有人提出,这些细菌类群丰度的变化可能通过增加短链脂肪酸的产生来介导二甲双胍的治疗作用,这与啮齿动物模型中葡萄糖和能量稳态的改善有关。
有证据表明,短链脂肪酸可以通过与G蛋白偶联受体的相互作用、通过其组蛋白脱乙酰酶抑制活性或仅作为能量来源触发肠内分泌细胞分泌GLP-1和PYY。因此,二甲双胍可能通过促进产生短链脂肪酸的物种的生长来间接刺激这些激素的释放。
或者,二甲双胍诱导的微生物群变化可能通过促进肠道屏障的完整性来调节葡萄糖稳态。已观察到二甲双胍可增加小鼠和人类中嗜粘蛋白不动杆菌的相对丰度,并且该物种的益生菌给药增强了葡萄糖耐量并改善了胰岛素信号转导。
从嗜粘蛋白不动杆菌中分离的外膜蛋白被证明可激活Toll样受体2(TLR2),并概括了完整嗜粘蛋白不动杆菌对小鼠葡萄糖和脂质代谢的积极影响 。有人认为TLR2信号可以增强肠道屏障功能,从而改善与糖尿病相关的代谢性内毒素血症。
也有人提出,肠道微生物群通过影响肠道激素的分泌来介导二甲双胍的作用。已发现服用二甲双胍的个体表现出肠促胰岛素激素胰高血糖素样肽1(GLP-1)的血浆水平升高,一些研究还报告了肽YY(PYY) 的增加,它与食欲控制有关。
当观察到二甲双胍单药治疗2型糖尿病个体样本中 PYY水平与拟杆菌门和厚壁菌门属丰度变化之间存在相关性时,二甲双胍对肠道激素分泌和微生物群之间可能存在联系。
▷二甲双胍使用增加了埃希氏菌和乳酸菌等
同时,微生物组成和代谢的调节可能会导致药物的副作用。与二甲双胍使用相关的胃肠道问题与埃希氏菌和志贺氏菌属的增加有关 ,并且二甲双胍已被证明会破坏细菌叶酸代谢 ,这可能解释了与其使用相关的叶酸状态降低的原因。
然而,二甲双胍治疗恢复了SGLT1表达和葡萄糖感应,同时也增加了乳酸菌的相对丰度。至关重要的是,将二甲双胍预处理的微生物群移植到喂食高脂肪饮食的大鼠的小肠中,也恢复了SGLT1表达和葡萄糖感应,支持肠道微生物群介导的机制。需要进一步的研究来准确确定乳酸菌如何上调这种营养传感器以增强GLP-1分泌和降低血浆葡萄糖水平。
▷二甲双胍还会影响胆汁酸代谢
微生物群还与二甲双胍对胆汁酸池的影响有关,这可能有助于该药物的抗高血糖作用。胆汁酸是溶解脂质以供肠道摄取所必需的,并且可以通过与膜受体蛋白(如G蛋白偶联受体5(TGR5)和法尼醇X受体(FXR))结合来改变代谢。
多项研究表明,二甲双胍治疗会诱导胆汁酸库的改变 ,并且有充分的证据表明胆汁酸与肠道微生物群之间存在串扰。
在一项研究中,在二甲双胍治疗个体中观察到的胆酸水平升高与微生物群的结构变化显著相关。研究人员推测,这些变化可能通过增加TGR5活性间接增加GLP-1水平。
有趣的是,另一项研究表明,补充胆酸会在小鼠中触发相同的微生物变化,这表明二甲双胍对微生物群的影响是该药物对胆汁酸代谢影响的结果。然而,这种相互作用似乎也以相反的方向发生,并且胆汁酸谱的变化可能是由二甲双胍诱导的微生物群改变驱动的。
靶向宏基因组学分析显示,二甲双胍治疗两个月后,T2D患者微生物群中胆盐水解酶(bsh)基因增加。这可以解释观察到的未结合胆汁酸的增加,这种影响与血糖水平显著呈负相关。最近的研究表明,二甲双胍通过降低脆弱拟杆菌丰度,提高糖熊去氧胆酸水平,据报道,糖熊去氧胆酸可抑制肠道FXR信号转导,从而改善胰岛素抵抗。
▷微生物群还可以影响其他治疗2型糖尿病的药物
小檗碱
虽然许多研究致力于了解二甲双胍-微生物群的相互作用,但也有证据表明微生物群在介导用于治疗2型糖尿病(T2D)的其他药物中的作用。据报道,小檗碱是一种具有抗糖尿病特性的传统中药,通过肠道细菌的降低活性转化为更易吸收的形式 ,并且在中国和非洲人群之间发现的小檗碱药代动力学特征的差异可归因于肠道微生物群组成的变化。
与二甲双胍类似,有人认为有益的短链脂肪酸的产生增加或微生物群对胆汁酸受体信号传导的抑制可能支持小檗碱的治疗效果。此外,小檗碱与能够合成支链氨基酸的细菌种类丰度降低有关,支链氨基酸是与胰岛素抵抗和肥胖发展有关的代谢物。
阿卡波糖
阿卡波糖是一种α-葡萄糖苷酶抑制剂,通过延迟小肠中复合碳水化合物的消化来帮助调节葡萄糖稳态。由于这种药物会影响可用于细菌发酵的底物,因此可能会选择性地促进某些分类群的生长,因此可以预期对微生物群产生影响。
事实上,几项研究表明,阿卡波糖会改变肠道中细菌群落的组成。在一项涉及52名糖尿病前期个体的随机对照试验中,阿卡波糖治疗与乳酸菌和糖尿病菌属的显著增加有关,后者与血糖水平呈负相关。
这表明微生物群结构的改变可能是该药物治疗效果的部分原因。与这一假设一致,一项单独的研究揭示了阿卡波糖诱导的肠道微生物群改变与改善血糖控制相关的胆汁酸池变化之间的密切关联。有趣的是,同一项研究还发现,可以根据他们的微生物群是以拟杆菌属还是普雷沃氏菌属为主来预测个体对阿卡波糖治疗的反应,这一结果可能具有重要的临床意义。
目前支持肠道微生物群参与其他T2D药物作用机制的证据还较少。有研究表明,噻唑烷二酮类药物吡格列酮可抑制高脂饮食啮齿动物中变形菌门的增加,而罗格列酮则恢复了细菌在回肠粘膜的空间分布,但未恢复其组成。
在T2D个体中,还观察到利拉鲁肽治疗后嗜粘蛋白不动杆菌的增加,这意味着肠道屏障功能可能得到改善。此外,一些用于提高GLP-4水平的二肽基肽酶-1抑制剂也可能通过微生物群发挥有益作用。例如,在喂食西方饮食的小鼠中,维格列汀治疗诱导了乳酸杆菌和短链脂肪酸的产生增加,而西格列汀也被发现部分纠正了糖尿病大鼠与高脂肪/高碳水化合物饮食相关的生态失调。
需要进一步的研究来评估这些药物诱导的微生物群变化与其治疗效果之间是否存在因果关系。
微生物在癌症的病因中起着重要作用,约占全球癌症的20%。了解肠道微生物群与癌症之间复杂相互作用所涉及的挑战因可能影响这两种因素的外部因素以及难以辨别微生物改变是疾病的原因还是结果而加剧。
▷癌症会直接或局部破坏微生物组
癌症可能直接和局部破坏微生物组,通过可溶性因子(例如CC-趋化因子配体25)间接破坏,以及通过改变的代谢效应全身破坏。此外,导致微生物群失调或影响微生物群产生毒素或代谢物的几种环境因素可以促进癌症或改变抗癌药物治疗。
此外,癌症和肠道菌群失调可能有一个共同点,即发生在这两个过程的上游。例如,宿主生活方式的选择和免疫系统状态可以调节微生物组和癌症的发展。
▷化疗会对肠道微生物群产生负面影响
几项研究表明,化疗药物会对肠道微生物群产生负面影响。例如,研究发现,在结直肠癌(CRC)大鼠模型中,基于伊立替康的化疗导致菌群失调,其特征是诱发腹泻的细菌(如梭菌簇XI和肠杆菌科)增加。
此外,暴露于为期5天的清髓性化疗方案的非霍奇金淋巴瘤患者表现出变形菌门的显著增加,同时厚壁菌门和放线菌门的丰度降低。
注释:清髓性化疗(Myeloablative chemotherapy)是一种强度较大的化疗方案,主要用于血液系统恶性肿瘤的治疗,特别是在造血干细胞移植之前的预处理阶段。主要特点就是使用大剂量化疗药物,能够彻底清除骨髓中的造血细胞。
一项调查吉西他滨对胰腺癌异种移植小鼠肠道菌群影响的研究发现,厚壁菌门和拟杆菌门种群减少,变形菌门和疣微菌门属增加。观察到的与炎症过程相关的细菌增加与癌组织中 NF-κB 的上调一致,这可能对吉西他滨治疗的结果产生负面影响。
注释:吉西他滨(Gemcitabine)是一种常见的嘧啶核苷类似物抗代谢药和抗肿瘤剂,能靶向抑制DNA合成,导致细胞自噬(autophagy)和凋亡(apoptosis)。
还值得注意的是,对结直肠癌小鼠模型的一项研究表明,细菌能够通过胞苷脱氨酶活性将吉西他滨代谢成无活性形式。总体而言,各种化疗药物可能引发肠道菌群失调,这可能会导致有害的副作用或降低药物疗效。
▷肠道微生物群会影响抗癌药物的疗效
相反,有证据表明肠道微生物群可以增强某些抗癌药物的疗效。例如,对无菌小鼠的研究表明,微生物群是对奥沙利铂或联合免疫疗法的最佳反应所必需的。同样,有报道称,已知会扰乱微生物生态系统的抗生素使用会对癌症治疗结果产生负面影响。
已经证明,肠道微生物群对用于治疗多种癌症的抗代谢药物5-氟尿嘧啶(5-FU)的疗效做出了重大贡献。细菌能够以最有效的氟嘧啶形式转化和排泄5-FU,以更高的功效靶向宿主。至关重要的是,这种机制依赖于完整的细菌核糖核苷酸挽救途径。肠道细菌也可能在对5-FU和其他用于治疗结直肠癌的药物产生耐药性中发挥作用。
据报道,与未复发的患者相比,化疗后肿瘤复发患者的Fusobacterium nucleatum丰度增加。研究发现,该物种通过靶向特异性 microRNA 和激活自噬来促进结直肠癌细胞的化疗耐药。这些观察结果强调了解开药物-微生物群相互作用所涉及的生化途径以改善癌症治疗结果的重要性。
由于已经确定肠道微生物群可以调节抗癌药物的作用(下表),旨在针对微生物群的干预措施可能代表有前途的佐剂或针对这种疾病的新疗法。

doi: 10.1146/annurev-pharmtox-010919-023612.
事实上,已经表明益生菌的给药可以改善患者的反应,尤其是与免疫疗法结合使用时。例如,据报道,口服双歧杆菌可促进PD-1配体1特异性抗体治疗在黑色素瘤小鼠模型中的疗效。
随后,三项研究进一步探讨了肠道微生物群对抗PD-1免疫治疗反应的作用。发现补充双歧杆菌可以将小鼠从与抗CTLA-4治疗相关的免疫病理学中拯救出来,而不会影响抗肿瘤免疫的刺激,而在抗CTLA-4治疗的情况下,也观察到脆弱拟杆菌具有抗癌特性。
然而,益生菌的潜在益处并不局限于免疫治疗,研究结果证明,两歧双歧杆菌 G9-1 通过抑制菌群失调和减轻炎症反应改善小鼠模型中 5-FU 诱导的粘膜炎 。此外,嗜酸乳杆菌和干酪乳杆菌益生菌菌株经证实可增加体外 5-FU 细胞凋亡能力 。
用于促进有益细菌生长的益生元化合物也可能增强抗癌药物的作用,已经有研究表明,当与化疗阿霉素联合给药时,菊粉显示出增强的抗肿瘤作用。
肠道微生物群也可以通过使用经过基因改造的细菌菌株来靶向,这些菌株将细胞毒性分子直接递送到肿瘤微环境。该策略在一项涉及减毒鼠伤寒沙门氏菌菌株的研究中成功实施,该菌株被设计为在达到群体密度阈值时同步循环裂解,导致抗肿瘤毒素溶血素E的周期性释放。口服这种工程菌株可提高5-FU在肝直肠转移小鼠模型中的疗效。
总体而言,这些研究提供了令人鼓舞的证据,表明基于微生物群的新型疗法可能是改善未来癌症治疗结果的有效方法。
药物-微生物群-宿主相互作用本质上是复杂的,因此需要结合实验和计算方法来进行解剖。用于此任务的实验工具可分为两大类:体外模型和体内模型。
▷选用的模型至关重要
体外模型为药物-微生物群相互作用的机制基础提供了深刻的见解,并可用于同时筛选大量实验条件。然而,要测试这些相互作用对宿主的生物学相关性,需要超越体外方法,利用无脊椎动物模式生物,这些模式生物有助于高通量技术,能够阐明体内药物-微生物群相互作用的影响。
黑腹果蝇已被提议作为药物发现和研究微生物群对宿主生理学作用的合适模型 ,但迄今为止尚未在该模型中进行专注于这两个因素之间相互作用的研究。相比之下,秀丽隐杆线虫由于其多功能性、易于处理、成本和可扩展性,在药物-微生物-宿主相互作用研究中越来越重要。
例如,秀丽隐杆线虫已成功用于探索负责抗癌药物 5-FU和多柔比星生物转化的微生物机制,并研究微生物群如何介导二甲双胍的延长寿命效应。
与所有动物模型一样,秀丽隐杆线虫既有优点也有缺点,在尝试解决与药物-微生物-宿主相互作用相关的问题时必须权衡这些优点和缺点。虽然在秀丽隐杆线虫中建立微生物单一关联很容易,从而能够进行高度的实验控制和操作,但其他模型更适合研究药物如何与微生物群落相互作用以影响治疗结果。
其中包括广泛用于药物-微生物群研究的小鼠模型以及斑马鱼,它在该领域的发展势头越来越好。
▷研究药物与微生物群相互作用的计算方法
研究药物与微生物群相互作用需借助分析微生物群复杂数据集的计算方法。
可以通过16S测序与QIIME2或mothur等平台结合使用,或通过使用Kraken2、Centrifuge、bioBakery或CLARK-S的宏基因组学数据集来分析结构水平的药物诱导变化。还可以使用MetaVelvet或metaSPAdes组装宏基因组,并且可以使用prokka等工具进行基因注释,以识别通过药物治疗差异富集的功能。
在功能水平上,可以使用SAMSA2、MetaTrans或Anvi’o分析元转录组数据;使用MetaLab或MaxQuant获取宏蛋白质组学数据;以及使用 PhenoMeNal或Workflow4Metabolomics的代谢组学数据。
至关重要的是,必须整合多个数据集才能形成具有生物学相关性和意义的结论。例如,多组学方法被有效地用于鉴定人类微生物组中可以代谢结直肠癌药物的某些代谢型。在这里,作者结合使用代谢组学和宏基因组学分析来解开这个错综复杂的问题并提取有用的生物学见解。
开发上述工具是为了解决与微生物生态系统相关的广泛问题。然而,可用于专门研究这种现象的工具数量有限。
PharmacoMicrobiomics是2011年发布的门户网站数据库,旨在探索药物和微生物之间的相互作用。最近,微生物药物协会数据库发布,其中包含5000多个条目,详细介绍了1000多种不同药物和近200种不同微生物之间的临床或实验支持的相互作用。
此外,2017年发布的 DrugBug 是一种生物信息学工具,包含491种人类肠道细菌菌株的代谢功能,并使用随机森林机器学习算法来预测人类肠道微生物组中存在的微生物酶对药物的生物转化。作者以地高辛为例来验证他们的工具,发现它准确地预测了参与该药物代谢的细菌属和酶,正如之前的体外和体内研究所支持的那样。
旨在整合微生物和宿主多组学数据集的新计算工具是一项有难度的计算工作,可能会为药物-微生物群-宿主相互作用提供进一步的机制见解。
模拟宿主代谢最成功的计算框架是基于约束的重建和分析(COBRA),它已经不断发展和完善了十多年。该框架已用于模拟肠道微生物组(AGORA)中773种不同细菌的代谢,该数据库现在构成了一个大型数据库的一部分,包含人类和微生物群代谢模型(Virtual Metabolic Human)并考虑了环境线索,例如营养输入。
此外,集成在COBRA工具箱中的微生物组建模工具箱、COMETS或CarveMe等工具可用于模拟微生物之间或微生物与宿主之间的代谢交换。
基于生理学的药代动力学(PBPK)模型使我们能够对宿主体内隔室的药物动力学进行数学建模。COBRA和PBPK模型整合的成功例子包括左旋多巴治疗帕金森病患者的研究和异烟肼给药的计算模拟,异烟肼是一种用于治疗结核分枝杆菌感染的抗菌药物。
然而,目前缺乏将微生物的作用整合到 COBRA-PBPK 模型中的模型。在未来几年,除了药物和营养物质等外部因素外,我们还将越来越多地使用整合微生物和宿主代谢的计算模型。
这些关于微生物组与药物吸收、分布、代谢和排泄(ADME)关系的基础性发现在药物开发管线和医疗实践中的转化应用仍然滞后于基础研究。制药行业在评估药物代谢和药代动力学时,目前还较少考虑微生物群对药物ADME特性的影响。
目前仍缺乏标准化的体外测试方法来评估候选药物的微生物代谢,而且在临床前动物模型的药代动力学研究中,也很少评估个体间或物种间微生物组差异可能产生的作用。这种疏忽可能会带来深远的影响。考虑到目前科学认知上的重大空白,以及在微生物组和药理学研究交叉领域工作所需要的专业化和跨学科专业知识(包括概念和方法论方面),这种情况也是可以理解的。
目前理解中的许多关键差距源于研究微生物组在药理学中作用的方法的局限性。关于微生物药物代谢的大多数数据都使用培养依赖性方法,要么在药物存在的情况下培养细菌分离株,要么通过人类粪便样本的离体培养。
虽然这些方法具有许多实际优势,但它们不能用于研究难以培养的肠道微生物群成员,并且在模拟饮食和宿主代谢物等环境因素的作用或微生物群改变药物处置和作用机制的更间接机制方面的能力有限。此外,鉴定负责的酶和由此产生的代谢物仍然是一个主要瓶颈。
参考文献
Trepka KR, Olson CA, Upadhyay V, Zhang C, Turnbaugh PJ. Pharma[e]cology: How the Gut Microbiome Contributes to Variations in Drug Response. Annu Rev Pharmacol Toxicol. 2024 Aug 6.
Pryor R, Martinez-Martinez D, Quintaneiro L, Cabreiro F. The Role of the Microbiome in Drug Response. Annu Rev Pharmacol Toxicol. 2020 Jan 6;60:417-435.
Strebhardt K, Ullrich A. 2008. Paul Ehrlich’s magic bullet concept: 100 years of progress. Nat. Rev. Cancer 8:473–80
Moreno L, Pearson AD. 2013. How can attrition rates be reduced in cancer drug discovery?. Expert Opin. Drug Discov. 8:4363–68
Kundu P, Blacher E, Elinav E, Pettersson S 2017. Our gut microbiome: the evolving inner self. Cell 171:1481–93
Veber DF, Johnson SR, Cheng HY, Smith BR, Ward KW, Kopple KD 2002. Molecular properties that influence the oral bioavailability of drug candidates. J. Med. Chem. 45:122615–23
Spanogiannopoulos P, Bess EN, Carmody RN, Turnbaugh PJ 2016. The microbial pharmacists within us: a metagenomic view of xenobiotic metabolism. Nat. Rev. Microbiol. 14:5273–87
Haiser HJ, Gootenberg DB, Chatman K, Sirasani G, Balskus EP, Turnbaugh PJ 2013. Predicting and manipulating cardiac drug inactivation by the human gut bacterium Eggerthella lenta.Science 341:6143295–98
Falony G, Joossens M, Vieira-Silva S, Wang J, Darzi Y et al. 2016. Population-level analysis of gut microbiome variation. Science 352:6285560–64
Rothschild D, Weissbrod O, Barkan E, Kurilshikov A, Korem T et al. 2018. Environment dominates over host genetics in shaping human gut microbiota. Nature 555:7695210–15
David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE et al. 2014. Diet rapidly and reproducibly alters the human gut microbiome.Nature 505:7484559–63