-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

人体消化系统包含大约几百到几千种不同的细菌种类,其丰度构成因人而异。
其中少数益生菌乳杆菌属,即嗜酸乳杆菌、植物乳杆菌、短乳杆菌、乳酸乳杆菌、干酪乳杆菌、保加利亚乳杆菌、发酵乳杆菌、鼠李糖乳杆菌特异性产生细胞外蛋白、胞外多糖、细菌素和脂磷壁酸,通过与上皮细胞相互作用影响宿主的健康和生理,增强宿主免疫系统。
在乳杆菌菌种中,植物乳杆菌(L. plantarum)是革兰氏阳性、短杆状、微需氧、耐酸、不形成孢子、不呼吸、低 G + C 含量、异型发酵的乳杆菌群,具有一系列作为发酵剂和防腐剂在食品工业中的应用。
它是一种非孢子形成细菌,可产生有机酸,例如乙酸、琥珀酸和乳酸作为主要代谢物。植物乳杆菌在人类和其他哺乳动物的胃和其他复杂的胆汁盐分泌物中的低缓冲能力下生长。
除了在食品工业中的应用外,肠道微生物植物乳杆菌是一种很有前途的益生菌,可治疗腹泻、高胆固醇和特应性皮炎等。它是如何工作的,它还有哪些其他好处?本文带您了解更多。
植物乳杆菌是一种分布广泛、用途广泛的乳酸菌。它代表了许多食物和饲料的微生物群的一部分,包括乳制品、肉类、鱼类、蔬菜发酵产品(例如,葡萄汁、酸菜、泡菜、酸面团)和青贮饲料;它也是人和动物粘膜(口腔、胃肠道、阴道等)的天然居民。
植物乳杆菌是一种具有抗癌、抗炎、抗肥胖和抗糖尿病特性的抗氧化剂 [ 1 ] .
植物乳杆菌菌株的微观形态图像
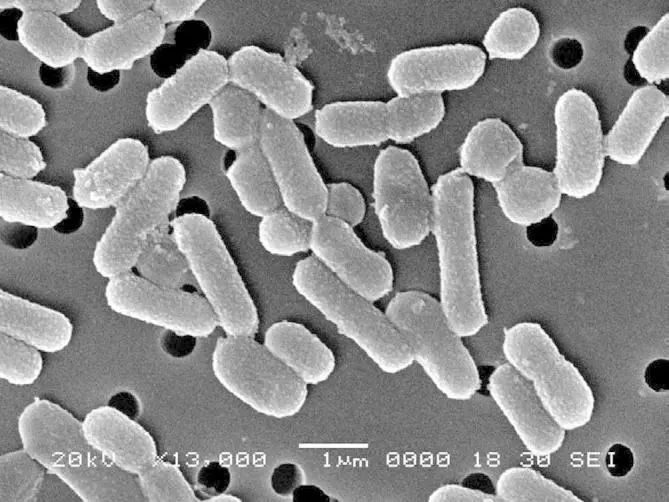
DOI:10.1099/ijs.0.65319-0
植物乳杆菌耐受不同范围的盐,尤其是 NaCl 和胆汁盐,pH 值为 4.0-8.0,温度为 28-45°C,并且分别在 37°C 和 pH 7.0 的温度下具有最佳细胞生长。鉴定出的菌株在上消化道中经受了各种生物障碍,例如低 pH 值、裂解酶和胆汁盐。能够利用广泛的糖类,尤其单糖和双糖。此外,淀粉酶和蛋白酶等细胞外酶的产生对其有利。
B族维生素
从生牛奶中分离出的植物乳杆菌能够产生 B 族维生素核黄素( B2 ) 和叶酸(B9 ) [ 2 ].
铁吸收
植物乳杆菌可使健康女性从果汁饮料中吸收的铁增加约 50% [ 3 ].
植物乳杆菌可以使女性对燕麦中铁的吸收提高 100% 以上 [ 4 ].
钙吸收
含有植物乳杆菌的发酵乳表现出更高的钙保留摄取 [ 5 ].
植物乳杆菌是体内的短暂居民。它可以轻松抵御胃酸,并可以完成从补充品进入口腔,到肠道,到结肠,到粪便的完整旅程。植物乳杆菌生长的最佳温度非常接近体温。
植物乳杆菌也是一种强大益生菌,可猛烈攻击体内的致病性有害细菌。通过杀死坏菌,它帮助我们自己的本地细菌变得更强壮,并帮助我们人体更能抵抗外来病原体的入侵。
除了作为增强免疫系统的重要方式之外,人类在所有有记录的人类历史中都食用了大量的植物乳杆菌。
该菌株用于许多食品中,例如:
酵母面包;酸菜;泡菜;发酵食物
注意
植物乳杆菌益生菌补充剂尚未获得国家药监局和FDA的医疗用途批准,可能缺乏可靠的临床研究。为防止罕见的副作用,请在使用益生菌之前咨询权威的医疗建议。
可能有效
1) 腹泻
乳酸菌益生菌在改善与各种疾病相关的腹泻方面表现出很大的希望,包括旅行者腹泻和抗生素相关性腹泻 [ 6、7 ] .
在一项针对 438 名患有抗生素相关性腹泻的儿童的临床试验中,植物乳杆菌益生菌减少了稀便或水样便和腹痛的发生率,而且没有产生不良副作用 [ 7 ].
2) 皮肤健康
在临床试验中,植物乳杆菌显着增加了面部和手部的皮肤水分含量。益生菌组志愿者在第 12 周时皱纹深度明显减少,皮肤光泽度在第 12 周时也有显着改善。益生菌组的皮肤弹性在4 周后改善了 13.17%,在 12 周后改善了 21.73% [ 8 ] .
当作为益生菌服用时,植物乳杆菌改善皮肤水合作用,对人体皮肤具有抗光老化作用[ 9、10 ] .
植物乳杆菌抑制胶原蛋白的降解并促进其合成,减少活性氧 ( ROS ) 的产生 [ 11 ] .
在无毛小鼠中,植物乳杆菌降低了 UVB 诱导的表皮厚度,抑制了水分流失并增加了神经酰胺水平 [ 12 , 13 ] .
特应性皮炎
每天摄入含有热灭活植物乳杆菌的柑橘汁可减轻人类特应性皮炎的症状[ 14 ] .
从泡菜中分离出的植物乳杆菌改善小鼠特应性皮炎[ 15 ] .
3) 溃疡性结肠炎
在多项临床试验中,乳酸菌益生菌已显示出减轻溃疡性结肠炎症状的希望。含有植物乳杆菌的合生元混合物在8周后显着改善了 73 名患者的 UC 症状 [ 16、17 ] .
4) 胆固醇
在许多临床试验中,乳酸菌益生菌降低了胆固醇。在一项针对 60 名高胆固醇志愿者的研究中,含有植物乳杆菌的益生菌在 12 周后将总胆固醇降低了 13.6% [ 18 ] .
在患有糖尿病的大鼠中,植物乳杆菌降低血液甘油三酯和“坏”低密度脂蛋白胆固醇的比率,同时增加“好”高密度脂蛋白胆固醇的水平 [ 19 ] .
摄入植物乳杆菌后,胆固醇升高的小鼠的总血清胆固醇和甘油三酯显着降低 [ 20 ] .
双涂层植物乳杆菌可降低高脂肪饮食小鼠的胆固醇水平 [ 21 ] .
证据不足
研究人员目前正在调查植物乳杆菌是否具有其他健康益处。本节中的潜在益处至少在一项临床试验中产生了积极的结果,但这些研究规模小、相互矛盾或存在其他局限性。出于任何原因补充植物乳杆菌之前,请谨慎。
5) 肥胖
辅以含有植物乳杆菌的富含益生菌的奶酪的低热量饮食降低了患有肥胖症和高血压的俄罗斯成年人的 BMI 和血压[ 22 ].
植物乳杆菌还保护小鼠免受饮食引起的肥胖。这种细菌可降低肥胖小鼠的体重、脂肪量、空腹血糖、血清胰岛素、瘦素水平和促炎标志物 [ 23、24、25 ] .
植物乳杆菌发酵大麦逆转了高脂肪饮食大鼠的葡萄糖耐受不良,改善了升高的胰岛素,降低了甘油三酯和总胆固醇水平 [ 26 ].
植物乳杆菌通过诱导丙氨酸氨基转移酶( ALT )、γ-谷氨酰转移酶 ( GGT )、血浆甘油三酯、总胆固醇浓度、肌酐、尿素和体重的降低,来改善肥胖大鼠的肝功能和泌尿功能 [ 27 ].
6) 血糖
植物乳杆菌降低了绝经后妇女的血糖水平[ 22 ].
含有植物乳杆菌的豆浆具有抗氧化特性,可减少 2 型糖尿病患者的 DNA 损伤[ 22 ].
植物乳杆菌降低小鼠的食物摄入量、血糖水平、糖化血红蛋白水平和瘦素水平。这种细菌还有利于调节胰岛素水平并增加“好”(HDL) 胆固醇 [ 28 ].
植物乳杆菌导致高脂肪饮食小鼠对胰岛素的血糖水平显着降低 [ 29 ].
用植物乳杆菌治疗可有效调节糖尿病大鼠的血糖、激素和脂质代谢 [ 30 ].
植物乳杆菌显着改善糖尿病大鼠的免疫学参数并保护胰腺组织。此外,这种益生菌治疗显着降低了胰腺和血浆脂肪酶活性以及血清甘油三酯和低密度脂蛋白胆固醇率,并增加了高密度脂蛋白胆固醇水平。它还对肝肾功能发挥有效的保护作用 [ 19 ] .
7) 伤口愈合
在一项针对 34 名腿部溃疡患者的小型临床研究中,局部应用植物乳杆菌减少了糖尿病和非糖尿病患者的感染性慢性静脉溃疡伤口细菌负荷、中性粒细胞、凋亡和坏死细胞,并诱导伤口愈合[ 31 ].
8) 牙齿健康
热灭活的植物乳杆菌减少了接受牙周支持治疗的患者的牙周袋深度 [ 32 ].
9) 免疫力
在一项对 171 名成年人进行的临床研究中,植物乳杆菌提高了免疫活性并降低了应激标记物 [ 33 ].
即使是热灭活的植物乳杆菌也会激活人类的先天性和获得性免疫力 [ 32 ].
植物乳杆菌增强免疫抑制小鼠小肠的免疫力[ 34 ].
抗病毒
在感染单纯疱疹病毒 1 型 (HSV-1) 的小鼠中,口服植物乳杆菌显着延缓了感染早期皮肤损伤的发展,并减少了大脑中的病毒数量 [ 35 ].
同样在小鼠中,从发酵的韩国卷心菜中分离出的植物乳杆菌赋予了 100% 的保护作用,防止致命的甲型流感病毒感染,防止显着的体重减轻并降低肺部病毒载量 [ 36 ].
10) 过敏
在一项针对 42 名成年人的临床研究中,植物乳杆菌发酵的柑橘汁改善了日本柳杉花粉症的症状[ 37 ].
在一项细胞研究中,植物乳杆菌降低了大豆粉的过敏性 [ 38 ].
口服植物乳杆菌可减轻小鼠的气道高反应性和过敏反应 [ 39 ].
11) 念珠菌病
在外阴阴道念珠菌病 (VVC) 患者中,植物乳杆菌减少了常规治疗后的阴道不适,并改善了阴道细菌含量和阴道 pH 值 [ 40 ].
在一项临床试验中,使用植物乳杆菌可使外阴阴道念珠菌病复发风险降低三倍 [ 41 ].
植物乳杆菌还在实验室中杀死念珠菌 [ 42 ].
动物和细胞研究(缺乏证据)
没有临床证据支持将植物乳杆菌用于本节所列的任何病症。以下是对现有动物和细胞研究的总结,应指导进一步的研究工作。但是,不应将下列研究解释为支持任何健康益处。
12) 排毒
植物乳杆菌在实验室中减轻镉 (Cd) 在人类肠道细胞和小鼠中诱导的细胞毒性[ 43、44 ].
植物乳杆菌通过减少肠道铝吸收和组织积累,改善肝损伤、肾脏和大脑氧化应激,从而防止小鼠受到铝中毒[ 45 ].
用植物乳杆菌处理可通过增加铜排泄和减少铜在组织中的积累来减轻铜毒性。植物乳杆菌还逆转了铜暴露引起的氧化应激,恢复了 ALT 和AST血液水平并改善了小鼠的空间记忆 [ 46 ].
13) 血管性痴呆
植物乳杆菌发酵豆浆提取物可作为降血压剂和神经保护剂,改善血管性痴呆大鼠的学习和记忆 [ 47 ].
14) 焦虑
长期摄入植物乳杆菌可增加运动活性、多巴胺和血清素水平,同时减少小鼠的焦虑样行为。它还减少了抑郁样行为和炎性细胞因子水平,并增加了遭受早期生活压力的小鼠血清中的抗炎细胞因子水平[ 48、49 ].
15) 心血管健康
血压
植物乳杆菌发酵豆浆提取物可作为大鼠的降血压剂 [ 47 ].
同样在大鼠中,用植物乳杆菌发酵的蓝莓降低了血压并改善了可能指示心血管疾病风险的标志物 [ 50 ].
动脉粥样硬化
来自植物乳杆菌的脂磷壁酸 (LTA)可抑制小鼠促炎细胞因子的产生,并抑制动脉粥样硬化斑块炎症 [ 51 ].
16) 炎症
植物乳杆菌显着降低小鼠和大鼠促炎细胞因子的产生 [ 52 , 53 ]. 它还减轻了氧化应激和肾上腺素水平 [ 52 ].
17) 肝脏健康
用植物乳杆菌治疗大鼠阻塞性黄疸可恢复活跃的肝屏障功能 [ 54 ].
植物乳杆菌可保护小鼠免受氧化应激和肝脏炎症损伤 [ 55 ].
植物乳杆菌减轻了高脂血症小鼠的肝损伤[ 56 ].
补充植物乳杆菌 5 周可恢复患有非酒精性脂肪性肝病 (NAFLD) 大鼠的肝功能,并降低肝脏中的脂肪堆积水平。此外,该细菌显着减少了促炎细胞因子 [ 53 ].
18) 肠道健康
植物乳杆菌减少肠上皮细胞的炎症 [ 57 ].
摄入植物乳杆菌可以抵消肠道中不需要的细菌 [ 3 ].
植物乳杆菌增强了洛哌丁胺诱导的便秘小鼠的胃肠道转运[ 58 ].
溃疡
口服植物乳杆菌可通过抗炎和免疫调节活性改善小鼠的溃疡性结肠炎 [ 59 ].
肠易激综合症
植物乳杆菌可减少肠易激综合征患者的胀气问题和疼痛 [ 60 ].
幽门螺杆菌感染
植物乳杆菌可预防小鼠幽门螺杆菌感染引起的胃粘膜炎症和胃微生物群改变[ 61 ].
植物乳杆菌延缓幽门螺杆菌在大鼠胃中的定植,减轻胃炎症并改善胃组织病理学 [ 62 ].
19) 婴儿成长
植物乳杆菌菌株在慢性营养不良期间维持幼鼠的生长 [ 63 ].
20) 身体耐力
植物乳杆菌显着降低小鼠的体重并增加相对肌肉重量、握力和耐力游泳时间 [ 64 ].
21) 女性生育能力
植物乳杆菌改善了小鼠炎症诱导的不孕症 [ 65 ].
植物乳杆菌增强了自然微生物群落,并导致感染大肠杆菌的小鼠的生育能力恢复[ 66 ].
22) 组胺不耐受
植物乳杆菌可以在实验室环境中降解生物胺。在组胺不耐受的人群中可能值得研究 [ 67 ].
癌症研究
植物乳杆菌增强了肠腺癌小鼠的抗肿瘤免疫反应并延缓了肿瘤形成 [ 68 ].
长期服用植物乳杆菌可预防大鼠患乳腺癌 [ 69、70 ].
植物乳杆菌抑制大鼠结肠癌发生的发展 [ 71 ].
纳米尺寸的植物乳杆菌还在小鼠中表现出抗结直肠癌活性 [ 72 ].
植物乳杆菌显着抑制肝癌细胞、胃癌细胞和结直肠腺癌细胞的增殖[ 73 ].
这些影响尚未在人类受试者中进行过研究。
在大鼠身上没有观察到任何类型的不良反应,即使在大量食用后也是如此。然而,与其他益生菌一样,在器官衰竭、免疫功能低下和肠道屏障机制功能失调的患者中使用可能会导致感染 [ 74 ].
为了避免不良事件,请在使用益生菌之前咨询医生。
尽管这种情况可能很少见,但如果出现以下任何可能与非常严重的副作用相关的体征或症状,请立即寻求医疗帮助:
参考文献:
[1] Arasu MV, Al-Dhabi NA, Ilavenil S, Choi KC, Srigopalram S. In vitro importance of probiotic Lactobacillus plantarum related to medical field. Saudi J Biol Sci. 2016 Jan;23(1):S6-S10.
[2] Li P, Zhou Q, Gu Q. Complete genome sequence of Lactobacillus plantarum LZ227, a potential probiotic strain producing B-group vitamins. J Biotechnol. 2016 Sep 20;234:66-70.
[3] Hoppe M, Önning G, Berggren A, Hulthén L. Probiotic strain Lactobacillus plantarum 299v increases iron absorption from an iron-supplemented fruit drink: a double-isotope cross-over single-blind study in women of reproductive age. Br J Nutr. 2015 Oct 28;114(8):1195-202.
[4] Bering S, Suchdev S, Sjøltov L, Berggren A, Tetens I, Bukhave K. A lactic acid-fermented oat gruel increases non-haem iron absorption from a phytate-rich meal in healthy women of childbearing age. Br J Nutr. 2006 Jul;96(1):80-5.
[5] ergillos-Meca T, Cabrera-Vique C, Artacho R, Moreno-Montoro M, Navarro-Alarcón M, Olalla M, Giménez R, Seiquer I, Ruiz-López MD. Does Lactobacillus plantarum or ultrafiltration process improve Ca, Mg, Zn and P bioavailability from fermented goats’ milk? Food Chem. 2015 Nov 15;187:314-21.
[6] Olek A, Woynarowski M, Ahrén IL, Kierkuś J, Socha P, Larsson N, Önning G. Efficacy and Safety of Lactobacillus plantarum DSM 9843 (LP299V) in the Prevention of Antibiotic-Associated Gastrointestinal Symptoms in Children-Randomized, Double-Blind, Placebo-Controlled Study. J Pediatr. 2017 Jul;186:82-86.
[7] Hilton E, Kolakowski P, Singer C, Smith M. Efficacy of Lactobacillus GG as a Diarrheal Preventive in Travelers. J Travel Med. 1997 Mar 1;4(1):41-43.
[8] Lee DE, Huh CS, Ra J, Choi ID, Jeong JW, Kim SH, Ryu JH, Seo YK, Koh JS, Lee JH, Sim JH, Ahn YT. Clinical Evidence of Effects of Lactobacillus plantarum HY7714 on Skin Aging: A Randomized, Double Blind, Placebo-Controlled Study. J Microbiol Biotechnol. 2015 Dec 28;25(12):2160-8.
[9] Jeong JH, Lee CY, Chung DK. Probiotic Lactic Acid Bacteria and Skin Health. Crit Rev Food Sci Nutr. 2016 Oct 25;56(14):2331-7.
[10] Kim H, Kim HR, Jeong BJ, Lee SS, Kim TR, Jeong JH, Lee M, Lee S, Lee JS, Chung DK. Effects of oral intake of kimchi-derived Lactobacillus plantarum K8 lysates on skin moisturizing. J Microbiol Biotechnol. 2015 Jan;25(1):74-80.
[11] Hong YF, Lee Hy, Jung BJ, Jang S, Chung DK, Kim H. Lipoteichoic acid isolated from Lactobacillus plantarum down-regulates UV-induced MMP-1 expression and up-regulates type I procollagen through the inhibition of reactive oxygen species generation. Mol Immunol. 2015 Oct;67(2 Pt B):248-55.
[12] Ra J, Lee DE, Kim SH, Jeong JW, Ku HK, Kim TY, Choi ID, Jeung W, Sim JH, Ahn YT. Effect of oral administration of Lactobacillus plantarum HY7714 on epidermal hydration in ultraviolet B-irradiated hairless mice. J Microbiol Biotechnol. 2014 Dec 28;24(12):1736-43.
[13] Kim HM, Lee DE, Park SD, Kim YT, Kim YJ, Jeong JW, Jang SS, Ahn YT, Sim JH, Huh CS, Chung DK, Lee JH. Oral administration of Lactobacillus plantarum HY7714 protects hairless mouse against ultraviolet B-induced photoaging. J Microbiol Biotechnol. 2014 Nov 28;24(11):1583-91.
[14] Harima-Mizusawa N, Kamachi K, Kano M, Nozaki D, Uetake T, Yokomizo Y, Nagino T, Tanaka A, Miyazaki K, Nakamura S. Beneficial effects of citrus juice fermented with Lactobacillus plantarum YIT 0132 on atopic dermatitis: results of daily intake by adult patients in two open trials. Biosci Microbiota Food Health. 2016;35(1):29-39.
[15] Won TJ, Kim B, Lee Y, Bang JS, Oh ES, Yoo JS, Hyung KE, Yoon J, Hwang S, Park ES, Park SY, Hwang KW. Therapeutic potential of Lactobacillus plantarum CJLP133 for house-dust mite-induced dermatitis in NC/Nga mice. Cell Immunol. 2012 May-Jun;277(1-2):49-57.
[18] Fuentes MC, Lajo T, Carrión JM, Cuñé J. Cholesterol-lowering efficacy of Lactobacillus plantarum CECT 7527, 7528 and 7529 in hypercholesterolaemic adults. Br J Nutr. 2013 May 28;109(10):1866-72.
[19] Bejar W, Hamden K, Ben Salah R, Chouayekh H. Lactobacillus plantarum TN627 significantly reduces complications of alloxan-induced diabetes in rats. Anaerobe. 2013 Dec;24:4-11.
[20] Yoo JY, Kim SS. Probiotics and Prebiotics: Present Status and Future Perspectives on Metabolic Disorders. Nutrients. 2016 Mar 18;8(3):173.
[21] Jeun J, Kim S, Cho SY, Jun HJ, Park HJ, Seo JG, Chung MJ, Lee SJ. Hypocholesterolemic effects of Lactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice. Nutrition. 2010 Mar;26(3):321-30.
[22] Sáez-Lara MJ, Robles-Sanchez C, Ruiz-Ojeda FJ, Plaza-Diaz J, Gil A. Effects of Probiotics and Synbiotics on Obesity, Insulin Resistance Syndrome, Type 2 Diabetes and Non-Alcoholic Fatty Liver Disease: A Review of Human Clinical Trials. Int J Mol Sci. 2016 Jun 13;17(6):928.
[23] Pothuraju R, Sharma RK, Kavadi PK, Chagalamarri J, Jangra S, Bhakri G, De S. Anti-obesity effect of milk fermented by Lactobacillus plantarum NCDC 625 alone and in combination with herbs on high fat diet fed C57BL/6J mice. Benef Microbes. 2016 Jun;7(3):375-85.
[24] Park JE, Oh SH, Cha YS. Lactobacillus plantarum LG42 isolated from gajami sik-hae decreases body and fat pad weights in diet-induced obese mice. J Appl Microbiol. 2014 Jan;116(1):145-56.
[25] Wu CC, Weng WL, Lai WL, Tsai HP, Liu WH, Lee MH, Tsai YC. Effect of Lactobacillus plantarum Strain K21 on High-Fat Diet-Fed Obese Mice. Evid Based Complement Alternat Med. 2015;2015:391767.
[26] Zhang J, Xiao X, Dong Y, Xu T, Wu F. Dietary supplementation with Lactobacillus plantarum dy-1 fermented barley suppresses body weight gain in high-fat diet-induced obese rats. J Sci Food Agric. 2016 Dec;96(15):4907-4917.
[27] Ben Salah R, Trabelsi I, Hamden K, Chouayekh H, Bejar S. Lactobacillus plantarum TN8 exhibits protective effects on lipid, hepatic and renal profiles in obese rat. Anaerobe. 2013 Oct;23:55-61.
[28] Li X, Wang N, Yin B, Fang D, Jiang T, Fang S, Zhao J, Zhang H, Wang G, Chen W. Effects of Lactobacillus plantarum CCFM0236 on hyperglycaemia and insulin resistance in high-fat and streptozotocin-induced type 2 diabetic mice. J Appl Microbiol. 2016 Dec;121(6):1727-1736.
[29] Sakai T, Taki T, Nakamoto A, Shuto E, Tsutsumi R, Toshimitsu T, Makino S, Ikegami S. Lactobacillus plantarum OLL2712 regulates glucose metabolism in C57BL/6 mice fed a high-fat diet. J Nutr Sci Vitaminol (Tokyo). 2013;59(2):144-7.
[30] Li C, Ding Q, Nie SP, Zhang YS, Xiong T, Xie MY. Carrot juice fermented with Lactobacillus plantarum NCU116 ameliorates type 2 diabetes in rats. J Agric Food Chem. 2014 Dec 10;62(49):11884-91.
[31] Peral MC, Rachid MM, Gobbato NM, Huaman Martinez MA, Valdez JC. Interleukin-8 production by polymorphonuclear leukocytes from patients with chronic infected leg ulcers treated with Lactobacillus plantarum. Clin Microbiol Infect. 2010 Mar;16(3):281-6.
[32] Iwasaki K, Maeda K, Hidaka K, Nemoto K, Hirose Y, Deguchi S. Daily Intake of Heat-killed Lactobacillus plantarum L-137 Decreases the Probing Depth in Patients Undergoing Supportive Periodontal Therapy. Oral Health Prev Dent. 2016;14(3):207-14.
[33] Nishimura M, Ohkawara T, Tetsuka K, Kawasaki Y, Nakagawa R, Satoh H, Sato Y, Nishihira J. Effects of yogurt containing Lactobacillus plantarum HOKKAIDO on immune function and stress markers. J Tradit Complement Med. 2015 Aug 21;6(3):275-80.
[34] Xie J, Yu Q, Nie S, Fan S, Xiong T, Xie M. Effects of Lactobacillus plantarum NCU116 on Intestine Mucosal Immunity in Immunosuppressed Mice. J Agric Food Chem. 2015 Dec 30;63(51):10914-20.
[35] Matsusaki T, Takeda S, Takeshita M, Arima Y, Tsend-Ayush C, Oyunsuren T, Sugita C, Yoshida H, Watanabe W, Kurokawa M. Augmentation of T helper type 1 immune response through intestinal immunity in murine cutaneous herpes simplex virus type 1 infection by probiotic Lactobacillus plantarum strain 06CC2. Int Immunopharmacol. 2016 Oct;39:320-327.
[36] Park MK, Ngo V, Kwon YM, Lee YT, Yoo S, Cho YH, Hong SM, Hwang HS, Ko EJ, Jung YJ, Moon DW, Jeong EJ, Kim MC, Lee YN, Jang JH, Oh JS, Kim CH, Kang SM. Lactobacillus plantarum DK119 as a probiotic confers protection against influenza virus by modulating innate immunity. PLoS One. 2013 Oct 4;8(10):e75368.
[37] Harima-Mizusawa N, Iino T, Onodera-Masuoka N, Kato-Nagaoka N, Kiyoshima-Shibata J, Gomi A, Shibahara-Sone H, Kano M, Shida K, Sakai M, Miyazaki K, Ishikawa F. Beneficial Effects of Citrus Juice Fermented with Lactobacillus plantarum YIT 0132 on Japanese Cedar Pollinosis. Biosci Microbiota Food Health. 2014;33(4):147-55.
[38] Frias J, Song YS, Martínez-Villaluenga C, González de Mejia E, Vidal-Valverde C. Immunoreactivity and amino acid content of fermented soybean products. J Agric Food Chem. 2008 Jan 9;56(1):99-105.
[39] Liu YW, Liao TW, Chen YH, Chiang YC, Tsai YC. Oral administration of heat-inactivated Lactobacillus plantarum K37 modulated airway hyperresponsiveness in ovalbumin-sensitized BALB/c mice. PLoS One. 2014 Jun 17;9(6):e100105.
[40] De Seta F, Parazzini F, De Leo R, Banco R, Maso GP, De Santo D, Sartore A, Stabile G, Inglese S, Tonon M, Restaino S. Lactobacillus plantarum P17630 for preventing Candida vaginitis recurrence: a retrospective comparative study. Eur J Obstet Gynecol Reprod Biol. 2014 Nov;182:136-9.
[41] Palacios S, Espadaler J, Fernández-Moya JM, Prieto C, Salas N. Is it possible to prevent recurrent vulvovaginitis? The role of Lactobacillus plantarum I1001 (CECT7504). Eur J Clin Microbiol Infect Dis. 2016 Oct;35(10):1701-8.
[42] Sharma A, Srivastava S. Anti-Candida activity of spent culture filtrate of Lactobacillus plantarum strain LR/14. J Mycol Med. 2014 Jun;24(2):e25-34.
[43] Zhai Q, Tian F, Zhao J, Zhang H, Narbad A, Chen W. Oral Administration of Probiotics Inhibits Absorption of the Heavy Metal Cadmium by Protecting the Intestinal Barrier. Appl Environ Microbiol. 2016 Jun 30;82(14):4429-40.
[44] Zhai Q, Wang G, Zhao J, Liu X, Narbad A, Chen YQ, Zhang H, Tian F, Chen W. Protective effects of Lactobacillus plantarum CCFM8610 against chronic cadmium toxicity in mice indicate routes of protection besides intestinal sequestration. Appl Environ Microbiol. 2014 Jul;80(13):4063-71.
[45] Yu L, Zhai Q, Liu X, Wang G, Zhang Q, Zhao J, Narbad A, Zhang H, Tian F, Chen W. Lactobacillus plantarum CCFM639 alleviates aluminium toxicity. Appl Microbiol Biotechnol. 2016 Feb;100(4):1891-1900.
[46] Tian F, Xiao Y, Li X, Zhai Q, Wang G, Zhang Q, Zhang H, Chen W. Protective Effects of Lactobacillus plantarum CCFM8246 against Copper Toxicity in Mice. PLoS One. 2015 Nov 25;10(11):e0143318.
[47] Liu TH, Chiou J, Tsai TY. Effects of Lactobacillus plantarum TWK10-Fermented Soymilk on Deoxycorticosterone Acetate-Salt-Induced Hypertension and Associated Dementia in Rats. Nutrients. 2016 May 2;8(5):260.
[48] Liu YW, Liu WH, Wu CC, Juan YC, Wu YC, Tsai HP, Wang S, Tsai YC. Psychotropic effects of Lactobacillus plantarum PS128 in early life-stressed and naïve adult mice. Brain Res. 2016 Jan 15;1631:1-12.
[49] Liu WH, Chuang HL, Huang YT, Wu CC, Chou GT, Wang S, Tsai YC. Alteration of behavior and monoamine levels attributable to Lactobacillus plantarum PS128 in germ-free mice. Behav Brain Res. 2016 Feb 1;298(Pt B):202-9.
[50] Ahrén IL, Xu J, Önning G, Olsson C, Ahrné S, Molin G. Antihypertensive activity of blueberries fermented by Lactobacillus plantarum DSM 15313 and effects on the gut microbiota in healthy rats. Clin Nutr. 2015 Aug;34(4):719-26.
[51] Kim JY, Kim H, Jung BJ, Kim NR, Park JE, Chung DK. Lipoteichoic acid isolated from Lactobacillus plantarum suppresses LPS-mediated atherosclerotic plaque inflammation. Mol Cells. 2013 Feb;35(2):115-24.
[52] Toshimitsu T, Mochizuki J, Ikegami S, Itou H. Identification of a Lactobacillus plantarum strain that ameliorates chronic inflammation and metabolic disorders in obese and type 2 diabetic mice. J Dairy Sci. 2016 Feb;99(2):933-946.
[53] Li C, Nie SP, Zhu KX, Ding Q, Li C, Xiong T, Xie MY. Lactobacillus plantarum NCU116 improves liver function, oxidative stress and lipid metabolism in rats with high fat diet induced non-alcoholic fatty liver disease. Food Funct. 2014 Dec;5(12):3216-23.
[54] Zhang M, Wang XQ, Zhou YK, Ma YL, Shen TY, Chen HQ, Chu ZX, Qin HL. Effects of oral Lactobacillus plantarum on hepatocyte tight junction structure and function in rats with obstructive jaundice. Mol Biol Rep. 2010 Jul;37(6):2989-99.
[55] Peng X, Jiang Y. Protective effects of Lactobacillus plantarum NDC 75017 against lipopolysaccharide-induced liver injury in mice. Inflammation. 2014 Oct;37(5):1599-607.
[56] Wang LX, Liu K, Gao DW, Hao JK. Protective effects of two Lactobacillus plantarum strains in hyperlipidemic mice. World J Gastroenterol. 2013 May 28;19(20):3150-6.
[57] Murofushi Y, Villena J, Morie K, Kanmani P, Tohno M, Shimazu T, Aso H, Suda Y, Hashiguchi K, Saito T, Kitazawa H. The toll-like receptor family protein RP105/MD1 complex is involved in the immunoregulatory effect of exopolysaccharides from Lactobacillus plantarum N14. Mol Immunol. 2015 Mar;64(1):63-75.
[58] Li C, Nie SP, Zhu KX, Xiong T, Li C, Gong J, Xie MY. Effect of Lactobacillus plantarum NCU116 on loperamide-induced constipation in mice. Int J Food Sci Nutr. 2015;66(5):533-8.
[59] Liu YW, Su YW, Ong WK, Cheng TH, Tsai YC. Oral administration of Lactobacillus plantarum K68 ameliorates DSS-induced ulcerative colitis in BALB
/c mice via the anti-inflammatory and immunomodulatory activities. Int Immunopharmacol. 2011 Dec;11(12):2159-66.
[60] Ducrotté P, Sawant P, Jayanthi V. Clinical trial: Lactobacillus plantarum 299v (DSM 9843) improves symptoms of irritable bowel syndrome. World J Gastroenterol. 2012 Aug 14;18(30):4012-8.
[61] Pan M, Wan C, Xie Q, Huang R, Tao X, Shah NP, Wei H. Changes in gastric microbiota induced by Helicobacter pylori infection and preventive effects of Lactobacillus plantarum ZDY 2013 against such infection. J Dairy Sci. 2016 Feb;99(2):970-981.
[62] Thiraworawong T, Spinler JK, Werawatganon D, Klaikeaw N, Venable SF, Versalovic J, Tumwasorn S. Anti-inflammatory properties of gastric-derived Lactobacillus plantarum XB7 in the context of Helicobacter pylori infection. Helicobacter. 2014 Apr;19(2):144-55.
[63] ME, Balmand S, Hudcovic T, Heddi A, Rieusset J, Kozakova H, Vidal H, Leulier F. Lactobacillus plantarum strain maintains growth of infant mice during chronic undernutrition. Science. 2016 Feb 19;351(6275):854-7.
[64] Chen YM, Wei L, Chiu YS, Hsu YJ, Tsai TY, Wang MF, Huang CC. Lactobacillus plantarum TWK10 Supplementation Improves Exercise Performance and Increases Muscle Mass in Mice. Nutrients. 2016 Apr 7;8(4):205.
[65] Bhandari P, Rishi P, Prabha V. Positive effect of probiotic Lactobacillus plantarum in reversing LPS-induced infertility in a mouse model. J Med Microbiol. 2016 May;65(5):345-350.
[66] Bhandari P, Prabha V. Evaluation of profertility effect of probiotic Lactobacillus plantarum 2621 in a murine model. Indian J Med Res. 2015 Jul;142(1):79-84.
[67] Capozzi V, Russo P, Ladero V, Fernández M, Fiocco D, Alvarez MA, Grieco F, Spano G. Biogenic Amines Degradation by Lactobacillus plantarum: Toward a Potential Application in Wine. Front Microbiol. 2012 Apr 2;3:122.
[68] Hu J, Wang C, Ye L, Yang W, Huang H, Meng F, Shi S, Ding Z. Anti-tumour immune effect of oral administration of Lactobacillus plantarum to CT26 tumour-bearing mice. J Biosci. 2015 Jun;40(2):269-79.
[69] Kassayová M, Bobrov N, Strojný L, Kisková T, Mikeš J, Demečková V, Orendáš P, Bojková B, Péč M, Kubatka P, Bomba A. Preventive effects of probiotic bacteria Lactobacillus plantarum and dietary fiber in chemically-induced mammary carcinogenesis. Anticancer Res. 2014 Sep;34(9):4969-75.
[70] Kassayová M, Bobrov N, Strojný L, Orendáš P, Demečková V, Jendželovský R, Kubatka P, Kisková T, Kružliak P, Adamkov M, Bomba A, Fedoročko P. Anticancer and Immunomodulatory Effects of Lactobacillus plantarum LS/07, Inulin and Melatonin in NMU-induced Rat Model of Breast Cancer. Anticancer Res. 2016 Jun;36(6):2719-28.
[71] Kumar RS, Kanmani P, Yuvaraj N, Paari KA, Pattukumar V, Thirunavukkarasu C, Arul V. Lactobacillus plantarum AS1 isolated from south Indian fermented food Kallappam suppress 1,2-dimethyl hydrazine (DMH)-induced colorectal cancer in male Wistar rats. Appl Biochem Biotechnol. 2012 Feb;166(3):620-31.
[72] Lee HA, Kim H, Lee KW, Park KY. Dead Nano-Sized Lactobacillus plantarum Inhibits Azoxymethane/Dextran Sulfate Sodium-Induced Colon Cancer in Balb/c Mice. J Med Food. 2015 Dec;18(12):1400-5.
[73] Wang K, Li W, Rui X, Chen X, Jiang M, Dong M. Characterization of a novel exopolysaccharide with antitumor activity from Lactobacillus plantarum 70810. Int J Biol Macromol. 2014 Feb;63:133-9.
[74] Biljana Novkovic, 11+ Health Benefits of Lactobacillus plantarum (L. plantarum). September 20, 2021. selfhacked
谷禾健康
过敏性鼻炎是个全球性健康问题,易反复发作,困扰着全世界大约着4亿人。自20世纪60年代以来,过敏性鼻炎的患病率持续上升。近几年,我国主要大中城市过敏性鼻炎的平均患病率从11.1%升高到17.6%。
过敏性鼻炎主要临床表现包括发痒、打喷嚏、鼻塞等,这些症状不加以改善,严重的话会导致睡眠障碍、学习障碍和行为改变等,最终影响患者的生活质量。
过敏性鼻炎与普通感冒不一样,它不是由任何病毒引起的,因此不会传染。过敏性鼻炎主要由过敏原引起,常见过敏原包括花粉、灰尘、动物毛发、皮屑等。
目前过敏性鼻炎的治疗主要基于鼻用皮质类固醇以及鼻用和口服H1-抗组胺药等。但这些药物的有效性是有限的,并且还具有多种副作用,会产生药物依赖性,药效下降等问题。
目前越来越多的研究表明,过敏性鼻炎是一个较复杂的免疫炎症反应疾病,其中肠道微生物群在该病的发生发展过程中扮演了不可替代的角色,针对菌群的干预,无论在动物还是人类临床上均显示出了较大的改善,以及作为药物治疗的补充综合改善措施。
本文我们来详细了解关于过敏性鼻炎的症状,发生过程,风险因素,与肠道微生物群的关系,益生菌在该病中发挥的作用,其他过敏性鼻炎相关治疗干预措施包括饮食、生活方式、益生元、合生元等。
【全文概览】
01 关于过敏性鼻炎,你需要知道
发病率、症状、风险因素、易感人群
与普通鼻炎的区别;与感冒的区别
02 过敏性鼻炎是如何形成的?
发病机理、如何与肠道相关联
03 过敏性鼻炎与肠道菌群之间的关系
04 肠道菌群在过敏性鼻炎中的重要作用(机理)
肠道菌群 ⇄ Th1/Th2 平衡
肠道菌群影响ILC2:过敏中的重要作用
肠道菌群对血清炎症因子的影响
肠道菌群对Treg/Th17细胞平衡的影响
肠道菌群对耐受树突状细胞活性的影响
肠道菌群对Toll样受体的刺激
05 过敏性鼻炎的治疗
06 基于菌群的干预,对过敏性鼻炎的改善
益生菌
益生元
合生元
细菌裂解物
粪菌移植
饮食
07 关于改善过敏性鼻炎的其他自然疗法
草药或补充剂等
锻炼
生活方式
在了解过敏性鼻炎是如何形成之前,我们先了解一下,什么是过敏性鼻炎?

据不完全统计,我国过敏性鼻炎的发病率在5%-25%之间,各个地区发病率不太一样,城乡差异也十分显著,估计全国患病人数在1亿以上。
尘螨在南方的致敏率最高,艾蒿、豚草和蒲公英则是西北最常见的过敏原。
大约 80% 的过敏性鼻炎症状在 20 岁之前出现,并在 20-40 岁达到高峰,然后逐渐下降。据报道,出生后头 5 年儿童过敏性鼻炎的发病率为 17.2%,诊断时的高峰年龄为 24 ~ 29 个月 (2.5%) .
过敏性鼻炎是一个常见病、多发病,可分为季节性(间歇性)或常年性(慢性),大约 20% 的病例是季节性的,40% 是常年性的,40% 的病例同时具有这两种特征。
最初可能出现的症状包括:
可能还会遇到其他较多症状,包括:
当身体对大多数人无害的物质(如花粉)反应过度时,就会发生过敏性鼻炎。
通常在接触某些物质后会出现过敏性鼻炎,过敏原一般分为以下四大类:
我们稍作展开讨论:
➤ 来自屋尘过敏原
实际上,携带过敏原的并不是尘螨本身,而是一种化学物质,在尘螨的排泄物中发现,一般会以人类皮屑为生,常见于家中的以下位置:
地毯、床垫、枕头、床单、窗帘等
➤ 来自树、草等花粉过敏原
根据一年中的不同时间,会出现不同类型的过敏原,因为从春季到深秋,树木、草都会产生花粉
树木包括:
桦木(非常常见)、雪松、榛、扁柏、角树、七叶树、菩提树、橄榄、松树、白杨、柳树等
草包括:
黑麦草、蒂莫西、艾蒿、荨麻、芭蕉、豚草等
➤ 来自动物毛发的过敏原
注意过敏原携带在动物的毛发上。引起过敏原的不是真正的毛发,而是毛发上携带的动物死皮屑、唾液、尿液等。
研究表明,早年接触通常携带过敏原的动物会降低晚年患此类过敏性鼻炎的患病率。
这类动物包括:
猫、狗(这两种非常常见)
牛、马、兔子、啮齿动物等
➤ 来自工作中明确遇到的过敏原
某些特定物质会在一些人身上引起过敏性鼻炎,因此如果职业要求接触以下的一种或多种过敏原,那么患过敏性鼻炎的风险就会增加。
过敏性鼻炎是由遗传和环境因素相互作用引起的。
父母或家庭成员患有过敏性鼻炎,则患过敏性鼻炎的几率更大。
根据卫生假说,过敏性鼻炎发病率的增加与环境因素的变化有关,例如:
近期发表的在小鼠实验中,万古霉素诱导的肠道菌群失调,通过改变短链脂肪酸,加剧肠粘膜屏障的破坏,增加小鼠过敏性鼻炎的易感性和严重性。
鼻粘膜的 H&E 染色
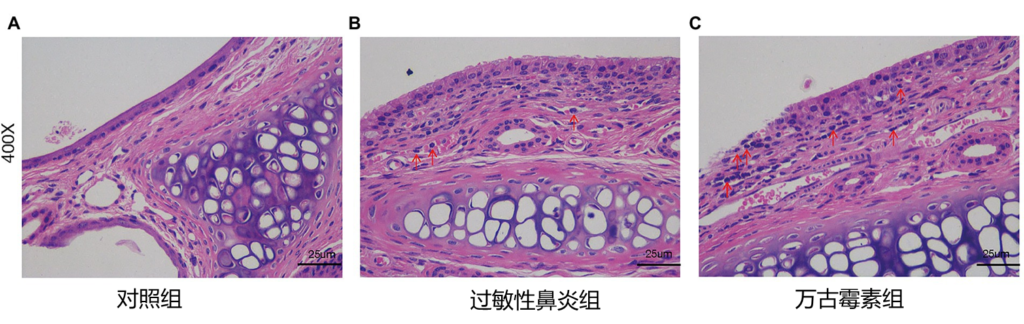
Zhen et al., Front. Microbiol. 2022
万古霉素诱导的肠道菌群失调加重了过敏性鼻炎的严重程度,加重了鼻粘膜的炎症细胞浸润和粘液分泌。
关于过敏性鼻炎,这里有几个需要注意的点:
鼻炎是鼻粘膜的炎症,它是一种上呼吸道疾病。鼻炎的临床症状包括阵发性打喷嚏、鼻塞、流鼻涕、流眼泪等,没有明显病因。而过敏性鼻炎作为鼻炎的一种,症状是由过敏原引发的。
很多人刚开始打喷嚏的时候,还以为是感冒了,赶紧吃感冒药,却发现并没有好转…
实际上过敏性鼻炎的症状往往与早期感冒的症状很相似。
一般来说,可以通过以下几点来区分到底是感冒还是过敏性鼻炎:
1
感冒通常伴有全身症状,如无力、发热、全身酸痛等,而过敏性鼻炎只是单纯的鼻部问题,除了可能有头痛,没有其他全身性疼痛症状。
2
过敏性鼻炎有可能会持续数周至数月,而感冒通常会在1-2周内自愈。
3
大多数过敏性鼻炎具有非常明显的季节性,尤其是春秋两季,而感冒一年四季都可能发生。
4
通过验血,大多数过敏性鼻炎在血液分析中显示嗜酸性粒细胞和 IgE 值升高,而其他值通常正常。相反,感冒通常具有升高的淋巴细胞值。
5
过敏性鼻炎过敏原阳性几率高,感冒几率低。
一旦过敏原吸入鼻腔,就会引起免疫反应。过敏原会和IgE抗体结合,激活肥大细胞。
也许对于普通人来说这没什么,但是对于过敏性鼻炎患者来说,就会引起过度反应,也就是说,免疫系统把花粉,灰尘等莫名扣上“通缉犯”,对其进行打击。
肥大细胞通过释放“组胺”,通知其他细胞,包括嗜酸性粒细胞、嗜碱性粒细胞、嗜中性粒细胞和T细胞等,会导致炎症和鼻粘膜充血:
• 本来好好的通道变窄了,气体很难通过就是鼻塞;
• 炎症刺激到神经,就是鼻子痒;
• 鼻粘膜分泌过多的粘液,结果就是流鼻涕…
过度分泌的粘液会堵塞两个鼻子的重要开口:
鼻泪管的作用是将眼泪从眼睛排到鼻子,一旦因为过敏性鼻炎,粘膜肿胀就会导致鼻泪管堵塞,这时候看起来像是“泪汪汪”的。

咽鼓管引流中耳分泌物,一旦因为过敏性鼻炎被堵塞,就会让人感觉到耳朵被塞住。

最后鼻腔内的神经受到刺激会开始打喷嚏

甚至,过敏性鼻炎患者会感到呼吸困难…

过敏性鼻炎的发病机理
鼻粘膜中的树突状细胞(DC)吸收过敏原 ➞ 引流淋巴结 ➞ 呈递给原始CD4+T细胞 ➞ 分化为过敏原特异性Th2细胞 ➞ 诱导B细胞活化产生浆细胞 ➞ 分化产生特异性IgE抗体 ➞ 在效应细胞(如肥大细胞和嗜碱性细胞)表面进行再循环和相互作用 ➞ 与IgE受体(FcεRI)结合 ➞ 炎症介质(如组胺、前列腺素、白三烯)释放 ➞ 介质与鼻感觉神经、血管系统和腺体相互作用,导致过敏性鼻炎症状
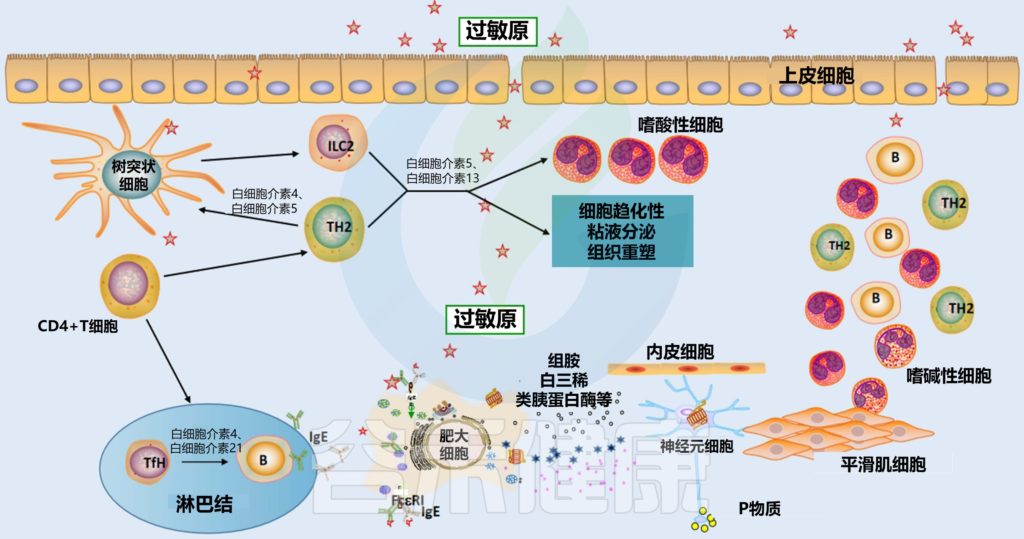
Liu P, et al., J Asthma Allergy. 2022
以上我们知道过敏性鼻炎涉及免疫反应,而人体内60%~70% 的免疫细胞集中在胃肠道中。肠道健康与过敏之间的联系始于免疫系统。
所有的免疫系统成分都直接或间接地受到微生物群的调节。
健康的微生物群会改变 Th1/Th2 细胞的比例,有利于 Th1 细胞,特应性疾病的特征在于对过敏原的 Th2 免疫反应。过敏性鼻炎以鼻腔黏膜Th2免疫反应为主的过敏性炎症反应,病变组织中存在大量Th2细胞因子浸润。
注:Th1细胞介导细胞免疫反应,直接攻击病原体或者促使其他细胞攻击病原体,就算病原体进入被感染的细胞,还会追进感染细胞里面去攻击;
Th2细胞介导体液免疫反应,它们会促使其他免疫细胞产生抗体,由这些抗体来攻击病原体。Th2细胞就不会进入被感染的细胞。
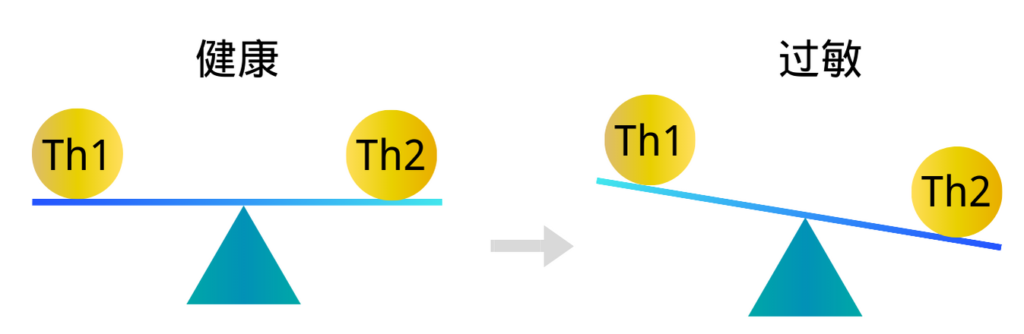
在免疫系统发育过程中,如果肠道失调通过将Th1/Th2细胞因子平衡向Th2反应转移,导致产生产生IgE的浆细胞,从而导致异常过敏反应。
越来越多的证据表明,平衡良好的肠道菌群对发育调节性T细胞(Tregs)至关重要,这对肠道耐受诱导至关重要。下一章节我们来讨论肠道菌群与过敏性鼻炎之间的关系。
注解:由于Th1细胞和Th2细胞都能分泌细胞因子促进自身的增殖并抑制对方的增殖,因此在正常情况下机体中 Th1细胞和Th2细胞处于相对平衡的状态。 但当机体发生功能异常时,常表现出平衡偏向其中一方,称为 “Th1/Th2漂移”。Th1细胞和Th2细胞之间的平衡状态被打破,会引起许多疾病的产生和发展。 包括肿瘤和一些自身免疫性疾病。
但是,不同的疾病表现出的Th1/Th2平衡漂移各不相同。如类风湿性关节炎、I型糖尿病、多发性硬化及慢性甲状腺炎等疾病中,Th1占优势状态;而在系统性红斑狼疮、硬皮病以及一些常见的变态反应性疾病比如过敏性鼻炎中,则Th2占优势状态。
我们知道,肠道菌群在人体中发挥着重要的生理作用,如影响维生素合成、免疫等,且与过敏性疾病的发生、发展相关。
肠道多样性的改变在过敏性疾病患者中较为常见。
目前已有的研究显示,与健康人相比,过敏性鼻炎患者的肠道菌群多样性显著较低(Chao1和Shannon多样性指数),其他菌群变化如下:
过敏性鼻炎患者肠道增加的菌群:
过敏性鼻炎患者肠道减少的菌群:
可见,健康个体和过敏性鼻炎患者的肠道菌群组成不同。
其中,普雷沃氏菌可能是影响免疫系统发育的重要微生物之一。
产丁酸盐的细菌,如梭状芽胞杆菌,可诱导调节性 T 细胞并通过预防肠道炎症来抑制过敏症状。
要解释肠道菌群是如何影响过敏性鼻炎的,我们要先从肠道菌群对免疫系统的塑造开始了解。
肠上皮细胞:将细菌和宿主的免疫系统连接起来
肠上皮细胞(IEC)翻译来自共生细菌的信号(细菌代谢物、细菌成分和细菌本身)并将它们发送到粘膜免疫细胞。可见,肠上皮细胞在肠道免疫中起关键作用。
微生物在肠道定植,并通过肠上皮细胞诱导血清淀粉样蛋白 A 的产生,从而改善 Th17 分化和 IL-22 的产生。
主要参与与定殖肠道细菌的串扰的免疫细胞主要见于固有层。其中,最常见的是树突状细胞(DCs)、Tregs、NK细胞和CD4+ T细胞。
树突状细胞:刺激 CD4+ T 细胞分化
树突状细胞在与先天性和适应性免疫反应的相互作用中起着至关重要的作用。它们迁移到次级淋巴组织并根据激活信号刺激 CD4+ T 细胞分化成亚型。
共生细菌衍生的代谢物影响树突状细胞的功能。例如,短链脂肪酸抑制 IL-12 并增加 IL-10 和 IL-23 的产生,降低 CCL3、CCL4、CCL5、CXCL9、CXCL10 和 CXCL11 的水平,间接调节 T 细胞功能。此外,它们通过树突状细胞的调制诱导 B 细胞IgA 类别转换和 IgA 产生,并调节其他适应性反应细胞功能。
巨噬细胞:摄取病原体
与肠上皮相关的巨噬细胞具有广泛的功能。它们可以摄取病原体,产生多种影响其他免疫细胞的细胞因子,并支持 Treg 的维持。
短链脂肪酸:促进巨噬细胞分泌抗炎 IL-10
微生物产生的短链脂肪酸促进巨噬细胞分泌抗炎 IL-10。此外,它们改变巨噬细胞的新陈代谢,降低 mTOR 激酶活性并增加抗菌肽的产生。
在正常情况下,微生物群和身体之间的相互作用是决定身体健康的基础,如果其中一个环节受损,可能会导致肠道菌群失衡。肠道微生物群的失调显著影响微生物群与宿主之间的代谢,并抑制宿主免疫系统。大多数过敏性疾病与肠道微生物群失衡有关,如过敏性鼻炎。
典型的过敏性鼻炎肠道菌群促进细胞因子的不利变化,从而促进过敏性鼻炎发展中涉及的 Th1/Th2 失衡。
过敏性鼻炎患者的肠道菌群失调及其对 Th1/Th2 平衡的影响
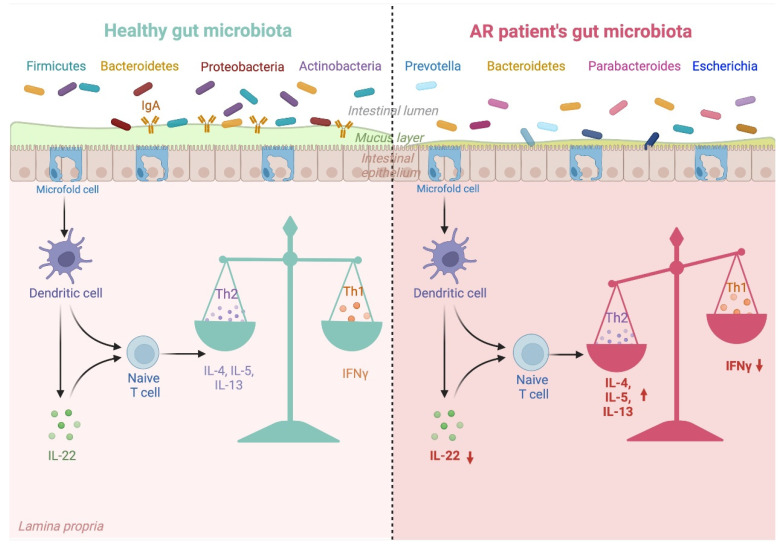
Kaczynska A, et al., Nutrients. 2022
肠道菌群的每一次紊乱都会对免疫系统产生负面影响,并破坏先天性和适应性反应。上图解释了改变的肠道微生物群组成与其对过敏性鼻炎患者免疫系统的影响之间的联系。
接下来章节,我们来详细了解,肠道菌群如何影响免疫系统从而引发过敏性鼻炎。
肠道菌群失调可能会破坏 Th1/Th2 细胞之间的稳态,这可能会对免疫耐受产生负面影响,破坏过敏原的正常清除,并增加过敏性鼻炎的风险。我们从以下六个方面详细展开讨论肠道微生物群在过敏性鼻炎中扮演的重要角色。
前面我们已经知道,过敏性鼻炎是一种I型过敏性疾病,与Th1/Th2平衡向Th2倾斜有关。
为什么生命早期肠道菌群多样性的变化会与过敏有关?
在生命早期,全身免疫反应偏向于Th2。研究表明,生命早期肠道菌群的多样性较低,会影响 IL-4 和 IFN-γ 的水平, IL-4 由Th2细胞产生的,IFN-γ由Th1产生,因此,这可能通过调节 Th1/Th2 平衡来影响气道炎症。
此外,在生命的前两年,较低的微生物多样性会延迟拟杆菌的定殖,并导致 Th1 型反应减少,从而导致Th1/Th2 平衡向Th2倾斜。
一些益生菌也能通过影响Th1/Th2 平衡,从而发挥作用。
植物乳杆菌(NR16)
从发酵韩国泡菜中提取的植物乳杆菌(NR16) 是一种强大的 Th1 诱导剂,当 NR16 与免疫细胞共培养时,它可以产生大量的 IFN-γ 和 IL-12,并且在同时口服 NR16 可降低小鼠气道高反应性和白细胞浸润。此外,口服 NR16 可以通过诱导 Th1 免疫反应来缓解过敏性鼻炎症状,这反过来又可以通过减少特定粘膜病变中 Th2 细胞因子的产生来重新平衡 Th1/Th2 比率。
植物乳杆菌可增加过敏性鼻炎小鼠模型中Th1型细胞因子(IFN-γ、特异性血清IgG2a)的产生,Th2型细胞因子(IL-4、IL-5、IL-13)减少并达到Th1/Th2的平衡。
泛福舒
一项随机对照研究表明,与对照组相比,泛福舒治疗后,泛福舒组鼻腔灌洗液中IL-4和IL-13的含量显著降低,而INF-γ的含量显著升高,导致IL-4/INF-γ的比值显著降低,泛福舒可以调节Th1/Th2细胞因子平衡,作为一种潜在的细胞信号机制,提高整体粘膜免疫。
短双歧杆菌
研究人员证实,口服短双歧杆菌可抑制 Th2 反应并诱导 CD4+CD25+Tregs 活性,但不引起 Th1 反应,但可调节 Th1/Th2 平衡并具有抗过敏作用。
其次,大剂量短双歧杆菌可显着减少打喷嚏的频率,同时降低血清IL-4和特异性IgE水平,增加脾脏中CD4+CD25+ Tregs的数量,显着降低鼻黏膜上皮的过敏反应,低剂量的短双歧杆菌只能轻微缓解过敏反应。
2型先天性淋巴细胞(ILC2)是一种先天性免疫细胞,缺乏表面标记物,因此难以识别。它们反映Th2型细胞,在过敏发展中发挥着重要作用。
我们知道,过敏性鼻炎是一种IgE介导的炎症,导致鼻粘膜中Th2细胞和II型细胞因子的数量增加。
研究人员发现鼻粘膜中ILC2的数量与过敏性鼻炎临床视觉模拟量表(VAS)评分呈正相关。
肠道微生物群失调如何影响过敏性鼻炎
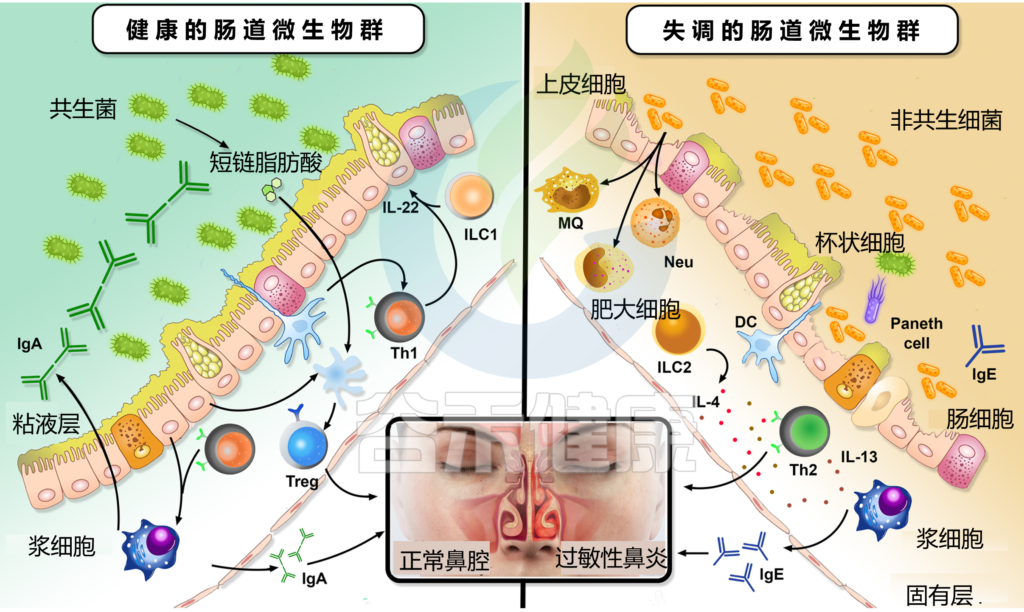
Li J, et al., Eur Arch Otorhinolaryngol. 2022
为什么ILC2在过敏性鼻炎的调节中起重要作用?
过敏性鼻炎患者中多种脂质受体上调,包括CysL1R(LTD4配体)和PGD2。尽管LTD4可激活ILC2中IL-4的产生,但过敏性鼻炎患者鼻分泌物中IL-4水平没有显著变化。
臭氧通过诱导ILC2释放IL-5和IL-13来加重过敏性鼻炎症状。
患有屋尘螨敏感的过敏性鼻炎的儿童外周血ILC2水平显著升高。所有这些发现表明ILC2在过敏性鼻炎的调节中起着重要作用。
肠道菌群对ILC2的影响
值得注意的是,肠道微生物群影响ILC2通过肠-肺轴从肠道向肺的迁移。例如,变形菌门显著促进了上述迁移,并促进了IL-33的产生。
此外,呼吸道过敏的发展与Ruminococcus gnavus的丰度增加有关联。
研究人员发现,肠道菌群失调刺激ILC2和树突状细胞产生2型细胞因子,并促进嗜酸性粒细胞和肥大细胞的肺浸润。
另一方面,肠道微生物群发酵膳食纤维产生的短链脂肪酸抑制ILC2的功能,防止肺部炎症。因此,研究表明ILC2s的活性受到肠道微生物群的调节,但其潜在机制尚未得到充分阐明。
益生菌可以通过抑制ILC2的激活来控制过敏性鼻炎的发生和发展
在一项木瓜蛋白酶诱导的BL6小鼠的研究中,益生菌大肠杆菌菌株Nisle 1917(ECN)的治疗导致IL-5的降低较小,IL-13,IL-33的水平显著降低。ECN处理的小鼠具有显著更低的CD3+CD4+IL5+和IL13+细胞频率。数据表明,ECN能够抑制Th2和ILC2的活化以及原型致敏IL-5和IL-13的产生。
然而目前的研究相对有限,需要更多的基础和临床研究来评估未来的长期治疗效果。
对于肠道菌群在人和动物过敏性鼻炎模型中的研究显示,在益生菌的作用下,大多数血清炎症因子都有不同程度的下降,如IL-4、IL-5、IL-13、IgE、特异性血清IgG1、嗜酸性粒细胞和嗜碱性粒细胞水平减少,但一些抗炎因子增加,如 IL-10、IFN-γ 和特异性血清 IgG2a 分泌增加。因此,益生菌可以通过提高血清中炎症因子的水平来缓解过敏性鼻炎患者的炎症反应,从而减轻他们的临床症状。
NVP-1703 益生菌混合物:IL-5↓ IL-13↓ IL-10↑
(长双歧杆菌IM55 和植物乳杆菌IM76)
一项关于多年过敏性鼻炎的成人研究评估了NVP-1703益生菌混合物(长双歧杆菌IM55和植物乳杆菌IM76)干预4周的疗效和安全性,IL-4血清中尘螨水平无明显变化,但尘螨特异性IgE水平显著降低。在第4周,与安慰剂组相比,NVP-1703组的血清IL-5和IL-13水平降低,而IL-10水平显著升高。
泛福舒:IL-4↓ IL-13↓ INF-γ↑
在早期研究中,60名过敏性鼻炎患者被随机分为泛福舒(BV)组和对照组。泛福舒治疗后,治疗组的药物评分明显低于对照组,且个体和总体鼻症状评分均显著低于对照组。
泛福舒组鼻腔灌洗液中的IL-4和IL-13水平显著降低,而干扰素γ(INF-γ)水平显著升高,这使得IL-4/INF-γ比值显著降低,嗜酸性粒细胞也显著减少,过敏性鼻炎患儿呼吸道病毒感染率/严重程度的增加可能由多种机制引起,但IFN-γ缺乏可能是其中之一,益生菌可以通过提高IFN-γ水平来改善呼吸道病毒感染。
植物乳杆菌:IL-4↓ IL-5↓ IL-13↓ IgE↓ IgG1↓ IFN-γ↑ IgG2↑
在过敏性鼻炎小鼠模型中,口服植物乳杆菌可减少过敏性鼻炎小鼠模型鼻腔和肺部浸润细胞数量,而支气管肺泡灌洗液和引流淋巴结标本显示免疫细胞计数减少,IL-4、IL-5、IL-13、血清IgE和特异性血清IgG1水平降低,IFN-γ和特异性血清IgG2a分泌增加,可改善过敏性鼻炎。
丁酸梭菌:IgE/G1↓ IL-10↑ 逆转Th1/Th2失衡
显着降低了肺阻力、肺气道炎症、肥大细胞脱粒、小鼠气道炎症重塑和 OVA 特异性 IgE/G1 表达。同时,它还逆转了Th1/Th2失衡,增加了抗炎血清因子IL-10.
益生菌发酵的红参:IL-4↓ IgE↓
益生菌发酵的红参(FRG)对卵白蛋白(OVA)诱导的小鼠过敏性鼻炎模型的影响是,FRG比红参更有效地降低支气管肺泡灌洗液、鼻液和血清中的IL-4和IgE水平,表明FRG比红参具有更好的免疫调节作用。 FRG 治疗可减少炎症。
瑞士乳杆菌SBT2171:IL-4↓ IL-13↓ IFN-γ↑ IL-10↑
瑞士乳杆菌SBT2171(LH2171)可在体外诱导抗原刺激的幼稚小鼠脾细胞产生细胞因子,从而抑制IL-4和IL-13的产生,并增加IFN-γ和IL-10的产生。
Treg作为免疫抑制性CD4+T细胞,而Th17作为炎性CD4+T细胞,两者之间的平衡是维持人体免疫系统稳定性的关键条件。 过敏性鼻炎患者Th1/Th2失衡。
益生菌可以通过调节Treg/Th17的平衡来改善过敏和免疫疾病的调节,并产生了一些具有相当效果的靶向治疗方法。
对变应性真菌性鼻窦炎患者的研究表明,血清中IL-1、IL-17、IL-21和TGF-β的分泌都有不同程度的增加,导致Th17/Treg平衡Th17方向的偏移。
研究数据证实,过敏性鼻炎患者外周血中炎性因子如IL-17、IL-35和Th17的分泌增加,炎性因子的增加导致Treg/Th17失衡,进而导致Th1/Th2失衡,导致一系列过敏性鼻炎典型临床症状和鼻粘膜纤毛破坏,鼻腺增生和炎性细胞浸润。
益生菌通过影响Treg / Th17的平衡调节自身免疫
梭菌孢子诱导CD4+FoxP3+Treg细胞可以抑制Th17细胞的促炎反应。
使用益生菌混合物VSL#3来诱导Treg细胞的增殖。
细胞实验表明,乳酸菌上清液可以减少CD4+T细胞、CD8+T细胞和粘膜相关恒定T细胞等的活化,乳酸菌的产物可以抑制这些细胞的增殖和脱颗粒。
其他研究表明,炎症引起的T细胞代谢变化会影响Treg细胞的免疫功能。例如,糖酵解过程中的烯醇化酶可以调节外显子中FoxP3的结合变体,以及应激状态引起的Treg代谢变化,这是触发自身免疫反应的重要部分。
使用干酪乳杆菌作为干预对照,结果表明,干预组脾脏中CD4+CD25+Foxp3+Treg的百分比增加,而CD4+IL-17A+Th17细胞的百分比降低,调节了Treg/Th17细胞比例的失衡。
另一项研究表明,鼠李糖乳杆菌GG(LGG)提取物可以通过Toll受体(TLR2)途径,降低IL-17+Th17的比率,增加CD25+Foxp3+Treg的比率,从而维持Treg/Th17的稳态。
树突状细胞(DC)是体内最有效的抗原呈递细胞(APC),通过调节对微生物抗原的耐受性和免疫性,可以有效诱导抗原特异性免疫应答。
益生菌可能通过调节树突状细胞成熟和免疫耐受性树突状细胞(TDC)产生,产生抗炎细胞因子,从而抑制炎症,影响免疫调节。
免疫耐受性树突状细胞在调节免疫耐受中发挥关键作用
其特征在于表达共刺激分子(CD80/CD86)的半成熟表型,其可通过TLR配体或通过暴露于特定细胞而激活,在因子环境中分化。
此外,它们还表达免疫调节分子并产生免疫抑制因子,半成熟的共刺激CD80/CD86信号通过CD28分子的作用影响T细胞上Treg的激活,进而诱导免疫耐受。
目前,一些临床试验正在进行,以探讨TDC作为免疫介导疾病的替代治疗方案的有效性。与抗炎分子相比,这些TDC具有半成熟表型,表现出低水平的T细胞共刺激特性,并且产生促炎细胞因子的能力降低,特别是通过调节性T细胞(Tregs)的扩增和/或诱导。
其他研究也表明,TDCs分泌抗炎细胞因子并调节T细胞,以促进小鼠和人类肠道中Foxp3+Treg的发育。在全球范围内,这些数据表明DC/Treg/B调节轴通过重新建立耐受性和调节Tregs在肠道中发挥中心作用。
菌群的免疫调节作用来自免疫细胞与肠道树突状细胞的相互作用
最近的证据表明,益生菌可能通过调节DC成熟和TDC产生,从而抑制炎症,从而影响体外和体内的免疫调节。益生菌的免疫调节作用来自免疫细胞与肠道DC的相互作用,从而调节先天和适应性免疫系统。
研究表明,益生菌能够与DC上的模式识别受体(PRR)反应,后者检测病原体上不同的进化保守结构(病原体相关分子模式,PAMP),或通过产生可溶性化合物,从而诱导TDCs。
不同种类和菌株的益生菌可能直接影响树突状细胞的成熟,益生菌可能调节抗炎细胞因子的水平,如转化生长因子β(TGF-β)、IL-10,并诱导Treg。
一项针对四种益生菌菌株(包括唾液乳杆菌、双歧杆菌、凝结芽孢杆菌和纳豆枯草杆菌)的研究,都诱导DC产生IL-10和TGF-β,双歧杆菌和凝结芽孢杆菌表现出更强的诱导IL-10和转化生长因子-β的能力。因此,益生菌诱导的树突状细胞活性产生抗炎细胞因子在免疫调节功能中起着关键作用。
总之,益生菌通过调节TDC活性是过敏性鼻炎治疗的潜在靶点。
Toll样受体(TLRs)是机体免疫的主要组成部分之一,是肠粘膜淋巴细胞和上皮细胞表面表达的识别受体,为入侵病原体和炎症反应提供防御屏障。
肠道共生菌群的一部分,可以通过与TLR相互作用,在控制免疫反应中发挥关键作用。
TLR位于细胞质膜和细胞内内体中,可检测细菌、病毒和真菌的一系列致病分子模式,树突状细胞中TLR的激活可影响适应性免疫反应。
许多微生物感染可以激活TLR4信号,而肠道共生微生物群的一部分,可以影响TLR4.
益生菌多糖胶囊可以通过调节Th1/Th2平衡、诱导T调节细胞分化和激活DC,进而通过TLR与肠道微生物群相互作用,在控制免疫反应中发挥关键作用。
在一项益生菌(鼠李糖乳杆菌GG)与舌下免疫疗法(SLIT)联合的研究中,组间分析表明,与SLIT维生素D组相比,SLIT益生菌组的CD4+CD25+Foxp3+诱导率显著增加,相比之下,TLR阳性细胞组的百分比降低更多。
研究表明,益生菌产生的瞬时蛋白可以诱导TLR的产生,这种蛋白可以缓解特定IgE引起的过敏反应。
此外,一些TLR可以刺激DC激活,进而导致Treg细胞产量增加。先前的研究指出,TLR可能是益生菌影响Treg细胞增殖和分化的潜在靶点。
菌群可以依赖TLR4/NF-κB途径调节过敏性炎症
在一项研究中,阐明了益生菌对TLR4/NF-kB通路在调节宿主对肺损伤和气道炎症的防御中的调节作用。过敏性婴儿哮喘和TLR有影响。
结果表明,β-乳蛋白刺激导致巨噬细胞TLR4/NF-κB信号通路的转导增加。
嗜酸乳杆菌KLDS 1.0738干预通过抑制TLR4通路显著减少过敏性炎症。此外,嗜酸乳杆菌KLDS 1.0738菌株可以显著降低TLR4转导和炎性细胞因子的产生,这与miR-146a水平的上调密切相关。
// 小结
总的来说,肠道菌群可以通过减少血清促炎因子、增加免疫细胞数量、调节Th1和Th2平衡、增加Treg数量和抑制Th17等方式来预防过敏性鼻炎的发生发展,此外,某些菌可以直接刺激TDC的形成或激活TLR通路以间接刺激DC,从而诱导Treg的形成。
通过增加有益细菌的水平可以调节肠道微生物群的稳定性,恢复肠道粘膜屏障,从而改善过敏性鼻炎。
可以根据疾病的具体严重程度、疾病类型和生活方式选择合适的治疗药物。
过敏性鼻炎的治疗选择

▸鼻用皮质类固醇
局部鼻用皮质类固醇起效迅速,尤其是缓解鼻塞。外用类固醇与特定的细胞质糖皮质激素受体 (GRs) 结合,激活抗炎基因转录并抑制促炎基因转录,外用类固醇的抗炎作用可减轻所有鼻部和眼部症状。
▸外用类固醇联合抗组胺药
MP Aze-Flu 是一种由盐酸氮卓斯汀和丙酸氟替卡松组成的鼻喷雾剂,在症状评分和生活质量方面比安慰剂或丙酸氟替卡松单独有效。
▸ 鼻塞减轻剂
由于鼻黏膜的反弹作用和习惯作用,连续使用最好不超过7天。大部分药物可使α肾上腺素受体起作用,引起血管舒张和收缩,可立即缓解鼻塞症状,主要包括伪麻黄碱、羟甲唑啉、三唑啉或去氧肾上腺素。
▸鼻用抗胆碱能药和色甘酸钠/肥大细胞稳定剂
主要影响鼻腔分泌物的鼻用色甘宁和抗胆碱能药有一些较早的研究,但没有足够的证据做出充分的推荐。
▸盐水冲洗
增加儿童的鼻腔冲洗是有益的,可以减少鼻嗜酸性粒细胞和中性粒细胞。
全身性糖皮质激素的所有机制均受 GR 的调节,GR 属于配体调节的核受体超家族,类固醇的抗炎作用可以通过三种广泛的分子机制来解释:促炎基因表达降低、抗炎炎症基因表达增加和非基因组机制。
▸口服抗组胺药
已在多种细胞上鉴定出四种组胺受体 H1 和 H2 受体,可刺激过敏反应的早期和晚期。第二代/第三代非镇静 H1 受体拮抗剂是过敏性鼻炎的首选抗组胺药。
许多研究表明西替利嗪是有效的,并且西替利嗪在症状缓解方面优于氯雷他定,并且具有良好的安全性。
▸白三烯受体拮抗剂(LTRA)
白三烯是炎症介质家族,包括LTA4、LTB4、LTC4、LTD4和LTE4,通过阻断半胱氨酸LT1(CysLT1)受体,LTRAs(如蒙特鲁甾醇)可以改善过敏性鼻炎和哮喘症状。目前,口服色甘酸作为肥大细胞稳定剂的研究不足。
迄今为止,过敏原免疫疗法是目前唯一可用于 IgE 介导的过敏性疾病患者的免疫调节和因果治疗。
过敏原免疫疗法的目的是对免疫系统进行重新编程以减少特异性IgE的产生,从而诱导对过敏原的耐受,可通过不同的给药途径分为皮下免疫和舌下免疫两种方式,通过不断增加过敏原剂量使患者脱敏。
同时,研究人员发现接种疫苗可以改善长期空气污染对过敏性呼吸道的负面影响。针对风疹、伤寒和天花的预防性免疫显示过敏性鼻炎的发生率较低,而麻疹疫苗的过敏性鼻炎发生率较高。
目前过敏性鼻炎的治疗仍然基于过敏原避免、症状缓解药物、抗炎治疗和过敏免疫治疗。现阶段过敏性鼻炎治疗药物不良反应多且无法治愈,症状易反复,免疫治疗疗程较长,依从性差,同时降低生活质量。
肠道微生物群正在成为早期治疗特应性疾病的新靶点,如过敏性鼻炎也是特应性疾病的一种。
益生菌可以用作宿主防御途径的免疫调节剂和激活剂,口服益生菌可以调节呼吸系统的免疫反应,并可以通过调节肠道微生物群和免疫反应的变化来预防和治疗上呼吸道疾病。
国际上对益生菌作为替代治疗方法的研究和应用正在增加,大多数研究表明益生菌可以显着改善过敏性鼻炎患者的症状。
接下来我们详细了解基于菌群干预的过敏性鼻炎疗法。
作为调节肠道菌群平衡的重要手段,益生菌包括多种细菌,其主要作用是维持免疫系统的平衡,改善菌群结构,恢复菌群平衡,同时,它可以减轻肠道局部黏膜炎症反应,恢复黏膜屏障,阻断外来病原体的入侵。
前面章节我们了解到,益生菌可以激活 Th1 或抑制 Th2,引起抗炎作用,还可以刺激免疫因子如IL-10的产生,其主要作用是抑制炎症反应。
因此益生菌治疗过敏性鼻炎的基础研究和临床应用越来越多。
➤ 关于益生菌改善过敏性鼻炎的研究
益生菌的使用可积极改善克雷伯菌与双歧杆菌的比例,并可预防过敏性疾病的发展。
对过敏性鼻炎大鼠的研究表明,婴儿双歧杆菌和长双歧杆菌的混合物LacB可以降低粘膜中H1受体和脱羧酶组氨酸的mRNA表达,从而减轻过敏性鼻炎表现。
在一项双盲安慰剂对照试验中,与安慰剂组相比,食用5个月的干酪乳杆菌(LcS)会导致IgG水平升高,IL-6、IL-5和干扰素γ(IFN-γ)水平显著降低。
研究人员还调查了嗜酸乳杆菌对患有实验性过敏性鼻炎的BALB/c小鼠的影响,并报告使用第二周后喷嚏明显减少,而对照干预措施在第四周减少了喷嚏。
在对1919名过敏性鼻炎患者的23篇论文进行的系统回顾和荟萃分析中,研究人员表明益生菌可能有效缓解过敏性鼻炎患者的症状和生活质量。
在另一项系统综述中,包括了11项关于使用益生菌治疗和预防过敏性鼻炎的随机对照试验。研究结果表明,益生菌的使用与过敏性鼻炎患者的生活质量和鼻腔症状的显著改善有关。
关于益生菌治疗过敏性鼻炎的研究


Liu P, et al., J Asthma Allergy. 2022
研究表明,添加益生菌可以通过恢复肠道菌群紊乱来调节过敏性鼻炎的免疫反应。
一项研究指出,用益生菌发酵乳治疗后,患者的血清特异性IgE显著降低,免疫功能显著改善,体内肠道菌群结构得到改善,肠道菌群平衡得到恢复,症状也显著缓解。
用从人类粪便和泡菜中分离的长双歧杆菌和植物乳杆菌的益生菌混合物(PM)进行过敏性鼻炎治疗,可以通过控制肠道菌群紊乱(显著抑制变形菌,增加拟杆菌和放线菌的组成)来缓解过敏性鼻炎。
也有结果表明,益生菌和L-谷氨酰胺可以有效调节过敏性鼻炎患儿治疗过程中胃肠肽的水平,恢复肠道菌群的平衡,并恢复肠黏膜的屏障功能,从而达到治疗目的。
基于上述研究结果,可以看出益生菌可以调节和恢复肠道微生物群紊乱以治疗过敏性鼻炎。
当然,也有研究中发现益生菌治疗后效果没有明显改善的,例如:
在一项关于益生菌治疗过敏性鼻炎疗效的研究中,患者的过敏症状没有明显缓解,但与治疗前相比,一些患者的鼻粘膜微环境有所改善。
17项纳入的研究发现,益生菌治疗至少在一个结果指标上比安慰剂有显著的治疗优势,而六项试验未发现效果。
目前,作为临床过敏性疾病研究的一个新方向,益生菌有望成为过敏性鼻炎控制和治疗的潜在新目标。益生菌治疗的可能机制如下图所示:
益生菌治疗过敏性鼻炎的简要机制

Liu P, et al., J Asthma Allergy. 2022
益生菌作为过敏性鼻炎的辅助疗法,不仅可以从深层次恢复肠道微生物群紊乱,缓解鼻过敏的典型症状,而且具有高性价比和低风险的优势。
然而需要注意的是,目前的关于益生菌的基础研究仍在进行中,益生菌的最佳菌株、剂量和持续时间还需要进一步探索,同时,在引入新的治疗方法的过程中,有必要注意其可能带来的副作用。
益生元是影响肠道微生物群组成和活性的特定膳食成分。常用的益生元是乳糖醇、乳果糖、菊粉、乳糖、低聚果糖、低聚半乳糖和大豆低聚糖等。
◣ 益生元对IgE水平高的过敏性鼻炎成人的影响
在52周内,患者接受乳糖,并测量其血清IgE水平。治疗一年后,血清IgE水平(尤其是花粉过敏原)显著降低,同时伴有过敏症状的缓解。
一项研究比较,干燥的Ma-al-Shaeer(一种富含纤维的传统伊朗药物,配方基于大麦)与非索非那定对成人过敏性鼻炎患者的影响。
受试者连续14天每天两次接受口头提及的制剂。两组过敏性鼻炎的临床病程均得到改善,而Ma al-Shaeer组的鼻塞、鼻后滴漏和头痛评分显著降低。
◣ 益生元被广泛用作婴儿配方奶粉的补充
一项研究评估了益生元寡糖对过敏的保护作用。
在这项随机对照试验中,具有特应性风险的健康婴儿在出生后的前六个月接受了补充益生元或补充安慰剂的配方奶粉喂养。随访期为五年。
补充益生元组的累计过敏表现发生率显著降低。该干预措施对预防过敏性鼻结膜炎和过敏性荨麻疹特别有益。
其他关于益生元预防/治疗哮喘或过敏性鼻炎的研究
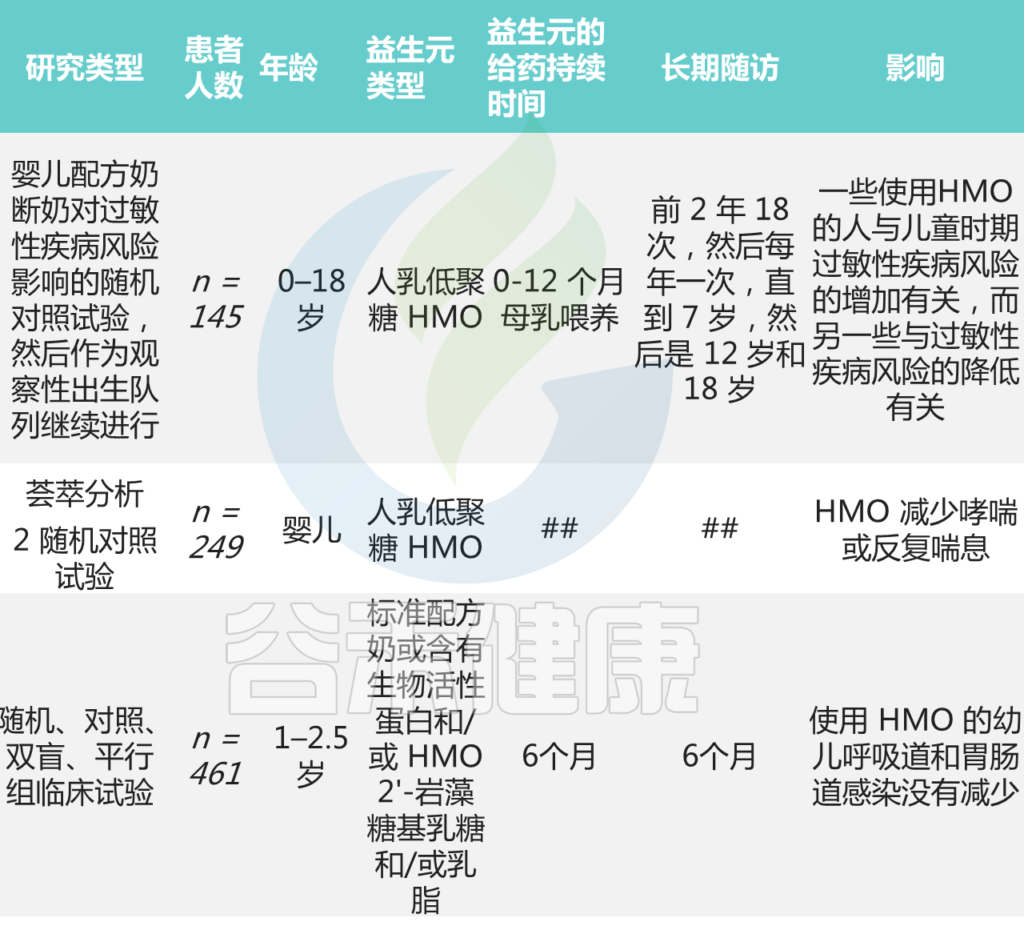
Meirlaen L, et al.,Nutrients. 2021
总之,关于益生元用于预防和治疗过敏性鼻炎的数据仍然不足。然而,它们调节细胞因子释放的能力,似乎是治疗过敏性疾病的一种新的、有前途的方法。
合生元治疗过敏性鼻炎的研究也很少,个别研究益生菌功效的试验实际上涉及合生元。
关于合生元预防/治疗过敏性鼻炎的研究
Meirlaen L, et al.,Nutrients. 2021
合生元对预防过敏性鼻炎的作用仍未得到解答,需要更多设计良好的研究,仅研究合生元对过敏预防和/或治疗的影响。
细菌裂解物是由源自呼吸道病原体的抗原组成的免疫调节制剂。最常见的是肺炎链球菌、流感嗜血杆菌、卡他莫拉菌、化脓性链球菌、绿色链球菌、金黄色葡萄球菌、肺炎克雷伯菌和奥扎纳克雷伯杆菌。
该制剂可通过化学或机械裂解获得。不同的生产方法可以产生不同的免疫效果。细菌裂解物可以口服、鼻内和舌下给药。这里讨论了口服给药对肠道环境的影响。
细菌裂解物的作用机制基于自然暴露于病原体抗原和随后的免疫反应。它们通过Toll样受体激活DC,促进抗病毒细胞因子释放、NK细胞活化和Th1/Th2平衡的恢复。
只有五项研究调查了细菌裂解物对过敏性鼻炎的影响。其中两个使用口服OM-85。
OM-85
一项开放标签的顺序研究,研究了在过敏性鼻炎、哮喘或慢性阻塞性肺疾病患者中使用OM-85对呼吸道感染率、原发病加重率和症状严重程度的影响。
减少过敏性鼻炎发作次数,严重程度减轻
患者分三个周期接受制剂,包括连续10天的摄入,然后休息20天。他们表明,与前一年相比,OM-85治疗减少了呼吸道感染和过敏性鼻炎发作的次数,并缓解了过敏症状的严重程度,而前一年患者只接受了标准的优化护理。
已证明血清和唾液IgA水平增加。为了进一步扩大这项研究,评估了60名常年过敏性鼻炎患者的临床效果。参与研究的参与者按照与前述研究相同的方案服用OM-85。治疗后,OM-85组的总鼻部症状评分、瘙痒评分、鼻溢评分、喷嚏评分和药物评分均显著下降。此外,观察到鼻IFN-γ增加,鼻IL-4和IL-13水平降低,鼻拭子中嗜酸性粒细胞数量减少。
细菌裂解物不会直接影响肠道细菌;然而,它们刺激的细胞因子可能会影响肠道环境。关于细菌裂解物对过敏性鼻炎的影响还需要更多的研究。
粪菌移植是将健康供体的粪便转化为粪便悬浮液,并将其施用于患者的肠道,以重建肠道微生物群的平衡的过程。目前,没有关于其在过敏性鼻炎治疗中的应用的研究;然而,这可能是恢复肠道细菌组成的一种有前途的方法。潜在地,它可能比益生菌更有效,因为其显著更丰富的注入微生物和永久定植肠道的能力。
一项研究证实了这一假设,他们研究了粪菌移植对成年特异性皮炎患者的影响。结果表明,粪菌移植后特应性皮炎评分显著降低。此外,在研究和随访期间,每周局部使用皮质类固醇的情况有所减少。
肠道微生物群的宏基因组分析显示,从供体到患者的细菌菌株传播显著。未观察到治疗的不良反应。
然而,关于其在过敏性疾病中的应用,仍然没有足够的数据;因此,需要更多的大样本研究。
高质量的饮食结构,如水果和蔬菜、高纤维食物、鱼、低脂食物、蛋白适量,可以增加肠道多样性,维持肠道菌群平衡,有助于平衡免疫反应。
研究表明饮食习惯和肠道微生物群与过敏性疾病有关。
一项研究招募了 186 名有过敏性鼻炎症状的参与者和 106 名没有过敏性鼻炎症状的对照受试者,该研究结果深入了解膳食营养素、肠道微生物组、肠道免疫系统和过敏性鼻炎发展之间的复杂相互作用。

维生素A
关联分析表明,视黄醇、维生素 A、隐黄素(维生素A原的一种)、铜与经年龄和性别调整后的过敏性鼻炎几率相关。
维生素A的主要膳食来源是动物性食物中的视黄醇,水果、蔬菜、蛋黄和黄油中的维生素A类胡萝卜素原。
在该研究人群中,维生素A和视黄醇的膳食摄入水平高度相关(R = 0.96).
维生素A对人体的多种功能至关重要,包括胚胎发育、良好视力、上皮分化和维持免疫功能,特别是在幼稚T细胞分化中。
如果没有维甲酸(注:维甲酸是维生素A的代谢产物),转化生长因子β(TGF-β)促进初始T细胞分化为Th17细胞,后者参与炎症、自身免疫和过敏性疾病。
在视黄酸的存在下,TGF-β帮助肠道树突状细胞介导幼稚T细胞分化为Treg细胞,从而抑制自身免疫反应。
在该研究中检测的类胡萝卜素中,只有隐黄素与过敏性鼻炎相关。
铜 和过敏性鼻炎之间:反向J形关系
铜是一种重要的微量金属,是许多氧化还原酶的辅因子,它参与铁代谢、抗氧化活性、神经肽合成和免疫功能。缺铜和过量铜都会对健康产生不利影响。
在该研究中,观察到铜和过敏性鼻炎之间的反向J形关系。这种反向J形曲线可能分别与铜在适当浓度和高浓度下的抗氧化和促氧化活性有关。
高膳食摄入视黄醇与类胡萝卜素与高丰度普雷沃氏菌的结合,可能对过敏性鼻炎的发展具有保护作用
该研究认为四种营养素(视黄醇、维生素A、隐黄质和铜)和两种肠道菌属(普雷沃氏菌属和大肠杆菌属)与过敏性鼻炎的年龄和性别调整几率相关。
此外,还观察到视黄醇和普雷沃氏菌的组合保护作用,与低视黄醇摄入量和低普雷沃氏菌丰度的受试者相比,高视黄醇摄入和高普雷沃氏菌丰度受试者的年龄和性别调整后的过敏性鼻炎几率低25倍。
绿叶蔬菜、时令水果,含有多种维生素和矿物质,有助于对抗过敏性鼻炎。
绿叶蔬菜包括菠菜、羽衣甘蓝、生菜、芝麻菜等,对于提高免疫系统非常重要。其他还包括黄瓜、大蒜、番茄、红椒、南瓜、红薯、西葫芦、西芹等,都是非常好的食物。水果包括香蕉、柠檬、橙子、蓝莓等。
当然并不是马上有效,这个饮食结构调整需要持续一定的时间。
生姜
生姜的抗炎特性有助于治疗花粉症引起的眼睛、鼻子和喉咙的瘙痒、刺激和炎症。
柑橘类水果
柑橘类水果有助于治疗过敏性鼻炎的症状以及由此引起的上呼吸道刺激。葡萄柚、柠檬、酸橙、橙子、浆果是维生素 C的丰富来源。
姜黄
姜黄抗炎和抗氧化特性,有助于治疗缓解过敏性鼻炎引起的症状。它有助于减少过敏引起的刺激和肿胀。 姜黄可以通过茶、药丸或酊剂服用,甚至可以添加到烹饪时食用的食物中。
西红柿
番茄红素是西红柿中的一种抗氧化化合物,有助于减少过敏引起的炎症。
洋葱
洋葱有抗炎和抗氧化特性,同时富含榭皮素,榭皮素是一种天然抗组胺剂,有助于减轻过敏性鼻炎的症状。
omega-3 脂肪酸
鱼(金枪鱼,三文鱼等)、杏仁、核桃、南瓜和亚麻籽富含的omega-3 脂肪酸的饮食,可以降低儿童和成人发生过敏的风险。
怀孕期间和产后早期摄入 omega-3 脂肪酸的母亲可能会调节免疫系统并降低孩子发生过敏症的风险。
其他饮食建议
易过敏体质尽可能从饮食中去除蛋,乳制品,麸质谷物等容易造成过敏的食品。尽可能减少摄入添加糖和加工食品。
研究发现,一些草药对过敏性鼻炎具有治疗作用,并显示出一些治疗前景。
Septilin
Septilin是一种阿育吠陀草药配方,含有苦皮草、堇叶天花粉、茜草、山茱萸、辣木和甘草,也显示出治疗过敏性鼻炎的巨大潜力。
在一项双盲研究中,190人接受了以上草药组合或标准抗组胺药(扑尔敏)治疗。结果表明,两种治疗方法同样有效。
在这项对32名健康人进行的双盲安慰剂对照试验中,使用Septilin 4周可显著减少皮下注射组胺引起的过敏反应。Septilin也被用作提高免疫力的治疗方法。
在一项针对40名持续性低度感染(如慢性咽痛或鼻窦感染)儿童的双盲安慰剂对照研究中,与安慰剂相比,服用Septilin1个月可显著改善病情。
异株荨麻
一项初步研究表明,异株荨麻 ( Urtica dioica ) 的冻干胶囊可减少患者的打喷嚏和瘙痒。推荐剂量为 600-900 mg TID。荨麻在植物医学中具有治疗咳嗽、肺结核和关节炎的历史用途。体外研究表明它还可能具有抗炎作用。
蓍草(Achillea millefolium)
蓍草是一种多年生草本植物,在欧洲和亚洲很常见。这种多用途草本植物具有抗氧化、健胃、解痉、收敛和透明的特性。传统上用于治疗感冒、流感和发烧,蓍草也可以是对抗过敏性鼻炎的有效药物。
它的抗菌和抗卡他性作用使其成为呼吸系统的理想草药,这种天然的治疗剂还治疗鼻窦炎和粉尘过敏。可以以茶的形式或作为酊剂服用。这是一种强效草本植物,不建议超过连续两周的限度。此外,如果对豚草过敏,应该避免这种草药。
蜂斗菜 ( Petasites hybridus )
在一项开放标签研究中,580名季节性过敏性鼻炎患者服用了50-75 mg BID的蜂斗菜提取物2周(每片含8 mg petasine)。
与基线相比,90%的患者在治疗后,改善了鼻漏、鼻塞、眼睛和鼻子发痒、眼睛发红和皮肤刺激等症状。
蜂斗菜也是一种温和的白三烯抑制剂,在一项研究中发现其与180 mg非索非那定一样有效。但蜂斗菜含有潜在的肝毒性吡咯里啶生物碱(PA),所以应谨慎使用,或者可以使用不含PA的提取物。它属于豚草科,因此对豚草过敏的人也应谨慎使用。
生蜂蜜
生蜂蜜含有很多种活性植物化学物质,有助于体内激素水平恢复正常,有助于构建强大的免疫系统,从而有助于预防过敏性鼻炎。一项随机对照试验表明,食用桦树花粉蜂蜜的过敏患者过敏症状减少了60%,在桦树花粉季节无症状天数增加了一倍。
维生素E
维生素E也可用于治疗过敏性鼻炎,因为它是一种温和的白三烯抑制剂。
一项研究发现,112名患有过敏性鼻炎的成年人在连续10周每天服用800IU维生素E后,鼻部症状明显改善。富含维生素E的饮食也被证明有助于预防过敏性鼻炎的症状,维生素的保护作用随着剂量的增加而增加。建议使用混合生育酚,而不是单独使用α.
注:生育酚,是维生素E的水解产物。天然的生育酚都是D-生育酚(右旋型),它有α、β、ϒ、δ等8种同分异构体,其中以α-生育酚的活性最强。作为抗氧化剂使用的生育酚混合浓缩物,是天然生育酚的各种同分异构体的混合物。
维生素 C
维生素 C具有抗组胺特性,有助于减轻过敏症状。此外,维生素C也有助于增强免疫系统。因此,它有助于预防感染,同时缩短过敏性鼻炎的持续时间。
因此,每天应多吃橙子、灯笼椒、西红柿、柠檬、草莓、豆芽、土豆、奇异果、西兰花、柚子等富含维生素C的食物。
金钗石斛
金钗石斛具有抗炎和免疫活性,近期的一项小鼠研究发现,石虎提取物的治疗抑制了PI3K/AKT/mTOR通路,在门和属水平上恢复了肠道菌群的平衡,并改善了调节T细胞分化,从而有效地扭转了过敏性鼻炎症状。
适度运动
定期锻炼有助于减少过敏反应,适度运动对有过敏症的人无害,过敏体质的人可以按照普通人群的运动建议进行。这包括每周至少 150 分钟的中等强度有氧运动或 75 分钟的高强度运动。
这些活动包括步行、跑步、骑自行车、跑步机锻炼、游泳等。
瑜伽
瑜伽可以通过很多种方式帮助缓解和治愈身体,甚至有助于缓解过敏性鼻炎的症状。瑜伽中的呼吸练习被称为调息,已被用作治疗哮喘的方法。它可能在减轻与过敏性鼻炎相关的症状方面发挥作用。
注意选择正规教师,一开始不要追求动作的完美,重要的是注意调息。
避免触发因素
一旦确定了过敏原,请尽量远离。例如:
洗鼻子
洗鼻液可以帮助清除鼻子中的过敏原。使用生理盐水喷雾有助于减少接触过敏原。
改善不良习惯
与其他过敏性疾病相比,肠道菌群在过敏性鼻炎发病机制中作用的证据仍然较少,但肠道菌群失调与 过敏性鼻炎之间的关系是显而易见的。
肠道微生物群的高度多样性有助于平衡免疫反应,其机制涉及增加代谢物(如短链脂肪酸)和减少炎症介质的产生。
肠道菌群结构异常与过敏性鼻炎的发生率密切相关,这为我们提供了一个新思路,即肠道菌群失调可能是过敏性疾病的重要预测因子。
目前很多研究已经发现益生菌在临床上治疗过敏性疾病的初步效果,可能会减少过敏症状的发生率和持续时间。然而也有一些研究发现,益生菌治疗并没有显着改善临床症状,这可能是因为临床试验包括许多变量,例如伴随疾病、年龄、性别和许多其他因素,还需进一步探索研究。同时,益生菌辅助联合疗法也是一个值得关注的领域。
总的来说,通过各种方式调节肠道微生物群,恢复肠道粘膜屏障,恢复免疫平衡,抑制炎症,有助于改善过敏性鼻炎,肠道菌群或将成为过敏性鼻炎早期干预的新靶点。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Li J, Fang F, Mei M, Wu D. The gut microbiome and allergic rhinitis; refocusing on the role of probiotics as a treatment option. Eur Arch Otorhinolaryngol. 2022 Oct 14. doi: 10.1007/s00405-022-07694-z. Epub ahead of print. PMID: 36239785.
Zhou MS, Zhang B, Gao ZL, Zheng RP, Marcellin DFHM, Saro A, Pan J, Chu L, Wang TS, Huang JF. Altered diversity and composition of gut microbiota in patients with allergic rhinitis. Microb Pathog. 2021 Dec;161(Pt A):105272. doi: 10.1016/j.micpath.2021.105272. Epub 2021 Nov 2. PMID: 34740809.
Zhu L, Xu F, Wan W, Yu B, Tang L, Yang Y, Du Y, Chen Z, Xu H. Gut microbial characteristics of adult patients with allergy rhinitis. Microb Cell Fact. 2020 Sep 1;19(1):171. doi: 10.1186/s12934-020-01430-0. Erratum in: Microb Cell Fact. 2020 Oct 8;19(1):192. PMID: 32873292; PMCID: PMC7466420.
Kaczynska A, Klosinska M, Chmiel P, Janeczek K, Emeryk A. The Crosstalk between the Gut Microbiota Composition and the Clinical Course of Allergic Rhinitis: The Use of Probiotics, Prebiotics and Bacterial Lysates in the Treatment of Allergic Rhinitis. Nutrients. 2022 Oct 16;14(20):4328. doi: 10.3390/nu14204328. PMID: 36297012; PMCID: PMC9607052.
Liu P, Hu T, Kang C, Liu J, Zhang J, Ran H, Zeng X, Qiu S. Research Advances in the Treatment of Allergic Rhinitis by Probiotics. J Asthma Allergy. 2022 Oct 7;15:1413-1428. doi: 10.2147/JAA.S382978. PMID: 36238950; PMCID: PMC9552798.
Sahoyama Y, Hamazato F, Shiozawa M, Nakagawa T, Suda W, Ogata Y, Hachiya T, Kawakami E, Hattori M. Multiple nutritional and gut microbial factors associated with allergic rhinitis: the Hitachi Health Study. Sci Rep. 2022 Mar 1;12(1):3359. doi: 10.1038/s41598-022-07398-8. PMID: 35233003; PMCID: PMC8888718.
Huang J, Zhang J, Wang X, Jin Z, Zhang P, Su H, Sun X. Effect of Probiotics on Respiratory Tract Allergic Disease and Gut Microbiota. Front Nutr. 2022 Feb 22;9:821900. doi: 10.3389/fnut.2022.821900. PMID: 35295917; PMCID: PMC8920559.
Zoabi Y, Levi-Schaffer F, Eliashar R. Allergic Rhinitis: Pathophysiology and Treatment Focusing on Mast Cells. Biomedicines. 2022 Oct 5;10(10):2486. doi: 10.3390/biomedicines10102486. PMID: 36289748; PMCID: PMC9599528.
Meirlaen L, Levy EI, Vandenplas Y. Prevention and Management with Pro-, Pre and Synbiotics in Children with Asthma and Allergic Rhinitis: A Narrative Review. Nutrients. 2021 Mar 14;13(3):934. doi: 10.3390/nu13030934. PMID: 33799367; PMCID: PMC7999316.

谷禾健康
在这个充满压力、紧张和焦虑的快节奏世界中,人人都容易患上许多身心疾病。
根据世界卫生组织 (WHO) 的数据,世界上每 8 人中就有 1 人患有精神障碍,其中焦虑症和抑郁症最为常见。尤其经历疫情,仅2020年,全球重度抑郁症患者增加27.6%(95%不确定区间(UI):25.1-30.3),焦虑症患者增加25.6%(95%不确定区间:23.2-28.0).

情绪健康对身体健康有直接影响,反之亦然。这背后的原因离不开肠道和大脑之间的双向交流,这两者之间的对话主要是由肠道微生物群介导的。
也就是说,肠道微生物群在神经精神疾病的发病机制中起着至关重要的作用。
精神障碍,包括抑郁、焦虑、恐惧、双相情感障碍、精神分裂症和其他精神病、痴呆、以及自闭症和创伤后应激障碍等,都有一系列症状,比如:异常的思想、感知、情绪、行为和人际关系等。

哪些因素会引发精神疾病?
大多数精神疾病是由环境、心理和生物因素共同引起的。遗传、脑损伤、微生物感染、药物滥用、营养不良或暴露于环境污染物都可能在精神障碍的发展中发挥重要作用。
环境污染物影响精神疾病易感性
随着世界各地工业流程和技术的进步,现代文明产生的各种环境污染物已大大增加。人们在日常生活中会接触到各种各样的污染物,这些污染物会影响肠道微生物群并操纵肠道和大脑之间的双向交流,从而导致精神或神经系统疾病的易感性。
精神益生菌:有助大脑健康的下一代益生菌
精神益生菌是一种能够影响肠-脑轴的益生菌菌株,对改善微生物群以及缓解中枢神经系统疾病的某些症状具有积极作用。常见的精神益生菌包括:乳酸杆菌、链球菌、双歧杆菌、大肠杆菌、肠球菌等。
//
本文讨论了各种环境污染物(重金属、邻苯二甲酸盐、双酚 A 、颗粒物等)如何影响错综复杂的微生物群-肠-脑轴,从而影响神经和整体心理健康,总结了精神益生菌如何通过菌群有效缓解多种中枢神经系统疾病的症状及改善心理健康。
本文涉及的专业术语
CNS—中枢神经系统
ENS—肠神经系统
HPA—下丘脑-垂体-肾上腺
GBA—肠脑轴
MGBA—微生物-肠-脑轴
GABA—一种中枢神经系统抑制性神经递质
VN—迷走神经
BDNF—脑源性神经营养因子
在了解环境污染物如何引发精神疾病之前,我们先来了解一下:微生物群-肠-脑轴。
微生物群-肠-脑轴是如何运作的?
它负责协调肠神经系统(ENS)和中枢神经系统(CNS)之间的双向交流,将外周消化活动与大脑的情绪、行为和认知中心联系起来。
微生物群-肠-脑轴 (MGB) 的双向交流
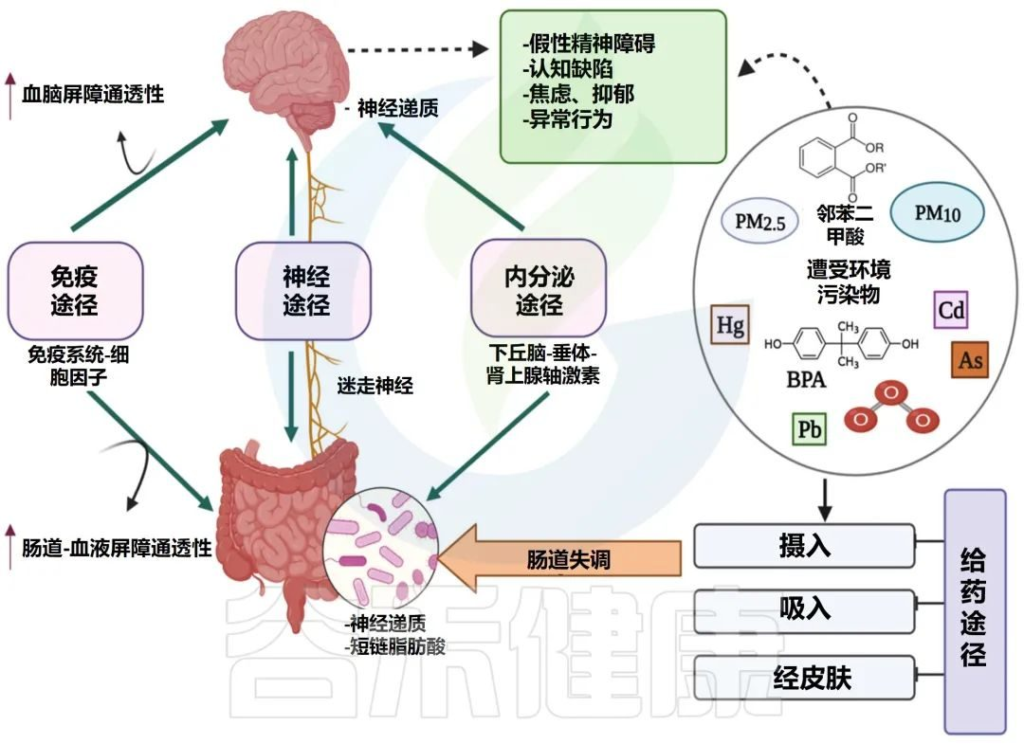
Singh S,et al., Microorganisms.2022
这种关联受皮质醇和下丘脑-垂体-肾上腺(HPA)激素、迷走神经(VN)系统和免疫反应等激素的调节。迷走神经是副交感神经系统的主要组成部分,可将肠道信号传递到中枢神经系统并刺激反应。
肠道菌群在肠-脑轴中如何发挥作用?
肠道菌群可以通过多种潜在机制改变大脑功能:
同时并产生具有神经活性特性的代谢物,例如短链脂肪酸、支链氨基酸、肽聚糖等。
这在我们之前的文章也有详细阐述过:
深度解读 | 肠道菌群和中枢神经系统的关系
微生物群-肠-脑轴如何影响压力、焦虑等?
肠-脑轴的作用已在几个生理过程中得到证实,例如饱腹感、食物摄入以及脂肪和骨代谢、葡萄糖调节和胰岛素分泌。
此外,宿主行为受肠神经系统和中枢神经系统与肠脑轴相关性的影响。这些系统活动的减少与压力或焦虑增加有关。
已经确定肠脑轴活性受降钙素基因相关肽(CGRP)的调节。当增加的病原微生物破坏肠道微生物群时,神经元可以产生CGRP并将其释放到肠道中。感染可诱导CGRP的分泌,进而激活宿主防御和降钙素受体的相应免疫反应。
微生物-肠-脑轴的存在表明,通过饮食、宿主衍生代谢物和不同环境污染物改变肠道微生物的组成和数量,可以影响中枢神经系统和肠神经系统,从而影响精神疾病的发生和发展。
菌群代谢产物——短链脂肪酸
有助于调节中枢神经系统
短链脂肪酸可以通过单羧酸盐转运蛋白穿过血脑屏障(BBB),通过过度表达紧密连接蛋白并保持血脑屏障的完整性。
短链脂肪酸可以调节神经营养因子 (BDNF) 的水平,促进神经发生,影响神经胶质细胞的形态和功能,有利于血清素形成并改善神经元稳态和功能,所有这些都有助于调节中枢神经系统中的神经炎症。
短链脂肪酸与这些肠-脑网络的结合可以直接或间接地改变认知、情绪和精神障碍的病理生理学。
通过调节途径(包括犬尿氨酸途径)改变神经递质活性,以及大脑中短链脂肪酸的可用性和影响的变化,都可能对脑源性神经营养因子(BDNF)功能产生影响,包括中枢神经系统中的神经元存活和分化。
如肽酪氨酸酪氨酸 (PYY)、胆囊收缩素(CCK)和胰高血糖素样肽-1(GLP-1)从表达游离脂肪酸受体(FF-R)的肠粘膜肠内分泌细胞中的释放。在啮齿动物中,血源性PYY和GLP-1会渗透到大脑中,并对神经递质和行为产生显著影响。
每天接触各种环境污染物会影响肠道微生物群,损害肠脑轴,它们是如何导致抑郁、焦虑等心理健康问题的?下一章节我们展开讨论。
我们知道,人体各类疾病(免疫性疾病、胃肠道疾病和神经行为疾病)可能是由于微生物群的变化而产生的,微生物群失调后致病菌增多,产生毒力因子,如脂多糖,从而引发一系列导致“肠漏”的过程。
所谓“肠漏”,即肠黏膜通透性增加,这可能使细菌、细菌毒素和其他小分子物质泄漏到血液中并引起全身炎症。
关于肠漏详见:什么是肠漏综合征,它如何影响健康?
细菌毒素因子和代谢物能够转移到远处的目标区域,例如大脑。激素合成、细菌产生的代谢物、模仿宿主产生的因子和表观遗传突变都是肠道菌群失调影响宿主的潜在机制。
✦ 环境污染物通过干扰菌群影响宿主
暴露于环境污染物会针对宿主和常驻肠道微生物群,其干扰可能会产生系统性影响,包括通过微生物群-肠-脑轴改变中枢神经系统的功能。
重金属、有机溶剂和空气污染物是研究最多的与人类精神疾病和心理功能有关的人造和天然毒物类型。
研究人员发现那些生活在土壤中重金属和重金属浓度较高的地区的人,患精神疾病的可能性更高。即使较低的水平也会导致肠道失调和对心理健康的负面影响。
重金属类型:
铅 (Pb)、镉 (Cd )、汞( Hg )等。
重金属可能以四种方式进入人体:
▸ 重金属如何对人类健康的不利影响?
在重金属到达大脑之前,初步的环境暴露预计会与肠道微生物群相互作用。
当重金属到达胃肠道系统时,重金属毒性可能由肠道微生物组通过代谢氧化或还原过程介导。另一方面,重金属会引起氧化应激,改变肠道屏障的通透性,扰乱人体健康的微生物群,导致菌群失调。肠道菌群失调提高了重金属和氧化应激的潜在破坏性影响,这与精神疾病有关。
肠道菌群对重金属的吸收和代谢的直接影响
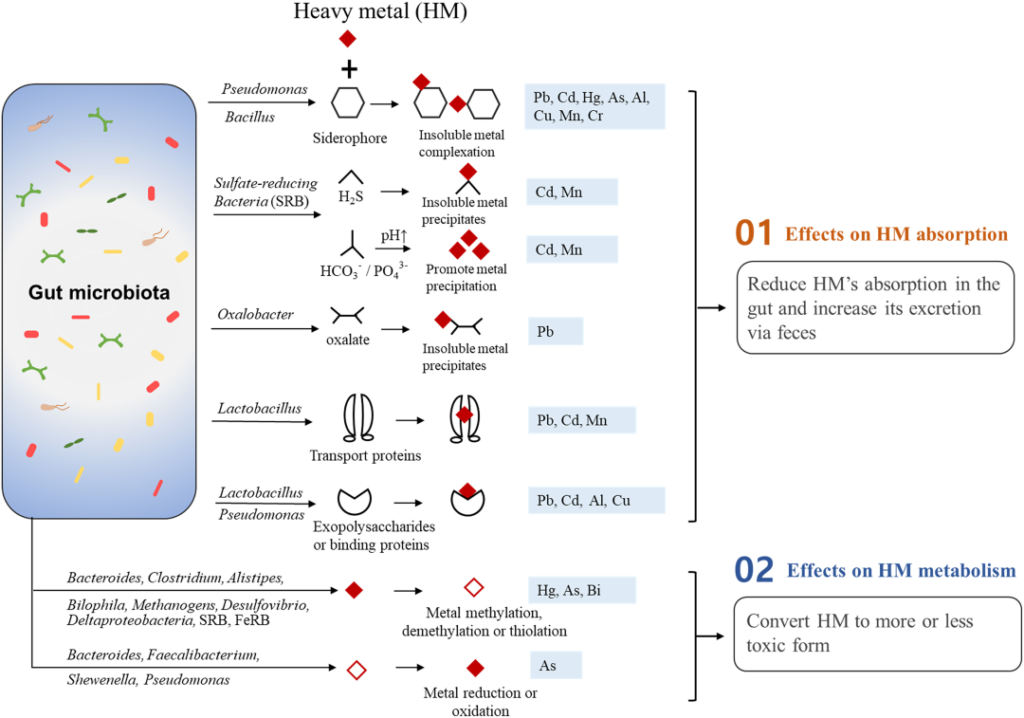
Duan H, et al., Sci Total Environ. 2020
【 铅 】
铅是一种众所周知的神经毒素,它对单胺信号传导 、下丘脑-垂体-肾上腺(HPA)轴和其他几个大脑系统的影响与情绪障碍有关。
几项动物研究表明,接触铅会导致HPA轴永久功能失调。
▸ 重金属导致线粒体功能障碍,与精神疾病有关
在某些精神疾病的病理生理学中,铅和镉等重金属可能导致线粒体生化级联反应发生故障。研究人员记录了 19 例线粒体疾病,这些疾病还伴有抑郁和焦虑等精神问题,确立了线粒体功能障碍和精神疾病之间的联系。
乳酸菌产生的支链氨基酸可以穿过血脑屏障,并通过增强线粒体生物合成来改变宿主生理,从而提高对活性氧的抗氧化作用。这就提供了重金属暴露、肠道微生物组和心理健康之间的重要联系。
根据肠道微环境因素,如 pH 值、氧化还原电位、氧气可用性、易感/耐药微生物的流行程度以及微生物群的总体多样性和代谢活动,推测肠道中有害金属的暴露会对常驻菌群产生不同的影响。
【 汞 】
汞中毒是第二大常见的重金属毒性。有几起因汞中毒引起的精神疾病的报告。汞的神经精神毒性主要涉及元素汞(Hg2+),它是通过甲基汞通过血脑屏障去甲基化而形成的。
▸ 汞积累可能引发脑损伤
由于大脑是汞的主要靶点,因此其产前暴露会导致人类和实验动物的大脑萎缩、大脑皮层和基底神经节损伤、细胞死亡、脑层紊乱和神经胶质增生。
由于Me-Hg中毒与年龄有关,因此汞中毒和汞沉积的症状因人在接触时的年龄而有很大差异。
▸ 过多接触汞的胎儿存在思维问题
在子宫内暴露于Me-Hg的儿童,可能在认知思维、记忆力、注意力、语言技能、肌肉控制和视觉空间技能方面存在问题。
急性Me-Hg暴露也改变了大鼠肠道微生物群的结构和功能,包括脱硫弧菌目、消化球菌科和幽门螺杆菌,所有这些都与特定的神经代谢物有关,如谷氨酸和γ-氨基丁酸 (GABA)。
在成熟的中枢神经系统中,谷氨酸和γ-氨基丁酸分别是主要的兴奋性和抑制性神经递质。它们的不平衡可能导致不同的精神和神经问题。
关于谷氨酸与肠道菌群详见:兴奋神经递质——谷氨酸与大脑健康
在鱼类中,Me-Hg处理增加了下列菌群:
Xanthomonadaceae,Pirellula,Cloacibacterium,
Comamonadaceae,Deltaproteobacteria FAC87
所有这些都参与了异生物质代谢和金属去除。有机和无机形式的汞通过胃肠道吸收并影响其他系统,包括中枢神经系统,引发心理问题。
【 砷 】
砷,也会导致认知功能障碍和易患情绪障碍,主要是通过破坏血清素和多巴胺代谢。
由于已知有几种肠道微生物有助于这些神经递质的生物合成,因此微生物群中的任何干扰都可能是导致肠脑串扰改变的可能原因。
▸ 砷处理小鼠:拟杆菌↑↑,厚壁菌↓↓,短链脂肪酸↓↓
在几项研究中,小鼠肠道微生物群中砷暴露的时间和剂量依赖性变化被确定为拟杆菌门的增加和厚壁菌门的减少。
研究还发现砷处理促进了与脂多糖产生、多重应激反应、DNA 修复和维生素生物合成有关的细菌基因转录,同时减少了短链脂肪酸生物合成有关的基因转录。
短链脂肪酸减少引起了:
慢性炎症、肠道通透性增加、条件致病菌增殖、金属摄入增加和血脑屏障功能障碍增加。
▸ 砷暴露的人类研究:致病菌↑↑ 共生菌↓↓
一项对尼泊尔人的研究发现,砷暴露通过富集挥发性细菌和致病菌,同时消耗肠道共生菌,从而改变了肠道微生物群组成。
此外,代谢组学分析显示了伴随的影响,几种肠道微生物群相关的代谢物在各种生物基质中被破坏。砷暴露不仅使肠道微生物群在丰度方面变化,还在代谢特征和功能方面也发生了变化 。
下列菌群因接触砷而发生显著变化,并可能与接触砷引起的疾病直接相关:
胃肠道上皮内的重金属离子相互作用或积累导致氧化应激、微生物群失调、细胞损伤和兼性厌氧菌丰度增加(包括变形杆菌和杆菌在内)。因此,上皮细胞可利用的氧气量增加,消耗产生短链脂肪酸的厌氧细菌,并降低抗炎和抗氧化代谢物的产生,这可能进一步破坏血脑屏障的完整性并减少神经发生,导致大脑功能紊乱。
重金属与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
小结
总体而言,重金属暴露会改变微生物组成,从而导致肠道微生物群的代谢改变,从而影响人体新陈代谢。
为了消除外源金属,需要一个稳定有效的肠道微生物群。预计膳食有毒金属缓解治疗可减轻有益肠道菌群的炎症负担,从而减轻精神疾病的发展。
一旦重金属进入人体,一些食物就会与它们螯合。水果和蔬菜提供了大量的抗氧化剂,能够减少重金属的损害。香菜、野生蓝莓、大蒜、柠檬水、小球藻、螺旋藻、咖喱、绿茶、大西洋海藻、大麦草、西红柿和益生菌是可以帮助逐渐去除体内金属的食物或补充剂。
重金属可能存在于:
– 处理过的木材中的防腐剂(砷和铜)
– 家用消毒剂(汞、铜和银)
– 厨具,如锅、锅、刀、汤匙和叉子(铝、铜和铅)
– 油漆(铅、汞、镉、锑)
– 杀虫剂、除草剂和杀菌剂(砷、锑和镉)
– 灭鼠药(铊)
– 鱼(汞)
– 大米(砷)
– 化妆品、染发剂(汞、铅)
– 纹身(汞)
– 地板蜡/抛光剂、织物柔软剂、汞合金填充物(汞)
– 巧克力、汽油、烟草烟雾(铅、镉)
– 罐头食品(铝、铅)
– 发酵粉、面粉、除臭剂、牙膏、胃抗酸剂、铝箔、泻药(铝)
– 自来水(铝, 镉)
– 含铅管道 (铅)
– 空气污染 (柴油机尾气、燃煤厂、钢铁和金属铸造厂、化肥公司)
邻苯二甲酸盐是存在于大量产品中的增塑剂,特别是润滑剂、地板材料和个人护理用品,如洗发水和肥皂。在产品使用和储存过程中,它们的浸出、迁移和氧化会污染各种水源、空气和土壤。
人类通过以下方式暴露于邻苯二甲酸盐:
对多个物种的研究表明,发育中的生物暴露于邻苯二甲酸盐会影响肠道微生物群,降低其多样性,特别是改变细菌代谢物的数量,这可能对健康产生严重影响。
✦ 邻苯二甲酸引起菌群失调:罗氏菌属和长双歧杆菌减少
新生儿的肠道微生物群受到早期药物治疗中接触邻苯二甲酸二酯 (DEHP) 的影响,这可能会影响他们以后的免疫反应。当婴儿静脉注射DEHP 时,会出现暂时的肠道微生物失调。DEHP暴露改变了细菌群落的组成和多样性,包括罗氏菌和长双歧杆菌的减少。
在小鼠中,DEHP暴露会导致肠道微生物群落结构以及粪便代谢物谱和雌性生殖毒性的改变。DEHP暴露引起的肠道菌群失调改变了微生物代谢物的水平,例如短链脂肪酸、支链氨基酸和单糖,它们是微生物群-肠-脑轴的重要组成部分。
对319 名在1999 年- 2006 年间在市中心分娩的不吸烟女性进行了研究,其中检测到了四种邻苯二甲酸酯代谢物:
其中三种邻苯二甲酸酯(DnBP、DiBP和BBzP)与一系列行为问题有关,包括焦虑、抑郁、躯体不适和退缩行为。
▸ 产前邻苯二甲酸酯暴露对儿童的神经发育产生负面影响
这些负面影响包括精神运动、认知和行为结果。通过干扰神经内分泌系统,这种污染物可能会损害神经元的分化和成熟,增加行为和认知缺陷的风险。
✦ 情绪问题通常与HPA轴有关
它会被邻苯二甲酸盐和双酚A等激素破坏。研究记录了青春期和成年小鼠在围产期暴露与DEHP时的焦虑和抑郁行为。在这些试验中,增加的焦虑相关行为与功能失调的HPA轴相关,表现为ACTH增加、皮质酮水平降低以及下丘脑GR水平升高。
▸ DEHP暴露后,小鼠菌群代谢物对甲酚上调
在年轻小鼠中,DEHP暴露通过增加合成代谢物前体的物种的丰度,来抑制丁酸盐合成并上调对甲酚的产生,对甲酚是一种与神经发育和行为问题相关的细菌代谢物。这证明了DEHP的神经毒性作用与肠道菌群失调之间的联系。
双酚A(BPA)是一种内分泌干扰化学品(EDC),用于生产聚碳酸酯塑料。饮食、空气、水和灰尘都是人类接触双酚A的可能来源。
由于双酚A的广泛使用,它的暴露正成为一个值得关注的问题。根据最近对暴露于双酚A的发育或成年动物调查,双酚可以改变一系列物种的肠道微生物群。
▸ 双酚A暴露减少了双歧杆菌,AKK菌,导致炎症,引发精神障碍
在一项研究中,肠道变化如下:
小鼠产前双酚A暴露减少了双歧杆菌,双歧杆菌已知具有抗炎特性,这可能导致全身炎症,从而导致各种健康问题,包括精神障碍。
▸ 产前母亲尿液双酚A浓度高的孩子,具有更高水平的焦虑和认知异常
各种实验和流行病学调查已将产前母亲尿液双酚A浓度的增加与儿童行为,空间学习和记忆结果联系起来。
更多的研究表明,通过过度激活HPA轴并破坏其基础和压力诱导,产前暴露于双酚A的动物具有更高水平的焦虑和认知异常,通过减少海马 GR 介导的反馈介导的HPA轴抑制,可能会增加在以后的生活中出现压力相关问题的风险。
数据表明,产前双酚A暴露和精神障碍持续增强通过重编程诱导的HPA轴激活联系起来。雌激素EDC已被证明以时间、性别和暴露依赖的方式影响大脑,尤其是下丘脑。
▸ 双酚A降低短链脂肪酸的水平,诱发炎症,损害认知
根据16SrRNA 扩增子测序分析,暴露于双酚A会导致β多样性的差异,而短链脂肪酸生产者的相对丰度显著下降。双酚A还降低了粪便短链脂肪酸的水平,同时增加了氧化应激 、全身脂多糖水平和肠道通透性,所有这些都是炎症引起的慢性疾病的早期迹象。
根据最近的一项调查,小鼠中双酚A暴露引起的神经毒性可能部分归因于MGBA的破坏。暴露于双酚A的雄性小鼠的结果表明,增加的神经炎症损害了它们的认知功能。神经递质血清素、其前体色氨酸及其代谢物5-羟基吲哚乙酸 (5-HIAA) 的脑、结肠和血清水平在暴露于双酚A后都会降低。
▸ 双酚A诱导的肠道菌群变化使粘蛋白、丁酸、血清素降低
随着肠道微生物群的改变,发现结肠中的粘蛋白水平和粘液分泌降低,丁酸水平也是如此。双酚A诱导的肠道菌群变化部分地调节了双酚A对心理和代谢健康的负面影响。
双酚A降低了粪便中短链脂肪酸和大脑中血清素水平,以及参与色氨酸代谢的不同类型的微生物,导致神经递质信号发生变化。双酚A改变了肠血屏障(GBB)和血脑屏障(BBB)的完整性,这可能与肠道和大脑的生态失调、认知能力下降和炎症增加有关。
内分泌干扰物与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
空气污染中最常见的化学物质包括一氧化碳、颗粒物、臭氧、二氧化氮和其他构成固体和液体成分(包括道路灰尘、车辆尾气和风吹土壤)。
▸ 空气污染物影响肠道菌群,诱发炎症,损害神经认知
空气污染已被证明会改变肠道微生物群的组成和功能,导致有害代谢物的产生,调节免疫反应,影响代谢途径,引发局部炎症,最后破坏肠血屏障,所有这些可能会进一步破坏血脑屏障并改变大脑功能。
空气污染会产生严重的神经认知后果,从行为改变到神经退行性疾病,这些后果可能会产生可怕的心理健康后果。
研究人员发现了长期和短期暴露于空气污染物(CO、PM10、PM2.5、NO2、SO2和O3)和精神障碍,如注意力缺陷多动障碍、抑郁症、自杀,焦虑和各种行为问题有关。
颗粒物与肠道微生物的相关研究

Oroojzadeh P,et al.J Mol Neurosci.2022
▸ 氧化应激升高和促炎细胞因子的产生
对PM、NO2和SO等空气污染物暴露的几项研究在各种动物模型中报告了氧化应激升高和促炎细胞因子的产生,以及脑组织中抗氧化活性降低导致精神障碍,这意味着空气污染暴露与心理健康问题之间存在关系。
▸ 通过血脑屏障或沿嗅觉神经易位到达大脑,引发促炎反应
根据人体尸检发现和动物实验研究,空气污染物,特别是细颗粒和超细颗粒,能够通过血脑屏障或沿嗅觉神经易位到达大脑。通过破坏血管调节过程,这些颗粒还可以在大脑中引发促炎反应。
通过改变肠道菌群的组成并通过活性氧产生和核因子NF-kB激活在体内引起持续的促炎倾向,空气污染物对肠道菌群产生有害影响。污染物通过破坏结肠上皮细胞中的紧密连接蛋白而导致肠道通透性增加。
▸ PM和臭氧:激活HPA轴
PM和臭氧是两种具有不同特性和反应性的常见污染物,已在实验中显示可激活HPA轴并释放糖皮质激素应激激素作为神经内分泌应激反应的一部分。这可能通过与肾上腺素能受体的作用相当的受体来调节肠道菌群的组成。
根据一项结合多组学和多指标技术进行的流行病学研究,PM2.5可能通过改变肠道菌群、色氨酸代谢、炎症因子和关键HPA轴激素来激活肠脑轴,从而导致神经和心理功能障碍。
▸ 空气污染导致的菌群及其代谢物变化
空气污染成分与增加和促炎细胞因子释放到肠道有关,以及拟杆菌门、厚壁菌门和疣微菌的相对数量发生显著变化,导致体内炎症水平升高,这与几种精神疾病的开始和发展有关。
短链脂肪酸的产生在接受治疗的小鼠中也发生了变化,盲肠中的支链脂肪酸(如异丁酸和异戊酸)丰度增加。它还导致丁酸盐耗竭,这与屏障功能的降低和对粘膜炎症的更易感性有关。
由于微生物代谢物从肠道迁移到体循环,空气污染物引起的肠道通透性增加,可能在增加全身炎症水平方面发挥重要作用,这将对中枢神经系统产生影响并促进精神疾病的发展。
考虑到微生物群-肠-脑轴在中枢神经系统功能中的重要性,调节微生物群-肠-脑轴的干预措施是改善心理健康的有希望的方法。
肠道微生物群已成为心理健康的重要渠道和前瞻性干预目标。益生菌、益生元、合生元和后生元都可以作为精神益生菌,其中一些是精神障碍的治疗干预措施。
“精神益生菌”:益生菌、益生元和所有微生物群靶向干预措施,它们可以操纵微生物群-肠-脑信号并对情绪、认知和焦虑等神经功能产生积极影响。
精神益生菌对心理的积极影响

Oroojzadeh P,et al.J Mol Neurosci.2022
➤ 益生菌
许多研究表明,以合适剂量服用益生菌可以减轻健康人群的压力、焦虑和抑郁。乳酸杆菌和双歧杆菌是用于精神心理研究最多的菌株。各种益生菌菌株的混合物也可用于产生协同效应或提高功效。
益生菌会影响血清素、脑源性神经营养因子、多巴胺和中枢神经系统抑制性神经递质的水平。迷走神经和肠神经系统在这方面起着至关重要的作用。益生菌还通过产生包括色氨酸和短链脂肪酸在内的代谢物间接改变中枢神经系统功能。
➤ 益生元
当宿主微生物有选择地利用益生元时,它会给宿主带来健康益处。具有双歧化特性的益生元,如低聚果糖、低聚半乳糖和短链低聚果糖,都已因其心理生物效应而受到研究。
除了这些多酚,Omega-3脂肪酸和母乳低聚糖,如具有益生元特性的 3’唾液酸乳糖 (3’SL) 或 6’唾液酸乳糖 (6’SL),在适量服用时显示出对心理健康的益处。
益生元可以通过增加双歧杆菌和减少致病菌来恢复肠道中的益生菌状态,从而潜在地缓解焦虑和抑郁等心理健康问题。
例如,短链脂肪酸对细胞系统的影响是通过免疫系统和内分泌途径以及神经和体液途径介导的。短链脂肪酸激活游离脂肪酸受体并与免疫和肠上皮细胞相互作用,从而影响肠黏膜的安全性和功能。
在环境方面,它还分别通过分泌白细胞介素和控制小胶质细胞的形态和功能来影响全身炎症和神经炎症。它还诱导肠道激素如胰高血糖素样肽1的分泌,这些激素通过迷走神经和全身通路将间接信号传递到大脑。所有这些途径最终都会影响学习、情绪和记忆。
➤ 合生元
合生元正在发展为通过调节肠道微生物群来改变情绪和行为的另一种方式。在多项研究中,合生元已被证明可以减轻特定人群的压力和焦虑样行为。
➤ 后生元
后生元,或故意灭活的全细胞或其成分,通过微生物群的变化、改善肠道屏障功能、调节代谢或免疫反应或神经系统信号传导来提供健康益处。
几项关于人类和动物模型的研究表明,后生元具有抗抑郁和抗焦虑作用。
对精神益生菌在人体的研究
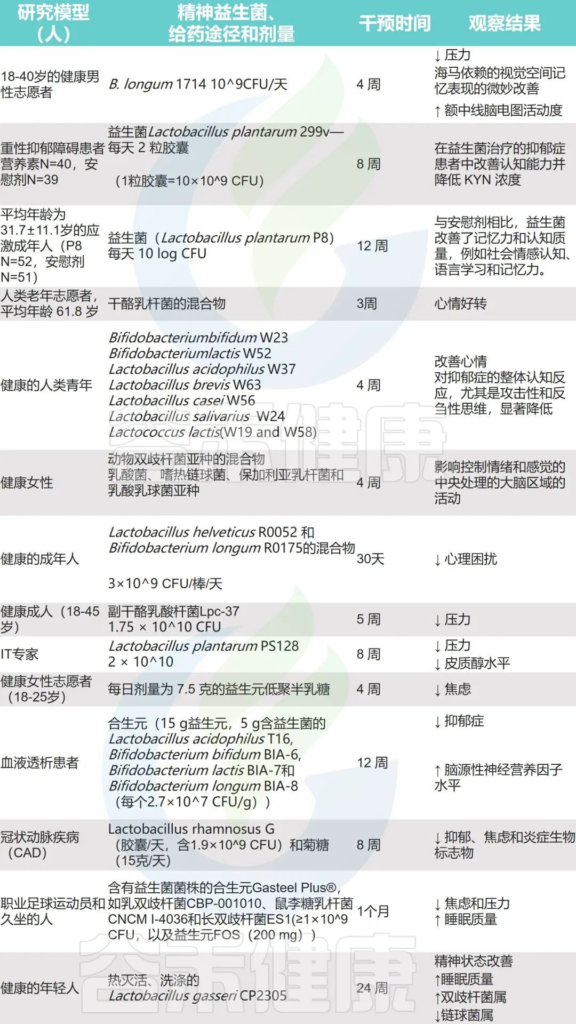
Singh S,et al.Microorganisms.2022
对精神益生菌的动物研究

Singh S,et al.Microorganisms.2022
精神益生菌的可能作用方式
HPA轴的调节、免疫反应和炎症的调节以及神经激素和神经递质的产生是精神益生菌发挥作用的主要机制。
精神益生菌通过恢复肠道中的益生菌状态和减轻精神障碍来影响细菌-肠道-大脑的关系。
✦ 精神益生菌调节神经递质,影响情绪
心理、智力、生理和神经元指数的变化是精神益生菌抗精神病作用的特征。精神益生菌可以调节神经递质和蛋白质,例如儿茶酚胺、乙酰胆碱、血清素和脑源性神经营养因子。它们影响情绪、认知表现、学习和记忆,以及维持大脑中的兴奋-抑制平衡。
当肠道中神经递质浓度升高时,血浆色氨酸水平下降,导致肠道细胞将化学物质释放到大脑中,从而缓解精神疾病。通过G-蛋白偶联受体产生主要作用的短链脂肪酸是精神益生菌对双向肠脑轴的另一个重要的拟议作用途径。短链脂肪酸可能通过加强血脑屏障、改变神经传递、改变神经营养因子水平和帮助记忆巩固来直接影响大脑功能。
精神益生菌的潜在作用模式
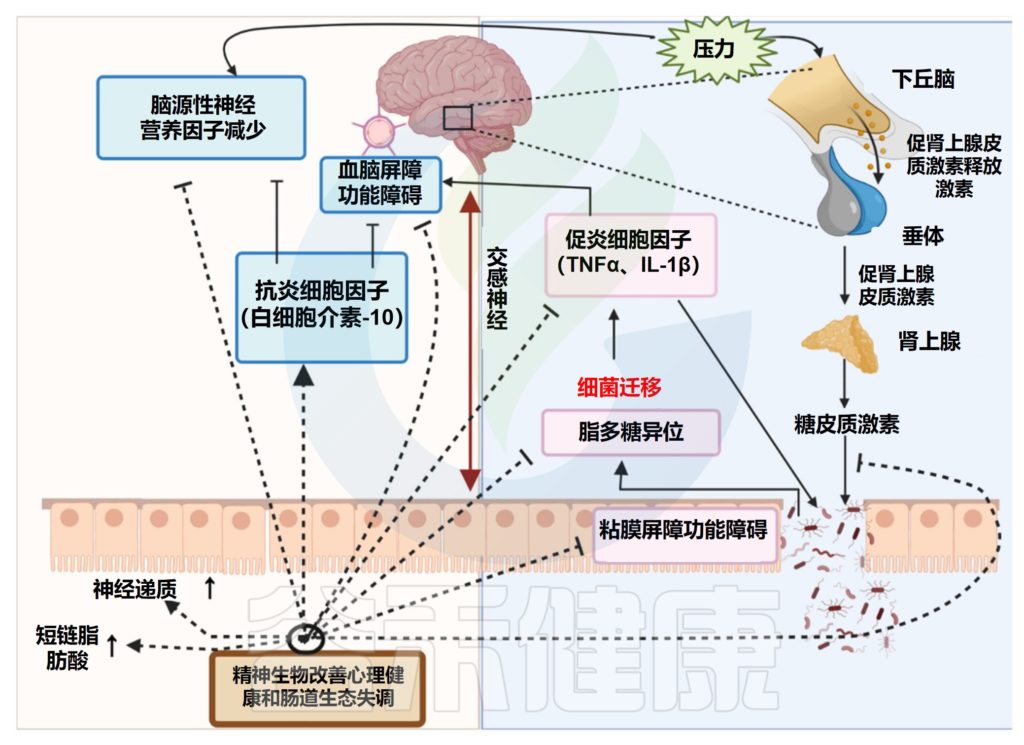
Singh S,et al.Microorganisms.2022
✦ 精神益生菌调节激素,改善认知
通过激素途径作用于大脑,影响身体的应激反应系统,即HPA轴,涉及肾上腺和大脑;当这种情况发生时,它会破坏压力荷尔蒙的产生和功能。这很可能是导致认知问题的主要因素。
精神益生菌可以通过调节HPA轴来降低糖皮质激素水平。糖皮质激素会破坏肠道屏障功能,降低上皮完整性,将细菌向外移动并引发炎症免疫反应。
✦ 精神益生菌调节免疫系统
精神益生菌可以通过直接减轻促炎细胞因子或通过增加抗炎细胞因子以迂回的方式减少炎症和恢复血脑屏障完整性来调节免疫系统的功能。管腔外的细菌迁移也可以通过增加促炎细胞成分的水平直接影响炎症。
✦ 调节肠脑轴中特定神经化学受体的表达,抗抑郁
一些可以产生中枢神经系统抑制性神经递质、去甲肾上腺素和血清素等神经递质的肠道微生物有:
嗜酸乳杆菌、干酪乳杆菌、婴儿双歧杆菌、长双歧杆菌、大肠杆菌、芽孢杆菌、酵母菌、念珠菌、链球菌、肠球菌。
这些可以通过调节肠脑轴中特定神经化学受体的表达来产生抗焦虑和抗抑郁作用。尽管对人类微生物组的研究仍处于初期阶段,但研究结果表明肠道微生物可能会影响人们的认知健康、行为和情绪。
一些能产生神经递质或神经激素的肠道微生物

Oroojzadeh P,et al.J Mol Neurosci.2022
生活方式、饮食、衰老和遗传等一系列因素促成了神经退行性疾病的发生和发展。益生菌对肠脑轴的影响可以通过影响中枢神经系统来实现。
肠道微生物群对神经系统疾病的影响
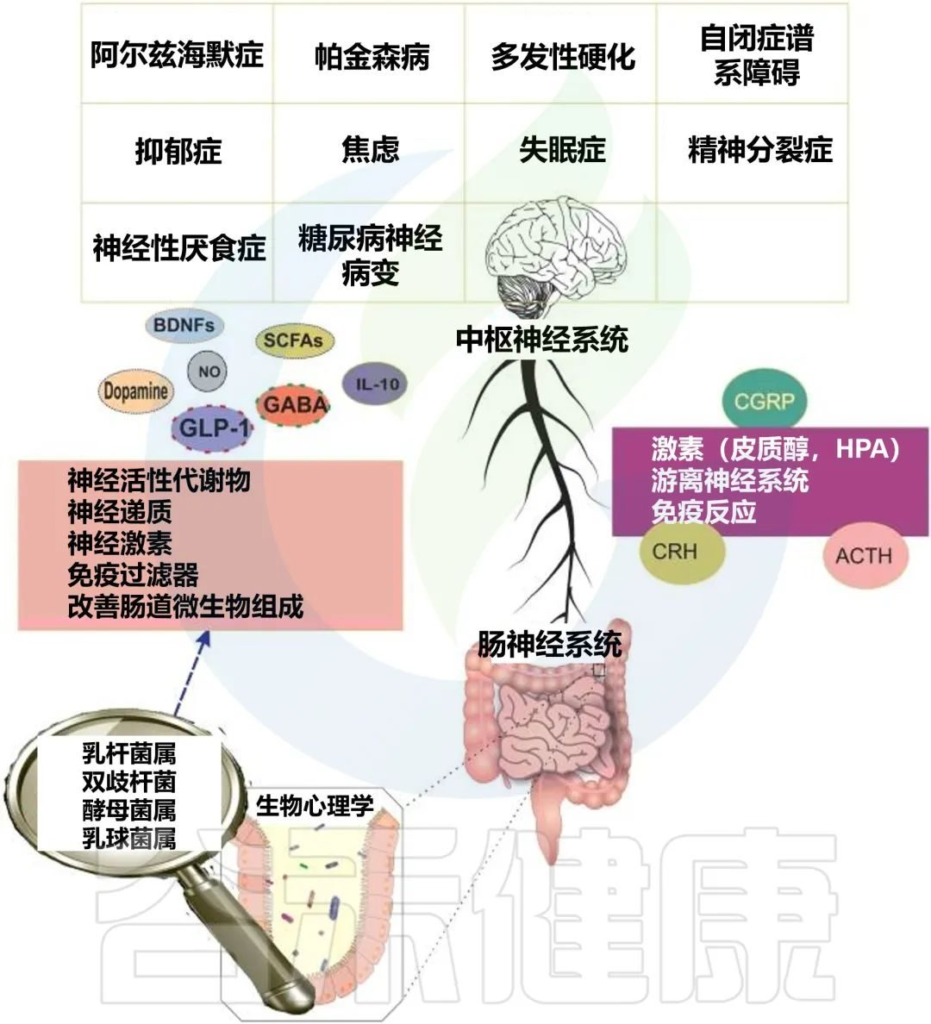
Oroojzadeh P,et al.J Mol Neurosci.2022
阿尔兹海默病是神经系统疾病中痴呆的主要原因。痴呆症通常发生在 60岁以上的人群中。这种疾病没有明确和有效的治疗方法。
研究表明,阿尔茨海默病的主要表现与细胞内Tau 神经原纤维缠结和细胞外淀粉样斑块的产生有关。
更好地了解这种疾病所涉及的生理机制可以帮助确定有效的治疗方法。
肠道微生物与阿尔茨海默症
鉴于肠道微生物群的损害可能与阿尔茨海默症等神经退行性疾病有关,因此调节肠道菌群是治疗阿尔茨海默症的一种可能方法。
炎症和氧化应激会破坏中枢神经系统中的神经细胞,从而导致阿尔茨海默症。
预防胆碱能神经元破坏以及大脑中乙酰胆碱水平的增加是成功治疗阿尔茨海默症所需要的。
已经证明,持续应用D-半乳糖可能会通过增加氧化应激和活性氧物质而导致认知异常和记忆障碍。
一些益生菌,包括植物乳杆菌,能够产生乙酰胆碱,并且可以保护由D-半乳糖消耗引起的记忆缺陷。
几种关于益生菌菌株补充的研究:
关于阿尔茨海默病与肠道菌群详见:阿尔茨海默病de饮食-微生物-脑轴
阿尔兹海默症与2型糖尿病
阿尔兹海默症的一个重要危险因素是2型糖尿病。胰高血糖素样肽-1(GLP-1)在肠道和中枢神经系统(尤其是脑干)中产生,并与神经保护以及认知功能和葡萄糖代谢有关。
GLP-1受体在不同组织(肾、肺、心脏、中枢神经系统等)中表达,可以上调参与脑细胞修复和分化的各种基因的表达。GLP-1还可以促进高血糖状态下的胰岛素分泌。
以前的研究表明,GLP-1在中枢神经系统中作为神经保护因子,可诱导神经细胞增殖/凋亡,改善学习和记忆,降低Aβ斑块沉积,保留多巴胺能神经元,刺激神经再生。
▸ GLP-1工程益生菌减少记忆障碍
研究人员研究了GLP-1工程益生菌(Lactococcus lactis MG1363)口服给药后对AD小鼠模型的影响。脂多糖和1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)分别诱导记忆障碍和运动功能障碍。
结果表明,工程菌株能够通过两种信号通路减少记忆障碍和运动功能障碍。此外,工程益生菌降低了病原体的丰度,并增加了Akkermansia muciniphila的丰度。
还观察到炎症反应下调、阻断NF-κB信号和 MAPKs/PI3K/AKT。已确定GLP-1和GIP(葡萄糖依赖性促胰岛素多肽)作为神经保护因子对2型糖尿病治疗的有效性。
探讨GLP-1/GIP/胰高血糖素三位一体治疗(30天)对AD小鼠认知行为的影响。结果表明,该治疗通过减少认知障碍和病理变化对阿尔茨海默病产生有益影响。
小结
总的来说,这些信息阐明了在阿尔兹海默症中用益生菌操纵肠道微生物群可以改善葡萄糖代谢受损、延缓阿尔兹海默症进展并减少神经炎症,从而有利于胰高血糖素样肽1的作用。
帕金森病是第二种常见且主要的神经退行性疾病。该疾病与突触核蛋白积累和多巴胺能神经元的进行性丧失有关,并以运动和非运动症状为特征。肠道功能异常的非运动症状主要是体重减轻、胃轻瘫、便秘和排便功能障碍。
目前,在治疗帕金森病时,服用精神生物药物备受关注。报告说,食用益生菌混合物对释放多巴胺的神经元提供有效保护,并随后减少小鼠的运动功能障碍恶化。
✦ 补充益生菌能改善帕金森病的相关症状
研究确定了益生菌副干酪乳杆菌对帕金森病大鼠运动障碍的影响,并且与对照组相比,有益生菌的大鼠运动障碍更少。
在一项临床研究中,评估了含有的L.casei Shirota发酵乳对帕金森病患者5周的效果,并报告了腹胀减少、便秘减少和腹痛减少。
每天一次服用含有多种益生菌菌株和益生元的发酵乳,持续4周,并报告改善了帕金森病患者的便秘。
每片使用60毫克两种益生菌:嗜酸乳杆菌和婴儿双歧杆菌,每天两次,持续3个月,40名帕金森病患者腹痛和腹胀缓解。
报告称,在接受8×10^9 CFU/天益生菌12周的帕金森病患者中,过敏反应降低,丙二醛水平降低,谷胱甘肽水平升高。
关于帕金森与肠道菌群详见:肠道微生物与帕金森以及相关影响因素
多发性硬化症是一种涉及中枢神经系统的自身免疫性疾病,其中髓鞘覆盖的轴突被破坏。
遗传和环境因素以及病毒感染被认为是多发性硬化症发展的主要风险因素。然而,这种疾病的确切原因尚不清楚。
✦益生菌可以改善多发性硬化症
越来越多的证据表明,益生菌可以通过改变肠道微生物组、抑制炎症通路和调节免疫系统来改善多发性硬化症患者的免疫系统。
评估了含有发酵乳杆菌、干酪乳杆菌、嗜酸乳杆菌和双歧杆菌的益生菌菌株的效果对接受益生菌混合物12周的多发性硬化症患者的心理健康、残疾和代谢状况的影响。
证明益生菌菌株增加了多发性硬化症小中抗炎细胞因子包括IL-4、IL-5、IL-10的表达,并减少了促炎 IFN-γ和IL-1β的分泌。
自闭症谱系障碍是社会交流、感觉运动行为和有限兴趣方面的一系列缺陷。
自闭症谱系障碍的表现始于儿童早期。自闭症患者表现出胃肠道症状。自闭症儿童的胃肠道功能障碍通常与攻击性行为、易怒和睡眠障碍有关。
✦益生菌对自闭症的有益影响
报告了益生菌对自闭症患者行为和胃肠道表现的有益影响。使用含有嗜酸乳杆菌、鼠李糖乳杆菌和长双歧杆菌的益生菌菌株治疗孤独症儿童3个月后,双歧杆菌和乳酸杆菌的数量增加,体重减轻,胃肠道症状改善。
此外,接受益生菌菌株1个月的自闭症儿童的自闭症核心症状有所改善,腹部症状有所减轻。
扩展阅读:自闭症,抑郁症等与维生素缺乏有关
抑郁症和焦虑症是常见的疾病之一。这两种疾病大多同时发生。抗抑郁药、抗焦虑药和催眠药通常用于治疗。临床上,抑郁与下丘脑-垂体-肾上腺失调之间存在关联。
研究表明,健康个体和重度抑郁症患者的肠道微生物群是不同的。重度抑郁患者双歧杆菌和乳杆菌减少,同时梭菌、链球菌、克雷伯菌、颤杆菌和Allistipes增加。
胃肠道细菌通过迷走神经通路激活压力回路。长期暴露于压力源会导致去甲肾上腺素的长期分泌,这会改变肠道微生物群并使肠道对细菌和毒素更具渗透性,然后是HPA轴的压力反应。
✦益生菌能降低压力改善焦虑
研究了益生菌菌株B. breve CCFM1025对粪便微生物组成和脑神经系统改变以及皮质酮、细胞因子和短链脂肪酸的血清水平的影响。总体而言,抑郁和焦虑样行为减少了。
研究指出,益生菌菌株B. longum 1714 能够降低压力水平并改善健康志愿者的记忆力。
评估了鼠李糖乳杆菌HN001对423名孕妇产后焦虑和抑郁表现的影响,并指出益生菌治疗组的抑郁状况显著降低。
益生菌菌株L. plantarum 299v可降低犬尿氨酸水平并增强重度抑郁症患者的认知功能。然而,其他调查并未报告接受益生菌的患者与对照组在焦虑和幸福感评分方面有任何显著差异。
有学者指出益生菌菌株长双歧杆菌NCC3001可以提高肠易激综合征患者的生活质量,并可以减少这些病例的抑郁症。
关于抑郁症与肠道菌群详见:抑郁症,恐惧,压力和肠道微生物群脱不开的关系
失眠
充足的睡眠是影响生活质量的关键因素。肠道菌群通过微生物-肠-脑轴影响宿主的精神状态和睡眠状态。
宿主的昼夜节律和睡眠质量取决于微生物组谱和代谢特性。益生菌被认为可以改善睡眠健康。GABA 是一种抑制性神经递质,能够通过减少焦虑来促进放松。
L.brevis DL1-11 是一种具有高GABA生产能力的益生菌菌株,其改善小鼠睡眠的潜力已得到证实。
关于睡眠与肠道菌群详见:肠道菌群与睡眠:双向调节
精神分裂症
精神分裂症是一种慢性衰弱性疾病。研究表明,肠道微生物群的破坏会增加全身炎症。因此,神经炎症会导致精神分裂症。
精神分裂症患者通常患有营养状况受损、压力反应高、炎症状态增加和乳糖不耐症。具有抗炎和免疫调节特性的益生菌可能有助于减轻精神分裂症患者。
✦ 益生菌减轻精神分裂症症状
报道了丁酸梭菌、粪链球菌和肠系膜芽孢杆菌的益生菌混合物可以减轻精神分裂症的症状。研究表明,益生菌菌株B. lactis Bb12 亚种的组合B. lactis Bb12 GG和鼠李糖乳杆菌菌株可以减少精神分裂症患者的肠道障碍。
研究了鼠李糖乳杆菌菌株GG和动物双歧杆菌乳亚种在慢性精神分裂症的可能免疫调节作用。报告称,血管性血友病因子浓度显著降低,同时脑源性神经营养因子、巨噬细胞炎性蛋白-1β、单核细胞趋化蛋白-1和RANTES(受激活、正常T细胞表达和分泌的调节)水平升高。因此,精神分裂症患者服用益生菌补充剂可能会改善胃肠道渗漏。
B. lactis Bb12有助于使男性患者的白色念珠菌抗体水平和白色念珠菌相关肠道不适正常化。
糖尿病性神经病变是一种与轴突萎缩、脱髓鞘疾病、再生能力下降、神经元炎症和周围神经病变有关的营养性神经退行性疾病。
糖尿病神经病变可通过神经元肠脑轴、门静脉(调节中枢神经系统中的能量代谢)和外周神经元传导丧失改变血糖调节以及肠道葡萄糖吸收不良。
2型糖尿病的特征是葡萄糖代谢失调,导致空腹和餐后高血糖。胰岛素和胰高血糖素分泌和功能受损是这种疾病的主要原因。
▸ 胰高血糖素样肽1(GLP-1)
GLP-1是肠细胞响应葡萄糖而分泌的一种肠促胰岛素激素,用于2型糖尿病治疗。它通过特定受体激活肠道神经元并调节肠道转运,增加胰岛β细胞的增殖,增强葡萄糖依赖性胰岛素分泌,减少胰岛α细胞的胰高血糖素分泌。
因此,它会降低2型糖尿病患者的血糖和食物摄入量。当 GLP-1被激活时,它会向迷走神经传递一个神经信息,该信息通过肠脑轴参与血糖调节。GLP-1 还具有神经保护和神经源性潜力,研究表明它在来自背根神经节的神经元的原代培养物中诱导轴突。因此,它可以有效地治疗糖尿病神经病变。
✦ 益生菌增强胰岛素分泌,改善肠神经系统
研究发现益生菌通过上调G蛋白偶联受体 、胰高血糖素原和转化酶原活性,通过葡萄糖触发的GLP-1 分泌来增强胰岛素分泌。
已经确定,当无菌小鼠被健康的肠道微生物群稳态定植时,肠神经系统和迷走神经的神经元活动得到恢复,但糖尿病小鼠的肠道微生物群却没有。
研究发现用罗伊氏乳杆菌喂养大鼠9天可以通过靶向肠道感觉神经中的钙依赖性钾通道来改善肠神经系统。
一些乳酸杆菌菌株(L. farciminis, plantarum, fermentum)可以产生一氧化氮作为神经递质,它能够影响神经元对GLP-1和葡萄糖代谢的反应。
✦ 益生菌降低胰岛素抵抗,增加抗氧化能力
研究了GLP-1在2型糖尿病大鼠体内,白藜芦醇和益生菌作用。给大鼠喂食各种益生菌,包括植物乳杆菌、保加利亚乳杆菌、干酪乳杆菌、婴儿双歧杆菌、嗜酸乳杆菌、长双歧杆菌、短双歧杆菌,剂量为 50 × 10^9 4周。发现与糖尿病组相比,这些益生菌和白藜芦醇可以降低葡萄糖和胰岛素抵抗(p < 0.001),并增加GLP-1以及总抗氧化能力(p < 0.001)。
发现两种菌株,L. kefiranofaciens M 和 L. kefiri K可以通过诱导GLP-1分泌,抑制细胞因子产生(促炎和炎症因子),增加IL-10的产生,改变肠道菌群向LAB和双歧杆菌的方向发展,减少产气荚膜梭菌和大肠菌群,从而降低小鼠模型中T1D的进展。
这些结果揭示了益生菌在增加GLP-1水平中的作用,这可以随后缓解高血糖症,并可能被认为是糖尿病治疗的潜在候选者。
关于2型糖尿病和肠道菌群详见:2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
神经性厌食症是另一种重要的精神障碍,与严重的体重减轻、精神合并症、对肥胖的恐惧和饮食限制有关。
根据对肠脑相互作用的深入了解以及益生菌对该轴的积极作用,可以为神经性厌食症治疗提供几种新的治疗策略。
✦ 益生菌改善神经性厌食症中的胃肠道不适
分析了益生菌对神经性厌食症患者的疗效,并通过分析血清和粪便样本测量了体重指数、心理/神经心理参数。他们报告了神经性厌食症中肠道微生物群落的正调节,以改善体重增加、胃肠道不适和炎症减少。
通过低聚果糖1.67g/天和益生菌(Saccharomyces boulardii 5×10^8 CFU)干预评估益生菌对神经性厌食症的影响。饮食限制后,与健康状态相比,总微生物群和代谢物减少,但补充低聚果糖和布拉式酵母通过改变以下菌群来恢复微生物群落。
研究显示了两种饮食(酸奶或牛奶)的积极作用,包括保加利亚乳杆菌和嗜热链球菌,它们能够诱导IFN-γ产生对抗儿童腹泻和神经性厌食症患者的感染。
值得注意的是,抗生素和25%的药物可能会影响微生物群,患者需要基于益生菌治疗来实现主要目标,如能量收集、体重增加、降低肠道通透性、炎症过程以及肠道微生物组群的改变等。
益生菌的作用主要是增强肠道健康。食用含有益生菌的健康食品在预防中枢神经系统疾病和通过调节肠道微生物群控制相关症状方面具有重要作用。这种效应通过微生物群-肠-脑轴发生,可以整合到临床试验中。
酸奶、开菲尔、豆豉和泡菜等发酵食品富含益生菌。一些益生菌产生活性神经元化合物或充当载体。一些双歧杆菌和乳酸杆菌菌株分泌γ-氨基丁酸 (GABA)。此外,对健康人的粪便样本进行分析,发现拟杆菌属、副拟杆菌属和埃希氏菌属物种能够调节产生GABA的途径。
GABA的功能障碍与抑郁和焦虑有关。GABA 是乳酸菌 (LAB) 的分泌代谢产物之一。它是哺乳动物中枢神经系统中抑制性传播的主要介质。食品工业通过生产含有能够产生 GABA 的益生菌物种的功能性食品,在减少抑郁和焦虑方面发挥着关键作用。
开菲尔颗粒含有Acetobacter aceti, L. fructivorans, Acetobacter sp., Enterococcus faecium, Leuconostoc spp., L. delbrueckii delbrueckii, L. fermentum, L. kefiranofaciens, Candida famata, Candida krusei.
益生菌菌株L. helveticus从发酵乳中分离得到,可以改善老年人和中年人的认知功能。
用短乳杆菌L. brevis BJ20浓缩发酵海带, 以确定其对老年人体质和短时工作记忆的影响。研究人员说,食用这种发酵食品可以为老年人的痴呆症提供保护机制。
由于包括牛奶、乳制品和豆制品在内的发酵产品的广泛使用,其他研究表明,含有干酪乳杆菌的发酵乳可以改善学生的情绪、增加粪便中的血清素并降低压力水平,瑞士乳杆菌影响认知功能。
含有发酵乳杆菌、干酪乳杆菌混合物的发酵牛奶降低了小鼠的亚硝化应激参数。含有B. lactis BB12和L. acidophilus LA5益生菌的酸奶可显著增强整体健康并减轻焦虑、抑郁和压力。
使用含有短乳杆菌L. brevis FPA 3709的发酵黑豆浆能够产生 GABA 在小鼠中显示出抗抑郁活性。
个体微生物组会受到宿主条件和环境的影响。肠道微生物群的紊乱会对宿主的生理反应和整体健康产生巨大影响。
大量证据表明,环境污染物与微生物群相互作用,而微生物群在肠脑轴中发挥着关键作用。长时间处于污染环境下,肠道生态失调,对宿主造成系统性和长期的影响。
精神益生菌在控制中枢神经系统疾病症状方面具有有效的特征,或将辅助治疗各类疾病。然而神经精神类疾病病情复杂,原因不一,有些益生菌也并不一定对所有患者有效,通过肠道菌群检测,可以了解个体肠道菌群,从而有针对性地采取相关干预措施。
主要参考文献
Singh, S.; Sharma, P.; Pal, N.; Kumawat, M.; Shubham, S.; Sarma, D.K.; Tiwari, R.R.; Kumar, M.; Nagpal, R. Impact of Environmental Pollutants on Gut Microbiome and Mental Health via the Gut–Brain Axis. Microorganisms 2022, 10, 1457. https://doi.org/10.3390/microorganisms10071457.
Oroojzadeh P, Bostanabad SY, Lotfi H. Psychobiotics: the Influence of Gut Microbiota on the Gut-Brain Axis in Neurological Disorders. J Mol Neurosci. 2022 Jul 18:1–13. doi: 10.1007/s12031-022-02053-3. Epub ahead of print. PMID: 35849305; PMCID: PMC9289355.
Liu, L.; Huh, J.R.; Shah, K. Microbiota and the gut-brain-axis: Implications for new therapeutic design in the CNS. eBioMedicine 2022, 77, 103908.
Long, D.; Liu, M.; Li, H.; Song, J.; Jiang, X.; Wang, G.; Yang, X. Dysbacteriosis induces abnormal neurogenesis via LPS in a pathway requiring NF-κB/IL-6. Pharmacol. Res. 2021, 167, 105543.
Duan H, Yu L, Tian F, Zhai Q, Fan L, Chen W. Gut microbiota: A target for heavy metal toxicity and a probiotic protective strategy. Sci Total Environ. 2020 Nov 10;742:140429. doi: 10.1016/j.scitotenv.2020.140429. Epub 2020 Jun 25. PMID: 32629250.
Briffa J, Sinagra E, Blundell R. Heavy metal pollution in the environment and their toxicological effects on humans. Heliyon. 2020 Sep 8;6(9):e04691. doi: 10.1016/j.heliyon.2020.e04691. PMID: 32964150; PMCID: PMC7490536.

谷禾健康


最近关于“益生菌”的风很大,我们越来越容易从各种渠道听到关于补充益生菌的科普,但依然一知半解。
我们每个人都需要补充益生菌吗?
不同益生菌有什么不同,如何选择?
为什么有的人补充有效,有的人无效?
益生菌真的能定植吗?与什么因素有关?
…..

本文我们来逐一解答这些问题。
对于这个问题而言,我们要明确的是,补充益生菌的目的是为了通过改善菌群,从而达到更健康的状态。补充益生菌是改善菌群的一种方式。
并不是每个人都需要补充益生菌,也并不是每个人都适合补充益生菌,所以首先第一步是判断:
目前已有研究的,与菌群相关的疾病包括:
消化系统(腹泻、腹胀、便秘等);
神经系统(自闭症、精神障碍等);
免疫系统(哮喘等);
代谢系统(肥胖、糖尿病等);
心血管疾病(高血压、中风等);
癌症(胰腺癌、结肠癌等);
…
本号里有各类与菌群相关疾病的研究进展。
假如你本身非常健康,同时也一直遵循着健康的饮食和生活方式,那就不需要补充。
假如在你身上出现的症状和菌群完全没有关联,补充益生菌可能起不到太大的效果。
如果症状与菌群有关,或者正经历慢性压力、营养不良、药物、环境变动、衰老、疾病、旅行、肠道菌群紊乱等情况,可以通过补充益生菌的方式来改善菌群从而缓解症状。
然而,不同益生菌有不同的功效,并不是可以随意补充,究竟该如何选择?
下一章节我们来详细了解。
目前市面上的益生菌种类五花八门,要从这么多益生菌中选择适合自己的能发挥作用的,并不是一件容易的事儿,我们可以尝试从以下几个方面来了解益生菌。
最可靠的益生菌是那些经过双盲测试的益生菌。如果不进行双盲试验,益生菌测试可能会有偏差这些信息应该清楚地印在包装上。要检查包装确认益生菌厂家是否告知检测结果。
使用标准化流程的可追溯性确保了消费者安全和产品注册,尽可能选择严格规范的公司生产的益生菌。
对于无活菌标识、无菌株号、无任何文献数据支持的类型,则需谨慎。
益生菌每个属内都有很多种和菌株,益生菌的作用因这些种和菌株而不同。哪怕同属于乳酸杆菌,菌株不同效果也不同,比如:
嗜酸乳杆菌有助于血压、胆固醇、过敏和消化;鼠李糖乳杆菌可以帮助降低血糖、免疫功能和胆固醇;瑞士乳杆菌可以降低血压、改善睡眠质量和骨骼健康。
这里提供一些常见的益生菌及目前已知的功能作为参考。


-357x1024.png)
-1024x426.png)
-1024x615.png)
<来源:谷禾健康数据库>
研究表明最好空腹服用,通常是在早上。服用益生菌的是为了让它到达大肠,因为这是菌群存活率最高的地方。当有食物时,胃酸分泌较多,益生菌可能会被胃酸杀死,因此最好空腹服用。
一天中,最佳时间是早上空腹时,其余的话饭前或睡前也可以,饭后服用效果较差。
绝大多数人开始服用益生菌是安全的。在开始服用前几天,可能会出现胃部不适、胀气、腹泻或腹胀等症状。这些症状通常会在身体习惯后消失。
服用益生菌可能出现的副作用


如果是小肠细菌过度生长等疾病患者,则需要注意,可能会出现腹胀、便秘等消化疾病问题。
此外,它也可能会跟某些药物相互作用,如果长期服用药物,或有严重感染和近期做过手术的人群,使用益生菌前请遵医嘱。
如有牛奶过敏或乳糖不耐症、怀孕或哺乳等情况,请咨询医生是否适合服用。
在通过胃肠道的不利和波动条件的运输过程中,包埋可以为益生菌提供显著的保护。
微胶囊化对益生菌的贮藏稳定性和贮藏后性能有显著的影响。微胶囊化可以提高其在不利环境条件下的存活率,确保一定数量的益生菌进入人体并且在肠道中释放,提高益生菌的使用价值。
益生菌的种类不同,存储方式可能也有所不一,
益生菌产品的储藏方式一般可以分为常温,冷藏和冷冻三种,市场上的很多益生菌产品都需要冷藏。请检查包装去了解如何储存。对于干性益生菌补充剂,一般来说需要在干燥、黑暗的地方存储(潮湿条件会导致代谢发酵或降解)。
关于这部分详见《益生菌的靶向递送:研究和商业化前景》
跟其他食品一样,益生菌也要看生产日期或到期日期。随着时间的推移,CFU 的数量可能会下降。因此最好检查包装上的日期。
如果已经使用某种益生菌补充剂几周甚至几个月了,但没有发现消化系统健康状况有所改善,那么是时候尝试换一种新的益生菌了。
与药物不同,更换益生菌补充剂不会产生重大副作用。
此外,可以利用好肠道菌群检测这个工具。可以从两个方面入手:
益生菌抑制其他菌群生长
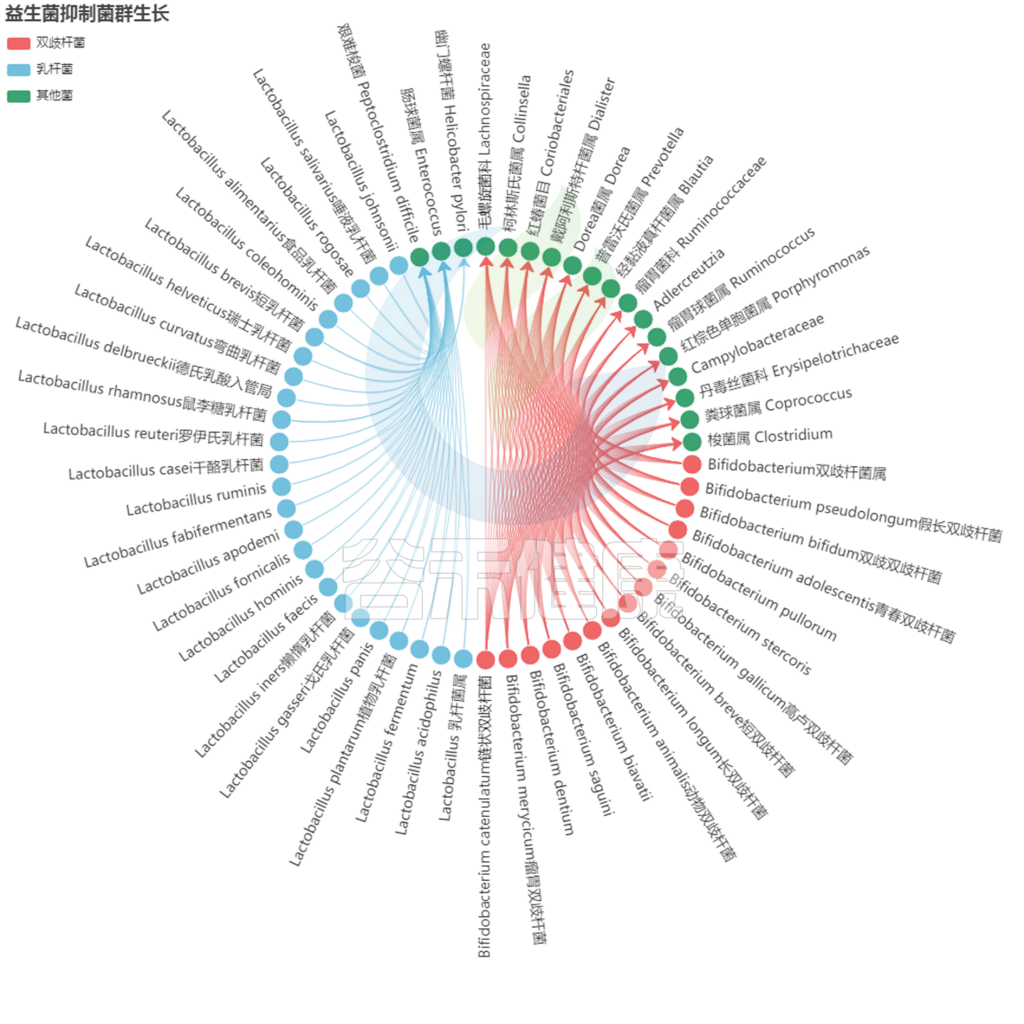

<来源:谷禾健康数据库>
注:以上红色代表双歧杆菌,蓝色代表乳杆菌,绿色则为其他菌群,箭头指向代表抑制的菌群。
我们知道,抗生素可以在杀死致病菌的同时,也会误伤体内的有益菌,破坏原有的菌群平衡状态。那能不能在抗生素使用的时候,补充一些益生菌使其恢复平衡?
目前针对益生菌和抗生素同时服用的研究,支持和不支持的都有。
√ 支持益生菌和抗生素同时服用的研究:效果显著
对给予益生菌的23项研究(3938名参与者)进行调查,22个试验报告了抗生素相关腹泻的发生率,结果显示,与活性、安慰剂或无治疗对照组相比,益生菌组显著受益(益生菌组8%,对照组19%)。
研究副作用的16项试验(n = 2455)中,没有一项记录了可归因于益生菌的任何严重副反应。作者认为益生菌对预防抗生素相关性腹泻具有保护作用。相对危险度为0.46 (95% CI为0.35 ~ 0.61),NNT为10。
作者认为鼠李糖乳杆菌或布氏酵母菌Saccharomyces boulardii 形成单位为每天50 – 400亿个是最合适的选择。
建议在进行进一步研究之前,应避免在有不良事件风险的儿童人群中使用益生菌。
× 反对益生菌和抗生素同时服用的研究:菌群恢复难
研究人员发现在服用抗生素4周后,接受11株益生菌治疗的人的肠道微生物群需要更长的时间才能恢复正常。这是在益生菌有效地在肠道定植的情况下。问题是新的细菌和酵母菌株的存在使肠道微生物群在整个6个月的研究期间无法恢复正常。
而那些没有服用益生菌的人的肠道菌群在停用抗生素三周后恢复正常。作者得出的结论是,这项研究只是检测了一种益生菌,不同的益生菌可能对服用不同抗生素的患者有帮助。不过他们也认为,在服用抗生素之后再服用益生菌可能是没有益处的。
还需要更多的研究来确定是否有其他方法来探索益生菌和抗生素的共存关系,如益生菌封装技术增强效果、自体粪菌移植等各种方式。
研究发现,封装的益生菌有一个由海藻酸钠或其他合适的生物相容性材料组成的保护壳,可以抵御抗生素;胶囊型益生菌对抗生素耐药病原体的治疗效果有所提高。这可能为益生菌和抗生素共同使用带来利好。
研究表明,自体粪便移植(在使用抗生素之前收集粪便样本并冷冻,在抗生素治疗后移植),8天内肠道菌群就恢复正常。未进行粪便移植的那一组的肠道菌群花了21天时间才恢复。
除了直接服用益生菌这种方式之外,有些食物中也富含益生菌,如:
还有其他方式也可以获取益生菌或者协助益生菌生长。
补充益生元,协助有益菌生长
益生元是一种可溶于水的可溶性纤维,可以作为益生菌的“食物”。
益生元可以通过小肠到达大肠和结肠,然后有益细菌会把它消化或发酵,形成乙酸盐、丙酸盐和丁酸盐等代谢物。
最广泛认可的益生元包括低聚果糖 (FOS)、菊粉和低聚半乳糖 (GOS) 等。
此外还包括抗性淀粉、果胶寡糖 (POS)、多酚等。
菊粉型果聚糖和阿拉伯木聚糖低聚糖等益生元表现出双歧化和产丁酸作用。产丁酸菌正需要这些益生元,例如直肠真杆菌、普拉氏粪杆菌和罗氏菌属。
有机酸的产生还可以形成对病原体的防御并增加矿物质的吸收。通过益生元和有益菌繁殖结合将导致较低的管腔 pH 值,阻止病原体在肠粘膜中的粘附和生长,并增加盲肠和结肠对矿物质,特别是钙和镁的吸收。
★ 哪些食物中含有益生元?
蒲公英嫩叶
蒲公英绿叶植物是菊粉和其他纤维的重要来源,每100克含有4克纤维。
蒲公英绿色植物也因其抗炎、抗氧化、降低胆固醇的功效而闻名,同时也有助于减轻便秘。
菊芋
每 100 克菊芋含有约 2 克膳食纤维,其中 3/4 由菊粉组成。它们还富含硫胺素和钾,可支持神经系统并促进适当的肌肉功能
青香蕉或青香蕉粉
未成熟的(绿色)香蕉富含抗性淀粉,绕过小肠的消化(可消化的淀粉转化为葡萄糖)并携带到结肠,被有益细菌发酵成代谢物。
香蕉中的纤维已被证明可以增加健康的肠道细菌并减少腹胀。
大麦和燕麦
大麦和燕麦由 3-8% 的 β-葡聚糖组成,这是一种益生元纤维,可促进肠道中有益细菌的生长。
还发现大麦和燕麦中的 β-葡聚糖可以降低 LDL 胆固醇(坏胆固醇)和血糖水平
大麦富含硒 – 支持甲状腺功能,抗氧化益处与预防多种癌症有关。
由于其酚酸含量,燕麦还提供抗氧化和抗炎保护。
魔芋根
魔芋根,也称为葡甘露聚糖,原产于亚洲部分地区,用于中药以及烹饪中作为增稠剂。它因其减肥益处和帮助降低低密度脂蛋白胆固醇而得到普遍认可。
除魔芋外,一项研究发现有助于减少粉刺并改善患者的整体皮肤健康。它还被发现有助于减少过敏。
菊苣根
菊苣根与蒲公英来自同一个家族,新鲜菊苣根由高达 70% 的菊粉组成,研究发现它有助于改善血糖控制,尤其是对糖尿病患者而言,并且还被发现有助于减轻体重。
菊苣根可以整个煮熟后与食物一起食用,也可以作为热饮冲泡,或者作为补充剂。
牛蒡根
通常作为茶饮用,具有广泛的益处,包括治疗癌症、糖尿病和炎症。其他好处包括帮助降低血糖水平和治疗糖尿病治疗和预防感染。
牛蒡可以作为茶服用,也可以作为补充剂的粉末服用。
亚麻籽
亚麻籽具有多种相关的健康益处。除了高纤维含量外,亚麻籽还富含蛋白质、omega-3 脂肪酸,以及一些维生素和矿物质的丰富来源。
一汤匙亚麻籽含有 3 克纤维,占每日推荐摄入量的 10%。亚麻籽有助于促进肠道中有益细菌菌株的生长,有助于降低血糖水平和治疗糖尿病、治疗和预防感染。
雪莲果根
雪莲果根的外观与甘薯相似,富含果糖(FOS),使其具有甜味。
豆薯根
豆薯根是一种可食用的根茎类蔬菜,原产于墨西哥,通常被称为墨西哥萝卜,由大约 5% 的膳食纤维组成。
海藻
海藻含有大量的生物活性化合物,如多糖和酚类物质,长期以来因其对健康的益处以及作为益生元的价值而得到认可。
海藻中发现的许多化合物对小肠的消化有抵抗力,但会刺激有益肠道细菌的生长及其发酵成短链脂肪酸。
土豆
土豆(以及土豆泥、薯条和炸薯条等土豆产品),一听就觉得是容易长胖的食物。确实,煮沸或油炸时,很容易在小肠中消化成葡萄糖。
然而,当土豆煮熟然后完全冷却至室温时,或者更好的是放在冰箱里,就会形成抗性淀粉。抗性淀粉属于膳食纤维的一种,抗性淀粉不被消化,进入结肠,作为菌群的营养源,菌群通过发酵,将碳水化合物代谢后生成丁酸等短链脂肪酸,促进肠道健康。
苹果
苹果含有丰富的纤维、维生素C、抗氧化剂和钾,具有显着的健康益处。它含有果胶,一种可溶性纤维,具有益生元作用并促进健康的肠道菌群。果胶会增加丁酸盐(短链脂肪酸),可以滋养有益的肠道细菌并减少有害细菌的数量。
其他协助益生菌的方式
▸ 适当锻炼
干预研究支持锻炼对肠道微生物群的有益影响。纵向研究表明,经常中等强度的耐力运动对肠道微生物产生最有益的影响,但是不同类型的运动训练方案(例如,阻力、间歇、伸展/柔韧性、耐力/有氧等)对肠道微生物群的影响存在差异。其他如训练状态,共享训练环境,自愿性,健康或疾病状况,年龄,性别等因素也是评估运动和肠道菌群的混杂因素。
关于运动锻炼对菌群的影响,详见:运动如何影响肠道微生物群,如何正确运动
▸ 足够睡眠
某些菌群会在睡觉时会大量繁殖,这些菌群在白天不会很好地繁殖。
如果你缩短睡眠时间,这些菌群可能会受到影响,没有机会增殖,从而影响肠道菌群的整体平衡。保持足够的睡眠对于健康的身体、肠道极为重要。
需要多少睡眠时间取决于年龄,并且因人而异。大多数成年人每晚至少需要七个或七个以上的睡眠时间。
新生儿(0到3个月):睡眠14到17个小时
婴儿(4至11个月):睡眠12至15小时
幼儿(1至2岁):睡眠11至14小时
学龄前儿童(3至5岁):睡眠10至13小时
学龄儿童(6至13岁):睡眠9至11小时
青少年(14至17岁):睡眠8至10小时
年轻人(18至25岁):睡眠7至9小时
成人(26至64岁):睡眠7至9小时
老年人(65岁或以上):睡眠7至8小时
当然以上只是参考,并不是所有人必须达到的标准,少数人的需要的睡眠时间本来就不多,且没有睡眠困扰或不适症状,则无需参考以上标准。
关于睡眠与肠道菌群详见:
肠道菌群与睡眠:双向调节
深度解析|睡眠健康与肠道健康之间的双向联系
有人说,益生菌在体内不能定植,很快就会被排出体外了…… 益生菌究竟能不能定植?


可以定植,但不容易。
首先,我们来看口服的益生菌在体内经历了什么?
▸口腔——唾液对益生菌的影响微乎其微
益生菌首先会接触到口腔中的唾液。唾液是一种透明且微酸性的黏液性外分泌物,由保护牙齿和黏膜表面的免疫和非免疫成分组成。
对多种乳酸杆菌、小球菌和双歧杆菌菌株进行的体外研究表明,与对照组相比,接触唾液时细胞计数没有显著损失。
▸胃——胃酸对大多数细菌都是极其致命的
通过食道后,益生菌到达胃部,转运需要5分钟到2小时,长时间暴露在酸性胃液中,对益生菌来说是一个巨大的挑战。
尤其是对不耐酸的细菌,会导致细菌细胞质pH降低。
氢离子(H+)的涌入导致糖酵解酶活性下降,进而影响F1F0 – ATP酶质子泵。低pH条件下F1F0 – ATP酶质子泵活性的降低,因此益生菌存活难。
胃中存在的其他不利条件:
包括离子强度、酶活性(胃蛋白酶)和机械搅拌对益生菌的生存能力有影响。例如,长双歧杆菌和短双歧杆菌的活细胞在模拟胃液中1小时内消失。


▸小肠——胆汁酸和消化酶影响益生菌生存
益生菌通过幽门到达小肠,那里有大量胰液和胆汁。在肠液的中和作用下,小肠内的pH约为6.0-7.0,比胃液温和得多。
然而,胆汁酸和消化酶(包括脂肪酶、蛋白酶和淀粉酶)也可以影响益生菌的生存能力,通过细胞膜破坏和DNA损伤等方式。
体外研究表明,在模拟肠液中唾液乳杆菌Lactobacillus salivarius Li01、Pediococcus pentosaceus Li05 的生存能力降低。
为了增强益生菌对胃液和胆汁的耐受性,可以将益生菌包裹在一层保护性外壳上,也就是前面说的微胶囊。近年来,微囊化技术在提高存活率和保证足够数量的活菌到达结肠方面取得了很大进展。
经历以上重重考验,益生菌的定植之路看起来并不容易。

而以上这些只是其中一部分原因。
等益生菌到了结肠之后,有更多的考验等着它。
共生菌的定植抗性,给益生菌的定植带来不利影响
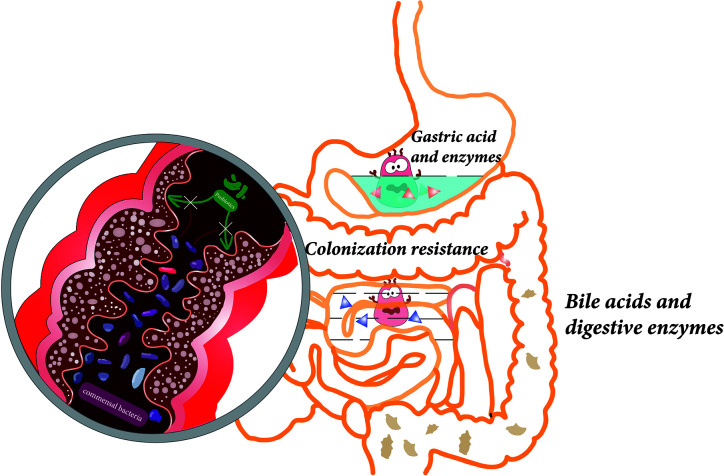
doi.org/10.3389/fcimb.2021.609722
由于定植抗性,大多数益生菌在口服后和消耗停止后不久随粪便排出结肠。
那么,什么是定植抗性?
通俗地说,在人类的菌群中,一个新的物种想要入侵并定居下来,也就是定植。但是本身存在的菌群会用各种方式,拒绝新的物种一起生活,就是所谓的“定植抗性”。
对于病原体而言,常驻微生物群的这种定植抗性,可以使其更难生长和繁殖,从而预防疾病的发生。
举个例子:
鼻腔微生物群的存在,可以保护人体免受呼吸道金黄色葡萄球菌感染,金黄色葡萄球菌想要入侵得过鼻腔微生物群这一关…
换句话说,益生菌如果想要定植,必须与宿主菌群竞争养分和粘附部位,争到了资源,活下来,才能繁衍后代。
具体的争抢资源的方式是什么?
包括以下各种方式:改变资源可用性、占领生态位、捕食、竞争等。
我们大致分成两种机制:直接和间接。
指严格通过与肠道菌群相关的因素,来限制外源微生物定植,独立于与宿主的任何相互作用。
这就涉及到菌群之间的相互作用。
一般这样的相互作用分为两种情况:
互利共生和竞争关系。
以拟杆菌为例。
▸ 互利共生(定植成功):
不同的拟杆菌种之间存在广泛的互利共生作用,也就说,拟杆菌群在肠道中团结友爱,稳定存在。
比如说,一些拟杆菌能够分解某种多糖,并释放出小分子物质,从而促进不能利用该多糖的拟杆菌生长。更有甚者,这种交互共生关系有时是以过量消耗某一种拟杆菌能量的前提下实现的。
延伸到其他菌群,可能会出现的情况:
里应外合:
准备入侵的菌与本地菌群偶然相互作用,促进定植;
抱团取暖:
两个非本地菌群之间的良好相互作用,可以使定植更加成功。
▸ 竞争关系(一争高下):
非病原菌与细菌竞争肠道上皮细胞刷状缘的结合位点,阻止病原菌的黏附、侵袭;
细菌竞争性利用营养素,消耗掉维持各自种群的生长原料。
有些菌群不直接和新来的菌群产生竞争,而是可以通过改变环境(改变pH值,胆汁酸浓度等)或释放抑制因子(如,代谢产物、细菌素等),从而决定另一个物种是否能成功定植。
结合肽聚糖抑制其他菌生长:
例如,拟杆菌的结构分子及代谢产物,能通过激活一系列的免疫细胞而参与宿主肠道免疫。
拟杆菌还能够更大量地刺激肠上皮细胞分泌RegIIIγ,它能够强力结合大部分革兰氏阳性菌表面的肽聚糖,抑制脂磷壁酸的合成从而抑制细菌的生长。
环境的改变如何影响其他菌群?
更高的营养浓度会导致微生物之间更多的负面相互作用
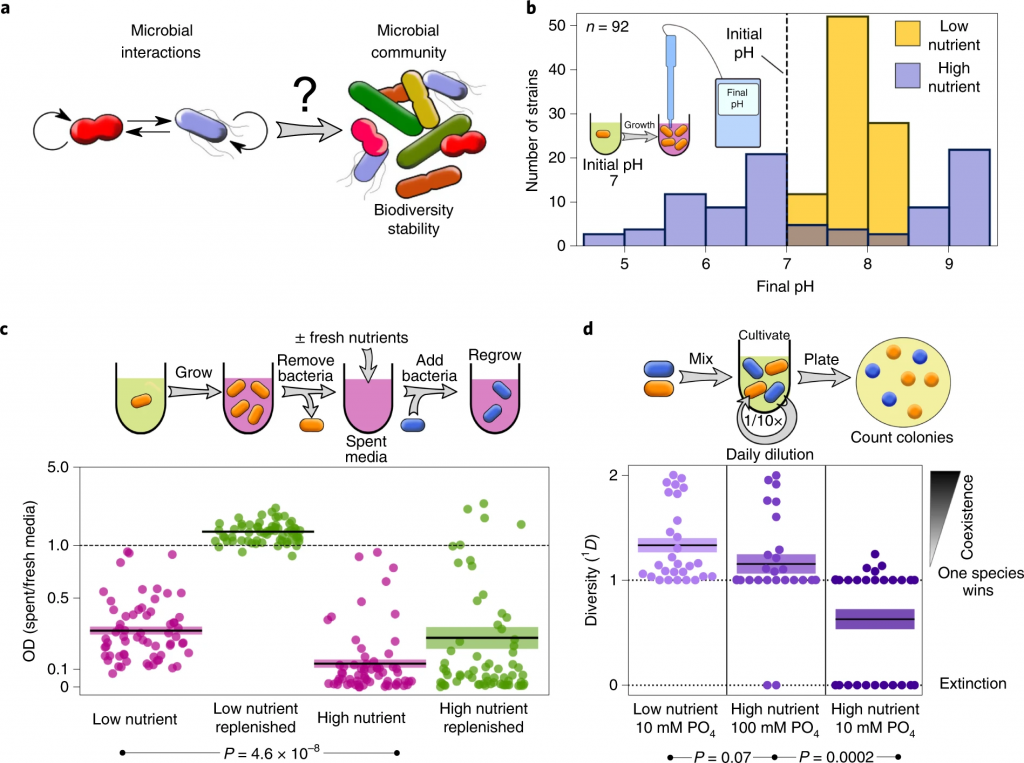

Ratzke C, et al., Nat Ecol Evol. 2020
在较高的营养浓度下,细菌会更强烈地改变环境pH值。
在较高的营养浓度下,细菌会产生更具生长抑制性的环境。
参考上图c,直接(紫色)或补充资源(绿色)后使用不同细菌的废培养基重新培养细菌。每个相互作用对的相对增长显示为散点图。
高营养浓度会减少相互作用对之间的共存。
低营养成分包括0.1%酵母抽提物和0.1%大豆酮。高营养的培养基与添加1%葡萄糖和0.8%尿素的培养基相同。所有28种共培养结果均显示为一个群体图。
微生物获得的营养浓度越高,它们生长的越多,它们代谢的底物就越多,因此它们可以改变环境的能力越强。
再看常见的益生菌,例如,乳酸杆菌和双歧杆菌:
乳酸杆菌和双歧杆菌在碳水化合物发酵过程中产生乙酸盐和乳酸,有机酸可以通过交叉喂养相互作用被其他细菌转化为丁酸盐。这些产生的有机酸降低了腔内的 pH 值,抑制了病原体的生长并增加了矿物质的吸收。
注:丁酸盐和其他短链脂肪酸对肠道健康至关重要,但也可能进入体循环并直接影响新陈代谢或外周组织的功能。短链脂肪酸在脂肪组织、骨骼肌中发挥重要作用和肝脏底物代谢和功能,有助于改善葡萄糖稳态和胰岛素敏感性。
以上,我们了解菌群之间相互作用机制。
可见菌群的定植并不容易,它们要面临的,可能是同伴的帮助,也可能是其他菌群的竞争或杀戮,又或者是受到环境的考验。
在经历此番折腾后,益生菌如果能顺利定植,它会在哪里,如何定植?
胃肠道的成功定植,是益生菌能够发挥足够的作用,是赋予健康益处的关键。粘膜粘附是益生菌定植的重要步骤。
在本小节中,我们将讨论肠道粘液层的组成和与益生菌粘附相关的特定蛋白质。
什么是肠粘膜和粘液层?
肠粘膜由上皮层、固有层和肌层组成。小肠绒毛由上皮细胞和伸入肠腔的固有层组成,覆盖在黏膜表面,负责肠内营养物质的吸收。
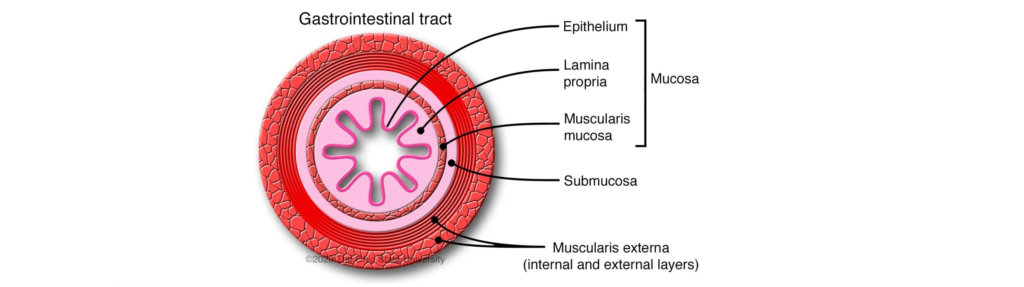
上皮细胞由吸收细胞、杯状细胞和内分泌细胞组成。杯状细胞分散在吸收细胞之间,分泌覆盖整个小肠腔的粘液,由碳水化合物、脂类、盐、蛋白质、细菌和细胞碎片组成。
粘液厚度约为 30 ~ 300 μm;从肠道到直肠的厚度都在增加。主要的蛋白质是粘蛋白,它聚合形成一个连续的凝胶基质,为粘膜层提供结构基础,保护肠道免受病原体、酶、毒素、脱水和磨损。
同时,肠道粘液中含有维生素、矿物质等外源性营养物质,为定植于肠道粘液中的细菌提供了巨大的生态生长优势。可以说,粘液是益生菌和病原体的绝佳生态位。
细菌粘附粘膜的过程包括可逆阶段和稳定阶段。
可逆阶段(初相识)
最初,益生菌通过非特异性的物理接触(包括空间和疏水识别)与粘膜结合,建立可逆的、弱的物理结合。
稳定阶段(如胶似漆)
随后,随着粘附素(通常是固定在细胞表面的蛋白)和互补受体之间的特异性相互作用,益生菌与粘液或肠上皮细胞(IECs)建立了稳定的结合,从而成功定植胃肠道。
益生菌可以编码大量的细胞表面因子,这些因子参与粘液蛋白或上皮细胞的粘附。
除蛋白质外,益生菌中还存在非蛋白分子,如磷壁酸和胞外多糖,它们可以与宿主细胞相互作用,影响粘附。
从目前的研究可以推断,没有固定的分子可以适用于所有菌株的益生菌。
许多粘附素似乎是种或株依赖性的。这些与粘附相关的益生菌表面分子和粘附相关的机制将在下面详细讨论(下表)。
表 益生菌中的粘附相关分子
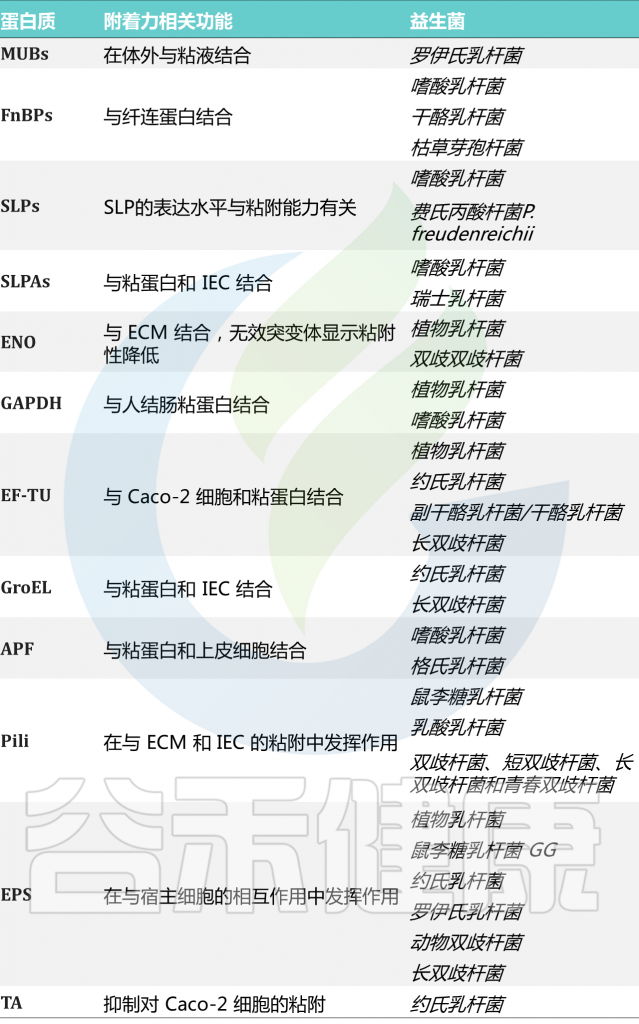

doi.org/10.3389/fcimb.2021.609722
粘液层的组成和与益生菌表面蛋白的结合
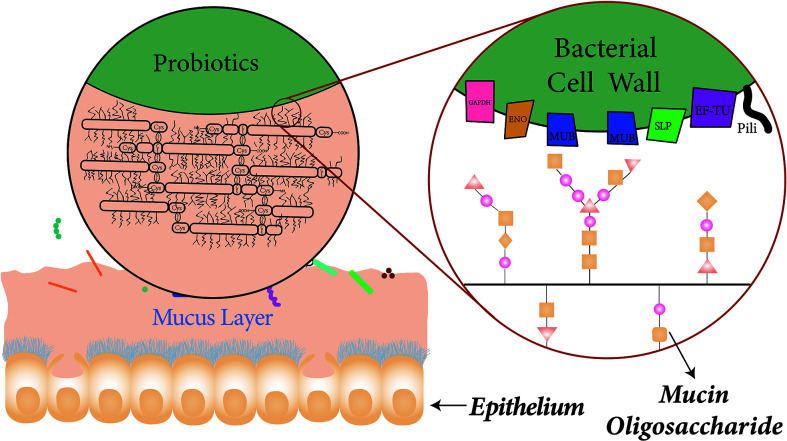
doi.org/10.3389/fcimb.2021.609722
杯状细胞分散在吸收细胞之间,吸收细胞可以分泌覆盖整个小肠的粘液。粘液主要由富含半胱氨酸的粘蛋白组成。粘液蛋白之间广泛的二硫键形成黏液特有的粘弹性。
益生菌表面的特异蛋白在益生菌粘附粘液中起着重要作用。例如,粘液结合蛋白可以通过与粘液蛋白的糖基修饰相互作用而与粘液层结合。
一旦粘附在肠道,益生菌通过将碳水化合物、蛋白质和其他次要化合物转化为能杀死病原菌的重要物质,如有机酸、酶、过氧化氢、细菌素和低分子量肽,可以产生细胞外抗菌成分。
以上是益生菌的定植给人体带来益处,当然这也不一定会发生在每个人身上。
益生菌定植的效果因人而异。
看一项有趣的研究,志愿者被分为两组,“允许型”和“抵抗型”。在允许组的人的肠道粘膜中益生菌菌株显著增加,而在抵抗组的人的肠道中没有检测到益生菌。
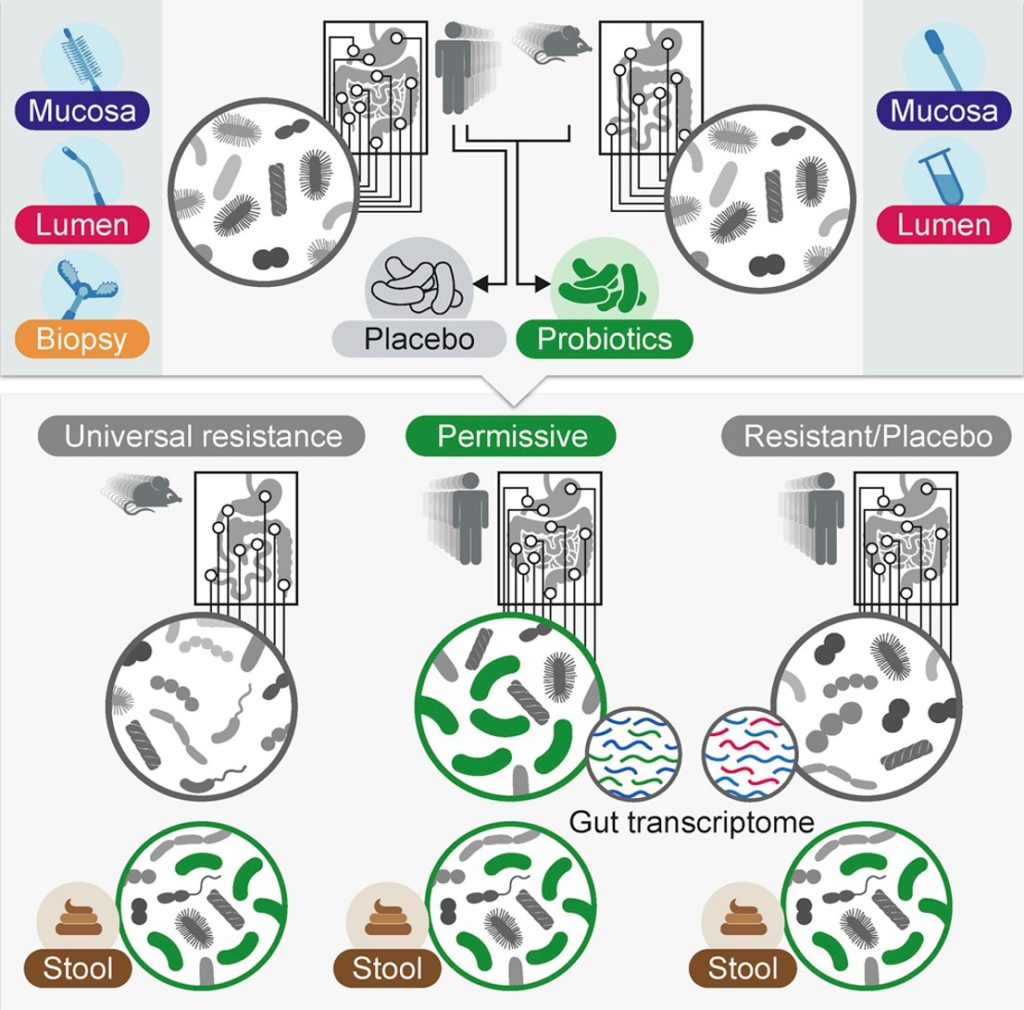
doi.org/10.1016/j.cell.2018.08.041
同样是补充益生菌,有些人身上可以看到非常明显的效果,而有些人的效果则不明显,这是为什么呢?
菌群都具有高度个体特异性,也就是人和人之间的菌群相差较大。
常驻微生物群对人类健康很重要,因为它们占据了可能被病原微生物占据的生态位。
就婴儿而言,影响初始菌群定植的因素包括:胎龄(足月or早产)、分娩方式(自然分娩or剖腹产)、喂养方式(母乳or配方奶)、药物使用(抗菌药物)、生长环境(城市or农村)等。
就成年人而言,年龄、饮食、生活方式、疾病状况、药物使用、环境等多因素都会影响肠道菌群多样性,这在前面的文章《菌群多样性是如何形成的,与健康的关系,如何改善?》已经详细阐述。
这些所有叠加后会形成一个具有高度特异性的个体菌群,构成的整体菌群环境会影响到其他新的菌群的定植。
那么,益生菌在什么样的菌群中更容易定植?
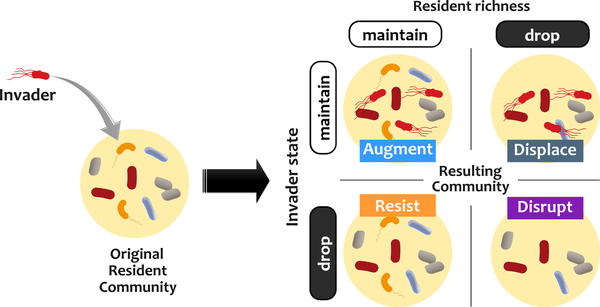
再来看一项研究,为了评估定植抗性,该研究建立了一种电子入侵分析方法,在该方法中,稳定的菌群受到不同种群规模的入侵者的挑战。
doi.org/10.1371/journal.pcbi.1008643(下同)
根据入侵者和常驻菌群的命运对结果进行分类。
有四种可能的结果:
增加入侵者的数量不会增加入侵者定植的概率。
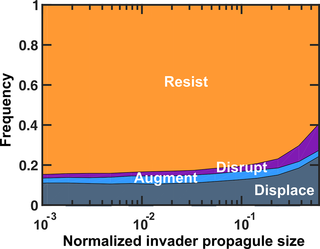
类比到益生菌,高剂量的益生菌可能并不会因此带来明显的定植效果。
基础增长率较高的入侵者更有可能取代常驻菌群,这可能是竞争潜力的主要指标。
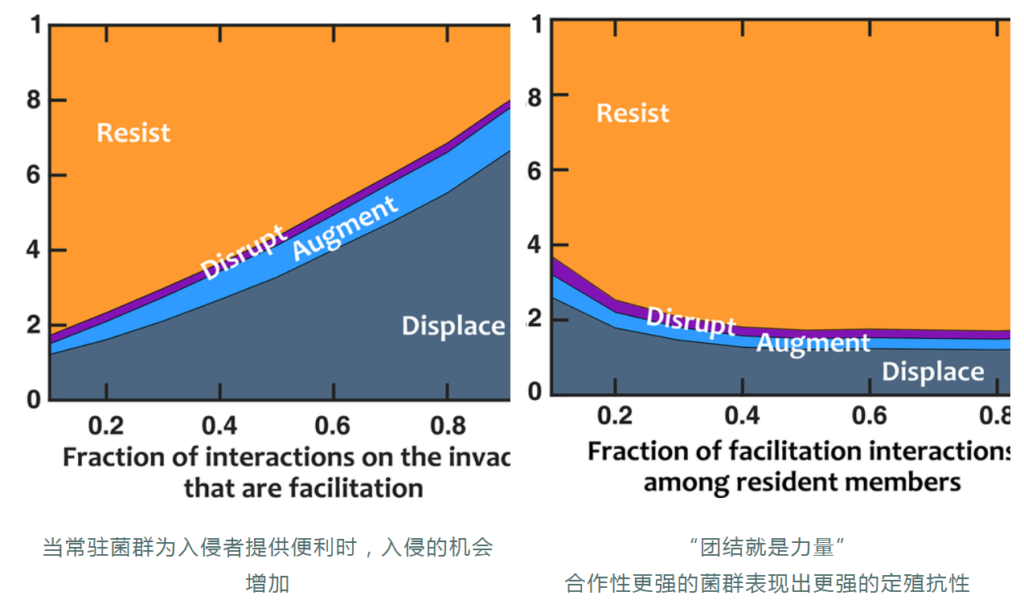

如果常驻菌群创造的化学环境有利于入侵者,入侵者会更成功。
这就说明,常驻菌群本身的结构特征也比较重要。益生菌带来的健康益处可能不仅是由单独补充的益生菌菌株引起的,而是与常驻肠道微生物群相互作用的结果。
研究人员在宏基因组和宏转录组学研究中表明,在 12 名健康老年人中食用鼠李糖乳杆菌GG益生菌菌株改变了常驻菌群的活性,而不会影响肠道微生物群组成本身。
益生菌虽然没有在菌群构成上带来改变,但是菌群的表达特征发生较大变化。尤其是益生菌服用后会大大促进双歧杆菌和主要丁酸产生菌:Roseburia和Eubacterium的鞭毛、运动,趋化性和粘附相关基因的表达。表明其能促进这些关键菌主动渗透进入肠粘膜的能力,提高宿主对于丁酸盐的利用度。
那么对于部分人群,益生菌不能有效定植,是否意味着益生菌无效?
有时候,益生菌并不是完全依靠在肠道的定植来产生影响。就算不能定植,它也有其他很多种方式来发挥优势。
益生菌:有助于维持宿主体内的动态平衡和防治疾病
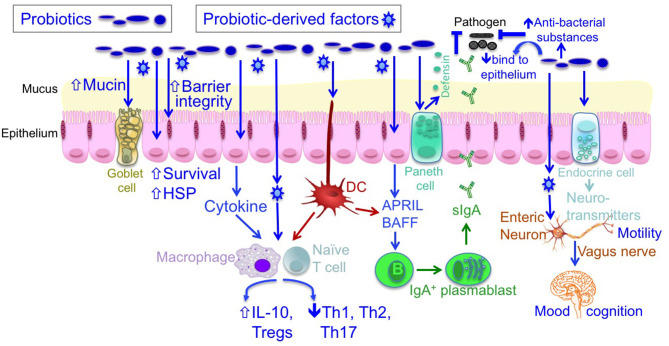
Yan F, Polk DB. Front Immunol. 2020
(1)通过产生抗菌物质和与病原体竞争结合上皮细胞来阻断致病细菌的作用
(2)通过增加屏障功能、粘液生成、存活和细胞保护反应来促进肠上皮细胞的稳态
(3)通过增加先天免疫,如IgA和防御素的产生,上调抗炎细胞因子的产生,抑制促炎细胞因子的产生,确定必要和过度防御免疫之间的平衡
(4)通过产生神经递质和迷走神经调节肠脑轴
益生菌衍生因子:有助于增强肠道屏障功能和刺激抗炎免疫反应
益生菌源因子对宿主反应的调控。一些益生菌衍生因子,包括产物和代谢物,对宿主发挥促进健康的作用。
益生菌的这些功能因子有助于增强肠道屏障功能,刺激抗炎免疫反应,从而改善肠道炎症紊乱。

Yan F, Polk DB. Front Immunol. 2020
益生菌混合物:减少成人肠道致病性或耐药性肠杆菌定植
益生菌补充剂可以减少肠道中潜在的耐药性或致病性肠杆菌,但有时候不能完全根除。
“如果益生菌单打独斗的力量不够,是不是可以寻求其他外援?”
比如多联益生菌,或者益生菌-益生元联合使用等方式。
多联益生菌减少肠杆菌:
为了根除潜在的肠杆菌,益生菌混合物(Bactiol duo ®:S. boulardii、L. acidophilus NCFM、L. paracasei Lpc-37、B. lactis Bl-04、B. lactis Bi-07 )的临床试验表明 ,在阿莫西林-克拉维酸治疗后,产 AmpC肠杆菌的定植会暂时增加,而在益生菌干预后会下降。
嗜酸乳杆菌CL1285、干酪乳杆菌LBC80R 和鼠李糖乳杆菌CLR2 (Bio-K+ ® )的混合物在预防成人抗生素相关性腹泻和初级预防艰难梭菌感染方面也表现出显着效果。
益生菌-益生元联合使用减少肠杆菌:
60名健康绝经前日本女性连续摄入发酵豆奶(含异黄酮)和干酪乳杆菌Shirota,能够降低肠道杆菌的粪便水平,并提高异黄酮的生物利用度。
当然以上只是小规模研究,还需进一步研究。
在人类中,一些临床干预可能会促进肠杆菌的肠道携带。益生菌可能有助于根除肠道携带的致病性或耐药性肠杆菌。
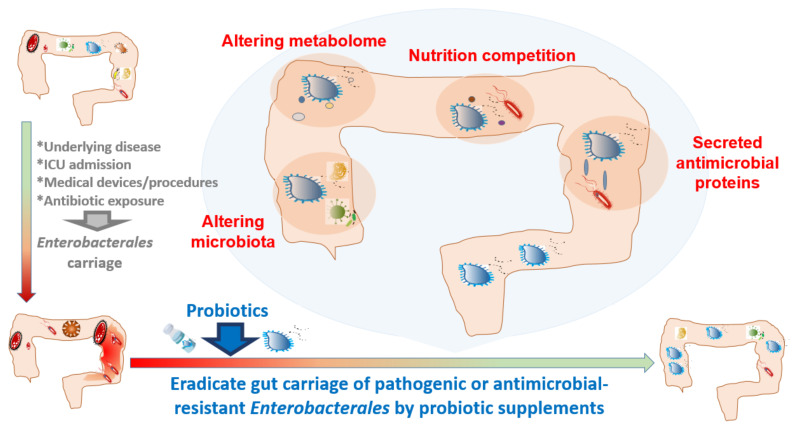
doi:10.3390/antibiotics10091086
综上,益生菌不能定植并不能说就是无效的,它有各种方式来影响人体健康。
“
广谱益生菌无论是否定植,在一定程度上都可以为我们的健康带来益处。当然每个人的菌群特征各不相同,结合肠道菌群检测结果,根据自身菌群特征,选择适合自己的益生菌,可以更加快速有效地帮助建立或恢复健康的菌群。
在服用益生菌的同时,如果能注意上述合理的饮食、健康的生活方式等,相当于开启了外挂,对于快速恢复菌群具有重要意义。主要参考文献:
Yan F, Polk DB. Probiotics and Probiotic-Derived Functional Factors-Mechanistic Insights Into Applications for Intestinal Homeostasis. Front Immunol. 2020;11:1428. Published 2020 Jul 3. doi:10.3389/fimmu.2020.01428
Hung, Yuan-Pin et al. “The Potential of Probiotics to Eradicate Gut Carriage of Pathogenic or Antimicrobial-Resistant Enterobacterales.” Antibiotics (Basel, Switzerland) vol. 10,9 1086. 8 Sep. 2021, doi:10.3390/antibiotics10091086
Wieërs G, Belkhir L, Enaud R, et al. How Probiotics Affect the Microbiota. Front Cell Infect Microbiol. 2020;9:454. Published 2020 Jan 15. doi:10.3389/fcimb.2019.00454
Pickard, Joseph M et al. “Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease.” Immunological reviews vol. 279,1 (2017): 70-89. doi:10.1111/imr.12567
Zmora N, Zilberman-Schapira G, Suez J, Mor U, Dori-Bachash M, Bashiardes S, Kotler E, Zur M, Regev-Lehavi D, Brik RB, Federici S, Cohen Y, Linevsky R, Rothschild D, Moor AE, Ben-Moshe S, Harmelin A, Itzkovitz S, Maharshak N, Shibolet O, Shapiro H, Pevsner-Fischer M, Sharon I, Halpern Z, Segal E, Elinav E. Personalized Gut Mucosal Colonization Resistance to Empiric Probiotics Is Associated with Unique Host and Microbiome Features. Cell. 2018 Sep 6;174(6):1388-1405.e21. doi: 10.1016/j.cell.2018.08.041. PMID: 30193112.
Han S, Lu Y, Xie J, Fei Y, Zheng G, Wang Z, Liu J, Lv L, Ling Z, Berglund B, Yao M, Li L. Probiotic Gastrointestinal Transit and Colonization After Oral Administration: A Long Journey. Front Cell Infect Microbiol. 2021 Mar 10;11:609722. doi: 10.3389/fcimb.2021.609722. PMID: 33791234; PMCID: PMC8006270.
de Melo Pereira GV, de Oliveira Coelho B, Magalhães Júnior AI, Thomaz-Soccol V, Soccol CR. How to select a probiotic? A review and update of methods and criteria. Biotechnol Adv. 2018 Dec;36(8):2060-2076. doi: 10.1016/j.biotechadv.2018.09.003. Epub 2018 Sep 26. PMID: 30266342.
Eloe-Fadrosh, Emiley A et al. “Functional dynamics of the gut microbiome in elderly people during probiotic consumption.” mBio vol. 6,2 e00231-15. 14 Apr. 2015, doi:10.1128/mBio.00231-15

谷禾健康
人类肠道菌群复杂多样,在与人类长期的共同进化过程中,具备了调节人体免疫应答、影响疾病发展等作用。这种作用与肠道菌群本身的多样性和关键核心菌种的是否存在等具有紧密联系。
在前面的文章我们已经了解到,肠道菌群失调与很多疾病相关,详见:
肠道菌群失衡的症状、原因和自然改善
造成菌群失调的原因有很多,比如抗生素的使用,膳食营养不均衡,感染,重金属污染,疾病发生以及过渡清洁肠道等。
一般肠道菌群失衡可以通过一些明显的迹象表明肠道菌群失衡,如腹胀气、腹泻、便秘、间歇性或慢性腹泻、肠易激综合征、溃疡性结肠炎和克罗恩病,频繁呼吸道感染、过敏、神经问题、免疫低下或代谢异常等来判别。
说到对改善修复肠道菌群,一般是针对菌群存在异常或者偏离健康状态的特定情况才进行针对性调节,这些调节思路主要包括 “清除”,“补充”,“置换”,“塑造”。常用的手段或措施如,使用抗生素或抗菌剂,益生菌,益生元,膳食纤维,粪菌移植,饮食或天然补充物等。
以上改善措施单一或者组合对改善和调节宿主微生态平衡发挥重要作用。不过个体的菌群构成和状态差异很大,由此带来的干预对不同个体和状态的干预效果同样有很大差异,这也反映在很多菌群干预临床研究上。
所以盲目的补充益生菌,益生元等单纯的从菌量或功效来评价益生菌产品的好坏,都可能不利于有效的改善健康状况和调整微生态平衡。除了对比如益生菌菌株,益生元结构区分等进行更加精细化的功能分析外,还需要结合肠道菌群检测,基于不同肠道菌群特点进行精准化的匹配干预和临床研究。
今天我们主要简单讲下不同的一些益生菌、益生元、天然调节剂等对肠道菌群的调节以及对宿主健康的影响及其差异化。
益生菌的现代定义为“活的微生物,当给予足够的剂量时,会赋予宿主健康”。益生菌主要存在于人体肠道内,通过维持肠道微生物平衡,在宿主体内发挥有益作用。在日常生活中,常见的益生菌,如乳酸杆菌或双歧杆菌,通常作为活性菌制剂食用。
近年来,益生菌的研究取得了重大进展。例如,益生菌益生菌可以改善肠道菌群的组成缓解便秘,IBS,IBD,改善腹泻,修复多种与肠道相关的损伤等,此外,益生菌可以在慢性炎症性疾病的治疗中发挥作用,具有抗癌、抗肥胖和抗糖尿病等作用。
本章节我们列举一些常见的益生菌及其功效。
双歧杆菌
人体内双歧杆菌的数量实际上随着年龄的增长而下降。双歧杆菌在提高整体免疫力、减少和治疗胃肠道感染以及改善腹泻、便秘和湿疹等方面发挥作用。
双歧杆菌中常见的种类有:双歧双歧杆菌、长双歧杆菌、婴儿双歧杆菌、乳酸双歧杆菌、短双歧杆菌等。
双歧双歧杆菌B.bifidum是一种通常用于改善消化问题的益生菌。B.bifidum与健康饮食相结合还可以改善血糖控制、减轻压力并帮助对抗感染,有助于增强免疫系统并减少过敏。
双歧双歧杆菌是在母乳喂养婴儿中发现的第二大菌种。在成年期,双歧杆菌的水平显著下降,但保持相对稳定 (2-14%),在老年时再次开始下降。
对其他肠道菌群的影响
在一项针对 27 名健康志愿者的临床试验中,双歧杆菌的摄入量减少了普氏菌科和普氏菌属,并增加了瘤胃球菌科和Rikenellaceae。
在一项针对 53 名慢性肝病患者的临床试验中,双歧双歧杆菌是成功防止小肠细菌过度生长的益生菌之一。同样,在一项针对 66 名酒精性肝损伤患者的试验中,它与植物乳杆菌(后面会讲到)的组合恢复了肠道菌群。
在对 30 人进行的另一项试验中,双歧双歧杆菌与嗜酸乳杆菌(后面会讲到)结合也在抗生素治疗后恢复了肠道菌群。
健康益处


双歧杆菌除在以上列举的疾病发挥作用之外,还在压力、过敏等方面发挥作用(小规模研究或临床试验单一)。
安全性
B. bifidum一般都是安全的,但应避免在免疫功能低下的个体、器官衰竭和“肠漏”的人群中使用。在这些情况下,益生菌可能会导致感染。在具有自身免疫性甲状腺疾病遗传易感性的人群中,双歧杆菌可能导致其发展和恶化。
短双歧杆菌是一种有益细菌,可以在人类母乳以及婴儿和成人的胃肠道中找到。随着个体年龄的增长,其肠道内的短双歧杆菌减少。
对肠道菌群的影响
在一项对 30 名没有其他畸形、染色体异常或宫内感染的低出生体重婴儿的研究中,早期给予短双歧杆菌促进了双歧杆菌的定植和正常肠道菌群的形成。
B. breve还显著减少了 10 名极低出生体重婴儿的吸入空气量并改善了体重增加。
健康益处


短双歧杆菌除在以上列举的疾病发挥作用之外,还在肥胖、坏死性小肠结肠炎、乳糜泻、感染等疾病中发挥作用(小规模研究或临床试验单一)。
目前已有文献中,部分关于短双歧杆菌菌株的研究:
短双歧杆菌M -16V (B. breveM-16V) 显着抑制 Th2 和 Th17 淋巴细胞亚群。
同时,B. breve M-16V 可能激活 MyD88 表达并促进 Th1 相关细胞因子 IL-12 的产生。此外,B. breve M-16V 可能部分恢复肠道菌群失调。
B. breve CCFM1025 是一种很有前途的候选精神生物菌株,可减轻抑郁症和相关的胃肠道疾病。
B. breve FHNFQ23M3可以缓解腹泻症状。
母乳分离的益生菌菌株B. breve CECT7263 是一种安全有效的婴儿绞痛治疗方法。
B. breve UCC2003 在生命早期驱动肠上皮稳态发育中发挥着核心作用。
安全性
B. breve被证明是适合早产儿常规使用的益生菌。
与使用短双歧杆菌相关的不良事件发生率极低,且严重程度较轻。
长双歧杆菌是一种革兰氏阳性、杆状细菌,天然存在于人体胃肠道中。它可以改善人体免疫反应并帮助预防肠道疾病。早期证据表明,它还可以抑制过敏、降低胆固醇和改善皮肤健康。
我们之前这篇文章有详细介绍,详见:双歧杆菌:长双歧杆菌
乳酸杆菌
鼠李糖乳杆菌是一种革兰氏阳性乳酸菌,是人类正常肠道菌群的一部分。通常都是安全的,并已广泛用于食品和保健品中。
健康益处


鼠李糖乳杆菌除在以上列举的疾病发挥作用之外,还在体重管理、肝功能、牙齿健康、免疫、怀孕与分娩等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
鼠李糖乳杆菌在健康成人中是安全的并且耐受性良好,并且似乎不会对年轻或老年受试者造成不良影响。
但是,免疫功能低下的人不应服用它,因为它可能导致菌血症。在器官衰竭、免疫功能低下状态和肠道屏障功能失调的患者中使用益生菌可能导致感染。
短乳杆菌L. brevis是一种植物来源的乳酸菌,L. brevis可以在酸菜和泡菜等发酵食品中找到。它也是人体肠道微生物群的正常组成部分。
健康益处


短乳杆菌除在以上列举的疾病发挥作用之外,还在睡眠、口腔黏膜炎等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
L. brevis被认为对人类食用是安全的。
L. brevis可以产生生物胺,如酪胺和腐胺。
对于器官衰竭、免疫功能低下和肠道屏障机制功能障碍的患者,应避免使用益生菌,因为可能会导致感染。为避免任何不利影响或意外相互作用,请在服用短乳杆菌之前咨询医生。
干酪乳杆菌是一种革兰氏阳性、非致病性乳酸菌。它存在于发酵乳制品(例如奶酪)、植物材料(例如葡萄酒、泡菜)以及人类和动物的生殖和胃肠道中。
作为一种营养补充剂,干酪乳杆菌已被证明可以改善肠道微生物平衡、关节炎、2 型糖尿病,并具有潜在的抗癌特性。
干酪乳杆菌在动物消化道中的运输过程中增强了免疫系统,可以刺激一氧化氮、细胞因子和前列腺素的产生。
干酪乳杆菌通过激活自然杀伤 (NK) 细胞、细胞毒性 T 细胞和巨噬细胞来促进小鼠化疗药物引起的免疫抑制的恢复。这些都是识别和消除肿瘤细胞和感染细胞的白细胞。
对其他肠道菌群的影响
干酪乳杆菌与普氏菌属、乳酸杆菌属、粪杆菌属、丙酸杆菌属、双歧杆菌属和一些拟杆菌科和毛螺菌属呈正相关,与梭菌属、芽孢杆菌属、沙雷氏菌属、肠球菌属、志贺氏菌属和希瓦氏菌属的存在呈负相关。
在志愿者实验中,L. casei 抑制了潜在有害的假单胞菌和不动杆菌。
含有干酪乳杆菌的发酵乳保留了肠道微生物群多样性,缓解了腹部功能障碍,在学业压力的健康医学生中,它并防止了皮质醇水平升高。
健康益处


干酪乳杆菌除在以上列举的方面发挥作用之外,还在压力、免疫力、呼吸道和胃肠道感染、病毒感染、炎症、关节炎、过敏、牙齿健康、心血管疾病、糖尿病、吸烟的并发症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
干酪乳杆菌通常具有良好的耐受性。应避免在器官衰竭、免疫功能低下和肠道屏障功能障碍的患者中使用益生菌。为避免不良反应,请在开始任何新的益生菌补充剂之前咨询医生。
格氏乳杆菌是一种乳酸菌,具有抗菌活性、产生细菌素以及调节先天和适应性免疫系统。
健康益处


格氏乳杆菌除在以上列举的疾病发挥作用之外,还在胆固醇、免疫力、肠道健康(腹泻、溃疡、幽门螺杆菌)、过敏、疲劳、子宫内膜异位症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
一般认为是安全的。然而,应避免在器官衰竭、免疫功能低下状态和肠道屏障功能障碍的患者中使用益生菌。为防止不良副作用,请在开始服用新的益生菌补充剂之前咨询医生。
嗜酸乳杆菌是一种革兰氏阳性乳酸菌,传统上广泛用于乳制品行业,最近还用作益生菌。
嗜酸乳杆菌因其风味和益生菌作用而被添加到商业酸奶和乳制品配方中,并且是最常选择的用于饮食的乳酸菌之一。
对其他肠道菌群的影响
接受嗜酸乳杆菌和纤维二糖的健康志愿者表现出乳酸杆菌、双歧杆菌、柯林氏菌和真杆菌的水平升高,而Dialister降低了。
酸奶中的嗜酸乳杆菌可正向改变肥胖小鼠的肠道微生物群并增加肠道双歧杆菌。
嗜酸乳杆菌增加了大鼠中乳酸杆菌和双歧杆菌的数量,增加了乙酸、丁酸和丙酸的水平,并降低了人体微生物群模拟器中的铵盐。


嗜酸乳杆菌除在以上列举的疾病发挥作用之外,还在改善儿童叶酸和 B12 状态、糖尿病、轻微肝性脑病、老化、疲劳等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
嗜酸乳杆菌通常耐受性良好。然而,应避免在器官衰竭、免疫功能低下状态和肠道屏障功能障碍的患者中使用益生菌,因为它可能导致感染。
肠道微生物植物乳杆菌是一种很有前途的,用于治疗腹泻、高胆固醇和特应性皮炎的益生菌。植物乳杆菌是一种广泛分布的乳酸菌。它常见于许多发酵的植物产品中,例如酸菜、泡菜、卤橄榄和韩国泡菜。
植物乳杆菌是一种具有抗癌、抗炎、抗肥胖和抗糖尿病特性的抗氧化剂。植物乳杆菌可以减少促炎细胞因子(IL-6、IL-8和MCP-1)的产生,增加抗炎细胞因子 ( IL-10 ) 的产生,降低 ALT 和 AST,减少NF-κB.
营养益处
从生牛奶中分离出的植物乳杆菌能够产生 B 族维生素核黄素(B2) 和叶酸(B9)。
植物乳杆菌可使健康女性从果汁饮料中吸收的铁增加约 50%。
植物乳杆菌可以将女性从燕麦基质中的铁吸收提高 100% 以上。
含有植物乳杆菌的发酵乳表现出更高的钙保留摄取。


植物乳杆菌除在以上列举的疾病发挥作用之外,还在改善肥胖、血糖、伤口愈合、牙齿健康、免疫、过敏、念珠菌病等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
在大鼠中未观察到任何类型的不良反应,即使在大量食用后也是如此。然而,与其他益生菌一样,用于器官衰竭、免疫功能低下状态和功能失调的肠道屏障机制的患者可能会导致感染。为了避免不良事件,请在使用益生菌之前咨询医生。
菊粉(不要与胰岛素混淆,胰岛素是一种控制血糖水平的激素)是一种存在于多种植物中的可溶性纤维。纤维是不被人体肠道消化或吸收的化合物。可溶性纤维吸水并在消化过程中变成凝胶。
来源及用处
菊粉存在于 36,000 种植物中,包括我们日常饮食中食用的植物,如小麦、洋葱、香蕉、大蒜和芦笋。它们也存在于不太常见的食物中,例如菊芋,尤其是菊苣,菊粉是商业提取菊粉的主要来源。
菊粉的其他天然来源有:菊苣根、龙舌兰、雪莲果根、新鲜香草等。不太常见的菊粉来源是蒲公英根、松果菊、牛蒡根等。
含有菊粉的植物用它来储存能量和抵御低温。当暴露于低温时,菊粉起到防冻剂的作用。
菊粉的溶解度使其能够吸收大量水分。当它膨胀时,它会形成一种凝胶,沿途聚集脂肪颗粒并将它们排出体外。
此外,它通过充当有益菌的食物,来增加肠道中有益细菌的数量。
对其他肠道菌群的影响
前面我们知道,双歧杆菌是肠道中的有益菌。菊粉基本上是双歧杆菌的食物并刺激它们的生长和活动。
多项研究表明,菊粉可刺激双歧杆菌的生长。例如:
8 名健康受试者被给予低聚果糖 15 天,并监测他们的粪便。虽然粪便中的细菌总数没有变化,但双歧杆菌成为主要类型。
在另一项研究中,10 名便秘的老年患者服用菊粉 19 天,并监测他们的大便情况。这些患者还表现出双歧杆菌数量增加,同时有害细菌减少。
此外,其他菌群似乎也受到菊粉的影响。
在一项针对 165 人的临床试验中,这种纤维还增加了厌氧菌的丰度(可以通过产生丁酸改善消化,甚至预防结肠癌),并减少嗜胆菌(与大便和便秘有关)。
不一样的研究结果
对实验室培养的细菌进行的一些研究表明,菊粉还会增加沙门氏菌等有害细菌,以及那些不会在正常人中引起疾病但可能导致免疫系统较弱的人感染的细菌,例如克雷伯氏菌和大肠杆菌。然而,其他实验室研究表明,菊粉通过增加双歧杆菌的生长来抑制艰难梭菌等有害细菌的生长。


菊粉除在以上列举的疾病发挥作用之外,还在增加钙和镁的摄取、骨骼健康、炎症性肠病、预防结肠癌的发展等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
注意事项
菊粉可能对敏感个体产生某些副作用,或者如果使用的剂量太大产生不良反应。这些包括:
肠道不适,包括胀气、腹胀、胃部噪音、嗳气和痉挛、结肠肿胀、腹泻等。
此外可能会发生严重的过敏反应,但很罕见。在一些孤立的案例中,它会导致过敏反应,可能与食物过敏反应有关。
此外,对于在怀孕和哺乳期间补充菊粉的效果知之甚少。因此,孕妇应避免服用菊粉补充剂。
对于肠易激综合征 (IBS) 患者,低剂量可能会调节肠道细菌并减轻症状,但大剂量可能会产生中性甚至负面影响。
果胶是一种复杂的碳水化合物(多糖),存在于植物细胞壁中,有助于维持其结构。它是一种粘性可溶性纤维,具有形成凝胶的能力。果胶由主要在大肠(结肠)中的有益菌群发酵,产生短链脂肪酸。
由于其凝胶状稠度,果胶是一种流行的食品添加剂,作为增稠剂和纤维的重要来源,具有许多潜在的健康益处。研究表明,它可能有助于治疗高胆固醇、反酸、减肥和糖尿病。
果胶含量高的水果和食物
果胶存在于水果、蔬菜、豆类和坚果中。柑橘皮中的果胶含量最高,如橙皮、柠檬皮和葡萄柚皮(30% 至 35%)和苹果果肉(15% 至 20%)。其他主要来源包括木瓜、李子、醋栗、樱桃、杏子、胡萝卜等 。


在食品工业中用作胶凝剂(用于果酱和果冻)或用作稳定剂(用于糖果、果汁和奶饮料)的果胶主要从苹果果肉或柑橘类水果的果皮中提取。


果胶除在以上列举的疾病发挥作用之外,还在改善糖尿病、减肥、辐射损伤、便秘、呕吐、降血压、溃疡性结肠炎、铅毒性等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。
对肠道菌群的影响
果胶在结肠中由不同的细菌属发酵,如双歧杆菌、乳酸杆菌、肠球菌、直肠真杆菌、普氏粪杆菌、梭菌、厌氧菌、Roseburia属,以促进其生长。
果胶的降解由不同的细菌衍生酶(如果胶酶、甲基酯酶、乙酰酯酶和裂解酶)促进,产生不同的POS,其取决于微生物群组成和果胶结构。
体外发酵系统报告的果胶效应


Blanco-Pérez F, et al., Curr Allergy Asthma Rep. 2021
果胶通过增加拟杆菌的丰度来改变肠道菌群的组成,并改善酒精诱导的肝损伤(在非酒精性脂肪肝中,拟杆菌的丰度降低)。
膳食纤维果胶可以改变肠道和肺微生物群中厚壁菌门与拟杆菌门的比例,增加粪便和血清中短链脂肪酸的浓度。
通过果胶产生的短链脂肪酸进行免疫调节

Blanco-Pérez F, et al., Curr Allergy Asthma Rep. 2021
果胶经肠道菌群发酵可产生短链脂肪酸。不同的属可以产生不同的短链脂肪酸。例如,乙酸盐可以由许多不同的属生产;丙酸主要由拟杆菌门和厚壁菌门产生,丁酸主要由梭状芽胞杆菌产生。短链脂肪酸结合“代谢感知”G蛋白偶联受体,如GPR41、GPR43、GPR109A和嗅觉受体(Olfr)-78。这些受体促进肠道内稳态和炎症反应的调节。GPRs及其代谢产物影响Treg活化、上皮完整性、肠道稳态、DC生物学和IgA抗体反应。通过抑制HDAC的表达或功能,短链脂肪酸还影响许多细胞和组织中的基因转录。
过敏:果胶在过敏反应中的作用存在争议
一些临床报告表明,食用果胶后出现过敏反应,这可能归因于果胶和过敏原之间的交叉反应。此外,果胶还被描述为防止胃中过敏原的消化,促进完整的过敏原分子到达肠道并诱发过敏反应。
然而,其他人则认为果胶有直接和间接免疫调节作用。已经提供了一系列广泛的证据,描述了应用果胶诱导有益微生物群的转变和SCFA水平的增加,这两者都与减少体内外的炎症和过敏反应有关。由于不同的果胶增加或减少了与人类健康相关的细菌数量,因此,施用果胶可能会对肠道中的菌群进行特异性调节。
果胶能够通过与TLR2的静电相互作用直接与免疫细胞(如DC和巨噬细胞)相互作用,从而抑制促炎症TLR2-TLR1途径,同时不影响TLR2-TLR6耐受途径。
此外,它能够结合LPS,影响其与TLR4的结合。其他类型的细胞,如T细胞、B细胞和NK细胞也被果胶激活,而腹腔巨噬细胞中的iNOS和COX-2表达则被IKK活性、MAPK磷酸化和NF-κB激活抑制,表明其具有抗炎特性。
炎症性肠病:果胶调节IBD相关菌群
在短链脂肪酸中,丁酸能滋养结肠细胞并抑制结肠肿瘤,因此在大肠中表现出促进局部健康的特性。
产丁酸菌(主要属于厚壁菌门)的流失被认为是IBD期间微生物失调的一个特征。果胶可以促进厚壁菌门中许多丁酸生产者的生长。
果胶物质在调节 IBD 相关肠道微生物群中的综合概况

Wu D, et al., Compr Rev Food Sci Food Saf. 2021
注:不同颜色表示不同的细菌门。绿色箭头表示果胶物质对细菌的调节作用,红色箭头表示 IBD 与特定微生物群之间的正相关或负相关。
注意事项
果胶通常对人类食用是安全的。然而,在临床试验中,纤维与果胶的混合物(每天 20 克,持续 15 周)会引起一些与肠道相关的副作用,例如腹泻、肠胃胀气和稀便。
与药物相互作用:
在 3 名高胆固醇患者中,每天服用 15 克果胶和 80 毫克降胆固醇药物(洛伐他汀)会增加 LDL 水平。
建议把果胶和地高辛分开至少 2 小时。
在一项对 7 名健康受试者进行的研究中,他们服用 12 克柑橘果胶和 25 毫克 β-胡萝卜素,果胶将 β-胡萝卜素(维生素 A的前体)血液水平降低了 50% 以上。
姜黄是一种来自植物的香料,通常用于调味或着色咖喱粉、芥末和其他食物。姜黄根也用于制造替代药物。
姜黄已被用于替代医学中,作为降低血液胆固醇、减轻骨关节炎疼痛或缓解慢性肾病引起的瘙痒的一种可能有效的帮助。
姜黄含有几种被称为类姜黄素的主要成分,姜黄素是姜黄中最活跃的植物化学物质。它占类姜黄素的 77%.
姜黄素的健康益处
姜黄素和整个姜黄根茎在治疗慢性疾病如胃肠道、心血管和神经系统疾病、糖尿病和几种癌症方面具有一些有益作用。


姜黄素除在以上列举的疾病发挥作用之外,还在关节痛和关节炎、克罗恩病(肠蠕动、腹泻和胃痛)、狼疮、糖尿病、经前综合症等方面发挥作用(小规模研究或临床试验单一,证据还不够充分)。

姜黄素目前已被认为可以治疗许多疾病,肠道微生物群在姜黄素生物活性机制中可能产生的作用,是一个有趣且有吸引力的研究领域。下面我们来看它们之间有怎样的互作关系。
姜黄素与肠道菌群的相互作用
★ 姜黄素直接调节肠道菌群
食用姜黄素与梭状芽孢杆菌、拟杆菌属物种的增加以及Blautia、Ruminococcus的减少有关。
研究证实,口服姜黄素能够显著改变肠道微生物群落中有益细菌和有害细菌的比例,有利于有益细菌菌株的生长,如双歧杆菌、乳酸杆菌和产丁酸菌,并减少致病菌的丰度,如普雷沃氏菌科、Coriobacteries、肠杆菌、Rikenellaceae.
姜黄素治疗会物种的微生物丰度,例如发现结直肠癌患者粪便中的普雷沃氏菌多。患有结肠癌的小鼠被喂食不同的颗粒饲料,姜黄素的计算人体等效剂量为8/mg/kg/天-162 mg/kg/天。最高剂量的姜黄素给药可减少或消除结肠肿瘤负担,增加乳酸杆菌,减少Coriobacteries。
还清楚地证明,姜黄素治疗可减少几种瘤胃球菌;这是一个有趣的发现,因为瘤胃球菌种类的增加与大肠癌的发生有关。此外,在使用致突变化合物治疗的小鼠中,膳食姜黄素能够将乳酸杆菌的数量恢复到控制水平,这已被证明具有抗肿瘤功能。
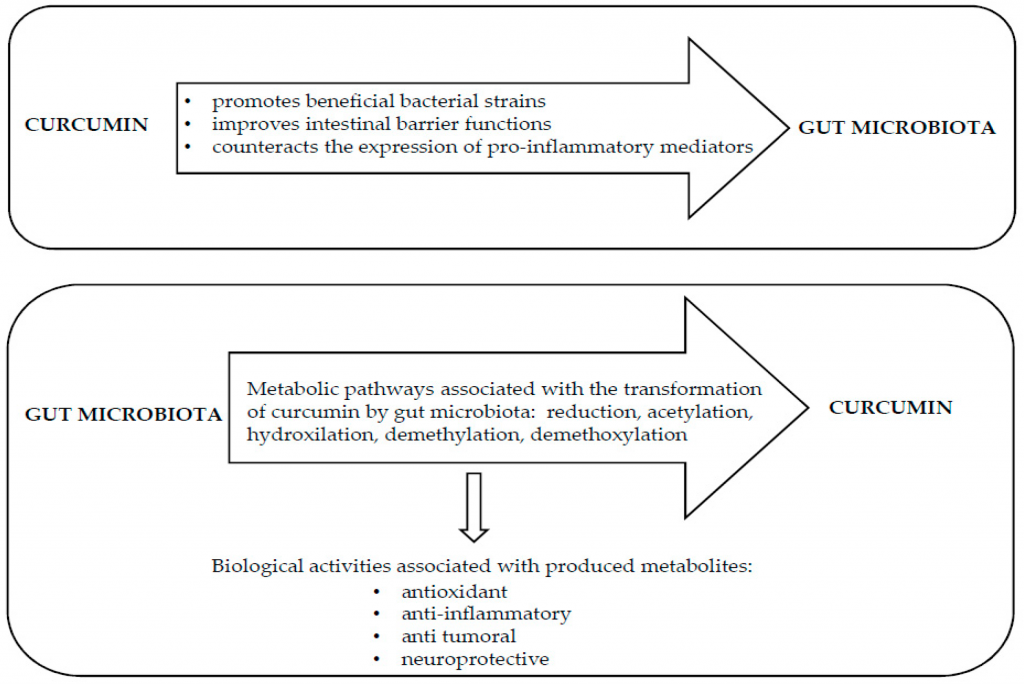

Scazzocchio B, et al., Nutrients. 2020
★ 肠道菌群对姜黄素进行生物转化,产生活性代谢物
姜黄素的代谢转化不仅发生在肠细胞和肝细胞中,还通过肠道微生物群产生的酶进行,这些酶产生许多活性代谢物。姜黄素代谢产物的生物活性可能不同于天然姜黄素,姜黄素的特定生物学特性实际上取决于肠道微生物群消化产生的生物活性代谢产物。
已经鉴定出几种能够修饰姜黄素的肠道细菌:对从人类粪便中分离的微生物的分析表明,大肠杆菌代表了姜黄素代谢活性最高的细菌,通过NADPH依赖的姜黄素/二氢姜黄素还原酶。这种酶能够将姜黄素转化为二氢姜黄素,然后转化为四氢姜黄素。
其他菌群,如长双歧杆菌、假链状双歧杆菌、粪肠球菌、嗜酸乳杆菌和干酪乳杆菌,代表了能够代谢姜黄素的相关菌株,母体化合物的还原率高于50%.
姜黄素代谢物具有与姜黄素相似的特性和效力:四氢姜黄素表现出与母体化合物相同的生理和药理特性,可能是通过β-二酮部分以及酚羟基。此外,四氢姜黄素能够预防氧化应激和神经炎症,还表现出抗癌作用,这可能是由于抑制了显着的细胞因子释放,例如 IL-6 和 TNFα。因此,在对姜黄素的进一步研究中应考虑细菌分解产物,因为它们可能具有有益作用。
对肠道屏障的影响
体外研究表明,姜黄素是一种潜在的化合物,可以恢复被破坏的肠道通透性。在 CaCo2 细胞中,姜黄素能够减轻肠上皮屏障功能的破坏,抵消 LPS 诱导的 IL-1β 分泌并防止紧密连接蛋白破坏。此外,姜黄素还能够减少由 IL-1β 诱导的 p38 MAPK 活化,以及随后紧密连接蛋白磷酸化的升高。
对肠道炎症的影响
代谢组学分析显示姜黄素对氧化应激和炎症的生物标志物具有有益作用,作者认为,姜黄素治疗抵消了非酒精性脂肪肝进展过程中一些细菌菌株的增加。
一项活体动物研究报告,新开发的纳米姜黄素通过抑制促炎介质的表达和诱导Treg扩张(同时伴随粪便丁酸水平的增加)积极改善DSS-结肠炎小鼠的炎症。将姜黄素与正常啮齿类动物饮食的粉末形式(含有0.2%(w/w)纳米姜黄素)混合:该化合物能够抑制NF-κB的激活和治疗小鼠结肠上皮细胞中促炎症介质的表达。
或者,姜黄素可以通过抑制TLR4/MyD88/NF-κB信号通路的激活来减轻LPS诱导的炎症。此外,姜黄素能抑制NF-κB核转位,并减轻其他在癌症中过度激活的促炎症基因的表达。
在喂食添加姜黄素(300 mg/kg姜黄素,与正常饲料混合)28天的断奶仔猪中,Gan等人证明,这种多酚能够通过抑制大肠杆菌增殖来减轻炎症,下调TLR4的表达。
虽然姜黄素迄今为止在体内研究中描述了所有有益的作用,但这些结果必须通过更大的人体临床试验得到一致的支持。
潜在风险和副作用
姜黄素通常耐受性良好。
常见的副作用包括便秘、消化不良(消化不良)、腹泻、腹胀、胃食管反流(胃酸反流)、恶心、呕吐和其他肠道问题。
极少的情况下,姜黄素会引起瘙痒或凹陷性水肿。
姜黄涂在皮肤上可能会引起过敏性接触性皮炎。
在高剂量体外模型中,姜黄素可引起细胞毒性和 DNA 损伤。
协同效应
添加胡椒碱(来自黑胡椒)可能会增加姜黄素在血液中的吸收。研究人员估计它可能会将姜黄素的生物利用度提高多达 2000%.
白藜芦醇是一种多酚,主要存在于葡萄皮和红酒中。
白藜芦醇是一种小多酚,在 1990 年代引起了科学界的关注。这种化合物被戏称为“瓶中的法国悖论”,因为在红酒中发现了白藜芦醇,法国人喜欢在高饱和脂肪饮食的同时食用不太适量的白藜芦醇。然而,法国人的心脏病发病率非常低。
虽然红酒中的白藜芦醇不太可能完全解释这一悖论,但一些科学家表示它可能是一个促成因素。
葡萄皮中的白藜芦醇含量很高,因为葡萄会产生白藜芦醇来防御毒素和寄生虫。它也存在于各种浆果、花生、大豆中。
有限的研究探索了它的抗氧化、抗炎、抗衰老和植物雌激素活性。白藜芦醇确实具有改善慢性疾病的一些潜力。
白藜芦醇有一个主要缺陷:生物利用度差。
白藜芦醇比其他多酚(如槲皮素)更容易从肠道吸收到血液中。但它会很快分解,在血液中留下很少的游离白藜芦醇。
与肠道菌群之间的关系
白藜芦醇和肠道菌群之间的双向相互作用:肠道菌群进行白藜芦醇生物转化,白藜芦醇对肠道菌群进行相互靶向,从而维持肠道稳态。
白藜芦醇的长期摄入改变了DSS诱导小鼠的肠道菌群,厚壁菌门/拟杆菌门的比例显著提高,这反过来又改变了白藜芦醇的代谢。
白藜芦醇补充对肠道生态系统的作用
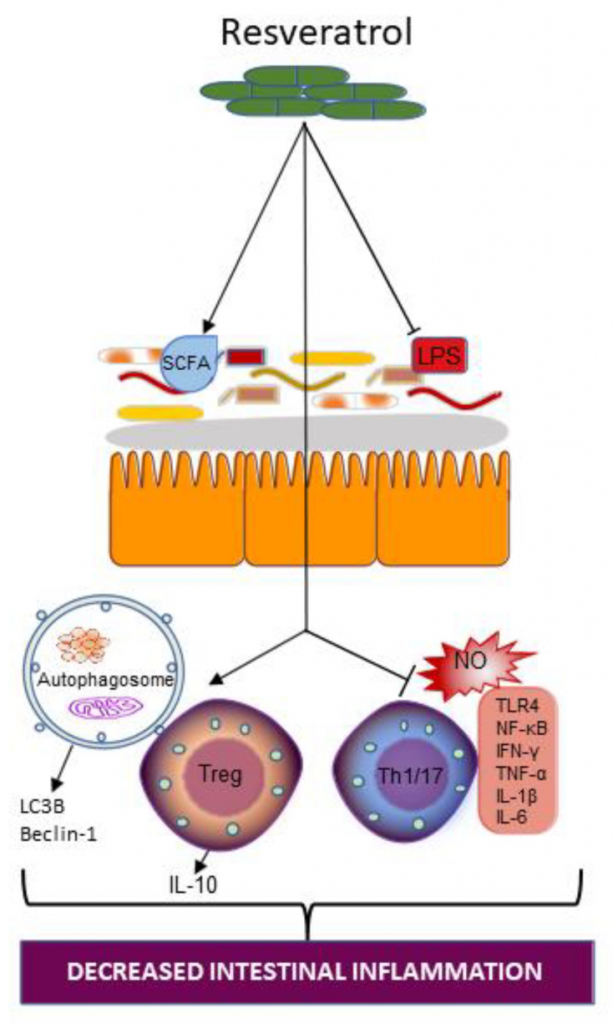

Wellington VNA, et al., Int J Mol Sci. 2021
白藜芦醇添加增加了产短链脂肪酸菌,同时减少了产生LPS的肠道细菌。
补充白藜芦醇也可以通过增加自噬小体的数量和诱导微管相关蛋白1A/1B-light chain 3和Beclin-1的表达来恢复自噬,这两种蛋白在自噬中都是重要的蛋白。白藜芦醇补充也可能会中断Th1/17和细胞因子依赖的促炎通路,一氧化氮依赖的促氧化通路,并干扰toll样受体(TLR) 4信号转导。
白藜芦醇能减轻LPS对小鼠肠道和肝脏的炎症损伤。白藜芦醇减少了拟杆菌和Alistipes的相对丰度,增加了乳酸杆菌的相对丰度。白藜芦醇治疗降低了肝脏中TNF-α、IL-6、IFN-γ、髓过氧化物酶和丙氨酸转氨酶的水平。
此外,益生菌Ligilactobacillus salivarious Li01促进白藜芦醇大量代谢为二氢藜芦醇、硫酸白藜芦醇和白藜芦醇葡萄糖苷酸。在代谢产物中,二氢藜芦醇水平升高最为显著。
肠道菌群的存在促进了二氢藜芦醇的产生,同时促进了硫酸白藜芦醇和白藜芦醇葡萄糖苷酸的消除。

补充剂量
大多数补充剂含有 50 – 500 毫克白藜芦醇。有些含有更高的剂量,高达 1,200 毫克。
临床数据仍然有限。可用的临床研究使用典型的白藜芦醇剂量:
口服纯白藜芦醇的剂量在 150 – 500 毫克/天之间变化。每天喝 1 – 2 杯葡萄酒(100 – 300 毫升)可降低患心脏病的风险并改善血管健康。不含酒精的葡萄酒可能更有益,尤其是对于已经有患心脏病风险的人。
注意:对于有自身免疫和组胺问题的人来说,葡萄酒可能不合适。某些慢病患者如果不确定每天喝一杯葡萄酒是不是安全,请咨询医生。
在接受高剂量(每天 2.5 克或 5 克)白藜芦醇 29 天的人中观察到频繁的胃肠道不适/腹泻。根据 NOAEL 研究,使用 10 倍的安全系数,对于体重 60 公斤的个体,每日 450 毫克白藜芦醇的剂量被认为是安全的。
补充形式
白藜芦醇有多种形式作为口服补充剂:
大多数研究得出结论,反式白藜芦醇是更活跃的白藜芦醇形式。
增加生物利用度的方法
一些可能增加白藜芦醇生物利用度的方法包括:
协同效应
在研究中探索了以下白藜芦醇协同作用:


与药物相互作用
白藜芦醇可能与肠道或肝脏中的药物相互作用,尤其是那些被相同肝酶 (CYP450) 分解的药物。
白藜芦醇还可以减少血液凝固,增强抗凝血药物(抗凝血剂或抗血小板药物,如阿司匹林、氯吡格雷、达肝素、肝素和华法林)的活性。
一起来看下白藜芦醇可能与之相互作用的药物:
“
他汀类药物(Mevacor)
降低高血压的药物(如硝苯地平)
用于减少心律失常的药物(胺碘酮)
抗真菌剂(Sporanox)
抗组胺药(Allegra)
镇静剂/抗焦虑药(安定等苯二氮卓类药物)
抗抑郁药(Halcion)
抗病毒药物和 HIV 药物(蛋白酶抑制剂)
降低免疫反应的药物(免疫抑制剂)
勃起功能障碍(ED)药物
抗凝血药物
NSAID 止痛药/抗炎药,如双氯芬酸 (Voltaren)、布洛芬 (Advil, Motrin)、萘普生 (Anaprox)
……
来源
你知道葡萄酒中含有多少白藜芦醇吗?
通常,白藜芦醇的总浓度为:
红葡萄酒中 0.2 – 5.8 mg/L(平均约为 2 mg/L)
白葡萄酒中仅约 0.68 mg/L
红葡萄酒的反式白藜芦醇含量是白葡萄酒的六倍;白葡萄酒含有高水平的顺式白藜芦醇。红葡萄酒是在不去除葡萄皮的情况下提取的。
白藜芦醇的其他食物来源包括:
黑巧克力、各种浆果、大豆和生或煮花生。
1 杯煮花生含有 1.28 毫克白藜芦醇,大多数食物中的白藜芦醇含量可能太低,无法指望太多特定的健康益处。
副作用
在对健康人进行的临床研究中,每天服用 500 毫克的白藜芦醇具有良好的耐受性。
给予癌症患者高剂量的高生物利用度白藜芦醇(每天 5 克)不会引起任何严重的副作用,但一些患者会出现恶心和胃部不适。
由于缺乏适当的安全数据,儿童应避免使用白藜芦醇。
有人提出,补充白藜芦醇在怀孕期间有益于平衡新陈代谢和产前健康。不过,没有充分的临床研究调查孕妇中的白藜芦醇。
注意事项
白藜芦醇可减少铁吸收和/或血液水平,这可能会恶化贫血。
白藜芦醇转向代表涉及铁代谢(肝素)的重要蛋白质的基因,这可能降低铁吸收。另一方面,白藜芦醇对铁代谢的影响可能是有益的铁过载。
“
肠道菌群的维护和有益菌等的获得以及核心菌群的定植等,与每个人自身的饮食,遗传,生活环境等息息相关,尽量保持饮食多样化,每天食物应该包括蛋白,肉,全谷物,蔬菜,水果,坚果,鱼油/亚麻籽,发酵和多酚食物,食材选择新鲜,无过渡添加/烹饪同时清洁干净的食物,此外,不滥用抗生素或过渡清洁肠道,合理睡眠,适量运动,保持乐观,将有利于肠道和菌群健康。
主要参考文献:
Kato-Kataoka A, Nishida K, Takada M, et al., Fermented Milk Containing Lactobacillus casei Strain Shirota Preserves the Diversity of the Gut Microbiota and Relieves Abdominal Dysfunction in Healthy Medical Students Exposed to Academic Stress. Appl Environ Microbiol. 2016 May 31;82(12):3649-58. doi: 10.1128/AEM.04134-15. PMID: 27208120; PMCID: PMC4959178.
Segers ME, Lebeer S. Towards a better understanding of Lactobacillus rhamnosus GG–host interactions. Microb Cell Fact. 2014;13 Suppl 1(Suppl 1):S7. doi:10.1186/1475-2859-13-S1-S7
Ren JJ, Yu Z, Yang FL, et al. Effects of Bifidobacterium Breve Feeding Strategy and Delivery Modes on Experimental Allergic Rhinitis Mice. PLoS One. 2015;10(10):e0140018. Published 2015 Oct 7. doi:10.1371/journal.pone.0140018
Diaz Ferrer J, Parra V, Bendaño T, Montes P, Solorzano P. Utilidad del suplemento de probioticos (Lactobacillus acidophilus y bulgaricus) en el tratamiento del sindrome de intestino irritable [Probiotic supplement (Lactobacillus acidophilus and bulgaricus) utility in the treatment of irritable bowel syndrome]. Rev Gastroenterol Peru. 2012 Oct-Dec;32(4):387-93. Spanish. PMID: 23307089.
Jeun J, Kim S, Cho SY, Jun HJ, Park HJ, Seo JG, Chung MJ, Lee SJ. Hypocholesterolemic effects of Lactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice. Nutrition. 2010 Mar;26(3):321-30. doi: 10.1016/j.nut.2009.04.011. Epub 2009 Aug 19. PMID: 19695834.
Yoo JY, Kim SS. Probiotics and Prebiotics: Present Status and Future Perspectives on Metabolic Disorders. Nutrients. 2016;8(3):173. Published 2016 Mar 18. doi:10.3390/nu8030173
Tursi A, Brandimarte G, Giorgetti GM, Forti G, Modeo ME, Gigliobianco A. Low-dose balsalazide plus a high-potency probiotic preparation is more effective than balsalazide alone or mesalazine in the treatment of acute mild-to-moderate ulcerative colitis. Med Sci Monit. 2004 Nov;10(11):PI126-31. Epub 2004 Oct 26. PMID: 15507864.
van Zanten GC, Krych L, Röytiö H, Forssten S, Lahtinen SJ, Abu Al-Soud W, Sørensen S, Svensson B, Jespersen L, Jakobsen M. Synbiotic Lactobacillus acidophilus NCFM and cellobiose does not affect human gut bacterial diversity but increases abundance of lactobacilli, bifidobacteria and branched-chain fatty acids: a randomized, double-blinded cross-over trial. FEMS Microbiol Ecol. 2014 Oct;90(1):225-36. doi: 10.1111/1574-6941.12397. Epub 2014 Sep 5. PMID: 25098489.
Kadooka Y, Sato M, Ogawa A, Miyoshi M, Uenishi H, Ogawa H, Ikuyama K, Kagoshima M, Tsuchida T. Effect of Lactobacillus gasseri SBT2055 in fermented milk on abdominal adiposity in adults in a randomised controlled trial. Br J Nutr. 2013 Nov 14;110(9):1696-703. doi: 10.1017/S0007114513001037. Epub 2013 Apr 25. PMID: 23614897.
Fujii T, Ohtsuka Y, Lee T, Kudo T, Shoji H, Sato H, Nagata S, Shimizu T, Yamashiro Y. Bifidobacterium breve enhances transforming growth factor beta1 signaling by regulating Smad7 expression in preterm infants. J Pediatr Gastroenterol Nutr. 2006 Jul;43(1):83-8. doi: 10.1097/01.mpg.0000228100.04702.f8. PMID: 16819382.
Kanjan P, Hongpattarakere T. Prebiotic efficacy and mechanism of inulin combined with inulin-degrading Lactobacillus paracasei I321 in competition with Salmonella. Carbohydr Polym. 2017 Aug 1;169:236-244. doi: 10.1016/j.carbpol.2017.03.072. Epub 2017 Apr 1. PMID: 28504142.
Micka A, Siepelmeyer A, Holz A, Theis S, Schön C. Effect of consumption of chicory inulin on bowel function in healthy subjects with constipation: a randomized, double-blind, placebo-controlled trial. Int J Food Sci Nutr. 2017 Feb;68(1):82-89. doi: 10.1080/09637486.2016.1212819. Epub 2016 Aug 5. PMID: 27492975.
Blanco-Pérez F, Steigerwald H, Schülke S, Vieths S, Toda M, Scheurer S. The Dietary Fiber Pectin: Health Benefits and Potential for the Treatment of Allergies by Modulation of Gut Microbiota. Curr Allergy Asthma Rep. 2021 Sep 10;21(10):43. doi: 10.1007/s11882-021-01020-z. PMID: 34505973; PMCID: PMC8433104.
Wu D, Ye X, Linhardt RJ, Liu X, Zhu K, Yu C, Ding T, Liu D, He Q, Chen S. Dietary pectic substances enhance gut health by its polycomponent: A review. Compr Rev Food Sci Food Saf. 2021 Mar;20(2):2015-2039. doi: 10.1111/1541-4337.12723. Epub 2021 Feb 16. PMID: 33594822.
Scazzocchio B, Minghetti L, D’Archivio M. Interaction between Gut Microbiota and Curcumin: A New Key of Understanding for the Health Effects of Curcumin. Nutrients. 2020;12(9):2499. Published 2020 Aug 19. doi:10.3390/nu12092499
Ding S, Jiang H, Fang J, Liu G. Regulatory Effect of Resveratrol on Inflammation Induced by Lipopolysaccharides via Reprograming Intestinal Microbes and Ameliorating Serum Metabolism Profiles. Front Immunol. 2021 Nov 15;12:777159. doi: 10.3389/fimmu.2021.777159. PMID: 34868045; PMCID: PMC8634337.
Wellington VNA, Sundaram VL, Singh S, Sundaram U. Dietary Supplementation with Vitamin D, Fish Oil or Resveratrol Modulates the Gut Microbiome in Inflammatory Bowel Disease. Int J Mol Sci. 2021;23(1):206. Published 2021 Dec 24. doi:10.3390/ijms23010206
Yao M, Fei Y, Zhang S, et al. Gut Microbiota Composition in Relation to the Metabolism of Oral Administrated Resveratrol. Nutrients. 2022;14(5):1013. Published 2022 Feb 28. doi:10.3390/nu14051013
Del Follo-Martinez A, Banerjee N, Li X, Safe S, Mertens-Talcott S. Resveratrol and quercetin in combination have anticancer activity in colon cancer cells and repress oncogenic microRNA-27a. Nutr Cancer. 2013;65(3):494-504. doi: 10.1080/01635581.2012.725194. PMID: 23530649.
Malhotra A, Nair P, Dhawan DK. Curcumin and resveratrol synergistically stimulate p21 and regulate cox-2 by maintaining adequate zinc levels during lung carcinogenesis. Eur J Cancer Prev. 2011 Sep;20(5):411-6. doi: 10.1097/CEJ.0b013e3283481d71. PMID: 21633290.

谷禾健康

运动对心肺健康、肌肉力量、葡萄糖代谢、免疫系统和心理健康有影响。新的横断面研究证据表明,运动锻炼与肠道微生物群组成之间可能存在密切关联。

干预研究支持锻炼对肠道微生物群的有益影响。纵向研究表明,经常中等强度的耐力运动对肠道微生物产生最有益的影响,但是不同类型的运动训练方案(例如,阻力、间歇、伸展/柔韧性、耐力/有氧等)对肠道微生物群的影响存在差异。其他如饮食摄入,结肠运送时间,训练状态,共享训练环境,自愿性,健康或疾病状况,年龄,性别等因素也是评估运动和肠道菌群的混杂因素。

反过来,肠道微生物群对运动表现、恢复和疾病模式的各种指标都有间接影响,例如通过肌细胞因子,激素,神经肽和其他代谢物发出信号,调节下丘脑-垂体-肾上腺轴的激活,以及影响与表现相关的代谢途径。
了解肠道微生物群在运动表现中的各种作用,对于寻求改善锻炼结果以及减少训练恢复时间的普通人和运动员来说都非常重要。
本文就以下方面进行详细阐述:

最近的研究表明,运动对肠道微生物群有很多好处。它与有益微生物物种数量的增加和微生物多样性的丰富以及短链脂肪酸合成和碳水化合物代谢的增强有关。
适度运动的频率会导致厚壁菌门的多样性更大。包括Faecalibacterium prausnitzii(产生丁酸,抗炎共生菌),颤螺菌属(Oscillospira) ,有助于更健康肠道环境的Lachnospira和Coprococcus属的成员。
体脂百分比、肌肉质量和身体活动与几种细菌种群显著相关
研究发现,锻炼与女性中具有促进健康功能的细菌的比例更高有关。包括以产生丁酸盐的能力而闻名的F. prausnitzii(普拉梭菌)和Roseburia hominis,以及运动员体内丰富的Akkermansia muciniphila,低水平与肥胖和糖尿病等代谢状况有关。
一项研究调查了 40 名国际职业橄榄球联盟球员的微生物组,并将其与 BMI 高或低的相似年龄的对照组进行比较。结果表明,运动员肠道微生物多样性显著著增加。
与对照组相比,许多其他参数也显示出显著改善的结果。其中包括短链脂肪酸 (SCFA),该研究发现与对照组相比,运动员体内的乙酸盐、丙酸盐、丁酸盐和戊酸盐水平明显更高。”
简而言之,运动已被证明可以显著改善与身体表现和健康相关的几个指标,特别是在有益细菌类型及其功能方面。
然而,这些观察性研究的结果只能确认训练状态和微生物群之间的关联,而不能确定因果关系。
运动与肠道微生物群组成之间的关联似乎是双向的。来自动物研究的越来越多的证据也表明肠道微生物群在宿主的身体机能中起着重要作用。肠道微生物群的组成和代谢活动可能有助于消化膳食化合物并改善运动期间的能量收集,这可以为运动员在高强度运动和恢复期间提供代谢益处。
观察性研究表明,与久坐的受试者相比,运动员微生物组中与氨基酸和碳水化合物代谢相关的代谢活动和途径增加。
在肠道中,细菌将不易消化的碳水化合物发酵成短链脂肪酸乙酸盐、丙酸盐和丁酸盐。训练和定期锻炼与人类粪便短链脂肪酸含量增加有关,并且在动物研究中,特定短链脂肪酸与改善身体机能有关。
大多数短链脂肪酸从肠道吸收并有助于宿主的能量代谢。
丁酸盐主要被结肠中的上皮细胞用作能量来源。
乙酸盐在肌肉组织中代谢,但也可以穿过血脑屏障。
丙酸盐可用作肝脏中葡萄糖合成的前体。
此外,短链脂肪酸可改善肠道屏障完整性,降低局部和全身炎症风险。临床前研究强烈表明短链脂肪酸可能是身体机能的关键调节剂。
值得注意的是,宿主可能不是唯一受益于运动期间与微生物群的共生关系的一方。
目前关于肠道微生物群与身体机能之间相互作用如下:
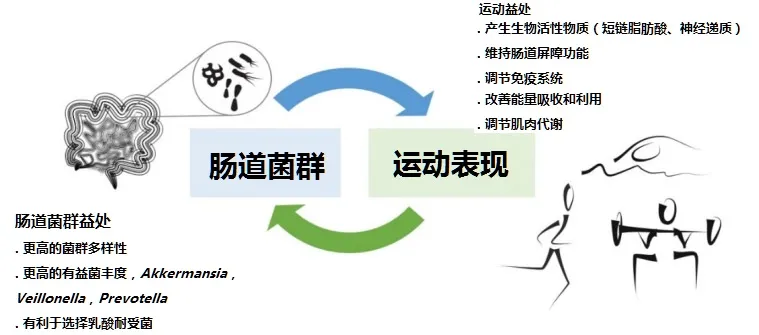
Maija Marttinen et al., Nutrients.2020

你可能想知道运动是否会改变微生物群,或者拥有健康的微生物群是否会让你更加活跃想运动。其实这用一句俗话讲就是“先有鸡还是先有蛋”的情景。
例如,肠道菌群失调会引起炎症,从而导致负面情绪,抑郁等症状,而抑郁不利于外出和积极运动锻炼。
多项研究表明,运动实际上可以改变你的肠道微生物群。
女性:运动与久坐女性菌群有差异
2017 年一项针对女性的研究表明,积极活动方式的女性和久坐女性之间肠道微生物群特征的差异。
积极参与者被选为在试验期间在 7 天内进行至少 10 小时运动的组。久坐组参加安静的活动,并从日常生活中不是经常运动的女性中挑选出来,每周进行 3 次不超过 30 分钟的适度运动。
11 个属(细菌的分类等级)在运动女性和久坐女性之间存在显著差异。重要的是,运动的女性群体拥有更丰富的促进健康的细菌,包括Faecalibacterium prausnitzii、Roseburia hominis和Akkermansia muciniphila.
他们还发现“体脂百分比、肌肉质量和身体活动与几种细菌种群显著相关。”
换句话说就是,过着积极的生活方式更能取悦某些细菌,这是一种正向反馈。
橄榄球运动员比久坐者具有更高的α多样性
一项对爱尔兰男性职业橄榄球运动员的研究表明,与久坐的对照组相比,运动员肠道微生物群的 α 多样性(细菌丰富度,例如在粪便样本中鉴定了多少细菌种类)更高。
肠道微生物群多样性与蛋白质消耗和血浆肌酸激酶水平呈正相关,血浆肌酸激酶水平是运动引起的肌肉损伤的生物标志物。
与高 BMI 对照组的比例相比,在橄榄球运动员和低体重指数 (BMI) 对照组中检测到的Akkermansia细菌比例更高。与低 BMI 的对照组相比,运动员中拟杆菌属的含量显著减少。
从大人群水平上看,Akkermansia和拟杆菌属与肥胖呈负相关。
在微生物代谢水平上也检测到橄榄球运动员和久坐对照组之间的差异,在运动员中检测到的氨基酸和碳水化合物代谢途径活性增加。此外,与久坐的对照组相比,橄榄球运动员的粪便 SCFA(乙酸盐、丙酸盐和丁酸盐)水平更高。
竞技自行车运动员中:经常训练者普氏菌高
在竞技自行车运动员中,每周训练超过 11 小时的自行车手比那些不经常训练的人的普氏菌相对丰度更高。
此外,元转录组学分析表明,普氏菌的转录与微生物组中的支链氨基酸 (BCAA) 代谢途径呈正相关。支链氨基酸,尤其是亮氨酸,是促进肌肉蛋白质合成的必需氨基酸,可以促进运动后的恢复。(详见本文09章节——蛋白质小节)
与业余自行车手相比,在职业自行车手中发现了更多的粪便Methanobrevibacter smithii。该菌与上调的甲烷代谢相关,这与肠道微生物组中短链脂肪酸代谢途径的上调呈正相关。
遗憾的是,该研究没有饮食控制和非运动员对照组。与在骑自行车的人中观察到的结果一致,在一小群精英竞走者中,粪便微生物群被分为普氏菌或拟杆菌为主的肠型。
马拉松运动员:韦荣球菌增加
马拉松运动员中的韦荣球菌丰度在马拉松后显著增加。此外,同一研究小组使用来自超级马拉松运动员和奥运会级别赛艇运动员的粪便样本进行宏基因组分析,结果显示与运动前样本相比,运动后与乳酸和丙酸代谢相关的基因富集。
在小鼠中进行的一项后续研究表明,研究人员从跑步者的粪便中分离培养出Veillonella atypica菌株,给小鼠灌注,结果发现,小鼠开始跑得更多,在跑步机上的跑步时间增加了 13% 。
中强度锻炼的人:促进健康和抗炎细菌增加
除了由专业或竞技运动员进行的高强度训练外,根据世界卫生组织 (WHO) 每周进行 150 分钟中等强度运动的指导方针,以推荐的最低水平进行运动 ,似乎足以改变肠道微生物群的组成。
与久坐不动的女性相比,以低强度进行连续运动的绝经前女性的嗜粘蛋白阿克曼菌、普拉梭菌等的丰度增加。这些都是与促进健康和抗炎作用相关的细菌种类。
此外,运动组和久坐组之间不同的饮食模式可能影响了肠道微生物群的组成,与久坐的女性相比,运动女性的膳食纤维摄入量明显更高,久坐组加工肉类的摄入量比例明显更高。
长期运动的人:菌群多样性更高
在迄今为止最长的运动干预中,研究了在 6 个月内,具有相似运动能耗的不同强度和方式的定期有氧训练对肠道微生物群的影响。
总共 88 名久坐的超重/肥胖受试者被随机分为四个组,包括习惯性生活(对照组)、非机动自行车积极通勤、休闲时间中等强度的运动或剧烈运动。
与对照组相比,所有运动组的 β多样性(样本间差异)都发生了变化,剧烈运动组的参与者组内菌群差异度变小,换句话说就是构成趋向一致。
此外,与对照组相比,剧烈运动组在3个月时的 α多样性增加更多。这表明可能需要更剧烈的运动来诱导久坐、超重/肥胖受试者的肠道微生物群发生变化。
在一项关于剧烈运动的研究中,拟杆菌门增加,厚壁菌门/拟杆菌门比率下降。这一结果与运动员有关,因为拟杆菌的增加在复杂糖聚合物的代谢转化和蛋白质降解中起着至关重要的作用。
梭菌属和Blautia属也减少了。梭菌在全身免疫反应中起着重要作用,而Blautia会增加促炎细胞因子的释放。有趣的是,结肠葡萄糖浓度与拟杆菌呈正相关,并与厚壁菌门、厚壁菌门/拟杆菌门比率和Blautia属相反。此外,Blautia属的丰度较低与更好的全身胰岛素敏感性相关。
这些结果强调了肠道底物摄取对全身的重要性,尤其是葡萄糖和蛋白质摄取,可能对肠道微生物群产生积极影响。
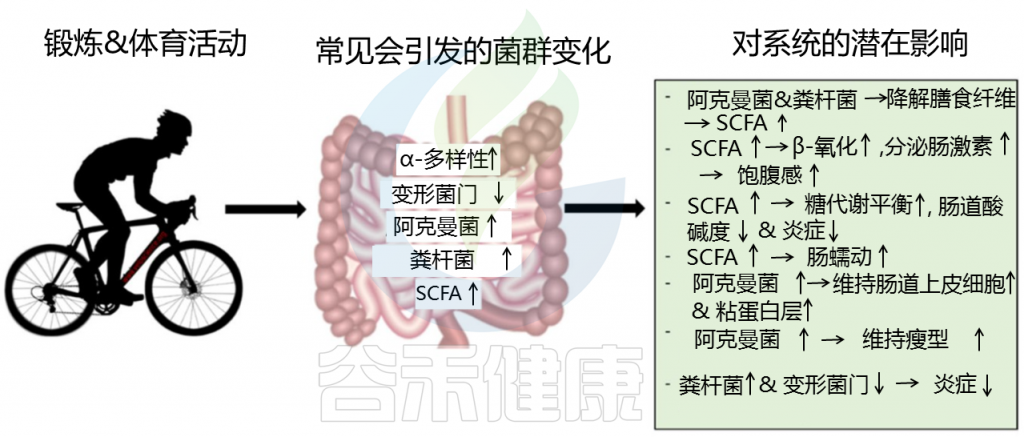

Lensu, S. et al., Metabolites, 2021
在儿童和老年人中也证明了身体活动水平与肠道微生物群组成之间的关联。
儿童:运动者菌群中梭菌目、毛螺菌科增加
来自美国肠道项目的 7-18 岁儿童研究队列中,在控制协变量(年龄、性别和使用抗生素和益生菌)。运动频率与富含厚壁菌门的肠道微生物群有关。此外,每天锻炼的儿童在梭菌目、毛螺菌科中的属增加了。
老年男性:与粪杆菌和Lachnospira菌有关
在老年男性中,根据步数和自我报告的活动测量的体力活动与微生物 α 多样性无关,但体力活动水平与粪杆菌属和Lachnospira属之间存在适度关联。
这些研究表明,运动员或经常运动人群与久坐人群之间的肠道微生物群组成存在差异。
运动者菌群特征可能与饮食有关
然而,运动员和身体活跃的人体内微生物群组成的一些特征可能是通过饮食来解释的,而不是运动的影响。
运动员经常遵循支持训练和表现的严格饮食,而极端运动通常与极端饮食有关。与正常人群相比,运动员的蛋白质摄入量可能要高得多。蛋白质补充剂通常用于满足训练者对蛋白质的更高需求,尽管蛋白质补充剂的流行也可能受到有关增加肌肉质量和改善性能和恢复的说法的影响。
摄入大量蛋白质后,未被吸收的蛋白质会进入结肠并促进特定细菌的生长和选择。
持续 10 周的蛋白质补充剂(乳清分离物和牛肉水解物)增加了跑步者拟杆菌的丰度,并减少了与健康相关的分类群,包括Roseburia spp、Blautia spp 和长双歧杆菌。然而,肠道微生物群组成的这种改变对宿主健康的长期影响仍不清楚。
动物研究:运动产生的变化与年龄、饮食、是否自愿、个体生理状态等因素都有关
很少有研究关注自愿运动对肠道微生物群的影响,迄今为止,除了七项实验研究外,所有研究都使用了小鼠模型。这些初步研究表明,运动会影响肠道微生物群的组成。
大鼠定期跑步运动与产丁酸菌的增加以及丁酸盐浓度的增加有关。其他动物研究表明,通过影响小鼠肠道微生物组成,每日轮式跑步运动可能会改善不健康状态的某些方面,例如饮食引起的肥胖、糖尿病和毒性。这些影响包括改变优势门厚壁菌门和拟杆菌门之间的比例。然而,这在研究之间并不总是相同。
在对动物进行的运动研究中,对于哪些种群受慢性运动的影响几乎没有达成一致。除了运动和乳酸杆菌之间的正相关关系之外,没有其他分类群在经常锻炼的小鼠或大鼠中相对丰度持续增加。
运动所产生的变化似乎取决于个人的生理状态。例如,无论是肥胖-高血压大鼠还是正常大鼠,有规律的强迫运动对微生物群的丰度都有不同的影响。高脂饮食的大鼠运动对微生物群的改变与正常饮食的大鼠不同,并且糖尿病小鼠产生的改变与其对照小鼠不同。
总的来说,这些发现表明,长期运动对微生物群的调节不仅取决于个体的生理状态,还取决于饮食。此外,动物强制运动与自愿运动之间的另一个显著差异是运动量。这在人类骑自行车的数据中得到了概括,需要在动物模型中进一步研究。
此外,年龄,性别也会呈现不同效果。据观察,与成年大鼠相比,运动对幼年大鼠的微生物群产生更有效的改变。在这些检查运动训练对肠道微生物群的影响的小鼠研究中,一个共同的发现是增加了α多样性。

在研究人类肠道微生物群时,很难分别研究运动和饮食。这种关系因饮食摄入变化而变得更加复杂(例如,抗阻力训练运动员的蛋白质摄入量增加或耐力运动员的碳水化合物摄入量增加,以及总体能量和营养摄入量的增加)。
为什么部分运动人群和久坐人群的菌群无显著差异?
高蛋白 + 膳食纤维少 = 运动改变菌群无效
韩国的一项研究表明,高蛋白/限制性膳食纤维与健康久坐人群之间的肠道微生物多样性或有益细菌没有显著差异。然而,当蛋白质或膳食纤维摄入量符合 KRDA(韩国推荐膳食允许量)时,肠道微生物多样性和有益细菌的相对丰度与健康久坐的受试者相比有显著差异。这些结果表明,运动对肠道微生物群的积极影响取决于蛋白质和膳食纤维的摄入量。结果还表明,在补充益生菌之前,应解决营养充足的问题。
研究人群之间膳食摄入量的差异,可能解释了不同研究结果之间观察到的一些不一致之处。
在韩国的一项临床研究中,总蛋白质摄入量与微生物多样性呈负相关 ,而爱尔兰职业橄榄球运动员的高蛋白质摄入量与微生物多样性增加有关。韩国运动员不符合膳食纤维摄入量的膳食建议(建议≥ 25 g/天;健美运动员的中位摄入量 19 g/天,耐力运动员 17 g/天),而爱尔兰橄榄球运动员的纤维摄入量处于推荐水平(中位摄入量 39 克/天)。
未消化的膳食纤维是肠道微生物群的重要能量和碳源,是短链脂肪酸合成的底物,是微生物多样性的关键贡献者。高蛋白饮食与低膳食纤维饮食相结合,可能对肠道微生物群组成有害,而不是单独摄入高蛋白。
营养补充剂介入运动和微生物关联
此外,主要来自动物研究的有限数据表明,流行的运动营养补充剂,如咖啡因、支链氨基酸、碳酸氢钠和肉碱,可以改变肠道微生物群的组成。大型研究队列的结果表明,运动与梭菌和毛螺菌科中的属增加有关。
其他小样本人群研究
尽管有几项研究调查了可能缺乏足够统计功效的小样本群,但有趣的是,通常诸如Akkermansia 和Prevotella等属在运动员和身体活跃的受试者中含量更高。然而,由于临床研究的数量仍然有限,参与者的人口统计学和膳食摄入量(特别是膳食纤维摄入量)差异很大,因此应谨慎得出结论。
运动前后营养变化不大,但是菌群有变化
运动对肠道菌群的影响需要考虑运动期间的饮食因素,那么运动前后对营养元素是否会显著变化?
一个研究小组表明,运动训练干预改变了久坐、未受过训练的芬兰女性的肠道微生物群组成,而饮食习惯、体重或身体成分没有改变。
作者证明,耐力运动改变了超重、久坐女性的肠道微生物群,这些女性参加了一项运动干预,包括每周 3 次、持续六周的自行车训练。研究表明,在训练干预后,总摄入量或常量营养素或膳食纤维的摄入量没有差异。
然而,耐力运动增加了Verrucomicrobia和Akkermansia相对丰度并减少肠道中与炎症相关的变形菌数量。此外,变形菌门和疣微菌门属对运动有反应,并且与年龄、体重、体脂百分比和食物摄入量无关。另一项研究为期 12 周的有氧运动训练计划显著增加了拟杆菌属的相对丰度,但是在年长、久坐的女性中,营养摄入没有变化。
下表总结了关于运动和/或运动饮食对肠道微生物群影响的研究



Mohr AE, et al., J Int Soc Sports Nutr. 2020

除了影响肠道微生物群,运动还会影响胃肠道生理机能。尽管运动通常是一种有益的或“刺激性”压力,但如果持续时间和强度的增加得不到足够的训练、休息、营养和抗氧化状态的支持,它就会变得有害。
运动后的生理效应
运动会激活自主神经系统,增加外周组织和胃肠道中皮质醇和儿茶酚胺、肾上腺素和去甲肾上腺素的循环浓度。这会导致流向胃肠道的血流量减少,导致缺氧、ATP 耗竭和氧化应激。这些作用会破坏肠道屏障,增加肠道通透性、内毒素血症、营养消耗和炎症。胃肠道通过释放与胃肠道紊乱相关的神经递质,如 γ-氨基丁酸 (GABA)、神经肽 Y 和多巴胺来应对压力激活。这些生理效应与运动的强度、持续时间和频率成正比。
长时间运动可能造成胃肠道紊乱
虽然低至中等强度的运动促进胃肠蠕动和转运时间,但剧烈的 [ >60%最大摄氧量(VO2max) ] 或长时间 (≥2 小时) 运动可能会产生相反的效果,并会造成急性胃肠道紊乱。定期运动可促进适应以维持肠道血流并减少炎症,当然恢复也必须足够。
为什么耐力运动员中常出现胃肠道问题?
胃肠道问题很常见,特别是在耐力运动员中,30-50% 的运动员出现胃肠道不适症状。这些症状可以通过生理,机械,心理,营养因子,包括血流量减少,增加的肠通透性引起的,产量增加应激激素和炎症细胞因子,胃排空不足。
然而,在耐力跑之外,很少评估胃肠道症状。例如,一项对参加 4 天严格越野滑雪行军的士兵的研究显示肠道通透性增加,但没有报告胃肠道症状,这使得对主观体验的影响和对运动表现的影响尚不清楚。
肠道上皮具有高周转率(3-5 天),需要大量的能量和营养。在没有足够燃料的情况下长时间高强度训练的运动员有可能出现肠道完整性和功能紊乱以及胃肠道症状。特别是,习惯性碳水化合物摄入量不足会增加对长时间、持续剧烈运动的促炎应激反应。

★
根据运动类型、强度、年龄和其他因素,20-50% 的运动员会出现胃肠道症状,并且随着运动强度的增加而增加。
高强度运动带来的负面影响
在对 29 名训练有素的男性铁人三项运动员的研究中,在比赛中,93% 的人报告消化功能紊乱,两名参与者因严重呕吐和腹泻而不得不放弃比赛。这些在运动员中很常见,因为在剧烈运动期间体温升高,血液从胃肠道流向周边肌肉和器官,如心脏和肺。远离肠道的血流重新分布以及对肠黏膜的热损伤可导致肠道屏障破坏,继而引发炎症反应。
在每周进行 4-10 小时耐力运动的健康年轻成年男性骑自行车者中,仅以 70% 的最大工作负荷进行 1 小时的运动就会产生内脏灌注不足,这会导致胃肠道循环减少、肠道通透性增加和小器官受损。
另一项研究表明,在 70% VO2max 下运动的人会导致内脏血流量减少 60-70%,当血流量减少 50% 时,运动引起的缺血会导致肠道通透性增加 。
加一句题外话,例如明星,网红为了美,限制碳水摄入,同时大量高强度锻炼来达到快速瘦身的效果,其实损害了肠道健康,可能会引起全身炎症反应,不要盲目效仿。
然而,研究主要集中在运动期间急性摄入(之前和期间)对胃肠道症状的影响,而不是习惯性饮食,尽管越来越多的运动员和研究人员关注避免食物的策略,例如低发酵低聚糖,二糖、单糖 、FODMAP 饮食或无麸质饮食。
剧烈运动 -> 胃肠道紊乱 -> 影响肠道微生物群
导致胃肠道症状的氧化应激增加和肠道屏障功能紊乱也会影响肠道微生物群。LPS(由肠道通透性增加引起的革兰氏阴性菌的成分)的易位会导致内毒素血症并触发促炎细胞因子分泌到胃肠道中,这可能会影响肠道微生物群并进一步加剧病情。
反过来:肠道微生物群失调 -> 胃肠道紊乱
相反,微生物代谢物丁酸盐和丙酸盐可作为结肠细胞的能量来源,减少粘膜降解、胃肠道通透性和炎性细胞因子。
肠道微生物群可作为生物标志物
由于微生物组成和多样性的改变与运动员胃肠道不适的流行有关,因此肠道微生物群组成可用作运动后代谢和全身压力的生物标志物。
例如,一项研究运动对血清和粪便代谢组以及肠道微生物群的急性影响的研究表明,一次运动上调骨骼肌底物利用和血清中碳水化合物代谢物的代谢途径,增加粪便氨和氨基酸代谢物,并增加梭菌的丰度。因此,微生物和代谢物谱的急剧变化可以提供有关运动对胃肠道和代谢影响的信息。
此外,考虑到运动对肠道微生物群的影响以及对以肠道为中心的饮食策略的需求,胃肠道症状评估可以补充有关肠道微生物群组成的信息。

一般运动员在运动训练中摄入大量单糖,以最大限度地储存糖原和维持血糖,同时尽量减少膳食纤维和抗性淀粉的摄入,以防止胃肠道紊乱。膳食纤维和抗性淀粉摄入不足可能会导致排便减少,从而导致肠道功能下降,也会降低肠道微生物群的多样性。
此外,运动员比非运动员消耗更多的动物蛋白来满足肌肉增生的需要。蛋白质摄入过多会导致肠道微生物中氮底物过量,产生腐败的发酵产物,如氨、硫化氢、胺、酚、硫醇和吲哚。随着食糜通过肠道,碳水化合物含量减少,腐烂的发酵变得更加有害。
实际上,蛋白质摄入过量,同时结肠中可发酵的膳食底物较低,会导致结肠黏膜DNA损伤。
高强度运动通过血液影响肠道微生物群
此外,高强度运动刺激血液从肠道器官重新分配到肌肉,同时它们积极进行细胞呼吸。血液的频繁重新分布可能会通过内脏低灌注和缺血以及随后的再灌注来扰乱肠道微生物群。因此,需要研究特定运动类型和运动员饮食对肠道微生物群的长期影响。
肠道微生物群在胃肠道功能、肠道免疫、内分泌以及调节氧化应激和水合水平等方面扮演多种角色,对肠道微生物群改善运动员肠道屏障功能的机制的研究也就越来越多。
微生物群产生的 SCFA 影响一系列宿主过程
在结肠和盲肠中,复杂的植物来源的多糖被消化,随后被肠道微生物(如乳杆菌、双歧杆菌、梭状芽孢杆菌、拟杆菌)发酵成短链脂肪酸和气体,这些气体也被专门的细菌(如还原性产乙酸菌)用作碳和能源、硫酸盐还原菌和产甲烷菌。肠道中乙酸盐、丙酸盐和丁酸盐在结肠和粪便中的摩尔比约为 60:20:20。肠道微生物群的组成,微生物群之间的代谢相互作用,及主要膳食宏量和微量营养素的数量和类型,决定了肠道微生物群产生的短链脂肪酸的类型和数量。
一个人吃的植物来源的多糖、寡糖、抗性淀粉和膳食纤维越多,这些细菌就越能将这些难以消化的食物来源发酵成有益的短链脂肪酸。微生物群产生的短链脂肪酸影响一系列宿主过程,包括控制结肠 pH 值,进而影响微生物群组成、肠道运动、肠道通透性和上皮细胞增殖。
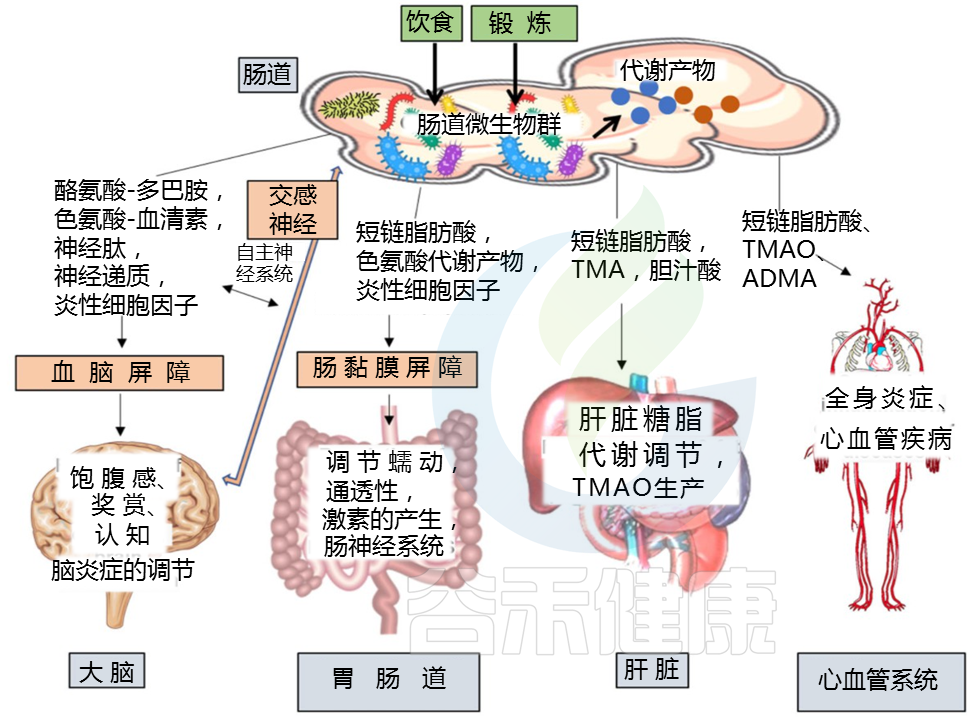
Lensu, S. et al., Metabolites, 2021

运动引起的压力会改变分解代谢激素、细胞因子和肠道微生物群,这可能会导致胃肠道紊乱、焦虑、抑郁和表现不佳。肠道微生物群在人类生物学的许多方面都具有基础性作用,包括新陈代谢、内分泌、神经元和免疫功能。
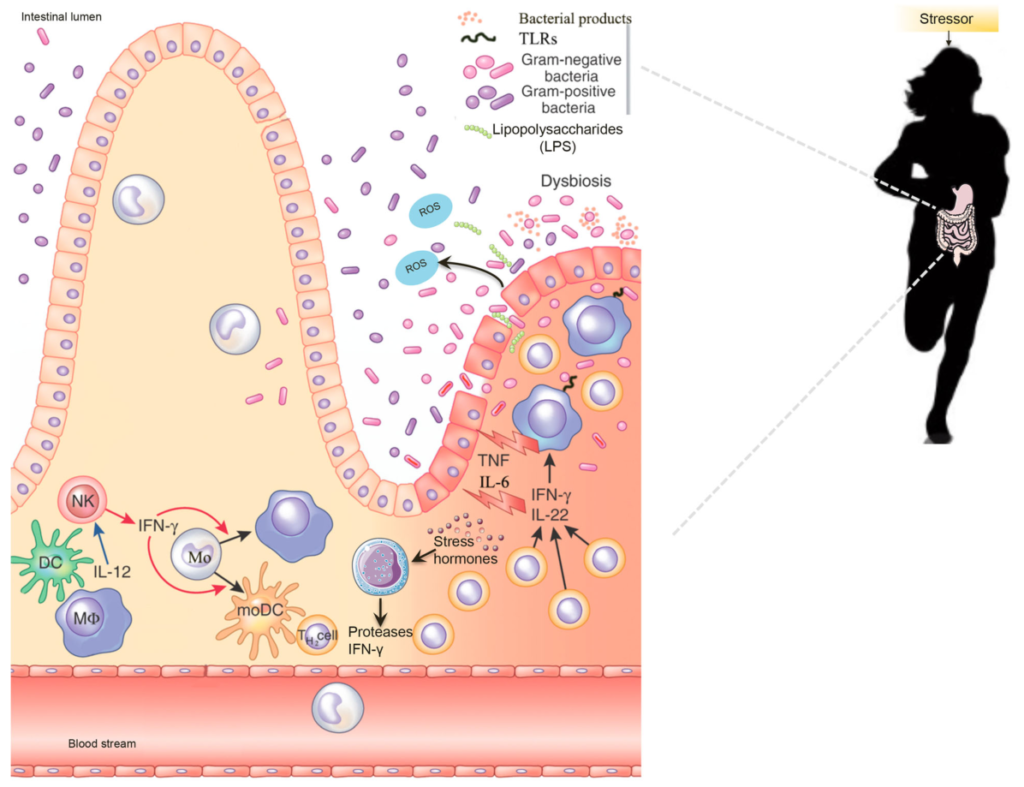
Allison Clark & Núria Mach,J Int Soc Sports Nutr. 2016
适当的肠道屏障功能对于维持健康和免疫力至关重要。但是训练和比赛数小时的精英运动员会经历身体和情绪压力,导致生理稳态发生变化,刺激SAM(交感神经-肾上腺髓质轴)和 HPA轴(下丘脑-垂体-肾上腺轴)高强度运动期间的胃肠道紊乱。
在剧烈运动期间,运动员的体温会升高,血液会在剧烈运动时从胃肠道流向周围肌肉和器官,例如心脏和肺。远离肠道的血流重新分布以及对肠黏膜的热损伤可导致肠道屏障破坏,继而引发炎症反应。长时间的剧烈运动会增加胃肠道中的应激激素和脂多糖 (LPS) 易位,从而引发免疫反应,这通常会导致促炎细胞因子和肠道通透性增加。
由于活性氧 (ROS) 的产生增加以及肠道微生物群组成和活性的改变(所谓的生态失调),肠道通透性可能会变得更糟。
胃肠道通过释放 GABA、神经肽 Y (NPY) 和多巴胺等激素来应对压力,这些激素会导致胃肠道紊乱、焦虑、抑郁、食物摄入减少和压力应对能力降低。相反,微生物群产生的丁酸盐和丙酸盐可以增加跨上皮抵抗,从而改善肠道屏障功能并减少炎症。
胃肠道通过释放 GABA、NPY和多巴胺等激素来应对压力
GABA,这是身体的主要抑制中枢神经系统的神经递质,调节血压和心率和在各种胃肠道功能中起着重要作用,如运动性,胃排空和瞬态下食道括约肌放松,以及焦虑、抑郁,疼痛感和免疫反应。
适度运动可以增加下丘脑中的 GABA 水平,从而降低静息血压、心率和交感神经张力。在 25 °C 水中强迫游泳时,发现大鼠海马 GABA 水平下降(基线的 70%)。
神经肽 Y(NPY)也会在胃肠道中响应各种压力刺激(例如剧烈运动)而释放,并在减弱 HPA 轴方面发挥作用。
注:神经肽Y是一种36个氨基酸的肽,位于整个肠脑轴,是大脑中最普遍的神经肽,在压力恢复和炎症过程中发挥作用。
检测了 12 名训练有素的赛艇运动员的神经肽 Y血清水平,发现运动后神经肽Y的浓度显著增加。虽然很少有研究研究了血清和海马 NPY 水平对运动的反应,但这些结果表明它在减少剧烈运动时的压力反应方面发挥作用。
多巴胺(去甲肾上腺素和肾上腺素的前体)也可以在胃肠道压力期间合成。
多巴胺的产生取决于几个因素:
整个肠道中有多种多巴胺受体,表明它在肠-脑轴中发挥作用。胃肠道、脾脏和胰腺会产生大量的多巴胺。在人胃上皮细胞中发现了多巴胺合成的限速酶酪氨酸羟化酶,表明其功能存在于大脑中的神经传递之外。每天大约 1-2 小时的习惯性运动已被证明会增加大脑中的多巴胺水平。
肠道微生物群如何与周围组织(如胃肠道粘膜层)的应激激素直接相互作用?
去甲肾上腺素(NE)已显示对肠道嗜水气单胞菌(Aeromonas hydrophila)、博德特氏菌属(Bordetella)、空肠弯曲杆菌(Campylobacter jejuni)、幽门螺杆菌(Helicobacter pylori)、李斯特菌(Listeria)和沙门氏菌(Salmonella enterica)有直接影响。
其中去甲肾上腺素促进致病细菌生长的一些方法是,通过增加其毒力因子 K99 菌毛粘附素的表达以及激活鼠伤寒沙门氏菌中毒力相关因子的表达来促进大肠杆菌粘附在肠壁上,然后使这些细菌更容易感染。
此外,去甲肾上腺素还会增加非致病性大肠杆菌和其他革兰氏阴性菌的水平。
微生物组如何调节运动引起的压力反应?
最近发表了一项研究,揭示了对胃肠道和全身健康很重要的,独特微生物群—宿主相互作用。
在结肠炎小鼠模型中,自愿跑步 6 周会减轻症状,而强制跑步机跑步会加剧肠道炎症和临床结果。粪便和盲肠水平与 6 周强制跑步机跑步组相比,与免疫功能和肠道疾病密切相关的在自愿跑步者中显著降低。
此外,与久坐组相比,强制组中的瘤胃球菌(Ruminococcus gnavus)在肠道粘液降解中具有明确的作用,以及增加了丁弧菌属、Oscillospira属和粪球菌属。
这项针对运动和压力动物的初步研究表明,运动可以改变微生物群的组成以及代谢功能,这可能根据运动强度和自愿性等对菌群产生积极或消极的影响。

由于营养、遗传和环境因素,在人类临床研究中剖析肠道微生物群对运动表现的确切作用可能很困难。无菌动物模型克服了其中的许多挑战,并已被用于证明肠道微生物群对身体表现结果所起的作用。
失去肠道微生物群的小鼠,运动表现下降
研究了无特定病原体 (SPF)、无菌 (GF) 和脆弱拟杆菌(Bacteroides fragilis)无菌小鼠的游泳能力。GF 小鼠从游泳到精疲力竭的时间最短,SPF小鼠最长,表明在没有肠道微生物群的情况下表现会下降。观察到与SPF小鼠相比,GF 小鼠表现降低的类似发现。
其他研究:失去肠道微生物群的小鼠运动表现无影响,但肌肉功能下降
与上述相反,另外的研究,GF 小鼠和 SPF 小鼠在运动至精疲力竭时的身体表现没有差异。然而,与 SPF 小鼠相比,GF 小鼠表现出肌肉质量减少、肌纤维减少和肌肉力量降低。GF 小鼠的肌肉萎缩与线粒体生物合成失调和氧化能力降低有关。SPF 小鼠肠道微生物群的移植恢复了 GF 小鼠的肌肉质量,与未治疗的 GF 小鼠相比,用短链脂肪酸混合治疗增加了 GF 小鼠的骨骼肌质量和肌肉力量。
抗生素治疗极大地改变了肠道微生物群的组成
研究证明肠道微生物群在光谱抗生素治疗后耗竭,同时减少了小鼠的耐力运行时间,通过重新接种微生物群恢复后,耐力能力恢复正常。耐力能力的变化与肌肉质量、肌纤维类型或线粒体功能的变化无关,但与肌糖原水平的变化有关,在重新接种后恢复。
多项研究报告了类似的发现,其中与未治疗的对照组相比,使用多种抗生素治疗的小鼠的跑步机运行时间更短。
SCFA 产生的影响及其对运动表现的作用
通过用具有不同底物可用性的纤维喂养小鼠,以在肠道中产生微生物 SCFA。与喂食高度可发酵纤维的小鼠相比,喂食可发酵纤维减少的小鼠的跑步时间显著缩短,这表明微生物群及其底物都与身体机能有关。
为了进一步探索 SCFAs 在表现能力中的假定作用,对抗生素治疗的小鼠进行皮下注射乙酸盐或丁酸盐。乙酸盐而非丁酸盐的输注改善了抗生素引起的剧烈运动带来的不良反应。
无菌动物当然是一种极端模型,可能无法解释在人类微生物群中观察到的更细微的差异。不过,无菌动物模型的研究已经建立了肠道微生物群与身体机能之间的因果关系。
总体而言,恢复肠道微生物群失调似乎可以有效恢复啮齿动物的运动能力和骨骼肌参数。
此外,肠道微生物群组成的差异或肠道微生物群的缺乏可以调节与肌肉结构、肌肉力量和/或能量利用相关的运动能力。
身体活动分为力量和耐力两大类,这取决于你的身体如何产生能量来维持你的运动表现。
无氧运动
力量运动通常高强度,如举重、短跑和拳击。这些运动通过锻炼细胞的无氧途径来增强肌肉质量。这就是说你的肌肉利用其有限的糖原储备来制造 ATP(肌肉的燃料),而无需使用氧气。
最近的一项研究表明,宿主骨骼肌在无氧运动期间产生的乳酸通过循环进入肠腔,为结肠中利用乳酸的物种提供了选择性优势。这项开创性工作的结果表明,在高强度运动期间,宿主以乳酸的形式为特定细菌提供燃料,这些细菌又会产生代谢物,例如丙酸盐,对运动宿主有益。
有氧运动
这与耐力运动不同,有氧运动允许身体以较低的强度进行运动,但运动时间要长得多,例如长跑、骑自行车和滑雪,此类运动肌肉使用氧气将脂肪和糖类转化为 ATP 作为燃料。
测量心血管健康最流行的方法是 V02最大值,它可以查看你的身体在剧烈运动期间可以使用的最大氧气量。用于评估耐力表现,并且可以通过高强度运动得到显著改善。
几项研究表明,微生物群组成与心肺健康之间的关系可以解释“分类丰富度”(微生物组中鉴定的细菌多样性)的 20% 以上的变化。注意到这些变化与其他因素无关,包括年龄、脂肪摄入量和碳水化合物摄入量。
有氧运动对微生物群及身体的益处
研究表明,有氧运动对你的微生物群有好处,包括有益菌和整体多样性丰度增加。
重复进行有氧运动可以增加健康个体和患有慢性便秘的中年患者的胃肠道转运时间。
有氧运动还会增加粪便 SCFA 浓度,从而降低结肠腔的 pH 值。
此外,作为运动副产物并在全身循环的代谢物(例如乳酸),可能会通过肠道过滤并作为某些细菌分类群(例如韦永氏菌)的能量来源。
有氧运动类型及建议
有氧运动是长期而稳定的,确保为你的肌肉提供氧气,以便它们可以产生燃料 (ATP)。这包括任何可以提高心率并长时间保持心率的运动。
比如:步行、慢跑、跳舞、慢骑自行车、椭圆机和健身房的划船机、登山、游泳等都是有氧运动。但是,锻炼的强度和持续时间还是根据身体的总体健康水平而异。
有氧运动是长期的。放轻松,坚持下去,你的身体会适应的。
NHS 已经发布了成人的运动建议:
至少150分钟中等的有氧运动,如骑自行车或快走
每周进行 2 天或更多天的力量锻炼,可以锻炼所有主要肌肉(腿部、臀部、背部、腹部、胸部、肩部和手臂)
或者
每周进行中等强度和剧烈有氧运动的组合——例如,两次 30 分钟的跑步加上 30 分钟的快走相当于 150 分钟的中等有氧运动
每周进行 2 天或更多天的力量锻炼,可以锻炼所有主要肌肉(腿部、臀部、背部、腹部、胸部、肩部和手臂)
适当的训练计划旨在平衡精英运动员所经历的全身压力因素以及个性化的饮食计划,以提高表现并减少运动引起的压力症状。
某种营养素对应激反应的调节程度取决于其持续时间、运动员的整体营养状况、运动的类型和强度、生理状况以及肠道微生物群的组成和功能。由于精英运动员的压力反应相当复杂(从肠漏到分解代谢和抑郁症),定义标准的饮食计划很困难。
一般来说,许多精英运动员被鼓励摄入大量的简单碳水化合物和蛋白质以及少量的脂肪和纤维,以提供快速的能量来源,同时避免潜在的消化问题,例如高纤维饮食有时会出现的胀气和腹胀。精英运动员的饮食计划也基于某些微量营养素的消耗,如铁、钙、氨基酸、必需脂肪酸和抗氧化剂。
饮食设计应考虑肠道微生物群
由于饮食强烈影响微生物群的组成和功能,通过营养治疗调节肠道微生物群可以改善运动员的压力反应并提高表现。可以假设,每个饮食计划可能都伴随着微生物群的同步调整。为运动员设计个性化饮食时的另一个重要考虑因素是了解微生物组如何随时间变化。
目前和未来运动员或经常的锻炼计划应根据其对肠道微生物群的潜在影响来考虑饮食策略,包括以运动为中心的饮食策略(例如,蛋白质补充剂、碳水化合物负荷)对肠道微生物群的影响以及以肠道为中心的饮食策略的影响。

对性能的饮食策略,除了摄入益生元、益生菌和合生元外,摄入足够的膳食纤维、多种蛋白质来源,并强调不饱和脂肪,尤其是 omega-3脂肪酸,在优化运动员的健康和表现。
蛋白质
蛋白质是骨骼肌的主要成分。然而,特定氨基酸在肝脏和骨骼肌的吸收和分解代谢以及它们调节肌肉蛋白质合成反应的能力方面有所不同。
必需氨基酸,尤其是支链氨基酸 (BCAA),对于肌肉蛋白质合成至关重要,并且比非必需氨基酸产生更大的肌肉蛋白质合成反应。因此,膳食蛋白质会影响蛋白质利用和骨骼肌对运动的合成代谢反应。
补充亮氨酸导致血浆亮氨酸和总支链氨基酸浓度显著增加,并改善耐力表现和上肢力量,影响血浆色氨酸:支链氨基酸比率。BCAA 的补充也被用于通过改变大脑神经递质的产生(如 5-HTP、多巴胺和去甲肾上腺素)来调节运动期间疲劳的影响。由于缺乏证据,无法对运动员应服用的 BCAA 类型或数量提出建议。
运动员可能需要的蛋白质是一般人群的两倍
用以维持蛋白质合成、能量产生、免疫功能和肠道完整性和运动引起的压力的结果。
这对于耐力和阻力训练的运动员来说比较重要。耐力运动员可能需要在运动后恢复期摄入更多的蛋白质,尤其是在禁食状态下进行耐力运动时,因为这可能会增加肌丝蛋白水解。
虽然根据饮食和生理因素而变化,例如消化率、氨基酸的数量和组成、食物基质以及其他营养素的存在,但约 10% 的蛋白质未被消化,可能会到达结肠被肠道细菌分泌的蛋白酶进行蛋白水解。
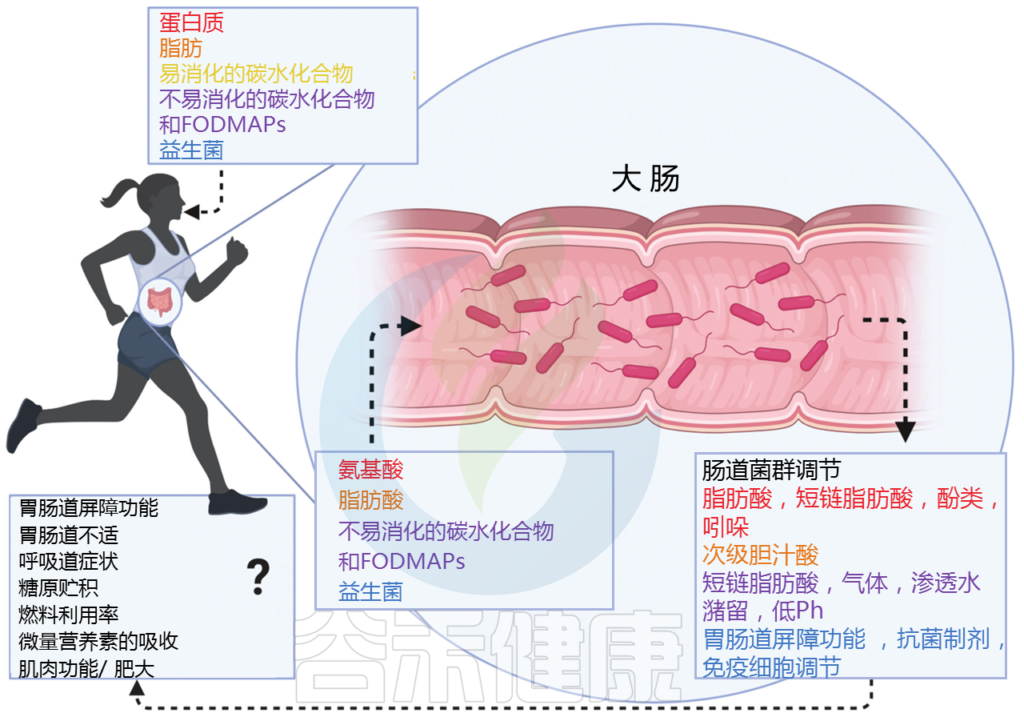
Hughes RL, et al., Adv Nutr. 2021
关于肠道微生物群代谢,氨基酸可以根据其发酵代谢产物进行分类:含硫氨基酸、芳香族氨基酸和色氨酸。
过量蛋白质摄入的不利影响
这些代谢物包括支链脂肪酸和短链脂肪酸、氨、硫化物、吲哚和酚类化合物。虽然其中一些代谢物(例如 SCFA 和吲哚)可能具有改善肠道完整性等有益效果,但其他代谢物(例如氨和对甲酚)会降低肠道上皮完整性。过量的蛋白质摄入可能会导致蛋白水解代谢物的产生水平超过宿主吸收、转化或解毒有害代谢物的能力,导致对肠道屏障功能、炎症和结肠健康的不利影响。
非蛋白质成分有助于运动后的蛋白质合成反应
另一个领域是全食物蛋白质与蛋白质补充剂的影响,因为全食物具有相同或更好的增效作用。例如,摄入全鸡蛋与蛋清相比,摄入全脂牛奶与脱脂牛奶相比,会导致更多的氨基酸摄入和运动后肌原蛋白合成,表明非蛋白质成分(例如,脂质、碳水化合物、微量营养素和其他生物活性化合物)有助于运动后的蛋白质合成反应。
过量蛋白质补充剂增加结直肠癌风险
蛋白质补充剂,包括添加到能量饮料中的支链氨基酸和牛磺酸,通常被运动员用来增强运动对骨骼肌的合成代谢和适应性作用,并促进恢复。过量的牛磺酸会导致牛磺胆酸(TCA)、脱氧胆酸(DCA) 和硫化氢 (H2S) 浓度升高,这与结直肠癌风险增加有关;然而,这些补充剂对运动肠道微生物群的影响尚不清楚。
谷氨酰胺
运动前几天食用高蛋白、低碳水化合物的饮食会导致运动后血浆谷氨酰胺浓度降低。然而,谷氨酰胺补充剂几乎没有得到对健康、营养良好的运动员的严格控制的科学研究的支持。此外,研究者指出谷氨酰胺补充剂应取决于症状(即血浆谷氨酰胺水平低、肠漏)。
酪氨酸
新的中央疲劳假说指出,当血清素水平升高而多巴胺水平降低时,疲劳就会开始,这可能是许多运动员服用酪氨酸补充剂以防止其消耗的原因,尽管尚未确定推荐的补充剂量。酪氨酸或 4-羟基苯丙氨酸可在体内由苯丙氨酸合成,存在于许多高蛋白食物中,如豆制品、鸡肉、火鸡、鱼、花生、杏仁、鳄梨、牛奶、奶酪、酸奶和芝麻。
肠道微生物群通过增加膳食蛋白质的生物利用度和吸收以及增加肌肉蛋白质合成影响肌肉功能
有证据表明,肠道微生物有助于蛋白质的吸收和利用。例如,益生菌补充剂(副干酪乳杆菌)增强了植物蛋白的生物利用度,将必需氨基酸和支链氨基酸的浓度提高到与动物蛋白相当的浓度。此外,当与蛋白质共同给药时,益生菌凝结芽孢杆菌(GBI-30,6086) 减少了上皮细胞炎症,改善了营养吸收,并产生了增加人类氨基酸吸收的蛋白酶。这些作用可以减少肌肉损伤并促进肌肉恢复,从而提高适应能力和表现。
需要注意的是,细菌虽发酵氨基酸,但它们代谢动物和植物蛋白的方式不同。每个饮食计划都伴随着微生物群组成和功能的同步调整。因此,纯素食者、素食者、杂食者和红肉摄入量高的饮食的微生物群组成差异很大。
多项研究表明在高蛋白饮食中添加抗性淀粉可以抵消高蛋白摄入的负面影响,进一步说明摄入足够的膳食纤维对肠道和整体健康的重要性。
碳水化合物
毫无疑问,充足的碳水化合物消耗对于繁重的训练计划和成功的运动表现至关重要。
碳水化合物怎么补充?
对于每天训练超过 2 小时的运动员,膳食碳水化合物的摄入量为每天 7 至 12 克/千克,脂肪摄入量通常小于每天体重的 1 克/千克(消耗总卡路里的 20%)。

碳水化合物在长时间的剧烈运动中恢复肌肉和肝脏糖原储存,减轻压力激素水平升高,如皮质醇,并可以限制与高强度运动相关的免疫抑制。高碳水化合物饮食(8.5 g/Kg/d;总能量摄入的 65%)和随意食用碳水化合物在高强度训练期间可以减少疲劳并改善身体机能和情绪。
运动前和运动中摄入大量简单碳水化合物
针对运动员的饮食建议在运动前摄入大量简单碳水化合物以维持葡萄糖稳态,并在运动前摄入低纤维以减少胃肠道不适,同时补充说,以植物为基础的高纤维饮食可能会降低能量供应。在运动前和运动期间摄入简单碳水化合物(例如,葡萄糖、果糖、蔗糖、右旋糖)可以减轻疲劳、提高运动表现、促进水重吸收和维持水分充足。
摄入等量的果糖和葡萄糖,优化果糖吸收减轻不适
然而,葡萄糖和果糖负荷以及果糖与葡萄糖的比例会影响肠道微生物发酵和胃肠道应激。葡萄糖和果糖的组合导致比摄入单一碳水化合物更高的碳水化合物氧化率,减少运动期间内源性能量储存的消耗。摄入等量的果糖和葡萄糖可优化果糖吸收,减少微生物发酵,从而减轻胃肠道不适症状。
乳糖提高运动表现和恢复能力
乳糖还可以作为运动前、运动中和运动后的良好燃料来源,以提高运动表现和恢复能力,同时还可能促进对肠道微生物群的有益影响,例如双歧杆菌和乳酸杆菌的增加。
注意:
高碳水化合物饮食不会改善免疫功能,也不会防止经过大量训练后血浆谷氨酰胺浓度降低。
富含简单和精制碳水化合物的饮食不会促进健康的肠道微生物群组成,也不会产生有益的短链脂肪酸。
需要更多的研究来了解微生物群从饮食中提取营养的能力,并包括宿主的代谢变化。
膳食纤维
一般每 1,000 卡路里摄入足够的纤维总量为 14 克,即成年女性为 25 克,成年男性为 38 克。
低膳食纤维供应与较低的微生物群多样性、较少的短链脂肪酸产生和较少的抗病原菌相关,所有这些都可能对宿主产生有害的长期后果。
运动员或运动锻炼期间可以通过增加植物性食物的摄入量(例如全谷类、豆类、蔬菜、水果和坚果),同时在恢复期和训练期减少来自高添加糖、精制碳水化合物和脂肪的加工食品的能量,从而获得足够的膳食纤维摄入量,因为在激烈的训练或比赛之前吃高纤维饮食可能会导致胃肠道不适,如腹胀、胀气。
腹胀详见:“肚子像气球?”“好像怀孕?”——可能是腹胀惹的祸
此外,膳食纤维和大量食用植物性食物似乎会抑制细菌从蛋白质中产生有害代谢物,这强调了摄入足够的复合碳水化合物以维持肠道微生物组碳水化合物发酵的重要性。
脂肪和多不饱和脂肪酸
运动员的脂肪消耗量往往很低,占膳食能量的 15-30% 。长时间运动期间脂肪代谢的增加(30-50% 的膳食能量)可能具有糖原节约作用,并可能改善耐力表现和健康。
高脂肠内营养可以减轻肠道灌注不足导致消化功能紊乱后的肠道炎症、细菌易位和肠道损伤。
高脂饮食的危害
另一方面,高脂饮食会导致类似焦虑的行为增加,选择性破坏探索性、认知性和刻板行为,神经炎症破坏肠道屏障功能的标志物,以及与高脂肪饮食的小鼠相比增加循环内毒素和淋巴细胞表达。
在人类中,与高碳水化合物饮食(65% 的饮食能量)相比,富含脂肪的饮食(62% 的饮食能量)可能对免疫功能有害。
这些作者比较了 10 名未经训练的年轻男性在每周 3-4 次持续 7 周的耐力训练期间食用富含碳水化合物的饮食,和10 名高脂饮食的受试者。高脂饮食的运动员的 NK 细胞活性较低。
注:NK 细胞溶解一定数量肿瘤靶细胞的能力
Omega-6 多不饱和脂肪酸
它可以改变细胞膜流动性并间接影响免疫功能,包括减少 IL-2 的产生和抑制有丝分裂原诱导的淋巴细胞增殖,从而在运动期间和运动后产生潜在的不良免疫功能。
omega-3 多不饱和脂肪酸
它的最佳剂量约为 1–2 g/d,二十碳五烯酸与二十二碳六烯酸的比例为 2:1,可能会减少运动过程中 ROS 的产生。

高脂饮食对运动的影响不明确
到目前为止,由于结果相互矛盾,很难就补充 omega-3 的数量和持续时间向运动员提出任何明确的建议。目前,高脂肪饮食对后续运动表现的影响是模棱两可的,并且缺乏关于压力个体的信息。
最重要的是,摄入高脂肪和卡路里的饮食与慢性“低度”全身炎症、肠道通透性和血浆LPS增加以及总细菌多样性降低以及拟杆菌和梭菌的相对比例增加有关。因此,似乎食用高脂肪饮食也可能导致肠道微生物群发生不利变化。
维生素和抗氧化剂
运动员通常不会补充维生素和其他抗氧化剂,但建议运动员应考虑增加抗氧化剂的摄入量,如维生素 C、E、β-胡萝卜素和多酚,以减少 ROS 的形成和脂质过氧化。

用蓝莓和绿茶提取物(作为布洛芬替代品)补充多酚并没有改变既定的炎症和氧化应激,但增加了肠道细菌多酚代谢特征的代谢物(例如马尿酸盐、4-羟基马尿酸、4-甲基儿茶酚硫酸盐)和跑步者在3天剧烈运动后恢复期间的生酮。
不推荐补充个别微量营养素或食用大剂量的简单抗氧化剂混合物
尽管没有任何负面影响的报道,但富含多酚提取物(蓝莓和绿茶)的运动员饮食并没有减轻剧烈运动带来的生理压力,也没有提高恢复速度。
摄入大剂量的个别维生素(在运动员中并不少见)可能弊大于利,因为大多数维生素在体内主要作为辅酶发挥作用。一旦这些酶系统饱和,游离形式的维生素就会产生毒性作用。因此,运动锻炼期间应该通过增加水果和蔬菜的摄入量来获得复杂的抗氧化化合物混合物。
益生菌
常规益生菌包括双歧杆菌属和乳酸杆菌,尽管在运动员中研究的其他细菌包括芽孢杆菌属、肠球菌属、链球菌属、韦永氏菌或酵母布拉氏酵母菌。
益生菌带来的健康益处及对运动效果的影响
益生菌可减少感染、炎症、肌肉酸痛和胃肠道通透性或不适。迄今为止,益生菌益处的最实质性证据是改善上呼吸道感染的发生率、持续时间和严重程度,这可能会间接提高运动成绩。
呼吸道症状改善的研究包括来自乳酸杆菌家族的有机体。L.salivarius也可能通过增加产生丁酸盐的类群Roseburia和Lachnospiraceae 来降低胃肠道通透性,并减少疣微菌。虽然有证据表明益生菌功能的共享机制,但益生菌的益处通常取决于益生菌的菌株和剂量。
益生菌可以通过改善肠道通透性和抗氧化状态以及减少炎症来减轻剧烈运动对运动员胃肠道不适和肌肉酸痛的影响。布拉氏酵母菌和嗜酸乳杆菌和双歧双歧杆菌的组合有助于预防旅行者腹泻。
益生菌还可以通过生物活性代谢物的产生(例如短链脂肪酸、神经递质)、肠道 pH 的调节和肠道的改变等机制改善营养吸收和利用、糖原储存、身体成分、能量收集、激素产生以及认知和情绪微生物群的活动。例如,植物乳杆菌增加了铁人三项运动员的耐力表现,同时增加了粪便短链脂肪酸。
一项对小鼠的研究表明,从一名奥林匹克举重运动员身上分离出的细菌菌株 [ L. salivarius亚种 salicinius (SA-03)] 通过增加肝脏和肌肉糖原并降低乳酸、血尿素氮、氨和肌酸激酶在运动后提高耐力表现和肌肉力量。
然而,更多的研究表明,多菌株益生菌比单菌株益生菌具有更强的增效作用,这表明多种菌株可能以互补的方式发挥作用以提供性能优势。
益生菌可能因此有利于通过直接和间接的机制,提高运动成绩,虽然增补效应的证据仍然稀少。
益生菌如何补充?
益生菌菌株和剂量的差异以及个人的基线饮食、免疫状态和微生物群组成可能会导致研究之间的结果存在差异,从而使比较和得出结论变得困难。
大多数针对运动员的益生菌补充研究并未评估肠道微生物群,因此很难确定疗效是否取决于基线或参与者肠道微生物群组成的变化。同时饮食摄入,尤其是纤维和益生元底物的摄入,也可能影响益生菌的作用,因此应在分析中加以考虑。因为消费者应该意识到,如果没有足够营养的饮食支持,单独补充益生菌可能不会产生预期的效果。
此外,针对运动的益生菌补充研究通常样本量较小(即 10 至 30 名参与者),并且通常仅包括或主要包括男性参与者,这是有问题的,因为存在可能是性别特定的影响。
发酵食品对运动的影响
人们越来越关注发酵食品中活培养物的影响 ,以及它们的影响或与肠道微生物群的关联。然而,很少有研究调查发酵食品(包括酸奶、开菲尔、酸菜)对运动的影响。
三项使用开菲尔或发酵乳的研究报告称,运动诱发的 CRP 或肌酸磷酸激酶和肌肉酸痛降低,表明这些发酵食品对减少炎症有积极作用。一项小鼠研究报告了开菲尔对力量和耐力的增效作用。因此,含有活微生物的发酵食品可能对炎症和运动表现有益。
合生元
合生元是“包含活微生物和宿主微生物选择性利用的底物的混合物,它赋予宿主健康益处”。合生元可能是益生菌和益生元的组合(互补合生元),尽管单个成分不一定需要满足益生菌和益生元的标准,只要它们在共同给药时协同作用(协同合生元)。因此,益生元成分可以增强益生菌(协同合生元)的功能,或者这两种成分在引入肠道及其常驻微生物(互补合生元)后可以提供独立的有益功能。
这种微生物和选择性利用底物的组合可能比单独补充益生元或益生菌具有不同的效果。然而,只有 1 项研究调查了这些成分对身体活跃的人类的协同和独立影响。合生元补充剂(副干酪乳杆菌431、动物双歧杆菌乳酸亚种BB-12、嗜酸乳杆菌LA-5、鼠李糖乳杆菌)与单独补充益生元(阿拉伯胶)相比,LGG、raftiline、raftilose、乳铁蛋白、免疫球蛋白、阿拉伯胶)与血清 IL-16 浓度的增加较小相关,但合生元补充剂和阿拉伯胶单独都不影响 SCFA 浓度、免疫或胃肠通透性。因此,与单独补充益生元或益生菌相比,合生元可能对运动员的健康和表现产生不同或额外的影响。
微量营养素
微量营养素有助于免疫功能、炎症、能量代谢和骨骼健康,影响运动表现。充足的铁、锌和维生素 A、E、C、B-6 和 B-12 的摄入量对于适当的免疫功能至关重要,在运动员的高强度训练和比赛条件下可能会受到影响。
此外,由于汗液和尿液的流失以及氧化应激的增加,运动员对某些微量营养素的饮食需求可能会增加。此外,女运动员或女性增加锻炼缺铁的风险更高,影响健康和表现。
微量营养素与肠道微生物群
缺乏抗氧化微量营养素(例如,维生素 C 和 E 以及硒)会减少共生肠道细菌的数量,同时促进大肠杆菌的增加。
在压力增加的动物中,维生素 C、维生素 E、多酚、硫辛酸和微生物抗氧化剂的抗氧化剂混合物可恢复肠道氧化还原状态,这与双歧杆菌和乳杆菌增加以及大肠杆菌减少有关。然而,过量摄入某些微量营养素也可能增加感染易感性。例如,婴儿过量补铁会增加病原微生物,包括大肠杆菌,并导致肠道炎症。
因此,在压力增加或微量营养素缺乏的情况下补充微量营养素可能对免疫和炎症具有微生物群介导的益处。
钙和维生素D
钙和维生素D支持骨骼健康。此外,维生素 D 可能通过调节钙依赖性收缩、蛋白质依赖性骨骼肌合成代谢、线粒体功能和胰岛素敏感性来影响骨骼肌质量和强度。纤维摄入后双歧杆菌、毛螺菌科和拟杆菌的增加与钙吸收的增加呈正相关。这可能是由于短链脂肪酸的产生,它通过降低结肠 pH 值或调节信号通路或基因表达来增加钙吸收。维生素 D 的摄入也会影响肠道微生物群,尽管结果的可变性排除了确定补充剂对特定分类群的影响的能力。摄入钙和维生素 D 与肠道微生物群之间的双向关系对所有年龄段运动员的骨骼健康都有重要意义,无论是生长还是维持骨密度,以降低骨折风险。
需避免的食物
胃肠道问题在运动员和长期运动锻炼人群中比较常见。为了缓解症状,运动员可能会避免或限制某些会引发症状的食物。运动员还可以采用营养策略来增加胃排空并改善水和营养物质的吸收,包括避免高 FODMAP食物和含麸质食物。
FODMAP 是不易消化的短链碳水化合物,可增加胃肠道内的渗透负荷。肠道微生物可以将这些膳食成分发酵形成气体,从而导致有些人出现腹胀和胃肠道不适。

最近一项调查耐力运动员 FODMAP 摄入量的研究报告称,高摄入量都会导致胃肠道症状。初步结果表明,低FODMAP饮食减轻了运动员胃肠道症状。然而,FODMAP也充当肠道微生物群的燃料,它们的限制可能会影响群落的组成和功能。
有一种推测,无麸质饮食之所以能改善胃肠道症状,并不是其本身,而是其中 FODMAP 食物的减少。
只有一项研究调查了无麸质饮食对非腹腔耐力运动员的影响,其中报告无麸质饮食对表现、胃肠道症状、健康、肠道损伤或炎症没有影响。

运动可能是改变肠道菌群组成和恢复肠道共生的重要干预措施
目前的研究支持运动作为一种重要的行为因素的作用,它可以影响肠道微生物组成和功能的定性和定量变化,并对宿主有益。运动可以丰富微生物群的多样性,刺激可以调节粘膜免疫、改善屏障功能的细菌的增殖,并刺激能够产生防止胃肠道疾病和提高性能的物质的细菌和功能通路。
尽管这些变化可能不会以类似的方式在个体间发生,也可能取决于微生物群和宿主的基线特征。
值得注意的是,某些菌群可能在运动员中富集,例如与瘦表型相关的A. muciniphila和产生丙酸盐的Veillonella(通过乳酸代谢)。精英运动员身上丰富多样的、有利于代谢的肠道微生物群,很可能是在整个青春期和成年期参加高水平运动期间,多年高营养摄入和高强度运动和训练的累积表现。
运动带来的益处涉及内在和外在因素的结合
常运动的人更有可能接触到他们的环境生物圈,并遵循整体健康的生活方式,因此拥有更健康的微生物群。
同时,耐力训练的内在适应性,例如血流量减少、组织缺氧以及转运和吸收能力增加,可导致胃肠道发生变化。胃肠道转运时间的变化又会影响结肠腔内的 pH 值,这可能导致肠道微生物群的组成发生变化。而较长的结肠转运时间与肠道微生物群多样性的减少有关,同时伴随着从近端结肠到远端结肠的转运过程中 pH 值的增加。
长时间过度运动对肠道功能产生不利影响
尽管运动通常有益健康,但如果持续时间和强度的增加,且得不到足够的休息、营养的支持,它就会变得有害。
剧烈运动将血液从内脏循环重新分配到活跃的呼吸组织。长时间的肠道低灌注会损害黏膜稳态并导致肠细胞损伤,可能会导致肠道缺血,特别是在脱水的情况下,表现为腹部绞痛、腹泻或偶尔血性腹泻,也会使肠道通透性增加,产生炎症。这种不利影响在耐力运动中尤其如此。
目前对人体肠道微生物群与运动之间相互作用的研究仍然缺乏
尤其是与控制饮食相结合的研究,这是一个重要的混杂因素。准确测量营养成分和饮食质量,将有助于把运动对肠道微生物群的影响与其他混杂因素区分开来。
研究还应记录液体摄入量或测量水合生物标志物(如和肽素),以确定水合状态是否影响肠道微生物群,反之亦然。
此外,饮食和运动对肠道微生物群的影响通常是短暂的,并且在干预完成后不会持续。这表明长期的生活习惯对于诱导肠道微生物群的稳定变化是必要的。在关键发育窗口期间的干预措施可能对肠道微生物群产生更持久的影响,当然这需要进一步研究。
未来与运动相关的肠道微生物群的研究领域

Mohr AE, et al., J Int Soc Sports Nutr. 2020
未来的研究应侧重于使用分层方法,使用人体临床试验来识别可能有益于运动表现的目标细菌,并使用动物和体外研究来确定因果关系和机制。
然后可以再次使用人体试验来确定是否补充已鉴定的细菌或实施饮食习惯(例如,益生元/不易消化的碳水化合物、ɷ-3 脂肪酸补充剂、蛋白质摄入量的类型/数量),以提高细菌丰度和/或功能有利于运动表现。
需要在控制饮食的情况下调查高蛋白饮食、全食物蛋白质来源和蛋白质补充剂的影响的临床研究,以确定这些饮食模式和成分对运动员肠道微生物群的影响。
此外,需要更多的研究来阐明膳食脂肪的数量和类型对肠道微生物群的影响以及随后微生物群介导的(例如,通过胆汁酸)对运动表现的影响。
总之,人们越来越意识到,微生物群的个体差异会导致运动反应和健康结果的差异性。
未来的研究还应该整合其他“组学”数据
整合其他“组学”数据,以确定可能导致、促成、介导或调节饮食和运动对肠道微生物群的影响的潜在代谢物、基因和表观遗传修饰。
“组学”数据的使用与机器学习方法相结合,有可能揭示肠道微生物群与其代谢物、饮食和运动表现之间的新关联,并预测对饮食策略的个性化反应。这些发现的影响包括提高运动员成绩和改善健康,尤其是胃肠道和呼吸系统健康的潜力。
此外,研究应对肠道微生物群、饮食和人类健康之间的相互作用有更深入的了解,这些相互作用可能具有超越运动人群的影响和应用,以造福所有人的健康。
声明:本账号发表的内容仅是用于信息的分享,仅供学习参考使用。在采取任何预防、治疗或治愈的措施之前,请先咨询临床医生。
主要参考文献:
Clark A, Mach N. Exercise-induced stress behavior, gut-microbiota-brain axis and diet: a systematic review for athletes. J Int Soc Sports Nutr. 2016;13:43. Published 2016 Nov 24. doi:10.1186/s12970-016-0155-6
Lensu, S.; Pekkala, S. Gut Microbiota, Microbial Metabolites and Human Physical Performance. Metabolites 2021, 11, 716.
Mohr AE, Jäger R, Carpenter KC, et al. The athletic gut microbiota. J Int Soc Sports Nutr. 2020;17(1):24. Published 2020 May 12. doi:10.1186/s12970-020-00353-w
Jang LG, Choi G, Kim SW, Kim BY, Lee S, Park H. The combination of sport and sport-specific diet is associated with characteristics of gut microbiota: an observational study. J Int Soc Sports Nutr. 2019;16(1):21. Published 2019 May 3. doi:10.1186/s12970-019-0290-yHughes RL,
Holscher HD. Fueling Gut Microbes: A Review of the Interaction between Diet, Exercise, and the Gut Microbiota in Athletes. Adv Nutr. 2021;12(6):2190-2215. doi:10.1093/advances/nmab077
Jollet M, Nay K, Chopard A, et al. Does Physical Inactivity Induce Significant Changes in Human Gut Microbiota? New Answers Using the Dry Immersion Hypoactivity Model. Nutrients. 2021;13(11):3865. Published 2021 Oct 29. doi:10.3390/nu13113865
Marttinen M, Ala-Jaakkola R, Laitila A, Lehtinen MJ. Gut Microbiota, Probiotics and Physical Performance in Athletes and Physically Active Individuals. Nutrients. 2020;12(10):2936. Published 2020 Sep 25. doi:10.3390/nu12102936
Sohail MU, Yassine HM, Sohail A, Thani AAA. Impact of Physical Exercise on Gut Microbiome, Inflammation, and the Pathobiology of Metabolic Disorders. Rev Diabet Stud. 2019;15:35-48. doi:10.1900/RDS.2019.15.35
Monda V, Villano I, Messina A, et al. Exercise Modifies the Gut Microbiota with Positive Health Effects. Oxid Med Cell Longev. 2017;2017:3831972. doi:10.1155/2017/3831972
Clauss M, Gérard P, Mosca A, Leclerc M. Interplay Between Exercise and Gut Microbiome in the Context of Human Health and Performance. Front Nutr. 2021;8:637010. Published 2021 Jun 10. doi:10.3389/fnut.2021.637010
Okamoto T, Morino K, Ugi S, Nakagawa F, Lemecha M, Ida S, Ohashi N, Sato D, Fujita Y, Maegawa H. Microbiome potentiates endurance exercise through intestinal acetate production. Am J Physiol Endocrinol Metab. 2019 May 1;316(5):E956-E966. doi: 10.1152/ajpendo.00510.2018. Epub 2019 Mar 12. PMID: 30860879.
Ticinesi A, Nouvenne A, Cerundolo N, et al. Gut Microbiota, Muscle Mass and Function in Aging: A Focus on Physical Frailty and Sarcopenia. Nutrients. 2019;11(7):1633. Published 2019 Jul 17. doi:10.3390/nu11071633
Hughes RL, Holscher HD. Fueling Gut Microbes: A Review of the Interaction between Diet, Exercise, and the Gut Microbiota in Athletes. Adv Nutr. 2021 Dec 1;12(6):2190-2215. doi: 10.1093/advances/nmab077. PMID: 34229348; PMCID: PMC8634498.
Zhao J, Zhang X, Liu H, Brown MA, Qiao S. Dietary Protein and Gut Microbiota Composition and Function. Curr Protein Pept Sci. 2019;20(2):145-154. doi: 10.2174/1389203719666180514145437. PMID: 29756574.
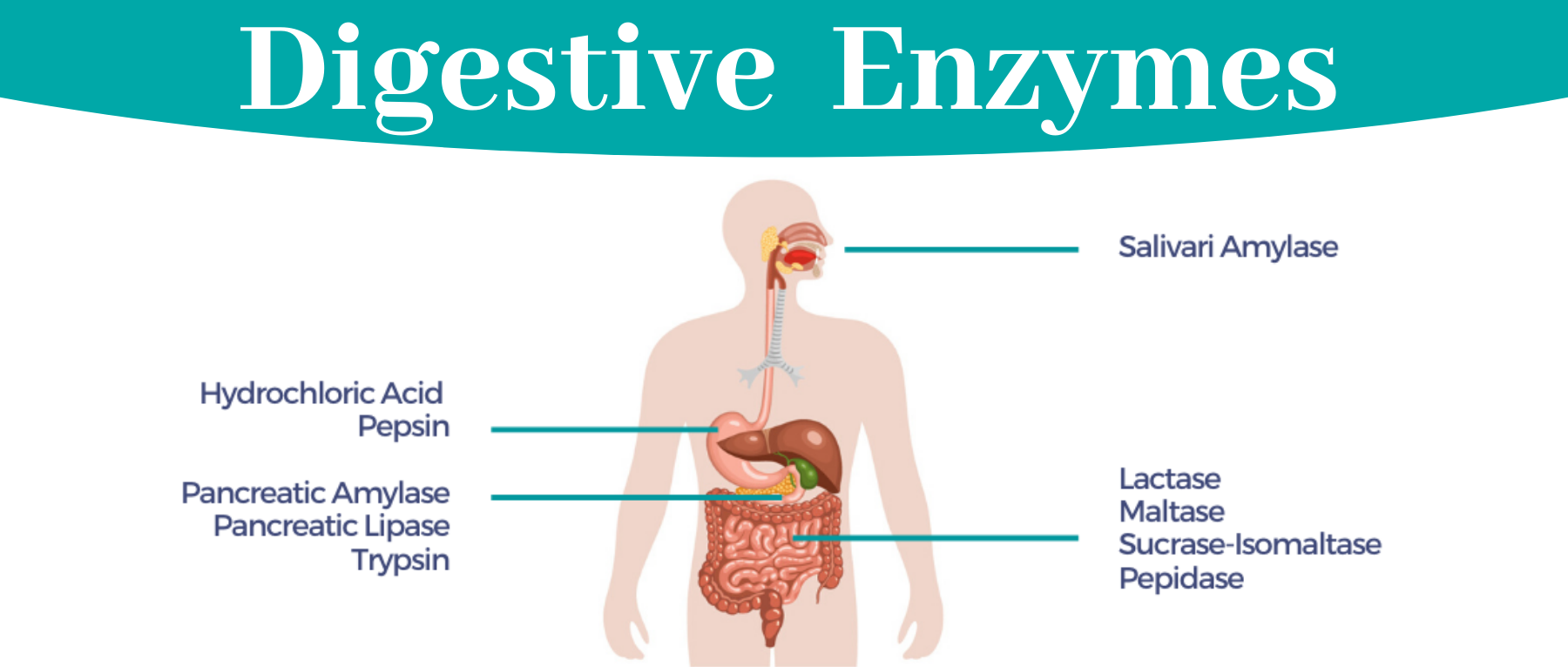
谷禾健康
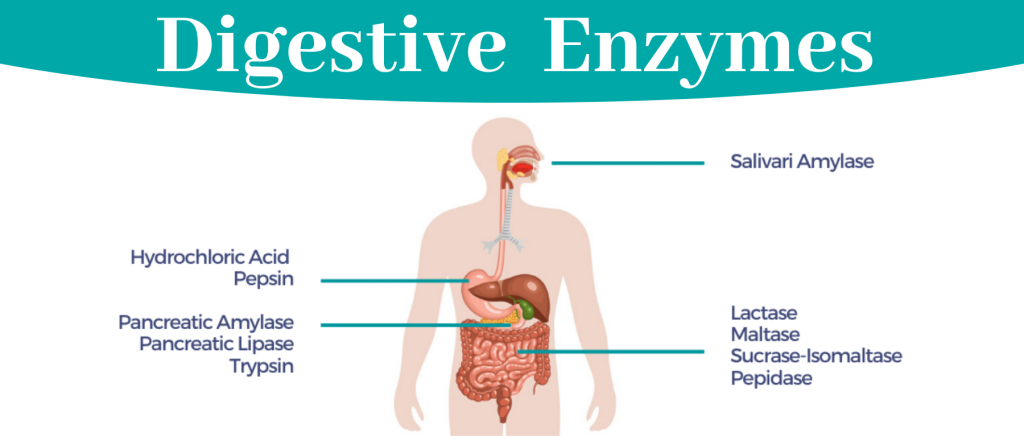
消化酶分解脂肪、蛋白质和碳水化合物,便于身体吸收营养。大部分消化酶由胰腺产生,其次是小肠、胃和口腔。
本文主要介绍不同酶的工作原理、酶水平背后的遗传因素和消化系统疾病以及自然促进消化的方法。
消化酶是一组广泛的酶,可将脂肪、蛋白质和碳水化合物等大营养素分解成更容易被身体吸收的较小营养素。人体在胰腺中自然产生大部分酶,而胃、小肠和口腔中产生少量酶。
以下酶可以帮助人体从特定的食物中吸收营养:
▪ 蛋白酶把蛋白质分解成氨基酸
▪ 脂肪酶把脂肪分解成脂肪酸
▪ 淀粉酶将碳水化合物分解成单糖,如葡萄糖
它们的主要作用是帮助消化,这些酶在你体内的数量和活性取决于一系列复杂的因素。初步研究表明,消化酶可能有助于缓解各种消化疾病、减轻炎症、肠道感染等。
消化酶水平低表明胰腺不能正常工作,难以产生重要的消化化合物。
在严重的时候,这种情况被称为外分泌胰腺功能不全(EPI)。这时,胰腺中产生消化酶的细胞会随着时间的推移而被破坏。
当然,EPI不是唯一的原因,各种因素都会导致消化酶水平降低:

消化酶主要分三大类:脂肪酶、淀粉酶、蛋白酶
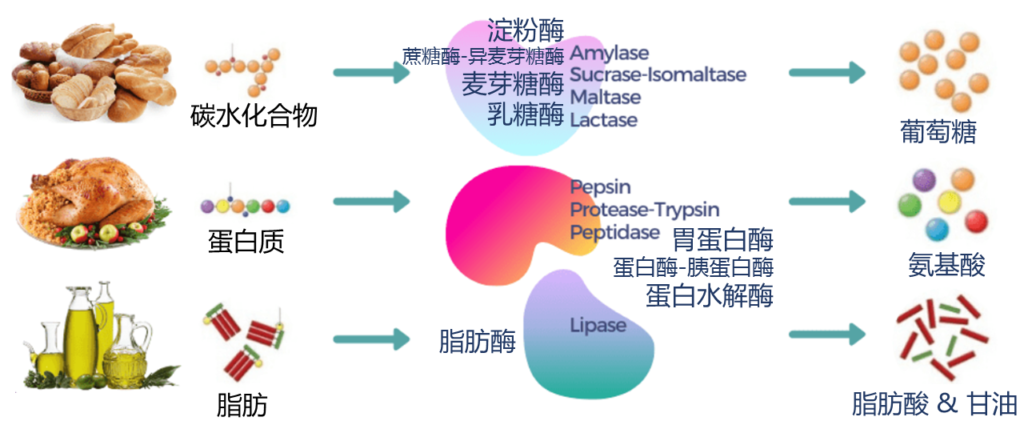
脂肪酶
脂肪酶是分解脂肪的酶,帮助维持胆囊功能正常。它们在胰腺中产生,但也可以从植物、动物和真菌中提取,并且足够稳定。
各种类型的脂肪酶参与不同的过程,例如脂肪代谢、运输、细胞信号传导、炎症等。

✓ 用于肠易激综合征(IBS)患者
含有脂肪酶和其他胰酶的补充剂可以帮助减少餐后的腹胀、胀气和饱腹感,尤其是脂肪含量高的食物。这些症状通常与消化问题有关,如肠易激综合征(IBS)。研究还表明,一些肠易激综合征患者可能存在胰腺外分泌功能不全,即由于胰腺产生的消化酶缺乏而无法正确消化食物。

谷禾健康
乳酸菌属益生菌是使用最广泛的益生菌之一。罗伊氏乳杆菌( L. reuteri ) 是一种经过充分研究的益生菌,可以在大量哺乳动物中定殖。
罗伊氏乳杆菌是一种革兰氏阳性杆状细菌,已在各种食物中发现,尤其是肉类和奶制品。在人类中,罗伊氏乳杆菌存在于不同的身体部位,包括胃肠道、泌尿道、皮肤和母乳。罗伊氏乳杆菌的丰度因个体而异。
可能的优势
● 可能促进皮肤光泽和头发浓密
● 可能有助于对抗感染
● 可能减少炎症并加强免疫
● 可能会改善肠道健康(减少 IBS 和 IBD 症状)
● 可能降低胆固醇
可能的副作用
● 可能对组胺不耐受的人不利
● 可能导致某些人体重增加
● 缺乏大规模临床研究
● 长期补充的安全性未知
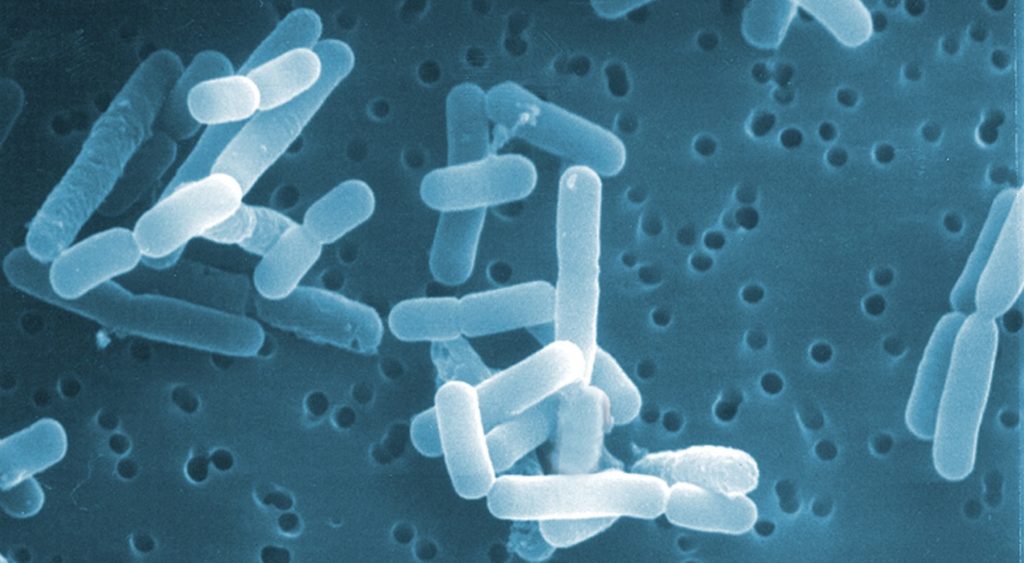
罗伊氏乳杆菌(Lactobacillus reuteri)名字来自德国微生物学家 Gerhard Reuter,他在1960 年代在人类肠道和粪便样本中发现了它。1960 年代被发现时,罗伊氏乳杆菌自然存在于 30-40% 的人体内,现在大约降至10-20%。科学研究者将这种下降与生活方式的改变联系起来。我们不像以前那样吃发酵食品,如酸菜,而是使用防腐剂,这会杀死食物和体内的细菌。
罗伊氏乳杆菌在发酵过程中能够产生葡聚糖和果聚糖。其中一种葡聚糖,α-1,4/1,6 葡聚糖,分子量为 40 MDa,支化度约为 16%,似乎是一种饱腹感诱导剂,对胰岛素和血糖水平有良好的影响在人类。葡聚糖不会在胃和空肠中降解,而是在结肠中完全降解。由于其慢淀粉特性,这种葡聚糖可能是烘焙应用中一种促进健康的成分。
不同菌株的Lactobacillus reuteri已被证明具有不同的生理作用。例如,Lactobacillus reuteri DSMZ 17648用于治疗幽门螺杆菌(H. pylori),而Lactobacillus reuteriNCIMB 30242 用于治疗高胆固醇。
但是,罗伊氏乳杆菌补充剂尚未获得批准用于医疗用途,而且有的益处和副作用缺乏可靠的临床研究。法规制定了补充剂的制造标准,但不保证它们是安全或有效的。
大多数关于Lactobacillus reuteri的研究是在动物或细胞中进行的。临床研究很少,而且大多数是低质量的、小规模的或可能存在偏见的。此外,使用的确切菌株因不同研究而异。
尽管罗伊氏乳杆菌在人类中是正常的,但并不是每个人的胃肠道中都有它。口服补充剂可以增加和补充胃肠道罗伊氏乳杆菌,然而它不一定会长期留在那里。
同样,罗伊氏乳杆菌的良好来源是乳制品和肉类,素食者和大多数素食者都避免食用这些食品,因此补充剂很重要。在母乳喂养时服用罗伊氏乳杆菌补充剂的女性更有可能将这些有益细菌转移给婴儿。
为消化和吸收而建,胃肠系统的某些部位已发展为对微生物定植不利。这方面的例子可以在由小肠上部胃酸和胆汁盐引起的低 pH 条件下看到。因此,在胃肠道定植的第一步就是在这样的环境中生存。幸运的是,罗伊氏乳杆菌对低 pH 值和胆汁盐具有抵抗力。这种抗性被认为至少部分取决于其形成生物膜的能力。
谷禾健康
自身免疫性疾病,包括炎症性肠病、多发性硬化和类风湿性关节炎,具有不同的临床表现,但肠道微生物群紊乱和肠道屏障功能障碍的潜在模式相同。但宿主因素的个体差异使得统一的方法不太可能。
我们往往会有这样的错觉:“自然”的东西一定是对健康有益的。我们是不是只要吃最原始的食物就能恢复健康?
事实上,优化人类健康的途径并不像照搬我们祖先的饮食或增加我们对微生物的接触那样简单。归根结底,过去和现在的环境是根本不同的,也许是不可逆转的。
因此,针对微生物群的饮食干预的目标不应是回到祖先的状态,而是操纵微生物群,优化宿主健康,直接适应日益工业化的世界。
本文介绍了关于饮食-局部炎症中的微生物群相互作用、肠道微生物群失衡和宿主免疫失调的知识。通过了解并结合个别饮食成分对微生物代谢输出和宿主生理的影响,研究了基于饮食的自身免疫性疾病预防和治疗的潜力。讨论了针对肠道微生物群的工具,如粪便微生物群移植、益生菌和正交小生境工程等。这些方法强调了在自身免疫性疾病不断增加的情况下,利用饮食精确操纵肠道微生物组的途径。
在肠道中,对微生物威胁作出适当反应的免疫平衡行为,对共生微生物和自身抗原的耐受,在生命早期尤其重要,这是定植微生物群和宿主免疫系统相互作用的窗口,引发促炎或抗炎倾向,可能对终身健康产生影响。
★ 婴儿期影响菌群的因素
看过我们文章的都知道,早期生活因素,如剖腹产、配方奶粉喂养和抗生素的使用,可能会干扰微生物群生长过程。
婴儿期母乳中的人乳低聚糖有助于双歧杆菌的定植,双歧杆菌在早期肠道微生物群中占主导地位,产生岩藻糖、乙酸盐、丙酮酸盐和1,2-丙二醇,通过交叉喂养支持微生物群的扩增,有助于对共生细菌的免疫耐受。
人类通常在6个月大时开始转变为固体食物饮食,自此菌群显著扩大,产生更多数量和种类的代谢物(例如,丁酸盐,它促进结肠粘液屏障的成熟,并阻止具有高致病潜力的细菌的生长)。
★ 抗性淀粉缓解系统性红斑狼疮
在一项涉及149名健康志愿者的研究中,脂多糖通过诱导TLR4耐受来抑制先天免疫过程。微生物抗原对TLR的不当刺激也可能影响自身免疫疾病的进展,并为其修复提供线索,如系统性红斑狼疮过度表达TLR7的小鼠模型中,通过添加抗性淀粉来改变微生物代谢产物和分类组成,狼疮进展得到缓解。
★ 微生物变化引起的免疫反应
在自身免疫性疾病患者中也发现了由微生物引起的适应性免疫反应失调。哺乳动物肠道中的共生微生物群,尤其是梭菌群IV和XIVa,它们将膳食纤维代谢成丁酸盐以诱导Treg细胞发育,与小鼠模型中的结肠炎严重程度呈负相关。
通常,自身免疫性疾病患者表现出产生耐受性IL-10的CD25 FOXP3 T细胞的丰度降低,自身反应性效应性T细胞亚群(如TH1细胞和TH17细胞)的丰度增加,从而使Treg细胞与效应性T细胞的比率偏离稳态水平。这些改变可能通过过度产生促炎细胞因子(如TNF和IL-17)进一步促进肠道通透性的增加,这些促炎细胞因子可调节紧密连接蛋白的表达。
自身免疫疾病共同的潜在驱动因素鼓励通过饮食干预或微生物群调节策略(下文讨论)来进行肠道微生物群工程,以将肠道微生物群转变为功能多样的“健康”状态。
饮食可直接影响肠道微生物群,调节其组成或代谢输出,从而可能促进疾病或形成稳态。

谷禾健康
2型糖尿病是一种血糖水平升高(高血糖)的慢性代谢疾病,主要由胰岛素抵抗和胰岛素分泌不足引起。2型糖尿病全球患病率在不断上升。
截止到2020年,根据美国糖尿病学会评估标准,糖尿病患病率已达到12.8%。其实在我国成年人中,已经有将近一半的人存在血糖异常,未来极有可能发展为2型糖尿病。如果不加干预治疗,会引发许多不良后果。
很多研究表明,肠道菌群在宿主的代谢和疾病状态中起着重要的作用。特别是2型糖尿病,其病因复杂,包括肥胖、慢性低度炎症,受肠道微生物群和微生物代谢产物的调节。
本文将从肠道菌群的角度了解其与2型糖尿病的关系;肠道菌群及其代谢物对葡萄糖代谢、免疫系统的影响;
从影响肠道菌群变化的因素来了解各种干预措施,包括药物,饮食,益生菌/益生元,粪菌移植,间接性禁食等方式。
葡萄糖主要通过食用的食物和饮料进入人体。胰腺会产生一种叫做胰岛素的激素,以帮助血液中的葡萄糖进入肌肉、脂肪和肝脏,用作能量。
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像钥匙打开锁一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
刚开始的时候,胰腺会觉得自己使不上力,于是不甘心开始拼命工作,产生更多的胰岛素来克服这种抵抗。
随着时间的推移,胰腺开始累了,力不从心,不能产生更多的胰岛素,这时候就是2型糖尿病开始了。
肠道微生物群可以直接或间接地影响人类健康,肠道微生物群失调可能会增加促炎疾病的患病率,如肥胖、炎症性肠病、2 型糖尿病、关节炎和癌症。
2型糖尿病人群中个体微生物群的差异
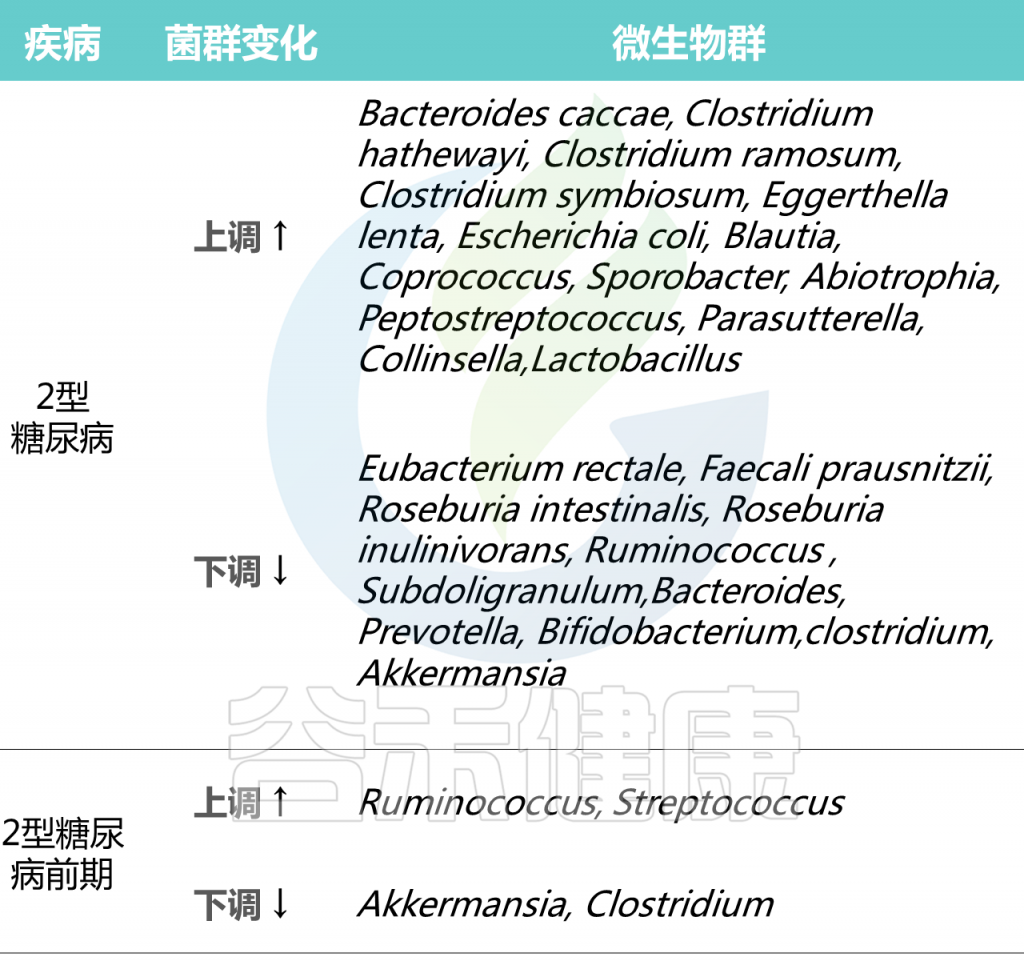

Cunningham A L et al., Gut Pathog, 2021
在2型糖尿病患者普遍具有相对高丰度的特定属:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
2型糖尿病患者中,产生丁酸菌特别缺乏,特别是梭菌目,包括:
Ruminococcus、Subdoligranulum,Eubacterium rectale、Faecali prausnitzii、Roseburia intestinalis 、
Roseburia inulinivorans
2型糖尿病患者中,其他明显较少的菌属有:
拟杆菌属、普雷沃氏菌属、双歧杆菌属