-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
刚过去的九九重阳节,唤起了我们对“长长久久”的生命期盼,这是根植于我们文化深处的向往。而今我们期盼的,不再只是生命时钟的不断前行,更是那份长长久久的能够自由行走、清晰思考、感受生活美好的“生命质量”。
衰老,正是稀释生命质量、为晚年带来挑战的关键因素。因此,理解衰老、干预衰老,让每一段生命都充满活力,成为了比单纯追求“长久”更重要的时代课题。

为何同龄人中,有些人看起来精力充沛、容光焕发,而另一些人却似乎被岁月过早地刻上了痕迹?
当看到市面上琳琅满目的NMN、NAD+补充剂,或是主打“肠道健康”的益生菌时,是否也曾好奇:这些宣称能“逆转时光”的产品,其背后真正的科学逻辑是什么?
…
衰老是一个每个人都无法回避的自然的生物学过程,包括基本生理功能的逐渐衰退和进行性衰老。随着年龄的增长,衰老加速,导致细胞内损伤积累,增加年龄相关疾病的易感性。衰老影响每个人,但对每个人影响的程度不同。
近年来,科学界已经逐步确定了一系列导致细胞、组织和整个生物体衰老的生物学过程,这些被扩展到包括衰老的十四个关键标志。它们包括基因组不稳定性、端粒磨损、表观遗传改变、蛋白质稳态丧失、细胞自噬失能、营养感应失调、线粒体功能障碍、细胞衰老、细胞外基质变化、干细胞耗竭、细胞间通讯改变、慢性炎症、菌群失调、心理-社会隔离。
这些特征为理解衰老过程提供了一个基本框架,并且相互之间有着深刻的联系。其中,免疫力下降、肠道菌群失衡和慢性炎症这三个因素相互影响,形成了一个加速衰老的恶性循环。简单来说,肠道不健康会削弱免疫功能,免疫力差又会让肠道问题更严重,最终导致全身慢性炎症,而这种炎症正是心脏病、糖尿病、老年痴呆和癌症等多种年龄相关疾病的共同土壤。
在这个复杂系统中,饮食营养扮演了连接环境、肠道与宿主免疫的中心枢纽角色。因此,我们的餐盘实质上成为了调控自身衰老速度和健康轨迹的“遥控器”。饮食中的每一个选择,都在向这个复杂的“微生物-免疫-炎症”网络发送信号,或促进平衡与修复,或加剧失调与衰败。
传统的营养学常常聚焦于维生素、矿物质等已知营养素。然而,前沿科学发现,食物中还存在大量曾被忽视的“营养暗物质”,如植物化学物质、多酚等。它们虽非传统必需营养素,却在调节健康、对抗衰老中扮演着至关重要的角色。
例如,石榴中的鞣花单宁,需要经过特定肠道微生物的代谢,才能转化为近来在抗衰老市场备受追捧的尿石素A(Urolithin A),后者已被证明能有效清除衰老线粒体,恢复细胞活力。这完美诠释了饮食、微生物和抗衰老之间的精妙联系。
在这些复杂联系之外,现代AI技术正为我们提供了系统化解决方案。目前,人工智能驱动的精准饮食干预将海量的多组学数据转化为可操作的饮食建议,通过分析生物年龄较高或较低人群的数据,机器学习模型能够识别出哪些特定的饮食模式、食物来源的信号分子或肠道菌群特征是“减速”或“加速”衰老的关键驱动因素。最终,可以为个体量身定制饮食方案。
本文将带您深入这一前沿领域,探讨肠道菌群失调与免疫衰老之间如何形成恶性循环,并共同催生“炎症衰老”,我们将了解各种干预方式,是如何成为打破这一循环、调控我们衰老速度的强大工具。
随着年龄增长,我们常常感觉身体变得更脆弱了:更容易感冒,伤口愈合得更慢,恢复得也更吃力。这背后一个很重要的原因,就是我们身体内部的免疫系统发生了变化。免疫力的衰退,即免疫衰老,是衰老过程中的一个核心环节。
这种变化主要体现在两个方面:
衰老过程中先天与适应性免疫系统的变化共同导向炎症性衰老状态
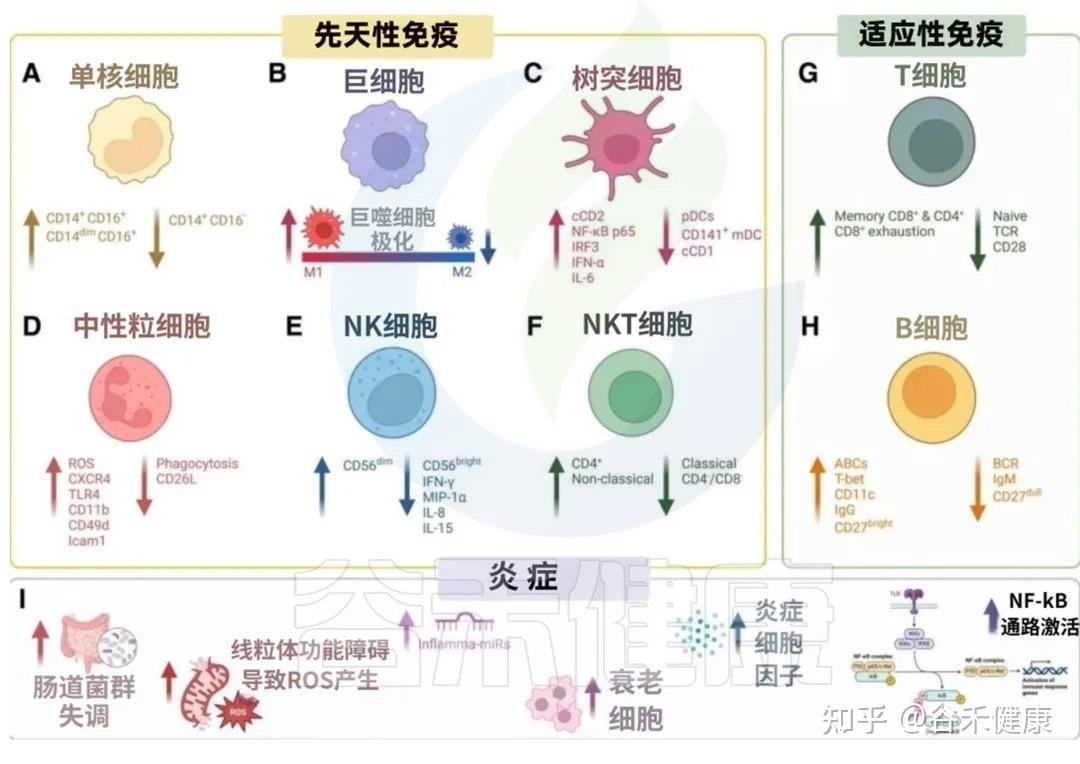
我们来看看衰老是如何影响我们免疫军队的两大核心分支的:先天免疫系统和后天免疫系统。
先天免疫是我们与生俱来的、快速反应的防御系统,是抵御病原体的第一道防线。但随着衰老,这支部队的效率和精确性都大打折扣。
这种功能失调的背后,涉及多种免疫细胞的变化。以下,我们将首先探讨先天免疫系统在衰老过程中的具体改变。
单核细胞:平衡 ➜ 促炎(经典型↓ 中间型、非经典型↑)
从单核细胞看炎症体质的形成:为什么你会感觉身体总在发炎?
在年轻健康时,单核细胞在血液中循环,一旦机体出现感染或损伤,便会迅速赶往炎症部位,并在此分化为巨噬细胞或树突状细胞。单核细胞还能吞噬病原体,并分泌信号分子,精细调控炎症反应。
根据细胞表面的蛋白标志物,人类单核细胞大致可分为三种主要表型:
▸ 衰老带来的失衡
研究表明,衰老导致:
值得注意的是,血液中单核细胞的总数通常保持稳定,这说明衰老的影响主要体现在细胞亚群的功能重塑上,而非数量变化。
▸ 这会带来什么后果?
这种细胞亚型的转变,意味着体内能高效分泌促炎因子的细胞群体增多,这直接助长了“炎症衰老”的慢性炎症状态,并削弱了机体有效修复损伤的能力。
你可能在体检报告上看到高敏C反应蛋白(hs-CRP)的指标,该指标升高往往与体内促炎单核细胞数量或活性增加、持续释放炎症因子有关。hs‑CRP 被视为心血管疾病等多种慢性病的风险预警信号。
巨噬细胞:平衡 ➜ 促炎( M1型↑ M2型↓ )
如果说单核细胞是血液中的巡逻兵,那么巨噬细胞就是驻扎在身体各组织(如皮肤、肝脏、大脑)里的多功能兵。巨噬细胞源自血液中的单核细胞,是处理局部问题的专家。
巨噬细胞的核心在于其“按需切换”的能力,主要有两种工作模式:
注:这里只是为了便于理解简化了,实际上巨噬细胞的极化是一个连续光谱(受多种细胞因子、代谢状态和组织微环境共同调控),往往呈现混合或中间表型,而非仅在两极之间来回切换。
在年轻健康的身体里,这两种模式的切换是及时且高效的。
▸ 衰老带来的失衡
衰老使巨噬细胞的平衡向促炎的M1型偏移。
▸ 这会带来什么后果?
伤口愈合变慢,组织修复能力下降
因为负责修复重建的M2型模式减少,所以在出现损伤(如割伤、手术后)时,组织的愈合过程会变得缓慢且不充分,更容易形成疤痕。
体内垃圾堆积,加速衰老进程
巨噬细胞的一个关键职责是吞噬并清除体内的“垃圾”,比如衰老的细胞和细胞碎片。尽管炎症信号增强,但吞噬与清理能力下降,功能失衡加剧。这导致衰老细胞无法被及时清除,它们在组织中不断累积,并释放更多炎症物质,形成一个“促炎-衰老细胞累积-更促炎”的恶性循环。
可能带来动脉粥样硬化
在血管壁中,功能失调的M1型巨噬细胞会疯狂吞噬胆固醇,但又无法有效代谢,最终变成充满脂质的泡沫细胞。这些泡沫细胞大量堆积,正是形成动脉粥样硬化斑块、导致血管堵塞的核心原因。
这削弱了它们有效召集其他免疫援军,并启动高效免疫反应的能力,进一步维持了体内的炎症状态。
树突状细胞:免疫反应启动效率下降
这些问题的答案,均指向了免疫系统中一个关键角色——树突状细胞(DCs) 的功能衰退。
树突状细胞是功能最强的抗原呈递细胞,重要职责是:
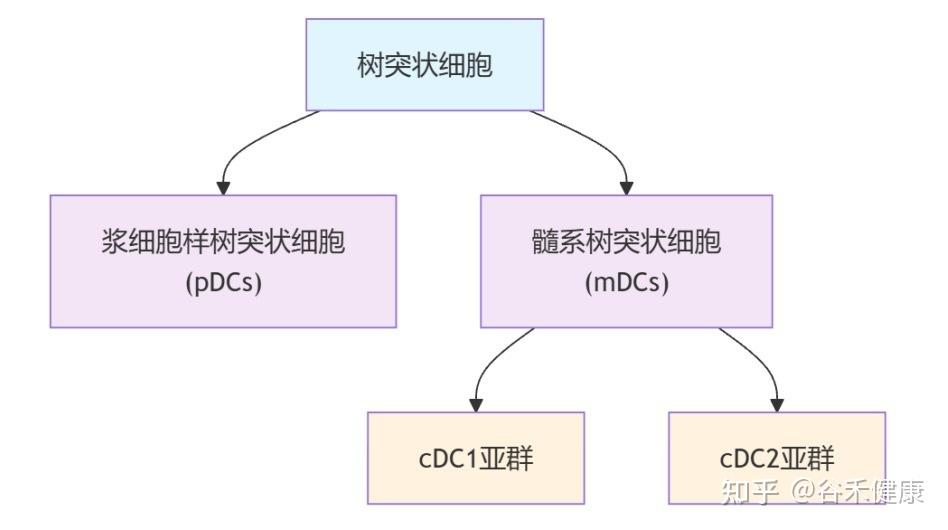
这其中,有一类名为 cDC1 的树突状细胞亚群,是专门负责激活T细胞的,T细胞是消灭病毒和肿瘤细胞的主力。
▸ 衰老影响这些DC亚群的组成和功能
关键指挥官cDC1 数量锐减:研究证实,体内负责激活抗病毒和抗肿瘤反应的 cDC1 细胞数量会显著减少。
剩余部队反应迟钝:剩下的树突状细胞,其呈报敌情的效率也大打折扣,激活T细胞的能力下降。
▸ 这会带来什么后果?
肿瘤和病毒的可乘之机
cDC1的减少,直接导致免疫系统的日常“巡逻监控”能力下降。体内的癌变细胞或潜伏的病毒(如导致带状疱疹的水痘-带状疱疹病毒)更不容易被及时发现和清除,从而大大增加了患癌和机会性感染的风险。
现代肿瘤治疗中的免疫疗法,其核心策略之一,就是想方设法重新激活这条“树突状细胞-T细胞”的攻击轴线。
加剧慢性炎症
这些功能失调的树突状细胞,在“消极怠工”的同时,还会错误地释放更多促炎信号,为身体的“炎症衰老”状态火上浇油。
树突状细胞功能的衰退,让我们在面对病毒和肿瘤时,免疫系统的启动速度和反应强度都打了折扣。
中性粒细胞:低效杀敌 + 高效自伤
中性粒细胞是免疫系统中的“快速反应部队”,一旦有病菌入侵,它们最先到达现场,通过吞噬、释放杀菌物质(如ROS,活性氧)等方式消灭病原体。
年轻时,它们是高效的杀手。但衰老后,它们的功能变得非常矛盾和具有破坏性。
▸ 衰老带来的变化
杀敌能力下降:它们吞噬病菌的效率变低了,用来捕捉病菌的“网”(NETs)也造得又少又差。这直接导致它们无法有效清除病原体,让小的感染迟迟不好,甚至恶化。
无差别攻击增强:虽然杀菌效率变差,但它们释放的化学武器——活性氧(ROS),却不减反增。ROS过度释放导致旁观细胞损伤和组织炎症,这正是“氧化应激”加剧的核心原因之一。
▸ 这对你的健康意味着什么?
这种“低效杀敌 + 高效自伤”的模式,让人在年老后,更容易发生组织损伤和慢性炎症,关节炎、血管损伤等都与这种失控的氧化应激有关。
这就是为什么“抗氧化”是抗衰老领域永恒的热点。市面上流行的维生素C、维生素E、富含多酚的食物等,其核心作用之一就是帮助身体中和这些过量的、由衰老免疫细胞产生ROS,从而减少对自身的伤害。
NK细胞:癌症巡逻减少
NK细胞,即“自然杀伤细胞”,是体内最警惕的“巡逻兵”,它们不需要预警,就能不停地识别并清除癌变细胞和病毒感染细胞。
▸ 衰老带来的变化
随着年龄增长,NK细胞的数量和组成都在变化:
“精锐”减少:NK细胞中功能最强、反应最迅速的“精锐亚群”(CD56亮细胞)数量下降。
“普通”功能下降:虽然细胞总数可能没变少,但整体战斗力和沟通能力都大幅下滑。它们在发现敌人后,释放的求援信号(如干扰素IFN-γ)显著减少,无法有效召集其他免疫细胞协同作战。
“后勤补给”被切断:维持NK细胞生长和活力的关键因子IL-15水平下降,相当于断了粮草,使其功能进一步衰退。
▸ 这对健康意味着什么?
是老年人健康最大的隐患之一。
癌症风险显著增加
免疫系统对早期癌细胞的监控和“清除”能力下降,给了癌细胞潜伏和发展的可乘之机。
病毒感染更易发生
对潜伏病毒(如引起带状疱疹的病毒)的压制力减弱,更容易导致病毒再激活和发病。
NK细胞因其在癌症预防和抗衰老中的巨大潜力,已成为再生医学和细胞治疗领域的绝对明星。
近年来,NK细胞疗法备受追捧,无论是通过体外扩增回输自体NK细胞,还是异体NK细胞产品,都旨在补充和激活这支重要的免疫力量。
据市场分析,全球NK细胞疗法市场预计在未来十年将以超过40%的年复合增长率高速发展,显示出巨大的市场潜力和消费者关注度。
我们的免疫系统分为两支主要部队:一支是反应迅速、指哪打哪的“特种部队”(后天免疫系统),另一支是冲锋在前、快速反应的“先锋部队”(先天免疫系统)。随着年龄增长,这两支部队都会出现不同程度的老化。
T细胞:精英特种兵 ➜ 疲惫老兵
T细胞是免疫系统中负责精准打击和长期记忆的核心战斗力。其中,
针对T细胞的免疫疗法是现代医学的重大突破,尤其是在癌症治疗领域(如CAR-T疗法)。在抗衰老领域,如何清除衰老的T细胞、恢复T细胞“新兵”的多样性,是前沿研究的核心。
▸ 新兵来源枯竭:免疫系统的“兵工厂”关闭了
T细胞的“训练营”是我们的胸腺。胸腺在年轻时非常活跃,源源不断地培养出充满活力、能识别各种新敌人的“新兵”(幼稚T细胞)。
但随着年龄增长,胸腺会严重萎缩,被脂肪取代。结果就是,“新兵”补充几乎断绝,我们识别和对抗全新病毒(比如新型流感病毒)的能力大幅下降。
▸ 老兵开始消极怠工
由于没有新兵补充,军队里只剩下了身经百战的老兵(记忆T细胞)。更糟糕的是,其中一部分老兵因常年作战而变得衰老和耗竭。它们不仅战斗力锐减,无法有效增殖去打仗,还会在体内释放大量“煽风点火”的炎症信号,成为慢性炎症的主要推手。
因此,“胸腺再生”已成为抗衰老领域的前沿探索方向之一。
再生思路:利用 iPSC(诱导多能干细胞)或胸腺组织工程技术,在体外或体内重建功能性胸腺,恢复或提升 T 细胞生成能力。
前沿:已有公司(如 Tolerance Bio)获得数千万美元融资,开展胸腺再生的临床前/临床研究;早期临床试验报告显示参与者的表观遗传年龄出现显著下降,提示胸腺再生可能对抗免疫衰老具有潜在价值。
B细胞:产能不足、武器型号单一
B细胞,是免疫系统的“抗体军工厂”,负责生产能够精准锁定并中和病原体的“导弹”——抗体,是我们获得长期免疫力的核心。
市场上的“抗体水平检测”服务,无论是针对新冠病毒还是其他病原体,其本质就是检测B细胞“军工厂”的工作成果。
随着年龄增长,这家军工厂不仅生产效率下降,更可怕的是,它开始生产出一批危险的“叛乱分子”。
▸ 衰老带来的变化
出现“叛乱分子”:危险的“年龄相关B细胞”(ABCs)崛起,具有极强的破坏性:
▸ 这对你的健康意味着什么?
自身免疫病风险剧增
许多自身免疫病,如类风湿性关节炎、干燥综合征、红斑狼疮,都在中老年时期高发或加重?这背后的一个关键推手,就是不断增多的ABCs细胞。它们产生的“错误抗体”攻击我们自身的关节、腺体乃至全身器官,导致了持续的疼痛和炎症。
抗体生产线僵化,难以应对新威胁
健康的免疫反应,在遇到新敌人时,会先迅速生产一批“通用型”的先锋抗体(IgM)来应急,然后再生产更精准、更持久的“定制型”主力抗体(IgG)。
衰老的B细胞系统彻底打乱了这个节奏:
这就是为何老年人接种流感或新冠疫苗后,产生的保护效果往往不如年轻人。他们的“抗体军工厂”已经失去了快速创新和应对新挑战的能力。
鉴于ABCs在自身免疫病和免疫衰老中的核心破坏作用,它们已成为药物研发的重点靶标。科学家们正在全力研究如何能精准地清除这些叛乱细胞,或抑制它们的活性,从而恢复免疫系统的正常秩序。
抗衰老前沿:研究者正探索通过 JAK‑STAT 抑制剂、代谢调控(如二甲双胍)或靶向 T‑bet/CD11c 等方式降低 ABCs 的频率或功能,以恢复更健康的 B 细胞谱系,提升老年免疫应答和疫苗效果。
如果说免疫系统是身体的“军队”,那么肠道菌群就是栖息在我们体内的、数量庞大的“盟友”与“潜在敌人”的复杂的生态系统,这对我们的健康至关重要,而它的构成也并非一成不变。随着年龄的增长,我们内在的微生物世界正在经历一场深刻的演替。
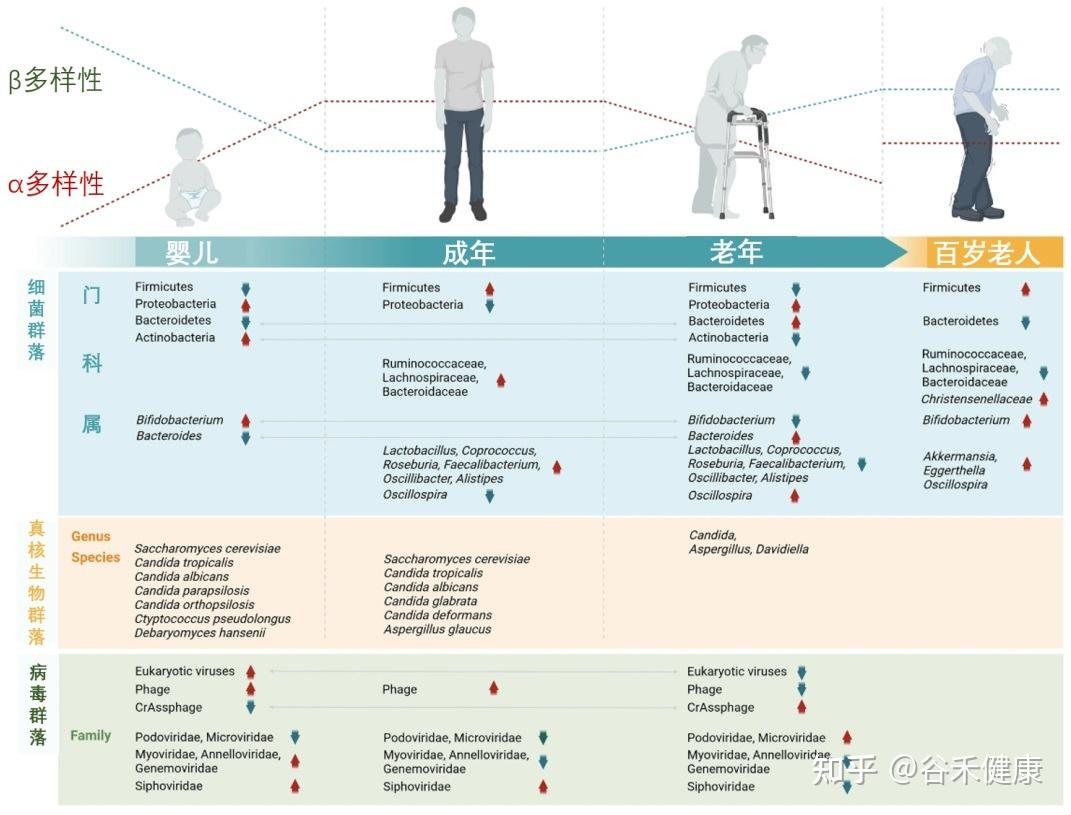
肠道菌群:随生命历程动态变化的生态系统
我们的肠道菌群从出生那一刻起就开始构建,并在3-4岁时基本成型,这个早期阶段的“地基”对一生影响深远。
婴儿期(奠定基础)
肠道菌群的“地基”搭建。新生儿的肠道以有益的双歧杆菌为主导,这对早期免疫系统的建立至关重要。
成年期(成熟稳定)
随着饮食日益多样化,细菌的种类和复杂性不断增加,而真菌的多样性则趋于减少。到成年时,菌群结构基本成型并进入一个相对稳定的阶段,主要由厚壁菌门和拟杆菌门两大类细菌主导。尽管宏观结构相似,但每个成年人的菌群构成都是独一无二的,如同指纹一般。
从婴儿到百岁老人,肠道微生物的组成和多样性在不同生命阶段呈现动态变化
衰老带来的关键转变:生态系统的失衡
随着年龄增长,这个稳定的生态系统开始出现显著的、通常是负面的变化,这一过程被称为“微生物群落老化”。
有益菌的流失,有害菌的增多
多样性降低:如同一个健康的森林退化成单一树种的林场,肠道菌群的总多样性下降,使其变得更加脆弱。
有益菌减少:对我们有益的细菌,如双歧杆菌 和乳杆菌属,数量显著下降。
有害菌增多:与此同时,一些具有促炎特性的“机会致病菌”开始占据优势,如变形菌门等,它们会持续地刺激免疫系统,导致全身性的低度炎症。
从青壮年(22-48岁)到准超级百岁老人(105-109岁)的进程中,一个显著的标志是:
关键功能的丧失:短链脂肪酸的减产
衰老菌群最核心的变化之一,是能够发酵膳食纤维并产短链脂肪酸的细菌大幅减少。
短链脂肪酸(如丁酸盐)是维持肠道健康和调节免疫的基石:它们为肠道壁细胞提供能量,维持肠道屏障的完整性,并能直接向免疫细胞发送“保持冷静”的信号。它们的减少,是肠道功能衰退的关键标志。
长寿的线索:从百岁老人的菌群中学习
随着全球老龄化的加速,研究越来越集中于理解生命晚期的微生物演替,以预测与衰老相关的疾病特征并促进健康老龄化。
有趣的是,研究发现健康长寿的老人(如百岁老人)的肠道菌群并未完全遵循上述的衰退轨迹。相反,它们展现出一些独特的“年轻化”特征:
与老年人(66-85岁)相比,他们的肠道菌群保留了更高的多样性,生态依然丰富。
在他们的肠道中富含长寿菌群,几种被认为与健康和长寿相关的细菌丰度更高,例如:
这些传统的有益菌在他们体内依然维持着高水平。

解密|肠道菌群与健康长寿7 赞同 · 0 评论 文章
“生物群落老化”:衰弱与菌群失调的关联
身体衰弱表现为精力差、活动少、体重减轻、肌肉流失的老年人,与特定的菌群失调模式相关。
研究发现,高衰弱评分的老年人,其肠道中特定的共生菌群,如Coprococcus eutactus、Prevotella copri等耗尽,而一些潜在有害菌,如Clostridium hathewayi,脆弱拟杆菌Bacteroides fragilis等则占据优势。
以下肠道菌群数量增加与衰老相关,并被认为是高衰弱评分的特征,包括:
这些微生物的转变与代谢改变密切相关,包括短链脂肪酸和色氨酸减少,以及苏氨酸、疏水性次级胆汁酸(石胆酸和脱氧胆酸)、三甲胺氧化物(TMAO)、对甲酚、乙醇和氨的增加。同时,依赖于果糖和木寡糖的关键纤维发酵菌群趋于减少。
总之,这些发现支持了“生物群落老化”机制,即微生物多样性减少,其特征是机会性/促炎微生物的增加和共生/有益成员的减少,与加速衰老和增加的衰弱有关。
肠道-免疫轴:菌群如何影响全身衰老
肠道菌群并非孤立地影响健康,它通过“肠道-免疫轴”与我们的免疫系统进行着持续而复杂的对话,直接影响着全身的衰老进程。
衰老的一个核心特征是炎症性衰老(Inflammaging)——一种长期、低度的全身性炎症状态。而肠道菌群失调,是点燃和助推炎症的关键因素之一,从而加剧炎症性衰老。
短链脂肪酸
众所周知,肠道菌群产生的短链脂肪酸(SCFAs)是重要的信号分子,能调节免疫细胞的分化和功能。
饮食中纤维缺乏会导致SCFA合成减少,进而导致黏蛋白降解菌增多,肠道黏液层变薄,屏障功能受损,促炎细胞因子(IL-33和IL-25)增多,最终引发更强的炎症反应。
色氨酸
另一个例子是色氨酸,它是一种由微生物衍生的代谢物,也是一种必需氨基酸。它的代谢产物对于维持肠道稳态至关重要。
在临床前的老年小鼠模型中,缺乏色氨酸的饮食会诱发肠道菌群失调并促进炎症性衰老。
这些机制表明,一个“健康”或“年轻”的微生物组,能够通过抑制慢性炎症和维持肠道屏障,在抵抗细胞衰老和炎症性衰老中发挥关键的抗衰老作用。
我们已经知道,衰老的肠道菌群呈现出多样性降低和功能失调的特征。但一个关键问题是:这种菌群失调究竟是衰老过程的果,还是驱动衰老的因?
越来越多的证据表明,这很可能是一个双向的恶性循环,而多种与年龄相关的因素共同推动了这个循环的加速。
以炎症性衰老为核心,这种系统性的低度慢性炎症状态,通过与宿主免疫系统的紧密互动,导致肠道微生物组的失调。反之,失调的菌群又会加剧炎症。而多种外部和内部因素,则像催化剂一样,不断加剧这个循环。

外部:生活方式与医疗因素的冲击
多种药物的使用
老年人常因多种慢性病而服用多种药物。许多非抗生素药物,如质子泵抑制剂、二甲双胍、非甾体抗炎药等,都会严重影响肠道菌群的组成和多样性。
它们可能引起食欲变化、口干(导致唾液酶分泌减少)和特定营养素吸收不良,共同塑造了一个不利于有益菌生长的环境。
营养不良与饮食改变
随着年龄增长,味觉和嗅觉减退、牙口问题、食欲下降等因素,常导致老年人饮食结构单一,特别是膳食纤维摄入量锐减。
纤维是许多有益肠道细菌(尤其是产短链脂肪酸的细菌)的主要“食粮”。纤维摄入不足,直接导致这些有益菌“挨饿”甚至消失,从而削弱了肠道屏障功能和抗炎能力。
缺乏体育锻炼与社交孤立
这些因素也被证明与肠道菌群多样性降低和不良健康状况相关,它们通过影响激素水平、应激反应和整体代谢,间接塑造了肠道微生态。
内部:消化系统自身的生理性衰退
随着年龄增长,我们消化系统本身的衰老,也在悄然改变着肠道菌群的生存环境。
胃肠道动力减弱
随着年龄增长,肠道蠕动和结肠转运功能减慢,容易导致便秘、腹胀等问题。食物残渣在肠道内停留时间过长,会改变发酵模式,可能有利于腐败菌的生长。
此外,肠神经系统(ENS)中神经元的退化也加剧了这一问题。
消化液分泌减少
注:胆囊逐渐对介导饱腹感的肽类激素——胆囊收缩素变得不敏感,导致其在血浆中的水平升高。这种被抑制的胆囊收缩素功能会逐渐导致食欲/饥饿感下降和食物摄入量减少,并促进老年人的营养不良,所有这些都会逐渐减少对维生素合成、能量代谢和免疫功能至关重要的有益肠道微生物。
有趣的是,百岁老人能产生独特的具有抗菌特性的次级胆汁酸(例如,石胆酸的独特异构体),是一种正向适应,这可能是他们维持肠道稳态的秘诀之一。
而在普通老年人中,失调的次级胆汁酸(如脱氧胆酸及其甘氨酸或牛磺酸结合形式)则与阿尔茨海默病等衰老相关疾病有关。

什么是胆汁酸,其与肠道微生物互作如何影响人体健康18 赞同 · 0 评论 文章

肠道微生物群对胆汁酸代谢和信号传导影响的最新研究成果20 赞同 · 1 评论 文章
肠道自身的衰老
肠上皮细胞(IECs)的更新能力随着年龄增长而下降。肠道干细胞耗竭,导致组织再生和愈合能力减弱。
衰老的肠上皮细胞和杯状细胞(负责分泌黏液)功能下降,导致保护性的黏液层变薄,肠道通透性增加(即“肠漏”),使得细菌及其产物(如LPS)更容易进入血液,引发全身性炎症。
最终后果:“肠道-器官轴”通讯中断
肠道并非一个孤岛,它通过免疫、神经、内分泌和代谢等多种途径,与我们全身所有器官(包括大脑、心脏、肝脏等)构成了一个复杂的双向通信网络。
肠道菌群正是这个网络中的关键,它们合成和调节着无数的信号分子,如:
当肠道菌群失调时,这个通信网络便会中断或充满错误信号。有益减少,有害增多,这种混乱的沟通状态,最终会体现在全身性的功能障碍上,包括免疫失调、心血管问题和认知能力下降等。
总结来说,肠道菌群的健康与否,直接关系到整个身体的衰老轨迹。它既是衰老过程的反映,也是一个可以主动干预、用以延缓衰老和促进老年健康的潜在靶点。
既然我们已经认识到肠道菌群在衰老过程中的重要地位,那么我们能否通过主动干预肠道菌群,来延缓衰老、促进健康长寿?答案是肯定的。
靶向肠道微生态的治疗干预措施,从生态失调中恢复生态平衡(稳态),不仅有望改善肠道健康,而且有望通过减轻年龄相关疾病促进整体健康和健康衰老和长寿。
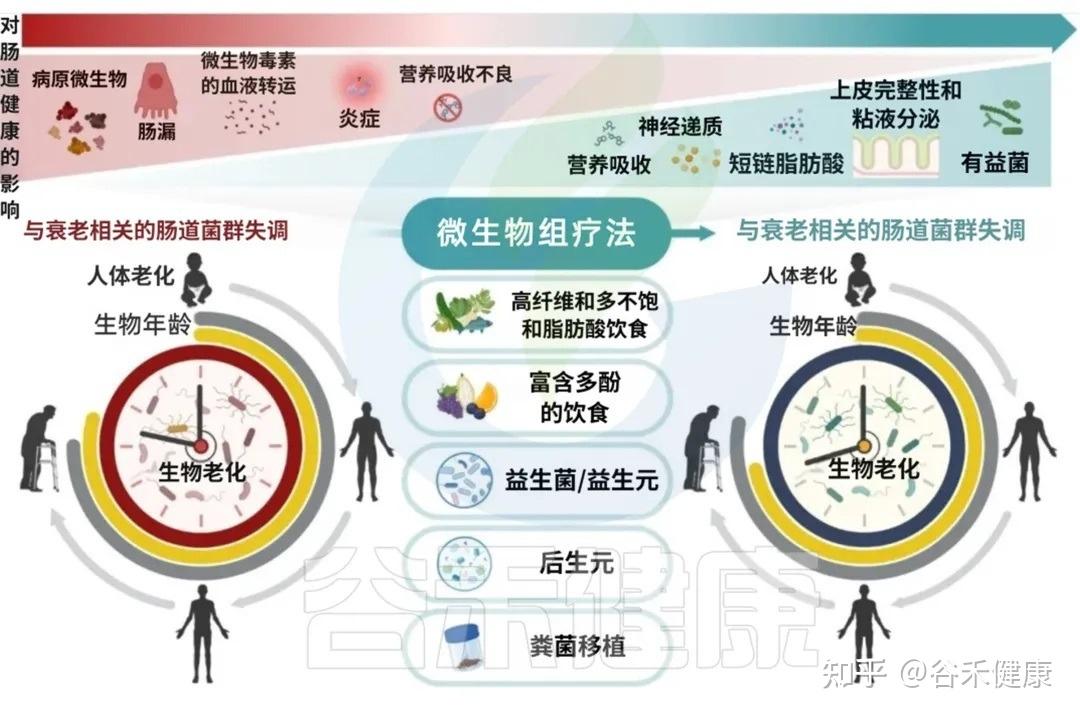
在所有影响肠道菌群的因素中,饮食是核心角色之一。尽管生理性的衰老不可避免,但大量短期、长期的饮食干预研究已证明,通过调整饮食,我们拥有巨大的潜力来延缓衰老的进程。
饮食如何塑造我们的衰老轨迹?
工业革命以来,人类的饮食结构发生了剧变,这种变化的速度远远超过了我们基因的适应速度。然而,我们的肠道微生物凭借其极短的代际时间迅速适应,从而演化出了由饮食、年龄、地理和健康状况共同塑造的高度个体化菌群。
下图清晰地展示了饮食对衰老轨迹的深远影响
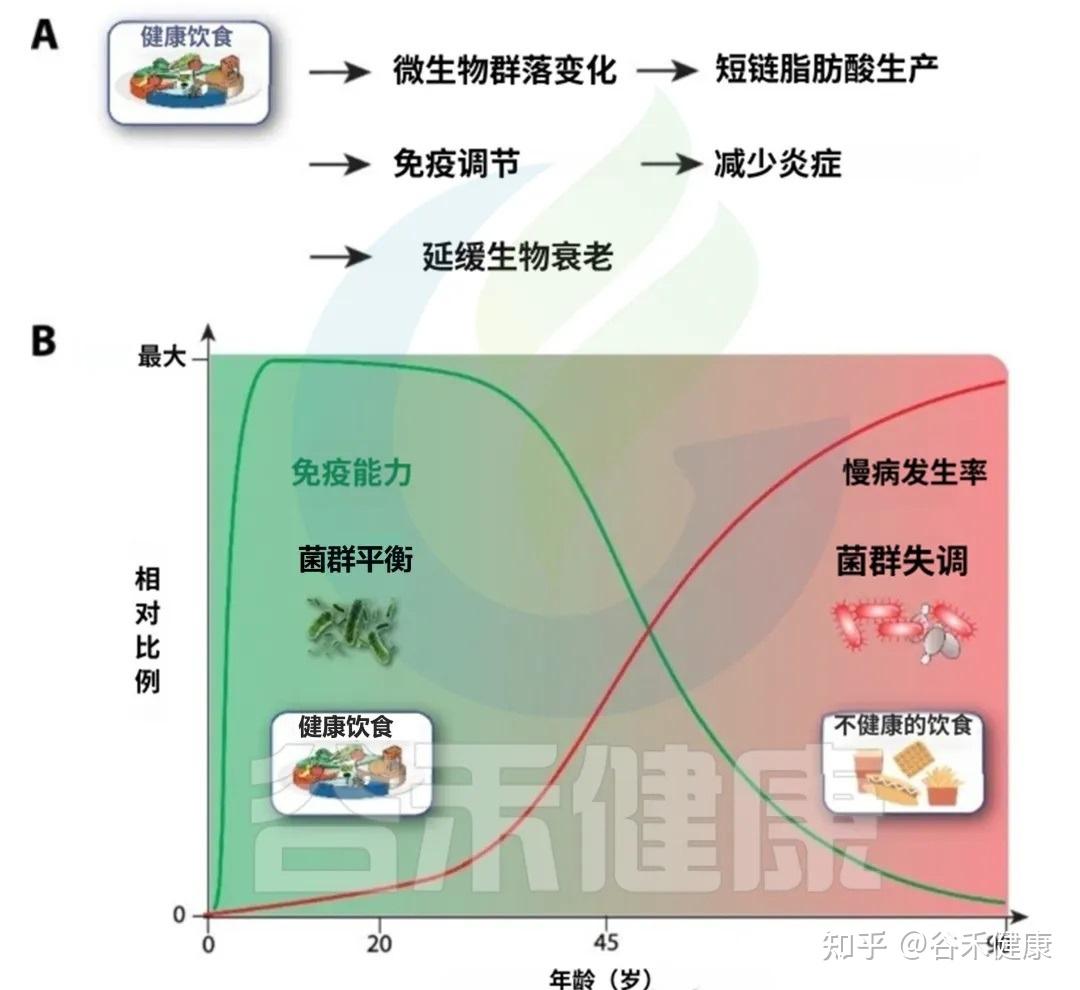
A健康的饮食促进有益的微生物群转变,增强短链脂肪酸的产生,调节免疫反应,并减少慢性低度炎症。这些效应共同导致生物衰老的延迟。
B免疫能力和非传染性疾病发病率与饮食质量的年龄相关轨迹示意图。早期坚持健康的饮食支持生态良好和强大的免疫功能(绿色曲线),而不健康的饮食与生态失调,炎症增加、随着时间的推移慢性病(NCD)负担增加有关(红色曲线)。
中年时期是一个关键的“十字路口”,此时的饮食选择将在很大程度上决定你未来,是走向健康的A路径,还是加速衰老的B路径。
地中海饮食:经过验证的减轻老年衰弱
一项长期、大规模的长期临床研究发现(注册号 NCT01754012),遵循地中海饮食模式与显著降低老年人的衰弱风险密切相关。
其背后的机制正是通过调节肠道菌群:这种饮食模式能有效增加有益菌的丰度,例如:
同时抑制与2型糖尿病、结直肠癌等疾病相关的潜在有害菌,例如:
改良地中海-生酮饮食(MkD):保护大脑功能
在针对轻度认知障碍老年人的研究中,改良的地中海-生酮饮食展现出显著的神经保护效果。其作用路径同样是通过肠道菌群:
高脂饮食:警惕坏脂肪,加剧炎症与菌群失调
近年来,老年人的饮食模式趋向于减少纤维、增加脂肪摄入。这会对衰老产生显著的负面影响。
促炎效应
高脂饮食会显著增加脂肪组织中的促炎因子(如TNF-α)和单核细胞趋化蛋白-1(MCP-1)的水平,并促使免疫细胞(巨噬细胞)向更具攻击性的M1型极化,加剧肝脏等器官的炎症。
破坏肠道菌群
高脂饮食会增加厚壁菌门的丰度(与炎症正相关),同时减少产丁酸菌,如瘤胃球菌科等。这会削弱肠道屏障的紧密连接,增加“肠漏”风险。
关键区别:并非所有脂肪都是有害的。
Omega-6多不饱和脂肪酸:通常具有促炎作用。
Omega-3多不饱和脂肪酸:如鱼油、亚麻籽油中的ALA,则具有明确的抗炎作用。
Omega-3能增加菌群多样性,促进双歧杆菌等有益菌的生长,减少肠杆菌,帮助改善肠道屏障功能,并增加有益的SCFA(富集产短链脂肪酸的毛螺菌科Lachnospiraceae)、减少有害的TMAO的产生。
控制总脂肪摄入并优化脂肪酸来源(尤其是增加Omega-3的比例),对于维护老年人的免疫健康和肠道稳态具有重要意义。
高蛋白饮食:复杂且需谨慎对待
高蛋白饮食对衰老的影响是复杂的,其效果因蛋白质的来源、数量以及个体的健康状况而异。
潜在益处:特定情境下的抗炎
在某些特定条件下,增加蛋白质摄入可能有助于抑制炎症。
例如,一项针对进行阻力训练的百名老年女性(60-90 岁)的研究发现,通过增加瘦红肉消费来提高蛋白质摄入的群体,其血浆中由运动引发的炎症标志物IL-6水平有所降低。这表明,在高蛋白饮食与规律运动相结合时,可能对控制炎症有积极作用。
潜在风险:促炎、免疫失衡、肠道菌群紊乱
——引发促炎反应与免疫失衡
多项研究将高蛋白饮食与促炎因子的升高联系起来。
在老年小鼠中,摄入全蛋白的高蛋白饮食会提高血浆中LPS、IL-6和IL-10的水平,而摄入水解蛋白则会额外增加TNF-α。表明高蛋白饮食,特别是当蛋白质未水解时,可能会在老年小鼠中引发更强烈的促炎反应。
此外,高蛋白、低碳水化合物的组合在老年大鼠中甚至表现出免疫抑制作用。
更为复杂的是,在一项结合了运动干预的研究中,富含Omega-3的高蛋白饮食反而导致了老年人体內具有抗炎作用的IL-10和IL-1Ra水平下降,这可能暗示着免疫调节机制的潜在紊乱。
——破坏肠道微生态与屏障功能
在老年女性中,高蛋白饮食与产丁酸菌的减少相关,而丁酸盐是维持肠道屏障功能和抑制炎症的关键短链脂肪酸,其减少可能导致肠道屏障受损。
动物实验也证实,摄入全蛋白的高蛋白饮食会破坏小鼠小肠的组织结构,减少保护性的杯状细胞数量,并导致链球菌(Streptococcus)等潜在有害菌增多,同时减少有益的双歧杆菌。
——产生有害代谢物
当蛋白质摄入过高(>1.6 g/kg体重/天)时,可能会导致肠道菌群发酵未被消化的蛋白质,产生有害代谢物。
例如,在老年男性中观察到,这种饮食模式与心血管疾病风险标志物——三甲胺氧化物(TMAO)的水平升高有关。虽然在大鼠中也观察到粪便乙酸盐水平的增加,但这同样可能源于蛋白质的异常发酵。
关键调节因素:蛋白质的“质”与“量”
蛋白质的类型(质)是决定其效果的关键。在上述破坏肠道结构的小鼠研究中,水解蛋白相较于全蛋白,显示出了截然不同的保护作用:它改善了小肠结构,增加了杯状细胞和有益的双歧杆菌,并减少了致病菌。这提示我们,蛋白质的消化吸收效率可能直接影响其对肠道健康的作用。
►▷
虽然高蛋白饮食近年来越发流行,但现有数据提示我们需谨慎对待,尤其是在老年群体中。当前的饮食指南建议将蛋白质摄入量限制在1.0-1.2 g/kg体重/天,并保证充足的碳水化合物摄入,这或许是避免潜在风险、维持免疫和肠道稳态的更为稳妥的策略。未来的研究需进一步阐明这些复杂的相互作用,以制定更精准的老年营养建议。
高纤维饮食:抗衰老,滋养有益菌,抑制炎症
高纤维饮食对免疫系统和肠道菌群的有益影响是明确且显著的。然而,大多数老年人的纤维摄入量远低于推荐标准(女性 21 g/天;男性 30 g/天)。
抗炎作用
膳食纤维(特别是可溶性纤维,如菊粉)是肠道益生菌的“首选食物”。它们通过发酵纤维产生大量丁酸盐等短链脂肪酸,这些物质能有效抑制全身和大脑中的炎症反应。
减轻神经炎症
高纤维饮食带来的丁酸盐水平增加,已被证明能有效减少中枢神经系统中“小胶质细胞”的促炎细胞因子表达,从而改善与衰老相关的神经炎症。
在人类研究中,食用富含纤维的谷物与多种炎症标志物水平降低相关,特别是C反应蛋白(CRP)和IL-1Ra。然而,有趣的是,来自水果和蔬菜的纤维并未显示出同样的效果。这提示我们,纤维的来源(如可溶性 vs. 不溶性)、是否存在其他生物活性化合物、以及加工方式都可能影响其最终的生物学效应,亟需进一步研究。
改善肠道菌群
高纤维饮食对肠道菌群的组成有着显著的积极影响,能够促进有益菌群的生长。
一项针对中国老年群体的研究显示,高纤维饮食者的肠道中瘤胃球菌科的丰度更高,而拟杆菌目和毛螺菌科的丰度较低。该变化可能与地理或膳食差异有关,并非绝对不良。
另一项针对55-80岁人群的研究,增加菊粉摄入量与更高的微生物多样性相关,显著提升了以下菌群的丰度:双歧杆菌、Alistipes shahii、Anaerostipes hadrus、Parabacteroides distasonis。
影响的复杂性:纤维类型、宿主年龄与性别的交互作用
尽管高纤维饮食益处明确,但其具体效果并非一成不变,而是受到多种因素的复杂调节。
效果的非普遍性
一项老龄小鼠研究发现,虽然含2.5%菊粉的饮食通过增加双歧杆菌和粪杆菌属(Faecalibacterium),并增强丁酸盐产量来改变了肠道微生物组,但它并未减少不同年龄组间的菌群总体差异,也未能改善全身性炎症或肠道生理指标。这表明纤维的干预效果是特定的,而非全局性的。
年龄特异性
在另一项小鼠研究中,菊粉能够有效降低厚壁菌门与拟杆菌门的比例,但其对特定菌属的影响具有年龄特异性——在老年小鼠中,菊粉显著增加了双歧杆菌和拟杆菌属 的数量。
性别依赖性
近期一项利用人源化小鼠模型的研究,更清晰地揭示了菊粉作用的性别差异。
对两性的共同影响:
对雌性小鼠的更强影响:
对雄性小鼠的特定影响:
高纤维饮食是维持老年健康的关键策略,它能有效抑制炎症并优化肠道菌群。然而,其效果并非“一刀切”。纤维的来源、类型(如菊粉)、宿主的年龄乃至性别,都会影响其最终的生物学功能。在制定未来营养策略时,需考虑个体化因素,以便实现更精准、高效的健康干预。
这提示我们,餐桌或许是最日常却最深远的抗衰老实验场。
色氨酸
讲究最佳剂量
色氨酸,一种必需氨基酸,在人体的应激反应、心理健康及炎症调节中扮演着核心角色。
色氨酸有几种饮食来源,包括:燕麦,香蕉,干梅子,牛奶,金枪鱼,奶酪,面包,鸡肉,花生等。
在衰老背景下,色氨酸对免疫系统和肠道微生物组的影响尤为复杂,呈现出显著的“剂量依赖性”,即适量摄入是关键。
核心机制:犬尿氨酸途径与免疫衰老
色氨酸的免疫调节功能主要通过犬尿氨酸途径实现。在衰老过程中,体内的慢性炎症会激活此通路中的关键酶(IDO),导致一系列的连锁反应,最终可能加速免疫系统的衰老。
具体而言,在该途径中,超过95%的游离色氨酸被关键的限速酶——吲哚胺-2,3-双加氧酶(IDO)所降解,产生犬尿氨酸及其下游代谢物。这些代谢物不仅参与调节免疫功能,还是合成烟酰胺腺嘌呤二核苷酸(NAD+)的前体。
衰老过程本身伴随着慢性低度炎症,这会提高IDO酶的活性。IDO活性增强导致犬尿氨酸/色氨酸比率升高,进而激活芳烃受体(AhR)信号通路。该通路通过上调Foxp3,增加Treg的活化,最终促进胸腺退化和细胞衰老,这一过程被称为免疫衰老。
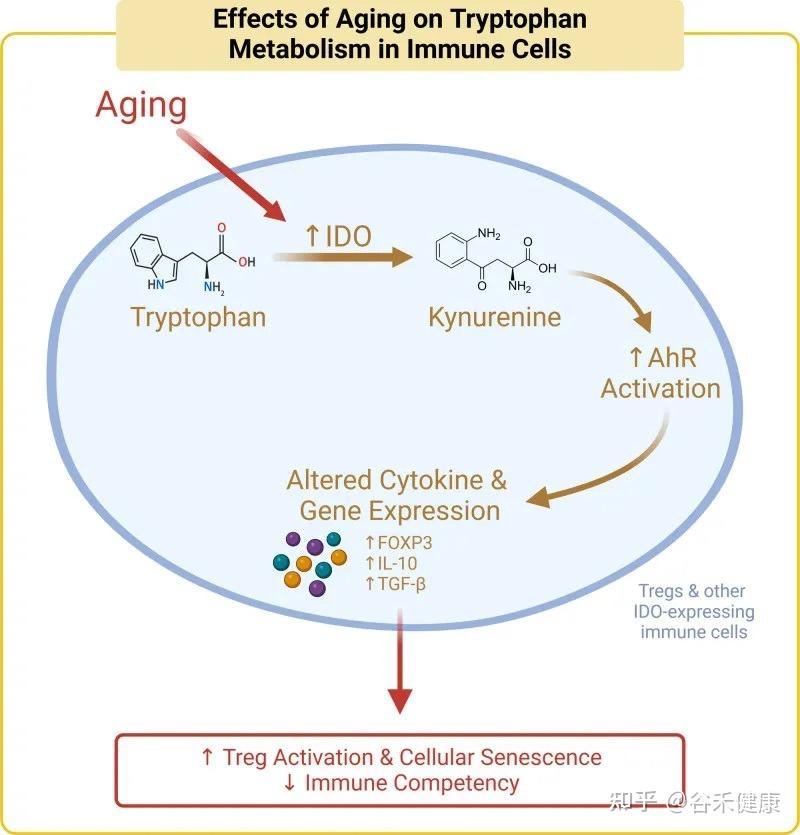
剂量决定效果:色氨酸摄入量的三重效应
关于色氨酸的摄入,研究揭示了一个非常关键的原则:并非越多越好,而是存在一个最佳窗口。
➦ 摄入过少(缺乏):加剧炎症与菌群失调
衰老本身就与小鼠体内色氨酸及其关键代谢物——吲哚的水平下降有关。在此基础上,色氨酸缺乏会进一步恶化健康状况。
一项针对老年小鼠的研究显示,与正常补充(0.2%)相比,缺乏色氨酸的饮食会导致促炎细胞因子IL-6、IL-17A和IL-1α显著增加,同时抗炎因子IL-27水平降低。
肠道微生物组也发生剧烈变化,包括下列菌群丰度均发生改变:
➦ 摄入适中,带来显著益处(最佳窗口)
一项老年小鼠研究中,摄入中等水平的色氨酸(占饮食的0.4%)显示出多重益处。这种饮食模式显著降低了潜在有害菌群的相对丰度,如丹毒丝菌属 (Erysipelatoclostridium)、肠球菌属(Enterococcus) 、Dubosiella菌属。
与此同时,它促进了有益菌的生长:
➦ 摄入过量,产生毒性,弊大于利
“越多越好”的原则在这里并不适用。摄入更高水平的色氨酸(占饮食的0.8%)则会加剧肠道黏膜屏障的损伤、氧化应激、炎症反应、严重的肠道菌群失调。
►▷
综上所述,色氨酸在衰老中的作用极为精准,呈现“剂量依赖性”。它不仅通过犬尿氨酸途径调控免疫,其摄入量还深刻影响肠道菌群与全身炎症。研究表明,存在一个有益的“最佳窗口”(如0.4%的补充),而缺乏或过量摄入均可能损害老年机体。这凸显了对色氨酸等营养素采取精准营养策略的必要性,未来的研究也应扩展至蛋氨酸、支链氨基酸等,以构建更全面的老年营养支持体系。

色氨酸代谢与肠内外健康稳态37 赞同 · 2 评论 文章
Omega-3 脂肪酸:强大的抗炎剂
Omega-3脂肪酸作为一类重要的多不饱和脂肪酸(PUFA),主要来源于鱼类、海鲜、坚果、种子和某些植物油。然而老年人群的Omega-3摄入量却常常低于最佳水平。大量研究证实,Omega-3脂肪酸具有强大的抗炎潜力,是维持衰老过程中免疫稳态的关键。
调节炎症介质产生
Omega-3脂肪酸(包括其前体α-亚麻酸ALA,以及EPA和DHA)能够显著减少促炎性类二十烷酸(如前列腺素E2、白三烯B4和LTC4)的合成。
在一项针对老年大鼠的研究中,补充Omega-3同时降低了IL-1β、MCP-1和TNF-α等多种细胞因子的浓度。
平衡脂肪酸比例
炎症状态不仅取决于Omega-3的绝对量,也取决于其与Omega-6脂肪酸的比例。体内Omega-6与Omega-3的比例过高,会直接导致TNF-α和IL-6等促炎细胞因子水平升高。
影响细胞功能与信号通路
Omega-3能直接影响免疫细胞的功能,包括调节白细胞活性和T细胞的发育。
在老年人的骨骼肌中,富含Omega-3的饮食被证明可以减少促炎细胞因子IL-1β的表达,并抑制mTOR(哺乳动物雷帕霉素靶蛋白)信号通路,从而减轻局部炎症和调节细胞代谢。
通过肠道微生物组介导
在人类中,Omega-3摄入被证实能通过改善肠道微生物组来抵消由肥胖引起的炎症和代谢紊乱。这种菌群改变有助于减少促炎性的循环脂多糖(LPS)水平,并抑制下游的NF-κB炎症信号通路。
协同效应:与生活方式干预结合效果更佳
Omega-3的抗炎效果可以与其他健康干预措施产生协同效应。
研究表明,在肥胖的绝经后女性中,虽然单独补充Omega-3或进行减肥都能降低体内的促炎因子水平,但当Omega-3补充剂与超过10%的体重减轻相结合时,其抗炎效果最为显著。
►▷
提高老年人Omega-3的摄入量,并将其与健康的生活方式(如体重管理)相结合,是抑制慢性低度炎症、维持免疫稳态的有效策略。

探索Omega-3脂肪酸:健康益处与营养补充12 赞同 · 0 评论 文章
膳食多酚:与菌群合作
膳食多酚:与菌群合作
多酚广泛存在于植物性食物中,如蓝莓、葡萄、可可、绿茶、苹果等。它们以强大的抗氧化和抗炎能力而闻名。在预防多种慢性疾病中显示出巨大潜力。
然而,其真正的抗衰老潜力并非通过直接吸收,而是通过与肠道菌群的复杂互动来“解锁”的。
核心机制:肠道菌群是多酚发挥作用的关键中介
由于其化学结构复杂且常常被糖基化,它们在小肠中的直接吸收率非常有限。但这恰恰成为了它们发挥更深远作用的起点。
大量未被吸收的多酚会到达大肠,成为肠道菌群的理想底物,并在此引发双重有益效应。
——直接作为养料,促进有益菌的生长
例如,研究证实,富含花青素和原花青素B2的饮食能够在衰老啮齿动物模型中,显著增加对肠道健康至关重要的产丁酸菌的丰度。
——代谢活化与菌群重塑
肠道菌群在享用多酚的同时,会将其分解代谢为一系列生物活性更强、更易被人体吸收的小分子代谢物。这个过程不仅激活了多酚的抗炎和抗氧化潜力,同时代谢过程本身及其产物还能温和地抑制有害菌,从而优化整个肠道菌群的结构。
多酚与益生菌的协同抗衰老效应
多项研究为肠道介导这一机制提供了有力证据,并揭示了多酚与益生菌之间的协同作用。
——减轻炎症性衰老
一项针对50岁及以上成年人的研究发现,在富含多酚的饮食基础上额外补充特定的益生菌,能够有效减轻慢性低度炎症,同时受试者肠道中的有益菌和短链脂肪酸水平也得到显著提升。
——传统补品的现代诠释
富含抗氧化物的传统草药——红参,其抗衰老效果同样与肠道菌群密切相关。它不仅能直接对抗氧化应激,还能促进有益菌的生长,并通过菌群代谢活动来强化肠道屏障功能。
更值得注意的是,当红参经过特定益生菌发酵后,其抗衰老特性得到显著增强。这归因于抗氧化相关基因的上调和对肠道菌群更有效的积极调节。
我们吃的食物不仅仅是在填饱肚子,更是在喂养体内的亿万微生物。通过多吃富含多酚的彩色果蔬和选择红参等天然补品,我们就能和肠道菌群打好配合,让它们帮我们把食物中的营养变成抗衰老的利器,实现从肠道到全身的健康。

肠道微生物群与膳食多酚互作对人体健康的影响30 赞同 · 3 评论 文章

多酚等膳食成分与肠道菌群协同作用可以更好地改善骨质疏松症3 赞同 · 1 评论 文章
益生菌干预的核心是直接向肠道输送特定的有益微生物,以实现靶向健康效益。
——改善大脑健康与情绪(调节肠-脑轴)
临床研究也证实,通过益生菌干预提高肠道中普拉梭菌(Faecalibacterium prausnitzii) 的水平,与焦虑、抑郁等神经精神症状的改善密切相关。
——强化肠道屏障,抑制全身性炎症
下一代益生菌:巨大潜力
研究的焦点正从传统的乳杆菌属和双歧杆菌属,扩展到一些新发现的、潜力巨大的肠道共生菌,它们被称为“下一代益生菌”。
其他潜力菌株也备受关注:

AKK菌——下一代有益菌21 赞同 · 0 评论 文章
通过精准干预肠道,我们可以恢复其稳态,进而增强免疫、改善代谢,并有效对抗衰老。益生元和合生元构成了这一策略的核心工具箱,它们在衰老的肠道环境中展现出显著的积极作用。
益生元:喂养有益菌
益生元是为有益肠道菌群提供营养的“食物”(如膳食纤维、低聚半乳糖GOS),为整个生态系统的健康奠定基础。
低聚半乳糖 (GOS) 是其中的典型代表,它来源于豆类、乳制品等。研究证实,补充GOS能够:
研究发现,补充GOS可以通过增强食糖细菌及其相关酶(β-半乳糖苷酶)的丰度,来改善肠道上皮完整性和粘液产生,从而调节衰老肠道的稳态。
合生元:益生菌与益生元的“强强联合”
一项临床研究报告称,老年女性在摄入名为MPRO3的合生元产品(由多种益生菌和膳食纤维组成)后,其血液代谢物谱、肠道菌群和整体肠道健康均得到积极调节。
后生元:更安全、更精准的有益物质
后生元是一个新兴且极具潜力的领域。它指的是“源自微生物的有益物质”,包括无活性的菌体、菌体碎片(如细胞壁)或细菌的代谢产物。
后生元的优势在于更稳定、更安全,因为它不涉及活菌的定植问题,而是直接提供发挥功效的“最终产物”。
——菌体成分
热灭活的益生菌(如副干酪乳杆菌)的细胞壁成分脂磷壁酸 (LTA),被证实能直接抑制炎症信号(NF-κB),同时促进黏液分泌,修复肠漏。
——代谢产物
这是指由微生物产生或将膳食成分转化而来的、具有健康效益的小分子物质。
在衰老模型中,它能通过下调 HMGB1-TLR4-NF-κB 炎症通路、减轻氧化应激并积极调节肠道菌群,来全面改善肠道功能。
——无活性的菌体
即便是完整但无活性的微生物,也能通过其细胞结构与人体免疫系统等发生互作,产生健康效益,这种方式被称为“幽灵效应”。
经过间歇灭菌(也称为廷德尔灭菌法)(一种温和加热灭活法)处理的长双歧杆菌(B.longum) 和嗜酸乳杆菌 (L. acidophilus) 菌株,在与运动干预相结合时,展现出改善阿尔茨海默病(AD)病理的潜力。其机制包括:
最终效果:减少大脑中淀粉样蛋白-β的聚集。
►▷
微生物的健康效应,并非完全依赖于其活性。
后生元绕开了活菌在储存、运输和定植中的不确定性,为开发更安全、更稳定、靶点更明确的新型疗法或辅助保健品铺平了道路。未来,后生元也将成为防治衰老疾病的重要途径。
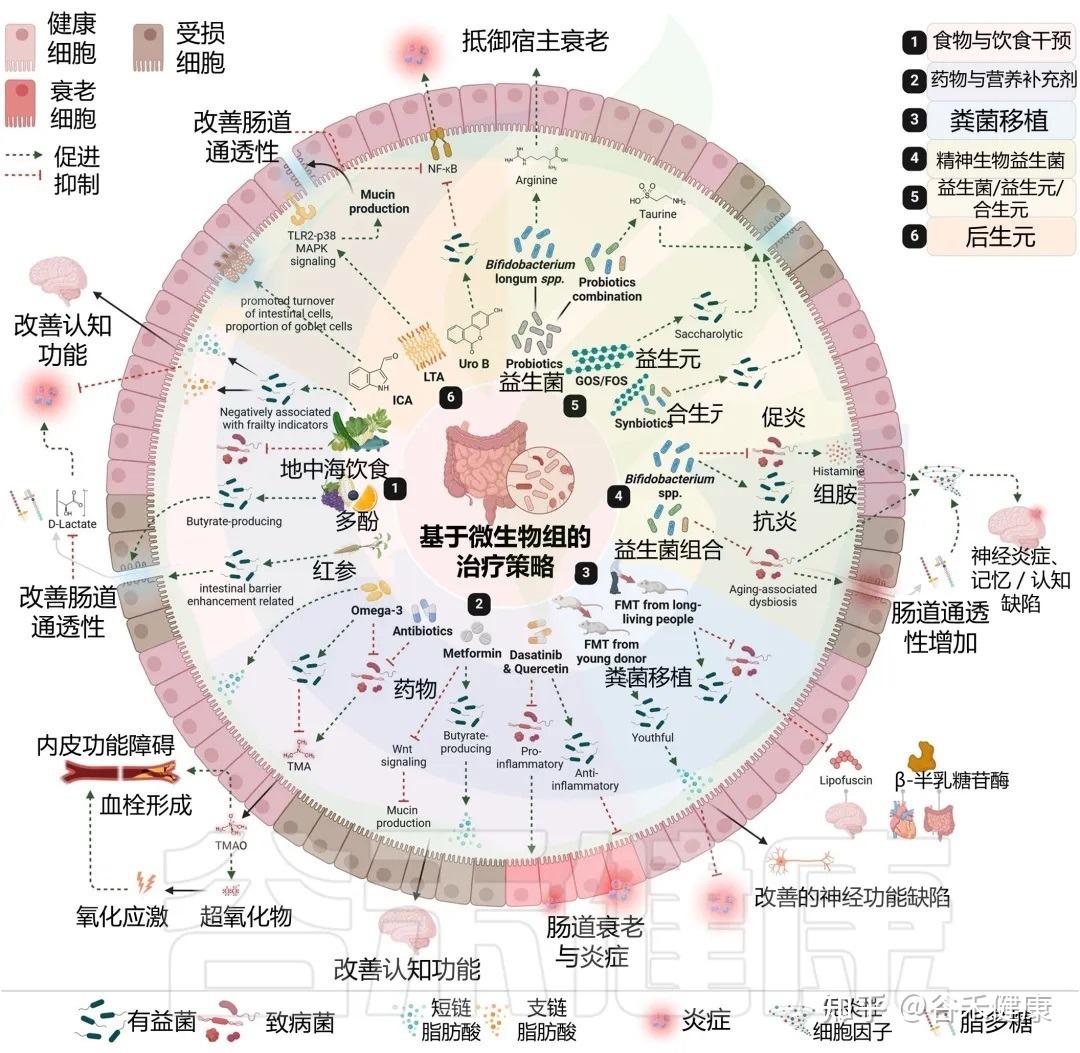
许多我们熟知的药物和膳食补充剂,其作用并非仅仅是简单的化学分子与人体细胞的直接互动。它们的抗衰老等多效性作用,在很大程度上是通过与肠道菌群的复杂“对话”和“合作”来实现的。
药物干预:从直接靶点到微生物介导
案例一:二甲双胍—— 经典的生物转化
作为一线降糖药,二甲双胍的益处远超血糖控制。最近的研究证明,肠道微生物组对其进行了关键的生物转化。
在老年小鼠中,二甲双胍治疗通过抑制Wnt信号通路,增强了肠道粘蛋白的产生,这一由菌群介导的过程最终对神经认知功能产生了积极影响。这表明,没有微生物组的参与,二甲双胍的某些重要功效可能无法完全发挥。
案例二:衰老细胞清除药物—— 协同调节
特定的“衰老细胞清除”药物(如达沙替尼和槲皮素),其作用也不再是单一的。研究表明,它们在清除体内衰老细胞的同时,还能主动调节肠道菌群——即促进抗炎微生物的生长,并抑制促炎微生物。
这一发现强烈暗示,这些前沿抗衰老药物的整体效果,至少部分是通过与肠道菌群的协同作用介导的,共同减少了肠道乃至全身的衰老和炎症。
膳食补充剂:菌群是关键中介
案例一:α-亚麻酸 (ALA) —— 清晰的微生物依赖途径
植物来源的ALA(一种Omega-3脂肪酸)的抗血栓效应,就是一个完美的例证。其作用并非直接,而是遵循一个清晰的微生物依赖路径:
案例二:NAD+抗衰老:肠道菌群的关键一环
补充烟酰胺单核苷酸(NMN)或烟酸(维生素B3)是目前流行的抗衰老策略,其核心机制是提升细胞内的NAD+水平。
研究发现,NMN也能通过调节肠道菌群来维持肠道稳态。鉴于肠道菌群拥有独特的酶来参与NAD+代谢,有理由推测,这类补充剂的抗衰老效果可能直接或间接地与肠道菌群的变化有关。

关于长寿因子(NAD+)你了解多少?——健康益处及如何提高补充效果6 赞同 · 1 评论 文章
粪便微生物群移植(FMT)不再是补充单一菌株或代谢物,而是通过移植一个完整的、健康的微生物生态系统,来彻底重置和改造宿主的肠道环境。
这一新兴策略正从治疗特定肠道疾病(如复发性艰难梭菌感染、IBS、克罗恩病等)的成功案例中,迈向一个更宏大的目标:促进健康衰老与延长寿命。
核心证据:从肠道到大脑的系统性年轻化
大量的临床前和临床研究表明,FMT的益处远不止于肠道本身,它能沿着“肠-脑轴”向上影响,实现系统性的抗衰老效果。
未来展望:建立“长寿菌群”生物样本库
FMT的潜力上限,取决于捐赠者菌群的质量。
关键发现:研究已证实,将长寿老年捐赠者(如百岁老人)的粪菌移植到小鼠体内,可以通过引入有益的细菌及其代谢物,有效改善受体的各项衰老相关指标。
基于这些证据,系统性地探索使用健康、长寿的捐赠者来建立一个特征明确的FMT生物样本库,可能为减轻与衰老相关的健康损害,提供一条有效的治疗途径。

粪菌移植——一种治疗人体疾病的新型疗法7 赞同 · 2 评论 文章
力量训练
中到高强度的抗阻训练,建议每周2-3次。训练强度通常设定在个人最大重复次数(1-RM)的60-85%之间,每个动作进行1-3组,每组重复8-12次。
例如,使用壶铃(一种具有特殊形状握把的重量,配有专门的训练方案)进行 8 周训练,可以改善与肌肉减少症和低度炎症相关的指标。
这种训练能够有效调节体内的微小核糖核酸(miRNAs)。它能抑制促进肌肉萎缩的miRNA,同时激活促进肌肉合成与生长的miRNA,从而打破肌肉流失的恶性循环,实现肌肉质量和力量的维持与增长,有效延缓衰老过程中的身体功能衰退。
高强度间歇训练 (HIIT) vs. 中等强度持续训练(MICT)
研究发现:两者对老年人的肠道菌群和肌肉功能有不同的调节效果。微生物组分析显示,HIIT组α多样性增加,并富集了产短链脂肪酸菌(如 Faecalibacterium prausnitzii),MICT组与多样性稳定和双歧杆菌适度增加相关。
HIIT在提升心肺功能和认知控制能力方面更优;而MICT则对改善情绪(心理健康)和帮助坚持运动更有利。
注:HIIT-涉及短时间高强度运动和短暂休息或低强度运动交替进行。MICT-中等强度持续一段时间的运动(如慢跑、骑行)。
瑜伽
一个为期12周的瑜伽项目,结合了体式、呼吸技巧和冥想,证实了其对阿尔茨海默病患者和其照护者的双重益处。
瑜伽是一种实用、经济的辅助方法,其成功也暗示了其他身心活动在延缓衰老相关疾病方面的潜力。
太极、有氧运动、八段锦
对于膝骨关节炎患者,这几种运动在减轻疼痛和改善身体功能方面的效果相当。
研究发现,太极能在12周内显著改善患者的疼痛管理(依据WOMAC量表评估)、姿势稳定性及功能性活动能力。
►▷
总的来说,老年人保持规律的活动总量(不一定要某种特定类型的运动或强度),能有效改善血管健康。 核心在于“动起来”,任何形式的规律运动都有益于心血管健康,不必过分纠结于某一种特定的运动方式。
要真正运用好肠道菌群来调节或延缓衰者,我们需要更强大、更智能的工具来指引方向。
从海量数据到精准洞察:AI与多组学的力量
我们的身体是一个极其复杂的系统。基因(基因组学)、代谢产物(代谢组学)、肠道菌群(微生物组学)……这些“多组学”数据共同交织,决定了我们的健康轨迹。在过去,我们很难看清这背后的规律。
而现在通过大数据可以整合分析这些不同维度的数据,帮助我们回答那个最核心的问题:在衰老过程中,究竟是哪些菌群、哪些营养分子,起到关键作用。
精准干预的前提:找到一把好的“衰老标尺”
要想知道我们的干预措施是否有效,首先需要一把能够精确测量“生物学年龄”的标尺。这个“标尺”就是衰老生物标志物。
根据国际性的衰老生物标志物联盟提出的全面框架,一把理想的“衰老标尺”必须满足六个关键维度:
可行性、有效性、懂机制、
适用广、反应灵敏、成本可控
换言之,一把好的“衰老标尺”,必须用得起、测得准、看得懂机制、适用广…幸运的是,最新的技术进展,特别是肠道菌群和免疫衰老的生物标志物,正为我们提供了构建这把“标尺”的强大工具。
精准营养时代:告别“一刀切”的健康建议
“精准营养”的最终目标,是根据每个人的独特性,提供量身定制的健康方案。
这意味着,通过对你个人的基因、代谢和肠道菌群进行综合检测,我们能知道,为什么对你有效的维生素D₃,对他来说可能Omega-3脂肪酸更重要。
一句话总结:我们已经推开了“通过调节菌群来抗衰老”这扇大门,但门后的世界依然充满未知。未来的研究方向很明确:通过更大规模的全球合作和更长时间的跟踪研究,全面揭示不同肠道菌群模式与健康衰老之间的内在联系,从而找到最精准、最个性化的方法,让每个人都能通过管理好自己的肠道菌群,实现更长久、更健康的生命。
抗衰老不应被视为与自然规律的对抗
而是一种与生命节奏的和谐共舞。
人间万事,生命最为宝贵;
生命长短,质量至关重要。
掌握科学的抗衰老智慧,
倾听肠道菌群等身体信号,
活出自己生命的最佳状态。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
谷禾健康
乳球菌属(Lactococcus)是一种革兰氏阳性、兼性厌氧、通常不产孢的乳酸菌,形态以球状或成对/短链出现,最早从乳制品与植物表面分离,现被广泛认为是乳制品发酵中的核心功能菌群之一。
其代表物种包括乳酸乳球菌(Lactococcus lactis)及干酪亚种 L.lactis subsp. cremoris 等,在食品工业与人类健康领域均具有重要价值。
乳球菌的代谢能力奠定了其功能基础与应用,其核心特征包括:
糖代谢与产酸能力:可快速降解乳糖、葡萄糖等糖类生成乳酸,降低pH,抑制腐败菌并塑造风味。
蛋白质与肽代谢:具外源蛋白酶与肽转运系统,能将酪蛋白等大分子蛋白分解为功能性肽,提升氨基酸供给,贡献鲜味与生理活性肽(如抗氧化、抗菌与免疫调节肽)。
胆固醇与脂代谢关联:部分菌株通过胆盐水解、吸附/同化胆固醇及调节短链脂肪酸产生,间接影响血脂与肝脂沉积,对代谢综合征相关表型(如葡萄糖耐受不良、胆固醇升高与脂肪堆积)具有干预潜力。
胞外多糖合成:合成与分泌多糖提高食品黏度与持水性,改善产品的口感与质构,同时作为可发酵底物参与肠道微生态与屏障功能调控。
在人体健康方面,乳球菌也可通过多重途径发挥作用:
一是在肠道与微生物群互作,提升黏液层与紧密连接蛋白,强化屏障;诱导抗菌肽与防御素分泌,抑制致病菌定植与增殖。
二是免疫调节,激活树突状细胞并促进 Treg 分化,上调抗炎因子(如 IL‑10、TGF‑β),抑制过度炎症。
三是在代谢健康和营养中的作用,通过糖发酵产生乳酸和短链脂肪酸,改善肠道代谢环境与能量底物利用。部分菌株还具胆盐水解/胆固醇同化能力,对胰岛素敏感性、脂肪堆积等代谢表型有改善趋势。
并有研究发现乳球菌属在多种代谢相关疾病患者体内(如肥胖、脂肪肝)以及炎症性肠病和肠道炎症患者中的丰度呈下降趋势。
综上所述,乳球菌属(Lactococcus)以其代谢能力和对人体健康的益处成为了贯通“食品发酵—肠道微生态—宿主免疫与代谢健康”的关键微生物。
1
细胞形态
乳球菌属(Lactococcus)为革兰氏阳性菌,细胞呈球形或卵圆形,大小约为0.5~1.2 μm × 0.5~1.5 μm,在显微镜下可观察到其典型形态。
在液体培养基中多呈单个、成对或短链排列;形成链状时,细胞常沿链方向伸长。
乳酸乳球菌亚种的扫描电子显微镜照片
doi.org/10.1002/9781118960608.gbm00610
乳球菌属无荚膜、亦不形成芽孢;同时缺乏鞭毛结构,因此不具备运动性。
2
研究历史
乳球菌属的研究历史甚至可以追溯到几百年前。
1780年:从酸牛奶中分离乳酸;
1857年:确认乳酸发酵的微生物本质;
1873年:获得首个纯培养并命名为Bacterium lactis;
1890年代:分离工业用菌株;
1909年:更名为Streptococcus lactis;
1933年:Lancefield血清学分类(N群);
1972年:发现质粒;
1985年:建立Lactococcus新属;
1990年代:浓缩深冻发酵剂技术逐渐成熟。
3
生长环境
温度范围:乳球菌是嗜温菌,适宜生长温度为10-40°C,部分菌株可在7°C下缓慢生长,大部分菌株无法在45°C下生长,但少数菌株可以耐受更高温度。
氧气需求:该属细菌具有兼性厌氧的特性,在有氧和无氧环境下都能生长,不过其代谢途径会因氧含量不同而有所差异。
盐耐受性:多数菌株可在4% NaCl中生长,但L.lactis subsp. cremoris仅耐受2% NaCl。
pH适应性:最适中性pH,生长下限约pH4.5。
主要栖息地:
⑴植物表面:这是许多乳球菌的天然栖息地与起源;
⑵农场动物:家畜乳腺、挤奶与牧场体系,参与乳源微生态交换;
⑶人与动物胃肠道:多为低丰度成员,短暂定植;摄入发酵食品/益生菌后检出率升高;
⑷鱼类与水产环境:部分物种可栖居于鱼类等水产环境,有时用于疾病研究背景;
⑸昆虫肠道:甚至有时可从白蚁、甲虫等分离,显示古老的生态关联。
4
代谢能力
乳球菌(Lactococcus)是一类重要的乳酸菌,具有多种代谢能力,在食品发酵和工业生产中发挥着关键作用。以下是乳球菌属细菌的主要代谢能力总结:
1.糖类代谢
最显著的特征是其高效的乳糖代谢能力。其发酵类型多为同型乳酸发酵,产酸能力较强,发酵效率可达80%-90%。
其可发酵乳糖生成L(+)-乳酸(同型发酵),据报道,在低pH值下生长时可以产生D-(-)-乳酸。
除乳糖外,Lactococcus还能代谢多种糖类,包括:
葡萄糖:通过糖酵解途径直接代谢;
半乳糖:通过Leloir途径代谢;
麦芽糖:部分菌株具有代谢能力;
注:为了最佳生长,乳球菌有时会需要生物素、吡哆醛、叶酸、核黄素、烟酰胺、硫胺素和泛酸。烟酸、泛酸和生物素是必需的。
乳酸乳球菌发酵的基础知识
Gaudu P,et al.Microbiol Spectr.2019
NADH/NAD+ 比率被列为乳酸乳球菌碳代谢选择的核心决定因素。(1)糖发酵产生ATP,用于氨基酸合成代谢。在厌氧条件和快速糖通量下,基本上所有糖都从丙酮酸(糖酵解)转化为乳酸(均乳酸发酵)。当糖通量较慢时,在存在葡萄糖或乳糖以外的糖或有氧生长时,可能会发生混合酸发酵。后一种条件的特点是 NADH/NAD+ 比率低于同乳酸发酵期间发现的比率。除了 NADH 之外,糖酵解还通过糖降解产生 ATP 和丙酮酸。
(2)丙酮酸脱氢酶 (Pdh) 在存在氧气时从丙酮酸中提供额外的 NADH。
(3)乳酸脱氢酶(Ldh)通过将丙酮酸转化为乳酸将NADH氧化为NAD+,从而在发酵过程中保持糖酵解活性。
(4)当氧气存在时,NADH可以被细胞质H2O形成NADH氧化酶(NoxE)氧化,生成NAD+。
(5)ATP酶以牺牲ATP为代价,以排出H+,以避免糖酵解引起的酸化。丙酮酸的积累导致乙酸盐或中性乙偶英和双乙酰的合成。
2.蛋白质代谢
乳球菌(Lactococcus)具有完整的蛋白水解系统,能够有效分解牛奶中的蛋白质:
•细胞壁相关蛋白酶(PrtP)能切割40%以上的肽键,产生100多种不同的寡肽;
•利用三种不同的转运系统摄取二肽、三肽和寡肽;
•细胞内肽酶将肽水解为生长所需的氨基酸;
•脂解酶(酯酶和脂肪酶)在奶酪成熟和风味发展中起有限作用
•多种氨基转移酶可将芳香族和支链氨基酸降解为挥发性芳香化合物。
3.产生细菌素
乳球菌属部分菌株可产生细菌素,这些细菌素具有抗菌活性能抑制一些有害菌生长,比如对李斯特菌有显著抑制效果。
•尼生素(Nisin):由Lactococcus. lactis subsp某些菌株产生的34个氨基酸的小肽。
•II类细菌素:含有高水平的小氨基酸(如甘氨酸),具有疏水结构域。
4.特殊代谢
部分菌株产胞外多糖(EPS),EPS有助于确定发酵乳制品的适当稠度,糖组分通常由半乳糖、葡萄糖和鼠李糖的重复单元组成。
有些乳球菌属菌株还能够利用柠檬酸作为碳源进行代谢,这一特性在发酵乳制品风味形成中发挥着重要作用。
在血红素存在时可进行呼吸代谢(通过细胞色素氧化酶bd)。
5
耐药性
乳球菌属(Lactococcus)细菌通常被认为是安全的微生物,但在某些情况下也可能表现出耐药性和特定的抗生素敏感性。以下是关于乳球菌属耐药性和抗生素敏感性的详细总结:
抗生素敏感性
乳球菌通常对以下抗生素敏感(基于实验室和临床观察):
•β-内酰胺类(如青霉素、氨苄西林)
•大环内酯类(如红霉素)
•林可酰胺类(如克林霉素)。
敏感原因:
缺乏常见的β-内酰胺酶基因(如blaZ)。
细胞壁合成途径对青霉素类敏感。
耐药性
已报道的耐药表型:
•四环素(tetS基因介导)
•氯霉素(cat基因介导乙酰化修饰)
•链霉素(str基因介导腺苷酸化)。
•其他潜在耐药:部分菌株可能通过mdtA外排泵对多种药物(如氟喹诺酮类)产生低水平耐药。
此外,这些基因可能通过水平基因转移从其他革兰氏阳性菌(如李斯特菌、葡萄球菌)获得,表明乳球菌在抗生素压力下可整合外源耐药元件。
噬菌体抗性
乳球菌通过质粒编码的机制抵抗噬菌体感染,包括:
•吸附抑制(阻断噬菌体结合受体);
•DNA注入阻断;
•限制-修饰系统(切割外来DNA);
•牺牲感染细胞以保护群体;
•工业中通过基因工程或筛选抗性菌株应对噬菌体污染。
6
遗传信息及主要菌种
截至2023年,已描述了22种乳球菌(Lactococcus),乳球菌的基因组相对较小,约2.3-2.8Mb,属于革兰氏阳性菌中较小的基因组。
乳球菌物种的系统发育分析
Mahony J,et al.Microb Biotechnol.2023
DNA G+C content (mol%): 34–43%,低于许多其他乳酸菌。
染色体结构:环状染色体,包含约2300-2800个基因,包含:
•糖酵解途径(如ldh基因编码乳酸脱氢酶)
•氨基酸合成(如支链氨基酸操纵子)
•质粒多样性:工业菌株常携带2–10个质粒(大小1–50 kb),功能包括:乳糖代谢(如lac操纵子)、噬菌体抗性(如abi基因簇)、抗生素耐药性(如pK214质粒)等。
▸ 乳酸乳球菌是模式菌种
乳酸乳球菌(Lactococcus lactis)是乳球菌属的模式菌种,包含两个重要亚种:L.lactis subsp. lactis(模式亚种)、L. lactis subsp. cremoris(常用于乳制品发酵)。
▸ 菌属下其他重要物种
Lactococcus garvieae
•常见于水生环境,是鱼类(如虹鳟鱼)的病原菌,引起乳球菌病。
•偶见人类感染案例(如心内膜炎、败血症)。
•耐药性:对青霉素敏感,但部分菌株携带多重耐药质粒(如pK214的同源基因)。
Lactococcus piscium
•分离自鱼类和冷冻海产品,与食品腐败相关。
•低温适应性强(可在4°C生长),是冷藏食品的潜在污染菌。
Lactococcus raffinolactis
•独特特征:可利用棉子糖作为碳源,区别于其他乳球菌。
•常见于植物表面和乳制品中,但工业应用较少。
乳球菌属(Lactococcus)不仅是乳制品发酵中的“重要参与菌”,也在临床前与部分临床证据中展现出多通路的健康促进潜力。
一方面,它们通过产生乳酸,帮助降低肠道局部 pH、抑制部分致病菌,并参与营养物质的初步分解与风味前体的形成;另一方面,部分菌株可产生细菌素、胞外多糖与功能性酶,可能影响黏膜屏障、微生态平衡与免疫应答。
综合多株研究发现,乳球菌通过重塑肠道微生态与代谢(提升短链脂肪酸、改善F/B比、富集 Muribaculaceae/Akkermansia 等有益菌),强化黏膜屏障与免疫稳态(上调 ZO‑1/Occludin/Claudin‑1、抑制 TLR4/NF‑κB、提升 sIgA/IFN 通路),并在代谢健康维度表现出抗肥胖、血脂优化、护肝与胰岛素敏感性改善等综合效应。
此外,特定菌株还涉及肠—脑轴调节(缓解内脏高敏、平衡 5‑HT 代谢)和脂质组学“去促炎化”(降低花生四烯酸相关氧脂素)。
1
调节肠道菌群
研究显示,乳球菌属(Lactococcus)可调节肠道微生群。其中,Lactococcus garvieae CF11通过“提升短链脂肪酸—重塑群落结构—增强代谢通路”多重机制改善肠道微生态。
▸ 提升物种丰富度与多样性,重塑群落结构
研究发现,补充 L.garvieae CF11 后,肠道 α 多样性显著提升:Observed_OTUs、PD_whole_tree、Shannon 指数均增加(p<0.05p<0.05)。
同时,β 多样性亦发生分离:加权 UniFrac 聚类显示实验组与对照组群落清晰区分,提示 CF11 重塑了整体群落结构。
同时还纠正年龄相关与炎症相关的F/B比异常(在老龄与老龄性结肠炎模型中均得到改善)。
▸ 富集产酸有益菌,抑制机会致病菌
属水平显著变化:Oscillospira、Coprococcus、Ruminococcus、Desulfovibrio、Dorea,以及科水平的 Lactobacillaceae、Streptococcaceae显著增加。
其中Oscillospira、Coprococcus、Ruminococcus 为重要的短链脂肪酸(乙酸/丙酸/丁酸)生产者。
门水平变化:Bacteroidetes 与 Proteobacteria比例上升,Firmicutes相对下降;同时家族层面 Ruminococcaceae 比例显著调整。
▸ 提高短链脂肪酸(SCFAs)产量
补充 L.garvieae CF11 后粪便短链脂肪酸显著升高:乙酸、丙酸显著增加,丁酸也上升。
功能推断:富集与丙酮酸发酵、乙酰辅酶A生成乙酸、琥珀酸/丙二醇生成丙酸相关的代谢通路,提示从碳水化合物与氨基酸发酵到乙酸/丙酸的转换被增强。
▸ 可能与健康相关作用
短链脂肪酸增加与产酸菌富集相互促进,推动代谢通路(糖酵解到丙酮酸、乙酰辅酶A、琥珀酸/丙二醇)活性提高,稳固健康型功能网络。
并且更高的乙酸/丙酸水平与能量代谢、抗氧化、免疫调节、屏障功能维护等相关。
2
增强肠道屏障
研究还表明,Lactococcus lactis HF08 具有肠道屏障保护作用,体现在:
▸ 强化紧密连接与上皮结构
上调紧密连接蛋白:在结肠中显著提高 Claudin‑1、Occludin‑1、ZO‑1 表达。
Lactococcus lactis HF08配合后生元能使紧密连接与桥粒清晰可见,单独Lactococcus lactis HF08也可使紧密连接蛋白变窄但连续,均优于未干预模型。
注:桥粒是角质形成细胞间连接的主要结构。
▸ 降低肠道通透性、修复屏障功能
血清FITC-葡聚糖与二胺氧化酶显著下降(老龄和老龄性结肠炎模型中均成立);在结肠炎模型中,Lactococcus lactis HF08配合后生元后降幅更大。
组织学改善:减少隐窝破坏、杯状细胞丢失与炎性浸润。
▸ 促进代谢支持屏障
Lactococcus lactis HF08还能够提升乙酸、丙酸、丁酸与总短链脂肪酸;短链脂肪酸与紧密连接蛋白呈正相关、与通透性和炎症指标呈负相关。
3
缓解肠易激综合征
在大鼠模型中发现,Lactococcus cremoris PS133对肠易激综合征(IBS)表现出多层面的改善作用,主要结论如下:
▸ 减轻症状与痛觉敏感
降低内脏高敏感性:经口补充14天后,PS133能显著阻断5-HTP诱发的结直肠胀气(CRD)致痛反应上升,提示对IBS核心表型(内脏高敏)有缓解作用。
▸ 保护肠黏膜屏障
保护并恢复黏液层:PS133可逆转5-HTP与CRD导致的结肠黏蛋白减少,黏液阳性面积显著增加。
提升紧密连接蛋白:PS133显著提高结肠上皮occludin与ZO-1水平与分布,提示降低通透性、强化屏障功能。
▸ 影响肠–脑轴与神经递质
脊髓疼痛相关神经肽:PS133显著降低Substance P(P物质)免疫反应强度,指向痛觉传导的下调。
脑内5-HT代谢:在前额叶与下丘脑,5-HTP使5-HT与其代谢产物5-HIAA升高及其比值改变;PS133有趋向性纠正(部分指标显著、部分为趋势),整体显示对5-HT/5-HIAA平衡具有调节潜力。
▸ 临床启示
在5-HTP诱导的肠易激综合征动物模型中,L.cremoris PS133可显著减轻内脏高敏,增强肠屏障,调节疼痛相关神经肽与5-HT代谢,并重塑特定肠菌群,显示其作为潜在益生干预的多通路作用前景。
4
调节免疫功能
乳球菌属(Lactococcus)具有菌株依赖的免疫调节活性,可通过先天免疫、黏膜免疫与体液/细胞免疫多层面协同,影响宿主免疫稳态。
▸ 先天免疫与树突状细胞激活
部分菌株(如 JCM5805)可被浆细胞样树突状细胞识别,经 TLR9 诱导 I/III 型干扰素,增强抗菌抗病毒防御(小鼠 mPIV 模型中存活率上升、肺部病理评分下降)。
同时促进巨噬细胞与 NK 细胞活性和吞噬功能,并上调 TNF‑α、IL‑6、IL‑12、IFN‑γ 等效应细胞因子(菌株依赖)。
▸ 黏膜免疫与屏障
在肠道等黏膜位点提升 sIgA/IgA,应增强 GALT 介导的局部免疫与病原阻断。
部分菌株还可抑制上皮炎性趋化因子(如 NCDO2118 抑制IL‑8),有助于缓解肠黏膜炎症。
▸ T细胞极化与过敏调节
倾向促进Th1相关细胞因子(IFN-γ、IL-12),同时下调IL-4/IgE通路,减轻IgE介导的过敏反应(如C59、G50、A17表现为升IgG2a/IFN-γ、抑制IgE)。
宿主与乳酸乳球菌之间的相互作用
Wu F,et al.World J Microbiol Biotechnol.2023
▸ 体液免疫与抗体谱
JCM5805还能提升特异性 IgA/IgG 水平;利用重组载体表达外源抗原,可在多个组织与黏膜部位诱导 IgA 与 IgG 的产生,同时动员并激活 CD4+ 与 CD8+ T 细胞,促进效应与记忆反应的建立与维持。通过这一策略,不仅增强体液免疫,还促进细胞免疫协同,形成更广泛且持久的免疫保护。
5
改善代谢健康
研究发现,在高脂高糖/西式饮食或高脂饮食模型中,Lactococcus(尤其是L.lactis subsp. cremoris ATCC 19257 与 L.lactis subsp. lactis LL‑1)可显著缓解体重增长、脂肪沉积、血脂异常与肝脏脂肪变;改善葡萄糖耐量和胰岛素敏感性;并通过调节肠道菌群与代谢产物,重塑宿主代谢网络,呈现抗肥胖、降脂与护肝效应。具体代谢改善如下:
▸ 减少体重与脂肪沉积
西式饮食下补充L.lactis subsp. cremoris ATCC 19257显著降低体重增长、BMI与内脏/系膜脂肪,且进食不增;呼吸交换率(RER)下降,提示底物利用向脂肪氧化倾斜。
▸ 降低血脂与胆固醇
L.cremoris有助于降低血清 TC、TG、LDL‑C,升高 HDL‑C(LL‑1);L.cremoris 将总胆固醇降至接近对照水平,且不改变粪便中中性甾醇,提示作用主要来自“吸收后”的宿主代谢重编程,而非肠腔吸收抑制。
Naudin CR,et al.Gastroenterology.2020
▸ 影响糖代谢与胰岛素敏感性
L.lactis可以改善葡萄糖耐量;纠正西式饮食诱导的 GIP 异常升高;降低胰岛素抵抗标志物 resistin。
注:抵抗素(Resistin)是一种富含半胱氨酸的来源于脂肪的肽激素,加速了动脉中低密度脂蛋白的积累。
▸ 改善肝脏与NAFLD相关指标
补充L.lactis可降低肝重并减少脂滴粒径,同时减轻肝脏炎症反应;此外,肝组织中炎性灶的面积与数量均下降,整体提示肝脏病理损伤得到缓解与改善。
同时整体表明对高脂饮食诱导的肝脏氧化应激与组织损伤具有保护作用,并有助于恢复肝功能指标至更趋正常的范围。
6
抗菌、抗高血压
乳球菌(Lactococcus)可作为“细胞工厂”,利用多种食源蛋白生产具免疫调节、抗菌与降压活性的生物活性物质。
▸ 降低动脉粥样硬化风险
其蛋白酶系统可生成 ACE 抑制剂,用于辅助控制高血压。作为辅助疗法,乳酸乳球菌可预防高胆固醇血症:在高胆固醇小鼠中显著降低动脉粥样硬化指数,提示具临床转化潜力。
▸ 抗炎、甚至有抗肿瘤作用
在健康肠道中,乳酸乳球菌(L.lactis)与宿主共生。表达胰腺炎相关蛋白(PAP,参与肠道稳态)的重组乳酸乳球菌 NZ9000 能预防小鼠黏膜炎;多株L.lactis还可抑制特定生态位病原定植,提示对黏膜炎具有潜在益处。
自然分离的 IBB109 与 IBB417 等菌株在细胞与小鼠肠道模型中表现出抗炎作用,可通过上调空肠 IL‑17、IL‑18、IL‑22,TLR2/5/6,以及 MyD88(MDPC88)调节肠道免疫。其通过重塑宿主微生物群调节免疫,降低肠易激综合征、腹泻与阴道感染风险。乳球菌亦被开发为多种药物,用于治疗人和动物的消化系统疾病;有研究显示其可用于癌症治疗并诱导 IL‑12 表达。
编者小结
乳球菌属(Lactococcus)对人体健康的主要益处体现在多个层面:
一是维持肠道微生物群平衡,促进有益菌群与短链脂肪酸(如乙酸、丙酸、丁酸)生成,滋养肠上皮、强化黏膜屏障并改善消化与代谢;
二是免疫调节,能下调促炎通路、增强抗菌肽与免疫细胞功能,从而降低炎症性肠病等肠道炎症风险并减轻相关症状;
三是代谢健康支持,包括帮助调节血脂与血糖、降低脂肪沉积与肝脂毒性、改善肝功能与胰岛素敏感性;
四是抗菌与安全替代潜力,部分菌株对致病菌有抑制作用,有助于减少抗生素依赖。
总体而言,乳球菌作为食品级益生菌,具有良好安全性与广泛应用前景,但具体效果依菌株与个体而异,仍需结合高质量临床证据与个体化使用。
1
胃癌患者中相对减少
证据强度:较高
在胃癌(GC)患者的肿瘤微环境与邻近非癌组织的配对比较中,乳球菌属(Lactococcus)在非癌组织中更为富集,而在癌组织中相对减少。
LEfSe分析显示:Lactococcus及其物种 Lactococcus lactis 为非癌组织的富集分类单元;相反,癌组织中富集的多为口源相关致病或条件致病菌(如 Streptococcus、Peptostreptococcus、Fusobacterium 等)。
2
结直肠癌患者手术后丰度增加
证据强度:较高
在未补充益生元的结直肠癌(CRC)患者中,手术后 Lactococcus(乳球菌属)相对丰度显著上升(术前约0.02%→术后约2.40%),与 Enterococcus、Streptococcus、Bacillus 等共生/机会致病菌同步上升,提示手术应激可推动部分兼性/共生菌群扩增与群落失衡。
在补充益生元的患者中,术后未观察到 Lactococcus 的显著上升,提示短期益生元干预对手术相关的 Lactococcus 扩增具有一定“缓冲/稳定”作用。
3
溃疡性结肠炎患者中丰度降低
证据强度:较高
在俄罗斯中欧地区的溃疡性结肠炎(UC)患者中,Lactococcus(乳球菌属)相对丰度显著降低(约降幅 5.9 倍),与健康对照相比呈一致性下行。
该下降与多种潜在有益/共栖菌的减少相伴(如 Butyricimonas、Fusicatenibacter等产丁酸菌),而与多种与炎症相关或条件致病菌的上升相对(如 Haemophilus、Prevotella、Peptostreptococcus 等)。
结合文献,Lactococcus具备潜在抗炎与免疫调节作用;其在UC中的降低或反映了黏膜屏障与免疫稳态受损的微生态特征。
4
肥胖患者中丰度降低
证据强度:较高
小鼠与人群的研究均显示,在肥胖及代谢紊乱个体中,乳球菌属(Lactococcus)的相对丰度普遍偏低;与此同时,补充乳酸乳球菌(Lactococcus lactis Subsp. lactis LL-1)以及并行使用的Lacticaseibacillus paracasei LP-16,能够通过调节肠道微生物群组成与相关代谢物谱,进而带来抗肥胖效果并降低血脂水平。
5
帕金森病中升高
证据强度:一般
在帕金森病(PD)小鼠模型中,肠道微生物群发生显著重塑:PD组乳杆菌科(Lactobacillaceae)、链球菌科(Streptococcaceae)等升高,而拟杆菌门下降、部分拟杆菌科与瘤胃球菌科类群减少。
就属水平看,PD 组中 Lactococcus(乳球菌属)相对丰度明显上升。而有氧运动训练(AET)可以使Lactobacillaceae 相对丰度下降。
6
缺铁性贫血患者口腔中丰度上升
证据强度:一般
在缺铁性贫血(IDA)患者的口腔微生物组中,Lactococcus(乳球菌属)相对丰度较健康对照发生改变。Lactococcus 在 IDA 组呈显著升高(作为差异丰度属被标注为在患者组富集/上调)。
Lactococcus在 IDA 患者中相对丰度显著升高,并具统计学意义;这一上升常与其他口腔兼性/发酵菌(如部分 Lactobacillus、Streptococcus)同步,反映铁缺乏环境下的生态位重排。
铁限制可选择性影响口腔菌群代谢策略与竞争格局。Lactococcus 作为兼性发酵菌,在低铁环境中可能具有一定适应优势,从而在 IDA 患者口腔中相对扩增。
乳球菌作为益生菌
乳酸乳球菌(Lactococcus lactis)作为益生菌应用前景广阔,已被广泛认可,列入“全球公认安全”(GRAS)与欧洲食品安全局的“合格安全推定”(QPS)清单。
▸ 具有改善代谢健康和降压等有益作用
乳酸乳球菌作为多功能细菌,部分亚种具有有益效应。L. lactis W19与 W58 可通过重塑肠道微生物群改善宿主代谢健康,涉及肥胖与心血管疾病。
此外,由野生型乳酸乳球菌 NRRL B-50,571 和 NRRL B-50,572 单独或共同发酵的牛奶在体外可抑制血管紧张素转化酶活性;这些发酵乳在自发性高血压大鼠中还表现出降压、降脂与降低心率的作用。
▸ 抑制肿瘤生长
经修饰表达肿瘤坏死因子相关凋亡诱导配体(TRAIL)的乳酸乳球菌(L. lactis hsTRAIL+)可诱导人结直肠癌细胞系 HCT116 与 SW480 凋亡,并在体外抑制 HCT116 肿瘤球生长。
▸ 增强免疫能力
乳酸乳球菌 RWP-3 与 RWP-7 能发酵多种碳水化合物并分泌多类胞外酶,且在摄入与胃肠道不利条件下仍保持活性。乳酸乳球菌 PTCC 1403 具备显著抗病能力。乳酸乳球菌 L19 可调节先天免疫、促进生长与食物消化,广泛用于乳制品发酵加工;其通过刺激肠黏膜、粘附定植并增强宿主免疫,提升生长性能、体液免疫并降低病原体负担。
乳球菌在食品中的应用
▸ 保护食品免受病原菌污染
研究显示,乳酸乳球菌产生的抗菌物质可作为天然屏障,有效防止病原体和腐败菌导致的食品变质。乳球菌在乳制品中应用时,通过下调葡萄球菌主要毒力调控器 AGR 系统抑制肠毒素生成,从而预防金黄色葡萄球菌食物中毒。它们亦可作为奶酪、酱料和罐头食品的天然防腐剂与抗肉毒毒素剂。
▸ 用于生产奶酪等乳制品
乳酸乳球菌对于乳清和奶酪等乳制品的制造至关重要。当乳酸乳球菌被添加到牛奶中时,细菌使用酶从乳糖中产生能量分子(ATP)。ATP能量产生的副产品是乳酸。细菌产生的乳酸使牛奶凝结,然后将其分离形成用于制作奶酪的凝乳。用于生产许多奶酪,包括布里干酪、卡门培尔奶酪、切达干酪、科尔比奶酪、格鲁耶尔干酪、帕尔马干酪和羊乳干酪。
▸ 改善质地和风味,产生发酵食品
据报道,部分乳球菌产生的胞外多糖可提高黏度与硬度、改善质地,使低脂产品更可口且更易吸收利用。此外,乳球菌还用于发酵腌制蔬菜、啤酒、葡萄酒、部分面包及其他食品。
乳球菌的其他应用
▸ 用于疫苗生产
乳酸乳球菌(L.lactis)因其作为蛋白载体的优势而备受关注。借助抗原递送系统,乳酸乳球菌 BFE920 可作为黏膜佐剂,诱导强烈的促炎免疫反应,从而在表达目标抗原时发挥显著疫苗效应。
作为活载体,乳酸乳球菌已用于递送多种抗原与蛋白,包括单核细胞增生李斯特菌的 LLO、SARS‑CoV 核壳蛋白、破伤风毒素 C 片段(TTFC)及幽门螺杆菌 Cag12 抗原。近期研究显示,表达戊型肝炎病毒(HEV)衣壳抗原的重组菌株可经口触发黏膜与系统免疫,提供宿主保护。
▸ 用于基因工程
除在疫苗中的重要作用外,乳酸乳球菌亦广泛用于基因工程。其基因组已完全测序、体积小(约2.3Mbp),并具成熟的克隆系统,因而成为理想的工作模型。
研究者已构建可产生并释放分枝杆菌 Hsp65 的转基因乳酸乳球菌。Hsp 为多种免疫细胞与共生菌表达的免疫显性热休克蛋白。口服给予该转基因菌释放的 Hsp65 可完全预防小鼠诱导性结肠炎,提示其有望为人类炎症性肠病的长期管理提供替代方案。
乳球菌可能存在的隐患
尽管乳球菌通常被视为安全,但仍可能存在一定的安全隐患。
▸ 一些菌株可能携带毒力基因
自1974年起即有乳酸乳球菌感染人类的报告,最初被误分类为人克雷伯菌,现已确认为乳球菌属成员。尽管其对健康人通常无害,但携带毒力基因的临床分离株可在有基础疾病者中致病。
其致病性与对人体组织与胃肠道的黏附相关,已发现与心内膜炎相关的毒力基因 efaA,以及编码参与生物膜形成的表面蛋白基因 esp;此外,一些菌株产生具 β 溶血作用的细胞溶素,进一步提高心内膜炎风险。
▸ 极少情况下可能引起脓肿或菌血症
个案报道包括:一名27岁男性出现右季肋痛逾10天,后确诊为由乳酸乳球菌引起的罕见肝脓肿,诊疗与其他脓肿相同。
另有两名婴幼儿首发感染表现为慢性腹泻:其一为5个月男婴(新生期肠扭转手术与回肠造口后)并发乳酸乳球菌相关慢性腹泻与菌血症;其二为6个月女婴导管相关血流感染后出现慢性腹泻。两例均经静脉万古霉素治愈。
此外,一名患唐氏综合征与Hirschsprung症(先天性巨结肠症)的1岁男童在消化道手术后发生导管相关乳酸乳球菌菌血症。
需注意,乳酸乳球菌在临床上可致显著感染,且与链球菌、肠球菌形态学相近,易被误判,可能导致早期分离株被误归类。
建议在特定人群(如免疫功能低下者、重症患者、装有植入式医疗器械者)中谨慎评估其使用风险,并加强菌株鉴定与质量控制。
主要参考文献
doi.org/10.1002/9781118960608.gbm00610
Liu X, Ma Y, Guan K, Liu R, Mao K, Xu X, Li Q, Wang R. Intestinal barrier, immunity and gut microbiota-based protective effects of Lactococcus lactis HF08 and its postbiotic derivative on aging and aging colitis mice. Food Res Int. 2024 Dec;197(Pt 1):115164.
Deng FS, Lin MH, Huang CL, Wu CC, Lu CL, Tsai YC. Effects of Lactococcus cremoris PS133 in 5-Hydroxytryptophan-Induced Irritable Bowel Syndrome Model Rats. Int J Mol Sci. 2025 Mar 10;26(6):2464.
Naudin CR, Maner-Smith K, Owens JA, Wynn GM, Robinson BS, Matthews JD, Reedy AR, Luo L, Wolfarth AA, Darby TM, Ortlund EA, Jones RM. Lactococcus lactis Subspecies cremoris Elicits Protection Against Metabolic Changes Induced by a Western-Style Diet. Gastroenterology. 2020 Aug;159(2):639-651.e5.
Gao P, Nie Y, Zhao L, Zhang J, Ge W. Lactococcus lactis Subsp. lactis LL-1 and Lacticaseibacillus paracasei LP-16 Influence the Gut Microbiota and Metabolites for Anti-Obesity and Hypolipidemic Effects in Mice. Antioxidants (Basel). 2025 May 1;14(5):547.
Mahony J, Bottacini F, van Sinderen D. Towards the diversification of lactococcal starter and non-starter species in mesophilic dairy culture systems. Microb Biotechnol. 2023 Sep;16(9):1745-1754.
Gaudu P, Yamamoto Y, Jensen PR, Hammer K, Lechardeur D, Gruss A. Genetics of Lactococci. Microbiol Spectr. 2019 Jul;7(4):10.1128/microbiolspec.gpp3-0035-2018.
Frelet-Barrand A. Lactococcus lactis, an Attractive Cell Factory for the Expression of Functional Membrane Proteins. Biomolecules. 2022 Jan 22;12(2):180.
Papadimitriou K, Alegría Á, Bron PA, de Angelis M, Gobbetti M, Kleerebezem M, Lemos JA, Linares DM, Ross P, Stanton C, Turroni F, van Sinderen D, Varmanen P, Ventura M, Zúñiga M, Tsakalidou E, Kok J. Stress Physiology of Lactic Acid Bacteria. Microbiol Mol Biol Rev. 2016 Jul 27;80(3):837-90.
Chen XH, Wang A, Chu AN, Gong YH, Yuan Y. Mucosa-Associated Microbiota in Gastric Cancer Tissues Compared With Non-cancer Tissues. Front Microbiol. 2019 Jun 5;10:1261.
Xie X, He Y, Li H, Yu D, Na L, Sun T, Zhang D, Shi X, Xia Y, Jiang T, Rong S, Yang S, Ma X, Xu G. Effects of prebiotics on immunologic indicators and intestinal microbiota structure in perioperative colorectal cancer patients. Nutrition. 2019 May;61:132-142.
Gryaznova MV, Solodskikh SA, Panevina AV, Syromyatnikov MY, Dvoretskaya YD, Sviridova TN, Popov ES, Popov VN. Study of microbiome changes in patients with ulcerative colitis in the Central European part of Russia. Heliyon. 2021 Mar 10;7(3):e06432.
Fan T, Li X, Zhang X, Zhang J, Sun L, Chen J, Fu C. Influence of aerobic exercise training on mice gut microbiota in Parkinson’s disease. Turk J Biol. 2022 Apr 25;46(4):288-297.

谷禾健康
当我们坐在餐桌前,精心挑选着盘中的食物时,一个常常被忽略的事实是:我们并非独自在享用这顿美餐。在我们的身体内部,一个无比繁华、拥挤而又充满活力的微观世界——肠道菌群,正翘首以盼,等待着我们送去的“补给”。这个由数万亿个细菌、真菌、病毒和古菌组成的复杂生态系统,其细胞总数甚至超过了我们自身的人体细胞,基因数量更是人类基因组的百倍以上。因此,科学家们形象地将其称为人体的“第二基因组”或“隐形器官”。
那么,究竟是什么决定了这个“隐形器官”的构成与功能?虽然遗传、年龄、生活方式及药物等多种因素都有关联,但研究普遍指出,饮食是最关键的驱动力。我们的食物不仅为自身提供能量和营养,也直接影响肠道微生物的“口粮”,不同食物成分会选择性促进不同微生物的生长,正如施用不同肥料会催生出不同的花草组合一样。
在众多营养素中,碳水化合物(尤其是膳食纤维)和脂肪对肠道菌群的影响已有深入研究,而蛋白质这一生命基础营养素,其调节肠道菌群的作用却长期被忽视。
我们都知道蛋白质对构建肌肉、修复组织、维持生命活动至关重要,但我们摄入的蛋白质究竟如何与肠道菌群互动?更重要的是,不同来源的蛋白质——例如,一块牛排(动物蛋白)与一盘扁豆(植物蛋白),会对我们体内的微观生态系统产生截然不同的影响吗?
这正是我们今天要深入探讨的核心问题。本文是基于最近发表在bioRxiv平台、题为《膳食蛋白源塑造肠道微生物结构和预测功能:一项结合机器学习的Meta分析》的重磅研究,为我们揭开提供了迄今为止较为全面、系统化的线索。
该研究巧妙地运用了Meta分析,汇集了全球范围内多项独立研究的数据,并通过前沿的机器学习算法进行深度挖掘,以前所未有的广度和精度,描绘出动物蛋白与植物蛋白在肠道菌群世界里投下的不同“身影”。
接下来,我们将解读这项研究的核心发现,包括动物蛋白和植物蛋白如何影响菌群的多样性与结构,不同饮食下的代表菌种,以及这些变化如何通过代谢功能影响我们的长期健康。
这不仅是对前沿科学的探索,也为我们的饮食选择带来了全新的认知。
在深入探讨研究的具体发现之前,先了解一下此次研究使用的两大“工具”:Meta分析(Meta-Analysis)和机器学习(Machine Learning)。
理解了它们的工作原理,我们才能更深刻地体会到这项研究结论的科学分量与可靠性。
1
Meta分析:站在巨人肩膀上看得更远
关于“不同蛋白质对肠道菌群的影响”,全球许多研究团队曾独立开展实验,
例如:
A研究组可能招募了20名志愿者,让他们分别食用富含牛肉和富含豆类的饮食;
B研究组则可能在小鼠身上测试了乳清蛋白和豌豆蛋白的效果;
C研究组的研究对象则可能是另一群不同文化背景的人。
每一项研究由于其样本量、实验设计、测量方法和地域人群的差异,得出的结论可能不尽相同,甚至有时会相互矛盾。例如,A研究发现动物蛋白显著降低了某种细菌,而B研究可能发现没有显著变化。这会让公众和政策制定者感到困惑:我们到底该相信谁?
Meta分析正是为应对这种问题而设立的统计方法。它并非进行新实验,而是系统收集并整合同一主题下尽可能多的高质量独立研究,利用统计工具合并与再分析这些数据,从而得出更具代表性和可信度的综合结论。
◮ Meta分析有三大优势:
增大样本量:通过合并多个研究,原本几十、几百的样本量可以瞬间扩大到成千上千,极大地提高了统计功效,使得我们能够洞察到在单个小规模研究中难以发现的、更细微但真实存在的效应。
解决不一致性:它可以评估不同研究结果之间的差异程度(即“异质性”),并探究造成这种差异的原因(例如,可能是因为研究对象的年龄不同,或是干预时间长短不一)。
提高结论的普遍性:因为数据来自不同地区、不同人群、不同实验条件,所以Meta分析得出的结论往往比任何单一研究更具普遍适用性。
在本研究中,作者首先进行了大规模文献筛选,在数千篇论文中,依据严格标准最终选取了13项高质量的人类干预研究,构建了总计近600个样本的数据集。
2
机器学习:从海量数据中挖掘模式的智能算法
收集到了海量数据仅仅是第一步。肠道菌群的数据是出了名的高维度、高复杂度。每个人的肠道里都可能有成百上千种不同的细菌,它们的丰度(数量多少)各不相同。面对这样一个由无数变量构成的复杂矩阵,传统的统计方法有时会显得力不从心。
◮ 机器学习对于数据统计和处理更高效
这时,机器学习就是重要的工具了。作为人工智能的一个分支,机器学习算法尤其擅长在看似杂乱无章的海量数据中,自动学习并识别出隐藏的模式和规律。它不像传统统计学那样需要研究者预先设定严格的假设,而是能够以一种更加“开放”和“探索性”的方式,让数据自己“说话”,以上两种方法也是谷禾健康构建人群肠道菌群数据库和识别菌群与健康以及营养的重要工具。
本研究主要采用了“随机森林”模型。可以这样理解:
如果我们想训练医生仅凭肠道菌群组成判断病人偏好动物蛋白还是植物蛋白,可先搭建一棵决策树:医生依次提问,例如“普雷沃氏菌丰度是否超过X?”、“拟杆菌丰度是否低于Y?”,通过一系列“是”或“否”,最终给出饮食类型诊断。
但单棵决策树容易因偶然因素产生偏误,就像初学医生容易过拟合少数病例一样。
为了避免这个问题,“随机森林”模型同时构建了成百上千棵这样的决策树,形成一片茂密的“森林”。它的高明之处在于“随机”二字:
通过这两个“随机”过程,保证了森林里的每一棵树都是独一无二、各具特色的。当需要做出最终判断时,模型会让森林里的每一棵树都进行一次独立的投票,然后采纳“少数服从多数”的原则,得出最终的、最稳健的分类结果。这就像一个由数百位不同背景、不同专长的医生组成的专家委员会进行会诊,其诊断结果自然远比单个医生更加准确和可靠。
◮ 随机森林的特点
样本随机:在构建每一棵树时,都不是使用全部的样本数据,而是从总样本中随机抽取一部分(有放回抽样)。
特征随机:在每个决策节点上选择“提问”的菌种时,也不是从所有菌种里挑选,而是随机抽取一部分菌种作为候选。
更妙的是,随机森林模型在完成分类任务后,还能告诉我们,为了做出准确的判断,它最依赖哪些“线索”。也就是说,它能计算出每一种细菌(即“特征”)对于区分“动物蛋白”和“植物蛋白”饮食模式的重要性得分。得分越高的细菌,就越有可能是区分两种饮食模式的“生物标志物”(Biomarker)。
通过将Meta分析的宏观整合能力与机器学习的微观挖掘能力相结合,这项研究得以在坚实的数据基础上,可以更系统地回答了文章开头提出的核心问题。
现在,让我们正式进入研究的重要发现环节。
在评估一个生态系统的健康状况时,通常会关注两个核心指标:
一是物种的丰富度与均匀度,即生态系统内物种数量多不多,分布均不均匀(对应谷禾健康报告里的多样性分值);
二是物种的组成结构,即这个生态系统主要由哪些类型的物种构成。对于肠道这个微观生态系统而言,这两个指标分别对应着α-多样性(Alpha Diversity)和β-多样性(Beta Diversity)。
1
α-多样性:肠道菌群的“贫富”指数
α-多样性用于衡量单个样本内微生物多样性的“丰富”和“均衡”程度。较高的α-多样性通常代表更健康的肠道生态,意味着功能更稳定、韧性更强,更能抵御外部干扰,如饮食变化或抗生素影响。就像物种繁多的雨林比单一农田更能抵抗病虫害。
那么,动物蛋白和植物蛋白饮食,谁更能促进肠道菌群的“共同富裕”呢?以往,一些小规模的研究在这个问题上存在争议。但这次,通过Meta分析整合了13项研究的庞大数据后,答案变得清晰起来。
◮ 摄入动物蛋白与植物蛋白α多样性的差异不大
研究结果显示,与摄入动物蛋白(如乳清、牛肉、猪肉)相比,摄入植物蛋白(如大豆、豌豆、藜麦)的受试者,其肠道菌群的α-多样性没有发生显著变化,甚至在某些指标上呈现出增加的趋势。
这一发现非常重要。它有力地反驳了一些人担心的“植物蛋白饮食可能会导致肠道菌群变得单一”的观点。恰恰相反,富含植物蛋白的饮食模式,至少在维持甚至提升肠道菌群多样性方面,表现出了与动物蛋白饮食相当甚至更优的潜力。
这背后的原因我们将在后文深入探讨,但一个关键因素在于,植物蛋白往往与一位“黄金搭档”——膳食纤维——相伴相生。这些纤维是许多有益肠道细菌的“顶级美食”,能够有力地支撑起一个物种繁盛的菌群环境。
2
β-多样性:划分肠道菌群的“派系”
如果说α-多样性关注的是菌群的“丰富程度”,那么β-多样性则衡量不同样本间微生物群落结构的差异。如果两组样本(如动物蛋白组和植物蛋白组)β-多样性差异显著,说明各自肠道菌群已经形成了截然不同的“派系”。
◮ 动物蛋白饮食下的菌群与植物蛋白的截然不同
在这项研究中,这正是最显著的发现之一。分析结果明确无误地显示,动物蛋白饮食和植物蛋白饮食塑造出了两种显著不同的肠道菌群结构。这意味着,如果你长期以动物蛋白为主食,你的肠道菌群整体面貌,将会与一个长期以植物蛋白为主食的人,有着清晰可辨的巨大差异。
为直观展示这种差异,研究者使用主坐标分析(PCoA)作图,每个点代表一个人的肠道菌群,点间距离反映差异大小。结果显示,动物蛋白组和植物蛋白组的样本在图上分成两个清晰分离的“星团”。
这一发现具有里程碑式的意义。它证实了膳食蛋白的“来源”,而不仅仅是“数量”,是决定我们肠道菌群生态类型的关键变量。你的餐盘上放的是牛排还是豆腐,正在以一种超乎想象的深度,重塑着你体内那个庞大的微生物帝国。
但问题也随之而来:这两个不同的菌群“派系”,究竟是由哪些具体的细菌成员构成的?又是哪些“关键先生”造成了如此显著的差异?这就要依靠机器学习的强大威力来找出了。
随机森林模型不仅能准确区分两种饮食模式,还给出了区分动物蛋白与植物蛋白饮食最关键的细菌“标志物”名单,这些细菌对于理解不同蛋白来源如何影响肠道菌群至关重要。
研究筛选出多种在两种饮食下丰度明显不同的“核心细菌”,其中值得关注的有:
1
动物蛋白饮食的“拥护者”
在摄入动物蛋白后,一些偏爱在富含蛋白质和脂肪环境中生长的细菌丰度显著增加。这些细菌通常被认为是“蛋白质发酵型”或“腐生菌”,它们擅长分解蛋白质和氨基酸,但其代谢产物有时可能对宿主健康构成潜在风险。
◮ Alistipes和Bilophila——动物蛋白饮食富集
Alistipes(另枝菌属)和Bilophila(嗜胆菌属):这两种菌是动物蛋白饮食下典型的富集菌。Alistipes属的某些菌株与肠道炎症和一些情绪障碍有关联。Bilophila wadsworthia则更为糟糕,它能利用动物性饮食中常见的含硫氨基酸(如牛磺酸,在红肉和海鲜中富含)产生硫化氢(H₂S)。
低浓度的硫化氢对肠道粘膜有保护作用,但过量产生则会破坏肠道屏障,诱发炎症,被认为是炎症性肠病(IBD)的一个潜在触发因素。关于这两种菌详见:
肠道重要菌属——另枝菌属(Alistipes),调节炎症情绪等的潜力菌
肠道重要菌属——嗜胆菌属 (Bilophila)喜欢脂肪、耐胆汁的促炎菌
◮ 动物蛋白饮食还能提升拟杆菌丰度
Bacteroides(拟杆菌属):这是一个庞大且复杂的菌属,主要为革兰式阴性菌,在西方化饮食(高蛋白、高脂肪)人群的肠道中通常占据主导地位。它们是多面手,既能利用碳水化合物,也能分解蛋白质。
动物蛋白饮食能够显著提升它们的丰度。虽然Bacteroides的许多成员是中性甚至有益的共生菌,但它们的过度扩张,特别是当缺乏足够膳食纤维来“喂养”它们时,可能会导致它们转向分解宿主肠道粘液中的糖蛋白,从而削弱肠道的第一道物理防线。
两种饮食结构下,主要菌属的相对丰度
2
植物蛋白饮食的“爱好者”
与动物蛋白饮食形成鲜明对比的是,植物蛋白饮食极大地促进了一批被广泛认可的“有益菌”的生长。这些细菌大多是“糖类发酵型”,它们热衷于分解植物性食物中富含的各种复杂碳水化合物(膳食纤维、抗性淀粉等),并产生对宿主健康至关重要的代谢产物。
◮ 植物蛋白饮食显著提升了双歧杆菌属丰度
Bifidobacterium(双歧杆菌属)和Lactobacillus(乳杆菌属):这两个名字对大众来说可能并不陌生,它们是市面上益生菌酸奶和补充剂中的“常客”。研究发现,植物蛋白饮食显著提升了Bifidobacterium的丰度。双歧杆菌是著名的“健康基石”,尤其在婴幼儿肠道中占据主导地位。它们能够产生短链脂肪酸(SCFAs),抑制病原菌生长,调节免疫系统,增强肠道屏障功能。
◮ 富含纤维的食物还能促进普雷沃氏菌和粪杆菌生长
Prevotella(普雷沃氏菌属)和Roseburia(罗伊氏菌属):Prevotella属偏爱在富含纤维和碳水化合物的饮食环境中生长,在非西方化、以植物为主食的人群中丰度极高。它们是高效的纤维分解者。
而Roseburia则是肠道中产生丁酸盐(一种至关重要的SCFA)的主力军之一。丁酸盐是结肠上皮细胞的首选能源,能直接为肠道细胞“加油”,同时具有强大的抗炎作用。
Faecalibacterium(粪杆菌属):特别是Faecalibacterium prausnitzii(普拉梭菌),被誉为“抗炎明星”。它的丰度降低与多种炎症性疾病(如克罗恩病)直接相关。植物性饮食,通过提供丰富的可发酵底物,为这类有益菌创造了理想的生长环境。
肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
编者小结
通过这份“红黑榜”,我们可以清晰地看到,动物蛋白和植物蛋白饮食,在肠道菌群的“物种选择”上,展现出了强烈的偏好性。动物蛋白倾向于富集那些擅长蛋白质发酵、但部分代谢产物可能存在健康隐患的细菌;而植物蛋白则大力扶持了那些以分解纤维、产生有益代谢物而闻名的“健康卫士”。
这不仅仅是细菌名单的改变,更深层次的,是整个肠道微生态系统功能的转变。
肠道菌群结构的变化最终会影响其功能层面,而我们更关注这些细菌在肠道中的具体作用。为此,研究人员采用了PICRUSt2生物信息学工具,通过已知的16S rRNA基因序列,预测菌群的功能基因谱和可能激活或抑制的代谢通路。
分析结果显示,不同饮食模式下肠道内存在截然不同的“代谢模式”。
1
动物蛋白饮食的代谢特征:BCAA代谢亢进
分析发现,动物蛋白饮食组的菌群,其与支链氨基酸(BCAAs)代谢相关的通路被显著上调。BCAAs包括亮氨酸、异亮氨酸和缬氨酸,是人体必需氨基酸,对肌肉生长至关重要。动物蛋白(特别是乳清蛋白)正是BCAAs的极佳来源。
◮ 过量代谢BCAA的细菌可能导致代谢疾病风险
然而,近年来,越来越多的证据表明,循环血液中过高水平的BCAAs及其相关代谢物,与胰岛素抵抗和2型糖尿病的风险增加密切相关。
肠道菌群在BCAA的分解代谢中扮演了重要角色。动物蛋白饮食不仅直接带来了更多的BCAA,还富集了那些能更活跃地代谢BCAA的细菌,这可能导致一系列代谢副产物的产生,这些副产物被认为可能干扰宿主的胰岛素信号通路,从而埋下代谢疾病的隐患。
此外,动物蛋白饮食还与同型半胱氨酸(homocysteine)代谢的上调有关。高水平的同型半胱氨酸是心血管疾病的一个独立风险因子。
2
植物蛋白饮食的代谢特征:SCFA生产菌更丰富
与此相反,植物蛋白饮食组的菌群,展现出了另一幅欣欣向荣的代谢图景。最核心的变化,是与短链脂肪酸(SCFAs)生物合成相关的通路被显著激活。
SCFAs,主要包括乙酸盐、丙酸盐和丁酸盐,是肠道有益菌发酵膳食纤维产生的主要“宝藏”代谢物。它们的功能极其广泛且对健康至关重要:
能源供应:丁酸盐是结肠细胞的主要能量来源,能维持肠道屏障的完整性和健康。
抗炎作用:SCFAs能够抑制炎症反应,对预防和缓解肠道及全身性炎症至关重要。
代谢调节:它们可以通过作用于肠道和远端器官(如肝脏、脂肪组织)的受体,参与调节血糖和血脂代谢,改善胰岛素敏感性。
“肠-脑轴”通讯:SCFAs还能穿过血脑屏障,参与调节食欲、情绪和认知功能。
◮ 植物蛋白饮食促进微生物发酵并产生短链脂肪酸
植物蛋白饮食能够显著促进短链脂肪酸(SCFA)的生成,其主要机制在于植物性食物富含的特定营养素。植物蛋白来源的食物,如豆类、全谷物及坚果,普遍含有高密度的可发酵膳食纤维与抗性淀粉。这些碳水化合物是肠道中特定菌群,例如双歧杆菌属(Bifidobacterium)和罗氏菌属(Roseburia),合成SCFA所偏好的主要底物。
因此,采用植物蛋白为主的饮食模式,实质上是为这些有益微生物提供了一个理想的发酵基质,从而高效促进其代谢活动与增殖。
这一功能差异很可能构成关键的、基于肠道菌群的分子机制,用以解释为何长期坚持植物性饮食与较低的心血管疾病、2 型糖尿病及部分癌症风险相关。
读到这里,一个关键问题值得我们深思:造成上述所有差异的,真的仅仅是蛋白质分子本身的来源不同吗?是牛肉里的氨基酸和豆腐里的氨基酸有什么本质区别吗?
回答并非绝对。
该项荟萃分析的深刻之处,在于其揭示了一个更为宏观的视角:人类摄入的并非孤立的营养素,而是一个完整的“食物基质”(Food Matrix)。不同蛋白质来源之所以产生差异化的生理效应,很大程度上归因于与蛋白质共同摄入的“伴随营养素”所产生的协同作用。
1
动物源性蛋白质的营养基质特征
当摄入动物性食物,如红肉或加工肉制品时,机体获取的是一个复杂的生物活性化合物组合,而非仅仅是动物蛋白。此基质通常包含以下组分:
• 高含量的饱和脂肪与胆固醇:
这类脂质会刺激肝脏合成并分泌更多的初级胆汁酸进入肠道,以辅助脂肪的乳化与吸收。然而,肠道内的特定菌群(如前文提及的嗜胆菌属 Bilophila)能够将这些初级胆汁酸代谢为次级胆汁酸,而后者具有潜在的促炎与致癌特性。
• 丰富的含硫氨基酸(蛋氨酸、半胱氨酸)与牛磺酸:
动物蛋白富含此类化合物,它们为肠道中能够产生硫化氢(H₂S)的细菌提供了充足的反应底物。高浓度的硫化氢可能对肠道细胞产生毒性作用。
• 高浓度的左旋肉碱(L-carnitine)与胆碱:
红肉是这两种物质的重要膳食来源,可被特定肠道菌群代谢为三甲胺(TMA)。TMA被吸收后在肝脏经含黄素单加氧酶氧化为氧化三甲胺(TMAO)。循环中TMAO水平升高已被证实与动脉粥样硬化和心血管疾病风险增加存在因果关系。
• 血红素铁:
尽管红肉中的血红素铁生物利用度高,但过量摄入会作为一种促氧化剂,催化活性氧(ROS)的生成,可能对肠道上皮细胞造成氧化损伤。
• 膳食纤维的缺失:
此为关键区别点。纯动物性食物基质中几乎不含膳食纤维。这使得依赖碳水化合物为主要能量来源的有益菌(即短链脂肪酸生产者)缺乏发酵底物,导致其丰度下降。这种变化为那些进行蛋白质发酵并可能产生有害代谢物的菌群创造了增殖的生态位。
2
植物蛋白的“黄金搭档”
相比之下,植物蛋白的“食物基质”则显得友好得多。当你吃下一碗扁豆、鹰嘴豆或一块豆腐时,你同时摄入的还有:
• 丰富的膳食纤维:
这是植物蛋白最大的优势。各种可溶性和不溶性纤维,是肠道有益菌的“益生元大餐”,直接支撑了SCFA的生产体系,并促进了菌群的多样性。
• 多酚类物质:
植物中含有成千上万种多酚化合物(如黄酮、花青素),它们不仅自身具有强大的抗氧化和抗炎活性,还能被肠道菌群代谢为更具生物活性的小分子物质,同时它们也能反过来调节菌群的组成,抑制有害菌,促进有益菌。
不饱和脂肪酸:
许多植物性食物(如坚果、种子)富含有益心血管健康的单不饱和和多不饱和脂肪酸。
较低的氨基酸密度和不同的氨基酸谱:
植物蛋白的消化速度通常比动物蛋白慢,这使得更多的蛋白质和氨基酸有机会到达结肠,但由于有大量纤维的存在,发酵的模式会更偏向于有益方向。
因此,这场动物蛋白与植物蛋白在肠道中的“较量”,实际上是一场整体饮食模式的较量。
通过对这项结合了Meta分析与机器学习研究的深度解读,我们得以清晰地看到,餐盘中的蛋白质来源,是调控我们肠道微生物的一个强有力杠杆。
★核心结论可以概括为:
结构重塑:膳食蛋白的来源(动物vs.植物)是塑造肠道菌群结构的关键驱动力,能形成两种显著不同的菌群“派系”。
物种筛选:动物蛋白饮食倾向于富集Alistipes、Bilophila等可能与炎症和不良代谢产物相关的细菌;而植物蛋白饮食则大力促进了Bifidobacterium、Roseburia等公认的“有益菌”的繁荣。
功能转向:在功能层面,动物蛋白饮食与支链氨基酸(BCAA)代谢等可能关联胰岛素抵抗的通路被激活相关;而植物蛋白饮食则显著上调了短链脂肪酸(SCFA)的生物合成通路,后者对维持肠道和全身健康至关重要。
这些差异不仅源于蛋白质本身,更重要的是由蛋白质来源食物的整个“食物基质”——包括伴随的脂肪类型、纤维、多酚等共同决定的。
启示和指导
上述结论并非倡导彻底弃用动物蛋白或推行严格纯素,更非妖魔化动物蛋白。科学研究的价值在于提供循证依据,帮助个体做出更明智、均衡的饮食选择。
基于本研究,可提出以下可操作的饮食策略:
1.优化蛋白质来源结构,提升植物蛋白占比:
建议在日常膳食结构中有意识地提升源自植物性食物的蛋白质比例。
优质的植物蛋白来源包括:
豆类: 如小扁豆、鹰嘴豆、黑豆等;
豆制品: 如豆腐、豆豉;
全谷物与准谷物: 如藜麦;
坚果与种子。
可采取循序渐进的策略以实现这一目标,例如,每周设定若干“低动物蛋白日”,或在烹饪时,尝试使用植物蛋白部分或全部替代原有的动物蛋白成分,以逐步调整和优化个人的饮食习惯。
2.优先选择“优质”动物蛋白:
优先选择“优质”动物蛋白:如果选择动物蛋白,可以优先考虑鱼类(富含Omega-3脂肪酸)、禽肉和鸡蛋,适度摄入红肉,并尽量减少加工肉制品(如香肠、培根)的消费。
3.采用基于“食物基质”的整体性评估方法:
在进行膳食选择时,应超越对孤立营养素的关注,建立对食物整体营养构成的认知。评估蛋白质来源时,需系统性地考量其伴随的营养成分。
例如,分析该蛋白质是与有益健康的膳食纤维和植物多酚(如豆类)共同摄入,还是与可能增加代谢负担的饱和脂肪、胆固醇及加工助剂(如加工肉制品)一同进入体内。
4.保证充足膳食纤维摄入:
无论蛋白质来源如何,每日从全谷物、蔬菜、水果、豆类获取足量纤维,是维持肠道微生态的关键。充足的膳食纤维能够为有益菌提供发酵底物,支持其稳态与代谢。
个性化将是未来的大趋势。每个人的初始肠道菌群、遗传背景和生活方式都不同,对同一种蛋白质的反应也可能存在差异。未来的营养学,或许能够根据你的个人菌群特征,为你量身定制最适合你的蛋白质摄入方案。
但在此之前,研究所揭示的宏观规律,已经为我们指明了通往更健康肠道微生态的清晰方向。下一次,当你站在超市的货架前,或在餐厅的菜单上做出选择时,请记住,你的每一次选择,不仅是在喂饱自己,更是在为你体内那个数万亿的微小盟友,投票决定它们的未来,也间接地,决定你自己的健康未来。
参考文献:
Adejumo, Samson, et al. “Dietary Protein Source Shapes Gut Microbial Structure and Predicted Function: A Meta-Analysis with Machine Learning.” bioRxiv (2025): 2025-04.

谷禾健康
孩子像有个停不下来的小马达,总是坐立不安、难以专注,对话像是没在听,还伴随着一些无法自控的小动作,比如频繁地挤眉弄眼、清嗓子或不自觉地耸动肩膀?…
这些常常被家长和老师贴上“不听话”、“坏习惯”标签的行为,背后可能隐藏着在儿童神经发育常见问题——注意缺陷多动障碍(ADHD,下文简称多动症)与抽动障碍(TD,下文简称抽动症)。
统计显示,全球学龄儿童中多动症的患病率约为3-7%,抽动障碍的患病率约为1-3%,且两者共病现象十分普遍。约50%-60%的抽动症患者同时患有多动症,男孩比女孩更常见。
注意力缺陷多动障碍(ADHD)和抽动障碍是儿童期常见的神经发育障碍,并不是很多家长以为的“学坏”或“故意捣乱”等行为问题。长期以来,医学界认为其病因主要与遗传、大脑结构发育及神经递质失衡有关。然而,近年来越来越多的研究发现,一个常被忽视的因素——肠道菌群。
例如,研究发现多动症儿童的肠道中,具有抗炎能力的普拉梭菌的丰度显著降低;而在抽动障碍的案例中,则观察到梭菌属和拟杆菌属等菌群的异常改变。
这些特定的菌群失衡,可以直接或间接地导致肠道通透性增加(即“肠漏”),引发低度炎症,甚至影响多巴胺等关键神经递质的合成与代谢。
肠道微生态的紊乱不仅影响消化吸收,更能通过神经、免疫及内分泌通路,远程影响大脑功能,从而可能加剧注意力缺陷、多动冲动以及不自主的抽动症状。
本文我们一起来深入了解一下多动症和抽动症,包括其症状、发病率、原因、共病现象等,重点探讨肠道菌群失调是如何影响这些神经发育障碍,并介绍肠道菌群检测在辅助诊断中的应用,以及如何通过调节肠道微生态进行相关干预,为管理这类神经发育障碍提供全新的视角与策略。
本文目录
一、认识多动症与抽动症
核心症状(多动症、抽动症症状、相似之处与不同之处)
患病率、共病现象
风险因素、原因
二、传统干预手段及其局限性
多动症的常用药物治疗
抽动障碍的常用药物治疗
传统药物治疗的共同困境
三、肠道菌群与抽动障碍和多动症的关联
多动症患者的肠道菌群特征
抽动障碍患者的肠道菌群特征
四、从菌群失调到神经炎症:发病机制新解
肠道屏障受损与全身性炎症
神经炎症与氧化应激
菌群代谢物的关键作用
菌群对神经递质的直接与间接调控
五、多动症与抽动症的诊断
多动症和抽动症的常规诊断流程
当前诊断的困境
整合肠道菌群检测:辅助诊断的新思路
肠道菌群检测如何为中西医结合提供桥梁
六、多动症与抽动症的干预新策略
饮食干预
– 地中海饮食、寡抗原饮食、人造食用色素去除
益生菌
– 双歧杆菌、植物乳杆菌PS128等
关键营养素补充
– Omega-3、维生素B6、B9、B12、D、锌、镁、铁等
粪菌移植(FMT)
中草药
– 健脾疏肝汤、菖麻熄风片、息风颗粒等
生活方式
– 运动、睡眠、行为干预等
核 心 症 状
▶ 注意缺陷多动障碍
注意缺陷多动障碍(ADHD,下文简称多动症)是一种复杂的神经发育障碍,其核心症状主要围绕三个方面:
😕 注意缺陷
– 难以持续集中注意力、容易分心、做事拖沓、经常丢失物品、在对话中似乎没有在听。
😖 多动
– 在座位上不停扭动、难以安静地坐着、话多、在不适当的场合跑来跑去或爬上爬下。
😡 冲动
– 难以等待、经常打断他人、不假思索地行动。
ADHD依据症状特点可分为三类:
患者常伴有执行功能缺陷、情绪失调和运动协调障碍等问题,这些都会严重影响其学习、社交能力和日常生活质量。
症状通常在 3~6 岁之间出现,平均诊断年龄为 7 岁。
成人多动症的多动表现可能不如儿童明显,更多体现在内心的躁动不安和精神层面的注意力不集中,体现在工作效率低下、人际关系处理困难、情绪波动大易发火、自我管理能力差等方面,而儿童则主要表现在学习障碍、行为问题上。
▶ 抽动障碍
抽动障碍(TD,下文简称抽动症)是一种神经发育障碍,以不自主、快速、重复、无节律的运动或发声为主要特征,即“抽动”。这些抽动在病程中的某个时间点出现,但不一定同时发生。
抽动障碍(TD)最严重的亚型是抽动秽语综合征(Tourette Syndrome, TS),其症状包括:
运动性抽动
– 简单的如眨眼、耸肩、摇头、皱眉等;
– 复杂的如模仿他人动作、做鬼脸、行走时的奇怪步态等。
发声性抽动
– 简单的如清嗓子、咳嗽、犬吠声;
– 复杂的如重复他人话语、说出不恰当的词语(秽语症,并非所有抽动患者都有)。
这些症状并非持续不变,其严重程度和频率会随时间波动,并受到压力、兴奋或疲劳等多种因素的影响。虽然大部分患者的症状在18岁前能够自行缓解,但仍有约三分之一的患者症状会持续到成年。
典型发病年龄在 6-7 岁左右,症状通常在 10-12 岁达到高峰。
▻ 两 者 相 似 之 处
▻ 不 同 之 处
抽动秽语综合征也会像多动症一样出现注意力不集中的情况,但这个注意力不集中可能是由抽动发生前令人分心的不适感(如压力、冲动感),以及抑制非自愿抽动本身所消耗的大量精力造成的。
流行病学与共病现象
► 多动症发病率
多动症是全球最普遍的儿童神经发育障碍之一,全球学龄儿童的患病率估计在3%~7%之间,男孩的诊断率是女孩的两倍以上。
18 岁以下患有多动症的儿童数量几乎是自闭症儿童的四倍。
儿童青少年多动症发病率主要统计数据
我国成人多动症的患病率约为4.4%,其中男性患病率高于女性。
柳叶刀的一项基于人群的研究显示:
疫情前,成人多动症的新增诊断平均为每月每10万人口8.8例。在疫情期间(2020年3月至2021年6月),这一数字上升至19.2例,每月增长率为4.9%(95%置信区间:[3.7, 6.2])。
疫情结束后,2021年7月的月度诊断率猛增107.3%[68.5, 155.0],此后每月继续以1.5%[0.4, 2.7]的速度增长,疫情后平均达到每10万人口34.8例。
► 抽动障碍发病率
《Pediatric Neurology》对 13 项儿童研究的荟萃分析显示,抽动秽语综合征的患病率为 0.77%(95%置信区间,0.39-1.51%)。男孩的患病率更高:1.06%的男孩受影响(95%置信区间,0.54-2.09%),而 0.25%的女孩受影响(95%置信区间,0.05-1.20%)。
全球抽动障碍流行病数据
► 多动和抽动共病现象
临床上一个巨大的挑战是这两种疾病的高度共病性。研究显示:
– 约50%-60%抽动症患者同时患有多动症
– 多动症往往在抽动症状出现之前就已存在
▻ 多动和抽动共病的影响
当两者共病时,多动症的症状通常在抽动症状出现之前出现。这就是为什么多年来抽动症状可能被错误地归因于兴奋剂药物的使用。
当孩子同时患有这两种疾病时,他们可能会消耗额外的精力和注意力,试图抑制抽动;这会加剧调节注意力和专注度的困难。
同时患有多动症和抽动症的儿童,往往比仅患有 多动症或仅患有抽动症的儿童面临更多的心理社会和行为问题,更容易受到欺凌,这些儿童还可能伴有认知和其他神经精神障碍。
▻ 共病强迫症
强迫症(OCD)也是常见的共病,约10%~35%的抽动症患者符合强迫症诊断标准。
注:多动症和抽动症儿童都容易患有焦虑症和强迫症。同时患有多动症和抽动症的儿童甚至比只患有其中一种疾病的儿童有更高的强迫症和广泛性焦虑症的发生率。更复杂的是,患有焦虑症的人还有额外的风险发展为抑郁症。因此,当孩子同时患有这两种疾病时,应常规监测情绪障碍和强迫症。
这种共病不仅使诊断复杂化,也严重影响患者的社会心理功能、自尊和生活质量,其背后可能隐藏着共同的病理生理机制。
风险因素
传统上,多动症和抽动症被认为是源于大脑的疾病,其病因复杂,涉及多种因素的相互作用。
► 遗 传 因 素
多动症和抽动障碍都具有明显的家族遗传性,家族史显著增加患病风险,遗传模式复杂,可能涉及多个基因的共同作用,相关基因如多巴胺受体基因(如DRD4)等可能参与其中。
► 产前 / 围产期因素
孕期吸烟、饮酒、接触有害物质等可能增加抽动和多动症的患病风险。
孕期感染也可能与神经发育障碍相关。
早产、低出生体重、缺氧等可能与抽动和多动症相关。
► 免 疫 因 素
免疫系统异常可能在抽动和多动症的发病中发挥作用。链球菌感染可能与部分抽动患者的发生有关。
► 营 养 因 素
铁、镁等微量元素缺乏可能与多动症的发生有关。
高糖、高脂肪饮食可能加重多动症症状。
► 早期生活环境
不良的家庭环境、虐待、忽视等可能增加抽动和多动症的患病风险。
► 屏幕时间
多动症患儿的屏幕使用时间(包括看电视、用平板/手机)显著高于正常儿童,并且过度的屏幕时间与多动症风险的升高有很强的统计学关联。
回归分析表明,屏幕时间增加与多动症风险升高相关(OR [95% CI] = 1.93 [1.28–4.27])。作者特别强调,由于研究是回顾性的病例对照设计,这个发现只能表明关联性,并不能证明是屏幕时间导致了多动症。
患有多动症或相关特质(如冲动、注意力不集中)的家长,可能更难为孩子设定和执行屏幕时间的规则,这本身就可能是一个混杂因素,同时也会影响他们报告的准确性。
什么原因引起的?
抽动和多动症的在遗传和神经学上存在相似的重叠,病因复杂,目前认为与神经递质失衡、脑结构和功能异常等因素有关,例如,涉及“去抑制”的相似神经回路。
这些因素可引发外周低度炎症(如细胞因子IL-6、TNF-α上调)和血脑屏障通透性增加,激活中枢小胶质细胞,干扰突触修剪和可塑性,最终导致额叶-纹状体/基底节环路的兴奋-抑制失衡,以及多巴胺、去甲肾上腺素和GABA等神经递质的调节异常,表现为注意缺陷、多动或抽动症状。这种机制并非单一,而是多通路交互的结果,后续章节将详述肠-脑轴的具体作用。
► 多动症
慢性低度神经炎症:风险因素(如早期营养/免疫失调)诱导外周炎症上行,激活小胶质细胞并干扰前额叶-纹状体环路的执行功能,导致注意缺陷和冲动控制问题。
多巴胺系统失调:遗传背景加剧多巴胺/去甲肾上腺素信号异常,与围产期因素交互,进一步放大行为症状。
代谢支持不足:营养相关失衡削弱神经保护,影响认知和情绪调节。
► 抽动症
感染触发与自身免疫:早期免疫因素(如链球菌感染)诱导异常自身免疫反应,错误靶向基底节,导致兴奋-抑制失衡和抽动发作。
基底节环路异常:遗传易感与环境应激放大多巴胺活性亢进和GABA抑制不足,阈值降低引发症状波动。
炎症-神经递质耦合:风险因素影响递质平衡,间接干扰运动控制。
根据美国儿科学会的最新指南,患有多动症的学龄前儿童(4~6岁)应首先接受家长培训的行为管理(PTBM)。若行为干预后功能障碍仍持续存在,可辅助使用哌甲酯治疗。
多动症的药物治疗:兴奋剂与非兴奋剂
▸中枢神经兴奋剂
这是最常用且被认为最有效的药物,代表药物是哌甲酯。这类药物通过抑制多巴胺和去甲肾上腺素的再摄取,提高突触间隙中这些关键神经递质的浓度,从而改善注意力和冲动控制。研究表明,治疗剂量的口服哌甲酯能显著增加人脑细胞外的多巴胺水平。
▸非兴奋剂
当患者对兴奋剂不耐受或效果不佳时,会考虑使用非兴奋剂。代表药物是托莫西汀,它是一种选择性去甲肾上腺素再摄取抑制剂,主要通过增加大脑中去甲肾上腺素的水平来发挥作用。
抽动障碍的药物治疗:多巴胺系统调节剂
对于抽动障碍,特别是症状严重影响生活的TS患者,药物治疗的目标是抑制多巴胺系统的过度活跃。根据美国神经病学学会(AAN)等权威指南,常用药物包括:
▸ α2-肾上腺素能激动剂
如可乐定和胍法辛,通常作为一线选择,尤其适用于伴有多动症的患者。它们副作用相对温和,但起效较慢。
▸ 抗精神病药(多巴胺受体拮抗剂)
典型抗精神病药:如氟哌啶醇和匹莫齐特,是FDA批准用于治疗抽动障碍的传统药物,效果显著但副作用风险较高。
非典型抗精神病药:如阿立哌唑和利培酮,因其对多巴胺和血清素系统的双重作用,被认为引发运动障碍的风险较低,已成为临床常用选择。此外,硫必利等药物也被广泛使用。
药物治疗的局限性
尽管上述药物在一定程度上有效,但其局限性同样显著,这也是驱动我们寻找新疗法的主要原因。
▸疗效的个体差异与不完全性
相当一部分患者对药物反应不佳或无效。即使有效,药物也通常只能控制症状,而不能根治疾病。对于许多患者来说,症状的改善是有限的,无法完全恢复正常功能。
▸可能带来副作用
ADHD药物:兴奋剂可能导致食欲不振、失眠、头痛、胃肠不适和情绪波动。长期使用还可能影响身高和体重发育。
抽动障碍药物:抗精神病药物的副作用尤为突出,包括镇静、头晕、嗜睡、体重增加和代谢综合征。更令人担忧的是,它们可能引发锥体外系症状,如肌肉震颤、僵硬和不自主运动(迟发性运动障碍),这些症状有时是不可逆的。
▸依从性挑战
由于副作用和疗效不确定性,患者(尤其是青少年)的治疗依从性往往较差。突然停药可能导致症状反弹或加重,给长期管理带来困难。
这种治疗上的困境促使科学界和医学界不得不将目光转向更深层次的病理生理学机制,以寻找新的干预靶点。在此背景下,“肠-脑轴”进入了研究者的视野。抽动障碍和多动症的神经系统功能紊乱,是否可能源于或受到肠道微生态失衡的影响?这为我们理解和治疗这些神经发育障碍开启了一个全新的视角,也正是我们下一章节将要探讨的内容。
肠-脑轴是指连接肠道和中枢神经系统(大脑)的一个复杂的双向通讯网络。它整合了神经、内分泌、免疫和代谢等多种信号通路,确保了大脑和肠道功能的协调。这个双向交流系统意味着,肠道的健康状况可以直接影响到我们的大脑,反之亦然。
既然肠-脑轴如此重要,那么我们来详细了解一下多动症和抽动障碍患者的肠道菌群。
多动症患者的肠道菌群
菌群多样性
β多样性(样本间物种组成的差异)分析通常能将多动症患者与健康对照区分开来,表明其菌群整体结构发生了改变。
特定菌群的变化
多项研究一致发现,多动症患者肠道中一些重要的有益菌丰度降低,特别是普拉梭菌(Faecalibacterium prausnitzii),这是一种主要的丁酸产生菌,具有强大的抗炎作用。此外,双歧杆菌属、粪球菌属(Coprococcus)和戴阿利斯特杆菌属(Dialister)的丰度也常被报道减少。
注:普拉梭菌在不同研究中结果矛盾。
一些研究观察到多动症患者肠道中拟杆菌属的某些种(如B. uniformis)、臭杆菌属(Odoribacter)、肠球菌属(Enterococcus)和链球菌属(Streptococcus)的某些种丰度增加。
与症状的关联
一项2025年的研究通过宏基因组和代谢组学分析发现,Lactobacillus sanfranciscensis的减少与多动症的三种核心症状注意缺陷、多动、冲动(p.adj = 1.04E–13; p.adj = 5.07E–07; p.adj = 2.61E–05)均显著相关。
多动症混合型菌群失调更严重
值得注意的是,多动症不同临床表现亚型(如ADHD-I和ADHD-C)可能对应着不同的菌群特征,这提示了疾病内部的异质性。例如,混合型(ADHD-C)患者的菌群失调程度通常比注意缺陷为主型(ADHD-I)更严重。
doi: 10.1080/19490976.2025.2537755
不同检测方法下儿童多动症的肠道菌群变化
doi: 10.3389/fpsyt.2025.1588135
抽动症患者的肠道菌群
针对抽动障碍(TD)和抽动秽语综合征(TS)的研究虽然起步较晚,但也揭示了相似的菌群失调模式。
门水平的变化
研究发现,与健康儿童相比,抽动障碍患儿粪便中厚壁菌门的相对丰度降低,而变形菌门和拟杆菌门的相对丰度升高。
属和种水平的特异性改变
一项研究发现,抽动障碍患儿肠道中普通拟杆菌(Bacteroides plebeius)、Ruminococcus lactaris的丰度显著高于健康儿童。这些细菌被认为与多种自身免疫性疾病有关。
另一项研究同样观察到TD患儿中双歧杆菌属和柯林斯菌属(Collinsella)丰度显著降低,而普雷沃氏菌属(Prevotella)和臭杆菌属(Odoribacter)丰度增加。
总的来说,多动症和抽动障碍患者的肠道菌群普遍呈现出促炎菌增多和有益菌减少的特征。这种失衡状态不仅是疾病的伴随现象,也可能是驱动疾病发展的关键因素之一。
肠道菌群的失调如何一步步影响到远端的大脑,并最终导致ADHD和抽动障碍的症状?科学家们提出了一个以“肠道菌群失调-神经炎症”为核心的通路。
肠道菌群失调如何通过炎症通路影响多动症
DOI: 10.1016/j.neuroscience.2025.01.031
1
肠道屏障受损与全身性炎症
肠道菌群失调被视为多动症和抽动症等神经发育障碍发病机制中的关键起点。
健康的肠道屏障能严格控制物质进入血液,但在菌群失调时,其通透性增加,即“肠漏”。
异常的肠道菌群组成可能激活肠道免疫系统,破坏屏障功能,也可能是有益菌群减少,对肠上皮细胞至关重要的“燃料”——短链脂肪酸生成不足,使得屏障细胞营养不良,细胞间的紧密连接蛋白松动,还有一些菌群降解肠道黏液层,削弱屏障保护。
屏障一旦受损,肠道内的细菌成分,如脂多糖(LPS)和有害代谢物便能渗入血液循环系统。这会触发强烈的免疫反应,因为免疫系统将这些物质识别为威胁。LPS会激活如TLR4(Toll样受体)等模式识别受体,刺激免疫细胞释放大量的促炎细胞因子,如IL-6(白细胞介素-6)、IL-1β(白细胞介素-1β)和TNF-α(肿瘤坏死因子-α)。
这些炎症因子在全身循环,形成了一种慢性的、低度的全身性炎症状态。这便是连接肠道与大脑问题的关键一步。
多动症和抽动症患者常常共患过敏性疾病(如哮喘、湿疹)和自身免疫性疾病,这从侧面印证了他们体内可能存在着异常的免疫激活状态。
肠道菌群通过肠-脑轴影响多动症的可能机制
doi: 10.3389/fpsyt.2025.1588135
2
神经炎症与氧化应激
上一节我们谈到,由肠道菌群失调引发的肠漏,引发了一场慢性的、低度的全身性炎症风暴,它的其中一个目标是突破人体的精密防线,也就是我们常说的血脑屏障。
一旦这道屏障因持续的炎症冲击而出现缝隙,炎症物质就直接去影响中枢神经系统,从而引发神经炎症与氧化应激,这是导致抽动症和多动症神经功能紊乱的核心病理环节。
一旦进入大脑,这些炎症物质会立即激活大脑内的免疫细胞——小胶质细胞和星形胶质细胞。这些细胞原本是大脑的管家,被激活的小胶质细胞会释放更多的炎症因子,将局部的火星煽动成燎原大火,形成一个恶性循环,导致持续的神经炎症。
神经炎症环境会产生大量的活性氧(ROS),引发氧化应激,损害神经元的线粒体功能、破坏细胞膜和DNA,最终导致神经元功能障碍甚至死亡,表现为多动症和抽动症的核心症状。
这一系列病理过程并非只是理论推测,在多动症患者身上已经找到了直接证据。多项研究发现:
从受孕到成年整个生命周期中,抽动和多动症接触免疫功能失调风险因素的时间、周围和中枢免疫炎症反应的变化、小胶质细胞激活的变化以及肠道菌群的改变如下图:
doi: 10.3389/fneur.2020.567407
这种由炎症和氧化应激共同驱动的神经毒性环境,会干扰正常的神经环路发育、突触可塑性和神经递质平衡,最终导致多动症的注意力不集中、多动冲动,以及抽动症的抽动、刻板行为等症状。
3
菌群代谢物(如短链脂肪酸)的关键作用
短链脂肪酸,主要包括丁酸、丙酸、乙酸,是肠道中的有益菌发酵膳食纤维后产生的重要代谢产物。
短链脂肪酸具有多重生理功能
Lactobacillus sanfranciscensis → 咪唑乙酸 → 注意力缺陷
在抽动和多动症中,短链脂肪酸的失调是一个核心环节。近日,一项针对多动症的队列研究明确指出,短链脂肪酸缺乏是其关键致病机制。
该研究发现,多动症患者体内普遍存在短链脂肪酸的缺乏,咪唑乙酸、4-氨基丁酸、4-胍基丁酸等多种SCFAs的水平显著降低。这种缺乏与我们前面提到的菌群失调有关,负责高效生产短链脂肪酸的有益菌减少。
研究通过因果中介分析发现,旧金山乳杆菌(Lactobacillus sanfranciscensis) 的减少,会引起肠道内咪唑乙酸水平的下降,而咪唑乙酸水平的下降,则直接导致了注意力不集中症状的加重。
注:Lactobacillus sanfranciscensis 对注意力不集中症状的总效应为−0.672,包括直接效应−0.535和中介效应−0.137,咪唑乙酸部分介导了这些效应,占总效应的 20.387%。
因此,这条病理链条变得清晰:
菌群失调 → 有益菌减少 → 短链脂肪酸产量不足 → 屏障失修,抗炎不力 → 肠道屏障和血脑屏障通透性增加→ 全身性炎症和神经炎症
总的来说,短链脂肪酸的缺乏,使得从肠道到大脑的整个防御体系变得脆弱。它为炎症的发展敞开了门,降低了身体抗炎能力,使神经系统遭受炎症和氧化损害,导致抽动症和多动症神经功能障碍。
4
菌群对神经递质的直接与间接调控
大脑的功能在很大程度上依赖于神经递质的精确平衡,它们是神经元之间传递信息的化学信使。
抽动症和多动症的核心病理之一,就是关键神经递质系统(尤其是多巴胺系统)的失衡。
菌群是神经递质及其前体的代谢工厂
如前所述,菌群可以合成GABA、5-HT等神经递质,或影响其前体物(如色氨酸、苯丙氨酸、酪氨酸)的代谢。
这里的关键在于,菌群的代谢活动能够直接决定这些原料的最终去向。
当多动症患者的肠道菌群异常地将大量色氨酸在外周(肠道内)就地转化为5-HT时,由于5-HT分子本身无法穿过血脑屏障,这实质上是一种“资源截留”。
这种外周的过度消耗,直接导致了能够进入大脑、用于合成中枢5-HT的色氨酸原料供给不足,最终引发中枢神经系统的5-HT缺乏。
菌群的功能缺陷会引发供应链中断
多巴胺和5-羟色胺等关键神经递质的合成,不仅需要前体原料,还需要维生素B6、叶酸等重要辅酶的参与才能顺利完成。
例如,多动症患者肠道菌群在维生素B6和叶酸代谢通路上的功能异常,可能影响到多巴胺、血清素等关键神经递质的合成,因为这些维生素是合成过程中的重要辅酶。肠道菌群是这些B族维生素的重要生产者,这在我们之前的文章可以详细了解,点击查看
当多动症患者的菌群失调时,相关维生素代谢异常,就像切断了神经递质合成的辅助工具供应,即使有足够原料,也会导致神经递质系统紊乱。
导致抽动秽语综合征的病理生理机制
doi: 10.2147/DDDT.S542423
多动症诊断
严格依据DSM-5或采用国际疾病分类第11版(ICD-11)作为诊断标准,强调症状需持续至少6个月,并在多个环境中可被观察到(如工作和家庭)都持续存在并造成影响。 必须有明确证据表明,这些症状已对社交、学业或职业功能造成实质性的负面影响。
确诊需通过临床访谈、评定量表等综合评估,并仔细排除焦虑、抑郁等其他可能引起相似症状的疾病。
为什么在儿童时期,诊断多动症的女孩少于男孩?
柳叶刀有一篇文章专门讲了这个问题:
症状表现不同:多动症的诊断标准更多基于男孩常见的、外显的多动-冲动行为。而女孩的症状更多是内化的、不易察觉,如健忘、分心、做事拖沓,这些安静的症状常被老师和家长忽视。
共病掩盖:女孩的多动症症状常被焦虑、抑郁等情绪问题所掩盖,导致她们被误诊为其他精神障碍。
社会因素与补偿行为:出于社会期望,女孩更倾向于通过加倍努力或发展补偿策略来伪装和隐藏自己的困难,这使得她们的内在挣扎更难被识别,从而错过了及时的诊断和干预。
抽动障碍诊断
由于该疾病的临床异质性、抽搐的可抑制性以及症状的时间可变性,抽动症的诊断和评估可能特别复杂。因此,在症状首次出现后,诊断可能会延迟 3~11 年,大约 73%患者会经历初次误诊。
目前,尚未发现任何早期诊断标志物,如影像学检查、血液检查或脑脊液生物标志物,可以在症状出现之前帮助诊断。
目前,关于多动症和抽动症的诊断在很大程度上依赖于“非客观性”的指标, 例如量表、临床晤谈与行为观察。
像康纳斯量表、SNAP-IV量表或耶鲁全球抽动严重程度量表(YGTSS)等工具,其本质并非客观检测,而是将主观的观察和感受进行结构化和量化的工具。
客观检查主要用于排除而非确诊: 医生可能会建议进行脑电图、头颅MRI、血液检查等医学检查。但这些检查的主要目的,是排除其他可能引起相似症状的神经系统疾病(如癫痫、脑损伤等)。
这也是为什么寻找可靠的方式,以实现更精准、客观的诊断,是该领域未来研究的重要方向。肠道菌群检测逐渐为多动症和抽动症的辅助诊断提供了新的思路和可能性。
整合肠道菌群检测
目前肠道菌群检测还不能作为诊断的独立标准,它是一种辅助性的、探索性的工具,旨在深化对个体病理状态的理解,从而指导更精准的个体化治疗。
► 肠道菌群检测结合病理生理机制
结合我们在前面提到的多动和抽动的多种病理生理机制,包括神经递质失衡(多巴胺、谷氨酸等)、神经炎症(小胶质细胞活化)和免疫功能障碍等,肠道菌群恰好在这些方面都扮演着关键角色。
肠道菌群能够合成或影响多种神经递质(如多巴胺、5-羟色胺、GABA)的代谢。谷禾肠道菌群检测通过构建基于大样本的数据库,能够评估关键神经递质指标,如多巴胺,血清素,GABA等。
通过分析特定菌群的丰度和代谢活性,谷禾肠道菌群检测能够推断个体神经递质的合成能力和代谢状态,例如,某些双歧杆菌和乳杆菌株能够产生GABA,对于多动症和抽动症患者而言,这些神经递质的失衡往往是核心病理机制之一。多巴胺系统异常与注意力缺陷和运动控制障碍密切相关,GABA不足则可能导致大脑过度兴奋和自控能力下降。
< 来源:谷禾肠道菌群检测数据库>
肠道菌群的代谢产物(如脂多糖LPS)是强烈的促炎物质,若肠道屏障受损(肠漏),LPS进入血液会引发全身性低度炎症,并可能通过血脑屏障影响大脑,激活小胶质细胞。
谷禾肠道菌群检测结果可以提示,患者是否存在由菌群失调导致的营养吸收障碍或炎症状态,例如肠道炎症水平、肠道屏障、脂多糖LPS等指标。
< 来源:谷禾肠道菌群检测数据库>
对于多动症和抽动症患者,这些炎症指标的异常往往提示存在”肠-脑轴“功能紊乱,慢性低度炎症可能正在影响大脑的神经发育和功能,导致注意力、情绪调节和运动控制等方面的问题加重。
► 肠道菌群检测结合中西医
中医诊断依赖于辨证论治,比如将患者分为“肝风内动”、“痰火扰心”、“脾虚肝亢”等不同证型。这种辨证主要依赖于医生的四诊(望、闻、问、切),缺乏现代生物学的客观指标。
菌群特征与中医“证”的关联
通过对不同证型的患者进行肠道菌群检测,可以探索特定菌群的构成模式是否与某种中医证型存在关联。例如我们可以去探索:
如果能建立这种关联,肠道菌群检测就能为中医的辨证提供客观的生物学证据,有了可以量化的数据支持。
如果肠道菌群检测发现患者有明显的菌群失调和炎症标志物升高,那么在常规治疗(如多巴胺受体拮抗剂)的基础上,结合具有抗炎作用的中药(如黄芩等),或者补充益生菌、调整饮食结构,可能效果更好。
医生还可以根据菌群偏好,推荐更具体的食疗方案(如富含多糖的山药、茯苓等药食同源的食物)。关于药食同源可详见谷禾之前的文章:
从药食同源到微生态健康:中华传统医学养生智慧在肠道菌群中的现代诠释
肠道菌群检测可以成为连接中医、西医理论和实践的桥梁。
饮 食 干 预
关于儿童注意力和饮食模式关系的研究强调,注意力问题的儿童零食和垃圾食品的摄入量更高,并且这些儿童可能表现出过度进食行为。此外,文献中有发现表明,有明显注意力缺陷特征的成年人由于比普通人更频繁地摄入零食和添加糖,因此肥胖的风险更高。
一项综述发现:
► 地中海饮食
对地中海饮食的更高依从性与短链脂肪酸产生菌种 Faecalibacterium prausnitzii、Eubacterium eligens、Bacteroides cellulosilyticus 的丰度增加以及纤维降解功能的增强相关,与Ruminococcus gnavus 和血液胆固醇水平的降低有关。
► 限制消除饮食(寡抗原饮食) 证据层级:强
食物过敏/超敏反应可能是导致部分儿童多动症症状的关键因素。寡抗原饮食通过在几周内只允许食用极少数低过敏性食物(如米、梨、多种蔬菜等),来完全移除可能引发症状的食物触发器。
Tips:这里可以记录饮食日记,以追踪饮食与症状严重程度之间的潜在关联,识别并消除潜在的食品诱因,考虑常见的诱因,比如咖啡因、人工添加剂、高糖食品、麸质、乳制品等。
以上效果堪比药物治疗,且无药物副作用。
► 人造食用色素去除 证据强度 中等
多项研究(包括著名的南安普顿研究)发现,去除饮食中的人造色素和防腐剂(如苯甲酸钠)可以小幅但显著地改善儿童的多动行为。然而,其效果远不如严格的寡抗原饮食。文章认为,单独去除人造食用色素可能只对一小部分儿童有效,或者改善程度有限,因为还可能存在其他未被识别的食物触发因素。
以上有益,但作用有限。
相关饮食的生理益处
doi: 10.3390/metabo15050335
益 生 菌
一项为期 12 周的随机双盲安慰剂对照试验,涉及 80 名 5-14 岁的儿童(39 名患有多动症,41 名患有自闭症)。益生菌补充剂显著改变了多动症和自闭症儿童的肠道菌群。多动症患者增加梭菌属 、瘤胃球菌科、毛螺菌科、Odoribacter等。
注:AB Biotics S.A.提供了安慰剂和益生菌。
► 多动症:双歧杆菌
一项针对75名儿童的研究使用了长双歧杆菌 (B. longum),但研究重点是评估其作为药物辅助治疗的可行性,而不是直接的治疗效果。在为期四周的研究中,研究人员观察到益生菌组的注意力不集中症状有所改善。但文章强调,这只是初步发现。
一项为期12周的随机双盲安慰剂对照试验显示,补充双歧杆菌Bf-688可显著改善多动症患者的注意力与反应速度。其机制在于,Bf-688能提高肠道厚壁菌门/拟杆菌门的比例,从而强化肠道屏障,改善神经递质(特别是多巴胺)的调节功能。同时,它还减轻了患者的胃痛、食欲不振等胃肠道问题。
儿童多动症益生菌治疗的临床研究
doi: 10.3389/fpsyt.2025.1588135
► 抽动症:植物乳杆菌PS128
一项研究发现,给抽动症模型大鼠喂食植物乳杆菌PS128后,大鼠的抽动行为得到显著改善。这可能与益生菌调节了肠道菌群(如增加了普氏菌科,降低了毛螺菌科),并增强了多巴胺系统的稳定性有关。
► 抽动症:益生菌+药物
一项涉及130名抽动症患儿的为期12周的随机对照试验显示,将益生菌与常规药物(泰必利)联合使用时,对改善抽动症状的效果最为显著。相比之下,单独使用益生菌的效果最不明显。
补充剂
一项研究发现,抽动秽语综合征儿童的钠摄入量显著更高,而维生素D和维生素K的摄入量显著更低。维生素 B3、维生素 B6 和维生素 C、微量元素磷和硒较少达到参考营养摄入量(这一趋势在自闭症儿童中也得到体现)。
► Omega-3 和 Omega-6 脂肪酸
理论基础是多动症患者体内可能存在这些脂肪酸水平较低的情况。这是研究最多的补充剂类型。
研究结果不一致。荟萃分析显示,补充Omega-3/6脂肪酸(特别是EPA和DHA的组合)后,在注意力、多动和冲动方面有微小但显著的改善。然而,许多其他研究未发现显著效果。效果可能受剂量、EPA/DHA比例以及个体差异的影响。
► 维生素D和镁
维生素 D 和镁补充剂在两项研究中显示出改善多动症症状的效果;然而,一项研究得出结论,维生素 D 补充剂仅在同时存在维生素 D 缺乏的多动症儿童中才有益。
在一项调查中,许多家长报告称,给孩子补充镁后,观察到抽动症状有所改善。镁是一种对身体的许多方面调节和功能起关键作用的矿物质,包括调节肌肉和神经功能、血压和血糖控制。
► 叶酸和维生素 B12
研究发现,多动症患者的叶酸和维生素 B12 水平较低,一项研究发现维生素 B12 水平与多动症症状呈负相关,而另一项研究则未发现这种关系。
► L-茶氨酸和维生素B6
一项初步研究表明,这两者联合使用能显著减轻抽动严重程度,并对缓解伴随的焦虑有积极作用。
► 锌
锌在神经递质多巴胺的代谢中起着关键作用,而多巴胺与多动症的核心症状密切相关。关于补充锌对多动症的治疗效果,目前的研究结论尚不一致。
► 铁
研究发现,多动症儿童体内的铁蛋白(ferritin)水平普遍较低,而铁蛋白是反映体内铁储存量的指标。补充铁剂已被证明可以改善多动症儿童的症状,其效果甚至可以与某些兴奋剂药物相媲美。但对于铁水平正常的儿童,效果不明确。
粪菌移植 (FMT)
粪菌移植(FMT)作为一种仍在探索中的疗法,已被尝试应用于多种伴有肠道菌群异常的难治性神经系统疾病,如自闭症等。
动物实验
动物实验发现,将健康小鼠的粪便移植给抽动模型小鼠后,小鼠的抽动症状得到缓解,同时其血清中的5-羟色胺水平升高。
儿童
2017 年报道了首例使用粪菌移植治疗的抽动症病例,9岁男孩服用中药和泰拉普丁2.5年后仍有症状。粪便来自14岁健康男孩,通过胃镜和肠镜送入患者肠道。治疗前YGTSS评分31,8周后降至5,抽搐行为几乎消失且注意力集中,表明FMT对抽动症有治疗效果。
随后用FMT治疗5名抽动症男童。4名儿童YGTSS评分降低超25%(7-35分),2名症状消失,1名评分增加4分。这表明FMT对部分抽动儿童有效,但其机制及适用性需进一步研究。
成人
2022年,一位 22 岁的女性因反复发作的艰难梭菌感染导致多次严重腹泻。接受 FMT 治疗后,共病 ADHD 和焦虑症状得到缓解,CGI–S 评分从治疗前的 5 分降至 2 分。
中 草 药
在抽动症的管理中,许多中药方剂被使用,包括天麻钩藤饮、柴胡疏肝散和六味地黄丸等。
抽动障碍治疗中 15 种高频中药的现代药理机制
doi: 10.2147/NDT.S543465
► 中医药联合治疗抽动秽语综合征的临床实践
▻ 健脾疏肝汤 + 盐酸泰必利
一项涉及98名抽动症儿童的随机对照试验,经过8周治疗,发现“健脾疏肝汤”与西药“盐酸泰必利”的联合使用疗效,在降低抽动严重程度、改善神经递质分泌方面效果显著,且复发率更低,安全性良好。
▻ 菖麻熄风片 + 氟哌啶醇片
一项随机对照试验(n=96),发现菖麻熄风片联合氟哌啶醇片治疗儿童抽动症,能有效改善抽动症患儿的临床症状、认知发育、脑电图结果和血清神经递质水平(多巴胺、去甲肾上腺素和血清素)。
▻ 息风颗粒 + 心理干预
一项随机对照试验(n=120)比较了“息风颗粒联合心理干预”与西药“硫必利”的疗效,息风颗粒与心理干预相结合,可显著改善抽动患儿的临床症状,有效缓解症状,安全性高。
▻ 针刺 + 安神颗粒
一项对118名“心肝火旺”型抽动症儿童的随机试验,比较了“针刺联合安神颗粒”与西药“盐酸替亚必利片”的疗效。结果表明,针刺与安神颗粒(Anshen Zhicheng Granule)的结合疗法在缓解抽动、改善神经递质和神经功能方面,效果优于单独使用西药,且不良反应更少。
▻ 耳穴贴压 + 益智宁神液
一项对90名抽动症儿童的随机对照试验,评估了“耳穴贴压”联合“益智宁神液”的疗效。结果显示,与单用药物相比,联合疗法的效果更优,且安全、无明显毒副作用。
▻ 小儿黄龙颗粒:改善多动症
中药复方“小儿黄龙颗粒”能有效改善多动症模型大鼠的多动、冲动和焦虑样行为。研究对比了胃溶、肠溶和结肠溶三种制剂,发现结肠靶向释放的治疗效果最为显著。
其作用机理涉及恢复肠道菌群稳态、减轻全身性炎症反应以及修复受损的肠道和血脑屏障。治疗后,多动症模型大鼠体内异常的氨基酸代谢、神经递质调控和短链脂肪酸生成得到纠正。
▻ 静安汤:改善多动症
静安汤是一种中药方剂,过去20年来,静安汤在临床、药理学和制药领域广泛研究。
注:静安汤是南京中医院研发的专有配方,已获江苏省医药产品管理局注册证书(苏药制字Z20100001)。
研究发现,静安汤能够增加肠道中产丁酸盐细菌(特别是毛螺菌科Lachnospiraceae NK4A136群)的丰度,从而提升结肠和纹状体中的丁酸盐水平。丁酸盐通过抑制TLR4/HDAC3/NF-κB信号通路,促进小胶质细胞向抗炎的M2型极化,进而减轻神经炎症,改善肠道屏障和血脑屏障的完整性,最终有效缓解抽动症相关的刻板行为、多动和认知障碍。
doi.org/10.1016/j.phymed.2025.157009
生 活 方 式
► 运动
运动可以帮助减轻压力、改善情绪,并可能减少抽搐的频率和严重程度。对于患有多动症的人来说,运动也有助于提高注意力并减少多动。
– 每天至少进行30分钟的中等强度运动
– 选择喜欢且可持续的活动
– 考虑参加团队运动或团体健身课程以进行社交互动
任何运动,包括骑自行车、跳舞、慢跑、滑冰、棒球、游泳等,都可能对抽动症孩子有所帮助。
▻ 运动的核心机制
▻ 不同运动类型的具体效果
急性有氧运动: 比如跑步、跳跃
– 改善执行功能,包括选择性注意、信息处理和任务规划。
慢性/长期有氧运动:
– 改善ADHD儿童普遍较弱的注意力和记忆能力。
开放性技能运动:如足球(环境多变,需要高度执行功能)
– 在改善执行功能,特别是抑制性控制方面,比封闭性技能运动更有效。长期参与有助于儿童形成定向行动模式,从而规范行为、减少冲动。
封闭性技能运动:比如跑步、骑行(环境稳定)
– 对改善工作记忆有显著效果,尤其是在长期训练后。
▻ 瑜伽的特殊作用:
一个例外研究显示,每周进行一次60分钟的瑜伽,持续20周后,儿童的多动和攻击性行为得到了改善。这表明对于以多动为主的ADHD个体,瑜伽可能是一种有重要意义的方法。
► 建立规律的睡眠习惯
充足的睡眠对于管理抽动秽语综合征和注意力缺陷多动障碍症状至关重要。睡眠不足会加剧抽动并增加注意力和冲动控制的难度。
– 设定固定的睡觉和起床时间
– 创建放松的睡前仪式
– 睡前限制屏幕使用时间
– 确保舒适的睡眠环境
► 解压练习
正念可以帮助个人更意识到他们的抽动冲动和注意力缺陷多动障碍症状,从而实现更好的管理。它还可以减轻整体压力和焦虑。研究显示,它对改善“注意力不集中”有中等效应。其最一致的积极效果是能显著减轻家长育儿压力、改善儿童情绪调节。
▻ 正念和冥想练习:
– 练习当下时刻的觉察
– 培养对思想和感觉的非评判性观察
– 在一天中穿插进行简短的正念练习
▻ 放松技巧和深呼吸练习:
– 练习膈式呼吸
– 尝试引导想象或视觉化练习
– 将渐进式肌肉放松融入日常生活
习惯逆转训练(HRT)已被证明在减少抽搐频率和严重程度方面具有显著效果。它使个人能够主动管理抽搐,而不是感到被抽搐所控制。
▻ 习惯逆转训练用于抽动管理:
– 增加对抽动欲望的意识
– 建立竞争性反应来替代抽动
– 练习放松技巧以减少整体紧张
以上这些技巧可以帮助减少整体紧张和焦虑,这可能导致抽动频率和严重程度的降低。它们还可以帮助患有注意力缺陷多动障碍的人平静快速的想法并提高注意力。
综上,我们了解到注意缺陷多动障碍与抽动障碍是与全身健康状态紧密相连的复杂病症。越来越多的科学证据揭示了肠道菌群通过“肠-脑轴”在其中的关键作用。从肠道通透性增加(“肠漏”)引发的低度炎症,到特定菌群失衡(如普拉梭菌或梭菌属)对神经递质代谢的直接影响,都为我们理解这两种疾病提供了全新的视角。
这一发现为我们开辟了全新的干预视角:从“头痛医头”的传统干预模式中跳脱出来,转向探寻并解决问题的根源。这种通过调理消化系统来改善大脑功能的思路,与中医“培土生金,调理脾胃以宁心神”的千年智慧不谋而合,也是中西医理论在更高维度上的融合与共鸣。
而要将这一整体观精准地应用于每个独特的个体,肠道菌群检测便扮演了关键的导航角色。当我们可以通过调整饮食、补充益生菌等方式来重塑肠道微生态时,就为改善这些多动症和抽动症等神经发育障碍提供了更加温和且可能更有效的干预手段。
主要参考文献
Martino D, Johnson I, Leckman JF. What Does Immunology Have to Do With Normal Brain Development and the Pathophysiology Underlying Tourette Syndrome and Related Neuropsychiatric Disorders? Front Neurol. 2020 Sep 16;11:567407.
Wang X, Wang N, Gao T, Zhang Y, Fu Z, Zhao Y, Huang Y, Zheng X, Gao X, Lu L, Yang L. Symptom-specific gut microbial and metabolic profiles in ADHD reveal SCFA deficiency as a Key pathogenic mechanism. Gut Microbes. 2025 Dec;17(1):2537755.
Wang Y, Xu H, Jing M, Hu X, Wang J, Hua Y. Gut Microbiome Composition Abnormalities Determined Using High-Throughput Sequencing in Children With Tic Disorder. Front Pediatr. 2022 May 4;10:831944.
You L, Peng H, Liu J, Sai N, Zhao W, Li X, Yang C, Guo P, Ni J. Xiaoer Huanglong pellets remodels the periphery microenvironment to improve attention deficit hyperactivity disorder based on the microbiota-gut-brain axis. Phytomedicine. 2025 Sep;145:157007.
Lewis N, Lagopoulos J, Villani A. Gut-Brain Inflammatory Pathways in Attention-Deficit/Hyperactivity Disorder: The Role and Therapeutic Potential of Diet. Metabolites. 2025 May 19;15(5):335.
Eder K, Schneider-Momm K, Puce TK, Tobergte M, Clement HW, Rauh R, Schulz E, Biscaldi M, Clement C, Fleischhaker C. The Acute and Long-Term Benefits of the Oligoantigenic Diet for Children and Adolescents on the Three Symptom Subdomains of ADHD: Inattention, Hyperactivity, and Impulsivity. Nutrients. 2025 Jun 3;17(11):1916.
Rizzo R, Prato A, Scerbo M, Saia F, Barone R, Curatolo P. Use of Nutritional Supplements Based on L-Theanine and Vitamin B6 in Children with Tourette Syndrome, with Anxiety Disorders: A Pilot Study. Nutrients. 2022 Feb 18;14(4):852.
Novau-Ferré N, Papandreou C, Rojo-Marticella M, Canals-Sans J, Bulló M. Gut microbiome differences in children with Attention Deficit Hyperactivity Disorder and Autism Spectrum Disorder and effects of probiotic supplementation: A randomized controlled trial. Res Dev Disabil. 2025 Jun;161:105003.
Smith BL, Vafeiadou K, Ludlow AK. Nutrient intake and food selectivity in children with Tourette syndrome. Nutr Neurosci. 2025 Jun;28(6):670-678.
Geng J, Liu C, Xu J, Wang X, Li X. Potential relationship between Tourette syndrome and gut microbiome. J Pediatr (Rio J). 2023 Jan-Feb;99(1):11-16.
Bai L, Jin M, Zhang Q, Sun S. Progress in research on nutrition, neuroinflammation and dopaminergic alterations in Tic disorders. Front Pediatr. 2025 May 20;13:1526117.
Teleanu RI, Moldoveanu ET, Niculescu AG, Predescu E, Roza E, Tincu IF, Grumezescu AM, Teleanu DM. Liposomal and Lipid-Based Drug Delivery Systems: Bridging Gut Microbiota and Pediatric Disorder Treatments. Pharmaceutics. 2025 May 28;17(6):707.
Li B, Zhu J, Zhang B, Ling Z, Zhao Y, Leng W, Zhang Q, Zhou X. Evidence Based Research on Medication Patterns in the Traditional Chinese Medicine Treatment of Tic Disorders: A Complete Review. Neuropsychiatr Dis Treat. 2025 Sep 10;21:2001-2016.
Yu X, Zhu M, Tang Q, An S, Tan H, Wang X, Zhang J, Tian J, Li J. Traditional Chinese Medicine in the Comprehensive Management of Tourette Syndrome: Insights from Genetics and Pathophysiology: A Review. Drug Des Devel Ther. 2025 Sep 11;19:8181-8194.
Navab F, Abbasi K, Heidari H, Ghiasvand R, Clark CCT, Bagherniya M, Hassanizadeh S, Rouhani MH. Associations between dietary inflammatory index (DII) scores and attention deficit hyperactivity disorder (ADHD) in children. Sci Rep. 2025 Aug 22;15(1):30884.
Kang X, Cheng E, Guo P, Xi L, Xiang C, Xu S, Zhang Y, Yang Y, Zhang J, Long H. Jing An decoction alleviates neuroinflammation in Tourette syndrome by regulating butyrate-mediated microbiota-gut-brain axis. Phytomedicine. 2025 Sep;145:157009.
Liu Y, Zhang P, Sun H. A narrative review of research advances in gut microbiota and microecological agents in children with attention deficit hyperactivity disorder (ADHD). Front Psychiatry. 2025 May 23;16:1588135.
Yu X, Zhu M, Tang Q, An S, Tan H, Wang X, Zhang J, Tian J, Li J. Traditional Chinese Medicine in the Comprehensive Management of Tourette Syndrome: Insights from Genetics and Pathophysiology: A Review. Drug Des Devel Ther. 2025 Sep 11;19:8181-8194.
Li B, Zhu J, Zhang B, Ling Z, Zhao Y, Leng W, Zhang Q, Zhou X. Evidence Based Research on Medication Patterns in the Traditional Chinese Medicine Treatment of Tic Disorders: A Complete Review. Neuropsychiatr Dis Treat. 2025 Sep 10;21:2001-2016.
Navab F, Abbasi K, Heidari H, Ghiasvand R, Clark CCT, Bagherniya M, Hassanizadeh S, Rouhani MH. Associations between dietary inflammatory index (DII) scores and attention deficit hyperactivity disorder (ADHD) in children. Sci Rep. 2025 Aug 22;15(1):30884.
Shah N, Nadella H, Williams S. Non-pharmacological Approaches to Managing Attention-Deficit Hyperactivity Disorder in Pediatric Populations: A Scoping Review. Cureus. 2025 Jul 13;17(7):e87810.
Di Salvo G, Filippo L, Perotti C, Pellegrini L, Rosso G, Maina G. Adult ADHD: associated medical conditions and related factors. Int J Psychiatry Clin Pract. 2025 Sep;29(3):125-129.
Chen L, Li Z, Fan Y. Neurodevelopmental disorders and gut-brain interactions: exploring the therapeutic potential of pycnogenol through microbial-metabolic-neural networks. Front Cell Infect Microbiol. 2025 Jun 11;15:1601888.
Wang N, Gao X, Zhang Z, Yang L. Composition of the Gut Microbiota in Attention Deficit Hyperactivity Disorder: A Systematic Review and Meta-Analysis. Front Endocrinol (Lausanne). 2022 Mar 18;13:838941.
Talat, A., Zuberi, A. & Khan, A.U. Unravelling the Gut–Microbiome–Brain Axis: Implications for Infant Neurodevelopment and Future Therapeutics. Curr Microbiol 82, 390 (2025).
Tas, E., Ulgen, K.O. Exploring the Integrated Gut-Brain Metabolic Model for ADHD. Biochem Genet (2025).
Sibley MH, Bruton AM, Zhao X, Johnstone JM, Mitchell J, Hatsu I, Arnold LE, Basu HH, Levy L, Vyas P, Macphee F, Gonzalez ES, Kelley M, Jusko ML, Bolden CR, Zulauf-McCurdy C, Manzano M, Torres G. Non-pharmacological interventions for attention-deficit hyperactivity disorder in children and adolescents. Lancet Child Adolesc Health. 2023 Jun;7(6):415-428.
Martin J. Why are females less likely to be diagnosed with ADHD in childhood than males? Lancet Psychiatry. 2024 Apr;11(4):303-310.
Trends of incident adult Attention-deficit/hyperactivity disorder diagnoses before, during and after the pandemic provincial state of emergency in British Columbia (2013–2023): a population-based study. Hu, Kevin et al.The Lancet Regional Health – Americas, Volume 0, Issue 0, 101223

谷禾健康
当一只狗突然出现全身僵硬、四肢抽搐、口吐白沫,往往会令主人陷入恐慌 —— 这很可能是癫痫发作的典型症状。
作为犬类最常见的慢性神经系统疾病之一,癫痫发病率高达0.6-0.75%,相当于每200只狗中就有1-2只受其困扰。更令人揪心的是,传统抗癫痫药物虽然有效,但约三分之一的患病狗狗对传统抗癫痫药物(如苯巴比妥、左乙拉西坦)反应不佳,最终发展成“耐药性癫痫”。
频繁发作不仅损害狗狗的大脑功能,还会导致焦虑、认知障碍等行为共病,严重降低生活质量,且药物副作用(嗜睡、共济失调、肝损伤、多食等)常常让主人进退两难。因此,迫切需要更深入地了解狗癫痫的潜在机制,并寻求提高疗效和减少副作用的新型治疗方法。
近年来,“肠道菌群–肠–脑轴”(MGBA)逐渐成为研究热点。肠道菌群——被誉为身体 “第二大脑” 的微型生态系统,越来越多的研究表明,狗狗肠道里那些看不见的微生物,不仅主管消化功能,还可以通过复杂的菌群-肠-脑轴系统与大脑建立起深度互联。其中涉及代谢、神经、免疫和内分泌机制,深刻影响着包括癫痫在内的神经系统健康。相反,微生态的失衡会对生理学产生不利影响,并可能是导致癫痫发作背后的 “隐形推手”。
研究显示,癫痫犬的肠道菌群与健康犬显著不同,尤其是与抑制性神经递质GABA和抗炎短链脂肪酸(SCFAs)相关的菌群(如假单胞菌目、普雷沃菌科、瘤胃菌科、消化球菌科)丰度下降。失衡菌群可通过四条途径——代谢产物(如SCFAs)、神经信号(如GABA、血清素)、内分泌(HPA轴)与免疫炎症——提升脑兴奋性,诱发或加重癫痫发作。由此,面向菌群的非传统“靶向疗法”展现出应用潜力。包括:
一、生酮饮食/MCT饮食: 效果最显著。多项临床研究显示,添加中链甘油三酯(MCT)的饮食,能使9-14%的癫痫犬完全无发作,13-43%发作频率减少超50%,还可能改善行为共病(如多动、恐惧)。
二、特定益生菌: 动物与人类研究均显示一定潜力,例如可提升产GABA菌的丰度,其可能有助于调节神经兴奋性。然而,就犬癫痫而言,其临床疗效仍缺乏充分证据,仍需高质量、严格设计的研究加以验证与确认。
三、抗生素: 个别案例表现出显著性效果,但风险高(可能诱发癫痫耐药性),还会破坏肠道微生态,非常规推荐。
四、粪便菌群移植(FMT): 初步研究显示对改善癫痫相关的行为共病(焦虑、多动)效果显著,对发作控制效果不一,是极具前景的新方向。
本文将深入探讨肠道菌群是如何影响犬类癫痫,并结合近年来最新的研究文献,为宠物主和兽医提供全新思路和创新治疗与管理方案。
▸ 什么是犬类癫痫?
癫痫是犬类常见的慢性神经系统疾病。其由皮质神经元异常引起,涉及抑制性神经递质功能受损或兴奋性神经递质过度释放,导致突发性的短暂脑功能紊乱。
临床表现包括反复自发性发作、感觉异常、肢体抽动、意识丧失、行为改变和肌痉挛。正常时,神经元依靠精确的电信号传递信息;发作时,神经元出现异常同步放电,进而引发短暂的脑功能障碍。
▸ 狗的癫痫发作包括三个阶段:
•发作前期:狗狗可能会出现焦躁、不安、躲藏、或寻求关注的异常行为,可能伴随呜呜声或者颤抖。
•发作期:意识丧失、倒地、全身或者局部抽筋、四肢划动(强直-阵挛最常见)、口吐白沫、大小便失禁等。
•发作后期:可能陷入短暂昏迷或意识混乱,有意识但还没有功能。
在发作后阶段,大脑逐渐恢复正常功能。但持续时间可从片刻至数小时甚至数天。此时动物常迷失方向、行为异常(如重复发声、强迫性行走不避障),并出现疲劳、共济失调、饥饿或口渴增加。还可能急于排尿排便、极度疲惫并长时间睡眠,偶见发作后失明或攻击性。
癫痫与其合并症之间复杂关系的简化
Peek SI,et al.Vet J.2024
临床上,癫痫多表现为运动症状,如面部抽搐、反复点头和有节律的眨眼;常伴自主神经兴奋(瞳孔散大、流涎、呕吐)及行为改变(异常黏人)。
▸ 癫痫发作的原因
国际兽医癫痫工作组(IVETF)将癫痫发作的原因分为反应性癫痫(毒性或代谢紊乱所致)、结构性癫痫(颅内/脑部病变)和特发性癫痫。
•特发性癫痫是最常见的类型
特发性癫痫也叫作原发性癫痫,它指的是狗狗在没有明显的外部原因或脑部结构异常的情况下出现的癫痫发作,一般认为和遗传因素有关,而导致的大脑皮层及皮层下中枢对外界刺激敏感性增高,容易感受来自外界环境的刺激。特发性癫痫的患病率为53.8%,是犬癫痫最常见的病因。
影响癫痫及其合并症的机制
Peek SI,et al.Vet J.2024
原发性癫痫一般在6个月—6岁的狗中比较常见,而且会随着年龄的增长,发作的次数也会更加频繁,程度也会更加严重。某些品种的狗狗更容易患病,如比格犬、比利时牧羊犬、拉布拉多犬等。
!
传统治疗方法的困境
传统治疗的困境在于:常用抗癫痫药物主要作用是抑制异常放电,但约30%的狗狗对药物反应不佳,并逐渐出现耐药性,导致控制效果有限、复发风险增加。与此同时,长期用药常伴随一系列不良反应,包括明显的嗜睡、步态不稳(共济失调)、食欲显著增加以及潜在的肝毒性等,进一步削弱生活质量。
需要强调的是,癫痫带来的负担远不止“发作那一刻”的痛苦,它会以持续、深刻的方式影响患犬的日常功能、情绪状态和家庭照护压力。相较之下,肠道菌群相关研究正在提供新的视角,有助于更深入地理解癫痫的致病机制,并为制定更具针对性的个体化治疗策略开辟新的思路。
狗狗的肠道是一个庞大而复杂的微生态系统,该生态系统包括肠上皮细胞、粘液层、免疫系统和管腔环境。其中定植着数万亿微生物,包括细菌(占绝大多数 98% 以上)、真菌、病毒等,其中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)是健康犬的核心优势菌群。
这些微生物不仅参与营养物质消化吸收的基础功能,还在新陈代谢、免疫系统调节和防御病原体等多个过程中发挥重要作用,从而影响全身健康:
▸ 肠道微生物群的作用
•代谢工厂:合成B族维生素、发酵膳食纤维产生短链脂肪酸(SCFAs),如乙酸盐、丙酸盐和丁酸盐等。短链脂肪酸为其他组织提供能量,支持肠道细胞的生长和分化,并有助于肠道pH值恒定。此外,这些脂肪酸具有抗炎特性。
•免疫屏障:刺激肠道黏膜免疫细胞(如 T 细胞、巨噬细胞),抵御病原体入侵。
•神经信号传递:通过菌群-肠-脑轴与大脑进行交流,影响神经递质合成、炎症反应和应激激素分泌。
▸ 狗的攻击性或恐惧与肠道菌群存在联系
大脑与肠道之间的交流是一个复杂且双向的过程,涉及多个系统:包括中枢神经系统、肠道神经系统、内分泌系统和免疫系统。
这些系统通过神经信号、激素信号和免疫信号进行沟通。近年来的研究发现,肠道微生物群可能对“肠-脑轴”有着重要的影响。因此,近期的研究将这一轴系命名为为“微生物群-肠-脑轴”。肠道微生物群产生各种代谢物,这些代谢物会对大脑功能产生影响,并潜在地调控着健康的诸多方面。例如,在狗和小鼠中,分别发现了菌群失调与行为/攻击性和应激反应之间的相关性。
•攻击性强的狗中链状杆菌属和巨单胞菌属增加
最近的一项研究就发现,狗的攻击性或恐惧行为,与肠道菌群失调存在关联。他们在攻击性强的狗狗粪便样本中,发现了异常的细菌结构、高度的变异性,以及某些细菌尤其是链状杆菌属(Catenibacterium)和巨单胞菌属(Megamonas)数量的增加。
对于存在恐惧行为的狗,仅见乳酸菌(Lactobacillus)增多,整体菌群无显著变化。乳酸菌可影响抑制性神经递质 GABA 的生成。研究者推测,这些菌群变化可能导致神经活性代谢物异常,并通过与中枢神经系统互动影响行为。
注:需强调的是,该研究仅显示肠道菌群异常与行为相关,尚无因果证据,无法确认菌群异常直接引发攻击性增加。
•癫痫狗体内GABA产生菌和短链脂肪酸产生菌减少
多项研究对比了健康狗与癫痫犬之间的肠道菌群,并发现了其中的差异性:
与健康犬相比,癫痫犬粪便中乳酸菌数量无显著差异。但β多样性分析显示,无论是否接受抗癫痫药物,癫痫犬的肠道菌群结构均与健康犬不同,且差异主要来自低丰度的非优势菌群。具体而言,癫痫犬的假单胞菌目(Pseudomonadales)、普雷沃氏菌科(Prevotellaceae)、瘤胃球菌科(Ruminococcaceae)和消化球菌科(Peptococcaceae)显著减少。
假单胞菌可将谷氨酸转化为重要的抑制性神经递质 GABA。尽管 GABA 不能直接穿过血脑屏障,但研究推测其可经迷走神经通路间接影响中枢神经系统。因此,GABA 产生菌减少或干扰癫痫发作的频率与严重程度。
普雷沃氏菌科、瘤胃球菌科与消化球菌科为短链脂肪酸(SCFAs)生产者。SCFAs 不仅能穿越血脑屏障,还可在大脑中调节 GABA、谷氨酸与谷氨酰胺水平,并以多种方式维持脑内稳态。
这些发现表明,肠道菌群失衡——尤其是 GABA 与 SCFAs 产生菌的减少——可能通过影响神经递质水平与脑功能,参与犬特发性癫痫的发病。
此外,有研究团队发现,脑膜脑脊髓炎犬的普雷沃菌氏科(Prevotellaceae)亦低于健康犬,提示该菌群减少或为多种犬类神经系统疾病的共同特征或潜在风险因素。
然而,还有团队的更新研究得出不同结论:癫痫犬的乳酸菌反而多于健康犬;经过一个月生酮饮食后,这一差异明显缩小,提示饮食干预可通过调节特定菌群影响癫痫状况。
▸ 肠道与大脑之间的信息交流
微生物群-肠-脑轴是一个复杂且动态的系统,肠道与大脑之间通过代谢、神经、内分泌和免疫途径参与信息交流传递:
•代谢通路中SCFAs降低神经元过低兴奋
正如前文所说,肠道菌群与宿主之间存在着复杂且互利的关系。肠道细菌可分解进入结肠的未消化膳食纤维,生成短链脂肪酸(SCFAs),包括乙酸、丙酸和丁酸。SCFAs 是结肠细胞的主要能量来源,有助于维持肠道稳态与屏障功能;例如,体外研究显示丁酸可通过促进紧密连接蛋白组装强化屏障。
SCFAs还能跨越血脑屏障(BBB),通过多种机制直接作用于大脑,如增强 BBB、调节神经传递、影响小胶质细胞的成熟与功能。通过抑制肠道与神经炎症,SCFAs 亦可能降低神经元过度兴奋,进而减少癫痫发作的频率或严重程度。
•调节神经递质的水平影响情绪和行为
肠道微生物群通过调节神经递质的水平(包括血清素、多巴胺、去甲肾上腺素和γ-氨基丁酸(GABA)),在神经功能中扮演着关键角色。尽管肠道产生的神经递质直接穿过血脑屏障、作用于中枢神经系统的可能性不大,但它们可能间接影响中枢神经系统,进而作用于情绪、行为等生理过程。这种神经信号的传递很可能通过迷走神经或肠神经系统实现。
代谢物在大脑的兴奋/抑制平衡和癫痫发生的作用
Shah H,et al.Microorganisms.2024
γ-氨基丁酸(GABA)是一种重要的抑制性神经递质,存在于中枢和肠道神经系统中,可由多种乳酸菌产生,包括乳杆菌属(Lactobacillus)、肠球菌属(Enterococcus)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus)、丙酸杆菌属(Propionibacterium)与魏斯氏菌属(Weissella)。GABA能抑制杏仁核过度活跃,防止异常情绪与行为;其失衡常与压力和焦虑相关。由此引出问题:肠道乳酸菌产生的 GABA 能否进入杏仁核,或通过投射至杏仁核的神经元发挥作用?
为探究乳酸菌来源的 GABA 如何调控情绪,在小鼠中发现,长期补充特定乳杆菌可通过调节杏仁核及其他脑区的GABA受体表达,降低焦虑与抑郁样行为;但该效应依赖完整的迷走神经。除焦虑与抑郁外,GABA 失衡亦与癫痫、精神分裂症与自闭症谱系障碍等相关。
•血清素影响进食、睡眠、社交、情绪等
肠道产生的另一种重要的神经递质是血清素(5-HT)。人体超过90%的血清素是在肠道中产生的,仅不到10%由大脑产生。念珠菌属(Candida)、链球菌属(Streptococcus)、埃希氏菌属(Escherichia)和肠球菌属(Enterococcus)等肠道菌群都能合成血清素。
血清素会影响进食、睡眠、认知、社交互动、焦虑和情绪调节等功能。有研究表明,肠道中产生的血清素也可通过刺激迷走神经影响大脑,影响情绪和神经应激反应。
•影响HPA轴调控多种生理过程
除了调控前面提到的通路,肠道微生物群还通过调节肠–脑轴相关的内分泌系统发挥关键作用,尤以影响下丘脑–垂体–肾上腺轴(HPA 轴)为甚。HPA 轴是维持内分泌稳态的核心系统,可随压力变化调控多种生理过程。
当身体处于压力状态时,下丘脑会释放促肾上腺皮质激素释放激素(CRH)。这种激素会刺激垂体,使其向血液中分泌促肾上腺皮质激素(ACTH)。而 ACTH 会进一步促使肾上腺产生皮质醇——人体最主要的应激激素。皮质醇的作用广泛,会影响免疫反应、新陈代谢和大脑功能等多个方面。
肠道菌群能影响 HPA 轴的平衡状态:某些细菌可能会过度激活这一系统的活动,进而改变身体对压力的行为反应。反过来,压力事件及由此引发的 HPA 轴激活,也会导致肠道菌群的组成发生变化。这种菌群变化可能破坏肠道屏障的完整性,增加肠道通透性,使得内毒素和病原体进入血液,引发不受控制的炎症反应。而细胞因子等炎症介质能穿过血脑屏障(BBB),进一步激活 HPA 轴,形成恶性循环:压力、炎症和菌群失衡相互加剧,越演越烈。
•产生炎症介质影响神经元健康和行为
肠道微生物会影响肠道和大脑中免疫细胞的活性与功能。肠道菌群通过模式识别受体(PRRs)与免疫系统互动,是激活免疫细胞的关键。这些受体能识别微生物的特定成分,进而触发免疫反应,比如促使身体产生肿瘤坏死因子-α(TNF-α)等细胞因子。
这些炎症介质可以穿过血脑屏障,作用于中枢神经系统(CNS):它们会激活大脑中的常驻免疫细胞——小胶质细胞,引发神经炎症,进而影响神经元健康和行为。事实上,神经炎症是多种神经系统疾病的基础,比如帕金森病、阿尔茨海默病(老年痴呆)和癫痫等。
小结
总的来说,菌群—肠—脑轴是一个由神经系统、免疫系统和肠道菌群共同构成的复杂双向交流网络。这种密切的相互作用,在调节心理健康、行为表现以及维持整个机体的稳态中,都发挥着至关重要的作用。
尽管目前已开发出许多抗癫痫药物,但大约1/3的狗癫痫病例被归类为耐药性。这也意味着即使在服用两种或两种以上的抗癫痫药物后,癫痫发作管理仍然可能无效。此外,许多抗癫痫药物会促进不良反应,例如镇静(表现为精神萎靡、嗜睡)、共济失调(出现步态不稳、呆滞)、多食症、代谢异常和肝脏损伤等。
因此,迫切需要能够改善狗癫痫临床症状的新疗法。新兴研究表明,一些非常规干预手段可能带来新希望:例如生酮饮食、抗生素、益生菌和粪菌移植等,他们或能通过调节菌群-肠-脑轴来调控管理犬特发性癫痫。
近期多项研究评估了靶向肠道微生物群的干预对犬癫痫控制的效果,我们据此总结了通过菌群–肠–脑轴进行干预的治疗策略。
1
生酮饮食
动物模型研究表明,患有癫痫动物的大脑存在葡萄糖利用与代谢异常,导致能量生成不足并提高发作易感性。常见问题包括糖酵解障碍与丙酮酸脱氢酶活性下降。鉴于大脑高能耗特性,这些异常会破坏膜电位稳定与神经信号调控。
生酮饮食是以高脂肪、低碳水化合物和适量蛋白质为特征,是管理癫痫的一种方法。它能维持较低的血糖水平,促使肝脏利用脂肪酸和氨基酸产生酮体(如β-羟基丁酸),即进入“酮症”状态。这些酮体可以作为葡萄糖之外的辅助燃料供大脑使用。
•补充中链甘油三酯可作为大脑的另一种能量来源
在常规含碳水化合物的饮食中添加中链甘油三酯(MCTs),为大脑提供了另一种高效的能量来源。MCTs在胃肠道中迅速水解,生成的中链脂肪酸(MCFAs)可快速吸收并进入门静脉,输送至肝脏和肝外组织,在肝脏中转化为酮体。
与长链脂肪酸不同,MCFAs和酮体一样,无需依赖丙酮酸脱氢酶活性即可进入三羧酸循环(TCA循环),从而为大脑提供更稳定、高效的能量。因此,生酮饮食能以较为稳定的方式满足大脑能量需求,成为一种有益的辅助抗癫痫策略。
•生酮饮食影响GABA和谷氨酸水平从而抗癫痫
除直接供能外,生酮饮食的抗发作效应还可能源于对肠道菌群的调节。多项研究表明,该饮食可重塑人和动物的肠道微生物群,并与抑制性递质 GABA 与兴奋性递质谷氨酸水平升高相关,从而发挥抗癫痫作用。
在犬的研究中,与标准饮食相比,生酮饮食使拟杆菌科增加、放线菌门减少,且 Negativicutes 纲与 Selenomonadales 目相对丰度上升。需强调,这些发现仅为相关性,非因果证据。
综上,生酮饮食,尤其结合MCT补充,可能成为犬特发性癫痫的有前景辅助策略;但其机制与长期不良反应(如肾结石、骨矿物质流失)仍待进一步研究。
2
使用益生菌
益生菌是对肠道健康有益的微生物,主要包含乳酸菌、双歧杆菌和酵母菌等。如今,它在兽医神经学领域,尤其是犬特发性癫痫的研究中,正受到越来越多的关注。
•益生菌有助于减轻癫痫的严重程度
研究显示,益生菌可能有助于控制癫痫发作。在癫痫模型大鼠中发现,补充益生菌可显著减轻发作严重度并改善认知;其机制或与强化肠屏障、降低全身炎症、产生有益代谢物有关。另一项针对儿童难治性癫痫的研究也显示,益生菌能降低发作频率和严重程度,提升生活质量。
然而,目前尚无公开证据证实其对癫痫犬的直接益处;不同菌株、剂量与疗程可能影响效果,仍需更多研究验证其在犬中的疗效。
综上所述,虽然益生菌为犬癫痫管理提供了新思路,但实际应用需谨慎基于科学证据。未来通过深入探索,益生菌有望成为辅助治疗犬癫痫的有效工具,帮助患病动物获得更优质的生活。
3
抗生素
•抗生素可能对犬癫痫具有治疗效果
研究发现,抗生素可能对某些抗癫痫药耐药犬的发作频率产生意想不到的影响。该研究起源于一例临床个案:一只确诊为特发性癫痫且对抗惊厥药物耐药的犬只,却因疑似感染接受了为期一个月的抗生素(阿莫西林-克拉维酸)治疗。令人惊讶的是,在服药期间,原本平均每周发作2.5次的这只犬竟未出现任何癫痫发作。然而停药后,症状再次出现。
随后,研究人员对另外4只耐药性癫痫犬使用同种抗生素为期33天的治疗。结果呈现较大差异:2只完全停止发作,1只发作频率减少80%,但1只反而加重。不过,这只发作加重的犬在治疗期间更换了饮食,这可能干扰了结果——既往研究显示,饮食可能通过改变肠道菌群影响大脑功能,进而关联癫痫,这或许是其发作加重的原因。遗憾的是,该研究未进行粪便分析,无法明确治疗前后肠道菌群的变化是否与发作频率相关。加之样本量极小(仅4只犬)、缺乏对照组、存在多种混杂因素,因此目前所得结论仅属个案观察,尚未具备统计学支持。
总体而言,证实抗生素对癫痫犬有益的证据仍十分有限。盲目用药不仅可能无效,某些抗生素(如头孢类及部分 β‑内酰胺类)还可能因抑制 GABA 受体而诱发癫痫;广谱抗生素长期使用亦带来耐药等公共卫生风险,须谨慎对待。抗生素能否作为犬癫痫的辅助治疗仍待高质量研究验证;治疗决策应基于兽医专业评估,权衡风险与获益。
4
粪菌移植
粪菌移植(FMT)是将健康供体粪便移入受体体内,以重建肠道菌群、改善相关胃肠疾病的疗法,已在人体医学中应用并证实有效。
有观点认为 FMT 或可用于癫痫治疗,但证据仍有限。首次报道一例合并克罗恩病与癫痫的患者在接受 FMT 后发作完全停止,然仅为个案,需更大样本验证。
•粪菌移植有助于改善肠道菌群和神经递质水平
近期,有团队开展探索性研究,评估FMT对耐药性癫痫犬行为并发症(恐惧、焦虑样行为)的影响。结果显示,FMT 可改善冲动行为并提升患犬及主人的生活质量。该研究的供体为仅用苯巴比妥且停发超过一年的特发性癫痫犬。
移植后,行为改善伴随肠道菌群及 GABA、谷氨酸等神经递质水平变化,但发作频率与严重度仅部分个体获益。需注意样本量很小,统计效力不足。
总体而言,FMT 显示出作为人犬癫痫辅助治疗的潜力,但仍需更多双盲随机对照试验以严谨评估其安全性与有效性。
近年来,犬特发性癫痫与肠道菌群的关系逐渐受到重视,提示肠道健康与神经系统疾病密切相关,并为防治提供新方向。现有证据显示,菌群失衡可能是诱发癫痫的关键因素之一;通过饮食调整、益生菌、抗生素或粪菌移植等方式调节菌群,或可帮助降低发作频率。
尽管在实验室动物模型及人类癫痫研究中,调节肠道菌群已展现出降低发作频率的积极效果,但针对狗狗的研究仍需进一步深入:
机制与长期影响待明确:目前尚不清楚肠道菌群调节干预狗狗癫痫的具体作用机制,其长期使用效果也需更多研究验证;
需结合临床与粪便分析:通过治疗前后的粪便菌群检测,搭配全面的临床研究,才能更清晰揭示 “肠—脑轴” 的运作规律,以及它如何影响癫痫发作;
安全用药是核心:给癫痫狗狗使用菌群调节疗法时,必须警惕潜在副作用与药物相互作用。无论是选择抗生素、定制专属饮食,还是挑选益生菌,都需严格筛选,才能兼顾安全性与有效性。
总体而言,探索肠道菌群对犬特发性癫痫的影响,已成为兽医领域极具潜力的新方向。随着对 “肠—脑轴” 机制的深入了解,未来有望开发出更高效的癫痫治疗方案,帮助患病狗狗更好地控制发作,提升生活质量。
主要参考文献
Blanquet L, Serra D, Marrinhas C, Almeida A. Exploring Gut Microbiota-Targeted Therapies for Canine Idiopathic Epilepsy. Int J Mol Sci. 2025 Feb 18;26(4):1742.
Peek SI, Twele F, Meller S, Packer RMA, Volk HA. Epilepsy is more than a simple seizure disorder: Causal relationships between epilepsy and its comorbidities. Vet J. 2024 Feb;303:106061.
Ding M., Lang Y., Shu H., Shao J., Cui L. Microbiota–Gut–Brain Axis and Epilepsy: A Review on Mechanisms and Potential Therapeutics. Front. Immunol. 2021;12:742449.
Wernimont S.M., Radosevich J., Jackson M.I., Ephraim E., Badri D.V., MacLeay J.M., Jewell D.E., Suchodolski J.S. The Effects of Nutrition on the Gastrointestinal Microbiome of Cats and Dogs: Impact on Health and Disease. Front. Microbiol. 2020;11:1266.
Alessandri G., Argentini C., Milani C., Turroni F., Cristina Ossiprandi M., van Sinderen D., Ventura M. Catching a glimpse of the bacterial gut community of companion animals: A canine and feline perspective. Microb. Biotechnol. 2020;13:1708–1732.
Mondo E., Barone M., Soverini M., D’Amico F., Cocchi M., Petrulli C., Mattioli M., Marliani G., Candela M., Accorsi P.A. Gut microbiome structure and adrenocortical activity in dogs with aggressive and phobic behavioral disorders. Heliyon. 2020;6:e03311.
谷禾健康
近年来,肠道屏障通透性异常增加(intestinal hyperpermeability)的临床诊断呈上升趋势,其病理生理机制涉及多个层面的复杂相互作用。
肠道屏障就像一堵城墙,一旦“城门大开”,各种“异类分子”如病原信号(PAMPs)、脂多糖(LPS)、未消化的蛋白碎片就会趁机溜进固有层和血液,掀起一场免疫风暴。
肠道固有层宛如“安检总站”,这里的树突状细胞和巨噬细胞负责利用“雷达”——比如Toll样受体——扫描入侵分子,然后拉响警报,释放大量炎症信号分子(TNF-α、IL-1β、IL-6)和趋化因子,引发局部炎症反应。
被激活的免疫细胞及其炎症介质通过门静脉循环和淋巴系统进入全身循环,触发远端器官的炎症反应,这种”肠-器官轴”的病理连接可能是类风湿关节炎、强直性脊柱炎、系统性红斑狼疮等自身免疫性疾病以及过敏性疾病、神经退行性疾病的潜在发病机制。
同时,肠道屏障功能受损导致肠道微环境稳态失调,有益共生菌群数量下降而潜在致病菌过度增殖,形成肠道菌群失调,进一步破坏肠道屏障功能并释放更多内毒素,加剧炎症反应,形成病理性正反馈循环。
造成肠道屏障告急的“罪魁祸首”很多:慢性压力、滥用抗生素、非甾体消炎药、高脂快餐、食品添加剂、各种感染和遗传易感性都可能“推波助澜”。理解这套复杂机制,有助于我们探索科学高效的“修复之路”。
本文介绍了目前肠道屏障受损的成因、健康影响和尝试干预改善过度渗透的肠屏障的一些方法。研究表明,预防肠道屏障受损以及在屏障受损时开发治疗方法至关重要。
肠上皮细胞是外界环境和体内环境之间最大的接触部位。胃肠道上皮屏障的功能是防止外来抗原和微生物进入,同时允许吸收必需的营养物质、水和电解质。
肠道屏障由物理屏障、生化屏障、免疫屏障和微生物屏障组成。
肠道屏障
Macura B,et al.Clin Exp Med.2024
▸ 物理屏障
物理(上皮)屏障是整个肠道屏障的重要组成部分。它由单层特化细胞组成:肠上皮细胞、杯状细胞(产生粘蛋白)、潘氏细胞(产生抗菌肽和蛋白质)、肠内分泌细胞、M细胞和肠干细胞。
这些细胞每3-5天更新一次。上皮细胞具有多种功能,并且紧密相连。
▸ 生化屏障
生化屏障由粘液构成,覆盖并保护上皮细胞免受病原体和有害物质侵害。
粘液是一种富含水分(90%–95%)、电解质、脂质(1%–2%)和蛋白质的稀薄分泌物,其中粘蛋白(1%–5%)为其主要结构和功能成分。
doi: 10.1007/164_2016_107.
上图展示了小肠和大肠粘液的生成与分布,包括内外粘液层的结构,并标示了杯状细胞从粘液产生到分泌和扩散的全过程(步骤1至7)。
粘液分泌是一个复杂的过程:杯状细胞在从隐窝底部迁移时用Muc2填充其分泌囊泡,并含有其他成分,例如IgG结合蛋白(FCGBP)的Fc片段、氯通道附件1(CLCA1)、酶原颗粒蛋白16(ZG16)和前梯度同源物2(AGR2)。这些囊泡与顶膜融合后,通过胞吐作用释放内容物,实现粘液分泌。
最后,粘蛋白可以分为两种不同的类型:跨膜粘蛋白和形成凝胶的粘蛋白。
▸ 免疫屏障
免疫屏障与肠道中淋巴组织的存在有关,称为肠道相关淋巴组织(GALT)。GALT系统分布于肠道粘膜及粘膜下层紧邻上皮细胞处,包括上皮内淋巴细胞、派伊尔集合淋巴结和淋巴细胞簇。
GALT系统含有抗原呈递细胞、T细胞、B细胞、浆细胞、巨噬细胞、肥大细胞和粒细胞,并且分泌型IgA(sIgA)主要在肠道中合成。
▸ 肠道屏障的功能-紧密连接调节通透性
大多数膳食蛋白质通过肠上皮细胞进行内吞作用。溶酶体降解导致蛋白质分解成更小的肽,从而避免激活免疫系统。液体和溶质在细胞之间运输。这种转运由紧密连接(TJ)调节。
紧密连接构建蛋白通过特殊的封闭小带蛋白(ZO)与肌动蛋白结合,肌动蛋白是细胞骨架的一部分。 这些蛋白质是调节紧密连接功能的分子的靶元件,因此负责调节肠屏障的通透性。
肠道屏障在外源性或内源性因素的作用下会受到损害,从而导致其正常功能被破坏。
▸ 饮食因素
不良饮食模式
高脂肪、高糖、高盐饮食
过度加工食品和快餐
缺乏膳食纤维的精制食品
过量饮酒
特定食物成分
人工添加剂、防腐剂
过量的乳化剂
某些人工甜味剂
过敏原食物(因人而异)
▸ 药物因素
抗生素:破坏肠道菌群平衡
非甾体抗炎药(NSAIDs):直接损伤肠粘膜
质子泵抑制剂:长期使用影响胃酸分泌
化疗药物:对肠道上皮细胞有毒性作用
▸ 生活方式因素
压力相关
慢性心理压力
睡眠不足或质量差
过度疲劳
运动相关
久坐不动的生活方式
过度剧烈运动(可能增加肠通透性)
▸ 环境因素
空气污染和化学毒素暴露
重金属污染
农药残留
吸烟
▸ 疾病和感染
肠道感染(细菌、病毒、寄生虫)
炎症性肠病
自身免疫疾病
糖尿病等代谢性疾病
▸ 年龄因素
衰老过程中肠道屏障功能自然下降
婴幼儿肠道屏障发育不完善
▸ 空气、水、食物污染等破坏了肠上皮屏障
近几十年来,城市化与全球化带来了巨大的环境变化,污染和气候变化,工业和家庭中常用的化学化合物,生态系统变化,不健康的饮食以及兴奋剂,主要是酒精,烟草和电子烟,可能会破坏皮肤和粘膜表面的上皮屏障。
空气、水、食物污染、微塑料、纳米颗粒、家用化学品和烟草烟雾是常见的上皮屏障破坏因素。这些因素复杂交互,但对生物体的影响取决于其组合及个体易感性。
▸ 微塑料和纳米颗粒会减少肠道粘液产生
近年来,食品和饮用水中的化学污染显著增加,即使是常用的食品添加剂、杀虫剂和饲料添加剂也在其中。最近,关于微塑料和纳米颗粒污染食品的报道越来越多。这些物质可以很容易地穿透组织并与细胞结构相互作用。
微塑料会改变蛋白质结构,与细胞膜脂质相互作用,诱导炎症基因转录,增加促炎细胞因子,导致内质网和线粒体功能障碍,甚至引发细胞因氧化应激而死亡。
纳米颗粒也能引起类似的蛋白结构变化和细胞膜相互作用。纳米塑料已被证明可以诱导炎症基因的转录,增加促炎细胞因子的水平,并改变某些蛋白质的表达。微塑料在胃肠道内吸收率高,可在体内外环境中积累。动物实验证实,聚苯乙烯微塑料会损伤肠道屏障并减少粘液分泌。
下表总结了被认为对肠道屏障状态具有有害影响的主要因素:微塑料,纳米颗粒,洗涤剂和乳化剂,肠道微生物群状态和饮食。
doi: 10.1007/s10238-024-01496-9
暴露于环境因素可以直接削弱肠道上皮屏障的完整性并改变微生物组结构。上皮屏障渗漏和肠道菌群失调常同时出现,促进炎症发生,部分原因是由于免疫细胞紧邻上皮层。
上皮屏障受损时,免疫系统被激活,引发局部炎症,炎症可通过免疫细胞及其分泌的细胞因子扩散至其他系统和器官。因此,多种疾病的发展与上皮屏障渗漏相关。肠上皮受损后,机会性病原体易定植,菌群多样性下降。微生物可移位至更深组织,导致微炎症。此外,化合物暴露还能诱导免疫系统表观遗传变化,促进某些疾病的发生。
▸ 生态失调→上皮损伤→慢性炎症
大量证据表明,微生物组对肠道上皮健康至关重要。正常微生物群调节紧密连接蛋白表达、血管生成、通透性和免疫功能。上皮屏障渗漏时,细菌和病原体穿透上皮,引发炎症并参与多种疾病。过敏性疾病的上升可能与菌群失调和多样性下降有关。
微生物群受到饮食、药物(特别是抗生素、精神药物、质子泵抑制剂)及遗传等影响。与人体共生的非致病性菌群有助于免疫调节,有利于预防慢性疾病并维持免疫平衡。
健康的微生物群通过调控屏障通透性、紧密连接和局部免疫,维持上皮屏障功能。缺乏免疫调节因子,如短链脂肪酸,可导致免疫系统过度激活、上皮炎症和疾病。这种反应主要由TH2细胞、ILC2和嗜酸性粒细胞介导,肥大细胞和巨噬细胞等也参与其中。而菌群失调、上皮损伤和慢性炎症会形成恶性循环,阻碍上皮再生。
同时损伤上皮中的炎症持续激活免疫细胞,可导致炎症扩散至其他器官。
微生物群变化、肠道屏障受损与疾病相互依存,但其因果关系仍有争议。尚不清楚是菌群失调导致屏障功能障碍和疾病,还是疾病先引发炎症和屏障损伤,进而加重细菌移位和器官损害。
因此,肠漏究竟是疾病的起因还是结果?此外,有研究表明,呼吸道或肠上皮屏障破坏以及其他屏障(如血脑屏障、血管内皮屏障)减弱,可能会促进代谢及自身免疫性疾病的发生。
▸ 胃食管反流病患者食管壁存在渗漏
胃食管反流病(GERD)最常见的症状是烧心和反酸,影响全球超过10%的成年人。胃镜检查显示,只有约30%的患者存在明显糜烂,其余70%(非糜烂性反流病,NERD)虽无可见损伤,但仍有症状。
GERD就像胃酸不断冲刷食管墙壁,表面虽完好但可能已“渗漏”,问题可能在于连接细胞的“水泥”。研究发现,GERD患者食管中即使无表面破损,其“水泥”成分也发生了变化:部分蛋白(如E-钙粘蛋白)减少,而其他蛋白(如CLDN-1和桥粒蛋白)则增加。
▸ 功能性消化不良存在十二指肠黏膜屏障渗漏
功能性消化不良(FD)是一种常见的胃肠道疾病,表现为早饱、腹胀、上腹痛或灼热,且常规检查无法发现明确病因。
最新研究发现,FD的核心问题在于十二指肠黏膜屏障渗漏,不仅离子,大分子也能穿透。该屏障损伤与肥大细胞和嗜酸性粒细胞增多,以及ZO-1和钙粘蛋白等紧密连接蛋白减少有关,说明低度炎症和屏障受损是FD的主要致病机制。
▸ 肠易激综合征与“肠漏”有关
肠易激综合征(IBS)是一种常见的功能性胃肠疾病,典型表现为反复腹痛和排便习惯改变(如腹泻、便秘或交替)。
尽管具体病因不明,但大量证据表明,其核心机制与“肠漏”有关。研究发现,几乎所有类型的IBS患者都存在肠道屏障通透性增加的问题。这具体表现为:肠道细胞间的“水泥”(即紧密连接蛋白ZO-1等)被破坏或减少,同时存在低度的黏膜炎症(如肥大细胞活化)。
这种屏障功能的损害,使得肠道内容物更容易“渗漏”过去,激活免疫系统,最终导致了IBS特有的腹痛和排便紊乱等一系列症状。
▸ 高血压患者肠道屏障功能障碍患病率较高
近年来,越来越多的研究关注肠道微生物群与高血压之间的关系。大量证据显示,肠道菌群的生态失调不仅可能促进高血压的发生和发展,还可能加重病情。
与此同时,高血压本身也会对肠道微生物群的组成产生影响,进一步加剧生态失调。研究表明,维持适当和健康的微生物群状态有助于血压的正常化,改善心血管系统的健康,而理想的血压水平同样有助于微生物群落的维持与恢复。
已有结果显示,高血压患者较非高血压患者更易出现肠屏障功能障碍,肠屏障的损伤被认为可能与高血压的发病机制密切相关。这一发现为进一步研究血压调控与肠道健康之间的复杂联系提供了新的思路,也提示改善肠道屏障功能或许有助于高血压的防治。
▸ 炎症性肠病患者即便无症状也会出现肠道通透性增加
炎症性肠病(IBD)患者的肠道微生物群特征主要表现为促炎细菌数量的明显增加,同时多种细胞因子的表达也发生了显著变化。这些变化会导致机体免疫反应失衡,加剧炎症进程。
值得注意的是,在患者尚未出现明显的临床症状之前,尽管处于无症状期,肠道的通透性实际上已经发生了异常改变。这表明肠道屏障功能的损伤可能早于症状表现,为疾病的早期诊断和干预提供了理论依据。
▸ 肠道屏障和菌群稳定影响肝脏健康
研究数据显示,肠上皮细胞和血管屏障的损伤在非酒精性脂肪肝的发展过程中起着关键和必要的作用。肠上皮屏障功能的破坏,使得肠道内容物更容易进入血液循环,进而促进肝脏炎症和脂肪堆积。
此外,肠道菌群的失调以及肠道菌群结构的破坏与这一过程密切相关。肠道菌群异常会导致有害菌数量增加,正常菌群比例下降,其产生的代谢产物也会对肠道细胞产生毒性作用,影响细胞功能和屏障完整性。
这些机制不仅涉及非酒精性脂肪肝的发生与发展,在酒精性肝病中同样存在。酒精摄入可加重肠上皮与血管屏障的损伤,进一步削弱肠道屏障功能,从而成为酒精性肝病患者肠上皮功能障碍的主要原因之一。由此可见,肠道屏障及菌群的稳定性对于肝脏健康至关重要。
▸ 免疫性疾病患者存在菌群失调和屏障渗漏
类风湿性关节炎患者表现为血清zonulin水平升高、肠道菌群失调和屏障渗漏,强直性脊柱炎患者可见亚临床肠道炎症。潘氏细胞对肠道菌群失调的激活可能是疾病早期症状的原因,并证实了脊椎-关节轴的存在。
▸ 帕金森、自闭症患者存在胃肠道症状
在帕金森病中,患者在诊断前数年就表现出胃肠道症状。α-突触核蛋白是帕金森病的典型蛋白质,在肠道中合成,然后通过迷走神经运送到中枢神经系统。相比之下,自闭症谱系障碍儿童会出现肠道症状,如便秘、腹痛和腹泻。对肠道微生物群的研究表明,微生物群多样性与神经系统疾病、拟杆菌减少以及肠粘膜中紧密连接蛋白表达减少之间存在负相关关系。
▸ 糖尿病患者的肠道通透性发生变化
研究显示,肠道通透性变化早于1型糖尿病的临床症状出现,并且与紧密连接蛋白和生态失调的改变,尤其是丁酸盐产生菌减少密切相关。2型糖尿病患者的肠道菌群失调加重了屏障损伤,并促进了炎症状态,导致胰岛素抵抗和β细胞功能障碍。
此外,2型糖尿病患者的高血糖有助于持续的促炎状态。肥胖则与慢性低度炎症密切相关,主要表现为脂肪组织中促炎巨噬细胞的活性增加。代谢紊乱在肥胖人群中也更为常见。
doi: 10.1007/s10238-024-01496-9
在间接或直接诊断试验中,可以评价肠屏障通透性水平。
▸ 口服物质测试
间接检测方法包括口服试剂后测定其在血液或尿液中的浓度,最常用的是糖。乳果糖/甘露醇(L/M)试验是评估小肠通透性的常用方法,通过测量尿中两者的排泄量进行判断。乳果糖为大分子,仅在细胞间连接受损时吸收,甘露醇为小分子能自由通过肠屏障。L/M试验非侵入性且灵敏度高,此外还可使用其他单一或多种糖类的检测方法。
▸ 测量内源物质水平
此外,还可以测量血液中内源性物质的水平。这样的生物标志物包括例如连蛋白、脂肪酸结合蛋白(FABP)、瓜氨酸、胰高血糖素样肽(GLP)-2、脂多糖、脂多糖结合蛋白(LBP)或粪便α1抗胰蛋白酶(AAT)。然而,这些测试不像糖测试那样敏感。
▸ 新型影像技术
新的成像技术,特别是共聚焦激光显微内镜,允许在体内评价静脉注射荧光素作为造影剂后肠屏障的完整性。共聚焦激光显微内镜目前用于诊断胃肠道癌症,以及肠易激综合征或乳糜泻。放大1000倍可以检测肠上皮内的病理变化。
▸ 肠道菌群检测
肠道菌群检测可以提供非常重要的间接线索和风险评估。肠道菌群与肠道屏障健康密切相关。菌群测序可以发现一些可能导致或指示肠道屏障通透性增加的风险因素,例如:嗜黏蛋白菌,AKK菌以及扭链瘤胃球菌等菌对的丰度,以及产丁酸菌减少,特定有害菌增多:某些细菌(如部分革兰氏阴性菌)会产生脂多糖(LPS),这是一种强烈的炎症触发物,会破坏肠道屏障。菌群多样性降低:通常一个多样性低、不稳定的菌群生态系统,其维护屏障功能的能力也会下降。
总之,肠道菌群检测可以揭示与肠道屏障功能受损相关的菌群失衡状态,提供有力的间接证据和风险预警。
功能性胃肠道疾病(FGID)在临床上发病率高、症状慢性且治疗效果有限,已成为重大公共卫生问题。多种病理机制被提出,其中屏障通透性受损是常见特征。局部免疫激活与屏障损伤的先后关系及其在症状发生中的作用仍需进一步研究。
目前的研究表明,治疗这些疾病的一个很有前景的策略,就是直接针对这道受损的屏障进行修复。
这主要包括两大类治疗方法:
一是直接使用药物来加固和修复肠道细胞间的连接,恢复屏障的完整性;
二是通过靶向调节局部的免疫反应,减轻炎症,从而间接保护和修复肠道屏障。
对屏障功能的直接影响
①谷氨酰胺可修复部分人群的肠道通透性
谷氨酰胺是一种非必需氨基酸,是肠细胞和结肠细胞的重要能量来源。谷氨酰胺在接受腔内禁食的Caco-2细胞中保持蛋白质合成和对离子和4 kDa葡聚糖分子的细胞旁渗透性。它还可降低大分子渗透性(40 kDa),其剥夺可促进TNF-α诱导的细菌易位,而不影响TEER。这些和其他体外研究表明,谷氨酰胺补充通过干扰泄漏途径恢复了对离子和小分子增加的细胞旁渗透性。
然而,在人身上的研究结果却不那么一致,有时甚至相互矛盾。这可能是因为补充谷氨酰胺的时机很关键——最好是在肠道屏障还没受损或者刚刚受损时就介入。
不过,最近一项针对腹泻型肠易激综合征(IBS-D)患者的研究带来了好消息:口服谷氨酰胺显著改善了患者的症状,并成功修复了他们受损的肠道通透性。这表明,对于特定人群,谷氨酰胺可能是一种修复“肠漏”的有效治疗选择。
②MLCK抑制剂有助于减轻肠漏
如前所述,通过肠上皮细胞的泄漏途径和细菌移位由肌球蛋白轻链激酶(MLCK)控制。因此,MLCK抑制剂可能是治疗或预防屏障功能改变的潜在药物。
MLCK的物质是控制肠道屏障“阀门”的关键开关。当它被激活时,肠道细胞间的连接就会松开,导致“肠漏”和细菌穿透。因此,开发能抑制MLCK的药物(即MLCK抑制剂)就成了一种非常有前景的治疗思路。
目前,这类药物在动物实验中已有效预防压力或毒素引起的肠道通透性增加及内脏高敏。如果能在人类中安全应用,MLCK抑制剂有望成为治疗“肠漏”相关胃肠疾病的新选择。
③Zonulin肽抑制剂可能修复通透性并预防肠炎
研究发现,Zonulin是一种调节肠道通透性的关键物质。当肠道受麸质或特定细菌等刺激时,Zonulin释放,可打开细胞间紧密连接,增加肠道通透性,导致“肠漏”。
基于此,科学家开发了Zonulin肽抑制剂(如醋酸拉唑肽),能有效阻断Zonulin作用,“锁上”肠道屏障。动物实验显示该药物可修复通透性并预防肠炎,但其在人类中的疗效尚需验证。
临床试验中,虽然乳糜泻患者用药后自觉症状改善,但肠道通透性并无明显下降。因此,Zonulin抑制剂是否能真正用于胃肠道疾病治疗,还需进一步研究确证。
对免疫激活的影响
研究发现,FGID中的炎症主要与肥大细胞、嗜酸性粒细胞和T细胞的轻度活化有关。因此,目前的治疗尝试大多集中在稳定“肥大细胞”上,因为它在肠易激综合征(IBS)等疾病中扮演了核心角色。
①药物治疗
一些药物已经显示出潜力:
-5-氨基水杨酸:可以减少炎症细胞的浸润。
-酮替芬和色甘酸二钠:作为肥大细胞稳定剂,它们在改善IBS和功能性消化不良(FD)的症状方面取得了良好效果,但其具体如何修复肠道屏障的机制还有待阐明。
此外,一些靶向神经调节和抑制肥大细胞的新型药物(如CRF拮抗剂、大麻素类物质)在动物实验中也表现不错,但它们在人体中的实际效果还需要进一步的临床研究来验证。
②缓解肠道炎症的药物
生物治疗主要包括促炎细胞因子抑制剂和整合素拮抗剂:抗TNF治疗、抗IL-12/23治疗、抗整合素治疗。生物疗法,尤其是抗TNF疗法是有效的治疗方法,但对TNF抑制剂的原发性无效或部分患者的继发性无效需要寻找新的治疗方案。
重要的是,炎症环境可能会对上皮干细胞的功能产生负面影响,因此可能会阻碍健康上皮的重建。 肠漏的治疗应该开始尝试确定肠屏障损伤的原因,然后消除这个因素。在肠道屏障恢复之前,使用缓解肠道炎症的药物似乎是合理的。
③恢复肠道微生物群
益生菌是活的微生物,对宿主的健康有有益的影响。益生菌管理减少肠渗漏,其中,影响肠道免疫调节和抗炎作用(例如,sIgA产生的增加)、抗炎作用、加强上皮屏障(例如,粘蛋白和短链脂肪酸(SCFA)的合成增加,以及限制病原微生物生长的细菌素(例如β防御素)的产生。
益生菌还可以增加构成紧密连接的蛋白质的合成。对肠道屏障状态具有保护作用的益生菌主要有鼠李糖乳杆菌GG、乳双歧杆菌BB-12、嗜酸乳杆菌、植物乳杆菌、双歧杆菌、大肠杆菌等。
恢复正常肠道微生物群的另一种方法是粪便微生物群移植(FMT)。该疗法涉及将从健康供体获得的胃肠道微生物群转移到受体的胃肠道。实施前需准确评估患者和供体的肠道及菌群状况,避免盲目移植导致免疫反应和屏障损伤。
④低FODMAP饮食并增加多酚摄入
FODMAP饮食以短链碳水化合物和多元醇为主,这些成分吸收不良且易发酵,因渗透性强会增加肠腔含水量。FODMAP对肠道微生物群和屏障功能有益,但IBS或IBD患者采用低FODMAP饮食更能减少气体和肠腔扩张,减轻症状。
研究显示,维生素A和D可多途径改善肠道屏障,充足摄入能提升微生物多样性、强化紧密连接、调节免疫反应。
膳食纤维通过发酵生成短链脂肪酸(如丁酸盐),有助于加强粘蛋白和紧密连接,调节免疫,防止屏障通透性增加。
多酚类物质有助于增强紧密连接和黏液分泌,提高抗氧化力,富含多酚的饮食有助于降低肠道屏障障碍风险。
部分草药如普洱茶、芙蓉、蒲公英、姜黄等具备调节微生物群、强化屏障和抗炎作用,但其机制和疗效尚不完全明确,需注意提取纯度。
蘑菇富含维生素D、多酚和多糖,是益生元来源,可通过调节儿茶酚胺及炎症反应影响肠道微生物群。
⑤适当体力活动可降低肠道屏障障碍风险
众所周知,体育活动或锻炼可以增加肠道微生物群的多样性,增强SCFA的产生并刺激抗炎机制,主要是有氧运动,如跑步,骑自行车,健身运动,可以降低肠道屏障功能障碍的风险。
研究结果表明,体力活动以依赖于运动强度的方式调节肠道屏障通透性水平。定期、中等强度的体育锻炼对肠道上皮状态和肠道屏障完整性有积极影响。运动增加了肠道微生物组的多样性,有助于维持肠道屏障的完整性,还显示出抗炎和抗氧化作用。适度的体力活动可能是治疗肠漏的一个有利因素。
但是,高强度的体力活动,典型的竞争性或极限运动,与胃肠道疾病和肠道通透性增加的症状的高发病率相关。这是身体的应激源,由于体内血液的重新分配,体温过高和脱水,导致肠细胞缺氧。
近几十年来,过敏性和自身免疫性疾病的发病率显著增加,例如哮喘、特应性皮炎、过敏性鼻炎、慢性鼻窦炎、食物过敏、乳糜泻和炎症性肠病。全身性和代谢性疾病,如糖尿病、肥胖症、多发性硬化症、类风湿性关节炎、红斑狼疮、强直性脊柱炎以及阿尔茨海默病、帕金森病、慢性抑郁症和自闭症谱系障碍也成为日益严重的健康问题。
现代生活中的食品添加剂、抗生素滥用、环境污染物、慢性压力和过度依赖加工食品等因素正是导致这一代人屏障功能普遍衰退的隐形杀手。面对这一挑战,当前的科学建议首先聚焦于预防屏障损伤,通过建立标准化检测体系、开发肠道友好型产品替代有害化学物质、推广个性化营养干预等手段来实现。
食品工业也将从”填饱肚子”向”滋养健康“转型、医疗健康从”治疗疾病”向”维护屏障”转变、营养保健从”营养补充”向”功能修复“升级等多个行业带来了前所未有的发展机遇。
通过将传统医疗手段与肠道屏障修复、微生物群调节相结合,不仅能显著提高疾病治疗效果,更重要的是实现从“治病”到”防病”的医疗模式转变。
主要参考文献:
Macura B, Kiecka A, Szczepanik M. Intestinal permeability disturbances: causes, diseases and therapy. Clin Exp Med. 2024 Sep 28;24(1):232.
Farré R, Vicario M. Abnormal Barrier Function in Gastrointestinal Disorders. Handb Exp Pharmacol. 2017;239:193-217.
Brandl C, Bucci L, Schett G, Zaiss MM. Crossing the barriers: Revisiting the gut feeling in rheumatoid arthritis. Eur J Immunol. 2021;51(4):798–810.
Ramakrishna BS. Role of the gut microbiota in human nutrition and metabolism. J Gastroenterol Hepatol. 2013;28(Suppl 4):9–17.
Bäumler AJ, Sperandio V. Interactions between the microbiota and pathogenic bacteria in the gut. Nature. 2016;535(7610):85–93.
Ostaff MJ, Stange EF, Wehkamp J. Antimicrobial peptides and gut microbiota in homeostasis and pathology. EMBO Mol Med. 2013;5(10):1465–83.
Hansson GC. Role of mucus layers in gut infection and inflammation. Curr Opin Microbiol. 2012;15(1):57–62.
Gerbe F, Legraverend C, Jay P. The intestinal epithelium tuft cells: specification and function. Cell Mol Life Sci. 2012;69(17):2907–17.
Anderson JM, Van Itallie CM. Physiology and function of the tight junction. Cold Spring Harb Perspect Biol. 2009;1(2):a002584.
Drąg J, Goździalska A, Knapik-Czajka M, Matuła A, Jaśkiewicz J. Nieszczelność jelit w chorobach autoimmunologicznych. Państwo i Społeczeństwo. 2017;17(4):133–46.
Camilleri M. Leaky gut: mechanisms, measurement and clinical implications in humans. Gut. 2019;68(8):1516–26.
Wood Heickman LK, DeBoer MD, Fasano A. Zonulin as a potential putative biomarker of risk for shared type 1 diabetes and celiac disease autoimmunity. Diabetes Metab Res Rev. 2020;36(5):e3309.
Chelakkot C, Ghim J, Ryu SH. Mechanisms regulating intestinal barrier integrity and its pathological implications. Exp Mol Med. 2018;50(8):1–9.
Wright SL, Kelly FJ. Plastic and human health: a micro issue? Environ Sci Technol. 2017;51(12):6634–47.
Yee M-L, Hii L-W, Looi CK, et al. Impact of microplastics and nanoplastics on human health. Nanomaterials.2021;11(2):496.
Holloczki O, Gehrke S. Can nanoplastics alter cell membranes? ChemPhysChem. 2020;21(1):9–12.
Holloczki O, Gehrke S. Nanoplastics can change the secondary structure of proteins. Sci Rep. 2019;9(1):16013.
Xu M, Halimu G, Zhang Q, Song Y, Fu X, Li Y, Li Y, Zhang H. Internalization and toxicity: a preliminary study of effects of nanoplastic particles on human lung epithelial cell. Sci Total Environ. 2019;694:133794.
Jin Y, Lu L, Tu W, Luo T, Fu Z. Impacts of polystyrene microplastic on the gut barrier, microbiota and metabolism of mice. Sci Total Environ. 2019;649:308–17.
谷禾健康
食源性微生物是影响食品安全的主要致病菌,因人类食用被致病菌或其毒素污染的食品(主要是动物制品)而引发全球范围的人类疾病。其中多数微生物具有人畜共患的特性,对公共卫生和经济领域产生重大影响。
细菌是全球三分之二人类食源性疾病的病原体。例如,金黄色葡萄球菌、沙门氏菌属、弯曲菌属、单核细胞增生李斯特菌和大肠杆菌是引发食源性疾病和死亡的主要人畜共患细菌性病原体,与食用受污染产品有关。
近年来,食源性病原体已成为全球重要的公共卫生问题,其对健康(显著的发病率和死亡率)和经济的影响日益受到重视。不同报告显示,每年全球约有6亿人(全球人口的十分之一)因食用受污染的食物而患病。由于未被发现或未被报告的爆发,食源性疾病的统计数据有所增加。
目前正值夏季,本文介绍食源性细菌性病原体的背景,并回顾常见的主要食源性人畜共患细菌性病原体。动物是许多食源性人畜共患细菌性病原体的主要储存宿主,动物源性食品是主要的传播载体。肉类、乳制品和蛋类是人类暴露于人畜共患细菌的主要途径。
由于人口快速增长,城市化,人均收入提高,全球化以及消费者习惯的改变(偏爱高蛋白饮食),肉类、牛奶和鸡蛋等动物产品的消费量有所增加。这种情况导致对动物源性食物的需求量大增,并导致集约化动物生产和产品加工,尤其是大规模生产和产品在全球范围内的流通。在此期间,从农场到餐桌的任何环节都可能出现有缺陷的加工实践,从而增加了污染和食源性病原体传播的机会。
人类肉源性疾病进展
doi: 10.3389/fpubh.2022.1045599.
★ 食品在不同阶段都可能受到污染
食品可能在食品链的不同阶段受到污染,包括生产、加工、分销、制备或最终消费过程中。食品被污染的风险很大程度上取决于食品处理者的健康状况、个人卫生、知识以及食品卫生的实践。
肉类供应链每一步都有污染风险
doi: 10.3389/fpubh.2022.1045599.
根据世界卫生组织(WHO)的定义,食源性疾病是指因食用食物或水引起的具有传染性或毒性的疾病。中毒(病原体产生的毒素引起食物中毒)、感染(摄入含有病原体的食物)和毒素感染(在人体肠道中生长时产生毒素)是食源性疾病的三种类型。
★ 动物食品是食源性感染的主要载体
大多数病原体具有人畜共患病的起源,动物源性食品被认为是食源性感染的主要载体。食用动物(牛、鸡、猪、鸭等)是许多食源性病原体的主要储存库。动物产品(肉、奶、蛋、鱼等)及其产品由于病原体含量、天然毒素、掺杂物和其他可能的污染物而具有高风险,当增加动物源性食品的消费时,人类患食源性疾病的风险也在增加。
编辑
doi: 10.3389/fpubh.2022.1045599.
图A描述了自1961年以来选定国家的个人肉类消费量。事实证明,人均收入较高的国家比人均收入较低的国家消费更多的肉类。世界每年生产近3.4亿公吨肉类,是50年前的三倍。图1B所示,到2050年,肉类消费量估计将增加至4.6亿-5.7亿公吨。病原性疾病,如狼疮性皮肤病,在主要畜牧国家越来越常见,对全球肉类和肉类产品的供应构成重大威胁。
在引起食源性中毒的细菌中,一些细菌在发病频率或疾病严重性方面尤为重要。各种细菌(包括革兰氏阳性和革兰氏阴性细菌)会产生引起食源性中毒的毒素,导致的症状从胃肠紊乱到瘫痪甚至死亡。据报道,革兰氏阴性细菌约占细菌性食源性疾病病例的69%。
虽然目前已确定有31种病原体可导致食源性疾病,但包括金黄色葡萄球菌(S.aureus)、非伤寒沙门氏菌、弯曲杆菌属、单核细胞增生李斯特菌(L.monocytogenes)和大肠杆菌(E.coli)在内的细菌性病原体,是全球食源性疾病和死亡的常见原因。下面我们就为大家一一介绍这些常见的食源性细菌病原体。
★ 沙门氏菌是最常见的食源性病原体
沙门氏菌广泛分布于自然界,是人类和动物的主要致病菌。它们是食源性疾病爆发中最常见的细菌来源,每年在全球范围内导致约9380万例食源性疾病和15.5万例死亡。
沙门氏菌已被认为是食源性疾病的主要原因,也是一个严重的公共卫生问题,人们越来越关注包括工业化国家在内的抗菌素耐药菌株的出现和传播。人类和动物的耐药沙门氏菌感染是普遍关注的问题,尤其是在发展中国家。
除了给人类和动物带来的发病率和死亡率成本外,贸易限制和丢弃受污染的食物也是该细菌造成的重要社会经济问题。
1
病原学特征 (Etiology)
分类: 沙门氏菌属包含超过2500种已识别的血清型,分属于肠道沙门氏菌 (Salmonella enterica) 和邦戈沙门氏菌 (Salmonella bongori) 两个种。其中,肠道沙门氏菌是人畜共患的主要病原体,又可细分为六个亚种。
常见致病菌株: 超过150种血清型可引起食源性沙门氏菌病,但鼠伤寒沙门氏菌 (S.typhimurium) 和肠炎沙门氏菌 (S.enteritidis) 是最常见的两种。
基本特性: 这类细菌属于肠杆菌科,是革兰氏阴性、兼性厌氧、不形成孢子、呈直杆状的细菌。在显微镜下或普通营养培养基上,它们与大肠杆菌无法区分。
2
流行病学特征 (Epidemiology)
全球公共卫生问题:沙门氏菌是全球主要的公共卫生问题之一,无论在发展中国家还是发达国家,它都是最常见的食源性疾病之一。
主要宿主与传染源
动物携带:动物是沙门氏菌食源性疾病的主要宿主,其在动物中的普遍携带是重要的流行病学因素。
自然栖息地:沙门氏菌的主要栖息地是动物(如农场动物、鸟类、爬行动物、昆虫)和人类的肠道。
导致暴发的因素:食用生或不安全的食物、交叉污染、不当的食品储存、不良的个人卫生习惯、食品冷却和再加热不充分,以及制备与食用间隔时间过长等,都是促使人类沙门氏菌病暴发的因素。
环境耐受性:它们能在典型的餐饮冷藏温度下存活,并在温度滥用(即不当的温度控制)的情况下繁殖。
高风险原因:不卫生的生活条件、人畜混居、以及食用生或未煮熟的动物源性食品,都增加了感染风险。
3
传播途径 (Transmission)
主要途径: 食源性传播被认为是沙门氏菌感染的主要原因。动物源性食品及其制品是沙门氏菌传播给人类的最常见载体。
其他途径: 传播也通过摄入被动物粪便污染的水、食物以及被污染的食品加工设备而发生。
主要污染食品: 禽类、猪、牛及其产品(如肉、蛋、奶)是导致人类沙门氏菌病暴发的最常见食品来源。尤其是鸡肉产品(包括鸡蛋)被公认为是沙门氏菌的重要宿主。
非伤寒沙门氏菌(NTS)的宿主和传播
doi: 10.3389/fpubh.2022.1045599.
污染过程
屠宰环节: 受污染的动物产品通常源于受感染的动物本身,或在屠宰过程中胴体或可食用器官被污染。
蛋类污染: 蛋壳和蛋内容物可能在母鸡生殖系统内形成时或从环境中(如粪便接触)被污染。
粪便污染: 胴体的粪便或肠道污染是人类食源性感染的主要来源。
特定菌株: 最近出现的多重耐药性鼠伤寒沙门氏菌DT104型,主要通过摄入受污染的牛肉传播。
4
致病机理 (Pathogenesis)
影响因素: 致病性受菌株毒力、感染剂量、感染途径和宿主易感性等因素影响。毒力质粒、毒素、菌毛和鞭毛等毒力因子有助于建立感染。
入侵过程
靶细胞: 微皱褶细胞(M细胞)是沙门氏菌致病性的靶细胞。
机制: 细菌首先利用菌毛(粘附结构)粘附于肠道上皮细胞,然后侵入上皮细胞引发肠胃炎。这一复杂的入侵过程由多种染色体基因产物介导。
宿主反应: 细菌入侵后,会诱导靶细胞膜起皱,将细菌内化到膜结合的液泡中。这个过程会引发一系列反应,包括中性粒细胞的募集和迁移、上皮细胞分泌细胞因子以及液体和电解质的分泌。
定植与生存: 肠道正常菌群可以抵抗沙门氏菌定植,因此口服抗生素会促进感染的建立。沙门氏菌能够避开胃部的宿主防御,到达肠道进行感染。
5
临床症状 (Symptoms)
潜伏期: 潜伏期为12至72小时。
临床表现严重程度不一,从自限性肠胃炎到败血症不等,这主要取决于宿主的易感性和菌株的毒力。
消化道症状: 通常为胃肠道症状,包括恶心、呕吐、腹部绞痛以及水样、绿色、有恶臭的腹泻或带粘液的血性腹泻。
其他症状: 还包括头痛、虚脱、疲劳(肌肉无力)和中度发烧。
预后与并发症: 该病通常是自限性的,不需要特殊治疗。但在幼儿、老人和免疫功能低下者中可能导致严重并发症。反应性关节炎、镰状细胞性贫血和骨髓炎等并发症在普通人群中也较为常见。
6
检测方法 (Detection)
常规方法: 通常的程序是使用选择性增菌培养基(如沙门氏菌-志贺氏菌琼脂)进行细菌的培养和分离。
血清分型: 血清分型是区分沙门氏菌菌株的公认方法,是公共卫生的重要工具。
快速方法: 市售的快速检测方法包括新型选择性培养基、改良的传统程序、免疫学检测法和核酸检测法。
免疫学检测: 包括ELISA、乳胶凝集试验、免疫扩散和免疫层析法(试纸条)。
分子检测: 主要技术是直接杂交(DNA探针)和扩增(PCR)方法。
7
预防与控制 (Prevention and Control)
综合策略:需要建立生物安全和生物防护措施,改进食品加工方法以及制备和储存实践。减毒的DNA重组活沙门氏菌疫苗,结合对动物、饲料和动物食品的综合控制策略,将有助于减少沙门氏菌病。
食品安全实践:应采取安全的食品制备方法,包括彻底煮熟、重新加热食物、牛奶的巴氏消毒(煮沸)、充分冷藏,并避免宠物和其他动物进入食品处理区域。
高危人群建议:建议易感人群避免食用未煮熟的肉和家禽、生牛奶、生鸡蛋以及含有生鸡蛋的食物。
二次污染控制:通过清洁消毒、人员卫生和适当的加工来防止二次污染。
金黄色葡萄球菌是全球最常见的食源性病原体之一,其高发生率仅次于沙门氏菌。
它可以作为一种共生菌存在于健康人和动物的皮肤、鼻子和粘膜上。然而,它也是一种众所周知的机会性食源性病原体,可引起多种严重程度不一的感染性疾病,在人和动物中引起广泛的疾病。
★ 金黄色葡萄球菌是食源性中毒的重要原因
金黄色葡萄球菌在人类消费品中的存在对食品工业至关重要,因为某些菌株是食源性中毒的原因。它们是导致食品腐败、降低食品安全和保质期以及引起食源性中毒的原因。
金黄色葡萄球菌是因食用被葡萄球菌肠毒素污染的食物而导致食物中毒的主要原因。
并且由于与多重耐药性相关的死亡率不断上升,它引起了公众的关注。抗生素的广泛使用以及细菌快速发展和获得抗菌素耐药性的能力促进了耐药菌株的出现,例如耐甲氧西林金黄色葡萄球菌(MRSA)。
注:MRSA最早于20世纪60年代初被报道,现在被认为是全球主要的医院获得性病原体。MRSA是人和兽医医学中常见的病原体。
1
病原学特征 (Etiology)
基本分类:金黄色葡萄球菌(S.aureus)是一种革兰氏阳性、过氧化氢酶阳性、凝固酶阳性、氧化酶通常为阴性的兼性厌氧球菌。
形态与生化特性: 这种细菌细胞呈球形,不运动,常形成葡萄状的菌落。它可以通过产生金色菌落、凝固酶、发酵甘露醇和海藻糖以及产生耐热核酸酶等特性,与其他葡萄球菌区分开来。
生存能力: S.aureus对环境有极强的适应能力,可在广泛的温度(7°C至48°C)、pH值(4.2至9.3)和高盐浓度(最高15% NaCl)下生长。这使其能够在多种食品中存活,尤其是在加工过程中需要较多人工操作的食品(如奶酪等发酵食品)。
2
流行病学特征 (Epidemiology)
重要性日益增加:由于其导致的感染增多(特别是MRSA菌株),在医学中的重要性,以及近年来发现其与动物相关的克隆谱系和人畜共患的潜力,该微生物在动物中的流行病学研究备受关注。
食源性疾病:S.aureus是全球食源性细菌性中毒的主要原因之一,也是全球报告的最常见的食源性疾病之一。
宿主与传播
人类携带:大约50%的健康人群在鼻腔、喉咙和皮肤中携带这种细菌。
动物来源:患有乳腺炎的奶牛是生牛奶中S.aureus的常见来源。该细菌广泛存在于多种宿主中,包括人类和猪、牛、山羊、鸡、鸭等食用动物。
污染途径:食品污染可能直接来自受感染的食用动物,也可能是由于食品生产、零售和储存过程中的卫生条件不佳所致。
耐甲氧西林金黄色葡萄球菌的风险因素:
免疫抑制
血液透析
外周灌注不良
高龄
长期住院
抗生素治疗不当
体内留置装置(如导管)
需要胰岛素治疗的糖尿病
褥疮溃疡等
3
传播途径 (Transmission)
主要来源:S.aureus主要通过受污染的动物源性食品传播。细菌有潜力在加工、制备、包装、切碎和储存过程中污染动物产品,从而进入食物链。
常见载体:污染可见于多种食品,如畜禽产品、海鲜以及烘焙产品。潮湿的、富含淀粉和蛋白质的食物特别容易被葡萄球菌肠毒素污染。牛奶、乳制品、猪肉、牛肉、羊肉、禽肉和鸡蛋是导致葡萄球菌食物中毒的常见载体。生肉也是S.aureus存活和耐药菌株在社区传播的良好媒介。
人为污染:携带S.aureus的食品处理者,其身体或手套也可能污染食物。
4
致病机理 (Pathogenesis)
毒力因子:S.aureus拥有多种毒力因子,这些因子单独或共同作用可导致严重感染。它能表达多种分泌性和细胞表面相关的毒力因子,以促进其粘附于宿主细胞外基质、破坏宿主细胞并对抗免疫系统。
关键致病物质:其产生的胞外活性物质被认为是致病的关键,包括凝固酶、溶血素、核酸酶、酸性磷酸酶、脂肪酶、蛋白酶、纤维蛋白溶酶、肠毒素和中毒性休克综合征毒素。
产生条件:如果食物在室温下存放一段时间,食物中的细菌就能产生毒素。
毒素稳定性:肠毒素能抵抗蛋白水解酶,且耐热。因此,即使食物中的S.aureus细菌已被杀死,毒素仍可能存在。
种类与作用:已分类出23种不同的葡萄球菌肠毒素(SEs)和SE样毒素。肠毒素会刺激中枢神经系统的呕吐中枢,并抑制小肠对水和钠的吸收,从而引起急性肠胃炎症状。
5
临床症状 (Symptoms)
疾病谱:该细菌可引起多种疾病,症状从简单的皮肤感染到更严重甚至危及生命的感染,如败血症、坏死性筋膜炎、感染性心内膜炎、坏死性肺炎和中毒性休克综合征。
潜伏期:潜伏期很短,通常在食用被污染食物后2-4小时内出现临床症状。
典型症状:特征为恶心、呕吐,体温多为偏低,伴有寒战、头痛和腹部绞痛,可有或无腹泻,但通常不发烧。最常见的症状是腹部绞痛、恶心和呕吐。
高危人群:在儿童和老年人等易感人群中,偶尔可能导致死亡。
MRSA感染症状:MRSA或多重耐药S.aureus菌株可引起院内感染,导致快速进展且可能致命的疾病,如威胁生命的肺炎、坏死性筋膜炎、心内膜炎、骨髓炎、严重败血症以及中毒性休克综合征等毒素病。
6
检测方法 (Detection)
常规检测
培养基: 使用一系列选择性和诊断性培养基(如甘露醇盐琼脂)来检测和计数食品中的葡萄球菌。
鉴定标准: 鉴定致病性葡萄球菌最广泛接受的标准是其产生凝固酶的能力。标准方法包括选择性增菌、分离具有典型形态的菌落,并通过微生物学和生化方法确认。
细菌检测:实时荧光定量PCR (RT-PCR) 和定量PCR越来越多地用于临床实验室,以快速检测和鉴定MRSA菌株。快速乳胶凝集试验也是一种常见的实验室测试。
肠毒素检测:检测食品中肠毒素最重要的方法是酶联免疫吸附试验(ELISA)。其他血清学测试如凝集试验和凝胶扩散法也可用于检测。近年来,核酸杂交、PCR和荧光免疫分析等分子生物学方法已成为最流行的检测手段。
7
预防与控制 (Prevention and Control)
基本原则: 葡萄球菌无处不在,无法从环境中根除。预防的关键在于切断其各种传播途径。
预防措施
食品安全: 彻底煮熟食物、防止污染和交叉污染、控制关键控制点是有效的预防方法。
公众教育: 提高公众关于安全处理肉类的意识以及其他公共卫生干预措施是预防疫情的基石。
控制方案
卫生实践: 改善医护人员和食品处理者的个人卫生习惯。
环境控制: 对设备、表面、衣物进行消毒。
医疗相关: 明智地使用抗生素,并实施筛查计划。对MRSA患者所在的区域应使用消毒剂进行彻底清洁。
弯曲杆菌属(Campylobacter)是全球人类细菌性食物传播腹泻病的主要原因,主要源于动物源性食品的污染。弯曲杆菌属可以在大多数温血动物和家禽中定殖。
弯曲菌病的人畜共患性质使其在全球范围内具有重要的临床和经济意义。它们导致了15%的食源性疾病相关住院和6%的食源性疾病相关死亡,据估计,每年有4亿例病例是由弯曲菌感染引起的。
1
病原学特征 (Etiology)
命名与形态:“Campylobacter”一词源于希腊语,意为“弯曲的杆菌”。这类细菌属于弯曲杆菌科,是微小(0.2–0.8μm×0.5–5μm)的革兰氏阴性、呈弯曲或螺旋状的微需氧菌。它们具有独特的“飞镖式”运动能力,过氧化氢酶和氧化酶呈阳性。当两个或多个细菌细胞聚集时,会形成“S”形或海鸥翅膀样的“V”形。
分类:弯曲杆菌属目前包含25个种和8个亚种。
主要致病菌:在众多弯曲杆菌中,空肠弯曲杆菌(C.jejuni)和结肠弯曲杆菌(C.coli),是重要的食源性病原体。其中,空肠弯曲杆菌是最常报告的种类(占80%至90%),其次是结肠弯曲杆菌(占5%至10%)。
2
流行病学特征 (Epidemiology)
动物宿主:它们广泛分布于自然界,被认为是人畜共患病原体,存在于众多动物宿主体内,尤其是鸟类。它们可以定植在野生和家养鸟类及哺乳动物(包括所有食用动物)的消化道中,也可存在于动物和人类的生殖器官、肠道和口腔中。
食品来源:散装牛奶、牛的组织标本和生碎牛肉中都可能发现这种细菌,但鸡蛋通常不被认为是该菌的重要来源。
暴发特点:弯曲杆菌病的暴发通常是散发性的,虽然不常导致死亡,但可能引起继发性并发症。
人类感染风险:旅行是导致人类感染弯曲杆菌病的最重要风险因素,其次是食用未煮熟的鸡肉、环境暴露以及与农场动物直接接触。
3
传播途径 (Transmission)
主要途径:人类感染弯曲杆菌的主要传播途径是处理、制备和食用受污染的食物,特别是禽肉产品。
其他途径:食品处理者在制备过程中对即食食品的交叉污染,以及与动物的直接接触也被确定为传播途径,或接触受污染的设备、水传播。
弯曲杆菌的储存库和传播
doi: 10.3389/fpubh.2022.1045599.
主要食品来源:感染主要来自食用受污染的家禽、牛肉、猪肉或其他动物肉类、肉制品、生(未经巴氏消毒)牛奶或奶酪等乳制品。
4
致病机理 (Pathogenesis)
关键毒力因子:细菌的运动能力、粘液定植、上皮细胞入侵、毒素产生、附着、内化和易位在疾病发展中起着重要作用。
入侵过程
运动与附着:鞭毛使细菌能够到达肠道内的附着位点。病原体对肠道上皮的附着对于定植和增加细菌毒素的分泌至关重要。
细胞入侵:空肠弯曲杆菌在被摄入后,会在肠道中繁殖并损害粘膜上皮,侵入上皮细胞和固有层内的细胞,导致自限性腹泻和腹痛。腹泻病可能由其产生的一种不耐热毒素引起。
防御机制:弯曲杆菌能产生超氧化物歧化酶,这种酶可以分解超氧自由基,是细菌对抗氧化损伤的主要防御机制之一。
5
临床症状 (Symptoms)
潜伏期:潜伏期为3至5天。
主要症状:人类弯曲杆菌病的特征是水样或血性腹泻、腹痛、痉挛、发烧、不适和呕吐。它也是“旅行者腹泻”的主要病原体。
高危人群: 这对幼儿尤其危险,因为腹泻会导致脱水和钠、蛋白质等营养物质的流失。在幼儿(<1岁)和免疫功能低下的患者中,可能会出现中毒性巨结肠、脱水和败血症。
感染后并发症:格林-巴利综合征(GBS)是最主要的感染后并发症,通常在感染后2-4周出现。其特征是周围神经的多发性神经炎,可能导致持续数周的肢体短期或长期麻痹。
其他并发症还可能包括脑膜炎、尿路感染和短期反应性关节炎。
6
检测方法 (Detection)
传统方法:传统上,鉴定方法包括使用选择性培养基(如Preston琼脂、木炭-头孢哌酮-脱氧胆酸盐琼脂等)结合生化测试。
分子技术:近年来,PCR已越来越多地应用于弯曲杆菌的检测和鉴定。
免疫学方法:作为替代方法,也可以使用免疫测定法等多种技术。
7
预防与控制 (Prevention and Control)
养殖场控制: 控制取决于畜舍的卫生设施和卫生状况,以减少动物环境中细菌的数量。
加工厂控制: 在肉类加工厂,可以通过实施HACCP体系,包括清洗、处理和冷冻胴体,来减少和控制细菌数量。
食品制备:提高餐馆和家庭厨房的食品处理技能将减少细菌的传播。 将家禽等生肉充分烹饪至内部温度达到82°C将能消灭该细菌。
新型干预: 精油、益生元、益生菌、细菌素、噬菌体和免疫措施在控制弯曲杆菌方面也具有重要作用。
它是一种主要的食源性人畜共患细菌,对公共卫生构成严重威胁,主要通过食用受污染的动物源性食品传播。单核细胞增生李斯特菌作为食源性病原体的出现可以追溯到1980年,当时发生了很多与食用受污染食品有关的李斯特菌病爆发和散发病例。
★ 李斯特菌感染病例死亡率较高
单核细胞增生李斯特菌是全球控制和监测机构一直试图控制的最具毒力的病原体之一,其病例死亡率约为30%,远高于其他常见的食源性病原体。
此外,食品中存在单核细胞增生李斯特菌还会造成重要的经济后果,例如产品从消费者市场撤回以及涉案产品销量下降。由于李斯特菌属无处不在的特性,以及它们在包括pH、温度和盐度在内的广泛环境压力下生存的独特能力,它们被认为是重要的食源性病原体。
1
病原学特征 (Etiology)
基本特性:李斯特菌属的生物是嗜冷、革兰氏阳性、可运动、兼性厌氧、不形成孢子的杆状细菌。
分类:李斯特菌属目前包含10个种,包括单核细胞增生李斯特菌 (L.monocytogenes)、伊万诺夫李斯特菌 (L.ivanovii) 等。
主要致病菌:尽管李斯特菌属有多个种,但由人类李斯特菌病引起的病例几乎全部是由单核细胞增生李斯特菌(L.monocytogenes)引起的。它是人类和动物的主要病原体。
生存能力:该细菌具有极强的环境适应能力,能够在冷藏条件、低pH值和高盐浓度下存活。它是一种兼性胞内菌,可在0°C至45°C的温度和4.4至9.4的pH值范围内生长。
2
流行病学特征 (Epidemiology)
地理分布:单核细胞增生李斯特菌在世界范围内广泛存在。李斯特菌病在全球以散发或流行的形式出现。
环境分布:李斯特菌属细菌无处不在,广泛分布于正常环境中。它们最常见于被土壤和水污染的蔬菜等生食,以及生的动物产品中。
主要污染食品:单核细胞增生李斯特菌经常从动物源性食品中分离出来,如即食肉制品、碎牛肉、香肠、鱼和鱼制品、牛奶以及经过巴氏消毒的乳制品(如软奶酪和冰淇淋)。
注:尽管巴氏杀菌可以消灭生奶中的单核细胞增生李斯特菌,但并不能消除乳制品后续被污染的风险。
职业与高危人群:人类可能因职业原因从动物源感染李斯特菌病,特别是农民、屠夫、家禽工人和兽医。
侵袭性李斯特菌病的主要风险人群是免疫功能低下者,如孕妇、未出生或新生婴儿、器官移植接受者、癌症和艾滋病患者以及老年人。
3
传播途径 (Transmission)
主要途径: 人类感染的最常见途径是食用被单核细胞增生李斯特菌污染的动物源性食品。
高危人群:孕妇、新生儿、老年人和免疫功能低下的人群感染风险更高。
单核细胞增生李斯特菌引起的宿主、传播和疾病
doi: 10.3389/fpubh.2022.1045599.
4
致病机理 (Pathogenesis)
独特毒力:李斯特菌拥有独特的毒力因子,使其能够侵入宿主、逃避免疫细胞并引起感染。
入侵过程
附着:L.monocytogenes 表面有D-半乳糖残基,可以附着到宿主细胞(通常是肠道粘膜的M细胞和派尔集合淋巴结)上的D-半乳糖受体。
穿透:附着后,细菌可以穿过肠道膜进入血液,成为血源性(败血性)病原体。
胞内生长:进入宿主的单核细胞、巨噬细胞或多形核白细胞后,细菌可以在其中生长。
跨越屏障: 作为一种胞内菌,它能够感染多种类型的细胞,并能穿过肠道、血脑和胎盘等生物屏障,引发感染。
5
临床症状 (Symptoms)
典型症状: L.monocytogenes通常表现为典型的“食物中毒”症状,包括流感样症状(如发烧、疲劳)和胃肠道症状(恶心、呕吐和腹泻)。
持续时间:李斯特菌病的症状通常持续7-10天。
严重感染:在高危人群中,它可能导致严重的、危及生命的感染,如败血症、脑膜炎、自然流产、死产或胎儿感染。
6
检测方法 (Detection)
传统方法:方法包括在选择性培养基中进行增菌,随后在琼脂平板上进行划线培养,并进行各种物种鉴定测试。
注:Christie–Atkinson–Munch–Peterson (CAMP) 试验有助于识别李斯特菌属的种类。
分子方法:由于其准确、灵敏和特异,PCR和RT-PCR等分子方法越来越多地用于从食品中鉴定L.monocytogenes。
免疫学方法:使用单克隆抗体的ELISA已被开发用于鉴定食品中的李斯特菌。
7
预防与控制 (Prevention and Control)
卫生措施
表面消毒:对食品接触表面进行有效的卫生处理可以预防李斯特菌病。
规范操作: 良好的卫生习惯、良好生产规范和卫生设施是操作程序中最合适的策略。
高危人群防护: 建议易感人群(孕妇、老年人和免疫抑制者)避免食用未经巴氏消毒的乳制品以降低风险。
法规与生产控制
法规:标准化的法律法规和对肉制品生产的控制应是保护食品免受L.monocytogenes污染的根本途径。
生产链控制:在食品生产链的不同阶段,防止细菌在加工厂传播是保护食品的最重要方法之一。
管理体系:实施HACCP方法并建立有效的关键控制点,可以显著降低许多加工食品中李斯特菌的污染水平。各国采用的冰淇淋/冷冻甜点巴氏杀菌标准对于减少李斯特菌病具有重要意义。
大肠杆菌是众多可进入动物源食品的病原微生物之一,被认为是粪便、土壤和水污染的可靠指标。一种新兴的克隆差异型大肠杆菌最早于1982年被确定为重要的食源性人畜共患病原体,当时它与美国爆发的严重血性腹泻有关,而这种腹泻的源头被追溯到食用未煮熟的汉堡包。
大多数大肠杆菌是动物和人类胃肠道(回肠下段和大肠)的正常居民,而另一些则对人类具有致病性。大肠杆菌具有人畜共患性质,构成公共卫生危害。产志贺毒素大肠杆菌与全球范围内多起危及生命的食源性疫情相关。
1
病原学特征 (Etiology)
基本特性:大肠杆菌是一种属于肠杆菌科的革兰氏阴性杆状细菌,长度可达3微米,能发酵葡萄糖和其他糖类,有周生鞭毛使其能够运动,并常有菌毛。
致病性分组:根据其毒力特征,可分为五个致病性组:肠道集聚性大肠杆菌(EAEC)、肠道出血性大肠杆菌(EHEC)、肠道侵袭性大肠杆菌(EIEC)、肠道致病性大肠杆菌(EPEC)和肠道产毒性大肠杆菌(ETEC)。
主要致病血清型:O157:H7是最著名的血清型之一,其致病型可引起人类食源性感染。它是一种广为人知的产志贺毒素细菌,也是主要的食源性和人畜共患病原体。
2
流行病学特征 (Epidemiology)
全球公共卫生问题:大肠杆菌O157:H7是最重要的食源性病原体之一,在世界各地报道日益增多,是导致全球暴发的新兴食源性病原体。据估计,仅在美国,每年就有约74000例病例和61例死亡归因于该菌。
主要宿主:牛是大肠杆菌O157:H7的主要宿主。其次是绵羊和山羊。一些研究报告称,小型反刍动物通过粪便排菌也是人类感染的来源之一。此外,也从马、狗和鹿中分离出该菌。
主要传染源:未煮熟的牛肉、受污染的碎牛肉以及其他牛源性食品被确定为暴发中的主要感染来源。牛奶和乳制品也是其来源之一。
促发因素:大肠杆菌O157:H7感染发病率上升的主要促成因素包括饮食习惯的改变、大规模餐饮、复杂且漫长的食品供应链(国际流动增加)以及不良的卫生习惯。
近期趋势:然而,最近关于该菌在牛肉和乳制品中出现水平的报告有增加的趋势。近年来已开展了一些研究来评估其在肉类和奶类等动物源性食品中的出现情况。
3
传播途径 (Transmission)
主要途径:人类感染大肠杆菌O157:H7最常见的传播方式是食用受污染的食物和水。它也可以通过人与人直接接触以及偶尔的职业暴露传播。
大肠杆菌O157:H7的储存库和传播
doi: 10.3389/fpubh.2022.1045599.
污染过程
屠宰环节:在加工厂的屠宰过程中,通过皮肤到胴体或粪便到胴体的转移导致胴体污染,这是人类感染的主要风险因素。
后续环节:交叉污染也可能在加工厂的后续加工、零售市场的牛肉分销和储存过程中发生。
4
致病机理 (Pathogenesis)
关键毒力因子:细菌的致病机制包括毒力因子、志贺样毒素和黏附因子。
黏附与损伤
黏附素基因(Intimin gene):该基因负责细菌与肠道细胞的紧密黏附,导致出现黏附/清除(A/E)病变,并擦除肠细胞刷状缘的微绒毛。
细胞结构改变:细菌黏附后会破坏微绒毛,并改变肠细胞的细胞骨架结构。
志贺毒素(Shiga toxin):志贺毒素的产生是导致出血性腹泻和溶血性尿毒综合征的核心。O157:H7菌株产生志贺毒素1(stx-1)和志贺毒素2(stx-2)。毒素会刺激细胞分泌并杀死结肠上皮细胞。
5
临床症状 (Symptoms)
潜伏期:潜伏期为2至10天。
主要症状:感染后出现腹泻、腹痛、呕吐。最初可能是伴有腹部绞痛的腹泻,几天内可能转为严重的血性腹泻,通常没有发烧。
严重并发症:可能导致出血性结肠炎、伴有急性肾衰竭的溶血性尿毒综合征(HUS)和血栓性血小板减少性紫癜(TTP)。
6
检测方法 (Detection)
金标准:大肠杆菌O157:H7的培养分离仍然是鉴定的金标准,并辅以生化测试。
选择性培养基:添加了头孢克肟和亚碲酸钾的山梨醇-麦康凯琼脂(SMAC)是分离O157:H7最灵敏和鉴别性的培养基之一。O157:H7不发酵山梨醇,因此在该培养基上会形成无色菌落。
免疫学方法:多种免疫测定技术和血清学技术可用于特异性诊断。
分子方法:PCR-ELISA、多种qPCR方法、环介导等温扩增(LAMP)等是检测志贺毒素的主要有效方法。
7
预防与控制 (Prevention and Control)
通用原则:预防由大肠杆菌引起的食源性疾病的方法与其他食源性细菌病相同,但由于其对幼儿的严重后果,需要特别注意。
养殖场策略:在养殖阶段采取干预措施,如使用益生菌、疫苗、抗菌剂、氯酸钠和噬菌体,以增加畜群对感染的抵抗力。
加工干预:开发了多种干预技术,如皮肤和胴体清洗、使用抗菌剂、蒸汽巴氏杀菌、伽马射线辐照等。
HACCP体系:在加工环节实施HACCP方法,该方法包括对产品进行微生物测试。
食品安全计划:证据表明,食品处理人员培训、食品经营场所检查以及旨在推广正确食品处理和制备技术的教育项目,是减少公众暴露于食源性病原体的有效组成部分。
人畜共患疾病是一个严重的公共卫生问题。大多数人类传染病都是由动物引起的。这些病原体不仅在动物中引起疾病,而且还对人类健康构成严重威胁。本文详细介绍了五种主要的食源性细菌性病原体——非伤寒沙门氏菌、金黄色葡萄球菌、弯曲杆菌、单核细胞增生李斯特菌和大肠杆菌O157:H7。这些病原体具有以下共同特点:
主要特征与危害:
-广泛分布于自然界,以动物为主要宿主;
-具有人畜共患特性,对公共卫生构成严重威胁;
-主要通过受污染的动物源性食品传播;
-可引起从轻微胃肠道症状到危及生命的严重并发症。
许多人畜共患病目前已得到控制,但我们对许多疾病的认识仍存在差距,特别是对疾病分布、病原学、病原体、宿主、媒介生物学、动力学、传播周期、易感因素和危险因素的认识。宿主、病原体和环境之间的平衡可能在任何时候受到人类活动和自然活动的干扰,从而引起人畜共患病的发生。
除前述针对不同病原菌(沙门氏菌、弯曲杆菌等)的传统培养、血清分型、免疫学检测及分子诊断等常规方法外,高通量测序技术正逐步成为重要补充工具。
以16S rRNA测序、宏基因组测序为代表的新型技术,无需依赖传统培养流程,可直接对粪便、食品或环境样本中的微生物群落进行全面解析。
未来预防与控制建议:
1.建立”从农场到餐桌”的全链条防控体系
-在养殖阶段加强生物安全措施,使用益生菌、疫苗等预防手段;
-在屠宰加工环节严格实施HACCP体系,加强胴体清洗和消毒;
-在零售和消费环节加强食品安全教育和监管。
2.强化多部门协作的”一体化健康”理念
-建立兽医、公共卫生、食品安全等部门的协调机制;
-完善动物疫病监测预警系统;
-加强抗菌药物合理使用,遏制耐药菌株传播。
3.推进科技创新与检测技术发展
-开发更快速、准确的分子检测方法;
-研发新型疫苗和生物防控技术;
-利用人工智能等技术提升风险预测能力。
4.加强公众教育与意识提升
-普及食品安全知识,提高消费者自我保护能力;
-加强食品从业人员培训;
-建立食品安全社会共治格局。
5.完善法律法规与标准体系
-制定和完善食品安全法律法规;
-建立严格的食品安全标准和检测体系;
-加大对违法行为的处罚力度。
面对人畜共患病的复杂挑战,我们需要以科学的态度、系统的思维和协作的精神,构建覆盖全社会、全过程的食品安全防控网络。消化道病原菌直接关系到我们的饮食和健康,尤其夏季食物易腐败或受污染,其检测更为重要。只有通过持续的努力和创新,才能有效预防和控制食源性人畜共患病的传播,保障人类健康和食品安全。
主要参考文献
Ali S, Alsayeqh AF. Review of major meat-borne zoonotic bacterial pathogens. Front Public Health. 2022 Dec 15;10:1045599.
Abebe E, Gugsa G, Ahmed M. Review on Major Food-Borne Zoonotic Bacterial Pathogens. J Trop Med. 2020 Jun 29;2020:4674235.
Rahman MT, Sobur MA, Islam MS, Ievy S, Hossain MJ, El Zowalaty ME, Rahman AT, Ashour HM. Zoonotic Diseases: Etiology, Impact, and Control. Microorganisms. 2020 Sep 12;8(9):1405.
Ed-Dra A, Giarratana F, White AP, Yue M. Editorial: Zoonotic bacteria: genomic evolution, antimicrobial resistance, pathogenicity, and prevention strategies. Front Vet Sci. 2024 Mar 8;11:1390732.
Ed-Dra A, Filali FR, Khayi S, Oulghazi S, Bouchrif B, El Allaoui A, Ouhmidou B, Moumni M. Antimicrobial Resistance, Virulence Genes, and Genetic Diversity of Salmonella enterica Isolated from Sausages. Eur J Microbiol Immunol (Bp). 2019 Apr 9;9(2):56-61.
Feng Y, Pan H, Zheng B, Li F, Teng L, Jiang Z, Feng M, Zhou X, Peng X, Xu X, Wang H, Wu B, Xiao Y, Baker S, Zhao G, Yue M. An integrated nationwide genomics study reveals transmission modes of typhoid fever in China. mBio. 2023 Oct 31;14(5):e0133323.
Mughini-Gras L, Kooh P, Augustin JC, David J, Fravalo P, Guillier L, Jourdan-Da-Silva N, Thébault A, Sanaa M, Watier L; Anses Working Group on Source Attribution of Foodborne Diseases. Source Attribution of Foodborne Diseases: Potentialities, Hurdles, and Future Expectations. Front Microbiol. 2018 Sep 3;9:1983.
Dhama K, Rajagunalan S, Chakraborty S, Verma AK, Kumar A, Tiwari R, Kapoor S. Food-borne pathogens of animal origin-diagnosis, prevention, control and their zoonotic significance: a review. Pak J Biol Sci. 2013 Oct 15;16(20):1076-85.

谷禾健康
随着夏季天气变得炎热,高温环境为病原微生物的繁殖创造了有利条件,同时也加速了食品的腐败变质过程,从而导致食源性感染的数量呈现出明显的增加趋势。
重要的食源性细菌病原体包括大肠杆菌、沙门氏菌、弯曲杆菌、小肠结肠炎耶尔森菌、葡萄球菌、肉毒杆菌等。近年来,弓形菌属(Arcobacter)已被确定为一种新兴的食源性人畜共患病原体。
弓形菌属(Arcobacter)是一类革兰氏阴性、螺旋形、不产芽孢的杆菌。其与弯曲杆菌属非常相似,但具有更强的耐氧性和低温耐受性。该属已包含三十多个物种,广泛分布于土壤、淡水、海水以及人类和各种动植物中,大约7%的人群粪便中能够检出。
与人类疾病相关的主要是四个菌种:A.butzleri、A.cryaerophilus、A.skirrowii和A.cibarius,其中A.butzleri最常见,是腹泻患者粪便中第四大弯曲杆菌样生物。该菌可引起胃肠炎、严重腹泻、菌血症、败血症、心内膜炎、腹膜炎等疾病,还存在于肝硬化和坏疽性阑尾炎患者的血液样本中。
Arcobacters对常用抗菌剂的耐药性也有所增加,研究显示,所有测试的Arcobacter菌株都对氨苄青霉素敏感,对氨基糖苷类和四环素类也表现出敏感性。但A.butzleri对氨苄西林耐药率为56%,其次是头孢噻肟(33%)和环丙沙星(33%),对恩诺沙星和庆大霉素敏感,这些是治疗Arcobacter感染的首选药物。所有A.skirrowii和大多数A.cryaerophilus分离株对阿莫西林/克拉维酸敏感,对青霉素、万古霉素、夫西地酸、氯唑西林和头孢唑啉耐药,对阿米卡星、恩诺沙星、氧氟沙星、土霉素、氯霉素、呋喃妥因、红霉素、氨苄西林舒巴坦和阿莫西林中度敏感。
本文全面介绍了这一重要食源性病原体的各个方面,包括不同Arcobacter物种的分布及临床相关性、毒力因子、感染症状和危害、药物敏感性以及与人体和其他菌群的相互作用。并提出使用草药活性成分、精油、噬菌体、益生菌、禽蛋抗体、RNAi技术等新治疗方法有助于防止抗生素耐药性发展和Arcobacter传播。基于肠道菌群检测等技术将进一步深化对Arcobacter感染的理解。
弓形菌属(Arcobacter)名称源自拉丁语”arcus”(弓形)和”bacter”(细菌),意为“弓形细菌”,反映了其弯曲的形态特征。其属于弯曲杆菌科(Campylobacteraceae)。这是一类革兰氏阴性、螺旋形、不产芽孢的杆菌。硝化弧菌(Arcobacter nitrofigilis)为其模式菌种。
弓形菌属(Arcobacter)于1977年首次从流产牛胎儿中分离获得。1991年,该属被归类为非典型弯曲杆菌属中的一组耐氧细菌,随后增加了两个新种。基于核糖体RNA遗传相似性95%的截断标准,该属被确立为独立属。
注:弓形菌属(Arcobacter)与弯曲杆菌属(Campylobacter)密切相关,两者都是Campylobacteriaceae家族的成员。它们的主要区别在于更高的耐氧性和在较低温度下生长的能力。
1
形态特征
弓形菌属(Arcobacter)的主要形态特征包括:
基本形态:革兰氏阴性、通常呈螺旋状、弯曲状或”S”形杆菌。
细胞大小:宽度0.2-0.9微米,长度0.5-3微米。
运动特性:具有单一的无鞘极性鞭毛,表现出独特的穿梭式螺旋运动。
特殊能力:能够通过0.45μm和0.65μm的膜过滤器,这一特性常用于分离培养。
doi.org/10.1111/j.1472-765X.2005.01841.x
2
生长环境
温度:弓形菌属(Arcobacter)的生长温度范围为15-37°C,最适温度30°C。该菌具有良好的低温耐受性,可在-20°C存活6个月,在-70°C存活24个月,但在55°C及以上温度下会迅速失活。
注:A.butzlerii能够在10°C下生长,这是这种微生物的最低可检测生长温度,并且在40°C时没有生长。
氧气:Arcobacter能够耐受氧气,这一点可区分于严格微需氧的弯曲杆菌属(Campylobacter)。
pH和渗透压耐受性:该菌pH耐受范围为5.5-9.5,最适pH为6.8-8.0,并能耐受高盐浓度和低水分。
3
代谢能力
代谢类型:呼吸型代谢,Arcobacter能够耐受氧气环境,主要进行有氧呼吸代谢。
碳源利用:可利用有机酸和氨基酸作为碳源,不发酵或氧化碳水化合物,但有新发现某些菌株能够代谢果糖。
酶活性:氧化酶、过氧化氢酶、吲哚乙酸水解酶和硝酸盐还原酶等均呈阳性。
4
主要菌种及分布
弓形菌属(Arcobacter)已包含三十多个物种,广泛分布于土壤、淡水、海水以及人类和各种动植物中。该属可在全球范围内从肉类、乳制品、蔬菜和海鲜中分离出来,被认为是新兴的人畜共患病原体。其致病菌种可引起人类急性持续性腹泻、恶心、呕吐和肠道功能紊乱,也可导致无腹泻的菌血症。
Arcobacter物种基于16S rRNA 基因的关系
doi: 10.1128/CMR.00034-10.
• 与人类疾病密切相关的主要有四种:
A.butzleri(最常见,与人类疾病关联最强)
A.cryaerophilus(第二常见菌种)
A.skirrowii(水环境污染中检出率13%)
A.cibarius
• 人群中的检出率:
健康人群:大约7%的人群粪便中能够检出Arcobacter。
腹泻患者:在一些研究中,A.butzleri是第三或第四常见的弯曲菌样病原体。
分布特点:遍布全球各大洲、发展中国家检出率相对较高、与环境卫生条件相关。
• A.butzleri—与人类疾病关联最强的
在所有Arcobacters中,A.butzleri是最常见的物种,与人类疾病有关,可引起肠炎、严重腹泻、菌血症和败血症等疾病,是腹泻患者粪便中第四大弯曲杆菌样生物。
A.butzleri感染的主要临床表现包括:
胃肠道症状:
-持续性水样腹泻(与空肠弯曲杆菌的血性腹泻不同);
-急性腹泻持续3-15天;
-腹痛和恶心;
-血性粪便(部分病例);
-恶心和呕吐;
全身症状:
-发热和寒战
-虚弱和乏力
-厌食和体重减轻
在下面的章节中我们也会主要以A.butzleri为例阐述该致病菌对人体的危害。
• A.cryaerophilus—新出现的食源性病原体
A.cryaerophilus是一种新兴的食源性病原体,与人类疾病也相关。A.cryaerophilus是人类粪便样本中第二常见的Arcobacter菌种,仅次于A.butzleri,并且在肠炎症状患者粪便样本中占43%,仅次于A.butzleri(55%)。
A.cryaerophilus主要引起人类传染性胃肠道疾病,症状包括急性或长期水样腹泻、腹痛、恶心、持续性腹泻,严重者可发生菌血症。
5
毒力因子
目前关于Arcobacter毒力基因/因子的研究信息有限。现有研究表明,粘附、病原体入侵、毒素分泌和促炎细胞因子(IL-8)在建立宿主感染中发挥主要作用。A.cryaerophilus和A.butzleri是迄今为止在粘附性和侵袭性方面研究最多的两个主要Arcobacter物种。
• 损害结肠上皮功能
A.butzleri感染会损害人HT-29/B6结肠上皮单层的上皮功能。Claudin蛋白家族对屏障功能至关重要,其中claudin-1、5和8具有屏障密封特性。A.butzleri感染期间,紧密连接蛋白claudin-1、-5和-8表达异常,导致上皮屏障功能障碍。类似的claudin-1功能障碍也在肠致病性大肠杆菌感染的人肠道T84单层中观察到。
据报道,血凝素特性也与A.butzleri有关,它与红细胞相互作用,因此有助于细菌的粘附。
与弯曲杆菌和幽门螺杆菌一样,Arcobacter感染中IL-8的释放可能在引起腹泻中发挥作用。促炎细胞因子的释放是幽门螺杆菌和弯曲杆菌的主要毒力因子,同样,Arcobacter也能导致促炎细胞因子的释放。
Arcobacter的毒力机制
编辑
doi: 10.1128/CMR.00034-10.
• 可以产生肠毒素和液泡毒素
当在Vero细胞中培养时,Arcobacter分离物会产生细胞伸长,这表明它们具有产生肠毒素的能力,部分分离株还能在细胞中产生液泡,显示其具有液泡毒素产生能力。
• 各种毒力基因参与不同的致病过程
目前已在A.butzleri ATCC 49616基因组中发现10个推定毒力基因:cadF、ciaB、cj1349、hecA、iroE、hecB、irgA、mviN、pldA和tlyA。这些基因分别编码外膜蛋白、侵袭蛋白、溶血素、磷脂酶A等,参与粘附、侵袭、溶血、铁获取等过程。
注:不同基因的功能包括: cadF基因和cj1349基因编码外膜蛋白,通过粘附纤连蛋白促进肠上皮细胞间接触;ciaB基因参与宿主细胞的侵袭,pldA基因编码水解酰酯键的外膜磷脂酶 A,tlyA基因是溶血素基因,irgA基因编码肠杆菌素的外膜受体,hecA基因是丝状血凝素家族的成员,hecB基因编码溶血素激活蛋白。
一项研究揭示了Arcobacter spp中的6个毒力基因 (cadF、ciaB、cj1349、mviN、pldA 和 tlyA)存在于所有A.butzleri分离株中,而在A.cryaerophilus和A.skirrowii中的分布存在差异。各种毒力基因负责不同的致病过程:CadF、HecA和Cj1349参与粘附,CiaB参与侵袭,HecB、TlyA和PldA参与红细胞裂解,IrgA和IroE参与铁获取,MviN参与肽聚糖生物合成。
6
药物敏感性
关于Arcobacter的抗菌药物敏感性数据有限,A.butzleri是研究最多的物种。现有报告表明,这种新兴病原体的抗菌素耐药性增加,导致常用抗菌剂治疗失败。并且A.butzleri比A.cryophilus和A.skirrowi表现出更强的耐药性。
Arcobacter的抗生素耐药性或检测到的基因组性状
Buzzanca D,et al.Antibiotics (Basel).2024
• 对氨苄青霉素敏感
研究显示,所有测试的Arcobacter菌株都对氨苄青霉素敏感,对氨基糖苷类和四环素类也表现出敏感性。A.butzleri对氨苄西林耐药率为56%,其次是头孢噻肟(33%)和环丙沙星(33%),对恩诺沙星和庆大霉素敏感,这些是治疗Arcobacter感染的首选药物。
在一项研究中,所有A.skirrowii和大多数A.cryaerophilus分离株对阿莫西林/克拉维酸敏感,对青霉素、万古霉素、夫西地酸、氯唑西林和头孢唑啉耐药,对阿米卡星、恩诺沙星、氧氟沙星、土霉素、氯霉素、呋喃妥因、红霉素、氨苄西林舒巴坦和阿莫西林中度敏感。
• 对头孢菌素和万古霉素具有耐药性
研究发现,Arcobacter对头孢菌素、新生霉素和万古霉素耐药,但对阿奇霉素、萘啶酸和庆大霉素敏感。71种Arcobacter分离株的抗菌素敏感性测试显示,所有分离株对一种或多种抗菌剂具有耐药性,对头孢菌素和万古霉素的耐药性最常见(96%),其次是甲氧西林、阿奇霉素和氨苄西林。所有分离株都对庆大霉素、链霉素、四环素和卡那霉素敏感。
比利时患者分离的A.butzleri和A.cryaerophilus菌株研究显示,大多数菌株对庆大霉素(99%)和四环素(89%)敏感,红霉素(78%)、环丙沙星(72%)和多西环素(76%)显示中等活性,仅9%的菌株对氨苄西林敏感。大多数A.butzleri菌株对环丙沙星敏感(87%),而一半的A.cryaerophilus分离株(51%)表现出高水平耐药性。
研究结果表明,大环内酯类药物不是Arcobacter感染的首选经验性抗生素,四环素类药物可用于治疗Arcobacter诱导的胃肠道感染。所有Arcobacter分离株均对万古霉素、利福平、甲氧苄啶、头孢曲松和头孢菌素耐药,而对土霉素、四环素、环丙沙星、红霉素、卡那霉素、阿米卡星、恩诺沙星和庆大霉素高度敏感。四环素类和氨基糖苷类药物可用于治疗人类Arcobacter感染。
7
与人体和其他菌群的相互作用
• 细胞粘附与侵袭
粘附因子:cadF、cj1349、hecA等基因编码外膜蛋白;
侵袭机制:通过ciaB基因介导的细胞侵袭;
紧密连接破坏:影响claudin-1、claudin-5、claudin-8等紧密连接蛋白。
• 免疫相互作用
促炎反应:诱导IL-8、TNF-α、IFN-γ、IL-6等细胞因子释放;
TLR激活:激活Toll样受体4(TLR-4)依赖的免疫反应;
氧化应激:诱导活性氧产生,损伤细胞。
• 与肠道菌群的关系
生态竞争:Arcobacter会与有益菌竞争营养和定植位点;
菌群失调:Arcobacter感染可导致肠道菌群结构改变,并造成菌群失调;
代谢产物影响:影响短链脂肪酸等有益代谢产物产生。
• 菌群相互作用
增强:
Bacteroidales
Bacteroides
Odoribacter
Peptococcaceae
抑制:
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Porphyromonas
Prevotella
Clostridium
Clostridiales incertae sedis
Clostridiales Family XIII. Incertae Sedis
Blautia
Coprococcus
Dorea
Lachnospiraceae
Ruminococcaceae
Ruminococcus
Dialister
Campylobacteraceae
Erysipelotrichaceae
被抑制:
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Bacteroidales
Bacteroides
Porphyromonadaceae
Odoribacter
Parabacteroides
Porphyromonas
Prevotella
Rikenellaceae
Alistipes
Turicibacter
Streptococcus
Clostridiales
Catabacteriaceae
Clostridium
Clostridiales incertae sedis
Peptoniphilus
Clostridiales Family XIII. Incertae Sedis
Lachnospiraceae
Blautia
Lachnospiraceae
Coprococcus
Dorea
Eubacterium
Lachnobacterium
Lachnospira
Roseburia
Lachnospiraceae
Peptococcaceae
Ruminococcaceae
Ruminiclostridium
Acetivibrio
Eubacterium
Faecalibacterium
Oscillospira
Ruminococcus
Acidaminococcus
Dialister
Phascolarctobacterium
Veillonella
Rubrivivax
Alcaligenaceae
Oxalobacter
Bilophila
Desulfovibrio
Campylobacteraceae
Enterobacteriaceae
Escherichia
Erysipelotrichaceae
Holdemania
Akkermansia
1
感染的危害
多项研究表明,Arcobacter在世界不同国家的人类中普遍存在,已从人类粪便和血液样本中分离出来。而其中的致病菌种A.butzleri和A.cryaerophilus已被多次证明与胃肠道疾病相关。持续性水样腹泻是A.butzleri的主要症状,与空肠弯曲杆菌病例中的血性腹泻形成对比,其余微生物学或临床特征非常相似。
注:Arcobacter spp.也被认为是旅行者腹泻的一种细菌因子,与大肠杆菌、志贺氏菌、沙门氏菌和弯曲杆菌并列。
• A.butzleri是第三普遍的弯曲杆菌病原体
一项通过分子方法的研究发现,在322份粪便标本中,A.butzleri是第三普遍的弯曲杆菌(6.2%),仅次于幽门螺杆菌(50.6%)和空肠弯曲杆菌(10.2%)。比利时和法国的两项独立研究显示,A.butzleri是从腹泻患者粪便中发现的第四种最常见的弯曲杆菌样生物。最近,该物种还被发现是美国和欧洲旅行者前往墨西哥、危地马拉和印度后发生旅行者腹泻的病因,患病率为8%,这是首次证明Arcobacter与此类感染关联的研究。
• 可引起肠炎,导致腹泻等症状
在所有研究中,A.butzleri的患病率往往最高,其次是A.cryaerophilus和A.skirrowii,直接分子检测报告的值分别为6.2%、2.9%和1.9%。A.skirrowii仅在少数情况下与胃肠炎相关。
A.butzleri近年来已被定位为一种新兴的人畜共患病原体,它被描述为急性细菌性胃肠炎的原因,伴有血便、大量腹泻、腹胀,在某些情况下是菌血症的原因。此外,A.butzleri和A.cryaerophilus引起的病例也偶有报道。
Arcobacter中的致病菌种丰度过高会导致以下危害:
急性胃肠炎
症状:水样腹泻(持续3-15天,严重可达2个月)
伴随症状:腹痛、恶心、呕吐、发热、寒战
病程特点:通常自限性,但可发展为慢性感染
严重系统性感染
菌血症:可发生原发性或继发性菌血症
心内膜炎:罕见但严重的并发症
腹膜炎:腹腔感染的重要病原体
败血症:在免疫功能低下患者中易发生
肝硬化和阑尾炎患者中也存在
在患有肝硬化和阑尾炎等临床疾病的患者的血液样本中也检测到弓形菌属(Arcobacter)。
• 诱导促炎细胞因子释放
A.butzleri感染会诱导小肠和大肠分泌更多促炎细胞因子,包括TNF、IFN-γ、IL-6和MCP-1。A.butzleri还以菌株依赖性方式诱导比共生大肠杆菌更明显的局部和全身免疫反应,表明A.butzleri不仅仅是人体中的共生体。
研究还发现miRNA在感染A.butzleri的巨噬细胞免疫信号中发挥作用。细菌感染期间有几种miRNA表达,其中miR-155、miR-212和miR-125等新型miRNA表达上调,它们在Toll样受体信号转导中起关键作用,参与免疫反应的产生。揭示了人类先天免疫细胞与Arcobacter在感染过程中的相互作用。
2
疾病相关的发病机制
• 肠道屏障功能破坏
物理屏障:破坏肠道上皮细胞紧密连接;
化学屏障:影响胃酸和胆汁酸的保护作用;
生物屏障:干扰正常肠道菌群的保护功能;
免疫屏障:调节肠道免疫系统反应。
• 与炎症性肠病的关联
炎症介质:激活NF-κB信号通路,促进炎症因子释放;
氧化应激:诱导活性氧产生,加重肠道损伤;
自身免疫:可能触发自身免疫反应;
菌群失调:加重肠道菌群紊乱。
• 毒力因子与致病机制
粘附侵袭:cadF、cj1349、ciaB、hecA;
毒素产生:hecB、tlyA、pldA(溶血素和磷脂酶);
铁获取:irgA、iroE(铁离子转运);
细胞壁合成:mviN(维持细胞完整性)。
3
感染途径
人类中的Arcobacter主要引起肠道问题,通过粪口传播、动物直接传播以及受污染的食物(蔬菜、鸡肉和猪肉)和水源等多种方式在宿主细胞中定植。
• 食源性传播
已从鸡肉、猪肉、牛肉和海鲜等各种肉类样本中分离出Arcobacter。据报道,鸡肉的Arcobacter患病率最高,其次是猪肉和牛肉。
注:据报道,鸡肉的A.butzleri发病率最高,为83%,其次是牛肉(20%)和猪肉(15%)。从哥斯达黎加销售的家禽内脏样本中分离出17%的Arcobacter,其中大多数分离株对氯霉素和氨苄青霉素具有耐药性。
四种弓形菌属(A.butzleri、A.cryaerophilus、A.skirrowii和A.cibarius)已从肉类中大量分离,尤其是从鸡尸体中。从牡蛎、鱼类、贝类和蛤蜊等海鲜中也可分离出Arcobacter。
来自世界不同地区的报告显示从牛奶样本中分离出Arcobacter,表明牛奶在其传播中可能起作用。其中A.butzleri是最主要的物种(60%),其次是A.cryaerophilus(40%)。并且研究表明A.butzleri和A.cryaerophilus在4°C和10°C储存的牛奶中存活了6天,因此牛奶可以作为人类Arcobacter感染的来源。
与Arcobacter相关的人类胃肠炎的几次爆发与食用受污染的新鲜蔬菜有关,因此可能成为重要的感染源。最近,在生菜和胡萝卜加工厂上报告了一些Arcobacter物种。在预切即食蔬菜上出现Arcobacter的比率为28%,其中91%(40/44)分离株为A.butzleri,9.1%(4/44)分离株为A.cryaerophilus。这些结果表明,直接食用生蔬菜可能存在健康风险。
• 经受污染的水源传播
受污染的水被认为是人类Arcobacter感染的重要来源。据估计,63%的A.butzleri感染是通过食用或接触受污染的水在人类中获得的。已从河流、湖泊、地下水、海水以及浮游生物中检测到了Arcobacter。
在土耳其伊兹密尔,来自不同来源(66个污水、25个河流、16个泉水和8个饮用水)的水样本中,有36%(41/115)的Arcobacter呈阳性。其中,34%的样本(39/115;24个污水、13条河流和2个泉水)报告了A.butzleri。这些结果表明,环境水样是Arcobacter的常见来源。
4
易感因素
虽然宿主特征(如年龄和免疫状态)在Arcobacter感染中的作用尚未明确确定,但很可能发挥重要作用。研究显示,以下人群可能更易受到感染:
• 免疫功能低下者
-慢性淋巴细胞白血病患者
-HIV感染者
-器官移植受者
-化疗患者
• 年龄相关易感性
-新生儿:可发生垂直传播
-老年人:易发生严重感染和并发症
-儿童:症状通常较轻但持续时间长
• 一些疾病患者中弓形菌属丰度也较高
弓形菌属(Arcobacter)还常见于患有其他潜在疾病的患者中,包括1型和2型糖尿病、肝硬化、坏疽性阑尾炎、癌症、慢性肾功能衰竭、内部假体植入、高尿酸血症和酗酒等。
一项研究通过多重PCR检测发现,患有2型糖尿病但无胃肠道症状的老年受试者中,粪便携带弓杆菌的患病率高达79%(30/38)。
针对新兴食源性病原体Arcobacter,需要采取一些控制措施来降低其感染风险或减轻疾病负担。
1
食品加工控制措施
肉类、奶类、海鲜等烹饪不当和受污染的动物源性食品可能是人类弓形菌属(Arcobacter)感染的重要来源。因此,彻底和良好的烹饪方法是预防感染的关键。
• 物理处理方法
高温处理:A.butzleri对热敏感,50°C热处理后会产生致命的协同效应;
辐射处理:A.butzleri对辐射的抗性比空肠弯曲杆菌更强;
低温储存:低温可抑制Arcobacter生长,但不能完全杀死。
• 化学处理方法
柠檬酸:1.0%浓度可抑制A.butzleri生长;
乳酸:2.0%浓度有效抑制生长;
乳酸钠:2%浓度有效抑制;
苯甲酸、苹果酸和山梨酸:具有较强抑制活性。
链球菌素50 IU/ml可将A.butzleri存活率降低约500%。磷酸三钠和EDTA在纯培养中能有效减少A.butzleri存活。
2
益生菌防控策略
• 益生菌菌株的抑制作用
植物乳杆菌(L.plantarum CFS)在12.5%浓度下完全抑制A. butzleri生长;
嗜酸乳杆菌(L.acidophilus)和罗伊氏乳杆菌(L.reuteri CFS)在25%浓度下完全抑制生长;
在TSB+MRS培养基中,所有乳酸杆菌在24-48小时内均能有效抑制A.butzleri。
• 益生菌抑制机制
酸化环境:益生菌产生的乳酸创造酸性环境(pH<3.0时A. butzleri在20分钟内无法生长);
代谢产物抑制:细胞无培养上清液(CFS)中的抗菌物质;
细菌素产生:如罗伊氏乳杆菌产生的罗伊氏菌素(Reuterin);
竞争性排斥:通过置换和排斥机制减少A. butzleri的肠道粘附。
3
植物提取物
• 精油类抗菌剂
百里香精油:对A.butzleri具有显著抗菌活性,抑制浓度为32-1024 μg/mL;
丁香精油:抑制浓度为512-1024 μg/mL;
其他精油:17种精油(迷迭香、大蒜、鼠尾草、熊果、多香果、黑胡椒、孜然、肉桂、香菜、百里香、丁香、茴香、甘草、圣约翰草、生姜、洋甘菊和薄荷等)均显示出抑制效果。
• 植物提取物
柠檬、甜橙和佛手柑油:可预防Arcobacter感染;
白藜芦醇植物提取物:通过抑制细菌代谢活动、影响DNA并阻断细胞分裂发挥杀菌作用;
草药提取物:洋甘菊、鼠尾草、肉桂、迷迭香、熊果提取物等。
4
环境控制和卫生措施
• 屠宰场和食品加工厂卫生
严格消毒:使用适当消毒剂,因为A.butzleri在常规消毒后仍可能存活;
HACCP体系:实施严格的胴体微生物监测、验证系统和良好生产规范;
表面处理:A.butzleri可在铜、不锈钢和塑料管道表面定植,需要加强清洁。
• 个人卫生
食品处理:彻底烹饪肉类、奶类、海鲜等动物源性食品;
交叉污染防控:避免生熟食品交叉污染。
• 水处理
氯化处理:尽管A.butzleri对氯敏感,但常规饮用水处理效果仍需加强;
水源保护:受污染的水是重要感染源,需要有效处理水资源。
5
新型治疗方案
面对抗生素耐药性上升,急需探索替代疗法,包括噬菌体疗法、益生菌、禽蛋黄抗体、细胞因子、RNAi技术、群体感应抑制剂、草药和精油等。噬菌体疗法已成功用于预防沙门氏菌、李斯特菌等,在屠宰场控制Arcobacter进入食物链方面具有良好前景。
主要参考文献
Ramees TP, Dhama K, Karthik K, Rathore RS, Kumar A, Saminathan M, Tiwari R, Malik YS, Singh RK. Arcobacter: an emerging food-borne zoonotic pathogen, its public health concerns and advances in diagnosis and control – a comprehensive review. Vet Q. 2017 Dec;37(1):136-161.
Collado L, Figueras MJ. Taxonomy, epidemiology, and clinical relevance of the genus Arcobacter. Clin Microbiol Rev. 2011 Jan;24(1):174-92.
García-Salguero C, González-Corralejo C, Marroyo Laso J, Delgado-Iribarren García-Campero A. Acute gastroenteritis due to Arcobacter butzleri: an emerging pathogen. Gut Pathog. 2025 Apr 11;17(1):22.
Buzzanca D, Chiarini E, Alessandria V. Arcobacteraceae: An Exploration of Antibiotic Resistance Featuring the Latest Research Updates. Antibiotics (Basel). 2024 Jul 18;13(7):669.
Ferreira S, Queiroz JA, Oleastro M, Domingues FC. Insights in the pathogenesis and resistance of Arcobacter: A review. Crit Rev Microbiol. 2016 May;42(3):364-83.
Chieffi D, Fanelli F, Fusco V. Arcobacter butzleri: Up-to-date taxonomy, ecology, and pathogenicity of an emerging pathogen. Compr Rev Food Sci Food Saf. 2020 Jul;19(4):2071-2109.
Prouzet-Mauléon V, Labadi L, Bouges N, Ménard A, Mégraud F. Arcobacter butzleri: underestimated enteropathogen. Emerg Infect Dis. 2006 Feb;12(2):307-9.
Vieira A, Mateus C, Fonseca IM, Domingues F, Oleastro M, Ferreira S. The dual action of probiotic lactobacilli in suppressing virulence and survival of Arcobacter butzleri. Microb Pathog. 2025 Jul;204:107589.
Bachus A, Beyer S, Bücker R, Sharbati S, Alter T, Gölz G. Pathogenicity of Arcobacter cryaerophilus in two human intestinal cell lines. Gut Pathog. 2025 Jun 22;17(1):48.
Jiménez-Guerra G, Casanovas MorenoTorres I, Moldovan TD, Navarro-Marí JM, Gutiérrez-Fernández J. Arcobacter butzleri and intestinal colonization. Rev Esp Quimioter. 2020 Feb;33(1):73-75.
Gölz G, Karadas G, Alutis ME, Fischer A, Kühl AA, Breithaupt A, Göbel UB, Alter T, Bereswill S, Heimesaat MM. Arcobacter butzleri Induce Colonic, Extra-Intestinal and Systemic Inflammatory Responses in Gnotobiotic IL-10 Deficient Mice in a Strain-Dependent Manner. PLoS One. 2015 Sep 25;10(9):e0139402.

谷禾健康
失眠是一种常见的睡眠障碍,近 40%的成年人表现出失眠症状,10.8%的成年人患有慢性失眠症。
失眠主要表现为睡眠质量差、入睡困难、睡眠时间不足等,并与认知能力下降、焦虑、慢性疲劳、注意力不集中和记忆力减退等身心后果相关。睡眠不足也会增加慢病风险(如心血管疾病、糖尿病和肥胖),形成恶性循环,进一步威胁患者的整体健康状况。
目前的失眠疗法主要包括药物治疗和心理治疗。然而,像苯二氮䓬类药物有不良影响,如过度的神经毒性、成瘾性和耐受性。心理疗法,如认知行为疗法,已显示出长期的有效性。然而,由于缺乏训练有素的理疗师和高昂的成本,其可用性有限。
近年来,随着微生物群-肠-脑轴理论的深入发展,研究人员发现了肠道微生物不仅参与消化代谢过程,还能通过多种途径影响脑功能和行为,为失眠的发病机制研究提供了全新的视角。
在这一背景下,中草药及其活性成分作为独特的益生元,展现出巨大的治疗潜力。它们不仅为肠道菌群的活动提供能量,还通过调节肠道菌群改善肠道微环境,从而影响身体的多种生理功能,特别是睡眠调节功能。例如:
本文阐述了肠道菌群如何通过肠道-脑轴的复杂通信网络调节睡眠质量,也介绍了利用中药及其活性成分调节肠道微生物群来改善睡眠质量的潜力,同时探讨了基于肠道菌群的其他针对失眠的干预措施,为失眠治疗开辟了一条融合传统智慧与现代科学的创新路径。
失眠意味着晚上难以入睡、难以保持睡眠,或两者都有,它是最常见的睡眠障碍之一。
仅数天的失眠发作称为短期(急性)失眠。当持续存在睡眠问题时,通常会被诊断为长期(慢性)失眠。
注:慢性失眠有许多不同的定义。一个普遍接受的定义是:每周超过3晚,持续至少3个月,或持续一个月或更长时间的失眠。
急性和慢性失眠都非常普遍。大约每3个成年人中有1个有可能出现失眠症状。
症 状
失眠症状可能包括:
哪些人群更容易失眠?
几乎每个人偶尔都会有失眠的夜晚。但下列人群更可能出现失眠的情况:
月经周期和更年期期间激素变化可能起作用。更年期时,夜间盗汗和潮热常常会扰乱睡眠。失眠在怀孕期间也很常见。
由于睡眠模式和健康状况的变化,随着年龄的增长,更有可能患有失眠。
可能是什么原因?
慢性失眠通常是由压力、生活事件或破坏睡眠的习惯引起的。慢性失眠的常见原因包括:
对工作、学校、健康、金钱或家庭的担忧会使思绪在夜间保持活跃,难以入睡。压力性生活事件,如亲人的去世或疾病、离婚或失业或搬家,也可能导致失眠。
身体的“内部时钟”,即昼夜节律,指导着诸如睡眠-觉醒周期、新陈代谢和体温等。破坏这些节律可能导致失眠。比如跨越多个时区的旅行导致的时差反应、上晚班或早班、频繁轮班或三班倒等都可能引发失眠。
包括每天上床睡觉和起床的时间不同、午睡、睡前过于活跃以及睡眠区域不舒服。
其他不良的睡眠习惯包括在床上工作、吃饭或看电视。在睡前使用电脑或智能手机、玩电子游戏或看电视可能会破坏睡眠周期。
睡前吃点清淡的小零食是可以的。但如果吃太多,可能会在躺下时感到不舒服。很多人还会出现胃灼热的情况。这是指胃酸反流到从口腔到胃的食物管道中。胃灼热可能会让人无法入睡。
焦虑症,如创伤后应激障碍,可能会扰乱你的睡眠。过早醒来可能是抑郁的迹象。失眠常常与其他心理健康问题同时发生。
许多处方药会影响睡眠,例如某些抗抑郁药和用于治疗哮喘或高血压的药物。许多非处方药,如一些止痛药、过敏和感冒药以及减肥产品,含有咖啡因和其他兴奋剂,这些物质会干扰睡眠。
与失眠相关的状况包括慢性疼痛、癌症、糖尿病、心脏病、哮喘、胃食管反流病(GERD)、甲状腺功能亢进、帕金森病和阿尔茨海默病。
睡眠呼吸暂停症会导致在夜间有时停止呼吸,从而扰乱睡眠。不安腿综合征会在你试图入睡时引起强烈的、不适的移动双腿的欲望,这可能无法入睡难以再次入睡。
咖啡、茶、可乐和其他含有咖啡因的饮料让人兴奋。在下午或晚上饮用会难以入睡。烟草产品中的尼古丁是另一种会破坏睡眠的兴奋剂。酒精可能会让你入睡,但它会阻止更深睡眠阶段,在半夜醒来。
肠道菌群可以通过肠-脑轴直接或间接地参与调节大脑的睡眠功能。肠道菌群的失调,通过减少肠道屏障完整性和短链脂肪酸含量以及增加触发炎症反应的炎症介质等机制,影响宿主的睡眠行为。详见下一章节。
失眠会影响肠道菌群的丰富度和多样性
与正常组相比,睡眠缺乏小鼠的Akkermansia muciniphila、拟杆菌和粪杆菌(Faecalibacterium)丰度显著降低,气单胞菌(Aeromonas)丰度显著增加。
临床研究中的失眠或其他睡眠障碍菌群特征
与对照组相比,失眠患者的Collinsella、Adlercreutzia、Clostridiales、Pediococcus、Erysipeltrichaceae、拟杆菌属、葡萄球菌属、Carnobacterium、Odoribacter、假单胞菌属、长双歧杆菌属、Phascolarctobacterium的丰度存在显著差异。
同样,阻塞性睡眠呼吸暂停患者在下列菌群丰度存在显著差异:乳杆菌属、瘤胃球菌科、 变形杆菌科、梭菌科(Clostridiaceae)、 颤螺菌科(Oscillospiraceae)、 克雷伯氏菌(Klebsiella)、脱硫弧菌科(Desulfovibrionaceae)、脆弱拟杆菌(Bacteroides fragilis)、普拉梭菌(Faecalibacterium prausnitzii)。
无论是与炎症相关的菌株的改变,如变形杆菌科、梭菌科、Oscillospiraceae、克雷伯氏菌,还是与肠道屏障完整性相关的菌株,如脱硫弧菌科、脆弱拟杆菌、F. prausnitzii,这些变化都与睡眠质量相关的参数显著相关。
失眠不仅会降低肠道的抗氧化能力、抗炎细胞因子水平、粘蛋白2(MUC2)和紧密连接蛋白表达,还会增加促炎细胞因子的水平,导致肠道黏膜损伤和屏障通透性增加。
实验证据:睡眠剥夺通过肠道菌群影响大脑功能
当睡眠剥夺动物的肠道微生物群移植到正常小鼠体内时,供体动物的肠道菌群发生了变化,导致脂多糖(LPS)和气单胞菌水平升高,丁酸盐和Lachnospiraceae_NK4A136水平降低,海马小胶质细胞活化和神经元死亡增加。
然而,用植物乳杆菌124或A.muciniphila预处理可以恢复被破坏的肠道微生物群,减少肠道中的氧化应激、炎症和屏障损伤,增加乙酸和丁酸水平,并防止LPS刺激的小胶质细胞-神经元共培养中的突触损失。
因此,肠道微生物群的破坏通过降低肠道屏障完整性和短链脂肪酸含量,增加引发炎症反应的炎症介质等机制,影响宿主的睡眠行为。
下面章节我们就来详细看一下肠道菌群参与失眠症调节的相关机制。
下丘脑-垂体-肾上腺轴
失眠激活并导致HPA轴功能障碍。微生物可能通过神经信号传导、短链脂肪酸、表观遗传学、肠道屏障完整性或血脑屏障(BBB)通透性影响HPA轴活性。因此,失眠引起的肠道微生物群失调可能与HPA轴的激活有关。
HPA轴的破坏与致病菌(包括肠杆菌科、链球菌科、韦荣球菌科)的增加和有益细菌(包括双歧杆菌和毛螺菌科)的减少有关。
某些特定的肠道微生物群可以抑制HPA轴的激活,并介导相关的脑功能。大肠杆菌(Escherichia coli)和粪肠球菌(Enterococcus faecalis)可以降低小鼠血清中的皮质醇水平,从而缓解压力和抑郁焦虑行为。
分析表明,粪便中的羟甲睾酮(Oxymesterone)可以介导皮质醇对副拟杆菌属(Parabacteroides)的负面影响,而3-(2,4-环戊二烯-1-基)-5α-雄甾烷-17β-醇可以介导皮质类固醇对气球菌(Aerococcus)的负面影响;洛伐他汀酸(Mevinolinic acid)还可以介导气球菌对皮质醇的负面影响。这表明肠道微生物群和HPA轴之间的信号传导是双向的。
doi: 10.3389/fphar.2025.1572007
微生物内分泌产物和代谢物
★ 褪 黑 素
什么是褪黑素?
褪黑素(Melatonin,MT)又称为”暗激素”,因为它主要在黑暗环境中分泌,是我们身体内重要的睡眠调节激素。夜幕降临,褪黑素水平开始上升,告诉我们的身体该睡觉了;当太阳升起时,它的分泌减少,帮助我们保持清醒。可以说,褪黑素就像是身体内部的生物钟管家,维持着我们正常的睡眠-觉醒周期。
色氨酸的”三岔路口”
要理解肠道微生物与褪黑素的关系,我们首先需要了解一个关键的氨基酸——色氨酸(Trp)。色氨酸是合成褪黑素的重要原料,但在正常情况下,人体内仅有不到5%的色氨酸用于合成血清素(5-HT)和褪黑素,而高达95%都通过肝脏中的犬尿氨酸(Kyn)途径进行代谢。
这就像是一个”三岔路口”:
压力→肠道菌群失调→褪黑素下降
长期压力会破坏肠道菌群平衡,导致失调,失调的微生物刺激犬尿氨酸通路过度活跃,本应用于合成褪黑素的色氨酸被大量转移到犬尿氨酸途径,最终导致循环中的褪黑素水平下降,影响睡眠质量。
有益菌的助眠作用
令人惊喜的是,肠道中的某些微生物也能够主动促进其合成。研究发现,罗伊氏乳杆菌和大肠杆菌这两种微生物激活TLR2/4/MyD88/NF-κB信号通路,促进关键酶AANAT(芳烷基胺N-乙酰基转移酶)的表达,推动褪黑素的合成。
微生物代谢产物的协同效应
除了直接合成,肠道微生物的代谢产物——短链脂肪酸(SCFA)也发挥着重要作用:
外源性褪黑素补充
不仅能直接改善睡眠,还能帮助生物钟恢复正常运转,改善肠道菌群的组成和功能,增加短链脂肪酸水平,改善肠脑交流,优化肠道与大脑之间的信息传递。
研究表明,褪黑素补充能够通过多个途径改善睡眠剥夺引起的认知障碍:
最后,这些在肠道中产生的褪黑素分子会通过血液循环系统到大脑,与大脑中的MT1或MT2受体结合,最终调节我们的睡眠行为。这就形成了一个完整的”肠道-血液-大脑“调节环路。
★ γ- 氨 基 丁 酸
什么是GABA?为什么它能帮助睡眠?
γ-氨基丁酸(GABA)是一种众所周知的促进睡眠的氨基酸,是一种天然的抑制性神经递质。当我们感到焦虑、紧张或难以入睡时,GABA帮助我们的神经系统冷静下来,促进放松和睡眠。
简单来说,GABA的作用就像给过度活跃的神经系统踩了一脚”刹车“,让我们从兴奋状态转向平静状态,为优质睡眠创造条件。
肠道:GABA的”第二生产基地”
许多人以为GABA只能在大脑中产生,但实际上,我们的肠道也是一个重要的GABA生产基地。在肠黏膜中,存在着一系列特殊的细胞——肠神经内分泌细胞(如STC-1和STC-2),它们就像是内置的”GABA工厂“,它们可以表达GABAA受体及其受体亚型(α1、α3、α5、β1、β3、δ)的mRNA。
除了胃肠神经内分泌细胞合成、储存和分泌GABA的能力外,肠道微生物群的某些成员也可以产生GABA。
乳酸菌和双歧杆菌是GABA产生的关键成员
– Limosilactobacillus fermentum L18:
高效分泌GABA的专业户,通过增加连接蛋白的浓度和有益肠道细菌的丰度来增强肠道屏障
– 鼠李糖乳杆菌GG:
除了保护肠道屏障外,还可以通过调节肠脑轴来提高海马和杏仁核中的脑源性神经营养因子(BDNF)和GABA受体水平。
– 短乳杆菌:
通过发酵产生高剂量GABA,可以提高肠道中有益细菌的相对丰度和SCFA的水平,进而可以上调GABA能和5-羟色胺能神经递质的mRNA和蛋白质表达水平。这将导致θ和δ波以及非快速眼动(NREM)睡眠的显著增加。
GABA如何在肠道中发挥多重功效?
– 维护肠道屏障:构建健康防线
刺激Ca²⁺信号传导;增加MUC2释放,强化肠道黏膜屏障;促进肠道干细胞增殖,维持肠道健康。
– 调节肠脑轴:远程遥控大脑
增加海马和杏仁核中的BDNF水平,促进神经元健康;上调大脑中GABA受体水平,增强镇静效果;拟杆菌丰度与GABA受体蛋白表达呈正相关。
GABA很难穿过血脑屏障直接作用于中枢神经系统,那么肠道产生的GABA是如何影响大脑和睡眠的呢?
肠神经系统:另辟蹊径的”高速公路”
有研究人员认为,肠道内分泌细胞中存在大量GABA受体,通过肠神经系统这个”第二大脑”发挥作用,不需要直接穿过血脑屏障,而是通过肠-脑轴的复杂网络影响大脑功能。
★ 血 清 素
什么是血清素?
血清素(5-羟色胺,5-HT),有时候被称为”快乐激素”,因为它不仅能让我们感到愉悦和放松,还是调节睡眠-觉醒周期的重要神经递质。当血清素水平充足时,我们更容易感到心情平静、思维清晰,也更容易获得优质的睡眠。
作为肠脑轴中的关键神经递质,血清素(5-HT,血清素)是肠道微生物群和大脑之间进行交流的重要介质,将肠道的信息准确传递给大脑,告诉大脑什么时候工作,什么时候该休息了。
肠道:血清素的主要生产基地
体内约95%的血清素来源于肠道,而大脑反而只是小作坊。
一般生产路径:
非经典调控途径:
肠道菌群如何助力血清素的生产?
肠道菌群代谢产生短链脂肪酸,短链脂肪酸通过调节血清素转运体(SERT);调节5-HT受体的敏感性;抑制色氨酸转化为犬尿氨酸,确保更多原料用于血清素合成来促进合成。
肠道菌群多样性影响血清素
肠道微生物群的多样性会影响5-HT水平,进而影响人体的睡眠模式。补充色氨酸和血清素已被证明可以改善肠道微生物群的多样性,增加肠道中短链脂肪酸的量,提高血清素的血液水平,所有这些都可以改善老年人和新生儿的睡眠质量。
血清素代谢失衡与睡眠障碍的病理关联
在用抗生素耗尽微生物群后,5-HT的表达水平降低,导致REM睡眠的发作频率增加,NREM和REM睡眠之间的频繁转换,最终对睡眠产生负面影响。
如何通过调节血清素改善睡眠?
例如,灵芝可以调节肠道微生物群和5-羟色胺相关途径,增加5-羟色胺和GABA的血清水平,同时降低HPA轴激素水平,有效缓解焦虑小鼠的失眠行为。显然,微生物群可以通过影响肠道中5-羟色胺的合成和释放来调节大脑中的睡眠行为。
影响睡眠的微生物群-肠道-大脑轴交流模式
Sen P, et al.,Trends Mol Med. 2021
★ 短 链 脂 肪 酸
短链脂肪酸(SCFA)是肠道细菌通过发酵我们吃下去的膳食纤维产生的主要代谢产物,被认为是神经调节物质,对肠道微生物群控制睡眠至关重要。通过免疫、神经、内分泌途径,微生物群与大脑睡眠过程形成密切联系;“肠-脑轴”是两者之间的纽带,SCFA起着信使的作用。
失眠会减少产短链脂肪酸的菌的数量
产短链脂肪的菌如粪杆菌(Faecalibacterium)、Roseburia、Ruminococacaceae,这反过来又降低了肠道中SCFA的数量,而SCFA的缺乏又会进一步影响睡眠质量,形成一个难以打破的恶性循环。
肠道短链脂肪酸水平升高可提高睡眠质量
相关研究表明,短链脂肪酸水平的升高可以通过穿越血脑屏障和调节大脑中血清素和多巴胺(DA)的产生来影响大脑发育。
短链脂肪酸不仅能直达大脑,在肠道局部也发挥着重要的睡眠调节作用。
增强睡眠相关物质:
调节压力系统:
调节免疫功能
SCFA调节HPA轴:缓解压力促进睡眠
通过显著增加SCFA含量,可以带来一系列积极变化:
短双歧杆菌207-1可以通过显著增加SCFA和GABA水平,整体抑制HPA轴相关激素来改善睡眠质量。
不同SCFA的作用
乙酸盐、丁酸盐、戊酸盐与HPA轴相关激素水平呈负相关;丙酸盐显示出相反的模式。
因此,微生物群产生的SCFA可以通过改善肠道屏障和肠道免疫环境来影响神经系统。它们通过增加肠道中SCFA的多样性和水平、刺激睡眠相关细胞因子的分泌和抑制炎症反应等机制,改善失眠。
★ 多 巴 胺
多巴胺(DA)被称为大脑中的”奖励分子”和”动力激素”,但在睡眠调节中,它是”人间清醒”。作为一种促进警觉性的强效神经递质,多巴胺对于控制我们的睡眠-觉醒周期至关重要。
当多巴胺水平充足时,我们会感到精神饱满、注意力集中、反应敏捷;而当多巴胺不足时,我们可能会感到昏昏欲睡、缺乏动力、思维迟钝。
多巴胺:肠道保护功能
多巴胺在肠道中并不仅仅是一个”过客”,它还承担着重要的肠道保护功能:
通过D5受体的作用:
通过D2受体的作用:
肠道菌群失调:多巴胺代谢的破坏者
肠道菌群可以影响多巴胺的水平,相关研究表明,肠道菌群失调导致多巴胺代谢紊乱(以高香草酸减少为特征),从而影响大脑的清醒和认知功能。
注:高香草酸是多巴胺代谢的重要产物,它的减少就像是”多巴胺工厂”生产效率下降的信号。
补充益生菌可以有效逆转这些紊乱
补充益生菌已被证明可以恢复Blautia、Dialister、F.prausnitzii、Ruminococcus、拟杆菌属,这些菌群与高香草酸水平呈显著正相关。这意味着它们能够有效修复多巴胺代谢通路,恢复正常的觉醒调节功能。
两种特别的”多巴胺生产专家”
粪肠球菌(Enterococcus faecalis)和屎肠球菌(Enterococcus faecium) 具有酪氨酸羟化酶和多巴脱羧酶活性,使其能够将酪氨酸转化为L-dopa(多巴胺的前体)。进一步的研究表明,粪肠球菌和屎肠球菌的移植增加了PGF小鼠肠道内多巴/多巴胺的合成,促进了多巴/多巴胺从肠道进入血液,从而提高了大脑中的多巴胺水平。
这表明,调节肠道微生物群中苯丙氨酸酪氨酸多巴多巴胺的生物合成途径可能会改善脑功能。
短链脂肪酸的协同作用
研究表明,肠道微生物群代谢产生的短链脂肪酸可以直接穿透血脑屏障,控制5-羟色胺和多巴胺的合成,进而影响大脑发育。因此,肠道细菌可以通过多种途径调节大脑的多巴胺能系统,从而影响大脑的唤醒能力和功能。
微生物群-迷走神经通路
迷走神经就像是连接肠道和大脑之间的一条专线电话,肠壁中富含迷走神经纤维,这些神经纤维就像是密布在肠道中的信号接收器,能够从肠道接收各种信号并将其精确地传递到大脑。可以说,迷走神经是肠道微生物群影响大脑功能、调节睡眠的重要通路之一。
肠道微生物如何启动迷走神经?
通过这条”迷走神经专线”,肠道细菌能够:
粪菌移植和罗伊氏乳杆菌
粪菌移植可以触发肠道的迷走神经系统,从而导致脑干和海马体的5-HT和DA神经传递途径的长期改变。
通过迷走神经依赖机制,罗伊氏乳杆菌还可以改变催产素和多巴胺能信号在腹侧被盖区(VTA)的传递方式。值得注意的是,海马体和VTA中的多巴胺能回路在维持睡眠-觉醒相关行为方面都起着至关重要的作用。
证据:迷走神经切断实验
为了证实迷走神经参与肠道和大脑之间的信息传递,研究人员进行了一个实验:膈下迷走神经切断术。就像是切断电话线,看看肠道和大脑之间的通讯是否会中断。
治疗效果消失:
注:选择性5-HT再摄取抑制剂是一类通过抑制突触前膜5-HT再摄取、增强突触间隙5-HT浓度的抗抑郁药物。
信号传递的机制
当肠道内的5-HT与迷走神经纤维上密集分布的5-HT受体结合时,迷走神经被激活。然后,神经元通过特定的投射对5-HT信号做出反应并进行分类,然后将其传递到大脑。
迷走神经刺激:治疗睡眠障碍的新策略
研究表明,迷走神经刺激可通过降低外周血和海马中IL-1β和IL-6的水平,以及防止星形胶质细胞和小胶质细胞激活,从而改善由睡眠剥夺引起的抑郁样行为。
微生物-免疫炎症通路
免疫炎症通路就像是身体内部的警报系统,当有危险信号出现时,它会迅速启动防御机制。在肠道微生物调节睡眠的过程中,它也扮演着至关重要的角色。这套系统运行正常时,我们能享受优质睡眠;而当系统失调时,就可能出现失眠、睡眠质量下降等问题。
微生物通过免疫炎症途径与大脑的睡眠调节功能建立复杂的相互作用。简单来说,肠道微生物可以通过调节免疫系统的炎症反应,间接影响大脑的睡眠中枢,就像是通过免疫语言与大脑进行对话。
睡眠剥夺:引发免疫炎症风暴的导火索
睡眠剥夺破坏肠道屏障和血脑屏障通透性,增加NLRP3水平,并激活肠道中的TLR4/NF-κB信号通路,导致炎症信号传递到大脑,从而加剧大脑中的神经炎症和小胶质细胞激活。
恢复被破坏的肠道微生物群可以缓解肠道氧化应激、炎症反应和屏障损伤,从而改善睡眠质量。
肠道微生物代谢物:TMAO的双面性
某些肠道微生物可以通过其代谢产物介导宿主的炎症反应来调节大脑的睡眠功能。例如,三甲胺N-氧化物(TMAO)是肠道微生物群的代谢产物,可以通过调节膜联蛋白A1信号传导来增强血脑屏障的完整性,保护大脑免受炎症损伤,还可以通过NF-κB信号通路促进NLRP3激活来影响睡眠。
特定菌群与炎症因子
睡眠剥夺会引发肠道微生物群失调,导致炎症因子如IL-1β、IL-6、TNF-α的表达失衡。
相关分析表明,IL-1β和TNF-α与肠道中的Ruminococcus_1和Ruminococcoccus e_UCG-005呈正相关。
– NLRP3炎症体:睡眠调节的关键开关
NLRP3是参与IL-1β调控睡眠的关键介质之一。NLRP3的组装可以激活caspase-1,激活的caspase-1随后将pro-IL-1β切割成成熟的IL-1β,然后调节中枢神经系统对生理睡眠的控制。
TNF-α和IL-1β受体通过配体激活介导NF-κB转录,触发参与睡眠调节和影响睡眠的炎症相关分子的转录。
这个指挥系统一旦启动,就会产生级联放大效应,小小的炎症信号最终可能对睡眠产生显著影响。
尽管睡眠剥夺对血脑屏障的影响在某种程度上是可逆的,但修复过程并不简单,即使在恢复正常睡眠模式后,恢复正常的血脑屏障功能仍然是一个漫长的过程。
这些发现为失眠的免疫治疗提供了新的思路,通过调节肠道微生物群来优化免疫炎症反应,进而改善睡眠质量。
源自中草药的药用食品及其生物活性化合物是独特的“益生元”,具有以下优点:副作用小、安全性高、提高患者依从性、适合长期食用。这些特性突显了这些草药在营养和治疗应用中的双重价值。此外,它们具有调节肠道微生物群稳定性的潜力,为通过调节肠道微生物组预防和治疗失眠提供了新的视角。
酸 枣 仁
酸枣仁(Ziziphi spinosae semen,SZR)是指鼠李科植物枣属种类中,中国枣(Ziziphus jujuba Mill. var. spinosa (Bunge) Hu ex H. F. Chou)的干燥成熟种子。
酸枣仁以其酸甜口味和中性特性为特征,靶向肝、胆囊、心经。它以“滋阴养心、补血养肝、安神安神”的功效而闻名,对治疗虚证和慢性失眠特别有效。正是因为其卓越的安神助眠功效,酸枣仁被誉为”东方睡眠果实“,在临床上广泛用于治疗失眠。
注:从历史角度看,酸枣仁在中医中一直受到高度重视,无论是作为单一草药还是复方制剂,都展现出了令人瞩目的疗效。
酸枣仁的”睡眠密码”:三大活性成分
皂苷、黄酮、生物碱是酸枣仁镇静和催眠作用的主要活性成分。先前的研究表明,酸枣仁可以调节氨基酸代谢、神经递质释放、炎症因子平衡和HPA轴稳态等生理过程,从而调节神经活动,实现神经系统的平衡,改善睡眠。
最近的研究表明,酸枣仁可以恢复失眠引起的肠道菌群失衡,增加大鼠体内有益菌的相对丰度,如乳杆菌、双歧杆菌、乳球菌、真杆菌,同时减少普雷沃氏菌的相对丰度。
菌群代谢产物——短链脂肪酸(SCFA)
梭菌和乳杆菌丰度的增加导致其代谢产物丁酸盐含量的增加,这进一步影响了体内的氨基酸代谢途径,从而显著恢复了患有睡眠-觉醒节律紊乱的小鼠的睡眠-觉醒节奏。
SCFA可以间接调节肠道和大脑中的5-HT水平。
研究表明,通过酸枣仁的微生物代谢增加的SCFA,可以调节结肠中TLR4/NF-κB/NLRP3相关信号通路中代表性因子的表达,从而调节微生物群-肠-脑轴,改善小鼠的失眠和抑郁行为。
注: TLR4:控制肠道免疫系统的”警报器”;NF-κB:调节炎症反应的”总开关”;NLRP3:影响炎症体的活化程度。
酸枣仁调节肠道菌群,而不是直接作用于大脑
显然,酸枣仁可以通过微生物群神经通路和微生物群免疫通路调节微生物群肠脑轴,从而实现对生物体睡眠行为的控制。这可能解释了酸枣仁的活性成分不能穿过血脑屏障,但仍然能改善睡眠质量。
卷 丹 百 合
在中医传统中,百合类植物一直被认为具有”润肺止咳、清心安神“的功效,而现代科学研究正在揭示其改善睡眠的深层机制。
卷丹百合(LB)可以通过降低血清中HPA轴激素的水平、增加5-HT和MT的水平、降低下丘脑中去甲肾上腺素(NE)的水平以及上调GABAA受体和5-HT1A受体的表达,来改善大鼠的下丘脑病理并缓解失眠行为。
肠道菌群调节:失眠改善的核心机制
卷丹百合调节肠道菌群的方式可能直接关系到它缓解失眠的效果。除了逆转失眠对肠道微生物群的多样性、丰度和粪便代谢表型的不利影响外,卷丹百合还控制花生四烯酸和色氨酸的代谢,从而降低与心理健康问题相关的化学物质犬尿氨酸的表达水平。
卷丹百合显著调节肠道内乳杆菌、埃希氏菌、Porphyromonadaceae的相对丰度,并积极调节下丘脑中的5-羟基-L-色氨酸,后者参与5-HT的代谢。通过卷丹百合干预,最重要和最基本的途径被认为是5-羟色胺能系统和花生四烯酸代谢途径。
复方协同:卷丹百合与地黄汤的联合
卷丹百合和地黄汤(LBRD)可以通过纠正肠道微生物群失调和避免肠道屏障受损或血脑屏障泄漏引起的炎症,来减轻与抑郁行为相关的神经元损伤。根据粪便微生物群移植和肠道微生物群组成研究,通过肠道-脑轴,乳杆菌、双歧杆菌、乳球菌(Lactococcus)被证明是地黄汤抗抑郁作用的重要因素。
灵 芝
灵芝的镇静作用与肠道菌群密切相关
当灵芝与罗伊氏乳杆菌发酵时,它可以增加血清中5-HT和GABA的水平,降低HPA轴激素的水平,有效缓解焦虑小鼠的失眠症状。
灵芝的乙醇提取物也对微生物组的结构产生了显著影响。
下丘脑的5-HT浓度与双歧杆菌和动物双歧杆菌呈正相关,这不仅提高了那里的5-HT水平,还增加了包括Tph2、Iptr3、Gng13在内的重要转录因子的产生。在用抗生素耗尽肠道微生物群后,灵芝乙醇提取物的促进睡眠作用以及与睡眠行为相关的粪便代谢物的变化完全消失。这表明肠道微生物群在灵芝的促睡眠作用中起着不可或缺的作用。
多糖成分的免疫调节与神经保护作用
来自灵芝的多糖已被证明可以提高小鼠大脑中的GABA和5-HT水平,并通过延长NREMS期间的δ波来提高其睡眠质量。
此外,灵芝多糖及其水解产物,即灵芝肽,通过各种途径表现出免疫调节活性。具体而言,灵芝多糖不仅降低了肠道中的F/B比值,而且显著上调了回肠中NF-κBp65、IL-2、IL-4的表达水平;它们还显著增强BDNF的表达,抑制促炎细胞因子的表达,并抑制小胶质细胞和星形胶质细胞的激活,从而发挥抗抑郁作用。
灵芝肽参与关键途径,如叶酸循环、脂肪酸的生物合成和代谢以及cAMP代谢。灵芝多糖在调节肠道微生物群稳态和提供神经保护方面具有巨大潜力。
茯 苓
茯苓(P.cocos)自古以来就被誉为”四时神药”,茯苓性平味甘,具有健脾利湿、宁心安神的功效,是古代人治疗失眠的首选核心药物之一,
传统核心药物的现代机制:多糖和三萜
茯苓含有多糖和三萜类化合物,是其镇静和诱导宁静的主要活性成分。研究表明,茯苓中的酸性多糖可以通过干预肠道微生物群和调节相关途径发挥镇静作用。
这些多糖不仅增加了肠道微生物群的丰度,如厚壁菌门、杆菌门、乳杆菌门、Fusicatenibacter、Prevotellaceae_UCG-001;它们还上调下丘脑中关键神经递质5-HT、DA、NE、GABA的水平,增加神经元细胞的数量,同时降低炎症因子的表达水平。
此外,来自茯苓的水提取物和水溶性多糖可以通过改善肠道微生物群失衡、缓解代谢紊乱、调节肠道神经肽和神经递质水平以及抑制TNF-α/NF-κB信号通路来有效预防焦虑的发作。
增加短链脂肪酸、促进色氨酸代谢
茯苓多糖可以通过增加肠道中的短链脂肪酸水平和促进色氨酸代谢来增强肠道屏障。它们不仅通过增加吲哚乳酸盐和吲哚-3-醛的水平来促进色氨酸代谢;还通过增加肠道中短链脂肪酸的水平、调节IL-2、IL-4、IL-6、IL-10、TGF-β、IFN-γ等关键免疫因子的表达,激活Wnt/β-Catenin信号通路来维持肠道屏障的完整性和功能。
色氨酸和短链脂肪酸的水平以及肠道屏障的健康稳态与肠道微生物群密切相关,对改善睡眠质量有重大影响。
人 参
人参被誉为”百草之王”,是中药中最珍贵的滋补品之一。作为五加科植物,人参含有丰富的活性成分,具有补元气、复脉固脱、补脾益肺、生津养血、安神益智等功效。现代研究发现,人参不仅能直接作用于大脑,还能通过调节肠道微生物群来改善睡眠质量。
多重活性成分的协同作用:跨越血脑屏障
人参中发现的肽、多糖、皂苷具有穿过血脑屏障并调节神经内分泌平衡和大脑代谢环境的能力。人参多糖通过增强肠道吸收和影响肠道微生物代谢来增强人参皂苷Rb1和微生物代谢产物的暴露。Rb1通过调节瑞士乳杆菌丰度和GABAA受体表达发挥神经保护作用。
人参皂苷Rg1(Rg1)对神经系统具有潜在的健康促进作用。Rg1可以改善吗啡诱导的肠道微生物群失调(特别是拟杆菌),抑制肠道微生物群衍生的色氨酸代谢,调节异常升高的血清素、5-羟色胺受体1B和5-羟色胺受体2A水平,使其回归正常范围。
人参皂苷的多途径神经保护机制
人参皂苷Rg可能影响肠道微生物群,并通过多种不同途径提供神经保护。
Rg1可以通过调节5-HT神经递质系统、阻止肠道微生物群产生的色氨酸代谢和改善肠道微生物群失调(特别是拟杆菌)来防止小鼠产生吗啡依赖。
Rg5不仅可以纠正不平衡的肠道微生物群,恢复肠道屏障的功能,还可以通过控制脂肪和葡萄糖的代谢,提高GABA/Glu比值,上调GABAA、GABAB和5-HT受体1A的表达,改变时钟相关蛋白质的节律特征,改善睡眠质量,进而影响GABA和5-HT神经递质系统。
复方协同与代谢循环优化
人参和酸枣仁的联合使用,可以改善肠道微生物群的结构,促进Glu/GBA-Gln代谢循环的正常运作,增加海马中GABA的合成和释放,从而显著改善失眠大鼠的睡眠状态。这表明人参可以通过多种途径干预肠道微生物群并调节大脑睡眠功能。
doi: 10.3389/fphar.2025.1572007
天 麻
天麻(G.Blume)是兰科植物天麻的干燥块茎,素有”定风草”之称,是著名的息风止痉、平抑肝阳的中药材。
天麻素的多重神经保护机制:从炎症调控到信号通路调节
从天麻中提取和分离天麻素(GAS)已被证明对中枢神经系统疾病有显著影响,包括但不限于失眠、焦虑、抑郁、认知障碍、缺血性中风。
天麻素通过控制IL-6、IL-1β等炎性因子的表达、B细胞淋巴瘤-2(Bcl-2)蛋白的活性以及p-ERK与ERK的比值,不仅改善了失眠小鼠的睡眠质量,而且通过调节TLR4/NF-κB和Wnt/β-catenin信号通路,改善了快速眼动睡眠剥夺引起的睡眠障碍。因此,天麻素在提高睡眠质量方面具有很大的潜力。
肠道微生物群调节
已经进行的研究表明,天麻素可以通过调节微生物群-肠-脑轴来抑制神经元凋亡,从而改善阿尔茨海默病小鼠的认知障碍和神经变性。
在抑郁的小鼠中,天麻的水提取物可以通过促进潜在有益菌(Alloprevotella、双歧杆菌、Defluviitaleaceae UCG-011、Akkermansia、Parabifidobacter)和粪便SCFA水平的增加和平衡,使结肠中5-羟吲哚乙酸与5-HT的比例正常化,并降低犬尿氨酸与色氨酸的比例来重塑肠道微生物组结构。抗生素混合物的给药部分消除了天麻素对阿尔茨海默小鼠的神经保护作用。
天麻及其活性成分对大脑功能的影响是显而易见的,因为它们部分针对微生物群-肠道-大脑轴。然而,支持天麻素可以通过这种微生物群-肠-脑轴调节大脑睡眠功能这一观点的确凿实验证据仍有待观察。需进一步研究来确定天麻素通过改变肠道微生物群来改善睡眠质量的确切过程,以便更谨慎地开发和使用天麻。
蒙 古 黄 芪
蒙古黄芪是豆科植物蒙古黄芪的干燥根,被誉为”补气圣药”,在中医药学中具有重要地位。黄芪性温味甘,具有补气固表、托毒排脓、利水消肿的功效,是临床上最常用的补气药之一。
现代研究发现,蒙古黄芪富含黄酮类化合物、多糖、皂苷,通过控制肠道微生物群的组成、代谢和活性,有助于保持肠道微环境的稳定。
黄芪多糖的免疫调节机制:特异性菌群调控的双向作用
研究发现,不同浓度的黄芪多糖(APS)对睡眠剥夺小鼠的脾脏和身体损伤具有缓解和保护作用。
进一步的研究表明,黄芪多糖可以通过调节与炎症和免疫反应、短链脂肪酸合成和TLR4/NF-κB通路有关的某些微生物来改善免疫功能障碍。
例如,黄芪多糖可以改善免疫功能低下的小鼠和大鼠的免疫功能,这是由于减少了Pseudoflavonifractor、Oscillibacter、Tyzzerealla、Paraprevotella、Lachnoclostridium的丰度,并增加了乳杆菌、双歧杆菌、Roseburia、脱硫原体、Paracoccus、副拟杆菌、Clostridium XIVb、Butyricicoccus的丰度。
然而,在肠道微生物群减少的免疫功能低下小鼠中,黄芪多糖并没有改善免疫功能。
肠脑轴的积极调控:从代谢产物到神经递质的全面优化
为了积极控制肠-脑轴,黄芪多糖不仅增加了肠道中乳杆菌和芽孢杆菌的相对丰度,还增加了粪便中短链脂肪酸和GABA的含量,提高了虾的免疫力。
此外,黄芪多糖可以显著减轻与年龄相关的肠道屏障破坏、胃肠酸碱平衡丧失、肠道长度缩短、肠道干细胞过度增殖以及衰老后的睡眠障碍。
因此,肠道微生物群不仅积极帮助身体吸收黄芪多糖,而且通过提高肠道SCFA水平来改善免疫功能障碍,并通过促进神经递质的释放来积极调节肠道脑轴。
龙 眼
龙眼肉,又称桂圆肉,自古以来就被誉为”智慧果”。在中医理论中,龙眼肉性温味甘,具有补益心脾、养血安神的功效,《神农本草经》将其列为上品药材。龙眼肉是中国传统医学中常用的治疗失眠的草药之一,但关于其改善睡眠质量的潜力的药理活性研究很少。
龙眼含有GABA,可以用作天然膳食补充剂。龙眼中富含多种氨基酸,如GABA和Glu,并且随着果实年龄的增长,其浓度也会增加。成熟后在冷藏温度下储存可以增加水果中的GABA含量。
此外,通过增加胃中Lactobacilli、Pediococci、 Bifidobacteria的数量,肠道微生物群对龙眼多糖的代谢可以提高琥珀酸和SCFA(乙酸、丙酸和丁酸)的水平,增强肠道免疫力。
无论是作为富含GABA的膳食补充剂还是通过调节肠道内的微生物代谢产物,龙眼肉都有可能通过影响肠道中GABA、MT、5-HT等睡眠相关神经递质的合成和释放来调节肠道微生物群-肠脑轴。这可以直接或间接地调节身体的睡眠-觉醒周期,从而发挥强大的睡眠促进作用。
其他中草药及其成分
中医药宝库中蕴藏着众多具有安神功效的珍贵药材,这些草药在千百年的临床实践中积累了丰富的应用经验。
除了前述的经典药材外,栀子、三七、莲子等传统药材同样具有改善睡眠的潜力,但它们通过肠道微生物群调节睡眠机制的研究相对较少。这里讨论了其他一些草药及其活性成分如何影响肠道菌群,从而提高睡眠质量的能力。
栀子、三七
研究表明,栀子可以通过调节肠道微生物群和降低TNF-α和IL-7β水平来改善睡眠质量和缓解焦虑症状。
由肠道微生物群代谢的三七总皂苷转化为人参皂苷Rg,其保护海马神经元并调节大脑中的神经递质水平,从而改善失眠、抑郁和认知障碍。
莲子、荷叶
莲子和荷叶都可以通过调节肠道微生物群的丰度和结构来调节GABA能系统,从而促进睡眠。然而,它们调节肠道微生物群的方式存在显著差异。具体而言:
枣、谷芽
枣具有改善睡眠质量和通过调节GABA能系统提供神经保护的潜力。具体而言,它可以上调Lachnoclosdium、Marvinbryantia的丰度,同时下调Alistipes、Akkermansia的丰度。
谷芽[Setaria italica(L.)Beauv]可能会增加肠道中普雷沃氏菌、乳酸菌、Ruminococcus的丰度,从而通过调节神经递质和炎症因子水平来提高SCFA水平并改善睡眠质量。
山茶、枸杞
山茶[(L.)Kuntze]可能通过改善肠道微生物群来影响神经内分泌途径和免疫系统,从而调节睡眠-觉醒周期。
枸杞可能通过改善肠道屏障和抑制TLR4信号通路来保护神经系统。
交泰丸
由黄连根茎和肉桂皮组成的交泰丸可以改善睡眠,并减轻慢性睡眠剥夺引起的炎症和胰岛素抵抗。组学结果表明,交泰丸治疗显著增加了小鼠中毛螺菌科、拟杆菌属、AKK菌属的相对丰度。
黄连温胆汤对失眠的机制可能与它抑制 5-羟色胺含量的降低和γ-氨基丁酸水平的升高有关。同样,研究发现甘麦大枣汤可以增加 NE 和 5-羟色胺的含量,改善睡眠,在一定程度上缓解抑郁,柴胡加龙骨牡蛎汤主要通过调节下丘脑-垂体-肾上腺轴(ACTH、CORT等)和脑单胺神经递质(NE、DA、5-羟色胺等)的水平来治疗失眠。
草药及其活性成分在改变肠道微生物群和提高睡眠质量方面的巨大潜力已经得到证实,尽管这一研究领域仍处于早期阶段。更多的研究不仅可以为治疗失眠提供坚实的支持,还可以通过阐明这些草药与微生物群-肠道-大脑轴相互作用的机制来调节与睡眠相关的大脑功能,从而帮助我们更明智地开发和使用这些草药。
针 灸
针灸治疗注重根据辨证选择穴位,基于辨证的针灸疗法可以取得良好效果并改善胃肠功能,针灸结合腹部环形按摩可以改善下丘脑和海马旁回的功能,从而达到改善失眠症状的效果。
此外,研究发现针灸可以抑制 HPA 轴的活性,从而改善失眠症状。
有研究在微生物-肠-脑轴理论指导下总结了针灸的原则:
可以直观地发现,这些针灸穴位与微生物-肠-脑轴的解剖部位有许多重叠。从健脾和胃治疗失眠的角度来看,主要穴位有中脘、关元、天枢、气海等。
这些针灸疗法可以通过调节神经递质和某些激素的分泌,以及下调 HPA 轴来抑制交感神经并改善内分泌,从而改善失眠症状,这些症状是微生物-肠-脑轴相同调节机制的一部分。
doi: 10.12998/wjcc.v12.i18.3314
饮 食 调 整
不良饮食模式的负面影响
长期高糖摄入会刺激免疫系统,诱发过度炎症反应,导致睡眠片段化。
肥胖人群中Faecalibacterium丰度显著下降,这在慢性失眠患者中同样存在。
健康饮食模式的积极作用
富含植物性食物、抗氧化剂和不饱和脂肪酸;促进产丁酸菌丰度增加,显著改变肠道微生物代谢活性,与更好的睡眠质量和更长的睡眠时间相关。
适用人群:肥胖青少年、结合增加体力活动
增加肠道中乳杆菌的丰度,乳杆菌以其促进睡眠的有益作用而闻名。
其他,如习惯性饮茶,可能通过肠道菌群-胆汁酸轴减轻慢性失眠引起的肠道菌群失衡和胆汁酸代谢紊乱。
益 生 菌
接受发酵益生菌 Lactobacillus brevis DL1-11 牛奶的小鼠表现出更短的睡眠潜伏期和更长的睡眠时间。因为 DL1-11 可以产生大量的 GABA,GABA 可以促进放松并增强睡眠。
Lactobacillus fermentum PS150TM通过增加下丘脑腺苷 A1 受体的表达,有效地促进了正常小鼠的睡眠,并缓解了咖啡因诱导失眠小鼠的失眠症状。PS150TM 能够恢复因首夜效应导致睡眠障碍的小鼠的非快速眼动睡眠,这可能是由于其重塑肠道菌群组成的能力,改变血清素能通路,减少慢性轻度压力大鼠的抑郁和焦虑。
Bifidobacterium breve CCFM1025 通过抑制 HPA 轴活性,改善了睡眠并缓解了压力水平。
Bifidobacterium adolescentis SBT2786 可以通过增加快速眼动睡眠时间来延长总睡眠时间,白天疲劳减少。
Lactobacillus plantarum PS128 显著增强了深度睡眠,并减少了疲劳和抑郁症状。
Lactobacillus gasseri CP2305 也已可以改善肠道微生物群组成,并降低唾液皮质醇浓度,从而减轻压力并增强睡眠 。
Lactobacillus casei Shirota 牛奶通过延长睡眠时间和减少觉醒时的嗜睡感,帮助面临考试压力的个体 。
Lactococcus lactis subsp. cremoris YRC3780 也显示出改善睡眠和缓解压力的潜力,这一点由日本进行的一项双盲、安慰剂对照的临床试验所证实,接受 YRC3780 干预的参与者主观睡眠质量和心理健康均有显著改善。
doi: 10.3390/ijms252313208
益 生 元
益生元饮食(由半乳寡糖、聚葡萄糖、乳铁蛋白和乳清蛋白浓缩牛奶脂肪球膜蛋白-10 组成)通过在正常情况下增强非快速眼动睡眠,并在压力情况下延长快速眼动睡眠,对小鼠的睡眠模式产生了积极影响。
接受益生元饮食(由半乳寡糖和聚葡萄糖组成)的大鼠在睡眠紊乱情况下表现出更长的非快速眼动睡眠和快速眼动睡眠。菌群分析发现,在益生组中,Parabacteroides distasonis 的相对丰度增加,这与促进睡眠和恢复昼夜节律有关。
在一项人体研究中,45 名参与者被随机分为三组,分别接受低聚果糖(FOS)、低聚半乳糖(GOS)或安慰剂。结果表明,低聚半乳糖组的参与者睡眠质量得到改善,唾液皮质醇觉醒反应显著降低。这种皮质醇的减少与肠道菌群中 Bifidobacteria 的相对丰度增加有关,这些菌具有代谢低聚半乳糖的能力,并对心理健康有积极作用。
抗性淀粉是另一种已被证明能通过减少炎症和 HPA 轴活性来改善 2 型糖尿病患者睡眠质量的益生元。
一项随机、双盲、安慰剂对照的研究也报道了益生元酵母甘露聚糖的改善睡眠效果。酵母甘露聚糖组的非快速眼动睡眠第 3 阶段睡眠时间和总睡眠时间均显著长于安慰剂组。
粪菌移植 (FMT)
目前,越来越多的研究将粪菌移植作为精神健康疾病的一种潜在治疗方法,因为肠道微生物群可以通过微生物群-大脑轴影响中枢神经系统。
临床研究表明,洗涤微生物群移植增加了有益细菌(如 Bifidobacterium、Ruminococcus gnavus 、Prevotella 7、Faecalibacterium)的相对丰度,并减少了有害细菌(如 Escherichia-Shigella 、 Streptococcus)的相对丰度,显著改善了患有各种潜在疾病的患者睡眠障碍。睡眠质量得到改善的患者在抑郁程度和 IBS 症状严重程度上也表现出更大的减少。
另一项开放标签的观察性研究发现,在患有胃肠道疾病且出现睡眠障碍的患者中,结果相似,作者认为整体改善归因于FMT治疗后菌群多样性的增加。
一项真实世界研究发现,粪菌移植显著改善了失眠患者的睡眠质量,缩短了睡眠潜伏期,并提高了睡眠效率。通过比较肠道菌群组成,研究人员发现,粪菌移植显著增加了产短链脂肪酸菌的相对丰度,包括 Lactobacillus、Bifidobacterium 、 Turicibacter。
注:所有这些研究都将失眠视为与其他疾病相关的共病,这表明睡眠的改善也可能归因于疾病症状的缓解,粪菌移植对睡眠障碍的有效性需要进一步研究。
随着现代医学对肠-脑轴研究的深入,传统中医药”治未病“的理念与现代微生态学理论完美融合,为失眠治疗开辟了全新视角。
未来研究应重点关注个体化精准治疗策略的制定。肠道菌群检测技术的应用将为临床实践提供重要指导,通过分析患者特异性的菌群结构,识别关键的失调菌群如拟杆菌、双歧杆菌、乳杆菌等,可为选择最适宜的中药配方提供科学依据。
同时,肠道菌群代谢产物如短链脂肪酸、GABA、血清素等关键代谢产物水平,这些在谷禾肠道菌群检测报告中也都有相应指标,结合肠道菌群检测报告有助于辅助评估治疗效果并优化用药方案。
<来源:谷禾肠道菌群检测数据库>
在中医药现代化进程中,应深入挖掘经典方剂如甘麦大枣汤、安神定志丸等复方的菌群调节机制,探索经典方剂与菌群协同效应的内在规律。同时,结合中医体质辨识与肠道菌群分型,建立”体质-菌群-证候“三位一体的诊疗模式。
通过构建中药-菌群相互作用数据库,为临床医师提供相对精准的用药指导,最终实现传统中医智慧与现代精准医学的深度融合,为失眠患者带来更加安全、有效的个性化治疗方案。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Wu C, Dou J, Song X, Yang F, Liu X, Song W, Zhang X. Gut microbiota: a new target for the prevention and treatment of insomnia using Chinese herbal medicines and their active components. Front Pharmacol. 2025 May 6;16:1572007.
Li C, Chen S, Wang Y, Su Q. Microbiome-Based Therapeutics for Insomnia. Int J Mol Sci. 2024 Dec 9;25(23):13208.
Ito H, Tomura Y, Kitagawa Y, Nakashima T, Kobanawa S, Uki K, Oshida J, Kodama T, Fukui S, Kobayashi D. Effects of probiotics on sleep parameters: A systematic review and meta-analysis. Clin Nutr ESPEN. 2024 Oct;63:623-630.
Patterson E, Tan HTT, Groeger D, Andrews M, Buckley M, Murphy EF, Groeger JA. Bifidobacterium longum 1714 improves sleep quality and aspects of well-being in healthy adults: a randomized, double-blind, placebo-controlled clinical trial. Sci Rep. 2024 Feb 14;14(1):3725.
Liwinski T, Lang UE, Brühl AB, Schneider E. Exploring the Therapeutic Potential of Gamma-Aminobutyric Acid in Stress and Depressive Disorders through the Gut-Brain Axis. Biomedicines. 2023 Nov 24;11(12):3128.
Li L, Wu L, Jiang T, Liang T, Yang L, Li Y, Gao H, Zhang J, Xie X, Wu Q. Lactiplantibacillus plantarum 124 Modulates Sleep Deprivation-Associated Markers of Intestinal Barrier Dysfunction in Mice in Conjunction with the Regulation of Gut Microbiota. Nutrients. 2023 Sep 15;15(18):4002.
Pan LM, Hong ZB, Guan RQ. Research progress on insomnia treated by traditional Chinese medicine and acupuncture based on microbial-gut-brain axis theory. World J Clin Cases. 2024 Jun 26;12(18):3314-3320.