-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com



短链脂肪酸这一词经常出现在谷禾的文章和报告中,那你真的了解短链脂肪酸吗?短链脂肪酸(SCFA)主要是肠道微生物群在结肠内通过发酵碳水化合物(包括膳食和内源性碳水化合物,主要是抗性淀粉和膳食纤维)和一些微生物可利用的蛋白质而产生的。
短链脂肪酸主要是乙酸、丙酸和丁酸,在结肠中的浓度比大致为60-70%:20-30%:10-20%。这些代谢产物能够被宿主利用,尤其是丙酸和丁酸,它们发挥一系列促进健康的功能。它们能被肠粘膜有效吸收,作为能量来源,还能作为基因表达调节剂以及特定受体识别的信号分子,对宿主生理产生重要影响。近几年的研究还发现其能够调节免疫细胞发育并抑制炎症。
然而,三种主要短链脂肪酸——乙酸盐、丙酸盐和丁酸盐——它们在体内的功能和组织分布不同,对宿主生理的影响存在显著差异。丁酸盐优先被肠粘膜用作能量来源,还具有抗炎特性,可增强肠道屏障功能和粘膜免疫。丙酸盐有助于抵抗肝脏中的脂肪形成、降低胆固醇、也有一定的抗炎和抗致癌作用。而乙酸在血液中浓度最高,可用作肝脏胆固醇和脂肪酸合成的底物,增加结肠血流量和氧气吸收,并通过影响回肠收缩来增强回肠运动。
其次,它们与宿主蛋白(如丁酸和丙酸抑制组蛋白去乙酰化酶)和受体的相互作用也不同。因此,特别需要考虑这些短链脂肪酸的微生物来源。与此同时,饮食结构和肠道生理变化如何影响这些脂肪酸的相对产量和在结肠中的浓度也是至关重要的。
本文将重点介绍丙酸盐和丁酸盐,因为这两种短链脂肪酸被认为对健康有重要影响,包括丁酸预防结直肠癌,丙酸促进饱腹感并降低胆固醇。而乙酸是大多数肠道厌氧菌的主要发酵产物,也可由还原性乙酸生成,而丙酸和丁酸则由不同的肠道细菌群产生。
我们将探讨在人类结肠微生物群中已知的形成这两种短链脂肪酸的途径,以及各种饮食和环境因素对其产生的调节可能性。详细了解肠道微生物群的短链脂肪酸代谢及其生理功能对于制定个性化的健康营养方案是必不可少的。
丙酸盐和丁酸盐在结构、来源、生理功能以及对健康的影响方面存在一些差异。
▸ 结构上的差异:
丙酸盐(Propionate)含有三个碳原子,羟基(-OH)位于第二个碳原子上。
丁酸盐(Butyrate)含有四个碳原子,羟基(-OH)位于第四个碳原子上。
▸ 来源上的差异:
丙酸盐通常由肠道细菌通过发酵L-鼠李糖、聚葡萄糖、阿拉伯木聚糖、D-塔格糖、甘露寡糖、昆布多糖等糖类物质产生。
丁酸盐可以通过肠道微生物群发酵富含抗性淀粉和果聚糖的食物来增加,如菊粉、马铃薯、洋葱等。
▸ 功能上的差异:
丙酸盐在体内的主要功能是作为肝脏中糖原合成的前体物质,有助于调节血糖水平,影响食欲。
丁酸盐是结肠上皮细胞的首选能源,有助于维持肠道屏障,发挥免疫调节和抗炎作用。丁酸盐还可以通过减少NF-kB信号传导和诱导凋亡来促进神经保护。
▸ 对健康的影响:
丙酸盐的健康益处主要是调节能量代谢和改善代谢综合征,可能对调节肠道菌群平衡也有积极作用,但其具体影响取决于个体的肠道菌群组成。
丁酸盐对健康的影响更为广泛,包括维持肠道稳态、促进肠道屏障的完整性、刺激绒毛的生长、促进粘蛋白的产生。以及改善认知功能、促进睡眠、调节社交行为和在糖尿病中的潜在益处。
丙酸盐是许多生物(从细菌到人类)的代谢副产物,产生丙酸的代谢途径可分为三类。主要发酵途径将不同的碳源分解代谢为丙酸盐(图A);分解代谢途径则能将多种氨基酸降解为丙酸盐(图B);此外,通过与从丙酮酸或二氧化碳生成生物质前体相关的合成代谢途径也可以生产丙酸盐(图C)。
产生丙酸盐的代谢途径
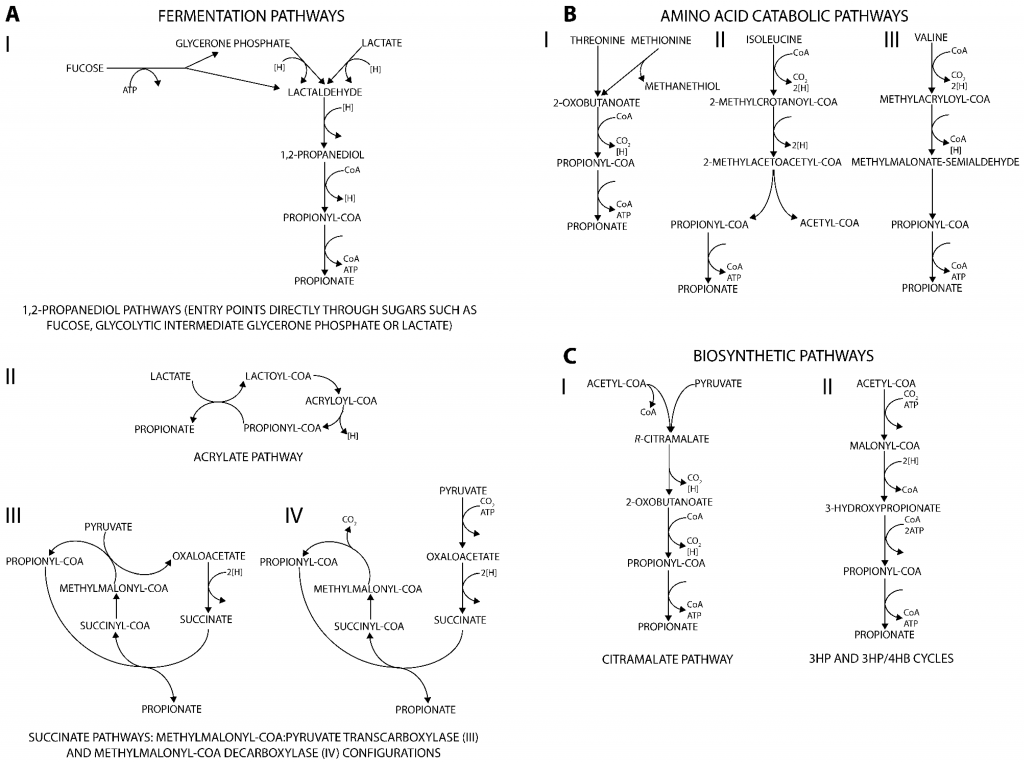
doi.org/10.3390/fermentation3020021
肠道微生物通过发酵不可消化的碳水化合物产生的丙酸盐是体内丙酸盐的主要来源。下面将讲述肠道中丙酸盐通过发酵碳水化合物的三种主要产生途径以及参与这些途径的微生物。
与氨基酸降解和生物合成途径相比,发酵途径不仅提供能量,还帮助消耗由糖分解代谢产生的还原辅因子。它们在能量产生和维持氧化还原平衡中的作用,使这些途径能够与细胞生长相耦合。
能够产生丙酸盐的微生物种类

doi.org/10.3390/fermentation3020021
▸
丙二醇相关途径
• 鼠伤寒沙门氏菌和Roseburia inulinivorans在这一过程可以产生丙酸
丙酸盐在肠胃中的生成是由1,2-丙二醇(PDO)发酵菌和PDO消耗菌组成的微生物联合作用的结果。已知一些生物体(如鼠伤寒沙门氏菌和Roseburia inulinivorans)能同时进行这两种过程。
在二醇脱水酶和两种常与乙酸代谢相关的混杂酶(辅酶A依赖性醛脱氢酶磷酸转酰基酶和乙酸激酶)的共同作用下,PDO分解代谢为丙酸,同时生成一个ATP和一个还原辅因子。
然而,通过该途径产生丙酸取决于可用于其他细菌生长的碳水化合物,据报道岩藻糖和鼠李糖是丙酸的前体。
通过1,2-丙二醇形成丙酸的微生物途径
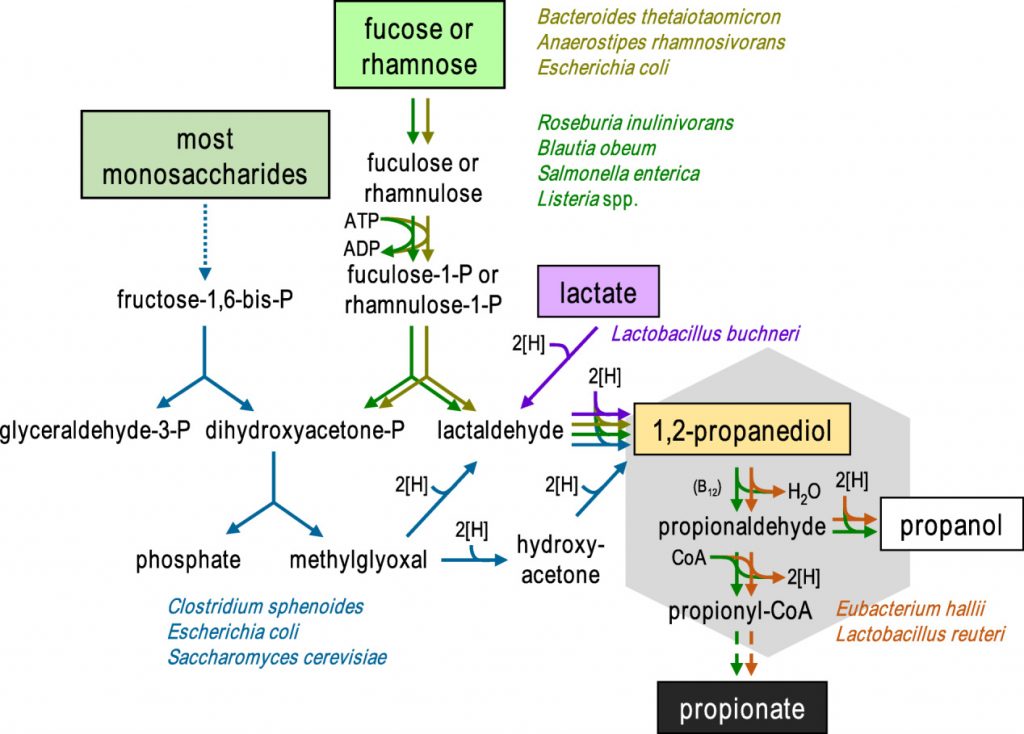
doi: 10.1111/1462-2920.13589.
霍氏大肠杆菌(E.hallii)和罗伊氏乳杆菌(Lactobacillus reuteri)虽然无法在岩藻糖或鼠李糖上生长,但仍然能够利用1,2-丙二醇产生丙酸和丙醇。此外,宏基因组研究表明,其他肠道厌氧菌,包括Flavonifractor plautii、Intestinimonas butyriproducens和Veillonella spp. 也可能能够从这种底物中产生丙酸。因此,不同细菌之间中间体 1,2-丙二醇可能在脱氧糖生产丙酸中发挥重要作用。
▸ 丙烯酸酯途径
丙烯酸酯途径在消耗NADH的情况下,使乳酸在ATP中性条件下转化为丙酸。该途径存在于几种细菌中,包括丙酸梭菌(Clostridium propionicum)、埃氏巨球菌(Megasphaera elsdenii)和瘤胃普氏菌(Prevotella ruminicola)。
虽然多种底物可以分解为丙酸和乙酸,包括乳酸、丝氨酸、丙氨酸和乙醇,但葡萄糖发酵在这过程中似乎不会导致任何天然生产者产生丙酸,这可能是因为葡萄糖发酵不会触发启动循环所需的乳酸消旋酶的表达。
▸ 琥珀酸途径
琥珀酸途径主要存在于拟杆菌门和厚壁菌门中,拟杆菌门的一些细菌从膳食碳水化合物生成丙酸,并且拟杆菌门的相对丰度与人类粪便中丙酸盐的相对水平相关。
• 琥珀酸转化为丙酸盐还需要维生素B12
琥珀酸是丙酸的前体,但在高pCO2(二氧化碳分压)和高稀释率等条件下,它可在磷酸烯醇式丙酮酸羧激酶受到抑制的拟杆菌属培养物中积累。琥珀酸转化为丙酸还需要维生素B12,如果缺乏B12,琥珀酸可能无法转化成丙酸盐。
人类结肠中的一些厚壁菌门细菌(例如Phascolarctobacterium succinatutens)能将琥珀酸转化为丙酸;其他革兰氏阴性菌通过琥珀酸途径(如韦荣氏球菌属)或丙烯酸酯途径(Megasphaera elsdenii)将乳酸转化为丙酸盐。
▸ 氨基酸降解产生丙酸
缬氨酸、苏氨酸、异亮氨酸和蛋氨酸的降解可导致通过丙酰辅酶A产生丙酸和ATP。
由于氨基酸的合成和随后的分解代谢途径存在于多种微生物中,因此可以使用氨基酸合成代谢和分解代谢途径的组合从葡萄糖生产丙酸。
几种拟杆菌在蛋白水解和肽形成丙酸方面发挥重要作用。
苏氨酸的产生和分解代谢已在大肠杆菌中得到广泛研究,作为丙酰辅酶A的可能来源,可用于生产各种化学物质,包括丙醇、红霉素和3-羟基戊酸。此外,考虑到氧化还原和能量平衡,缬氨酸/异亮氨酸和苏氨酸途径的组合具有协同作用,可以略微提高丙酸产量。
除此之外,可以利用丙酮酸经过柠檬酸途径产生丙酸,由于和菌群关联较小,在这就不展开描述了。
▸ 增加丙酸盐生成的底物
一些益生元等化合物可以影响丙酸盐的生产,不过由于浓度以及肠道微生物群落构成的不同,这些化合物的调节丙酸盐产生时具有一定差异。
• L-鼠李糖能够明显增加丙酸盐产量
L-鼠李糖或6-脱氧-L-甘露糖是一种天然脱氧糖。它存在于多种动物、植物和细菌多糖中。在短期体外实验中,L-鼠李糖已被证明能使丙酸产量增加四倍于乳果糖。
在一项人体体内研究中也获得了类似的结果,其中受试者在三个不同的时间被给予25克L-鼠李糖、乳果糖或D-葡萄糖。摄入后24小时测量血清丙酸,L-鼠李糖的血清丙酸明显高于乳果糖或D-葡萄糖的血清丙酸。
一项长期研究也证实了L-鼠李糖诱导丙酸的作用,该研究结果表明,与摄入D-葡萄糖作为对照相比,摄入25克L-鼠李糖可显著提高人体28天内的血清丙酸水平。
• 抗性淀粉有助于增加丙酸
抗性淀粉对淀粉酶降解具有抗性,但它会发酵成丁酸或丙酸。特别是,来自大米的抗性淀粉与丙酸产量增加有关。
研究了抗性淀粉在大鼠体内的发酵情况,饲喂抗性淀粉(630g/kg饲料)的大鼠的肝脏甘油三酯和总胆固醇浓度显著低于对照组。与此同时,血清丙酸浓度也显著增加。
• 菊粉对于增加丙酸和丁酸非常有效
菊粉属于果聚糖家族,主要由β-(2,1)连接的果糖基组成。它天然存在于菊苣和菊芋等开花植物中。作为益生元,菊粉已被证明对增加丁酸和丙酸的产量非常有效。使用人体肠道微生物体外模拟研究了菊粉增加丙酸的效果。
补充菊粉1周(5g/d)后观察到短链脂肪酸产生的代谢变化。较高浓度的短链脂肪酸源于丙酸和丁酸产量的增加。
此外一项针对喂食菊粉(10%)的大鼠的体内研究也导致丙酸产量大幅增加,高达 58.4mmol/。
• 聚葡萄糖
聚葡萄糖是一种支链、随机聚合的多糖,主要由葡萄糖合成,在胃肠道上部不会被消化。使用结肠模拟器研究了这种底物对结肠微生物组成和代谢活性的调节作用。与对照糖木糖醇(8.3mmol/L)相比,短链脂肪酸产量显著增加,尤其是丙酸盐(22.9mmol/L)。
• 阿拉伯木聚糖
阿拉伯木聚糖是许多谷物中发现的主要非淀粉多糖,是膳食纤维的一部分。
在体内研究中,比较了54只大鼠,这些大鼠分别喂食对照饮食(含710g/kg小麦)、阿拉伯木聚糖补充饮食(610g/kg小麦淀粉加100g/kg玉米阿拉伯木聚糖)和胆固醇补充饮食(不含或含2g/kg 胆固醇)。由于短链脂肪酸的积累,尤其是丙酸(摩尔百分比>45%),盲肠pH值从7降至6。然而,丁酸的产生不受影响。
车前草是一种可溶性纤维来源,可提供与麦麸阿拉伯木聚糖相当的多糖。在一项大鼠体内研究中,比较了车前草(5%)对盲肠和结肠发酵的影响与麦麸 (10%) 的影响。研究发现,车前草发酵可产生更高的短链脂肪酸,尤其是盲肠和所有结肠中的丙酸更多。
除此之外,D-塔格糖、甘露寡糖、昆布多糖等物质也可以增加人体丙酸盐的产生。
丙酸盐已被证明具有抗脂肪形成和降低胆固醇的作用。它还对体重控制和进食行为有很强的影响。此外,有研究表明,丙酸和丁酸一样,对结肠癌细胞具有抗增殖作用。
丙酸盐对健康的影响
doi: 10.1111/j.1753-4887.
然而,与结肠细胞用作能量来源的丁酸不同,丙酸在血液循环中的浓度较高。因此,丙酸的生物活性可能不仅限于结肠本身,还扩展到人体的其他部位。需要强调的是,了解体内结肠丙酸浓度或短链脂肪酸浓度不足以推断健康状况。
▸ 影响肝细胞的脂质合成
肝脏的脂质合成包括将饮食来源的脂肪酸和甘油转化为具有不同脂肪酸组成的胆固醇和甘油三酯。然后,这些肝脏脂质分子被结合到脂蛋白中,从而通过循环分布到各种组织中。
• 脂质合成受到短链脂肪酸的强烈影响
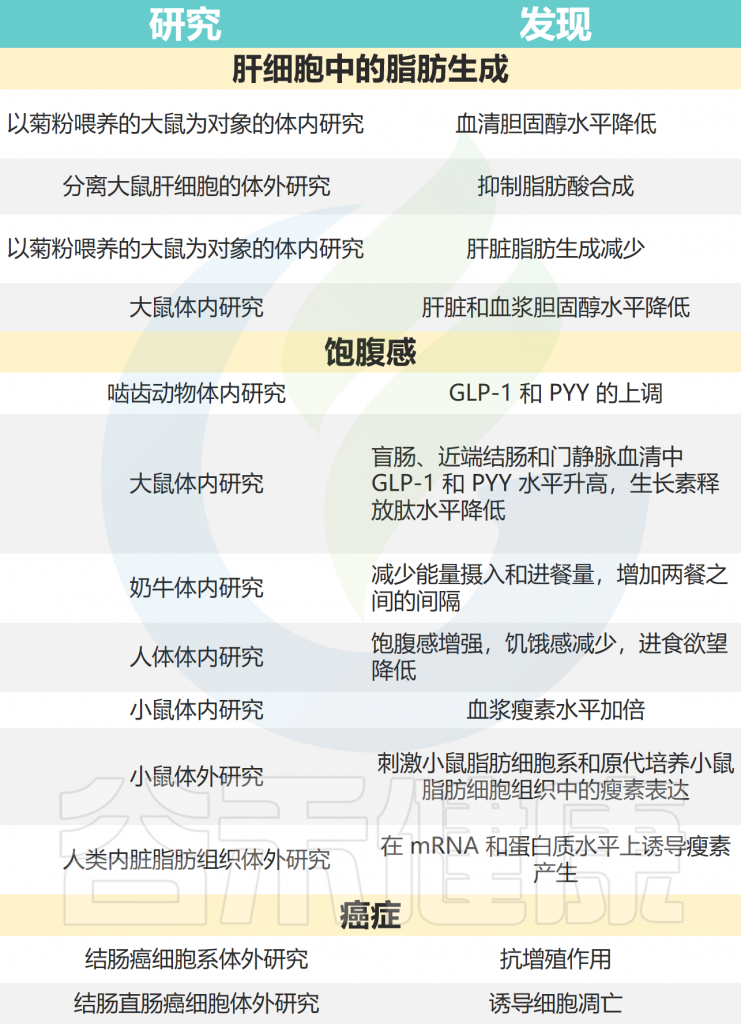
有趣的是,肝细胞中的脂质合成受到肠道纤维发酵产生的短链脂肪酸的数量和类型的强烈影响。丙酸盐已被确定在其中一些过程中发挥重要作用。
对肝脏脂质合成的饮食调节早期观察显示,膳食纤维摄入与肝脏脂质合成密切相关。这种影响的部分原因如下:1)粪便中胆固醇和胆汁酸从肠道排出的增加;2)胆固醇向胆汁酸的肝脏转化率较高;3)通过减少乳糜微粒的大小和降低胆固醇在乳糜微粒中的掺入来优化脂蛋白的外周代谢。
• 降低血清胆固醇水平、抑制脂肪酸合成
短链脂肪酸作为微生物碳水化合物发酵的产物,在肝脏脂质合成中发挥着特定作用,已被证明在喂食大鼠时可降低血清胆固醇水平。对分离的大鼠肝细胞的体外研究表明,丙酸对脂肪酸合成有抑制作用,但对胆固醇合成没有抑制作用。
其他大鼠实验表明,加入纤维的饮食可降低肝和血浆胆固醇水平及血浆甘油三酯中的胆固醇,而肝甘油三酯没有受到影响。
尽管这些研究的结果令人信服,但其他研究并不总是能够证实丙酸盐对脂质代谢的抑制作用。例如,每天在面包中补充9.9克丙酸盐不会改变6名健康志愿者的脂质代谢,甚至会导致5名受试者的甘油三酯浓度升高。
在另一项研究中,比较了丙酸盐对人和大鼠肝细胞脂质代谢的影响。发现浓度为0.1mmol/L的丙酸盐对大鼠乙酸盐合成脂质有抑制作用。然而,在人类肝细胞中,需要更高浓度的丙酸盐(约10-20 mmol/L)才能获得同样的抑制作用。该值比门静脉血中丙酸盐的浓度高100-200倍,表明大鼠模型不能完全外推到人类的情况。
▸ 作为影响饱腹感的分子
丙酸盐不仅具有降低胆固醇和抗脂肪生成的作用,还可能通过刺激饱腹感来控制体重。已有研究表明,短链脂肪酸(如乙酸、丙酸、丁酸)具有诱发饱腹感的作用。
• 丙酸盐影响肠道激素的形成进而影响饱腹感
现有证据表明,细菌调节肠道激素(如胰高血糖素样肽1(GLP-1)和肽YY(PYY))的形成,是通过短链脂肪酸介导的。乙酸、丙酸和丁酸的生理浓度,以及pH值从7.5降至6.0,会显著增加肠内分泌结肠细胞系STC-1中的胰高血糖素原和PYY。
GLP-1和PYY是刺激饱腹感的激素,由L细胞(主要位于回肠和结肠)响应营养摄入而释放。GLP-1促进胰岛素分泌和胰腺β细胞增殖,同时控制肌肉细胞中的糖原合成;而PYY则减缓胃排空。相反,生长素释放肽刺激食欲,主要由胃中的P/D1细胞产生。
不易消化的碳水化合物,如低聚果糖、乳糖醇和抗性淀粉,通过调节肠道肽GLP-1、PYY和生长素释放肽的产生,有效地诱导饱腹感,这一机制还涉及肠道微生物群落。
• 丙酸盐对摄食行为有显著影响,诱导瘦素产生
在短链脂肪酸中,丙酸盐被重点研究作为一种饱腹感诱导剂,对能量摄入和摄食行为有显著影响。人体和动物试验表明,丙酸盐给药(体内范围为130-930mmol/L,体外范围为0.01-10mmol/L)显著增强饱腹感并降低进食欲望。
丙酸盐触发的饱腹感信号之一是瘦素,这是一种强效的厌食激素,通过中枢神经系统中表达的受体抑制食物摄入。研究显示,每天服用500µmol的丙酸盐几乎使小鼠血浆中的瘦素浓度翻了一倍。
在另一项研究中,浓度为3mmol/L的丙酸在mRNA和蛋白质水平上诱导了人内脏脂肪组织中瘦素的产生。这些数据表明,肠道微生物群对肥胖的调节作用可能部分由短链脂肪酸(特别是来自微生物碳水化合物发酵的丙酸)介导。
▸ 影响心脑血管健康
丙酸盐通过与肠道受体GPR 41和GPR 43(也称为脂肪酸受体FFAR2和FFAR3)相互作用,对心脑血管健康具有一些潜在的影响。
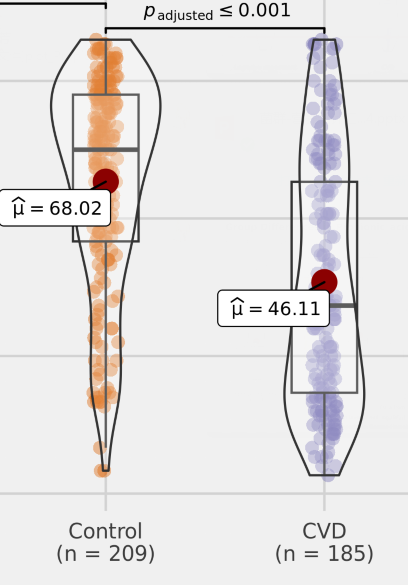
• 脑血管患者体内的丙酸盐含量较低
编辑
谷禾的数据中发现,与健康对照相比,脑血管疾病患者中的丙酸盐含量较低,并且具有明显的统计学差异。因此丙酸盐的含量可能是影响心脑血管健康的一个重要指标。
• 较高的丙酸盐浓度患冠状动脉硬化风险较低
最近一项大型横断面研究表明血浆丙酸浓度与冠状动脉疾病存在关联,较高浓度的丙酸盐与较低的冠状动脉粥样硬(CAD)风险相关,且与已知的心血管风险因素无关。
如上所述,越来越多的实验数据表明,丙酸盐可能对高血压、内皮功能障碍和高胆固醇血症等心血管风险因素产生有益影响。
▸ 丙酸盐在癌症中的潜在作用
短链脂肪酸对癌症(尤其是结肠癌)的影响已被广泛研究。丁酸能够调节基因表达,并对细胞凋亡和细胞周期的关键调节因子产生影响。
几种机制促成了丁酸对基因表达的调节作用。这些机制包括组蛋白和非组蛋白的过度乙酰化以及DNA甲基化的改变,从而增强了转录因子对核小体DNA的可及性。
• 丙酸盐诱导结直肠癌细胞凋亡
在一项研究中,丙酸盐和乙酸盐(浓度分别为26-40和9-16mmol/L)在人类结直肠癌细胞系中诱导了典型的细胞凋亡迹象。这些迹象包括线粒体跨膜电位的丧失、活性氧的产生、胱天蛋白酶3加工和核染色质凝聚。
• 抑制结肠癌细胞系的生长
短链脂肪酸对结肠上皮细胞增殖具有矛盾作用。虽然这些阴离子刺激正常隐窝细胞,但它们抑制结肠癌细胞系的生长。
丁酸盐和丙酸盐也是诱导分化和细胞凋亡的最有效脂肪酸。因此,它们通常可以预防癌症的发展,尤其是预防结直肠癌。虽然丁酸比丙酸更有效,但它主要被结肠细胞吸收作为能量来源。相比之下,丙酸和乙酸盐进入血液循环的浓度比丁酸高得多,并且它们被肝脏大量吸收(约60%)。由于这些阴离子在肝脏中的浓度很高,它们很可能会影响肝癌细胞以及已知会导致肝脏转移的其他典型癌细胞,例如乳腺癌和结肠癌。
一项针对猝死患者的研究表明,外周血中的短链脂肪酸数量可以量化。因此,这种循环中的丙酸盐、乙酸盐和丁酸盐的抗癌作用非常值得研究;例如,这种影响会在多大程度上延伸到小肠、大肠和肝脏之外,从而影响不同的组织?
!
• 丙酸盐过量可能与阿尔茨海默病相关
最近的几项研究提供了丙酸盐与阿尔茨海默病(AD)之间联系的证据。例如,分析了阿尔茨海默病患者和健康对照者的唾液样本,发现阿尔茨海默病患者的丙酸水平比健康对照者高出1.35倍。分析了轻度认知障碍者、阿尔茨海默病患者和健康对照者的唾液样本,也发现AD患者的丙酸水平显著升高。
几项啮齿动物研究也将粪便和循环中丙酸盐水平与阿尔茨海默病联系起来。接受AD患者粪便微生物群移植的小鼠丙酸水平高于对照组。
此外,发现阿尔茨海默病小鼠海马体中的丙酸增加了1.23倍。也发现阿尔茨海默病小鼠前额叶皮层中的丙酸浓度显著高于野生型小鼠,6个月大的阿尔茨海默病小鼠粪便中的丙酸浓度也显著更高。
• 丙酸血症的丙酸盐代谢异常
丙酸血症是人类最常见的有机酸代谢紊乱,是一种由丙酰辅酶A羧化酶基因缺陷引起的先天性代谢错误,丙酸过量且无法通过丙酰辅酶A转化。
丙酸血症患者的体内丙酸及其代谢物水平显著升高,会引起代谢性酸中毒、血氨升高,可能还会诱导一些严重的并发症如脑损伤、心肌病发生。
•有研究认为过多的丙酸盐可能导致肥胖和糖尿病
2019年哈佛大学公共卫生学院发表的一篇文献称:小鼠长期接触丙酸将导致肝细胞产生更多葡萄糖,形成高血糖症,这是糖尿病的一个典型特征。此外,研究人员还发现,长期服用丙酸盐剂量的小鼠,其体重会显著增加,胰岛素抗性也会增大。
还对14名健康人开展对照试验,受试者被随机分为两组,其中一组的餐食中添加1克丙酸盐,另一组添加安慰剂。结果显示,进餐后不久,丙酸盐组受试者血液中的去甲肾上腺素水平显著升高,胰高血糖素等激素水平也有所增长。这表明丙酸盐可能会作为“代谢破坏者”,增加人类患糖尿病和肥胖症的风险。
而这与前文丙酸盐会影响脂质合成与摄食行为相矛盾,因此,丙酸盐对人体的影响可能取决于其含量以及人体独特的肠道菌群结构与代谢能力。
内源性丙酸盐与外源性丙酸盐存在区别
内源性丙酸:指的是人体内部产生的丙酸,通常情况下,人体中的微生物能够在结肠中通过发酵未完全消化的碳水化合物来产生丙酸,这些丙酸对人体是有益的。
外源性丙酸:指的是从外部来源摄入的丙酸,比如通过食物摄入或作为补充剂。以及在一些药物中也可能含有丙酸盐。
★ 外源性丙酸盐摄入过多对代谢健康有害
但已经有各种研究表明,外源性地摄入和自体产生的丙酸作用并不一样,外来的丙酸对个体的许多代谢过程有不利影响。
哈佛大学公共卫生学院的研究人员完成了一项实验,发现从食品中摄入的丙酸在短期内会导致高血糖、胰岛素偏高,而且长期摄入将会造成肥胖和胰岛素抵抗等更严重的症状。
我们通过口腔摄入含丙酸添加剂的食物后,会激活我们的交感神经系统,并促使体内胰高血糖素和脂肪酸结合蛋白4等激素的升高。受到激素影响,肝糖原持续分解,血糖升高。身体开始分泌更多胰岛素进行代偿降低血糖浓度,最终导致胰岛素抵抗和肥胖产生。
这项研究表明,自身产生的丙酸和外界摄入的丙酸具有不同的功能,我们推测,这是因为从食物中摄入会极大地增加细胞和丙酸的接触,而细菌产生的仅仅只会局限在结肠部分。
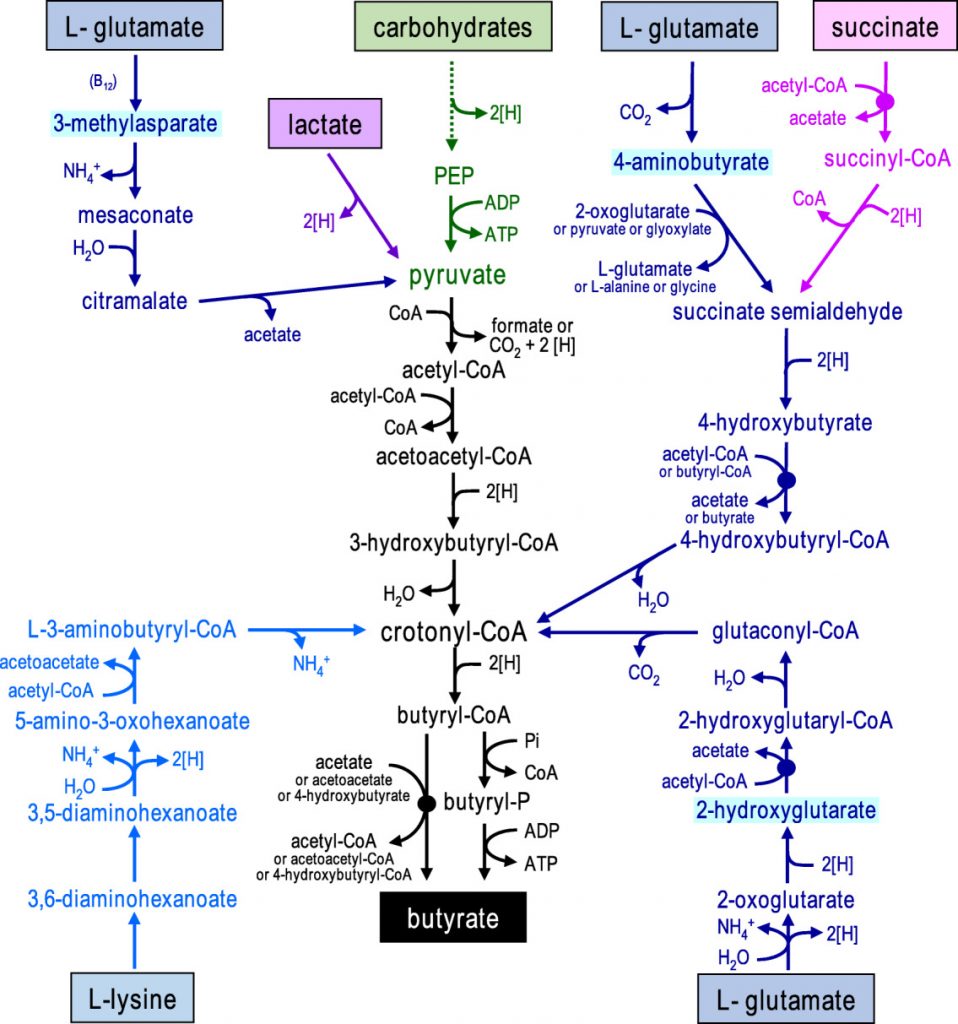
在人体肠道中,丁酸由膳食纤维经细菌发酵产生,通过两种代谢途径。在第一条途径中,丁酰辅酶A被磷酸化形成丁酰磷酸,并通过丁酸激酶转化为丁酸。在第二条途径中,丁酰辅酶A的辅酶A部分通过丁酰辅酶A:乙酸辅酶A转移酶转移到乙酸盐,从而形成丁酸和乙酰辅酶A。其中丁酰辅酶A:乙酸辅酶A转移酶途径占主导地位。
对人类粪便微生物群的放射性同位素分析也表明,肠道中的大多数丁酸盐是由碳水化合物通过Embden-Meyerhof-Parnas(糖酵解途径)由乙酰辅酶A产生的。
• 少量的丁酸盐也可由蛋白质合成
除了碳水化合物,少量的丁酸也可以通过谷氨酸、赖氨酸、戊二酸和γ-氨基丁酸途径由蛋白质合成。厚壁菌种也对氨基酸表现出高活性,特别是肠单胞菌(Intestinimonas AF211),它通过不同的途径将葡萄糖和赖氨酸发酵成丁酸。
形成丁酸盐的微生物途径
doi: 10.1111/1462-2920.13589.
碳水化合物通过糖酵解发酵为丙酮酸显示为绿色,从乙酰辅酶A形成丁酸盐显示为黑色,氨基酸发酵途径显示为蓝色(以中间体命名不同的谷氨酸途径),乳酸和琥珀酸发酵分别显示为紫色和粉色。
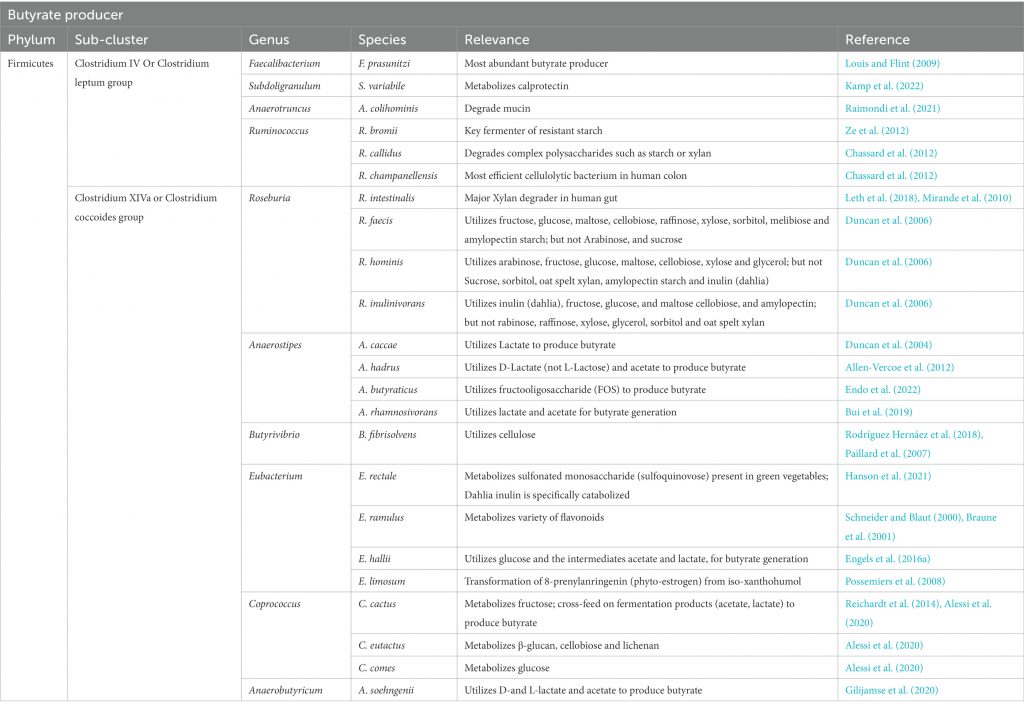
• 人结肠中的瘤胃球菌和毛螺菌是产丁酸的主力
除食源性丁酸,人体内丁酸主要是由盲肠和结肠的厌氧型细菌发酵产生,而由胃和小肠产生的丁酸含量极低。大肠产丁酸的菌种主要是梭菌属XIVa和IV族,以及真杆菌属和梭杆菌属
盲肠和结肠中丁酸的产生速度和数量主要取决于肠道微生物组成、日常膳食中可利用发酵成分组成等。在人的结肠中,厚壁菌门中的瘤胃球菌科(Ruminococcaceae)和毛螺菌科(Lachnospiraceae)这两个主要科,以及包括丹毒丝菌科(Erysipelotrichaceae)和梭菌科(Clostridiaceae)在内的其他厚壁菌门物种,都发现了丁酸生产菌种与非生产菌种的交替存在。
但应注意,许多人类结肠的主要厚壁菌门(例如Blautia spp.、Eubacterium eligens、Ruminococcus spp.)缺乏从碳水化合物中生成丁酸的能力。
产生丁酸盐的细菌被认为在生命的第一年内定植于宿主,并且在成年时占总细菌群落的20%以上。在消化道中发现的已知丁酸盐生产者中,大多数似乎属于毛螺菌科和瘤胃球菌科。我们将简要介绍两个丁酸生产菌。
▸ 普拉梭菌
普拉梭菌(Faecalibacterium prausnitzii)是健康人类微生物群中最丰富的菌种之一,也是主要的丁酸盐生产者之一。它通过丁酰辅酶A:乙酸辅酶A转移酶产生丁酸,并消耗乙酸。
虽然F.prausnitzii菌株是专性厌氧菌,但在核黄素(维生素B2)和还原性化合物(如半胱氨酸或谷胱甘肽)存在的情况下,低浓度氧气也能促进其生长。
氧气消耗会伴随丁酸形成的减少。F. prausnitzii分离株在利用食物多糖(如淀粉和半纤维素)生长方面能力有限,但一些菌株可以利用菊粉和果胶衍生物,并且普遍利用糖醛酸。
• 肠道炎症患者产生丁酸会减少
F. prausnitzii在炎症性肠病患者中很少见,尤其是克罗恩病,有证据表明它具有抗炎作用,因此引起了人们对其作为潜在治疗药物的兴趣。同样,据报道,Butyricicoccus pullicaecorum在炎症性肠病患者中较少见,并且也可能具有治疗潜力。
注:其他瘤胃球菌科细菌也能产生丁酸,但人们对大多数此类生物知之甚少。关于Faecalibacterium prausnitzii,详见:肠道核心菌属——普拉梭菌(F. Prausnitzii),预防炎症的下一代益生菌
▸ 毛螺菌科
直肠真杆菌(Eubacterium rectale)和密切相关的罗氏菌属(Roseburia)构成了产丁酸毛螺菌科的主要群体,它们具有相同的丁酰辅酶 A:乙酸辅酶 A 转移酶途径来生产丁酸,并且其丁酸合成基因的基因组组织也相同,从乙酰辅酶A到丁酰辅酶A。
• 罗氏菌属通过代谢饮食多糖产生丁酸
在某些Roseburia菌株中,特别是在弱酸性pH值下,丁酸几乎是唯一产生的发酵酸,乙酸的净消耗通常伴随着丁酸的形成。一些其他菌株和物种除了产生丁酸外,还产生甲酸和乳酸。基因组分析表明,该群体具有相当大的利用饮食来源的多糖的能力,包括淀粉、阿拉伯木聚糖和菊粉,不同菌株和物种之间的差异很大。
其他拥有丁酰辅酶A:乙酸辅酶A转移酶基因的毛螺菌科包括Eubacterium hallii、Anaerostipes hadrus、Coprococcus catus、与分离株SS3/4和M62/1有关的未鉴定物种。
• 一些毛螺菌科细菌利用乳酸和乙酸来产生丁酸
某些毛螺菌科能够在乳酸和乙酸盐存在下生长并产生丁酸,其总净化学计量为4mol乳酸和2mol乙酸盐产生3mol丁酸 。
这包括仅使用D-乳酸的物种Anaerostipes hadrus和能够利用两种乳酸异构体的E. hallii。
此外,双歧杆菌等常见益生菌配方中的微生物与丁酸盐生产者之间的交叉喂养相互作用已被证明是可以产丁酸盐的。
人体肠道中的主要丁酸生产者
doi: 10.3389/fmicb.2022.1103836.
▸ 增加丁酸盐生成的食物
饮食对人体微生物群有显著影响,通过饮食干预可显著改变细菌数量并增加微生物多样性。富含纤维的饮食对丁酸盐的产生特别有益,因为它可以滋养产生丁酸盐的细菌。
• 高纤维饮食能够有效增加丁酸盐的生成
蔬菜、水果、豆类和全谷物,它们含有膳食纤维,可被肠道细菌发酵成丁酸盐等有机化合物。通过食物增强微生物群是促进消化系统健康和丁酸盐生成的有效且安全的方法。因此,增加丁酸盐产量的最佳方法是通过高纤维饮食。
• 高脂、低纤维饮食不利于丁酸盐的生成
高蛋白、高脂肪、低碳水化合物的饮食已被证明会破坏微生物组中丁酸盐的产生。在一项研究中,研究人员分析了短期饮食限制碳水化合物摄入量的肥胖参与者的微生物组,从而限制了他们对植物性膳食纤维的消耗。
在低碳水化合物饮食(每天24克)和中等碳水化合物饮食(每天164克)4 周后,短链脂肪酸的浓度低于高碳水化合物饮食(每天399克)。具体来说,当碳水化合物摄入量减少时,丁酸盐浓度会降低。
同时还发现,厚壁菌门细菌Roseburia和E.Rectale的密度与丁酸盐浓度之间存在联系,两者都随着碳水化合物摄入量的减少而降低。
一些食源性物质产生短链脂肪酸的量
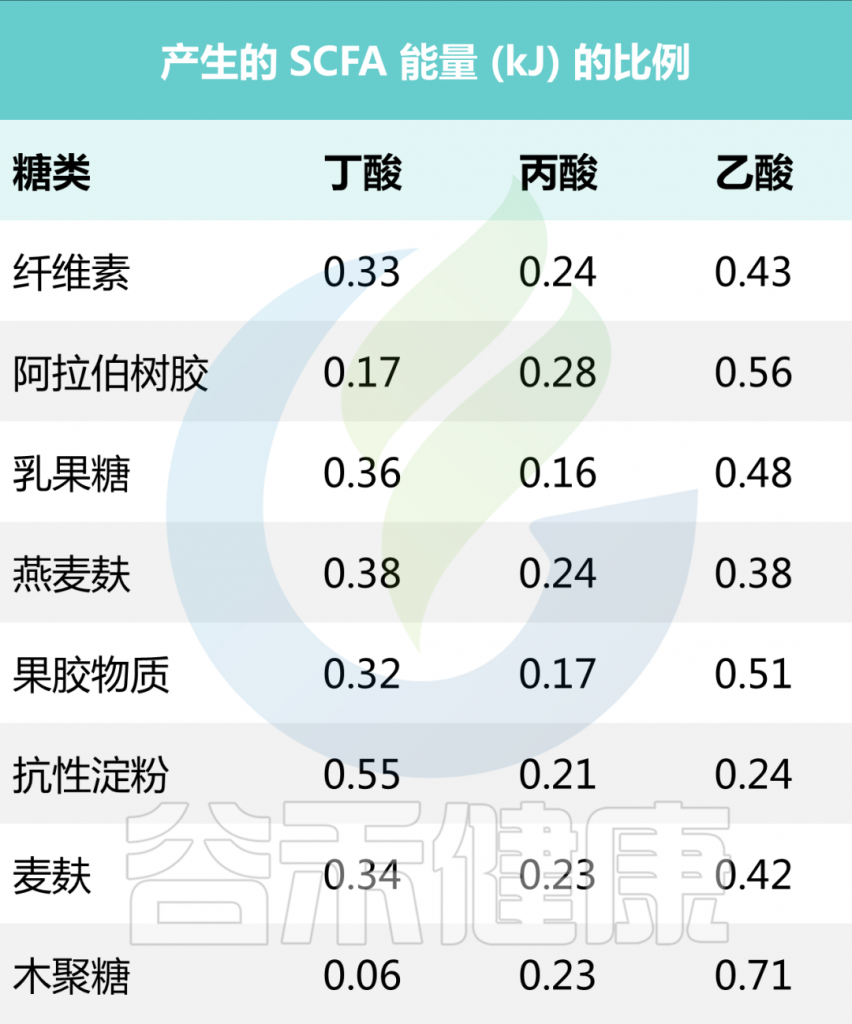
• 抗性淀粉
研究表明,从生马铃薯、高直链淀粉玉米和全谷物中提取的阿拉伯木聚糖中,含有高含量2型抗性淀粉的食物显著增加了丁酸盐的产量。
在174名健康年轻人的饮食中添加马铃薯抗性淀粉后,丁酸盐产量增加。玉米、菊苣和玉米中的抗性淀粉也进行了测试,但只有当食用土豆中的抗性淀粉时,粪便中的丁酸总量才会显著增加。
• 果聚糖(菊粉)
许多研究表明,菊粉可以增加短链脂肪酸的产量,包括丁酸盐。这可能解释了香蕉在溃疡性结肠炎和克罗恩病患者的饮食中如此有效的原因之一。然而,链长较短的果聚糖通常比链长的果聚糖(如菊粉)更容易喂养产丁酸菌。
也就说,抗性淀粉和果聚糖(短链低聚果糖和长链菊粉)在肠道中发酵时会产生丁酸盐。
富含抗性淀粉的食物:全麦面包、燕麦、大麦和糙米等全谷物;黑豆、红豆、绿豆等豆类;马铃薯、玉米、菊苣根、牛蒡根、魔芋根、亚麻籽。
富含果聚糖的食物:洋葱、菊苣、香蕉、朝鲜蓟、芦笋、大蒜、韭菜、西兰花、开心果。
需要注意的
由于人与人之间的常驻微生物存在显著差异,并且它们消化某些底物的能力不同,因此比较明智的选择是食用包含多种抗性淀粉和果聚糖的饮食。例如以马铃薯抗性淀粉、燕麦麸皮纤维或车前草种子或短链低聚半乳糖、长链低聚果糖和谷氨酰胺的混合物的形式短期补充,增加丁酸盐水平。
丁酸盐作为一种重要的的调节因子,是宿主-微生物串扰的关键介体。丁酸盐在体内可以通过脂肪酸氧化为机体供应能量,是肠道上皮细胞的主要供能物质。
丁酸盐还与机体健康密切相关,对调节肠道健康、修复肠道屏障、抑制炎症及癌症等病症意义重大。在养殖业中常添加丁酸盐保护动物健康生长,如预防断奶仔猪腹泻、调节鸡肠道菌群并增强其免疫力等。
▸ 为肠道细胞提供能量
丁酸盐是结肠细胞的主要能量来源,结肠细胞是构成肠道内壁的细胞。
与身体中使用糖(葡萄糖)作为主要能量来源的大多数其他细胞不同,肠道内壁细胞(结肠细胞)主要使用丁酸盐。如果没有丁酸盐,这些细胞就无法正确执行其功能。
• 丁酸盐为结肠细胞提供能量,细胞利于产丁酸盐细菌的生长
厚壁菌属的成员以产生丁酸盐而闻名,像Roseburia,Faecalibacterium prausnitzii,直肠真杆菌(E.rectale)等。
这种关系是相互的。丁酸盐为结肠细胞提供燃料,作为回报,这些细胞有助于提供一个无氧环境,有益的肠道微生物在其中茁壮成长。这可以控制炎症,保持肠道细胞健康,并使肠道细菌保持健康。
▸ 促进肠道运动
实验研究表明,丁酸盐通过作为短链脂肪酸受体的配体和激活剂,诱导肠道激素肽YY或介导肠嗜铬细胞释放5-羟色胺来促进肠道运动。
丁酸盐还可以通过上调Na+—H+交换器和诱导ATPase离子交换器基因来增强水和电解质的吸收。并且可能有益于预防某些类型的腹泻。
▸ 抗炎、抗癌特性
丁酸盐对肠道具有抗炎和抗癌功能。
肠道内壁会保持低水平的炎症,以防与微生物群接触的粘膜表面发生任何变化。低水平的炎症受到严格控制,但如果它被破坏,会导致氧化损伤,并可能在很长一段时间内导致癌症。
• 丁酸盐减少促炎细胞因子的产生
丁酸盐会阻止体内的一些促炎物质发挥作用。丁酸盐的抗炎作用可减少氧化应激并控制自由基造成的损害。
丁酸盐的抗炎特性,部分原因是其抑制核转录因子(NF-κB)的激活,通过下调NF-κB信号通路,丁酸盐可以调节促炎细胞因子的产生。
• 丁酸盐阻止结肠癌细胞的生长
丁酸盐也是一种组蛋白脱乙酰酶(HDAC)抑制剂。组蛋白脱乙酰酶是大多数癌症中产生的酶。因为丁酸盐是一种抑制剂,它实际上会改变基因表达,抑制细胞增殖,诱导细胞分化或凋亡。因此,它可以阻止癌细胞的发展。
有证据表明,结直肠癌(CRC)患者的微生物组图显示主要产丁酸菌属减少,包括罗氏菌属(Roseburia)、Clostridiales、Faecalibacterium和Lachnospiraceae科成员,而使用产丁酸的丁酸梭菌可有效减少癌细胞增殖并增强癌细胞凋亡。
▸ 修复肠道屏障,防止肠漏
肠上皮细胞的屏障功能是重要的第一道防线,确保上皮层具有适当的通透性。研究发现丁酸盐能够修复和增强肠上皮细胞的屏障功能。
• 丁酸盐上调粘蛋白的表达,增强粘液屏障
最新研究表明,丁酸对肠屏障功能具有保护作用。例如,丁酸能够上调粘蛋白2(MUC2)的表达。粘蛋白2是肠粘膜表面主要的粘蛋白,可增强粘膜层,从而限制有害物质通过肠道。
• 丁酸盐对肠道屏障的影响可能具有浓度依赖性
此外,丁酸还能增加三叶因子(TFF)的表达,这是一种粘蛋白相关肽,有助于维持和修复肠粘膜。丁酸还调节紧密连接蛋白的表达,以降低细胞旁通透性。其中一种机制是通过激活单分子层中的AMP活化蛋白激酶。
体外模型研究表明,丁酸对肠道屏障功能的影响可能具有浓度依赖性。丁酸在低浓度(≤2 mM)时可促进肠道屏障功能,但在高浓度(5或8 mM)时可能通过诱导细胞凋亡来破坏肠道屏障功能。
根据哺乳动物胃肠道中的生理浓度,目前体外模型中推荐使用的丁酸浓度为0-8mM。然而,考虑到大多数丁酸在结肠上皮中被代谢为能量底物,体内和体外模型中治疗剂量可能存在差异。
▸ 抗氧化能力
说起抗氧化,我们先了解一下自由基。它基本上是体内化学反应产生的废物。另一方面,抗氧化剂是身体抵御它们的防御措施。大量自由基会造成损害并压倒身体的修复系统。我们称之为氧化应激。氧化应激被认为是导致衰老和疾病的一个重要因素。
• 丁酸盐增加谷胱甘肽,可以中和自由基
结肠或大肠是身体产生的废物的储存容器。较高的丁酸盐水平已被证明会增加谷胱甘肽的水平,谷胱甘肽是一种在人体细胞中产生的抗氧化剂,可以中和肠道中的自由基(自由基与炎症和许多疾病有关),从而起到抗氧化作用。
▸ 调节肠道免疫
• 维持厌氧环境,阻止有害菌生长
丁酸通过增强结肠细胞的氧消耗和稳定缺氧诱导因子(HIF)来维持结肠内的厌氧环境,而丁酸的缺失则会促进潜在有害细菌和分子的积聚,例如沙门氏菌、大肠杆菌和一氧化氮(NO)。
肠道中丁酸水平降低,这促进了肠道上皮氧合和鼠伤寒沙门氏菌(S.Typhimurium)的生长,鼠伤寒沙门氏菌是食源性肠道炎症和腹泻的已知病因。
• 影响免疫细胞迁移、粘附
除了营造无氧环境外,短链脂肪酸,尤其是丁酸盐,还可以作为免疫细胞趋化和粘附的调节剂。丁酸可以调节肠上皮细胞介导的中性粒细胞向炎症部位的迁移,并且这种作用是浓度依赖性的。
此外,丁酸在细胞增殖和凋亡中发挥作用。丁酸刺激细胞生长和DNA合成,并诱导细胞周期G1期的生长停滞。虽然低浓度的丁酸会增强细胞增殖,但高浓度的丁酸会诱导细胞凋亡。
丁酸盐等短链脂肪酸可以在先天反应过程中通过影响巨噬细胞和粒细胞以及树突状细胞的抗原呈递发生,也可能在适应性免疫反应过程中通过影响T细胞和B细胞功能发生。
短链脂肪酸的免疫调节作用
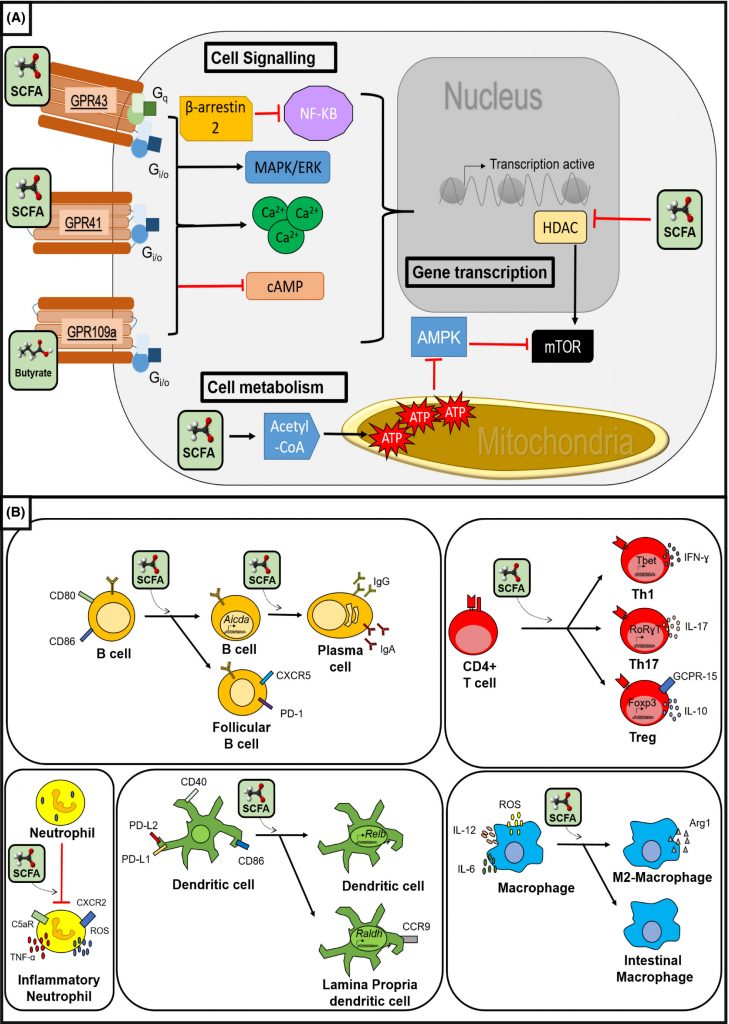
doi: 10.1111/apt.14689.
▸ 影响代谢健康
• 对肥胖存在一定影响,但还不能完全确定
包括丁酸盐在内的短链脂肪酸可通过激活肠细胞内的FFAR来降低食欲和体重。这促进胰高血糖素样肽1(GLP-1)和肽YY的释放,前者促进胰岛素分泌并抑制胰高血糖素分泌,后者降低食欲并减缓胃排空。
短链脂肪酸还能减少所谓的“饥饿激素”——胃促生长素(ghrelin)的分泌;FFAR2存在于ghrelin分泌细胞上,包括丁酸盐和丙酸盐在内的FFAR2激动剂可减少ghrelin分泌。
丁酸盐影响脂质代谢的机制
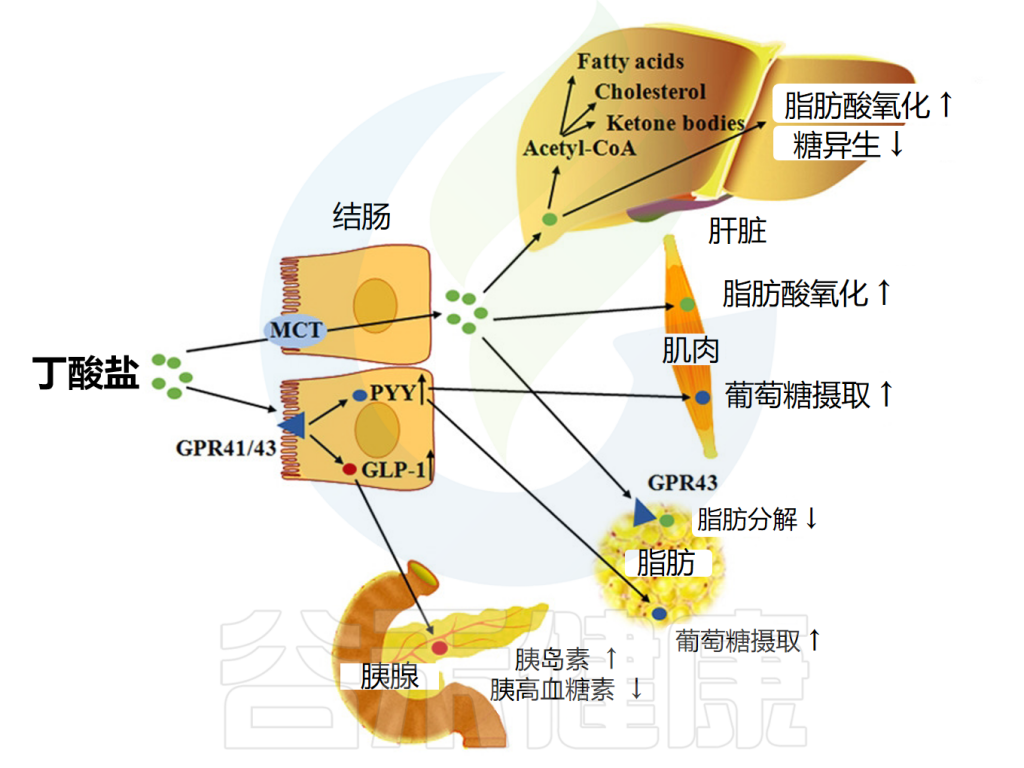
doi: 10.1093/advances/nmx009.
也有证据表明短链脂肪酸作用于交感神经系统,交感神经节中FFAR3的激活导致能量消耗增加。
然而,与丙酸盐一样,关于丁酸盐对食物摄入的影响,有相互矛盾的结果报道。
• 丁酸盐对控制血糖水平可能有潜在好处
研究发现,糖尿病患者和糖尿病前期受试者中丁酸盐水平降低。
丁酸在肠内分泌细胞(EEC)中与游离脂肪酸受体(FFAR)FFAR2和FFAR3结合,调节肠道激素释放,如胰高血糖素样肽1(GLP-1)和肽YY(PYY)。
丁酸盐通过多种途径影响糖代谢的调节
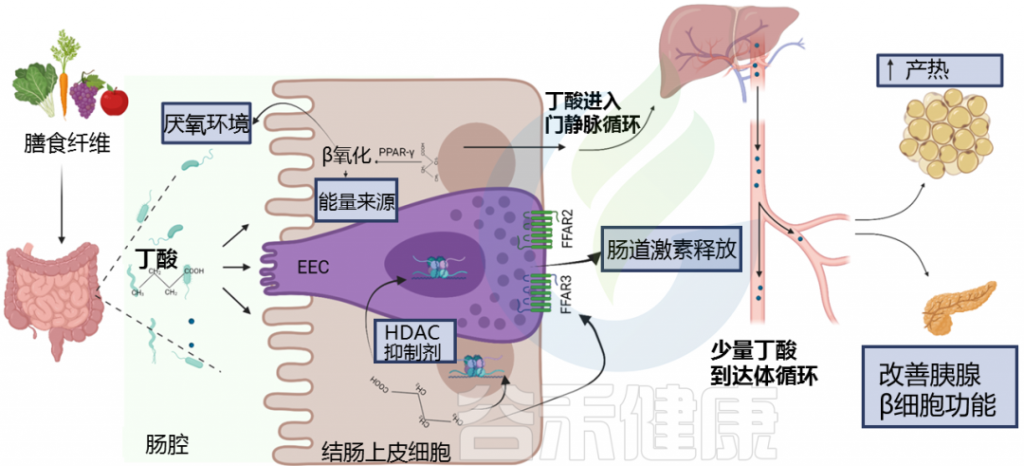
doi: 10.3389/fendo.2021.761834.
这些激素共同作用以保持血糖水平稳定。当血糖过高时,胰岛素会告诉身体的肌肉和脂肪细胞吸收多余的葡萄糖,所以说这些激素对肥胖和糖尿病很重要。丁酸盐增加这些肠道激素的释放,表明对控制血糖水平和防止体重增加有潜在的好处。
!
丁酸盐过低可能会导致以下危害:
•肠道屏障功能受损:丁酸盐有助于维持结肠的“生理性缺氧”,并提供能量给结肠细胞,有助于维持肠道稳态。丁酸盐的减少可能导致肠道屏障功能受损。
•增加慢性疾病风险:变形菌门的兼性厌氧细菌的扩张几乎总是伴随着产丁酸盐细菌丰度的减少,并与许多慢性疾病有关,包括炎症性肠病、肠易激综合症、结直肠癌、2型糖尿病、肥胖等。
•神经炎症:丁酸盐具有抗炎特性,对大脑健康具有重要意义。丁酸盐过低可能导致炎症增加,影响大脑健康。
•睡眠问题:丁酸盐可能作为细菌源性促睡眠信号,丁酸盐过低可能影响睡眠,导致睡眠问题。
•肠道菌群失衡:丁酸盐过低可能导致肠道菌群失衡,因为变形菌门的扩张伴随着产丁酸盐细菌的减少。
•不利于肠道损伤修复:在轻微炎症或轻度溃疡部位添加丁酸盐可以促进肠道损伤的修复,而丁酸盐过少可能不利于溃疡的恢复。
!
丁酸盐并不总是越多越好,低浓度丁酸促进细胞增殖和生长,高浓度丁酸反而抑制细胞增殖和生长,增加肠道的通透性。
• 不同部位对丁酸盐的耐受阈值存在差异
胃肠道不同部位对丁酸盐的耐受阈值也存在一定差异,胃和小肠对丁酸的耐受阈值低,结肠和盲肠耐受阈值高。
添加普通丁酸钠制剂(主要在肠道前端被吸收利用),反而造成肠道炎症、菌群失调。
• 肠道严重溃疡时丁酸盐可能加剧症状
更有意思的是,轻微炎症或者轻度溃疡部位添加丁酸盐可以促进肠道损伤的修复,在严重溃疡肠道部位添加,不利于溃疡的恢复,甚至加剧整个溃疡。
有学者发现溃疡部位的粘膜组织对丁酸的代谢降低,甚至只有正常粘膜组织的一半,主要是由于其转运载体和氧化相关的酶活降低。
主要参考文献
Louis P, Flint HJ. Formation of propionate and butyrate by the human colonic microbiota. Environ Microbiol. 2017 Jan;19(1):29-41.
Gill PA, van Zelm MC, Muir JG, Gibson PR. Review article: short chain fatty acids as potential therapeutic agents in human gastrointestinal and inflammatory disorders. Aliment Pharmacol Ther. 2018 Jul;48(1):15-34.
Hosseini E, Grootaert C, Verstraete W, Van de Wiele T. Propionate as a health-promoting microbial metabolite in the human gut. Nutr Rev. 2011 May;69(5):245-58.
Arora T, Tremaroli V. Therapeutic Potential of Butyrate for Treatment of Type 2 Diabetes. Front Endocrinol (Lausanne). 2021 Oct 19;12:761834.
Singh V, Lee G, Son H, Koh H, Kim ES, Unno T, Shin JH. Butyrate producers, “The Sentinel of Gut”: Their intestinal significance with and beyond butyrate, and prospective use as microbial therapeutics. Front Microbiol. 2023 Jan 12;13:1103836.
Gonzalez-Garcia, R.A.; McCubbin, T.; Navone, L.; Stowers, C.; Nielsen, L.K.; Marcellin, E. Microbial Propionic Acid Production. Fermentation 2017, 3, 21.
Reichardt N, Duncan SH, Young P, Belenguer A, McWilliam Leitch C, Scott KP, Flint HJ, Louis P. Phylogenetic distribution of three pathways for propionate production within the human gut microbiota. ISME J. 2014 Jun;8(6):1323-35.
Liu H, Wang J, He T, Becker S, Zhang G, Li D, Ma X. Butyrate: A Double-Edged Sword for Health? Adv Nutr. 2018 Jan 1;9(1):21-29.
谷禾健康
Phascolarctobacterium,考拉杆菌属,专性厌氧和革兰氏阴性细菌,可产生短链脂肪酸,包括乙酸盐和丙酸盐,并可能与宿主的代谢状态和情绪有关,在人体胃肠道大量定植。
每个人都有可能具有与其他人不同的个体特异性微生物遗传成分,并且可能从童年到成年持续存在。Phascolarctobacterium属物种在较长的时间内显示出相对较高的个体内稳定性。一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少)。
来自梅奥临床医学中心的研究人员研究发现比较容易减肥的人体肠道内考拉杆菌属水平较高。该菌除了减肥同时也是肠道菌群动态平衡的关键调节因素。
Phascolarctobacterium 多形棒状杆菌,0.5 × 2.0 µm 至 0.5 × 5 –20 µm。在琥珀酸的存在下,小棒会变成带有多个分支的细长和碎片状的棒。革兰氏染色阴性、不运动、不形成孢子的化学有机营养物。丙酸是琥珀酸发酵的主要终产物。富马酸盐抑制其生长。在 30–37°C 时生长最快。
系统发育上属于韦荣菌科,厚壁菌门。到目前为止, Succiniclasticum ruminis是最近的系统发育邻居。
DNA G + C 含量(mol %):41.4–42.3 ( Tm )
主要存在于人体肠道内,我们根据谷禾数据库认为其是基石核心菌。
目前报告的3个物种如下:
Phascolarctobacterium faecium
Phascolarctobacterium succinatutens
Phascolarctobacterium wakonense
其中,Phascolarctobacterium faecium (P. faecium)最早是从以有毒桉树叶为食的动物考拉中分离出来的,它可能与肠道菌群的解毒有关。因此,P. faecium可能在人体胃肠道中发挥有益作用。该菌种是一种专性厌氧和革兰氏阴性细菌,不形成孢子、不运动、分解酶,属于厚壁菌门。
它在普通琼脂上生长不良,但在培养基中添加琥珀酸盐可促进其生长。表明其利用生长需要琥珀酸。
虽然在人类胃肠道的样本中经常检测到与P. faecium密切相关的未培养菌落,但文献中尚未描述从人类胃肠道中分离出Phascolarctobacterium和扩大培养物,从而限制了Phascolarctobacterium faecium相关的功能研究和临床应用。
Phascolarctobacterium wakonense从普通狨猴 (Callithrixjacchus) 粪便中分离出,他们不仅利用了琥珀酸,还利用了丙酮酸。补充丙酮酸后,他们同时产生丙酸和乙酸,而琥珀酸仅产生丙酸。
肠道菌群的遗传特异性可用来做宿主的“微生物指纹”。
研究发现人体肠道菌群的遗传特征比其相对丰度更具有个体特异性。其中Phascolarctobacterium succinatutens 的鉴别准确率达到了88%。
饮食模式
一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少。作者指出这种现象可能与饮食习惯有关。
考拉杆菌属专注于利用其他细菌产生的琥珀酸盐,同时,琥珀酸的主要生产者拟杆菌属和副拟杆菌属的丰度因高脂饮食而增加,并且与体重呈正相关。
老年人和1岁以下个体消耗的脂肪相对较少,体重相对较低,这可能导致拟杆菌属和副拟杆菌属减少,可用于考拉杆菌属的琥珀酸盐减少。
已发现体重和脂肪量与Phascolarctobacterium丰度呈负相关,因此可以帮助预测肥胖风险。
与年轻人相比,老年人群的体育锻炼较少,这可能是Phascolarctobacterium减少的另一个原因。
高脂饮食组富含拟杆菌属和Phascolarctobacterium,在人体肠道微生物群中,拟杆菌属产生乙酸和琥珀酸作为主要代谢产物。琥珀酸在肠道中的过量积累会导致腹泻,而利用琥珀酸的细菌的存在可能对人类有益。因此,Phascolarctobacterium可能和拟杆菌,尤其Bacteroides thetaiotaomicron(常栖息在人类肠道中,能够消化多糖)等菌存在共生。
此外,除了Phascolarctobacterium,研究发现高脂肪饮食更有可能导致大量产生丙酸和乙酸的细菌物种,如奇异变形杆菌(Proteus mirabilis)和韦荣氏球菌 (Veillonellaceae)。
含淀粉类食物、谷物和奶制品,与较高的Phascolarctobacterium 相对丰度。
一些小样本证据显示:
菊粉、岩藻多糖、中等剂量木糖醇可以增加Phascolarctobacterium 的丰度,但是低聚果糖的补充会降低Phascolarctobacterium。
此外,小檗碱和二甲双胍可以显着增加这种菌,这反过来可能有助于这两种药物对宿主的有益作用。
与其他菌互作
人体肠道中存在多种微生物,其中一些被认为是相互作用的。大多数这些相互作用涉及细菌代谢物。考拉杆菌属Phascolarctobacterium几乎不用碳水化合物进行生长,而是使用琥珀酸盐作为底物。研究发现Bacteroides thetaiotaomicron产生的琥珀酸支持Phascolarctobacterium菌的生长和伴随的通过琥珀酸途径产生丙酸。
丙酸生产的三种不同生化途径包括琥珀酸、丙烯酸酯和丙二醇途径。拟杆菌属拥有琥珀酸途径,该途径也存在于Phascolarctobacterium。然而,由于缺乏延胡索酸还原酶,推测P. faecium JCM 30894 无法产生琥珀酸,这是琥珀酸途径的关键代谢物。因此,与产生琥珀酸的细菌(如拟杆菌属)共存对于考拉杆菌属是必不可少的。
此外,从琥珀酸到丙酸的转化反应之一涉及甲基丙二酰辅酶 A 变位酶,它需要维生素 B12 。Bacteroides thetaiotaomicron 一些菌株缺乏维生素 B族 所需的上游基因12生物合成。
此外,发现Phascolarctobacterium与颤螺菌属一般呈正相关。
在一项对 314 名中国健康青年样本的队列研究中,9 个核心属中的 8 个,包括Blautia、Clostridium、Ruminococcus、Faecalibacterium、Subdoligranulum、Roseburia、Coprococcus、Bacteroides,彼此之间呈显著正相关,而核心属Phascolarctobacterium与其他八个核心属呈负相关。综合谷禾数据库和相关研究结果:

环境条件
考拉杆菌属(Phascolarctobacterium),这些细菌与他们的种族/地理和生活方式有关。通过对来自9个省份与自治区、7个民族的20个健康年轻人群的314名居民粪便进行16SrRNA测序,发现厚壁菌门、拟杆菌门、变形杆菌门和放线菌门是4种最主要的细菌门,其中,来自厚壁菌门的考拉杆菌属在人群中丰度占比较高。
人体肠道微生物群是可塑的,与周围环境密切相关。医务人员在日常工作中不断与患者接触,并暴露于医院环境中,这种高风险的接触与暴露使很多病原微生物成为医务人员手部微生物群的一部分而被携带。
万献尧教授团队2021年发表在《Clin Microbiol Infect》上的研究评估了医务人员与非医疗人员肠道微生物组的变化。与非ICU工作人员相比,ICU工作人员肠道内Phascolarctobacterium丰度显著增加。
疾病状态
而与健康人相比,早期肝癌患者中,考拉杆菌属(Phascolarctobacterium)和瘤胃球菌属(Ruminococcus) 明显减少。
在重度抑郁、阿尔茨海默病(AD)、自闭症等疾病中发现Phascolarctobacterium高富集,尽管疾病组内异质性也较高,因此,有必要开展大人群队列和临床验证该菌对于神经类疾病的发生和发展贡献情况。
在参与一项小型研究的复发缓解型多发性硬化症(RRMS) 患者中确定了肉类消费与其如何影响肠道细菌、免疫细胞谱和新陈代谢之间的关系。发现许多与多发性硬化症和多发性硬化症患者残疾严重程度与肠道4种细菌产气柯林氏菌、Coprococcus come、Phascolarctobacterium succinatutens、Sutterella wadsworthensis呈正相关。
Phascolarctobacterium属的减少与结肠炎症的存在有关。
阻止艰难梭菌定植
宿主免疫在肠道微生物群介导的对艰难梭菌感染 (CDI) 的定植抗性中发挥重要作用。研究发现人类微生物群相关小鼠中的 IL-22 信号传导调节宿主糖基化,这使得消耗琥珀酸的细菌Phascolarctobacterium 能够生长。在肠道微生物群中,Phascolarctobacterium降低了琥珀酸的可用性,这是艰难梭菌生长的关键代谢物,因此阻止了艰难梭菌的生长。
Phascolarctobacterium有助于肺癌的免疫治疗
免疫检查点阻断(ICB),特别是PD1/PDL1轴的阻断,为非小细胞肺癌(NSCLC)的治疗开辟了新的标准。然而,尽管临床护理取得了重大进展,但许多患者仍然对这些疗法无效。PD-L1 表达和肿瘤突变负荷等生物标志物与 ICB 疗效相关。Phascolarctobacterium在具有临床益处的患者中富集,并与延长的无进展生存期相关,而Dialister在进展性疾病患者中的代表性更高,其较高的相对丰度与无进展生存期和总生存期降低相关,具有独立的预后价值多变量分析。
有助于减肥
研究发现,比较容易减肥的人体肠道内考拉杆菌属(Phascolarctobacterium)水平较高,因此该菌也用来预测肥胖指标。而难以减肥的人体内则小类杆菌属(Dialister)水平较高。此外,在代谢综合征女性中观察到的Phascolarctobacterium属的丰度高于代谢综合征男性。
无论健康的核心细菌是如何定义的,以及群体研究中的鉴定结果有多么不同,可以肯定的是,普遍和优势的核心细菌对于宿主肠道稳态和健康至关重要。因此,重要的是发现一个全面的核心微生物群概况,以定义健康的肠道微生物群并指导它们对宿主健康的干预。
考拉杆菌属作为我们东方人肠道的核心菌属 ,其丰度高低对于维持健康和情绪等非常重要,后续期待更多关于该菌的深入研究信息。
主要参考文献:
Wu F, Guo X, Zhang J, Zhang M, Ou Z, Peng Y. Phascolarctobacterium faecium abundant colonization in human gastrointestinal tract. Exp Ther Med. 2017;14(4):3122-3126. doi:10.3892/etm.2017.4878
Watanabe Y, Nagai F, Morotomi M. Characterization of Phascolarctobacterium succinatutens sp. nov., an asaccharolytic, succinate-utilizing bacterium isolated from human feces. Appl Environ Microbiol. 2012 Jan;78(2):511-8. doi: 10.1128/AEM.06035-11. Epub 2011 Nov 11. PMID: 22081579; PMCID: PMC3255759.
Ogata Y, Suda W, Ikeyama N, Hattori M, Ohkuma M, Sakamoto M. Complete Genome Sequence of Phascolarctobacterium faecium JCM 30894, a Succinate-Utilizing Bacterium Isolated from Human Feces. Microbiol Resour Announc. 2019;8(3):e01487-18. Published 2019 Jan 17. doi:10.1128/MRA.01487-18
Bhandarkar NS, Mouatt P, Majzoub ME, Thomas T, Brown L, Panchal SK. Coffee Pulp, a By-Product of Coffee Production, Modulates Gut Microbiota and Improves Metabolic Syndrome in High-Carbohydrate, High-Fat Diet-Fed Rats. Pathogens. 2021 Oct 22;10(11):1369. doi: 10.3390/pathogens10111369. PMID: 34832525; PMCID: PMC8624503.
Zheng YH, Xu Y, Ma HX, Liang CJ, Yang T. Effect of High-Fat Diet on the Intestinal Flora in Letrozole-Induced Polycystic Ovary Syndrome Rats. Evid Based Complement Alternat Med. 2021 Jun 25;2021:6674965. doi: 10.1155/2021/6674965. PMID: 34257691; PMCID: PMC8257354.

谷禾健康

肠道的内部环境作为外部环境和宿主之间的接口,不断受到宿主的消费习惯的挑战。在管腔一侧,微生物能够附着并定植于该空间,而在宿主一侧,胃肠道充当体内免疫细胞的最大隔室。
从解剖学上讲,肠道由不同的部分组成。十二指肠,空肠和回肠代表小肠(SI),它比由结肠和直肠组成的大肠(LI)占据更多的物理空间。与人类相比,啮齿动物的盲肠增大,盲肠囊是连接小肠和大肠的盲端囊。在小鼠中,盲肠充当了共生微生物的大贮藏库,这些微生物参与了无法通过其他方式裂解的纤维的发酵。 盲肠在小鼠中的作用很重要,因为它是短链脂肪酸(SCFA)产生的主要途径,去除盲肠会导致胃肠道远端部位炎症的增加 。在人类中,该部位微生物的体积远小于小鼠,但该隔室在兼性厌氧发酵中仍起着重要作用。
值得注意的是,共生微生物的组成和丰度在不同的胃肠道区域是不同的,例如,成年小肠中的微生物丰度低(<105个微生物/ mL),在结肠中则增加到1012。小肠和大肠具有独特的生理功能。 虽然十二指肠和空肠参与消化,营养吸收和运动过程,但大肠具有三个主要功能:吸收水和电解质,产生和吸收维生素以及形成和运输排泄的粪便。肠道不断暴露在食物颗粒和食物抗原,生理或机会性微生物群衍生的代谢产物以及其他免疫调节刺激。 胃肠道内的免疫细胞不仅对肠道内的抗原刺激作出反应,而且还显示出扩散到全身的远端器官,表明它们在全系统炎症稳态中的重要性。
微生物无处不在。 他们自我组织,在原本无法居住的生态环境中创建了复杂的生态系统,迅速适应了他们的环境。宿主依赖微生物组实现几种基本的共生功能,例如启动免疫系统和生产必需的维生素,以及从食物中获取能量。 肠道微生物群(定义为人类体内的微生物分类群)现在被认为是内分泌器官,可产生可在宿主中充当效应子的代谢产物,从而触发局部微环境或远端的靶器官系统(如心脏,肾脏,脉管系统)的反应和大脑。
肠腔内壁衬里是抵抗细菌感染的生理屏障,可以与毒素结合。此外,粘液是细菌的营养来源,因此会影响具有在粘液层中生存和扩展能力的微生物的定殖。Akkermansia muciniphila(AKK菌) 和Citrobacter rodentium (柠檬酸杆菌)能够降解粘蛋白,而后者在纤维缺乏期间会增殖。结肠粘液层完整性的丧失会增加宿主对病原体的敏感性。 在健康条件下,紧密的上皮层可防止病原微生物的入侵,而某些刺激物(如炎症性疾病或西餐)可导致肠道通透性和所谓的肠道渗漏综合征的发展。
随着高通量测序技术和代谢组学的建立以及高性能计算和人工智能的发展,人们逐渐破译生活方式,饮食,药物治疗和肠道微生物组之间的相互关系。每个人肠道微生物组随时间推移相对稳定,并与周围环境平衡共存。但是诸如抗生素,肠道感染以及饮食或生活方式变化等扰动都会引起短暂或持续的变化。
在过去的几十年中,实验和临床研究表明,先天性和适应性免疫系统的细胞在高血压,靶器官损害和心血管疾病(CVD)的发病机理中起着关键作用。促炎性效应记忆T细胞和 T辅助细胞亚型T辅助细胞17(Th17;产生IL-17)和1型辅助细胞(产生IFN-γ)促进高血压和心血管靶器官损伤,而调节性T细胞(Tregs)通常产生大量的抗炎性IL-10可以减轻血管,心脏和肾脏的损害。
此外,γδT细胞和髓样来源的抑制细胞在高血压的发病机理中也起着重要作用。 已经证明可以改变几种T细胞亚型激活状态的树突状细胞会增加盐反应性高血压,并提示其在菌群失调与血压(BP)之间的相互作用中发挥作用。
细菌可以直接或通过其产生的代谢产物与参与心血管的不同免疫细胞发生反应。例如,分段丝状细菌或Bifidobacterium adolescentis(青春双歧杆菌)可诱导Th17细胞,而Lactobacillus murinus(鼠乳杆菌)及其色氨酸代谢产物吲哚3乳酸则可抑制Th17细胞。 和SCFA丁酸盐是结肠中Treg的杰出诱导剂。
图 肠道微生物与宿主免疫相互作用

在宿主和微生物组方面均可发现肠道空间变异性。内腔和组织相关内容的相对水平在此处进行了说明,表明这两种功能的区域专业化。 已知肠道中的内腔含量在微生物负荷,微生物种群以及所产生的微生物产生的代谢产物方面有显着差异。尽管在整个胃肠道中的种群和区域规格都受到微生物的影响, 根据管腔内物质含量的变化,宿主免疫系统同样具有区域特异性。
这里显示的是免疫细胞,这些细胞在免疫稳态过程中表现出空间动态。
高血压的发病机制涉及多种因素,包括遗传、环境、激素、血液动力学和炎症等。越来越多的证据表明,肠道微生物群在高血压的发生和发病机制中起着重要作用。胃肠道是人体内最大的免疫细胞库,代表着环境和宿主的交汇点。因此,生活方式因素的形成和调节的微生物组,影响着高血压疾病形成和发生的风险。一个被广泛研究的例子是膳食纤维的消耗,能导致短链脂肪酸的产生,并有助于抗炎免疫细胞的扩张,从而防止高血压的进展。饮食干预如禁食也被证明通过微生物群影响高血压。
图 血压与肠道菌群的关系
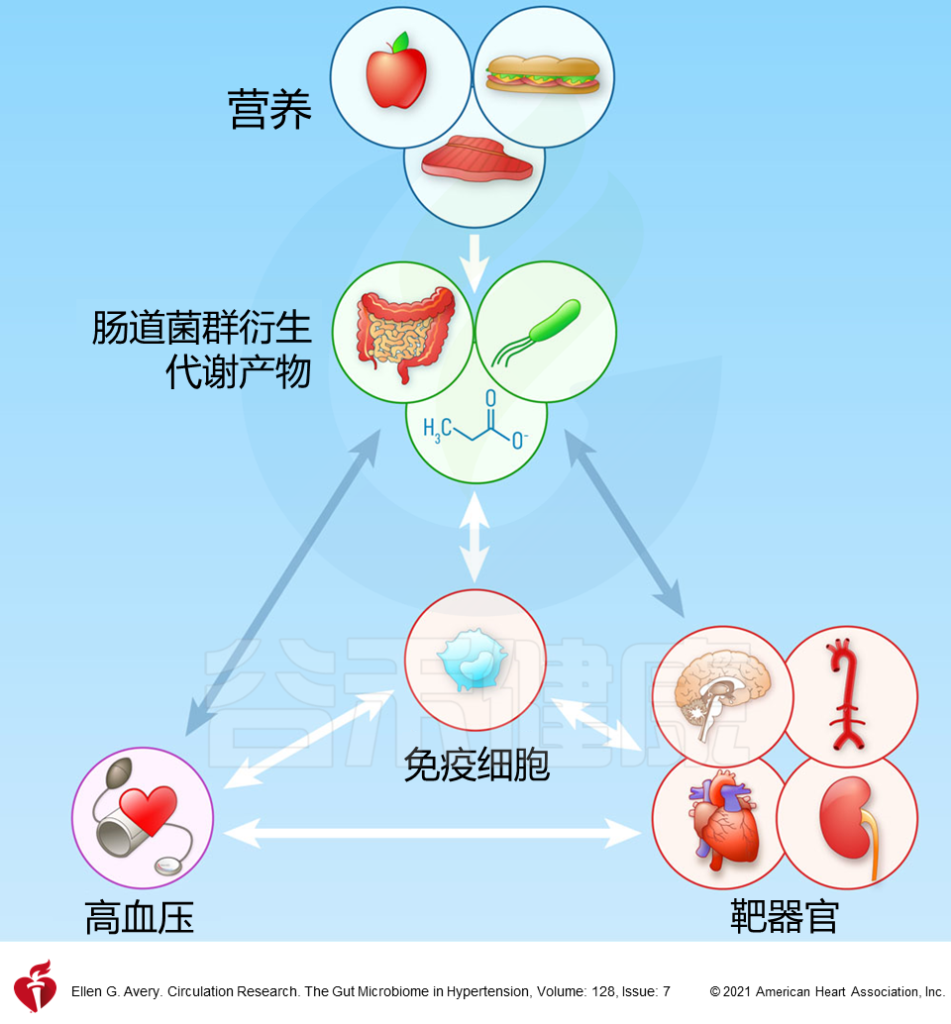
摄入的食物被肠道微生物群转化为小的代谢物。食物抗原、微生物产生的代谢物以及微生物本身都有助于免疫稳态。干扰宿主和微生物群之间的共生关系可通过免疫系统直接或间接导致血压变化和相关的心脏、血管或肾脏损害。
在过去的十年中,许多关于肠道微生物组和高血压的作用的证据已积累起来。多项针对人体的横断面研究表明,肠道微生物组与血压或高血压之间存在关联。高血压患者或血压较高的患者,α多样性降低,肥胖,高胰岛素血症和血脂异常也已观察到。 许多人类肠道微生物组研究报告了革兰氏阴性菌群较高的菌群之间的相关性,包括克雷伯菌,副细菌,脱硫弧菌和普氏菌,尽管并非所有研究都能确定这种模式。
来自HELIUS队列研究(城市环境中的健康生活)的研究表明,克雷伯菌属和链球菌属与血压呈正相关。此外,与高血压小鼠相比,从高血压人类供体接受粪菌移植的GF小鼠出现了与其供体相似的肠道菌群,以及8周后收缩压和舒张压升高。它从2个血压正常的供体那里接受了粪菌移植。
此外,还有几种有价值的啮齿动物高血压模型分析了肠道微生物组和血压的作用。自发性高血压大鼠存在失调,与正常血压WKY(Wistar-Kyoto)对照大鼠的微生物群存在显著差异。自发性高血压大鼠的肠道通透性和菌群失调也可能可通过使用降压药治疗大鼠来补救。
肠道微生物组与高血压之间的联系不是物种特异性的。 例如,在小鼠和人类中高盐处理都会减少乳酸杆菌属。 值得注意的是,未治疗的高血压患者中盐的适度降低能够降低血压并改善动脉顺应性。改善的临床结果伴随着8种循环SCFA的增加(包括2-甲基丁酸、丁酸、己酸、异戊酸和戊酸 )。此外,已证明益生菌乳酸菌处理可通过恢复吲哚3乳酸水平(抑制微生物色氨酸代谢)抑制Th17细胞并减轻盐敏感性高血压。
已显示,Lactobacillus coryniformis可以改善血管功能和胰岛素敏感性。Lactobacillus(乳杆菌)治疗不仅可以改善心血管疾病,还可以改善实验性自身免疫性疾病的结局。 对益生菌对高血压的作用进行调查的随机对照试验的系统评价表明,如果以足够高的剂量使用至少8周,含乳酸杆菌的益生菌是有效的。
在人类中,肠道中的核心微生物群落是稳定的,并且仅在响应诸如肠道感染,整体旅行或药物治疗等主要扰动时才发生变化,从而导致肠道微生物组发生短暂或持续的变化。 肠道菌群不仅对某些饮食刺激的比例具有反应性,而且还可能在时空环境中做出反应。
目前,我们对特定饮食变化影响炎症,自身免疫和心血管疾病易感性的确切机制的理解还很模糊。 使用经过微生物组组成和功能训练的机器学习算法可提供令人兴奋的机会,以促进更好地预测对营养刺激的反应。
新兴的研究表明,饮食因素(高盐或高纤维)和生活方式干预(盐分限制或热量限制)会影响微生物群落的结构和功能,这对免疫细胞活化和血压具有重要意义。西方人的生活方式通常涉及每天进食几顿主餐,并导致细菌多样性下降,某些食物喂养细菌的过度生长,以及随之而来的其他食物为底物的细菌的抑制。因此,菌群产生的代谢产物发生了转移,从而促进了炎症,最终可能导致肥胖症和动脉粥样硬化等疾病的发展。
从历史上看,餐食通常是新鲜烹制的,但如今,人们更经常食用通常含盐量更高的加工食品。这种生活方式通常会导致较高的盐摄入量 而不是医学指南或专家的建议。为减少心脏代谢疾病的风险,通常应节食健康的饮食和运动。 大多数建议的重点是将富含饱和脂肪,糖,盐和卡路里但纤维含量低的西方饮食改变为更健康的地中海式阻止高血压饮食方法,以实现最佳营养,平衡和降低盐摄入量,尽管合规性是一个重大挑战。
SCFA是最典型的微生物群代谢产物之一,它是在不易消化的纤维发酵过程中产生的。 乙酸,丙酸和丁酸是3种高丰度的SCFA。 膳食纤维是由≥3种单体组成的膳食碳水化合物的统称,如非淀粉多糖,抗性淀粉,菊粉,果胶,β-葡聚糖和低聚糖。 这些纤维状化合物中的大多数都被拟杆菌、厚壁菌和放线菌门微生物消化。Bifidobacterium adolescentis, Eubacterium rectale, Eubacterium hallii, Faecalibacterium prausnitzii ,Ruminococcus bromii 通常在大肠中定居,并具有消化纤维以生产SCFA的酶。
大肠的丙酸和丁酸水平比小肠高约4倍。SCFA在结肠中迅速吸收,而丁酸在很大程度上被用作向结肠上皮细胞提供能量的燃料。肠道SCFAs与门静脉血相比要高得多,而门静脉SCFAs较高,其次是肝脏血液,外周血最少,这表明SCFAs基本上被肝脏吸收。肝中丙酸的摄取是糖异生,脂肪生成的前体,以及蛋白质合成,而乙酸盐进入循环系统并被多个组织代谢,并且是胆固醇合成的底物。
SCFA可以与G蛋白偶联受体Gpr41(G蛋白偶联受体41),Gpr43( 小鼠中的G蛋白偶联受体43),Gpr109a(G蛋白偶联受体109 A),Olfr558(嗅觉受体558)和Olfr78(嗅觉受体78),也称为FFARs(游离脂肪酸受体)。FFARs存在于各种组织中,包括血管和肾脏,并参与调节丙酸、乙酸和丁酸的血管反应性。
Gpr41和Olfr78似乎都参与了血压的调节,尽管它们似乎促进了相反的作用。Olfr78激活后会诱导肾素分泌。与此相符的是,Gpr41敲除小鼠为高血压,有趣的是,醋酸盐以前曾用于血液透析缓冲液,但由于其降压作用而被大量废弃,这与SCFA在大多数情况下降低血压的观点一致。
纤维本身已被建议在一定程度上塑造微生物组成。
关于血压,纤维的刺激作用增加了SCFA生产者Faecalibacterium prausnitzii和Eubacterium rectale以及乳杆菌属的丰度。一项具有里程碑意义的研究表明,与传统上纤维含量高的未加工饮食的非洲儿童相比,食用西方饮食的欧洲儿童SCFA水平显着降低,Firmicutes与Bacteroidetes(F/B)比率高。自该研究以来,高F/B比率通常被用作肠道生态失调的替代指标,虽然也已知一些Firmicutes细菌产生有助于健康微生物组的微生物代谢物。
同样,实验工作通常依赖于F/B比作为疾病标志物。自发性高血压大鼠和易中风的自发性高血压大鼠显示F/B比率增加,这支持了这可以作为肠道生态失调的标志物的概念。
各种实验或临床研究已证明益生元高级纤维或后生SCFA治疗对血压的影响。研究报道丙酸在麻醉小鼠中诱导了急性的剂量依赖性降血压反应,这是由Gpr41介导的。益生元纤维不仅可以预防心血管疾病,而且这些营养素的缺乏可能是导致高血压和心血管疾病的危险因素。 还发现在低纤维饮食中添加益生元乙酸盐,丙酸盐或丁酸盐可改善血压并减少靶器官损害。
此外,GF小鼠的粪菌移植表明,与抗性淀粉相比,饮食中的肠道微生物组缺乏抗性淀粉。高纤维情况不仅在血管紧张素II攻击后导致较高的血压,而且还导致了心脏和肾脏损害的发病机制。
德国一项研究测试了在有和没有动脉粥样硬化的高血压小鼠中口服丙酸治疗的特性。在这两种模型中,丙酸治疗均能降低全身和局部炎症反应,血压以及心脏损害。丙酸的治疗作用是由Treg细胞介导的。但是该研究指出丙酸的降血压作用不是急性的,而是随着时间的推移而发生,提示SCFA的抗炎特性间接促进了血管表型的改善。Th17细胞和Th17与Treg的平衡介导SCFA在血压调节中的作用。
关于SCFA在血压中的作用的人类研究非常少见。对微生物群组成和高血压的一些研究表明,SCFA的生产者为Ruminococcaceae spp,Rothia或Roseburia spp. 与较低的血压相关。
在一项小型干预试验中,生物素丁酸酯(600 mg / d),益生素菊粉(10 g / d)以及这两者的组合均降低了代谢综合征患者的舒张压。在HELIUS队列中,将机器学习算法应用于微生物组数据可确定Roseburia spp解释对血压的最大绝对影响,甚至在调整混杂因素(包括使用药物)后,丰度也使收缩压降低4.1 mmHg。
相反,血压较高的患者的粪便SCFA水平较高。这种正相关与以前的研究一致,但似乎与血压与胃肠道内微生物SCFA生产者之间的负相关性相矛盾。 但是,粪便中的SCFA含量不一定反映肠道内的SCFA含量,而是反映肠道中产生的SCFA含量而宿主无法吸收的。
自发性高血压大鼠的实验工作支持了这一观点,表明实验性高血压会减少结肠丁酸对宿主的吸收。此外,AT1(血管紧张素II型1型)受体阻滞剂坎地沙坦(一种经常用于治疗高血压的药物) 已发现自发性高血压大鼠可以增加乳杆菌的丰度和粪便SCFA水平,改善肠道完整性并降低血压。
坎地沙坦治疗改善了重度肥胖受试者肠道中丁酸生成基因的缺失。总之,在HELIUS队列中,基于肠道微生物群组成的机器学习模型分别解释了收缩压和舒张压变异性的4.4%和4.3%。
纤维来源的SCFAs不仅影响血压,而且在其他心血管疾病和自身免疫中也起着关键作用。例如,用醋酸盐,丙酸盐或丁酸盐进行生物后处理可改善急性肾损伤。肾脏保护与局部和全身炎症反应减少,氧化性细胞应激和细胞凋亡。在多发性硬化症动物模型中,T细胞介导的中枢神经系统炎症性疾病丙酸盐增加了肠道和脾脏中抗炎Tregs的频率,这伴随着临床症状的改善。
高纤维摄入量和增加的SCFA浓度也被证明可以保护中枢神经系统。值得注意的是,多发性硬化症患者可以从丙酸盐治疗中获益。短期丙酸盐治疗导致显着和持续的富集功能正常的Tregs,同时1型辅助细胞和Th17细胞同时消耗。此外,补充SCFA或高纤维摄入对类风湿性关节炎(一种关节慢性炎症性疾病)的预后有积极影响。丙酸酯可增加骨量,并且发现SCFA通过增加Treg的数量刺激骨形成。
从机制上讲,SCFA可以影响不同的免疫细胞群。 例如,发现丙酸和丁酸处理后中性粒细胞产生的炎性细胞因子较少。丁酸还可以减少氧化应激和吞噬能力。
SCFA通过减少树突状细胞成熟并抑制CD4和CD8T细胞增殖来调节炎症过程。与乙酸盐相反,丁酸盐或丙酸盐通过HDAC(组蛋白脱乙酰基酶)抑制作用影响骨髓前体细胞的树突状细胞成熟。此外,丁酸可促使M1巨噬细胞分泌更少的炎性细胞因子,增加抗炎细胞因子IL-10的分泌。
SCFAs还引起人单核细胞和T细胞中抗炎标记的表达。 例如,丁酸抑制金黄色葡萄球菌刺激的人单核细胞中IL-12的产生并增强IL-10的分泌。
最近,研究证明了丙酸会降低Th17细胞分化的速率。还发现丁酸盐还通过Gpr43增加1型辅助细胞分化细胞中IL-10的分泌,由SCFA驱动的IL-10诱导激活STAT3(信号转导子和转录激活子3)和mTOR(雷帕霉素的机械靶标),从而上调转录因子B淋巴细胞诱导的表达成熟蛋白。
此外,SCFA最深入研究的特性之一是它们在诱导抗炎Treg中的作用。丁酸和丙酸可增加鼠和人Treg的分化并增强其抑制能力。除丁酸外,丙酸(而非乙酸)通过HDAC诱导外周新生Treg细胞形成。值得注意的是,Clostridia(梭菌)是共生微生物的主要类别,它介导了诱导性结肠Tregs,这与Clostridium butyricum(酪酸梭状芽胞杆菌)诱导Tregs并减少Th17细胞从而减轻实验性自身免疫的症状的发现是一致的。
越来越多的证据表明,禁食是控制代谢性疾病和炎性疾病的有效工具。热量限制会影响微生物组的基本原理令人兴奋。 然而,仍然缺乏关于人类的可靠数据。
一项研究关于10天定期禁食对15名健康男性的粪便微生物群的影响。禁食导致Lachnospiraceae和Ruminococcaceae菌减少。一项小型的人体试验研究表明,斋月禁食影响了健康受试者的微生物组,丰富了一些SCFA生产者。
在一项临床研究中,35名代谢综合征患者接受了5天的禁食,然后进行了3周的DASH饮食,也被译为「得舒饮食」,字面意思是防止高血压的饮食方法饮食。

对照组仅接受DASH饮食。禁食后接着DASH饮食降低血压,需要抗高血压药物和干预后3个月的体重,并改变影响SCFA生产者的肠道微生物群。队列对血压反应性的分层显示,空腹组中存在的免疫细胞变化在血压反应者中比在无反应者中更明显。
此外,禁食组的免疫移位与DASH组观察到的变化根本不同。观察到干预后禁食组中血压响应者特异性微生物组的变化(F.prausnitzii,拟杆菌和厚壁菌的富集;放线菌的消耗)。值得注意的是,丁酸盐生产者F.prausnitzii的富集甚至在禁食后3个月仍然存在。血压反应者和无反应者不仅对禁食反应不同,而且在基线时的丙酸合成能力不同。
将机器学习算法应用于基线免疫组或16S微生物组数据,预测模型通过重新分析调查禁食和血压影响队列(Mesnage数据集)证实,队列中显着的长期血压下降预计准确率约为70%,进一步支持这些发现可能是普遍化的想法。重要的是要强调,上述研究建立了微生物组和血压之间的关联,以应对禁食。禁食对许多患者来说是一项艰巨的挑战。能够操纵负责响应禁食的血压变化的机制将具有高临床效用。
禁食是热量限制的一种极端形式,在不同的文化和宗教习俗中起着重要的作用。 大量的热量限制不仅影响宿主的健康和生理,还降低了血压。生活方式和饮食引起的微生物群及其代谢产物的扰动可直接影响上皮细胞和免疫细胞的稳态。但是我们对营养,微生物群和微生物产物,免疫系统与宿主健康或疾病之间的联系仍处于‘婴儿期’。
宿主-微生物组相互作用对人类健康和疾病显然有影响。模型系统经常用于基础和临床前高血压研究,以研究疾病的发病机制和进展。小鼠和大鼠模型非常有用,可以提供人类队列研究无法获得的信息。然而,在模型系统中研究人-宿主-微生物组相互作用存在许多障碍。
差 异
01 胃肠生理学和形态学有许多方面,这在人类和啮齿动物物种之间是截然不同的。盲肠可能是人类和啮齿动物不同物种形成的最明显的例子,以及小鼠结肠粘液层的薄度。
02 小鼠和人类对炎症应激物的基因组反应是明显不同的,这可能与宿主特异性或微生物组特异性特征或两者的组合有关。
03 居住在胃肠道的微生物在小鼠和人类之间通常也是不同的。人和小鼠只有约15%的细菌谱系。虽然它们在属或门的水平上可能具有可比性,但物种特异性变化通常在高血压中具有临床重要性。
04 已知在每个微生物进化枝内,成员物种之间共享功能特性的程度例如,厚壁菌作为进化枝特别代谢不一致,当考虑到普遍使用F/B比率作为生态失调的标志物时,这再次提出了一个问题。
05 由于人类微生物组随时间的相对稳定性,实验室小鼠在这方面与人类不同。
06 小鼠和人体免疫组成和建立不同,人类免疫系统的强劲发展,需要接触各种真菌,病毒,微生物等,而GF小鼠与人或大鼠微生物的定殖不会诱导免疫成熟,只有小鼠特异性微生物能够诱导完全的免疫能力。
07 啮齿动物模型的嗜食性已被认为对微生物组具有独特的影响,这可以通过使用单一住房策略来避免,尽管这会诱发小鼠的应激反应,增加一个额外的混杂因素。
许多研究人员试图通过使用人类微生物定殖小鼠或野外捕获的小鼠来规避物种比较问题。这提出了两个重要的挑战,应该加以考虑。
一,存在宿主与其微生物之间相互作用的相互排斥的问题。事实上,这种相互作用的重要性在最近的一项研究中得到了证实,该研究表明GF小鼠与人或大鼠微生物的定殖不会诱导免疫成熟,只有小鼠特异性微生物能够诱导完全的免疫能力。有几点差异在小鼠和人体免疫组成之间注意到,这可能与免疫微生物组轴有关,例如,与小鼠(10%–25%)相比,外周血中性粒细胞的比例约为人类的两倍(50%–70%)。此外,CD8+T细胞在成年人非淋巴组织中的分布远高于无特定病原体的小鼠,这可能对细胞内感染或癌症的进展有影响。
二,尽管野外捕获的小鼠比实验室培养的无特定病原体的小鼠更准确地概括人体生理,可能与临床试验结果的一致性更高,对疾病的抵抗力更强。但是在科研研究和临床上应用大规模野外捕获老鼠的可能性会受到限制。
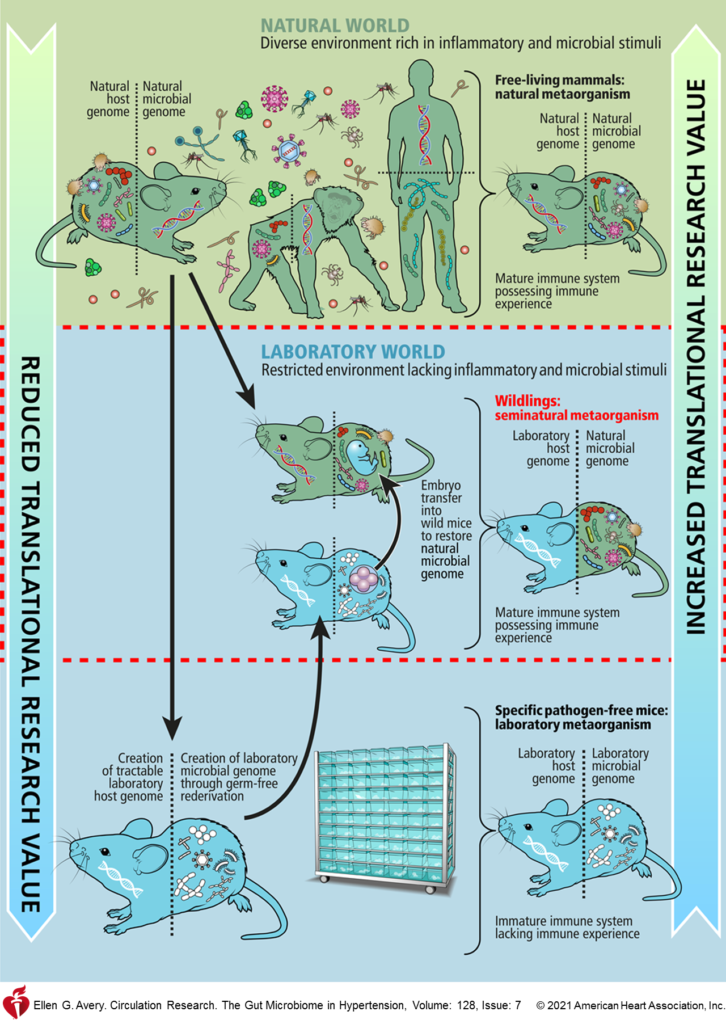
因此,在未来动物研究中,整个领域的程序标准化,例如使用同窝对照和可能影响微生物组的条件的稳健记录是必不可少的。要注意笼养,用品和饮食等因素可能会对结果产生重大影响。此外,采样时间,地点也尽量一致。
值得注意的是除了不同胃肠道区域的空间动态外,从粘膜和管腔空间取样的微生物组在小鼠和人类中是独特的。由于胃肠道是免疫细胞极化和微生物产生的代谢物吸收的作用部位,许多人质疑粪便取样是否正确研究宿主-微生物组界面的途径。粪便代表该系统的排泄产物。
然而,粪便取样是检查微生物组的最常见和实际适用的方法,特别是对于需要非侵入性方法的纵向研究。粪便的收集无疑有助于我们理解宿主-微生物组的相互作用。尽管怀疑局部产生的微生物副产物的相关性是重要的,特别是影响代谢物对循环的摄取并影响胃肠免疫细胞的活性,但是该隔室的测量是不发达的。在间质液中的作用部位鉴定微生物产生的化合物的能力可能提供对宿主-微生物组动力学的不同观点。
总之,尽管在解释微生物组数据时需要谨慎,但是,高血压中微生物组-宿主界面的研究是一个有前途且正在迅猛加速的研究领域。随着各种技术的进一步发展,针对微生物组领域的以药理学和辅助诊断方式为中心的方案可能会在不久的将来出现。
相关阅读:
参考文献:
Schluter J, Peled JU, Taylor BP, Markey KA, Smith M, Taur Y, Niehus R, Staffas A, Dai A, Fontana E, et al.. The gut microbiota is associated with immune cell dynamics in humans.Nature. 2020; 588:303–307.
Evangelou E, Warren HR, Mosen-Ansorena D, Mifsud B, Pazoki R, Gao H, Ntritsos G, Dimou N, Cabrera CP, Karaman I, et al.; Million Veteran Program. Genetic analysis of over 1 million people identifies 535 new loci associated with blood pressure traits.Nat Genet. 2018; 50:1412–1425.
Ellen G. Avery. CirculationResearch. The Gut Microbiome in Hypertension, Volume: 128, Issue: 7, Pages:934-950
Tierney BT, Yang Z, Luber JM, Beaudin M, Wibowo MC, Baek C, Mehlenbacher E, Patel CJ, Kostic AD. The landscape of genetic content in the gut and oral human microbiome.Cell Host Microbe. 2019; 26:283–295
Forslund K, Hildebrand F, Nielsen T, Falony G, Le Chatelier E, Sunagawa S, Prifti E, Vieira-Silva S, Gudmundsdottir V, Pedersen HK, et al.; MetaHIT Consortium. Disentangling type 2 diabetes and metformin treatment signatures in the human gut microbiota.Nature. 2015; 528:262–266.
Verger EO, Armstrong P, Nielsen T, Chakaroun R, Aron-Wisnewsky J, Gøbel RJ, Schütz T, Delaere F, Gausseres N, Clément K, et al.; MetaCardis Consortium. Dietary assessment in the metacardis study: development and relative validity of an online food frequency questionnaire.J Acad Nutr Diet. 2017; 117:878–888.