-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

俗话说:“病从口入”。饮食是决定个人健康状况的重要因素,饮食与疾病的发展有关,特别是胃肠道(GI)疾病。
与膳食相关的症状发生率很高,例如在吸收不良(如乳糖不耐症)情况下出现的腹痛和腹泻;乳糜泻、食物过敏人群在食用麸质类后出现的腹胀、腹痛、水肿;肠易激综合征患者在摄入一些刺激性食物后(酸、辣)的腹痛、排便异常等。饮食作为胃肠道症状的驱动因素已经逐渐被人们所认识。
然而对出现食物相关症状的机制仍不太清楚。随着对肠道微生物研究的深入,肠道微生物群也被认为是胃肠道疾病的重要影响因素,这促使人们研究微生物作为饮食和宿主生理之间的关键联系。
同样的饮食摄入效果会因人体的健康状况以及肠道个性化的微生物群落而产生的不同的效果。例如低聚果糖(FOS)会加重炎症性肠病(IBD)患者的炎症,但在健康个体中却具有抗炎作用。麸质、小麦、牛奶和大豆等物质直接注射到粘膜下层可以通过激活IBS患者的肥大细胞来引发免疫反应,但在健康受试者中则不然。还有纵向研究报告称,饮食蛋白质摄入量相似,但IBS-D患者的色氨酸和色胺水平(而非吲哚衍生物)高于健康人。另一方面,结肠内乙酸盐可增强对结肠直肠扩张的敏感性。具体影响可能取决于宿主健康和肠道中的整体代谢环境。
近年来,人们越来越认识到个性化的饮食干预在预防和治疗胃肠道疾病中的潜力。个性化饮食不仅考虑到个体的遗传背景、健康状况和生活习惯,还特别关注其独特的微生物群组成。通过分析和调整个体的饮食,可以优化肠道微生物群的平衡,增强其对疾病的抵抗能力。
在本文中,主要关注两种胃肠道疾病:肠易激综合征和炎症性肠病。宿主和肠道微生物群对膳食营养素的利用决定肠道中最终的生物活性代谢物特征以及这些代谢物对胃肠道生理学的生物效应。此外强调了单个代谢物的不同作用如何影响不同的胃肠道疾病,类似的饮食干预对多种疾病状态可能具有不同的影响。
食物在肠道内会被肠道菌群代谢、转化。食物成分本身的性质,加上肠道菌群作用后的代谢产物,共同决定了食物对人体健康的作用。因此,仅考虑食物成分是不够的,还要考虑个人肠道菌群状况,两者结合才能判断食物的健康效应。
例如,传统观点认为,大部分可消化的食物成分会通过小肠表面吸收。剩余的不可消化成分传递到远端,作为肠道微生物群的能量来源,产生如短链脂肪酸(SCFA)等发酵最终产物。
然而,这种观点简化了过程。肠道微生物群不仅依赖于难以消化的膳食成分,还可以从宿主上皮表面粘液层中的糖蛋白和多糖获取营养,尤其是在碳水化合物缺乏的情况下,如低纤维摄入时。
★ 不同的肠道微生物结构造就了独特的代谢
肠道微生物群与营养物质的利用:肠道微生物群如何利用营养物质取决于具体的营养成分和每种微生物的代谢能力。不同微生物有不同的代谢途径,使得营养利用变得复杂,而不是简单的化学计量问题。
微生物群落结构的影响:肠道中的微生物群落结构可以影响宿主和微生物之间的营养合作动态。比如,在体内平衡期间,宿主在小肠中有效吸收氨基酸,从而使得一些微生物无法获得这些氨基酸。
营养物质的竞争:某些细菌(如梭状芽孢杆菌)如果过度生长,就可能在一些情况下(如膳食蛋白质有限时)与宿主竞争氨基酸的吸收。
营养层次与利用率:更高级的营养物质(如单糖和双糖)的增加会降低某些细菌对氨基酸的利用率。这意味着营养物质的可用性对微生物代谢有影响。
调节信号的作用:肠道中的特定信号分子(如短链脂肪酸或肽YY)也能影响宿主对营养物质的利用方式。
在下面小节中,我们重点介绍两个例子(色氨酸和膳食纤维),以说明宿主和肠道微生物群在营养利用上的差异如何影响宿主的生理学。
色氨酸是一种必需氨基酸,是宿主神经递质血清素 (5-HT;胃肠道生理的重要调节剂) 的前体,也是微生物代谢物(如色胺和吲哚衍生物)的前体。色氨酸库很大程度上取决于饮食。
色氨酸被整合到蛋白质中并被宿主利用,通过不同的途径产生5-HT(1-2%)和犬尿氨酸(∼95%)。肠道微生物成员如Ruminococcus gnavus和Clostridium sporogenes含有色氨酸脱羧酶,可将色氨酸转化为色胺,而色胺则是血清素受体4(5-HT 4R)的激动剂。
同时,脆弱拟杆菌(Bacteroides fragilis)和大肠杆菌(Escherichia coli)等细菌含有色氨酸酶,这种酶有助于从色氨酸产生吲哚和吲哚衍生物。如吲哚乙酸和吲哚丙酸,可以通过激活芳烃受体(AHR)对宿主的免疫途径发挥生物学效应。
这些细菌产生的色氨酸衍生生物活性代谢物的水平取决于肠道菌群的组成、肠道细菌利用色氨酸的程度和位置,以及宿主色氨酸利用相关基因的活性。
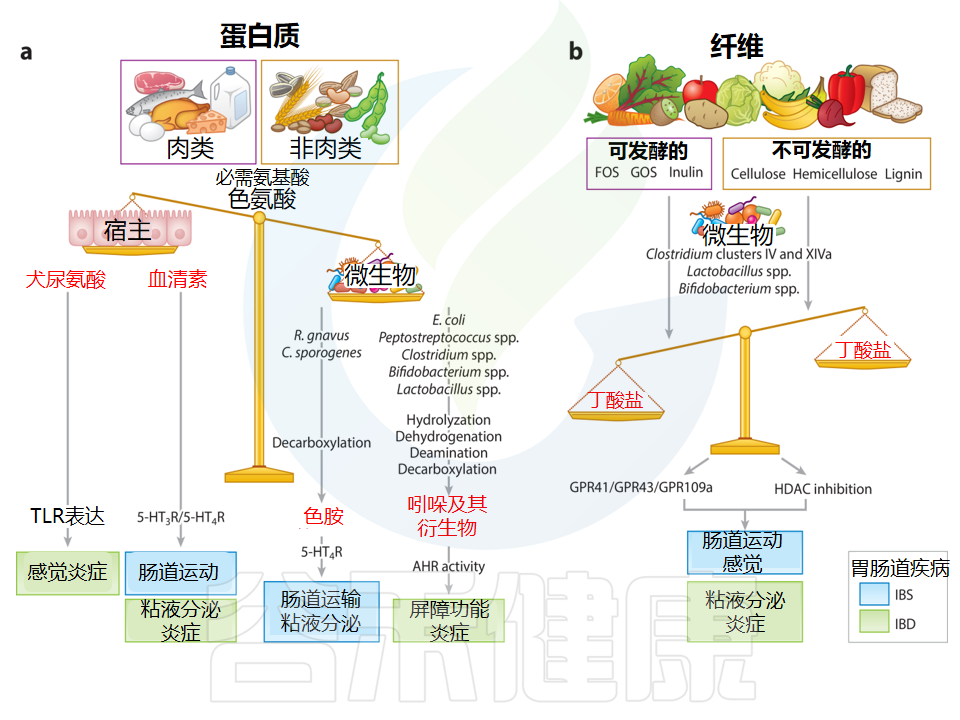
Jadhav A,et al.Annu Rev Nutr.2023
饮食衍生的代谢物可改变多种生物途径,而这些途径是多种胃肠道(GI)疾病的基础。
a)饮食蛋白质,包括肉类和非肉类(例如谷物、种子和坚果),都含有不同水平的氨基酸,例如色氨酸。可被宿主代谢产生犬尿氨酸和血清素(5-HT)。肠道微生物群还可以通过不同的代谢途径将色氨酸转化为色胺或吲哚和吲哚衍生物。色胺通过激活血清素受体4来增加肠道分泌和杯状细胞的粘液释放,而吲哚和吲哚衍生物是芳烃受体(AHR)的配体,在调节屏障功能和免疫反应中发挥重要作用。
b)膳食纤维包括可发酵[例如低聚果糖、低聚半乳糖和菊粉]和不可发酵(例如纤维素、半纤维素和木质素)纤维。根据肠道细菌的类型和纤维的类型,它们会发酵成不同的短链脂肪酸,例如丁酸盐和乙酸盐。丁酸盐可以增加血清素合成,增强结肠收缩力,缓解内脏过敏,增强屏障。
色氨酸衍生的生物活性代谢物取决于肠道菌群,那么纤维的发酵产物与微生物组成有关吗?
富含膳食纤维的饮食被认为是有益的,因为肠道微生物群会发酵纤维产生丁酸、乙酸和丙酸等短链脂肪酸,这些短链脂肪酸会影响宿主生理学的重要方面,包括代谢、细胞周转和免疫系统。
然而,人类研究表明,个体对纤维摄入量的反应存在显著差异,并且基于纤维类型的差异也很大。这并不奇怪,因为纤维是一个总称,包括具有不同连接和分子结构的不同碳水化合物群体。不同细菌携带的基因使它们能够利用具有特定连接和结构的碳水化合物。
膳食纤维的生物学效应取决于纤维的成分、个体肠道微生物群代谢特定纤维的潜力以及不同发酵最终产物的相对量。
▸ 低聚果糖在健康人体和炎症性肠病患者中作用大为不同
编辑
最近的一项研究发现,低聚果糖(FOS)会加重炎症性肠病(IBD)患者的炎症,而肠道细菌代谢它会减轻其在活动性炎症的IBD患者的炎症作用。
有趣的是,低聚果糖在健康个体中具有抗炎作用。因此,低聚果糖的炎症潜力取决于肠道微生物组成以及宿主疾病状态。
产生的短链脂肪酸的水平和类型可能因纤维组成和肠道微生物群而异。在饮食中添加菊粉会增加丁酸盐,但会降低乙酸盐的产生。相反,在消耗相同纤维量的患者亚组中,粪便丁酸水平较低,这归因于产生丁酸的细菌水平较低。这些结果有助于解释对纤维反应的个体间差异。
鉴于微生物代谢产物对宿主发挥多效性作用,因此,相同的代谢物可以影响多种宿主功能,每种功能都可能与不同的疾病状态相关。
色氨酸代谢物如色胺和5-HT会影响胃肠道转运,这与肠脑轴(DGBA)相关,而色胺和吲哚衍生物可以改变粘液和免疫反应,这对炎症性肠病具有影响。
同样,丁酸等发酵终产物会影响胃肠道运动以及上皮屏障功能,这分别与DGBA和IBD相关。
肠道微生物组的一个重要决定因素是饮食,它会对肠道微生物组产生长期和短期影响,它们会随着个体饮食的变化而变化。
与农业社会相比,工业化社会个体饮食的成分显著改变和肠道微生物多样性减少能证明习惯饮食的长期影响。
▸ 低纤维饮食会导致肠道微生物多样性逐渐减少
研究证明,低纤维饮食会导致人肠道微生物多样性逐渐丧失,这在早期阶段是可逆的,但可能会导致后代特定分类群的灭绝,而仅靠饮食干预是无法恢复的。
这一观察结果为西方人群中观察到的肠道微生物多样性较低提供了一种解释,并强调了微小的变化是如何在几代人的过程中积累起来的。因此,个体的微生物群落结构可能反映了人群的长期饮食模式。
▸ 短期饮食改变也会影响肠道微生物群,但可逆
短期的饮食改变也会改变肠道微生物组。虽然这些变化在不同程度上是可逆的,这取决于人体的基本恢复力和适应性,但短期变化可能在一定程度上解释慢性病患者症状的频率和严重程度不同。
这些短期影响也强调了微生物群导向的饮食干预作为治疗策略的潜力。
肠易激综合征(IBS)是一种常见的疾病,全球患病率约为11.2%。根据过去3个月内每周至少出现一次腹痛、伴有排便或大便频率或形式的变化并在过去6个月内出现症状进行诊断。
IBS一般可分为腹泻型(IBS-D)、便秘型(IBS-C)、混合型和未分类亚型。
胃肠道运输、分泌、感觉、免疫激活、肠道通透性和肠脑轴的改变等生理变化是IBS症状的基础。与IBS相关的危险因素包括宿主遗传、压力、抗生素使用和幼儿期经历,但饮食最常被认为是肠易激综合征的潜在罪魁祸首。基于人群的研究表明,近70%的IBS患者认为自己存在食物不耐受。
饮食引起症状的机制仍在研究中,但最近的研究已经开始阐明IBS中由饮食驱动的症状背后的微生物群独立机制和微生物群依赖机制。
研究发现将食物抗原(例如麸质、小麦、牛奶和大豆)直接注射到粘膜下层可以通过激活IBS患者的肥大细胞来引发免疫反应,但在健康受试者中则不然。
他们进一步表明,肥大细胞激活会引起内脏疼痛,并通过组胺刺激内脏神经元的敏化增加肠道通透性。虽然这项研究证明了一种独立于微生物群的机制,但其他研究发现,富含可发酵寡糖、二糖、单糖和多元醇(FODMAP)的饮食也可以通过Toll样受体4(TLR4)途径激活肥大细胞,这表明肠道微生物群的参与。
据报道,IBS-D患者中受饮食影响的微生物产物(如脂多糖和鞭毛蛋白)的血清水平显著升高。
脂多糖(LPS)是肠道细菌的一组异质细胞壁成分,充当TLR4的配体,在食用高脂肪饮食或高FODMAP饮食的个体中也会增加。除了在肥大细胞激活中的作用外,不同形式的LPS还能促进肠神经元的存活并增强平滑肌收缩力,这表明LPS浓度或结构的差异可能会驱动不同的宿主反应。
除微生物细胞壁成分外,宿主微生物代谢膳食成分产生的代谢终产物也可影响胃肠道生理,从而引发胃肠道症状。乙酸盐、丙酸盐和丁酸盐等短链脂肪酸由特定肠道微生物成员产生,其水平取决于微生物组成和膳食纤维摄入量。
丁酸盐是一种多效性代谢物,可通过G蛋白偶联受体(GPCR)直接发出信号,并通过表观遗传调控改变转录反应。丁酸盐可以浓度依赖性方式改变肠嗜铬细胞中的5-HT合成,通过直接影响肠道神经肌肉装置增加结肠收缩力,增强肠道上皮屏障,并通过与肠道神经胶质细胞相互作用调节内脏高敏感性。
另一方面,结肠内乙酸盐可增强对结肠直肠扩张的敏感性。具体影响可能取决于宿主健康和肠道中的整体代谢环境。
饮食、宿主粘液和微生物代谢都是肠道中氨基酸的主要来源。一项纵向研究报告称,尽管饮食蛋白质摄入量相似,但IBS-D患者的色氨酸和色胺水平(而非吲哚衍生物)高于健康人。
这种差异可能是由于肠道微生物群增加了色氨酸的产生和转化,或由于宿主对其利用率降低。胰蛋白酶激活肠细胞上的5-HT4R,进而增加肠液分泌。
另一项研究发现,IBS患者和健康受试者在结肠组织对色胺的5-HT4R表达或反应方面没有差异,这表明较高的色胺水平可能是腹泻的重要驱动因素。
在腹泻型(IBS-D)患者中,其他饮食和微生物驱动的途径也被描述了。无乳糜泻的IBS-D患者中经常报道麸质不耐症,这似乎部分依赖于宿主基因型和肠道微生物群组成。据报道,与阴性患者相比,HLA-DQ2/HLA-DQ8 阴性的IBS-D患者在无麸质饮食后腹胀显著减轻。
HLA-DQ2和HLA-DQ8基因是导致乳糜泻的主要基因。
其他研究表明,肠道微生物群可以对麸质的消化和免疫原性产生不同的影响。麸质对IBS-D影响的具体机制仍需进一步研究确定。
胆汁酸(BA)在肝脏中合成,储存在胆囊中,用于脂质乳化。膳食脂肪和姜黄是刺激初级胆汁酸释放到小肠中的重要因素。
近95%的初级胆汁酸在远端小肠中被重新吸收,剩余的初级胆汁酸在进入结肠后被肠道微生物去偶联、脱羟基和差向异构化为次级胆汁酸。
初级胆汁酸如鹅去氧胆酸通过氯化物通道增加结肠分泌,并降低健康个体的直肠感觉阈值。在啮齿类动物模型中,鹅去氧胆酸通过激活核受体法尼素X受体、释放神经生长因子和在背根神经节中下游表达瞬时受体电位香草素1(TRPV1),影响内脏敏感性。
▸ IBS-D患者的胆汁酸水平较高
IBS-D患者的粪便胆汁酸水平可能更高,这归因于胆汁酸吸收不良或肠道微生物群减少导致的继发性胆汁酸转化减少。因此,高脂肪饮食可以通过调节胆汁酸的释放,直接或通过胆汁酸的微生物代谢间接改变胃肠道生理学。
除此之外,最近的一项研究发现,感染后IBS-D患者的细菌编码的β-葡萄糖醛酸酶水平较低,这种酶可以解除胆红素的结合。
这些患者的结合胆红素水平较高,导致对宿主蛋白酶的抑制作用降低,肠道通透性增加,从而引发内脏超敏反应。
炎症性肠病(IBD)是一种特发性、慢性、使人衰弱的炎症性胃肠道疾病,包括两种疾病——克罗恩病(CD)和溃疡性结肠炎(UC)。克罗恩病表现为遍布整个胃肠道的斑片状透壁炎症,而溃疡性结肠炎则是结肠的持续性粘膜炎症。
这两种疾病都是由于环境、遗传和免疫因素共同作用下,对肠道微生物信号产生的不受控制的炎症反应引起的。从流行病学角度来看,IBD曾被认为是西方国家的疾病,欧洲和北美的发病率最高。但自20世纪90年代以来,IBD的高发区已大幅向东方扩展,在非洲、亚洲(如印度每10万人9.3例,中国每10万人3.3例)和南美洲的新兴工业化国家中,发病率迅速上升。
▸ 炎症性肠病的风险升高与饮食改变紧密相关
这些流行病的转变与全球饮食模式的转变相吻合,包括引入包装和加工食品;广泛接受和使用食品添加剂、防腐剂和抗生素;推广快餐连锁店,同时减少针对特定地区的当地饮食。
流行病学研究表明,饮食是形成炎症性肠病(IBD)的关键环境因素之一,从低发病地区迁移到高发病地区的人群中,IBD的患病率有所上升。此外,法国和西班牙的南北流行率差异也很微妙。在这些国家的北部地区观察到较高的IBD负荷,那里的个人食用更多的黄油、土豆、火腿、奶酪、香肠和啤酒,而南部地区的个人则遵循地中海饮食,主要由橄榄、新鲜水果和蔬菜、葡萄酒和海鲜组成。
饮食成分不仅可以直接影响炎症性肠病的病理生理学,而且还可以通过其在肠道微生物群中的转化间接影响疾病进程。让我们一起来了解下其中的具体机制。
饮食在炎症性肠病发病机制和预防中的作用
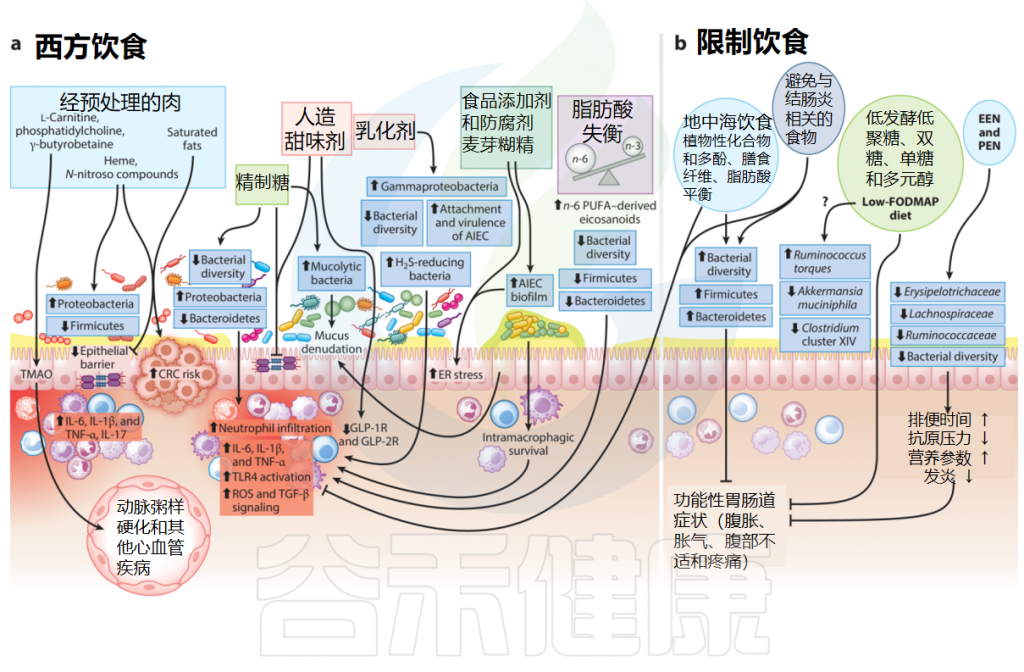
Jadhav A,et al.Annu Rev Nutr.2023
膳食中的大量营养素、微量营养素、添加剂和热量含量之间相互作用复杂;宿主免疫、遗传学和肠道微生物组可能是炎症性肠病(IBD)风险和临床病程的重要决定因素。
▸ 红肉饮食可能加剧炎症性肠病风险

最近一项由125445名参与者组成的大型前瞻性队列研究发现,西方饮食(包括红肉、家禽和加工肉类等动物蛋白)与溃疡性结肠炎发展可能性增加之间存在关联。
此外,红肉加剧炎症性肠病的影响在其他研究中也得到了证实。欧洲癌症和营养前瞻性调查队列表明,红肉摄入增加了亚油酸摄入量,从而使溃疡性结肠炎风险增加超过一倍。
同时,一项法国大型前瞻性问卷研究也支持这一观点。值得注意的是,加工红肉的摄入,与克罗恩病患者死亡率的显著增加有关。
▸ 红肉中的左旋肉碱等物质经微生物转化为氧化三甲胺与炎症呈正相关
红肉主要由蛋白质、脂肪和血红素组成,这些成分水平的增加会改变肠道微生物群的组成,进而对上皮细胞更新和肠道屏障完整性产生负面影响,并加剧肠道炎症。
值得注意的是,红肉中富含左旋肉碱、磷脂酰胆碱和γ-丁甜菜碱,这些物质通过肠道微生物代谢转化为三甲胺。三甲胺在宿主肝脏中通过含黄素单加氧酶形成氧化三甲胺(TMAO)。动物研究和人类流行病学研究表明,TMAO与炎症、心血管疾病、结直肠癌和死亡率之间有很强的正相关关系。
与传统的饮食习惯不同,西方饮食富含简单的精制碳水化合物、饱和脂肪以及超加工食品,而新鲜水果和蔬菜、豆类、全谷物和膳食纤维的含量较低。
超加工食品是在已经加工过的食品基础上再加工的食品,这类食品通常是高糖、高脂、高热量的食品。可涵盖多种食物,包括肉类、淀粉类零食、乳制品、豆类、水果和蔬菜。
研究报告了西方饮食对人类健康的不利影响,并将其与肥胖、糖尿病、炎症性肠病、慢性肾病和其他与生活方式相关的疾病联系起来。食品的(超)加工旨在提高其保质期、适口性以及储存和分销的便利性,其中涉及掺入许多非天然成分和添加剂,例如人造香料、稳定剂、防腐剂和乳化剂。
▸ 超加工食品的摄入量较高与炎症性肠病风险增加相关

最近一项针对来自7个地理区域 21个低收入、中等收入和高收入国家的大型前瞻性队列(116,087名成年人)的研究发现,超加工食品的摄入量较高与炎症性肠病风险呈正相关;然而,未加工的白肉、红肉、乳制品、淀粉、水果和蔬菜的摄入与炎症性肠病的发病率无关。
研究发现,炎症性肠病(IBD)风险与非酒精含糖饮料的消费存在正相关关系。
▸ 含糖饮料摄入过多增加炎症性肠病风险

最近的两项荟萃分析整合了关于饮料摄入量与IBD风险的观察性研究,表明高摄入量的含糖饮料与IBD风险增加相关。实验显示,高膳食糖摄入与炎症诱导和肠道微生态失调有关。一项基于问卷的研究比较了IBD患者与健康人群的饮食模式,发现IBD患者的含糖饮料消费量更高。
阿斯巴甜、糖精、安赛蜜和三氯蔗糖等人造甜味剂因其在不增加额外热量的情况下赋予食物甜味而广泛流行。然而,动物研究和健康人类试验报告称,这些非营养性甜味剂降低了肠道微生物多样性,使肠道炎症永久化,通过增加变形菌门(Proteobacteria)成员和减少有益微生物(如瘤胃菌科、毛螺菌科和梭状芽孢杆菌群XIVa)的比例来改变肠道微生物群,并损害肠道屏障的完整性。
▸ 麦芽糊精会加剧肠道炎症
麦芽糊精(E1400)是一种重要的食品添加剂,可用作加工食品的增稠剂,在小鼠结肠炎模型中,它通过诱导内质网应激和改变粘液层,以剂量依赖性方式加剧肠道炎症。小鼠模型中的报告还表明,麦芽糊精通过调节细菌基因表达,促进克罗恩病相关的粘附侵袭性大肠杆菌形成生物膜。
▸ 防腐剂会降低肠道微生物多样性
加工食品中的防腐剂会加剧有害影响。苯甲酸钠(E211)、亚硝酸钠(E250)和山梨酸钾(E202)这三种最常用的防腐剂会降低肠道微生物多样性,在人类肠道微生物群相关的小鼠模型中,变形菌门增加,梭状芽胞杆菌的减少。
注:尽管人类和动物研究已经提供了关于这些非营养性膳食添加剂对肠道菌群失调和肠道健康的负面影响的机制见解,但仍缺乏评估这些甜味剂对炎症性肠病人群影响的人体随机对照试验。
▸ 乳化剂过量食用会导致肠道微生物失调并促进慢性炎症
类似地,合成乳化剂,如聚山梨酯80和羧甲基纤维素,被用作增强质地和延长保质期的添加剂。在动物研究中,这些乳化剂被广泛认为会导致肠道微生态失调并促进慢性炎症。

▸ 摄入过多的脂肪增加炎症性肠病风险
进行的一项大型前瞻性流行病学研究,基于超过200,000名参与者的食物频率调查问卷,显示ω-6多不饱和脂肪酸的摄入量与溃疡性结肠炎(UC)风险增加之间存在显著关联。
高摄入总脂肪、ω-6多不饱和脂肪酸和肉类会增加患溃疡性结肠炎的风险;高摄入饱和脂肪、ω-6多不饱和脂肪酸和肉类也会增加患克罗恩病的风险。
▸ ω-6脂肪酸在炎症性肠病中具有促炎性
虽然主要的膳食ω-3不饱和脂肪酸,即二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),及其下游类二十烷酸具有抗炎特性,但ω-6多不饱和脂肪酸,如花生四烯酸(AA)及白三烯、羟基二十碳四烯酸、脂氧素和环氧二十碳三烯酸等在炎症性肠病中表现出强烈的促炎活性。
这些介质增强中性粒细胞的趋化性;增强血管通透性;以及炎症细胞因子的产生,例如肿瘤坏死因子(TNF-α)、白细胞介素(IL)-1β、IL-6和IL-8。有趣的是,这些脂肪酸介质的代谢在炎症粘膜中发生了改变,ω-6 花生四烯酸水平较高,ω-3 EPA水平较低,这表明脂肪酸代谢与炎症性肠病之间存在关联。
▸ ω-6促进肠道炎症与肠道微生物失调相关
最近的动物研究和人体试验已经将饮食中的ω-6多不饱和脂肪酸与肠道微生物微生态失调联系起来。γ-亚麻酸水平越高,2型糖尿病的发病率越高;肠道微生物多样性降低;有益微生物如普雷沃菌属(Prevotella)、Odoribacter、粪杆菌属、Paraprevotella、经黏液真杆菌属(Blautia)和丁酸弧菌属,以及梭菌目、Rikenellaceae和Coriobacteriaceae的成员减少。
在断奶阶段补充ω-6高脂肪饮食的小鼠显示,成年期结肠炎症和增生性病变的数量增加,厚壁菌门、梭状芽孢杆菌和毛螺菌属成员显著减少。在衰老小鼠模型中,补充ω-6也有类似效果,高ω-6脂肪饮食减少了厚壁菌门和拟杆菌门的有益成员,并导致肠道炎症。而补充鱼油可以逆转观察到的肠道微生态失调。
饮食成分在肠易激综合征和炎症性肠病等胃肠道疾病的病理生理学中发挥作用,使得通过饮食调节成为一种无创、更日常便利的治疗方法。
然而,目前的饮食策略缺乏特异性,在具有不同病理生理学的胃肠道疾病(如肠易激综合征和炎症性肠病)中也采用类似的方法。最常见的策略是限制、改变或补充营养。
▸ 可发酵碳水化合物不利于肠易激综合征患者的健康
治疗肠易激综合征(IBS)最常见的饮食干预之一是减少FODMAP食物(通常是吸收不良的“可发酵”碳水化合物,包括果糖、乳糖、多元醇、果聚糖和低聚半乳糖)摄入12周,然后缓慢恢复上述食物组。
这类营养素被认为是疾病病理生理学的重要驱动因素。基于这样的观点:FODMAP会增加渗透负荷并产生更高水平的氢,从而导致管腔扩张。这些碳水化合物还会会被结肠中的细菌发酵,并引起肠易激综合征特有的腹胀、胀气和腹痛等症状。
▸ 低FODMAP饮食改善肠易激综合征患者症状

对澳大利亚肠易激综合征患者进行的一项关键研究显示,与西方饮食相比,低FODMAP饮食可显著改善症状。最近的一项荟萃分析纳入了397名患者的七项随机对照研究,结果显示,与对照干预相比,低FODMAP饮食可减轻整体症状。
然而,这项荟萃分析中的三项随机对照试验比较了低FODMAP饮食和严格的对照饮食,这些试验之间的异质性较小,且效应量有限。因此,虽然低FODMAP饮食能够使肠易激综合征患者受益,但数据的整体质量较低。
这一发现表明,几种不同的饮食干预措施都可以改善IBS症状,找到它们之间的共同点将会很有帮助。
▸ 低FODMAP饮食的效果会因肠道微生物组成不同而存在差异
有趣的是,一项针对健康受试者的研究发现,低FODMAP饮食并没有减少结肠体积,这表明症状改善背后可能存在其他机制。低FODMAP饮食的效应是与肠道菌群存在重要联系。
荟萃分析还发现无麸质饮食对肠易激综合征患者无显著益处。如上所述,这种影响可能取决于宿主基因型或其他宿主/环境因素。麸质主要存在于小麦、大麦和黑麦中,它们是高FODMAP饮食的一部分;因此,在部分患者中观察到的改善也可能是限制FODMAP的结果,而不仅仅是麸质的结果。
最近的一项综述显示,炎症性肠病患者中非腹腔麸质敏感性患病率很高;但几乎没有证据支持这些患者采用无麸质饮食。临床前研究发现无麸质饮食可以改善炎症和通透性,但缺乏针对人类受试者的高质量前瞻性研究。关于麸质微生物降解对炎症性肠病和乳糜泻都具有重要意义,是未来研究的重要领域。
地中海饮食(MD)富含水果、蔬菜、面包、谷物、豆类、坚果和初榨橄榄油,以及适量的乳制品、鱼和肉。地中海饮食被认为是一种平衡且健康的长期饮食选择。
地中海饮食和低FODMAP饮食的效果


Jadhav A,et al.Annu Rev Nutr.2023
▸ 地中海饮食的炎症性肠病患者症状减轻
最近的一项前瞻性、随机研究纳入了100名患有轻度至中度疾病的青少年炎症性肠病患者,比较了地中海饮食与常规饮食的疗效,结果显示,小儿克罗恩病活动指数和小儿溃疡性结肠炎活动指数的临床评分显著下降。以及较低水平的炎症标志物,例如血清C反应蛋白、钙卫蛋白、TNF-α、IL-17、IL-12和IL-13。
临床试验,也观察到地中海饮食对炎症性肠病的有益作用。这项研究涉及142名炎症性肠病患者(84名 溃疡性结肠炎和58名克罗恩病)。接受地中海饮食治疗6个月,显著改善了体重指数和腰围,并导致肝脏脂肪变性和营养不良相关参数显著减少。其中40%的轻度至中度克罗恩病患者在接受6-12周的地中海饮食治疗后病情得到缓解。
▸ 地中海饮食与健康有益的微生物特征相关
地中海饮食与有益的肠道微生物特征相关,特别是与膳食纤维代谢物的富集有关,例如普拉梭菌、解纤维素拟杆菌和普雷沃氏菌,以及参与植物多糖降解和短链脂肪酸和次级胆汁酸生产的其他微生物。
地中海饮食富含ω-3不饱和脂肪酸,使得ω-3和ω-6脂肪酸达到平衡。在前瞻性溃疡性结肠炎队列中证明了EPA和其他不饱和脂肪酸的积极作用,其中肠道炎症细胞因子水平与PUFA、EPA和二十二碳五烯酸呈负相关。
▸ ω-3 不饱和脂肪酸有助于对抗肠道相关炎症
涉及ω-3脂肪酸代谢的三个关键基因(CYP4F3、FADS1和FADS2)的单核苷酸多态性与克罗恩病风险增加相关,这显示了炎症性肠病饮食相关调节的额外遗传因素。
ω-3 不饱和脂肪酸可能通过下游脂质介质(例如消解素、保护素和噬消素(maresins))发挥抗炎作用,这些介质可以对抗IBD相关炎症。从机制上讲,ω-3 不饱和脂肪酸已被发现:
(a)降低中性粒细胞和单核细胞对各种化学引诱剂的趋化性;
(b)通过阻断丝裂原激活蛋白激酶释放核因子κB来抑制TLR4表达和NOD2信号传导;
(c)抑制NLRP3炎性体激活并随后阻碍促炎细胞因子的释放;
(d)增加产生丁酸盐的细菌属如双歧杆菌属、罗氏菌属和乳杆菌属以及毛螺菌科成员的丰度。
▸ 地中海饮食通过微生物产生的短链脂肪酸也有助于减轻肠道炎症
由于可发酵碳水化合物含量较高,地中海饮食可导致肠道微生物群产生更多的短链脂肪酸。此外还发现,地中海饮食可改善坚持饮食的肠易激综合征患者的腹胀和腹痛。
膳食纤维、益生元和合生元等营养物质具有促进细菌群落生长的作用,对健康有益,并被证明可以改善宿主肠道炎症。
益生元和合生元在IBS和IBD中的作用




Jadhav A,et al.Annu Rev Nutr.2023
▸ 可溶性膳食纤维有助于改善肠道炎症
对14项随机对照研究(包括906名肠易激综合征患者)进行的荟萃分析发现,可溶性膳食纤维可显著改善症状,但麸皮则不然。
注:但这些研究大多数都使用纤维补充剂;他们中很少有人改变饮食以增加纤维摄入量。尽管有几项研究调查了益生元和合生元,但没有足够的数据来提出建议。
炎症性肠病的临床前模型发现,高纤维(主要是车前草)、低蛋白饮食可增强肠道屏障功能并减少炎症。因此,可溶性纤维似乎对肠易激综合征患者和炎症性肠病患者都有益。
最近的一项荟萃分析还发现,膳食纤维摄入量与克罗恩病风险之间存在线性剂量依赖性关系,每天每增加10克纤维摄入量,克罗恩病风险就会降低 13%。
▸ 补充益生元可以降低疾病活动性
一项针对肠易激综合征患者的随机、平行、双盲研究比较了地中海饮食和益生元补充剂(β-低聚半乳糖)与低FODMAP饮食和安慰剂木糖补充剂的效果,发现肠易激综合征患者的症状有所改善,但补充益生元后肠道微生物群分布更有利。这一发现突显了饮食调整和补充作为胃肠道疾病管理中限制性饮食习惯的替代方案的潜力。
基于食物和补充剂的纤维和益生元干预研究报告指出,富含纤维的半素食、车前子种子、燕麦麸和发芽大麦食品在缓解和显著改善胃肠道症状(如腹痛和反流)方面取得了令人振奋的成果。
在接受低聚果糖(每天15克,持续3-4周)、富含低聚果糖的菊粉(每天两次,每次10克,持续4周)、全麦麸(每天0.5杯,持续4周)、菊粉型果聚糖(每天7.5克,持续9周)和发芽大麦食品补充的活动性疾病队列中也报告了类似的结果,特别是显著降低了疾病活性并提高了生活质量。
▸ 纤维和益生元的益处会因个体健康状况和肠道菌群组成而不同
一项评估纤维摄入量对肠道微生物组组成影响分析表明,与安慰剂/低纤维饮食相比,高膳食纤维摄入与双歧杆菌属和乳杆菌属的丰度显著增加以及粪便丁酸盐含量增加相关。
不过这些研究主要针对成年炎症性肠病患者进行,对儿童的益处尚不清楚。膳食纤维被广泛用于包括一系列复合碳水化合物(包括益生元)。但如上所述,膳食纤维的效果可能会因碳水化合物结构、健康状况和肠道微生物群组成而异。
一些研究表明合生元对成年溃疡性结肠炎患者有益。与安慰剂组相比,补充长双歧杆菌和富含低聚果糖的菊粉4周可改善症状,并降低炎性细胞因子(TNF-α和IL-1β)的表达。
在一项随机对照试验中报告了类似的结果,该试验涉及补充8周由屎肠球菌、植物乳杆菌、嗜酸乳杆菌、嗜热链球菌、乳双歧杆菌、长双歧杆菌和低聚果糖组成的合生元混合物。
纯肠内营养(EEN)已被接受为儿科克罗恩病患者的一线饮食干预措施。特指经消化道途径(包括口服和管饲)提供营养物质的一种营养支持治疗方式,包含所有必需的常量营养素和微量营养素。
▸ 纯肠内营养有助于减轻克罗恩病患者症状
许多研究表明,纯肠内营养(EEN)在诱导轻度至中度克罗恩病儿科患者缓解方面的效果与皮质类固醇相当。例如,在澳大利亚和西班牙的独立试验中,补充EEN8周分别使84%和80%的受试者达到临床缓解。
EEN对患有克罗恩病的围手术期成年患者也有效。两项前瞻性队列研究的荟萃分析显示,术前接受EEN的患者(22%)与未接受EEN的患者相比,术后并发症显著减少。尽管有限,但其他研究已经描述了EEN在治疗穿透性克罗恩病、狭窄性克罗恩病和肠外克罗恩病方面的益处。
▸ 纯肠内营养增强肠道微生物群的抗炎作用
从机制上讲,EEN可能通过改变肠道菌群的组成和功能发挥作用。尽管它反而降低了肠道微生物多样性和通常被认为有益的菌群的丰富度(粪杆菌属、瘤胃球菌属和双歧杆菌属以及丹毒丝科、毛螺菌科的其他成员),但它根据代谢物的变化增强了肠道菌群的功能。
由于EEN的组成简单,降低抗原压力和肠道休息也可能是其重要的作用机制。此外,EEN配方中的活性成分可以改善营养参数,并可能对肠上皮产生抗炎作用。
在成人中,EEN作为二线或三线治疗使用,而皮质类固醇则是主要的诱导治疗,因为这些药物比EEN更有效地诱导临床缓解。
▸ 排除饮食减少肠道微生物的有害变化有助于病情缓解
部分肠内营养(PEN),即补充患者一半的热量需求作为肠内营养和全食物饮食,有助于克罗恩病患者维持病情缓解。
一项儿科克罗恩病队列研究中,无限制的PEN与元素配方结合效果有限;因此,研究人员认为需要一种针对克罗恩病和溃疡性结肠炎的排除饮食,排除某些有害食物。
克罗恩病排除饮食(CDED)与PEN相结合,是一种全食物饮食制度,旨在减少与肠道微生物群有害变化(如变形杆菌的扩张)、屏障完整性受损和胃肠道炎症相关的饮食成分和食物的暴露。
CDED不包含加工食品,并含有有益的纤维,再加上液体配方奶粉,以满足患者的能量需求。一项前瞻性研究报告称,与EEN相比,CDED加PEN在CD队列中具有更好的耐受性和更有效的效果,并且75%的CDED加PEN患者获得了无类固醇的临床缓解。
饮食衍生的代谢物因宿主健康状况和肠道微生物群中不同代谢途径而异,这反过来影响了饮食的生物学效应。因此,同一种食物可能对不同人群的生理功能具有不同的作用,可以影响多种疾病的病理生理,这也解释了相同饮食干预对不同疾病有益。
我们仍处于研究饮食-宿主-肠道菌群相互作用产生的生物活性分子如何影响慢性胃肠道疾病的病理生理和治疗反应的早期阶段。一个重要的考虑因素是,在评估饮食干预的反应时观察到的显著个体间差异。这种差异可能源于饮食中生物可利用营养素的差异(由于成分和加工方式(如烹饪)的差异)、影响宿主代谢途径或免疫状态的基因多态性,以及肠道菌群代谢能力的差异。此外,其他环境和宿主因素也可能影响反应。我们需要考虑所有这些因素,以便能够为患者提供个性化的饮食建议。
编辑
Jadhav A,et al.Annu Rev Nutr.2023
总而言之,饮食与个性化微生物群在胃肠道疾病中的相互作用是一个复杂且充满潜力的研究领域。理解这种相互作用不仅有助于揭示疾病的发病机制,还为个性化医疗和精准营养提供了新的视角和方法。随着科学技术的不断进步,我们有理由相信,通过优化饮食和微生物群的相互作用,可以实现对胃肠道疾病更加有效的预防和治疗。
在应用方面,谷禾专注于高通量检测技术和人工智能的结合,通过精确、便捷、无创的检测方式,以肠道菌群为核心,结合蛋白质及代谢物检测的多组学检测,开发多模态表征和大模型框架。肠菌检测作为一种基于实证的工具,它不仅可以评估个人肠道菌群及营养状况,还可以从整个个性化营养生态的视角出发,多场景、全方位地为疾病预防和健康管理解决方案提供帮助。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Jadhav A, Bajaj A, Xiao Y, Markandey M, Ahuja V, Kashyap PC. Role of Diet-Microbiome Interaction in Gastrointestinal Disorders and Strategies to Modulate Them with Microbiome-Targeted Therapies. Annu Rev Nutr. 2023 Aug 21;43:355-383.
Armstrong HK, Bording-Jorgensen M, Santer DM, Zhang Z, Valcheva R, Rieger AM, Sung-Ho Kim J, Dijk SI, Mahmood R, Ogungbola O, Jovel J, Moreau F, Gorman H, Dickner R, Jerasi J, Mander IK, Lafleur D, Cheng C, Petrova A, Jeanson TL, Mason A, Sergi CM, Levine A, Chadee K, Armstrong D, Rauscher S, Bernstein CN, Carroll MW, Huynh HQ, Walter J, Madsen KL, Dieleman LA, Wine E. Unfermented β-fructan Fibers Fuel Inflammation in Select Inflammatory Bowel Disease Patients. Gastroenterology. 2023 Feb;164(2):228-240.
Dong C, Chan SSM, Jantchou P, Racine A, Oldenburg B, Weiderpass E, Heath AK, Tong TYN, Tjønneland A, Kyrø C, Bueno de Mesquita B, Kaaks R, Katzke VA, Bergman MM, Boeing H, Palli D, Masala G, Tumino R, Sacerdote C, Colorado-Yohar SM, Sánchez MJ, Grip O, Lindgren S, Luben R, Huybrechts I, Gunter MJ, Mahamat-Saleh Y, Boutron-Ruault MC, Carbonnel F. Meat Intake Is Associated with a Higher Risk of Ulcerative Colitis in a Large European Prospective Cohort Studyø. J Crohns Colitis. 2022 Aug 30;16(8):1187-1196.
Narula N, Wong ECL, Dehghan M, Mente A, Rangarajan S, Lanas F, Lopez-Jaramillo P, Rohatgi P, Lakshmi PVM, Varma RP, Orlandini A, Avezum A, Wielgosz A, Poirier P, Almadi MA, Altuntas Y, Ng KK, Chifamba J, Yeates K, Puoane T, Khatib R, Yusuf R, Boström KB, Zatonska K, Iqbal R, Weida L, Yibing Z, Sidong L, Dans A, Yusufali A, Mohammadifard N, Marshall JK, Moayyedi P, Reinisch W, Yusuf S. Association of ultra-processed food intake with risk of inflammatory bowel disease: prospective cohort study. BMJ. 2021 Jul 14;374:n1554.
Khademi Z, Milajerdi A, Larijani B, Esmaillzadeh A. Dietary Intake of Total Carbohydrates, Sugar and Sugar-Sweetened Beverages, and Risk of Inflammatory Bowel Disease: A Systematic Review and Meta-Analysis of Prospective Cohort Studies. Front Nutr. 2021 Oct 1;8:707795.
IBD in EPIC Study Investigators; Tjonneland A, Overvad K, Bergmann MM, Nagel G, Linseisen J, Hallmans G, Palmqvist R, Sjodin H, Hagglund G, Berglund G, Lindgren S, Grip O, Palli D, Day NE, Khaw KT, Bingham S, Riboli E, Kennedy H, Hart A. Linoleic acid, a dietary n-6 polyunsaturated fatty acid, and the aetiology of ulcerative colitis: a nested case-control study within a European prospective cohort study. Gut. 2009 Dec;58(12):1606-11.
Dionne J, Ford AC, Yuan Y, Chey WD, Lacy BE, Saito YA, Quigley EMM, Moayyedi P. A Systematic Review and Meta-Analysis Evaluating the Efficacy of a Gluten-Free Diet and a Low FODMAPs Diet in Treating Symptoms of Irritable Bowel Syndrome. Am J Gastroenterol. 2018 Sep;113(9):1290-1300.

谷禾健康

就在前不久,世界卫生组织将阿斯巴甜列为可能致癌物,引发了人们不小的热议。阿斯巴甜作为人工甜味剂的一种,不提供任何卡路里,就可以提供蔗糖几百倍的甜度。
人工甜味剂几乎不提供热量,或只提供极少的热量,所以深受健身人士及减肥人群的喜爱。人工甜味剂相关产业发展迅速,许多无糖饮料、无糖冰淇淋、巧克力等食品中都有其身影。
除了人工甜味剂外,乳化剂、着色剂、防腐剂等食品添加剂也是现代食品产业的重要组成部分,用于维持或提高食品的口味、安全性、新鲜度和外观。
但随着食品中的添加剂越来越多,其对健康的影响正引起人们的担忧。在此背景下,食品添加剂对微生物群的影响受到广泛研究。
事实上许多国家允许的食品添加剂并不会直接对人产生有害影响,但是会改变肠道微生物及其代谢。近年来出现的证据表明食品添加剂和微生物群之间存在相互作用,这可能会间接影响宿主健康。
例如盐是用于食品保鲜的最常见天然添加剂之一。高盐摄入会改变肠道微生物群组成和粪便短链脂肪酸的产生,通过调节辅助T细胞17影响肠道免疫轴并促进局部和全身组织炎症,可能导致高血压和肥胖。
此外,人工甜味剂有可能引起糖代谢障碍。随着人工甜味剂摄入量的增加,患心血管疾病的风险上升,尤其是阿斯巴甜与脑血管疾病,安赛蜜和三氯蔗糖与冠动脉性心脏病的风险有关。
本文主要总结了食品添加剂中的人工甜味剂、多元醇、乳化剂、色素、防腐剂对人体肠道微生物的影响,并间接导致了一些宿主代谢的变化,已有研究发现过量摄入食品添加剂与肠道炎症之间存在关联。在最后,我们提出了一些有助于减轻食品添加剂对身体的损害的小建议。
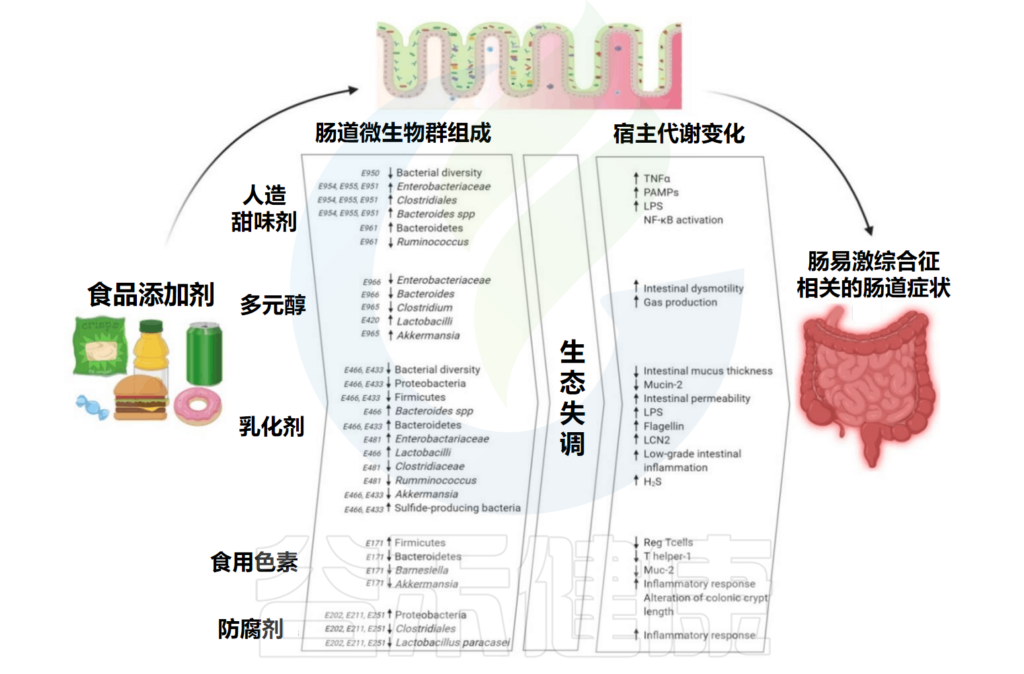
Rinninella E,et al.Int J Environ Res Public Health.2020
甜味剂与食品风味和人体健康密切相关,由于现在许多人们重视对身材的管理,无热量人工甜味剂逐渐兴起,其是蔗糖的替代品,特点是能够在不增加热量摄入的情况下具有更高的甜味强度,不会增加热量或引发血糖反应。
其中包括阿斯巴甜、安赛蜜、三氯蔗糖、糖精、纽甜和相应的化合物,主要存在于无糖饮料、无糖糖果和乳制品中。目前的研究已观察到人工甜味剂引起的肠道微生物群和代谢物的改变。
阿斯巴甜是一种低热量、强效的人造甜味剂。
•阿斯巴甜会改变人体肠道微生物的多样性
在人类中,阿斯巴甜可能不会改变粪便微生物群的丰度,但会改变其多样性。产生短链脂肪酸的细菌(例如双歧杆菌和另一项研究中检测到Blautia coccoides和拟杆菌/普雷沃氏菌比例下降。
•阿斯巴甜会影响短链脂肪酸浓度
在动物实验中,经阿斯巴甜处理后,厚壁菌门和柔嫩梭菌属(Clostridiumleptum)的丰度较高,肠球菌和副萨特氏菌 (Parasutterella)的丰度较低。
注:厚壁菌门和柔嫩梭菌都是重要的产丁酸菌属。
而在另一项人体研究中,随着阿斯巴甜的摄入,血清、粪便和盲肠内容物中的短链脂肪酸(包括丙酸和丁酸)浓度有所增加。
鉴于阿斯巴甜在不同动物和体外研究中存在一定的差异,阿斯巴甜对人体短链脂肪酸的影响还需要更多的实验研究,但目前可以确定的是,阿斯巴甜的摄入对人体短链脂肪酸的含量有影响。
阿斯巴甜存在一定的安全隐患!
需要注意的是,苯丙酮尿症患者苯丙氨酸代谢困难,应控制阿斯巴甜的摄入量。并且在此之前,美国一项研究发现,阿斯巴甜还会导致小鼠产生焦虑行为,这种影响还会跨代遗传。
阿斯巴甜对革兰氏阴性菌N-酰基高丝氨酸内酯(AHL)具有显著的抑制作用,通过群体感应抑制影响肠道微生物群落的平衡,从而促进消化系统疾病的进展。
此外,法国一项大规模前瞻性队列研究的结果表明,较高的人工甜味剂消耗量(尤其是阿斯巴甜)与心血管疾病风险增加之间存在潜在的直接关联。

安赛蜜,又称AK糖,是一种常用的人造甜味剂,也适合1-3岁儿童用于特殊医疗项目。
安赛蜜的可接受每日摄入量为9毫克/公斤体重
•安赛蜜在改变肠道微生物时具有性别特异性
在一项研究中,安赛蜜的摄入量在改变肠道微生物及其代谢物方面表现出高度的性别特异性。
在女性中,观察到乳杆菌属(Lactobacillus)和梭菌属(Clostridium)的丰度较低,Mucispirillum的丰度较高;而在男性中,拟杆菌属、萨特氏菌(Sutterella)、Anaerostipes有所增加。
•过量的安赛蜜会引起肠道炎症
在怀孕和哺乳期间将小鼠暴露于三氯蔗糖和安赛蜜会改变其后代肠道微生物群的α和β多样性,厚壁菌门增加和潜在抗炎细菌Akkermansia muciniphila的极度减少。
抗生素治疗后施用安赛蜜还会诱导硫酸盐还原菌脱硫弧菌的扩增以及结肠中促炎细胞因子的较高表达。
在炎症性肠病患者的粪便样本中,安赛蜜治疗后抗炎细菌减少,并伴有一些细菌功能改变,如脂多糖和胆汁酸合成。这表明安赛蜜诱导的肠道微生物组和代谢物扰动可能是破坏肠道稳态的因素,这可能会增加炎症性肠病的风险。
此外,安赛蜜可能会通过菌群失调引起吲哚美辛诱导的肠道损伤。
三氯蔗糖又名三氯半乳蔗糖,其甜度是蔗糖的600-650倍。
•长期摄入三氯蔗糖会改变肠道菌群并影响胰岛素水平
在人类研究中,摄入三氯蔗糖并不会在短期中影响肠道微生物,而年轻人摄入十周可能会导致Blautia coccoides增加和嗜酸乳杆菌减少,并改变肠道菌群和血清中的胰岛素和葡萄糖水平。
注:B. coccoides是一种参与促炎途径的细菌。
•三氯蔗糖的摄入导致体内多种代谢物改变
三氯蔗糖的摄入导致了多种代谢物的改变。酪氨酸水平升高,而对羟基苯乙酸和肉桂酸水平降低。这些化合物可以抑制参与色氨酸代谢的活性氧的产生。
此外,胆汁酸含量受损,盲肠内容物中胆酸浓度较高,胆酸/鹅去氧胆酸比率较高。研究人员认为这些代谢物的变化将导致引发和维持肝脏炎症。
▷大胆推测:三氯蔗糖会增加结肠炎的易感性
根据现有证据,我们认为三氯蔗糖对结肠炎有害,会增加促炎细菌的丰度。
三氯蔗糖会增加2,4,6,三硝基苯磺酸诱发的结肠炎易感性,并导致拟杆菌门和变形菌门的水平升高,厚壁菌门和放线菌门的数量减少。
最近的一项调查还发现,三氯蔗糖可能会增加患结肠炎相关结直肠癌的风险。
邻苯甲酰磺酰亚胺,俗称糖精。是一种热量为0的甜味剂,其甜度为蔗糖的300~500倍,但吃起来会有轻微的苦味和金属味。大部分糖精会被吸收并最终通过尿液排出,而未被吸收的糖精则通过粪便排出体外。
•糖精的消耗导致黏膜炎症细胞富集并改变肠道通透性
最近的一项研究发现,糖精的消耗会导致粘膜炎症细胞的富集并改变小鼠的肠道通透性。
此外,用抗生素预处理的糖精暴露小鼠可诱导较低水平的粘膜炎症和肠道屏障功能障碍。这些发现表明肠道菌群失调被认为是介导这些异常的原因。
•大量食用糖精会导致菌群失调
盲肠内容物中糖精的高含量与需氧菌群的增加有关。糖精暴露会导致严重的菌群失调,从而导致葡萄糖不耐受。许多增加的类群属于拟杆菌门和梭菌目,但厚壁菌门和蓝藻门减少了。
在无菌小鼠中无法诱导代谢变化,但在移植肠道微生物群后却发生了代谢变化。糖精还会导致肝脏炎症,导致阿克曼氏菌、棒状杆菌(Corynebacterium)和Turicibacter增加,并减少Anaerostipes、瘤胃球菌(Ruminococcus)和Dorea。
纽甜的味道比蔗糖甜7000-13000倍。纽甜的摄入降低了粪便微生物组的α多样性并改变了β多样性。
观察到厚壁菌门数量急剧下降。拟杆菌门,尤其是拟杆菌属的丰度增加。值得注意的是,毛螺菌科和瘤胃球菌科的多种成分显著减少,包括Blautia、Dorea、Oscillospira和瘤胃球菌属。
•纽甜的摄入改变了丁酸等物质的代谢
纽甜的摄入还改变了肠道微生物组的两种丁酸发酵途径。其中一条途径包括编码t4-羟基丁酰辅酶A脱水酶、丁酰辅酶A脱氢酶和乙酸辅酶A转移酶的三个基因的减少。这些基因参与了琥珀酸发酵为丁酸的过程。
另一方面,有关丙酮酸发酵丁酸的上游基因也被下调。此外,氨基酸代谢、脂多糖生物合成和抗生素生物合成增强,而脂肪酸和碳水化合物代谢途径减少。
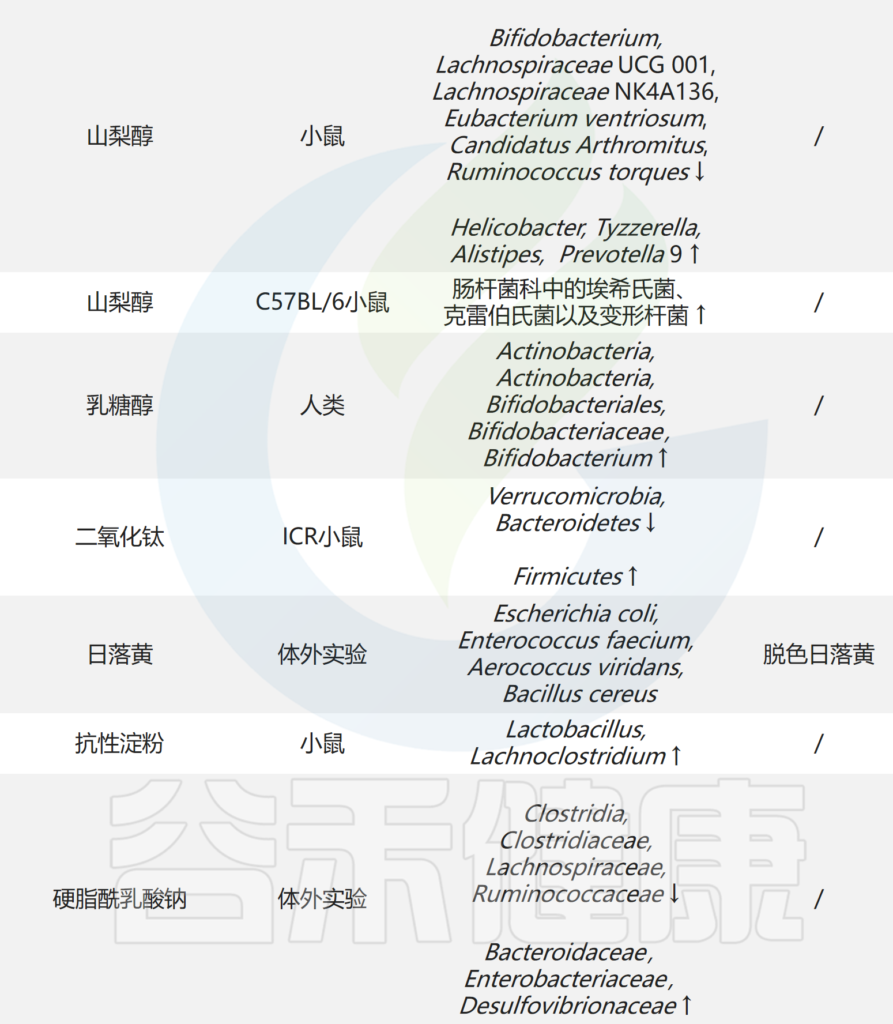
为了方便大家观看,谷禾将一些食品添加剂与肠道微生物群之间的相互作用整理在了下表:




Liu C,et al.Nutrients.2022
人工甜味剂对肠道功能和代谢的影响
多项研究探讨了人工甜味剂对肠道微生物群和宿主生理功能的影响。他们证明人工甜味剂消耗与胰岛素抵抗和葡萄糖耐受不良增加之间的关联。
•富含人工甜味剂的饮食可能导致病态肥胖
研究表明,与对照小鼠相比,食用糖精的小鼠的聚糖降解显著增加。鉴于肠道细菌将聚糖发酵成短链脂肪酸,接触糖精可能会减少短链脂肪酸的产生。
丁酸盐通过肠-脑神经回路降低食欲和激活棕色脂肪组织而具有关键的抗肥胖作用。因此富含人工甜味剂的饮食可能与成年人的病态肥胖有关。
这些结果强调了一些人工甜味剂对聚糖发酵和短链脂肪酸产生的潜在不利影响,从而导致代谢紊乱。
•长期食用人工甜味剂会诱导炎症反应
此外,分析了给予糖精6个月后的小鼠肝脏,报告显示,与对照组相比,糖精处理的小鼠肝脏出现明显的肝脏炎症,且TNF-α基因表达升高。
注:TNF-α是炎症中的关键细胞因子,TNF-α的表达可以激活NFκB通路并诱导细胞损伤和炎症反应。
如前所述,在动物模型中,人工甜味剂的摄入可能会增加拟杆菌和肠杆菌科。肠杆菌科,如大肠杆菌、克雷伯菌属和变形杆菌属,位于粘膜上皮附近。
病原体感染、化学诱导的结肠炎或宿主免疫力不足可能导致肠道炎症,并刺激肠杆菌科的生长。因此,人工甜味剂似乎与肠道微生态失调、肠道炎症以及肠易激综合征相关的症状有关。
谷禾在下图中汇总了各种食品添加剂对肠道代谢产物的影响:



Liu C,et al.Nutrients.2022
多元醇,也叫糖醇,是一种有机物。主要种类有赤藓糖醇、异麦芽酮糖醇、山梨糖醇和木糖醇。它们天然存在于一些水果、蔬菜和蘑菇中。
其热量约为白糖的一半,并且只会导致血糖轻微变化。它们中的大多数在宿主中不能被很好地吸收或代谢,并且一部分会被结肠中的微生物群发酵。
糖醇对肠道微生物和代谢物的影响
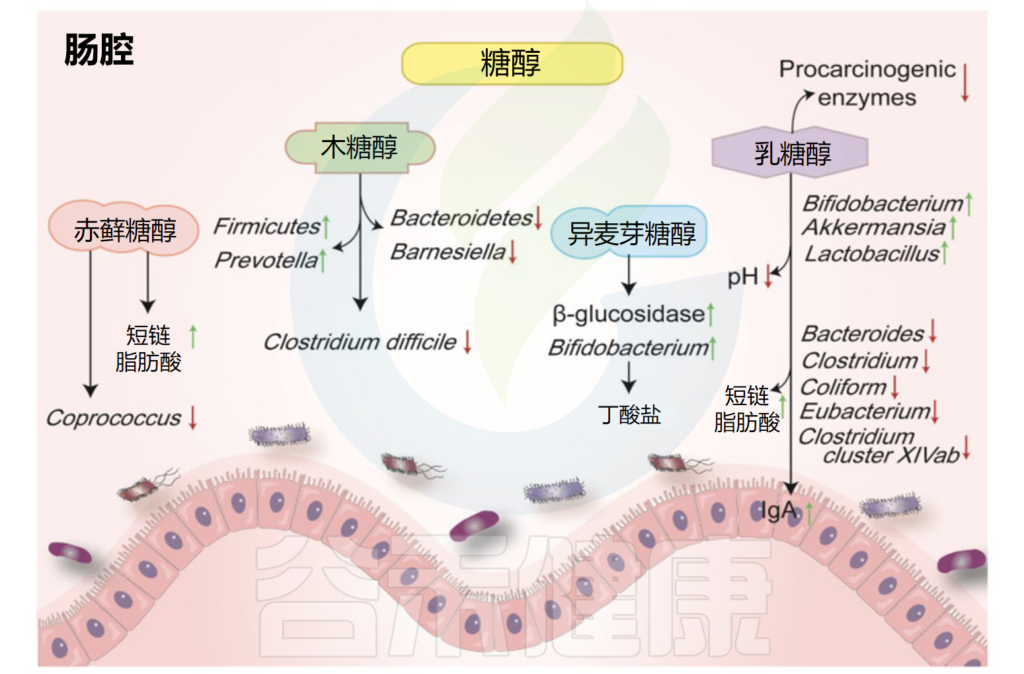
Liu C,et al.Nutrients.2022
赤藓糖醇在自然界中广泛存在,葡萄、梨、蘑菇、地衣中都有赤藓糖醇。摄入赤藓糖醇后,约90%可被小肠吸收,但代谢率很低,并主要以原形通过尿液排出体外。
•摄入赤藓糖醇增加了体内短链脂肪酸含量
在结肠中,肠道菌群可以代谢未吸收的部分。研究证明,摄入赤藓糖醇会导致丁酸和戊酸增加。考虑到到达大肠的赤藓糖醇数量有限,该化合物仅对肠道微生物群的组成产生轻微影响。
然而,赤藓糖醇会增强肠道微生物群以产生短链脂肪酸,从而减轻肠道炎症。赤藓糖醇被发现可以改善高脂肪饮食中的小肠炎症,并诱导粪球菌属丰度降低。
注:研究发现摄入赤藓糖醇后血清、粪便和白色脂肪组织中短链脂肪酸的浓度明显升高。
▷目前认为赤藓糖醇是一种对肠道稳定有利的物质
尽管缺乏赤藓糖醇对炎症性肠病的直接证据,但它被认为是一种对细菌友好的多元醇,可以稳定肠道微环境,并且可以降解为对炎症性肠病友好的代谢物。
异麦芽酮糖醇长期以来一直在食品和制药工业中用作甜味剂。微生物可以很容易地降解结肠中未吸收的异麦芽酮糖醇。
•异麦芽酮糖醇提高双歧杆菌的丰度
最近的研究认为它是一种益生元。在人类肠道中发酵的异麦芽酮糖醇可提高双歧杆菌的丰度并抑制致病菌,此外还降低了细菌β-葡萄糖苷酶的活性。
粪便中的短链脂肪酸、乳酸、胆汁酸、中性甾醇、苯酚和对甲酚也发生了变化。一些双歧杆菌菌株可以在体外发酵异麦芽,产生更高含量的丁酸盐。然而,暴露于异麦芽后没有发现不同的基因表达。
尽管很少有临床试验探讨异麦芽酮糖醇对肠道炎症的影响,但异麦芽酮糖醇可能被认为是一种双歧多元醇,是肠道稳态和微环境的“亲密朋友”。
木糖醇是是从白桦树、橡树、玉米芯、甘蔗渣等植物原料中提取出来的一种天然甜味剂。木糖醇被认为是一种非致龋性甜味剂,常被应用于口香糖中。
•木糖醇有一定的抗炎作用并能抑制变型链球菌
据报道,木糖醇会影响肠道菌群,并对脂多糖诱导的炎症细胞因子表达具有抑制作用。在一项人体研究中,摄入包括木糖醇在内的低消化性碳水化合物会导致Anaerostipes spp和粪便中的丁酸盐显著升高。
木糖醇降低了粪便拟杆菌(Bacteroidetes)和Barnesiella属的水平,而厚壁菌门和普雷沃氏菌(Prevotella)的丰度增加。较低的木糖醇浓度还可以抑制有害的变形链球菌。
注:变型链球菌是口腔天然菌群中占比例最大的链球菌属中的一种,是龋病的主要致病菌。
因此,我们认为木糖醇可能有利于肠道菌群的生长和代谢,而不会对肠道产生低有害刺激。
其他食品添加剂对肠道菌群及其功能的影响

编辑
Zhou X,et al.Molecules.2023
多元醇引起的菌群变化对肠道健康有益
多元醇属于所谓的“FODMAP”(可发酵低聚糖、二糖和单糖以及多元醇)饮食类别。近年来,FODMAP饮食已成为肠易激综合征患者的宝贵治疗选择,对其限制将改善肠易激综合征治疗的结果。
“FODMAP”一词于2004年创建,用于定义高度可发酵的碳水化合物和多元醇。
乳化剂在日常生活中被广泛应用,因为它们能够稳定乳液并通过防止储存期间分离来延长保质期。它们还可以通过食品中的脂肪分子充当胶凝剂和表面活性剂。
常见的乳化剂包括羧甲基纤维素、聚山梨酯、卡拉胶等。它们存在于各种加工食品中,如酱汁、布丁、人造黄油和冰淇淋,在西方饮食中非常普遍。研究发现乳化剂会通过肠道微生物影响人体健康。
乳化剂通过肠道微生物诱发结肠炎的机制
编辑
Liu C,et al.Nutrients.2022
羧甲基纤维素(CMC)和聚山梨酯80(P80)常见于食用油、冰淇淋、蛋糕粉、糖霜和巧克力糖浆中。然而,接触乳化剂CMC和P80会对肠道微生物群产生负面影响。
•可能通过微生物群驱动肠道炎症
有益菌如短链脂肪酸的生产菌减少
聚山梨酯80的施用引起了与炎症性肠病类似的人类肠道微生物群的改变,导致有益的双歧杆菌属、重要的短链脂肪酸生产者如粪杆菌属和罕见小球菌属 (Subdoligranulum)以及Clostridium leptum的减少。
炎症性肠病相关病原菌增长显著
在小鼠中,摄入P80会加剧吲哚美辛诱发的回肠炎,从而降低肠道微生物群的α多样性。包括肠杆菌科在内的硫化物生产者的生长和炎症性肠病相关物种奇异变形杆菌的群集行为得到显著促进。
群集是一种鞭毛介导的运动,需要营养细胞分化成一种称为群集细胞的特殊细胞类型。奇异变形杆菌的群集能力与其在炎症性肠病中的发病机制高度相关。
增加病原菌的入侵
研究发现长期摄入羧甲基纤维素或聚山梨酯80会诱发低度肠道炎症,并促进易患这种疾病的小鼠出现严重结肠炎,最终导致细菌入侵增加。
卡拉胶,又名角叉菜胶,是从麒麟菜、石花菜、鹿角菜等红藻类海草中提炼出来的亲水性胶体。它们常见于调味牛奶、冰咖啡、乳制品冰淇淋和冷冻甜点中。
卡拉胶的代谢主要由宿主肠道微生物群进行。因此,肠道微生物直接与卡拉胶相互作用,影响肠道稳态。有趣的是,不同种类和分子量的卡拉胶对宿主有不同的影响。
卡拉胶可分为低分子量或高分子量、降解或未降解卡拉胶。
•低分子量的卡拉胶会增加肠道通透性并与结肠炎相关
低分子量卡拉胶已被证明可以增加肠道通透性并与结肠炎的发生有关。据报道,角叉菜胶会诱发和加重肠道炎症,改变肠道微生物群组成。
卡拉胶的摄入导致变形菌门和脱铁杆菌门(Deferribacteres)的增加,以及厚壁菌门、放线菌门和拟杆菌门的减少。
卡拉胶的不同异构体均被认为会对肠道生态产生有害影响。对于人类肠道微生物群,每种异构体都会诱导α-多样性的变化并增加微生物群的促炎潜力。
κ-卡拉胶和λ-卡拉胶显著富集了拟杆菌,而ι-卡拉胶减少了Faecaliberium,处理后鞭毛蛋白含量更高。κ-卡拉胶在高脂饮食模型中诱导了结肠炎,显著增加了志贺菌并减少了双歧杆菌。两种炎症相关细菌Alistipes finegoldii和Bacteroides acidifaciens的丰度也显著增加。
然而,高分子量卡拉胶可能具有良好的抗肿瘤和抗氧化活性。此外,之前的研究认为,肠道微生物组的改变仅在饮用水中添加卡拉胶时观察到,而在补充卡拉胶的饮食中则未观察到,这表明与蛋白质等其他食物成分的结合可能改变其构象并消除其对某些细菌的生物利用度。
▷推测:食用卡拉胶不利于肠道炎症患者恢复
在一项研究中,两种协同菌株:Bacteroides xylanisolvens 38F6A4和E. coli 38F6C1是从健康人的粪便中获得的,并给予无菌小鼠,与卡拉胶一起食用时会加剧肠道炎症。
对于缓解期的溃疡性结肠炎患者,在含卡拉胶的饮食治疗后复发率较高。鉴于卡拉胶对炎症性肠病患者和肠道菌群的直接有害作用,我们推测卡拉胶可能由于肠道菌群和肠道稳态紊乱而对炎症性肠病患者产生有害影响。
!
乳化剂可能通过肠道微生物影响宿主心理
研究结果表明,膳食乳化剂也可能对肠脑轴产生影响,并通过微生物群依赖机制诱导暴露者的心理/行为障碍。
肠道微生物群中聚山梨酯80和羧甲基纤维素依赖性的变化也是小鼠性别特异性行为和神经改变的原因。特别是,雌性获得了反社会行为,而雄性表现出更高的焦虑水平。
这两种变化都与微生物群特征和α-黑素细胞刺激素水平的明显变化相关,这两个神经肽参与调节焦虑相关行为、食欲和能量。
小结
乳化剂中羧甲基纤维素和聚山梨酯80过量食用会导致生态失调,粘液降解细菌过度生长,以及白细胞介素10或Toll样受体5进一步缺乏。
乳化剂可能还会增加肠上皮屏障中病原微生物的易位,引起肠道炎症,从而导致炎症性肠病发病率增加。
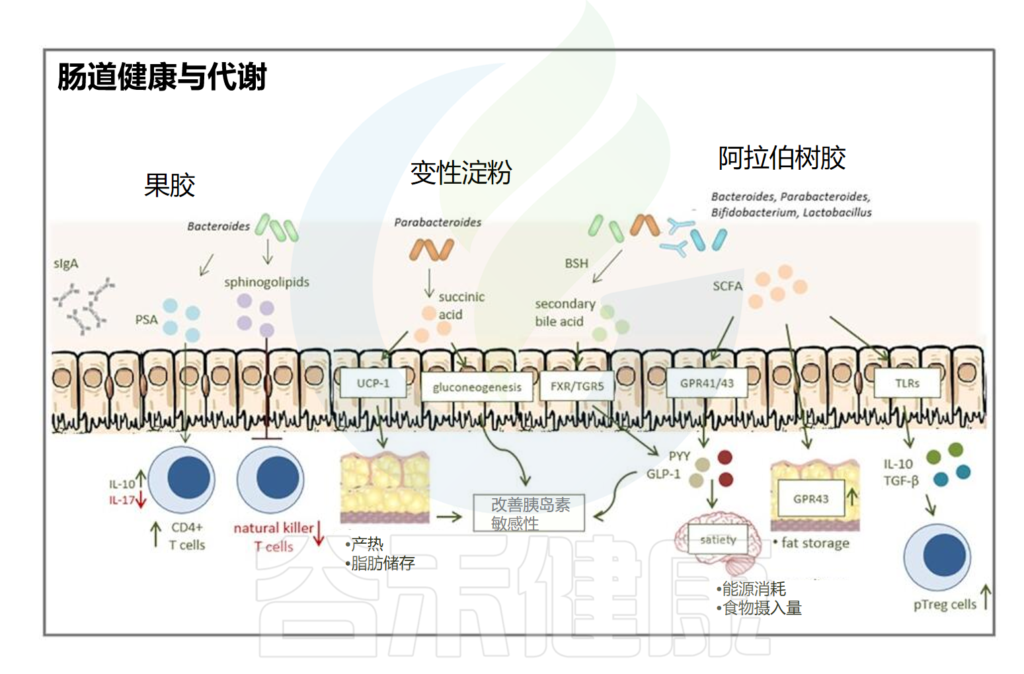
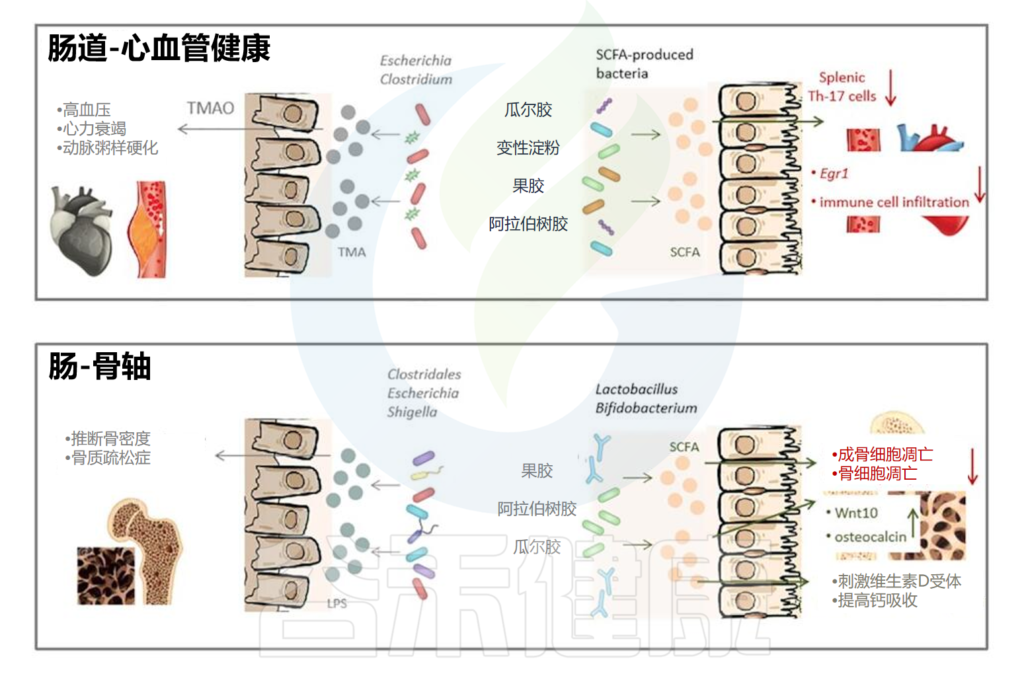
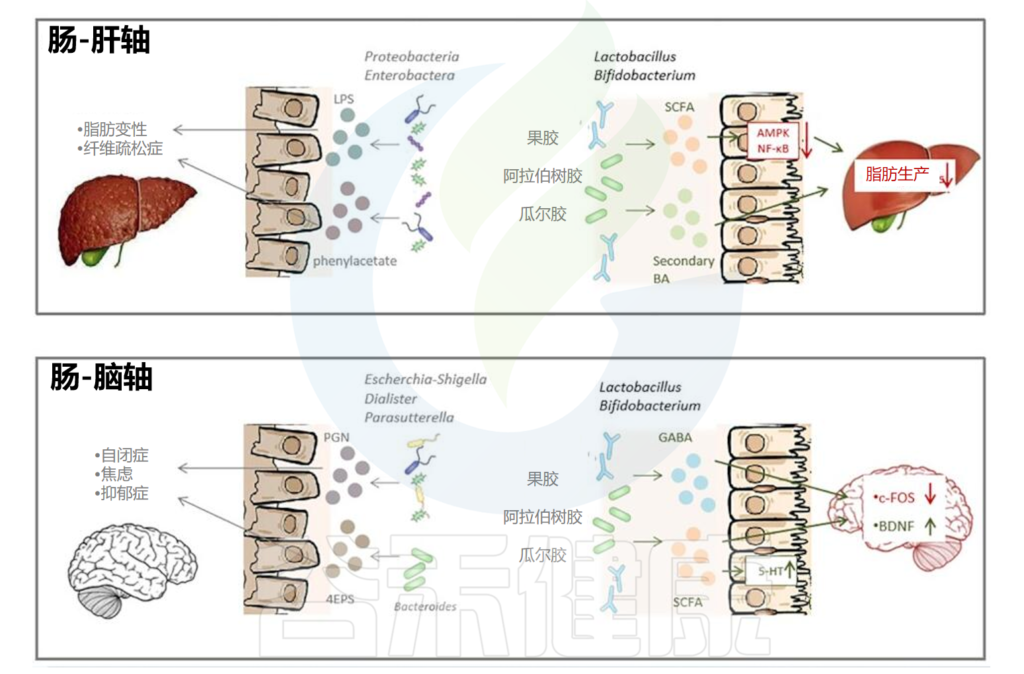
除此之外,乳化剂等胶体还会通过肠脑轴、肠肝轴、肠道与骨骼、心血管之间的联系进一步影响人体代谢和健康。
其他乳化剂在体内的生理影响



Tan H,Nie S.FEMS Microbiol Rev.2021
乳化剂和相关微生物代谢对人体的影响
编辑
Tan H,Nie S.FEMS Microbiol Rev.2021
食品着色剂又称食品色素,是以食品着色为主要目的,赋予食品色泽和改善食品色泽的物质。
食品着色剂主要添加到奶酪、酱汁、冰淇淋、糕点、糖果、巧克力和口香糖中。
二氧化钛(TiO2)是我国常用的食品着色剂,通常用作食品中的增白剂或增亮剂。
•二氧化钛影响肠道保护细菌的丰度
近年来,各种研究试图确定口服二氧化钛对小鼠和人类肠道微生物群组成的影响。在用二氧化钛处理的小鼠中,与对照组相比,观察到厚壁菌门显著增加,拟杆菌门减少。特别是,巴恩斯氏菌(Barnesiella),一种关键的保护性肠道细菌,其丰度受到二氧化钛暴露(160mg/kg/天,持续28天)的显著影响。
巴恩斯氏菌(Barnesiella)可以清除肠道中的有害细菌。消除对万古霉素耐药的肠球菌的定植,并抑制抗生素耐药细菌的传播。它还可以改善环磷酰胺等抗癌化合物的性能。
巴恩斯氏菌(Barnesiella)的减少可能与炎症性肠病的发病机制有关。此外,它们导致结肠中的炎症浸润和线粒体异常,粪便中Turicibacter属和格氏乳杆菌(Lactobacillus gasseri)和Lactobacillus NK4A136_group的增加。
•高剂量的二氧化钛会诱导肠道炎症加剧
在人类中,添加二氧化钛会导致肠道微生物群多样性适度下降,并导致卵形拟杆菌(Bacteroides ovatus)和Clostridium cocleatum减少。
卵形拟杆菌(Bacteroides ovatus)被誉为新一代益生菌,在肠道免疫、肿瘤治疗、膳食纤维代谢方面发挥重要作用。
剂量反应实验表明,单独使用微量二氧化钛对两组巨噬细胞的吞噬作用没有影响。然而,高剂量的二氧化钛与细菌抗原协同作用,可促进巨噬细胞产生 IL-8、肿瘤坏死因子-α和IL-10,并损害其转化生长因子-β分泌/吞噬细胞活性。
据报道,喂食富含二氧化钛饮食的小鼠肠道炎症加剧。特别是,微生物群组成发生了显著变化,活性氧释放增强,NLRP3炎症小体激活。
!
食品着色剂会影响肠道稳态
二氧化钛等食品着色剂可能会影响肠道稳态。事实上,各种研究已经证明了二氧化钛暴露与对肠道微生物群功能性不利影响之间的潜在关联。
炎症反应加剧
在口服二氧化钛一周(10mg/kg体重/天)的大鼠中,在派尔贴片的免疫细胞和参与炎症反应的调节性T细胞中检测到二氧化钛。具体而言,在二氧化钛暴露后,从Peyer贴片中分离的免疫细胞的刺激显示辅助性T细胞减少,IFN-γ分泌增加,Th1/Th17炎症反应增加。
注:更进一步研究表明二氧化钛暴露与啮齿动物肠道疾病和结直肠癌的发展之间可能存在关联。
短链脂肪酸水平降低
研究了小鼠体内不同剂量的二氧化钛(2、10、50 mg/kg体重/天),并报告了高剂量暴露后短链脂肪酸水平的降低、粘液相关基因表达的降低、炎症反应的增加和结肠隐窝长度的改变。
不同食品着色剂对粘膜屏障和肠道微生态的影响
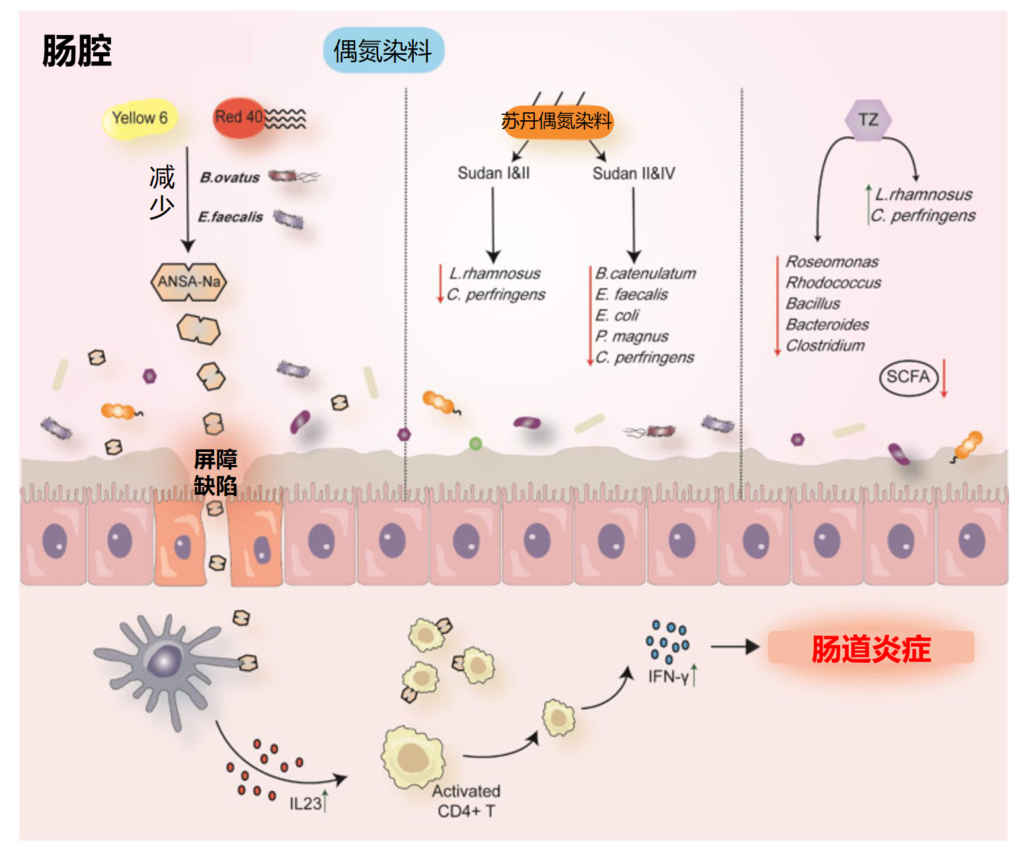
Liu C,et al.Nutrients.2022
所有这些发现表明,由于暴露于二氧化钛等食品着色剂而导致的菌群失调可能导致微生物群失调,其中特定科和属细菌的变异可能参与炎症性肠病的发病机制。
食品防腐剂可以延缓食品的降解,延长食品的保质期,限制微生物的生长,抑制食品的氧化。
防腐剂的益处和安全性存在争议,许多常见的防腐剂,如苯甲酸、山梨酸钾、亚硝酸钠和亚硫酸钠以及银纳米颗粒被报道可以诱导肠道微生物群的改变。
美国儿科学会警告说,防腐剂可能与恶化的多动行为或致癌风险有关。
苯甲酸和苯甲酸钠均可作为食品防腐剂,因为它们能够限制病原微生物的生长。所有吸收的苯甲酸均可完全降解为马尿酸。
•适量的苯甲酸会提高有益微生物的水平
最近的研究发现苯甲酸和苯甲酸钠通过调节氧化状态和免疫状态对肠道屏障功能和肠道微生物群的有益影响。
苯甲酸处理增强了回肠微生物群的生物多样性,以剂量依赖性方式降低了总需氧细菌的丰度。它还会减少十二指肠中革兰氏阴性菌的丰富度。在小猪中,苯甲酸处理增加了肠绒毛的高度,提高了有益微生物(例如双歧杆菌和乳杆菌)的水平,并减少了有害微生物的数量。
•过量摄入可能会破坏肠道屏障
然而,过量摄入苯甲酸可能会通过氧化还原状态破坏肠道屏障。
最近的研究报告称,苯甲酸增加了小鼠中诱导变形菌失调的易感性。值得注意的是,变形菌的增殖被认为是生态失调的潜在诊断标志物,并且与炎症性肠病等疾病的风险相关。
虽然现有的研究对苯甲酸表现出相互矛盾的观点,仍需要更多的研究来阐明其对肠道菌群和肠道炎症的影响。
山梨酸钾是一种低毒防腐剂,能强烈抑制腐败细菌和霉菌,其对感官特性影响轻微。
•山梨酸钾会降低肠道微生物多样性
先前的研究报道,山梨酸钾通过改变宿主免疫来抑制肠道微生物群的生存能力。暴露于山梨酸钾显著降低了斑马鱼肠道中IgG、IL-1β和TNF-α的含量,并激活了免疫系统。
在属水平上,有益菌粪杆菌(Faecalibacterium)以及病原菌气单胞菌(Aeromonas)和甲基杆菌(Methylobacterium)的含量呈现显著下降趋势。在体外,施用山梨酸钾后,普氏粪杆菌的生长也显著下降。
•革兰氏阳性菌可能阻碍山梨酸钾的传递
值得注意的是,山梨酸钾的亲脂性在调节不同类型的肠道微生物群中发挥着重要作用。革兰氏阴性细菌细胞壁中含有大量脂质,从而抑制转录和碳水化合物代谢途径。然而,革兰氏阳性菌含有较高的肽聚糖含量,可能会阻碍山梨酸钾的传递。大肠杆菌已被证明通过其外排泵机制对山梨酸钾具有抗性。
亚硫酸钠是常见的食品防腐剂之一。
•亚硫酸钠对人体有一定的危害
它强烈抑制普拉梭菌(Faecalibacterium prausnitzii)的生长。干酪乳杆菌、鼠李糖乳杆菌和植物乳杆菌因具有产生乳酸的能力而被认为是有益的肠道细菌,但它们也减少了。
在另一项研究中,亚硫酸钠持续降低奇异变形杆菌、Escherichia fergusonii、摩氏摩根菌(Morganellamorganii)的活力。亚硫酸钠对肠道有益菌较强的抗菌能力,可能诱发肠道疾病。
•具有抗炎特性的细菌可能对防腐剂更敏感
在一项体外研究中,发现人类肠道微生物对亚硝酸钠、苯甲酸钠和山梨酸钾高度敏感,尤其是酪丁酸梭菌(Clostridium tyrobutyricum)或副干酪乳杆菌(Lactobacillus paracasei),具有已知的抗炎特性,与具有促炎或致大肠杆菌特性的粪肠球菌或多形拟杆菌相比,对这三种防腐剂更敏感。
减轻食品添加剂对身体损害的一些建议
•选择天然食物:尽量选择天然食物,例如新鲜水果、蔬菜、全谷物和未经加工的肉类。这些食物通常不含添加剂。
•阅读食品标签:在购买加工食品时,仔细阅读食品标签。避免购买添加剂含量较高的食品,特别是那些含有大量人工色素和防腐剂的食品。
•自制食物:尽量选择自制食物,这样可以控制所使用的成分和添加剂的量。自制食物可以使用新鲜的食材,并尝试使用天然的调味料来增添风味。
•限制加工食品摄入量:减少加工食品的摄入量,特别是那些高度加工和包装的食品。这些食品通常含有更多的添加剂。
•多样化饮食:保持饮食的多样性,摄入各种不同类型的食物。这样可以减少对某一种食品及其潜在添加剂的过度依赖。
需要注意的是,并非所有的食品添加剂都对每个人都会产生负面影响。食品添加剂经过严格的监管和安全评估,以确保在合理摄入量下的安全性。
然而,对于敏感人群来说,或在过量摄入的情况下,某些食品添加剂可能会引起问题。因此,适度和平衡地摄入食品添加剂是很重要的。
越来越多的研究调查肠道微生物群与食品添加剂之间的相互作用,在总结当前研究中收集的信息后,我们得出结论:食品添加剂对肠道微生物群和肠道稳态产生多种影响,这可能与肠道炎症的发病和进展有关。
食品添加剂显著介导细菌功能的改变。总而言之,安赛蜜、三氯蔗糖和糖精等甜味剂可能通过提高细菌炎症潜力而诱发或加剧结肠炎。
羧甲基纤维素和聚山梨酯80等乳化剂被认为会改变肠道微生物群的多样性并增加细菌的侵入,从而对肠道健康有害。
食品着色剂的安全性应重新评估,因为其会引发肠道紊乱和菌群失调;然而,多元醇似乎通过改善肠道微生物的结构和功能而对肠道微生物群有益。
根据目前的证据和法规,必须谨慎考虑对炎症性肠病患者不利的食品添加剂,例如食品着色剂和乳化剂,包括羧甲基纤维素和聚山梨酯80。
尽管研究显示食品添加剂对肠道微生物组和肠道炎症有不同的影响,但将体外或动物模型中获得的相同结果归因于人类是不可行的。因此,未来的研究应该基于生物相关模型来复制人类的生理条件。
总之,需要更多的研究来阐明食品添加剂、肠道微生物群和人体健康之间的关系,并了解后代由于当代人的消费习惯而可能面临的炎症性肠病风险。
相关阅读:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
肠道微生物群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
主要参考文献
Zhou X, Qiao K, Wu H, Zhang Y. The Impact of Food Additives on the Abundance and Composition of Gut Microbiota. Molecules. 2023 Jan 7;28(2):631.
Rinninella E, Cintoni M, Raoul P, Gasbarrini A, Mele MC. Food Additives, Gut Microbiota, and Irritable Bowel Syndrome: A Hidden Track. Int J Environ Res Public Health. 2020 Nov 27;17(23):8816.
Tan H, Nie S. Functional hydrocolloids, gut microbiota and health: picking food additives for personalized nutrition. FEMS Microbiol Rev. 2021 Aug 17;45(4):fuaa065.
Liu C, Zhan S, Tian Z, Li N, Li T, Wu D, Zeng Z, Zhuang X. Food Additives Associated with Gut Microbiota Alterations in Inflammatory Bowel Disease: Friends or Enemies? Nutrients. 2022 Jul 25;14(15):3049.
Del Pozo S, Gómez-Martínez S, Díaz LE, Nova E, Urrialde R, Marcos A. Potential Effects of Sucralose and Saccharin on Gut Microbiota: A Review. Nutrients. 2022 Apr 18;14(8):1682.
Ravash N, Peighambardoust SH, Soltanzadeh M, Pateiro M, Lorenzo JM. Impact of high-pressure treatment on casein micelles, whey proteins, fat globules and enzymes activity in dairy products: a review. Crit Rev Food Sci Nutr. 2022;62(11):2888-2908.
Laudisi F, Stolfi C, Monteleone G. Impact of Food Additives on Gut Homeostasis. Nutrients. 2019 Oct 1;11(10):2334.
Abiega-Franyutti P, Freyre-Fonseca V. Chronic consumption of food-additives lead to changes via microbiota gut-brain axis. Toxicology. 2021 Dec;464:153001.

谷禾健康

有没有发现我们吃的食品正在变得越来越鲜艳,让人有食欲,“低脂”、“无糖”等字眼出现的频率越来越高,然而这其中必然会用到各类食品添加剂,如防腐剂,甜味剂,乳化剂,着色剂,香料等等。
可以看到孩子们喝的牛奶都是纯白无瑕的,事实上天然牛奶往往没有那么白;孩子们吃的五颜六色的糖果,糕点等也会结合一些人工色素,因此儿童比成人更容易接触到食用色素。

食品添加剂会诱发菌群失调,通过微生物群肠脑轴导致肠道疾病,代谢性疾病等各类问题的发生。这个过程是如何发生的?各类添加剂有什么不同的作用?为什么儿童学习、记忆受到影响?为什么与情绪也有关系?…
本文为大家解答相关疑惑。
首先,我们先来看看:食品添加剂都有哪些种类,它们起到什么样的作用,以及如何查看食品中是否存在添加剂。
工业界使用合成色素使其产品更有吸引力,使用防腐剂有助于保持其功能,适当pH值等特性,因此在大多数情况下,食品添加剂是不可或缺的存在。常见的食品添加剂及其功能用途见下表。


IFIC & FDA