-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
从吃什么到谁在消化
我们常常纠结于吃什么,食物的卡路里、蛋白质或脂肪含量,却可能忽略了一个关键问题:这些食物进入我们体内后,到底发生了什么?
我们吃下的每一口饭,其实都不是我们一个人在享用,在我们肠道里,还住着数万亿的成员——肠道菌群。我们吃进去的营养,需要先经过它们的“再加工”和“巧分配”,才能真正为我们所用。
我们很多人其实已经了解肠道菌群这个系统至关重要,但其内部精密的运作逻辑,对我们而言就像一个黑箱。
关于这些问题,我们用两篇研究来解析这一微观世界的运作机制。
发表在《The ISME Journal》的研究深入微观,揭示了菌群的“社会规则” 。肠道中大部分细菌都存在“氨基酸合成缺陷”,也就是说它们无法独立制造所有生存必需的氨基酸。这种缺陷却不一定是坏事,某种程度上反而驱动微生物群落多样性、稳定性,促成了它们之间广泛的“交叉喂养”(cross-feeding),形成了一个高度依赖、紧密协作的社会网络。
另一篇发表在《Cell》的研究,则是聚焦宏观,首次量化了菌群的“经济贡献” ,也就是说肠道微生物群每天向人体“输送”多少能量以及这一过程受饮食影响的规律。
通过构建一个精密的系统通量模型,该研究精确计算出,肠道微生物群的发酵产物(乙酸、丙酸、丁酸等)可为人体提供每日2%~10%的能量。这个比例受饮食结构(尤其是纤维摄入量)的显著影响,明确了微生物对宿主能量平衡的具体贡献值。
如果说前一篇回答了菌群之间如何协作,那么后一篇是让我们了解了菌群的协作对我们有什么用。这两篇一起能够让我们更系统、更完整地理解肠道菌群不仅是一个随机的微生物集合,而是一个遵循着内部协作规则、并能对外部宿主产生巨大影响的、有组织的生态系统。
本文将立足于这一整体视角,整合两大前沿发现,深入剖析菌群内部的互补协作逻辑与对宿主的代谢贡献,进而揭示“营养-微生物-宿主健康”核心轴线中的多层级调控规律。
氨基酸合成能力缺陷在肠道细菌中非常普遍
人类肠道内有些细菌,自己造不出某些生存必需的营养物质。比如氨基酸或维生素,它们必须依靠外部环境或其他细菌提供这些物质才能活下去,这种情况就叫“营养缺陷型”。这种“专性营养需求”会对单个细菌和整个菌群系统都产生很大影响。
发表在《The ISME Journal》这篇文章,通过对一个包含5414株肠道细菌的基因组目录进行分析后,选取了其中3687个高质量的基因组进行深入研究发现:
氨基酸合成能力缺陷在肠道细菌中非常普遍。例如,近64%的菌株缺乏合成色氨酸的能力。被“丢失”最多的氨基酸(如色氨酸、亮氨酸、异亮氨酸、缬氨酸等),恰好也是人类自身的必需氨基酸。
预测的氨基酸缺陷被分为人类必需和非必需氨基酸
doi.org/10.1038/s41396-023-01537-3
然而,这种看似的缺陷并非生存劣势,而是一种高效的进化策略与生态分工。
更有趣的是,研究还揭示了这种营养缺陷与特定发酵产物生成之间的深刻关联。例如:
这表明,当合成氨基酸的代谢路径被关闭时,其前体物质会被重新导向其他途径,生成对群落乃至宿主健康至关重要的发酵产物。
doi.org/10.1038/s41396-023-01537-3
总而言之,肠道菌群中的营养缺陷并非弱点,而是驱动群落形成社会性分工的关键。
有的细菌不会做饭,只能吃别人做的饭,但因为社区里有人乐意做、多余的饭还能分享,因此大家都能活得更好,整个微生物群落变得更有分工、更稳定。
通过这种交叉喂养,菌群不仅实现了整体的稳定与繁荣,更获得了强大的稳态韧性,使其在面对饮食波动或药物干扰等外界压力时,能更好地维持其核心功能,也增强了微生物与宿主之间的代谢联系。
“营养缺陷型”细菌越多,肠道菌群多样性越高
研究人员发现了一个有意思的现象:肠道菌群中“营养缺陷型”细菌的丰度,与菌群的多样性和长期稳定性呈显著正相关。也就是说,一个人肠道里营养缺陷型细菌越多,他的肠道菌群种类越丰富,也越稳定。
这其实验证了一个早期来自理论生态学的假说,即“代谢交叉喂养能创造新的生态位”。当细菌通过互相提供必需营养物来弥补彼此的合成缺陷时,它们便构筑了共存的基础,避免了直接的生存竞争。
为了验证该假说,研究团队分析了两个独立队列、跨度长达3~4年的纵向人体数据,结果高度一致:
这意味着,一个高度依赖内部“互助网络”的菌群,其整体结构更加稳固,对饮食波动、药物使用等外界干扰具有更强的抵抗力。
研究者引用的另一项关于B族维生素的研究也佐证了此观点:在小鼠模型中,即使科学家改变小鼠饮食中B族维生素的含量,小鼠肠道菌群的组成几乎没变化;B族维生素“缺乏型”的菌群比例也没明显改变。这说明这些菌并不是靠饮食提供的维生素生存,而是靠菌群内部那些“会合成维生素”的菌种提供营养。
因此,这又进一步印证了他们的观点:
肠道中的营养缺陷并非个体的弱点,反而是驱动群落走向更高层次合作与韧性的关键机制。营养缺陷型菌群的越多,越是促进了普遍的交叉喂养,由此形成的复杂互助网络,是维持整个生态系统平衡、健康和具备自我修复能力的核心。
超越肠道:菌群产物的全身性健康效应
研究人员发现肠道里“营养缺陷型”细菌,不仅仅影响菌群结构,也和宿主的代谢状态、体重以及血液代谢物水平之间存在联系。
研究团队注意到以前人们关注焦点是,“肠道菌群的代谢怎么影响人体健康”,但从来没有人专门去了解“这些营养缺陷型细菌的数量会不会和人体健康参数有关”。于是他们第一次统计分析了氨基酸营养缺陷型菌的比例与受试者健康指标的关系。
结果他们发现几个有意思的点:
①
营养缺陷型菌越多,BMI指数越低
他们发现某些氨基酸营养缺陷型菌的总数量跟人体的 BMI 呈负相关,也就是说,一个人的肠道里这些“营养依赖型”细菌比例越高,他的体重(或体脂)往往越低。
虽然不能说明因果,但这暗示了这些细菌群可能和更健康或更瘦的代谢状态有关。
同时,他们没发现这些细菌的丰度和血细胞计数(也就是血象指标)之间有明显关系,所以这种关联主要是代谢方面的,而不是炎症或免疫系统方面。
②
与血液中某些代谢物水平有关
色氨酸营养缺陷型细菌的比例跟血液中 3-吲哚乙酸(3-IAA)和 3-吲哚丙酸(3-IPA)含量呈正相关。
这两种物质都是由色氨酸经过微生物代谢产生的“吲哚类代谢物”,它们已知具有抗氧化、抗炎、神经保护作用,还能调节肠道屏障和免疫系统。
换句话说:这种缺色氨酸合成能力的细菌越多,人体血液里好的代谢产物越多。这说明这些缺陷菌可能刺激或依赖周围菌群代谢色氨酸,从而促进这些有益代谢物的产生。
不止色氨酸,其他几种氨基酸营养缺陷型(比如谷氨酸、天冬氨酸缺陷等)也和这些吲哚类代谢物呈现正相关。这种一致的趋势表明,肠道中代谢互助可能会提高吲哚相关代谢流通量。
③
与其他代谢物也存在相关性(尤其是胆汁酸和含氮代谢物)
他们发现特定氨基酸营养缺陷型细菌的总比例和对甲酚硫酸酯呈正相关。
这种物质是由肠道菌群将酪氨酸分解后经肝脏代谢转化的产物,通常被认为与肠道代谢活性有关。尽管高水平时可能与肾功能或炎症风险相关,但它也代表了一种活跃的芳香族氨基酸代谢通量。
这些胆汁酸变化说明,肠道代谢生态(由菌群活动决定)确实能影响宿主的脂肪吸收、胆盐循环与炎症信号。换句话说,这种“谁缺什么营养、谁提供什么”的群落特征不光影响菌和菌之间的平衡,也会通过代谢物反馈到宿主的肝脏和消化系统。
血清代谢物水平与肠道微生物组中营养缺陷型细菌频率之间的部分斯皮尔曼相关性
④
没有发现明显的氨基酸水平变化
意思是,虽然菌群结构(营养缺陷型比例)跟体重、代谢物水平有关系,但血液中的游离氨基酸浓度本身并没有明显改变。
这意味着这些影响不是因为“血液里多了或少了某种氨基酸”,而是因为菌群间代谢互动带来的代谢网络变化。
这为氨基酸交叉喂养提供了功能性证据:它不仅是“微生物之间共享营养”的现象,更是宿主健康稳态的化学纽带。
以上这些发现为“交叉喂养”提供了强有力的功能性证据。它不仅是微生物之间维持生存的生态策略,更是一条连接菌群内部互作与宿主全身健康稳态的关键化学纽带。
肠道菌群对宿主能量的直接贡献
肠道微生物群与人体的相互作用,主要通过一系列被称为发酵产物的小分子(以乙酸、丙酸和丁酸为主)来介导。
这些分子由大肠中厌氧微生物产生,这些微生物主要以植物性食物中的复合碳水化合物为食,如膳食纤维和抗性淀粉,以及通过小肠和粘蛋白的膳食蛋白质。
产生后,绝大部分发酵产物会被结肠上皮细胞吸收,并整合到宿主的代谢网络中,发挥多重生理效应:
► ▷
我们要讲的这篇发表在《Cell》的研究,其核心突破在于建立了一个“系统级通量模型”。
它是一个强大的计算框架,能够定量分析在真实生活状态下,人体肠道每天究竟产生了多少发酵产物,以及这些产物的代谢去向。
利用这个框架,研究者发现:
超过90%的可被微生物利用的碳水化合物最后会被转化为发酵产物,而这些发酵产物的大部分都被人体吸收。
这意味着发酵产物是肠道微生物与宿主之间最重要的代谢交换物质,对宿主的信号传导、行为和能量平衡都有显著影响。
微生物对能源供应的贡献
在缺氧的大肠中,微生物利用复合碳水化合物(膳食纤维、抗性淀粉)产生短链脂肪酸(乙酸、丙酸、丁酸)。
这些能量丰富的分子随即被结肠上皮细胞高效吸收,直接汇入人体的能量代谢系统。这一过程对宿主总能量的贡献不容小觑,其具体程度与饮食结构紧密相关:
换算成绝对通量,这意味着人体每天从肠道吸收的发酵产物总量约为 450–1500 mmol。这种“微生物供能”机制,因其难以直接测量,在传统营养学评估中常被忽视。而这项研究的定量模型则明确指出,它是一股对人体能量平衡有显著影响的“代谢暗流”。
DOI: 10.1016/j.cell.2025.07.005
饮食与菌群的明确分工:
饮食决定“量”,菌群决定“质”
研究的核心在于厘清了饮食与菌群在肠道发酵过程中的不同角色。结论非常明确:
饮食结构(尤其是微生物可利用碳水化合物 MACs 含量)是决定发酵产物通量的主因。
相比之下,菌群组成的变化对总产量的影响较小(约±10%),但它显著影响发酵产物的具体构成(如丁酸和乳酸的相对比例)。
研究团队首次利用宏基因组与通量模型估算了健康人肠道的发酵产能:
输入
每天约有 50–80克 的可发酵碳水化合物(MACs)进入结肠。
转化
微生物将其高效转化为 450–1500 mmol 的短链脂肪酸。
输出
这为宿主提供了 2%–10% 的总能量需求,具体比例因饮食模式而异。
这些SCFAs并非均质,而是有明确的组成和分工,其中:
这一发现可以用一句话概括:
“吃什么”(饮食)决定了发酵的总能量,而“谁在吃”(菌群)决定了这些能量以何种形式(哪种SCFA)被利用。
例如,高纤维饮食(>35 g/天)能显著增加短链脂肪酸总产量,促进产丁酸菌(如 Roseburia、Faecalibacterium)增殖,从而增强肠道的抗炎屏障。
相反,富集高蛋白与低碳水饮食则会使代谢转向蛋白质分解,增加氨和硫化氢等潜在有害物质的产生,使某些潜在致病菌(如 Bilophila wadsworthia)扩增。
营养-微生物共代谢模型:预测健康的新坐标
核心结论与研究启示
饮食作为核心驱动因素
研究最终明确指出,饮食是决定肠道发酵产物种类与总量的核心驱动力。它通过双重机制发挥作用:一方面,直接决定了可供发酵的底物(主要是MACs)的数量;另一方面,长期饮食模式会选择性地塑造菌群的结构。
研究者强调,理解宿主健康和微生物作用时,必须同时考虑饮食、微生物群组成与发酵产物之间的相互作用轴线。
对研究方法的反思与建议
该研究的一个重要启示是,粪便样本检测存在巨大局限性。由于高达95%的短链脂肪酸在结肠段即被宿主吸收,粪便中的残留量远不能反映肠道内真实的生产通量。因此,准确评估肠道发酵活动,必须超越简单的粪便分析,转而采用结合了饮食记录和微生物代谢通量计算的系统模型。
全球饮食模式与肠道生态的关联
将此模型应用于全球不同人群,研究揭示了饮食模式对肠道发酵功能的深刻影响。
数据显示,工业化国家(如美国的NHANES队列,平均产量286 mmol/天)的发酵产率显著低于仍保持传统高纤维饮食的人群(如哈扎狩猎采集者,产量最大可达~1000 mmol/天)。
发酵产物对宿主的能量贡献率也在 1.7% 至 12.1% 之间大幅波动。这些证据表明,现代饮食的精加工趋势可能正在系统性地削弱人类肠道微生物组的能量代谢功能。
对动物模型外推的审慎态度
研究还发现,实验常用的小鼠模型与人类在肠道发酵上存在显著的物种差异。按体重归一化后,小鼠的SCFA产率(~400 mmol/kg/天)远高于人类(~7 mmol/kg/天),其对微生物发酵的能量依赖也更高(小鼠>21% vs. 人类<12.1%)。
这一差异提醒科研人员,在涉及全身性代谢、能量平衡及行为的研究中,将小鼠数据直接外推至人类需格外谨慎。尽管如此,在局部肠道层面(比如每单位肠道表面积吸收的发酵产物量,人和鼠的数值相近),两者具有可比性,使小鼠在研究局部互作机制时仍具价值。
研究的宏观意义:迈向定量微生物生态学
总结来看,这项工作的核心贡献在于推动微生物组研究从定性的“存在性分析”迈向了定量的“通量分析”。它不再仅仅回答“微生物产生了什么分子”,而是通过整合代谢组学、宏基因组学和饮食数据,精确计算出宿主与微生物之间关键代谢物的交换速率与规模(即“通量”)。
这种对“剂量”的明确计算,为理解发酵产物如何具体影响宿主生理(即“剂量-效应关系”)提供了坚实的数据基础。
作者最后强调,这一强大的定量框架不仅适用于发酵产物,还具有广阔的应用前景,未来可扩展至氮循环、气体代谢、蛋白质降解等其他关键的宿主-微生物相互作用领域,从而开启一个系统化、定量化理解人体共生生态系统的新篇章。
精准氨基酸补充:基于菌群代谢特征
通过外源性氨基酸干预,可有选择地促进益生菌生长:
这种“氨基酸-选择性补养”策略可能成为未来益生营养的新方向。但其具体菌株配对及剂量效应仍需实验验证。
碳源结构优化:调控能量产物比例
通过调控可发酵碳水化合物的含量与结构,可以:
当菌群有充足、优质的碳源(可发酵碳水化合物)作为能量时,它们会优先利用这些碳源,从而减少对蛋白质的分解(即腐败发酵)。这会直接降低氨、硫化氢、部分吲哚和酚类等潜在有害物质的产生。
体化代谢预测:AI + 代谢组学融合
展望未来,我们可以通过整合微生物基因组尺度代谢模型、宿主代谢组学信息以及个体饮食数据,并利用机器学习算法进行深度分析,从而构建一个强大的综合预测模型。
该模型将能够精准评估个体的能量回收效率,预测其罹患肥胖、炎症性肠病(IBD)、2型糖尿病等代谢相关疾病的风险趋势,并模拟不同营养干预方案的个性化反应。这标志着我们正迈向一个能够为精准营养和预防医学提供坚实科学循证依据的新时代。
综合以上两篇《The ISME Journal》与《Cell》的标志性研究成果,一个突破性的生命科学框架逐渐清晰:肠道微生物群落本质上是一个分布式代谢系统 。其核心机制体现为“营养缺陷-代谢互补-发酵能量”的级联功能网络,三者通过动态互作构成人体代谢稳态的关键调控枢纽。
氨基酸营养缺陷型的普遍存在,说明肠道微生物早已从“个体独立的代谢单元”进化为“代谢互助的生态集合体”,代谢功能呈现出模块化和分工化趋势。
这令人联想到人类社会的分工协作:厨师专注烹饪、医生钻研医术、教师传道授业,正是通过放弃全能、追求专精,整个社会系统更能高效运转。菌群的营养缺陷何尝不是如此?
这种“丧失功能以换取依赖”的策略并非退化,而是一种进化经济学的最优解——正如团队成员通过各司其职提升整体效率,微生物通过外部化代谢与共生交换,降低了整个系统的能量成本。
群落层面的发酵产物研究进一步表明,这种微观的营养依赖会在更高层次上塑造整个碳流通量网络。
《Cell》的研究则将这一微观协作的宏观效应进行了精准量化,研究表明,正是通过交叉喂养(cross-feeding)等复杂的内部协作,菌群构建了一个强大的能量生态系统,最终能为宿主贡献每日高达2%-10%的能量。
这是从抽象概念到具体数值的飞跃,证明菌群这个微观社会,集体协作产生的巨大外部价值。这与人类社会的合作共赢理念不谋而合:供应链中上下游企业的互补、科研团队中不同领域专家的协作,都在印证同一个真理——真正的强大是群体互哺所带来的可量化的集体增益。
长期来看,这种“机制解析-模型构建-临床转化”的闭环路径,将重新定义健康管理的范式——从传统的宿主中心视角转向“菌群-宿主生态系统”的动态平衡监测。
未来,随着多组学检测成本的下降与算法迭代,这种“预测-干预-验证”的闭环管理模式有望成为常规临床实践的重要组成部分。结合AI驱动的多组学整合技术,我们有望实现从“疾病治疗”到“代谢稳态预测与维护”的跨越,为个性化营养干预与代谢疾病防治提供全新工具。
参考文献:
Starke S, Harris DMM, Zimmermann J, Schuchardt S, Oumari M, Frank D, Bang C, Rosenstiel P, Schreiber S, Frey N, Franke A, Aden K, Waschina S. Amino acid auxotrophies in human gut bacteria are linked to higher microbiome diversity and long-term stability. ISME J. 2023 Dec;17(12):2370-2380.
Arnoldini M, Sharma R, Moresi C, Chure G, Chabbey J, Slack E, Cremer J. Quantifying the varying harvest of fermentation products from the human gut microbiota. Cell. 2025 Sep 18;188(19):5332-5342.e16.

谷禾健康

编辑
双歧杆菌是人类肠道微生物组的重要成员,在整个宿主生命周期中表现出优越的定植和糖苷利用能力。
从出生开始,双歧杆菌在母乳喂养婴儿的肠道中迅速建立优势地位,并随着宿主年龄的增长和饮食结构的变化,不断调整自身的代谢策略,始终保持在肠道微生物群落中的关键地位。这种随年龄和饮食变化而演变的适应性,使双歧杆菌成为连接人类早期生命到老年期肠道微生态平衡的关键菌群。
我们在之前的文章也详细阐述过双歧杆菌的基本特性、不同种类、代谢特点、在人体各年龄段的分布变化、健康益处以及对疾病的潜在治疗作用等,点此详见:肠道核心菌属——双歧杆菌,你最好拥有它
然而,这里还有一些重要的内容需要补充,关于双歧杆菌在肠道微生态系统中的一个关键功能——”交叉喂养”机制及其在微生物网络中的特殊生态位选择策略。
今天要给大家科普的是,双歧杆菌如何通过精妙的代谢网络与其他微生物建立互惠关系,以及这种关系对肠道健康的深远影响。
什么是微生物的”交叉喂养”?
“交叉喂养”是指一种菌分解复杂糖分子后,释放中间产物到肠道环境中,而这些产物被其他无法直接分解原始糖分子的菌所利用的现象。这形成了一种资源共享的微妙生态平衡。
交叉喂养是肠道微生态系统稳定性和弹性的关键基础。通过交叉喂养,不同微生物贡献各自的酶系统,形成”流水线作业”,显著提高了整个微生物群落对复杂碳水化合物的利用效率。同时也能使微生物群落能够适应饮食变化和宿主生理状态的转变。
这种从“单一微生物”到“微生物网络”的研究视角转变,正引领我们进入微生物干预的新时代。
本文根据江南大学2024年发表在《Npj Biofilms and Microbiomes》的一篇综述性资料分享,探讨双歧杆菌的糖苷利用策略及其与其他微生物之间的交叉喂养关系,以及这些关系对宿主健康的潜在益处。
核心问题
了解双歧杆菌的糖苷利用和交叉喂养策略,不仅有助于揭示肠道微生态系统的运作机制,更为开发针对性的益生菌组合提供了科学基础,有助于改善肠道稳态和缓解相关疾病,包括由剖腹产和抗生素使用引起的菌群失调、代谢综合征和免疫缺陷等现代文明病。
通过深入理解这些微观世界的精妙协作,有望开发更精准的微生物干预措施,实现从”群落微生物学”向”分子营养学”的转型,为个性化健康管理和精准医学提供新思路。
定植早期肠道,随年龄增长发生选择和变化
双歧杆菌在生命很早期就开始在肠道中定植,可以通过母亲传递给后代,发现母乳喂养的幼儿肠道双歧杆菌含量很高。
随着年龄增长,人类肠道中双歧杆菌的数量和多样性会发生变化,随年龄的增长,双歧杆菌的数量会下降。
在婴儿期,粪便中常见的是:
在成年期下列是优势菌种:
青春双歧杆菌的相对丰度随年龄增长而减少,而短双歧杆菌(B. breve)和长双歧杆菌(B. longum) 在老年人肠道中占主导地位。关于长双歧杆菌,我们在以前的文章写过,详见:双歧杆菌:长双歧杆菌
这些变化反映了双歧杆菌与人体生命周期的密切关联,对理解肠道健康与衰老的关系具有重要意义。
双歧杆菌的定植优势以及交叉喂养潜力
肠道中的富含且复杂的碳源为肠道微生物群提供了一个营养生态位。糖类的差异利用影响了肠道生态位中的双歧杆菌的形成,这可能解释了为什么某些种类的双歧杆菌在婴儿或成人的肠道中更为常见。
婴儿的母乳和成人的饮食中含有大量复杂结构的糖类和寡糖,这些物质无法被人体消化,因此作为肠道微生物群的底物经过大肠。
双歧杆菌的”口味偏好”
双歧杆菌代谢单糖、双糖和寡糖;然而,不同种类的双歧杆菌有着各自的”口味偏好”:有些喜欢植物来源的菊粉型果聚糖(ITF);有些专门消化抗性淀粉(RS);有些则偏爱半乳糖聚糖、木聚糖、阿拉伯糖。还有一些”挑剔”的种类专门利用来自宿主的糖类,比如母乳中的人乳寡糖(HMO)或肠道粘液中的粘蛋白。
那么,这些微生物是如何分解这些复杂的糖分子的呢?
人类肠道微生物群通过碳水化合物活性酶(CAZymes) 介导复杂糖苷的代谢。
研究估计,双歧杆菌利用约14.64%的CAZyme基因,包括糖苷水解酶(GHs) 和糖苷转移酶(GTs),用于糖苷的运输、降解和调节,这一比例仅略低于拟杆菌,显示了它们在糖分代谢中的专业性。
拟杆菌是利用糖的多面手,谷禾以往的文章有专门写过,详见:
肠道核心菌——副拟杆菌属(Parabacteroides),是否是改善代谢减轻炎症的黑马?
拟杆菌属重要菌种——单形拟杆菌 (Bacteroides uniformis),控制好其稳态很重要
人群检出率较高的粪便拟杆菌(Bacteroides stercoris),你了解它吗?
肠道微生物群采用类似的策略来维持和分解复杂糖苷。
双歧杆菌编码一系列模块化的葡聚糖酶复合体,通过跨膜结构锚定在细胞表面。这些复合体包含编码GHs的基因,用于在细胞外消化长肽糖或糖苷,以及腺苷三磷酸(ATP)结合盒(ABC)运输系统的底物结合蛋白(SBPs),用于捕获在进入细胞前消化的寡糖。目前尚未发现能利用所有糖苷的菌株;然而,特定类型的糖苷是被利用的。
不同双歧杆菌与其他肠道微生物在可用糖苷的范围、种类及利用策略方面存在代谢特异性,没有任何一种双歧杆菌能够利用所有类型的糖分子,这促使它们发展出了一种巧妙的生存策略——”交叉喂养“,促进双歧杆菌在肠道的适应性。
在这种关系中,一种微生物分解复杂糖分子后,会释放一些中间产物到肠道环境中,而这些产物恰好可以被其他无法直接分解原始糖分子的微生物所利用。这是一种资源共享的微妙平衡。
例如,在婴儿肠道中,长双歧杆菌和双歧双歧杆菌能够分解母乳寡糖(HMO),释放出岩藻糖和短链脂肪酸等中间产物,这些物质随后被其他微生物(如嗜酸乳杆菌)所利用。这种交叉喂养策略不仅增强了整个肠道微生物对糖类的利用效率,也通过代谢产物的交换建立了微生物间的互惠关系,直接影响宿主的肠道稳态和健康。
如人乳寡糖和植物糖苷
双歧杆菌的定植优势依赖于特定营养资源的可用性、需求和消耗率。双歧杆菌在不同阶段的碳水化合物代谢方式影响其对不同肠道环境的选择性适应。
由于营养来源的差异,婴儿的肠道环境与成人不同,特征是以双歧杆菌为主,它们以母乳低聚糖为主要碳源,包括:
然而,在断奶后引入复杂饮食时,具有更强植物糖苷分解能力的双歧杆菌,如下列菌更普遍:
双歧杆菌对糖苷的分解依赖于分布于细胞外或细胞壁内的大量的糖苷水解酶。双歧杆菌进化出几种具有重叠但不同底物特异性的同源酶。不同的物种对不同的糖苷结构具有不同的肠道适应性。
复杂糖苷首先由细胞外的糖苷水解酶降解为单糖或低聚糖,其中一些通过转运蛋白直接运输到细胞质中,而另一些被磷酸化。这些单糖、低聚糖以及其他简单碳水化合物进入双歧代谢途径(果糖-6-磷酸磷酸酮酶中心发酵途径)进行代谢,并用于ATP的生产。
双歧杆菌的代谢途径与肠道中细胞外糖的类型和浓度紧密相关。双歧杆菌通常根据可用糖的数量产生各种代谢物,包括乙酸、乙醇和甲酸;
当细胞外糖丰盛时,会生成乙酸和乳酸。因此,双歧杆菌采取不同策略进行定植,双歧杆菌对糖苷的捕获、降解和代谢能够决定它们在肠道中的营养生态位。
双歧杆菌的主要聚糖利用策略
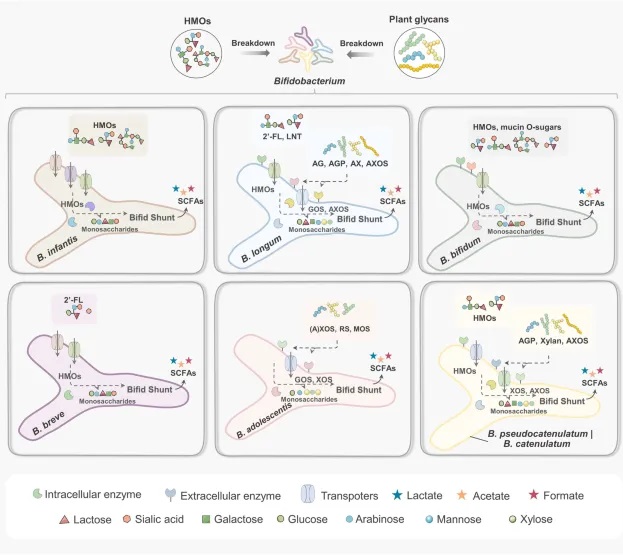
doi: 10.1038/s41522-024-00524-6
总结如下:
双歧杆菌的糖苷利用策略
到达结肠的复杂糖苷(如人乳寡糖和植物糖苷)被双歧杆菌通过两种主要方式利用:
不同种类的双歧杆菌具有不同的糖苷利用能力和策略。
主要双歧杆菌种类的糖苷利用特点
B.infantis
可通过转运系统内化大多数人乳寡糖
B.bifidum
通过丰富的胞外酶降解人乳寡糖(包括岩藻糖化糖苷)进行进一步内化和吸收
B.breve
利用有限的人乳寡糖(主要是2′-FL)
B.longum
擅长利用含有阿拉伯糖结构的植物糖苷
B.adolescentis
抗性淀粉的优秀利用者
B.pseudocatenulatum和B.catenulatum
可消耗一些人乳寡糖和植物糖苷
1
婴儿双歧杆菌 (B. infantis)
婴儿双歧杆菌主要利用人乳寡糖(HMOs)
婴儿双歧杆菌(B. infantis)在细胞内利用大多数母乳寡糖(HMOs)的能力使其相较于其他利用HMO物种(如B. breve)具有竞争优势,从而在母乳喂养期间在婴儿肠道中占据主导地位。婴儿双歧杆菌对2ʼ-富糖乳糖(2ʼ-FL) 的加工依赖于ABC转运蛋白进行细胞内消化。
婴儿双歧杆菌包含几种细胞内酶,包括富糖酶、β-半乳糖苷酶、LNB磷酸化酶、N-乙酰-β-氨基己糖苷酶和唾液酸酶,以降解富糖化和唾液酸化的HMOs。
婴儿双歧杆菌的特异性转运蛋白
婴儿双歧杆菌有专门的”接收器”(转运体)来吸收母乳中的特殊糖分。研究人员发现,这种细菌有两种特殊的转运体,可以吸收母乳中的两种岩藻糖基乳糖(2′-FL和3′-FL)。细菌体内有酶能将这些复杂糖分解为岩藻糖,然后进一步转化为其他物质,如1,2-丙二醇、乙酸和乳酸。
除了含岩藻糖的成分外,母乳中其他一些复杂糖分,如LNT、LNnT、LNB和N-乙酰葡萄糖胺,也能促进婴儿双歧杆菌的生长。

如上研究发现,一种特定的婴儿双歧杆菌株(EVC001)能利用LNT和LNnT这两种母乳糖分,这与它拥有一个名为Blon2175-2177的特殊转运体系统有关。
这个系统位于一个称为H5的基因簇中,包含了利用母乳寡糖所需的所有基因。没有这个H5基因簇的菌株在以这些母乳糖分为食物源时,生长就会受到限制。
这些发现说明了婴儿双歧杆菌如何专门适应于婴儿肠道环境,能高效利用母乳中的独特成分作为营养来源。
2
长双歧杆菌 (B. longum)
长双歧杆菌可以代谢阿拉伯木聚糖
长双歧杆菌(B. longum)是一种能在人体肠道中长期存在的有益菌,从出生到老年,它都能在我们体内稳定生存。这种菌的数量多少与我们在不同年龄段吃的食物有很大关系。当我们的饮食发生变化时,这种菌会相应调整自己的基因,改变获取和分解复杂碳水化合物的能力。
长双歧杆菌之所以能如此成功地在人体内定居,是因为它有两个特殊本领:
长双歧杆菌有些种类能分解母乳中特定类型的复杂糖分,特别是名为LNT和2′-FL的成分,但不能分解带有唾液酸的母乳糖分。它们还能利用肠道黏液中的某些糖链。这使得这些细菌在婴儿早期就能在肠道中找到自己的”生态位”(即生存空间)。

日本东京大学2017年的一项研究发现,一种特定的长双歧杆菌(JCM1217)能产生一种特殊的酶(LnbX),这种酶可以把母乳中的LNT分解成更小的糖分子(LNB和乳糖)供细菌使用。另外,研究人员还发现另一种长双歧杆菌(M12)含有一种叫做α-1-2-L-岩藻糖苷酶的酶,使它能够利用2′-FL和LNT这两种母乳糖分生长。
长双歧杆菌——植物纤维分解专家
长双歧杆菌有一套专门的工具(酶和转运蛋白)来分解植物中的复杂碳水化合物,特别是那些含有阿拉伯糖的复合物。这种能力让它在成人和老年人的肠道中具有生存优势。
这种细菌拥有多种GH43家族的酶,就像一套精密的”分子剪刀”,可以协同工作来切断植物纤维中的化学键。不同的长双歧杆菌菌株对不同类型的植物纤维有不同的偏好,这取决于纤维的具体结构、长度和复杂程度。
有些特别复杂的植物纤维(如阿拉伯半乳聚糖蛋白)对大多数肠道细菌来说太”难啃”了,但某些长双歧杆菌菌株进化出了特殊的酶,可以至少部分地分解这些复杂物质。科学家们发现了一种名为GAfase的新型酶,它能去除阻碍其他酶工作的部分,就像是先”清理障碍“然后再进行主要的分解工作。
不过,即使是长双歧杆菌也不能单独完全分解所有的复杂植物纤维,它需要与肠道中的其他细菌合作才能彻底利用这些物质。此外,长双歧杆菌还能分解一些含氮的糖类结构,通过多种酶的协同作用释放出甘露糖和N-乙酰葡萄糖胺等更简单的糖分子。
这些能力使长双歧杆菌成为肠道中一个重要的”食物分解专家“,能够适应人类饮食中各种复杂的植物纤维。
3
短双歧杆菌 (B. breve)
短双歧杆菌在复杂的人乳寡糖上生长有限
短双歧杆菌处理母乳中复杂糖分的方式与婴儿双歧杆菌很相似。它们都使用一种名为”ABC转运系统”的机制将完整的糖分子吸收进细胞内部,然后在细胞内进行分解。
不过,短双歧杆菌的能力有一定局限性。它不像婴儿双歧杆菌那样拥有处理所有母乳糖分的完整工具箱。短双歧杆菌主要能利用一些特定类型的母乳糖分,如LNT、LNnT和LNB,但对含有岩藻糖或唾液酸的更复杂糖分的处理能力有限。
短双歧杆菌的基因组中主要包含用于分解乳糖、岩藻糖、唾液酸等物质的基因。它有一种特殊的酶(外部唾液酸酶)可以从肠道粘液中释放唾液酸并利用它生长。另外,它还能分解某些含硫的糖分子。
菌株多样性与交叉喂养:依赖微生物网络的代谢策略

如上爱尔兰和荷兰团队研究了20种不同的短双歧杆菌菌株,发现它们都有各种类型的酶来分解不同的糖类物质,如麦芽糖、纤维二糖和半乳糖。
有趣的是,大多数短双歧杆菌不能直接利用母乳中含岩藻糖的成分(如2′-FL或3′-FL),但它们能利用其他细菌分解这些物质后产生的岩藻糖。这说明肠道菌群中的细菌会相互协作,共同分解利用复杂的食物成分。
4
两歧双歧杆菌(B. bifidum)
两歧双歧杆菌在细胞外降解HMOs和粘蛋白O-糖
两歧双歧杆菌与其他双歧杆菌有个显著不同:它有一套完整的”外部工具”(胞外酶)来处理母乳中的复杂糖分。这些酶可以在细菌细胞外直接分解复杂的母乳寡糖,将它们切成更小的部分,如乳糖、岩藻糖和唾液酸。
研究发现两歧双歧杆菌有一种特殊的酶(SiaBb2),它不仅能分解糖分,还能帮助细菌附着在肠道内壁上,这对细菌在肠道中的定居非常重要。
避免“内卷”,找到自己的“生存路”
有趣的是,两歧双歧杆菌似乎专门”选择”了一条与众不同的生存之路。它不太擅长处理一类叫做N-糖苷的物质,而是专注于另一类叫做O-糖苷的分子(主要存在于肠道粘液中) 。这种专业化让它避免了与其他双歧杆菌直接竞争,找到了自己的生态位。
两歧双歧杆菌拥有特殊的酶来分解肠道粘液中的糖类结构,还有一些特殊的”抓手“(碳水化合物结合模块)能帮助这些酶更好地接触到目标物质。研究还发现,它能分解粘液中特定的化学键以及含硫的糖分子,这些能力可能不仅影响它自己的生长,还能影响其他肠道细菌的代谢活动。
这些特性使两歧双歧杆菌成为肠道生态系统中一个独特而重要的成员,它以自己的方式与其他细菌和宿主建立互利关系。
5
青春双歧杆菌(B. adolescentis)
青春双歧杆菌更喜欢降解淀粉
青春双歧杆菌的竞争优势主要体现在其对植物糖甘露聚糖(如抗性淀粉、甘露寡糖和菊粉)的利用上。
抗性淀粉:一种通常不被我们消化系统完全分解的淀粉,存在于冷却的煮土豆、生香蕉等食物中
菊粉:一种存在于菊芋、洋葱等植物中的天然糖类
甘露寡糖:存在于豆类和某些坚果中的复杂糖类
青春双歧杆菌含有α-淀粉酶、糖原支链酶、聚糖酶和特定的淀粉结合模块,这些酶促进了抗性淀粉的完全降解。
编码其他糖甘露聚糖的酶,包括半乳糖苷酶、甘露糖苷酶、β-木糖苷酶和阿拉伯呋喃糖苷酶,也同样反映了青春双歧杆菌在降解膳食糖甘露聚糖方面的偏好。
青春双歧杆菌的寡糖代谢与短链脂肪酸产生能力
Mulualem等人从青春双歧杆菌ATCC15703中鉴定了一种α-半乳糖苷酶(BgaC),它通过转糖基作用从乳糖中产生半乳寡糖(GOS)。值得注意的是,青春双歧杆菌消耗寡糖,并且更倾向于在甘露寡糖(DP ≤ 4)和甘露糖上生长,使用β-葡萄糖苷酶(GH1)和β-果糖呋喃糖苷酶(GH32),而不是复杂的β-甘露聚糖。
Salas-Veizaga等人报道,青春双歧杆菌代谢葡萄糖醛酸化的木寡糖(GXOs)和木寡糖(XOs)(DP 2-6)以产生短链脂肪酸。青春双歧杆菌更喜欢(A)XOS而不是阿拉伯糖或木糖,并编码一种能够在小麦AX上生长的内切1,4-β-木糖酶基因。

6
假小链双歧杆菌(B. pseudocatenulatum)
假小链双歧杆菌和B. catenulatum消耗宿主和植物糖元
假小链双歧杆菌和B.catenulatum存在于婴儿和成人的肠道中。它们的CAZyme基因在不同年龄的宿主中有所不同,这表明这两种物种对宿主和植物糖类都有相对发达的降解系统。
消化母乳中的特殊糖分
假小双歧杆菌(B. pseudocatenulatum) MP80菌株有α-岩藻糖苷酶(GH29和GH95)这两种特殊酶,能够专门消化母乳中含岩藻糖的低分子量人乳寡糖,比如乳二岩藻四糖。这让它能在婴儿肠道中获取独特的营养来源。
分解植物纤维的能力
这种细菌还拥有内切-1,4-β-木聚糖酶(GH10),能够利用来自植物细胞壁的长链木聚糖衍生物(聚合度2-4的木寡糖)。这是很特别的能力,因为大多数双歧杆菌分解木聚糖的能力都很有限。
这种酶像”剪刀”一样切断木聚糖主链,产生木寡糖和木糖。有趣的是,这种细菌不会独占所有养分——部分产物自己吸收利用,其余则释放到肠道环境中供其他细菌使用,形成一种”共享经济”。
其他消化能力
在MCC10289菌株中,科学家们发现了β-L-阿拉伯糖苷酶,这种酶帮助细菌消化阿拉伯半乳聚糖蛋白侧链和L-阿拉伯糖,这些都是植物中常见的成分。

研究者Hosaka等人还发现JCM 1200菌株能产生蔗糖磷酸化酶和β-果糖苷酶,这些酶能分解蔗糖(普通食糖)和类似的二糖N-乙酰蔗糖胺。
总的来说,B. pseudocatenulatum拥有多种特殊的”消化工具“,使它能在肠道中高效利用不同来源的碳水化合物,无论是母乳中的特殊糖分还是植物纤维,这可能是它对人体健康有益的原因之一。
7
链状双歧杆菌 (B. catenulatum)
B. catenulatum的基因组中包含多种参与消化人乳寡糖、木聚糖、淀粉及其衍生低聚糖的糖苷水解酶基因,这让它能够适应宿主饮食的变化。这种细菌能将人乳寡糖(包括2′-岩藻糖乳糖和乳-N-二岩藻己糖)转运到细胞内,然后通过岩藻糖苷酶、β-半乳糖苷酶和乳-N-二糖苷酶的协同作用,将它们分解成N-乙酰葡萄糖胺和单糖。
此外,B. catenulatum的细胞外木聚糖酶能将阿拉伯木聚糖切割成木寡糖和阿拉伯木寡糖,这些产物随后被细胞内的阿拉伯糖苷酶和木糖苷酶进一步分解成阿拉伯糖和木糖。
简单总结说,链状双歧杆菌和前面提到的假小链双歧杆菌类似,都具有强大的消化能力。它能消化婴儿母乳中的特殊糖分,也能分解植物中的复杂纤维,将这些难以吸收的物质转化为简单的糖分。这种多样化的消化能力使它成为肠道中非常有价值的益生菌,能随着人从婴儿期到成人期饮食的变化而调整自己的代谢方式。
双歧杆菌的主要聚糖利用策略

doi: 10.1038/s41522-024-00524-6
肠道微生物的代谢网络
肠道微生物群大多是辅助营养型的,不同物种对糖复合物的同化可能相似(代谢冗余)。因此,它们仍然需要与其他物种竞争或从肠道环境中获取营养。依赖于释放代谢物到环境中的其他微生物,竞争物种可以在平衡中共存;这些无成本的代谢物促进了微生物之间的相互作用。
不同代谢物之间存在交叉喂养,特别是那些利用特定复杂化合物以释放代谢副产物的物种,这些副产物进一步被那些无法单独在这些化合物上生长的物种同化。双歧杆菌依靠其酶降解和寡糖运输系统从宿主中消耗糖复合物,导致肠道的稳定定植,并促进双歧杆菌种群内或与其他细菌(如拟杆菌和丁酸盐生产者)之间的交叉喂养关系。
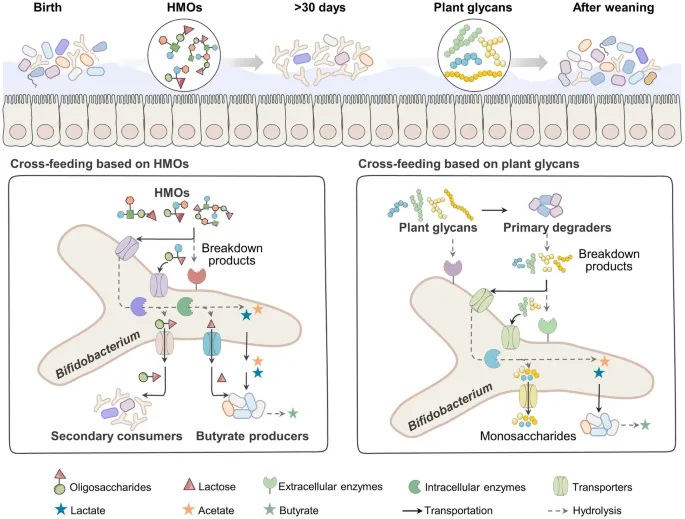
doi: 10.1038/s41522-024-00524-6
双歧杆菌在整个生命周期中都存在交叉喂养。主要类别是基于母乳低聚糖(HMO)和基于植物多糖的交叉喂养。具体而言,当同时培养于HMO上时,双歧杆菌更可能将HMO降解产物交叉喂养给其他非HMO降解主导细菌和丁酸盐生产者。当在植物多糖上进行交叉喂养时,双歧杆菌更可能依赖于其他主导降解细菌的细胞外降解产物而繁荣生长。
基于HMO的双歧杆菌交叉喂养使其在婴儿肠道中占主导地位
基于人乳寡糖的双歧杆菌与产丁酸菌的交叉喂养
B. infantis 代谢人乳寡糖,产生寡糖和代谢物(如 1, 2-丙二醇和乙酸),这些物质通过与其他细菌(如 Eubacterium hallii 和 Anaerostipes caccae)的交叉喂养,在母乳喂养婴儿的肠道中发挥重要作用。
Cheng 等人发现,B. infantis 利用 6ʼ-唾液糖乳糖(6ʼ-SL)进行乙酸的生产,并与 Faecalibacterium prausnitzii 进行交叉喂养以转换为丁酸,这导致 B. infantis 增殖。这可能与 F. prausnitzii 分泌细胞外唾液酶以促使 B. infantis 中唾液酶的表达,从与增加乙酸的生产有关,并且这种交叉喂养活动的发生依赖于人乳寡糖的分子结构。
两种双歧杆菌物种之间的合作性HMO降解
在细胞外降解人源低聚糖(HMOs)时,双歧杆菌(包括B. bifidum和B. longum)产生的产物部分释放到公共环境中,诱导与其他利用HMOs能力较弱的双歧杆菌种类进行交叉喂养。
例如,B. longum降解LNnT产生的产物可以被B. pseudocatenulatum交叉喂养,而B. pseudocatenulatum降解2ʼ-FL产生的低聚糖支持B. longum的生长。
B. bifidum并不是婴儿肠道中的主要物种;然而,作为HMOs的细胞外降解者,它通过释放HMO衍生物与其他物种进行交叉喂养,从而影响肠道微生物组的组成。B. bifidum与B. breve之间的人源低聚糖代谢是互补的,这也促进了这两种菌株之间的交叉喂养。B. bifidum利用岩藻糖酶和FL转运蛋白在细胞外释放乳糖和岩藻糖,这些产物交叉喂养给B. breve。这表明B. bifidum容易与缺乏细胞外岩藻糖酶的其他岩藻糖消费者交叉喂养。
然而,B. bifidum更倾向于在乳糖上生长而不是岩藻糖,这表明无私是其主要功能。除了合作外,B. breve可以与B. bifidum竞争乳糖;共存的关键在于B. bifidum通过上调相关酶和转运蛋白的基因表达释放更多乳糖。类似的现象也在粘蛋白和唇糖的共培养中观察到了。

研究人员证明B. bifidum从唾液酸化聚糖中释放唾液酸和乳糖,这支持了B. infantis和B. breve的生长,作为交叉喂养的次级代谢产物。
B. bifidum不吸收岩藻糖、半乳糖、唾液酸和N-乙酰氨基葡萄糖-6-磺酸,因此,粘蛋白O-糖链的降解可能与其他物种合作完成,例如B. breve,后者利用这些源自粘蛋白的碳水化合物片段。
HMO基础上双歧杆菌与其他肠道细菌的互喂养
建立在双歧杆菌与其他肠道细菌之间的交叉喂养关系可以帮助完善早期生活中肠道微生物群内的相互作用网络。程等人表明,通过发酵阿拉伯糖产生的代谢物1,2-PD可以促进重组肠道无菌小鼠中Limosilactobacillus reuteri的定植。

Nogacka等人研究了B. bifidum和Lactobacillus gasseri之间基于2-ʼFL的代谢相互作用,发现B. bifidum IPLA20048通过交叉喂养细胞外降解产物(半乳糖、阿拉伯糖和乳糖)促进了L. gasseri IPLA20136的增殖,并且在B. bifidum中与碳水化合物运输相关的α-阿拉伯糖苷酶编码基因上调,从而增加了碳水化合物的生产。
母乳喂养婴儿的肠道微生物群在断奶前后会因饮食而发生显著变化,从而促进更复杂的微生物相互作用,并诱导肠道微生物群的结构和成分逐渐稳固和成熟。
基于聚糖利用的双歧杆菌交叉饲养策略

doi: 10.1038/s41522-024-00524-6
基于植物糖苷的双歧杆菌与产丁酸菌的交叉喂养
乙酸和乳酸是双歧杆菌对寡糖代谢的最终产物,是双歧杆菌与丁酸菌之间交叉喂养的重要底物。当在AXOS上生长时,除了将乙酸转化为丁酸外,产丁酸菌消耗AXOS以生产阿拉伯糖和木糖,这些糖可以作为B. longum的底物。
Bhattacharya等人调查了基于半乳糖取代的β-甘露聚糖寡糖的B. adolescentis和Roseburia之间的交叉喂养。

Moens等人证实双歧杆菌可以轻易地在FOS和菊粉型果聚糖上进行交叉喂养,以产生双歧杆菌的生长与丁酸产生效应,并且乙酸转化为丁酸的程度与双歧杆菌种之间的糖苷酶降解能力差异密切相关。具体来说,当与F. prausnitzii共同培养时,B. breve只能利用果糖,不能消耗FOS和ITF,并依赖F. prausnitzii产生的单糖降解果聚糖以进行生长。
B. adolescentis更喜欢短链FOS而非ITF,使其能够将乙酸交叉喂养给F. prausnitzii,并利用其FOS继续生长。相反,B. longum或B. angulatum在ITF上与F. prausnitzii竞争,导致共培养系统中丁酸合成效率最低。
基于植物多糖的双歧杆菌物种之间的交叉喂养扩大了碳源的可用性
当共培养时,无法降解植物糖苷的双歧杆菌种类依赖于能够降解的其他种类。例如,Centanni等人报告称,当在高玉米淀粉培养时,B. pseudolongum通过产生1型外源性蒲白酶和α-淀粉酶释放葡萄糖、麦芽糖、麦三糖,这些产物交叉馈送给B. animalis。更重要的是,具有相似营养代谢的双歧杆菌种类可以通过交叉馈送相同的底物来扩展其营养生态位,而不是竞争。
例如:B. bifidum PRL2010缺乏利用植物糖苷的降解系统,如淀粉和木聚糖;然而,当与其他菌共培养时,如B. adolescentis 22 L、B. breve 12 L、B. thermophilum JCM1207,它可以利用其他双歧杆菌释放出的简单碳水化合物生长,并促进其糖利用基因的表达。
当与其他双歧杆菌共培养时,B. adolescentis在参与木糖代谢的基因表现出最显著的变化,反映了这些菌株的遗传适应性增强,这可能有助于宿主在特定饮食变化期间扩展碳水化合物的利用潜力。
双歧杆菌与其他肠道细菌协作降解复杂的植物糖苷
复杂糖类的降解产物在肠道微生物群中的交叉喂养取决于目标糖类的复杂性。由于缺乏完整的降解和转运系统,双歧杆菌对难以降解的植物糖类(包括木聚糖、长链菊粉和甘露聚糖)具有有限的能力;因此,它们依靠其他细菌将可溶性短糖类物质作为交叉喂养底物(如AXOS、XOS、FOS和甘露糖)在细胞外释放。一些拟杆菌属和乳酸菌属的成员是主要的糖类降解细菌,能够与双歧杆菌交叉喂养,包括B.longum、B.animalis、B. adolescentis。
当在简单的木聚糖(如葡萄糖醛酸木聚糖和小麦阿拉伯木聚糖)上培养时,B. adolescentis ATCC 15703依赖于来自Bacteroides ovatus ATCC 8483产生的AXOS,在缺乏木聚糖酶(GH98)降解系统的情况下生长。
果聚糖的交叉喂养与糖链的取代基和长度密切相关,复杂的果聚糖(即含有蔗糖单元的果聚糖)被主要降解者降解以产生短链化合物,供次级消费者利用。B. longum倾向于使用短链菊粉,促进与Lactobacillus paracasei的合作,完全降解长链菊粉并产生果糖、乳酸和乙酸。
B. longum与拟杆菌之间基于木聚糖、II型各糖苷和AGP存在交叉喂养关系。Wang等报告称,当与Bacteroides caccae ATCC 43185共同培养时,B. longum NCC 2705依靠B. caccae降解的落叶松木AG的碳水化合物片段生长良好。

Vega-Sagardía等报告称,B. ovatus HM222降解木聚糖并通过释放XOS和细胞外酶促进B. longum PT4的生长,并且B. longum PT4中α-L-阿拉伯糖苷酶、L-阿拉伯糖异构酶和木酮糖异构酶的分泌量增加。然而,由于拟杆菌在pH <5.5时生长不良,B. longum发酵产生乙酸和乳酸,导致拟杆菌基质转化(从琥珀酸转化为丙酸)的效率降低,进而导致琥珀酸积累。因此,交叉喂养拟杆菌受到pH限制,用于降解复杂AG或木聚糖的联菌种需要其他物种的参与,例如Prevotella、Roseburia intestinalis。
值得注意的是,B. longum与拟杆菌之间的交叉喂养关系是互惠的,B. longum的植物糖苷代谢的次级产品可以交叉喂养某些糖苷代谢系统较差的拟杆菌。例如,B. longum降解的与AGP相关的低聚糖可以与Bacteroides vulgatus交叉喂养,这促进了后者菌株中木糖苷酶的表达。
B. longum在与植物糖苷共同培养时促进了Bacteroides thetaiotaomicron中甘露糖苷酶和木糖苷酶的功能。
考虑到数据有限,双歧杆菌的交叉喂养互动是否对整个肠道群落内碳水化合物利用的平衡产生积极贡献仍有待确定。
协同组合
双歧杆菌产生的交叉喂养活动凸显了它们在获取或提供其他细菌的底物方面的关键生态作用。这种相互依赖的互动也可以增强参与者的代谢功能,从而扩展它们原有的营养生态位。补充含有双歧杆菌的多菌株共生菌可以帮助肠道微生物群在早期生活中成熟和稳定,并增加有益代谢物(如丁酸)的分泌,最终预防与肠道微生物群失衡相关的慢性疾病。
这种菌株的协同组合协同调节肠道微生物群和健康稳态,并且比单一菌株更不易受到内源性微生物的影响。然而,目前对多菌株共生菌调节健康的研究仅停留在现象描述层面,对组合的基本原因、配方基础和有效机制的明确解释仍然稀缺。
因此,应基于益生菌对糖苷的偏好及其交叉喂养关系探索这种多菌株共生菌的可能性和必要性。肠道微生物群常常受到年龄、饮食习惯和抗生素的影响,因此需要根据不同宿主的需求,使用适当和个性化的策略来调节菌群稳态。
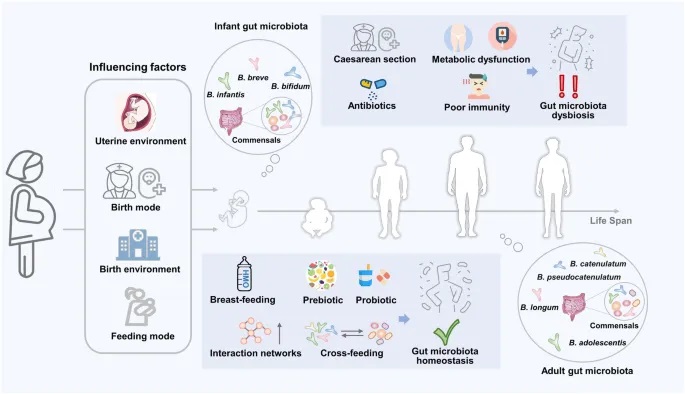
doi: 10.1038/s41522-024-00524-6
宿主的双歧杆菌从出生起受多种因素影响。母乳喂养以及益生菌和益生元的使用有助于建立肠道微生物群的互动网络,包括交叉喂养。这种交叉喂养关系可以促进多菌株合生元的配制,这对改善肠道稳态和缓解因剖腹产和抗生素使用而导致的相关疾病,包括菌群失调、代谢综合征和免疫缺陷,是有效的。
婴儿早期生命中交叉喂养的益处
○ 促进婴儿肠道微生物组的早期定植和多样性
○ 增强免疫系统发育和功能
○ 减少致病菌定植的风险
○ 缓解剖腹产和抗生素使用导致的微生物组变化
成人生命中交叉喂养的益处
○ 维持肠道微生物组的多样性和稳定性
○ 改善肠屏障功能
○ 增加短链脂肪酸的产生
○ 减轻代谢性疾病的风险
○ 调节免疫反应
老年期交叉喂养的益处
○ 延缓肠道微生物组多样性的年龄相关下降
○ 减轻炎症性疾病
○ 改善认知功能
○ 增强免疫系统功能
生命早期——双歧杆菌交叉喂养的有益效应
改善剖腹产和抗生素使用导致的微生物定植的不良后果
出生方式(剖腹产)和抗生素治疗对婴儿期肠道微生物群产生负面影响,这表现为致病菌的积累,双歧杆菌和拟杆菌的减少,以及增加婴儿代谢、炎症和免疫紊乱的风险。
补充具有广泛人乳寡糖代谢能力的双歧杆菌菌株(如婴儿双歧杆菌),益生菌和能够刺激双歧杆菌生长的益生元,已被用来逆转由分娩方式引起的肠道微生物群失调。
——补充R. gnavus可以促进B. breve的增殖
B. breve利用前者从2′-FL中释放的乳糖,并有助于将早产儿微生物组转变为富含双歧杆菌的群落。
——由Lactobacillaceae rhamnoides、B.breve 、Propionibacterium freundenreichii与FOS结合的混合物
该混合物促进了双歧杆菌的定植,并减少了肠球菌科、梭菌科和韦荣球菌科的丰度,最终纠正了由剖腹产和抗生素诱导导致的肠道微生物组的不良变化。
一项宏蛋白质组分析显示,双歧杆菌中用于HMO降解的酶(包括β-半乳糖苷酶和β-半乳糖基N-乙酰己糖胺磷酸化酶)表达显著,而鼠李糖乳杆菌可能从HMO降解释放的单糖中受益。这些研究表明,与肠道居住菌种(特别是双歧杆菌)作为盟友一起施用益生菌和/或益生元在恢复婴儿肠道微生物群失调方面是有效的;这种具有协同作用的多菌株和益生元组合可作为婴儿配方食品的补充。
促进双歧杆菌的优势地位和完善肠道菌群构建
基于HMO的代谢相互作用可以塑造婴儿肠道微生物群的组成。双歧杆菌(尤其是B. infantis)在母乳喂养婴儿的肠道定植中被优先考虑,这取决于它们吸收HMO的优越能力。
双歧杆菌在出生后不久基于HMO代谢发挥优先效应,消耗肠道中大部分碳源,从而阻止后来物种的定植,促进婴儿肠道稳态的建立,并抑制病原体(如艰难梭菌和沙门氏菌)的生长。
B. breve的肠道定植是优先效应的一个例子。
考虑到B. breve对HMO的有限利用能力,其优势地位的形成不仅仅与HMO消耗的表型相关,而是依赖于与其他双歧杆菌的交叉喂养。
双歧杆菌中涉及的交叉喂养活动在肠道微生物群的组装中起着关键作用。
B.infantis Bg2D9促进了Prevotella copri Bg131在营养不良小鼠肠道中的定植,并促进了含有阿拉伯聚糖的饮食中阿拉伯糖的释放,这通过交叉喂养促进了肠道中其他物种的增殖,包括B. catenulatum、Blautia obeum。这可用作严重急性营养不良儿童的饮食干预。
总之,肠道微生物群在出生后具有高度可塑性,可以通过引入含有适当协同生物的饮食来促进肠道稳态。确定这些相互作用的过程和结果可用于饮食干预,以实现个性化营养。
成年期间——双歧杆菌交叉喂养的有益效应
重建肠道微生物群结构和肠道稳态
内源性双歧杆菌的普遍存在程度在成年期低于早期生命阶段;然而,由于饮食多样性的增加,双歧杆菌参与的交叉喂养活动,促进了与肠道微生物群和宿主之间的更多相互作用。
多菌株合生元的膳食补充有助于促进双歧杆菌的增殖并重建稳定的肠道菌群。抗生素暴露可能破坏肠道微生物群的丰度和多样性,而引入已删除的核心微生物群可以通过互营关系帮助重建肠道免疫稳态。
一种人乳寡糖和婴儿型双歧杆菌的合生元,通过促进乙酸盐和丁酸盐的产生,来改善肠道微生物群的不平衡并影响肠杆菌科细菌的生长。
后续研究发现,这种依赖于人乳寡糖的双歧杆菌策略,可以增加乳酸摄取者(韦荣氏菌属)的丰度,并通过减少促炎代谢物对甲酚硫酸盐来缓解抗生素诱导的肠道微生物群失调。
对甲酚详见:对甲酚——自闭症辅助诊断和干预的关键指标
刺激有益代谢物分泌,改善2型糖尿病、肥胖等
由于与产丁酸菌的交叉喂养关系,双歧杆菌丰度的变化与粪便中乙酸盐和丁酸盐浓度密切相关,它们的代谢相互作用可以调节如2型糖尿病(T2D)和肥胖等代谢综合征。
丁酸盐在调节血糖水平方面发挥着重要作用。一种含有Akkermansia muciniphila、婴儿双歧杆菌(B.infantis)、三种产丁酸菌和菊粉的合生元,以改善2型糖尿病,并确定粘液噬菌菌和婴儿双歧杆菌与丁酸盐生产菌的交叉喂养活动促进了丁酸盐的产生,这需要体内验证。
扩展阅读:AKK菌——下一代有益菌
多菌株合生元也被用于改善肥胖个体的能量代谢、免疫功能和肠道微生物群。
引入了一种由GOS、长双歧杆菌(B. longum)和B. bifidum组成的合生元来调节肥胖,并确定瘤胃球菌(Ruminococcus)的增加可用于丁酸盐的生产。
Nguyen等人148通过共现网络分析使用阿拉伯木聚糖治疗肥胖,发现长双歧杆菌通过降解阿拉伯木聚糖释放寡糖,与拟杆菌属、考拉杆菌属(Phascolarctobacterium)和Subdoligranulum进行协同和相互作用,促进乙酸盐的产生并缓解肥胖。
扩展阅读:肠道核心菌属——考拉杆菌属(Phascolarctobacterium),与减肥相关?
饮食改变和合生元干预可用于增加肠道中双歧杆菌的丰度并促进有益代谢物的分泌,从而缓解代谢紊乱;然而,其临床意义仍有待确定。
不同阶段营养——驱动双歧杆菌的适应性演化
肠道中双歧杆菌的种群动态与宿主的营养阶段密切相关。从婴儿期的母乳(富含人乳寡糖等简单糖苷)到成年期的复杂植物糖苷(如阿拉伯木聚糖、β-葡聚糖),饮食结构的转变直接塑造了双歧杆菌的糖苷代谢偏好。
这种代谢适应性使其能够通过调整糖苷水解酶(GHs)和转运系统,在不同年龄段维持肠道定殖优势。然而,相比拟杆菌等肠道菌群,目前对双歧杆菌胞内外GHs酶系及其底物转运机制的认知仍存在显著空白,尤其是底物识别能力如何影响其与其他菌群的互作,亟待深入研究。
交叉喂养机制:协同互作与科学挑战
双歧杆菌通过糖苷偏好性与其他肠道微生物(如拟杆菌、乳酸杆菌)建立交叉喂养网络。例如,其分解阿拉伯木聚糖(AX)或阿拉伯半乳聚糖(AG)的代谢产物可被拟杆菌二次利用,而β-葡聚糖、果聚糖等糖苷的协同代谢机制尚未明确。
种间协作的未知领域:现有研究多聚焦单一菌种,而双歧杆菌属内(如长双歧杆菌与假链状双歧杆菌)及跨属(如与乳酸杆菌)的代谢分工机制亟待阐明。
研究范式局限:当前对多菌株协同效应的研究偏重健康干预的终点指标(如菌群丰度变化),却忽视对互作过程的动态解析(如底物传递路径、酶系统互作),导致协同组合设计缺乏理论依据。
未来研究方向与转化应用策略
机制层面:阐明双歧杆菌(如长双歧杆菌与假链双歧杆菌)间的种内协同机制,以及其与乳酸杆菌等菌的种间互作规律;
技术层面:结合多组学手段,揭示GHs酶系与转运系统的底物特异性,明确关键代谢节点;
应用层面:基于年龄或营养阶段特征,开发靶向双歧杆菌交叉喂养网络的个性化菌群配方,并优化干预时机。
个性化精准营养与功能性食品开发
基于双歧杆菌的糖苷偏好设计靶向性膳食补充剂或功能性食品。
可能的应用方向:
□ 开发含特定糖苷(如LNT、阿拉伯木聚糖)的“益生元+益生菌”组合产品,定向激活双歧杆菌的代谢通路;
□ 例如将B. infantis与丁酸产生菌和特定益生元(如人乳寡糖或阿拉伯木聚糖)结合,形成基于交叉喂养原理的协同生物产品;
□ 开发基于肠道菌群特征的“糖苷-菌株匹配算法”,优化益生元/益生菌组合方案;
□ 针对老年人肠道菌群特征,设计富含双歧杆菌偏好糖苷的老年营养配方(如抗性淀粉微胶囊);
□ 利用双歧杆菌的唾液酸代谢缺陷,设计不含唾液酸化糖苷的婴幼儿配方奶粉,抑制致病菌定殖。
□ 基于不同双歧杆菌菌株之间以及与其他微生物的交叉喂养关系,开发新型发酵食品,优化营养价值和健康效益。
代谢疾病干预与菌群疗法
通过调控双歧杆菌的交叉喂养网络治疗肥胖、糖尿病等代谢疾病。
可能的应用方向:
□ 筛选能高效分解膳食纤维(如β-葡聚糖)的双歧杆菌工程菌株,用于改善胰岛素抵抗;
□ 构建“双歧杆菌-乳酸杆菌”共生菌群胶囊,通过协同降解果聚糖缓解肠道炎症;
□ 开发靶向双歧杆菌GH43酶的小分子激活剂,增强植物纤维代谢能力以控制血糖。
跨学科健康管理工具开发
整合双歧杆菌研究数据构建健康预测与干预平台。
可能的应用方向:
□ 建立“肠道糖苷代谢图谱”数据库,结合机器学习预测更精细化的个体菌群失衡风险;
□ 整合肠道菌群多组学数据与饮食记录,训练机器学习模型预测特定双歧杆菌菌株对宿主代谢的影响阈值;
□ 开发便携式肠道糖苷检测设备(如生物传感器试纸),实时指导饮食调整。
□ 建立母乳低聚糖(HMO)与婴儿粪便中双歧杆菌丰度的关联数据库,指导母乳喂养不足时的精准营养补充。
通过将菌群营养研究提升至分子互作水平,可推动微生物组治疗向“分子营养学”转型,例如设计特定糖苷底物激活双歧杆菌的靶向代谢通路,或利用协同菌群组合重塑宿主-菌群互惠关系,从而为代谢疾病防治提供新策略,是微生物组治疗的未来趋势。
主要参考文献
Xiao M, Zhang C, Duan H, Narbad A, Zhao J, Chen W, Zhai Q, Yu L, Tian F. Cross-feeding of bifidobacteria promotes intestinal homeostasis: a lifelong perspective on the host health. NPJ Biofilms Microbiomes. 2024 Jun 19;10(1):47.
heng L, Kiewiet MBG, Logtenberg MJ, Groeneveld A, Nauta A, Schols HA, Walvoort MTC, Harmsen HJM, de Vos P. Effects of Different Human Milk Oligosaccharides on Growth of Bifidobacteria in Monoculture and Co-culture With Faecalibacterium prausnitzii. Front Microbiol. 2020 Oct 30;11:569700.
Nguyen NK, Deehan EC, et al., Gut microbiota modulation with long-chain corn bran arabinoxylan in adults with overweight and obesity is linked to an individualized temporal increase in fecal propionate. Microbiome. 2020 Aug 19;8(1):118.
Vega-Sagardía M, Delgado J, Ruiz-Moyano S, Garrido D. Proteomic analyses of Bacteroides ovatus and Bifidobacterium longum in xylan bidirectional culture shows sugar cross-feeding interactions. Food Res Int. 2023 Aug;170:113025.
Moens F, Weckx S, De Vuyst L. Bifidobacterial inulin-type fructan degradation capacity determines cross-feeding interactions between bifidobacteria and Faecalibacterium prausnitzii. Int J Food Microbiol. 2016 Aug 16;231:76-85.
Nogacka AM, Cuesta I, Gueimonde M, de Los Reyes-Gavilán CG. 2-Fucosyllactose Metabolism by Bifidobacteria Promotes Lactobacilli Growth in Co-Culture. Microorganisms. 2023 Oct 29;11(11):2659.
Hosaka H, Kawamura M, Hirano T, Hakamata W, Nishio T. Utilization of sucrose and analog disaccharides by human intestinal bifidobacteria and lactobacilli: Search of the bifidobacteria enzymes involved in the degradation of these disaccharides. Microbiol Res. 2020 Nov;240:126558.

谷禾健康


嗜粘蛋白-阿克曼氏菌(Akkermansia muciniphila,A.muciniphila),简称为 AKK,于 2004 年发现,是一种从人类粪便中分离出来的椭圆形革兰氏阴性细菌。
该细菌以荷兰微生物生态学家 Anton DL Akkermans 的名字命名,以表彰他对该领域的贡献。A. muciniphila 是人类肠道共生菌,并可以依靠肠粘液层的黏蛋白生存。
在过去十年中,越来越多的研究证明,在糖尿病、心血管疾病、疾病性肠病、神经疾病发现A. muciniphila丰度降低。最近的干预研究还证实如茶或富含多酚水果的饮食可增加其丰度,有助于改善糖尿病和肥胖个体的代谢功能。
总的来说,来自动物和人类研究的越来越多的证据表明A. muciniphila将成为下一代有临床应用前景的益生菌。尤其是它在预防和治疗糖尿病、肥胖症及癌症,这对未来的研究具有重要意义和发展。
A. muciniphila是一种厌氧、革兰氏阴性、无运动、没有内生孢子的卵圆形肠道细菌,其最适生长温度是37℃,最适生长pH为6.5,该菌的倍增时间大约是1.5 h。A. muciniphila属于疣微菌门,事实上,它是人类粪便样本中发现的属于这个特殊门的唯一物种。
值得注意的是,A. muciniphila具有一定的耐氧性,其暴露在空气中24 h,仍然有1%以上的存活率。此外,研究还发现低氧气浓度(纳摩尔)下可以显著促进A. muciniphila的生长。
A. muciniphila单独或者成对存在,很少成链生长,其代谢产物为乙酸盐、丙酸盐、1,2-丙二醇等。
在提供蛋白源的基础培养基中,加入N-乙酰氨基葡萄糖、N-乙酰半乳糖胺和葡萄糖作为能源,A. muciniphila可以生长,但是在果糖和纤维二糖等其他糖类作为能源的培养基中A. muciniphila不能生长,说明该菌的生长繁殖需要蛋白质。
A. muciniphila的特别有趣之处在于,与大多数其他有益细菌不同,它不完全依赖于我们的饮食来喂养。即使消化道中没有营养物质,它也会以粘膜层中的粘蛋白为食。
Akkermansia Muciniphila一般通过母体获得, 通常在儿童中大量存在,并随着年龄和疾病而减少。将其恢复到最佳水平可以带来许多好处。
肠道中低浓度的Akkermansia muciniphila可能表明黏液层较薄,从而导致肠道屏障功能减弱,此外还会增加细菌毒素的易位,炎症性肠病、哮喘、肥胖症和 II 型糖尿病患者的Akkermansia muciniphila浓度往往较低。
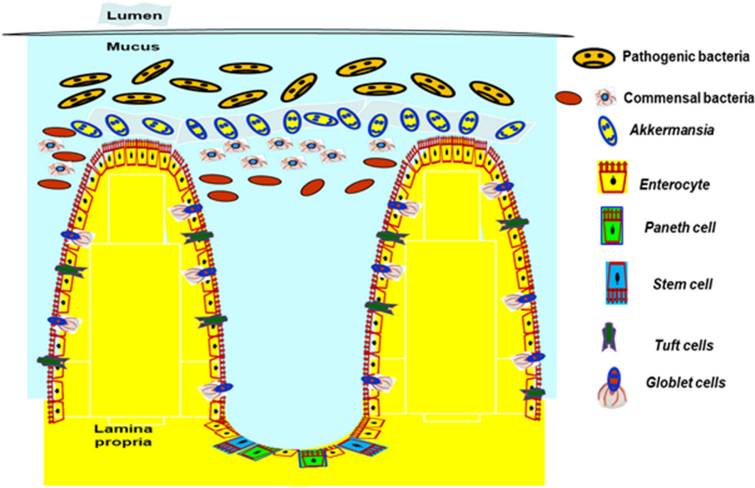
我们知道整个胃肠道 (GI) 的粘膜完整性对于维持人体健康至关重要。这其中,粘液屏障的完整性是胃肠道的第一道防线。肠道黏液层的周转包括黏液的合成、分泌和降解,这是一个需要调节和平衡的微妙过程,以确保黏液保持最佳的保护功能。
粘液由多种成分组成:水 (90%–95%)、电解质、脂质 (1%–2%)、蛋白质等。这种粘液是一种稀的、水性和粘弹性的分泌物,这要归功于被称为粘蛋白的特定粘液蛋白,它是粘液中存在的主要结构和功能成分,浓度为 1%–5%。
粘蛋白是一个大的、复杂的、糖基化的蛋白质家族,其特征是一个重要的元素,即“粘蛋白结构域”。它由一个蛋白质核心组成,该核心由含有氨基酸残基脯氨酸 (Pro)、苏氨酸 (Thr) 和丝氨酸 (Ser) 的序列组成,称为富含 PTS 的序列,通常串联重复,其中 Ser 和 Thr 广泛为 O-糖基化并赋予“瓶刷”状构象。
MUC2(黏糖蛋白2)的化学结构和肠道粘液的合成
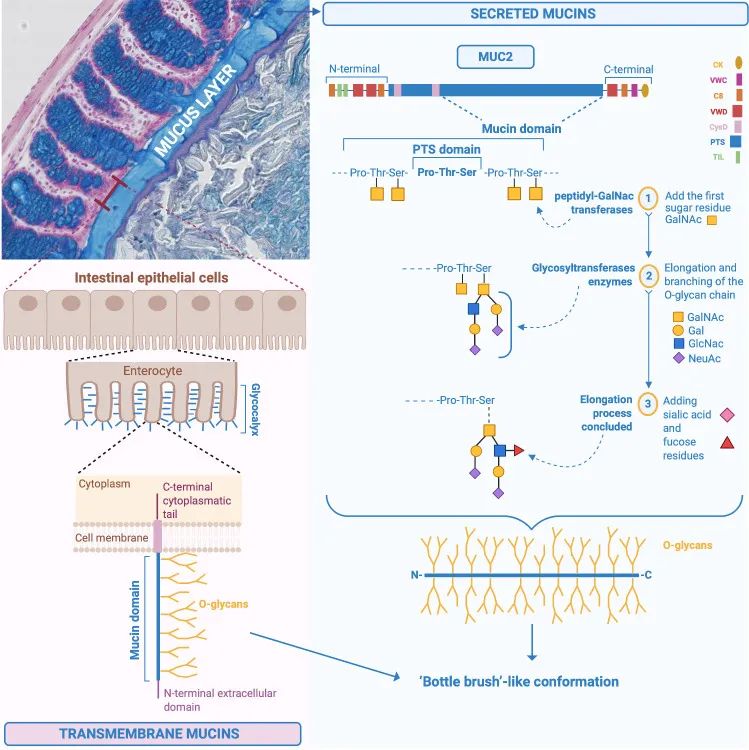

Paone P & Cani PD. Gut. 2020
肠道菌群在肠道中的分布梯度随其位置不同而变化;微生物密度从近端到远端肠道增加,每克肠道内容物的微生物细胞数量大约如下:
十二指肠中103 个
空肠中 104 个
回肠中 107个
结肠中1012 个
此外,微生物密度从上皮细胞向管腔增加,在后者中发现的细菌数量最多,与管腔相比,实际上很少有细菌物种能够很好地粘附和驻留在粘液层中。除了粘附这一重要功能外,肠道微生物群对调节肠道粘液层有很大贡献。
需要普及一个认知就是,当我们谈到构成微生物组的各种细菌物种时,有些菌似乎比其他细菌具有更显着的影响,比如肠道基石菌,核心菌,益生菌等,确保这些个体物种的最佳水平——不要太低,也不要太高——可以产生对健康深远的影响。这其中包括有益细菌的关键物种之一 Akkermansia Muciniphila。
谷禾肠道样本大数据库显示A. muciniphila缺乏或未检出情况在人群中很常见,尤其是那些有肠道问题的人。在健康个体中其约占肠道微生物群总数的0.5%–3%。
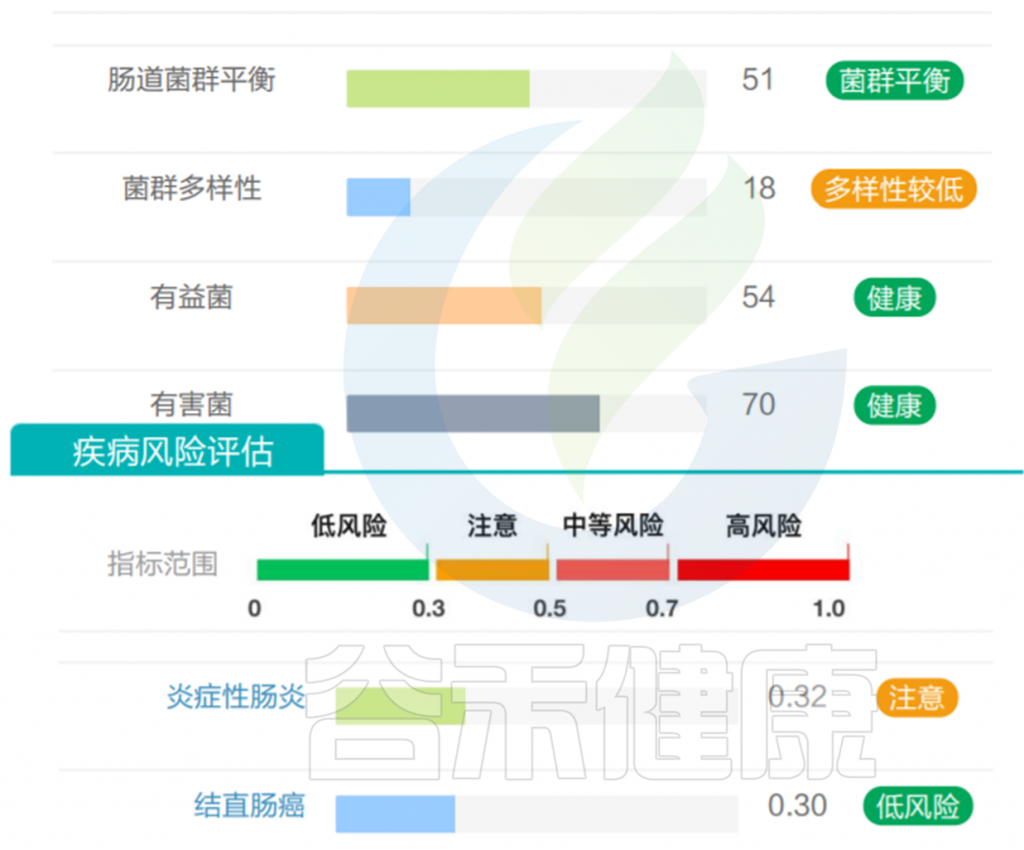
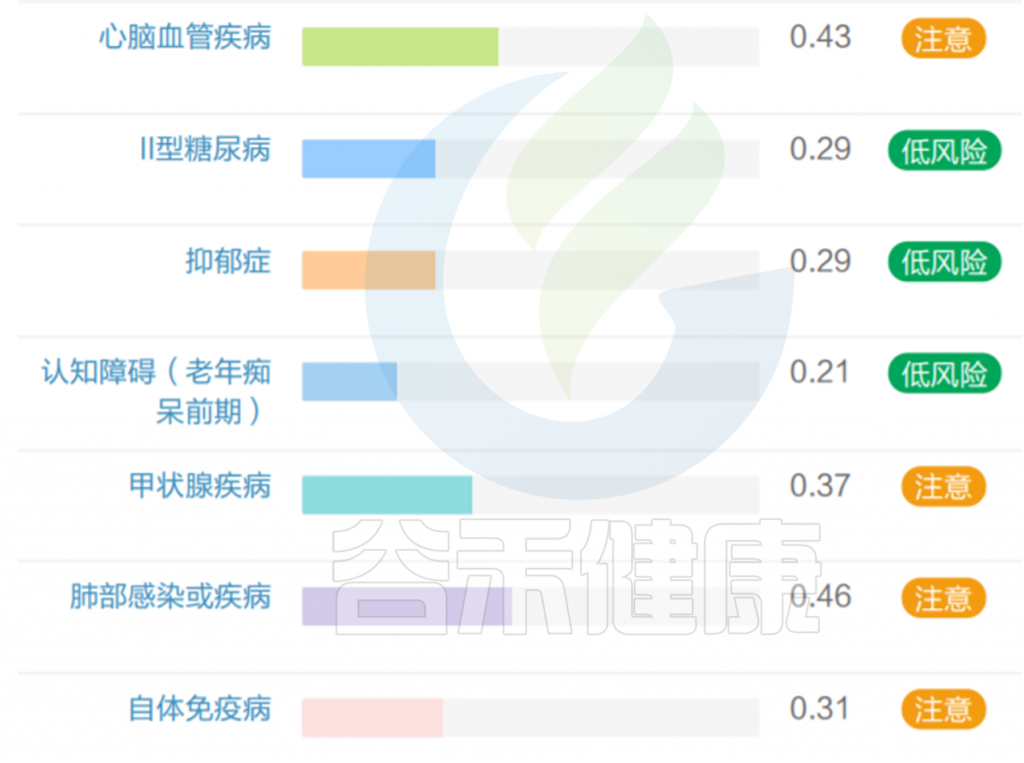
但是也有例外,在我们在最近的检测的一个56岁女士肠道内该菌的丰度占比超50%,菌群构成如下:


然而,好事太多也可能是坏事。它的名字——“muciniphila”的意思是粘液爱好者,指的是它独特的能力,降解黏蛋白和粘液层。过量的Akkermansia 将过度消耗粘液蛋白而存活下来,这是大多数其他细菌所缺乏的生存优势。在这种情况下,非粘液消耗物种的数量显着减少,导致物种多样性减少, Akkermansia 增殖异常,从而可能导致肠道屏障损伤,诱发肠道炎症、LPS 进入血液的增加、自身免疫性疾病有关,神经退行性疾病等。
该样本检测报告也显示菌群多样性低,肠炎和几项慢病注意风险:


此外,在其它研究文献中也得出Akkermansia muciniphila丰度高的负面研究,如:
在中国人中,A. muciniphila菌的丰度与2型糖尿病呈正相关。
血红素在肠道中的过度增生,与A. muciniphila的粘膜溶解活性有关,在特定情况中,A. muciniphila参与促进代谢综合征。
北京协和团队发现Akkermansia muciniphila可能参与了系统性红斑狼疮的发生发展,致自身免疫亢进特征。
通过细菌16S rRNA测序表明其属于疣微菌门(Verrucomicrobia),与Verrucomicrobium spinosum有92%序列相似性,是现在唯一已知的人类肠道疣微菌门成员。其中文译名尚无统一,在文献中以阿克曼黏细菌、艾克曼黏细菌等名字出现。
为了揭示A. muciniphila的功能潜力,对其基因组进行了测序和注释。发现Akkermansia muciniphila在其相对较小的基因组中编码了大量黏蛋白降解酶,黏蛋白被其降解后其下游聚糖副产物可以交叉饲养其他肠道细菌。
根据DNA-DNA杂交(Digital DNA-DNA hybridiztion,dDDH)将23个Akkermansia属的菌株分为4种,分别为:
Akkermansia sp.CAG
Akkermansia sp.KLE
Akkermansia. muciniphila
Akkermansia. glycaniphila
但是发现它包含许多候选粘蛋白酶编码基因,但缺乏编码典型粘液结合域的基因。
种内存在多样性。在整个基因组中发现的大量噬菌体相关序列,表明病毒在该物种的进化中发挥了重要作用。此外,发掘了 37 个胃肠道宏基因组中,确定Akkermansia序列的存在和遗传多样性。在 37 个中,11 个包含 16S 核糖体 RNA 基因序列,与A. muciniphila 的相同 > 95% , 称为Akkermansia-like 微生物。
瓦赫宁根大学微生物实验室从蟒蛇体内分离培养出于A. muciniphila 基因序列具有94.4%相似度的新菌株,并且发现它们也具有相似的特性,将该微生物命名为Akkermansia glycaniphila。
Akkermansia muciniphila是一种肠道中的黏蛋白降解细菌。粘蛋白是肠上皮黏液层的重要组成部分。粘蛋白由杯状细胞产生肠上皮,是高度糖基化的分子,还包括丝氨酸、苏氨酸和半胱氨酸,它们在肠组织表面形成透明的粘液层,是大量肠道微生物栖息的主要部位。
A. muciniphila主要定植在胃肠道的外黏液层,以胃肠道的黏蛋白作为自身生长的碳和氮来源,其消耗黏蛋白与杯状细胞再生黏蛋白能够达到动态平衡,从而维持黏液层稳定。A.muciniphila以及其分泌物,如囊泡(Extracellular vesicles, EV)通过与结肠上皮细胞Toll受体(Toll-like receptor,TLR)结合及调节紧密连接蛋白的表达等来维持肠道稳态,从而改善高脂饮食诱导的肥胖和炎症性肠病等疾病。
此外,粘蛋白还覆盖在呼吸道、消化道和泌尿生殖道的细胞表面。许多癌症(胰腺癌、肺癌、乳腺癌、卵巢癌、结肠癌和其他组织)都会增加粘蛋白的产生。粘蛋白也在肺部疾病中过度表达,例如哮喘、支气管炎、慢性阻塞性肺病 (COPD) 或囊性纤维化。
Akkermansia muciniphila 高度适应从粘蛋白降解中生存——例如,它需要苏氨酸才能生长,并且具有多种适合利用粘蛋白寡糖中的特殊糖类的酶,如唾液酸酶和岩藻糖苷酶,甚至硫酸酯酶。表明宿主动物和AKK菌之间的共同进化进入了高级阶段,并暗示了这些疣状微生物对宿主的潜在功能意义。由于其向其他细菌物种提供粘蛋白降解产物,该物种也是肠道重要的共生菌属。
Akkermansia muciniphila 能够使用粘蛋白作为碳、氮和能量的唯一来源。尽管宿主肠道层中的许多黏液降解微生物可能具有致病性,但A. muciniphila不一样。Akkermansia muciniphila从粘蛋白发酵中产生乙酸盐、丙酸盐和乙醇,以调节宿主的生物学功能,包括宿主免疫反应和脂质代谢。由于A. muciniphila保留在外黏膜层并且不会渗透到内层,因此它的定植是有益的,因为细菌会促进外黏蛋白层的自然更新。
除了基因序列多样性外,这种细菌还表现出多种生物学功能,包括:
促进肠道屏障完整性;
调节免疫反应;
抑制炎症;
交叉喂养他微生物群;
降低某些心脏病风险,如胰岛素抵抗、总血胆固醇和脂肪组织储存;
防止体重增加。

DOI: (10.1111/jam.14911)
促进肠道屏障
肠道屏障是一个多层复杂的系统,它允许营养吸收,同时防止微生物及其产物的易位。肠道屏障的破坏导致管腔内容物进入血流,激活免疫反应并诱发炎症。
粘液覆盖外肠上皮细胞层,起到物理保护作用,防止微生物和有害化合物的渗透。除了降解粘蛋白外,A. muciniphila还被发现可以刺激粘蛋白的产生 。
A. muciniphila在防止人类肠道致病菌增殖中的作用
Kalia VC, et al., Indian J Microbiol. 2021
今年发表在Gut Microbes研究得出,虽然A. muciniphila 是一种粘蛋白降解细菌,但是通过促进分泌型 IEC 的分化,反而增加了粘液的产生。A. muciniphila处理以 Gpr41/43 依赖性方式增强了ISC 增殖,加速肠上皮再生,促进 IEC 发育并维持肠道稳态。
注释:哺乳动物肠上皮细胞(IEC)更新较快,每 3-5 天补充一次。所有类型的 IEC 都源自肠干细胞(ISC)
粘蛋白的周转率为 6-12 小时,内层的周转率约为 1 小时,据信其分泌受神经、激素和旁分泌作用的调节。
在动物模型中,A. muciniphila补充剂使结肠粘液层的厚度增加了大约 3 倍,明显高于由有益细菌植物乳杆菌引起的厚度增加。此外,在体外,发现A. muciniphila通过直接与肠细胞结合来改善肠细胞单层完整性 。
A. muciniphila如何促进粘液厚度尚不清楚。原因之一可能是A. muciniphila通过从降解的粘蛋白中制造短链脂肪酸来刺激粘液周转率,这是合成和分泌粘蛋白的宿主上皮的优选能源。事实上,A. muciniphila补充剂增加了小鼠产生粘蛋白的杯状细胞的数量。
抑制炎症
有证据表明A. muciniphila可以调节炎症。在加速衰老的小鼠模型中补充这种细菌可以减轻炎症 。其他研究也显示了A. muciniphila在不同小鼠模型中的抗炎特性,包括无菌模型、肝损伤模型和肥胖模型。
A. muciniphila可以减少由牙龈卟啉单胞菌引起的瘦或肥胖小鼠的炎症。
此外,A. muciniphila分泌的囊泡能够降低TLR4(Toll-like receptor 4, TLR4)的表达,从而调节NF-κB通路,减少促炎因子IL-6、IL-8的分泌。
调节免疫
A. muciniphila在小鼠体内平衡期间,在诱导肠道驻留 T 细胞方面发挥着宿主相关的作用。
在一项针对围产期 HIV 感染儿童和青少年的横断面研究中报告说,A. muciniphila丰度与升高的IL-6 和可溶性 CD14 相关 。
A. muciniphila降解黏蛋白,释放可以被周围非黏液降解细菌利用的短链脂肪酸(SCFAs)、寡糖等代谢物。SCFAs能抑制组蛋白脱乙酰基酶,从而调节NF-κB通路,减少炎症因子的表达。丁酸可以促进Treg细胞的外周活化,增加结肠中Treg细胞亚群的数量,抑制促炎免疫细胞CD4+T淋巴细胞、CD8+T淋巴细胞活性。
免疫相关的皮肤病——牛皮癣
银屑病(俗称牛皮癣)是一种免疫介导的慢性炎症性皮肤病。研究表明银屑病和肠道炎症之间存在关联。一项研究评估了来自巴西的21名银屑病患者与24名健康对照者的肠道微生物群组成和多样性。与对照组相比,银屑病患者的 Akkermansia muciniphila 数量有所减少。
扩展阅读:牛皮癣看似皮肤病,实则关系到肠道
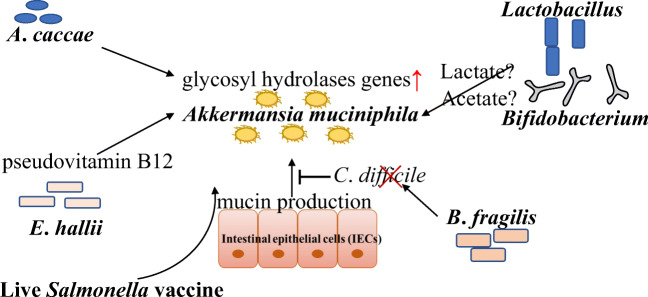
交叉喂养
除了A. muciniphila外,粘液层中还常见其他微生物。产生丁酸盐的细菌不具有降解粘液的能力,而是利用被粘蛋白降解的物种(如A. muciniphila)降解的碳和氮,这些微生物包括细菌如Faecalibacterium prausnitzii,罗斯氏菌等其产生抗炎短链脂肪酸(SCFA)。
产生的乙酸能够促进粪厌氧棒状菌(Anaerostipes caccae),霍氏真杆菌(Eubacterium hallii)。
报道共培养A. muciniphila与非粘液降解丁酸盐产生细菌F. prausnitzii、A. caccae和Eubacteriumhallii导致同养生长和丁酸盐的产生。因此,A. muciniphila不仅自身在保护肠道上皮方面发挥重要作用,而且还支持抗炎肠道微生物群。
A. muciniphila和其他细菌之间的相互作用
Hagi T, et al., Appl Microbiol Biotechnol. 2021
有些细菌不能降解粘蛋白,因此非粘蛋白降解细菌受益于粘蛋白降解细菌。
A. muciniphila产生来自粘液和短链脂肪酸的糖,如乙酸盐和丙酸盐。非粘液降解细菌,如Anaerostipes caccae, Eubacterium hallii and Faecalibacterium prausnitzii ,利用A. muciniphila从粘液中降解的糖进行生长。
A. muciniphila的粘蛋白降解支持了Anaerostipes caccae的生长和丁酸生产。Anaerostipes caccae诱导AKK中粘蛋白降解基因的表达增加,核糖体基因的表达减少。
防止体重增加
普遍发现A. muciniphila在瘦个体中更为丰富。在超重个体中,细菌的丰度较低。
在小鼠中,与肥胖小鼠的丰度相比,瘦动物粪便中A. muciniphila丰度增加之间的相关性表明了这种意义,并且观察到在数周内每天向高脂肪饮食诱导的肥胖小鼠喂食Akkermansia显然可以逆转这种诱导的肥胖以及改善上皮完整性和相关效应。
也有一些数据表明,A. muciniphila干预可能成为人类受试者肥胖改善方案的基础。但是强调只有活的Akkermansia菌才能在小鼠中产生这种效果,但是发现高温预处理杀菌的细胞甚至纯化的Akkermansia蛋白,与活细胞治疗的效果相比,Akkermansia的热杀死细胞似乎对高脂肪饮食肥胖小鼠具有相同甚至增强的有益效果。
此外,A. muciniphila通过分解粘蛋白产生醋酸盐这样的 SCFAs,对我们的体重产生积极影响。因为乙酸盐可以阻止我们感到饥饿,从而防止体重增加。
A.muciniphila治疗不会显著改变饮食诱导的肥胖小鼠的肠道微生物组成,但它可以逆转HFD诱导的代谢紊乱,包括脂肪质量增加、代谢内毒素血症、脂肪组织炎症和胰岛素抵抗,这表明它可能用于预防或治疗肥胖和相关的代谢紊乱。
人类肠道微生物群中丰富的A.muciniphila可预防疾病
Kalia VC, et al., Indian J Microbiol. 2021
改善代谢
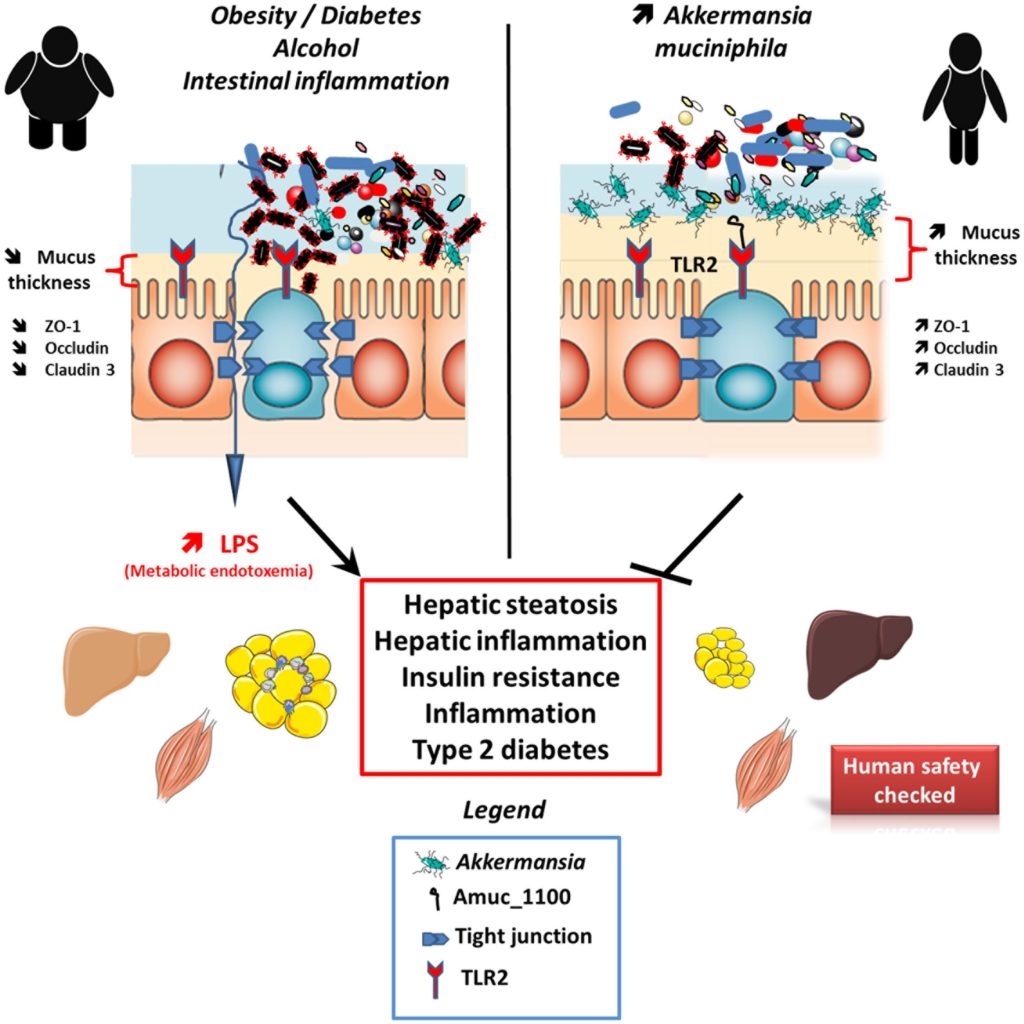
A. muciniphila补充剂能够恢复肥胖和 2 型糖尿病小鼠的粘液厚度,其中高脂肪饮食治疗破坏了肠道粘液;该治疗还导致血清脂多糖 (LPS) 显着减少,这是一种代谢性内毒素血症,并改善了代谢状况。
对肥胖小鼠施用Akkermansia还通过减少循环中的炎性脂多糖和减轻胰岛素抵抗而导致观察到的“代谢性内毒素血症”减少作为小鼠肥胖的心脏代谢并发症,如动脉硬化。至少来自小鼠模型的结论Akkermansia效应得到了许多不同研究的支持。
A. muciniphila及其衍生产物对宿主代谢的影响
Cani PD,et al.,Front Microbiol. 2017
非酒精性脂肪性肝
与野生型小鼠相比,在NAFLD小鼠中观察到A. muciniphila丰度显著降低,而导致A.muciniphila丰度增加的干预措施改善了代谢参数。使用益生元(如低聚果糖)可以恢复A.muciniphila的丰度,并改善相关疾病。
酒精性肝病
酒精性肝病(ALD)由脂肪变性、纤维化和肝硬化发展为急性酒精性脂肪性肝炎,死亡率高,但治疗方法非常有限。结果发现,内毒素血症水平升高的酒精性肝病患者肝损伤程度增加。乙醇消耗引起的肠道紧密连接的破坏导致炎症信号通过病原体相关的分子模式,如脂多糖。
研究ALD患者队列时,发现与健康受试者相比,ALD患者粪便A. muciniphila数量减少。给乙醇喂养的小鼠口服粘液粘菌A. muciniphila可恢复该细菌的消耗,减少肠漏,增加Claudin-3和Occludin的紧密连接表达。因此,炎症和肝损伤促进细胞因子白介素1β (IL-1β)和肿瘤坏死因子α (TNF-α)明显减少,导致MPO +中性粒细胞浸润,改善肝损伤。
扩展阅读:深度解析 | 肠道菌群与慢性肝病,肝癌
改善血糖和胰岛素抵抗
A. muciniphila在糖耐量正常的人群中比糖尿病前期或 II 型糖尿病人群中的数量更多。
事实上,这些细菌已被证明可以增强称为二甲双胍的抗糖尿病药物的作用。在喂食高脂肪饮食的小鼠中,二甲双胍治疗增加了A. muciniphila的数量 并改善了它们的血糖水平。
同样,喂食高脂肪饮食的小鼠口服A. muciniphila但不服用二甲双胍,对葡萄糖的耐受性也有所提高。因此,这种细菌通过改变肠道微生物群,可能有助于在未来找到控制 2 型糖尿病的新方法。
扩展阅读:2型糖尿病如何做到可防可控?肠道菌群发挥重要作用
癌症免疫治疗
Akkermansia muciniphila也可以积极影响宿主对癌症免疫疗法的反应。研究发现,抗生素的消耗与对免疫治疗 PD-1 阻断剂的反应较差有关。进一步研究确定较低水平的Akkermansia muciniphila确实对反应率有直接影响,给抗生素治疗的小鼠口服细菌补充剂,发现它恢复了它们对免疫疗法的反应。根据这项研究,有人建议维持健康的肠道菌群,主要包括Akkermansia muciniphila,对于提高癌症免疫治疗有效性很重要。
此外,Akkermansia muciniphila通过刺激 DCs 产生 IL-12 并促进 CCR9 + CXCR3 + CD4 +的积累来增强 ICB 功效 上皮肿瘤和淋巴结中的 T 细胞。
根据美国癌症研究中心新研究显示Akkermansia muciniphila提升免疫检查点抑制剂的效果,还能产生大量调节T细胞反应的肌苷。食用高纤维食物可以有效地调节肿瘤微环境中的单核巨噬细胞的组成,而食用得越多,Akkermansia muciniphila的肠道菌数量就会更多。
该菌还能产生大量环二腺苷酸,即使是无菌小鼠,仅仅植入Akkermansia muciniphila,它们也能有更强的抗癌反应。未来,或许一种通过食物和环二腺苷酸联合的促进抗癌疗法就在眼前。
神经退行性疾病
肌萎缩性侧索硬化症(amyotrophic lateral sclerosis, ALS)是一种复杂的神经退行性疾病,患者通常会出现运动神经元的过早死亡,导致诊断后的平均生存时间不足5年。然而,针对肌萎缩性侧索硬化症的药物所做的巨大努力却收效甚微。
急性ALS小鼠模型经抗生素治疗后显示,微生物群失调在渐冻症的进展和恶化中起着重要作用。
通过挑选11株与ALS相关的微生物菌株,包括A.muciniphila和单接种到经抗生素治疗的ALS小鼠中,只有A.muciniphila与运动神经元改善相关。
其他疾病,例如,帕金森病与对照组的肠道微生物组组成显著不同, Akkermansia 丰度增加。
年龄
年龄和地理环境等因素影响人体A. muciniphila的数量。从婴幼儿时期开始A. muciniphila在人类胃肠道定植,并在一年后迅速接近成年人的水平。随着年龄增长A. muciniphila在人体内的数量逐渐降低。
不同的是,另一研究发现大于60岁人群A. muciniphila的数量升高。此外,另外研究发现在百岁长寿老人中A. muciniphila数量显著增加,提示A. muciniphila水平的升高可能有助于延缓机体的衰老。
对两种类型的早衰综合征小鼠模型,外用该菌A. muciniphila可显著提高小鼠的健康寿命。
地理位置
另外,不同地理位置A. muciniphila在人群中定植也存在差别。如通过细菌16S rRNA分析发现,智利健康受试者粪便中的微生物菌群和巴布亚新几内亚受试者有明显不同;但与美国和阿根廷受试者接近;A. muciniphila在智利受试者的丰富度最高。
中国南方的男性和女性定植率没有差异,但是中国南方人群的A. muciniphila定植率低于欧洲人群。暨南大学理工学院在广州地区人群的A. muciniphila定植率为89.31%,平均丰度为5.825 lg(CFU/mL)。肠道消化模拟不同时间点的RT PCR结果显示,A. muciniphila在模拟人类肠道微生物菌群环境中具备生存能力;对Bifidobacterium属和Bacteroides属具有抑制效果,对Lactobacillus属具有促进作用。
2021年在Nature发表的文章中,研究人员将古肠道样本数据和一组来自于已测序的工业化及非工业化生活方式下现代人群的粪便样本数据进行对比。比起非工业化样本和古粪便,包括Akkermansia muciniphila(可降解人体粘液)在内的BloSSUM类群在工业化样本中更丰富。
工业化生活下微生物群落中的粘液降解菌和基因更普遍,这可能是由西方饮食导致的。
药物
药物是影响肠道A.muciniphila丰度的重要因素之一。首先,抗菌药物作用后可以直接影响肠道A.muciniphila的数量。
在小鼠出生后早期用万古霉素进行干预可以有效预防1型糖尿病,显著降低小鼠血糖值以及减轻胰岛炎症;而对8周龄小鼠未见明显预防效果。万古霉素作用于幼儿时期的小鼠使A. muciniphila成为胃肠道优势菌群,该研究提示A. muciniphila可能是推迟1型糖尿病的关键菌群。
对60例6~11个月的婴儿使用阿奇霉素治疗3 d后,婴儿A. muciniphila数量显著减少。此外Dubourg等的研究中,2例成人患者经过抗生素(强力霉素、哌拉西林、羟氯喹、亚胺培南等)治疗后,A. muciniphila数量显著增加,在肠道菌群的比例均大于40%。
有趣的是,在另外一项小鼠模型中也发现类似现象,给小鼠灌胃四联抗生素(氨苄青霉素,万古霉素,新霉素和甲硝唑)可显著逆转免疫抑制剂导致的A. muciniphila数量减少。这些研究表明抗菌药物等药物使用会影响肠道内A. muciniphila数量的变化,其对人体代谢产生的影响需进一步研究。
最新的研究发现,代谢综合征相关治疗药物对A.muciniphila丰度的影响可能参与其作用机制。如二甲双胍通常用作治疗代谢综合征(如肥胖和2型糖尿病)的一线用药。
对14例服用二甲双胍的糖尿病患者进行肠道菌群分析,与未服用二甲双胍的糖尿病患者以及健康受试者相比,A. muciniphila显著增加。在体外实验中,收集二甲双胍治疗组和对照组小鼠的粪便,发现二甲双胍培养组A. muciniphila的比例显著增加。
在另外一项研究使用另外一种代谢病治疗药物利拉鲁肽(Liraglutide)。对高脂饮食诱导的肥胖小鼠进行皮下注射给药,连续15 d给药后处死小鼠,收集肠道内容物进行菌群分析,发现治疗小鼠肠道中A. muciniphila显著增加。此外,抗肿瘤药物也可以影响肠道A.muciniphila的丰度。如在胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)异种移植的小鼠模型中发现,吉西他滨(Gemcitabine)治疗后使A. muciniphila在肠道中的数量显著增加(5%~33%)。
饮食方式
饮食对肠道A.muciniphila影响最显著。
与正常饮食组相比,高蛋白饮食显著降低大鼠肠道A. muciniphila。
Akkermansia 的数量随着短期(3 周)低FODMAPs饮食而减少。这不足为奇,因为 FODMAP 基本上与益生元纤维相同。
Akkermansia在生酮饮食中显着增加,并且与 Parabacteroides一起,可能是减少酮症癫痫发作的原因。
小鼠实验表明,A.muciniphila数量受到高脂饮食的强烈影响,高脂饮食三周后A.muciniphila丰度开始下降,并且A.muciniphila丰度与体脂呈负相关。
与高脂高糖饮食组相比,小鼠食用热带水果8周后,可以显著增加A. muciniphila在胃肠道中的丰度;同时干预后可以降低高脂高蔗糖饮食喂养小鼠的内毒素血症,改善其胰岛素敏感性。
饱和脂肪含量高的饮食与较高的炎症发生率有关。而富含多不饱和脂肪酸的饮食,如亚麻籽和鱼油中的那些,已被证明可以抵抗炎症,并且与更瘦的人有关。
这些膳食脂肪也会影响肠道中A. muciniphila的水平。

在一项研究中,老鼠被喂食由不同脂肪组成的不同饮食。一组喂猪油,另一组喂鱼油十一周,结果很有趣。
在鱼油喂养组中,A. muciniphila的丰度增加,乳酸杆菌的丰度也增加。
然后将两组的粪便材料移植到新的小鼠组中,在接受鱼油喂养小鼠粪便移植的小鼠中,它们的A. muciniphila水平增加,炎症水平降低。然而,接受猪油喂养小鼠移植的小鼠的炎症水平很高。
因此,摄入的膳食脂肪类型也会极大地影响肠道中A. muciniphila的数量。
我们已经知道多酚可以减少炎症并有助于预防许多疾病,因此高多酚食物可以增加Akkermansia.
多酚是强大的抗氧化剂,可以对抗体内的自由基(与多种疾病有关的化合物,包括糖尿病、心脏病和癌症)。
有许多不同类型的多酚。其中一些不能很好地被身体吸收留在肠道中,这对 Akkermansia来说是个好消息,它们吞噬了多酚并因此增强其力量,从而达到双赢。
此外,丁酸钠和菊粉、北极浆果提取物、绿茶提取物和异麦芽寡糖、膳食多酚等这些益生元也能增加Akkermansia丰度。
含有高水平多酚和鱼油的食物是提高A. muciniphila菌最好的食物。
高多酚食品
多酚使食物一般颜色丰富多彩,尝起来略带苦味或酸味。泡了很长时间的茶尝起来很苦:浸泡时间越长,茶多酚含量越高。浓橄榄油的青草味或红酒的味道也是很好的例子。

在自然界中,苦味可以抵御想要攻击植物的昆虫。有超过8000种多酚。一些例子是红酒中的白藜芦醇、辣椒中的辣椒素、百里香中的百里酚、肉桂中的肉桂酸、迷迭香中的迷迭香酸。
食物中多酚的含量在很大程度上取决于其生长的土壤、成熟度以及种植、运输和制备方式,因此以下列表仅供参考。
高多酚食品:
蔓越莓、石榴、山莓、黑莓、蓝莓、草莓、樱桃、李子、亚麻种子、黑巧克力、栗子、红茶、绿茶、苹果汁、苹果、黑麦面包、核桃、榛子、红酒。

其他常见的高多酚食物包括葡萄、橄榄、菠菜、李子和桃子。一般来说,颜色越深越好,所以选择绿色的黑橄榄和葡萄。
油性鱼
Akkermansia 喜欢鱼油,但目前还不清楚它们喜欢鱼油的特定成分——例如脂肪酸——或者它们喜欢所有的部分。所以目前,最好吃鱼。
尽管鱼油现在是有争议的,一些科学家认为它的好处被夸大了。研究人员发现,食用整条鲑鱼的一组人的 DHA(一种脂肪酸)水平是食用鱼油的一组人的 9 倍。食用鱼类的同时既增加鱼油,同时增加优质蛋白质摄入,均有助于A. muciniphila。
试着每周吃两到三份鱼:
沙丁鱼、鲭鱼、鲱鱼、三文鱼、鳟鱼、鳀鱼、旗鱼、金枪鱼

补充膳食纤维,选择有机产品。
含纤维的食物:
生菊苣根、绿色蒲公英 、麦麸 、芦笋 、大蒜、香蕉 、洋葱 、韭菜,也存在于燕麦片、红酒、蜂蜜、枫糖浆、豆类和其他食物中。
避免高脂肪饮食和酒精
微生物多样性是我们肠道健康的主要目标。实现这一目标的最佳方法是均衡饮食,吃能让肠道菌群快乐的食物,从而你的感觉也会良好。
难点
A. muciniphila与机体健康联系紧密,有潜力成为新型益生菌。但目前A. muciniphila是专性厌氧菌且难以培养,成为新型益生菌,还有以下几点重要问题亟待解决:
首先,需研发高效快速培养A. muciniphila的新技术。目前实验室或小规模已经成功在实验室中获得活性A. muciniphila,并且能够稳定,但是这只是实验室规模生产,大规模的工业生产仍是需要解决的问题。比如培养基中存在蛋白质来源问题,是否会对人体可能有过敏反应,工业化生产时需研发合理的工业化生产培养基。
其次,需确定安全有效的治疗人群。目前A. Muciniphila 与改善肝功能、降低葡萄糖毒性、减轻氧化应激和抑制炎症有强关联,但是,在炎症性肠病、动脉粥样硬化等其他疾病中的干预,不同研究中存在不同的结果,对于其作为药物面对的安全问题,其应用仍待商榷。
最后,需要优化A. muciniphila的补充或给药方式。在体外模拟胃肠道的释放实验中,发现包封的 A. muciniphila活性比直接分散在模拟胃肠道的系统中活性更高,并且能够定向在肠道释放细菌,显著增加A. muciniphila对胃的抵抗力,对于实现在肠道的定向给药还需要更多的实验进行优化。
最后,尽管已经有研究证明有活性的A. muciniphila或者是巴氏消毒的A. muciniphila对人体是安全的,但目前A. muciniphila的临床研究较少,在临床上应用还需要更多的实验验证。
主要参考文献
Hasani A, Ebrahimzadeh S, Hemmati F, Khabbaz A, Hasani A, Gholizadeh P. The role of Akkermansia muciniphila in obesity, diabetes and atherosclerosis. J Med Microbiol. 2021 Oct;70(10). doi: 10.1099/jmm.0.001435. PMID: 34623232.
Zhang T, Ji X, Lu G, Zhang F. The potential of Akkermansia muciniphila in inflammatory bowel disease. Appl Microbiol Biotechnol. 2021 Aug;105(14-15):5785-5794. doi: 10.1007/s00253-021-11453-1. Epub 2021 Jul 27. PMID: 34312713.
Druart C, Plovier H, Van Hul M, Brient A, Phipps KR, de Vos WM, Cani PD. Toxicological safety evaluation of pasteurized Akkermansia muciniphila. J Appl Toxicol. 2021 Feb;41(2):276-290. doi: 10.1002/jat.4044. Epub 2020 Jul 28. PMID: 32725676; PMCID: PMC7818173.
Kalia VC, Gong C, Shanmugam R, Lin H, Zhang L, Lee JK. The Emerging Biotherapeutic Agent: Akkermansia. Indian J Microbiol. 2021 Dec 16:1-10. doi: 10.1007/s12088-021-00993-9. Epub ahead of print. PMID: 34931096; PMCID: PMC8674859.
Yu Y, Lu J, Sun L, Lyu X, Chang XY, Mi X, Hu MG, Wu C, Chen X. Akkermansia muciniphila: A potential novel mechanism of nuciferine to improve hyperlipidemia. Biomed Pharmacother. 2021 Jan;133:111014. doi: 10.1016/j.biopha.2020.111014. Epub 2020 Nov 26. PMID: 33246225.
Cheng D, Xie MZ. A review of a potential and promising probiotic candidate-Akkermansia muciniphila. J Appl Microbiol. 2021 Jun;130(6):1813-1822. doi: 10.1111/jam.14911. Epub 2020 Nov 15. PMID: 33113228.
Hagi T, Belzer C. The interaction of Akkermansia muciniphila with host-derived substances, bacteria and diets. Appl Microbiol Biotechnol. 2021;105(12):4833-4841. doi:10.1007/s00253-021-11362-3
Anhê, F. F et al. (2016). Triggering Akkermansia with dietary polyphenols: A new weapon to combat the metabolic syndrome?. Gut microbes, 7(2), 146–153.
Schade L, Mesa D, Faria AR, Santamaria JR, Xavier CA, Ribeiro D, Hajar FN, Azevedo VF. The gut microbiota profile in psoriasis: a Brazilian case-control study. Lett Appl Microbiol. 2021 Dec 12. doi: 10.1111/lam.13630. Epub ahead of print. PMID: 34897759.
Belzer, C et al. (2017). Microbial Metabolic Networks at the Mucus Layer Lead to Diet-Independent Butyrate and Vitamin B12 Production By Intestinal Symbionts. American Society for Microbiology: 8(5).
Caesar, R et al. (2015). Crosstalk Between Gut Microbiota and Dietary Lipids Aggravates WAT Inflammation Through TLR Signalling. Cell Metab: 22(4), pp 658-668.
Dao, M, C et al. (2015). Akkermansia muciniphila and Improved Metabolic Health During a Dietary Intervention in Obesity: Relationship with Gut Microbiome Richness and Ecology. Gut.
de Vos, W, M. (2017). Microbe Profile: Akkermansia muciniphila: A Conserved Intestinal Symbiont that Acts as The Gatekeeper of our Mucosa. Microbiology: 163(5).
Derrien, M et al. (2017). Akkermansia muciniphila and its Role in Regulating Host Functions. Microbial Pathogenesis: 106, pp 171-181.
Everard, A et al. (2013). Cross-Talk Between Akkermansia muciniphila and intestinal Epithelium Controls Diet-Induced Obesity. PNAS: 110(22), pp 9066-9071.
Geerlings, S, Y et al. (2018). Akkermansia muciniphila in the Human Gastrointestinal Tract: When, Where, and How? Microorganisms: 6(3).
Krishnan, A. (2016). Akkermansia muciniphila: What You Need to Know About this Bacterium. uBiome.
Naito, Y et al. (2018). A Next-Generation Beneficial Microbe: Akkermansia muciniphila. J. Clin. Biochem. Nutr: 63(1), pp 33-35.
Ottman, N et al. (2017). Pili-Like Proteins of Akkermansia muciniphila Modulate Host Immune Responses and Gut Barrier Function. PLOS One.
Pierre, J, F et al (2015). Cranberry Proanthocynaidins Improve the Gut Mucous Layer Morpohology and Function in Mice Receiving Elemental Enteral Nutrition. JPEN J Parenter Enteral Nutr: 37(3), pp 401-409.
Shin, N, R et al. (2013). An Increase in the Akkermansia spp. Population Induced by Metformin Treatment Improves Glucose Homeostasis in Diet-Induced Obese Mice. Gut: 63, pp 706-707.
Zhang, T et al. (2019). Akkermansia muciniphila is a promising probiotic. Microbial Biotechnology.
Ouyang J, Lin J, Isnard S, et al. The Bacterium Akkermansia muciniphila: A Sentinel for Gut Permeability and Its Relevance to HIV-Related Inflammation. Front Immunol. 2020;11:645. Published 2020 Apr 9. doi:10.3389/fimmu.2020.00645
Zhou K. Strategies to promote abundance of Akkermansia muciniphila, an emerging probiotics in the gut, evidence from dietary intervention studies. J Funct Foods. 2017;33:194-201. doi:10.1016/j.jff.2017.03.045
Naito, Y., Uchiyama, K. & Takagi, T. A next-generation beneficial microbe: Akkermansia muciniphila. J Clin Biochem Nutr 63, 33–35 (2018).
Derrien, M., Vaughan, E. E., Plugge, C. M. & de Vos, W. M. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. Int. J. Syst. Evol. Microbiol. 54, 1469–1476 (2004).
Hansson, G. C. Role of mucus layers in gut infection and inflammation. Curr. Opin. Microbiol. 15, 57–62 (2012).
van der Lugt, B. et al. Akkermansia muciniphila ameliorates the age-related decline in colonic mucus thickness and attenuates immune activation in accelerated aging Ercc1-/Δ7 mice. Immun. Ageing 16, 6 (2019).
Lukovac, S. et al. Differential modulation by Akkermansia muciniphila and Faecalibacterium prausnitzii of host peripheral lipid metabolism and histone acetylation in mouse gut organoids. MBio 5, (2014).
Dao, M. C. et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut 65, 426–436 (2016).
Depommier, C. et al. Supplementation with Akkermansia muciniphila in overweight and obese human volunteers: a proof-of-concept exploratory study. Nat. Med. 25, 1096–1103 (2019).
Png, C. W. et al. Mucolytic bacteria with increased prevalence in IBD mucosa augment in vitro utilization of mucin by other bacteria. Am. J. Gastroenterol. 105, 2420–2428 (2010).
Anhê, F. F. et al. A polyphenol-rich cranberry extract protects from diet-induced obesity, insulin resistance and intestinal inflammation in association with increased Akkermansia spp. population in the gut microbiota of mice. Gut 64, 872–883 (2015).
Pierre, J. F. et al. Cranberry proanthocyanidins improve the gut mucous layer morphology and function in mice receiving elemental enteral nutrition. JPEN J Parenter Enteral Nutr 37, 401–409 (2013).
Vinson, J. A. & Cai, Y. Nuts, especially walnuts, have both antioxidant quantity and efficacy and exhibit significant potential health benefits. Food Funct 3, 134–140 (2012).
Mao, B. et al. Effects of different doses of fructooligosaccharides (FOS) on the composition of mice fecal microbiota, especially the bifidobacterium composition. Nutrients 10, (2018).