-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
近年来,免疫治疗在癌症治疗领域展现出了巨大的潜力,特别是针对PD1/PDL1通路的免疫检查点抑制剂(ICIs)已在多种实体瘤患者中取得显著疗效。然而,治疗反应的异质性和耐药性的出现依然是当前面临的主要挑战之一。越来越多的研究表明,肠道菌群作为人体内一个庞大的微生态系统,不仅参与机体代谢和免疫调控,而且在调节肿瘤免疫反应方面发挥着关键作用。
让我们快速了解一下肠道菌群如何通过细胞水平、分子信号通路和代谢产物来影响PD1/PDL1肿瘤免疫疗法的疗效。
1 核心菌群与免疫调控机制
多项临床与实验室研究均显示,特定菌群对PD1/PDL1免疫检查点抑制剂治疗具有显著的正向作用。
例如,Bifidobacterium属菌群被发现能显著促进抗PDL1疗法的抗肿瘤作用;而Akkermansia muciniphila在PD1抑制治疗中也表现出与治疗反应正相关的趋势。此外,研究还发现,黑色素瘤患者中较高的微生物多样性和特定菌群如Ruminococcaceae和Faecalibacterium的丰富度均与更长的无进展生存期相关。
肠道菌群对免疫调控的机制主要表现在以下几个方面:
促进树突状细胞成熟:某些菌群(如Bifidobacterium)可通过激活树突状细胞,从而增强抗原呈递能力,提高CD8+ T细胞的活性。
调节T细胞免疫状态:特定菌群通过影响细胞因子分泌和T细胞亚群分布,调节包括CD8+效应T细胞和调节性T细胞(Treg)在内的免疫平衡,从而实现抗肿瘤效应。
通过代谢产物发挥作用:菌群代谢产物,如短链脂肪酸(SCFAs)和次级胆汁酸,对免疫细胞储存、功能激活具有直接调控作用。
这些作用机制不仅在单一免疫治疗模式中发挥效应,同时也对联合治疗(例如PD1/PDL1抑制剂与CTLA-4抑制剂联合使用)产生协同增效作用。
2 关键代谢物及其信号调控路径
肠道菌群通过发酵膳食纤维等底物,产生大量的短链脂肪酸(SCFAs),如丁酸盐和丙酸盐,这些代谢物在调节宿主免疫功能中起到关键作用。研究发现,短链脂肪酸不仅参与维持肠道上皮屏障的稳定,还能调节T细胞分化和促炎/抗炎反应的平衡。此外,菌群代谢的次级胆汁酸也被证明在免疫抑制和调控细胞因子水平中起到重要作用。
值得注意的是,不同菌群通过生成不同的代谢产物,对免疫系统的影响可能存在正负两方面的效应。例如,有研究显示高浓度的丁酸盐和丙酸盐可能会在某些条件下限制CTLA-4抑制剂的疗效,从而提示适度平衡菌群代谢产物对于免疫治疗的成功至关重要。同时,某些菌群如Prevotellaceae和Rikenellaceae则可能通过降低丁酸盐水平来促进促炎性巨噬细胞M1型的极化,从而间接影响免疫治疗的疗效。
3 不同肿瘤类型中的菌群特征与免疫应答
肠道菌群对免疫治疗的影响在不同肿瘤类型中可能存在显著差异。下面介绍一下在黑色素瘤、非小细胞肺癌(NSCLC)、肝细胞癌(HCC)以及结直肠癌(CRC)中的相关发现。
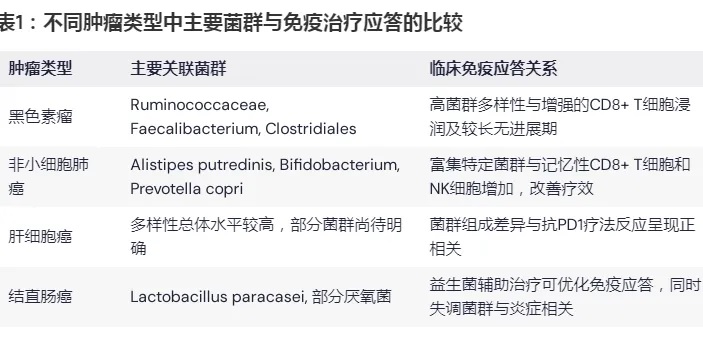
表1说明:各肿瘤类型中显示出菌群多样性和特定菌群丰度与PD1/PDL1免疫治疗效果之间存在明显相关性,该表对比了不同肿瘤中的主要菌群与免疫应答情况。
4 肠道菌群调控机制的分子与细胞通路
肠道菌群通过多条分子信号通路及细胞间相互作用调控宿主的免疫反应,进而影响PD1/PDL1免疫治疗的疗效。
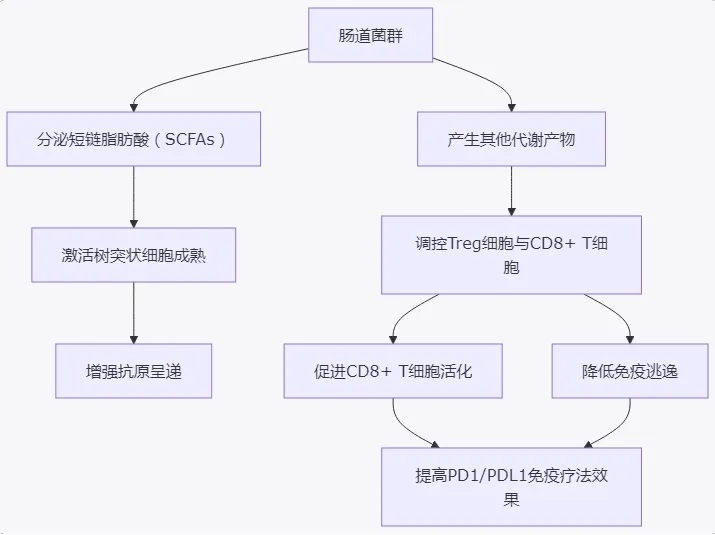
图1:肠道菌群通过分泌代谢产物调控树突状细胞成熟、T细胞活性与调节性T细胞平衡,从而增强PD1/PDL1免疫治疗效果。
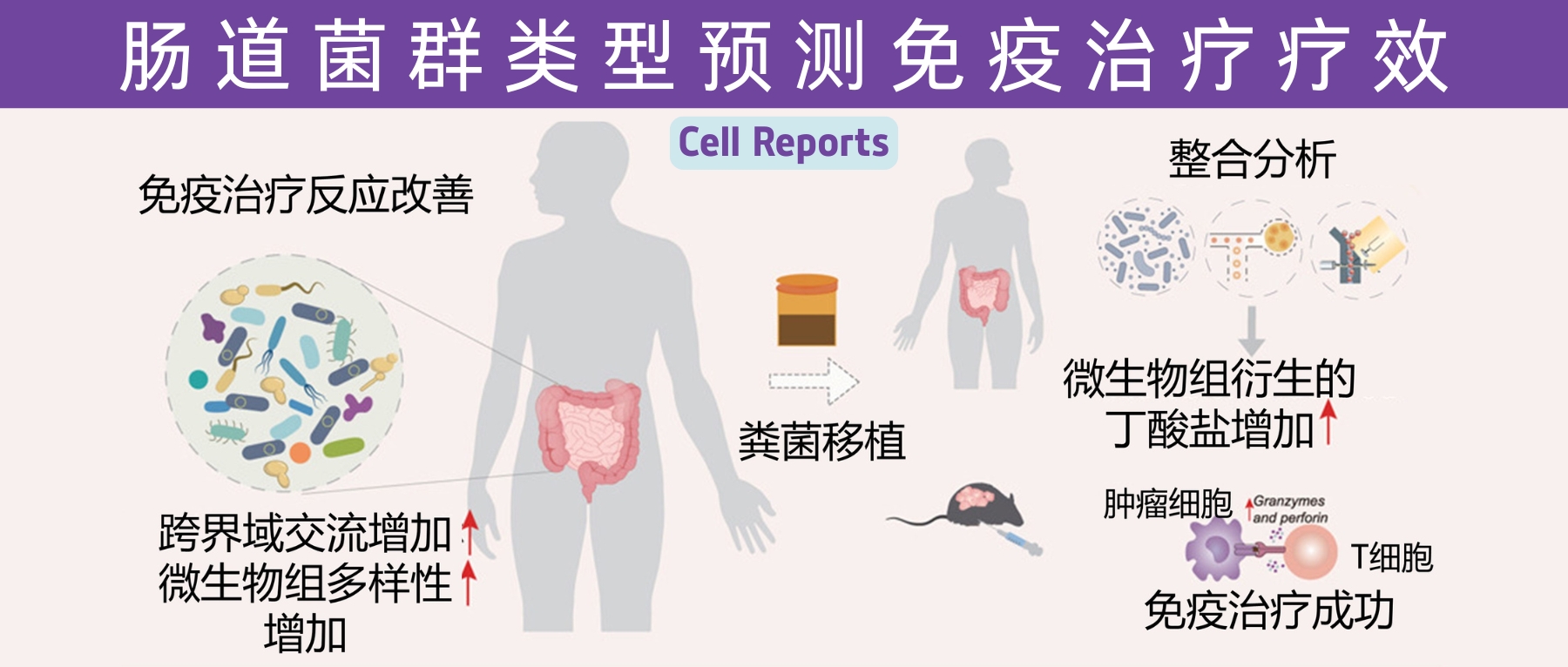
近日,一项来自上海交通大学医学院研究团队的成果发表在《Cell Reports》,通过整合多组学数据与临床队列,揭示了基于肠道菌群分类(有利型与不利型)与抗PD-1/PD-L1免疫治疗疗效的显著关联。

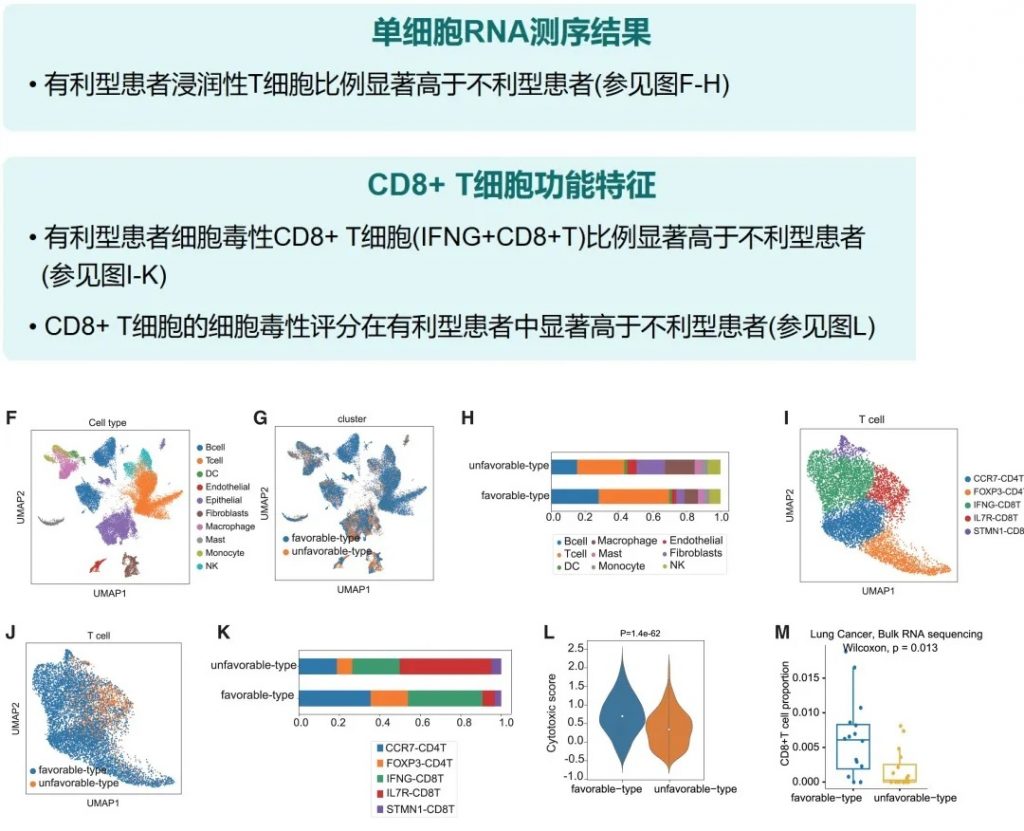
其中,有利型患者表现出更高的真菌与细菌多样性、富集丁酸代谢通路及促免疫菌群(如Faecalibacterium prausnitzii),以及肿瘤微环境中细胞毒性CD8+ T细胞浸润增强的特征,且在多癌种队列中显著关联于抗PD-1/PD-L1治疗的临床缓解与生存获益。
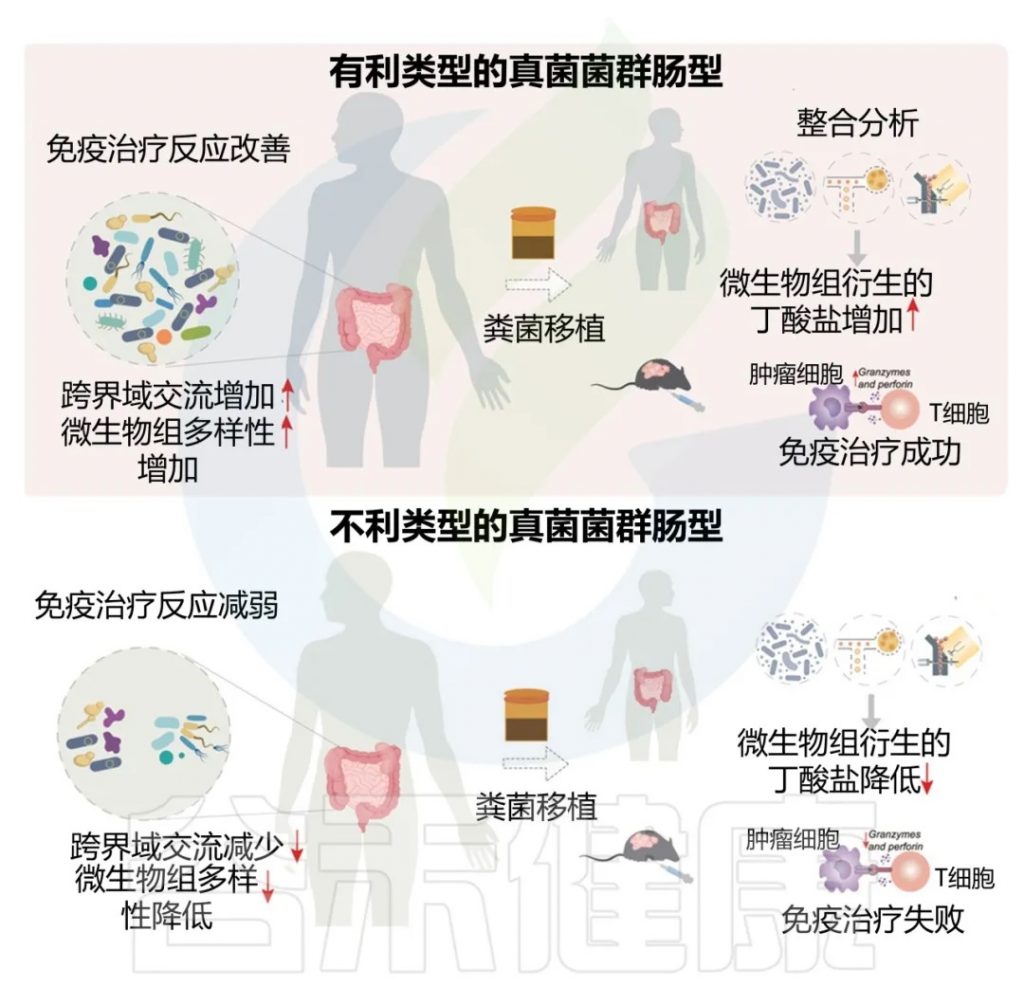
进一步通过FMT实验证实,移植来自有利型供体的粪便可显著提升受体对免疫治疗的敏感性,并重塑肠道菌群代谢功能。
这些发现不仅深化了对肠道真菌组-细菌互作网络的理解,为优化个体化免疫治疗提供了新型生物标志物,更为优化免疫治疗分层策略及FMT供体筛选提供了科学依据,具有重要的临床转化潜力。

多组学关联分析与肠道菌群类型特征
详细对比了两种肠道菌群类型的微生物群落特征差异,包括多样性、产丁酸菌含量、代谢通路等,并展示了它们与临床疗效的关联。
粪便微生物移植实验验证
呈现了临床FMT研究和动物模型验证结果,证明来自有利型供体的FMT可显著提升受体对免疫治疗的敏感性。
总结了研究的创新点及其在预测分层和干预优化方面的临床应用价值。
肠道菌群类型:免疫治疗疗效的新生物标志物
免疫检查点抑制剂(如抗PD-1/PD-L1)显著改变了癌症治疗格局,但患者反应差异大。
该研究团队采用无监督聚类方法分析肠道菌群组成,在多个独立队列中成功识别并验证了两种截然不同的类型——“有利型”与“不利型”,这一发现揭示了肠道菌群对免疫治疗应答的预测价值。

肠道菌群的类型不仅与临床反应相关,还与患者总生存期密切相关,为个体化治疗策略提供了新思路。
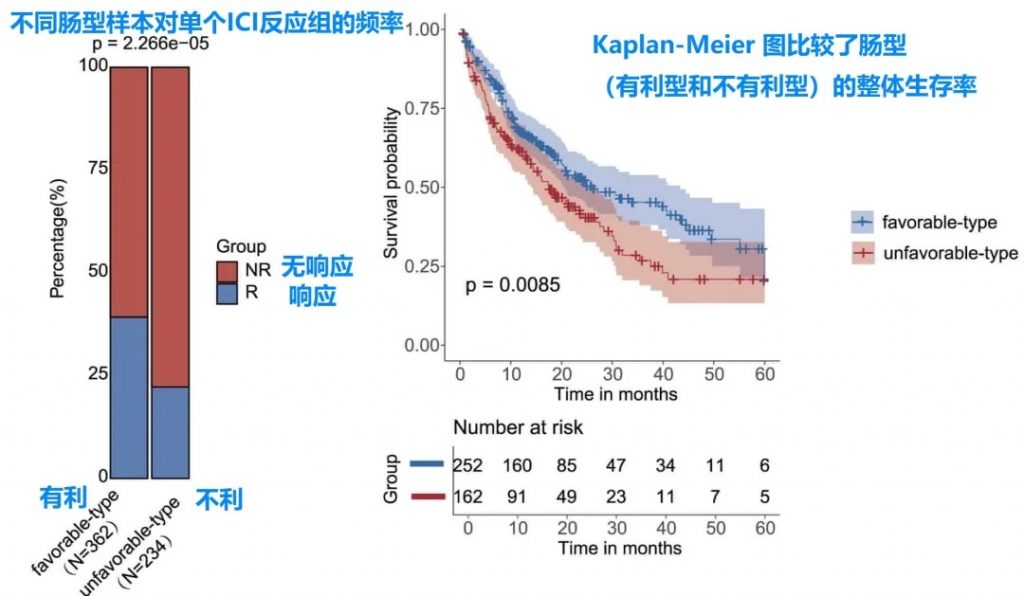
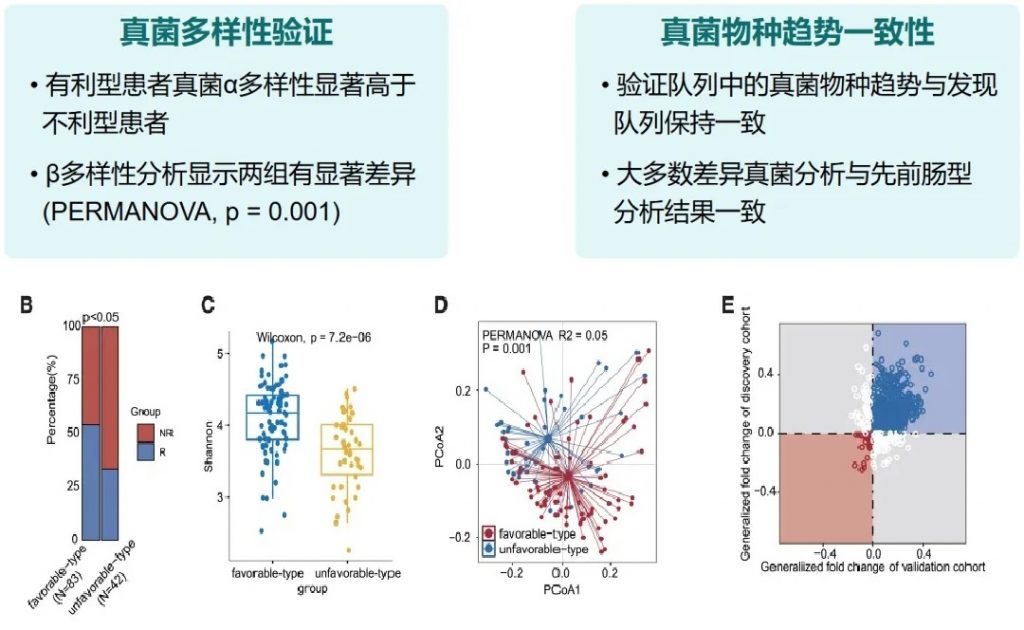
有利型患者对抗PD-1/PD-L1免疫治疗的响应率显著高于不利型 (p=2.266e−5),总生存期也更长 (p=0.0085)。
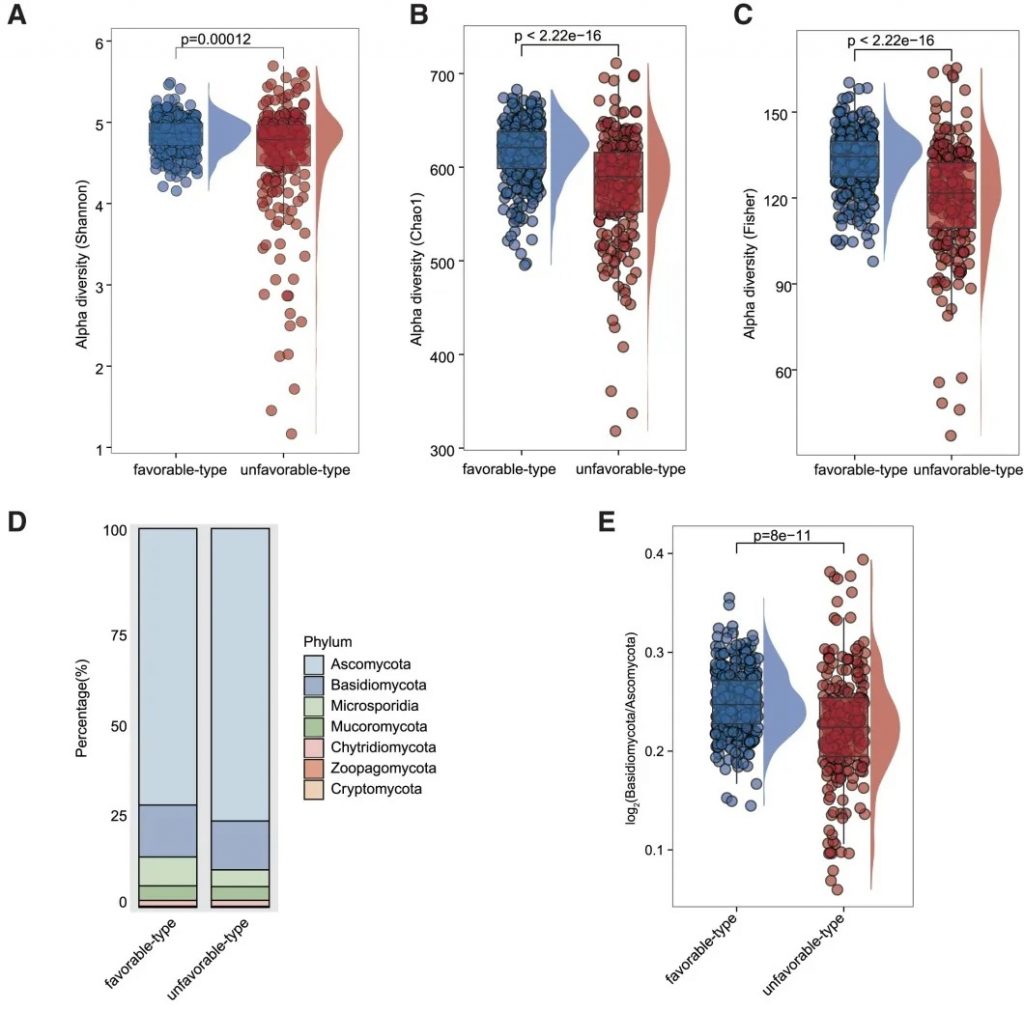
“有利型”和“不利型”肠道菌群差异 细菌、真菌
细菌 多样性
——α多样性差异
有利型患者表现出显著更高的细菌α多样性指数(Shannon、Chao1、Simpson),这与既往研究发现的免疫治疗响应者多样性更高的结论一致。
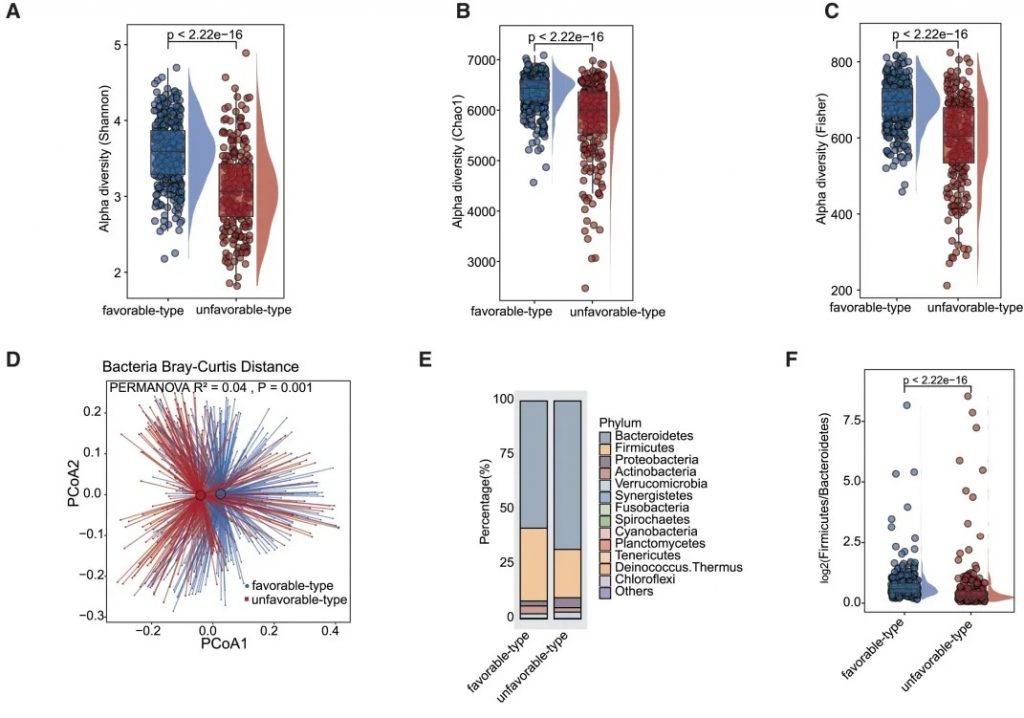
——β多样性差异
细菌 主要构成
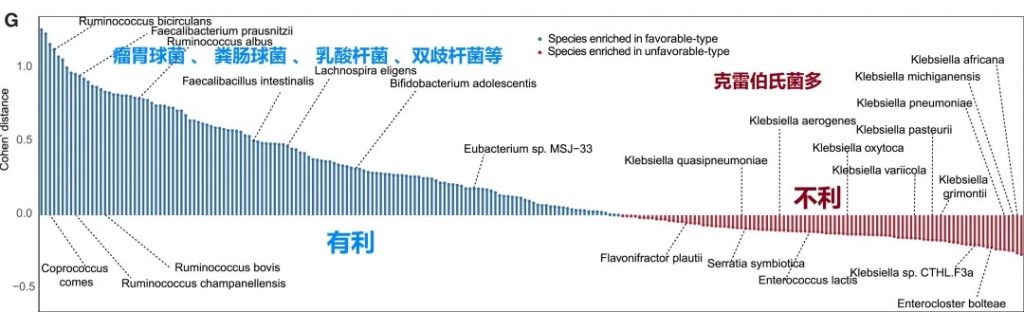
有利型患者表现出更高的Firmicutes/Bacteroides比值,这被认为是肠道菌群平衡的重要指标,与免疫治疗的良好反应相关。
有利型的患者肠道中富含产丁酸盐的细菌,特别是Faecalibacterium prausnitzii、Lachnospira eligens,这些细菌通过产生丁酸盐调节肠道微环境,增强抗肿瘤免疫反应。
真菌 多样性
有利型表现出更高的Shannon指数和OTU丰富度,真菌物种多样性更丰富,这与对免疫治疗的更好反应相关联。
真菌 主要构成
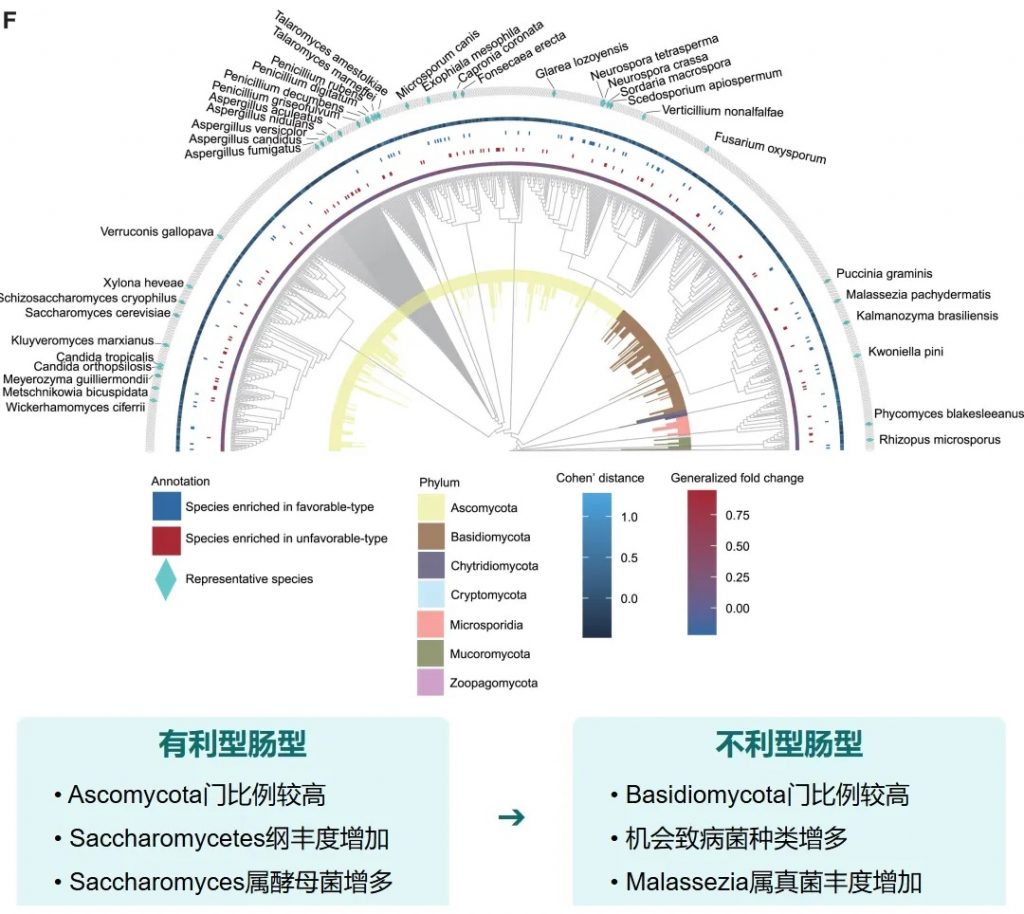
关键真菌与细菌的共现分析
有利型样本在真菌-细菌界中表现出增加的正相互作用,而不利型样本在菌-细菌界表现出更多的负相互作用。
关键真菌-细菌互作对有利型中的关键互作真菌-产丁酸盐细菌正向互作:
有利型的真菌群落结构似乎与某些细菌表现出更积极的共生关系。真菌-细菌间相互作用可能在抗PD-1/PD-L1 ICI的反应中发挥关键作用。
基于特定菌群类型的微生物功能分析
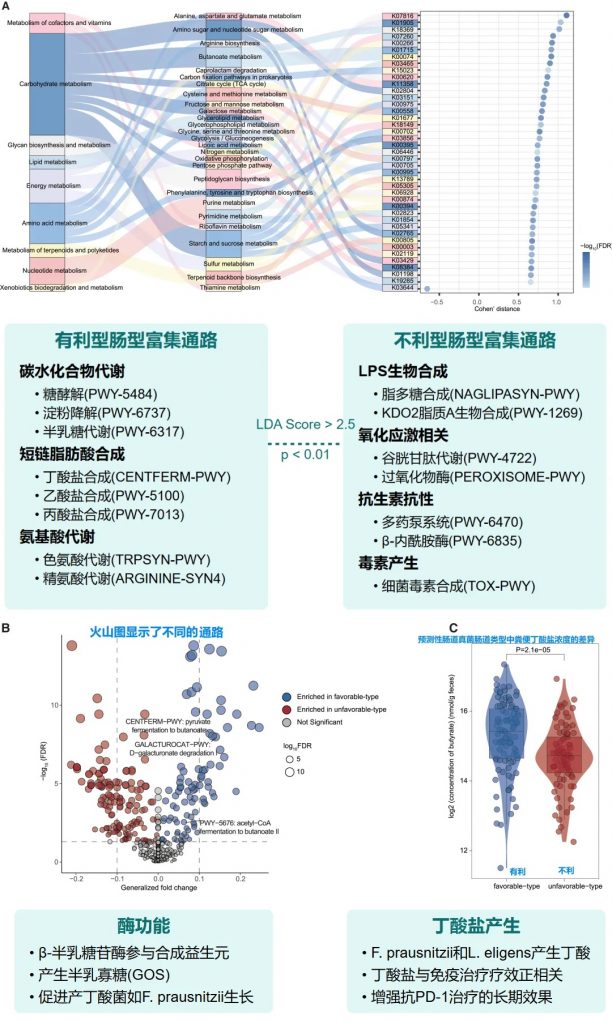
肠道菌群类型的外部验证与多组学分析
验证队列特征
• 125名接受PD-1抗体治疗的泛癌症患者
• 基于随机森林分类器(RandomForestClassifier)进行肠道菌群类型的预测
• 预测结果: 83名有利型患者,42名不利型患者
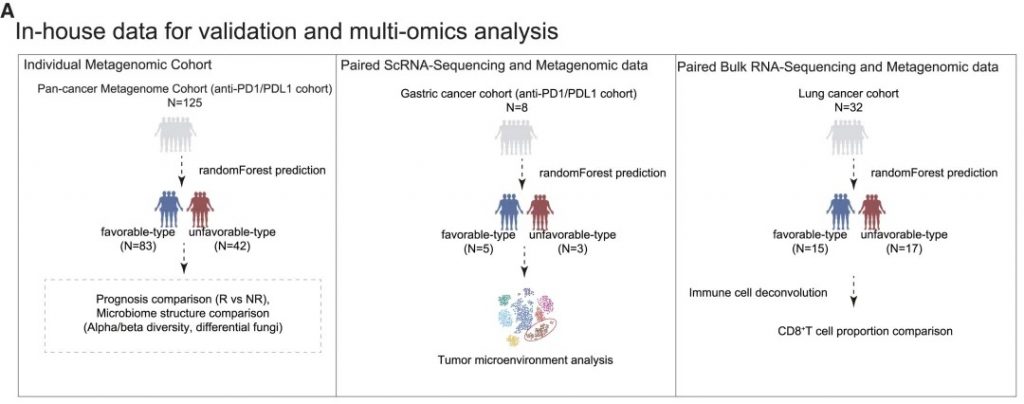
验证分析方法
• 基于机器学习的肠道菌群类型预测模型
• 随访评估对免疫治疗的临床反应
丁酸可促进CD8+ T细胞浸润肿瘤微环境,直接增强抗肿瘤免疫。
FMT供体选择:优化免疫治疗疗效
整合数据构成
• 3个近期发表的临床试验数据
• 12名FMT供体 (5名有利型, 7名不利型)
• 43名黑色素瘤患者接受者
• 包含宏基因组数据和临床结果
FMT临床疗效分析
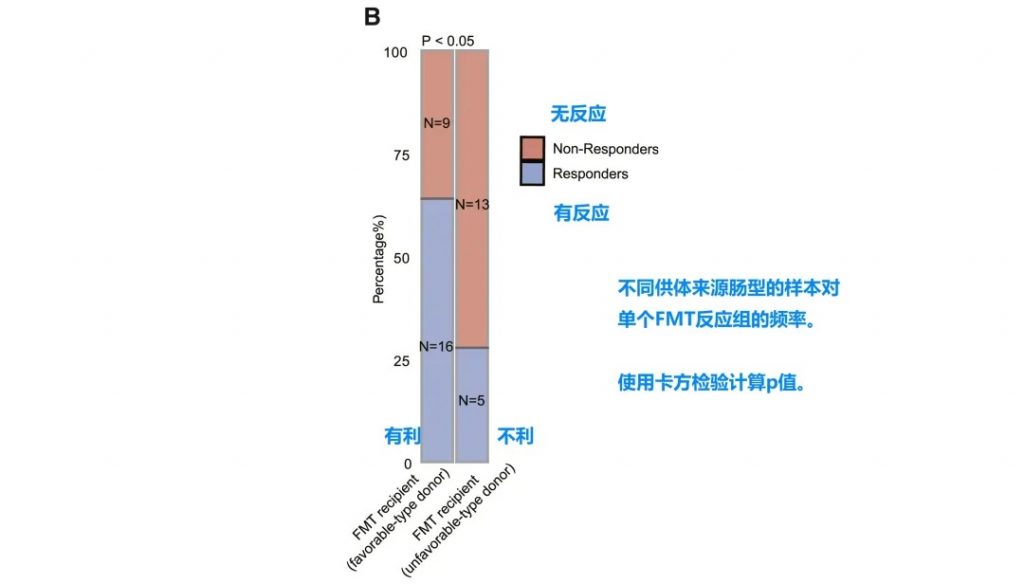
• 接受有利型供体FMT的患者对抗PD-1/PD-L1抗体免疫治疗的反应明显改善
• 卡方检验证实统计学显著差异 (p < 0.05)
接受“有利型”供体FMT的患者显示出对抗PD-1/PD-L1抗体免疫治疗的显著改善反应(p < 0.05)。这一发现具有临床指导意义,为FMT供体筛选提供了新的标准。
FMT前后微生物多样性变化
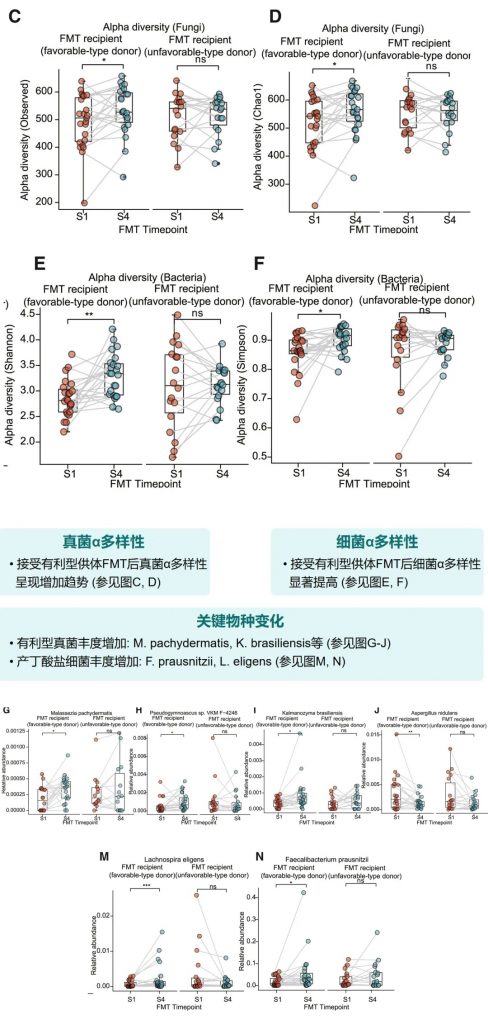
接受有利型供体FMT后,受者的真菌和细菌α多样性均有明显提高。特别是,有利型特征真菌和产丁酸菌的丰度显著增加,这与增强的免疫治疗效果相关。
体内验证实验结果
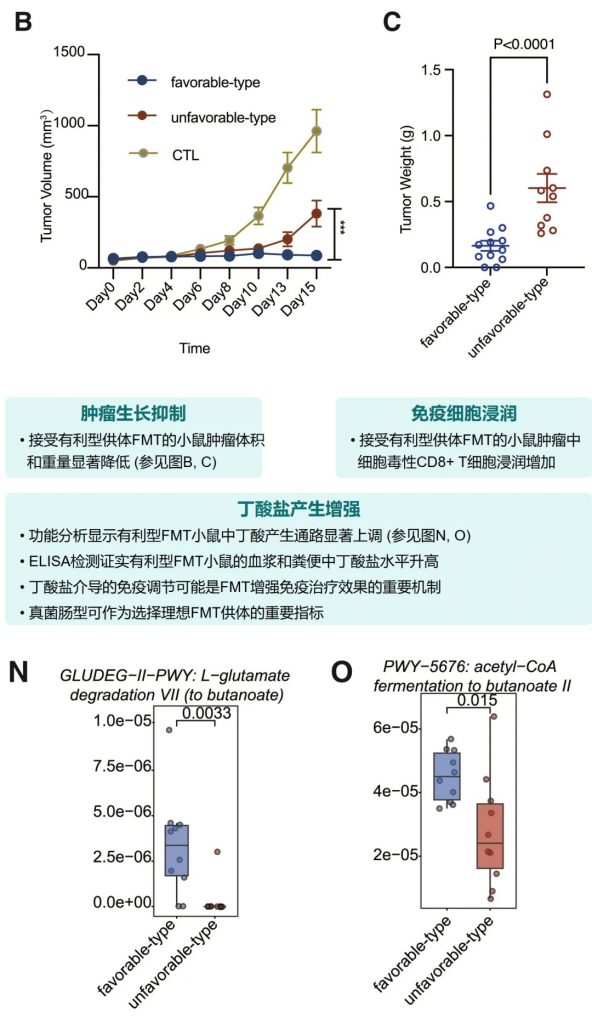
小鼠实验进一步确认了有利型供体FMT可以增强抗PD-1治疗效果,表现为肿瘤生长抑制、CD8+ T细胞浸润增加,以及丁酸盐产生增强。这为FMT增强免疫治疗提供了机制解释。
该研究揭示了肠道微生物群类型与免疫检查点抑制剂(ICI)疗效之间的密切关系,为优化癌症免疫治疗策略提供了新的视角。
肠道菌群与免疫治疗响应之间存在显著关联,且这种关联可通过粪菌移植等干预手段加以调控,为克服免疫治疗耐药提供新策略。
以下是几个具有前景的研究和临床应用方向:
辅助诊断的开发与实施
随着肠道菌群类型与免疫治疗疗效之间关联的确立,开发肠道微生物群分析作为免疫治疗的伴随诊断工具已成为一个明确的临床需求。
粪菌移植(FMT)作为辅助治疗手段
对于被确定为不利型的患者,粪菌移植提供了一种有前景的干预手段,可能显著提高免疫治疗的响应率。
更大规模的临床验证研究
为了将这些发现转化为临床实践,需要进行更大规模的验证研究:
未来,肠道微生物群检测有望成为免疫治疗患者的常规伴随诊断工具,帮助临床医生识别潜在的治疗无应答人群。
也就是说做免疫治疗的人群可以做肠道菌群评估作为辅助诊断,如果免疫治疗没有效果的病人,考虑通过FMT调整菌群后,提高治疗效果。来自有利型供体的粪菌移植可能成为提高治疗效果的有效辅助手段。
这一整合策略不仅能够优化现有免疫治疗的应用,也为开发新型微生物组靶向干预手段提供了方向,最终实现免疫治疗疗效的最大化和个体化。
在癌症精准医疗的框架下,肠道微生物组评估和干预将与基因组学、免疫学等多组学手段一起,共同构成未来肿瘤免疫治疗的个体化决策基础,为患者带来更好的临床获益。
主要参考文献
Hu M, Zhu X, Huang X, Hua L, Lin X, Zhang H, Hu Y, Tong T, Li L, Xuan B, Zhao Y, Zhou Y, Ding J, Ma Y, Jiang Y, Ning L, Zhang Y, Wang Z, Fang JY, Zhang Y, Xiao X, Hong J, Chen H, Li J, Chen H. Optimizing anti-PD-1/PD-L1 therapy efficacy and fecal microbiota transplantation donor selection through gut mycobiome-based enterotype. Cell Rep. 2025 Apr 20;44(5):115589.
谷禾健康
近年来,肠道微生物群作为人体健康的“隐形器官”备受关注,其在免疫调节、代谢平衡和疾病防御中的作用已被广泛认可。然而,当微生物群的平衡被打破时,可能会引发一系列健康问题,包括感染易感性增加。特别是在严重感染的背景下,肠道微生物群的失调可能不仅是疾病的结果,更可能是疾病发生的潜在驱动因素之一。
谷禾总结发现一些疾病或潜在健康风险人群肠道微生物群存在如下类型的几种失衡的潜在特征:
1
产丁酸菌减少,同时有害菌抬头
2
单一或几种菌属占比过高导致其他核心菌群丰度不足或偏低,尤其产生短链脂肪酸的菌
3
多样性单一或偏低,同时有害菌占比较高或几种机会病原菌超标
4
益生菌缺乏或不足,核心菌丰度占比较低同时构成比例不佳
5
变形菌门或梭杆菌门上升占比太高
以上情况可能单一或同时存在。如果同时存在,一般菌群和健康状况均不佳。
本文主要分享第一个菌群特征,产丁酸菌不足。
先说本文的结论:
肠道微生物群多样性和组成,特别是产丁酸菌丰度较高,与普通人群中因感染住院的风险降低有关。厌氧的产丁酸菌能够在一定程度上保护宿主免受全身性感染的侵害。
该结论的支持证据:
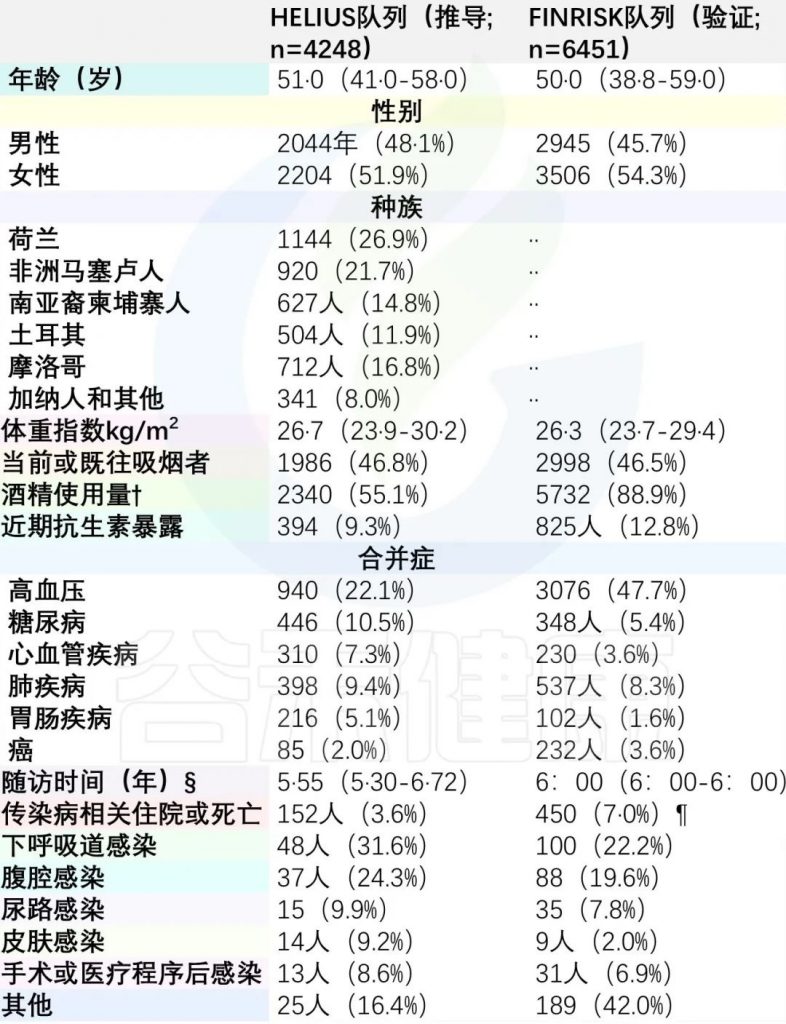
第一 荟萃研究分析和得出的假设验证,分析了10699名参与者的肠道微生物群【4248 (39.7%)来自推导队列,6451(60.3%)来自验证队列】。其中602例(5.6%)受试者【152例(3.6%)来自推导队列; 450例(7.0%)来自验证队列】在随访期间因感染住院或死亡。
这些参与者的肠道微生物群组成与未因感染住院的参与者不同。具体而言,产丁酸菌的相对丰度较高与感染住院风险降低相关(推导队列每增加10%产丁酸菌的原因特异性风险比为0.75 [95%CI 0.60 – 0.94],p= 0.013;验证队列每增加10%的原因特异性风险比为0.86 [0.77-0.96],p= 0.0077)。在调整人口统计学、生活方式、抗生素暴露和合并症后,这些相关性保持不变。
第二,谷禾的队列和2个独立的欧洲队列
【包括荷兰城市健康生活(HELIUS)研究(推导队列)和芬兰FINRISK 2002年人口调查(验证队列)】。
美国的Kullberg博士团队对在如上两个独立的观察队列中进行了这项研究验证:HELIUS是一项在荷兰阿姆斯特丹进行的多种族、基于人群的前瞻性队列研究。成年人(年龄18-70岁)从阿姆斯特丹市政登记处随机抽样,按种族分层,并邀请参加。HELIUS参与者与国家住院和死亡登记处相关联,涵盖2013年1月1日至2020年12月31日期间所有荷兰医院的入院和死亡情况。FINRISK 2002年队列是一项人口调查,包括来自芬兰六个地区的成年人(年龄25-74岁)的随机样本,按性别、地区和10岁年龄组分层。FINRISK参与者与芬兰医院出院和死亡原因登记册相关联。
在两个队列中,参与者完成问卷调查,接受体格检查,入选时提供粪便样本(HELIUS参与者为2013年1月3日至2015年11月27日,FINRISK参与者为2002年1月21日至4月19日)。在705名HELIUS参与者的子集中提供了饮食变量。为了纳入Kullberg博士团队研究,他们提供粪便样本并成功测序。在Illumina系统上用16S rRNA V4区测序。
目前全球约25%的死亡是由于感染。这一负担凸显了新的预防策略的必要性。因感染性疾病住院的患者经常表现出肠道紊乱,甚至是在抗生素治疗之前。
数据已经表明,这些患者的肠道厌氧菌丰度较低,潜在致病性肠道细菌数量增加。目前尚不清楚这些变化是否是疾病本身的结果(例如由全身性炎症或饮食变化引起),或者肠道微生物群的破坏从一开始就增加了对感染的易感性。
小鼠模型支持后一种假设,并表明肠道微生物群的扰动(通过使用驱虫处理或无菌小鼠)减弱了炎症反应,并增加了感染的易感性和严重性。微生物组的有益的全身效应通常归因于肠道厌氧菌产生的代谢物。
例如,临床前研究表明,微生物群代谢物丁酸盐增加单核细胞的抗微生物活性,并影响肺中的免疫环境。
检索了PubMed从数据库开始到2023年7月10日的数据,没有语言限制,在标题或摘要中使用检索词(“gut”或“intestinal”)AND(“microbiome”或“microbiota”)AND(“infection”或“infectious”)AND“risk”AND(“patients”或“participants”或“cohort”或“men”或“women”)。
本次检索识别出656篇文章。大多数人类研究描述了感染性疾病住院或重症监护病房住院期间的肠道微生物组破坏。
研究结果表明,基线肠道微生物群组成(感染发作前)与两个大型独立人群队列中因感染性疾病住院的风险有关,共有10699名参与者和602起事件(即因任何感染性疾病住院或死亡)。
在选定的极易感染的患者人群中(例如,在严重疾病期间或干细胞移植后),微生物多样性丧失、革兰氏阴性菌过度生长和产生短链脂肪酸丁酸的厌氧菌丰度低与(医院获得性)感染风险增加相关。
在这两个队列中,厌氧产丁酸菌的肠道定殖与预防感染性疾病住院有关。通过多变量比例风险模型和匹配病例(因感染住院的参与者)与对照(无感染相关住院的参与者),发现这种关系是稳健的,而且在调整年龄,性别,种族,生活方式,近期抗生素暴露和合并症后没有改变。
结合临床前研究,谷禾的检测实践和选定的严重感染高风险患者的发现,据我们所知,这是第一个提供证据证明厌氧肠道微生物群对人类一般人群感染易感性的影响。
这些主要结局是在研究入选时采集粪便样本后随访期间因任何感染性疾病而住院或死亡,以HELIUS(5-7年随访)或FINRISK(6年随访)。非传染性疾病导致的死亡被视为竞争风险。对于多次因感染入院的参与者,仅考虑第一次入院。
研究小组先前描述了在选定的高感染风险患者(例如,中风或异基因造血干细胞移植后)中,产生丁酸盐的厌氧肠道细菌的消耗与呼吸道感染风险增加之间的关联。厌氧的、产丁酸菌的有益影响可能超出这些高度易感的人群。
大型流行病学研究描述了与没有此类暴露的住院患者相比,在假定微生物群破坏(如艰难梭菌感染或广泛的抗生素治疗)的情况下,住院后因严重脓毒症再次入院的风险高出65-70%。
研究详细描述了统计分析方法,并在附录中提供了具体细节。研究主要评估了肠道微生物群的关键特征(包括群落组成、α多样性和产丁酸菌的相对丰度)与感染相关住院风险之间的关联。
产丁酸菌的丰度基于16种已知主要产丁酸菌的累积相对丰度计算,其预测粪便丁酸盐浓度的准确性已被独立验证。
敏感性分析包括:
1) 扩展研究范围至所有感染性疾病住院病例,而不仅限于以感染为主要诊断的住院病例;
2) 使用替代的产丁酸菌列表重新计算其丰度。
群落组成的差异通过基于Bray-Curtis距离的多变量方差分析(PERMANOVA)评估,驱动群落差异的细菌则通过DESeq2和ANCOM-BC方法识别。
基于HELIUS队列,研究构建了个体化的微生物群感染相关住院风险评分,并通过正则化Cox回归和10折交叉验证计算每种细菌的权重。随后,在FINRISK队列中验证了该风险评分。
竞争风险回归模型用于评估微生物群特征(多样性、产丁酸菌丰度和风险评分)与感染相关结局之间的关联,计算特定原因风险比(csHR)。
产丁酸菌作为连续变量时,csHR表示其相对丰度每增加10%时的风险变化。研究还进行了嵌套匹配病例对照分析,以比较HELIUS队列中感染相关住院病例与未住院对照的肠道微生物群差异。
多变量模型调整了基线年龄、性别、种族(仅限HELIUS队列)、吸烟、饮酒、身体活动、抗生素暴露(HELIUS为采样前3个月,FINRISK为4个月)以及合并症(如高血压、糖尿病、癌症、心血管疾病、肺部疾病和胃肠道疾病)。
缺失数据极少,并在多变量分析中作为分类变量处理。
对10699名参与者的肠道微生物群进行了表征,其中4248名(39.7%)来自HELIUS研究(推导队列,荷兰),6451名(60.3%)来自FINRISK(验证队列,芬兰),并用于本研究。
在两个队列中,肠道微生物群主要由厚壁菌门和拟杆菌门组成。
从样本采集到2020年12月31日,HELIUS研究的152名(3.6%)参与者因感染性疾病住院或死亡。在FINRISK研究中,450名(7.0%)参与者在6年随访期间因感染住院或死亡。
下呼吸道感染是两个队列中感染相关住院的最常见原因(表1)。
DOI: 10.1016/S2666-5247(24)00079-X
住院/死亡与非住院者肠道菌群是否有差异?
首先检查了因感染住院或死亡的HELIUS参与者与未因感染性疾病住院的参与者(包括死于非感染性原因的参与者)之间肠道微生物群组成是否存在差异。
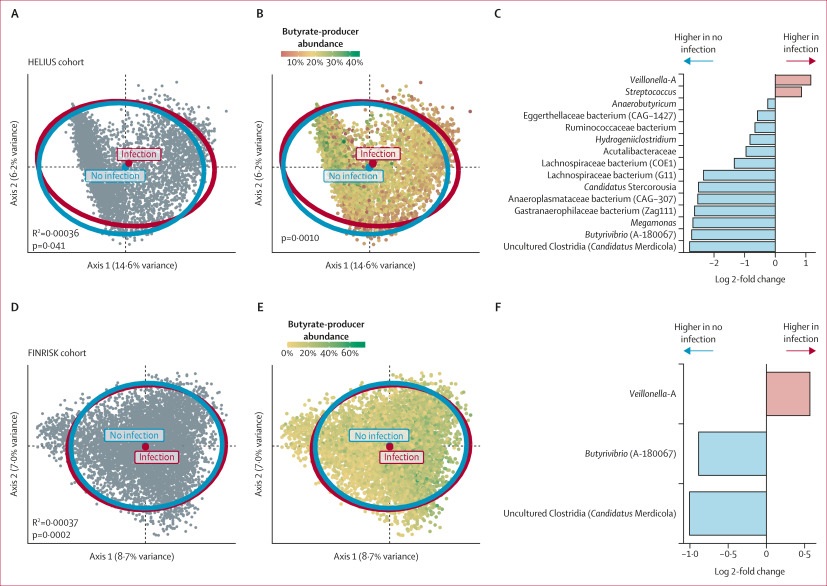
这些结果组之间存在可检测的分离(图1A),这通过排列检验(R2=0·00035,p=0·041)在统计学上得到证实。
Kullberg RFJ et al., 2024. Lancet Microbe.
这种分离在更高的分类学水平(属水平p= 0.040;科水平p= 0.024)和遗传学感知距离(加权UniFrac p= 0.040)下是稳健的,尽管效应量很小-即使考虑到多个经典决定因素(人口统计学,饮食,合并症,药物,社会经济和技术因素)通常解释微生物群组成的差异很小(R2= 0.09 – 0.12)。
产丁酸菌的相对丰度与微生物群组成相关,如通过主坐标分析的颜色编码所显示的(p=0·0010;图1B)。
使用DESeq 2模型来识别导致结果组之间差异的特定细菌,发现:
当使用ANCOM-BC代替DESeq 2时,获得了相似的结果。在验证队列(FINRISK)中,还观察到因感染住院的参与者与未因感染住院的参与者之间的肠道微生物群差异(R2=0·00037,p=0·0002;图1D,E)。
与推导队列一致,来自验证队列的因感染住院的参与者具有较低的丁酸弧菌相对丰度和较高的韦荣氏球菌相对丰度(图1F)。
总之,这些数据表明,在两个独立的队列中,基线肠道微生物群组成在随访期间因感染而住院的参与者和没有感染相关住院的参与者之间存在差异,这同样是由韦荣氏球菌的增加和专性厌氧菌丁酸弧菌的减少所驱动的。
产丁酸菌丰度是否与严重感染风险相关?
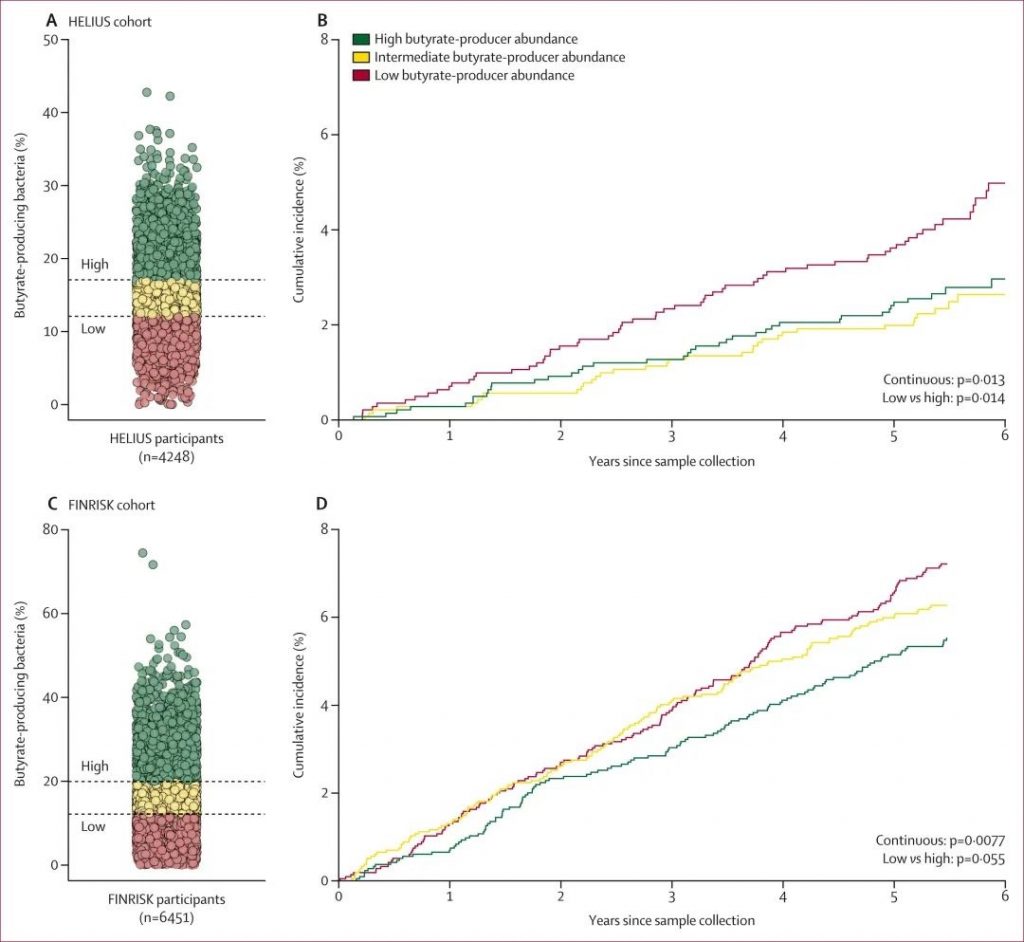
在衍生队列的4248名参与者中,产丁酸菌相对丰度的增加与未来因感染性疾病住院的风险降低相关。换句话说,每增加10%产丁酸菌的相对丰度,感染相关住院的csHR为0.75。
当比较产丁酸菌的三分位数时,也观察到这种关联:最高三分位数的1416名参与者中有42例严重感染,而最低三分位数的1416名参与者中有69例严重感染。
在验证队列中,观察到产丁酸菌相对丰度较高与感染住院风险较低之间存在相同的相关性。在推导和验证队列中,多变量分析中潜在混杂因素(年龄、性别、种族、吸烟、饮酒、体力活动、抗生素暴露和合并症)的校正对效应估计值和显著性均无实质性影响。
鉴于肠道微生物群和肥胖之间的双向关系,BMI不被认为是真正的混杂因素。然而,当BMI额外纳入多变量模型时,相关性未改变。 使用中心对数比转换校正微生物组数据的组成性质也不会影响这些发现。因此得出结论,在推导和验证队列中,产丁酸菌的定植与严重感染风险降低相关。
doi: 10.1016/S2666-5247(24)00079-X.
产丁酸菌相对丰度与感染疾病住院之间关联的多变量病因特异性竞争风险回归分析
在衍生队列的敏感性分析中,任何感染住院均被视为事件(而不是感染作为主要诊断)。观察到肠道微生物群与感染住院风险之间存在类似关联。此外,使用替代方法重新计算产丁酸菌的相对丰度也得到了与主要分析相似的结果,显示了微生物群-感染相关性的稳健性。
在衍生队列的嵌套、匹配、病例对照分析中,随访期间因感染住院的HELIUS参与者(病例)与未因感染性疾病住院的HELIUS参与者(对照)在年龄、性别、种族、抗生素暴露、糖尿病以及肺部和胃肠道合并症方面以1:1的比例匹配。病例和对照组的肠道微生物群多样性没有差异。
然而,与整个队列的数据一致,随访期间因感染性疾病住院的参与者与匹配的对照组相比,基线产丁酸菌相对丰度较低,总体肠道微生物群组成不同。
在进一步的探索性分析中,通过计算对比来检查人口统计学、生活方式因素、抗生素和合并症是否改变了产丁酸菌对感染风险的影响估计。
虽然有几个协变量(如性别,年龄,BMI和糖尿病)与产丁酸菌的相对丰度和因感染性疾病住院的风险相关,但产丁酸菌和因感染性疾病住院之间的关系并不受大多数协变量的影响。然而,在BMI为30或更高的参与者中,产丁酸菌与感染相关住院风险之间的关联似乎不存在。值得注意的是,未观察到微生物群-感染关联与种族之间的相互作用,饮食变量也与产丁菌密切相关。
在这些独立的大型观察性队列中,Kullberg博士团队发现肠道微生物群与一般人群中感染性疾病相关住院和死亡的风险相关。更高丰度的厌氧产丁酸菌与预防严重感染有关,即使在调整人口统计学,生活方式,抗生素暴露和合并症时也是如此。
不同地理位置的肠道微生物群与感染相关住院风险之间存在相似的关联。
这些研究结果表明,肠道微生物群可能是感染相关住院治疗的潜在可改变的风险因素,因此有必要进行干预性研究。
肠道微生物群经常在因严重感染住院的患者中被破坏,这与临床结果有关。然而,这些破坏可能是疾病的结果,或者在感染之前并影响易感性。
在感染发作前表征的肠道微生物群在随访期间因感染住院的参与者和那些没有因感染住院的参与者之间存在差异,表明肠道微生物群与严重感染的易感性相关。 在独立的队列中,结果组之间微生物群组成的这种差异同样是由Veillonella (韦荣氏球菌、一种包括与SARS-CoV-2感染期间出现严重症状的风险增加相关的机会性病原体并在COVID-19住院患者中富集的属)增加、Butyrivibrio(丁酸弧菌、一种产丁酸菌属)和严格厌氧未培养的菌Clostridia Candidatus减少引起的。
临床前研究表明,微生物代谢产物丁酸盐增强了对感染的保护,同时预防了免疫相关的病理学。丁酸盐诱导抗微生物肽的产生,增加定植抗性,并减少小鼠流感感染期间嗜中性粒细胞向气道的募集,从而限制组织损伤。
研究表明,减少产丁酸菌(仅为严格厌氧菌)会增加中风,肾移植和异基因造血干细胞移植后的感染风险。
此外,2023年发表的一项研究将3032名机械通气患者的观察数据与动物模型相结合,结果显示早期使用抗厌氧抗生素治疗会降低总体和无感染生存率。 在15908名急诊科患者中证实了抗厌氧菌抗生素的这些不良反应。有趣的是,通过这样的抗生素消耗厌氧微生物群导致肠杆菌科的扩增,并且先前确定了肠杆菌科相关微生物群特征与一般人群中的全因死亡率之间的关联。
本文的研究结论有荟萃和大型不同地理位置的独立队列支持。结论的可推广和参考性很强,这些发现表明厌氧、产丁酸盐的肠道微生物群在严重感染高危患者和普通人群中的重要性,并建议应重新考虑广泛使用抗厌氧抗生素。
但是基于这些在单个时间点表征微生物群,考虑肠道微生物群可能会随着时间的推移而变化,这可能会掩盖在遥远的时间点对结果的影响。然而,单个微生物群的组成非常稳定,许多细菌在几十年内都是居民。
此外,产丁酸菌的潜在有益作用可能超出丁酸盐,因为几种产丁酸菌能够生物合成次级胆汁酸和具有潜在免疫调节以及交叉喂养其他共生菌的作用。
本文分享有助于重新评估肠道微生物导向疗法(如靶向输送产丁酸细菌或限制肠道厌氧菌消耗)的干预性的潜在机会,有望降低对全身感染的易感性。

谷禾健康
健康的肠道微生物群特点是氧气含量低,并且存在大型专性厌氧菌细菌群落,这些共生菌通过限制肠道病原体的扩张为宿主提供益处。
那么是什么导致肠道健康走下坡路,是什么原因引起肠道菌群失调,在科学界一直有2种观点:
■ 一种是“营养生态位假说”
大肠内多种微生物的共存要求群落中的每个成员,都能够比所有其他成员在少数有限资源条件下,能更快地生长。
■ 另外一种是“氧气假说”
氧气增加将中断或抑制厌氧菌群的生长繁殖,同时导致将赋予兼性厌氧菌甚至需氧菌生态选择优势,使它们变得更具竞争力并可能过度生长。相反,对氧气敏感并因其存在而受到伤害的专性厌氧菌将处于不利地位。
当我们有肠道炎症时会发生什么?
上皮细胞,即肠道内的细胞,开始发炎,它们开始将氧气泄漏到肠道中。当这种情况发生时,许多机会性病原体如大肠杆菌、沙门氏菌和肠球菌属(Enterococcus)等喜欢氧气的菌,可以在有氧条件下利用氧气作为电子受体代替其他代谢途径,从而获得更多的能量和生长优势。
在不同的慢性疾病中,常常观察到兼性厌氧菌的过度生长,这些微生物可以在氧气存在时使用它们,并且会“竞争”,消耗其他有益微生物所需的营养物质,包括一些对维持肠道屏障非常重要的产丁酸菌,如毛螺菌科、梭状芽孢杆菌、真杆菌属、罗氏菌属、普拉梭菌等,导致肠道菌群失衡,从而引起多种消化系统问题和慢性疾病。
人体需要氧气才能生存。几乎人体内的每个细胞都需要氧气。
然而地球上大部分微生物却不能很好地耐受氧气,例如肠道的大多数微生物细胞在缺氧的环境中才可以茁壮成长。在健康状态下,结肠是一个低氧环境。如果肠道状态受到干扰,比如使用抗生素,发炎,氧气泄漏到肠道中,它会加剧细菌失衡和炎症,从而开始肠道生态失调、细胞处理能量饥饿和炎症的恶性循环中。
本文我们将重点讨论氧气与肠道菌群失调之间的联系,并分享总结氧气对肠道治疗的潜在影响。
# 1
健康的人类结肠含有估计超过30万亿个细菌细胞,这些细菌很重要,可以分解复杂的碳水化合物,蛋白质等,产生重要的肠道代谢物(如短链脂肪酸)等。然而这些细菌中大部分只能在缺氧的环境中生长和繁殖,属于专性厌氧菌。
婴儿时期,低氧环境利于专性厌氧菌定植
在婴儿的“经典”定植模式中,第一步涉及兼性厌氧菌,例如大肠杆菌(Escherichia coli)和肠球菌(Enterococcus)。
兼性厌氧菌在胃肠道的定植发生在,出生后立即发生氧化还原电位 (简称Eh) 高或呈阳性的肠道环境中。兼性厌氧菌的增加导致可用氧的消耗,从而产生一个氧气减少的环境,有利于出生后几天内专性厌氧菌的到来。然后,与氧气浓度相关的 Eh 降低到一个低水平,类似健康成人的肠道那样。
氧化还原状态通过创造抑制竞争者和潜在肠道病原体的生理环境来参与抵抗肠道定植。未经处理的小鼠大肠中的 Eh 约为 -200 mV。用链霉素处理后,脂肪酸水平下降,氧化还原态变为 +200 mV,同时沙门氏菌数量增加。
健康成人的肠道内:大量专性厌氧菌
在健康成人中,胃肠道远端的特点是低氧张力,通常含有大量专性厌氧菌群落:
大部分胃肠道的细菌在体外很难或还没有被培养出来,部分原因是它们的厌氧或对氧气的敏感性,及时培养出来的也需要长时间和费力的技术。
在过去的几十年中,健康人肠道微生物群的组成已经通过独立于培养的技术进行了探索,并通过测序分析进一步描述,在大人群水平的微生物群中鉴定出超过 20个门。两个主要的门,厚壁菌门和拟杆菌门,占肠道细菌的 90%,主要是专性厌氧菌。
在较低的分类学水平上,一个个体通常存在多达一千种。在个体间变异中,个体间共享的物种少于 60 种。这些物种代表了核心肠道微生物群。
肠道核心菌属
人体肠道菌群中的核心菌属是指在不同人群中普遍存在、数量相对较高、对人体健康具有重要作用的菌属。
目前对于核心菌属的定义还没有统一标准,但一般认为核心菌属应该具备以下特征:
1. 在不同人群中普遍存在:核心菌属应该在不同人群中都能够被检测到,而不是仅存在于某些特定人群中。
2. 数量相对较高:核心菌属应该在肠道菌群中占据较高的比例,而不是仅占据极小的比例。
3. 对人体健康具有重要作用:核心菌属应该对人体健康具有重要作用,如参与食物消化、维持肠道屏障功能、调节免疫系统等。
谷禾健康基于庞大的60万人肠道菌群检测样本数据,给出了人体肠道菌群核心菌属的标准:
在90%人群检出,人群平均丰度1%以上的菌属为核心菌属(双歧杆菌和乳杆菌作为益生菌相对丰度低于1%但是重要性很高)。
核心菌属及有益菌累加占总肠道菌群比例低于60%就可能出现肠道菌群紊乱。
# 2
现在,“肠道菌群失调”通常是指肠道微生物群的状态改变,一般与疾病有关。在肠道生态失调期间观察到的最一致和最强大的生态模式可能是属于变形菌门的兼性厌氧细菌的扩张。
变形菌门是人类肠道中常见的五种主要细菌门之一。它包括多种属,包括埃希氏菌属、志贺氏菌属、沙门氏菌属、螺杆菌属、弧菌属、耶尔森氏菌属、假单胞菌属、弯曲杆菌属和脱硫弧菌属,其中大多数被认为是机会性病原体。
关于变形菌门详见:
氧气的存在使变形菌门有了生存优势
在平衡的生态系统中,低丰度时无害的微生物,但当环境变得特别适合它们的生长时,它们会迅速扩散并引起问题。
导致变形杆菌快速扩张的一个环境因素是——氧气。大多数变形菌是兼性厌氧菌,这意味着它们可以在氧气存在的情况下生存和繁殖。这使它们在含氧环境中比有益的专性厌氧菌具有显着的竞争优势。
变形菌扩张的同时,产丁酸菌减少
值得注意的是,变形杆菌的扩张几乎总是伴随着产丁酸盐细菌丰度的减少。高变形菌和低产丁酸菌这种组合,是微生物群失调特征,并与许多慢性疾病有关,包括:炎症性肠病、肠易激综合症、结直肠癌、憩室炎、组胺不耐受、2 型糖尿病、肥胖等。
这个特征还表明,存在潜在的上皮功能障碍,这个后面会讲到。
# 3
专性厌氧菌产生的一种代谢物是丁酸盐。丁酸盐是这些细菌在结肠中代谢膳食纤维时产生的短链脂肪酸之一。我们之前写过丁酸盐对健康的好处,包括它能够减轻神经炎症、预防结肠癌和帮助维持肠道屏障功能。
丁酸盐给结肠细胞提供能量,该过程耗氧量大,由此导致的低氧对维持肠道稳态很重要
在健康的肠道中,丁酸盐提供结肠细胞所需能量的大约 70%。这些结肠细胞排列在结肠上,形成肠道屏障。被结肠细胞摄取后,丁酸盐和其他短链脂肪酸通过β 氧化途径在线粒体中分解。该过程使用大量氧气。事实证明,这种结肠细胞耗氧量对于维持肠道稳态非常重要。
2015 年,科罗拉多大学研究小组证明,丁酸盐的肠道代谢是维持结肠“生理性缺氧”所必需的。通过一系列实验,他们证明了丁酸盐以及较小程度上的短链脂肪酸丙酸盐和乙酸盐会耗尽结肠细胞中的氧气水平。低氧导致缺氧诱导因子 (HIF)的蛋白质稳定,它在细胞中充当一种“氧传感器”。
氧气含量高低如何影响HIF?
当氧气水平低时,HIF 会促进有助于协调肠道屏障保护的基因的表达。如果氧气水平升高,HIF 将不再稳定,这些肠道保护基因将不再表达。
抗生素是否会影响缺氧,从而影响肠道屏障?
研究人员仅使用三天广谱抗生素后,丁酸盐水平急剧下降,肠道含氧量上升,上皮缺氧状态消失。氧气传感器 HIF 不再稳定,肠道保护基因不再表达,导致肠道屏障功能丧失。
这不仅仅是因为缺乏纤维(纤维是生产丁酸盐的基质),抗生素治疗小鼠的肠道菌群,完全丧失了从膳食可发酵纤维中产生丁酸盐或其他短链脂肪酸的能力。不过好在他们又发现,补充丁酸盐能够挽救“生理性缺氧”,修复肠道屏障功能。
# 1
上皮细胞是排列在肠道壁上的细胞,是宿主与微生物通讯的主要界面。
正常代谢过程,正反馈循环维持稳态
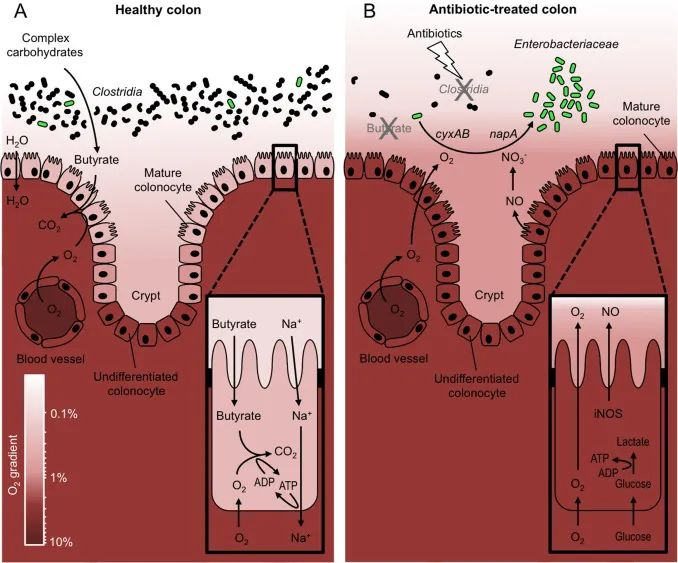
当肠道健康且处于体内平衡状态时,结肠细胞主要通过利用大量氧气的过程代谢丁酸等脂肪酸。由此导致的肠道粘膜缺氧有助于维持以专性厌氧菌为主的肠道微生物群。
这些专性厌氧菌反过来通过将纤维发酵成短链脂肪酸(如丁酸盐)来促进健康,短链脂肪酸被结肠上皮细胞吸收。这种正反馈循环可维持肠道健康状态。
异常:结肠细胞从其他途径获取能量带来的问题
然而,当干扰使结肠上皮细胞的代谢远离脂肪酸的 β 氧化时,系统就会崩溃。能量匮乏的结肠细胞必须寻找其他能量来源,最终从血液中提取葡萄糖并将其发酵成乳酸,这个过程不使用氧气。由此产生的炎症也会导致硝酸盐的产生增加。由于没有其他地方可去,氧气、乳酸盐和硝酸盐会“泄漏”到肠道粘膜中。
那么氧气泄露到肠道粘膜后会发生什么呢?
这种变化有利于变形杆菌门中的病原体茁壮成长。例如沙门氏菌、克雷伯氏菌、柠檬酸杆菌和大肠杆菌,它们可以耐受氧气并依靠乳酸和硝酸盐。
同时,结肠的氧合作用抑制了专性厌氧菌的生长,包括非常重要的产丁酸菌。换句话说,“结肠细胞的新陈代谢充当肠道微生物群的控制开关,调节群落在稳态和失调之间的转变。”
兼性厌氧菌:有氧也可以生长,包含许多肠道病原体,引发炎症
健康的结肠还可能含有少量兼性厌氧菌,它们能够在有氧或无氧环境中生长和繁殖。兼性厌氧菌包括许多肠道病原体。健康肠道的低氧浓度和丰富的专性厌氧菌都会抑制这些兼性厌氧菌的生长。
所以一般来说,兼性厌氧菌往往更容易发炎,所以它们往往会给肠道带来压力,引起炎症、结肠上皮细胞缺氧,肠道通透性增加,并且还会直接使肠道上皮细胞发炎,然后导致肠道产生更多的氧气。
病原菌破坏肠道菌群,继续扩张,形成恶性循环
因此,这些病原体几乎可以破坏肠道新陈代谢,为自己提供生存所需的底物,开始扩张,然后形成了一个恶性循环。兼性厌氧菌大多数都属于变形菌门,特别是肠杆菌科在这种氧气泄漏增加的情况下最常见,如在IBD中那样,潜在有害的变形菌,尤其是肠杆菌科的大量繁殖,也就是增强炎症反应。一些粘附侵入性大肠杆菌 (AIEC) 在 IBD 发病机制中发挥重要作用(关于IBD中肠道菌群变化与氧气相关在后面章节有详细介绍)。
这些观察结果表明变形杆菌的生态失调扩张是肠道菌群失调和上皮功能障碍的潜在诊断微生物特征。
# 2
抗生素介导的肠道微生物群破坏,会增加感染沙门氏菌引起的胃肠炎的风险,它会增加患者肠道携带沙门氏菌血清型的持续时间,并且偶尔会导致复发。
使用一种特殊的染色技术,有研究人员证明,抗生素治疗增加了结肠细胞的氧合作用并导致肠道粘膜缺氧的丧失(也就是说进去了些氧气)。这种缺氧丧失导致沙门氏菌和其他兼性厌氧菌在氧气驱动下扩张。
链霉素 -> 肠道菌群破坏 -> 兼性厌氧菌扩张
链霉素介导的小鼠肠道菌群破坏,与兼性厌氧肠杆菌科(例如共生大肠杆菌)或致病性肠沙门氏菌不受控制的扩张有关。
注:实验室特别选择了链霉素,因为它在消除梭状芽孢杆菌方面特别有效,这样他们就可以研究丁酸盐消耗对结肠代谢的影响。链霉素通常不用于人体口服;然而,已知许多其他广谱抗生素会影响产生丁酸盐的细菌,因此 1-2 周的其他抗生素疗程可能也会通过相同的机制促使氧气泄漏到肠道中。
链霉素治疗 -> 耗尽产短链脂肪酸菌 -> 短链脂肪酸降低
链霉素治疗,优先耗尽肠道相关微生物群落中属于梭状芽胞杆菌纲(Clostridia)的细菌。链霉素处理后恢复定植抗性的尝试表明,转移梭状芽胞杆菌(Clostridia)在防止小鼠肠道内共生大肠杆菌扩张方面最有效。
梭状芽胞杆菌是肠道相关微生物群落中短链脂肪酸的重要生产菌。链霉素治疗与大肠中短链脂肪酸浓度的显着降低有关。由于短链脂肪酸可在体外阻碍大肠杆菌或肠道沙门氏菌(S. enterica)的生长,因此有人提出短链脂肪酸这些代谢物的存在,通过代谢排斥限制了大肠中肠杆菌科的生长。
也有人认为,短链脂肪酸的代谢排斥不足以解释问题
然而,有的研究者认为,短链脂肪酸的代谢排除,无法解释共生肠杆菌科在健康个体中保持低丰度,因为过多的抑制物会导致它们被消除,而过少的抑制物会导致它们的扩张,直到另一种资源变得有限。将肠杆菌(Enterobactericeae)维持在恒定的低水平需要持续保持一种精确的抑制剂浓度,这与体内发生的短链脂肪酸浓度波动不相容。
一个更强大的抗定植概念框架:营养生态位假说
它提出大肠内多种微生物物种的共存,要求群落中的每个成员都能够比所有其他成员在少数有限资源上更快地生长。
为了解释抗生素治疗后肠杆菌科不受控制的扩张,营养生态位假说预测,抗生素介导的肠道微生物群破坏,增加了通常限制肠杆菌科生长的关键资源的可用性。
因此,要了解定殖抗性,揭示此类有限资源的特性,并阐明抗生素处理后它们的丰度升高的原因至关重要。
抗生素介导的肠道菌群消耗,增加了唾液酸和岩藻糖的可用性
肠道相关微生物群落中的糖分解细菌可以从复杂的碳水化合物中释放出这些糖分,并随后消耗它们。链霉素治疗提高了唾液酸和岩藻糖的可用性,这有助于链霉素治疗小鼠肠腔扩张。
链霉素处理后在小鼠盲肠粘膜中观察到的另一个变化是,诱导型一氧化氮合酶(iNOS)的合成增加,一种宿主酶,可催化l-精氨酸产生一氧化氮 (NO)。
源自一氧化氮的活性氮物种可以氧化单糖,例如半乳糖和葡萄糖,分别产生葡糖二酸和半乳糖二酸,这在链霉素处理的小鼠的生长过程中赋予大肠杆菌和鼠伤寒沙门氏菌的管腔适应性优势。
总的来说,这些数据表明糖是肠道中的关键资源,但目前尚不清楚为什么肠杆菌科在这些有限资源上,比肠道微生物群的所有其他成员生长得更快。
最近的数据表明,肠杆菌科可以在可用碳源上生长得更快,因为抗生素介导的微生物群落破坏,通过改变宿主生理学提高了呼吸电子受体的可用性。
在这方面特别重要的一种微生物代谢物是短链脂肪酸丁酸盐。肠道微生物群通过乙酰辅酶 A 途径、戊二酸途径、4-氨基丁酸途径或赖氨酸途径产生丁酸,编码这些途径的大多数细菌都是梭状芽胞杆菌纲的成员。
丁酸盐是结肠细胞的重要能量来源。结肠的主要功能是通过吸收钠 (Na + )产生渗透梯度来吸收水分。Na +通过位于表面结肠细胞顶膜中的通道沿着电化学梯度扩散,然后被位于其基底外侧膜中的 Na +泵(Na + K + ATP 酶)主动挤出。

DOI: 10.1016/j.freeradbiomed.2016.09.022
表面结肠细胞激活 Na+ 所需的 ATP运输来自微生物群衍生的丁酸盐氧化成二氧化碳 (CO2)。这种新陈代谢消耗大量氧气,从而使表面结肠细胞缺氧,这对应于小于 7.6 mmHg(<1% 氧气)的氧分压 (pO2)。相比之下,含氧量正常的宿主组织的 pO2在 23 和 70 mmHg 之间(即含氧量在 3% 和 10% 之间)。
# 3
某些病原体也可能利用这种结肠细胞转换在肠道中获得竞争优势。如果你曾经因急性食物中毒而倒下,之后又出现肠道健康问题,这可以解释原因。
在前面中提到的某些沙门氏菌菌株(特别是肠沙门氏菌血清型鼠伤寒沙门氏菌,以下缩写为S. Tm)可以操纵宿主上皮细胞以促进肠道菌群失调。
S. Tm 是一种特别有毒的细菌,它会侵入宿主粘膜,引起严重的炎症。这种炎症导致产生丁酸盐的梭状芽胞杆菌耗尽,进一步增强了S. Tm 在肠道中增殖的能力。换句话说,这表明某些病原体可能会“破坏”肠道新陈代谢以增加自身健康,从而损害健康细菌。
值得注意的是,丁酸盐生产者的消耗似乎比抗生素治疗更缓慢,大约需要 1-3 周,但恢复速度也慢得多。感染后 4 周,梭菌的丰度仍比基线水平低两个半数量级。
由S. Tm 引起的炎症还导致活性氧和氮物质释放到肠道中,它们与单糖反应形成底物,选择性地喂养S. Tm 和肠杆菌科(变形杆菌门)内的其他微生物。
这不仅适用于S. Tm。在小鼠模型中证明,柠檬酸杆菌(Citrobacter)和空肠弯曲杆菌(Campylobacter jejuni)感染也能够引起宿主肠道炎症并驱动肠杆菌科过度生长。
空肠弯曲杆菌详见:细菌大盘点(二) | 葡萄球菌、沙门氏菌、弯曲杆菌
总的来说,这表明肠道感染可能有助于结肠的氧合作用并促进肠道生态失调的长期状态。因此,清除现有感染可能是恢复肠道上皮细胞正常代谢和健康肠道微生物群的关键步骤。

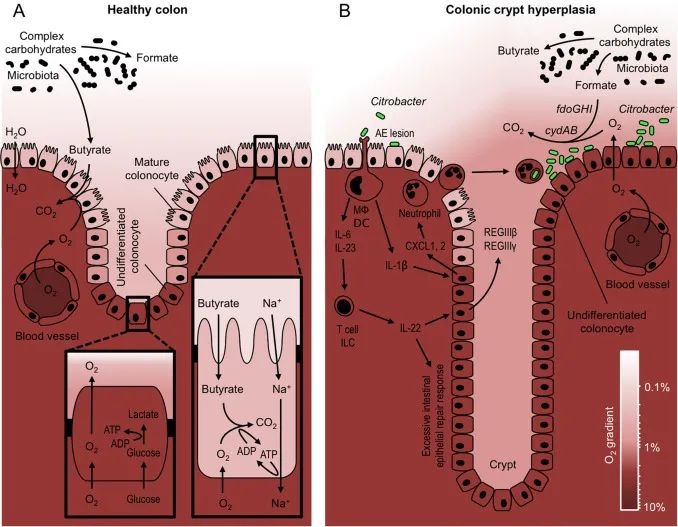
DOI: 10.1016/j.freeradbiomed.2016.09.022
(A) 专性厌氧菌降解复合碳水化合物产生发酵产物,如甲酸盐和丁酸盐。成熟的结肠细胞通过将丁酸氧化成二氧化碳 (CO2 ) 来产生能量 (ATP),这会导致粘膜表面缺氧。相反,位于隐窝中的未分化结肠细胞通过将葡萄糖发酵成乳酸来获取能量。
(B) 病原体C. rodentium ( Citrobacter ) 利用其毒力因子紧密附着在结肠细胞表面(AE 损伤)。树突状细胞 (DC) 和巨噬细胞 (MΦ) 引起的宿主反应导致产生作用于结肠细胞和淋巴细胞(T 细胞和 ILC)的细胞因子(IL-6、IL-23 和 IL-1β),从而诱导合成嗜中性粒细胞趋化因子(CXCL1, 2) 和 IL-22,可激活上皮增殖。
过度的上皮增殖导致隐窝伸长和粘膜表面未分化的含氧量正常的结肠细胞的积累。由此产生的氧气扩散到肠腔的增加,使用cydAB基因驱动C. rodentium的有氧扩张,编码高亲和力细胞色素bd氧化酶。由fdoGHI基因编码的氧依赖性甲酸脱氢酶使病原体能够消耗微生物群衍生的甲酸。
右下角显示的色标表示原理图着色方案表示的氧浓度。
#4
到目前为止,我们已经看到两个例子,其中丁酸盐耗尽导致肠道氧合和生态失调。鉴于丁酸盐的第一大来源来自膳食纤维,从理论上讲,低纤维饮食很可能可以通过相同的机制促进变形菌的扩张。
如果膳食纤维摄入量低,丁酸盐和其他短链脂肪酸的产生水平将无法满足结肠细胞的能量需求。结肠细胞将转向厌氧葡萄糖代谢。无氧代谢会消耗更少的氧气,并导致更多的氧气泄漏到肠道中。
虽然这种机制中的所有步骤并没有像低纤维饮食对抗生素和肠道感染的影响那样有序地得到证明,但一些研究确实将低纤维摄入量与较高水平的变形杆菌联系起来:
那么低纤维生酮饮食是否也如此?
正如之前讨论的,酮体乙酰乙酸和 β-羟基丁酸可以补充丁酸作为肠道上皮细胞的燃料来源。因此,低纤维生酮饮食不太可能激活这种机制来驱动肠道菌群失调。事实上,酮可能有助于恢复上皮缺氧。
#5
有趣的是,所有这些肠道菌群失调的驱动因素,包括抗生素、肠道感染和低纤维加工饮食,都与肠道炎症有关。
肠道炎症
2007 年,在动物模型中证明,肠道炎症本身足以破坏肠道微生物群并促进肠杆菌科的过度生长。通过敲除 IL-10,无论是接触葡聚糖硫酸钠(一种破坏肠道屏障完整性的化学物质),还是严重的遗传易感性,都能够导致肠道菌群失调。
其他更温和的炎症因子也可以促进这些炎症细菌的扩张。2015的一项研究表明,给小鼠喂食羧甲基纤维素和聚山梨醇酯 80(加工食品中常用的两种乳化剂),12 周会降低微生物多样性并导致粘膜相关变形菌增加。同样,发现给小鼠喂食无热量甜味剂阿斯巴甜 8 周会导致肠杆菌科细菌增多。
关于食品添加剂与肠道菌群详见:
你的焦虑可能与食品添加剂有关,警惕食品添加剂引起的微生物群变化
心理压力
压力还会促进炎症和肠道菌群失调。研究报道了在慢性社会心理压力的小鼠模型中变形杆菌的扩张。
食物不耐受
未被识别的食物不耐受也可能导致肠道炎症、结肠细胞代谢改变和肠道生态失调,尽管需要更多的研究来证实这一点。
以上,我们已经回顾了一些可能导致肠道缺氧和导致肠道菌群失调的因素。
在患有 IBD 的患者中观察到微生态失调。反复观察表明专性厌氧菌(F. prausnitzii)减少,兼性厌氧菌(肠杆菌科)增加,甚至出现需氧菌。加上远端肠道的正常厌氧肠道生理学,这些观察结果支持了细菌群落变化的假设,该变化是由氧气增加引起的,从而改变了胃肠道中的 Eh。
F. prausnitzii对氧气极其敏感,但仍可以看到粘附在氧气从上皮细胞扩散的肠道粘膜上。为了解释这个悖论,2012有研究报道说F. prausnitzii可以在低氧环境下生长。他们表明F. prausnitzii 利用黄素和硫醇的细胞外电子穿梭将电子转移到氧气。然而,存在于健康人体肠道中 的黄素和硫醇是普拉梭菌在氧气存在下存活所必需的,而在IBD患者的受损组织中可能并非如此。
IBD 患者中的肠道微生态失调
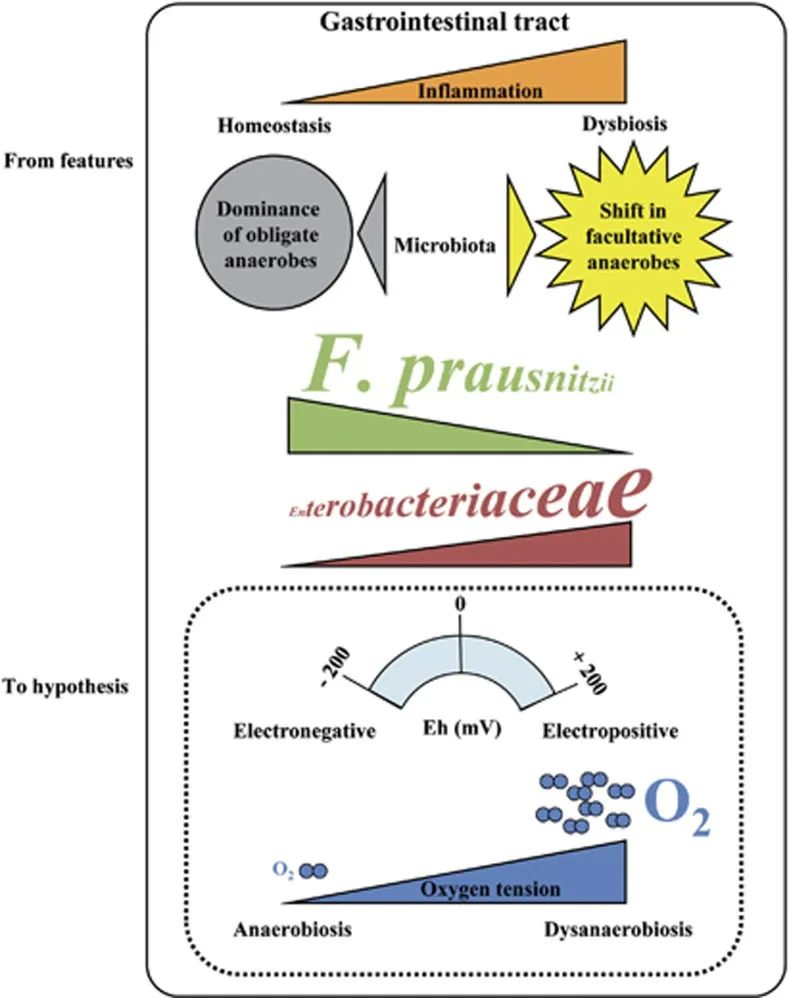

doi: 10.1038/ismej.2013.80
肠道微生物在肠道中的氧依赖性变化
研究在小肠移植和回肠造口术后监测微生物成分,肠道细菌群落从专性厌氧菌转变为以兼性厌氧菌为主的群落,并且肠杆菌科增加,就像 IBD 患者的微生物群一样。
在回肠造口关闭后,假设它提供了氧气入口,转变被逆转,专性厌氧菌再次占主导地位。
这些研究作者提出,氧气是菌群从专性厌氧菌转变为兼性厌氧菌或需氧菌的原因。
虽然肠杆菌科增加,但在大多数患者中未观察到炎症。与 IBD 菌群失调形成鲜明对比的是,乳酸杆菌也大量繁殖,后者很少见乳酸菌增加的报道。研究表明,乳酸杆菌及其细胞壁成分具有抗炎特性,这表明调节或补充乳酸杆菌可能会限制 IBD 患者的炎症反应。
菌群失调与炎症和氧气增加相关
在 IBD 中,氧气浓度的增加可能是由于血液进入胃肠道引起的,这种情况在慢性炎症期间经常观察到,这会促使携带氧气的血红蛋白在肠道细菌所在的肠粘膜和内腔中释放。小鼠模型表明,炎症可能导致微生物群失调,并促进肠杆菌科的过度生长。
一项初步研究评估了克罗恩病中抗肿瘤坏死因子-α 抗体治疗对粪便微生物群的组成和活性的影响,并报告了Faecalibacterium的适度增加, 这表明阻断炎症反应可能会促进这些菌增加。
氧气条件的变化也可能是由于炎症反应本身,导致肠道组织氧化爆发,例如,通过中性粒细胞释放活性氧。有趣的是,活性氧可以与内源性腔内硫化合物反应,形成肠道沙门氏菌使用的呼吸电子受体血清型 Typhimurium(一种好氧物种和属于肠杆菌科的肠道病原体),赋予沙门氏菌相对于专性厌氧菌的竞争性肠道微生物群的生长优势。
“
——丁酸盐有助于恢复肠道菌群
第一步只是确保有基本的健康。我们可以讨论各种先进的肠道干预措施,但最基础的永远都是要从源头上开始,比如说健康的饮食、锻炼、睡眠和压力管理等方式,如果饮食等很糟糕,那么再多肠道治疗,先进的疗法改变肠道和健康状况都不会持久。所以这是第一步。
健康的饮食对于不同人有不同的定义
是的。我们并不完全知道对肠道微生物组最好的饮食是什么,而且并没有一种所谓对肠道微生物组最好的饮食。每个人的微生物组都不同,大家知道,有些人可能对生酮饮食反应非常好,而有些人可能对包含更多植物性食物的饮食效果更好。
建议大家可以从自己身上进行健康探索,比如某一阶段进行某种健康的饮食或生活方式,坚持一段时间后进行肠道菌群检测,配合自身感受,更多角度更细微层次地去了解自己的身体状况。
假如说肠道真的发炎了,做一个短期的低过敏性饮食(比如自身免疫方案)可能是有益的,去除一些更容易引起炎症的食物,至少在一段时间内促进康复。减少炎症将从根本上阻止导致菌群失调的氧气泄漏。
如果变形菌过多和氧气失调的情况发生怎么办?它的典型症状是什么?
通过我们多年研究发现这个可以以很多不同的方式表现出来。基本上这种高变形杆菌和低产丁酸盐的微生物特征存在于各种不同的疾病中:炎症性肠病、肠易激综合症、结直肠癌,也可能是2型糖尿病、肥胖症、过敏以及牛皮癣等。
像这样情况的人通常倾向于腹泻或大便不成形?
不一定。在持续腹胀和胀气的患者身上看到了很多。这是看到的一个非常常见的问题,但它也可能因谷禾目前客户群体而有所偏差。
扩展阅读:“肚子像气球?”“好像怀孕?”——可能是腹胀惹的祸
建议补充丁酸盐可能会扭转这种生态失调状态?
是的,当然并不是单靠补充丁酸盐就一定能够解决这种生态失调。因此,本文概述了一些不同的因素,包括饮食和生活方式因素,以及可能有助于防止氧气泄漏到肠道并恢复体内平衡状态的补充因素,丁酸盐是其中的重要方式之一。
如果没有丁酸盐,氧气没有得到利用,就会溢出肠腔喂养病原体
基本上发生的氧气泄漏的部分原因是肠道内的上皮细胞缺乏能量。当极度缺乏能量时,如果它们没有丁酸盐,就不会代谢丁酸盐。所以从血液中提取葡萄糖,基本上发酵成乳酸,然后乳酸渗入肠道,除了通常通过丁酸代谢使用的氧气。所以实际上如没有丁酸盐存在,就意味着从血液流入上皮细胞的氧气没有得到利用。那就是它最终溢出到肠腔并喂养病原体的时候。
因此,从本质上讲,提供补充丁酸盐就是提供的是上皮细胞喜欢的能量。它们将使用更多的氧气作为丁酸代谢的一部分,并且基本上不需要进行厌氧葡萄糖发酵。这会产生乳酸,最终不会耗尽氧气,这意味着氧气和乳酸会渗入肠道,并喂养沙门氏菌、肠杆菌科和许多不同的变形菌。
抗生素治疗期间补充丁酸盐——雪中送碳
2019 年,在小鼠模型中证明,同时给予丁酸盐和抗生素可以减轻艰难梭菌引起的结肠炎。艰难梭菌是一种革兰氏阳性、形成孢子的细菌,是使用抗生素后肠道感染的常见原因。
在使用抗生素前一天开始补充丁酸盐,并在整个抗生素疗程和 5 天感染挑战期间持续使用。有趣的是,丁酸盐对艰难梭菌定植或毒素产生没有影响,但通过稳定 HIF-1 和增加肠道屏障的完整性,丁酸盐减少了肠道炎症和细菌穿过肠道屏障的运动。
研究人员继续测试另外两种提供丁酸盐的策略。在感染前后的三天内给予高剂量三丁酸甘油酯与丁酸盐具有同样的保护作用,就像在感染前服用抗生素后喂食高纤维饮食(含有高达25%的菊粉)一样。
显然,丁酸盐可以防止抗生素后病原体的扩张。但丁酸盐能否通过支持结肠细胞代谢来预防与抗生素相关的所有生态失调,这仍有待在对照研究中确定。
1
在分子生物学领域,过氧化物酶体增殖物激活受体 (PPAR) 是一组核受体蛋白,作为转录因子调节基因的表达。PPAR 在调节细胞分化、发育和代谢(碳水化合物、脂质、蛋白质)以及肿瘤发生中起着重要作用。
PPAR-γ:一个具体的结肠细胞代谢“开关”
如果说前面一直在抽象地谈论导致肠道菌群失调的结肠细胞代谢“开关”,那么这里来个具体的。研究人员已经确定了一种特殊的基因 PPAR-γ,它似乎可以调节这种转换。PPAR(过氧化物酶体增殖物激活受体的缩写)是一组与 DNA 结合以直接影响基因表达的蛋白质。PPAR-γ 在许多细胞中表达,但在脂肪(脂肪)组织和结肠中表达最高。
健康肠道:
丁酸盐 ⇔ PPAR-γ:互相促进,正向循环
在健康的肠道中,丁酸盐不仅可以为结肠细胞提供能量,还可以增强 PPAR-γ 的激活。这起到了一个正反馈循环的作用:PPAR-γ 激活了增加丁酸盐和其他脂肪酸代谢的基因。这会降低上皮细胞和肠粘膜中的氧气浓度,从而抑制致病性变形菌的生长,并促进有益的、产生丁酸盐的细菌的生长。
失调肠道:没有足够丁酸盐→ 较低的 PPAR-γ 表达→ 致病菌生长
然而,在失调的肠道中,没有足够的丁酸盐或其他底物来激活 PPAR-γ。较低的 PPAR-γ 表达导致 Nos2 的表达增加,Nos2 是编码诱导型一氧化氮合酶 (iNOS) 的基因,并且增加了硝酸盐释放到肠道中。这与厌氧糖酵解产生的乳酸和氧气一起促进了致病菌的生长。
PPAR-γ 激活对于维持肠道先天免疫也至关重要
2010 年发表在PNAS杂志上的一项研究通过一系列实验证明,PPAR-γ 有助于维持抗菌肽β-防御素的持续表达,后者调节结肠的微生物定植。缺乏 PPAR-γ 的小鼠表现出对白色念珠菌、脆弱拟杆菌、粪肠球菌和大肠杆菌的免疫防御缺陷。
分泌型 IgA 的产生也需要 PPAR-γ 。
IgA 详见:对抗病原菌,帮助共生菌定植的“重要开关”
2
多项研究表明,PPAR-γ 激活可能会预防或逆转与免疫激活相关的肠道菌群失调和组织损伤。例如,PPAR-γ 表达在炎症性肠病 (IBD) 中显着降低。
药物激活PPAR-γ :罗格列酮(不适合长期使用)
罗格列酮是一种与 PPAR-γ 结合并增加其活性的药物,在动物模型中已被证明在急性给药时可预防生态失调并减轻结肠炎的症状。虽然这种药物有时仍被用作抗糖尿病药物,但它有一些不良副作用,不适合长期使用。尽管如此,它证明了该途径对肠道微生物群产生重大变化的能力。
药物激活PPAR-γ :美沙拉嗪 (目前使用较多)
研究人员一直在寻找其他方法来刺激这一途径。另一种药物美沙拉嗪也可以激活 PPAR-γ,但程度适中。它在肠道中具有更多的局部作用,因此相对具有更少的全身副作用。这种药物现在被用作 IBD 的一线治疗药物。这种药物的抗炎作用是通过其上调 PPAR-γ 的能力介导的。此外,对照研究表明,美沙拉嗪处理可降低变形杆菌的丰度并增加粪杆菌和双歧杆菌的丰度。
药物激活PPAR-γ :丹参素冰片酯(激活程度小,但仍然提供显著保护作用)
北京的一组研究人员还发现丹参素冰片酯(DBZ)是一种 PPAR-γ 激动剂,具有预防或逆转肠道菌群失调的潜力。DBZ 是传统中药复方丹参中天然存在的两种化合物的合成版本。与罗格列酮和其他经典噻唑烷二酮类药物相比,DBZ 被发现对 PPAR-γ 的激活程度更小,但仍然能够在小鼠饮食模型中提供显着的保护作用,防止肠道菌群失调、肠屏障功能障碍、胰岛素抵抗和体重增加-诱发肥胖。
丁酸盐补充剂也可能参与激活
丁酸盐补充剂也被证明可以改变人类的肠道生态系统。一项针对 49 名 IBD 患者的前瞻性、随机、安慰剂对照研究发现,每天 1800 毫克的丁酸盐不仅可以减轻炎症并改善生活质量,而且还会增加产丁酸菌的数量。
经过两个月的补充,患有克罗恩氏病的人的丁酸球菌和Subdoligranulum丰度增加,而患有溃疡性结肠炎的人的毛螺菌科则大量增加。虽然研究人员没有直接测量 PPAR-γ,但考虑到产丁酸菌和炎症标志物的丰度发生了如此巨大的变化,这一途径可能参与其中。
▼
总而言之,这是一个非常有趣的研究领域,在未来几年无疑会受到更多关注。
《科学》杂志上的评论中写道:“结肠细胞的代谢重编程以恢复上皮细胞缺氧,代表了一种有前途的新治疗方法,可以在广泛的人类疾病中重新平衡结肠微生物群”。
换句话说,如果能够靶向结肠细胞的新陈代谢,我们就可以恢复肠道中的低氧环境,并有可能逆转肠道微生态失调。
谷禾也正积极开展研究合作,以确定丁酸盐和其他 PPAR-γ 激动剂是否可以预防抗生素引起的各种菌群失调。
3
以下是可能增加肠道 PPAR-γ 活性以支持肠道缺氧的干预措施的总结。可能有助于解决对其他治疗没有反应的肠道菌群失调疑难病例,尤其是那些以高变形杆菌和低丰度产丁酸菌为特征的肠道菌群失调。
首先应该关注的地方依然是日常能做到的,比如说健康的饮食,定期锻炼,充足的睡眠、阳光和健康的社交互动。
其他疗法包括:
美沙拉嗪 (5-ASA):该药物通常用作 IBD 的一线治疗药物。它的抗炎作用已被证明是通过其上调 PPAR-γ 的能力介导的。
丹参素冰片酯(DBZ):这种化合物来源于丹参酚和冰片,存在于中药复方丹参中。它上调 PPAR-γ,并已证明具有减轻微生态失调的潜力。注意:草药的来源和剂量应谨慎,最好是在草药方面经验丰富的医生的指导下。
丁酸盐:一种短链脂肪酸和 PPAR-γ 的有效刺激剂。即使是低浓度的丁酸盐也能将 PPAR-γ 蛋白表达增加 7 倍。
酮类: β-羟基丁酸和乙酰乙酸会激活肠上皮细胞中的 PPAR-γ,就像丁酸一样。生酮饮食已被证明可以在许多组织中上调 PPAR-γ,还可以为 β 氧化和上皮能量产生提供底物。希望能有更多支持这方面的研究。
禁食/热量限制:一项研究发现,在热量限制期间,交感神经系统激活需要肠道 PPAR-γ。然而,禁食或热量限制在多大程度上在肠道中诱导该通路仍不清楚。
运动:一个研究小组发现,在结肠炎模型和饮食诱导的肥胖模型中,自愿运动对肠道的保护作用是由运动增加肠道内源性糖皮质激素和上调 PPAR-γ 的能力介导的。
压力管理:压力会降低肠道中 PPAR-γ 的表达。
大麻素:大麻二酚 (CBD) 降低了溃疡性结肠炎患者直肠活检中的 iNOS 活性,这种作用是通过激活 PPAR-γ 介导的。
萝卜硫素:2008 年发现这种来自十字花科蔬菜的植物化学物质通过激活 PPAR-γ 增强先天免疫成分。
姜黄素:一项研究发现姜黄素通过激活 PPAR-γ 抑制小鼠化学诱导的结肠炎。达到这些效果所需的口服剂量尚不清楚。
其他草药:洋甘菊、当归、水飞蓟素、甘草根和柠檬香脂都是 PPAR-γ 的部分激活剂。
脂肪酸:共轭亚油酸 (CLA) 和 omega-3 脂肪酸 (DHA) 均可增强 PPAR-γ 的表达。
益生菌:对结肠细胞的体外研究表明,布拉酵母菌(Saccharomyces boulardii)具有增加 PPAR-γ 表达的能力。
益生元:对结肠细胞的体外研究表明,低聚糖 alpha3-唾液酸乳糖和 FOS 的抗炎作用是通过它们诱导 PPAR-γ 的能力介导的。
维生素 A:视黄酸是维生素 A 的一种形式,是 PPAR-γ 的激活和功能所必需的。维生素 A也称为“抗感染素”。
注:本账号内容仅作交流参考,不应将以上信息视为医疗建议。采取干预措施前请咨询医生,了解治疗是否适合。
主要参考文献
Bradley PH, Pollard KS. Proteobacteria explain significant functional variability in the human gut microbiome. Microbiome. 2017 Mar 23;5(1):36. doi: 10.1186/s40168-017-0244-z. PMID: 28330508; PMCID: PMC5363007.
Lucy Mailing. The oxygen-gut dysbiosis connection(What causes gut health to go downhill, and how to break the cycle of gut inflammation, dysbiosis, and epithelial energy starvation). 2019,11.14, lucymailing.
Rigottier-Gois L. Dysbiosis in inflammatory bowel diseases: the oxygen hypothesis. ISME J. 2013 Jul;7(7):1256-61. doi: 10.1038/ismej.2013.80. Epub 2013 May 16. PMID: 23677008; PMCID: PMC3695303.
Henson MA, Phalak P. Microbiota dysbiosis in inflammatory bowel diseases: in silico investigation of the oxygen hypothesis. BMC Syst Biol. 2017 Dec 28;11(1):145. doi: 10.1186/s12918-017-0522-1. PMID: 29282051; PMCID: PMC5745886.
Byndloss MX, Olsan EE, Rivera-Chávez F, Tiffany CR, Cevallos SA, Lokken KL, Torres TP, Byndloss AJ, Faber F, Gao Y, Litvak Y, Lopez CA, Xu G, Napoli E, Giulivi C, Tsolis RM, Revzin A, Lebrilla CB, Bäumler AJ. Microbiota-activated PPAR-γ signaling inhibits dysbiotic Enterobacteriaceae expansion. Science. 2017 Aug 11;357(6351):570-575. doi: 10.1126/science.aam9949. PMID: 28798125; PMCID: PMC5642957.
Roudsari NM, Lashgari NA, Zandi N, Pazoki B, Momtaz S, Sahebkar A, Abdolghaffari AH. PPARγ: A turning point for irritable bowel syndrome treatment. Life Sci. 2020 Sep 15;257:118103. doi: 10.1016/j.lfs.2020.118103. Epub 2020 Jul 15. PMID: 32681913.
What Is Dysbiosis? Written by WebMD Editorial Contributors. Medically Reviewed by Dan Brennan, MD on December 06, 2022
Yajie Wang, Yue Chen, Xiaoyu Zhang, Yangpeng Lu, Haixia Chen, New insights in intestinal oxidative stress damage and the health intervention effects of nutrients: A review, Journal of Functional Foods,2020. Volume 75,104248,
Shelton CD, Byndloss MX. Gut Epithelial Metabolism as a Key Driver of Intestinal Dysbiosis Associated with Noncommunicable Diseases. Infect Immun. 2020 Jun 22;88(7):e00939-19. doi: 10.1128/IAI.00939-19. PMID: 32122941; PMCID: PMC7309626.