-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
炎症,慢病
炎症,作为一种保护机制,其本身是有益的。因受伤或感染而产生的急性炎症具有适应性,能够成功支持先天和适应性免疫反应的精心协调。然而,无论是由心理因素还是器质性因素(如抗原或损伤)引起的,持续或反复激活免疫系统都会导致长期的炎症反应,从而引发低度慢性炎症。
失调的炎症作为影响最常见慢性病的驱动因素,它不分青红皂白地影响着整个人体。
人体,作为一个综合系统,一个变量的紊乱会通过多种途径对其他关键因素“造成”连锁反应,并且过程还与反馈相关。人体需要一种通用的方式在其不同的解剖部分之间进行交流,即一种共同的生理机制。炎症可能是了解疾病在体内如何发展和进展的关键,炎症不仅是身体系统的“表达语言”,也是解决多种慢性疾病的指标或目标。
因此,普遍存在的疾病彼此独立、需要通过离散的特定干预措施进行管理的孤立观点已不再站得住脚。疾病的“表型”特征只是整个系统紊乱的一种表现,即一个人身上“多种不同疾病”的个例,实际上是由炎症这一共同线索串联起来的。
因此,识别具体的炎症来源、标志物,并综合这些指标来判别定位这些影响的靶器官或组织,是预防和管理慢性病的重要思路。
未来的预防医学需要无创、便捷且准确的方法来判别炎症源和炎症反应影响的靶器官或组织。例如,识别促炎细胞因子如IL-1、IL-6、IL-12、IL-18、TNF-α、IFN-α,组织代谢物如尿酸盐晶体和肝素结合蛋白的变化以及是否高负荷状态,是未来医学的重要一环。
随着大数据和多组学技术的发展,目前还可以通过分析体温、血压、心率等生理指标的变化,同时结合微生物组学、基因组学、蛋白组学数据,识别出与炎症水平相关的身体标志物,将有助于为个体综合治疗管理提供更加全面的依据。
本文将回顾了促炎和抗炎调节的局部免疫级联以及与神经和心理通路相互关联的反馈回路。
共同探讨和尝试了解身体这个精细调节的系统,如果遭受持续不断的“超负荷”将导致全身性炎症,从而导致慢性疾病的出现。描述了几种常见疾病的途径,以及这些详细理解对临床医学、预防和卫生系统等的启思。

■ 免疫系统的主要目标:
清除体内外来或非自身细胞物质,如细菌、病毒、真菌、寄生虫和受损细胞。
■ 免疫系统由两个分支组成:
先天免疫系统是基本的首道防线,负责启动炎症反应。
适应性免疫系统进化得更高级,能够在生物体一生中接触抗原时“学习”并形成“记忆”。

免疫系统的两个分支虽然功能各异,但都致力于保护身体的健康。它们的主要任务是协同工作,并有效清除体内的有害物质(非自身细胞物质)。这两个分支都负责监测整个身体的抗原存在情况;但每个分支的启动方式却不同。
简而言之,这两个分支就像是身体的两支特种部队,各有所长,但通力合作,共同守护健康。
■ 初级淋巴器官
包括骨髓和胸腺,淋巴细胞在此生成和/或分化。例如,T 细胞在胸腺中分化并经历正向和负向选择,使 T 细胞进入血液,只有当识别具有主要组织相容性复合体 (MHC) 标记的细胞并呈递抗原时,T 细胞才会被激活。
■ 次级淋巴器官
包括淋巴结和脾脏,它们是幼稚免疫细胞的储存器。淋巴结过滤淋巴系统并提供抗原激活白细胞与 B 细胞和 T 细胞之间的相互作用。
幼稚白细胞监测血液和组织中的外来抗原和/或被免疫信使(如细胞因子)招募到炎症部位并被激活。一旦被激活,白细胞就会清除受影响区域的外来抗原、受感染、受伤或死亡的细胞,并协助修复。
免疫细胞利用细胞因子作为自分泌、旁分泌或内分泌信使,在彼此之间以及与其他生物系统之间进行交流,从而产生协同、拮抗或多重效应。
注:自分泌(Autocrine)信使:
自分泌信使是指细胞释放的化学物质作用于同一细胞自身。这种信号传递方式使细胞可以调节自身的功能和活动。例如,一种细胞产生某种激素或生长因子后,会通过自分泌方式使自身的生理活动发生变化。
旁分泌(Paracrine)信使:
旁分泌信使是指细胞释放的化学物质作用于邻近的细胞。这种类型的信号传递对于局部细胞间的通讯至关重要。例如,在伤口愈合过程中,某些细胞释放的生长因子可以影响周围细胞的增殖和修复能力。
内分泌(Endocrine)信使:
内分泌信使是指细胞或腺体释放的激素通过血液循环到达远离其来源的靶细胞,通常这种信号传递作用于身体内的多个系统。例如,胰腺分泌的胰岛素通过血液传播,调节各个组织的糖代谢。
细胞因子环境可以调节适应性免疫反应。例如, IL-2(白细胞介素 2) 和 IFN-γ(干扰素-γ) 的产生支持细胞毒性 T 淋巴细胞的激活,是抵抗细菌和病毒所必需的。然而,高水平的IL-4和IL-6支持B淋巴细胞的激活和增殖,有利于抗体的产生。
先天免疫系统不仅涉及细胞防御,还涉及物理和化学屏障。
物理屏障包括皮肤和呼吸系统及胃肠道系统的粘膜。化学屏障是胃的酸性 pH 值。
尽管先天免疫系统比较简单,但它是造成即时非特异性炎症的原因,例如皮肤割伤引起的发热、发红、疼痛、肿胀。
利用识别细菌常见膜配体的模式识别受体 (PRR),先天免疫系统可以检测多种微生物抗原并引发炎症反应。
注:模式识别受体(Pattern Recognition Receptors,PRR)是存在于宿主细胞表面或细胞内的一类受体,主要负责识别和应对病原体(如细菌、病毒、真菌和寄生虫)以及其他有害物质(如损伤相关分子模式,DAMPs)。这些受体在先天免疫系统中发挥关键作用,帮助机体快速识别并响应感染和损伤。
此外,血液中还存在可溶性模式识别受体,包括补体系统。补体是一系列蛋白质,可导致微生物膜上“穿孔”,并有助于招募炎症细胞。
积极参与先天免疫反应的免疫细胞包括巨噬细胞(活化单核细胞)、中性粒细胞、自然杀伤 (NK) 细胞和树突状细胞 (DC)。
利用吞噬作用清除抗原或微生物,并产生活性氧来杀死微生物。
裂解病毒感染的细胞。一旦被激活,NK 细胞就会继续通过细胞因子招募新的免疫细胞。
也称为抗原呈递细胞 (APC),会迁移到淋巴结以引发适应性免疫系统的激活。
对先天免疫系统有效性至关重要的细胞因子包括 IL-1、IL-6、TNF-α、IFN-α。这些免疫信使会引发发烧、疼痛和疲劳(临床上称为疾病行为),并激活下丘脑-垂体-肾上腺轴 (HPA轴)。
■ IL-1(白细胞介素-1):
IL-1是一种主要的促炎细胞因子,由巨噬细胞、单核细胞和其他免疫细胞产生。
它有两种主要形式:IL-1α 和 IL-1β。
主要功能包括促进炎症反应、刺激T细胞和B细胞的增殖、诱导发热,并参与机体对感染和损伤的反应。IL-1还可以促进其他细胞因子的产生,增强免疫反应。
■ IL-6(白细胞介素-6):
IL-6是一种多功能细胞因子,由多种细胞产生,包括巨噬细胞、内皮细胞和肌肉细胞。
它在急性炎症、免疫反应和细胞增殖中发挥重要作用。IL-6可以刺激B细胞分化为抗体产生细胞,促进T细胞增殖,并参与急性期反应,增加急性期蛋白的产生。
■ TNF-α(肿瘤坏死因子-α):
TNF-α是一种主要的促炎细胞因子,由巨噬细胞、T细胞和其他细胞产生。
它在免疫反应和炎症中发挥关键作用,能够诱导细胞凋亡、促进炎症反应、增强免疫细胞的活性,并参与各种疾病的病理过程,如自身免疫病和感染。
■ IFN-α(干扰素-α):
IFN-α是干扰素家族中的一种,主要由病毒感染的细胞、T细胞和树突状细胞产生。
它在抗病毒免疫中发挥重要作用,能够增强细胞的抗病毒能力,抑制病毒复制,并刺激邻近细胞产生其他抗病毒蛋白。IFN-α还可以增强白细胞的活性,促进适应性免疫反应。
这些细胞因子在免疫反应、炎症以及与多种疾病(如感染、癌症和自身免疫疾病)的发展中扮演着重要的角色,它们的相互作用和调控对于维持机体的免疫平衡和健康至关重要。
更进化的适应性免疫系统仅存在于脊椎动物中,负责增加抗原清除的强度和特异性,以及发展记忆,以便在二次接触时更快地清除抗原。

在人类中,适应性反应需要10-14 天才能产生原发性抗原特异性反应。
T 细胞有两种主要类型:辅助性T (TH) 细胞 (CD4+) 和细胞毒性T (TC) 细胞 (CD8+),它们在血液和淋巴系统中循环,并驻留在次级淋巴器官中。
一旦 T 细胞通过 APC 呈现抗原,它们就会分化为记忆细胞和效应细胞。TC效应细胞是细胞毒性 T 淋巴细胞 (CTL),可裂解携带抗原的细胞。
APC(抗原呈递细胞,Antigen-Presenting Cell)
是免疫系统中的一种特殊细胞,负责捕获、处理和呈递抗原(如病原体、毒素和其他外源性物质)以激活T细胞,从而启动适应性免疫反应。APC在免疫反应中的作用至关重要。
■ 常见的APC包括:
树突状细胞:最有效的抗原呈递细胞,负责捕获外来物质并在淋巴结中激活T细胞。
巨噬细胞:具有吞噬和消化病原体的能力,也能呈递抗原。
B细胞:虽然主要功能是产生抗体,但也能作为APC呈递抗原。
■ 抗原呈递的过程
抗原呈递涉及以下步骤:
捕获抗原:APC通过吞噬或内吞作用捕获外源性抗原,通常是在感染的部位或周围组织。
处理抗原:APC内的酶会将捕获的抗原分解成小肽片段。
呈递抗原:这些小肽片段与主要组织相容性复合体(MHC)分子结合,然后被转运到APC的细胞表面。

编辑
■ MHC分子分为两类:
MHC I类:呈递内源性抗原,通常由所有有核细胞表达,主要激活CD8+细胞毒性T细胞。
MHC II类:呈递外源性抗原,通常由APC(如树突状细胞和巨噬细胞)表达,主要激活CD4+辅助T细胞。
■ T细胞激活与免疫应答
T细胞激活:当T细胞的T细胞受体(TCR)识别并结合APC表面的抗原-MHC复合物时,它们被激活。激活后的T细胞会增殖,分化为效应T细胞,参与免疫应答。
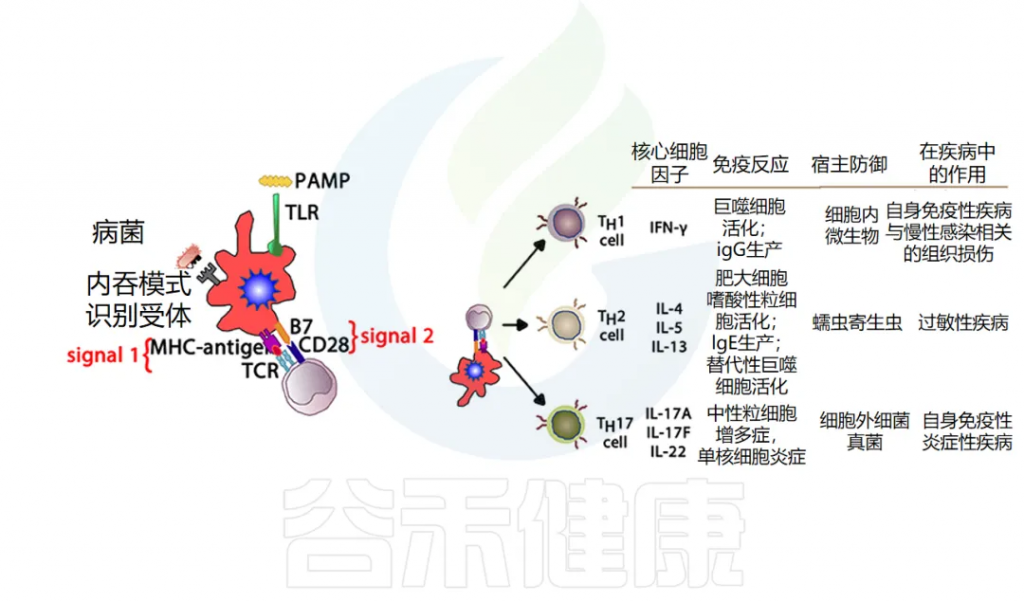
TH效应细胞功能:负责产生细胞因子并指导 B 细胞发育或动员。先天免疫细胞产生的当前细胞因子环境会影响 TH细胞的发育,进而影响免疫反应的进程,使其倾向于两个主要方向之一。
TH1 细胞产生细胞因子 IL-2、IFN-γ 和 TNF-α,这些细胞因子可驱动 CTL 活化并支持细胞免疫。这种细胞介导的免疫反应对于针对细胞内细菌和病毒产生有效反应至关重要。
注:CTL是适应性免疫系统中的主要效应细胞,负责识别和消灭被病毒感染的细胞以及肿瘤细胞。其主要功能是通过释放细胞毒性因子来诱导靶细胞凋亡,从而发挥抗感染和抗肿瘤的作用。
另一方面,TH2 细胞产生IL-4和IL-5,进而支持B细胞活化和分化,也称为体液免疫。
TH和TC记忆细胞通过血液和淋巴系统监测身体是否反复接触抗原。这两种细胞类型对于快速、有效地对抗原产生二次反应都至关重要。
其他T细胞亚群的作用
其他T细胞亚群也被定义为在宿主防御中发挥关键作用,并且更多 T 细胞亚群的重要性日益得到认可:T 调节细胞(Treg)和 TH17 细胞。
Treg细胞在调节其他免疫反应中起着核心作用,它们释放 TGF-β 和 IL-10 来下调 TH1 和 TH2 细胞的过度活化,如果不加以控制,这些细胞分别可能导致自身免疫或过敏性疾病。
TH17 会释放 IL-17,在涉及中性粒细胞募集(尤其是对粘膜)的抗菌防御中起重要作用,在防御某些特定病原体(如念珠菌)方面发挥着特别重要的作用。
■ 体液免疫的重要性
体液免疫反应,在对抗细胞外微生物和在对抗原的原发性和继发性反应期间产生抗体反应方面非常重要。
未成熟 B 细胞遍布全身,在淋巴结中浓度较高。活化的 B 细胞成为效应浆细胞,并制造抗原特异性抗体,以中和游离抗原或标记受感染细胞以进行破坏。
记忆 B 细胞是长效细胞,通过为吞噬或溶解免疫细胞创造更大的攻击目标(如在原发性反应中)来支持在第二次接触期间更快地清除。
例如,NK 细胞和巨噬细胞检测抗体复合物,从而导致抗体中和抗原或受感染细胞的吞噬。此外,抗体可以激活或延续补体级联。
当身体感受到感染、创伤、缺血、物理、化学或其他形式的“危险”时,就会引发炎症。
暴露于病原体相关分子模式 (PAMP) 和损伤相关分子模式 (DAMP) 会导致单核细胞-巨噬细胞谱系细胞激活,从而表达促炎基因并抑制抗炎基因。
■ 病原体相关分子模式 (PAMP)
定义:PAMP是指广泛存在于病原体(如细菌、病毒、真菌和寄生虫)中的特征分子,相较于宿主细胞而言,这些分子是特异性地存在于病原体中。
常见的PAMP示例包括:
特点:
PAMP通常是高度保守的分子结构,使得宿主的免疫系统能够快速识别和应对多种病原体。
功能:
PAMP通过与宿主细胞的模式识别受体(PRR,如Toll样受体等)结合,激活免疫反应,包括炎症反应、白细胞的招募和抗体的产生。它们在启动先天免疫反应中起到关键作用。
■ 损伤相关分子模式 (DAMP)
定义:DAMP是指宿主细胞在受到损伤、死亡或应激时释放的内源性分子。这些分子可以被免疫系统识别,从而触发免疫反应。
常见的DAMP示例包括:
特点:DAMP并不是特定于病原体的,而是在细胞受到损伤或应激时由宿主自身细胞释放的。
功能:DAMP通过与模式识别受体相互作用,促进免疫细胞的活化,诱导炎症反应,帮助机体清理损伤细胞并启动修复过程。
细胞因子和趋化因子在炎症中的作用
细胞因子、趋化因子和其他化学物质的产生会介导非特异性细胞募集和体液介导的血管变化。这些细胞过程由各种细胞内信号传导和核转录途径介导。
促炎反应:NF-κB 和 AP-1
NF-κB 和 AP-1 这两种转录因子在促炎反应中扮演关键角色,它们能够驱动促炎细胞因子(如TNF-α 和 IL-1)、趋化因子(如 CCL2 和 CXCL8)以及内皮粘附分子的表达,从而影响炎症反应的进程。
干扰素反应因子 IRF3 和 IRF7
另一方面,干扰素反应因子 IRF3 和 IRF7 则主要负责促进 I 型干扰素(如 IFN-α 和 β)的产生,这些干扰素在对抗病毒防御中具有重要作用。
然而,炎症反应并不仅仅由这些分子机制所限定。实际上,除了病原体引起的免疫激活外,非抗原性刺激也能触发炎症过程。
非抗原刺激引发的炎症反应
非抗原刺激可能被视为“危险”并引发炎症反应;这些影响包括创伤,如辐射、缺血、毒素暴露,甚至心理压力。
这些因素可能通过各种机制诱发炎症,包括激活神经内分泌通路(如情绪压力所见,见抑郁症部分),或通过上调刺激炎症信号传导的“应激”通路,如缺血性中风中的小胶质细胞激活。
环境毒素和化学物质的影响
如农药残留、添加剂、防腐剂等,也可能通过激活细胞色素 P450 通路、诱导活性氧或代谢为具有免疫毒性作用的反应中间体和新抗原,来诱发炎症活动。也就是说,我们日常接触的化学物质可能正悄悄影响着我们的免疫系统。
芳烃受体 AhR 在炎症中的角色
在探讨了化学物质如何诱发炎症之后,我们进一步了解到芳烃受体AhR在其中扮演的角色。芳烃受体AhR激活可以介导对一系列内源性和外源性配体的炎症反应,在粘膜免疫和正常屏障功能中发挥关键作用,同时也是各种致癌因素途径,如二恶英的致病。强调了环境因素与炎症性疾病之间的复杂联系。
临床上,炎症的典型表现是疼痛、发热、发红、肿胀和功能丧失。组织损伤会导致组胺释放,刺激毛细血管扩张,导致血管淤滞,使吞噬细胞迁移和血浆渗漏(发红、发热和肿胀)。
缓激肽的释放会增加含有神经末梢的组织的疼痛敏感性。功能丧失被认为是对疼痛的神经反射。
吞噬活性可清除病原体,炎症级联的下调可导致愈合。
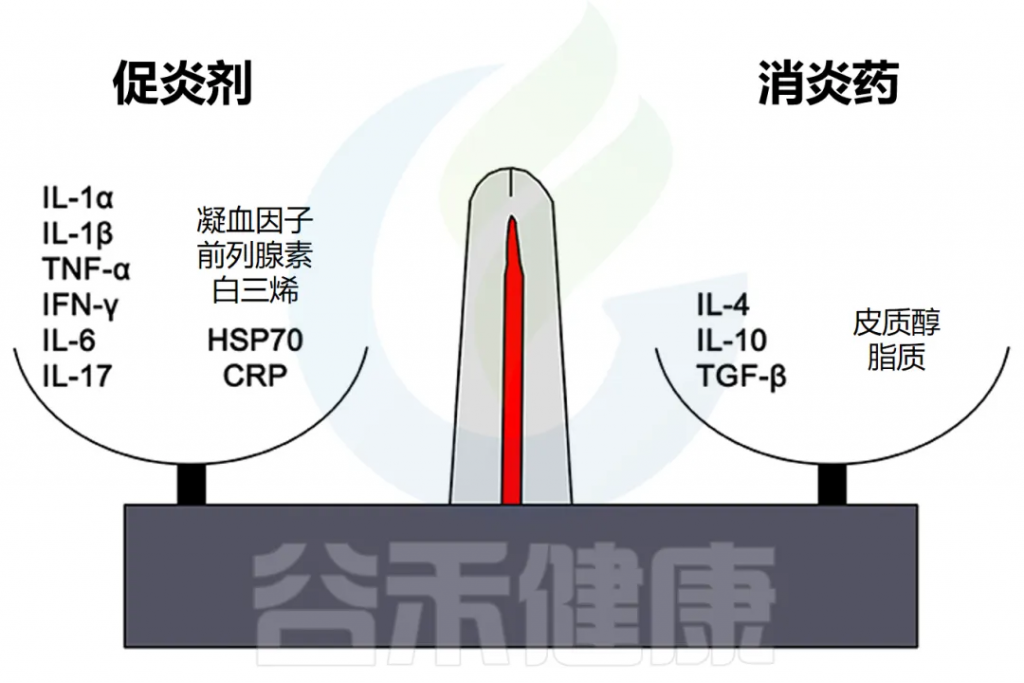
细胞因子在炎症中的双重作用
IL-1、IL-6 和 TNF-α 等因子有利于炎症,而 IL-10 和 TGF-β 等细胞因子可抑制炎症。
然而,这些区别并不是绝对的,有些因素起着双重作用。例如,IL-4 会干扰某些肿瘤的炎症,但有利于过敏症中的抗体产生。
慢性炎症中IL-6的作用
在慢性炎症的背景下,IL-6 通常被认为是促炎的,然而,也有 IL-6 具有抗炎作用的例子,也可能表明其他自然的持续过程,如组织修复。因此,在检查炎症水平时,结合背景至关重要,才得出正确的结论。
doi.org/10.3389/fmed.2018.00316
此外,炎症平衡的非细胞因子介质包括促炎化学物质,如 CXCL8 趋化因子和某些金属蛋白酶,以及抗炎剂,包括抗菌肽、TIMP(金属蛋白酶组织抑制剂)和趋化因子 CCL2 。
这些“宏观”炎症变化受免疫调节途径控制。然而,免疫反应释放的免疫介质和细胞因子会触发神经元反应,从而放大局部炎症反应,并触发全身神经内分泌和神经反应,最终导致炎症过程消退并恢复正常的稳态。
这些正常的反馈回路可能会因中枢神经系统长时间或不适当的激活而中断,从而导致激素抑制不足导致过度炎症,或因过度或长时间的抗炎反应导致不受控制的感染。
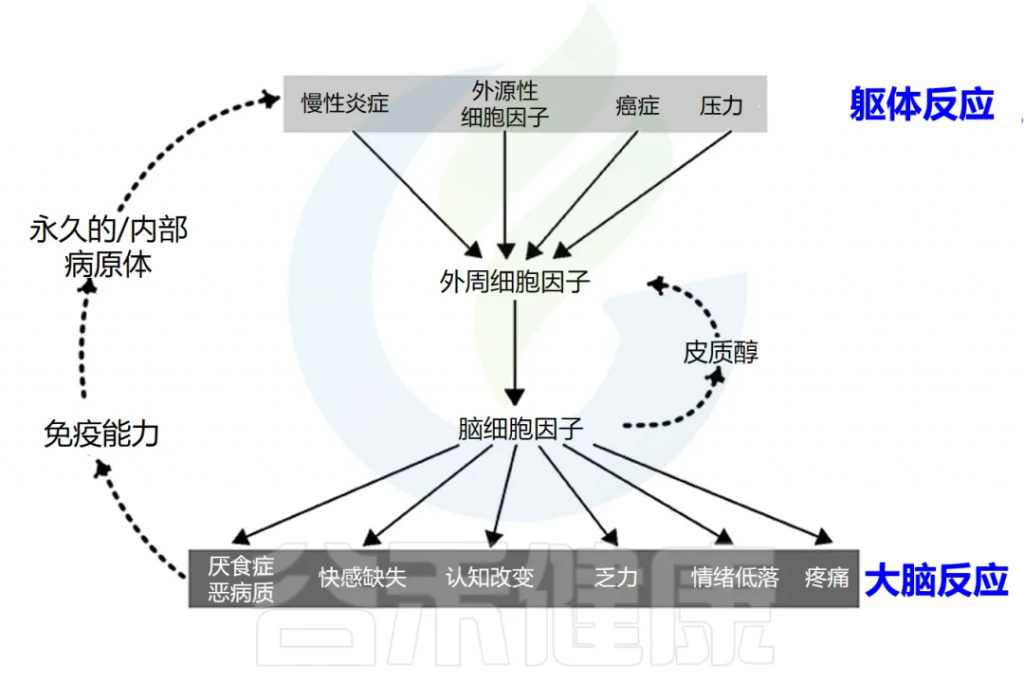
炎症会导致全身不适反应
可能会出现发烧、恶心、食欲不振、疲倦,睡眠质量差、易怒、情绪低落、注意力不集中、健忘、社交退缩等。
这些症状是由促炎细胞因子引发的,包括 IL-1α、IL-1β、TNF-α、IFN-γ、 IL-6等。虽然它们是对感染的局部反应,但它们会刺激大脑细胞因子系统,导致出现疾病症状,促使人们减少活动,多休息更好地应对感染。
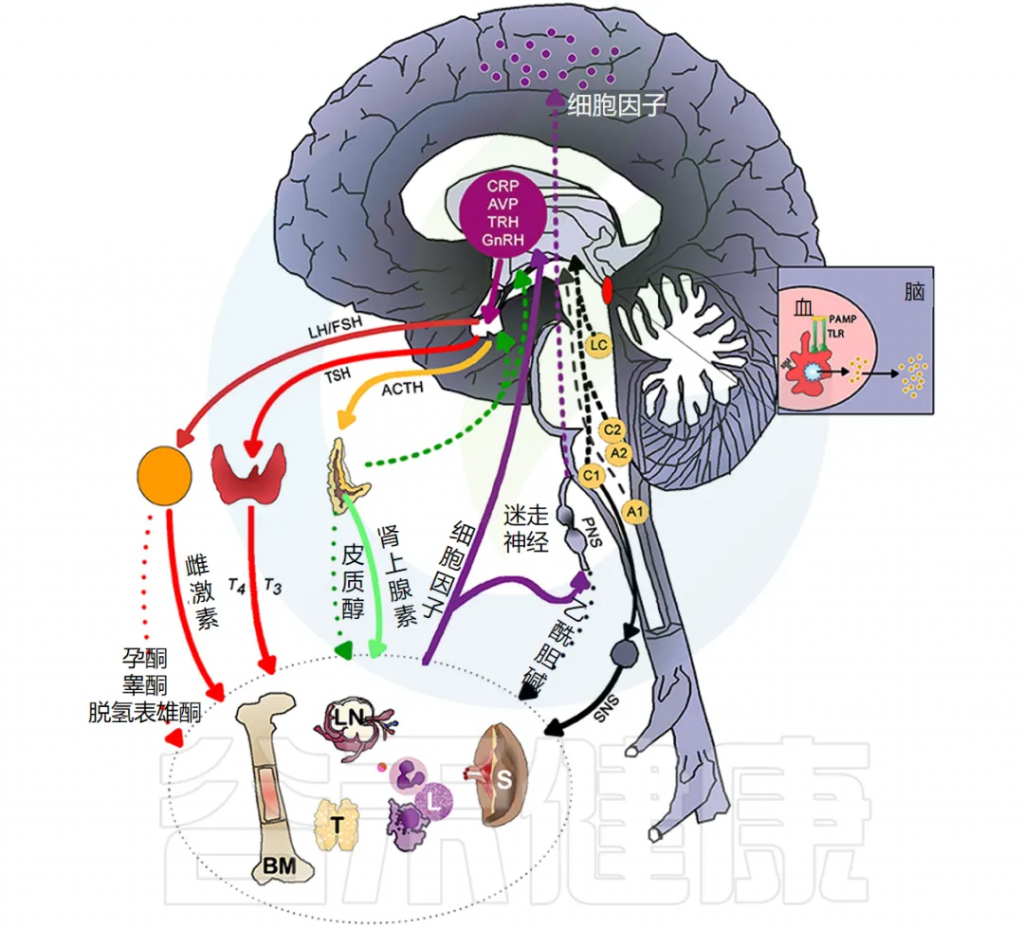
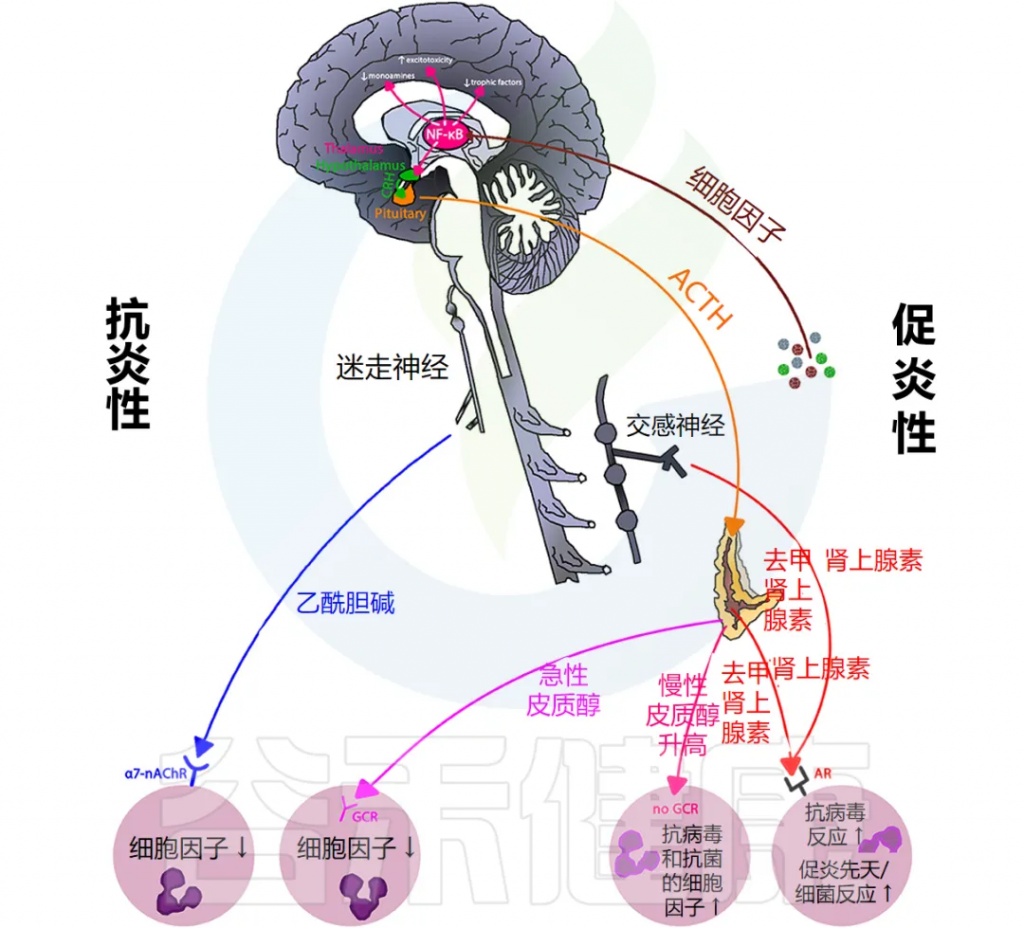
炎症通过激活许多不同的反馈回路触发全身反应。中枢神经系统 (CNS) 对环境刺激反应迅速,导致神经递质和神经肽与免疫介质刺激的相同信号通路结合。
炎症部位释放的免疫调节剂与疼痛通路的神经递质受体相互作用,反过来,局部神经肽可以释放组胺等促炎介质来增强局部炎症反应。
神经对炎症的反应很快,但会随时间而变化,并且可能对炎症过程产生放大或抑制作用,因此临床上观察到的疾病行为会随时间而变化。
总体而言,这些神经反应模式旨在维持正常的生理稳态,以响应免疫系统刺激和正常组织功能的恢复。
下图说明大脑免疫系统的主要通路和反馈回路。
doi.org/10.3389/fmed.2018.00316
交感神经系统 (SNS) 激活促进免疫细胞活动和全身免疫反应,而副交感神经系统 (PNS) 和下丘脑-垂体-肾上腺 (HPA) 轴通常会抑制炎症反应。然而,慢性应激反应系统的激活会导致免疫细胞过度活跃并促进全身炎症(详情将在下一节讨论)。
大脑中有小胶质细胞、巨噬细胞和树突状细胞等免疫细胞,它们在受到炎症刺激时会产生细胞因子和前列腺素,刺激神经和非神经脑细胞受体,从而影响大脑功能。
小胶质细胞和神经元可以对外周细胞因子的产生作出反应。此外,小胶质细胞是免疫系统中的常驻神经细胞,对细菌脂多糖 (LPS) 敏感,由于 Toll 样受体 (TLR) 的表达,它可直接引发中枢神经系统炎症,而无需外周细胞因子的参与。
无论是与实际年龄还是慢性疾病状态相关的衰老大脑,都有更多反应性小胶质细胞,它们对刺激有过度的细胞因子反应,并破坏神经可塑性以及行为和认知功能。
doi.org/10.3389/fmed.2018.00316
大脑对外周免疫反应的监测
大脑还通过传入神经刺激、体液途径、跨血脑屏障的细胞因子交换以及血管周围巨噬细胞和脑小静脉内皮细胞上的 IL-1 受体激活来监测外周免疫反应。
抗炎细胞因子的调节作用
大脑中的抗炎细胞因子 IL-10 和 TGF-rβ 可改善疾病体验。在健康状态下,大脑中的促炎和抗炎细胞因子保持平衡。由于衰老与先天免疫系统活动增加有关,因此大脑会产生大量的促炎细胞因子,但抗炎细胞因子的产生会减少,从而导致更明显的疾病行为。
皮质醇的基本功能
皮质醇是一种糖皮质激素,影响身体的日常功能,如能量利用/储存、记忆形成、呼吸、心率、胃肠功能和情绪。它有稳定的昼夜节律,但也会因内部(如过度免疫活动)和外部(如感知到的威胁)压力源而释放。皮质醇是下丘脑-垂体-肾上腺 (HPA) 轴的终产物。
HPA轴与皮质醇的调控
下丘脑的促肾上腺皮质激素释放激素 (CRH) 会启动垂体前叶释放促肾上腺皮质激素 (ACTH)。ACTH 通过血流传播并刺激肾上腺皮质产生皮质醇。
通过对海马中的糖皮质激素受体进行负反馈,皮质醇会阻止 CRH 和 ACTH 的进一步释放。其他各种激素,包括雄激素、雌激素、垂体后叶激素、加压素和催产素,都可以调节HPA轴。
皮质醇与免疫系统的相互作用
在调节良好的系统中,免疫细胞会表达糖皮质激素受体,从而使皮质醇抑制免疫细胞活化和促炎细胞因子释放。
然而,慢性压力可能会长时间升高皮质醇水平,导致糖皮质激素受体表达下调。因此,不受调节的免疫细胞会产生过量的促炎细胞因子。
“
皮质醇作为HPA轴的终产物,在调节身体对压力的响应、维持生理平衡以及抑制免疫反应中发挥着关键作用。理解皮质醇的生理作用及其调控机制,对于我们认识压力如何影响健康具有重要意义。同时,慢性压力下皮质醇水平的变化及其对免疫系统的潜在影响,也提示我们在面对长期压力时需要采取适当的应对策略,维护身心健康。
自主神经系统直接连接大脑和周围器官和组织。其两个独立分支发出相反的信息,即交感神经兴奋和副交感神经放松。
■ 交 感 神 经 系 统
交感神经支配将大脑直接与肾上腺髓质联系起来,让身体做好“战斗或逃跑”的准备。
交感神经激活后,肾上腺髓质会释放儿茶酚胺、肾上腺素和去甲肾上腺素,这些物质会导致心率、血压和呼吸频率增加,并将血液从非重要器官转移到主要肌肉群和大脑。
尽管儿茶酚胺的半衰期较短且在血液中代谢迅速,但交感神经系统 (SNS) 也直接支配作为免疫细胞储存器的次级淋巴结构。因此,慢性交感神经激活和去甲肾上腺素释放可导致免疫失调。例如,去甲肾上腺素促进核因子 κB (NF-κB) 活化,这会增加几种促炎介质的基因表达,进而增强炎症。
此外,肾上腺素在应激期间会增加 IL-6 和 TNF-α 的产生。因此,肾上腺素和去甲肾上腺素可以诱导促炎细胞因子的产生并增强全身炎症。
■ 副 交 感 神 经 系 统
副交感神经与交感神经的平衡
副交感神经系统 (PNS) 通过多种方式对抗交感神经系统,例如减慢心率、降低呼吸频率、促进消化和平静情绪。迷走神经具有传入和传出神经纤维,用于大脑和周围神经之间的双向通讯。
副交感神经的免疫调节作用
副交感神经激活会导致乙酰胆碱释放。乙酰胆碱可以与免疫细胞表面的 α7 烟碱型乙酰胆碱受体 (nAChR) 结合。α7 nAChR 刺激可抑制 NF-κB 改变炎症表达,从而导致细胞因子产生减少和抗炎作用。
PNS在压力管理中的角色
在静息期间,PNS控制着器官和身体功能。长期压力下,如果交感神经占主导地位,PNS对免疫功能的调节作用可能会受到抑制。
维持平衡的自主神经系统
即休息时迷走神经占主导地位,以及 PNS 的动态、可变激活,与情绪反应和压力脆弱性有关。Porges 的多重迷走神经理论利用进化和发展的方法,将 PNS 活动和社会沟通与支持对宁静、潜在危险和危及生命的环境做出适应性反应的电路层次联系起来。
神经内脏整合模型,以描述压力源(无论来源如何)如何从外周感觉汇聚到大脑,这些信息如何整合,以及 PNS 反应的灵活性,对于理解个体生理如何受到调节至关重要。
心率变异性的评估与意义
无论使用哪种视角,心率变异性 (HRV) 都可以评估 PNS 对 SNS 的影响,PNS 激活的变异性越大(即身体越平衡、越灵活),HRV 就越高。
因此,与 HRV 较低的人相比,HRV 较高的人功能更好,幸福感更强(例如,社交、情感、心理、生理),包括炎症更低。对于初级保健临床医生和为弱势群体服务的医疗工作者来说,HRV 可以作为个人功能状况的良好估计,包括免疫功能的间接替代指标。
炎症消退的其他途径
虽然本文主要关注神经内分泌系统和免疫系统之间的交集,但我们认识到还有其他途径可以消退炎症。例如,脂质介质(如消退素、保护素和马来素)在关闭和清除急性炎症反应方面起着关键作用。此外,这些生物活性脂质似乎可以阻断 NF-κB 活化,这与皮质醇和乙酰胆碱的作用相似。
Tips
因受伤或感染而产生的急性炎症具有适应性,能够成功支持先天和适应性免疫反应的精心协调。然而,无论是心理上还是器质性(即抗原、损伤)相关的,持续或重复激活免疫系统都会导致长期暴露,从而导致低度炎症。
这种慢性炎症会破坏多个系统,因为它会影响神经系统,并通过细胞因子受体在多个身体组织中表达而局部破坏多个系统。
作为一个综合系统,人体需要一种通用的方式在其不同的解剖部分之间进行交流,即一种共同的生理机制。炎症可能是了解疾病在体内如何发展和进展的关键,炎症受促炎和抗炎细胞因子的产生所调节。
因此,普遍存在的疾病彼此独立、需要通过离散的特定干预措施进行管理的孤立观点已不再站得住脚。疾病的“表型”特征只是整个系统紊乱的一种表现。在综合系统中,一个变量的紊乱会通过多种途径对其他关键因素“造成”连锁反应,并且总是与反馈相关,以调节“致病变量”的行为。
例如,外部因素和内部因素可导致相同的表型结果;社会经济地位低和脂肪组织过多都与慢性炎症有关。这种炎症加剧会导致大脑细胞因子信号增加,损害学习和记忆,并导致抑郁症状或病态行为;
这种反馈导致负面或不健康的系统性循环进一步传播。因此,不受控制或失调的炎症将慢性身心疾病的表现结合在一起,这些疾病通常普遍存在于高压力、脆弱的人群中(例如少数民族、社会经济地位较低等)。
目前,大多数疾病的病因都是由外部致病因素和/或内部生物医学变化导致疾病的宏观和/或微观表现所致。然而,一个显而易见但很少被提出的问题是:这些疾病是如何促成的?
大多数疾病(无论是急性还是慢性)都是由炎症引起的。
神经内分泌—免疫平衡失调,无论是受到“压力”和侵入性病原体等外部因素刺激,还是受到糖尿病或肾衰竭等代谢紊乱等内部因素刺激,都会导致免疫细胞活动失控。抗炎机制的同步丧失导致细胞因子负荷升高,进而激活 NF-κB和基因转录调控。
此外,许多疾病都是触发了“相关”疾病共病,如心脏病和糖尿病。疾病分类只提供了表型分类或命名,而不考虑潜在的病因和生理网络相互作用。
这些见解挑战了当前对“多重患病”的方法,一个人的表型疾病集合是精细调节的相互关联的生理网络反应的出现结果。
这里我们看到了,体内促炎与抗炎活动的微妙平衡,为我们提供了一种有效且高效的机制,以应对所有可能威胁生物体生存的内外干扰。这种平衡确保了我们能够迅速而恰当地响应各种挑战。
接下来我们将详细(但也不全面)地概述许多常见慢性疾病背后的一些重要炎症机制。特别是强调了,通过刺激下丘脑-垂体-肾上腺 (HPA) 轴而激活的炎症与慢性交感神经激活对疾病的促进之间的关联。
过去 30 年来,过敏性呼吸道疾病(过敏性气道疾病、哮喘和过敏性鼻炎)的患病率不断上升;哮喘影响约 8% 的人口,过敏性鼻炎影响 15% 至 20% 的人口。
过敏原的类型
过敏是指对环境中普遍存在且本质上相对无害的病原体产生的不适当的破坏性反应。
常年诱因包括:
屋尘螨、动物皮屑、霉菌、蟑螂蛋白。
季节性诱因包括:草、树、杂草的花粉。
更多过敏原及过敏的预防措施详见:
过敏的机制
过敏症,即在TH2 型 T 细胞的驱动下,对普遍存在的抗原产生过量 IgE 抗体。过敏症是由过敏原特异性 IgE 反应引起的,可通过表皮皮肤测试(下图)或血液过敏原特异性 IgE 测量来证实。
此类测试可揭示致敏的存在,但只有一小部分人会发展出临床上明显的过敏性疾病:过敏性皮炎(湿疹)、过敏性鼻炎、哮喘、食物过敏和其他过敏反应等。
特应性具有很强的遗传决定性
如果父母一方患有特应性,则患过敏性疾病的可能性约为 50%,而如果父母双方都患有特应性,则患过敏性疾病的可能性为 70%。
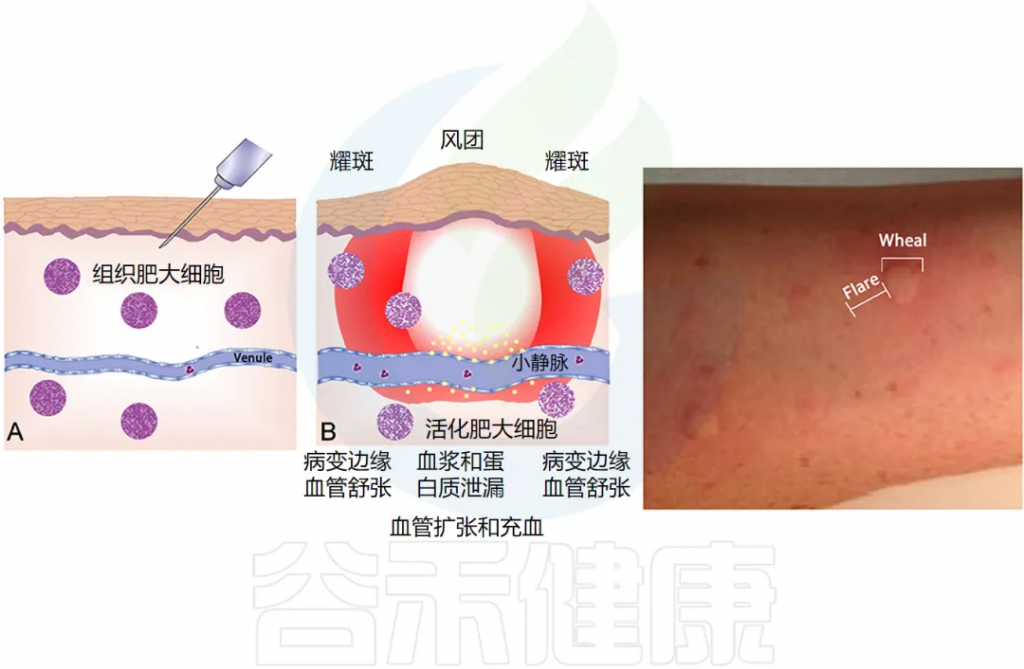
doi.org/10.3389/fmed.2018.00316
哮喘
哮喘是一种疾病,表现为反复发作的呼吸道受阻。特征包括时好时坏的气道堵塞、慢性的支气管炎症和对刺激表现出极强的敏感性。
过敏性哮喘的成因
这些问题主要是由于气道对某些过敏物质的强烈反应引起的,尤其是由一些特定化学物质(如白三烯)引发的过敏反应。
不过,对于约30%没有明确过敏原的哮喘患者,这种病可能是因为对多种刺激(如感染、药物、寒冷、胃酸倒流和运动)过度反应引起的。
非过敏性哮喘的成因
在所谓的“非过敏性”哮喘患者中,包含许多不同的亚群。其中一些亚群表现与典型过敏反应相似,但不产生过敏抗体,而另一些亚群则表现出不同的免疫特征。
过敏性呼吸道疾病的免疫机制
对于过敏性呼吸道疾病,免疫系统的某些细胞会将入侵体内的外来物(称作抗原)处理和呈递给免疫细胞,导致过敏反应的发生。这一过程需要多种信号进行协调,类似打响并引导免疫反应。
如果在抗原呈递过程中,有些特定信号分子(如IL-4)成为主导,会导致免疫细胞趋向于“过敏反应”,这时体内如哮喘的表现就可能加重。
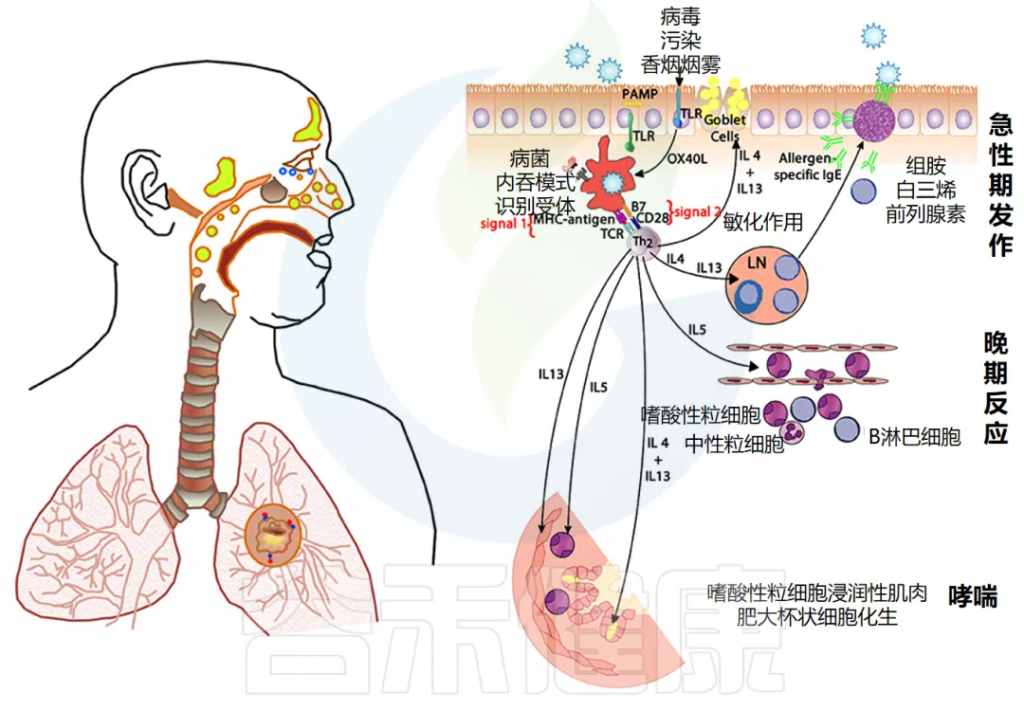
doi.org/10.3389/fmed.2018.00316
自身免疫性疾病影响大约 5% 的人口 ,并表现为一系列全身性疾病(如狼疮、硬皮病)和器官特异性性疾病(如慢性荨麻疹、甲状腺炎)。
自身免疫性疾病的成因
自身免疫性疾病是当身体的免疫系统错误地攻击自身组织时发生的。这种情况通常是因为身体的“中枢”和“外周”耐受机制失效了。
有些人可能携带自身抗体或免疫细胞,但这并不意味着他们一定会得自身免疫性疾病。这些抗体和细胞在某些情况下可能有助于清除体内的损伤产物。
自身免疫性疾病的诊断
在怀疑患有自身免疫性疾病的个体血清中检测抗体,在许多情况下都具有很大的诊断帮助作用。
例如,在系统性红斑狼疮 (SLE) 中检测 ANA,在类风湿性关节炎中检测抗环瓜氨酸肽 (anti-CCP),在乳糜泻中检测组织转谷氨酰胺酶 (tTG) 抗体。
然而,重要的是不要根据这些抗体的存在推断它们具有致病性。事实上,大多数可以识别抗体的自身免疫性疾病实际上主要由 T 细胞介导的病理学介导,抗体只不过是诊断上有用的附带现象。这些细胞介导的疾病的例子通常由相对较新定义的 TH17(IL-17 分泌)途径的过度活动主导,并涉及淋巴细胞和/或中性粒细胞浸润和炎症组织破坏,包括 1 型糖尿病、牛皮癣、桥本甲状腺炎、多发性硬化症、类风湿关节炎、克罗恩病。
自身免疫性疾病的风险因素
这些疾病的发生受遗传和环境多方面因素的影响,比如遗传缺陷、自身抗原的异常暴露或环境因素(如感染)都会增加风险。基因尤其在6号染色体上的影响较大,这与免疫系统在识别和耐受自体组织时发挥的作用有关。
doi.org/10.3389/fmed.2018.00316
心血管疾病是世界范围内慢性发病和死亡的最大原因,主要涉及冠状动脉和脑动脉。其基础是动脉粥样硬化,这是一种血管慢性炎症性疾病。
动脉粥样硬化的病理过程
动脉粥样硬化斑块的关键部位是其肩部区域,该区域被活化的 T 细胞、巨噬细胞和肥大细胞浸润,这些细胞会产生促炎介质和酶。斑块破裂会引发血小板聚集和血栓形成,导致急性缺血、临床症状和潜在的远端细胞死亡。
巨噬细胞在动脉粥样硬化中的作用
巨噬细胞是动脉粥样硬化病变的标志。
泡沫细胞的形成:它们通过清道夫和 Toll 样受体 (TLR) 摄入氧化低密度脂蛋白 (oxLDL)。胆固醇在细胞质中酯化,将巨噬细胞转化为泡沫细胞。
泡沫细胞的炎症作用:氧化脂蛋白向斑块周围的细胞发出信号,尤其是向内皮细胞和泡沫细胞发出信号,增加粘附分子的表达,进而吸引更多的单核细胞和淋巴细胞进入局部活化的内皮细胞。
泡沫细胞和活化的内皮细胞产生促炎细胞因子——IL-1、IL-6、IL-12、IL-18、IFN-γ、TNF-α,这会加剧炎症反应。
动脉粥样硬化病变的组成与免疫反应
动脉粥样硬化病变包含巨噬细胞、T细胞、树突状细胞、蛋白聚糖和平滑肌细胞以及从血液中渗出的胆固醇。氧化胆固醇会触发先天性和适应性免疫反应,导致 T 细胞活化和抗体产生。
TH2 细胞产生 IFN-γ,具有促炎作用,并通过激活巨噬细胞进一步驱动炎症活动,而 TH2 细胞产生 IL-4 和 IL-5。
TH1 和 TH2 活性是自我调节的:
在斑块内,TH1活性占主导地位,但被巨噬细胞和 TH2 细胞产生的 IL-10 所平衡(下图)。
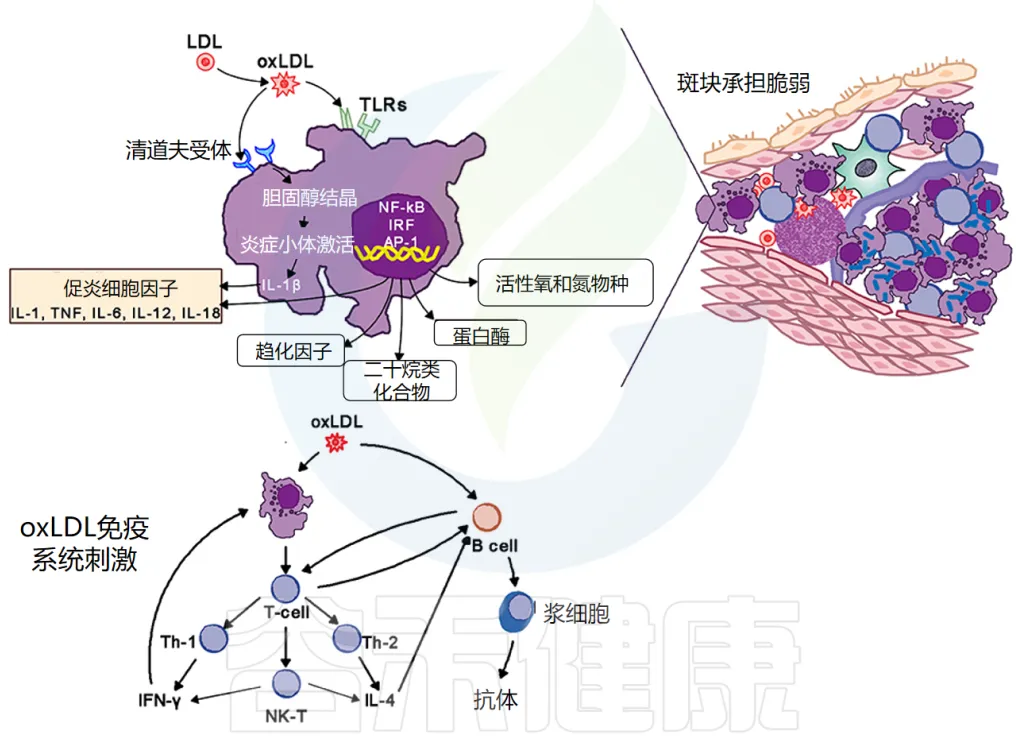
doi.org/10.3389/fmed.2018.00316
动脉粥样硬化的免疫调节和治疗策略
不同免疫细胞之间的相互作用有可能显著影响斑块炎症的结果。
实验研究表明,输注 IFN-γ、IL-12 或 IL-18 均会增加动脉粥样硬化,而输注 CD50L 和 oxLDL 抗体则会减少动脉粥样硬化。
抗炎治疗的潜力
TGF-β 被发现具有抗炎作用,一方面限制白细胞的募集,另一方面促进胶原蛋白的合成,从而稳定斑块。
此外,衣原体等生物体可能会激活 TLR 并促进动脉粥样硬化的炎症过程 。
他汀类药物的治疗作用
在治疗上,他汀类药物可抑制 Rho/ROCK 通路并阻断 IL-1β 的促炎作用。
扩展阅读:
心脏自主神经调节异常(心脏自主神经重塑,交感神经活动增加而副交感神经活动减少)会增加恶性心律失常和心源性猝死的风险,尤其是在患有心血管疾病的患者中。
如前提到的,交感神经激活具有促炎作用,而副交感神经调节具有抗炎作用,炎症可能在心律失常的发生中起着核心作用。
炎症生物标志物与猝死风险
事实上,炎症生物标志物水平升高与心源性猝死风险增加有关。在一项 17 年的随访期内,无论老年人是否患有心脏病(心力衰竭或心肌梗死),IL-6 或 C反应蛋白 (CRP) 水平升高都与心脏猝死风险增加有关。即使在调整基线风险因素后,IL-6 仍存在心脏猝死风险,但 CRP 则不存在。
炎症与心房颤动的关联
促炎途径也可能在心房颤动 (AF) 中发挥重要作用。研究证实,炎症过程会损害心房并促进电紊乱,最终导致 AF。具体来说,他们在孤立性心房颤动患者的心房活检中发现淋巴单核细胞浸润,但在对照受试者(Wolf-Parkinson’s-White 综合征患者)中从未发现过。
随后,许多临床研究证实了炎症生物标志物(CRP、IL-2、IL-6、IL-8、TNF-α;单核细胞趋化蛋白-1)与持续性和阵发性心房颤动之间存在密切关联。
抗炎治疗在心律失常治疗中的潜力
炎症与心房颤动(心律不齐的一种)和心源性猝死(心脏突然停止导致的死亡)有密切关系。因此,针对炎症的治疗可能成为治疗心律失常的新方法。
抗炎药物,如非甾体抗炎药(NSAID)和皮质类固醇,已经被证明可以降低手术期间心房颤动的风险。然而,在其他患者中,这些药物反而可能增加心房颤动的发生率。此外,这些药物对室性心律失常(心室的心律不齐)和猝死的影响还不清楚,需要进一步研究。
炎症正在成为衰老的最重要机制(称为炎症衰老),并在大多数解释模型中发挥着不可或缺的作用。
衰老是细胞损伤不断积累的结果,而这种损伤与无法清除损伤相关分子模式 (DAMP) 有关——坏死细胞的分解产物、细胞外 ATP、尿酸、淀粉样蛋白原纤维、游离胆固醇晶体。
注:关于损伤相关分子模式 (DAMP),我们在文章前面介绍过。
组织先天免疫细胞对DAMP的响应
组织先天免疫细胞包括巨噬细胞、脑中的小胶质细胞、肝脏中的库普弗细胞、骨中的破骨细胞和肾脏中的系膜细胞可以检测 DAMP。
慢性炎症与衰老
DAMP 负荷的增加导致炎症小体复合物的持续激活,从而释放促炎细胞因子(IL-6 和 IL-18),引起持续的低度慢性炎症。
慢性炎症的特征是血清或受影响器官组织内和周围促炎标志物持续低水平升高,临床上与神经退行性疾病、代谢紊乱、癌症、肌肉骨骼疾病、心血管疾病和虚弱有关。
衰老过程中炎症标志物的变化
与年轻人相比,50 岁以上的人群中促炎标志物(如 IL-6、IL-18、TNF-α 和 CRP)和血清淀粉样蛋白 A 升高 2-4 倍。值得注意的是,即使在没有特定疾病的情况下,多个器官的慢性低度炎症也会导致功能衰竭。
IL-6与衰老相关性
特别是,IL-6 水平较高与虚弱和残疾程度增加有关,临床上与步行速度慢、肌肉力量弱、小腿功能差和贫血有关。在老年患者中,体质虚弱的患者促炎标志物水平较高,而抗炎标志物水平较低,如皮质醇、IL-10。
扩展阅读:
免疫衰老
免疫衰老是指随着年龄增长,适应性免疫系统功能衰退,先天免疫系统过度活跃。
虽然绝对淋巴细胞计数保持不变,但 B 细胞、T 辅助细胞 (CD4+) 和 T 细胞毒性细胞 (CD8+) 的绝对数量减少,而 NK 细胞数量增加。
幼稚 T 细胞也会减少,导致对新抗原的反应减弱,T 细胞和 B 细胞克隆扩增,尤其是针对 CMV、EBV 和 VZV 等疱疹病毒的细胞。
因此,衰老的身体对新抗原呈递的反应能力下降,对已知抗原的记忆反应下降,使老年人更容易患上传染病 。此外,终生接触抗原会导致先天免疫细胞逐渐激活,进一步增加促炎细胞因子释放和慢性低度炎症 (下图)。

doi.org/10.3389/fmed.2018.00316
已经提出了两种炎症衰老机制:
脂肪在免疫功能中起着重要作用,因为白细胞浸润水平高——网膜脂肪占基础循环 IL-6 的 10-35%。
因此,随着年龄相关体重的增加,低度炎症会持续存在,这尤其会增加动脉粥样硬化中患糖尿病的风险。促炎细胞因子通过血脑屏障的被动扩散最初会由于 HPA 轴激活而引发主动的抗炎反应,从而导致肾上腺排出皮质醇。然而,过度的促炎负荷可激活 CRP 释放细胞,从而进一步激活 HPA 轴,最终导致皮质醇水平长期升高,进而导致糖皮质激素不敏感,进一步加剧促炎状态。
较高的外周炎性细胞因子负荷会影响衰老的小胶质细胞,从而触发脑内细胞因子的加速产生。高脑细胞因子负荷会影响神经元功能,导致与年龄相关的心理功能特征。
炎症与虚弱症
虚弱症本来就是由于高促炎负荷导致的炎症所致,而尿路感染或肺炎等感染导致的促炎负荷过度增加则极易导致虚弱症。
IL-1β对大脑功能的影响
IL-1β 的增加会触发影响大脑不同部位的适应不良疾病行为;谵妄会导致工作记忆受损和冷漠(海马体)、焦虑加剧和长期严重的活动减退(杏仁核)、HPA 轴激活(室旁核)以及无热感染和过度低体温(内侧视前核)。
如今,肥胖已成为最可预防的发病和过早死亡原因。肥胖可以通过体重指数 (BMI) 来评估,BMI在30-39 表示肥胖;40 或更高则被认为是病态肥胖。
脂肪组织的功能与影响
脂肪组织,特别是位于中心的脂肪组织,其行为方式很像内分泌腺,可以调节其他组织的活动,并受同位神经系统和免疫系统的影响。
巨噬细胞位于脂肪组织中。无论是肥胖发病机制中的一个关键因素,还是由于携带过量脂肪组织的身体压力所致,肥胖都与循环中促炎细胞因子的增加有关。
因此,肥胖个体会经历一种似乎与剂量相关的慢性炎症状态,并且无论不良健康行为和疾病状况如何都会存在。
压力会加剧肥胖个体的促炎状态
例如,肥胖女性对急性应激源表现出比非肥胖女性更强烈的炎症应激反应。脂肪组织产生的促炎细胞因子(如 IL-1、IL-6 和 TNF-α )或应激反应可激活下丘脑-垂体-肾上腺 (HPA) 轴;因此,肥胖、全身炎症和应激反应之间的关系本质上是周期性的。在中断此周期之前,临床医生和其他健康倡导者必须首先意识到它的存在。
减肥可降低炎症
包括 CRP、TNF-α、IL-6 和 IL-18,单独控制饮食或结合身体活动干预后,这种效果可持续维持长达 2 年。通常,联合干预(饮食和身体活动)最有效,因为可以减少脂肪质量组成;然而,由于脂肪减少和身体活动增加之间的内在联系,很难确定哪个因素推动了炎症的减少。
例如,与身体活动较少相比,身体活动较多可降低慢性炎症,但当考虑 BMI 和瘦素水平时,这种关系不再存在。
在一项纵向研究中,低度炎症的增加与肥胖有关,但与身体健康无关。
总之,尽管身体活动和锻炼与降低炎症有关,但由于个人脂肪量的管理与全身炎症升高密切相关,因此似乎是整体健康的更关键因素。
当个体细胞对胰岛素吸收血液中葡萄糖的信息不敏感时,就会发生胰岛素抵抗。
这种不敏感性导致胰腺产生更多的胰岛素;从而引发一个永无止境的负面循环,这通常会导致 β 细胞疲劳或凋亡,并引发 2 型糖尿病等代谢疾病。全身性炎症似乎在这两种代谢异常中都起着关键作用(下图)。
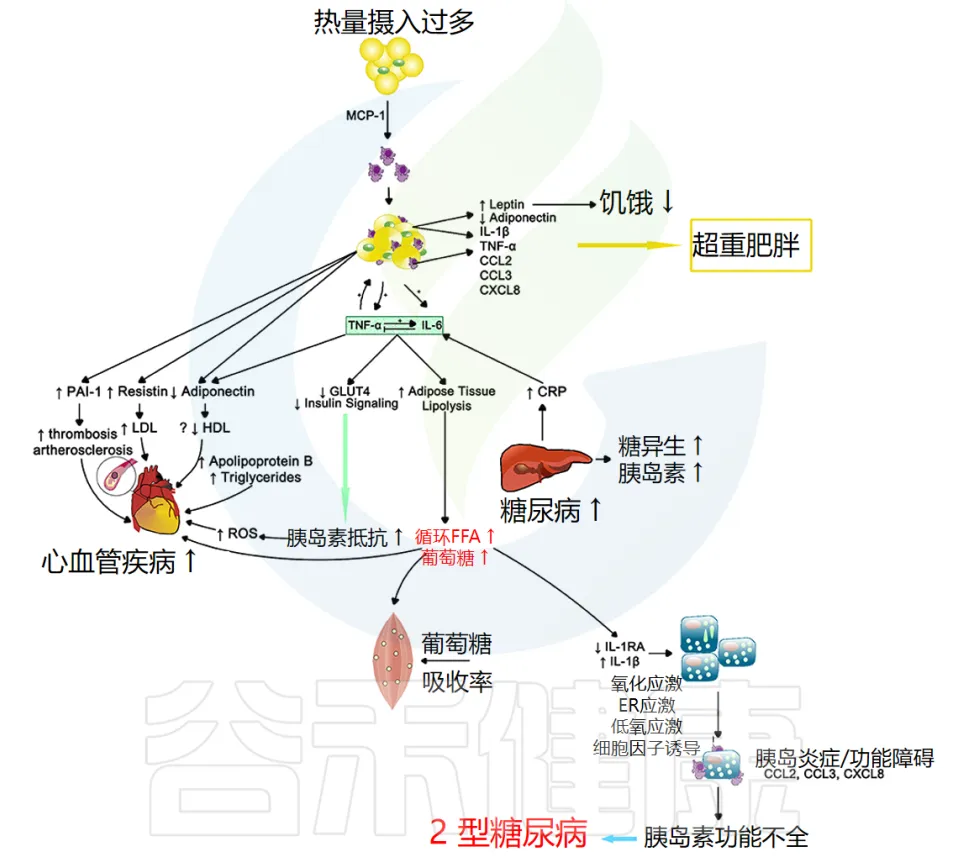
doi.org/10.3389/fmed.2018.00316
注:CRP指的是C反应蛋白(C-reactive protein)。C反应蛋白是一种由肝脏产生的蛋白质,其水平在体内炎症或感染时会升高。CRP常被用作炎症的生物标志物。
炎症与胰岛素抵抗的关系
较高的 CRP 水平与胰岛素抵抗有关,这表明炎症加剧可能导致 2 型糖尿病进展。事实上,在控制了 BMI 和 2 型糖尿病家族史后,女性健康研究中的 CRP 和 IL-6 升高 在 4 年期间独立预测了 2 型糖尿病的发展。因此,全身性炎症本身就可以促进胰岛素抵抗,但肥胖似乎会使情况更加复杂。
肥胖与炎症的相互作用
如肥胖部分所述,BMI 增加或肥胖与全身炎症(例如 CRP、IL-6 和 TNF-α 水平)增加有关。肥胖引起的炎症也与胰岛素抵抗的形成有关,即使控制 BMI 也是如此,这表明胰岛素抵抗带来的额外身体压力除了脂肪量外,还会增加慢性炎症。
此外,胰岛素抵抗会加剧炎症相关疾病,如丙型肝炎感染 ,而类风湿性关节炎患者服用 TNF-α 抑制剂会增加他们的胰岛素敏感性。
扩展阅读:
胎球蛋白 A 在胰岛素抵抗中的作用
有充分证据表明炎症与胰岛素抵抗和/或 2 型糖尿病之间存在关联。胎球蛋白 A 是一种肝脏急性期蛋白,可能提供关键机制。胎球蛋白 A 水平升高与胰岛素抵抗和/或 2 型糖尿病的横断面发生和纵向发展相关 。
胎球蛋白 A 有两种内源性效应支持这些数据:
治疗 2 型糖尿病的行为和药物干预可减轻炎症
与通过生活方式管理降低 BMI 可减轻炎症类似,减肥干预可降低血浆 IL-18 并增加胰岛素敏感性;这表明降低 BMI 和/或脂肪组织的努力可以改善对胰岛素的敏感性。二甲双胍和罗格列酮等血糖控制药物可同时减轻炎症并增加胰岛素敏感性;然而,炎症改善的确切机制仍不清楚。
IL-18(白细胞介素-18):
IL-18(白细胞介素-18)是一种由免疫系统细胞产生的细胞因子,属于白细胞介素家族。它在免疫反应中发挥重要作用,特别是在促进炎症和调节免疫细胞活性方面。
IL-18的主要功能和作用包括:
精神和身体疲劳是抑郁症的主要症状,包括注意力不集中、动力不足或没有动力、对以前喜欢的活动缺乏兴趣、睡眠和食欲紊乱、易怒、无望和社会孤立。
几十年来, HPA 轴失调一直与抑郁症有关;然而,抑郁症与炎症之间的关系最近才有所发展。
抑郁症与炎症的新认识
抑郁症常常与炎症相关疾病如心血管疾病和癌症并发 ;这表明慢性炎症可能与抑郁症有关。事实上,社区成年人的重度抑郁症和抑郁症状与慢性炎症有关,其严重程度呈现剂量依赖性模式。
由于长期和过度的应激激活导致免疫细胞不受控制或失调,可能会导致这种观察到的关系(下图)。
doi.org/10.3389/fmed.2018.00316
与非抑郁个体的免疫细胞相比,抑郁症患者的免疫细胞由于皮质醇敏感性降低而具有更高的 NF-κB 活性,从而创造了一种有利于持续产生促炎细胞因子的细胞内环境。
抑郁和炎症之间的关系是双向的
例如,在健康志愿者中,接触促炎细胞因子可产生病态行为或抑郁样症状,包括消极情绪、疲劳和精神运动迟缓。
细胞因子会影响血清素和多巴胺等神经递质的产生和代谢,而这些神经递质在情绪中起着至关重要的作用。
抗炎药物在抑郁症治疗中的作用
与同时服用抗抑郁药和安慰剂的患者相比,在临床抑郁症患者中,当同时服用非甾体抗炎药(如 COX-2 抑制剂或阿司匹林)时,血清素和去甲肾上腺素再摄取抑制剂的抗抑郁作用会增强。
抑郁症的周期性与炎症
抑郁症,尤其是重度抑郁症,具有周期性,因此增加确定其起源的困难:全身炎症增加还是抑郁症状增加。炎症对心理健康有影响吗?鉴于抑郁症与炎症之间存在显著联系,答案是肯定的。
炎症与其他精神疾病的关联
精神分裂症、躁郁症和创伤后应激障碍等其他精神疾病也与炎症加剧有关。因此,临床医生在治疗患有慢性炎症性疾病或抑郁症和其他潜在神经精神疾病的患者时,需要敏锐地意识到这种心理-生理关系。慢性炎症,无论是精神障碍的驱动因素还是结果,都开始模糊我们对身体和心理健康状况的理解,提示我们需要将它们视为相互关联的整体体验。
扩展阅读:
软骨破坏、软骨下骨重塑和滑膜炎症是骨关节炎的典型特征。最初,骨关节炎被认为是一种导致软骨损失的“磨损”疾病,这是临床上的主要特征;然而,现在显然滑膜炎是该疾病的主要驱动因素。流行病学研究表明,骨关节炎的进展与滑液中促炎细胞因子的数量相关,特别是 IL-1β、TNF-α 和 IL-6。
滑膜炎症是骨关节炎的一个重要的早期特征
其特征是滑膜内膜增生、巨噬细胞和淋巴细胞浸润、新血管生成和纤维化。滑膜炎导致滑液、滑膜、软骨下骨和软骨中的促炎细胞因子 IL-1β 和 TNF-α 增加。滑膜炎的程度在临床上与疼痛和功能丧失、骨赘形成和软骨损失的进展相关。
炎症的引发因素与机制
炎症可由感染性和非感染性刺激物引发,如透明质酸、滑液中的蛋白质和晶体,导致模式识别受体 (PRR) 和 Toll 样受体 (TLR) 激活,从而增加滑液中炎性细胞因子,如 IL-1β 和 IL-17。
炎症——软骨破坏
IL-1β 和 TNF-α 以及 PRR 和 TLR 的刺激,使软骨细胞内原本严格控制的合成/分解软骨稳态转向分解代谢程度更高的状态。一氧化二氮、自由基氧和前列腺素 E2 的产生增加,增加了基质金属蛋白酶 (MMP) 的释放,并抑制了软骨细胞中 II 型胶原蛋白和蛋白聚糖的表达,导致软骨破坏。
骨关节炎中的骨重塑
IL-1β 和 TNF-α 也显著上调软骨细胞释放 IL-6,激活成骨细胞释放 IL-1β、PTH 和 PGE2,进而激活破骨细胞活性,导致软骨下骨吸收。同时,这些介质刺激细胞间 IL-6 产生,维持破骨细胞活性。骨赘反映新骨形成,仅在疾病晚期出现(下图)。
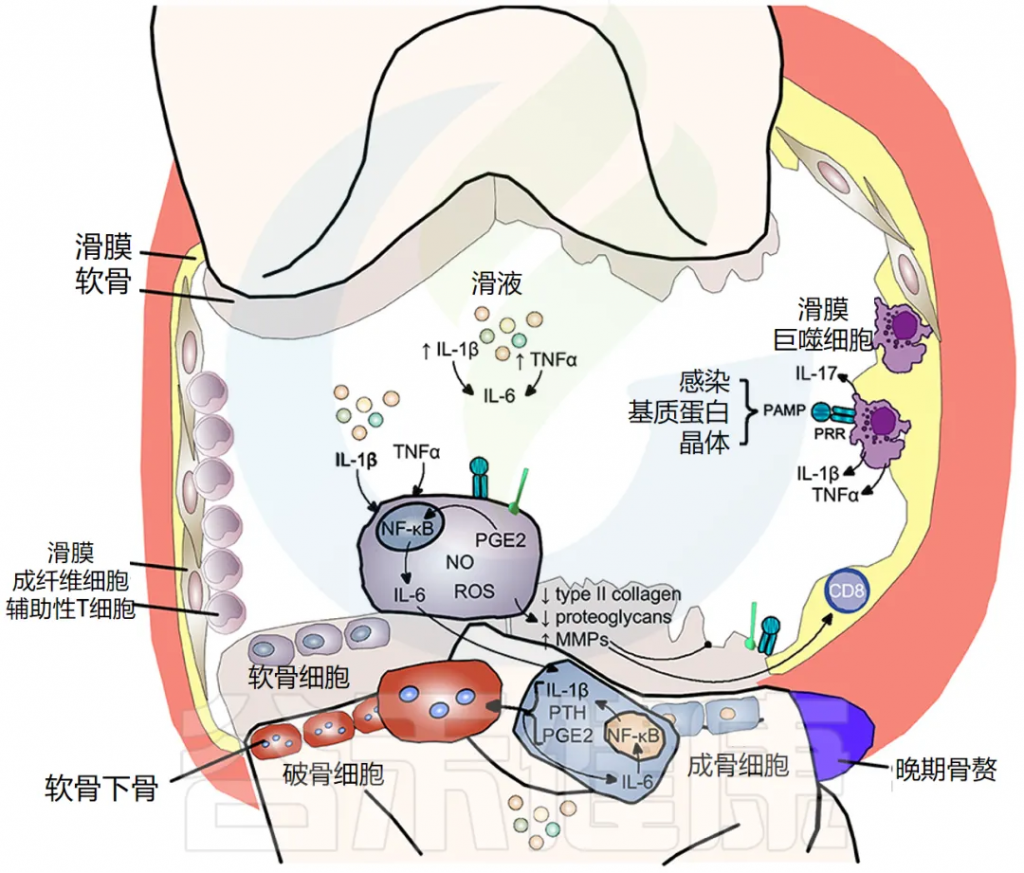
doi.org/10.3389/fmed.2018.00316
现在人们认识到骨关节炎是一种由低度炎症驱动的全身性疾病和衰老,与智力衰退、脑血管病和心血管疾病等常见衰老情况有关。肥胖,特别是内脏脂肪,会导致促炎细胞因子产生显著增加,而脂肪因子、血糖水平升高和ox-LDL都会加剧低度炎症活动。特别是脂肪因子与直接扰乱软骨稳态有关;减肥的好处更可能来自于炎症负荷的减少,而不是关节机械负荷的减少。
随着对健康和疾病理解的深入,我们认识到19世纪的生物医学模型已不足以应对21世纪的慢性疾病挑战。现代研究显示,疾病是一个相互关联的复杂网络构成,而非孤立事件。炎症作为连接宏观疾病与个体体验的桥梁,强调了疾病发生的多因素性质。
面对这一现实,临床医学需要超越传统的生物医学方法,采用更全面的生物心理社会模型,关注患者的生活环境和心理状态。
监测炎症标志物如CRP、IL-6等,对于评估和控制疾病至关重要,尽管这些指标的解读需要考虑多种影响因素。
成功控制炎症疾病状态需要三个简单的步骤:
预防等于减少促炎活性
鉴于炎症在疾病发病机制和/或预后中的作用,我们需要改变疾病和疾病预防的方法。由于炎症活动会导致患病并产生可定义的疾病,因此成功的预防计划需要针对个人及其社会环境中促进促炎刺激的那些领域。
个体层面的抗炎预防
个人层面的预防策略应该从孕期就开始着手,目的是增强并维持母亲的适应能力,这一过程应该持续终身。
为了提高身体的适应力,我们应该采取以下措施:
“你吃什么,你就是什么”,这句老话在近年来得到了新的科学支持。随着理论和技术的发展,我们的饮食与健康之间的联系变得更加清晰。一个低饱和脂肪和精制糖、高复合碳水化合物、高纤维、富含鱼类蛋白质、坚果中的健康多不饱和脂肪酸(PUFA)、新鲜水果和蔬菜的饮食模式,一直被认为是健康的黄金标准。
肠道微生物研究为我们提供了更深入的理解
肠道微生物不仅帮助我们消化食物,还影响我们的免疫系统、肠壁的完整性,甚至影响大脑功能和行为。脑-肠轴理论认为,这些细菌及其消化副产物能够调节炎症、神经递质、神经递质前体的产生,以及肠神经系统的功能。
现在,我们已经能够测肠道微生物组的组成,并且可以实时观察食物变化对肠道微生物组的影响。复合碳水化合物和不饱和脂肪有助于支持抗炎细菌的生长,而简单碳水化合物(如精制糖)和不健康的脂肪(如过多的omega-6脂肪酸)则支持促炎细菌。肠道炎症的加剧与身心健康的损害密切相关。因此,关注肠道健康,选择加工程度较低的食物,或采取慢食的生活方式,是预防和干预炎症的关键步骤。
➣
总的来说,对疾病的理解应转向综合征概念,这有助于我们更好地识别和治疗如纤维肌痛等复杂疾病(例如,多达50%的纤维肌痛患者有抑郁症史)。未来的医学实践需要整合跨学科的知识,以更全面地理解炎症的作用,更有效地管理慢性疾病,并推动医学向更精准的方向发展。
主要参考文献:
Wang Y, Ma H, Zhang X, Xiao X, Yang Z. The Increasing Diagnostic Role of Exosomes in Inflammatory Diseases to Leverage the Therapeutic Biomarkers. J Inflamm Res. 2024 Jul 25;17:5005-5024.
Bennett JM, Reeves G, Billman GE, Sturmberg JP. Inflammation-Nature’s Way to Efficiently Respond to All Types of Challenges: Implications for Understanding and Managing “the Epidemic” of Chronic Diseases. Front Med (Lausanne). 2018 Nov 27;5:316.
Giacca M. SARS-CoV-2 infection boosts inflammation in atherosclerotic plaques. Nat Cardiovasc Res. 2023 Nov;2(11):966-967.
Matter MA, Tschaikowsky T, Stähli BE, Matter CM. Acute-on-chronic inflammation in acute myocardial infarction. Curr Opin Cardiol. 2024 Aug 20.

谷禾健康

//
近日,多地发生诺如病毒感染事件,诺如病毒引起的急性感染性腹泻进入发病高峰期。那么什么是诺如病毒?我们又该如何预防?
诺如病毒和轮状病毒都是传染性很强的肠道病毒,是导致急性胃肠炎的最重要原因之一。会引起腹泻、脱水或呕吐等症状,在最严重的情况下甚至会导致患者死亡。
根据世界卫生组织的报告,腹泻疾病在全球死亡原因中占相当一部分,它们是一个重要的健康问题,关注肠道健康非常重要。
在本文中,谷禾介绍了目前对诺如病毒和轮状病毒的一些了解,包括它们的基本信息,致病性、易感人群以及对身体的危害。
组织血型抗原在诺如病毒和轮状病毒感染中起重要作用,同时近年来的研究发现宿主的肠道微生物群会影响诺如病毒等肠道的病毒感染。这些相互作用可能改进针对这些病毒的预防策略。
在成都妇女儿童医院谢晓丽主任课题组(谷禾开放基金)研究项目中针对诺如病毒感染的婴幼儿肠道菌群进行的检测分析,发现诺如病毒感染会极大的改变肠道菌群构成,破坏正常肠道菌群,导致肠道炎症。诺如病毒感染的同时有超过一半的患者存在肠道细菌感染。
在最后,谷禾针对现有的技术和医疗条件,给出了一些对于诺如病毒和轮状病毒的预防及治疗措施,希望能有效地防治这些肠道病毒,在今后的生活中拥有更健康的肠道。
本文主要内容
●诺如病毒的介绍
●轮状病毒的介绍
●诺如病毒与肠道相关疾病
●轮状病毒与肠道感染
●肠道微生物在病毒感染中的作用
●诺如病毒、轮状病毒的预防及治疗
诺如病毒(Norovirus),又称诺瓦克病毒,是人类杯状病毒科中诺如病毒属的一种病毒。
人类诺如病毒是世界范围内非细菌性胃肠炎的主要原因,具有高发病率和高死亡率。据估计,在全球范围内,人类诺如病毒每年导致6.99亿人患病和21.9万人死亡。
▼
诺如病毒为无包膜单股正链RNA病毒,病毒粒子直径约27-40nm。
电子显微镜下的诺如病毒
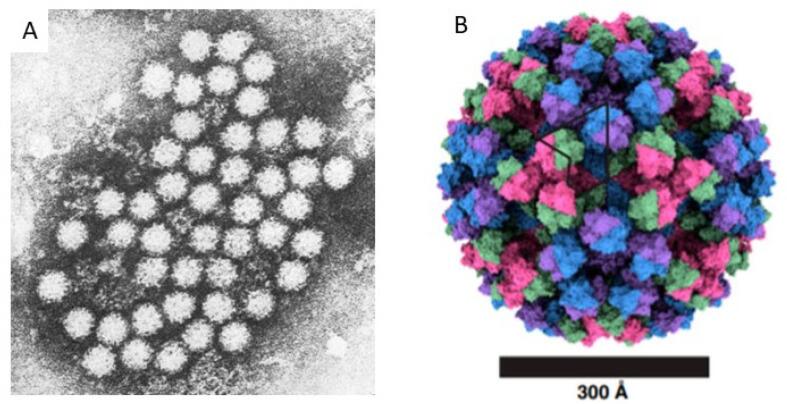
Lucero Y,et al.Viruses.2021
A.在急性胃肠炎患者的粪便样本中通过免疫电子显微镜观察到的小圆结构病毒的原始图像;B.高分辨率冷冻电子显微镜下的GII.4诺如病毒颗粒
详细结构
基因组全长约7.5-7.7kb,分为三个开放阅读框(ORFs),两端是5’和3’非翻译区,3’末端有多聚腺苷酸尾。ORF1编码一个聚蛋白,翻译后被裂解为与复制相关的7个非结构蛋白,其中包括RNA依赖的RNA聚合酶。
ORF2和ORF3分别编码主要结构蛋白(VP1)和次要结构蛋白(VP2)。病毒衣壳由180个VP1和几个VP2分子构成,180个衣壳蛋白首先构成90个二聚体,然后形成二十面体对称的病毒粒子。
根据蛋白在衣壳中的位置,每个衣壳蛋白可分为两个主要区域,分别为壳区(S区)和突出区(P区),二者之间是由8个氨基酸组成的铰链区(Hinge)连接。S区由衣壳蛋白的前225个氨基酸组成,形成病毒内壳,围绕病毒RNA。P区由剩余的氨基酸组成,进一步分为两个亚区P1区和P2区。P区通过二聚体相互作用增加衣壳稳定性并形成电镜下可见的病毒粒子突出端。P2区高度变异,包含潜在的抗原中和位点和受体组织血型抗原(HBGAs)识别位点。VP2位于病毒粒子内部,被认为参与衣壳聚集。
▼
人类诺如病毒对组织血型抗原(HBGAs)的识别和结合被描述为病毒颗粒进入细胞之前的原始步骤。
HBGAs是红细胞、呼吸道、消化道和泌尿生殖道粘膜上皮细胞表面的一类复杂糖类,可结合糖蛋白及糖脂类物质,同时以游离寡糖的形式存在于唾液、乳汁和血液等体液中。HBGAs 的FUT2基因分泌状态影响人的易感性。
在人类诺如病毒中,组织血型抗原结合点位于VP1的P结构域的P2亚结构域,这是高度可变的。在不同的诺如病毒基因组中发现了该结合位点的可变性。这是由于每个诺如病毒基因组/基因型可以结合不同的组织血型抗原。
✦组织血型抗原影响对诺如病毒抵抗力
一项研究表明,人类诺如病毒与组织血型抗原的相互作用是低亲和力的,并且不诱导VP1中显著的结构重排。
有易感性研究表明一些个体对人类诺如病毒感染有抗性。组织血型抗原的产生是由岩藻糖基转移酶2介导的。呈现这种功能基因的个体被称为分泌者,易受人类诺如病毒感染。
岩藻糖基转移酶2(FUT2),该基因是编码半乳糖苷2-L-岩藻糖基转移酶的两个基因之一。编码的蛋白质对于可溶性ABO血型抗原合成途径的最后一步很重要。它还参与细胞间相互作用、细胞表面表达和细胞增殖。
FUT2作为岩藻糖基转移酶的一种,分布在口腔黏膜上皮,呼吸道上皮,泌尿生殖道细胞以及体液中。岩藻糖基转移酶2与ABO血型、原发性硬化性胆管炎、溃疡性结肠炎、克罗恩病、急性胃肠炎等相关。
相比之下,没有这种功能基因的人被称为非分泌者,对人类诺如病毒感染有抵抗力。组织血型抗原作为个体对病毒感染易感性的关键因素,事实上,已经表明分泌者阳性个体感染轮状病毒的可能性是非分泌者个体的26.6倍。
★ 易感人群
虽然人类诺如病毒可以感染所有年龄段的人,但是高危人群主要是是5岁以下的儿童,老年人以及免疫力低下的人群,其中老年人是死亡率最高的。
•婴幼儿
婴幼儿身体的各项器官发育的不是特别完善,断奶后失去了母乳提供的抗体。所以在这种情况下身体是比较虚弱的,会非常容易受到轮状病毒的感染。
•免疫力低下的人
诺如病毒具有较强的传染性,传播途径也比较广泛,如果患者平时没有保持良好的生活习惯,不注意锻炼身体,身体免疫力可能会比较低下,诺如病毒更容易侵入这类人群的体内,感染几率会增加。
•有基础疾病的人
如果患者本身患有慢性消化系统疾病、心脑血管疾病等基础疾病,也会增加诺如病毒感染的风险。
•没有做好防护的人
如果患者经常外出,在外出时没有做好防护工作,诺如病毒可能会通过气溶胶传播,这类人群也容易感染。
▼
✦发病时间
潜伏期为24-48小时,一般不超过96小时。
✦症状
与其他病毒性胃肠炎相似,起病突然,主要症状为发热、恶心、呕吐、痉挛性腹痛及腹泻。可单有呕吐或腹泻,亦可先吐后泻,也称为诺如病毒感染性腹泻。
成人腹泻较突出,儿童呕吐较多。粪便呈黄色稀水便,每日数次至十数次不等,无脓血与黏液。可伴有低热、咽痛、流涕、咳嗽、头痛、肌痛、乏力及食欲减退。
病程长及病情较重者排毒时间也较长,传染性可持续到症状消失后两日。本病免疫期短暂,可反复感染。
提醒:以呕吐、腹痛、腹泻为主要症状的胃肠道疾病,在不同季节发作的特点各有不同。
夏季由于气温高,食物容易变质滋生细菌,所以夏季胃肠道疾病多因大肠杆菌等细菌感染所致,症状严重的话,除了腹泻特别厉害,还会出现脓血便的特点。
而秋季在婴幼儿中出现较多的腹泻主要是秋季轮状病毒感染,症状严重者一天多次呕吐(5、6次及以上),同时会拉蛋花样大便。患儿一般先呕吐、后腹泻,病程稍长,一般为7天。
而冬季诺如病毒所致的胃肠道疾病,儿童一般以腹痛、呕吐多见,腹泻较为少见,病程一般1至3天。容易因群体传染而致病。
▼
一项志愿者人体试验研究表明,诺如病毒的免疫保护力一般可持续6-24个月,即使先前感染过诺如病毒,同一个体仍可重复感染同一毒株或不同毒株的诺如病毒。
部分人群即使暴露于大剂量诺如病毒仍不会感染,这可能与先天宿主因素和后天获得性免疫有关。组织血型抗原(HBGAs)包括H型、ABO血型和Lewis抗原被认为是诺如病毒的可能受体。1,2-岩藻糖转移酶基因突变导致组织血型抗原缺乏表达者(非分泌型),可能不容易感染诺如病毒。
先天免疫
先天免疫系统针对RNA病毒如人类诺如病毒的主要细胞途径,是控制病毒复制的I型和III型干扰素(IFN)系统。
RNA病毒主要通过模式识别受体(PRRs)检测,其包括TLR和RIG-I样受体(RLR)家族成员。
TLR3位于巨噬细胞、B淋巴细胞和cDCs的细胞内区室中,并且它被表征为RNA病毒。属于RLR家族的RIG-1和MDA5同样是检测细胞内RNA病毒的细胞质传感器。
TLR3识别内体区室中的任何dsRNA,而MDA5识别长dsRNA,RIG-1感知细胞质中含有dsRNA的三磷酸。
✦干扰素限制诺如病毒复制
少数报道表明干扰素途径的效应物限制了人类诺如病毒复制。据报道,人α干扰素(IFN-α)在控制Huh-7细胞和BHK21细胞中的人类诺如病毒复制中发挥作用,这表明干扰素的产生可能是控制诺如病毒感染的宿主抗病毒机制之一。
此外,以下证据表明,I型和III型干扰素系统可以在控制人类诺如病毒感染中发挥重要作用:
1.在接种GII.4菌株的猪的肠道内容物和血清中检测到高IFN-α细胞因子产生;
2.MNV-1的复制在体内和体外对I型和III型干扰素系统敏感;
3.用基因组诺如病毒RNA转染Huh-7细胞后,当细胞用来自已用干扰素诱导剂、聚肌苷酸/聚胞嘧啶酸(poly I:c)转染的细胞的上清液预处理以诱导IFNα/β产生时,抑制了细胞中的诺如病毒复制;
4.胆汁酸允许GI.1、GII.3和GII.17 人类诺如病毒菌株的复制,并在人类肠道肠道中的GII.4变体中增强。
在最近的研究中使用诺如病毒复制子系统,有可能评估不同类型干扰素的抗病毒活性。具体来说,这些研究表明,三种类型的干扰素对人类诺如病毒复制有限制作用:I型干扰素 (IFNα)、II型干扰素 (IFNγ)和III型干扰素(IFNλ1和3)。
不过还需要进一步的研究来了解诺如病毒与宿主相互作用,以便设计针对这些病毒的适当抗病毒疗法。
适应性免疫
针对人类诺如病毒的适应性免疫反应几乎不为人所知。然而,一些研究提供了关于人类如何对这些病毒产生体液和细胞免疫反应的见解。
✦抗体对诺如病毒感染起到一定防护
文献中的几项研究表明,成人中针对诺如病毒的高水平血清抗体与针对这种病毒的未来感染的保护相关。
同样,在成年志愿者中进行的其他研究结果表明,与先前抗体滴度较低的志愿者相比,感染前存在高血清或粪便滴度的特异性抗体降低了感染该病毒的概率。此外,在儿童中,高血清抗体水平似乎与保护有关,可能是由于短期免疫和最近接触这些病毒。
•多次暴露于诺如病毒下可能产生抗体
这些证据表明,频繁暴露于诺如病毒可以刺激对诺如病毒诱导的疾病的抗性。这些观察结果背后的一个可能机制是多次暴露于人类诺如病毒诱导抗体产生,已知IgA抗体在针对病毒的短期免疫保护中起作用。
粘膜IgA在诺如病毒感染志愿者的小肠组织中产生。为了支持这一观点,需要进一步的研究来充分阐明对人类诺如病毒的短期免疫背后的机制。
✦诺如病毒在几年后可能会再次感染
另一方面,没有证据证明对这些病毒具有长期保护性免疫力。事实上,一些在诺如病毒攻击后发病的志愿者在6-14周后再次暴露于病毒后,表现出对该疾病的部分免疫力。
然而,这种部分免疫保护在2-3年后完全丧失。尽管如此,来自世界不同地区的大量流行病学报告证明了长期的保护性免疫反应,这些报告显示了“诺如病毒高活性”时期,这与新的GII.4毒株的出现相关。
在这一现象之后的几年里,人类诺如病毒爆发的数量有所减少,这表明人群中产生了群体免疫,从而防止GII.4诺如病毒感染。然而,重要的是要记住,如果出现新的毒株,个体可能再次变得易感。
总之,人类诺如病毒感染后的体液保护具有非常复杂的异型免疫应答模式。迄今为止,没有任何研究表明,人类诺如病毒感染者血清中存在高交叉反应性和交叉阻断活性,这可能是由于人类诺如病毒衣壳基因的快速分子进化,保证了对这些病毒未来感染的长期保护。
✦诺如病毒感染后细胞免疫也增强
还研究了人类诺如病毒的细胞免疫反应。具体而言,来自10名受诺如病毒(GI.1-1968株)感染的志愿者中的6名外周血单个核细胞(PBMC),在体外用不同同源或异源GI株进行刺激后,IFN-γ分泌显著增加。
有趣的是,发现细胞免疫反应优先靶向替代的胃肠道VLP,而不是感染菌株。这些数据表明Th1反应是针对同源和异源人类诺如病毒菌株的。
此外,患有人类诺如病毒胃肠炎的旅行者的粪便样品中,IFN-γ (Th1细胞因子)也显著增加。对于白细胞介素2 (白细胞介素细胞因子)和IL-5 (Th2细胞因子),也检测到了比攻击前滴度更小但显著的增加。
总之,由快速进化的RNA病毒引起的免疫反应很难实现。事实上,随着时间的推移,这些病毒在免疫显性表位的关键残基中突变的能力表明了病毒衣壳的进化,这使得病毒不仅能够逃避宿主适应性免疫反应,而且还能够适应它们与任何组织血型抗原的结合。
对诺如病毒的体液和细胞免疫反应的完全理解还需要更多的研究发现。
轮状病毒(Rotavirus,简称RV)是一种双链核糖核酸病毒,属于呼肠孤病毒科。它是婴儿与幼儿腹泻的主因。
几乎世界上每个大约五岁的小孩都曾感染过轮状病毒至少一次。然而,每一次感染后人体免疫力会逐渐增强,后续感染的影响就会减轻,因而成人就很少受到其影响。
轮状病毒总共有七种,以英文字母编号为A、B、C、D、E、F与G。其中,A种是最为常见的一种,而人类轮状病毒感染超过90%的案例也都是该种造成的。
▼
病毒颗粒大约直径76.5 nm,并且并没有病毒包膜。
轮状病毒的基因组包括了11条独特的核糖核酸双螺旋分子,这11条中总共有18555个核苷碱基对。每一条螺旋或是分段即是一个基因,并且依照分子尺寸由大到小依次编号为1到11。
每一个基因都可以编码成一种蛋白质,而其中第9基因与第11基因比较特别,它们都可以编码成两种蛋白质。核糖核酸外围则是包围了三层二十面体的蛋白质壳体。
人轮状病毒直立和反向刺突蛋白构象
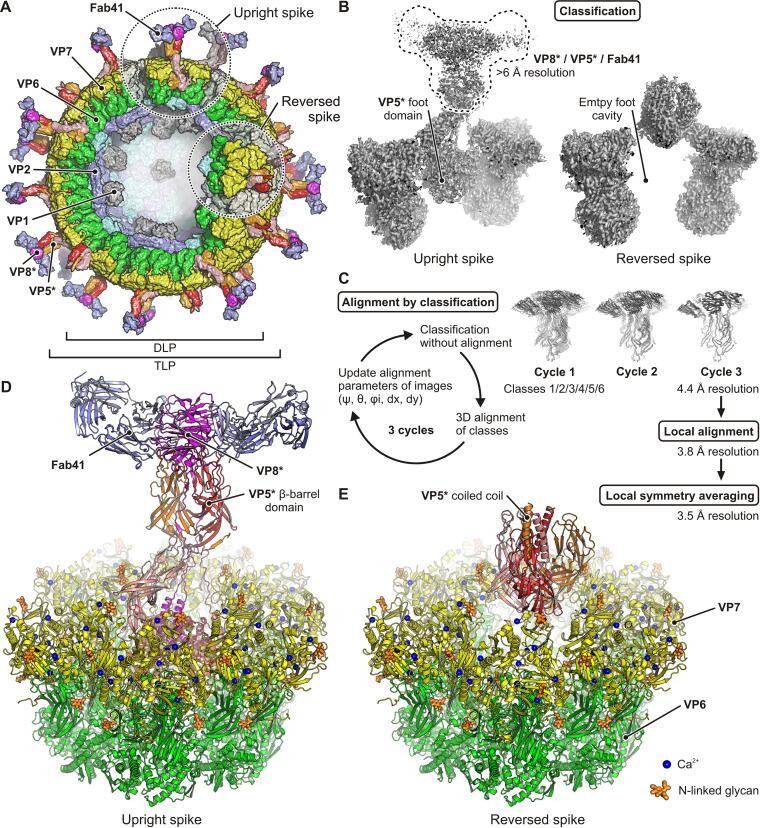
Jenni S,et al.J Virol.2022
▼
一些观察性研究调查了不同组织血型抗原或基因型与体内轮状病毒感染易感性之间的关联。
✦组织血型抗原也影响轮状病毒感染率
组织抗原缺乏者——非分泌型,可能不容易感染轮状病毒。
来自几个国家和大洲的几项后续研究报道阳性分泌状态与P8和P4基因型的轮状病毒易感性密切相关。随后的研究也证实了P6基因型的轮状病毒易感性和Lewis缺乏表型之间的强关联性。
尽管关于P4基因型的研究较少,但类似的差异已有报道,一些研究表明分泌者和Lewis阳性(Lewis b表型)是易感性的标志,而不仅仅是分泌者阳性。一项研究,报道在非分泌者中没有P4感染,但是Lewis阳性非分泌者易受P8轮状病毒感染。
总之,观察性研究提供了强有力的证据,证明分泌抗原和Lewis抗原在P基因型依赖的轮状病毒易感性中起重要作用。
一些研究也将ABO血型与易感性联系起来,但还需要更多的研究。
★ 易感人群
•6~24个月的婴儿
由于婴儿免疫机制还没有发育完整,免疫力低下,尤其早产儿,发生感染以及严重脱水和胃肠道并发症的风险较高。
•免疫抑制患者:
免疫抑制的患者由于体内免疫系统异常,尤其是原发性免疫缺陷和造血干细胞移植患儿,发生并发症风险高。
•与患者密切接触的人群
由于该病毒也可在接触感染者的生活用品后感染疾病,所以如果未感染的人群与患者的体液和排泄物的密切接触,很容易被病毒感染。
•不注意个人卫生的群体:
该疾病的传播途径和是粪-口传播,不注意饭前便后洗手的人群易感染该类细菌病毒。
▼
轮状病毒肠胃炎是一种从温和到严重的疾病,有一些表征像是呕吐,水状腹泻,以及低程度的发热。当儿童受到这类病毒感染时,在症状发生前大约会有两天的潜伏期。
症状通常是从呕吐开始,接着是四到八天的大量腹泻。轮状病毒感染造成的腹泻常引起脱水的现象。
注意:脱水是轮状病毒感染的最常见的死因。
▼
已知病毒感染可激活宿主抗病毒先天免疫反应,这依赖于宿主模式识别受体(PRRs)对病毒的识别,如TLRs、RIG1样受体和黑色素瘤分化相关基因-5。
另一方面,病毒依赖宿主细胞生存;因此,它们进化出各种机制来逃避或削弱宿主免疫力,从而操纵宿主细胞蛋白质成功复制和传播。
✦干扰素也能限制轮状病毒感染
轮状病毒感染在肠粘膜中迅速引发先天免疫反应,在此期间产生I型和III型干扰素和其他细胞因子,限制病毒复制。干扰素是控制轮状病毒感染和调节抗病毒免疫反应的核心。
病毒感染的和未感染的肠上皮细胞与肠造血细胞一起产生I型和III型干扰素。这些I型和III型干扰素是宿主抗病毒防御机制的主要部分,因此缺乏它们的受体会增加对病毒感染的易感性。
大多数细胞可以感知和应答I型干扰素,而上皮细胞只应答III型干扰素。虽然很少有关于能够分泌IFN-λ的特定细胞的公开数据,但是有研究证明一些细胞可以产生IFN-λ和I型IFN。
人群中IFN-λ及其受体的存在支持了它们在轮状病毒感染中起保护作用的假设。对III型IFN在病毒感染和抗病毒免疫中的作用的综述中得出结论,IFN-λs在病毒感染的初始阶段在上皮表面提供抗病毒保护。
此外,这些细胞因子使Th1和Th2细胞平衡向Th1表型转移。因此,IFN-λ作为先天免疫的一个组成部分,可能参与了适应性免疫反应的调节。
•干扰素还能防治病毒在肠道外复制
此外,这两种干扰素一起防止轮状病毒在肠道外复制。与其他几种病毒感染类似,轮状病毒宿主范围的限制是由同源和异源轮状病毒干扰宿主IFN反应的不同效率决定的。
✦其他宿主蛋白抑制轮状病毒感染
有许多关于轮状病毒和其他宿主蛋白之间相互作用的研究,结果显示一些宿主蛋白对轮状病毒具有抵抗作用。
STAG2缺失增加抗病毒性
STAG2(粘附蛋白复合物的一部分)的缺失赋予了对细胞培养物和人肠道中轮状病毒复制的抗性。缺乏STAG2导致gDNA损伤和强烈的干扰素表达,导致JAK-STAT活化和ISG表达,从而保护免受轮状病毒感染。
鞭毛蛋白诱导NOD样受体C4分泌白细胞介素
NOD样受体C4 (NLRC4)和TLR5在抗轮状病毒宿主免疫应答中起重要作用。鞭毛蛋白诱导的树突状细胞TLR5激活刺激了白细胞介素22的产生,导致肠上皮细胞中保护性基因表达系统的产生。
鞭毛蛋白还通过诱导NOD样受体C4 (NLRC4)刺激白细胞介素18的产生,从而导致立即清除轮状病毒感染的细胞。
NOD样受体P9b限制轮状病毒感染
最近还证明了NOD样受体P9b (Nlrp9b)在抗轮状病毒宿主免疫反应中的作用,Nlrp9b限制了肠上皮细胞中轮状病毒的感染。他们显示肠内NLRP9b的减少在活生物体内导致小鼠对轮状病毒复制的易感性增强。
诺如病毒和轮状病毒有什么区别?
轮状病毒与诺如病毒都是引起感染性腹泻的肠道病毒,均可导致呕吐、腹泻等不适症状,但二者属于两种不同的病毒,有各自的感染特点。两者的主要区别主要包括流行时间、感染对象、传播途径,病程持续时间等。
1.流行时间:轮状病毒一般在秋季流行,而诺如病毒则全年都可流行,主要在寒冷季节高发;
2.感染对象:轮状病毒感染对象以婴幼儿更为多见,而诺如病毒在学龄儿童和成人中也均可感染;
3.传播途径:轮状病毒主要经粪-口传播,而诺如病毒可经由食用被污染的食物或水源而传染;
4.病程时间:在病程方面,轮状病毒的病程大概持续在3~8天左右;而诺如病毒大概在3~5天左右,严重的患者可能会持续一个星期。
腹泻病是低收入国家5岁以下儿童死亡的重要原因,也是中高收入国家医疗资源利用的重要原因。儿童腹泻的主要原因是病毒(70-90%)。
历史上,轮状病毒是儿童病毒性腹泻的主要原因,然而,随着轮状病毒疫苗的引入,诺如病毒已成为中度-重度腹泻的主要原因。
病毒通过几种机制产生腹泻,包括上皮细胞的损伤或死亡、上皮吸收的改变、通过对肠神经系统,以及由病毒因子介导的分泌。
▼
最近的体外和体内研究发现,免疫细胞和肠上皮细胞受到诺如病毒的感染。小鼠诺如病毒有效感染免疫细胞,包括培养的巨噬细胞、树突状细胞和B细胞。
一些证据证实了诺如病毒对体内免疫细胞的感染性。在从人类诺如病毒感染的志愿者获得的肠道活检的单核固有层细胞中检测到病毒抗原。
同样,病毒感染的黑猩猩在十二指肠中显示出病毒阳性的树突状细胞和B细胞,人类诺若病毒感染的共生小牛在肠道固有层中含有类似巨噬细胞的抗原阳性细胞,人类诺如病毒感染的免疫低下小鼠在脾脏和肝脏中含有抗原阳性细胞,其形态与巨噬细胞相似。
诺如病毒感染细胞的一些证据

Karst SM,et al.J Med Virol.2016
▼
诺如病毒感染大多是急性的,在12-48小时的潜伏期后出现症状。典型症状包括呕吐、腹部绞痛、发烧、大便中出现粘液、水样腹泻、头痛、发冷和肌痛。
✦免疫功能弱的群体症状持续时间长
在健康成人中,肠胃炎是自限性的,临床症状往往持续2-3天。然而,在其他更易受感染的人群中,如老年人和幼儿或免疫功能受损的人,临床症状可能更严重,持续时间更长。
需要注意的是,诺如病毒感染在儿童早期可能是无症状的,可能是由于母乳喂养和转移的母体抗体。
▼
✦症状消失后体内可能还存在病毒
尽管人类诺如病毒感染引起的症状会迅速消失,但人们仍会较长时间在粪便中排出病毒。事实上,无症状感染的人可以摆脱病毒长达60天,这相当于表现出典型症状的人的时间,而免疫功能受损的患者可在数月甚至数年内慢性释放病毒。
这些数据表明宿主内存在延长的诺如病毒复制,其发生与有症状的感染无关,并且可能是人类群体中病毒维持的主要促成因素。
与人类体内诺如病毒脱落时间延长一致,感染人类诺如病毒的黑猩猩粪便脱落时间延长,并且感染鼠诺如病毒的小鼠表现出与结肠持续感染相关的慢性粪便脱落。
▼
除了诺如病毒感染的急性症状表现外,还有一些证据表明诺如病毒感染与后遗症有关,包括感染后肠易激综合征(IBS)和炎症性肠病(IBD)。
✦感染过诺如病毒容易出现肠易激综合征
在一项为期两年的前瞻性队列研究中,分析了一起由食源性诺如病毒,经历过急性胃肠炎的受试者的肠易激综合征患病率显著高于对照组受试者。
另一项对病毒性胃肠炎大规模爆发的个体进行的研究也表明,病毒性胃肠炎可导致相当比例的患者出现感染后肠易激综合征。
✦诺如病毒影响炎症性肠病的严重性
诺如病毒和炎症性肠病之间的一个有趣的联系也被发现。在右旋糖酐硫酸钠治疗的背景下,发现人炎症性肠病易感基因Atg16L1突变的小鼠中持续的诺如病毒感染会导致肠道病理学增强。
★ Atg16L1基因异常使致死率和发病率增加
在突变ATG16L1等位基因纯合子的人炎症性肠病患者中观察到潘氏细胞细胞的组织学变化。Atg16L1表达亚型的小鼠在潘氏细胞细胞的形态和转录谱方面显示出显著变化,促炎细胞因子和脂质代谢基因的表达增加。
潘氏细胞回肠隐窝底部的上皮细胞,是专门分泌多种抗微生物化合物和蛋白质的分泌细胞,如α-防御素和TNF-α,它们共同充当宿主-微生物相互作用的关键介质。
在一项相关研究中,肠上皮细胞中特异性Atg16L1的缺失导致诺如病毒感染和治疗小鼠时致死率和临床疾病的增加。
有趣的是,使用抗肿瘤坏死因子α(TNFα)或γ干扰素的阻断抗体,或使用广谱抗生素治疗,可以减少感染小鼠中观察到的肠道病理学增强。
注意:该模型的抗生素反应性作为一个早期迹象,表明微生物群可能在肠内诺如病毒感染的影响中起重要作用。
总之,这些研究表明,在一些环境和遗传背景下,诺如病毒可能是肠易激综合征或炎症性肠病的病毒触发因素,也表明肠道微生物群可能对诺如病毒的发病机制很重要。
谷禾会在后面的章节具体讲述肠道内病毒和肠道细菌之间许多有趣的相互作用。
病毒进入体内后,会感染粘膜上皮细胞,并在细胞胞质溶胶中复制。病毒细胞进入有两种途径,包括直接进入上皮质膜,或通过上皮细胞内吞作用。
因此,病毒和靶细胞受体之间的分子相互作用影响病毒的进入途径。
轮状病毒细胞进入过程包括蛋白水解引发、细胞附着、外壳的消化和轮状病毒双层颗粒(DLPs)内化进入细胞质。
▸ 轮状病毒入侵的具体过程
轮状病毒细胞进入过程
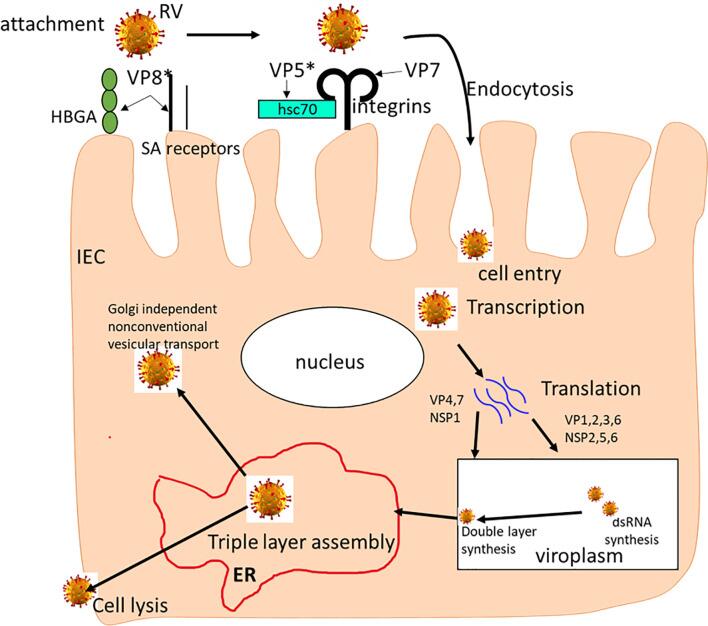
Amimo JO,et al.Front Immunol.2021
轮状病毒需要VP7和切割的VP4之间的相互作用来启动细胞进入过程。VP4蛋白被切割成VP8*和VP5*结构域,每个结构域在细胞进入过程中发挥不同的作用。
胰蛋白酶化的轮状病毒诱导Cr的快速释放由VP5*切割产物促进的细胞,该切割产物使脂质小泡通透在试管内。因此,VP5*是参与轮状细胞细胞进入的特异性透膜衣壳蛋白。
另一方面,受体介导的胞吞作用依赖于内体的酸化,导致部分脱壳或进入细胞;然而,通过直接穿透进入轮状细胞不受溶体营养剂或内吞抑制剂的抑制。不考虑进入途径,已报道轮状病毒进入机制涉及膜透化和外壳层的脱壳。
▼
✦肠上皮细胞对轮状病毒有一定的抵抗作用
轮状病毒主要靶向末端分化的肠上皮细胞,主要是回肠和空肠,因此肠上皮细胞充当第一道物理屏障。除了物理屏障外,肠上皮细胞还利用几种先天免疫机制来抑制肠道病原体的感染。
上皮细胞用来抵抗轮状病毒感染的机制包括粘液产生、细胞因子/趋化因子的分泌以及TLR表达和信号传导。轮状病毒感染的第一步是使用细胞表面分子如组织血型抗原和整联蛋白作为受体或共受体。
✦特定聚糖影响轮状病毒的附着
轮状病毒对肠细胞的附着发生在特定的聚糖(包括粘蛋白聚糖和细胞表面聚糖)存在的情况下。虽然宿主聚糖特异性是调节轮状病毒传染性的关键因素之一,但其他因素也被认为影响不同人群中不同轮状病毒基因型的相对流行和出现。
这些因素可包括但不限于不同基因型轮状病毒的可变聚糖识别和结合亲和力、额外辅受体/辅因子的存在或缺乏、免疫反应的差异以及其他未定义的宿主因素。
注:先前的工作表明,多聚糖识别机制的变化与轮状病毒物种嗜性、人畜共患病潜力、适应性和流行病学流行率的差异相一致。
▼
粘蛋白是高分子量上皮细胞的高分子量产物。这些高度糖基化的蛋白质是粘液的关键成分。粘蛋白作为天然免疫系统的一部分,具有化学屏障和结合病原体的功能。
✦粘蛋白对轮状病毒具有抑制作用
通过补充鼠肠粘蛋白抑制了轮状病毒与细胞的结合,这表明粘蛋白的分子模拟允许它们干扰病毒-细胞附着。
然而,他们表明神经氨酸酶处理去除鼠血清唾液酸(SA)抑制粘蛋白阻止轮状病毒附着于宿主细胞的能力,表明粘蛋白聚合结构和血清唾液酸含量在其诱导作用中的功能意义。
在回肠中,响应轮状病毒感染而产生的聚糖的可用性有利于大量的聚糖降解细菌,这导致粘蛋白对轮状病毒感染的保护作用进一步降低。
例如,粘蛋白降解细菌具有比非粘蛋白降解细菌更接近宿主上皮的能力,从而间接促进轮状病毒与上皮的附着。
总之,粘蛋白结构似乎是轮状病毒的一个重要的宿主屏障。因此,深入了解轮状病毒与粘蛋白多糖的相互作用可以为轮状病毒适应、传播和宿主限制提供更多的见解,这可能有助于开发针对轮状病毒感染的靶向治疗。
由细菌、真菌等组成的大量不同的共生微生物群栖息在胃肠道中。共生微生物群和它们的宿主的共同进化导致了互利的条件,其中宿主可以受益于微生物群提供的生理、代谢和免疫调节,而共生微生物群绝对依赖于宿主获得营养和繁殖场所。
作为肠道病原体,诺如病毒和轮状病毒与它们相互作用。在病毒感染的调节中,肠道微生物群可以通过不同的机制促进或抑制病毒传染性。
▼
几项研究证明了益生菌对肠道病毒感染和许多其他疾病的有益作用。益生菌通过调节肠道微生物群组成、增强肠道屏障功能和促进粘膜免疫来保护宿主免受病毒感染。
✦益生菌可以抑制诺如病毒
此外,它们通过竞争性排斥来干扰病毒与其靶细胞的结合,通过阻断病毒受体和结合表面的病毒来促进它们在粪便中的消除。
一些益生菌抑制诺如病毒的证据:
Bifidobacterium adolescentis的存在抑制了体外人诺如病毒与上皮细胞的粘附。
类似地,干酪乳酪杆菌(Lacticaseibacillus casei)和Escherichia coliNissle 1917损害了GI.1P颗粒对HT-29细胞的附着。
在另一项研究中,用Lacticaseibacillus rhamnosus GG和Escherichia coli Nissle 1917定植的新生猪感染了GII.3和GII.4基因型的人类诺如病毒,观察到病毒粪便脱落低于检测极限,表明这种细菌的定植对诺如病毒感染有显著抑制。
✦部分细菌对轮状病毒也有抗性作用
至于轮状病毒,Escherichia coli Nissle 1917 似乎通过调节免疫反应减少了无菌猪的腹泻。
细菌鞭毛蛋白对轮状病毒感染有效,因为它诱导产生白细胞介素22和白细胞介素18。
Ruminococcus gauvreauii,一种从人胆汁中分离的细菌,因此可能存在于轮状病毒感染部位(小肠),可以结合轮状病毒。这种结合可能是由细菌表面存在的组织血型抗原介导的。
进一步实验证明Ruminococcus gauvreauii在体外干扰轮状病毒感染,因为在它的存在下发现病毒感染性降低了三分之二,证明了这种细菌的抗轮状病毒作用。
▼
尽管有关于肠源性细菌在抑制病毒感染中的作用的重要证据,但一些研究认为微生物群在促进病毒感染中的作用。
当使用脊髓灰质炎病毒、呼肠孤病毒和小鼠乳腺肿瘤病毒感染无菌或抗生素治疗的小鼠时。观察到与微生物定居的小鼠的感染相比,感染发生了实质性的减弱。将肠道微生物重建到抗生素治疗的小鼠中足以恢复脊髓灰质炎病毒的致病性。
✦部分肠道菌群会增强病毒致病性
与对照组小鼠相比,抗生素治疗组的肠道呼肠孤病毒滴度显著降低。当使用抗生素治疗或无菌小鼠时,轮状病毒和诺如病毒也报告了类似的发现,表明一部分微生物群增强了多个肠道病毒家族的致病性。
肠道微生物群可以通过几种机制直接促进肠道病毒复制,包括稳定病毒颗粒和促进病毒附着于宿主细胞。
✦细菌影响抗病毒免疫反应,导致病毒传染性和致病性增强
通过改变抗病毒免疫反应,间接增强肠道病毒的感染。受益于微生物群的几种肠道病毒结合细菌表面多糖,导致病毒传染性和致病性增强。当脊髓灰质炎病毒和其他微小核醣核酸病毒科成员与脂多糖结合,可以观察到在高温和稀释的氯漂白剂存在下热稳定性和抗失活性的增加。
诺如病毒与肠道微生物群成员的相互作用已经得到证实,包括:
阴沟肠杆菌(Enterobacter cloacae);
大肠杆菌(Escherichia coli);
幽门螺杆菌(Helicobacter pylori)。
•组织血型抗原介导菌群与病毒的作用
这些相互作用是通过这些细菌表面表达的组织血型抗原介导的,尽管已有报道称诺如病毒可结合微生物群中广泛表达的其他碳水化合物残基。在体外,人诺如病毒能够在组织血型抗原包被的细菌存在下感染B细胞,并且如果细菌不存在,在该模型中观察到病毒复制的减少。
如果细胞与阴沟肠杆菌一起孵育,B细胞的感染会恢复,这表明病毒颗粒与组织血型抗原包被细菌的结合能够将病毒摄入宿主细胞。
还观察到,表达组织血型抗原的细菌,如一些大肠杆菌菌株,在热处理过程中保护诺如病毒,如食品加工过程中完成的一种,促进其传播。
在具有移植的人类肠道微生物群的共生猪中进行的实验表明,人类诺如病毒GII.4/2006b菌株的复制受到微生物群的刺激,这增加了脱落滴度和持续时间;在抗生素治疗的小鼠中的实验表明,消除微生物群可防止小鼠诺如病毒CR6菌株的持续感染。
有人认为,肠道微生物群限制了依赖干扰素λ的先天免疫,从而允许诺如病毒持续存在。
▼
以婴儿为供体的粪便材料移植在模型中没有限制传染性,这表明供体的微生物群不能控制该模型中的轮状病毒感染,并且该过程需要小鼠自身细菌。
尽管不能排除取决于宿主和病毒株的差异,但所有这些数据都表明微生物群是限制轮状病毒复制的主要因素。
✦维生素A通过影响乳酸杆菌丰度加强抗诺如病毒的作用
关于微生物群对诺如病毒传染性的数据较少。流行病学研究表明,补充维生素A有抗诺如病毒的作用。
对小鼠诺如病毒的研究表明,补充维生素A后,小鼠肠道乳酸杆菌的数量增加,并且假设这些细菌的抗病毒作用(在体外对RAW264.7细胞进行了证明)可以减少诺如病毒感染。
✦胆汁酸丰度影响病毒的感染
如上一节所述,其他动物模型和诺如病毒的使用表明微生物群在该病毒群的复制中具有积极作用。
然而,需要注意的是,对抗生素治疗小鼠进行的最新和详细分析表明,尽管微生物群增强了肠道远端区域的小鼠诺如病毒株MNV-1感染,但它限制了近端小肠的感染性。
这种效应的区域化是由取决于肠道位置的胆汁酸受体的明显丰度介导的,胆汁酸受体参与触发近端肠道细菌增强的抗诺如病毒IFNλ反应。因此,小肠中胆汁酸的微生物修饰对不同肠道位置的小鼠诺如病毒感染有影响。
用梭状芽胞杆菌(Clostridium scindens,一种已知能将初级胆汁酸转化为次级胆汁酸的细菌,在抗生素治疗的动物中被降低)接种抗生素治疗动物,恢复了近端小肠中的病毒抑制作用,尽管它不会增强远端肠道的感染。
免疫调节正在成为这一现象的基础机制,并扩展到不针对肠道的病毒。特定的细菌类群也被描述用于预防病毒性疾病,如小鼠脑心肌炎病毒全身感染,其中抗生素治疗也加剧了感染。
✦经黏液真杆菌可以限制病毒复制
与其他测试的肠道细菌相反,在肠道微生物群成员中,发现了经黏液真杆菌属(Blautia coccoides)是一种能够限制单克隆小鼠全身脑心肌炎病毒复制的细菌。在携带经黏液真杆菌属的动物中,巨噬细胞诱导IFNβ的能力得以恢复,IFNβ可抵抗脑心肌炎病毒。
注意:I型干扰素(IFNβ)在对抗病毒病原体的反应中起着关键作用。缺乏细菌会导致较弱的先天免疫反应,其特征是IFNβ的低表达,这阻碍了有效的巨噬细胞抗病毒反应。
一些细菌成分或衍生代谢物通过产生IFNβ参与引发宿主对呼吸道病毒的先天免疫,例如来自拟杆菌在流感感染中或乙酸盐(以及丙酸盐或丁酸盐),其本身能够在小鼠的肺中诱导IFNβ反应,并在补充到饮用水中时保护它们免受呼吸道合胞病毒的感染。
✦白细胞介素在对抗轮状病毒中起重要作用
上述研究证实了微生物群对肠道病毒感染以及其他非肠道病毒的影响。然而,对于轮状病毒和诺如病毒来说,其发生的机制还不清楚,需要新的研究来获得关于它们的知识。
识别细菌鞭毛蛋白的TLR4和炎症体的NLR-C4成分对于白细胞介素22和白细胞介素18的产生是至关重要的,白细胞介素22和白细胞介素18在对抗轮状病毒中是重要的。
研究表明,微生物群的减少导致白细胞介素22的产生减少,并且通过施用白细胞介素22可以实现针对轮状病毒的保护。
在这种情况下,白细胞介素22介导的保护不涉及干扰素,因为在缺乏转录因子STAT1的小鼠中也发现了干扰素,STAT1增加了干扰素刺激基因的表达。
✦微生物通过免疫球蛋白限制感染
微生物群可以用来限制感染的另一个可能的机制是分泌型免疫球蛋白A (sIgA)。免疫球蛋白A分子被分泌到肠腔中,在那里它们附着抗原并作为粘膜防御的第一道屏障。
肠道微生物群已被证明能够调节免疫球蛋白的产生,并且肠道中的IgA水平在无菌小鼠中显著降低。
认识了危害我们肠道健康的诺如病毒和轮状病毒后,重点在于如何防治它们。
谷禾在这里整理了一些预防诺如病毒及轮状病毒的方法,以及在出现症状之后能做的一些措施。
▼
✦保持手部卫生
保持良好的手部卫生是预防诺如病毒感染和控制诺如病毒传播最重要和最有效的措施。
上完厕所或换完尿布后;在吃或处理食物之前;在给自己或别人吃药之前,用肥皂和水彻底洗手。
注:诺如病毒可以在你的呕吐物或粪便中发现,甚至在你开始感到恶心之前。在你感觉好些后,这种病毒还会在你的粪便中停留两周或更长时间。在这段时间里,继续经常洗手是很重要的。
✦注意食物卫生
在准备和食用食物之前,仔细清洗水果和蔬菜。将食物彻底煮熟,避免生食。可能被诺如病毒污染的食物应该扔掉。
注:诺如病毒相对耐热,它们可以在高达145华氏度的温度下存活。
✦与病患及时隔离
患者应根据病情居家或入院隔离至症状完全消失后3天;检测呈诺如病毒阳性但无感染性腹泻症状的隐性感染者,也须居家隔离3天。
尽量不要和其他健康的家人近距离接触,尤其不要做饭或照顾老人和幼儿。
✦做好消毒工作
保持室内空气流通,每日开窗通风不少于2次,每次不少于30分钟。无人的空间可定期用紫外线对空气消毒,每次不少于30分钟。
有人呕吐或腹泻后,应立即彻底清洁和消毒整个区域:对患者呕吐物或粪便污染的环境和物品须使用含氯制剂进行消毒。在清理受到呕吐物污染的物品时,应戴塑胶手套和口罩,避免直接接触污染物。
消毒过程:戴上橡胶或一次性手套,用纸巾擦拭整个区域,然后按照产品标签上的说明,使用以漂白剂为基础的家用清洁剂消毒该区域。
将漂白消毒剂留在受影响的区域至少五分钟,然后用肥皂和热水再次清洁整个区域。最后,清洗脏衣服,倒垃圾,洗手。
▼
对于诺如病毒,目前尚无特效的抗病毒药物,也没有可用于预防的疫苗,出现呕吐、腹泻主要是靠对症治疗或支持疗法。
✦日常护理
应注意患者的饮食卫生,少吃生食,少吃冷食,同时注意患儿的保暖,并少去人群过于集中的公共场所。
✦预防脱水
虽然此病大部分可以自行恢复,但医生提醒,脱水是诺如病毒感染性腹泻的主要死因,对严重病例尤其是幼儿及体弱者应及时输液或口服补液,以纠正脱水、酸中毒及电解质紊乱。
✦营养治疗
腹泻营养治疗原则是饮食上进行调整,停止进食高脂肪和难以消化的食物,以减轻胃肠负担,逐渐恢复消化功能,切忌滥用抗生素。积极采取饮食治疗对恢复体力非常重要。
✦止泻治疗
诺如病毒容易引起肠道感染,患者出现反复腹泻或腹泻比较严重时,可在专业医生指导下给予止泻药物进行治疗,如蒙脱石散等。
蒙脱石散对肠道内的细菌以及病毒,具有较好的抑制作用,对于改善腹泻有较好的效果,此外,蒙脱石散还具有保护肠道黏膜的作用。不过过量服用蒙脱石散可能会造成便秘。
▼
轮状病毒的预防大部分与诺如病毒类似,主要还是从环境方面注意。
✦远离传染源
轮状病毒的发病一般与接触传染源有关,因此必须要主动隔离传染源,对密切接触者和患者进行严密观察和隔离,防止水源和食物被污染,而患者粪便要做好消毒工作,儿童玩具和餐具也要及时清洁消毒。
✦切断传播途径
轮状病毒可通过粪便或口腔接触传播。因此,排便后要用消毒洗手液或肥皂洗手,同时要避免接触任何受污染的物体,在疾病高发期,必须保持环境卫生和个人卫生,以此来切断病毒传播途径。
✦接种疫苗
轮状病毒感染患病率比较高,传染性强,目前最为有效的预防方法之一就是接种疫苗,能够降低发病率,轮状病毒疫苗有两种,一种是适合6个月以内的宝宝,一种是适合6个月以上的,要根据孩子的情况正确选用。
两种对抗轮状病毒A种感染的疫苗已经证明对儿童是安全而且有效的:分别是由葛兰素史克制造的“罗特律”(Rotarix®)与由默克大药厂制造的“轮达停”(RotaTeq®)。
▼
当自己有腹泻、恶心、呕吐、发热等症状时,大家要引起注意,及时去医院做检查,并积极地进行治疗。
✦补充电解质
轮状病毒主要造成腹泻,腹泻最主要的危害是容易出现脱水、酸碱平衡紊乱和电解质紊乱,所以预防腹泻引起的症状很重要,监测患儿有无脱水表现。
如果有轻度脱水可给予口服补液盐预防脱水,严重可通过输液纠正脱水、酸碱平衡紊乱和电解质紊乱。
✦调理肠道
尽量食用一些柔软温和的食物,部分患儿腹泻时间较长还可给予补锌治疗,因为锌是修复肠道上皮细胞很重要的微量元素,补锌能够促进肠道上皮修复。
注意:小肠绒毛要一周才能修复,再此之前患儿若喝奶粉、牛奶、蔗糖类食物,还可能延长拉肚子的时间。
✦益生菌疗法
体外试验和动物模型研究发现部分益生菌菌株,可用于治疗轮状病毒感染。
对轮状病毒相关腹泻患者的益生菌治疗产生了更短的腹泻持续时间、更少的轮状病毒脱落、更快的粪便稠度改善和更少的排便次数。
益生菌在临床试验中治疗轮状病毒的作用


Peña-Gil N,et al.Int J Mol Sci.2021
✦干扰素
近年来,干扰素(IFN)也被用来治疗轮状病毒感染、这种药可以抑制病毒在人体内的繁殖,从而减轻症状,缩短病程。
诺如病毒以及轮状病毒等肠道病毒严重影响着人们的健康。这些病毒不仅影响着肠道,还有可能对全身免疫产生影响。
同时越来越多的证据表明,细菌、真菌、古细菌等肠道微生物在维持肠道内环境稳定中的重要性。许多肠道病毒,如诺如病毒和轮状病毒,与肠道微生物群具有密不可分的联系。
对宿主、肠道微生物群和肠道病毒之间建立的复杂关系深入研究,将为新的抗诺如病毒和抗轮状病毒疗法开辟新途径。
主要参考文献
Peña-Gil N, Santiso-Bellón C, Gozalbo-Rovira R, Buesa J, Monedero V, Rodríguez-Díaz J. The Role of Host Glycobiology and Gut Microbiota in Rotavirus and Norovirus Infection, an Update. Int J Mol Sci. 2021 Dec 15;22(24):13473. doi: 10.3390/ijms222413473. PMID: 34948268; PMCID: PMC8704558.
Jenni S, Li Z, Wang Y, Bessey T, Salgado EN, Schmidt AG, Greenberg HB, Jiang B, Harrison SC. Rotavirus VP4 Epitope of a Broadly Neutralizing Human Antibody Defined by Its Structure Bound with an Attenuated-Strain Virion. J Virol. 2022 Aug 24;96(16):e0062722. doi: 10.1128/jvi.00627-22. Epub 2022 Aug 4. PMID: 35924923; PMCID: PMC9400500.
Hassan E, Baldridge MT. Norovirus encounters in the gut: multifaceted interactions and disease outcomes. Mucosal Immunol. 2019 Nov;12(6):1259-1267. doi: 10.1038/s41385-019-0199-4. Epub 2019 Sep 9. PMID: 31501514; PMCID: PMC7479810.
Peters T, Creutznacher R, Maass T, Mallagaray A, Ogrissek P, Taube S, Thiede L, Uetrecht C. Norovirus-glycan interactions – how strong are they really? Biochem Soc Trans. 2022 Feb 28;50(1):347-359. doi: 10.1042/BST20210526. PMID: 34940787; PMCID: PMC9022987.
Campillay-Véliz CP, Carvajal JJ, Avellaneda AM, Escobar D, Covián C, Kalergis AM, Lay MK. Human Norovirus Proteins: Implications in the Replicative Cycle, Pathogenesis, and the Host Immune Response. Front Immunol. 2020 Jun 16;11:961. doi: 10.3389/fimmu.2020.00961. PMID: 32612600; PMCID: PMC7308418.
Komoto S, Fukuda S, Murata T, Taniguchi K. Human Rotavirus Reverse Genetics Systems to Study Viral Replication and Pathogenesis. Viruses. 2021 Sep 8;13(9):1791. doi: 10.3390/v13091791. PMID: 34578372; PMCID: PMC8473093.
Antia A, Pinski AN, Ding S. Re-Examining Rotavirus Innate Immune Evasion: Potential Applications of the Reverse Genetics System. mBio. 2022 Aug 30;13(4):e0130822. doi: 10.1128/mbio.01308-22. Epub 2022 Jun 14. PMID: 35699371; PMCID: PMC9426431.