-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
拟杆菌属下有众多成员,而卵形拟杆菌(Bacteroides ovatus)正是其中一员,它是一种革兰氏阴性、严格厌氧、不形成孢子的细菌。作为肠道微生物群中的主要菌种之一,它存在于约80%健康人的胃肠道中,对宿主健康具有重要影响。
卵形拟杆菌(B.ovatus)展现出极其多样化的碳水化合物代谢能力,是肠道中碳源利用的多功能专家,能够代谢超过三十种植物多糖,且对多糖代谢具有优先级。还能够代谢一些胆汁酸、有机酸和氨基酸。
B.ovatus代谢可生成乙酸、丙酸、异丁酸和异戊酸,还能消耗色氨酸和谷氨酸,合成神经活性化合物谷氨酰胺和γ-氨基丁酸(GABA)。表明B.ovatus能选择性地影响肠道神经递质的存在。粪便IgA产生依赖肠道微生物群定植,研究发现B.ovatus是最能诱导肠道IgA产生的物种。
近年来,不少研究发现卵形拟杆菌(B.ovatus)在临床上具有重要意义,对于治疗改善动脉粥样硬化、结肠炎、胰岛素抵抗、非酒精性脂肪性肝病、肾纤维化、癌症等疾病具有生理功效,被认为是一种潜在益生菌。同时有研究发现其在新型冠状病毒感染(COVID-19)、注意力缺陷,多动障碍、以腹泻为主的肠易激综合征、高甘油三酯相关急性胰腺炎等患者体内丰度降低。
本文主要从卵形拟杆菌(B.ovatus)的细菌学特性、功能特性、临床疾病改善作用及疾病相关丰度变化这几方面综述卵形拟杆菌的研究现状。
1933年,首次在粪便中分离鉴定出卵形拟杆菌(Bacteroides ovatus),作为拟杆菌属的成员,卵形拟杆菌(B.ovatus)是一种革兰氏阴性、厌氧、杆状细菌。该菌不具鞭毛、不形成芽孢,但有荚膜,对光敏感,是人类肠道微生物组中的重要共生菌。
▸ 形态
卵形拟杆菌(B.ovatus)一般呈杆状,大小约0.5-0.8μm×1.5-5μm,细胞末端呈圆形或略微尖锐,有时可见轻微膨大的卵形结构。无鞭毛,无芽孢,电子显微镜下可见典型的革兰氏阴性双层膜结构。
在培养基上形成圆形、光滑、半透明至不透明的米色或灰白色菌落,菌落直径通常为1-2mm(48小时培养)。
▸ 生长条件与分布
卵形拟杆菌(B.ovatus)适宜生长条件为:pH值5.5-7.5(偏酸性至中性),严格厌氧(<0.5%氧气浓度),温度37-40°C。
但其对胆汁和氯化钠具有一定的耐受性,能在胆汁存在的情况下生长,这对肠道定植至关重要。
耐受氯化钠:能够在不同浓度的氯化钠环境中生长;
耐受乙醇:对一定浓度的乙醇具有耐受性;
耐受过氧化氢:能够承受一定程度的氧化应激。
B.ovatus可定植于人和动物的肠道、口腔、上呼吸道及生殖道,主要定植于人类和哺乳动物肠道,特别是结肠环境。
人群分布特征
存在于大约80%健康人群的肠道中,相对丰度因人而异,通常占肠道菌群的0.5-4%。
随年龄变化:婴儿期低丰度,随固体食物引入增加,成人期达到稳定,老年期可能略有下降
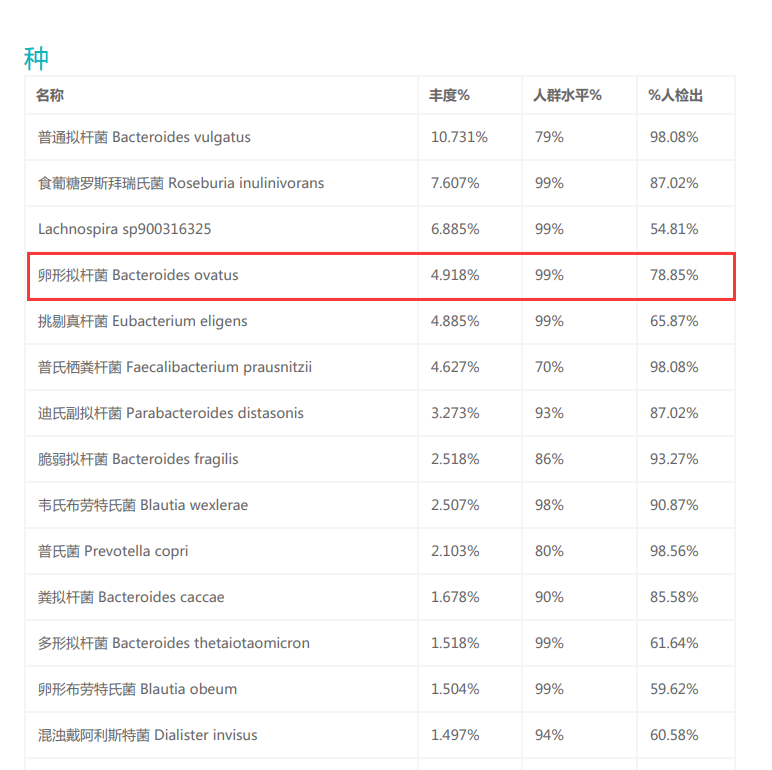
注:谷禾数据库显示在大约80%健康人群中可以检出该物种
▸ 代谢能力与产物
卵形拟杆菌展现出极其多样化的碳水化合物代谢能力,是肠道中碳源利用的多功能专家,这也是其在肠道生态系统中成功定植的关键。
具有丰富的多糖降解能力:
含有丰富的糖苷水解酶,包括β-葡萄糖苷酶、α-木糖苷酶、β-甘露糖苷酶等;多糖利用位点(PULs)数量居拟杆菌属之首,赋予其降解复杂膳食纤维的卓越能力。
卵形拟杆菌(B.ovatus)可降解超过30种不同的植物多糖,包括木聚糖、果胶、葡甘露聚糖、阿拉伯木聚糖、菊粉、乳糖、麦芽糖、棉子糖、鼠李糖、淀粉、蔗糖等并形成酸和少量气体,但不参与甘露醇、松三糖、水杨苷、山梨糖醇和海藻糖的代谢。
卵形拟杆菌对多糖代谢具有优先级
研究还发现卵形拟杆菌与多形拟杆菌的多糖利用优先级不同,如卵形拟杆菌更快利用多聚半乳糖醛酸聚糖;高优先级聚糖通常抑制低优先级聚糖基因转录;并且某些多糖的转录敏感性随培养基中残余浓度变化。
还能利用有机酸和氨基酸
除碳水化合物外,B.ovatus还能利用一些有机酸作为生长底物:包括2-羟基-苯甲酸、α-酮戊酸、β-羟基-丁酸、乙酸、乙酰乙酸、β-甲基-D-葡萄糖醛酸、己酸、辛酸、柠檬康酸、γ-氨基戊酸、D-半乳糖醛酸、D-苹果酸、乙醇酸、甘氧酸和L-苹果酸。
其中包括辛酸(癸酸),一种存在于饱和脂肪、椰子油、棕榈仁油和牛奶中的中链脂肪酸;以及苹果酸,一种贡献水果酸味的二羧酸,常用作食品添加剂。这些有机酸可能代表肠道环境中未被充分探索的营养生态位。
B.ovatus对氨基酸利用能力有限,仅能微弱利用,单独氨基酸可能不足以支持其良好生长,需要额外碳源才能有效生长。研究显示卵形芽孢杆菌ATCC 8384能利用L-精氨酸、L-瓜氨酸、L-亮氨酸、L-赖氨酸、甘氨酸、羟基-L-脯氨酸等氨基酸。
卵形拟杆菌还会参与胆汁和胆固醇代谢,它既有结合胆酸盐的能力,又有分解胆酸盐的能力,对体内胆汁和胆酸盐的代谢起着十分重要的作用。
影响短链脂肪酸和神经递质丰度
卵形拟杆菌还可以产生短链脂肪酸和神经递质,并影响其丰度。研究分析发现,B.ovatus能生成乙酸、丙酸、异丁酸和异戊酸。
体外实验中,B.ovatus消耗色氨酸和谷氨酸,合成神经活性化合物谷氨酰胺和γ-氨基丁酸(GABA)。与无菌对照相比,卵形拟杆菌小鼠肠道中乙酸、丙酸、异丁酸和异戊酸水平升高,GABA浓度增加,而色氨酸和谷氨酰胺浓度降低。
注:卵形拟杆菌还具备合成多种维生素B族的能力,包括B1、B2、B9等。
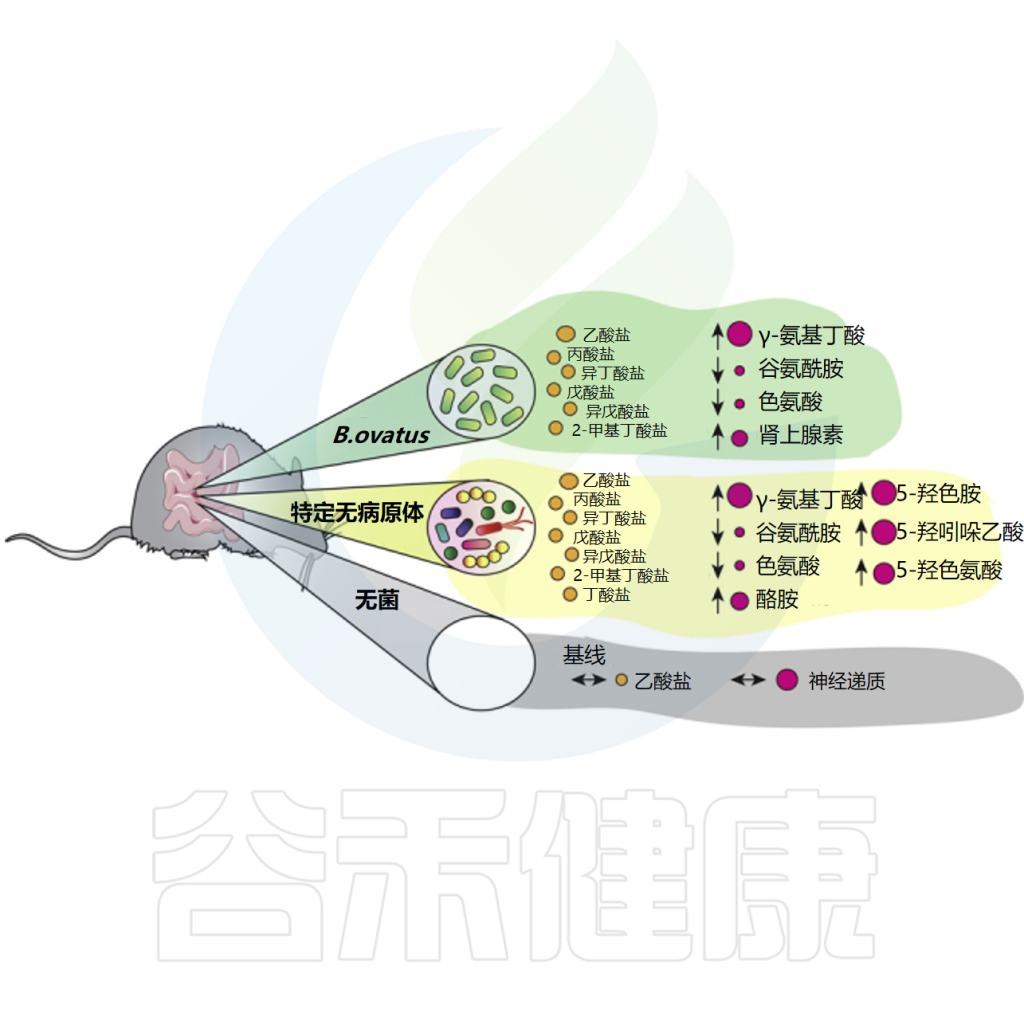
Horvath TD,et al.iScience.2022
B.ovatus影响肠道神经递质水平,尤其是GABA/Glu/Gln通路,可能对人类健康产生深远影响。
▸ 耐药性与抗生素敏感性
B.ovatus天然耐药谱包括对氨基糖苷类(如庆大霉素、卡那霉素)自然耐药、对多种喹诺酮类中度耐药及对万古霉素天然耐药。
获得性耐药性方面,临床分离株约25-30%对克林霉素耐药,近年来对碳青霉烯类耐药性增加。
抗生素敏感性表现为对甲硝唑高度敏感,对β-内酰胺/β-内酰胺酶抑制剂复合物敏感,对氯霉素、红霉素和四环素敏感性良好。
▸ 与其他肠道菌群的相互作用
卵形拟杆菌(B.ovatus)在肠道微生物生态系统中扮演着重要角色,与多个菌群之间存在相互作用:
卵形拟杆菌代谢多糖为其他菌群提供能量
卵形拟杆菌可降解海藻产生的卡拉胶、琼脂糖、藻酸盐等多糖及其低聚糖,通过两种酶降解藻酸盐、古罗糖醛酸和甘露糖醛酸低聚糖。菌群在多糖中生长时存在专业的交互共生酶系统,卵形拟杆菌消化菊粉的产物可供普通拟杆菌利用。卵形拟杆菌通过降解膳食多糖为肠道其他菌群提供营养,展示了肠道细菌间的合作性互动模式。
与产丁酸菌的互养关系
为产丁酸菌(如瘤胃球菌属和粪杆菌属)提供代谢底物
释放寡糖,支持共栖菌群生长,与产丁酸菌形成”食物链”,提高碳水化合物利用效率。
与双歧杆菌的协同作用:为双歧杆菌提供生长因子,共同参与复杂碳水化合物降解的分工,协同增强肠道屏障功能。
与其他拟杆菌的竞争与协作
与脆弱拟杆菌(B.fragilis)在生态位上部分重叠但功能互补;
与B.vulgatus共享部分营养资源,但各有专长;
与单形拟杆菌(B.uniformis)协同分解复杂多糖。
拟杆菌属重要菌种——单形拟杆菌 (Bacteroides uniformis),控制好其稳态很重要
特殊的菌间互作
与Clostridium scindens形成特殊互利关系,促进胆汁酸转化;
抑制产生硫化氢的细菌生长,如脱硫弧菌属(Desulfovibrio)。
卵形拟杆菌(B.ovatus)与人体宿主建立了复杂的互利共生关系,影响多个生理系统:
•免疫系统调节
Bacteroides ovatus是最能诱导肠道IgA产生的物种。
B.ovatus可通过IL-10和TGF-β信号诱导调节性T细胞(Treg)分化,通过分泌吲哚-3-乙酸促进IL-22分泌,增强肠上皮屏障功能,并通过抑制NF-κB通路减轻过度炎症反应。
卵形拟杆菌产生的吲哚乙酸(AA)增加了CD103+/CD11c+免疫群体的丰度,这些免疫细胞对维持肠道免疫稳态和诱导耐受性免疫反应至关重要。
降低肠道促炎细胞因子(TNF-α、IL-6、IL-1β)表达,并通过促进肠道相关淋巴组织(GALT)发育塑造黏膜免疫系统。
•代谢功能影响
代谢底物供应:B.ovatus产生短链脂肪酸为结肠上皮细胞提供约60-70%能量需求,并参与胆固醇和胆汁酸代谢,提高膳食纤维利用效率增加能量获取。
胰岛素敏感性调节:改善IRS-1/PI3K/Akt级联胰岛素信号通路,减少内毒素血症降低炎症介导的胰岛素抵抗,通过SCFAs活化GLP-1分泌改善糖代谢。
脂质代谢影响:抑制脂肪生成相关基因表达(SREBP-1c、FAS),促进脂肪氧化(PPARα、CPT1),调节胆固醇代谢促进胆固醇至胆汁酸转化。
•肠-脑轴影响
神经递质前体合成:参与色氨酸代谢影响5-HT(血清素)合成,产生GABA前体物质,影响肾上腺素和多巴胺等多种神经递质的代谢。
肠神经系统发育:调节肠神经丛发育和成熟,影响肠道蠕动和分泌功能,通过迷走神经信号影响脑功能。
行为与情绪调节:动物研究表明B.ovatus可减轻焦虑样行为,影响应激反应和HPA轴功能,可能参与情绪调节,研究显示与抑郁症状呈负相关。
此外,通过多项临床和实验室研究表明,卵形拟杆菌(B.ovatus)在多种疾病状态下展现出改善作用。
1
B.ovatus改善动脉粥样硬化

一项最新研究发现,卵形拟杆菌(Bacteroides ovatus)在在动脉粥样硬化(AS)中具有重要作用。
B.ovatus主要通过恢复肠道屏障和增强胆汁酸代谢来缓解动脉粥样硬化(AS),特别是通过产生色氨酸衍生的代谢物吲哚-3-乙酸(IAA)。IAA抑制M1巨噬细胞中的TLR4/MyD88/NF-κB 通路,促进M2巨噬细胞极化,恢复 M1/M2 极化平衡,最终减轻主动脉炎症。
2
改善肠道屏障,减轻结肠炎

研究发现卵形拟杆菌(B.ovatus)通过多重机制增强肠道屏障完整性:
①增强紧密连接蛋白表达
核心屏障蛋白上调:分析证实卵形拟杆菌提高肠道中Occludin和Claudin-1表达;
连接复合体加强:ZO-1、JAM-A等紧密连接相关蛋白表达增加并分布更加规则;
结构完整性修复:电子显微镜观察显示卵形拟杆菌(B.ovatus)丰度较高的个体肠上皮细胞间连接更紧密,微绒毛排列更规则。
②肠粘膜保护与修复
黏液分泌增加:卵形拟杆菌促进杯状细胞分泌MUC2黏蛋白,加强黏液层屏障;
细胞再生促进:促进肠上皮细胞增殖和更新,维持肠上皮完整性。
③调节肠道免疫平衡
抗炎因子增加:肠道内IL-10水平升高(从3.43±0.72 pg/mg增至7.86±1.05 pg/mg);
促炎因子下降:TNF-α和IL-6水平显著降低。
④降低结肠炎症
除了改善肠道屏障外,研究发现肠道共生Bacteroides ovatus ATCC8384还可以通过多重机制降低结肠炎症。其具体机制如下:
调节树突状细胞群体:在无菌小鼠中,B.ovatus改变了CD11b+/CD11c+和CD103+/CD11c+树突状细胞群,这些免疫细胞对维持肠道免疫稳态和诱导耐受性免疫反应至关重要;
促进IL-22产生:卵形拟杆菌产生吲哚-3-乙酸(IAA),这种代谢物能结合树突状细胞上的芳烃受体(AhR),在TNBS结肠炎模型小鼠中,B.ovatus处理明显上调结肠组织中IL-22的表达,IL-22通过STAT3通路激活促进上皮修复和并抑制结肠炎。
B.ovatus调节免疫和肠道炎症
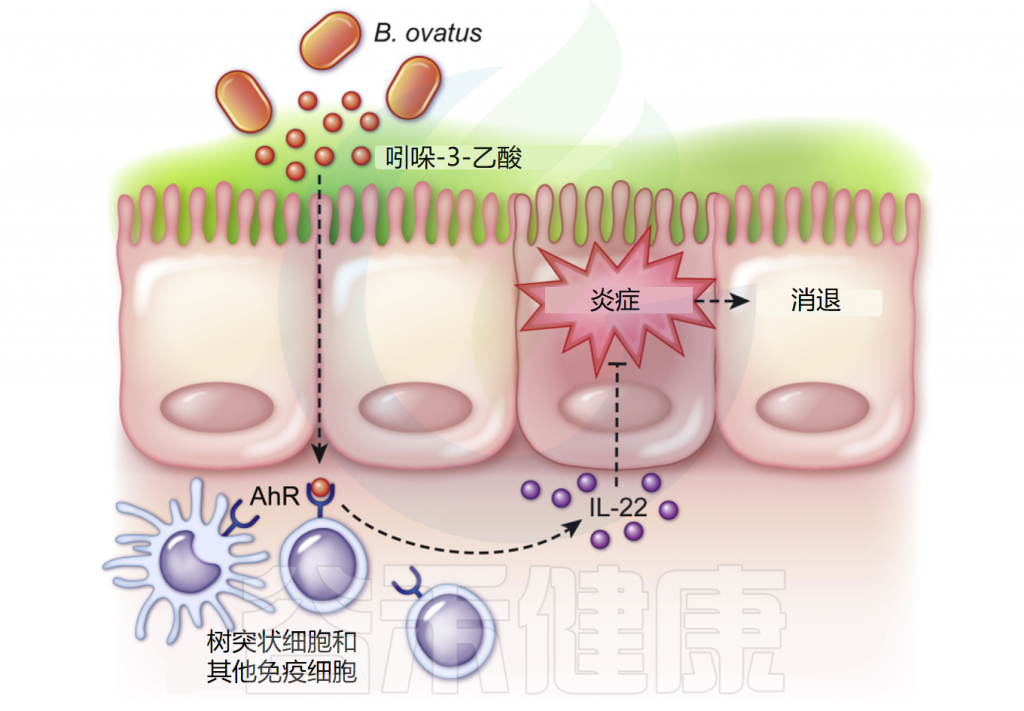
doi: 10.1016/j.ajpath.2021.01.009.
B.ovatus处理降低了结肠炎小鼠血清中多种促炎细胞因子水平,包括:KC (IL-8)、单核细胞趋化蛋白-1 (MCP-1)、肿瘤坏死因子 (TNF)、IL-6、IL-1α和IL-1β。
3
改善胰岛素抵抗
卵形拟杆菌(Bacteroides ovatus)通过多重协同机制改善胰岛素抵抗。补充卵形拟杆菌后小鼠生理发生以下变化:
①代谢参数改善
血糖调控指标:空腹血糖降低(从8.15±0.41降至6.23±0.36 mmol/L,降低23.6%)、空腹胰岛素水平下降、糖化血红蛋白(HbA1c)降低。
血脂改善:甘油三酯(TG)降低、总胆固醇(TC)降低、低密度脂蛋白胆固醇(LDL-C)降低、高密度脂蛋白胆固醇(HDL-C)升高。
体重和脂肪分布改善:体重减轻,高脂饮食诱导的体重增加得到部分逆转;内脏脂肪减少;脂肪细胞大小减小:组织学分析显示脂肪细胞平均直径减小。
②胰岛素信号通路增强
IRS-1/PI3K/Akt通路激活:IRS-1磷酸化增强、PI3K活性增加、Akt磷酸化增强、GLUT4膜转位增加:肌肉细胞中GLUT4从细胞质向细胞膜转位增加,促进葡萄糖摄取。
③胰岛素抵抗指标改善
胰岛β细胞功能改善:组织学分析显示胰岛形态更加正常,β细胞功能恢复;
肝脏胰岛素敏感性提高:肝脏糖异生减少,PEPCK和G6Pase表达下调;
葡萄糖耐量改善:口服葡萄糖耐量测试(OGTT)中血糖曲线下面积(AUC)减少43.5%;
胰岛素敏感性提高:胰岛素耐量测试(ITT)显示胰岛素敏感性指数提高58.7%
④JNK/IKK炎症信号抑制
JNK磷酸化抑制:p-JNK/JNK比值降低,减少IRS-1丝氨酸307磷酸化;
IKK活性降低:减少NF-κB信号通路激活;
减轻炎症导致的胰岛素信号通路负调控。
卵形拟杆菌具有改善胰岛素抵抗的作用:增强肠道屏障功能减少内毒素转位及炎症反应;调节IRS-1/PI3K/Akt等胰岛素信号通路活性;并通过短链脂肪酸和胆汁酸调节产物参与全身代谢调控。这种多靶点、多层次的作用机制使卵形拟杆菌有望成为改善胰岛素抵抗的潜在益生菌干预方案。
4
缓解非酒精性脂肪性肝病
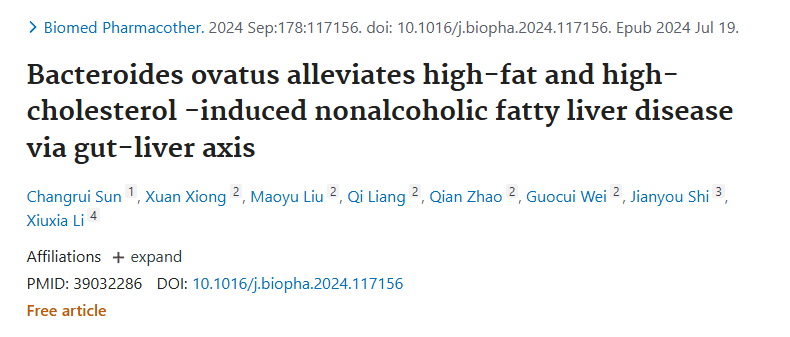
卵形拟杆菌(B.ovatus)还被发现可能对非酒精性脂肪性肝病(NAFLD)具有治疗作用。将小鼠随机分为 3组:对照组(NCD)接受对照标准饮食,模型组(M)接受高脂高胆固醇(HFHC)饮食,另一组饲喂HFFC并补充卵形拟杆菌。结果发现:用B.ovatus治疗可以减轻体重,预防肝脂肪性肝炎和肝损伤。
机制上,B.ovatus改变肠道微生物组成,降低厚壁菌门/拟杆菌门比率,减少变形菌门、疣微菌门及Ruminococcus torques、Ruminococcus gauvreauii和丹毒梭菌属丰度,同时显著增加Lachnospiraceae_NK4A136_group、norank_f__Oscillospiraceae和Colidextribacter。
与对照组相比,卵形拟杆菌处理改变粪便短链脂肪酸构成,降低血清脂多糖、CD163、IL-1β、TNF-α水平,减少肝脏巨噬细胞数量。此外,B.ovatus下调脂肪生成相关基因(Srebfl、Acaca、Scd1、Fasn),上调脂肪酸氧化相关基因(如Ppara)。研究证实B.ovatus通过调节肠-肝轴改善非酒精性脂肪肝病。
5
预防肾纤维化
肾纤维化、炎症和肠道菌群失调都与慢性肾病(CKD)相关。而有研究发现Bacteroides ovatus可以预防肾纤维化。

慢性肾病患者的卵形拟杆菌丰度降低
通过对比几十名慢性肾病(CKD)患者和相同数量年龄和性别匹配的健康对照发现:CKD患者中Bacteroides eggerthii、Bacteroides uniformis和Bacteroides vulgatus的相对丰度没有显著变化。
但Bacteroides thetaiotaomicron的相对丰度显著增加。同时B.ovatus显著降低。B.ovatus的丰度与血尿素氮和血清肌酐呈显著负相关。
B.ovatus提高猪去氧胆酸减轻肾纤维化
从机制上讲,B.ovatus通过上调一种肠道细菌 Clostridium scindens来提高肠道猪去氧胆酸(HDCA)水平,该菌株具有在小鼠体内直接产生HDCA的能力。
HDCA通过上调肠道中TGR5的表达和下调法尼醇X受体(FXR)的表达,显著促进GLP-1的分泌。肾脏GLP-1R的激活减轻了肾纤维化,同时延缓了慢性肾病的后续发展。
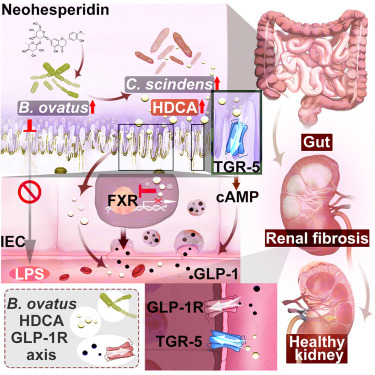
doi: 10.1016/j.celrep.2024.114830.
6
减轻移植物抗宿主病
急性胃肠道移植物抗宿主病(aGI-GVHD)是同种异体造血干细胞移植的严重并发症,肠道菌群已知会影响其严重程度。
在37名aGI-GVHD患者研究中,我们发现皮质类固醇治疗无反应与先前使用碳青霉烯类抗生素及微生物组中卵形拟杆菌缺失相关。在碳青霉烯类加重的GVHD小鼠模型中,引入卵形拟杆菌降低了GVHD严重程度并提高生存率。
卵形拟杆菌(Bacteroides ovatus)通过将膳食多糖代谢为单糖,减少另一种肠道共生菌Bacteroides thetaiotaomicron对结肠粘液的降解,从而抑制粘液降解并降低GVHD相关死亡率。
卵形拟杆菌(Bacteroides ovatus)的丰度或活性水平的改变与众多疾病状态密切相关,可能作为这些疾病发生或进展的标志物或调节因素。与卵形拟杆菌相关的疾病包括但不限于以下几种:
1
COVID-19患者中B.ovatus丰度降低

新型冠状病毒(SARS-CoV-2)感染后会导致我们人体的肠道微生物群发生变化。通过对几十名新型冠状病毒感染(COVID-19)患者的粪便样本进行了鸟枪法宏基因组测序分析发现如下:
与对照组相比,COVID-19患者的粪便微生物组发生了显著变化,其特征是机会性病原体的富集和有益共生物的消耗。即使在清除SARS-CoV-2(从咽拭子确定)和呼吸道症状消退后,耗竭的共生体和肠道菌群失调仍然存在。
Coprobacillus、Clostridium ramosum和 Clostridium hathewayi的基线丰度与COVID-19严重程度相关;普拉梭菌(Faecalibacterium Prausnitzii)(一种抗炎细菌) 的丰度与疾病严重程度呈负相关。
4种拟杆菌种包括Bacteroides dorei、Bacteroides thetaiotaomicron , Bacteroides massiliensis和Bacteroides ovatus,与粪便中SARS-CoV-2含量呈显著呈负相关。
2
低B.ovatus丰度与认知障碍有关
注意力缺陷/多动障碍患者中B.ovatus丰度降低
研究发现注意力缺陷/多动障碍(ADHD)患者粪便样本中Bacteroides ovatus丰度显著降低,与健康对照组相比,ADHD患者B.ovatus降低47.4%。

B.ovatus可能影响认知功能
B.ovatus丰度与ADHD临床表现(包括多动性、冲动性和注意力缺陷)显著负相关,与韦氏智力量表评分显著正相关,尤其与语言类测试的表现相关。
而补充B.ovatus改善了ADHD大鼠的空间工作记忆缺陷并逆转了θ脑电图节律改变,同时增强海马CA1亚区神经元激活。
B.ovatus影响认知功能的可能机制
影响神经发育关键通路:B.ovatus缺乏导致神经发育通路的下调,包括神经元分化、突触传递和神经元轴突引导等。
影响突触可塑性:ADHD小鼠海马突触可塑性受损,包括长时程增强(LTP)减弱,电生理测量显示突触传递能力下降。
影响葡萄糖代谢:B.ovatus缺乏导致支持神经发育的代谢通路受损,特别是葡萄糖代谢相关通路;
PET-CT显示小鼠脑部葡萄糖代谢显著降低,尤其是前额叶皮质和海马区域。
作用于血清代谢物:B.ovatus影响宿主代谢,产生影响大脑发育的代谢物,研究发现24种代谢物与B.ovatus丰度显著相关;
其中果糖乙酰磷酸(F1P)下降是关键因素,补充F1P可部分恢复小鼠认知功能,而B.ovatus通过调节肝脏中的醛缩酶表达影响F1P生成。
阿尔兹海默病中B.ovatus丰度也降低
与野生小鼠相比,阿尔兹海默病小鼠表现出多种拟杆菌属物种的总体丰度显著降低,包括 Bacteroides ovatus、Bacteroides dorei 和 Bacteroides vulgatus。
3
以腹泻为主的肠易激综合征中丰度降低
肠道菌群失衡和粪便胆汁酸(BA)异常被认为是腹泻为主的肠易激综合征(IBS-D)的关键因素。
研究招募了25名IBS-D患者和15名健康对照者进行胆汁酸相关的代谢和宏基因组分析,临床研究显示,IBS-D患者中与胆盐水解酶活性相关的肠道菌群(如Bacteroides ovatus)显著减少,同时伴有总和原发性BA水平升高。
本研究对IBS-D队列进行胆汁酸相关代谢组学和宏基因组学分析,发现卵形拟杆菌(Bacteroides ovatus)、胆盐水解酶(BSH)基因与胆汁酸之间的相互作用与IBS-D患者密切相关。
4
慢性炎症性脱髓鞘性多发性神经根神经病
CIDP患者中B.ovatus丰度降低
慢性炎症性脱髓鞘性多发性神经根神经病(CIDP)是一种罕见的获得性免疫介导性神经病。微生物可能是一个促成因素。
结果显示,换着血清胆汁酸谱受到干扰,CIDP的花生四烯酸(AA)显著增加。CIDP受试者血清中牛磺熊去氧胆酸(TUDCA)水平的降低与Bacteroides sp. PHL_2737、Bacteroides sp.M10 和 Bacteroides ovatus呈显著正相关;甘氨脱氧胆酸(GDCA)水平的降低与Bacteroides caccae和Bacteroides coprosuis呈显著正相关;牛磺石胆酸(TLCA)水平下降与Bacteroides caccae呈显著正相关;TCDCS的增加与Ruminococcus gnavus呈显著正相关。
肠道微生物可能影响CIDP中血清BA/AA水平
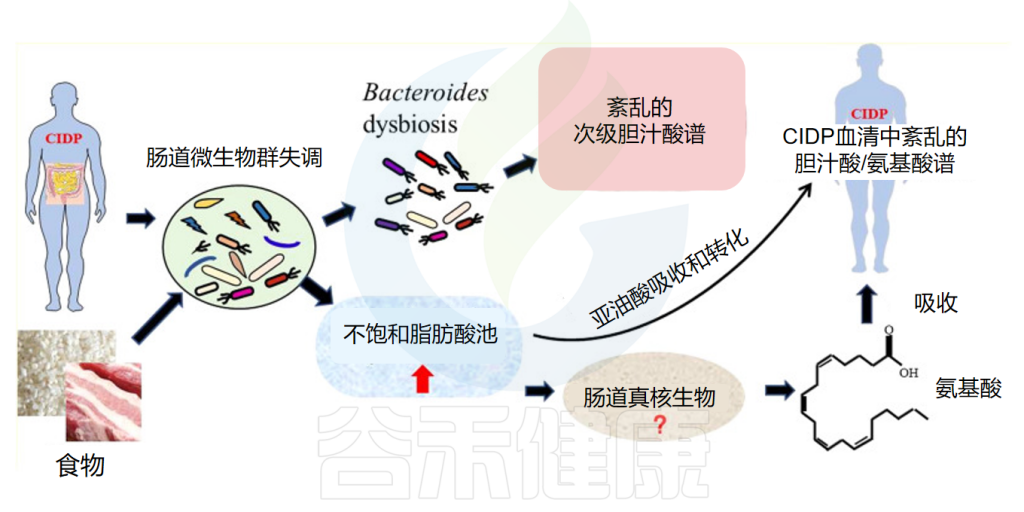
Fu J,et al.Cell Biosci.2023
5
高甘油三酯相关急性胰腺炎中丰度较低

肠道菌群在急性胰腺炎(AP)进展中发挥重要作用,高甘油三酯血症相关急性胰腺炎(HTGAP)与疾病严重程度和发病率增加相关。
与非HTGAP组相比,HTGAP 组的微生物多样性较差,埃希氏菌/志贺氏菌和肠球菌的丰度较高,但Dorea longicatena、Blautia wexlerae和Bacteroides ovatus的丰度较低。肠道菌群的改变与HTGAP患者的疾病严重程度和不良预后相关,表明肠道菌群与高甘油三酯血症相关的急性胰腺炎之间存在潜在的病理生理联系。
6
2型糖尿病患者中B.ovatus会影响VB12
导致2型糖尿病患者维生素B12缺乏症
有研究报告说, 2型糖尿病患者肠道中卵形拟杆菌(Bacteroides ovatus)的相对丰度与二甲双胍诱导的维生素B12缺乏有关。
注:二甲双胍是治疗2型糖尿病的一线口服降糖药。
来自前瞻性患者队列的数据,其中包括接受二甲双胍治疗3至6个月的新诊断2型糖尿病受试者。发现二甲双胍处理上调了微生物btuB基因的表达并调节了卵形拟杆菌中三磷酸腺苷(ATP)的产生,从而增强了其捕获VB12的能力,随后降低了宿主体内VB12的血清水平。
7
结直肠癌等一些疾病中丰度也降低
卵形拟杆菌(Bacteroides ovatus)在免疫性疾病和结直肠癌中也被发现丰度降低。
自身免疫性疾病:自身免疫性疾病(如类风湿性关节炎和系统性红斑狼疮)患者的肠道微生物群出现改变,包括卵形拟杆菌减少。
结直肠癌:卵形拟杆菌水平降低与结直肠癌风险增加相关。该细菌产生的化合物可能抑制癌细胞生长并促进细胞凋亡。
B.ovatus(卵形拟杆菌)是肠道菌群中的一种重要共生菌,已被多项研究证明与宿主健康密切相关,包括改善炎症、促进代谢健康和增强肠道屏障功能。根据文献及补充搜索,以下是调整B.ovatus丰度的主要方法:
1
膳食多糖/膳食纤维补充
①果胶类多糖
多项研究显示B.ovatus能有效利用果胶作为生长底物,B.ovatus能利用不同来源的果胶,且优先利用均聚半乳糖醛酸(果胶的主链成分)。在人类饮食添加果胶可显著增加拟杆菌的丰度,特别是B.ovatus。
高果胶含量的食物有:柑橘类水果及其果皮、苹果、浆果类(如草莓、蓝莓、覆盆子、黑莓)、香蕉、柿子、梨、水蜜桃、黄桃、番石榴、木瓜;胡萝卜、土豆、山药、秋葵(黏液中含有丰富果胶)、南瓜、花椰菜、茄子、甜菜。
②菊粉和低聚果糖
多项研究表明B.ovatus可有效利用菊粉进行生长,一项随机对照试验中,摄入菊粉和低聚果糖的患者粪便中B.ovatus水平显著增加,表明饮食可以显著影响B.ovatus的体内水平。
富含低聚果糖的食物:洋葱、大蒜、韭菜、小香葱;菊苣根(工业提取低聚果糖的主要来源)、菊芋、牛蒡、山药;芦笋、茄子、秋葵朝鲜蓟(洋蓟);香蕉、哈密瓜、桃子、无花果、李子、柿子;全谷物包括燕麦、大麦、黑麦及杏仁、亚麻籽。
③橙子纤维
在《Cell》发表的一篇研究表明,B.ovatus可以代谢橙子纤维(OF)产生N-甲基羟色胺,这种代谢物能促进宿主降低体重,减轻脂肪和加快肠道转运。
④纤维二糖
B.ovatus具有降解纤维二糖的能力,相关研究发现其新多糖利用位点(PUL)参与纤维二糖的捕获和降解,表明其可利用植物细胞壁相关成分生长。
⑤葡甘露聚糖
研究表明葡甘露聚糖(KGM)能显著增加B.ovatus的丰度,这与KGM降解相关基因有关。酵母甘露聚糖还可选择性促进B.thetaiotaomicron和B.ovatus的生长,揭示了两种拟杆菌之间的协同关系。
2
混合膳食策略
①多糖组合
B.ovatus在面对混合多糖时表现出底物优先使用顺序:优先利用果胶的均聚半乳糖醛酸部分,然后是β-葡聚糖,最后是阿拉伯木聚糖、鼠李半乳糖醛酸和中性侧链。
②益生元补充
综合多种益生元(如菊粉、果胶、木聚糖和甘露聚糖)可能比单一益生元更有效地增加B.ovatus丰度,因为这能满足其多样化的碳水化合物利用能力。
3
微生物组合策略
与B.thetaiotaomicron协同:研究表明B.thetaiotaomicron能产生B.ovatus可以利用的多糖降解产物,特别是在利用酵母甘露聚糖时。
微生物交叉喂养:B.ovatus与B.vulgatus之间的相互喂养关系可以增强B.ovatus的适应性。
!
重要考虑因素
个体差异:不同人群对同一膳食干预的反应可能存在差异,这可能与个体基线微生物组成有关。
宿主因素:B.ovatus的生长还受宿主特定因素影响,如血红素的存在对其代谢某些底物(如橙子纤维)至关重要。
酶系统:B.ovatus表达多种糖基水解酶,包括GH2、GH5、GH92等家族,这些酶对其降解复杂多糖的能力至关重要。
调整B.ovatus丰度的最有效方法是通过膳食干预,特别是补充其偏好的多糖底物,如果胶、菊粉、葡甘露聚糖、β-葡聚糖、阿拉伯木聚糖和橙子纤维等。考虑到B.ovatus的多样化底物利用能力,混合多种膳食纤维可能比单一底物更有效。
卵形拟杆菌(Bacteroides ovatus)作为拟杆菌属的重要成员,在人类肠道微生物组中发挥着独特而关键的作用。其卓越的植物多糖代谢能力,能够降解超过三十种复杂多糖,并影响谷氨酰胺和γ-氨基丁酸等神经递质的水平。
卵形拟杆菌与宿主建立了复杂的互利共生关系,参与调节多个生理系统。在免疫调节方面,它是最能诱导肠道IgA产生的菌种,能诱导调节性T细胞分化并抑制NF-κB通路减轻过度炎症反应。在代谢功能方面,卵形拟杆菌产生短链脂肪酸为结肠上皮细胞提供能量,参与胆固醇和胆汁酸代谢,并通过改善IRS-1/PI3K/Akt信号通路增强胰岛素敏感性。在肠-脑轴方面,卵形拟杆菌影响神经递质前体合成,通过代谢色氨酸和谷氨酸合成GABA和谷氨酰胺等神经活性物质,调节肠神经系统发育并可能影响情绪和认知功能。
临床研究显示,卵形拟杆菌在动脉粥样硬化、结肠炎、胰岛素抵抗、非酒精性脂肪肝、肾纤维化和癌症等疾病中具有重要的保护作用。相反,在COVID-19、注意力缺陷多动障碍、腹泻型肠易激综合征和高甘油三酯相关急性胰腺炎等疾病患者中,其丰度显著降低,提示卵形拟杆菌的减少可能与这些疾病的发生发展相关。
主要参考文献
Sun C, Xiong X, Liu M, Liang Q, Zhao Q, Wei G, Shi J, Li X. Bacteroides ovatus alleviates high-fat and high-cholesterol -induced nonalcoholic fatty liver disease via gut-liver axis. Biomed Pharmacother. 2024 Sep;178:117156.
Si ZL, Wang HY, Wang T, Cao YZ, Li QZ, Liu K, Huang Z, Liu HL, Tan YJ, Wang YY, Huang FQ, Ma GX, Alolga RN, Yan M, Chen C, Li JH, Li J, Liu HW, Zhang ZH. Gut Bacteroides ovatus ameliorates renal fibrosis by promoting the production of HDCA through upregulation of Clostridium scindens. Cell Rep. 2024 Oct 22;43(10):114830.
Yang C, Mogno I, Contijoch EJ, Borgerding JN, Aggarwala V, Li Z, Siu S, Grasset EK, Helmus DS, Dubinsky MC, Mehandru S, Cerutti A, Faith JJ. Fecal IgA Levels Are Determined by Strain-Level Differences in Bacteroides ovatus and Are Modifiable by Gut Microbiota Manipulation. Cell Host Microbe. 2020 Mar 11;27(3):467-475.e6.
Horvath TD, Ihekweazu FD, Haidacher SJ, Ruan W, Engevik KA, Fultz R, Hoch KM, Luna RA, Oezguen N, Spinler JK, Haag AM, Versalovic J, Engevik MA. Bacteroides ovatus colonization influences the abundance of intestinal short chain fatty acids and neurotransmitters. iScience. 2022 Mar 25;25(5):104158.
Hayase E, Hayase T, Mukherjee A, Stinson SC, Jamal MA, Ortega MR, Sanchez CA, Ahmed SS, Karmouch JL, Chang CC, Flores II, McDaniel LK, Brown AN, El-Himri RK, Chapa VA, Tan L, Tran BQ, Pham D, Halsey TM, Jin Y, Tsai WB, Prasad R, Glover IK, Ajami NJ, Wargo JA, Shelburne S, Okhuysen PC, Liu C, Fowler SW, Conner ME, Peterson CB, Rondon G, Molldrem JJ, Champlin RE, Shpall EJ, Lorenzi PL, Mehta RS, Martens EC, Alousi AM, Jenq RR. Bacteroides ovatus alleviates dysbiotic microbiota-induced intestinal graft-versus-host disease. Res Sq [Preprint]. 2023 Jan 31:rs.3.rs-2460097.
Ihekweazu FD, Engevik MA, Ruan W, Shi Z, Fultz R, Engevik KA, Chang-Graham AL, Freeborn J, Park ES, Venable S, Horvath TD, Haidacher SJ, Haag AM, Goodwin A, Schady DA, Hyser JM, Spinler JK, Liu Y, Versalovic J. Bacteroides ovatus Promotes IL-22 Production and Reduces Trinitrobenzene Sulfonic Acid-Driven Colonic Inflammation. Am J Pathol. 2021 Apr;191(4):704-719.
Zuo T, Zhang F, Lui GCY, Yeoh YK, Li AYL, Zhan H, Wan Y, Chung ACK, Cheung CP, Chen N, Lai CKC, Chen Z, Tso EYK, Fung KSC, Chan V, Ling L, Joynt G, Hui DSC, Chan FKL, Chan PKS, Ng SC. Alterations in Gut Microbiota of Patients With COVID-19 During Time of Hospitalization. Gastroenterology. 2020 Sep;159(3):944-955.e8.
Liu W, Wang J, Yang H, Li C, Lan W, Chen T, Tang Y. The Metabolite Indole-3-Acetic Acid of Bacteroides Ovatus Improves Atherosclerosis by Restoring the Polarisation Balance of M1/M2 Macrophages and Inhibiting Inflammation. Adv Sci (Weinh). 2025 Mar;12(11):e2413010.
Fu J, Shan J, Cui Y, Yan C, Wang Q, Han J, Cao G. Metabolic disorder and intestinal microflora dysbiosis in chronic inflammatory demyelinating polyradiculoneuropathy. Cell Biosci. 2023 Jan 11;13(1):6.
Chen M, Shu Y, Li Q, Kang Z, Liu T, Zhou H, Huang W, Zhang W. Bacteroides ovatus accelerates metformin-induced vitamin B12 deficiency in type 2 diabetes patients by accumulating cobalamin. NPJ Biofilms Microbiomes. 2023 Jul 24;9(1):51.
Tan H, Yu Z, Wang C, Zhang Q, Zhao J, Zhang H, Zhai Q, Chen W. Pilot Safety Evaluation of a Novel Strain of Bacteroides ovatus. Front Genet. 2018 Nov 6;9:539.
谷禾健康
胰腺癌是致命的癌症之一,其特点是:
难发现(发现多为晚期),病程短,发展恶化速度快,中位生存期为3-6个月,正所谓 “无声杀手”。
胰腺癌为什么难发现?这要从胰腺癌的位置说起。
胰腺位于人体后腹部深处,被胃、肝等层层围绕,且体积小,胰腺癌早期几乎没有不适。普通检查手段较难发现。
随着胰腺肿瘤的生长,出现的许多症状看起来与其他疾病的症状很像,比如:发冷和出汗、发热、腹胀、腹泻、恶心、疲劳、食欲不振、不明原因体重减轻、上背部或上腹部疼痛、手臂或腿部肿胀、黄疸迹象等。这就容易导致误诊。


胰腺癌的发病率近年来呈快速上升的趋势,死亡率排在首位,因此也被称为“癌中之王”。
胰腺癌的诊断难,治愈也难,应对胰腺癌治疗这样的难题,科学界在不断努力中。
胰腺癌独特的免疫抑制微环境是免疫治疗面临的最大障碍,而微生物群的改变也被认为是塑造肿瘤局部微环境并影响免疫治疗的重要因素。
科学家发现微生物群在调节代谢和免疫反应中起着关键作用。通过维持相对健康的微生物群类型,提高胰腺癌化疗药物和免疫治疗的有效性,为胰腺癌患者带来新的希望。
接下来,本文详细列举口腔、肠道和胰腺微生物群在胰腺癌发展中的作用的关键信息,讨论不同类型的微生物群,它们在调节药物代谢、耐药性、免疫反应和胰腺癌治疗潜力中的潜在作用,以及相关预防措施。
图源:知易社
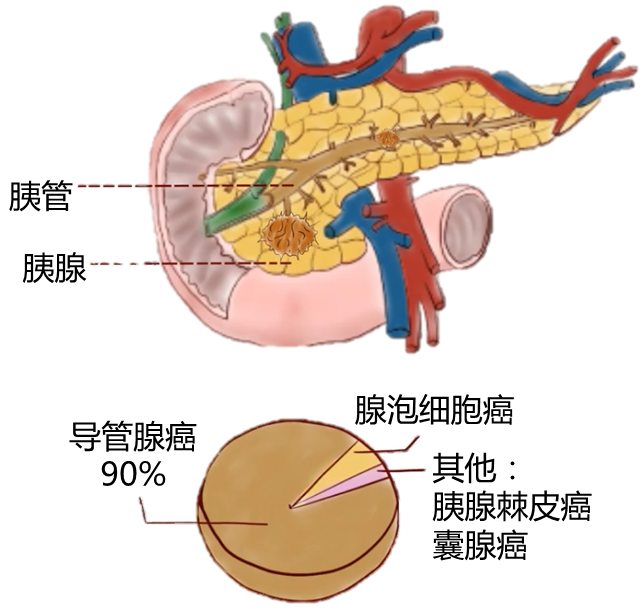
一般说的胰腺癌主要是指胰腺导管腺癌,简称PDAC,下同:
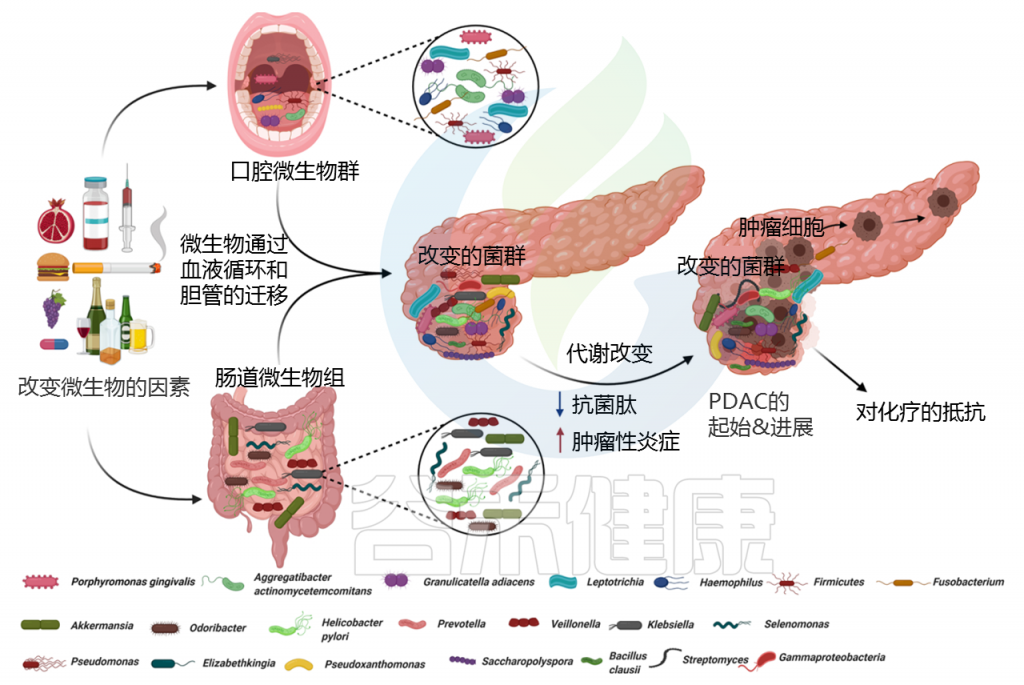
从临床和解剖学的角度来看,胰腺与肠道微生物群没有直接的物理联系,因此胰腺被认为是无菌组织。但微生物可以通过消化道中的胆管迁移到胰腺。

Pandya Gouri,et al., Semin Cancer Biol, 2021
许多研究表明,口腔、胃肠道、粪便和器官特异性(胰腺)微生物群的组成与PDAC高度相关。

PDAC的口腔、唾液、舌苔微生物群
口腔和唾液微生物群组成的改变与PDAC的风险相关。最近的研究表明,口腔中参与PDAC肿瘤发生的主要致病菌有:
牙龈卟啉单胞菌(Porphyromonas gingivalis)、梭杆菌(Fusobacterium)、缓症链球菌(Streptococcus mitis )、长奈瑟氏球菌(Neisseria elongata ).
牙龈卟啉单胞菌和Aggregatibacter actinomycetemcomitans 与胰腺癌高风险之间的相关性,表明口腔微生物群可能是导致PDAC肿瘤发生的危险因素。据推测,牙龈卟啉单胞菌可能分泌肽基精氨酸脱亚胺酶,通过引起KRAS和TP53基因突变来降解精氨酸代谢。
唾液微生物群
在胰腺癌患者的唾液样本中,与健康对照组相比,PDAC患者的长奈瑟氏球菌和缓症链球菌的水平明显降低,而Granulicatella adiacens的水平明显升高。
——作为预测胰腺癌的非侵入性生物标志物
在区分PDAC病患者和健康个体时,长奈瑟氏球菌和缓症链球菌的组合显示出96.4%的敏感性和82.1%的特异性。这项研究的结果表明,唾液微生物群可以作为预测胰腺癌的非侵入性生物标志物。
有研究对胰腺癌患者的唾液样本进行了微生物鉴定,发现纤毛菌Leptotrichia的丰度较高,而卟啉单胞菌和奈瑟氏球菌的比例相对较低。因此,唾液中纤毛菌Leptotrichia与卟啉单胞菌的显著高比率(L/P比率)可用作PDAC的预测标记。
口腔微生物组
PDAC和对照组在相关类群的平均相对比例上观察到差异。
PDAC患者 :高水平的厚壁菌门和相关类群,包括:乳杆菌科(Lactobacillales)、嗜热链球菌(Bacillli Streptococcus thermophilus)、链球菌科(Streptococcaceae)
对照组:具有相对较高水平的变形菌和相关分类群,包括:γ变形菌(Gammaproteobacteria)、巴氏杆菌科(Pasteurellaceae)、副流感嗜血杆菌(Haemophilus parainfluenzae);β变形菌(Betaproteobacteria),奈瑟氏球菌(Neisseria),黄奈瑟氏球菌(Neisseria flaviscen)
舌苔微生物群
胰头癌患者优势菌群如下:梭杆菌属Fusobacterium, 纤毛菌属Leptotrichia, 放线菌属Actinomyces, 罗氏杆菌属Rothia, 奇异菌属Atopobium, 棒状杆菌Corynebacterium, 莫拉氏菌属Moraxella, 消化链球菌属Peptostreptococcus, 产线菌属Filifactor, Oribacterium,坦纳菌属Tannerella
对照组优势菌群如下:嗜血杆菌Haemophilus, 卟啉单胞菌属Porphyromonas,Paraprevotella
在健康对照组和胰头癌患者中分别观察到嗜血杆菌、卟啉单胞菌和纤毛杆菌、梭杆菌的富集量有显著差异。
类似地,在胰头癌患者中观察到链球菌和罗氏菌属相对较高的富集,而在肝癌患者中SR1的相对丰度较高。因此,SR1和链球菌可用于区分肝癌和胰头癌。
*SR1:SR1 genera incertae sedis
对PDAC与微生物群的变化在多样性和组成方面的关联研究非常有限。需要在一个大队列中进一步的调查证实这些发现,从而得出确切的结论。

PDAC的胃肠道微生物群
——肠道微生物群可以直接影响胰腺微环境
给WT小鼠口服荧光标记的粪肠球菌Enterococcus faecalis,有趣的是,在这些小鼠的胰腺中观察到荧光,这表明细菌从肠道向胰腺迁移。
在另一项研究中,将抗生素混合物口服给药于PDAC、结肠癌和黑色素瘤的小鼠模型,观察到在所有受试模型中肠道微生物群的减少显著减弱了肿瘤的生长。
几个小组观察到,吸烟是胰腺癌的一个关键风险因素,可导致微生物群的显著变化,特别是在人类的肠道中。吸烟者肠道中厚壁菌门和放线菌门的减少,梭菌门、拟杆菌门、变形菌门的数量显著增加。
——胰腺癌患者和健康对照者粪便样本显著差异
微生物谱分析 (胰腺癌患者粪便样本,基于属水平的线性鉴别分析)
显著富集普雷沃菌属(Prevotella)、韦荣球菌属(Veillonella)、肠杆菌属(Enterobacter)、克雷伯氏菌属(Klebsiella)、哈氏菌属(Hallella)、月形单胞菌属(Selenomonas)、Cronobacter spp.
显著减少双歧杆菌属(Bifidobacterium)、芽孢杆菌属(Gemmiger)、梭状芽孢杆菌属(Clostridium IV)、Coprococcus、经黏液真杆菌属(Blautia)、Flavonifractor、丁酸球菌属(Butyricicoccus)、厌氧菌属(Anaerostipes)、Dorea spp.
这种粪便微生物群组成的显著差异表明,胰腺癌的胃肠道微生物是独一无二的。此外,本研究的数据表明,与脂多糖(LPS)生产、类异戊二烯和亮氨酸的生物合成相关的微生物有显著的富集/定殖,而已观察到产丁酸菌和益生菌的减少。
16S rRNA测序分析
分析PDAC患者和对照的粪便标本微生物群,观察到不同的优势菌:
PDAC患者:变形菌门(Proteobacteria),互养菌门(Synergistetes),广古菌门(Euryarchaeota),Akkermansia,韦荣氏菌科Veillonellaceae,Odoribacter
健康肠道:Clostridiacea,瘤胃球菌科,Ruminococcaceae,毛螺科Lachnospiraceae
除此之外,幽门螺杆菌感染和胰腺癌之间也呈正相关。在胃癌(69%)和胰腺癌(65%)患者的血液样本中,幽门螺杆菌感染率异常高。Meta分析和前瞻性队列研究表明,幽门螺杆菌感染的患者患胰腺癌的风险明显较高。然而,为了明确解决幽门螺杆菌在PDAC的影响,需要进行更多的人群和动物研究。
PDAC的胰腺微生物群
过去几十年科学家一直认为,在胰腺中存在蛋白酶,且胰腺环境是高碱性的,那么微生物无法生存。
胰腺中存在细菌,PDAC患者细菌更多
用16S rRNA基因特异性PCR对胰腺囊肿液体标本进行分析,发现优势菌:氨基酸球菌属Acidaminococcus, 埃希氏杆菌属Escherichia, 拟杆菌属Bacteroides, 志贺氏杆菌Shigella。这表明胰腺囊液可能是微生物群分析的良好来源。
最近,对PDAC样本进行的16S rRNA荧光探针和qPCR实验都证实,与正常人相比,PDAC患者的胰腺组织中存在细菌(约为正常人的1000倍)。
PDAC的标本中的主要菌
对人类PDAC肿瘤标本进行16S rRNA测序,发现了13个不同的门。
PDAC患者:变形菌门 (45 %);拟杆菌门(31 %);厚壁菌门 (22 %);放线菌门 (1%);假长双歧杆菌Bifidobacterium;
·pseudolongum【Kras(G12D)介导的胰腺癌小鼠模型】;假单胞菌属 Pseudomonas;Elizabethkingia;梭杆菌 Fusobacterium
对照组:乳酸菌 Lactobacillus
梭杆菌——预后生物标志物
PDAC肿瘤内梭杆菌Fusobacterium的定殖与PDAC患者的预后更差相关。这项研究的结果表明,梭杆菌属可以作为PDAC的预后生物标志物。
耐药患者的组织标本中 γ -变形菌定植
从耐受”吉西他滨”的PDAC中获得的组织标本中,γ-变形菌门Gammaproteobacteria定植,表明γ -变形菌可能干扰吉西他滨的代谢,并产生耐药性。
男女患者菌群差异
男性和女性患者之间微生物群组成的差异,各自的主导菌群如下:
男性患者:A. ebreus,Acinetobacter baumannii
女性患者:Geobacillus kaustophilus HTA426 ,Escherichia coli 55989
吸烟与非吸烟差距
此外,吸烟PDAC患者与非吸烟PDAC患者的对比,鲍曼不动杆菌A. baumannii 和M. hyopneumoniae高度富集,且与不良临床结果相关。这些微生物显示出富集的致癌信号和抑制肿瘤和免疫信号。
胰腺癌转移相关菌群
胰腺组织中微生物群的丰度与患者的转移和总生存率相关。M. hyopneumoniae、Sitophilus zeamais、宋内志贺菌Shigella sonnei、肠道沙门氏菌Salmonella enteric的高丰度与转移呈正相关。
更具体地说,Acidovorax ebreus与PDAC患者的转移和高肿瘤分级相关。
长期、短期生存的菌群不同
对长期和短期生存的PDAC患者的肿瘤标本进行了16S rRNA测序,肿瘤内微生物群:
PDAC长期生存者:多样性高;以下菌丰富:Pseudoxanthomonas, Saccharopolyspora, Bacillus clausii, Streptomyces
PDAC短期生存者:拟杆菌,梭状芽孢杆菌
上述数据表明,确定微生物群进入胰腺的机制以及这些微生物与胰腺癌的进展和转移之间的关系还有很大的研究空间。
宿主和微生物群形成共生关系。宿主可以通过其遗传、饮食摄入和生活方式影响微生物群的组成和生物量,而微生物群可以通过分泌微生物代谢物、代谢营养物、合成维生素和消化酶来影响宿主。
细菌成分及其代谢物可以渗透到宿主的体循环中,并被运输到发挥激素样作用的部位。这些生物活性代谢物调节宿主中的信号转导,以调节基因表达调节中涉及的各种途径。
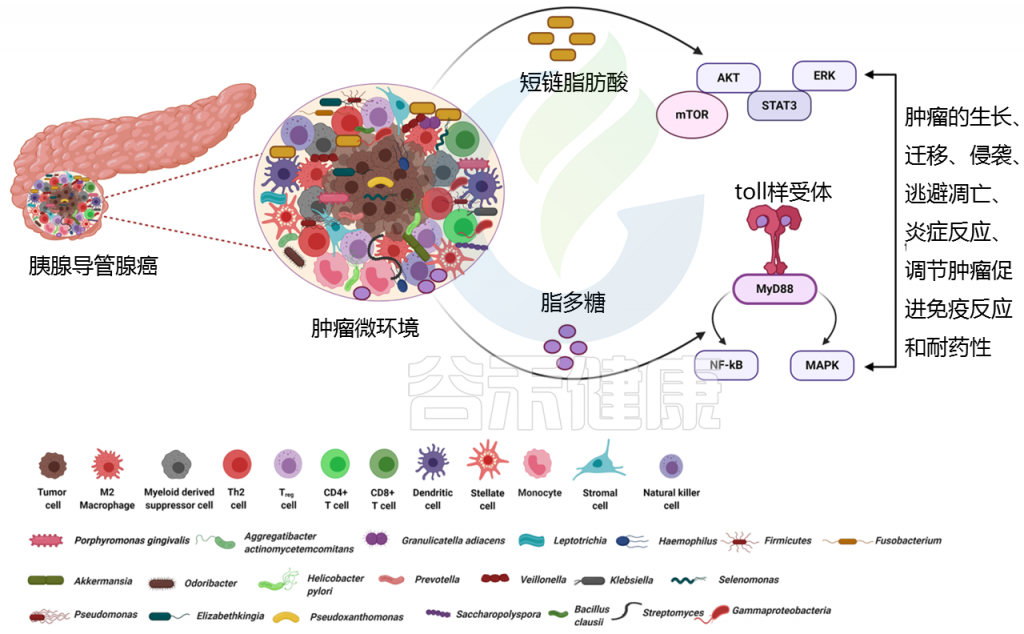
代谢物对肿瘤的发生有促进和抑制作用
丁酸盐、乙酸盐和丙酸盐是主要的短链脂肪酸(SCFAs),由结肠中的粪肠球菌、双歧杆菌和梭状芽孢杆菌 等细菌产生,可发挥抗癌作用。
短链脂肪酸通过与游离脂肪酸受体(FFAR2/FFAR3)结合发挥作用,游离脂肪酸受体通常在癌细胞、基质细胞和肠细胞上表达,刺激G蛋白偶联受体,通过激活致癌途径(包括PDAC的AKT、ERK、mTOR和STAT3)促进肿瘤生长和转移。
对微生物代谢物在PDAC和胰腺中刺激FFAR2/3的作用的理解需要进一步详细研究。
改变的微生物群在PDAC免疫反应调节中的作用

Pandya Gouri,et al., Semin Cancer Biol, 2021
体外研究表明,丁酸盐可以减少PDAC细胞的增殖,同时诱导它们向分泌表型分化。
此外,透明质酸与丁酸盐的共轭物显示出在PDAC细胞中诱导细胞抑制作用。据报道,丙戊酸(一种合成SCFA)结合5-FU对PDAC细胞有抑制细胞生长的作用。
PDAC患者多胺代谢失调
在PDAC患者中,益生菌和产丁酸的细菌被大量抑制。细菌可以合成多种多胺,如腐胺、精胺、亚精胺和尸胺。据报道,在PDAC患者中,多胺代谢严重失调。在小鼠模型和患者血清样本中,多胺均上调,并随着肿瘤的进展而进一步增多。
微生物代谢物可作为非侵入性生物标志物
罗伊乳酸杆菌Lactobacillus reuteri 在4个月大的KPC(K-rasLSL.G12D; p53R172 H/+; Pdx1-Cre)小鼠肿瘤标本(K-rasLSL)中定殖。罗伊乳酸杆菌参与多胺代谢。与2个月大的KPC鼠血清标本相比,4个月大的KPC鼠血清标本中多胺的浓度显著高。这些结果表明,微生物代谢物可被开发并用作潜在的非侵入性生物标志物,用于PDAC病的诊断,尤其是在肿瘤变得可见和明显之前的早期阶段。
脂多糖是与炎症、代谢性疾病和胰腺癌相关的关键因素
在PDAC患者中,脂多糖存在于高度富集的革兰氏阴性菌的细胞壁上。
脂多糖与线粒体的代谢重编程有关,从而有助于糖酵解、活性氧和炎症导致肿瘤发生。
脂多糖如何导致免疫抑制?
脂多糖可以有效地与免疫细胞上的toll样受体相互作用,并募集MyD88/TRIF分子来刺激NF-κB和MAPK信号产生炎性细胞因子,从而导致免疫抑制。
代谢产物——脱氧胆酸(DCA)
一些肠道相关细菌代谢原始胆汁并形成脱氧胆酸(DCA)。DCA通过与TGR5 (G蛋白偶联的细胞表面BA受体)结合发挥作用,TGR5反过来刺激PDAC细胞中的EGFR、MAPK和STAT3信号,并进一步导致细胞周期的进展。
代谢产物——熊去氧胆酸
与此相反,熊去氧胆酸通过抑制PDAC细胞系上皮细胞向间充质细胞的转化而显示出抗癌作用。
γ -变形菌科合成酶将化疗药代谢成不活跃形式
肿瘤内细菌属γ -变形菌科,能够合成胞苷脱氨酶(CDD),该酶能有效地将化疗药物吉西他滨代谢成2′,2′-difluorodeoxyuridine(不活跃的形式)。
说到化疗药物,为什么同样的药物治疗,有些人有效,有些人无效?这与微生物会有什么样的联系?
我们将在接下来的章节详细阐述。
肠道微生物群在改变癌症治疗中药物治疗的疗效方面发挥着既定的关键作用。当然,化疗药物也会使肠道微生物群失调。
二十多年来,吉西他滨单独和/或与化疗剂/药物联合用于治疗PDAC病患者。
引起化疗耐药性——猪支原体
人皮肤成纤维细胞中猪支原体(Mycoplasma hyorhinis)的存在,在体外和小鼠模型中导致了对吉西他滨的抗性,其中它被代谢为其非活性和脱氨代谢物,名为2’,2’-二氟脱氧尿苷。
引起化疗耐药性——γ – 变形菌
除此之外,γ – 变形菌能够通过表达胞苷脱氨酶(CDD)的长形式灭活吉西他滨。分析113个PDAC患者组织样本时,86个样本(76%)显示了γ – 变形菌的存在。
在结肠癌小鼠模型中,γ – 变形菌诱导的吉西他滨耐药可通过联合应用环丙沙星抗生素逆转。表明这种耐药是可逆的。
引起化疗耐药性——大肠杆菌
大肠杆菌可导致几种药物如克拉屈滨、吉西他滨、CB1954、氟达拉滨的原始化学结构发生改变。
在体外和体内小鼠模型中,非致病性大肠杆菌菌株引起了对吉西他滨治疗的化学抗性。
改变微生物群——更好的抗癌效果
最近,FOLFRNOX已被用于针对PDAC患者的多中心试验。结果报告了比吉西他滨更好的长期生存率。在这些试验中,患者腹泻和恶心的发生率很高。表明药物可以改变微生物群以产生更好的抗癌效果。
其他代谢疾病与胰腺癌的相关性
另一方面,肥胖、2型糖尿病和胰腺癌病例增加之间有很强的联系。
在KC小鼠中,高脂肪热量饮食(HFCD)显示完整腺泡的丧失和胰腺上皮内瘤形成的发展。此外,在小鼠模型中,高脂肪热量饮食显示出明显的微生物群组成变化,特别是梭状芽胞杆菌。
二甲双胍对这些小鼠的治疗与KC小鼠中PDAC的抑制相关,Akkermansia的定植显著增加,梭状芽胞杆菌的丰度显著减少。二甲双胍通过降低循环中脂多糖的水平来促使HFCD-KC小鼠模型的肠道菌群失调。这可以进一步抑制胰腺中M1巨噬细胞的脂多糖依赖性极化,从而抑制上皮内瘤的形成。
药物联合益生菌抗癌
吉西他滨与益生菌联合给药后,随着波形蛋白和Ki-67表达的抑制,上皮内瘤PanIN的形成明显减少。
鼠伤寒沙门氏菌与吉西他滨和贝伐单抗的组合在PDAC异种移植模型中产生了协同抗肿瘤作用。
肠道微生物群在调节化疗反应、将药物代谢成非活性形式,甚至对某些药物产生化学抗性方面起着不可避免的作用,越来越多的临床研究证明了微生物群对化疗的影响。这为癌症患者的治疗目的操控肠道菌群提供了基础。
免疫系统和微生物群之间的健康互动对于健康的生活方式和身体稳态至关重要。微生物群的失调会导致全身炎症和细菌代谢物介导的免疫反应,这可能进一步促进免疫调节,从而促使癌症发生和发展。
在胰腺癌的发展过程中,已经观察到胰腺组织内的微生物群和免疫细胞之间存在复杂的关系。癌症免疫可以通过微生物群的存在来改变。
菌群与胰腺癌发生的关系
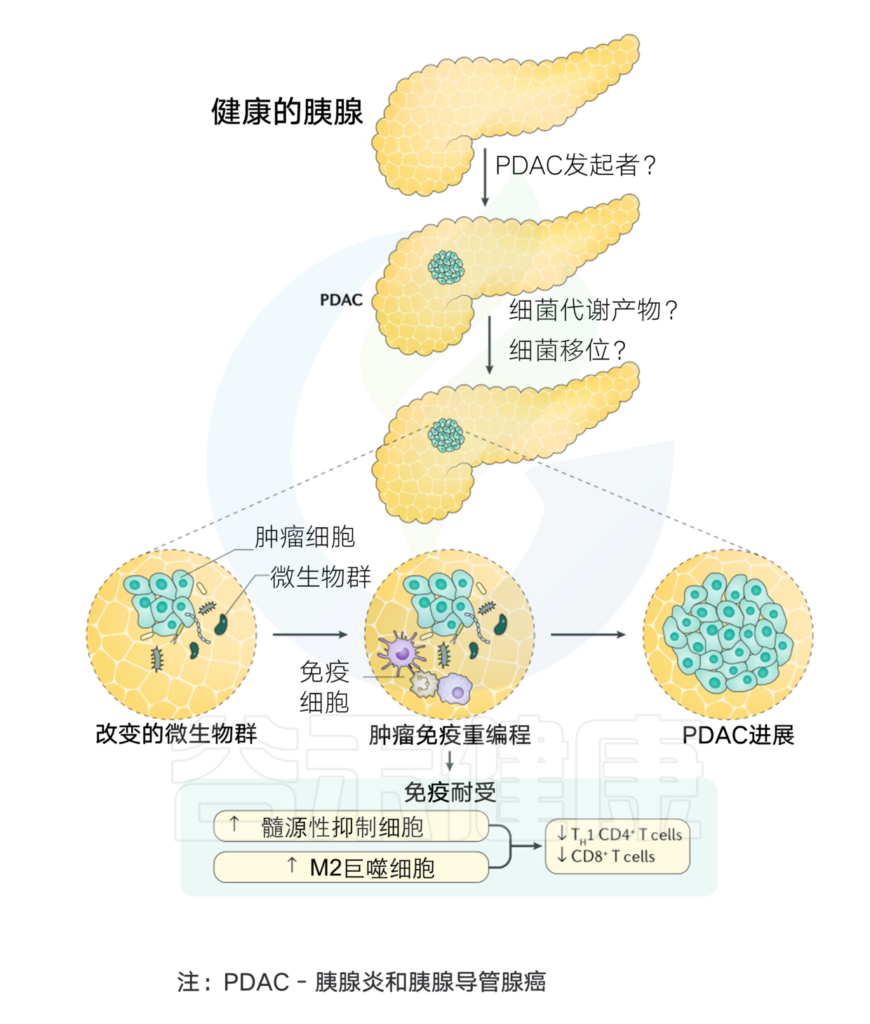
Thomas R M, et al.,Nature Reviews Gastroenterology & Hepatology, 2019
详见: 微生物,或许是下一个癌中之王(胰腺癌)诊断和干预治疗的新出路
微生物群对免疫系统的影响
当粘膜内层受到任何损伤时,微生物往往会进入肠道固有层,然后迁移到远处的淋巴器官,激活宿主免疫系统。PDAC肿瘤微环境基本上与免疫细胞交织在一起,其中免疫细胞与某些炎症因子一起负责促进肿瘤发生、免疫细胞浸润和疾病进展。
微生物衍生产物或代谢物,如脂蛋白、脂多糖、脂肽、单链或双链DNA,甚至CpG DNA可以有效地结合PPRs以激活TLRs,TLRs通过抑制胰腺癌的免疫反应在炎症和肿瘤发生过程中起关键作用。这与NF-κB和MAPK信号通路的激活有关,导致产生促进肿瘤的细胞因子和其他促炎分子,从而导致癌症的发展。
假长双歧杆菌促进肿瘤发生(TLRs)
假长双歧杆菌Bifidobacterium pseudolongum在肠道和肿瘤区域高度占优势,通过TLR介导的信号传导促进侵袭性肿瘤发生,TLR4和TLR7在PDAC的肿瘤微环境中特别强有力地表达。有研究显示,刺激TLRs会导致胰腺炎,并与K-ras协同促进胰腺癌在动物模型中的发展。
TLR7在人和鼠胰腺癌标本中有强有力的表达,并显示出刺激MAPK、NF-κB、STAT3和Notch信号以增强致癌作用。TLR7阻断可以通过阻止以上通路刺激,从而抑制胰腺癌。
肠道微生物群影响抗癌免疫治疗反应
肠道微生物群(脆弱双歧杆菌、双歧杆菌)的组成通过阻断CTLA-4和PD-1影响抗癌免疫治疗反应。
PDAC肿瘤微环境的产生在小鼠模型中具有免疫抑制作用,这归因于特定的肠道和胰腺内微生物。这也证明了随着免疫治疗抗性的增强,癌症进展的增强。
此外,微小核糖核酸与PDAC患者的生长、血管生成、化疗耐药性和转移增加有关。已知某些微生物如幽门螺杆菌和鼠伤寒沙门氏菌也能调节上述微小核糖核酸的表达,而这些微小核糖核酸又能调节宿主的免疫反应。
这表明肠道微生物群控制宿主免疫反应,从而提高免疫疗法的有效性,并在与PDAC相关的癌症领域具有巨大的意义。
微生物具有巨大的潜力,可用于设计不同的治疗方法,以对抗疾病的发展和进展。更具体地说,新出现的证据表明,微生物可能导致人类对恶性肿瘤的易感性,也可能影响对治疗的反应,还可能影响治疗相关的毒性。
用有益菌如拟杆菌和伯克霍尔德氏菌Burkholderiales恢复肠道提高了CTLA-4封闭的治疗效果。
双歧杆菌的存在增强了PDL-1阻断的抗癌潜力。
因此,微生物群的保护和恢复对改善治疗效果至关重要。
粪便微生物群移植(FMT)是一种直接有效的方法。肿瘤小鼠接受了来自短期生存期PDAC患者、长期生存期无疾病证据(LTS-NED)和健康对照组的粪便微生物群,发现肿瘤生长明显减少。这表明,在PDAC鼠模型中,来自长期存活者的FMT比来自短期存活者或没有PDAC的那些接受FMT的人对肿瘤有更好的保护作用。
此外,FMT在应对化疗的副作用方面显示出潜力,化疗会导致其他恶性肿瘤如转移性肾细胞癌的腹泻。这表明,用益生菌恢复肠道是一种可行的方法,可以与其他治疗方案一起使用,并且在治疗癌症方面可能非常有效。
目前这些研究探索了微生物群的多样性和组成,以及患者的菌群失调,与健康人的差异等,尽管还需要做深入研究,但这个方向的探索对于癌症治疗无疑是很有希望的。
虽然说没有完全避免胰腺癌的特定方法,但以下方法可以降低风险:
■ 戒烟
可避免的最重要的风险因素,戒烟有助于降低患胰腺癌风险
■ 维持正常体重
如果你现在正处于超重或肥胖阶段,减肥有助于降低胰腺癌风险;适当进行锻炼
■ 健康饮食
加工过的红肉和含糖饮料也可能增加患胰腺癌的风险。美国癌症协会建议遵循包括大量水果、蔬菜和全谷物在内的健康饮食模式,并限制或避免红肉和加工肉类、含糖饮料和高度加工食品
■ 不酗酒
大量饮酒与胰腺癌有关,也可能患上慢性胰腺炎,后期有发展成为胰腺癌的风险
■ 避免使用工作场所化学品
工作场所中的某些化学品会增加患胰腺癌和其他癌症的风险
■ 进行肠道菌群检测
维持一个相对健康的肠道菌群,监测健康状态,降低胰腺癌的风险
微生物组是一个新兴的前沿领域,它为胰腺癌的诊断、预后和转移的新生物标志物等提供了新的方向。
微生物治疗的个性化在于每个个体微生物群具有独特性,微生物群又与日常饮食,生活习惯,慢性病等息息相关,通过这些方式的改变使菌群维持或恢复到相对健康的状态,这对于胰腺癌及其他癌症的预防、治疗具有重大意义。
主要参考文献:
G.A. Vitiello, D.J. Cohen, G. Miller, Harnessing the microbiome for pancreatic cancer immunotherapy, Trends Cancer 5 (11) (2019) 670–676.
R. Mendez, K. Kesh, N. Arora, L. Di Martino, F. McAllister, N. Merchant, S. Banerjee, S. Banerjee, Microbial dysbiosis and polyamine metabolism as predictive markers for early detection of pancreatic cancer, Carcinogenesis 41 (5) (2020) 561–570.
R.M. Thomas, R.Z. Gharaibeh, J. Gauthier, M. Beveridge, J.L. Pope, M.V. Guijarro, Q. Yu, Z. He, C. Ohland, R. Newsome, J. Trevino, S.J. Hughes, M. Reinhard, K. Winglee, A.A. Fodor, M. Zajac-Kaye, C. Jobin, Intestinal microbiota enhances pancreatic carcinogenesis in preclinical models, Carcinogenesis 39 (8) (2018) 1068–1078.
Pandya Gouri,Kirtonia Anuradha,Singh Aishwarya et al. A comprehensive review of the multifaceted role of the microbiota in human pancreatic carcinoma.[J] .Semin Cancer Biol, 2021
B. Gupta, D. Sadaria, V.U. Warrier, A. Kirtonia, R. Kant, A. Awasthi, P. Baligar, J.K. Pal, E. Yuba, G.Sethi, M. Garg, R.K. Gupta, Plant lectins and their usage in preparing targeted nanovaccines for cancer immunotherapy, Semin. Cancer Biol.(2020).
J. Chakladar, S.Z. Kuo, G. Castaneda, W.T. Li, A. Gnanasekar, M.A. Yu, E.Y. Chang, X.Q. Wang, W.M. Ongkeko, The pancreatic microbiome is associated with carcinogenesis and worse prognosis in males and smokers, Cancers 12 (9) (2020).
J.S. Chang, C.R. Tsai, L.T. Chen, Y.S. Shan, Investigating the association between periodontal disease and risk of pancreatic Cancer, Pancreas 45 (1) (2016) 134–141.
H. Tilg, T.E. Adolph, Beyond digestion: the pancreas shapes intestinal microbiota and immunity, Cell Metab. 25 (3) (2017) 495–496.
Can Pancreatic Cancer Be Prevented? American Cancer Society. May 31, 2016.