-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

通过膳食来改善健康的观点已逐渐深入人心,目前越来越多的食品,尤其功能性食品,特膳甚至药膳等成分表中常出现低聚果糖(果寡糖)、低聚半乳糖等成分。
低聚糖又名寡糖,通常被视为介于单糖(如葡萄糖、果糖)和多糖(如淀粉、纤维素)之间的物质。简单来说,单糖是最基本的糖单位,就像盖房子的小砖块,而低聚糖就是由几个这样的小砖块连接起来的 “小建筑”,但又没有淀粉、纤维素这种“高楼大厦”那么大。
低聚糖是一种新型功能性糖源,集营养、保健、食疗于一体,甜度和热量都低于传统糖类。
除了具备“糖”的作用外,低聚糖最大的特点是其益生元功能。低聚糖可以作为肠道有益菌的“食物”,促进双歧杆菌等有益菌的生长,调节肠道菌群平衡,改善肠道功能。并且不同低聚糖可特异性促进某些有益菌增殖,你可以理解为不同的益生菌擅于利用不同的低聚糖。
低聚糖除了作为益生元促进肠道有益菌增殖外,对人体还有多种益处。一些低聚糖具有直接的抗菌作用,部分低聚糖可以与免疫细胞相互作用,调节免疫功能。母乳喂养的婴儿具有较强的免疫力,这其中“母乳低聚糖”发挥了不可或缺的作用。
低聚糖还可以通过靶向肠道微生物群和微生物代谢物来增强肠道屏障,改善肠道功能;调节血糖水平,影响胰岛素敏感性;调节脂肪代谢,降低血脂;影响神经递质的产生;调节炎症反应等。这些能力在改善便秘、治疗或减轻肥胖、糖尿病、炎症性肠病、抑郁症等疾病中发挥了重要作用。还有研究发现,低聚糖对于减轻COVID-19(新型冠状病毒)的长期后遗症具有一定效果。
尽管目前的证据大多表明低聚糖对肠道菌群和人体健康有益,但是不同人群的菌群构成不同,身体健康状况存在差异,如何更好的选择合适的,单独的低聚糖产品或与低聚糖组合的产品需要更多的数据和了解。
本文今天将详解介绍什么是低聚糖,常见的低聚糖种类,来源和差异,在此基础上我们通过检索的研究资料总结汇总不同低聚糖对肠道菌群以及人体健康的影响差异,阐述它们如何通过调节肠道微生物和相关代谢物影响宿主的免疫系统、炎症水平和能量代谢,从而影响糖尿病、肥胖、抑郁、炎症性肠病及便秘等慢性疾病的发生发展。这可能是通过饮食干预促进人类健康和对抗慢病的新策略。
什么是低聚糖?
在谷禾营养素那篇文章(什么是营养,什么是营养素,什么是宏量和微量营养素?)简单地提到过低聚糖,低聚糖是一类由2到10个单糖分子通过糖苷键连接而成的碳水化合物。
自然界中典型低聚糖的结构
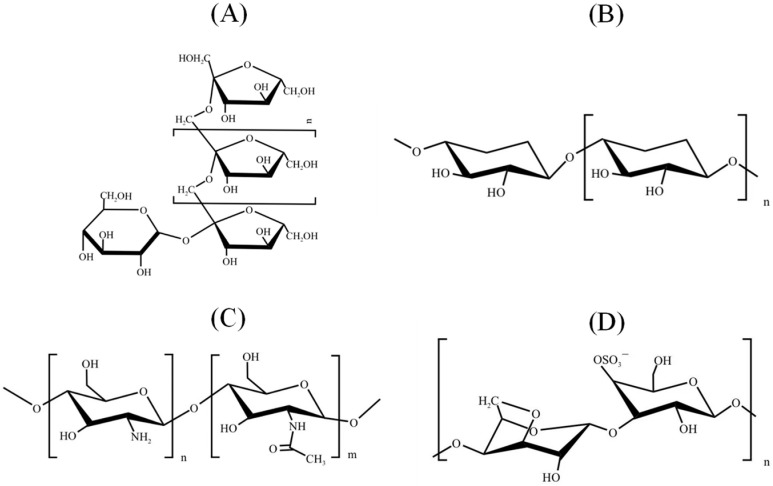
Cheong KL,et al.Pharmaceuticals (Basel).2023
(A):典型的低聚糖结构,多个单糖单位通过糖苷键连接在一起,如麦芽低聚糖或纤维低聚糖。
(B):线性低聚糖结构,单糖单位通过1,4-糖苷键连接,是纤维素或类似的低聚糖。
(C):含有氨基修饰的低聚糖,可能是壳寡糖或类似的氨基低聚糖。
(D):这是一个含有硫酸基团(-OSO₃⁻)的低聚糖,是硫酸化低聚糖(如硫酸软骨素或硫酸化海藻糖)。
低聚糖广泛存在于自然界,尤其是在植物中,如洋葱、大蒜、香蕉、燕麦和大豆等食物中,具有多种生物学功能和健康益处。
低聚糖(寡糖)主要根据单糖组成和结构进行分类,常见种类:
低聚果糖(FOS),组成:果糖+葡萄糖,主要来源有菊苣、洋葱、香蕉,可以促进双歧杆菌增殖。
低聚半乳糖(GOS),组成:半乳糖+葡萄糖,主要来源母乳、乳制品等,被报道可以增强钙吸收。
低聚异麦芽糖(IMO),组成:葡萄糖(α-1,6糖苷键),主要来源发酵食品、麦麸、蜂蜜,常用于烘焙。
低聚木糖(XOS),组成:木糖,来源有玉米芯、甘蔗渣等。
除此之外,还有其他一些分类方式
•按单糖组成分类
同质低聚糖:由相同的单糖分子聚合而成。比如麦芽低聚糖,它是由多个葡萄糖分子以α-1,4糖苷键连接而成。
异质低聚糖:由不同种类的单糖分子聚合而成。例如低聚乳糖,由半乳糖和葡萄糖以β-1,4糖苷键连接而成。
•按来源分类
天然低聚糖:天然存在于各种动植物中的低聚糖。
人工合成低聚糖:通过化学合成或生物技术手段制备得到的低聚糖。
目前市场上的低聚糖主要是提取来自食物或药材,主流原料来源:
•豆科植物:大豆低聚糖占全球产量35%;
•菊科植物:菊苣根提取低聚果糖(FOS);
•乳制品:乳清加工获取低聚半乳糖(GOS);
•中药材:黄芪、党参等含黄芪低聚糖。
提取技术对低聚糖的纯度影响比较大,水提醇沉法到固定化酶解再到色谱分离,已经可以达到食品级纯度了。
此外,低聚糖也可以通过生物合成路径合成,主要是三大生产路线:
1.酶法合成(主流工艺)
果糖基转移酶生产FOS,转化率达75%
β-半乳糖苷酶制备GOS
2.微生物发酵
芽孢杆菌发酵玉米淀粉产低聚异麦芽糖(IMO)
酵母工程菌产低聚木糖(XOS)
3.化学合成
酸水解法制备低聚壳聚糖(COS)
★ 不同低聚糖与益生菌和食药组合的健康改善效果不同
不同常见低聚糖的主要靶向菌群和产物
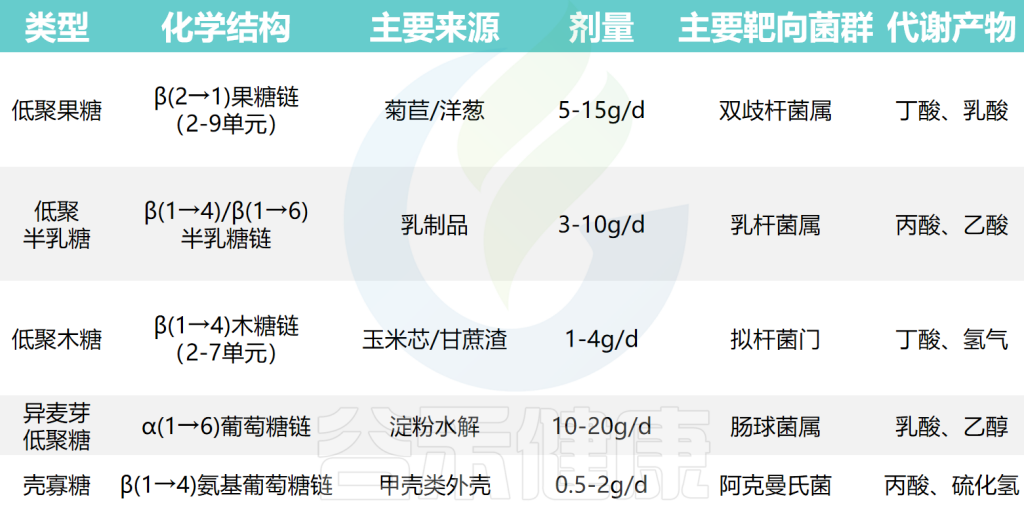
低聚糖与药食成分组合的效果

不同低聚糖与菌群互作的功效
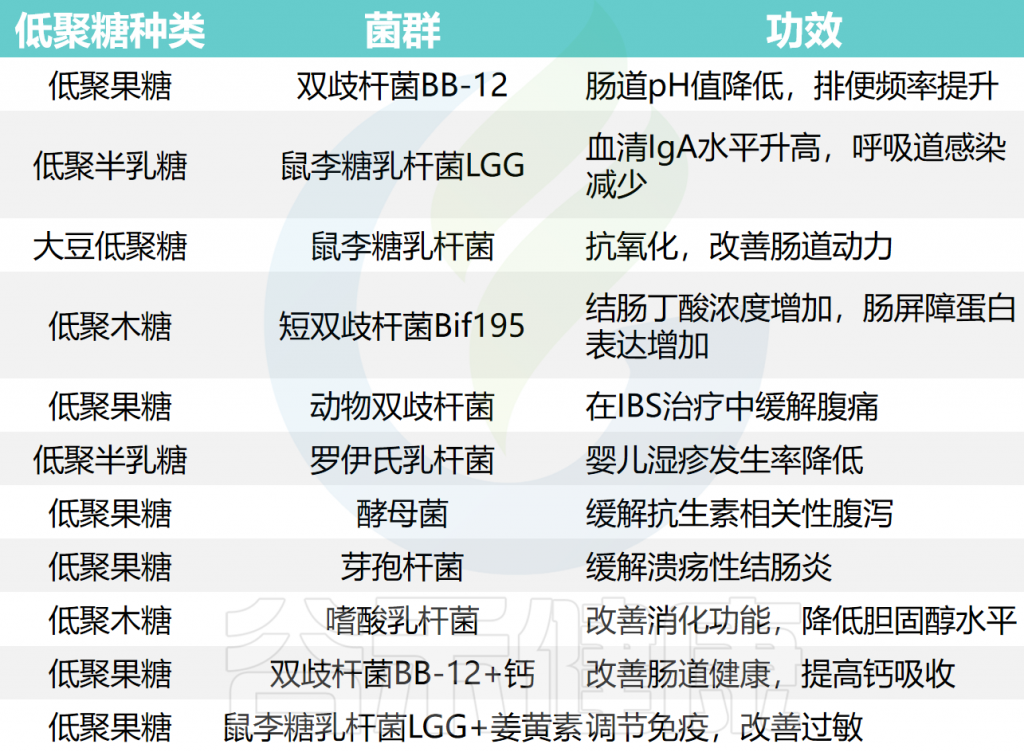
注意:以上部分支持性证据不是很足,尤其有些未完成人类的临床试验,若使用需根据自身情况咨询医疗建议后选择。
① 促进有益菌生长
低聚糖是肠道中特定有益细菌(如双歧杆菌和乳酸杆菌)的 “食物”,可被其选择性利用发酵。这些细菌通过糖苷酶分解和发酵低聚糖,使其茁壮成长并主导肠道微生物群落,在肠道内形成优势菌群,有助于抑制有害菌的生长,改善肠道微生态环境。
② 增强肠道屏障,改善肠道功能
肠道有益菌的增加能够促进肠道蠕动,帮助消化和吸收食物中的营养成分。同时,低聚糖在肠道内发酵产生短链脂肪酸,如丁酸、丙酸等,这些短链脂肪酸可以为肠道细胞提供能量,促进肠道细胞的生长和修复。
通过与G蛋白偶联受体(GPCR)结合,增强肠道屏障功能,有助于维持正常生理功能,预防便秘和腹泻等肠道问题。
③ 具有抗菌、抗病毒活性
低聚糖中的一些种类,如母乳低聚糖(HMO)可抑制病原体生长。研究发现,多种HMO显著抑制B组链球菌(GBS)三种菌株的生长,表明其具有抗菌活性。这一结论通过比较有无HMO条件下的细菌生物量得出,并在不同生长条件下显示出显著抑制作用。
HMO还能通过显著降低多种抗生素(如庆大霉素、红霉素等)对GBS的最低抑菌浓度,增强抗生素对耐药菌的有效性。此外,HMO可提高甲氧苄啶的效力,使其对GBS的MIC显著降低。
在病毒感染方面,体外研究表明HMO(如2’FL、LNnT等)具有预防流感和呼吸道合胞病毒(RSV)感染的能力。6′SL和LNnT预处理24小时可减少呼吸道上皮细胞中的流感复制,而2′FL预处理在两种细胞系中均显示出对RSV的保护作用,3′SL仅在一种细胞系中有效。
④ 调节血糖水平,影响胰岛素敏感性
低聚糖的化学结构和物理性质使其在胃肠道内不易被消化酶完全水解,吸收速度较慢。摄入含低聚糖的食物后,碳水化合物的消化吸收过程被延缓,避免血糖短时间内急剧升高,使血糖上升曲线更平缓。这对糖尿病患者控制血糖水平至关重要,有助于稳定血糖,减少波动带来的并发症风险。
一些研究表明,低聚糖的摄入可能通过调节肠道菌群等机制,改善机体的胰岛素敏感性。胰岛素敏感性的提高意味着身体细胞能够更有效地利用胰岛素,将血液中的葡萄糖转运到细胞内进行代谢,从而降低血糖水平,减轻胰岛素抵抗,对预防和管理糖尿病具有积极作用。
⑤ 与免疫细胞相互作用,调节免疫功能
低聚糖被认为在调节免疫反应中发挥作用,已知与低聚糖相互作用的免疫细胞包括源自先天和适应性免疫系统的巨噬细胞、树突状细胞、B细胞、T细胞和自然杀伤细胞等。
低聚糖增强巨噬细胞的吞噬活性,提高其吞噬和消除病原体的能力;影响树突状细胞(DC)的成熟状态;还可以影响NK细胞的活化状态和表型;并影响B细胞产生抗体。
母乳低聚糖与肠道免疫轴相互作用
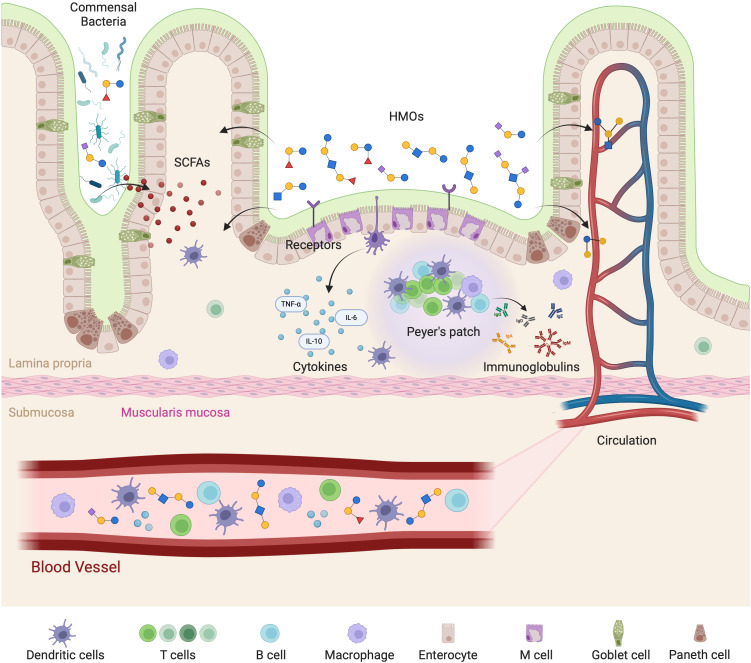
Slater AS,et al.Front Immunol.2025
⑥ 影响炎症反应,可能有助于治疗IBD
低聚糖具有调节免疫系统和减少炎症的能力,可能通过平衡Th1和Th2反应来实现。HMO增加了CD25+/CD4+T细胞的数量,这是T细胞的调节亚群,表明HMO有助于建立Th1/Th2平衡。
低聚糖还可以调节T细胞产生细胞因子,从而影响促炎和抗炎免疫反应之间的平衡。研究表明,某些低聚糖能够增强IL-10等抗炎细胞因子的产生,同时减少T细胞产生IFN-γ和IL-17等促炎细胞因子。
低聚糖被视为炎症性肠病(IBD)的潜在治疗剂。临床前研究表明,唾液酸化HMO(如3′-SL和6′-SL)具有抗炎特性,有助于维持肠道屏障完整性。
正在进行的临床试验评估HMO补充剂在缓解IBD症状和减少炎症方面的疗效,部分已显示症状改善。动物模型中,HMO在减轻炎症和改善肠道屏障功能方面表现出潜力,但仍需临床试验进一步验证其在人类IBD治疗中的效果。
⑦ 调节脂肪代谢,降低血脂
低聚糖在肠道内可与胆汁酸结合,阻止其重吸收,促使肝脏利用血液中的胆固醇合成新的胆汁酸,从而降低血液中的胆固醇含量。同时,低聚糖还调节肠道菌群,影响胆固醇的代谢,减少胆固醇吸收,有助于降低血脂水平,特别是降低低密度脂蛋白胆固醇(LDL-C,即“坏胆固醇”),从而降低心血管疾病的风险。
低聚糖通过调节肠道菌群及其代谢产物,可能影响脂肪代谢相关基因的表达和信号通路,减少脂肪合成,促进脂肪分解和代谢,有助于控制体重,预防肥胖及其相关的心血管疾病和代谢紊乱。
⑧ 预防龋齿
低聚糖在口腔环境中不易被细菌利用产酸。与传统糖类不同,低聚糖不会为致龋菌(如变形链球菌)提供能量,从而减少了口腔细菌产生酸性物质对牙齿的腐蚀。这有助于维持口腔微生物群落的平衡,降低龋齿发生风险,保护牙齿健康。
⑨ 可能具有抗肿瘤活性

还有研究分析了低聚糖的抗肿瘤活性。低聚糖通过重塑肠道菌群、促进短链脂肪酸生成、激活免疫应答及直接调控肿瘤细胞代谢,形成多层次抗肿瘤网络。
例如短链脂肪酸通过AMPK/mTOR通路调控能量代谢,抑制肿瘤细胞增殖。丁酸通过组蛋白修饰抑制癌基因(如c-Myc)表达,同时激活抑癌基因(如p21、p53)。
•化学结构与聚合度:传统糖类中的单糖,如葡萄糖和果糖,是最简单的糖结构,无法进一步水解为更小的糖单位。双糖如蔗糖由一分子葡萄糖和一分子果糖组成,麦芽糖则由两分子葡萄糖构成。低聚糖由2到10个单糖聚合而成,聚合度高于单糖和双糖,但低于多糖(多糖由超过10个单糖聚合而成,如淀粉和纤维素)。
•甜度:一般来说,传统糖类甜度较高,例如蔗糖甜度较高,是常见的甜味剂。而低聚糖的甜度普遍低于传统糖类,有的低聚糖甜度仅为蔗糖的30%-60%左右。
•消化吸收特点:单糖可以直接被人体吸收,为身体提供能量。双糖在消化酶的作用下水解为单糖后被吸收。低聚糖在胃肠道内部分可被消化吸收,但速度较慢;另一部分则无法被消化酶完全水解,进入大肠供肠道有益菌利用。
•血糖反应:传统糖类摄入后迅速被吸收,导致血糖快速上升并产生较大波动。相比之下,低聚糖的消化吸收较慢,对血糖的影响更为平缓,不会引起急剧升高,更适合需要控制血糖的人群。
•生理功能:传统糖类主要为人体提供能量。低聚糖除了提供一定能量外,还具有特殊的生理功能,如作为肠道有益菌的“食物”,促进双歧杆菌等有益菌的生长,调节肠道菌群平衡,改善肠道功能,并具有调节血脂和增强免疫力等潜在健康益处。
•化学成分与来源:代糖是一类甜味剂,包括天然代糖(如甜菊糖苷、罗汉果甜苷等,提取自植物)和人工合成代糖(如阿斯巴甜、糖精钠等,通过化学合成制备)。低聚糖是天然存在的碳水化合物,来源于多种动植物,但含量较低,当然也可以由人工合成。
•甜度:代糖的甜度差异较大,部分人工合成代糖如阿斯巴甜的甜度是蔗糖的180-220倍,远高于低聚糖和传统糖类。天然代糖的甜度则各异,有些与蔗糖相近或略低。
•热量:代糖的热量通常极低或几乎没有,因此被广泛用于替代传统糖类,以满足人们对甜味的需求并减少热量摄入。虽然低聚糖的热量相对传统糖类较低,但每克仍能提供约2-4千卡的能量。
•安全性与健康影响:一般来说,在规定使用范围内,代糖被认为是安全的,但一些人工合成代糖的长期大量摄入潜在健康影响仍存在争议。低聚糖是天然碳水化合物,适量摄入对大多数人安全,并具有调节肠道菌群和改善代谢等健康益处。然而,肠道敏感人群大量摄入低聚糖可能会引起胃肠道不适。
拓展:不适合摄入低聚糖的人群
通常情况下,大多数人都能适量摄入低聚糖并从中受益,但以下几类人群可能不太适合或需要谨慎摄入:
肠道敏感人群:部分肠道极为敏感的人群,如患有肠易激综合征(IBS)且症状较为严重的患者,在摄入低聚糖后,肠道可能无法适应。低聚糖虽然一般可促进有益菌生长,但对于这类肠道极度敏感的人,可能会迅速改变肠道内的微生物环境和渗透压,引发肠道不耐受反应,如腹胀、腹痛、腹泻等症状加重。他们的肠道本身就处于高敏状态,对这类物质的耐受性较差。
对低聚糖过敏人群:极少数过敏体质者可能对低聚糖产生过敏反应,免疫系统将其视为有害物质并引发免疫反应,导致皮疹、瘙痒、呼吸急促、口腔肿胀等症状。这类人群应严格避免摄入可能致敏的低聚糖。
正在使用特定抗生素或药物的人群:某些抗生素在杀灭有害菌的同时也会影响有益菌。使用此类抗生素期间,若大量摄入低聚糖,由于有益菌数量减少,低聚糖可能在肠道内过度发酵,导致胃肠不适。
特殊阶段的糖尿病患者:低聚糖对血糖的影响虽小于传统糖类,但糖尿病患者在血糖控制不稳定或急性并发症(如酮症酸中毒、高渗高血糖综合征)发作期,应严格控制碳水化合物摄入,即使是低聚糖也可能引起血糖波动,需在医生指导下谨慎食用。此外,某些因基因突变导致糖代谢异常敏感的特殊糖尿病患者,也应谨慎摄入低聚糖,以避免血糖失控。
此外,正在服用可能影响肠道菌群或糖代谢的药物(如某些免疫抑制剂、化疗药物等)的患者,在摄入低聚糖前应咨询医生,因为药物与低聚糖之间可能存在相互作用,影响药效或对身体产生不良影响。
糖苷键以多种方式连接,不同的排列组合形成了多种低聚糖,赋予它们各自不同的特性和功能。
这些低聚糖的功能和来源多样,使其在营养和健康方面的作用各不相同。常见的天然低聚糖包括母乳低聚糖(HMO)、低聚木糖(XOS)、阿拉伯木质低聚糖(AXOS)、异麦芽低聚糖(IMOS)、甲壳素低聚糖(NACOS)、甘露寡糖(MOS)、低聚半乳糖(GOS)和低聚果糖(FOS)。

1
母乳低聚糖
母乳在婴儿大脑和免疫系统的发育中至关重要,这很大程度上归功于母乳中的低聚糖。母乳低聚糖(HMO)是由乳腺中的乳糖生物合成的一组低聚糖,是母乳中仅次于乳糖和脂质的第三丰富固体成分。
母乳的组成成分
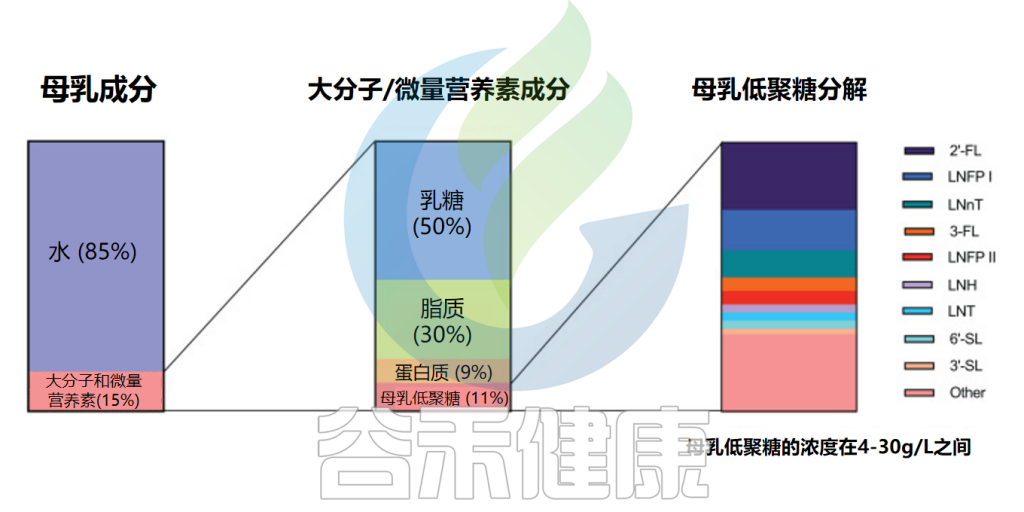
Slater AS,et al.Front Immunol.2025
• 母乳低聚糖对婴幼儿免疫系统的影响重大

最近发表的一项研究发现,母乳低聚糖对婴幼儿的免疫系统及肠道健康和功能具有重要影响:
(1)母乳低聚糖减少免疫系统中选择素介导的细胞间相互作用,降低白细胞在活化内皮细胞上的滚动,从而减少粘膜白细胞的浸润和活化,影响免疫细胞动力学。
(2)母乳低聚糖直接影响肠上皮细胞,调节参与各种细胞过程的基因表达,导致细胞表面聚糖和其他细胞反应发生变化,从而影响肠道健康和功能。
(3)母乳低聚糖能调节淋巴细胞产生细胞因子,促进平衡的Th1/Th2免疫反应。
母乳低聚糖对免疫反应的影响
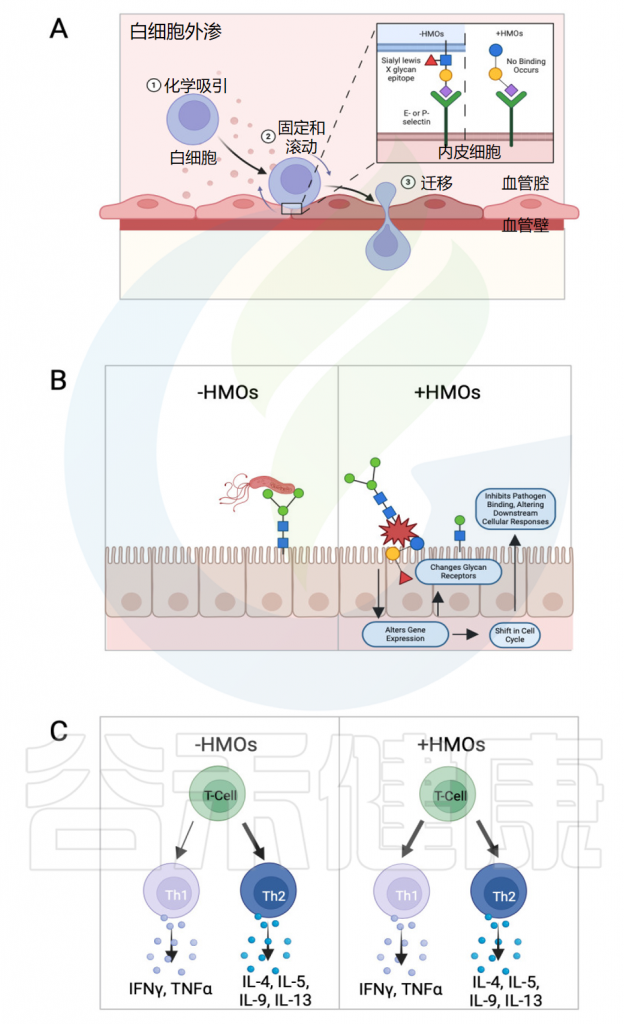
Slater AS,et al.Front Immunol.2025
• 促进有益细菌的生长,抑制宿主感染
作为一种益生元,母乳低聚糖选择性地促进共生肠道细菌的生长而不是病原体,以保护宿主。母乳低聚糖是婴儿肠道中特定有益细菌(如双歧杆菌和乳酸杆菌)的营养来源。
多样化的肠道微生物组与改善整体健康相关,包括更好的营养吸收、增强免疫功能和抵御病原体。母乳低聚糖通过促进粘蛋白产生维持肠道屏障完整性,防止有害细菌和毒素进入血液。
它还可以通过扮演诱饵受体的作用来抑制宿主感染,这些诱饵受体结合病原体以抑制细胞粘附。
2
低聚果糖
低聚果糖(FOS)是一种天然存在于多种植物中的短链碳水化合物,通常被视为益生元。它广泛存在于人们常食用的植物中,如香蕉、黑麦、大蒜、牛蒡、芦笋根、小麦、洋葱、马铃薯、雪莲果、菊芋和蜂蜜等。
• 促进消化吸收,增强肠粘膜
低聚果糖是一种天然活性成分,存在于水果、蔬菜和蜂蜜中,无法被胃肠道的消化酶分解,是优质的水溶性膳食纤维。此外,FOS可增强肠黏膜的保护功能,从而减少胃肠道疾病的发生。摄入低聚果糖可使粪便松软,并促进肠道功能。
• 促进有益菌生长,抑制病原体感染
研究表明,摄入低聚果糖后,肠道内双歧杆菌的数量可明显增加,有害菌如大肠杆菌、梭状芽孢杆菌等的数量则会相应减少。这有助于改善肠道功能,增强肠道屏障功能,预防便秘、腹泻等肠道疾病,还能降低肠道感染的风险。
低聚果糖通过与肠壁上的受体竞争来抑制病原体,从而降低感染风险,并有效竞争营养物质以预防感染。
• 促进矿物质吸收
低聚果糖有助于增加肠道对钙、镁等矿物质的吸收,对骨骼健康起到积极作用。
• 控制血糖和胆固醇
低聚果糖作为一种新型食疗剂,能有效降低血清胆固醇、甘油三酯和游离脂肪酸的含量,对因高血脂引起的高血压和动脉硬化等心血管疾病有良好改善作用。研究显示,在小鼠饲料中添加10%低聚果糖,饲养8周后,实验组小鼠的血浆总胆固醇水平显著低于对照组,表明低聚果糖可能有助于调节血脂代谢。
3
低聚木糖
低聚木糖(XOS)是木聚糖的水解产物,是一种新型的功能性低聚糖。天然低聚木糖,通常占少数,主要存在于一些植物中,例如橄榄、甘蔗、杨树。
一些食物中也含有低聚木糖,包括:燕麦、大麦、黑豆、红豆、竹笋、甜菜、胡萝卜、洋葱和香蕉。
• 促进双歧杆菌增殖的能力是其他低聚糖的数倍
与其他低聚糖(如低聚果糖和低聚异麦芽糖)相比,它对肠道双歧杆菌的增殖促进作用更强,其双歧因子功能是其他低聚糖的10-20倍。
注:双歧因子是促进双歧杆菌生长的营养物质。
• 在抗肿瘤活性中发挥作用
低聚木糖在抗肿瘤活性方面发挥两种作用。首先,其能高度选择性地促进肠道中双歧杆菌的增殖,双歧杆菌是重要的益生菌,能够抑制有害菌生长并减少内源性致瘤物质的产生,同时通过增加免疫细胞数量和活性发挥抗肿瘤作用。
其次,低聚木糖促进短链脂肪酸(SCFA)的产生,短链脂肪酸具有显著的抗肿瘤作用,能降低肠道pH值,从而抑制病原菌和有害菌的生长,降低肿瘤发生率。
此外,低聚木糖还在调节血糖、降低血脂和预防肠道疾病方面发挥重要作用。
4
阿拉伯木质低聚糖
阿拉伯木质低聚糖(AXOS)是阿拉伯木聚糖(AX)的一种酶解产物。在没有外源木聚糖降解酶的情况下,阿拉伯木聚糖可以通过木聚糖酶等降解酶转化为 AXOS,这些酶由肠道中的拟杆菌门等细菌分泌。AXOS通过特定的运输载体进入细菌,并被糖苷水解酶进一步降解为单糖,如木糖和阿拉伯糖。嗜酸乳杆菌、短乳杆菌和双歧杆菌等物种产生这些酶。
• 可产生短链脂肪酸
阿拉伯木质低聚糖可被肠道微生物群用于产生短链脂肪酸(SCFA),研究表明,分子量小于400Da的AXOS具有更好的活性。丁酸可作为结肠细胞的能量来源,刺激结肠上皮细胞的生长并抑制结肠肿瘤细胞的生长。发酵产生的乙酸和丙酸被吸收,并分别参与体内的脂质代谢和糖代谢。
5
低聚异麦芽糖
淀粉中发现的低聚异麦芽糖(IMO)通常以支链淀粉或多糖的成分形式存在,除了在淀粉、玉米、牛奶、麦麸、豆浆、酱油和蜂蜜中存在外,很少以游离状态天然存在。
• 改善肠道环境,维持菌群平衡
低聚异麦芽糖(平均分子量900Da)可被肠道微生物群降解,从而改善肠道环境,选择性地促进双歧杆菌的增殖,并维持肠道微生物群的平衡。
同时,IMO还可以通过产生短链脂肪酸(SCFA)和有机酸等发酵产物,预防手足口病(HFMD)引起的全身和组织炎症、葡萄糖耐量不良、全身性肥胖等症状。
6
低聚半乳糖
低聚半乳糖(GOS)是天然低聚糖,动物的乳汁中存在微量的低聚半乳糖,母乳中含量稍多。此外,某些豆类、魔芋和卡拉胶中也存在低聚半乳糖。
• 能够促进多种有益菌的增殖
低聚半乳糖(GOS)与低聚果糖(FOS)和低聚异麦芽糖(IMO)相比,是三种低聚糖中唯一能被人体肠道内八种有益菌利用的。它是双歧杆菌和嗜酸乳酸杆菌等有益菌的优质营养源和增殖因子,有助于改善肠道的消化吸收功能。
• 低聚半乳糖对婴儿消化和免疫很重要
新生儿的消化功能比较薄弱,母乳中含有的低聚半乳糖,它不但能改善婴儿的消化功能,还能促进钙的吸收,增强婴儿的免疫力。
不同的低聚糖在聚合程度、糖苷键和整体结构复杂性(如侧链)等方面存在差异。这些差异导致与低聚糖相互作用的多种微生物群,表现为有益细菌增殖程度、有害细菌受抑制程度以及酸和气体产生的差异。
以木聚糖为例,进入肠道后,被拟杆菌门分泌的糖苷水解酶降解为低聚木糖(XOS),并转运至细胞周质中。木聚糖及其代谢产物可通过转运蛋白进入双歧杆菌或其他细菌中,并被革兰氏阳性菌PUL编码的碳水化合物活性酶进一步降解。
• 低聚木糖可被降解为单糖用于产生短链脂肪酸
低聚木糖(XOS)可被肠道微生物分泌的d-木糖苷酶和阿拉伯糖苷酶水解为单糖,用于生产短链脂肪酸,如乙酸盐、丙酸盐、丁酸盐、乳酸和琥珀酸。研究表明,XOS可显著增加有机酸含量,摄入阿拉伯糖—低聚木糖后乙酸浓度也显著升高。
SCFA作为有机酸,可降低肠道pH值,促进胃肠蠕动,抑制硝酸盐还原菌的生长,从而预防肠道疾病。此外,SCFA通过调节表皮屏障、免疫介导炎症和抑制肠道病原体感染,影响宿主免疫功能,并通过抑制结直肠肿瘤细胞的生长、诱导分化和凋亡发挥抗肿瘤作用。
肠道中木聚糖和低聚木糖的代谢
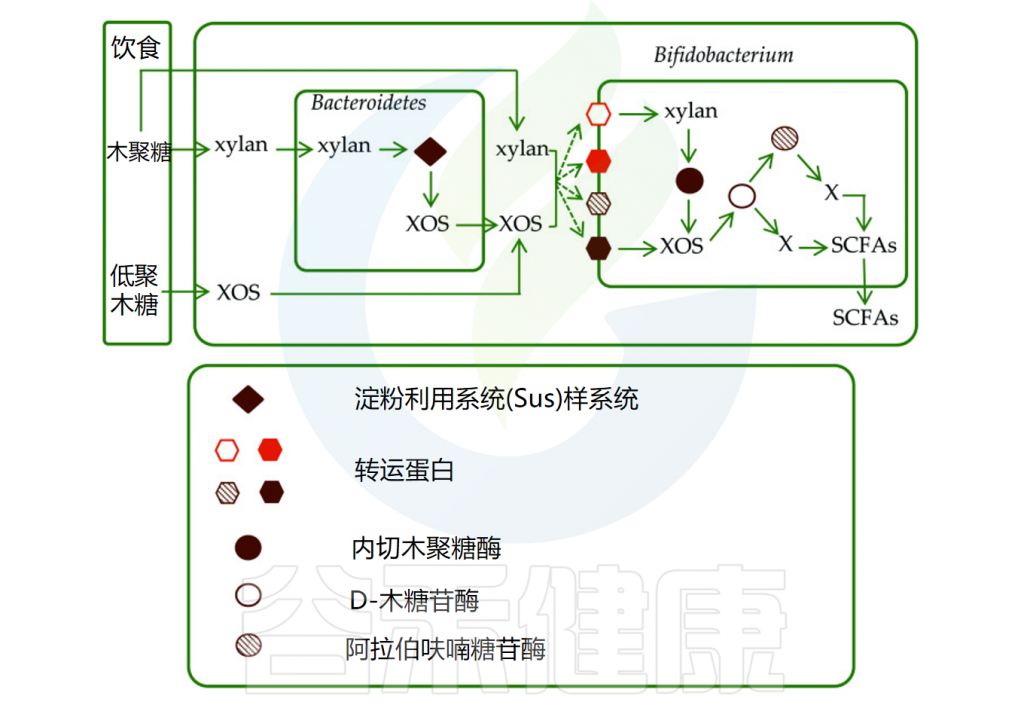
doi: 10.1039/d0ra00344a.
具有不同聚合度(DP)的低聚糖可以被不同的菌株利用。例如,DP3低聚果糖(FOS)在体外促进双歧杆菌生长,同时抑制梭菌增殖,显示出更优越的选择性刺激活性。
• 不同细菌喜好代谢不同的低聚糖
研究证明乳双歧杆菌(Bifidobacterium lactis DR10)消耗的低聚糖(低聚半乳糖)具有较高的聚合度,而鼠李糖乳杆菌(Lactobacillus rhamnosus DR20)更喜欢使用半乳糖。
评估了具有不同DP的竹笋壳低聚木糖(XOS)的益生元能力,结果显示高聚合度(>X5)的低聚木糖增加有益菌(如拟杆菌属)的丰度,而低聚合度(X2-X3)则促进其他有益菌(如Lachnochlostridium)的增殖。青春双歧杆菌(Bifidobacterium adolescentis)和嗜酸乳杆菌(Lactobacillus acidophilus)主要利用X2-X3组分。
• 低聚合度的聚糖更能支持肠道菌群增殖
微生物降解高聚合度的低聚糖通常需要更多能量,因为微生物优先将其降解为低聚合度的低聚糖,这限制了肠道微生物群的代谢能力。相反,低聚合度的低聚糖的分解较简单,所需能量较少,因此更能支持肠道微生物群的生长和增殖。
例如,关于低聚糖的研究表明,DP3-4(≥80%)的成分被所有益生菌菌株利用,DP5-6的部分被一些菌株利用,而DP≥7的部分仅被乳酸菌(LAB)和双歧杆菌利用。DP3-5中的异麦芽糖比DP2更易消化,尽管其到达结肠的几率更高,但对有益益生菌的发酵选择性较低。
• 不同聚合度的低聚糖经菌群产生的代谢物不同
不同聚合度的低聚糖对肠道菌群产生的主要代谢物影响不同。首先,具有不同聚合度的低聚糖导致肠道微生物群产生不同类型和比例的短链脂肪酸。高聚合度的低聚糖发酵较慢,逐渐释放更多丁酸盐,作为诱导产丁酸盐细菌增殖的潜在底物;而低聚合度聚糖快速发酵,产生更多乙酸盐和丙酸盐。
此外,具有不同聚合度的低聚糖在发酵过程中产生的气体(如氢气和二氧化碳)数量也不同。通常,高聚合度的低聚糖因发酵速度较慢,产气量较少,而低聚合度的低聚糖发酵速度较快,产气量较多。
低聚糖在肠道中的发酵过程涉及低聚糖的摄入,这些低聚糖首先被细菌膜上的模块化聚糖酶识别并水解为低聚合度的低聚糖。随后,低聚合度的低聚糖通过膜转运蛋白进入细胞,并被酶分解为二糖和单糖。
• 不同低聚糖经分解后的产物不同
例如,低聚半乳糖(GOS)被β-半乳糖苷酶水解为半乳糖和葡萄糖,随后进入Leloir途径和糖酵解。低聚果糖(FOS)首先通过ABC转运蛋白被嗜酸乳杆菌吸收,降解为β-葡萄糖苷,进一步被果糖苷酶和β-呋喃糖苷酶分解为果糖和葡萄糖。在婴儿双歧杆菌亚种中,母乳低聚糖(HMO)底物通过ABC转运蛋白完整运输,随后由多种细胞质糖苷酶水解,包括α-岩藻糖基化酶和2,3/6-α唾液酸酶。
• 益生菌的诱导生长能力与糖苷键相关
低聚糖的不同结构对肠道微生物组有不同影响,包括糖苷键类型和连接模式。例如,异麦芽低聚糖(IMO)中形成的α-(1→3)-和α-(1→2)-连接的葡萄糖寡糖(GlcOSs)促进了双歧杆菌属和乳酸杆菌属的生长,其发酵选择性高于仅含α-(1→6)-连接的IMOs。
研究了不同二糖键的低聚糖对乳酸菌的影响,发现大多数物种对α-(1→6)-IMOs的生长速率较低,而β-(1→4)-连接的纤维二糖和β-(1→6)-连接的龙胆二糖显著促进了短乳杆菌(L.brevis ATCC 8287)、鼠李糖乳杆菌(L.rhamnosus ATCC 53103)、植物乳杆菌(L.plantarum WCFS1)和加氏乳杆菌(L.gasseri ATCC 33323)的增殖。
同样,研究了二糖的益生元指数(PI),发现α-葡萄糖二糖的PI高于β型。比较了β-低聚糖、β-低聚半乳糖和α-低聚半乳糖对肠道菌群代谢的影响,结果显示含β-糖苷键的低聚果糖和低聚半乳糖是双歧杆菌的首选底物,对微生物组成影响显著。
此外,摄入含β-1,3、β-1,4和β-1,6糖苷键的低聚果糖在健康志愿者中显示出更好的益生元效应。双歧杆菌、乳酸杆菌和屎肠球菌对主要含有β-1,3和β-1,6糖苷键的低聚果糖的发酵活性优于含单个β-1,4糖苷键的低聚果糖。这与另一项研究的结论相似,后者发现双歧杆菌、乳酸杆菌和链球菌更偏好含β-1,6糖苷键的半乳糖,而非β-1,4糖苷键的半乳糖。
总之,益生菌的生长诱导能力与糖苷键的类型相关,因此了解低聚糖的结构-活性关系至关重要。
• 取代基的数量和类型影响微生物的组成和发酵速率
低聚糖中取代基的数量会影响微生物的发酵速率。低取代的低聚糖优先被发酵,导致高取代的低聚糖积累,表明取代基的存在可能延迟或完全阻碍发酵。
研究表明,木糖低聚糖(XOS)上的取代基会影响双歧杆菌的发酵,导致乳酸产量不同。未取代的XOS中乳酸含量高于取代的XOS,说明未取代的XOS更易被肠道微生物发酵。此外,已有研究描述了双歧杆菌在体外和体内对低取代XOS的偏好,表明微生物可能根据低聚糖的结构优先生长或被抑制,从而改变微生物群落的组成。
低聚糖中取代基的类型同样影响微生物的发酵速率和组成。在人类粪便体外发酵实验中,线性木糖低聚糖和阿拉伯糖取代的木糖低聚糖(AXOS)的发酵速度快于乙酰化木糖低聚糖,而含有4-O-甲基葡萄糖醛酸基团(GlcAmeXOS)的木糖低聚糖发酵速度最慢。与AXOS相比,使用XOS作为唯一碳源时,拟杆菌门表现出优异的生长性能,其降解XOS的过程包括细胞外降解和骨骼的分枝,随后是寡聚体的细胞内水解,最终产生乙酸盐、丙酸盐和丁酸盐作为主要代谢产物。
• 低聚糖的链长和形状特异性地影响菌群生长
此外,低聚糖的链长和形状也很重要。例如,长链低聚糖对上肠的水解和降解具有更强的抵抗力,能更有效地刺激双歧杆菌、普雷沃菌属和乳酸菌的生长。
双歧杆菌在利用不同链长的低聚果糖(FOS)时表现出选择性特异性,通常短链FOS优先被发酵,其次是长链FOS。环状异麦芽低聚糖(IMO)已被证明可以抑制链球菌,而具有更多分支的小麦阿拉伯木聚糖水解物则只能部分被双歧杆菌和拟杆菌发酵。
综上所述,聚合度、取代基和糖苷键类型显著影响益生菌的活性和增殖能力,因此针对不同的益生菌需要施用对应特点的低聚糖。
低聚糖作为一种重要的功能性食品成分,近年来在多种疾病的治疗中显示出显著的潜力。其通过调节肠道微生物群、改善代谢功能和增强免疫反应等机制,成为研究的热点。
接下来将探讨低聚糖在不同疾病人群中的治疗效果,特别是在肥胖、糖尿病、肠道疾病、抑郁症和便秘等方面的应用。甚至还有研究发现了低聚糖在新型冠状病毒(COVID-19)感染后的潜在调节作用。
肠道微生物失调是肥胖患者和动物模型的常见特征。研究表明,益生元低聚糖(如低聚果糖、低聚木糖和低聚半乳糖)通过调节肠道微生物群具有抗肥胖作用。
• 低聚糖通过调节肠道菌群发挥抗肥胖作用
一项针对肥胖小鼠模型的研究发现,低聚糖的给药增加了拟杆菌门的丰度,降低了厚壁菌门的丰度,并改变了100多个细菌类群。另一项研究发现低聚木糖饮食减少了小鼠的内脏脂肪,这与肠道微生物群的变化有关,具体表现为拟杆菌门增加和厚壁菌门减少。在科和属水平上,f_S24-7_Unclassified显著增加,而链球菌科、粪球菌属、瘤胃球菌属和乳球菌属显著减少。
此外,高脂饮食(HFD)导致血浆脂多糖(LPS)水平持续升高,进而引发全身炎症反应,促进肥胖患者的胰岛素抵抗。在一项针对肥胖女性的研究中,低聚果糖干预后双歧杆菌和普拉梭菌的丰度增加,肠道菌群的变化与脂肪量、血清脂多糖水平和代谢(如马尿酸、乳酸和血浆蛋白C)的变化相关。
同样,食用低聚木糖可降低肥胖小鼠的代谢内毒素血症。结果表明,低聚糖可以抑制促炎菌的生长,如瘤胃球菌、变形菌门和一些产生毒素的梭菌属,并促进有益细菌(如双歧杆菌、乳酸杆菌和普雷沃氏菌)的生长,从而有助于缓解肠道炎症并降低肥胖风险。
因此,通过低聚糖调节肠道微生物群的组成被认为是预防和治疗肥胖的有效方法。
• 通过代谢产生短链脂肪酸抑制脂肪合成
肥胖的直接原因是脂肪合成的速度超过脂肪消耗的速度。因此,阻断脂肪合成和增加能量消耗是对抗肥胖的最有效策略。低聚糖对减肥的影响主要归因于肠道微生物群产生短链脂肪酸,因为它们在调节食物摄入和能量代谢中起着重要作用。
乙酰辅酶A羧化酶(ACCase)是脂肪酸合成过程中的关键酶。通过抑制ACCase活性,可以减少脂肪酸的合成,这有助于预防肥胖。乙酸盐被催化成乙酰辅酶A,丁酸盐被转化为丁酰辅酶A,作为限速酶(ACCase)脂肪酸合成的抑制剂,以减轻肥胖。
丁酸盐通过摄入低聚糖而丰富,调节肠道微生物群中丁酸盐与乙酸盐的比例是治疗肥胖的潜在策略。研究表明,低聚半乳糖通过调节短链脂肪酸的合成改善小鼠的脂质代谢。膳食补充甘露寡糖可以通过重塑肠道微生物组成和增强短链脂肪酸的形成来减少肥胖。
• 通过影响胆汁酸的合成和释放调节能量代谢
低聚糖还可以通过影响与胆汁酸(BA)代谢相关的肠道微生物群来调节胆汁酸的合成和释放,例如梭菌、拟杆菌门、乳酸杆菌和双歧杆菌。
研究发现,几丁寡糖干预后,肠道菌群可以促进胆汁酸的释放,进而激活TGR5,增强棕色脂肪产热和TGR5主导的脂肪酸氧化信号通路,从而在减肥和降脂方面发挥作用。
其他研究表明,低聚半乳糖显著影响了小肠中胆汁酸的浓度,改善了葡萄糖代谢,并通过调节脂质消化影响脂质吸收。果胶低聚糖也被证明可以通过肠道微生物群及其代谢物介导胆固醇代谢。
// 编者小结
肠道微生物群能够利用低聚糖产生营养代谢物,这些代谢物充当细菌群落的“信使”,影响宿主能量稳态并调节宿主代谢,从而有助于对抗肥胖。
低聚糖对肥胖和2型糖尿病的影响
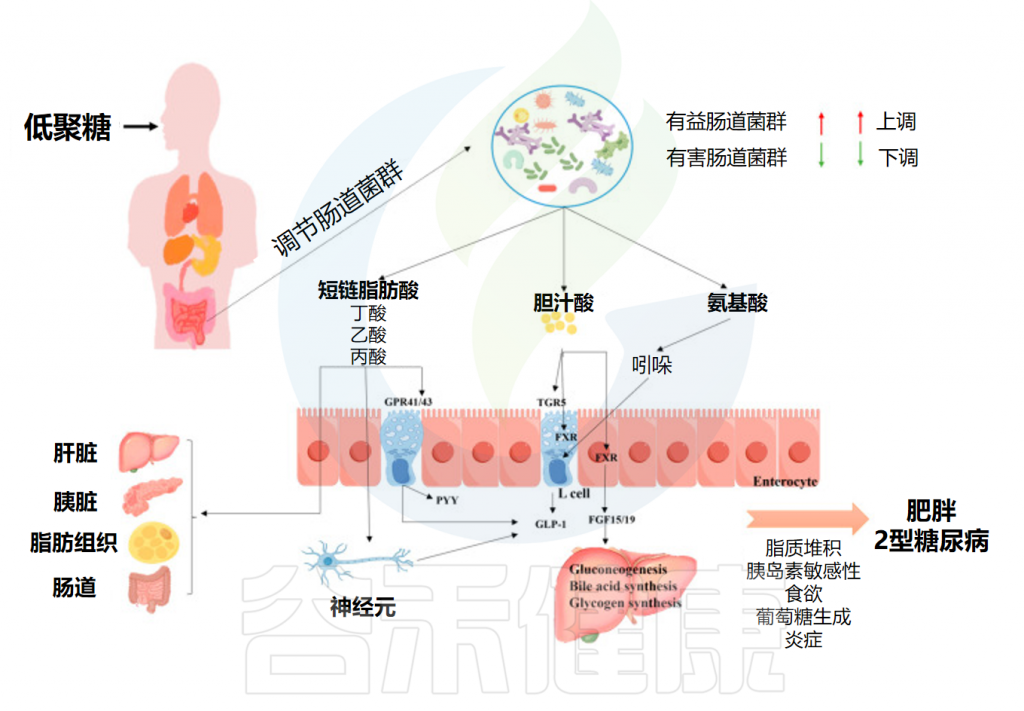
Yuan M,et al.Foods.2024
糖尿病是一种以高血糖为特征的慢性疾病,主要由胰岛素分泌绝对或相对不足和利用受损引起。目前,增加膳食纤维摄入量是2型糖尿病(T2DM)患者的推荐饮食疗法之一。
• 低聚糖通过增加双歧杆菌等特定有益菌,改善糖尿病
研究表明,低聚糖(NDO)能够通过调节肠道菌群,丰富或减少特定微生物,从而有效改善糖尿病。例如,在T2DM大鼠中,双歧杆菌属、罗氏菌属、粪杆菌属、拟杆菌属和阿克曼氏菌属这些有益菌的丰度下降,而脱硫杆菌属、颤杆菌克属、梭杆菌属、瘤胃球菌属和Blautia属的丰度增加。
经过16周的低聚果糖治疗,T2DM模型大鼠的物种α多样性降低,双歧杆菌的相对丰度增加,瘤胃球菌的相对丰度显著降低。后续对低聚果糖和低聚半乳糖的研究发现了Phascolarctobacterium、Coprococcus和Oscillospira的丰度也有所降低。
• 产生短链脂肪酸影响胰岛素敏感性
此外,低聚糖通过影响微生物产生的有益代谢物,如短链脂肪酸(SCFAs)、氨基酸代谢物和生物活性多肽,来调节胰岛素敏感性、血糖和脂质代谢,从而缓解糖尿病的发病和进展。
研究表明,SCFA调节胰腺的胰岛素分泌,防止胰岛素抵抗并增强胰岛素敏感性。丙酸盐通过多种机制增强葡萄糖刺激的胰岛素释放,并维持胰腺β细胞的功能和数量,包括抑制细胞凋亡、促进细胞增殖和减少α细胞向β细胞的反向分化。因此,丙酸盐有助于维持胰岛功能的完整性和稳定性。
此外,丁酸盐在小鼠模型和大型人群队列中被证明能提高胰岛素敏感性并防止胰岛素抵抗,其机制与促进能量消耗和刺激线粒体功能有关。
作为信号分子的SCFA通过激活G蛋白偶联受体GPR41和GPR43来调节胰岛素水平并抑制肝脏糖异生,从而维持宿主能量稳态。它们还促进胰高血糖素样肽-1(GLP-1)和肽YY的分泌,GLP-1通过降低血糖水平和改善胰岛素分泌与抵抗参与葡萄糖稳态。SCFA在T2DM的发展中起着关键作用,并可作为代谢紊乱或体内平衡的标志物。
• 摄入低聚糖形成的氨基酸代谢物影响血糖水平
摄入低聚糖可产生多种氨基酸代谢产物,影响血糖水平和胰岛素敏感性。一些氨基酸可被特定肠道微生物转化为生物活性代谢物,例如吲哚、丙酸咪唑和酪胺。
色氨酸(Trp)可被多种细菌代谢成吲哚,并调节GLP-1的分泌。Trp也可被某些肠道微生物转化为吲哚丙(IPA),如C.caloritolerans和C.paraputrificum,IPA可显著降低大鼠的空腹血糖和胰岛素水平,改善胰岛素抵抗。
此外,研究发现,低聚糖干预后T2DM模型大鼠中糖原氨基酸(如脯氨酸、丝氨酸和亮氨酸)的含量增加。丝氨酸和谷氨酰胺的增加可降低T2DM的风险。
总之,低聚糖通过调节肠道菌群和碳水化合物、脂质、蛋白质的代谢。同时,肠道微生物群产生的众多代谢物可反馈到大脑,影响许多胃肠道过程。
炎症性肠病(IBD)是一种常见的非特异性慢性胃肠道炎症性疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC)。越来越多的证据表明,功能性低聚糖作为天然活性物质,可以有效改善IBD。
• 丰富肠道菌群的多样性
低聚糖可以通过调节肠道菌群来缓解肠道炎症。研究发现,IBD患者粪便中大肠埃希菌和粪肠球菌的水平显著高于正常人,而乳酸菌和双歧杆菌的丰度显著降低。肠道微生物失调导致肠粘膜生态失衡,促炎细胞因子的产生增加,抗炎细胞因子的产生减少。
低聚果糖通过促进乳酸菌的生长来缓解肠道炎症。增加的有益菌产生短链脂肪酸可被肠上皮细胞吸收并抑制促炎细胞因子IL-8和IL-6的产生,从而减轻结肠上皮细胞的炎症反应。
总之,低聚糖可以通过减少促炎菌的丰度、增加抗炎菌的丰度和促进短链脂肪酸的产生来缓解IBD的症状。
• 保护肠道屏障
在炎症性肠病中,紧密连接蛋白(如claudin1、occludin和ZO-1)和粘附连接蛋白(如E-钙粘蛋白和β-catenin)的改变通常伴随肠道通透性增加和肠道结构破坏。
低聚糖通过调节肠道微生物群的多样性来帮助恢复粘膜屏障的完整性。例如,母乳低聚糖恢复了结肠炎小鼠的紧密连接蛋白和MUC-2的表达,抑制了脂多糖和内毒素结合蛋白的产生,并恢复了肠道屏障的完整性。此外,魔芋低聚糖增加了小鼠结肠中短链脂肪酸的浓度,促进IL-18并修复IEC的完整性。
• 免疫稳态的调节
肠上皮细胞和免疫细胞中的Toll样受体(TLR)识别并响应不同的微生物结构。当病原体入侵时,巨噬细胞通过TLR识别病原体相关分子模式(PAMP)并分泌各种促炎细胞因子(如TNF-α、IL-1β、IL-6、IL-12等)。
IBD患者的调节性T(Treg)细胞数量减少。短链脂肪酸可以诱导T细胞分化为调节性T细胞细胞,促进抗炎细胞因子的合成以调节免疫反应,并恢复Th1/Th2和Th17/调节性T细胞的平衡。一项研究表明,低聚木糖被代谢成SCFAs,丙酸盐和丁酸盐可以促进CD4+ T细胞分化为调节性T细胞,从而减缓炎症性肠病。同样,阿魏酰化寡糖促进了调节性T细胞的百分比和相应特异性细胞因子的产生,从而调节炎症性肠病的Th17/调节性T细胞免疫稳态。
此外,肠道微生物群还可以刺激B细胞产生影响其他免疫细胞和免疫球蛋白(如sIgA)的抑制性细胞因子(如IL-10和TGF-β)。
低聚糖通过调节肠道微生物群来缓解炎症性肠病
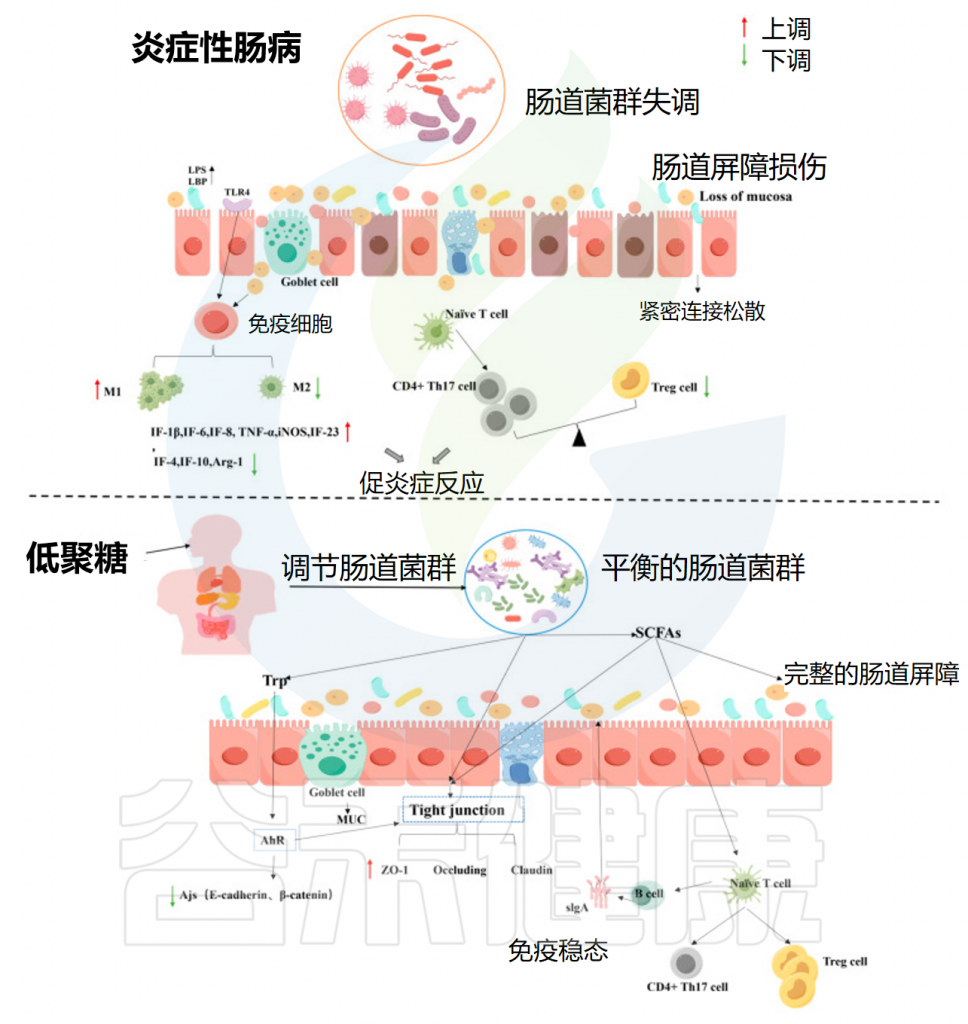
Yuan M,et al.Foods.2024
低聚糖可能通过调节肠道微生物群影响抑郁症的发展。例如,低聚果糖抑制抑郁相关细菌(如Lachnospiraceae incertae sedis、Oscillibacter、Proteobacteria和Streptococcus)。
• 使用低聚糖后减轻了抑郁症状
此外,低聚果糖(FOS)和低聚半乳糖(GOS)的组合已被证明可以减轻抑郁症状,具体来说,它们增加了海马脑源性神经营养因子(BDNF)和皮质血清素的水平,同时降低了升高的皮质酮水平和体温。三周的慢性社交压力显著减少了社交互动,而FOS+GOS给药可以防止这种影响。FOS和GOS的组合还降低了开放空间测试和迷宫测试中的焦虑水平。
在微生物水平上,有证据表明两者的结合可以防止放线菌和变形菌门比例的变化,这是重度抑郁症患者的典型特征。对低聚果糖和标准抗抑郁药氟西汀进行了比较分析,指出它们具有相似的效果,并且FOS和氟西汀都促进了Dialister属的生长。
注:最近的一项队列研究报道,在抑郁患者中未发现Dialister。换句话说,FOS和氟西汀可能通过调节Dialister的存在来改善抑郁症状。
• 低聚糖的菌群代谢物是保护神经系统的关键
肠道微生物可以通过神经、免疫和内分泌途径以及微生物代谢物影响大脑,甚至通过微生物产生的神经递质刺激肠道的迷走神经末梢。已知受肠道菌群影响的神经递质包括短链脂肪酸(SCFA)、γ-氨基丁酸(GABA)、色氨酸(Trp)和血清素(5-HT)。
例如,丁酸盐的增加可能直接影响中枢神经系统。发现口服丁酸盐会影响脑代谢和海马神经发生。因此,低聚糖补充剂可能通过增强SCFA的形成来抑制抑郁症的发展,包括改善认知功能和缓解焦虑行为。
另一个重要途径是色氨酸→血清素(5-HT)。色氨酸是合成神经递质5-HT的唯一前体,影响抑郁症的发展。阿魏酰化寡糖(FOs)通过调节5-HTP(血清素前体)表现出抗抑郁和抗焦虑作用,表明肠道微生物群和微生物代谢是支持FOs保护神经系统的关键介质。
同样,另一项研究揭示了巴戟天寡糖(MOO)调节肠道菌群中的5-HT合成途径(Trp→5-HTP→5-HT),肠道菌群中升高的5-HTP被吸收到血液中,然后穿过血脑屏障,提高大脑中的5-HT水平。这些发现表明,肠道微生物群可以调节神经递质水平以影响抑郁症的发展。
肠道菌群与低聚糖互作改善抑郁症
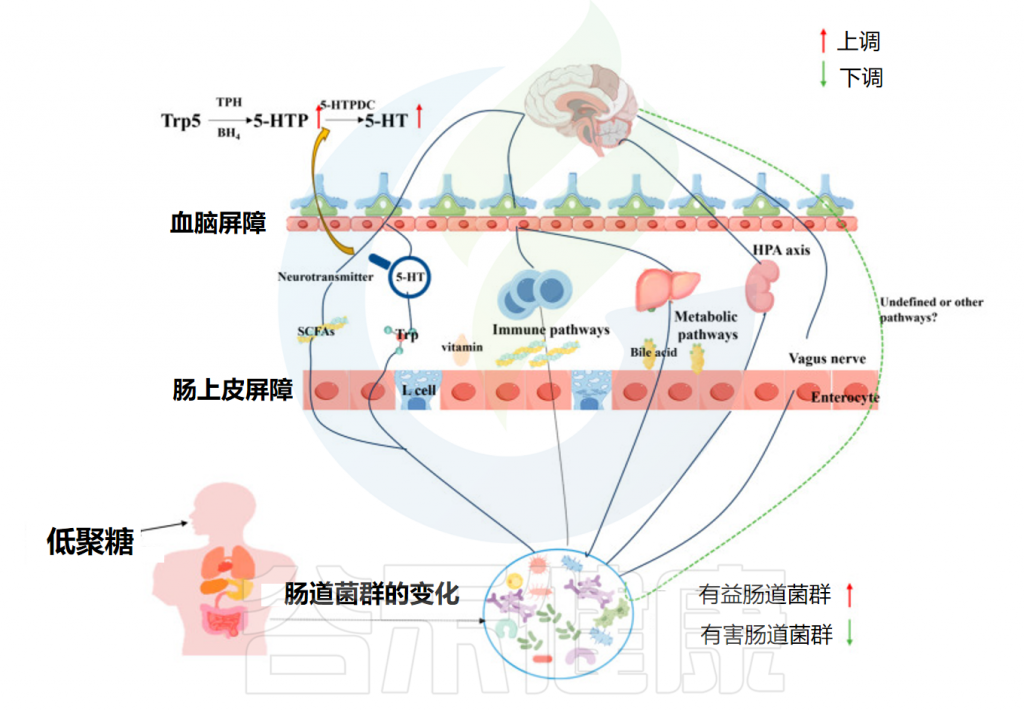
Yuan M,et al.Foods.2024
肠道蠕动受肠道免疫系统、分泌物、微生物群及其发酵产物的相互作用调节,蠕动受损可导致便秘。益生菌(如双歧杆菌和Alistipes)丰度增加,以及与结肠运输相关的细菌丰度减少,有助于缓解便秘。
• 低聚糖促进肠道蠕动改善便秘
低聚糖,如低聚果糖、异麦芽低聚糖和低聚半乳糖,能显著提高排便频率并缩短结肠转运时间,且副作用小。除了低聚糖本身占据肠道体积以增加粪便量和促进蠕动外,研究还表明低聚糖在微生物群重塑方面对缓解便秘有显著益处。
具体而言,乳酸菌利用低聚果糖提高粪便稠度并减少排便时间。异麦芽低聚糖有效改善受试者的粪便稠度和排便频率,可能是由于结肠发酵后某些微生物丰度增加。莲子低聚糖通过刺激宿主肠道有益菌的生长促进蠕动和排便,从而缓解便秘。
• 通过代谢产生的短链脂肪酸来改善肠道蠕动
此外,研究证明低聚半乳糖可以通过调节肠道代谢物的产生改善便秘。低聚糖的摄入增加了益生菌发酵的底物量并促进了短链脂肪酸的产生。特别是丁酸盐、乙酸盐和丙酸盐,与刺激结肠上皮细胞的生长有关,从而恢复肠道形态并增加肠道蠕动以缓解便秘。
目前的研究表明,丁酸盐可以通过影响水和电解质代谢来改善肠道蠕动。同样,低聚半乳糖通过恢复恶化的水电解质代谢(包括AQP3/4和ENaC-β/γ)表达来缓解便秘。其中,AQP3/4将水从肠腔输送到结肠上皮,ENaC-β/γ介导Na+摄取到结肠上皮细胞中。
• 调节代谢途径,改善便秘
低聚糖改善便秘可能与调节代谢途径有关,包括脂质代谢、胆汁酸代谢和色氨酸代谢。代谢异常与肠道炎症反应相关,炎症会破坏肠上皮完整性,减少神经递质和激素分泌,影响胃肠蠕动并诱发便秘。
胃肠道激素在中枢和周围神经系统中作为神经递质和调节剂,促进肠道蠕动和内容物运输。内皮素、生长抑素和血管活性肠肽为抑制性神经递质,而褪黑激素和P物质为兴奋性神经递质。
此外,色氨酸代谢对胃肠蠕动有显著促进作用。L-色氨酸、5-HTP及其他中间代谢产物是神经递质和调节剂的底物,可增强内脏神经敏感性并刺激蠕动。研究表明,NDO 可通过激活5-HT信号通路缓解便秘。同时,胆汁酸通过肠道细菌的代谢调节便秘也发挥重要作用。
// 编者小结
低聚糖可以通过促进肠道蠕动、增强屏障功能和调节免疫反应,有效缓解便秘。这些发现表明低聚糖在治疗便秘方面的潜在价值,进一步支持了通过靶向肠道微生物群及其代谢功能来改善便秘的研究方向。
低聚糖缓解便秘的作用机制
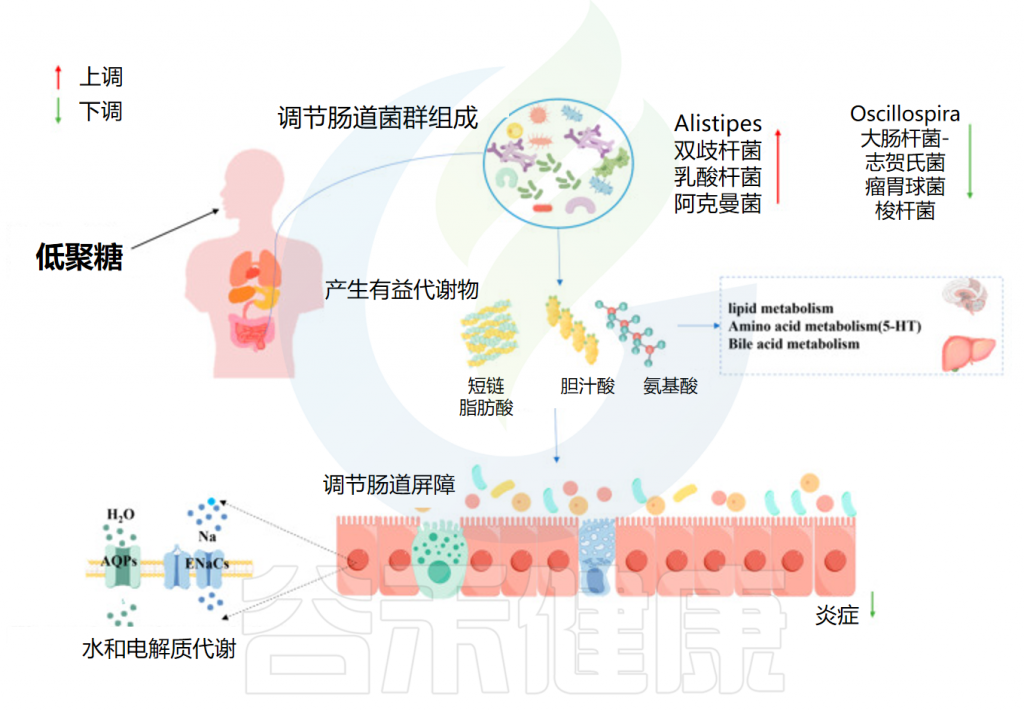
Yuan M,et al.Foods.2024
COVID-19(新型冠状病毒)大流行对全球健康产生了深远影响,许多人面临长期后遗症,需制定有效的管理策略应对COVID-19后综合征,如腹泻、疲劳和慢性炎症。
食物中存在的低聚糖被证明具有益生元作用,且新证据表明其可能具备免疫调节和抗炎作用,这对缓解COVID-19的长期影响尤为重要。
• 低聚糖通过阻止病毒复制,减轻后遗症
感染COVID-19后患者即使从急性期恢复,体内也可能携带少量病毒载量,这会激活肠道ACE2受体并引起腹泻等胃肠道症状。低聚糖具有生物活性特性,能够增强免疫系统,抑制病毒复制和传染性,并提供对病毒感染的保护。
注:ACE2存在于人体的各种细胞上,包括呼吸道和胃肠道的细胞,已被确定为新型冠状病毒的功能宿主受体。
低聚果糖、低聚木糖、低聚半乳糖等低聚糖可选择性促进双歧杆菌和乳酸杆菌等有益菌的生长。这些益生菌产生的脂肽分子(如解淀粉芽孢杆菌的枯草杆菌蛋白酶、卷曲乳杆菌的curvacin A、沙克乳酸杆菌的sakacin P和乳酸乳球菌的乳球菌素Gb)与人ACE2具有更高的结合亲和力,通过竞争性抑制阻止SARS-CoV-2与表达ACE2的宿主上皮细胞结合和繁殖。
低聚糖抑制COVID-19病毒复制
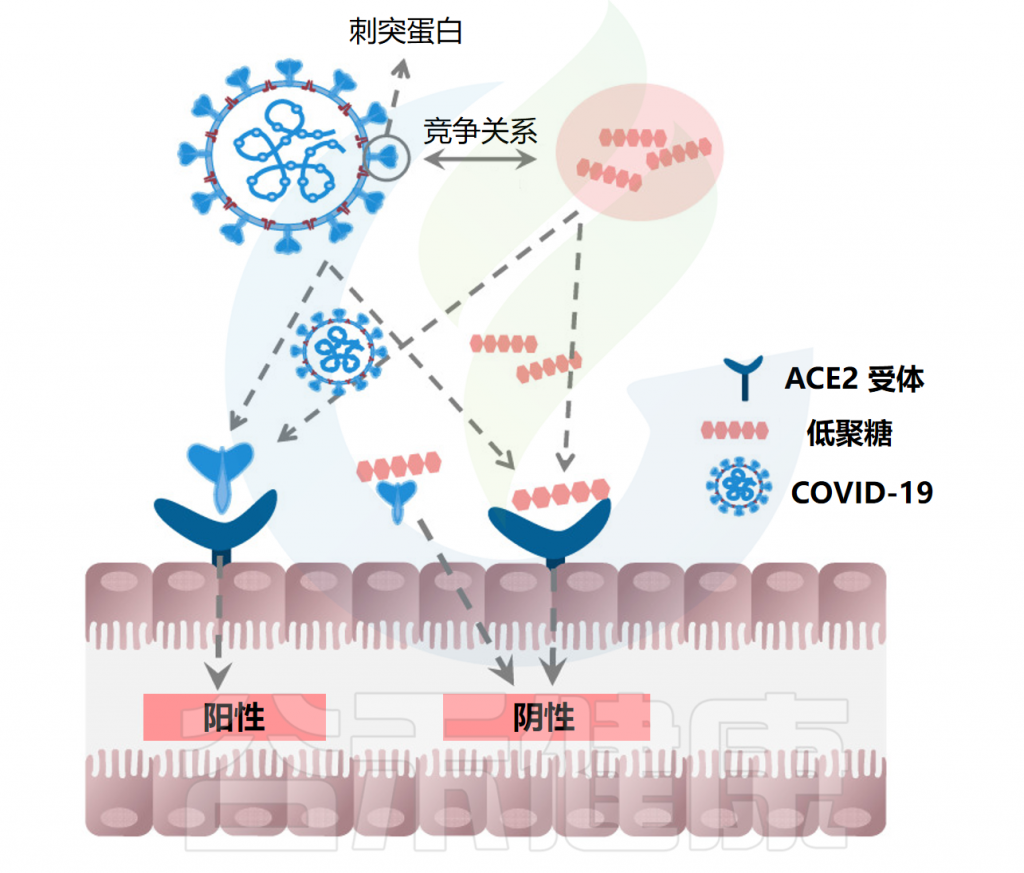
Cheong KL,et al.Pharmaceuticals (Basel).2023
• 增加肠道有益菌丰度及相关代谢物,调节炎症反应
临床研究表明,低聚果糖可通过肠-脑轴调节微生物群与大脑的交流,改善肠道多样性,减少高5-羟色胺状态和多巴胺代谢紊乱。粪便代谢物分析显示,COVID-19患者在疾病消退前后短链脂肪酸浓度显著降低。
有证据表明,低聚糖可以增加产生短链脂肪酸的细菌和短链脂肪酸的产生。例如,蔓越莓阿拉伯木聚糖和果胶低聚糖促进了嗜酸乳杆菌、植物乳杆菌和发酵乳杆菌等乳酸菌物种的生长,也增加了短链脂肪酸的产生,其中丁酸盐是最突出的SCFA。
此外,果胶低聚糖或菊粉可以通过特异性增加B.vulgatus的丰度来差异调节炎症反应。B.vulgatus具有强大的免疫调节作用,有助于预防结肠炎等炎症。
低聚糖在减少COVID-19后综合征方面的潜在影响

Cheong KL,et al.Pharmaceuticals (Basel).2023
低聚糖已广泛存在于我们的食品和生活中,作为一种重要的益生元,它通过调节肠道微生物群的组成和功能,促进有益代谢物的生成,从而对人体健康产生积极影响。在缓解各种人类慢性疾病(如糖尿病、抑郁症、便秘、结肠炎和肥胖)方面展现出巨大潜力。
但我们想要更好地利用低聚糖来开发新的膳食补充剂和功能性食品,为慢性疾病提供有效的预防和治疗策略。需要进一步研究低聚糖与肠道菌群之间的相互作用,进一步探索低聚糖在不同慢病中的具体机制,并比较不同低聚糖类型的作用。
这将有助于揭示低聚糖的功能差异,为开发针对特定疾病的个性化营养干预方案提供科学依据,并推动低聚糖在功能性食品和临床治疗中的应用。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Slater AS, Hickey RM, Davey GP. Interactions of human milk oligosaccharides with the immune system. Front Immunol. 2025 Jan 14;15:1523829.
Yuan M, Zhang Z, Liu T, Feng H, Liu Y, Chen K. The Role of Nondigestible Oligosaccharides in Alleviating Human Chronic Diseases by Regulating the Gut Microbiota: A Review. Foods. 2024 Jul 8;13(13):2157.
Wu Y, Chen Y, Lu Y, Hao H, Liu J, Huang R. Structural features, interaction with the gut microbiota and anti-tumor activity of oligosaccharides. RSC Adv. 2020 Apr 24;10(28):16339-16348.
Cheong KL, Chen S, Teng B, Veeraperumal S, Zhong S, Tan K. Oligosaccharides as Potential Regulators of Gut Microbiota and Intestinal Health in Post-COVID-19 Management. Pharmaceuticals (Basel). 2023 Jun 9;16(6):860.
Wu D.-T., Nie X.-R., Gan R.-Y., Guo H., Fu Y., Yuan Q., Zhang Q., Qin W. In Vitro Digestion and Fecal Fermentation Behaviors of a Pectic Polysaccharide from Okra (Abelmoschus esculentus) and Its Impacts on Human Gut Microbiota. Food Hydrocoll. 2021;114:106577.
Wang X., Yang Z., Xu X., Jiang H., Cai C., Yu G. Odd-Numbered Agaro-Oligosaccharides Alleviate Type 2 Diabetes Mellitus and Related Colonic Microbiota Dysbiosis in Mice. Carbohyd. Polym. 2020;240:116261.
Huang C., Yu Y., Li Z., Yan B., Pei W., Wu H. The Preparation Technology and Application of Xylo-Oligosaccharide as Prebiotics in Different Fields: A Review. Front. Nutr. 2022;9:996811.
Divyashri G., Karthik P., Murthy T.P.K., Priyadarshini D., Reddy K.R., Raghu A.V., Vaidyanathan V.K. Non-Digestible Oligosaccharides-Based Prebiotics to Ameliorate Obesity: Overview of Experimental Evidence and Future Perspectives. Food Sci. Biotechnol. 2023;32:1993–2011.
谷禾健康
让食物成为你的药物,让药物成为你的食物
随着现代生活节奏的加快,疲劳、压力、不均衡的饮食,都在悄悄侵蚀着我们的健康。多糖,这些来自植物、真菌乃至海洋生物的天然赠礼,正以其独特的方式,为我们提供了一种全新的健康支持。
多糖由单糖通过糖苷键结合而成的高分子碳水化合物。研究表明,多糖具有多种生物活性,包括调节免疫功能、降低血脂和血糖、抗癌、抗病毒、抗肥胖、抗精神病、抗氧化、抗炎、抗凝血、止吐、抗辐射等作用。因此,多糖已成为最重要的天然成分之一,并引起了世界上越来越多研究者的关注。
虽然部分多糖如淀粉可以在人体胃和小肠中被消化吸收,但仍有许多特殊结构的多糖不能在这两个部位分解。对于那些不能被宿主消化的多糖,它们可以进入结肠,而结肠是大多数肠道菌群居住的地方。在结肠中,多糖可以与肠道菌群相互作用,从而发挥营养或药理作用。
多糖与肠道菌群之间相互作用可以影响健康,同时也通过肠道菌群的代谢作用,转化为有益的代谢产物,如短链脂肪酸,这些产物对维持肠道屏障的完整性、调节免疫反应发挥着至关重要的作用,甚至扩展到了全身的健康状况,可以影响我们的精力水平、情绪状态,对疾病的抵抗力等方方面面。
本文将深入探讨多糖,了解其在人体内的消化过程、与肠道菌群的相互作用,以及它们如何通过调节肠道菌群代谢物影响健康,如短链脂肪酸、三甲胺、色氨酸,还讨论了多糖在疾病预防和治疗中的应用,包括它们在改善代谢性疾病、炎症性肠病、缓解疲劳、改善肿瘤,神经系统疾病等方面的潜在效果。这为靶向肠道菌群开发新型的营养补充剂和药物提供了新的思路。

本文目录
01 多糖
02 多糖调节肠道菌群的组成
为什么多糖可以调节肠道菌群的组成?
多糖促进或抑制肠道微生物群
多糖分子量、糖苷键影响其细菌调节活性
03 肠道微生物将多糖代谢为短链脂肪酸
短链脂肪酸的生物学效应
人体内的多糖代谢
多糖补充与短链脂肪酸的生成
04 多糖调节其他肠道微菌群代谢物
三甲胺和氧化三甲胺(TMAO)
色氨酸及其代谢产物
胆汁酸、脂多糖、胃肠道气体
05 多糖调节肠道菌群修复肠道屏障
06 多糖通过肠道菌群改善疾病
2型糖尿病、非酒精性脂肪肝、肥胖、高血脂症
炎症性肠病、其他肠胃疾病、肿瘤
疲劳、神经系统疾病(认知障碍、抑郁等)
07 部分多糖营养与菌群调节
路易波士茶多糖、地黄多糖、五指毛桃根多糖
大蒜多糖、槐耳多糖、黄芩多糖、枸杞多糖
岩藻多糖、桑叶多糖、沙棘多糖、蘑菇多糖
08 结语
糖,这个小小的分子,是能量的源泉,是细胞的加油站。除了我们熟知的葡萄糖以外,还有一种叫做多糖,由许多糖分子手拉手组成,从植物的根茎到海洋生物的细胞壁,它们以复杂多样的形态存在。
根据糖单元的数量,碳水化合物可分为几类:
多糖是由多个单糖分子通过糖苷键连接而成的聚合物,属于高分子碳水化合物。它们广泛存在于自然界中,包括植物、真菌和海藻等生物体内。根据其来源和结构特性,多糖具有多种生物活性,如免疫调节、抗氧化、抗肿瘤等。
多糖是由10个以上相同或不同的单糖通过α或β糖苷键连接而成的大分子化合物,分子量从几万到数百万。
多糖的空间构象非常复杂,具有一级、二级、三级和四级结构。研究表明,多糖的活性与其结构密切相关。此外,通过分子修饰,如乙酰化、硫酸化、羧甲基化、硒化、磷酸化和磺化等可显著提高多糖的生物活性。
根据来源和结构的不同,多糖可以分为天然多糖和合成多糖,其中天然多糖又可根据其在自然界中的分布分为植物多糖、动物多糖、微生物多糖等。
例如,透明质酸和硫酸软骨素属于动物多糖,而纤维素、淀粉和糖原是常见的植物多糖。
淀粉
由大量葡萄糖分子通过α-1,4-糖苷键和α-1,6-糖苷键连接而成,形成直链淀粉和支链淀粉两种结构。广泛存在于谷物(如大米、小麦、玉米)、薯类(如土豆、红薯)等食物中。在人体消化过程中,被淀粉酶逐步分解为葡萄糖,为身体提供能量。
纤维素
由葡萄糖分子通过β-1,4-糖苷键连接而成,形成长而直的链状结构。是植物细胞壁的主要成分,在蔬菜(如芹菜、菠菜)、水果(如苹果)中含量丰富。由于人体缺乏分解β-1,4-糖苷键的酶,纤维素难以被人体消化吸收,但对促进肠道蠕动、预防便秘等具有重要作用。
果胶
是一种复杂的多糖,由半乳糖醛酸等组成。常见于水果(如柑橘、苹果)中。在食品工业中,常用于制作果酱、果冻等,增加其黏稠度和稳定性。
尽管功能性糖因其在健康和疾病预防中的潜在作用而受到越来越多的关注,但它们的天然可用性相对较小。这意味着,为了充分利用这些有益的分子,需要采用特定的提取方法来增加它们的可获得性,多糖提取常用的方法有热水提取、酸提取、碱提取和酶水解等。
近年来,一些新的方法,如超声波提取、微波提取、超滤、高压电场法、超临界流体萃取、亚临界水萃取等也用于多糖的提取。这些方法不仅能够提高多糖的提取率,还能够在一定程度上保护多糖的结构完整性,从而保留其生物活性。
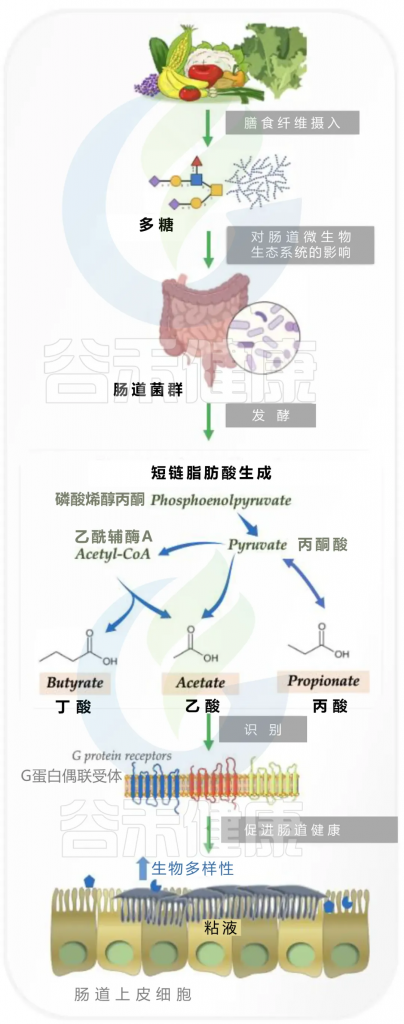
通常,人体分泌的消化酶只能分解几种多糖,而纤维等许多多糖不能被吸收和直接使用。因此,多糖可以通过小肠进入结肠,这是大多数肠道细菌居住的地方,然后与肠道微生物群相互作用。
细菌在肠道中通过发酵降解多糖
doi.org/10.3390/nu14194116
多糖转化为短链脂肪酸
首先与多糖能够发酵生成酸性的短链脂肪酸密切相关。未电离的短链脂肪酸能够穿过细菌细胞膜,对肠道细菌产生一系列影响,例如改变DNA合成和氨基酸摄取。
短链脂肪酸对肠道细菌的影响
例如,短链脂肪酸能够通过调节侵袭基因的表达,抑制沙门氏菌(一种常见的食源性病原体)的生长。因此,短链脂肪酸的增加可以改变肠道菌群的功能,进而影响其组成。
肠道pH值的变化
短链脂肪酸的增加还会导致肠道pH值下降,影响细菌的适应能力。每种细菌都有其适宜的pH范围,不同细菌在特定pH条件下的适应能力各异。
多糖的降解产物作为能量来源
多糖对肠道菌群组成的调节作用还与其降解产物有关。一些肠道细菌能够利用多糖的降解产物作为碳源和能量来源,而另一些细菌则不能。
综上所述,多糖通过影响肠道菌群的代谢功能,直接调节了肠道菌群的组成。这些发现为我们理解多糖如何通过肠道菌群影响宿主健康提供了新的视角。
多糖的益生元效应
具有选择性刺激有益微生物生长能力的多糖被称为益生元,例如果聚糖,它能丰富乳酸菌和/或双歧杆菌。这些有益细菌的减少与糖耐量受损密切相关。一些多糖能够丰富这些细菌,因此可以用来改善糖尿病表型。
多糖抑制病原菌
病原菌在胃肠道中的定植和增加会导致一系列疾病,而抑制它们可以控制疾病的严重程度。例如,致病性 Sutterella、Desulfovibrionaceae、Streptococcaceae 、Clostridium 的比例较高与肥胖发展呈正相关。
多糖的双向调节作用
疾病的发生是一个复杂的过程,涉及不同的微生物,包括有害细菌和有益细菌。例如:
多糖能够对肠道微生物发挥双向调节作用,即促进有益细菌的同时抑制有害细菌。
例如,口服灰树花多糖(GFHP)对非酒精性脂肪肝病的积极作用与调节肠道菌群有关。
在分子量方面,不同分子量的魔芋葡聚糖(KGM)对2型糖尿病(T2DM)大鼠的降血糖作用研究表明,中等分子量的KGM显著增加了Muribaculaceae,减少了Romboutsia和Klebsiella,但高分子量和低分子量的KGM对这些细菌的影响不显著。
灵芝的低分子量多糖(<10 kDa)具有更好的发酵和更高的产气能力,刺激肠道细菌快速生长。另一方面,高分子量多糖(>100 kDa)更难被肠道细菌发酵,并且在肠道中的停留时间更长,导致对肠道微生物群的影响更长。
高分子量的黄芪多糖具有一定的生物活性,但其相对分子量较大,溶解性差,生物利用度低,限制了其功效的发挥。低分子量的黄芪多糖具有较好的水溶性,能够在更大程度上刺激巨噬细胞摄取中性红、NK细胞增殖,发挥免疫活性。
多糖由各种通过糖苷键连接的单糖组成,糖苷键的类型和位置导致肠道微生物群的选择性发酵存在差异。
多糖的单糖组成越复杂,调节细菌的活性越强
一项关于龙眼多糖和燕麦多糖的研究表明,龙眼多糖能显著促进干酪乳杆菌、嗜酸乳杆菌、植物乳杆菌、粪肠球菌的增殖,但燕麦多糖的作用并不明显。原因是龙眼多糖由葡萄糖、甘露糖和阿拉伯糖组成,而燕麦多糖的单糖主要是葡萄糖。
短链脂肪酸(SCFA)是一组含有少于六个碳的脂肪酸,包括甲酸盐、乙酸盐、丙酸盐、丁酸盐、戊酸盐。
乙酸盐、丙酸盐和丁酸盐是肠道中的主要SCFA,约占所有SCFA的95%,三者的比例约为3:1:1。
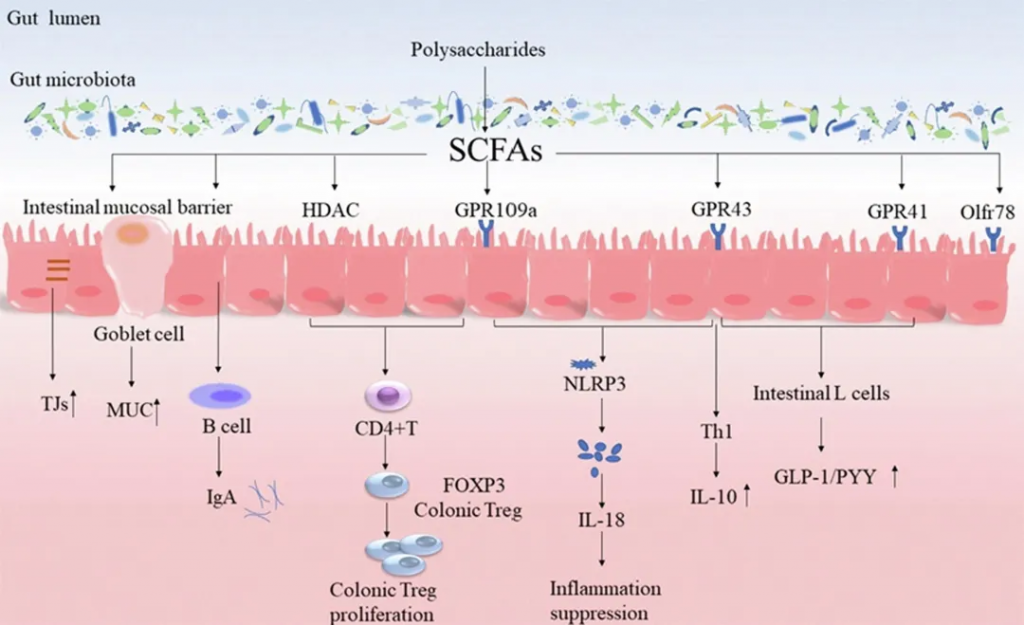
作为肠道微生物群和宿主的重要能量来源,短链脂肪酸通过不同的作用模式在健康和疾病中发挥着重要作用。
作用机制
与GPRs的相互作用
抗炎作用
免疫调节
HDAC抑制作用
丁酸盐的作用
与疾病的关系
多糖对SCFA的调节及其对靶标的影响
doi.org/10.1016/j.foodres.2022.111653
人体内消化酶的局限
在人体消化系统中,我们自身分泌的消化酶往往难以分解复杂的多糖。这些多糖分子,因其结构复杂,通常在我们体内无法被有效代谢。
肠道菌群的代谢作用
我们的肠道菌群拥有破解这些复杂多糖的秘密武器——一系列的酶,统称为碳水化合物酶(CAZymes)。这些酶能够分解多糖,将其转化为对人体健康有益的短链脂肪酸。
碳水化合物酶的种类
肠道菌群中的“专家”与“通才”
在肠道菌群中,拟杆菌门和厚壁菌门是编码CAZymes的两大主力。
多糖的初步降解
在属的水平上,多糖最初可以由某些微生物降解,例如双歧杆菌属、真杆菌属、梭菌属、罗氏菌属(Roseburia spp.)。
SCFAs的生成途径
尽管人体自身无法分解复杂的多糖,但我们的肠道菌群却具备了这一能力,它们通过一系列特殊的酶,将多糖转化为对人体健康有益的短链脂肪酸。
多糖对SCFAs生成的促进作用
饮食补充多糖可以为产生SCFAs的细菌提供有利的生长环境,从而促进SCFAs的生成。例如,沙棘多糖(CCPP)通过调节肠道菌群和SCFAs,能够缓解2型糖尿病。
沙棘多糖调节肠道菌群和SCFAs,缓解2型糖尿病
枸杞多糖调节肠道菌群,提高SCFAs
多糖结构对短链脂肪酸生成的影响
不同的多糖因其分子结构的不同,对SCFAs的调节作用也不尽相同。
多糖的疗效与SCFAs的非直接关联
尽管大多数多糖可以被代谢成SCFAs,但它们的疗效并不一定与SCFAs直接相关。
多糖通过调节肠道菌群和促进SCFAs的产生,对健康具有多方面的益处。然而,多糖的结构与它们对SCFAs生成的调节作用之间的关系仍需进一步研究。此外,多糖的疗效可能不仅限于SCFAs的产生,还可能涉及肠道菌群产生的其他分子。
在肠道微生物群的作用下,脂质和蛋白质等饮食成分可以代谢为一系列代谢产物,如三甲胺-N-氧化物(TMAO)、色氨酸、脂多糖(LPS)等。此外,肠道微生物群还可以与宿主合成和释放的化合物相互作用。例如,肠道微生物群可以将初级胆汁酸(BA)转化为次级胆汁酸。由于肠道微生物群的组成与肠道微生物群代谢物的产生直接相关,因此可以推断,除了SCFAs,多糖还可以调节其他肠道微生物群代谢产物,如BA。
三甲胺和TMAO的代谢过程
在肠道中,饮食中的四胺类物质如胆碱、L-肉碱和卵磷脂(来自红肉、鸡蛋、鱼、海鲜)首先被微生物胆碱三甲胺裂解酶分解成三甲胺(TMA)。随后,TMA被吸收进入门脉循环,并运输到肝脏,在黄素单加氧酶1和黄素单加氧酶3的作用下转化为三甲胺-N-氧化物(TMAO)。
TMAO的潜在危害
值得注意的是,TMAO是一种潜在的有害代谢产物。多项研究指出,TMAO水平的增加与多种疾病的发生和发展呈正相关。例如,TMAO可以直接增强血小板的反应性,促进血栓形成,并通过激活核因子κB(NF-κB)和NLRP3炎症体影响血管炎症。
多糖对TMA和TMAO代谢的影响
最近的研究表明,TMA和TMAO在理解多糖的作用机制中扮演重要角色。例如:
不同多糖对肠道菌群的调节作用
不同的多糖可以通过调节相同的肠道细菌来降低TMA和TMAO的代谢,例如变形菌门。研究表明,变形菌门负责TMA的转化,增加变形菌门可能导致TMA增加。然而,也有研究表明TMAO与变形菌门呈负相关,这表明多糖调节变形菌门与TMA产生的效应之间的关系需要进一步研究。
多糖通过调节肠道菌群,影响TMA和TMAO的代谢,从而可能对人体健康产生积极影响。然而,多糖与TMAO之间的关系复杂,需要更多的研究来阐明这些相互作用的确切机制。
色氨酸代谢的重要性
色氨酸(Trp)是人体必需的氨基酸。它的代谢可以分为内源性代谢和细菌性代谢。内源性代谢主要通过犬尿氨酸途径(KP)和5-羟色氨酸途径进行,前者产生犬尿氨酸(KYN)、犬尿酸(KA)、烟酸、黄嘌呤酸等,后者转化为5-羟色氨酸(5-HT)和褪黑素。
色氨酸代谢物的生理功能
增强免疫:色氨酸可加强免疫力,减少炎症。
神经保护:KA作为谷氨酸受体拮抗剂,具有神经保护和抗惊厥作用,还能调节能量代谢。
情绪调节:5-HT作为神经递质,可调节情绪、肠道通透性和肠道蠕动。
肠道菌群在色氨酸代谢中的作用
肠道细菌代谢色氨酸产生吲哚及其衍生物,如吲哚丙酸、吲哚乙酸等,这些物质可以缓解炎症,促进肠道上皮屏障功能。肠道菌群的色氨酸代谢异常与肠易激综合症、代谢综合症和结肠癌等疾病有关。例如,结肠癌患者常伴有色氨酸水平下降和KP代谢物水平升高。
多糖影响肠道微生物色氨酸代谢,从而改善疾病
吲哚是硫酸吲哚酚的前体,是一种蛋白结合尿毒症毒素,是心血管疾病的危险因素。对于患有终末期肾病心血管疾病的患者,吲哚水平升高,患者粪便中产吲哚细菌丰富。
总的来说,多糖可以通过调节肠道菌群来改变色氨酸代谢,最常见的是增加乳杆菌和阿克曼菌,从而缓解疾病。
胆汁酸的生物合成与功能
胆汁酸(BAs)是一类由肝脏产生的特殊类固醇分子,经过肠道菌群转化。肝脏中存在两种BA生物合成途径:
CA和CDCA是体内的主要胆汁酸。经过肠道菌群的改造,CA转化为脱氧胆酸(DCA),CDCA转化为鹅去氧胆酸(LCA)。
胆汁酸受体及其作用
胆汁酸受体包括细胞表面受体和细胞内受体。细胞表面受体包括TGR5,细胞内受体包括法尼酰X受体FXR、孕烷X受体、维生素D3受体(VDR)和组成型雄烷受体。胆汁酸通过激活相应的受体调节脂质、葡萄糖和能量代谢。例如,TGR5和VDR的激活导致GLP-1和FGF19分泌,GLP-1可以改善胰岛素敏感性,FGF19可以通过抑制脂肪生成减少肝脏脂肪变性。
多糖对胆汁酸代谢的调节作用
近年来的研究表明,多糖可以通过恢复胆汁酸的代谢来缓解疾病。
多糖对胆汁酸代谢影响的总结
多糖通过调节肠道菌群的组成,特别是Bacteroides、Lactobacillus、Clostridium、Ruminococcus、Bifidobacteria,影响胆汁酸的代谢。
某些多糖如岩藻聚糖和灰树花多糖减少了Clostridium的水平,这与文献报道的促进胆汁酸转化的作用似乎矛盾,需要进一步研究确认这些肠道细菌与多糖之间的关系。
脂多糖的危害
脂多糖(LPS)是由革兰氏阴性细菌(如大肠杆菌)产生的内毒素。持续暴露于LPS或LPS异常增加,可通过减少肠道上皮细胞活性、降低肠道细胞增殖、抑制肠道细胞迁移和诱导肠道细胞凋亡等方式,导致肠道损伤。
LPS的转移还能损伤肠道,并可能通过与多种受体的相互作用,如LPS结合蛋白、簇分化14、髓样分化2和Toll样受体4,引发糖尿病、非酒精性脂肪肝病、肥胖、动脉粥样硬化等一系列疾病。
多糖对LPS产生菌的抑制作用
许多多糖能够抑制产生LPS的细菌。例如,在链脲佐素(STZ)诱导的糖尿病肾病模型中:
多糖调节肠道菌群的矛盾效应
尽管多糖可以通过调节肠道细菌来抑制LPS,但对特定细菌的调节作用可能存在矛盾。例如,作为LPS产生菌的拟杆菌门,在多糖处理后的水平变化并不一致。有研究表明,黄精多糖和蝉花多糖增加了拟杆菌门的水平,而竹荪多糖却降低了它。这些研究表明,多糖对肠道菌群的调节效应有时可能相互矛盾,需要进一步研究以确认结果。
胃肠道气体的生成
胃肠道内通过细菌发酵食物,会产生一系列气体,包括氢气(H2)、甲烷(CH4)、二氧化碳(CO2)、硫化氢(H2S)和一氧化氮(NO)。这些气体在胃肠道中发挥着调节作用,例如影响结肠蠕动、神经通讯、血管功能和免疫反应等。
气体产生的部位和作用
CO2 主要在胃中产生,而其他气体如 H2、CH4、CO2 和 H2S 主要在小肠和结肠中产生。
这些气体对人体健康至关重要,它们可以调节肠道功能,影响营养物质的吸收和疾病的发生。
多糖对气体产生的调节
尽管多糖对 H2、CH4 和 CO2 的产生有明显影响,但关于多糖结构与气体产生之间具体关系的研究会相对较少。需要更多的研究来明确这些关系,以及多糖如何通过影响肠道菌群来调节气体的产生。
肠道菌群是一个复杂的微生物群落,具有显著的组成和功能多样性。不同的微生物可以介导相同或不同的代谢物的产生,相同的微生物也有助于不同代谢物的生产。
例如,持续的研究表明:
拟杆菌门(特别是Bacteroides thetaiotaomicron、Bacteroides fragilis)、厚壁菌门(如Clostridiaceae、Erysipelotrichia)、以及变形菌门可以促进TMA的产生。
放线菌门(如Bifidobacteria)、厚壁菌门(如Lactobacillus、Clostridium、Peptostreptococcus)、拟杆菌门(如Bacteroides)可以促进色氨酸(Trp)的转化。
双歧杆菌、乳酸菌、梭菌、Peptostreptococcus、拟杆菌也有助于次级胆汁酸(BAs)的产生。
因此,就像肠道菌群组成的调节一样,多糖对特定肠道菌群代谢物功能的调节作用不是孤立的。
肠道是我们抵御外界有害物质和病原体侵袭的第一道防线。它由多个层次的子屏障构成:
生物屏障:由肠道细菌和病毒组成;
化学屏障:包含免疫球蛋白A(IgA)、抗菌肽(AMPs)和粘液(MUC);
物理屏障:由肠道上皮细胞构成;
免疫屏障:含有T细胞、B细胞、巨噬细胞和树突细胞等免疫细胞。
这些子屏障协同工作,限制病原体与肠道的接触,维持肠道稳定。肠道屏障的损伤与多种疾病正相关,包括肠易激综合症(IBS)、代谢综合征、过敏、肝脏炎症等。
肠道菌群及其代谢物可以直接或间接影响肠道屏障:
越来越多的证据表明,多糖通过调节肠道菌群对肠道屏障有益。正常的肠道菌群组成可以通过竞争性排除,通过消耗营养源和占据附着位点,作为抵御外界病原体的屏障。
多糖→ 调节肠道菌群→ 修复肠道屏障
肠道菌群可以刺激宿主产生抗菌化合物,如IgA和AMPs,这些是化学屏障的关键组成部分。
例如,菊粉型果聚糖可以促进乳杆菌的丰度和IgA的分泌。在DSS诱导的溃疡性结肠炎小鼠模型中,金银花多糖通过增加双歧杆菌和乳杆菌,增加了分泌型IgA含量,从而调节肠道屏障。
在DSS诱导的结肠炎小鼠中,海蜇皮多糖增加Akkermansia,Akkermansia muciniphila作为粘液的降解者,可以增强肠道屏障的完整性,减少炎症。同时海蜇皮多糖增加结肠中TJs和MUC2的表达,保护了肠道屏障。
多糖→ 短链脂肪酸→ 修复肠道屏障
短链脂肪酸和胆汁酸等肠道菌群代谢物在调节肠道屏障功能中也扮演重要角色。
多糖→ 色氨酸和胆汁酸代谢→ 修复肠道屏障
这些研究表明,多糖可以通过调节肠道菌群及其代谢物,维护肠道屏障的完整性。
代谢性疾病包括一组因碳水化合物、脂质和蛋白质代谢错误而导致的疾病。2 型糖尿病 (T2DM)、非酒精性脂肪性肝病 (NAFLD) 和肥胖是常见的代谢性疾病。
生活方式干预、全身药物治疗和外科手术等多种方法被用于预防和治疗代谢性疾病。尽管代谢性疾病的药物治疗取得了最新进展,但潜在的不良反应仍然是关键挑战。
使用天然物质的药物治疗被认为是改善代谢疾病的一种有前途且可行的方法。
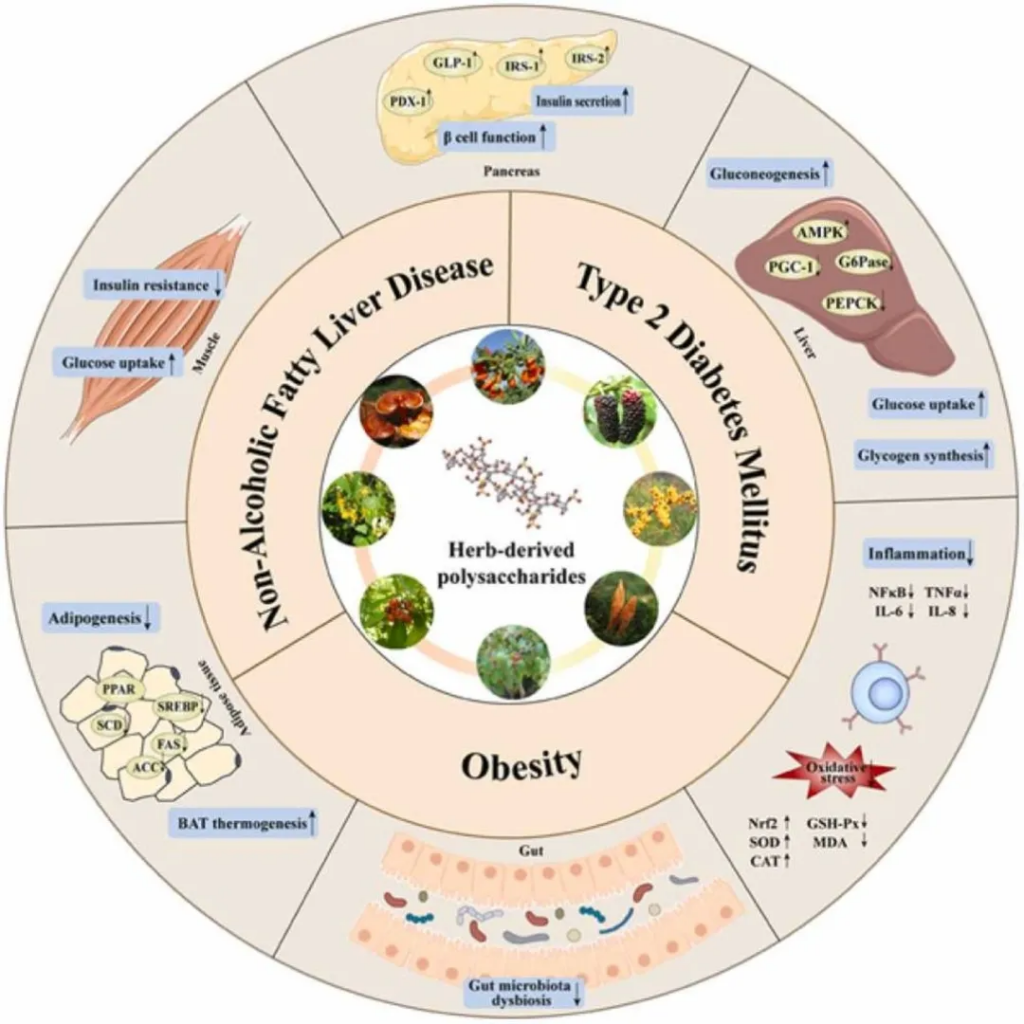
doi.org/10.1016/j.biopha.2023.114538
多糖通过多种机制在治疗2型糖尿病方面表现出良好的效果,比如:
肠道菌群在代谢紊乱,特别是 2 型糖尿病的发展中起着重要作用。
◤车前子多糖 对 STZ 诱导的 2 型糖尿病大鼠有抗糖尿病作用,这可能与其调节肠道菌群和增加短链脂肪酸水平有关。车前子多糖可显著增加糖尿病大鼠粪便中Bacteroides vulgatus、发酵乳杆菌、Prevotella loescheii、Bacteroides vulgates等结肠细菌的多样性和丰度,以及短链脂肪酸的浓度。
◤桑果多糖 可以丰富糖尿病小鼠的功能菌并调节微生物多样性。具体而言,该多糖显著富集了一些有益细菌(拟杆菌目、乳杆菌属、Allobaculum、拟杆菌属、阿克曼菌属),同时减少了一些致病菌(葡萄球菌、棒状杆菌属、Jeotgalicoccus、Aerococcus、Enterococcus、Facklamia)。
◤罗布麻叶的两种富含多糖的提取物改善了糖尿病小鼠的肠道微生物群失调,包括增加了Odoribacter、Anaeroplasma、Parasutterella、Muribaculum的丰度,并降低了肠球菌属、克雷伯菌属、Aerococcus的丰度。这可能有助于它们的抗糖尿病作用。
◤菊粉补充增加了双歧杆菌的丰度并增强了肠道屏障的完整性,这与2型糖尿病呈负相关。
◤青钱柳叶中分离的多糖通过增加 SCFAs 含量和有益的肠道细菌瘤胃球菌科来减轻 HFD/STZ 诱导的 2 型糖尿病大鼠的糖尿病症状。
◤苦瓜中的天然多糖通过增加 SCFAs 含量和Prevotella loescheii、Lactococcus laudensis 的丰度来改善 HFD/STZ 诱导的 2 型糖尿病大鼠的高血糖、高脂血症、高胰岛素血症。
◤天然南瓜多糖通过增加阿克曼氏菌和减少丹毒丝菌科(Erysipelotrichaceae)来显示出对 HFD/STZ 诱导的 2 型糖尿病的降血糖作用。此外,南瓜多糖还能增加 2 型糖尿病模型中肠道短链脂肪酸的产生。
◤灵芝多糖(GLP)通过恢复HFD/STZ诱导的肠道微生物群失调,特别是通过增加Blautia、拟杆菌、Dehalobacterium、Parabacteroides,以及减少有害的肠道细菌Aerococcus、Corynebacterium、Ruminococcus、Proteus,显示出抗糖尿病作用。
◤薏苡仁多糖通过降低厚壁菌门/拟杆菌门的比例和增加SCFAs的含量,在HFD/STZ诱导的T2DM小鼠模型中表现出降血糖活性。
◤葡甘聚糖作为铁皮石斛、芦荟和魔芋的天然多糖,通过增加厚壁菌门的丰度和减少拟杆菌门、变形杆菌的丰度,改善HFD/STZ喂养大鼠的T2DM代谢紊乱。
多糖对改善NAFLD具有有益作用,比如:
多糖可以改善肠道菌群失调并保护非酒精性脂肪性肝动物的肠道屏障完整性
◤枸杞多糖结合有氧运动通过改善肠道菌群失调改善 NAFLD,包括调节肠道菌群的丰度和多样性,增加微生物代谢产物 SCFA 的水平,减少变形菌和厚壁菌门/拟杆菌门的比例。厚壁菌门和拟杆菌门是参与宿主代谢和脂肪积累的关键细菌。
◤麦冬多糖可以通过调节肠-肝轴显著保护 NAFLD。具体来说,这种多糖显著降低了一些有害细菌的相对丰度,包括乳球菌、肠杆菌、Turicibacter、Clostridium- sensu-stricto -1、Tyzzerella、Oscillibacter,并增加一些有益菌的相对丰度,如Alistipes、Ruminiclostridium、Rikenella。这种多糖还显著增加了两种产SCFAs菌( Butyricimonas、Roseburia )的丰度以及乙酸和戊酸的水平,从而改善了炎症反应和肝脏脂质代谢。
◤灰树花杂多糖可通过调节肠道菌群来改善高脂饮食诱导的NAFLD,包括显著增加Allobaculum、拟杆菌属和双歧杆菌属丰度,减少Acetatifactor、Alistipes、Flavonifractor、Paraprevotella、Oscillibacter的丰度。
◤黄芪多糖可减轻HFD喂养小鼠的NAFLD,丰富了脱硫弧菌属,尤其是作为SCFAs、乙酸的产生者的Desulfovibrio vulgaris,减轻肝脂肪变性。
◤诺尼果多糖来源于辣木,通过促进短链脂肪酸的产生缓解HFD喂养小鼠的NAFLD,并通过改善肠道微生物群的多样性和组成逆转HFD诱导的肠道微生态失调。
◤核桃青皮多糖通过提高肠微生物群(包括普氏菌科、Allobaculum)的SCFAs含量和丰度,预防HFD喂养大鼠的肥胖和NAFLD。
◤从贻贝中提取的贻贝多糖,α-D-葡聚糖(MPA)可保护HFD喂养的大鼠的NAFLD,补充MPA可逆转HFD抑制的微生物微生态失调和SCFAs。
◤海带可溶性多糖通过降低厚壁菌门/拟杆菌门的比例,促进Verrucomirobia和丙酸盐产生菌拟杆菌和阿克曼菌,减轻高脂饮食喂养小鼠的NAFLD。
多糖通过多种机制表现出良好的抗肥胖作用,作用机制如:
◤枸杞多糖补充剂可降低厚壁菌门与拟杆菌门的比例,增加产短链脂肪酸菌,如Lacticigenium、Butyricicoccus、Lachnospiraceae_NK4A136_group数量,从而改善肥胖小鼠的肠道菌群失调。
◤桑叶多糖治疗可调节肥胖小鼠肠道菌群的组成和功能,这与增加Allobaculum、Parabacteroides、Porphyromonadaceae、Butyricimonas、Ruminococcus 的水平有关。
◤黄精多糖调节HFD喂养的肥胖大鼠的肠道微生物群结构,包括降低梭菌、肠球菌、Coprobacillus、乳球菌、Sutterella的相对丰度。
◤沙蒿多糖给药8周显著上调了屏障完整性的结肠基因,并通过增加有益细菌(双歧杆菌和Olsenella)和抑制有害细菌(Mucispirillum和幽门螺杆菌)改善了肥胖小鼠的肠道微生物微生态失调。同时,它显著富集了与促进SCFAs产生相关的碳水化合物代谢,同时显著抑制了与肥胖和肠道微生态失调相关的氨基酸代谢。
◤从海带中提取的天然多糖可通过使肠道菌群正常化来缓解小鼠HFD引起的肥胖,特别是通过增加拟杆菌目和Rikenellaceae的丰度。
◤从杏鲍菇中分离出的蘑菇多糖通过增加产生 SCFA 的肠道细菌Anaerostipes和Clostridium 的数量,在高脂饮食喂养的小鼠中表现出抗肥胖作用。
◤茶树菇多糖对HFD诱导的小鼠脂肪堆积和减肥的影响,发现脱硫弧菌减少,副拟杆菌增加,从而显著降低肥胖相关的TNF-α 和 IL-6 的水平。
◤从苦瓜中获得的多糖通过增加有益细菌(如放线菌、Coprococcus、乳酸杆菌)和减少有害细菌(变形菌和幽门螺杆菌)来改善HFD诱导的小鼠肥胖。
◤日本刺参的硫酸多糖通过富集益生菌Akkermansia、减少携带内毒素的变形杆菌和提高SCFAs含量来预防HFD诱导的小鼠肥胖。
◤ 破壁灵芝孢子多糖能逆转 HFD 喂养小鼠中许多细菌的相对丰度,特别是一些潜在的益生菌,包括Allobaculum、双歧杆菌,这与抗肥胖呈正相关。双歧杆菌、乳杆菌和阿克曼菌可促进SCFAs的产生,并抑制梭菌科、脱硫弧菌和肠球菌的丰度,这将有助于减少体重和脂质积累。
总的来说,多糖可通过作用于多个环节、调控多个疾病相关靶点来改善这三种代谢性疾病。
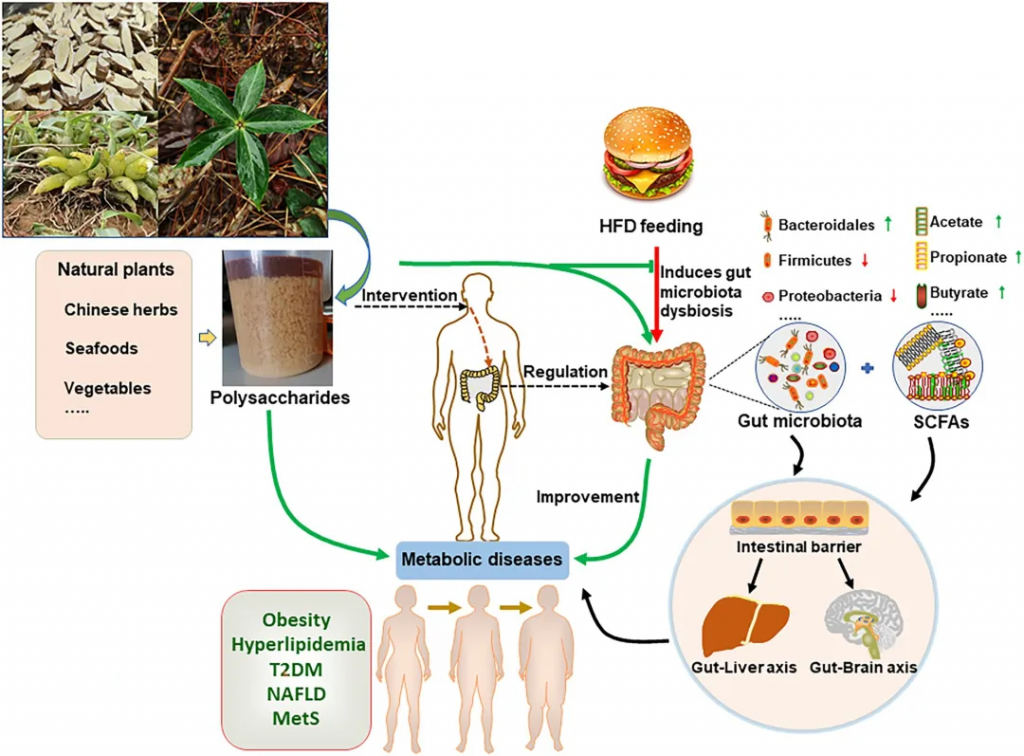
doi.org/10.3389/fmicb.2022.859206
高脂血症是指脂质代谢紊乱,其特征是甘油三酯 (TG)、总胆固醇 (TC) 和低密度脂蛋白浓度升高,同时高密度脂蛋白水平降低。
◤果胶多糖(高支链 RG-I,531.5 kDa)显著改善了 HFD 引起的脂质代谢异常,TG、TC、LDL-C 和游离脂肪酸水平降低。它还通过增加Roseburia、Clostridium等产生 SCFA 的细菌的数量来恢复肠道菌群失衡。
◤裙带菜多糖 ( Undaria pinnatifida )修复了高脂饮食引起的肠道微生物群改变,特别是Prevotellaceae_UCG-001,发现这与脂质代谢紊乱有关。
◤鲍鱼性腺多糖显著增加了丁酸水平,丁酸是一种重要的短链脂肪酸,它通过GPR依赖性途径抑制脂质相关基因的表达。
◤龙须菜多糖调节拟杆菌、瘤胃球菌_1和乳酸杆菌的相对丰度来增强胆固醇向BAs的转化。在遗传水平上,有人认为BA代谢的调节主要涉及CYP39A1和CYP7B1。
炎症性肠病 (IBD) 包括溃疡性结肠炎 (UC) 和克罗恩病 (CD),其特点是胃肠道持续炎症。IBD 的症状包括腹泻、腹胀、腹痛、便血、体重减轻和不适。
◤银耳多糖(TPs)通过多途径调节肠道菌群及其代谢物,改善了DSS诱导的溃疡性结肠炎。TPs可以增加Lactobacillus的丰度,从而改善色氨酸的分解代谢。这导致黄嘌呤酸、KA和吲哚衍生物(如5-羟吲哚、5-羟吲哚-3-乙酸、5-羟吲哚乙酰酸)的增加。
TPs还可以增加Romboutsia的水平,促进DCA的产生。因此,TPs可以通过影响色氨酸代谢和胆汁酸代谢来保护小鼠免受结肠炎的侵害。
◤金针菇多糖已被证明可以通过控制结肠微生物失调、增加短链脂肪酸和抑制 TLR4-NF-κB 信号通路来缓解结肠炎。能促进益生菌的生长,抑制致病菌的生长,恢复肠道稳态,缓解IBD症状。
◤竹荪多糖由59.84%的葡萄糖、23.55%的甘露糖和12.95%的半乳糖组成,已被证明可以通过增加粘蛋白和紧密连接蛋白的表达,抑制有害细菌(如γ-变形菌、变形菌、拟杆菌科、拟杆菌科和肠杆菌科)并增强有益细菌(如嗜酸乳杆菌)来改善肠道菌群组成和肠道屏障功能。
◤坛紫菜多糖通过上调紧密连接蛋白,增加粘液层及其分泌,调节肠道微生物群落,富集有益细菌,如拟杆菌、Muribaculum和乳酸杆菌,从而减轻DSS诱导的结肠损伤,从而改善结肠粘膜屏障的完整性。
◤白术多糖可以缓解在DSS诱导的溃疡性结肠炎小鼠模型炎症。白术多糖可以增加Butybacterium、Lactobacillus,同时减少Actinomyces、Akkermansia、Faecalibaculum、Verrucomicrobia、Bifidobacterium等。
肠道菌群的变化逆转了DSS引起的短链脂肪酸的减少以及色氨酸和色氨酸相关代谢物5-羟基-N-甲酰基犬尿氨酸和吲哚-3-乙酸的减少。白术多糖还剂量依赖性地逆转了LCA、DCA、缬氨酸、亮氨酸等的异常变化。
天然植物多糖治疗IBD的机制
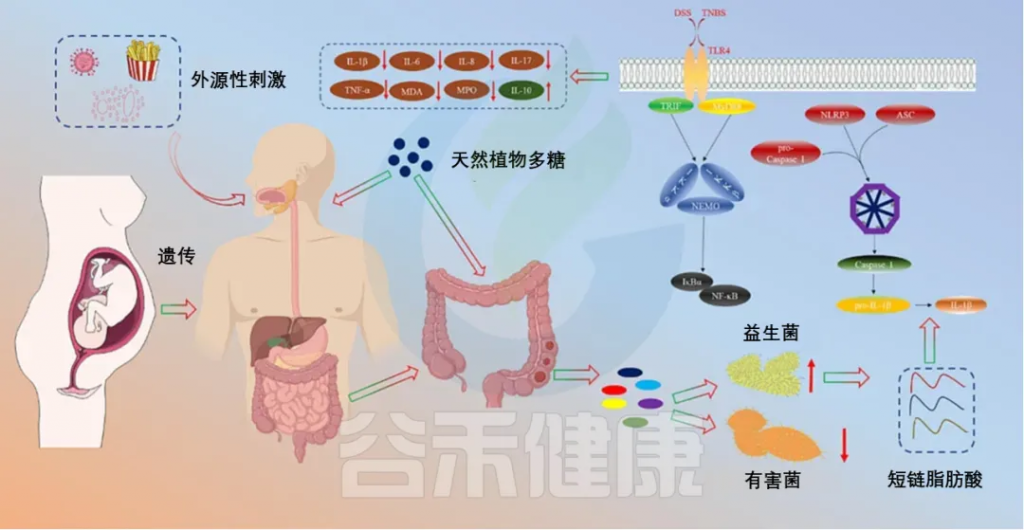
doi.org/10.1016/j.ijbiomac.2023.126799
◤甘草多糖GPS上调乳杆菌科、S24–7、Turicibacteraceae、Verrucomicrobiaceae和双歧杆菌科的丰度,下调脱硫弧菌科、瘤胃球菌科、毛螺菌科、肠杆菌科、丹毒丝菌科的丰度。GPS能促进乳杆菌、拟杆菌和产SCFAs菌的生长繁殖,起到减轻炎症、升高IL-10水平、抑制TLR4活化、降低血浆LPS水平的作用,从而保护肠道免受LPS诱导的炎症。
◤何首乌多糖(TSG)的给药显著增加了厚壁菌门和拟杆菌门的相对丰度,同时也降低了幽门螺杆菌和拟杆菌门的属水平,改善了肠道菌群,起到治疗IBD的作用。

doi.org/10.3390/nu15153321
◤乳果糖通过重塑肠道菌群组成和代谢物,改善了由洛哌丁胺引起的便秘小鼠模型中的肠道水和盐代谢。具体来说,乳果糖上调了Bacteroides的丰度,并显著降低了厚壁菌门和Verrucomicrobia的水平。
此外,乳果糖减少了胆汁酸(包括CA、DCA等)、粪便中高浓度的吲哚(高浓度吲哚对细胞有毒)并增加了丙酸。
◤西洋参多糖(WQP) 可增强大鼠肠道结构的恢复,降低炎性细胞因子水平,改善短链脂肪酸 (SCFA) 水平,促进肠道菌群和肠黏膜屏障的恢复,并减轻盐酸林可霉素引起的腹泻和菌群失调等抗生素相关副作用。
◤葛根多糖( PPL )可缓解抗生素相关性腹泻引起的结肠病理改变和肠道菌群失调。
◤紫菜中提取的多糖(Nemacystus decipiens)能显著缓解小鼠抗生素相关性腹泻(AAD)的症状,并且显著增加了 Muribaculum、Lactobacillus 和 Bifidobacterium 的丰度,降低Enterobacter 、Clostridioides 的丰度。
◤茯苓多糖(PCP)通过恢复7种肠道菌菌缓解了抗生素相关性腹泻小鼠的症状,包括:Parabacteroides distasonis、Akkermansia muciniphila、Clostridium saccharolyticum、Ruminococcus gnavus、Lactobacillus salivarius、Salmonella enterica、Mucispirillum schaedleri.
适当调节免疫反应可以降低炎症反应引起的病原体入侵的风险。
结直肠癌
◤灵芝多糖在缓解结直肠癌症状方面比瓜尔胶更有效,因为它们能增加Akkermansia、结肠长度,并下调直肠癌相关基因。灵芝多糖通过动态调节肠道菌群和宿主免疫反应,已证明具有预防和治疗癌症的功能。
灵芝多糖通过调节乳酸杆菌、双歧杆菌等有益菌的相对丰度,诱导SCFAs的产生,改善肠道屏障损伤,抑制TLR4/MyD88/NF-κB信号通路,从而降低结肠炎和致癌风险。
◤绞股蓝与灵芝多糖联合使用显著提高了SCFAs产生菌的丰度,提高了丁酸和异丁酸水平,抑制了硫酸盐还原菌的丰度。
乳腺癌
◤来自灵芝破壁孢子(分子量为 3659 Da)的多糖可作为乳腺癌治疗的天然佐剂,增加细胞毒性 T 细胞和辅助性 T 细胞的数量。
灵芝孢子提取物(ESG)重塑了4T1荷瘤小鼠的肠道菌群:厚壁菌门和变形菌门的相对丰度增加,放线菌、拟杆菌门和蓝藻的相对丰度降低。
◤灵芝多糖联合紫杉醇对4T1乳腺荷瘤小鼠有抗肿瘤作用。联合治疗能显著富集拟杆菌、瘤胃球菌等5个菌属,降低脱硫弧菌和Odoribacter的丰度,平衡肠道菌群,抑制肿瘤代谢。
疲劳是一种普遍的不适感,表现为极度疲倦和力竭,通常在生理、病理或心理失衡时出现。体力劳动、心理压力、高原缺氧和长期疾病都可能引发疲劳。疲劳不仅影响日常生活,还可能导致内分泌、免疫、代谢等系统功能受损,甚至与癌症、糖尿病等严重疾病相关。此外,疲劳还与焦虑、抑郁和神经系统疾病有关。
近年来,天然多糖因其在缓解运动性疲劳中的潜在效果和较少的副作用而受到关注。研究表明,肌肉功能与肠道菌群的多样性和组成密切相关,而天然多糖如决明子、灵芝、枸杞和冬虫夏草等可通过不同机制发挥抗疲劳作用。
doi.org/10.3390/foods12163083
多糖抗疲劳机制如下:
抗疲劳多糖干预后肠道菌群的变化
doi.org/10.3390/foods12163083
肠道-肌肉轴是肌肉与消化道之间的双向沟通,微生物可以通过微生物-肠道-肌肉轴作用于全身的肌肉。肠道微生物在膳食多糖的作用下,产生一些代谢产物(短链脂肪酸等),有些代谢产物会直接穿过肠道上皮细胞,通过血液循环直接或间接作用于肌肉组织和细胞,引起细胞发生生理生化反应,对疲劳产生一定的影响。
补充膳食多糖通过作用于肠道菌群及其代谢产物,间接激活AMPK/PGC-1α、PI3K/AKT、NF-κB、Nrf2/Keap1信号通路,调节能量代谢,降低炎症水平,增强线粒体功能和抗氧化能力,进一步维持肌肉质量和功能,从而缓解疲劳。
扩展阅读:
◤银杏叶中的一种水溶性多糖(GPS)可减轻压力引起的抑郁症并逆转肠道菌群失调。GPS 治疗可以缓解压力引起的血清素阳性和多巴胺阳性细胞密度降低。GPS 逆转了与抑郁相关的肠道菌群失调,并增加了乳杆菌的丰度,而乳杆菌已被证明是缓解抑郁的途径。
◤从秋葵中提取的多糖,发现它对抑郁小鼠的肠道菌群有明显的恢复作用,表现为厚壁菌门比例上调,拟杆菌门和放线菌门相对比例下调。这种调节有助于强化肠黏膜屏障,维持肠道免疫系统正常功能,减少肠道炎症反应,对抗抑郁有效,抑郁症小鼠的抑郁症状有所改善。用秋葵多糖治疗的小鼠体内的SCFAs显著增加,而SCFAs作为重要的通讯介质,对抗抑郁障碍有积极的影响。
◤接受金针菇多糖 (FVP)治疗的小鼠的肠道微生物组成发生显著改变,放线菌、丹毒菌和拟杆菌的丰度增加,梭菌的丰度降低,并且接受FVP治疗的小鼠的学习和记忆能力得到改善。
◤肉苁蓉多糖可以通过恢复小鼠模型中D-半乳糖诱导的衰老引起的肠道菌群稳态来抑制氧化应激和外周炎症,从而改善小鼠的认知功能。
◤从黄芪中提取的一种多糖已被证明可以通过改变糖尿病小鼠的肠道菌群来改善认知障碍。
扩展阅读:
以下是关于一些多糖的详细介绍,包括其功效,与肠道菌群的关联等,更深入地了解多糖在人体中的重要作用。
路易波士茶是什么?
路易波士茶(Rooibos)又名Aspalathus linearis,中文也有译作“路易博士茶”,取自原产于南非的一种豆科植物的茎叶。虽然带有一个茶字,但路易波士茶并不是传统意义上的茶叶。
路易波士茶因不含咖啡因、单宁含量低而受到南非人的喜爱,并在全球范围内进行商业化种植和销售。2014年,中国卫生和计划生育委员会批准路易波士茶作为新的食品原料,丰富了中国的食品和药物资源。
路易波士茶具有良好的抗氧化、抗过敏、解痉和降血糖作用。也可以预防心血管疾病、神经退行性疾病、各种癌症、骨质疏松症等。
路易波士茶多糖
一项研究从路易波士茶中分离得到均一酸性多糖(ALPs) ,水溶性多糖ALP由β-糖苷键连接,含有吡喃糖环,主要由岩藻糖、鼠李糖、阿拉伯糖和半乳糖组成。
结合RT-PCR结果推测,ALP可能通过降低Cyp2e1和Keap1的mRNA表达,增加Nrf2和HO-1的mRNA表达,激活Cyp2e1/Keap1-Nrf2-HO-1信号通路,调控下游抗氧化酶活性和炎症因子表达,减轻氧化应激损伤和炎症反应造成的损伤,从而改善急性酒精性肝损伤。
路易波士茶多糖对肠道菌群的影响
多样性
急性酒精性肝病模型对照组(MC)的物种多样性和丰富度显著降低(p≤0.05)。高剂量和低剂量ALP处理组的物种多样性和丰富度有所增加,其中高剂量组的增加更为显著。
干预后改善的菌群
ALP 干预后疣微菌丰度显著升高(p≤0.01),而脱硫杆菌丰度及F / B值均降低,但差异不显著。
肠道菌群中乳酸杆菌科的丰度与肝脏 AST 和 ALT 水平呈负相关。小鼠ALP干预后,乳酸杆菌科的丰度显著增加(p ≤ 0.05),而Rikenellaceae的丰度显著降低(p ≤ 0.05)。
ALP 显著改善了小鼠急性酒精性肝损伤中Alloprevotella和Alistipes丰度显著降低的情况( p ≤ 0.05)。
“肠-肝轴”途径
对属级别排名前20位的菌种进行了 Spearman 相关性分析。
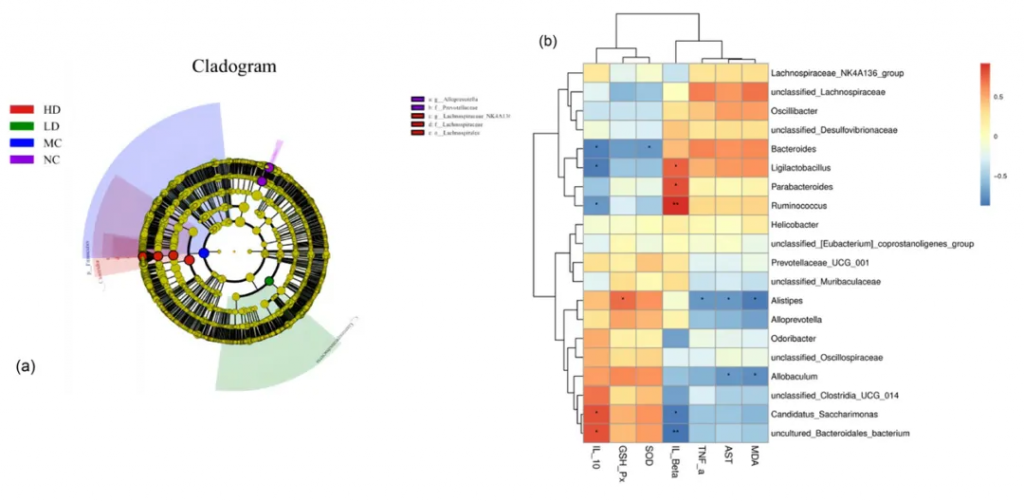
推测ALP可能通过“肠-肝轴”通路促进肠道菌群与抗氧化酶及炎症因子相互作用,从而减轻酒精性肝损伤,而上述菌群与酒精损伤标志物、抗氧化酶及炎症因子的表达均密切相关。
酒精及其代谢产物会影响肠道菌群的平衡和组成,导致肠道功能受损。这反过来又会影响肝脏健康,而肝脏健康与肠道菌群稳态密切相关。肠道和肝脏之间的相互作用被称为“肠-肝轴”通路。
地黄是玄参科地黄属植物,在我国拥有久远的药用历史,作为滋阴补肾的传统中药,也被《神农本草经》列为上品。
多糖是地黄中的主要活性成分之一。地黄多糖具有免疫调节、抗肿瘤、抗氧化、抗衰老等多种生物活性。
迄今为止,从地黄中分离纯化了20多种多糖,主要由阿拉伯糖、鼠李糖、半乳糖、葡萄糖、甘露糖、木糖、岩藻糖和半乳糖酸组成。
地黄多糖能增加DSS诱发小鼠的体质量指数和结肠长度、降低DAI评分,改善组织病理学损伤。同时,地黄多糖能阻断NF-κB信号通路,降低细胞内促炎因子表达,减轻炎症,增加紧密连接蛋白表达,维持肠道上皮屏障。
地黄多糖可能在肠道微生物作用下发酵转化为SCFAs,增加肠道中乙酸、丙酸和丁酸的含量,起到缓解IBD的作用。
拟杆菌属、乳酸杆菌属、Alistipes是导致DSS结肠炎组肠道微生物组失衡的关键细菌类型,而补充地黄多糖可以逆转这种有害变化。
五指毛桃,又叫粗叶榕(Ficus hirta Vahl),常被用作滋补品的草药成分,以其丰富的多糖含量和生物活性而闻名。
一项研究发现,FHVP-3 对肠道微生物群产生影响:
下列菌群富集:
FHVP-3 抑制了下列机会性致病菌属的丰度:
作为可发酵底物,FHVP-3 还增加了短链脂肪酸的浓度,包括乙酸盐、丙酸盐和丁酸盐。FHVP-3 对脂多糖 (LPS) 诱导的 RAW 264.7 巨噬细胞表现出显着的抗氧化活性和显着的抗炎作用。
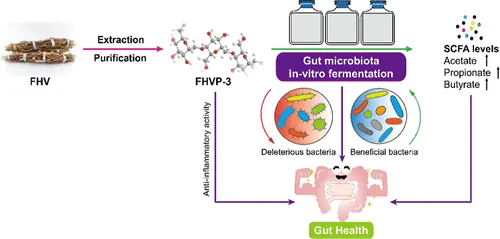
doi.org/10.1021/acsfoodscitech.3c00626
大蒜多糖 (GP) 占大蒜干重的 75% 以上。它们的特征是具有 2,1- β – d -Fruf 主链和 2,6- β – d -Fruf 分支的果聚糖。
研究表明,大蒜多糖在调节肠道微生物群方面发挥着作用,但它们是否具有维持肠道健康的全面功能并可作为有效的益生元仍不清楚。
为了探索这一点,通过管饲法给昆明小鼠施用不同剂量的大蒜多糖(1.25-5.0g/kg 体重)和菊粉(作为阳性对照),并评估它们对肠道上皮、化学和生物屏障的影响。还使用洛哌丁胺建立了便秘模型,以研究大蒜多糖对缓解便秘的潜在影响。
施用大蒜多糖显著上调昆明小鼠小肠组织中紧密连接蛋白和粘蛋白的表达。大蒜多糖提高了盲肠丁酸含量,降低了脱硫杆菌的丰度,并降低了厚壁菌门与拟杆菌门的比例(F/B)。大蒜多糖还促进了 Bacteroides acidifaciens、Clostridium saccharogumia的生长。
Tax4Fun 功能预测表明,大蒜多糖具有预防人类疾病的潜力,可降低胰岛素抵抗、传染病和耐药性的风险。
大蒜多糖还通过增强小肠转运、软化粪便稠度、加速排便和促进兴奋性神经递质的释放,在缓解洛哌丁胺引起的便秘症状方面表现出有益作用。
多年来,槐耳 (Trametes robiniophila Murr) 一直被用于药物治疗。槐耳含有多种成分,包括多糖、蛋白质、酮和生物碱,其中蛋白聚糖和多糖是主要的生物活性成分。
槐耳提取物具有免疫调节活性,并可通过激活自噬、抑制铁死亡、抑制内质网应激等过程对细胞发挥保护作用。研究表明,槐耳水提取物可通过抑制NLRP3炎症囊泡活化,减轻肠道屏障损伤和炎症反应,并抑制DSS和氧化偶氮甲烷 (AOM) 联合诱导的结肠肿瘤形成。
可缓解 DSS 引起的肠道菌群紊乱
一项小鼠研究显示,槐耳多糖干预显著逆转了 DSS 引起的Muribaculaceae_unclassified、Anaerotruncus、Ruminococcaceae_unclassified丰度的下降以及Escherichia-Shigella丰度的增加( p < 0.05)。
其中,Muribaculaceae_unclassified是健康人中发现的肠道微生物,参与丁酸代谢和色氨酸代谢,可产生对人体有益的短链脂肪酸。
相关性分析,Muribaculaceae_unclassified与结肠长度、SOD 和 T-AOC 呈正相关,而与 DAI 评分以及炎症和氧化指标呈负相关。
Anaerotruncus与结肠长度、SOD 和 T-AOC 呈正相关,但与炎症标志物 LPS、MDA 和 MPO 呈负相关。
黄芩的根通常用作药物,用于清热利湿、泻火解毒。多糖是黄芩的最重要成分之一。
一种来自黄芩的多糖通过抑制 NF-κB 信号传导和NLRP3 炎症小体活化来改善溃疡性结肠炎。在多糖的分离和纯化过程中,研究人员还获得了另一种名为 SP2-1 的均质多糖。SP2-1由甘露糖、核糖、鼠李糖、葡萄糖醛酸、葡萄糖、木糖、阿拉伯糖和岩藻糖组成。
研究人员发现其对肠道菌群紊乱、肠道屏障改善以及短链脂肪酸产生影响。
在UC患者中,SP2-1显著抑制了促炎性细胞因子IL-6,IL-1β和TNF-α。
溃疡性结肠炎患者的屏障完整性被破坏,TJ 蛋白的表达发生改变,SP2-1增加小鼠TJ蛋白的表达,修复肠道屏障。
SP2-1对肠道菌群的影响
SP2-1组的粪便微生物群多样性明显高于DSS组。
临床上,溃疡性结肠炎患者的双歧杆菌和乳酸杆菌的丰度降低。与模型组相比,SP2-1 组的双歧杆菌、乳酸杆菌和Roseburia的水平提高。
而拟杆菌和葡萄球菌的种群受到抑制。肠道菌群中存在过量的拟杆菌和葡萄球菌对肠道免疫系统有害。
Roseburia 通过调节调节性 T 细胞的发育和分化、增加抗炎细胞因子的分泌和抑制促炎细胞因子的产生来缓解UC。
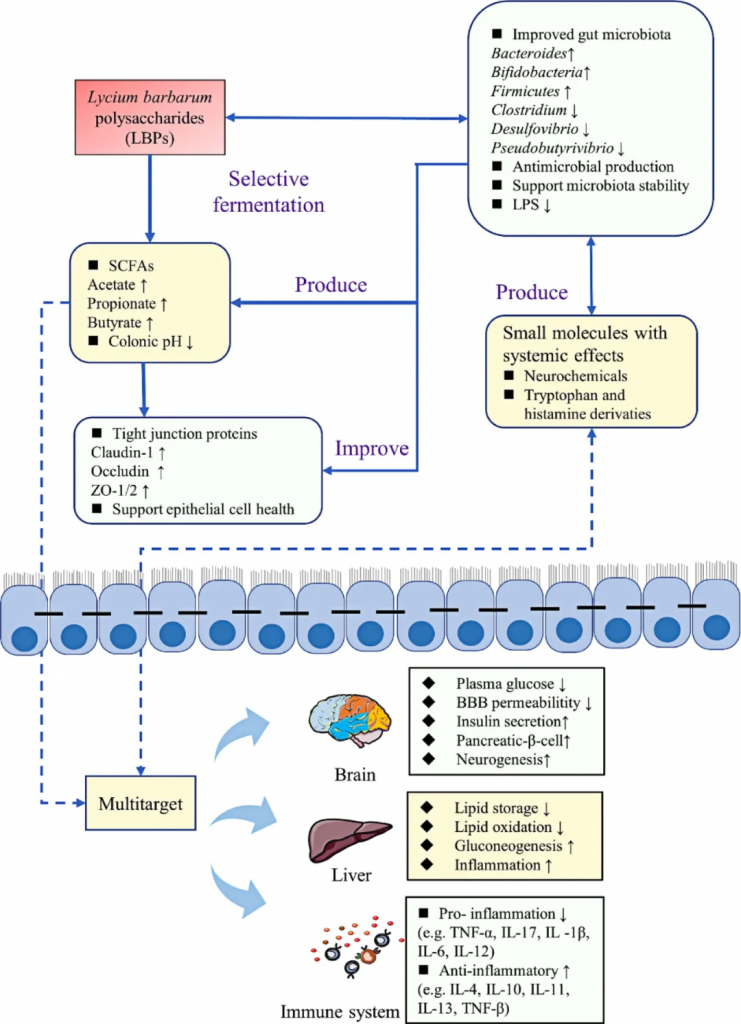
枸杞多糖(简称LBPs)是从枸杞中提取的一类多糖物质。枸杞是一种多年生灌木,属于茄科,枸杞多糖因其多样的药理活性和生理功能而受到越来越多的关注。
枸杞多糖 (LBPs)作为最重要的生物活性分子,可通过肠道微生物参与有益作用,包括调节代谢、降血糖、神经保护、抗衰老、保护各种器官免受氧化应激相关疾病的侵害。
枸杞多糖对肠道菌群的影响
癌症
一般来说,抗癌化疗药物除了会诱导癌细胞凋亡外,还会对肠道菌群产生不利影响,主要表现在肠绒毛缩短,乳酸杆菌和肠球菌丰度下降,节段丝状菌丰度增加。而枸杞多糖治疗可通过增加有益菌相对丰度来改善肠道环境和免疫功能,逆转环磷酰胺引起的有害菌(瘤胃拟杆菌科、Longibraceae、脱硫弧菌和厌氧拟杆菌科)相对丰度的增加。
还发现毛螺菌科、瘤胃菌科、脱铁菌科、脱硫弧菌科、Aneoplasmataceae与细胞因子IL-2、IL-6、IL-1β、TNF-α、IFN呈负相关。因此,主要肠道菌群的相对丰度可能与免疫调节有关。
厚壁菌门与拟杆菌门(F/B)比例的变化与许多疾病状态有关,它被视为菌群失调的重要指标,有助于了解肝脏和代谢疾病的发展。枸杞多糖可降低高脂饮食大鼠的 F/B 比,表明补充枸杞多糖有助于调节肠道菌群失调。
doi.org/10.1080/10408398.2022.2128037
神经系统
枸杞多糖可通过调节肠道菌群-肠-脑轴的神经免疫通路,对中枢神经系统产生多方面的保护作用。枸杞多糖可改善菌群失调、肠道屏障受损等问题,并通过抑制细胞凋亡、促进自噬等机制发挥神经保护效应。
肝脏
枸杞多糖能够影响NAFLD患者的肠道菌群组成、肠道屏障及肝脏炎症。
代谢(肥胖、糖尿病)
肥胖个体的研究中,肠道内F/B比例较高,因此推测肠道内F/B比例与肥胖呈显著正相关。
后续研究发现,LBPs可通过调节肠道菌群组成和短链脂肪酸生成来改善肥胖。
枸杞多糖可作为2型糖尿病的潜在辅助药物。
LBPs能调节肠道菌群,激活大鼠肠黏膜TLR2+上皮细胞γδT细胞,增强肠道屏障功能,改善糖尿病。此外,LBPs能明显降低血浆中促炎性细胞因子IL-1β、IL-6、IL-17A和TNF-α,而抗炎性细胞因子IL-10水平在糖尿病大鼠中有所升高。
哮喘
枸杞多糖还可以通过直接或间接地改变肠道菌群,参与炎症介质的调控,从而改善肺功能和过敏性哮喘症状。
肠道菌群测序分析显示,LBPs能够促进哮喘小鼠肠道中乳酸杆菌和双歧杆菌增加,并降低厚壁菌门和放线菌水平,通过肠道介导缓解哮喘。
岩藻糖(Fucose),参与构成肠上皮细胞(IEC)顶端表达的聚糖,并介导肠道中的许多生物过程,尤其是宿主-微生物相互作用。
释放的岩藻糖可被微生物用作膳食聚糖、能量来源或合成结构蛋白。肠道中岩藻糖的变化影响微生物群的定植。
岩藻多糖
岩藻多糖是一种含有岩藻糖和硫酸基团的多糖,可改善糖尿病肾病。
一项小鼠研究发现,岩藻多糖可显著改善肾小球滤过率高滤过和肾纤维化,其机制与短链脂肪酸产生菌富集、增加盲肠内乙酸浓度、提高肾脏ATP水平以及改善线粒体功能障碍有关。此外,岩藻多糖还可通过抑制MAPKs通路来改善肾脏炎症和纤维化。总之,岩藻多糖可通过改善线粒体氧化应激和抑制MAPKs通路,靶向肠道菌群-线粒体轴,改善早期糖尿病肾病。
桑叶的药用功能最早在2000多年前的汉代被发现,并记载于《神农本草经》。明代李时珍在《本草纲目》中对桑叶的药用功效有更详细的描述,包括活血化瘀、祛风、清热解毒等功能。桑叶已被列入国家卫生健康委员会公布的食药同源资源名单。
桑叶多糖(Mulberry Leaves Polysaccharides,MLPs)是从桑树(Morus alba L.)叶片中提取的一种植物多糖。它们是桑叶中主要的活性成分之一,由多种单糖组成,主要包括木糖、阿拉伯糖、果糖、半乳糖、葡萄糖、甘露糖等。
桑叶多糖对人体的影响
桑叶多糖具有多种生物学活性,包括降低血糖、抗氧化、免疫调节、抗肿瘤、抗菌、抗凝和调节肠道菌群等。这些活性使得MLPs在医药和食品领域具有广泛的应用前景。并且安全、有效、低毒、副作用小。
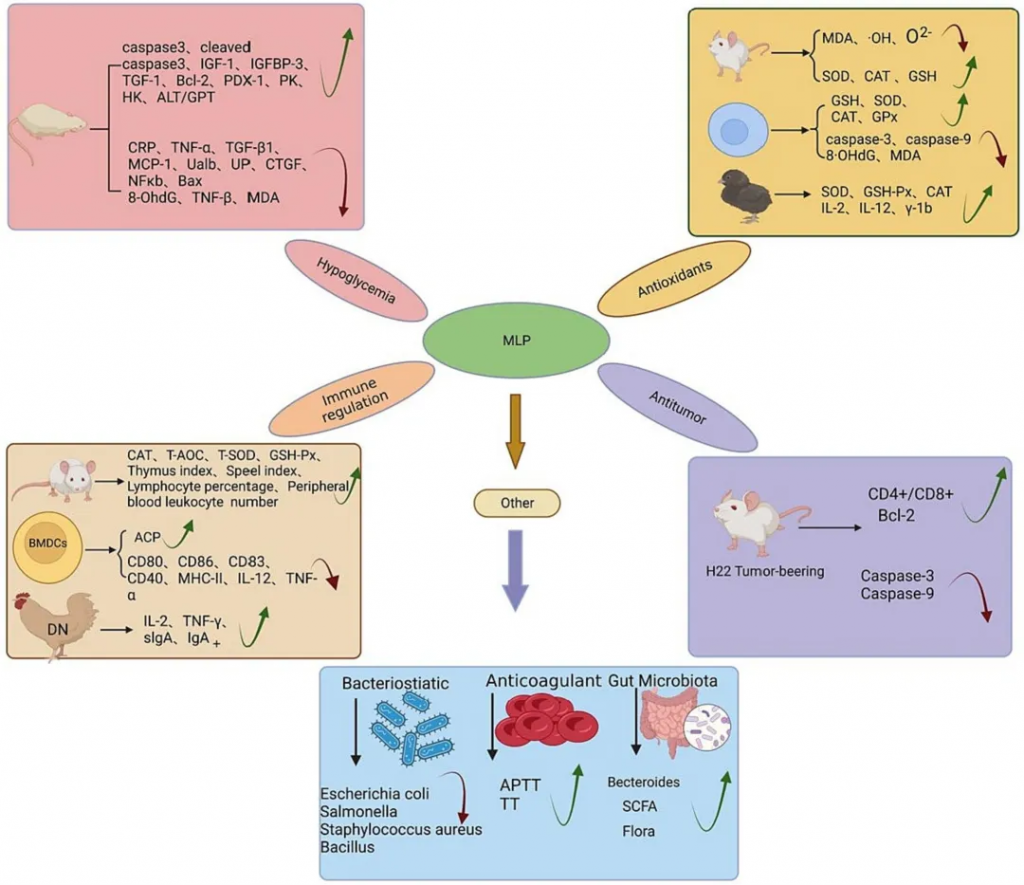
doi.org/10.1016/j.ijbiomac.2023.128669
桑叶多糖对肠道菌群的影响
桑叶多糖通过调节肠道菌群的平衡,进而对人体的健康产生积极的影响。以下是桑叶多糖影响的肠道菌群及其变化情况:

桑叶多糖能够调节短链脂肪酸和肠道菌群的相对丰度,降低真细菌与过敏性细菌的比例,从而改善肠道屏障功能。
沙棘果实在藏族食品和药物中已有数千年的传统。沙棘多糖 (SP) 是沙棘果实中的主要功能成分之一。
对高脂饮食诱导的肥胖小鼠:沙棘多糖治疗提高了 p-AMPKα 和 PPARα 蛋白的表达,刺激了小鼠肝脏中 ACC1 的磷酸化,并抑制了 FAS、PPARγ 和 CD36 的蛋白表达。
沙棘多糖上调Muribaculaceae_unclassified、双歧杆菌、Rikenellaceae_RC9_gut_group、Alistipes、Bacteroides的比例,并下调Lactobacillus、 Firmicutes_unclassified 、Dubosiella Bilophila、 Streptococcus 的比例,重组了HFD诱导的肥胖小鼠的肠道微生物群。
此外,粪便中的微生物代谢物短链脂肪酸 (SCFAs) 的产生也有所增加。此外,相关性分析结果表明沙棘多糖的肥胖改善作用与粪便中的SCFAs水平高度相关。因此,沙棘多糖对肝脏脂质代谢的调节可能是由于肠道微生物群的变化和SCFAs产生量的增加。这些结果表明,沙棘多糖可以通过调节肠-肝轴发挥改善肥胖的潜在营养保健作用。
蘑菇多糖是一类存在于蘑菇中的生物活性多糖,它们包括但不限于几丁质、甘露聚糖、半乳糖聚糖、木聚糖、葡聚糖、云芝多糖、灵芝多糖、半纤维素。这些多糖在蘑菇细胞壁中含量丰富,赋予蘑菇独特的结构和生物活性。
蘑菇多糖的功效
蘑菇多糖对人体具有多种潜在的健康益处。它们可以增强免疫系统、具有抗肿瘤活性、调节肠道菌群、抗氧化、抗糖尿病、抗衰老作用。
蘑菇多糖对肠道菌群的影响
促进益生菌生长
蘑菇多糖通过选择性地促进益生菌的生长,增强肠道健康。例如,灵芝和茯苓中的多糖被发现可以增加有益细菌的数量,这些细菌可以对抗肥胖、产生短链脂肪酸和乳酸。香菇中的多糖也显示出对嗜酸乳杆菌(Lactobacillus acidophilus)有促进作用。
抑制病原菌
蘑菇多糖能够通过增强肠道屏障功能和促进益生菌的生长来间接抑制病原菌。双孢蘑菇中的多糖已被证明可以限制大肠杆菌的生长。
增强肠道屏障功能
蘑菇多糖通过增强肠道上皮细胞的功能,提高肠道屏障的完整性,减少有害物质的渗透。云芝(Trametes versicolor)中的多糖肽PSK和PSP能够调节肠道菌群,增加有益菌双歧杆菌和乳杆菌的数量,同时减少有害菌如梭状芽孢杆菌和金黄色葡萄球菌。在降低腹泻、艰难梭菌感染、炎症性肠病等方面发挥作用。
调节免疫反应
蘑菇多糖通过激活肠道相关淋巴组织,增强机体的免疫反应。灵芝多糖能刺激和增加免疫细胞如自然杀伤细胞、T淋巴细胞和巨噬细胞的数量。
产生短链脂肪酸
蘑菇多糖在肠道发酵过程中产生短链脂肪酸,这些物质对维持肠道健康和调节宿主代谢具有重要作用。蚝菇(Pleurotus ostreatus)中的β-葡聚糖衍生物能够诱导前列腺癌细胞的凋亡,并且显示出免疫调节、巨噬细胞激活、抗肿瘤和免疫刺激活性。

多糖的多样性和复杂性使其在人体内的作用千变万化,它们能够通过与肠道菌群的互动,从调节免疫功能到改善代谢性疾病等。
然而,利用天然多糖通过肠道菌群治疗疾病仍存在一些限制和挑战。对肠道菌群和多糖之间相互作用的全面了解需要进一步研究,由于大多数研究都是在动物身上进行的,因此开展研究多糖-微生物组-疾病相互作用的临床试验并实现临床转化至关重要。
幸运的是,随着生命科学领域新兴技术的发展,我们有了更多的工具来揭示这些复杂问题。高通量测序技术、多组学技术、人工智能和大数据分析的交叉融合,为研究多糖和肠道菌群的相互作用提供了强大的技术支持,推动了这一领域的快速发展。
此外,多糖与肠道菌群之间的相互作用不仅揭示了多糖的生物活性,也突显了肠道菌群对健康的重要贡献。多糖与肠道菌群的相互作用为我们提供了一个全新的视角,了解个体的肠道菌群组成,不仅有助于我们理解自身的健康状况,更为个性化的营养和健康管理提供了科学依据。肠道菌群检测可以揭示个体对多糖等营养成分的响应差异,从而为制定个性化的饮食和治疗计划提供指导。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Xue H, Mei CF, Wang FY, Tang XD. Relationship among Chinese herb polysaccharide (CHP), gut microbiota, and chronic diarrhea and impact of CHP on chronic diarrhea. Food Sci Nutr. 2023 Aug 6;11(10):5837-5855.
Xu X, Wang L, Zhang K, Zhang Y, Fan G. Managing metabolic diseases: The roles and therapeutic prospects of herb-derived polysaccharides. Biomed Pharmacother. 2023 May;161:114538
Zhang D, Liu J, Cheng H, Wang H, Tan Y, Feng W, Peng C. Interactions between polysaccharides and gut microbiota: A metabolomic and microbial review. Food Res Int. 2022 Oct;160:111653.
Chen R, Zhou X, Deng Q, Yang M, Li S, Zhang Q, Sun Y, Chen H. Extraction, structural characterization and biological activities of polysaccharides from mulberry leaves: A review. Int J Biol Macromol. 2024 Feb;257(Pt 2):128669.
Lan Y, Sun Q, Ma Z, Peng J, Zhang M, Wang C, Zhang X, Yan X, Chang L, Hou X, Qiao R, Mulati A, Zhou Y, Zhang Q, Liu Z, Liu X. Seabuckthorn polysaccharide ameliorates high-fat diet-induced obesity by gut microbiota-SCFAs-liver axis. Food Funct. 2022 Mar 7;13(5):2925-2937.
Feng Y, Song Y, Zhou J, Duan Y, Kong T, Ma H, Zhang H. Recent progress of Lycium barbarum polysaccharides on intestinal microbiota, microbial metabolites and health: a review. Crit Rev Food Sci Nutr. 2024;64(10):2917-2940.
Cui L, Guan X, Ding W, Luo Y, Wang W, Bu W, Song J, Tan X, Sun E, Ning Q, Liu G, Jia X, Feng L. Scutellaria baicalensis Georgi polysaccharide ameliorates DSS-induced ulcerative colitis by improving intestinal barrier function and modulating gut microbiota. Int J Biol Macromol. 2021 Jan 1;166:1035-1045.
Tang YF, Xie WY, Wu HY, Guo HX, Wei FH, Ren WZ, Gao W, Yuan B. Huaier Polysaccharide Alleviates Dextran Sulphate Sodium Salt-Induced Colitis by Inhibiting Inflammation and Oxidative Stress, Maintaining the Intestinal Barrier, and Modulating Gut Microbiota. Nutrients. 2024 Apr 30;16(9):1368.
Zhao Q, Jiang Y, Zhao Q, Patrick Manzi H, Su L, Liu D, Huang X, Long D, Tang Z, Zhang Y. The benefits of edible mushroom polysaccharides for health and their influence on gut microbiota: a review. Front Nutr. 2023 Jul 6;10:1213010.
Álvarez-Mercado AI, Plaza-Diaz J. Dietary Polysaccharides as Modulators of the Gut Microbiota Ecosystem: An Update on Their Impact on Health. Nutrients. 2022 Oct 3;14(19):4116.
Tang M, Cheng L, Liu Y, Wu Z, Zhang X, Luo S. Plant Polysaccharides Modulate Immune Function via the Gut Microbiome and May Have Potential in COVID-19 Therapy. Molecules. 2022 Apr 26;27(9):2773.
Sun CY, Zheng ZL, Chen CW, Lu BW, Liu D. Targeting Gut Microbiota With Natural Polysaccharides: Effective Interventions Against High-Fat Diet-Induced Metabolic Diseases. Front Microbiol. 2022 Mar 15;13:859206.
Gan L, Wang J, Guo Y. Polysaccharides influence human health via microbiota-dependent and -independent pathways. Front Nutr. 2022 Nov 9;9:1030063.
Chen J, Gao Y, Zhang Y, Wang M. Research progress in the treatment of inflammatory bowel disease with natural polysaccharides and related structure-activity relationships. Food Funct. 2024 Jun 4;15(11):5680-5702.
Chen P , Hei M , Kong L , Liu Y , Yang Y , Mu H , Zhang X , Zhao S , Duan J . One water-soluble polysaccharide from Ginkgo biloba leaves with antidepressant activities via modulation of the gut microbiome. Food Funct. 2019 Dec 11;10(12):8161-8171.
Wang, A.; Liu, Y.; Zeng, S.; Liu, Y.; Li, W.; Wu, D.; Wu, X.; Zou, L.; Chen, H. Dietary Plant Polysaccharides for Cancer Prevention: Role of Immune Cells and Gut Microbiota, Challenges and Perspectives. Nutrients 2023, 15, 3019.
Zhou, Y.; Chu, Z.; Luo, Y.; Yang, F.; Cao, F.; Luo, F.; Lin, Q. Dietary Polysaccharides Exert Anti-Fatigue Functions via the Gut-Muscle Axis: Advances and Prospectives. Foods 2023, 12, 3083
Shen, Y.; Song, M.; Wu, S.; Zhao, H.; Zhang, Y. Plant-Based Dietary Fibers and Polysaccharides as Modulators of Gut Microbiota in Intestinal and Lung Inflammation: Current State and Challenges. Nutrients 2023, 15, 3321
Lv H, Jia H, Cai W, Cao R, Xue C, Dong N. Rehmannia glutinosa polysaccharides attenuates colitis via reshaping gut microbiota and short-chain fatty acid production. J Sci Food Agric. 2023 Jun;103(8):3926-3938.

谷禾健康

糖,作为我们日常饮食中不可或缺的一部分,不仅为我们提供能量,还影响着我们的健康。然而,糖与健康的关系比我们想象的要复杂得多。
它们可以是单糖(例如葡萄糖、果糖、半乳糖)或二糖(例如蔗糖、麦芽糖、乳糖)或更复杂的形式(例如聚合物或多糖)。
然而,当这些类型的糖作为成分添加到加工食品中以赋予甜味时,它们通常与慢性疾病相关的过量糖摄入有关。例如,添加糖与代谢综合征、肥胖、心脏病、胰岛素抵抗、脂肪生成、糖尿病和相关的视网膜病、肾脏疾病和炎症有关。
糖与这些疾病之间的联系至少部分是通过肠道微生物组实现的,这意味着现有糖和新型甜味剂消耗的增加,改变了微生物组可用的碳水化合物库,在肠道中创造了独特的环境,包括充满了外源微生物或经过适应的内源微生物,其中一些是致病性的。
高糖摄入量会通过肠道微生物群的平衡,例如,改变变形菌门和拟杆菌门的比例,从而增加促炎特性、降低免疫调节功能和降低调节上皮完整性的能力。高肪高糖饮食通过消耗 Th17 诱导微生物促进代谢疾病。
有时候明明知道糖或甜食不能吃多,可就是忍不住… 超加工食品和垃圾食品以及添加糖和人造甜味剂等成分会改变肠道中的微生物组成。这会增加有害菌数量,不利于健康,然而,当我们吃这些食物越多,相关有害菌越繁殖,增加我们对某些食物的渴望,从而陷入恶性循环中。
为了了解糖类对我们健康的影响,我们需要清楚地了解它们是什么、有何不同,以及为什么某些类型被认为“不太健康”,而另一些类型“更有利于健康”,不同种类的糖会影响不同的菌群,本文我们来了解一些关于糖的基本知识,探讨不同种类的糖对肠道菌群和健康的影响,以及如何通过饮食调节来优化肠道菌群,从而促进全身健康。
▼
糖从哪里来?
最早人们从咀嚼甘蔗中感受到甜味,甘蔗种植可以追溯到公元前9000年~6500年之间的大洋洲。后来甘蔗种植传到中国。
起初,糖仅限于医疗用途,是贵族的奢侈品。但在17世纪,南美和加勒比地区出现了奴隶经营的糖料种植园,降低了糖的成本,增加了糖的供应。从那时起,糖被添加到日常食品中,如茶、水果、面包和肉类,工人阶级也能享用,成为西方生活的必需品。
随着人们对糖的了解越来越深入,从最初对糖的简单使用,到逐渐认识到糖的多样性和复杂性。
膳食糖包括不同来源的糖,可以是天然存在的或添加的。目前有几种膳食糖的定义,其中包括添加糖、游离糖、总糖等。认识不同类型的糖之间的区别,对于更好地理解糖摄入量与健康之间的关联至关重要。
“天然糖”: 即天然存在于食物中的糖,如水果中的果糖和葡萄糖,牛奶中的乳糖等。这些糖是食物固有的成分,通常与食物中的其他营养成分(如纤维、维生素和矿物质)共同存在。
“添加糖”,即在食品加工和制备过程中添加的所有糖和糖浆。它们不包括牛奶、水果和蔬菜中的天然糖分。
含糖饮料是饮食中添加糖的最大来源。这些糖不是食物固有的成分,而是额外添加的。添加糖常见于加工食品、饮料、甜点和调味品中。过量摄入添加糖与肥胖、糖尿病、心脏病等健康问题密切相关。
“游离糖”,根据世界卫生组织的定义,包括制造商、厨师或消费者添加到食品中的所有单糖和双糖,以及天然存在于蜂蜜、糖浆和果汁中的糖。成人摄入量要控制在每日能量的10%以内。
完整水果中天然存在的糖以及母乳或婴儿配方奶粉、牛/羊奶中天然存在的乳糖,以及无糖奶制品不是游离糖。
可以看到,一般来说,游离糖和添加糖没有太大区别。因此,如果看到一些食品标签写着「无游离糖」、「无添加糖」其实都是差不多意思。
“总糖”,包括食物中天然存在的所有糖以及添加的糖。例如牛奶和水果中的糖以及产品中可能存在的任何添加糖。
这些定义自然包括所有单糖和双糖。
注:单糖如葡萄糖、果糖、半乳糖,是最基本的糖单元,不能再分解为更简单的糖。
双糖如蔗糖、乳糖、麦芽糖,由两个单糖分子组成。
糖的常见膳食来源
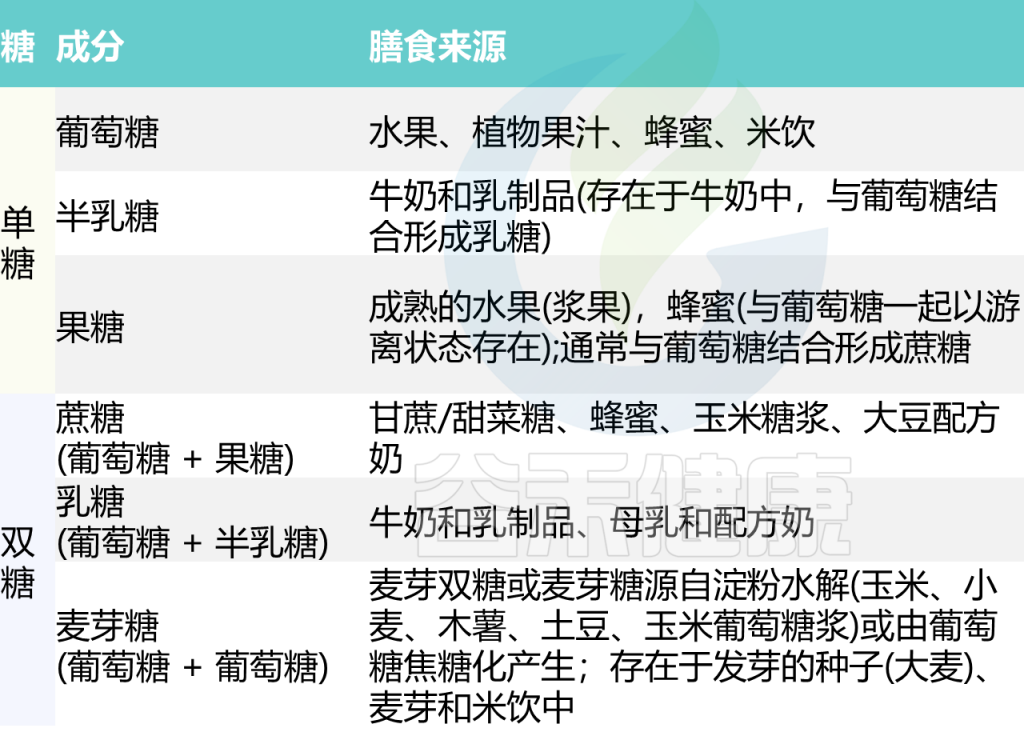
10.1097/MPG.0000000000001733
首先,根据《GB28050-2011预包装食品营养标签通则》:
当食物或饮料中的单双糖含量≤ 0.5g/100(固体)或100 mL(液体)时,可以标注为“无糖”、“不含糖”或“0糖”。
低糖一般指固体产品每100克中含糖量不超过5克,或液体每100毫升中含糖量不超过2.5克。
“0蔗糖”,就是没有添加蔗糖。我们常见的糖,比如说白砂糖、冰糖、红糖、黄糖、黑糖的主要成分都是蔗糖。也就是没有添加白砂糖这类糖。
市面上所谓的无糖食品,如无糖糕点、无糖月饼、无糖粽子等,这些食品只是不放蔗糖,但是有别的果糖,木糖醇等。所以严格来说,也不是没有糖。
果糖GI(升糖指数)较低,对血糖更友好;不易产生龋齿;增强口感等诸多优势,成为了不少所谓无糖食品的甜味来源。
不要以为只有蛋糕、饼干、甜甜圈和糖果等含有添加糖,添加糖隐藏在许多意想不到的食物中,例如加工冷冻食品、婴儿食品、干果、谷物、麦片、即食燕麦片、沙拉酱、番茄酱、烧烤酱、意大利面酱、调味酸奶、蛋白质棒等,甚至一些有机食品和其他健康食品中。
加工食品中的隐形糖
食品制造商在生产“低脂”和“脱脂”产品时,通常会提高糖含量以保持风味和质地。有些高档饮料可能含有比你想象的更多的糖,有时候午餐吃的“健康”沙拉上的“精简”调味料也是如此。
糖的主要功能是它们的甜味。所有糖都会传达一定的甜味感觉,但甜味的强度、质量和时间分布(定义为强度随时间的变化)因糖的类型而异。
普通糖的相对甜度值占等浓度蔗糖甜度的百分比
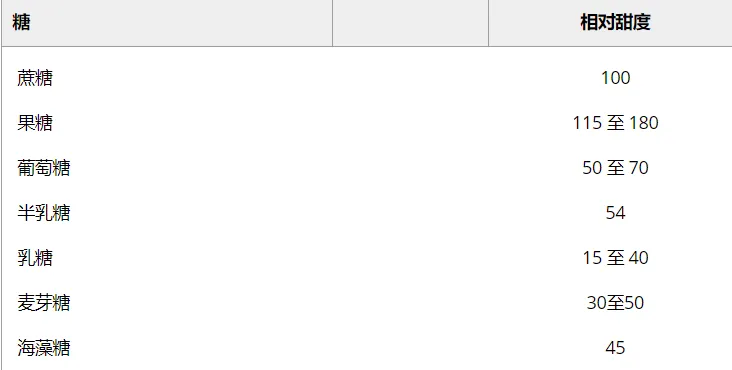
doi.org/10.1111/1541-4337.12194
不同糖类食物升高血糖的速度和程度不同,用GI值表示。葡萄糖的GI值定义为100,其他食物与之比较。
也就是说,高GI的食物会快速升高血糖,身体分泌大量胰岛素使血糖快速下降,造成饥饿感,导致吃的更多,恶性循环。
高 GI 被定义为 70 或更高,与面包、早餐麦片或大米有关,精制的糖通常GI值较高,蔗糖的GI为65。
用加工过的谷物或其他碳水化合物来源代替蔗糖可能会导致升糖指数更高,从而对血糖反应产生更大的影响。
而低 GI 被定义为 55 或更低,与豆类、面食、水果和乳制品有关,天然全食中的糖GI值较低。
果糖的GI值非常低。
并非所有加工食品都具有高 GI,也有中等 GI 的加工食品与蔗糖相当,包括各种巧克力或谷物棒、蛋糕或某些早餐谷物。
很多人都喜欢各式各样的糖,它为食物和饮料增添了风味,包括甜点、糖果、奶茶、冰淇淋、汽水等。然而,随着人们对健康饮食意识的提高,糖分摄入对健康影响的讨论也日益增多。糖分的摄入不仅关系到口感享受,更与我们的身体健康紧密相连。
注:适用于人类饮食的糖一词是一个统称。例如,食糖基本上是纯蔗糖,而果汁、蜂蜜和糖浆通常含有蔗糖、葡萄糖、果糖和不同的低聚糖。这里说的“糖”包括所有这些术语。
从有利的角度来说,糖是身体的首选燃料来源,也是日常活动的必需营养素。当我们吃糖时,我们的系统中有消化酶将其分解成葡萄糖,这是细胞所需的能量形式。糖也会以糖原的形式储存在肌肉和肝脏中,以供将来用作能量。
当你处于饥饿或禁食状态时,肝脏中储存的葡萄糖会通过糖原分解和糖异生的过程释放出来,为肌肉提供稳定的燃料流并保持血糖稳定。
当你吃东西时,胰岛素激素会刺激糖酵解的过程,将吃的糖分解成能量。身体需要持续供应葡萄糖,这就是为什么每隔几个小时吃一次各种碳水化合物来源很重要。
没有糖,你可能会难以集中注意力和记住事情,如果糖不足,可能会感到疲劳,甚至出现脑雾等。
糖能让我们快乐,有些人甚至经常渴望吃糖。当吃糖时,大脑中会释放负责愉悦奖励和动机的神经递质多巴胺。吃糖和甜食的动力很大程度上是由多巴胺系统控制的,这就是为什么当你吃甜食时,情绪会发生变化。
但任何食物都讲究适量,过量摄入糖分也会给身体带来一系列的健康问题。
影响大脑功能
过多的添加糖会改变大脑的功能,并与认知能力下降和退行性疾病(如阿尔茨海默病和痴呆)有关。
2019 年一项针对 1,200 多名 60 岁以上马来西亚成年人的研究发现,过量摄入糖与较差的认知功能有关。
影响血糖
食用大量精制碳水化合物和添加糖会导致血糖急剧上升,你可能会在一段时间内感到精力充沛,但是这种短期修复可能会让你更加难受,陷入迟钝和疲劳。
它还可能导致胰岛素抵抗,从而导致长期高血糖。随着时间的推移,高血糖会对神经、心脏、眼睛和肾脏的小血管造成损害。
对于患有糖尿病或其他代谢疾病的人来说,即使是适量的糖也可能过多,这涉及代谢的问题,我们后面会详细讲。
影响体重
含糖产品,尤其是饮料,不会让你感到饱腹,而糖分的飙升会让你感觉更饿。饥饿感的增加会导致你吃得比你需要的多,甚至暴饮暴食。
增加压力
吃糖还会让人上瘾。甜食可以在短期内降低压力荷尔蒙皮质醇的水平,但从长远来看,它们可能会引起问题。糖会在大脑中释放舒缓的化学物质。问题在于,这种感觉良好的效果是暂时的,一旦消失,就会导致摄入更多的糖。
皮肤老化更快
过量糖分与皮肤老化加速有关,皮肤的弹性和紧致度主要依赖于胶原蛋白。糖化产物AGEs通过与这些蛋白质结合,使它们硬化和断裂,导致皮肤失去弹性和紧致度,加速出现皱纹和松弛。
糖化过程还会产生自由基,增加氧化应激,损伤皮肤细胞,干扰细胞的正常功能和修复过程,还可能激发炎症反应。
增加患慢性病的风险
过量添加糖会增加体内炎症和氧化应激,从而损害器官和组织。过量食用添加糖还与心血管疾病、 2型糖尿病、非酒精性脂肪肝和认知能力下降等慢性疾病的风险增加有关。
以上是我们了解到糖对人体直接影响,接下来我们逐步深入到糖在体内如何被处理,以及它如何间接通过影响肠道微生物群来影响健康。
糖进入人体内是如何消化的?
食用后,糖代谢在口腔内开始。口腔微生物组具有代谢糖的能力;然而,并非所有口腔微生物都以同样的方式代谢糖。变形链球菌被认为是口腔中与龋齿有关的关键微生物。
● 蔗糖长期以来被认为是最容易致龋的糖源。
● 乳糖致龋性低于葡萄糖、果糖、麦芽糖和蔗糖。
● 海藻糖的致龋性比蔗糖低,并且可能具有抗致龋特性。
注:糖并不是导致龋齿的唯一饮食因素。膳食来源的淀粉还可以直接通过微生物的新陈代谢或通过其在口腔中有限的水解成糖来促进龋齿。
在胃中糖的消化较少。食物进入小肠后,消化过程加速。胰腺分泌的胰液中含有多种消化酶,如淀粉酶,继续分解糖分子。小肠壁上的细胞也产生酶,如蔗糖酶、乳糖酶和麦芽糖酶,这些酶帮助将双糖分解成单糖,如葡萄糖和果糖。
单糖通过小肠壁的特殊运输蛋白被吸收进入血液。葡萄糖的吸收主要通过两种机制进行:
葡萄糖和半乳糖的“搬运工”:SGLT1、GLUT2
它们主要通过一种叫做SGLT1的”搬运工“被吸收。它位于肠细胞面向食物的一侧。SGLT1会抓住葡萄糖和半乳糖,同时也会抓住钠离子,然后把它们一起带进肠细胞内。这个过程像坐电梯,要消耗能量,通过Na+K+-ATP酶把钠离子泵出肠上皮细胞。
注:SGLT1,钠葡萄糖连接转运蛋白-1,是肠道中主要的葡萄糖转运蛋白(和传感器)
当葡萄糖和半乳糖进入肠细胞后,会遇到另一位”搬运工”叫GLUT2。GLUT2会把它们从肠细胞的另一侧送出去,进入我们的血液。然后,血液会把这些糖类运送到肝脏,供身体使用。
GLUT2 的神经元在大脑的不同区域充当葡萄糖传感器,有助于控制葡萄糖稳态和进食行为。
果糖:GLUT5搬运工数量有限,果糖吸收不良
而果糖的吸收方式有点不同。它主要通过一位叫做GLUT5的”搬运工”进入肠道细胞内,这个过程不需要消耗能量。然后和葡萄糖、半乳糖一样,果糖也通过GLUT2进入血液,最后到达肝脏。
不过,由于GLUT5这个”搬运工”的数量有限,而且很容易被果糖占满,所以果糖的吸收速度比葡萄糖和半乳糖要慢一些。
当单独大量摄入果糖(不含葡萄糖)时,会超过正常的果糖吸收能力,导致果糖在远端小肠和结肠中通过。这会导致胃肠道不适,包括痉挛和腹泻。这种现象被称为果糖吸收不良。
常见膳食糖和甜味剂的使用和吸收
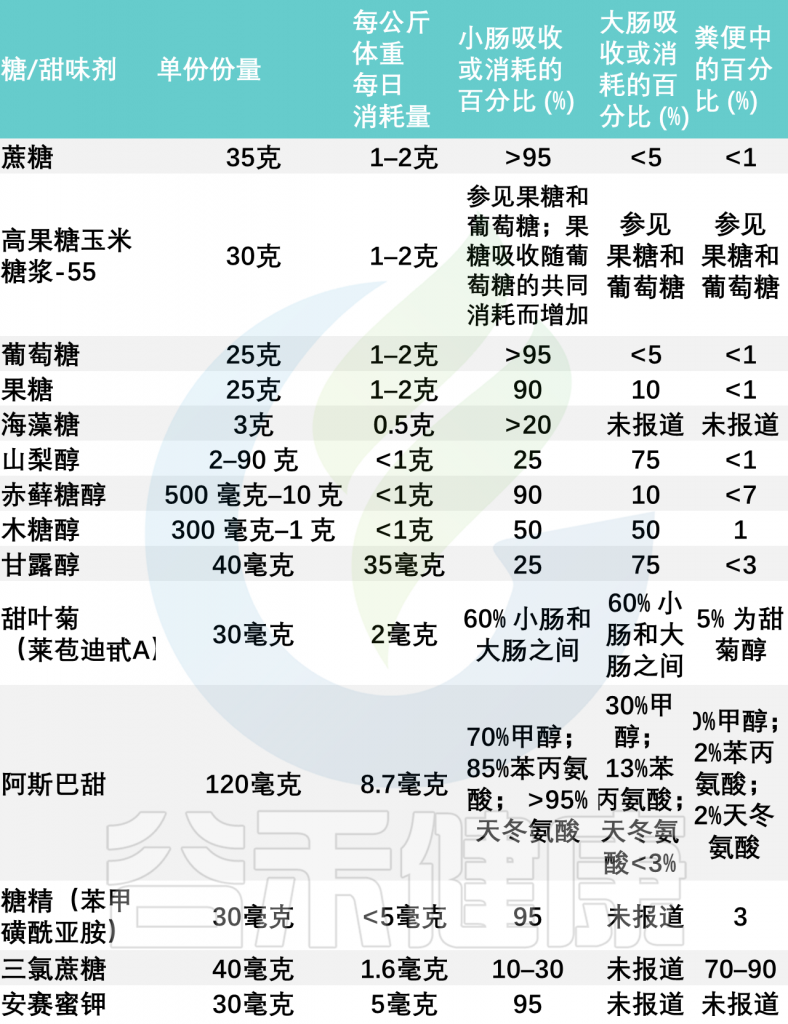
doi: 10.1093/advances/nmz118
大多数糖和甜味剂通过糖转运蛋白在小肠中被主动吸收,因此,与大肠相比,小肠肠道环境中的糖和甜味剂含量丰富约10倍。这些可用糖是小肠微生物的重要底物。
当然,大肠中也并不缺乏糖和甜味剂。果糖、糖醇和一些甜味剂(例如三氯蔗糖)在小肠中被动地、缓慢地或非常差地吸收,高达 30-90% 的糖和甜味剂会进入大肠。过量食用这些糖和甜味剂很容易导致吸收不良并溢出到大肠。在那里它们成为肠道微生物的食物来源。这可能带来肠道菌群的变化,导致胃肠道不适和其他健康问题。
肠道菌群对糖的适应
宿主糖/甜味剂吸收、微生物产物和不同肠道条件的复杂性,会导致肠道内产生过多的肠道微环境。
“餐厅假说”——不同微生物觉得舒适的区域不同
在餐厅假说中,每一个环境都可以看作一家提供不同食物的餐厅,微生物在最能满足其营养和环境需求的环境中茁壮成长,这个环境就是它的生态位,且这个环境中来自其他微生物的竞争最少。
肠道从头到尾像是一个微生物主题公园,不同区域有不同的”餐厅“和”居民“。这就是肠道微生物的”生物地理学”。
沿着肠道找到的微生物变化,可能取决于肠道不同部位存在的糖/甜味剂的变化。微生物就好比食客,环境提供什么,它们就吃什么,最终你在哪里找到它们,取决于哪里有它们最爱的食物。
当然,相同的微生物可以存在于多个不同的、空间上分离的微环境中。也就是说微生物可以在不同的餐厅吃,为了最好地利用每种微环境,相同的微生物可能需要不同的调节、代谢和遗传适应。
这就可以理解为什么有些微生物在适应的环境是好的,在特定条件或特定肠道位置就开始致病。
微生物对糖的适应能力让它们在各种环境中生存并发挥作用,从而也会影响到人体健康。
碳水化合物改变肠道菌群的能力主要依赖于这些底物的不可消化或可消化性质。
可消化的碳水化合物,例如蔗糖或乳糖,通过一系列胃肠道酶降解为单糖(例如葡萄糖、果糖)后在小肠中被吸收。
果糖、糖醇和一些非营养性甜味剂(例如三氯蔗糖)在小肠中被动、缓慢或吸收很差,并溢出到大肠。这种动态会导致肠道菌群发生显著改变,包括微生物多样性减少以及与代谢健康状况相关的某些细菌门的相对丰度改变。
高糖饮食:拟杆菌门↓↓ 变形菌门↑↑
促炎,破坏肠道屏障
摄入大量葡萄糖、果糖或蔗糖的饮食模式会导致肠道微生物多样性的丧失,其特征是拟杆菌门比例降低和变形菌门比例增加。
变形菌占健康肠道微生物群的一小部分,但如果它们批量增加,可能会发生炎症。该门内的γ-变形菌纲和肠杆菌科携带脂多糖(LPS)分子,这些分子是炎症反应的强烈触发因素。
该门内的γ-变形菌纲和肠杆菌科携带脂多糖(LPS,内毒素)分子,这些分子是炎症反应的强烈触发因素。
在肠上皮细胞中,LPS 诱导IL-8的释放,这是一种负责诱导炎症反应的关键趋化因子,进而改变紧密连接并导致上皮完整性受损。
而拟杆菌属是拟杆菌门中的优势属,它能很好地适应竞争激烈的肠道环境,并利用复杂的植物和宿主衍生的多糖。该属与许多健康益处有关,包括下调肠道炎症反应。
变形菌门和拟杆菌门之间的平衡,在维持肠黏膜的免疫稳态和上皮完整性方面发挥作用。与此一致,一项研究表明,IBD患者粪便微生物群中肠细胞IL-8表达水平与肠杆菌科呈正相关,而拟杆菌属、普雷沃氏菌属和脆弱拟杆菌的丰度降低。
高糖饮食:短链脂肪酸↓↓ 促炎,破坏肠道屏障
过量摄入膳食糖会减少肠道中短链脂肪酸的产生,这可能导致肠道屏障受损。这会导致中性粒细胞浸润迅速增加,同时加速脂多糖(LPS)的转移。LPS与TLR4结合,激活核因子-κB(NF-κB)信号通路,最终诱导炎症因子IL-6、IL-1β和TNF-α的产生。
另一方面,过量的膳食糖含量使脆弱拟杆菌和普雷沃氏菌大量繁殖,从而破坏肠黏膜。同时,可溶性糖细菌Sutterellaceae的相对丰度增加,而属于厚壁菌门的Lachnospiraceae和Lactobacillaceae的丰度下降,最终增加了炎症细胞因子IL-6、TNF-a、Lcn2、Cox2的水平。中性粒细胞浸润增加和炎症因子产生加重了IBD的发生和发展。
膳食糖对肠道微生物组的调节
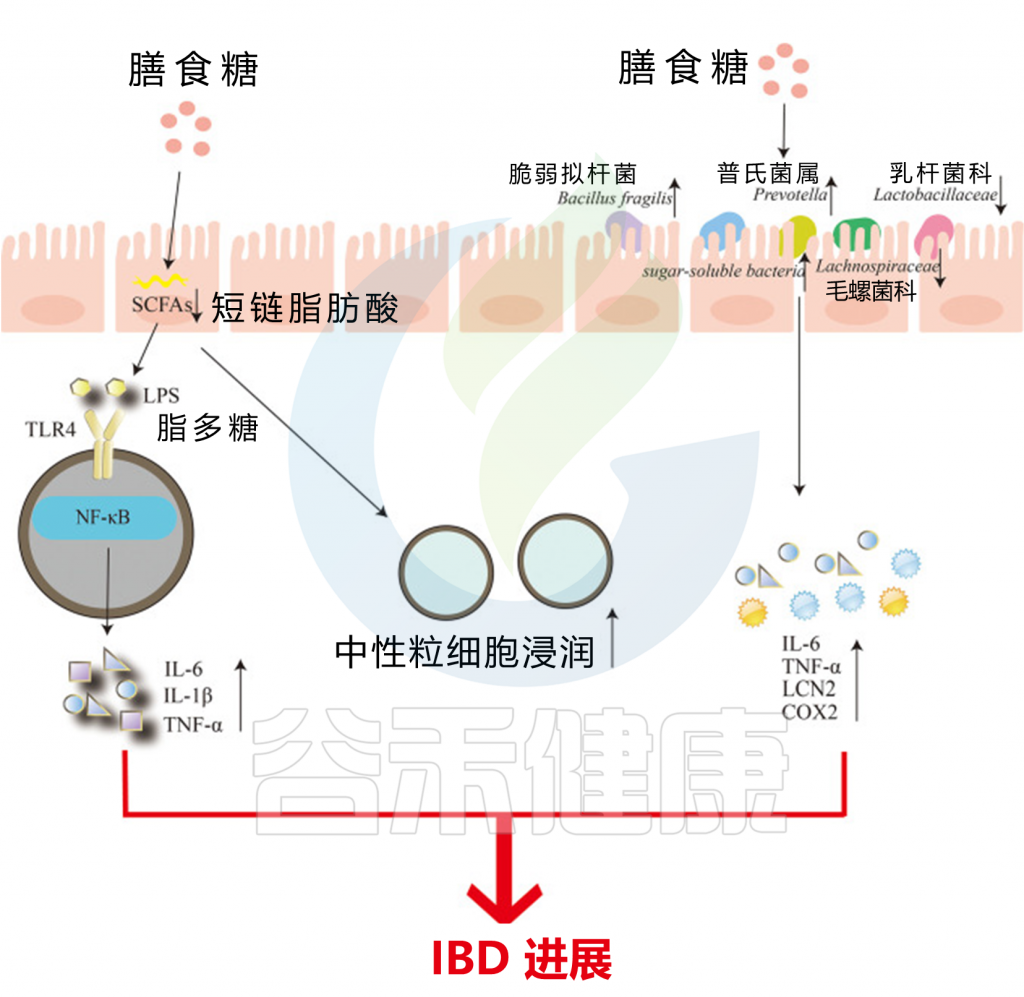
doi : 10.3389/fimmu.2022.988481
糖介导的巨噬细胞炎症
高水平的饮食糖导致TLR4活性增加,进而激活下游的NF-κB和MAPK信号通路,从而促进炎症因子IL-6、IL-1β和TNF-α的上调。此外,膳食糖介导的树突状细胞和中性粒细胞炎症也是通过激活 TLR4 来实现的。
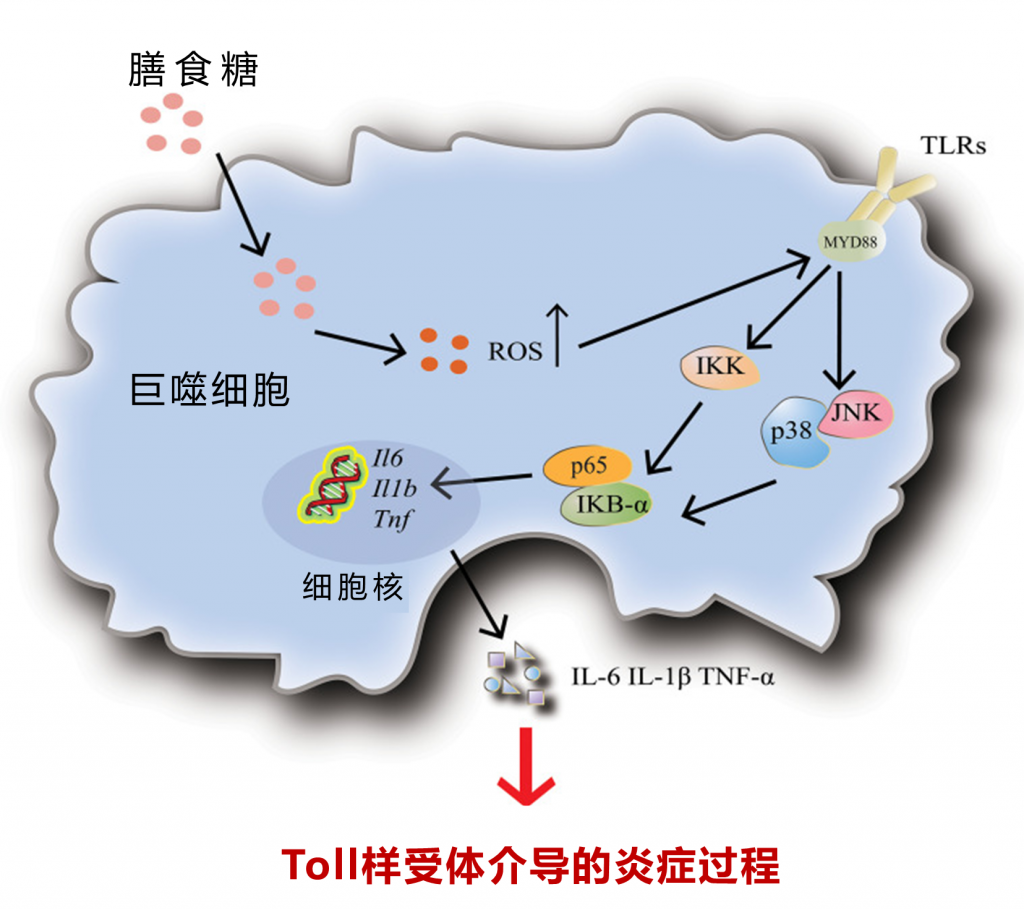
doi : 10.3389/fimmu.2022.988481
类风湿关节炎(RA)是由遗传、环境和内源性因素引起的最常见的全身性慢性自身免疫性疾病之一。其特点是全身炎症和持续性滑膜炎。
近年来大量研究表明,含糖饮料在类风湿性关节炎的发病机制中发挥着关键作用。在一项后续调查中,研究人员发现,与不喝含糖饮料的女性相比,每天喝 1 美元含糖饮料的女性患血清阳性类风湿关节炎的风险更高,尤其是 55 岁以上的女性。
随后的一项研究表明,含糖饮料导致类风湿关节炎,除了在自身免疫镶嵌中发挥重要作用外,还在于它更有可能改变微生物群,从而影响下游炎症途径。大量摄入葡萄糖、果糖和含糖饮料会减少肠道中的有益菌群,尤其是普雷沃氏菌,它被发现与类风湿关节炎的发病机制有关。此外,与高糖西方饮食相比,地中海饮食可以降低类风湿关节炎的发病率。
多发性硬化症(MS)是一种中枢神经系统自身免疫性疾病,其症状影响全身多个系统,包括视力障碍、运动障碍、疲劳、认知和情绪障碍、疼痛等。
一项研究指出,患有多发性硬化症的受试者比对照组摄入更多的碳水化合物。
虽然高糖饮食对多发性硬化症的影响尚未在临床研究中得到证实,但在多发性硬化症的疾病模型中发现,高葡萄糖和高蔗糖饮食可以加重实验性自身免疫性脑脊髓炎(EAE)的病情进展。
一方面,高糖饮食可以直接作用于CD4+ T细胞,通过诱导T细胞分化为Th17细胞,从而增加EAE小鼠体内Th17细胞的比例。
另一方面,高糖饮食通过改变肠道微生物组结构刺激 Th17 细胞分化并加剧 EAE。
牛皮癣是一种慢性炎症性皮肤病,其特征是表皮角质形成细胞异常增殖和分化。
新的研究数据表明,饮食成分(简单的糖和脂肪)而不是肥胖本身会加剧牛皮癣。西方饮食激活了IL-23信号通路,进一步增加了IL-23刺激后γδT细胞中IL-17A的产生。细胞因子IL-17A对于皮肤炎症的全面发展是必需的。
同时,IL-23 过度表达,导致喂食西方饮食的小鼠微生物多样性下降和明显的肠道菌群失调。当 IL-23 释放后,小鼠从西方饮食转向标准饮食时,皮肤炎症减少,肠道微生物群部分逆转。
因此,牛皮癣患者应考虑少糖的健康饮食模式。
炎症性肠病(IBD)是一种慢性炎症性胃肠道疾病,主要包括克罗恩病和溃疡性结肠炎。肠道中的共生菌群和粘液层对于体内平衡至关重要,因为它可以防止病原微生物的入侵和粘附,并有助于维持肠道屏障的完整性。
近年来,由于西方饮食(即高脂和高糖饮食)在世界各地的同步兴起,IBD也已成为全球健康问题。最近的临床和实验研究表明,高脂肪饮食可能是IBD的触发因素,但高糖在IBD发病机制中的作用仍存在争议。
一项具有里程碑意义的研究表明,2 型糖尿病可通过肠上皮细胞的转录重编程和改变紧密粘附连接的完整性而导致肠屏障功能障碍;它还可以通过引起肠道微生物代谢敏感性的变化来增加疾病风险。
此外,基于人群的研究表明,约 10% 的 IBD 患者认为吃含糖食物会引发病情发作并使症状恶化。在一些前瞻性研究中,还发现食用高果糖玉米糖浆和 含糖饮料与 IBD 风险呈正相关。
生命早期过量摄入添加糖会通过肠道微生物群对记忆功能产生负面影响。
糖改变了肠道菌群,尤其是显著增加了Parabacteroides丰度,特别是P. distasonis和P. johnsonii,与记忆表现呈负相关。
在幼年大鼠中实验性富集这些Parabacteroides物种也会损害记忆功能,表明糖诱导的Parabacteroides在认知缺陷中起因果作用。这些发现突出了肠-脑轴在介导早期生活饮食对神经认知发育影响方面的重要性。
在采用回顾性和纵向方法的情况下,发现高糖饮食与重度抑郁或抑郁症状之间存在显着相关性。
我国的一项大型研究发现,每周饮用四杯或以上 含糖饮料(特别是软饮料或苏打水)的人,与饮用少于一杯的人相比,抑郁症状的患病率增加了一倍。另一项研究发现,每天摄入超过 500 mL 含糖饮料的人患抑郁症和自杀意念的风险增加 60%。
其他研究表明高糖饮食会导致焦虑、压力、多动和行为问题。当然,研究要应对大量混杂因素,需进一步研究其相关性。
成瘾和多巴胺能改变
摄入美味食物,包括糖,刺激下丘脑腹侧被盖区(VTA)释放多巴胺,激活奖赏通路(从VTA到NAcc),这可以超越饱食信号。
反复接触美味食物会改变中脑边缘多巴胺回路,破坏稳态控制,强化食物线索,增加进食。
这些多巴胺能信号通路被认为对奖赏动机和记忆至关重要,特别是情景记忆和工作记忆。
奖赏通路的激活导致糖的寻求和摄入增加。多巴胺信号传导的改变可导致NAcc可塑性降低,这会导致成瘾病例中的记忆损害。
在大鼠模型中,过量摄入糖会引起成瘾的迹象,表现为暴饮暴食、戒断、抑郁样行为、奖赏寻求增加等。
间歇性糖摄入导致NAcc胞外多巴胺增加,脑啡肽mRNA表达减少,以及与戒断相关的阿片样修饰。糖还激活下丘脑(饱食和饥饿行为的主要调节器),抑制生长素和瘦素的产生,减少饱腹感,促进过度摄入。
肠道菌群紊乱和神经炎症
高脂肪和高糖饮食通过减少保护性微生物数量、影响肠黏膜、破坏紧密连接和增加细菌易位而损害肠壁通透性,导致炎症细胞因子信号增加。
人类和动物研究表明,糖摄入会显著改变肠道菌群。
果糖与粪肠球菌和嗜热链球菌(两种具有抗炎特性和促进肠道健康的有益菌)显著负相关。
使用高果糖饮食的啮齿动物研究,微生物群的剧烈变化、促炎细胞因子增加、抗炎细胞因子减少、肝脏脂质积累和神经炎症。这些损伤被观察到独立于体重或热量摄入而发生。
肠壁通透性的结构损伤使脂多糖进入血流,激活Toll样受体-4,导致促炎细胞因子过度产生。
这种低度全身炎症被称为代谢性内毒素血症,可导致几种慢性炎症状况,果糖诱导的菌群失调引发小鼠海马神经炎症和神经元丢失,可能突出了与糖和肥胖相关的神经和精神障碍的潜在机制。
代谢综合征是一组健康状况,例如高血糖,它们共同增加心血管疾病和糖尿病的风险。
根据小鼠实验,饮食、肠道细菌和免疫细胞之间错综复杂的关系有助于预防肥胖和其他代谢状况。
哥伦比亚大学的研究人员发现,在小鼠体内,某些肠道细菌通过诱导辅助性T17(TH17)细胞水平上升,有助于预防代谢综合征的疾病。作者发现,这些免疫细胞减少了肠道对脂质的吸收。
高脂肪、高糖饮食消除了有益细菌,但给小鼠补充细菌可以防止它们患上肥胖和代谢综合征。仔细观察该饮食中的成分发现,其高糖含量促进了Erysipelotrichaceae的生长,从而杀死了免疫调节细菌。
从饮食中去除糖可以防止小鼠出现肥胖或代谢综合征,但前提是这些动物仍然含有细菌诱导的 TH17细胞。
糖尿病是最常见与糖摄入相关的疾病。糖是否是糖尿病的独特原因或促成因素是另一个有争议的问题。许多前瞻性和回顾性研究的结果各不相同且不一致。然而,大多数研究发现糖,特别是果糖和含糖饮料摄入量与2 型糖尿病 (T2DM) 风险呈正相关。
食用含糖饮料会导致胰岛素信号受损以及空腹血糖和胰岛素增加,这种关联在女性中尤其明显。
来自 175 个国家的重复横截面数据的计量经济学模型表明,糖分与糖尿病风险呈剂量依赖性显着相关,糖分减少与糖尿病发病率下降相关。
也有一项对照干预试验的荟萃分析显示,在能量匹配的替代研究中,当糖被替换为其他宏量营养素时,含糖饮料并不会对血糖控制产生不利影响。只有当饮食摄入过多卡路里时,含糖饮料才会对血糖控制产生有害影响,这表明能量平衡而不是饮食中的糖本身是导致2型糖尿病发展的关键因素。
膳食糖可扩大病原体,并消除在代谢疾病中协调保护性肠道免疫反应的共生细菌
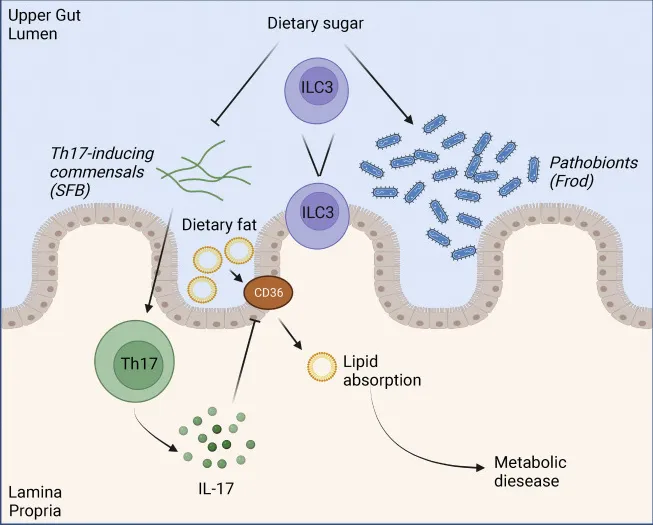
doi.org/10.1016/j.cmet.2022.09.006
注:Frod, Faecalibaculum rodentium; SFB, 分节丝状菌
膳食蔗糖支持一种致病菌(Frod)的生长,该致病菌在上肠中超过SFB,这是一种需要ILC3的反应。共生SFB诱导Th17免疫,通过下调脂肪酸转运蛋白CD36的表达来抑制脂质吸收。膳食糖导致诱导Th17的SFB丢失,促进过度脂质吸收,在小鼠饮食诱导的代谢性疾病早期阶段促进过度肥胖。
自 1975 年以来,全球肥胖率增加了两倍,而糖消费量的下降以及肥胖人数的持续增加,这是为什么呢?一种解释认为这种转变是由代际延迟引起的。由于儿童消费往往预示着成人肥胖,因此成人肥胖(例如,40-70 岁)的增加反映了 20 世纪50年代-80年代儿童饮食不良。
另一种提出的解释是从传统糖向糖替代品(低热量、人工甜味剂)的转变,2008 年至 2015 年间,全球糖替代品的年增长率约为 5.1%。近年来的研究开始调查这些糖替代品的影响,并发现特定甜味剂与肥胖、心血管疾病及其他疾病之间的联系。
接下来,我们来看看甜味剂对肠道菌群有哪些影响,如何通过肠道菌群影响健康。
多元醇(也称为糖醇),多元醇的常见例子是木糖醇、山梨糖醇、赤藓糖醇、甘露醇、异麦芽糖醇、麦芽糖醇和乳糖醇。
多元醇与肠道菌群组成和功能之间的关系在不同的动物模型中也得到了强调。
木糖醇是一种五碳多元醇,天然存在于水果、浆果、蔬菜、燕麦和蘑菇中,其甜度为蔗糖的95%。人体也会产生一小部分。木糖醇常用于无糖糖果和口香糖。
在较高剂量下,木糖醇引起双歧杆菌属、乳酸杆菌属和Erysipelotrichaceae的丰度增加,而Blautia和葡萄球菌的含量减少。
山梨糖醇,是一种异构多元醇,天然存在于苹果,梨,桃子,杏子和一些蔬菜中。IBS患者对山梨糖醇有不良的胃肠道反应,对健康个体是安全的,在高剂量时具有通便作用,大多数健康个体可耐受∼10 g 山梨糖醇/天,仅伴有轻微的胃肠道不适,例如肠胃胀气或腹胀。
几项研究表明,山梨糖醇的摄入会扰乱肠道菌群。相应地,接受10%山梨糖醇(2.07 g/day)16天的雄性Wistar大鼠表现出盲肠和结肠中乳酸杆菌丰度和丁酸盐水平的增加。
异麦芽酮糖醇用于泡泡糖、明胶、巧克力、涂料、烘焙食品和酸奶。它能量低,不致龋,并且与其他多元醇一样甜。异麦芽酮糖醇的未消化或未吸收部分到达结肠并由肠道微生物群发酵;摄入的异麦芽酮糖醇的发酵部分为∼90%。
临床试验:
一项研究测试了19个人连续4周每天消费30克异麦芽糖醇在交叉设计中的效果,以及额外4周的安慰剂对照干预,每天30克蔗糖。与安慰剂相比,异麦芽糖醇显著提高了双歧杆菌数量。因此,异麦芽糖醇可能有助于健康的结肠环境。
乳糖醇是一种非天然存在的糖醇,通过乳糖氢化而得。与其他多元醇相比,其甜味能力有限,因此通常与强甜味剂结合使用。乳糖醇可作为益生元增强肠道微生物群,不致龋。
临床试验:
低剂量的乳糖醇(每天10克)在75个人身上测试7天,增加了双歧杆菌群,这导致了乙酸和乳酸的增产。这一事实可能有助于交叉喂养,其他细菌可以产生丙酸和丁酸。
在40个人身上测试了通过巧克力棒逐步补充麦芽糖醇,持续6周,达到每天45.6克,增加了双歧杆菌。
注:这几项研究都是在2006年到2010年间发表的,文献中极少有其他关于多元醇的最新人类研究。

doi.org/10.3390/diabetology3040042
口服不同的非营养性甜味剂会也出现肠道菌群失调的情况。
糖精是一种水溶性酸,在pH值较低的环境中易被吸收。在人体中,85%-95%的摄入糖精作为完整分子被吸收,因为它不经历胃肠道代谢。一旦被吸收,它就会与血浆蛋白结合,分布到全身,并通过主动管状运输从尿液中排出。少量未吸收的糖精通过粪便排出,高浓度的非营养性甜味剂可能改变肠道微生物群的组成。
当给予 0.1 mg/mL 糖精 10 周时,肥胖雄性小鼠表现出葡萄糖耐量受损、罗伊氏乳杆菌减少以及粪便拟杆菌属和梭状芽胞杆菌目增加。
连续 6 个月服用 0.3 mg/mL 糖精,引发肝脏 TNF-α 和 iNOS(诱导型一氧化氮合酶)过度表达,同时Turicibacter、棒状杆菌、Roseburia丰度增加,瘤胃球菌含量和Anaerostipes降低。
临床试验:
一项研究调查了7天内相当于每天360毫克的糖精补充对七名健康人的葡萄糖耐受性和微生物变化的影响。研究人员发现,在补充前后发展出较差的血糖反应的个体中,微生物群的变化更为明显,即拟杆菌属过度,而Clostridiales不足。
每天补充180毫克糖精(可接受日摄入量[ADI]的20%)对20个个体的肠道微生物群、血液代谢组和葡萄糖耐受性的影响,并与另外五组各包含20个个体的对照组和非营养性甜味剂补充组进行了比较。
糖精显著增加了普雷沃氏菌和Bacteroides xylanisolven的水平。普雷沃氏菌与基线时的葡萄糖耐受性测试增量曲线下面积(GTT-iAUC)呈正相关,而Bacteroides xylanisolven与此曲线呈负相关。作者认为这些变化是有害的。实验期间丁酸也增加了。大多数微生物顶级负荷与糖酵解和葡萄糖代谢有关。
三氯蔗糖(E-955)是一种低热量、无营养的合成甜味剂,其结构与蔗糖非常相似。像糖精一样,三氯蔗糖不会被人体代谢;然而,与糖精不同的是,大多数摄入的三氯蔗糖通过胃肠道在粪便中被排出,其余到达肾脏进行尿液排泄。
大鼠每天服用 1.1、3.3、5.5 或 11 毫克/公斤的三氯蔗糖 12 周后,体重增加,拟杆菌、双歧杆菌、梭菌和乳杆菌数量减少。
临床试验:
一项研究调查了高剂量的三氯蔗糖(每天780毫克)连续7天对34名男性干预组和对照组的肠道微生物群及代谢反应的影响,补充后肠道微生物群没有变化。
然而在另一项研究中,20个个体每天补充102毫克的三氯蔗糖,为期2周,确实改变了肠道微生物群,在试验期间增加了Eubacterium 和Dorea longicatena。Eubacterium与基线时的葡萄糖耐受性测试增量曲线下面积(GTT-iAUC)呈正相关,而Eubacterium与之呈负相关。作者认为这些变化是有害的。大多数微生物顶级负荷与嘌呤代谢相关。
阿斯巴甜是市场上使用最广泛的糖替代品之一,当它被人体加工时,在肠道酯酶和肽酶的作用下产生3种常见的代谢产物包括天门冬氨酸、苯丙氨酸和甲醇,类似于水果、果汁、发酵饮料在体内的分解。
甜叶菊是一种灌木,属于菊科,由于甜味强度高,由甜菊糖苷引起,因此被用作天然无热量甜味剂。
临床试验:
一项研究测试了240毫克/天(占ADI的8%)阿斯巴甜对20个健康个体2周内的影响,并发现它改变了肠道微生物群,Bacteroides fragilis(脆弱拟杆菌)、Bacteroides acidifaciens(产酸拟杆菌)和Bacteroides coprocola(粪拟杆菌)的丰度增加,许多微生物顶级负荷与多胺代谢有关。
此外,在这次干预中,每天摄入180毫克(占ADI的75%)的甜叶菊也改变了肠道微生物群:
两种Prevotella减少了,而Bacteroides coprophilus、Parabacteroides goldsteinii和一种Lachnospira增加了。几种微生物顶级负荷与脂肪酸生物合成有关。
甜味剂对肠道菌群的影响

doi.org/10.3390/diabetology3040042
低聚糖在自然界中广泛存在,常见于某些蔬菜、水果和全谷物中。低聚糖是由3-10个单糖分子通过糖苷键连接而成的碳水化合物,准确来说,它们不属于单糖双糖类的范畴,比单糖和双糖的结构更复杂一些,且低聚糖对甜味影响微乎其微,这里我们主要来了解一下它们的益生元作用以及对肠道健康的其他益处。
肠道益生菌通过细胞外降解和/或完整内化以进行细胞内水解,将功能性低聚糖用作能量来源。不可消化的功能性低聚糖的同化可改善益生菌的生长和活性,同时改变短链脂肪酸、氨基酸和胆汁酸代谢物的产生。肠道微生物群及其代谢物相结合,可以逆转宿主肠道微生物群的动态平衡失调并修复肠道损伤。这些代谢物还激活肠道中的先天性和适应性免疫反应,有助于减轻肠道炎症和屏障功能障碍。
低聚半乳糖在食品加工过程中具有较高的稳定性,可用于食品应用。此外,低聚半乳糖比果糖玉米糖浆具有更高的溶解度、更好的保湿能力、更低的甜度(蔗糖的三分之一)和更高的粘度。这些特性为食品提供了令人愉悦的味道、质地特性和口感的改善。
低聚半乳糖的益生元潜力
实验和临床研究证明, 低聚半乳糖选择性地促进双歧杆菌的生长,增加乙酸盐和丙酸盐的产量。
在含有成人型微生物群的动态且经过验证的大肠模型中,确定了长双歧杆菌、双歧杆菌、链状双歧杆菌、加氏乳杆菌、唾液乳杆菌参与 GOS 发酵和代谢。
低聚半乳糖对肠道健康的影响
低聚半乳糖可有效缓解小鼠结肠炎,改善体重减轻症状并减少结肠缩短。它通过抑制结肠分泌白介素 (IL)-6、肿瘤坏死因子 (TNF)-α 和髓过氧化物酶来调节炎症反应。
低聚木糖因其成本竞争力、热稳定性和 pH 稳定性、感官特性以及对人类健康的多维影响,而具有作为食品成分的巨大潜力。
低聚木糖天然存在于竹笋、水果和蔬菜中,而商业低聚木糖通常源自木质纤维素材料,如玉米芯、稻草、麦麸、甘蔗渣、竹子等。
XOS已显示出多种有益作用,包括刺激益生元的生长、减少肠道内的腐败产物、降低血液胆固醇水平和抑制血糖水平。
低聚木糖的益生元潜力
XOS可以抵抗上胃肠道的消化,并选择性地刺激结肠中有益细菌的生长/活性,从而有利于宿主的健康。 DP 为 2-5 的低聚木糖作为唯一碳源可显着改善体外乳杆菌、双歧杆菌和拟杆菌的生长。
支链低聚木糖的发酵速度缓慢可能有利于益生菌的生长和丁酸的积累。此外,低聚木糖还能抑制病原微生物的生长,如肠球菌、大肠杆菌、艰难梭菌和产气荚膜梭菌。
低聚木糖对肠道健康的影响
与传统化疗策略相比,低聚木糖可能是肠道免疫干预的有用替代品。来自杏仁壳的部分O-乙酰化和脱乙酰木寡糖对大鼠胸腺细胞表现出直接的免疫刺激作用,增强了T细胞有丝分裂原诱导的增殖。
甘露寡糖是新兴的益生元,具有许多生物活性特性,可以刺激各种类型肠道益生菌的生长,并在胃肠道的不同部位释放有益的发酵产物。此外,甘露寡糖通过在结肠细胞中诱导不同的基因标记物,表现出抗癌和免疫调节作用。
甘露寡糖的益生元潜力
不同来源的甘露寡糖表现出不同的益生元活性。
甘露寡糖的结构影响其被益生菌利用的情况。分子量较低的甘露寡糖具有更好的细胞扩散性和分子移动性,因此更容易被利用。
甘露寡糖对肠道健康的影响
甘露寡糖可以直接激活肠道巨噬细胞,并抑制DSS诱导的促炎介质的产生。
壳寡糖表现出良好的理化性质,如低粘度和高溶解度。而且它们在人体肠道内很容易降解消化并进入血液循环,是理想的营养食品添加剂。
壳寡糖的益生元潜力
壳寡糖作为一种天然抗菌剂,不仅能抑制多种致病细菌、真菌和病毒的生长,而且对益生菌具有增殖作用。
带正电的壳寡糖与带负电的细胞壁成分结合,从而改变微生物膜的渗透性、细胞质膜屏障功能和/或微生物细胞的营养物质运输。
抗菌活性与壳寡糖的结构特征和靶微生物的类型有关。
壳寡糖对肠道健康的影响
壳寡糖已被公认具有抗炎活性,因此可能在炎症性肠病治疗中具有巨大潜力。
壳寡糖可以在生长、侵袭和转移阶段干扰癌细胞的增殖。
婴儿配方奶和母乳之间的主要区别之一是 HMO。 HMO 是母乳中继乳糖和脂质之后的第三大固体成分,占母乳总量的 1%。可以帮助肠道菌群增殖,抑制病原体粘附,从而有助于婴儿身体和免疫系统的发育。
人乳低聚糖的益生元潜力
到目前为止,已经研究了几种 HMO 成分的益生元作用,可以改变肠道微生物组成。
HMO 对病原微生物具有抗粘附作用。
HMO 的益生元活性,高度依赖于其组成和结构特征以及菌株特异性。
人乳低聚糖对肠道健康的影响
人乳低聚糖可通过调节肠道微生物群的生长和代谢,以及激活黏膜和全身免疫应答,有益于肠道健康。
母乳喂养可显著保护婴儿和幼儿期腹泻,降低发病率和死亡率。

HUIZENG HU / Getty Images
世界卫生组织建议,成人和儿童每日添加糖摄入量不应超过总能量摄入的10%,进一步降低到5%会有额外的健康益处。但是控糖不是马上能做到,以下方式或许能帮你控制糖摄入量。
调节肠道菌群缓解糖摄入的危害
★ 增加膳食纤维的摄入
膳食纤维是有益菌群的”粮食”,可以促进有益菌的生长,抑制有害菌的繁殖。同时,膳食纤维还能增加饱腹感,减少对糖的渴求。
关于膳食纤维详见:膳食纤维对代谢健康和肥胖的影响
★ 特定植物化学物质
姜黄素是一种从姜黄中提取的主要生物活性化学成分,已被发现具有一系列神经保护作用,包括减少淀粉样蛋白负荷、神经炎症、氧化应激、感染和炎症。
研究表明,姜黄素通过多种途径抑制高果糖引起的炎症。
在一些临床试验中,食用姜黄素后,血浆葡萄糖和甘油三酯的降低以及β细胞功能和afamin水平的改善也很明显。
姜黄素丰富了有益的肠道菌群,包括科水平上的Oscillospiraceae和Rikenellaceae ,属水平上的Oscillibacter、Alistipes、Pseudoflavonifractor、Duncaniella、Flintibacter。这些微生物组与改善代谢综合征、减少炎症以及对肝脏和心血管健康的潜在积极作用有关。
★ 选择低GI食物
低GI食物释放糖分较慢,不会引起血糖的快速升高,有助于维持肠道菌群的稳定。相反,高GI食物会导致血糖的快速波动,刺激有害菌群的生长。与豆类、面食、水果和乳制品有关,天然全食中的糖GI值较低。
★ 摄入益生元
益生元是一类能够选择性地刺激肠道有益菌群生长的物质,如我们前面章节提到的低聚果糖、低聚半乳糖等。摄入益生元可以优化肠道菌群的组成,减少对糖的渴求。
★ 尽可能避开高脂饮食
研究表明,含糖饮料和高脂饮食的共同摄入会破坏肠道微生物的平衡。这样的肠道微生态变化会使小鼠易感化学诱导性结肠炎。肠道炎症的增强与病原体的有利定植相关。
蔗糖溶液摄入使高脂饮食背景下Prevotellaceae和Enterobacteriaceae的相对丰度显著升高。通常Prevotellaceae成员与加重肠道炎症相关。
因此,选择低脂低糖,富含膳食纤维的饮食方式可以帮助肠道稳态,可参考地中海饮食。
其他有利控糖的措施
★ 设定具体、实用的目标
可以寻找逐步减少糖摄入量的实用方法通常更容易实现。
逐步做到少喝或不喝额外的含糖饮料,包括普通苏打水、运动饮料、果汁、许多瓶装茶、调味拿铁和咖啡奶精都含有大量糖。
可以尝试水、不加糖的茶或咖啡、100% 果汁等代替。
★ 选择天然食品,而非加工食品
从天然来源摄入足够的糖,对于维持充足的能量水平和全天保持血糖稳定是必要的。
因此,最好选择尽可能接近自然状态的食物。
水果是大自然的糖果。可以将它们用作原味酸奶、煎饼和烘焙食品等食品中的甜味剂。它们还可以很好地融入冰沙和果汁中。
除了甜味和风味外,水果还富含维生素、矿物质和抗氧化剂。
整个水果是健康饮食的重要组成部分。
一些专家建议从不同的食物类别中选择一些天然食品,例如:
全谷物:燕麦片(未调味)
蛋白质:亚麻籽或奇亚籽
可以尝试自制食品
减少外出就餐或外带食物,避免食用过多不了解的添加糖成分。
同时,也可以避开一些沙拉酱、意大利面酱等,可能含较多糖。
★ 烘焙时更换糖
如果想避免添加糖,那么需要限制蛋糕和饼干等烘焙食品。但这并不意味着彻底放弃。
不要使用全糖版本,而是尝试使用其他成分来尝试最喜欢的食谱。流行的糖替代品包括苹果酱、磨碎的水果或蔬菜、干果或花生。当然也可以少用糖而不添加其他成分。
一些人造甜味剂(例如阿斯巴甜和糖精)不适合烘焙。
尝试用香料代替食糖进行烘焙,比如说:
香草(天然且不加糖)、肉桂、肉豆蔻、丁香、甘草、干根或提取物(来自植物的天然甘草,而不是糖果)等。
★ 可以适当阅读食物标签
查看营养成分表中的”总糖“或”碳水化合物-糖“项,了解食品中糖的总含量。
查看配料表,了解食品中所含糖的种类。常见的糖包括蔗糖、葡萄糖、果糖、麦芽糖、乳糖等。
很多时候,配料表中的成分按照重量从高到低排列。如果糖出现在配料表的前几位,说明该食品中糖的含量较高。
注意营养成分表中的”每份含量”或”每100克/毫升含量”,了解每份食品或每100克/毫升食品中糖的具体含量,算一下总量,要不要吃完。
★ 如果一定需要甜味剂,可以尽量选择天然的
天然甜味剂有多种选择,热量不一定低。但一些天然甜味剂,如罗汉果和甜叶菊,也可以尝试,下表供参考,总的来说取决于自身健康状况、口味偏好以及如何使用。

注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
McDougle M, de Araujo A, Singh A, et al. Separate gut-brain circuits for fat and sugar reinforcement combine to promote overeating[J]. Cell metabolism, 2024, 36(2): 393-407. e7.
Gillespie, K.M.; Kemps, E.; White, M.J.; Bartlett, S.E. The Impact of Free Sugar on Human Health—A Narrative Review. Nutrients 2023, 15, 889.
Kawano Y, Edwards M, Huang Y, et al. Microbiota imbalance induced by dietary sugar disrupts immune-mediated protection from metabolic syndrome[J]. Cell, 2022, 185(19): 3501-3519. e20.
Prinz P. The role of dietary sugars in health: molecular composition or just calories?[J]. European Journal of Clinical Nutrition, 2019, 73(9): 1216-1223.
Garcia, K.; Ferreira, G.; Reis, F.; Viana, S. Impact of Dietary Sugars on Gut Microbiota and Metabolic Health. Diabetology 2022
Pessoa, J.; Belew, G.D.; Barroso, C.; Egas, C.; Jones, J.G. The Gut Microbiome Responds Progressively to Fat and/or Sugar-Rich Diets and Is Differentially Modified by Dietary Fat and Sugar. Nutrients 2023
Yang S, Wu C, Yan Q, et al. Nondigestible functional oligosaccharides: enzymatic production and food applications for intestinal health[J]. Annual Review of Food Science and Technology, 2023, 14: 297-322.
Satokari R. High intake of sugar and the balance between pro-and anti-inflammatory gut bacteria[J]. Nutrients, 2020, 12(5): 1348.
Noble E E, Olson C A, Davis E, et al. Gut microbial taxa elevated by dietary sugar disrupt memory function[J]. Translational Psychiatry, 2021, 11(1): 194.
Ma X, Nan F, Zhang D. Excessive intake of sugar: An accomplice of inflammation[J]. Frontiers in immunology, 2022, 13: 988481.
Conz, A.; Salmona, M.; Diomede, L. Effect of Non-Nutritive Sweeteners on the Gut Microbiota. Nutrients 2023, 15, 1869
Shon W J, Jung M H, Kim Y, et al. Sugar-sweetened beverages exacerbate high-fat diet-induced inflammatory bowel disease by altering the gut microbiome[J]. The Journal of Nutritional Biochemistry, 2023, 113: 109254.
Lamichhane, G.; Liu, J.; Lee, S.-J.; Lee, D.-Y.; Zhang, G.; Kim, Y. Curcumin Mitigates the High-Fat High-Sugar Diet-Induced Impairment of Spatial Memory, Hepatic Metabolism, and the Alteration of the Gut Microbiome in Alzheimer’s Disease-Induced (3xTg-AD) Mice. Nutrients 2024, 16, 240.