-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

通过膳食来改善健康的观点已逐渐深入人心,目前越来越多的食品,尤其功能性食品,特膳甚至药膳等成分表中常出现低聚果糖(果寡糖)、低聚半乳糖等成分。
低聚糖又名寡糖,通常被视为介于单糖(如葡萄糖、果糖)和多糖(如淀粉、纤维素)之间的物质。简单来说,单糖是最基本的糖单位,就像盖房子的小砖块,而低聚糖就是由几个这样的小砖块连接起来的 “小建筑”,但又没有淀粉、纤维素这种“高楼大厦”那么大。
低聚糖是一种新型功能性糖源,集营养、保健、食疗于一体,甜度和热量都低于传统糖类。
除了具备“糖”的作用外,低聚糖最大的特点是其益生元功能。低聚糖可以作为肠道有益菌的“食物”,促进双歧杆菌等有益菌的生长,调节肠道菌群平衡,改善肠道功能。并且不同低聚糖可特异性促进某些有益菌增殖,你可以理解为不同的益生菌擅于利用不同的低聚糖。
低聚糖除了作为益生元促进肠道有益菌增殖外,对人体还有多种益处。一些低聚糖具有直接的抗菌作用,部分低聚糖可以与免疫细胞相互作用,调节免疫功能。母乳喂养的婴儿具有较强的免疫力,这其中“母乳低聚糖”发挥了不可或缺的作用。
低聚糖还可以通过靶向肠道微生物群和微生物代谢物来增强肠道屏障,改善肠道功能;调节血糖水平,影响胰岛素敏感性;调节脂肪代谢,降低血脂;影响神经递质的产生;调节炎症反应等。这些能力在改善便秘、治疗或减轻肥胖、糖尿病、炎症性肠病、抑郁症等疾病中发挥了重要作用。还有研究发现,低聚糖对于减轻COVID-19(新型冠状病毒)的长期后遗症具有一定效果。
尽管目前的证据大多表明低聚糖对肠道菌群和人体健康有益,但是不同人群的菌群构成不同,身体健康状况存在差异,如何更好的选择合适的,单独的低聚糖产品或与低聚糖组合的产品需要更多的数据和了解。
本文今天将详解介绍什么是低聚糖,常见的低聚糖种类,来源和差异,在此基础上我们通过检索的研究资料总结汇总不同低聚糖对肠道菌群以及人体健康的影响差异,阐述它们如何通过调节肠道微生物和相关代谢物影响宿主的免疫系统、炎症水平和能量代谢,从而影响糖尿病、肥胖、抑郁、炎症性肠病及便秘等慢性疾病的发生发展。这可能是通过饮食干预促进人类健康和对抗慢病的新策略。
什么是低聚糖?
在谷禾营养素那篇文章(什么是营养,什么是营养素,什么是宏量和微量营养素?)简单地提到过低聚糖,低聚糖是一类由2到10个单糖分子通过糖苷键连接而成的碳水化合物。
自然界中典型低聚糖的结构
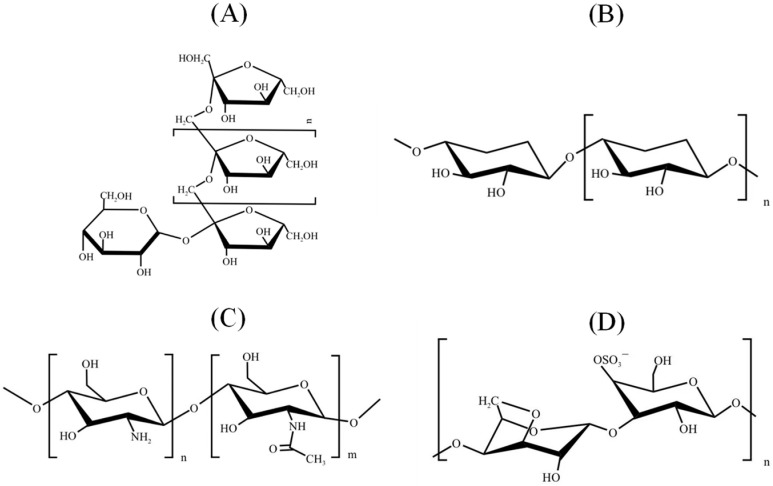
Cheong KL,et al.Pharmaceuticals (Basel).2023
(A):典型的低聚糖结构,多个单糖单位通过糖苷键连接在一起,如麦芽低聚糖或纤维低聚糖。
(B):线性低聚糖结构,单糖单位通过1,4-糖苷键连接,是纤维素或类似的低聚糖。
(C):含有氨基修饰的低聚糖,可能是壳寡糖或类似的氨基低聚糖。
(D):这是一个含有硫酸基团(-OSO₃⁻)的低聚糖,是硫酸化低聚糖(如硫酸软骨素或硫酸化海藻糖)。
低聚糖广泛存在于自然界,尤其是在植物中,如洋葱、大蒜、香蕉、燕麦和大豆等食物中,具有多种生物学功能和健康益处。
低聚糖(寡糖)主要根据单糖组成和结构进行分类,常见种类:
低聚果糖(FOS),组成:果糖+葡萄糖,主要来源有菊苣、洋葱、香蕉,可以促进双歧杆菌增殖。
低聚半乳糖(GOS),组成:半乳糖+葡萄糖,主要来源母乳、乳制品等,被报道可以增强钙吸收。
低聚异麦芽糖(IMO),组成:葡萄糖(α-1,6糖苷键),主要来源发酵食品、麦麸、蜂蜜,常用于烘焙。
低聚木糖(XOS),组成:木糖,来源有玉米芯、甘蔗渣等。
除此之外,还有其他一些分类方式
•按单糖组成分类
同质低聚糖:由相同的单糖分子聚合而成。比如麦芽低聚糖,它是由多个葡萄糖分子以α-1,4糖苷键连接而成。
异质低聚糖:由不同种类的单糖分子聚合而成。例如低聚乳糖,由半乳糖和葡萄糖以β-1,4糖苷键连接而成。
•按来源分类
天然低聚糖:天然存在于各种动植物中的低聚糖。
人工合成低聚糖:通过化学合成或生物技术手段制备得到的低聚糖。
目前市场上的低聚糖主要是提取来自食物或药材,主流原料来源:
•豆科植物:大豆低聚糖占全球产量35%;
•菊科植物:菊苣根提取低聚果糖(FOS);
•乳制品:乳清加工获取低聚半乳糖(GOS);
•中药材:黄芪、党参等含黄芪低聚糖。
提取技术对低聚糖的纯度影响比较大,水提醇沉法到固定化酶解再到色谱分离,已经可以达到食品级纯度了。
此外,低聚糖也可以通过生物合成路径合成,主要是三大生产路线:
1.酶法合成(主流工艺)
果糖基转移酶生产FOS,转化率达75%
β-半乳糖苷酶制备GOS
2.微生物发酵
芽孢杆菌发酵玉米淀粉产低聚异麦芽糖(IMO)
酵母工程菌产低聚木糖(XOS)
3.化学合成
酸水解法制备低聚壳聚糖(COS)
★ 不同低聚糖与益生菌和食药组合的健康改善效果不同
不同常见低聚糖的主要靶向菌群和产物
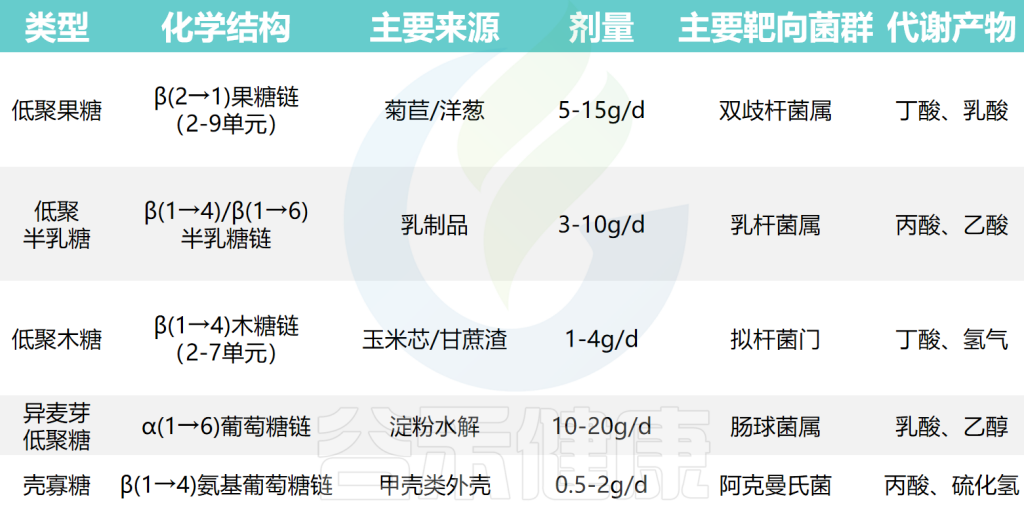
低聚糖与药食成分组合的效果

不同低聚糖与菌群互作的功效
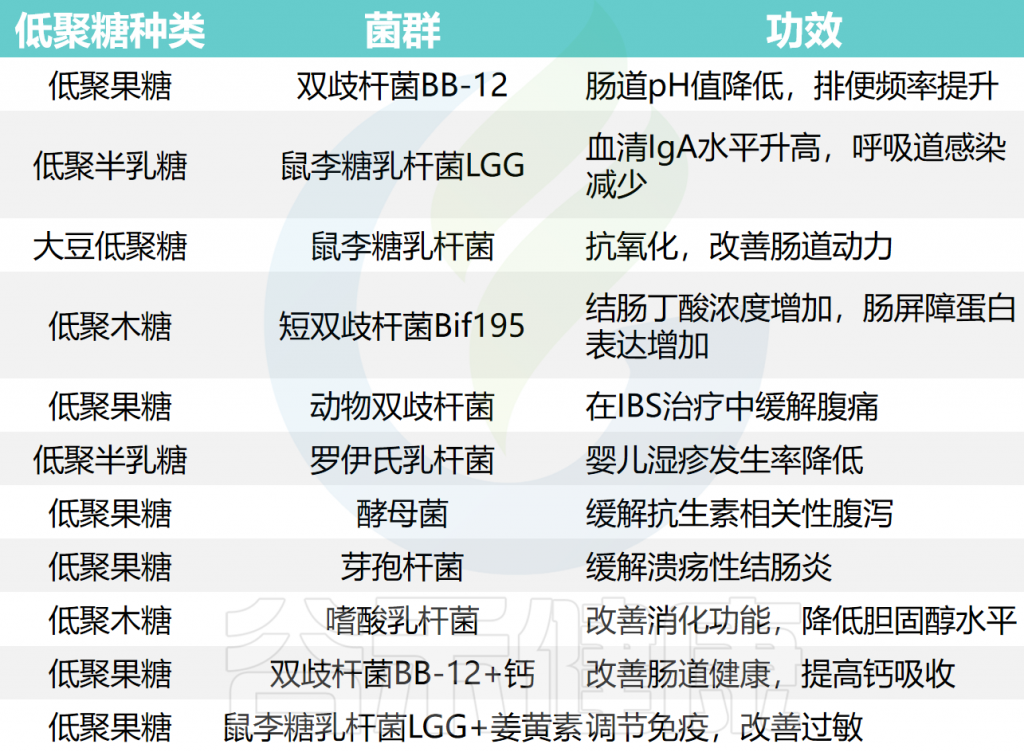
注意:以上部分支持性证据不是很足,尤其有些未完成人类的临床试验,若使用需根据自身情况咨询医疗建议后选择。
① 促进有益菌生长
低聚糖是肠道中特定有益细菌(如双歧杆菌和乳酸杆菌)的 “食物”,可被其选择性利用发酵。这些细菌通过糖苷酶分解和发酵低聚糖,使其茁壮成长并主导肠道微生物群落,在肠道内形成优势菌群,有助于抑制有害菌的生长,改善肠道微生态环境。
② 增强肠道屏障,改善肠道功能
肠道有益菌的增加能够促进肠道蠕动,帮助消化和吸收食物中的营养成分。同时,低聚糖在肠道内发酵产生短链脂肪酸,如丁酸、丙酸等,这些短链脂肪酸可以为肠道细胞提供能量,促进肠道细胞的生长和修复。
通过与G蛋白偶联受体(GPCR)结合,增强肠道屏障功能,有助于维持正常生理功能,预防便秘和腹泻等肠道问题。
③ 具有抗菌、抗病毒活性
低聚糖中的一些种类,如母乳低聚糖(HMO)可抑制病原体生长。研究发现,多种HMO显著抑制B组链球菌(GBS)三种菌株的生长,表明其具有抗菌活性。这一结论通过比较有无HMO条件下的细菌生物量得出,并在不同生长条件下显示出显著抑制作用。
HMO还能通过显著降低多种抗生素(如庆大霉素、红霉素等)对GBS的最低抑菌浓度,增强抗生素对耐药菌的有效性。此外,HMO可提高甲氧苄啶的效力,使其对GBS的MIC显著降低。
在病毒感染方面,体外研究表明HMO(如2’FL、LNnT等)具有预防流感和呼吸道合胞病毒(RSV)感染的能力。6′SL和LNnT预处理24小时可减少呼吸道上皮细胞中的流感复制,而2′FL预处理在两种细胞系中均显示出对RSV的保护作用,3′SL仅在一种细胞系中有效。
④ 调节血糖水平,影响胰岛素敏感性
低聚糖的化学结构和物理性质使其在胃肠道内不易被消化酶完全水解,吸收速度较慢。摄入含低聚糖的食物后,碳水化合物的消化吸收过程被延缓,避免血糖短时间内急剧升高,使血糖上升曲线更平缓。这对糖尿病患者控制血糖水平至关重要,有助于稳定血糖,减少波动带来的并发症风险。
一些研究表明,低聚糖的摄入可能通过调节肠道菌群等机制,改善机体的胰岛素敏感性。胰岛素敏感性的提高意味着身体细胞能够更有效地利用胰岛素,将血液中的葡萄糖转运到细胞内进行代谢,从而降低血糖水平,减轻胰岛素抵抗,对预防和管理糖尿病具有积极作用。
⑤ 与免疫细胞相互作用,调节免疫功能
低聚糖被认为在调节免疫反应中发挥作用,已知与低聚糖相互作用的免疫细胞包括源自先天和适应性免疫系统的巨噬细胞、树突状细胞、B细胞、T细胞和自然杀伤细胞等。
低聚糖增强巨噬细胞的吞噬活性,提高其吞噬和消除病原体的能力;影响树突状细胞(DC)的成熟状态;还可以影响NK细胞的活化状态和表型;并影响B细胞产生抗体。
母乳低聚糖与肠道免疫轴相互作用
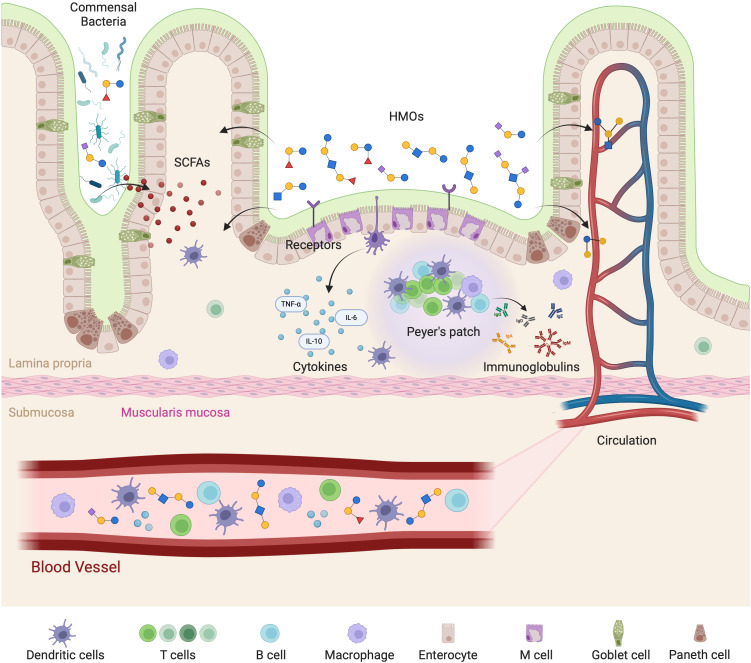
Slater AS,et al.Front Immunol.2025
⑥ 影响炎症反应,可能有助于治疗IBD
低聚糖具有调节免疫系统和减少炎症的能力,可能通过平衡Th1和Th2反应来实现。HMO增加了CD25+/CD4+T细胞的数量,这是T细胞的调节亚群,表明HMO有助于建立Th1/Th2平衡。
低聚糖还可以调节T细胞产生细胞因子,从而影响促炎和抗炎免疫反应之间的平衡。研究表明,某些低聚糖能够增强IL-10等抗炎细胞因子的产生,同时减少T细胞产生IFN-γ和IL-17等促炎细胞因子。
低聚糖被视为炎症性肠病(IBD)的潜在治疗剂。临床前研究表明,唾液酸化HMO(如3′-SL和6′-SL)具有抗炎特性,有助于维持肠道屏障完整性。
正在进行的临床试验评估HMO补充剂在缓解IBD症状和减少炎症方面的疗效,部分已显示症状改善。动物模型中,HMO在减轻炎症和改善肠道屏障功能方面表现出潜力,但仍需临床试验进一步验证其在人类IBD治疗中的效果。
⑦ 调节脂肪代谢,降低血脂
低聚糖在肠道内可与胆汁酸结合,阻止其重吸收,促使肝脏利用血液中的胆固醇合成新的胆汁酸,从而降低血液中的胆固醇含量。同时,低聚糖还调节肠道菌群,影响胆固醇的代谢,减少胆固醇吸收,有助于降低血脂水平,特别是降低低密度脂蛋白胆固醇(LDL-C,即“坏胆固醇”),从而降低心血管疾病的风险。
低聚糖通过调节肠道菌群及其代谢产物,可能影响脂肪代谢相关基因的表达和信号通路,减少脂肪合成,促进脂肪分解和代谢,有助于控制体重,预防肥胖及其相关的心血管疾病和代谢紊乱。
⑧ 预防龋齿
低聚糖在口腔环境中不易被细菌利用产酸。与传统糖类不同,低聚糖不会为致龋菌(如变形链球菌)提供能量,从而减少了口腔细菌产生酸性物质对牙齿的腐蚀。这有助于维持口腔微生物群落的平衡,降低龋齿发生风险,保护牙齿健康。
⑨ 可能具有抗肿瘤活性

还有研究分析了低聚糖的抗肿瘤活性。低聚糖通过重塑肠道菌群、促进短链脂肪酸生成、激活免疫应答及直接调控肿瘤细胞代谢,形成多层次抗肿瘤网络。
例如短链脂肪酸通过AMPK/mTOR通路调控能量代谢,抑制肿瘤细胞增殖。丁酸通过组蛋白修饰抑制癌基因(如c-Myc)表达,同时激活抑癌基因(如p21、p53)。
•化学结构与聚合度:传统糖类中的单糖,如葡萄糖和果糖,是最简单的糖结构,无法进一步水解为更小的糖单位。双糖如蔗糖由一分子葡萄糖和一分子果糖组成,麦芽糖则由两分子葡萄糖构成。低聚糖由2到10个单糖聚合而成,聚合度高于单糖和双糖,但低于多糖(多糖由超过10个单糖聚合而成,如淀粉和纤维素)。
•甜度:一般来说,传统糖类甜度较高,例如蔗糖甜度较高,是常见的甜味剂。而低聚糖的甜度普遍低于传统糖类,有的低聚糖甜度仅为蔗糖的30%-60%左右。
•消化吸收特点:单糖可以直接被人体吸收,为身体提供能量。双糖在消化酶的作用下水解为单糖后被吸收。低聚糖在胃肠道内部分可被消化吸收,但速度较慢;另一部分则无法被消化酶完全水解,进入大肠供肠道有益菌利用。
•血糖反应:传统糖类摄入后迅速被吸收,导致血糖快速上升并产生较大波动。相比之下,低聚糖的消化吸收较慢,对血糖的影响更为平缓,不会引起急剧升高,更适合需要控制血糖的人群。
•生理功能:传统糖类主要为人体提供能量。低聚糖除了提供一定能量外,还具有特殊的生理功能,如作为肠道有益菌的“食物”,促进双歧杆菌等有益菌的生长,调节肠道菌群平衡,改善肠道功能,并具有调节血脂和增强免疫力等潜在健康益处。
•化学成分与来源:代糖是一类甜味剂,包括天然代糖(如甜菊糖苷、罗汉果甜苷等,提取自植物)和人工合成代糖(如阿斯巴甜、糖精钠等,通过化学合成制备)。低聚糖是天然存在的碳水化合物,来源于多种动植物,但含量较低,当然也可以由人工合成。
•甜度:代糖的甜度差异较大,部分人工合成代糖如阿斯巴甜的甜度是蔗糖的180-220倍,远高于低聚糖和传统糖类。天然代糖的甜度则各异,有些与蔗糖相近或略低。
•热量:代糖的热量通常极低或几乎没有,因此被广泛用于替代传统糖类,以满足人们对甜味的需求并减少热量摄入。虽然低聚糖的热量相对传统糖类较低,但每克仍能提供约2-4千卡的能量。
•安全性与健康影响:一般来说,在规定使用范围内,代糖被认为是安全的,但一些人工合成代糖的长期大量摄入潜在健康影响仍存在争议。低聚糖是天然碳水化合物,适量摄入对大多数人安全,并具有调节肠道菌群和改善代谢等健康益处。然而,肠道敏感人群大量摄入低聚糖可能会引起胃肠道不适。
拓展:不适合摄入低聚糖的人群
通常情况下,大多数人都能适量摄入低聚糖并从中受益,但以下几类人群可能不太适合或需要谨慎摄入:
肠道敏感人群:部分肠道极为敏感的人群,如患有肠易激综合征(IBS)且症状较为严重的患者,在摄入低聚糖后,肠道可能无法适应。低聚糖虽然一般可促进有益菌生长,但对于这类肠道极度敏感的人,可能会迅速改变肠道内的微生物环境和渗透压,引发肠道不耐受反应,如腹胀、腹痛、腹泻等症状加重。他们的肠道本身就处于高敏状态,对这类物质的耐受性较差。
对低聚糖过敏人群:极少数过敏体质者可能对低聚糖产生过敏反应,免疫系统将其视为有害物质并引发免疫反应,导致皮疹、瘙痒、呼吸急促、口腔肿胀等症状。这类人群应严格避免摄入可能致敏的低聚糖。
正在使用特定抗生素或药物的人群:某些抗生素在杀灭有害菌的同时也会影响有益菌。使用此类抗生素期间,若大量摄入低聚糖,由于有益菌数量减少,低聚糖可能在肠道内过度发酵,导致胃肠不适。
特殊阶段的糖尿病患者:低聚糖对血糖的影响虽小于传统糖类,但糖尿病患者在血糖控制不稳定或急性并发症(如酮症酸中毒、高渗高血糖综合征)发作期,应严格控制碳水化合物摄入,即使是低聚糖也可能引起血糖波动,需在医生指导下谨慎食用。此外,某些因基因突变导致糖代谢异常敏感的特殊糖尿病患者,也应谨慎摄入低聚糖,以避免血糖失控。
此外,正在服用可能影响肠道菌群或糖代谢的药物(如某些免疫抑制剂、化疗药物等)的患者,在摄入低聚糖前应咨询医生,因为药物与低聚糖之间可能存在相互作用,影响药效或对身体产生不良影响。
糖苷键以多种方式连接,不同的排列组合形成了多种低聚糖,赋予它们各自不同的特性和功能。
这些低聚糖的功能和来源多样,使其在营养和健康方面的作用各不相同。常见的天然低聚糖包括母乳低聚糖(HMO)、低聚木糖(XOS)、阿拉伯木质低聚糖(AXOS)、异麦芽低聚糖(IMOS)、甲壳素低聚糖(NACOS)、甘露寡糖(MOS)、低聚半乳糖(GOS)和低聚果糖(FOS)。

1
母乳低聚糖
母乳在婴儿大脑和免疫系统的发育中至关重要,这很大程度上归功于母乳中的低聚糖。母乳低聚糖(HMO)是由乳腺中的乳糖生物合成的一组低聚糖,是母乳中仅次于乳糖和脂质的第三丰富固体成分。
母乳的组成成分
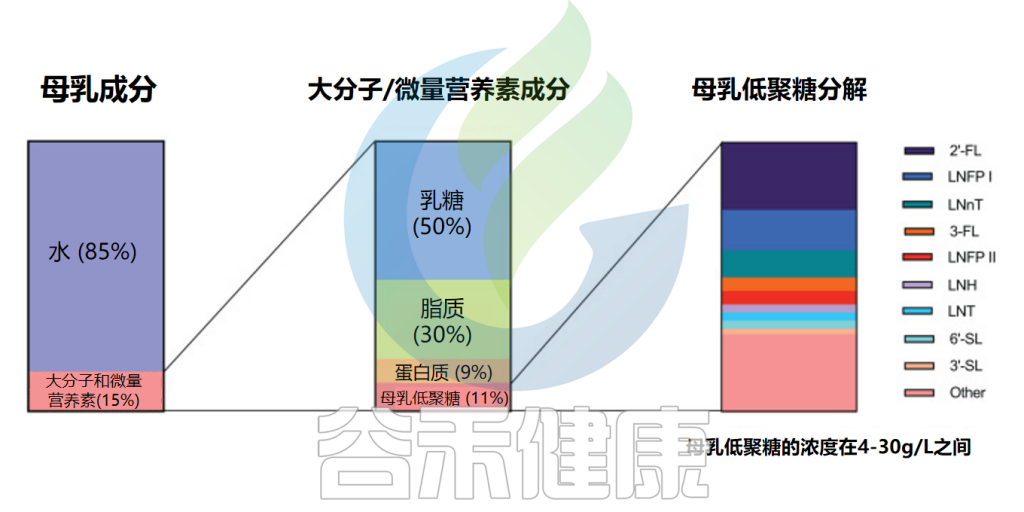
Slater AS,et al.Front Immunol.2025
• 母乳低聚糖对婴幼儿免疫系统的影响重大

最近发表的一项研究发现,母乳低聚糖对婴幼儿的免疫系统及肠道健康和功能具有重要影响:
(1)母乳低聚糖减少免疫系统中选择素介导的细胞间相互作用,降低白细胞在活化内皮细胞上的滚动,从而减少粘膜白细胞的浸润和活化,影响免疫细胞动力学。
(2)母乳低聚糖直接影响肠上皮细胞,调节参与各种细胞过程的基因表达,导致细胞表面聚糖和其他细胞反应发生变化,从而影响肠道健康和功能。
(3)母乳低聚糖能调节淋巴细胞产生细胞因子,促进平衡的Th1/Th2免疫反应。
母乳低聚糖对免疫反应的影响
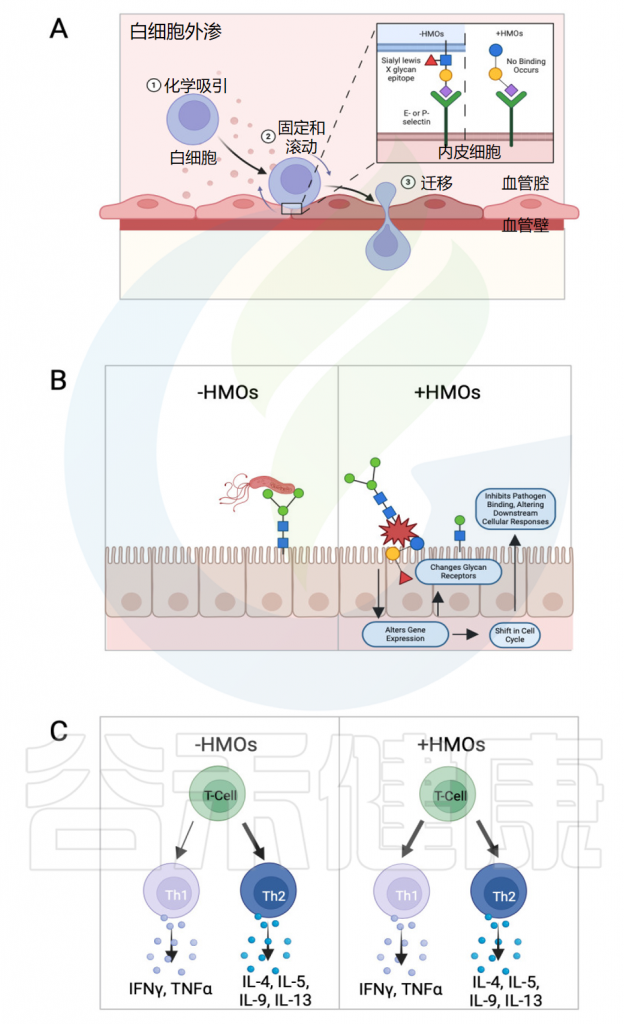
Slater AS,et al.Front Immunol.2025
• 促进有益细菌的生长,抑制宿主感染
作为一种益生元,母乳低聚糖选择性地促进共生肠道细菌的生长而不是病原体,以保护宿主。母乳低聚糖是婴儿肠道中特定有益细菌(如双歧杆菌和乳酸杆菌)的营养来源。
多样化的肠道微生物组与改善整体健康相关,包括更好的营养吸收、增强免疫功能和抵御病原体。母乳低聚糖通过促进粘蛋白产生维持肠道屏障完整性,防止有害细菌和毒素进入血液。
它还可以通过扮演诱饵受体的作用来抑制宿主感染,这些诱饵受体结合病原体以抑制细胞粘附。
2
低聚果糖
低聚果糖(FOS)是一种天然存在于多种植物中的短链碳水化合物,通常被视为益生元。它广泛存在于人们常食用的植物中,如香蕉、黑麦、大蒜、牛蒡、芦笋根、小麦、洋葱、马铃薯、雪莲果、菊芋和蜂蜜等。
• 促进消化吸收,增强肠粘膜
低聚果糖是一种天然活性成分,存在于水果、蔬菜和蜂蜜中,无法被胃肠道的消化酶分解,是优质的水溶性膳食纤维。此外,FOS可增强肠黏膜的保护功能,从而减少胃肠道疾病的发生。摄入低聚果糖可使粪便松软,并促进肠道功能。
• 促进有益菌生长,抑制病原体感染
研究表明,摄入低聚果糖后,肠道内双歧杆菌的数量可明显增加,有害菌如大肠杆菌、梭状芽孢杆菌等的数量则会相应减少。这有助于改善肠道功能,增强肠道屏障功能,预防便秘、腹泻等肠道疾病,还能降低肠道感染的风险。
低聚果糖通过与肠壁上的受体竞争来抑制病原体,从而降低感染风险,并有效竞争营养物质以预防感染。
• 促进矿物质吸收
低聚果糖有助于增加肠道对钙、镁等矿物质的吸收,对骨骼健康起到积极作用。
• 控制血糖和胆固醇
低聚果糖作为一种新型食疗剂,能有效降低血清胆固醇、甘油三酯和游离脂肪酸的含量,对因高血脂引起的高血压和动脉硬化等心血管疾病有良好改善作用。研究显示,在小鼠饲料中添加10%低聚果糖,饲养8周后,实验组小鼠的血浆总胆固醇水平显著低于对照组,表明低聚果糖可能有助于调节血脂代谢。
3
低聚木糖
低聚木糖(XOS)是木聚糖的水解产物,是一种新型的功能性低聚糖。天然低聚木糖,通常占少数,主要存在于一些植物中,例如橄榄、甘蔗、杨树。
一些食物中也含有低聚木糖,包括:燕麦、大麦、黑豆、红豆、竹笋、甜菜、胡萝卜、洋葱和香蕉。
• 促进双歧杆菌增殖的能力是其他低聚糖的数倍
与其他低聚糖(如低聚果糖和低聚异麦芽糖)相比,它对肠道双歧杆菌的增殖促进作用更强,其双歧因子功能是其他低聚糖的10-20倍。
注:双歧因子是促进双歧杆菌生长的营养物质。
• 在抗肿瘤活性中发挥作用
低聚木糖在抗肿瘤活性方面发挥两种作用。首先,其能高度选择性地促进肠道中双歧杆菌的增殖,双歧杆菌是重要的益生菌,能够抑制有害菌生长并减少内源性致瘤物质的产生,同时通过增加免疫细胞数量和活性发挥抗肿瘤作用。
其次,低聚木糖促进短链脂肪酸(SCFA)的产生,短链脂肪酸具有显著的抗肿瘤作用,能降低肠道pH值,从而抑制病原菌和有害菌的生长,降低肿瘤发生率。
此外,低聚木糖还在调节血糖、降低血脂和预防肠道疾病方面发挥重要作用。
4
阿拉伯木质低聚糖
阿拉伯木质低聚糖(AXOS)是阿拉伯木聚糖(AX)的一种酶解产物。在没有外源木聚糖降解酶的情况下,阿拉伯木聚糖可以通过木聚糖酶等降解酶转化为 AXOS,这些酶由肠道中的拟杆菌门等细菌分泌。AXOS通过特定的运输载体进入细菌,并被糖苷水解酶进一步降解为单糖,如木糖和阿拉伯糖。嗜酸乳杆菌、短乳杆菌和双歧杆菌等物种产生这些酶。
• 可产生短链脂肪酸
阿拉伯木质低聚糖可被肠道微生物群用于产生短链脂肪酸(SCFA),研究表明,分子量小于400Da的AXOS具有更好的活性。丁酸可作为结肠细胞的能量来源,刺激结肠上皮细胞的生长并抑制结肠肿瘤细胞的生长。发酵产生的乙酸和丙酸被吸收,并分别参与体内的脂质代谢和糖代谢。
5
低聚异麦芽糖
淀粉中发现的低聚异麦芽糖(IMO)通常以支链淀粉或多糖的成分形式存在,除了在淀粉、玉米、牛奶、麦麸、豆浆、酱油和蜂蜜中存在外,很少以游离状态天然存在。
• 改善肠道环境,维持菌群平衡
低聚异麦芽糖(平均分子量900Da)可被肠道微生物群降解,从而改善肠道环境,选择性地促进双歧杆菌的增殖,并维持肠道微生物群的平衡。
同时,IMO还可以通过产生短链脂肪酸(SCFA)和有机酸等发酵产物,预防手足口病(HFMD)引起的全身和组织炎症、葡萄糖耐量不良、全身性肥胖等症状。
6
低聚半乳糖
低聚半乳糖(GOS)是天然低聚糖,动物的乳汁中存在微量的低聚半乳糖,母乳中含量稍多。此外,某些豆类、魔芋和卡拉胶中也存在低聚半乳糖。
• 能够促进多种有益菌的增殖
低聚半乳糖(GOS)与低聚果糖(FOS)和低聚异麦芽糖(IMO)相比,是三种低聚糖中唯一能被人体肠道内八种有益菌利用的。它是双歧杆菌和嗜酸乳酸杆菌等有益菌的优质营养源和增殖因子,有助于改善肠道的消化吸收功能。
• 低聚半乳糖对婴儿消化和免疫很重要
新生儿的消化功能比较薄弱,母乳中含有的低聚半乳糖,它不但能改善婴儿的消化功能,还能促进钙的吸收,增强婴儿的免疫力。
不同的低聚糖在聚合程度、糖苷键和整体结构复杂性(如侧链)等方面存在差异。这些差异导致与低聚糖相互作用的多种微生物群,表现为有益细菌增殖程度、有害细菌受抑制程度以及酸和气体产生的差异。
以木聚糖为例,进入肠道后,被拟杆菌门分泌的糖苷水解酶降解为低聚木糖(XOS),并转运至细胞周质中。木聚糖及其代谢产物可通过转运蛋白进入双歧杆菌或其他细菌中,并被革兰氏阳性菌PUL编码的碳水化合物活性酶进一步降解。
• 低聚木糖可被降解为单糖用于产生短链脂肪酸
低聚木糖(XOS)可被肠道微生物分泌的d-木糖苷酶和阿拉伯糖苷酶水解为单糖,用于生产短链脂肪酸,如乙酸盐、丙酸盐、丁酸盐、乳酸和琥珀酸。研究表明,XOS可显著增加有机酸含量,摄入阿拉伯糖—低聚木糖后乙酸浓度也显著升高。
SCFA作为有机酸,可降低肠道pH值,促进胃肠蠕动,抑制硝酸盐还原菌的生长,从而预防肠道疾病。此外,SCFA通过调节表皮屏障、免疫介导炎症和抑制肠道病原体感染,影响宿主免疫功能,并通过抑制结直肠肿瘤细胞的生长、诱导分化和凋亡发挥抗肿瘤作用。
肠道中木聚糖和低聚木糖的代谢
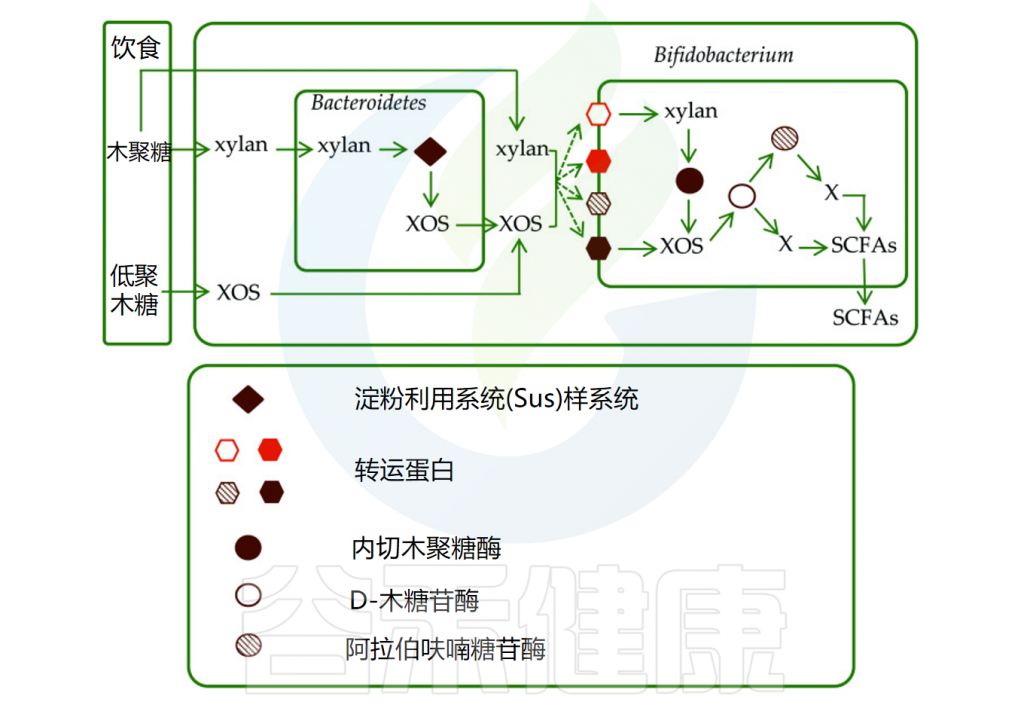
doi: 10.1039/d0ra00344a.
具有不同聚合度(DP)的低聚糖可以被不同的菌株利用。例如,DP3低聚果糖(FOS)在体外促进双歧杆菌生长,同时抑制梭菌增殖,显示出更优越的选择性刺激活性。
• 不同细菌喜好代谢不同的低聚糖
研究证明乳双歧杆菌(Bifidobacterium lactis DR10)消耗的低聚糖(低聚半乳糖)具有较高的聚合度,而鼠李糖乳杆菌(Lactobacillus rhamnosus DR20)更喜欢使用半乳糖。
评估了具有不同DP的竹笋壳低聚木糖(XOS)的益生元能力,结果显示高聚合度(>X5)的低聚木糖增加有益菌(如拟杆菌属)的丰度,而低聚合度(X2-X3)则促进其他有益菌(如Lachnochlostridium)的增殖。青春双歧杆菌(Bifidobacterium adolescentis)和嗜酸乳杆菌(Lactobacillus acidophilus)主要利用X2-X3组分。
• 低聚合度的聚糖更能支持肠道菌群增殖
微生物降解高聚合度的低聚糖通常需要更多能量,因为微生物优先将其降解为低聚合度的低聚糖,这限制了肠道微生物群的代谢能力。相反,低聚合度的低聚糖的分解较简单,所需能量较少,因此更能支持肠道微生物群的生长和增殖。
例如,关于低聚糖的研究表明,DP3-4(≥80%)的成分被所有益生菌菌株利用,DP5-6的部分被一些菌株利用,而DP≥7的部分仅被乳酸菌(LAB)和双歧杆菌利用。DP3-5中的异麦芽糖比DP2更易消化,尽管其到达结肠的几率更高,但对有益益生菌的发酵选择性较低。
• 不同聚合度的低聚糖经菌群产生的代谢物不同
不同聚合度的低聚糖对肠道菌群产生的主要代谢物影响不同。首先,具有不同聚合度的低聚糖导致肠道微生物群产生不同类型和比例的短链脂肪酸。高聚合度的低聚糖发酵较慢,逐渐释放更多丁酸盐,作为诱导产丁酸盐细菌增殖的潜在底物;而低聚合度聚糖快速发酵,产生更多乙酸盐和丙酸盐。
此外,具有不同聚合度的低聚糖在发酵过程中产生的气体(如氢气和二氧化碳)数量也不同。通常,高聚合度的低聚糖因发酵速度较慢,产气量较少,而低聚合度的低聚糖发酵速度较快,产气量较多。
低聚糖在肠道中的发酵过程涉及低聚糖的摄入,这些低聚糖首先被细菌膜上的模块化聚糖酶识别并水解为低聚合度的低聚糖。随后,低聚合度的低聚糖通过膜转运蛋白进入细胞,并被酶分解为二糖和单糖。
• 不同低聚糖经分解后的产物不同
例如,低聚半乳糖(GOS)被β-半乳糖苷酶水解为半乳糖和葡萄糖,随后进入Leloir途径和糖酵解。低聚果糖(FOS)首先通过ABC转运蛋白被嗜酸乳杆菌吸收,降解为β-葡萄糖苷,进一步被果糖苷酶和β-呋喃糖苷酶分解为果糖和葡萄糖。在婴儿双歧杆菌亚种中,母乳低聚糖(HMO)底物通过ABC转运蛋白完整运输,随后由多种细胞质糖苷酶水解,包括α-岩藻糖基化酶和2,3/6-α唾液酸酶。
• 益生菌的诱导生长能力与糖苷键相关
低聚糖的不同结构对肠道微生物组有不同影响,包括糖苷键类型和连接模式。例如,异麦芽低聚糖(IMO)中形成的α-(1→3)-和α-(1→2)-连接的葡萄糖寡糖(GlcOSs)促进了双歧杆菌属和乳酸杆菌属的生长,其发酵选择性高于仅含α-(1→6)-连接的IMOs。
研究了不同二糖键的低聚糖对乳酸菌的影响,发现大多数物种对α-(1→6)-IMOs的生长速率较低,而β-(1→4)-连接的纤维二糖和β-(1→6)-连接的龙胆二糖显著促进了短乳杆菌(L.brevis ATCC 8287)、鼠李糖乳杆菌(L.rhamnosus ATCC 53103)、植物乳杆菌(L.plantarum WCFS1)和加氏乳杆菌(L.gasseri ATCC 33323)的增殖。
同样,研究了二糖的益生元指数(PI),发现α-葡萄糖二糖的PI高于β型。比较了β-低聚糖、β-低聚半乳糖和α-低聚半乳糖对肠道菌群代谢的影响,结果显示含β-糖苷键的低聚果糖和低聚半乳糖是双歧杆菌的首选底物,对微生物组成影响显著。
此外,摄入含β-1,3、β-1,4和β-1,6糖苷键的低聚果糖在健康志愿者中显示出更好的益生元效应。双歧杆菌、乳酸杆菌和屎肠球菌对主要含有β-1,3和β-1,6糖苷键的低聚果糖的发酵活性优于含单个β-1,4糖苷键的低聚果糖。这与另一项研究的结论相似,后者发现双歧杆菌、乳酸杆菌和链球菌更偏好含β-1,6糖苷键的半乳糖,而非β-1,4糖苷键的半乳糖。
总之,益生菌的生长诱导能力与糖苷键的类型相关,因此了解低聚糖的结构-活性关系至关重要。
• 取代基的数量和类型影响微生物的组成和发酵速率
低聚糖中取代基的数量会影响微生物的发酵速率。低取代的低聚糖优先被发酵,导致高取代的低聚糖积累,表明取代基的存在可能延迟或完全阻碍发酵。
研究表明,木糖低聚糖(XOS)上的取代基会影响双歧杆菌的发酵,导致乳酸产量不同。未取代的XOS中乳酸含量高于取代的XOS,说明未取代的XOS更易被肠道微生物发酵。此外,已有研究描述了双歧杆菌在体外和体内对低取代XOS的偏好,表明微生物可能根据低聚糖的结构优先生长或被抑制,从而改变微生物群落的组成。
低聚糖中取代基的类型同样影响微生物的发酵速率和组成。在人类粪便体外发酵实验中,线性木糖低聚糖和阿拉伯糖取代的木糖低聚糖(AXOS)的发酵速度快于乙酰化木糖低聚糖,而含有4-O-甲基葡萄糖醛酸基团(GlcAmeXOS)的木糖低聚糖发酵速度最慢。与AXOS相比,使用XOS作为唯一碳源时,拟杆菌门表现出优异的生长性能,其降解XOS的过程包括细胞外降解和骨骼的分枝,随后是寡聚体的细胞内水解,最终产生乙酸盐、丙酸盐和丁酸盐作为主要代谢产物。
• 低聚糖的链长和形状特异性地影响菌群生长
此外,低聚糖的链长和形状也很重要。例如,长链低聚糖对上肠的水解和降解具有更强的抵抗力,能更有效地刺激双歧杆菌、普雷沃菌属和乳酸菌的生长。
双歧杆菌在利用不同链长的低聚果糖(FOS)时表现出选择性特异性,通常短链FOS优先被发酵,其次是长链FOS。环状异麦芽低聚糖(IMO)已被证明可以抑制链球菌,而具有更多分支的小麦阿拉伯木聚糖水解物则只能部分被双歧杆菌和拟杆菌发酵。
综上所述,聚合度、取代基和糖苷键类型显著影响益生菌的活性和增殖能力,因此针对不同的益生菌需要施用对应特点的低聚糖。
低聚糖作为一种重要的功能性食品成分,近年来在多种疾病的治疗中显示出显著的潜力。其通过调节肠道微生物群、改善代谢功能和增强免疫反应等机制,成为研究的热点。
接下来将探讨低聚糖在不同疾病人群中的治疗效果,特别是在肥胖、糖尿病、肠道疾病、抑郁症和便秘等方面的应用。甚至还有研究发现了低聚糖在新型冠状病毒(COVID-19)感染后的潜在调节作用。
肠道微生物失调是肥胖患者和动物模型的常见特征。研究表明,益生元低聚糖(如低聚果糖、低聚木糖和低聚半乳糖)通过调节肠道微生物群具有抗肥胖作用。
• 低聚糖通过调节肠道菌群发挥抗肥胖作用
一项针对肥胖小鼠模型的研究发现,低聚糖的给药增加了拟杆菌门的丰度,降低了厚壁菌门的丰度,并改变了100多个细菌类群。另一项研究发现低聚木糖饮食减少了小鼠的内脏脂肪,这与肠道微生物群的变化有关,具体表现为拟杆菌门增加和厚壁菌门减少。在科和属水平上,f_S24-7_Unclassified显著增加,而链球菌科、粪球菌属、瘤胃球菌属和乳球菌属显著减少。
此外,高脂饮食(HFD)导致血浆脂多糖(LPS)水平持续升高,进而引发全身炎症反应,促进肥胖患者的胰岛素抵抗。在一项针对肥胖女性的研究中,低聚果糖干预后双歧杆菌和普拉梭菌的丰度增加,肠道菌群的变化与脂肪量、血清脂多糖水平和代谢(如马尿酸、乳酸和血浆蛋白C)的变化相关。
同样,食用低聚木糖可降低肥胖小鼠的代谢内毒素血症。结果表明,低聚糖可以抑制促炎菌的生长,如瘤胃球菌、变形菌门和一些产生毒素的梭菌属,并促进有益细菌(如双歧杆菌、乳酸杆菌和普雷沃氏菌)的生长,从而有助于缓解肠道炎症并降低肥胖风险。
因此,通过低聚糖调节肠道微生物群的组成被认为是预防和治疗肥胖的有效方法。
• 通过代谢产生短链脂肪酸抑制脂肪合成
肥胖的直接原因是脂肪合成的速度超过脂肪消耗的速度。因此,阻断脂肪合成和增加能量消耗是对抗肥胖的最有效策略。低聚糖对减肥的影响主要归因于肠道微生物群产生短链脂肪酸,因为它们在调节食物摄入和能量代谢中起着重要作用。
乙酰辅酶A羧化酶(ACCase)是脂肪酸合成过程中的关键酶。通过抑制ACCase活性,可以减少脂肪酸的合成,这有助于预防肥胖。乙酸盐被催化成乙酰辅酶A,丁酸盐被转化为丁酰辅酶A,作为限速酶(ACCase)脂肪酸合成的抑制剂,以减轻肥胖。
丁酸盐通过摄入低聚糖而丰富,调节肠道微生物群中丁酸盐与乙酸盐的比例是治疗肥胖的潜在策略。研究表明,低聚半乳糖通过调节短链脂肪酸的合成改善小鼠的脂质代谢。膳食补充甘露寡糖可以通过重塑肠道微生物组成和增强短链脂肪酸的形成来减少肥胖。
• 通过影响胆汁酸的合成和释放调节能量代谢
低聚糖还可以通过影响与胆汁酸(BA)代谢相关的肠道微生物群来调节胆汁酸的合成和释放,例如梭菌、拟杆菌门、乳酸杆菌和双歧杆菌。
研究发现,几丁寡糖干预后,肠道菌群可以促进胆汁酸的释放,进而激活TGR5,增强棕色脂肪产热和TGR5主导的脂肪酸氧化信号通路,从而在减肥和降脂方面发挥作用。
其他研究表明,低聚半乳糖显著影响了小肠中胆汁酸的浓度,改善了葡萄糖代谢,并通过调节脂质消化影响脂质吸收。果胶低聚糖也被证明可以通过肠道微生物群及其代谢物介导胆固醇代谢。
// 编者小结
肠道微生物群能够利用低聚糖产生营养代谢物,这些代谢物充当细菌群落的“信使”,影响宿主能量稳态并调节宿主代谢,从而有助于对抗肥胖。
低聚糖对肥胖和2型糖尿病的影响
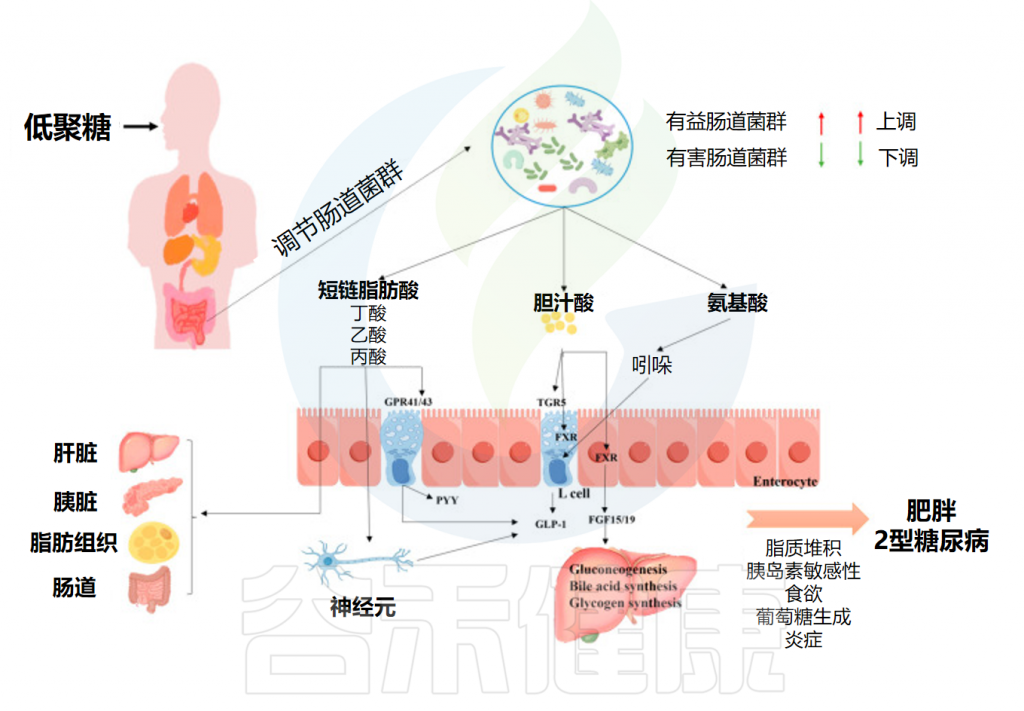
Yuan M,et al.Foods.2024
糖尿病是一种以高血糖为特征的慢性疾病,主要由胰岛素分泌绝对或相对不足和利用受损引起。目前,增加膳食纤维摄入量是2型糖尿病(T2DM)患者的推荐饮食疗法之一。
• 低聚糖通过增加双歧杆菌等特定有益菌,改善糖尿病
研究表明,低聚糖(NDO)能够通过调节肠道菌群,丰富或减少特定微生物,从而有效改善糖尿病。例如,在T2DM大鼠中,双歧杆菌属、罗氏菌属、粪杆菌属、拟杆菌属和阿克曼氏菌属这些有益菌的丰度下降,而脱硫杆菌属、颤杆菌克属、梭杆菌属、瘤胃球菌属和Blautia属的丰度增加。
经过16周的低聚果糖治疗,T2DM模型大鼠的物种α多样性降低,双歧杆菌的相对丰度增加,瘤胃球菌的相对丰度显著降低。后续对低聚果糖和低聚半乳糖的研究发现了Phascolarctobacterium、Coprococcus和Oscillospira的丰度也有所降低。
• 产生短链脂肪酸影响胰岛素敏感性
此外,低聚糖通过影响微生物产生的有益代谢物,如短链脂肪酸(SCFAs)、氨基酸代谢物和生物活性多肽,来调节胰岛素敏感性、血糖和脂质代谢,从而缓解糖尿病的发病和进展。
研究表明,SCFA调节胰腺的胰岛素分泌,防止胰岛素抵抗并增强胰岛素敏感性。丙酸盐通过多种机制增强葡萄糖刺激的胰岛素释放,并维持胰腺β细胞的功能和数量,包括抑制细胞凋亡、促进细胞增殖和减少α细胞向β细胞的反向分化。因此,丙酸盐有助于维持胰岛功能的完整性和稳定性。
此外,丁酸盐在小鼠模型和大型人群队列中被证明能提高胰岛素敏感性并防止胰岛素抵抗,其机制与促进能量消耗和刺激线粒体功能有关。
作为信号分子的SCFA通过激活G蛋白偶联受体GPR41和GPR43来调节胰岛素水平并抑制肝脏糖异生,从而维持宿主能量稳态。它们还促进胰高血糖素样肽-1(GLP-1)和肽YY的分泌,GLP-1通过降低血糖水平和改善胰岛素分泌与抵抗参与葡萄糖稳态。SCFA在T2DM的发展中起着关键作用,并可作为代谢紊乱或体内平衡的标志物。
• 摄入低聚糖形成的氨基酸代谢物影响血糖水平
摄入低聚糖可产生多种氨基酸代谢产物,影响血糖水平和胰岛素敏感性。一些氨基酸可被特定肠道微生物转化为生物活性代谢物,例如吲哚、丙酸咪唑和酪胺。
色氨酸(Trp)可被多种细菌代谢成吲哚,并调节GLP-1的分泌。Trp也可被某些肠道微生物转化为吲哚丙(IPA),如C.caloritolerans和C.paraputrificum,IPA可显著降低大鼠的空腹血糖和胰岛素水平,改善胰岛素抵抗。
此外,研究发现,低聚糖干预后T2DM模型大鼠中糖原氨基酸(如脯氨酸、丝氨酸和亮氨酸)的含量增加。丝氨酸和谷氨酰胺的增加可降低T2DM的风险。
总之,低聚糖通过调节肠道菌群和碳水化合物、脂质、蛋白质的代谢。同时,肠道微生物群产生的众多代谢物可反馈到大脑,影响许多胃肠道过程。
炎症性肠病(IBD)是一种常见的非特异性慢性胃肠道炎症性疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC)。越来越多的证据表明,功能性低聚糖作为天然活性物质,可以有效改善IBD。
• 丰富肠道菌群的多样性
低聚糖可以通过调节肠道菌群来缓解肠道炎症。研究发现,IBD患者粪便中大肠埃希菌和粪肠球菌的水平显著高于正常人,而乳酸菌和双歧杆菌的丰度显著降低。肠道微生物失调导致肠粘膜生态失衡,促炎细胞因子的产生增加,抗炎细胞因子的产生减少。
低聚果糖通过促进乳酸菌的生长来缓解肠道炎症。增加的有益菌产生短链脂肪酸可被肠上皮细胞吸收并抑制促炎细胞因子IL-8和IL-6的产生,从而减轻结肠上皮细胞的炎症反应。
总之,低聚糖可以通过减少促炎菌的丰度、增加抗炎菌的丰度和促进短链脂肪酸的产生来缓解IBD的症状。
• 保护肠道屏障
在炎症性肠病中,紧密连接蛋白(如claudin1、occludin和ZO-1)和粘附连接蛋白(如E-钙粘蛋白和β-catenin)的改变通常伴随肠道通透性增加和肠道结构破坏。
低聚糖通过调节肠道微生物群的多样性来帮助恢复粘膜屏障的完整性。例如,母乳低聚糖恢复了结肠炎小鼠的紧密连接蛋白和MUC-2的表达,抑制了脂多糖和内毒素结合蛋白的产生,并恢复了肠道屏障的完整性。此外,魔芋低聚糖增加了小鼠结肠中短链脂肪酸的浓度,促进IL-18并修复IEC的完整性。
• 免疫稳态的调节
肠上皮细胞和免疫细胞中的Toll样受体(TLR)识别并响应不同的微生物结构。当病原体入侵时,巨噬细胞通过TLR识别病原体相关分子模式(PAMP)并分泌各种促炎细胞因子(如TNF-α、IL-1β、IL-6、IL-12等)。
IBD患者的调节性T(Treg)细胞数量减少。短链脂肪酸可以诱导T细胞分化为调节性T细胞细胞,促进抗炎细胞因子的合成以调节免疫反应,并恢复Th1/Th2和Th17/调节性T细胞的平衡。一项研究表明,低聚木糖被代谢成SCFAs,丙酸盐和丁酸盐可以促进CD4+ T细胞分化为调节性T细胞,从而减缓炎症性肠病。同样,阿魏酰化寡糖促进了调节性T细胞的百分比和相应特异性细胞因子的产生,从而调节炎症性肠病的Th17/调节性T细胞免疫稳态。
此外,肠道微生物群还可以刺激B细胞产生影响其他免疫细胞和免疫球蛋白(如sIgA)的抑制性细胞因子(如IL-10和TGF-β)。
低聚糖通过调节肠道微生物群来缓解炎症性肠病
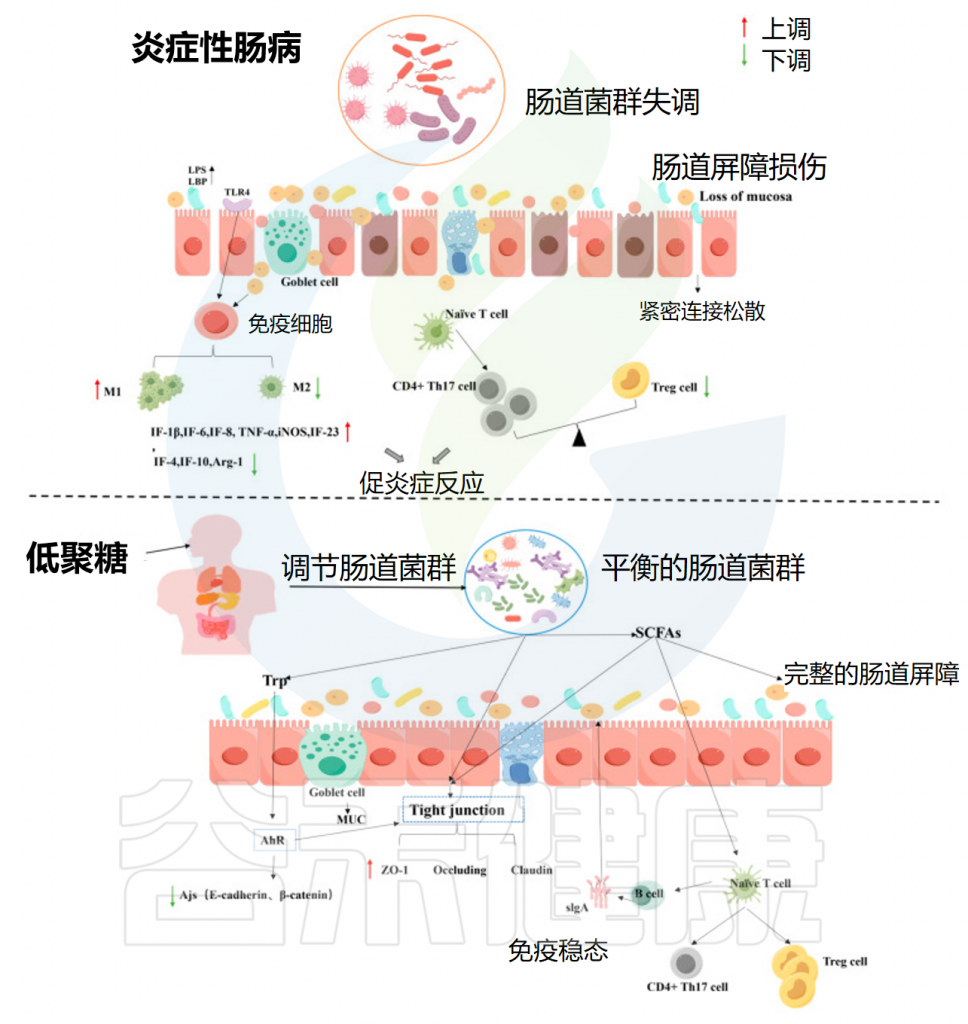
Yuan M,et al.Foods.2024
低聚糖可能通过调节肠道微生物群影响抑郁症的发展。例如,低聚果糖抑制抑郁相关细菌(如Lachnospiraceae incertae sedis、Oscillibacter、Proteobacteria和Streptococcus)。
• 使用低聚糖后减轻了抑郁症状
此外,低聚果糖(FOS)和低聚半乳糖(GOS)的组合已被证明可以减轻抑郁症状,具体来说,它们增加了海马脑源性神经营养因子(BDNF)和皮质血清素的水平,同时降低了升高的皮质酮水平和体温。三周的慢性社交压力显著减少了社交互动,而FOS+GOS给药可以防止这种影响。FOS和GOS的组合还降低了开放空间测试和迷宫测试中的焦虑水平。
在微生物水平上,有证据表明两者的结合可以防止放线菌和变形菌门比例的变化,这是重度抑郁症患者的典型特征。对低聚果糖和标准抗抑郁药氟西汀进行了比较分析,指出它们具有相似的效果,并且FOS和氟西汀都促进了Dialister属的生长。
注:最近的一项队列研究报道,在抑郁患者中未发现Dialister。换句话说,FOS和氟西汀可能通过调节Dialister的存在来改善抑郁症状。
• 低聚糖的菌群代谢物是保护神经系统的关键
肠道微生物可以通过神经、免疫和内分泌途径以及微生物代谢物影响大脑,甚至通过微生物产生的神经递质刺激肠道的迷走神经末梢。已知受肠道菌群影响的神经递质包括短链脂肪酸(SCFA)、γ-氨基丁酸(GABA)、色氨酸(Trp)和血清素(5-HT)。
例如,丁酸盐的增加可能直接影响中枢神经系统。发现口服丁酸盐会影响脑代谢和海马神经发生。因此,低聚糖补充剂可能通过增强SCFA的形成来抑制抑郁症的发展,包括改善认知功能和缓解焦虑行为。
另一个重要途径是色氨酸→血清素(5-HT)。色氨酸是合成神经递质5-HT的唯一前体,影响抑郁症的发展。阿魏酰化寡糖(FOs)通过调节5-HTP(血清素前体)表现出抗抑郁和抗焦虑作用,表明肠道微生物群和微生物代谢是支持FOs保护神经系统的关键介质。
同样,另一项研究揭示了巴戟天寡糖(MOO)调节肠道菌群中的5-HT合成途径(Trp→5-HTP→5-HT),肠道菌群中升高的5-HTP被吸收到血液中,然后穿过血脑屏障,提高大脑中的5-HT水平。这些发现表明,肠道微生物群可以调节神经递质水平以影响抑郁症的发展。
肠道菌群与低聚糖互作改善抑郁症
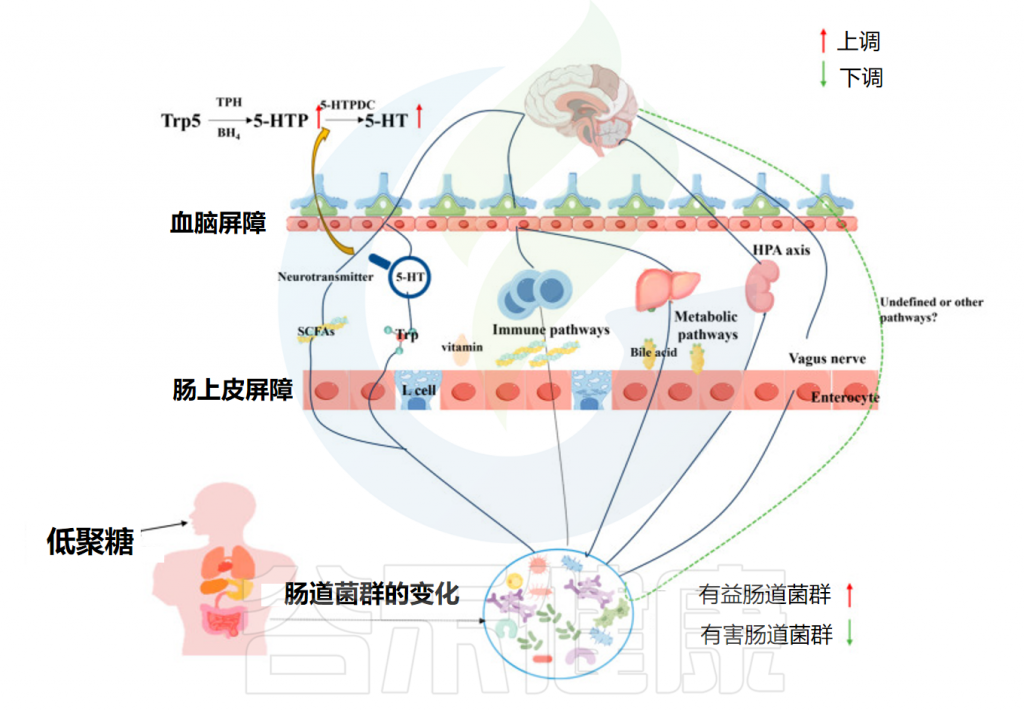
Yuan M,et al.Foods.2024
肠道蠕动受肠道免疫系统、分泌物、微生物群及其发酵产物的相互作用调节,蠕动受损可导致便秘。益生菌(如双歧杆菌和Alistipes)丰度增加,以及与结肠运输相关的细菌丰度减少,有助于缓解便秘。
• 低聚糖促进肠道蠕动改善便秘
低聚糖,如低聚果糖、异麦芽低聚糖和低聚半乳糖,能显著提高排便频率并缩短结肠转运时间,且副作用小。除了低聚糖本身占据肠道体积以增加粪便量和促进蠕动外,研究还表明低聚糖在微生物群重塑方面对缓解便秘有显著益处。
具体而言,乳酸菌利用低聚果糖提高粪便稠度并减少排便时间。异麦芽低聚糖有效改善受试者的粪便稠度和排便频率,可能是由于结肠发酵后某些微生物丰度增加。莲子低聚糖通过刺激宿主肠道有益菌的生长促进蠕动和排便,从而缓解便秘。
• 通过代谢产生的短链脂肪酸来改善肠道蠕动
此外,研究证明低聚半乳糖可以通过调节肠道代谢物的产生改善便秘。低聚糖的摄入增加了益生菌发酵的底物量并促进了短链脂肪酸的产生。特别是丁酸盐、乙酸盐和丙酸盐,与刺激结肠上皮细胞的生长有关,从而恢复肠道形态并增加肠道蠕动以缓解便秘。
目前的研究表明,丁酸盐可以通过影响水和电解质代谢来改善肠道蠕动。同样,低聚半乳糖通过恢复恶化的水电解质代谢(包括AQP3/4和ENaC-β/γ)表达来缓解便秘。其中,AQP3/4将水从肠腔输送到结肠上皮,ENaC-β/γ介导Na+摄取到结肠上皮细胞中。
• 调节代谢途径,改善便秘
低聚糖改善便秘可能与调节代谢途径有关,包括脂质代谢、胆汁酸代谢和色氨酸代谢。代谢异常与肠道炎症反应相关,炎症会破坏肠上皮完整性,减少神经递质和激素分泌,影响胃肠蠕动并诱发便秘。
胃肠道激素在中枢和周围神经系统中作为神经递质和调节剂,促进肠道蠕动和内容物运输。内皮素、生长抑素和血管活性肠肽为抑制性神经递质,而褪黑激素和P物质为兴奋性神经递质。
此外,色氨酸代谢对胃肠蠕动有显著促进作用。L-色氨酸、5-HTP及其他中间代谢产物是神经递质和调节剂的底物,可增强内脏神经敏感性并刺激蠕动。研究表明,NDO 可通过激活5-HT信号通路缓解便秘。同时,胆汁酸通过肠道细菌的代谢调节便秘也发挥重要作用。
// 编者小结
低聚糖可以通过促进肠道蠕动、增强屏障功能和调节免疫反应,有效缓解便秘。这些发现表明低聚糖在治疗便秘方面的潜在价值,进一步支持了通过靶向肠道微生物群及其代谢功能来改善便秘的研究方向。
低聚糖缓解便秘的作用机制
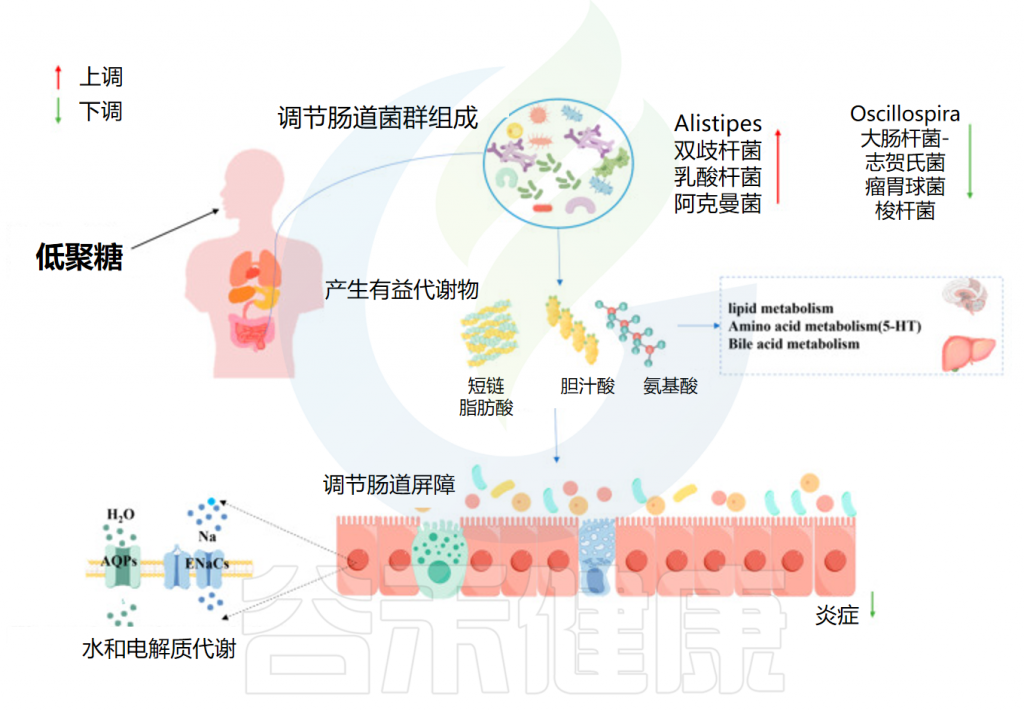
Yuan M,et al.Foods.2024
COVID-19(新型冠状病毒)大流行对全球健康产生了深远影响,许多人面临长期后遗症,需制定有效的管理策略应对COVID-19后综合征,如腹泻、疲劳和慢性炎症。
食物中存在的低聚糖被证明具有益生元作用,且新证据表明其可能具备免疫调节和抗炎作用,这对缓解COVID-19的长期影响尤为重要。
• 低聚糖通过阻止病毒复制,减轻后遗症
感染COVID-19后患者即使从急性期恢复,体内也可能携带少量病毒载量,这会激活肠道ACE2受体并引起腹泻等胃肠道症状。低聚糖具有生物活性特性,能够增强免疫系统,抑制病毒复制和传染性,并提供对病毒感染的保护。
注:ACE2存在于人体的各种细胞上,包括呼吸道和胃肠道的细胞,已被确定为新型冠状病毒的功能宿主受体。
低聚果糖、低聚木糖、低聚半乳糖等低聚糖可选择性促进双歧杆菌和乳酸杆菌等有益菌的生长。这些益生菌产生的脂肽分子(如解淀粉芽孢杆菌的枯草杆菌蛋白酶、卷曲乳杆菌的curvacin A、沙克乳酸杆菌的sakacin P和乳酸乳球菌的乳球菌素Gb)与人ACE2具有更高的结合亲和力,通过竞争性抑制阻止SARS-CoV-2与表达ACE2的宿主上皮细胞结合和繁殖。
低聚糖抑制COVID-19病毒复制
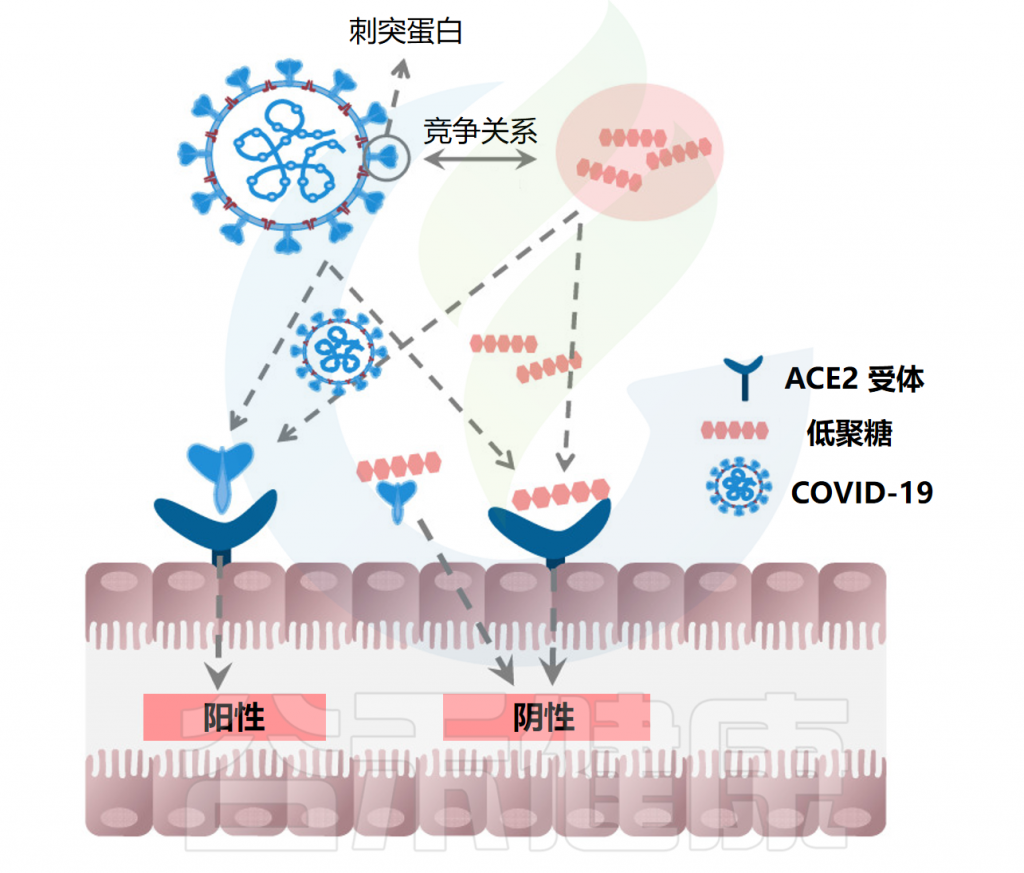
Cheong KL,et al.Pharmaceuticals (Basel).2023
• 增加肠道有益菌丰度及相关代谢物,调节炎症反应
临床研究表明,低聚果糖可通过肠-脑轴调节微生物群与大脑的交流,改善肠道多样性,减少高5-羟色胺状态和多巴胺代谢紊乱。粪便代谢物分析显示,COVID-19患者在疾病消退前后短链脂肪酸浓度显著降低。
有证据表明,低聚糖可以增加产生短链脂肪酸的细菌和短链脂肪酸的产生。例如,蔓越莓阿拉伯木聚糖和果胶低聚糖促进了嗜酸乳杆菌、植物乳杆菌和发酵乳杆菌等乳酸菌物种的生长,也增加了短链脂肪酸的产生,其中丁酸盐是最突出的SCFA。
此外,果胶低聚糖或菊粉可以通过特异性增加B.vulgatus的丰度来差异调节炎症反应。B.vulgatus具有强大的免疫调节作用,有助于预防结肠炎等炎症。
低聚糖在减少COVID-19后综合征方面的潜在影响

Cheong KL,et al.Pharmaceuticals (Basel).2023
低聚糖已广泛存在于我们的食品和生活中,作为一种重要的益生元,它通过调节肠道微生物群的组成和功能,促进有益代谢物的生成,从而对人体健康产生积极影响。在缓解各种人类慢性疾病(如糖尿病、抑郁症、便秘、结肠炎和肥胖)方面展现出巨大潜力。
但我们想要更好地利用低聚糖来开发新的膳食补充剂和功能性食品,为慢性疾病提供有效的预防和治疗策略。需要进一步研究低聚糖与肠道菌群之间的相互作用,进一步探索低聚糖在不同慢病中的具体机制,并比较不同低聚糖类型的作用。
这将有助于揭示低聚糖的功能差异,为开发针对特定疾病的个性化营养干预方案提供科学依据,并推动低聚糖在功能性食品和临床治疗中的应用。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Slater AS, Hickey RM, Davey GP. Interactions of human milk oligosaccharides with the immune system. Front Immunol. 2025 Jan 14;15:1523829.
Yuan M, Zhang Z, Liu T, Feng H, Liu Y, Chen K. The Role of Nondigestible Oligosaccharides in Alleviating Human Chronic Diseases by Regulating the Gut Microbiota: A Review. Foods. 2024 Jul 8;13(13):2157.
Wu Y, Chen Y, Lu Y, Hao H, Liu J, Huang R. Structural features, interaction with the gut microbiota and anti-tumor activity of oligosaccharides. RSC Adv. 2020 Apr 24;10(28):16339-16348.
Cheong KL, Chen S, Teng B, Veeraperumal S, Zhong S, Tan K. Oligosaccharides as Potential Regulators of Gut Microbiota and Intestinal Health in Post-COVID-19 Management. Pharmaceuticals (Basel). 2023 Jun 9;16(6):860.
Wu D.-T., Nie X.-R., Gan R.-Y., Guo H., Fu Y., Yuan Q., Zhang Q., Qin W. In Vitro Digestion and Fecal Fermentation Behaviors of a Pectic Polysaccharide from Okra (Abelmoschus esculentus) and Its Impacts on Human Gut Microbiota. Food Hydrocoll. 2021;114:106577.
Wang X., Yang Z., Xu X., Jiang H., Cai C., Yu G. Odd-Numbered Agaro-Oligosaccharides Alleviate Type 2 Diabetes Mellitus and Related Colonic Microbiota Dysbiosis in Mice. Carbohyd. Polym. 2020;240:116261.
Huang C., Yu Y., Li Z., Yan B., Pei W., Wu H. The Preparation Technology and Application of Xylo-Oligosaccharide as Prebiotics in Different Fields: A Review. Front. Nutr. 2022;9:996811.
Divyashri G., Karthik P., Murthy T.P.K., Priyadarshini D., Reddy K.R., Raghu A.V., Vaidyanathan V.K. Non-Digestible Oligosaccharides-Based Prebiotics to Ameliorate Obesity: Overview of Experimental Evidence and Future Perspectives. Food Sci. Biotechnol. 2023;32:1993–2011.