-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

小克里斯滕森氏菌(Christensenella minuta)是一种革兰氏阴性、不产生孢子、不运动的细菌:它属于厚壁菌门,这是细菌界中最大的门之一,包括多种对人类健康有重要影响的细菌。
在厚壁菌门下,C.minuta属于梭菌纲,这一纲的细菌多为厌氧菌,能在缺氧的环境中生长。梭菌目是梭菌纲下的一个目,包含了多种与消化道健康密切相关的细菌。
在梭菌目下,C.minuta属于Christensenellaceae属,这是一个与肠道健康紧密相关的科。由Christensenella minuta和少数其他菌种组成的属。
Christensenella minuta于2012年首次从健康人类粪便中发现,被认为是新一代益生菌。克里斯滕森菌科(Christensenellaceae)及其成员Christensenella minuta已被证明具有许多健康益处。
研究表明,Christensenella minuta在2型糖尿病和肥胖等代谢紊乱以及炎症性肠病中的丰度显著下降。其相对丰度与低 BMI 指数相关的瘦表型呈正相关。
除此之外,支气管哮喘和过敏性疾病、肾结石、情感障碍、甲状腺癌、粘膜类天疱疮、多囊卵巢综合征和复发性口疮性口炎等疾病中Christensenella minuta的丰度也较低。
Christensenella minuta能够代谢多种碳水化合物,例如纤维素、半纤维素和果胶,产生乙酸和丁酸等短链脂肪酸,这些物质不仅对肠道健康有益,还能调节宿主的代谢过程。
C.minuta通过几种机制影响代谢健康,包括使肠道微生物群重新正常化、产生功能性短链脂肪酸、抑制脂肪生成、维持肠道上皮完整性以及通过胆汁酸代谢调节能量代谢。
此外,C.minuta还通过抑制NF-κB信号通路和促炎细胞因子IL-8的分泌来缓解炎症性肠病。
C.minuta还可能对患有过敏性疾病的患者大有裨益,因为它可以改善肠道通透性并减轻全身炎症。而患有哮喘、湿疹和食物过敏的患者更容易出现“肠漏”,这被认为是导致疾病发病和诱发病情的一个因素。
鉴于其能够限制肠道干细胞增殖,未来C.minuta衍生的益生菌也可能对恶性肿瘤患者有益,尤其是结肠癌患者。
此外,Christensenella minuta显示出与其他潜在有益菌株的强烈相关性;由于C.minuta能够产生短链脂肪酸或塑造酸性环境,有利于其他有益菌(如Akkermansia muciniphila和Roseburia faecis)或与传统益生菌菌株(如双歧杆菌和乳酸杆菌)的生长,C.minuta还能够产生氢气,为M.smithii提供代谢底物(它利用H2和CO2产生甲烷),同时会抑制如克雷伯菌、大肠杆菌等机会性病原体的定值和增殖。
本文从基本属性、人群分布、Christensenella minuta的丰度与一些人体疾病(如肥胖、炎症性肠病和 2 型糖尿病)中的关联,以及与其他细菌的相关性,讲述了可能成为新一代益生菌的Christensenella munita。更好的了解Christensenella可以为基于肠道微生物群的个性化药物或疗法铺平道路。
▸ 发现历史
小克里斯滕森氏菌(Christensenella minuta)(DSM 22607) 于2012年通过 16S rRNA 测序发现,并首次从健康日本男性的粪便样本中培养出来。
2021年,发现了另一个C.minuta菌株DSM33407。其序列与菌株DSM22607有 99% 的一致性,并表现出相似的微生物学特性。次年,另一株菌株C.minuta DSM 33715 被公布并登记。
此外发现了两个新的细菌物种Christensenella massiliensis和Christensenella timonensis ,经 16S rRNA 测序,它们与C. minuta的序列相似性分别为 97.4% 和 97.5%。
而Caldicoprobacter oshimai JW/HY-331 T、Tindallia californiensis DSM 14871 T和Clostridium ganghwense JCM 13193 T是最近的亲属。
▸ 基本属性
从分类学上讲,Christensenella minuta属于厚壁菌门、梭菌纲和梭菌目。该细菌以丹麦微生物学家 Henrik Christensen 的名字命名,其种名反映其小巧的体型(Minuta在拉丁语中是“小”的意思)。该菌株的基因组相对较小,由大约150万个碱基对组成。
Christensenella minuta的细胞形态
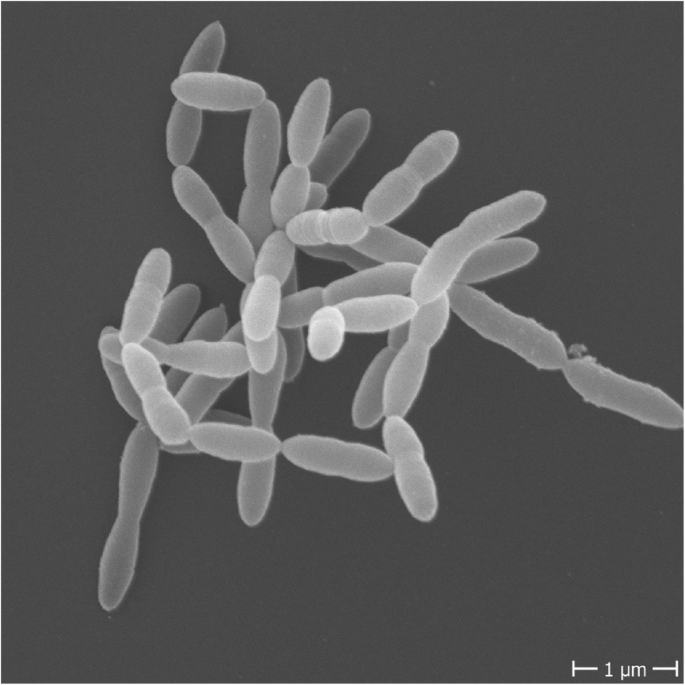
doi: 10.1186/s12915-019-0699-4.
Christensenella minuta是一种小型杆状细菌,末端呈锥形、大小从0.5毫米到1.9毫米不等、革兰氏阴性、不产生孢子、不运动的细菌,可形成圆形、几乎无色的菌落。菌落的平均尺寸为:宽度0.507±0.04μm、长度1.27±0.28μm、直径0.5–1.0μm,单独或成对出现。
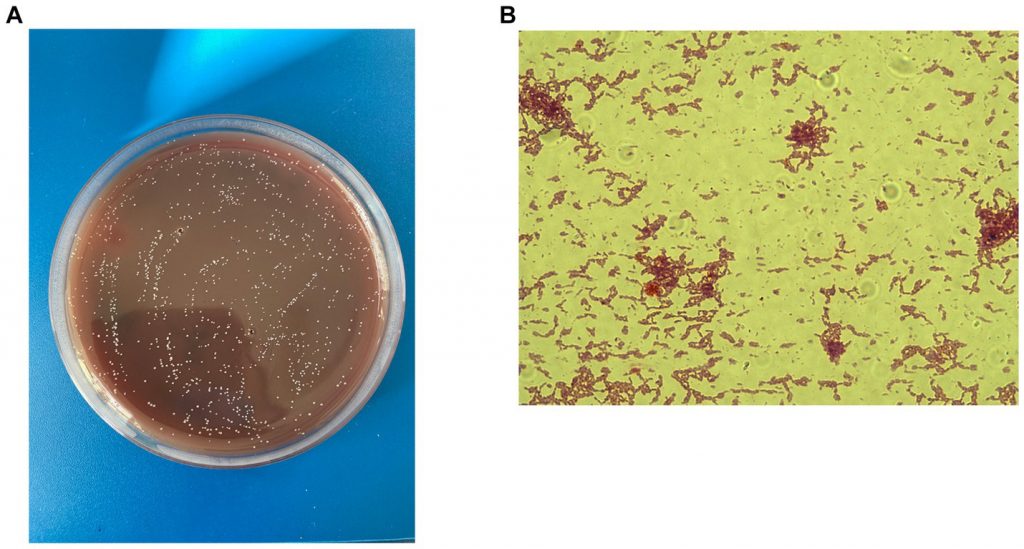
Ignatyeva O,et al.Front Microbiol.2024
A)革兰氏染色;B)在Schaedler琼脂上生长的菌落
-暴露于空气中会显著降低活性
它最初被描述为严格厌氧的;然而,后来的研究表明,它可以耐受氧气数小时。与普遍看法相反,暴露在大气中不会立即杀死细菌,而是会降低其活力。Christensenella minuta在37–40°和pH7.5时生长最快。它不是特别挑剔,可以在各种培养基中生长。
Christensenella minuta具有边界清晰的细胞壁,由丙氨酸、谷氨酸、丝氨酸和LL-二氨基庚二酸组成,这些细胞壁与半乳糖、葡萄糖、鼠李糖和核糖作为全细胞糖连接。
-对氨苄西林和四环素有抗性
菌株DSM22607的胆汁抗性为20%,而菌株 DSM33715的胆汁抗性高达80%。
对氨苄西林和四环素有抗性,但对氯霉素、克林霉素、美罗培南、甲硝唑、莫西沙星和哌拉西林/他唑巴坦敏感。
-可以利用多种单糖,但无法代谢色氨酸
在碳源利用方面,Christensenella minuta显示出对多种碳水化合物的利用能力,包括纤维素、半纤维素和果胶等。这些碳水化合物在肠道中不易被宿主消化酶分解,但C. minuta能够通过其独特的酶系统进行发酵,从而获取能量和营养物质。
C.minuta可以利用多种单糖,如葡萄糖、D-木糖、L-阿拉伯糖、L-鼠李糖和D-甘露糖,进行糖酵解发酵。C. minuta对葡萄糖的主要发酵产物是短链脂肪酸(乙酸和丁酸)。此外,已证明它可以通过发酵转化有机底物以产生大量氢气。
C. minuta对过氧化氢酶、氧化酶和脲酶的检测结果均为阴性。它也不能还原硝酸盐,也不能代谢色氨酸。最近, C. minuta菌株之一 DSM 22607被证明能产生一种新型胆盐水解酶(BSH)。
克里斯滕森菌科(Christensenellaceae)成员遍布各大洲。它们生活在各种动物的微生物群中,从蟑螂和蜥蜴到鸟类和哺乳动物,包括人类。这些细菌主要存在于胃肠道中,但也存在于灵长类动物的呼吸道和泌尿生殖道。
▸ 不同种族和性别之间丰度差异显著
Christensenella minuta作为健康成人结肠中的亚优势共生微生物种群,约占细菌总种群的0.2%到2%。其流行率在个体之间差异很大。在人群中,与克里斯滕森菌科(Christensenellaceae)不同相对丰度相关的特征包括种族和性别。
例如,对居住在阿姆斯特丹的2000多名不同种族的个体进行了研究,报告称荷兰受试者的Christensenellaceae科相对丰度最高。同样,比较了1673名居住在美国的人种族间微生物组差异,报告称与其他种族相比,亚太岛民的粪便样本中Christensenellaceae科的总体代表性较低。

一项研究还发现,与男性相比,女性中Christensenellaceae的相对丰度更高,在动物中也报告了类似的观察结果。这些种族和性别差异的根本原因尚不清楚。
▸ 百岁老人和瘦体型的人群中丰度更高

还有研究表明,在中国、意大利和韩国等国,百岁老人和超百岁老人体内的Christensenellaceae相对丰度高于年轻人群,因此Christensenellaceae可能与人类长寿有关。
针对多个地理位置的相对年轻个体的研究也发现了Christensenellaceae与年龄的正相关的关系 。鉴于这些研究均未对同一个体进行长期跟踪,因此 Christensenellaceae 与年龄的关联可能反映的是队列效应,而非年龄效应。
例如,随年龄而变化的饮食模式可能会影响这种关联,或者较早出生的个体体内的Christensenellaceae含量可能一直高于较晚出生的个体。
基于 16S rRNA 基因的肠道微生物群检测,该菌群在瘦体型个体中较为丰富。M.smithii是最丰富的产甲烷菌,它利用H2和CO2(C.minuta细菌发酵膳食纤维的产物)产生甲烷,表明以H2为基础的共营养与瘦表型和健康状态相关。这表明C.minuta和M.smithii之间存在跨物种氢转移,并且这两个物种与瘦表型呈正相关。
▸ 炎症性肠病等疾病中丰度降低
研究发现,C. minuta在健康个体的肠道微生物群中普遍存在,但在患有炎症性肠病(IBD)等特定疾病的个体中,其丰度显著降低。
这种分布的差异性提示了C. minuta在维持肠道健康和预防疾病方面可能具有重要作用。
越来越多的研究揭示了Christensenella minuta在人体健康和疾病中的重要作用。Christensenellaceae与多种代谢过程密切相关。研究表明,这种细菌在调节宿主的能量平衡、脂质代谢、脂多糖代谢、抗炎作用以及维持肠道屏障功能方面发挥着关键作用。
进一步的研究还发现,Christensenellaceae的丰度与肥胖、糖尿病、炎症性肠病等多种疾病的风险呈负相关。它还与健康衰老有关。在短短10年内,已经积累了大量证据表明,Christensenellaceae在许多疾病中显著减少。
Christensenellaceae与人类健康之间的关联

Ignatyeva O,et al.Front Microbiol.2024
▸ 肥胖患者中减少 ↓
肥胖是一种复杂的疾病,由体内过多的脂肪堆积引起,会对身体健康产生不利影响。许多非传染性疾病,如心血管疾病、各种癌症、2 型糖尿病、高血压和中风,以及精神健康问题都与肥胖有关。
研究认为,肥胖的病因与肠道菌群失调和先天性瘦素缺乏有关。已提出了几种机制将肥胖的发生与肠道菌群组成联系起来,这些机制是通过代谢和炎症活动的功能障碍实现的。
肥胖的发生涉及肠道菌群和宿主,是通过与近端器官的直接相互作用或通过代谢物分泌与肝脏、脂肪组织和大脑等远处器官的间接相互作用介导的。
在许多研究中,C. minuta被反复与其治疗性抗肥胖潜力联系在一起,这表明C. minuta在肠道微生物生态系统中的作用与宿主代谢的调节之间存在很强的相关性。C. minuta发挥治疗性抗肥胖作用的机制包括调节肠道上皮完整性、产生短链脂肪酸、改善脂质代谢和胆汁酸代谢。
Christensenella minuta抗肥胖作用的潜在机制
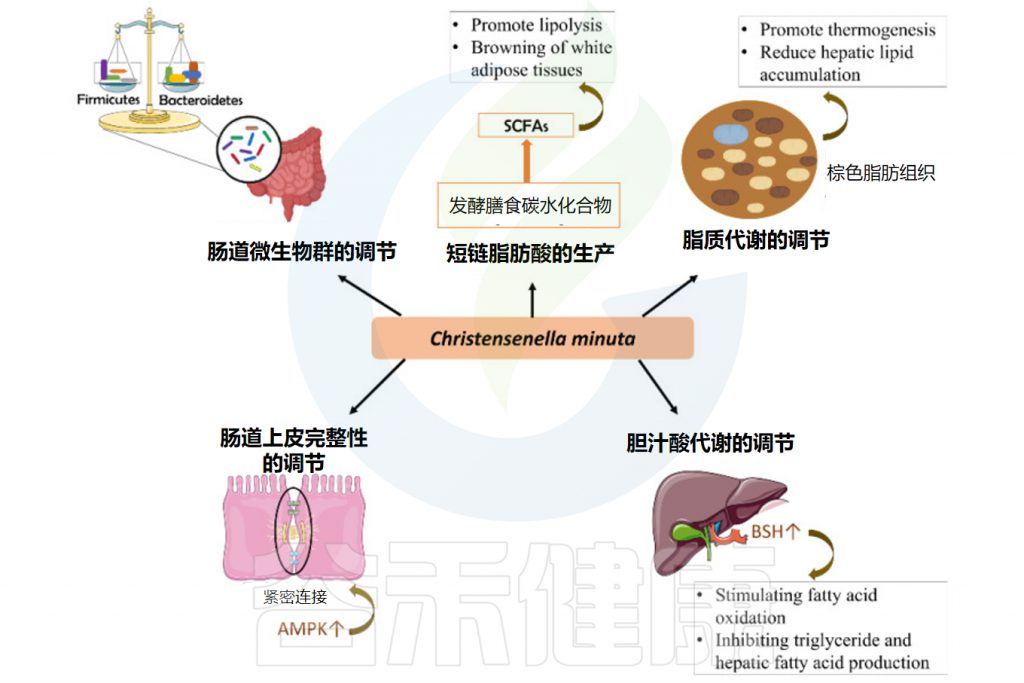
Ang WS,et al.Foods.2023
-产生短链脂肪酸来调节能量代谢和肠道稳态
研究发现C. minuta DSM 22607以5:1的比例产生高水平的乙酸盐和中等水平的丁酸盐,而不产生丙酸盐。
同时,在近端和远端结肠中均发现了低水平的支链脂肪酸,即异丁酸、异戊酸和异己酸,这表明C.minuta可降低细菌蛋白水解并刺激碳水化合物发酵。
肠道菌群通过短链脂肪酸(SCFA)产生参与调节能量代谢和肠道稳态。SCFA 被吸收并充当宿主体内葡萄糖和脂质代谢的能量来源或前体。SCFA可能通过G蛋白偶联受体,即游离脂肪酸受体2(FFAR2)和3(FFAR3)与结肠、肝脏、肌肉和脂肪组织相互作用。
-调节瘦素水平,减少脂肪的生成
此外,短链脂肪酸会上调抑制饥饿的瘦素合成,抑制脂肪生成并促进脂肪分解。研究评估了丁酸盐的施用可以通过促进脂肪细胞形成和脂肪组织褐变来减少能量摄入,增强脂肪氧化和能量消耗,从而治疗和预防肥胖。
这些由肠道微生物群产生的短链脂肪酸还与结肠粘膜中的肠内分泌细胞相互作用,诱导释放胰高血糖素样肽1(GLP-1)和肽YY(PYY)。这些激素进入体循环并对许多器官和组织发挥作用,最重要的是胃和胰腺。GLP-1和PYY共同防止胃排空过快,抑制酸分泌和运动,减缓胃肠道运输,从而导致食欲减少和食物摄入量减少。GLP-1还能刺激胰岛素分泌并防止胰腺β细胞衰竭。
–C.minuta改善了肠道上皮完整性,增强肠道屏障

此外,C. minuta合成的两种短链脂肪酸可能都参与维持肠上皮屏障。例如,乙酸和丁酸可通过与G蛋白偶联受体GPR43和GPR109A 结合来激活核苷酸结合寡聚化结构域3(NLRP3)炎症小体,这会增加IL-18的释放,促进上皮细胞的修复。
丁酸能稳定缺氧诱导因子(HIF),后者是屏障保护和组织再生的关键分子,它上调紧密连接蛋白,增加杯状细胞的黏蛋白生成,从而增强肠道屏障。
一项研究表明,C. minuta在体外和涉及高脂饮食组的动物研究中改善了肠道紧密连接蛋白(ZO-1)、闭合蛋白(OCLN)和紧密连接蛋白-1(CLDN1)的表达。
肠道通透性增加被认为是脂肪诱导性肥胖的一个驱动因素,与肠道菌群失调和肠道炎症有关。已证实肥胖小鼠的紧密连接减少,这表明肥胖是由肠道通透性增加和跨上皮阻力降低引起的。
肠道紧密连接蛋白下调可导致肠道渗漏,其中脂多糖细菌物质和其他炎症介质通过紧密连接扩散并与宿主免疫细胞相互作用,导致低度炎症、暴食并最终导致体重增加。
-调节甘油三酯和游离脂肪酸的积累
此外,与肥胖水平或体脂相关的身体质量指数(BMI)也与肠道中C.minuta的丰富程度密切相关。调节脂肪酸的合成和氧化以及抑制脂肪生成对体脂和体重有有利的影响。
早期的一项研究表明,肠道微生物群中C.minuta的存在与肥胖降低之间存在联系。一项针对C.minuta的干预研究表明,在饮食诱导的肥胖小鼠模型中,肝脏甘油三酯和游离脂肪酸的积累受到阻碍。这一发现与基因表达水平一致,在补充了C.minuta的动物模型中,编码肝脏葡萄糖激酶的gck基因受到强烈抑制。
葡萄糖激酶的过度表达促进了糖的过度吸收、肝脏脂质积累和棕色脂肪组织(BAT)中产热蛋白的下调,导致肥胖。从机制上讲,增强BAT中的脂肪组织产热作用并诱导白色脂肪组织(WAT)褐变可导致体重减轻。
-通过调节胆汁酸代谢来发挥抗肥胖能力
胆汁酸代谢对于调节葡萄糖和能量代谢、肠道完整性和免疫力至关重要。胆汁酸代谢的改变与肥胖密切相关。胆汁酸代谢通过刺激脂肪酸氧化和抑制甘油三酯和肝脏脂肪酸的产生。
C.minuta的抗肥胖潜力还通过结肠中的胆酸/牛磺胆酸(CA/TCA)比率来展现。这一发现意义重大,为抗肥胖与糖分解代谢以及初级胆汁酸的有效解离之间的关联提供了重要的理论基础。
C.minuta菌株 DSM33407和DSM22607在80%胆汁存在48小时的情况下均对胆汁酸具有高度耐受性。胆汁酸水解酶(BSH)基因已在两种C.minuta菌株中被鉴定,并且由于其水解结合胆汁酸的强能力而高度表达。
C.minuta还通过法尼醇x受体和G蛋白偶联胆汁酸受体(TGR5)促进胆汁酸代谢,而 TGR5 在肠道中高度表达。一些体内研究表明,肠道生态系统中BSH的高水平表达被认为是抗肥胖的关键调节因素,可显著降低体重、肥胖、循环低密度脂蛋白(LDL)胆固醇和甘油三酯。
注:BSH活性是肥胖控制的关键机制目标。利用具有高BSH活性的细菌菌株来丰富肠道微生物群可能是预防和控制肥胖的一种策略。
▸ 炎症性肠病中减少 ↓
炎症性肠病(IBD)是一种影响胃肠道的慢性炎症性疾病,主要有两种类型:克罗恩病和溃疡性结肠炎,每种类型都有不同的生理症状。研究发现,IBD患者的微生物组成会发生变化,其特征是厚壁菌门与拟杆菌门的比例下降。
-抑制NF-κB信号通路和IL-8来减轻结肠炎症
肠道菌群失调伴有短链脂肪酸组成的变化,随后是肠道屏障完整性的破坏,最终通过免疫系统调节引发炎症反应。尽管 IBD 的病因仍不太清楚,但研究表明,它们是由不受控制的炎症反应引发的,与白细胞介素8(IL-8)细胞因子和活性氧(ROS)的增加有关。
许多研究已经证明克罗恩病(CD)和溃疡性结肠炎(UC)患者的Christensenellaceae会减少。在发作前立即观察到静止期CD患者中Christensenellaceae的丰度显著下降,这可能表明它们在疾病进展中发挥了作用。在腹泻患者中也观察到了Christensenellaceae的丰度较低。
最近的体外和体内研究表明,C.minuta具有强效抗炎和免疫调节特性。C. minuta通过抑制 NF-κB 信号通路和促炎细胞因子IL-8的分泌来减轻结肠炎症。
-克罗恩病患者缺乏C.minuta

一项对C.minuta的介入研究表明,克罗恩病(CD)患者中缺乏Christensenella minuta(C.minuta),并且有记录证明它们会在人类上皮细胞中诱导抗炎作用,这支持了它们作为一种新型生物疗法的潜力。
在两种不同的急性结肠炎动物模型和一种人类肠道细胞系中,C.minuta限制结肠损伤、促进粘膜愈合并降低因炎症引起的中性粒细胞(特别是髓过氧化物酶和嗜酸性粒细胞过氧化物酶)的活化。
在C.minuta治疗动物模型中,肠道炎症的非侵入性生物标志人脂质运载蛋白-2(LCN-2)的浓度降低。在基因层面,携带克罗恩病风险基因 IL23R 的个体体内与C.minuta相关的微生物丰度降低,表明肠道微生物组受到宿主遗传学的影响。
据报道,当小鼠补充C.minuta时,IL23R 保护性编码变体会增加,从而预防克罗恩病。C.minuta还会产生丁酸,通过丁酸受体 GPR109a 来控制脂肪细胞、肠上皮细胞和免疫细胞中的炎症反应。
值得注意的是,C.minuta的抗炎功效已被证实与美沙拉嗪(也称为5-氨基水杨酸(5-ASA),一种用于治疗IBD的药物)相似。
▸ 2型糖尿病患者中减少 ↓
2型糖尿病(T2D)是一种复杂的代谢和内分泌功能障碍,其特征是胰岛素抵抗、胰腺β细胞功能障碍、低度全身炎症、肠道菌群失调、肥胖和其他内分泌疾病引起的高血糖。
中药是一种源自天然产物的补充药物,在治疗代谢综合征方面具有潜力。口服中药干预会影响肠道微生物群,但由于其活性成分(如黄酮类化合物)的亲脂性较差,因此生物利用度较低。肠道菌群的生物转化促进药物的吸收,这对药理学有重大影响。
-增加C.minuta有助于改善糖尿病
中药成分可能会调节宿主肠道菌群的数量。黄芪苓化散(HQLHS)由黄芪、灵芝、桦褐孔菌和苦瓜组成,是专门用于治疗2型糖尿病的中药复方。

最近的一项研究表明,在小鼠模型中,HQLHS抑制了致病菌并丰富了有益菌,特别是C.minuta和Christensenella timonensis。值得注意的是,该研究表明HQLHS显著增加了小鼠肠道菌群中Christensenella的相对丰度。该研究还描述了C.minuta对肝脏代谢的影响,为理解C.minuta在糖尿病治疗和控制中的药理机制奠定了基础。
-减少氧化应激、改善葡萄糖代谢
在同一项研究中,C. minuta DSM 22607 降低了糖尿病大鼠体内的氧化应激、色氨酸和酪氨酸等糖尿病诱因。抗氧化酶和脂质过氧化生物标志物 MDA 的水平也得到了控制。
C. minuta的抗糖尿病特性有多种机制,例如改善糖脂代谢、通过抑制肠道葡萄糖转运中SGLT1和GLUT2的表达来抑制葡萄糖吸收、促进GLP-1分泌以刺激胰岛素抵抗并调节葡萄糖稳态。
▸ 支气管哮喘和过敏性疾病中减少 ↓
-C.minuta丰度较高时患哮喘的可能性较低
小克里斯滕森氏菌(Christensenella minuta)还与支气管哮喘和过敏性疾病有关。研究发现,粪便微生物组中富含C. minuta的儿童患湿疹和对吸入性过敏原致敏的可能性较小。
值得注意的是,家庭环境中克里斯滕森菌科的丰富程度可能在支气管哮喘中发挥重要作用。分析了从健康儿童以及患有哮喘的儿童和成人家中收集的灰尘的宏基因组学谱。他们发现,克里斯滕森菌科在“健康”房屋的灰尘中显著过多,而在“哮喘”房屋的灰尘中却很少。
其他一些研究还发现:肾结石、情感障碍、甲状腺癌、粘膜类天疱疮、多囊卵巢综合征和复发性口疮性口炎也与Christensenellaceae科丰度较低有关。
▸ 过高在一些患者中可能有害 ↑
然而,有证据表明,Christensenellaceae科的丰度较高可能与一些病理之间存在联系。在一项研究中,Christensenellaceae科的丰度较高会增加重症监护病房中患有神经系统疾病的危重患者的死亡风险。
该分类单元在帕金森病患者中显著富集,尤其是在临床特征较差的患者中。在患有阿尔茨海默病、多发性硬化症和神经性厌食症的人中也观察到了Christensenellaceae科的丰富度增加。
Christensenellaceae科与健康表型或疾病之间关联




Ignatyeva O,et al.Front Microbiol.2024
C.minuta和Christensenellaceae科的有益作用可能归因于它们与肠道中许多其他细菌群落相互作用的特殊能力。除了直接作用外,C.minuta还可以通过促进或限制某些分类群的生长来间接影响宿主。
-与Christensenellaceae正相关的菌群
Christensenellaceae与许多菌群呈正相关,包括:
颤螺菌属(Oscillospira)
瘤胃球菌属(Ruminococcus)
粪球菌属(Coprococcus)
普雷沃氏菌属(Prevotella)
嗜粘蛋白-阿克曼氏菌(Akkermansia muciniphila)
罗氏菌属(Roseburia)
-与Christensenellaceae负相关的菌群
相反,几个属与Christensenellaceae呈负相关:
克雷伯氏菌属(Klebsiella)
链球菌属(Streptococcus)
梭杆菌属(Fusobacterium)
经黏液真杆菌属(Blautia)
Magamonas
▸ 能够促进一些有益菌的生长
此外, Christensenellaceae丰度越高,微生物丰富度和多样性就越高。值得注意的是,几种与之呈正相关的菌群已被提议作为新一代益生菌(Oscillospira、Roseburia)或目前已经是这种身份(Akkermansia)。
–C.minuta能够促进双歧杆菌生长
C.minuta能够促进双歧杆菌属的生长,这是通过产生代谢产物如短链脂肪酸(SCFAs),特别是乙酸和丁酸,这些SCFAs是双歧杆菌属的重要能量来源。这种交叉喂养关系有助于双歧杆菌属在肠道中的定植和增殖。
–C.minuta塑造适合乳酸杆菌生长的环境
C.minuta可能通过产生乳酸来降低肠道pH值,从而为乳酸杆菌属创造一个更适宜的生长环境。此外,C.minuta产生的代谢产物可能直接或间接地激活乳酸杆菌属的代谢途径,增强其在肠道中的竞争力。
–C.minuta促进普拉梭菌生长
Faecalibacterium prausnitzii是一种潜在的下一代益生菌,具有高丁酸生产、抗炎和预防肠道病原体的作用。
研究发现,Christensenella minuta通过产生外源乙酸、半胱氨酸、脯氨酸和赖氨酸来交叉喂养F.prausnitzii,这些都是F. prausnitzii发酵和繁殖所必需的。从而促进了Faecalibacterium prausnitzii的增殖。
–C.minuta与粪肠球菌
C.minuta与F.prausnitzii之间存在正向的相互作用。C.minuta产生的代谢产物可能作为F.prausnitzii的底物,促进其生长和SCFA的生产,特别是丁酸盐,这是一种对肠道健康至关重要的短链脂肪酸。
▸ 减少一些有害菌群
有趣的是,在存在Christensenellaceae的情况下通常会减少几种有害菌群,例如机会性病原体,已知会导致人类和动物感染的克雷伯氏菌和链球菌,以及可能导致癌症的微生物梭杆菌。
因此,我们假设C. minuta可以通过支持有益物种的生长和抑制潜在有害物种来调节肠道微生物群。
–C.minuta抑制克雷伯菌的定植
C.minuta可能通过竞争营养物质或产生抗菌物质来抑制K.pneumoniae等潜在的病原菌。这种竞争和抑制作用有助于维持肠道微生物群的平衡,防止病原菌的过度生长。
–C.minuta限制大肠杆菌的增殖
C.minuta可能通过调节肠道中的氧化还原电位来影响大肠杆菌的生长。由于C.minuta是严格的厌氧菌,它可能通过降低肠道的氧化还原电位来限制需氧菌如大肠杆菌的增殖。
▸ 与甲烷杆菌存在互作并可能影响体重
不同细菌种属很可能通过代谢物转移进行相互作用。Christensenellaceae科和甲烷杆菌科的相互作用可能影响体重指数并呈负相关。

对来自10项独立研究的1821个样本进行了荟萃分析,证实了在科水平(Christensenellaceae科和甲烷杆菌科)和种水平(C.minuta和Methanobrevibacter smithii)之间均存在很强的正相关性。
此外,发现了它们之间的物理和代谢相互作用。作为一种氢气生产者,C.minuta有效地支持了依赖氢气供应的M.smithii的生长。在共同培养时,C.minuta释放的氢气量足以确保M.smithii的生存力,与氢气过量的单一培养中相当。
反过来,M.smithii也能调节C.minuta的代谢,导致短链脂肪酸的产生从丁酸转向乙酸。根据观察到的乙酸盐产量的增加。除此之外,甲烷杆菌科的甲烷生产会导致碳损失和宿主可用能量减少,这可能部分解释了该细菌与体重减轻之间的关联。
Christensenellaceae可能是一种高效益生菌药物的来源,可使许多患者群体受益,尤其是那些患有代谢紊乱和炎症性胃肠道疾病的患者。我们在下面总结了C.minuta作为益生菌在人体健康中的一些作用。
▸ 抗炎作用
C.minuta益生菌活性的所有潜在机制尚未完全了解;不过,已经取得了许多积极的进展。在一系列体外和体内实验中测试了C. minuta DSM 22607。首先,该细菌及其上清液均表现出强大的抗炎潜力,因为它们能够限制HT-29细胞中的IL-8产生,此外发现上清液还能抑制NF-kB信号通路。
从9位捐献者身上分离并测试了 32 株新的C.minuta菌株,以确定最佳候选益生菌药物。他们在一系列实验中分析了这些菌株的抗炎和保护特性,并选出了5种主要候选菌株。五种候选菌株均在体外细胞模型中阻止TNF-α刺激后的NF-kB通路激活并诱导IL-10的产生。
在动物模型中,五种菌株中的两种显著改善了TNBC引起的炎症病变,并具有明显的局部抗炎作用。
此外,还证明了C.minuta菌株在体外模型中刺激人源 PBMC 产生 IL-10的能力。
▸ 保护肠道屏障
其次,C.minuta还显示出保护 TNF-α 受损的 Caco-2 细胞中肠道屏障的能力。这些结果在二硝基苯磺酸(DNBS)和三硝基苯磺酸(TNBS)诱发的结肠炎小鼠模型中得到了证实。
在这两项实验中,C.minuta表现出独特的抗炎特性,保护结肠组织的效果与5-氨基水杨酸(5-ASA)一样有效。该细菌减少了宏观和微观化学损伤,减少了结肠中的免疫细胞浸润(ICI),限制了氧化应激,并降低了促炎细胞因子的分泌和脂质运载蛋白-2的表达。
▸ 能够产生乙酸盐、丁酸盐
实验还揭示了C. minuta的代谢作用,特别是其产生大量乙酸盐和适量丁酸盐的能力。据报道, C.minuta可以同时产生短链脂肪酸(SCFA)中的乙酸盐和丁酸盐,而大多数微生物只能产生丁酸盐或乙酸盐其中一种。
▸ 抗肥胖能力
对C.minuta DSM22607 的抗肥胖能力进行了研究。他们发现,每天施用2×10^9个C. minuta菌落形成单位(CFU)可防止喂食高脂饮食(HFD)的小鼠体重增加和高血糖,但不影响它们的食物摄入量。
令人惊讶的是,食用益生菌菌株的动物和喂食正常食物的动物在体重增加方面没有统计学上的显著差异;然而,接受载体的HFD喂养小鼠体重增加明显且快速。这强烈表明C.minuta通过改变新陈代谢而不是影响进食行为来限制脂肪堆积。
这些发现与对血清代谢标志物的观察结果相关,即高脂饮食小鼠的瘦素和抵抗素水平下降。C.minuta可能破坏了肝脏脂肪生成,这通过编码葡萄糖激酶的Gck基因表达降低来证明。
此外,益生菌菌株通过上调编码主要紧密连接蛋白的Ocln和Zo1基因,对肠道通透性具有强大的保护作用。这也可能有助于C. minuta通过限制由肠漏引起的全身炎症而发挥抗肥胖作用。
▸ 改善糖尿病
进一步证实了C. minuta的有益作用及其在代谢过程中的关键作用的证据。使用两种Christensenella属菌株(C.minuta DSM 22607 和C.timonesis DSM 102800)治疗小鼠2型糖尿病,两种菌株均改善了许多代谢指标。
管饲益生菌可降低血糖水平、限制氧化应激、促进受损胰岛和肝细胞的修复,并抑制肝脏和结肠中几种促炎细胞因子和 TLR4 的表达。
重要的是,用C.minuta和C.timonesis治疗还上调结肠中的Zonula occludens-1和Claudin-1,从而加强肠道屏障。测试对象血清脂多糖水平下降支持了这一发现。这两种菌株还通过刺激胰高血糖素原的表达、增加血清胰高血糖素样肽-1(GLP-1)水平和限制肝糖异生,对代谢产生了重大影响。
总体而言,C.minuta和C.timonesis改善了2型糖尿病的代谢过程并减轻了炎症反应。
▸ 免疫调节作用
C.minuta能够通过调节肠道微环境影响宿主的免疫系统。研究表明,C. minuta能够促进Th17细胞的分化,这些细胞在维持肠道免疫耐受和防御病原体入侵方面发挥着关键作用。
此外,C.minuta还可能通过与其他肠道共生菌的复杂相互作用,间接影响宿主的免疫系统。肠道微生物群落之间的相互作用是复杂的,C.minuta通过其代谢产物和分泌物,可以影响其他菌群的生长和功能,进而调节宿主的免疫反应。这种间接调节机制为宿主免疫系统提供了额外的调节途径。
最后,C.minuta对宿主免疫系统的调节作用可能还与其在肠道中的定植能力有关。研究表明,C.minuta在人体肠道中具有较高的遗传性,这意味着它能够有效地定植并长期存在于宿主肠道中。这种定植能力可能是C. minuta发挥其免疫调节作用的基础。
▸ 增加有益菌丰度,改善肠道菌群组成
此外,Christensenella菌株通过增加许多有益微生物(如双歧杆菌和Phascolarctobacterium)的丰度来改变肠道微生物群的组成。
06
调节C.minuta的策略
调节C.minuta的策略可以通过多种途径实现,包括饮食调节、益生菌和益生元的使用、药物治疗以及功能性食品的摄入。
▸ 通过饮食调节C.minuta的策略
调节肠道共生菌C.minuta的一种有效方法是通过饮食。
研究表明,某些食物成分可以促进C.minuta的生长和活性。例如,高纤维食物,如全谷物、豆类、坚果和水果,可以作为益生元,为C.minuta提供必要的营养物质。这些纤维在肠道中被微生物发酵,产生短链脂肪酸,这些物质对C.minuta的生长至关重要。
此外,一些特定的益生元,如低聚果糖和菊粉,已被证明能够特异性地增加C.minuta的数量。
▸ 益生元和合生元的应用
益生元是指能够促进肠道内有益菌生长的非消化性食品成分,而合生元则是益生元和益生菌的组合。在调节C.minuta中,益生元和合生元的应用是两个重要的策略。
益生元如多糖、半纤维素、果胶等,能够通过刺激C.minuta的生长,增强其在肠道中的竞争力。合生元则结合了益生元和益生菌的双重优势,通过提供C.minuta所需的营养物质和直接补充C.minuta,更有效地调节肠道微生物群。
▸ 药物和功能性食品的作用
在某些情况下,药物和功能性食品也可以用于调节C.minuta。例如,某些抗生素可以在必要时用来减少有害菌的数量,为C.minuta提供更好的生长环境。
功能性食品,如含有特定益生菌的酸奶或补充剂,可以直接补充C.minuta,增加其在肠道中的数量。此外,一些植物提取物和天然化合物也被研究用于调节肠道微生物群,包括C.minuta。
主要参考文献
Ignatyeva O, Tolyneva D, Kovalyov A, Matkava L, Terekhov M, Kashtanova D, Zagainova A, Ivanov M, Yudin V, Makarov V, Keskinov A, Kraevoy S, Yudin S. Christensenella minuta, a new candidate next-generation probiotic: current evidence and future trajectories. Front Microbiol. 2024 Jan 11;14:1241259.
Ang WS, Law JW, Letchumanan V, Hong KW, Wong SH, Ab Mutalib NS, Chan KG, Lee LH, Tan LT. A Keystone Gut Bacterium Christensenella minuta-A Potential Biotherapeutic Agent for Obesity and Associated Metabolic Diseases. Foods. 2023 Jun 26;12(13):2485.
Pan T, Zheng S, Zheng W, Shi C, Ning K, Zhang Q, Xie Y, Xiang H, Xie Q. Christensenella regulated by Huang-Qi-Ling-Hua-San is a key factor by which to improve type 2 diabetes. Front Microbiol. 2022 Oct 12;13:1022403.
Mazier W, Le Corf K, Martinez C, Tudela H, Kissi D, Kropp C, Coubard C, Soto M, Elustondo F, Rawadi G, Claus SP. A New Strain of Christensenella minuta as a Potential Biotherapy for Obesity and Associated Metabolic Diseases. Cells. 2021 Apr 6;10(4):823.
Relizani K, Le Corf K, Kropp C, Martin-Rosique R, Kissi D, Déjean G, Bruno L, Martinez C, Rawadi G, Elustondo F, Mazier W, Claus SP. Selection of a novel strain of Christensenella minuta as a future biotherapy for Crohn’s disease. Sci Rep. 2022 Apr 11;12(1):6017.
Waters JL, Ley RE. The human gut bacteria Christensenellaceae are widespread, heritable, and associated with health. BMC Biol. 2019 Oct 28;17(1):83.
Pető, Á.; Kósa, D.; Szilvássy, Z.; Fehér, P.; Ujhelyi, Z.; Kovács, G.; Német, I.; Pócsi, I.; Bácskay, I. Scientific and Pharmaceutical Aspects of Christensenella minuta, a Promising Next-Generation Probiotic. Fermentation 2023, 9, 767.
Xu C, Jiang H, Feng LJ, Jiang MZ, Wang YL, Liu SJ. Christensenella minuta interacts with multiple gut bacteria. Front Microbiol. 2024 Feb 19;15:1301073.

谷禾健康
梭杆菌属(Fusobacterium),是梭菌门最主要的菌属,厌氧革兰氏阴性细菌,与拟杆菌属、普氏菌属、卟啉单胞菌属一样都是医学上重要的厌氧革兰氏阴性杆菌。
梭杆菌属是人类和动物的身体共生菌之一,主要定植在人类和动物的粘膜中,两个最主要的聚集地是口腔和结肠,某些类型物种属于机会性病原体,会引起菌血症和各种快速进展的感染。这些微生物比大多数正常的厌氧菌群更具毒性,产生重要的 脂多糖(LPS),内毒素和溶血素等,这可能是毒力的原因。
其中具核梭杆菌(Fusobacterium nucleatum, 简F. nucleatum)和坏死梭杆菌(Fusobacterium necrophorum,简F. necrophorum) 是可怕的厌氧病原体之一,最常存在于口腔、牙菌斑中,与牙周病、急性坏死性牙龈炎、口腔癌、溃疡性结肠炎、克罗恩病和结直肠癌有关。
此外,梭杆菌与大约一半的头颈部厌氧菌感染有关,包括牙龈和牙齿感染、慢性扁桃体炎、慢性鼻窦炎、中耳炎、咽旁感染以及口腔感染。它们不仅在这些组织中繁盛,而且很容易扩散,有时会引起肿瘤、息肉、囊肿和其他无害组织块的破坏。即使是局部炎症环境的变化也可能导致无功能组织过度生长,因此也称为“癌杆菌”。
梭杆菌属对粘菌素和卡那霉素敏感,这将它们与拟杆菌属和卟啉单胞菌区分开来。一些菌株产生β-内酰胺酶并对青霉素耐药。
梭杆菌
梭杆菌是一种独特的细菌门,是以前研究不足的分类群中的一个主要例子。该门下研究广泛的主要是梭杆菌属。
梭杆菌属细菌是革兰氏阴性、不形成孢子的厌氧菌,球状、多形性小球(坏死梭杆菌)到杆状的一系列细胞形态。当杆状时,梭杆菌细胞具有平行的壁,具有圆形或锥形末端,可分为运动和不运动。
梭杆菌属DNA(G + C)含量约为26~34mol%,正常存在于人或动物的口腔、消化道和土壤中,已知对人和动物致病的有十几种以上,其中主要代表为具核梭杆菌(F. nucleatum)和坏死梭杆菌(F. necrophorum).
在健康人的粪便中,发现以下数量的梭杆菌:
幼儿: 108-109 CFU/g
成人: 107-1010 CFU/g
老年人:108-109 CFU/g
通常,在成人的口腔中,含有 102 -104 CFU/g 的梭杆菌。
在血琼脂上,梭杆菌会形成圆形或不规则的针状菌落,一些物种,如具核梭杆菌,在孵化 3 至 5 天后会形成伞形“煎蛋”菌落。根据菌株的不同,它们可以是溶血的,并且一些菌株具有血凝作用。
临床感染中最常见的梭杆菌属有:
具核梭杆菌、坏死梭杆菌。
它们几乎存在于儿童的所有类型的感染中,包括菌血症,与耳科疾病相关的脑膜炎 ,内脏破裂后的腹膜炎,以及口腔或肛门口附近的皮下脓肿等。
致病梭杆菌在生物膜(特别是软组织)中粘附革兰氏阴性和革兰氏阳性菌斑微生物的卓越能力使其成为一种高度侵入性的病原体。
最常存在于口腔、牙菌斑中,与牙周病、急性坏死性牙龈炎、溃疡性结肠炎和克罗恩病有关。在免疫缺陷中,可引起继发性坏疽和化脓性坏疽过程。对于扁桃体炎,疱疹性口炎,儿童营养不良,免疫缺陷病,可能会发生梭菌病,扁桃体,口腔粘膜的坏死性炎症过程。
梭杆菌具有独特的代谢能力, 梭杆菌细胞通过发酵碳水化合物和蛋白获得能量。这种发酵产生丁酸盐,在某些情况下产生乙酸作为主要的代谢副产物。这是梭杆菌属物种与其他革兰氏阴性、非孢子杆状细菌的区别。
致病性
在革兰氏阴性厌氧菌中,梭杆菌作为主要病原体侵入人类宿主的能力很强。已经描述了许多毒力决定因素,包括白细胞毒素、蛋白水解酶、脂多糖(LPS)和血凝素的表达。
虽然是人体组织正常菌群的一部分,但梭杆菌可以在手术或意外创伤、水肿、缺氧和/或组织破坏后侵入组织。
★ 坏死梭杆菌 (F. necrophorum)
坏死梭杆菌在其细胞壁中含有特别强大的内毒素脂多糖,并产生一种促进凝块形成的凝固酶。此外,它还产生多种外毒素,包括杀白细胞素、溶血素、脂肪酶和细胞质毒素,所有这些都可能导致其致病。
坏死梭杆菌的粘附素和菌毛在宿主细胞附着中起关键作用。
白细胞毒素是已知的坏死梭菌的毒力因子,可能促进脓肿形成。内毒素和溶血素似乎也是脓肿形成和局部感染组织坏死增加的重要毒力因子。血凝素和尚未确定的导致血小板聚集的因素与Lemierre 综合征中发现的血栓形成后果相关性很大。
★ 具核梭杆菌 (F. nucleatum)
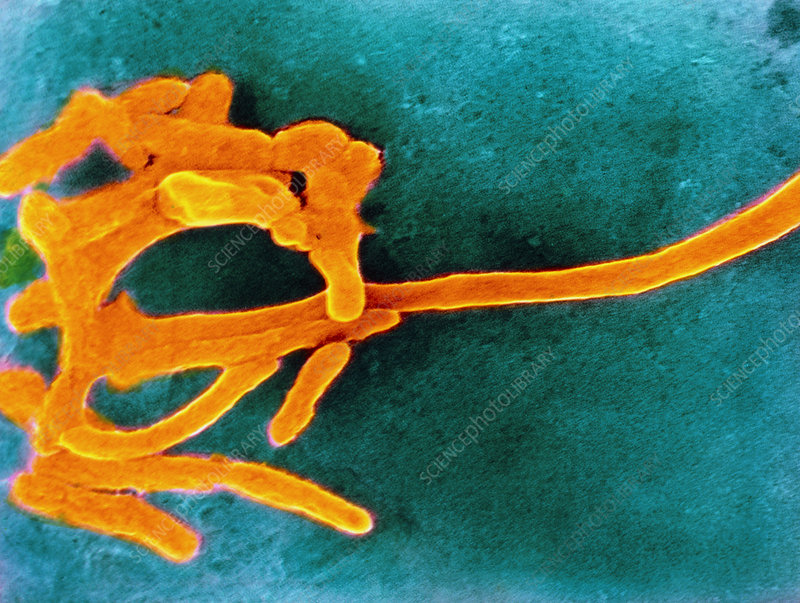
具核梭杆菌是少数利用氨基酸分解代谢来提供能量的非产孢厌氧物种之一,能使用谷氨酸、组氨酸和天冬氨酸。梭杆菌代谢通过消耗氨基酸和释放氨自然增加其局部环境的 pH 值,从而使酸敏感细菌(如牙龈卟啉单胞菌)生长。
但是,具核梭杆菌不使用葡萄糖作为其主要能源。现有数据表明,葡萄糖用于细胞内分子的生物合成,而不是能量代谢。具核梭杆菌也可以在低至 5 的 pH 值下存活。
——粘附各种细菌和细胞
具核梭杆菌是革兰氏阳性和革兰氏阴性物种之间物理相互作用的中心物种,可能对生物膜的形成很重要。
F. nucleatum具有外膜,于其细胞外表面上有大量蛋白质,可以发现细菌与宿主细胞表面上的各种互补结构具有特定的相互作用。这种粘附是由粘附素介导的。这种依从性对于易感宿主中感染的定植和建立非常重要。
它是附着在牙齿和上皮表面的共生体与真正的病原体。F. nucleatum有两种物质:菌毛和非菌毛粘附素,用于附着在其他细菌和细胞上。这些物质有助于定植以及细菌发病机制和感染。
——梭杆菌粘附 A (FadA)
梭杆菌粘附A (FadA) 是一种菌毛粘附蛋白,最近被证明是细菌附着和侵入牙龈上皮和内皮细胞所必需的。它在栖息于口腔黏膜的梭杆菌属中是保守的,并且对细胞结合很重要。
FadA 是一种含有 129 个氨基酸的蛋白质,具有 18 个氨基酸的信号肽。它具有一种分泌形式,可导致 β-连环蛋白途径和 Wnt 基因表达上调,这两种重要的发育途径在失调时都是致癌的主要原因。
FadA 的晶体结构揭示了一种独特的“亮氨酸链”结构,该结构在发生突变时会破坏宿主细胞的结合。尽管他们没有确定 FadA 的受体结合位点,但他们认为 FadA 作为细丝发挥作用,该区域的治疗靶点可能适用于未来的临床治疗。
梭杆菌多样性和生态位
从 1880 年代和 1890 年代开始,科学家们在各种人畜共患病和人类样本中发现了梭形杆状物,包括健康和患病的口腔。
以前梭杆菌属区分开来的特征主要是代谢与发酵和分泌的有机酸谱、吲哚和硫化氢的产生以及胆汁敏感性有关。尽管这些指标在区分梭杆菌中无法真正有效,从基因组上层面区分和鉴定梭杆菌属是在测序时代,而且还提高了对梭杆菌内部差异的理解。
目前梭杆菌属鉴定的有30 多个物种,包括:
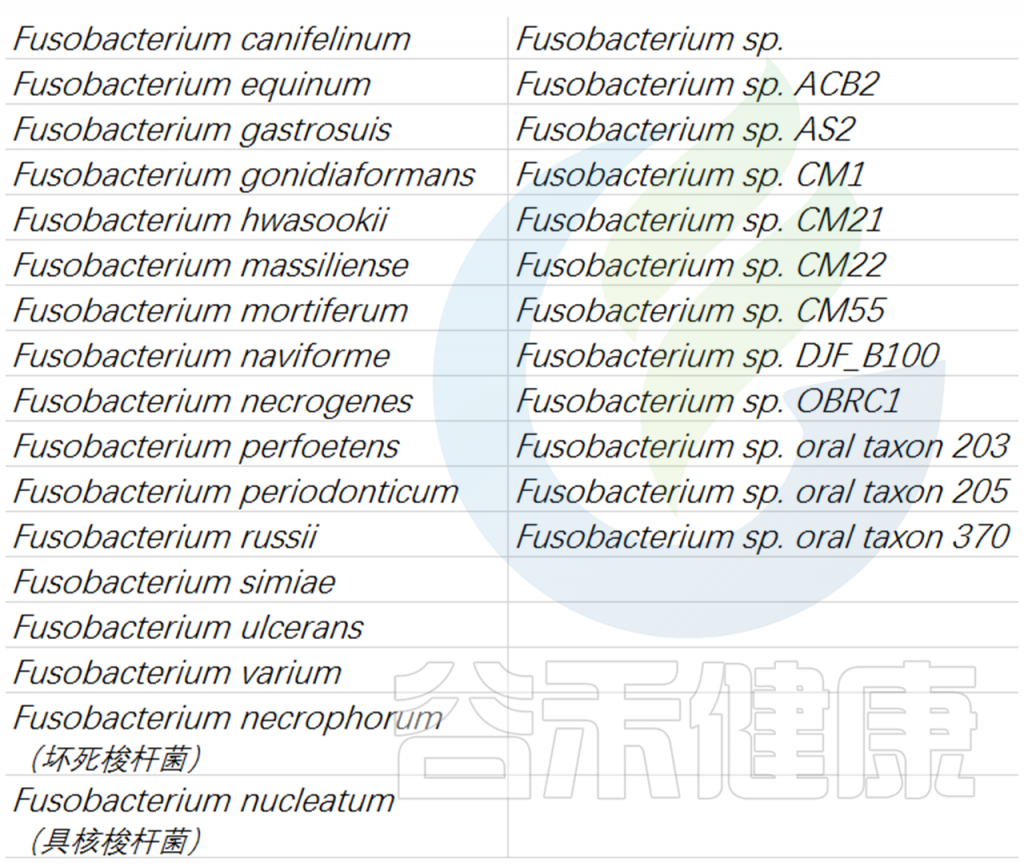
通过对 16s rRNA 序列的系统发育分组分析,发现F. nucleatum与拟杆菌属和黄杆菌属密切相关。
比较基因组学研究表明,梭杆菌物种之间主要可以分为三个谱系。在这个模型中,F. nucleatum 进化为与牙周梭杆菌的谱系,这些物种不仅共享一个生态位,而且还具有与宿主细胞入侵相关的相似功能。
F. nucleatum本身可进一步划分为四个亚种:nucleatum、animalis、vincentii、polymorphum
虽然有人认为这些亚种在 DNA 水平上有足够的差异,可以被认为是独立的物种。
梭杆菌栖息在人类和动物的粘膜中,是两者的病原体。由于其致病性和寄生性,梭杆菌不会直接影响环境,但它可能会通过对受感染宿主动物菌群的影响来改变生态系统。
常见感染
一些梭杆菌菌株会导致多种人类疾病,包括牙周病、Lemierre 综合征和局部感染或溃疡。
较早的研究表明梭杆菌在人类口咽部很常见,但目前的共识是梭杆菌应始终被视为病原体。与拟杆菌属相比,梭杆菌属具有强效的脂多糖。
在与牙周病统计学相关的所有牙周菌群中,具核梭杆菌是在其他身体部位发现的临床感染中最常见的。
“具核梭杆菌心包炎”——一名疑似感染分枝杆菌的 49 岁男子胸部发现具核梭杆菌心包炎。被认为分枝杆菌是原因,因此对他使用了抗结核药物。然而,这是F. nucleatum导致的。这一发现使人们认识到,具核梭杆菌通过口咽入口进入是导致此类疾病的原因。这是较早的发现之一,即具核梭杆菌也可能影响除口腔以外的其他体腔。
一些身体感染包括:皮肤溃疡、扁桃体周围脓肿、脓肌炎和化脓性关节炎、菌血症、肝脓肿、宫内感染、细菌性阴道病、尿路感染、心包炎和心内膜炎、肺和胸膜肺感染。巧合的是,它更常见于儿童体内。
F. necrophorum 在某些类型的感染中可能具有很强的毒性。在心绞痛后脓毒症(Lemierre 综合征)中,感染始于膜感染,如扁桃体炎,然后发展为伴有转移性感染的败血症,包括肺脓肿、脓胸、肝脓肿、骨髓炎和化脓性关节炎。
梭杆菌属以多种方式与其他细菌相互作用。相对于人类口腔和胃肠道中同时存在的微生物,梭杆菌属可以是互惠者、促进者、拮抗者和/或协同者。
梭杆菌代谢的副产物可以促进其他细菌种类的生长。上面提到的梭杆菌粘附素库就允许与许多不同的菌属共聚集,甚至可以促进其他非侵入性细菌物种的入侵。
担当调解者——连接主要定植菌和厌氧菌——有益牙周健康
F. nucleatum在有助于牙周健康和疾病的生物膜中发挥不可或缺的有益作用。在牙菌斑生物膜中,具核梭菌作为桥梁生物在结构上起到支持作用,将主要定植菌(如链球菌属)与主要厌氧的次级定植菌(牙龈卟啉单胞菌和Aggregatibacter actinomycetemcomitans )连接起来。
许多口腔微生物,包括梭杆菌属是专性厌氧的,并且作为生物膜的一部分存在于口腔的富氧环境中。然而,溶解在唾液中的氧气可能会通过牙龈下生物膜中的通道深入渗透到牙龈下生物膜中。尽管在单一培养中,对氧气极为敏感的口腔菌斑衍生微生物(如牙龈卟啉单胞菌)无法在这种微通气条件下存活,但与更耐氧的具核梭菌共培养可以促进专性厌氧菌的生长,这可能是由于梭杆菌对局部还原条件的贡献。
能在酸性条件存活,增加pH值,促进其他菌生长
除了在低氧水平下生长的能力,F. nucleatum也可以在低至 5 的 pH 值下存活。梭杆菌代谢通过消耗氨基酸和释放氨自然增加其局部环境的 pH 值,从而使酸敏感细菌(如牙龈卟啉单胞菌)生长。除了促进其他细菌的生长,梭杆菌细胞可以将它们的 “同居者” 固定在适当的位置。
梭杆菌属,特别是具核梭杆菌,已显示与所有测试的口腔细菌属可以发生共聚集。然而,这种聚合并不是无差别的。在每个属中,梭杆菌分离物优先与特定的某些菌株而非其他菌株共聚集。由于这种相互作用,具核梭菌是口腔生物膜发育的重要贡献者,是早期和晚期定植者之间的桥梁。
接下来,我们了解一下,F. nucleatum可能与之共聚的细菌。
与肠源性细菌共聚集——协同作用
梭杆菌细菌素可以通过去除特定的口腔和/或肠道微生物来促进其他微生物的生长,从而促进互惠相互作用的选择性。
通过与具核梭菌的侵入性菌株共聚集,一种具有粘附和侵入哺乳动物细胞能力的梭杆菌分离物——非侵入性细菌“乘客”可以穿梭到哺乳动物细胞中。
例如,具核梭菌的侵入性菌株,促进一些源自口腔的非侵入性细菌能够侵入人类口腔细胞。有趣的是,尽管F. nucleatum原产于人类口腔已证明菌株但是能够与人类胃肠道结直肠区域的原生细菌共聚集。
细菌共聚集可能对人类健康产生的影响
这种共聚集能力可能通过协同相互作用在结直肠癌(CRC)的病因中发挥作用。
尽管大量研究调查了结肠微生物群与结直肠癌进展之间的联系,结直肠癌病例相关的细菌包括F. nucleatum、产肠毒素脆弱拟杆菌(ETBF)、致肠致病大肠杆菌(EPEC)、侵入性大肠杆菌(AIEC)、粪肠球菌、弯曲杆菌属和Leptotrichia spp 等。
已发现具核梭杆菌和以上菌可能协同加速结直肠癌进展和/或转移。
早在 1936 年,科学家就将梭杆菌感染与颈静脉血栓性静脉炎联系起来。
最近,梭杆菌感染的发病率有所增加。虽然这种增加的原因尚不清楚,但抗生素使用减少和检测技术改进有关的理论可能解释了这种变化。
临床医生能够发现梭杆菌属感染的早期迹象至关重要,这种感染会迅速出现一系列并发症,如 Lemierre 综合征(心绞痛后脓毒症)、菌血症、骨髓炎和感染性休克。
儿童发病 ↓↓↓
儿科人群中的梭杆菌感染主要影响头部和颈部区域,因为细菌主要存在于口腔内。急性中耳炎是最常见的感染部位,尤其是在 2 岁及以下的儿童中。
一项研究了 27 名中位年龄为 3.5 岁的儿童的梭杆菌感染的神经系统表现,发现其中 5 人出现意识水平下降,7 人在开始治疗前癫痫发作。
厌氧菌引起的中耳感染不到 1%;但是,如果不及时治疗,可能会出现严重的并发症,例如骨膜下和硬膜外脓肿。
菌血症是一种严重的并发症,常见于高达 77% 的儿童梭杆菌病例,可能是由于颅内窦靠近乳突骨所致。在 40% 的患者中也观察到骨髓炎,并且通常是多灶性的,需要长期静脉内抗生素治疗。
成年发病
在免疫功能正常的患者中,男性和女性的发病率相等。最初的症状包括发烧(38°C ~ 39°C)并伴有急性中耳炎,通常进展为乳突炎。实验室评估显示炎症标志物升高:C 反应蛋白水平、白细胞计数和中性粒细胞绝对计数。
梭杆菌引起的脑膜炎罕见且被描述少于 20 次;然而,人们经常注意到它会导致严重的发病率和死亡率。
Lemierre 综合征
有人提出,Lemierre 或 Lemierre 样综合征的发展通常发生在梭杆菌感染中耳之后。这是由于中耳感染延伸到静脉窦血栓形成。
Lemierre 综合征是梭杆菌感染的严重并发症。
在一项对 12 名感染患者的研究中,58% 的患者发展为 Lemierre 或 Lemierre 样综合征。该综合征以颈内静脉脓毒性血栓性静脉炎或血栓形成为特征,可在肺部或其他无菌部位引起脓毒性栓塞性病变。
坏死梭杆菌(F. necrophorum)是导致 Lemierre 综合征的梭杆菌属物种,是造成 10% 的急性咽喉痛和 21% 的复发性咽喉痛的原因,其余由引起由A 组链球菌或病毒引起。
F. necrophorum的其他并发症包括脑膜炎,并发脑静脉血栓形成, 以及泌尿生殖道和胃肠道感染。
菌血症
具核梭杆菌引起的菌血症不常见,但死亡率高
一些危险因素包括恶性肿瘤、年龄较大、酗酒、免疫抑制和透析;通常是通过医院感染。然而,F. nucleatum菌血症的死亡率可达 10%,并且与基础疾病的严重程度相关。
有一项研究调查了有梭杆菌属感染事件病例。研究期间的菌血症(每年 0.55 例/100,000 人),具核梭杆菌是最常见的物种(61%),其次是坏死梭杆菌(25%)。
许多具核梭杆菌菌血症发生在不同的疾病患者(糖尿病、肠道、肺部、肝脏或妇科疾病),其中口咽部、胃肠道、泌尿生殖道和呼吸道,通常是F. nucleatum定植,可能成为感染源。
在强化化疗后患有恶性肿瘤(白血病和淋巴瘤)的血液病患者中,发生了具核梭杆菌菌血症。在大多数情况下,发生在口腔粘膜炎患者中。值得注意的是,F. nucleatum菌血症的病程似乎比由F. necrophorum等梭杆菌属引起的其他菌血症更有利,后者通常会导致 Lemierre 综合征。
F. nucleatum 感染与新冠感染有关
比利时研究团队报告了2020 年 3 月和 2020 年 4 月,比利时布鲁塞尔的 2 家主要医院观察到 4例 具核梭菌感染病例,均与冠状病毒病(COVID-19)患者的严重急性呼吸综合征冠状病毒 2(SARS-CoV-2)感染有关。
在口腔中,细菌、真菌、病毒和古细菌在不同的栖息地自然定殖,包括牙齿、牙龈沟、舌头、脸颊、软硬腭和扁桃体。口腔微生物群是指这些生物的高度多样化和复杂的生态系统。超过 700 种细菌是口腔特有的,而本土口腔菌群则可以防止外来细菌的定居。
口腔菌群的两面性
口腔中的一些细菌是有害的,会导致严重的疾病,而同时也有许多口腔细菌上对预防疾病是有益的。
现在已经确定,许多慢性炎症状况是由宿主-微生物群相互作用之间的不平衡引起的。口腔共生菌在口腔疾病的发展中起着至关重要的作用,包括牙周病和牙齿脱落,以及维持正常的口腔生理环境。此外,已知口腔共生菌参与了肺炎、心血管疾病、糖尿病、痴呆等系统性疾病的发病和发展。
梭杆菌在口腔疾病中的作用
梭杆菌是口腔中常见的专性厌氧革兰氏阴性菌,可充当牙菌斑中早期和晚期定植细菌之间的桥梁,并在口腔和口腔外感染中发挥作用。
具核梭杆菌是一种常见于人类牙菌斑中的细菌。这种细菌已被证明在牙菌斑形成和牙龈炎等其他疾病中起着核心作用。
这是因为它能够粘附广泛的革兰氏阳性和革兰氏阴性菌斑微生物,例如牙龈卟啉单胞菌。与牙周炎以及头部和颈部、胸部、肺部、肝脏和腹部的侵入性人类感染密切相关。由于其粘附能力,它可以与病毒相关联,病毒粘附在宿主组织细胞上作为入侵并调节宿主的免疫反应。
口腔鳞状细胞癌中的梭杆菌
最近已经表明,在口腔鳞状细胞癌(OSCC)组织中检测到梭杆菌一种口腔共生细菌。OSCC 组织表面生物膜内需氧菌和厌氧菌的比例约为 1:2,而健康对照组为 2:1,表明 OSCC 表面为厌氧菌提供了重要的储存库。梭杆菌在 OSCC 组织中的分布可能与健康口腔粘膜组织中的分布不同。
具核梭杆菌侵入上皮细胞
与P. gingivalis相比,F. nucleatum 显着粘附并侵入人牙龈上皮细胞 (HGEC) 。具核梭菌的自发突变体无法侵入HGEC ,这表明它们的侵入需要细菌成分。
此外,葡萄糖抑制试验表明,凝集素样相互作用参与了具核梭菌与 OSCC 细胞的附着。
具核梭杆菌在上皮细胞促进细胞迁移
具核梭杆菌的感染在人类上皮细胞中促进细胞迁移,可能通过刺激 Etk/BMX、S6 激酶 p70 和 RhoA 激酶,并通过激活丝裂原活化蛋白激酶 p38 增加 MMP-13(胶原酶 3)的产生 。
然而,梭杆菌在 OSCC 细胞中的粘附以及具核梭杆菌介导的OSCC细胞侵袭的详细机制仍不清楚。但是,普遍共识认为在OSCC 患者的口腔中富含具核梭杆菌这一事实似乎在口腔癌的肿瘤发生和/或进展中很重要。
具核梭杆菌通过产生有毒代谢物成为牙周病原体
这些有毒成分具有杀死或阻止附近牙周正常细胞(成纤维细胞)增殖的能力。
F. nucleatum形成的硫化物可能为细菌提供了一种避开宿主免疫系统的方法。丁酸(以组织刺激性丁酸的形式)、丙酸和铵离子,由具核梭菌产生,抑制人牙龈成纤维细胞的增殖。
具核梭杆菌有穿透牙龈上皮的能力
且在与牙周炎相关的斑块中,以高水平存在。
因此,它们可能对产生牙龈炎等口腔疾病具有非常重要的作用。
毒素的作用对细胞来说不是致命的,但成纤维细胞增殖的抑制很严重,因为伤口快速愈合的潜力受到了损害。
通过对龈下菌斑样本进行聚类分析,发现牙菌斑中的细菌之间存在特定关联。如下图,如金字塔所示,存在各种细菌。具核梭杆菌在金字塔的中间。
梭杆菌属参与口腔癌发生和癌症进展的示意图
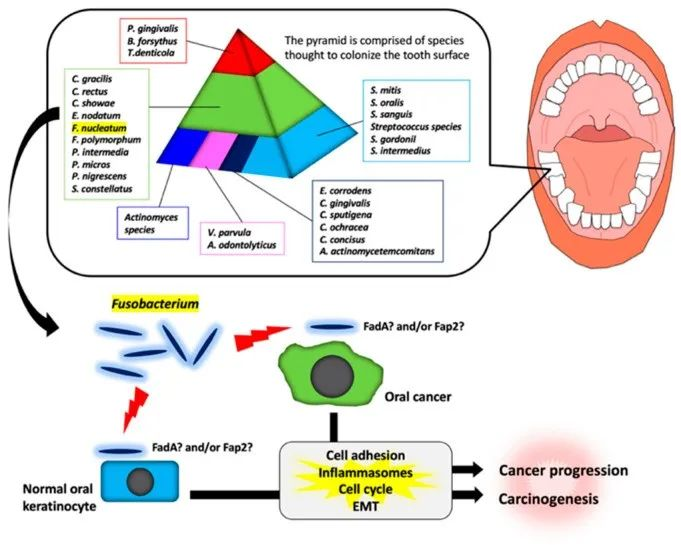
编辑
Fujiwara, Natsumi et al, INT J MOL SCI, 2020
在金字塔中部的物种中,具核梭菌在牙菌斑形成后期的牙齿生物膜中占优势。
如上所述,梭杆菌感染通过各种反应影响 OSCC 的肿瘤发生和发展。然而,梭杆菌的靶分子仍然未知。需要进一步的研究来阐明梭杆菌参与 OSCC 肿瘤发生和发展的证据。
梭杆菌属物种可能与炎症性肠病 (IBD) 有关,包括溃疡性结肠炎和克罗恩病。IBD 是一个已知的危险因素,它是结直肠癌的三个最高风险因素之一。
已报道了几种梭杆菌菌株与 IBD 相关。然而,大多数 (69%) 与F. nucleatum相关。
F. nucleatum和其他梭杆菌属物种可以引发宿主促炎反应,并具有促进它们与宿主上皮细胞粘附的毒力特征以及它们侵入上皮细胞的能力细胞。
因此,与正常邻近组织和健康对照中的水平相比,结直肠癌中的具核梭杆菌富集,这些微生物可能导致肿瘤发生的可能性,可能在有限的患者亚群中,最可能是通过炎症介导的机制。
具核梭杆菌在结直肠癌患者中丰度及作用
最近的一项荟萃分析表明,与邻近的健康组织和对照组的健康组织相比,结直肠肿瘤组织中检测到具核梭杆菌DNA 的几率更高。与对照组的健康组织相比,结直肠息肉组织中的具核梭杆菌DNA 也较高。
结直肠癌患者粪便样本中,具核梭杆菌高
研究表明,结直肠癌患者的粪便样本中F. nucleatum 含量丰富。Meta 分析发现,与健康对照组相比,结直肠癌患者粪便样本中具核梭菌阳性的综合几率更高;与结直肠息肉患者相比,结直肠癌患者更高;但与健康对照相比,结肠直肠息肉患者的情况并非如此。
F. nucleatum已从消化道其他部位的癌症中分离出来,即胰腺 、食道和胃。
肿瘤内具核梭杆菌可能起源于口腔
有趣的是,已经表明结直肠癌中的具核梭杆菌菌株与从口腔中分离的该物种的菌株相同,这表明肿瘤内具核梭杆菌可能起源于口腔。如果来自口腔的具核梭菌在口腔外部位的癌症发展中起作用,那么假设这种细菌可能导致口腔本身的致癌作用是合理的。
具核梭菌感染诱导特定的肿瘤分子事件
F. nucleatum曾经被认为是胃肠道中的被动细菌。然而,现在人们认识到,具核梭菌感染可以在结直肠癌中诱导一系列特定的肿瘤分子事件,包括 CpG 岛甲基化表型、微卫星不稳定性以及BRAF和TP53的基因突变。
肿瘤内有具核梭杆菌的存在,与较差生存率相关
此外,许多这些研究已经确定,肿瘤内有具核梭杆菌的存在与较差的生存率有关 。还观察到,具核梭杆菌感染与更差的临床病理学特征相关,例如更大的肿瘤、更差的分化、淋巴结和远处转移、晚期肿瘤分期和更深的肿瘤侵袭。
总之,结直肠癌微生物组的基因组分析揭示了这些癌症中梭杆菌属的显着富集,尤其是与具核梭杆菌、死亡梭菌和坏死梭杆菌具有最大相似性的种系型。这种富集通过肿瘤组织的组织学分析以及结肠肿瘤转移中梭杆菌DNA 的鉴定得到证实。
梭杆菌介导结直肠癌发生,随着肿瘤转移进肝脏
2017年发表在《Science》肠道细菌Fusobacterium介导结肠癌的发生及伴随肿瘤的转移。作者进行以下操作:
结果发现,10个患者里面,只有2个患者的原位病灶和肝转移病灶中Fusobacterium含量不一样,其他8个病人是高度吻合的(Fuso-qPCR)。
由以上结果我们可以得知:Fusobacterium阳性的患者中,原发灶和肝转移灶中的细菌谱是高度相似的。Fusobacterium很有可能能够随着结肠癌一起进入肝脏。
接下来,作者从病人体内分离出Fusobacterium,通过给小鼠口服Fusobacterium,发现可以诱导结肠癌的产生。同时再次分离小鼠结肠癌中的细菌,通过测序发现,小鼠结肠癌中的细菌谱跟之前病人结肠癌中的细菌谱也是高度一致的。
是否可通过抗生素消灭具核梭杆菌及其他细菌,能否抑制结肠癌的生长?
作者先使用了没有Fusobacterium的细胞系HT-29,通过皮下成瘤,发现甲硝唑并不能够抑制肿瘤的生长。然后使用了从结肠癌患者的肿瘤组织中分离出Fusobacterium,诱导产生结肠癌。发现甲硝唑能够显著抑制肿瘤的生长。
具核梭杆菌高与复发相关
此外,上海交通大学仁济医院房静远教授团队在《Cell》上发表了相关论文,发现在肿瘤复发患者中肠菌具核梭杆菌含量明显升高,并明确了该菌诱导癌细胞自噬而导致化疗耐药与肿瘤的术后复发机制,从而引起大肠癌患者五年生存率降低。
另外,2017年发表在《Gastroenterology》上复旦大学肿瘤研究所领衔完成和《Oncotarget》(由西南医科大学领衔完成)杂志上的两篇也从另外的角度阐述了具核梭杆菌促进肿瘤发生发展的分子机制。
总结一下梭杆菌与结肠癌的进展:
1)研究发现Fusobacterium在结肠癌组织中大量富集;
2)研究发现Fusobacterium能够抑制免疫,减少T细胞的在肿瘤组织中的浸润;
3)研究发现Fusobacterium能够促进结肠癌的发生和发展,通过给小鼠口服Fusobacterium可以诱导结肠癌的产生;
4)研究发现Fusobacterium在结肠癌原位和肝转移灶都能检测到,意味着Fusobacterium可能能够跟随肿瘤细胞一起转移到肝;
5)研究发现使用抗生素消灭Fusobacterium后可以抑制结肠癌细胞的生长(这里使用甲硝唑做实验并不代表今后治疗中可以直接使用,毕竟这是个广谱抗生素)。
那这些研究对我们临床有什么启示呢?
近些年来的很多研究都表明,Fusobacterium与结直肠癌的发生有很大的关联性。我们知道肿瘤防治重点在于防而不在于治。关于肿瘤跟细菌的相关研究,大家最熟悉的是幽门螺杆菌和胃癌的研究。
2017年8月《Nature》首度报道了幽门螺杆菌导致胃癌发生的机制。通过对幽门杆菌的清除可以将胃癌的患病风险降低65%,那么通过以后监测Fusobacterium以及清除Fusobacterium可能为以后结肠癌的预后提供新的思路。同时,为什么Fusobacterium能够介导结肠癌的发生也同样值得研究。
越来越多的证据表明,微生物会影响癌症治疗的效果。具核梭杆菌在具有不同微卫星不稳定性 (MSI) 状态的结直肠癌中,诱导不同的免疫反应。
增强PD-L1阻断剂疗效
高F. nucleatum水平与结直肠癌患者对 PD-1 阻断的治疗反应改善相关。此外,F. nucleatum增强了 PD-L1 阻断剂对小鼠结直肠癌的抗肿瘤作用并延长了生存期。结合F. nucleatum补充免疫疗法,挽救了 PD-L1 阻断的治疗效果。
激活信号,诱导 PD-L1 表达
此外,具核梭杆菌通过激活 STING 信号传导诱导 PD-L1 表达,并在 PD-L1 阻断治疗期间增加干扰素-γ (IFN-γ) + CD8 +肿瘤浸润淋巴细胞 (TIL) 的积累,从而增强肿瘤对PD-L1 阻断。
最后,源自患者的类器官模型表明,增加的具核梭菌水平与改善对 PD-L1 阻断的治疗反应相关。这些发现表明,F. nucleatum可能会调节结直肠癌的免疫检查点治疗。
1
与其他微生物共聚集
F. nucleatum是早期和晚期定植者之间的关键“桥梁”生物,其外膜粘附素 Fap2 部分负责促进多物种生物膜的形成 。当口腔生物膜中报告牙龈卟啉单胞菌(P. gingivalis)时,始终存在F. nucleatum,这表明它先于该物种,并且是其殖民化所必需的。
P. gingivalis是一种酸敏感细菌,但F. nucleatum可以通过发酵谷氨酸和天冬氨酸产生氨,从而为P. gingivalis定殖提供更中性的环境。
F. nucleatum和P. gingivalis可能协同工作,通过引发慢性炎症来促进肿瘤变化,刺激了人 OSCC 细胞的体外增殖 。
白色念珠菌是一种机会性致病酵母,常见于胃肠道和口腔。最近的真菌生物组研究表明,OSCC 中包括白色念珠菌在内的几种真菌种类的丰度增加 。众所周知,口腔中的念珠菌属具有乙醇脱氢酶,负责催化酒精产生乙醛,乙醛是一种有效的致癌物质 。已经表明,具核梭菌与念珠菌共聚集,这可以促进定殖。念珠菌口腔白斑的定植与F. nucleatum水平升高有关。F. nucleatum可能通过增加口腔黏膜与念珠菌产生的乙醛的接触而间接增加口腔癌的风险。
2
激活细胞增殖
最简单的癌症是不受控制的细胞生长,而有核梭菌已被证明通过与内皮钙粘蛋白(E-钙粘蛋白)相互作用来影响癌细胞的增殖。梭杆菌 FadA 与在宿主细胞膜表面表达的 E-钙粘蛋白结合。E-cadherin 是一种通过 β-catenin 发挥作用的肿瘤抑制因子。梭杆菌 FadA 与 E-cadherin 的相互作用激活 WNT/β-catenin 信号传导,导致细胞增殖并增加致癌和炎症基因的表达。
类似地,已显示F. nucleatum通过激活 Toll 样受体 4 (TLR4) 向 MYD88 发出信号来增加小鼠异种移植物中的 CRC 增殖,从而导致核因子 NFκB 的激活和 miR21 的表达增加;这种 miRNA 降低了负责控制细胞增殖和分化的 RAS GTPase RASA1 的水平 。
由细胞周期蛋白激活的细胞周期蛋白依赖性激酶促进细胞周期进程。F. nucleatum感染与细胞周期蛋白 D1 的激活有关,这促进了肠道肿瘤的发生 。在 OSCC 中,F. nucleatum和P. gingivalis均被证明能够通过上调 cyclin D1 和 c-Myc显着刺激 OSCC 细胞增殖。
TLR4 的细菌激活导致白细胞介素 6 (IL-6) 的表达增加,白细胞介素 6 (IL-6) 反过来又激活了 STAT3,这是一种负责调节细胞周期蛋白 D1 和 c-Myc 的关键信号分子 。而且,F. nucleatum通过降低 p27(一种细胞周期蛋白依赖性激酶抑制剂)的表达和加速细胞周期来引起 DNA 损伤并促进口腔癌细胞的细胞增殖 。此外,具核梭菌下调 DNA 修复蛋白 Ku70 和 p53,从而削弱细胞修复能力。
最近的一项研究发现,HNSCC 中具核梭菌的富集与宿主基因启动子甲基化有关,包括肿瘤抑制基因LXN和SMARCA2的高甲基化。SMARCA2是一种参与与 DNA 修复和复制相关的 ATP 依赖性染色质重塑的基因。这表明F. nucleatum感染可能通过表观遗传沉默导致细胞增殖。
3
炎症的诱导
F. nucleatum的促炎潜力已得到充分证明,因为它可以促进活性氧 (ROS) 的产生和细胞因子的产生 。慢性炎症在致癌过程中起着关键作用,并且可以解释牙周炎与 OSCC 高风险之间的密切关联。已发现具核梭菌与 CRC 和 OSCC 中的高细胞因子水平相关,从而产生支持肿瘤进展的炎症微环境 。LPS,存在于细胞外膜中F. nucleatum激活 TLR4 介导的 NF-κB 信号通路以产生促炎细胞因子,如 IL-6、IL-8 和肿瘤坏死因子 α 。
4
抗肿瘤免疫反应
F. nucleatum在 ApcMin/+ 小鼠模型中已显示将骨髓来源的抑制细胞募集到肿瘤微环境中。髓源性抑制细胞可抑制 T 细胞增殖并诱导 T 细胞凋亡 。
这与最近发现的F. nucleatum的数量与结肠直肠癌和乳腺癌组织中 CD3 和 CD4 T 细胞的密度之间的负相关的发现一致。
还观察到 OSCC 中具核梭菌负荷与 B 淋巴细胞、CD4 T 辅助淋巴细胞、M2 巨噬细胞和成纤维细胞的标志物之间存在显着负相关。
F. nucleatum抑制蛋白还可以通过将细胞阻滞在细胞周期的 G1 期来抑制人类 T 细胞活化 。梭杆菌 Fap2 粘附素结合并激活具有 Ig 和 ITIM 结构域 (TIGIT) 的 T 细胞免疫受体,TIGIT 是 T 细胞和自然杀伤 (NK) 细胞中的一种免疫调节信号受体。这种 Fap2-TIGIT 相互作用可保护具核梭菌和附近的肿瘤细胞免于被免疫细胞杀死。局部免疫抑制也可能发生,因为有核梭菌的Fap2和 RadD 外膜蛋白会诱导淋巴细胞中的细胞死亡。
F. nucleatum还通过促进有核梭菌相关 CRC中巨噬细胞的 M2 极化发挥免疫抑制作用,可能通过 TLR4/IL-6/p-STAT3/c-MYC 信号通路。
5
细胞迁移和侵袭
基质金属蛋白酶 (MMP) 是一个锌依赖性内肽酶家族,它们共同能够降解细胞外基质 (ECM) 的所有成分。MMP 在 ECM 过度降解的病理状况中发挥作用,包括肿瘤侵袭和转移。P. gingivalis和F. nucleatum都可以通过不同的机制产生 MMP,从而促进癌细胞的侵袭和转移。
在 OSCC 中,已观察到暴露于牙龈卟啉单胞菌和具核梭菌导致 MMP-1 和 MMP-9 的诱导。同样,与F. nucleatum一起孵育的 AT3 小鼠乳腺癌细胞也表现出 MMP-9 的过表达。
上皮-间质转化 (EMT) 定义为上皮细胞采用间充质表型的过程,是在癌症发展和进展中观察到的现象。
一般来说,进入 EMT 的细胞表现出上皮标志物(如 E-钙粘蛋白)的下调和间充质标志物的上调,包括神经钙粘蛋白(N-钙粘蛋白)和波形蛋白 。这种细胞分化行为的转变是由一组转录因子控制的,包括锌指 E-box 结合同源框 1 和 2 蛋白 (ZEB1/2)、SNAIL 和 TWIST。
CRC 中高水平的具核梭杆菌与 E-cadherin 表达呈负相关,但与 N-cadherin 表达呈正相关。同样,OSCC 细胞系暴露于F. nucleatum与 E-cadherin 转录的显着降低以及 N-cadherin、vimentin 和 Snail 的上调有关。
F. nucleatum可以上调ZEB1 在口腔癌细胞中诱导这种间充质状态,一种先前已在H. pylori感染的胃上皮细胞中发现的机制。
痛风
痛风患者中普氏杆菌(Prevotella)、梭杆菌(Fusobacterium)和拟杆菌(Bacteroides)的相对丰度增加,而肠杆菌科(Enterobacteriaceae)和产丁酸盐菌的相对丰度减少。
胃肠道肿瘤
梭杆菌属(Fusobacterium)在胃肠道肿瘤的发生和发展中起重要作用。与正常组织样本,尤其是正常血源性样本相比,原发肿瘤中梭杆菌较多。泛癌分析还显示,在原发肿瘤组织和邻近正常组织样本中,将所有胃肠道癌(n = 8)与非胃肠道癌(n = 24)进行比较时,梭杆菌丰富度都是较高的。
胰腺导管腺癌
与其他肿瘤相比,胰腺导管腺癌中的肿瘤相关细菌 Gammaproteobacteria较多,尤其是肠杆菌Enterobacterales,与胃癌和结肠癌不同的是,它们的梭杆菌fusobacteria 较少。
口腔和唾液微生物群组成的改变与PDAC(胰腺癌主要是指胰腺导管腺癌,简称PDAC)的风险相关。最近的研究表明,口腔中参与PDAC肿瘤发生的主要致病菌有:
在健康对照组和胰头癌患者中分别观察到嗜血杆菌、卟啉单胞菌、纤毛杆菌、梭杆菌的丰度有显著差异。
PDAC肿瘤内梭杆菌的定殖与PDAC患者的预后更差相关。这项研究的结果表明,梭杆菌属可以作为PDAC的预后生物标志物。
梭杆菌的严重程度和传播范围,决定了所需治疗程度
一般所有梭杆菌感染都必须用抗生素治疗,并且通常对 β-内酰胺类药物敏感,例如青霉素或头孢菌素或其衍生物。
一些梭杆菌菌株被发现含有 β-内酰胺酶,因此建议使用特定的厌氧抗生素,例如甲硝唑或克林霉素。
适当的抗生素治疗与手术清创相结合可预防并发症
抗生素治疗通常通过肠胃外给药 1 至 2 周,然后进行大约 10 天的口服治疗。有些孩子需要切除坏死组织或手术引流。
在一项对 7 名小于 2.2 岁的梭杆菌感染患者的监测研究中,除了乳突切除术外,所有患者都需要一根通气管。
在以色列对 22 名感染梭杆菌的儿童进行的一项为期 14 年的研究中,5 名出现 Lemierre 综合征的患者中有 3 名接受了低分子量肝素治疗以缓解脑窦静脉血栓形成的症状,但是该治疗仍存在争议。
一项 40 年文献回顾确定了, 12 例 2 岁以下儿童的梭杆菌感染病例;所有儿童都出现了乳突炎,并接受了乳突切除术和抗生素治疗,无论严重程度如何,都取得了成功。
早期发现和适当治疗,可以有效阻止和逆转感染的进展
梭杆菌感染在 2 岁及以下的儿童中,临床表现为急性中耳炎,但如果不及时治疗,则会发展为乳突炎和更严重的菌血症、骨髓炎症状,并可能出现 Lemierre 综合征和感染性休克。
使用适当的抗菌检测技术以及适当的成像程序应允许及时使用抗生素和手术参与,以防止感染的进一步传播。
虽然对梭杆菌感染的研究和分析有限,但对感染症状和严重程度的重要认识可以帮助临床医生发现感染的早期发作并将患者引导至适当的专科医生处。
口腔牙周病感染中,高达 90% 的菌群由专性厌氧菌组成,钙化合物已被证明是牙科中有价值的材料。钙与酯的配方在牙齿结构的愈合过程中表现出显着的特性。根据国外“Calcium Therapy Institute”研究所的介绍,他们长达16 年的时间里,发现使用钙化合物来开发治疗牙髓和牙周(牙龈和骨)感染的牙周治疗钙法 (CMPT)具有重要意义。
口腔厌氧菌分散的一个原因是梭杆菌在上颌骨中获得了稳定的立足点,以增殖并将其大量的毒素释放到多孔的上颌骨、上颚和下牙列中。这个过程与人体正常的进食、呼吸、说话和吸吮机制相联系,是梭杆菌对人体细胞异常失衡的完美寄生关系。
北美该研究人员最近报告了的一项突破,发现厌氧细菌被局部刺激或炎症所吸引,会开启“饥饿触发”信号,向侵袭性细菌发出信号,释放一种酶以减少抗生素的影响。
这种自我饥饿细菌的“饥饿信号”会产生一种冬眠状态,或者说是防御状态,直到不再使用抗菌药物。他们进入休眠状态,只是为了在更有利的条件下重新发动进攻。
该研究所实验人员发现舌下颌下腺唾液肽的生物学特性,以及用于根管和牙周治疗的钙材料有助于深入了解答案。
它们是具有解热、抗炎、定时释放特性的非类固醇。几项临床研究表明,长期摄入唾液腺分泌物和对组织有益的钙材料具有积极的全身作用。
——降低有害菌的复制率
在 1980 年代中期,一些的血清研究表明,某些钙质材料不会杀死细菌,而是“降低”它们的复制率,而流行的抗菌剂在几毫秒内杀死一切,包括健康的细胞和细菌。在那项研究中,根据对口腔组织钙治疗的多年临床观察,消除细菌需要十个小时。关键因素是时间。
鉴于饥饿细菌的发现,钙材料会发出警报,但不会造成伤害。
——饿死那些“自我饥饿的细菌”
几十年来,钙疗法已被证明对口腔或皮肤的任何正常健康细胞无害,同时它们还能维持环境“围攻”。不是直接杀死它们,而是逐渐将饥饿细菌饿死。
然后,由于几乎没有复制能力,它们开始消亡,而健康细胞迅速蓬勃发展并主导该领域,尤其是在定时释放钙离子的情况下。
如果厌氧梭杆菌最常存在于口腔、牙菌斑中,并且与牙周病和炎症性牙龈炎有关,那么梭杆菌的下一个最有利的栖息地是结肠,可以刺激溃疡性结肠炎、癌症和克罗恩病。
口腔和结肠这两个区域很容易受到异常水平的梭杆菌的影响,这会长时间造成炎症环境并增强细胞的扩散或分布,甚至会扩散到以厌氧微生物而臭名昭著的身体远处器官。众所周知,生物膜菌落容易引起囊性和脓肿感染。
梭杆菌的管理,中和它们的毒素仍然在控制厌氧微生物环境的范围内。同样,健康的一个主要考虑因素是限制侵入性病原体的局部和全身传播。
从用钙材料管理口腔环境可以明显看出,下颌前切牙上的斑块沉积快速愈合和减少。对口腔黏膜和牙周组织进行长期钙治疗的患者会显著减少牙菌斑和牙石。
考虑到梭杆菌的两个最主要的聚集地,口腔和结肠,那么未来继续研究钙材料应该是价值的。这种病原体比预期的更容易控制,至少在口腔和下消化道的炎症和感染的早期阶段是如此。
声明:关于药物、诊断和治疗方法的部分中提供的信息仅供医疗专业人员交流使用,并非使用说明。
主要参考文献:
Brennan CA, Garrett WS. Fusobacterium nucleatum – symbiont, opportunist and oncobacterium. Nat Rev Microbiol. 2019 Mar;17(3):156-166. doi: 10.1038/s41579-018-0129-6. PMID: 30546113; PMCID: PMC6589823.
Susan Bullman et al. Analysis ofFusobacteriumpersistence and antibiotic response in colorectal cancer, Science (2017). DOI: 10.1126/science.aal5240
Castellarin M, Warren RL, Freeman JD, Dreolini L, Krzywinski M, Strauss J, Barnes R, Watson P, Allen-Vercoe E, Moore RA, Holt RA. Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma. Genome Res. 2012 Feb;22(2):299-306. doi: 10.1101/gr.126516.111. Epub 2011 Oct 18. PMID: 22009989; PMCID: PMC3266037.
Kostic AD, Gevers D, Pedamallu CS, Michaud M, Duke F, Earl AM, Ojesina AI, Jung J, Bass AJ, Tabernero J, Baselga J, Liu C, Shivdasani RA, Ogino S, Birren BW, Huttenhower C, Garrett WS, Meyerson M. Genomic analysis identifies association of Fusobacterium with colorectal carcinoma. Genome Res. 2012 Feb;22(2):292-8. doi: 10.1101/gr.126573.111. Epub 2011 Oct 18. PMID: 22009990; PMCID: PMC3266036.
Vidaurrazaga MM, McKinley GF, Camins BC. Postpartum Fusobacterium gonidiaformans bacteremia. Anaerobe. 2020 Apr;62:102168. doi: 10.1016/j.anaerobe.2020.102168. Epub 2020 Jan 28. PMID: 32045837.
Centor RM, Huddle TS. Should the risk of Fusobacterium necrophorum pharyngotonsillitis influence prescribing empiric antibiotics for sore throats in adolescents and young adults? Anaerobe. 2021 Oct;71:102388. doi: 10.1016/j.anaerobe.2021.102388. Epub 2021 Jun 2. PMID: 34089856.
Duncan SH, Hold GL, Harmsen HJM, Stewart CS, Flint HJ. Growth requirements and fermentation products of Fusobacterium prausnitzii, and a proposal to reclassify it as Faecalibacterium prausnitzii gen. nov., comb. nov. Int J Syst Evol Microbiol. 2002 Nov;52(Pt 6):2141-2146. doi: 10.1099/00207713-52-6-2141. PMID: 12508881.
Arane K, Goldman RD. Fusobacterium infections in children. Can Fam Physician. 2016 Oct;62(10):813-814. PMID: 27737977; PMCID: PMC5063768.
Peluso EA, Scheible M, Ton-That H, Wu C. Genetic Manipulation and Virulence Assessment of Fusobacterium nucleatum. Curr Protoc Microbiol. 2020 Jun;57(1):e104. doi: 10.1002/cpmc.104. PMID: 32539234; PMCID: PMC7398570.
Broadley M, Schweon SJ. Get the facts about Fusobacterium. Nursing. 2017 May;47(5):64-65. doi: 10.1097/01.NURSE.0000515524.23032.d5. PMID: 28445341.
Tadepalli S, Narayanan SK, Stewart GC, Chengappa MM, Nagaraja TG. Fusobacterium necrophorum: a ruminal bacterium that invades liver to cause abscesses in cattle. Anaerobe. 2009 Feb-Apr;15(1-2):36-43. doi: 10.1016/j.anaerobe.2008.05.005. Epub 2008 May 24. PMID: 18595747.
Mark J. Manhart DDS, Thomas B. Steg DDS,2011, Calcium Method of Fusobacteria Management. Alciumtherapy.com