-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

人体复杂的内部环境中栖息着种类繁多、功能各异的微生物群,这些微生物群落对人类的基本生理功能和各种疾病状态都产生着深刻而持续的影响。
人类胃肠道系统代表着宿主机体与宿主相关微生物群落之间最为重要和最大规模的生物接触界面。长期定植于这一特殊环境中的常驻细菌群体,经过漫长的进化历程,已经发展出高度专门化和精细调节的生物学机制,以实现对现有营养物质的最优化获取和高效利用,这些独特的适应性机制使得它们能够在激烈的生存竞争中胜过其他微生物,并在整个肠道的不同区域中成功建立起稳定而特定的微生物群落结构。
宿主与微生物群之间的众多复杂相互作用主要基于各种代谢物的交换和信号传递,因此无论是在生理稳态条件还是在各种疾病状态下,这些相互作用都会受到微生物代谢活动和环境中营养物质可用性的显著而持续的影响。
举例来说,结肠组织在正常生理稳态条件下维持着严格的厌氧环境特征,这种特殊的环境条件特别有利于那些主要通过底物水平磷酸化过程获取生存必需能量的专性厌氧微生物的成功定植和繁殖。
然而,当机体处于各种疾病条件下时,无论这些病理状态是由外来病原体感染引起,还是由非感染性自身免疫疾病如溃疡性结肠炎和克罗恩病等慢性炎症性疾病所导致,肠道上皮细胞的代谢模式都会发生显著变化,这些变化最终导致原本稀缺的氧气分子流入肠腔空间,从而为那些能够有效利用氧气进行有氧呼吸的兼性厌氧菌创造了有利的生长环境,促进了这类微生物的快速扩增和繁殖。
微生物对碳源和能量的高效获取能力始终是决定群落组成结构和功能表现的最主要驱动力量。肠道微生物群和各种肠道病原体经过长期的适应性进化,已经成功发展出多种多样的生物学机制来获得膳食来源的碳水化合物如糖醇类化合物和Amadori产物,以及来源于宿主机体的各种内源性代谢物如与粘蛋白分子密切相关的代谢产物。
注:Amadori产物是糖类与氨基酸或蛋白质发生非酶糖化反应(Maillard反应)的重要中间产物。
除此之外,微生物对各种关键微量营养素的成功获得,包括多种维生素化合物和重要的金属元素如铁、锰、铜、锌、钼、镍等,也在很大程度上控制和调节着微生物群落的整体结构组织。
本文将全面而深入地介绍肠道共生细菌和病原菌如何采用各种不同的生物学策略来获取和代谢肠道环境中丰富的宏量营养素,以实现高效的能量产生并促进其在宿主肠道中的成功定植和长期生存。
★ 不同细菌的能量代谢来源各异
环境细菌和人体相关细菌表现出惊人的代谢多样性。微生物生理学的一个关键决定因素是能量代谢,微生物根据其首选的碳源(有机物与CO2)、能源来源(阳光与化学反应)和氢供体来源(有机与H2O)可大致分类。
任何生物体要想存活,必须通过化学反应产生足够的吉布斯自由能来合成ATP并建立离子梯度。
注:吉布斯自由能可以简单理解为反应的”净可用能量”。
例如,硫杆菌属(Thiobacillus spp)等硫氧化细菌使用元素硫、硫化氢(H2S)或硫代硫酸盐作为电子供体,以氧为电子受体生成硫酸盐和其他氧化硫化合物;并通过电子传递链建立质子动力。
而大多数肠道共生菌降解有机化合物,从膳食和宿主来源(化学有机异养生物)中获得能量和代谢中间体。虽然肠道微生物营养策略多样,但人体结构严格限制了不同肠段栖息的细菌类型及其代谢模式。
▸ 肠道不同部位微生物群结构和代谢不同
人体已经进化出专门的机制,使特定微生物在肠道不同部位选择性定植,从而塑造微生物群落结构和代谢模式。
饮食和宿主因素决定了肠道微生物群的代谢

Muramatsu MK,et al.Cell Host Microbe.2024
★ 小肠以需氧和兼性厌氧菌为主,密度较低
小肠pH值从胃部酸性逐渐升至回肠末端的微酸性或中性,影响微生物群落多样性。十二指肠和空肠主要栖息耐酸需氧菌和兼性厌氧菌,如乳酸杆菌属(Lactobacillus)和链球菌属(Streptococcus)以及变形菌门(假单胞菌属)。
此外,肝胆系统释放的初级胆汁酸(BA)和牛磺酸或甘氨酸偶联的胆汁酸(CBA)以及潘氏细胞释放的抗菌肽抑制了小肠中许多细菌的生长。因此,小肠微生物密度远低于大肠,从近端至远端小肠的每克约103-7个细菌增加到结肠中的每克1011-12个细菌。
★ 大肠环境有利于专性厌氧菌定植
大肠塑造了与小肠截然不同的微生物群落结构和代谢模式。结肠的主要过滤器是缺氧环境,有利于专性厌氧菌定植。
结肠细胞大量消耗氧气进行β氧化,维持上皮缺氧状态,限制氧气从血管向肠腔扩散,促进厌氧厚壁菌门和拟杆菌门等专性厌氧菌定植。微生物产生的丁酸盐促进结肠细胞β氧化,形成宿主-微生物代谢反馈回路。由于氧气稀缺,兼性厌氧菌仅占次要地位。
大部分胆盐在回肠被吸收,剩余的初级胆盐由大肠微生物代谢。饮食营养在胃中分解后,单糖和氨基酸在小肠被吸收,而不可消化的碳水化合物(膳食纤维)和多元醇进入结肠,成为细菌的主要碳源和能源。
肠道微生物群的代谢构成了人体内最为活跃和复杂的生化反应工厂,这一庞大的微观生态系统依靠多元化的能量来源维持着自身的生存繁殖和功能发挥。肠道微生物主要是将宿主无法消化的复杂碳水化合物、膳食纤维、抗性淀粉以及内源性黏蛋白转化为可被利用的能量物质。
▸ 降解复杂多糖
由于大多数简单的营养物质在小肠中被吸收,因此大肠微生物群的许多成员主要碳和能量来源是膳食复杂多糖(纤维)。这类分子包括植物来源的聚糖,如纤维素、半纤维素、β-葡聚糖、菊粉和果胶,以及动物来源的糖原。
★ 拟杆菌等菌属具有强大的复合多糖降解能力
复杂多糖含有多样化的糖苷键,需要特异性糖苷水解酶降解。拟杆菌属等革兰氏阴性专性厌氧菌,如 Bacteroides spp. 和 Prevotella spp.,在复杂多糖的降解方面表现极强的能力。这些细菌拥有大量的碳水化合物活性酶(CAZymes),例如由不同多糖利用位点编码的碳水化合物结合蛋白、糖苷水解酶和多糖裂解酶。
拟杆菌淀粉利用系统(SUS)是多糖利用位点的经典例子:淀粉结合蛋白(SusD、SusE、SusF)识别并固定细菌表面的淀粉分子,糖苷水解酶(SusG)将其降解为寡糖,寡糖通过外膜蛋白SusC转运至周质,再被糖苷水解酶(SusA、SusB)进一步降解为单糖,最终转运至细胞质并发酵产生乙酸、琥珀酸和丙酸。拟杆菌编码众多SUS样系统和CAZymes,与膳食聚糖的多样性相匹配。
B.thetaiotaomicron中的淀粉利用系统(SUS)

Muramatsu MK,et al.Cell Host Microbe.2024
★ 毛螺菌和瘤胃球菌也能降解复杂多糖并产生短链脂肪酸
毛螺菌科(Lachnospiraceae)和瘤胃球菌科(Ruminococcaceae)等革兰氏阳性梭菌同样降解复合多糖并产生短链脂肪酸。
革兰氏阳性菌的降解机制涉及细胞外CAZymes和高亲和力转运蛋白(如ATP结合盒转运蛋白、主要促进子超家族转运蛋白和磷酸转移酶系统),底物特异性酶活性通常以基因簇形式编码。
注:虽然纤维素体降解植物细胞壁的能力在瘤胃微生物中常见,但在大多数人类肠道微生物中缺失,仅在农村和狩猎采集人群的微生物组中观察到此类活性。
▸ 代谢膳食糖醇和多元醇
多元醇是由糖类通过醛或酮基还原形成醇基而天然合成生成的糖醇。自然界中发现的主要多元醇包括赤藓糖醇、山梨糖醇、木糖醇、甘露醇和麦芽糖醇等天然形式,以及乳糖醇、异麦芽酮糖醇和氢化淀粉水解物等合成形式。
由于在胃肠道中吸收不完全,多元醇常用作低卡路里人造甜味剂。高脂肪饮食联合抗菌治疗会消耗氧敏感的多元醇降解梭菌,导致山梨糖醇不耐受。
★ 大肠杆菌能够利用甘露醇
甘露醇代谢在多种细菌中被广泛研究。在大肠杆菌中,甘露醇通过特异性磷酸烯醇式丙酮酸磷酸转移酶系统被吸收并磷酸化为甘露醇-1-磷酸,随后被甘露醇-1-磷酸脱氢酶转化为果糖-6-磷酸进入糖酵解途径。
另一途径是甘露醇以半乳糖基-甘露醇偶联物形式进入细胞,被β-半乳糖苷酶水解后,甘露醇通过甘露醇-2-脱氢酶转化为果糖,再被己糖激酶磷酸化。
★ 双歧杆菌代谢异麦芽酮糖醇并产生丁酸盐
除了甘露醇外,其他多元醇同样可被肠道微生物代谢。中等剂量的异麦芽酮糖醇和乳糖醇摄入后,肠道微生物群组成偏向双歧杆菌,为某些共生菌提供生长优势。体外实验显示双歧杆菌可代谢异麦芽酮糖醇,增加丁酸盐产生,这对维持结肠上皮细胞厌氧环境至关重要。
★ 沙门氏菌会与共生大肠杆菌竞争半乳糖醇
半乳糖醇天然存在于某些植物中,酵母也可产生。沙门氏菌通过gat操纵子利用半乳糖醇,包含磷酸转移酶系统gatABC将其转运并磷酸化,最终转化为磷酸二羟基丙酮和3-磷酸甘油醛。半乳糖醇是定植抗性的关键代谢物,沙门氏菌与共生大肠杆菌竞争这一有限资源。
▸ 粘蛋白:微生物的”应急储备”
肠道微生物群落还可分为管腔、黏液相关和上皮/隐窝相关群体。黏蛋白形成重要屏障,保护肠道上皮免受微生物侵害,其中MUC2是主要类型。小肠黏液层呈多孔状,含抗菌肽(如肠道α防御素)和凝集素(如RegIIIγ),限制微生物与上皮相互作用的同时允许营养吸收。
★ 食物缺乏时,某些细菌会消化黏蛋白
结肠黏液则形成细菌无法穿透的致密内层和松散外层,而嗜黏蛋白阿克曼菌(Akkermansia muciniphila)等可利用外层获取营养。在没有膳食纤维的情况下,肠道微生物开始消化粘蛋白,增加了患结肠炎的风险。
黏蛋白是富含脯氨酸、苏氨酸和丝氨酸的大糖蛋白家族。丝氨酸和苏氨酸残基作为N-乙酰半乳糖胺(GalNAc)的O-连接糖基化附着点,可被半乳糖和N-乙酰葡糖胺等单糖进一步修饰,形成长支链聚糖并用唾液酸、岩藻糖和硫酸盐残基末端修饰。
十二指肠、空肠和回肠的黏蛋白高度唾液酸化和硫酸化,结肠黏蛋白则含唾液酸化、硫酸化和岩藻糖化聚糖。近端结肠唾液酸化程度较高,远端结肠硫酸化程度较高。
类似膳食聚糖降解,黏蛋白的微生物消化需要多种降解菌(如嗜黏蛋白阿克曼菌及拟杆菌门、厚壁菌门成员)协同形成营养网络。降解过程由岩藻糖苷酶和唾液酸酶水解末端糖结构,硫酸酯酶去除硫酸盐基团引发。
★ 降解过程中可为其他细菌提供营养
去除这些末端结构可能会成为粘蛋白降解的潜在瓶颈,因为这些末端结构可以保护底层聚糖链免受糖基水解酶的降解,并且需要特定的酶。肠道微生物群的不同成员编码的酶可以去除这些结构并使其成为其他细菌的营养来源。
例如,扭链瘤胃球菌(Ruminococcus torques)很容易使用细胞外CAZymes消化肠粘蛋白上的聚糖。Bacteroides thetaiotaomicron通常更喜欢膳食聚糖而不是粘蛋白,并且在体外使用粘蛋白生长不佳。但R.torques产生的低聚糖的交叉喂养促进了B.thetaiotaomicron在粘蛋白上的生长。
同样,卵形拟杆菌(Bacteroides ovatus)和Roseburia intestinalis降解半纤维素成分β-甘露聚糖。而普拉梭菌(Faecalibacterium Prausnitzii)无法自行有效降解 β-甘露聚糖,但可以获得卵形拟杆菌和R.intestinalis释放的甘露寡糖。
这些例子强调了肠道营养网络的重要性以及定植于肠道的一些细菌之间的互惠关系。
唾液酸和岩藻糖降解—糖利用的例子
唾液酸和岩藻糖是复合多糖降解的常见中间体,为肠道微生物糖利用提供典型例子。
唾液酸的代谢
唾液酸(N-乙酰神经氨酸,Neu5Ac)是一种9碳单糖,通过α2-3/6键与半乳糖和GalNAc残基结合,覆盖胃肠道黏蛋白聚糖链末端。人乙状结肠MUC2分析显示,结肠中最常见表位是与α2-6 N-乙酰半乳糖胺醇结合的Neu5Ac,而小鼠中与GlcNAc结合的Neu5Ac更常见。
两物种的微生物群均编码特异性唾液酸酶,可识别特定糖苷键并去除末端Neu5Ac残基,启动糖苷水解酶的分解代谢。
部分细菌(如脆弱拟杆菌)可直接裂解和代谢唾液酸,而其他细菌仅能清除游离唾液酸分子。唾液酸转运(NanT)后,醛缩酶(NanA)将Neu5Ac代谢为丙酮酸和N-乙酰甘露糖胺(ManNAc)。ManNAc经ManNAc激酶(NanK)磷酸化,再由差向异构酶(NanE)转化为磷酸化N-乙酰葡糖胺(GlcNAc-6-P),最终代谢为果糖-6-磷酸进入糖酵解途径。
扭链瘤胃球菌(Ruminococcus torques)采用独特的唾液酸代谢策略获得竞争优势。其编码的分子内反式唾液酸酶在糖蛋白裂解时产生2,7-脱水-N-乙酰神经氨酸(2,7-anhydro-Neu5Ac)而非唾液酸,阻止其他利用唾液酸的细菌使用该底物。进入细菌细胞后,新型氧化还原酶(NanOx)将2,7-脱水-Neu5Ac转化为唾液酸。
肺炎链球菌和沙门氏菌等病原体中也检测到NanOx直系同源物和推定的2,7-脱水-Neu5Ac转运蛋白,表明该化合物可能是病原体体内定植的重要代谢物。
岩藻糖的代谢
L-岩藻糖是一种6碳脱氧糖,广泛存在于生命各分支。人和小鼠中,岩藻糖基转移酶Fut2负责胃肠道大部分岩藻糖基化,将岩藻糖附着在聚糖的基端α(1,6)和末端α(1,2)、(1,3)或(1,4)位。胃肠道中,岩藻糖通过肠道微生物分泌的α-L-岩藻糖苷酶从膳食或宿主黏蛋白聚糖中释放,随后被部分肠道微生物吸收代谢。
大肠杆菌的岩藻糖利用已被广泛研究,其编码岩藻糖利用操纵子(fucOAPIKR)。岩藻糖通过专用通透酶(FucP)导入细胞,经异构酶FucI转化为L-岩藻酮糖,再被激酶FucK磷酸化。岩藻酮糖1-磷酸被醛缩酶(FucA)裂解为乳醛和DHAP。
厌氧条件下,乳醛被氧化还原酶(FucO)还原为1,2-丙二醇;有氧条件下(如肠道炎症期间),乳醛转化为乳酸并氧化为丙酮酸进一步代谢。缺乏fucK和fucAO的大肠杆菌突变体虽能在小鼠肠道初步定植,但无法长期稳定定植,表明岩藻糖获取和利用能力是维持哺乳动物肠道环境的关键。多形拟杆菌和脆弱拟杆菌也利用岩藻糖在小肠中保持竞争优势。
有趣的是,共生肠道细菌可诱导小鼠肠道宿主Fut2表达,形成富含岩藻糖的生态位,既保护宿主聚糖又允许岩藻营养细菌扩增。无菌小鼠经常规小鼠粪便浆液处理可诱导小肠岩藻糖基化。广谱抗生素处理的常规小鼠杯状和柱状上皮细胞岩藻糖基化严重减少,表明共生菌在宿主Fut2表达和肠聚糖岩藻糖基化中发挥作用。
一些细菌的存在,如丝状细菌、多形拟杆菌和沙门氏菌等细菌可在无菌小鼠回肠诱导宿主岩藻糖基化。虽然肠道共生体诱导Fut2介导岩藻糖基化的信号分子仍不明确,但葡聚糖硫酸钠和霍乱毒素等促炎环境压力源可诱导岩藻糖基化。
除饮食偏好(高脂肪西餐vs富含纤维饮食)、食物类别(蔬菜vs肉类)和食品添加剂外,食物制备方法也影响微生物代谢。
▸ 食物制备方法会影响微生物代谢
法国科学家Maillard最早描述了一种导致烹饪中观察到的褐变效应的反应,称为美拉德反应。当单糖羰基与氨基酸氨基反应时产生Amadori产物,其聚合形成更复杂的类黑精。常见食品加工方法(加热、干燥)产生多种Amadori化合物,如果糖-谷氨酰胺(F-Gln)、果糖-苯丙氨酸(F-Phe)和果糖-天冬酰胺(F-Asn)。
注:美拉德反应(Maillard reaction)是食品工业中广泛存在的一种非酶褐变现象,由还原糖与氨基化合物(如氨基酸、蛋白质)在常温或加热条件下发生复杂反应,生成类黑精等棕色物质,并产生大量风味物质。类黑精是指含有半缩醛羟基的化合物(醛、还原糖)与含有氨基的化合物等经缩合、聚合反应生成的高分子量聚合物。
★ 肠道共生菌和病原菌均可利用美拉德反应产物
人肠道分离株肠单胞菌AF211(毛螺菌科成员)可代谢果糖赖氨酸(F-Lys)并产生丁酸盐、乳酸盐和氨。F-Lys通过ABC转运蛋白输入,被YhfQ磷酸化形成6-磷酸果糖-赖氨酸,再被6-磷酸果糖-赖氨酸脱糖酶(Yhfn)转化为6-磷酸葡萄糖(G6P)和赖氨酸。
肠道病原体沙门氏菌通过fra操纵子(fraRBDAE)利用F-Asn作为碳氮源。F-Asn首先被果葡天冬酰胺酶FraE转化为果糖-天冬氨酸(F-Asp),再由F-Asp转运蛋白FraA导入。随后F-Asp被FraD磷酸化形成F-Asp-6-磷酸,再被脱糖酶FraB代谢为G6P和天冬氨酸。
▸ 发酵是能源生产的主要模式
发酵作为厌氧环境中的关键生化过程,构成了肠道微生物能源生产的主要模式,这一代谢途径在维持微生物群落的生存和功能发挥方面起着至关重要的作用。
肠道微生物会使用大量的分子,特别是通过复合多糖降解释放的单糖以及氨基酸(Stickland 反应),进行发酵。
注:Stickland反应为专性厌氧细菌的梭菌属中常见的一种反应。
★ 发酵产生乳酸、短链脂肪酸等产物
发酵过程中需在细菌细胞内平衡氧化还原反应,避免还原当量(如NADH)积累。维持适当的NAD+/NADH比率对氧化还原稳态和NAD+依赖性酶功能至关重要。
最简单的发酵中,葡萄糖在Embden-Meyerhof-Parnas途径中转化为两个丙酮酸分子,净产生两个ATP和四个还原当量。丙酮酸代谢物用于恢复NAD+/NADH平衡,如将丙酮酸还原为乳酸(乳酸发酵)或将乙醛还原为乙醇(乙醇发酵)。肠道发酵的常见终产物包括乳酸、甲酸、琥珀酸及短链脂肪酸(乙酸、丙酸、丁酸)。
一些发酵途径广泛存在,如从丙酮酸产生乙酸的Pta-AckA途径。铁氧还蛋白氧化还原酶、丙酮酸甲酸裂解酶或丙酮酸脱氢酶将丙酮酸转化为乙酰辅酶A,再经磷酸乙酰转移酶转化为乙酰磷酸。乙酸激酶活性从乙酰磷酸和ADP生成ATP,同时产生乙酸。
发酵是肠道共生细菌产生细胞能量的主要方式
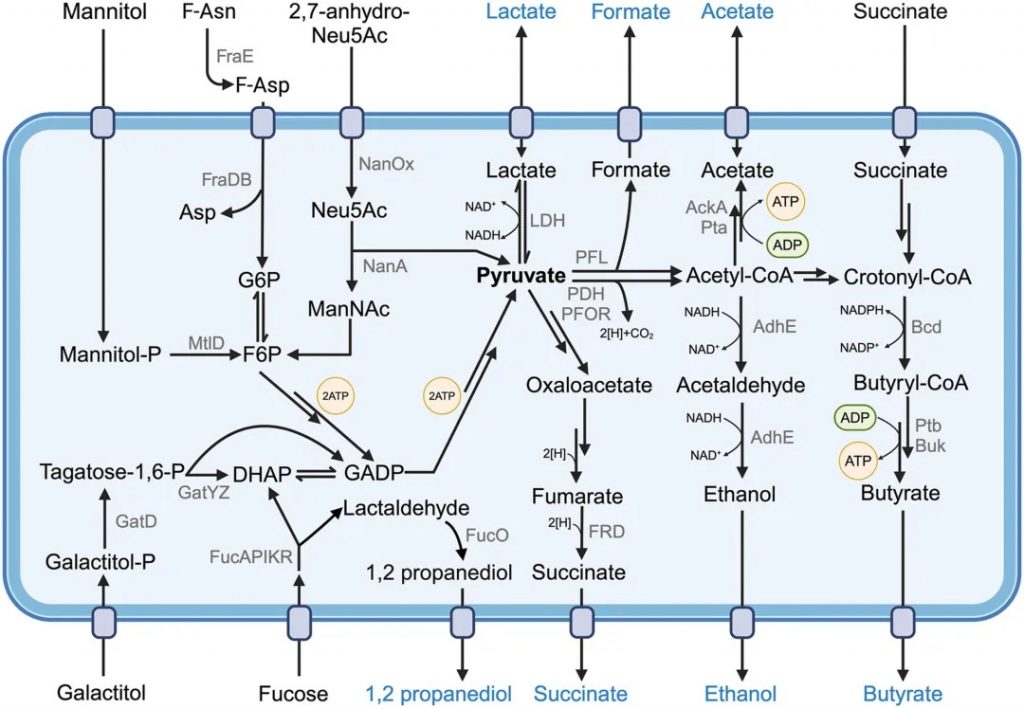
Muramatsu MK,et al.Cell Host Microbe.2024
★ 短链脂肪酸变化可反映肠道健康状态改变
丁酸主要由毛螺菌科和瘤胃球菌科成员通过聚糖直接降解或交叉发酵乳酸、乙酸、琥珀酸产生。两个乙酰辅酶A分子融合形成乙酰乙酰辅酶A,经数步转化为巴豆酰辅酶A和丁酰辅酶A,平衡NAD+/NADH池。类似Pta-AckA途径,丁酰辅酶A产生ATP并形成丁酸。另外,琥珀酸可在多步过程中还原为4-羟基丁酰辅酶A,再转化为巴豆酰辅酶A和丁酰辅酶A。戊二酸和赖氨酸也可转化为巴豆酰辅酶A。
短链脂肪酸的产生是关键代谢输出,指导结肠上皮进行β氧化,维持肠腔厌氧环境。该过程在肠道病原体感染、口服抗菌剂或高脂饮食时被破坏,导致肠道微生物群显著改变、丁酸产生减少和兼性厌氧菌扩增。
★ Stickland反应是肠道代谢物的重要来源
Stickland反应是某些肠道细菌产生能量的特殊发酵过程。在此反应中,成对氨基酸同时脱氨,一个被氧化,另一个被还原,产生ATP和NAD+。该反应主要见于梭菌属,已鉴定出特定的供体氨基酸(丙氨酸、缬氨酸、丝氨酸)和受体氨基酸(甘氨酸、脯氨酸、天冬氨酸)组合。氧化反应中供电子氨基酸转化为羧酸并产生ATP;还原反应中受电子氨基酸将NADH氧化为NAD+,产生乙酸、5-氨基戊酸、异己酸等代谢物。
编码甘氨酸还原酶途径基因的生物体可通过甘氨酸还原产生ATP、氨和乙酸。氨基酸氧化或还原可补充其他能量产生形式。丙氨酸和丝氨酸氧化脱氨产生的丙酮酸可用于TCA循环。氨基酸还原发酵通过再生NAD+等高能电子载体辅助糖酵解。编码和使用红杆菌氮酶(RNF)样复合物的生物体可将氨基酸代谢与质子驱动力产生结合以提高ATP产量。在厌氧菌具核梭杆菌(Fusobacterium nucleatum)中,RNF复合物的破坏导致ATP生成减少、氨基酸代谢减少和毒力受损。
肠道细菌中的Stickland发酵和硫代谢

Muramatsu MK,et al.Cell Host Microbe.2024
Stickland反应产生大量在小鼠肠道和人血中发现的代谢物。人肠道共生梭状芽孢杆菌(C.sporogenes)通过丝氨酸脱水酶氧化发酵丝氨酸和还原精氨酸产生ATP。由脯氨酸和芳香族氨基酸Stickland反应形成的还原代谢物(5-氨基戊酸、苯丙酸、3-(4-羟基苯基)丙酸、吲哚丙酸)也存在于人血中,表明还原Stickland反应衍生代谢物可离开肠道进入循环系统。这表明Stickland反应是哺乳动物肠道和远端部位代谢物的重要但被低估的来源。
★ 艰难梭菌的胶原蛋白降解与脯氨酸利用策略
许多依赖Stickland反应的细菌具有蛋白水解作用,可通过细胞外蛋白酶快速降解蛋白质。肠道病原体艰难梭菌导致宿主释放胶原蛋白应对毒素介导的炎症。胶原纤维主要由脯氨酸、甘氨酸和羟脯氨酸组成。艰难梭菌降解这些纤维,将反式-4-羟基-L-脯氨酸转化为L-脯氨酸,通过prd操纵子进行还原发酵产能。缺乏4-羟脯氨酸脱水酶HypD的突变菌株致病力受损。其他梭状芽胞杆菌如Paeniclostridium spp.在体外与艰难梭菌竞争脯氨酸,影响其发酵能力。
综上所述,这表明反式-4-羟基-L-脯氨酸的利用是艰难梭菌用于在体内获得脯氨酸的一种策略,并且脯氨酸发酵在艰难梭菌的体内存活中发挥作用。
呼吸作用过程中,电子通过电子传递链转移至外源电子受体,通过酶复合物质子泵活动或标量化学形成质子动力。
厌氧呼吸,特别是富马酸还原,在肠道细菌中常见。伯克氏菌科(Burkholderiaceae)、爱格氏菌属(Eggerthella)和丹毒丝菌科(Erysipelotrichaceae) 成员对膳食电子受体表现出种属特异性利用。
▸ 胆汁酸的利用
胆汁酸(BA)是消化系统重要组成部分。肝脏产生的主要胆汁酸包括胆酸(CA)和鹅去氧胆酸(CDCA),分泌前与牛磺酸或甘氨酸结合。人体内牛磺酸与甘氨酸结合胆汁酸的比例取决于饮食,牛磺酸主要来源于肉类、鱼类和贝类。
★ 胆汁酸有助于发酵过程中的能量转化
胆汁酸(BA)经细菌活动进一步修饰,包括转化和解偶联。在胆酸(CA)向脱氧胆酸和CDCA/熊去氧胆酸向石胆酸的多步转化中,7-羟基被去除,使梭菌科和爱格氏菌属(Eggerthella)能够将NADH转化为NADPH,有助于发酵过程中维持理想的NAD+/NADH比率。共生微生物从BA中解离牛磺酸,导致肠道游离牛磺酸浓度升高。胆盐水解酶通过催化类固醇部分C-24位置与BA氨基酸侧链间的酰胺键水解促进解偶联。
★ 肠道存在多种胆盐代谢细菌,包括致病菌
肠道微生物群含有许多编码不同底物特异性胆盐水解酶的细菌。厚壁菌门和放线菌门成员可降解大多数结合胆汁酸,而拟杆菌门菌株偏爱牛磺酸结合胆汁酸,双歧杆菌属和约氏乳杆菌(Lactobacillus johnsonii)乳杆菌等富含胆盐水解酶。结合胆汁酸的解离高度依赖于产胆盐水解酶微生物的位置:小鼠近端小肠中的乳酸杆菌开始解离,而人类中解离直到末端回肠和结肠才发生。
释放的牛磺酸可被不同肠道微生物利用。沃氏嗜胆菌(Bilophila wadsworthia)是肠道微生物群的亚硫酸盐还原致病菌,虽仅占正常肠道微生物群的0.01%,但与多种临床疾病相关。当IL-10缺陷小鼠饲喂低脂饮食并补充牛磺酸结合胆汁酸时,会导致肠道B.wadsworthia种群激增。B.wadsworthia利用异化亚硫酸盐还原酶复合物(Dsr)从有机磺酸盐释放的亚硫酸盐产生H2S。
牛磺酸转运入细胞后,B.wadsworthia利用两个基因簇(ald-tpa-sarD和adhE-islA-islB)代谢牛磺酸。牛磺酸首先被Tpa和Ald转化为磺基乙醛,再被SarD转化为乙硫磺酸盐。异羟乙基磺酸进入细菌微区室后,IslAB形成甘油自由基酶,促进C-S键裂解,将其转化为乙醛和亚硫酸盐。乙醛被AdhE代谢成乙酰辅酶A,再通过Pta-AckA途径转化为乙酸,而亚硫酸盐被Dsr系统用作亚硫酸盐呼吸中的电子受体。
▸ 硫酸酯酶和硫酸盐的利用
多糖常被硫酸盐修饰,需释放硫酸盐基团才能接触糖基团。GlcNAc和半乳糖的硫酸化发生在不同羟基位置,特别是GlcNAc的6-羟基(6S-GlcNAc)和半乳糖的3-、4-或6-位置。利用O-糖核心结构中这些硫酸盐基团需要能识别并裂解特定糖苷键的碳水化合物硫酸酯酶。
★ 硫酸酯酶表达菌释放硫酸盐供硫酸盐还原菌利用
表达硫酸酯酶的细菌释放的硫酸盐通过交叉喂养被硫酸盐还原细菌(SRB)利用。SRB存在于约50%的人群中,进行异化硫酸盐还原,将硫酸盐还原为腺苷-5′-磷酸硫酸盐、亚硫酸盐,并进一步还原为H2S。与缺乏成熟硫酸酯酶的B.thetaiotaomicron 菌株相比,当与从肠道粘蛋白中释放硫酸盐的B.thetaiotaomicron菌株共定植时,其在体内的相对丰度增强。H2S具有剧毒,宿主将其解毒为硫代硫酸盐,后者可用作Desulfovibrio spp.的电子受体。
▸ 外部电子转移
寻找合适的电子供体和受体对是细菌产能的关键。部分细菌已开发利用外源性电子受体的策略。外部电子转移(EET)连接细胞质氧化还原反应,将电子转移至与细菌直接接触或远端的外部电子受体。该过程已在环境细菌中广泛描述,近期在哺乳动物微生物群和肠道病原体中也有报道。
★ 细菌具有直接电子转移和介导电子转移两类
革兰氏阴性菌的胞质膜、肽聚糖层和外膜对EET构成物理屏障。为克服这些障碍,电活性细菌进化出两类方法:直接电子转移和介导电子转移(MET)。直接电子转移主要见于环境生物体如Shewanella oneidensis,电子直接传输至与外膜接触的外部电子受体。
MET则需要电子穿梭介导电子从细菌转移至外部电子受体。铜绿假单胞菌释放苯嗪(含氮杂环化合物)将电子转移至分子氧,植物乳杆菌利用醌1,4-二羟基-2-萘甲酸还原铁。P.prausnitzii与上皮细胞相关,该专性厌氧菌可能使用黄素和硫醇作为细胞外电子穿梭来减少宿主组织释放的氧气。
★ 细菌获取外部电子的方式影响其环境适应性
在革兰氏阳性肠道病原体单核细胞增生李斯特菌中,基于黄素的EET(FLEET)途径将NADH脱氢酶(Ndh2)产生的电子穿梭至质膜中脂溶性去甲基甲萘醌衍生物,再转移至膜结合脂蛋白(PplA)上的黄素或黄素单核苷酸基团,最终传递给末端电子受体。
研究表明,单核细胞增生李斯特菌厌氧条件下代谢糖醇需要FLEET通路,ndh2突变体在小鼠肠道定植能力受损。FLEET通路基因的直系同源物在数百种厚壁菌门和人类病原体中均有发现。这些研究突出了电子受体的重要性,表明细菌已进化出复杂机制获取外部电子受体池,以增强其在特定环境中的生长能力。
▸ 肠道炎症时的能量代谢
肠道炎症会导致微生物群水平变化,变形菌门(尤其是兼性厌氧肠杆菌科)丰度增加。呼吸电子受体的释放是这些群落变化的关键驱动因素,重塑了肠道细菌的能量代谢。
★ 电子受体的释放影响肠道菌群的能量代谢
例如,沙门氏菌(Salmonella)诱导胃肠炎时,活性氧(ROS)将宿主产生的硫代硫酸盐氧化为连四硫酸盐。沙门氏菌编码连四硫酸盐利用基因簇(ttrRSBCA),实现厌氧连四硫酸盐呼吸。炎性ROS和活性氮(RNS)分解产生硝酸盐,为沙门氏菌提供高能电子受体。
肠道炎症改变了末端电子受体的可用性

Muramatsu MK,et al.Cell Host Microbe.2024
★ 炎症导致氧气泄漏促进需氧病原体增殖
此外,炎症相关的结肠细胞代谢变化使氧气泄漏至肠腔,支持肠道病原体生长。电子受体的可用性不仅实现高效的电子传输产能,还可利用发酵终产物(如琥珀酸、乳酸和1,2-丙二醇),将其完全氧化为二氧化碳。
类似的机制正在驱动非感染性结肠炎期间肠道微生物群的水平变化。硝酸盐和氧气呼吸有助于共生肠杆菌科细菌的繁殖,例如非感染性结肠炎小鼠模型中的大肠杆菌、肠杆菌属和克雷伯氏菌属。上皮细胞释放的活性氧被过氧化氢酶解毒,过氧化氢酶是一种产生分子氧的反应,支持大肠杆菌的呼吸。
此外,口服抗菌治疗期间产生丁酸盐的梭状芽胞杆菌的耗竭会改变结肠细胞代谢;氧气的流入导致肠杆菌科种群的扩大。
呼吸电子受体可用性增加引起微生物群水平变化表明,碳和氮并非细菌生长的限制因素,而能量代谢和从有限底物库产能的能力才是肠道微生物群组成和功能的关键决定因素。
本文介绍了共生菌和病原菌在肠道中获取营养素和产生能量的机制。细菌可氧化有机和无机化合物产生生长必需的能量。在不同微环境中的产能能力是群落结构的关键决定因素。
人体肠道包含多个动态生态位,肠道微生物群在受宿主营养摄入、栖息地过滤器和疾病炎症影响的环境中调节能量产生。
人类微生物组研究传统上侧重于识别与健康和疾病相关的关键细菌种类(如炎症性肠病、艰难梭菌感染、抗生素相关菌群失调等)。但宿主-微生物和微生物间相互作用及其代谢机制同样重要。研究显示,细菌有效利用特定营养物质的能力(无论独立利用还是通过细菌营养网络)是微生物群组成和功能的关键驱动因素。
对宿主健康而言,微生物执行的代谢功能非常重要。这在致病性菌群相关的生态失调中显而易见,共生微生物因面临新代谢环境和成员间相互作用挑战而异常增殖并致病。
发现疾病相关代谢途径对个性化医疗具有重要意义。未来,随着对肠道微生物代谢功能理解的不断深入,我们有望开发出更加精准的个性化医疗策略,包括恢复特定代谢缺陷的微生物疗法,以及深入理解宿主-微生物代谢相互作用的分子机制。通过调节肠道微环境、优化营养网络以及恢复关键代谢途径,我们将能够更有效地治疗与微生物群失调相关的疾病,为人类健康开辟新的治疗途径。
主要参考文献
Muramatsu MK, Winter SE. Nutrient acquisition strategies by gut microbes. Cell Host Microbe. 2024 Jun 12;32(6):863-874.
Yersin S, Vonaesch P. Small intestinal microbiota: from taxonomic composition to metabolism. Trends Microbiol. 2024 Oct;32(10):970-983.
Murdoch CC, Skaar EP. Nutritional immunity: the battle for nutrient metals at the host-pathogen interface. Nat Rev Microbiol. 2022 Nov;20(11):657-670.
Miller BM, Bäumler AJ. The Habitat Filters of Microbiota-Nourishing Immunity. Annu Rev Immunol. 2021 Apr 26;39:1-18.
Salzman NH, Hung K, Haribhai D, Chu H, Karlsson-Sjöberg J, Amir E, Teggatz P, Barman M, Hayward M, Eastwood D, Stoel M, Zhou Y, Sodergren E, Weinstock GM, Bevins CL, Williams CB, Bos NA. Enteric defensins are essential regulators of intestinal microbial ecology. Nat Immunol. 2010 Jan;11(1):76-83.
La Rosa SL, Ostrowski MP, Vera-Ponce de León A, McKee LS, Larsbrink J, Eijsink VG, Lowe EC, Martens EC, Pope PB. Glycan processing in gut microbiomes. Curr Opin Microbiol. 2022 Jun;67:102143.
Eberl C, Weiss AS, Jochum LM, Durai Raj AC, Ring D, Hussain S, Herp S, Meng C, Kleigrewe K, Gigl M, Basic M, Stecher B. E. coli enhance colonization resistance against Salmonella Typhimurium by competing for galactitol, a context-dependent limiting carbon source. Cell Host Microbe. 2021 Nov 10;29(11):1680-1692.e7.
Schaus SR, Vasconcelos Periera G, Luis AS, Madlambayan E, Terrapon N, Ostrowski MP, Jin C, Hansson GC, Martens EC. Ruminococcus torques is a keystone degrader of intestinal mucin glycoprotein, releasing oligosaccharides used by Bacteroides thetaiotaomicron. bioRxiv [Preprint]. 2024 Jan 16:2024.01.15.575725.

谷禾健康

拟杆菌是革兰氏阴性、专性厌氧菌,在人类肠道微生物群中含量丰富,构成了肠道菌群中大部分比例。
Bacteroides uniformis (一般简称为 B.uniformis),翻译为单形拟杆菌或普通拟杆菌,是拟杆菌属的主要成员,在肠道中起着重要的作用。也被鉴定为阴道微生物组的组成部分。
Bacteroides uniformis是与人类粪便中异黄酮染料木黄酮降解相关的特定细菌物种,可以产生纤维素酶和淀粉酶,降解复杂多糖。
Bacteroides uniformis与肠炎、厌食、肥胖、糖尿病、腹胀、认知发育与情绪运动、多动症、慢性肾病、骨质疏松等相关,是可引起人类或动物疾病的物种,不太可能在人群中传播,并且存在足够的预防或治疗方法。
对单形拟杆菌进行深入研究,有助于我们更好地理解其在人体肠道中的功能,并为相关疾病的预防和治疗提供新的思路。
Bacteroides uniformis是一种革兰阴性细菌,呈杆状。它们通常具有弯曲或弯钩形态,并且没有芽胞。

图源:Microbe Canvas
生理特性
Bacteroides uniformis是一种厌氧菌,不能在氧气存在的环境中生长。它们通常能够利用多糖类物质作为碳源,如淀粉、纤维素和其他复杂碳水化合物。还可以产生一些酶,如纤维素酶和淀粉酶,用于降解消化这些复杂碳水化合物。
分布和生存环境
Bacteroides uniformis是人体肠道,阴道中常见的细菌之一,也可以在其他动物的肠道中找到。它们在肠道中扮演重要的生态角色,参与食物消化、营养吸收和免疫调节等过程。Bacteroides uniformis能够适应肠道的微生态环境,与其他肠道细菌相互作用。
功能和代谢
Bacteroides uniformis在肠道中具有多种功能和代谢活性。它们参与葡萄糖和其他碳水化合物的代谢,并产生短链脂肪酸(如丙酸和乙酸),这些酸有益于肠道健康。此外,Bacteroides uniformis还参与胆固醇代谢、氨基酸代谢和维生素合成等生物化学过程。
肥胖和肥胖相关疾病构成了世界范围内的重大公共卫生问题。除了传统的减肥药物外,下一代益生菌(NGP)似乎非常有希望作为潜在的肥胖预防和治疗药物。
主要的候选NGP已在肥胖和肥胖相关疾病的临床前模型中显示出前景,例如:
B.uniformis已被证明具有对抗肥胖和代谢紊乱的有益特性。在动物模型中, B. uniformis与减肥、降低血清胆固醇和甘油三酯水平以及改善肝脂肪变性有关。此外,它还与血清瘦素水平降低、空腹血糖浓度降低和糖耐量改善有关。
推测的机制包括调节肠道菌群和改善肠道菌群失调、改善肠道屏障功能、减少慢性低度炎症和调节肠道肽分泌。
一项对41名体重指数(BMI)正常的个体肠道菌群和内脏脂肪面积 (VFA)的研究显示,内脏脂肪面积高/低(VFA)两组的肠道菌群存在显著差异,在 L-VFA 组中,B. plebeius 和B.uniformis含量很高。此外,B.uniformis与血清 LDL-胆固醇水平呈负相关。
另一项对32名肥胖成年人(14 名接受了腹腔镜袖状胃切除术 (LSG))和30名基线健康对照者的肠道菌群以及身体指标的研究,并在术后 6 个月进行了随访。通过磁共振成像测量腹部内脏脂肪面积(VFA)和皮下脂肪面积(SFA)。腰围、臀围、腰臀比(WHR)和体重指数(BMI)被列为简单的肥胖参数。通过宏基因组测序分析肠道微生物组。在与腹部内脏脂肪面积(VFA)负相关的物种中,Eubacteria eligens相关性最强,其次是Clostridium citroniae、C. symbiosum、Bacteroides Uniformis、E. ventriosum、C. hathewayi等。
一项涉及 45 名儿童(6 至 12 岁)的横断面研究调查了肠道微生物群与儿童肥胖之间的关系。发现两个BMI组之间的多样性存在差异。这种差异包括真杆菌属(Eubacterium)、普拉梭菌(Faecalibacterium prausnitzii)、Dialister、Monoglobus pectinilyticus、Bifidobacterium pseudocatenulatum、Intestinibacter bartlettii、 Bacteroides intestinalis、Bacteroides uniformis (单形拟杆菌)和 史密斯甲烷杆菌(Methanobrevibacter smithii)。
一项针对减肥手术是否显著改善体重的研究显示单形拟杆菌的丰度可能影响手术后的效果。
术前属于拟杆菌门和厚壁菌门的成员丰度存在差异无应答组:
富含拟杆菌科、拟杆菌属、单形拟杆菌、Alistipes Finegoldii、Alistipes alistipes、Dorea formicigenerans 、瘤胃球菌。
应答组:
富含消化链球菌科、 Gemmiger、Gemiger formicilis、Barnesiella、Prevotellaceae 、 Prevotella。
线性判别分析 >2;p < 0.05。与有反应组相比,无反应组中普氏菌与拟杆菌的比率显着较低 (p = 0.048)。
神经性厌食症(Anorexia nervosa, AN)的特点是一种神秘的食物回避模式,导致严重的营养不良,这种疾病在青春期早期发展。近期,在《Nature Microbiology》上发表的文章研究了77名患有神经性厌食症的成年女性和70名被认为是健康体重的对照组。
利用宏基因组学,作者对微生物组的细菌和病毒成分进行了深入分析。细菌基因组中的结构变异,特别是Bacteroides uniformis(单形拟杆菌)中的结构变异,可能造成了硫胺素生产的破坏。
硫胺素(或称维生素B1)缺乏会影响人体健康,包括记忆丧失、焦虑、抑郁、易怒、失眠、食欲减退和胃肠道不适。这也可以解释在神经性厌食症患者中普遍观察到的硫胺素缺乏的现象。
认知发展
一项针对健康以色列阿拉伯儿童的横断面研究显示一些菌群分类学差异与儿童智商测试FSIQ评分显着正相关,包括Prevotella(普雷沃氏菌属)、Dialister属、Sutterella(萨特氏菌属)、Ruminococcus callidus和Bacteroides uniformis(单形拟杆菌)。
情绪相关
一项针对长期封闭环境中心理变化和肠道菌群的研究,鉴定出四种潜在的“精神抗生素”(单形拟杆菌Bacteroides Uniformis、Roseburia inulinivorans、Faecalibacter prausnitzii、Eubacterectale )。
根据宏基因组、宏蛋白质组和代谢组学分析,四种潜在的精神抗生素主要通过与神经系统功能相关的三种途径改善情绪:
首先,通过发酵膳食纤维,它们可能产生短链脂肪酸,例如丁酸和丙酸;
其次,它们可能调节天冬氨酸、谷氨酸、色氨酸等氨基酸代谢途径(例如,将谷氨酸转化为γ-氨基丁酸;将色氨酸转化为血清素、犬尿酸或色胺);
第三,它们可能调节其他途径,例如牛磺酸和皮质醇代谢。此外,动物实验的结果证实了这些潜在的精神抗生素对情绪的积极调节作用和机制。
运动相关
肠道微生物群可能有助于改善运动表现。日本庆应义塾大学先进生命科学研究所通过分析25名男性长跑运动员的比赛成绩后发现,运动员粪便中单形拟杆菌(Bacteroides uniformis)的丰度与其3000米比赛成绩间存在相关性。
在随后的一项随机、双盲、安慰剂对照研究中,研究人员让健康男性志愿者服用α-环糊精,以增加肠道中的单形拟杆菌总量。结果表明,补充α-环糊精可以提高人体的耐力运动能力。
此外,在小鼠实验中,食用单形拟杆菌显著延长了动物游泳的持续时间;动物盲肠短链脂肪酸浓度以及肝脏中与糖异生相关酶的基因表达均上升,肝糖原含量降低。该研究表明,单形拟杆菌可能通过促进肝脏内源性葡萄糖生成,增强个体的耐力运动能力。
妊娠糖尿病
妊娠合并糖尿病包括孕前糖尿病(PGDM)和妊娠期糖尿病(GDM)。 一项针对234份孕妇粪便样本的16S rRNA测序数据显示,随着妊娠的进展,妊娠糖尿病PGDM 组的肠道细菌种类数量有所减少。巨单胞菌、拟杆菌和 Roseburia Enteris 在 PGDM 组中富集,而 Bacteroides vulgatus、Faecalibacter prausnitzii、Eubacterectale、Bacteroides uniformis(单形拟杆菌)、Eubacteria eligens、Subdolilegum在对照组中比例更高,这些菌血糖与血糖特征呈负相关。
二型糖尿病
一项针对亚洲人的包括36个不同二型糖尿病T2DM研究(健康,n = 3378;T2DM,n = 551)的meta分析显示,T2DM 组中普通杆菌菌、单形拟杆菌和普氏粪杆菌较低。
另一项包括29名T2DM患者和28名健康对照者研究显示,Megamonas funiformis 和 Escherichia 的丰度在T2DM患者的肠道中显着增加。相反,Bacteroides stercoris、单形拟杆菌和Phascolarctobacterium faecium的丰度降低。
单形拟杆菌 (Bacteroides uniformis) 还可能调节动物肠道稳态,减轻小鼠结肠炎。一项研究使用B.uninis JCM5828 及其代谢物对患有葡聚糖硫酸钠盐 (DSS) 诱导的结肠炎的雌性 C57BL/6J小鼠进行治疗。
Bacteroides uniformis治疗显著减轻了结肠炎的进展并恢复了机械和免疫屏障蛋白的表达。此外,Bacteroides uniformis还增加了共生菌双歧杆菌和阴道乳杆菌的丰度,同时减少了致病性埃希氏菌、志贺氏菌的丰度,并调节了肠道胆汁酸代谢。
Bacteroides uniformis在很大程度上调节结肠组织中NF-κB和丝裂原激活蛋白激酶(MAPK)信号通路关键调节蛋白的表达以及TH17细胞的分化。然而,Bacteroides uniformis在体外不能直接抑制TH17细胞分化;它应该是通过参与胆汁酸代谢和调节关键代谢物(α-鼠胆酸、猪去氧胆酸和异石胆酸)来调节固有层的过程,从而调节肠道免疫反应。
此外在一项溃疡性结肠炎(UC)患者的菌群研究中,六种拟杆菌属表现出显着较低的相对丰度,十二种拟杆菌属被发现与至少一项疾病活动指标显着相关。五个物种( Alistipes putredinis、Bacteroides stercoris、Bacteroides Uniformis、Bacteroides rodentium、Parabacteroides merdae )的相对丰度与溃疡性结肠炎活性的四个指标中的三个相关。
12 个关键物种表达了与 UC 发病机制相关的5 个基因(TARP、C10ORF54、ITGAE、TNFSF9和LCN2 )。作为潜在生物标志物的关键物种的丧失可能会加剧 UC 活动。
比较功能性腹胀和膨胀(FABD)患者和12健康个体粪便微生物群的多样性和组成,并评估小肠细菌过度生长 (SIBO) 。结果显示FABD 组的微生物多样性显着低于对照组。与健康对照相比,FABD 患者中变形菌的比例显着升高,放线菌的比例显着降低。与健康对照相比,FABD患者中粪杆菌的比例显着升高,而SIBO(+)FABD患者中普氏菌和粪杆菌的比例也显着升高。与健康对照相比,FABD 患者的普氏粪杆菌 (Faecalibacter prausnitzii) 的丰度显着增加,但单形拟杆菌 (Bacteroides uniformis)和青春双歧杆菌数量明显减少。
乳糜泻患者肠道中的 Bacteroides distasonis、Bacteroides fragilis / Bacteroides thetaiotaomicron、Bacteroides Uniformis、Bacteroides ovatus比对照组更少(p<0.05)。
骨质疏松
一项研究中,与对照组相比,几个物种的丰度发生了变化,在骨质疏松组中发现了特定的功能途径,骨质疏松组中下列菌群的水平下降:
类风湿性关节炎
一项研究包括 76 名类风湿关节炎患者的粪便宏基因组和血浆代谢组的分期概况。
骨关节炎
骨关节炎是一种病因不明的慢性退行性疾病。一项研究针对骨关节炎患者(n = 32)和正常对照组(n = 57)肠道菌群检测,宏基因组测序显示,骨关节炎患者中Bacteroides stercoris、Bacteroides vulgatus、Bacteroides uniformis在物种水平上的丰度显著降低,大肠杆菌、肺炎克雷伯菌、Shigella flexneri、唾液链球菌在骨关节炎中显著增加。
特应性皮炎AD
使用 16S rRNA 测序分析了 93 名志愿者的粪便样本,其中包括 44 名 AD 患者和 49 名健康对照受试者,年龄为 6-22 岁。
卟啉单胞菌科、Blautia、Parabacteroides、Bacteroides ovatus、Bacteroides uniformis 和 Prevotella stercorea 的相对丰度显著较高(P < 0. 05) AD 患者高于健康对照者。与 AD 患者相比,健康对照受试者中梭状芽胞杆菌和粪疟原虫含量较高 (P < 0.05)。
儿童多动症
对11项儿童多动症研究的meta分析显示,拟杆菌属与多动和冲动水平相关。在物种水平上,多动症儿童Faecalibacterium丰度较低,但Bacteroides uniformis、肠球菌、双歧杆菌和Odoribacter增加,可能导致中枢神经系统多巴胺相关功能受损。
此外,多动症儿童肠道中Faecalibacterium丰度的降低可能导致炎症细胞因子的渗透性和交叉性更高。
一项调查多动症儿童及其饮食模式和肠道菌群的研究显示,在注意缺多动障碍(ADHD)组中,粪肠拟杆菌(B. coprocola)的相对丰度降低,而单形拟杆菌(B.uniformis)、卵形拟杆菌(B.ovatus)和粪类杆菌(S. stercoricanis)的相对丰度升高。
结直肠癌转移组
转移性结直肠癌组和非转移性结直肠癌组患者的肠道菌群存在差异。在属水平上,拟杆菌属菌种脆弱拟杆菌和单形拟杆菌组成在转移组中显着高于非转移组。
PD-1免疫疗法反应
肠道微生物群被认为是调节免疫检查点抑制剂治疗功效的关键因素。一项波兰黑色素瘤患者队列中PD-1疗法反应与基线肠道微生物组的研究显示,普氏菌和单形拟杆菌的丰度与反应有关,而无反应者的肠道微生物群富含普氏粪杆菌和脱硫弧菌以及一些未分类的厚壁菌门。
慢性肾病
一项台湾地区人群肠道菌群研究显示,在慢性肾病 (CKD)患者中发现的最丰富的属是拟杆菌属,在物种水平上,血液透析患者中的B. ovatus、B. caccae 、 B.uniformis表现出显著丰度,而腹膜透析患者中的Blautia表现出较高的丰度。
白塞病
在活动性白塞病BD患者其单形拟杆菌丰度显著高于其匹配的健康对照和处于非活动状态的疾病患者 ( p = 0.038)。
单形拟杆菌可以消化多种膳食纤维,作为一种代谢膳食纤维产生乙酸的肠道菌已有大量研究表明日常膳食纤维摄入会影响单形拟杆菌的丰度。
一项横断面研究中检查了全谷物和精制谷物、纤维和麸质的习惯摄入是否与肠道微生物群相关。对779 名参与者137 项食物频率的调查问卷和肠道菌群的分析显示。最高全谷物摄入量四分位与较高丰度的普通拟杆菌、普氏粪杆菌、Blautiaproducta和Rikenellaceae以及较低丰度的单形拟杆菌有关。
一项对不同特异性(低-低聚果糖、低至中-2 型抗性淀粉、中-果胶和高-不溶性 β-1,3-葡聚糖特异性)纤维的微生物发酵研究显示,高特异性不溶性β-葡聚糖促进目标细菌大量增加,Anaerostipes sp. 平均从0.3%增加到16.5%,单形拟杆菌平均为 2.5% 至 17.9%,这与这些细菌所在的每个微生物群落中相关代谢物(分别为丁酸盐和丙酸盐)比例的增加有关。
水溶性醋酸纤维素 (WSCA) 是一种合成纤维来源,可以导致拟杆菌属成员的丰度增加,尤其是单形拟杆菌。在四种具有代表性的人类肠道拟杆菌属中,只有单形拟杆菌在WSCA上的纯培养物中生长并活跃地产生乙酸。
一项对健康志愿者进行了为期 4周的营养干预分析天然单宁提取物混合物对肠道微生物变化的研究显示。从前两周起就可以观察到微生物群的组成和功能的变化,测序显示以下菌相对丰度增加,例如:
利用同位素标记发,发现食用菊粉富集的前三种细菌为单形拟杆菌(Bacteroides uniformis)、产酸拟杆菌(Bacteroides acidifaciens)和狄氏副拟杆菌(Parabacteroides distasonis)。
一项研究评估富含黄酮类化合物的蔓越莓多酚(CP)和龙舌兰(AG)(一种高支链龙舌兰衍生的新果聚糖)对C57BL6雄性小鼠的心脏代谢反应、肠道微生物群组成、代谢内毒素血症和粘膜免疫调节的影响,该雄性小鼠喂食致肥胖高脂肪高糖(HFHS)饮食9周。AG,单独或与CP(CP+AG)联合,主要刺激聚糖降解细菌:
与未经治疗的小鼠相比,接受AG的肥胖小鼠中聚糖降解细菌的增加与丁酸水平的显著增加一致。
总的来说,研究发现高特异性不溶性β-葡聚糖、天然单宁提取物混合物、菊粉、蔓越莓多酚和龙舌兰能增加Bacteroides uniformis的丰度。
主要参考文献:
Vallianou NG, Kounatidis D, Tsilingiris D, Panagopoulos F, Christodoulatos GS, Evangelopoulos A, Karampela I, Dalamaga M. The Role of Next-Generation Probiotics in Obesity and Obesity-Associated Disorders: Current Knowledge and Future Perspectives. Int J Mol Sci. 2023 Apr 4;24(7):6755.
Nie X, Chen J, Ma X, Ni Y, Shen Y, Yu H, Panagiotou G, Bao Y. A metagenome-wide association study of gut microbiome and visceral fat accumulation. Comput Struct Biotechnol J. 2020 Sep 20;18:2596-2609.
Murga-Garrido SM, Ulloa-Pérez EJ, Díaz-Benítez CE, Orbe-Orihuela YC, Cornejo-Granados F, Ochoa-Leyva A, Sanchez-Flores A, Cruz M, Castañeda-Márquez AC, Plett-Torres T, Burguete García AI, Lagunas-Martínez A. Virulence Factors of the Gut Microbiome Are Associated with BMI and Metabolic Blood Parameters in Children with Obesity. Microbiol Spectr. 2023 Feb 14;11(2):e0338222.
Lapidot Y, Maya M, Reshef L, Cohen D, Ornoy A, Gophna U, Muhsen K. Relationships of the gut microbiome with cognitive development among healthy school-age children. Front Pediatr. 2023 May 19;11:1198792.
Cheng M, Zhao Y, Cui Y, Zhong C, Zha Y, Li S, Cao G, Li M, Zhang L, Ning K, Han J. Stage-specific roles of microbial dysbiosis and metabolic disorders in rheumatoid arthritis. Ann Rheum Dis. 2022 Aug 19;81(12):1669–77.
Shirvani-Rad S, Ejtahed HS, Ettehad Marvasti F, Taghavi M, Sharifi F, Arzaghi SM, Larijani B. The Role of Gut Microbiota-Brain Axis in Pathophysiology of ADHD: A Systematic Review. J Atten Disord. 2022 Nov;26(13):1698-1710.
Wang LJ, Yang CY, Chou WJ, Lee MJ, Chou MC, Kuo HC, Yeh YM, Lee SY, Huang LH, Li SC. Gut microbiota and dietary patterns in children with attention-deficit/hyperactivity disorder. Eur Child Adolesc Psychiatry. 2020 Mar;29(3):287-297.
Hao Z, Meng C, Li L, Feng S, Zhu Y, Yang J, Han L, Sun L, Lv W, Figeys D, Liu H. Positive mood-related gut microbiota in a long-term closed environment: a multiomics study based on the “Lunar Palace 365” experiment. Microbiome. 2023 Apr 24;11(1):88.
Ren Y, Hao L, Liu J, Wang P, Ding Q, Chen C, Song Y. Alterations in the Gut Microbiota in Pregnant Women with Pregestational Type 2 Diabetes Mellitus. mSystems. 2023 Apr 27;8(2):e0114622.
Wu X, Park S. Fecal Bacterial Community and Metagenome Function in Asians with Type 2 Diabetes, According to Enterotypes. Biomedicines. 2022 Nov 21;10(11):2998.
Lv M, Li L, Li W, Yang F, Hu Q, Xiong D. Mechanism research on the interaction regulation of Escherichia and IFN-γ for the occurrence of T2DM. Ann Palliat Med. 2021 Oct;10(10):10391-10400.
Yan Y, Lei Y, Qu Y, Fan Z, Zhang T, Xu Y, Du Q, Brugger D, Chen Y, Zhang K, Zhang E. Bacteroides uniformis-induced perturbations in colonic microbiota and bile acid levels inhibit TH17 differentiation and ameliorate colitis developments. NPJ Biofilms Microbiomes. 2023 Aug 14;9(1):56.
Nomura K, Ishikawa D, Okahara K, Ito S, Haga K, Takahashi M, Arakawa A, Shibuya T, Osada T, Kuwahara-Arai K, Kirikae T, Nagahara A. Bacteroidetes Species Are Correlated with Disease Activity in Ulcerative Colitis. J Clin Med. 2021 Apr 17;10(8):1749.
Noh CK, Lee KJ. Fecal Microbiota Alterations and Small Intestinal Bacterial Overgrowth in Functional Abdominal Bloating/Distention. J Neurogastroenterol Motil. 2020 Sep 30;26(4):539-549.
Wang H, Zhang K, Wu L, Qin Q, He Y. Prediction of Pathogenic Factors in Dysbiotic Gut Microbiomes of Colorectal Cancer Patients Using Reverse Microbiomics. Front Oncol. 2022 Apr 27;12:882874.
Ye S, Yan F, Wang H, Mo X, Liu J, Zhang Y, Li H, Chen D. Diversity analysis of gut microbiota between healthy controls and those with atopic dermatitis in a Chinese population. J Dermatol. 2021 Feb;48(2):158-167.
Zhou P, Dai Z, Xie Y, Li T, Xu Z, Huang Y, Sun D, Zhou Y. Differences in tissue-associated bacteria between metastatic and non-metastatic colorectal cancer. Front Microbiol. 2023 Jun 9;14:1133607.
Shivani S, Kao CY, Chattopadhyay A, Chen JW, Lai LC, Lin WH, Lu TP, Huang IH, Tsai MH, Teng CH, Wu JJ, Hsieh YH, Wang MC, Chuang EY. Uremic Toxin-Producing Bacteroides Species Prevail in the Gut Microbiota of Taiwanese CKD Patients: An Analysis Using the New Taiwan Microbiome Baseline. Front Cell Infect Microbiol. 2022 Apr 26;12:726256.
Kim JC, Park MJ, Park S, Lee ES. Alteration of the Fecal but Not Salivary Microbiome in Patients with Behçet’s Disease According to Disease Activity Shift. Microorganisms. 2021 Jul 6;9(7):1449.
Um CY, Peters BA, Choi HS, Oberstein P, Beggs DB, Usyk M, Wu F, Hayes RB, Gapstur SM, McCullough ML, Ahn J. Grain, Gluten, and Dietary Fiber Intake Influence Gut Microbial Diversity: Data from the Food and Microbiome Longitudinal Investigation. Cancer Res Commun. 2023 Jan 11;3(1):43-53.
Cantu-Jungles TM, Bulut N, Chambry E, Ruthes A, Iacomini M, Keshavarzian A, Johnson TA, Hamaker BR. Dietary Fiber Hierarchical Specificity: the Missing Link for Predictable and Strong Shifts in Gut Bacterial Communities. mBio. 2021 Jun 29;12(3):e0102821.
Molino S, Lerma-Aguilera A, Jiménez-Hernández N, Rufián Henares JÁ, Francino MP. Evaluation of the Effects of a Short Supplementation With Tannins on the Gut Microbiota of Healthy Subjects. Front Microbiol. 2022 Apr 27;13:848611.