-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

细菌耐药性
抗生素耐药性细菌感染的发生率正在上升,而新抗生素的开发由于种种原因在制药行业受重视程度下降。
最新在《柳叶刀-微生物》(The Lancet Microbe)上,科学家提出了基于细菌适应性、竞争和传播的生态原则的跨学科研究方法,可能开辟新途径来对抗抗生素耐药性感染。
许多兼性细菌病原体使用人类粘膜表面作为其主要储藏库,并在微生物组和宿主的某些病理状态下诱发传染病,以帮助其横向传播到新的宿主生物体。
有益的细菌共生体可以战胜特定的病原体,从而降低病原体传播和引起严重感染的能力。然而,尽管具有临床相关性,但对其自然栖息地中的共生-病原体相互作用的了解仍然很少。
本文将在人类微生物组和宿主生物学背景下讨论细菌病原体和共生体之间相互作用的研究最新内容,为预防和治疗传染病提供一些新视角。
The Gut Microbiome
对人类微生物组完整性作为健康需求的日益认可,正在极大地改变人们对细菌微生物组成员及其相互作用的评价,无论是微生物之间的互动还是与宿主的互动。这种理解的变化使得微生物生态学的原则成为了预防和治疗主要人类疾病的创新方法的核心。
从海量数据中分析推断出的微生物组特征正被考虑作为不同疾病诊断中的生物标志物,这些疾病包括各种类型的癌症,如结肠癌或乳腺癌,以及自身免疫性疾病,如类风湿性关节炎或银屑病。
粪便微生物移植在治疗艰难梭菌感染方面已被有效使用,而补充微生物组成员(例如AKK菌)或微生物组产品(例如短链脂肪酸),已显示出在改善代谢紊乱和癌症的健康结果方面的潜力。
然而,环境与人类相关的微生物生态系统之间存在根本性差异。许多环境微生物组代表了广阔、不受限制的生态系统,通常具有无限的生命周期,对微生物扩散几乎没有障碍。相比之下,与宿主相关的微生物组,如人类肠道中的微生物组,是受限的生态系统,具有较短的生命周期。
与宿主相关的微生物组需要特定的细菌机制来在个体和世代之间传播,并在其首选的生活条件之外暂时持续存在。
此外,宿主将微生物定殖者暴露于环境栖息地以外的压力源中,特别是通过其粘膜免疫系统。
Microbial Symbiosis and Pathogenicity
▸ 过去,对共生体和病原体的理解不全面
从历史上看,对与宿主相关的微生物生态系统的研究,曾局限于不同研究团队分别对中性或共生的细菌共生体和有害病原体进行的独立调查。因此,对这些不同组的与宿主相关细菌的当前理解高度不对称,且存在对病原体的强烈偏见,这阻碍了对人类微生物组生态的全面理解。
虽然这些细菌组在自然栖息地中有广泛的相互作用,但关于共生菌和病原体相互作用的实验研究却很少。例如,典型的病原体可以被发现几乎是人类微生物组的驯化成员,而共生菌则可以与病原体勾结,这会像多重微生物感染中那样。
▸ 共生菌和致病菌的区分较复杂
尽管在感染医学中,共生菌和致病菌之间的传统区分仍然是一个重要标准,但在生态学上下文中,这两组微生物固有的属性重叠使得这种区分变得不够充分。
有益的共生现象和对立的致病性代表了细菌行为范围的两个极端(下图),尽管很少有细菌微生物组成员表现出真正的致病行为。多细菌物种或菌株可以根据其环境背景和宿主生理状态动态改变其作为共生体或病原体的能力,这进一步使区别变得复杂。
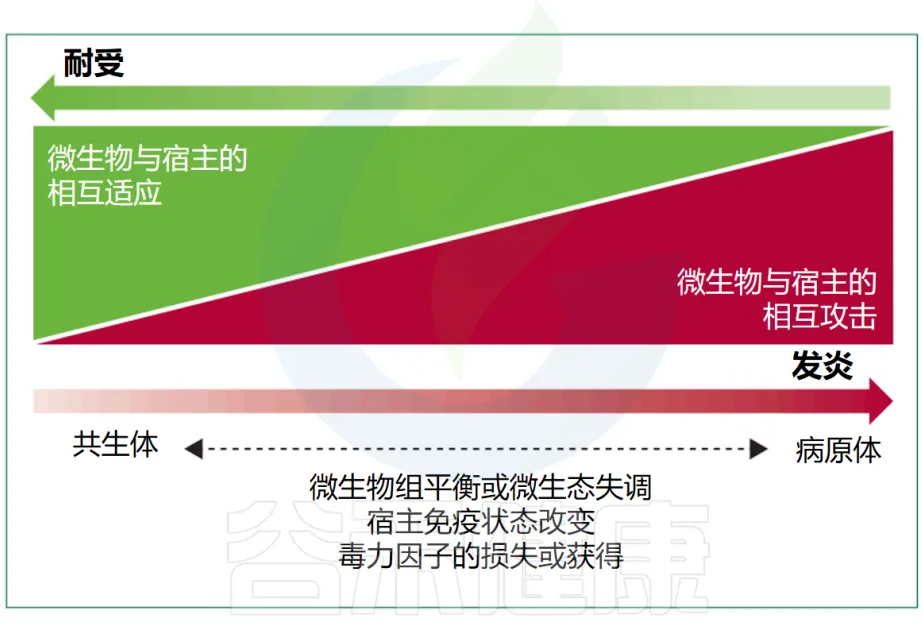
Maier L, et al. Lancet Microbe. 2024
例如,微生物组失调和宿主免疫缺陷,可以将肠球菌(Enterococcus faecium)从一个几乎无害的肠道微生物组成员转变为血流感染的原因。
单个水平基因转移事件可以改变共生生活方式和致病生活方式之间的平衡,例如,当预测的编码毒素成为肠出血性大肠杆菌或皮肤定植和口咽定植的白喉杆菌的主要毒力因子时。这意味着,原本可能是相对无害的微生物,在获得某些特定基因后,其生物学性质和行为可能发生显著变化,从而增加了其致病潜力。这种基因的转移和表达可以使这些微生物在宿主体内表现出更强的侵袭性和病原性,从而对宿主健康构成更大的威胁。
Redefining “Infection”
条件性细菌病原体之间的共生与致病性的动态变化,这挑战了当前对“感染”一词的使用,这种使用往往不一致。
《柳叶刀-微生物》全体作者建议仅将“感染”这个术语,保留用于由特定器官组织中出现的细菌菌株引起的病理状态。例如下列情况:
因此,在这篇个人观点文章中,我们也建议将常规引起感染的细菌称为病原体,而不常引起感染的细菌称为共生菌,尽管这些术语有其局限性,并不能适当描述所有类型的微生物与宿主之间的对抗关系。
目前病原体与共生菌之间的界限模糊,也挑战了科赫的假说,该假说提出了特定微生物与相应疾病之间的单一因果关系。然而,实际上,有些疾病是由多种细菌种类的间接效应引起的,当微生物群落失衡而不仅仅是这些种类的存在,导致了一种特定的病理状态,而这种状态目前并不被视为典型的感染。
Understanding of Bacterial Pathogens and Symbiotic Bacteria
微生物组科学,尤其测序技术的快速进展以及新技术的出现,为微生物学开启了一个新阶段,这一阶段的研究将细菌病原体和共生菌整合在一起,超越了简化的研究方法。
为了探究环境变化如何影响细菌微生物组成员的动态行为变化,来自不同背景的微生物学家应当合作,并结合系统生物学、天然产物化学、粘膜免疫学和临床传染病等互补学科的专业知识。这些新方法可能有助于回答一些最相关和明显的问题:
Future Research on Commensal Bacteria
由于其高度的临床相关性以及培养和操控相对容易,像S. flexneri(志贺氏菌)、S. aureus(金黄色葡萄球菌)和 S. pneumoniae(肺炎链球菌)这样的主要细菌病原体已经被研究了几十年,远超过典型的宿主相关共生菌。相比之下,主要的人类相关共生菌,例如来自属如拟杆菌属、梭菌属(Clostridium)、Cutibacterium,仅被少数实验室研究。
实际上,大多数人类微生物组成员仍然难以培养,并且在遗传上不易处理。在特定情况下可以成为偶发性病原体的一些共生菌,如医院获得性大肠杆菌、粪肠球菌(E.faecium)或表皮葡萄球菌(Staphylococcus epidermidis),已经在一定程度上被研究。但为什么这些特定的细菌比其他更无害的共生菌更频繁地引起侵袭性感染,这一点仍然不清楚(如下表)。


Maier L, et al. Lancet Microbe. 2024
The Important Role of Symbiotic Bacteria in Human Health
越来越多的证据表明,一些共生细菌对人类健康至关重要。
▸ Blautia producta 抑制粪肠球菌
例如,Blautia producta 的共生菌株通过产生特定的抗菌化合物,可以抑制并排除粪肠球菌(E.faecium),而Staphylococcus lugdunensis的共生菌则可以抑制并排除金黄色葡萄球菌。
▸ 枯草芽孢杆菌阻止金黄色葡萄球菌
肠道中的枯草芽孢杆菌(Bacillus subtilis)释放一种抑制性化合物,可以阻止金黄色葡萄球菌的定植能力,或抑制肠球菌(Enterococcus faecalis)的毒力因子表达。
一些共生菌还能产生对宿主有直接益处的化合物,例如促进肿瘤疗法的成功。病原体的研究可以帮助理解这些有益共生菌的生物学特性,并利用它们来对抗细菌感染。
共生菌的许多重要特性在不同菌株间可能会有所不同,这取决于例如获得或丢失移动遗传元素,如编码抗性或适应性特征的基因岛。用于病原体菌株特异性分类的现有方法,如序列分型方案,也可以应用于共生菌。这些方法可以帮助提升当前的诊断策略,达到个性化感染医学的新水平,不仅监测特定有害病原体的存在,还监测如那些保护免受潜在病原体定植的特定有益共生菌的缺失。
bacterial pathogens and symbiotes
▸ 共生菌的宿主特异性适应
与许多主要的细菌病原体一样,很多共生菌也特定于特定的宿主物种。这种适应过程导致宿主特异性,可能作为一种策略来增加细菌在与其他适应性较差的微生物竞争中的生存能力。这些基础机制对于病原体来说理解得很少,对于非致病性共生菌来说则基本上是不清楚的。
▸ 共生菌的粘附与持续定殖机制
特定宿主的持续定殖往往依赖于有效地粘附到上皮细胞的结合基序,如表面蛋白、蛋白多糖或糖脂。尽管在许多主要病原体中已经在一定程度上研究了相应的细菌粘附素,但现在才开始探索共生微生物中的这些机制。
▸ 共生菌与宿主免疫系统的相互作用
细菌在上皮表面的生存受到粘膜宿主防御机制的限制,这些机制包括IgA、抗菌肽和脂质以及活性氧和氮化合物的产生。先天和适应性免疫机制,通过感知与微生物相关的分子模式分子或通过粘膜白细胞检测微生物抗原来启动,有助于粘膜免疫过程,导致促炎或抗炎信号和效应分子的释放。
宿主的持续定殖依赖于细菌耐受抗菌免疫效应分子的能力或通过诱导免疫耐受来减少它们的表达。具有对抗菌宿主效应分子增强耐受性的细菌甚至可以诱导和利用抗菌宿主反应来消除更易感的竞争者。
根据宿主免疫反应,与微生物群其他成员的拮抗干扰已在表皮葡萄球菌和鼠伤寒沙门氏菌中得到记录。广泛的研究揭示了主要病原体的免疫逃避机制,但共生菌是否使用类似或不同的策略仍然未知。
▸ 共生菌免疫调节的复杂性及其潜在影响
例如,一些肠道共生菌通过产生非炎症性鞭毛蛋白来钝化先天免疫反应,这些蛋白抑制人类的Toll样受体5,或产生可以在粘膜表面诱导调节性T细胞的短链脂肪酸,以促进免疫耐受。然而,这些潜在的控制机制可能会被干扰,并可能在宿主无法启动耐受并以炎症反应的情况下导致疾病,例如当口腔共生菌异位定殖在肠道时。
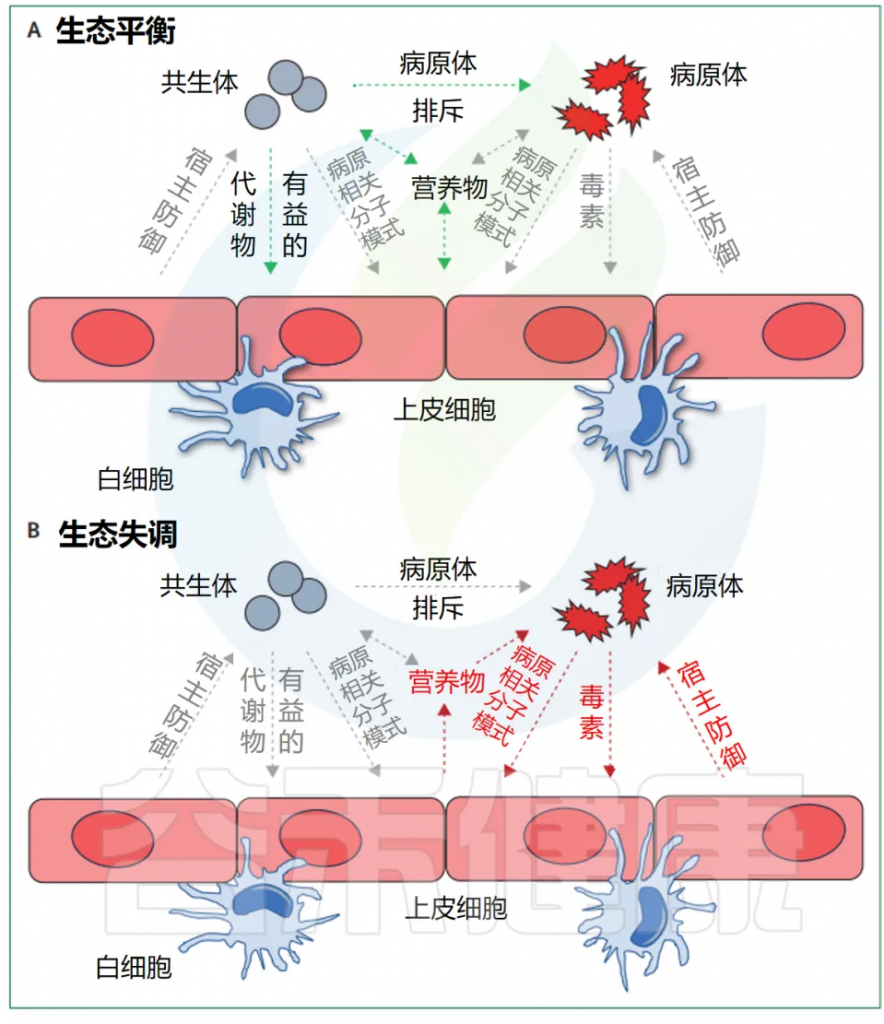
doi.org/10.1016/S2666-5247(24)00049-1
总的来说,宿主相关生态系统中的细菌间的相互作用很大程度上依赖于分泌的因子,这些因子可以通过专门的分泌系统以单独的可溶性分子的形式释放出来,或者作为膜囊泡的组成部分释放出来(上图)。
因此,细菌病原体的分泌毒力因子已经被广泛研究。相比之下,共生菌分泌的初级或次级代谢产物或蛋白质介质如何调节与病原体和宿主的相互作用的研究较少。这些研究显示,例如一些共生菌可以释放杀菌素等分子,消灭金黄色葡萄球菌等病原体,或产生营养物促进艰难梭菌等病原体的扩展,由此凸显了宿主相关微生物生态系统中的一个新的复杂层面。
Fitness mechanisms of facultative human pathogens
许多主要的人类细菌病原体不是专性病原体,而是作为常见微生物组成员定植于人类或动物体表面,但不会引起疾病(下表)。

doi.org/10.1016/S2666-5247(24)00049-1
事实上,在大多数兼性病原体的共生生活方式中,急性感染是罕见的。然而,研究主要集中在S.flexneri、金黄色葡萄球菌、肺炎链球菌等病原体的毒力机制上,而在共生行为期间引导这些生物体与其他微生物组成员竞争的适应性的机制仍然被忽视。
从微生物的角度来看,感染是否以及哪些类型确实对细菌有利,或者应该被视为偶然事件,而不利于它们在几代宿主中的长期进化成功,目前尚不清楚。
Importance of a Deep Understanding of Bacterial Infections
现在比以往任何时候都更需要深入理解细菌感染,因为全球抗菌药物抗性和细菌感染的负担日益增加。目前对细菌感染的了解主要限于少数模型病原体,如金黄色葡萄球菌和肺炎链球菌。相比之下,一些臭名昭著的抗生素抗性细菌种类,根据以下病原体种属的首字母被命名为ESKAPE病原体,包括粪肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、假单胞菌和肠杆菌,这些病原体的研究细节远不够充分。
▸ ESKAPE病原体的持久抗性与适应性进化
抗生素抗性机制在某些情况下可能会给细菌带来适应性的负担,即抗性可能会影响细菌的其他生存能力,但在没有抗生素的环境中,这种抗性通常会消失。然而,一些被称为ESKAPE病原体的细菌已经进化出了一种能力,使它们能够在医疗环境之外保持这种抗性特征。补偿性突变可以帮助这些细菌克服由于抗性而带来的适应性负担,从而促进抗性菌的成功和抗性的传播。
▸ 社区相关的抗性细菌扩散
这就是为什么社区相关的甲氧西林抗性金黄色葡萄球菌(MRSA)和万古霉素抗性屎肠球菌(VRE)等细菌,能够如此有效地在社区中扩散和扩张,甚至以牺牲它们对抗生素敏感的同类为代价,这一现象仍然是科学界未解之谜。这表明这些细菌可能已经发展出了一些未知的机制来维持和增强其抗性,即使在抗生素使用减少的环境中也是如此。这种现象需要进一步的研究来解明其背后的具体机制和因素。
The Relationship Between Bacterial and Ecological Success
生态学概念在普通微生物学和环境微生物学领域很常见,但尚未广泛应用于对病原菌的理解。
细菌在与其他微生物组成员的竞争中的成功依赖于多种机制,包括利用生长限制性营养物质的能力,从其他细菌那里获取促进生长的共同物质如聚合物水解酶或微量金属捕获剂,抵抗由微生物群体成员释放的抗菌分子,或者附着在少数上皮细胞附着点上。
一个细菌种类或菌株的长期生态成功来自于该种类在特定宿主体内的增殖和向新宿主体传播的综合效应。为了研究一个种类在特定宿主体内的增殖,应采用一系列研究策略,从共生菌的研究到对主要专业和偶发病原体的调查。
细菌有两种主要的传播方式:垂直传播和横向传播。
每个人体内都有大量细菌,它们组成了独特的微生物组。这些细菌有的倾向于垂直传播,有的倾向于横向传播,不同细菌的传播方式和速度是不一样的。
2022年的一项研究就发现,微生物组中的细菌在这两种传播方式的偏好上有所不同。我们已经对一些常见的致病细菌的横向传播有了较多了解,比如幽门螺杆菌、肺炎链球菌、金黄色葡萄球菌等。它们能在人群中快速传播,传播过程也被很好地监测和记录。但目前对这些细菌是如何在人体外存活,又是如何进入新的人体的,还不太清楚。
The association between the epidemic spread of pathogens
主要病原体的流行扩散很可能与它们引起的感染类型和严重程度有关(下图)。
▸ 感染类型
疾病特性对细菌传播的贡献在引起腹泻的病原体(如志贺氏菌)中最为明显,这类病原体通过污染的污水传播而获益。
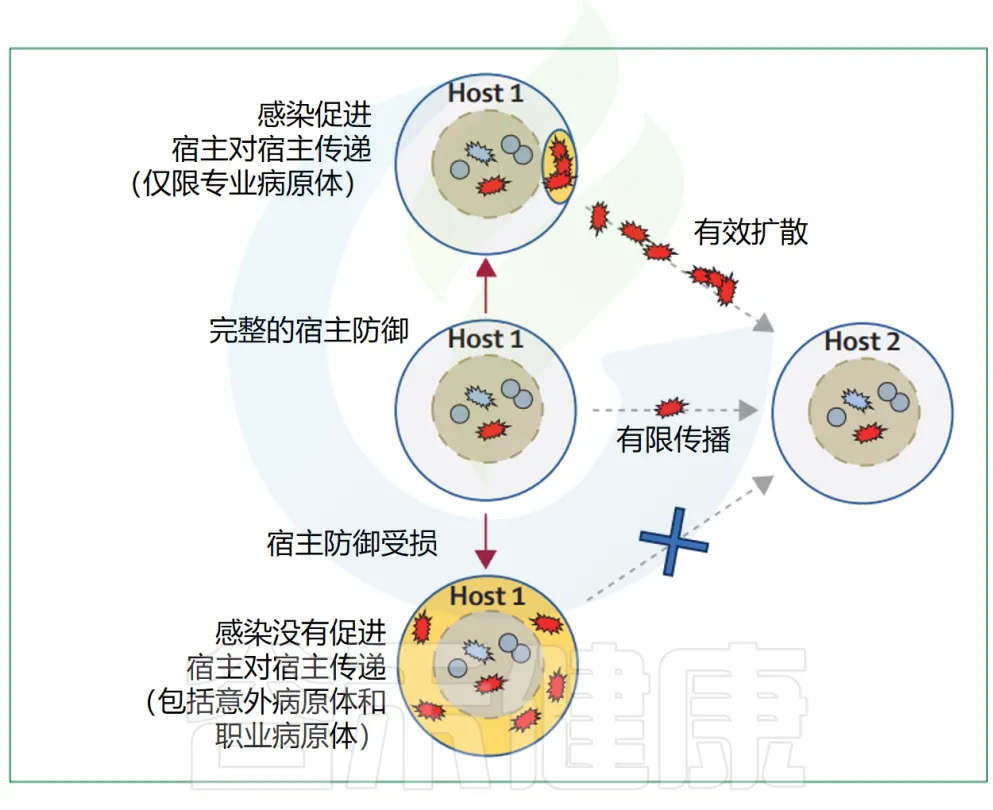
其他常见的感染表现可能也具有类似的作用。例如,金黄色葡萄球菌引起的典型感染——化脓性皮肤和伤口感染,会导致大量的S.aureus细胞在体表出现,从而支持通过皮肤接触的宿主间传播。
类似的机制也可以使尿生殖道病原体,如淋病奈瑟菌Neisseria gonorrhoeae在宿主间迅速传播。引起呼吸道感染的病原体,如百日咳博德特氏菌Bordetella pertussis、化脓性链球菌Streptococcus pyogenes或肺炎链球菌S pneumoniae则通过咳嗽或打喷嚏的个体释放的气溶胶传播。
▸ 严重程度
关于疾病的严重程度如何通过支持传播来增强病原体的适应性已有讨论,例如在SARS-CoV-2的背景下,但尚未对细菌病原体进行系统性评估。值得注意的是,大多数专业化的细菌病原体并非人类微生物组的核心成员,它们只是暂时性地定植在人类体内(见表1),这就需要它们具备有效的横向传播机制。
专业人类病原体(如志贺氏菌和淋病奈瑟菌N.gonorrhoeae)的持续定植在人群中较为罕见,或仅在人群的一小部分(如金黄色葡萄球菌)或特定年龄组(如化脓性链球菌或肺炎链球菌)中发现,这表明维持广泛的致病力涉及与其他微生物组成员竞争时的重大适应性负担。
诸如粪肠球菌(E.faecium)和表皮葡萄球菌( S.epidermidis )等偶然病原体表达的因子有助于其免疫逃避能力,但几乎不表达任何侵袭性毒素,这可能导致这些病原体在人类微生物组中比大多数专业病原体具有更高的患病率和持久性。
由于偶发性病原体主要在免疫力低下的个体中引起感染,它们也常被称为机会性病原体。然而,这一术语也经常用于诸如金黄色葡萄球菌和肺炎链球菌等专业病原体,这些病原体在免疫力低下的个体中引起的感染类型不同且更为严重(通常是血流感染),而在免疫力正常的个体中则不然。因此,专业病原体有时也可能引起偶发性感染,这种感染并不促进病原体的传播。偶发性人类感染也可以由适应于非人类宿主的病原体如军团菌(Legionella pneumophila)或霍乱弧菌引起,这些病原体只在特定的环境条件下感染人类。
The association between the epidemic spread of pathogens
在自然环境中同时研究共生菌和病原体,可以帮助我们更好地控制微生物,对抗感染以及其他与微生物组相关的疾病。
共生细菌对传染病的影响远比先前假设的要复杂得多。一些共生菌种采用主动防御策略,如释放抗菌肽或通过依赖接触的V型、VI型或VII型分泌系统消除其他细菌,这些系统在针对特定目标物种的特异性上可能有很大差异。此外,共生菌还可以使用更微妙的抑制策略来增加其在抗击病原体定植方面的生态成功,这基于代谢干扰。
共生细菌群落可以以依赖于群落多样性及其与病原体的代谢重叠的协作方式,阻止诸如克雷伯肺炎菌和鼠伤寒沙门氏菌等病原体获取营养物。
病原体的排除可能是由于共生菌释放的金属载体螯合必需的微量金属,或产生抑制性代谢产物而产生的。例如,一些肠道共生菌可以将原生胆酸转化为抑制肠道病原体艰难梭菌C difficile孢子生长的次生胆酸代谢产物。
Challenges in Fecal Microbiome Transplantation Treatment
粪便微生物组移植(FMT)是治疗艰难梭菌感染的一种有效策略。粪便微生物组移植成功至少部分是由于恢复了有益细菌群及其代谢产物,这些代谢产物能抑制艰难梭菌的生长。然而,粪便微生物组移植难以标准化,其对抗其他病原体的效果仍不明确。
目前,临床前和临床试验正在评估使用基于共生菌的生命治疗产品来预防处于风险中的个体被抗生素耐药病原体定植。然而,那些防止病原体定植的共生菌往往比目标病原体更易受抗生素影响,这可能会消除共生菌的有益效果,并在抗生素治疗期间加剧与菌群失调相关的疾病。
因此,研究人员需要平衡使用共生菌治疗产品的风险和好处。深入了解不同共生菌菌株对抗生素的敏感性,以及这些菌株如何与目标病原体相互作用。只有通过深入的研究和严格的监测,才能确保共生菌的治疗潜力得到充分发挥,同时避免不良后果的发生。
系统评估关键共生菌群的抗生素敏感性,并将这些知识纳入个性化的、基于微生物组的抗生素管理方案中,对于最小化广谱抗生素对微生物组的附带伤害至关重要。
除了我们通常使用的抗生素之外,许多针对人类的其他药物也可能意外地影响到人体肠道中的有益细菌。这种药物的副作用在未来的医疗实践中需要被特别注意,特别是对于那些需要同时使用多种药物治疗多种疾病的患者。此外,人体内的微生物群体本身可能是一种新型抗菌剂的重要来源。通过系统地研究和描述这些微生物产生的创新化合物,我们可能会发现新的药物,这些药物有望用于预防或消除病原体在人体内的定植。
Antibiotic Resistance Issues in Treatment
在现代医疗中,我们常用的广谱抗生素不仅攻击病原体(引起病症的微生物),还会影响到人体内的有益共生细菌。这种广泛的攻击会导致细菌之间的抗药性基因传递,特别是通过一些可以在不同细菌间转移的元素,如质粒和噬菌体。这种基因的传递可能导致抗生素更难以消灭病原体。
由于这种抗药性基因的传递,需要更好地监控不仅是病原体的抗药性发展,也要监控那些可能是抗药性传播者的共生菌。这样可以更有效地控制病原体的传播和抗药性的发展。
此外,通过理解这些微生物之间的生态关系,可以更好地发现病原体的弱点,从而开发出新的治疗方法。
这些方法不仅限于传统的抗生素,还包括能够利用有益共生菌或宿主防御机制的新型药物。这些新药物的开发需要在模拟真实生态环境的实验模型中进行,比如使用人类挑战模型,这种模型允许我们在受控的环境中测试病原体和治疗方法。
总之,通过更好地理解微生物之间的相互作用和生态平衡,可以开发出更有效的策略来对抗病原体,同时减少对有益共生菌的损害。这种方法有助于限制病原体的传播和疾病的爆发。
主要参考文献:
Maier L, Stein-Thoeringer C, Ley RE, Brötz-Oesterhelt H, Link H, Ziemert N, Wagner S, Peschel A. Integrating research on bacterial pathogens and commensals to fight infections-an ecological perspective. Lancet Microbe. 2024 Apr 9:S2666-5247(24)00049-1. doi: 10.1016/S2666-5247(24)00049-1. Epub ahead of print. PMID: 38608681.

谷禾健康

芽孢杆菌属(Bacillus)是革兰氏阳性、杆状、芽孢杆菌科细菌的一个属,属于厚壁菌门。
芽孢杆菌属物种可以是专性需氧微生物(依赖氧气)或兼性厌氧微生物(具有需氧或厌氧的能力)。当使用或存在氧气时,它们的过氧化氢酶检测呈阳性。
▸ 芽孢杆菌分布广泛
芽孢杆菌在自然界中无处不在,包括自由生活(非寄生)和寄生致病菌种。在压力环境条件下,细菌可以产生椭圆形内生孢子,这不是真正的“孢子”,但细菌可以将自身缩小到内生孢子,并在很长一段时间内保持休眠状态,正是由于这些特征最初定义了该属。
芽孢杆菌属主要栖息地是土壤,但它广泛分布在环境中。这些生物通常存在于腐烂的有机物、灰尘、蔬菜、水中,农作物、食物以及有些物种是人体正常菌群的一部分。它们形成的孢子对热、冷和普通消毒剂具有抵抗力,使它们经常从院内污染物中分离出来。
▸ 小部分芽孢杆菌可能是机会性病原体
芽孢杆菌属大多没有致病潜力,并且很少与人类或其他动物的疾病相关;但是也有几个例外,炭疽杆菌是炭疽病的病原体;蜡状芽孢杆菌,通常会引起食源性中毒,也会引起局部和全身感染,是人类和牲畜的病原体,特别影响免疫抑制个体、新生儿和术后患者。此外,偶尔也从食物相关疾病病例中分离出地衣芽孢杆菌、枯草芽孢杆菌和短小芽孢杆菌。幼虫芽孢杆菌、慢孢芽孢杆菌、蒺藜芽孢杆菌、球形芽孢杆菌和苏云金芽孢杆菌是特定昆虫类群的病原体。
芽孢杆菌引起的感染临床谱包括自限性食物中毒、与外伤有关的局部感染(如眼部感染)、深部软组织感染和全身感染(如脑膜炎、心内膜炎、骨髓炎和菌血症)。暴发性眼部感染被广泛认为是非炭疽芽孢杆菌感染的并发症,最常见的是蜡状芽孢杆菌。
目前芽孢杆菌属尚未被认为是主要的人类病原体,随着医疗技术的最新进步和免疫抑制患者数量的增加,它们越来越多地被认为是住院患者中的机会病原体。大多数临床实验室无法鉴定芽孢杆菌属。
▸ 一些芽孢杆菌可作为益生菌
但是,一些芽孢杆菌属物种可用作益生菌,包括凝结芽孢杆菌和枯草芽孢杆菌。研究结果显示摄入这种细菌的可以缓解肠易激综合症的症状,还可以缓解类风湿性关节炎和胀气的症状以及肠道炎症和泌尿生殖感染以及停止腹泻等。
芽孢杆菌属的益生菌比较特殊,因为它们多一个厚厚的“保护衣”——芽孢,跟直接裸露的孢子相比,被保护得好好的芽孢存活率更高。凝结芽孢杆菌有很强的耐受性,耐高温,耐胃酸和耐胆盐,因此可以顺利通过肠道,达到他们的目的地,起到很好的益生效果,这也是芽孢杆菌益生菌的不同之处,因此也被称为“菌中之王”。此外,芽孢杆菌属还参与肠道微生物组的各个方面,例如色氨酸代谢、维持肠道屏障完整性和影响宿主免疫反应,而它们的丰度可能受到雌激素缺乏和宿主遗传学等因素的影响。
芽孢杆菌的孢子经常被动物和人类无意中通过食物和饮料以及一些发酵食品摄入。但是注意该属细菌的许多作用不仅取决于物种,还取决于菌株,但该属细菌的一个重要共性是它们可以刺激免疫系统,这可能是好是坏,取决于具体肠道整齐情况。
已知芽孢杆菌属能够从环境中的其他细菌获取质粒。这些质粒可能是无害的,也可能包含抗生素耐药性或毒素产生的信息。此外,某些用作益生菌的芽孢杆菌具有抗生素耐药性,因此如果正在服用它们,需要谨慎。
此外,芽孢杆菌的孢子穿过胃形成营养细胞,一旦环境条件不利,营养细胞就会重新形成孢子从肠道转移肠外,在许多情况下,人体的免疫系统会消灭它们,但可能会发生感染。
该属的成员具有重要的微生物用途。许多酶、抗生素和其他代谢物具有医疗、农业、制药和其他工业应用。由芽孢杆菌属形成的抗生素的例子,包括地衣芽孢杆菌或枯草芽孢杆菌产生的杆菌肽、多粘芽孢杆菌产生的多粘菌素以及短芽孢杆菌产生的短杆菌肽。某些芽孢杆菌菌株已被用作抗生素和其他测定中的生物对照。
本文将从属层面介绍芽孢杆菌,包括其历史,分类,代谢属性以及代表性的益生菌种和致病菌种。
1 历史
对芽孢杆菌属的兴趣可以追溯到19世纪,因为通过对枯草芽孢杆菌及其孢子的观察,费迪南德·科恩 (Ferdinand Cohn, 1876)最终能够质疑自然发生理论;以及罗伯特·科赫(Robert Koch, 1876)对炭疽芽孢杆菌的发现标志着临床细菌学的起源。
罗伯特·科赫发现了炭疽杆菌的显微照片。死于炭疽病的动物血液中始终存在这种细菌,为炭疽杆菌(炭疽芽胞杆菌),首次证明特定细菌是特定疾病的病因。
芽孢杆菌(Bacillus),意思是“棍子”,是一类杆状革兰氏阳性细菌,属于厚壁菌门,已鉴定出超过270个菌种,细菌类的复数名称是Bacilli。
• 形态
它们呈棒状,直或稍弯曲,可以单独或成对出现,有时也成串出现。通常具有圆形末端,尽管一些细胞被描述为方形(例如蜡样芽孢杆菌)。由于周鞭毛的存在,它们中的绝大多数是可移动的,也就是说,它们向各个方向伸出。然而,炭疽杆菌缺乏鞭毛。
细胞的直径为0.4至1.8微米,长度为0.9至10.0微米。每个物种和每个菌株内的细胞尺寸通常几乎没有变化。
当通过相差显微镜观察时,培养物似乎由单个细胞和成对的分裂细胞组成。在其他情况下,子细胞可能仍然相互附着,因此可以看到细胞链。
• 可产生芽孢
长期以来,在有氧存在的情况下产生抗性内生孢子一直是其定义特征。
该属的成员可能是需氧的或兼性厌氧的,并且它们也有望具有革兰氏阳性细胞壁结构(尽管它们的染色反应,也可能是革兰氏可变的或坦率地说是革兰氏阴性的)。
细胞壁由多层肽聚糖组成,肽聚糖之间交联,形成坚固的支架,维持细胞形状,并含有磷壁酸和脂磷壁酸。
大约75年来,这些特征一直是该属定义的一部分,但自1995年以来,已提出了三种严格厌氧芽孢杆菌。这种对定义的破坏是因为16S rRNA基因序列分析允许识别属边界,而属之前是通过表型来定义的,作为共享关键(即诊断)特征的物种的实用集合。此外,在单一可用的盐芽孢杆菌菌株中仅观察到球状细胞,因此芽孢杆菌不再仅仅是杆状细胞属。
• 具有良好的适应能力
该属的许多物种表现出广泛的生理能力,使它们能够生活在各种自然环境中。每个细胞仅形成一个内生孢子,孢子耐热、耐寒、耐辐射、耐干燥和耐消毒剂。
孢子形态是一种分类学特征,尽管特定菌株内可能存在一些变异。最常见的孢子形状为椭圆形或卵形,但形状范围从圆柱形到椭圆形、球形或不规则形状。
炭疽杆菌需要氧气才能形成孢子;这一限制对流行病学和控制具有重要影响。在体内,炭疽芽孢杆菌产生一种多肽(聚谷氨酸)胶囊,可保护其免受吞噬。
内生孢子对热、辐射、消毒剂和干燥的抵抗力以及特定孢子的粘附特性促进它们附着在加工设备上并抵抗清洁导致这些生物体成为临床环境、生物技术过程和食品生产中的污染物。香料、奶粉和谷物产品等干燥食品通常受到孢子的严重污染,在食品制备过程中如果有水,这些孢子可能会发芽,导致腐败或食物中毒。
• 流行病学
虽然芽孢杆菌的主要栖息地是土壤,但它广泛分布在环境中。这些生物通常存在于腐烂的有机物、灰尘、蔬菜、水中,有些物种是正常菌群的一部分。
健康无症状个体粪便中蜡状芽孢杆菌的携带率在0-43%之间。在医院环境中,疫情和流行病可追溯到受污染的呼吸机设备、含酒精的消毒湿巾、消毒剂和透析设备。
食源性疫情中蜡样芽胞杆菌的来源包括大米、肉饼、面包、肉类和植物等。
尽管芽孢杆菌分布广泛,但它们很少与实际感染有关,更常见的是作为培养物的污染物被分离出来。仔细的临床评估对于确定芽孢杆菌分离的意义非常重要。
原料乳容易受到污染
据报道,芽孢杆菌属在原料乳中污染最严重。农场中的饲料、土壤和粪便等易受芽孢杆菌污染,牛舍周围也广泛存在芽孢杆菌,这些菌易污染奶牛乳头表面,使芽孢杆菌污染原料乳。当原料奶中有较多的芽孢时,加工后贮存过程中芽孢转化为营养体,随着贮存期的延长会出现酸包、胀包现象。
• 临床感染
芽孢杆菌引起的感染临床谱包括自限性食物中毒、与外伤有关的局部感染(如眼部感染)、深部软组织感染和全身感染(如脑膜炎、心内膜炎、骨髓炎和菌血症)。
暴发性眼部感染被广泛认为是非炭疽芽孢杆菌感染的并发症,最常见的是蜡状芽孢杆菌 。
与严重感染有关的各种物种包括蜡状芽孢杆菌、枯草芽孢杆菌、球形芽孢杆菌、蜂房芽孢杆菌、侧孢芽孢杆菌、地衣芽孢杆菌、巨大芽孢杆菌和短小芽孢杆菌 。
• 实验室诊断
芽孢杆菌属物种分类的早期尝试基于两个特征:需氧生长和内生孢子形成。这导致许多具有不同生理机能并占据不同栖息地的细菌聚集在一起。因此,生理学、生态学和遗传学的异质性使得芽孢杆菌属鉴定变得困难。
大多数临床实验室无法鉴定芽孢杆菌属。许多芽孢杆菌属物种很容易在营养琼脂或蛋白胨培养基上生长。有时葡萄糖也可以促进生长,但血液或血清则不能。最适生长温度为25°C至37°C。在营养状态下,55°C的湿热可在1小时内杀死芽孢杆菌。
注:枯草芽孢杆菌的孢子可以承受煮沸数小时。
传统上,对未知芽孢杆菌菌株的可靠诊断采用多相方法,其中包括基本表征、16S rRNA的部分序列分析、宏基因组等分析以及区分个体表型测试。
早在1981年,就有人指出,根据rRNA序列,芽孢杆菌属的遗传多样性与肠杆菌科和弧菌科的联合科一样高。根据rRNA 序列,(1993)区分了六个不同的群体。今天,只有rRNA 第1组的代表,其中包含B.subtilis、B.pumilus、B.licheniformis、B.simplex、B.megaterium、B. cereus、B.smithii、B.firmus、B.coagulans等物种,以及B.alcalophilus仍被归入芽孢杆菌属,而其他类群的代表现在被归入其他几个属。
该系统图基于16S rRNA序列包含273个芽孢杆菌属物种,并在命名法中具有最新地位。
(http://www.bacterio.net/bacillus.html)
尽管系统图反映了不同物种之间的分类学差异,但在许多情况下它对于不同物种的分类学分辨率还远远不能令人满意且不足。通常,不同物种之间的 16S rRNA相似性超过物种谱系的97%,人们普遍认为,超过97%的序列相似性支持归入一个物种。然而,随着全基因组DNA序列的可用性不断增加,分类学越来越依赖于核心基因组序列。
芽孢杆菌属和梭菌属构成芽孢杆菌科。革兰氏阳性需氧杆菌以越来越多的不同属和科为代表。伯杰手册的最新版本列出了属于芽孢杆菌科的19个不同属,例如芽孢杆菌属、碱杆菌属、盐杆菌属、慢杆菌属、海洋杆菌属和维吉杆菌属。许多物种最初被描述为芽孢杆菌属的成员,现在被重新分类为不同属和科的代表。
随着16S rRNA基因序列数据的积累,芽孢杆菌属已被划分。芽孢杆菌有160多个物种,获得的新物种数量比它因新属而失去的数量还要多。此外,还描述了42个含有需氧内生孢子形成物种的属,这些物种最初不属于芽孢杆菌属。
对细菌多样性认识的爆炸性增长和细菌类群数量的巨大扩张(不限于需氧内生孢子形成菌)是由来自新的、通常是外来环境的菌株的发现推动的。许多新物种的描述主要是基于16S rRNA 基因序列相似性和DNA-DNA相关性;它们的表型描述可能很简短——通常仅限于对单个分离株的观察,因此用于区分其中一些的常规表型特征的数量可能很少且几乎没有实用价值。
自1990年以来提出的一百三十或更多芽孢杆菌属物种中的许多都是基于对单一分离株的研究。其他几个物种的描述仅基于两个品系,因此该属中近40%的物种(以及自1990年以来出版的物种中约50%)的代表性较差,而且我们对它们内部的信息很少或根本没有——物种变异。
缺乏对物种品系间变异的了解几乎总是会导致识别困难,进一步的分离通常会导致描述的修正,并且经常导致分类学和命名法的变化。然而,由于许多新生物体是从外源或极端环境中分离出来的,不必太担心这种分类学的扩展;对于与其利益相关的物种来说,这并不代表分类学的剧变。
芽孢杆菌属仍然是最大的属,并且继续包含大多数最著名的名称,例如枯草芽孢杆菌(模式种)、蜡状芽孢杆菌、地衣芽孢杆菌、短小芽孢杆菌和苏云金芽孢杆菌;很少有其他熟悉的名称(其中一些具有潜在的临床意义)被转移到较新的属中。
例如短芽孢杆菌、球形赖氨酸芽孢杆菌、多粘类芽孢杆菌和浸软芽孢杆菌,并且在此基础上提出了几种新的芽孢杆菌和类芽孢杆菌物种临床来源中未知意义的单一分离株。
Logan NA. J Appl Microbiol. 2012
芽孢杆菌属已知的物种分类,详见附录一。
它们的共同特征包括降解大多数植物和动物来源的底物,例如纤维素、淀粉、果胶、蛋白质、琼脂、碳氢化合物等;此外还有抗生素生产;硝化作用;反硝化作用;固氮作用;自养;嗜酸;嗜碱性;嗜冷;嗜热和寄生等。
• 产生多种细胞外产物
不同种类的芽孢杆菌产生多种细胞外产物,包括少数种类的抗菌物质、酶、色素和毒素。
培养物中存在的酶包括淀粉酶、胶原酶、卵磷脂酶、磷脂酶、蛋白酶和脲酶。
蜡状芽孢杆菌在指数生长过程中会产生两种不同类型的肠毒素:引起腹泻的肠毒素和催吐毒素。
最近对蜡状芽孢杆菌毒力因子的研究表明,溶血素、一种三重皮肤坏死渗透因子和体内粗外毒素制剂在接种后4小时内引起生物体眼内炎。
蜡状芽孢杆菌可能具有与卵磷脂酶样活性相关的三种不同形式的酶活性;磷脂酰胆碱水解酶是研究最多的形式,通常称为磷脂酶C。这种酶可能通过破坏因其他毒素的作用而暴露的宿主细胞膜磷脂,从而在眼部感染中发挥次要作用。
根据KEGG,芽孢杆菌属代谢通路详见附录二。
• 体外和体内敏感性
治疗严重芽孢杆菌感染时,需要根据体外药敏情况选择抗生素。最近有关于芽孢杆菌属体外敏感性的研究已被报道 。
最常见的具有临床意义的分离株是蜡状芽孢杆菌(Bacillus cereus)。其他分离的菌株包括巨大芽孢杆菌、多粘芽孢杆菌、短小芽孢杆菌、枯草芽孢杆菌、环状芽孢杆菌、解淀粉芽孢杆菌和地衣芽孢杆菌。
使用微量稀释药敏法,所有蜡状芽孢杆菌菌株对亚胺培南、万古霉素、氯霉素、庆大霉素和环丙沙星敏感。大多数菌株对克林霉素、头孢唑啉和头孢噻肟耐药。
纸片扩散敏感性显示, 蜡样芽孢杆菌菌株对所有青霉素、苯唑西林和头孢菌素(美洛西林除外)具有耐药性。而许多非蜡状芽孢杆菌菌株对青霉素、头孢菌素和甲氧苄氨嘧啶-磺胺甲恶唑敏感。
许多菌株对红霉素和四环素敏感。超过95%的非蜡状芽孢杆菌菌株对亚胺培南、万古霉素、达托霉素和环丙沙星敏感。
75%至90%的菌株对青霉素、苯唑西林、头孢唑啉、头孢噻肟和氯霉素敏感。环状芽孢杆菌和多粘芽孢杆菌比其他非蜡状芽孢杆菌更有可能对青霉素、苯唑西林、头孢唑林和头孢噻肟产生耐药性。
体外协同研究显示,克林霉素-庆大霉素组合比万古霉素-庆大霉素组合拥有更高的杀菌协同率(60%vs40%)。这种杀菌作用可能在临床上很重要,例如眼内炎,其中宿主对感染的免疫反应导致终末器官损伤,以及免疫功能低下的宿主已被证明处于发生蜡样芽孢杆菌感染的风险中。
体内研究仅限于动物模型中的眼部感染。在由蜡状芽孢杆菌引起的外伤后眼内炎实验模型中, 玻璃体内注射100ug环丙沙星,在外伤和接种后1小时和6小时给药可预防疾病的发展。
在实验性外伤后蜡状芽孢杆菌眼内炎猪模型中,比较了环丙沙星、万古霉素和亚胺培南的玻璃体内注射效果。万古霉素和亚胺培南治疗的动物比对照动物有更少的炎症和组织破坏。而环丙沙星治疗的动物表现出明显更多的眼内破坏,并且与对照组没有区别。
• 抗菌疗法
芽孢杆菌的分离需要仔细的临床评估以确定发现的意义。某些危险因素与显著的芽孢杆菌感染有关,包括静脉内药物滥用、恶性肿瘤引起的镰状细胞病、中性粒细胞减少症和皮质类固醇治疗以及外来装置,包括留置血管内导管、中枢神经系统分流器、乳房植入物和起搏器。
首选药物为万古霉素或克林霉素
根据体外数据,治疗芽孢杆菌引起的严重感染的首选药物是万古霉素 ,因为蜡样芽孢杆菌是最常见的分离株。而根据临床数据,万古霉素和克林霉素均已成功使用。
单一疗法是否足够或联合疗法是否更好尚未在体外模型或临床试验中得到解决。其他高活性且可能具有杀菌作用的药物包括伊米培南、环丙沙星和庆大霉素。四环素、氯霉素、克林霉素和红霉素也对芽孢杆菌有活性。
大多数芽孢杆菌对头孢菌素具有耐药性
大多数芽孢杆菌菌株对广谱头孢菌素和替卡西林-克拉维酸具有耐药性。在进行药敏试验之前,应避免对血培养结果为革兰氏阳性需氧芽孢杆菌的免疫功能低下患者进行经验性覆盖后一种药物。
由芽孢杆菌引起的严重感染,包括眼部感染、心内膜炎、菌血症和败血症、肺炎、脑膜炎、肌肉骨骼感染等,通常需要全身抗生素治疗。
蜡状芽孢杆菌引起的食物中毒是一种自限性疾病,无需抗菌治疗。治疗通常是对症治疗,对于严重脱水的患者可能需要补充体液。
枯草芽孢杆菌是一种普遍存在的革兰氏阳性细菌,存在于水、土壤、空气、植物残渣以及山羊、绵羊和牛等反刍动物的胃肠道中,也存在于人类胃肠道中。
该名称于1872年由费迪南德·科恩(Ferdinand Cohn)命名,他还展示了枯草芽孢杆菌形成耐热孢子的能力。
枯草芽孢杆菌是一种友好且有益的细菌,因为它不具有引起疾病的特征。
尽管在20世纪50年代(抗生素出现的时期)之后,这种好细菌失去了人们的青睐——在人们开始使用抗生素之前,不同培养物的枯草芽孢杆菌在全世界都很流行。当时,人们使用这种友好的细菌作为免疫刺激剂来帮助治疗泌尿道和胃肠道疾病。
枯草芽孢杆菌也被广泛用作农场动物和家禽业中抗生素的替代品。它还用于食品比如日本纳豆和韩国清国酱的生产。
✦ 枯草芽孢杆菌的特点
由于枯草芽孢杆菌产生内生孢子(一种在某些细菌细胞内发育的抗性无性孢子),因此这种细菌可以在环境的极端高温和干燥条件下生存。
例如,如果其孢子被灰尘覆盖以保护其免受太阳紫外线的伤害,它可以在太空中存活长达六年。枯草芽孢杆菌还产生一系列蛋白酶和其他酶,这使其能够降解多种天然基质并促进养分循环。
低GC革兰氏阳性菌(低G+C革兰氏阳性菌DNA中鸟嘌呤和胞嘧啶核苷酸含量低于50%,而高G+C革兰氏阳性菌DNA中鸟嘌呤和胞嘧啶核苷酸含量超过50%)。
低GC革兰氏阳性菌中特征最明显的:
-棒状
-形成耐热、休眠的孢子
-具有单个环状基因组(染色体)
-有细胞质膜和厚的细胞壁,但没有外膜
-枯草芽孢杆菌的基因组测序包含4214630个碱基对
枯草芽孢杆菌基因组很容易进行遗传操作,生产各种重要的商业产品,特别是蛋白酶和淀粉酶。由于其商业重要性和易于基因操作,已被深入研究。
枯草芽孢杆菌是一种益生菌,通过平衡肠道微生物群,可能具有许多健康益处。在此,我们为您带来基于科学的枯草芽孢杆菌的一些健康益处清单。
• 枯草芽孢杆菌对减肥有益
动物研究表明,枯草芽孢杆菌(枯草芽孢杆菌 B10 菌株)可以通过减少氧化应激以及改善脂质代谢来减少肥胖小鼠的体重增加。
• 枯草芽孢杆菌具有抗氧化特性
枯草芽孢杆菌(菌株 B. subtilis BMB 44)已被证明具有高抗氧化和DNA保护活性。抗氧化剂对于保护细胞免受自由基及其有害作用至关重要。
• 枯草芽孢杆菌对胃肠道很有价值,因为它可以积极调节肠道微生物群
益生菌,例如不同种类的乳酸菌和双歧杆菌,对健康有许多益处。它们甚至可能对您的心理健康产生积极影响并减轻抑郁症状。
然而,有时肠道内的平衡会发生变化,有害细菌开始占主导地位,从而引发胃肠道问题、菌群失调,进而引发其他严重疾病。
幸运的是,枯草芽孢杆菌可以有益地改变肠道微生物群,因为它可以促进乳杆菌和双歧杆菌的生长,并减少大肠杆菌。
• 枯草芽孢杆菌有助于减少胆固醇
研究结果表明,通过改变肠道微生物群的组成(枯草芽孢杆菌R-179 和屎肠球菌R-026 的组合菌株)可以通过降低胆固醇水平来改善宿主健康。
• 枯草芽孢杆菌可能对糖尿病有帮助
一项研究表明,枯草芽孢杆菌 SPB1 生物表面活性剂所表现出的降血糖(降低血糖)和抗血脂(促进血液中脂质水平降低)活性足以有效缓解大鼠的糖尿病。
因此,根据研究结果,枯草芽孢杆菌 SPB1 生物表面活性剂可被认为是预防和治疗糖尿病的潜在有力候选物。
生物表面活性剂是由微生物产生的活性化合物(在细胞外合成,即在微生物细胞表面产生或分泌),可以降低表面张力和界面张力。
已知许多微生物能够产生相对大量的生物表面活性剂。已发现生物表面活性剂可用于多种用途。例如,在食品工业中,生物表面活性剂用于改善味道和质地、稳定性和延长保质期。
• 枯草芽孢杆菌可以缓解便秘
枯草芽孢杆菌可能有助于缓解健康人偶尔出现的便秘。例如,在一项研究中,服用枯草芽孢杆菌(枯草芽孢杆菌 DE111 菌株)的人报告称,与服用安慰剂的人相比,正常粪便的丰度有所增加。
因此,每天10亿CFU的枯草芽孢杆菌 DE111 剂量可以改善偶发性便秘,同时有助于维持胃肠道健康。
• 枯草芽孢杆菌可能有助于治疗腹泻
一项研究结果表明,枯草芽孢杆菌(枯草芽孢杆菌 CU1 菌株)预防性治疗可能具有有效的止泻活性。并且可以增强结肠在腹泻情况下吸收水分的能力。此外,枯草芽孢杆菌可以改善肠道的蠕动功能。
• 枯草芽孢杆菌可能对腹泻型或交替型 IBS 有益
尽管还需要更多的研究,但来自亚洲的一项研究表明,与安慰剂相比,枯草芽孢杆菌和屎链球菌等益生菌可成功减少腹泻为主型或交替型肠易激综合征(IBS)中腹痛的频率和严重程度。
• 枯草芽孢杆菌可能有助于治疗炎症性肠病
在一项亚洲动物研究中,研究人员发现,在缓解期间长期(6周)持续口服枯草芽孢杆菌,可以通过调节上皮细胞增殖、保护肠道完整性、调整微生物结构和功能来促进炎症性肠病的缓解。
此外,肠道微生物结构明显改善,大肠杆菌、志贺氏菌、肠球菌等有害菌显著减少,有益菌及相应的微生物增多。
• 枯草芽孢杆菌可能有助于对抗幽门螺杆菌感染
幽门螺杆菌是一种引起胃部感染的有害细菌。这种细菌是消化性溃疡的首要原因,也可能导致胃炎和胃癌。
遗憾的是,只有有限数量的抗生素可用于对抗幽门螺杆菌感染,因此抗生素耐药性威胁着治疗的成功。科学家试图寻找有效治疗幽门螺杆菌感染的新方案。
幸运的是,一项研究结果表明,枯草芽孢杆菌(枯草芽孢杆菌3号菌株的无细胞上清液)可以抑制幽门螺杆菌的生长,而且这种抑制作用并不是像最初想象的那样是由于有机酸的产生,而是由于抗菌物质的生产。
• 枯草芽孢杆菌可以刺激免疫系统
一项针对健康老年人(60-74岁)的研究表明,尽管在整个人群中对常见传染病没有显著的效果,但食用枯草芽孢杆菌(枯草芽孢杆菌 CU1 菌株)显著刺激了老年人的全身免疫反应,增加血清IFN-γ水平。
尽管仍需要进一步研究,但这些发现表明,冬季每日施用枯草芽孢杆菌 CU1 可能是增强老年人粘膜和全身免疫反应的安全有效方法。
• 枯草芽孢杆菌可能有助于对抗感染
枯草芽孢杆菌和解淀粉芽孢杆菌都是有害细菌最著名的敌人,因为它们可以产生不同的抗真菌代谢物。
例如,枯草芽孢杆菌可以不断产生和分泌大量潜在的抗真菌剂,这些抗真菌剂可以直接与真菌细胞表面相关蛋白结合,对细胞膜造成终末损伤,从而避免耐药性。一些枯草芽孢杆菌菌株还用作食品工业中的商业生物防治剂。
您甚至可以说枯草芽孢杆菌菌株是一种抗生素,因为它们产生多种抗生素,包括核糖体和非核糖体肽抗生素,以及杆菌溶菌素和新海藻糖二胺。
枯草芽孢杆菌还被证明对从烧伤感染中分离出的一些多重耐药细菌病原体具有治疗作用。
• 枯草芽孢杆菌可能有助于治疗肝脏疾病
动物研究表明,摄入枯草芽孢杆菌可能会减轻酒精引起的肝损伤,减轻肝脏和肠道损伤,并协调肠道微生物群和调节基因表达谱(同时测量数千个基因的活性)。
这里提供质量极高的枯草芽孢杆菌补充剂,可抵抗消化酸并帮助建立腹部平衡。
• 枯草芽孢杆菌可能具有皮肤愈合特性
动物研究表明,口服枯草芽孢杆菌可以减轻特应性皮炎皮肤病变的发展。
此外,由细菌纤维素凝胶膜和枯草芽孢杆菌细胞组成的生物复合材料可能具有很强的伤口愈合作用。
• 枯草芽孢杆菌可能有助于治疗牙周炎
一项研究结果表明,枯草芽孢杆菌可能对牙周炎患者有帮助,因为与日本常用的漱口液 Neosteline Green 相比,使用 Extraction 300E(含有枯草芽孢杆菌 E-300)漱口可显著减少牙周病原体。
• 来自枯草芽孢杆菌的多糖可能有助于降低糖尿病患者的心血管疾病风险
糖尿病是一种可能引发白内障、视网膜病变、肾病、多发性神经病以及心血管损害等并发症的疾病。
一项动物研究表明,来自枯草芽孢杆菌的胞外多糖,可能会改善糖尿病大鼠的高血糖、血脂异常和心血管疾病风险。
• 枯草芽孢杆菌可能有助于对抗白色念珠菌感染
研究表明,枯草芽孢杆菌可能是一种有效对抗白色念珠菌的益生菌,并且对不同的人类致病性白色念珠菌物种具有抗菌活性。此外,它还可以防止念珠菌感染期间的组织损伤。
★ 含有枯草芽孢杆菌的食物
含有枯草芽孢杆菌的食物主要包括一些发酵食品:
发酵乳制品:部分酸奶产品会添加枯草芽孢杆菌作为益生菌,奶酪中可能也含有这种菌株;
发酵蔬菜:如泡菜、酸菜等自然发酵过程中可能产生枯草芽孢杆菌;
发酵豆制品:如豆豉、天然发酵的豆腐乳等;
益生菌补充剂:市面上有些益生菌胶囊或粉剂中含有枯草芽孢杆菌。
蜡样芽孢杆菌(Bacillus cereus)最近被认为是眼部感染的主要病原体,可引起眼内炎。眼内炎是一种严重疾病,可在接种后12-48小时内导致视力受损。
1.4µm革兰氏阳性杆状细菌,通常成对和短链出现。
蜡样芽孢杆菌是兼性厌氧菌,具有能动性并能够形成内生孢子,具有直径约2-7毫米的菌落形态,并具有白色颗粒状结构。
蜡样芽孢杆菌生长温度高于10-20°C,低于35-45°C,最适温度约为37°C。这些细菌能够产生六种类型的毒素:五种肠毒素和一种催吐毒素,根据菌株的不同,这些毒素可以是热稳定的或热不稳定。
• 致病性/毒性
蜡样芽孢杆菌可以引起自限性(24-48小时)食物中毒综合征(腹泻型和呕吐型)、机会性感染,并与眼内炎和其他眼部感染等临床感染有关。
蜡样芽孢杆菌食物中毒的腹泻形式特点是腹部绞痛、大量水样腹泻和直肠里急后重,偶尔还会出现发烧和呕吐。蜡状芽孢杆菌食物中毒的呕吐形式的特点是恶心、呕吐和不适,偶尔伴有腹泻。
蜡样芽孢杆菌可引起伤口感染、菌血症、败血症、脑膜炎、肺炎、中枢神经系统感染、心内膜炎、心包炎、呼吸道感染和外周感染。
免疫功能低下个体的感染可能危及生命。蜡样芽孢杆菌菌株还含有携带炭疽芽孢杆菌样毒力因子的质粒,可在免疫功能正常的人群中引起严重肺炎。
• 感染剂量
在腹泻疾病中,毒素是由小肠中的生物体产生的,感染剂量为每克食物10^4 -10^9个细胞。催吐毒素在食物中预先形成且不消化(每克约10^5 -10^8 个细胞才能产生足够的毒素)。
• 传播方式
主要传播方式是通过摄入被蜡样芽孢杆菌污染的食物:呕吐型食物中毒主要与食用大米和面食有关,而腹泻型食物中毒主要通过奶制品、蔬菜和肉类传播。它形成孢子并容易传播。在医院中,蜡状芽孢杆菌可通过受污染的物品等传播。
注:蜡样芽孢杆菌不会在人与人之间传播
• 潜伏期
蜡样芽胞杆菌腹泻形式的发病期为8-16小时,而呕吐形式的发病期为1-6小时。恢复通常在24小时内完成。
注:腹泻或呕吐会导致大量体液流失,这可能会引起脱水。如果不及时补充水分和电解质,可能会对身体健康造成严重影响。因此,在出现腹泻或呕吐时,应该注意及时补充液体,并且如果情况严重或持续不止,应该寻求医疗帮助。
• 对化学药物的敏感性
蜡样芽孢杆菌产生大量β内酰胺酶,对青霉素、氨苄西林、头孢菌素、甲氧苄啶耐药。
戊二醛是一种用于对受芽孢杆菌污染的材料进行灭菌的化学试剂。1%次氯酸钠、过氧乙酸、活性过氧化氢、二氧化氯可杀死孢子、甲醛、碘、酸、碱。这些化学试剂应该是高度浓缩的,并且需要更长的接触时间才能杀死孢子。恶唑烷酮也是蜡状芽孢杆菌的有效抗菌剂。
注:每当在具有感染临床症状的免疫功能低下患者的血液或脑脊液中发现革兰氏阳性杆状细胞时,经验性抗生素治疗应涵盖蜡样芽胞杆菌(蜡样芽胞杆菌通常对克林霉素、氨基糖苷类、万古霉素、氯霉素和红霉素敏感)。
• 物理灭活
蜡样芽孢杆菌在土壤和植被中生存,通常具有耐热性,因此可以在食品热加工过程中存活,无论是否对细胞造成损伤。
0.15%NaCl溶液中的脉冲电场可灭活蜡样芽孢杆菌。蜡样芽孢杆菌孢子可以耐热和辐射,但在100°C下加热5分钟会导致细胞膜和核糖体受损。此外2-5 kGy的伽马射线照射才能灭活蜡样芽胞杆菌细胞。
• 预防
目前暂无针对蜡样芽孢杆菌的疫苗。在急性非炎症性感染性腹泻的情况下,使用次水杨酸铋进行药物预防可能有用,每次两片,每日四次,随餐和睡前服用。使用时间不应超过3周。
• 风险食品
蜡样芽孢杆菌是一种产生毒素的细菌,是食物中毒最常见的原因之一,也称为“炒饭综合症”。根据《微生物学前沿》杂志2019年发表的一篇文章,美国每年发生约63000起由蜡样芽孢杆菌引起的食物中毒病例。然而,绝大多数病例都没有报告,因为症状通常很轻微,通过休息和补水会自行消退。
纽约大学兰格尼健康中心的微生物学家兼临床教授菲利普·蒂尔诺说,剩下的炒饭是罪魁祸首。米饭煮熟后,通常会在室温下放置两个多小时,待冷却后再与其他配料一起炒。冷却米饭可确保成品炒饭不会结块或变湿。但重新加热并不能消除细菌已经产生的毒素。
第一种毒素在细菌被摄入后在小肠中释放,引起腹泻、痉挛,偶尔恶心,但很少呕吐。症状通常在食用受污染的食物(包括各种肉类、牛奶、蔬菜或鱼类)后6至15小时开始出现,大约24小时后消退。
第二种毒素是食物中的细菌在食用前释放的。大米等淀粉类食物是受影响的最常见食物来源。食用受污染的食物后30分钟至6小时内,毒素会导致呕吐和恶心,大约24小时后症状消退。
• 疾病所需的蜡样芽孢杆菌最少数量
蜡样芽孢杆菌食物中毒并不简单地与摄入蜡样芽孢杆菌的量有关。例如,饮用250–450 mL的牛奶,其中自然污染了多达10^8 CFU mL耐冷蜡状芽孢杆菌,但没有引起胃肠道不适;而三名老年人在食用蔬菜泥后死亡,其中每克含有3.2 × 10^5 CFU蜡样芽孢杆菌。
根据食物中毒病例的流行病学数据,估计疾病所需的蜡样芽胞杆菌数量为10^5至10^8个活蜡样芽胞杆菌。
注:由于食用、食物中毒症状的发展和食物样本分析之间的时间延迟,阻碍了获得有关剂量反应的可靠数据。此外,食物中毒事件中相关且妥善储存的食物样本很少可用于微生物分析。
特别提醒
由于蜡样芽胞杆菌菌株、宿主生理学和食品异常大的变异性,腹泻性食物中毒的确切“感染剂量”的确定变得复杂,这极大地影响了疾病的发展和严重程度。
首先,蜡状芽胞杆菌可以拥有多种不同组合和不同表达水平的毒素基因。与高温下的嗜温菌株相比,耐冷菌株的发芽、生长和肠毒素产生通常降低。
此外,细胞类型非常重要,营养细胞缺乏孢子的耐酸和耐胆汁能力。因此,与孢子相比,营养细胞在胃肠道中存活的能力非常低,这可能导致引起疾病所需的数量增加。
其次,几乎所有宿主方面都高度可变。每个人都有特定的肠道微生物群、健康状况和用药史。人们在饮食习惯、胃排空以及胃酸和胆汁的分泌方面表现出很大的差异。这些特征主要因年龄和性别而异,免疫系统以及药物和抗生素的使用也有显著影响。
同时在我们的标准化体外实验中,食物颗粒的存在对蜡样芽孢杆菌的胃肠道存活和肠毒素产生没有直接影响。
然而,食物预计会发挥一些间接作用。食物类型决定了可用的营养物质和竞争性微生物群的组成。此外,储存温度(和温度滥用)决定蜡样芽胞杆菌是否可以繁殖,如果可以,则主要是耐冷菌株或嗜温菌株。最后,食物类型、膳食量和食用时间影响许多消化过程的动力学,这反过来又影响胃肠道期间细菌的存活。
益生菌潜力:芽孢杆菌属中的某些物种,例如凝结芽孢杆菌和枯草芽孢杆菌,已对其益生菌特性进行了研究。益生菌是活的微生物,当摄入足够量时,可以为宿主带来健康益处。这些芽孢杆菌种类与促进消化健康、支持免疫功能并可能减轻某些胃肠道疾病有关。
抗生素生产:一些芽孢杆菌属产生抗生素,例如杆菌肽和多粘菌素,已在医学上用于治疗细菌感染。这些抗生素可有效对抗某些革兰氏阳性细菌。然而,值得注意的是,抗生素的使用应在医疗保健专业人员的指导下进行,以确保适当的治疗并最大程度地降低抗生素耐药性的风险。
孢子形成能力:芽孢杆菌以其形成孢子的能力而闻名,孢子是高度抵抗的结构,可以承受恶劣的条件。这一特性使得芽孢杆菌能够在包括人体在内的各种环境中生存。在某些情况下,形成孢子的芽孢杆菌属物种可能会引起感染,特别是对于免疫系统受损的个体。
食品安全和保存:一些芽孢杆菌属物种,例如蜡样芽孢杆菌,与食源性疾病有关。这些细菌会产生毒素,引起胃肠道症状,包括恶心、呕吐和腹泻。正确的食品处理、储存和烹饪方法对于预防芽孢杆菌相关的食源性疾病至关重要。
工业和环境应用:芽孢杆菌属物种在农业、生物技术和废物管理等领域具有工业应用。它们用于生产酶、生物农药和生物肥料等应用。此外,某些芽孢杆菌物种具有降解污染物并有助于环境修复的能力。
值得注意的是,虽然某些芽孢杆菌具有有益作用,但其他芽孢杆菌却可能引起感染或食源性疾病。对人类健康的具体影响取决于所涉及的物种、它们的特征以及它们遇到的环境。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
Bacillus abyssalis
Bacillus acidiceler
Bacillus acidicola
Bacillus acidiproducens
Bacillus acidopullulyticus
Bacillus acidovorans
Bacillus aeolius
Bacillus aeris
Bacillus aerius
Bacillus aestuarii
Bacillus aidingensis
Bacillus akibai
Bacillus alcaliinulinus
Bacillus alcalophilus
Bacillus algicola
Bacillus alkalinitrilicus
Bacillus alkalisediminis
Bacillus alkalitelluris
Bacillus alkalitolerans
Bacillus alkalogaya
Bacillus altitudinis complex
Bacillus alveayuensis
Bacillus amiliensis
Bacillus andreesenii
Bacillus aporrhoeus
Bacillus aquimaris
Bacillus arbutinivorans
Bacillus aryabhattai
Bacillus asahii
Bacillus aurantiacus
Bacillus azotoformans
Bacillus badius
Bacillus baekryungensis
Bacillus bataviensis
Bacillus benzoevorans
Bacillus beringensis
Bacillus berkeleyi
Bacillus beveridgei
Bacillus bogoriensis
Bacillus bombysepticus
Bacillus borbori
Bacillus boroniphilus
Bacillus butanolivorans
Bacillus canaveralius
Bacillus carboniphilus
Bacillus casamancensis
Bacillus caseinilyticus
Bacillus catenulatus
Bacillus cavernae
Bacillus cecembensis
Bacillus cellulosilyticus
Bacillus cereus group
Bacillus cf. pumilus SG2
Bacillus chagannorensis
Bacillus chandigarhensis
Bacillus chungangensis
Bacillus cibi
Bacillus cihuensis
Bacillus circulans
Bacillus clausii
Bacillus coagulans
Bacillus coahuilensis
Bacillus cohnii
Bacillus composti
Bacillus coniferum
Bacillus crassostreae
Bacillus cucumis
Bacillus daliensis
Bacillus danangensis
Bacillus decisifrondis
Bacillus decolorationis
Bacillus deramificans
Bacillus deserti
Bacillus djibelorensis
Bacillus drentensis
Bacillus ectoiniformans
Bacillus eiseniae
Bacillus encimensis
Bacillus enclensis
Bacillus endophyticus
Bacillus endoradicis
Bacillus farraginis
Bacillus fastidiosus
Bacillus fengqiuensis
Bacillus ferrariarum
Bacillus filamentosus
Bacillus firmis
Bacillus firmus
Bacillus flavocaldarius
Bacillus flexus
Bacillus foraminis
Bacillus fordii
Bacillus fortis
Bacillus freudenreichii
Bacillus fucosivorans
Bacillus fumarioli
Bacillus funiculus
Bacillus galactosidilyticus
Bacillus galliciensis
Bacillus gibsonii
Bacillus ginsenggisoli
Bacillus ginsengihumi
Bacillus ginsengisoli
Bacillus glycinifermentans
Bacillus gobiensis
Bacillus gottheilii
Bacillus graminis
Bacillus granadensis
Bacillus hackensackii
Bacillus halmapalus
Bacillus halochares
Bacillus halodurans
Bacillus halosaccharovorans
Bacillus hemicellulosilyticus
Bacillus hemicentroti
Bacillus herbersteinensis
Bacillus horikoshii
Bacillus horneckiae
Bacillus horti
Bacillus huizhouensis
Bacillus humi
Bacillus hunanensis
Bacillus hwajinpoensis
Bacillus idriensis
Bacillus indicus
Bacillus infantis
Bacillus infernus
Bacillus intermedius
Bacillus iranensis
Bacillus isabeliae
Bacillus israeli
Bacillus jeotgali
Bacillus kochii
Bacillus kokeshiiformis
Bacillus koreensis
Bacillus korlensis
Bacillus kribbensis
Bacillus krulwichiae
Bacillus kyonggiensis
Bacillus lehensis
Bacillus lentus
Bacillus ligniniphilus
Bacillus litoralis
Bacillus locisalis
Bacillus lonarensis
Bacillus longiquaesitum
Bacillus longisporus
Bacillus luciferensis
Bacillus luteolus
Bacillus luteus
Bacillus malikii
Bacillus mangrovensis
Bacillus mannanilyticus
Bacillus marcorestinctum
Bacillus marisflavi
Bacillus marmarensis
Bacillus massilioanorexius
Bacillus massiliogorillae
Bacillus massiliosenegalensis
Bacillus megaterium
Bacillus meqaterium
Bacillus mesonae
Bacillus methanolicus
Bacillus muralis
Bacillus murimartini
Bacillus nanhaiisediminis
Bacillus nealsonii
Bacillus neizhouensis
Bacillus nematocida
Bacillus niabensis
Bacillus niacini
Bacillus niameyensis
Bacillus nitritophilus
Bacillus novalis
Bacillus oceani
Bacillus oceanisediminis
Bacillus ohbensis
Bacillus okhensis
Bacillus okuhidensis
Bacillus oleivorans
Bacillus oleronius
Bacillus olivae
Bacillus oryzae
Bacillus oryzaecorticis
Bacillus oshimensis
Bacillus pakistanensis
Bacillus panacisoli
Bacillus panaciterrae
Bacillus paraflexus
Bacillus patagoniensis
Bacillus persicus
Bacillus pervagus
Bacillus pichinotyi
Bacillus piscicola
Bacillus plakortidis
Bacillus pocheonensis
Bacillus polyfermenticus
Bacillus polygoni
Bacillus polymachus
Bacillus pseudalcaliphilus
Bacillus pseudofirmus
Bacillus pseudomegaterium
Bacillus pseudomycoides
Bacillus psychrosaccharolyticus
Bacillus pumilus
Bacillus purgationiresistens
Bacillus qingdaonensis
Bacillus qingshengii
Bacillus racemilacticus
Bacillus rhizosphaerae
Bacillus rigiliprofundi
Bacillus rubiinfantis
Bacillus ruris
Bacillus safensis
Bacillus salarius
Bacillus saliphilus
Bacillus salmalaya
Bacillus salsus
Bacillus sediminis
Bacillus selenatarsenatis
Bacillus senegalensis
Bacillus seohaeanensis
Bacillus shacheensis
Bacillus shackletonii
Bacillus shandongensis
Bacillus siamensis
Bacillus similis
Bacillus simplex
Bacillus siralis
Bacillus smithii
Bacillus soli
Bacillus solimangrovi
Bacillus songklensis
Bacillus sp.
Bacillus sp. 2+3
Bacillus sp. 3EC3A1
Bacillus sp. CBMAI 1158
Bacillus sp. DHT-33
Bacillus sp. HC10.2Y2
Bacillus sp. HC15
Bacillus sp. N-16
Bacillus sp. T41
Bacillus sp.10 SA10
Bacillus sp.20R2
Bacillus sp.20R7
Bacillus sp.3.5R*5
Bacillus sp.7RP2-26
Bacillus sp.H-46
Bacillus sp.LW-10
Bacillus sp.LW-14
Bacillus sp.RP8
Bacillus sp.U0684
Bacillus sporothermodurans
Bacillus stamsii
Bacillus subterraneus
Bacillus subtilis group
Bacillus taeanensis
Bacillus taiwanensis
Bacillus tequilensi
Bacillus thaonhiensis
Bacillus thermoalkalophilus
Bacillus thermoamyloliquefaciens
Bacillus thermoamylovorans
Bacillus thermocopriae
Bacillus thermolactis
Bacillus thermophilus
Bacillus thermoproteolyticus
Bacillus thermoterrestris
Bacillus thermotolerans
Bacillus thermozeamaize
Bacillus thioparans
Bacillus tianmuensis
Bacillus tianshenii
Bacillus timonensis
Bacillus tipchiralis
Bacillus trypoxylicola
Bacillus vanillea
Bacillus vietnamensis
Bacillus vireti
Bacillus viscosus
Bacillus vitellinus
Bacillus wakoensis
Bacillus xiamenensis
Bacillus xiaoxiensis
Bacillus zhanjiangensis
丙氨酸、天冬氨酸和谷氨酸代谢
氨基糖和核苷酸糖代谢
氨酰-tRNA生物合成
氨基苯甲酸酯降解
花生四烯酸代谢
精氨酸和脯氨酸代谢
精氨酸生物合成
抗坏血酸和丙二酸代谢
碱基切除修复
苯甲酸酯降解
抗生素的生物合成
次生代谢物的生物合成
不饱和脂肪酸的生物合成
生物素代谢
丁酸代谢
C5-支链二元酸代谢
碳青霉烯生物合成
碳代谢
阳离子抗菌肽 (CAMP) 耐药性
氯烷和氯烯烃降解
柠檬酸循环(TCA循环)
氰基氨基酸代谢
半胱氨酸和蛋氨酸代谢
D-丙氨酸代谢
D-精氨酸和D-鸟氨酸代谢
D-谷氨酰胺和 D-谷氨酸代谢
DNA复制
芳香族化合物的降解
脂肪酸生物合成
脂肪酸降解
脂肪酸代谢
叶酸生物合成
果糖和甘露糖代谢
半乳糖代谢
香叶醇降解
谷胱甘肽代谢
甘油脂代谢
甘油磷脂代谢
糖酵解/糖异生
乙醛酸和二羧酸代谢
组氨酸代谢
同源重组
磷酸肌醇代谢
胰岛素抵抗
硫辛酸代谢
脂多糖生物合成
甲烷代谢
不同环境下的微生物代谢
单菌素生物合成
萘降解
烟酸和烟酰胺代谢
氮代谢
非同源末端连接
新生霉素生物合成
核苷酸切除修复
氧化磷酸化
泛酸和 CoA 生物合成
戊糖和葡萄糖醛酸相互转化
磷酸戊糖途径
肽聚糖生物合成
苯丙氨酸、酪氨酸和色氨酸生物合成
聚酮糖单元生物合成
卟啉和叶绿素代谢
丙酸代谢
嘌呤代谢
嘧啶代谢
丙酮酸代谢
RNA降解
RNA聚合酶
核黄素代谢
硒化合物代谢
淀粉和蔗糖代谢
链霉素生物合成
苯乙烯降解
硫代谢
酮体的合成和降解
牛磺酸和亚牛磺酸代谢
萜类骨架生物合成
硫胺素代谢
泛醌和其他萜醌生物合成
缬氨酸、亮氨酸和异亮氨酸生物合成
缬氨酸、亮氨酸和异亮氨酸降解
万古霉素耐药性
维生素B6代谢
α-亚麻酸代谢
β-丙氨酸代谢
β-内酰胺抗性
主要参考文献:
Logan NA. Bacillus and relatives in foodborne illness. J Appl Microbiol. 2012 Mar;112(3):417-29.
Weber DJ, Rutala WA. Bacillus species. Infect Control Hosp Epidemiol. 1988 Aug;9(8):368-73.
Ehling-Schulz M, Lereclus D, Koehler TM. The Bacillus cereus Group: Bacillus Species with Pathogenic Potential. Microbiol Spectr. 2019 May;7(3):10.1128/microbiolspec.GPP3-0032-2018.
Ceuppens S, Boon N, Uyttendaele M. Diversity of Bacillus cereus group strains is reflected in their broad range of pathogenicity and diverse ecological lifestyles. FEMS Microbiol Ecol. 2013 Jun;84(3):433-50.
Mongkolthanaruk W. Classification of Bacillus beneficial substances related to plants, humans and animals. J Microbiol Biotechnol. 2012 Dec;22(12):1597-604.
Kaneda T. Fatty acids of the genus Bacillus: an example of branched-chain preference. Bacteriol Rev. 1977 Jun;41(2):391-418.
Setlow P. Small, acid-soluble spore proteins of Bacillus species: structure, synthesis, genetics, function, and degradation. Annu Rev Microbiol. 1988;42:319-38.