-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
糖尿病,一个日益严峻的全球健康挑战,其影响远不止血糖升高那么简单。在血糖波动的背后,看不见的慢性低度炎症,正悄然侵蚀着患者的健康,加速并发症的到来。
当我们谈论炎症时,脑海中浮现的可能是皮肤割伤后的红肿热痛,那是身体对损伤的快速、有益的防御反应,属于急性炎症;然而还有一种更隐蔽、更持久的炎症形式——慢性低度炎症,它没有明显症状,却像温水煮青蛙般长期损害我们的身体,被认为是心脏病、癌症以及糖尿病等诸多慢性疾病的共同根源。
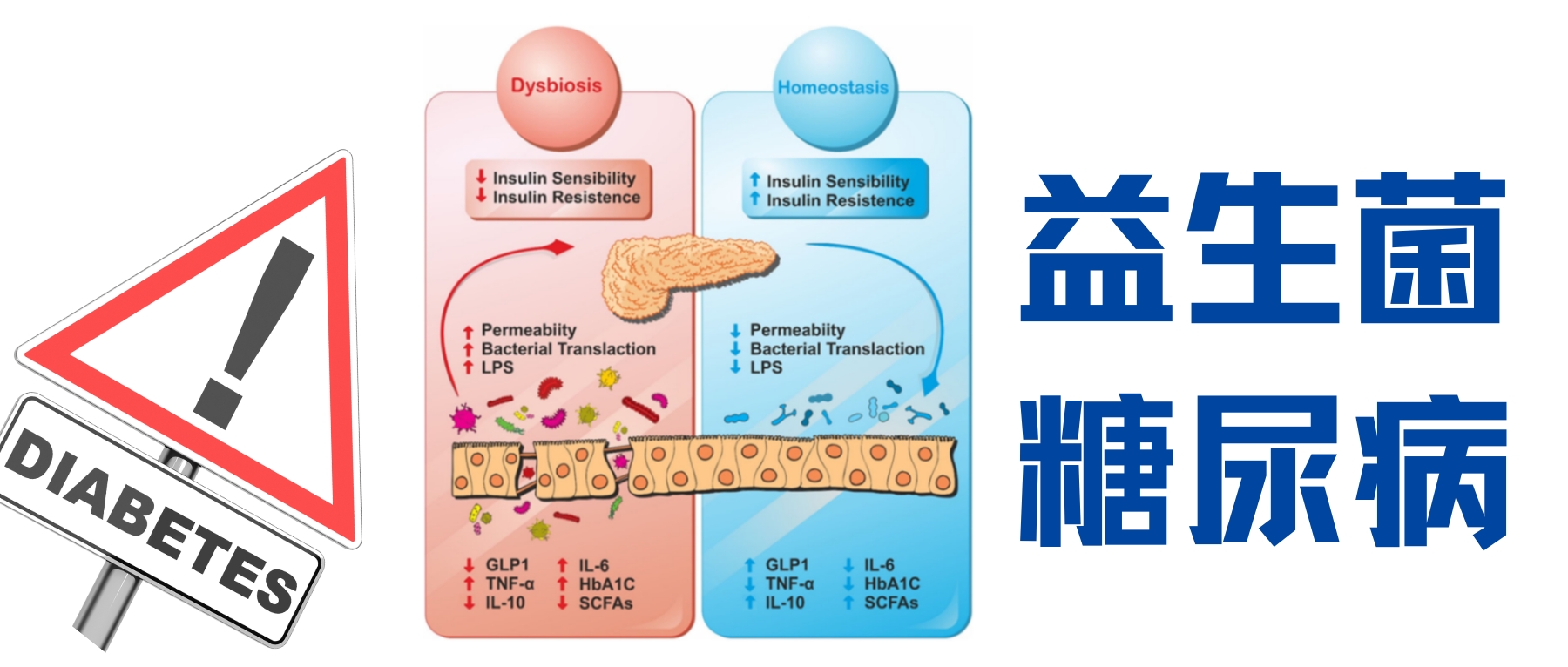
这场炎症风暴的源头可能隐藏在我们体内最复杂的微生态系统——肠道菌群中。研究发现,糖尿病患者常存在菌群失衡:有益菌(如双歧杆菌、乳杆菌)减少,潜在致病菌增多,这些改变会导致肠道通透性增加(肠漏),使脂多糖(LPS)等微生物成分进入血液,通过 Toll 样受体激活引发全身性炎症。形成“菌群失调→肠漏→炎症→胰岛素抵抗”的恶性循环。
能否通过调节肠道菌群来阻断这一恶性循环?益生菌,作为定植于肠道的友好菌群,为我们提供了新的解题思路。在代谢性疾病中常见的益生菌属包括双歧杆菌属、乳杆菌属等通过发酵膳食纤维产生短链脂肪酸(SCFAs)——如丁酸(增强肠道屏障、直接抗炎)、丙酸(调节肝脏糖代谢)、乙酸(参与全身代谢),这些短链脂肪酸具有抗炎和改善胰岛素敏感性的作用。
但益生菌的抗炎效果是否真能得到科学验证?不同菌株、剂量的干预差异何在?这些问题亟待更权威的证据解答。
近日,一篇荟萃分析发表在《Frontiers in Cellular and Infection Microbiology》上,该研究系统整合了46项随机对照试验,覆盖3580名糖尿病患者,旨在揭示益生菌及其代谢产物对糖尿病患者体内炎症标志物的真实影响。
这项研究不仅回答了“益生菌是否有效”的简单疑问,更深入探究了“哪种方案更优”、“需要多长时间见效”以及“其作用机制是否与短链脂肪酸直接相关”等核心问题。为临床实践提供了可靠的循证医学指导,也为未来精准干预策略的制定奠定了坚实的科学基础。
在糖尿病患者体内,慢性炎症状态尤为普遍。它不仅是疾病的结果,更是推动疾病恶化的帮凶。
炎症因子,作为炎症反应中的信使分子,在其中扮演了关键角色,就像一支特殊的信号部队,负责传递指令,协调免疫系统的行动。炎症因子主要分为两大类:
促炎因子
点燃和助长炎症的分子,如肿瘤坏死因子-α (TNF-α)、白细胞介素-6 (IL-6) 和 白细胞介素-1β (IL-1β)。
在糖尿病中,这些因子水平的升高会干扰胰岛素信号传导,加剧胰岛素抵抗,损害血管内皮功能,为心血管并发症埋下祸根。
抗炎因子
它们是负责对抗炎症和修复的分子,其中最著名的是白细胞介素-10 (IL-10)。它能够抑制促炎因子的产生,帮助炎症反应消退,维持免疫系统的平衡。
还有一个重要的炎症标志物——C反应蛋白 (CRP)。它由肝脏在炎症刺激下产生,是临床上常用于衡量全身性炎症水平的指标之一。在糖尿病患者中,CRP水平的持续轻度升高,预示着心血管事件的风险增加。
研究表明,在明显的临床症状出现之前,这些炎症因子的水平可能已经悄然改变。而最早发出预警信号的,可能就是我们的肠道菌群。
健康的肠道菌群平衡(共生)对维持新陈代谢和免疫稳态至关重要。然而,在糖尿病患者中,这种平衡常常被打破,出现所谓的菌群失调——有益菌(如双歧杆菌、乳酸杆菌)减少,而一些潜在的致病菌增多。
菌群失调会导致肠道屏障功能受损,即肠漏。这使得细菌的某些成分(如脂多糖LPS)更容易进入血液,触发全身性的炎症反应。因此,通过调节肠道菌群来恢复平衡,成为控制糖尿病相关炎症的一个极具前景的策略。
益生菌,即“摄入足够数量时能对宿主健康产生有益作用的活的微生物”,正是实现这一目标的有力工具。常见的用于改善代谢疾病的益生菌属包括乳杆菌属、双歧杆菌属等。
益生菌发挥作用的一个关键机制,是通过发酵我们无法消化的膳食纤维(如菊粉、低聚果糖等益生元),产生一系列代谢产物如短链脂肪酸 (SCFAs) 。其中最重要的三种是:
这些短链脂肪酸不仅在肠道局部发挥作用,还能进入血液循环,对全身的免疫细胞和代谢器官产生深远影响,被认为是连接肠道菌群与宿主免疫的关键信使。
那么,补充益生菌是否真的能增加短链脂肪酸,是否能有效降低糖尿病患者的炎症水平呢?
为了解决更深入了解以上问题,近日一项大规模的系统回顾和荟萃分析,严格遵循PRISMA指南,从全球六大数据库中检索了从2000年1月至2024年3月的所有相关研究。
经过层层筛选,最终纳入了46项符合标准的随机对照试验,共涉及3580名1型或2型糖尿病患者。这些研究评估了口服益生菌或合生元(合生元是指益生菌+益生元)对炎症标志物(CRP, IL-6, TNF-α, IL-10)和短链脂肪酸水平的影响。
(对炎症标志物和菌群代谢物的影响)
经过对46项研究数据的严谨分析,研究者们得出了相关结果。以下我们将详细解读益生菌/合生元对各项关键指标的影响。
C-反应蛋白(CRP)——显著下降
在34项报告了CRP数据的研究中,合并分析结果显示,与安慰剂组相比,益生菌/合生元干预显著降低了CRP水平(SMD = –0.54;95% CI:–0.72 至–0.35;p < 0.0001),异质性为中度(I² = 64%),这是一个中等强度的、具有临床意义的改善。
更深入的亚组分析揭示了几个关键因素:
干预时长是关键
干预时间≥8周的研究显示出更强的CRP降低效果(SMD = –0.66),而短于8周的干预效果较弱(SMD = –0.31)。这表明,调节肠道菌群并影响全身免疫系统需要一定的时间。
“1+1 > 2”的合生元效应
使用合生元(益生菌+益生元如菊粉或低聚果糖)的干预比单独使用益生菌效果更优(SMD = –0.71 vs. –0.45)。这印证了益生元为益生菌提供食物,从而增强其功能和代谢产物生成的理论。
研究者发现,体内丁酸和丙酸水平的升高与CRP的下降显著相关。这首次在如此大规模的人群证据中,将益生菌的代谢产物(SCFAs)与全身炎症标志物的改善直接联系起来,揭示了其作用的可能机制。
白介素-6(IL-6):关键促炎因子下降
IL-6是驱动胰岛素抵抗和血管功能障碍的关键促炎因子。在29项报告了IL-6数据的研究中,益生菌/合生元干预同样显示出显著的降低效果(SMD = –0.41)。
亚组分析发现,干预时长≥12周时效果更为明显(SMD = –0.51),进一步证实了长期干预的必要性。
此外,分析还提示了菌株的特异性,含有干酪乳杆菌 (Lactobacillus casei) 和 短双歧杆菌(Bifidobacterium breve) 的制剂在降低IL-6方面表现尤为突出。
多变量荟萃回归模型再次证实,即使在校正了年龄和BMI等混杂因素后,丁酸和丙酸水平的升高仍然是IL-6降低的独立预测因素。这强有力地支持了肠道来源的短链脂肪酸通过抑制细胞因子来缓解糖尿病中代谢应激的假说。
益生菌来源的SCFAs降低IL-6的机制通路
doi.org/10.3389/fcimb.2025.1677671
TNF-α:胰岛素抵抗元凶之一被抑制
TNF-α在脂肪组织炎症和胰岛素抵抗中扮演着核心角色。26项RCTs的数据显示,益生菌干预显著降低了TNF-α水平(SMD = –0.48)。分析发现了一些有趣的差异:
对2型糖尿病更有效
在2型糖尿病患者中,TNF-α的降低效果(SMD = –0.52)比1型糖尿病患者(SMD = –0.36)更显著。这可能因为2型糖尿病通常与更严重的代谢综合征和胰岛素抵抗相关,为益生菌提供了更大的改善空间。
多菌株的协同作用
使用多菌株混合制剂的干预效果优于单菌株制剂(SMD = –0.50 vs. –0.28),这提示不同菌株之间可能存在功能互补和协同增效的作用。
相关性分析再次给出了强有力的证据:
在那些同时测量了丁酸水平的研究中,丁酸水平的变化与TNF-α的变化呈现出极强的负相关(r = –0.72)。这意味着丁酸水平越高,TNF-α的下降越明显。
益生菌衍生的丁酸盐在糖尿病中调节TNF-α和炎症信号通路
doi.org/10.3389/fcimb.2025.1677671
IL-10:抗炎主力军增强
与促炎因子下降相反,抗炎因子IL-10的水平在干预后出现了显著升高(SMD = +0.38),这表明免疫系统正向着一个更平衡、更具耐受性的状态转变。在18项研究中,这一发现在统计学上非常稳健。
合生元再次显示出其优越性,其提升IL-10的效果最为强劲(SMD = +0.49)。与IL-10升高最相关的菌株包括植物乳杆菌 (Lactobacillus plantarum) 和 长双歧杆菌 (Bifidobacterium longum)。
荟萃回归分析发现,丙酸浓度的升高是IL-10增加的强预测因子。这为SCFAs不仅能抑制促炎因子,还能增强抗炎因子提供了证据,共同促进了免疫稳态的恢复。
微生物代谢物变化
21项研究直接定量了SCFAs,为上述所有发现提供了直接的生化基础。合并分析显示,干预后:
这些代谢物的增加在使用合生元和多菌株配方的研究中最为明显,特别是那些包含长双歧杆菌 (B.longum)、鼠李糖乳杆菌 (L. rhamnosus) 和 植物乳杆菌 (L.plantarum) 的制剂。
这些发现无可辩驳地证明,益生菌/合生元干预确实能够改变肠道菌群的代谢功能,增加有益的短链脂肪酸产量。而这些短链脂肪酸,正是连接肠道与全身免疫系统,发挥抗炎作用的关键介质。
稳健性于偏倚性
为了确保结论的可靠性,研究者还进行了一系列严格的敏感性分析和发表偏倚评估。结果显示,即使剔除单个研究或质量较低的研究,总体结论依然不变,表明结果非常稳健。
虽然在CRP的分析中检测到轻微的发表偏倚(倾向于发表阳性结果的研究),但经过校正后,其显著的抗炎效果依然存在。这大大增强了本研究结论的可信度。
doi.org/10.3389/fcimb.2025.1677671
这项荟萃分析的意义不仅在于学术层面,更在于为临床实践和个人健康管理提供了清晰的指导。它系统地证明了益生菌和合生元作为辅助疗法,在管理与糖尿病相关的代谢性炎症方面的巨大潜力。
研究结果反复指向短链脂肪酸的核心作用。科学界目前认为,短链脂肪酸主要通过以下途径发挥抗炎作用:
这些机制共同解释了在这项荟萃分析中,短链脂肪酸水平的升高与炎症标志物的改善呈现出如此强烈的相关性。
实践建议:如何选择和使用益生菌?
基于这项研究的发现,我们可以总结出一些给糖尿病患者的实用建议,以最大化益生菌的抗炎效益:
优先选择合生元或多菌株产品
研究明确指出,含有益生元(如菊粉、低聚果糖)的合生元产品,以及包含多种菌株(特别是乳杆菌属和双歧杆菌属)的混合产品,效果优于单一菌株的益生菌。寻找包含如干酪乳杆菌、植物乳杆菌、短双歧杆菌、长双歧杆菌等经研究验证的菌株。
保证足够的使用剂量和时长
为了达到有效的抗炎效果,建议的剂量通常在每天 109~1010 CFU(菌落形成单位)。更重要的是,干预需要足够长的时间,至少应持续 8-12周,甚至更长,才能观察到显著的免疫调节效果。
关注饮食协同
益生菌的效果离不开“燃料”。在补充益生菌的同时,增加膳食纤维的摄入(如全谷物、豆类、蔬菜、水果),可以为益生菌提供充足的食物,促进短链脂肪酸的产生,达到事半功倍的效果。
对于那些已经存在明显代谢性炎症(如CRP/IL-6升高)、中心性肥胖或非酒精性脂肪肝(NAFLD)的糖尿病患者,益生菌干预可能带来更大的获益。
作为辅助而非替代疗法
益生菌是一种辅助管理策略,不能完全替代标准的降糖药物和生活方式管理,益生菌可以从源头改善,通过调节肠道微生态,靶向慢性炎症,缓解糖尿病,且减少并发症的风险。
益生菌与常规治疗相结合,共同控制疾病。益生菌创造的低炎症、更健康的肠道环境,可能有助于提高身体对降糖药物的反应,并优化健康饮食的营养吸收效果。这种协同作用,最终可能带来比单一策略好得多的整体管理效果。
肠道菌群与糖尿病炎症的深度关联,已从基础研究走向临床转化的关键节点。益生菌通过调节短链脂肪酸代谢实现抗炎降糖,但“菌株选择、剂量优化、疗效预测”等核心问题,始终依赖对个体菌群特征的精准洞察。
益生菌通过重塑肠道微生态、修复肠道屏障、抑制慢性炎症,为2型糖尿病的辅助管理开辟了充满希望的新途径。它从源头上干预了由菌群失调驱动的代谢紊乱,展现出巨大的应用潜力。
从盲目补充到精准调养
肠道菌群检测将成为个性化健康管理的起点。通过检测,你能清晰了解自身菌群结构(如双歧杆菌、乳杆菌等有益菌丰度)、短链脂肪酸代谢能力及炎症风险,从而告别试错式补充,精准匹配最适合的菌株与饮食方案(如搭配益生元增强效果),让益生菌的抗炎潜力得到最大释放。
从单一产品到生态协同
人群研究数据(如干预≥8周效果提升、合生元方案优于单一益生菌)揭示,肠道菌群调节需“检测-干预-跟踪”的闭环支持。
主要参考文献
Xie Y, Zheng Y, Jiang F, Cai X. Meta-analytical insight on probiotic metabolites and inflammatory markers in diabetes. Front Cell Infect Microbiol. 2025 Sep 22;15:1677671.