-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
肠道屏障是将宿主与外界隔离的主要防御,具有多项关键生理功能,包括营养消化、吸收以及防止潜在有害的膳食抗原和致病微生物的侵害。然而,饮食、药物、昼夜节律紊乱、年龄、肠道微生物群、微生物代谢物和遗传易感性等多种因素都可能破坏肠道屏障。这种破坏可能导致细菌易位,进而引发肠肝和全身性炎症。
目前,肠道屏障受损已被认为与多种疾病的发病机制有关,包括炎症性肠病(克罗恩病和溃疡性结肠炎)、肠易激综合征和结直肠癌等肠道疾病。此外,肝病(如代谢功能障碍相关脂肪性肝病、酒精性肝病和原发性硬化性胆管炎)和全身性代谢疾病(如糖尿病和肥胖)也与肠道屏障受损有关。
然而,目前大多数临床数据仅显示相关性,尚无法明确肠道屏障损伤是这些疾病的原因还是结果。目前,全世界药监督管理局尚未批准专门用于修复肠道屏障损伤的药物。现有疗法主要侧重于疾病的预防和管理,并严重依赖免疫抑制剂来控制炎症。
不幸的是,持续的屏障损伤和延迟愈合会降低这些治疗的疗效,并可能导致治疗耐受甚至复发。因此,开发直接靶向肠道上皮屏障的治疗策略至关重要。
本文介绍肠道屏障的基本功能,生理结构和功能、影响其完整性的内外因素,重点介绍一些潜在的治疗策略,旨在恢复屏障完整性,改善和优化疾病管理。
肠道是一个独特的器官,在食物消化、营养吸收、动态的宿主与环境互动以及维持身体稳态方面发挥着关键作用。
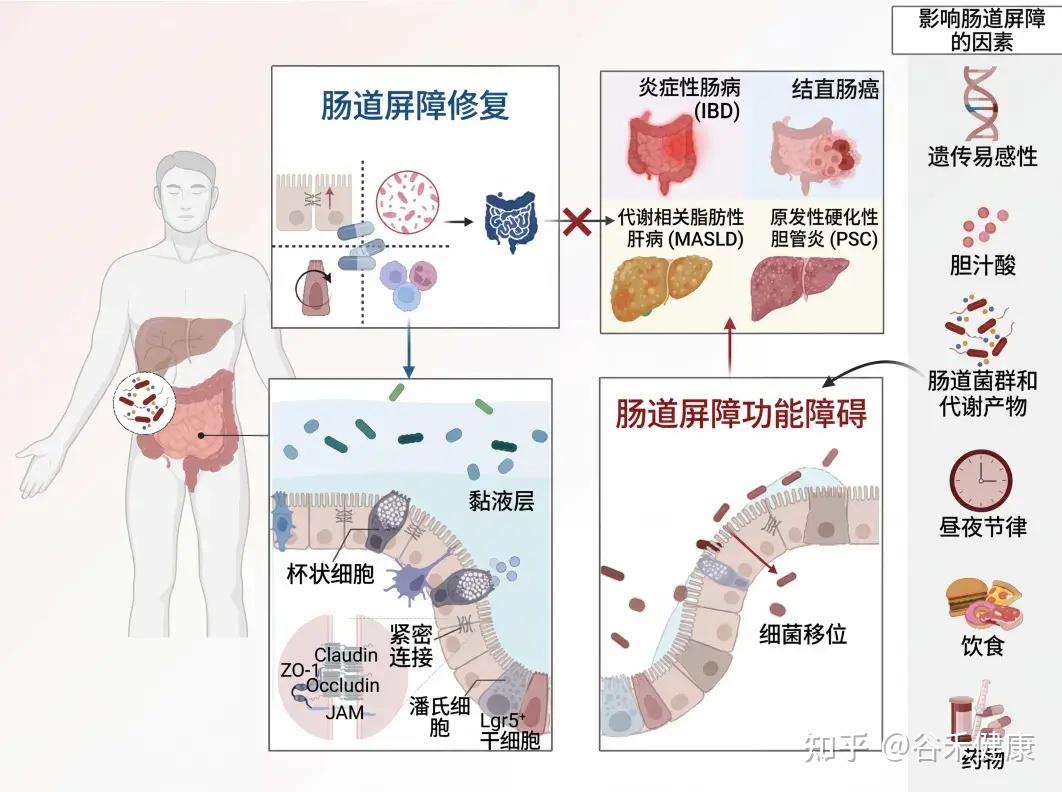
为了保护宿主免受外部威胁,例如长期暴露于膳食抗原和病原微生物,肠道上皮细胞(IECs)形成了多种类型的屏障,包括机械屏障、富含共生微生物的粘液层,以及由免疫细胞及其活性物质组成的免疫屏障(下图)。

机械屏障:由紧密连接(TJs)形成的紧密排列的IECs层构成,确保肠道的结构完整性,调节肠道通透性,并控制水和大分子的运输。
粘液层:由杯状细胞分泌的粘蛋白组成,为共生细菌提供栖息地和营养。其独特的结构特征限制了病原体的渗透,进一步增强了TJs的物理隔离功能。
干细胞微环境:位于肠腺隐窝底部,由隐窝驻留肠道干细胞(ISCs)、间充质细胞、免疫细胞以及肠道分泌细胞(如杯状细胞和潘氏细胞)组成。这个微环境具有高度增殖性,因此负责组织更新和肠道屏障修复。它还介导抗原吞噬并释放抗菌肽(AMPs),通过清除潜在病原体来维持内部稳态。
这些元素共同构建了物理和生化屏障,保护宿主并调节内部和外部环境之间的交流。这种复杂的平衡对于胃肠系统的正常运作和维持身体整体平衡至关重要。
1
粘液层组成与免疫监测
粘液层的物理与生化屏障
粘液层是胃肠道的第一道防线,主要由90%-95%的水、1%-2%的脂质和1%-5%的粘蛋白组成。粘蛋白通过糖基转移酶高度糖基化,含有50%-80%的碳水化合物(w/w)。
粘蛋白聚糖多样而复杂的结构,为粘液相关细菌(如 R.torques、A.muciniphila、B.bifidum和R.gnavus)提供了理想的定植位点和营养来源。
动态防御:细菌即是住客,也是建筑师
MUC2是胃肠道中表达的主要粘蛋白。在细菌暴露后,杯状细胞通过meprin β介导的裂解机制分泌MUC2,形成保护性粘蛋白层。该结构允许共生微生物在外粘液层定植,并利用其多糖降解酶从粘蛋白O-聚糖中获取营养能量。这种宿主与微生物的相互作用,有助于调节近端结肠微生物群的结构和转录。
别让细菌吃肠壁:低纤维饮食的代价
研究表明,低纤维饮食会促进微生物群降解宿主粘蛋白,导致粘液层变薄,从而削弱屏障功能。Muc2缺陷小鼠表现出结肠组织学损伤增加、细菌易位至肝脏增多以及肠道紧密连接蛋白显著减少。此外,粘蛋白O-糖基化紊乱导致的粘液屏障完整性和功能受损与代谢疾病的发病机制有关。
粘液层的水龙头:谁在掌控肠道保护液的释放?
最近的研究发现,Gasdermin D (GSDMD) 是一种参与细胞凋亡的成孔效应蛋白,它通过scinderin介导的F-肌动蛋白解聚,促进钙依赖性胞吐作用,从而调节杯状细胞的粘蛋白分泌。GSDMD缺陷会破坏粘液屏障,使病原体粘附到上皮细胞,导致肠道疾病的发生。
严防细菌偷渡:一套保护肝脏的精密免疫系统
粘液层凭借其独特的粘弹性,能够有效滞留并扩散来自潘氏细胞和杯状细胞的抗菌物质及免疫细胞因子,形成化学屏障。
-抗菌肽 (AMPs) 与IgA的协同作用
潘氏细胞产生隐匿防御素、抗菌素和溶菌酶等AMPs。这些AMPs大量存在于肠道上皮表面,能够直接清除有害微生物。在新生非肥胖糖尿病小鼠模型中,生态失调导致的结肠AMPs缺乏会导致1型糖尿病中的胰腺自身免疫。
AMPs与微生物特异性免疫球蛋白IgA协调作用,在维持屏障稳定性和抑制炎症中发挥关键作用。
-IL-17和IL-22的调控
它们的调节受T辅助17(Th17)细胞和III型固有淋巴细胞(ILC3)产生的IL-17和IL-22的影响。
ILC3依赖于树突状细胞(DC)相关的Mincle信号通路,该通路与酪氨酸激酶偶联的C型凝集素受体有关。在Mincle缺失或酪氨酸激酶受损的情况下,肠道再生胰岛衍生III-γ(RegIIIγ)和IgA的合成会减少,从而导致肠道微生物群移位,进而引发肝脏炎症和脂质代谢失调。
这些发现表明粘液层完整性在维持肠肝稳态中的关键作用。
2
上皮连接:构筑肠壁防线的灰浆与砖块
微绒毛:不仅仅是吸收养分的地毯
功能:肠道上皮细胞顶端的微绒毛密集排列成刷状缘。它们既是营养吸收的高效界面(扩大表面积),又是阻止细菌附着的第一道物理防线。
脆弱性:在克罗恩病中,这些绒毛会变短、基因表达混乱。
破坏机制:就像拆除帐篷的支柱一样,肠出血性大肠杆菌的毒力因子通过CDK1-Formin信号轴,攻击支撑微绒毛的骨架蛋白(ACT-5),导致微绒毛坍塌消失,引发严重腹泻、出血性结肠炎等。
紧密连接(TJs):细胞间的拉链
在微绒毛下方,紧密连接(TJs)像拉链一样把相邻细胞的细胞膜紧紧锁死。
核心作用:这种吻合结构封堵了细胞间的空隙,相当于门控功能——只允许特定的物质通过,严防细菌和有害大分子渗透。
关键零件:谁在控制拉链的松紧?
病菌如何撬开防御?
紧密连接的稳定性高度依赖于细胞骨架的支撑,这成为了病原体的攻击目标:
3
动态防御机制:从干细胞再生到免疫感知
隐窝深处的生命源泉:肠道干细胞 (ISCs)
肠道屏障之所以能抵御消化道内持续的磨损与危害,归功于其惊人的自我更新能力。
核心机制: 位于肠道隐窝底部的肠道干细胞是这一过程的“总工程师”。它们通过持续增殖,不断分化补充受损的肠道上皮细胞(IECs),维持着组织的修复与动态平衡。
谁在调控修复?信号通路、压力与衰老
ISCs 的功能受到微环境信号的精密调控,同时也易受外部因素干扰:
-修复的加速器
当肠道受损时,IL-1R1 信号 和 Wnt 激动剂 RSPO3 会协同作用,强力促进 ISCs 的修复功能,加速伤口愈合。
-心理压力:让干细胞电量耗尽
心理压力不仅仅是情绪问题,它能产生实实在在的生理毒性。
心理压力会导致 ISCs 内部的 线粒体能量代谢 受损,进而干扰细胞分化。这种微观层面的能量危机削弱了宏观的肠道屏障,这科学地解释了为何精神疾病患者常伴有肠道问题。
-衰老的阻滞剂
随着年龄增长,ISCs 的数量和活性会下降,导致屏障完整性受损及菌群失衡。
关键原因:维持 ISCs 活性的关键信号——Wnt 信号通路随衰老而减弱,导致干细胞枯竭。
簇状细胞:不仅是免疫哨兵
簇状细胞是肠道屏障中一种重要的分泌型肠上皮细胞,与潘氏细胞和杯状细胞共同发挥作用。它们通过分泌IL-25来抵御病原体感染,激活2型免疫并清除病原体。簇状细胞还能感知病原体代谢物,并通过G蛋白偶联信号通路产生PGD2,从而刺激杯状细胞分泌粘液并促进自身增殖,进一步增强抗菌防御。此外,在肠道损伤时,簇状细胞可以充当储备肠道干细胞,协助屏障修复。
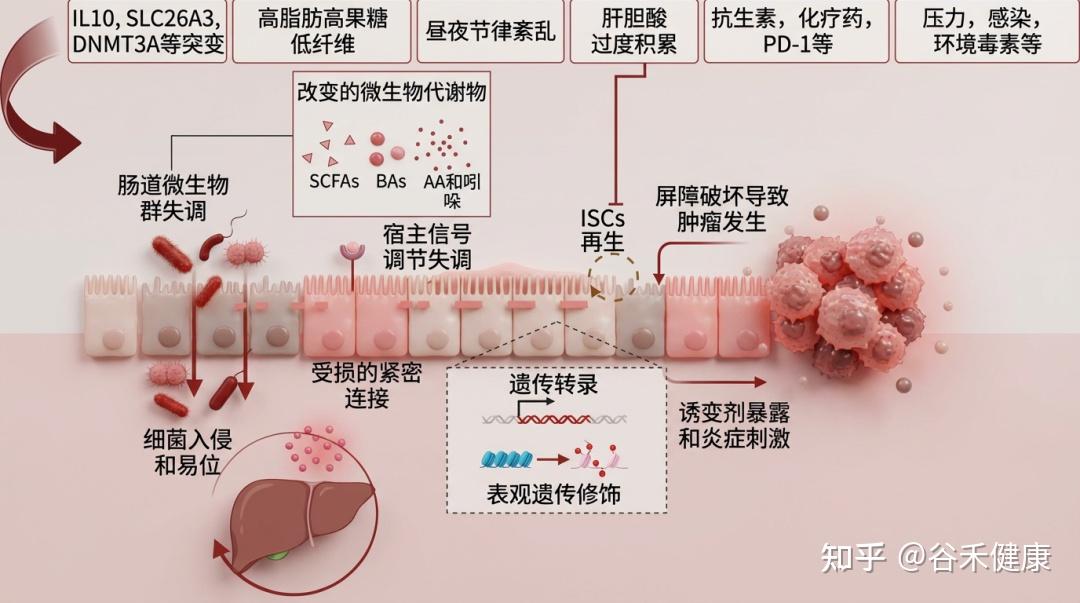
肠道屏障的健康受多种因素影响,包括遗传、饮食(如西式饮食)、药物(抗生素等)、疾病、生活习惯(昼夜节律)、心理状态(压力)和生理过程(衰老)。这些因素共同作用,可导致肠道微生物失衡,进而引发全身性代谢紊乱。这些代谢紊乱又会加剧炎症反应,进一步损害肠道屏障,形成一个恶性循环,持续破坏肠道健康。
下表总结了影响肠道和肝脏疾病的因素及机制与肠道屏障功能障碍相关的研究

1
遗传易感性
基因组关联研究(GWAS)的进展显著提升了疾病易感基因的识别和相关生物学通路的理解,这对临床转化具有重要价值。这些研究分析基因组中的遗传变异,以探索基因型和表型之间的关系。
免疫刹车失灵:IL-10 信号通路的遗传缺陷
尽管基因突变与肠道屏障功能障碍之间的直接联系有限,但GWAS已识别出许多与IBD(炎症性肠病)发展相关的基因座。例如,IL10基因突变是首批被发现能诱发IBD的突变之一。IL10基因敲除小鼠会自发发展结肠炎并增加肠道微生物易位。IL10受体(IL10R)的突变(由IL10RA和IL10RB基因编码的IL10R1和IL10R2蛋白组成)已与早发性小肠结肠炎相关联。这些突变损害了IL10诱导的信号传导,这可能增加TNF-α和其他促炎细胞因子的分泌,从而加剧炎症并削弱肠道耐受性。
离子转运障碍:SLC26A3 与物理屏障的松动
GWAS还显示SLC26A3基因(编码DRA蛋白,一种肠道氯离子转运蛋白)的显著下调。该基因在人类基因组中有害IBD变异中排名在前1%。SLC26A3表达的降低显著增加结肠旁细胞通透性,降低紧密连接(TJ)和黏附连接(AJ)蛋白的表达,从而增加对IBD的易感性。
黏液防线的溃败:ST6GALNAC1 与糖基化异常
糖蛋白组学分析揭示,先天性IBD(炎症性肠病)患者可能携带ST6GALNAC1(ST6)基因突变,该基因编码一种对维持黏液屏障稳态至关重要的唾液酸转移酶。该基因的突变会导致肠道黏膜层厚度减少,并破坏其保护功能。阐明这些调控机制对于理解先天性IBD的发病机制至关重要。此外,屏障功能还受到遗传易感性和环境因素相互作用的影响。DNA甲基转移酶编码基因DNMT3A的突变与IBD风险增加相关,已被证明能减少杯状细胞数量,缩短黏附连接(AJ)复合体,并增加肠道通透性。这些改变增加了对结肠炎的易感性,并阻碍了上皮再生和修复过程。
2
胆汁酸
胆汁酸(BAs)不仅是消化和脂质吸收的关键,还扮演着调节全身代谢和免疫的激素角色。它们通过激活FXR和TGR5等受体发挥作用。
修复的动力(次级胆汁酸)
最近研究发现,胆汁酸在维持肠道上皮屏障方面至关重要,能刺激Lgr5+肠道干细胞(ISCs)的自我更新,从而促进肠道修复。
修复的阻力(过量初级胆汁酸)
然而,过量的初级胆汁酸(如胆酸)会通过抑制脂肪酸氧化来减缓ISC的增殖,进而影响屏障修复。另一方面,TGR5在肠道代谢稳态中作用显著,其被次级胆汁酸(脱氧胆酸)激活后,会促进ISCs中YAP1和SRC等因子的转录,从而有效驱动肠道上皮的再生。
孕烷X受体 (PXR):抗炎与修复的化学感应器
孕烷X受体(PXR)是调节肠道上皮屏障稳态的关键核受体,它通过调控外源性物质代谢和先天免疫发挥作用。
溃疡性结肠炎患者中PXR及其靶基因的下调表明,PXR功能受损可能导致肠道损伤后屏障修复缺陷。PXR缺陷会加剧肠道上皮功能障碍,并增加对肠道损伤的易感性。
PXR的激活(例如通过石胆酸LCA)通过抑制NF-κB通路和炎症因子释放,以及维持紧密连接的完整性来发挥保护作用。
维生素 D 受体 (VDR):从抗菌防御到防癌屏障
胆汁酸也是维生素D受体(VDR)的内源性配体,对肠道稳态具有保护作用。VDR通过调节上皮分化和增强紧密连接表达来维护肠道屏障完整性,并支持潘氏细胞的抗菌功能。然而,在炎症性肠病(IBD)和结直肠癌(CRC)中,VDR的保护机制受损,其信号通路的失调与CRC的加速进展和不良预后密切相关。VDR激活不仅直接抑制肿瘤细胞增殖,还能通过增强黏膜屏障完整性来限制肿瘤进展,从而抑制CRC。
3
肠道微生物群及衍生代谢物
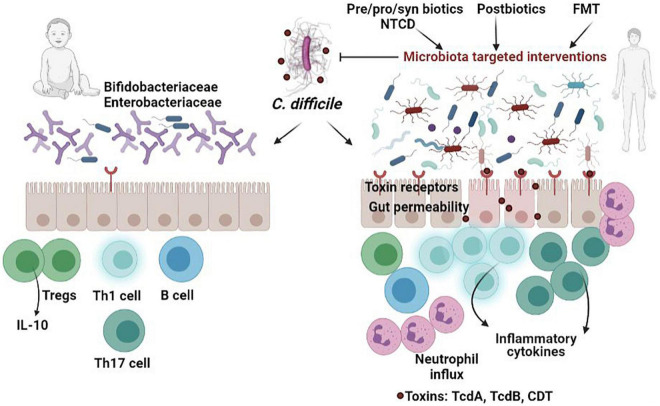
肠道微生物群通常与宿主共生,并被肠道上皮屏障限制在黏液层外。但有些微生物能突破屏障,损害胃肠道健康。抗生素虽看似能保护肠道,但实际上可能削弱屏障功能,增加新发炎症性肠病(IBD)的风险,这已在大量的研究中得到证实。与此相反,良好的肠道微生物结构对肠道屏障修复有积极作用。研究发现,肠道微生物群能通过激活巨噬细胞信号促进结肠上皮前体细胞生长,从而帮助修复受损的肠道上皮屏障。
色氨酸代谢物:PXR 与 AhR
肠道微生物群通过产生多种代谢物(如次级胆汁酸和色氨酸衍生物)来维护肠道屏障的完整性和整体健康。在IBD患者中,色氨酸水平显著降低,其代谢改变对疾病进程和预后有重要影响。
路径一:芳烃受体 (AhR) 的激活
色氨酸衍生物中的吲哚类物质是芳烃受体(AhR)的天然配体,AhR的激活能调节免疫细胞(如Tregs和Th17)及其细胞因子(特别是IL-22)的产生,从而促进肠道屏障的保护、修复和稳态。
路径二:孕烷 X 受体 (PXR) 的增强
除了AhR途径,这些代谢物还能通过孕烷X受体(PXR)增强屏障。例如,吲哚-3-丙酸(IPA)作为内源性PXR激动剂,通过TLR4信号通路减轻肠道通透性和炎症。PXR激活通过稳定紧密连接蛋白ZO-1、抑制MLCK表达和JNK1/2磷酸化来保护肠道屏障。
综上所述,色氨酸衍生的吲哚代谢物通过同时激活PXR和AhR信号通路,对肠道上皮发挥双重保护作用。
反面:犬尿氨酸 (Kyn) 途径
色氨酸代谢的犬尿氨酸(Kyn)途径与IBD进展密切相关,其限速酶IDO在炎症下促进Kyn途径,IDO的抑制或缺陷可减轻肠道炎症并增强屏障功能。
短链脂肪酸:能源与信号的结合
短链脂肪酸(SCFAs),包括丁酸、乙酸和丙酸,是肠道微生物分解膳食纤维等产生的关键代谢物,对肠道屏障功能至关重要。它们通过激活G蛋白偶联受体(如GPR43或FFAR2)来增强肠道屏障,并保护免疫细胞免受损伤,从而有助于预防结直肠癌(CRC)。
丁酸抑制组蛋白脱乙酰酶(HDACs)以调节基因转录,并通过调控紧密连接处的蛋白来促进屏障修复。GPCR信号和HDAC共同抑制维护上皮屏障完整性。此外,SCFAs还能刺激杯状细胞分泌黏蛋白,进而促进黏蛋白降解菌生长,通过消耗黏蛋白促进肠道干细胞分化,确保肠道上皮的再生能力。
4
昼夜节律
昼夜节律,常被称为生物钟,是代谢稳态的内部控制系统,旨在同步诸如光暗周期等周期性环境信号。该系统通过转录、转录后和翻译后修饰,在特定时间协调基因表达,以实现最佳代谢适应。
“什么时候吃”可能比“吃什么”更重要
多项研究表明,昼夜节律紊乱与代谢疾病之间存在密切关联。具体而言,不规律的进食时间会增加小肠暴露于膳食抗原和微生物刺激的风险,从而加重肠上皮细胞(IECs)主要组织相容性复合体II(MHC II)的负担。这种紊乱会削弱肠道微生态的调节功能,并减少IL-10的分泌。
神经免疫回路的失调:VIP 与 ILC3 的博弈
昼夜节律还会影响肠道中的神经免疫回路,这些回路受进食行为激活,并在饮食不规律时可能导致病理变化。食物摄入会触发肠道神经元分泌血管活性肠肽(VIP),该肽会上调与脂质吸收和转运相关的蛋白质。同时,VIP会降低IECs中的AMP水平,并减少ILC3产生的IL22。这种饮食节律的紊乱有助于病原体的肠道定植,尤其是在神经免疫回路的屏障功能受损时。
微生物振荡器:细菌也有生物钟
肠道微生物群自身也表现出丰度和功能的昼夜波动,被称为微生物振荡器,它们通过微生物代谢物或自身抗原影响宿主昼夜节律。肠道微生物群与宿主生物钟之间的这种相互作用显著影响屏障完整性和先天免疫反应。例如,短链脂肪酸通过抑制组蛋白脱乙酰酶(HDAC)活性,有助于调节小肠的昼夜节律相移。
肠道中的分节丝状细菌(SFB)驱动着与宿主节律同步的节律性ILC3回路振荡,从而通过时间依赖性地表达抗菌肽(AMPs)来介导感染抵抗力的昼夜变化。
5
饮食
高脂与快餐:胆汁酸的黑化与致癌风险
高脂肪和高糖、高加工饮食,与现代社会代谢疾病患病率的增加密切相关。饮食成分通过改变肠道微生物群以及主动参与宿主生理过程的次级代谢产物的产生,显著影响肠道微环境。
研究表明,现代快餐和西方饮食引起的肠道微生物群变化会提高脱氧胆酸(DCA)水平,这通过激活肠道FXR和I型干扰素(IFN)信号通路损害潘氏细胞。
动物研究进一步揭示,高脂肪饮食(HFD)在不同的结肠癌模型中,包括偶氮甲烷(AOM)-葡聚糖硫酸钠(DSS)诱导模型以及Apc突变诱导的自发模型,都会加剧肠道屏障损伤。HFD受损的肠道屏障允许更多病原体和衍生代谢物穿透上皮,从而加速结直肠癌(CRC)的发展。
糖衣炮弹:果糖与高血糖的双重打击
除了高脂肪摄入,过量的膳食果糖摄入也会损害上皮屏障。果糖水平升高会增加循环内毒素,从而激活巨噬细胞上的Toll样受体4(TLR4),引发全身性炎症反应。同时,葡萄糖代谢既对代谢综合征具有治疗潜力,也是肠道屏障功能的关键协调者。
在瘦素缺乏(ob/ob)和瘦素受体(LepR)缺乏(db/db)的2型糖尿病(T2DM)小鼠模型中,高血糖通过诱导肠上皮细胞(IECs)中葡萄糖转运蛋白2(GLUT2)依赖性转录重编程来破坏肠道屏障,这随后损害了紧密连接(TJ)和黏着连接(AJ)结构的完整性。
富含果糖的食物

6
药物
抗生素:精准打击与地毯式搜捕
抗菌素的使用对肠道微生物群落的丰度和结构有着深远的影响,进而影响肠道屏障的完整性。
例如,利福昔明-α (Rifaximin-α)常用来治疗小肠细菌过度生长:这种抗生素可以减少破坏粘膜的细菌,增加肠道内TNF-α和IL-17的水平,从而增强对病原体的抵抗力。它还能通过增加回肠中的乳杆菌水平来改善应激引起的肠道屏障功能障碍。
广谱抗生素会降低肠道微生物多样性,导致免疫失调,并增加感染的易感性。在健康成年小鼠中,广谱抗生素治疗会导致菌群失调,肠道上皮紧密连接(TJ)的完整性受损,表现为ZO-1表达减少和NLRP3炎症小体激活。
非抗生素药物:阿司匹林的隐形副作用
非抗生素药物也可能损害肠道屏障,例如阿司匹林,广泛用作消炎镇痛药,但会引起胃肠道损伤。
它会激活肠道FXR信号,并减少戈氏副拟杆菌(Parabacteroides goldsteinii)的数量。
戈氏副拟杆菌产生7-酮-LCA,这种物质能抑制肠道干细胞(ISC)的干性,从而减缓肠道屏障的修复。
化疗药物:再生能力的丧失
化疗药物:化疗是导致肠道屏障损伤的另一个主要原因。例如,5-氟尿嘧啶会加速黏膜细胞的死亡,而非再生。因此,超过40%的化疗患者会出现胃肠道损伤,表现为腹泻、便秘和消化不良等症状。
免疫检查点抑制剂:免疫激活的附带损伤
免疫检查点抑制剂(ICIs):靶向PD-1的ICIs彻底改变了抗肿瘤治疗。尽管这些抗体通过阻断PD-1通路来重建正常的免疫反应,但它们经常引起胃肠道毒性。
PD-1信号被发现对调节结肠淋巴组织诱导(LTi)细胞(ILC3的一个特定亚群,对维持免疫稳态至关重要)至关重要。
PD-1信号的缺失会导致LTi细胞中脂肪酸氧化过度激活,并反馈抑制LTi细胞的激活和IL-22的产生。这种失衡导致生态失调、肠道屏障损伤,并增加肠炎的易感性。
功能性测试:探针分子与 LMR 比值
乳果糖/甘露醇比值 (LMR) 是评估肠道通透性的重要生物标志物。
注:乳果糖(大分子)的尿液排泄量反映“肠漏”程度和上皮损伤。甘露醇(小分子)主要通过跨细胞途径吸收,代表非特异性上皮转运。
通过口服探针分子后检测尿液排泄来评估肠道通透性,这是最常用和直接的方法。
常用的探针分子包括不易代谢、吸收差的糖类(如甘露醇、鼠李糖、三氯蔗糖、乳果糖)或低分子量聚乙二醇(PEG)和乙二胺四乙酸(EDTA)。
为了避免饮食干扰,这些探针常使用同位素标记。
乳果糖-甘露醇测试 (LMT) 是临床广泛使用的评估方法。
在动物模型中,常用FITC标记的葡聚糖或铬-51标记的EDTA (51Cr-EDTA) 吸收到体循环的量来评估肠道屏障完整性。
其他方法:生物标志物的间接分析和多组学分析平台也是新兴的评估手段。
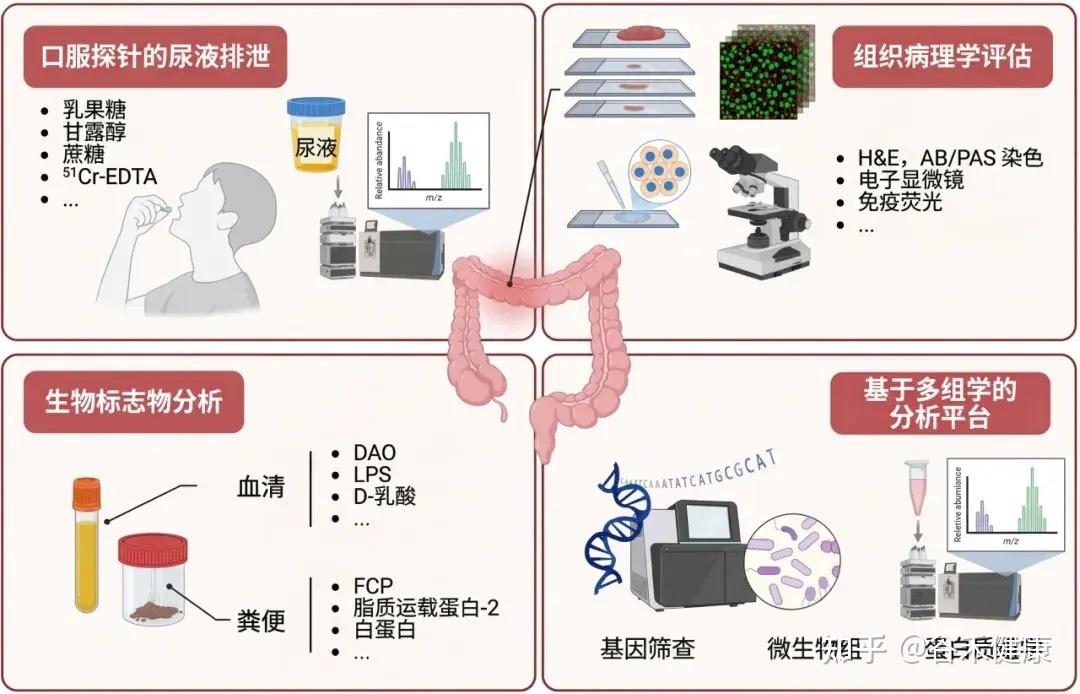
生物标志物:血液与粪便的线索
血清蛋白质组学和基因筛查技术:用于早期检测屏障功能障碍,并支持对其潜在原因的机制研究。
这些间接方法通过检测血液、粪便或分子水平上的特定物质,提供肠道屏障健康状况的重要信息。
组织病理学:屏障损伤的可视证据
内窥镜活检标本的组织病理学评估可以详细检查上皮绒毛形态和评估肠道屏障完整性。可以使用黏蛋白特异性阿尔辛蓝/过碘酸-希夫 (AB/PAS) 染色来评估黏液层,使用电子显微镜进行超微结构分析,以及使用免疫荧光技术精确定位和量化紧密连接 (TJ) 蛋白的表达,从而系统地分析黏膜成分的结构改变。
这些方法共同为评估肠道屏障完整性提供了全面的视角。
肠道上皮屏障的失调对多种肠道和肝脏疾病的发展和进展具有重要意义。肠道上皮的紧密连接功能障碍增加了通透性,促进细菌及其致病因子穿越屏障进入全身循环及其他组织。这种入侵会引发全身性炎症,破坏代谢稳态,而代谢稳态是肠道和肝脏疾病发生和进展的关键事件。虽然尚不确定肠道屏障的损伤是主要驱动因素还是偶然的病理特征,但越来越多的证据表明,肠道屏障的完整性在这些疾病的病因中起着关键作用。
1
炎症性肠病与结直肠癌
IBD 的病理核心:炎症因子的破坏机制
炎症性肠病 (IBD),包括克罗恩病 (CD) 和溃疡性结肠炎 (UC) 的特征是慢性胃肠道炎症。上皮屏障功能障碍是导致 IBD 发生和发展的关键因素。
临床研究表明,UC 和 CD 患者的肠道紧密连接 (TJ) 结构发生改变,导致肠道通透性增加。此外,黏膜免疫激活会引起TNF-α、IL-13、IL-17等细胞因子的产生。
屏障损伤是“因”而非“果”
进一步研究表明,由于 TJ 功能障碍和细胞骨架变化,细胞旁通透性增加可能在疾病发生前就已出现,例如 CD 患者亲属中早期肠屏障异常以及肠易激综合征 (IBS) 的较高患病率。同样,大规模队列研究已经发现 CD 诊断前三年内的屏障障碍标志物。这些发现支持屏障功能障碍是疾病进展的主要原因,而不是次要效应。
致癌风险:暴露于诱变环境
上皮屏障缺陷会使肠道内壁暴露于诱变化合物或长期炎症刺激,这可能通过氧化应激等机制启动并促进结直肠肿瘤的发生。在早期和晚期结直肠癌中,各种屏障相关蛋白的表达显著降低,这促进了微生物移位,引发炎症,并进一步加速肿瘤生长。然而,结直肠癌发生发展过程中上皮屏障成分异常表达的确切机制仍不清楚。
关键分子机制:GOLM1 与 NDRG2
事实上,实验模型表明,上皮屏障受损的小鼠更容易患结肠炎和炎症驱动的肿瘤。例如:
-GOLM1 缺失(细胞分化紊乱)
高尔基体膜蛋白 1 (GOLM1) 的缺失会过度激活 Notch 通路,从而破坏肠道稳态,改变肠上皮细胞 (IEC) 的分化和分泌细胞谱,并减少杯状细胞的数量,所有这些都会增加肠道通透性和促肿瘤炎症。机械屏障在预防结直肠癌发展中也至关重要。
-NDRG2(肿瘤抑制基因)
肿瘤抑制基因 N-myc 下游调节基因 2 (NDRG2) 已被证明可以增强 E3 连接酶 FBXO11 和 E-钙粘蛋白抑制剂 Snail 之间的相互作用,促进 Snail 泛素化。E-钙粘蛋白的这种稳定作用增强了黏附连接,从而限制了结肠炎相关肿瘤的发展。
2
慢性肝病
慢性肝病,包括 MASLD、ALD 和 PSC,常伴有肠道屏障受损和肠肝轴的失调。胃肠道物质,如营养素、分泌因子和微生物代谢物, 通过门静脉进入肝脏,并被代谢用于全身利用。这一过程使肝脏对病原体相关分子模式(PAMPs)极为敏感,成为肠道物质的主要靶点。
代谢功能障碍相关脂肪性肝病
代谢功能障碍相关脂肪性肝病 (MASLD, Metabolic dysfunction-associated steatotic liver disease):以前被称为NAFLD(非酒精性脂肪性肝病)。它是一种与代谢功能障碍相关的肝脏疾病,通常与肥胖、2型糖尿病、高血压和血脂异常有关。主要特征是肝脏中脂肪过度积聚,但与大量饮酒无关。
MASLD中,内毒素血症常见,提示肠屏障与肝炎症相关。DSS诱导小鼠肠屏障损伤加剧肝损伤。Il-10敲除鼠中,西方饮食+DSS处理降低BA水平,抑制肝脏FXR信号,加重MASLD。
肠道菌群失调是MASH早期驱动因素,宏基因组研究表明MASLD患者肝病发作前已存在肠道菌群失调。MASH患者粪外囊泡可能通过nmMLCK机制降低TJ表达,加剧肠屏障功能障碍。恢复肠屏障可逆转结肠炎引起的肝脂代谢失衡,特别是通过调节次级BA-TGR5/mTOR/氧化磷酸化通路。
酒精性肝病
酒精性肝病 (ALD, Alcoholic Liver Disease):是由于长期过度饮酒引起的肝脏损伤。 它可以表现为脂肪肝、酒精性肝炎和肝硬化等不同阶段。
酒精暴露破坏上皮连接,诱导肠屏障分解。ALDH2缺乏加剧酒精引起的肠道TJ/AJ蛋白降解,肠道ALDH2可能是酒精诱导的肠-肝轴损伤靶点。慢性酒精摄入减少肠道cDCs,导致AMP产量下降,保护性A. muciniphila丰度下降,AJs破坏,最终通过IL-12-IFNγ信号通路引起肝损伤。
原发性硬化性胆管炎 (PSC)
原发性硬化性胆管炎 (PSC, Primary Sclerosing Cholangitis):是一种慢性胆汁淤积性肝病,其特征是肝内外胆管的炎症和瘢痕形成。 最终可能导致胆管狭窄、肝硬化和肝功能衰竭。
PSC常与溃疡性结肠炎共病。PSC患者肠道微生物群与健康个体不同。门静脉中存在微生物提示肠屏障破坏,可能导致细菌易位。肺炎克雷伯菌等致病菌可通过接触依赖性细胞凋亡诱导上皮孔形成,加剧炎症和肝胆损伤。BDL诱导胆汁肝病小鼠模型中,肠道屏障破坏独立于菌群失调发生。敲除CHOP可缓解BDL小鼠肠屏障损伤、ISC干性丧失以及肝脏炎症和纤维化。
肠道屏障受损可刺激PSC中的保护性负反馈回路,LPS激活NF-κB通路抑制肝细胞BA代谢,减缓胆汁性肝病进展。抗生素或泛半胱天冬酶抑制剂能减弱菌群失调诱导的内毒素易位或NLRP3炎症小体激活,有望治疗PSC。
免疫靶向疗法,包括抗炎药、免疫抑制剂和生物制剂,已被证明在控制多种肠道疾病(如炎症性肠病)炎症方面有效。然而,这些治疗并不能直接解决肠道屏障的根本损伤。不幸的是,长期使用这些药物甚至可能增加感染、耐药性和疾病复发的风险,以及恶性肿瘤和死亡等严重不良反应。
确实,虽然减少炎症至关重要,但促进上皮屏障的愈合和恢复对于肠道疾病,尤其是炎症性肠病(IBD)的长期缓解至关重要。目前,没有临床批准的疗法专门针对肠道屏障的修复和维护。鉴于屏障功能障碍与肠道和肝脏疾病发病机制的密切联系,及时修复和恢复上皮屏障是一种有前景的治疗策略。与其仅关注症状管理,提升上皮愈合和健康完整性的治疗方法,可以减缓肠道和肝脏疾病的进展。
通过加强屏障,这类疗法还可能减少细菌易位、炎症以及肝损伤的加重。

1
紧密连接蛋白调节
靶向 MLCK:紧密连接稳态的核心调控
肠道屏障的维持在很大程度上依赖于多种 TJ 蛋白。肌球蛋白轻链激酶(MLCK)被视为开发炎症性肠病障碍疗法的有力候选目标,其在调节 TJs 及其分解中发挥核心作用,通过调节紧密连接(TJs)及其分解来保护屏障功能免受免疫诱导损伤。
对 MLCK 的缺失或抑制可以有效保护屏障功能免受免疫诱导损伤,但这些干预无法预防晚期结肠炎,后者涉及细胞凋亡和黏膜损伤,这些过程与 MLCK 介导的 TJ 分解无关。这些发现反映了 MLCK 抑制剂的治疗局限性。目前的 MLCK 抑制剂对上皮和平滑肌的催化域缺乏特异性,因此可能出现毒性副作用。
新机制发现:TCPTP 的双重保护
紧密连接 (TJ) 通过调节闭合蛋白 (occludin) 和封闭蛋白 (claudin) 来维持肠道完整性,而闭合蛋白和封闭蛋白是两种关键蛋白。
一项研究发现,上皮细胞中的蛋白酪氨酸磷酸酶 (TCPTP) 通过以下两种方式保护肠道屏障:
后者可以防止闭合蛋白 (occludin) 错位并降低上皮细胞的通透性。
目前尚无专门针对 TJ 蛋白的药物进入临床试验阶段,因此,需要在此领域进行深入研究和开发。
2
肠道微生物群的生态调控
益生菌疗法:从天然菌株到工程改造
益生菌已被发现通过多种机制调节屏障功能。例如,罗伊氏乳杆菌(Lactobacillus reuteri)激活Wnt/β-catenin信号通路,诱导Paneth细胞分化和AMP(抗菌肽)分泌,同时刺激Lgr5+肠道干细胞(ISCs)增殖以促进上皮修复。
此外,罗氏菌属(Roseburia)的鞭毛蛋白与Toll样受体5(TLR5)结合,可以上调occludin和MUC2,从而改善肠道屏障完整性,并增加IL-22和REG3γ水平,进一步调节肠道生态。
嗜黏蛋白阿克曼氏菌(AKK菌,Akkermansia muciniphila)也通过调节ISC程序来支持肠道上皮的修复、增殖、分化和稳定。因此,靶向肠道微生物失调成为恢复受损屏障功能的一种有前景的治疗策略。
最新的进展包括使用生物纳米材料包裹过表达人工酶的基因工程益生菌,这是一种用于黏膜修复和炎症治疗的新方法。长双歧杆菌(Bifidobacterium longum)经过修饰以表达过氧化氢酶和超氧化物歧化酶,表现出增强的肠道定植能力、强大的抗炎活性,促进肠道屏障重塑,并调节微生物平衡。这些进展有望减少传统抗炎药物的不良反应。
胆汁酸信号:FXR 激动剂的多重获益
胆汁酸在宿主与肠道菌群的交流以及肠道菌群的构成调节中起着关键作用。胆汁酸合成失调与多种疾病的发生密切相关。激活法尼酯X受体(FXR)能有效缓解胆汁酸过量带来的危害,它通过抑制胆固醇代谢、促进肝细胞将胆汁酸转运出去,从而减少胆汁淤积性肝损伤。
研究显示,FXR激动剂奥贝胆酸(OCA)能够:
此外,OCA治疗还能通过稳定内皮细胞内的β-连环蛋白来防止肠道血管屏障受损。
色氨酸代谢:AHR 通路与 IDO 的平衡
-AHR:屏障完整性的总开关
AHR(芳香烃受体)是一种色氨酸代谢物的受体,对维持肠道屏障的完整性至关重要。研究发现,Ahr−/−小鼠(即缺乏AHR的小鼠)的上皮屏障功能明显丧失,表现为肠道机械屏障受损以及细胞无法正常分化。缺乏AHR配体的小鼠也会出现类似的症状。
进一步研究表明,来自食物的AHR配体可以通过促进细胞内的锌离子(Zn2+)信号传导,从而提高紧密连接(TJ)蛋白的表达,有效预防损害肠道屏障功能的疾病。
-AHR 激动剂的治疗潜力:以尿石素 A 为例
其他AHR激动剂,例如微生物代谢产物尿石素A(UroA),也显示出保护肠道屏障功能的潜力。UroA具有抗炎作用,并且可以通过激活AhR–NrF2依赖性通路来上调TJ蛋白的表达,从而促进肠道屏障的修复。
这些研究表明,激活肠道AHR通路对于治疗酒精性肝病(ALD)具有重要意义,因为ALD与TJ屏障的丧失密切相关。因此,AHR可能成为修复肠道屏障的一个有价值的治疗靶点,尤其是在与肠道屏障功能障碍相关的慢性疾病中。
-IDO 抑制剂:代谢平衡与潜在毒性
正向:抑制 IDO -> 阻断色氨酸向犬尿氨酸转化 -> 迫使色氨酸转化为吲哚
抑制IDO(一种将色氨酸转化为犬尿氨酸的酶)可能有助于治疗肠道屏障功能障碍。IDO抑制剂通过促进色氨酸转化为吲哚,增加AHR配体的生成,从而改善肠道完整性。
虽然IDO抑制剂在癌症治疗中显示出潜力,但它们在治疗肠道屏障损伤方面的应用仍需更多研究。Indoximod是一种IDO抑制剂,已被证明能有效维持细胞间的紧密连接,并显著减轻DSS诱导的结肠损伤。
反向:过度抑制 IDO -> 减少犬尿酸生成 -> GPR35 失去激活 -> 削弱屏障保护
需要注意的是,IDO抑制也可能导致不良的肠道毒性反应。完全阻断犬尿氨酸通路可能会适得其反,损害上皮屏障的完整性。
研究表明,化疗药物引起的肠道损伤会激活色氨酸-犬尿氨酸-犬尿酸通路,增加肠道内犬尿酸的生成。犬尿酸随后激活GPR35,从而增强肠道完整性。这意味着,过度抑制犬尿氨酸通路可能会降低犬尿酸水平,削弱GPR35介导的保护作用,并可能延缓屏障修复。
综上所述,色氨酸代谢在肠道健康中扮演着复杂的角色。因此,在开发治疗肠道屏障功能障碍的新方法时,需要进行更深入的研究。
临床挑战:个体化差异
虽然大量研究表明直接调节肠道微生物群可以改善肠道屏障功能并缓解肠肝疾病,但基于微生物的疗法在临床应用上仍然受到限制。
肠道微生物群产生的有益代谢物,如吲哚-3-乳酸(ILA),其增强肠道屏障的特性取决于宿主特异性的微生物群调节。临床疗效主要取决于患者的初始肠道微生物群组成,这会影响微生物的定植情况。
此外,宿主的遗传变异也是治疗结果的关键因素。例如,携带CARD9风险基因的炎症性肠病(IBD)患者,其膳食色氨酸向芳香烃受体(AHR)激活代谢物的微生物转化能力受损。这些发现解释了微生物靶向疗法中个体差异显著的分子机制。
益生菌作为疾病状态下耗尽的共生微生物,需要稳定的宿主微环境才能定植和发挥作用。如果事先不恢复受损的肠道生态系统,微生物干预疗法往往无法建立持久的微生物平衡或实现有意义的临床结果。因此,未来的治疗策略应采用结合微生物调节和微环境恢复的双靶点方法。
3
肠道干细胞再生
Lgr5+ 肠道干细胞 (ISCs):修复的原动力
肠上皮细胞的更新、修复和再生在很大程度上依赖于位于隐窝底部的Lgr5+肠道干细胞(ISCs)。
Lgr5作为ISCs的特异性标记,编码一种受体,该受体能够响应Wnt等信号,从而触发ISCs重编程为上皮细胞谱系。ISC的活性受到细胞外信号和旁分泌信号的精密调控,以维持肠道稳态,并在损伤发生时启动适应性分化,从而保障肠道的基本生理功能。
调控胆汁酸水平,恢复干细胞活力
胆汁酸在介导肠肝轴通讯中扮演着关键角色,并整合了调控ISC功能的饮食和代谢信号。近期研究提示,通过减少病理条件下肠道内过量的胆汁酸累积,或可为治疗炎症性肠病(IBD)相关的肠道损伤提供新的干预策略。
例如,FXR激动剂治疗通过抑制肝脏中CYP8B1的表达,进而降低肠肝胆汁酸水平,从而减轻胆汁酸对Lgr5+ ISCs的相关毒性。上述发现提示,基于跨器官代谢调节靶向ISCs有望成为治疗IBD的新型目标。
4
免疫调节
传统抗炎疗法的局限性
传统的抗炎疗法,包括皮质类固醇、5-氨基水杨酸制剂以及新型TNF-α单克隆抗体,一直是炎症性肠病(IBD)和其他免疫介导疾病的标准治疗方法。
虽然这些疗法能有效减轻炎症并缓解症状,但它们在实现长期愈合方面往往力有不逮,尤其是在肠道屏障方面。许多患者随着时间推移出现疗效丧失和疾病复发。例如,尽管抗IL-6抗体疗法在临床试验中对中度至重度克罗恩病(CD)或溃疡性结肠炎(UC)有效,但在一些患者中仍持续发生脓肿和肠穿孔等严重不良反应。
这些疗法通常未能解决根本的上皮功能障碍问题,而这正是维持慢性肠道炎症的关键因素。
新兴策略:直接靶向屏障修复
为了解决这些局限性,人们对靶向更直接参与上皮屏障修复的免疫通路越来越感兴趣。IL-10是一种有效的抗炎和组织再生细胞因子,最近开发的IL-10制剂旨在通过靶向黏膜屏障来增强治疗效果。
另一个有前景的靶点是IL-22,其受体IL-22R在上皮细胞上表达,这使得IL-22和IL-22R成为旨在恢复上皮完整性和增强黏膜愈合疗法的潜在候选者。
IL-22通过刺激AMPs(抗菌肽)和粘蛋白的产生以及ISC(肠道干细胞)的再生,在维持肠道稳态中发挥关键作用。因此,IL-22被认为是屏障修复的潜在治疗方法。
IL-22 激动剂的临床与代谢获益
IL-22融合蛋白激动剂Efmarodocokin alfa (UTTR1147A) 目前正在研究中,用于活动性溃疡性结肠炎(UC)和克罗恩病(CD)的治疗(NCT02749630)。
临床试验表明,UTTR1147A在UC患者和健康个体中都能激活IL-22R信号通路,并改善UC相关的菌群失调。
此外,肠道中IL-22信号的特异性激活可以在代谢紊乱模型中以微生物依赖的方式增强肝脏和全身葡萄糖和脂质代谢稳态。此外,IL-22还对MASLD(代谢功能障碍相关脂肪性肝病)、ALD(酒精性肝病)和饮食诱导的肥胖表现出积极作用。
当外源性给药时,IL-22通过其在肠上皮细胞(IECs)而非肝细胞上的受体发挥治疗作用,然后激活STAT3并抑制WNT–β-catenin信号传导以减少吸收性肠上皮细胞的数量。
然而,IL-22在肠道屏障维持中的作用仍存在争议,人们担心可能产生致病性的免疫调节作用,例如在结肠组织中介导CXCR2+中性粒细胞的趋化作用,以及增加对IL-23单克隆抗体Ustekinumab的抵抗力。这些观察结果表明,IL-22靶向疗法可能并非总能达到预期的疗效,需要进一步研究以更好地了解IL-22激活的全部影响和潜在副作用。
5
肠道屏障功能增强相关的临床试验进展
前面介绍了目前针对肠道屏障完整性的多种创新疗法,包括药物、微生物疗法、吸附剂、饮食干预和工程益生菌,并同时也探讨了这些疗法在临床验证中的进展和未来面临的挑战。
其实核心要点如下:
创新疗法:多项创新疗法正在进行临床验证,以靶向肠道屏障完整性。
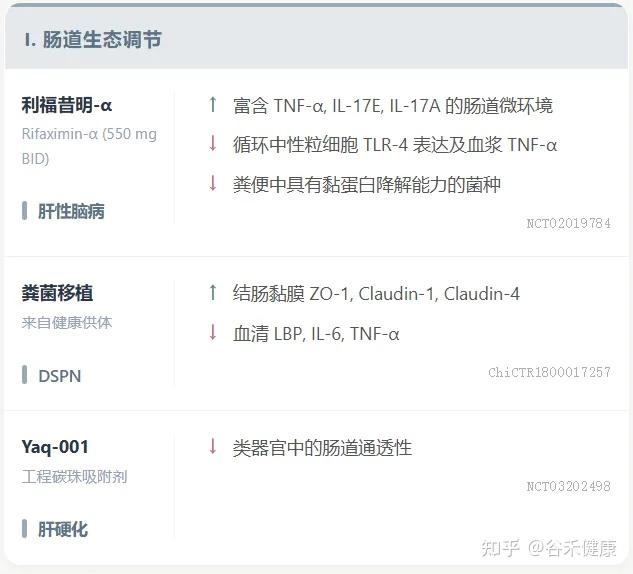
小分子创新 / 微生物疗法
ISM5411:一种新型肠道限制性选择性脯氨酰羟化酶结构域(PHD)抑制剂,通过AI平台开发,已完成I期临床试验。其在肠黏膜修复和免疫调节方面具有双重机制,在IBD模型中显示出显著疗效。
利福昔明-α (Rifaximin-α):通过上调粪便中的TNF-α和IL-17E来调节肠道微环境,增强抗菌防御,有效促进肠道屏屏障修复。
ZED1227:在乳糜泻中,作为转谷氨酰胺酶2抑制剂,显著改善十二指肠黏膜结构,减少上皮内淋巴细胞浸润,通过抑制免疫原性谷蛋白肽中谷氨酰胺残基的脱酰胺化来防止T细胞活化和黏膜损伤。
粪便菌群移植(FMT):健康供体FMT在恢复糖尿病远端对称性多发性神经病变(DSPN)患者肠道屏障功能和减轻全身炎症方面显示出治疗潜力。
工程益生菌:在恢复肠道屏障完整性和维持黏膜稳态方面具有显著治疗潜力,目前研究重点是结合其屏障增强和免疫调节作用,但仍在临床前阶段。
吸附剂:非吸收性、肠道限制性工程化碳珠吸附剂Yaq-001通过改善肠道屏障功能障碍和减少全身内毒素负荷,在肝硬化中显示出临床疗效。

饮食干预
临床研究证实,膳食干预在多种胃肠道疾病中有效。
谷氨酰胺补充剂:显著恢复肠道通透性并缓解感染后肠易激综合征的腹泻 (NCT01414244)。
在肠易激综合征-腹泻、代谢紊乱和轻中度克罗恩病中均显示出益处。

未来挑战
尽管这些进展显示了靶向屏障修复策略的广阔前景,但仍需要在人体试验中全面评估长期安全性和有效性,以推进临床应用。
肠道屏障功能障碍是多种胃肠和肠外疾病(如IBD、MASLD)的关键因素。传统免疫抑制疗法虽能改善症状,但无法根治屏障问题,且副作用明显。新型疗法应结合屏障修复策略,如干细胞再生、微生物疗法、胆汁酸调节、TJ调节剂等。
肠道屏障功能障碍与疾病互为因果,受遗传、环境等因素影响。屏障破坏可引发炎症和多器官功能障碍,导致MASH、IBD、CRC等。同时,疾病微环境反过来又损害屏障,形成恶性循环。
免疫抑制疗法可能抑制黏膜愈合,加剧微生物失衡。需深入研究肠道细胞间通讯,以确定有效治疗靶点。
独立于免疫抑制的屏障防御和修复是治疗肝肠疾病的重要目标。个性化治疗策略可能更有效。增强肠道屏障完整性在MASLD预防和逆转中潜力巨大。未来人体研究至关重要。
恢复肠道屏障是治疗肝肠疾病的重要机遇。新生物技术、再生医学和微生物组研究有望重塑胃肠道治疗格局。
主要参考文献:
Zhang Y, Liu Y, Liang X, Wen Y, Zhao J, He Y, Xie Q, Xie C. Intestinal barrier in chronic gut and liver diseases: Pathogenesis and therapeutic targets. Acta Pharm Sin B. 2025 Nov;15(11):5515-5536.
Macura B, Kiecka A, Szczepanik M. Intestinal permeability disturbances: causes, diseases and therapy. Clin Exp Med. 2024 Sep 28;24(1):232.
Farré R, Vicario M. Abnormal Barrier Function in Gastrointestinal Disorders. Handb Exp Pharmacol. 2017;239:193-217.
Brandl C, Bucci L, Schett G, Zaiss MM. Crossing the barriers: Revisiting the gut feeling in rheumatoid arthritis. Eur J Immunol. 2021;51(4):798–810.
Ramakrishna BS. Role of the gut microbiota in human nutrition and metabolism. J Gastroenterol Hepatol. 2013;28(Suppl 4):9–17.
Bäumler AJ, Sperandio V. Interactions between the microbiota and pathogenic bacteria in the gut. Nature. 2016;535(7610):85–93

谷禾健康

在自然界中,一些引人注目的共生现象出现在能够改变宿主行为的微生物与其宿主之间。
这些病原体的“精神控制”能力激发了许多末日小说作品,如HBO剧集《最后生还者》中令人毛骨悚然的真菌感染场景。
延展小知识
关于细菌沃尔巴克氏体、狂犬病毒、偏侧蛇虫草菌
Wolbachia pipientis 操控昆虫生殖及神经
Wolbachia pipientis 被喻为生物基因“木马”,可以操控昆虫生殖。常见于节肢动物门和部分线虫体内,影响所寄生动物的生殖和发育。除了影响生殖外,当它们转移到一个新的物种时,会使新寄主产生各种严重的神经系统并发症。2009年开始,科学家发现Wolbachia pipientis阻止登革热病毒在蚊子体内复制增殖,从而阻隔登革热的传播。
2019年,中山大学的研究人员利用利用Wolbachia pipientis感染的雄蚊使得雌蚊无法繁殖下一代几乎消灭了世界上最具侵入性的蚊子种类 – 亚洲虎蚊(白纹伊蚊,本地俗称花脚蚊)。
狂犬病病毒 (Rabies virus)
狂犬病病毒(Rabies virus,RABV) 感染宿主中枢神经系统的重要人兽共患病,一旦发病死亡率接近100%,每年造成全球几万人死亡。
Ophiocordyceps unilateralis,僵尸蚂蚁
Ophiocordyceps unilateralis ,也被称为偏侧蛇虫草菌,是一种拟寄真菌,偏侧蛇虫草菌在感染蚂蚁后,能够通过释放化学物质改变和控制蚂蚁的行为,让变成蚂蚁自己的傀儡,直到最终死亡。HBO新剧《最后生还者》(The Last of Us)第一季让大家领教了真菌的厉害。剧中的这种致命真菌就是偏侧蛇虫草(Ophiocordyceps unilateralis),它能够入侵昆虫的大脑,使其成为僵尸。
然而,改变行为的微生物并不仅限于这些极端的寄生生物。在自然界中,已有关于共栖和互利微生物驱动宿主行为操控的描述。这个观点在发现胃肠道内的细菌可以调节宿主中枢神经系统后,得到了广泛关注和逐步证实。
肠道微生物群——这一动态且多样化的微生物群落,被认为是肠-脑相互作用的关键调节器。与自然界中那些极端的”精神控制”案例不同,人体肠道微生物群以更加微妙和复杂的方式影响着我们的情绪、认知和行为。
各种证据表明,肠道细菌发出的信号可以循环到大脑,或影响肠-脑轴免疫和内分泌细胞的功能。一个庞大的神经网络——外周神经系统,不断且迅速地在肠道和大脑这两个远距离器官之间传递信息,使大脑能够协调胃肠功能,而肠道也能够影响情绪、认知和行为。
临床意义:当微生物失衡遇上疾病
肠道微生物结构的改变与这些生物系统的变化相关,并对人类代谢、神经精神和肠道健康产生重要影响。焦虑、抑郁、自闭症谱系障碍(ASD)和帕金森病等多种神经疾病都具有明确的胃肠疾病合并症。诸如肠易激综合征(IBS)和炎症性肠病等胃肠疾病常常表现为心理症状。关键是,这些临床相关性与失衡的微生物群和紊乱的肠—脑信号密切相关。
四条通路:微生物与大脑的对话方式
目前已经比较清晰的知道,连接肠道微生物群和大脑的四种主要通信方式。
肠道微生物群-脑轴
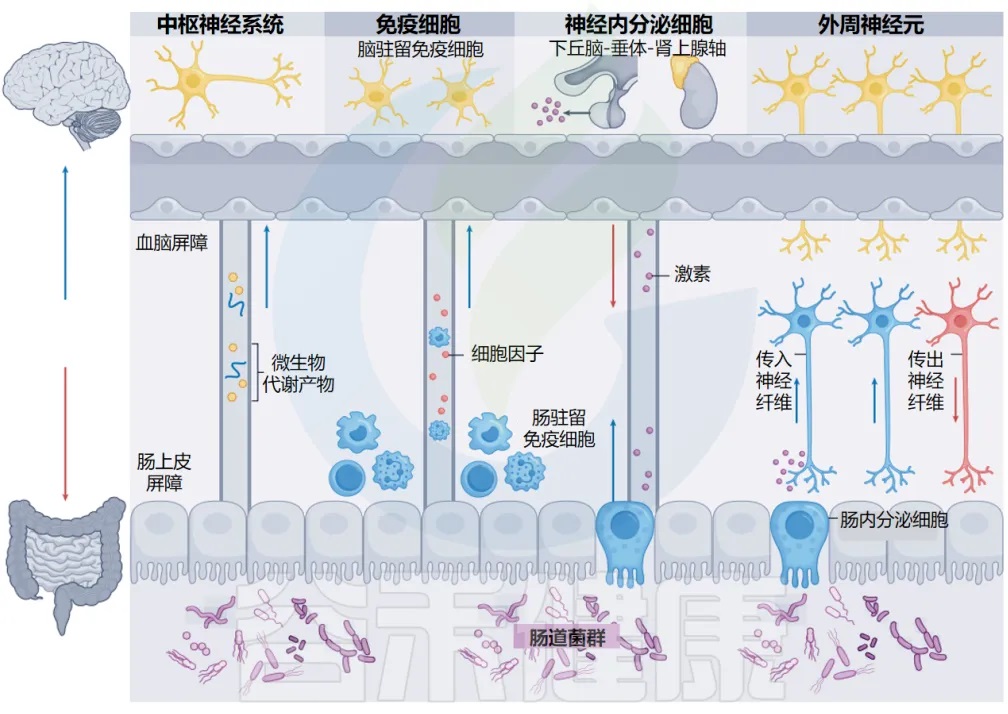
doi.org/10.1038/s41579-024-01136-9
聚焦核心:肠道神经上皮回路的精密机制
这些途径以多种方式相互交叉和影响。免疫细胞和周围神经元之间(神经-免疫轴)、神经内分泌细胞和免疫细胞之间(神经内分泌-免疫轴)、以及肠上皮细胞和周围神经元之间的双向串扰(肠神经上皮轴),为肠道和大脑之间的通信增加了额外的复杂性。
其中,肠上皮的化学感应细胞与支配肠道并延伸到中枢神经系统的周围神经元之间的关系尤为关键。这些肠道神经上皮回路代表了微生物-宿主相互作用的最前沿和最精密的机制。
本文我们将深入了解这些肠道神经上皮回路的分子机制、细胞间相互作用,以及它们如何导致疾病状态,揭示肠道微生物群如何通过这一精密的神经网络实现对宿主行为的影响。理解这些途径有助于促进基于微生物组的胃肠道和神经系统疾病新疗法的开发。
胃肠道免疫系统和神经系统
在哺乳动物中,胃肠道包含最大的免疫系统、微生物群生态系统和内源性神经系统,它们之间复杂的相互作用有助于维持正常的胃肠道生理功能。
特别是胃肠道的固有神经系统,即肠神经系统,调节着重要的胃肠道功能。肠神经系统回路的破坏会导致全身性的胃肠道症状,如腹泻、便秘、内脏疼痛等,这些症状影响着世界上高达40%的人口。
注:肠神经系统,enteric nervous system,简称 ENS,被誉为”第二大脑”。
神经免疫微环境的动态感知机制
胃肠道免疫系统和神经系统都进化出了感知和快速响应动态肠道环境的机制,能够实时监测并快速响应肠腔内的营养、微生物及病理性刺激信号。
许多神经将胃肠道粘膜中的局部免疫细胞连接起来,形成神经元免疫细胞单位,这些细胞单位可以通过肠道管腔营养来源和微生物来源的线索重塑。这些单元不仅能够独立启动局部免疫应答,还通过细胞间通讯网络进行信息整合,最终形成由肠道微生物群精密调控的”肠道神经-免疫轴”。这些协调一致的信号轴调节胃肠道屏障功能、免疫力和宿主保护。
病原感染中的神经免疫协同防御
肠道神经和免疫相互作用在感染期间尤为重要。感染应激可激活特定的胃肠道功能,可以通过腹泻反应快速清除病原体,腹泻反应可以通过增加局部水分泌到管腔中并促进推进性收缩模式来清除病原体,这两种反应都需要肠神经系统(ENS)的输入。
此外,感染或炎症引起的肠神经系统结构和/或活动紊乱可以促进或减少炎症,产生胃肠道症状,并限制组织病理学。
肠神经系统也可以再生,从而在损伤后恢复胃肠道功能。然而,在许多情况下,完全恢复往往受到限制,并且肠神经系统的损害可能产生长期后果,例如感染后胃肠道疾病。
肠道神经和免疫的相互作用的证据
尽管免疫系统与神经系统过去被分开单独研究,但现在越来越清楚,这两个复杂系统在功能上密切相关。这两个系统相互交流并不是一个新概念。两千年前,罗马医生Aulus Cornelius Celsus将炎症的四个主要症状归纳为:
疼痛、发红、肿胀、发热
其中疼痛由感觉神经系统引起,后三者则与血管和免疫功能相关。
神经对于宿主抵御病原体的调控也是进化上保守的特性,这一点从简单的多细胞动物(如线虫)到脊椎动物(如鱼和哺乳动物)的研究中都有明确证据。
过去几十年,科学家们发现神经—免疫交流在生理、抗感染、防御、修复和疾病中的多种作用。
肠道神经解剖——层层保护系统
肠道的神经解剖结构由居于器官内外的感觉神经元和自主神经元共同组成(感觉神经元负责感知信息,自主神经元负责自动控制),胃肠道在解剖学上由肠系膜、浆膜、肌肉、粘膜下层、固有层和上皮组成,由多个周围神经元群支配,这些神经元群与局部免疫细胞配合和协调反应。
肠系膜:是连接肠道与腹壁的重要结构,其主要功能是支撑、固定和保护肠道,同时为肠道提供血液供应和淋巴引流。
浆膜:保护器官,减少摩擦,参与免疫反应、维持器官位置。
肌肉:负责肠道蠕动的动力系统,推动食物通过消化道、进行机械性消化以及促进营养物质的吸收。
粘膜下层:提供营养和支持,还通过其神经和血管网络调节消化和分泌活动。
固有层:为上皮细胞提供结构支持,是免疫细胞聚集的防御前线,参与免疫防御、营养吸收和消化过程。
上皮:保护、分泌、吸收、免疫防御。
肠道支配神经元的命名法基于细胞体是位于胃肠道外部还是内部。肠道相关神经元通常归类为属于内源性肠道神经系统(ENS)。
相比之下,肠道外源性神经元包括体感神经元和自主神经神经元,其细胞体位于外周感觉或自主神经节、脊髓或脑干中。
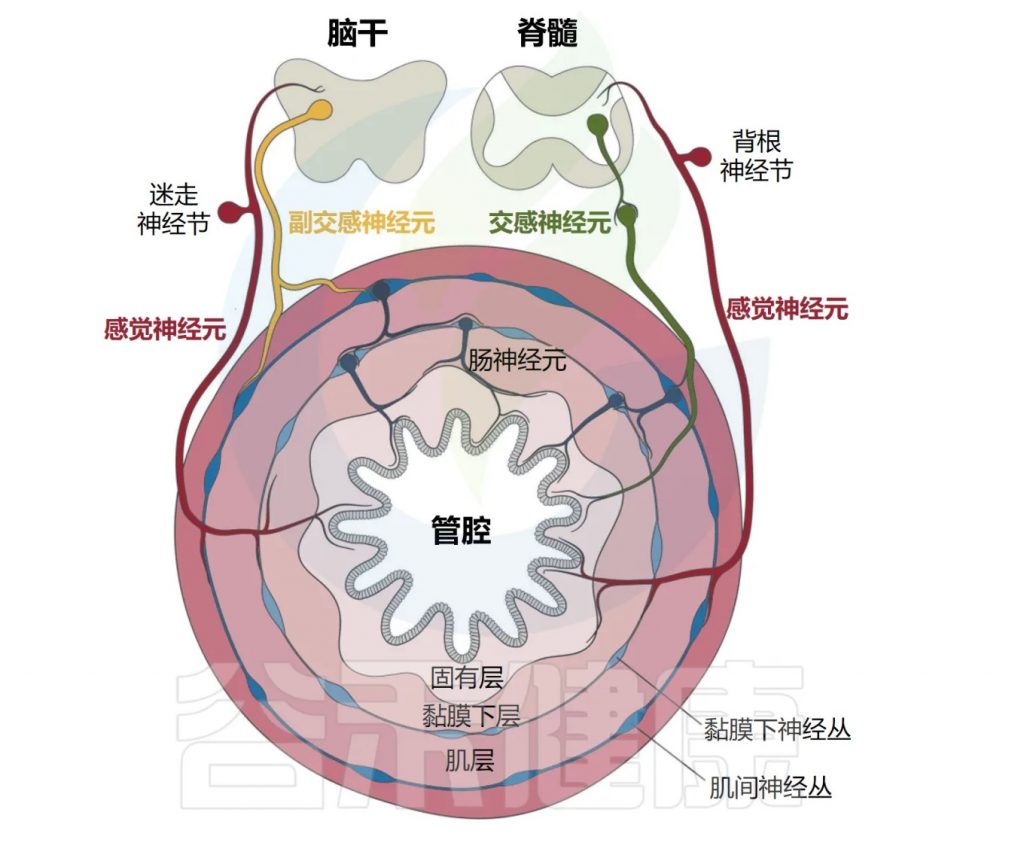
Yang et al. Cell Mol Immunol, 2023.
肠道外源性感觉神经元位于结节/颈静脉迷走神经节(VG)和背根神经节(DRG)中,分别将信号从肠道传递到脑干和脊髓。
自主神经神经元也支配肠道,包括迷走神经传出副交感神经运动神经元和位于自主神经节中的交感神经元。
肠道还拥有自己的内在和自主神经系统,由肠道神经元组成,它们的细胞体位于肌间神经丛和粘膜下神经丛中(如下图)。
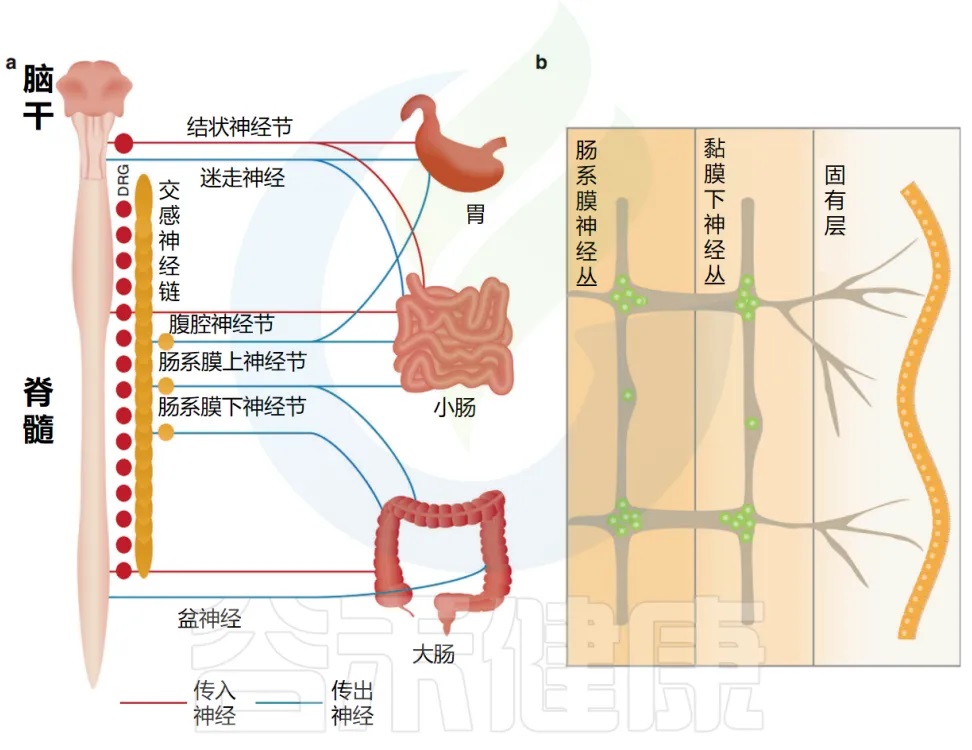
doi.org/10.1038/s41385-020-00368-1
交感神经 vs 副交感神经:肠道的刹车和油门
交感神经元和副交感自主神经神经元分别起源于脊髓和脑干,并介导从大脑到肠道的信号转导。
神经支配的地理分布
迷走神经副交感神经元沿前尾方向支配胃肠道,胃的神经支配密度最高,小肠和结肠的神经支配密度降低。
这种分布差异与不同肠段的消化功能需求相关:胃的高密度神经支配支持其机械研磨与酸性环境调控,而结肠的低密度则反映其以水分吸收和粪便塑形为主的生理特性。
交感神经元和副交感神经元都与肌间神经丛中的 ENS 形成连接,形成错综复杂的局部神经回路。
神经元——两根触手
它们能感知什么?
这些感觉神经元群检测营养物质、机械拉伸、管腔威胁和免疫刺激,包括细胞因子。
除了感知,还会“说话”
这些神经元还通过从周围神经末梢释放神经肽在肠道内发出信号(神经肽就像”化学信号”,用来和周围的细胞交流。)。迷走神经节神经元主要支配近端小肠,而 DRG 神经元支配整个胃肠道。
肠道神经网络的双层架构
肠道神经元完全驻留在胃肠道内,并组织成环绕肠管的神经节网络,并在空间上分为两层:肌间神经丛,位于圆形和纵向肌肉层之间,以及粘膜下层的粘膜下神经丛。
这两个神经丛通过中间神经元、运动神经元和肠神经胶质细胞紧密相连。它们一起形成介导蠕动和分泌功能的反射回路。
此外,它们还整合来自外源性感觉、副交感神经和交感神经神经元的信号,以介导肠道生理学。
肠道神经和免疫的共同语言
神经系统和免疫系统已经进化出一种共同的语言,在它们对环境损伤的每一步反应中进行交流,从起始到解决。
神经系统和免疫系统:互相听懂语言
微生物:神经-免疫对话的调节员
神经系统与免疫系统之间的交流机制从进化角度来看是有道理的,因为这种机制减少了应对某些损伤的代价,并使两个系统能够协调复杂的宿主反应。微生物组在调节神经元激活和免疫发育中也起着关键作用。
鉴于免疫细胞和神经元都可以直接或间接感知微生物,微生物组的组成在神经元分化或成熟中起着关键作用,以调节内脏疼痛、肠道蠕动和肠道生理的其他方面。
中枢神经系统的调节
短链脂肪酸它如何发挥作用?
尽管生物屏障严重限制微生物进入 CNS,但是某些肠道微生物代谢物,如短链脂肪酸(SCFA),可以穿过血脑屏障并起神经调节剂的作用。例如,乙酸盐优先被下丘脑吸收,下丘脑是参与食欲控制的大脑中枢,直接抑制摄食行为 。
尽管 SCFA 受体在大脑中通常以低水平表达,但这些纤维发酵产物可以通过抑制组蛋白脱乙酰酶来调节神经元基因表达。
4-乙基苯基硫酸盐,参与情绪处理的大脑区域
除了 SCFAs,最近有报道称微生物代谢物 4-乙基苯基硫酸盐可以改变参与情绪处理的大脑区域,例如海马体和杏仁核,并诱导小鼠的焦虑样行为。由于无菌动物在基线时表现出异常的大脑化学和结构,这些改变发生的时间已成为一个关键的研究重点。目前越来越多的工作揭示了母婴肠道微生物组对早期神经发育结果的影响。
免疫细胞的调节
在皮肤、肺和肠道等屏障组织中,免疫细胞和神经纤维紧密相邻,它们经常互相聊天,交换神经免疫调节分子来保护身体健康。
为什么要这样合作?
这种神经免疫轴在面对感染、过敏原或毒素时尤为重要,因为这些情况需要快速的组织保护反应,然后进行行为适应以避免未来再次遭遇。
具体怎么合作?
– 食物过敏的例子:
通过食物过敏的动物模型,两项最近的研究发现,肠道里的肥大细胞发现过敏原,它们向大脑发送特定信息,大脑记住这种食物,下次就会产生回避行为。
– 皮肤过敏的例子:
皮肤中的γδ T细胞受到微生物调节,它们能调节感觉神经元的活动,控制过敏反应的强度。肠道黏膜γδ T细胞是否参与神经元信号传递仍有待确定。
免疫细胞的远程通讯:如何向大脑发送消息?
免疫细胞不只是在局部工作。它们还有两种方式向大脑汇报:
方式一:血液快递
免疫细胞把细胞因子释放到血液中,就像发快递一样,把信息送到大脑。
方式二:亲自出差
肠道中某些免疫细胞,例如IgA+浆细胞(专门产生抗体)和自然杀伤细胞(专门杀死异常细胞),也能搬家到大脑或脑膜,从而在中枢神经系统中发挥作用。
肠道细菌的重要作用
这些细胞的功能成熟很大程度上依赖于来自肠道的微生物信号。
– 实验证据:
无菌动物(没有肠道菌群的动物)大脑中的IgA+浆细胞和“激活”的自然杀伤细胞数量会减少。
大脑常驻免疫细胞也会受到肠道细菌的影响
例如小胶质细胞和T细胞,也会受到来自肠道菌群的信号影响。 在这方面,细胞因子IL-17,特别是来自脑膜γδ T细胞的IL-17,作为肠道菌群和行为之间潜在的联系受到了广泛关注。
神经内分泌细胞的调节
下丘脑:身体的应激总指挥
下丘脑也是通过下丘脑-垂体-肾上腺(HPA)轴调节身体应激反应的关键指挥者。这个主要的神经内分泌系统包含几个严格调控的激素级联反应(就像接力赛一样,一个传一个),促进器官间的稳态。
肠道细菌影响压力反应
无菌动物具有夸大的HPA反应,并伴有应激诱导的糖皮质激素水平升高。
早期接触共生微生物对HPA轴的正常调节非常重要。简单说,婴儿期的肠道细菌会影响我们一生应对压力的能力。
肠内分泌细胞:肠道里的激素工厂
肠道也包含其自身的神经内分泌细胞群,称为肠内分泌细胞 (EECs):
这些激素调节消化、葡萄糖稳态、食欲。虽然主要在营养感知的背景下进行研究,但 EECs 越来越被认为是肠道菌群的关键传感器和肠-脑信号传导的介质。
肠道激素:连接肠道与大脑的信使
肠道菌群会影响多种循环激素的分泌:
这些激素作用范围很广
这些激素中的大多数在胃肠道神经纤维、下丘脑和其他大脑区域都有靶点。
由于这些激素及其前体也由身体的各种神经元和非神经元细胞产生,因此了解 EEC 来源的信号对动物行为的具体贡献一直是一个重大挑战,近年来随着基因工具的进步,解决这一问题成为可能。
外周神经元的调节
第四条高速路:外周神经系统的闪电传输
肠道微生物与大脑之间的第四个联系是外周神经系统 (PNS),特别是自主神经系统 (ANS),它具有副交感神经和交感神经两个分支。
神经传输有什么特点?
与前面提到的激素传输或细胞迁移不同,神经系统传输信息超级快:
肠道的双重神经网络:外在 vs 内在
– 外在
作为一种内脏器官,胃肠道由“外在”传入和传出神经纤维支配,其细胞体位于大脑或脊髓区域,分别介导肠道到大脑和大脑到肠道的信号传递 。
– 内在
“内在”肠神经系统 (ENS) 的神经纤维也分布在胃肠道中,其细胞体位于肠壁外层。它们在很大程度上自主地执行基本的肠道功能,并接收来自微生物组和中枢神经系统的输入。
迷走神经:肠脑对话的专线电话
迷走神经作为副交感神经系统的主要分支,尤其与肠-脑通讯密切相关,具有传入和传出神经纤维。它在维持肠道稳态以及调节情绪、食欲和能量平衡方面发挥重要作用。
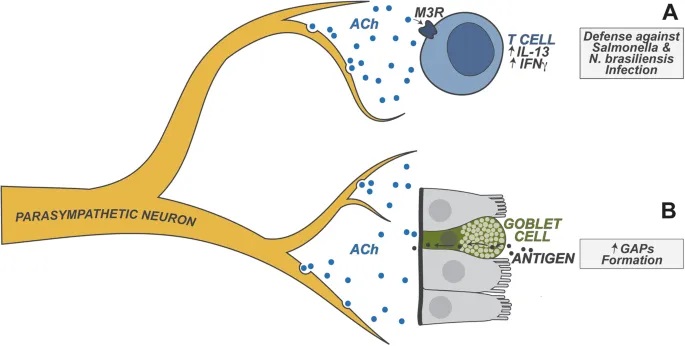
doi.org/10.1038/s41423-023-01054-5
实验证据
在迷走神经切断动物(即接受了迷走神经切断术的动物)中,肠道菌群的许多效应都会消失。然而,微生物信号是否能直接调节体内迷走神经的活动,目前证据仍然有限。
脊髓传入神经:疼痛信号的传递者
脊髓传入神经通过脊髓将感觉信息从肠道分别传递到大脑。我们对微生物组通过脊髓神经发出信号的许多了解都与内脏疼痛有关,因为许多这些纤维都是疼痛感应的。无菌动物表现出对结直肠扩张的超敏反应,而益生菌治疗可以缓解这种反应。共生微生物是否通过脊髓通路影响大脑生理或行为,目前仍不清楚。
交感神经系统:应激反应的调节者
交感神经系统调节多种胃肠道功能,尤其是在应对急性应激时。无菌小鼠的交感神经活动长期升高,这与这些动物体内HPA轴反应的增强相呼应。有趣的是,微生物群对交感神经活动的调节依赖于迷走神经传入纤维的信号,突显了周围神经系统相互关联的性质。
肠道神经元:免疫系统的调度员
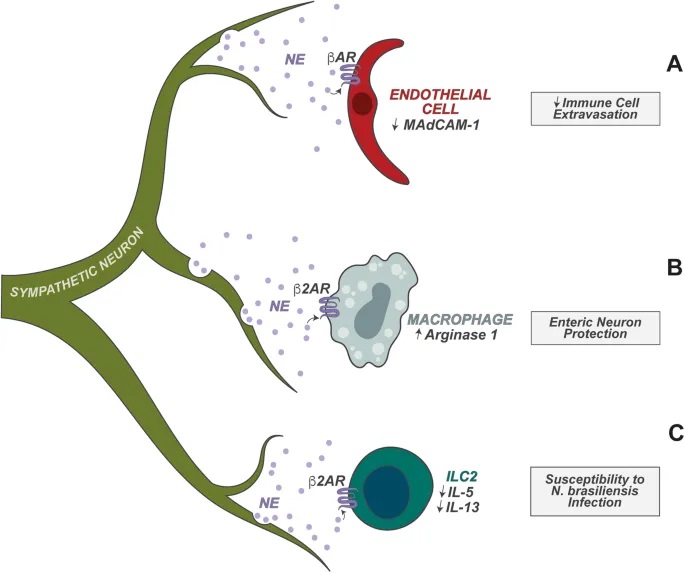
肠道神经元是异质性的,能释放两大类物质来调节免疫功能:
– 细胞因子:
IL-18:调节抗菌肽的杯状细胞表达,抗菌肽介导宿主对肠道鼠伤寒沙门氏菌感染的保护
IL-6:抑制结肠中 RORγ+ 调节性T细胞的分化
– 神经肽:
NMU(神经调节素U)
CGRP(降钙素基因相关肽)
VIP(血管活性肠肽)
神经元与先天淋巴细胞的密切合作
肠道神经元还协调肠道先天淋巴细胞 (ILC) 的功能方面也起着重要作用。ILC 是协调下游适应性免疫的早期反应先天淋巴细胞。
– 空间优势
肠道神经元靠近 ILC,为这些神经元调节 ILC 功能奠定了细胞基础。
– ILC2的调节:过敏反应控制
ILC2 高度表达 NMUR1,NMUR1 是神经肽神经中介U(NMU)的受体。肠道感觉神经元的一个亚群表达 NMU,NMU 在过敏情况下释放。
– ILC3的调节:昼夜节律与宿主防御
肠道神经元在调节肠固有层 3 型 ILC (ILC3) 的功能中也起着关键作用。ILC3 表达高水平的 VIPR2,VIPR2 是神经肽 VIP 的受体。
肠道神经元的一个子集(以及迷走神经感觉神经元)表达高水平的 VIP,并且已发现它们在稳态和宿主防御期间调节 ILC3 功能。
– 具体调节过程
进食触发:食物消耗以昼夜节律方式触发VIP的神经元产生;
抑制作用:VIP抑制ILC3介导的IL-22产生,消除抗菌肽的肠道表达;
实验验证:VIP+神经元的化学激活导致IL-22+ ILC3比例降低,使宿主易受口腔啮齿柠檬酸杆菌感染。
doi.org/10.1038/s41423-023-01054-5
肠道上皮每天都要面对来自食物和肠道菌群的各种化学物质。有时,有害刺激物和病原体会进入胃肠道,需要迅速采取损害控制措施。
为了理解管腔环境并区分“好”和“坏”,EEC(肠内分泌细胞) 和周围神经共同形成了一个广泛的肠道感觉网络。
信息处理:局部处理 vs 上报大脑
这些感觉信息有两种处理方式:
同时,大脑也会向肠道发送指令,引起特定的器官间反馈反应。
肠道神经上皮界面的肠道微生物群到大脑通路
Ohara et al. 2025. Nat Rev Microbiol
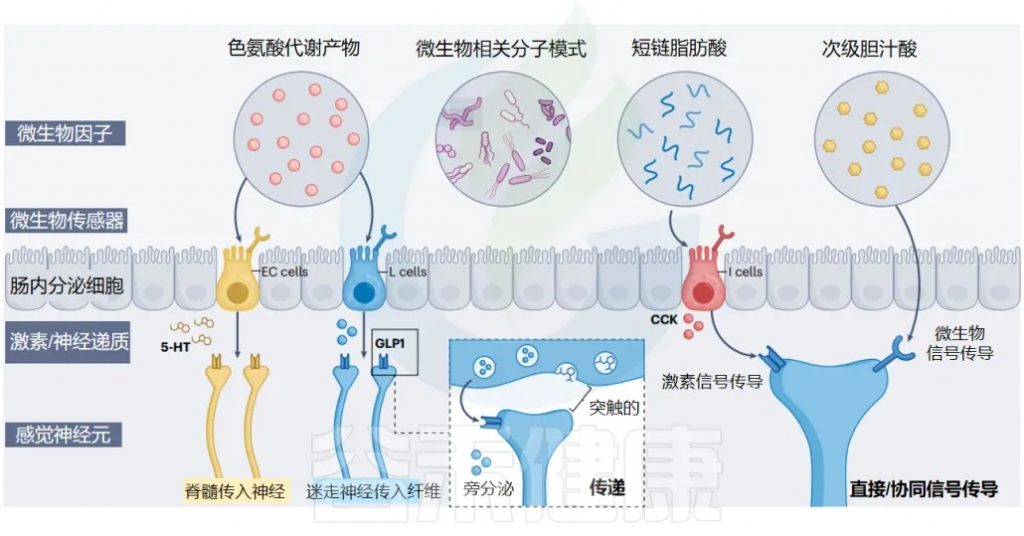
肠内分泌细胞:肠道的化学传感器
肠内分泌细胞 (EECs) 是肠道的主要化学感应上皮细胞,通常根据其主要激素产物进行分类。产生 CCK、GLP1/PYY 和 5-HT 的 EEC 分别称为 I 细胞、L 细胞、肠嗜铬细胞(EC)。
在 EEC 家族中,这三个亚群最密切地参与肠-脑通讯:
EECs的灵活性
一些 EEC 在其生命周期中分泌多种不同的激素或经历激素转换,这表明 EEC 亚型并非完全固定。
重要的是,微生物组感应受体在远端肠道的 L 细胞和 EC 细胞中富集,这个区域正好是细菌载量最高的地方,并且主要被认为发生微生物-EEC 信号传导。
简单说,细菌最多的地方,正好是感应细菌信号的传感器最多的地方。
微生物相关分子模式 (MAMP)
MAMP
微生物相关分子模式(MAMP)就想是细菌身上的身份标识牌,是微生物上进化上保守的结构,就像每个细菌都带着固定的身份证。宿主细胞可以通过模式识别受体来读取这些身份信息,特别是先天免疫细胞,它们是识别细菌身份的专家。
Toll样受体
在模式识别受体中,Toll 样受体(TLR)在维持肠上皮细胞稳态中起着至关重要的作用。
肠内分泌细胞表达不同的TLR
体外和体内研究表明,肠内分泌细胞 (EECs) 表达几种不同的功能性 TLR,包括:
TLR信号如何影响激素分泌?
肠道中的 TLR 信号传导与 CCK(胆囊收缩素)、GLP1(胰高血糖素样肽1) 、5-HT(血清素)分泌的调节有关,但这仍有待进一步验证。
TLR4 也在感觉传入神经元中表达,但其与微生物组感应的相关性尚不清楚。
短链脂肪酸(SCFA)
短链脂肪酸(SCFA)是膳食纤维发酵的最终产物,由厌氧菌在结肠中大量产生。
特定的支链短链脂肪酸,如异戊酸盐和异丁酸盐,由肠道细菌通过支链氨基酸发酵制成。特征最明显的 SCFA 受体是游离脂肪酸受体2 (FFAR2)和 FFAR3,它们都在多个 EEC 亚群中表达,说明很多肠内分泌细胞都能听到SCFA的信号。
FFAR受体:如何传递SCFA信号?
FFAR 是一种 G 蛋白偶联受体,当被激活时,它与几个下游信号级联反应相连,就像按下按钮后,触发一连串的反应。
– 对L细胞的影响
SCFA 与 L 细胞上的 FFAR2 和 FFAR3 结合会触发细胞内钙动员(也就是钙离子在细胞内快速移动)以及 GLP1 和 PYY 的释放。
EC细胞:用嗅觉受体来感应SCFA
在结肠中,EC 细胞也通过 FFAR 以及嗅觉 G 蛋白偶联受体 OLFR78 和 OLFR558(refs)受到 SCFA 的调节。
不同种类的SCFA有不同的分工
尽管FFAR3在 I 细胞中广泛表达,但尚不清楚 SCFA 是否调节CCK的产生。FFAR2 和 FFAR3 在肠道支配感觉神经元中也有功能表达,表明传入神经纤维可能直接对SCFA做出反应。
次级胆汁酸
次级胆汁酸是肠道微生物群产生并被宿主识别的另一类重要代谢物。最初是肝脏产生的初级胆汁酸,这些初级胆汁酸到达远端肠道后,被肠道细菌进行”二次加工“,变成了次级胆汁酸。
简单说,这是肝脏和肠道细菌合作的产物。
主要的次级胆汁酸:两大明星分子
脱氧胆酸(DCA)和石胆酸是两种含量最丰富的次级胆汁酸,能够通过多种宿主受体发出信号,特别是 TGR5(也称为 G 蛋白偶联胆汁酸受体 1)和法尼醇 X 受体。两种受体都在 L 细胞中表达,并参与 GLP1 和 PYY 释放的调节,这就解释了为什么肠道细菌的变化会影响我们的血糖控制和食欲调节。
对EC细胞的影响:调节血清素产生
次级胆汁酸还向 EC 细胞发出信号,通过 TGR5 和可能通过 Tph1 的下游转录指导 5-HT 的产生,Tph1 编码 5-HT 生物合成的限速酶。
目前尚不清楚次级胆汁酸是否作用于 I 细胞,但这些胆汁酸的一部分可以通过肠肝循环到达近端肠道,并且表达 CCK A 型受体的迷走神经传入神经亚群以 TGR5 依赖性方式对 DCA 有反应。
色氨酸和吲哚衍生物
色氨酸是一种从膳食蛋白质中获得的必需氨基酸,人体无法自己制造,其分解产物代表了另一类有助于宿主健康的微生物代谢物。
吲哚途径:细菌的化学加工厂
在色氨酸降解的三个主要途径中,吲哚途径由肠道中的许多细菌物种进行,将色氨酸转化为吲哚及其衍生物,如吲哚-3-乙酸(IAA)和吲哚-3-醛。
吲哚类物质如何影响EECs?
吲哚是 L 细胞中 GLP1 分泌的已知诱导剂。也就是说,吲哚能够刺激L细胞释放GLP1。
在斑马鱼中,吲哚和吲哚-3-醛强烈激活 EEC 并通过瞬时受体电位锚蛋白 1 通道触发 5-HT 释放。
瞬时受体电位锚蛋白1:多功能的感应通道
瞬时受体电位锚蛋白 1 不仅能感应吲哚类物质,还有其他身份,它也是环境刺激物的传感器,比如能感应芥末油(这就解释了为什么吃芥末会有刺激感)。
瞬时受体电位锚蛋白 1 在哺乳动物EC细胞和感觉神经元中高度表达,可能是促进胃肠道蠕动和清除摄入毒素的机制。
在检测到微生物群衍生因子后,肠道感觉网络将此信息传递给CNS。这种传输究竟是如何发生的,特别是在脑-身体通信的背景下,是目前积极研究的一个领域。
新兴的经典肠道神经上皮通路涉及:
肠道感觉网络
肠内分泌细胞(EEC)和肠道支配感觉神经元在肠粘膜屏障处共同形成一个复杂的感觉网络,能够感知和响应各种微生物结构和代谢物。这些包括色氨酸代谢物、微生物相关分子模式、短链脂肪酸和次级胆汁酸。
结肠中的两大主力
在结肠中,有两类重要的EEC:
这两类细胞都表达这些微生物信号的受体,能够直接听到细菌的声音。
I细胞主要位于小肠中,生产胆囊收缩素(CCK),同样表达微生物传感器。
信号传递的两种方式
当EEC被激活时,它们会通过两种方式释放信号分子:
EEC会释放:
传递给:
不仅影响EEC,还直接影响神经
微生物输入还可以直接调节感觉神经纤维的敏感性,从而增强 EEC-神经荷尔蒙信号传导。
不同信号走不同高速路
根据所涉及的微生物传感器、EEC 亚群、神经肽和感觉神经元类型,不同的微生物线索可以通过不同的肠道神经上皮途径输送,最终对大脑功能和行为产生不同的影响。
感觉细胞多样性
肠道里的神经元是怎么工作的?
肠道中有两大类感觉传入神经负责不同的监测任务:
最近对迷走神经和脊髓神经元的分析发现了多种感觉神经元细胞类型,甚至在化学感受器和机械感受器中也是如此。
为什么需要这么多不同类型的神经元?
结合遗传的研究方法,得出一个研究的共识,即单个感觉神经元之间存在很大的分工。每种神经元都有自己的专业领域,就像专科医生一样。
这些神经元到底分工有多细?
一些具体的例子:
复杂分工的深层原因:系统的精密设计
这种刺激特异性神经元反应可能反映了肠道神经上皮水平信息感知和传递方式的复杂性,部分原因是 EEC 和感觉神经元群的异质性。这种精密的设计确保了肠道能够准确识别和传递各种不同的信号。
未来:寻找微生物组专属神经元
这些观察结果提出了一个有趣的问题,即是否有专门的“微生物组响应”感觉神经元来支配肠道,以及是否存在基于微生物刺激的亚型。
当然,GPR65 + 迷走神经神经元是不错的候选者,因为它们是在整个胃肠道中具有致密粘膜神经末梢的化学感受器。
然而,随着迷走神经支配沿结肠长度向远端减少,脊神经可能同样有助于将微生物线索传递给 CNS。
旁分泌传递与突触传递
传统方式:EEC的广播信号传递
当EEC受到刺激后,它们会采用最常见的信号传递方式:
这通常被认为以旁分泌方式发生——即最接近 EEC 范围,只要表达相关受体的纤维,就能接收信号并传播给大脑,也就是“近水楼台先得月”。
新发现:EEC的专线连接方式
科学家们发现了一种更直接的连接方式!研究发现了一种独特的 I 细胞和 L 细胞亚群,被称为”神经足”细胞。
– 什么是”神经足”细胞?
更多证据:EC细胞也有类似的专线
对于 EC 细胞和脊髓传入纤维提出了类似类型的连接。支持这种突触连接的证据:
然而,最近的高分辨率成像研究尚未发现令人信服的证据证明 EEC 和传入神经之间存在突触接触,这表明神经足细胞要么非常罕见,要么仅存在于某些 EEC 亚型中。另一种解释是,考虑到大多数 EEC 的寿命较短,EEC-神经突触是高度动态的。
了解 EEC 的特定子集是否可以直接进入大脑很有价值,因为它们将是影响与肠道微生物群相关的情绪和行为变化的候选者。
协作微生物-宿主信号传导
到目前为止,我们已经将肠道神经上皮回路描述为一条线性通路,信号在到达 CNS 之前从肠道微生物群传递到 EEC,再传递到内脏传入神经。
微生物群 → EEC → 内脏传入神经 → 中枢神经系统
新发现:微生物的捷径通道
一些微生物因子,包括 SCFA、次级胆汁酸、蛋白酶,可以绕过上皮层,并直接作用于感觉传入神经。
协同作用:1+1>2的效果
感觉神经纤维如何整合微生物和宿主来源线索的细节开始浮出水面。
– 例子1:DCA + CCK的强强联合
注:它是一种次级胆汁酸,由肠道菌群代谢初级胆汁酸而产生。
– 例子2:丙酸盐增强CCK效果
这些发现表明,微生物代谢物可以与肠道激素合作以影响感觉神经放电。
复杂的生物网络系统
鉴于最近对免疫细胞在协调脑-身体回路和肠胶质细胞在塑造肠道神经活动中的作用的见解,微生物群-神经上皮相互作用可能涉及多个细胞输入的影响,这个系统作为更大的互连生物系统网络的一部分,远比简单的线性通路复杂。
简单说,肠脑通讯不是一条高速公路,而是一个复杂的交通网络,有多条道路、多个路口,各种车辆(不同的信号分子和细胞)在其中协调运行。
肠道感觉网络收集的有关微生物组的信息,在组织本身、脑干和脊髓以及高级大脑区域内进行整合和处理。
大脑处理完信息后会做什么?
中枢神经系统的效应肢体会积极响应,主要包括:
它们的任务是对动态变化的肠道环境做出反应,调节胃肠道生理学的各个方面。
近年来,宿主通过局部和远程信号传导机制对肠道微生物群的定向作用受到了相当大的关注。
肠神经上皮界面的脑到肠道微生物群通路
doi.org/10.1038/s41579-024-01136-9
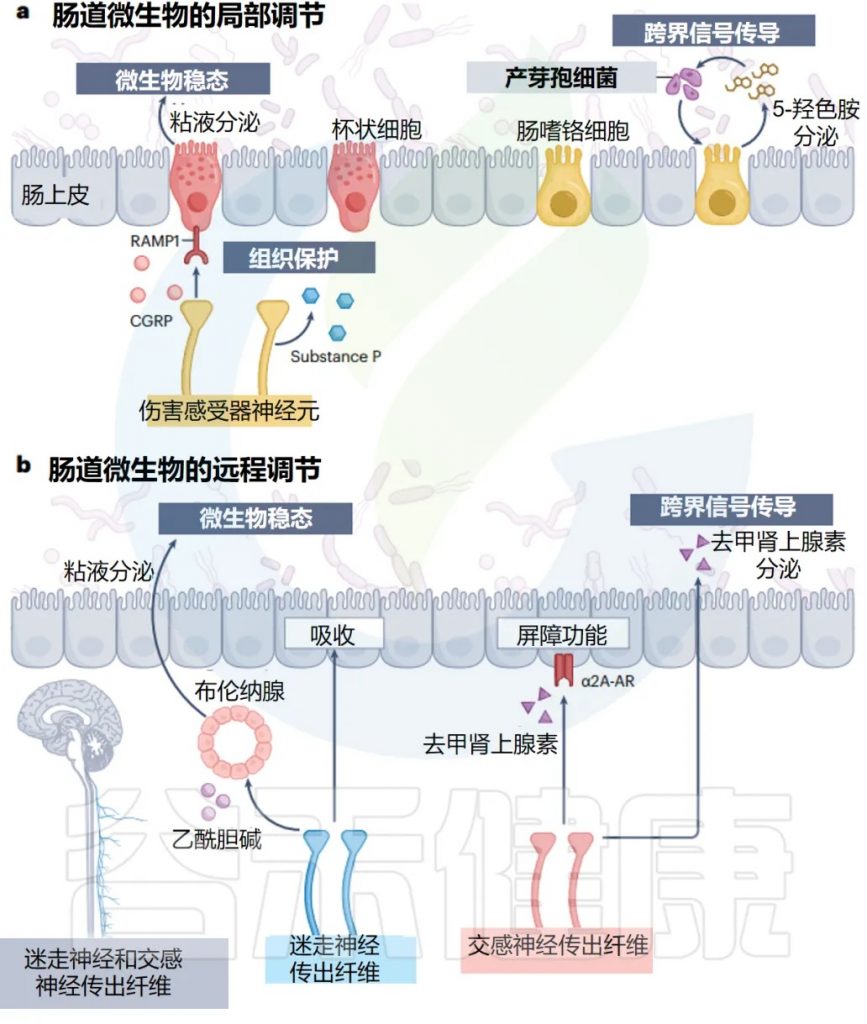
局 部 调 控
传统认知:感觉神经只负责”上报”信息
传统上,感觉神经是将信息传递到 CNS 的传入纤维,就像信息传递员一样,只负责把肠道的情况报告给大脑。
新发现:感觉神经还有”管理”功能
现在人们普遍认识到,感觉神经元还通过在屏障组织局部释放各种神经肽和神经递质来执行传出功能。
– 管理方式:
通过作用于附近的免疫和非免疫细胞,感觉传入神经是维持组织健康不可或缺的一部分。
肠道中的疼痛神经:伤害感受器
在肠道中,许多具有局部效应功能的感觉神经元是伤害感受器,它们通常在皮肤中介导疼痛感。
– 伤害感受器:微生物管家
尽管它们的确切特征和功能正在阐明,但最近的两项互补研究发现,伤害感受器在调节肠道微生物稳态方面具有新作用。
– 实验证据:
在没有功能性伤害感受器的情况下,小鼠以微生物组依赖性方式更容易患结肠炎。
伤害感受器的保护机制:释放保护性分子
伤害感受器通过释放 P 物质和降钙素基因相关肽来促进组织保护,这些肽向邻近的肠道杯状细胞发出信号以驱动粘液分泌。
有趣的是,伤害感受器释放的 P 物质和降钙素基因相关肽受共生信号调节。因此,感觉神经元同时监测和调整肠道菌群的组成以支持肠道稳态。
EC细胞与5-HT的调节系统
一个显著的例子是 EC 细胞,它在压力、机械压力和迷走神经刺激下将 5-HT 释放到肠腔中。
– 微生物的影响:
微生物的策略:操控宿主为自己服务
因此,孢子形成细菌识别肠腔中的 5-HT,并通过结肠中的 EC 细胞进一步诱导宿主 5-HT 的产生,来促进自身在微生物组中的成员身份。
这种微生物群-EEC 串扰是孢子形成者独有的,还是其他细菌物种参与界间信号传导仍有待确定。
远 端 调 节
宿主调节微生物的双重策略:局部 vs 远程
宿主有两套不同的调节策略:
策略1:局部信号调节——就地解决问题
策略2:远程肠脑回路调节——统筹全局管理
ANS 的两个主要分支——迷走神经和交感神经,通过它们在胃肠道中的不同功能输出,来协调这种反馈反应。
迷走神经:身体休息和消化时的管家
虽然大多数迷走神经纤维将感觉信息传递到大脑,但有些也向肠道提供副交感神经流出,主要支配 ENS 并促进肠道蠕动和上皮分泌物,作为身体“休息和消化”反应的一部分。
最近的证据表明,迷走神经传出纤维在通过近端小肠 Brunner 腺调节肠道微生物群方面,具有惊人的作用。
– 对特定微生物的影响:
乳酸菌属对这种神经腺回路的扰动特别敏感,在迷走神经刺激时扩大,并在参与压力信号时丰度降低。
迷走神经传出神经元的活动,也极大地影响了肠上皮的吸收能力,可能会改变饮食-微生物群动力学和微生物代谢物对宿主的获取。
交感神经:压力状态下的应急管理员
– 交感神经的基本功能
交感神经为肠道提供肾上腺素能神经纤维,在那里它们支配 ENS 和肠粘膜,并释放去甲肾上腺素,尤其是在应对压力时。
– 对微生物群的具体影响
交感神经激活导致粘蛋白降解剂(如Akkermansia)增多,Turicibacter spp137 减少。
这些微生物组的变化伴随着粘液产生、抗菌基因表达和上皮周转率的变化,揭示了交感神经、上皮细胞和肠道细菌之间的密切关系。
交感神经的化学武器:去甲肾上腺素的直接作用
– 直接的化学信号传递
交感传出神经元影响微生物组的另一种机制是,通过将去甲肾上腺素释放到肠腔中。
– 跨界信号传导的例子
QseC 组氨酸激酶对宿主来源的儿茶酚胺(如肾上腺素和去甲肾上腺素)的细菌感应,是王国间信号传导的另一个例子。
– 对病原菌的影响
在某些大肠杆菌菌株中,儿茶酚胺可以改变毒力基因表达和致病性。有趣的是,肠腔中游离儿茶酚胺的水平部分受肠道微生物群的调节。
这可能具有临床意义,因为 GLP1 受体激动剂利拉鲁肽是一种常见的抗糖尿病药物,被发现可以激活交感神经传出纤维,触发去甲肾上腺素释放到肠腔中,并诱导大肠杆菌的扩增 。
总的来说,这些研究表明,交感神经可以直接影响肠道细菌定植。
神经免疫学是一个快速发展的领域。最近在不同的神经元亚群如何调节肠道免疫反应方面的突破,加深了我们对生理和病理条件下肠道免疫的理解。
除了被动接受和应对有害的威胁外,免疫系统还向神经系统发出信号以启动防御性反应。同时,神经系统在对潜在威胁的预期和感知下,积极调节肠道中的免疫反应。神经系统和免疫系统之间的协调使宿主能够正确处理复杂的刺激和不断变化的环境。
肠道微生物群也是调节肠脑轴中神经元和免疫激活的关键臂。结合微生物组、转录组、蛋白质组的多组学研究,配合光遗传学和化学遗传学等新兴技术,将深化我们对神经元如何塑造肠道生态系统的理解。
肠道菌群检测技术的应用将成为连接基础研究与临床实践的重要桥梁。基于微生物组构成和神经反应模式的个体化治疗将成为现实,通过功能性微生物组分析,结合肠道菌群检测报告中的神经递质等相关指标,实现疾病风险预测和治疗效果的个性化评估。自迷走神经电刺激在减轻炎症方面的发现以来,生物电子医学在临床应用中展现出广阔前景,无创迷走神经刺激已在克罗恩病临床试验中显示疗效。
神经递质和神经肽受体信号传导的治疗靶向为药物创新提供了新思路。β-肾上腺素能受体拮抗剂和CGRP受体拮抗剂等现有药物,凭借其调节肠道免疫的能力,可重新用于胃肠道功能障碍治疗,同时基于微生物代谢物的新药开发和靶向EEC的小分子化合物研究正在兴起。
这些突破将更大地改变焦虑、抑郁、自闭症、帕金森病等神经疾病以及肠易激综合征、炎症性肠病等消化系统疾病的治疗策略。通过微生物疗法、肠道靶向神经调节和神经-免疫平衡调节的联合治疗,未来,临床医生可能会根据患者的肠道菌群特征、免疫状态和神经系统表型制定个性化治疗方案。
医学正从标准化治疗转向个体化精准医疗,肠道-菌群-免疫-神经将成为未来疾病治疗的重要方向。短链脂肪酸、色氨酸代谢物以及其他菌群代谢产物正被开发为新型神经调节剂,它们能通过血脑屏障或迷走神经途径影响中枢神经系统功能。
早期干预肠道菌群失调可能成为预防神经精神疾病的关键途径,特别是对具有遗传风险的人群。肠道健康将成为整体健康管理的重要组成部分。
主要参考文献
Jacobson, A., Yang, D., Vella, M. et al. The intestinal neuro-immune axis: crosstalk between neurons, immune cells, and microbes. Mucosal Immunol 14, 555–565 (2021).
Ohara, T.E., Hsiao, E.Y. Microbiota–neuroepithelial signalling across the gut–brain axis. Nat Rev Microbiol 23, 371–384 (2025).
Yang, D., Almanzar, N. & Chiu, I.M. The role of cellular and molecular neuroimmune crosstalk in gut immunity. Cell Mol Immunol 20, 1259–1269 (2023).
谷禾健康
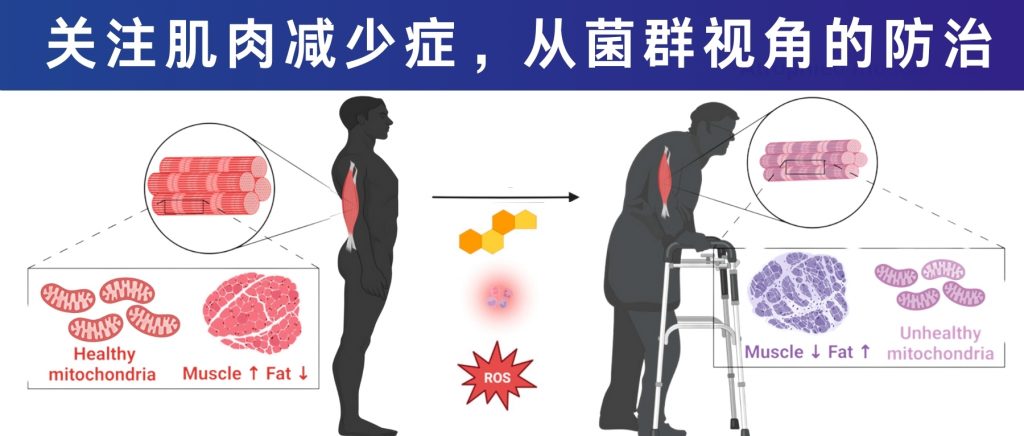
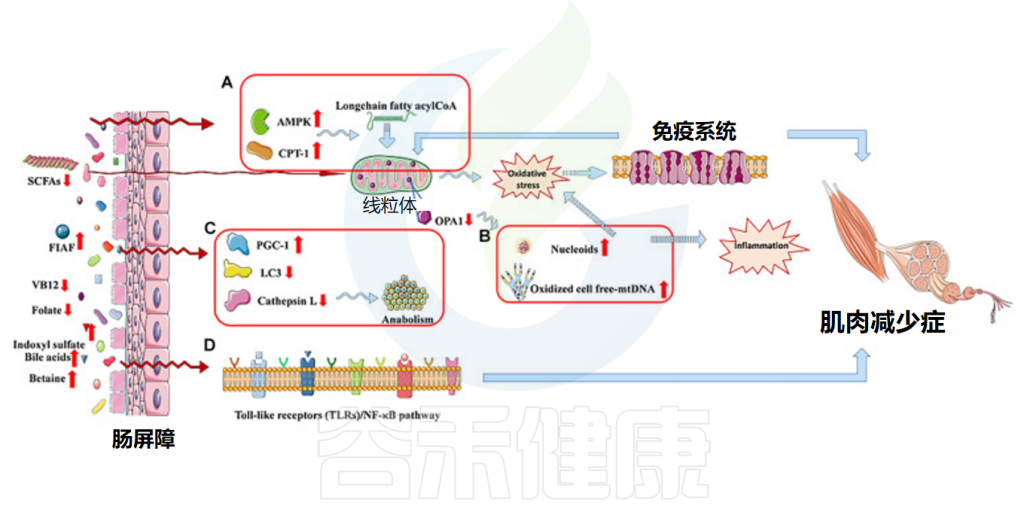
我国的老龄化问题日益突显,老年群体的生活质量是一个高度关注的焦点。许多老年人都会出现行走缓慢、起身或是爬楼梯困难、易失去平衡而摔跤、肌肉明显萎缩等症状。这很多时候都源于一种疾病——肌肉减少症。
肌肉减少症是一种与年龄相关的骨骼肌疾病,其特征是肌肉质量进行性丧失和肌肉力量下降。大约从30岁以后,肌肉质量会因为老化开始逐渐流失;到了40岁后,肌肉会开始以每10年约8%左右的速度流失,如果没有营养和运动干预,70岁时,人体肌肉质量下降约40%,到了80岁,肌肉大约会流失掉50%。据估计,60-70岁人群肌肉减少症的发病率为5-13%,80岁及以上人群更是高达11-50%。
肌肉作为生命的”隐形盔甲”,——它保护关节、储存营养、影响代谢等,许多人把肌肉流失当作“自然衰老”,直至跌倒骨折才认识其严重性。肌肉减少症对健康老龄化构成威胁,因为它不仅影响日常活动能力,还会损害代谢与免疫功能,增加肥胖、心血管等疾病病风险,甚至导致死亡率的升高。并且肌肉减少症不仅影响老年人,也威胁中、青年健康。肌肉减少会降低代谢率,易导致肥胖和三高,并与糖尿病、心梗和脑中风密切相关。
如今肌肉减少症已不仅限于老年人,部分年轻人也受其影响。长期”葛优躺”、”咸鱼瘫”、”办公坐”。无论是白天上班,还是晚上回家,很多人动都不愿多动一下,只想瘫着。长此以往后发现,不仅爬个楼梯就膝盖痛,甚至有时连拿个东西都觉得无力。肌肉减少症的主要原因是自然衰老,但缺乏运动、不良的饮食、慢性炎症、肥胖等一些疾病也都会促进肌肉减少症的发生,而这些正是当代年轻人普遍的生活特征。
如何提前预防、减缓或治疗改善肌肉减少症?除了常规的抗阻运动和充足且均衡的营养摄入外。不少研究发现肠道微生物群在肌肉减少症中发挥了不可忽视的作用,并提出了“肠道-肌肉轴”。紊乱的微生物组成可能导致肌肉老化和肌肉减少症的发展。肌肉减少症患者肠道菌群多样性和丰富度都较低,表现为放线菌门和梭杆菌门比例下降,普雷沃氏菌(Prevotella)与拟杆菌(Bacteroidetes)比率(P/B)降低,以及粪球菌属(Coprococcus)和毛螺菌科(Lachnospiraceae)的等产生短链脂肪酸的细菌丰度降低。
肠道微生物群似乎通过多种途径影响肌肉系统:包括调节饮食效果与营养传导,改变肠道通透性和炎症状态,影响肌肉合成代谢/分解代谢平衡,调节线粒体功能与激素分泌,以及影响骨骼肌纤维组成和神经肌肉传递等。
肠道微生物群分析有望帮助我们提前评估营养状况和预测肌肉减少症风险。谷禾肠道微生物检测报告不仅分析菌群状况,还提供营养评估和相关健康指标,有助于早期风险预警。同时有研究证实补充益生菌可以改善肌肉减少症,因此通过调节肠道微生物群可能成为治疗该症的新靶点。
肌肉减少症的定义
肌肉减少症(Sarcopenia),临床上也将其称为“肌少症”。医学定义是肌肉质量、力量和功能逐渐丧失而引起的综合症。
下面是肌肉减少症的一些最常见症状:
•肌无力
•活动时失去耐力或持久力
•行走缓慢
•难以进行日常活动
•爬楼梯困难
•易失去平衡
•肌肉明显萎缩
患病情况
▸ 主要发生在老年人,随年龄增长发病率增高
肌肉减少症通常发生在60岁及以上的老年人群,发病率随年龄的增长明显上升。60-70岁人群发病率为5-13%,80岁及以上人群高达11-50%。
依据2019年亚洲肌少症工作组制订的诊断标准,一项基于我国社区人群的流行病学调查研究结果显示,60岁以上人群的肌少症患病率为14.7%,其中男性肌少症患病率为17.3%,女性为12.5%。
▸ 不良生活习惯导致年轻人群患病增加
然而,近年来有统计发现,我国30岁以下的年轻人,竟有超过两成患“肌少症”。随着生活节奏加快,很多年轻人久坐少动、饮食不规律。
此外,再加上”白幼瘦”等审美观念影响,种种因素相加,增加了年轻人的肌肉流失,使这种原本的老年病,也变得越来越年轻化。肌少症已成一种全球性健康威胁。
肌少症的危害
肌肉和身体健康之间紧密相关,肌肉作为人体最重要的器官之一,意味着力量和生命力。有研究显示,肌肉减少对人体的影响和危害巨大:
肌肉减少10%左右,就可能出现机体免疫功能下降,感染风险增加;
肌肉减少20%左右,就可能出现肌肉无力,日常生活能力下降,跌倒风险增加,伤口愈合延迟;
肌肉减少30%左右,就可能出现日常生活能力下降甚至失能,还易发生压疮;
肌肉减少40%以上,则死亡风险明显增加。
肌肉减少症是一个严重的问题。一旦你失去了大量的肌肉和力量,你可能很难做一些事情,比如从椅子上站起来、打开罐子或搬运物品。也可能变得虚弱,跌倒、骨折、残疾和死亡的风险更高。我们总结肌肉减少症的危害主要有以下几方面:
▸ 身体功能下降与日常生活能力丧失
•跌倒风险增加;
•骨折风险增加;
•行动受限,步行变慢,难以上下楼梯;
•逐渐丧失独立生活能力,无法自理基本日常活动。
▸ 代谢与免疫功能受损
•影响糖代谢,胰岛素敏感性降低;
•炎症水平升高,导致”炎症老化”状态;
•免疫功能下降,增加感染风险;
•肌肉脂肪浸润增加,导致肌肉质量和功能持续下降。
▸ 共病风险增加
•肥胖和三高:中年后很容易出现肥胖等代谢问题。以前大家都把它归咎于吃太多,运动不足,但肌肉减少,基础代谢率降低也是关键所在;
•心血管疾病风险增加:肌少型肥胖者的高血压风险,会高出正常者两倍之多;
•呼吸功能下降:影响呼吸肌功能和肺活量;
•认知功能下降:肌肉减少症与认知障碍有关联;
•术后并发症增加:手术恢复更慢,术后风险更高;
•全因死亡率增加:研究显示肌肉减少症与死亡率有一定的关联。
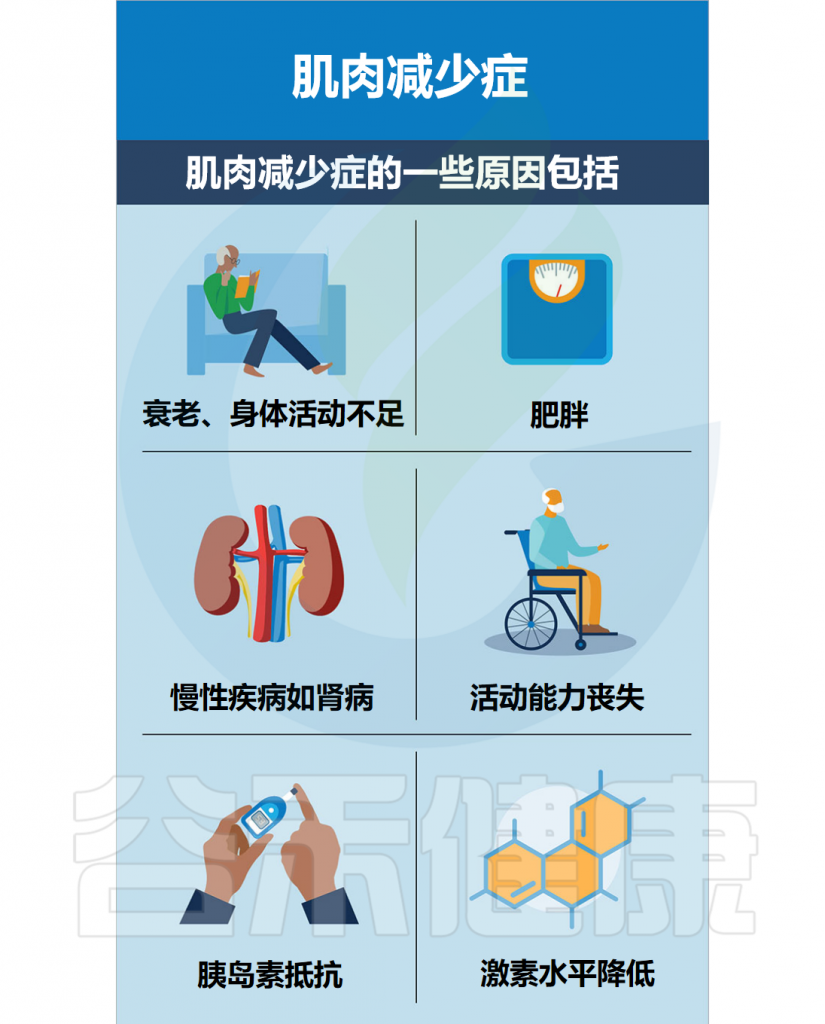
导致肌肉减少症的原因
▸ 自然衰老
肌肉减少症最常见的原因是自然衰老。尽管并非所有长寿者都患此症,但大约从35岁以后,肌肉质量就会因老化开始逐渐流失。到了40岁后,肌肉会开始以每10年约8%左右的速度流失,如果没有营养和运动干预,70岁时,人体肌肉质量下降约40%,到了80岁,肌肉大约会流失掉50%。
随着年龄的增长,我们身体中会发生一些可能导致肌肉减少症的事情:
•负责从大脑向肌肉发送信号以开始运动的神经细胞减少;
•某些激素的浓度较低,包括生长激素、睾酮和胰岛素样生长因子;
•将蛋白质消化利用的能力下降;
•炎症增加,部分原因是疾病。
除了生理性衰老外,还有其他风险因素,例如缺乏运动、不良饮食和慢性疾病,这些因素都会导致肌肉和力量的丧失。
▸ 缺乏运动
研究表明,保持活跃可显著降低肌肉减少症风险。久坐卧床时间越长,肌肉质量和力量流失越多。即使在固定时间锻炼,长时间不活动仍会导致肌肉和力量损失。
▸ 不良饮食
劣质饮食可能导致肌肉减少症,蛋白质摄入不足被认为是主要原因,因为老年人体内蛋白质转化能力下降。部分研究显示蛋白质摄入不足与肌肉减少症相关。水果蔬菜摄入不足也可能是影响因素。富含超加工食品(高糖、高盐、多添加剂和不健康脂肪)的饮食同样与低肌肉质量有关。
一般来说,营养不良的老年人,无论是摄入量不足还是营养质量不佳,都面临更高的肌肉减少症风险,且病情恶化速度更快。
▸ 肥胖
肥胖似乎会加重肌肉减少症。高水平的体脂会增加炎症并改变胰岛素反应,这两者都可以加速肌肉流失。肥胖还会降低活动能力,形成肌肉流失和脂肪堆积的恶性循环。
▸ 慢性疾病
患有慢性阻塞性肺病(COPD)、肾病、糖尿病、癌症或艾滋病等慢性疾病会增加患肌肉减少症的风险。
人们有时会将肌肉减少症与其他疾病混淆,以下是两种症状相似且易混淆的疾病。
▸ 肌肉减少症与恶病质的区别
病因不同:恶病质主要由癌症、感染、肾病等慢性消耗性疾病引起;肌肉减少症主要由自然老化、激素水平和蛋白质合成减少相关。
表现差异:恶病质除肌肉流失外,还伴有明显的非自愿性体重减轻和脂肪组织丢失,是全身性消耗,并且进展迅速,常在数周或数月内显著恶化;而肌肉减少症进展缓慢,通常在数年间发展,且主要影响肌肉组织。
危害:肌肉减少症主要是增加跌倒和骨折风险、降低日常生活自理能力;而恶病质严重影响治疗效果,是晚期疾病的不良预后标志,显著增加死亡风险。
▸ 肌肉减少症与身体虚弱的区别
病因不同:身体虚弱源于多系统生理储备减退,涉及肌肉、神经、内分泌和免疫系统等,且心理社会因素在发病过程中具有重要影响。
表现差异:表现为虚弱表型五项特征(非自愿体重减轻、自我报告的疲劳感、肌力下降、步行速度减慢、体力活动水平降低),虽与肌肉减少症高度重叠但不等同,范围更广,涵盖全身各系统功能衰退。
危害:身体虚弱会导致全方位健康状况恶化的风险更高,面对应激时缺乏稳态解决能力,对各种医疗干预的耐受性下降。
我们知道,肠道微生物群在免疫、内分泌、能量代谢稳态和整体健康等方面都起着至关重要的作用。肠道菌群失调和肌肉减少症又都常见于老年人,那么两者之间是否存在一定的联系呢?
近年来许多研究聚焦于肌肉减少症与肠道菌群组成之间关系,发现菌群失调与骨骼肌量和功能降低相关。并有研究发现,肠道微生物群及其代谢物可以作用于肌肉,还提出了“肠-肌肉轴”理论 。
参与“肠肌肉轴”发病机制的关键驱动因素
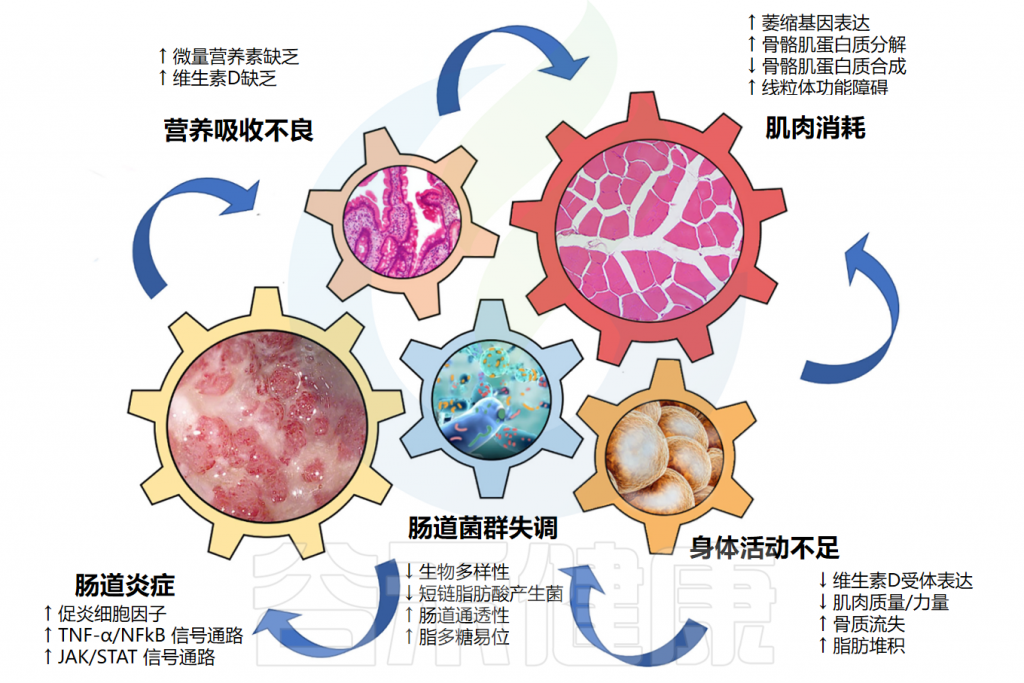
Nardone OM,et al.Front Immunol.2021
2024年一项涉及4307名43至87岁参与者的17项随机对照研究荟萃分析,基于16S rRNA基因测序揭示了肌肉减少症患者肠道菌群特征变化。

肌肉减少症患者的肠道菌群变化
▸ 肠道菌群的多样性和丰富度低于正常人
研究发现,肌肉减少症患者肠道菌群的多样性和丰富度低于健康对照组。在门水平上,放线菌门和梭杆菌门的比例下降(梭杆菌门减少20%至28%,放线菌门减少7%至10%),而其他门没有显著变化。
在属水平上,Akkermansia、Dialister、Dorea、Lachnospiraceae、Ruminococcaceae、Coprococcus、Faecalibacterium、Megamonas、Phascolarctobacterium、Prevotella、Lachnoclostridium、Paraprevotella、Ruminococcus_2、Streptococcus和Subdoligranulum的比例下降,瘤胃球菌科、粪杆菌属、普雷沃氏菌属、 Lachnoclostridium 显著减少(下调3%),而其他细菌略有减少(下降1%)。
Alistipes、Bacteroidota、Escherichia、Eubacterium_rectale_group、Flavonifractor、g-Bacteroides、 g-Lactobacillus、o-Clostridiales、g-Parabacteroides和Shigella的比例增加,其中拟杆菌属的增加幅度最大(上调12%),副拟杆菌属和志贺氏菌的比例增加2%,其他细菌增加1%。
▸ 菌群的变化可能是肌少症的早期迹象或标志物
具体来说,普雷沃氏菌(Prevotella)与拟杆菌(Bacteroidetes)比率(P/B)的降低,以及粪球菌属(Coprococcus)和毛螺菌科(Lachnospiraceae)的丰度降低,是重要的指标。
普雷沃氏菌(Prevotella)和拟杆菌(Bacteroidetes)参与膳食纤维的发酵和短链脂肪酸(SCFA)的产生,这对维持肌肉质量和功能至关重要。较低的P/B比率表明SCFA的产生能力降低,这可能会对肌肉健康产生负面影响。同样,粪球菌属(Coprococcus)和毛螺菌科(Lachnospiraceae)也是产生SCFA的细菌,它们的减少与SCFA水平降低有关,导致肌肉萎缩和无力。因此,监测这些特定的细菌标志物可以提供肌肉减少症的早期迹象,从而允许及时干预。
肠道菌群和肌肉力量
肠道菌群和肌肉功能参数也显示出了一定的关联,肌肉力量下降是肌肉减少症的一个重要特征。通过使用手持测力计测量优势侧握力评估肌肉力量。
注:该参数在生理上会随着年龄的增长而下降,但在满足肌肉减少标准的患者中,其降低通常更为明显。
▸ 肌肉力量下降的人群体内促炎微生物更丰富
在最近的一项观察性研究中发现,过度饮酒的人们的握力较低,变形菌门、萨特氏菌属、梭状芽胞杆菌属和霍尔德曼氏菌属的相对丰度较高,而粪杆菌属的相对丰度较低。
粪便微生物群的这些变化伴随短链脂肪酸水平降低,表明存在促炎微环境。这些结果表明微生物群可能对肌肉力量产生一些影响。
▸ 调整肠道微生物群有助于改善握力等肌肉功能
一项对60名疗养院老人的随机对照试验显示,菊粉和低聚果糖益生元干预13周后,握力显著提升。虽未直接评估肠道菌群,但菊粉和低聚果糖对肠道微生物群组成有已知有益的影响。补充菊粉可以提高人体中双歧杆菌、嗜胆菌的相对丰度,而低聚果糖具有选择性增加双歧杆菌丰度的能力。益生元还刺激微生物合成SCFAs,从而改善钙吸收和骨矿化。
正如最近的一项系统评价所表明的那样,骨骼健康和钙稳态与肌肉减少症发作密切相关。因此,握力改善可能由肠道菌群变化调节炎症和代谢平衡所致。
综上,人类肠道菌群与肌肉力量可能相关,双歧杆菌和粪杆菌被认为是主要参与者。这两个属之间存在相互作用,粪杆菌合成丁酸盐的能力是由双歧杆菌的丰度介导的,在可能的肌肉力量-微生物群关联中也应考虑。
肠道菌群和步行速度
步行速度是衡量老年肌肉减少症的一项参数,能预测行动不便和死亡率,且与多种慢性疾病进展相关。慢步态(≤0.8m/s)与事故残疾显著相关,尽管临界值因环境和人群而异。
注:步行速度通常在4米直线路径上以患者平常行走速度测量,推荐使用电子设备以提高精度和可重复性。
▸ 肠道菌群可以影响运动功能
肠道菌群与步行速度关系的研究较少。一项动物实验显示,无菌状态或抗生素使用导致运动过度活跃,比肠道菌群正常的移动更快。向无菌果蝇添加特定乳酸菌后恢复正常运动行为,表明肠道菌群可通过调节糖代谢和章鱼胺能系统(相当于人类去甲肾上腺素系统)影响运动功能。
一项对32名65岁以上久坐女性的非随机比较试验显示,躯干肌肉训练与有氧运动后肠道菌群组成发生特异性变化,拟杆菌属丰度与6分钟步行测试中步态速度增加呈正相关。另一项绝经前健康女性研究表明,拟杆菌属丰度与心肺健康相关,但未直接评估步态速度。
最后,在一项随机对照试验中,在36名肝硬化患者中测试了多菌株益生菌与安慰剂的效果发现,益生菌给药诱导的肠道微生物群有益修饰与步态速度的改善有关。
这些研究表明肠道菌群组成可能与步行速度相关,但均未针对肌肉减少症老年人开展,研究未能确立菌群与步态速度变化间的因果关系。
此外,步行速度作为功能参数不仅依赖肌肉力量和功能,还取决于中枢神经系统功能。衰老过程中,微生物群通过多种机制影响大脑生理学,这些机制可能影响老年人步行速度和功能依赖性。肠道细菌产生神经递质(γ-氨基丁酸、去甲肾上腺素和多巴胺)的能力及调节宿主产生血清素的能力,似乎与菌群组成和步行速度的关联有关。因此,这些关联可能不仅取决于肠道-肌肉轴,还与微生物对大脑的影响有关。
改善微生物群对肌肉的影响
▸ 肠道菌群失调可能导致炎症引发神经肌肉功能受损
评估肠道菌群改善对肌肉质量和功能影响的研究较少,多集中于动物模型。一项研究证明,向小鼠癌症模型给予含罗伊氏乳杆菌(一种FoxN1调节剂)的益生菌可抑制恶病质发展并维持肌肉质量。
部分益生菌具有明显抗炎作用,可能通过促进合成代谢有益肌肉健康。例如,含普拉梭菌(主要SCFA生产者之一)的益生菌制剂能改善小鼠肝脏合成代谢并减少全身炎症。同样,螺旋藻(一种食品添加剂或补充剂)治疗可改善老年小鼠炎症和氧化应激生物标志物。
此外,动物研究还评估了抗生素引起的肠道菌群失调的全身影响。肠道菌群失调与骨骼强度和机械性能受损相关,可能因成骨减少导致合成代谢刺激不足。抗生素诱导的菌群失调会干扰小鼠神经肌肉传递,可能促进肌肉蛋白质分解代谢。
越来越多证据显示肠道菌群可能参与肌肉减少症的病理生理学。但肠道微生物群及其代谢物究竟是如何影响肌肉减少症的?
我们通过查阅文献并汇总,认为肠道菌群可能通过以下方式影响肌肉减少症:
微生物群作为营养信号的传感器
▸ 肠道微生物群会影响饮食的效果、营养的传导
肠道微生物群会影响宿主代谢平衡。例如无菌小鼠即使在喂食高脂肪饮食时也表现出持续的瘦表型。即使在均衡饮食的情况下,将营养不良人类的粪便微生物群移植到无菌小鼠也会导致生长缺陷。
将猪肠道菌群移植到瘦无菌小鼠中,导致肌肉纤维结构发生显著变化,类似于猪的典型变化。因此,微生物群可以作为向宿主发送营养信号的基本转导,而饮食则塑造微生物群组成和功能。
肠道菌群与营养和肌肉功能
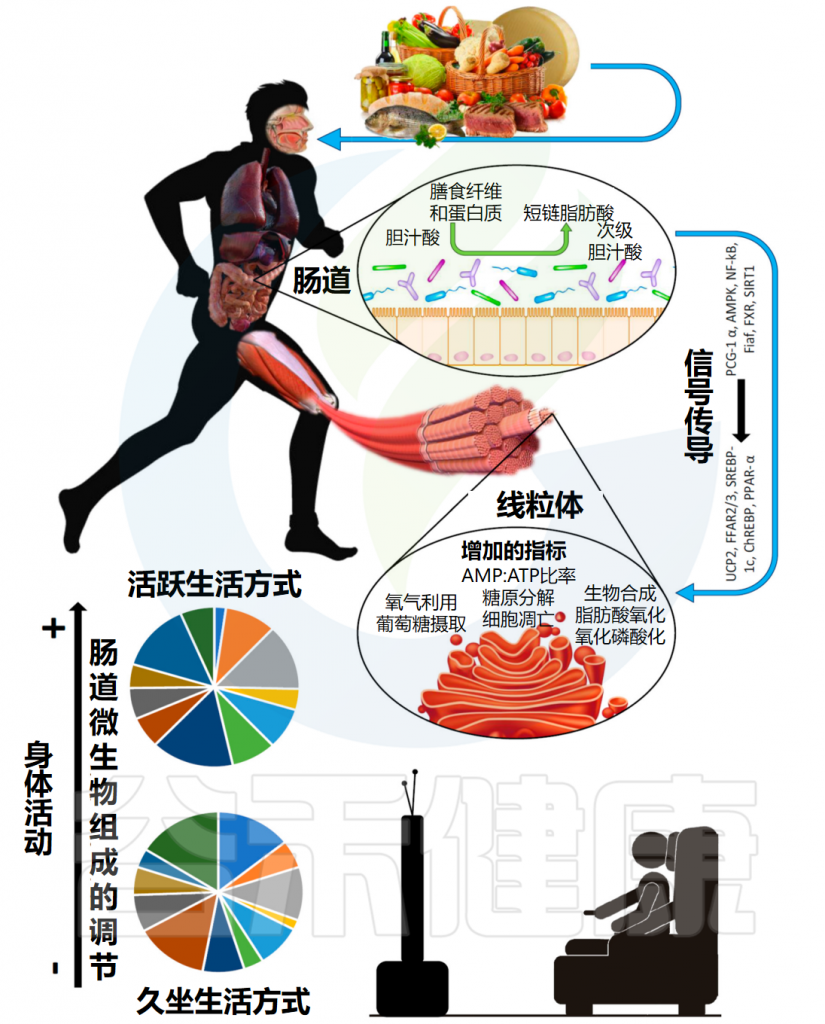
doi: 10.3390/nu9121303.
饮食会影响微生物群的组成;反过来,微生物群将一些营养物质(包括纤维和蛋白质)代谢成介质,例如短链脂肪酸,进入体循环。
这些介质通过调节炎症和促进胰岛素敏感性产生的多种信号通路,对肌细胞,即对它们的线粒体产生已知影响。图下半部分显示体育锻炼能直接调节肠道菌群组成,并标明了相关参与因子。
▸ 肠道微生物群对氨基酸吸收和肌肉合成很重要
蛋白质摄入对骨骼肌具有公认的促合成代谢作用,有利于肌肉质量的沉积与体育锻炼协同作用。这种影响可能是由肠道微生物群介导的。例如在肉鸡中,在类似的饮食方案下,肌肉质量的增长速度深受特定肠道微生物群代谢型的影响,这表明肠道微生物群在氨基酸吸收和促进肌肉合成代谢方面发挥着重要作用。
一项对38名超重人群的随机对照试验显示,与麦芽糖糊精对照组相比,接受酪蛋白和大豆蛋白3周补充后,细菌代谢明显转向氨基酸降解和发酵。这表明肠道菌群可通过增加氨基酸生物利用度并刺激骨骼肌中胰岛素分泌和反应来促进蛋白质合成代谢。动物研究表明,微生物产生的支链氨基酸(BCAA)增加与胰岛素敏感性和蛋白质合成改善相关。
▸ 但过度高蛋白饮食并不一定对肌肉有利
需要注意的是,高蛋白饮食对微生物群的影响可能并不总是对肌肉有利。高蛋白饮食小鼠的肠道菌群表现为厚壁菌门/拟杆菌门比率降低、病原体(如肠杆菌科)增加,同时产生代谢调节剂(如SCFA)的菌群减少,导致体重减轻并可能对肌肉代谢产生负面影响,包括炎症调节减少和胰岛素抵抗增加。一项人体随机对照试验也发现,耐力运动员长期服用牛肉蛋白补充剂导致健康相关菌群(包括双歧杆菌、Roseburia和Blautia)减少。
因此,蛋白质摄入与微生物群组成的关系及其对宿主代谢的影响复杂且尚未完全明确。蛋白质摄入对肠道菌群组成及肌肉质量沉积的影响可能取决于蛋白质质量和微生物群代谢型,微生物群介导的蛋白质摄入促合成代谢反应可能因个体差异而不同。
肠道菌群影响肌肉质量
肠道微生物群参与氨基酸的代谢、吸收和活力。膳食蛋白质被宿主和细菌的蛋白酶/肽酶水解成肽和氨基酸,这些产物能够调节全身能量状态,支持肠道菌群生长和生存。
▸ 肠道菌群可以影响肌肉合成对蛋白质的需求
有证据表明,肠道微生物群组成的改变可以决定肌肉合成对蛋白质的更高需求,那些老年肌细胞的特征现象(即所谓的“合成代谢抵抗”)。合成代谢抵抗是导致肌肉蛋白质合成减少和随之而来的肌肉生理改变的原因,促进肌肉减少症发生。
合成代谢抵抗现象与参与肌肉合成的蛋白质基因表达改变有关,受损的氨基酸转运到肌肉中,使流向骨骼肌的营养血流失调,减弱蛋白质消化和吸收,肌肉蛋白分解增加和骨骼肌干细胞的损失。
▸ 短链脂肪酸等菌群代谢物会调节肌肉合成代谢
证据支持肠道-肌肉轴的存在,其中肠道微生物群组成可以通过产生介质来影响肌肉质量合成代谢和宿主的功能。一般来说,随年龄增长,肠道菌群中短链脂肪酸(SCFA)生产者减少。SCFA能够调节蛋白质调节途径,增加ATP的产生,通过调节全身合成代谢/分解代谢平衡来影响骨骼肌蛋白质沉积刺激骨骼肌葡萄糖摄取,并影响胰岛素敏感性和炎症等功能。
肠道菌群影响氨基酸进入门静脉循环供全身使用。菌群失调会降低膳食蛋白质和促进肌肉蛋白合成的特定氨基酸(如色氨酸)的生物利用度。
肠道菌群代谢物可能参与骨骼肌功能

doi: 10.3390/nu9121303.
▸ 肠道微生物群本身也可以合成一些氨基酸
肠道微生物群本身可以合成氨基酸,这是肌肉蛋白质合成代谢的关键底物,衰老会损害微生物群合成赖氨酸、异亮氨酸、亮氨酸和缬氨酸的能力,从而增加其蛋白水解功能。肠道微生物群还参与维生素的合成,包括叶酸、维生素B12和核黄素,介导这些营养素对骨骼肌细胞的促合成代谢作用。
▸ 肠道菌群变化会改变骨骼肌纤维组成并影响肌肉力量
此外,肠道菌群的年龄相关变化能诱导肌内脂肪浸润。动物模型显示,特定菌群会改变骨骼肌纤维组成。值得注意的是,随年龄增长,肌肉力量下降幅度大于肌肉质量,主要由于肌肉纤维分布改变(I型纤维比例增高、II型纤维萎缩)以及肌纤维间脂肪积累。
肠道与肌肉的交流可能是双向的。研究表明,运动训练与有益的菌群谱(生物多样性和代谢活性物质产生)相关。
炎症性衰老导致肌肉减少
老年人肠道菌群特征是由促炎与抗炎途径失衡引起的慢性低度炎症(”炎症性衰老”)所促成。炎症性衰老部分源于免疫衰老现象,表现为免疫功能失调、CD-28共刺激分子丧失和端粒缩短。
▸ 肠道菌群及其代谢物影响炎症性衰老
肠道菌群及其代谢物在炎症性衰老中扮演重要角色。衰老的肠道菌群抵抗有害微生物、清除代谢物的能力下降,循环内毒素水平升高。因此,调整肠道菌群的饮食改变可能影响促炎/抗炎介质释放,维持表型变化。
免疫系统受菌群与肠道细胞间互动调节。健康肠道菌群调控免疫系统发育和稳态,维持炎症平衡并抑制慢性炎症。短链脂肪酸通过减少促炎细胞因子和趋化因子分泌及巨噬细胞浸润发挥抗炎作用。特别是,丁酸盐诱导IL-10、视黄酸和TGF-β分泌,并刺激抗炎调节性T细胞产生。
▸ 炎症反应会通过影响合成代谢导致肌肉减少
肠道菌群通过维持肠屏障功能调控脂多糖和促炎细菌内毒素的吸收,参与炎症调节。动物研究表明,年龄相关的肠道菌群变化与肠道通透性增加相关,这主要由上皮紧密连接损伤引起。屏障功能的这种改变促进宿主全身炎症。肠道菌群失调会刺激肠上皮细胞分泌粘蛋白,增加病原体进入肠粘膜的几率。丁酸盐则通过增强紧密连接组装减轻炎症,阻止内毒素易位。
这些机制导致炎症反应改变,可能通过在骨骼肌促进分解代谢并抑制合成代谢来加速肌肉流失。
菌群失调导致线粒体功能障碍
肠道菌群能影响肠道屏障稳态,实验表明,在肠道菌群存在时,肠道上皮能产生生理水平的氧化应激。氧化应激与肠道菌群组成、功能及肠壁通透性相互作用,从而调节外源分子进入体循环的可能性。
▸ 不健康的菌群会使线粒体损伤进而改变肌肉稳态
不健康的肠道菌群抗氧化能力下降,可能导致年龄相关的肌细胞线粒体质量降低。线粒体损伤释放的分子激活线粒体DNA诱导的炎症途径,促使炎症细胞释放细胞因子、趋化因子、活性氧和一氧化氮,造成慢性炎症持续并形成恶性循环,从而改变肌肉稳态。
线粒体功能障碍影响肌肉减少症
doi: 10.3389/fbioe.2020.590869.
研究表明,肌细胞质量控制过程的变化可能参与肌肉减少症的发生。老年肌细胞中线粒体功能障碍和自噬信号分子表达降低是衰老现象的组成部分。这些变化可能导致受损线粒体清除效率低下和功能失调细胞器积累,引起肌肉萎缩。肠道菌群产生的短链脂肪酸等代谢物可能积极参与骨骼肌中的线粒体生物发生。
肠道微生物群和骨骼肌的分子信号通路
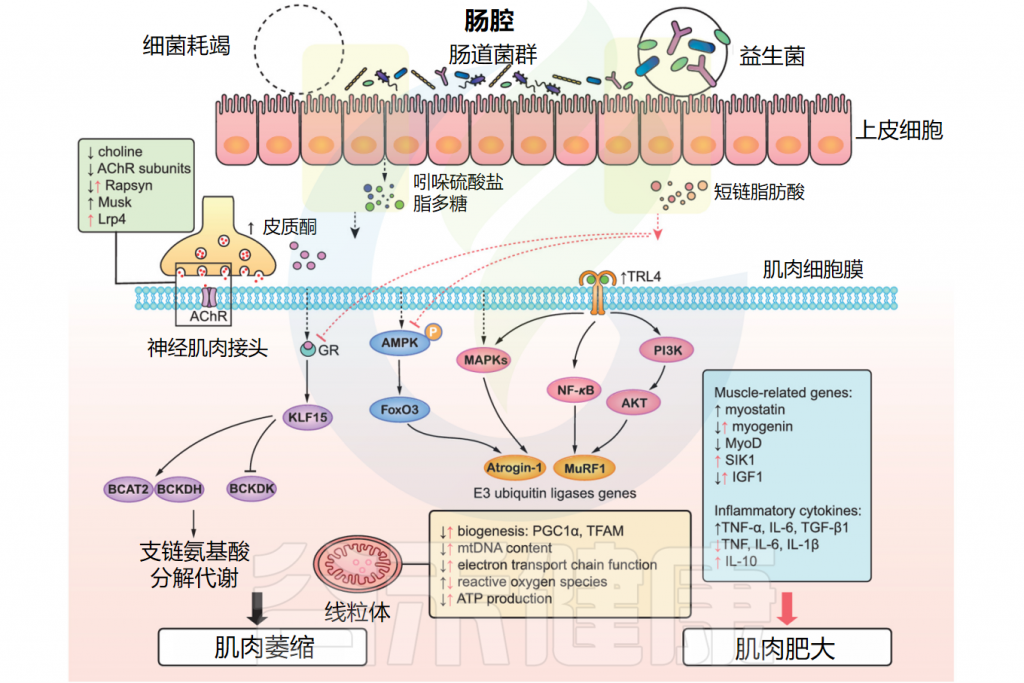
doi: 10.1002/jcsm.12784.
有害细菌代谢物(硫酸吲哚酯和脂多糖)和肠道菌群缺失诱导肌肉萎缩。这些物质通过激活PI3K/AKT、NF-κB和MAPKs信号通路,上调E3泛素连接酶基因(Atrogin-1/MAFbx和MuRF1)及炎症因子,导致肌肉萎缩和炎症。
细菌耗竭条件下,AMPK-FoxO3-Atrogin-1/MuRF1级联反应和BCAAs分解代谢被激活,同时IGF1、肌生成素和MyoD表达降低,肌肉生长抑制素升高,神经肌肉接头和线粒体功能受损。
胰岛素抵抗加速肌肉损失
健康肠道菌群可降低胰岛素抵抗。肠道菌群失调和肠屏障改变导致短链脂肪酸和次级胆汁酸减少,同时脂多糖和支链氨基酸的吸收与循环水平增加,这些变化共同导致胰岛素抵抗。
短链脂肪酸增强胰岛素敏感性,在调节葡萄糖摄取和代谢中发挥关键作用。它们提高能量消耗,改善葡萄糖耐量。次级胆汁酸则通过激活胰高血糖素样肽-1分泌防止胰岛素抵抗,影响葡萄糖稳态。脂多糖结合并激活toll样受体4信号通路,诱导胰岛素抵抗、亚临床炎症和肥胖。循环支链氨基酸水平升高与2型糖尿病发病率增加5倍相关。
▸ 胰岛素抵抗会加速肌肉质量和力量的流失
胰岛素抵抗和糖尿病与肌肉质量和力量的加速损失有关。胰岛素在刺激肌细胞中线粒体蛋白合成和抑制蛋白水解中起关键作用。由于信号系统的改变,响应胰岛素的蛋白质合成正常增加受损,促进了肌细胞中与年龄相关的合成代谢抵抗。
众所周知,肌肉减少症(即肌肉生长和再生的损害)的特征是生长激素(GH)和胰岛素样生长因子1(IGF-1)浓度下降。有证据表明,短链脂肪酸促进全身性 IGF-1 释放,这表明由于细菌失调而改变这些微生物群介质可能会影响肌肉健康。
肠道微生物群与肌肉健康密切相关,构成”肠道-肌肉轴“。这一关系使肠道菌群可能成为肌肉减少症早期诊断、预防和辅助治疗的重要指标和潜在干预靶点。
谷禾的肠道微生物群检测可为肌肉减少症的早期诊断和预防提供哪些关键信息?让我们接着往下看。
作为肌肉减少症的生物标志物
许多研究表明,肌肉减少症患者肠道菌群的多样性和丰富度低于健康对照组,这种变化先于临床症状出现。
▸ 关键菌属丰度变化
•放线菌门和梭杆菌门的比例下降;
•普雷沃氏菌(Prevotella)和粪球菌(Coprococcus)等有益菌群减少;
•普雷沃氏菌(Prevotella)与拟杆菌(Bacteroidetes)比率(P/B)的降低;
•变形菌门尤其大肠杆菌等机会病原菌增加;
•产丁酸盐菌群(如Lachnospiraceae和Ruminococcaceae科细菌)减少。
▸ 菌群代谢物作为生物标志物
短链脂肪酸:尤其是丁酸盐,在肌肉健康中起关键作用。检测报告中显示的短链脂肪酸水平可作为评估风险的生物标志物。
次级胆汁酸:次级胆汁酸水平改变与胰岛素敏感性和肌肉质量相关。
色氨酸代谢物:肠道菌群参与色氨酸代谢,其代谢产物(如血清素等)与系统性炎症和肌肉功能相关。
评估营养状况
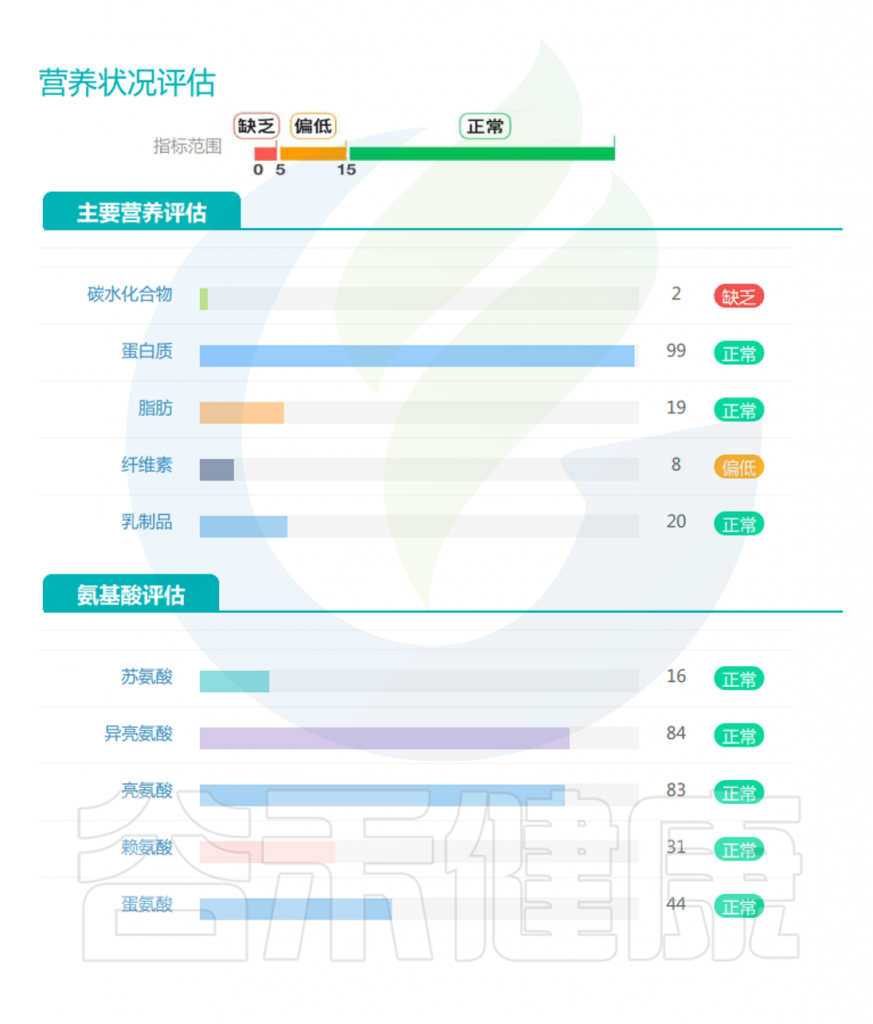
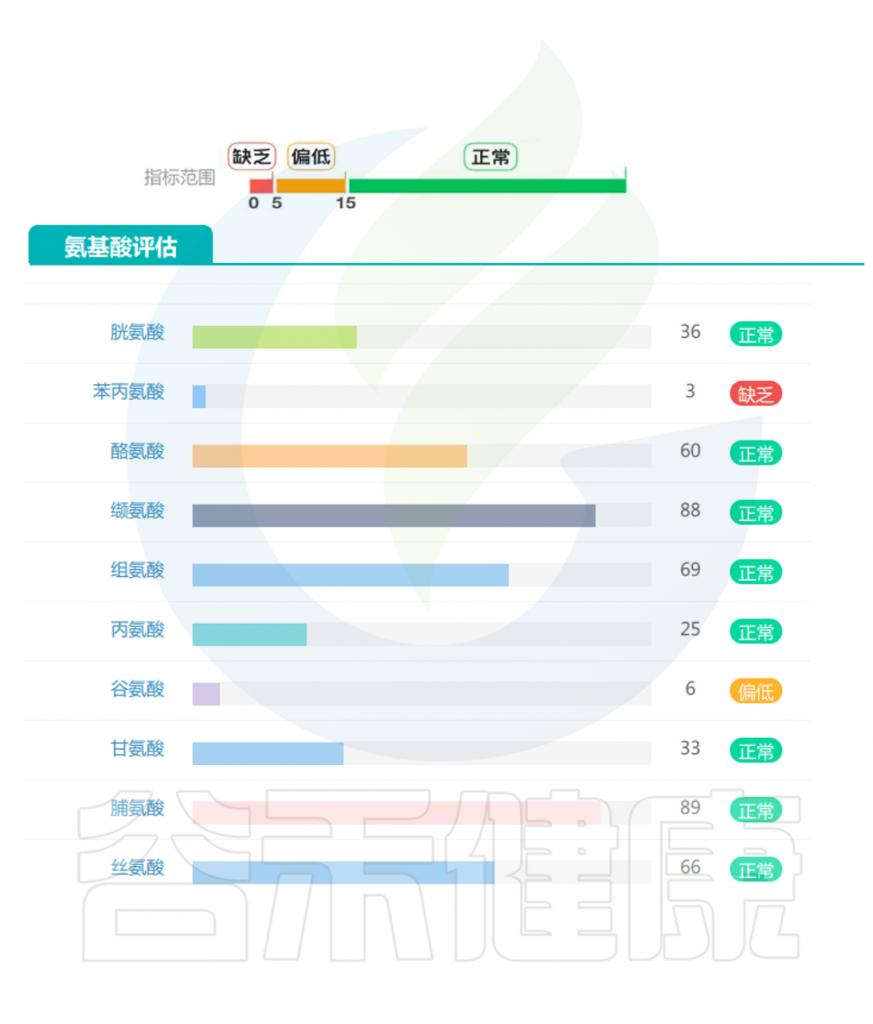
营养不足是肌肉减少症的主要原因之一,谷禾肠道微生物检测报告中有专门的营养评估内容,以及一些与营养相关的健康指标,这些有助于提前预测肌肉减少症风险。
<来源:谷禾健康肠道菌群检测数据库>
▸ 根据营养指标评估是否营养不良
蛋白质和氨基酸:这是与肌肉减少症最直接相关的重要指标。作为构成肌肉组织的基本单位,蛋白质及其组成成分氨基酸的代谢状况直接影响肌肉的合成与分解平衡,因此在预测和诊断肌肉减少症风险中具有核心意义。
短链脂肪酸(SCFAs):作为膳食纤维发酵的主要产物,肠道SCFAs水平直接反映了膳食纤维摄入状况。丁酸盐、丙酸盐和乙酸盐的比例和浓度在肌肉健康中起关键作用。
氨基酸代谢物:支链氨基酸(BCAAs)代谢异常与肌肉减少症相关。
次级胆汁酸:胆汁酸代谢反映肠道对脂质消化吸收的能力,次级胆汁酸水平的变化与胰岛素敏感性和肌肉质量维持相关。
注:谷禾健康与临床机构合作成立的临床营养检测评估技术中心,致力于使营养检测更具体、更直观,扩展肠道菌群检测应用,克服传统营养评估方法局限,为临床提供更有价值的数据支持。
▸ 宏基因组反映消化吸收能力
肠道微生物的功能基因组学分析也可提供营养代谢能力的证据:
KEGG通路富集分析:与蛋白质消化、氨基酸代谢和能量转换相关的功能通路在肌肉减少症患者中表现异常。
碳水化合物活性酶谱:反映消化复杂碳水化合物的能力。
蛋白酶和肽酶活性:与蛋白质消化吸收效率相关。
除了在预防和提前诊断中发挥作用外,肠道菌群还能够在改善或治疗肌肉减少症患者中起到一定辅助作用。
补充益生菌改善肌肉减少症
已经有不少研究证实使用益生菌可以改善肌肉质量和力量。2021年一项随机双盲临床试验证实,口服植物乳杆菌(Lactobacillus plantarum TWK10)六周可有效提升虚弱老年人的肌肉质量和功能,预防肌肉减少症。
同年另一项研究表明,植物乳杆菌TWK10通过提高肌肉组织糖原浓度和调节肠道菌群,预防小鼠因衰老导致的肌肉无力、骨质流失和认知障碍。
此外研究发现,补充干酪乳杆菌(L.casei Shirota)(LcS)可通过肠道肌肉轴减轻衰老小鼠的肌肉减少症。LcS通过改变肠道菌群组成、改善线粒体功能、降低炎症和活性氧水平及维持短链脂肪酸水平,减缓与衰老相关的肌肉质量损失。
从一位举重金牌运动员肠道分离出的长双歧杆菌(Bifidobacterium longum OLP-01),连续补充4周可剂量依赖性地提高小鼠握力和耐力。
肌肉减少症的发展可以受肠道微生物群调节
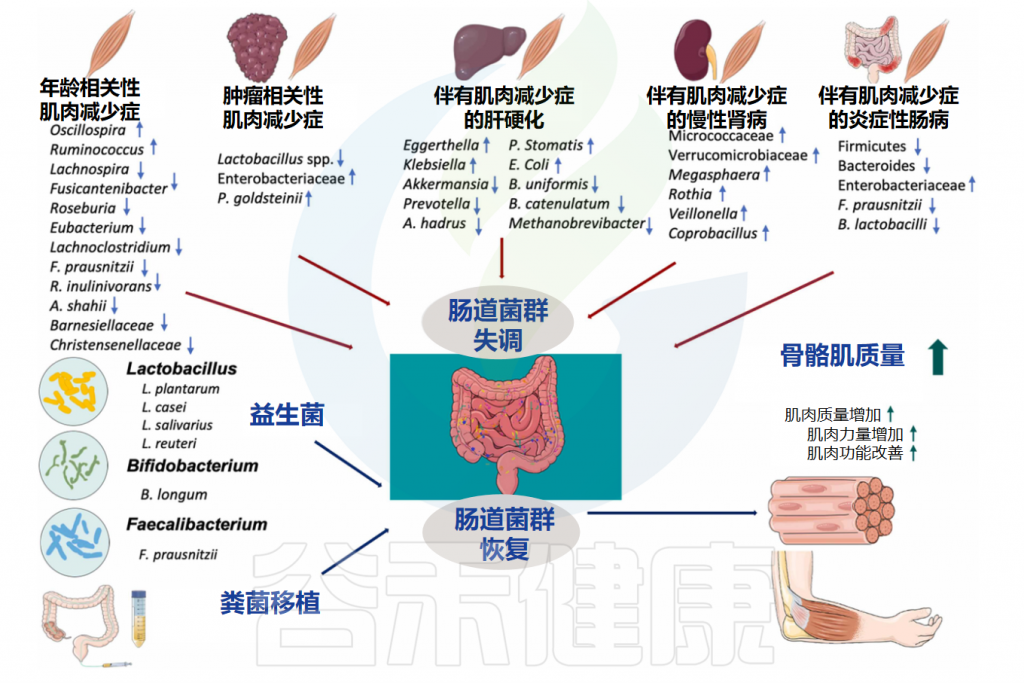
Zhang T,et al.Ageing Res Rev. 2022
益生菌改善肌肉减少症的作用机制可能通过以下几点:
1.提高蛋白质分解吸收效率
肌肉减少症的一个关键问题是营养吸收不足,特别是蛋白质摄入和利用效率下降。研究表明,益生菌能够显著提高蛋白质的消化吸收率,尤其是对植物性蛋白质。
2020一项安慰剂对照、随机、双盲、多中心交叉研究中证实,益生菌补充能显著增加植物蛋白中氨基酸的吸收率。这对素食者或依赖植物蛋白为主要蛋白质来源的老年人尤为重要。
2.增强肠道屏障功能
肠漏被认为与肌肉减少症有关,由于肠道屏障的破坏,其通透性增加,调节有害物质转移的能力降低,从而触发免疫系统和炎症反应。低度慢性炎症是被认为导致合成代谢抵抗和肌肉减少症发展的因素之一 。
而特定益生菌能够增强肠道上皮细胞间的紧密连接,减少肠道通透性。
3.作为肌肉营养传感器
肠道核心菌属普拉梭菌(Faecalibacterium prausnitzii)干预显著增加高脂肪饮食小鼠的肌肉质量,可能与增强线粒体呼吸、ATP合成酶水平提高、肠道菌群改变及肠道完整性改善有关。
肠道微生物群可能还是肌肉营养的调节传感器,肠道菌群的产物,尤其是短链脂肪酸(SCFA)被发现可以改善肌肉质量。喂养SCFA的年轻无菌小鼠的新证据表明,与未治疗的对照相比,骨骼肌质量和力量增加。
粪菌移植
与补充益生菌相比,粪菌移植(FMT)是一种更激进的治疗选择。
▸ 来自健康供体的粪菌移植后改善了原本的肌肉质量
许多研究表明,粪菌移植可能是一种改善骨骼肌质量和功能的方法。与肠道菌群正常的无病原体小鼠相比,缺乏肠道菌群的无菌小鼠表现出骨骼肌萎缩增加,以及与骨骼肌生长和线粒体功能相关的基因表达降低。
在将无病原体小鼠的肠道微生物群移植到无菌小鼠体内后,观察到肌肉质量增加,肌肉萎缩改善,肌肉氧化代谢能力增强,神经肌肉连接相关基因Rapsyn 和 Lrp4 表达增加。
注:Rapsyn 和 Lrp4是肌肉发育和功能中极其重要的两个基因,尤其是在突触后膜乙酰胆碱受体(AChR)聚集和信号转导方面。
上述结果表明肠道菌群在调节骨骼肌质量和功能中的重要作用。当肠道稳态受损时,通过益生菌或粪菌移植(FMT)干预可增强肌肉功能并缓解疾病症状,从而为宿主带来益处。
常规的防治措施
除了通过肠道微生物群干预外,肌肉减少症的常规防治方法我们也应掌握。
▸ 营养充足且均衡的饮食
营养不良和肌肉减少症在老年患者中经常重叠,老年人的营养和能量摄入通常会随着年龄的增长而下降,因此预防和治疗肌肉减少症的主要方法之一是促进营养充足。
蛋白质、维生素D、抗氧化营养素和长链多不饱和脂肪酸的充足摄入量受到特别重视,因为这些营养素能够抵消合成代谢抵抗,促进蛋白质合成并调节炎症,从而防止其对肌肉细胞的有害后果。
营养不良或肌肉减少症老年人的推荐蛋白质摄入量(1.2-1.5 g/kg/天)需高于健康活跃老年人(1.0-1.2 g/kg/天),以满足更高能量需求并防止肌肉损失。
▸ 运动锻炼
目前没有专门用于治疗肌肉减少症的药物,其治疗方法还有肌肉强化和步态训练的物理疗法。
长期研究证实,运动训练(尤其是阻力训练)是改善老年人肌肉质量和力量的最有效方法,几乎所有临床试验均证实了运动对预防肌肉减少症的积极作用。
此外,运动对肠道微生物组有显著影响,研究表明运动能增加肠道菌群多样性并促进有益代谢功能菌群的增长。
随着人口老龄化加剧和不健康生活方式,肌肉减少症已从传统的老年疾病逐渐年轻化,成为威胁全民健康的重要问题。本文深入探讨了肌肉减少症的定义、症状、危害及其与肠道菌群的密切关系,揭示了这一隐形健康杀手的多重面貌。
本文主要从“肠道-肌肉轴”的新视角重新审视肌肉减少症的发生机制及防治。研究表明,肠道菌群通过多种途径影响肌肉系统:调节饮食效果与营养传导,影响肌肉合成代谢/分解代谢平衡,改变肠道通透性和炎症状态,调节线粒体功能与激素分泌,以及影响骨骼肌纤维组成和神经肌肉传递。
并且肌肉减少症患者普遍存在肠道菌群多样性和丰富度降低,表现为特定菌群比例失调,尤其是产生短链脂肪酸细菌的减少。
在日益重视健康老龄化的时代背景下,深入理解肠道菌群与肌肉健康的关联至关重要。肠道微生物群分析有望成为肌肉减少症的早期预警手段,益生菌等菌群调节手段可能成为创新治疗靶点。未来研究需聚焦个体化肠道菌群干预策略,为各类人群提供精准肌肉和营养健康管理方案,使”肌”不可失的健康意识深入人心。
主要参考文献:
Song Q, Zhu Y, Liu X, Liu H, Zhao X, Xue L, Yang S, Wang Y, Liu X. Changes in the gut microbiota of patients with sarcopenia based on 16S rRNA gene sequencing: a systematic review and meta-analysis. Front Nutr. 2024 Jun 28;11:1429242.
Zhang T, Cheng JK, Hu YM. Gut microbiota as a promising therapeutic target for age-related sarcopenia. Ageing Res Rev. 2022 Nov;81:101739.
Liao X, Wu M, Hao Y, Deng H. Exploring the Preventive Effect and Mechanism of Senile Sarcopenia Based on “Gut-Muscle Axis”. Front Bioeng Biotechnol. 2020 Nov 5;8:590869.
de Marco Castro E, Murphy CH, Roche HM. Targeting the Gut Microbiota to Improve Dietary Protein Efficacy to Mitigate Sarcopenia. Front Nutr. 2021 Jun 21;8:656730.
Prokopidis K, Cervo MM, Gandham A, Scott D. Impact of Protein Intake in Older Adults with Sarcopenia and Obesity: A Gut Microbiota Perspective. Nutrients. 2020 Jul 30;12(8):2285.
Zhao J, Huang Y, Yu X. A Narrative Review of Gut-Muscle Axis and Sarcopenia: The Potential Role of Gut Microbiota. Int J Gen Med. 2021 Apr 13;14:1263-1273.
Ticinesi A, Nouvenne A, Cerundolo N, Catania P, Prati B, Tana C, Meschi T. Gut Microbiota, Muscle Mass and Function in Aging: A Focus on Physical Frailty and Sarcopenia. Nutrients. 2019 Jul 17;11(7):1633.
Sarcopenia Cruz-Jentoft, Alfonso J et al.The Lancet, Volume 393, Issue 10191, 2636 – 2646.
Casati M, Ferri E, Azzolino D, Cesari M, Arosio B. Gut microbiota and physical frailty through the mediation of sarcopenia. Exp Gerontol. 2019 Sep;124:110639.
Ticinesi A, Lauretani F, Milani C, Nouvenne A, Tana C, Del Rio D, Maggio M, Ventura M, Meschi T. Aging Gut Microbiota at the Cross-Road between Nutrition, Physical Frailty, and Sarcopenia: Is There a Gut-Muscle Axis? Nutrients. 2017 Nov 30;9(12):1303.
谷禾健康
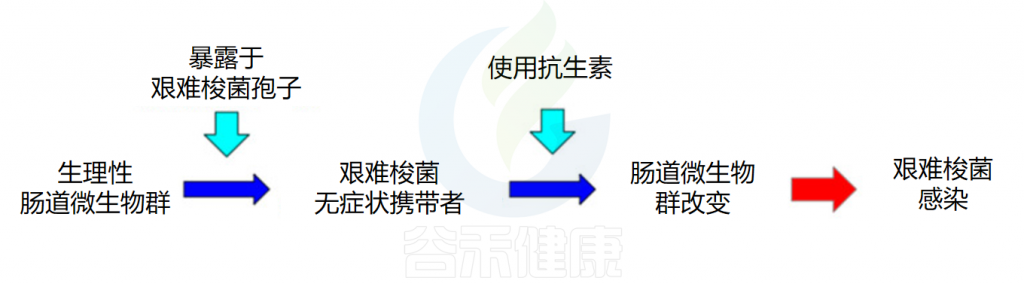
艰难梭菌是一种革兰氏阳性、形成孢子的厌氧芽孢杆菌,是艰难梭菌感染(CDI)的病原体。该菌于1935年首次分离得到,1977年报道了第一例确诊的CDI病例。从那时起,CDI的发病率逐年上升,艰难梭菌感染现在是全世界医院腹泻的最常见原因。
艰难梭菌在我国健康成年人结肠的定植率约为4%-7%,而腹泻患者的检出率高达15%-40%。但为什么一些人群肠道中存在艰难梭菌,却没有出现任何症状?而另一些则会出现腹泻、腹痛,甚至发展为假膜性结肠炎?
这是因为艰难梭菌可分为产毒型和非产毒型,通常只有产毒型会引发临床症状,其感染的表现主要受多种毒力因子影响,这些毒力因子可能比艰难梭菌的存在更为重要。并且健康的肠道微生物组对艰难梭菌感染具有保护作用。平衡的微生物和宿主因子可抑制艰难梭菌的发芽和生长,同时微生物群与宿主免疫系统的相互作用调节免疫反应,刺激抗菌肽和分泌型IgA的产生,维持菌群平衡,通过营养竞争、生态竞争和生态位排斥等机制抵抗艰难梭菌的定植和感染。
例如一些有益菌通过产生短链脂肪酸降低管腔pH值(不利于艰难梭菌),并刺激粘蛋白和抗菌肽的生成以增强防御屏障。丁酸盐还能稳定缺氧诱导因子-1(HIF-1)、增强紧密连接,保护肠道上皮免受艰难梭菌毒素损害。
艰难梭菌的孢子和生长依赖特定胆汁酸,肠道共生细菌通过调节胆汁酸代谢产物,抑制其萌发和定植。例如,Clostridium scindens可催化胆汁酸7α-脱羟基化,生成次级胆汁酸,从而增强对艰难梭菌感染的抵抗力。
当肠道微生物组的平衡状态受到干扰或破坏时,艰难梭菌感染(CDI)的易感性会显著增加。例如由于使用抗生素,年龄增长、其他胃肠道疾病,营养状态不佳、肥胖、癌症化疗这些因素都会增加艰难梭菌感染的风险。
由于艰难梭菌的危害由毒力因子决定,检测产毒菌株或基因显得尤为重要。目前,一些检测方法只能识别艰难梭菌菌株,无法区分是否为产毒菌株,可能导致误诊或过度治疗。为提高诊断准确性,近年来开发了多种技术,包括检测毒素基因的分子诊断技术和直接检测毒素蛋白的免疫学方法。16S测序仅能分辨到物种层面,宏基因组测序(包括一些靶向的测序)则可识别毒力基因。这些技术能够较快速、准确地识别产毒菌株,帮助临床医生制定更有效的治疗方案,减少不必要的抗生素使用及相关并发症。
艰难梭菌感染的治疗和预防也是人们所关心的,其治疗方法包括针对细菌(抗生素)、针对毒素(抗体、结合剂)以及微生物群(保护或恢复)的方法,在暴发性病例或非手术治疗失败时,还可选择结肠切除术或其他微创手术。通过疫苗和益生菌预防艰难梭菌感染的研究逐渐显示出一定的临床效果。
希望通过本文的内容,能够帮助人们更加全面和清晰地了解艰难梭菌的相关知识,同时提高对其危害的认识,从而采取更加科学和有针对性的措施来预防和应对艰难梭菌感染。
艰难梭菌是一种革兰氏阳性、形成孢子的厌氧芽孢杆菌,近年来,由于抗生素的滥用导致肠道菌群失调,艰难梭菌感染(CDI)的发病率在中国和全球范围内不断上升,显示出这一公共卫生问题的严重性。
2022年,中国艰难梭菌感染治疗市场规模达34.14亿元,全球艰难梭菌感染治疗市场规模达到78.74亿元,预计全球艰难梭菌感染治疗市场规模将在2028年达到147.95亿元。
艰难梭菌的感染率不断上升,很多人可能想知道自己体内是否存在这种细菌,以及是否艰难梭菌存在于人体就会致病及造成危害?随着谷禾的视角一起往下看。
1
毒力因子影响艰难梭菌的致病性
首先要强调的一点是,艰难梭菌感染的临床表现受到多种毒力因子的影响,这些毒力因子可能比艰难梭菌的存在更为重要。艰难梭菌分为产毒型和非产毒型,通常只有产毒型会引发临床症状。
产毒艰难梭菌主要产生毒素A(肠毒素)和毒素B(细胞毒素),少部分仅产生毒素B。高毒力菌株(如027型)除了产生这两种毒素外,还产生二元毒素。
据国外综合医院统计,A(+)B(+)占艰难梭菌的57%,A(-)B(+)占34%,A(-)B(-)占9%。毒素A阳性,毒素B阴性的菌株尚未被发现,毒素B可以单独导致艰难梭菌致病。
◮ 艰难梭菌的毒力因子
毒素A:主要作用于肠道,导致肠道上皮细胞的损伤和炎症反应。它通过结合肠道细胞表面的受体,诱导细胞内信号转导,导致细胞凋亡和肠道通透性增加,从而引发腹泻。
毒素B:具有更强的细胞毒性,能够直接破坏细胞骨架,导致细胞死亡,破坏紧密连接并丧失肠道屏障功能。它在致病过程中,尤其是在高毒力菌株中,起着关键作用。
二元毒素:一种ADP-核糖基转移酶,导致肌动蛋白细胞骨架解聚(导致屏障功能丧失和紧密连接破坏)和微管突起(导致艰难梭菌粘附增加)。
致病性基因和毒素作用方式
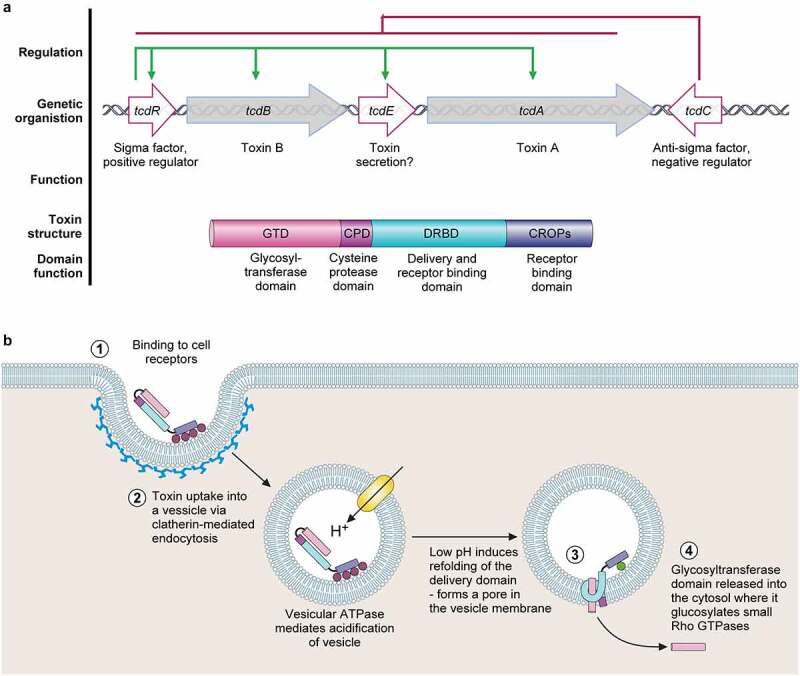
Buddle JE,et al.Virulence.2023
◮ 毒素诱导引发的免疫反应导致各种症状
这些毒素在致病性位点(PaLoc)内编码,能够与肠上皮细胞的受体结合并被内化。在细胞内,它们使小的Rho蛋白葡萄糖化,导致紧密连接破裂、上皮完整性降低,并增加细菌对宿主上皮的粘附。
毒素诱导的肠道屏障损伤会引发免疫反应,其特征是分泌促炎细胞因子和趋化因子,导致中性粒细胞、肥大细胞、单核细胞和先天性淋巴细胞的募集和激活;以及花生四烯酸代谢物的分泌、P物质和活性氧中间体的生产。这些细胞因子和免疫细胞的作用会引发艰难梭菌感染的临床症状。例如,肥大细胞脱颗粒刺激组胺释放,增加肠道屏障的通透性,导致大量液体流失到管腔中,从而引发严重的腹泻、痉挛、脱水和伪膜性肠炎等症状。
艰难梭菌的各种毒力因子

Buddle JE,et al.Virulence.2023
2
产毒艰难梭菌及我国的流行情况
目前已鉴定出几十种艰难梭菌菌株,其相对比例在过去几年中迅速变化,且毒力和感染能力可能存在差异。我们这里简单介绍几种高毒性艰难梭菌菌株以及我国的主要流行情况。
◮ 毒力较高的艰难梭菌
⑴027菌株
027菌株是近年来备受关注的高毒力菌株,部分027菌株在体外能够产生更多毒素,并且更容易与人类肠道上皮细胞结合,通常与严重腹泻和高死亡率相关。该菌株在北美和欧洲的医院中广泛传播,成为医院获得性腹泻的主要原因。
⑵017菌株
这种菌株在1990年代首次被识别,主要在亚洲地区流行。017菌株通常被认为是毒素A阴性、毒素B阳性的菌株。由于毒素A检测通常用于识别粪便样本中的艰难梭菌,因此可能会遗漏这种菌株。
⑶078菌株
078介导的艰难梭菌感染患者更常见于靠近农场的地区,078菌株是食用动物中最常见的类型,在牛和猪中都有发现,人可能通过食用动物导致感染。078菌株的毒力特征与027菌株相似,所有027和078菌株似乎都具有完整的肌动蛋白特异性ADP核糖基化毒素。
⑷其他菌株
除了027、017和078菌株,还有其他核糖型的艰难梭菌菌株,如001、106和053等。然而每种核糖型的相对比例在过去几年中迅速变化。核糖型001的比例从25.1%下降到7.8%,核糖型106的比例从26.2%下降到20.2%,且106几乎只在英国发现。
◮ 我国的艰难梭菌流行情况

一项荟萃分析统计了我国大陆部分省份的艰难梭菌感染发病率及主要流行和耐药的艰难梭菌。
艰难梭菌在健康成年人结肠的定植率约为4%-7%,而国内腹泻患者的检出率为15%-40%(共分析了15,313个样本)。在中国大陆,ST-37(017)和ST-3是最普遍的菌株;幸运的是,ST-1(027)和ST-11(078)等高毒力菌株迄今很少出现。
并且不同省份的阳性率存在差异显著:
湖北:23%
河北:19%
安徽:19%
四川:17%
宁夏:4%
河南:3%
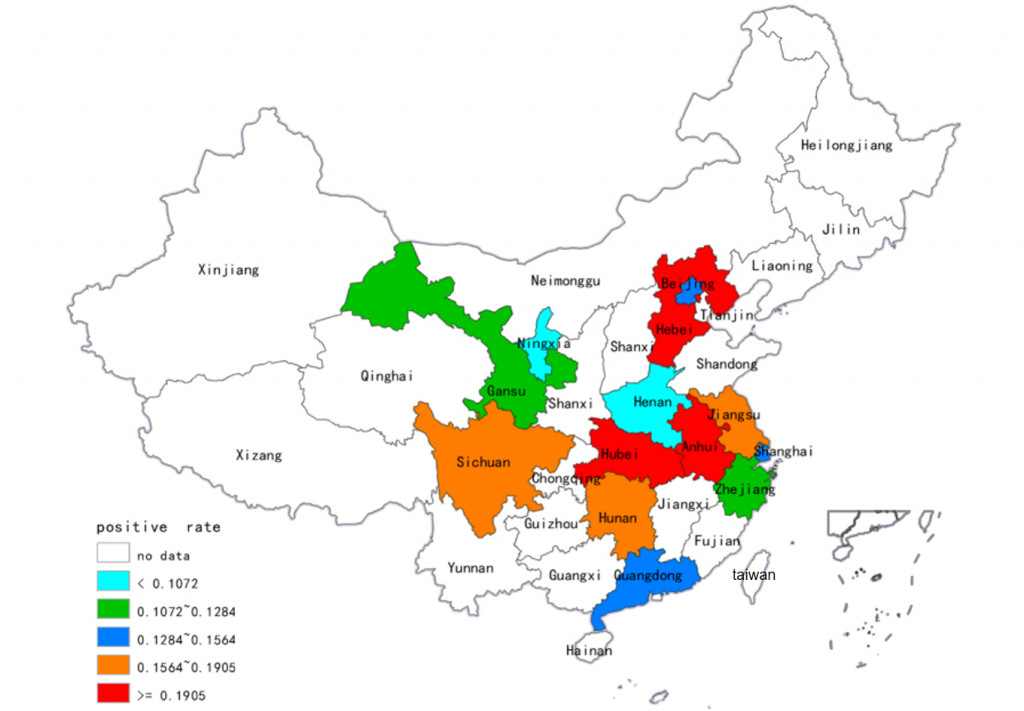
doi: 10.1038/srep37865.
中国临床艰难梭菌的分子特征
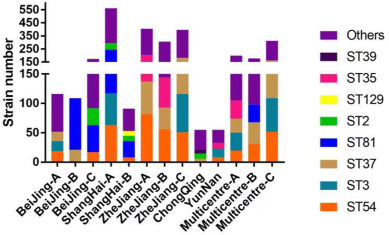
Wu Y,et al.Anaerobe.2022
中国大陆的流行艰难梭菌株并非高毒力类型,这可能是近年来没有艰难梭菌感染爆发的原因。此外,关于毒素A阴性和毒素B阳性菌株的报道逐渐增加,许多研究也发现了这一现象。在亚洲,毒素A阴性和毒素B阳性菌株的数量明显高于欧美国家。
◮ 我国的艰难梭菌耐药情况
我国的艰难梭菌对环丙沙星、克林霉素和红霉素的耐药率高于其他地区;然而,报道的艰难梭菌分离株均未对甲硝唑、万古霉素、替加环素或哌拉西林/他唑巴坦耐药。
3
非产毒艰难梭菌
◮ 菌株特性不同,不会致病
非产毒性艰难梭菌(NTCD)是指那些不产生致病毒素的艰难梭菌菌株。这些菌株能够在肠道中定殖,并且通常从无症状个体中分离出来。
非产毒性艰难梭菌菌株表现出与产毒性菌株不同的表型特征,如更高的甲硝唑耐药性和更高的孢子形成效率。
◮ 非产毒菌株定植可能具有保护作用
非产毒性艰难梭菌能够在肠道中定殖而不引起症状,并有研究发现其可能有助于降低由产毒性艰难梭菌引起的感染风险。研究表明,NTCD的定殖可以通过竞争性抑制机制,防止产毒性菌株的定殖和毒素产生。
临床应用与研究:在临床试验中,NTCD-M3等菌株已被用于预防艰难梭菌感染,通过诱导肠道和系统性免疫反应,从而减少产毒性艰难梭菌的附着和感染。
了解艰难梭菌感染的发病机制对于制定有效的疾病治疗和预防措施至关重要。让我们一起来看下人体是如何感染艰难梭菌以及感染后会出现的症状。
◮ 艰难梭菌主要通过孢子传播感染
艰难梭菌(C.difficile)作为一种专性厌氧菌,通常无法在大气中存活,那么它是如何传播到人体的呢?这是通过形成孢子来实现的,这些孢子即使在恶劣的环境条件下也能存活。除了提供对氧的抵抗力外,孢子还对紫外线、干燥、热、许多消毒剂和抗生素具有抵抗力。
注:艰难梭菌孢子已在各种环境来源中检测到,包括家畜、水源和土壤。
艰难梭菌感染的发病机制
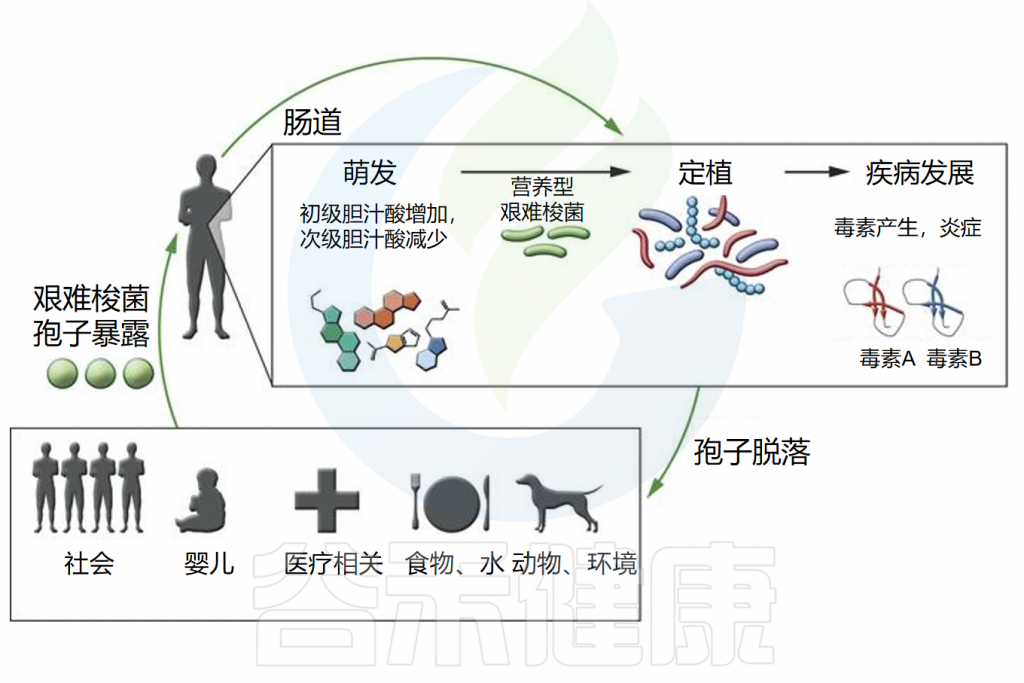
doi.org/10.1172/JCI72336.
1
感染过程
◮ 孢子生长必须依赖特定的胆汁酸
通过粪口途径摄入艰难梭菌孢子后,孢子需要发芽并生长为定植于胃肠道的营养细胞。然而,摄入孢子并不总是会导致定植,因为胃肠道环境必须适宜这一过程的发生。
体外研究表明,发芽和生长成营养形式取决于特定初级胆汁酸(如牛磺胆酸)的存在。相反,其他胆汁酸,如鹅去氧胆酸,可能会抑制艰难梭菌孢子的发芽。
胃肠道内的微生物在胆汁酸代谢中起关键作用,微生物群落的调节会影响代谢物的可用性。来自抗生素处理小鼠的盲肠提取物含有高水平的胆盐并促进孢子萌发,而来自未处理小鼠的盲肠提取物则没有。我们推测:抗生素的使用改变了肠道微生物群的代谢,导致胆汁酸种类更易促进艰难梭菌孢子的生长。
◮ 定植后毒素介导炎症和疾病
一旦定植,艰难梭菌会引发毒素介导的炎症和疾病。它产生两种主要毒素,即艰难梭菌毒素A和B(TcdA和TcdB),这些毒素在营养生长的静止期产生,主要导致粘膜上皮损伤和炎症反应。
另一种毒素,艰难梭菌二元毒素(CDT),会破坏肌动蛋白细胞骨架,研究表明其存在可能增加菌株的毒力。
由于孢子暴露和艰难梭菌定植不一定导致临床疾病,胃肠道微生物群和宿主在艰难梭菌的疾病发展中可能发挥重要作用。
2
艰难梭菌感染后的临床症状
产毒艰难梭菌菌株感染的临床表现通常从无症状携带到轻度或中度腹泻,或是暴发性,有时是致命的。症状在定植后不久开始,中位发病时间为2至3天。
◮ 常见的症状
腹泻:这是艰难梭菌感染最常见的症状,通常表现为水样腹泻,频率可达每天多次。腹泻可能伴有粘液或脓性分泌物。
腹痛和腹部不适:患者常感到腹部绞痛或不适,疼痛可能是间歇性的,且通常与腹泻发作相关。
发热:部分患者可能出现低热,体温通常在37.5°C至38.5°C之间。
恶心和食欲减退:患者可能会感到恶心,伴随食欲减退,进而导致体重下降。
脱水:由于频繁腹泻,患者可能出现脱水症状,如口干、尿量减少、皮肤弹性下降等。
腹胀:部分患者可能会感到腹部胀气或腹部膨胀。
◮ 严重并发症
在一些情况下,艰难梭菌感染可能导致更严重的并发症,包括:
伪膜性结肠炎:表现为严重的腹痛、腹泻和发热,肠道内形成伪膜。
肠穿孔:极少数情况下,感染可能导致肠道穿孔,表现为剧烈腹痛和急性腹膜炎。
中毒性巨结肠:具有全身中毒症状及全结肠或节段性结肠扩张的临床表现。是一种危及生命的并发症,表现为腹痛、腹胀、腹泻和全身症状加重,可能需要手术干预。
◮ 肠外表现
艰难梭菌感染不仅会导致肠道相关的症状,还可能引发一些肠道之外的表现,包括脱水、电解质紊乱、低白蛋白血症、低血压、肾功能衰竭、全身炎症反应综合征、关节炎、菌血症、败血症甚至死亡。
感染的核心是肠道菌群平衡被破坏
艰难梭菌感染发病机制的核心是微生物群的破坏。健康的肠道微生物群对于防止病原体定植(称为定植抗性)至关重要 。
未被破坏的微生物群能够抵抗病原体的定植,健康平衡的微生物和宿主因子均可抑制艰难梭菌的发芽和生长。同时微生物群和宿主免疫系统之间的串扰导致调节免疫反应。此外,微生物群可以刺激抗菌肽和分泌型IgA的产生,从而维持微生物群的组成。并且已经提出了多种机制来解释为什么微生物群被破坏会导致定植抗性丧失,包括营养竞争、生态竞争和生态位排斥。
而由于抗生素使用、药物、年龄变化、饮食或炎症等因素导致微生物群的破坏,可导致艰难梭菌感染的发展。由于结构或代谢环境的变化,菌群失调会导致定植抗性丧失。特定群落成员的损失可能会影响微生物和宿主产生的代谢物的水平,从而促进孢子萌发和艰难梭菌生长。菌群失调也可能通过免疫调节的丧失和促炎状态导致免疫反应失衡,这两者都会影响疾病的发展。营养型艰难梭菌产生的毒素可刺激炎性细胞因子、中性粒细胞和抗毒素抗体的生成。
微生物群对CDI期间病原体抗性和宿主的机制
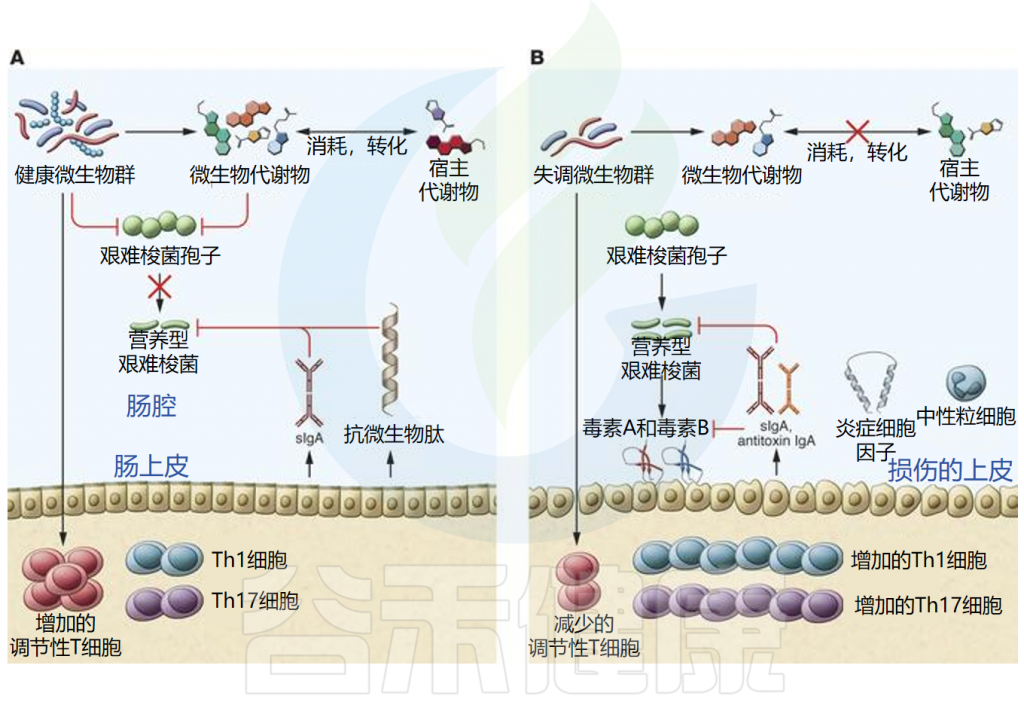
doi.org/10.1172/JCI72336.
据研究文献报道,以下这些因素会增加获得CDI的风险。
1
使用抗生素
◮ 使用过抗生素的人患病率更高
使用抗生素是艰难梭菌感染中最常见的诱发因素。一项大型回顾性研究分析了10154例艰难梭菌感染患者的数据,发现78%的患者在感染前3个月内使用过抗生素。
大多数抗生素都与艰难梭菌感染(CDI)发展相关,但最常见的药物包括青霉素、头孢菌素和氟喹诺酮类药物。在一项关于社区获得性CDI中抗生素使用情况的荟萃分析中,克林霉素发生社区获得性CDI的风险最高,然后依次是氟喹诺酮类药物、头孢菌素类、青霉素类、大环内酯类和磺胺类/甲氧苄啶类。
◮ 使用抗生素导致肠道微生物平衡被破坏增加艰难梭菌感染的风险
抗生素的使用,尤其是广谱抗生素,会显著改变肠道微生物群的组成和多样性,导致微生物群失调。这种失调主要表现为有益菌群(如双歧杆菌、乳酸菌等)数量减少,抑制艰难梭菌的生长和毒素产生的能力减弱,导致更易感染艰难梭菌。
艰难梭菌感染的发病机制
Piccioni A,et al.Int J Mol Sci.2022
2
高龄
◮ 高龄人群CDI的患病率和死亡率更高
正如多项研究所记录的那样,高龄是CDI的重要风险因素。65岁及以上的老人患病人数显著增加,人口发病率比其他年龄组高5倍以上。
并且还发现CDI的死亡率随着年龄的增长而显著升高。在2011年对美国CDI负担的最新研究中,发现65岁及以上的人大约占CDI病例总数的57%,但该年龄组的CDI死亡占CDI死亡总数的83%。
◮ 年龄增长免疫退化、微生物多样性下降
年龄增长会影响肠道微生物组结构。人类肠道微生物组在一生中经历显著变化,老年人群的微生物组多样性较低且不断变化。研究发现,老年人保护性物种(如双歧杆菌和部分厚壁菌门成员)减少,有害物种(如变形菌门)增加。这些变化与免疫系统退化(即免疫衰老)有关。
尽管年龄是CDI的独立危险因素,但其与抗生素使用增加、更频繁的医院就诊及疾病发展密切相关,这些因素共同提高了艰难梭菌的易感性。
新生儿与成人艰难梭菌感染的比较
Vasilescu IM,et al.Front Microbiol.2022
3
其他胃肠道疾病
患有其他胃肠道疾病的患者也可能更容易感染艰难梭菌。炎症性肠病(IBD)已被证实是CDI的危险因素,并与更严重的疾病结果相关。IBD患者肠道菌群呈现多样性降低,同时存在以变形菌门为主的多种潜在致病菌。然而,这些微生物群落如何影响艰难梭菌易感性的具体机制较为复杂。
◮ 肠道炎症性疾病会促进艰难梭菌感染
宿主免疫反应能调节微生物群,而IBD加重CDI病情表明炎症可促进CDI发展。抗菌肽脂质运载蛋白-2和钙卫蛋白等炎症产物限制肠道环境中营养物质可用性,可能为艰难梭菌创造有利条件。肠道菌群类型影响粘膜IgA库,复发性CDI患者结肠活检中IgA产生细胞减少。
还观察到各种微生物会影响T细胞的亚群,例如梭菌属诱导Treg物种和分段丝状细菌诱导Th17细胞分化。这些微生物种群的调节,例如抗生素后,可能会影响艰难梭菌的定植。
4
其他风险因素
除此之外,还有一些因素也会增加艰难梭菌感染的风险。如:
医疗机构暴露:住院患者,特别是长期住院者,长期护理机构居住者容易艰难梭菌感染;
胃酸抑制剂使用:质子泵抑制剂(PPIs)和H2受体拮抗剂,降低胃酸可能导致艰难梭菌孢子存活率增加,长期使用与CDI风险增加相关。
手术和医疗操作:胃肠道手术、鼻胃管和胃肠营养管的使用、结肠镜检查会导致艰难梭菌感染风险升高;
营养状态不佳:低蛋白血症、营养不良的人群易感染艰难梭菌;
肥胖、癌症化疗也可能会增加艰难梭菌感染的风险。
肠道微生物群被破坏是艰难梭菌感染发病的关键机制。健康的肠道菌群对防止艰难梭菌定植和感染至关重要。那么,微生物群究竟如何在这一过程中发挥作用?那我们一起来看看。
艰难梭菌感染中的微生物群改变
正常的肠道菌群通过对艰难梭菌的定植抗性在预防 艰难梭菌感染中起着核心作用。这导致了一个问题,即是否存在一种微生物群紊乱模式,这种模式易导致艰难梭菌定植和感染。
◮ 菌群多样性降低,厚壁菌门增加
多项研究一致显示,与健康人群相比,艰难梭菌感染(CDI)患者的菌群复杂性和丰富度明显降低。这种多样性降低被认为是CDI发病和复发的关键因素。
厚壁菌门(Firmicutes)减少:CDI患者中厚壁菌门的丰度和多样性显著降低,尤其是瘤胃球菌科(Ruminococcaceae)和毛螺菌科(Lachnospiraceae)等保护性菌群。
拟杆菌门(Bacteroidetes)改变:CDI患者通常表现为拟杆菌门多样性降低,但有研究显示有症状患者中某些拟杆菌属(Bacteroides)可能增加。
变形菌门(Proteobacteria)增加:CDI患者体内变形菌门(特别是肠杆菌科)的比例明显增高。
◮ 产丁酸细菌减少,机会性病原体增加
接受多轮抗生素治疗的复发性CDI患者肠道微生物群组成遭受严重破坏。对比CDI患者、艰难梭菌阴性院内腹泻患者和健康对照受试者的远端肠道微生物群发现,艰难梭菌感染可能导致功能性菌群发生以下变化:
产丁酸盐细菌减少:包括罗氏菌属(Roseburia)、普拉梭菌(Faecalibacterium Prausnitzii)、假丁酸弧菌属等。
产乳酸细菌增加:特别是肠球菌属(Enterococcus)。
机会性病原体增加:研究发现,与健康者相比,白色念珠菌和光滑念珠菌在艰难梭菌阳性样本中更常见。
在艰难梭菌感染患者的肠道微生物群中,肠球菌、乳酸菌、大肠杆菌、肠杆菌、副拟杆菌、嗜粘蛋白阿克曼菌的相对丰度增加,以及粪杆菌、Roseburia、Blautia、Prevotella、链球菌的水平降低。
艰难梭菌感染相关的肠道微生物群失调

Vasilescu IM,et al.Front Microbiol.2022
生化和免疫紊乱影响感染
肠道菌群失调还引发多种生化和免疫紊乱:如短链脂肪酸(SCFA)水平降低、初级胆汁酸增多、碳水化合物可利用性提高、免疫功能受抑及竞争微生物缺乏。这些变化共同促进艰难梭菌的定植、孢子萌发和生长繁殖。
◮ 丁酸盐有助于减轻艰难梭菌毒素的损害
短链脂肪酸可以通过降低管腔pH值(对艰难梭菌不利)并通过产生粘蛋白和抗菌肽来刺激防御屏障。丁酸盐还可以通过稳定缺氧诱导因子-1(HIF-1)和增加紧密连接来保护肠道上皮免受艰难梭菌毒素的损害,抑制肠道炎症和细菌易位。
在小鼠的饮用水中添加丁酸盐,施用丁酸盐的前药、三丁酸甘油酯或富含菊粉的饮食(菊粉可以被肠道共生细菌发酵,产生短链脂肪酸,主要是乙酸盐、丙酸盐和丁酸盐)可使小鼠免受CDI的侵害。
◮ 胆汁酸会影响艰难梭菌的定植和生长
艰难梭菌孢子萌发由蛋白酶CspC和CspA感知胆汁盐和氨基酸复合物而调控。某些胆酸盐衍生物和甘氨酸可促进孢子萌发,而脱氧胆酸盐抑制艰难梭菌生长,鹅去氧胆酸盐则阻断牛磺胆酸盐介导的萌发过程。
共生肠道梭菌通过调节胆汁酸代谢产物,创造不利于艰难梭菌萌发和定植的环境。例如,Clostridium scindens能催化胆汁酸7α-脱羟基化,产生次级胆汁酸,增强对艰难梭菌感染的抵抗力。失去这类能将初级胆汁酸转化为具抗菌活性次级胆汁酸的微生物,将显著增加CDI风险。
◮ 艰难梭菌会刺激其他细菌产生吲哚造成不利肠道环境
最近的研究发现,CDI患者肠道腔中的吲哚水平增加(色氨酸代谢物参与微生物生长、毒力诱导、抗酸性、生物膜形成),艰难梭菌本身不能产生这种代谢物,但会刺激其他细菌产生吲哚,以阻止和抑制吲哚敏感菌株的生长和发展,包括保护性肠道微生物群代表, 从而确保有利于艰难梭菌生存的肠道环境。
微生物群介导艰难梭菌的定植和感染
一些人群中虽然有艰难梭菌定植,但并不会出现致病症状,这可能与肠道微生物群的保护作用相关。
◮ 婴儿艰难梭菌的定植率较高,但很少出现症状
由于婴儿肠道的不成熟和肠道微生物群的不稳定,其特别容易受到艰难梭菌定植的影响,但并不会出现症状和发展为疾病。
在<1个月大的婴儿中,艰难梭菌的平均定植率为 37%,范围在0到61%之间。在1到6个月大之间,定植率仍然很高,为30%,出生后第一年结束时下降到约10%。不同研究报告的12个月以下儿童的定植率从14%到71%不等,这个年龄组最常被艰难梭菌定植,并且他们没有症状。
无症状携带率在3岁左右下降至0-3%,接近成人水平。同时,出生至24个月间血清针对毒素A和B的IgG抗体浓度逐渐升高。3岁左右,儿童肠道微生物群趋于稳定并具备成人特征,这可能导致症状性CDI从该年龄开始增加。
注:新生儿微生物群以革兰氏阳性球菌、肠杆菌科或双歧杆菌科为主,逐渐过渡到以双歧杆菌科为主。双歧杆菌可通过上调肠道树突状细胞产生IL-10,解释了艰难梭菌定植婴儿无症状的原因。在剖宫产新生儿中,T细胞和CD4+辅助性T细胞水平降低,可能因未成熟的免疫系统无法激活炎症反应所致。
研究发现,配方奶喂养婴儿的艰难梭菌定植率高于母乳喂养婴儿,且母乳喂养婴儿的菌落计数明显更低,这可能与母乳中含有毒素A和B的抗体有关。
总之,新生儿艰难梭菌定植的高携带率可以用新生儿肠道的不成熟和肠道微生物群的存在来解释。然而,出生后的母乳喂养带有毒素抗体,加上艰难梭菌毒素受体的缺乏,可以帮助婴儿免受艰难梭菌毒素的有害影响。
◮ 肠道微生物多样性降低的人群和老年人更易受艰难梭菌影响
几项研究还比较了老年人群的肠道微生物样本,这些人群更容易受到艰难梭菌影响。
老年艰难梭菌感染患者的肠杆菌科、肠球菌属和乳酸杆菌的数量较高,而健康的老年人携带更多样化的拟杆菌属菌株。并且与任一老年人群相比,健康成年人也更有可能拥有更多的双歧杆菌和拟杆菌。最近使用16S rRNA 基因高通量测序的研究更深入地研究了艰难梭菌阳性人群的群落结构。观察到,与健康患者相比,活动性CDI患者的肠道微生物群多样性较低。
类似研究发现,与健康成人相比,CDI腹泻患者的肠道微生物群多样性显著降低,尤其是厚壁菌门的多样性较低。健康人群中以Lachnospiraceae、Ruminococcaceae和Bacteroidaceae为主导,而CDI和非CDI腹泻患者的微生物群落高度相似,表明腹泻或炎症可能与特定微生物群落相关。
在小鼠模型中进行了类似观察,与人类相似,抗生素降低了小鼠肠道微生物群多样性,使其更易患肠道疾病,包括CDI。研究发现,头孢哌酮、克林霉素或多种抗生素处理后,易感小鼠感染前以乳酸菌科和肠杆菌科为主,而对CDI具有保持抗性的动物以Lachnospiraceae为主。后续研究表明,被Lachnospiraceae定植的小鼠比被大肠杆菌定植的小鼠艰难梭菌定植减少且病情较轻。小鼠模型为识别CDI保护性成分提供了可测试的方法。
◮ 复发性CDI:微生物群恢复不完全
艰难梭菌感染(CDI)最常见的并发症是恢复不完全和反复感染。初次感染后复发率约为20-30%,3次感染后高达60%。研究发现,复发患者的微生物群多样性低于单次CDI患者,这表明可能可以根据感染期间存在的微生物群落预测复发。尽管一些研究在分析中包含了复发样本,但尚未确定复发性CDI患者特有的微生物特征。
另外有研究发现,复发性CDI患者体内初级胆汁酸浓度较高。粪菌移植后,次级胆汁酸浓度增加,接近健康供体水平,而这些酸在FMT前样本中未检测到。该结果与体外和小鼠研究一致,表明次级胆汁酸(如石胆酸和脱氧胆酸)可抑制艰难梭菌生长。尽管细菌群落决定代谢环境,但不同细菌群落可能通过相似功能实现相同代谢结果,仅靠群落结构可能不足以预测复发风险。
如何定义艰难梭菌感染病例?
只有产生毒素的产毒艰难梭菌菌株才具有致病性。根据欧洲临床微生物学和传染病学会(ESCMID)指南,CDI定义为:(i)符合CDI的临床表现,且粪便中检测到毒素A或毒素B的艰难梭菌,且无其他腹泻原因;或(ii)伪膜性结肠炎(PMC)患者。
美国医疗保健流行病学学会和美国传染病学会的定义类似:CDI病例需具备症状(通常为腹泻),且粪便检测产毒艰难梭菌或其毒素阳性,或结肠镜或组织病理学显示PMC。
那我们该如何检测艰难梭菌感染(CDI)?艰难梭菌感染检测通常包括以下方法:
1
临床评估
•症状:难梭菌感染病的主要症状包括腹泻(每天3次或以上稀便,持续2天以上)、腹痛、发热、恶心和脱水等。严重病例可能出现伪膜性结肠炎(PMC)、中毒性巨结肠或感染性休克。
•病史:重点关注患者的抗生素使用史(尤其是第三代头孢菌素、氟喹诺酮类等)、住院史、免疫抑制状态以及质子泵抑制剂(PPI)的使用。
2
实验室检测方法
◮ 细菌培养
用环丝氨酸头孢西丁果糖琼脂培养基(CCFA)等进行厌氧培养,需时72小时,灵敏度高且可获得菌株,但不能检测毒素不能区分非产毒株。
但分离菌株后,可以通过直接从菌落悬浮液或细菌生长的肉汤上清液中检测其体外毒素的产生来确定其致病潜力。
◮ 高通量测序
高通量测序可检测艰难梭菌菌株或毒力基因,16S测序仅能分辨到物种层面,可通过谷禾16S健康报告的解读,并结合自身有没有腹泻症状。然后进一步去判别是否存在产毒菌株。
与此同时,宏基因组测序(包括一些靶向的测序)则可识别毒力基因。
◮ 谷氨酸脱氢酶测定
谷氨酸脱氢酶(GDH)是所有艰难梭菌菌株表达的代谢酶,可通过ELISA或免疫层析法检测。阳性结果仅表明存在艰难梭菌,无法判断其是否产毒。由于其高阴性预测值(NPV,80.0%-100%),GDH阴性结果通常可排除感染,常用于初筛。
◮ 毒素检测
细胞毒性测定被认为是检测艰难梭菌的游离毒素(主要是毒素 B)的参考方法。
酶联免疫吸附试验(EIA):检测艰难梭菌毒素A或毒素B,快速但敏感性较低。
细胞毒素中和试验:检测毒素活性,敏感性和特异性较高,但耗时较长。
◮ 核酸扩增检测(NAATs)
实时PCR或环介导等温扩增法(LAMP) :检测艰难梭菌毒素基因,耗时短,敏感性高,但可能检测到无症状定植者,且成本高。
3
综合算法
根据欧洲临床微生物学和传染病学会(ESCMID)指南,推荐使用两步或三步算法:
初筛:谷氨酸脱氢酶(GDH)抗原检测或核酸扩增试验(NAAT)。
确认:毒素检测(EIA或细胞毒素试验)。
4
其他辅助检查
血常规:轻、中度感染者外周血白细胞可正常,严重感染者白细胞升高。
降钙素原(PCT):对诊断CDI意义不大,但PCT>0.2 ng/ml时,提示CDI有重症化趋势。
腹部CT:对重症CDI患者有辅助诊断意义,即结肠壁增厚、结节状结肠袋增厚、水肿厚度>4 cm,特别是炎症部位在升结肠。
内镜检查:内镜检查可作为辅助诊断,典型征象包括黏膜充血、水肿、糜烂、溃疡、直肠乙状结肠有多发性隆起的斑片或融合为大片的灰绿色、黄褐色伪膜覆盖黏膜表面。部分患者表现可不典型,尤其炎症性肠病合并艰难梭菌感染时多无特征性病变。伪膜性改变可能表明感染了产毒艰难梭菌。
艰难梭菌感染(CDI)的治疗包括针对细菌(抗生素)、针对毒素(抗体、结合剂)、宿主反应(调节炎症)或微生物群(保护或恢复)的方法,以及在暴发性病例或非手术方法失败的情况下,结肠切除术或其他侵入性较小的手术。选择取决于疾病严重程度、病史和宿主因素。
1
针对细菌——抗生素
停用有问题的抗生素以恢复正常肠道菌群是治疗CDI的理想方法。但在感染负担高或需持续抗生素治疗其他感染时,通常需要使用针对艰难梭菌的抗菌药物。
然而,几乎所有抗生素,包括针对艰难梭菌的药物,都可能进一步破坏肠道微生物群,延迟耐药性菌群的恢复,并增加再次感染的风险。目前用于治疗CDI的主要抗菌药物包括:
•万古霉素:万古霉素是美国食品药品监督管理局(FDA)批准的第一种CDI药物。最近的临床试验数据表明,万古霉素在治疗重症时优于甲硝唑。
•甲硝唑:与万古霉素的疗效相当,成本优势以及对万古霉素耐药肠球菌传播的担忧,甲硝唑成为CDI的推荐药物。但随着艰难梭菌流行菌株 BI/NAP1/027/III 的出现,甲硝唑治疗失败的报道越来越多。
•非达霉素:非达霉素也是获得FDA批准的其他治疗CDI药物。
•新型小分子抗菌剂:乳酸菌素3147是一种由乳酸乳球菌产生的双组分抗生素,它靶向细胞壁前体脂质II,抑制肽聚糖的生物合成,并在细胞膜上形成孔,实现细胞死亡。粪便发酵模型证明了乳酸素 3147 对一系列艰难梭菌分离株的强效细胞杀伤活性,在 30 分钟内完全消除艰难梭菌。
与传统药物相比,这种窄谱抗菌药物可能具有多种优势,包括减少对微生物组的影响、降低复发率、优于常规治疗以及改善药代动力学特征。然而,在保持非孢子形成厌氧菌和总革兰氏阴性厌氧菌完好无损的同时,这种抗菌剂对乳酸杆菌和双歧杆菌产生了负面影响。
2
针对毒素——阻断、中和毒素
CDI的发病机制以毒素介导为主,因此中和或阻断毒素是合理策略。但尽管抗毒素在动物模型中可改善疾病,但在人类中仅表现为减少复发性CDI。
•单克隆抗体:一项随机双盲安慰剂对照研究评估了针对艰难梭菌毒素A和B的两种中和单克隆抗体。在200名参与者中,治疗组的CDI复发率显著低于安慰剂组。然而,单克隆抗体未能缩短腹泻持续时间、降低严重程度或减少住院时间。住院、年龄较大、有严重潜在疾病或重症CDI的患者对治疗反应较差。
•Tolevamer:Tolevamer 是一种高分子量苯乙烯磺酸盐聚合物,可在体外中和艰难梭菌毒素。一项针对轻中度疾病的研究显示,6克剂量的Tolevamer与每日500毫克万古霉素疗效相当。
注:然而,Tolevamer的临床成功率低于甲硝唑和万古霉素。汇总分析显示,Tolevamer组的临床成功率为44.2%,显著低于甲硝唑组的72.7%和万古霉素组的81%。随着疾病严重程度增加,Tolevamer的疗效进一步下降。
•免疫球蛋白(IG):在人体研究中,针对毒素A和B的血清IgG抗体与保护相关,静脉注射IG治疗复发性或重症CDI的效果尚无系统研究支持,仅有少量病例报告和系列报道提供个案证据。剂量、给药次数和间隔存在较大差异。静脉注射IG对临床效果的差异可能与人群中抗毒素抗体水平的不可预测性有关。
3
微生物疗法
肠道微生物群的扰动是艰难梭菌感染(CDI)发生的关键因素。一些抗生素治疗无症状感染会导致艰难梭菌持续脱落和复发风险增加。通过特定微生物群恢复受损的肠道微生物群,已成为打破CDI-抗生素-CDI循环的策略。
• 粪菌移植的治疗效果优于仅用抗生素
粪菌移植(FMT)或微生物群替代疗法的原理是通过正常供体的粪便恢复CDI患者受损的肠道微生物群。系统评价显示,CDI患者接受FMT的腹泻消退率约为77%-90%。
一项随机对照试验比较了粪菌移植(FMT)与两种对照方案。FMT组在口服万古霉素(500mg,每天4次)4-5天后接受移植,对照组则接受14天相同剂量的万古霉素治疗。结果显示,FMT组3个月症状消退率为81%,显著高于万古霉素组(31%)和万古霉素加灌肠组(23%)。
尽管FMT已使用数十年,但其对严重复杂CDI的疗效、免疫功能低下患者的安全性及不明供体粪便长期安全性仍存疑。据报道,28.5%的患者出现FMT相关不良事件,最常见为腹部不适和排便异常,具体取决于给药途径。
• 口服微生物组疗法—SER-109
SER-109是一种由活性厚壁菌门细菌孢子组成的口服微生物组疗法,用于降低艰难梭菌感染复发风险。其机制可能通过与艰难梭菌竞争必需营养物质或调节胆汁酸谱来重建定植抵抗力,或两者兼具。
进行了一项3期、双盲、随机、安慰剂对照试验,其中艰难梭菌感染发作3次或以上(包括符合条件的急性发作)的患者在标准护理抗生素治疗后接受SER-109或安慰剂(每天4粒胶囊,持续3天)。
结果显示,在接受标准护理抗生素治疗后艰难梭菌感染症状消退的患者中,口服SER-109在降低复发感染风险方面优于安慰剂。
以微生物群为中心的治疗方法

Vasilescu IM,et al.Front Microbiol.2022
4
手术干预
艰难梭菌感染(CDI)的手术治疗通常用于严重或复杂病例,尤其是当药物治疗(如抗生素或粪便微生物群移植)无效,或患者出现危及生命的并发症时。以下是艰难梭菌感染的主要手术治疗方法:
• 全结肠切除术
适应症:严重的中毒性结肠炎、肠穿孔或肠坏死;严重的腹腔感染(腹膜炎),药物治疗无效且病情迅速恶化。
优点:快速去除感染源,降低死亡风险。
缺点:创伤较大,术后恢复时间长,可能影响生活质量。
• 分段结肠切除术
适应症:感染局限于结肠的某一部分。
优点:保留更多的肠道功能。
缺点:感染可能扩散,手术效果不如全结肠切除术稳定。
• 回肠造口术联合结肠灌洗
适应症:不适合全结肠切除的高危患者(如老年人或伴有多种合并症)。
优点:创伤较小,适合高危患者。
缺点:疗效可能不如全结肠切除术。
• 腹腔引流术
适应症:腹腔内脓肿或局部感染。
优点:辅助治疗,减轻感染负担。
缺点:仅适用于局部并发症,不能根治感染。
5
噬菌体疗法
噬菌体疗法利用天然噬菌体感染并裂解病原菌,是应对抗菌药物耐药性危机的潜在治疗方法。与抗生素不同,噬菌体具有进化能力,可持续克服细菌的抗性机制,从而避免疗法过时。
• 噬菌体可以降低艰难梭菌的生长和毒素水平
一些噬菌体在治疗艰难梭菌感染中表现出潜力。例如,ФCD27在CDI分批发酵模型中可显著降低艰难梭菌的生长和毒素水平。一种噬菌体组合已在体外完全裂解艰难梭菌,并在小鼠模型中减轻疾病症状和细菌定植。该组合进一步优化为4种噬菌体,成功在发酵容器中彻底根除艰难梭菌,显示出作为治疗选择的可行性。
总体而言,特异性以及对抗细菌耐药性的能力表明噬菌体治疗作为艰难梭菌治疗剂的巨大前景。
6
通过疫苗预防艰难梭菌感染
随着艰难梭菌感染(CDI)的发病率、死亡率和医疗成本不断上升,预防疾病的免疫接种成为理想选择。人类研究表明,对艰难梭菌毒素的强体液反应可减少复发和无症状定植。目前,多种候选疫苗正在开发中,包括基于类毒素、重组毒素肽、DNA和表面蛋白抗原的疫苗,但大多处于临床前阶段。
• 疫苗有助于减少复发和无症状定植
已发现部分纯化的类毒素A和B疫苗在30名健康成人中具有安全性和免疫原性,≥90%的受试者对两种毒素产生血清抗体反应。在一项试点研究中,3名多次复发CDI患者在第0、7、28和56天接受类毒素肌肉注射,其中2人对毒素A和B的IgG水平显著升高,且3人均在疫苗接种后停用万古霉素,随访6个月无复发。
两项2期试验已完成,测试疫苗在高危中老年人和首发CDI患者中的效果。一项3期试验正在17个国家中进行,计划评估疫苗在多达15,000名参与者中预防首发CDI的效果。其他候选疫苗包括基因和化学修饰的全长TcdA和B及重组融合蛋白IC84,其1期研究已完成,但结果尚未公布。
7
通过益生菌预防艰难梭菌感染
• 益生菌有助于预防艰难梭菌定植及相关腹泻
多项小型研究及荟萃分析表明,益生菌的使用可能与预防艰难梭菌相关腹泻有关。益生菌通常通过抑制艰难梭菌定植、调节肠道微生物群和胆汁酸代谢、破坏细胞壁和细胞膜、下调炎症反应、改善肠道屏障功能以及缓解病原性结肠炎来预防和治疗CDI。
最常研究的益生菌为嗜酸乳杆菌和双歧杆菌属。最近,一项多中心、随机、双盲、安慰剂对照研究测试了含嗜酸乳杆菌和双歧杆菌(双歧双歧杆菌和乳双歧杆菌)的高剂量益生菌制剂对≥65岁接受抗生素治疗患者的疗效。1,493名受试者接受益生菌,1,488名接受安慰剂。分析显示,益生菌组发生抗生素相关性腹泻和艰难梭菌感染的数量少于安慰剂组。
• 益生菌发挥抗菌活性抑制艰难梭菌定植
短双歧杆菌(YH68)通过抑制生长、孢子形成、毒力发生及毒力基因表达,展现出抗艰难梭菌活性,并增强抗艰难梭菌抗生素的体外效果或预防体内临床表现。
克劳氏芽孢杆菌和罗伊氏乳杆菌可分泌直接抑制艰难梭菌的可溶性化合物,而Clostridium scindens等产生次生胆汁酸的菌体可增强艰难梭菌的定植抗性。
此外,研究发现了一些可能有效的新型益生菌和制剂,如:
Bacteroides thetaiotaomicron,
E.thailandicus strain d5B,
B.amyloliquefaciens C-1,
B.longum JDM301,
Pediococcus pentosaceus LI05,
B.breve (YH68)
未来需要更大样本量的多中心双盲研究,以明确益生菌在CDI中的作用,同时考虑菌株和抗菌剂类型等因素。
艰难梭菌感染作为一种全球性公共卫生挑战,其发病率和医疗负担正不断攀升。通过本文的系统介绍,我们可以了解到,艰难梭菌感染的致病性主要取决于其产生的毒素,而非仅仅是菌株的存在。
健康的肠道微生物群在预防艰难梭菌感染中扮演着至关重要的角色,肠道微生物平衡的破坏是导致感染风险增加的关键因素。随着科学研究的深入,我们对艰难梭菌的检测、诊断、治疗和预防手段也在不断完善,从传统抗生素到粪菌移植、益生菌干预和疫苗开发等多元化策略均显示出积极成效。
了解艰难梭菌感染的本质和发病机制,对于临床医生制定合理治疗方案、减少不必要的抗生素使用以及患者接受适当预防措施至关重要。希望在未来研究的推动下,我们能够进一步降低艰难梭菌感染的发病率和复发率,减轻其对公共健康的威胁。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Buddle JE, Fagan RP. Pathogenicity and virulence of Clostridioides difficile. Virulence. 2023 Dec;14(1):2150452.
Piccioni A, Rosa F, Manca F, Pignataro G, Zanza C, Savioli G, Covino M, Ojetti V, Gasbarrini A, Franceschi F, Candelli M. Gut Microbiota and Clostridium difficile: What We Know and the New Frontiers. Int J Mol Sci. 2022 Nov 1;23(21):13323.
Wu Y, Wang YY, Bai LL, Zhang WZ, Li GW, Lu JX. A narrative review of Clostridioides difficile infection in China. Anaerobe. 2022 Apr;74:102540.
Arcay R, Barceló-Nicolau M, Suárez L, Martín L, Reigada R, Höring M, Liebisch G, Garrido C, Cabot G, Vílchez H, Cortés-Lara S, González de Herrero E, López-Causapé C, Oliver A, Barceló-Coblijn G, Mena A. Gut microbiome and plasma lipidome analysis reveals a specific impact of Clostridioides difficile infection on intestinal bacterial communities and sterol metabolism. mBio. 2024 Oct 16;15(10):e0134724.
Vasilescu IM, Chifiriuc MC, Pircalabioru GG, Filip R, Bolocan A, Lazăr V, Diţu LM, Bleotu C. Gut Dysbiosis and Clostridioides difficile Infection in Neonates and Adults. Front Microbiol. 2022 Jan 20;12:651081.
Maslanka JR, Gu CH, Zarin I, Denny JE, Broadaway S, Fett B, Mattei LM, Walk ST, Abt MC. Detection and elimination of a novel non-toxigenic Clostridioides difficile strain from the microbiota of a mouse colony. Gut Microbes. 2020 Nov 9;12(1):1-15.
Nibbering B, Gerding DN, Kuijper EJ, Zwittink RD, Smits WK. Host Immune Responses to Clostridioides difficile: Toxins and Beyond. Front Microbiol. 2021 Dec 21;12:804949.
Samarkos M, Mastrogianni E, Kampouropoulou O. The role of gut microbiota in Clostridium difficile infection. Eur J Intern Med. 2018 Apr;50:28-32.
Kelly CR, Fischer M, Allegretti JR, LaPlante K, Stewart DB, Limketkai BN, Stollman NH. ACG Clinical Guidelines: Prevention, Diagnosis, and Treatment of Clostridioides difficile Infections. Am J Gastroenterol. 2021 Jun 1;116(6):1124-1147.
Dawson LF, Valiente E, Wren BW. Clostridium difficile–a continually evolving and problematic pathogen. Infect Genet Evol. 2009 Dec;9(6):1410-7.

谷禾健康
胆汁酸是一种代谢胆固醇的物质,它具有两个亲和性不同的区域,即一部分能够与水分子相互作用(亲水),而另一部分则不能与水分子相互作用(疏水)。
由于拥有这种两亲性质,胆汁酸能够在生物体内与胆固醇等脂类物质结合并形成混合物,从而起到降低血液中胆固醇水平的作用。
胆汁酸不仅是代谢胆固醇的物质,还有其他重要的功能。胆汁酸可以通过激活肝脏和肠道中的受体,调节血糖水平、胆固醇代谢和免疫信号等。
其中,初级胆汁酸是由肝细胞合成并储存在胆囊中的,而次级胆汁酸则是由肠道中的微生物代谢初级胆汁酸形成的。
随着研究的深入,发现肠道菌群和胆汁酸在人体健康和疾病中发挥着重要的作用。肠道菌群可以代谢胆汁酸,影响其在体内的水平和作用,从而影响脂质代谢、肝胆功能和肠道健康等方面。
同时,胆汁酸也可以影响肠道菌群的组成和功能,维持肠道微生物的平衡和多样性。因此,肠道菌群和胆汁酸之间的相互作用关系对于人体健康和疾病的发生、发展和治疗具有重要的意义。
肠道微生物主要的代谢产物包括:短链脂肪酸、色氨酸、胆汁酸等。
以往我们写过短链脂肪酸(详见:你吃的膳食纤维对你有帮助吗?)、
色氨酸(详见:色氨酸代谢与肠内外健康稳态 )。
本文我们主要阐述胆汁酸及其代谢,与肠道微生物群之间的关联及其在疾病中的作用。
本文目录/contents
Part1:胆汁酸及其代谢
Part2:影响胆汁酸代谢的因素
Part3:肠道菌群与胆汁酸之间的相互作用
Part4:微生物群-胆汁酸相互作用的影响
Part5:微生物与胆汁酸在疾病中的作用
Part6:调节胆汁酸代谢的方法
Part7:结语
本文提及的专业名词缩写
FXR——法尼醇X受体,胆汁酸是FXR的天然配体,因此FXR又称为胆汁酸受体。
SHP——是LRH-1(肝脏受体同源物-1)在肝细胞激活的主要靶基因,胆汁酸通过LRH-1诱导SHP的表达,表达的SHP结合并失活LRH-1,从而抑制胆汁酸合成相关基因及SHP自身的表达。
TGR5——又称G蛋白偶联胆汁酸受体,是一种胆汁酸受体。在外周组织器官如肝、脾、肾、脂肪等多种组织中表达水平较高,能调控脂类和葡萄糖代谢。
GLP-1——胰高血糖素样肽-1是一种由肠道细胞所分泌的激素,属于一种肠促胰岛素。
FXR-Fgf15轴——回肠肠细胞中FXR的激活释放Fgf15(FGF19是人的同源基因),Fgf15通过门静脉循环到达肝细胞,与FGFR4结合并抑制CYP7A1,从而抑制肝细胞胆汁酸的合成。
当胆固醇在肝细胞内代谢时,会产生一种叫做胆汁酸的化合物。胆汁酸可以溶解脂肪,促进脂肪消化和吸收,同时还能帮助排泄体内多余的胆固醇。
胆汁酸一般可分为初级胆汁酸和次级胆汁酸
初级胆汁酸(primary bile acids):
初级胆汁酸是由肝细胞合成并储存在胆汁中的胆汁酸,它是胆汁中最主要的成分。初级胆汁酸的结构比较简单,含有羟基(-OH)和羧基(-COOH)等官能团,因此具有良好的水溶性。初级胆汁酸可以在肠道中与脂肪结合成胆汁酸盐,参与脂肪的乳化和吸收过程。
初级胆汁酸包括胆酸、鹅去氧胆酸、甘氨胆酸、牛磺胆酸、甘氨鹅去氧胆酸、牛磺鹅去氧胆酸。
次级胆汁酸(secondary bile acids):
次级胆汁酸是由肠道中的微生物代谢初级胆汁酸生成的,也称为微生物代谢产物。次级胆汁酸的结构更加复杂,它经过羟化、氧化、甲基化等反应后形成。次级胆汁酸相对于初级胆汁酸来说,具有更强的亲脂性和生物活性。
次级胆汁酸主要有去氧胆酸、石胆酸、甘氨去氧胆酸、牛磺去氧胆酸、甘氨石胆酸、牛磺石胆酸。
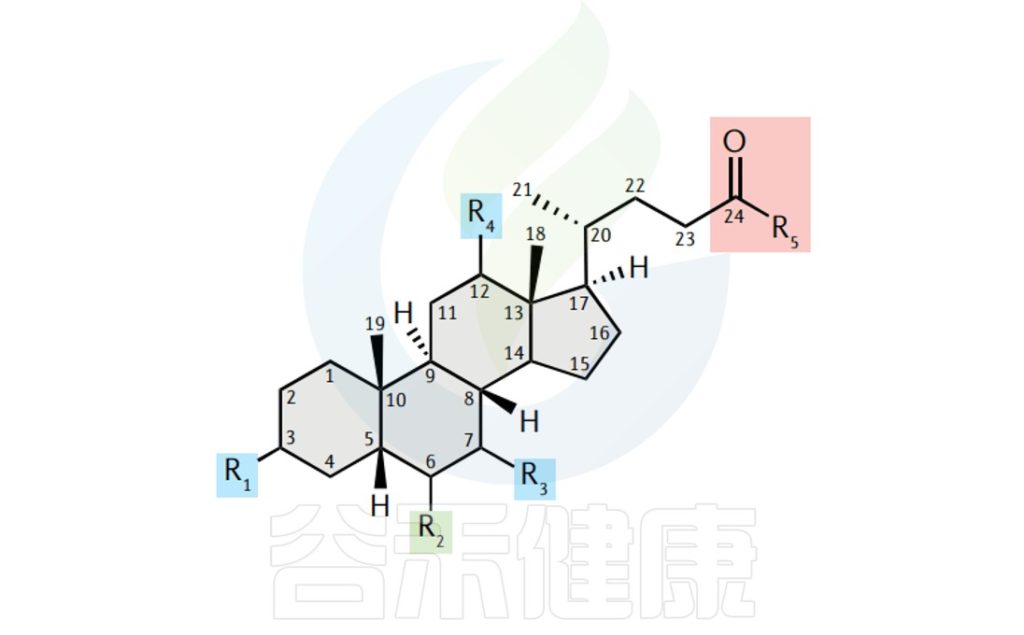
胆汁酸的结构有助于它们的功能。胆汁酸一般由一个甾醇核心组成,该核心由三个六元碳环和一个五元碳环组成,通常具有5β-氢和沿前两个稠合环平面的顺式结构。
一般胆汁酸的结构
Collins SL,et al.Nat Rev Microbiol.2023
胆汁酸的种类由与其结合的羟基、羧基、硫酸根和氨基酸基团的数量和位置决定。羟基和羰基面向甾醇核心的同一侧,而甲基面向相反的一侧。这使得胆汁酸具有两亲特性,因为一侧是疏水的,而另一侧是亲水的。
胆汁酸的不同种类

Poland JC,et al.Physiology (Bethesda).2021
胆汁酸的疏水性取决于甾醇环上羟基和硫酸根的数量和位置,以及胆汁酸是否与氨基酸结合,在小鼠中主要是牛磺酸,在人类中主要是甘氨酸。
胆汁酸的肠肝循环是一个精细调节的过程。
初级胆汁酸由肝脏中的胆固醇通过胆固醇7α-羟化酶(CYP7A1)介导途径或固醇27-羟化酶(CYP27A1)介导途径合成。
然后初级胆汁酸与牛磺酸或甘氨酸结合,储存在胆囊中,然后在摄入食物后分泌到十二指肠中,以促进膳食脂质和脂溶性维生素的吸收。
95%以上的胆汁酸会被重吸收
排入肠道的各种胆汁酸约95%以上要被重吸收。回肠部的重吸收是主动重吸收,其余肠段为被动重吸收,并运回肝脏进行代谢回收。
注:虽然少量初级胆汁酸可以通过被动扩散吸收,但有效吸收需要由回肠上皮细胞中表达的顶端胆汁酸转运蛋白 (ASBT) 介导的主动转运。结合的初级胆汁酸主要由回肠胆汁酸结合蛋白 (IBABP) 通过肠细胞转运。
这个过程在人体中每天发生4到12次,并确保维持胆汁酸稳态。
人体胆汁酸的肠肝循环
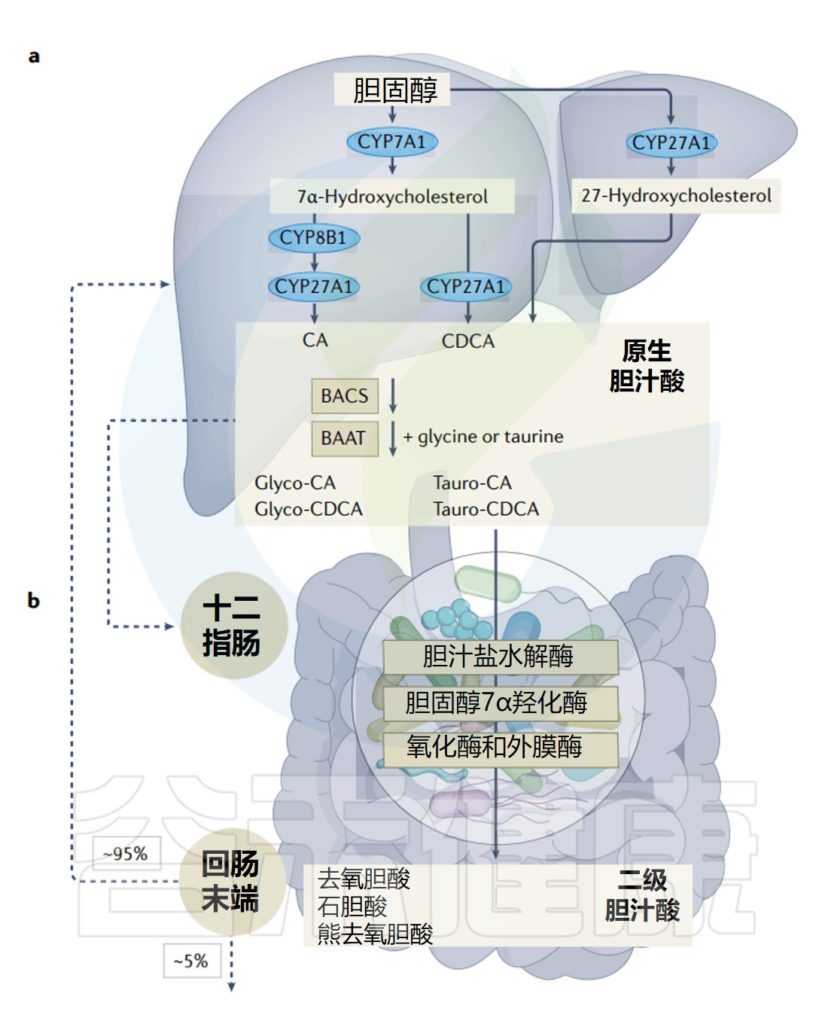
Collins SL,et al.Nat Rev Microbiol.2023
在肠道中,结合的初级胆汁酸受微生物群作用并转化为次级胆汁酸,从而进一步增加胆汁酸库的多样性和整体疏水性。
次级胆汁酸代谢的第一步是通过胆汁盐水解酶(BSH)水解氨基酸部分。胆汁盐水解酶在所有主要的肠道微生物(拟杆菌(Bacteroidetes)、厚壁菌(Firmicutes)和放线菌(Actinobacteria))中都是高度保守的,但由于它们对甘氨酸偶联或牛磺酸偶联的胆汁酸具有优先活性,因此在细菌之间是不同的。
✦细菌对胆汁酸的代谢一般是有益的
细菌胆汁酸去偶联对一般细菌有益,因为它们从氨基酸和宿主那里获得能量,它降低了胆汁酸的毒性。然而,对于胆汁盐水解酶是否对细菌有益存在一些争论。
细菌其他的作用包括氧化,脱硫,酯化和偶联。将在本文后面的章节具体展开描述。
从分类上看,多种细菌都能在体外将氨基酸与胆汁酸结合,其中双歧杆菌(Bifidobacterium)、拟杆菌(Bacteroides)和肠球菌(Enterococcus)的结合量最大。
微生物生产者的胆汁酸代谢

Cai J,et al.Cell Host Microbe.2022
药物、运动、饮食或其他不良状态导致肠道菌群组成或活性的改变都会扰乱胆汁酸代谢。
影响细菌转化胆汁酸的因素
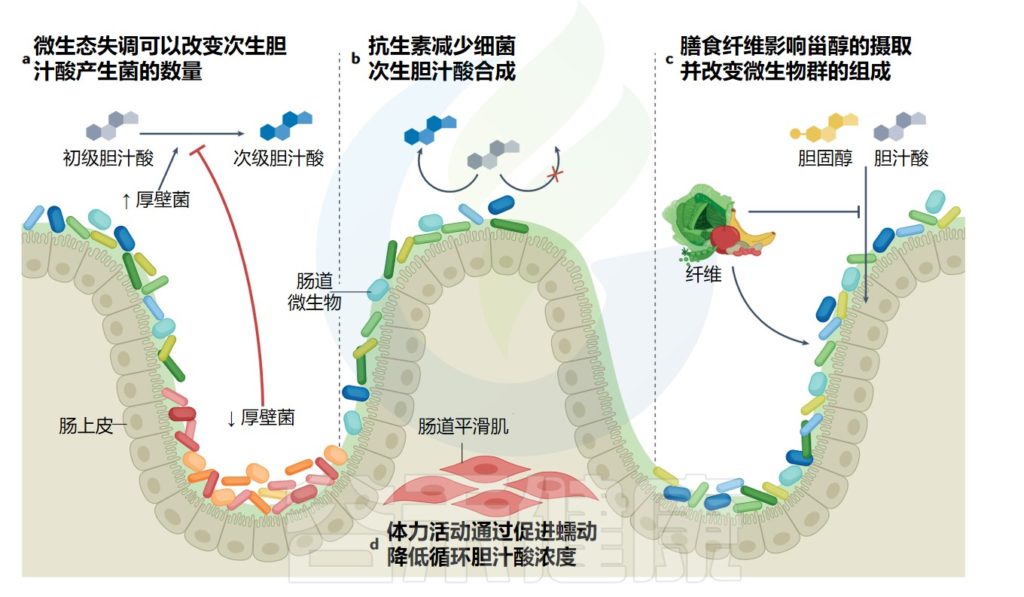
Collins SL,et al.Nat Rev Microbiol.2023
肠道微生物可以代谢胆汁酸,影响其在体内的水平和作用。肠道微生物失调可能会导致胆汁酸代谢紊乱,从而影响脂质代谢、肝胆功能和肠道健康等方面。
具体来说,肠道微生物失调可能会导致以下影响:
•胆汁酸合成减少:肠道微生物可以参与胆汁酸的合成过程,肠道微生物失调可能会导致胆汁酸合成减少,从而影响胆汁酸代谢。
•胆汁酸代谢紊乱:肠道微生物可以代谢胆汁酸,影响其在体内的水平和作用。肠道微生物失调可能会导致胆汁酸代谢紊乱,从而影响脂质代谢、肝胆功能和肠道健康等方面。
•肠道屏障功能受损:肠道微生物失调可能会导致肠道屏障功能受损,从而影响肠道对胆汁酸的吸收和代谢。
•炎症反应增加:肠道微生物失调可能会导致肠道炎症反应增加,从而影响胆汁酸代谢和肠道健康。
因此,保持肠道微生物的平衡和稳定,对于维持胆汁酸代谢的正常和健康具有重要的意义。
抗生素等药物对胆汁酸有着巨大的影响。抗生素治疗对宿主破坏最严重的代谢途径之一是胆汁酸代谢。
•影响次生胆汁酸的水平
随着细菌的耗竭,可用于解除宿主胆汁酸结合的胆汁盐水解酶减少,次级胆汁酸也不再产生。因此,使用抗生素,可观察到共轭胆汁酸和一些次生胆汁酸水平下降。
其他药物,如抗抑郁药物帕罗西汀,也可以扰乱胆汁酸水平。
次级胆汁酸的损失进一步加剧了胆汁酸的失调,因为胆汁酸的生物合成被上调,导致初级胆汁酸库更大。
几项研究将锻炼与不同的胆汁酸联系起来,但结果存在一些矛盾。
•适度运动可增加胆汁酸的排泄
啮齿类动物研究发现,由于胃肠运动或胆固醇摄取增加,适度运动可增加胆汁酸排泄。然而,令人惊讶的是,这些啮齿动物的胆汁酸合成和信号传导不受运动的影响。
•运动可使循环胆汁酸总体减少
在人类中,持续时间的增加和运动的一致性导致血清和粪便胆汁酸的总体减少。这对结直肠癌和非酒精性脂肪性肝病具有意义,其中循环胆汁酸增加与负面结果相关。
注:除了宿主胆汁代谢外,体育活动还可以逆转非酒精性脂肪性肝患者的微生物群失调,这可能导致不同的次生胆汁酸水平。
此外,对运动训练有生理适应的长跑运动员具有较少的诱变性次生胆汁酸。需要更多的研究来阐明体育活动对肠道和肝脏中胆汁酸的影响。
人们早就知道,饮食,尤其是脂肪和纤维的摄入,可以极大地改变微生物群和胆汁酸代谢。
•胆固醇摄入多会提高胆汁酸总体水平
摄入胆固醇会提高人体内胆汁酸的总体水平,因为胆固醇是胆汁酸的前体,并上调胆汁酸的合成途径。
在高脂肪饮食的人群中,由于表达7α-去羟化酶和表达胆汁酸水解酶的细菌数量的增加,次生胆汁酸和非共轭胆汁酸水平特别高。
•纤维诱导胆汁酸的排泄、抑制其吸收
相比之下,膳食纤维可以在胃肠道消化过程中通过吸附作用促进胆汁酸的排泄以及抑制胆汁酸在肠道的吸收。
高脂肪、低纤维饮食的胆汁酸特性与结肠癌患者有关。最近的一篇文章表明,小鼠的热量限制减少了总胆汁酸,包括石胆酸和去氧胆酸,也减少了总微生物群的含量。
•肝胆系统疾病会导致胆汁酸代谢紊乱
肝胆系统疾病如肝硬化、胆囊疾病等可能会影响胆汁酸的合成和代谢,导致胆汁酸代谢紊乱和相关疾病的发生。
肝细胞受到了损伤,就会出现代谢问题,导致患者的总胆汁酸偏高。
•孕妇的总胆汁酸会偏高
怀孕期间孕妇体内的孕激素水平改变会引起胆汁酸代谢异常,从而使得孕妇总胆汁酸偏高
一些遗传因素也可能会影响胆汁酸代谢,特定的宿主基因变异会影响胆汁酸代谢和肠腔内的胆汁酸含量,导致相关疾病的发生。
▼
人类与微生物群的交流部分依赖于宿主受体对微生物代谢物的反应。微生物群通过几种关键的宿主胆汁酸受体调节胆汁酸的代谢和转运。
肠道菌群调节胆汁酸主要体现在生物转化、生物合成和胆汁酸的运输。
胆汁酸信号传导和网络
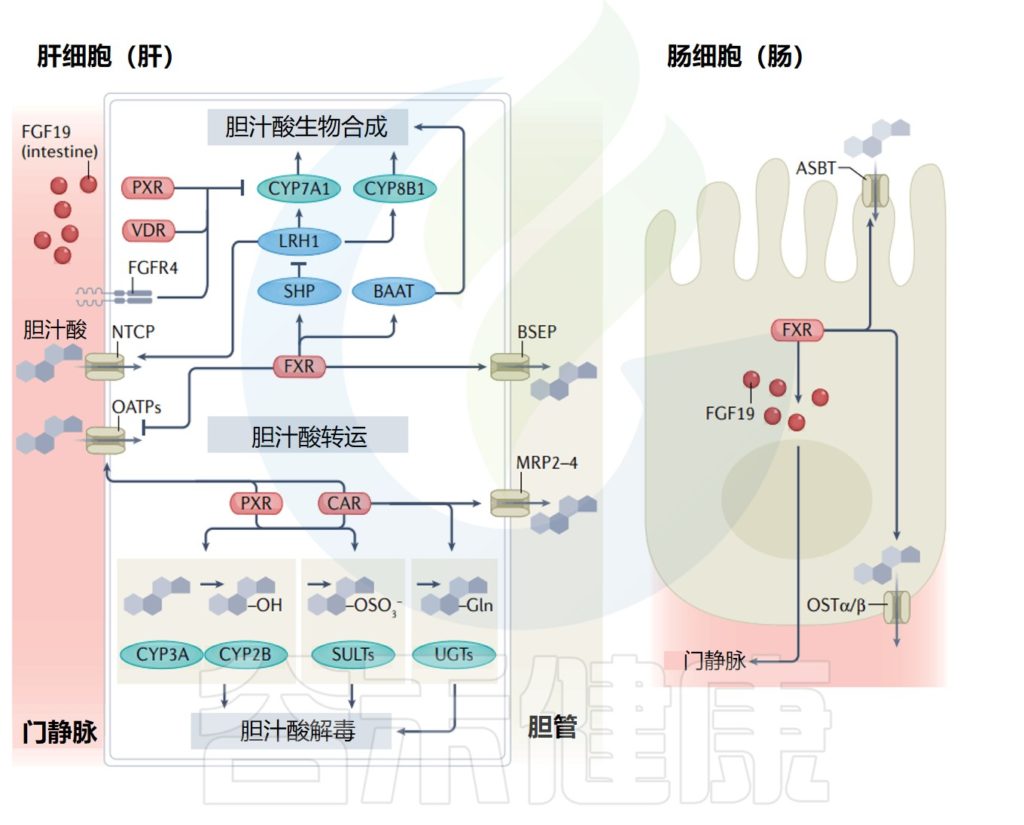
Collins SL,et al.Nat Rev Microbiol.2023
1
肠道菌群调节胆汁酸的生物转化
胆汁酸在肝脏中合成并通过胆道系统释放到肠道,部分释放到远端回肠或结肠,在那里它们被肠道菌群进一步代谢。
✦影响胆汁酸生物毒性和肠道吸收
肠道微生物可以改变胆汁酸,因为它们具有不同的 胆汁酸代谢酶。肠道微生物群通过去结合、7ɑ-脱羟基、异构化、氧化、脱硫和酯化来调节胆汁酸的化学多样性,进而影响其生物毒性和肠道吸收。
去共轭和7ɑ-脱羟基是两个值得注意的反应。
主要通过胆汁酸水解酶进行的微生物去结合是肠道环境中微生物进一步修饰胆汁酸的关键一步。
胆汁酸水解酶编码基因已在各种肠道微生物中检测到并表征,包括双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)、肠球菌(Enterococcus)、梭菌(Clostridium)、拟杆菌(Bacteroides)等。
✦小部分细菌通过脱羟基作用转化胆汁酸
已经表明,怀孕期间分泌胆汁酸水解酶的拟杆菌丰度增加会促进胆汁酸解偶联,从而减少肠细胞胆汁酸的摄取。
胆盐水解酶去结合的胆汁酸随后通过肠道菌群产生的7ɑ-脱羟基作用脱水,并最终转化为次级和三级胆汁酸。
然而,7α-脱羟基作用仅由少数厌氧物种进行,目前的估计表明,只有大约0.0001%的结肠细菌可以进行这种反应,占肠道微生物群总数的不到0.025%。
16S rRNA 序列分析表明,这些细菌主要是梭菌属,包括C.hiranonis、C.scindens、C.hylemonae(簇 XIVa)和C.sordelli(簇 XI)。
在大肠中,梭菌属物种可以通过7α-脱羟基作用将胆酸和鹅去氧胆酸分别转化为去氧胆酸和石胆酸。
✦氧化反应导致差向异构化
氧化和环氧化在胆汁酸的微生物修饰和代谢反应中也受到特别关注,一些肠道微生物合成能够进行可逆氧化还原反应和羟基环氧化的羟基类固醇脱氢酶 (HSDH)。
羟基类固醇脱氢酶(HSDH)活性存在于肠道微生物群的四个主要类别中:
放线菌门(Actinobacteria);
变形菌门(Proteobacteria);
厚壁菌门(Firmicutes);
拟杆菌门(Bacteroidetes)。
这些氧化反应最终会导致差向异构化。然而,由于缺乏合适的分析方法,人们对微生物通过羟基类固醇脱氢酶调节胆汁酸异构化反应的机制知之甚少,但这些反应性胆汁酸的疏水性和毒性是无可辩驳的。
✦肠道微生物的破坏导致胆汁酸代谢紊乱
2019年进行的一项研究支持肠道微生物群的破坏会导致胆汁酸代谢紊乱。这项研究发现,在接受各种抗生素治疗的大鼠的血浆和粪便中,牛磺酸结合的胆汁酸显著增加,而游离胆汁酸减少,胆汁酸的多样性也显著降低。
一项较早的研究还指出,肠道微生物群对胆汁酸有显著影响。无菌小鼠胆汁酸的多样性减少,并且缺乏未结合的和次级胆汁酸。
注:与正常小鼠相比,盲肠、结肠和粪便中的胆汁酸水平降低,但胆囊和小肠中的胆汁酸水平升高。
✦微生物群影响胆汁酸受体信号
实验研究进一步证明了微生物群影响FXR信号。当用tempol处理小鼠时,减少了乳酸杆菌属。及其胆汁酸水解酶改变肠道微生物群的活性,导致厚壁菌门:拟杆菌门比率降低,次级胆汁酸降低,以及牛磺酸-β-鼠胆酸 (T-β-MCA) 积累。
Tempol是一种超氧化物歧化酶(SOD)类似物,可有效中和活性氧。
虽然次级胆汁酸是有效的FXR激动剂,而T-β-MCA是FXR拮抗剂,但抑制胆汁酸受体信号会导致胆汁酸合成增加和胆汁酸库大小增加。
但由于参与胆汁酸脱氢的梭状芽孢杆菌簇XI和XVIa的减少,胆汁酸多样性下降。脱硫弧菌(Desulfovibrionales)也可以逆转这一过程,脱硫弧菌负责从饮食和宿主来源代谢含硫化合物。富含脱硫弧菌的肠道微生物群可以调节胆汁酸的代谢,从而使肠道产生更多的次生胆汁酸。
2
肠道菌群影响胆汁酸的生物合成
✦影响关键酶的表达从而调节胆汁酸的合成
肠道微生物群对胆汁酸形成的调节是复杂的,包括由至少17种不同酶催化的几个反应步骤。然而,更重要的是,肠道微生物群对胆汁酸的代谢会影响许多参与胆汁酸从头合成的关键酶的表达,包括CYP7A1、CYP7B1、CYP8B1和CYP27A1。
在厚壁菌中,可以通过FXR-FGF15/19 反馈机制调节胆汁酸的合成。在肝细胞中,通过来自 SHP/LRH-1/LXRα 的负反馈调节胆汁酸合成。
SHP是LRH-1在肝细胞激活的主要靶基因,胆汁酸通过LRH-1诱导SHP的表达,表达的SHP结合并失活LRH-1,从而抑制胆汁酸合成相关基因及SHP自身的表达。
抑制过程
一旦肝脏FXR被激活,SHP就会立即被触发以抑制LRH转录,从而抑制CYP7A1和CYP8B1转录。在肠道细胞中,FXR通过FXR/FGF19/FGFR4通路抑制胆汁酸合成,其中FXR诱导FGF19/FGF15,后者又与FGFR4和β-klotho复合物结合,触发 MAPK/ERK1/2 通路并最终抑制该基因CYP7A1在肝脏中的表达。
✦没有细菌的情况下无法产生胆汁酸受体激活剂
研究证实肠道在没有细菌的情况下无法产生胆汁酸受体激活剂。肠道微生物群可以通过降低T-MCA水平和促进回肠中FXR依赖性FGF15的表达来抑制CYP7A1和胆汁酸的合成,从而表明肠道微生物群通过FXR-FGF15/19反馈机制调节胆汁酸的合成。
注:正如已经提到的,脱硫弧菌(Desulfovibrionales)衍生的硫化氢除了有利于含7α-脱羟基细菌的生长外,还可以诱导肝脏 FXR 并抑制CYP7A1表达和胆汁酸合成。
3
肠道菌群调节胆汁酸的运输
微生物群还可以通过法尼醇X受体(FXR)反馈机制调节胆汁酸运输。
✦通过影响法尼醇X受体调节胆汁酸的重吸收
肝脏中FXR的激活诱导胆盐输出泵(BSEP)、MRP、OSTα和OSTβ复合物以增强胆汁酸的肝脏消除,同时通过抑制Na+/牛磺胆酸盐对肝细胞中基底外侧NTCP和OATP1B1和OATP1B3的下调来减少胆汁酸重吸收。
肠道中的法尼醇X受体激活上调肠道胆汁酸结合蛋白 ,以促进胆汁盐通过回肠肠细胞,并增强OSTα和 OSTβ表达以帮助胆汁酸从肠道进入门脉循环。
OSTα/β——有机溶质转运蛋白,一种表达在肠上皮细胞基底膜的异二聚体蛋白,主要负责转运胆汁酸入静脉血。
此外,法尼醇X受体可以通过下调ASBT,通过SHP和FGF15/19通路调节肠细胞和胆管细胞对胆汁酸的重吸收。
ASBT——顶端膜钠依赖性胆汁酸转运蛋白
▼
肠道中的胆汁酸被微生物群进一步代谢,进而影响微生物组成。胆汁酸已被证明对肠道微生物群有直接和间接的影响。
胆汁酸是微生物群丰度、多样性和代谢活性的重要决定因素。
1
破坏了胆汁酸不耐受细菌的结构
研究表明,较高的胆汁酸浓度表现出抗菌活性,当胆汁酸不耐受细菌暴露于高浓度胆汁酸时,胆汁酸 会溶解磷脂并分离内在的膜蛋白,导致细胞膜被完全破坏,导致细胞内物质溢出。
除了膜损伤外,胆汁酸还通过干扰RNA二级结构、破坏大分子的稳定性、引起DNA损伤和促进蛋白质错误折叠,从而破坏肠道微生物的组成,从而表现出直接的抗菌活性。
在胆汁酸喂养的大鼠中,厚壁菌门的丰度显著增加,丹毒丝菌(Erysipelotrichi)和梭状芽胞杆菌(Clostridia)中的一些微生物也增加了。
✦胆汁酸的含量对不同细菌作用不同
一般来说,胆汁酸池的减少似乎有利于革兰氏阴性细菌的生长,这些细菌能够产生脂多糖,其中一些具有致病潜力。
相比之下,随着胆汁酸池的增加,观察到革兰氏阳性厚壁菌门的生长,从而促进了次级胆汁酸的产生。
2
影响微生物群的多样性及功能
尽管它们具有毒性作用,但胆汁酸也支持微生物群的多样性。在人体中,牛磺-β-鼠胆酸和牛磺酸胆酸对多种微生物的发展至关重要。
✦胆汁酸的分泌可以提供能量支持微生物多样性
虽然尚未证实其机制,但胆汁酸的分泌可能提供足够的能量来支持大量微生物的多样性。除了成分的改变,胆汁酸还改变了微生物群的功能能力。
例如,去氧胆酸、牛磺胆酸和牛磺酰脱氧胆酸会破坏小鼠中细菌的核苷酸和碳水化合物代谢。
3
抑制细菌的过度生长
研究发现小鼠肠道微生物群落过度增殖和细菌易位,通过使用口服胆汁酸,以诱导法尼醇X受体激活,从而抑制细菌过度生长。
✦胆汁酸受体诱导抗菌肽和宿主免疫反应
这是因为法尼醇X受体可以诱导参与肠道保护的基因,法尼醇X受体诱导抗菌肽产生和宿主免疫反应调节来塑造微生物组。
在回肠中缺乏法尼醇X受体受体表达细胞的小鼠也表现出肠道微生物数量的变化,拟杆菌和厚壁菌的数量分别增加和减少。其主要原因是法尼醇X受体敲低后胆汁酸的合成增加,这表明胆汁酸可以抵消法尼醇X受体信号通路,从而影响肠道微生物的组成。
小结
一般来说,肠道微生物群和胆汁酸之间存在双向相互作用。
肠道微生物群可以调节胆汁酸的合成和代谢,相反,胆汁酸可以改变肠道菌群的组成。
因此,维持胆汁稳态对肠道微生态非常重要。然而,还需要更多的研究来了解胆汁酸对肠道微生物群的功能操作如何影响宿主-微生物群的交流。
微生物群和胆汁酸之间的相互作用会影响肠道屏障功能的维持,调节先天免疫和适应性免疫,并调节定植抵抗力。
胆汁酸对宿主细胞的影响主要由膜相关和胆汁酸受体介导,包括法尼醇X受体(FXR)、G蛋白偶联受体5(TGR5)、孕烷X受体(PXR)和维生素D受体(VDR)。
FXR和TGR5在肝脏、回肠远端和结肠、上皮细胞、内皮细胞和免疫细胞中高度表达。除了在调节胆汁酸合成中的作用外,这两种受体对于维持肠道屏障完整性和限制炎症都是必不可少的。
注:胆汁酸激活TGR5的能力不同,顺序为石胆酸>去氧胆酸>鹅去氧胆酸>熊去氧胆酸>胆酸。
肠上皮细胞形成紧密连接的能力对于肠屏障的形成和维持至关重要。几项研究支持胆汁酸在调节紧密连接功能中的作用。
胆汁酸介导的肠道屏障功能调节
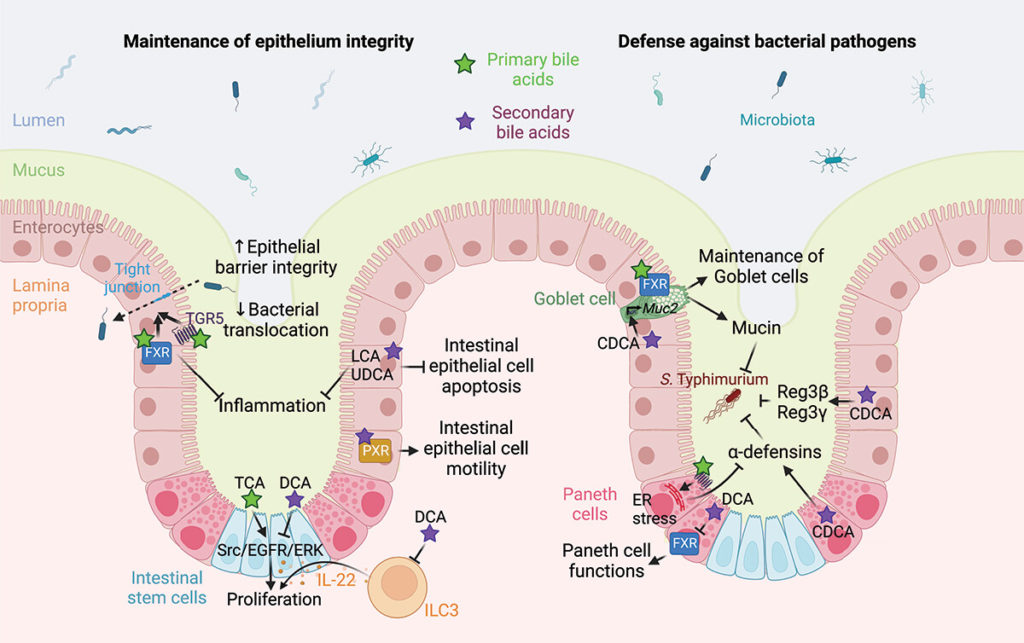
Larabi AB,et al.Gut Microbes.2023
▷肠道通透性与胆汁酸浓度有关
在喂食高脂肪饮食的小鼠和大鼠中,肠道通透性增加和紧密连接蛋白表达减少与盲肠和血浆胆汁酸浓度的改变有关,总胆汁酸库和次级胆汁酸增加。
法尼醇X受体缺失会增加肠道通透性
胆汁酸对肠上皮完整性的调节是由其激活受体的能力介导的。在小鼠和大鼠胆管结扎胆汁流阻塞模型中,法尼醇X受体的缺失增加了肠道通透性和细菌移位,并降低了紧密连接蛋白的表达。
同样,在化学诱导的结肠炎小鼠模型中,法尼醇X受体的激活限制了上皮屏障的通透性并防止了肠道炎症。
法尼醇X受体在肠上皮稳态中的作用是通过FGF蛋白介导的。补充喂食去氧胆酸的小鼠会出现生态失调,这会减少胆汁酸去结合,从而限制FXR-FGF15轴的激活并损害粘膜屏障功能。
G蛋白偶联受体5缺陷小鼠肠道通透性增加
此外,与野生型小鼠相比,G蛋白偶联受体5缺陷小鼠表现出紧密连接的表达改变、肠道通透性增加并且更易患化学诱导的结肠炎,表明这种胆汁酸受体在维持肠道屏障中的作用。
▷诱导上皮细胞增殖
胆汁酸还诱导肠上皮细胞增殖并限制细胞凋亡。在小鼠中,次级胆汁酸石胆酸和熊去氧胆酸可防止肠道炎症并限制上皮细胞凋亡。胆汁酸通过作用于肠道干细胞中的G蛋白偶联受体5受体来促进上皮再生。
牛磺胆酸诱导肠上皮细胞增殖
在体外,化学激动剂对法尼醇X受体的刺激增加了肠上皮细胞的运动和伤口闭合。牛磺胆酸通过表皮生长因子受体(EGFR)和胞外调节蛋白激酶(ERK)激活在体外诱导肠上皮细胞增殖,而去氧胆酸通过法尼醇X受体依赖性机制抑制细胞增殖。
最后,高脂肪饮食诱导的去氧胆酸增加通过减少3型先天淋巴细胞的数量来减少肠道干细胞的增殖和分化,从而减少潘氏细胞和杯状细胞。
▷调节粘液层的形成和组成
胆汁酸还调节粘液层的形成和组成,粘液层由浸泡在抗菌药物(如防御素)中的粘蛋白组成。
补充鹅去氧胆酸粘蛋白转录增加
在化学诱导的结肠炎小鼠模型中,法尼醇X受体的激活可防止产生粘蛋白的杯状细胞的损失。补充鹅去氧胆酸饮食的小鼠表现出潘氏细胞α-防御素的表达增加,杯状细胞Muc2(粘蛋白2-编码基因)的转录增加,回肠上皮C型凝集素Reg3β和Reg3γ的合成增强。
次级胆汁酸去氧胆酸具有刺激作用,而熊去氧胆酸在体外抑制人β-防御素-1和β-防御素-2的表达和分泌,这可能对维持肠道稳态也有影响。
微生物群产生的胆汁酸调节免疫的不同方面,包括诱导炎症基因募集先天性和适应性免疫细胞。
微生物衍生的胆汁酸调节肠道先天性和适应性免疫
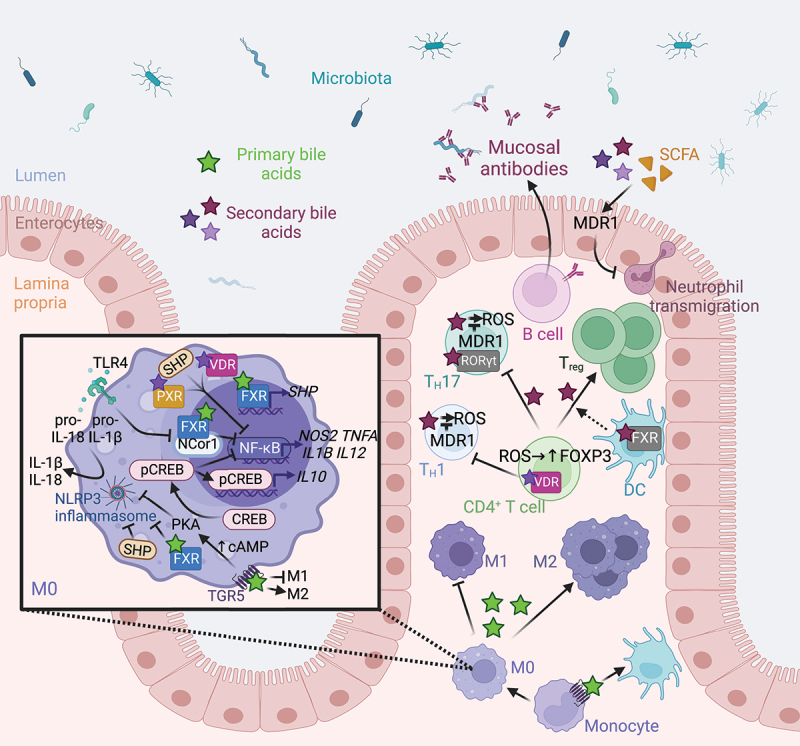
Larabi AB,et al.Gut Microbes.2023
▷调节促炎基因表达
胆汁酸受体FXR、TGR5和PXR调节促炎基因表达。在化学诱导的结肠炎小鼠模型中,FXR缺陷恶化,而FXR激动剂奥贝胆酸治疗可防止粘膜炎症并促进抗菌基因的表达。
胆汁酸受体影响促炎基因的表达
此外,法尼醇X受体可以通过直接结合促炎基因的启动子,以不依赖于SHP的方式调节促炎基因的表达。
病原体相关分子模式激活Toll样受体4会导致促炎基因启动子释放NCor1,从而激活其转录。最后,孕烷X受体和维生素D受体直接抑制NF-κB信号,从而减少促炎反应。
▷限制炎性体的产生
胆汁酸也限制炎症小体的激活。FXR和SHP通过与NLRP3炎症小体和胱天蛋白酶-1的物理相互作用来抑制炎症小体的组装,而TGR5环磷酸腺苷(cAMP)途径的激活通过诱导其泛素化来阻断NLRP3炎性小体的激活,这最终限制了白细胞介素-1β和白细胞介素-18的产生。
施用胆汁酸可减轻部分炎症
将去氧胆酸和石胆酸直肠给药于各种小鼠结肠炎模型可减轻炎症,部分是通过作用于TGR5受体。因此,溃疡性结肠炎患者体内菌群失调引起的次级胆汁酸缺乏可能会促进炎症,而炎症可以通过恢复次级胆汁酸水平得到缓解。
相反,另一项研究报告称,结肠中的去氧胆酸给药可部分通过刺激组织蛋白酶B释放来激活 NLRP3 炎性体,这会增加巨噬细胞分泌白细胞介素-1β并加剧结肠炎。
鉴于结肠炎模型中次级胆汁酸的相反作用,需要进一步的研究来更好地了解其在肠道炎症中的作用。
▷影响免疫细胞的募集和分化
胆汁酸还指导各种免疫细胞的募集和分化。与野生型小鼠相比,法尼醇X受体缺陷小鼠在结肠炎期间表现出炎症细胞募集减少。
接受鹅去氧胆酸补充剂的小鼠表现出向肠粘膜募集的单核细胞、巨噬细胞和嗜中性粒细胞减少,其中鼠伤寒沙门菌(S.Typhimurium)和柠檬酸杆菌(C.rodentium)感染期间B细胞的相对数量增加。
最近的研究表明,次级胆汁酸的氧代、异代和同种异体调节T细胞分化。
在体内,微生物群衍生的IsoDCA通过限制法尼醇X受体活性增加树突状细胞的免疫刺激特性,从而间接促进结肠调节性T细胞的分化。
▷通过抑制中性粒细胞迁移限制肠道炎症
暴露于固有层中的胆汁酸会驱动效应细胞TH1和TH17中的氧化应激。效应T细胞在迁移到回肠时通过上调外源性转运蛋白多药耐药蛋白1(MDR1,也称为P-糖蛋白)的表达来适应,以限制胆汁酸驱动的氧化应激。
胆汁酸与短链脂肪酸协同作用限制了肠道炎症
胆汁酸和微生物群衍生的短链脂肪酸协同作用,调节MDR1的表达,抑制中性粒细胞迁移,从而限制肠道炎症。
总之,肠道微生物组产生次级胆汁酸的能力是调节炎症以及先天和适应性免疫细胞募集、分化和激活的重要因素。
相反,适应性免疫调节微生物群和次级胆汁酸的产生。因此,维持这些因素之间的平衡对于维持肠道稳态是必要的。
微生物群通过竞争资源和产生限制细菌生长的代谢产物,如短链脂肪酸,来保护细菌免受机会性感染。
微生物群衍生的限制细菌生长的代谢产物可以被视为选择最适合环境的代谢特征的栖息地过滤器。微生物群通过与宿主合作来防止机会病原体在肠道定植。
微生物群介导的胆汁酸代谢和对病原体的防御
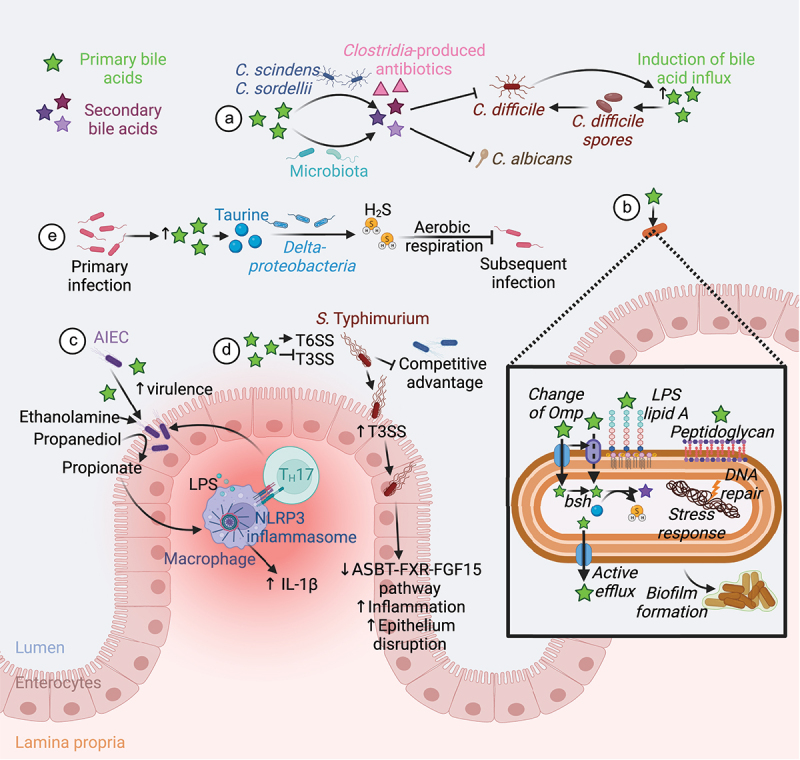
Larabi AB,et al.Gut Microbes.2023
▷增强了对病原体的防御
微生物群对胆汁酸的调节在保护宿主免受致病性感染方面发挥作用。
在人类中,肠道微生物群中胆汁酸水解酶的丰度和活性越高,通过降解激活病原体毒力基因表达的牛磺胆酸,对霍乱弧菌(Vibrio cholerae)感染的抵抗力就越强。
次级胆汁酸对艰难梭菌具有定值抗性
将初级胆汁酸转化为次级胆汁酸的共生细菌提供了对艰难梭菌(C. difficile)的定植抗性。初级胆汁酸可诱导艰难梭菌孢子萌发,而次级胆汁酸对营养细胞有毒。
编码操纵子的共生梭菌通过产生抑制艰难梭菌萌发、生长和毒素产生的次级胆汁酸来保护艰难梭菌不受感染。
石胆酸和去氧胆酸对白色念珠菌具有抵抗性
在体外,次级胆汁酸石胆酸和去氧胆酸对白色念珠菌具有直接的抗真菌活性。相反,通过改变微生物群组成和减少肠道单核吞噬细胞和TH17细胞的数量,向抗生素治疗的小鼠施用牛磺胆酸会加剧白色念珠菌的定植和传播。
因此,微生物群对胆汁酸的作用调节了定植抗性,直接通过抑制病原体生长或间接通过调节粘膜固有和适应性反应。
▷作为致病菌和病原体的环境信号
由于胆汁酸及其代谢产物是肠道环境的关键特征,许多机会性病原体利用这些线索来调节肠道定植所需的毒力因子的表达。
粘附侵袭性大肠杆菌(AIEC) 是一种独特的常驻粘膜相关病理细菌,克罗恩病患者中富含这种细菌。利用特定的肠道环境来增加它们的复制并诱发炎症。
在管腔中,胆汁酸促进AIEC毒力基因的表达,例如有利于细菌在肠道中持久存在的鞭毛蛋白FliC,以及促进细菌与潘氏斑相互作用和生长的长极性菌毛LpF。
此外,胆汁盐的存在激活了次级代谢途径,使AIEC能够使用乙醇胺作为氮源,使用丙二醇作为碳源,从而赋予这些菌株相对于其他共生细菌的竞争优势。但也与脂多糖协同作用,触发白细胞介素-1β的产生和TH17细胞的激活,从而促进T细胞依赖性肠道炎症。
影响病原菌的毒力和运动性
鼠伤寒杆菌(S.Typhimurium)暴露于胆汁会增加其VI型蛋白分泌系统(T6SS)的活性,将具有抗菌活性的效应蛋白输送到邻近细胞,从而杀死共生细菌并成功地在肠道定植。
在霍乱弧菌(V. cholerae)中,初级胆汁酸增加了毒力和运动性。艰难梭菌(C. difficile)在宿主定植过程中诱导胆汁酸快速流入肠道,这有助于孢子萌发和生长。
▷会记住过去的感染,以便在未来更好地抵抗
肠道病原体感染会破坏胆汁酸的回肠吸收和胆汁酸产生的内分泌调节。
表现出更强的定值抗性
实验小鼠在感染假结核耶尔森菌(Y.pseudotuberculosis)数周后,表现出对肺炎克雷伯菌(Klebsiella pneumoniae)更强的定植抗性。
潜在的机制是感染假结核耶尔森菌(Y.pseudotuberculosis),一种侵入回肠派尔氏斑块的肠道病原体,增加了肠道微生物群中Deltaproteobacteria的丰度。
注:Deltaprotoebacteria是一类代谢胆汁酸衍生的牛磺酸的细菌。
Deltaproterobacteria摄入牛磺酸会导致硫化氢的释放,可以通过有氧呼吸抑制肺炎克雷伯菌生长。
Deltaproteobacteria丰度的增加也增强了对柠檬酸杆菌(C.rodentium)的定殖抗性,是一种需要氧气才能在肠道环境中生长的病原体。
这些研究表明微生物群衍生的硫化氢限制了兼性厌氧机会性病原体的生长。
注意
尽管结肠中胆汁酸浓度的增加可能有利于增强定植抵抗力,但胆汁酸浓度过高与炎症性疾病和结直肠癌有关。
因此,需要对胆汁酸代谢进行精细调节,以增强定植抵抗力,同时限制对宿主的有害影响。
肠道菌群和胆汁酸在人体健康和疾病中发挥着重要的作用。肠道菌群可以代谢胆汁酸,影响其在体内的水平和作用,从而影响脂质代谢、肝胆功能和肠道健康等方面。
同时,胆汁酸也会影响艰难梭菌感染、癌变与细胞周期失调。下面谷禾列举了胆汁酸在影响人类疾病中的一些例子。
宿主和微生物群依赖性胆汁酸对人类疾病的影响
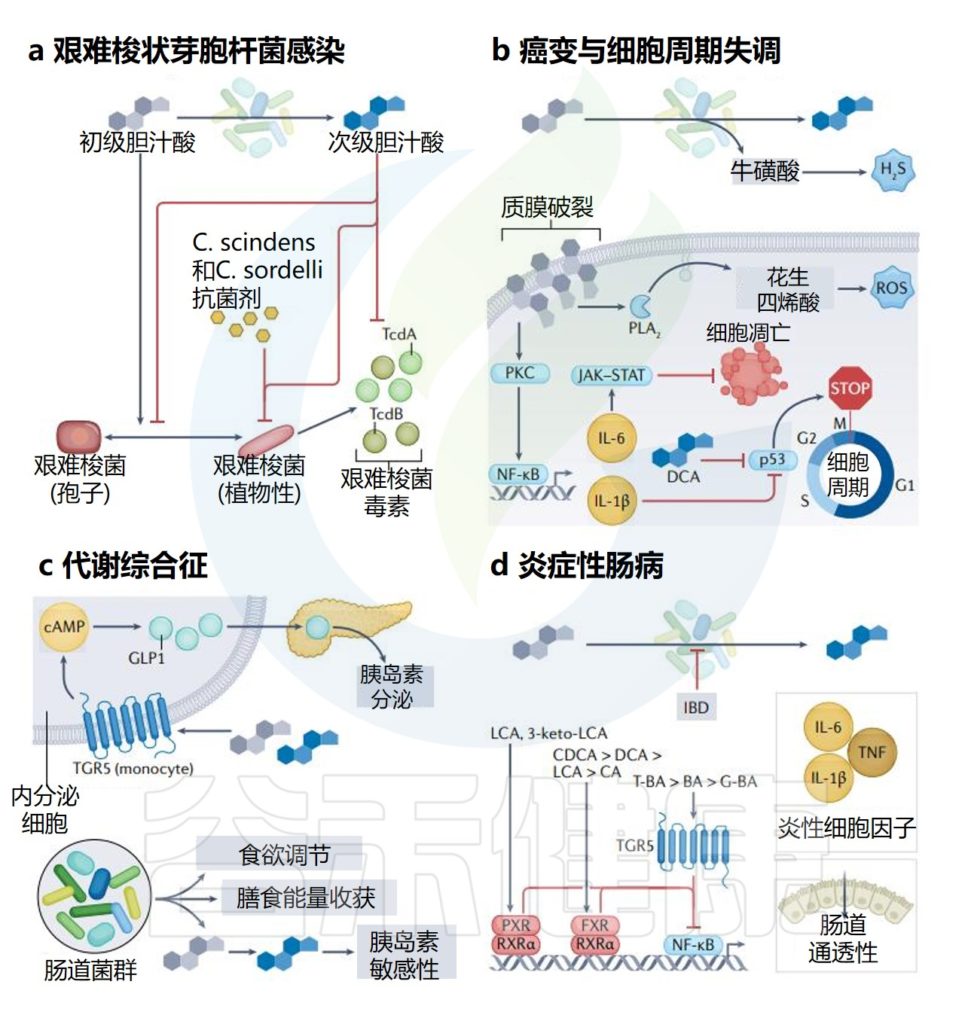
编辑
Collins SL,et al.Nat Rev Microbiol.2023
代谢综合征是指至少有以下三种体征的个体:高血压、肥胖、血液甘油三酯水平升高或血糖水平升高。
患有代谢综合征的人有多种疾病的风险,包括糖尿病、中风、心脏病和结直肠癌。
√肠道菌群改变胆汁酸对代谢稳态非常重要
遗传、饮食和环境都在代谢性疾病中起作用,其中包括微生物群和胆汁酸组成。微生物群通过增加膳食能量收获、调节食欲和改变胆汁酸池对代谢稳态至关重要。
√次级胆汁酸与非酒精性脂肪肝相关
抗生素相关的厚壁菌门细菌丰度减少和次级胆汁酸的消耗与代谢综合征患者胰岛素敏感性降低相一致,而微生物群依赖的次级胆汁酸水平增加与非酒精性脂肪肝相关,强调了微生物群相关胆汁酸对代谢健康的重要性。
√次级胆汁酸影响脂质和葡萄糖稳态
虽然次级胆汁酸可能有助于缓解代谢综合征,但其机制尚不清楚。胆汁酸受体如FXR和TGR5维持脂质(胆固醇和甘油三酯)和葡萄糖稳态。
被胆汁酸激活的受体增加胰岛素敏感性
被胆汁酸激活的TGR5通过诱导胰高血糖素样肽-1(GLP1)的分泌而增加胰岛素敏感性。虽然FXR的激活也会增加GLP1的分泌,但它在代谢性疾病中的作用是复杂的,似乎是特定于环境的。
在一些研究中,激活FXR对胆固醇、甘油三酯和葡萄糖水平有有益的影响。例如,肝脏FXR激活通过抑制SREBP1c脂质生成途径来抑制甘油三酯的产生。
√胆汁酸通过法尼醇X受体活性影响代谢
包括奥贝胆酸在内的强效合成FXR激动剂的临床试验显示,非酒精性脂肪肝患者体重减轻,可能是通过刺激棕色脂肪分化和代谢。
然而,关于奥贝胆酸对非酒精性脂肪肝患者胰岛素抵抗的影响,有相互矛盾的报道。此外,在一些研究中,敲除小鼠体内的法尼醇X受体与激活法尼醇X受体有相似的效果(防止体重增加和增加胰岛素敏感性)。
FXR基因敲除小鼠的益处依赖于微生物群,因为微生物群从这些小鼠转移到无菌小鼠可以减轻体重,降低体脂率和胰岛素敏感性。
因此,在检查胆汁酸对肥胖和代谢性疾病的影响时,应仔细考虑肠道和肝脏FXR活性。
艰难梭菌感染(CDI)是全世界范围内最常见的感染之一,一部分感染者为无症状携带者,严重的患者可能出现腹泻、发烧,甚至会死亡。
当正常的微生物群被抗生素耗尽时,就会出现艰难梭菌感染。抗生素消耗的常驻微生物群减少了分泌抗菌肽的梭状芽胞杆菌(Clostridium spp.)的数量,而梭状芽胞杆菌通常控制艰难梭菌的数量。
√微生物胆汁酸代谢对预防艰难梭菌感染有益
此外,原生微生物群将原发性胆汁酸转化为继发性胆汁酸对于预防艰难梭菌感染至关重要。事实上,抗生素相关的原发性胆汁酸升高和继发性胆汁酸水平降低与复发性艰难梭状芽胞杆菌感染有关。
一些初级胆汁酸会诱导艰难梭菌到产毒状态
微生物胆汁酸代谢对预防艰难梭菌感染的益处是多方面的。某些初级胆汁酸,包括胆酸、牛磺胆酸和甘氨胆酸,可诱导艰难梭菌从孢子萌发到活跃的产毒状态。
次级胆汁酸能直接抑制艰难梭菌的生长
相反,去氧胆酸和石胆酸已被证明能直接抑制艰难梭菌的萌发和生长。这部分解释了为什么编码胆汁酸的梭状芽胞杆菌(如C. scindens)产生次生胆汁酸可以保护艰难梭菌感染。
注:C.scindens和Clostridium也分泌抗艰难梭菌的抗菌剂,与去氧胆酸和石胆酸结合使用更有效。
次级胆汁酸可以降低艰难梭菌毒性
次级胆汁酸也直接结合并隔离艰难梭菌毒素B(TcdB)以降低其毒性。细菌胆汁酸代谢对预防艰难梭菌感染很重要,这一认识可能会提供新的治疗选择。
粪菌移植作为抗生素的替代方法已被证明可以通过恢复次级胆汁酸来成功减轻艰难梭菌感染。
肠道菌群相关的胆汁酸会影响胃肠道炎症和肿瘤的发展。
早在20世纪30年代,去氧胆酸就被证明会引起小鼠注射部位的肿瘤。特别是与高脂肪饮食相结合,两种主要的次级胆汁酸(去氧胆酸和石胆酸)长期以来都与胃肠道癌症有关,特别是结直肠癌和肝细胞癌。
√胆汁酸影响致癌作用
微生物群的组成和胆汁酸合成潜力对炎症和癌症的进展至关重要。
高脂肪饮食更容易发生肝细胞癌
高脂肪饮食喂养的小鼠更容易发生肝细胞癌,部分原因是革兰氏阳性群体增加,它们通过7α-去羟基化酶产生去氧胆酸。
由于其疏水性,次级胆汁酸如去氧胆酸和石胆酸比初级胆汁酸更具有致癌性。在肝细胞癌和结直肠癌中,疏水性胆汁酸的癌症加速是基于它们损伤细胞和诱导炎症的能力。
未结合的疏水性去氧胆酸和石胆酸更容易作为清洁剂破坏细胞膜并诱导细胞损伤反应。
抑制法尼醇X受体活性进一步加剧了次级胆汁酸的致癌潜力。许多研究已经观察到人类结直肠癌中法尼醇X受体激活降低,法尼醇X受体敲除小鼠易患结肠和肝脏肿瘤。
作为胆汁酸的受体,法尼醇X受体是癌症进展过程中脂质代谢和细胞信号中断事件之间的重要联系。
炎症会降低法尼醇X受体的激活从而影响癌变
炎症,特别是通过NF- κB信号通路分泌肿瘤坏死因子和白细胞介素-1β,降低了法尼醇X受体的激活。因此,上述细胞对去氧胆酸和石胆酸的促炎反应会促进癌变。
法尼醇X受体失活还会增加胆汁酸的合成并减少肝细胞的胆汁酸输出,进一步加剧胆汁酸积累介导的损伤和炎症。
细菌水解的牛磺酸偶联胆汁酸的促癌作用的另一种机制已被提出。去偶联释放的牛磺酸最终通过磺酸代谢为硫化氢,这是一种强效致癌物。
√炎症性肠病中胆汁酸代谢失调
炎症性肠病是胃肠道慢性炎症性疾病的集合,最常见的是克罗恩病和溃疡性结肠炎。溃疡性结肠炎只影响结肠,而克罗恩病可以同时影响小肠和结肠。
在炎症性肠病发作期间,肠上皮发炎并失去屏障的完整性。虽然炎症性肠病的病因尚不完全清楚,但与肠道菌群的大规模变化有关。
炎症性肠病中胆汁酸代谢明显失调,特别是当微生物群被破坏时。活动性炎症性肠病患者粪便中共轭胆汁酸水平升高,次级胆汁酸水平降低。
注:一项利用计算预测炎症性肠病患者和健康人微生物群的解偶联和修饰潜能的研究发现,炎症性肠病患者微生物群的胆汁酸代谢潜能受到干扰。
次级胆汁酸受体促进肠上皮再生并预防肠道炎症
次级胆汁酸激活G蛋白偶联受体5(TGR5)可促进肠上皮细胞再生并预防肠道炎症。胆汁酸受体FXR和 TGR5被胆汁酸衍生物或其他激动剂激活,刺激靶向通路以调节肠道稳态,预防炎症和肿瘤发生。
炎症性肠病和结直肠癌中的胆汁酸受体
Cai J,et al.Cell Host Microbe.2022
然而,一些因素使胆汁酸、微生物群和炎症性肠病之间的关系复杂化。特别是,活动性炎症性肠病患者肠道转运率的增加减少了总微生物群数量,限制了代谢胆汁酸的足够反应时间。
胆汁酸能预测炎症性肠病的早期缓解
胆汁酸不仅与疾病发生高度相关,而且能够预测炎症性肠病的早期缓解。在最近发表的一项研究中,进行了粪便宏基因组学、血清代谢组学和蛋白质组学,以揭示预测炎症性肠病中抗细胞因子和抗整合素治疗的不同反应的微生物决定因素。
血清胆汁酸,如甘氨石胆酸钠、甘氨脱氧胆酸和熊去氧胆酸的富集可预测接受抗细胞因子治疗的炎症性肠病患者的早期病情缓解。
此外,微生物种类的多样性与与抗细胞因子反应相关的缓解可能性呈正相关,这表明微生物特征可能有利于炎症性肠病的生物治疗反应。
√胆汁酸与结直肠癌发病相关
根据2020年美国癌症协会的统计数据,在美国,结直肠癌是男性和女性癌症死亡的第三大原因。炎症性肠病和结直肠癌密切相关,炎症性肠病被认为是结直肠癌的主要风险因素。
与炎症性肠病类似,结直肠癌也是一种与肠道菌群密切相关的异质性疾病。鉴于肠道微生物群与结肠肿瘤发生之间的联系以及结直肠癌的异质性,多组学技术已被应用于了解疾病的病因学、发现预后或预测性生物标志物以及开发治疗或预防药物。
人体炎症性肠病和结直肠癌中的胆汁酸
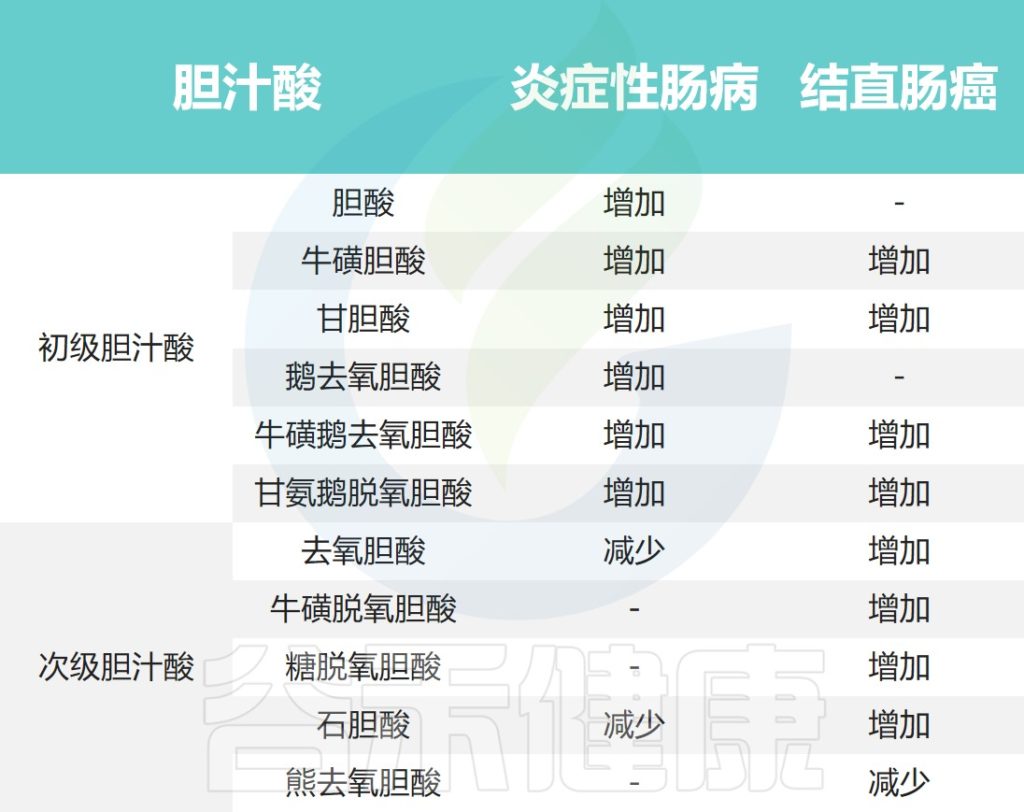
Cai J,et al.Cell Host Microbe.2022
胆汁酸合成基因与结直肠癌显著相关
研究发现胆汁酸合成相关基因的丰度与人类结直肠癌显著相关。
在对来自七个不同国家的八项结直肠癌研究进行的无偏倚荟萃分析中,胆汁酸基因在基因组和转录组水平上都在结直肠癌患者的粪便中高度富集,这可能被用作结直肠癌诊断的替代微生物组标志物。
胆盐水解酶与结直肠癌存在联系
在另一项关于人类微生物组的全球宏基因组研究中,主要来自厚壁菌门的胆汁酸水解酶基因的丰度与结直肠癌呈负相关,这与之前显示结直肠癌患者中厚壁菌门减少的研究一致, 表明胆盐水解酶丰度与人类结直肠癌之间的关系。
胆汁酸含量与肿瘤风险相关的研究:
在一项全基因组鸟枪法宏基因组学和代谢组学研究中,粪便样本取自结直肠肿瘤不同阶段的患者,研究了多步肿瘤发生过程中的微生物组和代谢组学变化。多发性息肉样腺瘤患者的去氧胆酸显著增加。
在欧洲癌症与营养前瞻性调查队列中的一项病例对照研究中,七种血浆胆汁酸的水平,包括甘氨胆酸、牛磺胆酸、牛磺去氧胆酸和甘胆酸等与结肠癌风险呈正相关,而未结合的胆汁酸和三级胆汁酸与癌症风险无关。
其他研究发现,在粪便代谢组学研究中,血清胆汁酸在腺瘤组中升高,并与拟杆菌(Bacteroides)呈正相关而与健康对照相比,结直肠癌患者粪便样本中的熊去氧胆酸有所减少。
一些研究表明去氧胆酸可能有助于结直肠癌的发病机制,不过还需要更多的研究来确定其他胆汁酸,尤其是原发性胆汁酸在人类结直肠癌中的作用。
胆固醇结石病 (GS) 是一种世界范围内流行的疾病,尤其是在西方国家。最近的调查发现,它在中国上海的发病率超过12%。
√胆汁酸分泌异常与胆结石形成相关
导致胆结石的先决生化障碍是胆囊中胆固醇过饱和胆汁的形成。研究中,我们发现胆固醇结石患者和胆结石易感小鼠的粪便中富含脱硫弧菌(Desulfovibrio),诱导胆结石形成。
肝脏胆固醇积聚和胆汁胆固醇分泌增强
我们进一步证明,携带脱硫弧菌与肠道微生物群活化胆汁酸脱羟基作用导致的次级胆汁酸产生增加有关,导致胆汁酸疏水性增加,从而促进肠道胆固醇吸收,导致肝脏胆固醇积聚和胆汁胆固醇分泌增强。
微生物群促进胆固醇结石形成的潜在机制
Hu H,et al.Nat Commun.2022
√易患胆结石的微生物群调节胆汁酸的方式:
易患胆结石的微生物群(富含脱硫弧菌)通过以下方式调节肝胆汁酸代谢:
(1) 增加7α-脱羟基细菌在盲肠中产生更多的次级胆汁酸;
(2) 产生硫化氢并调节肝FXR-CYP7A表达,这些物质影响胆汁酸的合成以及在肝脏中的重吸收;
(3) 导致去氧胆酸增加,进而提高胆汁酸的疏水性指数,抑制肝胆汁酸合成;
(4) 促进肠道胆固醇吸收,导致肝脏胆固醇超载;(5) 促进小管胆固醇分泌到胆汁中并诱导胆固醇胆结石形成。
通过改变微生物群的组成或微生物群代谢某些胆汁酸的能力,或通过施用次生胆汁酸,来控制微生物胆汁酸代谢,具有提供健康益处的潜力。
随着研究阐明了特定胆汁酸对健康的确切影响,治疗可以从更普遍的改变微生物群的方法(例如,粪便移植、益生菌和益生元)转向专门针对单个胆汁酸。
粪便微生物群移植是将健康供体的粪便微生物转移到受体患者,最初是为了恢复完整的微生物群而开发的。
•粪菌移植可以治疗艰难梭菌感染
粪菌移植治疗艰难梭菌感染的成功可能部分是由于恢复了依赖胆汁酸水解酶的次级胆汁酸生产。
尽管一些初级胆汁酸,如牛磺胆酸,促进艰难梭菌孢子萌发,但次级胆汁酸去氧胆酸和石胆酸抑制艰难梭菌生长和艰难梭菌孢子发芽,并且它们的水平在艰难梭菌感染抗性个体中升高。
•减轻肠道炎症等相关疾病
虽然粪菌移植在治疗溃疡性结肠炎方面的效果不一,但石胆酸的衍生物3-oxo LCA的恢复与粪菌移植相关,并表明次级胆汁酸在减轻疾病方面的作用。
减少产生胆汁酸水解酶的细菌缓解肠易激综合征
粪菌移植可以通过减少胆汁酸水解酶活性细菌的数量来缓解与腹泻型肠易激综合征相关的次级胆汁酸过量产生。
•粪菌移植也可用于治疗生态失调
粪菌移植也在小鼠身上进行了研究,以治疗观察到微生态失调的各种其他情况(例如衰老)。
粪菌移植缺乏特异性
粪菌移植广泛应用的主要限制之一是其在调节微生物群方面缺乏特异性,这可能导致意想不到的不良反应。
在完整的细菌群落及其对人类健康的影响尚不清楚的情况下,设计一种成功的粪菌移植治疗方法仍然具有挑战性。
具有明确胆汁酸代谢特性的活微生物可用于改变生态失调和疾病中的胆汁酸库。
•使用益生菌更具针对性
与粪菌移植相比,益生菌的优势在于它们更具针对性,具有明确的作用机制。具有7α-去羟基化活性的梭状芽胞杆菌(Clostridium spp.),特别是C.scindens,被证明可以通过产生抑制性的次级胆汁酸来消除艰难梭菌。
注:通过基因工程,来自具有7α-脱羟基活性的细菌的操纵子已被移植,以将这些益处赋予共生产孢梭菌菌株。这种方法可以将胆汁酸合成归因于各种共生细菌,并精确地生成需要的胆汁酸。
生孢梭菌——能够成为具有发展前景的癌症治疗手段
•益生菌可以调节胆汁酸受体
益生菌的使用可以调节胆汁酸受体如法尼醇X受体、维生素D受体的激活。
•益生菌通过调节胆汁酸降低胆固醇水平
益生菌混合物VSL#3可以治疗肠易激综合征和溃疡性结肠炎,但也含有表达胆汁酸水解酶的细菌,可以增加胆汁酸的解结和排泄。
VSL#3通过抑制FXR-FGF15途径上调肝脏胆汁酸生物合成。这种作用可能有利于降低循环中的胆固醇水平。
•益生菌还可以减少肠道炎症和肿瘤形成
然而,同样的益生菌混合物在结直肠癌患者中可能具有相反的恢复法尼醇X受体激活的效果。事实上,施用VSL#3可防止结直肠癌相关的胆汁酸下调,并减少炎症和肿瘤形成。
另一种活性益生菌,罗伊氏乳杆菌NCIMB 30242,在人类中具有类似的抗炎和降胆固醇作用,这表明这些细菌的有益作用依赖于将共轭胆汁酸转化为次级胆汁酸。
与其给药产生胆汁酸的细菌,不如直接给药具有生物活性的次级胆汁酸,因为它们具有相似的预期效果。
•施用熊去氧胆酸可以抑制胃肠道癌症
熊去氧胆酸主要用作抗胆汁淤积剂,是原发性胆道自身免疫性疾病(如原发性胆道胆管炎)患者的主要治疗选择,但也可能抑制胃肠道癌症(如结直肠癌和肝细胞癌)的进展。
注:熊去氧胆酸减轻结直肠癌的发生是由胆汁酸膜受体TGR5介导的。
•施用次级胆汁酸降低了结肠炎的严重程度
胆汁酸也可能有助于结肠炎患者的症状缓解。石胆酸代谢物通过调节转录因子RORγt和产生线粒体活性氧,支持T细胞分化为调节性T细胞而不是促炎性T辅助17细胞。
这种次级胆汁酸介导的对调节性T细胞分化的促进降低了结肠炎的严重程度,并且部分地解释了细菌联合治疗小鼠结肠炎的益处。
•改善肥胖患者胆固醇及甘油三酯含量
熊去氧胆酸和石胆酸均为法尼醇X受体激动剂,可通过FXR-FGF15途径减轻代谢综合征。由于FXR-FGF15的激活,肥胖小鼠在接受熊去氧胆酸和石胆酸治疗后,胆固醇、血浆甘油三酯和血浆脂肪酸水平降低了。
因此,产生这些次生胆汁酸的细菌,如狄氏副拟杆菌(Parabacteroides distasonis),有助于降低高脂血症。
注:合成的FXR激动剂奥贝胆酸是一种被批准用于治疗原发性胆道胆管炎的药物,并且在治疗非酒精性脂肪性肝炎和肥胖症方面也取得了成功。
提示
虽然直接补充胆汁酸可以产生对致癌、结肠炎和代谢综合征有益的结果,但这些效果可能只在治疗期间持续。相反,改变微生物群以增加胆汁代谢可能有助于延长效果。因此调节肠道微生物群的平衡十分重要。
细菌转化胆汁酸的失衡是代谢性、炎症性、感染性和肿瘤性疾病的重要因素,主要通过胆汁酸受体的失调来实现。
由于许多胆汁酸受体在胃肠道以外的组织中表达(例如,脑,T细胞和平滑肌),因此值得进一步研究胆汁酸在其他部位的影响。
随着对肠道菌群和胆汁酸的深入研究,我们将更好地了解它们在人类健康中的作用机制,以及它们与人类疾病的关系。
同时,我们也将探索更多的方法来维护肠道菌群和胆汁酸的平衡,如饮食、运动、药物等。这些研究将为预防和治疗相关疾病提供新的思路和方法,为人类健康事业做出更大的贡献。
主要参考文献
Collins SL, Stine JG, Bisanz JE, Okafor CD, Patterson AD. Bile acids and the gut microbiota: metabolic interactions and impacts on disease. Nat Rev Microbiol. 2023 Apr;21(4):236-247. doi: 10.1038/s41579-022-00805-x. Epub 2022 Oct 17. PMID: 36253479.
Yu L, Liu Y, Wang S, Zhang Q, Zhao J, Zhang H, Narbad A, Tian F, Zhai Q, Chen W. Cholestasis: exploring the triangular relationship of gut microbiota-bile acid-cholestasis and the potential probiotic strategies. Gut Microbes. 2023 Jan-Dec;15(1):2181930. doi: 10.1080/19490976.2023.2181930. PMID: 36864554; PMCID: PMC9988349.
Cai J, Sun L, Gonzalez FJ. Gut microbiota-derived bile acids in intestinal immunity, inflammation, and tumorigenesis. Cell Host Microbe. 2022 Mar 9;30(3):289-300. doi: 10.1016/j.chom.2022.02.004. PMID: 35271802; PMCID: PMC8923532.
Hu H, Shao W, Liu Q, Liu N, Wang Q, Xu J, Zhang X, Weng Z, Lu Q, Jiao L, Chen C, Sun H, Jiang Z, Zhang X, Gu A. Gut microbiota promotes cholesterol gallstone formation by modulating bile acid composition and biliary cholesterol secretion. Nat Commun. 2022 Jan 11;13(1):252. doi: 10.1038/s41467-021-27758-8. PMID: 35017486; PMCID: PMC8752841.
Poland JC, Flynn CR. Bile Acids, Their Receptors, and the Gut Microbiota. Physiology (Bethesda). 2021 Jul 1;36(4):235-245. doi: 10.1152/physiol.00028.2020. PMID: 34159805; PMCID: PMC8526331.
Larabi AB, Masson HLP, Bäumler AJ. Bile acids as modulators of gut microbiota composition and function. Gut Microbes. 2023 Jan-Dec;15(1):2172671. doi: 10.1080/19490976.2023.2172671. PMID: 36740850; PMCID: PMC9904317.
McCarville JL, Chen GY, Cuevas VD, Troha K, Ayres JS. Microbiota metabolites in health and disease. Annu Rev Immunol [Internet] 2020; 38:147–170.