-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com



短链脂肪酸这一词经常出现在谷禾的文章和报告中,那你真的了解短链脂肪酸吗?短链脂肪酸(SCFA)主要是肠道微生物群在结肠内通过发酵碳水化合物(包括膳食和内源性碳水化合物,主要是抗性淀粉和膳食纤维)和一些微生物可利用的蛋白质而产生的。
短链脂肪酸主要是乙酸、丙酸和丁酸,在结肠中的浓度比大致为60-70%:20-30%:10-20%。这些代谢产物能够被宿主利用,尤其是丙酸和丁酸,它们发挥一系列促进健康的功能。它们能被肠粘膜有效吸收,作为能量来源,还能作为基因表达调节剂以及特定受体识别的信号分子,对宿主生理产生重要影响。近几年的研究还发现其能够调节免疫细胞发育并抑制炎症。
然而,三种主要短链脂肪酸——乙酸盐、丙酸盐和丁酸盐——它们在体内的功能和组织分布不同,对宿主生理的影响存在显著差异。丁酸盐优先被肠粘膜用作能量来源,还具有抗炎特性,可增强肠道屏障功能和粘膜免疫。丙酸盐有助于抵抗肝脏中的脂肪形成、降低胆固醇、也有一定的抗炎和抗致癌作用。而乙酸在血液中浓度最高,可用作肝脏胆固醇和脂肪酸合成的底物,增加结肠血流量和氧气吸收,并通过影响回肠收缩来增强回肠运动。
其次,它们与宿主蛋白(如丁酸和丙酸抑制组蛋白去乙酰化酶)和受体的相互作用也不同。因此,特别需要考虑这些短链脂肪酸的微生物来源。与此同时,饮食结构和肠道生理变化如何影响这些脂肪酸的相对产量和在结肠中的浓度也是至关重要的。
本文将重点介绍丙酸盐和丁酸盐,因为这两种短链脂肪酸被认为对健康有重要影响,包括丁酸预防结直肠癌,丙酸促进饱腹感并降低胆固醇。而乙酸是大多数肠道厌氧菌的主要发酵产物,也可由还原性乙酸生成,而丙酸和丁酸则由不同的肠道细菌群产生。
我们将探讨在人类结肠微生物群中已知的形成这两种短链脂肪酸的途径,以及各种饮食和环境因素对其产生的调节可能性。详细了解肠道微生物群的短链脂肪酸代谢及其生理功能对于制定个性化的健康营养方案是必不可少的。
丙酸盐和丁酸盐在结构、来源、生理功能以及对健康的影响方面存在一些差异。
▸ 结构上的差异:
丙酸盐(Propionate)含有三个碳原子,羟基(-OH)位于第二个碳原子上。
丁酸盐(Butyrate)含有四个碳原子,羟基(-OH)位于第四个碳原子上。
▸ 来源上的差异:
丙酸盐通常由肠道细菌通过发酵L-鼠李糖、聚葡萄糖、阿拉伯木聚糖、D-塔格糖、甘露寡糖、昆布多糖等糖类物质产生。
丁酸盐可以通过肠道微生物群发酵富含抗性淀粉和果聚糖的食物来增加,如菊粉、马铃薯、洋葱等。
▸ 功能上的差异:
丙酸盐在体内的主要功能是作为肝脏中糖原合成的前体物质,有助于调节血糖水平,影响食欲。
丁酸盐是结肠上皮细胞的首选能源,有助于维持肠道屏障,发挥免疫调节和抗炎作用。丁酸盐还可以通过减少NF-kB信号传导和诱导凋亡来促进神经保护。
▸ 对健康的影响:
丙酸盐的健康益处主要是调节能量代谢和改善代谢综合征,可能对调节肠道菌群平衡也有积极作用,但其具体影响取决于个体的肠道菌群组成。
丁酸盐对健康的影响更为广泛,包括维持肠道稳态、促进肠道屏障的完整性、刺激绒毛的生长、促进粘蛋白的产生。以及改善认知功能、促进睡眠、调节社交行为和在糖尿病中的潜在益处。
丙酸盐是许多生物(从细菌到人类)的代谢副产物,产生丙酸的代谢途径可分为三类。主要发酵途径将不同的碳源分解代谢为丙酸盐(图A);分解代谢途径则能将多种氨基酸降解为丙酸盐(图B);此外,通过与从丙酮酸或二氧化碳生成生物质前体相关的合成代谢途径也可以生产丙酸盐(图C)。
产生丙酸盐的代谢途径
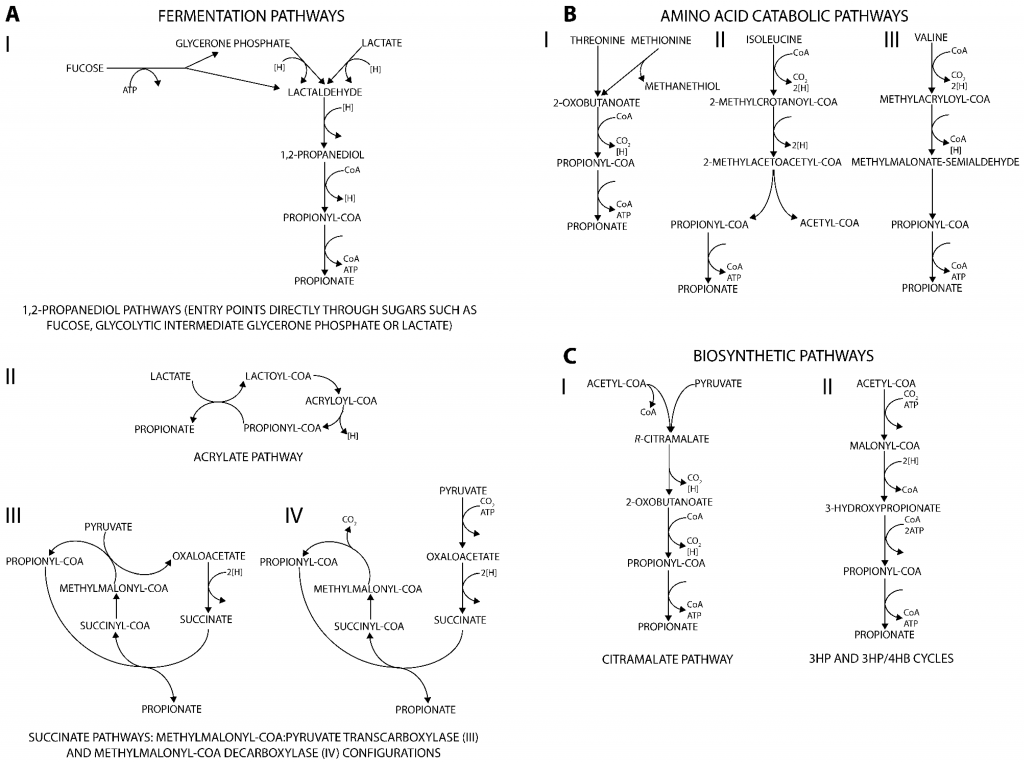
doi.org/10.3390/fermentation3020021
肠道微生物通过发酵不可消化的碳水化合物产生的丙酸盐是体内丙酸盐的主要来源。下面将讲述肠道中丙酸盐通过发酵碳水化合物的三种主要产生途径以及参与这些途径的微生物。
与氨基酸降解和生物合成途径相比,发酵途径不仅提供能量,还帮助消耗由糖分解代谢产生的还原辅因子。它们在能量产生和维持氧化还原平衡中的作用,使这些途径能够与细胞生长相耦合。
能够产生丙酸盐的微生物种类

doi.org/10.3390/fermentation3020021
▸
丙二醇相关途径
• 鼠伤寒沙门氏菌和Roseburia inulinivorans在这一过程可以产生丙酸
丙酸盐在肠胃中的生成是由1,2-丙二醇(PDO)发酵菌和PDO消耗菌组成的微生物联合作用的结果。已知一些生物体(如鼠伤寒沙门氏菌和Roseburia inulinivorans)能同时进行这两种过程。
在二醇脱水酶和两种常与乙酸代谢相关的混杂酶(辅酶A依赖性醛脱氢酶磷酸转酰基酶和乙酸激酶)的共同作用下,PDO分解代谢为丙酸,同时生成一个ATP和一个还原辅因子。
然而,通过该途径产生丙酸取决于可用于其他细菌生长的碳水化合物,据报道岩藻糖和鼠李糖是丙酸的前体。
通过1,2-丙二醇形成丙酸的微生物途径
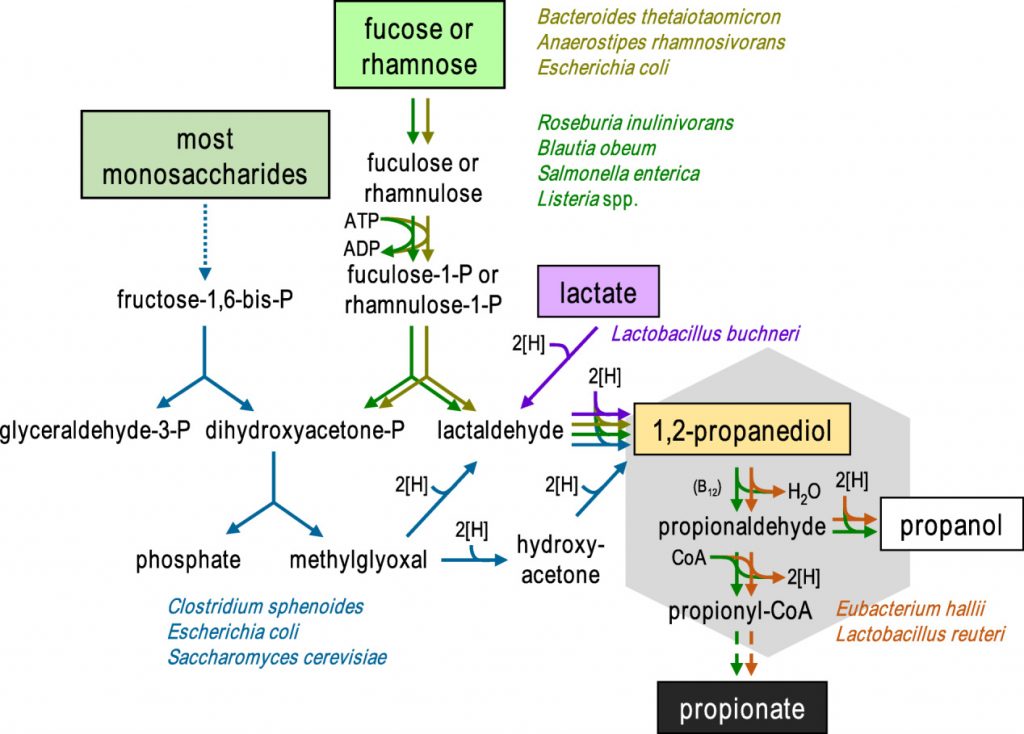
doi: 10.1111/1462-2920.13589.
霍氏大肠杆菌(E.hallii)和罗伊氏乳杆菌(Lactobacillus reuteri)虽然无法在岩藻糖或鼠李糖上生长,但仍然能够利用1,2-丙二醇产生丙酸和丙醇。此外,宏基因组研究表明,其他肠道厌氧菌,包括Flavonifractor plautii、Intestinimonas butyriproducens和Veillonella spp. 也可能能够从这种底物中产生丙酸。因此,不同细菌之间中间体 1,2-丙二醇可能在脱氧糖生产丙酸中发挥重要作用。
▸ 丙烯酸酯途径
丙烯酸酯途径在消耗NADH的情况下,使乳酸在ATP中性条件下转化为丙酸。该途径存在于几种细菌中,包括丙酸梭菌(Clostridium propionicum)、埃氏巨球菌(Megasphaera elsdenii)和瘤胃普氏菌(Prevotella ruminicola)。
虽然多种底物可以分解为丙酸和乙酸,包括乳酸、丝氨酸、丙氨酸和乙醇,但葡萄糖发酵在这过程中似乎不会导致任何天然生产者产生丙酸,这可能是因为葡萄糖发酵不会触发启动循环所需的乳酸消旋酶的表达。
▸ 琥珀酸途径
琥珀酸途径主要存在于拟杆菌门和厚壁菌门中,拟杆菌门的一些细菌从膳食碳水化合物生成丙酸,并且拟杆菌门的相对丰度与人类粪便中丙酸盐的相对水平相关。
• 琥珀酸转化为丙酸盐还需要维生素B12
琥珀酸是丙酸的前体,但在高pCO2(二氧化碳分压)和高稀释率等条件下,它可在磷酸烯醇式丙酮酸羧激酶受到抑制的拟杆菌属培养物中积累。琥珀酸转化为丙酸还需要维生素B12,如果缺乏B12,琥珀酸可能无法转化成丙酸盐。
人类结肠中的一些厚壁菌门细菌(例如Phascolarctobacterium succinatutens)能将琥珀酸转化为丙酸;其他革兰氏阴性菌通过琥珀酸途径(如韦荣氏球菌属)或丙烯酸酯途径(Megasphaera elsdenii)将乳酸转化为丙酸盐。
▸ 氨基酸降解产生丙酸
缬氨酸、苏氨酸、异亮氨酸和蛋氨酸的降解可导致通过丙酰辅酶A产生丙酸和ATP。
由于氨基酸的合成和随后的分解代谢途径存在于多种微生物中,因此可以使用氨基酸合成代谢和分解代谢途径的组合从葡萄糖生产丙酸。
几种拟杆菌在蛋白水解和肽形成丙酸方面发挥重要作用。
苏氨酸的产生和分解代谢已在大肠杆菌中得到广泛研究,作为丙酰辅酶A的可能来源,可用于生产各种化学物质,包括丙醇、红霉素和3-羟基戊酸。此外,考虑到氧化还原和能量平衡,缬氨酸/异亮氨酸和苏氨酸途径的组合具有协同作用,可以略微提高丙酸产量。
除此之外,可以利用丙酮酸经过柠檬酸途径产生丙酸,由于和菌群关联较小,在这就不展开描述了。
▸ 增加丙酸盐生成的底物
一些益生元等化合物可以影响丙酸盐的生产,不过由于浓度以及肠道微生物群落构成的不同,这些化合物的调节丙酸盐产生时具有一定差异。
• L-鼠李糖能够明显增加丙酸盐产量
L-鼠李糖或6-脱氧-L-甘露糖是一种天然脱氧糖。它存在于多种动物、植物和细菌多糖中。在短期体外实验中,L-鼠李糖已被证明能使丙酸产量增加四倍于乳果糖。
在一项人体体内研究中也获得了类似的结果,其中受试者在三个不同的时间被给予25克L-鼠李糖、乳果糖或D-葡萄糖。摄入后24小时测量血清丙酸,L-鼠李糖的血清丙酸明显高于乳果糖或D-葡萄糖的血清丙酸。
一项长期研究也证实了L-鼠李糖诱导丙酸的作用,该研究结果表明,与摄入D-葡萄糖作为对照相比,摄入25克L-鼠李糖可显著提高人体28天内的血清丙酸水平。
• 抗性淀粉有助于增加丙酸
抗性淀粉对淀粉酶降解具有抗性,但它会发酵成丁酸或丙酸。特别是,来自大米的抗性淀粉与丙酸产量增加有关。
研究了抗性淀粉在大鼠体内的发酵情况,饲喂抗性淀粉(630g/kg饲料)的大鼠的肝脏甘油三酯和总胆固醇浓度显著低于对照组。与此同时,血清丙酸浓度也显著增加。
• 菊粉对于增加丙酸和丁酸非常有效
菊粉属于果聚糖家族,主要由β-(2,1)连接的果糖基组成。它天然存在于菊苣和菊芋等开花植物中。作为益生元,菊粉已被证明对增加丁酸和丙酸的产量非常有效。使用人体肠道微生物体外模拟研究了菊粉增加丙酸的效果。
补充菊粉1周(5g/d)后观察到短链脂肪酸产生的代谢变化。较高浓度的短链脂肪酸源于丙酸和丁酸产量的增加。
此外一项针对喂食菊粉(10%)的大鼠的体内研究也导致丙酸产量大幅增加,高达 58.4mmol/。
• 聚葡萄糖
聚葡萄糖是一种支链、随机聚合的多糖,主要由葡萄糖合成,在胃肠道上部不会被消化。使用结肠模拟器研究了这种底物对结肠微生物组成和代谢活性的调节作用。与对照糖木糖醇(8.3mmol/L)相比,短链脂肪酸产量显著增加,尤其是丙酸盐(22.9mmol/L)。
• 阿拉伯木聚糖
阿拉伯木聚糖是许多谷物中发现的主要非淀粉多糖,是膳食纤维的一部分。
在体内研究中,比较了54只大鼠,这些大鼠分别喂食对照饮食(含710g/kg小麦)、阿拉伯木聚糖补充饮食(610g/kg小麦淀粉加100g/kg玉米阿拉伯木聚糖)和胆固醇补充饮食(不含或含2g/kg 胆固醇)。由于短链脂肪酸的积累,尤其是丙酸(摩尔百分比>45%),盲肠pH值从7降至6。然而,丁酸的产生不受影响。
车前草是一种可溶性纤维来源,可提供与麦麸阿拉伯木聚糖相当的多糖。在一项大鼠体内研究中,比较了车前草(5%)对盲肠和结肠发酵的影响与麦麸 (10%) 的影响。研究发现,车前草发酵可产生更高的短链脂肪酸,尤其是盲肠和所有结肠中的丙酸更多。
除此之外,D-塔格糖、甘露寡糖、昆布多糖等物质也可以增加人体丙酸盐的产生。
丙酸盐已被证明具有抗脂肪形成和降低胆固醇的作用。它还对体重控制和进食行为有很强的影响。此外,有研究表明,丙酸和丁酸一样,对结肠癌细胞具有抗增殖作用。
丙酸盐对健康的影响
doi: 10.1111/j.1753-4887.
然而,与结肠细胞用作能量来源的丁酸不同,丙酸在血液循环中的浓度较高。因此,丙酸的生物活性可能不仅限于结肠本身,还扩展到人体的其他部位。需要强调的是,了解体内结肠丙酸浓度或短链脂肪酸浓度不足以推断健康状况。
▸ 影响肝细胞的脂质合成
肝脏的脂质合成包括将饮食来源的脂肪酸和甘油转化为具有不同脂肪酸组成的胆固醇和甘油三酯。然后,这些肝脏脂质分子被结合到脂蛋白中,从而通过循环分布到各种组织中。
• 脂质合成受到短链脂肪酸的强烈影响
有趣的是,肝细胞中的脂质合成受到肠道纤维发酵产生的短链脂肪酸的数量和类型的强烈影响。丙酸盐已被确定在其中一些过程中发挥重要作用。
对肝脏脂质合成的饮食调节早期观察显示,膳食纤维摄入与肝脏脂质合成密切相关。这种影响的部分原因如下:1)粪便中胆固醇和胆汁酸从肠道排出的增加;2)胆固醇向胆汁酸的肝脏转化率较高;3)通过减少乳糜微粒的大小和降低胆固醇在乳糜微粒中的掺入来优化脂蛋白的外周代谢。
• 降低血清胆固醇水平、抑制脂肪酸合成
短链脂肪酸作为微生物碳水化合物发酵的产物,在肝脏脂质合成中发挥着特定作用,已被证明在喂食大鼠时可降低血清胆固醇水平。对分离的大鼠肝细胞的体外研究表明,丙酸对脂肪酸合成有抑制作用,但对胆固醇合成没有抑制作用。
其他大鼠实验表明,加入纤维的饮食可降低肝和血浆胆固醇水平及血浆甘油三酯中的胆固醇,而肝甘油三酯没有受到影响。
尽管这些研究的结果令人信服,但其他研究并不总是能够证实丙酸盐对脂质代谢的抑制作用。例如,每天在面包中补充9.9克丙酸盐不会改变6名健康志愿者的脂质代谢,甚至会导致5名受试者的甘油三酯浓度升高。
在另一项研究中,比较了丙酸盐对人和大鼠肝细胞脂质代谢的影响。发现浓度为0.1mmol/L的丙酸盐对大鼠乙酸盐合成脂质有抑制作用。然而,在人类肝细胞中,需要更高浓度的丙酸盐(约10-20 mmol/L)才能获得同样的抑制作用。该值比门静脉血中丙酸盐的浓度高100-200倍,表明大鼠模型不能完全外推到人类的情况。
▸ 作为影响饱腹感的分子
丙酸盐不仅具有降低胆固醇和抗脂肪生成的作用,还可能通过刺激饱腹感来控制体重。已有研究表明,短链脂肪酸(如乙酸、丙酸、丁酸)具有诱发饱腹感的作用。
• 丙酸盐影响肠道激素的形成进而影响饱腹感
现有证据表明,细菌调节肠道激素(如胰高血糖素样肽1(GLP-1)和肽YY(PYY))的形成,是通过短链脂肪酸介导的。乙酸、丙酸和丁酸的生理浓度,以及pH值从7.5降至6.0,会显著增加肠内分泌结肠细胞系STC-1中的胰高血糖素原和PYY。
GLP-1和PYY是刺激饱腹感的激素,由L细胞(主要位于回肠和结肠)响应营养摄入而释放。GLP-1促进胰岛素分泌和胰腺β细胞增殖,同时控制肌肉细胞中的糖原合成;而PYY则减缓胃排空。相反,生长素释放肽刺激食欲,主要由胃中的P/D1细胞产生。
不易消化的碳水化合物,如低聚果糖、乳糖醇和抗性淀粉,通过调节肠道肽GLP-1、PYY和生长素释放肽的产生,有效地诱导饱腹感,这一机制还涉及肠道微生物群落。
• 丙酸盐对摄食行为有显著影响,诱导瘦素产生
在短链脂肪酸中,丙酸盐被重点研究作为一种饱腹感诱导剂,对能量摄入和摄食行为有显著影响。人体和动物试验表明,丙酸盐给药(体内范围为130-930mmol/L,体外范围为0.01-10mmol/L)显著增强饱腹感并降低进食欲望。
丙酸盐触发的饱腹感信号之一是瘦素,这是一种强效的厌食激素,通过中枢神经系统中表达的受体抑制食物摄入。研究显示,每天服用500µmol的丙酸盐几乎使小鼠血浆中的瘦素浓度翻了一倍。
在另一项研究中,浓度为3mmol/L的丙酸在mRNA和蛋白质水平上诱导了人内脏脂肪组织中瘦素的产生。这些数据表明,肠道微生物群对肥胖的调节作用可能部分由短链脂肪酸(特别是来自微生物碳水化合物发酵的丙酸)介导。
▸ 影响心脑血管健康
丙酸盐通过与肠道受体GPR 41和GPR 43(也称为脂肪酸受体FFAR2和FFAR3)相互作用,对心脑血管健康具有一些潜在的影响。
• 脑血管患者体内的丙酸盐含量较低
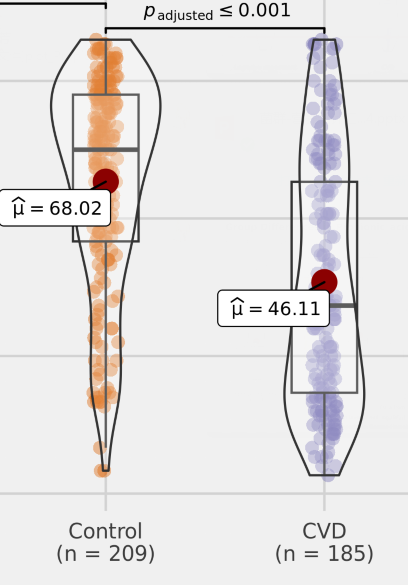
编辑
谷禾的数据中发现,与健康对照相比,脑血管疾病患者中的丙酸盐含量较低,并且具有明显的统计学差异。因此丙酸盐的含量可能是影响心脑血管健康的一个重要指标。
• 较高的丙酸盐浓度患冠状动脉硬化风险较低
最近一项大型横断面研究表明血浆丙酸浓度与冠状动脉疾病存在关联,较高浓度的丙酸盐与较低的冠状动脉粥样硬(CAD)风险相关,且与已知的心血管风险因素无关。
如上所述,越来越多的实验数据表明,丙酸盐可能对高血压、内皮功能障碍和高胆固醇血症等心血管风险因素产生有益影响。
▸ 丙酸盐在癌症中的潜在作用
短链脂肪酸对癌症(尤其是结肠癌)的影响已被广泛研究。丁酸能够调节基因表达,并对细胞凋亡和细胞周期的关键调节因子产生影响。
几种机制促成了丁酸对基因表达的调节作用。这些机制包括组蛋白和非组蛋白的过度乙酰化以及DNA甲基化的改变,从而增强了转录因子对核小体DNA的可及性。
• 丙酸盐诱导结直肠癌细胞凋亡
在一项研究中,丙酸盐和乙酸盐(浓度分别为26-40和9-16mmol/L)在人类结直肠癌细胞系中诱导了典型的细胞凋亡迹象。这些迹象包括线粒体跨膜电位的丧失、活性氧的产生、胱天蛋白酶3加工和核染色质凝聚。
• 抑制结肠癌细胞系的生长
短链脂肪酸对结肠上皮细胞增殖具有矛盾作用。虽然这些阴离子刺激正常隐窝细胞,但它们抑制结肠癌细胞系的生长。
丁酸盐和丙酸盐也是诱导分化和细胞凋亡的最有效脂肪酸。因此,它们通常可以预防癌症的发展,尤其是预防结直肠癌。虽然丁酸比丙酸更有效,但它主要被结肠细胞吸收作为能量来源。相比之下,丙酸和乙酸盐进入血液循环的浓度比丁酸高得多,并且它们被肝脏大量吸收(约60%)。由于这些阴离子在肝脏中的浓度很高,它们很可能会影响肝癌细胞以及已知会导致肝脏转移的其他典型癌细胞,例如乳腺癌和结肠癌。
一项针对猝死患者的研究表明,外周血中的短链脂肪酸数量可以量化。因此,这种循环中的丙酸盐、乙酸盐和丁酸盐的抗癌作用非常值得研究;例如,这种影响会在多大程度上延伸到小肠、大肠和肝脏之外,从而影响不同的组织?
!
• 丙酸盐过量可能与阿尔茨海默病相关
最近的几项研究提供了丙酸盐与阿尔茨海默病(AD)之间联系的证据。例如,分析了阿尔茨海默病患者和健康对照者的唾液样本,发现阿尔茨海默病患者的丙酸水平比健康对照者高出1.35倍。分析了轻度认知障碍者、阿尔茨海默病患者和健康对照者的唾液样本,也发现AD患者的丙酸水平显著升高。
几项啮齿动物研究也将粪便和循环中丙酸盐水平与阿尔茨海默病联系起来。接受AD患者粪便微生物群移植的小鼠丙酸水平高于对照组。
此外,发现阿尔茨海默病小鼠海马体中的丙酸增加了1.23倍。也发现阿尔茨海默病小鼠前额叶皮层中的丙酸浓度显著高于野生型小鼠,6个月大的阿尔茨海默病小鼠粪便中的丙酸浓度也显著更高。
• 丙酸血症的丙酸盐代谢异常
丙酸血症是人类最常见的有机酸代谢紊乱,是一种由丙酰辅酶A羧化酶基因缺陷引起的先天性代谢错误,丙酸过量且无法通过丙酰辅酶A转化。
丙酸血症患者的体内丙酸及其代谢物水平显著升高,会引起代谢性酸中毒、血氨升高,可能还会诱导一些严重的并发症如脑损伤、心肌病发生。
•有研究认为过多的丙酸盐可能导致肥胖和糖尿病
2019年哈佛大学公共卫生学院发表的一篇文献称:小鼠长期接触丙酸将导致肝细胞产生更多葡萄糖,形成高血糖症,这是糖尿病的一个典型特征。此外,研究人员还发现,长期服用丙酸盐剂量的小鼠,其体重会显著增加,胰岛素抗性也会增大。
还对14名健康人开展对照试验,受试者被随机分为两组,其中一组的餐食中添加1克丙酸盐,另一组添加安慰剂。结果显示,进餐后不久,丙酸盐组受试者血液中的去甲肾上腺素水平显著升高,胰高血糖素等激素水平也有所增长。这表明丙酸盐可能会作为“代谢破坏者”,增加人类患糖尿病和肥胖症的风险。
而这与前文丙酸盐会影响脂质合成与摄食行为相矛盾,因此,丙酸盐对人体的影响可能取决于其含量以及人体独特的肠道菌群结构与代谢能力。
内源性丙酸盐与外源性丙酸盐存在区别
内源性丙酸:指的是人体内部产生的丙酸,通常情况下,人体中的微生物能够在结肠中通过发酵未完全消化的碳水化合物来产生丙酸,这些丙酸对人体是有益的。
外源性丙酸:指的是从外部来源摄入的丙酸,比如通过食物摄入或作为补充剂。以及在一些药物中也可能含有丙酸盐。
★ 外源性丙酸盐摄入过多对代谢健康有害
但已经有各种研究表明,外源性地摄入和自体产生的丙酸作用并不一样,外来的丙酸对个体的许多代谢过程有不利影响。
哈佛大学公共卫生学院的研究人员完成了一项实验,发现从食品中摄入的丙酸在短期内会导致高血糖、胰岛素偏高,而且长期摄入将会造成肥胖和胰岛素抵抗等更严重的症状。
我们通过口腔摄入含丙酸添加剂的食物后,会激活我们的交感神经系统,并促使体内胰高血糖素和脂肪酸结合蛋白4等激素的升高。受到激素影响,肝糖原持续分解,血糖升高。身体开始分泌更多胰岛素进行代偿降低血糖浓度,最终导致胰岛素抵抗和肥胖产生。
这项研究表明,自身产生的丙酸和外界摄入的丙酸具有不同的功能,我们推测,这是因为从食物中摄入会极大地增加细胞和丙酸的接触,而细菌产生的仅仅只会局限在结肠部分。
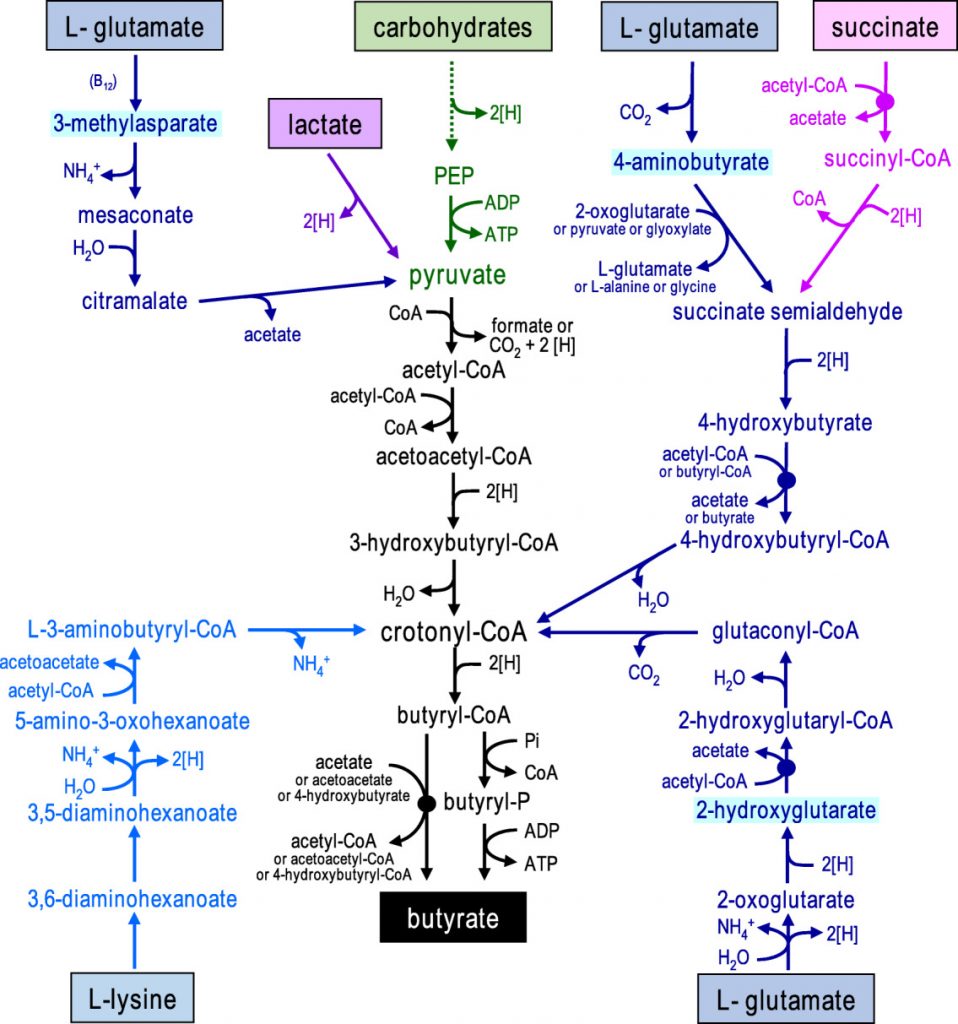
在人体肠道中,丁酸由膳食纤维经细菌发酵产生,通过两种代谢途径。在第一条途径中,丁酰辅酶A被磷酸化形成丁酰磷酸,并通过丁酸激酶转化为丁酸。在第二条途径中,丁酰辅酶A的辅酶A部分通过丁酰辅酶A:乙酸辅酶A转移酶转移到乙酸盐,从而形成丁酸和乙酰辅酶A。其中丁酰辅酶A:乙酸辅酶A转移酶途径占主导地位。
对人类粪便微生物群的放射性同位素分析也表明,肠道中的大多数丁酸盐是由碳水化合物通过Embden-Meyerhof-Parnas(糖酵解途径)由乙酰辅酶A产生的。
• 少量的丁酸盐也可由蛋白质合成
除了碳水化合物,少量的丁酸也可以通过谷氨酸、赖氨酸、戊二酸和γ-氨基丁酸途径由蛋白质合成。厚壁菌种也对氨基酸表现出高活性,特别是肠单胞菌(Intestinimonas AF211),它通过不同的途径将葡萄糖和赖氨酸发酵成丁酸。
形成丁酸盐的微生物途径
doi: 10.1111/1462-2920.13589.
碳水化合物通过糖酵解发酵为丙酮酸显示为绿色,从乙酰辅酶A形成丁酸盐显示为黑色,氨基酸发酵途径显示为蓝色(以中间体命名不同的谷氨酸途径),乳酸和琥珀酸发酵分别显示为紫色和粉色。
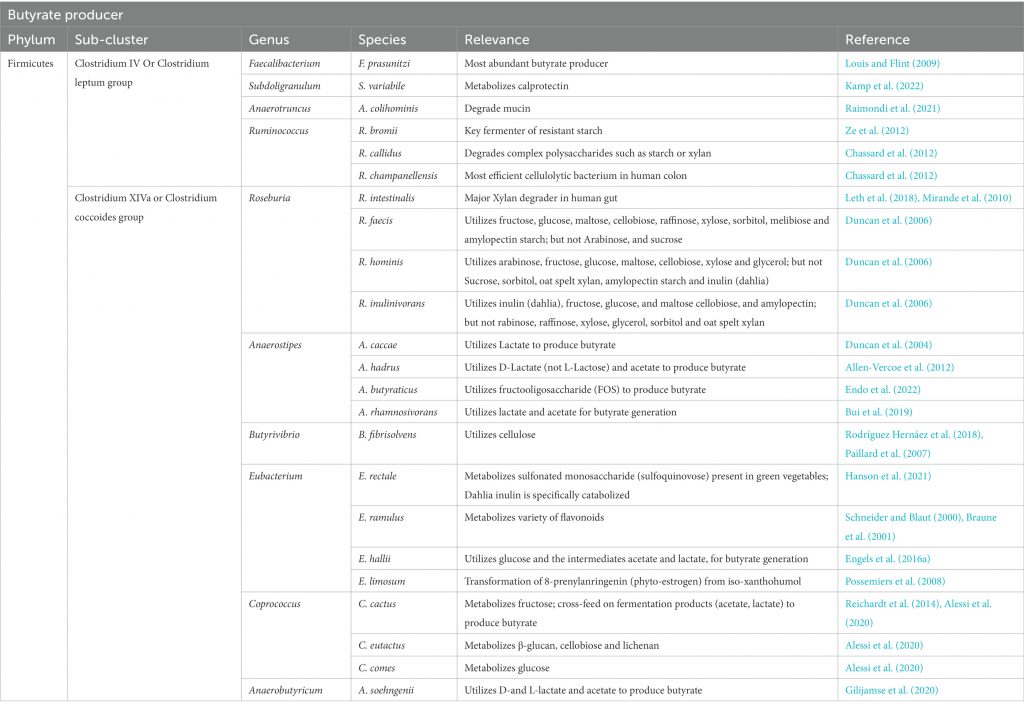
• 人结肠中的瘤胃球菌和毛螺菌是产丁酸的主力
除食源性丁酸,人体内丁酸主要是由盲肠和结肠的厌氧型细菌发酵产生,而由胃和小肠产生的丁酸含量极低。大肠产丁酸的菌种主要是梭菌属XIVa和IV族,以及真杆菌属和梭杆菌属
盲肠和结肠中丁酸的产生速度和数量主要取决于肠道微生物组成、日常膳食中可利用发酵成分组成等。在人的结肠中,厚壁菌门中的瘤胃球菌科(Ruminococcaceae)和毛螺菌科(Lachnospiraceae)这两个主要科,以及包括丹毒丝菌科(Erysipelotrichaceae)和梭菌科(Clostridiaceae)在内的其他厚壁菌门物种,都发现了丁酸生产菌种与非生产菌种的交替存在。
但应注意,许多人类结肠的主要厚壁菌门(例如Blautia spp.、Eubacterium eligens、Ruminococcus spp.)缺乏从碳水化合物中生成丁酸的能力。
产生丁酸盐的细菌被认为在生命的第一年内定植于宿主,并且在成年时占总细菌群落的20%以上。在消化道中发现的已知丁酸盐生产者中,大多数似乎属于毛螺菌科和瘤胃球菌科。我们将简要介绍两个丁酸生产菌。
▸ 普拉梭菌
普拉梭菌(Faecalibacterium prausnitzii)是健康人类微生物群中最丰富的菌种之一,也是主要的丁酸盐生产者之一。它通过丁酰辅酶A:乙酸辅酶A转移酶产生丁酸,并消耗乙酸。
虽然F.prausnitzii菌株是专性厌氧菌,但在核黄素(维生素B2)和还原性化合物(如半胱氨酸或谷胱甘肽)存在的情况下,低浓度氧气也能促进其生长。
氧气消耗会伴随丁酸形成的减少。F. prausnitzii分离株在利用食物多糖(如淀粉和半纤维素)生长方面能力有限,但一些菌株可以利用菊粉和果胶衍生物,并且普遍利用糖醛酸。
• 肠道炎症患者产生丁酸会减少
F. prausnitzii在炎症性肠病患者中很少见,尤其是克罗恩病,有证据表明它具有抗炎作用,因此引起了人们对其作为潜在治疗药物的兴趣。同样,据报道,Butyricicoccus pullicaecorum在炎症性肠病患者中较少见,并且也可能具有治疗潜力。
注:其他瘤胃球菌科细菌也能产生丁酸,但人们对大多数此类生物知之甚少。关于Faecalibacterium prausnitzii,详见:肠道核心菌属——普拉梭菌(F. Prausnitzii),预防炎症的下一代益生菌
▸ 毛螺菌科
直肠真杆菌(Eubacterium rectale)和密切相关的罗氏菌属(Roseburia)构成了产丁酸毛螺菌科的主要群体,它们具有相同的丁酰辅酶 A:乙酸辅酶 A 转移酶途径来生产丁酸,并且其丁酸合成基因的基因组组织也相同,从乙酰辅酶A到丁酰辅酶A。
• 罗氏菌属通过代谢饮食多糖产生丁酸
在某些Roseburia菌株中,特别是在弱酸性pH值下,丁酸几乎是唯一产生的发酵酸,乙酸的净消耗通常伴随着丁酸的形成。一些其他菌株和物种除了产生丁酸外,还产生甲酸和乳酸。基因组分析表明,该群体具有相当大的利用饮食来源的多糖的能力,包括淀粉、阿拉伯木聚糖和菊粉,不同菌株和物种之间的差异很大。
其他拥有丁酰辅酶A:乙酸辅酶A转移酶基因的毛螺菌科包括Eubacterium hallii、Anaerostipes hadrus、Coprococcus catus、与分离株SS3/4和M62/1有关的未鉴定物种。
• 一些毛螺菌科细菌利用乳酸和乙酸来产生丁酸
某些毛螺菌科能够在乳酸和乙酸盐存在下生长并产生丁酸,其总净化学计量为4mol乳酸和2mol乙酸盐产生3mol丁酸 。
这包括仅使用D-乳酸的物种Anaerostipes hadrus和能够利用两种乳酸异构体的E. hallii。
此外,双歧杆菌等常见益生菌配方中的微生物与丁酸盐生产者之间的交叉喂养相互作用已被证明是可以产丁酸盐的。
人体肠道中的主要丁酸生产者
doi: 10.3389/fmicb.2022.1103836.
▸ 增加丁酸盐生成的食物
饮食对人体微生物群有显著影响,通过饮食干预可显著改变细菌数量并增加微生物多样性。富含纤维的饮食对丁酸盐的产生特别有益,因为它可以滋养产生丁酸盐的细菌。
• 高纤维饮食能够有效增加丁酸盐的生成
蔬菜、水果、豆类和全谷物,它们含有膳食纤维,可被肠道细菌发酵成丁酸盐等有机化合物。通过食物增强微生物群是促进消化系统健康和丁酸盐生成的有效且安全的方法。因此,增加丁酸盐产量的最佳方法是通过高纤维饮食。
• 高脂、低纤维饮食不利于丁酸盐的生成
高蛋白、高脂肪、低碳水化合物的饮食已被证明会破坏微生物组中丁酸盐的产生。在一项研究中,研究人员分析了短期饮食限制碳水化合物摄入量的肥胖参与者的微生物组,从而限制了他们对植物性膳食纤维的消耗。
在低碳水化合物饮食(每天24克)和中等碳水化合物饮食(每天164克)4 周后,短链脂肪酸的浓度低于高碳水化合物饮食(每天399克)。具体来说,当碳水化合物摄入量减少时,丁酸盐浓度会降低。
同时还发现,厚壁菌门细菌Roseburia和E.Rectale的密度与丁酸盐浓度之间存在联系,两者都随着碳水化合物摄入量的减少而降低。
一些食源性物质产生短链脂肪酸的量
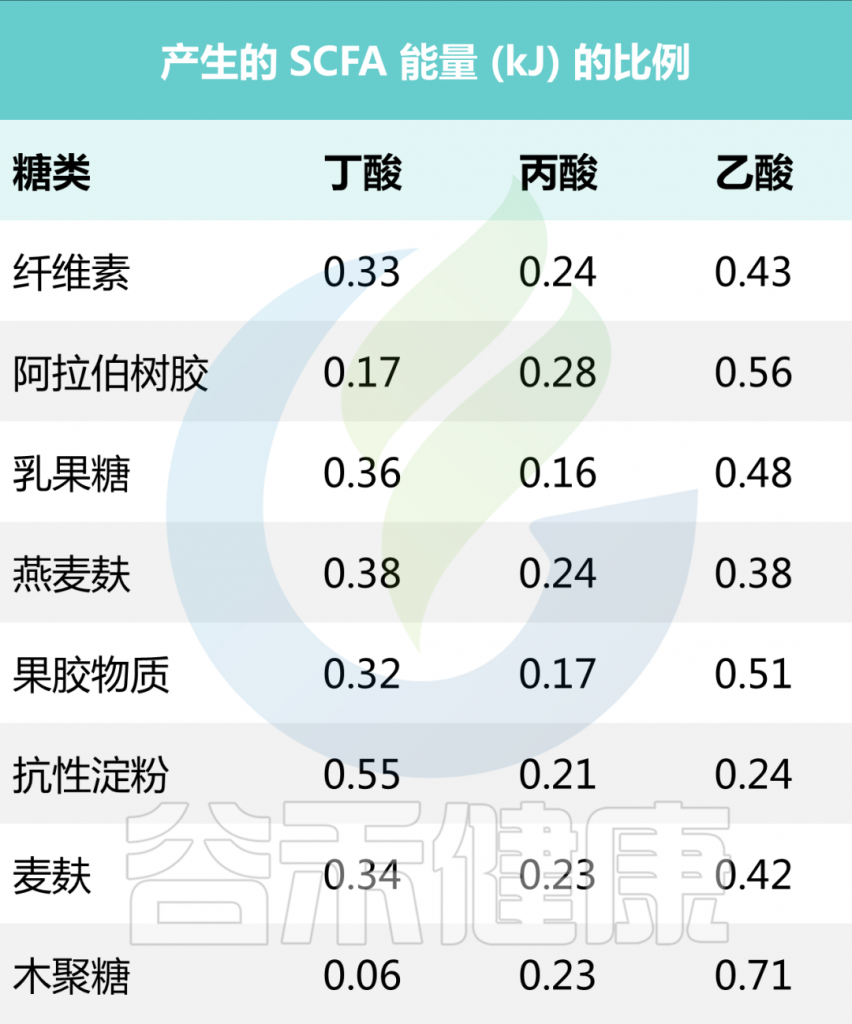
• 抗性淀粉
研究表明,从生马铃薯、高直链淀粉玉米和全谷物中提取的阿拉伯木聚糖中,含有高含量2型抗性淀粉的食物显著增加了丁酸盐的产量。
在174名健康年轻人的饮食中添加马铃薯抗性淀粉后,丁酸盐产量增加。玉米、菊苣和玉米中的抗性淀粉也进行了测试,但只有当食用土豆中的抗性淀粉时,粪便中的丁酸总量才会显著增加。
• 果聚糖(菊粉)
许多研究表明,菊粉可以增加短链脂肪酸的产量,包括丁酸盐。这可能解释了香蕉在溃疡性结肠炎和克罗恩病患者的饮食中如此有效的原因之一。然而,链长较短的果聚糖通常比链长的果聚糖(如菊粉)更容易喂养产丁酸菌。
也就说,抗性淀粉和果聚糖(短链低聚果糖和长链菊粉)在肠道中发酵时会产生丁酸盐。
富含抗性淀粉的食物:全麦面包、燕麦、大麦和糙米等全谷物;黑豆、红豆、绿豆等豆类;马铃薯、玉米、菊苣根、牛蒡根、魔芋根、亚麻籽。
富含果聚糖的食物:洋葱、菊苣、香蕉、朝鲜蓟、芦笋、大蒜、韭菜、西兰花、开心果。
需要注意的
由于人与人之间的常驻微生物存在显著差异,并且它们消化某些底物的能力不同,因此比较明智的选择是食用包含多种抗性淀粉和果聚糖的饮食。例如以马铃薯抗性淀粉、燕麦麸皮纤维或车前草种子或短链低聚半乳糖、长链低聚果糖和谷氨酰胺的混合物的形式短期补充,增加丁酸盐水平。
丁酸盐作为一种重要的的调节因子,是宿主-微生物串扰的关键介体。丁酸盐在体内可以通过脂肪酸氧化为机体供应能量,是肠道上皮细胞的主要供能物质。
丁酸盐还与机体健康密切相关,对调节肠道健康、修复肠道屏障、抑制炎症及癌症等病症意义重大。在养殖业中常添加丁酸盐保护动物健康生长,如预防断奶仔猪腹泻、调节鸡肠道菌群并增强其免疫力等。
▸ 为肠道细胞提供能量
丁酸盐是结肠细胞的主要能量来源,结肠细胞是构成肠道内壁的细胞。
与身体中使用糖(葡萄糖)作为主要能量来源的大多数其他细胞不同,肠道内壁细胞(结肠细胞)主要使用丁酸盐。如果没有丁酸盐,这些细胞就无法正确执行其功能。
• 丁酸盐为结肠细胞提供能量,细胞利于产丁酸盐细菌的生长
厚壁菌属的成员以产生丁酸盐而闻名,像Roseburia,Faecalibacterium prausnitzii,直肠真杆菌(E.rectale)等。
这种关系是相互的。丁酸盐为结肠细胞提供燃料,作为回报,这些细胞有助于提供一个无氧环境,有益的肠道微生物在其中茁壮成长。这可以控制炎症,保持肠道细胞健康,并使肠道细菌保持健康。
▸ 促进肠道运动
实验研究表明,丁酸盐通过作为短链脂肪酸受体的配体和激活剂,诱导肠道激素肽YY或介导肠嗜铬细胞释放5-羟色胺来促进肠道运动。
丁酸盐还可以通过上调Na+—H+交换器和诱导ATPase离子交换器基因来增强水和电解质的吸收。并且可能有益于预防某些类型的腹泻。
▸ 抗炎、抗癌特性
丁酸盐对肠道具有抗炎和抗癌功能。
肠道内壁会保持低水平的炎症,以防与微生物群接触的粘膜表面发生任何变化。低水平的炎症受到严格控制,但如果它被破坏,会导致氧化损伤,并可能在很长一段时间内导致癌症。
• 丁酸盐减少促炎细胞因子的产生
丁酸盐会阻止体内的一些促炎物质发挥作用。丁酸盐的抗炎作用可减少氧化应激并控制自由基造成的损害。
丁酸盐的抗炎特性,部分原因是其抑制核转录因子(NF-κB)的激活,通过下调NF-κB信号通路,丁酸盐可以调节促炎细胞因子的产生。
• 丁酸盐阻止结肠癌细胞的生长
丁酸盐也是一种组蛋白脱乙酰酶(HDAC)抑制剂。组蛋白脱乙酰酶是大多数癌症中产生的酶。因为丁酸盐是一种抑制剂,它实际上会改变基因表达,抑制细胞增殖,诱导细胞分化或凋亡。因此,它可以阻止癌细胞的发展。
有证据表明,结直肠癌(CRC)患者的微生物组图显示主要产丁酸菌属减少,包括罗氏菌属(Roseburia)、Clostridiales、Faecalibacterium和Lachnospiraceae科成员,而使用产丁酸的丁酸梭菌可有效减少癌细胞增殖并增强癌细胞凋亡。
▸ 修复肠道屏障,防止肠漏
肠上皮细胞的屏障功能是重要的第一道防线,确保上皮层具有适当的通透性。研究发现丁酸盐能够修复和增强肠上皮细胞的屏障功能。
• 丁酸盐上调粘蛋白的表达,增强粘液屏障
最新研究表明,丁酸对肠屏障功能具有保护作用。例如,丁酸能够上调粘蛋白2(MUC2)的表达。粘蛋白2是肠粘膜表面主要的粘蛋白,可增强粘膜层,从而限制有害物质通过肠道。
• 丁酸盐对肠道屏障的影响可能具有浓度依赖性
此外,丁酸还能增加三叶因子(TFF)的表达,这是一种粘蛋白相关肽,有助于维持和修复肠粘膜。丁酸还调节紧密连接蛋白的表达,以降低细胞旁通透性。其中一种机制是通过激活单分子层中的AMP活化蛋白激酶。
体外模型研究表明,丁酸对肠道屏障功能的影响可能具有浓度依赖性。丁酸在低浓度(≤2 mM)时可促进肠道屏障功能,但在高浓度(5或8 mM)时可能通过诱导细胞凋亡来破坏肠道屏障功能。
根据哺乳动物胃肠道中的生理浓度,目前体外模型中推荐使用的丁酸浓度为0-8mM。然而,考虑到大多数丁酸在结肠上皮中被代谢为能量底物,体内和体外模型中治疗剂量可能存在差异。
▸ 抗氧化能力
说起抗氧化,我们先了解一下自由基。它基本上是体内化学反应产生的废物。另一方面,抗氧化剂是身体抵御它们的防御措施。大量自由基会造成损害并压倒身体的修复系统。我们称之为氧化应激。氧化应激被认为是导致衰老和疾病的一个重要因素。
• 丁酸盐增加谷胱甘肽,可以中和自由基
结肠或大肠是身体产生的废物的储存容器。较高的丁酸盐水平已被证明会增加谷胱甘肽的水平,谷胱甘肽是一种在人体细胞中产生的抗氧化剂,可以中和肠道中的自由基(自由基与炎症和许多疾病有关),从而起到抗氧化作用。
▸ 调节肠道免疫
• 维持厌氧环境,阻止有害菌生长
丁酸通过增强结肠细胞的氧消耗和稳定缺氧诱导因子(HIF)来维持结肠内的厌氧环境,而丁酸的缺失则会促进潜在有害细菌和分子的积聚,例如沙门氏菌、大肠杆菌和一氧化氮(NO)。
肠道中丁酸水平降低,这促进了肠道上皮氧合和鼠伤寒沙门氏菌(S.Typhimurium)的生长,鼠伤寒沙门氏菌是食源性肠道炎症和腹泻的已知病因。
• 影响免疫细胞迁移、粘附
除了营造无氧环境外,短链脂肪酸,尤其是丁酸盐,还可以作为免疫细胞趋化和粘附的调节剂。丁酸可以调节肠上皮细胞介导的中性粒细胞向炎症部位的迁移,并且这种作用是浓度依赖性的。
此外,丁酸在细胞增殖和凋亡中发挥作用。丁酸刺激细胞生长和DNA合成,并诱导细胞周期G1期的生长停滞。虽然低浓度的丁酸会增强细胞增殖,但高浓度的丁酸会诱导细胞凋亡。
丁酸盐等短链脂肪酸可以在先天反应过程中通过影响巨噬细胞和粒细胞以及树突状细胞的抗原呈递发生,也可能在适应性免疫反应过程中通过影响T细胞和B细胞功能发生。
短链脂肪酸的免疫调节作用
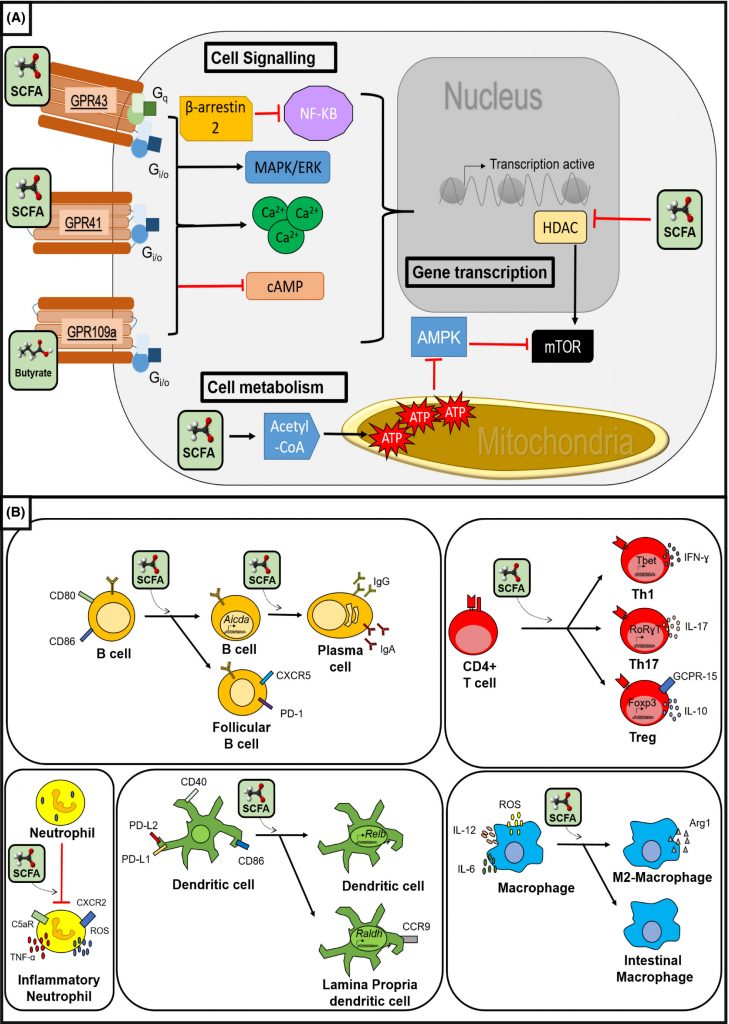
doi: 10.1111/apt.14689.
▸ 影响代谢健康
• 对肥胖存在一定影响,但还不能完全确定
包括丁酸盐在内的短链脂肪酸可通过激活肠细胞内的FFAR来降低食欲和体重。这促进胰高血糖素样肽1(GLP-1)和肽YY的释放,前者促进胰岛素分泌并抑制胰高血糖素分泌,后者降低食欲并减缓胃排空。
短链脂肪酸还能减少所谓的“饥饿激素”——胃促生长素(ghrelin)的分泌;FFAR2存在于ghrelin分泌细胞上,包括丁酸盐和丙酸盐在内的FFAR2激动剂可减少ghrelin分泌。
丁酸盐影响脂质代谢的机制
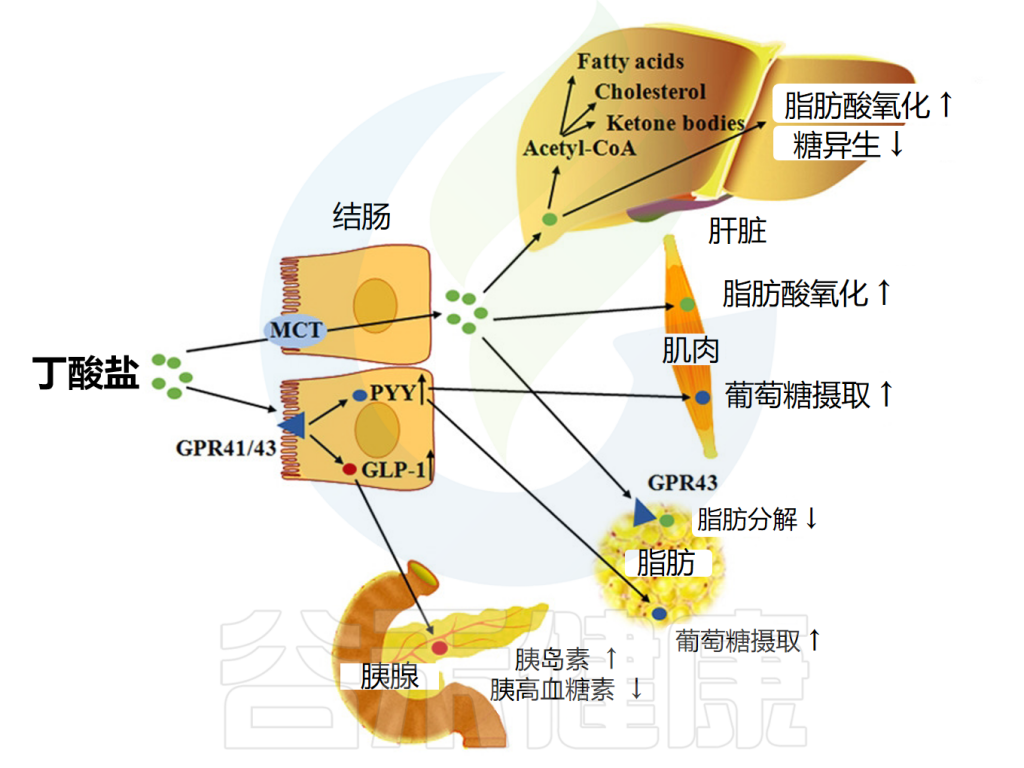
doi: 10.1093/advances/nmx009.
也有证据表明短链脂肪酸作用于交感神经系统,交感神经节中FFAR3的激活导致能量消耗增加。
然而,与丙酸盐一样,关于丁酸盐对食物摄入的影响,有相互矛盾的结果报道。
• 丁酸盐对控制血糖水平可能有潜在好处
研究发现,糖尿病患者和糖尿病前期受试者中丁酸盐水平降低。
丁酸在肠内分泌细胞(EEC)中与游离脂肪酸受体(FFAR)FFAR2和FFAR3结合,调节肠道激素释放,如胰高血糖素样肽1(GLP-1)和肽YY(PYY)。
丁酸盐通过多种途径影响糖代谢的调节
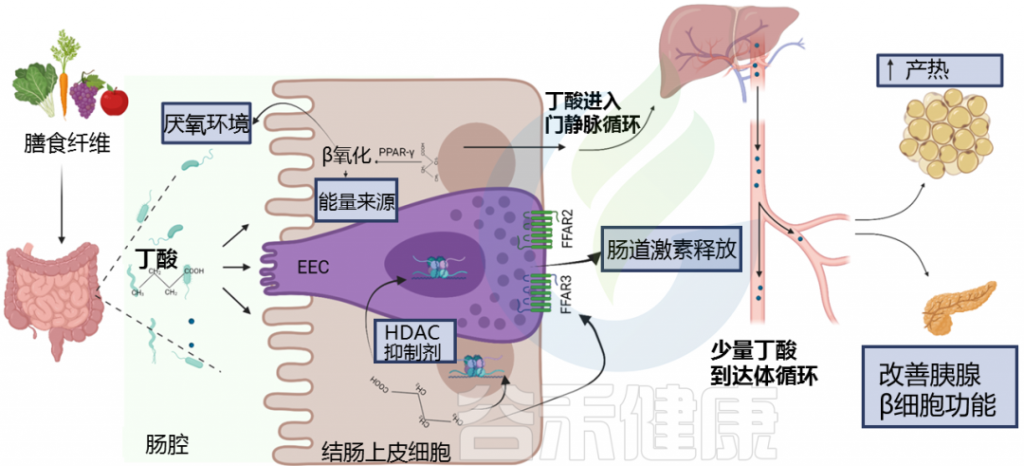
doi: 10.3389/fendo.2021.761834.
这些激素共同作用以保持血糖水平稳定。当血糖过高时,胰岛素会告诉身体的肌肉和脂肪细胞吸收多余的葡萄糖,所以说这些激素对肥胖和糖尿病很重要。丁酸盐增加这些肠道激素的释放,表明对控制血糖水平和防止体重增加有潜在的好处。
!
丁酸盐过低可能会导致以下危害:
•肠道屏障功能受损:丁酸盐有助于维持结肠的“生理性缺氧”,并提供能量给结肠细胞,有助于维持肠道稳态。丁酸盐的减少可能导致肠道屏障功能受损。
•增加慢性疾病风险:变形菌门的兼性厌氧细菌的扩张几乎总是伴随着产丁酸盐细菌丰度的减少,并与许多慢性疾病有关,包括炎症性肠病、肠易激综合症、结直肠癌、2型糖尿病、肥胖等。
•神经炎症:丁酸盐具有抗炎特性,对大脑健康具有重要意义。丁酸盐过低可能导致炎症增加,影响大脑健康。
•睡眠问题:丁酸盐可能作为细菌源性促睡眠信号,丁酸盐过低可能影响睡眠,导致睡眠问题。
•肠道菌群失衡:丁酸盐过低可能导致肠道菌群失衡,因为变形菌门的扩张伴随着产丁酸盐细菌的减少。
•不利于肠道损伤修复:在轻微炎症或轻度溃疡部位添加丁酸盐可以促进肠道损伤的修复,而丁酸盐过少可能不利于溃疡的恢复。
!
丁酸盐并不总是越多越好,低浓度丁酸促进细胞增殖和生长,高浓度丁酸反而抑制细胞增殖和生长,增加肠道的通透性。
• 不同部位对丁酸盐的耐受阈值存在差异
胃肠道不同部位对丁酸盐的耐受阈值也存在一定差异,胃和小肠对丁酸的耐受阈值低,结肠和盲肠耐受阈值高。
添加普通丁酸钠制剂(主要在肠道前端被吸收利用),反而造成肠道炎症、菌群失调。
• 肠道严重溃疡时丁酸盐可能加剧症状
更有意思的是,轻微炎症或者轻度溃疡部位添加丁酸盐可以促进肠道损伤的修复,在严重溃疡肠道部位添加,不利于溃疡的恢复,甚至加剧整个溃疡。
有学者发现溃疡部位的粘膜组织对丁酸的代谢降低,甚至只有正常粘膜组织的一半,主要是由于其转运载体和氧化相关的酶活降低。
主要参考文献
Louis P, Flint HJ. Formation of propionate and butyrate by the human colonic microbiota. Environ Microbiol. 2017 Jan;19(1):29-41.
Gill PA, van Zelm MC, Muir JG, Gibson PR. Review article: short chain fatty acids as potential therapeutic agents in human gastrointestinal and inflammatory disorders. Aliment Pharmacol Ther. 2018 Jul;48(1):15-34.
Hosseini E, Grootaert C, Verstraete W, Van de Wiele T. Propionate as a health-promoting microbial metabolite in the human gut. Nutr Rev. 2011 May;69(5):245-58.
Arora T, Tremaroli V. Therapeutic Potential of Butyrate for Treatment of Type 2 Diabetes. Front Endocrinol (Lausanne). 2021 Oct 19;12:761834.
Singh V, Lee G, Son H, Koh H, Kim ES, Unno T, Shin JH. Butyrate producers, “The Sentinel of Gut”: Their intestinal significance with and beyond butyrate, and prospective use as microbial therapeutics. Front Microbiol. 2023 Jan 12;13:1103836.
Gonzalez-Garcia, R.A.; McCubbin, T.; Navone, L.; Stowers, C.; Nielsen, L.K.; Marcellin, E. Microbial Propionic Acid Production. Fermentation 2017, 3, 21.
Reichardt N, Duncan SH, Young P, Belenguer A, McWilliam Leitch C, Scott KP, Flint HJ, Louis P. Phylogenetic distribution of three pathways for propionate production within the human gut microbiota. ISME J. 2014 Jun;8(6):1323-35.
Liu H, Wang J, He T, Becker S, Zhang G, Li D, Ma X. Butyrate: A Double-Edged Sword for Health? Adv Nutr. 2018 Jan 1;9(1):21-29.

谷禾健康

拟杆菌门细菌是革兰氏阴性菌的代表,具有外膜、肽聚糖层和细胞质膜。它们无氧呼吸的主要副产物是乙酸、异戊酸和琥珀酸。是最耐氧的厌氧菌之一。
参与人体结肠中许多重要的代谢活动包括碳水化合物的发酵、含氮物质的利用以及胆汁酸和其他类固醇的生物转化。大多数肠道细菌是糖酵解的,这意味着它们通过碳水化合物分子的水解获得碳和能量。
多糖而不是单糖是拟杆菌的主要能量来源,拟杆菌是肠道生态系统中非常成功的竞争者,表现出相当大的营养灵活性和对宿主和肠道环境施加的压力做出反应的能力。
很难说肠道拟杆菌是否对宿主产生负面或正面影响。拟杆菌能够通过预防可能定植和感染肠道的潜在病原体感染来使宿主受益。但是,拟杆菌衍生的代谢物——羧酸和单糖也可能对宿主产生损害。例如,肠出血性大肠杆菌(EHEC) 通过感觉拟杆菌属作为标志性生物体,沿着胃肠道寻找感染生态位。
特别是,对拟杆菌衍生的琥珀酸和岩藻糖的检测会启动转录级联,导致肠出血性大肠杆菌代谢的转录重编程和毒力因子的诱导。
在发炎的肠道中,拟杆菌衍生的短链脂肪酸(SCFA)不再发挥保护功能,而是可能被兼性厌氧病原体利用作为无氧呼吸的碳源。类似的,在抗生素引起的生态失调时,通过拟杆菌属的代谢活动从复杂多糖中释放出琥珀酸和单糖,交叉喂养肠杆菌和艰难梭菌。
本文再次聚焦拟杆菌门,拟杆菌属,及其代表菌种多形拟杆菌(B.thetaiotaomicron),以多形拟杆菌讲述了一个基于动态环境下共生菌群或菌种与其他菌互作及其生存进化的复杂故事范例。请注意拟杆菌,不仅交叉喂养病原体,而且在健康的肠道环境中交叉喂养益生菌物种,这有助于抵抗定植。
“
拟杆菌属细菌属于人类肠道微生物群中最普遍和最丰富的成员。虽然偶尔充当肠道外的病原体,但这些细菌被认为是结肠腔和粘膜层的共生定殖者,并且长期以来已知可提供针对肠道病原体的定殖抵抗力。然而,基于粪便微生物组学的相关性研究经常会得出关于它们对宿主健康与疾病的贡献相互矛盾的结果,尤其在肠道感染中的作用比预期的更加微妙。
我们结合谷禾大量检测实践,越来越认识到拟杆菌介导的定植抗性背后的复制和矛盾性,以及不同肠道病原体利用它们来建立感染的可能性。
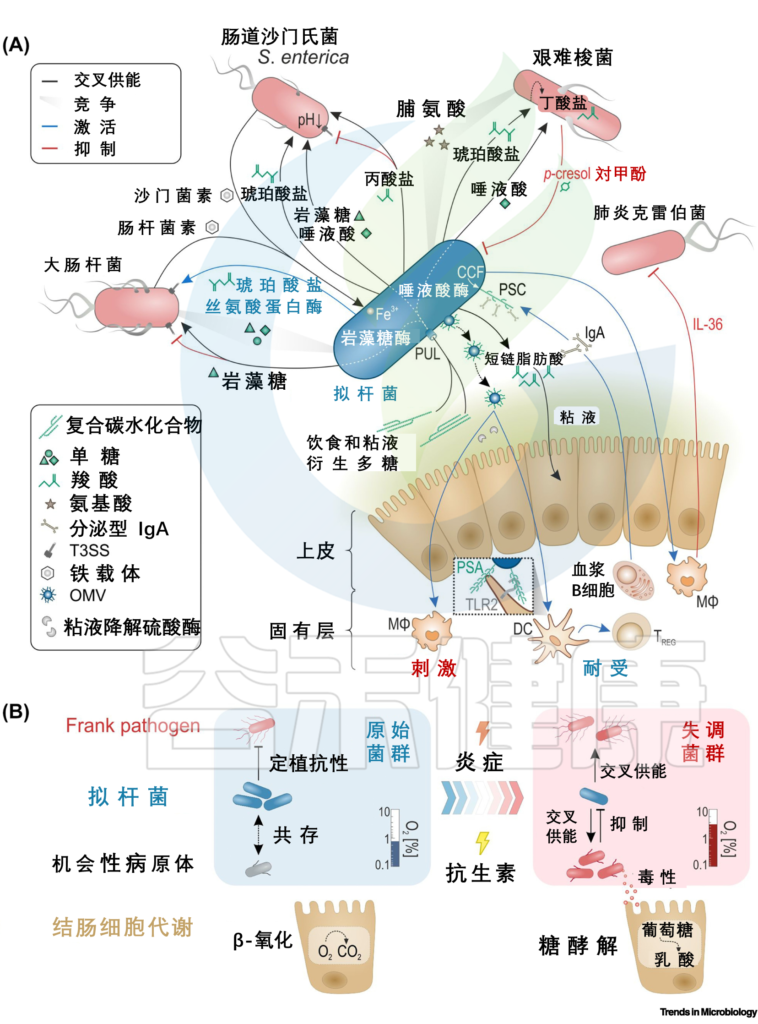
DOI: 10.1016/j.tim.2021.11.009
A) 互利拟杆菌属的相互作用。与肠粘膜以及与直接病原体肠出血性大肠杆菌(EHEC)和鼠伤寒沙门氏菌以及机会性病原体艰难梭菌和肺炎克雷伯菌有关。根据最近的文献汇编。肠道拟杆菌属也可能相互影响,例如,通过分泌的抗菌蛋白或通过某种“共享物”。
(B)通过病原体诱导(炎症)或治疗诱导(抗生素)破坏微生物群滋养免疫力,从原始微生物群向生态失调转变的简单化观点。
结肠细胞线粒体中的β-氧化会消耗氧气,造成管腔厌氧,而糖酵解则不消耗氧气,从而导致上皮氧合增加。拟杆菌属,不仅交叉喂养病原体,还在健康的肠道环境中交叉喂养益生菌物种,这有助于抵抗定植。
“
多形拟杆菌(Bacteroides thetaiotaomicron,B. thetaiotaomicron)是成人肠道的主要组成部分,已被用作研究人类细菌共生的有用模型。
降解植物多糖
它对人类的代谢不可忽缺功能是降解植物多糖,这是人类肠道非常重要的能力。此外,在产后母乳和富含植物淀粉的饮食之间的过渡过程中,这一点也有非常重要。
由于多形拟杆菌感应潘氏细胞发出微生物信号,它可以刺激肠道内的血管生成(从现有血管中生长出新血管)。B. thetaiotaomicron 通过为其他微生物帮助处理的营养物质提供足够的吸收能力来使其宿主受益。
塑造肠道粘膜屏障
多形拟杆菌介导的肠道内另一个出生后发育过程是肠粘膜屏障的形成,它通过调节物种特异性蛋白质抗生素的表达来帮助保护宿主免受病原体入侵。B. thetaiotaomicron 中存在的环境感知“调节装置”允许适应性食物寻找,从而稳定食物网,进而有利于群落的稳定和长寿。这种适应性“觅食”的能力是生物技术感兴趣的领域。
有异常大的“糖生物组”
多形拟杆菌是人类肠道远端的厌氧共生体,具有异常大的糖生物组,参与多糖获取和代谢的基因库。当膳食多糖受到限制时,这种糖生物组使 B. thetaiotaomicron 能够转向宿主多糖。B. thetaiotaomicron 不仅可以水解宿主衍生的聚糖,还可以主动确定肠道上皮细胞产生的聚糖的类型。
促进微生态系统稳定
B. thetaiotaomicron 诱导宿主衍生的聚糖可能具有适应性功能,为自身创造一个其他亲糖生物可以利用的生态位,从而促进生态系统的稳定性和功能多样性。这些独特的特征促使 B. thetaiotaomicron 被定性为关键物种。
B. thetaiotaomicron 可能稳定微生物生态以实现健康的宿主-微生物群关系的另一种机制涉及其能够诱导抗菌肽血管生成素,从而杀死机会性或致病性生物体,与此同时不能杀死 B. thetaiotaomicron 或其他共生体。
抵抗炎症变化
此外,B. thetaiotaomicron 通过过氧化物酶体增殖物激活受体-γ (PPARγ) 依赖性核因子-κB 亚基 p65 的核输出来抑制促炎基因的转录,从而潜在地抵抗可能破坏共生微生物群稳定的炎症变化。
例如,细胞毒性 T 淋巴细胞蛋白 4 (CTLA4) 阻断免疫疗法依赖于特定拟杆菌属物种(多形拟杆菌和脆弱拟杆菌)。这些结果表明,深入了解对拟杆菌类群的肠道微生物群特定成员的免疫反应,可能有助于为癌症治疗奠定基础。
“
根据微生物群滋养免疫概念,宿主应用栖息地过滤器来主动塑造其微生物群并维持互利共生状态。其中一种栖息地过滤器是上皮缺氧(关于这个详细的介绍我们在氧气与肠道共生菌那篇文章里讲过,详见:肠道漏氧会发生什么,健康的肠道是什么样?),这是成熟结肠细胞中线粒体β-氧化的结果。
粘膜表面的低氧浓度促进了专性厌氧细菌(包括拟杆菌属和一些产丁酸菌)的优势。反过来,这些细菌积极调节其肠道环境并影响宿主生理(例如,负责的免疫调节分子至少部分地通过外膜囊泡细菌表面衍生的双层球体,可以通过粘液屏障扩散)递送至真核靶细胞。
确保“正确的微生物”做“正确的事”
宿主栖息地过滤器不仅确保“正确”的微生物保留在肠道中,而且还确保它们做“正确的事情”。例如,血浆 B 细胞产生针对具有促炎潜力的拟杆菌表面结构的免疫球蛋白(主要是 IgA) ;这些免疫球蛋白减轻粘膜炎症,维持细菌分类群的多样性(关于IgA调节菌群多样性和菌定植的详细介绍可以参考我们以前的文章,详见对抗病原菌,帮助共生菌定植的“重要开关”),并调节拟杆菌代谢。
有趣的是,最近的发现表明某些拟杆菌属,增选 IgA 反应。例如,脆弱拟杆菌有意表达 IgA 反应性表面多糖C,使其被抗体修饰,从而改善粘液粘附,使细菌能够进入确定的空间生态位并促进与宿主的长期共生。
“
枢纽
拟杆菌属对宿主生态位的抢占、免疫系统的教育以及“益生菌”细菌的交叉喂养提供了针对病原入侵者的定植抵抗力。此外,拟杆菌与病原体竞争宿主来源的氨基酸(特别是脯氨酸和羟脯氨酸)和单糖(包括核糖、岩藻糖、阿拉伯糖、鼠李糖和果糖)并产生短链脂肪酸(SCFA),可以直接对抗发病机制。
从机制上讲,后者最好是丙酸盐,其质子化形式扩散到肠沙门氏菌(可能还有其他肠杆菌科)中,酸化受体的细胞质并减缓生长。此外,肠道拟杆菌属产生共生定植因子(CCF),即物种特异性碳水化合物利用系统,以强化肠道免疫屏障,保护宿主免受肺炎克雷伯菌定植和传播。
然而,拟杆菌衍生的代谢物——羧酸和单糖也可能对宿主产生损害。例如,肠出血性大肠杆菌(EHEC) 通过感觉拟杆菌属作为标志性生物体,沿着胃肠道寻找感染生态位。
特别是,对拟杆菌衍生的琥珀酸和岩藻糖的检测会启动转录级联,导致肠出血性大肠杆菌代谢的转录重编程和毒力因子的诱导。
肠出血性大肠杆菌(EHEC) 和其他病原体分泌的效应蛋白引起上皮炎症,在此过程中结肠细胞的能量代谢从β-氧化转向无氧糖酵解。这破坏了宿主栖息地过滤器,并开辟了新的生态位,这些生态位优先由肠杆菌科成员填充。
在发炎的肠道中,拟杆菌衍生的短链脂肪酸(SCFA)不再发挥保护功能,而是可能被兼性厌氧病原体利用作为无氧呼吸的碳源。类似的,在抗生素引起的生态失调时,通过拟杆菌属的代谢活动从复杂多糖中释放出琥珀酸和单糖,交叉喂养肠杆菌和艰难梭菌。
反过来,艰难梭菌释放抑菌化合物来抑制革兰氏阴性竞争者(包括拟杆菌属)的生长。然而,拟杆菌属已经进化出适应与肠道发炎、菌群失调相关的新环境的机制。例如,多形拟杆菌,利用其“异铁载体利用系统”(由xusABC_操纵子编码)来劫持沙门氏菌和大肠杆菌。大肠杆菌铁螯合剂,使其在结肠炎期间能够接触到这种必需的辅助因子。
拟杆菌属对于肠道感染来说是一把双刃剑
在提供针对病原体入侵的初始定植抵抗力的同时,它们可以被相同的病原体利用作为炎症和抗生素治疗期间的“利基”指标和资源提供者。
截至目前,我们还不完全了解除了感染剂量之外还有哪些因素会导致这些接触的结果对宿主有利或有害,但随着微生物分子组学发展包括转录组学领域的最新进展可能会成为这个任务中的改变者。
“
以多形拟杆菌为例,因为多形拟杆菌是研究最广泛的人类肠道共生体之一。2001有研究就使用与多形拟杆菌单一关联的无菌小鼠,并通过DNA 微阵列分析全局宿主转录反应。发现多形拟杆菌定植后上调的宿主基因包括:
这些基因共同证明共生细菌可以帮助强化宿主上皮屏障。受与多形拟杆菌单关联影响的其他宿主基因涉及出生后成熟(腺苷脱氨酶)、营养吸收和代谢(SGLT-1、辅脂肪酶和 L-FABP)以及血管生成处理(血管生成素-3)的调节。这项研究证明了单一物种的共生生物如何恢复以前无菌宿主的许多结构、代谢和发育缺陷。
随着B. thetaiotaomicron基因组被测序了解后,人们对驱动这种共生关系的分子机制有了更深入的了解。B. thetaiotaomicron含有 4,779 个成员的蛋白质组,缺乏与已知粘附素同源的蛋白质。然而,它已经进化出两种外膜多糖结合蛋白(SusC和SusD)的163个旁系同源物、226个预测的糖苷水解酶和15个多糖裂解酶。
B.thetaiotaomicron的全基因组转录分析揭示,与在由基本培养基组成的肉汤中生长相比,当把B.thetaiotaomicron引入无菌小鼠肠道时,B.thetaiotaomicron表达不同的碳水化合物和葡萄糖(MM-G)利用基因。
通过比较采用标准富含多糖的食物饮食或缺乏可发酵多糖的简单糖饮食的无菌小鼠的细菌基因表达,发现富含多糖的饮食诱导了碳水化合物利用基因(如木聚糖酶、阿拉伯糖苷酶和果胶酸裂合酶)的上调,而仅葡萄糖和蔗糖饮食则导致参与从粘液聚糖中回收碳水化合物的不同基因子集的表达增加,如己糖胺酶、α-岩藻糖苷酶和唾液酸酶。这些基因还可以介导细菌附着于粘液聚糖,以避免细菌从肠道中流失。
在荚膜多糖合成(CPS)位点中发现了体外与体内生长期间以及饮食控制过程中另一个值得注意的基因表达变化,这表明B. thetaiotaomicron能够改变其表面碳水化合物,作为宿主免疫逃避策略改变聚糖觅食行为。
B. thetaiotaomicron讲述了一个基于营养代谢的宿主-细菌互利共生的复杂故事范例。具有从宿主无法消化的营养物质回收能量的能力为细菌维持在宿主肠道中的驻留提供了进化驱动力。尽管缺乏粘附细胞器,B. thetaiotaomicron可以通过其外膜聚糖结合蛋白的全部介导将自身附着到营养支架(食物颗粒、粘液层和脱落的上皮细胞 )上。
由于其灵活的聚糖觅食能力,当膳食多糖变得稀缺时,B.thetaiotamicron通过转向宿主多糖来赋予肠道生态系统稳定性。这种非常成功的人类肠道共生体已经进化出一个复杂而庞大的基因组,可以针对不断变化的营养环境调动功能多样的适应性反应,从而保证与宿主的永久和互惠关系。
“
铁是许多生物体和细胞的必需营养素和生长限制元素,同时也是促炎剂。在人体内,大多数铁与原卟啉 IX (PPIX) (PPIX) 形成亚铁或三价铁络合物,此处简称为“血红素”,它在 O2和电子的运输和存储中发挥着多种作用,并且在催化作用中。
在检测到入侵病原体后,作为人类和动物先天免疫反应的一部分,促生长铁以血红素和非血红素形式被螯合。因此,环境微生物和病原微生物,包括经过充分研究的假单胞菌属、卟啉单胞菌属和葡萄球菌属成员,都进化出了多种机制来释放和同化血红素和非血红素铁的不同化学物质。
虽然许多兼性病原体大量产生和消耗血红素铁,但大多数胃肠道厌氧菌是血红素营养缺陷型微生物。拟杆菌是许多健康胃肠道菌群中的优势细菌群。其中B. thetaiotaomicron是一种共生血红素营养缺陷型,是该群体的代表,该菌优先使用并最终以血红素形式超积累铁,但是似乎不会从添加非血红素铁中获得进一步的生长益处。
胃肠道微生物组可能拥有足够的铁储备,足以替代人类几天的典型营养铁需求,构成大量的铁储存库和潜在的贫血缓冲剂。生物信息学分析表明,hmu操纵子编码拟杆菌门成员中血红素摄取和代谢的厌氧机制,在拟杆菌门中广泛存在,但仅限于拟杆菌门。
来自该操纵子的基因同样广泛存在于从健康人类收集的宏基因组样本中。因此,我们预计拟杆菌,特别是hmu介导的血红素代谢将构成代表微生物组和宿主从宿主饮食血红素中调动铁的主要机制。这种机制必须是稳健的,因为粪便中检测到的血红素通常归因于宿主衍生的潜血,可以诊断下消化道出血 。
营养研究表明,与典型的植物源性非血红素铁复合物相比,血红素是人类膳食铁的生物利用度更高的来源;然而,即使是血红素铁也不能被宿主完全吸收,这表明它必须与微生物组共享。
拟杆菌门对血红素的优先使用可能使它们在胃肠道环境中具有选择性优势。血红素促进拟杆菌的强劲生长。由于血红素依赖性富马酸还原酶增强了富马酸向琥珀酸的转化,从而发酵葡萄糖。反过来,相对于另一个优势门厚壁菌门的成员,复含血红素密集红肉的宿主饮食与结肠微生物组中更大比例的拟杆菌门相关。
拟杆菌密集的微生物群和红肉饮食都与结肠癌的诱发有关。目前尚不清楚这些宿主病理是否与血红素或卟啉本身的促炎特性有关,它们是否是由微生物组中受血红素刺激的部分的其他代谢活动引起的,还是两者的某种组合。
简而言之,拟杆菌门在共生环境中优先积累血红素,而不是直接促进发病机制,反而可能导致物种失衡(生态失调)以及随后对宿主生态系统的生化破坏。
这些例子说明了肠道病原菌和拟杆菌属之间从稳态到病理学之间复杂的种间相互作用。这也是谷禾健康不断积累和迭代不同人群样本库,以及长期纵向追踪不同人群疾病发生或症状改善以及与微生物群的潜在因果关系的价值所在。通过研究更大、更多样化的人群,检查不同疾病甚至同一疾病亚型内的微生物群组成,我们可以更全面、更准确地了解微生物群反馈及其对健康的影响。
分析肠道微生物群不仅仅涉及检测单个细菌种类或属。确定每种细菌的正常阈值需要全面了解大样本全局微生物群落以及种间互作等。
附录:
以下为本门当中比较著名的种属及其所属的纲目
主要参考文献:
Bornet E, Westermann AJ. The ambivalent role of Bacteroides in enteric infections. Trends Microbiol. 2022 Feb;30(2), pp.104-108.
A gut commensal-produced metabolite mediates colonization resistance to Salmonella infection. Cell Host Microbe, 24 (2018), pp. 296-307 e7
Commensal Bacteroidetes protect against Klebsiella pneumoniae colonization and transmission through IL-36 signalling. Nat. Microbiol., 5 (2020), pp. 304-313
Microbiota-liberated host sugars facilitate post-antibiotic expansion of enteric pathogens. Nature, 502 (2013), pp. 96-99
谷禾健康
Phascolarctobacterium,考拉杆菌属,专性厌氧和革兰氏阴性细菌,可产生短链脂肪酸,包括乙酸盐和丙酸盐,并可能与宿主的代谢状态和情绪有关,在人体胃肠道大量定植。
每个人都有可能具有与其他人不同的个体特异性微生物遗传成分,并且可能从童年到成年持续存在。Phascolarctobacterium属物种在较长的时间内显示出相对较高的个体内稳定性。一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少)。
来自梅奥临床医学中心的研究人员研究发现比较容易减肥的人体肠道内考拉杆菌属水平较高。该菌除了减肥同时也是肠道菌群动态平衡的关键调节因素。
Phascolarctobacterium 多形棒状杆菌,0.5 × 2.0 µm 至 0.5 × 5 –20 µm。在琥珀酸的存在下,小棒会变成带有多个分支的细长和碎片状的棒。革兰氏染色阴性、不运动、不形成孢子的化学有机营养物。丙酸是琥珀酸发酵的主要终产物。富马酸盐抑制其生长。在 30–37°C 时生长最快。
系统发育上属于韦荣菌科,厚壁菌门。到目前为止, Succiniclasticum ruminis是最近的系统发育邻居。
DNA G + C 含量(mol %):41.4–42.3 ( Tm )
主要存在于人体肠道内,我们根据谷禾数据库认为其是基石核心菌。
目前报告的3个物种如下:
Phascolarctobacterium faecium
Phascolarctobacterium succinatutens
Phascolarctobacterium wakonense
其中,Phascolarctobacterium faecium (P. faecium)最早是从以有毒桉树叶为食的动物考拉中分离出来的,它可能与肠道菌群的解毒有关。因此,P. faecium可能在人体胃肠道中发挥有益作用。该菌种是一种专性厌氧和革兰氏阴性细菌,不形成孢子、不运动、分解酶,属于厚壁菌门。
它在普通琼脂上生长不良,但在培养基中添加琥珀酸盐可促进其生长。表明其利用生长需要琥珀酸。
虽然在人类胃肠道的样本中经常检测到与P. faecium密切相关的未培养菌落,但文献中尚未描述从人类胃肠道中分离出Phascolarctobacterium和扩大培养物,从而限制了Phascolarctobacterium faecium相关的功能研究和临床应用。
Phascolarctobacterium wakonense从普通狨猴 (Callithrixjacchus) 粪便中分离出,他们不仅利用了琥珀酸,还利用了丙酮酸。补充丙酮酸后,他们同时产生丙酸和乙酸,而琥珀酸仅产生丙酸。
肠道菌群的遗传特异性可用来做宿主的“微生物指纹”。
研究发现人体肠道菌群的遗传特征比其相对丰度更具有个体特异性。其中Phascolarctobacterium succinatutens 的鉴别准确率达到了88%。
饮食模式
一项调查中国南方1-80 岁健康个体研究发现,随着年龄的增长(1至60岁),该菌数量逐渐增加,维持在高水平,但随着年龄继续增加,老年人(> 60岁)的其数量反而减少。作者指出这种现象可能与饮食习惯有关。
考拉杆菌属专注于利用其他细菌产生的琥珀酸盐,同时,琥珀酸的主要生产者拟杆菌属和副拟杆菌属的丰度因高脂饮食而增加,并且与体重呈正相关。
老年人和1岁以下个体消耗的脂肪相对较少,体重相对较低,这可能导致拟杆菌属和副拟杆菌属减少,可用于考拉杆菌属的琥珀酸盐减少。
已发现体重和脂肪量与Phascolarctobacterium丰度呈负相关,因此可以帮助预测肥胖风险。
与年轻人相比,老年人群的体育锻炼较少,这可能是Phascolarctobacterium减少的另一个原因。
高脂饮食组富含拟杆菌属和Phascolarctobacterium,在人体肠道微生物群中,拟杆菌属产生乙酸和琥珀酸作为主要代谢产物。琥珀酸在肠道中的过量积累会导致腹泻,而利用琥珀酸的细菌的存在可能对人类有益。因此,Phascolarctobacterium可能和拟杆菌,尤其Bacteroides thetaiotaomicron(常栖息在人类肠道中,能够消化多糖)等菌存在共生。
此外,除了Phascolarctobacterium,研究发现高脂肪饮食更有可能导致大量产生丙酸和乙酸的细菌物种,如奇异变形杆菌(Proteus mirabilis)和韦荣氏球菌 (Veillonellaceae)。
含淀粉类食物、谷物和奶制品,与较高的Phascolarctobacterium 相对丰度。
一些小样本证据显示:
菊粉、岩藻多糖、中等剂量木糖醇可以增加Phascolarctobacterium 的丰度,但是低聚果糖的补充会降低Phascolarctobacterium。
此外,小檗碱和二甲双胍可以显着增加这种菌,这反过来可能有助于这两种药物对宿主的有益作用。
与其他菌互作
人体肠道中存在多种微生物,其中一些被认为是相互作用的。大多数这些相互作用涉及细菌代谢物。考拉杆菌属Phascolarctobacterium几乎不用碳水化合物进行生长,而是使用琥珀酸盐作为底物。研究发现Bacteroides thetaiotaomicron产生的琥珀酸支持Phascolarctobacterium菌的生长和伴随的通过琥珀酸途径产生丙酸。
丙酸生产的三种不同生化途径包括琥珀酸、丙烯酸酯和丙二醇途径。拟杆菌属拥有琥珀酸途径,该途径也存在于Phascolarctobacterium。然而,由于缺乏延胡索酸还原酶,推测P. faecium JCM 30894 无法产生琥珀酸,这是琥珀酸途径的关键代谢物。因此,与产生琥珀酸的细菌(如拟杆菌属)共存对于考拉杆菌属是必不可少的。
此外,从琥珀酸到丙酸的转化反应之一涉及甲基丙二酰辅酶 A 变位酶,它需要维生素 B12 。Bacteroides thetaiotaomicron 一些菌株缺乏维生素 B族 所需的上游基因12生物合成。
此外,发现Phascolarctobacterium与颤螺菌属一般呈正相关。
在一项对 314 名中国健康青年样本的队列研究中,9 个核心属中的 8 个,包括Blautia、Clostridium、Ruminococcus、Faecalibacterium、Subdoligranulum、Roseburia、Coprococcus、Bacteroides,彼此之间呈显著正相关,而核心属Phascolarctobacterium与其他八个核心属呈负相关。综合谷禾数据库和相关研究结果:

环境条件
考拉杆菌属(Phascolarctobacterium),这些细菌与他们的种族/地理和生活方式有关。通过对来自9个省份与自治区、7个民族的20个健康年轻人群的314名居民粪便进行16SrRNA测序,发现厚壁菌门、拟杆菌门、变形杆菌门和放线菌门是4种最主要的细菌门,其中,来自厚壁菌门的考拉杆菌属在人群中丰度占比较高。
人体肠道微生物群是可塑的,与周围环境密切相关。医务人员在日常工作中不断与患者接触,并暴露于医院环境中,这种高风险的接触与暴露使很多病原微生物成为医务人员手部微生物群的一部分而被携带。
万献尧教授团队2021年发表在《Clin Microbiol Infect》上的研究评估了医务人员与非医疗人员肠道微生物组的变化。与非ICU工作人员相比,ICU工作人员肠道内Phascolarctobacterium丰度显著增加。
疾病状态
而与健康人相比,早期肝癌患者中,考拉杆菌属(Phascolarctobacterium)和瘤胃球菌属(Ruminococcus) 明显减少。
在重度抑郁、阿尔茨海默病(AD)、自闭症等疾病中发现Phascolarctobacterium高富集,尽管疾病组内异质性也较高,因此,有必要开展大人群队列和临床验证该菌对于神经类疾病的发生和发展贡献情况。
在参与一项小型研究的复发缓解型多发性硬化症(RRMS) 患者中确定了肉类消费与其如何影响肠道细菌、免疫细胞谱和新陈代谢之间的关系。发现许多与多发性硬化症和多发性硬化症患者残疾严重程度与肠道4种细菌产气柯林氏菌、Coprococcus come、Phascolarctobacterium succinatutens、Sutterella wadsworthensis呈正相关。
Phascolarctobacterium属的减少与结肠炎症的存在有关。
阻止艰难梭菌定植
宿主免疫在肠道微生物群介导的对艰难梭菌感染 (CDI) 的定植抗性中发挥重要作用。研究发现人类微生物群相关小鼠中的 IL-22 信号传导调节宿主糖基化,这使得消耗琥珀酸的细菌Phascolarctobacterium 能够生长。在肠道微生物群中,Phascolarctobacterium降低了琥珀酸的可用性,这是艰难梭菌生长的关键代谢物,因此阻止了艰难梭菌的生长。
Phascolarctobacterium有助于肺癌的免疫治疗
免疫检查点阻断(ICB),特别是PD1/PDL1轴的阻断,为非小细胞肺癌(NSCLC)的治疗开辟了新的标准。然而,尽管临床护理取得了重大进展,但许多患者仍然对这些疗法无效。PD-L1 表达和肿瘤突变负荷等生物标志物与 ICB 疗效相关。Phascolarctobacterium在具有临床益处的患者中富集,并与延长的无进展生存期相关,而Dialister在进展性疾病患者中的代表性更高,其较高的相对丰度与无进展生存期和总生存期降低相关,具有独立的预后价值多变量分析。
有助于减肥
研究发现,比较容易减肥的人体肠道内考拉杆菌属(Phascolarctobacterium)水平较高,因此该菌也用来预测肥胖指标。而难以减肥的人体内则小类杆菌属(Dialister)水平较高。此外,在代谢综合征女性中观察到的Phascolarctobacterium属的丰度高于代谢综合征男性。
无论健康的核心细菌是如何定义的,以及群体研究中的鉴定结果有多么不同,可以肯定的是,普遍和优势的核心细菌对于宿主肠道稳态和健康至关重要。因此,重要的是发现一个全面的核心微生物群概况,以定义健康的肠道微生物群并指导它们对宿主健康的干预。
考拉杆菌属作为我们东方人肠道的核心菌属 ,其丰度高低对于维持健康和情绪等非常重要,后续期待更多关于该菌的深入研究信息。
主要参考文献:
Wu F, Guo X, Zhang J, Zhang M, Ou Z, Peng Y. Phascolarctobacterium faecium abundant colonization in human gastrointestinal tract. Exp Ther Med. 2017;14(4):3122-3126. doi:10.3892/etm.2017.4878
Watanabe Y, Nagai F, Morotomi M. Characterization of Phascolarctobacterium succinatutens sp. nov., an asaccharolytic, succinate-utilizing bacterium isolated from human feces. Appl Environ Microbiol. 2012 Jan;78(2):511-8. doi: 10.1128/AEM.06035-11. Epub 2011 Nov 11. PMID: 22081579; PMCID: PMC3255759.
Ogata Y, Suda W, Ikeyama N, Hattori M, Ohkuma M, Sakamoto M. Complete Genome Sequence of Phascolarctobacterium faecium JCM 30894, a Succinate-Utilizing Bacterium Isolated from Human Feces. Microbiol Resour Announc. 2019;8(3):e01487-18. Published 2019 Jan 17. doi:10.1128/MRA.01487-18
Bhandarkar NS, Mouatt P, Majzoub ME, Thomas T, Brown L, Panchal SK. Coffee Pulp, a By-Product of Coffee Production, Modulates Gut Microbiota and Improves Metabolic Syndrome in High-Carbohydrate, High-Fat Diet-Fed Rats. Pathogens. 2021 Oct 22;10(11):1369. doi: 10.3390/pathogens10111369. PMID: 34832525; PMCID: PMC8624503.
Zheng YH, Xu Y, Ma HX, Liang CJ, Yang T. Effect of High-Fat Diet on the Intestinal Flora in Letrozole-Induced Polycystic Ovary Syndrome Rats. Evid Based Complement Alternat Med. 2021 Jun 25;2021:6674965. doi: 10.1155/2021/6674965. PMID: 34257691; PMCID: PMC8257354.