-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

癌症——这个困扰人类几个世纪的疾病,至今仍是全球死亡率最高的疾病之一。
国际癌症研究机构调查显示,2022年,全球有超过 1900 万新诊断的癌症病例和近1000 万癌症死亡病例,无数家庭因此经历痛苦。
癌症是一种复杂的多步骤慢性疾病,由活跃分裂细胞在 DNA 复制过程中获得的自发突变积累而成,环境也对癌症风险产生了相当大的影响。
传统的癌症治疗方法——手术切除、放射治疗和化学疗法,虽然在过去几十年中挽救了无数患者的生命,但它们的局限性也日益明显:手术无法完全清除微小转移灶;放疗和化疗的副作用严重,往往让患者雪上加霜;而且,即便是相同类型、相同分期的癌症患者,对同一治疗方案的反应也可能截然不同。
传统的癌症生物学理论难以完全解释这些差异。
这些问题引发了研究人员的深思:也许我们需要超越单纯关注癌细胞本身,将目光投向更广阔的“宿主环境”——患者的整体生理状态、免疫系统功能,以及体内的微生态系统。
从结直肠癌到肝癌,从乳腺癌到胰腺癌,微生物的”指纹”无处不在,它们通过复杂的代谢网络和免疫调节机制,参与肿瘤的发生、发展、转移和治疗反应全过程。
例如,肠道微生物群与宿主黏膜表面之间存在相互作用,后者在肿瘤发生中起着主要作用。微生物可能通过在胃黏膜中诱导氧化应激来损伤 DNA,增强上皮炎症并破坏黏膜屏障,从而增加肿瘤发生风险。
本文我们主要来了解微生物与癌症之间错综复杂的关系,探讨微生物如何成为癌症研究的新焦点,以及这一领域如何有可能彻底改变我们对癌症的认知和治疗方法。
随着年龄增长,我们的身体就像一台逐渐磨损的精密机器,各个部件的功能开始下滑。这种时间依赖性的细胞和生理功能退化过程,被称为”衰老“,它是多种重大疾病的主要风险因素之一,也包括癌症。
衰老的基本特征
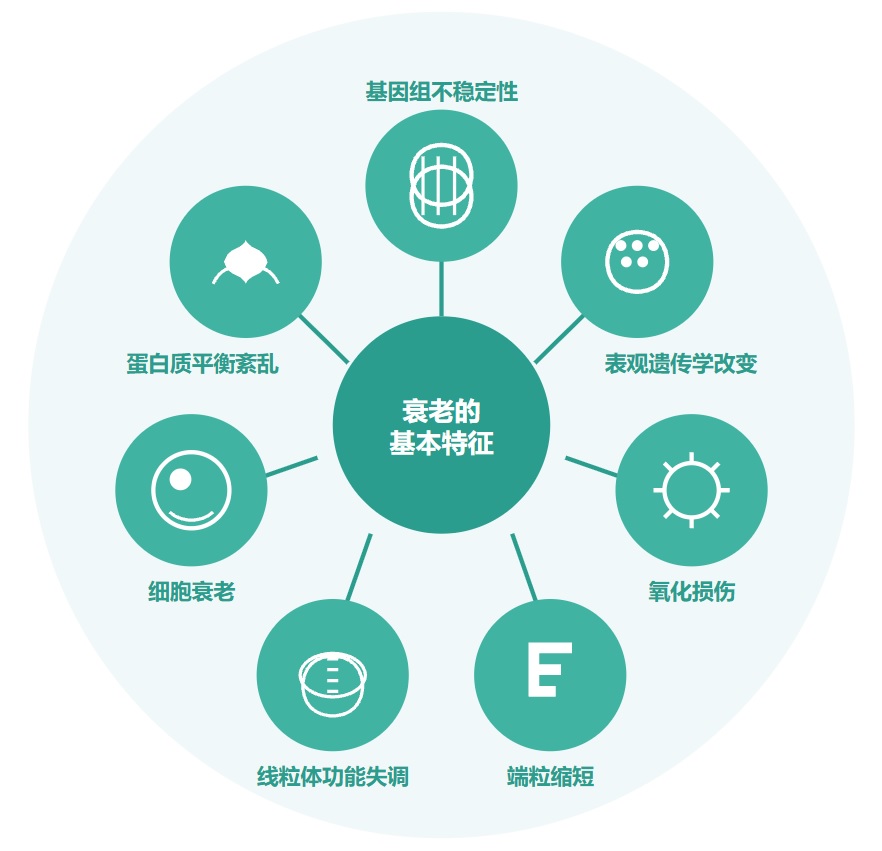
有人提出,尽管存在显著的个体间异质性和生活方式、饮食和治疗等外部因素的影响,但人类的肠道微生物组成在衰老过程中会逐渐变化。
多项报告表明,与有益菌相比,微生态失调在衰老过程中会增加,并导致促炎共生菌的大量存在,这些菌的富集,可以滋养生理性炎症。
对人类老龄化队列的研究表明,包括 Akkermansia、Anaerotruncus、Eggerthella、Bilophila 在内的一组属的丰度随着年龄的增长而显著增加,而 Faecalibacterium、Prevotella、Bacteroides 的丰度在老年人中相对较低。
衰老可能导致癌症,癌症治疗可能导致过早衰老

doi.org/10.1186/s12935-025-03787-x
微生物代谢物如何影响细胞衰老和健康?
短链脂肪酸,包括丁酸,可以帮助减缓细胞衰老。它们通过抑制组蛋白脱乙酰化酶来实现这一点,这调节代谢过程,增加胰岛素分泌,并调节免疫反应。
相比之下,致病菌的代谢产物,如脂多糖(LPS),通过加速炎症和增加氧化应激来增强细胞衰老,这是衰老的一个标志。
此外,铜绿假单胞菌和幽门螺杆菌产生的毒素会导致宿主 DNA 损伤并增加氧化应激。
因此,这加剧了 DNA 损伤反应、基因组不稳定性和细胞衰老。
菌群失调和细菌毒素促进衰老人群中衰老细胞的积累、DNA 损伤和促炎微环境的形成。这导致代谢紊乱,并创造一个促进肿瘤细胞生存和增殖的 肿瘤微环境,最终导致癌症。
癌症如何开始?
癌症起源于普通细胞中的遗传变化。当细胞DNA受到致癌物损伤时,会触发一系列变化。这些变化可能不会立即表现出来,但会逐渐积累。关键的基因突变会赋予细胞生长优势和抵抗死亡的能力,导致异常增殖,最终形成肿瘤。

癌细胞有什么特别之处?
癌细胞最显著的特征之一是它们的代谢方式发生了改变,也就是“代谢重编程”。正常细胞和癌细胞使用能量的方式完全不同。癌细胞即使在氧气充足的环境中也会进行糖酵解,这种现象称为”有氧糖酵解“。
此外,它们还进行大分子合成、维持氧化还原平衡,谷氨酰胺分解代谢,所有这些都有助于细胞快速增殖和生长。所有这些都有助于癌细胞快速分裂、扩散并侵入身体不同部位。
一个具体例子是D-2-羟基戊二酸的累积,这个代谢物抑制细胞分化,加速癌症发展。这是由于异柠檬酸脱氢酶-1/2 的连续突变。这表明通过抑制分化直接促进癌症的发生和进一步发展。
一个肿瘤内部并非完全一致,不同区域的细胞可能有不同的代谢特性,这种现象称为肿瘤异质性,这使得癌症治疗更加复杂。

肿瘤微环境:癌症的”生态系统”
肿瘤微环境(TME)是另一个在癌症发生和进展中发挥关键作用的组成部分。
肿瘤微环境是围绕癌细胞形成的高度组织化区域,就像一个小型社会,其中癌细胞只是众居民之一。其他成员如下图:

这个微环境如何影响癌症发展?
癌细胞能够改造邻居,使整个环境有利于肿瘤生长。
比如,癌细胞怎样获得养分和氧气?它们促使血管内皮细胞形成新血管。肿瘤相关巨噬细胞(TAMs)被招募后,会分泌生长因子和细胞因子,刺激血管生成和肿瘤侵袭。
癌细胞甚至能重新编程癌细胞相关成纤维细胞(CAFs),使它们分泌ECM蛋白和血管生成因子(如VEGF-A)。ECM则作为信号分子的储存库,增强细胞间通讯、粘附和迁移。
因此,TME 的不同组成部分通过影响各种细胞过程,有助于癌症的发生、进展和迁移。更深入地了解调节癌症进展和可塑性的分子机制,有助于开发精确和针对性的癌症治疗疗法,并预防复发。
微生物如何影响癌症发展?
最直接的联系是某些微生物直接致癌的能力:
动物研究显示,微生物可促进多种癌症的发展,包括:

doi.org/10.1186/s12935-025-03787-x
微生物群如何变化?
高通量DNA测序揭示了癌症相关的微生物群落变化:
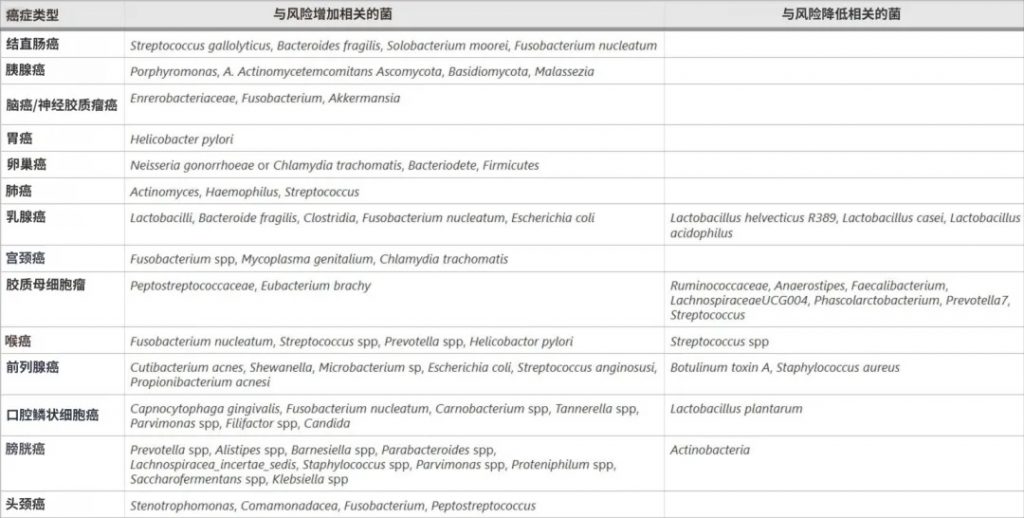
doi.org/10.1186/s12935-025-03787-x
微生物如何促进癌症?
微生物可能通过多种机制促进肿瘤发生:
了解微生物与癌症的关系,可能帮助我们开发新的癌症预防策略、提高治疗效果,甚至预测哪些患者可能对特定治疗产生耐药性。
实际上,微生物群可以同时扮演促进肿瘤发展和抑制肿瘤生长的双重角色,这取决于肿瘤进展的阶段以及微生物群的功能和分布位置,那么,哪些微生物会致癌?又是如何作用的?
微生物的促癌作用
结直肠癌
脆弱拟杆菌、大肠杆菌、Streptococcus gallolyticus、Enterococcus faecalis、Fusobacterium nucleatum、Parvimonas micra等在结直肠癌患者肠道中大量存在,通过分泌短链脂肪酸等代谢物、DNA甲基化、组蛋白修饰等表观遗传机制影响肿瘤形成。
胰腺癌
牙龈卟啉单胞菌、奈瑟菌、放线菌、链球菌、双歧杆菌、拟杆菌、梭杆菌等与胰腺癌的发生有关,它们通过引起炎症和免疫抑制影响肿瘤生长。
口腔微生物群和幽门螺杆菌通过诱导炎症而成为胰腺癌症的危险因素。
乳腺癌
对人类乳腺癌症组织16S rRNA基因序列的分析显示,与早期乳腺肿瘤相比,晚期乳腺肿瘤中卟啉单胞菌、Lacibacter、Ezakiella、Fusobacterium的丰度更高。
具核梭杆菌(Fusobacterium nucleanum)和脆弱拟杆菌通过定植于乳腺肿瘤和促进癌症细胞的自我更新来加重乳腺癌症的生长和转移。
脑癌
Enterobacteriaceae、Fusobacterium、 Akkermansia是脑癌患者肠道中的主要菌群,它们可能通过免疫抑制、激活炎症、限制细胞死亡以及促进血管生成和侵袭性来影响胶质瘤。
微生物虽然不能穿过血脑屏障,但能释放具有穿透能力的细胞外囊泡,这些囊泡有能力穿过屏障进入大脑。
其他
其他癌症相关的微生物还包括:
这些菌在相应的癌症中大量存在,并通过改变代谢和免疫反应、增强炎症和毒性以及改变信号通路来提高肿瘤易感性。
微生物的抗癌作用
一些微生物如乳杆菌、双歧杆菌、Faecalibaculum rodentium、Streptococcus thermophiles等具有抗肿瘤特性,它们主要通过以下机制抑制肿瘤生长:
调节免疫系统
一组共生肠道细菌,如Paraprevotella xylaniphila、Bacteroides dorei、 Parabacteroides distasonis,可以诱导 CD8 T 细胞产生 IFNγ,抵抗单核细胞增生李斯特菌感染,并增强免疫检查点抑制剂在小鼠体内的疗效。
产生抑制性毒素
其他细菌,如铜绿假单胞菌、鼠伤寒沙门氏菌、艰难梭菌,分别在黑色素瘤、胰腺癌和乳腺癌癌症中表现出抗肿瘤特性。它们通过产生抑制增殖、使细胞停滞在G1-S期并诱导细胞凋亡的毒素来实现这一点,从而促进抗癌活性。
嗜热链球菌还抑制细胞增殖,引发细胞周期阻滞,增强体外结直肠细胞的凋亡,并减少结直肠癌异种移植物的生长。此外,肠道微生物群通过抑制结肠lncRNA Snhg9和上调p53表达来限制小鼠结直肠癌癌症的进展。
产生有益代谢物
– 微生物本身及其毒素能抗癌
科利毒素:赋予宿主抗肿瘤免疫力。
产气荚膜梭菌毒素(CPE)能识别乳腺癌、前列腺癌等细胞表面高表达的claudin-3/4蛋白,与这些蛋白结合后直接引发癌细胞死亡。
Akkermansia muciniphila在肝癌小鼠模型中减少免疫抑制细胞(单核MDSC、M2巨噬细胞),同时增强PD-1免疫治疗的疗效。
– 微生物代谢产物:短链脂肪酸抗癌
丁酸钠,在非小细胞肺癌中消除肿瘤细胞生长,诱导细胞周期阻滞,促进细胞凋亡,并改变免疫反应。
异丁酸,通过减少肿瘤体积来提高癌症结肠癌小鼠模型中抗PD-1免疫疗法的效率。
色氨酸,是人体必需氨基酸,其代谢途径包括:
拟杆菌、Clostridium sporogenes、 Eubacterium、Ruminococcus gnavus等菌群通过吲哚途径产生吲哚-3-乳酸、吲哚-3-丙酸、吲哚-3-乙酸等代谢物,这些物质既能抑制肿瘤免疫逃逸,也可能促进癌细胞生长,具体作用取决于代谢物种类和浓度。
吲哚代谢物可改善化疗和免疫治疗效果,但菌群失衡可能导致色氨酸代谢紊乱,反而加速癌症进展。
微生物与肿瘤微环境的相互作用
具核梭杆菌的Fap2蛋白可与抑制性受体TIGIT结合,抑制NK细胞和T细胞清除肿瘤的能力。
幽门螺杆菌与微环境中的巨噬细胞互动,诱导其极化为M2样巨噬细胞,促进胃癌进展。
肿瘤内微生物也参与肿瘤生成和进展,例如:
也有报道称,一些瘤内微生物可以增强抗肿瘤免疫反应,从而抑制肿瘤进展。
了解微生物在癌症中的双重作用,可能为开发新型抗癌疗法提供思路,包括调节微生物群落和利用微生物产物来增强现有治疗方法的效果。
转移是癌症细胞的一个关键标志,大多数癌症类型的晚期通常以转移开始为特征。
转移,是指癌症细胞通过血液循环从原发肿瘤转移到其他器官的继发部位。它涉及上皮间质转化(EMT)、迁移、侵袭、外渗和继发部位的定植。
转移过程包括哪些步骤,癌细胞面临哪些挑战?
这个过程对癌细胞来说充满了物理和化学挑战,包括需要穿越坚硬的细胞外基质、承受液体剪切应力、逃避免疫监视,并最终在可能与原发部位环境截然不同的部位建立殖民地。
微生物如何协助癌细胞转移?
– 乳腺癌:细菌随转移扩散
– 具核梭杆菌的多重促转移机制
有核梭杆菌可诱导乳腺癌、结直肠癌、喉癌的转移。它是口腔中常见的革兰氏阴性菌,通常与牙周病、口臭有关。
结直肠癌

doi.org/10.1186/s12935-025-03787-x
喉癌
– 抗生素治疗的启示
当然,微生物并不总是促进转移,已知许多微生物群也能抑制转移,从而为防止癌症进展提供了一种自然的方法。
微生物如何阻止转移?
– 抑制转移的菌群代谢物
– 调节肿瘤微环境
膀胱癌中的菌群关联:
– 抗癌微生物的鉴定
前列腺癌数据分析:
肿瘤内微生物种类在转移中的重要性在其他癌症中也得到了证实(下表)。

doi.org/10.1186/s12935-025-03787-x
这些研究表明,癌症中微生物的特异性靶向可以抑制肿瘤的转移,从而成为抗癌联合治疗的重要组成部分。未来需揭示菌群与宿主互作的具体机制,探索“以菌治癌”的精准策略,为癌症治疗提供新突破口。
微生物不仅参与癌症的发生和发展,还可能影响癌症治疗的效果。为什么有些患者对治疗产生耐药性?微生物可能是其中一个关键因素。
微生物如何影响抗癌疗效?
微生物群主要通过两种方式来影响抗癌疗效:
这样一来,药物的疗效和对癌细胞的毒性都会发生变化。
以环磷酰胺(CTX)为例,它是一种常用的抗癌药,用于治疗各种血液系统恶性肿瘤和实体瘤。
环磷酰胺不仅能杀伤癌细胞,还能调节肠道微生物的组成。它会促使一些特定的革兰氏阳性细菌从肠道转移到次级淋巴器官,而这些细菌到达那里后,会激活致病性 T 辅助细胞,从而增强环磷酰胺的抗癌活性。
但如果通过某种方式消除肠道微生物,比如用无菌小鼠或给小鼠喂食抗生素,特别是针对Barnesiella intestinihominis、Enterococcus hirae等特定菌群时,就会发现一个很棘手的问题:环磷酰胺的抗癌效果会变差,耐药性出现了。这说明肠道微生物群在化疗耐药性中扮演着重要的角色。
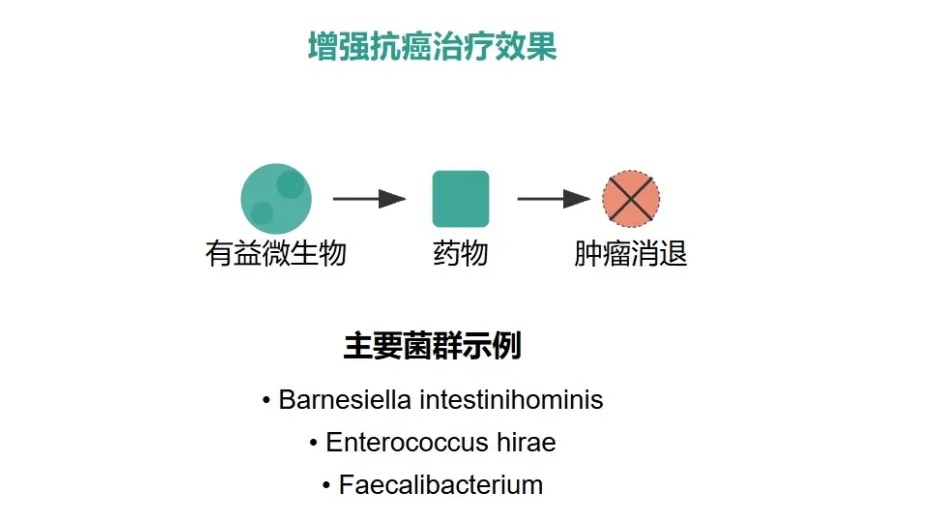
不过,这里又出现了一个违反我们直觉的情况。抗生素虽然可以杀菌,但用多了反而会导致细菌耐药性增加。
研究还在不断深入,科学家们发现:
微生物群调节有助于提高癌症治疗的效率,并通过改变代谢和免疫反应促进更好的预后。
比如,García-González 等人做了一项很有意思的研究,大肠杆菌可改变线虫体内代谢通路,增强5-氟尿嘧啶(FUDR)的疗效。
同样,在黑色素瘤患者的治疗中,研究发现粪杆菌Faecalibacterium能帮助增加免疫细胞和抗原呈递,从而让细胞毒性 CD8 + T 细胞在肿瘤床的浸润程度更高,引发大规模的免疫反应,这对抗 PD-1治疗很有帮助。
基于这些发现,有人提出一个大胆的想法:
肠道微生物群也可以用作生物标志物,来预测患者化疗和免疫治疗的治疗反应和疗效。
肝癌患者的肠道菌群失衡指数(Ddys) 反映了HCC患者粪便样本中的微生物干扰,可用于预测治疗效果。
失衡指数是根据HCC患者粪便样本中有益菌与有害菌的相对丰度计算的。
工程菌成为抗癌新武器
直接杀伤癌细胞:
靶向递送药物:
激活免疫:
现有研究揭示了微生物群在癌症治疗中的多重价值:增强药效、预测疗效、直接作为治疗载体。需深入解析不同癌症特异的菌群特征,明确特定菌种的作用机制,同时解决工程菌的生物安全性问题。
化疗不仅直接作用于肿瘤,同时也会对人体内的微生物群落产生显著影响。肠道微生物在应对化疗时,会通过代谢和免疫调节来影响化疗的疗效和毒性。
化疗如何破坏肠道菌群平衡?
化疗不仅攻击癌细胞,还会显著扰乱肠道微生物的组成。例如,在肠道中,化疗可能会破坏黏液层,使部分肠道微生物能够穿透黏膜层,引发免疫反应。
在结直肠癌患者中,化疗会降低肠道菌群的多样性,这种变化可能反向影响治疗效果——菌群结构越失衡,化疗耐药风险可能越高。
菌群网络的重构:竞争还是合作?
梭杆菌、拟杆菌、粪杆菌分别与肿瘤标志物CEA、CA724、CA242相关,但它们的丰度不受不同化疗阶段的影响。这提示特定菌群可能成为化疗反应的独立预测指标。
注:CEA是一种糖蛋白,最初在胚胎组织和结肠癌组织中发现。作为最早被应用于临床的肿瘤标志物之一,CEA主要用于消化系统肿瘤的辅助诊断和监测。
CA724是一种高分子量糖蛋白,是胃癌较为特异的肿瘤标志物。
CA242是一种新型的消化系统肿瘤标志物,主要用于胰腺癌和胆道系统肿瘤的辅助诊断。
菌群如何“对抗”化疗药物?
某些细菌通过代谢转化直接削弱药物活性:
菌群失衡是否会加剧化疗副作用?
5-氟尿嘧啶(5-FU)为例
5-氟尿嘧啶用于治疗乳腺癌、结直肠癌、胃癌、胰腺癌、胃癌等。其作用方式涉及DNA损伤,导致细胞凋亡或RNA合成抑制。
菌群也能增强化疗效果吗?
奥沙利铂和丁酸盐为例
奥沙利铂是晚期结直肠癌患者的一线化疗药物。
研究表明,肠道微生物产生的代谢物丁酸盐能增强奥沙利铂的抗癌效果。
丁酸盐通过依赖ID2的方式激活CD8 + T细胞。在结直肠癌患者中,对奥沙利铂有反应的患者血清丁酸盐水平高于无反应患者。这表明,肠道微生物产生的丁酸盐可能是决定患者对奥沙利铂反应的关键因素。
临床转化方向
预测性生物标志物
精准调控策略
化疗与肠道菌群存在双向影响:药物破坏菌群平衡,菌群则通过代谢和免疫调控反作用于药物疗效。未来研究需结合菌群检测,在分子机制与临床干预之间架起桥梁,最终实现精准治疗策略。
多项研究表明,放射治疗和微生物群之间存在相互交织的关系。虽然放射治疗可以杀死有益的微生物群,但某些微生物群也可以通过影响患者的免疫系统来提高放射治疗的敏感性。
例如,口腔中的具核梭杆菌会被转移到结直肠肿瘤部位,从而降低放疗的治疗效果。
而甲硝唑是一种针对具核梭杆菌的抗生素,研究发现,在结直肠癌小鼠模型中,甲硝唑可以作为一种放疗增敏剂,提高放疗的效果。
微生物群导致放疗抵抗
丁酸盐在肠道健康中通常被认为有益,为何在放疗中反而有害?
由Lachnospiraceae合成的丁酸盐与放疗抵抗有关
细菌和真菌对放疗的影响相反
小鼠模型(黑色素瘤、乳腺癌)研究发现:
关键分子:免疫受体Dectin-1(感知真菌感染)高表达的乳腺癌患者生存率较差。抑制Dectin-1可提升放疗疗效。
临床转化方向
精准菌群干预:
免疫微环境重塑:
传统癌症治疗方法存在很多局限性,例如对正常细胞的附带损伤、产生治疗耐药性的可能性以及无法完全穿透肿瘤等。因此,迫切需要开发新的、更好的癌症治疗方法。有文献表明,对癌症患者的肠道微生物群进行干预可以增强当前抗癌药物的疗效,如化疗和免疫疗法。
微生物群提高各种肿瘤免疫疗法的效率
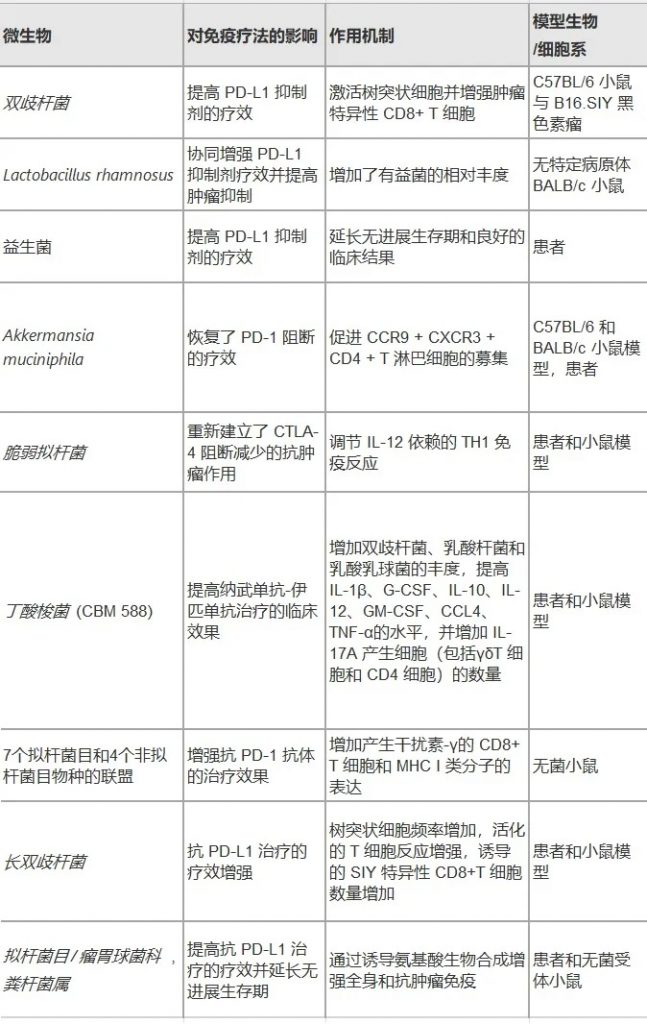
doi.org/10.1186/s12935-025-03787-x
细菌疗法
早在1868年,William Coley发现细菌感染可导致肿瘤消退,开创了细菌疗法的先河。现代研究揭示了细菌靶向肿瘤的独特机制:
研究人员改造了专性厌氧鼠伤寒沙门氏菌菌株YB1,并通过在神经母细胞瘤小鼠模型的肿瘤核心注射这种修饰的细菌观察到对肿瘤生长的抑制。
重组减毒沙门氏菌菌株SL7207被用作在黑色素瘤小鼠模型中递送工程肿瘤疫苗的载体。活细菌也可以与纳米粒子结合,形成有效的药物递送系统。
挑战:
细菌介导的抗癌疗法带来了一些挑战,包括半衰期短、DNA不稳定性和微生物的内在致病潜力。
基因工程有助于删除致病菌株的一些毒力基因,从而可以控制其抗肿瘤活性、特异性和定植。
目前,一些临床试验正在确定功能化鼠伤寒沙门氏菌菌株的效果。这些菌株要么通过各种遗传技术进行工程改造,要么通过纳米粒子或其他试剂进行表面修饰,以显示出所需的肿瘤靶向和定植。
粪菌移植 (FMT)
最近的研究表明,使用FMT重塑微生物群失调可以潜在地抑制癌症进展,特别是结直肠癌。
结直肠癌(CRC)
移植健康小鼠粪便至CRC模型,逆转菌群失衡,增加CD8+ T细胞浸润,减少促炎因子(IL-6、IL-17),抗炎细胞因子IL-10增加,抑制肿瘤进展。
临床试验进展

注:部分试验中FMT导致腹泻等副作用,提示需优化供体筛选。
宏基因组分析显示,在反应者中,FMT后Prevotella copri、Ruminoccocaceae、Eubacterium丰富。此外,与非反应者相比,反应者在FMT后一个月的粪便样本在小鼠模型中抑制肿瘤生长的能力更强。
涉及粪便微生物移植的临床试验

doi.org/10.1186/s12935-025-03787-x
关于 FMT的研究我们之前也写过,详见:
益生菌
益生菌如何帮助对抗癌症?
最近的一项队列研究中,发现益生菌的低等和中等摄入量与癌症死亡率的降低显著相关。
益生菌通过以下机制发挥作用:
鼠李糖乳杆菌(LGG)通过释放脂磷壁酸(LTA)激活TLR2信号,保护肠道干细胞免受放疗损伤。
另一种益生菌Prohep由鼠李糖乳杆菌GG(LGG)、具有活性的大肠杆菌Nissle 1917(EcN)和热灭活VSL3组成,用于在HCC小鼠模型中通过减少Th17细胞和IL-17细胞因子来减少肿瘤生长。
工程化益生菌有何突破?
益生菌要适量
益处:适量补充益生菌可降低癌症死亡率。
风险:过量可能干扰免疫治疗,如黑色素瘤模型中PD-1抑制剂疗效下降。
益生元
益生元——激活菌群抗癌潜能的“燃料”
益生元选择性地促进有益菌(如产丁酸菌)增殖,协同抗癌治疗。
益生元如何优化药物递送?
临床启示与风险管控
个体化菌群干预:
动态监测必要性:
风险提示:
免疫缺陷患者慎用活菌制剂,优先选择灭活益生菌或纯化代谢产物。
总的来说,益生菌双刃剑效应显著,需严格把控种类和剂量;而益生元通过调节菌群代谢,相对安全增强化疗/免疫疗效。
益生菌+益生元+传统疗法可能成为癌症治疗新方向,但需更多临床验证。
抗癌药物
为什么同种药物在不同患者中效果差异显著?
肠道微生物群还参与抗癌药物的生物转化和代谢,导致这些药物的差异吸收和生物利用度。在药物的生物转化过程中,微生物群采用各种机制,如脱氨基、水解、去甲基化、葡萄糖醛酸化和其他反应。
伊立替康(CPT11):
5-氟尿嘧啶(5-FU):
如何减轻菌群介导的副作用或耐药?
抑制特定酶活性:
调控菌群组成:
壳寡糖通过降低肠球菌、大肠杆菌-志贺氏菌、Turicibacter的密度以及促进丁酸产生菌的生长,对结直肠癌具有保护潜力。

临床潜在方向
未来,建立“菌群-药物代谢”数据库,结合人工智能预测个体化用药方案。例如,对高β-葡萄糖醛酸酶活性的患者,优先选择不受该酶影响的化疗药物(如奥沙利铂)。
关于常用药物和肠道菌群之间复杂的双向相互作用,我们之前的文章也写过,详见:
为什么药物对人效果不一?探索药物-微生物群相互作用对效果的影响
全球癌症治愈率依然不高,肠道微生物群在癌症发生、发展、转移和药物反应中的关键作用正逐渐成为研究热点,为精准抗癌策略提供了全新思路。
菌群在癌症治疗中的关键作用
微生物通过多种机制影响癌症治疗效果:
doi.org/10.1186/s12935-025-03787-x
当前挑战:从实验室到临床的鸿沟
– 研究方法的“碎片化”
样本收集(粪便 vs 肿瘤组织)、测序技术(16S rRNA vs 宏基因组)的差异导致结果难以比较;
解决方案:建立全球统一的微生物组分析标准。
– 个体化差异
年龄、饮食、地理因素使菌群组成差异巨大——同一疗法在不同人群中的响应率波动;
突破口:开发基于AI的个体化菌群图谱,预测治疗敏感性与毒性风险。
– 治疗复杂性的叠加
在现有化疗/免疫治疗基础上引入菌群调控,可能引发不可预见的药物-微生物相互作用;
未来方向:迈向精准菌群医学
– 精准菌群分层
通过多组学技术(宏基因组+代谢组)构建个体化菌群图谱,识别“促癌菌”与“抑癌菌”。
针对不同化疗方案调整菌群结构,丁酸水平低者优先使用奥沙利铂联合益生元。
– 联合干预策略
饮食-菌群协同:高纤维饮食联合特定益生元(如菊粉),可使MEK抑制剂疗效提升。
个性化膳食(如高纤维饮食)联合益生菌,改善肠道健康并增强治疗响应。
结合基因、饮食等多维度数据定制治疗方案。
工程菌开发:设计靶向降解耐药相关酶(如β-葡萄糖醛酸酶)的工程菌。
– 临床转化路径
推动大规模临床试验,验证菌群移植(FMT)、益生元/菌在特定癌种中的疗效。
探索菌群标志物(如丁酸盐水平)作为治疗响应预测指标。
开发微生物群-人工智能联合预测模型,优化治疗决策。
将菌群检测纳入癌症辅助诊疗,实现早筛与疗效监控。
总的来说,微生物组研究不仅扩展了我们对癌症发生发展的认知,更为癌症治疗提供了新的可能性。通过系统化的菌群检测与精准干预,跨学科协作与技术创新,未来有望实现真正的个体化治疗方案,提高抗癌疗效并改善患者生活质量。这一领域的进步,代表着癌症治疗从单一靶向向生态系统整体调控的深刻范式转变。
主要参考文献
Adlakha YK, Chhabra R. The human microbiome: redefining cancer pathogenesis and therapy. Cancer Cell Int. 2025 Apr 28;25(1):165.
Shi Z, Li Z, Zhang M. Emerging roles of intratumor microbiota in cancer: tumorigenesis and management strategies. J Transl Med. 2024 Sep 11;22(1):837.
Murayama M, Hosonuma M, Kuramasu A,et al., Isobutyric acid enhances the anti-tumour effect of anti-PD-1 antibody. Sci Rep. 2024 May 17;14(1):11325.
Jia D, Kuang Z, Wang L. The role of microbial indole metabolites in tumor. Gut Microbes. 2024 Jan-Dec;16(1):2409209.
Sun X, Shan X, Zhu B, Cai Y, et al., 5-Fluorouracil Loaded Prebiotic-Probiotic Liposomes Modulating Gut Microbiota for Improving Colorectal Cancer Chemotherapy. Adv Healthc Mater. 2025 Feb;14(4):e2403587.
Zhang H, Xu Z. Gut-lung axis: role of the gut microbiota in non-small cell lung cancer immunotherapy. Front Oncol. 2023 Nov 22;13:1257515.
Wang S, Yin F, Guo Z, Li R, Sun W, Wang Y, Geng Y, Sun C, Sun D. Association between gut microbiota and glioblastoma: a Mendelian randomization study. Front Genet. 2024 Jan 4;14:1308263.

谷禾健康

癌症是一种恶性肿瘤,它可以发生在人体的任何部位,包括肺、乳房、结肠、胃、肝、宫颈等。根据世界卫生组织的数据,全球每年有超过1800万人被诊断出患有癌症,其中约有1000万人死于癌症。癌症已成为全球范围内的主要健康问题之一。
癌症免疫疗法的概念在很早前就提出,但直到最近才被广泛接受为对抗癌症的新型选择。随着现代生物医学技术的发展,已经开发了各种类型的免疫治疗策略。
然而,癌症患者对免疫疗法的个体反应各不相同,并且经常观察到严重的副作用,这限制了这种新方法的进一步利用。
近年来的研究表明,肠道微生物群在免疫疗法的效果及副作用中的起到一定的介导作用,因为某些微生物物种或相关代谢物与癌症患者的反应密切相关。
已经对植物或动物天然产品的营养价值以及它们对肠道微生物群和肿瘤免疫疗法的调节进行了大量研究。膳食真菌因其丰富的营养价值和对人体的调节功能而成为近年来的研究热点。
本文将重点介绍天然产物中膳食真菌的摄入与肠道微生物群调节之间的关系,以及它们在癌症免疫治疗中的生物学作用和潜在机制。
本文出现的专业名词
CTLA-4(细胞毒性T淋巴细胞相关蛋白4),是一种蛋白受体,其作为免疫检查点起作用并下调免疫应答。
PD-1(程序性死亡受体1),是一种重要的免疫抑制分子。通过向下调节免疫系统对人体细胞的反应,以及通过抑制T细胞炎症活动来调节免疫系统并促进自身耐受。
PDL1(细胞程序性死亡-配体1),是一种跨膜蛋白,细胞程序性死亡受体-1(PD-1)与细胞程序性死亡-配体1(PD-L1)结合,可以传导抑制性的信号,减低淋巴结CD8+ T细胞的增生与免疫系统的抑制有关。
CAR-T细胞:技术人员通过基因工程技术,将T细胞激活,并装上定位导航装置CAR(肿瘤嵌合抗原受体),专门识别体内肿瘤细胞,并通过免疫作用释放大量的多种效应因子,它们能高效地杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。
什么是癌症免疫疗法?
癌症免疫疗法是一种治疗癌症的新型方法,它利用人体自身的免疫系统来攻击癌细胞。传统的癌症治疗方法如化疗、放疗等是通过外源性方式杀死癌细胞来治疗癌症,但这些方法也会对正常细胞造成损伤。而免疫疗法则是通过激活或增强人体自身的免疫系统来攻击癌细胞,从而达到治疗癌症的目的。
癌症免疫疗法的优点是可以避免传统癌症治疗方法的副作用,同时可以提高患者的生存率和生活质量。然而,癌症免疫疗法仍然存在一些挑战和限制,如个体间治疗效果差异较大、治疗费用较高等问题,但其作为治疗癌症的新兴手段有着不错的前景。因此,目前仍需要进一步的研究和发展,以提高癌症免疫疗法的治疗效果和安全性。
免疫检查点阻断疗法(ICB)
免疫检查点阻断疗法(ICB)是一种新型的癌症免疫疗法,它通过阻断肿瘤细胞和免疫细胞之间的信号传导通路,从而激活免疫系统攻击癌细胞。
在正常情况下,免疫系统会通过检查点来控制和限制免疫细胞的活性,以避免对正常细胞的攻击。但是,癌细胞可以利用这种机制来逃避免疫系统的攻击,从而导致肿瘤的生长和扩散。 免疫检查点阻断疗法的主要作用是通过抑制免疫检查点分子的功能,从而激活免疫细胞攻击癌细胞。
免疫检查点阻断疗法(ICB)是基于“免疫监视”理论和在T细胞上发现免疫检查点分子(包括CTLA-4和PD-1等)的最具革命性的技术之一。
▸ 作用机理
CTLA-4与CD80/86细胞结合后转导的信号和PD-1与PD-L1结合后转导的信号抑制T细胞的“过度激活”,在预防慢性疾病的异常免疫反应中起重要作用。
阻断受体分子增强了肿瘤杀伤活性
然而,为了增强T细胞清除癌细胞的活性,需要取消这些信号。根据以往的研究,使用CTLA-4或PD-1/PD-L1单克隆抗体治疗的患者通过上调免疫活性产生了显著的抗肿瘤反应。
机理研究表明,CTLA-4或PD-1/PD-L1阻断显著增强了肿瘤特异性T细胞中的T细胞受体信号,从而导致更强的肿瘤杀伤活性,肿瘤微环境中T细胞的浸润和存活率也相应提高。
▸ 免疫检查点阻断适用于的癌症
目前,免疫检查点阻断已被批准用于各种类型的癌症,包括黑色素瘤、非小细胞肺癌、肾细胞癌、头颈部鳞状细胞癌、膀胱癌、肝细胞癌、霍奇金淋巴瘤,作为一线或二线治疗。
此外,许多其他靶向共刺激因子的激动性和拮抗性免疫检查点调节剂,如4-1BB、ICOS、GITR、OX-40、CD40等,目前正在研究中。
✦免疫检查点阻断疗法的局限性
随着临床实践的进展,免疫检查点阻断疗法仍有许多局限性。一个显著的问题是不同类型的癌症反应普遍较低。
•个体差异影响免疫检查点阻断疗法效果
虽然抗PD-1/PD-L1的有效性已经在黑色素瘤和非小细胞肺癌中得到明确证明,但来自其他类型癌症的结果不太明确,并且个体对免疫检查点阻断疗法的反应各不相同,这表明包括遗传、环境、行为甚至肠道微生物群在内的其他因素对免疫检查点阻断治疗效率的影响。
•会出现重度免疫相关毒副反应
免疫检查点阻断疗法的另一个限制是相关的副作用,称为重度免疫相关毒副反应(irAEs)。重度免疫相关毒副反应是免疫检查点阻断疗法诱导的过度炎症反应,可影响多个器官,在某些情况下甚至导致死亡。
据报道,免疫检查点阻断疗法总的重度免疫相关毒副反应发生率约为70-90%。irAEs最常见的症状涉及皮肤、胃肠道、肝脏、内分泌器官和肺,而它在不同类型的癌症和治疗中有所不同。
例如,结肠炎是胃肠道中最常见的irAEs类型,免疫检查点阻断治疗的10-20%的患者中发生。皮肤反应,包括皮疹、瘙痒和白癜风,也是免疫检查点抑制剂治疗中常见的副作用,其中大约50%的患者受到影响。
重度免疫相关毒副反应发生的确切机制仍在研究中,有人提出,过度激活的T细胞攻击正常组织,细胞因子不受控制的分泌,自身抗体的扩增,甚至免疫检查点抑制剂抗体与正常组织的结合(脱靶效应)是导致重度免疫相关毒副反应发生的原因。
肠道微生物影响ICB疗法
有趣的是,已经发现肠道微生物群可能影响免疫检查点阻断疗法的疗效以及相关重度免疫相关毒副反应的发生率。
•调节宿主免疫反应
粪便移植(FMT)已被证明可有效改善黑色素瘤或上皮肿瘤患者对PD-1治疗的总体反应,这表明肠道微生物群在PD-1治疗后调节宿主免疫反应中的重要作用。
•降低相关副作用发病率
另一方面,一项针对接受抗CTLA-4治疗的黑色素瘤患者的研究表明,拟杆菌(Bacteroidetes)的富集与结肠炎的发病率降低密切相关。
尽管有这些发现,但仍然迫切需要提高效率并消除免疫检查点阻断疗法的副作用,这依赖于对宿主与免疫检查点阻断反应的机制的深入理解,以及宿主免疫反应、免疫检查点阻断疗法和肠道微生物群之间相互作用。
嵌合抗原受体免疫疗法
嵌合抗原受体免疫疗法(CAR-T细胞疗法)是一种新型的癌症免疫疗法,它利用改造后的T细胞来攻击癌细胞。
CAR-T细胞疗法的基本原理是将患者的T细胞收集后,通过基因工程技术将其改造成能够识别并攻击癌细胞的CAR-T细胞,再将其注入患者体内。
▸ 作用机理
传统上,T细胞活化依赖于T细胞受体与细胞表面主要组织相容性复合体(MHC)呈递的特异性抗原(包括肿瘤细胞相关抗原)之间的相互作用,这种相互作用经常被肿瘤细胞下调。
为了克服这一问题,研究人员设计了一种嵌合抗原受体蛋白(由癌症抗原特异性B细胞的外结构域和T细胞的细胞内结构域组成),并在患者的正常T细胞中人工表达,以产生CAR-T细胞。
CAR-T细胞具有更强的杀伤性
与正常T细胞相比,CAR-T细胞在体外和体内对肿瘤细胞表现出更高的亲和力和更强的杀伤活性。CAR-T疗法最早用于治疗包括淋巴瘤和白血病在内的血癌,与传统疗法相比,CAR-T疗法表现出更好的效果。
✦嵌合抗原受体免疫疗法适用于的癌症
目前,CAR-T疗法已被批准用于治疗各种癌症,包括复发性或难治性多发性骨髓瘤、弥漫性大B细胞淋巴瘤、高级别B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤、急性淋巴细胞白血病等。
此外,CAR-T疗法治疗其他类型癌症的潜力也在临床和临床前研究中进行了评估。
✦嵌合抗原受体免疫疗法的局限性
•产生耐药性、抗原逃逸
CAR-T疗法也有明显的缺点,最具挑战性的问题之一是肿瘤对单一抗原靶向CAR构建体的耐药性。
尽管施用CAR-T细胞最初产生高反应率,但相当比例的患者经历了靶抗原表达的部分或完全丧失,这被称为抗原逃逸。
据报道,70-90%的急性淋巴细胞白血病患者在初始阶段对CD19 CAR-T治疗表现出持久的反应;但复发后CD19抗原表达下调或丢失的比例为30-70%
在CAR-T治疗的多发性骨髓瘤患者中,也观察到包括B细胞成熟抗原(BCMA)在内的其他靶点的下调。
•全身细胞因子释放综合征
CAR-T治疗在临床上的另一个挑战是全身细胞因子释放综合征(CRS),其特征是低血压、心功能障碍、循环衰竭、呼吸衰竭、肾衰竭、多器官系统衰竭等,如果控制不好可能会危及生命。
注意:促炎性白细胞介素1和白细胞介素6被认为是CAR-T治疗中CRS的关键介质;因此,IL-6/IL-6R阻断被认为是消除CRS的潜在途径。
然而,即使使用tocilizumab,一种食品药品监督管理局批准的用于治疗严重全身细胞因子释放综合征的IL-6R单抗,症状仍然持续并最终导致患者死亡。
迄今为止,仍然缺乏对抗CAR-T疗法诱导的全身细胞因子释放综合征的有效策略。
此外,CAR-T治疗实体瘤的疗效因组织浸润能力低而降低,导致治疗结果较差。利用局部注射代替全身给药来促进CAR-T细胞的肿瘤浸润,而这仅适用于单个肿瘤病变/低转移疾病。
✦肠道微生物可能在CAR-T疗法起作用
最近发现了肠道微生物群和CAR-T疗法的反应/毒性之间的相关性。
根据一项队列研究,肠道微生物谱与B细胞恶性肿瘤患者接受抗CD19 CAR-T细胞治疗后的反应和毒性密切相关,这表现在接受/未接受抗生素治疗的患者中不同的细菌分类和代谢途径,以及暴露于抗生素的患者中观察到的较差存活率和增加的神经毒性。
最新发表的一项研究表明,在开始CAR-T治疗前,患者的基线肠道菌群特征可以预测之后对治疗的应答情况,但前提是这些患者没有预先使用广谱抗生素,因为这会破坏菌群与治疗反应间的关联。
然而,关于肠道微生物群在CAR-T治疗结果中的作用,仍然有很大程度的未知,并且仍然缺乏对其机理的认识,需要更多相关研究阐述其机制。
其他免疫疗法
除了上述的主流癌症免疫疗法,还有其他几种已经开发或正在研究的免疫疗法。
细胞因子疗法
白细胞介素-2(IL-2)是细胞因子疗法的典型例子,并于1992年被批准用于治疗转移性肾细胞癌,但包括毛细血管渗漏综合征和多器官功能障碍在内的严重毒性限制了白细胞介素-2的使用。
T细胞受体工程疗法
T细胞受体工程(TCR-T)疗法是一种类似CAR-T的过继细胞转移(ACT)疗法,其特点是通过植入肿瘤抗原特异性TCR分子对T细胞进行基因修饰。
TCR-T的优势已在临床前和临床研究中得到充分证明
除此之外,癌症疫苗和溶瘤病毒疗法也被认为是治疗癌症的有效策略。然而,肠道微生物群在调节癌症免疫疗法的效率或毒性方面的作用仍然需要解决。
肠道微生物群是生活在消化道中的复杂微生物群落,与身体的任何其他部分相比,其数量和种类最多。
众所周知,人类肠道中的微生物对宿主的健康起着重要作用。微生物群成分之间的相互作用以及它们与宿主免疫系统的关系以多种方式影响疾病的发展。
例如,它通过定居粘膜表面和分泌各种抗微生物物质来保护宿主免受病原体的侵害,这有助于增强免疫反应。
此外,肠道菌群在消化代谢、控制上皮细胞增殖分化、调节胰岛素抵抗、脑肠联系等方面发挥着重要作用。
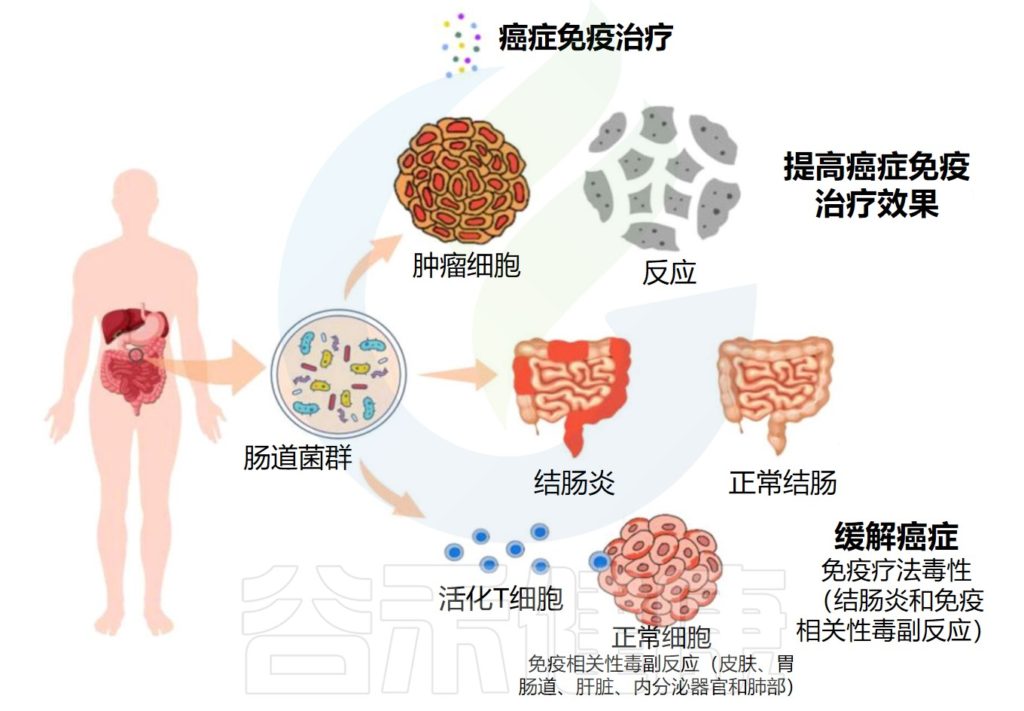
★ 肠道菌群对癌症免疫治疗的效果和副作用有显著影响
关于癌症免疫疗法,来源于肠道微生物群的组成、生物活性和代谢产物显示出对治疗的效率和副作用有显著影响。
编辑
Wei Y,et al.Front. Oncol.2023
肠道菌群影响癌症免疫疗法效果
先前的一些研究已经揭示了黑色素瘤中肠道微生物群和抗PD-1功效之间的关系。
肠道菌群影响黑色素瘤细胞的生长
检查了在两个设施中饲养的遗传相似的小鼠中黑色素瘤的皮下生长。
他们发现,其中一组肿瘤生长更具侵略性,这与肿瘤内CD8+ T细胞积累显著降低有关,而这受肠道菌群组成的影响。
不同肠道微生物群接受癌症免疫治疗反应不同
一组研究人员检查了接受抗PD-1治疗的黑色素瘤患者的肠道微生物群,并观察到有反应者和无反应者之间肠道微生物群的多样性和组成有显著差异。
肠道微生物影响CAR-T治疗的患者生存率
此外,一项回顾性队列研究发现,在CAR-T治疗前四周暴露于抗生素可能会降低患者的生存率并增加神经毒性的发生率,这强调了肠道微生物群与CAR-T治疗效率之间的关联。
特定的肠道微生物在癌症免疫治疗中的参与也被发现。
✦双歧杆菌在免疫治疗中的抗肿瘤作用
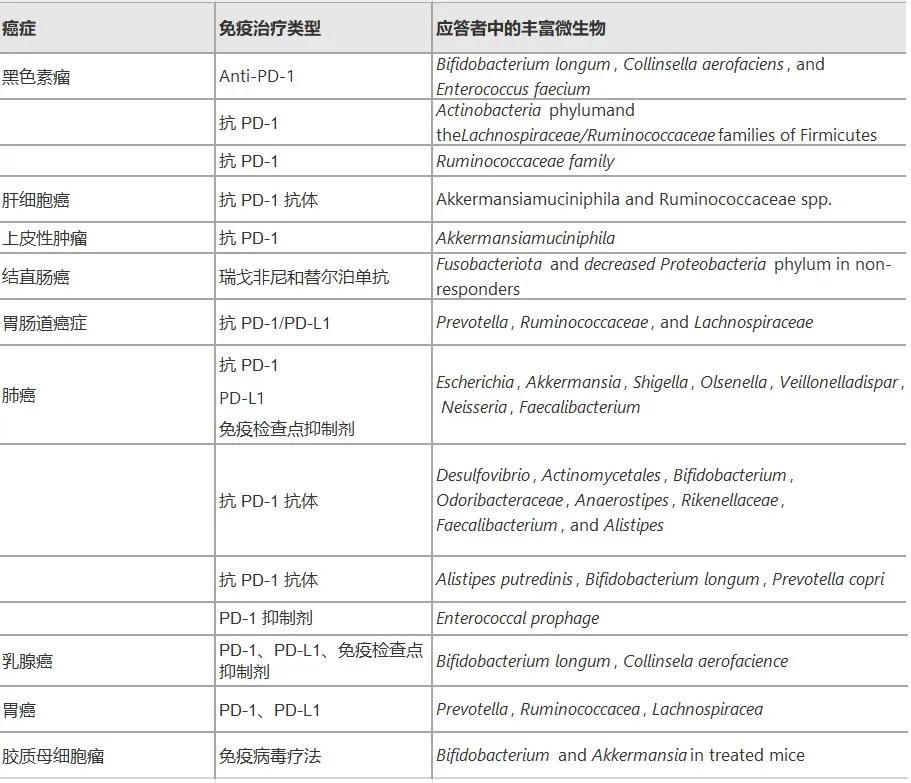
在抗PD-1免疫治疗前从转移性黑色素瘤患者收集的粪便样本,发现长双歧杆菌(Bifidobacterium Longum)、产气柯林斯菌(Collinsella aerofaciens)以及屎肠球菌(Enterococcus faecium)在应答者中更丰富,这表明在PD-1免疫疗法的背景下双歧杆菌的抗肿瘤作用。
✦拟杆菌影响CTLA-4阻断剂的抗肿瘤作用
类似地,先前的研究表明CTLA-4阻断的抗肿瘤作用依赖于不同的拟杆菌物种,因为T细胞对多形拟杆菌(B.thetaiotaomicron)或脆弱拟杆菌(B.fragilis)
的特异性反应与CTLA-4阻断剂的疗效相关。
✦肠道菌群调节癌症免疫治疗效率
为了确定肠道菌群在调节患者对免疫检查点阻断治疗反应中的生物学作用,评估了粪菌移植(来自PD-1应答者)和抗PD-1给药联合治疗PD-1难治性黑色素瘤患者的疗效。
结果显示,应答者表现出先前被证明与抗PD-1反应相关的类群丰度增加,CD8+ T细胞激活增加,白细胞介素8表达髓系细胞频率降低。
应答者具有不同的蛋白质组和代谢组特征,跨域网络分析揭示了肠道微生物群在调节这些变化中的主导作用。这些结果证实了肠道微生物群在提高抗PD-1对黑色素瘤的效率方面的作用。
✦肠道微生物增强PD-1疗法对抗其他癌症
除此之外,还发现肠道微生物群在增强PD-1疗法对抗其他癌症类型。某些肠道微生物物种在调节癌症免疫疗法效率方面的生物学作用已经在以前的研究中得到了解决。
双歧杆菌(Bifidobacterium)在抗PD-1治疗过程中有利于促进抗肿瘤免疫应答。
脆弱拟杆菌(B.fragilis) 肠道定植与CTLA – 4阻断治疗之间的因果关系已通过粪便移植和脆弱拟杆菌植入得到很好的证明。
阿克曼菌提高了黑色素瘤患者PD-1的阻断效果
在一项类似的研究中,嗜黏蛋白阿克曼菌(Akkermansia muciniphila)在调节黑色素瘤患者对抗pd -1治疗的反应中的起作用。
在无应答者粪菌移植后口服嗜黏蛋白阿克曼菌(A.muciniphira),显著恢复了PD-1阻断的功效。
总之,这些发现强调了肠道菌群在提高癌症免疫治疗效率方面的重要性。
肠道微生物群改善癌症免疫疗法的毒性
关于癌症免疫治疗中肠道微生物群的另一个问题,是肠道微生物的组成或生物活性的改变如何影响免疫疗法相关毒性风险。
✦肠道菌群影响癌症免疫治疗后结肠炎的患病率
研究表明,肠道菌群的组成可以预测患者在接受阻断CTLA-4的单克隆抗体治疗后是否会发生结肠炎。
无结肠炎患者的拟杆菌门比例较高
16S rRNA基因测序/16S rDNA测序结果显示,在治疗前,结肠炎组和无结肠炎组的微生物组成相似,但治疗后仍无结肠炎的患者的拟杆菌门比例较高。
以下菌属在结肠炎耐药患者粪便中含量较高:
拟杆菌(Bacteroidaceae)、
巴恩斯氏菌科(Barnesiellaceae)
Rikenellaceae
注:上面三种细菌都是拟杆菌门下的生物
宏基因组测序分析进一步显示,与多胺转运和B族维生素生物合成相关的4个微生物模块在无结肠炎患者的微生物区系中更为丰富。
✦肠道微生物群缓解CAR-T疗法副作用
肠道微生物群也可用于预测抗PD-1/PD-L1疗法的副作用风险。
免疫相关毒副反应程度不同下的菌群丰度也不同
根据一项观察性研究,严重免疫相关毒副反应的患者以下菌属丰度较高:
链球菌(Streptococcus)
Paecalibacterium
Stenotrophomonas
轻度免疫相关毒副反应患者则富含Faecaliberium和毛螺菌(Lachnospiraceae)。
类似地,另一项临床研究显示,在经历临床显著性或不显著性irAEs的患者之间,肠道微生物群存在明显的组成差异。
拟杆菌丰度可能影响免疫治疗的相关副作用
在一项更全面的研究中,77名接受靶向PD-1和CTLA-4的联合免疫检查点阻断治疗的晚期黑色素瘤患者的血液、肿瘤和肠道微生物组被分析,在以结肠炎和黏膜白细胞介素1b上调为特征的毒性患者中发现肠拟杆菌丰度显著更高。
此外,如上所述,在接受CD19 CAR-T治疗的B细胞淋巴瘤和白血病患者中,抗生素暴露与神经毒性的高发相关。这间接证实了肠道菌群可以缓解CAR-T治疗的相关副作用。
肠道微生物治疗了免疫疗法引起的结肠炎
作为免疫检查点阻断疗法的另一个常见副作用,结肠炎通常用免疫抑制药物治疗,包括皮质类固醇或靶向肿瘤坏死因子-α (TNF-α)的药物,所有这些都具有明显的副作用。
显示结肠炎和炎症性肠病可以通过肠道微生物群操作成功治疗。
谷禾与浙一团队合作的研究,通过比较不同CAR-T治疗阶段的肠道菌群的多样性和组成,我们发现患者之间和治疗阶段之间的肠道菌群特征存在差异,并且可能反映复发/难治性多发性骨髓瘤(MM)、急性淋巴细胞白血病(ALL)和非霍奇金淋巴瘤(NHL)患者对治疗的反应。

这项研究对于理解肠道菌群在CAR-T治疗血液恶性肿瘤患者的治疗反应性中的生物学作用具有重要意义,并可能指导治疗干预以增加疗效。MM、ALL和NHL的治疗反应以及多发性骨髓瘤中严重细胞因子释放综合征的发生与特定的肠道菌群变化相关。
小结
总的来说,肠道微生物群在调节癌症免疫疗法的疗效和副作用方面的生物学作用已被充分证明,这预示着未来促进癌症免疫疗法的新策略的发展。
随着对肠道菌群的深入了解,最近也对优化患者和健康人群肠道微生物的潜在方法进行了评估。
粪菌移植和单菌移植(益生菌给药)在改善患者健康方面取得了良好的效果,但对暴露于粪菌移植的异体菌株的患者可能是有害的,并使人们容易患上自身免疫性疾病等慢性疾病。
相反,饮食干预或益生元补充可能更适合普通人群,因为它被认为危害较小,更容易被接受。同时,有必要阐明饮食干预对肠道微生物群调节机制。
不同饮食对肠道菌群的影响
许多膳食补充剂被确定具有“微生物调节”活性。
✦大量摄入动物性食品导致菌群结构不健康
动物性食品是动物来源的食物,包括畜禽肉、蛋类、水产品、奶及其制品等。
总的来说,动物性食品中氨基酸发酵产物含量较高,碳水化合物发酵产物含量较低,而氨基酸发酵产物含量与耐胆汁的拟杆菌(Bacteroides)和梭状芽孢杆菌(Clostridia)等微生物数量呈正相关。
相比之下,有益细菌,如双歧杆菌(Bifidobacteria)与动物食品的消费呈负相关。
高脂肪和动物性饮食可以促进沃氏嗜胆菌生长(Bilophila wadsworthia)——产生硫化氢的细菌,这可能是胃肠道炎症的原因。然而,大量摄入多不饱和脂肪会促进瘤胃球菌(Ruminococcus)在肠道内的生长。
✦富含纤维的饮食有助于维持肠道菌群稳态
几项研究揭示了纤维在植物性饮食中的作用。例如,富含碳水化合物和纤维的饮食增加了肠道微生物的多样性和丰富性,其特征是拟杆菌门(Bacteroidetes)数量增加,厚壁菌门/拟杆菌门比例降低。
高纤维摄入还促进了厚壁菌(Firmicutes)和变形菌(Proteobacteria)的生长,而这两种细菌在食用高脂肪饮食的受试者中通常很低。而大量摄入单糖而非纤维导致拟杆菌(Bacteroides)大量生长。
素食不含任何肉类或鱼类,但富含碳水化合物和纤维。食用素食导致短链脂肪酸的产生增加,这有利于预防胃肠道炎症和维持肠道微生物菌群的稳态。
✦优质的蛋白可以增加肠道菌群多样性
研究发现蛋白质的摄入增加了肠道菌群的多样性;然而,影响取决于蛋白质的来源。
值得注意的是,乳清和豌豆蛋白的摄入增加了双歧杆菌(Bifidobacterium)和乳酸杆菌(Lactobacillus)的水平,同时限制了脆弱拟杆菌(Bacteroides fragilis)和产气荚膜梭菌(Clostridium perfringens)的生长。
此外,豌豆蛋白增加了胃肠道中短链脂肪酸的水平。同时,动物蛋白饮食刺激耐胆汁厌氧菌。
植物化学物质对肠道菌群的调节
除了评估动物或植物性饮食对肠道微生物群的作用,还评估了植物化学物质以及益生元对肠道微生物群的调节活性。
包括多酚、类胡萝卜素、植物甾醇、木脂素、生物碱在内的植物化学物质已被证明对肠道微生物群的调节具有积极作用。
✦类胡萝卜素有助于维持肠道免疫稳态来提高抗肿瘤效率
补充类胡萝卜素如虾青素或视黄酸有助于通过诱导IgA产生来维持肠道免疫稳态。一项研究表明越橘花青素的消耗通过调节肠道微生物群的组成来促进免疫检查点阻断疗法的效率。
抗PD-L1抗体的抗肿瘤效率在口服越橘花青素后增强,同时在粪便中富集梭状芽孢杆菌(Clostridia)和约氏乳杆菌(Lactobacillus johnsonii)。
✦益生元通过调节共生微生物增强抗肿瘤效果
益生元,包括低聚果糖、低聚半乳糖、大豆低聚糖、菊粉等。通过增加共生菌如乳酸杆菌和双歧杆菌的数量,在调节肠道微生物群方面发挥作用。
一项研究报告称,口服菊粉凝胶可以通过调节共生微生物来增强α-PD-1治疗的抗肿瘤疗效,并通过激发记忆性CD8+T细胞反应来产生有效的长期抗肿瘤效果。
膳食真菌对肠道微生物群的影响
尽管在植物和动物的天然产物中发现了有趣的发现,但很少有研究研究来自膳食真菌的天然产物,这也可能对肠道微生物的组成和生物活性的调节有潜在影响。
1
香菇多糖调节了肠道微生物多样性
香菇是一种富含多种多糖的食用菌,研究表明,给予香菇多糖显著改变了小鼠小肠、盲肠、结肠和远端结肠(粪便)微生物群的多样性。具体而言,减少了拟杆菌(Bacteroidetes)与增加了变形菌(Proteobacteria)。
一项研究报道,香菇副产物(LESDF-3)可以促进拟杆菌(Bacteroides)的产生,表明香菇在调节肠道菌群方面的重要性。
与此同时,多项研究也证实了冬虫夏草多糖、黑木耳多糖、灵芝多糖、灰树花多糖、平菇多糖、猴头菌多糖、野生羊肚菌多糖在重塑肠道菌群、调节免疫等方面的生物学功能。
2
灵芝孢子油可以增强免疫活性,减少有害菌
灵芝长期以来被认为在药物治疗和饮食补充方面有价值。
根据最近的一项研究,灵芝孢子油具有很强的免疫增强活性,可导致几种有益细菌的丰度升高:
罗伊氏乳杆菌(Lactobacillus reuteri) ↑↑↑
肠乳酸杆菌(Lactobacillus intestinalis) ↑↑↑
Turicibacter ↑↑↑
Romboutsia ↑↑↑
并降低葡萄球菌(Staphylococcus)和幽门螺杆菌(Helicobacter)的丰度。
这些肠道菌群的改变进一步导致一系列关键代谢产物的分泌,如多巴胺、谷氨酰胺、蛋氨酸、L-苏氨酸、硬脂酰肉碱等,以增强巨噬细胞的吞噬能力和自然杀伤细胞的细胞毒性。
3
膳食真菌中的β-葡聚糖移植有害菌,上调
有益菌丰度
菊粉是一种存在于各种天然产品中的天然多糖,被认为是一种强有力的益生元,有趣的是,膳食真菌中的β-葡聚糖也表现出与菊粉相当的效果。
β-葡聚糖是由葡萄糖单位组成的多聚糖。它能够活化巨噬细胞、嗜中性白血球等,因此能提高白细胞素、细胞分裂素和特殊抗体的含量,全面刺激机体的免疫系统。
具体而言,β-葡聚糖可以通过抑制有害肠道微生物群的增殖,同时上调有益拟杆菌的丰度,从而调节肠道微生物群的结构和组成。
此外,β-葡聚糖和菊粉都能选择性地促进双歧杆菌(Bifidobacterium)的生长。来自蘑菇的D-葡聚糖对肠道菌群的调节也有类似的作用,因此可以认为是一种新型的益生元。
膳食真菌在调节肠道微生物群中的作用总结于下表:
膳食真菌中生物活性成分在调节肠道菌群中的作用

Wei Y,et al.Front. Oncol.2023
膳食真菌对癌症免疫治疗的影响
先前的研究已经调查了来自膳食真菌的关键成分在癌症免疫调节中的作用。
✦真菌中β-葡聚糖增强抗肿瘤免疫反应
真菌细胞壁的主要成分是β-葡聚糖,据报道,β-葡聚糖可作为有效的免疫调节剂,通过调节单核细胞骨髓源抑制细胞(MDSCs)的分化和功能来增强抗肿瘤免疫反应。
骨髓源抑制性细胞——它含义是骨髓来源的一群抑制性细胞,是树突状细胞、巨噬细胞或粒细胞的前体,具有显著抑制免疫细胞应答的能力。
姬松茸多糖刺激MDSC从M2向M1型分化,通过toll样受体2介导抑制肿瘤免疫逃避。
后来发现,自然杀伤细胞、巨噬细胞和树突状细胞负责介导真菌产物引起的抗肿瘤免疫反应。
✦双孢菇多糖激活自然杀伤细胞对结肠癌细胞的治疗作用
一项研究表明,双孢蘑菇多糖MH751906通过激活肠道自然杀伤细胞对结肠癌产生免疫治疗作用,这些激活的自然杀伤细胞对人结肠癌细胞具有稳定的杀伤作用。
✦灵芝中的成分在抗肿瘤过程中起到重要作用
灵芝多糖可部分或完全拮抗B16F10黑素瘤细胞对腹腔巨噬细胞活力的抑制,提示其在癌症免疫治疗中的潜在作用。
后续研究发现灵芝的抗肿瘤作用来自于在体内刺激树突状细胞成熟和启动对Th1辅助细胞极化的适应性免疫应答。
两项研究均表明灵芝介导的免疫调节机制在抗肿瘤过程中起作用。
✦其他一些膳食真菌成分的抗肿瘤作用
一项研究报告称牛肝菌RNA也可以刺激自然杀伤细胞对抗骨髓性白血病。
另一项研究揭示了孤苓多孔菌多糖-蛋白复合物的免疫调节活性,通过激活巨噬细胞介导的宿主免疫应答发挥抗肿瘤作用。
此外,云芝多糖肽(PSP)可增强巨噬细胞的吞噬作用,增加细胞因子和趋化因子的表达,促进树突状细胞和T细胞向肿瘤的浸润,具有免疫治疗肿瘤的作用。
膳食真菌在癌症免疫治疗中的确切作用除了少数报道了相关作用的研究外,在很大程度上仍然是未知的。
✦膳食真菌可以增强免疫阻断疗法效果
一项研究发现蛹虫草多糖通过抑制肿瘤相关巨噬细胞和T淋巴细胞之间的PD-1/PD-L1轴,将免疫抑制巨噬细胞转化为M1表型并激活T淋巴细胞,这可能提高抗PD-1/PD-L1免疫治疗的有效性。
另一项研究表明,人参多糖改变了肠道菌群和犬尿氨酸/色氨酸的比例,增强了PD-1/PD-L1免疫治疗的抗肿瘤作用。阐明了真菌多糖通过肠道菌群增强免疫检查点阻断疗法抗肿瘤作用。
✦提高癌症疫苗疗效
除了增强免疫检查点阻断疗法的治疗效果外,服用真菌产物也有提高癌症疫苗疗效的报道。口服香菇菌丝体提取物可增强肽疫苗的抗肿瘤活性,表明香菇提取物在癌症免疫治疗中具有重要作用。
总的来说,全面了解膳食真菌在癌症免疫治疗中的作用及其分子机制是非常有前景的,肠道菌群在这一过程中的参与也需要进一步研究。
膳食真菌在调节针对癌症的宿主免疫反应中的作用总结于下图:
膳食真菌在治疗各种类型癌症中的生物学作用和机制

Wei Y,et al.Front. Oncol.2023
膳食真菌对癌症免疫治疗的临床研究
迄今为止,已经进行了一些临床研究来评估真菌产物的抗肿瘤活性和潜在机制。
•灰树花抑制肺癌或乳腺癌转移
研究表明,灰树花能抑制肺癌或乳腺癌的转移,减小肿瘤的大小,这是通过增加自然杀伤细胞活性和促进Th1细胞反应实现的,而Th2细胞活性降低。
•灵芝多糖对晚期癌症的抗肿瘤作用
另一项研究表明,灵芝多糖对多种类型的晚期癌症具有抗肿瘤作用,这是通过刺激宿主免疫反应来实现的,包括白细胞介素2、白细胞介素6、人干扰素-g(IFN-g)的分泌增加,自然杀伤细胞活性增强,而白细胞介素-1b和肿瘤坏死因子的浓度较基线降低。
48名乳腺癌患者接受了灵芝孢子粉,并显示治疗后患者血清中肿瘤坏死因子的浓度显著降低,这伴随着肿瘤负荷的减轻。
•双孢蘑菇对前列腺癌具有一定抗肿瘤作用
此外,一项I期试验证明双孢蘑菇通过调节白细胞介素15水平和骨髓源抑制性细胞活性对前列腺癌具有抗肿瘤作用。
•平菇和羊角草也具有抗肿瘤活性
平菇,也被发现通过调节宿主免疫具有抗肿瘤作用。
通过临床试验研究了羊角草的抗肿瘤活性,发现血清中人干扰素-g和白细胞介素12水平随着自然杀伤细胞活性的升高而升高,提示Th1免疫应答参与了羊角草的靶向抗肿瘤活性。
临床上还评估了活性己糖相关化合物(AHCC,从担子菌蘑菇香菇中获得)对腺癌的抗肿瘤作用和免疫调节活性,治疗导致中性粒细胞增加,CD4+/CD8+、CD3+/CD16+/CD56+NK细胞的比例也相应增加,而淋巴细胞和单核细胞的数量减少。
总的来说,真菌产品的抗肿瘤作用以及分子机制已被很好地记录,然而,大多数结论仅基于小样本得出。
此外,尽管临床研究已经证实真菌产品可以增强化疗和放疗的抗肿瘤作用,但关于真菌产品在癌症免疫治疗中的有效性的临床证据仍然缺乏。因此,还需要额外的试验来研究真菌产品对癌症免疫治疗的临床效果。
膳食真菌在不同癌症中的作用总结下图:
膳食真菌治疗不同类型癌症的结果

Wei Y,et al.Front. Oncol.2023
近年来,随着高通量多组学技术(包括微生物扩增子、宏基因组、宏转录组、代谢组)的发展,肠道微生物群对人类健康的生物学相关性已得到充分认识。
肠道微生物在调节宿主免疫稳态方面具有多种功能,这有利于预防许多疾病,对改善癌症免疫治疗也有一定作用。
由于肠道微生物群与癌症患者在治疗时的临床特征密切相关,因此可通过评估其肠道微生物群来预测个体的情况。
食用真菌含有多种能被肠道微生物识别的营养物质,对肠道微生物群起到多种影响,并在癌症免疫治疗中起到作用。对膳食真菌和肠道微生物群的研究将为当前的免疫抗癌疗法提供非常有价值的帮助。
主要参考文献
Wei Y, Song D, Wang R, Li T, Wang H and Li X (2023) Dietary fungi in cancer immunotherapy: From the perspective of gut microbiota. Front. Oncol. 13:1038710. doi: 10.3389/fonc.2023.1038710.
Waldman AD, Fritz JM, Lenardo MJ. A guide to cancer immunotherapy: From T cell basic science to clinical practice. Nat Rev Immunol (2020) 20(11):651–68. doi: 10.1038/s41577-020-0306-5.
June CH, O’Connor RS, Kawalekar OU, Ghassemi S, Milone MC. Car T cell immunotherapy for human cancer. Science (2018) 359(6382):1361–5. doi: 10.1126/science.aar6711.
Zhao Q, Jiang Y, Xiang S, Kaboli PJ, Shen J, Zhao Y, et al. Engineered tcr-T cell immunotherapy in anticancer precision medicine: Pros and cons. Front Immunol (2021) 12:658753. doi: 10.3389/fimmu.2021.658753.
Tan S, Li D, Zhu X. Cancer immunotherapy: Pros, cons and beyond. BioMed Pharmacother (2020) 124:109821. doi: 10.1016/j.biopha.2020.109821.
Yan Z, Zhang H, Cao J, Zhang C, Liu H, Huang H, et al. Characteristics and risk factors of cytokine release syndrome in chimeric antigen receptor T cell treatment. Front Immunol (2021) 12. doi: 10.3389/fimmu.2021.611366.
Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol (2021) 19(1):55–71. doi: 10.1038/s41579-020-0433-9.