-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
慢性肾病(CKD)在全球具有高发病率,并且发病率还在不断上升。CKD进展的机制之一涉及肾脏与肠道之间紊乱的器官间关系,被称为肾-肠轴。
在慢性肾病(CKD)中,两种病理性肠道状况——尿毒症性菌群失调(肠道微生物组成紊乱)和肠道通透性增加——促进了CKD的进展。
菌群失调与肠道源性尿毒症毒素产生增加、肠道渗漏和慢性系统性炎症相关,导致尿毒症恶化,进而加重肠道状况。这种恶性循环应该成为CKD治疗策略的目标。
对尿毒症性菌群失调的调节,包括益生元、益生菌和合生元,一直是典型的治疗方法,尽管关于其有效性的临床证据不足。一些非抗生素药物对人类肠道细菌有影响,这被认为在其肾功能临床疗效中发挥作用。
营养疗法,包括低蛋白饮食、膳食纤维、地中海饮食和全谷物,对肠道微生物群组成产生积极影响,并已与CKD风险降低相关联。
目前正在探索使用后生元、微生物组测序技术和粪菌移植等新策略来治疗或改善慢性肾病。
近年来,肾脏和肠道之间的器官间关系引起了关注。这种关系,被称为肾-肠轴,涉及肠道激素如生长激素释放肽和肠促胰岛素对肾脏的作用,以及尿毒症毒素吸收对肾功能的影响。
研究表明,在慢性肾脏疾病(CKD)中,某些肠道基因的表达和肠道微生物组成会发生改变。在终末期肾脏疾病患者中也观察到了类似的肠道微生物群落变化。
我们在之前的文章中也讲过:
肾-肠轴代表了一种以肾脏为中心的新型器官间关系,并且越来越被认为是CKD的潜在治疗靶点。
肾肠轴
Wakino S,et al.Nutrients.2025
✔ 肾功能下降时肠道微生物产生的毒素在体内积累
随着肾功能下降,由肠道细菌产生的尿毒症毒素在体内积累。已确定的毒素包括:
-对甲酚硫酸酯(pCS)
-吲哚硫酸酯(IS)
-三甲胺-N-氧化物(TMAO)
-二甲基甘氨酸
-戊二酸
这些毒素都与心血管事件有关。其中,吲哚硫酸酯(IS)和对甲酚硫酸酯(pCS)已知会增加心血管组织中的氧化应激,导致组织损伤。
这些毒素被认为源于肠道,是由于肾衰竭相关的肠道微生物群落改变所致。此外,研究表明肾衰竭时肠道通透性增加,这一过程由紧密连接蛋白如claudin、occludin和zonula occludens-1(ZO-1)调控。在慢性肾病中,这些维持上皮完整性的紧密连接蛋白表达下调。
肠道衍生的尿毒症毒素
Wakino S,et al.Nutrients.2025
✔ 肾衰竭患者存在肠道菌群失调和肠漏
在慢性肾衰竭大鼠模型中,观察到肠道内拟杆菌属增加,同时吲哚(肾毒素IS的前体)产生增加。相反,乳酸杆菌属丰度下降,导致toll样受体表达减少,继而紧密连接蛋白水平下降。紧密连接蛋白减少导致肠道通透性增加,促进吲哚的系统性吸收,吲哚随后在肝脏中转化为吲哚硫酸酯(IS)并促进系统性炎症。
IS水平升高与细胞因子产生增加相关,特别是白细胞介素-6(IL-6),这与CKD中心血管并发症风险增加相关。因此,肠道的两个关键病理变化——尿毒症菌群失调和肠道通透性增加(肠漏)——可能导致肾衰竭中的心血管事件。
肾功能衰竭中肠道环境的变化
Wakino S,et al.Nutrients.2025
菌群失调存在几种潜在机制:
其中一种是进行性肾功能衰竭中血液尿素或尿酸浓度升高。肠道细菌通过肠道分泌物接触尿素,导致尿素通过细菌尿素酶转化为氨。这种高浓度的尿素导致含有尿素酶的细菌家族过度生长。与健康对照组相比,终末期肾病(ESRD)患者体内产生尿酸酶和吲哚及对甲酚形成酶的细菌家族数量增加。
<来自:谷禾肠道菌群健康检测数据库>
关于对甲酚,我们在之前的文章中也写过:对甲酚——自闭症辅助诊断和干预的关键指标
同样,慢性肾病中尿酸分泌增加也导致产生尿酸酶的细菌种类增加。然而,在人类中,有时无法将尿毒症的影响与个体间差异、合并症以及饮食和药物干预的影响区分开来。
研究型试验使用实验性慢性肾病大鼠模型,显示5/6肾切除导致细菌组成丰度与对照动物相比有显著差异。这些实验证据支持菌群失调是慢性肾病的一种影响的结论。
✔ 菌群代谢物短链脂肪酸对肾脏有保护作用
肠道菌群还通过产生如短链脂肪酸(SCFAs)等代谢物对肾脏损伤起保护作用。急性肾损伤动物模型研究显示,SCFA给药可减轻肾脏损伤。SCFAs有助于维持肠屏障,促进调节性T细胞(Tregs)分化和增殖,这些细胞抑制炎症并调节肠道免疫。SCFAs还增强胰高血糖素样肽-1(GLP-1)分泌,这种肠源性激素调节葡萄糖和脂质代谢并具有抗炎作用。
在慢性肾病中,由于富含钾食物的饮食限制以及与产毒素微生物群的竞争,产生SCFA的肠道细菌数量减少,加剧疾病进展。研究显示,除产生尿毒症毒素的细菌增加外,产生SCFA的物种如乳酸杆菌、普雷沃菌和双歧杆菌数量减少。
这些变化归因于多种因素:包括尿毒症毒素积累、代谢性酸中毒、口服铁制剂和螯合剂对肠道功能的影响、缺血引起的肠道功能障碍,以及纤维摄入不足和便秘导致的肠道通过时间延长。
最近小鼠慢性肾病模型研究确定了新途径:普拉梭菌(Faecalibacterium prausnitzii)可能有助于肾功能恢复。这种效果与丁酸盐介导的G蛋白偶联受体43(GPR-43)在肾脏中的信号激活相关,突显了慢性肾病管理的潜在治疗途径。
目前有哪些通过针对肾-肠轴相互作用机制来改善慢性肾病的治疗干预策略和方法,以及这些策略在临床实践中的应用现状如何?
1
益生菌、益生元、合生元
✔ 通过调节肠道菌群有助于降低肾脏毒素
肾脏-肠道轴治疗慢性肾病主要通过改善菌群失调和减少尿毒症毒素发挥作用。益生元、益生菌和合生元虽能降低血液中吲哚硫酸盐和对-甲酚硫酸盐等毒素,但缺乏改善肾功能和生存率的证据。
近期研究显示,乳酸菌和双歧杆菌对慢性肾病G3期患者的干预改善了铁代谢、炎症和脂质代谢,但未显著影响肾小球滤过率(eGFR)。对血液透析糖尿病患者使用益生菌改善了葡萄糖稳态和营养状态,但同样未能改善肾功能。
注:肾小球滤过率(eGFR)是评估肾功能的核心指标,反映肾脏每分钟过滤血液的能力,用于早期发现肾功能损伤和监测慢性肾病进展。
补充产生短链脂肪酸的微生物和调节肾脏菌群可能有助于减缓慢性肾病进展,但目前证据显示益生菌虽能降低尿毒症毒素,却不改善肾功能。2022年意大利一项研究发现,在低蛋白饮食基础上添加益生菌12周可减少尿毒症毒素和药物剂量,但尿蛋白或eGFR无显著改善,仅情感功能有所提升。
SYNERGY II研究中,合生元补充12个月改变了肠道菌群,与肾小球滤过率(eGFR)下降相关,但两组在心血管功能、毒素水平、血压等方面无显著差异。
✔ 调整肠道菌群可降低炎症标志物,配合饮食干预效果更佳
近期荟萃分析显示益生元、益生菌或合生元在慢性肾病管理中的证据支持有限。一项涵盖16项随机对照试验的分析显示,这些干预对慢性肾病患者血清尿素和尿毒素几乎无影响。虽然合生元增加了双歧杆菌丰度,但临床意义不明确。另一项透析患者分析显示益生菌补充可降低炎症标志物并提高高密度脂蛋白水平。
尽管结果矛盾,生物制剂治疗仍有前景。研究局限包括试验时间短、样本量小、菌株差异大等导致结果不一致。改进建议包括延长试验时间、基于科学证据选择菌株。
需要认识到肾-肠轴只是慢性肾病病理的一部分,尿毒症毒素积累还受肾脏排泄减少等因素影响,慢性肾病进展涉及多种病理机制。单纯调节微生物群效果可能有限,需结合全面营养治疗来改善菌群失调。
2
非抗生素药物的影响
多种药物具有益生元效果,包括许多非抗菌药物都能改变肠道菌群。
SGLT-2抑制剂,中文名为钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂,可以抑制肾脏对葡萄糖的重吸收,使过量的葡萄糖从尿液中排出,降低血糖。
✔ 卡格列净提升乳杆菌水平并减少尿毒症毒素
SGLT-2抑制剂是降血糖药物,通过抑制肾脏糖重吸收增加尿糖排泄。卡格列净对SGLT-2选择性较低,也轻微抑制小肠的SGLT-1。研究发现,在肾切除大鼠中,卡格列净使结肠腔葡萄糖浓度增加,提高了乳酸杆菌水平,增强肠紧密连接蛋白表达,改善了菌群失调和肠漏。
卡格列净主要用于治疗2型糖尿病,可与二甲双胍、二甲双胍/磺酰脲类药联合使用。
此外,卡格列净降低了血液中尿毒症毒素水平,显著减轻了心肌纤维化和血管壁增厚,抑制了相关标志物表达。
✔ 药物会引起肠道菌群变化并影响肠道环境
被称为”肾脏吸尘器”的克里美净AST-120在肾功能衰竭大鼠中显示出改善作用。肾功能不全组拟杆菌增加、乳酸杆菌减少,AST-120治疗后乳酸杆菌增加。同时,治疗后紧密连接蛋白表达和杯状细胞比例得到改善。这表明AST-120通过减少吲哚水平或改变黏蛋白层来改善肠道环境,从而降低血液中吲哚硫酸盐和炎症因子。
研究表明SGLT-2抑制剂和AST-120的部分益处可能通过调节肠道微生物群实现。广泛的药物都能影响肠道菌群,包括针对慢性肾病的药物以及抗糖尿病药二甲双胍、非甾体抗炎药、抗精神病药、质子泵抑制剂、泻药和他汀类药物。这些药物引起的微生物群变化不一定有害,某些情况下反而增强药物疗效。
药物-微生物组-宿主相互作用的研究刚刚兴起,未来可能优化药物治疗并帮助开发新药。
1
低蛋白饮食
膳食成分影响肠道微生物群,蛋白质限制饮食的效果已得到研究。多项研究显示,有益的短链脂肪酸产生菌如乳杆菌科、拟杆菌科和链球菌属数量增加,同时埃格特氏菌(Bacteroides eggerthii)和Roseburia faecis减少,可能降低尿毒素水平。
✔ 蛋白质限制饮食搭配益生元降低尿毒素
由于蛋白质限制饮食对微生物群有积极影响,研究者尝试与肠道菌群干预联合应用。意大利研究给予3-4期慢性肾病患者0.6g/kg标准体重/天蛋白质限制饮食及每日19g菊粉,持续6个月后生活质量评分显示日常功能和整体健康认知改善。
另一项意大利研究也显示代谢作用和功能状态改善,但对肾功能无影响。还有研究显示,蛋白质限制至0.8g/kg体重/天同时补充13.5g β-葡聚糖,虽然肾功能无显著差异,但血液尿毒素有所下降。
✔ 能量摄入足够情况下,低蛋白饮食负面影响较小
关于低蛋白饮食目前有一些担忧,即低蛋白饮食会加剧慢性肾病(CKD)患者的营养不良或蛋白质-能量-消耗状况。不过临床研究已否定这一假设。无论是否补充酮类似物,甚至在老年人群中,低蛋白饮食通过改善代谢性酸中毒或胰岛素抵抗,保护CKD患者免受肌肉退化。
在摄入足够能量的情况下实行膳食蛋白质限制,充足的能量不会导致氨基酸通过酮生成和糖生成途径被降解用于能量生,并维持肌肉蛋白质。因此,对于没有营养状况不良的慢性肾病个体,应优先考虑蛋白质限制,并将其作为个性化营养干预的一部分。一旦引入,应定期监测其营养状况和能量摄入(注意要考虑患者的代谢状况)。
虽然目前对肾功能的影响令人信服,但不能忽视对某些虚弱慢性肾病个体的潜在负面影响。然而,蛋白质限制饮食值得在临床实践中应用。在这种情况下,蛋白质限制饮食最好与协同生物干预结合,以期获得代谢和功能效果。
2
高纤维饮食
膳食纤维被联合国粮农组织/世界卫生组织定义为存在于谷物、种子、蔬菜和水果中的不可消化碳水化合物。欧洲食品安全局将其定义为具有健康益处的不可消化、不可吸收碳水化合物聚合物和木质素。膳食纤维被分为以下四类:
(i)非淀粉多糖
(ii)不可消化多糖
(iii)不可消化淀粉
(iv)木质素
下表中总结了各组的特性:
Wakino S,et al.Nutrients.2025
✔ 膳食纤维可促进肠道细胞蠕动
膳食纤维对整体健康有益,其中一个关键优势是在肠道蠕动中的作用。黏性纤维遇水后形成凝胶,软化粪便并刺激肠道细胞促进蠕动。
✔ 膳食纤维产生短链脂肪酸并具有抗炎作用
更重要的是,纤维为糖分解菌提供能量,这些菌发酵糖类并产生短链脂肪酸(SCFAs)。糖分解菌被认为有益,因其产生的SCFAs为肠道细胞提供能量,增强肠道屏障功能,支持免疫反应,并具有全身抗炎作用。
肠道细菌分为糖分解菌(代谢碳水化合物)和蛋白分解菌(代谢蛋白质和氨基酸)。
此外,糖分解菌抑制蛋白分解菌生长,后者产生腐败性代谢物如吲哚硫酸盐、对甲酚和TMAO。这些代谢物促进炎症并在慢性肾病患者体内积累。抑制蛋白分解菌增殖是膳食纤维的主要益处。
膳食纤维的抗炎特性已通过流行病学研究证实。NHANES III研究显示,每增加10克膳食纤维摄入量,健康个体C反应蛋白水平降低11%,CKD患者则降低38%。健康个体推荐每日纤维摄入量为20-35克,但目前人群摄入量仍不足。
✔ 膳食纤维摄入与慢性肾病发病率成反比
研究表明膳食纤维摄入与慢性肾病发病率呈反比。队列研究发现高纤维摄入者CKD发病率比低摄入者低40-50%,荟萃分析显示素食饮食与更低白蛋白尿和更高肾小球滤过率相关。益生元如菊粉、抗性淀粉等可增加有益菌群,改善肾功能并减少并发症。膳食纤维还可降低血清肌酐和尿毒症毒素水平,但其减缓CKD进展的作用尚需更多研究证实。
肾衰竭饮食中,为限制钾摄入常减少水果蔬菜消费,导致纤维摄入不足。然而,研究发现血清钾与饮食钾摄入关系不强,且摄入更多蔬果的透析患者死亡率更低。因此,对纤维、蔬菜和水果摄入的限制可能弊大于利。
✔ 补充抗性淀粉有助于减少尿毒症毒素及改善肾功能
在膳食纤维中,抗性淀粉(RS)已引起关注。RS是一类在小肠内抵抗消化并到达结肠发酵的淀粉,分为五个亚型(RS1-RS5),如下表所示。
抗性淀粉的分类
Wakino S,et al.Nutrients.2025
实验性慢性肾病模型证明,抗性淀粉(RS)促进双歧杆菌和乳酸菌生长,增强短链脂肪酸产生,并减少肠道尿毒症毒素生成。CKD患者临床研究中,RS补充改变了血液透析患者肠道微生物组成,但未降低系统性尿毒症毒素浓度。
人类研究调查了CKD患者抗性淀粉补充情况,部分研究报告透析患者生化指标改善。荟萃分析显示,抗性淀粉补充可减少尿毒症毒素水平并改善肾功能,但不能减轻CKD患者炎症。
尽管膳食纤维摄入有益,但可能存在缺点,包括氨基酸、维生素B12、铁和锌缺乏。此外,不健康素食饮食通常含有高度加工食品、防腐剂和添加剂,可能对CKD患者有害。因此,专门饮食干预应在营养师指导下个性化定制。
3
全谷物饮食
全谷物富含膳食纤维、植物化学物质、矿物质、抗氧化剂、维生素等有益营养素。高摄入全谷物可降低2型糖尿病、冠心病和癌症风险。与精制谷物相比,全谷物对肠道微生物组成产生积极影响,并发挥抗炎和抗氧化作用,有助于预防各种疾病。
✔ 较低的全谷物摄入与慢性肾病风险增加相关
人群研究表明,相对于精制谷物,较高全谷物摄入与CKD患者心血管疾病、肾衰竭和死亡风险降低相关。值得注意的是,CKD患者易便秘,部分因肠道微生物失调所致,而富含纤维的全谷物可缓解这一问题。
大型队列研究报告了便秘与慢性肾病(CKD)患病率和进展的关联。全谷物有可能预防或减缓CKD进展。
大米是主食,特别在亚洲,也是全球消费最多的谷物之一。在生产过程中,粗米经脱壳得到糙米,再经碾磨去除米糠生产白米。糙米是富含生物活性化合物的全谷物,如类黄酮、酚类、维生素、植物固醇和油脂,这些化合物主要集中在糙米糠层。考虑到全谷物对CKD的有利影响以及糙米的抗炎和抗氧化特性,预期其消费将减轻CKD进展。
4
地中海饮食和其他健康饮食模式
地中海饮食富含蔬菜、水果、鱼类、橄榄油等不饱和脂肪酸,具有多种健康益处。相比之下,西式饮食含红肉、加工食品和精制谷物,富含糖、盐和饱和脂肪。
✔ 地中海饮食有助于改善肾功能
研究显示两种饮食对肠道微生物组成影响不同。地中海饮食促进糖分解细菌增殖,西式饮食有利于蛋白分解细菌生长。观察性研究表明地中海饮食可能通过调节肾-肠轴缓解慢性肾病尿毒症状况。
临床证据有限,但近期研究显示地中海饮食使肥胖和糖尿病患者肾功能下降减缓,减少尿蛋白排泄。另一项研究证明地中海适当平衡饮食有助于维持CKD患者肾功能。
✔ 以植物为主的饮食可能更适合肾病患者
除地中海饮食外,PLADO饮食(植物为主的低蛋白饮食)也被认为适合慢性肾病(CKD)患者,特点是蛋白质摄入0.6-0.8克/公斤/天,至少50%来自植物,避免超加工食品,保持适当能量摄入及低钠摄入。弹性素食饮食也以植物为基础,但可含少量动物制品。虽无相关随机对照试验,但这些植物性饮食增加纤维摄入,改善了肠道微生物群。
关于植物性饮食的担忧包括高钾血症和蛋白质消耗风险,但实际上植物食品中的钾与碱化效应相关,纤维减少便秘,碳水化合物促进钾进入细胞,降低高钾风险。观察性研究表明植物性饮食可减缓CKD进展,用豆类替代红肉与终末期肾病风险降低相关。
尽管通过生物制剂、膳食纤维和全谷物对肾-肠轴的干预效果有限,但饮食模式改变,如转变为限制蛋白质饮食或地中海饮食,对肾功能有效。这种有利效果源于其对预防CKD发生和进展的多方面优势。
地中海饮食含有充足膳食纤维、全谷物,并促进产生短链脂肪酸的糖分解细菌生长。当这种饮食模式持续应用时,其效果可持续。因此,在临床实践中,转变或坚持健康饮食可成为慢性肾病患者的合理治疗策略。
后生元制剂是由灭活微生物及其发酵产物组成的新兴干预措施。2019年,国际益生菌和益生元科学协会将后生元定义为”能够为宿主带来健康益处的非活性微生物或其组分的制剂”。
✔ 微生物靶向治疗减轻炎症和氧化应激
临床前研究已评估了超声处理的副干酪乳杆菌(Lactobacillus paracasei)在高脂饮食诱导的肾损伤以及GABA盐、乳-GABA盐和后生物-GABA盐在急性肾损伤中的作用。虽然这种策略在CKD和透析领域的临床应用仍处于临床前阶段,但一项单中心非随机试点研究显示,20名维持性透析患者接受短链脂肪酸丙酸钠给药后,促炎症参数和氧化应激减少,胰岛素抵抗和铁代谢改善。
✔ 评估微生物组对精准和个性化治疗至关重要
肠道微生物靶向治疗的效果取决于饮食、生活方式、年龄和药物使用的个体差异。为解决这些局限性,微生物组测序技术对实现更精确和个性化干预至关重要。一项使用16S rRNA测序的研究比较了健康对照组与慢性肾病、膜性肾病、IgA肾病、微小变化病和缺血性肾损伤患者,发现肠道微生物组失调与慢性肾病亚型间有强烈相关性。评估每个患者的微生物组对选择和监测针对CKD管理的饮食和生物策略至关重要。
粪便微生物移植(FMT)通过将健康供体的肠道微生物转移到患者体内来恢复微生物平衡。研究发现,FMT减少了IgA肾病小鼠模型中的蛋白尿并改善肾功能。随机对照试验评估胶囊化粪便微生物效果显示,FMT组CKD进展率低于安慰剂组,且FMT组的血清肌酐和尿素氮水平维持稳定。
虽然FMT对CKD或透析患者的临床应用仍处于临床前阶段,但已有一项单中心、双盲、随机、安慰剂对照试验报道。2-4期CKD患者随机接受FMT或安慰剂胶囊治疗6个月后,FMT组患者疾病进展较少。
如前所述,这些治疗策略仍处于早期阶段,尚未形成临床使用的产品或方案。其可行性或适应临床实践的能力有待进一步研究。
我们了解了肾-肠轴、治疗策略及其在慢性肾病(CKD)中的临床意义。关键发现是乳酸杆菌在肾衰竭时水平下降,破坏肠屏障,增加尿毒症毒素前体(如吲哚)侵入,这些毒素导致肾损伤、心血管疾病和全身炎症。
多种药物会影响肠道微生物组成和尿毒症毒素水平。SGLT-2抑制剂卡格列净调节肠道微生物,减少尿毒症毒素;AST-120改善肠道菌群失调,促进乳酸杆菌恢复,降低循环毒素水平,可能保护肾功能。
肾-肠轴背景下的饮食治疗对CKD管理至关重要。虽然食物是基本营养来源,但CKD中排泄和代谢障碍可将某些饮食成分转变为有害物质。营养治疗必须考虑CKD中的肠功能障碍,因为肾衰竭改变肠道微生物、吸收和蠕动。这种变化应纳入饮食治疗考量,表明肾衰竭营养治疗已进入新阶段。
慢性肾病(CKD)临床实践中应考虑肾-肠轴紊乱。通过单一治疗方案(包括生物制剂治疗、蛋白质限制饮食、膳食纤维和全谷物)部分纠正肾-肠轴紊乱,虽可能对患者生活质量有积极影响,但不足以阻止CKD进展。
转向健康整体饮食模式——采用以植物为基础的饮食(如地中海饮食),整合多种针对肾-肠轴的治疗策略,是CKD治疗的合理措施。未来研究还应集中于开发更有效的益生菌、益生元和微生物代谢调节药物,不仅针对CKD,也适用于其他系统性疾病。
主要参考文献
Wakino, Shu, Kazuhiro Hasegawa, Masanori Tamaki, Masanori Minato, and Taizo Inagaki. 2025. “Kidney-Gut Axis in Chronic Kidney Disease: Therapeutic Perspectives from Microbiota Modulation and Nutrition” Nutrients 17, no. 12: 1961.
Yoshifuji, A.; Wakino, S.; Irie, J.; Tajima, T.; Hasegawa, K.; Kanda, T.; Tokuyama, H.; Hayashi, K.; Itoh, H. Gut Lactobacillus protects against the progression of renal damage by modulating the gut environment in rats. Nephrol. Dial. Transplant. 2016, 31, 401–412.
Wong, J.; Piceno, Y.M.; DeSantis, T.Z.; Pahl, M.; Andersen, G.L.; Vaziri, N.D. Expansion of urease- and uricase-containing, indole- and p-cresol-forming and contraction of short-chain fatty acid-producing intestinal microbiota in ESRD. Am. J. Nephrol. 2014, 39, 230–237.
Vaziri, N.D.; Wong, J.; Pahl, M.; Piceno, Y.M.; Yuan, J.; DeSantis, T.Z.; Ni, Z.; Nguyen, T.H.; Andersen, G.L. Chronic kidney disease alters intestinal microbial flora. Kidney Int. 2013, 83, 308–315.
Koh, A.; De Vadder, F.; Kovatcheva-Datchary, P.; Bäckhed, F. From dietary fiber to host physiology: Short-chain fatty acids as key bacterial metabolites. Cell 2016, 165, 1332–1345.
Furusawa, Y.; Obata, Y.; Fukuda, S.; Endo, T.A.; Nakato, G.; Takahashi, D.; Nakanishi, Y.; Uetake, C.; Kato, K.; Kato, T.; et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature 2013, 504, 446–450.
Kasubuchi, M.; Hasegawa, S.; Hiramatsu, T.; Ichimura, A.; Kimura, I. Dietary gut microbial metabolites, short-chain fatty acids, and host metabolic regulation. Nutrients 2015, 7, 2839–2849.
Andrade-Oliveira, V.; Amano, M.T.; Correa-Costa, M.; Castoldi, A.; Felizardo, R.J.; de Almeida, D.C.; Bassi, E.J.; Moraes-Vieira, P.M.; Hiyane, M.I.; Rodas, A.C.; et al. Gut bacteria products prevent AKI induced by ischemia-reperfusion. J. Am. Soc. Nephrol. 2015, 26, 1877–1888.
Chung, S.; Barnes, J.L.; Astroth, K.S. Gastrointestinal microbiota in patients with chronic kidney disease: A systematic review. Adv. Nutr. 2019, 10, 888–901.
Li, H.B.; Xu, M.L.; Xu, X.D.; Tang, Y.Y.; Jiang, H.L.; Li, L.; Xia, W.J.; Cui, N.; Bai, J.; Dai, Z.M.; et al. Faecalibacterium prausnitzii Attenuates CKD via Butyrate-Renal GPR43 Axis. Circ. Res. 2022, 131, e120–e134.
Schepers, E.; Glorieux, G.; Vanholder, R. The gut: The forgotten organ in uremia? Blood Purif. 2010, 29, 130–136.
Simeoni, M.; Citraro, M.L.; Cerantonio, A.; Deodato, F.; Provenzano, M.; Cianfrone, P.; Capria, M.; Corrado, S.; Libri, E.; Comi, A.; et al. An open-label, randomized, placebo-controlled study on the effectiveness of a novel probiotics administration protocol (ProbiotiCKD) in patients with mild renal insufficiency (stage 3a of CKD). Eur. J. Nutr. 2019, 58, 2145–2156.
谷禾健康
由于肉类和肉制品含有丰富的脂质和蛋白质,因此易于发生氧化反应。脂质氧化会产生一系列氧化衍生物,主要影响食物的颜色和风味,同时也会导致肌肉蛋白质的功能和稳定性丧失。同样,蛋白质容易被活性氧化物质(ROS)和氧化应激的次级副产物氧化。蛋白质氧化是一个会导致构象和结构改变、聚集和断裂的过程,从而损害蛋白质的功能特性,进而影响肉品的质量。
脂质氧化-蛋白质氧化在肉类中是密不可分的,因为脂质氧化可能会诱发蛋白质氧化。这些积累的氧化蛋白质和脂质,包括它们的次级产物,被认为在食用肉制品和随后的消化时对人类构成健康风险。因此,控制肉类和肉制品中的蛋白质氧化非常重要。
已经进行了许多消化率试验和相关研究,以揭示与肉类蛋白质相关的分子变化和潜在风险。蛋白质消化是一种复杂的过程,涉及消化酶对膳食蛋白质的集体作用。这个过程受多种因素的影响,包括蛋白质的饮食来源、消化酶的活性、胃肠道菌群,pH值、肠道蠕动和内源性分泌物等。通过动物模型的研究,已经证明摄入过多的加工肉类可能会促进与非酒精性脂肪肝和肥胖相关的蛋白水解细菌的增殖。
另外,大量摄入红肉后会刺激结肠中的氧化反应。过多摄入肉类氧化产物可能会导致肠道菌群失调,损害结肠的代谢能力,并对结肠粘膜产生有害影响。
前不久南京农业大学食品科技学院李春保教授等人发表了题为“Molecular Changes of Meat Proteins During Processing and Their Impact on Quality and Nutritional Values”的综述论文。重点介绍了肉类蛋白质的分子变化、对新鲜肉类和加工肉类营养价值的影响、肉类蛋白质的消化和吸收、与高肉类摄入量相关的健康风险以及为改善这些情况而采取的预防策略。希望能够对生活中肉类的食用有一定帮助。

编辑
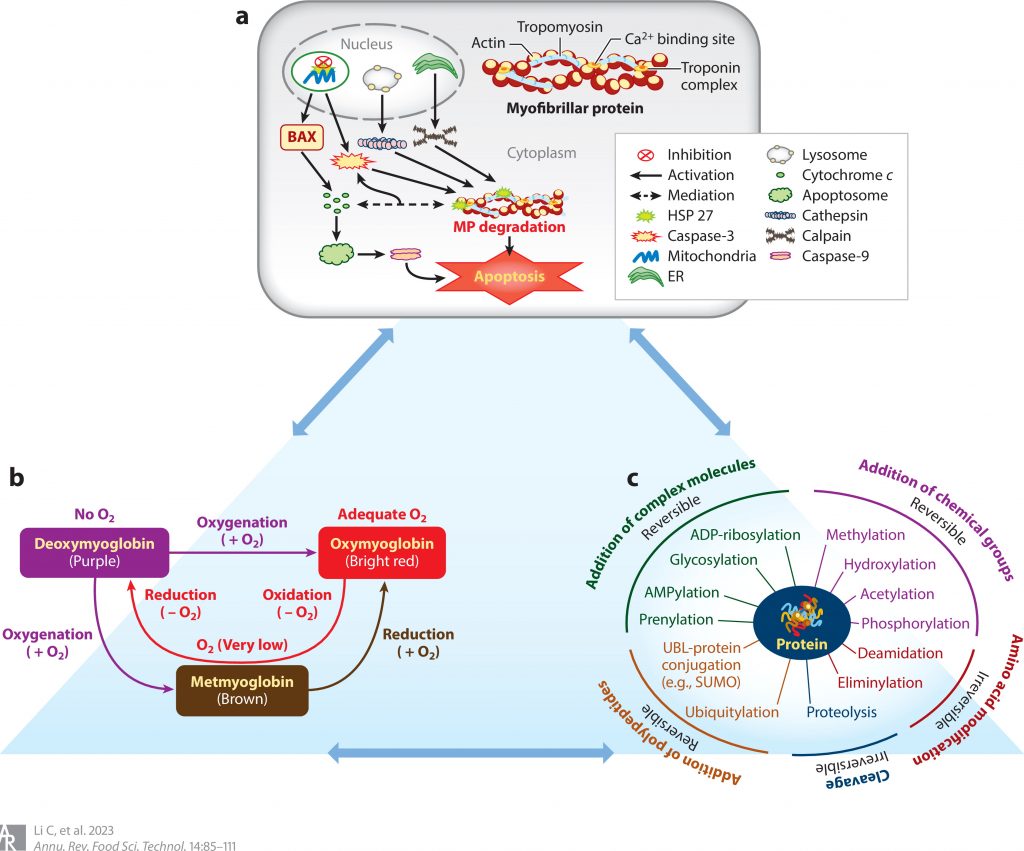
肉质通常会受到理化和代谢变化的影响。这些变化主要包括pH值下降、肌原纤维蛋白降解、蛋白质氧化和蛋白质翻译后修饰。
Li C,et al.Annu Rev Food Sci Technol.2023
肉的颜色是一个不可或缺的质量属性,也是消费者的第一判断点,其变化与购买的可能性密切相关。
鲜肉颜色通常由着色剂的浓度和所需颜色在储存期间或零售展示期间的稳定性为特征。色调和色度由肌红蛋白主导,其变化取决于其生化状态,特别是氧化或还原程度。
注:肌红蛋白是肌肉中主要的携氧血红素蛋白,而血红蛋白则在血液中输送氧气。肌红蛋白比血红蛋白具有更高的氧亲和力。
•在空气中暴露不同的时间导致产生不同颜色
肌红蛋白与空气中的氧气接触后,随着时间的推移,新鲜肉呈紫红色;暴露在空气中30~40min后,颜色变为鲜红色;最后肉类自身存在的耗氧酶会消耗掉渗入肉中的氧气使肉质产生褐变。
颜色变化的具体机制
最近,已经进行了生化研究来阐明肉的颜色机制。利用从深色牛肉中分离的线粒体(肌肉pH>6)注意到,深色牛肉的电子损失高于对照(即从正常牛肉肌肉中分离出的线粒体,pH=5.6)。
这表明线粒体较多的肌肉,如腰大肌,可以产生活性氧并发生氧化变化。在大腰肌中检测到高丰度的次黄嘌呤和肌苷,而在腰最长肌中观察到腺苷、肌肽和l-组氨酸,表明不同肌肉类型之间的嘌呤代谢率不同。
另一项研究同样报道了深色牛肉中较高的线粒体蛋白质和DNA含量。这一发现也证实了最近的一项蛋白质组学研究,该研究表明,与线粒体电子传输和糖原分解相关的蛋白质的变化分别促进了高氧摄入和pH值的增加,从而抑制了深色肉中的肌红蛋白氧化。
肌原纤维蛋白占肌肉总蛋白的60-70%,肌原纤维蛋白的分子内和分子间相互作用,例如氢键和疏水性、离子性和范德华相互作用,极大地影响肉的质地、结构和品质。
胶原蛋白浓度和溶解度、肉收缩的程度以及肌原纤维蛋白在死后老化过程中的蛋白水解变化是与肉嫩度相关的整体因素。老化最初提供了对机械应力的缓冲。它通过肌肉组织的酶促结构降解和随后的肌肉细胞肿胀来冷冻。肌纤维中的大部分水分被限制在肌原纤维中,肌原纤维蛋白降解可能与水分减少有关。
最近研究报道,溶酶体Fe2+促进脂质过氧化和线粒体肿胀,导致线粒体功能障碍,随后促进细胞色素c氧化和线粒体Ca2+积累,从而诱导肌原纤维蛋白变性。
线粒体是最初因死后变化而受损的主要细胞器,并且是进一步细胞反应和最终死后肉嫩化不可或缺的一部分。活性氧在死后衰老过程中不可避免地产生,并通过多不饱和脂肪酸的过氧化进一步侵入线粒体膜,导致线粒体损伤。
此外,离子强度和pH值可能会导致蛋白质结构发生改变,使疏水残基暴露于表面并影响表面疏水性。研究表明,在冷冻过程中,未冷冻水中的pH值降低,离子强度增加,导致肌球蛋白丝的内部结构破坏,并有助于其构象变化以及随后的溶解和变性。
氧气损失导致死后早期从有氧代谢转变为无氧代谢。伴随着这样的过程,会发生以下复杂的变化。
磷酸化是一种蛋白质翻译后修饰,在死后肌肉质量属性中发挥着不可或缺的作用。特别是,蛋白质磷酸化是苏氨酸、丝氨酸和酪氨酸残基的主要蛋白质翻译后修饰,调节信号转导、代谢和其他重要的生物过程,例如分化和增殖。它通过调节肌动球蛋白解离、蛋白质变性和宰后μ-钙蛋白酶活性来影响肉质。
先前的研究表明,肌浆蛋白和肌原纤维蛋白的磷酸化状态会在死后发生变化,这种变化与肉质有关。在一项磷酸蛋白质组学研究报告中称,季节也会导致肉质变化,包括pH值和保水能力下降。季节转换期间的温度变化可能会通过某些伴侣蛋白的过度表达导致猪的冷应激或热应激,从而导致肉质苍白、柔软、渗出性缺陷。
酶在肉类的生化变化中至关重要,例如碳水化合物降解、蛋白水解、氨基酸降解反应(脱氨、转氨基、脱羧)、Strecker 降解、美拉德反应、脂肪分解和 脂质氧化。在死后老化过程中,通过内源性蛋白水解作用使肉中的细胞骨架肌原纤维蛋白变性,可显著提高质量,例如多汁性、风味或嫩度。
钙蛋白酶和组织蛋白酶是参与死后蛋白水解的酶系统。钙蛋白酶系统的两种μ/m同工型在死后老化过程中均被激活,并且通过降解结蛋白和肌钙蛋白-T对肉嫩化至关重要。
另一方面,随着死后肌肉pH值降低,溶酶体膜减弱,组织蛋白酶从溶酶体中释放出来,使它们能够水解肌原纤维蛋白。因此,与死后肌肉储存过程中发生的肌原纤维蛋白相比,组织蛋白酶处理的肌原纤维蛋白具有不同的变性模式。
•热休克蛋白可以抑制肉的老化
热休克蛋白(HSP)家族以其在细胞保护中的重要性而闻名。高丰度的热休克蛋白是肌肉抗细胞凋亡不可或缺的一部分,并可能抑制肉的老化,影响肉的嫩度。
据报道,小热休克蛋白可以保护死后肌肉中的细胞骨架结构,例如肌联蛋白、肌动蛋白和肌钙蛋白。它们可以模拟肌动蛋白单体并与肌动蛋白-肌动蛋白结合位点结合,有效阻碍肌动蛋白聚合。μ-钙蛋白酶的蛋白水解活性通过小热休克蛋白的抑制调节而受到最终肉类pH值的影响。
HSP27是一种分子伴侣蛋白,大量存在于骨骼肌中,与肉品质相关。研究发现HSP27似乎抑制蛋白水解的启动,但随着肉在屠宰后7至14天的老化过程中,HSP27的存在有助于肉的嫩化。HSP27可能通过与酶、底物或两者的相互作用来调节蛋白水解活性。
在肉类加工过程中,根据叠加的时间温度条件和工艺流程,不同程度地发生多种结构变化。肌肉细胞在机械变化过程中被氧气降解和包裹,从而增加了脂质氧化-蛋白质氧化的可能性。
热处理会导致主要蛋白质成分发生严重变化,这是由蛋白质变性、氨基酸氧化和聚集过程引起的。
谷禾将不同加工方法及其对肉品质影响的优缺点简单总结在了下表:

Li C,et al.Annu Rev Food Sci Technol.2023
1
加热
加热引起构象变化,称为蛋白质变性。它还诱导蛋白质之间相互作用,导致蛋白质聚集。熟肉中蛋白质聚集体的形成主要影响产品的技术和营养特性。
粉碎产品和非粉碎产品的差异很大。例如,与煮熟的火腿相比,乳化香肠含有更多的不溶性蛋白质残留物。胶原蛋白的存在意味着高分子量蛋白质聚集体,可能是热处理和不同工艺过程的结果。这些聚集体的特征是肌原纤维与肌浆的比例很高,这表明肌原纤维蛋白,特别是肌动蛋白,在构建热诱导的超分子蛋白质组装过程中相互作用。
在研究烹饪对肉类蛋白质的影响时,观察到氨基酸氧化变化呈上升趋势,特别是在可溶性胶原蛋白中,而不溶性部分中的肌球蛋白最容易受到其他热诱导的修饰(例如美拉德反应)的影响。
注:最近发现范德华力和氢键产生肌球蛋白-醛结合相互作用,从而为维持/控制肉味的机制提供了新的见解。
•胶原蛋白在长时间加热后有更好的提取性
一项蛋白质组学研究表明,干燥加热有助于一些三维结构显著变化的肉类蛋白质的聚集,例如肌酸激酶M型和肌球蛋白重链。
尽管在尿素-硫脲溶液中检测到总蛋白质可提取性显著损失,但与其他蛋白质相比,骨骼肌中的主要胶原蛋白(I型和III型)在长时间烹饪后表现出相对更好的可提取性。
•低温加热可能拥有更好的抗氧化特性
据报道,在较低温度下热诱导的I型胶原蛋白部分解折叠或氧化可能会暴露出更多胃蛋白酶消化的活性位点,而过热会导致蛋白质聚集、聚合、交联和氧化,从而诱导对酶降解的抵抗。
真空低温烹调12小时增加了抗氧化活性肽的数量,这可以显著减少脂质氧化和蛋白质氧化的发生。这表明具有潜在抗氧化特性和生物活性、可穿透细胞的肽可能在低温和短时间下产生。
2
烘干
干肉和肉制品通常通过热风干燥技术来实现。一般来说,肉类蛋白质的连续和密集加工会因必需氨基酸的损失和消化率受损而导致营养变化。
•烘干会导致蛋白质消化率下降
为了揭示脂质氧化、肌原纤维氧化和蛋白质消化率的变化,研究发现风干牦牛肉蛋白质消化率的下降归因于氧化诱导的蛋白质交联和羰基化,影响了底物与胃蛋白酶的结合。
•冷干燥可以减少氧化,延长保质期
另外,据报道,冷干燥可以通过降低温度来减少热敏食品的快速氧化过程,从而延长保质期。冷风干鱼的蛋白质降解和脂肪酸氧化下降。
注:在4°C下冷干燥的凤尾鱼和鳟鱼样品比在恒定气流下在10°C、15°C和20°C下干燥的样品具有更高的功效。
3
加盐
盐是加工产品中不可或缺的成分。它促进肉类蛋白质的溶解,并充当肉类和脂肪之间的粘合剂,改善质地、嫩度、香气和适口性。
感知到的咸味主要归因于Na+阳离子,风味强度取决于盐含量。盐水平在肌动球蛋白的氧化、结构和消化中发挥着重要作用,表明对肉类营养和蛋白质消化率有很大影响。
•施用盐影响了蛋白质的消化率
由于肌红蛋白的刚性和消化效率低,氯化钠处理降低了蛋白质结合能力,导致肌红蛋白被胃蛋白酶快速消化。尽管如此,过量的氯化钠会损害蛋白质功能,因为肌原纤维蛋白具有高度盐溶性。
最近有报道称,氯化钠处理会改变血红素结构和肌红蛋白疏水腔,降低蛋白质消化率。因此,氯化钠减少对蛋白质氧化的影响各不相同,这与氯离子与蛋白质残留、蛋白水解和肌原纤维状况之间的关联有关。
•盐类物质可能改变了蛋白质的结构
人们对各种氯化物盐如氯化钙、氯化钾和氯化镁进行了研究,以确定它们作为肉制品中氯化钠替代品的效力。因此,观察到一价(钾)和二价阳离子(镁和钙)在凝胶化过程中增强了肉蛋白的功能。
为了评估用KCl、MgCl2或CaCl2部分替代NaCl对肌原纤维蛋白的影响,证明NaCl能够展开肌原纤维蛋白结构并增强凝胶质量,而25%KCl增加肌原纤维蛋白疏水性和粒径、二硫化物和羰基含量,在类似离子下比其他盐组合更好地增强凝胶结构和凝胶强度力量。尽管MgCl2或CaCl2导致蛋白质不溶和聚合,但前者极大地影响凝胶性质。
4
包装
人们开发了各种包装技术,以减少氧化过程并提高肉质。
•低氧浓度抑制蛋白质氧化,利于保持肉的嫩度
数据发现低氧浓度(10%O2/90%N2)抑制蛋白质氧化,而高氧包装增加了肉的损失并降低了肉的嫩度。
在高氧浓度(80%O2/20%CO2)包装牛肉中,揭示了高分子量蛋白质聚合物的生成,表明高氧化和交联导致高氧包装肉中的肌球蛋白聚合。
•富含天然抗氧化性的物质对健康有益
通过将食品、保鲜和包装系统纳入可食用、可生物降解和防潮薄膜中,可食用薄膜或涂层显著改善了包装。这种包装可以防止颜色退化、氧化变化和异味,延长保质期,并赋予肉类及其衍生物功能。
据报道,富含天然抗氧化剂的提取物、多糖和精油的不同涂层可增强膜的机械性能,并抑制肉制品中高铁肌红蛋白的形成和脂质氧化–蛋白质氧化过程的形成。
注:先前关于天然抗氧化剂在肉类工业中应用的研究也进行了综述。这些生物活性物质一旦摄入,也会对消费者的健康有益。
5
其他处理方法
最近,消费者的注意力已逐渐从营养转向对身体产生积极生理反应的食品。超声波处理、高压处理和脉冲电场(PEF)等创新工具已被证明可以增强肉类和肉制品的基本生化和功能特性。
•高压处理可以降低烹饪损失,改善消化
人们发现高压处理可以通过形成丝状网状网络(甚至在肌肉纤维内)来改善肉糊的质量,从而降低烹饪损失。
在一项蛋白质组学研究中,揭示高压处理加速蛋白水解,表明肌动蛋白与肌球蛋白不同,存在差异性变性。他们还证实,高压处理对直链醛(己醛、壬醛、庚醛和戊醛)的形成有积极影响,从而改善干腌火腿的味道和香气。高压处理和脉冲电场也被证明对消化过程中肉蛋白的酶水解产生积极影响。
•超声辅助可以改善肉的质地和结构
最近还发现,超声辅助的表没食子儿茶素没食子酸酯共价反应基团表现出更高的消化率,这与消化蛋白酶的可及性和减少肌原纤维蛋白聚集有关。证明集成超声波和低温短时加热(40kHz,0.2W/cm2,55°C,15分钟)协同促进必需肉类蛋白酶(组织蛋白酶 B、钙蛋白酶和总蛋白酶)的失活。这显著减少了肉类蛋白质的降解,改善了肉的质地和微观结构。
同样,液相色谱与串联质谱联用(LC-MS/MS)的结果表明,超声处理可促进小分子量肽的生成,这可能与线粒体能量代谢的上升趋势有关。
肉类是膳食蛋白质的重要来源,是具有良好平衡性和高生物利用度的必需氨基酸。然而,蛋白质氧化和肉类结构的变化会影响蛋白质的水解速率,从而影响蛋白质的生物利用度。
•烹饪程度影响蛋白酶的敏感性
虽然轻度蛋白质氧化可能诱导部分解折叠,促进蛋白水解酶与蛋白质底物的结合,但严重的蛋白质氧化条件会改变蛋白质与蛋白水解酶的结合位点,并通过聚合使蛋白质结构变得紧凑,从而降低蛋白酶敏感性。
一个例子如美洲鸵鸟肉,烹饪抑制了肌原纤维蛋白对胃蛋白酶活性的敏感性。烹饪后胰酶的蛋白水解率增加支持了蛋白质聚集在肉类蛋白质营养特性中的重要性。
•肉的类型影响蛋白质成分和消化敏感性
肉的营养质量取决于多种因素,从动物和肌肉类型到成熟度和烹饪条件。在蛋白质组研究中,证明猪肉中的股二头肌对消化的敏感性最高,相互作用分析表明差异蛋白主要与糖酵解和肌肉收缩有关。
因此,蛋白质成分和消化敏感性的变化可能归因于肉质类型。然而,营养质量还必须考虑肉的脂肪酸组成和可能产生有害物质的过氧化过程。
加工过程中生肉和预煮肉制品中蛋白质氧化衍生物含量较高可能归因于高脂肪-蛋白质比率、低蛋白质水平或强烈的切碎和烹饪方法。烹饪过程中蛋白质氧化的发生以及进一步消化过程中氧化序列的释放导致生物活性变化,主要来自胶原蛋白和肌联蛋白检测到的肽以及消化过程中新产生的肽。最近证明,蛋白质来源和脂肪含量影响食品基质的流变特性和微观状态,进一步影响蛋白质水解程度和消化率。
•低消化率会降低蛋白质的生物利用度
还有研究证明肌动球蛋白在100°C下持续加热会导致二硫键的形成、聚集和残基氧化,从而通过破坏部分切割位点导致消化率降低,很大程度上改变了蛋白质消化物中的肽组成。肌红蛋白在胰酶和胃蛋白酶消化中的水解程度也相对较低。
低消化效率可能会抑制蛋白质的生物利用度及其在盲肠和结肠中的积累,蛋白质或其片段在盲肠和结肠中由肠道微生物群发酵。
评估了胃肠道消化对肉和肉制品产生的生物活性肽的影响。胃肠道中生物活性肽的模拟研究表明,肉蛋白是抗二肽基肽酶活性、血管紧张素转换酶抑制和一定程度抗氧化活性的来源。
因此,为了使肉释放生物活性肽并表现出生理效应,肽必须完整地通过胃肠道。
饮食成分和饮食习惯对肠道健康很重要,包括肠道微生物成分和平衡。在消化和吸收过程中,胃肠道从食物中提取营养物质,以提供基本营养和健康。虽然有些食物富含抗炎生物活性化合物,但其他食物则含有促炎化合物。
定期摄入富含抗炎生物活性化合物的食物有益于肠道微生物的流行,将食物成分降解为代谢物以维持体内平衡。相比之下,摄入富含促炎化合物的饮食可能导致生态失调,产生可能对健康构成风险的致病代谢产物。
过量摄入高脂肪肉类带来的不利影响
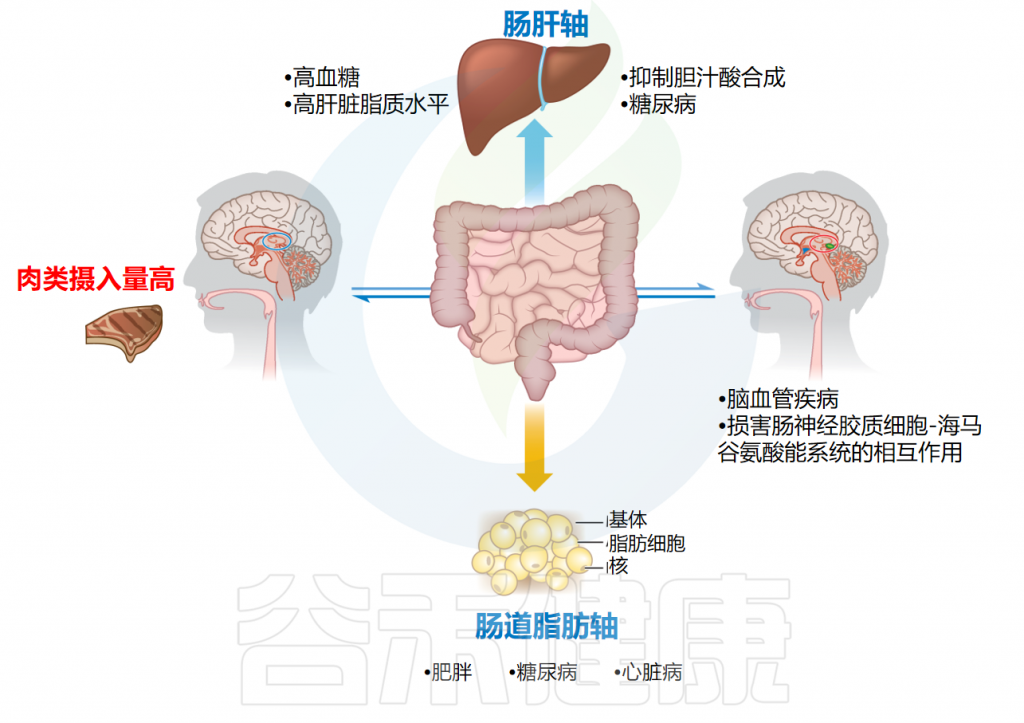
Li C,et al.Annu Rev Food Sci Technol.2023
•合理的肉类摄入有助于平衡肠道微生物以及抗氧化作用
在均衡饮食中,摄入肉类蛋白质已被证明可以对肠道微生物成分、能量代谢和抗氧化产生积极影响。报道称,在长期食用蛋白质来源(酪蛋白、牛肉、鸡肉和大豆等)的过程中,肉类蛋白质保持了更平衡的肠道微生物成分,并降低了肠道微生物对宿主的抗原负荷和炎症反应。
有研究称,与大豆相比,肉类蛋白质有利于新陈代谢和生长。最近声称,与牛肉、猪肉和大豆蛋白相比,鸡肉和鱼肉蛋白显著诱导肝脏抗氧化应激。因此,在推荐剂量下,肉类蛋白质可以促进甘油三酯分解和胆固醇降解,并将能量平衡维持在健康水平。
不同肉类摄入对健康的影响


Li C,et al.Annu Rev Food Sci Technol.2023
•膳食酪蛋白有助于减少肥胖
此外,由于氧化应激是肥胖、糖尿病等慢性疾病的主要推动因素,在不损害营养价值的情况下合理摄入肉类可以改善健康风险。
几项研究证明了积极的发现。在一项研究中与膳食鸡肉相比,膳食酪蛋白增加了实验动物盲肠中乳酸乳球菌(Lactococcus lactis)的丰度,并上调了与肥胖抑制相关的基因表达。
一致地,在喂养小鼠的膳食蛋白质来源(大豆、牛肉、去皮鸡肉、酪蛋白、鳕鱼片或猪肉)中,与其他饮食相比,酪蛋白饮食大大减少了脂肪量并防止了肥胖的发展。
富含酪蛋白的食物:酪蛋白是一种乳清蛋白,主要存在于乳制品中。例如牛奶、酸奶、奶酪、奶粉,以及一些鱼类、豆类。
•天然益生元通过肠道菌群有利于健康
在喂食富含菊粉的加工猪肉产品(发酵香肠和煮熟的火腿)的两种结直肠癌动物模型中,息肉减少,抗炎和纤维发酵微生物群呈上升趋势。
值得注意的是,与淀粉不同,菊粉等果聚糖在到达结肠之前不会在人类胃肠道中发生改变,在结肠中它们被双歧杆菌、乳酸杆菌和其他短链脂肪酸产生物种等益生菌用作能量和碳源。
富含角豆果提取物的肉制品还被发现可以在晚期2型糖尿病模型中提供预防和治疗作用,例如诱导更高的肠道微生物丰富度、增强结肠屏障完整性、促进足够的短链脂肪酸水平以及在远端结肠粘膜。
丁酸盐是结肠细胞的首选能量来源,具有促进结肠健康和抗肿瘤的功效,支持粘膜完整性,并通过其对表观遗传调节、免疫和基因表达的影响来预防炎症和癌变。
需要注意的是,过量地摄入肉类也不利于人体健康。
•高肉高脂肪饮食会损害神经递质平衡
报道称,高猪肉或高鸡肉饮食(40%或以上)和高脂肪含量会损害谷氨酸能系统和神经递质平衡,并对海马谷氨酸能系统和肠胶质细胞之间的关联产生巨大影响。
同样,高脂饮食中过量的肉类蛋白摄入可能会促进代谢紊乱、全身炎症、中枢神经系统功能的改变,并最终导致神经退行性疾病的发展。
•高肉类饮食影响肠道微生物组成
高脂饮食中的蛋白质显著影响肠道微生物组成、肝脏代谢特征、肠道炎症基因表达和血清内毒素水平,其中许多代谢物影响血清内毒素、炎症和肠道通透性。
研究表明,肠道炎症通过高脂饮食引起的肠道血管屏障功能障碍诱导肝损伤,强调了肠道微生物、肠道屏障和非酒精性脂肪性肝病发展的饮食之间的关系。
特定的肠道微生物可能通过调节宿主消化蛋白的分泌来影响蛋白质的消化和吸收,特别是在长期食用肉类蛋白之后。研究表明,与替代品相比,高膳食肉类蛋白会降低肝脏中吲哚和粪臭素代谢酶的活性。
还报道了饮食蛋白质喂养的大鼠盲肠微生物群组成的快速变化。说明了肉类摄入量与肠道微生物之间的关联,表明过量肉类消费会增加心血管疾病风险和动脉硬化。
•高肉饮食会导致糖代谢紊乱
最近评估了不同氧化损伤程度的熟猪肉对小鼠葡萄糖代谢的影响,并得出结论,摄入高氧化损伤猪肉饮食会损害葡萄糖耐受性,并导致低胰岛素血症和高血糖,表明葡萄糖代谢紊乱。
•高肉饮食影响胆汁酸的分泌与合成
肠道微生物还会在肉类和其他膳食来源中产生三甲胺。三甲胺被肝脏含黄素单加氧酶氧化为氧化三甲胺,可能抑制胆汁酸的合成和分泌,还会促进动脉粥样硬化。
胆汁酸对于宿主改变肠道微生物组成至关重要,因为它与左旋肉碱有很强的相互作用,次级胆汁酸(如石胆酸和脱氧胆酸)的升高归因于摄入高脂饮食,这可能会引发结直肠癌风险。
研究发现肉类诱导的氧化三甲胺形成受到肝脏基因表达水平变化以外的机制的调节,可能涉及肠道微生物改变。重要的是,该研究表明,将富含红肉的饮食改为白肉或非肉类蛋白质来源(但保持相同的卡路里和膳食蛋白质比例)会导致氧化三甲胺水平在几周内大幅下降。
研究了膳食蛋白质来源与血浆氧化三甲胺水平的相互作用,以及通过饮食改变降低氧化三甲胺水平所需的时间,强调除了数量之外,饮食成分(与蛋白质来源有关,但与饱和脂肪含量无关)影响氧化三甲胺的整体代谢。
推荐剂量的肉类蛋白质可以增强胆固醇降解和甘油三酯分解,并保持能量合成处于健康状态。
以下几点可以使肉类在保存和加工过程中保持较好的营养价值和肉质:
采用低温保存,控制温度在0-4°C范围内,可以减缓肌红蛋白的氧化程度,保持肉类颜色。
选择肌肉类型含有较高线粒体的肉类,如鸡肉,可以减少肌红蛋白的氧化程度。
适度使用盐可以改善肉质,但不要过量,以免损害蛋白质。
避免高温长时间加工,如不必要的高温煮熟,可以防止蛋白质变性和聚集。
选择加工方法温和的肉制品,如熏肉比烤肉更易保留营养。
适量食用肉类,可以促进肠道微生物平衡,但过量可能影响健康。
食用肉类时搭配蔬菜水果等食物,可以提供抗氧化营养成分,共同保护肉类免受氧化损害。
总体来说,低温保存、温和加工和适量食用,可以最大限度地保留肉类的营养价值和肉质质量。
主要参考文献:
Li C, Bassey AP, Zhou G. Molecular Changes of Meat Proteins During Processing and Their Impact on Quality and Nutritional Values. Annu Rev Food Sci Technol. 2023 Mar 27;14:85-111.