-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
随着冬季到来,天气逐渐转冷,大部分呼吸道病原体在外界存活时间延长,同时人体的免疫力下降,呼吸道感染性疾病进入高发季节。
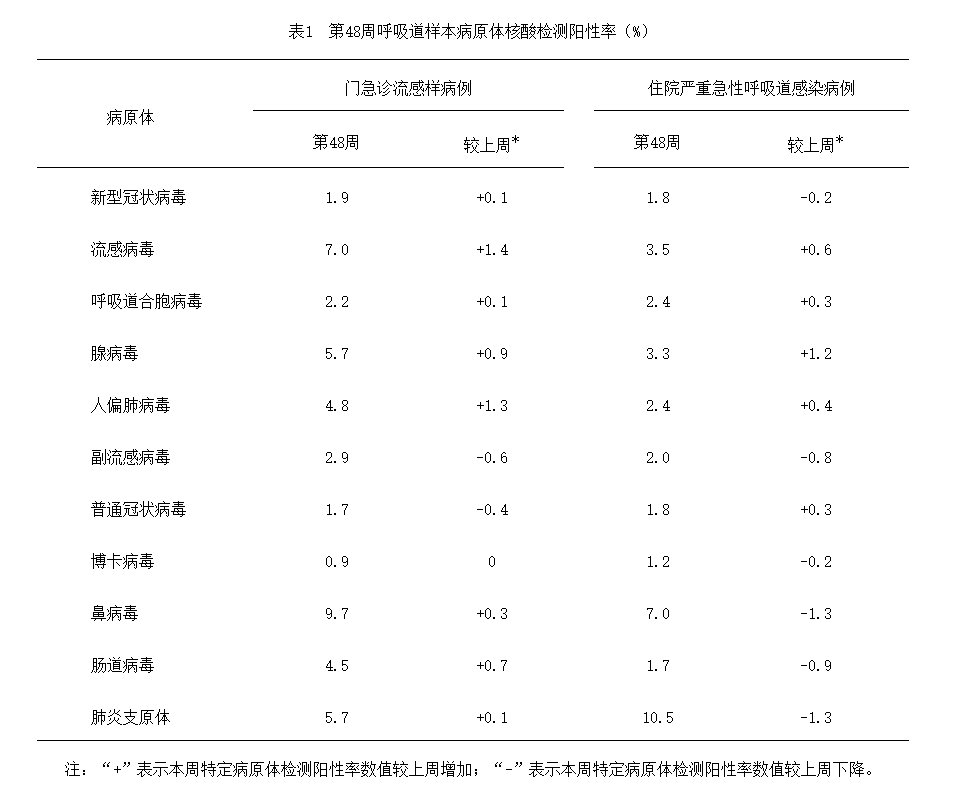
2024年第48周(11月25日—12月1日),对全国哨点医院(不含港澳台)采集的门急诊流感样病例和住院严重急性呼吸道感染病例的呼吸道样本,开展了多种呼吸道病原体检测,检测结果如下表所示:
呼吸道病原体检测阳性率(%)
来源:中国疾病预防控制中心
呼吸道主要病原体检测阳性率区域差异

来源:中国疾病预防控制中心
呼吸道感染是最常见的传染病类别,也是全球发病率和死亡率的主要原因之一。2019年冬天爆发新型冠状病毒(SARS-CoV-2)就对人类产生了深远且持续的影响,影响了健康、日常生活、经济和心理等多个方面。
呼吸道是一个复杂的器官系统,分为不同的区域;上呼吸道包括鼻腔、咽和喉,而下呼吸道则由传导气道(气管和支气管)、小气道(细支气管)和呼吸区(肺泡)组成。曾经被认为是无菌器官的健康肺现在被描述为拥有自己的特定微生物种群——肺微生物群。
肺微生物群被认为是不断吸入和消除的细菌的短暂定居点。这些共生细菌作用于免疫系统,诱导保护性反应并防止病原体入侵和定植。同时,它们通过生产抗菌物质直接抑制病原体的生长。共生菌与常驻上皮细胞和免疫细胞之间的持续互作支持肺稳态。
肺部微生物群被视为“肺部健康状况的镜子”:多项研究表明,在肺部疾病发生期间,肺部细菌组成和肺部环境会发生巨大变化。另一方面,肺与肠道进行连续的双向串扰,并且任一部位微生物群组成的改变都会导致远端疾病的发展和进展。
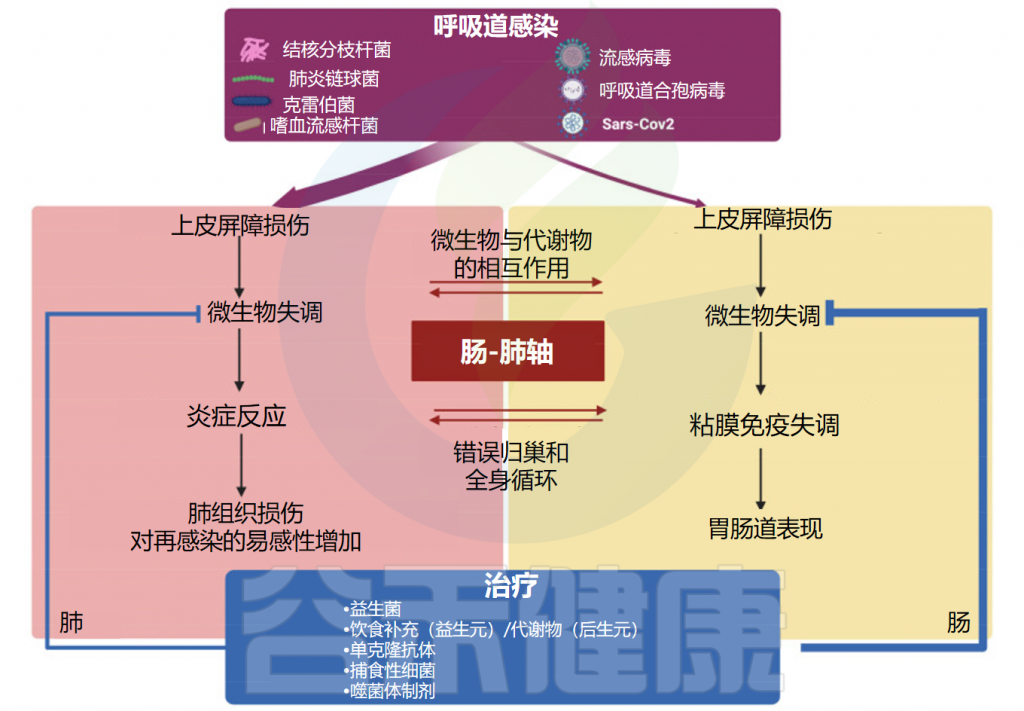
在本文中,我们将重点关注宿主-微生物群相互作用在健康和最常见的呼吸道细菌(结核分枝杆菌、肺炎链球菌、肺炎克雷伯菌和流感嗜血杆菌)和病毒(流感病毒、呼吸道合胞病毒和严重急性呼吸系统综合症冠状病毒)感染中的作用,描述肺微生物群在生理防御以及疾病环境中的变化。
最后,本文总结了基于微生物群的治疗方法在呼吸道感染中的作用,包括新型微生物基础疗法(益生菌和膳食补充剂)以及微生物靶向疗法(抗菌单克隆抗体和噬菌体),有助于重塑常驻微生物群落并恢复呼吸道健康。
doi: 10.3390/ijms25074051.
肺部微生物群是指存在于肺部的微生物群落,包括细菌、病毒、真菌和其他微生物。尽管肺部长期被认为是无菌的,但近年来的研究表明,健康的肺部也存在复杂的微生物群,其组成和功能对维持肺部健康和免疫平衡至关重要。
★ 肺部相比肠道微生物较少,但也存在
肺部环境通常不适合细菌群落的发育,导致与肠道环境相比,细菌复制率相对较低,生物量也较低(103-105VS1011-1012个细菌/克组织)。
健康个体的上呼吸道(URT)微生物群更复杂一些,其中口腔共生菌普遍存在。相比之下,下呼吸道(LRT)的微生物群生物量较低,其组成受上呼吸道微吸入的影响,同时因粘膜纤毛活动和先天免疫功能的作用,局部微生物复制受到限制。
大量研究表明,健康的肺部含有拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的微生物群,其中普雷沃氏菌(Prevotella)、链球菌(Streptococcus)、奈瑟菌(Neisseria)、嗜血杆菌属(Haemophilus)、梭杆菌属(Fusobacterium)和Veilonella是最丰富的属。
16S rRNA 分析确定了健康URT和LRT之间微生物群的空间差异。从口腔到下肺不断发现与链球菌属的细菌重叠。然而,葡萄球菌通常栖息在上呼吸道,而普雷沃氏菌属和韦荣氏菌主要栖息在下呼吸道。
★ 呼吸道微生物定植在出生后就开始
呼吸道定植在出生后24小时内立即开始。在健康状态下,来自链球菌属(Streptococcus)、葡萄球菌属(Staphylococcus)、普雷沃氏菌属(Prevotella)、莫拉氏菌属(Moraxella)、嗜血杆菌属(Haemophilus)、乳杆菌属(Lactobacillus)、棒状杆菌属(Corynebacterium)和Dolosigranulum的物种代表了生命早期呼吸道的初始定植者,有助于平衡和动态的微生物群落。
从新生儿到成熟期,呼吸道中的细菌数量逐渐增加,多样性和功能能力受到分娩方式、母乳喂养、抗生素使用和烟雾暴露等因素的影响。动物模型研究显示,出生后前两周内细菌量明显增加,菌群从γ‐变形菌纲和厚壁菌门逐步转向拟杆菌门。
★ 微生物可以通过空气吸入和扩散进肺部
微生物迁移是通过吸入空气中的细菌、沿粘膜表面直接扩散发生的,后者被认为是健康受试者中占主导地位和普遍存在的途径。事实上,下呼吸道的细菌群落在很大程度上类似于口腔微生物群的组成。
与微生物群落具有高度抗性的高生物量粘膜(即口腔、肠道)的微生物相比,肺微生物组的动态性质可能是一个重要的独特特性。
★ 影响肺部微生物群的因素
影响肺微生物组成的因素主要有以下几个方面:
1.宿主因素
-年龄
-性别
-体重
-遗传因素
-健康状况(基础疾病)
2.环境因素
-空气质量
-吸烟
-职业暴露
-居住环境
3.生活方式因素
-饮食
-口腔卫生
-运动
-抗生素使用
4.其他因素
-季节变化
-医院环境暴露
-抗生素的使用
-疫苗接种
此外还有局部微生物竞争、宿主上皮细胞相互作用和免疫细胞活化等。术语“菌群失调”表示健康肺微生物组的三个决定因素(微生物迁移、微生物消除和繁殖率)平衡的变化,肺部菌群失调与许多不良生物学事件有关,并参与呼吸系统疾病的发生和发展。
★ 肺部微生物群的变化与疾病存在相关性
比较患病肺和健康肺发现,肺部微生物组成存在显著差异,疾病状况与细菌多样性的丧失有关,或者与一小群分类群的优势有关。微生物菌群失调是各种肺部疾病的特征,其中微生物多样性减少可能与疾病进展有关。
肺微生物组的生长条件在病理过程中发生了显著变化,导致适合受伤气道的疾病和患者的微生物群落。例如肺部富集的口腔厌氧菌群(如Prevotella和Veillonella)与炎症增强和免疫反应改变导致的感染易感性增加有关。
此外,肺微生物群成分的改变对某些个体造成更大的感染风险。肺微生物群的改变与多种肺部疾病的恶化有关,不同的细胞免疫反应与暴露于各种肺部微生物有关。例如在慢性肺部炎症中,来自病理性人支气管肺泡系统的假单胞菌(Pseudomonas)和乳杆菌(Lactobacillus)的富集与Th17型反应的增强相关。一些致病体还会诱导严重的不依赖性Toll样受体2的气道炎症和肺部免疫病理学。
呼吸道微生物组成影响人类和小鼠的炎症反应,调控肺γδ T细胞产生IL-17及肺泡巨噬细胞的分化,并影响抵抗呼吸道感染的能力。副流感嗜血杆菌通过TLR4激活促炎反应,阻碍皮质类固醇通路,诱导炎症性Th2途径,最终导致支气管反应。
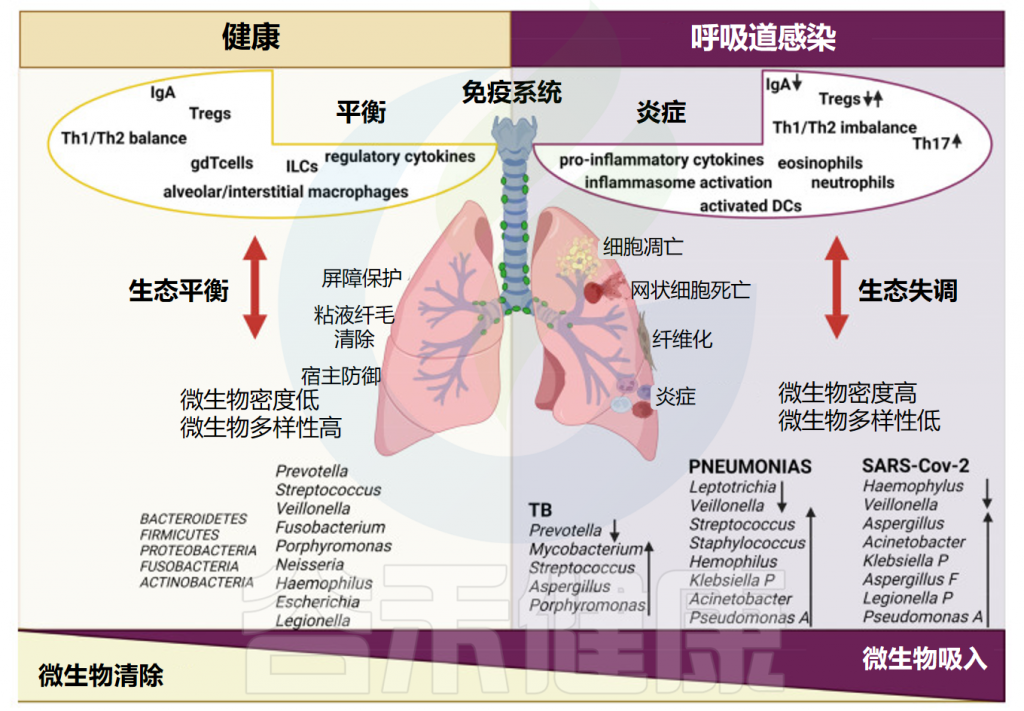
健康和呼吸道感染期间的肺微生物群和免疫
doi: 10.3390/ijms25074051.
肺部感染包括病原体的获得、传播和侵入下呼吸道。
肺炎是肺实质的炎症。在病因学上,它被归类为社区获得性肺炎(先前健康的个体的感染)或医院获得性肺炎(住院个体在入院后48小时内的感染)。革兰氏阳性肺炎链球菌(Streptococcus pneumoniae)是大多数社区获得性肺炎病例的原因,也是2岁以下儿童、老年人和免疫功能低下个体患病的主要原因。
★ 不同人群易感的病原体有所差异
由流感嗜血杆菌和肺炎克雷伯菌引起的肺炎易在50岁以上的慢性阻塞性肺病或酗酒患者中传播,而由肺炎支原体和肺炎衣原体引起的肺炎则在儿童中更为广泛。由呼吸道合胞病毒(RSV)和腺病毒引起的病毒性肺炎在健康人群中很少见,而由流感病毒引起的肺炎仍然是老年人和基础疾病患者高死亡率的原因。
在成人中,肺炎链球菌(S.Pneumonia)、乳杆菌(Lactobacilli)和罗斯氏菌属(Rothia)的优势与肺炎有关。新生儿中肺炎链球菌、流感嗜血杆菌或莫拉菌的定植与患支气管炎的风险较高有关。在流感患者中还发现假单胞菌增多。
主要病原体检测阳性率年龄组差异

来源:中国疾病预防控制中心
★ 呼吸道病原体感染导致肺部疾病的发展
人体研究表明,不同菌株的早期定植与发生呼吸道感染的风险增加有关。因此,病原体感染和微生物相互作用都可能影响疾病的进程。从生态学上讲,感染的特点是微生物负荷增加和群落多样性减少,以及宿主炎症和组织损伤增加。上呼吸道微生物组的改变是导致肺炎的细菌感染发生的原因。
最近的一项研究描述了严重肺部感染中病毒复制的显著增加,以及轻度和重度疾病患者之间微生物相互作用的差异,尤其是与常见病原菌之间的关联。流感导致的高死亡风险主要归因于继发性细菌感染。病毒通过多种机制增加了宿主对细菌定植的脆弱性。
注:鼻内接种H1N1病毒以模拟人类流感的小鼠微生物组、肺转录组和代谢组显示出显著变化,这些变化在恢复期持续存在。这表明感染对微环境的稳态产生了长期影响,有利于潜在病原体。
结核病
结核分枝杆菌(Mtb)是导致肺结核(TB)疾病中肺部肺炎的原因。在小鼠和人类身上进行的研究表明,肺部微生物组在抵抗结核分枝杆菌感染方面发挥作用。
结核病患者肺部存在特殊的菌群富集
一些细菌菌株可能与结核病的发病、复发和治疗失败有关。例如假单胞菌的丰度与治疗失败的风险增加有关。与健康对照组相比,感染结核分枝杆菌的个体的微生物群多样性降低,并且经常表现出链球菌和假单胞菌的富集。
在结核病中,肺部和整个下呼吸道具有特殊的微生物特征:结核分枝杆菌、金黄色葡萄球菌和乳酸克鲁维酵母(Kluyveromyces lactis)在123名结核病患者的支气管肺泡灌洗液 (BALF)中高度富集,而副流感嗜血杆菌在未感染的肺部富集。
使用鼻咽拭子样本的研究表明,结核分枝杆菌感染显著改变了微生物群组成:与健康对照组相比,结核病患者的变形杆菌、γ-变形杆菌、假单胞菌和莫拉菌科增加,而芽孢杆菌和毛螺菌属减少。
肺泡微生物多样性降低可能由炎症环境引起
与健康对照组相比,结核病患者的肺泡微生物群多样性降低(链球菌和梭杆菌减少,结核分枝杆菌丰度增加)。这些变化可能是由炎症环境决定的,因为结核分枝杆菌可以释放毒力因子,从而抑制巨噬细胞的反应。
在另一项研究中,链球菌在结核病中显著增加,而结核病中的Th1反应可能是由奈瑟菌(Neisseria)和嗜血杆菌(Haemophilus)引发的。
新冠肺炎
2019年,一种新型冠状病毒严重急性呼吸系统综合症2(SARS-CoV-2)引起了新型冠状病毒病(COVID-19)大流行。疾病严重程度和死亡率因年龄及合并症而异,其中许多与肠道和肺部微生物改变有关。这表明菌群失调可以在一定程度上预测COVID-19的严重程度。
新冠病毒感染者肺部微生物群失调
一般来说,与健康或病情较轻的COVID-19个体相比,危重症COVID-19患者的肺部物种多样性降低,细菌负荷增加。不良的临床结果与支原体的下呼吸道富集有关。
一项研究描述了来自重症COVID-19患者的支气管肺泡灌洗液(BALF)样本,假单胞菌丰度显著更高,而来自COVID-19肺炎阴性患者的 BALF 的特征是流感嗜血杆菌和韦荣氏球菌等的富集。
据报道,20名已故 COVID-19 患者的肺组织微生物组以不动杆菌(Acinetobacter)为主,不动杆菌通常与引起肺炎的肺部感染有关。
在上呼吸道和下呼吸道中,宿主免疫系统对潜在的有害物质做出反应,并将它们与自身成分、外来非危险物质和有益共生微生物群区分开来。
◆ 气道上皮产生粘蛋白形成抵御病原体的屏障
气道上皮是与当地微生物群相互作用的场所,也是生物物理保护屏障。产生粘液的气道上皮分泌细胞是肺先天免疫系统的关键要素。一些数据表明,呼吸道微生物群调节塑造粘液产生的上皮屏障。具体来说,在小鼠模型中,证明了粘蛋白与肺部感染反应之间存在联系。
◆ 产生lgA阻止病原体的吸附
除粘蛋白外,气道上皮细胞还提供抗原特异性分泌型IgA屏障,能够保护气道表面。分泌型IgA的作用是阻止病原体的吸附,中和它们在粘膜上皮的毒性产物,介导感染上皮细胞中病毒的消除,并促进对病原体的杀伤。
多项研究证明,IgA在防御呼吸道感染中发挥重要作用:IgA缺陷小鼠对牛分枝杆菌卡介苗(BCG)鼻内感染的易感性增加。鼻内给药中和IgA后,接种流感病毒(IV)或呼肠孤病毒导致小鼠模型中肺部病毒滴度显著降低,肺炎严重程度减轻。值得注意的是,静脉注射抗原特异性聚合物IgA可通过血清中的IgA分泌保护小鼠免受流感感染。
◆ 分泌抗菌肽来对抗病原体
局部呼吸道还分泌称为抗菌肽(AMP)的保护性介质,包括溶菌酶、乳铁蛋白、脂质运载蛋白、过氧化物酶、氨肽酶、集合蛋白(表面活性剂蛋白A和表面活性剂蛋白D)、甘露聚糖结合凝集素(MBL)、cathelicidins和β-防御素。
值得注意的是,β-防御素和cathelicidins具有抗菌和免疫调节作用,并参与塑造微生物群组成。事实上,炎症反应的直接抗菌活性和免疫调节是由微生物群的成员触发的。
免疫细胞在呼吸道病原体感染中至关重要,是机体防御系统的核心。接下来,我们一起来了解一下不同免疫细胞与病原微生物感染之间的相互作用。
▸ 巨噬细胞
肺中存在不同类型的先天免疫细胞:肺泡巨噬细胞(AMs)是最具代表性的细胞,似乎是几种呼吸道感染发病机制的核心,包括结核分枝杆菌(MTB)、肺炎链球菌、鼻病毒、流感病毒(IV)和呼吸道合胞病毒(RSV)。
◆ 肺巨噬细胞失调影响呼吸道感染的死亡率和并发症
AMs启动白细胞募集,并使用几种病原体特异性机制直接消除病原体,例如分泌促炎细胞因子/趋化因子(IL-6、IL-8或CXCL10),启动I型IFN信号传导,增强模式识别受体的表达,以及抑制病毒基因组的核输出。
并发症发生率和死亡率的增加与肺泡巨噬细胞耗竭有关,无论是在实验过程中还是在自然过程中,呼吸道病毒感染都是相关的。此外还发现,重症COVID-19的一个一致特征是肺巨噬细胞失调。
▸ 树突状细胞
肺部的树突状细胞(DC)在防止呼吸道感染方面发挥作用,对病原体产生强大的适应性免疫反应。树突状细胞可以启动抗病毒CD8细胞毒性T细胞反应,导致病毒清除,还可以控制炎症反应的水平。
◆ 树突状细胞可作为继发性肺炎的生物标志物
炎症期间和之后的树突状细胞(DC)改变可用作继发性肺炎易感性的生物标志物,以及有希望的治疗靶点,以改善患者的预后。在结核分枝杆菌(MTB)感染中,DC在将先天免疫反应转变为适应性免疫方面发挥着多因素作用。值得注意的是,树突状细胞在防御SARS-CoV-2感染方面也发挥着关键作用。
▸ 黏膜相关不变T细胞
黏膜相关不变T(MAIT)细胞是非常规T细胞的一个亚群,对微生物感染进行免疫监视和免疫反应。
◆ 进行免疫监视和免疫反应
不同的研究表明,MAIT 细胞通过识别和杀死细菌感染的细胞(包括树突状细胞和肺上皮细胞)在结核分枝杆菌感染的免疫控制中发挥作用。
此外,MAIT细胞在人和小鼠中都需要细胞因子来响应结核分枝杆菌抗原,这可能是由于它们在感染部位募集。一项新的研究证实,急性SARS-CoV-2感染患者循环中的MAIT被激活,但频率降低,而它们在致命性COVID-19患者的肺部蓄积。
▸ 自然杀伤T细胞
不变自然杀伤T(iNKT)细胞在控制共生菌(包括机会性病原微生物群)中发挥作用,反过来,微生物群调节iNKT细胞。
在原发性呼吸道合胞病毒(RSV)感染期间,肺iNKT细胞的激活除了导致肺嗜酸性粒细胞增多和纤维化外,还导致抗病毒CD8 T淋巴细胞反应和病毒清除。
◆ 活动性结核病患者存在iNKT细胞缺乏
人类iNKT细胞缺乏可能是活动性/急性结核病发展的基础:与潜伏性结核病患者相比,活动性结核病患者的外周iNKT细胞较少,并且通过活动性结核病的治疗可以重建正常的iNKT细胞频率。据报道,重症 COVID-19 肺炎患者 iNKT 细胞减少,表明该亚群可能作为疾病严重程度的生物标志物发挥作用。
▸ γδT细胞
肺驻留γδT细胞是粘膜上皮屏障的主要T细胞成分,对维持肺稳态和影响多种肺部疾病的进展至关重要。γδT细胞是肺炎克雷伯菌感染中 IL-17A 的主要来源,也是宿主对急性铜绿假单胞菌肺部感染的早期免疫防御。
◆ γδT细胞对肺部感染进行早期免疫防御
在肺炎链球菌肺部感染期间,观察到活化的γδ T细胞数量显著增加。γδ T 细胞对冠状病毒感染的反应仍在研究中,之前关于SARS-CoV-2感染的报道显示对感染的靶标单核细胞系具有很强的溶细胞活性。
▸ 调节性T细胞
调节性T(Treg)细胞对于肺对空气传播的过敏原的免疫耐受以及减少对自身和非自身抗原的危险免疫反应至关重要。Treg耗竭通过抗原致敏在衣原体肺炎感染的发病机制中发挥作用。
◆ 调节性T细胞对肺炎链球菌肺炎具有保护作用
此外,Tregs通过与TGF-β通路相关的机制对肺炎链球菌引起的肺炎具有保护作用。其他研究使用呼吸道合胞病毒和甲型流感病毒的小鼠模型表明,Treg细胞的耗竭可能导致CD8+ T细胞亚群的迁移延迟。
最近的研究显示,COVID-19患者的Tregs数量显著减少,导致Treg/Th17比值失衡,这与呼吸衰竭风险相关。
此外,呼吸道微生物群的成员通过TLR反复暴露于病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs),诱导树突状细胞和肺泡巨噬细胞的模式识别受体(PRR)耐受性。总之,呼吸道微生物群与气道上皮细胞和吞噬细胞形成正反馈回路,以实现免疫耐受并避免失控的炎症反应。
呼吸道中的宿主-微生物相互作用主要发生在粘膜部位。常驻微生物可以局部或全身引发免疫细胞(如上皮细胞、树突状细胞和中性粒细胞)的反应。这些物质能够进入循环并到达其他器官。
◆ 呼吸道微生物群与免疫和呼吸健康密切相关
呼吸道微生物组为宿主免疫系统提供重要信号,这些信号对免疫训练、器官发生和免疫耐受的维持至关重要。观察结果表明,在生命早期存在一个关键时期,正确的微生物群感知对免疫成熟和呼吸健康至关重要。
动物模型研究了微生物组在影响和管理宿主免疫系统中的作用,以及免疫系统在塑造微生物组中的作用。
例如,在小鼠模型中,拟杆菌门的成员相比流感嗜血杆菌减少了炎症、中性粒细胞募集和TLR2介导的细胞因子产生。
鼻内接种金黄色葡萄球菌导致单核细胞募集到肺部,并分化为抑制肺泡巨噬细胞的IV诱导炎症反应。
尽管肺炎链球菌被视为病原体,但它也是上呼吸道的一种共生菌。在小鼠鼻腔中同时定植肺炎链球菌和流感嗜血杆菌创造了炎症环境,导致C-X-C基序趋化因子配体2和中性粒细胞的高水平募集。协同反应依赖于肺炎链球菌产生的溶细胞毒素,表明其存在调节了对流感嗜血杆菌的免疫反应。遭受流感嗜血杆菌攻击的小鼠表现出严重的肺部疾病,显示出明显的中性粒细胞通路和高浓度的促炎细胞因子。
然而,如果小鼠在吸入共生普雷沃氏菌后进行预处理,炎症会显著减少,且不存在组织病理。腺病毒诱导的记忆肺泡巨噬细胞在小鼠急性鼻内感染中表现出主要组织相容性复合体II类(MHCII)表达增加,以及与宿主防御、趋化性、抗原呈递和糖酵解代谢相关的基因转录上调。
在呼吸道病原体引起的菌群失调期间,共生细菌受到干扰,致病菌可同时出现在肺和肠道中,因此可能导致两个部位的组织损伤。
肠道和肺之间的密切生理和病理联系主要依赖于宿主-微生物的串扰。事实上,肺和肠道细菌的成员可以通过血流成分和代谢物直接交换,从而促进这两个部位的健康或疾病。
肠-肺轴主要相互作用的示意图
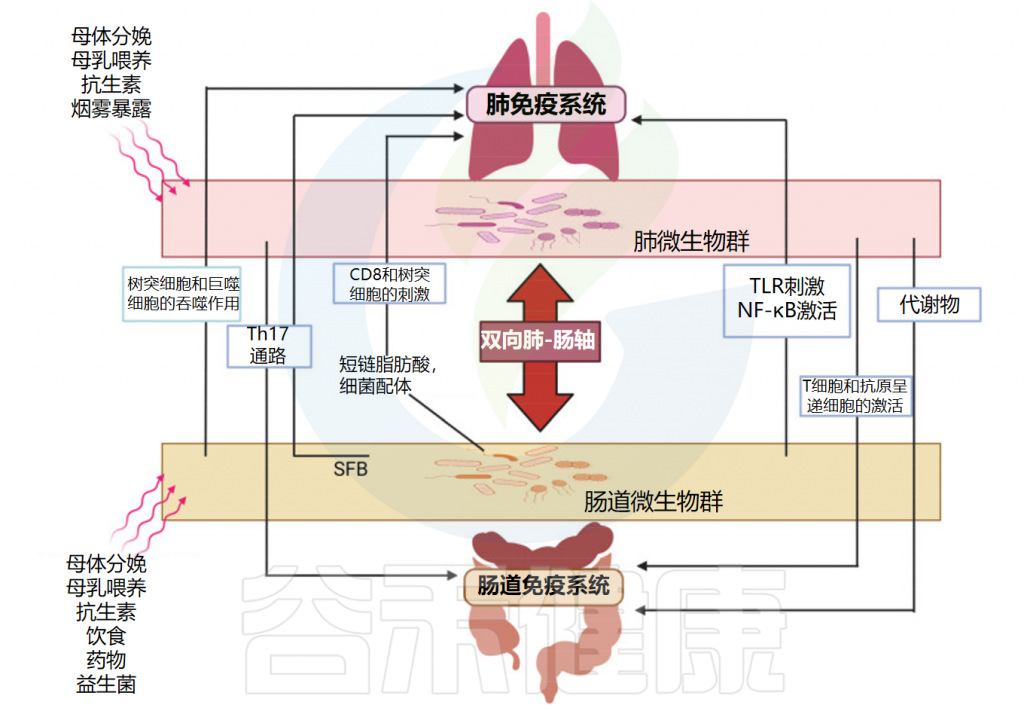
doi: 10.3390/ijms25074051.
呼吸道感染对肠道菌群的影响
研究发现,肺微生物群的改变调节肠道微生物群落,从而影响肠道信号传导。已知结核分枝杆菌感染会导致免疫系统失调,从而使肠道微生物组改变。
◆ 结核病患者肠道微生物群发生显著改变

在一项研究中,比较了成年结核病患者与健康对照的肠道微生物组,发现厚壁菌门、变形菌门和疣微菌门减少,而放线菌门、拟杆菌门和梭杆菌门增加。
另一项研究分析了新发和复发性结核病患者,报道了拟杆菌门、普雷沃氏菌属和毛螺菌属的减少,而放线菌门和变形菌门的富集。
最后,在一组受影响的儿童中,观察到放线菌门和厚壁菌门的减少,而包括拟杆菌属、双歧杆菌属、Dorea属、粪杆菌属、瘤胃球菌属和普氏粪杆菌(F.prausnitzii)属、肠球菌属和普氏菌属的数量增加。
◆ 结核病患者的微生物代谢也变得不平衡
结核病患者可能导致微生物代谢物的产生不平衡,例如短链脂肪酸(SCFA),这可能会重置肺微生物组和通过“肠-肺轴”的免疫反应。这些发现也可能解释了结核分枝杆菌在胃肠道中的定植和肺结核患者发生肠结核的原因。普氏粪杆菌(F.prausnitzii)还被描述具有抗炎作用,可抵御胃肠道疾病。
很少有研究分析人类呼吸道病毒感染期间发生的肠道微生物群改变的性质。在流感期间,尽管肠道中明显不存在病毒,但一些患者仍会出现类似胃肠炎的症状。
◆ 流感病毒感染患者的肠道菌群也存在失衡
一项针对H7N9病毒感染患者的研究显示,拟杆菌门(包括经黏液真杆菌属(Blautia)、罗氏菌属(Roseburia)和瘤胃球菌(Ruminococcus))减少,但厚壁菌门和变形菌门以及属(包括埃希氏菌(Escherichia)、梭菌属(Clostridium))增加。
另一项在流感亚型H1N1患者中进行的研究报告了放线菌门和厚壁菌门的减少,以及包括Dorea、粪杆菌、瘤胃球菌、链球菌在内的属,放线菌科和微球菌科的富集。
在最近的一篇综述中,11项不同的研究报告了与健康对照相比,确诊或疑似呼吸道感染(RTI)患者的肠道微生物组改变。总之,患者的肠道微生物组改变始终是多样化的,包括一些菌的枯竭和富集。
◆ 新冠病毒感染可在肠道中检测到病毒RNA
与甲型流感病毒(IAV)和呼吸道合胞病毒(RSV)的情况相反,在SARS-CoV-2(新型冠状病毒)感染期间,即使病毒RNA不再存在于呼吸道中,也可以在肠道中检测到病毒RNA,从而指出消化道是病毒复制和活性的潜在部位。
◆ 产丁酸抗炎菌减少,机会性病原体增多
SARS-CoV-2感染患者的肠道菌群失调与COVID-19疾病进展和严重程度以及COVID-19后综合征相关。它的特点是双歧杆菌和粪杆菌等抗炎菌减少,丁酸盐生产者丰度降低,例如瘤胃球菌科和毛螺菌科的几个属。
相反,还存在炎症相关微生物群(包括链球菌和放线菌)的富集,以及机会性细菌病原体的过度生长。
最近的一篇论文也表明,SARS-CoV-2感染会导致小鼠肠道微生物组失调,以及潘氏细胞和杯状细胞以及屏障通透性标志物的改变。同样,从96名 COVID-19患者收集的微生物组样本显示,抗菌素耐药物种在内的机会性病原菌属大量繁殖,这种肠道菌群失调与肠道细菌的继发性血流感染有关。
◆ 通过促炎因子和食物摄入减少影响肠道菌群
肺部感染的细胞免疫反应会导致食欲不振,从而改变肠道微生物组和代谢。研究发现,消除CD8+细胞可以阻止食物摄入量的减少并逆转肠道微生物群的变化,这可能是通过分泌TNF-α实现的。实际上,在呼吸道合胞病毒感染期间,中和这种细胞因子可以减少体重减轻并缓解肠道微生物群的扰动。
总的来说,炎性细胞因子的释放和食物摄入量减少是急性病毒性呼吸道感染影响肠道微生物群的可能机制。另一种机制涉及浸润的CD4+ T细胞或全身 IFN释放,它改变了上皮细胞的代谢,导致营养物质的积累,肠腔的微生物为此竞争。这些发现可能在呼吸道病毒感染期间的肠道菌群失调和胃肠道疾病中发挥作用。
肠道微生物群对呼吸道感染的影响
◆ 炎症性肠病患者通常存在肺部受损
肠道和肺之间的重要联系主要体现在炎症性肠病(IBD)患者的肺部受累范围广泛且严重,从亚临床改变到明显的慢性炎症性肺病。气道受累的症状最常见于有长期IBD病史的患者,这与肠道发育不良或全身性不当免疫反应有关。
◆ 肠道菌群失调与呼吸道感染易感性增加相关
除了慢性疾病,肠道菌群失调还与呼吸道感染的易感性增加有关。临床观察强调了健康肠道微生物群在预防病毒呼吸道感染方面的重要性。在肾移植受者和同种异体造血干细胞移植(HSCT)患者中,产丁酸盐的肠道细菌减少与病毒呼吸道感染的风险和发生率增加相关。
在COVID-19(新冠病毒感染)患者中也发现了肠道菌群失调和肠道代谢产物的变化,这与炎症反应和疾病并发症相关。值得注意的是,将COVID-19患者的粪便移植到无菌小鼠体内会导致肺部炎症,并在多重耐药肺炎克雷伯菌感染期间导致更糟糕的结果,这表明微生物群可能直接导致疾病后遗症。
此外,肠道菌群还可以调节血管紧张素转换酶2(ACE2)受体的结肠表达。这些证据可能有助于解释肠道菌群失调患者(如老年人、免疫功能低下患者和有其他合并症的患者)疾病易感性和胃肠道症状的增加。
◆ 肠道微生物及其代谢物可以调节肺部免疫反应
在几种细菌和病毒呼吸道感染的实验模型中,肠道共生菌的缺失或通过抗生素耗竭导致微生物传播、炎症、器官损伤和死亡率增加。这些影响大多与肠道微生物群塑造全身免疫的能力有关。由肠道微生物及其代谢物(如SCFAs)触发的免疫细胞和细胞因子可以到达体循环,并调节肺部、健康和疾病中的免疫和炎症反应。
此外,据报道,炎症性肠病患者的肠道淋巴细胞缺乏组织特异性;这可以解释IBD患者肠外器官存在炎症的原因。菌群失调介导的炎症也会导致粪便钙卫蛋白、血浆C反应蛋白、IL-6和IL-8的循环水平升高,这可能导致肺部感染期间的并发症发生。
肠道菌群失调也可能通过减少营养吸收和能量可用性来影响肺部感染的结果,这反过来会干扰患者产生有效免疫反应的能力。
关于肠道微生物群如何影响呼吸道感染的机制,动物研究提供了更多见解。
在抗生素处理的小鼠中,腹膜巨噬细胞中IFN-γRI、MHC-I、CD86和CD40分子的表达在对病毒感染的早期反应中减弱,这表明肠道微生物群在病毒在宿主体内复制之前就向先天免疫反应发出信号。
Th1、IgA和巨噬细胞对呼吸道病毒感染的反应建立取决于肠道微生物。直肠TLR刺激为IL-1β和IL-18分泌提供信号,恢复了抗生素处理小鼠的肺CD4+和CD8+ T细胞对感染的反应。
最近报道了一种常见细菌种类,即分段丝状细菌(SFB)在肠道中的定植,重新编程了肺泡巨噬细胞,使其增殖、补体产生和吞噬作用增强,从而增强了对流感病毒、呼吸道合胞病毒和SARS-CoV-2的保护。
总体而言,这些发现证实了肠道微生物刺激在先天抗病毒免疫反应激活中的重要性。在感染模型中,抗生素消耗肠道微生物群增加了结核分枝杆菌的负担和传播。菌群失调特别降低了肺树突状细胞中先天受体和巨噬细胞诱导的C型凝集素的表达,导致对幼稚T细胞的刺激功能受损,从而减少了感染小鼠的效应细胞和记忆T细胞数量。
◆ 肺部重叠感染可能受肠道微生物群的影响
肺部重叠感染可能是肺部原发感染诱导的肠道微生物组成改变的进一步后果。对继发性细菌感染的易感性增加,特别是由肺炎链球菌和金黄色葡萄球菌诱导的细菌感染,经常发生在患有呼吸道病毒感染的儿童和老年人中,导致并发症和死亡。
流感期间的肠道菌群失调通过改变短链脂肪酸的产生导致肺炎链球菌重叠感染。在接受甲型流感病毒条件微生物群的小鼠中,乙酸盐的产生减少,改变了肺泡巨噬细胞的杀菌活性,降低了肺对继发性肺炎链球菌感染的防御能力,并促进了重叠感染小鼠的死亡。肠道疾病也可能导致重症 COVID-19 患者伴随或继发性细菌感染。
因此,局部肺部或肠道菌群失调,改变了微生物间相互作用的动力学以及微生物代谢,可能会增强潜在致病细菌物种的增殖。
揭示肺和肠道之间的复杂相互作用有助于更好地了解共生微生物群作为各种呼吸道传染病的治疗靶点。
使用益生菌(微生物)、有利于其生长的产品(如益生元)或微生物代谢物(如后生元)的给药可以通过与病原微生物的直接竞争、改善上皮屏障功能或免疫调节,在呼吸系统疾病期间提供宿主保护。
病毒感染下的治疗
◆ 使用益生菌能够减少流感风险和发生率
在一项系统评价中,评估了益生菌在大规模健康受试者中预防病毒性呼吸道感染(RTI)的疗效。乳杆菌(Lactobacillus)是最常用的益生菌,其次是双歧杆菌(Bifidobacterium)和乳球菌(Lactococcus)。
大多数研究表明,益生菌的使用与病毒RTI的风险和发生率降低相关。然而,在临床表现、病毒载量和免疫学结局的改善方面尚无共识。益生菌鼠李糖乳杆菌和短乳杆菌也与流感感染发生率的减少有关。
在新型冠状病毒(COVID-19)背景下,一项针对SARS-CoV-2诱发肺炎的ICU患者的回顾性研究显示,与单独使用标准治疗相比,使用乳杆菌、双歧杆菌和链球菌属的益生菌混合物治疗与死亡率降低相关。
◆ 益生菌增强了免疫反应,有助于提高生存率
几份报告描述了口服益生菌对病毒性呼吸道感染结果的影响,也提供了机制见解。在感染流感病毒或呼吸道合胞病毒之前服用益生菌,如乳杆菌、双歧杆菌、肠球菌或乳球菌,可缓解症状并提高生存率。肺部和鼻腔冲洗液中的病毒载量也有一定程度的降低。
从机制上讲,益生菌可以通过参与免疫细胞并诱导特定的细胞因子/趋化因子产生来引发针对病毒呼吸道感染的保护性反应,尽管其作用似乎是高度菌株特异性的。
研究表明,益生菌给药后,自然杀伤细胞活性增加,浸润性巨噬细胞和中性粒细胞减少,支气管肺泡灌洗液中的病毒特异性IgA/G滴度增加。粘膜乳杆菌抑制呼吸道合胞病毒复制并降低血炎细胞(如粒细胞和单核细胞)的比例。
用副流感病毒对用益生菌治疗的小鼠肺淋巴细胞进行离体刺激,导致IFN-α和IFN-β的高度表达。病毒感染期间IL-10的上调和IL-6的相应减少也由益生菌给药引发。除了这些保护作用外,经鼻给药鼠李糖乳杆菌GG和嗜酸乳杆菌L-92还增加了IL-1β和单核细胞趋化蛋白1细胞因子以及趋化因子eotaxin和M-CSF的水平。
注意:尽管益生菌具有令人满意的安全性,但它们的使用可能与体弱人群感染或发病率的较高风险有关。因此,人们对使用非活微生物越来越感兴趣。动物研究证明了热灭活益生菌在呼吸道感染中的有益作用,尽管它们的全球影响似乎仅次于活益生菌。
◆ 通过饮食补充益生元提高了抗病毒感染的能力
肠道微生物群可以通过产生短链脂肪酸来调节免疫反应。摄入微生物可利用的膳食纤维(益生元),促进特定共生微生物的多样性和活性的增加,导致对微生物代谢物产生不同影响,进而对宿主对感染的反应产生不同影响。
高纤维(可发酵菊粉)饮食通过两种互补机制传达对流感的保护。小鼠表现出增强的选择性激活巨噬细胞的骨髓生成,这些巨噬细胞促进CXCL1介导的中性粒细胞募集到气道的能力有限,从而导致感染期间组织免疫病理学受限。
同时,饮食衍生的短链脂肪酸刺激CD8+ T细胞抗病毒活性。这种作用是由丁酸盐通过游离脂肪酸受体(FFAR)介导的。同样,高纤维(可发酵果胶)饮食通过刺激肺上皮细胞中的I型IFN 反应来防止呼吸道感染,这种保护是由乙酸盐通过GPR43介导的。
此外,有研究报道,流感感染期间口服醋酸盐补充剂以FFAR2依赖性方式加强了肺部对继发性肺炎球菌感染的防御能力,并降低了重叠感染小鼠的致死结局。同样,鼻内醋酸盐增加了鼻病毒感染期间的干扰素依赖性反应,降低了肺病毒载量。
有趣的是,一项评估益生元(低聚半乳糖和聚葡萄糖)预防新生儿病毒性呼吸道感染功效的试验表明,与益生菌相比,益生元显示出更好的有益效果,这可能与对预先存在的有益细菌生长的直接刺激作用有关。
细菌感染下的治疗
通过调节微生物群对肺部细菌感染又有怎样的效果,让我们接着往下看。大多数研究分析了益生菌在预防和治疗ICU患者肺部感染中的疗效。
◆ 口服益生菌降低了细菌性肺部感染的概率
口服或口咽给予干酪乳杆菌和鼠李糖乳杆菌,可以减少铜绿假单胞菌或相关病原体对下呼吸道的定植和感染。一项研究观察到,在脓毒症患者中,使用短双歧杆菌、副干酪乳杆菌和低聚半乳糖的混合物后,呼吸机相关性肺炎(VAP)的发生率降低。
对感染肺炎链球菌的小鼠研究表明,口服不同的益生菌,如乳杆菌属和链球菌属的菌株,可增加对感染的抵抗力,降低肺细菌负荷,提高存活率。
◆ 鼠李糖乳杆菌等益生菌增强了肺部的免疫反应
鼠李糖乳杆菌的使用通过增加 Foxp3 + Treg 和减少促炎IL-6来增强抗炎反应。在气管内给予其他乳杆菌菌株后,在感染的小鼠中也观察到这种抗炎特征。
活的或灭活的益生菌长双歧杆菌 51A的给药通过增强肺泡巨噬细胞中活性氧的产生和减少促炎性TNF-α和IL-6来刺激肺炎克雷伯菌的肺清除。然而,只有活的益生菌诱导了IL-10水平的同时升高,主要是由醋酸盐介导的。
经鼻或口服接种能有效激活Nod2受体的细菌菌株(分别为脆弱乳杆菌、金黄色葡萄球菌和表皮葡萄球菌,或罗伊氏乳杆菌、粪肠球菌和解黄酮梭菌)可保护小鼠免受肺炎链球菌或肺炎克雷伯菌感染。
补充乳杆菌还可以恢复肺部树突状细胞介导的抗结核分枝杆菌免疫。在感染结核分枝杆菌的小鼠中,口服A.muciniphila或A.mucinihila介导的棕榈烯酸通过表观遗传抑制肿瘤坏死因子,强烈抑制了结核病感染。
呼吸道益生菌
虽然大多数用作益生菌的共生菌起源于肠道,但已经尝试使用呼吸道共生菌。特别是,在婴儿小鼠中鼻内施用Corynebacterium pseudodiphteriticum能够改善呼吸道合胞病毒原发感染和继发性肺炎链球菌重叠感染的特征,降低病原体负荷和肺损伤。据我们所知,迄今为止还没有人类研究评估过呼吸益生菌(即滴注或雾化到下呼吸道的活菌群)的潜力。
在动物模型中,细菌B.bacteriovorus和M.aeruginosavorus的鼻内给药大大降低了呼吸道肺炎克雷伯菌的负担。它们随后被宿主先天免疫机制消除,没有产生不良影响,这预示了它们可能用于治疗人类细菌性肺炎。
◆ 单克隆抗体特异性对抗细菌病原体
使用单克隆抗体(mAb)选择性消耗机会性细菌病原体,通过靶向和灭活细菌及其毒力因子或毒素,成为对抗传染病的一种有前景的方法。
这些抗体因其靶标特异性,不会对本身微生物群产生不良影响,且不太可能导致广泛耐药性。此外,多价mAb经过工程改造,能够发挥多种抗菌作用,包括灭活毒力因子、促进补体沉积和激活先天免疫。
Gremubamab(MEDI3902;AstraZeneca)是一种双特异性人IgG1 mAb,能选择性结合铜绿假单胞菌毒力因子,用于预防高危患者的医院肺炎。该单克隆抗体促进中性粒细胞清除细菌,并防止其附着在气道上皮细胞。Gremubamab的预防性和治疗性给药在急性铜绿假单胞菌肺炎中表现出高度保护作用。
单克隆IgM抗体帕诺巴单抗(AR-101,Aerumab;Aridis Pharmaceuticals)正在临床开发中,用于治疗医院获得性肺炎中的铜绿假单胞菌。帕诺巴单抗的给药减少了急性铜绿假单胞菌感染小鼠模型中的细菌负荷,并减轻了肺部炎症。
另外两种抗体已被检测用于预防和治疗金黄色葡萄球菌肺炎。舒拉妥珠单抗(MEDI4893;Aridis Pharmaceuticals)特异性结合并灭活金黄色葡萄球菌的成孔α-毒素,这是一种关键的毒力因子。在针对金黄色葡萄球菌定植的机械通气ICU患者的临床试验中,单克隆抗体显著缩短了部分患者的肺炎、住院时间和ICU住院时间。
◆ 噬菌体及其内溶素有助于治疗细菌感染
噬菌体疗法在治疗细菌病原体的呼吸道感染方面受到了临床关注,因为它能够在不影响宿主微生物群的情况下选择性地消除目标细菌,与抗生素相容性好,免疫原性低。
噬菌体制剂在治疗铜绿假单胞菌、肺炎克雷伯菌、鲍曼不动杆菌或大肠杆菌方面显示出很强的临床疗效,目前正在临床上评估用于治疗人类呼吸道感染。四种针对铜绿假单胞菌呼吸道感染的专性裂解噬菌体混合物被用于成功治疗肺炎和肺气肿患者。
噬菌体衍生的内溶素或溶酶在对抗细菌感染方面可能优于全噬菌体制剂,因为其细胞壁靶标的保守性使得耐药性难以产生。在鼻咽定植小鼠模型中,噬菌体内溶素的给药降低了肺炎链球菌的滴度,并有效保护小鼠免受致命性肺炎球菌肺炎或铜绿假单胞菌感染,显示出其在预防和治疗呼吸道细菌感染中的潜力。
呼吸道感染是最常见的病毒或细菌来源的传染病之一,造成严重社会和经济负担。研究发现呼吸道感染会导致肺部微生物群的多样性和组成发生变化,进而影响宿主与病原体的相互作用、炎症信号和免疫细胞因子的产生,最终影响疾病的进展和结果。
肺和肠道之间的重要性和复杂的串扰以及肠-肺轴与呼吸健康的紧密联系越来越受到认可,特别强调了肺-肠轴在调节炎症和免疫反应中的双向通信作用。然而,对涉及肠-肺轴的机制的理解,特别是在呼吸道感染的情况下才刚刚开始。需要更好地了解微生物组、呼吸道粘膜和潜在免疫途径之间的相互作用。
迄今为止,大多数用作益生菌的共生菌都来自胃肠道。由于肠道微生物群在影响免疫系统方面起关键作用,它会影响局部和全身(肺部)对病原体的反应。因此,改变肠道微生物组的微生物群靶向疗法(如益生菌、益生元和噬菌体疗法)已被证明对急性和慢性呼吸系统疾病都有益处。
然而,最近的研究表明,与肠道微生物群落相比,肺微生物群与肺免疫变化的相关性始终更密切。此外,肺共生菌的实验性调节直接和持续地改变了肺免疫反应,表明它们可能具有作为局部应用益生菌预防和管理呼吸道感染的潜力。
值得注意的是,致病细菌的抗生素耐药问题。下呼吸道感染是多重耐药感染导致死亡的主要原因,通常与金黄色葡萄球菌、肺炎克雷伯菌、肺炎链球菌、鲍曼不动杆菌和铜绿假单胞菌等重点病原体相关。同时,新变种的出现使呼吸道病毒感染愈加难以控制。
未来的研究应进一步揭示肺和肠道微生物群在健康和疾病状态下的具体机制,特别是它们如何通过代谢产物和免疫细胞影响呼吸道的免疫稳态。此外,需要更多的临床数据来验证这些微生物组干预措施在改善呼吸道感染预后方面的有效性。通过深入理解肺-肠轴的复杂相互作用,有望开发出新的预防和治疗策略,以减轻呼吸道感染的负担并改善患者的整体健康状况。
主要参考文献
Marrella V, Nicchiotti F, Cassani B. Microbiota and Immunity during Respiratory Infections: Lung and Gut Affair. Int J Mol Sci. 2024 Apr 5;25(7):4051. doi: 10.3390/ijms25074051.
Wypych T.P., Wickramasinghe L.C., Marsland B.J. The influence of the microbiome on respiratory health. Nat. Immunol. 2019;20:1279–1290.
Mathieu E., Escribano-Vazquez U., Descamps D., Cherbuy C., Langella P., Riffault S., Remot A., Thomas M. Paradigms of Lung Microbiota Functions in Health and Disease, Particularly, in Asthma. Front. Physiol. 2018;9:1168.
Sommariva M., Le Noci V., Bianchi F., Camelliti S., Balsari A., Tagliabue E., Sfondrini L. The lung microbiota: Role in maintaining pulmonary immune homeostasis and its implications in cancer development and therapy. Cell. Mol. Life Sci. 2020;77:2739–2749.
Natalini J.G., Singh S., Segal L.N. The dynamic lung microbiome in health and disease. Nat. Rev. Microbiol. 2023;21:222–235.
Wu B.G., Segal L.N. The Lung Microbiome and Its Role in Pneumonia. Clin. Chest Med. 2018;39:677–689.
Yagi K., Huffnagle G.B., Lukacs N.W., Asai N. The Lung Microbiome during Health and Disease. Int. J. Mol. Sci. 2021;22:10872.
Belizário J., Garay-Malpartida M., Faintuch J. Lung microbiome and origins of the respiratory diseases. Curr. Res. Immunol. 2023;4:100065.

谷禾健康

呼吸道感染在婴幼儿中很常见,会导致儿童经常出现哮喘、呼吸困难和呼吸窘迫,是5岁以下儿童住院的最常见原因。
在生命早期接触各种细菌和病毒是不可避免的,这对免疫系统的健康发育至关重要。随着孩子的成长,免疫系统也在发育和成熟,因此,在这段动态变化的时间里,感染的影响可能会产生长期的后果。
婴幼儿免疫系统的发育与呼吸道粘膜表面的微生物群具有相互作用。虽然病毒感染似乎是早期喘息/呼吸窘迫发作的关键触发因素,但暴露于某些细菌物种可以起到保护作用。
本文重点讲述生命早期呼吸道感染如何影响终生呼吸系统健康,结合了关于婴幼儿免疫成熟自然轨迹的最新数据,以及在这一关键发育时期发生的呼吸道感染的性质和类型如何影响免疫。
与呼吸系统疾病有关的术语表
阻塞性肺病——气道收缩或闭塞,使人难以呼出空气。与慢性阻塞性肺病、哮喘、支气管扩张、囊性纤维化和细支气管炎有关。
限制性肺病——肺部更硬,使肺部更难扩张以吸入空气。与肺纤维化、神经肌肉疾病和肥胖相关。
肺表面活性剂——由肺泡II型肺细胞产生的特定脂质、蛋白质和碳水化合物的复杂混合物,具有降低肺泡气液界面表面张力的功能。
气管吸入——一种非侵入性方法,从插管和通气的患者中获取含有气道分泌物的深层呼吸样本。
呼吸道吸入物——通常从鼻咽部获得,含有呼吸道分泌物。
支气管肺泡灌洗——通常在支气管镜检查中获得,在注入生理盐水后获得的下呼吸道液体样本。
支气管镜检查——一种微创手术,将一根带有摄像头和光源的细管(支气管镜)通过鼻子或喉咙进入气道,并进入气道进行采样。
毛细支气管炎——一种常见于婴幼儿的疾病,由一系列不同的病原体引起,但通常是呼吸道合胞病毒。伴有呼吸困难、喘息性咳嗽和粘液增多。
气液界面培养——将气道细胞三维培养的技术。培养物的基侧处于培养基中,液体从培养物的上部抽出,这促进了构成气道的不同上皮细胞的分化,包括那些有跳动的纤毛和产生粘液的上皮细胞。
生命早期的呼吸道感染会对发育中的肺部和免疫系统产生深远的影响。
来自全球的各项研究证据表明,对一些儿童来说,生命早期呼吸道感染会导致严重的终生呼吸道疾病,并可能影响其他合并症的发生,如心血管疾病、糖尿病和抑郁症。
在英国,大约一半的儿童在6岁之前至少经历过一次哮喘,几乎所有的哮喘都是由呼吸道合胞病毒(RSV)或鼻病毒(RV)引起的下呼吸道病毒感染引起的。
注:在英国因急性哮喘发作而入院的患者中,6岁以下儿童占75%。至少有三分之一的6岁以下急性呼吸窘迫儿童在童年时有反复发作的喘息。
随着学龄前儿童呼吸道感染的不断增加,了解为什么一些儿童对常见的季节性病原体有严重的、异常的免疫反应,以及这些多重感染对儿童及以后的免疫和肺部发育的影响是至关重要的。
▼
√早期下呼吸道感染的儿童肺功能降低
来自欧洲150,090名儿童的个体研究数据显示,早期(6个月至5岁)下呼吸道感染儿童的肺功能明显较低,学龄期(中位7岁)患哮喘的风险也较高。
√肺功能模式与相关疾病
在塔斯马尼亚纵向健康研究(n=2422)中,对7岁学龄儿童至53岁的成年人进行了随访,确定了四种终生肺功能模式:
(1)阻塞性肺功能模式,与哮喘和慢性阻塞性肺疾病(COPD)等呼吸道疾病有关(25%);
(2)限制性肺功能模式,通常见于肺间质性和实质性疾病(10%);
(3)阻塞性和限制性混合(3.5%);
(4)肺功能正常(60%)。
53岁时慢性阻塞性肺疾病患病率以混合型最高,其次为阻塞性。这种混合模式与儿童呼吸道疾病和成人哮喘有关。
限制性模式的非呼吸系统疾病患病率最高,包括成人肥胖、糖尿病、心血管疾病、高血压和阻塞性睡眠呼吸暂停。
注:在低收入和中等收入国家的队列中也显示出对早期下呼吸道感染的不良影响。
√低肺功能与反复的喘息和严重的哮喘有关
在成年早期未能达到最大肺功能会导致慢性阻塞性肺疾病的风险增加。
英国两个大型队列(n=1046)的肺功能轨迹显示,从学龄前到成年的持续低肺功能可归因于反复发作的喘息和严重的哮喘发作;并且来自美国的独立队列显示,在生命的第四个十年中,低肺功能与早期呼吸道合胞病毒感染和儿童哮喘有关。
!
注意
到目前为止,没有证据表明在生命的前5年过后肺功能会恢复。此外令人担忧的是,现在有证据表明,持续的低肺功能会增加早期全因死亡率的风险。
从出生到成年的肺功能轨迹
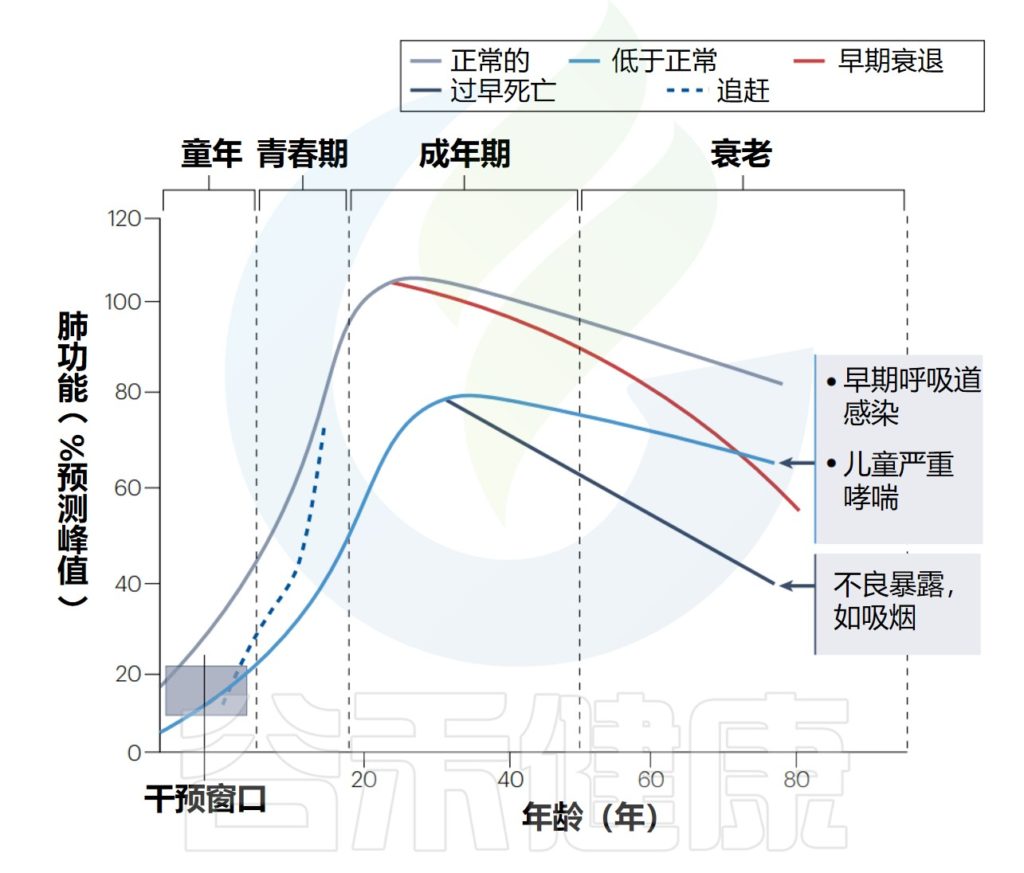
Lloyd CM,et al.Nat Immunol.2023
解读:肺功能发育正常的例子(灰线),在成年早期达到预期的峰值,随后在正常的衰老过程中缓慢下降。
成人接触不良环境(如吸烟)可能会加速下降。由于不良的早期生活事件,如复发性呼吸道感染和严重的儿童哮喘(蓝线),未能在成年早期(20岁)达到“正常”肺功能峰值,导致成年肺部疾病的风险增加,即使在成年期间肺功能可能没有任何加速下降。
现在人们普遍认为,免疫成熟是在出生后的几天和几个月内按照规定的过程发生的。
虽然大部分信息来自小鼠模型,但新方法和技术的出现促进了免疫细胞在非常小的样本中的蛋白质组学和转录组学细节,揭示了免疫发育的正常轨迹。
检查这种免疫发育轨迹是至关重要的,以便了解偏离标准如何导致呼吸系统健康状况不佳。
▼
将早产儿和足月儿纳入研究表明,他们的免疫状况在出生时有所不同。
“
早产儿的促炎信号更强烈
发现早产与强烈的促炎信号有关,其特征是趋化因子CXCL11和CXCL8的表达增强。
CXCL11是一小分子的细胞因子属于CXC趋化因子家族,又被称作“干扰素诱导的T细胞a趋化因子”
CXCL8是CXC趋化因子家族的一员,是炎症反应的主要介质编码的蛋白质
“
新生儿的免疫系统具有更多的个体差异
总的来说,与成年人相比,新生儿免疫系统表现出更多的个体差异,突出了这一关键窗口期免疫的动态性。
“
出生后免疫细胞组成发生变化
此外,出生后免疫细胞组成发生变化,中性粒细胞数量减少,CD4+和CD8+ T细胞比例增加。
出生前3个月是B细胞、自然杀伤细胞和树突状细胞表型发育的关键时期,这些表型受环境因素的影响。当单核细胞在出生后的第一个月扩充和收缩时,B细胞的数量从第一个月开始增加。
另一项研究分析了剖宫产足月婴儿血液中的免疫细胞成分。通过刺破脚跟获得的血液与匹配的脐带血进行比较,发现免疫细胞在出生后几小时内就发生了快速变化。
胎儿(脐带血)和新生儿(脚后跟刺破)样本的基本免疫表型比例相同。效应T细胞增殖增加,这些效应T细胞表现出增强的细胞因子分泌能力。
▼
研究人员通过检查器官捐献者的血液、淋巴组织和粘膜组织,绘制了60年来人类T细胞区隔化的空间图。他们揭示了与年龄相关的一些T细胞亚群在体内特定部位的比例变化。
“
淋巴组织中的T细胞发生了动态变化
淋巴结发生了动态变化,而粘膜部位的T细胞表型保持更稳定。表达组织驻留记忆T细胞(TRM)特征的效应记忆T(TEM)细胞亚群主要分布在粘膜部位,而淋巴组织内的效应记忆T细胞亚群在整个生命过程中都有变化。
“
儿童与成人之间的免疫细胞数量不同
对从婴儿器官供体收集的淋巴组织和粘膜组织中收集的T细胞进行的更系统的分析显示,T细胞分化和调节功能在生命的前2年进行早期划分。
调节性T细胞在儿童组织中占CD4+ T细胞的比例相对较高(30-40%),而在成人组织中则低得多(<10%)。
来自婴儿供体的T细胞可以抑制内源性T细胞活化,并且早期T细胞功能仅限于最低Treg:TEM细胞比率的粘膜部位,这表明早期生活中T细胞反应的局部控制。
▼
产后暴露可导致先天免疫训练,从而通过表观遗传组蛋白修饰产生持久的程序,增强或减弱细胞因子反应。
产后暴露不仅包括环境因素,如感染史和污染,还包括生活方式,如营养、压力、吸烟、与兄弟姐妹一起生活等。这些因素一起影响发育中的新生儿免疫系统。
“
粘膜相关不变T细胞对免疫影响巨大
非常规T细胞,如粘膜相关不变T(MAIT)细胞,在生命早期对来自局部微生物群的信号有反应,这对组织免疫的调节具有终身影响。有证据表明,粘膜相关不变T细胞与皮肤局部微生物群之间的相互作用对于促进组织损伤后的伤口修复至关重要。
尽管我们知道粘膜相关不变T细胞细胞在成人肺中大量存在,并且被认为在控制呼吸道病毒感染中起重要作用,但尚未在儿童肺中进行研究。
由于先天免疫细胞对疫苗接种的成功至关重要,并且受每次接触的水平和性质的影响,因此了解这些不同的接触如何影响免疫系统的各个分支,以了解如何促进充分的免疫增强非常重要。
先进的测序技术揭示了人体是一个由细菌、真菌、病毒和寄生虫组成的复杂生态系统。这种微生物群普遍存在于包括肺在内的粘膜屏障部位,尽管其密度远低于肠道。
★ 微生物群与免疫系统的相互作用至关重要
微生物群与免疫系统的相互作用现在被认为对免疫发育和疾病预防至关重要。局部微生物群落和免疫细胞之间的密切相互作用促进了从对母体和自身抗原的耐受到对促进疾病的因子的保护的转变。
因此,生命早期可能是微生物生态失调破坏免疫发育的关键阶段。
▼
呼吸道是一个复杂的系统,分为不同的区域:上呼吸道包括鼻腔、咽部和喉部,下呼吸道包括传导气道(气管和支气管)、小气道(细支气管)和肺泡。
在健康或疾病时,微生物群在呼吸道的不同区域定植
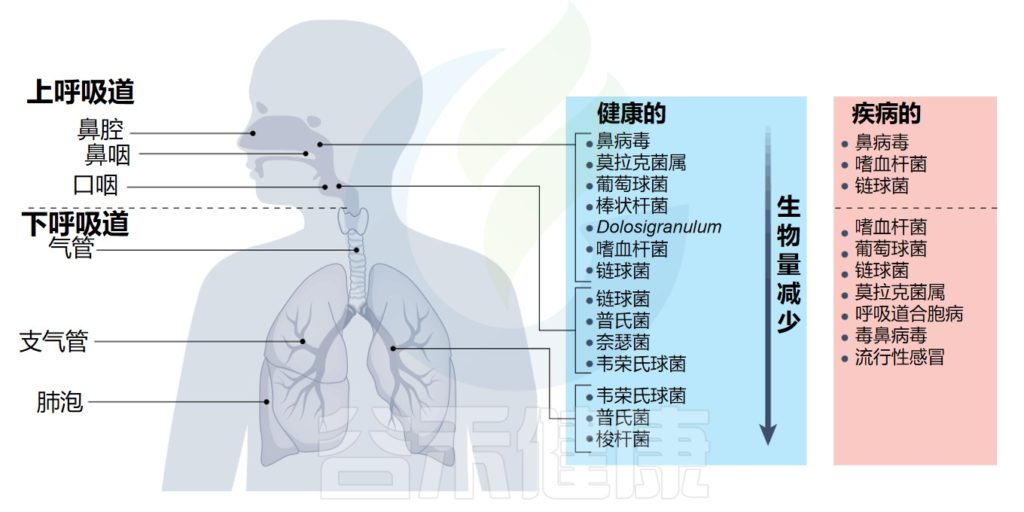
Lloyd CM,et al.Nat Immunol.2023
总的来说,这个大的表面积容纳了一系列不同的微生物群落,其中最高的细菌负荷位于上呼吸道内。
▼
一般认为,新生儿在出生时收集了其最初的微生物种类。这些微生物主要来源于母体,由阴道、肛门、直肠和皮肤微生物群组成,其组成取决于分娩方式。
根据解剖生态位和环境影响施加的局部选择压力,这种最初均匀的细菌物种“初始包”迅速多样化。在金黄色葡萄球菌(Staphylococcus aureus)最初占优势后,鼻咽微生物群迅速多样化,棒状杆菌(Corynebacterium)和狡诈球菌属( Dolosigranulum )的定植和生长。
从6周大开始,莫拉克菌属(Moraxella)开始繁殖,并最终在3个月大时占主导地位。微生物群在出生后7周在呼吸道中成熟,并建立了多样性。
▸ 上呼吸道的微生物群
口咽菌群是上呼吸道所有生态位中最多样化的,与鼻咽相比,幼儿和成人的微生物组成相似,由厌氧菌属组成,如链球菌(Streptococcus)、普雷沃氏菌(Prevotella)、奈瑟菌(Neisseria)和韦荣氏球菌(Veillonella)。
注:最近对出生第一周婴儿样本的分析显示,口咽和鼻腔代表着细菌和真菌的不同生态位。
▸ 下呼吸道的微生物群
下呼吸道环境特别专门化,反映了特定的环境。例如,肺表面活性剂的分泌有助于形成富含磷脂的环境,从而有助于维持更多样化的微生物群。
注:考虑到下气道的不可接近性,对这个生态位进行采样是具有挑战性的,研究使用气管吸入物作为细菌的来源。
虽然下呼吸道的总生物量较低,但健康婴儿的微生物群在出生后的前2个月内发育,并随着时间的推移而增加。
链球菌是下呼吸道的关键物种
观察到韦荣氏球菌属(Veillonella)、普雷沃氏菌(Prevotella)和梭杆菌(Fusobacterium),并确定链球菌(Streptococcus)是下呼吸道微生物群落结构的关键物种。
▼
尽管人们普遍认为肠道微生物群在免疫发育中起着至关重要的作用,但对局部肺微生物群的作用却知之甚少。
✦防止不必要的免疫反应
研究认为,生命早期的微生物群在建立耐受原免疫途径中起着重要作用,以防止对自身抗原和无害的吸入抗原(如过敏原)产生不必要的免疫反应。
✦诱导调节性T细胞
对肠道共生体的分析表明,梭菌(Clostridia)通过转化生长因子-β在小鼠和人类结肠中诱导FOXP3+Treg细胞,而脆弱拟杆菌(Bacteroides fragilis)通过Toll样受体2的参与诱导Treg细胞
普雷沃氏菌(Prevotella)、罗氏菌属(Roseburia)和韦荣氏球菌(Veillonella)在下呼吸道的富集与典型TH17细胞因子谱呈正相关,白细胞介素-1α (IL-1α), IL-1β, IL-6和IL-17增加,并伴有TH17和中性粒细胞在肺部的募集。
✦肺部微生物多样性与长期肺部健康相关
对一组出生后最初几个月的儿童气道吸入物的检查显示,1个月时的微生物多样性与6岁时的哮喘有关。
具体来说,韦荣氏球菌(Veillonella)和普雷沃氏菌(Prevotella)的相对丰度与呼吸道免疫相关,其特征是CCL2和CCL17增加,肿瘤坏死因子和白细胞介素1β减少。
CCL2——趋化因子配体2,可招募单核细胞、记忆性T细胞和树突状细胞到组织损伤或感染引起的炎症位点。
CCL17——又称胸腺和激活调节趋化因子(TARC),是一种强大的趋化因子,通常与2型免疫反应相关,其编码基因在人类中位于16号染色体上。
小结
尽管大多数研究使用小鼠模型来检查呼吸道微生物生态系统与发育中的免疫系统之间的关系,但似乎很有可能呼吸道免疫弹性降低和肺部微生物群多样性沿着共同的轨迹发展,以促进肺部健康。
生命的最初几周是微生物在粘膜表面定植的关键时期。然而,理想的微生物丰富度和多样性可能会被感染或抗生素治疗等事件所破坏,这些事件会影响自然发育过程,有时会产生持久的影响。
出生时胎龄是微生物成熟和多样性的关键驱动因素,也是出生方式和喂养方式的关键驱动因素。微生物群结构的其他重要决定因素包括环境因素,如兄弟姐妹的存在,环境污染,以及感染史。
肺免疫和微生物组受到一系列内在和外在因素的影响
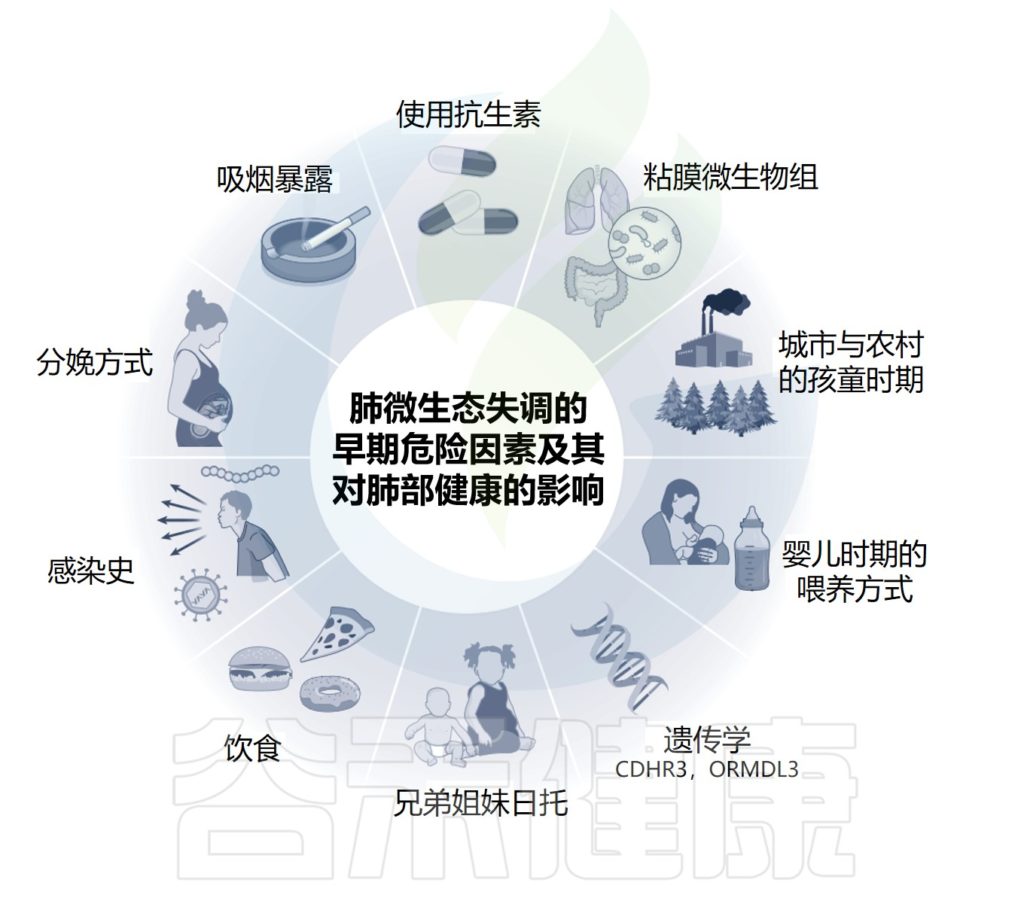
Lloyd CM,et al.Nat Immunol.2023
免疫力和微生物组在整个生命过程中可能遇到的各种因素的影响,但由于婴儿正处于紧张的发育期,他们特别容易受到影响。
免疫系统和微生物组之间的局部关系是高度动态的,外部刺激和生活方式的选择可能导致肺生态位内细胞和细菌群落的振荡,甚至可能对肺功能产生终身影响。
在生命的第一年导致下呼吸道疾病的两种最常见病原体包括呼吸道合胞病毒和人类鼻病毒。
▼
许多观察性研究报道,反复出现的病毒性下呼吸道感染,尤其是严重的下呼吸道感染,与儿童反复喘息和哮喘发作增加有关。
一项由35项研究组成的系统综述和荟萃分析估计,呼吸道合胞病毒下呼吸道感染对儿童喘息性疾病具有直接影响。
•免疫预防可能改变呼吸道细菌组成
在8项介入研究中评估呼吸道合胞病毒免疫预防对哮喘的保护作用时,虽然观察到保护作用,但效果并不显著。
接受呼吸道合胞病毒免疫预防的早产儿在1岁和6岁时的上呼吸道微生物组的特征是:在1岁时葡萄球菌(Staphylococcus)明显减少;在6岁时与更多的嗜血杆菌(Haemophilus)和明显减少的莫拉克菌(Moraxella)。
这表明呼吸道合胞病毒免疫预防与改变呼吸道细菌微生态失调之间的相互作用可能与疾病保护有关。
▼
另一个队列包括1304份鼻咽样本,这些样本是从连续11次定期采样中获得的,以及在生命第一年急性呼吸道感染期间获得的。
呼吸道病毒的定量PCR检测显示,早期无症状的鼻病毒与以后呼吸道感染的易感性增加和复发相关。
直到最近,鼻病毒被认为是一种只引起上呼吸道感冒症状的病毒,对下呼吸道疾病影响不大;然而,我们现在了解到三种鼻病毒 (RV-A, RV-B和RV-C)可能诱导不同的感染模式和毒力。
•个人因素影响呼吸道疾病的严重程度
个人因素,如肺功能和免疫,特别是与年龄相关的因素(例如干扰素)反应在幼儿中较低,可能部分解释了这个年龄组鼻病毒疾病的严重程度,并影响鼻病毒感染的下呼吸道结局。
鼻病毒的粘膜免疫反应至关重要;伴有变应性炎症的干扰素反应的质量影响鼻病毒喘息的风险。
几种宿主因素导致严重鼻病毒疾病和喘息的风险增加。年轻时易患喘息或发热性疾病,尤其是RV-C感染。遗传因素也会增加鼻病毒相关喘息的风险。17q12-21区单核苷酸多态性与急性喘息和哮喘发展相关。
▼
在调查生命早期呼吸道感染和未来的喘息/哮喘和肺功能影响的研究中,发现与特定病原体(鼻病毒或呼吸道合胞病毒)及细菌(莫拉氏菌、嗜血杆菌、链球菌、葡萄球菌)之间的关联有关。
•特定病原体和细菌与呼吸道疾病风险相关
与定义肺功能轨迹类似,在出生队列中也描述了微生物组轨迹,并与复发性喘息和哮喘的风险相关。
参与哮喘童年起源研究的儿童(N=285)在7个时间点提供了鼻咽粘膜样本,健康时相隔1-3个月,生命的头2年,急性呼吸道疾病期间提供了额外的样本。6岁、11岁、13岁和18岁时的发育微生物群轨迹与哮喘有关。
生命最初6个月的葡萄球菌优势菌群与3岁时复发性喘息和整个儿童期持续哮喘的风险增加有关。在急性喘息疾病中,鼻病毒的检测和莫拉菌的优势与整个儿童后期持续存在的哮喘相关。
▼
最近,一项包括美国247家医院婴儿的前瞻性研究证明了特定病毒、细菌种类、免疫反应和代谢后遗症之间相互作用的重要性:研究对象是因毛细支气管炎住院的婴儿(小于1岁)。
研究过程
在初次急性发作期间收集临床资料和鼻咽样本,以评估微生物组、呼吸道病毒、细胞因子和代谢组谱。
随后,对这些婴儿进行随访至5岁,并对病毒和微生物、炎症和代谢组学特征进行无偏见的综合分析,以确定与喘息和哮喘持续存在相关的不同感染模式,而不是症状缓解。
对13%经历过鼻病毒相关性细支气管炎的婴儿分析定义了一个特定的RV-C儿童亚组,莫拉菌优势加上2型高细胞因子反应,预测3岁时持续喘息和5岁时哮喘风险增加。
住院的呼吸道合胞病毒毛细支气管炎患儿中,IgE致敏和呼吸道合胞病毒/鼻病毒共感染比例高、链球菌/莫拉克菌共优势、IFNα和IFNγ反应高的组发生哮喘的风险明显更高。
!
注意
从一岁前采集的上呼吸道样本中出现了一种模式,将症状前病毒(鼻病毒和呼吸道合胞病毒优势)和微生物谱(莫拉克菌、嗜血杆菌、链球菌优势)与随后的喘息/哮喘风险联系起来。
在急性发作期间病原体生态失调,病毒和细菌谱的类似改变也与随后的呼吸道疾病有关。
缺乏证据表明上呼吸道微生物群与病毒检测和下呼吸道微生物群之间存在关系。这一点至关重要,因为我们知道,长期的有害后果与生命早期出现的下呼吸道疾病密切相关,而与上呼吸道症状无关。
纵向收集儿童下呼吸道样本极具挑战性;因此,数据主要依赖于临床指征手术(如支气管镜检查)期间采集的横断面样本。
将同一患者的咽拭子与支气管肺泡灌洗液中的微生物组进行比较,发现同一患者的上下气道样本在α多样性(丰富度、均匀度或Shannon多样性指数)方面没有差异,而个体之间的差异大于上下气道样本之间的差异。
进一步支持上呼吸道和下呼吸道样本之间关系的是,在患有严重复发性喘息的学龄前儿童无症状稳定疾病期间,在支气管肺泡灌洗样本中发现了不同的簇。
从下呼吸道样本中描述的鼻病毒/莫拉菌属/特应性集群在患有严重喘息的儿童3岁时表现出与第一次下呼吸道疾病期间婴儿队列中发现的非常相似的呼吸道微生态失调,这是哮喘发生的最大风险。
在免疫和肺部发育的关键时期(生命的前5年),外部暴露(环境、病毒和细菌感染)之间的平衡决定了先天免疫反应和健康的肺功能,或导致肺功能下降和不可逆且长期预后不良的病理反应。
需要在这一免疫和肺部发育时期采取有针对性的干预措施,以便赶上肺部生长和疾病改变。
下图展示了早期呼吸道感染、环境暴露、宿主免疫反应与终生肺部健康之间的相互作用:
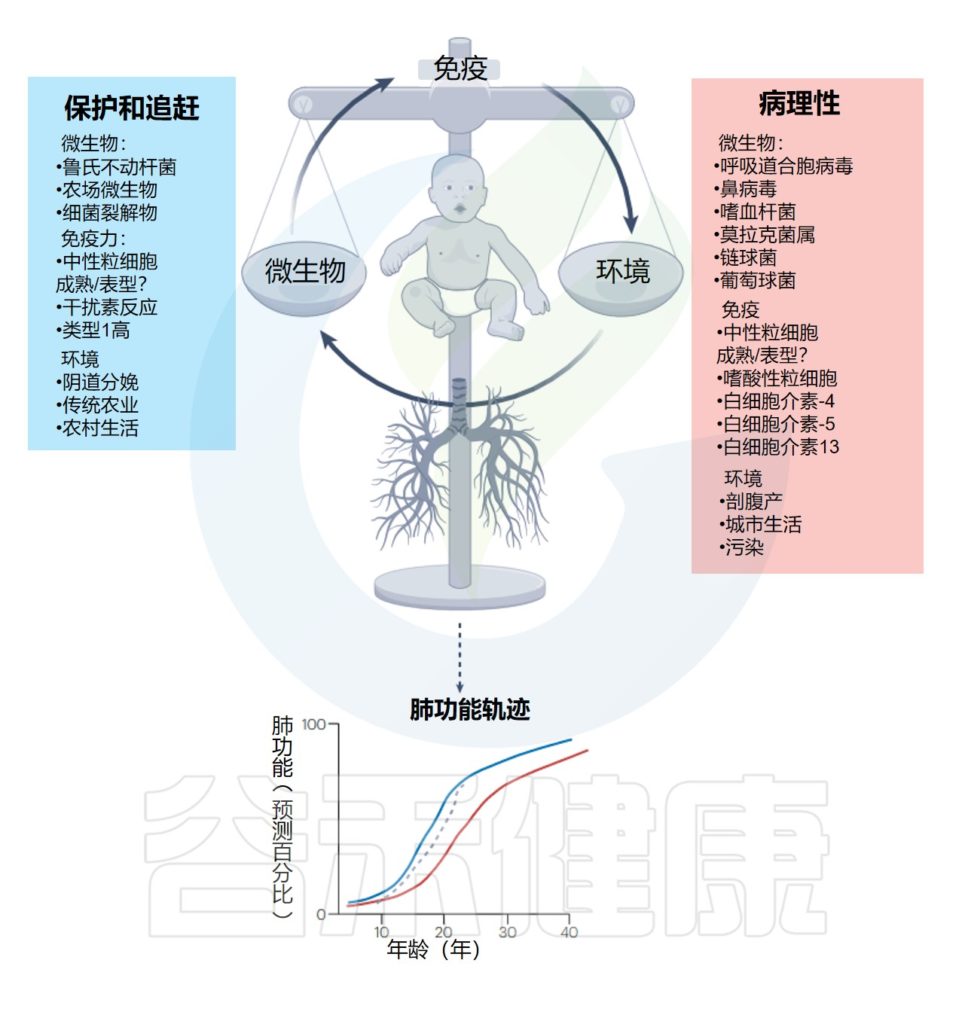
编辑
Lloyd CM,et al.Nat Immunol.2023
▷
流行病学数据表明,特定的环境暴露对儿童哮喘和过敏性疾病提供了强有力的保护,并可能提高对感染性病原体的先天免疫反应的效率。
这种保护作用最好的例子也许是阿米什儿童和哈特派信徒儿童的比较。
阿米什实行传统农业,因此孩子们在整个童年时期,甚至在出生前,都与农场和动物密切接触。
相比之下,哈特派人使用工业化农业方法,因此家庭往往与他们的动物和农场分开居住。
阿米什儿童的哮喘和喘息的患病率要低4倍,而哈特派儿童的患病率与北美土著人口相同。
值得注意的是,两组儿童在先天免疫细胞的比例、表型和功能方面存在显著差异。
与动物接触密切的儿童中性粒细胞较高
具体来说,阿米什儿童有较高的循环中性粒细胞,其独特的表型表现为CXCR4和CD11b的表达减少,这可能是由于持续的环境微生物暴露导致的不成熟的表型。
趋化因子受体CXCR4是趋化因子基质细胞衍生因子-1(CXCL12)的特异受体。
与动物接触密切的儿童T细胞活性较高
对T细胞表型的分析表明,阿米什儿童表现出增强的活化调节性CD4+T细胞表型(CD45RO+ICOS+),而传统的CD4+T淋巴细胞表达较低水平的共刺激和活化标志物。
此外,阿米什儿童的CD28null CD8+细胞比例高于哈特派儿童,这与高T细胞干扰素γ产生和低血清IgE浓度相关。
阿米什儿童在外周血白细胞中也表现出更高的先天基因TNF和TNF诱导蛋白3 (TNFAIP3)的表达,并伴有抑制表型的单核细胞。
总的来说,传统的农场环境可以通过参与和塑造生命早期的先天和适应性免疫反应来预防哮喘。
▷
有趣的是,在农场长大也与呼吸道感染和肺功能低下呈强烈的负相关。因此,暴露于动物棚内不同的环境微生物群似乎是预防哮喘的关键。
农场环境下婴儿的肠道菌群与哮喘风险降低有关
在传统农业环境中长大的出生队列中,2至12个月大的婴儿肠道微生物组的成熟已经被建模。12个月大婴儿的估计微生物组年龄与先前的农场接触和学龄前患哮喘的风险降低有关。
微生物组年龄介导了19%的保护作用。粪便丁酸水平、预测丁酸产生的细菌分类群以及编码丁酰辅酶A:乙酸辅酶A转移酶基因的相对丰度与哮喘呈负相关。
这些数据表明,农场微生物对哮喘发展的保护机制可能是通过微生物代谢物改变和更成熟的肠道微生物群,以及代谢物通过肠-肺轴影响肺免疫反应。
▷
儿童口服混合细菌裂解物的临床试验进一步证明了保护性肠道微生物群在预防生命早期下呼吸道感染方面的重要性。
口服或舌下给药混合呼吸道致病菌的裂解物已被用于预防呼吸道感染,以及预防可能由呼吸道感染引起的喘息和哮喘加重。
一项关于细菌裂解物治疗对学龄前儿童喘息发作和哮喘加重效果的系统综述显示,儿童喘息发作(平均减少2.35次)和哮喘加重(平均减少0.90次)均有所减少。
// OM-85
细菌裂解液混合物OM-85包括呼吸道病原体混合物的21种细菌菌株的冻干组分。在感染鼻病毒前,对成人健康对照和哮喘或慢性阻塞性肺疾病患者培养的原代人支气管上皮细胞进行预孵育,结果显示,所有三组患者的干扰素γ分泌均显著增加。
也有体外证据表明OM-85能抑制鼻病毒和流感病毒对支气管上皮细胞的感染,从而增加上皮细胞的存活率。
// MV130
MV130是一种灭活的多细菌化合物,人舌下或小鼠鼻内给药,其作用机制是通过对小鼠骨髓祖细胞和体外人类单核细胞进行重新编程来诱导经过训练的免疫力,促进细胞因子产生(TNF)的增强,该增强依赖于通过增加乳酸产生的代谢转变。
注:该实验还没有在早期生命模型中进行,也没有在儿童的免疫细胞中进行。
呼吸道微生物组是一个尚未充分研究的治疗靶点,以促进良好的肺部健康结果。细菌代谢产物在调节免疫功能和保护过敏和哮喘方面的机制作用已被证明,但仅在肠道微生物组的背景下。
小结
微生物代谢产物,或在改变呼吸道微生物组以提供保护方面重要的特定分子的作用仍然未知。至关重要的是,农场提取物中提供保护的微生物是冻干和灭活的,因此不太可能产生代谢产物。
因此,未来干预措施的机制假设需要侧重于研究提供保护的吸入农场微生物的特定分子成分。
此外,与哮喘风险增加相关的共生细菌病原体(M.catarrhalis、肺炎链球菌、流感嗜血杆菌)和更具保护性的微生物(双歧杆菌、棒状杆菌)之间的相互作用也可能导致呼吸道代谢产物之间的不平衡,从而导致TH2偏斜的免疫反应。
建立健康的呼吸系统,在正确的时间接触正确的微生物是关键。
肺部免疫在生命的最初几个月形成。婴儿通过呼吸道暴露于多种不同的病原体。如鼻病毒,呼吸道合胞病毒,莫拉菌属(Moraxella)、嗜血杆菌(Haemophilus)、链球菌(Streptococcus)都会引起呼吸道感染,进而导致反复的喘息和哮喘等呼吸系统疾病。
当然,也有一部分细菌对呼吸系统是有益的,例如普雷沃氏菌(Prevotella)、罗氏菌属(Roseburia)和韦荣氏球菌(Veillonella)。
这些不同病原体、发育中的免疫系统和成熟的呼吸系统以及环境之间的关系对于儿童时期的慢性呼吸系统疾病和建立具有终身影响的肺部免疫健康轨迹至关重要。
对健康呼吸系统分子机制的更深入了解,能够有效防止儿童喘息障碍发展为慢性哮喘和低肺功能直至成年。
相关阅读:
主要参考文献
Lloyd CM, Saglani S. Early-life respiratory infections and developmental immunity determine lifelong lung health. Nat Immunol. 2023 Jul 6.
Sandall, J. et al. Short-term and long-term effects of caesarean section on the health of women and children. Lancet 392, 1349–1357 (2018).
Achten, N. B., van Rossum, A. M. C., Bacharier, L. B., Fitzpatrick, A. M. & Hartert, T . V . Long-term respiratory consequences of early-life respiratory viral infections: a pragmatic approach to fundamental questions. J. Allergy Clin. Immunol. Pract. 10, 664–670 (2022).
van Meel, E. R. et al. Early-life respiratory tract infections and the risk of school-age lower lung function and asthma: a meta-analysis of 150,000 European children. Eur. Respir. J. 60, 2102395 (2022).
Bose, S., Pascoe, C. & McEvoy, C. Lifetime lung function trajectories and COPD: when the train derails. Lancet Respir. Med. 11, 221–222 (2022).
Zar, H. J. et al. Early-life respiratory syncytial virus lower respiratory tract infection in a South African birth cohort: epidemiology and effect on lung health. Lancet Glob. Health 8, e1316–e1325 (2020).
Ariyakumar, G. et al. Activation of lymphocytes in healthy neonates within hours of birth. Front. Immunol. 13, 883933 (2022).