-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
门诊室32岁的林女士第三次向医生说自己的困扰:
月经周期紊乱、体重莫名上升
为什么运动和饮食控制
对我的症状收效甚微?
…

多囊卵巢综合征
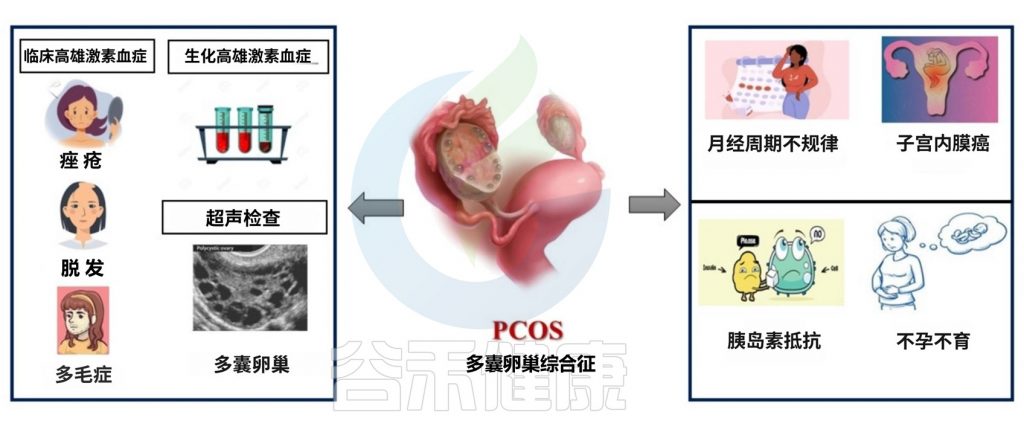
多囊卵巢综合征(PCOS)是一种常见的主要影响生育力的妇科内分泌疾病。其特征为月经不调、雄激素水平升高、排卵功能障碍等。
据柳叶刀统计, 多囊卵巢综合征约占不孕症病例的 30%和无排卵性不孕症病例的 80%。
据估计所有PCOS女性中约70%–80%患有不孕症。
2021年的一项荟萃分析显示,我国生育期女性PCOS患病率为8.6%,青春期女性的患病率为10.26%。
2024年的一项荟萃分析显示,全球 PCOS 的患病率为 9.2%(95% CI:6.8-12.5%)。
多囊卵巢综合征的病因是多因素的,涉及遗传易感性、激素分泌异常、胰岛素抵抗、慢性低度炎症等多个层面的相互作用。
由于多囊卵巢综合征的临床表现复杂,治疗策略通常是针对症状的,缺乏精确性,增加了治疗成本。传统诊疗方案对这部分”隐形异常”的漏检率高,当女性在激素调节和促排卵治疗中反复尝试时,一个关键的环节正在被重新认识——肠道菌群。
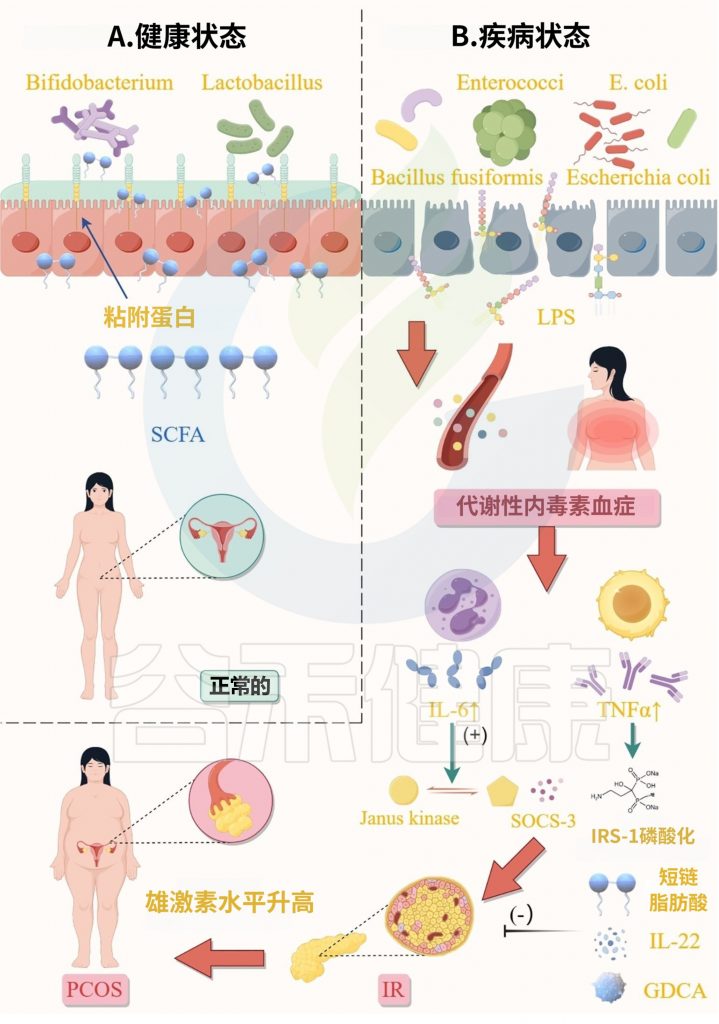
多囊卵巢综合征不仅是妇科内分泌疾病,更是一个涉及肠道-卵巢-代谢轴的系统性疾病。越来越多的证据表明,多囊卵巢综合征患者的肠道菌群多样性降低和菌群结构改变,比如,Bacteroides vulgatus显著升高,导致这些个体出现代谢紊乱。
肠道菌群失衡会破坏肠道屏障完整性,使脂多糖等有害物质进入血液循环,触发全身慢性炎症反应,进而干扰胰岛素信号传导,加剧胰岛素抵抗。同时,菌群失调还会影响短链脂肪酸的产生、胆汁酸代谢以及神经递质的合成,形成代谢紊乱与炎症反应相互恶化的恶性循环,最终导致高雄激素血症、排卵障碍等典型临床表现。
本文带大家了解一下肠道菌群在多囊卵巢综合征的发病机制和代谢紊乱中的作用,具体包括胰岛素抵抗、激素失衡、胆汁酸代谢紊乱、IL-22介导的免疫失调以及脑-肠轴紊乱。此外,还总结了当前针对肠道菌群的治疗策略,旨在为临床干预提供理论基础,实现从”对症治疗”到”源头调控”的转变。
多囊卵巢综合征(PCOS)是一种常见的妇科内分泌疾病,也是导致无排卵性不孕的主要原因。此外,多囊女性患肥胖、高血压、代谢综合征和心血管疾病的风险更高。
多囊卵巢是指那些有很多未成熟卵泡囊肿(卵泡)的卵巢。但是并非所有多囊卵巢综合征患者都有卵巢囊肿。
临床表现
– 有些完全无月经(闭经)。
– 月经期间出血量极大。
– 即使在非月经期也有随机出血。
根据2023年国际循证多囊卵巢综合征指南,不规则的月经周期定义如下:
· 初潮后第一年内作为青春期过渡的一部分是正常的
·初潮后1-3年内,月经周期间隔小于21天或大于45天
· 初潮后3年至围绝经期期间,月经周期间隔小于21天或大于35天,或一年少于8个周期。
· 初潮后任何一年内的周期,间隔 大于 90 天。
·15 岁前原发性闭经或青春期(乳房发育)后 3 年以上闭经。
脱发模式差异很大,通常出现在头顶、后脑或弥漫性模式。更严重的雄激素亢进的女性可能会出现双颞脱发和前额发际线后退。
可能会长出过多的面部毛发,或经历手臂、胸部和腹部毛发过度生长。
在体格检查中,应使用改良 Ferriman-Gallwey 评分系统客观评估多毛症。
PCOS 可能导致痤疮 ,尤其是在背部、胸部和面部;有些持续的爆发,尤其是在下颌线和下巴上,可能难以治疗。应警惕 20 多岁到 30 多岁女性中持续或加重的痤疮背后的雄激素亢进。
即使节食和运动也不容易减肥,尤其渴望碳水化合物和甜食;总是感到疲倦或精神不振,即使充分休息后也是如此。虽然 38%~ 88%PCOS女性体重超重或肥胖,但与 BMI 匹配的对照相比,PCOS女性倾向于有更多的腹部脂肪积累。因此,正常BMI不应排除 PCOS 的诊断。
一会儿感觉快乐,一会儿又感到易怒, PCOS 会增加你情绪波动、抑郁或焦虑的风险,比如持续的悲伤或对以前喜欢的事物失去兴趣;持续的担忧、不安,或恐慌发作。这可能是由于激素变化以及应对 PCOS 症状的压力所引起的。
颈部褶皱、腹股沟、乳房下皮肤变暗。
– 有些患者可能在月经期间以及偶尔在其他时间感到下腹部(盆腔)疼痛。
多囊有可能没症状吗?
是的,有几种情况。
有些人可能患有轻度 PCOS,其症状并不严重到足以引起注意。
许多人根本没有症状。这就是为什么高达 70%的 PCOS 患者不知道自己患有这种疾病。
有些人甚至直到怀孕困难或不明原因的体重增加时,才意识到自己患有多囊卵巢综合征。
并发症
PCOS 会导致流产吗?
研究表明,部分患者因激素失衡、代谢紊乱等问题间接影响妊娠维持,但许多患者仍能成功妊娠并生育健康宝宝。
多囊卵巢综合征患者可以生孩子吗?
可以,如果你有多囊卵巢综合征,仍然有可能自然怀孕,因为有些月份可能仍然会排卵。然而,在严重的情况下,例如当月经长时间停止时,自然怀孕的机会可能会更加困难。
PCOS有多常见?
多囊卵巢综合征正被公认为全球育龄女性中最常见的内分泌疾病,影响着 5%~ 26%的女性。
鹿特丹标准(RC)是流行病学研究中最常用的标准,其包含的指标比第二常用的美国国立卫生研究院 1990 年标准更广泛。
根据美国国立卫生研究院 2012 年工作会议报告,PCOS 估计影响着美国约 500 万名育龄女性。 诊断和治疗多囊卵巢综合征对医疗系统的成本每年约为 40 亿美元,不包括与 PCOS 相关的严重合并症的成本。
PCOS 的患病率与一级亲属、青春期前肥胖、先天性男性化疾病、妊娠期平均或低出生体重、早发性肾上腺皮质功能元进以及使用丙戊酸作为抗癫痫药物有关。
研究还表明,墨西哥裔美国人的 PCOS 患病率高于非西班牙裔白人和非裔美国人。
必须考虑全球范围内诊断标准组成部分的患病率差异和异质性。
随着时间的推移,典型 PCOS(A 型)的患病率在女性中下降,在 5 年的长期随访研究中不再符合 PCOS 标准。
具体有哪些类型?
▸经典型(A型,高雄激素+无排卵+多囊卵巢)
同时满足以下三项中的两项:
最常见的类型,常伴胰岛素抵抗、肥胖、代谢异常。
▸排卵型(B型,高雄激素+无排卵,卵巢正常)
较少见,患者可能有月经周期,但高雄激素症状明显,需排除其他高雄激素病因(如先天性肾上腺皮质增生)
▸非高雄激素型(C型,无排卵+多囊卵巢,无高雄激素)
少见,可能由其他内分泌疾病(如甲状腺功能异常、高泌乳素血症)或无明确病因导致,需谨慎鉴别诊断。
▸高雄激素型(D型,高雄激素+多囊卵巢,排卵正常)
罕见,患者可能因高雄激素症状(如多毛、痤疮)就诊,但生育能力正常,需与肾上腺或卵巢肿瘤鉴别。
注:部分学者认为D型(排卵正常的高雄激素型)可能不属于经典PCOS范畴,需进一步研究其病理机制。
从什么年龄开始?
PCOS的病理生理机制可能始于青春期前,但典型PCOS 的症状通常在第一次月经来潮时开始出现。有时症状会在月经来潮一段时间后才出现。
PCOS的遗传倾向和早期代谢异常提示需对以下人群加强青春期监测:
与什么原因相关?
雄激素水平升高
PCOS 时,卵巢可能产生过高雄激素,干扰排卵过程,导致卵子不能正常发育和释放。过量雄激素还会引起多毛和痤疮。
胰岛素抵抗
胰岛素水平升高会导致卵巢产生并释放雄激素。雄激素增加会抑制排卵,并导致 PCOS 的其他症状。它还会使体重更容易增加,更难减轻。
胰岛素帮助身体处理葡萄糖并将其用于能量。胰岛素抵抗意味着身体无法正确处理胰岛素,导致血液中葡萄糖水平升高。
注:并非所有胰岛素抵抗者都有升高的血糖或糖尿病,但胰岛素抵抗可能导致糖尿病。超重或肥胖也会导致胰岛素抵抗。即使你的血糖正常,胰岛素水平升高也可能表明存在胰岛素抵抗。
慢性低度炎症
研究表明,多囊卵巢综合征患者有一种长期低度炎症,这会导致多囊卵巢产生雄激素。这可能导致心脏和血管问题。促炎因子(TNF-α、IL-6)升高,进一步恶化胰岛素抵抗和卵巢功能障碍。
遗传因素
单卵双胞胎姐妹患有多囊几率是双卵双胞胎和其他姐妹的两倍,多囊患者的直系亲属中患病率更高。
家族聚集现象及全基因组关联研究发现,与内分泌紊乱(雄激素过量的DENND1A和低FSH水平的FSHR)、代谢紊乱(葡萄糖代谢功能障碍的RAB5B)、无排卵(LHCGR和INSR)相关的基因。
体重增加
体重与多囊之间的关系很复杂。体重增加可能在多囊发展中起作用,多囊也可能导致体重增加。
肠道菌群失调
菌群多样性降低(厚壁菌门/拟杆菌门比例失衡)、促炎菌(如大肠杆菌)增殖,通过短链脂肪酸减少、内毒素泄漏等加剧炎症和代谢紊乱。这在后面的章节我们会详细了解。
多囊卵巢综合征肠道菌群有什么特征?
多样性下降
研究表明,多囊卵巢综合征(PCOS)患者肠道微生物群的多样性和组成发生了变化。
PCOS小鼠中肠道菌群多样性呈下降趋势,人类研究报告称PCOS患者的α多样性降低,然而,关于β多样性的研究结果在各研究中并不一致。
注:一些研究表明,肠道菌群α多样性越高,宿主的健康状况越好,而较低的值则与代谢或内分泌紊乱有关。然而,我们不能简单地假设高α多样性总是有益的。
在门水平上
与健康对照组相比,患有多囊卵巢综合征的女性表现出:
拟杆菌门 / 厚壁菌门比例增加
拟杆菌门和厚壁菌门是人类肠道菌群中的两个主要门类,它们的比例失衡与多种代谢性疾病有关。在多囊患者中,拟杆菌门与厚壁菌门的比例增加。
研究人员分析了 24 名 PCOS 患者(包括 12 名肥胖者和 12 名非肥胖者)和 19 名健康对照的粪便样本,PCOS 组的拟杆菌门丰度显著升高,而厚壁菌门丰度明显降低,导致拟杆菌门与厚壁菌门的比例增加。
Liu 等人的研究(涉及 33 名 PCOS 患者和 15 名健康对照)也报道了类似的结果。
拟杆菌门的过度增殖,可能通过负向影响宿主代谢和免疫反应,导致致病性影响。
在属水平上
在雄激素水平较高的 PCOS 女性中,发现 Lactobacillus、Bacteroidetes 的组成减少,而 Prevotella melaninogenica、沙眼衣原体Chlamydia trachomatous、Nocardiaceae、 Clostridiaceae的组成增加。
除了厚壁菌门丰度的整体减少外,在 PCOS 患者中,在厚壁菌门内部也在变化,厚壁菌门内的瘤胃球菌、粪球菌的丰度增加。
厚壁菌门内瘤胃球菌和粪球菌的相对丰度增加,可能通过影响宿主的短链脂肪酸代谢和促炎信号通路,在 PCOS 病理发展中发挥重要作用。
促炎菌升高、有益菌降低
促炎细菌升高如体内的拟杆菌,会导致一系列代谢变化。
具体而言,拟杆菌与促进PCOS女性胰岛素抵抗有关。某些属于拟杆菌属、埃希氏/志贺氏菌的革兰氏阴性菌,在患有多囊合并肥胖的女性肠道中显著增加,但Akkermansia减少,对肠黏膜有一定的保护作用。
PCOS患者的乳酸杆菌和双歧杆菌等有益菌水平显著降低,不利于提高肠道免疫力。
注:由于肠道菌群的复杂性,不同研究的结果有时是有偏见的、有争议的,且尚未完全被理解。
一项研究中,对 50 名 PCOS 患者和 43 名健康对照者的粪便样本进行宏基因组测序, PCOS 组中有益菌如 Akkermansia、 Bifidobacterium 的丰度显著降低。相反,与代谢异常和炎症相关的脱硫弧菌(Desulfovibrio)属的丰度显著增加。
注:脱硫弧菌产生硫化氢,诱导炎症和氧化应激。关于脱硫弧菌详见我们之前的文章:
也有研究报告说 PCOS 患者的普雷沃氏菌属丰度有所下降。
在所有差异物种中,Bacteroides vulgatus对差异贡献最大,其在PCOS患者中的丰度显著更高。
B. vulgatus 参与胆汁酸代谢,导致 PCOS 女性 GDCA 和 TUDCA 水平降低,从而抑制肠道先天淋巴细胞3 (ILC3)分泌IL-22,进而导致 PCOS 中的卵巢功能障碍和代谢紊乱。
地域差异与个体化特征
来自不同地理区域和不同睾酮水平的PCOS患者的肠道微生物群组成各不相同。值得注意的是,
需要注意的是,针对个体患者的肠道菌群研究结果可能与大规模流行病学数据存在一定出入。这种差异部分源于研究方法学的不同,也可能反映了微生物研究中固有的复杂性和个体化特征。因此,在评估PCOS患者的肠道菌群变化时,应当综合考虑多种因素,避免简单化结论。
人类和啮齿动物模型的研究结果证明肠道菌群失调与多囊卵巢综合征之间的关联


doi: 10.1016/j.clnu.2024.10.028. Epub 2024 Oct 22.
多囊卵巢综合征患者的肠道菌群特征性改变不仅体现在微生物组成和多样性上,更重要的是这些改变与疾病的病理生理过程密切相关。然而,这些菌群改变究竟如何与PCOS的病理特征代谢紊乱相互作用?微生物代谢产物通过哪些途径影响胰岛素敏感性、脂质代谢和炎症状态?下一章节我们来了解PCOS中肠道菌群与代谢紊乱的关系。
肠道菌群改变会在体内引发一系列代谢紊乱,包括以胰岛素抵抗为主要特征的葡萄糖代谢异常、与肥胖相关的脂质代谢失调和短链脂肪酸的改变、以黄体生成素(LH)和雄激素水平升高为标志的性激素代谢紊乱,以及氨基酸和胆汁酸代谢紊乱等。
这些微生物组成和代谢途径的这些综合改变导致了PCOS的异质性临床表现。代谢失衡和炎症反应之间的相互作用会进一步加剧肠道菌群失调,使相互恶化的循环永久化。
肠道菌群失衡如何引发胰岛素抵抗?
胰岛素抵抗(IR) 是 PCOS 患者中一个普遍存在的问题,被认为是其病理性的核心部分。50%~70%的 PCOS 患者有不同程度的胰岛素抵抗,尤其是在肥胖患者中。
PCOS 患者的糖尿病风险高于正常女性。胰岛素抵抗和肥胖会加剧 PCOS 患者葡萄糖和脂质代谢紊乱以及血中雄激素升高。
胰岛素抵抗型 PCOS 患者的肠道菌群组成与其他正常 PCOS 患者和健康女性存在差异:有益菌减少,而有害菌增加。
Zeng 等人比较了胰岛素抵抗的 PCOS 患者与健康对照组的肠道菌群,发现前者中普雷沃氏菌的丰度降低,而拟杆菌的丰度增加。
这种菌群失衡会导致两种关键后果:
当肠道菌群被饮食紊乱、药物滥用或压力破坏时,致病菌释放的脂多糖(LPS)增加,同时促炎因子活性增强。这些变化会削弱肠道上皮细胞的紧密连接,使肠道屏障通透性升高,LPS等有害物质穿过肠壁进入血液,引发全身性炎症反应。
由于肠漏,进入血液的LPS会激活免疫系统,触发TNF-α、IL-6等炎症因子释放,直接干扰胰岛素信号传导,损害胰岛素受体的功能。
动物实验表明,通过抗生素抑制革兰氏阴性菌或补充益生菌(如乳酸杆菌),可减少LPS入血液,并改善胰岛素敏感性,揭示了肠道菌群与胰岛素抵抗的因果关系。
短链脂肪酸:肠道菌群的“代谢调节器”
丁酸、丙酸和乙酸等短链脂肪酸,是肠道菌群分解膳食纤维的代谢产物,在调节葡萄糖和糖脂代谢方面至关重要。
——调节胰岛素分泌与敏感性
在胰岛β细胞中,短链脂肪酸通过激活游离脂肪酸受体FFAR2/FFAR3,促进GLP-1分泌,从而增强胰岛素释放并抑制食欲。然而,PCOS患者的肠道SCFAs水平显著低于健康人群,这可能与其菌群多样性下降(如产丁酸的罗斯氏菌属减少)相关。
注:GLP-1,胰高血糖素样肽-1,能够通过刺激胰岛素分泌、抑制胰高血糖素释放、延缓胃排空和增加饱腹感来降低血糖水平。
FFAR2(游离脂肪酸受体2,又称GPR43)和FFAR3(游离脂肪酸受体3,又称GPR41)是两种G蛋白偶联受体,主要被短链脂肪酸如乙酸、丙酸、丁酸激活。FFAR2更偏向于代谢-免疫整合调控,FFAR3则聚焦于能量平衡与神经内分泌调节。
——修复肠道屏障与抗炎作用
短链脂肪酸,尤其是丁酸,能增强肠上皮紧密连接蛋白表达,修复“肠漏”屏障;同时抑制炎症因子释放,减轻胰岛素受体氧化损伤。
动物研究表明,口服丁酸钠可改善糖尿病小鼠的胰岛素抵抗,但这一机制在PCOS中的效果仍需进一步探索。
肠道细菌“山寨”人体酶:DPP4的双重作用
乔杰及其同事提出了肠道细菌衍生的宿主同工酶的新概念,证明在肠道菌群与其宿主的共同进化过程中,某些细菌会产生与宿主相似的酶,并参与疾病过程。
一个显著的例子是,二肽基肽酶4 (Dipeptidyl peptidase 4),主要由拟杆菌门的成员合成。在肠道屏障完整性受损的情况下,微生物来源的 DPP4 可以像人类同源酶一样,通过使胰高血糖素样肽-1失活来破坏葡萄糖稳态。
支链氨基酸:营养信号还是代谢陷阱?
支链氨基酸(BCAAs),包括缬氨酸、亮氨酸、异亮氨酸,是体内重要的营养信号和代谢调节因子,在葡萄糖稳态中发挥着重要作用。葡萄糖和氨基酸代谢密切相关。
在多囊卵巢综合征患者中,BCAAs 的分解和合成异常。血液中 BCAAs 水平的升高可能对胰岛素抵抗、葡萄糖不耐受、2 型糖尿病和肥胖的发展产生负面影响。一些研究人员提出,BCAAs 的血浆水平可以作为 2 型糖尿病发病的预测指标。
研究表明,胰岛素抵抗个体的血清 BCAAs 水平显著升高,这可能是由于肠道菌群参与了 BCAAs 的代谢。此外,在其他研究中,补充 BCAAs 可以通过涉及肠道菌群的作用机制,减轻高脂饮食诱导的代谢性脂肪肝疾病。
高雄激素血症(HA)是多囊患者的关键临床特征,表现为体内雄激素(如睾酮)水平异常升高。其成因涉及多系统交互作用,包括下丘脑-垂体-性腺轴(HPG)调控异常、肾上腺雄激素过度分泌、糖脂代谢紊乱引发的胰岛素抵抗(IR)、肠道菌群失衡、慢性炎症以及遗传易感性等。
doi.org/10.1016/j.steroids.2024.109455
肠道菌群如何影响雄激素水平?
Tremellen等人于2012年提出的肠道菌群失调理论阐释多囊卵巢综合征的症状:
该假说认为,肠道菌群失调,损害了肠道黏膜屏障并提高了肠道黏膜通透性,促进了脂多糖(LPS)进入血液,从肠道到全身循环,LPS触发全身慢性炎症,破坏胰岛素受体功能,导致高胰岛素血症;胰岛素水平升高直接刺激卵巢卵泡膜细胞过度分泌雄激素,损害卵泡发育。
该研究强调,PCOS中异常的雄激素和雌激素合成主要来源于卵泡膜细胞和颗粒细胞,肾上腺皮质也起着一定的辅助作用。
PCOS卵泡膜细胞中细胞色素P450 17α-羟化酶A1(CYP17A1)的过度表达会促进雄激素的过度积累和内源性类固醇生成的紊乱。而CYP19A1表达的下调会阻碍雄激素向雌激素的转化。
PCOS 患者与健康对照组的粪便代谢物比较分析显示存在显著差异,表明肠道菌群的α多样性降低,与 PCOS 个体的高睾酮水平和多毛症相关,暗示肠道菌群对循环睾酮浓度具有调节作用。
雄激素本身也可调节雌性大鼠的肠道菌群组成。
具体而言,Alloprevotella 的丰度与雄激素水平呈正相关,而 Candleria 的丰度与循环雄烯二酮浓度相关。
益生菌干预在 PCOS 患者中显示出降低血清睾酮水平和缓解多毛症等症状的有效性。
编辑
doi.org/10.3389/fendo.2025.1526468
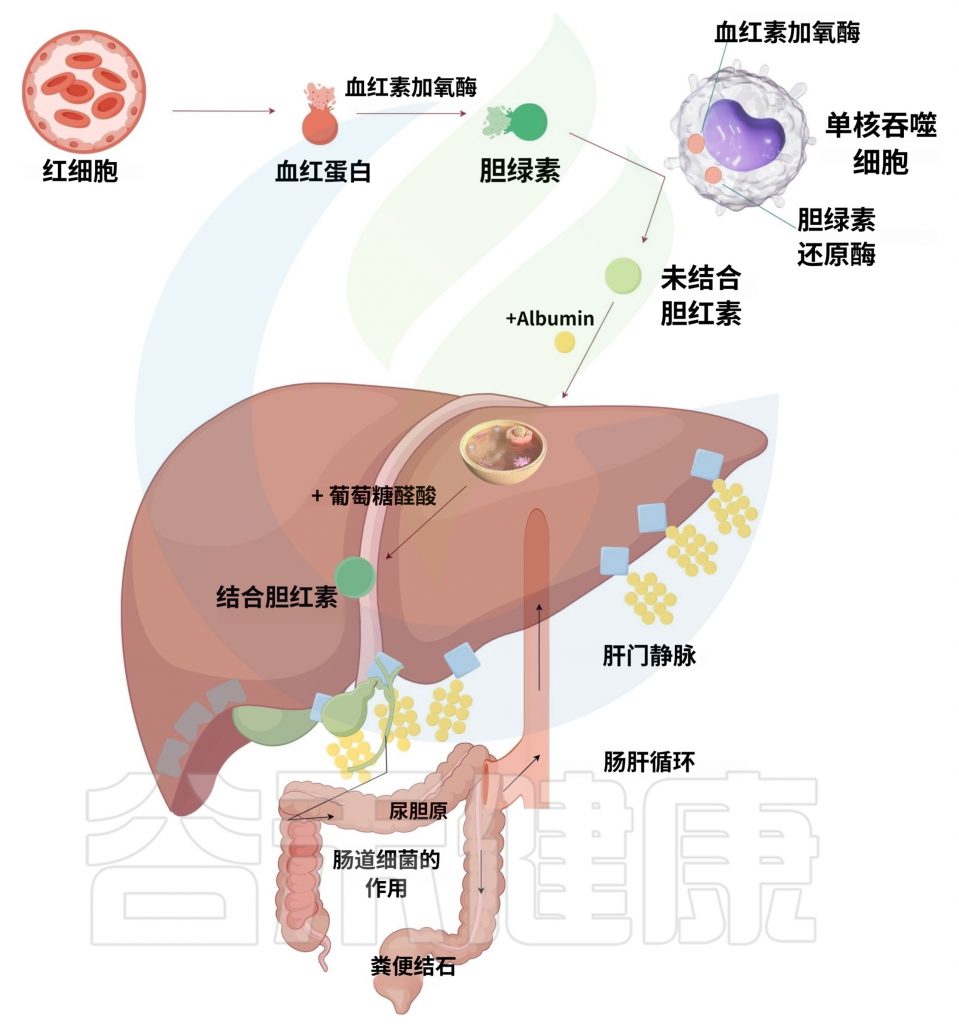
亲水胆汁酸对肝细胞具有保护作用,而疏水胆汁酸具有细胞毒性。这些酸过多积累会导致肝细胞损伤、坏死和凋亡。
在PCOS患者中,胆汁酸代谢失衡是加剧代谢紊乱的关键机制之一。肠道菌群通过调控胆汁酸的合成、转化及信号通路,直接影响宿主的糖脂代谢和炎症反应。
胆汁酸变化与肠道菌群多样性密切相关。PCOS 患者的肠道菌群多样性与健康个体存在显著差异,具体表现为乳杆菌、链球菌和大肠杆菌在 PCOS 患者中更丰富,而瘤胃球菌、毛螺菌科和普雷沃氏菌则更少。
菌群失调导致胆汁酸转化障碍
“拟杆菌不足时,初级胆汁酸无法转化为次级胆汁酸。这些未加工的初级胆汁酸堆积在体内,干扰血糖和脂肪的正常代谢。”
初级胆汁酸堆积: 肝脏合成的初级胆汁酸(如胆酸)需依赖肠道菌群(尤其是拟杆菌门)转化为次级胆汁酸(如脱氧胆酸)。但PCOS患者的肠道菌群中拟杆菌门比例显著降低,导致初级胆汁酸无法有效转化,堆积在肠道和肝脏中。
次级胆汁酸不足: 次级胆汁酸是激活胆汁酸受体(如FXR)的关键分子。FXR信号通路被抑制后,无法下调肝脏糖异生相关酶(如PEPCK和G6Pase),导致血糖升高。
结合型胆汁酸水平升高:这种肠道菌群失衡可能导致胆汁酸代谢和合成的改变,导致 PCOS 患者主要结合型胆汁酸(如 GCA、TCA 和 GCDCA)水平升高,从而影响卵巢功能并引起排卵障碍。
胆汁酸受体信号异常加剧代谢紊乱
“次级胆汁酸是激活代谢“开关”(FXR和TGR5)的钥匙。钥匙不足时,血糖调控失效,胰岛素抵抗加重,脂肪更易堆积。”
FXR信号通路受损: 次级胆汁酸(如脱氧胆酸)通过激活FXR受体,抑制肝脏糖异生并增强胰岛素敏感性。然而,PCOS患者次级胆汁酸水平降低,FXR信号通路活性减弱,导致肝脏持续释放葡萄糖入血,加重胰岛素抵抗。
PCOS 患者的肠道微生物群与健康个体存在显著差异。特定肠道细菌(如 Ruminococcus、Lachnospiraceae、Prevotella)在 PCOS 患者中较少,而 Lactobacilli、Streptococcus 、 Escherichia coli 的丰度较高。这种菌群失调可能影响胆汁酸代谢,从而影响 FXR 的激活。
TGR5受体功能受限: 次级胆汁酸还可激活肠道TGR5受体,促进GLP-1分泌,但PCOS患者次级胆汁酸不足导致这一调控失效,食欲抑制和胰岛素分泌功能受损。
胆汁酸失衡与脂质代谢异常
脂肪分解异常: 初级胆汁酸堆积会抑制脂肪分解酶(如脂肪甘油三酯脂肪酶ATGL)活性,导致脂肪组织分解减少,血脂异常和腹型肥胖。
胆固醇代谢紊乱: 胆汁酸代谢异常导致胆固醇逆向转运受阻,低密度脂蛋白(LDL)水平升高,增加心血管疾病风险。
炎症通路激活:肠道菌群失调产生的内毒素(如脂多糖LPS)通过激活Toll样受体4(TLR4),增加TNF-α和IL-6等促炎因子表达,诱导全身性炎症反应。
doi.org/10.3389/fendo.2025.1526468
胆汁酸与免疫调节通路
胆汁酸变化还影响关键免疫调节机制:
IL-22信号通路异常:胆汁酸能影响肠道型3先天淋巴细胞(ILC3)功能,调节白细胞介素-22(IL-22)的分泌。IL-22在维持肠道屏障完整性和调节免疫炎症平衡中起关键作用,其异常与PCOS病理进程密切相关。
注:IL-22 是由肠道先天淋巴细胞分泌的一种分子,具有多种保护作用,并在维持肠道免疫稳态中发挥关键作用。IL-22 参与多种慢性炎症性疾病的调节。
免疫-代谢轴平衡失调:胆汁酸通过核受体和膜受体调节多种免疫细胞功能,包括巨噬细胞极化和T细胞分化,形成复杂的免疫-代谢互作网络。PCOS患者胆汁酸谱异常导致这一网络平衡被打破。
总之,胆汁酸可能通过调节肠道菌群、影响卵巢细胞功能、诱导炎症反应以及通过多种机制调节免疫反应,在 PCOS 的形成和发展中发挥重要作用。
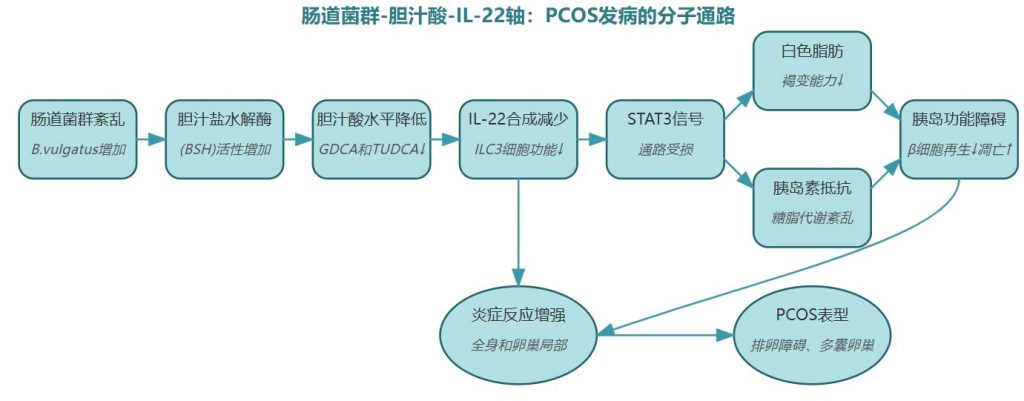
菌群失衡如何“切断”保护信号?
在乔杰院士团队的研究中,科学家们发现,多囊卵巢综合征患者的肠道菌群存在显著特征:拟杆菌属(Bacteroides vulgatus)的丰度异常升高。
这一变化看似微小,却像多米诺骨牌一样引发连锁反应,患者粪便和血清中的甘氨脱氧胆酸(GDCA)与牛磺熊去氧胆酸(TUDCA)水平显著降低,而这两种胆汁酸正是调控免疫因子IL-22的关键“信号分子”。
IL-22不足时,脂肪代谢紊乱,卵巢炎症,加剧PCOS
GDCA和TUDCA通过激活肠道中的GATA3蛋白,指挥ILC3分泌IL-22。IL-22就像一名“代谢调解员”,通过STAT3信号通路促进白色脂肪褐变(将“坏脂肪”转化为“好脂肪”),同时抑制卵巢炎症。
B.vulgatus的过度增殖导致胆汁酸水平下降,IL-22分泌减少。研究发现,PCOS患者的血清和卵泡液中的IL-22水平降低。这种缺失使得:
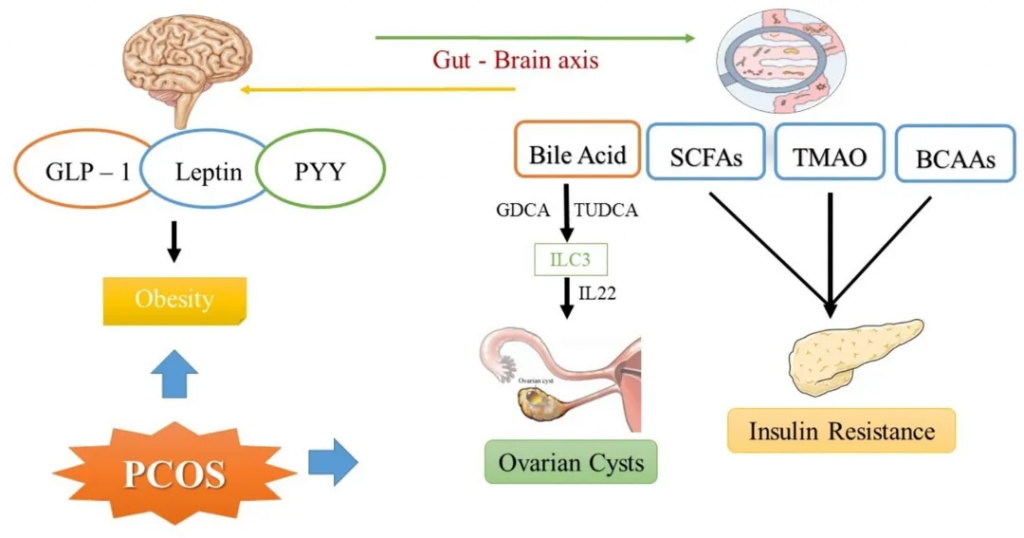
脑-肠轴代表一个连接胃肠道与中枢神经系统的双向信号网络。大量研究表明肠道与大脑之间存在相关性,揭示了一些相同的肽类物质存在于胃肠道和中枢神经系统中。这些肽类物质,包括生长素释放肽、肽YY(PYY)、血清素,也被称为脑-肠介质。
神经递质调控
“肠道菌群生产的信号分子通过迷走神经这条高速公路传递到大脑,告诉身体什么时候分泌激素、如何调节情绪。当有害菌占据上风,信息传递打乱,导致激素分泌混乱。”
在多囊卵巢综合征患者中,血清中血清素、生长素释放肽和 PYY 的水平与非多囊女性相比显著降低。研究发现特定菌群会影响肠道激素的分泌。例如,拟杆菌、大肠杆菌/志贺氏菌、Blautia与生长素释放肽呈负相关,而AKK菌与其呈正相关。
doi.org/10.1016/j.steroids.2024.109455
这种关联性提示我们:肠道菌群组成的改变可能是影响脑-肠介质水平的重要因素。那么,这些菌群是如何影响脑-肠介质的呢?
一些能产生短链脂肪酸的细菌,如普拉梭菌、丁酸单胞菌和艾克曼氏菌的增殖会导致肠道短链脂肪酸产量的增加。 它们能够:
因此,PCOS 患者中肠道菌群和短链脂肪酸的变化可以触发脑介质的释放,例如胃饥饿素和 PYY,进而影响性激素的分泌、中枢神经递质的调节、下游神经元功能以及免疫调节。
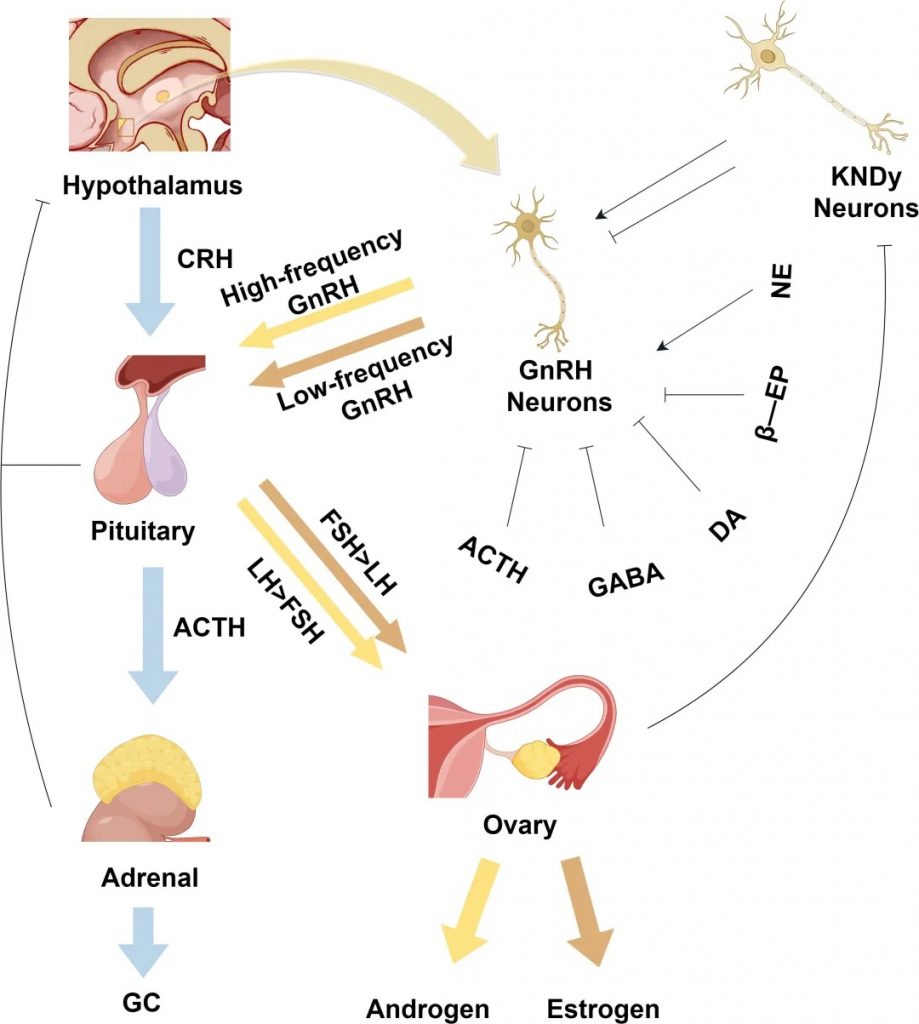
下丘脑-垂体-性腺轴
下丘脑的GnRH神经元如同生殖系统的“指挥中心”,通过脉冲式释放GnRH,调控垂体分泌促卵泡激素(FSH)和黄体生成素(LH)。正常情况下,高频GnRH脉冲优先刺激LH分泌(促进卵巢分泌雄激素),低频脉冲则促进FSH分泌(支持卵泡发育)。
研究发现,PCOS患者的GnRH神经元过度活跃,导致LH水平显著升高,而FSH相对不足。这一失衡引发连锁反应:
在神经调控方面,Kisspeptin通过GPR54受体促进GnRH释放,而GABA则抑制GnRH过度分泌。
PCOS患者GABA生成不足(可能与肠道菌群失调有关),导致抑制机制失效。
肠道菌群通过两种途径参与调控:
正常下丘脑-垂体激素轴的生理调节机制
编辑
doi.org/10.3389/fendo.2025.1526468
下丘脑-垂体-肾上腺轴
当人体处于压力状态,如过度劳累、紧张或生活压力时,下丘脑-垂体-肾上腺轴会被激活。
“HPA轴就像一个压力警报器,长期响铃会让警报器失灵,最终导致皮质醇泛滥成灾”
下丘脑的室旁核会分泌促肾上腺皮质激素释放激素(CRH),刺激垂体前叶释放促肾上腺皮质激素(ACTH),进而促使肾上腺分泌皮质醇。
正常情况下,皮质醇通过负反馈抑制HPA轴,维持激素平衡。
然而,在PCOS患者中,长期压力导致皮质醇水平持续升高,引发受体脱敏,形成“HPA轴过度激活→皮质醇抵抗→进一步激活”的恶性循环。
HPA轴失调如何加剧PCOS症状?
生殖激素紊乱:
高皮质醇抑制下丘脑GnRH脉冲频率,导致促黄体生成素(LH)和促卵泡激素(FSH)分泌失衡。LH升高刺激卵巢过度分泌雄激素,而FSH不足阻碍卵泡发育,形成多囊卵巢。
代谢与情绪双重打击:
皮质醇促进内脏脂肪堆积,加重胰岛素抵抗;同时抑制血清素等激素生成,增加抑郁风险。
为什么PCOS患者的HPA轴更难刹车?
这与肠道菌群密切相关。
有益菌帮助减压:
促炎菌火上浇油:
动物实验显示,补充益生菌的小鼠皮质醇水平下降30%,卵巢功能显著改善。
以上详细探讨了PCOS患者肠道菌群的特征性改变以及菌群失调与多囊卵巢综合征代谢紊乱之间的密切关联。从肠道微生物组成变化到代谢产物异常,从免疫失衡到神经内分泌调节紊乱,这些发现不仅深化了我们对PCOS发病机制的理解,更为临床干预提供了全新的靶点和思路。
那么通过调节肠道菌群是否能够改善患者的代谢状态和内分泌功能?哪些干预策略对PCOS患者最为有效?临床证据支持这些干预的疗效如何?下一章节我们继续了解。
饮 食
一项针对 39471 名女性的系统综述和荟萃分析表明,患多囊卵巢综合征的女性整体饮食质量较低,膳食摄入较差(胆固醇含量较高,镁和锌含量较低),以及总身体活动量较低。
应根据个体患者的需求和目标制定以饮食为中心的干预措施,涵盖生育调节、月经管理、减肥或高雄激素症状控制等多个方向,包括地中海饮食和营养补充剂。
蛋白质
支链氨基酸(BCAAs)包括缬氨酸、亮氨酸、异亮氨酸,是重要代谢调节因子。研究显示,BCAAs水平与PCOS患者(无论瘦型或肥胖型)的胰岛素抵抗程度密切相关,且高水平BCAAs摄入增加2型糖尿病风险。
减少动物蛋白摄入并增加有氧运动,可降低BCAAs水平、提高SCFAs产生,有望改善PCOS患者的胰岛素敏感性和血糖控制。
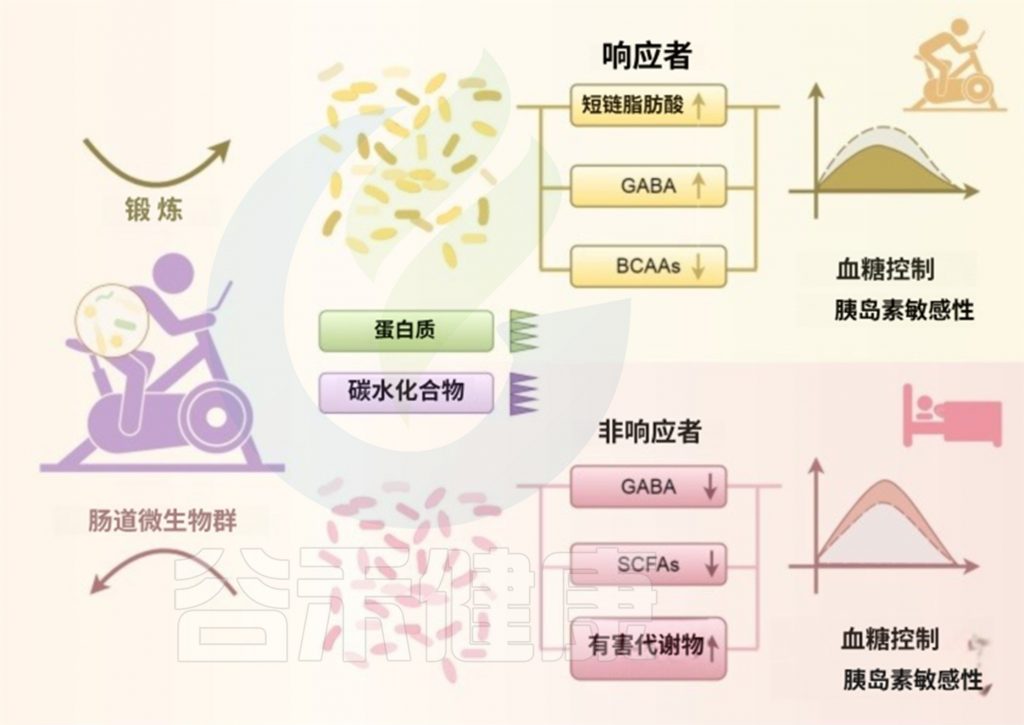
doi: 10.3389/fendo.2025.1529703
膳食纤维
研究表明,与健康个体相比,PCOS患者的膳食纤维摄入量明显较低。
随着该领域的研究不断发展,有理论认为膳食纤维是生物膜形成的良好基质。这些生物膜的形成促进了细菌之间以及细菌与其宿主之间的协同相互作用。
关于生物膜在我们之前的文章也详细写过:
例如,乳酸菌在麦麸等基质上形成生物膜时表现出更高的生物活性。PCOS患者普遍存在的膳食纤维摄入不足会对健康肠道菌群的组成和功能产生不利影响。
抗炎食物
许多 PCOS 症状与炎症增加有关。选择抗炎食物可能会有所帮助。避免添加糖和饱和脂肪。增加新鲜蔬菜,尤其是绿叶蔬菜(例如羽衣甘蓝、菠菜、生菜)、水果、坚果和富含油脂的鱼类。
避免高脂高热量饮食
PCOS患者的饮食模式通常以高脂肪和高热量含量为特征,通常导致肥胖。研究发现,门水平上厚壁菌门与拟杆菌门的比例升高,是肥胖肠道菌群的一个显著特征。
维生素D
研究表明,PCOS患者体内的维生素D受体(VDR)经常出现特定变异,这些变异(如 iApa-I、Taq-I、Cdx2 和 Fok-I)会影响身体对维生素D的反应能力。简单来说,即使摄入足够的维生素D,但如果体内的”接收器”(受体)工作不正常,维生素D也无法发挥应有的作用。
VDR 基因变异和 VitD3 水平会影响 PCOS 的临床特征,VDR 不足或缺乏是 PCOS 发病的风险因素。
维生素D对PCOS患者有多方面的积极影响:
显著改善葡萄糖代谢
提高生育能力
因此,维生素 D 是治疗 PCOS 的有效方法。
PCOS患者可以:
注:如需补充维生素D,正确的补充剂量应在医疗专业人士的指导下确定,以避免过量补充可能带来的副作用。
益 生 菌
在血糖调节方面,益生菌可以增加短链脂肪酸的产生以维持肠道屏障的完整性或调节免疫反应,激活 G 蛋白偶联受体,并促进 GLP-1 和 PYY 等肽的释放以降低血糖。益生菌可以减少 TNF-α和IL-6 等促炎细胞因子,增强肠道屏障,减少脂多糖进入血液,改善慢性炎症对胰岛素信号的影响,并提高胰岛素敏感性。
基于人体研究,60 名多囊卵巢综合征患者被随机分为两组,分别接受益生菌补充(双歧杆菌、乳杆菌等)和安慰剂对照试验。12 周后,发现试验组的性激素结合蛋白增加,毛发过多评分降低,胰岛素敏感性增加,脂蛋白减少,表明益生菌的干预治疗对多囊卵巢综合征患者有一定效果。
在糖尿病和肥胖小鼠的饮食诱导模型中,B. lactis B420 菌株已被证明有助于改善胰岛素抵抗和减少脂肪含量。
临床研究表明,使用 B. lactis可以改善 PCOS 患者的性激素水平。益生菌可能成为未来干预 PCOS 肥胖的重要方法。
胰岛素抵抗是 PCOS 的常见特征,导致肝脏产生 VLDL 增加,进而引起高甘油三酯血症。这种脂质失衡会导致动脉粥样硬化变化,并增加 PCOS 患者患心血管疾病的风险。
在服用下列补充剂 L. rhamnosus、L. casei、L. acidophilus、 L. bulgaricus、 B. longum、 B. breve 、Streptococcus thermophiles 8 周后,PCOS 女性经历了相同的结果。这些治疗显著降低了血清胰岛素和血浆葡萄糖水平。
益 生 元
益生元抗性淀粉,可以促进产丁酸菌(如 Faecalibister prausnitzii)的增殖,上调丁酸合成相关基因,增强结肠丁酸水平,然后激活宿主 GPR41/43 受体以改善胰岛素敏感性。并可能减少多囊卵巢综合征患者的雄激素过多和月经周期不规律。
抗性淀粉的来源多样,包括绿色香蕉、冷却后的米饭、土豆以及豆类等食物。
补充益生元如菊粉(RS)或低聚果糖(FOS)可显著降低 PCOS 患者的 HOMA-IR 和游离睾酮水平;宏基因组分析进一步证实了微生物群的功能基因重塑。这些研究为益生菌和益生元的激素和脂质代谢调节应用提供了证据。
一项研究发现,益生元的摄入会增加结肠中双歧杆菌的丰度,并增强结肠 L 细胞产生 GLP-1,从而有助于改善胰岛素抵抗。
某些肠道微生物可以合成和分泌γ-氨基丁酸(GABA)。例如,某些乳酸杆菌和双歧杆菌菌株已被证明可以产生 GABA,鉴于许多 PCOS 患者存在胰岛素抵抗和代谢综合征,研究表明 GABA 可能在调节能量代谢中发挥作用,可能影响胰岛素分泌及其利用,从而影响该人群的代谢健康。
多 酚
多酚通过调节肠道菌群改善多囊卵巢综合征的机制涉及多个关键菌群及其代谢途径。
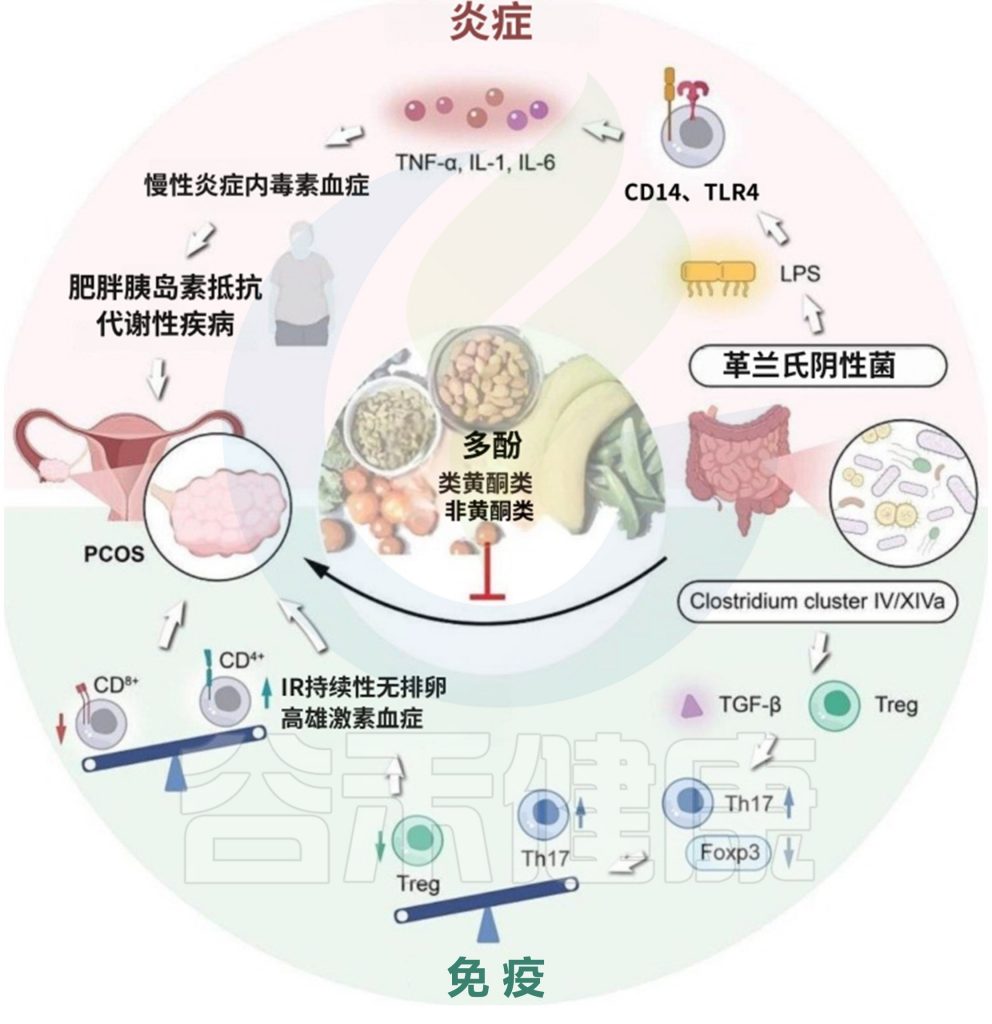
doi: 10.1186/s13048-024-01354-y
多酚对特定菌群的调节作用:
◆ 花青素(来源于葡萄、浆果)
Bifidobacterium、Lactobacillus、Enterococcus的丰度显著增加,增强肠道屏障功能(如上调紧密连接蛋白Claudin-3和ZO-1),减少炎症因子(IL-6、TNF-α)。花青素具有抗氧化应激损伤的作用,不仅调节了多囊卵巢综合征大鼠的血清性激素水平,还改善了卵巢形态。
◆ 绿茶儿茶素(EGCG)
儿茶素可以显著下调子宫 p-NF-κB p65 表达和促炎因子(IL-1β、IL-6 和 TNF-α)的蛋白表达,以及调节子宫组织中与基质降解相关的 MMP2 和 MMP9 表达。
来自乌龙茶的儿茶素可以通过抑制 p-STAT3 信号通路来抑制子宫炎症和基质降解。
补充绿茶提取物可以显著降低雌二醇戊酸诱导的 PCOS 大鼠的血清 LH 水平。此外,在绿茶提取物处理组中观察到胰岛素抵抗指数的降低。
◆ 白藜芦醇(红葡萄酒)
提升Bifidobacterium、Lactobacillus丰度,减少E. coli等致病菌,缓解氧化应激。白藜芦醇可以减少窦卵泡数量,增加二级卵泡数量,减少颗粒细胞死亡,并降低氧化应激水平。白藜芦醇还可以降低雄激素水平并提高胰岛素敏感性。
它存在于多种水果中,如葡萄(及其果汁)、橙子、蔓越莓、醋栗和花生皮等。
◆ 葡萄籽多酚(含没食子酸、表儿茶素)
促进Bifidobacterium、Lactobacillus ,抑制Clostridium histolyticum、Prevotella的增殖,降低肠道通透性,减少LPS入血引发的系统性炎症。
◆ 芒果籽提取物(MKE)
促进革兰氏阳性菌(如Lactobacillus)生长,抑制革兰氏阴性菌(如Bacteroides)扩张,缓解代谢紊乱。
◆ 异黄酮
异黄酮通常存在于大豆制品中,能在多种疾病中发挥抗炎和抗氧化作用。大豆苷元作为一种异黄酮,是雌激素受体的弱配体,能发挥雌激素效应。此外,大豆苷元可以通过肠道菌群转化为雌马酚,这表明肠道菌群与异黄酮代谢之间存在密切关系。异黄酮对 PCOS 具有治疗作用。
对PCOS患者在异黄酮干预三天后的粪便样本进行16S rRNA测序,发现异黄酮干预将PCOS组的α多样性提高到健康基线水平。此外,在对照组女性中,产Equol细菌的总体为42%(8/19),而在PCOS女性中为21%(5/24),这与PCOS患者血清Equol水平降低相一致,表明异黄酮在调节PCOS肠道微生物组成中可能发挥的作用。
中 药
一项先前的研究表明,半夏泻心汤可以通过调节肠道菌群来缓解 PCOS。
桂枝茯苓丸可以通过调节肠道菌群来抑制 PCOS 大鼠模型的胰岛素敏感性。
小檗碱具有通过调节肠道菌群来缓解 PCOS 的能力。
因此,针对肠道菌群的单味中药和复方中药为肥胖、胰岛素抵抗、糖尿病等代谢性疾病的干预和治疗提供了新靶点,也为 PCOS 的临床诊断和治疗提供了新的研究方向。
针灸是一种古老的疗法,可能有助于缓解慢性疼痛和辅助减肥。研究表明,针灸可以增加卵巢的血液流动并提高胰岛素敏感性。
粪 菌 移 植
粪菌移植(FMT)是治疗炎症性肠病的一种新疗法。FMT 将健康个体的粪便移植到患者的肠道中,通过改善和重建肠道菌群来达到治疗目的。
一项研究发现,将健康大鼠的FMT应用于来曲唑诱导的多囊卵巢综合征大鼠模型中,可导致雄激素水平下降、动情周期增强、卵巢形态正常化、普氏菌减少以及乳杆菌、梭菌(Clostridium)增加。
一项体内研究发现,FMT可以提高雌激素水平,降低血液雄激素水平,并支持正常的月经周期。
其 他 补 充 剂
用于多囊卵巢综合征症状的补充剂包括:
➦ 槲皮素 (QUR)
槲皮素是一种天然的类黄酮化合物,人体内不产生,存在于多种食物和药用植物中,如苹果、洋葱、葡萄、樱桃、橙子、番茄、银杏、连翘等。
槲皮素是一种潜在的缓解 PCOS 的药物。QUR 补充剂显著增加了肥胖小鼠中 Akkermansia 的相对丰度,并降低了厚壁菌门/拟杆菌门的比率。
连续 16 周喂食 1% 槲皮素会增加短链脂肪酸的产生。短链脂肪酸是由肠道菌群碳水化合物代谢产生的能量调节信号分子,可以改善胰岛素敏感性、下调炎症因子并促进脂肪酸氧化。
➦ 姜黄 Turmeric (Curcuma longa)
姜黄由于其抗氧化、抗炎、胰岛素增敏和促排卵特性,已成为一种有前景的 PCOS 补充疗法。
姜黄素补充剂可显著改变肠道菌群组成,使Ruminococcaceae、Burkholderiaceae、Verrucomicrobia丰度下降,Lactococcus、Turicibacter、Parasutterella增加,提示肠道菌群发生有益转变。
➦ 锌
补锌(50 毫克/天)治疗 8 周的多囊卵巢综合征(PCOS)女性,与健康对照组相比,显示出显著提高血清锌水平,同时降低血糖和胰岛素水平。这种效果被认为是由锌的抗氧化特性、其在稳定胰岛素六聚体中的作用以及增强胰岛素与肝细胞膜结合的结果。此外,补锌可能减少身体毛发生长并改善头发生长。
➦ 豆蔻 Cardamom (Elettaria cardamomum)
在肥胖的PCOS患者中,小豆蔻显著降低了黄体生成素(LH)、雄烯二酮和脱氢表雄酮(DHEA)水平,同时提高了卵泡刺激素水平,血清炎症标志物(TNF-α、IL-6、CRP)显著降低。
豆蔻下调了与肥胖和糖尿病相关的基因(FTO、CPT1A、LEPR、LAMIN),并上调了PPAR-γ,可能改善胰岛素抵抗和代谢异常。
➦ 圣罗勒 Tulsi (Ocimum tenuiflorum)
在PCOS大鼠模型中,圣罗勒提取物(100 mg/kg 和 200 mg/kg)显著逆转了睾酮、葡萄糖、总胆固醇和低密度脂蛋白胆固醇的升高(均 p<0.001),并提高了雌二醇和高密度脂蛋白胆固醇水平(p<0.001)。此外,圣罗勒提取物使卵巢中的囊肿消失,并减少了颗粒细胞的凋亡。圣罗勒提取物恢复了因PCOS诱导而耗损的抗氧化剂水平。
➦ 生姜 Ginger
在PCOS诱导的雌性大鼠模型中,高剂量生姜提取物(500 mg/kg)显著逆转了雌激素、孕酮和卵泡刺激素(FSH)的异常变化,效果与标准治疗药物克罗米芬柠檬酸盐相当,且无副作用。
一项大鼠实验显示,低剂量姜粉(100 mg/kg)长期给药(10天)可增加窦卵泡计数和卵巢间质血管内皮生长因子(VEGF),可能促进卵泡发育和生育能力。
一项针对PCOS女性的研究中,为期12周的生姜补充剂联合普拉提运动显著降低了黄体生成素(LH)、睾酮和空腹胰岛素水平,同时提高了FSH和性激素结合球蛋白(SHBG)。
生姜的非挥发性成分(如姜辣素、姜烯酚)通过抑制活性氧生成和调节氧化应激通路,可能改善PCOS相关的氧化损伤。
➦ 其他
运 动
每天运动对患有多囊卵巢综合征的人来说很重要。然而,运动过度可能会加剧激素失衡。找到适合自己的运动方式很重要。
力量训练、高强度间歇训练、瑜伽、普拉提、自身体重训练都是治疗多囊卵巢综合征的运动方式。
有氧运动和温和的活动包括:
骑行、慢跑、瑜伽、游泳、太极、走路、深呼吸、冥想、正念等。
多囊卵巢综合征的发病机制跨越遗传、代谢、内分泌与肠道微生态,而肠道菌群失调作为“代谢-炎症-免疫”失衡的核心枢纽,为治疗提供了全新视角。
随着肠道菌群检测技术的革新,多囊的早期诊断有望突破传统生化指标局限,通过识别特异性菌群标志物(如拟杆菌丰度、产丁酸菌缺失或促炎菌过度增殖),实现亚型分型与风险预测。
临床干预可结合菌群检测结果定制方案,例如,对F/B比例失衡者补充膳食纤维,对GABA合成不足者靶向补充乳酸杆菌,对LPS泄漏者采用抗炎益生元等方式。
肠道菌群的复杂性与个体异质性仍是临床转化的挑战。需进一步开展多中心临床研究,明确不同人群的菌群标志物阈值,建立标准化的检测与干预指南。
随着”微生物组-宿主”互作机制的深入解析,未来,整合肠道菌群动态监测与多组学数据,人工智能预测模型不断迭代更新,基于肠道菌群调控的多维度整合疗法有望成为多囊精准医学的新范式。
主要参考文献
Zhou P, Feng P, Liao B, Fu L, Shan H, Cao C, Luo R, Peng T, Liu F, Li R. Role of polyphenols in remodeling the host gut microbiota in polycystic ovary syndrome. J Ovarian Res. 2024 Mar 27;17(1):69.
Li C, Cheng D, Ren H, Zhang T. Unraveling the gut microbiota’s role in PCOS: a new frontier in metabolic health. Front Endocrinol (Lausanne). 2025 Mar 18;16:1529703.
Shukla A, Rasquin LI, Anastasopoulou C. Polycystic Ovarian Syndrome. [Updated 2025 May 4]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-.
Sun Y, Gao S, Ye C, Zhao W. Gut microbiota dysbiosis in polycystic ovary syndrome: Mechanisms of progression and clinical applications. Front Cell Infect Microbiol. 2023 Feb 24;13:1142041.
Mallya P, Lewis SA. Curcumin and its formulations for the treatment of polycystic ovary syndrome: current insights and future prospects. J Ovarian Res. 2025 Apr 15;18(1):78.
Patibandla S, Gallagher JJ, Patibandla L, Ansari AZ, Qazi S, Brown SF. Ayurvedic Herbal Medicines: A Literature Review of Their Applications in Female Reproductive Health. Cureus. 2024 Feb 29;16(2):e55240.
Chen T, Jia F, Yu Y, Zhang W, Wang C, Zhu S, Zhang N, Liu X. Potential Role of Quercetin in Polycystic Ovary Syndrome and Its Complications: A Review. Molecules. 2022 Jul 13;27(14):4476.
Li J, Qiao J, Li Y, Qin G, Xu Y, Lao K, Wang Y, Fan Y, Tang P, Han L. Metabolic disorders in polycystic ovary syndrome: from gut microbiota biodiversity to clinical intervention. Front Endocrinol (Lausanne). 2025 Apr 28;16:1526468.
Khobragade NH, Sheth DB, Patel CA, Beladiya JV, Patel S, Dalal M. Polycystic ovary syndrome: Insights into its prevalence, diagnosis, and management with special reference to gut microbial dysbiosis. Steroids. 2024 Aug;208:109455.
Ravat FK, Goswami JR, Nair SM, Thummar KN. A review of metabolic and microbial influences on women with polycystic ovarian syndrome. Steroids. 2024 Dec;212:109512.
Gao H, Qian B, Ni Y, Sun L, Fu J. 多囊卵巢综合征发病机制研究进展 [Research Progress in the Pathogenesis of Polycystic Ovary Syndrome]. Sichuan Da Xue Xue Bao Yi Xue Ban. 2024 Jul 20;55(4):1049-1054. Chinese.
Gautam R, Maan P, Patel AK, Vasudevan S, Arora T. Unveiling the complex interplay between gut microbiota and polycystic ovary syndrome: A narrative review. Clin Nutr. 2024 Dec;43(12):199-208.
Senthilkumar H, Arumugam M. Gut microbiota: a hidden player in polycystic ovary syndrome. J Transl Med. 2025 Apr 15;23(1):443
谷禾健康
消化是人体获取能量和营养的过程。膳食脂质因其在水中的不溶特性,从而导致其难以被小肠中的消化酶有效地识别和分解,而胆汁酸在脂质消化吸收中发挥关键作用,缺少胆汁酸会导致脂肪吸收不良和脂溶性维生素缺乏。
在过去,胆汁酸主要被认为是帮助消化和吸收脂肪及脂溶性维生素的消化剂。它们在消化过程中起到分解脂肪,使之能够在小肠中被水溶化和吸收的作用。
然而,随着科学研究的深入,人们对胆汁酸的理解发生了变化。胆汁酸被发现不仅仅是消化助手,它们还是强大的营养信号激素。胆汁酸通过真核生物、细菌和古细菌酶的作用进行结构调整,通过与特定的受体相互作用,如法尼醇X受体(FXR)和G蛋白偶联受体(TGR5),参与调节多种生理过程,包括脂质和葡萄糖代谢、能量平衡、炎症反应以及细胞增殖和死亡等。
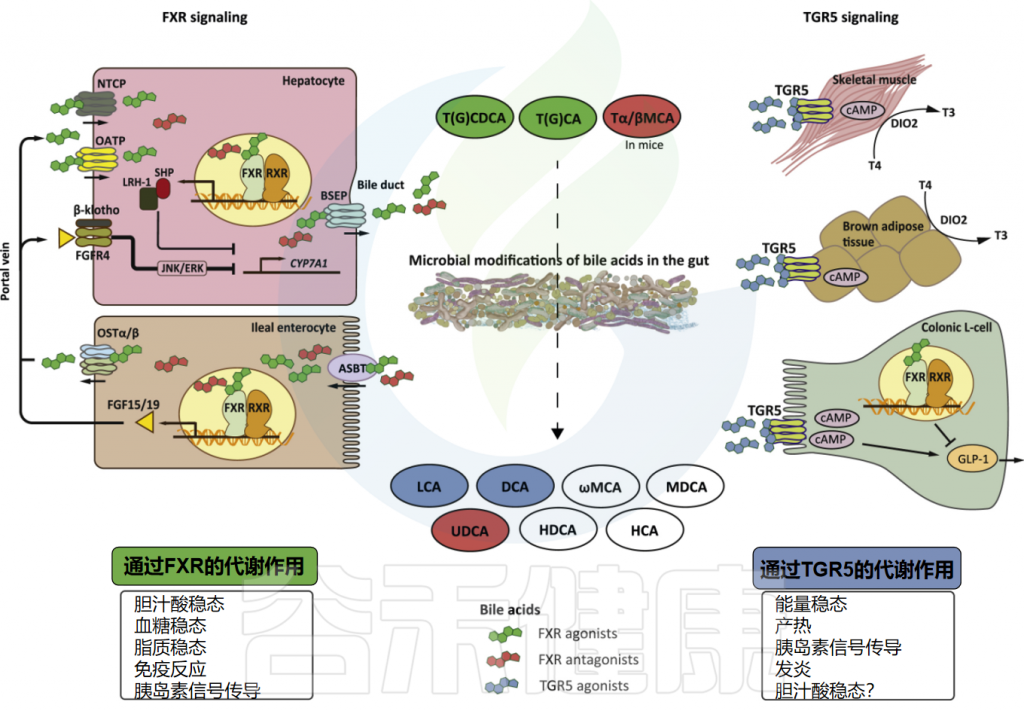
Wahlström A,et al.Cell Metab.2016
这些发现极大地扩展了我们对胆汁酸功能的认识,将其从单一的消化辅助因子转变为重要的内分泌调节因子,影响着包括胃肠道疾病和人体健康的多个方面。
在肠肝循环中,肠道微生物将来自宿主的初级胆汁酸转化为众多代谢物,即次级胆汁酸。胆汁酸的这种转化被认为是微生物与宿主之间交流的主要方式之一,同时也是宿主感知、反应并影响其共生微生物组成的关键双向互动模式。
值得注意的是,微生物代谢生成的疏水性次级胆汁酸,如脱氧胆酸(DCA)和石胆酸(LCA),成为众多宿主受体的首选配体,优于它们的原始初级胆汁酸。在过去几十年里,由于相对缺乏运动,以及偏好低纤维、高加工碳水化合物和饱和脂肪的饮食,导致胃肠道中胆汁量和胆汁酸库的疏水性增加,进而提高了人类患肝胆疾病和胃肠癌的风险。
微生物通过它们的代谢产物以独特的方式与我们沟通。在本文中,我们重点介绍了肠道微生物对一些次级胆汁酸的代谢影响。这些反应可能改变胆汁酸池以及它们的结构和功能,我们还总结了关于次级胆汁酸衍生物如何影响宿主免疫功能的最新发现。并希望通过采取相应的措施来调节受微生物代谢的胆汁酸所影响的多种人类疾病。
胆汁酸是生理清洁剂,可促进肠道吸收和运输脂质、维生素等营养物质。胆汁酸也是激活核受体和细胞通路的信号分子和炎症因子。
胆汁酸作为肝脏合成的一种重要物质,是人体胆汁的主要成分,具有多种重要作用,主要包括以下几点。
胆汁酸的结构与功能
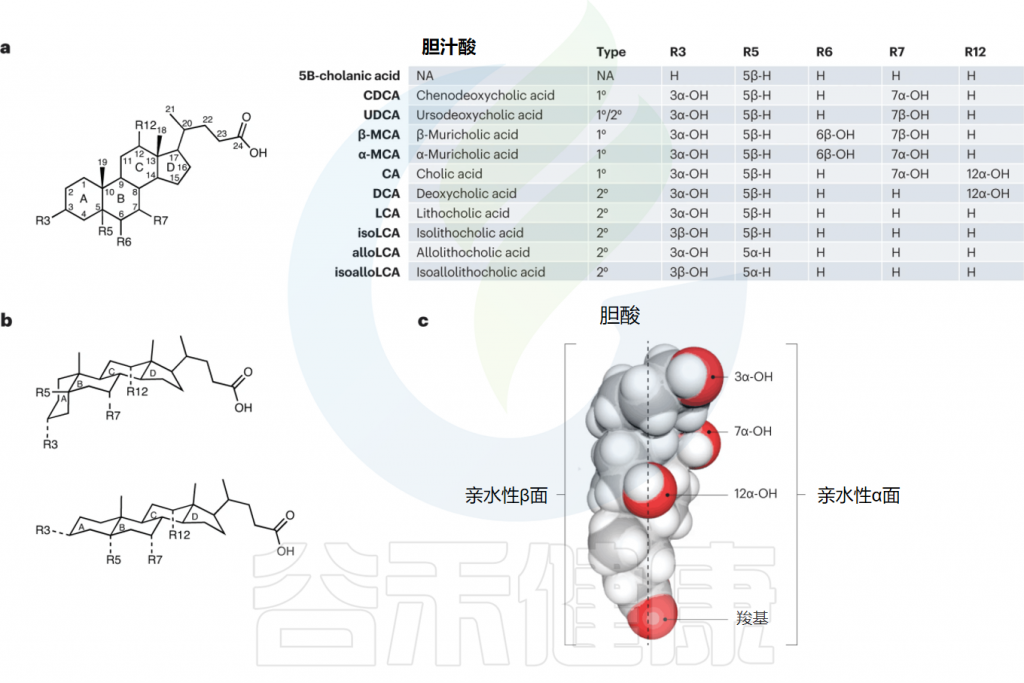
Ridlon JM,et al.Nat Rev Gastroenterol Hepatol.2024
1
促进脂质消化吸收、调节代谢
胆汁酸促进脂肪与脂溶性维生素(如维生素A、D、E、K)的消化吸收,通过乳化作用将大块脂肪球分解为细小颗粒,增加其与消化酶的接触面积,提升脂肪消化效率。
胆汁酸还激活多种核受体(例如FXR、TGR5),参与调控脂质和糖的代谢以及能量平衡,对保持代谢健康发挥着关键作用。
2
调节胆汁分泌、保护肝脏
胆汁酸参与调节胆囊的收缩,通过负反馈机制影响胆汁的储存和释放,维持体内胆汁酸水平平衡。当食物进入小肠时,胆汁酸的浓度变化会促使胆囊收缩,将胆汁排入小肠中,参与消化过程。
胆汁酸还能通过激活肝细胞核受体(FXR受体)促进肝细胞再生和修复,抑制多种促炎和促氧化应激的信号通路,减少肝脏中的炎症反应和氧化损伤,从而起到保护肝脏的作用。
3
排泄毒素、参与药物代谢
胆汁酸是肝脏排泄胆红素(血红蛋白代谢产物)和其他代谢废物的重要途径。通过与这些物质结合,胆汁酸有助于将它们从体内排出,维持体内环境的稳定。
胆汁酸还通过影响肝脏的药物代谢酶,参与药物的代谢过程,影响药物的清除速率和生物利用度。
4
调节胆固醇水平、预防胆结石
胆汁酸的合成是消耗胆固醇的主要途径之一。通过将胆固醇转化为胆汁酸,肝脏可以调节体内胆固醇的水平,有助于降低血清胆固醇,从而维持血脂平衡。
胆固醇结石形成的基础为胆固醇、胆汁酸以及卵磷脂等成分的比例失调,进而发生结晶、析出、结聚成石。而胆汁酸有助于减少胆固醇,进而预防胆固醇结石的形成。
5
免疫调节、抑制肠道中细菌的过度生长
胆汁酸通过影响肠道免疫系统,参与调节机体的免疫反应,有助于维持免疫系统的平衡。
胆汁酸具有一定的抗菌作用,能够抑制小肠中过度的细菌生长,保持肠道微生态的平衡。
胆汁酸在一些疾病中也发挥着重要作用,详细内容可见谷禾之前的文章。
胆汁酸在人体中的这些作用说明了它对于维持正常的生理功能和健康状态的重要性。然而,胆汁酸的异常代谢或积累也可能导致或加剧某些疾病,如胆石症、肝病和胆汁淤积性皮肤病等。
因此,维持胆汁酸的正常代谢与平衡对于健康极为重要。接下来,我们将重点介绍最新研究所总结的肠道微生物群对胆汁酸代谢影响的内容。
在人体复杂的生理系统中,肠道微生物群扮演着不可或缺的角色,尤其是在胆汁酸的代谢过程中。胆汁酸作为重要的消化液成分,不仅参与脂肪的消化和吸收,还与体内多种代谢途径紧密相关。
在这个过程中,肠道微生物群通过其多样化的酶系统,对胆汁酸进行一系列复杂的生物转化作用,影响着胆汁酸的结构和功能。
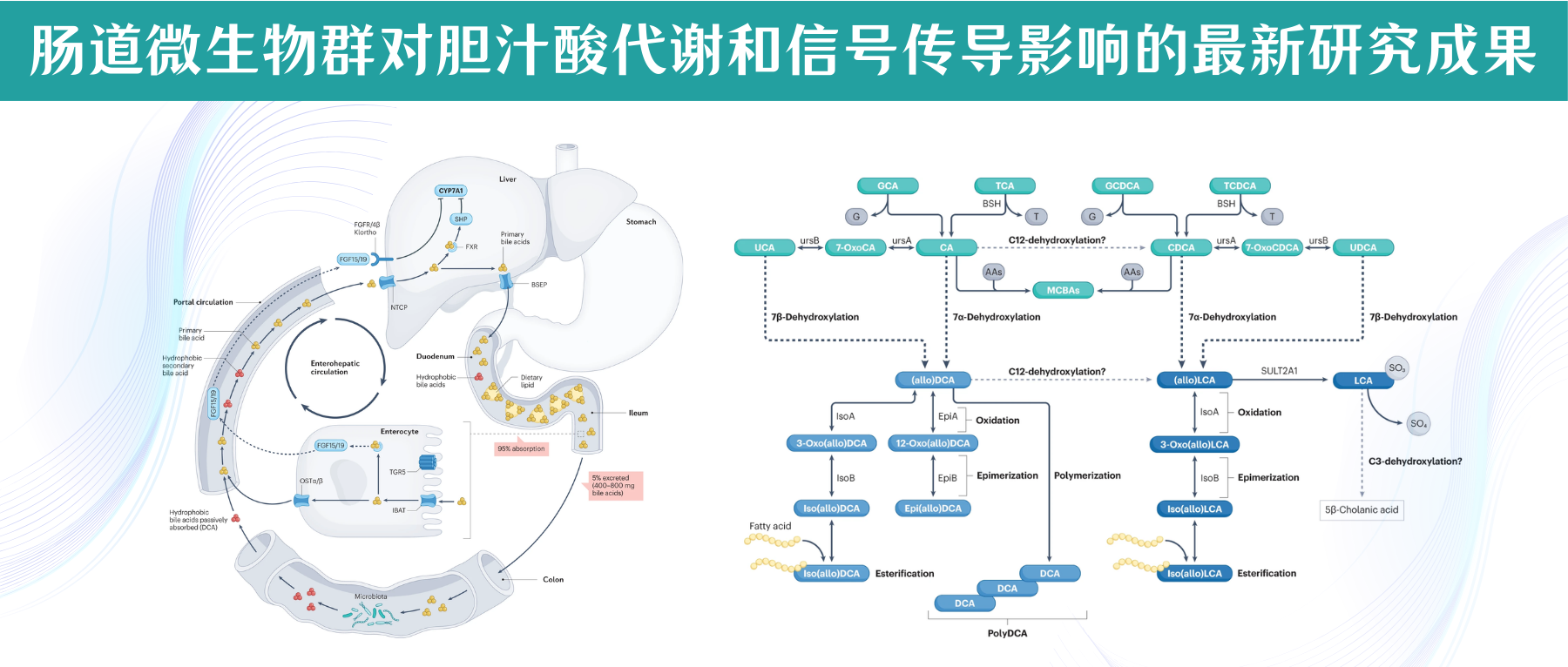
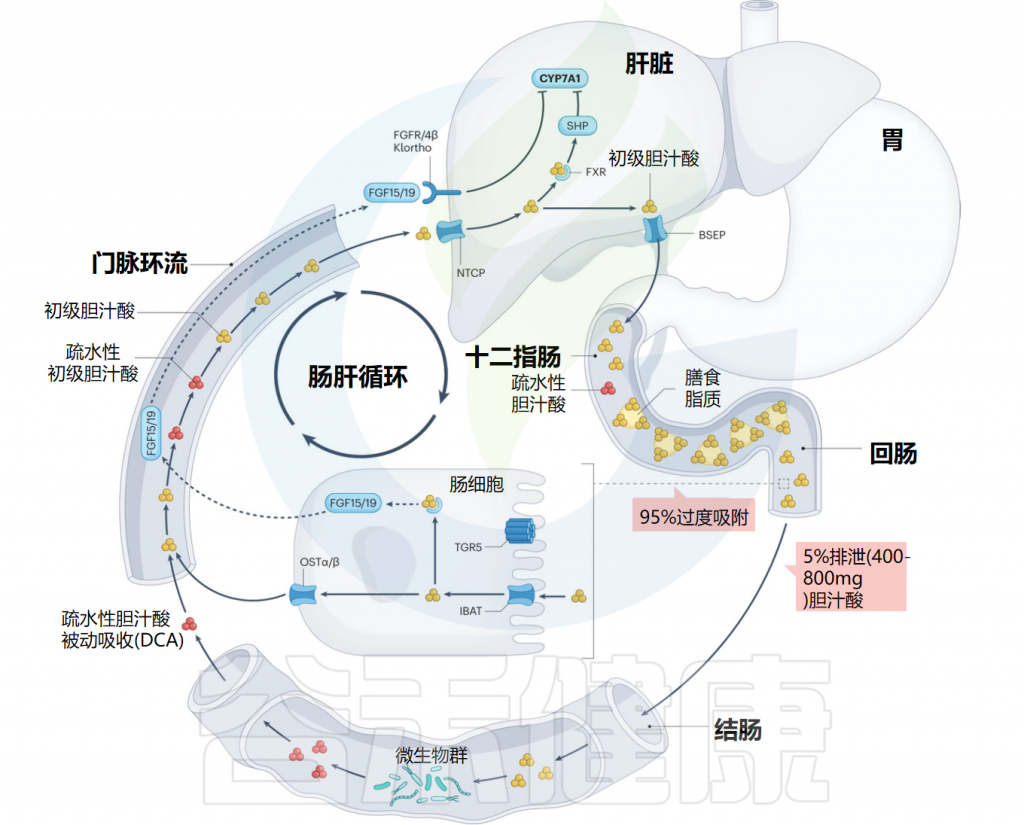
初级胆汁酸由胆固醇在肝细胞中合成,并通过转运蛋白BSEP分泌到胆汁中。吃饭时,胆囊会收缩,把胆汁释放至十二指肠,在那里与磷脂、脂肪酸、胆固醇及脂溶性维生素形成混合胶束,这些胶束由两亲性的共轭胆汁酸包裹。使其在通过肠细胞顶侧和底外侧的高亲和力转运蛋白通过门静脉循环转运回肝脏之前能够被吸收。
胆盐输出泵(BSEP)位于肝细胞胆小管面的细胞膜上,是胆汁酸外排最重要的转运蛋白,负责将胆盐从肝细胞输送到胆小管。
每天,数百毫克结合的胆汁酸脱离肠肝循环进入大肠,在大肠中被细菌胆盐水解酶(BSH)迅速解除结合,释放出牛磺酸或甘氨酸和游离胆汁酸。
注:胃肠道中存在几种利用牛磺酸的途径;然而,厌氧菌对牛磺酸的微生物呼吸导致硫化氢的形成,在人体研究和动物模型中硫化氢的过量形成与结直肠癌有关。
胆汁酸的反应与细菌胆盐水解酶相关
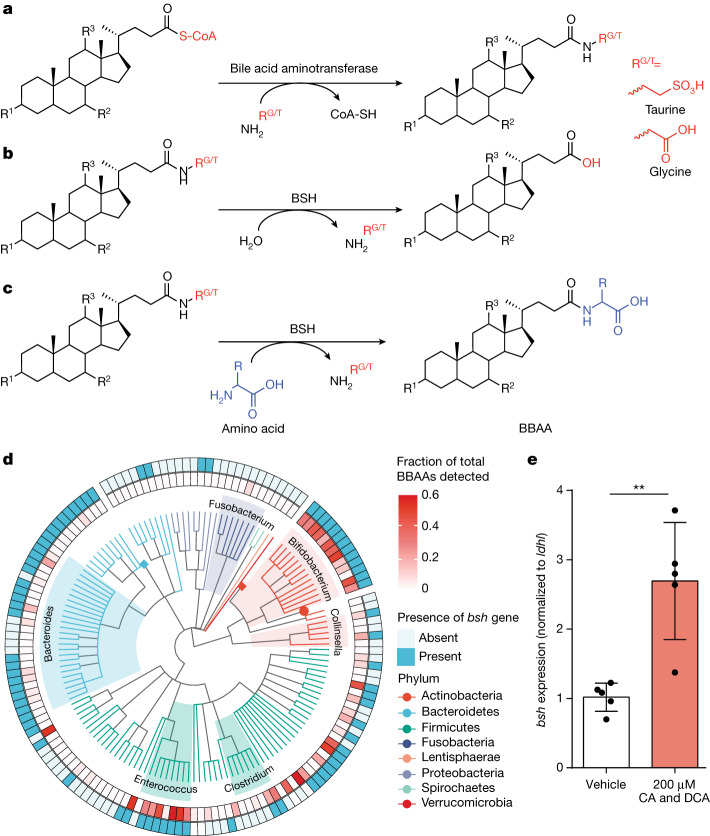
Rimal B,et al.Nature.2024
当结合胆汁酸到达回肠末端时,它们通过回肠钠-胆汁酸共转运蛋白(IBAT)转运到肠细胞中,与重组人脂肪酸结合蛋白6(FABP6)结合并通过肠细胞基底外侧表达的OSTα和OSTβ转运到门静脉循环中。
• 负反馈调节使胆汁酸水平保持稳定
作为胆汁酸合成负反馈功能的一部分,细胞内胆汁酸激活肠上皮细胞中的核法尼醇X受体(FXR),导致FGF15/19蛋白合成和分泌到门静脉循环中的上调。FGF15/19以依赖成纤维细胞生长因子受体FGFR4/β-Klortho受体的方式结合,导致肝脏胆汁酸生物合成的限速酶(CYP7A1)受到抑制。
返回肝脏的胆汁酸由牛磺胆酸共转运蛋白(NTCP)运输。肝细胞中FXR的激活抑制依赖于小异二聚体伴侣(SHP)和肝脏相关同源物1(lr h1)的CYP7A1表达。这个过程使胆汁酸水平保持在稳定状态。
• 肠道微生物改变胆汁酸的结构和功能
肠干细胞中TGR5的激活促进肠细胞的再生。大约5%的胆汁酸(每天400-800毫克)从回肠运输中逃逸并进入大肠,大肠是胆固醇排出体外的主要途径。在大肠中,胆汁酸的结构和功能因肠道微生物群而变化。这种多样化的一部分是增加大肠中胆汁酸的疏水性,允许结肠细胞被动吸收并进入门静脉循环,其中次级胆汁酸(主要是脱氧胆酸)积累到健康人体胆汁酸库的大约四分之一。
Ridlon JM,et al.Nat Rev Gastroenterol Hepatol.2024
宿主的初级胆汁酸通过肠道微生物代谢的首个证据是混合粪便细菌和微生物分离物对结合胆汁酸的解偶联。
• 众多肠道细菌中都存在胆汁酸代谢酶
胆盐水解酶(BSH)是研究最广泛的微生物胆汁酸代谢酶之一,在肠道微生物组内广泛存在,涵盖多个门类的各种物种。包括乳杆菌、双歧杆菌属和肠球菌在内的革兰氏阳性共生细菌,以及在拟杆菌属等革兰氏阴性菌,均表现出BSH活性。
哺乳动物胃肠道中常见的古细菌也表达BSH。系统发育分析表明BSH基因从芽孢杆菌(Bacillota)向肠道产甲烷菌的水平基因转移。BSH是病原体胃肠道定植所必需的,包括流产布鲁氏菌(Brucella abortis)和单核细胞增多性李斯特菌(Listeria monocytogenes)。
• 胆汁酸的检测可为胃肠道定植提供信号
结合胆汁酸的检测为胃肠道定植提供了重要的环境信号。BSH基因可能是一种定居因子,提供碳、氮、硫和能量来源的氨基酸组合;防止结合胆汁酸的去污剂特性,促进胃肠定植和持续存在;并增强细菌膜的抗张强度、流动性和电荷,保护细菌免受宿主免疫攻击。
应注意,BSH在不同分类群中发挥不同作用,且在可能的情况下,对BSH基因的同源性应通过产生突变体来确定其在细菌生理和宿主生理中的具体功能。
• BSH酶活性影响胆汁酸水平进而影响宿主代谢健康
相比之下,小肠中的BSH活性产生的非结合胆汁酸极性较低,并且通过回肠钠-胆汁酸共转运蛋白(SLC10A2)的转运效率较低,导致粪便中胆汁酸排泄增加。这种增加的胆汁酸排泄促使胆固醇更多地转化为胆汁酸或通过胆固醇反向转运回肝脏,从而降低血清胆固醇。BSH活性通过减少胶束脂质和胆固醇的重吸收以及增加粪便中胆汁酸的损失,并刺激胆固醇转化为胆汁酸,促使血清胆固醇降低。
一项针对2-7岁儿童的研究支持BSH与大环内酯类抗生素治疗引起的体重增加之间的负相关关系。最新的组学应用表明,BSH活性对宿主的生理影响可能主要通过肠道和肝脏中的细胞信号传导介导,而不仅仅是通过其洗涤剂作用和脂质吸收。
BSH活性影响宿主胃肠成熟并改变与昼夜节律、肝脏葡萄糖和脂质稳态以及免疫功能相关的肝脏和肠道基因表达。由于BSH酶在氨基酸缀合物(如甘氨酸和牛磺酸)和甾醇核底物特异性方面的差异,靶向BSH酶的子集可能是实现特定临床结果所需的。大规模宏基因组调查揭示了BSH基因与人类慢性病之间的联系,提示需要进一步的功能表征。
针对BSH酶的特异性抑制剂已被开发,对这些酶的不同亚群的药理学抑制的进一步改进可能对人类疾病和动物生产都有治疗作用。
肠道微生物产物能调节胆汁酸在肝脏的结合,展现出潜在的治疗优势。”三级胆汁酸”一词用以指代由二级胆汁酸在肝脏代谢后形成的特殊胆汁酸。
• 一些“三级胆汁酸”具有抗糖尿病效果
二级胆汁酸石胆酸(LCA)的II期代谢可产生三级胆汁酸3-磺基石胆酸。此外,石胆酸的微生物转化及其在回肠的吸收也促进了肝脏中其他胆汁酸的硫酸化。2021年的研究显示,接受部分袖状胃切除手术的人和小鼠粪便中,石胆酸诱导了7-硫酸胆酸的增加,这种胆酸是肠道特异性TGR5激活剂,能刺激胰高血糖素样肽1的释放,具有抗糖尿病的效果。
肠道微生物通过表达芳基硫酸酯酶,能从三级胆汁酸移除硫酸盐,这一过程与Peptococcus, Clostridium, Pseudomonas和Fusobacterium有关。但是,参与的微生物硫酸酯酶的具体身份还未确定。
肠道微生物群也可能在肠道内进行胆汁酸的硫酸化,这一机制过去被认为完全依赖宿主酶。如果这一假设得到验证,细菌对胆汁酸的硫酸化作用将淡化二级胆汁酸与三级胆汁酸之间的区别。
“异二级胆汁酸”(是一类特殊的胆汁酸,它们在化学结构上与常见的二级胆汁酸有所不同。在正常情况下,胆汁酸主要由肝脏合成,并以初级胆汁酸的形式分泌到小肠中。当初级胆汁酸进入肠道后,部分会被肠道微生物通过各种酶作用转化为二级胆汁酸。这一过程称为胆汁酸的微生物代谢。
“异二级胆汁酸”是在这一微生物代谢过程中,通过非典型或不常见的代谢途径生成的二级胆汁酸。这意味着它们的化学结构或代谢途径与通常所见的二级胆汁酸有所区别。
研究已经发现了生成异二级胆汁酸的两种途径。
• 直接途径通过酶催化转变
我们将第一种途径称为“直接途径”,其中初级胆汁酸通过hylemon–bjӧrkhem途径转化为alloDCA或alloLCA。
在限速的7α-脱水步骤(由BaiE催化)后,形成3-oxo-4-DCA或3-oxo-4-LCA中间体。在Hylemon–Björkhem途径中,3-氧代-4-DCA通过BaiCD(胆汁酸5β-还原酶)和BaiA(3α-羟基类固醇脱氢酶)的催化还原转化为脱氧胆酸。或者,3-氧代-4-DCA可经由BaiP或BaiJ(胆汁酸5α-还原酶)和BaiA的催化还原转化为alloDCA。
• 间接途径还需要细菌参与反应
第二种途径,我们称之为“间接途径”,首先依赖于能产生DCA或LCA的胆汁酸7-脱羟基细菌,如C.scindens。在此情境下,表达3α-HSDH、胆汁酸5β-还原酶和胆汁酸5α-还原酶的肠道微生物通过代谢调节DCA和alloDCA间的平衡,通过3-氧代-4-DCA中间体的环立体化学重置,产生异二级胆汁酸。
直接与间接途径对异二级胆汁酸形成的贡献程度目前尚不明确,这可能在不同个体之间存在差异。
石胆酸(LCA)是由鹅去氧胆酸(CDCA)和熊去氧胆酸(UDCA)经C7脱羟基反应后的微生物产物,属于单羟基化胆汁酸,是脊椎动物中最主要的胆汁酸之一。
• 石胆酸是一种潜在的致癌物
作为潜在的致癌物,石胆酸能产生活性氧和DNA加合物,通过抑制DNA修复酶,发挥肿瘤启动作用,促进体外抗凋亡细胞增殖。研究CDCA或UDCA治疗胆结石期间的人类石胆酸代谢揭示,LCA经过广泛硫酸化,形成3-磺基LCA(3-sulfoLCA)。
DNA加合物是DNA片段与致癌化学物质结合形成的复合物,在科学实验中通常作为暴露的生物标注物。
• 微生物代谢可产生不属于胆汁酸的新型物质
已知LCA是VDR的强配体,能诱导磺基转移酶SULT2A1表达。LCA的硫酸化在II期代谢中形成亲水性衍生物,促进其排泄,不易被肠道吸收。肠道细菌通过表达芳基硫酸酯酶,使3-磺基LCA解偶联,释放LCA,形成宿主II期代谢与微生物解偶联的“来回”过程。有证据显示,存在一种微生物代谢路径能跳出此循环,产生不再定义为胆汁酸的产物。
• C3脱羟基是胆汁酸代谢的一种重要方式
虽然胆汁酸脱羟基研究主要聚焦于Hylemon–Björkhem途径,但也报道了包括C3脱羟基在内的其他胆汁酸脱羟反应。C3脱羟基将胆汁酸转变为5β-胆烷酸衍生物,对胆汁酸代谢谱构成特殊挑战。
研究显示,人类粪便悬浮液能将3-磺基LCA转化为异LCA、Δ3-cholenic acid和5β-cholanic acid,肠道微生物在其中可能起到了重要作用。加入万古霉素抑制了3-sulfoLCA的代谢,而选择性培养3-sulfoLCA 代谢的革兰氏阳性孢子形成细菌(如经加热和酒精处理的粪便)则不受影响。梭菌纯培养物能从3-磺基LCA产生异LCA、Δ3-胆酸和5β-胆酸。
研究报告鹅去氧胆酸在人类粪便悬浮液中转化为7α-羟基-5β-胆甾烷-24酸,显示Hylemon–Björkhem途径产生LCA不需C3脱羟基先行。需要进一步研究以确定C3脱羟基及其机制,及其胆汁酸底物范围。
★ 胆汁酸C3脱羟基可能是预防胃肠道癌症的策略
5β-胆烷酸的生理影响尚不明确,但胆汁酸C3脱羟基可能是降低胃肠道胆汁酸浓度,预防胃肠道癌症的策略之一,类似于通过肠道细菌增强胆固醇转化为粪甾醇以降低血清胆固醇的方法。
一系列5β-胆烷酸衍生物被证明有效激活FXR,比羟基化胆汁酸更为有效。肝胃肠疾病背景下,肝细胞癌原位小鼠模型使用显示,FXR激动剂与TGR5拮抗剂结合使用,显著抑制肿瘤生长。因此,确认宿主或微生物衍生的5β-胆烷酸衍生物的生理相关性应非常重要。
拓展:胆汁酸7α-脱羟基的几个关键方面
在该领域的研究中,胆汁酸7α-脱羟基化的几个关键方面已经显现出来。首先,胆汁酸C24酰胺(结合胆汁酸)不是底物。因此,胆汁酸水解是胆汁酸7α-脱羟基的先决条件。值得注意的是,BSH抑制剂确实被观察到能使宿主富含初级胆汁酸。
第二,胆汁酸7α-脱羟基作用似乎只存在于相对较少的杆菌属物种中(Ruminococcaceae, Peptostreptococcaceae, Lachnospiraceae and Oscillospiraceae)。
第三,根据胆酸转化为脱氧胆酸的相对速率,将这些物种种群分为两组(低活性与高活性),其差异相差很大,约为100倍。
第四,尽管种群数量很小,但已确定的微生物群落的复杂性从少数到100个成员不等,这表明具有bai操纵子的生物体是脱氧胆酸和石胆酸形成所必需的。
第五,微生物中的bai途径酶已经演化出对其宿主产生的内源性胆汁酸的识别能力。因此,虽然肠道微生物可以将βMCA转化为脱氧胆酸,但在无菌小鼠中定植的人类肠道微生物群却无法将胆汁酸转化为脱氧胆酸或鹅去氧胆酸转化为石胆酸,熊去氧胆酸(UDCA)是个例外,它可以通过7β-脱羟基转化为石胆酸(LCA)。
最后,bai途径是一个涉及净双电子还原的氧化还原过程,即胆汁酸充当电子受体,这一点对其演化至关重要。在结肠这样一个高度还原、厌氧的环境中,微生物需要处理还原当量,而通过还原不饱和胆汁酸的脱羟基过程,微生物在一定程度上完成了这一任务。然而,还可能有同等或更重要的潜在动机,包括但不限于通过增加有毒胆汁酸的产生和增强与宿主之间的结构性信号交流来消除对关键营养素的微生物竞争,从而提高胆汁酸生产者在肠道环境中的适应性。
• 肠道菌群通过生物转化形成微生物结合胆汁酸
下一代测序技术的兴起和计算能力的增强共同推动了肠道微生物学的快速发展。非靶向代谢组学的显著进步为化学信息学家揭示新的微生物代谢产物铺平了道路。
这种化学信息学方法已成功鉴定了微生物结合胆汁酸(MCBA),微生物结合胆汁酸(MCBA)是一类由肠道微生物群通过生物转化作用产生的化合物。在这一过程中,肠道细菌(例如Enterocloster boltaea)通过特定的酶作用,将非传统的氨基酸或其他分子与胆汁酸发生结合(酰胺化反应),从而形成MCBA。
两项新研究表明,BSH酶能够产生具有特定氨基酸序列和结合特异性的MCBA。MCBA主要在小肠产生,且BSH酶活性最高。研究表明MCBA能够通过PXR和FXR发出信号,从而影响人体代谢。
• 肠道菌群通过短链脂肪酸等酯化胆汁酸可能降低毒性
胃肠道细菌能够通过醇类、短链脂肪酸和长链脂肪酸酯化胆汁酸。据报道,乳酸杆菌、真杆菌和拟杆菌相关的胆汁酸酯化过程依赖于乙醇的添加。细菌还能产生胆汁酸脂肪酸酯,其中长链脂肪酸(如C16和C18脂肪酸)以及短链脂肪酸(如乙酸盐)与异脱氧胆酸和异石胆酸的C3位点相连。
有研究描述了DCA(脱氧胆酸)分子的C24羧基与另一个DCA分子的3α-羟基通过低聚反应形成聚酯链。这些反应被认为是一种降低排泄物中疏水性次级胆汁酸以及有毒脂肪酸和醇浓度的解毒策略。
需要注意的是,粪便样本中的胆汁酸酯测量相对较少。健康人粪便样本的比较分析显示,总胆汁酸(主要是异DCA和异LCA)的10%至30%形成了酯化物。
因此,在设计粪便胆汁酸提取方案以解决特定临床和研究问题时,考虑细菌胆汁酸结合物的多样性和数量是至关重要的。目前,方法学的进步使得我们能够鉴定新的胆汁酸代谢产物,发现新的胆汁酸代谢酶,并通过靶向微生物菌株和生化途径来改变胆汁酸代谢。
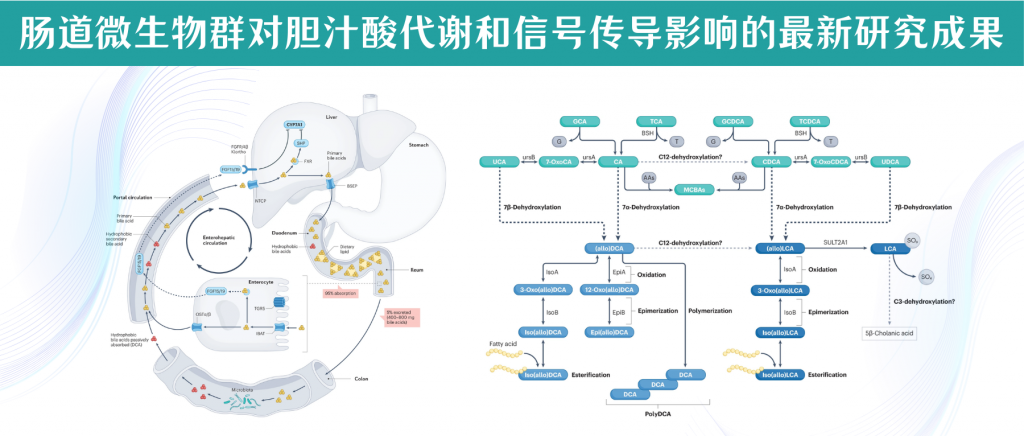
历史上,初级胆汁酸被定义为含有7α-羟基的胆汁酸,而去除7α-羟基的过程产生的胆汁酸则被定义为次级胆汁酸。如今,次级胆汁酸被认为是宿主初级胆汁酸经过微生物反应产生的产物,这包括通过微生物氧化、差向异构化和脱羟基等过程的产物。胆汁酸结构的多样性反映了胃肠道中分布广泛的细菌和古菌门中存在多种酶途径。
• 过高疏水性次级胆汁酸与胃肠道癌症和结石相关
研究表明,过高的疏水性次级胆汁酸水平与胃肠道癌症和胆固醇结石的形成有关。因此,识别出负责产生脱氧胆酸和石胆酸的肠道细菌,了解这些转化过程中产生的胆汁酸中间体,以及鉴定催化这些生物转化的酶基因和每种反应的催化机制对于解释微生物组数据和设计预防或治疗疾病的胆汁酸代谢组干预措施至关重要。
据报道,bai操纵子在体内和体外都能催化胆酸转化为脱氧胆酸。人类粪便样本中bai基因的测量现在正成为炎症性肠病和抗生素治疗中胆汁酸失调或胃肠道癌症中胆汁酸过量的标记。
• 胆汁酸的水平可以反映出一些疾病
与胃肠道癌症密切相关的疏水性次级胆汁酸(如脱氧胆酸和石胆酸)在宿主免疫功能、血清素产生、细胞信号传递、预防艰难梭菌定植、营养吸收以及抵抗肠道病毒感染方面发挥着重要生理作用。
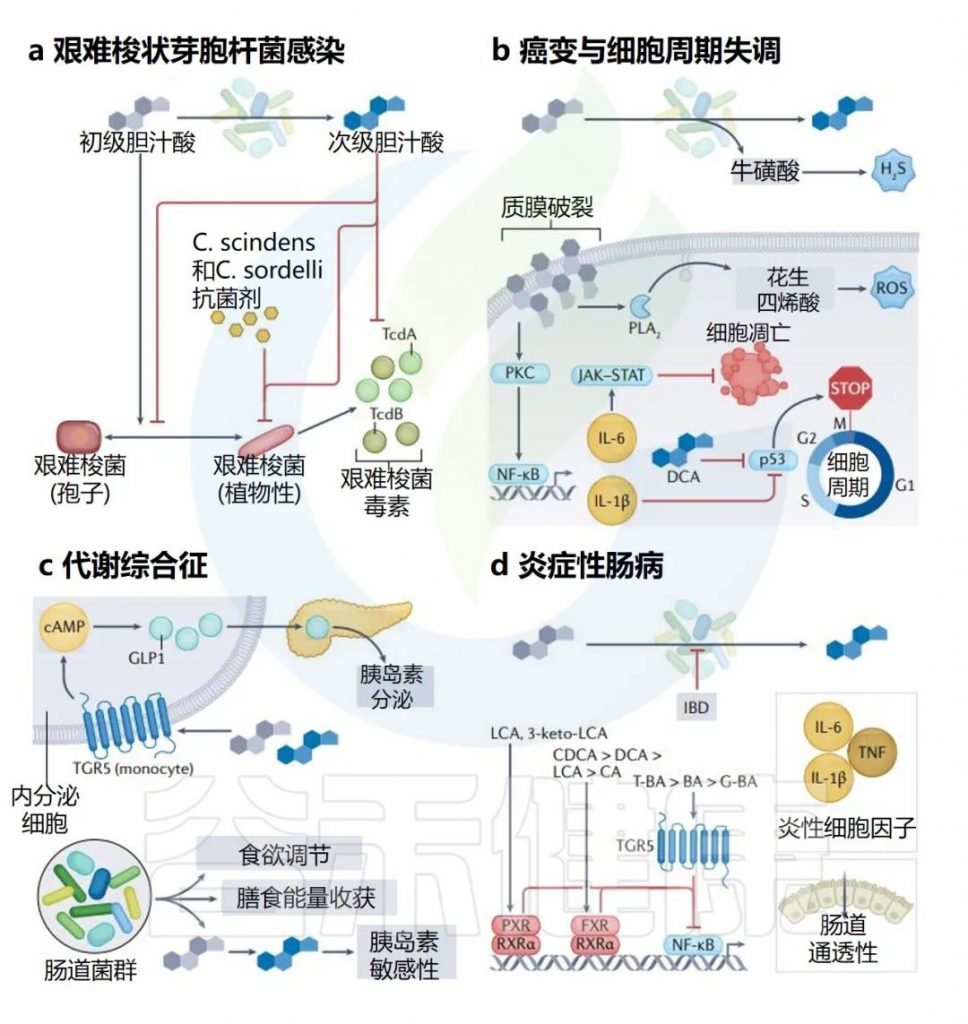
Collins SL,et al.Nat Rev Microbiol.2023
通过采用低动物蛋白和脂肪、高复合碳水化合物和纤维的饮食,可以降低肠道胆汁酸水平,保持疏水性胆汁酸的益处,同时减少因粪便中胆汁酸水平升高和脱氧胆酸富集而带来的风险。
与同龄健康人相比,肝硬化患者的胆汁酸库显著减少,7α-脱羟基胆汁酸生成细菌的丰度降低,粪便中脱氧胆酸和石胆酸含量减少,伴随有以毒性革兰氏阴性菌为特征的微生态失调。而肝硬化患者接受肝移植后,观察到胆汁酸分泌增加、粪便中次级胆汁酸含量上升、肠道微生物多样性提高和全身炎症减轻。
• 通过调节肠道菌群改善次级胆汁酸水平
粪便微生物群移植能恢复认知功能,改善炎症状况,与此同时,粪便中脱氧胆酸和石胆酸含量增加,伴随着与次级胆汁酸形成相关的革兰氏阳性菌数量增加。
此外观察到预后不佳的患者血清和粪便中次级胆汁酸水平显著降低,与次级胆汁酸生成相关的细菌基因数量减少,这些发现突显了维持疏水性次级胆汁酸和肝肠轴平衡的重要性。
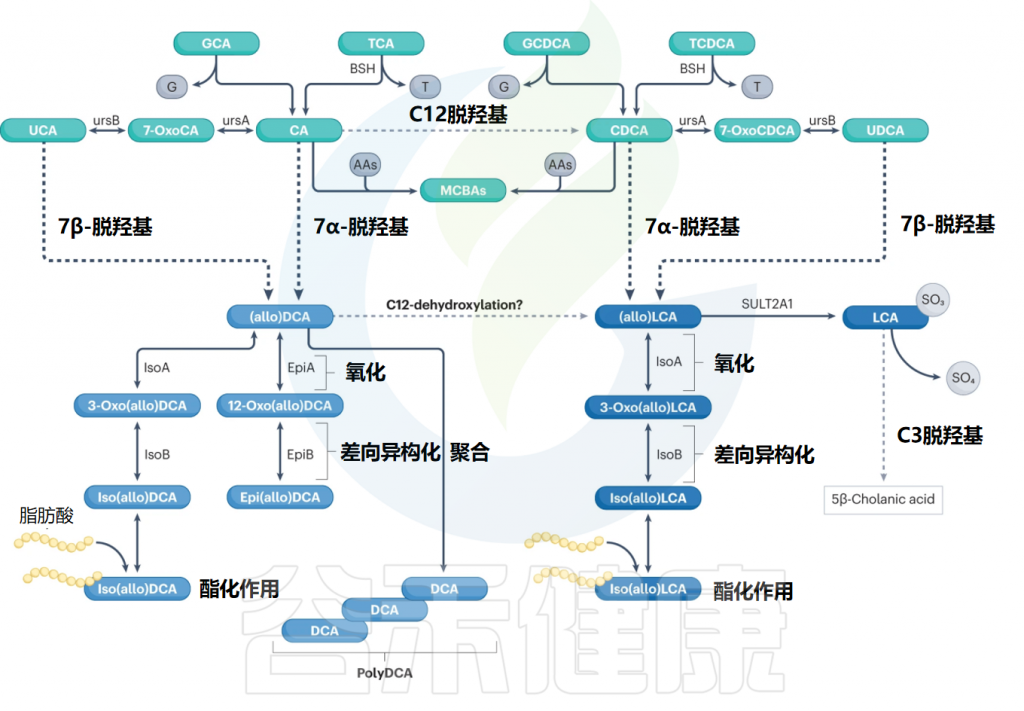
人体肠道中胆汁酸的生物转化
Ridlon JM,et al.Nat Rev Gastroenterol Hepatol.2024
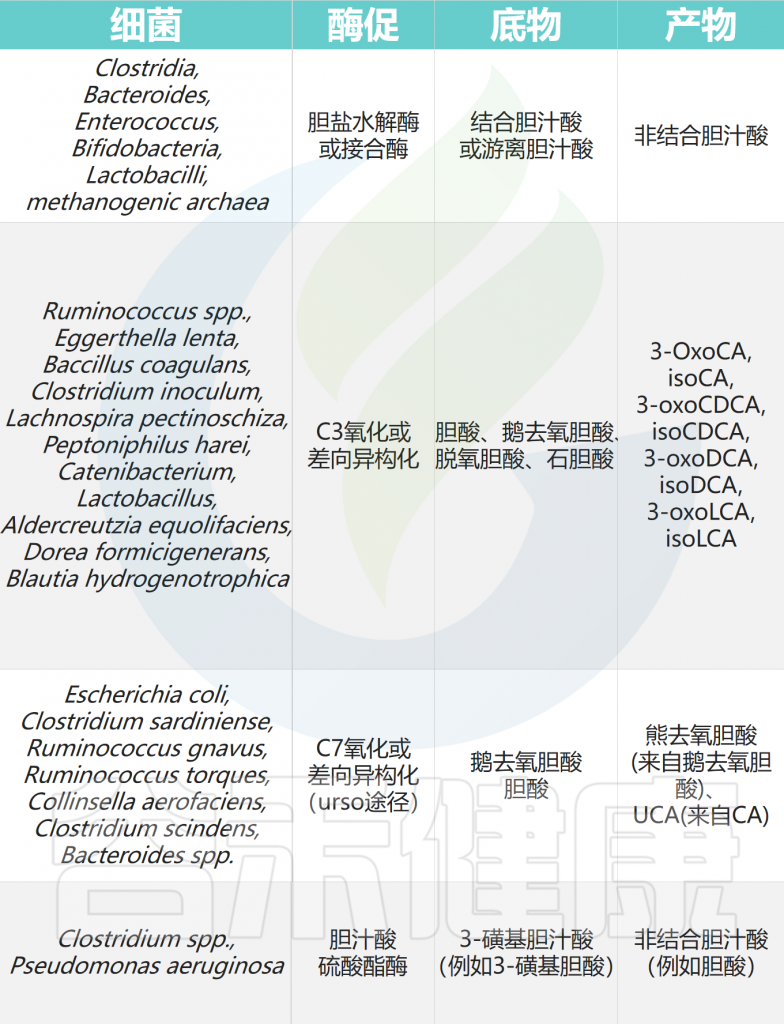
人类结肠中参与胆汁酸代谢的细菌类群
Ridlon JM,et al.Nat Rev Gastroenterol Hepatol.2024
重点:靶向微生物群-胆汁酸相互作用
作为胃肠和代谢疾病的潜在治疗方法
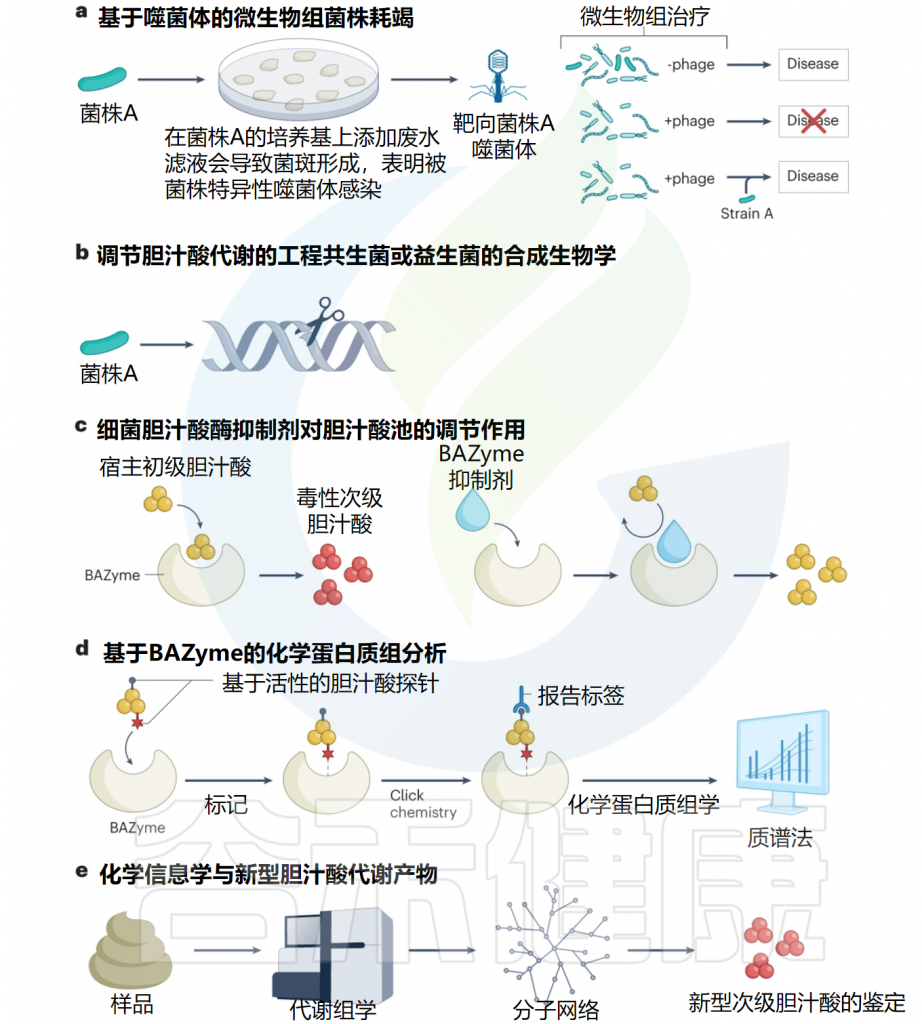
编辑
a.研究表明,选择细菌菌株依赖性噬菌体来去除在炎症性肠病等疾病中起因果作用的微生物菌株具有潜在的实用性。
b.合成生物学提供了合理设计共生菌或益生菌以调节活体胆汁酸代谢的潜力。
c.针对微生物组的特异性抑制剂的开发有望提供治疗潜力。胆汁盐水解酶(BSH)酶抑制剂的开发使人们能够探究改变胆汁酸代谢的影响。
d.使用化学胆汁酸探针的化学蛋白质组分析允许发现参与胆汁酸代谢的新型细菌酶。在胆汁酸探针与胆汁酸结合酶(BAZyme)共价结合后,蛋白质组学质谱法可以鉴定候选基因序列。
e.化学信息学将代谢组学与计算相结合,以获得代谢网络,其中一些节点代表揭示先前未知细菌代谢的新代谢产物。
胆汁酸羟基的氧化和差向异构化显著增加了胆汁酸代谢产物的多样性。早期研究发现,E.lenta、Blautia producta、Clostridium absonum、产气荚膜梭菌、副腐败梭菌、大肠杆菌、脆弱拟杆菌和瘤胃球菌等物种能够氧化和还原胆汁酸,这对于鉴定和表征编码这些酶的HSD基因至关重要。
这些过程涉及羟基在三个稳定位置(例如3α-OH、3-3-oxo氧代和3β-OH)之间的转换,由特异性和立体特异性的吡啶核苷酸依赖性HSDH酶催化。
•胆汁酸的异构化对代谢和免疫至关重要
含氧胆汁酸和胆汁酸差向异构体对生理具有重要影响。例如,7-OxoCDCA能够竞争性抑制肝脏11β-HSD2,影响糖皮质激素代谢。
研究还发现,破坏11β-羟基类固醇脱氢酶1(11β-HSD1)亚型的活性可增加饮食中普雷沃氏菌(Prevotellaceae)和西方饮食中拟杆菌(Bacteroidaceae)的相对丰度。
次级含氧胆汁酸如3-oxoLCA能够抑制胃肠道中辅助T细胞17的发育。胆汁酸和其衍生物的差向异构化,如鹅去氧胆酸和胆酸的可逆氧化及差向异构化,产生了熊去氧胆酸。熊去氧胆酸因其在治疗胆道和胃肠道疾病中的应用而具有悠久历史,是治疗原发性硬化胆管炎的一种疗法。
长期以来,次级胆汁酸与慢性炎症相关的胃肠疾病有关,包括炎症性肠病和结肠直肠癌,大量文献提供了与多种作用机制一致的数据,包括直接细胞毒性、直接DNA损伤、与NF-κB活化相关的炎症、活性氧诱导导致的细胞氧化还原平衡扰动以及通过激活各种细胞周期和炎症信号通路增强的细胞增殖。
一般认为,这些作用在不同程度上反映了次级胆汁酸的疏水性,导致宿主细胞的膜损伤,以及它们通过与细胞表面和核受体的相互作用激活许多细胞信号级联。还有大量报道称次级胆汁酸在离体和体外系统中发挥抗炎和免疫抑制反应。
“
通过微生物和宿主细胞控制次级胆汁酸的代谢可能是防止局部炎症的一种方式
如前所述,现在很清楚的是,通过多种酶促途径,肠道微生物群能够产生高度多样化的次级胆汁酸代谢组,由于分析技术不完善和缺乏次级胆汁酸含量较低的化学标准,很少对其衍生物进行测量。
正是这种多样的次级胆汁酸代谢组整体上可能有助于设定结肠中的炎症张力和肿瘤细胞生长的调节。需要更多的工作和新的组织和细胞工程方法来更完整和准确地了解次级胆汁酸代谢组如何促进局部炎症和生长控制。有了这些新知识,就有可能确定一系列无害的方法,通过微生物和宿主细胞来控制次级胆汁酸的共代谢,以防止局部炎症或恢复正常生长控制。
尽管如此,通过使用一种无菌小鼠,微生物工程和各种基于组学的方法,一些以前被忽视的胆汁酸衍生物的贡献正在出现新的见解,这些衍生物似乎可以调节致病性TH17炎症和具有抗炎特性的Treg细胞之间的平衡;简要总结如下。
“
石胆酸的衍生物对T细胞具有关键调节作用
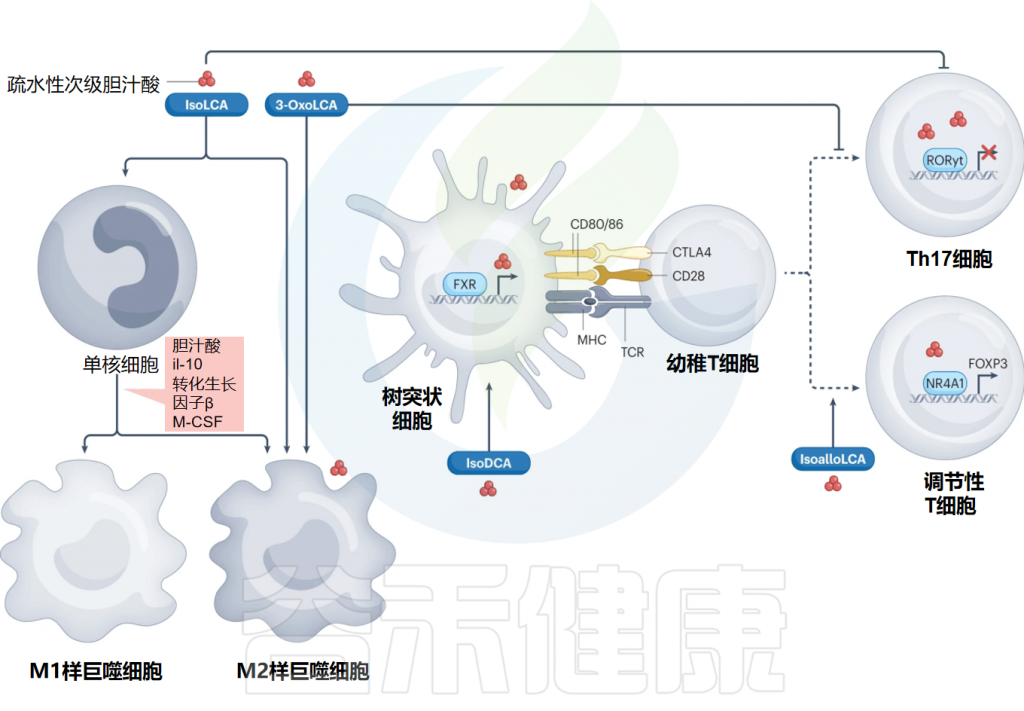
研究通过在TH17细胞或Treg细胞分化条件下的体外试验中筛选30种初级和次级胆汁酸代谢产物的文库,发现了两种LCA衍生物——3-oxoLCA和isoalloLCA——对小鼠原始CD4+T细胞分化具有关键调节作用。
具体来说,3-oxoLCA能够抑制TH17细胞的分化,表现为IL-17a表达的减少,而异alloLCA则增强了Treg细胞的诱导,表现为FOXP3表达的增加。
FOXP3是一种调节性T细胞特异性转录因子,主要在调节性T细胞中表达,被认为是调节性T细胞的主要标志物之一。
进一步的研究表明,3-oxoLCA通过直接与关键转录因子视黄酸受体相关孤儿受体γt(RORγt)结合来抑制TH17细胞的分化,而异alloLCA则通过增强线粒体活性氧的产生来促进Treg细胞的分化,进而增加FOXP3的表达。
“
其他次级胆汁酸对TH17细胞和Treg细胞的调节作用
之前的研究已经表明,多种氧化甾醇能够与RORγt转录因子相互作用,这为3-oxoLCA通过直接与RORγt结合来抑制TH17细胞分化提供了先例。与此同时发布的其他研究进一步强调了次级胆汁酸在调节TH17细胞和Treg细胞分化中的重要作用。
研究发现石胆酸(LCA)和3-oxoLCA通过与核受体VDR相互作用调节表达RORγ+的FOXP3+Treg细胞的证据。通过筛选在小鼠和人类中发现的主要去偶联胆汁酸在体外提高Foxp3诱导能力的研究中,还发现异DCA(脱氧胆酸)通过降低树突状细胞的免疫刺激特性,从而增加Foxp3的诱导。
异DCA增强Treg细胞的生成依赖于树突状细胞中FXR的表达,这为异DCA与FXR在髓系细胞中相互作用的参与提供了证据,并可能有助于在小鼠肠道中诱导外周的Treg细胞。
次级胆汁酸异等位LCA通过与核激素受体NR4A1相互作用增强Treg细胞的分化,激活了Foxp3基因的转录,并在肠道拟杆菌门中鉴定了一个生物合成基因簇,该基因簇将3-oxoLCA转化为异等位。
通过分析HMP2 IBDMDB队列中132名参与者(包括克罗恩病、溃疡性结肠炎患者及对照组)的粪便样本的代谢组学和宏基因组图谱,发现炎症性肠病患者中异alloLCA及其生物合成基因显著减少。
值得注意的是,在HMP2队列的代谢组学数据中,与对照组相比,克罗恩病和溃疡性结肠炎患者中异alloLCA的倍数变化是所有已鉴定胆汁酸中最大的。
次级胆汁酸衍生物对炎症和免疫细胞分化及功能的调节
Ridlon JM,et al.Nat Rev Gastroenterol Hepatol.2024
小结
数据揭示了特定次级胆汁酸衍生物对巨噬细胞前体的分化、树突状细胞的抗原呈递能力以及CD4+T细胞早期分化过程有着不同的作用,这对胃肠道炎症的调节产生影响。
简而言之,异石胆酸(isoLCA)和3-oxoLCA影响巨噬细胞的极化状态,异脱氧胆酸(isoDCA)通过诱导树突细胞中FOXP3的表达来减弱其免疫激活特性,平面型异石胆酸通过与核激素受体NR4A1相互作用促进调节性T细胞(Treg)的分化,激活FOXP3基因的转录,而3-oxoLCA则抑制辅助性T细胞17的分化。
因此,多项研究证明了次级胆汁酸衍生物通过调节TH17细胞和Treg细胞之间的平衡,有效地影响肠道的炎症状态。
本文讲述了有关肠道微生物群对胆汁酸代谢和信号传导影响的最新研究进展,包括胆汁酸的水解、氧化、差向异构化以及C3脱羟基作用等。还介绍了异二级胆汁酸和三级胆汁酸等特殊胆汁酸的产生方式和作用。
特别强调了这些微生物修饰的胆汁素代谢产物与人类健康及疾病之间的联系,尤其是在免疫功能方面。考虑到胆汁酸在调节葡萄糖、脂质和能量代谢中的作用,它们可能成为肠道微生物群与代谢疾病之间联系的基础,包括肥胖、糖尿病和代谢功能障碍相关的脂肪性肝病。
了解肠道微生物对胆汁酸的多重作用,所获得的知识将推动基于微生物组的新干预措施的发展,通过调控胆汁酸库,以预防和治疗胃肠道疾病甚至是更多人类疾病。
主要参考文献
Ridlon JM, Gaskins HR. Another renaissance for bile acid gastrointestinal microbiology. Nat Rev Gastroenterol Hepatol. 2024 Feb 21.
Rimal B, Collins SL, Tanes CE, Rocha ER, Granda MA, Solanki S, Hoque NJ, Gentry EC, Koo I, Reilly ER, Hao F, Paudel D, Singh V, Yan T, Kim MS, Bittinger K, Zackular JP, Krausz KW, Desai D, Amin S, Coleman JP, Shah YM, Bisanz JE, Gonzalez FJ, Vanden Heuvel JP, Wu GD, Zemel BS, Dorrestein PC, Weinert EE, Patterson AD. Bile salt hydrolase catalyses formation of amine-conjugated bile acids. Nature. 2024 Feb;626(8000):859-863.
Mancin L, Wu GD, Paoli A. Gut microbiota-bile acid-skeletal muscle axis: (Trends in Microbiology, corrected proof). Trends Microbiol. 2023 Mar;31(3):322.
Garcia M, Thirouard L, Sedès L, Monrose M, Holota H, Caira F, Volle DH, Beaudoin C. Nuclear Receptor Metabolism of Bile Acids and Xenobiotics: A Coordinated Detoxification System with Impact on Health and Diseases. Int J Mol Sci. 2018 Nov 17;19(11):3630.
Pushpass RG, Alzoufairi S, Jackson KG, Lovegrove JA. Circulating bile acids as a link between the gut microbiota and cardiovascular health: impact of prebiotics, probiotics and polyphenol-rich foods. Nutr Res Rev. 2022 Dec;35(2):161-180.
Frisch K, Alstrup AKO. On the Evolution of Bile Salts and the Farnesoid X Receptor in Vertebrates. Physiol Biochem Zool. 2018 Mar/Apr;91(2):797-813.
Cai J, Sun L, Gonzalez FJ. Gut microbiota-derived bile acids in intestinal immunity, inflammation, and tumorigenesis. Cell Host Microbe. 2022 Mar 9;30(3):289-300.