-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
肌醇(Inositol,i-Inositol或myo-Inositol)
肌醇,它不仅是构成细胞膜的基础材料,更是一个连接新陈代谢、细胞信号和肠道微生态的核心枢纽。在其九种立体异构体中,主要以其特定形式(myo-inositol)参与广泛的生理过程,包括构成细胞膜磷脂、介导胰岛素信号、调节渗透压、基因表达等。
近年来,研究人员发现,肌醇代谢的紊乱正日益被视为多种疾病的促成因素,如代谢综合征、2型糖尿病、多囊卵巢综合征、神经退行性疾病如阿尔茨海默病乃至皮肤健康。
近期证据同时凸显,肠道菌群在塑造肌醇的生物可利用性和生物转化中扮演着决定性角色。有益的共生菌群(如Anaerostipes)能将膳食肌醇转化为促进健康的短链脂肪酸,而与肥胖相关的微生物则会过度降解肌醇,从而促进脂质吸收和脂肪堆积。
本文将一起整理讨论关于肌醇的以下方面知识:
1)肌醇:从化学结构到生理功能
2)肌醇缺乏或过量的影响
3)调控其合成、分解代谢与利用的机制
4)肌醇与肠道菌群的相互作用
5)影响肌醇代谢的因素
6)肌醇与代谢性疾病
7)肌醇与神经精神健康
8)肌醇与皮肤健康
9)诊断指标与临床相关性
10)恢复代谢稳态的循证营养与治疗策略
注:肌醇(Inositol) 是一个总称,它有多种异构体(分子式相同但结构不同)。
肌醇(myo-inositol) 是这些异构体中最常见、在自然界中分布最广、生物活性也最重要的一种形式。我们通常所说的“肌醇”,在文中没有特别指明的情况下,往往就是指这种形式。
游离myo-Ins 就是指不与其他分子结合、以独立形态存在的肌醇。
关于肌醇的研究发展
在过去二十年里,我们对肌醇的认识发生了深刻的转变。肌醇已从一个仅仅被视为“类维生素”的化合物,转变为一个深度参与葡萄糖和脂质调节的多功能信号分子。尽管有时被称为“维生素B8”,但肌醇并非必需维生素,因为人体自身就能以葡萄糖为原料(通过葡萄糖-6-磷酸经肌醇-3-磷酸合酶催化),实现内源性合成。
肌醇的重要性体现在其作为细胞信号的核心角色上。肌醇及其立体异构体D-手性肌醇(D-chiro-inositol, DCI)一起,充当着响应胰岛素的“第二信使”,负责传达葡萄糖摄取、糖原合成和脂肪代谢等关键指令。持续的研究发现,在糖尿病和胰岛素抵抗的状态下,这两种信使水平会显著下降。
与此同时,一个更前沿的发现是,肠道菌群对我们体内的肌醇水平有着深刻影响。肠道菌群不仅通过代谢膳食肌醇,还能将其转化为短链脂肪酸(SCFAs)。因此,理解肌醇、宿主代谢、肠道微生物群之间的这种三方互动,为个体化营养和精准医学提供了全新的视角。
肌醇的化学性质与合成
结构与立体化学
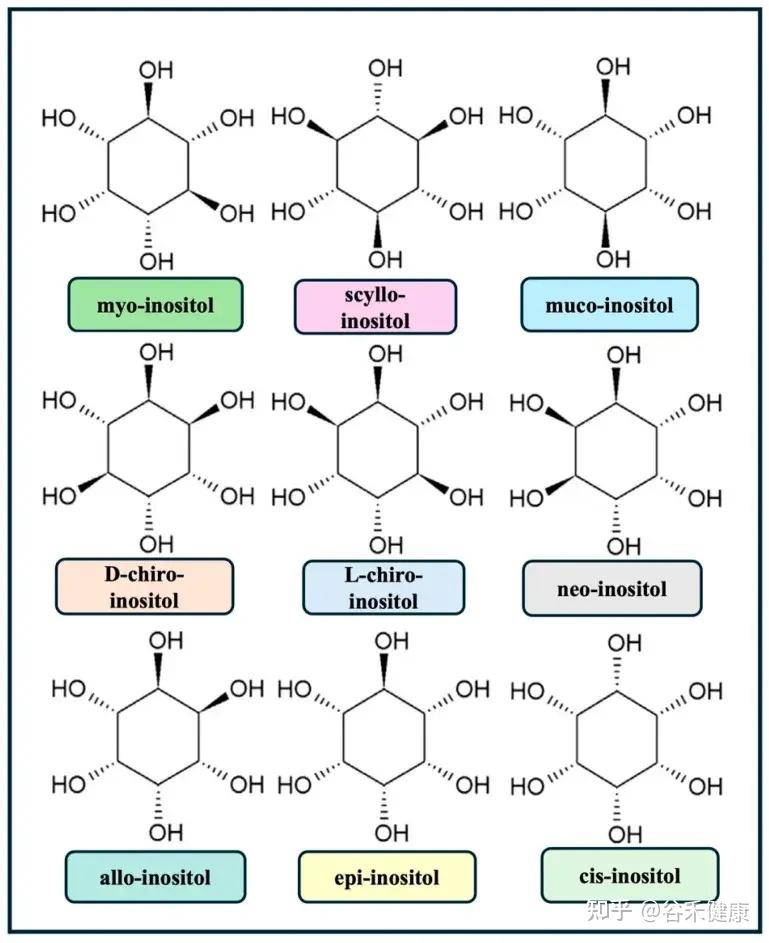
肌醇是一种结构类似于葡萄糖的天然多羟基环己六醇(C₆H₁₂O₆),形成一个稳定的六元环,每个碳原子上均带有一个羟基。
正是这些羟基在空间中朝向的不同,造就了肌醇的多种立体异构体。在其九种可能的立体异构体中,肌醇(myo-inositol)在哺乳动物组织中占比超过99%。每一种异构体都因其独特的空间结构,而具备了不同的生化活性和信号传导能力。
肌醇九种异构体的结构
生物合成途径
人体能够自行合成肌醇,内源性生物合成主要发生在肾脏、肝脏和大脑,这个过程始于我们最熟悉的能量物质——葡萄糖,通过一个两步酶促转化过程完成:
该途径受到葡萄糖可利用性、胰岛素水平和渗透压应激的严密调控,确保按需生产。
膳食来源
肌醇以游离myo‑Ins 和其结合形式植酸(肌醇六磷酸, IP6)两种形式存在,后者在以下食物中含量丰富:
加工过程(如浸泡、发酵)会显著影响其生物可及性,因为植酸酶能将植酸降解为可吸收的形式。
肌醇的生理功能
肌醇:细胞信号转导
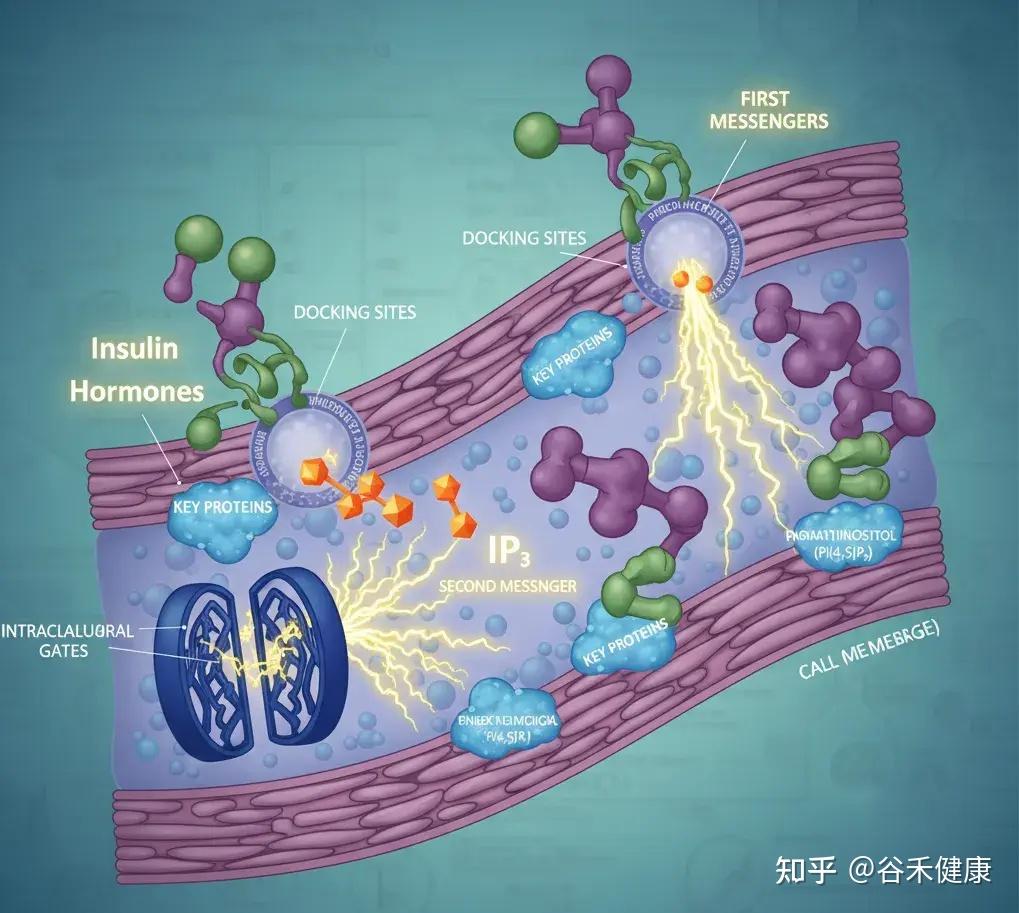
肌醇是细胞信号传导通路中的关键一环。在细胞膜上,它的衍生物磷脂酰肌醇(如 PI(4,5)P₂)就像是为关键蛋白预留的停靠位点。
当胰岛素或激素(第一信使)敲响细胞的大门时,它自己不进去,而是派 IP₃(第二信使)在细胞内部跑腿传达命令。IP₃ 的一个重要任务就是去打开钙离子的阀门,而钙离子就像是启动细胞各种功能的电火花。
如果这个信号系统失灵会出现胰岛素抵抗,也就是说你吃了东西,胰岛素(第一信使)发出了指令,但细胞内部(第二信使)没反应过来,导致血糖降不下去,人会饭后特别困、容易饿、精力不济,并且脂肪更容易堆积。
渗透压调节:细胞的脱水危机与肌醇的救援
为了回收水分,我们的肾脏会创造一个盐分极高的“高渗环境”,普通细胞在这种环境下会像腌菜一样脱水。
肌醇(Myo-Ins)此时便作为一种有机渗透调节物,被 SMIT1 等转运蛋白大量泵入肾脏细胞内,提升细胞内部浓度,以对抗外界的高渗应激。这相当于给细胞喝足了保护液,防止其在极端环境下功能失常。
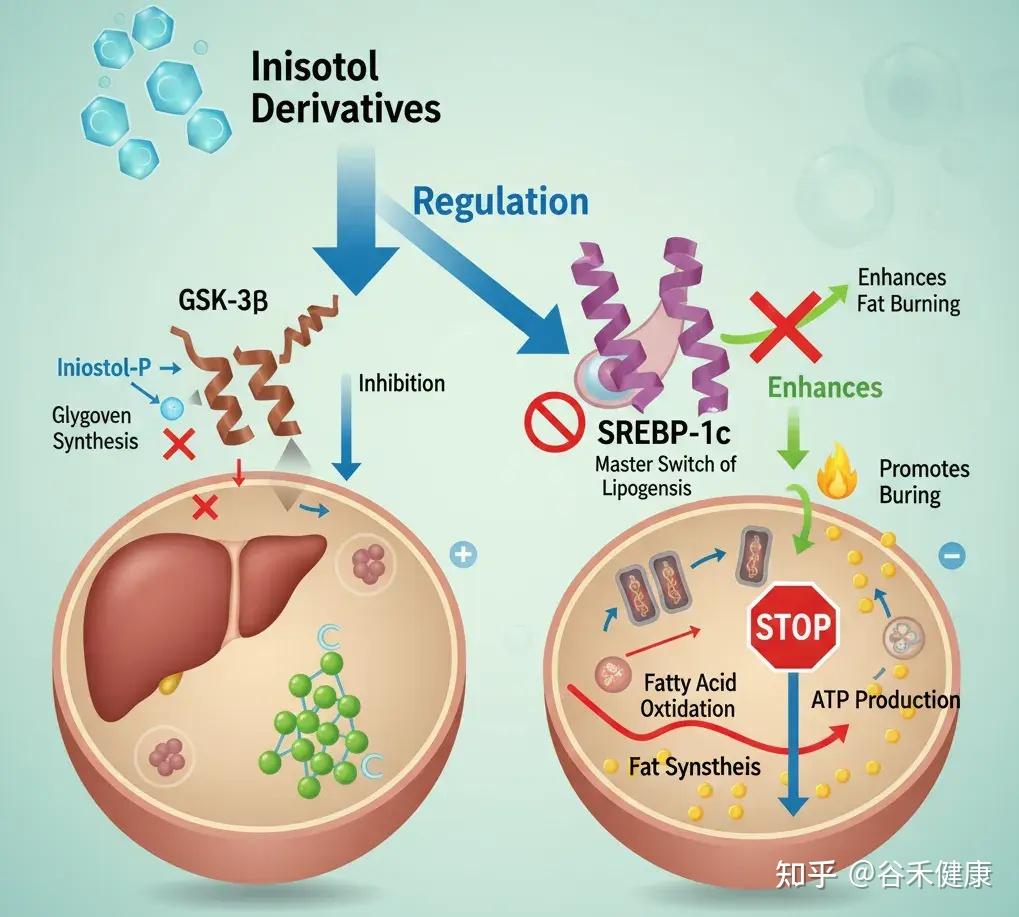
肌醇与脂肪肝:从源头阻断脂肪堆积
肌醇衍生物能精准调控肝脏和脂肪细胞内的关键酶,如糖原合酶激酶-3β(GSK-3β)和固醇调节元件结合蛋白-1c(SREBP-1c)。
例如,它能抑制 SREBP-1c 这个脂肪生成总开关的活性。当 SREBP-1c 过于活跃时,肝脏就会不停地合成脂肪。同时,肌醇还能增强脂肪酸氧化,也就是促进脂肪的燃烧。
当这个开关失控时,SREBP-1c 持续开启,会导致肝脏甘油三酯堆积,在体检报告上就表现为非酒精性脂肪肝。反映在体型上,就是腹部脂肪顽固、向心性肥胖。
肌醇:备孕路上的好助手
在女性体内,myo-肌醇调节卵泡刺激素(FSH),确保卵巢能准确接收指令,促进卵母细胞的正常成熟,这解释了为何补充肌醇能有效改善多囊患者的排卵状况和月经周期。
肌醇在男性精浆中的浓度非常高,它对精子的正常生理功能起着关键作用。补充肌醇,特别是肌醇(Myo-inositol),已被证明可以显著改善精子的活力、数量和形态。主要通过增强线粒体功能、提供能量和抗氧化作用。这使肌醇成为治疗男性不育的有效营养方案。
肌醇:如何稳定你的情绪?
在中枢神经系统中,肌醇衍生物参与磷脂酰肌醇循环,这与血清素受体活性、情绪稳定和神经保护有关。血清素是决定我们情绪的“快乐激素”。如果这个循环不畅,大脑就无法有效利用血清素,就会出现情绪波动大、容易焦虑、烦躁或感到莫名的情绪低落等问题。
平衡总是一体两面的。如果说缺乏肌醇会打破身体的稳定,那么,过量的肌醇就一定更好吗?接下来,我们就将深入探讨肌醇在体内的失衡状态——即缺乏与过量,分别会带来怎样的病理生理学后果。
缺乏机制
肌醇耗竭的产生途径包括:
临床表现
虽然不存在“经典的肌醇缺乏症”,但经验证据表明,组织中myo‑Ins水平低下与以下情况有关:
潜在毒性与过量
高达每日12克的剂量通常是安全的,仅有轻微的胃肠道不适报告。
当口服补充剂量很大时(通常指每日超过12克),肌醇可能无法被小肠完全吸收。未被吸收的肌醇在肠道内会产生渗透效应,像吸水海绵一样将水分吸入肠腔,从而导致轻微的胃肠道不适,如腹胀、排气和腹泻。
极高浓度可能扰乱渗透压平衡,尤其是在肾功能不全的患者中。
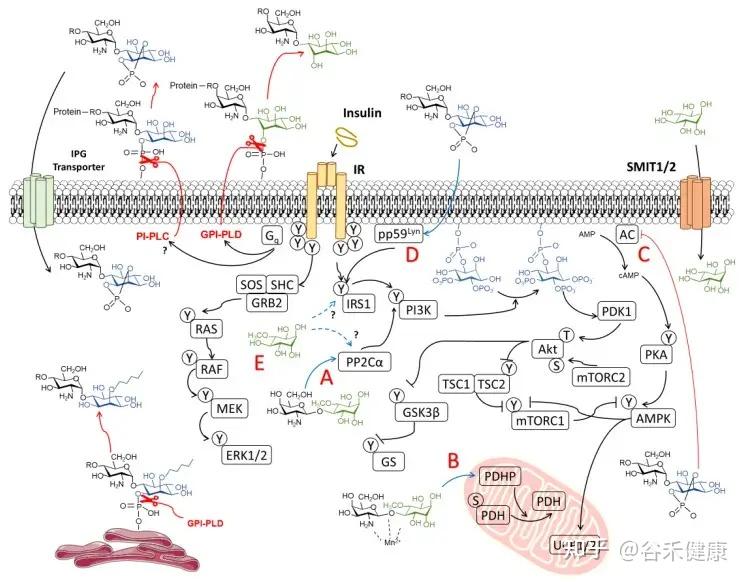
肌醇在人体内的转化与胰岛素信号
这里要介绍肌醇的两种异构体形式:
肌醇(Myo-Ins)和D-手性肌醇(DCI)。
生理转化(Myo ➜ DCI)
Myo‑Ins通过一种胰岛素依赖性的表异构酶(epimerase)转化为D-手性肌醇(DCI)。
myo/DCI的比例在不同组织中有所不同,例如:
这种差异化分布支持了组织特异性的胰岛素作用。
然而,在胰岛素抵抗的病理状态下,如在糖尿病和多囊卵巢综合征(PCOS)中,这种转化机制会受损。
胰岛素抵抗中的失衡
表异构酶活性的不足,导致myo‑Ins耗竭和DCI生成不足,损害了糖原合成和细胞葡萄糖摄取。
研究表明,补充肌醇(myo‑Ins)能有效恢复两种异构体的平衡,而单独补充DCI,则可能破坏生理比例,反而达不到理想的治疗效果。
肌醇在胰岛素信号传导中的作用机制
肠道菌群对肌醇的降解:诱发肥胖的关键机制
肠道菌群:肌醇代谢的隐形参与者
新兴证据正在引领我们对宿主-微生物协同代谢的理解。肠道菌群可以直接代谢膳食myo-肌醇,从而影响宿主的能量平衡。
Anaerostipes属等菌种能将肌醇转化为丙酸和乙酸,这两种主要的短链脂肪酸参与抑制肝脏糖异生和改善胰岛素敏感性。
相反,与肥胖相关的菌种(例如,高脂饮食下富集的某些厚壁菌门成员)表现出降解肌醇的活性,耗尽肠腔内的myo-Ins,并增强肠道对脂质的吸收。
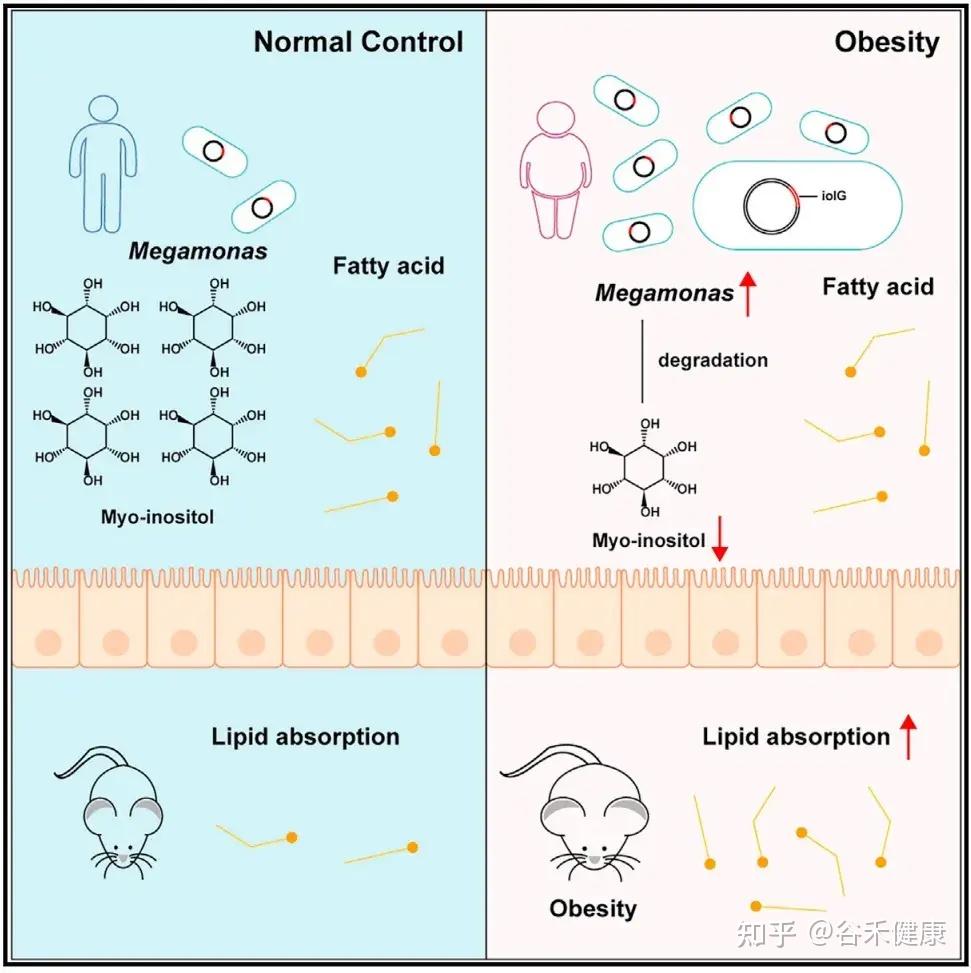
肌醇缺乏,如何导致肥胖?
最新研究揭示了一个事实:肠道微生物可以降解肌醇,而这种降解与肥胖密切相关。
研究人员在肥胖人群中发现了一种名为Megamonas rupellensis(巨单胞菌代表物种)的细菌显著富集。这种细菌具有强大的肌醇降解能力,其降解途径(PWY-7237)及相关基因(iolG、iolI、iolE、iolD、iolB)在肥胖个体中丰度和表达水平均显著升高。
肌醇的抗肥胖作用
在正常情况下,肌醇能够通过下调几个基因表达,有效抑制小肠对脂肪的吸收。
肌醇下调的是三个关键脂肪酸转运蛋白基因:
菌群降解肌醇的后果
当M. rupellensis 定植在小鼠肠道后,它会大量消耗肌醇,导致肠道内的myo-肌醇水平几乎耗尽。这直接削弱了肌醇抑制脂肪吸收的功能,最终引发一系列肥胖表型:肠道脂质吸收增加、体重与脂肪增加、肝脏脂肪堆积以及血糖升高等。
研究人员进一步进行了一项巧妙的实验:
仅将肌醇降解的第一个关键酶基因(iolG)转入原本不能降解肌醇的大肠杆菌中,就足以复现上述肥胖现象:体重增加、脂肪组织增多、肝脏脂肪堆积。这证明了:
肌醇降解本身(而非其他细菌因素),是导致肥胖的直接原因。
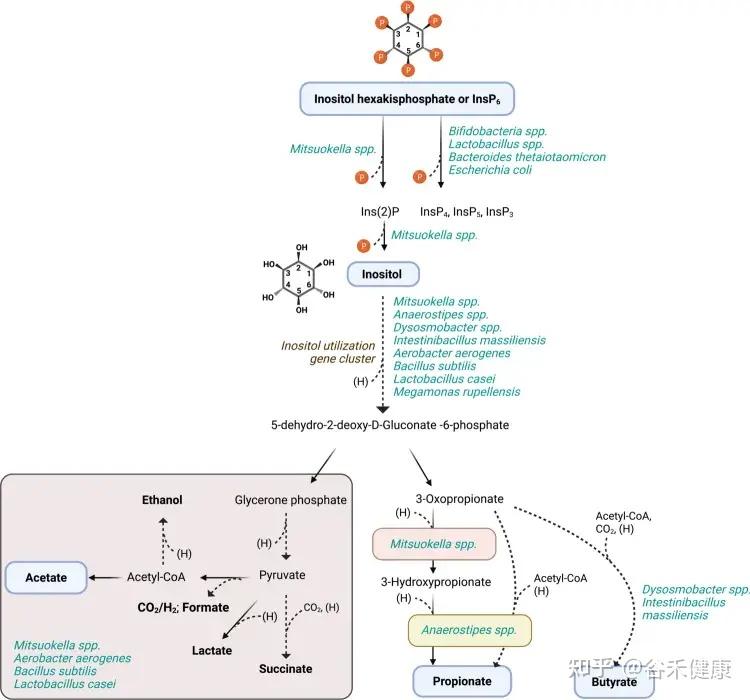
人体肠道内微生物肌醇及植酸降解推导途径
肠道菌群的另一面:合成有益的肌醇脂质
并非所有细菌都是反派。一些共生菌,特别是拟杆菌属,实际上能利用肌醇来合成对自身和宿主都有益的——肌醇脂质。
例如,人类肠道中的常驻菌多形拟杆菌(Bacteroides thetaiotaomicron)拥有完整的肌醇脂质合成基因簇。这些脂质能够帮助细菌抵抗宿主的抗菌肽,从而更好地在肠道中定植。
这体现在功能保护和结构支撑两方面:
然而,这个过程的影响远不止于细菌自身。研究发现,一旦细菌失去合成肌醇脂质的能力,会直接扰乱宿主的基因表达,特别是那些与碳水化合物降解和能量合成相关的关键代谢通路,这表明菌群的这一行为与宿主的能量平衡息息相关。
更重要的是,这背后还隐藏着一个精巧的生态循环系统。
我们摄入的食物中含有植酸(比如小麦、糙米、藜麦、玉米、花生、大豆、芝麻等),肠道中广泛存在的植酸酶,可以降解食物中的植酸,释放出肌醇。这些被释放的肌醇并不会被浪费,随后可被拟杆菌等细菌重新利用,作为原料去合成上述的肌醇脂质。
这一发现具有重要的临床意义:
不仅揭示了这种有益的合成能力在肠道菌群中远比我们想象的更为普遍,也展示了一个复杂的“宿主-微生物-肌醇”循环系统。
肌醇的降脂效果,要看肠道菌群的脸色
肌醇的代谢调控能力还体现在一个更宏观的战场上——直接对抗由现代不良饮食习惯(尤其是高糖饮食)引发的代谢紊乱。一个关键的动物研究,为我们深入揭示了肌醇是如何与我们的肠道菌群联手,共同调控肝脏脂肪代谢的。
高蔗糖饮食的影响
研究证实,高蔗糖饮食可触发一系列级联负面效应,涵盖肝脏代谢、基因转录及肠道微生态。
核心指标:肝脏甘油三酯水平显著升高(这是通往脂肪肝的快车道)。
伴随变化:肝脏总脂质、胆固醇含量及肝脏重量均呈现上升趋势,表明脂肪变性的发生。
上游通路激活:果糖代谢关键酶酮己糖激酶(KHK)与糖酵解关键酶丙酮酸激酶(PKLR)的表达被显著上调,为脂肪酸合成提供了充足的底物。
新生脂肪合成全面上调:涉及脂肪生成的全套关键基因表达均上调,包括:
核心转录因子激活:脂肪合成的主调控因子 SREBP1 与 ChREBP 的mRNA水平显著升高,从转录层面驱动了整个脂肪生成程序。
注:SREBP1(固醇调节元件结合蛋白1);
ChREBP(碳水化合物反应元件结合蛋白)。
肠道微生物组失调:
α-多样性显著降低:菌群的物种丰富度和系统发育多样性下降,生态系统稳定性减弱。
β-多样性显著变化:菌群的整体结构发生重组,偏离了健康状态。
特定菌属丰度改变:
削弱了有益菌(如Lactobacillus, Bifidobacterium),打击了负责肠道屏障的AKK菌,纵容了可能引发炎症或与代谢病相关的菌群(如 Desulfovibrio)的过度生长。
在这一片混乱中,肌醇的补充扮演了力挽狂澜的角色。
肌醇补充的干预效果
肌醇补充显著逆转了肝脏中甘油三酯和胆固醇的积累。
此作用具有选择性,因为肝脏的磷脂水平未发生变化,表明干预主要靶向异常的脂质沉积。
肌醇显著抑制了脂肪生成通路中的关键限速酶(尤其是FAS)的表达。
更重要的是,它显著降低了主转录因子 SREBP1 和 ChREBP 的mRNA水平,从源头上削弱了脂肪生成的转录驱动力。
同时,它减弱了糖酵解相关酶的上调趋势,减少了流向脂肪合成的碳水化合物底物。
肠道菌群:关键中介及潜在生物标志物
该研究最关键的发现之一,在于揭示了肌醇并非在孤军奋战,它的降脂效果,高度依赖肠道菌群这个关键盟友。
研究建立了一个重要的关联模型——乳杆菌属丰度的降低与拟杆菌属丰度的增加,这两项指标与血浆脂质升高及肝脏甘油三酯累积存在显著的正相关性。
这一结论提示,特定的肠道微生物特征可以作为评估宿主-微生物共代谢中肌醇代谢效率的有效生物标志物,为未来临床评估和干预提供了新的视角。
事实上,肌醇在体内的整个代谢网络,都受到一系列内在和外在因素的精密调控,任何一个环节的改变都可能影响其最终的生物学效应。接下来,我们将探讨哪些因素在影响着肌醇代谢。
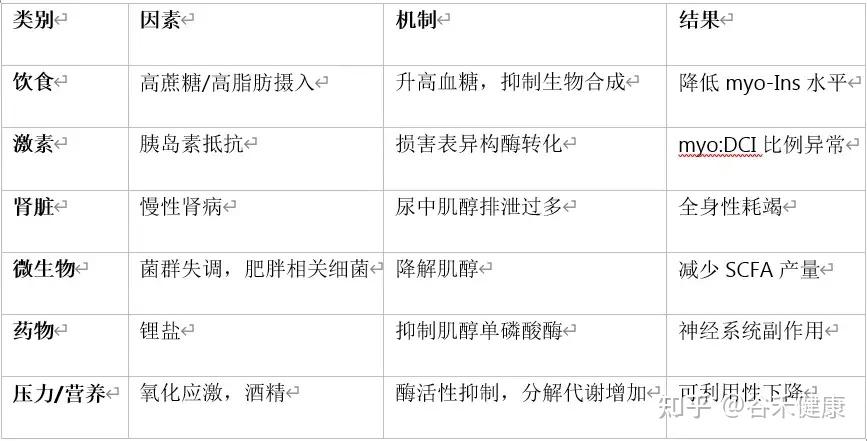
肌醇的体内平衡受多种因素调控,失衡会导致功能性缺乏。以下是五个主要影响因素:
高糖与高脂饮食
这是最核心的干扰因素,通过四种方式产生负面影响:
– 竞争抑制
葡萄糖与肌醇结构相似,当血糖水平过高时,葡萄糖会抢占细胞为肌醇准备的转运通道,导致细胞内的肌醇供应不足。
– 加速流失
高血糖导致糖尿时,会顺带让大量肌醇从尿液中流失,造成体内总量下降。
– 抑制合成
长期高糖饮食会抑制体内合成肌醇的关键酶活性,减少内源性供应。
– 扰乱菌群
高糖高脂环境促使肠道中有害菌增殖,这些菌会过度消耗肌醇,或阻止其向有益的短链脂肪酸转化。
胰岛素抵抗
胰岛素抵抗既是肌醇失衡的结果,也是其恶化的推手。
– 转化障碍
胰岛素信号失灵,身体将“基础版”的肌醇(myo-肌醇)转化为其重要异构体“D-手性肌醇”(DCI)的能力会下降,影响糖原合成等功能。
– 组织失衡
在某些组织(如卵巢)中,身体为了代偿胰岛素抵抗而分泌更多胰岛素,造成“高胰岛素血症”。这反而会过度消耗myo-肌醇,导致两种异构体比例失调,这也是多囊卵巢综合征(PCOS)的核心病理机制之一。
肠道菌群失调
肠道菌群扮演着“双刃剑”的角色。
有益菌:像 Anaerostipes 属的细菌,能将肌醇转化为丙酸、乙酸等有益的短链脂肪酸,帮助改善整体代谢。
有害菌:与肥胖相关的菌群则会直接吞噬肌醇,减少其在体内的可用量,并可能促进脂肪吸收,进一步加剧代谢问题。
肾脏功能障碍
肾脏是回收肌醇、防止其流失的关键器官。在健康状态下,肾脏会重吸收超过99%被过滤的肌醇。然而,当患有慢性肾病或糖尿病肾病时,肾脏的重吸收功能受损,会导致大量肌醇随尿液排出,引起全身性的耗竭。
药物与生活方式
药物影响:例如,用于治疗双相情感障碍的锂盐,会抑制肌醇在细胞内的循环再生,导致功能性缺乏。
生活方式:长期饮酒和慢性压力会持续增加肌醇的代谢消耗,同时干扰其在肝脏和神经系统中的正常功能。
以上我们了解到肌醇的体内平衡,易受到现代生活方式和普遍健康问题的干扰。这种平衡的打破,绝非一个简单的营养素缺乏问题,它构成了多种复杂疾病发生与发展的核心病理生理基础。
多囊卵巢综合征
多囊卵巢综合征(PCOS)是育龄女性最常见的内分泌与代谢紊乱疾病。虽然其典型症状如月经不调、高雄激素、卵巢多囊样改变——都指向生殖系统,但其病理根源远不止于此。PCOS的本质,是一种与胰岛素抵抗及代偿性高胰岛素血症密切相关的全身性代谢失调。
在这一背景下,肌醇作为一种关键营养素,其代谢紊乱被发现是PCOS病程中的核心环节。这引出了一个重要概念:PCOS患者普遍存在一种“功能性肌醇耗竭”。这并非指吃得不够,而是细胞层面无法有效利用肌醇,尤其是其两种关键异构体——肌醇(myo-Ins)和D-手性肌醇(DCI)。
两种肌醇,两大职责
在健康人体内,胰岛素如同“总指挥”,精确调控着两种肌醇的转化与功能。它们分工明确:
肌醇失衡:与PCOS有重要关联
在PCOS患者中,普遍存在的胰岛素抵抗破坏了这个过程。
细胞对胰岛素不敏感(即胰岛素抵抗),导致将 myo-Ins 转化为 DCI 的酶活性不足。这使得细胞无法有效利用葡萄糖,进一步加剧高血糖和高胰岛素血症。
矛盾的是,卵巢对胰岛素依然高度敏感。全身循环中的高水平胰岛素在卵巢过度激活了转化酶,导致卵巢内的 myo-Ins 被大量、过早地消耗,转化为 DCI。
这就造成了卵巢微环境中灾难性的后果:myo-Ins 严重相对缺乏,而 DCI 严重相对过量。
肌醇失衡如何破坏生育力?
这种卵巢内的肌醇失衡直接导致了PCOS的两大核心生殖障碍:
作为FSH信号的关键信使,myo-Ins的耗竭损害了卵泡对FSH的反应。卵泡在募集后无法发育成优势卵泡,最终发育停滞,形成了一串“小囊泡”——即卵巢的多囊样改变。同时,myo-Ins的缺乏也直接影响卵母细胞的质量,导致受孕困难和流产风险增加。
卵巢内过量的DCI会反过来刺激卵泡膜细胞,使其对胰岛素和促黄体生成素(LH)的信号反应过度,从而过量合成雄激素。
治疗思路:补充肌醇,打破不良循环
理解了肌醇原因,那么外源性补充肌醇的逻辑便十分清晰了。其目的正是为了纠正卵巢内的营养失衡,打破恶性循环。
临床研究发现,单独补充大剂量DCI效果不佳甚至可能有害。因为它无法解决卵巢中真正耗竭的myo-Ins,反而可能加剧失衡比例。
直接喂养处于“饥饿”状态的卵巢,恢复其对FSH信号的敏感性,促进卵泡正常发育与排卵。
从根源改善:在全身层面改善胰岛素敏感性,降低血清胰岛素水平,从而减轻对卵巢转化酶的过度刺激。
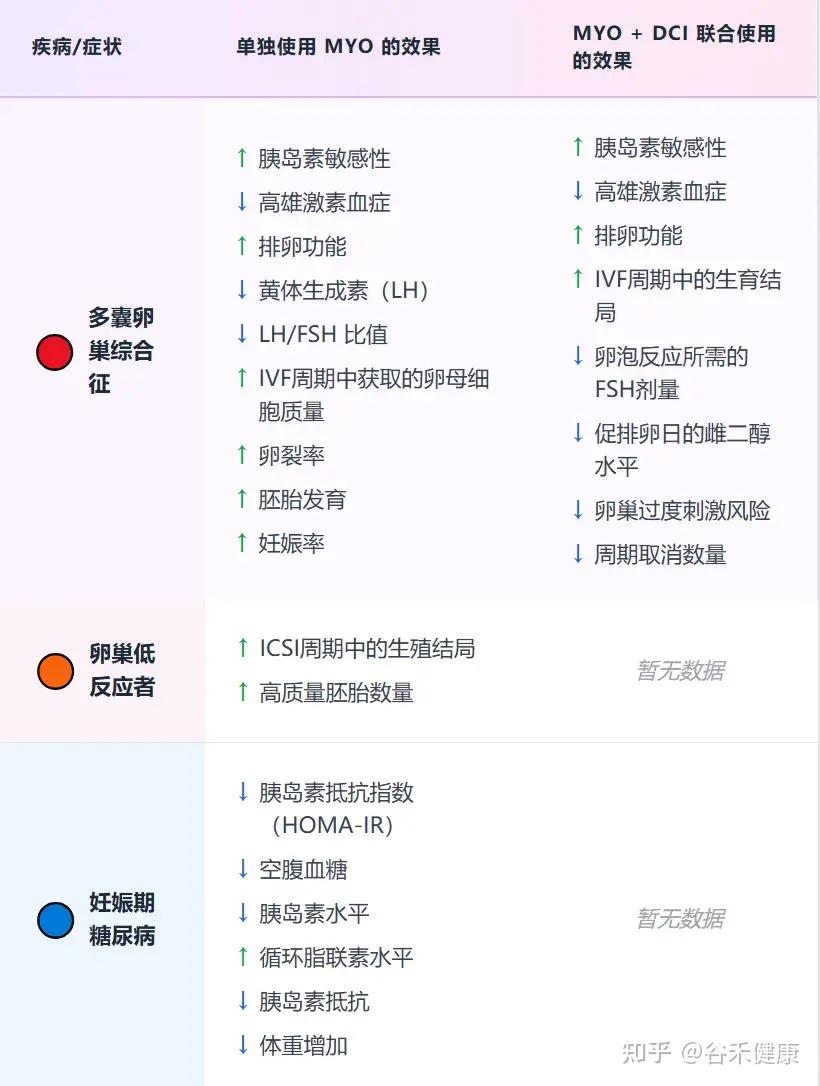
目前,大量高质量的临床研究证实,补充肌醇,特别是以生理比例40:1混合的myo-Ins和DCI,能够显著改善PCOS患者的内分泌和代谢指标,包括:
糖尿病
在糖尿病及其前驱状态(胰岛素抵抗)的复杂病理中,肌醇代谢的紊乱扮演着一个核心角色,它既是后果又是驱动因素,形成了一个自我强化的恶性循环。
高血糖如何耗尽肌醇?
高血糖通过“入口”和“出口”两个维度,造成了体内肌醇的严重耗竭。
葡萄糖与肌醇的化学结构高度相似,它们共享细胞膜上的部分转运通道,尤其是钠/myo-肌醇协同转运体(SMIT)。
当血糖持续升高时,血液中过量的葡萄糖霸占转运通道。这种竞争性抑制作用,极大地阻碍了细胞对肌醇的有效吸收。这就导致了一个矛盾的现象:即使血液中的肌醇浓度尚可,真正需要它的细胞(如神经、肝脏、肾脏细胞)内部却已处于饥饿状态,即功能性耗竭。
高血糖对肾脏也构成了巨大压力。当血糖超过肾脏的处理极限时,多余的葡萄糖会随尿液排出(即糖尿)。由于转运通道被葡萄糖占据,本应被肾脏回收的肌醇也同步受损,大量地随尿液流失。这直接削减了身体的肌醇总储备,是糖尿病患者体内肌醇水平显著偏低的关键原因。
肌醇耗竭如何反噬代谢?
当肌醇耗竭发生后,它会对糖尿病的病理产生关键的反噬作用,让情况变得更糟。
肌醇是胰岛素信号通路中不可或缺的第二信使。可以把它想象成信号传导链条上的一个关键齿轮。当细胞内肌醇水平下降,这个齿轮就脱落了,导致信号中断,加剧胰岛素抵抗。
也就是说,胰岛素虽然与细胞受体结合了,但信号无法有效向下游传递(无法有效激活下游的PI3K/Akt等关键激酶)。这使得负责将葡萄糖运入细胞的“大门”(GLUT4转运蛋白)无法正常打开,细胞摄取和利用葡萄糖的能力大幅下降。这直接加重了胰岛素抵抗。
恶性循环的闭环
至此,一个恶性循环正式形成:
高血糖 ➔ 抑制肌醇吸收 & 加速其流失 ➔ 细胞内肌醇耗竭 ➔ 胰岛素信号链中断 ➔ 胰岛素抵抗加剧 ➔ 血糖进一步升高
这个循环一旦启动,便会不断自我强化,使血糖控制变得愈发困难。
连锁反应:损害远不止于血糖
肌醇的缺乏会间接促进肝脏的脂肪生成,并导致血脂异常,从而显著增加糖尿病患者并发脂肪肝和心血管疾病的风险。
肌醇对维持神经细胞的渗透压平衡和正常信号传导至关重要。其长期耗竭是导致糖尿病周围神经病变(如手脚麻木、刺痛感)的核心原因之一。
因此,肌醇在糖尿病中的角色是一个从宏观器官功能(肾脏流失)到微观细胞信号(胰岛素抵抗)的系统性障碍。理解这一恶性循环,为通过补充肌醇来干预和改善糖尿病代谢状态提供了重要的理论依据。
脂质代谢(血脂异常)
代谢综合征(MetS)是一组以腹型肥胖、高血压、高血糖和血脂异常为核心特征的病理状态集合,其共同的病理生理基础是胰岛素抵抗。
研究表明,肌醇之所以能在改善血脂方面大有可为,是因为它能通过至少三条关键路径,协同作战,调控脂质代谢。

路径一:直击源头——为肝脏的脂肪工厂刹车
肝脏是全身的脂质代谢中心。在胰岛素抵抗和高糖负荷的状态下,肝脏的“新生脂肪合成”功能会失控,如同一个被过度激活的工厂,不停地将碳水化合物(糖)转化为脂肪。
肌醇的作用,就是为这个失控的工厂精准刹车。它通过抑制 SREBP-1c 和 ChREBP 这两个控制脂肪合成的总开关,直接从源头上减少了肝脏的脂肪产量。这不仅能降低血液中的甘油三酯(TG)水平,也是改善非酒精性脂肪肝(NAFLD)的关键一步。
路径二:切断原料——修复外周脂肪组织的失灵开关
胰岛素抵抗不仅会引发高血糖,还会导致另一个严重问题:脂肪组织中一个叫“激素敏感性脂肪酶(HSL)”的开关失灵了。
这些泛滥的原料被肝脏大量吸收,进一步加剧了甘油三酯和“坏胆固醇”(VLDL,极低密度脂蛋白)的生产。肌醇通过修复细胞内的胰岛素信号通路(如PI3K/Akt通路),重新恢复了对HSL的抑制作用。这相当于切断了肝脏过度生产脂肪的原料供应。
这个过程不仅能降低血脂,还能减少脂肪在肝脏、肌肉等不该堆积之处的沉积,从而进一步改善全身的胰岛素敏感性,形成一个宝贵的良性循环。
路径三:另辟蹊径——优化肠道菌群(肠-肝轴)
肌醇还通过一条全新的路径——调节肠道菌群,来间接实现降脂效果。
它扮演着益生元的角色,为特定的有益菌(如Anaerostipes属)提供食物。这些有益菌在代谢肌醇后,会产生丙酸和乙酸等短链脂肪酸。这些有益物质通过肠道进入肝脏,发挥重要作用,例如,丙酸可以抑制肝脏合成胆固醇。
更重要的是,一个健康的肠道菌群能够强化肠道屏障,防止脂多糖(LPS)等内毒素进入血液,从而减轻体内的低度炎症状态,而这种炎症正是驱动胰岛素抵抗和肝脏脂肪合成的关键推手。因此,肌醇通过优化肠道微生态,利用肠-肝轴,间接抑制了炎症和脂质生成。
其他潜在机制
除了上述三大路径,研究还提示肌醇可能通过以下方式发挥作用:
正是这种在多个层面、通过多种通路协同作用的综合效应,使肌醇成为一种极具潜力的天然营养干预策略,用以改善代谢综合征患者的血脂谱和整体健康。
肌醇是中枢神经系统中浓度第二高的有机小分子(仅次于谷氨酸),其重要性远不止于一个简单的结构单元。
它在维持神经精神健康中扮演着两大关键角色:既是细胞信号传导的基石,也是神经元功能的稳定器。肌醇代谢的紊乱,已与抑郁症、焦虑症、双相情感障碍等多种疾病的病理生理学紧密相连。其核心作用机制围绕着两个主要方面:
➷ 肌醇——信号传导的基石
肌醇是大脑最重要的信号传导系统,磷脂酰肌醇(PI)信号通路的绝对基石。
可以这样理解:几乎所有与情绪、认知相关的神经递质,包括血清素(5-HT)、去甲肾上腺素、多巴胺等,都好比是信使。但信使发出的信号要被细胞内部听到并执行,就需要一个高效的扩音系统,而PI通路就是这个系统。
细胞信号传导过程 – PI通路
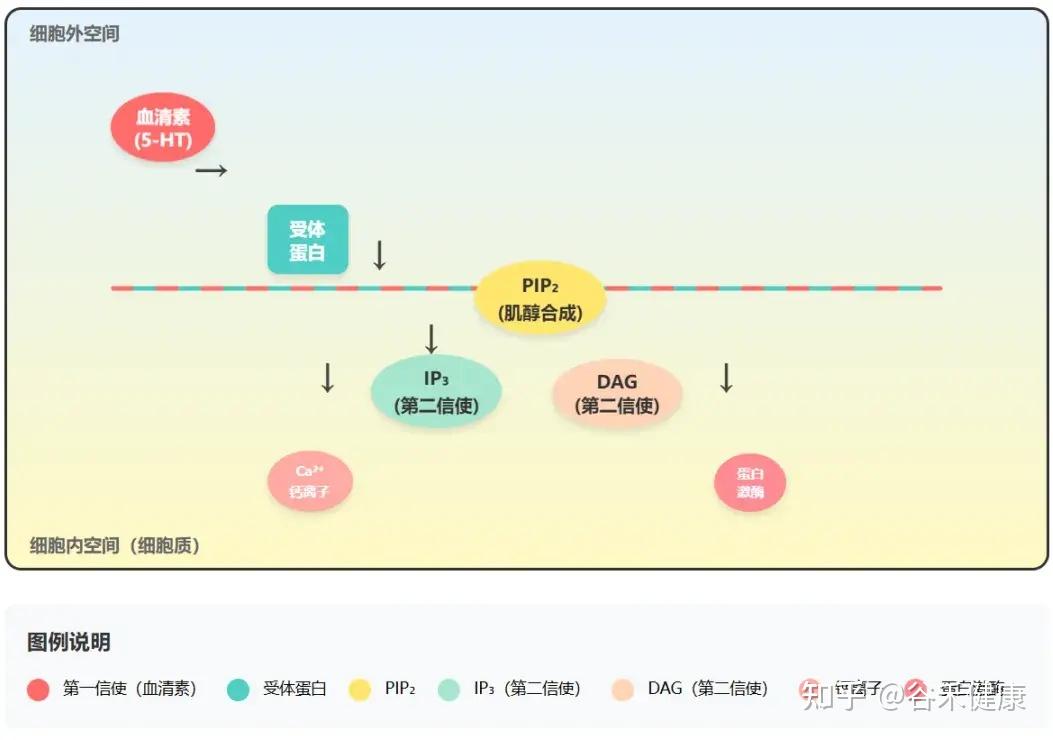
1.
“信使”(如血清素)与细胞外的受体结合。
2.
激活PI通路,将细胞膜上的PIP₂(由肌醇合成)分解为两个关键的“第二信使”——IP₃(肌醇三磷酸)和DAG(二酰甘油)。
3.
这两个第二信使在细胞内触发一系列反应,如IP₃调动钙离子、DAG激活蛋白激酶等,最终将“信使”的指令转化为实际的神经元活动。
因此,脑内充足的肌醇,是确保血清素等“快乐激素”的信号能被有效放大和传递的根本前提。
研究人员已反复在抑郁症和焦虑症患者的脑脊液中观察到,肌醇水平的显著降低。这强烈暗示,肌醇水平下降导致PI信号通路功率减弱,使得神经递质的信号无法被有效传导,从而引发情绪低落、快感缺失和焦虑。
这也解释了为何在多项临床试验中,补充大剂量肌醇(每日高达12-18克)显示出与标准抗抑郁药相当的疗效,它直接为这个“信号放大系统”补充了燃料。
➷ 肌醇——神经元功能的稳定器
大脑的细胞环境并非一成不变,脱水、高血糖等状态都可能引起渗透压的剧烈变化,威胁神经元的生存。
肌醇此时扮演着“渗透压稳定器”或“细胞海绵”的角色。它能在细胞内累积或释放,灵活调节细胞内外的水分平衡,防止神经元因过度肿胀或皱缩而受损。这种保护功能对于维持神经元的结构完整性和正常电生理活动至关重要。
来自临床与疾病的佐证
双相情感障碍的锂盐治疗
治疗双相情感障碍的经典药物——锂盐,其作用机制就从反面印证了肌醇的核心地位。锂盐通过抑制肌醇的再循环【锂盐抑制肌醇单磷酸酶(IMPase)和肌醇多磷酸-1-磷酸酶(IPPase)】,导致细胞内PI信号通路的信号减弱。这种信号抑制是锂盐平复躁狂心境的关键,这从反面印证了肌醇信号通路在情绪调节中的核心地位,但也可能因此产生副作用。
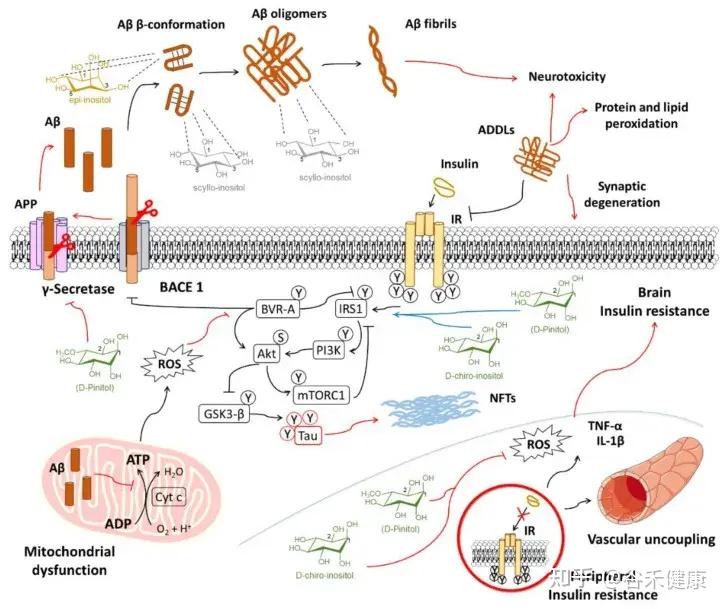
阿尔茨海默病的关联
研究发现,肌醇有助于预防脑内胰岛素信号传导的早期损伤和血管功能障碍。这些功能障碍会促进氧化应激和炎症,最终在阿尔茨海默病的背景下,助长淀粉样蛋白的病理改变。
肌醇在导致阿尔茨海默病进展的机制中相互作用的示意图
综上所述,肌醇并非直接充当神经递质,而是作为神经信号传递系统的燃料和细胞环境的稳定器。当大脑的肌醇供应不足或代谢受阻时,整个神经系统的效率都会大打折扣,引发情绪和认知问题。
因此,维持充足的肌醇水平,是通过恢复最基础的细胞功能来支持整体神经精神状态的健康。这也使其成为现代营养精神病学中备受关注的干预策略之一。
尽管肌醇在皮肤健康领域的知名度远不及在代谢和神经科学中的应用,但它作为细胞功能的基础分子,通过调节细胞信号、脂质代谢和炎症,对维持皮肤的整体稳态发挥着不可或缺的幕后作用。
肌醇对皮肤的影响,主要通过以下三个层面实现:
1
强化皮肤屏障,构筑坚固屏障
肌醇是构成细胞膜关键成分——磷脂酰肌醇(PI)的核心原料。一个健康的细胞膜,是维持皮肤细胞功能和构建坚固皮肤屏障的基础。
可以把皮肤屏障想象成一道砖墙:角质细胞是砖块,细胞间的脂质(神经酰胺、胆固醇等)是水泥。肌醇参与的PI信号通路,深刻影响着砖块也就是角质细胞的增殖、分化和凋亡。
2
调节皮脂与炎症,从根源控痘
肌醇通过其在脂质代谢和胰岛素信号中的核心作用,直接影响着皮脂腺的活动——这与痤疮(也就是痘痘)的形成密切相关。
痤疮的形成与皮脂分泌过多、毛囊口角化异常、痤疮丙酸杆菌增殖和炎症反应四大因素相关。
这种状态会刺激皮脂腺过度活跃,分泌过多油脂,同时促进角化,为痤疮的爆发创造了土壤。
肌醇,特别是myo-肌醇,扮演着代谢调节器的角色:
这与它在治疗多囊卵巢综合征(常伴有痤疮的疾病)中观察到的效果一致:通过改善内部代谢,皮肤状况也随之显著好转。
3
改善全身代谢
皮肤是身体内部健康状况的一面镜子。代谢综合征(由胰岛素抵抗、血脂异常和慢性炎症引起)常常伴随着典型的皮肤问题,如黑棘皮病(皮肤皱褶处天鹅绒般的色素沉着)、皮赘以及更差的伤口愈合能力。
肌醇通过系统性地改善糖脂代谢、降低全身炎症水平,能够从根本上扭转这些病理状态,从而改善甚至消除这些皮肤表现。一个代谢平衡的身体,其皮肤的血液循环、营养供应和自我修复能力都会得到提升,自然会显得更有光泽和弹性。
综上肌醇并非一种传统意义上的护肤维生素,而是由内而外地改善,确保了皮肤细胞能够正常沟通、有序更新,并帮助控制那些由内部代谢失衡所驱动的皮肤问题(如过度出油和炎症)。因此,维持充足的肌醇水平,是实现由内而外的持久皮肤健康的重要一环。
评估体内的肌醇状态,通常需要结合临床表现和实验室检测。可以从以下几个方面,判断是否存在肌醇代谢紊乱的可能性。
症状信号
当患者出现以下看似不相关、但背后可能都与肌醇代谢紊乱有关的特定情况时,应引起警惕:
代谢:
尽管努力控制饮食,但血糖水平依然居高不下或难以控制。
肝脏:
体重正常,甚至偏瘦,但体检却发现存在脂肪肝。
生殖:
育龄女性出现无排卵或月经周期严重不规律(提示多囊卵巢综合征的可能)。
精神:
患有抑郁症或焦虑症,但对常规的血清素类药物(如SSRI)反应不佳。
生物标志物
使用气相色谱-质谱(GC-MS)或液相色谱-质谱(LC-MS)定量检测血清、尿液或组织中的myo‑Ins可提供直接测量。
这是最直接、最准确的评估方法。
辅助指标
胰岛素抵抗评估
检测空腹血清胰岛素和计算HOMA-IR指数,是评估胰岛素抵抗严重程度的核心指标。
血脂与肝功能检测
检查肝脏中的甘油三酯和胆固醇水平,以评估与肌醇代谢密切相关的脂肪肝状况。
肠道微生态分析
通过粪便样本分析,评估肠道菌群的构成,以及肌醇在肠道内的代谢产物,短链脂肪酸的水平,从而了解肠道在肌醇代谢通路中扮演的角色。
综合这些临床症状和辅助指标,可以为判断是否存在肌醇功能性缺乏以及是否需要进行营养干预提供有力的证据。
一般情况下, 以下建议可以帮助补充肌醇。
饮 食
富含天然肌醇来源的食物——全谷物、豆类、柑橘类水果、坚果、动物肝脏,可提供游离和结合形式的肌醇。发酵食物(如酸面包、酸奶发酵)能提高其生物利用度。
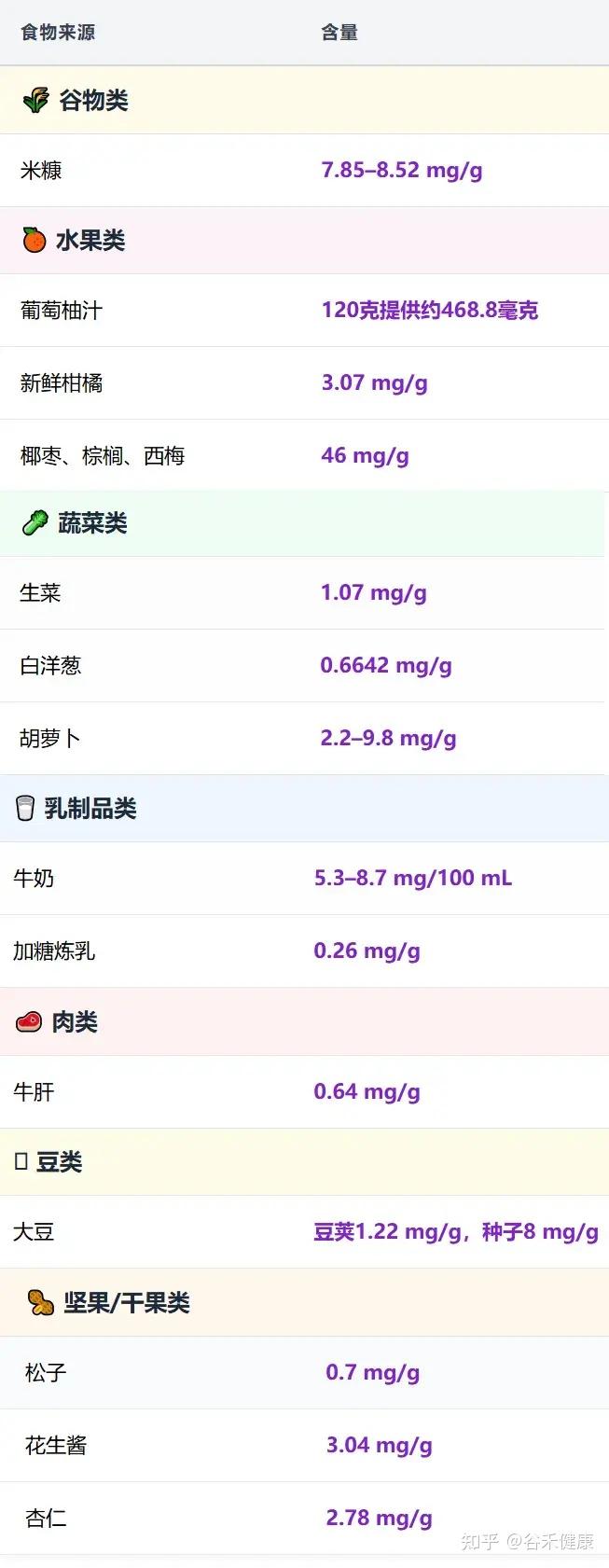
肌醇可以在以下食物来源中找到:
注:新鲜水果和蔬菜中的肌醇含量,远高于干燥或罐装水果和蔬菜。
磷脂酰肌醇也存在于卵磷脂中,因此以下所有富含卵磷脂的食物都是很好的来源:
注:动物来源通常比植物来源提供更大的卵磷脂来源。
D-手性肌醇(用作抗氧化剂,与肌醇结合用于多囊卵巢综合征)的最佳来源是荞麦。
肌醇食物来源含量表
补 充 剂 量
针对不同需求剂量有些差异
高剂量应用于神经与精神健康
对于抑郁症、焦虑症、强迫症及饮食失调等精神健康问题,临床研究倾向于使用每日12克甚至更多的剂量。研究人员认为需要如此高的剂量才能有效穿过血脑屏障,显著提升大脑中的肌醇与血清素水平,从而发挥稳定情绪的作用。
低剂量应用于代谢与生殖健康
相比之下,在处理代谢和生殖相关问题时,采用的剂量要温和得多。对于改善生育能力、调理多囊卵巢综合征、辅助减重以及提升胰岛素敏感性,每日2~4克的肌醇(Myo-inositol)已被证实是行之有效的。
在治疗PCOS时,一个关键的策略是将肌醇(Myo-inositol)与D-手性肌醇(D-chiro-inositol, DCI)联合使用,并遵循40:1的生理比例。一个典型的例子是:每日服用4克的肌醇,同时配以100毫克的D-手性肌醇,这种组合被证实能最有效地恢复代谢和卵巢功能。
也有单独的D-手性肌醇,每天500毫克~1.2克的剂量,改善激素状况并恢复排卵。每天1克改善了接受控制性卵巢过度刺激的女性的卵子质量。
注:联合补充剂可能比单独使用肌醇效果更好。
对于妊娠期糖尿病,每天服用1.75克肌醇和250毫克DCI,可以降低血糖和母婴健康风险。
补充形式
补充剂的形态对吸收率有显著影响。
研究表明,软胶囊的生物利用度远高于粉末,仅需约30%的剂量即可达到同等效果。例如,一项针对经前情绪障碍的研究发现,每日3.6克的软胶囊与12克的粉末效果相当。
增强效果的协同组合
为了最大化肌醇在生殖和代谢方面的益处,常常推荐将其与其他营养素协同使用。临床实践表明,将肌醇与叶酸或Omega-3脂肪酸联合补充,可以起到1+1>2的效果,进一步增强其对生殖和代谢健康的积极影响。
MYO或MYO + DCI给药对生育治疗和健康妊娠的影响
生 活 方 式
规律运动:有氧运动能增强体内将myo-肌醇转化为DCI的关键酶的活性。
优质睡眠:充足的睡眠有助于减少压力激素(皮质醇)对肌醇的降解。
限制不良习惯:减少精制糖的摄入和限制饮酒,能有效稳定血液中的肌醇水平。
调 节 肠 道 菌 群
益生元纤维(如菊粉、抗性淀粉)和益生菌(如鼠李糖乳杆菌、婴儿双歧杆菌)有助于培养有益的微生物群落,这些菌群能产生短链脂肪酸,支持肌醇介导的代谢健康。
根据肌醇缺乏机制定制
根据五大缺乏机制,可以针对性的策略:
1- 针对「膳食摄入不足」
策略:重点增加全谷物、豆类和坚果的摄入。如果饮食难以保证,应考虑直接补充。
2- 针对「内源合成障碍」(如基因缺陷)
风险人群:携带 ISYNA1 基因变异者;有唐氏综合征家族史的备孕人群。
策略:必须依赖外源性补充,且可能需要比常规更高的剂量。
3- 针对「肾脏过度清除」(如糖尿病状态)
风险人群:高血糖、糖尿病、肥胖及高血压患者。
策略:
-严格控制血糖是重中之重。
-补充 myo-肌醇以弥补流失。
-定期监测肾功能。
4- 针对「肠道吸收障碍或竞争」
A. 葡萄糖竞争
挑战:与高糖食物同服会降低吸收。
策略:选择在空腹或两餐之间服用肌醇。
B. 高剂量DCI的竞争
挑战:单独补充高剂量DCI会反过来抑制myo-肌醇的吸收。
策略:严格遵守40:1或更高的 myo-Ins/DCI 比例,避免使用高剂量DCI的单一配方。
C. 肠道菌群失调
策略:采用组合方案,myo-肌醇 (2-4g/天) + α-乳白蛋白 (作为益生元, 2-3g/天) + 乳杆菌/双歧杆菌益生菌,并配合高纤维饮食。
5- 针对「药物诱导的消耗」
A. 影响中枢神经的药物(锂盐、丙戊酸等)
策略:进行外周补充以缓解副作用。此时配比可能需要调整为 80:1 (myo:DCI)。需定期监测多尿、皮肤问题等代谢指标。
B. 影响肠道菌群的药物(PPI、他汀类、泻药等)
策略:联合补充益生元和益生菌,必要时临时增加myo-肌醇的补充。
特殊人群的注意事项
在为以下人群制定方案时,应格外谨慎,并从低剂量开始:
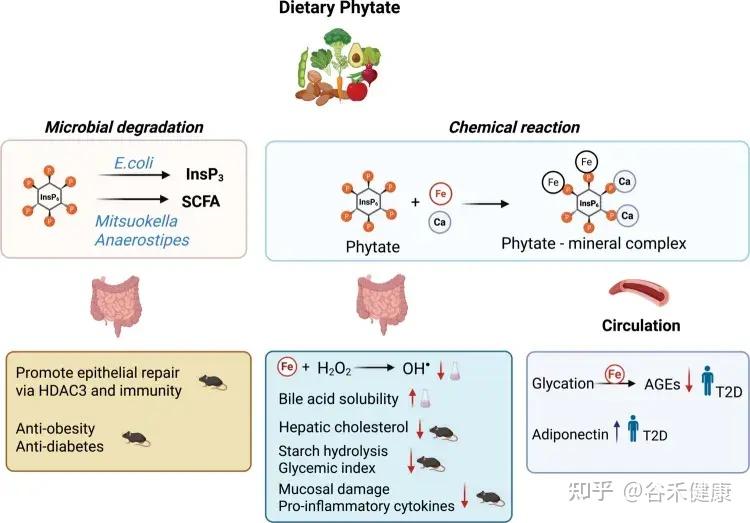
基于体外和体内模型以及人体研究肌醇肌醇六磷酸盐对健康影响
肌醇的研究正进入一个新纪元,其重要性已远远超越了传统的代谢调节范畴,延伸至癌症、神经保护和肠道健康等前沿领域,进一步巩固了它作为连接人体与微生物生态的核心分子的地位。
癌症代谢的新武器
研究发现,肌醇及其衍生物(如IP6)通过调节细胞内关键的 PI3K/AKT 信号通路并抑制肿瘤血管的生成,表现出显著的抗肿瘤增殖特性。这为开发基于营养的癌症辅助治疗策略提供了新思路。
神经保护的希望之星
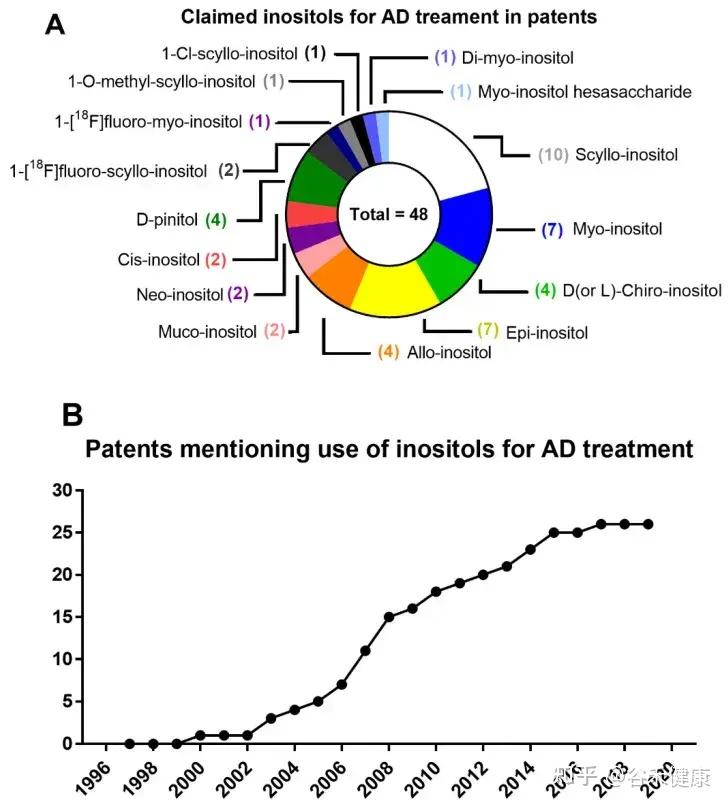
在阿尔茨海默病等神经退行性疾病的研究中,肌醇显示出巨大潜力。它被证实可以减少β-淀粉样蛋白的聚集和脑内的氧化应激,这是阿尔茨海默病的两大核心病理过程。事实上,已有大量专利被授予,用于探索和应用肌醇来治疗阿尔茨海默病,突显了其在该领域的应用前景。
提及和要求使用肌醇治疗阿尔茨海默的专利数量
肠-肝轴的协同调控
最新研究揭示,将肌醇与牛磺酸联合使用,能够有效重编程肝脏的基因表达,不仅能防止因高糖饮食诱导的脂肪肝,还能显著改善肠道内有益的短链脂肪酸。
这些发现共同描绘了:肌醇是一个卓越的整合分子,它能够巧妙地协调宿主自身的代谢节律与体内庞大的微生物生态系统。
肌醇深刻影响着全身的能量平衡与健康信号。过去,我们补充肌醇,期望它能在体内某个需要的地方恰好生效。现在,我们知道肌醇的效能并非孤立存在,它也同时取决于我们的肠道菌群。
基于此,“先养菌,再补剂”可能会成为新的黄金法则。我们可以先通过饮食、生活方式、益生元或益生菌来改造肠道环境,为肌醇补充铺平道路。未来可能将有更深入的研究,去识别究竟是哪些微生物基因簇在主导肌醇的转化;也许我们会找到那些由肌醇衍生出的、尚未被发现的新型健康信使。
主要参考文献:
Lepore E, Lauretta R, Bianchini M, Mormando M, Di Lorenzo C, Unfer V. Inositols Depletion and Resistance: Principal Mechanisms and Therapeutic Strategies. Int J Mol Sci. 2021 Jun 24;22(13):6796.
Jessen H, Bui TPN. Metabolism of inositol derivatives by the gut microbiome. Gut Microbes. 2025 Dec 31;17(1):2564765.
López-Gambero AJ, Sanjuan C, Serrano-Castro PJ, Suárez J, Rodríguez de Fonseca F. The Biomedical Uses of Inositols: A Nutraceutical Approach to Metabolic Dysfunction in Aging and Neurodegenerative Diseases. Biomedicines. 2020 Aug 20;8(9):295.
Wu C, Yang F, Zhong H, Hong J, Lin H, Zong M, Ren H, Zhao S, Chen Y, Shi Z, Wang X, Shen J, Wang Q, Ni M, Chen B, Cai Z, Zhang M, Cao Z, Wu K, Gao A, Li J, Liu C, Xiao M, Li Y, Shi J, Zhang Y, Xu X, Gu W, Bi Y, Ning G, Wang W, Wang J, Liu R. Obesity-enriched gut microbe degrades myo-inositol and promotes lipid absorption. Cell Host Microbe. 2024 Aug 14;32(8):1301-1314.e9.
Fazio A, Rosenstiel P. Language of a Long-Term Relationship: Bacterial Inositols and the Intestinal Epithelium. Cell Metab. 2020 Oct 6;32(4):509-511.
Caputo M, Bona E, Leone I, Samà MT, Nuzzo A, Ferrero A, Aimaretti G, Marzullo P, Prodam F. Inositols and metabolic disorders: From farm to bedside. J Tradit Complement Med. 2020 Mar 24;10(3):252-259.
Bui TPN, Mannerås-Holm L, Puschmann R, Wu H, Troise AD, Nijsse B, Boeren S, Bäckhed F, Fiedler D, deVos WM. Conversion of dietary inositol into propionate and acetate by commensal Anaerostipes associates with host health. Nat Commun. 2021 Aug 10;12(1):4798.
Lentini G, Querqui A, Monti N, Bizzarri M. PCOS and Inositols – Advances and Lessons We are Learning. A Narrative Review. Drug Des Devel Ther. 2025 May 21;19:4183-4199.
Min M, Afzal N, Maloh J, Dulai AS, Ahmad N, Pinzauti D, Sivamani RK. Prospective Comparative Study of an Oral Synbiotic and a Myoinositol-Based Herbal Supplement in Modifying Hormone Levels and the Gut Microbiome in Non-cystic Acne. Dermatol Ther (Heidelb). 2025 Jun;15(6):1331-1350.
Vitacolonna E, Masulli M, Palmisano L, Stuppia L, Franzago M. Inositols, Probiotics, and Gestational Diabetes: Clinical and Epigenetic Aspects. Nutrients. 2022 Apr 8;14(8):1543.
Placidi M, Casoli G, Tatone C, Di Emidio G, Bevilacqua A. Myo-Inositol and Its Derivatives: Their Roles in the Challenges of Infertility. Biology (Basel). 2024 Nov 16;13(11):936.

谷禾健康
《血糖,微生物,胰岛素》
2型糖尿病(T2D)是一种全球性慢性代谢性疾病,目前已影响超过 4.6亿人,其社会经济负担巨大,迫切需要寻求有效的治疗方法。
根据中华医学会糖尿病学分会发布的《中国2型糖尿病防治指南》,我国2型糖尿病的管理路径清晰而规范:以生活方式干预为基石,以二甲双胍为一线首选,后续根据情况采取阶梯式的强化治疗。
然而,尽管指南明确,临床上仍然面临治疗反应个体差异大这一核心难题,这导致我国仍有近半数患者血糖控制不达标。为何同样的“金标准”方案,效果却天差地别?
多项研究发现,2型糖尿病的肠道菌群组成与健康人存在明显差异,菌群失衡可能通过影响短链脂肪酸合成、胆汁酸代谢及胰岛素敏感性等途径促进代谢紊乱。
甚至连二甲双胍这些药物的降糖效应,竟有相当一部分是依赖其对患者肠道微生物群的重塑和调节。
本文将介绍当前有关肠道微生物群调控葡萄糖稳态的潜在机制,并重点探讨近年来通过靶向肠道菌群改善糖代谢的研究进展。其中包括粪菌移植、益生元、益生菌、合生元与外源性代谢调节物质等多种策略在动物模型中的应用及其转化潜力。这些非侵入性干预手段有望为2型糖尿病带来新的、有效的治疗或至少是辅助选择。
要揭示肠道菌群与个体糖尿病的关系,需要谨慎和长期的队列研究
肠道菌群:一个多因素互动的复杂网络
然而,事情并非绝对“好细菌”与“坏细菌”的简单对抗。肠道菌群是一个复杂的生态系统,这个复杂的网络包括:
所有这些因素交织在一起,共同决定了我们的代谢健康状况。
因此,要真正揭示肠道菌群在糖代谢中的作用机制,就需要做到:
这类研究不仅能为糖尿病的早期预测和个体化干预提供坚实证据,也将为利用肠道菌群进行精准营养调控和代谢重塑奠定科学基础。
谷禾已经通过14,846例2型糖尿病患者(包括妊娠糖尿病)构建了早期糖尿病预测模型,但该模型仍面临若干挑战。
未来谷禾会继续推进研究结合代谢组,药理学等多组学数据,并通过多中心、纵向的设计来控制药物等潜在混杂因素,以实现更高精度、更具普适性的肠道菌群早期糖尿病预测模型。
通过深入探索这些微生物是通过哪些机制影响血糖平衡和代谢功能的,也许会为糖尿病治疗带来新的突破。
肠道屏障受损:免疫与糖代谢的微妙联系
肠道屏障是先天性免疫系统的重要组成部分,它的主要工作就是筑起一道坚固的墙,将肠道内的细菌、病原体及其代谢产物牢牢地限制在肠道内,防止进入血液循环。
▸当肠道屏障出现漏洞
然而,高脂饮食(HFD)会破坏肠道微生物群平调,诱发肠漏,这使得细菌内毒素,特别是革兰阴性菌产生的脂多糖(LPS),更容易进入血液循环,形成“代谢性内毒素血症”。
▸炎症的触发机制
—警报响起
泄漏到血液中的LPS会激活免疫细胞表面的Toll样受体4 (TLR4)。
—信号传导
TLR4被激活后,会启动一个信号级联反应,导致细胞核内的 NF-κB激活。NF-κB是调控炎症反应的总开关。
—促炎因子
被激活的NF-κB会命令细胞大量生产和释放促炎细胞因子,如肿瘤坏死因子-α (TNF-α)、白介素-6(IL-6)等。在全身造成低度慢性炎症。
值得注意的是,近期研究发现,不同菌种来源的LPS在影响葡萄糖代谢、炎症反应及肠屏障完整性方面存在差异,说明仅以LPS总量评价肠漏程度可能并不准确。
▸ 慢性炎症:导致胰岛素抵抗的元凶
这种炎症状态是导致代谢紊乱的关键因素之一,例如,TNF-α会直接干扰肌肉细胞对胰岛素的响应,阻碍血糖的正常利用,最终引发胰岛素抵抗、高血糖及高胰岛素血症。
▸免疫系统与菌群的双向互动
免疫系统和肠道菌群的关系并非单向的,而是一个复杂的双向互动。
关键免疫细胞:Th17细胞
这是一种特殊的T细胞,它在正常情况下分泌IL-17和IL-22等因子,对于维持肠道屏障的完整性和抵御病原体至关重要。可以看作是城墙的守护者。
➦ 菌群 → 免疫系统
证据1(生酮饮食):生酮饮食会减少肠道中Th17细胞的数量。但如果给无菌小鼠移植了采用生酮饮食的人的粪菌,小鼠的Th17细胞也会减少。而补充双歧杆菌则可以恢复Th17细胞的水平。
证据2(高糖高脂饮食):高糖高脂饮食会减少那些能够诱导Th17细胞发育的特定细菌。如果给高糖高脂饮食喂养的小鼠补充这些特定的细菌,它们的Th17细胞水平得以恢复,血糖也得到改善。
➦ 免疫系统 → 菌群
证据(过继转移):将Th17细胞直接移植到肥胖小鼠体内,这些小鼠的肠道菌群结构发生了有益的改变,葡萄糖耐量也得到了改善。
doi.org/10.1146/annurev-physiol-051524-094728
►▷
不良饮食 → 菌群失调 → 肠漏 → LPS进入血液 → 激活免疫系统(TLR4)→ 慢性炎症(TNF-α)→ 胰岛素抵抗。
菌群的改变会影响关键免疫细胞(如Th17)的数量,而免疫系统的状态反过来又能重塑肠道菌群的构成。
这种菌群与肠道免疫之间错综复杂的相互作用,是理解代谢性疾病病理生理的核心,也为未来的治疗提供了新的靶点。
短链脂肪酸:菌群送给你的控糖礼物
短链脂肪酸(SCFAs)包括丁酸、丙酸、乙酸,它们是由肠道细菌通过碳水化合物发酵产生。
它们不仅仅是代谢产物,更是重要的信号分子,是肠道菌群与我们身体对话的语言。
▸ 短链脂肪酸如何调控血糖?
▸ 动物研究,直接补充SCFA改善血糖
多项动物实验表明,外源性补充SCFAs可改善能量代谢与血糖稳态,表现为体重下降、葡萄糖耐受性提升及胰岛素抵抗减轻。
▸ 人体研究,效果不一致
例如,口服丁酸仅在健康受试者中改善血糖控制,而对代谢综合征患者无显著效应,提示代谢紊乱本身,可能就损害了人体对SCFA信号的响应能力。
▸ 口服补充为何会失效?
口服补充SCFA是不符合生理规律的。
在自然状态下,绝大多数SCFA是在远端肠道(结肠)中由细菌产生的。
口服的缺陷:口服的SCFAs在到达结肠之前,可能早已在胃或小肠中被吸收或代谢掉,无法到达它们应该发挥主要作用的地方。
有力的证据: 一项巧妙的研究解决了这个问题。科学家设计了一种“菊粉-丙酸酯”,这种特殊结构可以保护丙酸不被提前吸收,精准地将其运送到结肠释放。结果发现,这种精准投放的丙酸,确实能够有效改善超重和肥胖人群的能量代谢和胰岛素敏感性。
这说明,SCFA在哪里释放,比释放了多少,可能更为重要。
▸ 为何病人的粪便里SCFA反而更高?
库存 ≠ 产量
一些研究发现,代谢疾病患者粪便中的SCFA含量反而更高。这似乎与“SCFA是有益的”这一观点相矛盾?
合理解释:粪便中的SCFA含量,仅仅是未被肠道吸收和利用的“剩余物资”。
▸ 肠道菌群-短链脂肪酸-肠道激素轴
短链脂肪酸通过与肠内分泌细胞(EECs)上的受体结合,刺激激素的释放,比如说,GLP-1(胰高糖素样肽-1)、PYY(肽YY)、GIP(胃抑制肽)、CCK(胆囊收缩素)等。GLP-1与GIP为主要的“促胰素”,能够在摄食后迅速加强胰岛素分泌反应,是控制餐后血糖的关键。
doi.org/10.1146/annurev-physiol-051524-094728
近年来的新发现进一步揭示,微生物群可通过调控宿主营养感知机制影响肝脏糖异生,形成由GLP-1介导的“肠–脑–肝”信号轴。
►▷
由于肠道菌群与上皮层密切接触,它可能通过改变肠内分泌细胞的营养感知机制,并利用短链脂肪酸及其他微生物代谢物作为信号分子,调控肠激素分泌和葡萄糖平衡。这种微生物与宿主的相互作用网络为解析肠源信号调控代谢疾病提供了新的理论框架。
菌群把胆汁酸变成影响血糖的信号
肠道是一个高度复杂的生态系统,如同一个动态的生物反应器,在这个反应器里,无数的微生物与我们吃进去的食物、以及我们身体自己分泌的物质(如胆汁)发生反应,生成了大量独特的代谢产物。
关于肠源性代谢产物我们前面已经讨论过短链脂肪酸,现在焦点转向另一位主角:胆汁酸。
★ 胆 汁 酸
▸ 初级胆汁酸
出生地: 肝脏。 原料: 胆固醇。
初始形态:在肝脏合成后,它们会与牛磺酸(主要在小鼠中)或甘氨酸(主要在人类中)结合,形成结合型初级胆汁酸。
主要工作:进入肠道,帮助我们消化和吸收脂肪。
▸ 次级胆汁酸
一旦初级胆汁酸完成了消化任务并进入肠道后段,肠道菌群就接管了,对胆汁酸进行两步关键的改造:
这种从初级到次级的转变至关重要,因为不同形态的胆汁酸,会像不同的钥匙一样,激活不同的细胞受体“锁”,从而触发完全不同的生理效应。
doi.org/10.1146/annurev-physiol-051524-094728
▸ 两大关键受体:TGR5 与 FXR
次级胆汁酸主要通过激活两个著名的受体来发挥信号作用:
—— TGR5受体 (明确益处)
激活机制:菌群将初级胆汁酸(如鹅去氧胆酸)转化为次级胆汁酸(如石胆酸),后者是TGR5受体的强效激动剂。
明确的益处:激活肠道细胞上的TGR5受体,能够促进GLP-1的分泌,从而改善高脂饮食动物的血糖稳态。
—— FXR受体 (更具争议)
FXR受体则要复杂得多,它的作用似乎取决于它在哪个器官被激活。
在肝脏中(作用清晰):
激活肝脏的FXR受体,可以改善健康和糖尿病小鼠的胰岛素敏感性。
在肠道中(作用矛盾):
一些研究报告称,使用激动剂激活肠道FXR能改善胰岛素抵抗和葡萄糖耐量。
而另一些研究(包括我们之前讨论的产乳酸菌的研究)则发现,使用拮抗剂抑制肠道FXR,或者直接把肠道FXR基因敲除掉,反而能改善血糖稳态。
这说明,FXR在肠道中的作用远非简单的“开”或“关”,而是受到多种因素调控的复杂网络。
★ 其他代谢产物
这些肠源性代谢产物通过影响能量代谢、免疫反应以及宿主信号通路,构成肠道微生物–代谢–宿主疾病之间的重要生物学纽带。
既然我们已经明确,肠道菌群是糖尿病发生发展的关键一环,那么一个问题随之而来:我们目前广泛使用的那些经典降糖疗法,比如二甲双胍等,它们的疗效背后,是否也隐藏着菌群的秘密?下面我们就来看看,常见的治疗方式是如何通过影响肠道菌群来帮助我们控制血糖的。
二甲双胍
二甲双胍是最常见的降糖药之一。它降低血糖的传统机制是减少肝脏制造葡萄糖的能力。但近些年,人们发现——它在肠道里也发挥着巨大作用。
研究发现,口服二甲双胍比注射更能有效降糖,提示它在消化道内可能有额外的作用通路。科学家进一步发现,二甲双胍能改变肠道菌群结构:
更有趣的是,如果把“吃过二甲双胍的小鼠”的小肠菌群移植到其他糖尿病老鼠体内,这些受体小鼠体内的营养感知通路得以恢复,进而抑制了肝脏的葡萄糖生成——也就是说,药效可以通过菌群“传递”出来。
这说明,二甲双胍不仅是“肝药”,更是“肠药”。它同时通过肠道菌群、胆汁酸,以及“肠–脑–肝”信号网络,共同调控血糖代谢。
GLP-1受体激动剂
GLP-1受体激动剂(胰高糖素样肽-1受体激动剂,GLP-1RAs)是一类降糖药物,GLP-1受体激动剂通过多靶点机制发挥作用:
▸肠道菌群对GLP-1的双重影响
促进分泌:肠道菌群能够促进肠道内GLP-1激素的分泌,这是一种有益的代谢效应。
限制作用:分泌的GLP-1在体内极易被二肽基肽酶-IV(DPP-IV)快速降解,导致其对血糖和食欲的系统性调节作用受限,仅产生局部、短暂的代谢效应。
注:DPP-IV 是 Dipeptidyl Peptidase-IV 的缩写,中文名称为 二肽基肽酶-4。它是一种丝氨酸蛋白酶(serine protease),广泛存在于人体的多种组织中,包括肠道上皮、肝脏、肾脏、免疫细胞以及血浆中。
因此,肠道菌群在介导GLP-1药物系统性效应中的具体角色仍不明确。
▸动物与人体研究中的差异
关于GLP-1RAs对肠道菌群的影响,现有研究结果存在不一致。
动物研究:在高脂饮食或糖尿病动物模型中,GLP-1RAs治疗能够增加肠道菌群的多样性,并提升有益菌(如Akkermansia muciniphila、乳酸杆菌)的丰度。
🧍♀️人类研究:也有观察到双歧杆菌数量增加。但大多数人类临床研究报告称,在接受GLP-1RAs治疗后,患者的肠道菌群组成并无显著变化。
▸给药途径:可能是造成差异的关键因素之一
大部分GLP-1RAs均经皮下注射给药,因此菌群改变或许是药物通过影响肠道生理功能(如延缓胃排空、降低肠蠕动等)所致的间接效应,而非药物直接作用于菌群。
目前,虽然口服剂型司美格鲁肽已获批准,但其对肠道菌群的直接影响尚缺乏系统性评估。
▸新视角:来自肠道菌群的DPP-IV
近期的一项关键研究为理解这一复杂关系提供了重要的新视角:
部分肠道微生物自身能够产生并分泌DPP-IV酶。这种细菌源性的DPP-IV同样会降解宿主的GLP-1,从而削弱其生理活性。
临床关联: 研究发现,在对DPP-IV抑制剂药物西他列汀反应不佳的个体中,其肠道微生物的DPP-IV活性显著更高。
干预潜力: 基于此,研究人员已鉴定出一种能特异性抑制微生物DPP-IV的抑制剂,并在动物模型中证实其能改善葡萄糖耐受性,并降低粪便DPP-IV活性。
►▷
这一发现为2型糖尿病(T2D)的治疗开辟了新思路。未来可能开发出一种联合干预策略,即同时靶向宿主和菌群来源的DPP-IV。这种策略有望更有效地保护内源性GLP-1,从而实现更优的血糖控制效果。
减重手术
两种常见的减重手术——Roux-en-Y胃旁路术(RYGB)和 袖状胃切除术(VSG),在胃肠道生理结构上的改变机制不同,但它们在治疗肥胖和糖尿病方面的效果及益处相当。
起初,人们认为手术后的机械性限制,也就说胃容量变小减少食物摄入,是体重下降与代谢改善的主要原因。然而,后续研究发现,减重手术会引发一系列深远的胃肠道生理适应,包括肠道激素分泌、胆汁酸代谢及 肠道微生物群的显著变化,这些因素彼此关联,共同促进体重下降与血糖耐受性改善。
▸ 肠道菌群的核心作用与证据
——菌群持久且独立的变化
研究表明,减肥手术后,肠道菌群会发生显著且持久的变化(至少维持十年)。这种改变似乎是独立于体重减轻或热量限制本身。
证据:与仅节食减肥个体相比,RYGB手术患者的菌群多样性增加;并且,RYGB手术的肥胖大鼠菌群,与体重相当的假手术组大鼠(未真正手术但体重通过节食控制)的菌群显著不同。
——因果关系的探索 (动物、人类)
动物实验:将接受了RYGB手术小鼠的肠道菌群移植到无菌小鼠体内,能够复制体重下降的效果,这强烈暗示了由手术介导的菌群改变在驱动体重减轻中可能具有部分因果作用。
人类研究:然而,在人类研究中结果更为复杂。将术后一年且体重下降30%的供体的菌群移植给代谢综合征患者,并未能改善其葡萄糖稳态。但值得注意的是,这种移植确实阻止了受体胰岛素敏感性的进一步恶化(相比之下,接受其他代谢综合征患者菌群移植的对照组则出现了恶化)。
这说明,肠道微生物群在RYGB的代谢改善中虽起到一定作用,但更可能是与其他机制协同发挥效应,而非单一决定因素。
▸ 菌群发挥作用的关键途径
近期的证据揭示了菌群影响代谢的具体机制,主要涉及以下两个方面:
——胆汁酸信号通路
垂直袖状胃切除术的降糖效果依赖于肠道菌群,并且需要功能正常的FXR和TGR5受体(两者均为胆汁酸受体)。
手术后的菌群改变会增加肠道中胆汁酸转运体的表达,从而促进石胆酸 (lithocholic acid) 的吸收并将其运输至肝脏。
在肝脏,石胆酸被转化为CA7S,这种物质可以直接激活TGR5受体,从而增加GLP-1的分泌,最终改善血糖控制。
——短链脂肪酸信号通路
减肥手术后,肥胖个体循环系统中的丁酸和丙酸水平显著增加,而乙酸水平则降低。
这些短链脂肪酸的变化,同样被认为有助于改善体重和葡萄糖稳态。
减肥手术带来的全面健康益处(体重减轻和葡萄糖稳态改善)不能归因于任何单一机制。它很可能是多种因素,包括肠道菌群的深远影响、胆汁酸信号的改变和短链脂肪酸的产生等共同作用的结果。
总结来说,不同的减重手术(如胃旁路术和袖状胃切除术)虽然操作方式差别很大,但减重与控糖效果相近。关键并非只是吃得少、吸收少,而是对肠道—代谢轴的系统性重启。
肠道菌群、胆汁酸、激素信号和神经代谢网络共同协作,把机体从易胖、胰岛素抵抗的状态,切换回更健康、更稳定的能量代谢模式。
以上这些发现让我们意识到,我们可能一直在间接利用菌群的力量。这自然而然地将我们引向了糖尿病治疗的下一个前沿:与其依赖药物对菌群的附带效应,不如直接将肠道菌群作为干预的核心。接下来,我们将探索那些专门为此设计的创新途径。
FMT 是目前临床上应用最广泛且成功率最高的治疗方法之一,特别是在治疗艰难梭菌感染以及其他多种胃肠道疾病中表现突出。近年来,FMT 也被探索作为一种新型的神经系统、免疫系统及代谢性疾病(包括肥胖与2型糖尿病)替代疗法。
▸ 动物研究中,FMT显著成效
糖尿病小鼠实验:持续为糖尿病模型小鼠(db/db小鼠)移植健康人类的粪便菌群,能够改善它们的葡萄糖耐量和新陈代谢。
运动与饮食实验:从健康饮食并坚持运动的小鼠身上获取菌群,并将其移植给久坐不动的高脂饮食小鼠,可以改善后者的葡萄糖耐量并减少其脂肪堆积。
肠道内容物移植:将健康大鼠的小肠内容物移植到高脂饮食的大鼠体内,可以迅速改善其对葡萄糖的耐受能力,并减少葡萄糖的生成。
动物研究普遍表明,移植健康的肠道菌群能够有效改善代谢问题。
▸ 🧍♀️人体临床研究的:效果有限且短暂
关键研究案例: 在两项人类研究中,患有代谢综合征的男性受试者,接受了来自瘦型的健康捐赠者的FMT。
短期效果(6周后): 受试者的胰岛素介导的葡萄糖摄取能力得到改善,糖化血红蛋白(HbA1c)水平也下降了。这是一个积极的信号。
长期效果(18周后):然而,之前观察到的有益效果不再显著。
▸ 为什么在人类身上效果不佳?
▸ 未来的改进方向
为了让FMT成为治疗代谢疾病的可行方案,需要更精细化的策略:
优化方案:需要调整FMT的时间、重复和剂量。
联合疗法:将FMT与生活方式干预(如改变饮食、补充膳食纤维)相结合。
近期的两项临床试验证明,当FMT与饮食改变或膳食纤维补充相结合时,这种联合策略确实能改善肥胖或2型糖尿病患者的代谢结果。
个性化FMT:类似于个性化医疗,未来可能需要发展“个性化粪菌移植”。即根据每个患者的具体情况,精心挑选或设计最适合他们的菌群来进行移植。
谷禾也会根据肠道菌群检测报告为合作方提供相关指标,便于更好地筛选与匹配。
多项研究表明,在代谢性疾病(包括肥胖与2型糖尿病)的动物和人类模型中,补充益生菌可在急性及长期阶段均显著改善多项代谢指标。
在这里,介绍用产乳酸菌、产丁酸菌和特定物种Akkermansia muciniphila治疗2型糖尿病和其他代谢疾病状态的效果。
AKK菌|Akkermansia muciniphila
Akkermansia muciniphila(简称AKK菌)是一种革兰氏阴性菌,具有降解黏蛋白的能力,主要定植于肠道黏液层,并可在粪便样本中检测到。
肠道粘液层的主要成分是粘蛋白(Mucins),粘蛋白是一种富含糖基的结构蛋白,是肠道黏液层的重要组成部分,这也是Akk菌的“主食”。
AKK菌与健康的关系:绝大多数证据指向有益
大量研究发现,在啮齿动物与人类中,肥胖或2型糖尿病患者体内的Akk菌丰度都显著偏低;当其丰度减少时,常伴随炎症水平上升、肝脏脂肪变性以及胰岛素抗性增强。
有一项宏基因组学研究报告指出,AKK菌的增加与2型糖尿病相关,理由是它降解粘蛋白会破坏肠道粘液层的完整性。
更多的研究表明,AKK菌的丰度与更厚的粘液层和更低的肠道通透性(即更少的“肠漏”)正相关。它似乎能通过一种尚不完全明确的机制,刺激肠道中负责生产粘蛋白的杯状细胞数量增加,从而实现“越吃越有”的良性循环。
Akk菌如何发挥作用?
Akk菌的益处主要通过其菌体上的特定成分和它分泌的蛋白质来实现。
Akk菌外膜上的一种叫 Amuc_1100 的蛋白质。
作用过程: 这种蛋白质可以激活肠道细胞上的TLR2受体,进而调节一系列负责细胞连接的紧密连接蛋白(如Claudin 3,Occludin等)的表达。
最终效果: 这大大增强了肠道细胞间的连接,加固了肠道屏障。屏障加固后,肠道中的有害物质(如内毒素LPS)就难以泄漏到血液中,从而减轻了全身的低度炎症,最终改善胰岛素抵抗和血糖控制。
最近,科学家发现Akk菌还能分泌一种名为 P9 的新型蛋白质。
作用效果: 在小鼠实验中,P9被证实能够促进GLP-1(一种重要的降糖激素)的分泌,从而改善葡萄糖耐量。
研究发现,活的Akk菌和巴氏杀菌的Akk菌都有效,但高温彻底灭活(Heat-killed/Autoclaved)的Akk菌则无效。
原因在于:巴氏杀菌的温度(约70°C)足以杀死细菌,但不会破坏关键蛋白Amuc_1100的结构和活性。而更高的灭菌温度则会使其变性失效。这为开发安全的菌剂产品提供了重要依据。
🧍♀️人体临床证据
Akk菌的益处已经在人体上得到初步验证。
安全性:早期的临床研究证实,无论是活菌还是巴氏杀菌的Akk菌,对人体都是安全且耐受性良好的。
有效性: 在一项针对代谢综合征患者的研究中,与安慰剂组相比,服用巴氏杀菌Akk菌的患者出现了显著的积极变化:
►▷
综合来看,上述动物与早期临床研究一致显示:
AKK菌的干预可重建肠道屏障完整性、降低代谢炎症并改善血糖稳态,提示该菌株具有成为治疗肥胖与2型糖尿病的潜在候选益生菌的巨大应用前景。
产丁酸菌
产丁酸菌并非单一菌种,而是一个庞大的功能性菌群。产丁酸菌是一类能够在厌氧环境下、通过发酵多种底物产生丁酸的肠道共生菌群。
★ Faecalibacterium prausnitzii
F. prausnitzii 是一种严格厌氧、产丁酸的共生菌,在小鼠与人类结肠中含量丰富。
为什么它如此重要?(关联性证据)
研究发现,2型糖尿病患者体内 F. prausnitzii 的丰度显著降低,而在接受减重手术后,该菌丰度显著增加,且与炎症标志物水平呈显著负相关。
这一系列发现表明,F. prausnitzii 可能通过减少肠道炎症、增强肠屏障完整性、改善代谢性内毒症,从而发挥潜在益生作用。
它如何发挥作用?
在结肠炎小鼠模型中,给予 F. prausnitzii 或其上清液,可显著增加肠上皮紧密连接蛋白表达,并降低炎症性细胞因子水平。
一个关键的发现是:单独使用丁酸,其抗炎效果远不如用F. prausnitzii的培养上清液。这说明,F. prausnitzii的益处并不仅仅来自于丁酸,它还分泌其他抗炎的有益物质。
研究人员后来确实鉴定出了一种由F. prausnitzii产生的“微生物抗炎分子”(microbial anti-inflammatory molecule, MAM),这种分子能够修复糖尿病小鼠的肠道屏障功能,并上调紧密连接蛋白表达。
给予F.prausnitzii可以改善啮齿动物的葡萄糖稳态,并且对2型糖尿病患者进行GLP-1RA治疗可以增加粪便中F.prausnilzii的丰度,这与空腹血糖呈负相关。
虽然目前尚无直接临床试验验证F. prausnitzii 在血糖调节中的疗效,但近期一项研究已证实,其长期补充在人体中是安全且可耐受的,并已启动相关的临床试验以进一步评估其作为下一代益生菌的潜力。
★ Anaerobutyricum soehngenii
这个菌它最初是在一项粪菌移植临床试验中引起关注的。研究者观察到,Anaerobutyricum属增加与受试者胰岛素敏感性改善密切相关。
动物实验:给糖尿病小鼠补充 A. soehngenii 可显著提高粪便中丁酸及次级胆汁酸水平,增强胰岛素敏感性,提升能量消耗。
🧍♀️人体临床试验:两项针对代谢综合征人群的临床试验表明,A. soehngenii 的口服或十二指肠输注均安全且耐受良好;单次十二指肠灌注实验显著提升GLP-1水平,并改善胰岛素分泌与敏感性。
►▷
无论是F. prausnitzii还是A. soehngenii,它们的益处是多方面的,不仅仅是生产丁酸,还包括分泌其他抗炎分子和调节宿主激素(如GLP-1)。这些产丁酸菌的研究都凸显了它们作为治疗代谢疾病的新型疗法的巨大潜力。
产乳酸菌
产乳酸菌是一类耐酸的革兰氏阳性菌,通常不具运动性,主要通过发酵碳水化合物产生乳酸作为主要代谢产物。乳酸是厌氧呼吸中的重要代谢物,既是宿主能量代谢中关键的中间产物,也可作为底物被其他肠道菌群利用以产短链脂肪酸。
明星成员: 其中最著名、研究最广泛、应用最普遍的就是乳杆菌属和双歧杆菌属的成员。
动物研究,效果显著
在啮齿类动物模型中,补充多种乳酸生成菌可显著带来以下代谢益处:
在多项研究中,使用以下菌株治疗,显著改善小鼠的血糖控制:
乳杆菌属
双歧杆菌属
核心作用机制:巧妙抑制FXR信号,促进GLP-1分泌
产乳酸菌改善血糖的机制相当精妙,其中一个核心通路与胆汁酸受体FXR有关:
1
分泌“胆盐水解酶” (BSH)
许多乳杆菌能产生一种叫做“胆盐水解酶”的工具。
2
分解胆汁酸
胆盐水解酶这个工具可以将“结合型胆汁酸”分解为“游离型胆汁酸”。
3
抑制肠道FXR活性
“游离型胆汁酸”激活肠道FXR受体的能力较弱,因此,这一过程的最终结果是降低了肠道FXR信号的整体活性。
4
解放GLP-1
关键点来了,肠道中的FXR受体被激活时,会抑制GLP-1(一种重要的降糖激素)的分泌。因此,当产乳酸菌抑制了FXR后,就相当于解除了对GLP-1的束缚,从而促进了GLP-1的释放,改善了血糖控制。
双重协同作用:抑制FXR还能增强短链脂肪酸诱导GLP-1分泌的效果。同时,某些产乳酸菌自身也能促进丁酸等短链脂肪酸的产生。这种 抑制FXR + 增加短链脂肪酸的协同作用,可能共同放大了GLP-1的分泌。
🧍♀️ 人体临床研究,好坏参半
与动物实验的普遍成功形成鲜明对比,产乳酸菌在人体临床试验中的表现,结果好坏参半:
☺一项研究显示,包含多种产乳酸菌的复合益生菌产品,相比安慰剂,能够降低2型糖尿病患者的糖化血红蛋白(HbA1c)和空腹血糖。
☺另一项研究发现,单独使用植物乳杆菌也能降低餐后血糖和HbA1c。
☹ 然而,与安慰剂对照组相比,补充罗伊氏乳杆菌、嗜酸乳杆菌或乳双歧杆菌并没有显著改善健康或糖尿病患者的血糖控制或胰岛素敏感性。
☺一个值得注意的细节是,在一项研究中,乳双歧杆菌(B. lactis)虽然没有改善代谢综合征患者的指标,但成功维持了他们的胰岛素敏感性,阻止了其进一步恶化。
鉴于在糖尿病患者体内,许多产乳酸菌(尤其是双歧杆菌)的数量有所减少,那么通过“缺啥补啥”的思路来恢复它们的水平,理论上应是一种有前景的治疗方法。
然而,现有的人体临床证据有限,乳酸菌对改善代谢性疾病的作用不足,因为每个人的饮食、基线肠道菌群和疾病表现都千差万别(即高度异质性),想用标准化的益生菌对所有人都产生效果,是不容易的。因此,益生元等可以增加整体微生物群的多样性和丰富性,而不是单一细菌,这可能会为更广泛的人群提供更有效的治疗选择。
2型糖尿病的治疗策略
doi.org/10.1146/annurev-physiol-051524-094728
益生元被定义为:“能够被选择性发酵,并导致胃肠道微生物群组成和/或活性产生特定变化,从而对宿主健康带来益处的成分。”
简单来说,一种物质要被称为“益生元”,必须满足苛刻的条件:
基于这些标准,许多食物或成分都可以被归入益生元的范畴。在众多候选物质中,当前研究最为集中、并在糖尿病治疗中表现出潜在疗效的包括几类新型功能性益生元。
菊粉型果聚糖(ITFs)
菊粉型果聚糖(ITFs)——主要包括菊粉(inulin)、低聚果糖(OFS)和果寡糖(FOS),它们本质上是一类由果糖分子链组成的不可消化性碳水化合物。能够被肠道细菌发酵利用,从而促进宿主健康。
它们如何发挥作用?—— 多途径、多靶点的系统工程
核心作用:精准“施肥”,优化菌群
机制一:放大GLP-1信号,控制血糖
这是菊粉型果聚糖改善血糖的核心途径。
证据: 益生菌(特别是双歧杆菌)利用菊粉型果聚糖作为底物,发酵产生短链脂肪酸,如乙酸和丁酸。而短链脂肪酸是已知的肠道L细胞分泌GLP-1的强效刺激剂。
铁证: 在GLP-1受体被基因敲除的小鼠中,或者在使用了GLP-1受体拮抗剂的小鼠中,菊粉型果聚糖带来的所有降糖益处都完全消失了。这证明了GLP-1通路在其中的决定性作用。
菊粉型果聚糖也能显著提高人和动物的餐后GLP-1水平。
机制二:激活GLP-2信号,修复肠道屏障
GLP-2可以看作是GLP-1的兄弟,它主要负责维持和修复肠道屏障的完整性。
研究发现,补充菊粉型果聚糖能够增加内源性GLP-2的分泌。如果在小鼠中阻断GLP-2受体,那么菊粉型果聚糖带来的修复肠道屏障、抗炎等益处也大部分会消失。
机制三:调节内源性大麻素系统
这是一个更深层的机制。菊粉型果聚糖诱导的菌群变化(或AKK菌的增加)能够调节肠道的内源性大麻素信号系统(endocannabinoid),增加2-棕榈酰甘油(2-palmitoylglycerol)、2-油酰甘油(2-oleoylglycerol)和2-花生四烯酰甘油(2-arachidonoylglycerol);降低花生酰胺(anandamide)水平;进而增强肠道屏障功能,减少LPS泄漏。
🧍♀️ 人体临床证据
虽然不是所有研究都报告了积极结果,但大量的临床试验已经证实了菊粉型果聚糖在人体中的益处:
►▷
菊粉类果聚糖代表了一种非常有前景的、非侵入性的2型糖尿病治疗方案。它不像直接补充益生菌那样面临能否存活和定植的问题,而是通过为体内已有的有益菌(如Akk菌和双歧杆菌)提供精准的养料,激发一连串有益的生理反应——核心是驱动GLP-1和GLP-2的分泌,最终达到控制血糖和修复肠道屏障的双重目的。
其他膳食纤维
首先,一个基本共识是:增加膳食纤维的摄入量,能显著降低患上肥胖和2型糖尿病的风险。
膳食纤维主要分为两大类:
🧬 植物来源的主要可溶性纤维包括:
然而,研究发现,不同可溶性纤维的效果差异很大,这取决于纤维的用量、食物来源、补充方式(是直接吃食物还是吃提纯的纤维补充剂)等因素。
几种可溶性纤维的表现:
🧪 β-葡聚糖—— 全能选手
来源: 主要存在于燕麦和大麦中。
一项对比研究发现,在高脂饮食中添加富含β-葡聚糖的大麦粉,能增加肠道丁酸、改善血糖。但如果直接添加提纯的β-葡聚糖纤维,同样能改善代谢。这表明β-葡聚糖本身就是强效的功能成分。
⁎ 作用机制
无论是动物还是人体研究,都强有力地支持β-葡聚糖作为一种益生元,在改善血糖和治疗代谢疾病方面具有巨大潜力。
🌽 抗性淀粉—— 瞒过小肠的特工
抗性淀粉它本质上是淀粉,但由于其特殊的结构,能抵抗小肠的消化,完整地到达结肠,成为微生物的食物。
来源:冷却的米饭、土豆、未完全成熟的香蕉等。
⁎ 作用机制(与β-葡聚糖类似):
🧍♀️ 人体证据
在患有代谢综合征和2型糖尿病的人群中,补充抗性淀粉(特别是2型抗性淀粉,如高直链玉米淀粉)能够改善胰岛素敏感性并降低空腹血糖,同时也能观察到短链脂肪酸产量的增加。
一个有趣的发现:补充高直链玉米淀粉会特异性地增加双歧杆菌的丰度,而双歧杆菌正是一种擅长发酵抗性淀粉的细菌。
🍎 果胶 —— 机制独特
来源: 广泛存在于水果中,如苹果、柑橘等。
⁎ 作用机制(与其他不同):
►▷
简而言之,膳食纤维是“好菌的食物,也是代谢的调节器”:当你吃更多含纤维的天然食物(燕麦、豆类、全谷、蔬果),肠道菌群就会发酵产出丁酸等代谢产物,能修复肠道、提升GLP-1分泌、降低炎症、帮助降糖。β-葡聚糖与抗性淀粉尤其被视为下一代代谢健康促进纤维,未来可能成为糖尿病膳食疗法的核心成分。
合生元是一种同时包含益生菌和益生元的产品。
这个设计的初衷是,通过提供益生菌最喜欢吃的益生元,来帮助它在复杂的肠道环境中更好地存活、定植并发挥作用。
鉴于益生菌能产生短链脂肪酸,而益生元是产生短链脂肪酸的代谢前体物质(原料),那么将两者结合,应能够协同增加短链脂肪酸的产生,从而对代谢健康产生比单独使用任何一种都更强大的益处。
🧬 合生元的常见组合
双歧杆菌/乳杆菌 + 低聚糖/膳食纤维
这种组合的设计理念是:由益生元提供底物,使益生菌能够在肠道定植并活跃代谢,从而增强肠道生态修复与宿主代谢调节效应。
并未实现“1+1 > 2”的突破
动物与人体研究均表明,补充益生元或益生菌本身即可带来代谢性益处,合生元干预能够改善肠道菌群生态与增加粪便SCFA含量。然而,在大多数研究中,联合应用(合生元)并未显示出明显优于单独使用益生元或益生菌的效果。
为什么这个看似完美的策略效果不理想?
研究人员认为是由于缺乏精准匹配,也就是说大多数研究在设计合生元产品时,只是想当然地将一种常见的益生菌和一种常见的益生元组合在一起,但未能首先验证,这个益生菌是否真的喜欢吃、并且能高效利用配给它的那个益生元。
这并不意味着合生元的理念是错误的,而是说明我们的执行方式需要更加科学和严谨。
改进:在进行昂贵且复杂的人体临床试验之前,必须增加一个关键的验证步骤:
►▷
合生元的概念本身极具潜力,但需确保益生菌和益生元是真正的天作之合,这种“1+1>2”的协同效应才会在临床上有更好的效果。这要求我们对菌株和底物的特性有更深入的了解和更严格的前期验证。
外源化合物(Xenobiotics)被定义为:“在机体内非天然存在的外来化学物质。”这个范畴非常广泛,从化妆品、药物到膳食补充剂中的成分都可能属于外源物。
前文已提到二甲双胍(metformin)与GLP-1受体激动剂(GLP-1RA)的降糖作用同样被认为与肠道微生物介导机制相关,而这些药物本质上也属于外源化合物的范畴。
虽然很多外源物对健康有害,但我们这里聚焦的是那些有益的外源物,重点分析两种备受关注的有益外源物:多酚和小檗碱。
多 酚 类 化 合 物 (Polyphenols)
多酚是一大类存在于植物中的化合物,如白藜芦醇、类黄酮等。
多酚类化合物是植物来源的次级代谢物,主要包括:
这些分子既能调节肠道微生物群结构,也能改善2型糖尿病的多种代谢指标。
💊白藜芦醇(Resveratrol)
白藜芦醇是多酚中研究最为深入的代表性化合物之一。
来源: 葡萄皮、红酒、花生等。
它可显著改善胰岛素敏感性、葡萄糖稳态、血脂水平、高血压等。但它的生物利用度很低,口服后能进入血液循环的量很少,而且大部分还和蛋白质绑定,无法发挥活性。
那它是如何起作用的?
答案指向了肠道。
口服有效。 多项研究发现,口服白藜芦醇可以改善小鼠的血糖,但腹腔注射(绕过了肠道)则无效。这有力地证明了它的作用点在肠道内。
口服补充剂也有益地改变了啮齿动物的肠道微生物组,降低了厚壁菌门/拟杆菌的比例,增加了Akk菌、双歧杆菌和乳杆菌的丰度,这与改善葡萄糖稳态和炎症标志物有关。
最终证据——粪菌移植: 将服用过白藜芦醇的小鼠的粪菌移植给普通高脂饮食的小鼠,后者也出现了血糖改善的效果。
🧍♀️ 人体临床研究
尽管研究尚少,但已有临床试验发现,补充白藜芦醇可以增加代谢综合征男性体内的AKK菌,并轻微改善血糖。
💊 黄酮类化合物(Flavonoids)
除白藜芦醇外,黄酮类化合物也能增加肠道有益菌数量,并改善葡萄糖耐受性、抑制炎症反应、增强肠屏障功能。
来源: 广泛存在于各种水果、蔬菜、茶中。
动物实验研究
在高脂饮食诱导的肥胖或糖尿病小鼠模型中:
蔓越莓提取物可提高胰岛素敏感性、降低HOMA-IR与循环内毒素(LPS)水平;同时伴随AKK菌丰度显著上升与肠屏障完整性增强。
蓝莓原花青素含有丰富的花青素与原花青素,同样可改善葡萄糖耐受;增加AKK菌含量;并增厚胃肠道黏液层。
苹果原花青素处理高脂饮食小鼠时,也观察到一致的结果:肠道屏障功能及AKK菌丰度同步提升。
这些研究揭示不同植物来源的黄酮类多酚均通过促进有益菌的富集和黏液层重塑,实现改善肠屏障与系统代谢功能的作用。
🧍♀️ 人体及体外研究证据
尽管人群中关于单独考察黄酮类化合物作用的临床研究仍然有限,但已有体外模拟与部分干预研究提供了支持性证据:
红酒葡萄提取物或红茶多酚在人体肠道模拟模型中均能增加AKK菌的丰度。
可可黄烷醇则在健康人群中可显著增加双歧杆菌和乳杆菌的数量,表明其对肠道菌群结构也具有积极调节作用。
综上,黄酮类化合物以其独特的双重功能而受到关注:
这些作用共同促进了葡萄糖代谢与胰岛素敏感性的改善,为其作为代谢性疾病营养干预的潜在候选物提供了有力依据。
小 檗 碱
来源: 黄连、黄柏等中草药的主要活性成分。
小檗碱可以直接作用于肝细胞,激活AMPK(一个关键的能量代谢开关),从而改善血糖(增强胰岛素敏感性与葡萄糖稳态控制)。但它的口服生物利用度同样很低。
小檗碱是否进入循环系统,依赖肠道菌群
小檗碱只有在被肠道菌群代谢为更易吸收的衍生物后,其药效才能被充分发挥。
——肠道菌群:加工
肠道菌群能将小檗碱转化为更容易被人体吸收的形式,帮助它进入血液循环。
例如,某些肠道细菌可将小檗碱还原为二氢小檗碱,这种形式在肠上皮中的吸收效率更高,随后可重新氧化为小檗碱并在全身循环中发挥作用。
——肠道菌群:效应放大器
动物实验表明,口服(而非注射)小檗碱能增加肠道产丁酸菌的数量和丁酸产量,并改善空腹血糖。这说明小檗碱的另一部分功效是通过调节菌群-丁酸实现的。
临床研究与争议
动物研究:在动物模型中,小檗碱改善血糖的机制似乎与增加GLP-1/GLP-2、增加次级胆汁酸(DCA)从而激活TGR5受体、增加SCFA产量等有关。这是一个非常清晰、正面的通路。
人体研究的反转:迄今为止唯一一项相关的糖尿病人体研究却得出了矛盾的结果:小檗碱使血液中次级胆汁酸和有益的产短链脂肪酸菌的显著下降了,但同时它确实又显著降低了患者的糖化血红蛋白。
这凸显了小檗碱作用机制的复杂性。小檗碱确实是一种有效的降糖物质,但它究竟是如何通过菌群在人体内发挥作用的,远比我们想象的要复杂,目前仍是一个充满争议和未解之谜,其肠道依赖机制亟需更多临床研究验证来阐明。
►▷
小檗碱就像一个“需要肠道助手的药”:它自己难以被吸收,但一旦被肠道菌群“加工”成可利用的形式,便能帮助调节血糖、减少炎症、修复肠屏障。不过,因为每个人肠道菌群不同,它在不同人身上可能表现出截然不同的效果。
尽管大量动物研究已明确证实,肠道菌群在血糖稳态调控中扮演着核心角色,但将这些发现直接转化为对人类有效的通用疗法却挑战重重。其根本原因在于人类肠道菌群的复杂性与高度个体化。
这种个体差异正是许多干预措施(如益生元或益生菌)效果因人而异的关键。
益生元:当人们吃下富含β-葡聚糖的特制大麦面包后,只有一部分人的代谢状况得到了改善。科学家检查后发现,这些“有效者”在干预开始时,体内就存在着“无效者”所缺乏的特定肠道细菌。是这些细菌帮助他们更好地利用了膳食纤维。
益生菌:吃下益生菌,不代表它们就能在你的肠道里安家落户,一项研究发现,11种常见益生菌能否成功在肠道定植,取决于每个人已有的菌群构成。
既然每个人都是不同的,那么治疗方案也必须因人而异,兼顾菌群个体差异与动态变化。这个“个性化”会是什么样子呢?
比如,个性化饮食算法,这个算法不仅分析一个人吃了什么,更整合了这个人肠道菌群数据、血液指标等多种参数。这样不仅可以预测这个人吃下特定食物后的血糖反应,更能反过来为他量身定制一套可以最大程度平稳餐后血糖的个性化饮食方案。
在糖尿病前期人群中,通过整合基线菌群特征,机器学习模型,也能预测哪些患者能通过什么样的运动有效改善血糖,而哪些患者则收效甚微。
简而言之,要让基于微生物群的疗法真正在人体中奏效,我们需要摆脱“一刀切”的思路,而是把每个人的肠道菌群当作独特的生态系统。未来的糖尿病干预,可能需要“定制化的微生物处方”:先读取你的菌群模式,再精准投喂适合的菌与食物,让微生物群自己帮你稳糖、抗炎、调代谢。
深入理解并善用
每个人的独有菌群信息
将是我们开启
代谢疾病精准治疗
新时代大门的钥匙
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献
Weninger, Savanna N., Andrew Manley, and Frank A. Duca. “Managing Glucose Homeostasis Through the Gut Microbiome.” Annual Review of Physiology 88 (2025).
Howard, Elizabeth J., Tony KT Lam, and Frank A. Duca. “The gut microbiome: connecting diet, glucose homeostasis, and disease.” Annual review of medicine 73 (2022): 469-481.
Cho, Hyoung-Soo, et al. “Structure of gut microbial glycolipid modulates host inflammatory response.” Cell 188.19 (2025): 5295-5312.
Sun, Hanxiao, et al. “GLP‐1 receptor agonists alleviate colonic inflammation by modulating intestinal microbiota and the function of group 3 innate lymphoid cells.” Immunology 172.3 (2024): 451-468.
Su, Lili, et al. “Health improvements of type 2 diabetic patients through diet and diet plus fecal microbiota transplantation.” Scientific reports 12.1 (2022): 1152.
Anhê, Fernando F., et al. “Metabolic endotoxemia is dictated by the type of lipopolysaccharide.” Cell reports 36.11 (2021).
Baroni, Irene, et al. “Probiotics and synbiotics for glycemic control in diabetes: A systematic review and meta-analysis of randomized controlled trials.” Clinical Nutrition 43.4 (2024): 1041-1061.

谷禾健康
在过去几十年中,人类的饮食行为发生了巨大的变化。传统的早餐-午餐-晚餐模式已被频繁的小吃、夜间大餐和不吃早餐所取代。这种不规律的饮食模式可能对心血管代谢疾病风险产生不利影响,如肥胖、胰岛素抵抗、高血糖症、2型糖尿病等。
间歇性禁食已被越来越多的人认为是一种有前途的治疗心血管代谢疾病(CMD)的方法。一些神经科学家认为,我们的身体已经进化到能够不吃东西几个小时,甚至几天。
进食时机和频率可以一定程度上改善生活方式和心血管代谢,防止2型糖尿病和心血管疾病的发生。
间歇性禁食(IF),包括周期性禁食和限时饮食(TRF)等开始越来越流行。

本文讨论肠道微生物组的组成和功能改变,对代谢、高血压、2型糖尿病、肥胖症及其长期微血管和大血管并发症发展的风险之间潜在联系的新证据,同时也包括间歇性禁食的安全性,将间歇性禁食融入日常生活的建议等。
本文关键词

间歇性禁食在进食和禁食之间循环,通常是只能在特定时间进食,比如通过每周12小时至几天的限制进食。它关注的不是吃什么,而是在什么时间段内可以吃。
在食物缺乏的时间内,人体新陈代谢通过产生和利用脂肪酸衍生的酮,以及通过自噬增加细胞水平的营养循环,将脂肪从储存转换到动员。
注:脂肪动员是指储存在脂肪细胞中的脂肪,被脂肪酶逐步水解为游离脂酸(FFA)及甘油并释放入血液,被其他组织氧化利用的过程。
目前已有许多研究表明,间歇性禁食在减轻体重、改善葡萄糖稳态和血脂以及抗炎作用等方面都带来益处。
间歇性禁食包括以下几种常见的方式:
隔日禁食(ADF)
在某一天规律进食和第二天不进食之间进行交替。
周期性禁食(5:2天)
5:2天的进食也称为周期性禁食,其特征是一周两天极度限制或完全禁食,而一周其他五天可以不受限制地进食。
模拟禁食的饮食(FMD)
定期禁食的一种变体,特点是连续几天低热量摄入周期,然后每一到四个月或每隔一周进行一次正常的饮食循环。
限时饮食(TRF)
不那么极端的饮食,将每天的食物摄入量限制在4-12小时内,例如,分别在12:12小时或16:8小时(禁食:进食),包括斋月期间的禁食。
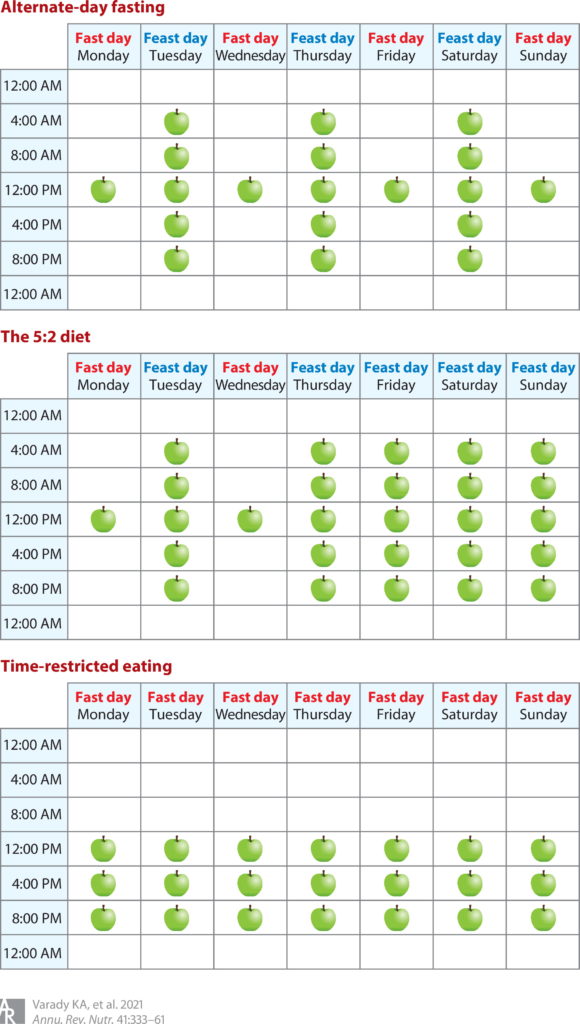
此图概述了一周中每一天的隔日禁食、5:2 饮食和限时进食 (TRE)(此处显示 8 小时 TRE)期间的食物摄入时间。食物摄入时间用苹果图标表示。
临床上对间歇性禁食的研究结果不一致:
几项临床研究表明,间歇性禁食可延长预期寿命并提供广泛的益处,包括减轻肥胖、高血压、2型糖尿病和心血管疾病。
然而,其他研究发现,特定时间的饮食在改善心血管和代谢结果方面并不优于控制能量的饮食。
因此,禁食和进食期间代谢转换的机制值得进一步研究。
最近,间歇性禁食已被证明会影响肠道菌群,几乎涉及宿主生理学的所有方面,这表明间歇性禁食生理影响的全新机制。
人类研究中,关于禁食对肠道菌群的影响

Angoorani P, et al.,Nutr Metab (Lond). 2021
本小节重点介绍一些关于肠道微生物组在间歇性禁食中作用的显著发现,肠道微生物组反过来影响心血管疾病相关的代谢表现,如肥胖、高血糖、高血压等。
我们知道,体重增加是由于过多的能量摄入加上较低的能量消耗,这通常是由体内脂肪的积累造成的。脂肪积累会对心血管系统造成严重的威胁。
关于肥胖与菌群的关系详见我们之前的文章:
体重增长:目前为止我们所知道的一切(更新你的减肥工具箱)
对人体随机对照试验的Meta分析表明,每周定期禁食2-3天的间歇性能量限制可改善超重和肥胖使体重减轻,降低体脂。这些改善的重要贡献可归因于肠道微生物群对脂质代谢和能量平衡的影响。
其中一种机制涉及脂肪组织,这是一种对营养刺激敏感并在间歇性禁食期间经历动态重塑的异质器官。
在哺乳动物中发现了两种不同形式的脂肪组织:
▸ 肠道菌群在隔日禁食介导的代谢改善中具有因果作用
喂食高脂肪食物并接受隔日禁食方案的肥胖小鼠在WAT中表现出白色脂肪积累增加,同时伴有体重减轻和肠道微生物组组成改变。
值得注意的是,向接受隔日禁食的肥胖小鼠补充抗生素消除了隔日禁食的有益代谢作用,并且将 隔日禁食小鼠的粪便移植到抗生素治疗的肥胖小鼠的粪便改善了代谢健康,表明肠道微生物组在隔日禁食介导的代谢改善中具有因果作用。
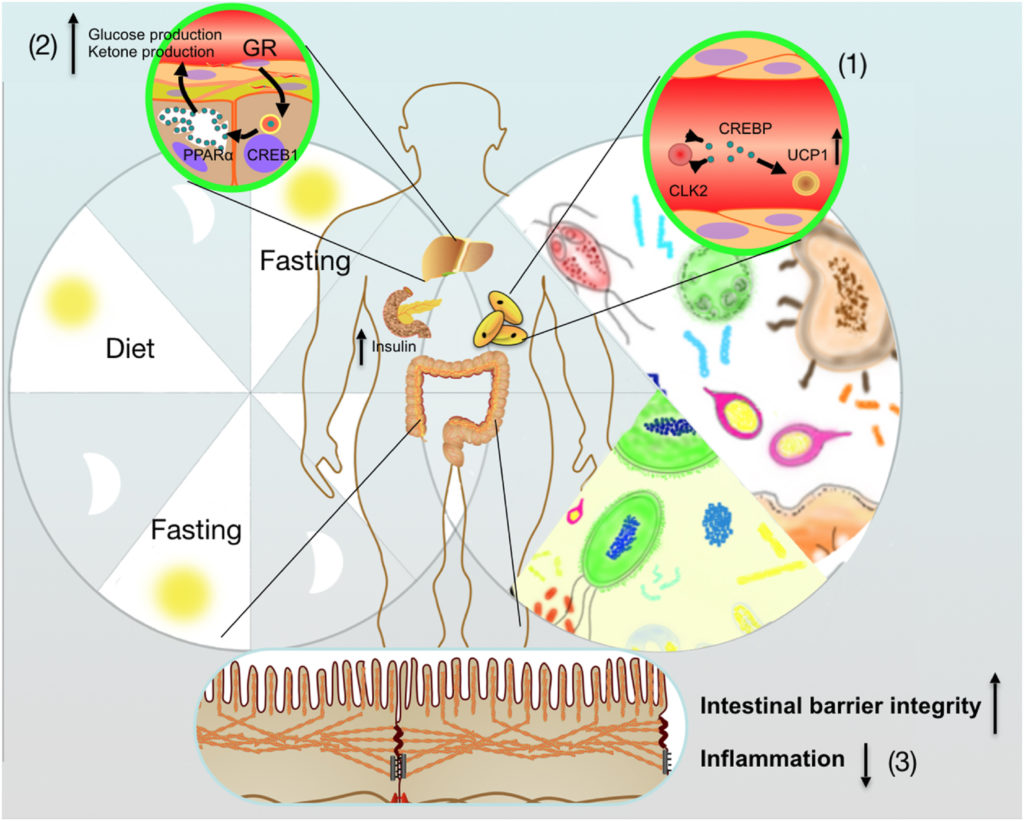
间歇性禁食介导的肠道微生物群调节宿主能量代谢的积极作用
Rong B, et al.,Anim Nutr. 2021
(1) 间歇性禁食通过改善肠道菌群,促进WAT米色脂肪组织
(2) 在不摄入营养期间,肠道微生物群参与增加肝酮的产生
(3) 间歇性禁食优化的微生物群还负责保护宿主肠道屏障
▸ 隔日禁食诱导多种肠道细菌产生乙酸和乳酸
将盲肠代谢组学与Shotgun宏基因组学相结合,发现隔日禁食会导致肠道微生物群的组成发生变化,从而导致产生乳酸和乙酸的细菌(如罗伊氏乳杆菌)发生变化,进而导致血清乳酸和乙酸的积累。
关于罗伊氏乳杆菌详见:认识罗伊氏乳杆菌(Lactobacillus reuteri)
隔日禁食还通过促进米色脂肪生成来增加能量消耗,并改善体重增加和其他代谢紊乱。
在另一项研究中,仅在喂食正常饲料的小鼠中,乳酸杆菌水平在隔日禁食喂养的小鼠身上重复升高,而Allobaculum属则只在隔日禁食和高脂肪饲料的小鼠中富集。Allobaculum属是一种活性的葡萄糖代谢产物,能产生丁酸盐和乳酸盐。
这些结果表明,隔日禁食诱导多种肠道细菌产生乙酸和乳酸。然而,还需要更多的研究来确定乳酸和短链脂肪酸对WAT褐变以及对宿主产热和能量消耗的影响。
肠道微生物群的变化除了影响脂肪细胞产热之外,也可能影响适时进食过程中的脂质摄取。
控制宿主昼夜脂质吸收可能通过以下几种机制发生:
▸核因子白细胞介素-3 (NFIL3)的调节
核因子白细胞介素-3是一种受昼夜节律控制的转录因子,调节参与肠上皮细胞中脂质的摄取、加工和储存的基因的节律性表达。
NFIL3中的节律振荡由肠道微生物组通过激活先天免疫细胞反应驱动。
▸组蛋白脱乙酰酶3(HDAC3)的调节
刺激HDAC3的节律性表达和向染色质招募导致肠上皮组蛋白乙酰化的同步昼夜振荡,这反过来调节营养转运蛋白的基因表达,从而影响营养物质摄取和脂质吸收。
总的来说,肠道微生物群通过调节控制脂质和营养摄入的基因,以及通过产生影响脂肪组织的微生物代谢物来影响能量代谢。
间歇性禁食导致肠道微生物组分和功能的改变,这反过来可能影响心血管代谢健康
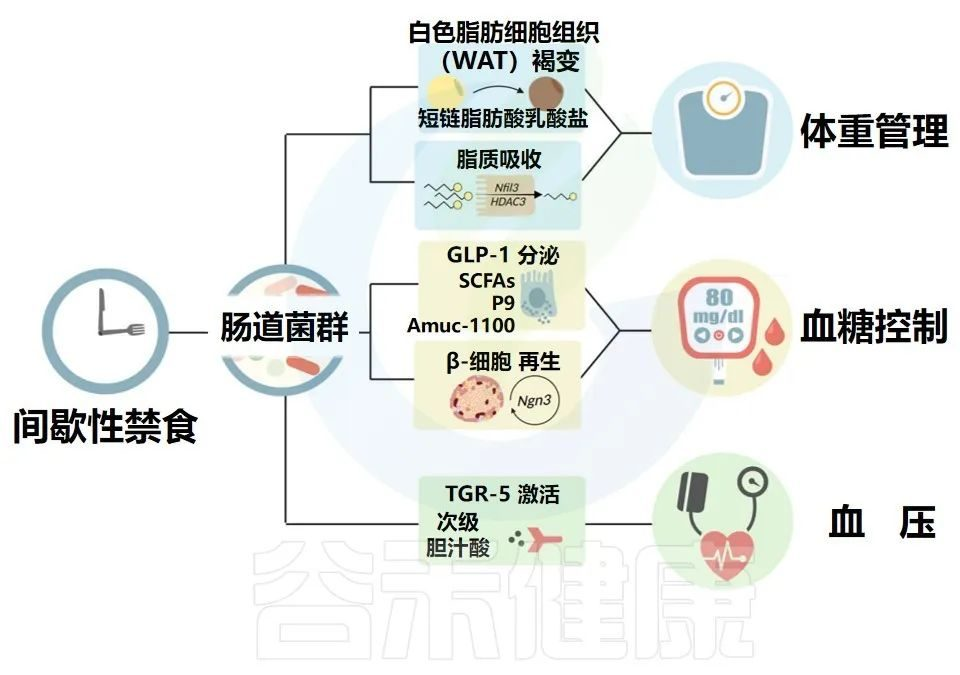
Karina R,et al.Rev Art Jou of Dia.2022
肠道微生物群驱动的WAT褐变和脂质吸收有助于体重管理。微生物通过GLP-1分泌和β细胞再生对血糖控制的影响。
微生物衍生的次级胆汁酸激活TGR-5以控制血压。
对啮齿动物和猴子的研究表明,间歇性禁食对血糖控制具有持续的有益作用。
肠道微生物组分与血糖水平相关,并适应日常生活中的禁食和再喂养期,包括昼夜饮食模式和限时饮食(例如,作为宗教禁食的一部分)。
在小鼠中,乳酸杆菌属在禁食期间高度富集,而Akkermansia muciniphila在喂养期间高度富集。除了昼夜变化外,A. muciniphila在接受限时饮食的人和小鼠体内都显著扩增。
▸A. muciniphila的增加如何在血糖控制中发挥作用?
这些成分的变化很有趣,因为A. muciniphila 与啮齿动物和人类的血糖水平呈负相关。
此外,A. muciniphila的增加与GLP-1的分泌增强有关,GLP-1是一种促胰岛素激素,由肠内分泌L细胞分泌,对膳食作出反应,并在全身血糖控制中发挥关键作用。
▸ 微生物群的昼夜变化 & GLP-1的昼夜分泌
GLP-1的分泌遵循昼夜节律,在活动期葡萄糖负荷后,餐后GLP-1水平较高,而在静息期,GLP-1水平较低,此外还受L细胞时钟机制的调节。
在喂食西方饮食的肥胖小鼠和缺乏微生物组的小鼠中,GLP-1的波动性分泌减弱。这项研究表明,通过将食用正常食物的常规小鼠的粪便微生物群转移到肥胖小鼠中,可以恢复无菌小鼠GLP-1的昼夜节律。
间歇性禁食、肠道微生物群和昼夜节律之间的多向关系
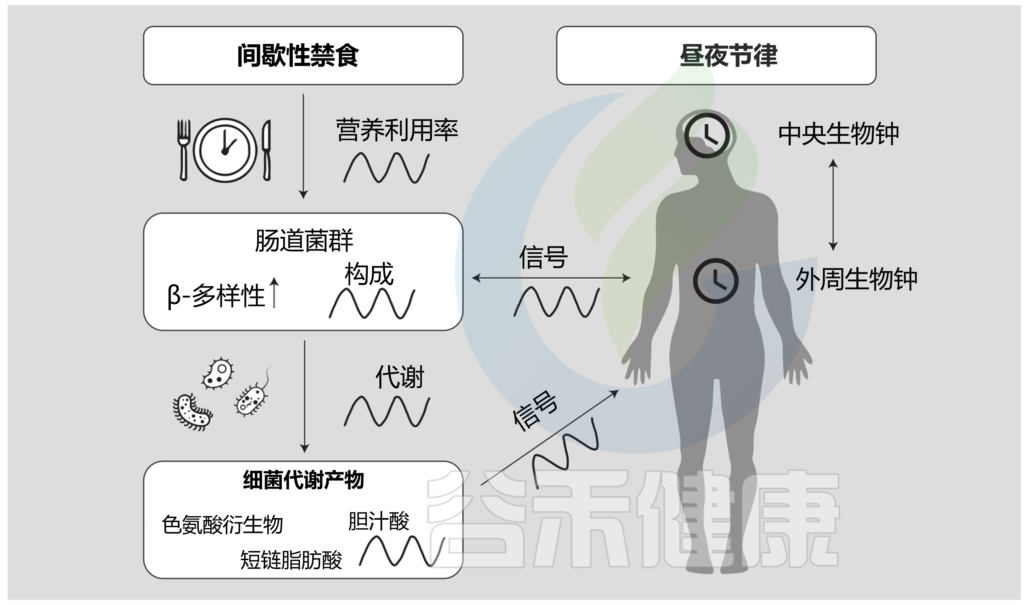
Daas MC, et al.,Benef Microbes. 2021
这些结果表明,微生物群的昼夜变化可能在GLP-1的昼夜分泌及其对葡萄糖稳态的后续影响中起着核心作用。至于机制,最近的研究已经确定了由A. muciniphila产生的几个假定的生物分子,它们可以触发肠L细胞分泌GLP-1。其中,丙酸盐和蛋白P9和Amuc-1100可刺激L细胞分泌GLP-1。
▸ 间歇性禁食改善血糖调节和2型糖尿病
给予肥胖和高血糖小鼠或缺乏瘦素受体的糖尿病db/db小鼠间歇性禁食或模拟禁食的饮食(FMD),可分别改善血糖控制和2型糖尿病。
模拟禁食的饮食有益于葡萄糖稳态的一个主要潜在机制包括神经生长素3(Ngn3)的激活,Ngn3是产生胰岛素的β细胞发育所必需的转录因子。β细胞的再生发生在暴露于间歇性模拟禁食的饮食后,并表明其遵循肠道微生物群的重组,这与db/db小鼠的血糖水平相关。
根据粪便微生物群的16S rRNA测序,
模拟禁食的饮食增加了下列菌的丰度:
模拟禁食的饮食降低了下列菌的丰度:
这与低血糖水平相关。
在此背景下,发现在模拟禁食饮食中具有较高丰度的Blautia,在糖尿病大鼠经2型糖尿病药物治疗后相对增加。
总之,营养时间对肠道微生物群、GLP-1分泌以及β细胞增殖的影响可能有助于改善血糖控制和胰岛素敏感性,从而为基于饮食和微生物群的2型糖尿病治疗潜力提供理论基础。与间歇性禁食对啮齿动物β细胞再生的影响一致,人类随机临床试验表明,与每日热量限制的匹配组相比,定期禁食(5:2饮食)对空腹胰岛素的影响更为显著。
有几个迹象表明,间歇性禁食和进餐时间可能有助于改善小鼠和人类的高血压。
不过间歇性禁食的有效性仍有争议,但DASH饮食(阻止高血压的饮食方法)提供了一种可以降低高血压的低钠饮食。
最近的一项研究表明,在高血压代谢综合征患者中,五天禁食后进行改良DASH饮食可以降低收缩压。
▸ 五天禁食通过改变肠道菌群影响血压
这种禁食还改变了肠道微生物群,包括一些与短链脂肪酸产生相关的菌群和基因。
使用对基线微生物组数据的机器学习分析来预测持续的收缩压反应,确定以下菌群为控制高血压的潜在贡献菌:
在大鼠中,五周的隔日禁食治疗可显著降低易患高血压卒中动物的血压。这种表型变化伴随着微生物组结构的改变,包括下列菌升高:
Shi H, et al.,Circ Res. 2021
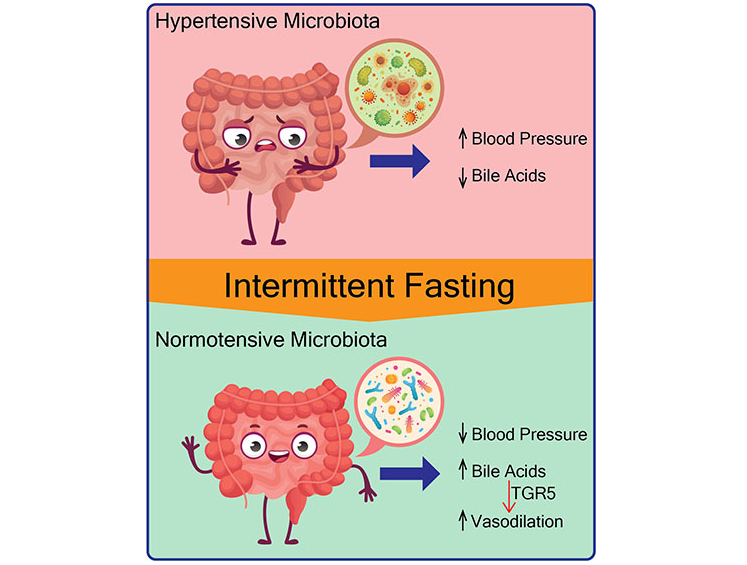
▸ 隔日禁食饮食的调节血压机制
从机理上讲,隔日禁食饮食与微生物向产生次级胆汁酸的细菌转移有关,包括共轭和非共轭的二级胆汁酸(如牛磺胆酸、牛磺脱氧胆酸、牛磺脱氧胆酸[TUDCA]、LCA、甘鹅脱氧胆酸等),以及胆汁酸受体TGR5的激活。
此外,用胆酸或TGR5激动剂治疗这些高血压大鼠可降低血压,从而超过隔日禁食的需要。
从隔日禁食喂养的大鼠到无菌大鼠的粪菌移植可防止收缩压升高,表明肠道微生物群在降低血压方面的因果作用。
进一步的研究需要确定对次级胆汁酸产生反应的靶组织和细胞类型,以及这些胆汁酸诱导的导致血压下降的细胞途径。此外,还需要更多的试验来确定不同的间歇性禁食在降低各种心血管代谢紊乱患者血压方面的疗效和可持续性。
心血管代谢疾病是一种进行性疾病,具有长期和毁灭性的后果。
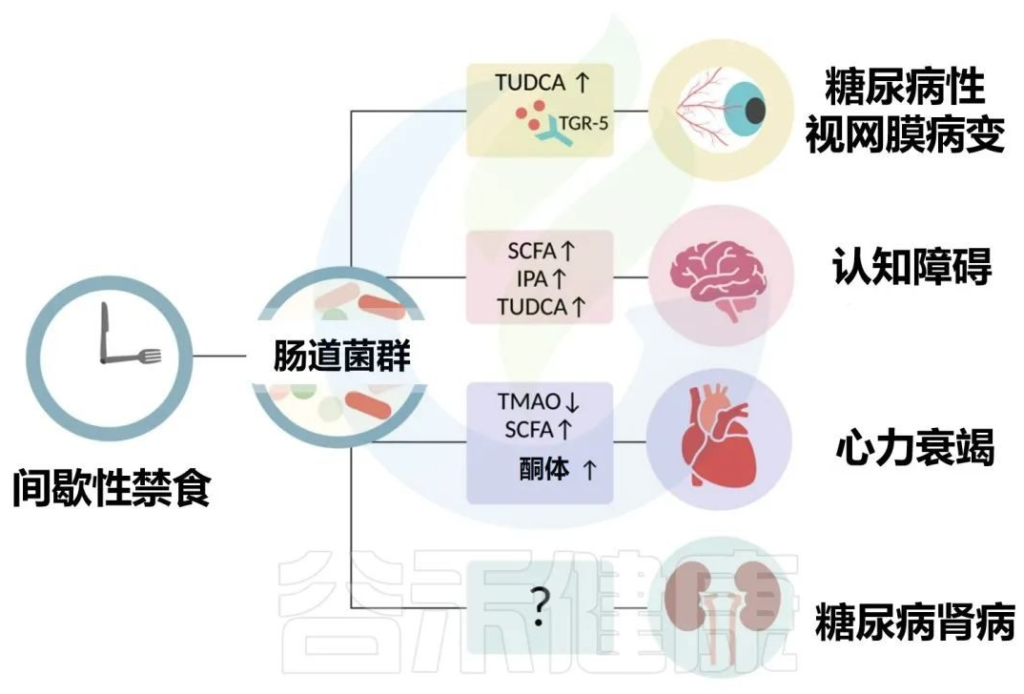
2型糖尿病患者的常见表现是微血管并发症,包括视网膜病和肾病以及心血管疾病。作为营养疗法的一部分,间歇性禁食已经成为治疗2型糖尿病几种长期并发症的潜在干预措施,包括视网膜病、认知能力下降、心力衰竭和肾病。
Karina R,et al.Rev Art Jou of Dia.2022
糖尿病性视网膜病变是2型糖尿病的一种并发症,它会影响视网膜的血管,并可能导致未经治疗的个体失明。
幸运的是,通过早期检测和及时治疗可以控制血糖水平和血压,可以降低糖尿病性视网膜病变导致的失明风险。
▸ 糖尿病性视网膜病变的菌群变化
以下三者之间的肠道微生物群存在显著差异:
比如说,研究人员Das等人发现,糖尿病视网膜病变患者中菌群变化:
在这项观察性研究之后,其他研究人员提出了肠道微生物组作为糖尿病视网膜病变鉴别生物标志物的潜在用途,并发现以下细菌是区分2型糖尿病患者和糖尿病视网膜病变患者的主要生物标志物:
这可能有助于视网膜病变的诊断。
其中,巴氏杆菌科在患有视网膜病的2型糖尿病患者中特别减少,这种细菌的减少可以作为该疾病的预测生物标志物。
▸ 隔日禁食干预后,糖尿病小鼠的菌群变化
研究人员使用糖尿病小鼠(db/db)比较了隔日禁食喂养的小鼠与随意喂养的小鼠糖尿病视网膜病变的经典标志物,发现隔日禁食方案阻止了无细胞视网膜毛细血管数量的增加,并减少了炎性细胞对视网膜的浸润。
隔日禁食的糖尿病小鼠具有厚壁菌门显著扩张的特征,更具体地说,在属的水平上,下列菌群丰度增加:
下列菌群减少:
随着肠道微生物组组成的变化, 作者观察到,与非糖尿病小鼠相比,糖尿病小鼠表现出昼夜微生物模式的差异,这种差异也在对隔日禁食的反应中发生了改变。
▸ 隔日禁食引起的代谢变化,有助于改善及诊断视网膜病变
值得注意的是,隔日禁食仅在糖尿病小鼠中增强了初级至次级胆汁酸的代谢,如TUDCA。
TUDCA的受体TGR5在视网膜神经节细胞中表达,这表明TUDCA的微生物生产可能会潜在地影响视网膜。
给糖尿病小鼠补充TGR5的强效激动剂导致糖尿病视网膜病变减少,其特征是视网膜炎症减少和无细胞毛细血管减少。
因此,隔日禁食可能导致次级胆汁酸的肠道细菌生产发生改变,激活视网膜TGR5,防止视网膜变性。
综上所述,这些结果表明,如果隔日禁食等干预措施可能导致肠道微生物群和代谢物的独特改变,这可能有助于视网膜病的诊断,并可能潜在地改善糖尿病视网膜病变。
▸ 2型糖尿病 → 认知障碍
2型糖尿病可引起明显的中枢神经系统并发症,包括结构改变或脑萎缩、脑微血管损伤、神经炎症以及最终导致认知缺陷的脑电生理特性改变。
随着时间的推移,这些认知和大脑结构的改变可能会导致认知能力的加速下降,并增加老年痴呆症等与年龄相关的神经退行性变的风险。
多项因素会导致糖尿病认知障碍,包括大脑胰岛素抵抗和葡萄糖摄取降低以及神经递质代谢紊乱。在动物模型中,各种类型的间歇性禁食有益于大脑健康,延缓神经退行性疾病的发展。
▸ 肠道菌群在调节隔日禁食诱导的认知功能中发挥作用
在隔日禁食治疗糖尿病db/db小鼠期间,肠道微生物组与认知功能之间存在联系。
糖尿病小鼠表现出认知能力下降,但28天的隔日禁食方案改善了焦虑行为、运动活动和突触结构,同时保护了海马中的胰岛素信号和线粒体生物生成。
隔日禁食干预小鼠组脑功能的改善伴随着下列菌群增加:
下列菌群减少:
抗生素治疗后,隔日禁食对糖尿病小鼠认知功能的保护作用被部分消除。学者发现隔日禁食组的初级和次级胆汁酸生物合成途径丰富。
▸ 菌群代谢物在调节隔日禁食诱导的认知功能中发挥作用
此外,db/db隔日禁食小鼠组的粪便和血浆中几种微生物相关代谢物的水平升高,其中包括短链脂肪酸、TUDCA(也可预防视网膜病变的次生胆汁酸)、吲哚-3-丙酸(IPA)和血清素。
补充这些代谢物可改善db/db小鼠的认知功能和胰岛素敏感性。
总的来说,隔日禁食诱导的肠道细菌种类和代谢物可能有助于减轻糖尿病诱导的认知障碍,并表明即使在没有隔日禁食的情况下,细菌代谢物也可能调节大脑功能的特征。
胰岛素抵抗的小鼠模型表明,如TRF和FMD等饮食方式可以改善高血压、血脂异常、高血糖和高胰岛素血症,所有这些都是心血管健康的一般指标。
▸心力衰竭与肠道菌群联系的证据
多项研究表明,心力衰竭患者肠道微生物群的组成发生了改变。对Dahl盐敏感大鼠进行的一项研究表明,补充益生菌植物乳杆菌可降低其对心力衰竭的易感性,并可在心肌梗死后更好地恢复。
已经提出了几种机制来解释肠道微生物组与心力衰竭之间的潜在联系,包括微生物组诱导的炎症调节、肠道通透性以及与细菌过度生长和细菌生物膜形成的关联。
▸肠道菌群影响心血管健康的机制:增加短链脂肪酸产生菌,为心脏提供能量
在几项研究中,在心力衰竭患者中也检测到几种病原菌的扩增。一项研究揭示了间歇性禁食对心脏的益处,提出肠道微生物群可以产生短链脂肪酸,在禁食期间为心脏提供充足的能量。
与常规小鼠相比,无菌小鼠的肝脏酮体生成量减少。根据这项研究,禁食与更高丰度的拟杆菌有关,这些拟杆菌可能负责产生短链脂肪酸,尤其是乙酸盐,可用于肝脏生酮,从而为心脏提供能量来源。
▸肠道菌群影响心血管健康的机制:TMAO降低
一项开创性研究表明,肠道微生物代谢膳食胆碱和左旋肉碱产生TMA,TMA被宿主肝脏转化为 TMAO.
研究发现,TMA-TMAO通路与动脉粥样硬化、血小板过度活跃和血栓形成有关,并用于预测心血管疾病风险的增加。
禁食影响肝脏代谢,与TMAO降低有关。此前有研究表明,维持低水平的TMAO可能对预防2型糖尿病相关的心肌病特别有帮助。
最近,在白天和夜间的db/db小鼠中发现TMAO水平升高,这与各种肠道细菌的昼夜振荡消失有关。作者建议,可以通过限制活跃期的摄食来恢复失去的细菌的昼夜振荡。
根据啮齿类动物的研究结果,间歇性禁食是否能够利用肠道微生物群,调节氧化三甲胺水平,并导致2型糖尿病患者心血管预后的有效改善,仍有待确定。
糖尿病可能导致肾功能障碍或肾病。在糖尿病患者中,血糖控制不良和高血压可导致肾小球滤过、蛋白尿、肾病性蛋白尿,并发展为终末期肾脏疾病。
多项研究表明,糖尿病肾病患者的肠道细菌丰度发生改变,总体上较低的细菌多样性与疾病进展相关。
在啮齿类动物中,糖尿病肾病与菌群及其代谢物(如苯基硫酸盐)的改变有关,并与肾素-血管紧张素系统的激活相关。
已有多项观察性研究测试了斋月禁食对糖尿病肾病严重程度的影响,但没有一项研究显示肾功能有显著变化。这些报告不是随机对照研究,样本量小,并且包含使用不同药物或透析治疗的患者。
目前,间歇性禁食对肾功能和糖尿病肾病的疗效以及肠道菌群在这一过程中的作用尚未阐明。
间歇性禁食除了前面章节提到的,通过脂质代谢来调节能量平衡从而减轻肥胖之外,还可以改善食欲调节,促进减肥。
▸ 三项短期研究评估:间歇性禁食增加饱腹感
在为期8周的ADF试验中,从基线检查到治疗后,主观饥饿感保持不变,饱腹感水平增加。这些饱腹感的增加与肽YY(PYY)的增加平行,肽YY是一种有效的饱腹激素。然而在任何时间点,饱腹感和PYY的变化与体重减轻或静息代谢率无关。
其他研究也有类似的发现。12周ADF后,肥胖受试者的饥饿感未受影响,饱腹感显著增加。饱腹感增加与体重减轻之间没有显著关系。
研究人员比较了ADF和每日卡路里限制对体重减轻后食欲的影响(比基线降低5%)。饥饿感在两组中都有类似的下降,但饱足指数保持不变。
▸ 一项长期研究评估:间歇性禁食对食欲调节没有长期有益影响
Kroeger等人进行的一项为期12个月的试验表明,ADF期间体重下降不理想和饮食依从性差与食欲没有任何有益变化有关。
总之,对ADF的短期研究表明,主观食欲有所改善(最常见的是饱腹感增加),而对ADF的长期研究表明,在食欲调节方面没有长期的益处。这方面还需要更多的研究。
目前似乎还没有任何人体试验检测ADF或5:2饮食对睡眠的影响,但有几项研究测试了限时进食对睡眠的影响。
▸三个限时进食试验:限时进食期间睡眠质量无变化
研究一:经过8周的4小时或6小时限时进食后,睡眠质量没有改变。
研究二:观察到8小时限时进食治疗12周后对睡眠质量没有影响。
研究三:10周10小时限时进食后,睡眠质量没有变化。
虽然这一初步证据表明,限时进食不会影响睡眠质量,但应该注意的是,这些研究的参与者基本上都是良好的睡眠者。因此,通过干预,他们的睡眠质量没有进一步改善,这并不奇怪。
▸限时进食不会影响睡眠时间
限时进食是否会改变睡眠时间也已得到评估。
前面的研究指出,4小时或6小时限时进食的睡眠时间没有变化。同样,8小时和9小时限时进食的睡眠时间保持不变。
然而,大多数参与者的平均睡眠时间为每晚约7小时,这符合国家睡眠基金会规定的最低7小时。这些受试者已经有足够的睡眠时间,这可以解释为什么限时进食不会影响睡眠时间。
▸限时进食可能改善睡眠
研究还评估了限时进食对失眠严重程度的影响。
研究人员推测,睡前禁食2-3小时可能会改善睡眠。更具体地说,睡前不吃脂肪和酸性食物可以减少胃酸反流和夜间胃灼热,这可能有助于降低失眠率。
在6小时限时进食研究中,受试者在基线检查时表现出阈下失眠症,到8周试验结束时,没有出现具有临床意义的失眠症。
相比之下,对于基线检查时无临床意义失眠的受试者,4小时和8小时限时进食对失眠严重程度没有影响。
综上所述,这些发现表明,对于已经显示出健康睡眠习惯的受试者来说,使用限时进食进行轻度减肥不会影响睡眠质量或睡眠时间。相比之下,限时进食可能有助于减轻受这种情况困扰的人的失眠严重程度。需要更多的研究来证实这些初步发现。
间歇性禁食虽然带来以上种种益处,但其安全性一直受到质疑。有些人对胃肠道问题、能量水平紊乱、饮食失调症状和激素紊乱的发生率增加表示担忧。这些饮食是否会对饮食质量产生负面影响也是一个问题。
人体试验的结果表明,禁食通常不会产生任何长期的胃肠道不良反应,例如便秘、腹泻、恶心、口干或口臭。不过早期的 6 小时限时进食导致了一些轻微的呕吐和腹泻病例。
最近的几项试验证明了,间歇性禁食也不会导致易怒、疲劳或头晕的程度增加。因此,迄今为止的研究结果表明,间歇性禁食几乎不会产生胃肠道问题或能量水平紊乱。
禁食因可能增加饮食失调风险而受到质疑。
来自 ADF 和限时进食研究的最新数据表明,这类饮食不会增加抑郁、暴饮暴食、通便行为或对肥胖的恐惧的发生率。
事实上,一项研究表明,ADF 可能对身体形象感知产生很小的有益影响。ADF 的这些发现与每日卡路里限制的发现相当。
在减少能量摄入的长期影响综合评估 (CALERIE) 试验中,将能量限制 25% 不会增加饮食失调症状,也没有其他有害的心理影响。
因此,间歇性禁食,也和卡路里限制一样,不会增加饮食失调症状,并且对身体形象感知具有良性或有益的影响。
然而,应该指出的是,这些研究排除了有饮食失调史的参与者。对于诊断为饮食失调的人来说,间歇性禁食是否安全仍然未知。
▸甲状腺激素
在健康人群和亚临床甲状腺功能减退人群中,研究了禁食期间甲状腺激素水平的变化。
招募年轻男性运动员参加8小时限时进食与阻力训练相结合的试验。8周后,血浆总三碘甲状腺原氨酸(T3)略有下降,但促甲状腺激素(TSH)无明显变化。在这些受试者中未观察到体重变化。游离甲状腺素(fT4)的变化没有报道,因此很难确定限时进食是否破坏这些甲状腺功能正常受试者的T3:fT4比率。
其他研究人员比较了ADF和每日卡路里限制对肥胖和亚临床甲状腺功能减退患者甲状腺水平的影响。24周后,ADF和卡路里限制(8%)同样降低体重,循环fT4、T3和TSH保持不变。这些试点数据表明,在间歇性禁食期间,瘦人的T3水平可能会略有降低,但这些影响不会发生在肥胖和亚临床甲状腺功能减退的人身上。
▸ 生殖激素
在 5:2 禁食 24 周后,绝经前妇女的睾酮、雄烯二酮、脱氢表雄酮硫酸盐、性激素结合球蛋白或催乳素没有变化。
相比之下,在 8 小时限时进食 8 周后,年轻男性的游离和总睾酮浓度降低。合成代谢激素睾酮的减少并没有导致身体成分的任何有害变化或肌肉力量的损害。
由于缺乏这方面的数据,因此很难就禁食对生殖健康的影响得出结论。此外,这些变化如何影响生育能力仍然未知,因为没有研究测试过这些饮食对男性和女性怀孕能力的影响。
据推测,在限时进食期间限制进食时间窗口期会导致高能量食物的消耗增加和补偿性地多喝(即,增加无糖苏打水和咖啡因的摄入)。
研究人员评估了4小时和6小时限时进食期间饮食质量的变化。
▸ 纤维摄入量偏少
8周后,4小时和6小时限时进食组的糖、饱和脂肪、胆固醇和钠摄入量与对照组相比没有显著差异。然而,限时进食受试者纤维摄入量远远低于(∼10-15克/天)在基线检查和治疗后的推荐量[25-38克/天]。ADF和5:2饮食试验中也经常报告纤维摄入不足。
▸ 饮料、酒等摄入量没有变化
至于饮料摄入,8周后,4小时限时进食、6小时限时进食和对照组的饮食苏打水、含咖啡因饮料(即咖啡、茶和能量饮料)和酒精的摄入没有差异。
作为这些发现的补充,一项为期一年的ADF试验报告称,饮料摄入量没有变化。
这些初步发现表明,间歇性禁食不会对饮食质量或饮料摄入产生不利影响。然而,应在间歇禁食期间向受试者提供膳食咨询以增加纤维摄入量,以确保肠道健康。
▸ 间歇性禁食并不代表胡吃海喝
重要的是,个人应注意间歇禁食期间的饮食质量。诚然,这些方案要求个人更多地关注用餐时间,而不是所摄入的营养素类型。虽然如此,临床医生应该向患者明确指出,进食窗口时间并不能让患者完全不考虑健康影响,彻底放纵自己乱吃。
为了使这些方案成为改善健康的可持续解决方案,应鼓励间歇性禁食的人食用水果、蔬菜和全谷物含量高、加工食品含量低的饮食。
本章节总结了一些关于如何开始禁食方案,以及如何将这些方法融入日常生活的实用建议。同时,就哪些人不应该使用间歇性禁食来控制体重提供建议。
对于大多数人来说,大约需要1-2周才能完全适应这种新的饮食模式。
据报道,在初期可能会出现头晕,头痛和便秘,但这些不良反应通常在禁食第二周后消退。
头痛通常是由于水分摄入不足导致脱水,当食物受到限制时可能会发生脱水。增加饮水量(每天增加1.5升)可能有助于个人在禁食期间缓解头痛。
与普遍的看法相反,禁食时锻炼确实是可能的。已经进行了几项将禁食与运动相结合的人体试验。
这些研究中的受试者可以在12-36小时的禁食期内进行中等强度到高强度的耐力或阻力训练。
有趣的是,在研究中,受试者在快节奏的日子里感觉到能量的增强,这对那些希望锻炼的人来说是有利的。
然而ADF期间,建议个人在运动后食用禁食日餐。一些人在运动后会出现能量摄入的代偿性增加。因此,把饭留到运动后吃,可能有助于个人保持在禁食日卡路里目标的范围内。
虽然对于间歇性禁食期间摄入的食物类型没有具体的建议,但始终建议强调多吃水果、蔬菜和全谷类食物。
这些食物可以帮助禁食参与者增加纤维摄入量,从而有助于缓解禁食期间偶尔出现的便秘。
避免超加工食品也很重要。与富含能量相匹配的未加工食品的饮食相比,富含加工食品的饮食会导致自由摄入的能量增加和体重增加。
间歇性禁食期间允许饮酒。然而不建议在ADF和5:2禁食模式中的禁食日饮酒。
禁食日的能量摄入非常有限(∼500千卡),因此建议将这些卡路里花在能提供营养的健康食品上,而不是酒精上,因为酒精会消耗营养。
无论是在禁食期间还是在进食窗口,都允许喝含咖啡因的饮料。越来越多的证据表明,与基线相比,个体在禁食期间的含咖啡因饮料消费模式没有显著改变。
不过,将咖啡因的摄入限制在上午和下午可能是值得的,这样它就不会干扰一个人晚上的入睡能力。
除以上人群之外,一般都可以安全地进行间歇性禁食,这可能是一种生活方式的改变。
如果尝试间歇性禁食后持续发现,异常焦虑、头痛、恶心或其他症状,不要勉强继续,说明暂时还不适合这种方式,可暂停。
间歇性禁食导致肠道菌群结构改变,以及细菌产生特定的代谢物发生变化,如次级胆汁酸和酮体,可能会潜在地影响正常宿主生理,及心血管代谢异常的临床结果。这些发现可以作为治疗干预的潜在基础。
当相同的膳食在不同的时间提供时,餐后对食物的反应因人而异。由于肠道微生物群参与了个人对食物的反应,因此有理由假设个人对间歇性禁食的反应也与肠道微生物群有关。这也是将间歇性禁食方案转化为临床实践的一个挑战。
需要更多控制良好的、前瞻性的、纵向的临床研究,来确定不同饮食带来的微生物变化,以便进一步转化为临床实践。同时包括肠道菌群健康检测在内的对个体肠道微生物组的进一步了解,或将为最终的临床实践带来益处。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Ratiner K, Shapiro H, Goldenberg K, Elinav E. Time-limited diets and the gut microbiota in cardiometabolic disease. J Diabetes. 2022 Jun;14(6):377-393. doi: 10.1111/1753-0407.13288. Epub 2022 Jun 13. PMID: 35698246.
Angoorani P, Ejtahed HS, Hasani-Ranjbar S, Siadat SD, Soroush AR, Larijani B. Gut microbiota modulation as a possible mediating mechanism for fasting-induced alleviation of metabolic complications: a systematic review. Nutr Metab (Lond). 2021 Dec 14;18(1):105. doi: 10.1186/s12986-021-00635-3. PMID: 34906176; PMCID: PMC8670288.
Varady KA, Cienfuegos S, Ezpeleta M, Gabel K. Cardiometabolic Benefits of Intermittent Fasting. Annu Rev Nutr. 2021 Oct 11;41:333-361. doi: 10.1146/annurev-nutr-052020-041327. PMID: 34633860.
Shi H, Zhang B, Abo-Hamzy T, Nelson JW, Ambati CSR, Petrosino JF, Bryan RM Jr, Durgan DJ. Restructuring the Gut Microbiota by Intermittent Fasting Lowers Blood Pressure. Circ Res. 2021 Apr 30;128(9):1240-1254. doi: 10.1161/CIRCRESAHA.120.318155. Epub 2021 Feb 18. Erratum in: Circ Res. 2022 Mar 4;130(5):e18. PMID: 33596669; PMCID: PMC8085162.
Aron-Wisnewsky J,Clément K.The gut microbiome, diet,and links to cardiometabolic and chronic disorders. Nat RevNephrol. 2016;12(3):169-181.
Di Francesco A, Di Germanio C, Bernier M, de Cabo R. A time to fast. Science. 2018;362(6416):770-775.
Daas MC, de Roos NM. Intermittent fasting contributes to aligned circadian rhythms through interactions with the gut microbiome. Benef Microbes. 2021 Apr 12;12(2):147-161. doi: 10.3920/BM2020.0149. Epub 2021 Feb 3. PMID: 33530881.
Rong B, Wu Q, Saeed M, Sun C. Gut microbiota-a positive contributor in the process of intermittent fasting-mediated obesity control. Anim Nutr. 2021 Dec;7(4):1283-1295. doi: 10.1016/j.aninu.2021.09.009. Epub 2021 Oct 9. PMID: 34786501; PMCID: PMC8567329.