-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
随着夏季天气变得炎热,高温环境为病原微生物的繁殖创造了有利条件,同时也加速了食品的腐败变质过程,从而导致食源性感染的数量呈现出明显的增加趋势。
重要的食源性细菌病原体包括大肠杆菌、沙门氏菌、弯曲杆菌、小肠结肠炎耶尔森菌、葡萄球菌、肉毒杆菌等。近年来,弓形菌属(Arcobacter)已被确定为一种新兴的食源性人畜共患病原体。
弓形菌属(Arcobacter)是一类革兰氏阴性、螺旋形、不产芽孢的杆菌。其与弯曲杆菌属非常相似,但具有更强的耐氧性和低温耐受性。该属已包含三十多个物种,广泛分布于土壤、淡水、海水以及人类和各种动植物中,大约7%的人群粪便中能够检出。
与人类疾病相关的主要是四个菌种:A.butzleri、A.cryaerophilus、A.skirrowii和A.cibarius,其中A.butzleri最常见,是腹泻患者粪便中第四大弯曲杆菌样生物。该菌可引起胃肠炎、严重腹泻、菌血症、败血症、心内膜炎、腹膜炎等疾病,还存在于肝硬化和坏疽性阑尾炎患者的血液样本中。
Arcobacters对常用抗菌剂的耐药性也有所增加,研究显示,所有测试的Arcobacter菌株都对氨苄青霉素敏感,对氨基糖苷类和四环素类也表现出敏感性。但A.butzleri对氨苄西林耐药率为56%,其次是头孢噻肟(33%)和环丙沙星(33%),对恩诺沙星和庆大霉素敏感,这些是治疗Arcobacter感染的首选药物。所有A.skirrowii和大多数A.cryaerophilus分离株对阿莫西林/克拉维酸敏感,对青霉素、万古霉素、夫西地酸、氯唑西林和头孢唑啉耐药,对阿米卡星、恩诺沙星、氧氟沙星、土霉素、氯霉素、呋喃妥因、红霉素、氨苄西林舒巴坦和阿莫西林中度敏感。
本文全面介绍了这一重要食源性病原体的各个方面,包括不同Arcobacter物种的分布及临床相关性、毒力因子、感染症状和危害、药物敏感性以及与人体和其他菌群的相互作用。并提出使用草药活性成分、精油、噬菌体、益生菌、禽蛋抗体、RNAi技术等新治疗方法有助于防止抗生素耐药性发展和Arcobacter传播。基于肠道菌群检测等技术将进一步深化对Arcobacter感染的理解。
弓形菌属(Arcobacter)名称源自拉丁语”arcus”(弓形)和”bacter”(细菌),意为“弓形细菌”,反映了其弯曲的形态特征。其属于弯曲杆菌科(Campylobacteraceae)。这是一类革兰氏阴性、螺旋形、不产芽孢的杆菌。硝化弧菌(Arcobacter nitrofigilis)为其模式菌种。
弓形菌属(Arcobacter)于1977年首次从流产牛胎儿中分离获得。1991年,该属被归类为非典型弯曲杆菌属中的一组耐氧细菌,随后增加了两个新种。基于核糖体RNA遗传相似性95%的截断标准,该属被确立为独立属。
注:弓形菌属(Arcobacter)与弯曲杆菌属(Campylobacter)密切相关,两者都是Campylobacteriaceae家族的成员。它们的主要区别在于更高的耐氧性和在较低温度下生长的能力。
1
形态特征
弓形菌属(Arcobacter)的主要形态特征包括:
基本形态:革兰氏阴性、通常呈螺旋状、弯曲状或”S”形杆菌。
细胞大小:宽度0.2-0.9微米,长度0.5-3微米。
运动特性:具有单一的无鞘极性鞭毛,表现出独特的穿梭式螺旋运动。
特殊能力:能够通过0.45μm和0.65μm的膜过滤器,这一特性常用于分离培养。
doi.org/10.1111/j.1472-765X.2005.01841.x
2
生长环境
温度:弓形菌属(Arcobacter)的生长温度范围为15-37°C,最适温度30°C。该菌具有良好的低温耐受性,可在-20°C存活6个月,在-70°C存活24个月,但在55°C及以上温度下会迅速失活。
注:A.butzlerii能够在10°C下生长,这是这种微生物的最低可检测生长温度,并且在40°C时没有生长。
氧气:Arcobacter能够耐受氧气,这一点可区分于严格微需氧的弯曲杆菌属(Campylobacter)。
pH和渗透压耐受性:该菌pH耐受范围为5.5-9.5,最适pH为6.8-8.0,并能耐受高盐浓度和低水分。
3
代谢能力
代谢类型:呼吸型代谢,Arcobacter能够耐受氧气环境,主要进行有氧呼吸代谢。
碳源利用:可利用有机酸和氨基酸作为碳源,不发酵或氧化碳水化合物,但有新发现某些菌株能够代谢果糖。
酶活性:氧化酶、过氧化氢酶、吲哚乙酸水解酶和硝酸盐还原酶等均呈阳性。
4
主要菌种及分布
弓形菌属(Arcobacter)已包含三十多个物种,广泛分布于土壤、淡水、海水以及人类和各种动植物中。该属可在全球范围内从肉类、乳制品、蔬菜和海鲜中分离出来,被认为是新兴的人畜共患病原体。其致病菌种可引起人类急性持续性腹泻、恶心、呕吐和肠道功能紊乱,也可导致无腹泻的菌血症。
Arcobacter物种基于16S rRNA 基因的关系
doi: 10.1128/CMR.00034-10.
• 与人类疾病密切相关的主要有四种:
A.butzleri(最常见,与人类疾病关联最强)
A.cryaerophilus(第二常见菌种)
A.skirrowii(水环境污染中检出率13%)
A.cibarius
• 人群中的检出率:
健康人群:大约7%的人群粪便中能够检出Arcobacter。
腹泻患者:在一些研究中,A.butzleri是第三或第四常见的弯曲菌样病原体。
分布特点:遍布全球各大洲、发展中国家检出率相对较高、与环境卫生条件相关。
• A.butzleri—与人类疾病关联最强的
在所有Arcobacters中,A.butzleri是最常见的物种,与人类疾病有关,可引起肠炎、严重腹泻、菌血症和败血症等疾病,是腹泻患者粪便中第四大弯曲杆菌样生物。
A.butzleri感染的主要临床表现包括:
胃肠道症状:
-持续性水样腹泻(与空肠弯曲杆菌的血性腹泻不同);
-急性腹泻持续3-15天;
-腹痛和恶心;
-血性粪便(部分病例);
-恶心和呕吐;
全身症状:
-发热和寒战
-虚弱和乏力
-厌食和体重减轻
在下面的章节中我们也会主要以A.butzleri为例阐述该致病菌对人体的危害。
• A.cryaerophilus—新出现的食源性病原体
A.cryaerophilus是一种新兴的食源性病原体,与人类疾病也相关。A.cryaerophilus是人类粪便样本中第二常见的Arcobacter菌种,仅次于A.butzleri,并且在肠炎症状患者粪便样本中占43%,仅次于A.butzleri(55%)。
A.cryaerophilus主要引起人类传染性胃肠道疾病,症状包括急性或长期水样腹泻、腹痛、恶心、持续性腹泻,严重者可发生菌血症。
5
毒力因子
目前关于Arcobacter毒力基因/因子的研究信息有限。现有研究表明,粘附、病原体入侵、毒素分泌和促炎细胞因子(IL-8)在建立宿主感染中发挥主要作用。A.cryaerophilus和A.butzleri是迄今为止在粘附性和侵袭性方面研究最多的两个主要Arcobacter物种。
• 损害结肠上皮功能
A.butzleri感染会损害人HT-29/B6结肠上皮单层的上皮功能。Claudin蛋白家族对屏障功能至关重要,其中claudin-1、5和8具有屏障密封特性。A.butzleri感染期间,紧密连接蛋白claudin-1、-5和-8表达异常,导致上皮屏障功能障碍。类似的claudin-1功能障碍也在肠致病性大肠杆菌感染的人肠道T84单层中观察到。
据报道,血凝素特性也与A.butzleri有关,它与红细胞相互作用,因此有助于细菌的粘附。
与弯曲杆菌和幽门螺杆菌一样,Arcobacter感染中IL-8的释放可能在引起腹泻中发挥作用。促炎细胞因子的释放是幽门螺杆菌和弯曲杆菌的主要毒力因子,同样,Arcobacter也能导致促炎细胞因子的释放。
Arcobacter的毒力机制
编辑
doi: 10.1128/CMR.00034-10.
• 可以产生肠毒素和液泡毒素
当在Vero细胞中培养时,Arcobacter分离物会产生细胞伸长,这表明它们具有产生肠毒素的能力,部分分离株还能在细胞中产生液泡,显示其具有液泡毒素产生能力。
• 各种毒力基因参与不同的致病过程
目前已在A.butzleri ATCC 49616基因组中发现10个推定毒力基因:cadF、ciaB、cj1349、hecA、iroE、hecB、irgA、mviN、pldA和tlyA。这些基因分别编码外膜蛋白、侵袭蛋白、溶血素、磷脂酶A等,参与粘附、侵袭、溶血、铁获取等过程。
注:不同基因的功能包括: cadF基因和cj1349基因编码外膜蛋白,通过粘附纤连蛋白促进肠上皮细胞间接触;ciaB基因参与宿主细胞的侵袭,pldA基因编码水解酰酯键的外膜磷脂酶 A,tlyA基因是溶血素基因,irgA基因编码肠杆菌素的外膜受体,hecA基因是丝状血凝素家族的成员,hecB基因编码溶血素激活蛋白。
一项研究揭示了Arcobacter spp中的6个毒力基因 (cadF、ciaB、cj1349、mviN、pldA 和 tlyA)存在于所有A.butzleri分离株中,而在A.cryaerophilus和A.skirrowii中的分布存在差异。各种毒力基因负责不同的致病过程:CadF、HecA和Cj1349参与粘附,CiaB参与侵袭,HecB、TlyA和PldA参与红细胞裂解,IrgA和IroE参与铁获取,MviN参与肽聚糖生物合成。
6
药物敏感性
关于Arcobacter的抗菌药物敏感性数据有限,A.butzleri是研究最多的物种。现有报告表明,这种新兴病原体的抗菌素耐药性增加,导致常用抗菌剂治疗失败。并且A.butzleri比A.cryophilus和A.skirrowi表现出更强的耐药性。
Arcobacter的抗生素耐药性或检测到的基因组性状
Buzzanca D,et al.Antibiotics (Basel).2024
• 对氨苄青霉素敏感
研究显示,所有测试的Arcobacter菌株都对氨苄青霉素敏感,对氨基糖苷类和四环素类也表现出敏感性。A.butzleri对氨苄西林耐药率为56%,其次是头孢噻肟(33%)和环丙沙星(33%),对恩诺沙星和庆大霉素敏感,这些是治疗Arcobacter感染的首选药物。
在一项研究中,所有A.skirrowii和大多数A.cryaerophilus分离株对阿莫西林/克拉维酸敏感,对青霉素、万古霉素、夫西地酸、氯唑西林和头孢唑啉耐药,对阿米卡星、恩诺沙星、氧氟沙星、土霉素、氯霉素、呋喃妥因、红霉素、氨苄西林舒巴坦和阿莫西林中度敏感。
• 对头孢菌素和万古霉素具有耐药性
研究发现,Arcobacter对头孢菌素、新生霉素和万古霉素耐药,但对阿奇霉素、萘啶酸和庆大霉素敏感。71种Arcobacter分离株的抗菌素敏感性测试显示,所有分离株对一种或多种抗菌剂具有耐药性,对头孢菌素和万古霉素的耐药性最常见(96%),其次是甲氧西林、阿奇霉素和氨苄西林。所有分离株都对庆大霉素、链霉素、四环素和卡那霉素敏感。
比利时患者分离的A.butzleri和A.cryaerophilus菌株研究显示,大多数菌株对庆大霉素(99%)和四环素(89%)敏感,红霉素(78%)、环丙沙星(72%)和多西环素(76%)显示中等活性,仅9%的菌株对氨苄西林敏感。大多数A.butzleri菌株对环丙沙星敏感(87%),而一半的A.cryaerophilus分离株(51%)表现出高水平耐药性。
研究结果表明,大环内酯类药物不是Arcobacter感染的首选经验性抗生素,四环素类药物可用于治疗Arcobacter诱导的胃肠道感染。所有Arcobacter分离株均对万古霉素、利福平、甲氧苄啶、头孢曲松和头孢菌素耐药,而对土霉素、四环素、环丙沙星、红霉素、卡那霉素、阿米卡星、恩诺沙星和庆大霉素高度敏感。四环素类和氨基糖苷类药物可用于治疗人类Arcobacter感染。
7
与人体和其他菌群的相互作用
• 细胞粘附与侵袭
粘附因子:cadF、cj1349、hecA等基因编码外膜蛋白;
侵袭机制:通过ciaB基因介导的细胞侵袭;
紧密连接破坏:影响claudin-1、claudin-5、claudin-8等紧密连接蛋白。
• 免疫相互作用
促炎反应:诱导IL-8、TNF-α、IFN-γ、IL-6等细胞因子释放;
TLR激活:激活Toll样受体4(TLR-4)依赖的免疫反应;
氧化应激:诱导活性氧产生,损伤细胞。
• 与肠道菌群的关系
生态竞争:Arcobacter会与有益菌竞争营养和定植位点;
菌群失调:Arcobacter感染可导致肠道菌群结构改变,并造成菌群失调;
代谢产物影响:影响短链脂肪酸等有益代谢产物产生。
• 菌群相互作用
增强:
Bacteroidales
Bacteroides
Odoribacter
Peptococcaceae
抑制:
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Porphyromonas
Prevotella
Clostridium
Clostridiales incertae sedis
Clostridiales Family XIII. Incertae Sedis
Blautia
Coprococcus
Dorea
Lachnospiraceae
Ruminococcaceae
Ruminococcus
Dialister
Campylobacteraceae
Erysipelotrichaceae
被抑制:
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Bacteroidales
Bacteroides
Porphyromonadaceae
Odoribacter
Parabacteroides
Porphyromonas
Prevotella
Rikenellaceae
Alistipes
Turicibacter
Streptococcus
Clostridiales
Catabacteriaceae
Clostridium
Clostridiales incertae sedis
Peptoniphilus
Clostridiales Family XIII. Incertae Sedis
Lachnospiraceae
Blautia
Lachnospiraceae
Coprococcus
Dorea
Eubacterium
Lachnobacterium
Lachnospira
Roseburia
Lachnospiraceae
Peptococcaceae
Ruminococcaceae
Ruminiclostridium
Acetivibrio
Eubacterium
Faecalibacterium
Oscillospira
Ruminococcus
Acidaminococcus
Dialister
Phascolarctobacterium
Veillonella
Rubrivivax
Alcaligenaceae
Oxalobacter
Bilophila
Desulfovibrio
Campylobacteraceae
Enterobacteriaceae
Escherichia
Erysipelotrichaceae
Holdemania
Akkermansia
1
感染的危害
多项研究表明,Arcobacter在世界不同国家的人类中普遍存在,已从人类粪便和血液样本中分离出来。而其中的致病菌种A.butzleri和A.cryaerophilus已被多次证明与胃肠道疾病相关。持续性水样腹泻是A.butzleri的主要症状,与空肠弯曲杆菌病例中的血性腹泻形成对比,其余微生物学或临床特征非常相似。
注:Arcobacter spp.也被认为是旅行者腹泻的一种细菌因子,与大肠杆菌、志贺氏菌、沙门氏菌和弯曲杆菌并列。
• A.butzleri是第三普遍的弯曲杆菌病原体
一项通过分子方法的研究发现,在322份粪便标本中,A.butzleri是第三普遍的弯曲杆菌(6.2%),仅次于幽门螺杆菌(50.6%)和空肠弯曲杆菌(10.2%)。比利时和法国的两项独立研究显示,A.butzleri是从腹泻患者粪便中发现的第四种最常见的弯曲杆菌样生物。最近,该物种还被发现是美国和欧洲旅行者前往墨西哥、危地马拉和印度后发生旅行者腹泻的病因,患病率为8%,这是首次证明Arcobacter与此类感染关联的研究。
• 可引起肠炎,导致腹泻等症状
在所有研究中,A.butzleri的患病率往往最高,其次是A.cryaerophilus和A.skirrowii,直接分子检测报告的值分别为6.2%、2.9%和1.9%。A.skirrowii仅在少数情况下与胃肠炎相关。
A.butzleri近年来已被定位为一种新兴的人畜共患病原体,它被描述为急性细菌性胃肠炎的原因,伴有血便、大量腹泻、腹胀,在某些情况下是菌血症的原因。此外,A.butzleri和A.cryaerophilus引起的病例也偶有报道。
Arcobacter中的致病菌种丰度过高会导致以下危害:
急性胃肠炎
症状:水样腹泻(持续3-15天,严重可达2个月)
伴随症状:腹痛、恶心、呕吐、发热、寒战
病程特点:通常自限性,但可发展为慢性感染
严重系统性感染
菌血症:可发生原发性或继发性菌血症
心内膜炎:罕见但严重的并发症
腹膜炎:腹腔感染的重要病原体
败血症:在免疫功能低下患者中易发生
肝硬化和阑尾炎患者中也存在
在患有肝硬化和阑尾炎等临床疾病的患者的血液样本中也检测到弓形菌属(Arcobacter)。
• 诱导促炎细胞因子释放
A.butzleri感染会诱导小肠和大肠分泌更多促炎细胞因子,包括TNF、IFN-γ、IL-6和MCP-1。A.butzleri还以菌株依赖性方式诱导比共生大肠杆菌更明显的局部和全身免疫反应,表明A.butzleri不仅仅是人体中的共生体。
研究还发现miRNA在感染A.butzleri的巨噬细胞免疫信号中发挥作用。细菌感染期间有几种miRNA表达,其中miR-155、miR-212和miR-125等新型miRNA表达上调,它们在Toll样受体信号转导中起关键作用,参与免疫反应的产生。揭示了人类先天免疫细胞与Arcobacter在感染过程中的相互作用。
2
疾病相关的发病机制
• 肠道屏障功能破坏
物理屏障:破坏肠道上皮细胞紧密连接;
化学屏障:影响胃酸和胆汁酸的保护作用;
生物屏障:干扰正常肠道菌群的保护功能;
免疫屏障:调节肠道免疫系统反应。
• 与炎症性肠病的关联
炎症介质:激活NF-κB信号通路,促进炎症因子释放;
氧化应激:诱导活性氧产生,加重肠道损伤;
自身免疫:可能触发自身免疫反应;
菌群失调:加重肠道菌群紊乱。
• 毒力因子与致病机制
粘附侵袭:cadF、cj1349、ciaB、hecA;
毒素产生:hecB、tlyA、pldA(溶血素和磷脂酶);
铁获取:irgA、iroE(铁离子转运);
细胞壁合成:mviN(维持细胞完整性)。
3
感染途径
人类中的Arcobacter主要引起肠道问题,通过粪口传播、动物直接传播以及受污染的食物(蔬菜、鸡肉和猪肉)和水源等多种方式在宿主细胞中定植。
• 食源性传播
已从鸡肉、猪肉、牛肉和海鲜等各种肉类样本中分离出Arcobacter。据报道,鸡肉的Arcobacter患病率最高,其次是猪肉和牛肉。
注:据报道,鸡肉的A.butzleri发病率最高,为83%,其次是牛肉(20%)和猪肉(15%)。从哥斯达黎加销售的家禽内脏样本中分离出17%的Arcobacter,其中大多数分离株对氯霉素和氨苄青霉素具有耐药性。
四种弓形菌属(A.butzleri、A.cryaerophilus、A.skirrowii和A.cibarius)已从肉类中大量分离,尤其是从鸡尸体中。从牡蛎、鱼类、贝类和蛤蜊等海鲜中也可分离出Arcobacter。
来自世界不同地区的报告显示从牛奶样本中分离出Arcobacter,表明牛奶在其传播中可能起作用。其中A.butzleri是最主要的物种(60%),其次是A.cryaerophilus(40%)。并且研究表明A.butzleri和A.cryaerophilus在4°C和10°C储存的牛奶中存活了6天,因此牛奶可以作为人类Arcobacter感染的来源。
与Arcobacter相关的人类胃肠炎的几次爆发与食用受污染的新鲜蔬菜有关,因此可能成为重要的感染源。最近,在生菜和胡萝卜加工厂上报告了一些Arcobacter物种。在预切即食蔬菜上出现Arcobacter的比率为28%,其中91%(40/44)分离株为A.butzleri,9.1%(4/44)分离株为A.cryaerophilus。这些结果表明,直接食用生蔬菜可能存在健康风险。
• 经受污染的水源传播
受污染的水被认为是人类Arcobacter感染的重要来源。据估计,63%的A.butzleri感染是通过食用或接触受污染的水在人类中获得的。已从河流、湖泊、地下水、海水以及浮游生物中检测到了Arcobacter。
在土耳其伊兹密尔,来自不同来源(66个污水、25个河流、16个泉水和8个饮用水)的水样本中,有36%(41/115)的Arcobacter呈阳性。其中,34%的样本(39/115;24个污水、13条河流和2个泉水)报告了A.butzleri。这些结果表明,环境水样是Arcobacter的常见来源。
4
易感因素
虽然宿主特征(如年龄和免疫状态)在Arcobacter感染中的作用尚未明确确定,但很可能发挥重要作用。研究显示,以下人群可能更易受到感染:
• 免疫功能低下者
-慢性淋巴细胞白血病患者
-HIV感染者
-器官移植受者
-化疗患者
• 年龄相关易感性
-新生儿:可发生垂直传播
-老年人:易发生严重感染和并发症
-儿童:症状通常较轻但持续时间长
• 一些疾病患者中弓形菌属丰度也较高
弓形菌属(Arcobacter)还常见于患有其他潜在疾病的患者中,包括1型和2型糖尿病、肝硬化、坏疽性阑尾炎、癌症、慢性肾功能衰竭、内部假体植入、高尿酸血症和酗酒等。
一项研究通过多重PCR检测发现,患有2型糖尿病但无胃肠道症状的老年受试者中,粪便携带弓杆菌的患病率高达79%(30/38)。
针对新兴食源性病原体Arcobacter,需要采取一些控制措施来降低其感染风险或减轻疾病负担。
1
食品加工控制措施
肉类、奶类、海鲜等烹饪不当和受污染的动物源性食品可能是人类弓形菌属(Arcobacter)感染的重要来源。因此,彻底和良好的烹饪方法是预防感染的关键。
• 物理处理方法
高温处理:A.butzleri对热敏感,50°C热处理后会产生致命的协同效应;
辐射处理:A.butzleri对辐射的抗性比空肠弯曲杆菌更强;
低温储存:低温可抑制Arcobacter生长,但不能完全杀死。
• 化学处理方法
柠檬酸:1.0%浓度可抑制A.butzleri生长;
乳酸:2.0%浓度有效抑制生长;
乳酸钠:2%浓度有效抑制;
苯甲酸、苹果酸和山梨酸:具有较强抑制活性。
链球菌素50 IU/ml可将A.butzleri存活率降低约500%。磷酸三钠和EDTA在纯培养中能有效减少A.butzleri存活。
2
益生菌防控策略
• 益生菌菌株的抑制作用
植物乳杆菌(L.plantarum CFS)在12.5%浓度下完全抑制A. butzleri生长;
嗜酸乳杆菌(L.acidophilus)和罗伊氏乳杆菌(L.reuteri CFS)在25%浓度下完全抑制生长;
在TSB+MRS培养基中,所有乳酸杆菌在24-48小时内均能有效抑制A.butzleri。
• 益生菌抑制机制
酸化环境:益生菌产生的乳酸创造酸性环境(pH<3.0时A. butzleri在20分钟内无法生长);
代谢产物抑制:细胞无培养上清液(CFS)中的抗菌物质;
细菌素产生:如罗伊氏乳杆菌产生的罗伊氏菌素(Reuterin);
竞争性排斥:通过置换和排斥机制减少A. butzleri的肠道粘附。
3
植物提取物
• 精油类抗菌剂
百里香精油:对A.butzleri具有显著抗菌活性,抑制浓度为32-1024 μg/mL;
丁香精油:抑制浓度为512-1024 μg/mL;
其他精油:17种精油(迷迭香、大蒜、鼠尾草、熊果、多香果、黑胡椒、孜然、肉桂、香菜、百里香、丁香、茴香、甘草、圣约翰草、生姜、洋甘菊和薄荷等)均显示出抑制效果。
• 植物提取物
柠檬、甜橙和佛手柑油:可预防Arcobacter感染;
白藜芦醇植物提取物:通过抑制细菌代谢活动、影响DNA并阻断细胞分裂发挥杀菌作用;
草药提取物:洋甘菊、鼠尾草、肉桂、迷迭香、熊果提取物等。
4
环境控制和卫生措施
• 屠宰场和食品加工厂卫生
严格消毒:使用适当消毒剂,因为A.butzleri在常规消毒后仍可能存活;
HACCP体系:实施严格的胴体微生物监测、验证系统和良好生产规范;
表面处理:A.butzleri可在铜、不锈钢和塑料管道表面定植,需要加强清洁。
• 个人卫生
食品处理:彻底烹饪肉类、奶类、海鲜等动物源性食品;
交叉污染防控:避免生熟食品交叉污染。
• 水处理
氯化处理:尽管A.butzleri对氯敏感,但常规饮用水处理效果仍需加强;
水源保护:受污染的水是重要感染源,需要有效处理水资源。
5
新型治疗方案
面对抗生素耐药性上升,急需探索替代疗法,包括噬菌体疗法、益生菌、禽蛋黄抗体、细胞因子、RNAi技术、群体感应抑制剂、草药和精油等。噬菌体疗法已成功用于预防沙门氏菌、李斯特菌等,在屠宰场控制Arcobacter进入食物链方面具有良好前景。
主要参考文献
Ramees TP, Dhama K, Karthik K, Rathore RS, Kumar A, Saminathan M, Tiwari R, Malik YS, Singh RK. Arcobacter: an emerging food-borne zoonotic pathogen, its public health concerns and advances in diagnosis and control – a comprehensive review. Vet Q. 2017 Dec;37(1):136-161.
Collado L, Figueras MJ. Taxonomy, epidemiology, and clinical relevance of the genus Arcobacter. Clin Microbiol Rev. 2011 Jan;24(1):174-92.
García-Salguero C, González-Corralejo C, Marroyo Laso J, Delgado-Iribarren García-Campero A. Acute gastroenteritis due to Arcobacter butzleri: an emerging pathogen. Gut Pathog. 2025 Apr 11;17(1):22.
Buzzanca D, Chiarini E, Alessandria V. Arcobacteraceae: An Exploration of Antibiotic Resistance Featuring the Latest Research Updates. Antibiotics (Basel). 2024 Jul 18;13(7):669.
Ferreira S, Queiroz JA, Oleastro M, Domingues FC. Insights in the pathogenesis and resistance of Arcobacter: A review. Crit Rev Microbiol. 2016 May;42(3):364-83.
Chieffi D, Fanelli F, Fusco V. Arcobacter butzleri: Up-to-date taxonomy, ecology, and pathogenicity of an emerging pathogen. Compr Rev Food Sci Food Saf. 2020 Jul;19(4):2071-2109.
Prouzet-Mauléon V, Labadi L, Bouges N, Ménard A, Mégraud F. Arcobacter butzleri: underestimated enteropathogen. Emerg Infect Dis. 2006 Feb;12(2):307-9.
Vieira A, Mateus C, Fonseca IM, Domingues F, Oleastro M, Ferreira S. The dual action of probiotic lactobacilli in suppressing virulence and survival of Arcobacter butzleri. Microb Pathog. 2025 Jul;204:107589.
Bachus A, Beyer S, Bücker R, Sharbati S, Alter T, Gölz G. Pathogenicity of Arcobacter cryaerophilus in two human intestinal cell lines. Gut Pathog. 2025 Jun 22;17(1):48.
Jiménez-Guerra G, Casanovas MorenoTorres I, Moldovan TD, Navarro-Marí JM, Gutiérrez-Fernández J. Arcobacter butzleri and intestinal colonization. Rev Esp Quimioter. 2020 Feb;33(1):73-75.
Gölz G, Karadas G, Alutis ME, Fischer A, Kühl AA, Breithaupt A, Göbel UB, Alter T, Bereswill S, Heimesaat MM. Arcobacter butzleri Induce Colonic, Extra-Intestinal and Systemic Inflammatory Responses in Gnotobiotic IL-10 Deficient Mice in a Strain-Dependent Manner. PLoS One. 2015 Sep 25;10(9):e0139402.
谷禾健康
艰难梭菌是一种革兰氏阳性、形成孢子的厌氧芽孢杆菌,是艰难梭菌感染(CDI)的病原体。该菌于1935年首次分离得到,1977年报道了第一例确诊的CDI病例。从那时起,CDI的发病率逐年上升,艰难梭菌感染现在是全世界医院腹泻的最常见原因。
艰难梭菌在我国健康成年人结肠的定植率约为4%-7%,而腹泻患者的检出率高达15%-40%。但为什么一些人群肠道中存在艰难梭菌,却没有出现任何症状?而另一些则会出现腹泻、腹痛,甚至发展为假膜性结肠炎?
这是因为艰难梭菌可分为产毒型和非产毒型,通常只有产毒型会引发临床症状,其感染的表现主要受多种毒力因子影响,这些毒力因子可能比艰难梭菌的存在更为重要。并且健康的肠道微生物组对艰难梭菌感染具有保护作用。平衡的微生物和宿主因子可抑制艰难梭菌的发芽和生长,同时微生物群与宿主免疫系统的相互作用调节免疫反应,刺激抗菌肽和分泌型IgA的产生,维持菌群平衡,通过营养竞争、生态竞争和生态位排斥等机制抵抗艰难梭菌的定植和感染。
例如一些有益菌通过产生短链脂肪酸降低管腔pH值(不利于艰难梭菌),并刺激粘蛋白和抗菌肽的生成以增强防御屏障。丁酸盐还能稳定缺氧诱导因子-1(HIF-1)、增强紧密连接,保护肠道上皮免受艰难梭菌毒素损害。
艰难梭菌的孢子和生长依赖特定胆汁酸,肠道共生细菌通过调节胆汁酸代谢产物,抑制其萌发和定植。例如,Clostridium scindens可催化胆汁酸7α-脱羟基化,生成次级胆汁酸,从而增强对艰难梭菌感染的抵抗力。
当肠道微生物组的平衡状态受到干扰或破坏时,艰难梭菌感染(CDI)的易感性会显著增加。例如由于使用抗生素,年龄增长、其他胃肠道疾病,营养状态不佳、肥胖、癌症化疗这些因素都会增加艰难梭菌感染的风险。
由于艰难梭菌的危害由毒力因子决定,检测产毒菌株或基因显得尤为重要。目前,一些检测方法只能识别艰难梭菌菌株,无法区分是否为产毒菌株,可能导致误诊或过度治疗。为提高诊断准确性,近年来开发了多种技术,包括检测毒素基因的分子诊断技术和直接检测毒素蛋白的免疫学方法。16S测序仅能分辨到物种层面,宏基因组测序(包括一些靶向的测序)则可识别毒力基因。这些技术能够较快速、准确地识别产毒菌株,帮助临床医生制定更有效的治疗方案,减少不必要的抗生素使用及相关并发症。
艰难梭菌感染的治疗和预防也是人们所关心的,其治疗方法包括针对细菌(抗生素)、针对毒素(抗体、结合剂)以及微生物群(保护或恢复)的方法,在暴发性病例或非手术治疗失败时,还可选择结肠切除术或其他微创手术。通过疫苗和益生菌预防艰难梭菌感染的研究逐渐显示出一定的临床效果。
希望通过本文的内容,能够帮助人们更加全面和清晰地了解艰难梭菌的相关知识,同时提高对其危害的认识,从而采取更加科学和有针对性的措施来预防和应对艰难梭菌感染。
艰难梭菌是一种革兰氏阳性、形成孢子的厌氧芽孢杆菌,近年来,由于抗生素的滥用导致肠道菌群失调,艰难梭菌感染(CDI)的发病率在中国和全球范围内不断上升,显示出这一公共卫生问题的严重性。
2022年,中国艰难梭菌感染治疗市场规模达34.14亿元,全球艰难梭菌感染治疗市场规模达到78.74亿元,预计全球艰难梭菌感染治疗市场规模将在2028年达到147.95亿元。
艰难梭菌的感染率不断上升,很多人可能想知道自己体内是否存在这种细菌,以及是否艰难梭菌存在于人体就会致病及造成危害?随着谷禾的视角一起往下看。
1
毒力因子影响艰难梭菌的致病性
首先要强调的一点是,艰难梭菌感染的临床表现受到多种毒力因子的影响,这些毒力因子可能比艰难梭菌的存在更为重要。艰难梭菌分为产毒型和非产毒型,通常只有产毒型会引发临床症状。
产毒艰难梭菌主要产生毒素A(肠毒素)和毒素B(细胞毒素),少部分仅产生毒素B。高毒力菌株(如027型)除了产生这两种毒素外,还产生二元毒素。
据国外综合医院统计,A(+)B(+)占艰难梭菌的57%,A(-)B(+)占34%,A(-)B(-)占9%。毒素A阳性,毒素B阴性的菌株尚未被发现,毒素B可以单独导致艰难梭菌致病。
◮ 艰难梭菌的毒力因子
毒素A:主要作用于肠道,导致肠道上皮细胞的损伤和炎症反应。它通过结合肠道细胞表面的受体,诱导细胞内信号转导,导致细胞凋亡和肠道通透性增加,从而引发腹泻。
毒素B:具有更强的细胞毒性,能够直接破坏细胞骨架,导致细胞死亡,破坏紧密连接并丧失肠道屏障功能。它在致病过程中,尤其是在高毒力菌株中,起着关键作用。
二元毒素:一种ADP-核糖基转移酶,导致肌动蛋白细胞骨架解聚(导致屏障功能丧失和紧密连接破坏)和微管突起(导致艰难梭菌粘附增加)。
致病性基因和毒素作用方式
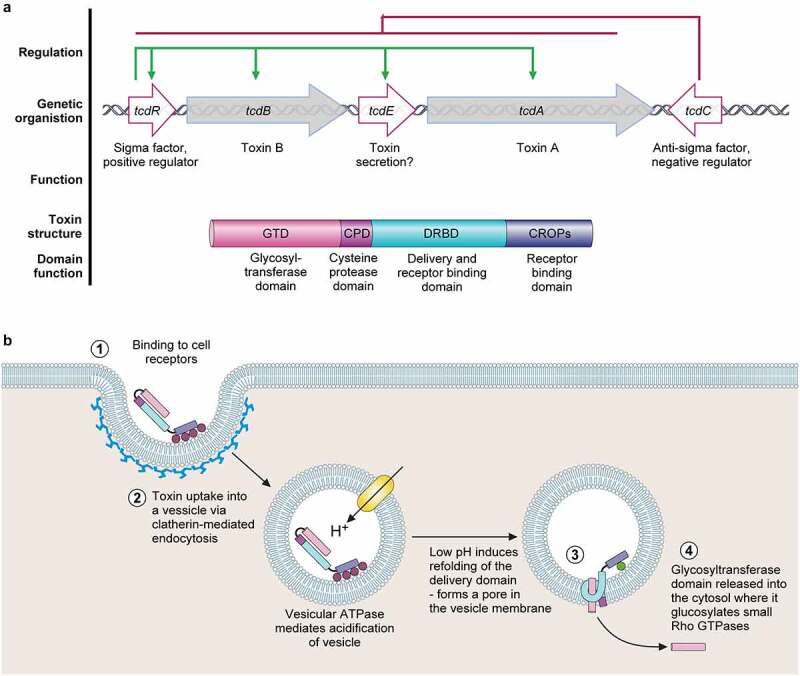
Buddle JE,et al.Virulence.2023
◮ 毒素诱导引发的免疫反应导致各种症状
这些毒素在致病性位点(PaLoc)内编码,能够与肠上皮细胞的受体结合并被内化。在细胞内,它们使小的Rho蛋白葡萄糖化,导致紧密连接破裂、上皮完整性降低,并增加细菌对宿主上皮的粘附。
毒素诱导的肠道屏障损伤会引发免疫反应,其特征是分泌促炎细胞因子和趋化因子,导致中性粒细胞、肥大细胞、单核细胞和先天性淋巴细胞的募集和激活;以及花生四烯酸代谢物的分泌、P物质和活性氧中间体的生产。这些细胞因子和免疫细胞的作用会引发艰难梭菌感染的临床症状。例如,肥大细胞脱颗粒刺激组胺释放,增加肠道屏障的通透性,导致大量液体流失到管腔中,从而引发严重的腹泻、痉挛、脱水和伪膜性肠炎等症状。
艰难梭菌的各种毒力因子

Buddle JE,et al.Virulence.2023
2
产毒艰难梭菌及我国的流行情况
目前已鉴定出几十种艰难梭菌菌株,其相对比例在过去几年中迅速变化,且毒力和感染能力可能存在差异。我们这里简单介绍几种高毒性艰难梭菌菌株以及我国的主要流行情况。
◮ 毒力较高的艰难梭菌
⑴027菌株
027菌株是近年来备受关注的高毒力菌株,部分027菌株在体外能够产生更多毒素,并且更容易与人类肠道上皮细胞结合,通常与严重腹泻和高死亡率相关。该菌株在北美和欧洲的医院中广泛传播,成为医院获得性腹泻的主要原因。
⑵017菌株
这种菌株在1990年代首次被识别,主要在亚洲地区流行。017菌株通常被认为是毒素A阴性、毒素B阳性的菌株。由于毒素A检测通常用于识别粪便样本中的艰难梭菌,因此可能会遗漏这种菌株。
⑶078菌株
078介导的艰难梭菌感染患者更常见于靠近农场的地区,078菌株是食用动物中最常见的类型,在牛和猪中都有发现,人可能通过食用动物导致感染。078菌株的毒力特征与027菌株相似,所有027和078菌株似乎都具有完整的肌动蛋白特异性ADP核糖基化毒素。
⑷其他菌株
除了027、017和078菌株,还有其他核糖型的艰难梭菌菌株,如001、106和053等。然而每种核糖型的相对比例在过去几年中迅速变化。核糖型001的比例从25.1%下降到7.8%,核糖型106的比例从26.2%下降到20.2%,且106几乎只在英国发现。
◮ 我国的艰难梭菌流行情况

一项荟萃分析统计了我国大陆部分省份的艰难梭菌感染发病率及主要流行和耐药的艰难梭菌。
艰难梭菌在健康成年人结肠的定植率约为4%-7%,而国内腹泻患者的检出率为15%-40%(共分析了15,313个样本)。在中国大陆,ST-37(017)和ST-3是最普遍的菌株;幸运的是,ST-1(027)和ST-11(078)等高毒力菌株迄今很少出现。
并且不同省份的阳性率存在差异显著:
湖北:23%
河北:19%
安徽:19%
四川:17%
宁夏:4%
河南:3%
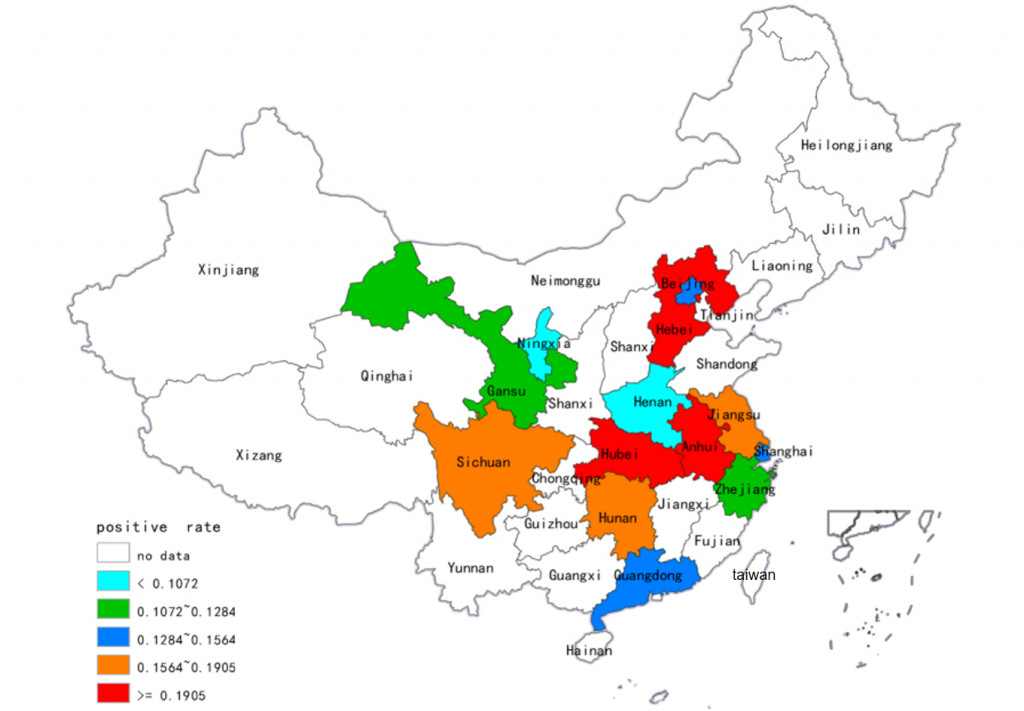
doi: 10.1038/srep37865.
中国临床艰难梭菌的分子特征
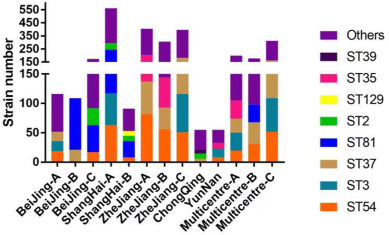
Wu Y,et al.Anaerobe.2022
中国大陆的流行艰难梭菌株并非高毒力类型,这可能是近年来没有艰难梭菌感染爆发的原因。此外,关于毒素A阴性和毒素B阳性菌株的报道逐渐增加,许多研究也发现了这一现象。在亚洲,毒素A阴性和毒素B阳性菌株的数量明显高于欧美国家。
◮ 我国的艰难梭菌耐药情况
我国的艰难梭菌对环丙沙星、克林霉素和红霉素的耐药率高于其他地区;然而,报道的艰难梭菌分离株均未对甲硝唑、万古霉素、替加环素或哌拉西林/他唑巴坦耐药。
3
非产毒艰难梭菌
◮ 菌株特性不同,不会致病
非产毒性艰难梭菌(NTCD)是指那些不产生致病毒素的艰难梭菌菌株。这些菌株能够在肠道中定殖,并且通常从无症状个体中分离出来。
非产毒性艰难梭菌菌株表现出与产毒性菌株不同的表型特征,如更高的甲硝唑耐药性和更高的孢子形成效率。
◮ 非产毒菌株定植可能具有保护作用
非产毒性艰难梭菌能够在肠道中定殖而不引起症状,并有研究发现其可能有助于降低由产毒性艰难梭菌引起的感染风险。研究表明,NTCD的定殖可以通过竞争性抑制机制,防止产毒性菌株的定殖和毒素产生。
临床应用与研究:在临床试验中,NTCD-M3等菌株已被用于预防艰难梭菌感染,通过诱导肠道和系统性免疫反应,从而减少产毒性艰难梭菌的附着和感染。
了解艰难梭菌感染的发病机制对于制定有效的疾病治疗和预防措施至关重要。让我们一起来看下人体是如何感染艰难梭菌以及感染后会出现的症状。
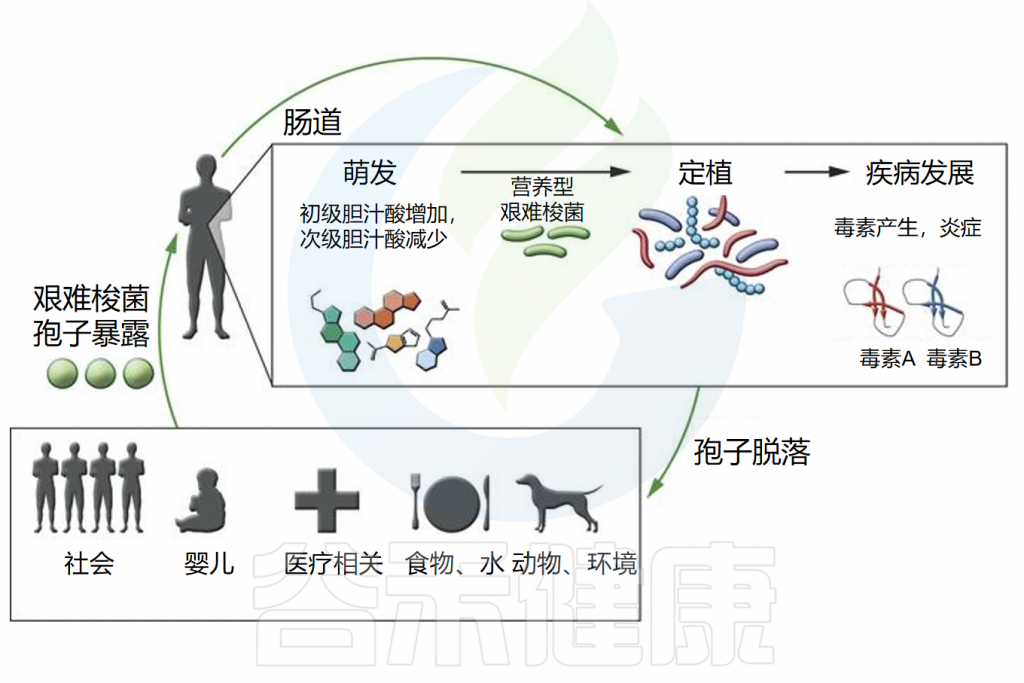
◮ 艰难梭菌主要通过孢子传播感染
艰难梭菌(C.difficile)作为一种专性厌氧菌,通常无法在大气中存活,那么它是如何传播到人体的呢?这是通过形成孢子来实现的,这些孢子即使在恶劣的环境条件下也能存活。除了提供对氧的抵抗力外,孢子还对紫外线、干燥、热、许多消毒剂和抗生素具有抵抗力。
注:艰难梭菌孢子已在各种环境来源中检测到,包括家畜、水源和土壤。
艰难梭菌感染的发病机制
doi.org/10.1172/JCI72336.
1
感染过程
◮ 孢子生长必须依赖特定的胆汁酸
通过粪口途径摄入艰难梭菌孢子后,孢子需要发芽并生长为定植于胃肠道的营养细胞。然而,摄入孢子并不总是会导致定植,因为胃肠道环境必须适宜这一过程的发生。
体外研究表明,发芽和生长成营养形式取决于特定初级胆汁酸(如牛磺胆酸)的存在。相反,其他胆汁酸,如鹅去氧胆酸,可能会抑制艰难梭菌孢子的发芽。
胃肠道内的微生物在胆汁酸代谢中起关键作用,微生物群落的调节会影响代谢物的可用性。来自抗生素处理小鼠的盲肠提取物含有高水平的胆盐并促进孢子萌发,而来自未处理小鼠的盲肠提取物则没有。我们推测:抗生素的使用改变了肠道微生物群的代谢,导致胆汁酸种类更易促进艰难梭菌孢子的生长。
◮ 定植后毒素介导炎症和疾病
一旦定植,艰难梭菌会引发毒素介导的炎症和疾病。它产生两种主要毒素,即艰难梭菌毒素A和B(TcdA和TcdB),这些毒素在营养生长的静止期产生,主要导致粘膜上皮损伤和炎症反应。
另一种毒素,艰难梭菌二元毒素(CDT),会破坏肌动蛋白细胞骨架,研究表明其存在可能增加菌株的毒力。
由于孢子暴露和艰难梭菌定植不一定导致临床疾病,胃肠道微生物群和宿主在艰难梭菌的疾病发展中可能发挥重要作用。
2
艰难梭菌感染后的临床症状
产毒艰难梭菌菌株感染的临床表现通常从无症状携带到轻度或中度腹泻,或是暴发性,有时是致命的。症状在定植后不久开始,中位发病时间为2至3天。
◮ 常见的症状
腹泻:这是艰难梭菌感染最常见的症状,通常表现为水样腹泻,频率可达每天多次。腹泻可能伴有粘液或脓性分泌物。
腹痛和腹部不适:患者常感到腹部绞痛或不适,疼痛可能是间歇性的,且通常与腹泻发作相关。
发热:部分患者可能出现低热,体温通常在37.5°C至38.5°C之间。
恶心和食欲减退:患者可能会感到恶心,伴随食欲减退,进而导致体重下降。
脱水:由于频繁腹泻,患者可能出现脱水症状,如口干、尿量减少、皮肤弹性下降等。
腹胀:部分患者可能会感到腹部胀气或腹部膨胀。
◮ 严重并发症
在一些情况下,艰难梭菌感染可能导致更严重的并发症,包括:
伪膜性结肠炎:表现为严重的腹痛、腹泻和发热,肠道内形成伪膜。
肠穿孔:极少数情况下,感染可能导致肠道穿孔,表现为剧烈腹痛和急性腹膜炎。
中毒性巨结肠:具有全身中毒症状及全结肠或节段性结肠扩张的临床表现。是一种危及生命的并发症,表现为腹痛、腹胀、腹泻和全身症状加重,可能需要手术干预。
◮ 肠外表现
艰难梭菌感染不仅会导致肠道相关的症状,还可能引发一些肠道之外的表现,包括脱水、电解质紊乱、低白蛋白血症、低血压、肾功能衰竭、全身炎症反应综合征、关节炎、菌血症、败血症甚至死亡。
感染的核心是肠道菌群平衡被破坏
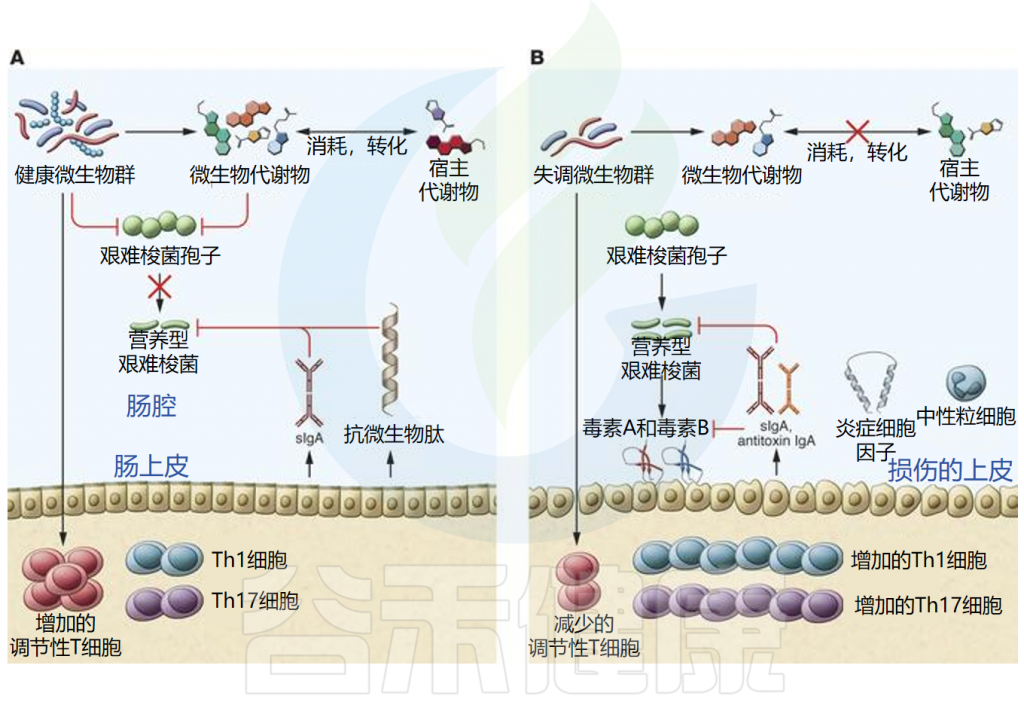
艰难梭菌感染发病机制的核心是微生物群的破坏。健康的肠道微生物群对于防止病原体定植(称为定植抗性)至关重要 。
未被破坏的微生物群能够抵抗病原体的定植,健康平衡的微生物和宿主因子均可抑制艰难梭菌的发芽和生长。同时微生物群和宿主免疫系统之间的串扰导致调节免疫反应。此外,微生物群可以刺激抗菌肽和分泌型IgA的产生,从而维持微生物群的组成。并且已经提出了多种机制来解释为什么微生物群被破坏会导致定植抗性丧失,包括营养竞争、生态竞争和生态位排斥。
而由于抗生素使用、药物、年龄变化、饮食或炎症等因素导致微生物群的破坏,可导致艰难梭菌感染的发展。由于结构或代谢环境的变化,菌群失调会导致定植抗性丧失。特定群落成员的损失可能会影响微生物和宿主产生的代谢物的水平,从而促进孢子萌发和艰难梭菌生长。菌群失调也可能通过免疫调节的丧失和促炎状态导致免疫反应失衡,这两者都会影响疾病的发展。营养型艰难梭菌产生的毒素可刺激炎性细胞因子、中性粒细胞和抗毒素抗体的生成。
微生物群对CDI期间病原体抗性和宿主的机制
doi.org/10.1172/JCI72336.
据研究文献报道,以下这些因素会增加获得CDI的风险。
1
使用抗生素
◮ 使用过抗生素的人患病率更高
使用抗生素是艰难梭菌感染中最常见的诱发因素。一项大型回顾性研究分析了10154例艰难梭菌感染患者的数据,发现78%的患者在感染前3个月内使用过抗生素。
大多数抗生素都与艰难梭菌感染(CDI)发展相关,但最常见的药物包括青霉素、头孢菌素和氟喹诺酮类药物。在一项关于社区获得性CDI中抗生素使用情况的荟萃分析中,克林霉素发生社区获得性CDI的风险最高,然后依次是氟喹诺酮类药物、头孢菌素类、青霉素类、大环内酯类和磺胺类/甲氧苄啶类。
◮ 使用抗生素导致肠道微生物平衡被破坏增加艰难梭菌感染的风险
抗生素的使用,尤其是广谱抗生素,会显著改变肠道微生物群的组成和多样性,导致微生物群失调。这种失调主要表现为有益菌群(如双歧杆菌、乳酸菌等)数量减少,抑制艰难梭菌的生长和毒素产生的能力减弱,导致更易感染艰难梭菌。
艰难梭菌感染的发病机制
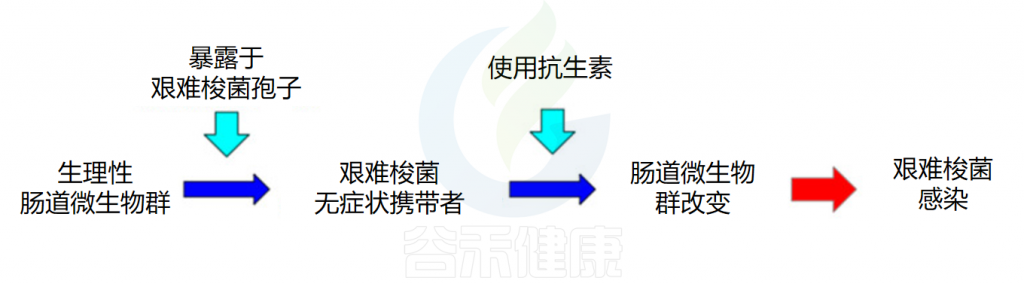
Piccioni A,et al.Int J Mol Sci.2022
2
高龄
◮ 高龄人群CDI的患病率和死亡率更高
正如多项研究所记录的那样,高龄是CDI的重要风险因素。65岁及以上的老人患病人数显著增加,人口发病率比其他年龄组高5倍以上。
并且还发现CDI的死亡率随着年龄的增长而显著升高。在2011年对美国CDI负担的最新研究中,发现65岁及以上的人大约占CDI病例总数的57%,但该年龄组的CDI死亡占CDI死亡总数的83%。
◮ 年龄增长免疫退化、微生物多样性下降
年龄增长会影响肠道微生物组结构。人类肠道微生物组在一生中经历显著变化,老年人群的微生物组多样性较低且不断变化。研究发现,老年人保护性物种(如双歧杆菌和部分厚壁菌门成员)减少,有害物种(如变形菌门)增加。这些变化与免疫系统退化(即免疫衰老)有关。
尽管年龄是CDI的独立危险因素,但其与抗生素使用增加、更频繁的医院就诊及疾病发展密切相关,这些因素共同提高了艰难梭菌的易感性。
新生儿与成人艰难梭菌感染的比较
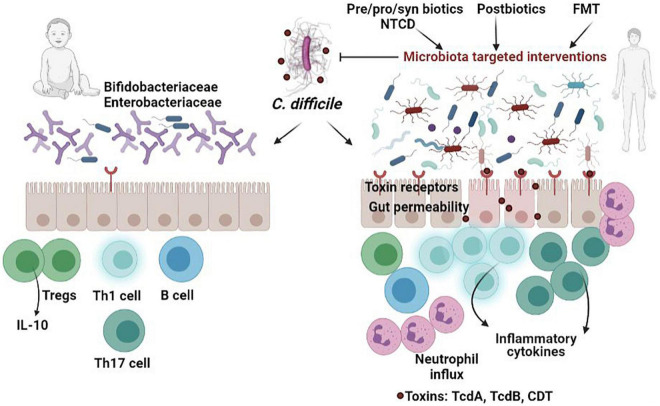
Vasilescu IM,et al.Front Microbiol.2022
3
其他胃肠道疾病
患有其他胃肠道疾病的患者也可能更容易感染艰难梭菌。炎症性肠病(IBD)已被证实是CDI的危险因素,并与更严重的疾病结果相关。IBD患者肠道菌群呈现多样性降低,同时存在以变形菌门为主的多种潜在致病菌。然而,这些微生物群落如何影响艰难梭菌易感性的具体机制较为复杂。
◮ 肠道炎症性疾病会促进艰难梭菌感染
宿主免疫反应能调节微生物群,而IBD加重CDI病情表明炎症可促进CDI发展。抗菌肽脂质运载蛋白-2和钙卫蛋白等炎症产物限制肠道环境中营养物质可用性,可能为艰难梭菌创造有利条件。肠道菌群类型影响粘膜IgA库,复发性CDI患者结肠活检中IgA产生细胞减少。
还观察到各种微生物会影响T细胞的亚群,例如梭菌属诱导Treg物种和分段丝状细菌诱导Th17细胞分化。这些微生物种群的调节,例如抗生素后,可能会影响艰难梭菌的定植。
4
其他风险因素
除此之外,还有一些因素也会增加艰难梭菌感染的风险。如:
医疗机构暴露:住院患者,特别是长期住院者,长期护理机构居住者容易艰难梭菌感染;
胃酸抑制剂使用:质子泵抑制剂(PPIs)和H2受体拮抗剂,降低胃酸可能导致艰难梭菌孢子存活率增加,长期使用与CDI风险增加相关。
手术和医疗操作:胃肠道手术、鼻胃管和胃肠营养管的使用、结肠镜检查会导致艰难梭菌感染风险升高;
营养状态不佳:低蛋白血症、营养不良的人群易感染艰难梭菌;
肥胖、癌症化疗也可能会增加艰难梭菌感染的风险。
肠道微生物群被破坏是艰难梭菌感染发病的关键机制。健康的肠道菌群对防止艰难梭菌定植和感染至关重要。那么,微生物群究竟如何在这一过程中发挥作用?那我们一起来看看。
艰难梭菌感染中的微生物群改变
正常的肠道菌群通过对艰难梭菌的定植抗性在预防 艰难梭菌感染中起着核心作用。这导致了一个问题,即是否存在一种微生物群紊乱模式,这种模式易导致艰难梭菌定植和感染。
◮ 菌群多样性降低,厚壁菌门增加
多项研究一致显示,与健康人群相比,艰难梭菌感染(CDI)患者的菌群复杂性和丰富度明显降低。这种多样性降低被认为是CDI发病和复发的关键因素。
厚壁菌门(Firmicutes)减少:CDI患者中厚壁菌门的丰度和多样性显著降低,尤其是瘤胃球菌科(Ruminococcaceae)和毛螺菌科(Lachnospiraceae)等保护性菌群。
拟杆菌门(Bacteroidetes)改变:CDI患者通常表现为拟杆菌门多样性降低,但有研究显示有症状患者中某些拟杆菌属(Bacteroides)可能增加。
变形菌门(Proteobacteria)增加:CDI患者体内变形菌门(特别是肠杆菌科)的比例明显增高。
◮ 产丁酸细菌减少,机会性病原体增加
接受多轮抗生素治疗的复发性CDI患者肠道微生物群组成遭受严重破坏。对比CDI患者、艰难梭菌阴性院内腹泻患者和健康对照受试者的远端肠道微生物群发现,艰难梭菌感染可能导致功能性菌群发生以下变化:
产丁酸盐细菌减少:包括罗氏菌属(Roseburia)、普拉梭菌(Faecalibacterium Prausnitzii)、假丁酸弧菌属等。
产乳酸细菌增加:特别是肠球菌属(Enterococcus)。
机会性病原体增加:研究发现,与健康者相比,白色念珠菌和光滑念珠菌在艰难梭菌阳性样本中更常见。
在艰难梭菌感染患者的肠道微生物群中,肠球菌、乳酸菌、大肠杆菌、肠杆菌、副拟杆菌、嗜粘蛋白阿克曼菌的相对丰度增加,以及粪杆菌、Roseburia、Blautia、Prevotella、链球菌的水平降低。
艰难梭菌感染相关的肠道微生物群失调

Vasilescu IM,et al.Front Microbiol.2022
生化和免疫紊乱影响感染
肠道菌群失调还引发多种生化和免疫紊乱:如短链脂肪酸(SCFA)水平降低、初级胆汁酸增多、碳水化合物可利用性提高、免疫功能受抑及竞争微生物缺乏。这些变化共同促进艰难梭菌的定植、孢子萌发和生长繁殖。
◮ 丁酸盐有助于减轻艰难梭菌毒素的损害
短链脂肪酸可以通过降低管腔pH值(对艰难梭菌不利)并通过产生粘蛋白和抗菌肽来刺激防御屏障。丁酸盐还可以通过稳定缺氧诱导因子-1(HIF-1)和增加紧密连接来保护肠道上皮免受艰难梭菌毒素的损害,抑制肠道炎症和细菌易位。
在小鼠的饮用水中添加丁酸盐,施用丁酸盐的前药、三丁酸甘油酯或富含菊粉的饮食(菊粉可以被肠道共生细菌发酵,产生短链脂肪酸,主要是乙酸盐、丙酸盐和丁酸盐)可使小鼠免受CDI的侵害。
◮ 胆汁酸会影响艰难梭菌的定植和生长
艰难梭菌孢子萌发由蛋白酶CspC和CspA感知胆汁盐和氨基酸复合物而调控。某些胆酸盐衍生物和甘氨酸可促进孢子萌发,而脱氧胆酸盐抑制艰难梭菌生长,鹅去氧胆酸盐则阻断牛磺胆酸盐介导的萌发过程。
共生肠道梭菌通过调节胆汁酸代谢产物,创造不利于艰难梭菌萌发和定植的环境。例如,Clostridium scindens能催化胆汁酸7α-脱羟基化,产生次级胆汁酸,增强对艰难梭菌感染的抵抗力。失去这类能将初级胆汁酸转化为具抗菌活性次级胆汁酸的微生物,将显著增加CDI风险。
◮ 艰难梭菌会刺激其他细菌产生吲哚造成不利肠道环境
最近的研究发现,CDI患者肠道腔中的吲哚水平增加(色氨酸代谢物参与微生物生长、毒力诱导、抗酸性、生物膜形成),艰难梭菌本身不能产生这种代谢物,但会刺激其他细菌产生吲哚,以阻止和抑制吲哚敏感菌株的生长和发展,包括保护性肠道微生物群代表, 从而确保有利于艰难梭菌生存的肠道环境。
微生物群介导艰难梭菌的定植和感染
一些人群中虽然有艰难梭菌定植,但并不会出现致病症状,这可能与肠道微生物群的保护作用相关。
◮ 婴儿艰难梭菌的定植率较高,但很少出现症状
由于婴儿肠道的不成熟和肠道微生物群的不稳定,其特别容易受到艰难梭菌定植的影响,但并不会出现症状和发展为疾病。
在<1个月大的婴儿中,艰难梭菌的平均定植率为 37%,范围在0到61%之间。在1到6个月大之间,定植率仍然很高,为30%,出生后第一年结束时下降到约10%。不同研究报告的12个月以下儿童的定植率从14%到71%不等,这个年龄组最常被艰难梭菌定植,并且他们没有症状。
无症状携带率在3岁左右下降至0-3%,接近成人水平。同时,出生至24个月间血清针对毒素A和B的IgG抗体浓度逐渐升高。3岁左右,儿童肠道微生物群趋于稳定并具备成人特征,这可能导致症状性CDI从该年龄开始增加。
注:新生儿微生物群以革兰氏阳性球菌、肠杆菌科或双歧杆菌科为主,逐渐过渡到以双歧杆菌科为主。双歧杆菌可通过上调肠道树突状细胞产生IL-10,解释了艰难梭菌定植婴儿无症状的原因。在剖宫产新生儿中,T细胞和CD4+辅助性T细胞水平降低,可能因未成熟的免疫系统无法激活炎症反应所致。
研究发现,配方奶喂养婴儿的艰难梭菌定植率高于母乳喂养婴儿,且母乳喂养婴儿的菌落计数明显更低,这可能与母乳中含有毒素A和B的抗体有关。
总之,新生儿艰难梭菌定植的高携带率可以用新生儿肠道的不成熟和肠道微生物群的存在来解释。然而,出生后的母乳喂养带有毒素抗体,加上艰难梭菌毒素受体的缺乏,可以帮助婴儿免受艰难梭菌毒素的有害影响。
◮ 肠道微生物多样性降低的人群和老年人更易受艰难梭菌影响
几项研究还比较了老年人群的肠道微生物样本,这些人群更容易受到艰难梭菌影响。
老年艰难梭菌感染患者的肠杆菌科、肠球菌属和乳酸杆菌的数量较高,而健康的老年人携带更多样化的拟杆菌属菌株。并且与任一老年人群相比,健康成年人也更有可能拥有更多的双歧杆菌和拟杆菌。最近使用16S rRNA 基因高通量测序的研究更深入地研究了艰难梭菌阳性人群的群落结构。观察到,与健康患者相比,活动性CDI患者的肠道微生物群多样性较低。
类似研究发现,与健康成人相比,CDI腹泻患者的肠道微生物群多样性显著降低,尤其是厚壁菌门的多样性较低。健康人群中以Lachnospiraceae、Ruminococcaceae和Bacteroidaceae为主导,而CDI和非CDI腹泻患者的微生物群落高度相似,表明腹泻或炎症可能与特定微生物群落相关。
在小鼠模型中进行了类似观察,与人类相似,抗生素降低了小鼠肠道微生物群多样性,使其更易患肠道疾病,包括CDI。研究发现,头孢哌酮、克林霉素或多种抗生素处理后,易感小鼠感染前以乳酸菌科和肠杆菌科为主,而对CDI具有保持抗性的动物以Lachnospiraceae为主。后续研究表明,被Lachnospiraceae定植的小鼠比被大肠杆菌定植的小鼠艰难梭菌定植减少且病情较轻。小鼠模型为识别CDI保护性成分提供了可测试的方法。
◮ 复发性CDI:微生物群恢复不完全
艰难梭菌感染(CDI)最常见的并发症是恢复不完全和反复感染。初次感染后复发率约为20-30%,3次感染后高达60%。研究发现,复发患者的微生物群多样性低于单次CDI患者,这表明可能可以根据感染期间存在的微生物群落预测复发。尽管一些研究在分析中包含了复发样本,但尚未确定复发性CDI患者特有的微生物特征。
另外有研究发现,复发性CDI患者体内初级胆汁酸浓度较高。粪菌移植后,次级胆汁酸浓度增加,接近健康供体水平,而这些酸在FMT前样本中未检测到。该结果与体外和小鼠研究一致,表明次级胆汁酸(如石胆酸和脱氧胆酸)可抑制艰难梭菌生长。尽管细菌群落决定代谢环境,但不同细菌群落可能通过相似功能实现相同代谢结果,仅靠群落结构可能不足以预测复发风险。
如何定义艰难梭菌感染病例?
只有产生毒素的产毒艰难梭菌菌株才具有致病性。根据欧洲临床微生物学和传染病学会(ESCMID)指南,CDI定义为:(i)符合CDI的临床表现,且粪便中检测到毒素A或毒素B的艰难梭菌,且无其他腹泻原因;或(ii)伪膜性结肠炎(PMC)患者。
美国医疗保健流行病学学会和美国传染病学会的定义类似:CDI病例需具备症状(通常为腹泻),且粪便检测产毒艰难梭菌或其毒素阳性,或结肠镜或组织病理学显示PMC。
那我们该如何检测艰难梭菌感染(CDI)?艰难梭菌感染检测通常包括以下方法:
1
临床评估
•症状:难梭菌感染病的主要症状包括腹泻(每天3次或以上稀便,持续2天以上)、腹痛、发热、恶心和脱水等。严重病例可能出现伪膜性结肠炎(PMC)、中毒性巨结肠或感染性休克。
•病史:重点关注患者的抗生素使用史(尤其是第三代头孢菌素、氟喹诺酮类等)、住院史、免疫抑制状态以及质子泵抑制剂(PPI)的使用。
2
实验室检测方法
◮ 细菌培养
用环丝氨酸头孢西丁果糖琼脂培养基(CCFA)等进行厌氧培养,需时72小时,灵敏度高且可获得菌株,但不能检测毒素不能区分非产毒株。
但分离菌株后,可以通过直接从菌落悬浮液或细菌生长的肉汤上清液中检测其体外毒素的产生来确定其致病潜力。
◮ 高通量测序
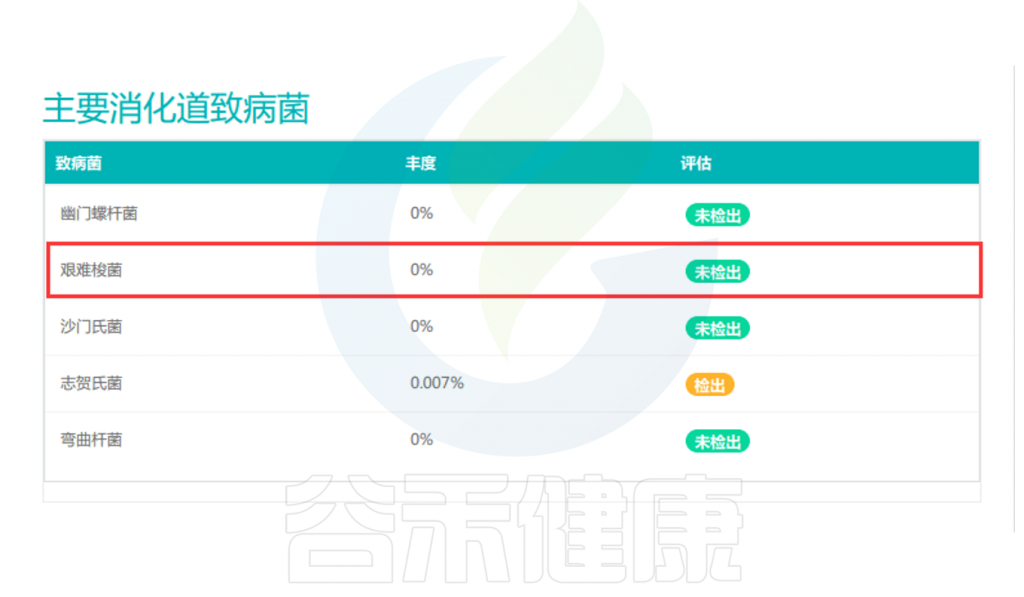
高通量测序可检测艰难梭菌菌株或毒力基因,16S测序仅能分辨到物种层面,可通过谷禾16S健康报告的解读,并结合自身有没有腹泻症状。然后进一步去判别是否存在产毒菌株。
与此同时,宏基因组测序(包括一些靶向的测序)则可识别毒力基因。
◮ 谷氨酸脱氢酶测定
谷氨酸脱氢酶(GDH)是所有艰难梭菌菌株表达的代谢酶,可通过ELISA或免疫层析法检测。阳性结果仅表明存在艰难梭菌,无法判断其是否产毒。由于其高阴性预测值(NPV,80.0%-100%),GDH阴性结果通常可排除感染,常用于初筛。
◮ 毒素检测
细胞毒性测定被认为是检测艰难梭菌的游离毒素(主要是毒素 B)的参考方法。
酶联免疫吸附试验(EIA):检测艰难梭菌毒素A或毒素B,快速但敏感性较低。
细胞毒素中和试验:检测毒素活性,敏感性和特异性较高,但耗时较长。
◮ 核酸扩增检测(NAATs)
实时PCR或环介导等温扩增法(LAMP) :检测艰难梭菌毒素基因,耗时短,敏感性高,但可能检测到无症状定植者,且成本高。
3
综合算法
根据欧洲临床微生物学和传染病学会(ESCMID)指南,推荐使用两步或三步算法:
初筛:谷氨酸脱氢酶(GDH)抗原检测或核酸扩增试验(NAAT)。
确认:毒素检测(EIA或细胞毒素试验)。
4
其他辅助检查
血常规:轻、中度感染者外周血白细胞可正常,严重感染者白细胞升高。
降钙素原(PCT):对诊断CDI意义不大,但PCT>0.2 ng/ml时,提示CDI有重症化趋势。
腹部CT:对重症CDI患者有辅助诊断意义,即结肠壁增厚、结节状结肠袋增厚、水肿厚度>4 cm,特别是炎症部位在升结肠。
内镜检查:内镜检查可作为辅助诊断,典型征象包括黏膜充血、水肿、糜烂、溃疡、直肠乙状结肠有多发性隆起的斑片或融合为大片的灰绿色、黄褐色伪膜覆盖黏膜表面。部分患者表现可不典型,尤其炎症性肠病合并艰难梭菌感染时多无特征性病变。伪膜性改变可能表明感染了产毒艰难梭菌。
艰难梭菌感染(CDI)的治疗包括针对细菌(抗生素)、针对毒素(抗体、结合剂)、宿主反应(调节炎症)或微生物群(保护或恢复)的方法,以及在暴发性病例或非手术方法失败的情况下,结肠切除术或其他侵入性较小的手术。选择取决于疾病严重程度、病史和宿主因素。
1
针对细菌——抗生素
停用有问题的抗生素以恢复正常肠道菌群是治疗CDI的理想方法。但在感染负担高或需持续抗生素治疗其他感染时,通常需要使用针对艰难梭菌的抗菌药物。
然而,几乎所有抗生素,包括针对艰难梭菌的药物,都可能进一步破坏肠道微生物群,延迟耐药性菌群的恢复,并增加再次感染的风险。目前用于治疗CDI的主要抗菌药物包括:
•万古霉素:万古霉素是美国食品药品监督管理局(FDA)批准的第一种CDI药物。最近的临床试验数据表明,万古霉素在治疗重症时优于甲硝唑。
•甲硝唑:与万古霉素的疗效相当,成本优势以及对万古霉素耐药肠球菌传播的担忧,甲硝唑成为CDI的推荐药物。但随着艰难梭菌流行菌株 BI/NAP1/027/III 的出现,甲硝唑治疗失败的报道越来越多。
•非达霉素:非达霉素也是获得FDA批准的其他治疗CDI药物。
•新型小分子抗菌剂:乳酸菌素3147是一种由乳酸乳球菌产生的双组分抗生素,它靶向细胞壁前体脂质II,抑制肽聚糖的生物合成,并在细胞膜上形成孔,实现细胞死亡。粪便发酵模型证明了乳酸素 3147 对一系列艰难梭菌分离株的强效细胞杀伤活性,在 30 分钟内完全消除艰难梭菌。
与传统药物相比,这种窄谱抗菌药物可能具有多种优势,包括减少对微生物组的影响、降低复发率、优于常规治疗以及改善药代动力学特征。然而,在保持非孢子形成厌氧菌和总革兰氏阴性厌氧菌完好无损的同时,这种抗菌剂对乳酸杆菌和双歧杆菌产生了负面影响。
2
针对毒素——阻断、中和毒素
CDI的发病机制以毒素介导为主,因此中和或阻断毒素是合理策略。但尽管抗毒素在动物模型中可改善疾病,但在人类中仅表现为减少复发性CDI。
•单克隆抗体:一项随机双盲安慰剂对照研究评估了针对艰难梭菌毒素A和B的两种中和单克隆抗体。在200名参与者中,治疗组的CDI复发率显著低于安慰剂组。然而,单克隆抗体未能缩短腹泻持续时间、降低严重程度或减少住院时间。住院、年龄较大、有严重潜在疾病或重症CDI的患者对治疗反应较差。
•Tolevamer:Tolevamer 是一种高分子量苯乙烯磺酸盐聚合物,可在体外中和艰难梭菌毒素。一项针对轻中度疾病的研究显示,6克剂量的Tolevamer与每日500毫克万古霉素疗效相当。
注:然而,Tolevamer的临床成功率低于甲硝唑和万古霉素。汇总分析显示,Tolevamer组的临床成功率为44.2%,显著低于甲硝唑组的72.7%和万古霉素组的81%。随着疾病严重程度增加,Tolevamer的疗效进一步下降。
•免疫球蛋白(IG):在人体研究中,针对毒素A和B的血清IgG抗体与保护相关,静脉注射IG治疗复发性或重症CDI的效果尚无系统研究支持,仅有少量病例报告和系列报道提供个案证据。剂量、给药次数和间隔存在较大差异。静脉注射IG对临床效果的差异可能与人群中抗毒素抗体水平的不可预测性有关。
3
微生物疗法
肠道微生物群的扰动是艰难梭菌感染(CDI)发生的关键因素。一些抗生素治疗无症状感染会导致艰难梭菌持续脱落和复发风险增加。通过特定微生物群恢复受损的肠道微生物群,已成为打破CDI-抗生素-CDI循环的策略。
• 粪菌移植的治疗效果优于仅用抗生素
粪菌移植(FMT)或微生物群替代疗法的原理是通过正常供体的粪便恢复CDI患者受损的肠道微生物群。系统评价显示,CDI患者接受FMT的腹泻消退率约为77%-90%。
一项随机对照试验比较了粪菌移植(FMT)与两种对照方案。FMT组在口服万古霉素(500mg,每天4次)4-5天后接受移植,对照组则接受14天相同剂量的万古霉素治疗。结果显示,FMT组3个月症状消退率为81%,显著高于万古霉素组(31%)和万古霉素加灌肠组(23%)。
尽管FMT已使用数十年,但其对严重复杂CDI的疗效、免疫功能低下患者的安全性及不明供体粪便长期安全性仍存疑。据报道,28.5%的患者出现FMT相关不良事件,最常见为腹部不适和排便异常,具体取决于给药途径。
• 口服微生物组疗法—SER-109
SER-109是一种由活性厚壁菌门细菌孢子组成的口服微生物组疗法,用于降低艰难梭菌感染复发风险。其机制可能通过与艰难梭菌竞争必需营养物质或调节胆汁酸谱来重建定植抵抗力,或两者兼具。
进行了一项3期、双盲、随机、安慰剂对照试验,其中艰难梭菌感染发作3次或以上(包括符合条件的急性发作)的患者在标准护理抗生素治疗后接受SER-109或安慰剂(每天4粒胶囊,持续3天)。
结果显示,在接受标准护理抗生素治疗后艰难梭菌感染症状消退的患者中,口服SER-109在降低复发感染风险方面优于安慰剂。
以微生物群为中心的治疗方法

Vasilescu IM,et al.Front Microbiol.2022
4
手术干预
艰难梭菌感染(CDI)的手术治疗通常用于严重或复杂病例,尤其是当药物治疗(如抗生素或粪便微生物群移植)无效,或患者出现危及生命的并发症时。以下是艰难梭菌感染的主要手术治疗方法:
• 全结肠切除术
适应症:严重的中毒性结肠炎、肠穿孔或肠坏死;严重的腹腔感染(腹膜炎),药物治疗无效且病情迅速恶化。
优点:快速去除感染源,降低死亡风险。
缺点:创伤较大,术后恢复时间长,可能影响生活质量。
• 分段结肠切除术
适应症:感染局限于结肠的某一部分。
优点:保留更多的肠道功能。
缺点:感染可能扩散,手术效果不如全结肠切除术稳定。
• 回肠造口术联合结肠灌洗
适应症:不适合全结肠切除的高危患者(如老年人或伴有多种合并症)。
优点:创伤较小,适合高危患者。
缺点:疗效可能不如全结肠切除术。
• 腹腔引流术
适应症:腹腔内脓肿或局部感染。
优点:辅助治疗,减轻感染负担。
缺点:仅适用于局部并发症,不能根治感染。
5
噬菌体疗法
噬菌体疗法利用天然噬菌体感染并裂解病原菌,是应对抗菌药物耐药性危机的潜在治疗方法。与抗生素不同,噬菌体具有进化能力,可持续克服细菌的抗性机制,从而避免疗法过时。
• 噬菌体可以降低艰难梭菌的生长和毒素水平
一些噬菌体在治疗艰难梭菌感染中表现出潜力。例如,ФCD27在CDI分批发酵模型中可显著降低艰难梭菌的生长和毒素水平。一种噬菌体组合已在体外完全裂解艰难梭菌,并在小鼠模型中减轻疾病症状和细菌定植。该组合进一步优化为4种噬菌体,成功在发酵容器中彻底根除艰难梭菌,显示出作为治疗选择的可行性。
总体而言,特异性以及对抗细菌耐药性的能力表明噬菌体治疗作为艰难梭菌治疗剂的巨大前景。
6
通过疫苗预防艰难梭菌感染
随着艰难梭菌感染(CDI)的发病率、死亡率和医疗成本不断上升,预防疾病的免疫接种成为理想选择。人类研究表明,对艰难梭菌毒素的强体液反应可减少复发和无症状定植。目前,多种候选疫苗正在开发中,包括基于类毒素、重组毒素肽、DNA和表面蛋白抗原的疫苗,但大多处于临床前阶段。
• 疫苗有助于减少复发和无症状定植
已发现部分纯化的类毒素A和B疫苗在30名健康成人中具有安全性和免疫原性,≥90%的受试者对两种毒素产生血清抗体反应。在一项试点研究中,3名多次复发CDI患者在第0、7、28和56天接受类毒素肌肉注射,其中2人对毒素A和B的IgG水平显著升高,且3人均在疫苗接种后停用万古霉素,随访6个月无复发。
两项2期试验已完成,测试疫苗在高危中老年人和首发CDI患者中的效果。一项3期试验正在17个国家中进行,计划评估疫苗在多达15,000名参与者中预防首发CDI的效果。其他候选疫苗包括基因和化学修饰的全长TcdA和B及重组融合蛋白IC84,其1期研究已完成,但结果尚未公布。
7
通过益生菌预防艰难梭菌感染
• 益生菌有助于预防艰难梭菌定植及相关腹泻
多项小型研究及荟萃分析表明,益生菌的使用可能与预防艰难梭菌相关腹泻有关。益生菌通常通过抑制艰难梭菌定植、调节肠道微生物群和胆汁酸代谢、破坏细胞壁和细胞膜、下调炎症反应、改善肠道屏障功能以及缓解病原性结肠炎来预防和治疗CDI。
最常研究的益生菌为嗜酸乳杆菌和双歧杆菌属。最近,一项多中心、随机、双盲、安慰剂对照研究测试了含嗜酸乳杆菌和双歧杆菌(双歧双歧杆菌和乳双歧杆菌)的高剂量益生菌制剂对≥65岁接受抗生素治疗患者的疗效。1,493名受试者接受益生菌,1,488名接受安慰剂。分析显示,益生菌组发生抗生素相关性腹泻和艰难梭菌感染的数量少于安慰剂组。
• 益生菌发挥抗菌活性抑制艰难梭菌定植
短双歧杆菌(YH68)通过抑制生长、孢子形成、毒力发生及毒力基因表达,展现出抗艰难梭菌活性,并增强抗艰难梭菌抗生素的体外效果或预防体内临床表现。
克劳氏芽孢杆菌和罗伊氏乳杆菌可分泌直接抑制艰难梭菌的可溶性化合物,而Clostridium scindens等产生次生胆汁酸的菌体可增强艰难梭菌的定植抗性。
此外,研究发现了一些可能有效的新型益生菌和制剂,如:
Bacteroides thetaiotaomicron,
E.thailandicus strain d5B,
B.amyloliquefaciens C-1,
B.longum JDM301,
Pediococcus pentosaceus LI05,
B.breve (YH68)
未来需要更大样本量的多中心双盲研究,以明确益生菌在CDI中的作用,同时考虑菌株和抗菌剂类型等因素。
艰难梭菌感染作为一种全球性公共卫生挑战,其发病率和医疗负担正不断攀升。通过本文的系统介绍,我们可以了解到,艰难梭菌感染的致病性主要取决于其产生的毒素,而非仅仅是菌株的存在。
健康的肠道微生物群在预防艰难梭菌感染中扮演着至关重要的角色,肠道微生物平衡的破坏是导致感染风险增加的关键因素。随着科学研究的深入,我们对艰难梭菌的检测、诊断、治疗和预防手段也在不断完善,从传统抗生素到粪菌移植、益生菌干预和疫苗开发等多元化策略均显示出积极成效。
了解艰难梭菌感染的本质和发病机制,对于临床医生制定合理治疗方案、减少不必要的抗生素使用以及患者接受适当预防措施至关重要。希望在未来研究的推动下,我们能够进一步降低艰难梭菌感染的发病率和复发率,减轻其对公共健康的威胁。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Buddle JE, Fagan RP. Pathogenicity and virulence of Clostridioides difficile. Virulence. 2023 Dec;14(1):2150452.
Piccioni A, Rosa F, Manca F, Pignataro G, Zanza C, Savioli G, Covino M, Ojetti V, Gasbarrini A, Franceschi F, Candelli M. Gut Microbiota and Clostridium difficile: What We Know and the New Frontiers. Int J Mol Sci. 2022 Nov 1;23(21):13323.
Wu Y, Wang YY, Bai LL, Zhang WZ, Li GW, Lu JX. A narrative review of Clostridioides difficile infection in China. Anaerobe. 2022 Apr;74:102540.
Arcay R, Barceló-Nicolau M, Suárez L, Martín L, Reigada R, Höring M, Liebisch G, Garrido C, Cabot G, Vílchez H, Cortés-Lara S, González de Herrero E, López-Causapé C, Oliver A, Barceló-Coblijn G, Mena A. Gut microbiome and plasma lipidome analysis reveals a specific impact of Clostridioides difficile infection on intestinal bacterial communities and sterol metabolism. mBio. 2024 Oct 16;15(10):e0134724.
Vasilescu IM, Chifiriuc MC, Pircalabioru GG, Filip R, Bolocan A, Lazăr V, Diţu LM, Bleotu C. Gut Dysbiosis and Clostridioides difficile Infection in Neonates and Adults. Front Microbiol. 2022 Jan 20;12:651081.
Maslanka JR, Gu CH, Zarin I, Denny JE, Broadaway S, Fett B, Mattei LM, Walk ST, Abt MC. Detection and elimination of a novel non-toxigenic Clostridioides difficile strain from the microbiota of a mouse colony. Gut Microbes. 2020 Nov 9;12(1):1-15.
Nibbering B, Gerding DN, Kuijper EJ, Zwittink RD, Smits WK. Host Immune Responses to Clostridioides difficile: Toxins and Beyond. Front Microbiol. 2021 Dec 21;12:804949.
Samarkos M, Mastrogianni E, Kampouropoulou O. The role of gut microbiota in Clostridium difficile infection. Eur J Intern Med. 2018 Apr;50:28-32.
Kelly CR, Fischer M, Allegretti JR, LaPlante K, Stewart DB, Limketkai BN, Stollman NH. ACG Clinical Guidelines: Prevention, Diagnosis, and Treatment of Clostridioides difficile Infections. Am J Gastroenterol. 2021 Jun 1;116(6):1124-1147.
Dawson LF, Valiente E, Wren BW. Clostridium difficile–a continually evolving and problematic pathogen. Infect Genet Evol. 2009 Dec;9(6):1410-7.
谷禾健康

肠球菌属(Enterococcus)是厚壁菌门中一种革兰氏阳性球菌,常成对或短链出现,大部分物种无鞭毛,没有明显的荚膜。
其耐受性非常好,可在10至45°C的温度范围内生长,pH值范围4.6–9.9内生长,对胆汁盐也具有耐受性。目前,肠球菌属包含四十多种已知菌种,可以存在于各种环境中,包括人类、动物和昆虫的消化系统,食物、水源、土壤和一些植物中。
但在35-37°C下生长最佳,因此非常适合在人体肠道内定植。人体肠道中常见的肠球菌是粪肠球菌(E.faecalis)(90-95%)和屎肠球菌(E.faecium)(5-10%)。而粪肠球菌也是其模式菌种。
肠球菌可以发酵多种底物,包括葡萄糖、甘油、乳酸、苹果酸、柠檬酸、氨基酸和许多α-酮酸。能量产生的主要途径是葡萄糖通过糖酵解途径同质生成l-乳酸。粪肠球菌还可以通过降解粘蛋白来获取能量。
肠球菌具有“多种面孔”,其的健康益处可能是由于能够产生具有抑菌活性的“肠素”(细菌素),对李斯特菌、金黄色葡萄球菌等具有抑制作用。
进而可被用作天然的食品生物防腐剂。一些特殊的肠球菌株还被用作益生菌,具有不同有益特性:如刺激免疫力、抗炎活性、降胆固醇作用以及预防/治疗肠易激综合征和抗生素引起的腹泻,减少鼻窦炎患者的复发等。
然而,就像一枚硬币的两面,尽管它们具有促进健康的特性,但它们也具有有害特性。肠球菌也被视为机会性病原体,其表现出复杂的毒力机制,能够在各种宿主组织中定植,并对许多抗生素具有耐药性,包括四环素、β-内酰胺类药物、氟喹诺酮类药物、头孢菌素、磺胺甲噁唑/甲氧苄啶等,还可能导致耐药性的传播。
它们能够从胃肠道转移到各种组织和器官,进而造成感染或疾病。目前,肠球菌是革兰阳性菌中仅次于葡萄球菌属的重要医院感染病原菌,其感染最常见的为尿路感染,其次为腹部和盆腔等部位创伤和术后感染、败血症、心内膜炎和脑膜炎。此外由于其具有耐药性,所以感染治疗起来会更困难。同时,在心力衰竭、房颤、肥胖和炎症性肠病患者中发现了肠球菌属丰度的增加。
1
形态
肠球菌属(Enterococcus)是一种革兰氏阳性、不生芽孢的兼性厌氧菌,细胞呈球形或卵圆形,大小约在0.6~2.0μm×0.6~2.5μm,呈单个、成对或短链状排列。
大部分物种无鞭毛,但极少部分菌株可以通过稀少的鞭毛而运动。没有明显的荚膜。在35-37°C下生长最佳,因此非常适合在人体肠道内定植。
注:DNA G+C 含量(mol%):35.1–44.9
2
发现历史
“肠球菌”一词最早于1899年提出,用于描述具有致病能力的肠道共生菌。由于形态和生化上的相似性,肠球菌曾被归为链球菌属。
1970年,基于生化和培养特性分析,建议将其归为独立的肠球菌属。1984年,这一建议得到广泛接受,并在1986年版《伯杰氏系统细菌学手册》中出现。
2009年,基于16S rRNA基因相似性提出肠球菌科,包括肠球菌属(Enterococcus) 、迷走球菌 (Vagococcus)、Tetragenococcus和Melissococcus。迄今为止,肠球菌属已包含五十多个物种。
肠球菌的发现历史
doi: 10.1128/CMR.00058-18.
3
常见物种及分布
肠球菌(粪肠球菌和较少的屎肠球菌)在出生后7-10天内定植于大多数健康母乳喂养婴儿的消化系统中。这些微生物主要来自母亲生殖道的生理菌群,但肠球菌也会动态地定植于剖宫产新生儿的胃肠道。
这些菌种对胆汁盐表现出抵抗力,这使它们能够穿过人体消化系统并在大肠中定植。成年人也会从某些食物中获得各种肠球菌种,例如猪肉、家禽和凝乳酶奶酪。
▸ 粪肠球菌为模式菌种
粪肠球菌(Enterococcus faecalis)是肠球菌的模式菌种。人体肠道中主要存在以下两种肠球菌:粪肠球菌(E.faecalis)(90-95%)和屎肠球菌(E.faecium)(5-10%)。人体中较少见的菌群还有E.casseliflavus、E.gallinarum和E.raffinosus。肠球菌很少从阴道和口腔中分离出来,如果发现,极有可能是病原体感染。
粪肠球菌(Enterococcus faecalis)
粪肠球菌(Enterococcus faecalis)是一种革兰氏阳性菌,它不能形成孢子,但对恶劣的环境条件相当耐受,在肠道免疫中起重要作用
粪肠球菌是人类肠道的正常居民,存在于大约90-95%的人中。这种细菌通常是生命早期定植于人类胃肠道的首批微生物之一,在肠道免疫系统的发育中发挥着重要作用。
Enterococcus faecalis T-110:这种粪肠球菌菌株与枯草芽孢杆菌TO-A和丁酸梭菌TO-A结合使用作为益生菌(B10-THREE)。这三种菡株一起可以减少手术患者的术后感染并缩短急性腹泻患儿的住院时间。
Enterococcus faecais YM0831:一项交叉研究发现,对健康人类受试者单次施用该菌株可显著改善血糖对蔗糖耐量试验的反应。
▸ 肠球菌的常见种
临床上分离率最高的是粪肠球菌(E.faecalis),其次是屎肠球菌(E.faecium)。除此之外,还有以下的菌种:
向上滑动阅览
鸟肠球菌(E.avium)
酪黄肠球菌(E.casseliflavus)
坚忍肠球菌(E.durans)
鸡肠球菌(E.galinarum)
芒地肠球菌(E.mundii)
恶臭肠球菌(E.maladoratum)
希拉肠球菌(E.hirae)
孤立肠球菌(E.solitarius)
棉子糖肠球菌(E.raffinosus)
假鸟肠球菌(E.pseudoavium)
粪肠球变异株(E.faecalis var)
Enterococcus gallinarum
Enterococcus gilvus
Enterococcus haemoperoxidus
Enterococcus hawaiiensis
Enterococcus hermanniensis
Enterococcus hirae
Enterococcus inusitatus
Enterococcus italicus
Enterococcus lactis
Enterococcus lemanii
Enterococcus malodoratus
Enterococcus moraviensis
Enterococcus mundtii
Enterococcus olivae
Enterococcus pallens
Enterococcus pernyi
Enterococcus phoeniculicola
Enterococcus plantarum
Enterococcus pseudoavium
Enterococcus quebecensis
Enterococcus raffinosus
Enterococcus ratti
Enterococcus rattus
Enterococcus rivorum
Enterococcus rotai
Enterococcus saccharolyticus
Enterococcus silesiacus
Enterococcus sp.
Enterococcus sp. 2011_Ileo_MS_B2
Enterococcus sp. C6I11
Enterococcus sp. SI-4
Enterococcus sulfureus
Enterococcus termitis
Enterococcus thailandicus
Enterococcus ureasiticus
Enterococcus ureilyticus
Enterococcus viikkiensis
Enterococcus villorum
Enterococcus xiangfangensis
environmental samples
▸ 粪肠球菌和屎肠球菌是人体肠道中常见的肠球菌物种
肠球菌种的分布会因环境、人类和动物而异。粪肠球菌和屎肠球菌在人类胃肠道中最为常见,人类粪便中的粪肠球菌数量为每克105至107个,屎肠球菌的数量为每克104至105个。
▸ 其他动植物中的肠球菌
牲畜中分离出的屎肠球菌和粪肠球菌丰度低于从人类粪便中分离出的。家畜中常见的肠球菌有屎肠球菌(Enterococcus faecium)、盲肠球菌(Enterococcus cecorum)、粪肠球菌(Enterococcus faecalis)、Enterococcus hirae和耐久肠球菌(Enterococcus durans);相比之下,鹑鸡肠球菌(Enterococcus gallinarum)和鸟肠球菌(Enterococcus avium)是罕见的。
粪肠球菌(Enterococcus faecalis)是狗和猫的直肠和扁桃体中常见的一种。而鸽子肠中最常见的是柱状肠球菌(Enterococcus columbae),其次是盲肠球菌(Enterococcus cecorum)。
此外,在爬行动物、蜗牛、采蜜昆虫、白蚁中也发现了肠球菌。肠球菌还可以从食物、植物、土壤和水中分离出来。虽然这些细菌被认为只是植物菌群的临时组成部分,但在良好的条件下,它们可以在植物表面繁殖。从植物中分离出粪肠球菌、屎肠球菌、海氏肠球菌(Enterococcus hirae)、Enterococcus mundtii、Enterococcus casseliflavus和硫肠球菌)。
它们通常从花中分离出来,而不是从芽或叶中分离出来。这表明昆虫可能参与了肠球菌的传播。
▸ 一些食物中也存在肠球菌
肠球菌是许多食物中常见的一部分,尤其是那些动物来源的食物,如牛奶和奶制品、肉类和发酵香肠。它们通常被认为是食品的二级污染物,通常在其腐败中起作用,尽管某些菌株对成熟和香气有积极的影响。
然而,随着某些类型奶酪的开发。肠球菌甚至被用作某些产品中的益生菌培养物。
另一方面,已经证明在发酵剂和食物肠球菌菌株中存在毒力因子,以及毒力决定因素向发酵剂菌株的转移。
▸ 一些具有致病性的肠球菌
以下是临床中发现具有致病性的常见肠球菌物种:
Enterococcus avium
Enterococcus gallinarum
Enterococcus faecium
Enterococcus faecalis
Enterococcus raffinosus
Enterococcus durans
Enterococcus columbae
Enterococcus villorum
Enterococcus dispar
4
生存条件
▸ 肠球菌的耐受性非常好,但人体肠道温度最适宜生长
肠球菌可在10至45°C的温度范围内生长,但大多数物种在35-37°C下生长最佳。许多(但不是全部)品种能在42°C甚至45°C以及(缓慢地)在10°C下生长。
粪肠球菌和屎肠球菌均可在60°C的高温下存活 30 分钟。
▸ 肠球菌耐高盐、高碱、高胆汁、干燥
肠球菌可在pH值范围4.6–9.9内生长,最适pH值为 7.5。它们还可耐受40%(w/v)胆汁盐并在其中生长。粪肠球菌可在6.5% NaCl 中生长,并具有阳离子稳态,这被认为有助于其抵抗pH值、盐、金属和干燥。
5
代谢
肠球菌可以发酵多种底物,包括葡萄糖、甘油、乳酸、苹果酸、柠檬酸、氨基酸和许多α-酮酸。能量产生的主要途径是葡萄糖通过糖酵解途径同质生成l -乳酸。
由于肠球菌可以利用多种糖源,因此它可以在多种环境中生存。在肠道中,粪肠球菌的大部分能量来自未吸收糖的发酵。粪肠球菌还可以通过降解粘蛋白来获取能量,粘蛋白是一种由肠道杯状细胞产生的高度糖基化的碳水化合物。
注:能量也可以通过一些氨基酸的降解获得,如精氨酸、酪氨酸、丝氨酸、苯丙氨酸等。
▸ 在不同环境条件下,可代谢产生不同的物质
在有氧条件下,葡萄糖代谢为乙酸、乙酰和CO2。在pH 5.0-6.0时,丙酮酸被粪肠球菌转化为乳酸,但在中性或微碱性的pH下,丙酮酸以2:1:1的比例转化为甲酸盐、乙醇和醋酸盐。
在营养缺乏的情况下,丙酮酸转化为乙醇和醋酸盐。粪肠球菌通过诱导的特异性苹果酸酶代谢苹果酸。葡萄糖酸盐被磷酸化为6-磷酸葡萄糖酸盐,然后异化为乳酸盐和二氧化碳。
粪肠球菌能将甘油氧化为乙酸、二氧化碳和少量过氧化氢和微量乙酰甲基甲醇;将棘皮酸水解成甘氨酸和苯甲酸。
▸ 肠球菌还具有的代谢通路
卟啉和叶绿素代谢
丙酸代谢
蛋白质输出
嘌呤代谢
嘧啶代谢
丙酮酸代谢
RNA降解
核黄素代谢
次级胆酸生物合成
链霉素生物合成
苯乙烯降解
硫代谢
牛磺酸和亚牛磺酸代谢
硫胺素代谢
色氨酸代谢
缬氨酸、亮氨酸和异亮氨酸的生物合成
缬氨酸、亮氨酸和异亮氨酸降解
维生素B6代谢
β-丙氨酸代谢
2-氧代羧酸代谢
丙氨酸、天冬氨酸和谷氨酸代谢
氨基糖和核苷酸糖代谢
精氨酸和脯氨酸代谢
精氨酸生物合成
抗坏血酸和醛糖酸代谢
不饱和脂肪酸的生物合成
生物素代谢
丁酸代谢
C5-支链二元酸代谢
氯代烷和氯代烯烃降解
氯环己烷和氯苯降解
柠檬酸循环(TCA循环)
芳香族化合物的降解
果糖和甘露糖代谢
半乳糖代谢
谷胱甘肽代谢
甘油脂代谢
甘油磷脂代谢
甘氨酸、丝氨酸和苏氨酸代谢
糖酵解/糖异生
乙醛酸和二羧酸代谢
6
毒力
肠球菌作为一种条件性致病菌,与其致病性有关的特性包括毒力因子和抗生素耐药菌株的增加。
毒力因子是一种效应分子,这些因子有助于其在宿主体内定植和引起感染,会增强微生物致病能力。肠球菌的毒力因子在其致病性中起着重要作用。
▸ 肠球菌能够产生的一些毒力因子
肠球菌中最常见且描述最详尽的毒力因子是聚集物质(agg、asa1)、溶细胞素(cyl)、明胶酶(gelE)、细胞外表面蛋白(esp)、粘附于胶原蛋白(ace、acm)和粘连样心内膜炎抗原(efaAfs和efaAfm)。
粪肠球菌和屎肠球菌主要毒力因子
Sangiorgio G,et al.Pathogens.2024
毒力因子的具体作用机制
聚集物质(agg和asa1)是诱导肠球菌菌株表面蛋白的毒力因子,可在细菌结合过程中促进聚集体的形成,并介导与上皮细胞的特异性结合以进行定植以及携带毒力特性和抗生素抗性基因的质粒的交换。
此外,聚集物质可以与细胞外基质蛋白结合,如I型胶原、纤连蛋白和血小板反应蛋白。agg基因增加肠球菌表面的疏水性,诱导胆固醇定位于吞噬体并延缓与溶酶体囊泡融合。不过迄今为止,agg决定簇仅存在于粪肠球菌菌株中。
溶细胞素(或β-溶血素)是一种具有双重功能的蛋白质细菌素/溶血素,是肠球菌中研究最多的毒力因子。它是一种肽类毒素,能够通过在细菌靶细胞的细胞质膜上形成孔隙来裂解细胞 。由产生溶细胞素的肠球菌感染引起的死亡频率比不产生溶细胞素的肠球菌感染引起的死亡频率高5倍。
明胶酶是一种胞外锌金属内切肽酶(EC 3.4.24.30),参与明胶、胶原蛋白、β-胰岛素、血红蛋白、酪蛋白和其他生物活性肽的水解。明胶酶能够裂解纤维蛋白并损伤宿主组织,从而使细菌迁移和扩散,这使得其与肠球菌特别是粪肠球菌的毒力有关。此外,这种蛋白酶在生物膜的形成中起着重要作用。
细胞外表面蛋白(esp)是一种与细胞间粘附(特别是粘附于真核细胞和逃避宿主的免疫反应)有关的致病基因决定簇。该基因可促进定植,位于肠球菌属内高度保守的染色体区域,在屎肠球菌中最常见。
efaA毒力基因与心内膜炎密切相关。最为人所知的是粪肠球菌的efaAfs和屎肠球菌的efaAfm。
总体而言,屎肠球菌菌株中这些毒力因子的发生率低于粪肠球菌菌株。毒力最高的肠球菌种是在临床中的分离株,其次是食品分离株,然后是发酵剂菌株。
许多因素会影响肠球菌种的毒力,例如:
(1)在胃肠道(正常的栖息地)定植的能力;
(2)粘附于多种细胞外基质蛋白的能力,包括血小板反应蛋白、乳铁蛋白和玻璃粘连蛋白;
(3)粘附于尿道上皮、口腔上皮和人胚肾细胞的能力。
大多数感染被认为是内源性的,细菌通过肠道上皮细胞易位,然后通过淋巴结引起感染,从而扩散到体内的其他细胞。
7
耐药性
肠球菌对常用抗生素的耐药性是另一个重要的毒力特性,这极大地增强了肠球菌的致病性,使其成为可能引起感染的条件性致病菌。
▸ 肠球菌对许多常用抗生素具有耐药性
肠球菌对许多β-内酰胺类药物、氟喹诺酮类药物、林可胺类药物、头孢菌素、磺胺甲噁唑/甲氧苄啶和低浓度氨基糖苷类药物具有天然耐药性。
肠球菌还可以通过质粒或转座因子从其他微生物获得耐药性,对氯霉素、红霉素、四环素、青霉素、氨苄西林、大环内酯类、氨基糖苷类(如庆大霉素、卡那霉素、链霉素)和糖肽类药物尤其是万古霉素表现出耐药性。
▸ 对万古霉素具有耐药性的肠球菌会造成严重的健康后果
万古霉素耐药菌株会带来严重的健康问题,一项报告了7066例由肠球菌引起的菌血症病例,所有病例中有28%是抗生素耐药性的。万古霉素耐药肠球菌(VRE)的死亡风险为75%,而感染敏感菌株的患者死亡风险为45%。
数据显示,在从血液中分离的肠球菌中,2%的粪肠球菌和60%的屎肠球菌分离菌对万古霉素具有耐药性。
万古霉素耐药肠球菌(VRE)对临床医生来说是一个挑战,因为这种抗生素传统上被认为是治疗肠球菌感染的“最后手段”,因为它经常被用来替代过敏患者的青霉素、氨苄西林和氨基糖苷类药物。
因此,人们开始评估新药作为万古霉素的替代候选药物,例如喹奴普丁和达福普汀、恶唑烷酮和达托霉素。
▸ 其他动物和环境中也存在耐药性肠球菌,并可能影响人体
在世界各地的食用动物和环境中都发现了其他抗生素耐药性肠球菌。事实上,从牛(80%)、鸡(62-64%)、猪(57%)、动物源性食品(如白肉和红肉) 、未煮熟的食物(如生菜)、污水中分离出的肠球菌(粪肠球菌、屎肠球菌和鸡肠球菌)中观察到了较高的庆大霉素、卡那霉素、链霉素、四环素和糖肽耐药性。
肠球菌抗生素耐药性的主要机制
Sangiorgio G,et al.Pathogens.2024
总体而言,在所有这些不同的宿主和环境中都出现了高抗生素耐药性,表明耐药基因在菌株间存在传播。
8
细菌素
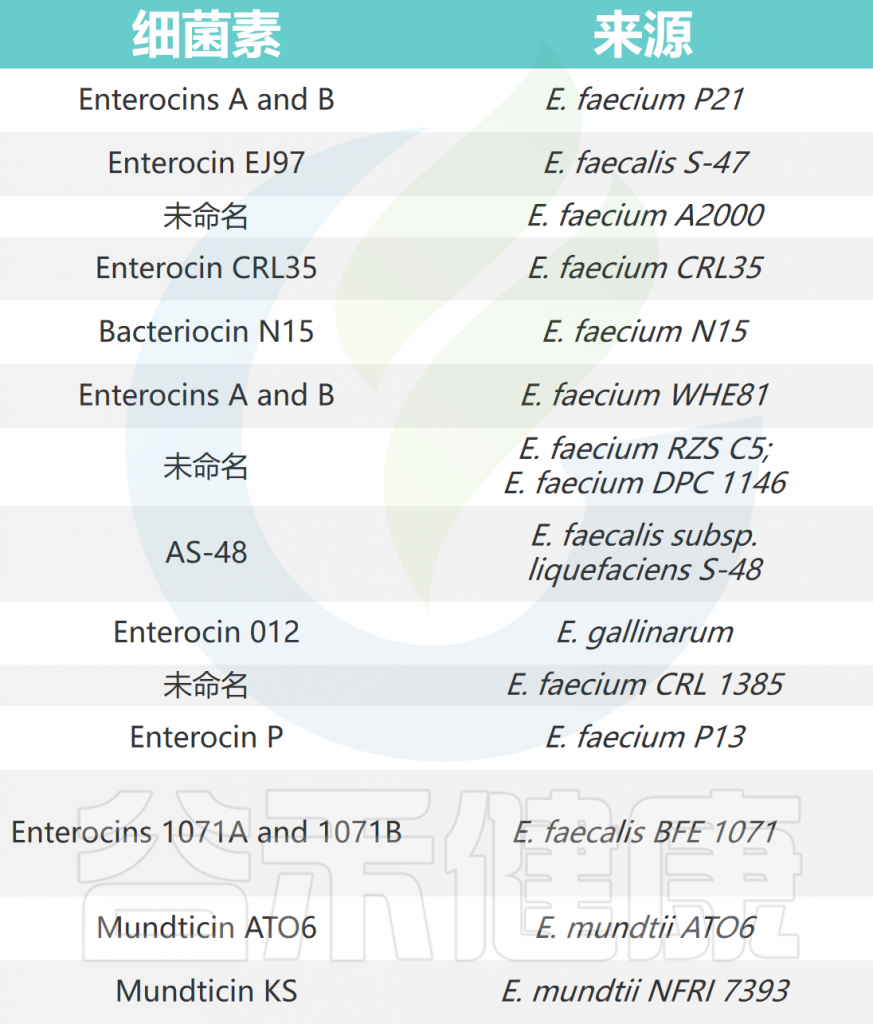
细菌素是核糖体合成的、细胞外释放的抗菌肽,对一些细菌物种有抑菌活性。
▸ 肠球菌能够产生具有抑菌活性的肠素
肠球菌产生的细菌素被称为“肠球菌素”,对其他肠球菌和菌群具有抑菌活性。肠球菌素分为四类:
(I类)羊毛硫抗生素肠素,如溶细胞素;
(II类)非羊毛硫抗生素肠素 ,有三个亚类,如肠素A(II-1类)、肠素Q(II-2类)和肠素B(II-3类);
(III类)其次是环状肠素,如肠素AS-48;
(IV类)高分子量肠素,如肠溶素A。
注:大多数已知的肠素属于II类。
肠球菌产生的细菌素
doi: 10.1099/mic.0.026385-0.
▸ 肠球菌素对李斯特菌、金黄色葡萄球菌等具有抑菌活性
已从乳制品、发酵肉以及蔬菜和植物中分离出产”肠球菌素”的肠球菌。它们对李斯特菌(Listeria)、梭菌(Clostridum)和金黄色葡萄球菌(Staphylococcus aureus)有抑菌活性。
E. faecium RZS C5 是一种天然奶酪分离物,具有抗李斯特菌特性。来自E. faecalis S-47的肠素 EJ97也表现出抗李斯特菌特性,浓度为20 AU ml−1时,6小时后细菌数量减少 ,24小时后完全抑制。
肠素 AS-48(由E. faecalis A-48-32 产生)可抑制罐装水果和蔬菜中冷藏和高温条件下凝结芽孢杆菌(Bacillus coagulans)细胞的生长。细菌素对抗革兰氏阴性菌的活性并不常见,但来自E. mundtii的细菌素 ST15已被证明可有效对抗一系列革兰氏阳性菌和革兰氏阴性菌,包括不动杆菌(Acinetobacter)、芽孢杆菌(Bacillus)、梭菌(Clostridium)、克雷伯氏菌(Klebsiella)、乳酸杆菌(Lactobacillus)和假单胞菌(Pseudomonas)。
▸ 肠球菌素如何发挥抑菌作用?
细菌素的杀菌作用被认为是由于细胞膜的通透性。细菌素的随机卷曲肽与细胞膜接触后形成螺旋结构,该结构融入并跨越膜,从而产生孔隙。这种作用方式已在肠素P中观察到。由此产生的孔隙导致K+离子泄漏、膜电位耗散和抑制氨基酸吸收。ATP 驱动的细胞吸收K+和细菌素介导的K+释放的循环会导致细胞死亡,从而抑制一些菌种的定值。
9
与其他菌的互作
肠球菌作为一类广泛存在于人类和动物肠道中的微生物,它们与肠道微生物群中的其他成员之间存在着复杂的相互作用。以下是谷禾通过查阅相关文献对肠球菌与其他肠道微生物群相互作用的总结:
▸ 屎肠球菌可以抑制李斯特菌、伤寒沙门氏菌等
屎肠球菌(Enterococcus faecium)是一种在人体中广泛存在的细菌,它能够产生一种名为肠球菌素的抗菌物质,这种物质具有广谱抗菌活性,可以抑制如植物乳杆菌(Lactobacillus plantarum)、单核细胞增生李斯特菌(Listeria monocytogenes)以及伤寒沙门氏菌(Salmonella paratyphi)等细菌的生长。
除此之外,一些研究表明肠球菌还可以抑制Peptoclostridium的生长与活性。
注:肠球菌因为这一特性可作为生物防腐剂,它们通过抑制病原菌和降解菌的生长,确保了产品的质量和安全。与传统的化学防腐剂相比,肠球菌素等具有更佳的生物相容性和环境友好性。
▸ 抑制肠球菌的细菌
Blautia producta 的共生菌株通过产生特定的抗菌化合物,可以抑制并排除粪肠球菌(E.faecium)。
此外,肠道中的枯草芽孢杆菌(Bacillus subtilis)释放一种抑制性化合物,可以阳止金黄色葡萄球菌的定植能力,或抑制肠球菌(Enterococcus faecalis)的毒力因子表达。
肠球菌(Enterococcus)是人类微生物群的天然组成部分。它们常定植于下消化道,口腔和生殖道中较少见。
★ 肠球菌是人体共生菌之一
人体肠道中约有106至107个肠球菌,结肠中发现的肠球菌高达1%,其中大多数是粪肠球菌(105-107 CFU/克粪便)或屎肠球菌(104 -105 CFU/克粪便)。
除了粪肠球菌(E. faecalis)和屎肠球菌(E. faecium)外,还经常分离出盲肠肠球菌(E. cecorum)和坚忍肠球菌(E. durans),偶尔也会检测到干酪肠球菌(E.caseliflavus)、海氏肠球菌(E. hirae)、鸡肠球菌 (E. gallinaroum)和鸟肠球菌(E. avium)。
参与营养物质代谢、激活免疫细胞
由于肠球菌在人体微生物群中存在大量,这表明它们可能在消化道中发挥重要作用。作为共生菌,它们参与营养物质(碳水化合物、脂质和蛋白质)的代谢,以及维持其生存环境的pH值,合成对正常功能很重要的维生素和其他代谢物,防止腐败细菌的定植和扩散,并对人体免疫系统(体液免疫和细胞免疫)产生影响。
研究发现,粪肠球菌(E.faecalis)可以起免疫调节作用,负责激活CD4、CD8(CD 分化簇)细胞和B淋巴细胞。
同时肠球菌还会影响肠道淋巴系统(肠道相关淋巴组织,是负责产生分泌性免疫球蛋白A(sIgA)的免疫器官)。sIgA 是肠道屏障的重要组成部分,它可以防止微生物粘附到上皮细胞上、中和细菌毒素、覆盖和凝集微生物,并具有抑菌作用。
作为一种益生菌
一些肠球菌菌株(如屎肠球菌M74和屎肠球菌SF-68)已被证明可作为一种安全有效的益生菌制剂。例如FortiFlora®和Cernivet®(含屎肠球菌SF68)和含粪肠球菌的Symbioflor®1。
• 缓解肠易激综合征和抗生素引起的腹泻

肠球菌益生菌可用于治疗或预防某些人类疾病,特别是在治疗腹泻方面。研究发现屎肠球菌(E.faecium strain SF68)可以缓解肠易激综合征症状和接受抗生素治疗的慢性肺结核患者的腹泻发病率,并预防了粘膜炎(可能是维生素缺乏的后果)。
使用屎肠球菌SF68 治疗腹泻被认为是抗生素治疗的替代方案。临床研究还显示,屎肠球菌对治疗儿童和成人肠炎有效, 对屎肠球菌SF68 治疗肠炎的“双盲”对照研究表明,腹泻持续时间和大便正常化时间显著减少。
• 减少鼻窦炎患者的复发

使用肠球菌还可以治疗慢性和复发性上呼吸道感染、鼻窦相关的慢性疾病(慢性鼻窦炎)。
一项双盲、安慰剂对照研究调查了157名患有慢性复发性鼻窦炎的患者在使用细菌免疫刺激剂(由人粪肠球菌细菌的细胞和自溶物组成)治疗期间急性复发的发生情况,并与使用安慰剂的患者进行了比较。结果表明,在使用粪肠球菌制成的免疫刺激剂后,复发的发生率(50次)约为安慰剂下观察到的复发次数(90次)的一半。
目前,粪肠球菌的益生菌制剂(有时富含大肠杆菌和乳杆菌)被推荐用于治疗鼻窦炎或支气管炎以及普通感冒等疾病。
注:在德国,粪肠球菌(DSM 16431) 以 Symbioflor 1的商品名作为药物出售,推荐用于治疗急性和复发性鼻窦炎或支气管炎。
• 一些菌种能产生丁酸,具有抗炎作用
已发现E. durans M4-5 能产生丁酸、短链脂肪酸 (SCFA),其可诱导显著的抗炎作用并有助于肠道上皮的完整性。
• 降低胆固醇水平

研究发现肠球菌(例如E.faecium M-74、E.durans KLDS)还具有降低胆固醇水平的特点。这些细菌产生一种水解酶,可催化胆汁酸解离过程,帮助胆固醇整合到细菌细胞壁中,或在酸性环境中帮助沉淀。
• 抗癌、免疫调节作用
此外,一些肠球菌还表现出抗诱变、抗致癌和免疫调节作用。
最近,菌株E. durans LAB18s还被推荐用作膳食硒补充剂的来源,而E.faecium LCW 44和E.durans 6HL 分别被证实对革兰氏阳性菌和革兰氏阴性菌具有很强的抑制作用。
益生菌E. faecium M-74 可用于治疗患有髓性白血病患者的胃肠道并发症。在小鼠模型中发表的另一份报告表明,海氏肠球菌(Enterococcus hirae)有助于形成抗癌免疫反应。
在食品中的益处
• 改善发酵乳制品的质地和口感
肠球菌存在于未经处理的牛奶、奶酪、肉类和植物产品(发酵蔬菜)等食品中。在食品工业中,精选的肠球菌菌株有助于改善发酵乳制品的香气、质地和口感。
肠球菌菌株可以将蛋白质降解为肽和氨基酸,分解柠檬酸盐,并产生具有脂解和蛋白水解特性的芳香物质。它们具有蛋白水解、脂解以及柠檬酸和丙酮酸代谢的能力,因此被用作乳制品的发酵剂。
• 一种天然的食品防腐剂
此外,肠杆菌通过产生肠素来抑制腐败微生物的增殖,这些细菌素可用作食品防腐剂。
由于它们对热处理(烹饪、巴氏灭菌或发酵)具有耐受性,因此它们也可用作食品生产中的天然防腐剂和卫生指标。
在养殖业中的作用
益生菌制剂也用于养殖业,以预防或治疗肠道疾病,或作为生长促进剂。
• 免疫调节作用、防止腹泻
例如,一些肠球菌益生菌被纳入饲料添加剂类别,用于稳定单胃动物和反刍动物消化道的微生物群落。屎肠球菌NCIMB 11181 和屎肠球菌DSM 7134 菌株已获批准作为牛和猪的饲料添加剂。益生菌屎肠球菌SF68®和粪肠球菌Symbioflor 1 也用于预防或治疗猪、家禽、牲畜和宠物的腹泻。屎肠球菌SF68对幼犬肠粘膜和消化系统发育具有免疫调节作用。
• 促进生长、提高代谢效率
此外,肠球菌对动物的生长和健康特征具有积极影响。用肠球菌益生菌属喂养猪,发现能减少肠道病原体。同样,给断奶后小猪口服屎肠球菌NHRD IHARA可提高血清和粪便中的IgA水平,改善小猪的生长。研究还表明,屎肠球菌能促进鸡的生长、肠道形态和盲肠微生物群的稳态。据报道,屎肠球菌还能提高肉鸡的代谢效率,降低炎症反应。
• 抑制水生病原体,改善鱼类生长
另一方面,许多研究表明肠球菌在水产养殖中具有有益作用。一些研究报道了屎肠球菌对水生病原体具有广泛的抑制作用,包括Yersinia ruckeri、哈维氏弧菌(Vibrio harveyi)、无乳链球菌(Streptococcus agalactiae)和维氏气单胞菌(Aeromonas veronii)。
此外,许多试验发现了将屎肠球菌添加到饲料中以改善鱼类生长和刺激免疫反应的功效。
肠球菌属(Enterococcus)普遍存在于人类及动物肠道内。正常情况下,肠球菌被认为是一种无害的共生菌,甚至被认为对许多胃肠道和全身疾病有积极作用。
然而,当与宿主的共生关系被破坏时,肠球菌可引起一些感染或疾病。目前,肠球菌是革兰阳性菌中仅次于葡萄球菌属的重要医院感染病原菌,其感染最常见的为尿路感染,其次为腹部和盆腔等部位创伤和术后感染、败血症、心内膜炎和脑膜炎。此外由于其具有耐药性,所致感染治疗困难。
注:目前几乎所有的院内肠球菌感染都是由粪肠球菌或屎肠球菌引起的。其中,粪肠球菌是致病性最强的菌种,但屎肠球菌的重要性日益增加,因为它通常对抗菌药物的耐药性更强。
肠球菌血流感染

肠球菌血流感染(BSI)与高死亡率相关。最近一项对加拿大医院的大型调查研究显示,住院患者肠球菌BSI发病率为每100000人 6.9 例,其中大多数病例由粪肠球菌引起(每100000人4.5例)。
• 肠球菌血流感染的死亡风险很高
在瑞士, 2008年至2014年间肠球菌血流感染发病率有所增加(每100000人9至14例),总体而言,院内肠球菌BSI的死亡率相当高,为25%至50%。
大多数肠球菌性血流感染病例被认为是肠球菌从肠道易位到血液所致。其他感染途径包括静脉注射、心内膜炎、尿路感染和脓肿。
肠球菌血流感染的死亡危险因素包括病情严重程度、患者年龄以及使用第三代头孢菌素或甲硝唑。
研究发现,感染溶血性、庆大霉素耐药粪肠球菌菌株的患者与感染非溶血性、庆大霉素敏感菌株的患者相比,三周内死亡风险增加5倍。
2
尿路感染
肠球菌是从尿路感染中分离出的最常见的革兰氏阳性菌,2011年至2014年期间,国家医疗保健安全网络报告了超过 20000 例病例。在这些病例中,超过50%是由粪肠球菌引起的,其次是“其他肠球菌种”(约30%)和屎肠球菌(约 20%)。
最令人担忧的是,约85%的屎肠球菌分离株对万古霉素具有耐药性,并且耐药分离株的比例每年都在增加。
3
心内膜炎
在肠球菌引起的感染中,感染性心内膜炎(IE)是治疗难度最大的感染之一。肠球菌占所有IE病例的10%至20%,其中大多数是由粪肠球菌引起的。
在感染性心内膜炎中,细菌在心内膜定植会导致组织内出现赘生物,并在细菌周围形成生物膜状基质,免疫系统或抗生素都难以穿透这些基质。
4
根管治疗失败
粪肠球菌(E. faecalis)是根管治疗失败的一个重要原因,部分原因是它对许多消毒剂和抗菌剂具有耐药性。
• 根管治疗常用的消毒剂无法完全杀灭粪肠球菌
在导致根管治疗失败的慢性和持续性根尖周围病变病例中尤其如此,24%~77%的病例中分离出粪肠球菌。氢氧化钙是根管治疗常用的消毒剂,已证实其本身无法完全杀死粪肠球菌,其他消毒剂如柠檬酸也是如此。
粪肠球菌能在根管内长时间耐受饥饿,并通过牙槽骨和牙周膜的血清复苏。获得充足食物后,粪肠球菌利用SprE和GelE蛋白酶及胶原结合蛋白Ace与牙本质结合并形成生物膜,进而影响根管治疗的效果。
注:一旦感染,最有效的治疗方法包括用次氯酸钠或洗必泰溶液长时间冲洗根管。在初始过程中使用洗必泰或次氯酸钠冲洗被认为是预防粪肠球菌感染根管和防止失败的最佳选择。
5
组织挫伤
肠球菌感染在宿主体内引发病理变化。这可能由宿主的炎症反应,或是粪肠球菌分泌的毒素、蛋白酶及有毒代谢副产物直接造成的组织损伤引起。
• 肠球菌脂磷壁酸具有炎症性
肠球菌脂磷壁酸(LTA)与多种生物过程有关,LTA的一些特性包括调节宿主的免疫反应和介导肠球菌粘附于宿主细胞。
研究发现肠球菌的LTA与革兰氏阴性菌的脂多糖一样具有炎症性。肠球菌结合物质(EBS)(至少部分源自 LTA)缺陷且蛋白质粘附素AS缺陷的粪肠球菌菌株在注射到兔子体内会诱发临床疾病症状。
• 肠球菌溶细胞素和蛋白酶对细胞具有一定毒性
肠球菌溶细胞素和两种蛋白酶(一种是锌金属蛋白酶(明胶酶)、一种是丝氨酸蛋白酶)是会导致疾病严重程度的分泌因子。溶细胞素的存在还被证实会促进粪肠球菌在血液中的出现。
这种毒素它既具有细菌素活性,又会对多种哺乳动物细胞类型有毒性。
使用兔眼内炎模型获得了由细胞溶素引起的病理损伤最直接和定量的证据。感染后24小时 β 波反应减弱和视网膜结构完全破坏明确证明了细胞溶素在组织病理学中的作用。
在无菌大鼠模型中,一种蛋白水解(Gel+)菌株表现出致龋活性,而三种非蛋白水解菌株几乎没有致龋性。
• 产生过量的过氧化氢造成细胞损伤

除了分泌蛋白外,粪肠球菌和屎肠球菌还被证明会产生有毒的氧代谢物,从而导致细胞或器官损伤。
一项研究表明,所检测的绝大多数(87/91)粪肠球菌菌株产生超氧化物(O2–),而屎肠球菌分离株产生超氧化物的频率较低。经研究推测,氧自由基的膜损伤作用可能会增强附近肠上皮细胞的细胞损伤。此外,细胞外超氧化物和过氧化氢的产生会损害结肠上皮细胞 DNA。
6
食源性肠球菌的危害
肠球菌的威胁不仅存在于临床感染。由于卫生条件差造成的污染导致食品中存在肠球菌也具有一定危害。粪肠球菌或屎肠球菌是造成手工和传统奶酪污染的最常见原因,但也发现了其他菌种(E.casseliflavus、E.durans、E.hirae和E.gallinarum)。
例如,从散装牛奶储罐中分离出E. casseliflavus和粪肠球菌。禽肉在加工过程中也可能被粪肠球菌和屎肠球菌污染,这种情况很常见。
• 对抗生素的耐药性会通过被肠球菌污染的食物传播
抗菌药物的广泛使用促进了耐药微生物的出现和传播。食物链是耐药性在环境和人类之间传播的关键因素。

人们发现临床材料和食物之间的细菌耐药性特征相似。最常见的是,这些细菌菌株对链霉素、红霉素、四环素和利福平表现出耐药性。
从即食食品中分离的肠球菌菌株中检测到氨基糖苷类、四环素类和大环内酯类药物的耐药基因水平转移。
研究显示,携带耐药基因的食源性肠球菌数量众多可能会显著降低抗生素治疗肠道感染的有效性。由于其高度适应能力,食物中的肠球菌会暂时或永久地定植于消化道,这增加了基因转移至肠道菌群的危险。
• 肠球菌会导致食物腐败
肠球菌也会导致食物腐败。它们会产生酪胺、组胺、苯乙丙氨酸、尸胺和腐胺等热稳定性胺,这些胺可引起过敏反应或中毒。
7
肠球菌在其他疾病中的丰度变化
通过查阅相关文献和谷禾的数据库,我们还发现肠球菌和以下疾病的联系:
• 移植物抗宿主病
一些细菌如肠球菌(Enterococcus spp.)与移植物抗宿主病(GVHD)高风险有关。
• 心力衰竭和房颤患者中丰度增加
与对照相比,心力衰竭患者肠道菌群中的肠球菌属(Enterococcus)丰度增加,在心脏病变患者中也观察到肠球菌属和肠球科的升高。
较多的基因和属种表明房颤患者体内可能存在多种有害细菌过度生长。瘤胃球菌(Ruminococcus)、链球菌(Streptococcus)、韦荣氏球菌(Veillonella)和肠球菌(Enterococcus)等在房颤患者中更为富集。
• 肥胖和炎症性肠病中肠球菌数量增加
肥胖是一种慢性代谢性疾病,引起肥胖的因素众多,如遗传因素、环境变化、生活和饮食习惯等,其中肠道微生物群的影响越来越受到人们的重视。
在属的水平上,分枝杆菌属、粪杆菌属、拟杆菌属、副拟杆菌属、粪杆菌属、毛螺菌属等显著减少,而梭菌属、芽孢杆菌属、布劳氏菌属、肠球菌属(Enterococcus)、萨特氏菌属、克雷伯氏菌属、柯林氏菌属、普雷沃氏菌属和乳酸杆菌属显著增加。
而在活跃期炎症性肠病与某些菌群的数量过多有关,如:
肠杆菌科(Enterobacteriaceae) ↑↑↑
梭杆菌属(Fusobacterium) ↑↑↑
咽峡炎链球菌(Streptococcus anginosus) ↑↑↑
肠球菌(Enterococcus) ↑↑↑
• 可能存在一定的致癌作用
肠道微生物群中的几种菌,这些细菌除了它们的致病性之外,还被可能对结肠直肠癌具有致癌作用,包括幽门螺杆菌、肝螺杆菌(Helicobacter hepaticus)、牛链球菌(Streptococcus bovis)、大肠杆菌、脆弱拟杆菌(B. fragiis)、败血梭菌(Clostnidium septicum)、粪肠球菌(Enterococcus faecalis)、具核梭杆菌(F.nucleatum)和牙龈卟啉单胞菌(Porphyromonas gingivalis),这些细菌都显示出潜在的致癌作用。
此外,肝外胆管癌患者体内也检测到大量肠球菌(Enterococcus)。
• 百岁老人肠球菌属含量较低
研究发现,与100岁以下人群相比,百岁老人体内肠道细菌(如拟杆菌属、脱硫弧菌属、瘤胃球菌科、乳杆菌、嗜粘蛋白阿克曼氏菌、发酵短杆菌属)含量较高,而Faecalibacter、普雷沃氏菌属、克雷伯氏菌属、链球菌属、肠杆菌属、肠球菌属含量较低。因此,我们推测肠球菌的丰度过高可能不利于健康。
肠球菌属(Enterococcus)是一种革兰氏阳性、兼性厌氧球菌,广泛存在于胃肠道中,在阴道或口腔中较少见。粪肠球菌(Enterococcus faecalis)和屎肠球菌(Enterococcus Faecium)是人类中最常见的菌种。作为共生菌,肠球菌定植于消化系统中并参与营养物质代谢及调节人类的免疫系统。
肠球菌还因其生物特性(酶和蛋白水解活性)而被用作食品发酵的发酵剂,或因其产生的抗菌细菌素(称为肠素)而被用作天然的食品生物防腐剂。一些特殊的肠球菌株还被用作益生菌,具有不同有益特性:如刺激免疫力、抗炎活性、降胆固醇作用以及预防/治疗肠易激综合征和抗生素引起的腹泻,减少鼻窦炎患者的复发等。
然而,就像一枚硬币的两面,尽管它们具有促进健康的特性,但它们可能具有有害特性。由于肠球菌菌株表现出复杂的毒力机制,使其能够在各种宿主组织中定植,并对许多抗生素具有耐药性,可能会导致耐药性的传播,肠球菌也被视为机会性病原体。
它们能够从胃肠道转移到各种组织和器官,进而造成感染或疾病。目前,肠球菌是革兰阳性菌中仅次于葡萄球菌属的重要医院感染病原菌,其感染最常见的为尿路感染,其次为腹部和盆腔等部位创伤和术后感染、败血症、心内膜炎和脑膜炎。此外由于其具有耐药性,所以感染治疗起来会更困难。同时,在心力衰竭、房颤、肥胖和炎症性肠病患者中发现了肠球菌属丰度的增加。

需要更深入地了解具体肠球菌种的健康益处、毒力特性,尤其是抗生素耐药性的增加,以便充分认识到肠球菌在改善健康和致病方面的复杂性。
通过深入理解肠球菌与宿主之间的微妙平衡,我们可以更好地利用这种微生物来促进人类健康,并开发新的治疗策略来对抗相关疾病。
主要参考文献
Krawczyk B, Wityk P, Gałęcka M, Michalik M. The Many Faces of Enterococcus spp.-Commensal, Probiotic and Opportunistic Pathogen. Microorganisms. 2021 Sep 7;9(9):1900.
Sangiorgio G, Calvo M, Migliorisi G, Campanile F, Stefani S. The Impact of Enterococcus spp. in the Immunocompromised Host: A Comprehensive Review. Pathogens. 2024 May 15;13(5):409.
García-Solache M, Rice LB. The Enterococcus: a Model of Adaptability to Its Environment. Clin Microbiol Rev. 2019 Jan 30;32(2):e00058-18.
Dubin K, Pamer EG. Enterococci and Their Interactions with the Intestinal Microbiome. Microbiol Spectr. 2014 Nov;5(6):10.1128/microbiolspec.BAD-0014-2016.
Kayser FH. Safety aspects of enterococci from the medical point of view. Int J Food Microbiol. 2003 Dec 1;88(2-3):255-62.
Byappanahalli MN, Nevers MB, Korajkic A, Staley ZR, Harwood VJ. 2012. Enterococci in the Environment. Microbiol Mol Biol Rev 76:.
Chajęcka-Wierzchowska W, Zadernowska A, Zarzecka U, Zakrzewski A, Gajewska J. Enterococci from ready-to-eat food – horizontal gene transfer of antibiotic resistance genes and genotypic characterization by PCR melting profile. J Sci Food Agric. 2019 Feb;99(3):1172-1179.
Fisher K, Phillips C. The ecology, epidemiology and virulence of Enterococcus. Microbiology (Reading). 2009 Jun;155(Pt 6):1749-1757.
Ramos S, Silva V, Dapkevicius MLE, Igrejas G, Poeta P. Enterococci, from Harmless Bacteria to a Pathogen. Microorganisms. 2020 Jul 25;8(8):1118.
Fiore E.Van Tyne D.Gilmore MS. 2019. Pathogenicity of Enterococci. Microbiol Spectr 7:10.1128/microbiolspec.gpp3-0053-2018.
Ben Braïek O, Smaoui S. Enterococci: Between Emerging Pathogens and Potential Probiotics. Biomed Res Int. 2019 May 23;2019:5938210.

谷禾健康

牛奶蛋白过敏(CMPA)是婴儿最常见的食物过敏类型之一。粪便病原菌培养显示产气荚膜梭菌阳性率超过30%,明显高于其他细菌。因此推测产气荚膜梭菌定植可能是婴儿牛奶蛋白过敏的发病因素之一。
一项真实世界的研究,杨敏团队从我国一家大型三甲医院(广州市妇女儿童医疗中心)招募患有腹泻、粘液便和/或血便的 0-6 个月婴儿的研究中,通过飞行质谱法证实了用于检测产气荚膜梭菌的粪便病原体培养物,并通过PCR鉴定了潜在的毒素基因。随访12个月后,记录牛奶蛋白过敏和食物过敏的诊断。通过Pearson相关分析评估相关性。
这项研究表明产气荚膜梭菌肠道定植在婴儿中很常见,与婴儿牛奶蛋白过敏和食物过敏的发生有关。
产气荚膜梭菌是一种厌氧、革兰氏阳性芽孢杆菌,是一种可引起胃肠道或皮肤和深层组织感染的细菌。产气荚膜梭菌的定植可能导致侵袭性胃肠道感染,产生肠毒素,可能破坏肠上皮细胞间的紧密连接,造成上皮损伤,引起肠道菌群失衡,导致宿主免疫反应异常。
本文我们来详细看一下这项研究过程及相关结果,结合产气荚膜梭菌的生物学特性、毒素等相关知识,深入探讨产气荚膜梭菌定植对婴幼儿过敏相关疾病及其他健康问题的影响,了解这些可以帮助我们更好地了解其在婴幼儿免疫系统发育中的作用,为临床上预防和治疗相关疾病提供新的思路和方法。
在这项广州妇女儿童医疗中心的研究中,共招募了358名0-6个月的婴儿。对这些婴儿粪便样本进行病原培养,其中128名产气荚膜梭菌呈阳性。
共有270名婴儿(44.07% 为女孩;平均年龄为 2.78 ± 2.84 个月)参加了为期 12 个月的跟踪调查。
注:
▪ 2020年1月1日至2021年12月31日期间因胃肠道症状住院或门诊的所有0-6个月大的婴儿
▪ 排除先天性代谢性疾病、免疫缺陷性疾病和恶性肿瘤的患者

doi: 10.1186/s13099-023-00572-x
专门针对食物过敏和牛奶蛋白过敏的临床诊断,其中包括湿疹、过敏性鼻炎以及食物蛋白诱导的过敏性直肠结肠炎等相关病症。食物过敏是根据症状、饮食排除和口服食物挑战进行临床诊断的。
病程差异
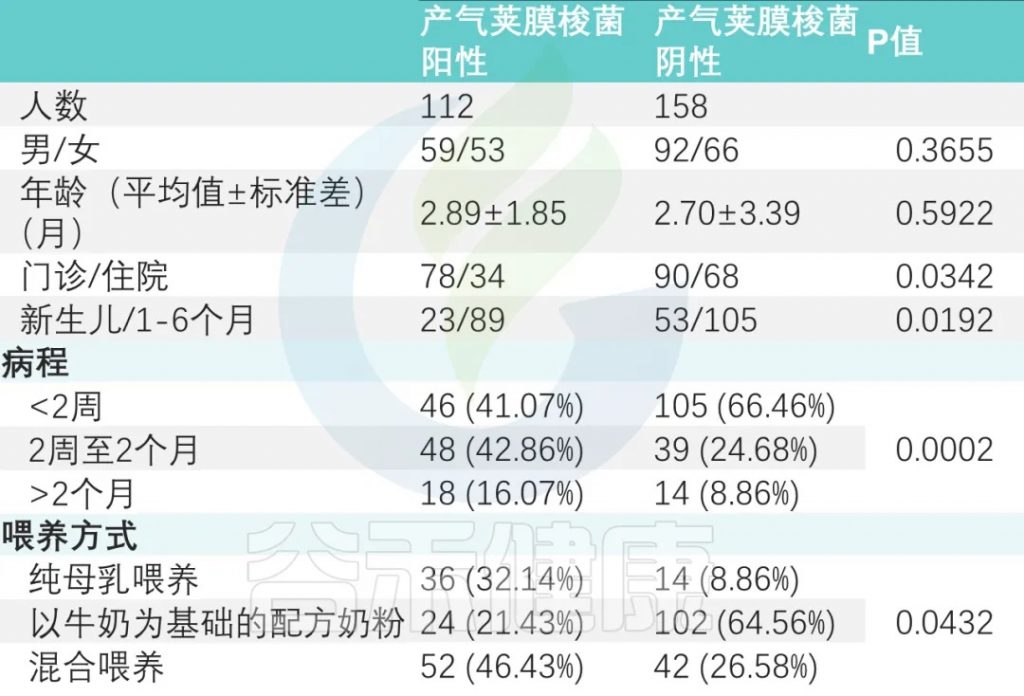
产气荚膜梭菌阴性组与产气荚膜梭菌阳性组显著差异(P < 0.001)。
喂养方式
纯母乳喂养组、母乳添加配方奶喂养组和纯配方奶喂养组产气荚膜梭菌定植阳性率分别为 32.14%、46.43%、21.43%(P<0.05)(下表)。
doi: 10.1186/s13099-023-00572-x
主要症状及诊断
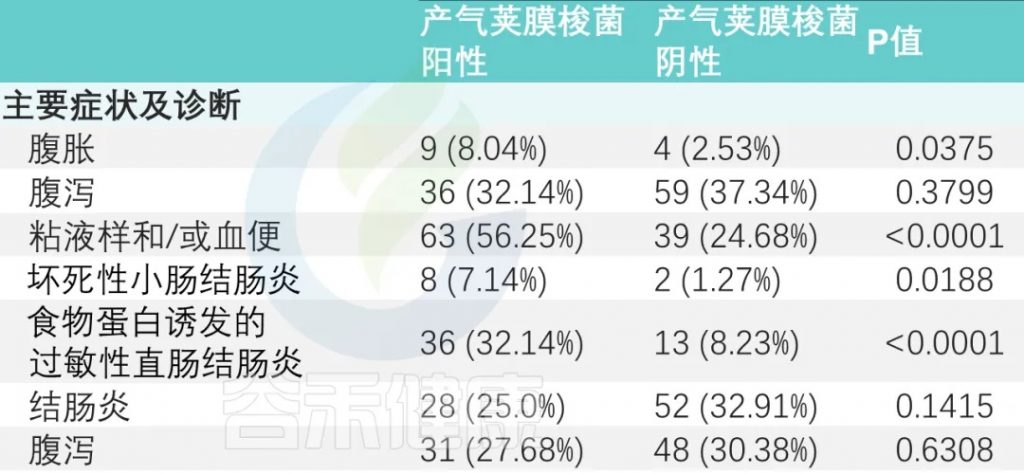
主要症状是腹胀、腹泻和粘液便和/或血便。
有或没有产气荚膜梭菌定植的婴儿,腹胀和粘液样便和/或血便的发生率存在显著差异(P<0.05)。
与产气荚膜梭菌阴性组相比,阳性组NEC(坏死性小肠结肠炎)和FPIAP(食物蛋白诱发的过敏性直肠结肠炎)发生率显著升高(下表)。
抗生素
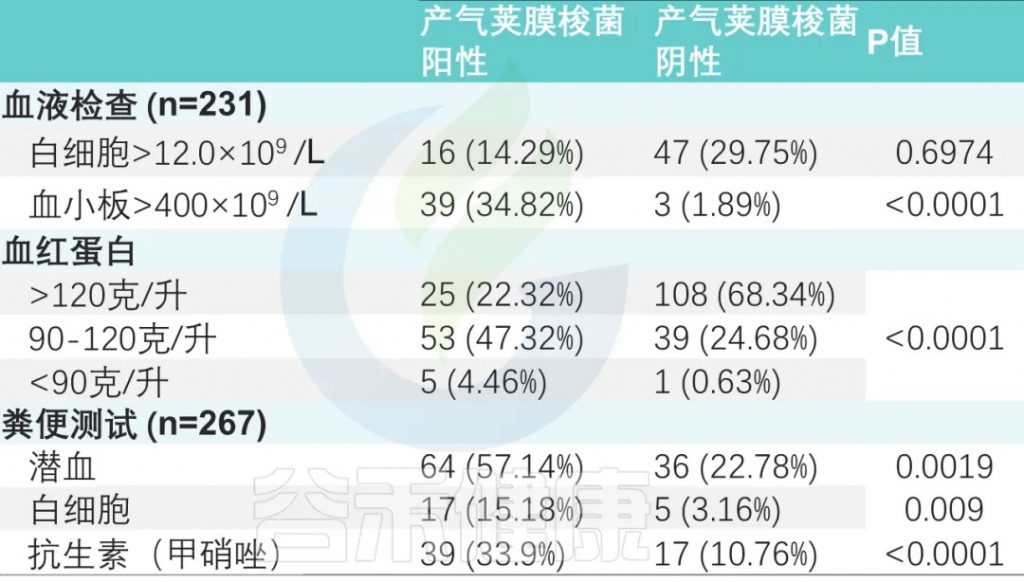
甲硝唑给药率:产气荚膜梭菌阳性组高于阴性组(33.9% vs. 10.76%)(P < 0.0001)。
血常规检查 (231名患者)
两组之间白细胞增多、血小板增多和中性粒细胞减少事件的数量存在显著差异。
粪便常规检查 (267次)
粪便潜血阳性率为37.45%(100/267),
粪便白细胞阳性率为8.2%(22/267)。
两组比较差异有显著性(P <0.001)(下表)。
在 30 名患者不同时间点(0、2、4、12 和 24 周)的 85 份粪便样本中检测到了潜在的特异性毒素基因。
产气荚膜梭菌携带潜在特异性毒素基因的出现率如下:
没有携带其他毒素的分离株。
对83份样本进行基因型鉴定,其中:
17例患者中同时检测到A基因型和C基因型。
经过12个月的随访调查,根据症状、饮食排除和口服食物挑战,临床诊断如下:
24.44%的病例(66/270)食物过敏,其中18.5%的儿童(50/270)患有牛奶蛋白过敏。
在产气荚膜梭菌阳性组队列中:
这两个比例都显著高于产气荚膜梭菌阴性组 [分别为7.59%(12/158)和5.06%(8/158)] (P<0.0001)
(下图)。
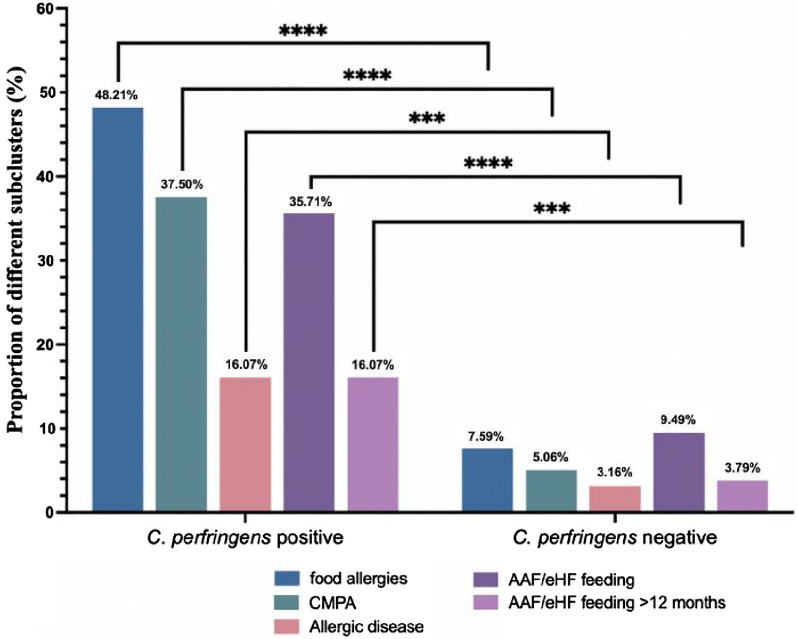
共有8.52%(23/270)的儿童被诊断为过敏性疾病,其中:
共有20.37%(55/270)的儿童喂养氨基酸配方奶粉(AAF)或深度水解配方奶粉(eHF),其中8.89%(24/270)喂养时间超过12个月。
产气荚膜梭菌阳性组氨基酸配方奶粉/深度水解配方奶粉利用率为35.71%,高于阴性组9.49%(P < 0.0001)。两组中喂养氨基酸配方奶粉和/或深度水解配方奶粉超过12个月的儿童人数分别为 16.07%和 3.79%(P = 0.0005)
为了探索产气荚膜梭菌阳性与食物过敏之间的相关性,进行了皮尔逊相关分析,生成了热图,显示食物过敏与产气荚膜梭菌阳性显著相关,粪便潜血、粪便中的白细胞、抗生素使用、血小板增加,血红蛋白减少(P <0.0001)。
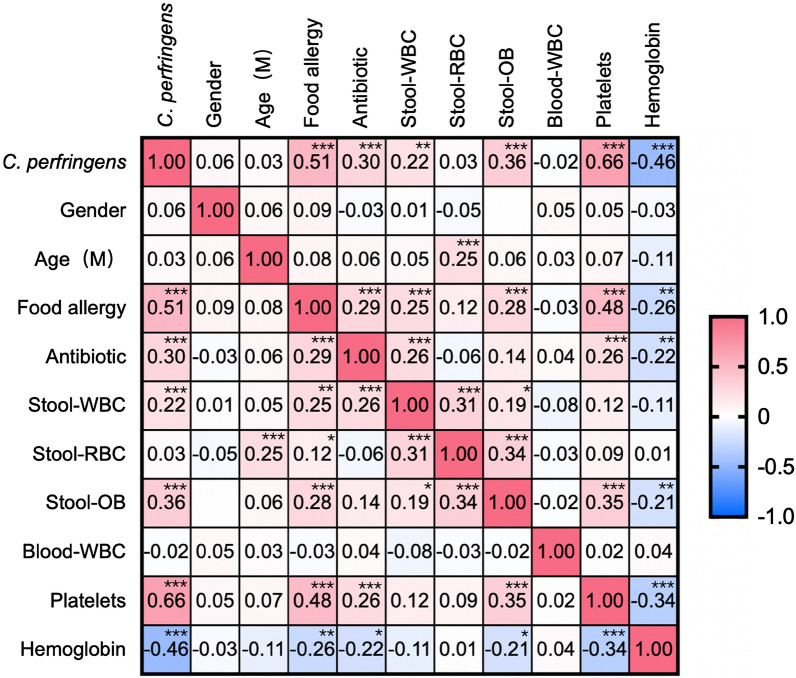
据报道,血小板与食物过敏反应有关,并且与过敏反应的严重程度相关。我们的研究显示食物过敏与血小板之间呈正相关(P<0.0001),这与报道的研究一致。婴儿食物过敏的常见症状包括腹泻和血便,常被误诊为急性或慢性肠炎而采用抗生素治疗。持续便血可能导致贫血,这可以解释本研究中食物过敏与抗生素使用(P<0.0001)和血红蛋白水平(P=0.0001)之间的相关性。
这项真实世界研究结果首次表明,产气荚膜梭菌在有胃肠道症状的中国婴儿中定植率很高,并且与食物过敏和牛奶蛋白过敏的发生有关。
产气荚膜梭菌广泛存在于健康人和动物的胃肠道中。
本研究显示,有胃肠道症状的婴儿中有33.52%有产气荚膜梭菌定植,新生儿和1~6月龄婴儿产气荚膜梭菌阳性率分别为30.25%和45.88%。不同的定植率可能是由于不同的患者群体、分娩方式、喂养方法和胃肠道疾病状况所致。
产气荚膜梭菌和艰难梭菌是可能与婴儿胃肠道感染和过敏相关的致病性梭菌。
先前的研究表明,产气荚膜梭菌定植可能导致多种病理状况,从无症状感染到严重危及生命的败血性休克,例如气性坏疽、食物中毒、坏死性肠炎、抗生素相关性腹泻、菌血症、肠毒血症和严重血管内感染溶血。
研究重点是产气荚膜梭菌感染及其产生一系列致命毒素(七种主要毒素型 A-G)和酶(例如卵磷脂酶、纤维蛋白酶、透明质酸酶、胶原酶和 DNA 酶)的能力,这些酶有助于其侵袭性。
大多数已确定的腹泻相关病原体是病毒,但在近 80% 的报告病例中并未发现特定病原体。这些病例的病因可能包括产气荚膜梭菌胃肠道感染和饮食/环境因素。
目前还没有关于产气荚膜梭菌定植是否影响儿童食物过敏发生的报道。在112名确诊产气荚膜梭菌定植婴儿队列中,其中 48.21% 出现食物过敏,37.5% 出现牛奶蛋白过敏,这两种患病率均显著高于产气荚膜梭菌阴性组(7.59% 和 5.06%),并且显著高于一般儿科人群中报告的水平。
此外,相关分析显示,食物过敏与该研究队列中产气荚膜梭菌定植、抗生素使用、粪便潜血、粪便白细胞、血小板和血红蛋白水平显著相关。该研究结果清楚地表明,产气荚膜梭菌在出生后第一年定植可能会促进食物过敏和牛奶蛋白过敏的发生。
研究表明,产气荚膜梭菌肠毒素(CPE)在促进紧密连接分解和诱导上皮损伤方面发挥着关键作用,从而导致微生物群变化并触发宿主免疫反应。免疫细胞群的变化很大程度上是由环境和微生物抗原驱动的。
关于产气荚膜梭菌定植与食物过敏的研究很少,但结果并不一致。有报道,过敏婴儿的拟杆菌和/或克雷伯氏菌定植率较高,而产气荚膜梭菌/丁酸梭菌定植率较低。
总之,研究人员推测产气荚膜梭菌定植会因其肠毒素而引起侵袭性胃肠道感染,导致紧密连接分解、上皮损伤、微生物群变化、宿主免疫反应异常,并最终导致食物过敏。
需要进一步的研究来阐明产气荚膜梭菌定植的婴儿发生食物过敏的潜在免疫学和分子机制。
总的来说,产气荚膜梭菌定植为婴儿牛奶蛋白过敏和食物过敏提供了一个思路,应用肠道菌群检测可以帮助识别食物过敏的风险,从而采取相应的预防措施。
此外,对于产气荚膜梭菌定植的抵抗力、空间和特定营养物质的竞争或毒素功能的研究,也能为进一步探索肠道菌群与过敏关系及预防和治疗提供了新的视角。
通过深入研究肠道菌群的变化及其与过敏疾病的关联,这可能涉及有效的药理学抑制剂/化合物的合理设计,调节补充剂/益生菌等各种方式对肠道菌群加以改善,有望为未来开发更加个性化的过敏预防和治疗策略提供重要参考。
这里我们来系统地了解一下产气荚膜梭菌。
产气荚膜梭菌是一种革兰氏阳性,产毒厌氧细菌,有荚膜、非运动、无鞭毛,属于梭菌属,是人类和动物肠道固有的机会病原体。
芽胞形成能力强,可在不利环境下存活
可以形成在传播过程中至关重要的孢子。产气荚膜梭菌孢子对高温、氧气或低营养水平等应激环境具有极强的抵抗力。当遇到有利条件时,内生孢子迅速萌发,产气荚膜梭菌的世代时间最短,为 6.3 分钟。在缺氧环境下生长迅速,能快速繁衍和侵袭宿主组织。对抗生素和化学消毒剂具有一定耐受性。
这些特征有利于其在不同的环境生态位中生存,包括土壤、粪便、污水、食物以及人类和动物的肠道。
这种“生存能力”意味着产气荚膜梭菌与许多感染和疾病有关,包括食源性细菌性疾病等。
具有多种水解酶
可分解蛋白质、脂肪等营养物质,为自身生长提供营养。
产气荚膜梭菌产生大量胞外降解酶,例如蛋白酶(例如梭菌蛋白酶)、透明质酸酶(mu毒素)、胶原酶和糖苷内切酶。
内切-N-乙酰半乳糖酰胺酶 EngCP,在 A 型菌株引起的气性坏疽期间很重要,而两种锌金属蛋白酶则导致 G 型菌株引起的禽坏死性肠炎。
最广为人知的产气荚膜梭菌降解酶是神经氨酸酶,它从宿主细胞表面或粘液中的各种唾液酸糖结合物上产生游离的神经氨酸。产生三种神经氨酸酶,分别为NanJ、NanI、NanH。
产生多种细胞外毒素
已知它能分泌超过20 种毒素,每种毒素类型都与特定疾病相关
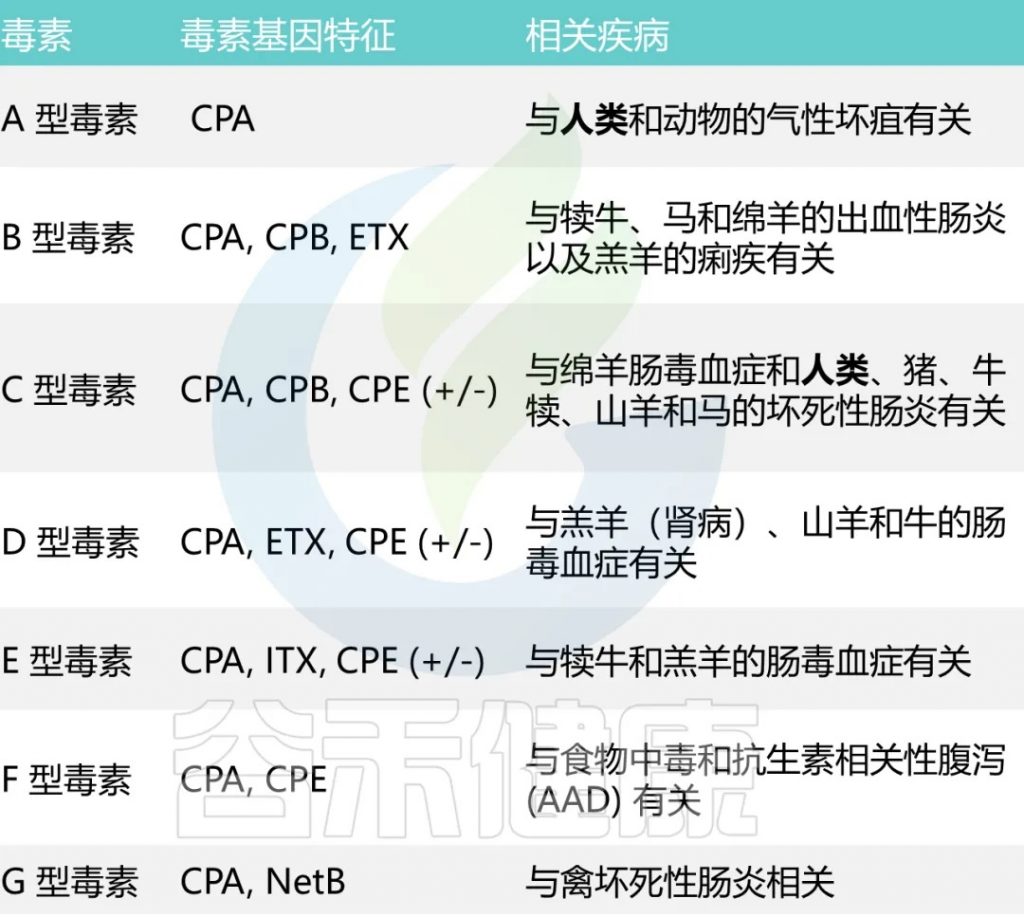
A型和C型毒素被认为会引起人类疾病。
A型毒素是导致大多数与产气荚膜梭菌相关的食物中毒和非食源性腹泻疾病的主要因素。根据CDC对食源性疾病暴发的流行病学监测数据,产气荚膜梭菌占5%的暴发事件,10%的疾病病例,4%的住院率。
男性的发病率略高(65%),大多数病例发生在20-49岁人群中。
C型毒素与1944年-1949年在德国战后出现的地方性坏死性肠炎,以及在巴布亚新几内亚高地出现的猪痢有关。严重营养不良会增加对 C 型感染的易感性。
CPE基因,在孢子形成后细胞裂解时产生肠毒素CPE,可能会导致胃肠炎。
产气荚膜梭菌主要毒素的结构域示意图
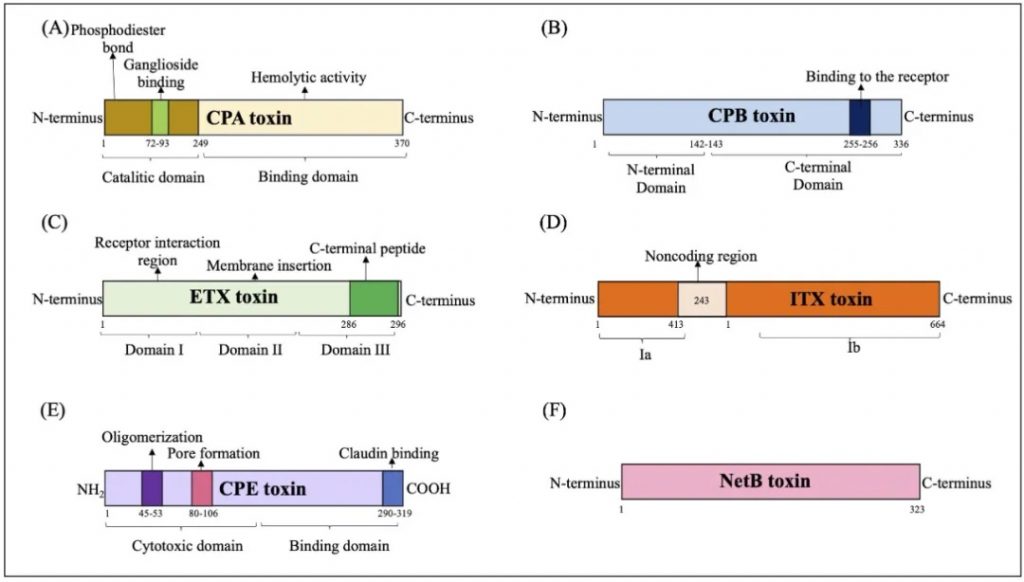
doi.org/10.1080/22221751.2024.2341968
(A) CPA 毒素:CPA毒素与GM1a相互作用,水解磷脂酰胆碱(PC)和鞘磷脂(SM),导致二酰甘油(DAG)和神经酰胺(CER)的形成,并激活原肌球蛋白激酶A受体(TrKA),并触发细胞内信号级联与IL-8释放。磷脂酰肌醇 3 (IP3) 的激活促进细胞质内钙 (Ca+) 进入。
(B) CPB 毒素:CPB 与血小板内皮细胞粘附分子 1 (PECAM-1) 结合,随后释放三磷酸腺苷 (ATP) 并形成允许离子交换进出细胞的孔。
(C) ETX 毒素:ETX 毒素与蛋白质“髓磷脂和淋巴细胞”(MAL) 相互作用,形成活性孔,诱导离子跨细胞膜运输和交换。
(D) ITX 毒素:Ib与脂解刺激脂蛋白受体(LSR)受体的结合介导其进入宿主细胞,通过内吞作用促进Ia进入通道的形成,随后肌动蛋白丝解聚,产生形态变化和改变细胞通透性。
(E) CPE 毒素:CPE毒素与紧密连接蛋白受体结合,通过离子交换和渗透失衡促进细胞表面孔的形成。
(F) NetB 毒素:通过形成允许 Na+、Cl–y 和 Ca2+等离子进入的七聚体亲水孔来识别细胞膜中的无胆固醇区域。
有研究培养从 333 名婴儿的粪便样本中分离出的产气荚膜梭菌,其中29.4% 的婴儿在出院前已被产气荚膜梭菌定植。
三个因素与携带概率呈负相关:
产气荚膜梭菌在母乳中生长不良,说明母乳喂养在早产新生儿护理中的重要性。
长期使用抗生素或持续气道正压通气(CPAP)氧气治疗会在早产儿肠道中为产气荚膜梭菌创造一个不利的环境,从而降低携带的可能性。
产气荚膜梭菌分离物在营养丰富的培养基或母乳中生长,可以作为单一培养物,也可以与婴儿双歧杆菌共培养,婴儿双歧杆菌被选为代表典型的竞争性肠道物种。
食源性疾病
产气荚膜梭菌是食源性疾病(食物中毒)的常见原因,产生肠毒素导致急性胃肠炎。食源性产气荚膜梭菌会导致:腹泻、腹部绞痛、胀气和腹胀。
通常,人们在摄入细菌及其孢子后,当微生物在肠道中形成孢子时,就会形成毒素,通常在 6-24 小时内就会出现症状。腹泻突然发生,但通常症状会在 24-48 小时内消失。
非食源性胃肠道感染
这种类型的感染通常归因于抗生素的使用。但有些人即使不服用抗生素,也会因产气荚膜梭菌而出现偶发性胃肠道症状。免疫系统较弱的人患此类疾病的风险最大。
非食源性产气 荚膜梭菌胃肠道感染导致:
这种类型的产气荚膜梭菌感染通常发生在最近服用过抗生素的60 岁以上成年人中。症状与食源性梭菌感染相似,但持续三天到几周不等。
这种类型的梭菌感染可导致严重脱水(体内水分流失)。然而,人们通常会康复。
一项研究表明,与健康个体 [5%] 相比,IBD 成年患者[19-27%] 产气荚膜梭菌的患病率更高,这表明与 IBD 存在潜在关联。
产气荚膜梭菌具有大量HMO消化所需的糖苷水解酶,表明它具有婴儿肠道机会性定植的可能性,从而导致临床疾病。
皮肤和深层组织感染
产气荚膜梭菌与严重外伤后可能发生的严重皮肤和深层组织感染(气性坏疽)有关。
从受污染的伤口(例如复合性骨折、产后子宫)开始,感染会在 1-3 天内扩散。
皮肤或深层组织产气荚膜梭菌感染(气性坏疽)会导致:
有时,感染仅导致厌氧性筋膜炎或蜂窝织炎。
其他感染
如乳腺炎、子宫内膜炎等。
促进定植
定植能力,即体内持续和增殖/存活的能力,是一些产气荚膜梭菌感染(例如F型菌株非食源性人类胃肠道疾病)的重要特征,产气荚膜梭菌定植通常涉及生长/生存和粘附所需的营养获取。例如,F型非食源性胃肠道疾病即使在腹泻时也能持续长达数周,这表明肠道粘附和营养获取对于这些 F型菌株在腹泻时稳定定植于肠道是必需的。
肠道粘附
为了在胃肠道中定殖,产气荚膜梭菌使用多种分子策略,包括产生唾液酸酶。虽然产气荚膜梭菌产生三种唾液酸酶,但 NanI 是由持续存在于肠道中的 F 型非食源性胃肠道疾病菌株产生的。这种相关性表明 NanI 对产气荚膜梭菌慢性肠道疾病有重要贡献。
NanI 的蛋白酶激活可能进一步促进产气荚膜梭菌菌株引起的定植。
增加营养物质的获取
多项体外研究支持 NanI 对与肠道感染相关的产气荚膜梭菌菌株的生长和存活的贡献。例如,NanI在宿主粘蛋白或培养的 Caco-2 细胞存在的情况下支持F 型非食源性疾病菌株 F4969 的体外生长和存活。这种生长促进涉及 NanI 生成的唾液酸的产生和利用,然后唾液酸可以被产气荚膜梭菌代谢。
可能涉及几种潜在的机制:
NanI 可能通过修饰肠细胞表面来促进产气荚膜梭菌粘附,从而允许暴露用于结合的未知受体,和/或减少该表面上唾液酸的负电荷。
大批量烹制并在不安全温度下保存的食物,通常会导致产气荚膜梭菌食物中毒的爆发。通常与产气荚膜梭菌食物中毒有关的特定食物包括:
产气荚膜梭菌食物中毒的爆发往往发生在为大量人群提供服务并且将食物保持在适当温度可能很困难的环境中,例如医院、学校食堂、监狱、疗养院和提供餐饮的大型活动。
组织感染
食物中毒
将食物煮至安全的内部温度杀死细菌。使用食物温度计进行检查,尤其是整只家禽和大块烤肉。
如果煮熟的食物不尽快食用,请将其保持在60 ℃或更高温度或4℃或更低温度。
烹饪食物或将其从保持安全内部温度的器具中取出后 2 小时内,将剩菜冷藏在4℃或更低的温度下。如果食物暴露在32℃以上的温度下(例如炎热的汽车或野餐),请在 1 小时内冷藏。
热食可以直接放入冰箱。
将大锅食物(例如汤和炖菜)和大块肉类(例如烤肉)分成小份,以帮助其在冰箱中快速冷却。
食用前将剩菜重新加热至74℃或更高温度。
主要参考文献
Huang KY, Liang BS, Zhang XY, Chen H, Ma N, Lan JL, Li DY, Zhou ZW, Yang M. Molecular characterization of Clostridium perfringens isolates from a tertiary children’s hospital in Guangzhou, China, establishing an association between bacterial colonization and food allergies in infants. Gut Pathog. 2023 Oct 8;15(1):47.
Yao PY, Annamaraju P. Clostridium perfringens Infection. [Updated 2023 Aug 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-.
McDonald AG, Lisacek F. Simulated digestions of free oligosaccharides and mucin-type O-glycans reveal a potential role for Clostridium perfringens. Sci Rep. 2024 Jan 18;14(1):1649.
Low KE, Smith SP, Abbott DW, Boraston AB. The glycoconjugate-degrading enzymes of Clostridium perfringens: Tailored catalysts for breaching the intestinal mucus barrier. Glycobiology. 2021 Jun 29;31(6):681-690.
Mehdizadeh Gohari I, A Navarro M, Li J, Shrestha A, Uzal F, A McClane B. Pathogenicity and virulence of Clostridium perfringens. Virulence. 2021 Dec;12(1):723-753.
Camargo A, Rámirez JD, Kiu R, Hall LJ, Muñoz M. Unveiling the pathogenic mechanisms of Clostridium perfringens toxins and virulence factors. Emerg Microbes Infect. 2024 Apr 9:2341968.
Arjomand Fard N, Wine E. Clostridium perfringens: A Potential Pathobiont in Inflammatory Bowel Disease. J Crohns Colitis. 2024 Feb 16:jjae019.
Kiu R, Shaw AG, Sim K, Acuna-Gonzalez A, et al., Particular genomic and virulence traits associated with preterm infant-derived toxigenic Clostridium perfringens strains. Nat Microbiol. 2023 Jun;8(6):1160-1175.

谷禾健康

腹泻是常见的健康问题,相信绝大多数人在生活中都曾遭受过腹泻的困扰。
根据2016年柳叶刀期刊统计,慢性腹泻影响全世界 3%-20% 的成年人。全球每年有17亿儿童腹泻病例,腹泻是五岁以下儿童死亡的第五大原因,每年约有52.5万儿童死亡。儿童时期腹泻还可能与营养不良相关,甚至对健康带来终生影响(后面文中会提到)。

全球对所有腹泻原因中特定类型细菌性腹泻患病率的估计包括大肠杆菌10%-25%、志贺氏菌10%、沙门氏菌3%、弯曲杆菌3%-6%。
我国是15个腹泻高发国家之一。十年纵向监测研究显示,主要病毒病原体来自A型轮状病毒和诺如病毒,主要的细菌病原体来自腹泻性大肠杆菌、非伤寒沙门氏菌。
腹泻的种类多、原因复杂,有病原体感染引起的急性腹泻,也有胃肠道疾病、神经系统疾病、食物过敏等伴随的慢性腹泻。
在腹泻期间肠道环境的短暂氧化,专性厌氧肠道菌群急剧消失,肠道菌群可能出现短暂失调。实际上,每次腹泻对肠道引起的波动不容小觑,人体内的肠道菌群相当于“历了个劫”。
DOI: 10.1016/bs.pmbts.2022.08.002
针对腹泻问题的处理,一般人可能认为偶尔腹泻一两天就过去了没什么,甚至有人还觉得拉肚子有助于减肥…
实际上如果不引起重视没有及时干预,或者说身体免疫系统没有将病原体彻底清除,一些病原体残留在体内,可能引起多次腹泻,反复多次后可能逐渐形成慢性腹泻,甚至悄悄延伸到其他慢性疾病。
我们也有时候会看到这样的现象:
– 有些人在腹泻后疲倦了好一阵恢复不过来…
– 在几次腹泻的一段时间后,突然对某些食物开始过敏了…
– 甚至某一天不明所以地出现了自身免疫疾病…
– 也有人在腹泻后突然爆发了一些大面积的皮肤状况…
本文我们就来详细了解一下关于腹泻的病因,腹泻后的肠道菌群有哪些变化,这些变化会不会与其他疾病相关,在与腹泻相关的疾病中肠道微生物群发挥的作用,以及实际应用中的干预措施。

腹泻一般会出现以下症状:
可能还会伴随着:
腹泻可能引起脱水,如果不及时治疗,有可能危及生命。脱水对儿童、老年人和免疫系统功能低下者来说尤其危险。
成人脱水症状:
婴幼儿脱水症状:
★ 感染
感染可能是由于食用了被某种致病菌污染的食物,或饮用受污染的水,其中可能含有细菌、寄生虫等。
常见的感染有:细菌、病毒、真菌、寄生虫等。
★ 旅行者腹泻
旅行者腹泻是由食用被细菌、病毒或寄生虫污染的食物或饮用水引起的。旅行者腹泻最常见的是急性腹泻。然而,一些寄生虫会引起持续时间更长的腹泻。
部分地方可能很难将废水和污水与烹饪、饮用和洗澡的水分开,就比较容易出现腹泻。
★ 药物
许多药物都可能引起腹泻,包括抗生素、抗酸剂(含镁)、口服糖尿病药物、抗癌药物、降胆固醇药、秋水仙碱等。
★ 食物问题
食物过敏:对牛奶、大豆、谷物、鸡蛋、海鲜等食物过敏可能会导致慢性腹泻。
乳糖不耐受:很多人有这个问题。乳糖是存在于奶类和其他乳制品中的一种糖。有乳糖消化障碍的人在食用奶制品后会出现腹泻。
有些人小时候喝牛奶没事,长大后慢慢出现腹泻的情况了。由于人体内帮助消化代谢乳糖的酶会随着年龄的增长有所减少,乳糖不耐受症的情况也会随着年龄的增长而增多。
其他比如说果糖,天然存在于水果和蜂蜜中,有时,也作为甜味剂添加到一些饮料中。对于有果糖消化障碍的人来说,果糖可引起腹泻。
有些人可能吃含糖、辛辣、高脂肪或油炸食品,也会腹泻。食物中成分刺激胃黏膜和肠道,引起胃肠道炎症和蠕动加快,从而导致腹泻。
★ 慢性疾病
★ 手术
许多人在腹部手术后可能会出现腹泻。腹部手术包括对阑尾、胆囊、大肠、肝脏、胰腺、小肠、脾脏或胃的手术。消化道可能需要一段时间才能恢复从吃的食物中正常吸收营养。
关于围手术期相关知识详见我们之前的文章:
★ 营养不良
腹泻是五岁以下儿童营养不良的主要原因。每一次腹泻都会使他们的营养不良更加严重。
对于大多数感染来说,营养不良和腹泻之间的相互作用是双向的。也就是说,营养状态改变宿主对感染的反应,营养不良会导致对肠道病原体的抵抗力下降,增加腹泻的风险;而反复腹泻则会改变营养状态。当感染频繁时,尤其是复发性腹泻病,宿主营养状况也在相应变化且逐渐恶化,导致营养不良,免疫力下降,发育矮小。
关于儿童营养不良我们之前的文章写过,详见:全球队列显示儿童营养不良关键在肠道菌群
▸ 急性腹泻
持续一到两天的稀稀水样腹泻。这是最常见的类型,通常无需治疗,在几天内自行消失。
大多数急性腹泻病例都有感染性病因。
急性腹泻有没有可能发展为其他疾病?
急性感染性腹泻会导致原有的肠道微生态失调恶化,如果这种情况发生在儿童身上,从长远来看,粘膜免疫系统的发育和成熟以及肠道屏障的完整性可能会受到影响,使儿童更有可能因肠漏而患上自身免疫性疾病。(我们在后面会详细讲到)。
▸ 持续性腹泻
持续约两到四个星期的腹泻。
▸ 慢性腹泻
持续超过四个星期或在很长一段时间内有规律地发作和发作。
慢性腹泻通常是腹腔疾病、慢性胰腺炎、病理性胆汁吸收、慢性炎症性疾病的症状,或是药物、进食、肠道手术、放疗的副作用。慢性腹泻也可能继发于肠易激综合征,其特征是与腹痛相关的排便习惯改变(腹泻和/或便秘)。
功能性腹泻是一种特殊类型的慢性腹泻,根据Roma IV临床标准定义为腹泻性大便,发生时间超过25%,在诊断前3至6个月的时间范围内,肠壁没有任何结构异常。
全球每年有17亿儿童腹泻病例,腹泻是五岁以下儿童死亡的第二大原因,每年约有52.5万儿童死亡。
慢性腹泻影响全世界 3%-20% 的成年人。
全球对所有腹泻原因中特定类型细菌性腹泻患病率的估计包括大肠杆菌10%-25%、志贺氏菌10%、沙门氏菌3%、弯曲杆菌3%-6%。
美国细菌性腹泻约占所有腹泻的31%。 导致食源性腹泻的细菌病原体比例为:沙门氏菌15.4%,弯曲杆菌11.8%,志贺菌4.6%,产志贺毒素的大肠杆菌(STEC)约3%。
我国是15个腹泻高发国家之一。以下是一项对我国长达十年(2009-2018年)的纵向监测研究。

▸在患者中检测到的两种主要病毒病原体:
其次是腺病毒和星状病毒。
▸两种主要的细菌病原体:
其次是志贺氏菌和副溶血性弧菌。
▸年龄对病原体检测的影响:
以上我们了解了关于腹泻的一些基本信息,腹泻作为一种常见的消化系统症状,与肠道微生物群的平衡之间有什么关联呢?下一章节我们详细了解一下。
这里我们从两个方面来了解:
下面要介绍的菌群,如果在肠道菌群检测报告中发现超出正常范围,那么腹泻的发生与这些菌群密切相关,在食物卫生方面需要格外留意。
■气单胞菌属 (Aeromonas)
气单胞菌属细菌更常见于海鲜、肉类,有时也存在于蔬菜中。症状往往在食用受污染食品后不久出现,可以持续几天到2周。除了腹泻,一般没有腹痛,呕吐和发烧可能存在,也可能不存在。
■ 蜡样芽孢杆菌(Bacillus cereus)
“炒饭综合征”,即蜡样芽孢杆菌引起的食源性疾病,具有明显的季节性,多发生在6月到10月;蜡样芽孢杆菌污染的食品,外观一般无明显变化,看不到腐败变质现象。潜伏期在1至16小时之间,在这段时间之后,症状才会变得明显,总体短暂仅持续约1至2天。除了大量腹泻,还有呕吐和腹痛。发烧通常不会发生在由蜡样芽孢杆菌引起的细菌性肠胃炎中。
■ 弯曲菌属(Campylobacter)
弯曲菌常见于乳制品、不同肉类和家禽中。潜伏期为2至4天,之后出现症状。整个病程在5至7天之间。呕吐通常不会发生。不过,腹泻时伴有发热、腹痛。
■ 梭菌属(Clostridium)
通常与食源性感染相关的是艰难梭菌和产气荚膜梭菌。
艰难梭菌感染的潜伏期是可变的。艰难梭菌引起的腹泻症状通常在用抗生素后 5-10 天开始,但也可能在第一天或长达 2个月后出现;艰难梭菌的病程也有很大差异。
艰难梭菌轻中度感染症状:
严重感染时通常会脱水,需要住院治疗。
(关于艰难梭菌感染我们在后面还会详细讲)
产气荚膜梭菌感染的潜伏期通常不超过1天,可以短至几个小时,病程大概仅持续约1天。呕吐一般较轻,通常不发烧,但腹泻时确实会出现腹痛。
■大肠杆菌(E.coli)
虽然我们说大肠杆菌自然存在于人类的肠道中,但一些菌株可能会导致严重的疾病。
不同的腹泻大肠杆菌菌株表现出不同的流行病学,并分为肠致病性大肠杆菌(EPEC,婴儿腹泻的主要原因)、肠出血性大肠杆菌,根据病理类型、定植部位、毒力机制和临床症状,可分为肠毒素性大肠杆菌(ETEC,旅行者腹泻和婴儿腹泻的主要原因)和肠侵袭性大肠杆菌。
在食品中,它通常来源于碎牛肉,但也可能在蔬菜中找到,尤其是当灌溉水被人或动物粪便污染时。肠出血性大肠杆菌潜伏期为1至8天,通常持续约3至6天。
通常不呕吐,可能发烧,也可能不发烧,但腹痛伴有腹泻。产肠毒素大肠杆菌的潜伏期为1至3天,疾病持续约3至5天。低烧伴呕吐、腹痛、腹泻。
■ 李斯特菌属(Listeria)
李斯特菌属细菌常见于牛奶和乳制品中。潜伏期约1天,期间无症状。这种疾病往往会持续3天左右。有些人确实会呕吐,但通常并不常见。出现发烧,腹痛可能也可能不会与腹泻同时发生。
■ 邻单胞菌属(Plesiomonas)
邻单胞菌更常见于海鲜中,食用受污染的牡蛎后容易感染。这种疾病往往在食用受污染的食物后很短一段时间内开始,并可持续2周。除腹泻外,呕吐、发热和腹痛等其他症状可能存在,也可能不存在。
■沙门氏菌属(Salmonella)
沙门氏菌是一种革兰氏阴性兼性厌氧细菌,存在于许多不同的食品中,包括乳制品、鸡蛋、肉类、豆芽、黄瓜等。潜伏期可以是几小时到3天。这种被称为沙门氏菌病的疾病可以持续约2至7天。除了腹泻(水样腹泻),还有呕吐、发烧、腹痛、胃痉挛。粪便颜色可能出现绿色。
大多数沙门氏菌引起的腹泻患者可以完全康复。一些沙门氏菌感染者在感染结束后会出现关节疼痛,称为反应性关节炎。一些患有反应性关节炎的人在排尿时会出现眼睛刺激和疼痛。
■志贺氏菌属(Shigella)
志贺氏菌一般分四类:
志贺菌属引起志贺菌病,这是常见的细菌性痢疾类型之一。痢疾志贺氏菌产生志贺毒素,引起细菌性痢疾。宋内氏志贺氏菌毒性不如其他志贺氏菌,但容易暴发和流行。
如果由患病且不保持良好卫生的人处理,任何食品中都会发现这种病毒。用受污染的水烹制的生鲜食品或用受污水污染的水灌溉的蔬菜也可能是一个问题。
潜伏期最长可达2天。志贺菌病通常持续2至7天。表现为高烧、腹痛伴腹泻,即使肠子空了也感觉还需要排便。呕吐通常不会发生。5 岁以下的儿童最容易患志贺氏菌病,但所有年龄段的人都可能患上这种疾病。志贺氏菌感染中约有 5% 具有广泛耐药性。
志贺氏菌等感染后伴随发烧症状,可能是一些人群的肠道屏障薄弱,致病菌就容易进入到血液,引起发烧。大多数志贺氏菌感染是自限性的。
■葡萄球菌属(Staphylococcus)
食品中的葡萄球菌可能存在于乳制品和肉类中。它也可能出现在蛋黄酱等食品中。潜伏期很短,约2至6小时。这种疾病是短暂的,持续时间仅为1天左右。通常不会发烧。出现呕吐、腹痛和腹泻。
■ 弧菌属(Vibrio)
弧菌属细菌通常存在于牡蛎等海鲜中。较为知名的弧菌种类是霍乱弧菌,它是霍乱的病因。它通常通过受污染的水传播。弧菌感染的潜伏期非常短,最多1天左右。这种病最长可以持续5年。
■ 小肠结肠炎耶尔森菌(Yersinia enterocolitica)
小肠结肠炎耶尔森菌通过未充分煮熟的猪肉传播给人类。它也可能通过受污染的水传播。潜伏期可以持续数小时到6天不等。这种疾病最短可持续1天,最长可达45天。通常症状包括发烧、呕吐、腹痛伴腹泻。
如果在这种急性腹泻的时候进行肠道菌群检测,可以对应相关症状,辅助判别引起本次腹泻的病原菌。如果某些菌群超标,则与腹泻相关。
谷禾长期的肠道菌群检测实践发现,很多的健康人或者是说非腹泻人群的肠道菌群检测报告中,也可能会携带以上这些菌群,这是为什么呢?
有些致病菌可能是一过性的,最近旅行,或者吃的不干净的食物中把这些菌带进去了,但是它在健康的肠道中没有定植成功,又从粪便排出体外,因此肠道菌群检测就检出了这些菌。
致病菌也可能悄悄潜伏在身体内,正常情况下没有反应,但当有时候没睡好太累了免疫力低下的时候,或者其他病理炎症感染的时候,或者服用抗生素之后正常菌群一定程度存在失调,这些致病菌趁虚而入,定植成功,就到了它们发挥作用的时候,腹泻也就随之而来。
以上所提及的菌群与腹泻有直接联系,那么在腹泻期间,整体肠道菌群是否会受到影响呢?
一些菌群的变化是否与细菌性感染或病毒性感染相关呢?
我们接着看。
腹泻早期肠道菌群失调
这里将疾病的早期定义为腹泻症状没有消退的时期,通常是在疾病发作或出现在医院后的前三到五天内。
与年龄、位置匹配的健康个体相比,腹泻导致分类丰富度和多样性显著降低。重复冲洗可能会极大地侵蚀微生物群,腹泻粪便中较高的含水量(较低的排便时间)与较低的α多样性有关。
腹泻发作后,兼性厌氧菌的增殖
腹泻发作后,肠道微生物组发生了显著的分类变化,有利于快速生长的兼性厌氧菌的增殖。变形杆菌(主要是肠杆菌科/大肠杆菌)和链球菌(主要是唾液链球菌和Streptococcus gallolyticus)在早期阶段富集最为显著,在粪便微生物群中的相对丰度可能高达80%。
肠道短暂氧化,专性厌氧肠道共生菌的急剧消失
腹泻期间肠道环境的短暂氧化,促进了这些细菌的繁殖,编码低亲和力细胞色素氧化酶的基因相应升高证明了这一点。这种丰度的增加伴随着专性厌氧肠道共生菌的急剧消失(Blautia、Prevotella、Faecalibacterium、Lachnospiraceae、Ruminococceae等),导致相关代谢产物如短链脂肪酸耗竭。
然而,腹泻细菌通常是短暂的和/或低丰度的(第一天的霍乱弧菌除外)。
并不是在所有腹泻患者中都发生菌群失调
部分感染患者的粪便微生物群与健康对照组的粪便微生物组非常相似。特别是,腹泻儿童的肠道微生物组可以分为四种肠道类型,每种类型都以一个分类单元为主:双歧杆菌、拟杆菌、链球菌或大肠杆菌。
目前尚不清楚这些不同的初始配置如何影响临床结果和恢复,但链球菌的相对丰度较高与住院时间或腹泻持续时间呈正相关。
感染性腹泻下的肠道微生物组演替
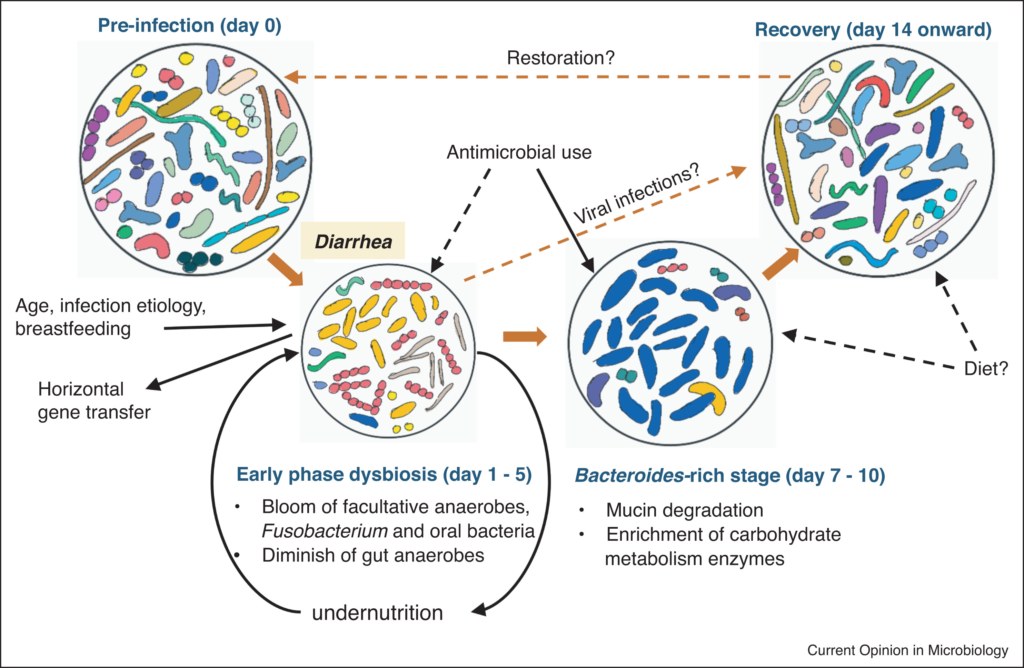
doi: 10.1016/j.mib.2022.01.006
F. mortiferum过多可能是肠道失调的一般标志
除了埃希氏菌和链球菌,腹泻粪便微生物群中也发现了其他细菌过多,即使在整个肠道微生态没有失调的情况下也是如此。
在越南的研究强调,其中包括 Fusobacterium mortiferum,以及人类口腔微生物群的几个菌(Granulicatella、Gemella、放线菌、Rothia、具核梭杆菌等)。
厌氧F. mortiferum通常在中国人的胃肠道定植(虽然丰度较低),但在西方人群中没有定植,最近在大肠息肉患者中注意到其增殖。
这些结果表明,F. mortiferum过多可能是肠道失调的一般标志,尤其是在亚洲人群中。
口腔细菌与腹泻肠道微生物群的紧密联系
计算分析表明,根据分类群共丰度模式推断,口腔细菌可能在腹泻肠道微生物群中形成紧密的相关网络。这表明它们可能共存于多微生物生物膜中,与口腔中存在的类似,但它们在腹泻病中的意义目前尚未研究。
对健康个体来说,微生物在口腔-肠道轴上的移位是频繁发生的,而腹泻所产生的生态贫瘠环境可能是这些口腔菌群临时定居的理想条件。
不同腹泻病因的菌群存在一些细微的差异
虽然整体的生态失调模式与不同的腹泻病因无关,但存在一些细微的差异。
这可能表明,病毒感染导致厌氧肠道共生菌减少的程度较低,可能是因为大多数病毒(轮状病毒、诺如病毒)感染的是小肠内壁的细胞,而不是结肠。在小鼠模型中,轮状病毒感染仅在回肠微生物群中导致拟杆菌和阿克曼菌群(均具有粘蛋白降解能力)增加,但这两个分类群在人类轮状病毒感染中过度生长的证据尚不确定。
另一方面,贾第虫引起的腹泻,始终与γ变形菌减少和普雷沃氏菌属富集有关。
痢疾(粘液性/血性腹泻)是一种严重的感染性腹泻,肠道炎症加剧,需要抗菌治疗和更长的住院时间。痢疾腹泻中存在过多的兼性厌氧菌(大肠杆菌、链球菌、肠球菌等),同时具有免疫调节作用的细菌(Lactobacillus ruminis, Bifidobacterium pseudocatenulatum)减少。
这些发现表明,细菌感染和痢疾通常伴随着与健康状况进一步不同的失调状态,这可能是病原体引发的炎症和/或频繁使用抗菌药物的影响。
腹泻后恢复阶段
腹泻后恢复期患者的肠道菌群与疾病早期不同,并向健康人群的肠道菌群趋同。恢复阶段标志着肠道微生物群的分类丰富度和多样性逐渐增加,但微生物群落演替在感染个体中显示出较高的时间变异性。
中期:拟杆菌↑↑,晚期:普雷沃氏菌属,产短链脂肪酸菌↑↑
通过对感染了霍乱弧菌和产肠毒素大肠杆菌的孟加拉国患者的研究,研究人员提出了肠道菌群恢复的逐步(中晚期)演替模型。大肠杆菌/链球菌的扩张最终耗尽肠道环境中的氧气,导致其种群在恢复阶段下降。
中期的特征是拟杆菌数量相当丰富(最早出现在发病后的第7天),而晚期则含有更丰富、更多样的普雷沃氏菌属和产短链脂肪酸的厚壁菌。碳水化合物代谢基因(主要为拟杆菌属)在中期富集最显著,使这些细菌能够灵活地从饮食来源和宿主来源的碳水化合物(分别富含纤维和粘蛋白)中提取能量。
这种按时间顺序排列的微生物组合,类似于服用抗生素后肠道微生物组恢复的情况。大量研究指出,经过抗生素治疗后,拟杆菌大量增殖,而厚壁菌和放线菌则减少了。
拟杆菌成为结肠生态恢复的关键物种
类似地,等渗性腹泻诱发短暂的肠道扰动,冲洗后立即出现明显的拟杆菌繁殖。拟杆菌属,如单形拟杆菌(Bacteroides uniformis),多形拟杆菌(Bacteroides thetaiotaomicron),因其粘蛋白降解能力被确定为初级恢复相关类群。通过利用宿主衍生的营养物质,拟杆菌成为结肠生态恢复的关键物种。
这随后启动了一个复杂的交叉喂食网络,以加快其他厌氧菌和产短链脂肪酸的菌(双歧杆菌、玫瑰杆菌、粪便杆菌等)的重新繁殖,从而建立一个分类学和功能多样性的群落。
患者恢复的微生物群是否恢复到感染前状态?
由于缺乏腹泻队列研究,此类数据有限。一项弯曲杆菌人类挑战研究结果表明,在比较恢复期和感染前的微生物组,显著的成分差异仍然存在,恢复期拟杆菌的丰度归因于抗菌药物的使用。
相比之下,在病毒性肠胃炎的康复过程中,拟杆菌富集期的存在并不突出,这可能是由于其不太严重的失调状态和很少使用抗菌药物。
儿童腹泻带来的长期影响
虽然腹泻大多是急性的,但反复腹泻可能会对儿童健康产生终身影响。长期以来,研究表明,腹泻和营养不良相互影响,使儿童在成年后容易发育迟缓、认知障碍和葡萄糖不耐受。
腹泻→多样性↓↓,与发育迟缓相关
秘鲁儿童的纵向微生物组跟踪表明,腹泻频率的增加,大大降低了肠道微生物组的多样性和丰富度,而发育迟缓儿童的这种影响更为严重。发育迟缓还与微生物群恢复速度较慢有关,而长期的扰动反过来又降低了对随后肠道感染的适应能力,形成了腹泻和营养不良的恶性循环。
口腔菌群→肠道定植,可能引发炎症
非洲发育迟缓的儿童的小肠和结肠中口腔细菌过度生长,口腔细菌占优势,如唾液乳杆菌和链球菌。研究人员推测,反复腹泻增加了移位口腔细菌适应紊乱肠道环境的机会,口腔菌群稳定定植可能会引发炎症并改变微生物组的功能。
无症状携带的肠道病原体也会重塑肠道微生物组
感染弯曲杆菌、诺如病毒或肠聚集性大肠杆菌的儿童具有显著更高丰度的Ruminococcus gnavus,它与克罗恩病密切相关,并产生促炎多糖。与腹泻类似,弯曲杆菌的无症状感染与发育迟缓有关,突出了菌群失调在腹泻之外的重要性。
腹泻:耐药基因水平转移,促进新的耐药性表型
肠杆菌科在腹泻早期的扩张,大大增加了它与攻击性病原体的接触,从而增加了水平基因转移的可能性。实验模型已经证实,由于结肠炎诱导的肠杆菌科细菌增多,质粒很容易从沙门氏菌转移到大肠杆菌。
越南的研究发现,共生大肠杆菌和致病性Shigella sonnei中存在相同的多药耐药质粒,这两种质粒都是从一名腹泻儿童身上分离出来的。这表明,一旦病原体进入肠道感染发生率和抗菌药物使用率高的环境,肠道的肠杆菌科可以成为促进新的多药耐药性表型出现的有效宿主。
腹泻后的肠道微生态失调是短暂且可逆的,但其负面影响在脆弱人群中会被放大。
以上是关于感染性腹泻与肠道菌群之间的关联,实际上研究表明,肠道菌群的失调与慢性腹泻之间也存在密切的联系。接下来,我们从具体疾病中一一来看它们之间的关联机制。
腹泻可能是许多疾病的症状。这里我们介绍一些常见的与肠道菌群相关的包括腹泻症状的疾病,例如肠易激综合征、胆汁酸腹泻、乳糜泻、炎症性肠病、抗生素治疗腹泻、放射性腹泻、酮症腹泻等。
IBS的特征是慢性腹痛或不适以及排便习惯改变,其诊断是根据罗马 IV 标准在临床上确定的,该标准将 IBS 定义为过去三个月内平均每周至少一天发生的复发性腹痛,涉及以下两种或多种相关症状:排便、大便频率的变化或大便外观的变化。
IBS的亚类包括:
什么人群更易出现IBS?
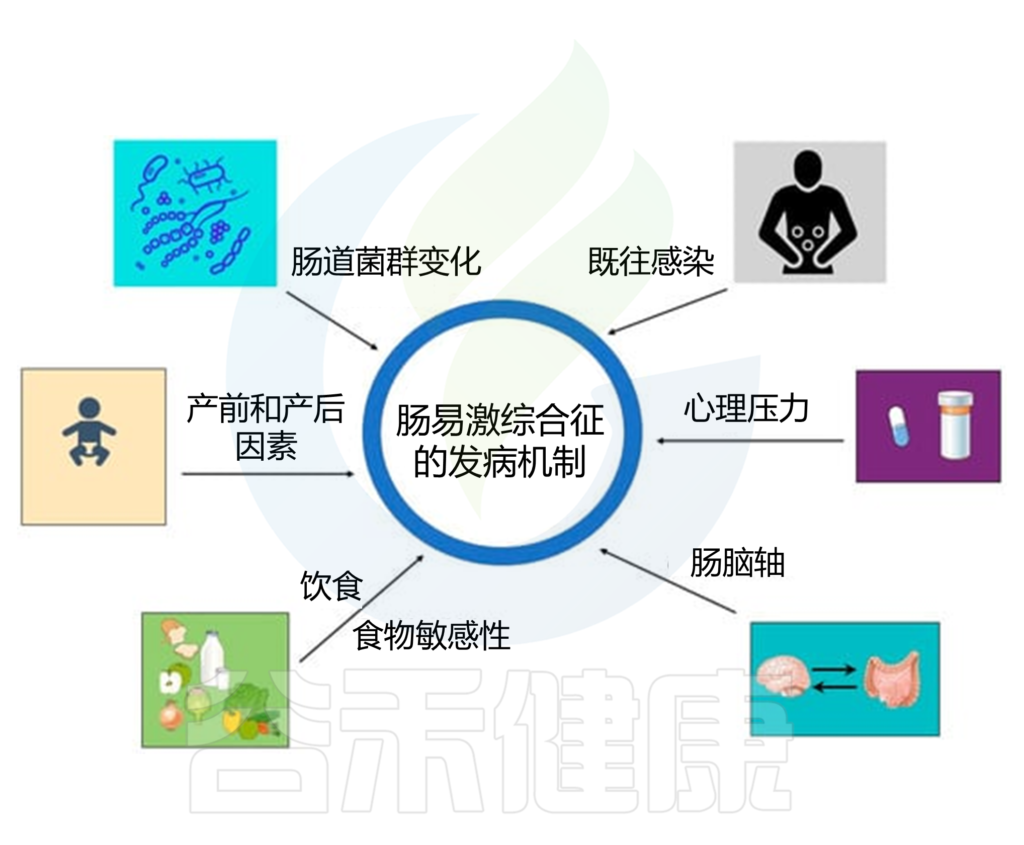
IBS的多种病理生理机制
如运动能力改变、屏障功能受损、免疫激活、内脏过敏和中枢神经系统异常,并可能与个人和环境风险因素有关,包括遗传易感性、压力、抗生素使用、肠道感染、心理困扰、饮食等。
doi.org/10.3390/jcm12072558
脑-肠轴的失调会改变胃肠道系统的运动、感觉、自主和分泌功能,进而改变肠道蠕动、肠道通透性、内脏敏感性和肠道微生物群组成,所有这些都与 IBS 的发病机制有关。
关于内脏敏感详见我们之前的文章:
腹胀、腹痛、肠胃不明原因疼痛?–可能是内脏高敏感,详细了解内脏高敏的原因后果
IBS 中常见的肠道蠕动变化是由血清素代谢改变介导的。肠神经系统的肠嗜铬细胞释放血清素,刺激肠道蠕动并调节分泌和血管舒张功能。肠神经系统失调可导致血清素分泌增加或减少,分别表现为腹泻或便秘。
IBS的肠道菌群变化
IBS-D 的特点是粪便微生物群的微生物多样性总体下降,厚壁菌门显著减少,拟杆菌门增加。

多种类型IBS的菌群变化:
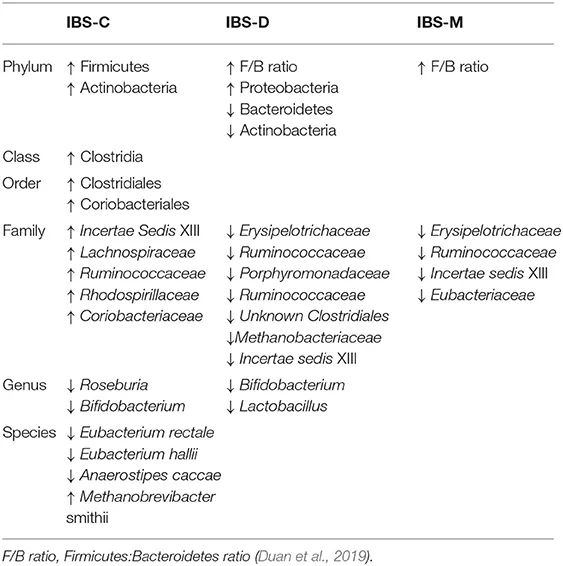
低度炎症和免疫功能障碍在 IBS 中发挥作用
研究发现 IBS 患者的促炎细胞因子水平升高,部分原因可能是压力所致。
10%的IBS病例是在最近患有胃肠道疾病的情况下感染后发生的,这通常会导致粘膜和全身炎症。
IBS症状与心理、生理和神经胃肠道因素有关
肠道微生物组的改变也会导致一些炎症和免疫学变化,这些变化可能会通过增加肠道通透性来损害胃肠粘膜屏障。这反过来可能会干扰胃肠道稳态,并使脑-肠伤害感受通路失调,导致内脏过敏或胃肠道疼痛感增强。
IBS相关干预措施
IBS患者饮食方面要注意,豆类、含乳糖食品和人工甜味剂中存在的可发酵低聚糖、单糖、二糖和多元醇 (FODMAP) 由于其发酵和渗透作用,可能会加剧部分患者的症状。
注:FODMAP 在小肠中吸收不良,导致大结肠中的水分吸收增加和发酵产生气体,这可能会导致与 IBS 相关的几种症状,包括腹痛和腹胀。摄入 FODMAP 的渗透效应也可能导致胃肠道系统扩张,并在肠道蠕动异常中发挥作用。
消除 FODMAP饮食 可以改善 IBS 整体症状,消除饮食涉及短时间(即几天到几周)而不是永久地禁食各种食物。
IBS基于病理生理学的分类和治疗建议

四分之一的 IBS-D 患者实际上患有特发性胆汁酸腹泻,接下来我们来看看胆汁酸腹泻。
胆汁酸腹泻
胆汁酸腹泻(BAD)是一种常见的疾病,其起因是原发性胆汁酸流失增加,并可导致微生物群变化,同时与腹泻型肠易激综合征(IBS-D)有重叠之处。
胆汁酸腹泻患者报告的最常见症状是爆发性腹泻、难闻的气味或水样腹泻(80%)、尿急 (85%) 以及腹胀或肿胀 (54%)。
实际上,25-33%的慢性腹泻患者患有原发性胆汁酸腹泻。继发性胆汁酸腹泻继发于终末期回肠切除或发生在克罗恩病或放射线后。
胆汁酸腹泻是怎么回事?
胆汁酸由肝脏产生并储存在胆囊中。吃脂肪食物时,胆汁酸会释放到小肠中分解脂肪,之后胆汁酸被重新吸收并送回肝脏重新利用。通常,只有很少的胆汁酸最终进入大肠。
胆汁酸的正常肝肠循环
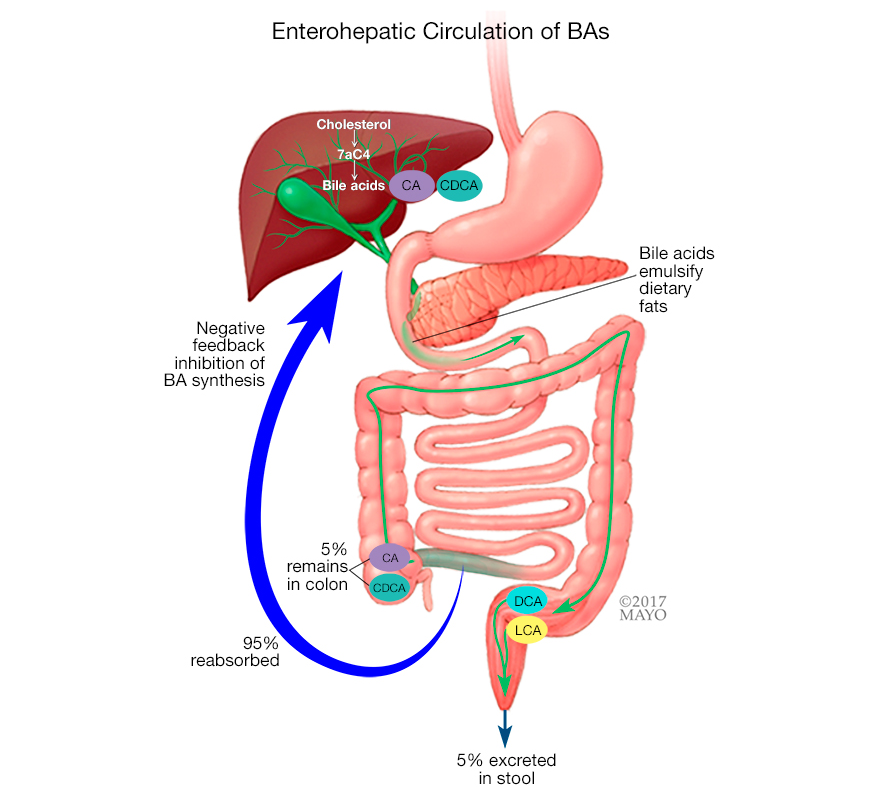
对于 BAD 患者,大量胆汁酸会被冲入大肠。这会导致肠道内液体增加。液体通过肠道的运动速度加快,结果是水样大便。
胆汁酸合成由与肠肝循环相关的负反馈回路调节,该负反馈回路依赖于法尼素X受体和成纤维细胞生长因子。这些反馈回路的中断会导致胆汁酸的过量产生,从而导致胆汁酸腹泻。
低脂饮食可能有助于改善与胆汁酸腹泻相关的症状。
与肠道菌群有什么关联?
由于电解质失衡,胆汁酸的吸收不良或过量产生会导致肠道菌群失调和腹泻。
肠道菌群负责初级胆汁酸的去结合、脱氢、7α脱氢和差向异构化,在胃肠腔产生次级胆汁酸,并介导胆汁酸合成的反馈控制。肠道菌群是胆汁酸的主要调节者,反过来又调节微生物群的组成和丰富度及其特征。
在一组胆汁酸排泄过多的IBS-D患者(BA+IBS-D)中,一种以胆汁酸转化梭菌物种富集为特征的特定肠道菌群能够增强胆汁酸总排泄量,这与粪便胆汁酸和血清7-羟-4-胆甾酮(C4)水平较高有关。
另一项最新研究显示,BAD患者粪便细菌多样性降低,其他菌群变化如下:
BAD患者的初级粪便胆汁酸比例也较高,可能是由于肠道微生物群中双歧杆菌和Leptum减少,大肠杆菌增加所致。这可能会改变胆汁酸对FXR和TGR5的亲和力,从而导致FXR活性降低,胆汁酸向结肠的输送增加。
另有研究表明,双歧杆菌丰度增加的同时,次级粪便胆汁酸减少,从而导致乙酸盐和丙酸盐水平升高。
乳糜泻 (CD) 是一种常见的全身性疾病,是由于人体免疫力对麸质摄入的异常反应而导致的。
注:麸质是一种存在于小麦、大麦、黑麦等谷物中的蛋白质,可溶于酒精。
乳糜泻的发病机制涉及遗传和环境因素的复杂相互作用。肠道微生物群在乳糜泻的发病机制中发挥着复杂的作用。
与乳糜泻相关的微生物群的变化
包括有益菌丰度降低,特别是以其抗炎和免疫调节特性而闻名的双歧杆菌。
还有乳杆菌通过多种机制,包括分泌抗炎细胞因子和改变Th1免疫反应。
某些细菌的过度生长与肠道通透性增加有关,这是乳糜泻的一个标志。具体来说:
肠道微生物群导致乳糜泻的可能发病机制
这里从环境因素的作用、微生物群本身的作用、遗传学因素、围产期因素等几个方面来说。
环境因素的作用:
一种假设是,一些肠道细菌表达模仿麦醇溶蛋白(麸质的一种成分)的表位,可以引发宿主免疫反应。这种反应导致免疫系统激活并产生攻击肠道内壁的抗体。
另一个假设与脂多糖有关,脂多糖是革兰氏阴性细菌外膜中发现的分子。脂多糖可以通过产生IL-15在先天性和适应性免疫系统中发挥相关作用,IL-15可以引发肠道炎症。
一些细菌,例如铜绿假单胞菌,与麸质结合可导致粘膜炎症加剧。这两个因素的结合可能会导致肠道内壁进一步受损,并加剧乳糜泻症状。
最后,病毒感染也可以触发先天免疫系统的激活。具体来说,TLR3是一种可以识别病毒感染并做出反应的受体,导致先天免疫系统激活和肠道炎症。
微生物群本身的作用:
– 通过产生特异性免疫原性或耐受性面筋肽
– 释放影响肠道通透性的连蛋白(zonulin)
– 通过促进上皮粘膜成熟,改变麸质的消化,从而促进乳糜泻发病
– 肠道菌群产生的促炎或抗炎肽和细胞因子也可能通过调节免疫系统发挥作用
微生物群代谢产物的作用:
肠道细菌还可以通过释放短链脂肪酸来调节,具体来说,短链脂肪酸通过促进紧密连接形成、抑制促炎细胞因子的产生以及促进调节性T细胞分化,参与维持肠上皮屏障的完整性。通过这种方式,肠道细菌及其产物的平衡可能会影响宿主对包括麸质在内的膳食抗原的耐受能力,可能导致乳糜泻的发生。
遗传学的作用:
– 乳糜泻家族风险婴儿的基因型(携带HLA-DQ2单倍型的),影响早期肠道菌群的组成
– 有乳糜泻遗传易感性的婴儿肠道菌群组成不同(即拟杆菌比例)
– 出生后前6个月微生物群变化增加了包括乳糜泻在内的自身免疫性疾病的发病风险
患有乳糜泻一级亲属的婴儿的大规模前瞻性出生队列研究,在引入食物(包括麸质)之前,4-6个月大的婴儿中几种链球菌和粪球菌的丰度减少与患乳糜泻的遗传风险有关。发生乳糜泻的标准遗传风险和高遗传风险与拟杆菌和肠球菌种类增加有关。出生后4-6个月时,下列菌群丰度下降:
围产期因素的作用:
剖腹产:由于粪肠球菌增加,拟杆菌属和副拟杆菌属数量减少,导致乳糜泻的风险更高。
喂食类型:婴儿配方奶粉喂养可能是发生乳糜泻的危险因素,但结果不一致。
任何的配方奶粉(无论是纯配方奶粉喂养还是与母乳混合喂养的儿童)都与短双歧杆菌数量减少相关。
抗生素使用:与乳糜泻之间存在关系,这可能是剂量依赖性的。
胃肠道感染:出生后 6-18 个月内的胃肠道感染会因肠道通透性增强而增加患乳糜泻的风险。
肠病毒、腺病毒12型、正呼肠病毒和白色念珠菌也与乳糜泻风险增加有关。
以上所有这些机制凸显了肠道微生物组、麸质和免疫系统在乳糜泻发展过程中复杂的相互作用。
炎症性肠病(IBD)常见症状是腹痛、腹泻和体重减轻。炎症性肠病主要包括:克罗恩病(CD)和溃疡性结肠炎(UC)。
IBD 类型通常通过炎症位置和胃肠道的组织病理学特征来区分。临床上:
这两种情况均源于遗传易感宿主对微生物和/或环境因素的不适当免疫反应。
炎症性肠病患者肠道菌群变化
炎症性肠病患者肠道菌群多样性较低,对大多数炎症性肠病患者的报告了厚壁菌门、拟杆菌门和变形菌门内特定细菌类群的丰度变化,具有攻击性的菌群的增多,如变形杆菌、梭杆菌属、瘤胃球菌,同时具有保护性的菌群的减少,例如Faecalibacterium、罗氏菌属 、毛螺菌科、双歧杆菌属。
当粘蛋白降解细菌(如瘤胃球菌)过度生长时,粘液层开始变薄,肠壁更容易受到肠道微生物的促炎信号的影响。
当这种情况变成慢性时,肠壁中的异常炎症反应似乎成为常态,导致我们在 IBD 中看到的肠壁损伤以及特征性的高粪便钙卫蛋白和FIT。慢性炎症会使肠道菌群失调和肠道屏障功能障碍长期存在,形成恶性循环。
肠道中高水平的具核梭杆菌(一种来自口腔的共生细菌),与炎症性肠病的进展有关。
其他例如普拉梭菌等一些产丁酸菌也减少,丁酸盐有助于肠壁修复和调节炎症。如果肠道丁酸生成量低,肠壁可能会变得渗透性过高,并由于这种微生物介导的愈合机制的丧失而出现慢性炎症。
关于IBD在我们之前的文章有详细阐述其机制,以及肠道微生物群与IBD之间的密切关联,详见:肠道菌群失调与炎症性肠病的关联
抗生素相关性腹泻(AAD)通常是指与服用抗生素相关且无法以其他方式解释的腹泻。腹泻可发生在抗生素治疗期间和治疗停止后长达8周。
发病率:
AAD的临床病程因是否涉及艰难梭菌而异,大多数非艰难梭菌发作。艰难梭菌AAD严重程度轻微,自限性强,仅持续几天。
一项对住院患者抗生素相关性腹泻相关细菌的荟萃分析显示,艰难梭菌、产气荚膜梭菌、产酸克雷伯菌(Klebsiella oxytoca)、金黄色葡萄球菌是全球AAD住院患者中最常见的细菌。
AAD组动物模型中变形菌门和放线菌门丰度较高。更重要的是,模型组乳杆菌的丰度明显低于对照组,而肠球菌的丰度明显高于对照组。
抗生素治疗还增加了柠檬酸杆菌(Citrobacter)、窄养单胞菌(Stenotrophomonas)和谷氨酸杆菌(Glutamicibacter)的丰度,而抗生素降低了支原体和幽门螺杆菌的丰度。
■ 艰难梭菌感染
艰难梭菌是一种革兰氏阳性厌氧芽孢杆菌,是一种重要的医院病原体。艰难梭菌是属于厚壁菌门的正常微生物群的一部分,正常在特定范围内。
近年来,由于抗生素过量使用,艰难梭菌相关性腹泻(CDAD)的发病率有所增加。
艰难梭菌相关性腹泻发展的关键风险因素:
艰难梭菌感染的临床表现各不相同,从无症状或非常轻微的腹泻到严重的伪膜性结肠炎。艰难梭菌感染的发病机制似乎与正常肠道微生物群的破坏有关,主要来自抗生素治疗,如阿莫西林、氟喹诺酮、氨苄青霉素、克林霉素和头孢菌素,这些药物可能导致肠道微生态失调。
注:健康微生物组的共生菌群通过定植抗性控制艰难梭菌等病原体的定植。在抗生素和抗肿瘤或免疫抑制药物对正常肠道菌群产生破坏性影响后,肠道易被艰难梭菌定殖,或者这种影响可能导致肠道环境中预先存在的微生物种群过度生长,从而导致CDAD。
病原体通过粪口途径和孢子传播,一旦摄入,可以在胃酸中存活并定植于结肠,释放肠毒素A和细胞毒素B,这在很大程度上是造成临床严重程度的原因。
与未发生艰难梭菌感染的患者相比,抗生素治疗后艰难梭菌感染患者的微生物群多样性较低。与对照艰难梭菌抗性小鼠相比,发现数量显著增加的初级胆汁酸和某些碳水化合物有利于艰难梭菌的生长。
对于复发性艰难梭菌感染,可以使用粪菌移植FMT治疗,目前临床上有较好的反馈,随着研究的深入和技术的成熟,成功率也越来越高,关于FMT我们在后面章节也会讲到。
有时候常常将食物过敏与食物不耐受混为一谈。虽然这两种情况可能会导致类似的症状,但它们是由不同的机制触发的。
食物过敏是由于免疫系统对特定食物物质的过度反应引起的。食物过敏的主要原因是蛋白质。
蛋白质存在于花生、坚果、鸡蛋、乳制品、鱼、小麦、大豆和虾等贝类中。
牛奶过敏是婴幼儿期常见的食物过敏,牛奶蛋白质分为两大类:酪蛋白和乳清蛋白,所有蛋白质都可能是潜在的过敏原,并且可以诱导IgE 和非 IgE 介导的免疫反应,从而导致广泛的临床表现和不同的表型。
非 IgE 介导的牛奶过敏涵盖多种疾病,包括食物蛋白诱发的过敏性直肠结肠炎、食物蛋白诱发的小肠结肠炎综合征和食物蛋白诱发的肠病。
当身体遇到少量的有害食物时,它都会释放组胺,肠道内布满了具有组胺受体的细胞。当组胺与这些受体结合时,会引起消化系统的肌肉收缩,导致腹部痉挛和腹泻。
患有慢性小肠结肠炎综合征的婴儿表现出更多的慢性症状,如呕吐、慢性腹泻和生长发育不良。
案
例
一名6个月的患者,基本情况:中度营养不良,牛奶蛋白过敏,每日腹泻较多。
肠道菌群检测报告如下:
<来源:谷禾健康肠道菌群数据库>
以上我们可以看到:
病原菌中:
对应的菌属中:链球菌属,志贺氏菌属,梭菌属这几类有害菌较多的菌属属于人群中较高。
<来源:谷禾健康肠道菌群数据库>
针对牛奶蛋白过敏,以及出现中度营养不良和腹泻的情况,对应报告中:
消化道疾病部分的显示的,肠炎高风险,细菌性腹泻、病毒性腹泻和过敏性腹泻均提示注意。
结合前面病原菌的超标和每日腹泻症状,判断较大可能存在细菌性腹泻的可能。较大可能存在肠炎的情况,并引发肠道屏障损伤,导致乳蛋白过敏的情况。
干预建议:
牛奶过敏暂时可以使用深度水解的奶粉减少过敏。另外可以适当开始摄入米粉等辅食,补充碳水化合物。
基于肠道炎症的情况,可以考虑少量服用姜黄素,并补充益生菌。
扩展阅读:生命早期微生物接触和过敏风险:如何预防
放射性腹泻患者的肠道微生物群落变化比非放射性腹泻患者的肠道微生物群落变化更大,因此,肠道微生物群对于预防放射性腹泻至关重要。
腹泻患者的拟杆菌、Dialister、Veillonella和未分类细菌种类增加,梭菌XI和XVIII、Faecalibacterium、Oscillobacter、Prevotella、Parabacteroides减少。
一些证据还表明,接受放射治疗的患者艰难梭菌感染的发生率很高,这与高死亡率有关。研究表明,肠道微生物群组成可作为放射治疗引起的腹泻和疲劳发展的预测标志。
肠道微生物组对辐射诱导的胃肠道粘膜炎发病机制的影响,是通过调节氧化应激和炎症过程、肠道通透性、粘液层组成、上皮修复和抵抗有害刺激的能力,以及免疫效应分子在肠道中的表达和释放介导的。
肠道微生物组可以通过两种机制影响辐射诱导的胃肠道粘膜炎:易位和微生态失调。
辐射破坏肠道屏障和粘液层,导致细菌移位,从而激活炎症反应。生物失调,无论是由辐射还是其他因素引起,都会影响局部和全身免疫反应。
TLR 具有抗辐射保护作用的另一个潜在机制是激活 NF-κB 信号传导,这对于保护肠道免受辐射诱导的细胞凋亡至关重要。也就是说 TLR 可能通过 NF-κB 途径影响肠道对辐射诱导的上皮损伤的反应。
由于缺乏纤维,便秘往往是生酮饮食的最大问题,但事实上,生酮饮食也会导致腹泻。酮症腹泻可能只是比平时更多的水样大便和/或更频繁地排便。
酮症腹泻的原因可能如下:
脂肪很难消化
一般来说,身体消化脂肪需要更长的时间。在像酮这样的高脂肪饮食中,你会突然比平常吃更多的鳄梨、坚果、种子、肉类、橄榄油和其他脂肪,这会扰乱消化。当你改用这种高脂肪饮食时,可能会导致腹泻。
人工甜味剂和糖醇可能会对胃造成伤害
在生酮饮食中经常摄入更多的糖醇和其他人造甜味剂。这些甜味剂虽然碳水化合物含量低且通常是安全的,但过量食用可能会导致腹胀和腹泻。因此,如果有人食用大量糖醇含量高的酮类产品,他们可能会患酮类腹泻。
破坏肠道菌群
一些小型研究发现,在进行生酮饮食三个月后,肠道菌群发生了很大变化,这可能会导致一些人腹泻。与基线相比,3个月时,脱硫弧菌属统计显着增加(p = 0.025)。脱硫弧菌属与食用动物源性脂肪相关的肠道粘膜炎症状况恶化有关。还需要做更多的研究。
酮症腹泻持续多久?
酮症腹泻并不是一个永久性的问题。通常是暂时的,一般会发生在一开始改变饮食的时候,可能是在身体能够调整之前的第一到四周。
然而,如果高脂肪饮食对一个人的身体来说不容易消化,或者肠道微生物群确实发生了变化,腹泻可能是一个长期的副作用。
如果酮类腹泻持续存在,就值得重新考虑饮食计划。一种饮食计划不太可能适合所有人,其他可能考虑地中海饮食等饮食方式。
关于腹泻相关的干预,我们分三步走:
▼
1. 腹泻未发生 → 预防
预防腹泻相关措施
勤洗手:可以预防感染性腹泻的传播,比如准备食物前后,如厕、换尿布、打喷嚏、咳嗽、擦鼻涕等之后都要洗手。
正确储存食物:在正确的温度下储存食物,并烹饪所有食物直至达到建议的温度。不要冒险食用过期的食物或饮料。
预防旅行者腹泻:到卫生条件不完善的地区旅行时,需要注意食品安全。吃完全煮熟的热食,吃水果要吃可以去皮的,喝原包装的瓶装水,包括刷牙也用瓶装水。避开未经高温消毒的牛奶或果汁产品。合理摄入一些益生元,降低旅行者腹泻的风险。
保持肠道菌群平衡:当我们肠道菌群在一个良好的状态时,可以提高我们的免疫力,甚至能抵抗病原菌的定植,通过均衡饮食、保持良好的作息规律、适度运动、减少压力等各个方面,维持肠道菌群平衡。
当腹泻发生时,首先要判别感染源和感染原因。
如果是急性腹泻,很可能是因为病原体引起的,进行常规的病原物判别,医院可以进行相关检测,当然也可以结合肠道菌群检测,找出感染的原因,进行针对性治疗。
在处理优先级上,首先要解决感染问题
细菌性感染
如果是细菌性感染腹泻,就需要用到相关抗生素治疗。比如说大肠埃希氏菌、沙门氏菌、志贺氏菌等感染,可以考虑β-内酰胺类抗生素,如头孢曲松、拉氧头孢等。
不过需要注意的是,使用抗生素的时候尽量遵医嘱一次性吃到位,如果吃了一天感觉好了就不吃了,没有起到彻底杀菌的作用,则可能出现病情反复,那么这时候也会带来抗生素耐药性问题,即便吃了抗生素药也不一定很快好转。
因此关于抗生素用药需要谨慎,要么不用,要么用到位,尽量避免形成抗生素耐药性问题。如果有进行肠道菌群检测,也可以看到有没有抗生素耐药性问题,如果存在某种抗生素耐药,则可以避免该药物,改用其他抗生素代替。
病毒性感染
如果主要症状是腹泻+呕吐,也可能伴随出现一些腹痛、头痛、发烧、畏寒、肌肉酸痛等情况,则考虑可能是病毒性感染。一般病毒性感染具有自限性。
病毒性感染则需要避免使用抗生素。配合一些补液及益生菌,辅助治疗。
研究表明,鼠李糖乳杆菌GG可减少病毒性腹泻持续时间和每天排便次数。其他包括嗜酸乳杆菌NCFM,可有效增强轮状病毒疫苗效果。
其次,考虑其他功能性问题
肠道感染也是IBS的危险因素,如果是IBS患者,饮食因素可诱发或加重IBS症状。
短期使用利福昔明可以改善IBS的腹痛、腹泻、腹胀症状。洛哌丁胺的随机双盲安慰剂对照研究证实其可以显著降低IBS排便频率。
一些不确定病因的腹泻,比如说腹部绞痛、头痛、持续排出恶臭气体,进食后马上又腹泻,怀疑是否是因为胆汁酸吸收不良引起的腹泻,这时候可能需要配合进行SeHCAT测试、或血清7αC4检测、或粪便胆汁测试等进行相关诊断。一般来说,胆汁酸腹泻在克罗恩病和肠易激综合征患者中比较常见。
医生可能会开出胆汁酸螯合剂来减少胆汁的循环。通常为10-14天。
有些不明原因的腹痛、腹胀、腹泻、各种不适,在进行肠道菌群健康检测后,如果发现存在失调的情况,比如说肠道菌群多样性过低,有益菌缺乏,一些其他有害菌超标,那么需要结合相应的指标去综合判别,纠正可能的诱发因素。
案
例
我们来看一个案例:一名患者50岁,主诉腹泻。

<来源:谷禾健康肠道菌群数据库>
可以看到肠道菌群多样性明显缺乏,且埃希氏菌属明显超标。大肠埃希氏菌在正常情况下对人体无害,但某些菌株也可能引起感染和疾病,导致胃肠道症状,如腹泻、腹痛等。
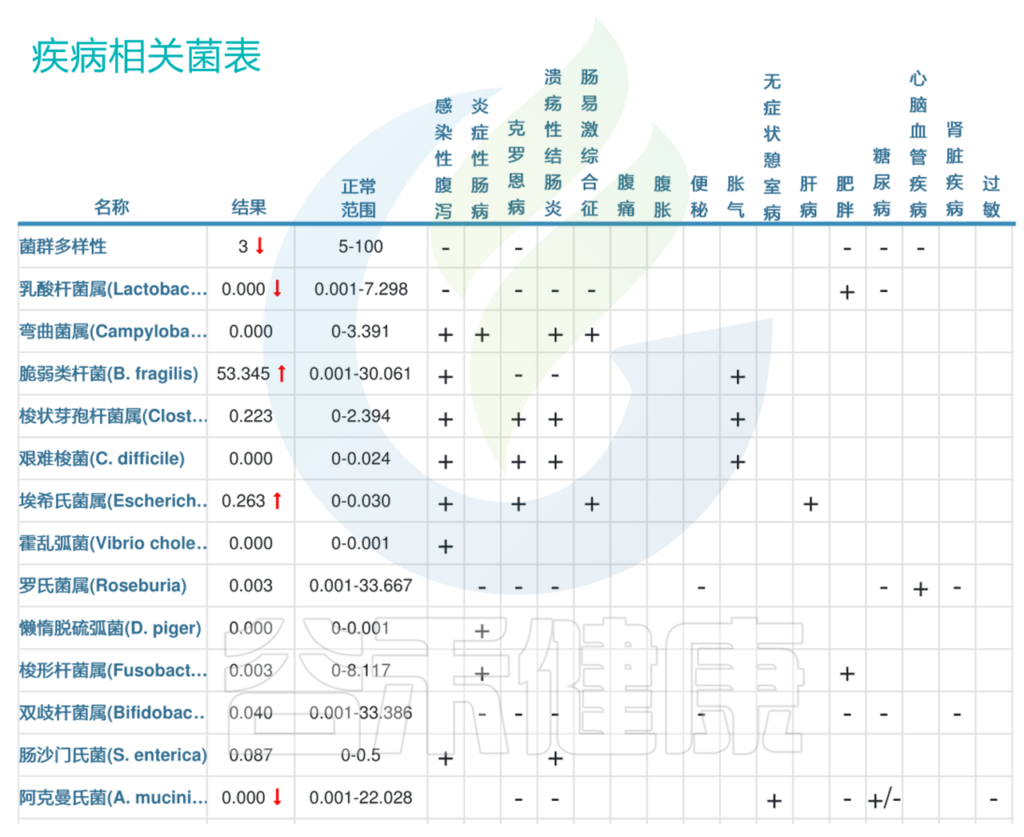
<来源:谷禾健康肠道菌群数据库>
以上我们可以看到最明显的,脆弱拟杆菌53.345,明显超标,脆弱拟杆菌这一行右边第一格显示“+”,说明脆弱拟杆菌丰度与“感染性腹泻”呈正相关,那么脆弱拟杆菌超标也就意味着该患者很有可能存在感染性腹泻。
其他菌群例如第二行乳酸杆菌属,结果0.000,也就是没有检出,低于正常范围。而乳酸杆菌属与“感染性腹泻”、“克罗恩病”、“溃疡性结肠炎”、“肠易激综合征”都呈负相关(都显示“–”)。患者刚好低于正常范围,也就是说乳酸杆菌属低,提示该患者很有可能存在以上这些肠道类疾病。
整体肠道菌群检测结果也与该患者“腹泻”的症状吻合,可以作为临床上的参考。
比如说过敏性腹泻,则应识别过敏源,在过敏源不明确的情况下,应该短期采用限制性食物疗法,排除蛋奶等可能引发过敏的食物,如果在这段时间内症状消失,则可定期有计划地引入单一食物,对于过敏食物进行回避。
在纠正诱发因素后,可以采取措施进行调理,提升免疫力,合理应用微生态制剂,也就到了接下来第三步。
一次腹泻,对于我们肠道来说,就好比打了一场仗,各大菌群忙着争夺领地、占据优势地位,肠道菌群的平衡却遭受了巨大的打击,有益菌可能被削弱,而有害菌则可能过度繁殖,甚至肠粘膜都受损。因此,腹泻后的肠道养护很重要。
我们从两个方面进行养护肠道,营养和菌群。
营 养
腹泻后可以吃什么?
土豆(不带皮),含有维生素B6、维生素C、烟酸和微量矿物质碘等营养成分。不要加黄油那些会刺激肠道的添加物,可以直接吃。
生吃蔬菜可能很难消化。可以通过剥皮、去除种子和彻底煮熟吃更好。
面食,提供膳食纤维和碳水化合物。
燕麦片,很容易消化,并且富含具有治疗作用的抗氧化剂。它还含有维生素 B1、硒和锰,也是可溶性纤维的良好来源。
香蕉,较温和,容易消化,是治疗腹泻的好选择。它们也是钾的良好来源,钾是一种可能因腹泻而流失的重要电解质。
苹果酱,比生苹果更好,因为水果的皮含有不溶性纤维。苹果酱还含有果胶,可以帮助粪便凝固。
腹泻后避免吃什么?
以上只是关于腹泻期间饮食的普适性建议,临床上病人腹泻情况复杂,可能需要根据不同类别的腹泻进行分层管理。
对于 IBS 患者来说,则需额外避免:
对于 胆汁酸腹泻患者来说,其他干预包括:
对于炎症性肠病患者来说,一些干预措施包括:
每个人的身体状况,肠道菌群特征各不相同,并不适用于所有人。比如说有些人吃香蕉后腹泻会更严重,这个就需要避免,根据自身情况而定。
扩展阅读:深度解析 | 炎症,肠道菌群以及抗炎饮食
菌 群
除了上述营养之外,也可以通过对肠道菌群的调理,促进有益菌生长,抑制有害菌过度生长,优化菌群组成;增强肠道屏障功能,加强抵抗病原体入侵后的定植;从根本上改善人体免疫力。
▼ 益生菌
普遍认为,益生菌的功能在于:
一项研究表明,益生菌大肠杆菌抑制其他大肠杆菌菌株,以及病原菌金黄色葡萄球菌和表皮葡萄球菌的生物膜形成。
小鼠研究表明,短双歧杆菌和Bifidobacterium pseudocantenulatum DSM20439 可以抑制肠出血性大肠杆菌产生的志贺毒素的表达。
益生菌的摄入也可以降低住院患者中艰难梭菌相关腹泻和抗生素诱导腹泻的发生率。含益生菌的嗜酸乳杆菌(L.acidophilus)和干酪乳杆菌(L.casei)菌株在预防艰难梭菌相关腹泻方面取得了良好的效果,没有严重的不良反应报告。布拉氏酵母菌也为治疗艰难梭菌相关腹泻提供了很好的前景。
罗伊氏乳杆菌DSM 17938 可能有助于调节肠道微生物群、消除感染以及减轻结肠炎、抗生素相关的胃肠道症状。无论是儿童还是成人,罗伊氏乳杆菌都能缩短急性感染性腹泻的持续时间,并改善结肠炎或炎症性肠病患者的腹痛。
益生菌似乎也能有效治疗痢疾;在接受乳杆菌和双歧杆菌菌株以及一种链球菌菌株组合治疗的患者中,腹泻的血液持续时间和住院时间都显著缩短。
益生菌也可以减轻与抗生素使用有关的肠道微生物群的改变,并可能抑制抗生素耐药性细菌的生长。
▼ 益生元
益生元也可以对腹泻患者产生积极影响。益生元的主要靶标是乳酸杆菌和双歧杆菌。益生元的摄入会增加短链脂肪酸的产生,这对维持肠道屏障的完整性很重要。由于丁酸盐在促进正常细胞增殖和分化方面的作用,它是被认为对肠道健康最有益的短链脂肪酸。
一些益生元,如低聚半乳糖、低聚果糖、菊粉、乳果糖和果胶低聚糖,可以拮抗病原体对上皮细胞的粘附,从而抑制定植并促进肠道病原体的清除。此前的研究表明,益生元可以缩短急性水样腹泻的持续时间,对腹泻有良好的治疗作用。
白术挥发油通过调节肠道菌群缓解急性溃疡性结肠炎。白术挥发油可以有效缓解溃疡性结肠炎小鼠的出血性腹泻、结肠组织损伤和结肠炎症。白术挥发油抑制了潜在的有害细菌(Turicibacter、Parasuterella、Erysipelatoclosstridium)的生长,富集了潜在有益菌(Enterorhabdus、Parvibacter、Akkermansia)。综上,白术挥发油可能作为一种新型益生元缓解溃疡性结肠炎。
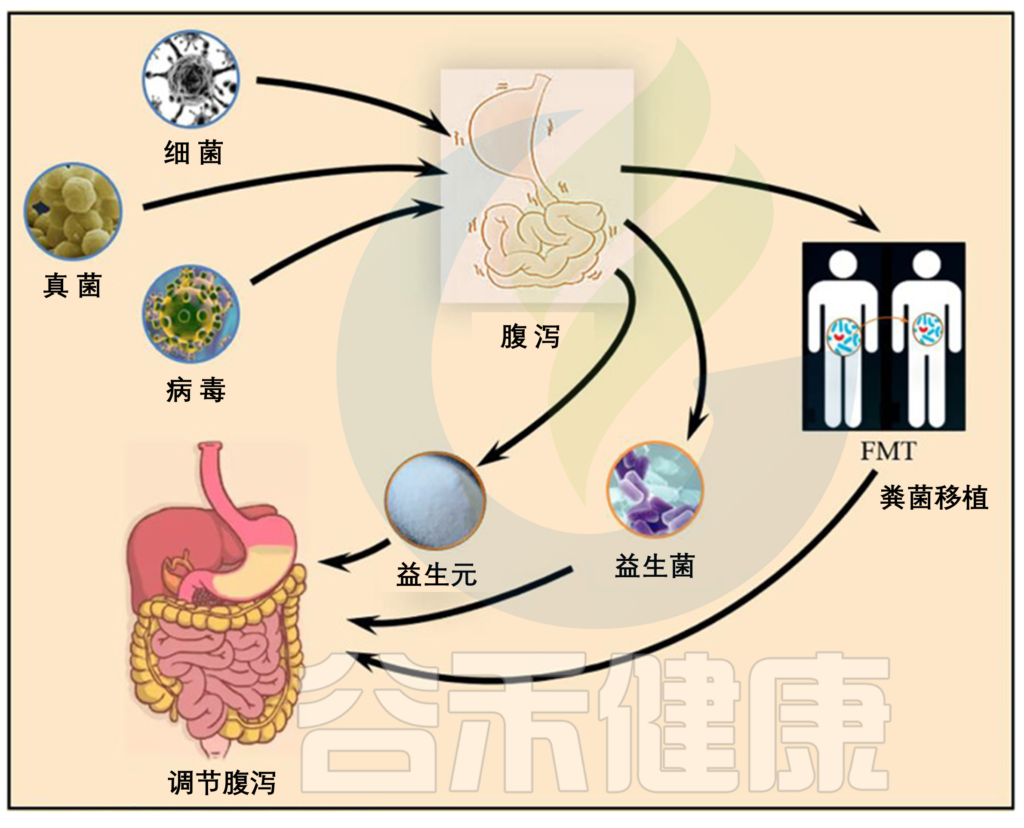
doi.org/10.3389/fcimb.2021.625210
▼ 粪菌移植(FMT)
我们知道一般腹泻用抗生素治疗可见明显好转,但也有些用了抗生素,病情没有好转,反而产生耐药性,形成慢性腹泻,反反复复,那这样的情况就可能需要用到FMT。
在腹泻患者中使用FMT的好处是基于这样一种观点,即通过FMT引入的健康微生物群可以战胜病原体,并将恢复健康肠道微生物组的组成。
在许多研究中,FMT已成功用于治疗难治性艰难梭菌诱导的腹泻。现有文献支持FMT的使用,并将其作为复发性艰难梭菌相关腹泻的安全有效的治疗方法。
此外,FMT在4 周后, IBS患者的生活质量方面显著优于安慰剂(平均差 [MD] = 7.47,95% 置信区间 [CI]:2.05-12.89,p = 0.04)
单臂分析显示,IBS 症状改善的发生率为 57.8%(45.6%-69.9%),IBS-SSS 减少(MD = -74,95% CI:-101.7 至 -46.3)。
一项临床研究表明,FMT可能安全有效地改善慢性放射性肠炎患者的肠道症状和粘膜损伤。此外,FMT 也是缓解急性放射综合症的有效疗法。
扩展阅读:粪菌移植——一种治疗人体疾病的新型疗法
▼ 中 药
越来越多的研究支持:中草药配方通过调节肠道菌群缓解腹泻症状。传统中药方剂,如“四君子汤、痛泻要方、补中益气汤、参苓白术汤”等,广泛用于治疗慢性腹泻。
升姜泻心汤通过改变肠道菌群和肠道代谢稳态来改善抗生素相关性腹泻。升姜泻心汤可以显著提高肠道菌群多样性,显著增加了拟杆菌属的相对丰度(p < 0.01),并降低了埃希氏杆菌属-志贺氏杆菌的相对丰度(p < 0.001)。
升姜泻心汤可以有效预防人类伊立替康引起的迟发性腹泻的发生。增强肠道屏障功能并减轻小鼠结肠炎。改善胆汁酸代谢和氨基酸代谢。
七味白术散(QWBZP)是一种治疗各种原因引起的腹泻的中药配方。七味白术散煎剂和七味白术散总苷,在抗生素相关性腹泻小鼠中,促进乳杆菌的增殖,抑制变形杆菌、梭状芽胞杆菌、真杆菌、Facklamia、埃希氏菌的生长。还增加了脱氧胆酸和 β-鼠胆酸的水平,并降低了牛磺胆酸、牛磺-α-鼠胆酸和牛磺-β-鼠胆酸的水平。乳杆菌是响应七味白术散总苷的关键细菌属。
清化止泻汤可调节肠道微生物群,减少5-羟色胺和血管活性肠多肽,改善腹泻症状。葛根芩连汤具有止泻作用和肠道微生物调节功能。香连丸可能通过恢复肠道菌群和减轻黏膜损伤来治疗抗生素相关性腹泻。经典中草药复方参苓白术可以通过调节结肠腔和粘膜微生物群,恢复肠道离子转运,缓解乳糖诱导的腹泻。
肠安Ⅰ号方治疗IBS-D临床能够明显降低IBS-SSS积分,提高AR应答率,疗效优于安慰剂,临床未发现明确不良反应。
在一项为期28天的双盲、随机、对照初步研究中,香沙六君子汤(XSLJZT)对IBS患者的腹泻(定义为频繁排便)有改善,但对稀便或急便没有改善。
除了中药配方,越来越多的证据表明,中国单一草药,如生姜、人参发酵物、苍术、小檗碱、黄柏提取物还具有止泻特性,恢复不平衡的肠道微生物群。
一项荟萃分析报告称,肠溶薄荷油可改善整体 IBS 症状。
中草药多糖是由单糖组成的天然聚合物,广泛存在于中草药中,是重要的活性成分,作为肠道微生物群的重要能量来源,具有止泻作用。
中草药多糖对慢性腹泻患者肠道微生物群的影响
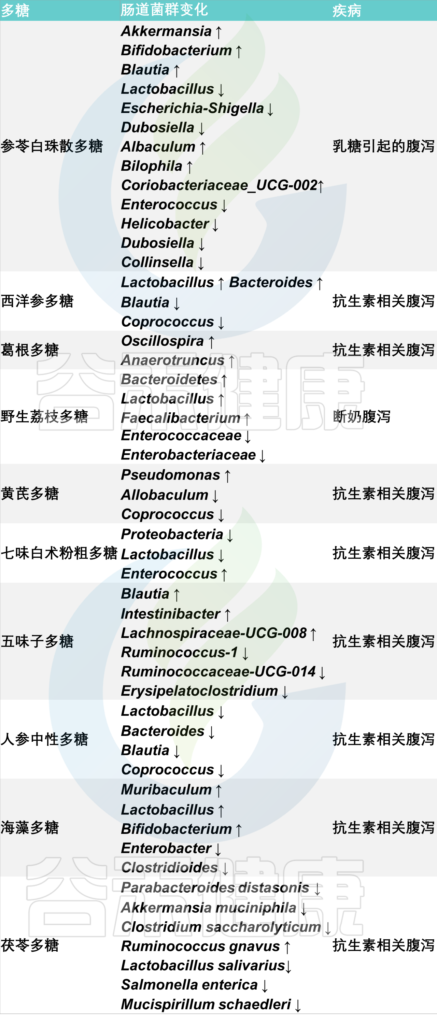
以上这些都是关于腹泻的相关干预措施。
一次看似偶然的腹泻,实际上可能是我们肠道菌群平衡打破的一声警钟。平衡的肠道菌群可以帮助我们抵抗腹泻病原菌的定植。
当腹泻发生后,我们首先应该去寻找腹泻的原因,传统的医学检查往往需要繁琐的流程和耗时的等待以及不确定的结果,而依托于高通量测序和人工智能等技术的肠道菌群检测,则极大地提高了效率和精确性,在医疗手段飞速发展的时代,“快检、便检”已经逐渐开始成为获得关键医学信息的刚需,便于临床医生能够快速判断疾病类型和严重程度,有针对性地制定治疗方案。
结合个体差异,深入分析肠道菌群变化和疾病发展的关联,更好地了解每个人的疾病风险和治疗响应,可以提升治疗效果,缩短治疗时间,提高生活质量,减轻医疗负担,从而有助于将个性化医学推向前沿。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
相关阅读:
关 于 谷 禾
杭州谷禾健康专注于利用高通量测序技术进行肠道菌群和精准健康检测,是国家高新技术企业。
公司于2012年成立于浙江大学校内,核心创始团队主要来自浙江大学。谷禾在高通量基因测序领域独立研发大量独有技术,已授权包括采样,提取和数据库相关国家发明专利6项,此外还有9项软件和作品著作权。并通过ISO19001认证,并建有II级病原微生物P2实验室,并正在申请更全面的资质。公司为150多家国内顶级医院和医疗以及健康相关机构提供科研和检测服务。
经过多年的积累,已完成检测并构建了超过70万例各类人群样本数据库。自主构建了肠道菌群参考注释数据库,同时建立了基于近7万人群的肠道菌群人群分布及正常范围。在Nature Communications,Gut,PNAS等国际顶级学术期刊发表多项研究论文。支持合作50多项目临床开放基金项目,已发表研究成果20多项。
谷禾更大的数据和人工智能平台意味着可以更可靠和准确地反应您当前的菌群和健康状况。
主要参考文献:
Li Y, Xia S, Jiang X, Feng C, Gong S, Ma J, Fang Z, Yin J, Yin Y. Gut Microbiota and Diarrhea: An Updated Review. Front Cell Infect Microbiol. 2021 Apr 15;11:625210.
GBD 2016 Diarrhoeal Disease Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of diarrhoea in 195 countries: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis. 2018 Nov;18(11):1211-1228.
Chung The H, Le SH. Dynamic of the human gut microbiome under infectious diarrhea. Curr Opin Microbiol. 2022 Apr;66:79-85.
Ramamurthy T, Kumari S, Ghosh A. Diarrheal disease and gut microbiome. Prog Mol Biol Transl Sci. 2022;192(1):149-177.
Moshiree B, Heidelbaugh JJ, Sayuk GS. A Narrative Review of Irritable Bowel Syndrome with Diarrhea: A Primer for Primary Care Providers. Adv Ther. 2022 Sep;39(9):4003-4020.
Xue H, Mei C F, Wang F Y, et al. Relationship among Chinese herb polysaccharide (CHP), gut microbiota, and chronic diarrhea and impact of CHP on chronic diarrhea[J]. Food Science & Nutrition, 2023, 11(10): 5837-5855.
抗菌药物临床应用指导原则修订工作组. 抗菌药物临床应用指导原则[M]. 2015: 21-39
Mada PK, Alam MU. Clostridioides difficile Infection. 2023 Jan 23. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 28613708.
Shaikh SD, Sun N, Canakis A, Park WY, Weber HC. Irritable Bowel Syndrome and the Gut Microbiome: A Comprehensive Review. J Clin Med. 2023 Mar 28;12(7):2558.
Holtmann G J, Ford A C, Talley N J. Pathophysiology of irritable bowel syndrome[J]. The lancet Gastroenterology & hepatology, 2016, 1(2): 133-146.
Farrugia A, Arasaradnam R. Bile acid diarrhoea: pathophysiology, diagnosis and management. Frontline Gastroenterol. 2020 Sep 22;12(6):500-507.
Piovezani Ramos G, Camilleri M. Current and Future Therapeutic Options for Irritable Bowel Syndrome with Diarrhea and Functional Diarrhea. Dig Dis Sci. 2023 May;68(5):1677-1690.
Jay P. Sanford. 桑德福抗微生物治疗指南[M]. 范洪伟译. 北北京: 中国协和医科大学出版社. 2013: 71-76
Camilleri M, Boeckxstaens G. Irritable bowel syndrome: treatment based on pathophysiology and biomarkers. Gut. 2023 Mar;72(3):590-599.
Cheng H, Zhang D, Wu J, Liu J, Tan Y, Feng W, Peng C. Atractylodes macrocephala Koidz. volatile oil relieves acute ulcerative colitis via regulating gut microbiota and gut microbiota metabolism. Front Immunol. 2023 May 2;14:1127785.
Wellens J, Vissers E, Matthys C, Vermeire S, Sabino J. Personalized Dietary Regimens for Inflammatory Bowel Disease: Current Knowledge and Future Perspectives. Pharmgenomics Pers Med. 2023 Jan 12;16:15-27.
何礼贤. 国家抗微生物治疗指南[M]. 北北京: 人民卫生出版社. 2012: 196-210
Elhusein AM, Fadlalmola HA. Efficacy of Fecal Microbiota Transplantation in Irritable Bowel Syndrome Patients: An Updated Systematic Review and Meta-Analysis. Gastroenterol Nurs. 2022 Jan-Feb 01;45(1):11-20.
Altomare A, Di Rosa C, Imperia E, Emerenziani S, Cicala M, Guarino MPL. Diarrhea Predominant-Irritable Bowel Syndrome (IBS-D): Effects of Different Nutritional Patterns on Intestinal Dysbiosis and Symptoms. Nutrients. 2021 Apr 29;13(5):1506.
Saviano A, Brigida M, Migneco A, Gunawardena G, Zanza C, Candelli M, Franceschi F, Ojetti V. Lactobacillus Reuteri DSM 17938 (Limosilactobacillus reuteri) in Diarrhea and Constipation: Two Sides of the Same Coin? Medicina (Kaunas). 2021 Jun 23;57(7):643.
人体消化系统包含大约几百到几千种不同的细菌种类,其丰度构成因人而异。
其中少数益生菌乳杆菌属,即嗜酸乳杆菌、植物乳杆菌、短乳杆菌、乳酸乳杆菌、干酪乳杆菌、保加利亚乳杆菌、发酵乳杆菌、鼠李糖乳杆菌特异性产生细胞外蛋白、胞外多糖、细菌素和脂磷壁酸,通过与上皮细胞相互作用影响宿主的健康和生理,增强宿主免疫系统。
在乳杆菌菌种中,植物乳杆菌(L. plantarum)是革兰氏阳性、短杆状、微需氧、耐酸、不形成孢子、不呼吸、低 G + C 含量、异型发酵的乳杆菌群,具有一系列作为发酵剂和防腐剂在食品工业中的应用。
它是一种非孢子形成细菌,可产生有机酸,例如乙酸、琥珀酸和乳酸作为主要代谢物。植物乳杆菌在人类和其他哺乳动物的胃和其他复杂的胆汁盐分泌物中的低缓冲能力下生长。
除了在食品工业中的应用外,肠道微生物植物乳杆菌是一种很有前途的益生菌,可治疗腹泻、高胆固醇和特应性皮炎等。它是如何工作的,它还有哪些其他好处?本文带您了解更多。
植物乳杆菌是一种分布广泛、用途广泛的乳酸菌。它代表了许多食物和饲料的微生物群的一部分,包括乳制品、肉类、鱼类、蔬菜发酵产品(例如,葡萄汁、酸菜、泡菜、酸面团)和青贮饲料;它也是人和动物粘膜(口腔、胃肠道、阴道等)的天然居民。
植物乳杆菌是一种具有抗癌、抗炎、抗肥胖和抗糖尿病特性的抗氧化剂 [ 1 ] .
植物乳杆菌菌株的微观形态图像
DOI:10.1099/ijs.0.65319-0
植物乳杆菌耐受不同范围的盐,尤其是 NaCl 和胆汁盐,pH 值为 4.0-8.0,温度为 28-45°C,并且分别在 37°C 和 pH 7.0 的温度下具有最佳细胞生长。鉴定出的菌株在上消化道中经受了各种生物障碍,例如低 pH 值、裂解酶和胆汁盐。能够利用广泛的糖类,尤其单糖和双糖。此外,淀粉酶和蛋白酶等细胞外酶的产生对其有利。
B族维生素
从生牛奶中分离出的植物乳杆菌能够产生 B 族维生素核黄素( B2 ) 和叶酸(B9 ) [ 2 ].
铁吸收
植物乳杆菌可使健康女性从果汁饮料中吸收的铁增加约 50% [ 3 ].
植物乳杆菌可以使女性对燕麦中铁的吸收提高 100% 以上 [ 4 ].
钙吸收
含有植物乳杆菌的发酵乳表现出更高的钙保留摄取 [ 5 ].
植物乳杆菌是体内的短暂居民。它可以轻松抵御胃酸,并可以完成从补充品进入口腔,到肠道,到结肠,到粪便的完整旅程。植物乳杆菌生长的最佳温度非常接近体温。
植物乳杆菌也是一种强大益生菌,可猛烈攻击体内的致病性有害细菌。通过杀死坏菌,它帮助我们自己的本地细菌变得更强壮,并帮助我们人体更能抵抗外来病原体的入侵。
除了作为增强免疫系统的重要方式之外,人类在所有有记录的人类历史中都食用了大量的植物乳杆菌。
该菌株用于许多食品中,例如:
酵母面包;酸菜;泡菜;发酵食物
注意
植物乳杆菌益生菌补充剂尚未获得国家药监局和FDA的医疗用途批准,可能缺乏可靠的临床研究。为防止罕见的副作用,请在使用益生菌之前咨询权威的医疗建议。
可能有效
1) 腹泻
乳酸菌益生菌在改善与各种疾病相关的腹泻方面表现出很大的希望,包括旅行者腹泻和抗生素相关性腹泻 [ 6、7 ] .
在一项针对 438 名患有抗生素相关性腹泻的儿童的临床试验中,植物乳杆菌益生菌减少了稀便或水样便和腹痛的发生率,而且没有产生不良副作用 [ 7 ].
2) 皮肤健康
在临床试验中,植物乳杆菌显着增加了面部和手部的皮肤水分含量。益生菌组志愿者在第 12 周时皱纹深度明显减少,皮肤光泽度在第 12 周时也有显着改善。益生菌组的皮肤弹性在4 周后改善了 13.17%,在 12 周后改善了 21.73% [ 8 ] .
当作为益生菌服用时,植物乳杆菌改善皮肤水合作用,对人体皮肤具有抗光老化作用[ 9、10 ] .
植物乳杆菌抑制胶原蛋白的降解并促进其合成,减少活性氧 ( ROS ) 的产生 [ 11 ] .
在无毛小鼠中,植物乳杆菌降低了 UVB 诱导的表皮厚度,抑制了水分流失并增加了神经酰胺水平 [ 12 , 13 ] .
特应性皮炎
每天摄入含有热灭活植物乳杆菌的柑橘汁可减轻人类特应性皮炎的症状[ 14 ] .
从泡菜中分离出的植物乳杆菌改善小鼠特应性皮炎[ 15 ] .
3) 溃疡性结肠炎
在多项临床试验中,乳酸菌益生菌已显示出减轻溃疡性结肠炎症状的希望。含有植物乳杆菌的合生元混合物在8周后显着改善了 73 名患者的 UC 症状 [ 16、17 ] .
4) 胆固醇
在许多临床试验中,乳酸菌益生菌降低了胆固醇。在一项针对 60 名高胆固醇志愿者的研究中,含有植物乳杆菌的益生菌在 12 周后将总胆固醇降低了 13.6% [ 18 ] .
在患有糖尿病的大鼠中,植物乳杆菌降低血液甘油三酯和“坏”低密度脂蛋白胆固醇的比率,同时增加“好”高密度脂蛋白胆固醇的水平 [ 19 ] .
摄入植物乳杆菌后,胆固醇升高的小鼠的总血清胆固醇和甘油三酯显着降低 [ 20 ] .
双涂层植物乳杆菌可降低高脂肪饮食小鼠的胆固醇水平 [ 21 ] .
证据不足
研究人员目前正在调查植物乳杆菌是否具有其他健康益处。本节中的潜在益处至少在一项临床试验中产生了积极的结果,但这些研究规模小、相互矛盾或存在其他局限性。出于任何原因补充植物乳杆菌之前,请谨慎。
5) 肥胖
辅以含有植物乳杆菌的富含益生菌的奶酪的低热量饮食降低了患有肥胖症和高血压的俄罗斯成年人的 BMI 和血压[ 22 ].
植物乳杆菌还保护小鼠免受饮食引起的肥胖。这种细菌可降低肥胖小鼠的体重、脂肪量、空腹血糖、血清胰岛素、瘦素水平和促炎标志物 [ 23、24、25 ] .
植物乳杆菌发酵大麦逆转了高脂肪饮食大鼠的葡萄糖耐受不良,改善了升高的胰岛素,降低了甘油三酯和总胆固醇水平 [ 26 ].
植物乳杆菌通过诱导丙氨酸氨基转移酶( ALT )、γ-谷氨酰转移酶 ( GGT )、血浆甘油三酯、总胆固醇浓度、肌酐、尿素和体重的降低,来改善肥胖大鼠的肝功能和泌尿功能 [ 27 ].
6) 血糖
植物乳杆菌降低了绝经后妇女的血糖水平[ 22 ].
含有植物乳杆菌的豆浆具有抗氧化特性,可减少 2 型糖尿病患者的 DNA 损伤[ 22 ].
植物乳杆菌降低小鼠的食物摄入量、血糖水平、糖化血红蛋白水平和瘦素水平。这种细菌还有利于调节胰岛素水平并增加“好”(HDL) 胆固醇 [ 28 ].
植物乳杆菌导致高脂肪饮食小鼠对胰岛素的血糖水平显着降低 [ 29 ].
用植物乳杆菌治疗可有效调节糖尿病大鼠的血糖、激素和脂质代谢 [ 30 ].
植物乳杆菌显着改善糖尿病大鼠的免疫学参数并保护胰腺组织。此外,这种益生菌治疗显着降低了胰腺和血浆脂肪酶活性以及血清甘油三酯和低密度脂蛋白胆固醇率,并增加了高密度脂蛋白胆固醇水平。它还对肝肾功能发挥有效的保护作用 [ 19 ] .
7) 伤口愈合
在一项针对 34 名腿部溃疡患者的小型临床研究中,局部应用植物乳杆菌减少了糖尿病和非糖尿病患者的感染性慢性静脉溃疡伤口细菌负荷、中性粒细胞、凋亡和坏死细胞,并诱导伤口愈合[ 31 ].
8) 牙齿健康
热灭活的植物乳杆菌减少了接受牙周支持治疗的患者的牙周袋深度 [ 32 ].
9) 免疫力
在一项对 171 名成年人进行的临床研究中,植物乳杆菌提高了免疫活性并降低了应激标记物 [ 33 ].
即使是热灭活的植物乳杆菌也会激活人类的先天性和获得性免疫力 [ 32 ].
植物乳杆菌增强免疫抑制小鼠小肠的免疫力[ 34 ].
抗病毒
在感染单纯疱疹病毒 1 型 (HSV-1) 的小鼠中,口服植物乳杆菌显着延缓了感染早期皮肤损伤的发展,并减少了大脑中的病毒数量 [ 35 ].
同样在小鼠中,从发酵的韩国卷心菜中分离出的植物乳杆菌赋予了 100% 的保护作用,防止致命的甲型流感病毒感染,防止显着的体重减轻并降低肺部病毒载量 [ 36 ].
10) 过敏
在一项针对 42 名成年人的临床研究中,植物乳杆菌发酵的柑橘汁改善了日本柳杉花粉症的症状[ 37 ].
在一项细胞研究中,植物乳杆菌降低了大豆粉的过敏性 [ 38 ].
口服植物乳杆菌可减轻小鼠的气道高反应性和过敏反应 [ 39 ].
11) 念珠菌病
在外阴阴道念珠菌病 (VVC) 患者中,植物乳杆菌减少了常规治疗后的阴道不适,并改善了阴道细菌含量和阴道 pH 值 [ 40 ].
在一项临床试验中,使用植物乳杆菌可使外阴阴道念珠菌病复发风险降低三倍 [ 41 ].
植物乳杆菌还在实验室中杀死念珠菌 [ 42 ].
动物和细胞研究(缺乏证据)
没有临床证据支持将植物乳杆菌用于本节所列的任何病症。以下是对现有动物和细胞研究的总结,应指导进一步的研究工作。但是,不应将下列研究解释为支持任何健康益处。
12) 排毒
植物乳杆菌在实验室中减轻镉 (Cd) 在人类肠道细胞和小鼠中诱导的细胞毒性[ 43、44 ].
植物乳杆菌通过减少肠道铝吸收和组织积累,改善肝损伤、肾脏和大脑氧化应激,从而防止小鼠受到铝中毒[ 45 ].
用植物乳杆菌处理可通过增加铜排泄和减少铜在组织中的积累来减轻铜毒性。植物乳杆菌还逆转了铜暴露引起的氧化应激,恢复了 ALT 和AST血液水平并改善了小鼠的空间记忆 [ 46 ].
13) 血管性痴呆
植物乳杆菌发酵豆浆提取物可作为降血压剂和神经保护剂,改善血管性痴呆大鼠的学习和记忆 [ 47 ].
14) 焦虑
长期摄入植物乳杆菌可增加运动活性、多巴胺和血清素水平,同时减少小鼠的焦虑样行为。它还减少了抑郁样行为和炎性细胞因子水平,并增加了遭受早期生活压力的小鼠血清中的抗炎细胞因子水平[ 48、49 ].
15) 心血管健康
血压
植物乳杆菌发酵豆浆提取物可作为大鼠的降血压剂 [ 47 ].
同样在大鼠中,用植物乳杆菌发酵的蓝莓降低了血压并改善了可能指示心血管疾病风险的标志物 [ 50 ].
动脉粥样硬化
来自植物乳杆菌的脂磷壁酸 (LTA)可抑制小鼠促炎细胞因子的产生,并抑制动脉粥样硬化斑块炎症 [ 51 ].
16) 炎症
植物乳杆菌显着降低小鼠和大鼠促炎细胞因子的产生 [ 52 , 53 ]. 它还减轻了氧化应激和肾上腺素水平 [ 52 ].
17) 肝脏健康
用植物乳杆菌治疗大鼠阻塞性黄疸可恢复活跃的肝屏障功能 [ 54 ].
植物乳杆菌可保护小鼠免受氧化应激和肝脏炎症损伤 [ 55 ].
植物乳杆菌减轻了高脂血症小鼠的肝损伤[ 56 ].
补充植物乳杆菌 5 周可恢复患有非酒精性脂肪性肝病 (NAFLD) 大鼠的肝功能,并降低肝脏中的脂肪堆积水平。此外,该细菌显着减少了促炎细胞因子 [ 53 ].
18) 肠道健康
植物乳杆菌减少肠上皮细胞的炎症 [ 57 ].
摄入植物乳杆菌可以抵消肠道中不需要的细菌 [ 3 ].
植物乳杆菌增强了洛哌丁胺诱导的便秘小鼠的胃肠道转运[ 58 ].
溃疡
口服植物乳杆菌可通过抗炎和免疫调节活性改善小鼠的溃疡性结肠炎 [ 59 ].
肠易激综合症
植物乳杆菌可减少肠易激综合征患者的胀气问题和疼痛 [ 60 ].
幽门螺杆菌感染
植物乳杆菌可预防小鼠幽门螺杆菌感染引起的胃粘膜炎症和胃微生物群改变[ 61 ].
植物乳杆菌延缓幽门螺杆菌在大鼠胃中的定植,减轻胃炎症并改善胃组织病理学 [ 62 ].
19) 婴儿成长
植物乳杆菌菌株在慢性营养不良期间维持幼鼠的生长 [ 63 ].
20) 身体耐力
植物乳杆菌显着降低小鼠的体重并增加相对肌肉重量、握力和耐力游泳时间 [ 64 ].
21) 女性生育能力
植物乳杆菌改善了小鼠炎症诱导的不孕症 [ 65 ].
植物乳杆菌增强了自然微生物群落,并导致感染大肠杆菌的小鼠的生育能力恢复[ 66 ].
22) 组胺不耐受
植物乳杆菌可以在实验室环境中降解生物胺。在组胺不耐受的人群中可能值得研究 [ 67 ].
癌症研究
植物乳杆菌增强了肠腺癌小鼠的抗肿瘤免疫反应并延缓了肿瘤形成 [ 68 ].
长期服用植物乳杆菌可预防大鼠患乳腺癌 [ 69、70 ].
植物乳杆菌抑制大鼠结肠癌发生的发展 [ 71 ].
纳米尺寸的植物乳杆菌还在小鼠中表现出抗结直肠癌活性 [ 72 ].
植物乳杆菌显着抑制肝癌细胞、胃癌细胞和结直肠腺癌细胞的增殖[ 73 ].
这些影响尚未在人类受试者中进行过研究。
在大鼠身上没有观察到任何类型的不良反应,即使在大量食用后也是如此。然而,与其他益生菌一样,在器官衰竭、免疫功能低下和肠道屏障机制功能失调的患者中使用可能会导致感染 [ 74 ].
为了避免不良事件,请在使用益生菌之前咨询医生。
尽管这种情况可能很少见,但如果出现以下任何可能与非常严重的副作用相关的体征或症状,请立即寻求医疗帮助:
参考文献:
[1] Arasu MV, Al-Dhabi NA, Ilavenil S, Choi KC, Srigopalram S. In vitro importance of probiotic Lactobacillus plantarum related to medical field. Saudi J Biol Sci. 2016 Jan;23(1):S6-S10.
[2] Li P, Zhou Q, Gu Q. Complete genome sequence of Lactobacillus plantarum LZ227, a potential probiotic strain producing B-group vitamins. J Biotechnol. 2016 Sep 20;234:66-70.
[3] Hoppe M, Önning G, Berggren A, Hulthén L. Probiotic strain Lactobacillus plantarum 299v increases iron absorption from an iron-supplemented fruit drink: a double-isotope cross-over single-blind study in women of reproductive age. Br J Nutr. 2015 Oct 28;114(8):1195-202.
[4] Bering S, Suchdev S, Sjøltov L, Berggren A, Tetens I, Bukhave K. A lactic acid-fermented oat gruel increases non-haem iron absorption from a phytate-rich meal in healthy women of childbearing age. Br J Nutr. 2006 Jul;96(1):80-5.
[5] ergillos-Meca T, Cabrera-Vique C, Artacho R, Moreno-Montoro M, Navarro-Alarcón M, Olalla M, Giménez R, Seiquer I, Ruiz-López MD. Does Lactobacillus plantarum or ultrafiltration process improve Ca, Mg, Zn and P bioavailability from fermented goats’ milk? Food Chem. 2015 Nov 15;187:314-21.
[6] Olek A, Woynarowski M, Ahrén IL, Kierkuś J, Socha P, Larsson N, Önning G. Efficacy and Safety of Lactobacillus plantarum DSM 9843 (LP299V) in the Prevention of Antibiotic-Associated Gastrointestinal Symptoms in Children-Randomized, Double-Blind, Placebo-Controlled Study. J Pediatr. 2017 Jul;186:82-86.
[7] Hilton E, Kolakowski P, Singer C, Smith M. Efficacy of Lactobacillus GG as a Diarrheal Preventive in Travelers. J Travel Med. 1997 Mar 1;4(1):41-43.
[8] Lee DE, Huh CS, Ra J, Choi ID, Jeong JW, Kim SH, Ryu JH, Seo YK, Koh JS, Lee JH, Sim JH, Ahn YT. Clinical Evidence of Effects of Lactobacillus plantarum HY7714 on Skin Aging: A Randomized, Double Blind, Placebo-Controlled Study. J Microbiol Biotechnol. 2015 Dec 28;25(12):2160-8.
[9] Jeong JH, Lee CY, Chung DK. Probiotic Lactic Acid Bacteria and Skin Health. Crit Rev Food Sci Nutr. 2016 Oct 25;56(14):2331-7.
[10] Kim H, Kim HR, Jeong BJ, Lee SS, Kim TR, Jeong JH, Lee M, Lee S, Lee JS, Chung DK. Effects of oral intake of kimchi-derived Lactobacillus plantarum K8 lysates on skin moisturizing. J Microbiol Biotechnol. 2015 Jan;25(1):74-80.
[11] Hong YF, Lee Hy, Jung BJ, Jang S, Chung DK, Kim H. Lipoteichoic acid isolated from Lactobacillus plantarum down-regulates UV-induced MMP-1 expression and up-regulates type I procollagen through the inhibition of reactive oxygen species generation. Mol Immunol. 2015 Oct;67(2 Pt B):248-55.
[12] Ra J, Lee DE, Kim SH, Jeong JW, Ku HK, Kim TY, Choi ID, Jeung W, Sim JH, Ahn YT. Effect of oral administration of Lactobacillus plantarum HY7714 on epidermal hydration in ultraviolet B-irradiated hairless mice. J Microbiol Biotechnol. 2014 Dec 28;24(12):1736-43.
[13] Kim HM, Lee DE, Park SD, Kim YT, Kim YJ, Jeong JW, Jang SS, Ahn YT, Sim JH, Huh CS, Chung DK, Lee JH. Oral administration of Lactobacillus plantarum HY7714 protects hairless mouse against ultraviolet B-induced photoaging. J Microbiol Biotechnol. 2014 Nov 28;24(11):1583-91.
[14] Harima-Mizusawa N, Kamachi K, Kano M, Nozaki D, Uetake T, Yokomizo Y, Nagino T, Tanaka A, Miyazaki K, Nakamura S. Beneficial effects of citrus juice fermented with Lactobacillus plantarum YIT 0132 on atopic dermatitis: results of daily intake by adult patients in two open trials. Biosci Microbiota Food Health. 2016;35(1):29-39.
[15] Won TJ, Kim B, Lee Y, Bang JS, Oh ES, Yoo JS, Hyung KE, Yoon J, Hwang S, Park ES, Park SY, Hwang KW. Therapeutic potential of Lactobacillus plantarum CJLP133 for house-dust mite-induced dermatitis in NC/Nga mice. Cell Immunol. 2012 May-Jun;277(1-2):49-57.
[18] Fuentes MC, Lajo T, Carrión JM, Cuñé J. Cholesterol-lowering efficacy of Lactobacillus plantarum CECT 7527, 7528 and 7529 in hypercholesterolaemic adults. Br J Nutr. 2013 May 28;109(10):1866-72.
[19] Bejar W, Hamden K, Ben Salah R, Chouayekh H. Lactobacillus plantarum TN627 significantly reduces complications of alloxan-induced diabetes in rats. Anaerobe. 2013 Dec;24:4-11.
[20] Yoo JY, Kim SS. Probiotics and Prebiotics: Present Status and Future Perspectives on Metabolic Disorders. Nutrients. 2016 Mar 18;8(3):173.
[21] Jeun J, Kim S, Cho SY, Jun HJ, Park HJ, Seo JG, Chung MJ, Lee SJ. Hypocholesterolemic effects of Lactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice. Nutrition. 2010 Mar;26(3):321-30.
[22] Sáez-Lara MJ, Robles-Sanchez C, Ruiz-Ojeda FJ, Plaza-Diaz J, Gil A. Effects of Probiotics and Synbiotics on Obesity, Insulin Resistance Syndrome, Type 2 Diabetes and Non-Alcoholic Fatty Liver Disease: A Review of Human Clinical Trials. Int J Mol Sci. 2016 Jun 13;17(6):928.
[23] Pothuraju R, Sharma RK, Kavadi PK, Chagalamarri J, Jangra S, Bhakri G, De S. Anti-obesity effect of milk fermented by Lactobacillus plantarum NCDC 625 alone and in combination with herbs on high fat diet fed C57BL/6J mice. Benef Microbes. 2016 Jun;7(3):375-85.
[24] Park JE, Oh SH, Cha YS. Lactobacillus plantarum LG42 isolated from gajami sik-hae decreases body and fat pad weights in diet-induced obese mice. J Appl Microbiol. 2014 Jan;116(1):145-56.
[25] Wu CC, Weng WL, Lai WL, Tsai HP, Liu WH, Lee MH, Tsai YC. Effect of Lactobacillus plantarum Strain K21 on High-Fat Diet-Fed Obese Mice. Evid Based Complement Alternat Med. 2015;2015:391767.
[26] Zhang J, Xiao X, Dong Y, Xu T, Wu F. Dietary supplementation with Lactobacillus plantarum dy-1 fermented barley suppresses body weight gain in high-fat diet-induced obese rats. J Sci Food Agric. 2016 Dec;96(15):4907-4917.
[27] Ben Salah R, Trabelsi I, Hamden K, Chouayekh H, Bejar S. Lactobacillus plantarum TN8 exhibits protective effects on lipid, hepatic and renal profiles in obese rat. Anaerobe. 2013 Oct;23:55-61.
[28] Li X, Wang N, Yin B, Fang D, Jiang T, Fang S, Zhao J, Zhang H, Wang G, Chen W. Effects of Lactobacillus plantarum CCFM0236 on hyperglycaemia and insulin resistance in high-fat and streptozotocin-induced type 2 diabetic mice. J Appl Microbiol. 2016 Dec;121(6):1727-1736.
[29] Sakai T, Taki T, Nakamoto A, Shuto E, Tsutsumi R, Toshimitsu T, Makino S, Ikegami S. Lactobacillus plantarum OLL2712 regulates glucose metabolism in C57BL/6 mice fed a high-fat diet. J Nutr Sci Vitaminol (Tokyo). 2013;59(2):144-7.
[30] Li C, Ding Q, Nie SP, Zhang YS, Xiong T, Xie MY. Carrot juice fermented with Lactobacillus plantarum NCU116 ameliorates type 2 diabetes in rats. J Agric Food Chem. 2014 Dec 10;62(49):11884-91.
[31] Peral MC, Rachid MM, Gobbato NM, Huaman Martinez MA, Valdez JC. Interleukin-8 production by polymorphonuclear leukocytes from patients with chronic infected leg ulcers treated with Lactobacillus plantarum. Clin Microbiol Infect. 2010 Mar;16(3):281-6.
[32] Iwasaki K, Maeda K, Hidaka K, Nemoto K, Hirose Y, Deguchi S. Daily Intake of Heat-killed Lactobacillus plantarum L-137 Decreases the Probing Depth in Patients Undergoing Supportive Periodontal Therapy. Oral Health Prev Dent. 2016;14(3):207-14.
[33] Nishimura M, Ohkawara T, Tetsuka K, Kawasaki Y, Nakagawa R, Satoh H, Sato Y, Nishihira J. Effects of yogurt containing Lactobacillus plantarum HOKKAIDO on immune function and stress markers. J Tradit Complement Med. 2015 Aug 21;6(3):275-80.
[34] Xie J, Yu Q, Nie S, Fan S, Xiong T, Xie M. Effects of Lactobacillus plantarum NCU116 on Intestine Mucosal Immunity in Immunosuppressed Mice. J Agric Food Chem. 2015 Dec 30;63(51):10914-20.
[35] Matsusaki T, Takeda S, Takeshita M, Arima Y, Tsend-Ayush C, Oyunsuren T, Sugita C, Yoshida H, Watanabe W, Kurokawa M. Augmentation of T helper type 1 immune response through intestinal immunity in murine cutaneous herpes simplex virus type 1 infection by probiotic Lactobacillus plantarum strain 06CC2. Int Immunopharmacol. 2016 Oct;39:320-327.
[36] Park MK, Ngo V, Kwon YM, Lee YT, Yoo S, Cho YH, Hong SM, Hwang HS, Ko EJ, Jung YJ, Moon DW, Jeong EJ, Kim MC, Lee YN, Jang JH, Oh JS, Kim CH, Kang SM. Lactobacillus plantarum DK119 as a probiotic confers protection against influenza virus by modulating innate immunity. PLoS One. 2013 Oct 4;8(10):e75368.
[37] Harima-Mizusawa N, Iino T, Onodera-Masuoka N, Kato-Nagaoka N, Kiyoshima-Shibata J, Gomi A, Shibahara-Sone H, Kano M, Shida K, Sakai M, Miyazaki K, Ishikawa F. Beneficial Effects of Citrus Juice Fermented with Lactobacillus plantarum YIT 0132 on Japanese Cedar Pollinosis. Biosci Microbiota Food Health. 2014;33(4):147-55.
[38] Frias J, Song YS, Martínez-Villaluenga C, González de Mejia E, Vidal-Valverde C. Immunoreactivity and amino acid content of fermented soybean products. J Agric Food Chem. 2008 Jan 9;56(1):99-105.
[39] Liu YW, Liao TW, Chen YH, Chiang YC, Tsai YC. Oral administration of heat-inactivated Lactobacillus plantarum K37 modulated airway hyperresponsiveness in ovalbumin-sensitized BALB/c mice. PLoS One. 2014 Jun 17;9(6):e100105.
[40] De Seta F, Parazzini F, De Leo R, Banco R, Maso GP, De Santo D, Sartore A, Stabile G, Inglese S, Tonon M, Restaino S. Lactobacillus plantarum P17630 for preventing Candida vaginitis recurrence: a retrospective comparative study. Eur J Obstet Gynecol Reprod Biol. 2014 Nov;182:136-9.
[41] Palacios S, Espadaler J, Fernández-Moya JM, Prieto C, Salas N. Is it possible to prevent recurrent vulvovaginitis? The role of Lactobacillus plantarum I1001 (CECT7504). Eur J Clin Microbiol Infect Dis. 2016 Oct;35(10):1701-8.
[42] Sharma A, Srivastava S. Anti-Candida activity of spent culture filtrate of Lactobacillus plantarum strain LR/14. J Mycol Med. 2014 Jun;24(2):e25-34.
[43] Zhai Q, Tian F, Zhao J, Zhang H, Narbad A, Chen W. Oral Administration of Probiotics Inhibits Absorption of the Heavy Metal Cadmium by Protecting the Intestinal Barrier. Appl Environ Microbiol. 2016 Jun 30;82(14):4429-40.
[44] Zhai Q, Wang G, Zhao J, Liu X, Narbad A, Chen YQ, Zhang H, Tian F, Chen W. Protective effects of Lactobacillus plantarum CCFM8610 against chronic cadmium toxicity in mice indicate routes of protection besides intestinal sequestration. Appl Environ Microbiol. 2014 Jul;80(13):4063-71.
[45] Yu L, Zhai Q, Liu X, Wang G, Zhang Q, Zhao J, Narbad A, Zhang H, Tian F, Chen W. Lactobacillus plantarum CCFM639 alleviates aluminium toxicity. Appl Microbiol Biotechnol. 2016 Feb;100(4):1891-1900.
[46] Tian F, Xiao Y, Li X, Zhai Q, Wang G, Zhang Q, Zhang H, Chen W. Protective Effects of Lactobacillus plantarum CCFM8246 against Copper Toxicity in Mice. PLoS One. 2015 Nov 25;10(11):e0143318.
[47] Liu TH, Chiou J, Tsai TY. Effects of Lactobacillus plantarum TWK10-Fermented Soymilk on Deoxycorticosterone Acetate-Salt-Induced Hypertension and Associated Dementia in Rats. Nutrients. 2016 May 2;8(5):260.
[48] Liu YW, Liu WH, Wu CC, Juan YC, Wu YC, Tsai HP, Wang S, Tsai YC. Psychotropic effects of Lactobacillus plantarum PS128 in early life-stressed and naïve adult mice. Brain Res. 2016 Jan 15;1631:1-12.
[49] Liu WH, Chuang HL, Huang YT, Wu CC, Chou GT, Wang S, Tsai YC. Alteration of behavior and monoamine levels attributable to Lactobacillus plantarum PS128 in germ-free mice. Behav Brain Res. 2016 Feb 1;298(Pt B):202-9.
[50] Ahrén IL, Xu J, Önning G, Olsson C, Ahrné S, Molin G. Antihypertensive activity of blueberries fermented by Lactobacillus plantarum DSM 15313 and effects on the gut microbiota in healthy rats. Clin Nutr. 2015 Aug;34(4):719-26.
[51] Kim JY, Kim H, Jung BJ, Kim NR, Park JE, Chung DK. Lipoteichoic acid isolated from Lactobacillus plantarum suppresses LPS-mediated atherosclerotic plaque inflammation. Mol Cells. 2013 Feb;35(2):115-24.
[52] Toshimitsu T, Mochizuki J, Ikegami S, Itou H. Identification of a Lactobacillus plantarum strain that ameliorates chronic inflammation and metabolic disorders in obese and type 2 diabetic mice. J Dairy Sci. 2016 Feb;99(2):933-946.
[53] Li C, Nie SP, Zhu KX, Ding Q, Li C, Xiong T, Xie MY. Lactobacillus plantarum NCU116 improves liver function, oxidative stress and lipid metabolism in rats with high fat diet induced non-alcoholic fatty liver disease. Food Funct. 2014 Dec;5(12):3216-23.
[54] Zhang M, Wang XQ, Zhou YK, Ma YL, Shen TY, Chen HQ, Chu ZX, Qin HL. Effects of oral Lactobacillus plantarum on hepatocyte tight junction structure and function in rats with obstructive jaundice. Mol Biol Rep. 2010 Jul;37(6):2989-99.
[55] Peng X, Jiang Y. Protective effects of Lactobacillus plantarum NDC 75017 against lipopolysaccharide-induced liver injury in mice. Inflammation. 2014 Oct;37(5):1599-607.
[56] Wang LX, Liu K, Gao DW, Hao JK. Protective effects of two Lactobacillus plantarum strains in hyperlipidemic mice. World J Gastroenterol. 2013 May 28;19(20):3150-6.
[57] Murofushi Y, Villena J, Morie K, Kanmani P, Tohno M, Shimazu T, Aso H, Suda Y, Hashiguchi K, Saito T, Kitazawa H. The toll-like receptor family protein RP105/MD1 complex is involved in the immunoregulatory effect of exopolysaccharides from Lactobacillus plantarum N14. Mol Immunol. 2015 Mar;64(1):63-75.
[58] Li C, Nie SP, Zhu KX, Xiong T, Li C, Gong J, Xie MY. Effect of Lactobacillus plantarum NCU116 on loperamide-induced constipation in mice. Int J Food Sci Nutr. 2015;66(5):533-8.
[59] Liu YW, Su YW, Ong WK, Cheng TH, Tsai YC. Oral administration of Lactobacillus plantarum K68 ameliorates DSS-induced ulcerative colitis in BALB
/c mice via the anti-inflammatory and immunomodulatory activities. Int Immunopharmacol. 2011 Dec;11(12):2159-66.
[60] Ducrotté P, Sawant P, Jayanthi V. Clinical trial: Lactobacillus plantarum 299v (DSM 9843) improves symptoms of irritable bowel syndrome. World J Gastroenterol. 2012 Aug 14;18(30):4012-8.
[61] Pan M, Wan C, Xie Q, Huang R, Tao X, Shah NP, Wei H. Changes in gastric microbiota induced by Helicobacter pylori infection and preventive effects of Lactobacillus plantarum ZDY 2013 against such infection. J Dairy Sci. 2016 Feb;99(2):970-981.
[62] Thiraworawong T, Spinler JK, Werawatganon D, Klaikeaw N, Venable SF, Versalovic J, Tumwasorn S. Anti-inflammatory properties of gastric-derived Lactobacillus plantarum XB7 in the context of Helicobacter pylori infection. Helicobacter. 2014 Apr;19(2):144-55.
[63] ME, Balmand S, Hudcovic T, Heddi A, Rieusset J, Kozakova H, Vidal H, Leulier F. Lactobacillus plantarum strain maintains growth of infant mice during chronic undernutrition. Science. 2016 Feb 19;351(6275):854-7.
[64] Chen YM, Wei L, Chiu YS, Hsu YJ, Tsai TY, Wang MF, Huang CC. Lactobacillus plantarum TWK10 Supplementation Improves Exercise Performance and Increases Muscle Mass in Mice. Nutrients. 2016 Apr 7;8(4):205.
[65] Bhandari P, Rishi P, Prabha V. Positive effect of probiotic Lactobacillus plantarum in reversing LPS-induced infertility in a mouse model. J Med Microbiol. 2016 May;65(5):345-350.
[66] Bhandari P, Prabha V. Evaluation of profertility effect of probiotic Lactobacillus plantarum 2621 in a murine model. Indian J Med Res. 2015 Jul;142(1):79-84.
[67] Capozzi V, Russo P, Ladero V, Fernández M, Fiocco D, Alvarez MA, Grieco F, Spano G. Biogenic Amines Degradation by Lactobacillus plantarum: Toward a Potential Application in Wine. Front Microbiol. 2012 Apr 2;3:122.
[68] Hu J, Wang C, Ye L, Yang W, Huang H, Meng F, Shi S, Ding Z. Anti-tumour immune effect of oral administration of Lactobacillus plantarum to CT26 tumour-bearing mice. J Biosci. 2015 Jun;40(2):269-79.
[69] Kassayová M, Bobrov N, Strojný L, Kisková T, Mikeš J, Demečková V, Orendáš P, Bojková B, Péč M, Kubatka P, Bomba A. Preventive effects of probiotic bacteria Lactobacillus plantarum and dietary fiber in chemically-induced mammary carcinogenesis. Anticancer Res. 2014 Sep;34(9):4969-75.
[70] Kassayová M, Bobrov N, Strojný L, Orendáš P, Demečková V, Jendželovský R, Kubatka P, Kisková T, Kružliak P, Adamkov M, Bomba A, Fedoročko P. Anticancer and Immunomodulatory Effects of Lactobacillus plantarum LS/07, Inulin and Melatonin in NMU-induced Rat Model of Breast Cancer. Anticancer Res. 2016 Jun;36(6):2719-28.
[71] Kumar RS, Kanmani P, Yuvaraj N, Paari KA, Pattukumar V, Thirunavukkarasu C, Arul V. Lactobacillus plantarum AS1 isolated from south Indian fermented food Kallappam suppress 1,2-dimethyl hydrazine (DMH)-induced colorectal cancer in male Wistar rats. Appl Biochem Biotechnol. 2012 Feb;166(3):620-31.
[72] Lee HA, Kim H, Lee KW, Park KY. Dead Nano-Sized Lactobacillus plantarum Inhibits Azoxymethane/Dextran Sulfate Sodium-Induced Colon Cancer in Balb/c Mice. J Med Food. 2015 Dec;18(12):1400-5.
[73] Wang K, Li W, Rui X, Chen X, Jiang M, Dong M. Characterization of a novel exopolysaccharide with antitumor activity from Lactobacillus plantarum 70810. Int J Biol Macromol. 2014 Feb;63:133-9.
[74] Biljana Novkovic, 11+ Health Benefits of Lactobacillus plantarum (L. plantarum). September 20, 2021. selfhacked