-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康

丁酸弧菌属(Butyrivibrio)是人体的重要菌属,属于厚壁菌门毛螺菌科,毛螺菌科包括了人体很多重要的菌属,与健康紧密相关。该菌最早于1956年被发现,其革兰氏染色呈阴性,但具有非常薄的革兰氏阳性细胞壁结构。
丁酸弧菌属严格厌氧,不产生孢子。目前已知该菌属包含60多种菌株,溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)为其的模式菌种,能够发酵多种糖和纤维。该菌对植物结构(主要是半纤维素)的降解具有特别重要的作用。因此该菌常见于牛和其他反刍动物(如绵羊、山羊、驯鹿)中,可能与经常摄入纤维有关。该菌也存在于人体的胃肠道中,并且研究发现其丰度与纤维摄入量相关。
丁酸弧菌是一种重要的丁酸生产者,其主要通过代谢可溶性多糖以及植物纤维来产生丁酸盐。而丁酸盐具有多种健康益处,会影响维生素的合成,有助于维持肠道上皮,发挥抗炎、抗氧化作用,以及对其他器官的正常功能也存在一定影响。此外,丁酸弧菌通过蛋白质分解(氨是其最主要的氮源)调节体内的氨水平,还能产生细菌素影响其他菌,例如可以抑制多种革兰氏阳性病原菌,以此来调节人体免疫。
由于丁酸弧菌能够产生丁酸盐,目前认为其是一种对人体有益的菌属。并且已经有一些研究发现在病原体感染、2型糖尿病、白塞氏病、婴儿胆汁淤积症、肺动脉高压、银屑病关节炎、肥胖和代谢紊乱、阿尔兹海默病患者中丁酸弧菌(Butyrivibrio)的丰度显著下降。
丁酸弧菌对抗生素比较敏感,因此在使用一些广谱抗生素时可能也会降低其丰度,但是对四环素具体耐药性。由于丁酸弧菌主要代谢纤维和多糖等物质,通过补充富含儿茶素、花青素、原花青素、咖啡酸、绿原酸和芦丁等多酚类物质的水果和蔬菜,或是使用合生元疗法如共同施用枯草芽孢杆菌和L-丙氨酰-L-谷氨酰胺可以提高丁酸弧菌的丰度。
▼1
丁酸弧菌(Butyrivibrio)一般为弯杆状,末端呈锥形或圆形,大小约为0.3~0.8μm×1.0~5.0μm,它们以单链或短链或长链的形式出现,呈螺旋状排列。成对的细胞可能以“S”形排列,有时呈丝状。
不同菌株之间存在相当大的差异。一些菌株的细胞几乎是纺锤形的,而另一些菌株的细胞非常弯曲,可以形成由2到4个细胞组成的螺旋。Butyrivibrio crossotus直径往往比Butyrivbrio fibrisolvens大。
溶纤维丁酸弧菌的电子显微镜照片
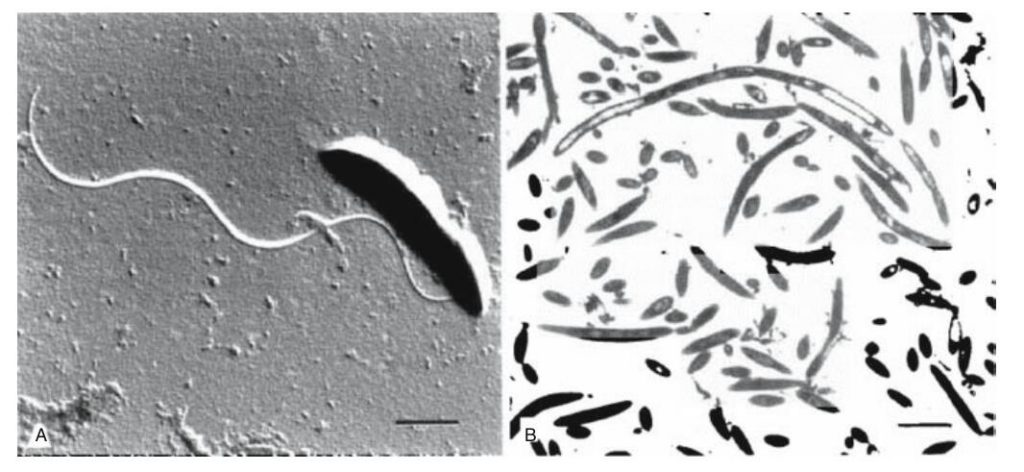
Sewell et al.2008.
✦ 革兰氏染色阴性,但细胞壁属革兰氏阳性类型
丁酸弧菌染色为革兰氏阴性,但缺乏与革兰氏阴性菌相关的三层外膜结构。一些菌株具有非典型的,非常薄的革兰氏阳性细胞壁结构。与正常革兰氏阳性菌壁(约30-50nm)相比,薄壁(约12-20nm)可能是菌株染色反应呈革兰氏阴性的原因。
丁酸弧菌菌株的肽聚糖含有乳酸、葡萄糖胺、丙氨酸、谷氨酸和中氨基戊酸。这些成分符合二氨基苯甲酸直接交联结构。此外,一些丁酸弧菌中还含有少量的甘氨酸和天冬氨酸,表明这些氨基酸可能存在反应。
✦ 菌落的特点
许多丁酸弧菌菌株在含复合碳水化合物琼脂培养基上生长时,表面菌落直径为2至4mm,完整,微凸,半透明,颜色为浅褐色至白色。
一些菌株会产生具有丝状边缘的粗糙菌落,可能代表菌株产生很少的细胞外多糖物质。相比之下,CF型菌株产生大量的胞外多糖,菌落呈粘液状,可见菌落中冒出气泡。
在含纤维素的培养基中,消化纤维素的菌株被纤维素降解区包围,降解区大小和消化程度(通常较弱)都是可变的。当使用含有天然木聚糖的培养基时,也会出现类似的观察结果。
▼2
丁酸弧菌属(Butyrivebrio spp.)是牛和其他反刍动物(如绵羊、山羊、驯鹿)瘤胃中的常见菌,在喂食饲料含量高的动物中数量可观,通常是数量较多的细菌物种之一。它们也存在于这些动物的盲肠和结肠中。
除了反刍动物,丁酸弧菌也存在于各种其他哺乳动物的胃肠道中,并已从兔子、马、人类和猪的粪便或盲肠内容物中分离出来。
还应该注意的是,丁酸弧菌可以在动物以外的环境中生存,并且已经从Napier草食厌氧消化器中分离出菌株。
▼3
通常只有少数细胞表现出运动性。表现出以快速或强烈的振动运动为特征的平移运动。运动是通亚极性鞭毛进行的,鞭毛附着在腋下。
✦ 运动性与生长条件相关
在分离菌株中缺乏运动性通常是由于所采用的培养条件。报道了15株菌株在瘤胃液-葡萄糖-纤维素二糖培养基中生长时不活动,但如果去除纤维素二糖并降低葡萄糖浓度,则所有菌株都可以活动。大多数菌株生长迅速(2小时或更短时间内翻倍),并产生大量酸。由于产酸造成的低pH值可能会抑制运动,也会抑制生长。
▼4
丁酸弧菌是一种严格的厌氧菌,存在于各种家畜和人类的胃肠道系统中。最佳生长温度是37°C,在30°C以下或45°C以上时很少生长或不生长。
它们具有发酵代谢的能力,能够代谢多种碳水化合物,能够利用各种半纤维素和木聚糖。大多数菌株可以降解淀粉和果胶,但很少有菌株可以在纤维素上生长。大多数菌株可以发酵各种可溶性糖、双糖或低聚糖,形成丁酸盐、乳酸盐和醋酸盐。
▸ 代谢多种糖类产生丁酸盐、乙酸盐等产物
几乎所有菌株都能发酵15到20种不同的可溶性碳水化合物,包括葡萄糖、麦芽糖、蔗糖、果糖、纤维素二糖、木糖和阿拉伯糖。
许多研究都集中在特定模式菌株的碳水化合物代谢上。在溶纤维丁酸弧菌ATCC 19171和CE 51中,葡萄糖培养的细胞干物质产量和生长速度高于木糖培养。在后一种培养中,更多的碳被转化为代谢物,而较少的碳被转化为细胞物质。
当同时提供葡萄糖和木糖时,溶纤维丁酸弧菌ATCC 19171和86同时使用两种糖,菌株X1和CE 51表现出典型的先使用葡萄糖生长,而菌株X2D62先缓慢使用木糖直到耗尽,然后快速使用葡萄糖。
此外,菌株CE 51也发生了磷酸烯醇丙酮酸依赖性的葡萄糖磷酸化。溶纤维丁酸弧菌菌株49能迅速水解淀粉,产生葡萄糖、麦芽糖、麦芽糖三糖、麦芽糖四糖和麦芽糖戊二糖。
溶纤维丁酸弧菌发酵葡萄糖的最终产物包括甲酸盐、丁酸盐、乙酸盐以及不同数量的乳酸盐和琥珀酸盐。
然而,菌株之间有相当大的差异:菌株D1和A38显示产生少量乳酸,而菌株49和菌株37产生大量乳酸,但这可以被抑制,而乙酸的存在会产生丁酸盐。
▸ 代谢和降解植物纤维
丁酸弧菌可以利用植物细胞壁的各种成分,丁酸弧菌在各种植物降解中的作用已被广泛研究。
溶纤维丁酸弧菌与其他瘤胃细菌共培养能够降解大麦秸秆、高粱秸秆、苜蓿干草和紫菜干草、棉花秸秆、小麦秸秆和苜蓿。
在不同来源果胶利用的比较研究中,溶纤丁酸弧菌对柑橘果胶的利用效果最好,对甜菜果胶的利用效果优于苹果果胶和苜蓿果胶。与生长在l-阿拉伯糖和d-葡萄糖上的培养物相比,生长在果胶上的溶纤维丁酸弧菌787产生了更多的乙酸和更少的丁酸、乳酸、琥珀酸和氢。
但丁酸弧菌的代谢也被其中一些化合物所抑制。例如,溶纤丁酸弧菌菌株49的生长受到酯连接的阿魏酰和对香豆醇基的限制。酚酸-碳水化合物复合物的生长限制因其水解碳水化合物键的能力而异。
▸ 氨为大多数丁酸弧菌的氮源
大多数丁酸弧菌能以氨为唯一氮源;许多菌株也可以使用尿素。一些菌株还可以使用氨基酸混合物或更复杂的氮源(胰酶、酪蛋白水解物、蛋白胨)。然而,当这些化合物以限制生长的浓度提供时,氨比等量的肽或氨基酸氮支持更多的生长。
多肽不是必需的,但在含氨培养基上经常刺激生长。并且不同的丁酸弧菌可能所需的营养物质不同,据报道菌株E14生长需要蛋氨酸,菌株S2生长需要脂肪酸。添加维生素/酪蛋白水解物混合物或酵母提取物可以刺激菌株TC33在含有葡萄糖的澄清瘤胃液中的生长。最快速的生长是通过添加叶酸、吡哆胺.2HCl和酪蛋白酶解产物的组合获得的。
▸ KEGG 通路
氨基酸的生物合成
抗生素的生物合成
次生代谢产物的生物合成
不饱和脂肪酸的生物合成
生物素代谢
丁酸代谢
2-氧代羧酸代谢
丙氨酸、天冬氨酸和谷氨酸代谢
氨基糖和核苷酸糖代谢
氨酰-tRNA生物合成
花生四烯酸代谢
精氨酸和脯氨酸代谢
精氨酸生物合成
抗坏血酸和醛糖酸代谢
C5-支链二元酸代谢
碳代谢
阳离子抗菌肽(CAMP)耐药性
柠檬酸循环(TCA循环)
氰氨基酸代谢
半胱氨酸和蛋氨酸代谢
D-丙氨酸代谢
D-谷氨酰胺和D-谷氨酸代谢
DNA复制
芳香族化合物的降解
脂肪酸生物合成
脂肪酸降解
脂肪酸代谢
叶酸生物合成
果糖和甘露糖代谢
半乳糖代谢
谷胱甘肽代谢
甘油脂代谢
甘油磷脂代谢
甘氨酸、丝氨酸和苏氨酸代谢
糖酵解/糖异生
乙醛酸和二羧酸代谢
组氨酸代谢
肌醇磷酸代谢
柠檬烯和蒎烯的降解
脂多糖生物合成
赖氨酸生物合成
赖氨酸降解
甲烷代谢
不同环境中的微生物代谢
单环内酰胺生物合成
烟酸和烟酰胺代谢
氮代谢
非核糖体肽结构
新生霉素的生物合成
泛酸和辅酶 A 的生物合成
戊糖和葡萄糖醛酸相互转化
磷酸戊糖途径
肽聚糖生物合成
苯丙氨酸代谢
磷酸转移酶系统(PTS)
聚酮糖单元生物合成
卟啉和叶绿素代谢
丙酸代谢
蛋白质输出
嘌呤代谢
嘧啶代谢
丙酮酸代谢
RNA降解
RNA聚合酶
核黄素代谢
硒化合物代谢
淀粉和蔗糖代谢
链霉素生物合成
硫代谢
硫磺中继系统
牛磺酸和亚牛磺酸代谢
萜类化合物主链的生物合成
硫胺素代谢
色氨酸代谢
酪氨酸代谢
缬氨酸、亮氨酸和异亮氨酸的生物合成
缬氨酸、亮氨酸和异亮氨酸降解
万古霉素耐药性
维生素B6代谢
β-丙氨酸代谢
▼5
丁酸弧菌于1956被首次发现,当时只提出了一个物种,即溶纤维丁酸弧菌(Butyrivibrio fibrisolvens),这也是丁酸弧菌的模式菌种。
目前主要的丁酸弧菌有三个菌种,溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)、Butyrivibrio crossotus和Butyrivibrio hungatei。
▸ 溶纤维丁酸弧菌为模式菌种
溶纤维丁酸弧菌细胞呈革兰氏阴性,但细胞壁很薄,具有革兰氏阳性的超微结构。葡萄糖培养基中的生长变化从均匀的浑浊到絮状或粒状沉积物。37°C时生长良好,一般在45°C时生长,但在30°C时生长较慢。在22以下或50°C以上时没有生长。
溶纤维丁酸弧菌是正常瘤胃菌群中的一种非致病性成员,并且能够产生丁酸盐,被认为对人体健康有益。
DNA的G+C (摩尔%)是42
模式菌株:ATCC 19171
菌株将葡萄糖或纤维素二糖作为能量来源,氨基酸混合物和铵盐作为氮源,矿物质,B族维生素和半胱氨酸等营养物质也会影响生长。氨基酸混合物通常促进生长,醋酸酯也能刺激生长。
▸ Butyrivibrio crossotus
Butyrivibrio crossotus是从人类粪便或直肠内容物中分离出来的,目前还不知道是否具有致病性。
细胞形态与属描述中呈现的相同,只有少数菌株在厌氧培养的血琼脂板上生长。除非存在可发酵的碳水化合物,否则在蛋白胨酵母提取物肉汤中生长很差。
最佳生长温度是37°C,在30°C时生长缓慢,有些菌株可以在45°C时生长。
DNA G+C (摩尔%):37
模式菌株:ATCC 29175
▸ Butyrivibrio hungatei
Butyrivibrio hungatei,以美国微生物学家罗伯特·e·亨盖特(Robert E. Hungate)命名,他在20世纪60年代分离出了类似的菌株。
细胞形态与属描述相同,由单极或近极鞭毛运动的。可以在39°C无氧环境生长,但在25°C时无法生长,在45°C时生长受限。
色氨酸、尿素和明胶不被利用。不表现出显著的纤维水解或蛋白水解活性,主要利用寡糖和单糖作为生长底物。
可以产生α-半乳糖苷酶、α-阿拉伯糖苷酶、苯丙氨酸芳基酰胺酶和亮氨酸芳基酰胺酶。未检测到淀粉酶、木聚糖酶、β-内切葡聚糖酶、层粘连酶、果胶水解酶、蛋白酶或DNA酶活性。
DNA G+C (摩尔%):44.8
模式菌株:JK 615 (= DSM 14810 = ATCC BAA-456).
▸ 丁酸弧菌的其他菌种
对丁酸弧菌菌株16S rDNA基因的系统发育研究揭示了12种rRNA类型,形成了三个不同谱系。下图给出了这些组的详细视图。
不同丁酸弧菌群的详细组成
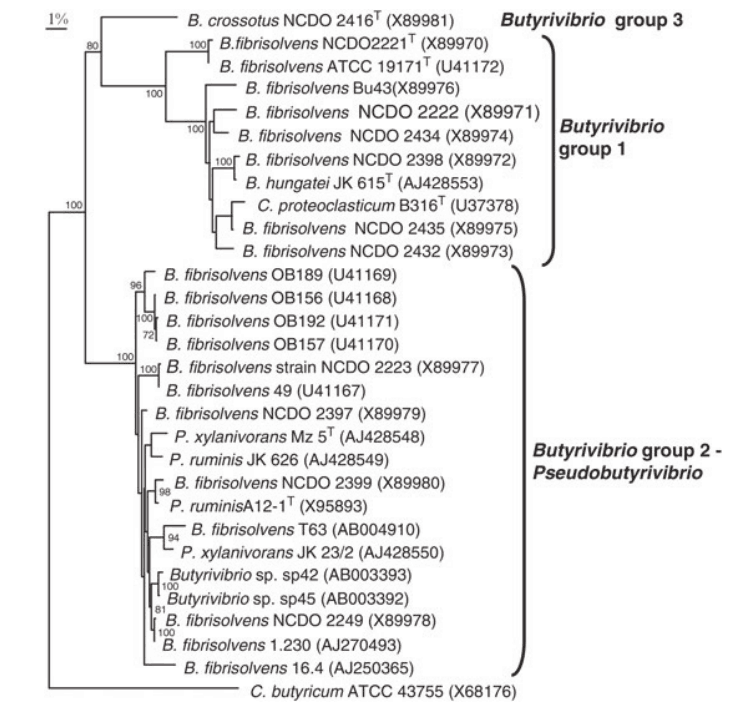
DOI: 10.1002/9781118960608.gbm00640.
核糖体RNA1 – 7型形成第一组,其中rRNA 1型(包括溶纤维丁酸弧菌型菌株)是最外围的。16S rDNA序列与2-7型rRNA序列相似性为93-94%,与2-7型rRNA序列相似性为96-98.5%。
除溶纤维丁酸弧菌外,至少报道了13个不同的丁酸弧菌基因型群,下面给出了属于这些组的菌株的概述。
根据遗传信息将菌株划分为不同的丁酸弧菌群
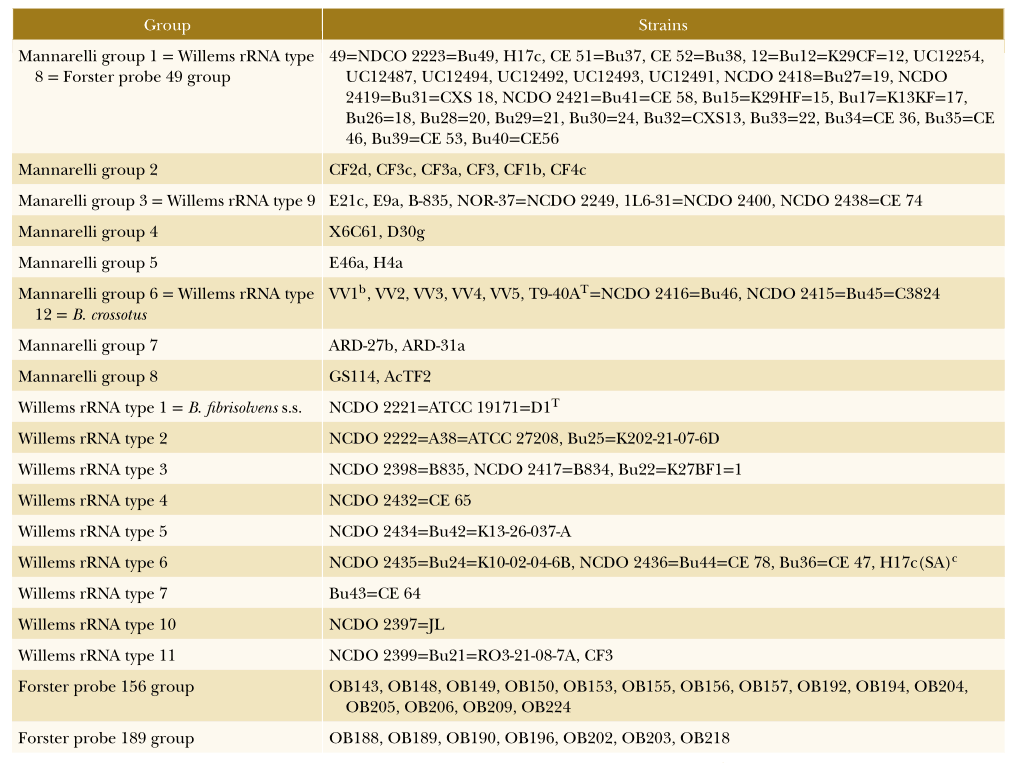
DOI: 10.1002/9781118960608.gbm00640.
目前已知的致病菌种有以下几种:
Butyrivibrio sp AE3009
Butyrivibrio sp XPD2006
Butyrivibrio sp NC2007
▼6
▸ 对大部分影响细胞壁合成的抗生素敏感
溶丁酸弧菌菌株对高水平的萘啶酸(一种DNA旋切酶抑制剂,30-500 μg/ml)具有耐药性。它们通常对许多其他抗生素敏感,特别是那些影响细胞壁合成的抗生素,如β-内酰胺类、头孢菌素和杆菌肽。5株瘤胃溶纤丁酸弧菌对离子载体和蛋白质合成抑制剂非常敏感,但对阿霉素不敏感。
它们对碳水化合物代谢抑制剂和解偶联剂相对不敏感,对盐碱霉素、金霉素和杆菌肽的敏感性各不相同。
▸ 对四环素具有耐药性
溶纤维丁酸弧菌中存在两种类型的四环素耐药基因:一种是非传染性的,其序列与肺炎链球菌tet(o)相同;另一种是传染性耐药基因tet(W)。该基因的DNA GC含量高于其他溶纤丁酸弧菌基因,类似的序列也存在于其他瘤胃厌氧菌中,表明最近在瘤胃细菌之间发生了属间转移。
▼7
许多溶纤维丁酸弧菌菌株(从羊、鹿和牛中分离出的菌株超过50%)具有抗菌活性,可能是由于它们产生不同的抑制化合物。
▸ 可以产生一些细菌素
来自牛瘤胃的溶纤维丁酸弧菌菌株JL5产生一种细菌素,这种细菌素可以抑制多种革兰氏阳性菌,如专门氨基酸发酵的粘连梭菌和嗜氨梭菌,并可能在体内调节氨的产生中发挥作用。
此外,菌株AR10的细菌素样活性是由于单个肽与先前报道的细菌素没有同源性。菌株OR79产生类似细菌素的活性,具有广谱活性。氨基酸序列比较表明,这些分子代表一种新型抗生素。
▼8
丁酸弧菌通过代谢植物纤维素和其他碳水化合物,产生丁酸等短链脂肪酸,为宿主提供能量。同时,丁酸弧菌还能影响其他菌株的生长,包括促进和抑制作用。以下是丁酸弧菌对其他菌株生长影响作用的总结:
▸ 可以增强以下菌属的生长:
Bacteroidales
Bacteroides
Odoribacter
Peptococcaceae
Bacteroidales
Bacteroides
Odoribacter
Peptococcaceae
Bacteroidales
Bacteroides
Odoribacter
Peptococcaceae
▸ 可以抑制以下菌属的生长:
向上滑动阅览
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Porphyromonas
Prevotella
Clostridium
Clostridiales incertae sedis
Clostridiales Family XIII. Incertae Sedis
Blautia
Coprococcus
Dorea
Lachnospiraceae
Ruminococcaceae
Ruminococcus
Dialister
Campylobacteraceae
Erysipelotrichaceae
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Porphyromonas
Prevotella
Clostridium
Clostridiales incertae sedis
Clostridiales Family XIII. Incertae Sedis
Blautia
Coprococcus
Dorea
Lachnospiraceae
Ruminococcaceae
Ruminococcus
Dialister
Campylobacteraceae
Erysipelotrichaceae
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Porphyromonas
Prevotella
Clostridium
Clostridiales incertae sedis
Clostridiales Family XIII. Incertae Sedis
Blautia
Coprococcus
Dorea
Lachnospiraceae
Ruminococcaceae
Ruminococcus
Dialister
Campylobacteraceae
Erysipelotrichaceae
▸ 受到以下菌属的抑制作用
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Bacteroidales
Bacteroides
Porphyromonadaceae
Odoribacter
Parabacteroides
Porphyromonas
Prevotella
Rikenellaceae
Alistipes
Turicibacter
Streptococcus
Clostridiales
Catabacteriaceae
Clostridium
Clostridiales incertae sedis
Peptoniphilus
Clostridiales Family XIII. Incertae Sedis
Lachnospiraceae
Blautia
Lachnospiraceae
Coprococcus
Dorea
Eubacterium
Lachnobacterium
Lachnospira
Roseburia
Lachnospiraceae
Peptococcaceae
Ruminococcaceae
Ruminiclostridium
Acetivibrio
Eubacterium
Faecalibacterium
Oscillospira
Ruminococcus
Acidaminococcus
Dialister
Phascolarctobacterium
Veillonella
Rubrivivax
Alcaligenaceae
Oxalobacter
Bilophila
Desulfovibrio
Campylobacteraceae
Enterobacteriaceae
Escherichia
Erysipelotrichaceae
Erysipelotrichaceae
Holdemania
Akkermansia
丁酸弧菌(Butyrivibrio)是一种重要的微生物,广泛分布于人体和反刍动物的胃肠道中,对胃肠道生态系统的健康和功能发挥着至关重要的作用。
在众多生理功能中,产生丁酸盐等短链脂肪酸和共轭亚油酸的能力尤为关键。以下是对丁酸弧菌产生丁酸盐进而对健康影响的总结性描述:
▼1
✦ 维持肠道厌氧环境,减少病原体的定值
结肠细胞利用丁酸产生能量,从而增加上皮氧消耗。因此,产丁酸细菌的存在有助于维持肠道的厌氧环境,从而进一步防止机会性需氧病原体(如沙门氏菌和大肠杆菌)的定植。
✦ 产生具有广谱抗菌活性的肽
丁酸还调节cathelicidins的产生,cathelicidins 是一种参与哺乳动物先天免疫并对潜在肠道病原体表现出广谱抗菌活性的多聚阳离子肽。
✦ 增强巨噬细胞的抗菌活性
丁酸通过抑制 HDAC 来调节固有层中的结肠巨噬细胞,并限制促炎性IL-12和IL-6的产生,以及脂多糖刺激的巨噬细胞产生的抗菌一氧化氮。
丁酸通过代谢物增强巨噬细胞的 GPCR 独立的抗菌活性,一项研究表明,在微生物丁酸存在下生长的巨噬细胞上调了抗菌蛋白钙卫蛋白的表达,但降低了抗炎 IL-10 的表达。此外,微生物丁酸可显著增强巨噬细胞消除潜在病原体(如肠道沙门氏菌和柠檬酸杆菌)的能力。
因此,丁酸可增强肠道对侵入性病原体的防御能力,而不会引起组织损伤性炎症或过度反应。
产丁酸的微生物群在肠道中的动态作用
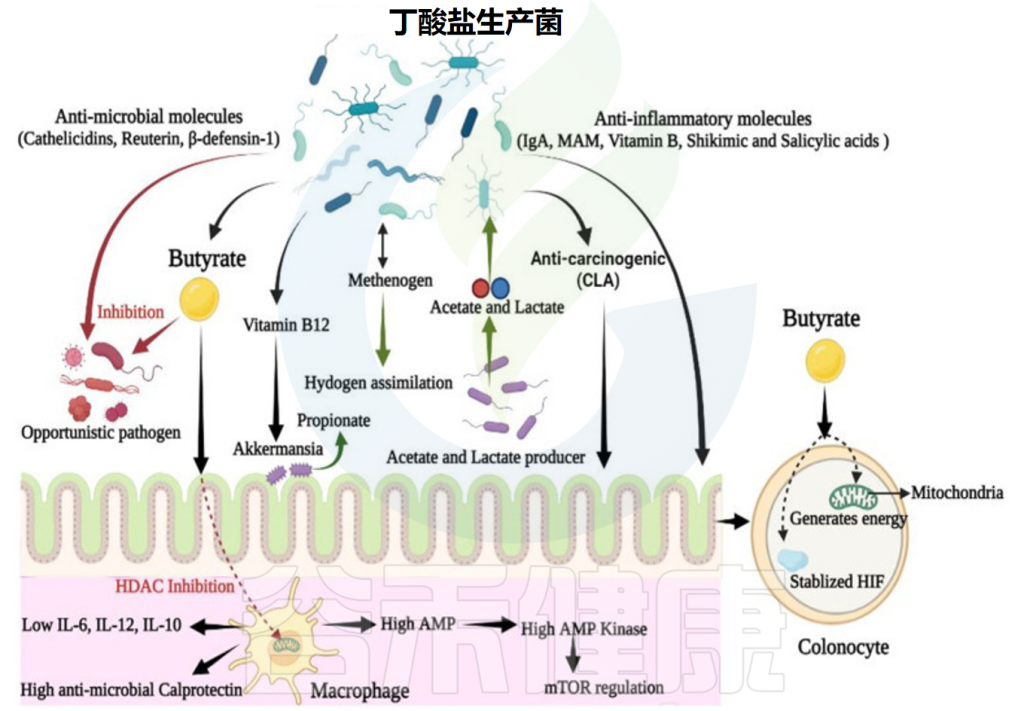
Singh V,et al.Front Microbiol.2023
▼2
体外和体内研究表明,丁酸生产者参与维生素生物合成,特别是维生素B复合物的生物合成。维生素B复合物是各种代谢活动中必需的辅助因子,也与调节宿主的免疫稳态有关。
健康的肠道屏障对于维生素的吸收至关重要,许多脂溶性维生素(如维生素A、D、E和K)需要通过肠道吸收才能进入血液循环。丁酸盐通过促进肠道健康,间接地支持了维生素的吸收过程。
▼3
肠上皮是一种单层结构,外覆黏液层,是抵御肠道病原体的第一道防线。肠上皮细胞通过紧密连接相互连接。肠上皮含有分泌黏液的杯状细胞,这些细胞通过分泌黏液提供屏障保护,黏液还充当免疫球蛋白IgA和抗菌肽的储存器。
✦ 增强粘液的形成
丁酸弧菌是人体肠道中的重要丁酸生产者,它通过增加杯状细胞分化与粘蛋白糖基化相关的基因表达来增强粘液形成。
临床研究表明,霍乱患者口服抗性淀粉(一种丁酸前体)后迅速康复。此外,肠道细菌产生的丁酸会加速肠道上皮细胞中线粒体依赖的氧消耗,从而稳定 缺氧诱导因子(HIF)。丁酸本身也会抑制降解 HIF 的 HIF-脯氨酰羟化酶。稳定化的HIF调节紧密连接蛋白claudin-1、MUC2表达和抗菌肽β防御素-1的生成。
✦ 调节肌动蛋白结合蛋白
丁酸还通过诱导抗炎细胞因子 IL-10RA 依赖性抑制 claudin-2 蛋白来加强肠上皮细胞屏障,而 claudin-2 蛋白在紧密连接处形成旁细胞通道并增加肠道通透性。
最近的一项研究还证明了丁酸在调节肌动蛋白结合蛋白突触蛋白(SYNPO)中的作用,该蛋白在肠上皮紧密连接中表达,对肠屏障完整性至关重要。
✦ 促进肠道蠕动,缓解便秘
另外,肠道中的丁酸一方面可以促进胃肠肌肉的收缩能力,增强胃肠的蠕动;另一方面还可以促进神经递质的传递,以此来促进胃肠蠕动,缓解便秘问题。
▼4
✦ 肠道炎症患者中的丁酸弧菌减少
在小鼠中开展的结肠炎研究证实,产生丁酸的丁酸弧菌群减少,肠道中丁酸水平降低,这导致了需氧肠杆菌科细菌的扩张,这是肠道菌群失调的常见标志。
研究表明,溃疡性结肠炎患者肠道中产丁酸的丁酸弧菌数量减少。另一方面,据报道, 丁酸弧菌的培养上清液对小鼠模型中的IBD(克罗恩病) 和结肠炎有效。
✦ 增强IL-10抗炎细胞因子,减少促炎细胞因子
微生物丁酸作为配体参与抗炎反应,通过芳烃受体(AhR)和各种G蛋白偶联受体(如GPR109a、GPR43 和 GPR41)来减轻炎症并维持肠道稳态。
AhR和GPR是转录因子,激活后可控制各种免疫调节剂的转录机制。AhR通过增强抗炎IL-10分泌B细胞和Th2细胞,同时减少促炎Th1和Th17细胞,发挥抗炎作用。
丁酸激活的GPR109a促进Treg细胞分化,增强产生抗炎IL-10的Th2细胞和血浆IL-10水平,进而抑制促炎性IL-17。GPR43降低CD4 T 细胞增殖并限制促炎性细胞因子(如IL-17和IL-22)的分泌。
▼5
✦ 提高谷胱甘肽的水平
生物体处于应激状态时,体内积累大量未能被消除的活性氧,破坏氧化还原平衡,导致DNA、脂质和蛋白质受到破坏,机体物理屏障受损。丁酸能够提高细胞内谷胱甘肽(一种内源性抗氧化剂清除剂)的水平。
一项首次利用人体研究丁酸盐对于氧化作用影响的实验开展,结果表明丁酸盐处理结肠后,促进了肠粘膜中还原性谷胱甘肽表达通路的进行,还原性谷胱甘肽的含量显著提高。
✦ 影响酶促抗氧化系统
丁酸还可以通过影响酶促抗氧化系统达到抗氧化作用。在日粮中添加适量丁酸钠,其血浆中超氧化物歧化酶和过氧化氢酶的含量显著高于对照组,并且增强了机体免疫能力。然而丁酸对于机体的抗氧化作用从根本上说是源自对基因和蛋白的调控。
Nrf-2是抗氧化反应基因的重要调节因子,肠道内的丁酸通过静脉门转移到肝脏,在肝脏中激活Nrf-2并通过AMPK激活或抑制HDAC诱导Nrf-2在细胞中的表达;另外,丁酸还可以抑制Keap1蛋白(Nrf-2的一种胞质抑制因子)的表达,以此维持氧化还原平衡。
▼6
丁酸生产者丁酸弧菌与各种肠器官轴相关,例如肠脑、肠肺、肠肝、肠道、肾脏和肠心脏轴。在这种复杂的关系中,丁酸弧菌充当微生物调节剂,并通过其代谢物丁酸盐发挥作用。
✦ 与精神状态如抑郁相关
如前所述,丁酸充当AhR的配体,使丁酸生产者成为肠脑轴中的相关群落。研究已经确定了产生丁酸的丁酸弧菌的抗抑郁作用以及它们在抑郁症个体中的减少。
✦ 丁酸盐的减少与肺部疾病风险增加相关
研究还证实了肠肺轴,因为研究发现肠道菌群失调与哮喘和肺部疾病的发生密切相关。据报道,婴儿肠道微生物多样性降低会增加哮喘和传染性呼吸道疾病的风险。特别是,肠道中产丁酸菌丰度的减少与过敏症和哮喘风险的增加密切相关。
此外,在流感等病毒感染期间,丁酸盐通过GPCR41受体增强肺中的Ly6C-单核细胞,这些单核细胞分化为替代激活的巨噬细胞(AAM),通过限制中性粒细胞进入呼吸道,减轻肺部的免疫病理反应。
✦ 产丁酸菌株可抑制肝脏炎症和氧化应激
肠道微生物群也参与肠肝轴,因为肝脏大约70%的血液供应来自肠道,甚至在慢性肝病期间门静脉和肝循环中存在较高的微生物脂多糖(LPS)水平。丁酸可维持肠道屏障的完整性,并抑制LPS的流入。在小鼠研究中,发现以三丁酸甘油酯形式的丁酸补充剂可有效缓解酒精引起的肝损伤。
酒精引起的菌群失调会显著减少厚壁菌门和毛螺菌科的成员,其中产丁酸的属(如Butyrivibrio)的数量较少。一项基于大量人类群体的研究(n =1148)也发现,产丁酸的丁酸弧菌菌株可抑制非酒精性脂肪肝病(NAFLD)中的氧化应激和肝脏炎症指标。
✦ 减少心血管疾病风险,降低血压
蛋白质发酵的代谢物,如胆碱、磷脂酰胆碱和肉碱,被肠道微生物代谢为三甲胺,三甲胺在肝脏中通过含黄素的单加氧酶(FMO)进一步转化为氧化三甲胺(TMAO)。已知 TMAO 会导致慢性肾病(CKD)并诱发心血管疾病,如动脉粥样硬化和冠心病。
而丁酸可以通过刺激含 apoA-IV 的脂蛋白的分泌,通过逆向胆固醇转运降低循环胆固醇。此外,丁酸还能增强肠道分泌胰高血糖素样肽-1(GLP-1),从而降低血压。
近年来的研究表明,肠道微生物群的平衡与疾病或健康状况密切相关,丁酸弧菌在不同疾病中的丰度会发生变化。
我们通过查阅和整理相关研究,将丁酸弧菌(Butyrivibrio)在不同疾病中的丰度变化总结在下面。
感染患者中的丰度较低

丁酸盐产生菌水平较低与人群严重感染风险增加存在关联。因感染住院的参与者中,Veillonella和链球菌的相对丰度更高,而丁弧菌相(Butyrivibrio)对丰度较低。未因传染病住院的受试者具有较高水平的专性厌氧菌,如Butyrivibrio。
2型糖尿病患者中的丰度较低

几种细菌(如Butyrivibrio和Faecalibacterium)和参与纤维降解的酶(如木聚糖酶EC3.2.1.156)与纤维摄入呈正相关,与流行的2型糖尿病(T2D)呈负相关。
通过对一项11394名参与者的队列研究发现,膳食纤维摄入量与丁酸弧菌(Butyrivibrio)和普拉梭菌(Faecalibacterium)等肠道细菌,以及吲哚丙酸和3-苯基丙酸等代谢产物相关,这些细菌及代谢产物又与较低的2型糖尿病风险关联。
在白塞氏病患者中丁酸弧菌减少

在患有白塞氏病(BD)的患者中,放线菌门、乳杆菌科和双歧杆菌属的肠道微生物群相对丰度增加。而超巨型巨单胞菌、丁酸弧菌、婴儿链球菌和Filifactor属的相对丰度显著减少。
Eggerthella lenta、Acidaminococcus物种、Lactobacillus mucosae、Bifidobacterium bifidum、Lactobacillus iners、Streptococcus物种和Lactobacillus salivarius的相对丰度在白塞氏病患者中显著增加。而与BD患者相比,正常个体中Megamonas hypermegale、Butyrivibrio、Streptococcus infantis和Filifactor物种的相对丰度显著增加。
在PICRUSt的功能注释分析中,研究发现白塞氏病患者中普遍存在戊糖磷酸途径和肌苷单磷酸生物合成的基因功能。数据表明白塞氏病患者中的肠道微生物改变了核酸和脂肪酸的合成。
婴儿胆汁淤积症中丰度降低

本研究结果显示,在属的水平上,婴儿胆汁淤积症(IC)组婴幼儿的瘤胃球菌属、丁酸弧菌属、产粪真杆菌属、粪杆菌属、毛螺菌科的丰度均显著降低。先前的研究表明,瘤胃球菌和丁酸弧菌参与胆汁酸羟基的氧化和熊去氧胆酸的生成,而产粪真杆菌属中含有胆盐水解酶(BSH),影响胆汁酸的代谢。
差异菌属与代谢物的相关性分析进一步显示,瘤胃球菌和丁酸弧菌与α-亚麻酸呈负相关,且研究发现IC患者的差异代谢物中α-亚麻酸代谢产物和亚油酸代谢产物含量丰富。亚麻酸的代谢产物二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)通过提高ALT和AST活性,减轻肝细胞炎症反应和肝脏脂肪沉积,从而减轻儿童非酒精性脂肪性肝病的症状。
但婴儿胆汁淤积症(IC)患者肝细胞功能受损,影响亚麻酸在肝脏的代谢和DHA的合成,导致代谢产物蓄积,可能加重肝细胞异常炎症反应。
婴儿胆汁淤积症患者应早期加强肠内营养和氨基酸摄入
因此,婴儿胆汁淤积症(IC)患者应早期加强肠内营养和氨基酸摄入,减少长链脂肪酸摄入,增加短链和中链脂肪酸摄入比例,改善肝功能和营养状况,减轻肝脏负担,促进营养吸收和肠道菌群稳态的逆向调控。
肺动脉高压患者中减少
肺动脉高压(PAH)是一种以肺血管压力和阻力升高为特征的疾病,是由肺小动脉的增殖、外源性和纤维化重塑引起的。
在PAH患者肠道菌群中,产生三甲胺(TMA)/氧化三甲胺(TMAO)的细菌增加,但产生丁酸盐和丙酸盐的细菌减少,具体包括粪球菌(Coprococcus)、丁酸弧菌(Butyrivibrio) 、真杆菌(Eubacterium)、阿克曼氏菌(Akkermansia)、拟杆菌(Bacteroides)和毛螺菌(Lachnospiraceae)。
代谢紊乱和肥胖人群中减少
研究发现肥胖与宿主肠道菌群组成存在关联。肥胖患者肠道中微生物多样性降低、厚壁菌门与拟杆菌门比值(Firmicutes:Bacteroidetes)增加。
而较低的丁酸弧菌丰度与代谢紊乱和肥胖有关。这暗示了丁酸弧菌可能在体重管理和代谢健康中发挥作用。较高水平的丁酸弧菌可能有助于防止体重增加。
银屑病关节炎患者中减少
纽约大学的研究人员发现,银屑病关节炎患者的特定细菌类型水平较低,包括阿克曼氏菌、瘤胃球菌和丁酸弧菌。
阿尔兹海默症患者中减少
阿尔茨海默病除了其他清醒症的思维之外,海默组中丁酸合成细菌的种类(例如丁酸弧菌属Butyrivibrio和真细菌属 Eubacteria)有所减少。
✦ 补充多酚、儿茶素、花青素等益生元
补充益生元对丁酸弧菌丁酸生产者有积极影响,因为它们将益生元代谢为丁酸。不可消化的膳食纤维通常用作益生元,但其他生物活性分子,如多酚,也可以作为益生元产生丁酸。多酚干预显著增加了丁酸生产者如丁酸弧菌和瘤胃球菌科成员的丰度。
在其他多酚中,儿茶素、花青素和原花青素作为益生元的影响更为明显,因为它们增加了丁酸弧菌和粪杆菌属的丰度。
据报道,咖啡酸、绿原酸和芦丁等其他酚类化合物也能增加微生物丁酸的产生。此外,不同益生元的微生物可及性在丁酸生产者之间也存在差异;因此,施用不同的益生元可以选择性地丰富特定的丁酸生产者。
以下食物中含有较多的多酚等物质:
水果:颜色较深的水果当中多酚含量比较高,如樱桃、李子、蓝莓、草莓、李子等,平时可以多吃这些水果补充多酚类物质;
蔬菜:蔬菜中含有一定的多酚,比较常见的有卷心菜、香菜、胡萝卜、洋葱、菠菜等,紫甘蓝中的多酚含量偏高,适当吃能为机体补充多酚类物质,还能身体提供维生素等多种营养,维持身体健康;
全谷类:比较常见的粗粮食物,包括小麦、黑麦、燕麦等,里面都有多酚的成分,平时适当吃对身体健康有帮助,能快速补充多酚;
豆类:比如黄豆、豌豆等,里面含有天然的类黄酮成分以及多酚,都是对人体有益的营养物质;
其他食物:包括坚果类,如核桃、山核桃、栗子、亚麻籽等,里面的多酚化合物属于天然植物代谢物,进入人体之后能发挥一定的作用。黑巧克力中也含有多酚类物质,主要是可可豆中的天然多酚含量比较高。
✦ 补充合生元也能促进丁酸弧菌的丰度
除益生元外,还可以使用合生元疗法来促进肠道产生丁酸。合生元含有益生元和益生菌的组合,它们的协同作用比单独使用益生元和益生菌更为突出。
用枯草芽孢杆菌DSM 32315 和L-丙氨酰-L-谷氨酰胺进行合生元治疗可以增加主要丁酸生产菌,如普拉梭菌(F.prausnitzii)和丁酸弧菌(Butyrivibrio),从而增加丁酸水平。
另一项研究报道了在富含纤维的酸奶中使用合生元后,产生丁酸的丁酸弧菌丰度增加。
丁酸弧菌属(Butyrivibrio)是一类在人体肠道微生物群中占有重要地位的细菌,它们属于革兰氏阴性厌氧菌,能够产生丁酸,作为肠道细胞的主要能量来源,促进肠道屏障的完整性,调节免疫反应,以及抑制炎症。
在谷禾的大人群数据库中,丁酸弧菌属的检出率为35.58%,表明它在人群中的分布较为普遍。然而,在某些疾病状态下,该菌的丰度可能会降低,这可能与疾病的发生发展有关。例如,肠道炎症性疾病、肥胖、糖尿病等情况下,丁酸弧菌属的丰度可能会受到影响。
丁酸弧菌属的代谢特性使其能够利用纤维素和氨,这意味着富含纤维的食物(如蔬菜、水果、全谷物)和高蛋白食物(如肉类、豆类)可能有助于增加其丰度。此外,多酚类化合物(存在于许多植物性食物中)也可能对丁酸弧菌属的生长有积极影响。
在谷禾的检测报告中,如果能够看到丁酸弧菌属的丰度高低,结合相关的研究和文献,可以进一步了解其在健康中的作用和生理代谢机制。例如,高丰度的丁酸弧菌属可能与更好的肠道健康、更低的炎症水平和更稳定的肠道屏障功能相关。
总之,丁酸弧菌属作为人体重要的产丁酸菌之一,其丰度的变化可能与多种健康状况有关。通过饮食调整和生活方式的改变,可能有助于维持或增加其在肠道微生物群中的丰度,从而促进肠道健康。
主要参考文献
Wang Z, Peters BA, Yu B, Grove ML, Wang T, Xue X, Thyagarajan B, Daviglus ML, Boerwinkle E, Hu G, Mossavar-Rahmani Y, Isasi CR, Knight R, Burk RD, Kaplan RC, Qi Q. Gut Microbiota and Blood Metabolites Related to Fiber Intake and Type 2 Diabetes. Circ Res. 2024 Mar 29;134(7):842-854.
Singh V, Lee G, Son H, Koh H, Kim ES, Unno T, Shin JH. Butyrate producers, “The Sentinel of Gut”: Their intestinal significance with and beyond butyrate, and prospective use as microbial therapeutics. Front Microbiol. 2023 Jan 12;13:1103836.
Jin M, Cui J, Ning H, Wang M, Liu W, Yao K, Yuan J, Zhong X. Alterations in gut microbiota and metabolite profiles in patients with infantile cholestasis. BMC Microbiol. 2023 Nov 18;23(1):357.
Pidcock SE, Skvortsov T, Santos FG, Courtney SJ, Sui-Ting K, Creevey CJ, Huws SA. Phylogenetic systematics of Butyrivibrio and Pseudobutyrivibrio genomes illustrate vast taxonomic diversity, open genomes and an abundance of carbohydrate-active enzyme family isoforms. Microb Genom. 2021 Oct;7(10):000638.
Onohuean H, Agwu E, Nwodo UU. A Global Perspective of Vibrio Species and Associated Diseases: Three-Decade Meta-Synthesis of Research Advancement. Environ Health Insights. 2022 May 18;16:11786302221099406.
Rodríguez Hernáez J, Cerón Cucchi ME, Cravero S, Martinez MC, Gonzalez S, Puebla A, Dopazo J, Farber M, Paniego N, Rivarola M. The first complete genomic structure of Butyrivibrio fibrisolvens and its chromid. Microb Genom. 2018 Oct;4(10):e000216.
Sengupta K, Hivarkar SS, Palevich N, Chaudhary PP, Dhakephalkar PK, Dagar SS. Genomic architecture of three newly isolated unclassified Butyrivibrio species elucidate their potential role in the rumen ecosystem. Genomics. 2022 Mar;114(2):110281.
Kelly WJ, Leahy SC, Altermann E, Yeoman CJ, Dunne JC, Kong Z, Pacheco DM, Li D, Noel SJ, Moon CD, Cookson AL, Attwood GT. The glycobiome of the rumen bacterium Butyrivibrio proteoclasticus B316(T) highlights adaptation to a polysaccharide-rich environment. PLoS One. 2010 Aug 3;5(8):e11942.

谷禾健康
花青素-肠道微生物群-健康轴
经常听到一些专家在介绍食品或保健品时说富含花青素,那么究竟什么是花青素?对我们的健康又有何益处?
花青素是在植物组织中发现的天然水溶性色素,水果、蔬菜、花卉中的呈色物质大部分与之有关,是类黄酮的一个亚类,迄今为止已鉴定出700多种结构不同的花青素。
花青素是一种重要的营养素,具有多种生物活性和保健作用,如抗氧化、抗炎、抗癌、降血压、降血糖、保护视力及心血管健康。
花青素在消化过程中还会影响肠道中的细菌代谢。花青素及其衍生物还通过调节肠道屏障功能和有益细菌的定植来促进肠道健康,从而更好地抵御病原体,改善营养代谢和整体免疫反应。
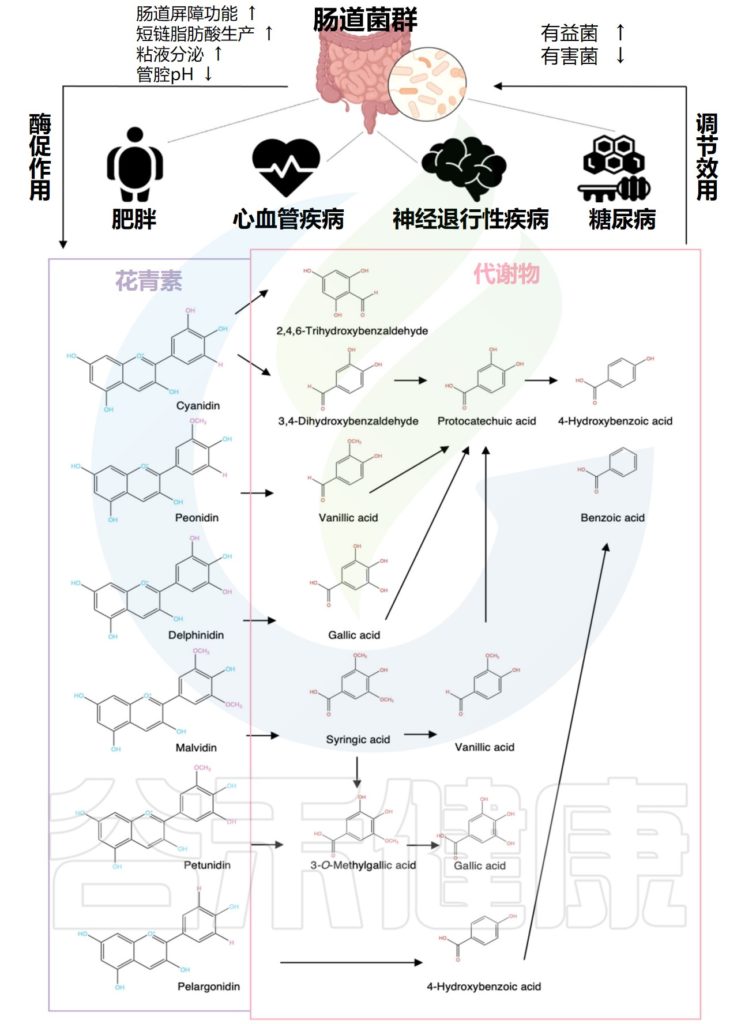
在本文中,谷禾简要介绍了不同类型的花青素,它们常见的饮食来源和通过胃肠道(包括胃、小肠和结肠)的吸收和代谢。
本文还总结了膳食花青素对健康的直接影响,以及肠道微生物群作为“媒介”时的影响。花青素-微生物的相互作用可能成为肥胖、2型糖尿病、心血管疾病、神经退行性疾病、炎症性肠病、癌症、慢性肾脏病和骨关节炎等疾病的治疗新途径。
目录
1.常见的花青素及膳食来源
2.膳食花青素在人体内的吸收和代谢
3.花青素对肠道微生物群的影响
4.花青素-微生物群对肥胖的改善作用
5.花青素-肠道菌群对糖尿病的影响
6.花青素改善心血管疾病
7.花青素降低神经退行性疾病风险
8.花青素对其他疾病的影响
9.日常补充膳食花青素的一些建议
花青素又称花色素,是自然界一类广泛存在于植物中的水溶性天然色素,是花色苷水解而得的有颜色的苷元。
水果、蔬菜、花卉中的主要呈色物质大部分与之有关。在植物细胞液泡不同的PH值条件下,花青素使花瓣呈现五彩缤纷的颜色。
▼
已知现有的花青素多达几百种,食物中重要的有6种,即天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、牵牛花色素和锦葵色素。
花青素具有2-苯基苯并吡喃结构,具有完全不饱和的C环和3位的羟基。
植物性食物中主要花青素的结构
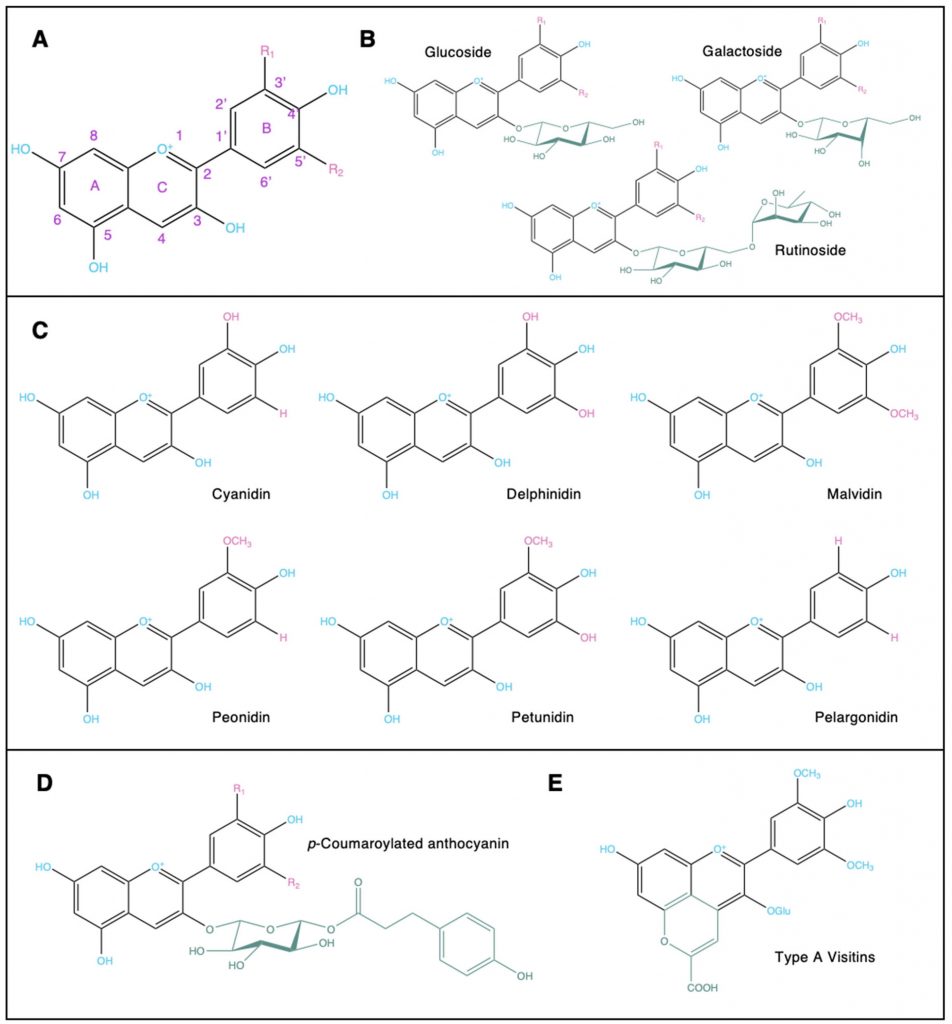

Liang A,et al.Crit Rev Food Sci Nutr.2023
(A)花青素中的2-苯基苯并吡喃骨架 (B)附着在糖基化花青素上的常见糖部分 (C)植物性食物中常见的花青素 (D)酰化花青素 (E)吡喃花青素
▼
植物性食品中花青素的浓度和组成高度依赖于植物品种、生长区域、植物部位、加工方法和测量方法。
花青素在各种红色、紫色和蓝色水果(如浆果、石榴、血橙和红梅)中含量丰富,这些水果代表了人类饮食中花青素的主要摄入。
常见水果中的花青素
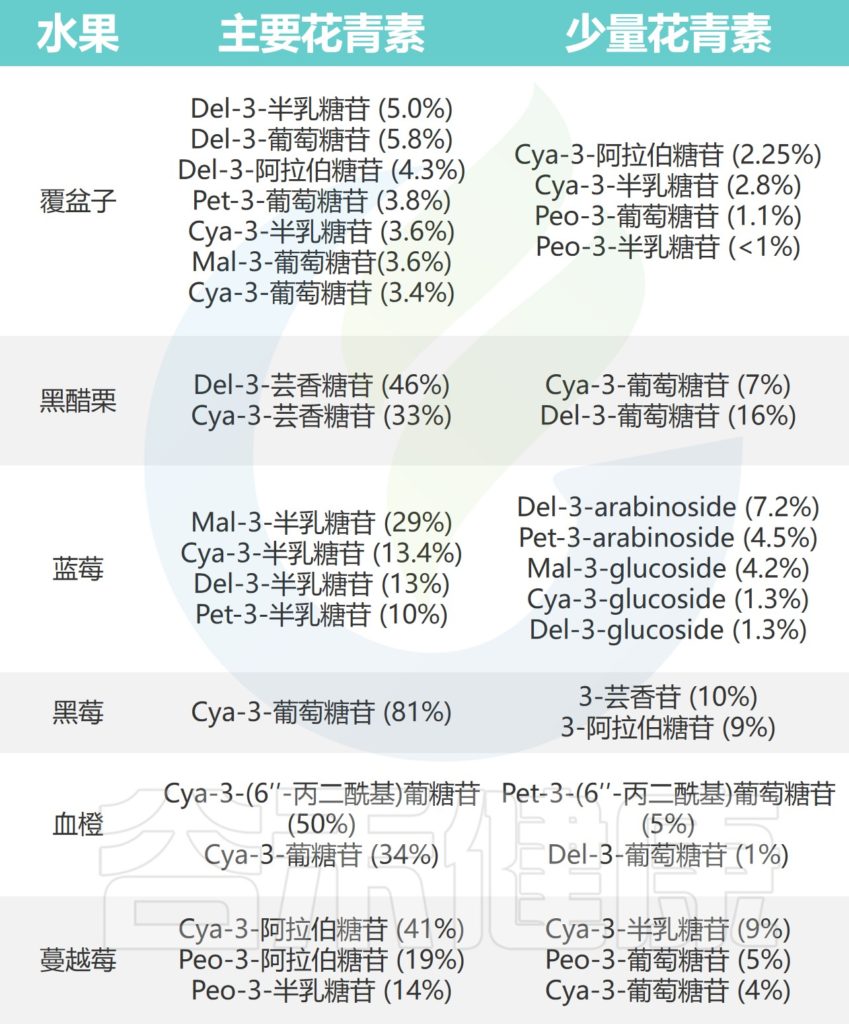
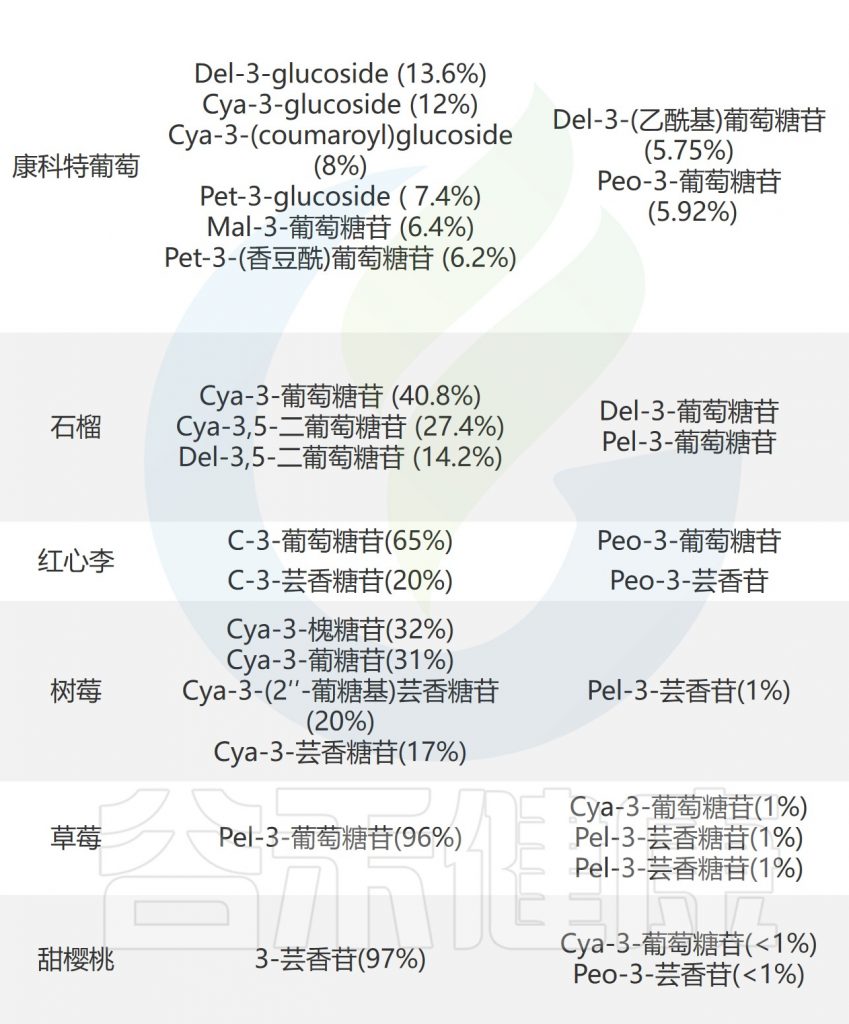

Liang A,et al.Crit Rev Food Sci Nutr.2023
•花青素在不同酸碱度下颜色不同
花青素在水果中根据pH条件,它会显示红色(pH<3)、紫色(pH=7-8)及蓝色(pH>11)。
例如飞燕草色素通常存在于花朵和葡萄中,它们提供蓝紫色,而天竺葵色素为许多浆果和水果提供橙色和红色,包括树莓、草莓和石榴。
•酰化花青素具有更强的耐热性和耐光性
酰化花青素是通过糖基和有机酸的乙酰化酯键得到的,进一步扩大了食品中花青素的多样性。常见的酰化酸包括脂肪酸(乙酸、丙二酸、苹果酸、草酸和琥珀酸)和环状酸(对香豆酸、咖啡酸、芥子酸、没食子酸和阿魏酸)。
在葡萄中鉴定出酰化花青素,在黑胡萝卜、红薯和红甘蓝中发现了肉桂酸酰化的花青素。在红萝卜中发现了多达12种酰化花青素。
酰化花青素在加工过程中表现出更强的耐热性和耐光性,因此被广泛用作食品工业中的着色剂。
•吡喃花青素具有更强的抗氧化能力
吡喃花青素是另一组具有额外吡喃环的花青素,主要在红酒的酒精发酵和陈酿过程中产生。少量吡喃花青素天然存在于血橙、草莓和黑加仑等水果中。
吡喃花青素的主要类别包括A型和B型视黄素、甲基吡喃花青素、羟基苯基吡喃花青素和黄烷基吡喃花青素。
相较于单体花青素,吡喃花青素,在更大范围的pH条件下保持其颜色,这是因为额外的吡喃环可以防止亲核攻击和无色甲醇碱的形成。
吡喃花青素在二氧化硫漂白和热降解过程中也具有更大的稳定性,并且相对于单体花青素具有更强的抗氧化能力。
由于这些原因,吡喃花青素作为颜料和生物活性剂广泛用于食品加工。
膳食花青素是指可以通过饮食摄入的一类花青素,广泛存在于深红色、紫色或蓝色蔬菜水果中,如葡萄、蓝莓、紫甘蓝、紫薯、黑枸杞等。
膳食花青素的代谢和治疗活性取决于其生物可及性(可从食物基质中获得的量)和生物利用度(在人体肠道中的吸收)。这受到许多因素的影响,包括化学结构、与食物基质的相互作用、其他膳食化合物的存在以及个体遗传学和生理学差异。
★ 不同结构的花青素消化率存在差异
例如,具有双糖部分的糖基化花青素相对于单葡萄糖苷和苷元更耐消化。酰化花青素的消化率低于非酰化化合物,主要是因为极性降低和酰基的阻碍。吡喃花青素和聚合物花青素在刺激消化过程中更稳定。
花青素及其衍生物在人体内的消化吸收发生在胃、小肠和大肠中。
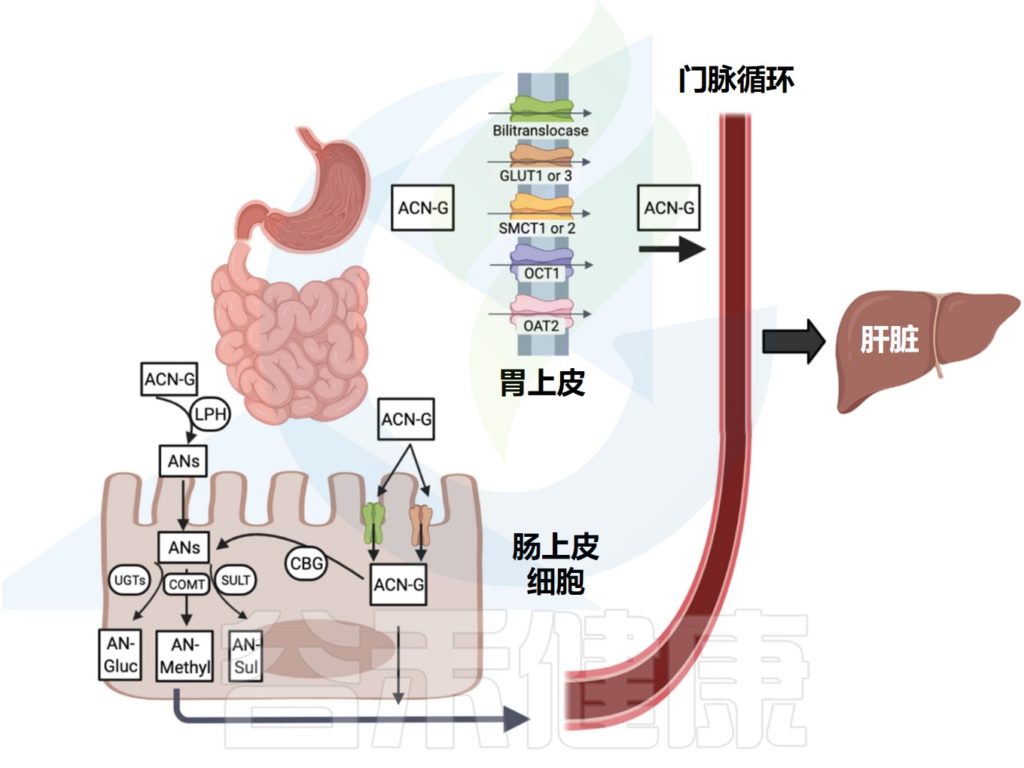
Liang A,et al.Crit Rev Food Sci Nutr.2023
▼
食用食物后第一个吸收花青素的部位是胃,在胃中,一小部分花青素穿过胃细胞屏障(大部分以完整的糖基化形式),并在血浆中检测到。
在胃内,花青素保持相对稳定,在大鼠胃肠道研究期间,从流出物中可回收总摄入花青素的75-79%,在体外研究期间可回收75-88%。
✦胃吸收效率受膳食成分影响
胃吸收效率也受到膳食成分的影响,在高葡萄糖 (>40mM)存在的情况下,花青素通过胃细胞屏障的摄取速率显著降低。
✦参与胃中花青素代谢的蛋白
胃胆转位酶是一种膜蛋白载体,可将完整的花青素转运穿过胃屏障。花青素的糖苷部分优先满足双转位酶提供的结构规格,因此无需去糖基化即可被吸收。
后来,葡萄糖转运蛋白GLUT1和GLUT3也参与了胃对花青素的摄取。花青素中的A环和C环以及葡萄糖部分在与人类GLUT1和GLUT3载体的跨膜结合中起重要作用。
其他参与花青素在胃中吸收的转运蛋白包括单羧酸转运蛋白(SMCT1和SMCT2)和有机阳离子/阴离子转运蛋白(OCT1和OAT2)。
胃以前被认为是花青素吸收而非代谢的部位,直到最近在胃上皮细胞中发现结合酶活性才证实了胃的代谢功能。
此外,红酒中花青素在体外消化(使用胃MKN-28和肠道Caco-2细胞)过程中代谢物malvidin-3-O-葡糖苷酸的存在提供了花青素在胃内代谢的证据。
▼
空肠(小肠中部)是花青素吸收的主要部位。花青素在小肠内的吸收通过膜转运蛋白促进的被动扩散或主动转运发生。
✦花青素的主动转运吸收
与胃吸收类似,完整的糖基化花青素被肠上皮细胞内的转位酶和葡萄糖转运蛋白(SGLT1和GLUT2)吸收。
SGLT1转运蛋白是一种在肠细胞顶端表面发现的钠-葡萄糖共转运蛋白1,而GLUT2转运蛋白是主要在上皮细胞基底外侧膜上发现的促进载体。这两种转运蛋白都与花青素的葡萄糖部分相互作用,并负责基于葡萄糖的花青素的肠道吸收。
除了己糖转运(糖、葡萄糖、果糖等简单碳水化合物的转运系统)外,最近发现有机阴离子转运多肽转运体(OATP)也参与了大鼠空肠上皮对完整β型酰化花青素的吸收,但其吸收率很低,仅为0.2%~2.2%。
✦花青素的被动扩散吸收
另一方面,当花青素被乳糖酶-根皮苷水解酶、β-葡萄糖苷酶、α-鼠李糖苷酶和β-葡萄糖醛酸酶等水解为其苷元形式时,花青素通过肠上皮的被动扩散吸收。
✦花青素的转运速率
最近使用Caco-2细胞(人类结直肠腺癌细胞)作为人类肠道屏障功能的模型,可以评估花青素的运输,并表明运输效率取决于附着在花青素骨架上的苷元或糖的类型,以及花青素是否为聚合物。
Caco-2细胞模型还估计,达到系统循环的花青素比例约为总膳食摄入量的1%。
✦肠道内花青素的代谢
在肠道内吸收的花青素经历第一阶段代谢,包括氧化、还原和水解,但它们发生的频率较低,在多酚代谢中也不太重要。
第二阶段的生物转化更加密集和快速,它们首先发生在小肠,然后发生在肝脏和肾脏。一旦被肠细胞吸收,花青素及其分解代谢物就会发生结合反应。
包括分别由UDP葡萄糖醛酸基转移酶(UGTs)、硫转移酶(SULT)和邻苯二酚-O甲基转移酶(COMT)催化的葡萄糖醛酸化、硫酸化和甲基化。
这些生物转化产生葡萄糖醛酸、硫酸盐和甲基化代谢产物,这些代谢产物由活性ATP结合盒蛋白转运,因为它们过于亲水,无法被动扩散到细胞中。
活性ATP结合盒蛋白——一个膜内在蛋白质超家族。将ATP水解释出的能量提供给各种分子进行穿膜转运。
花青素进入血液后,通过门静脉分布到肝组织,进行进一步的偶联反应,增加其在水中的溶解度,并最终促进其在尿液中的排泄。
▼
膳食中花青素的低生物利用度以及粪便和尿液样本中花青素的低回收率表明,花青素在结肠中会被降解。
例如,食用覆盆子后,总膳食花青素的40%从回肠液中回收。这些来自小肠的未被吸收的花青素通过细菌或化学降解进行生物转化,潜在地提高了它们的生物利用度,并允许通过结肠上皮壁吸收。
花青素的微生物降解需要多种细菌,如拟杆菌、Enterococcus casseliflavus、优/真杆菌属(Eubacterium)和梭状芽胞杆菌(Clostridium)等,它们产生各种酶,如β-葡萄糖苷酶、α-半乳糖苷酶和α-鼠李糖苷酶,用于微生物分解代谢。
✦原儿茶酸是最丰富的代谢物
由于这些相互作用,通过肠道微生物降解产生了各种代谢产物。代谢物原儿茶酸占花青素摄入量的73%,是花青素消耗后最丰富的人体代谢物。
桑椹的矢车菊素-3-O-葡萄糖苷和矢车菊苷-3-O-芸香糖苷的体外粪便发酵产生了原儿茶酸、对香豆酸和间苯三酚醛,而飞燕草素-3-O-芸香糖苷的发酵产生了没食子酸、丁香酸和间苯三酚醛。
✦其他花青素的代谢产物
桑椹的矢车菊素-3-O-葡萄糖苷和矢车菊苷-3-O-芸香糖苷的体外粪便发酵产生了原儿茶酸、对香豆酸和间苯三酚醛,而飞燕草素-3-O-芸香糖苷的发酵产生了没食子酸、丁香酸和间苯三酚醛。
在与结肠细菌孵育24小时后,Malvidin-3-O-葡萄糖苷会完全代谢为丁香酸。
如体内人体研究和体外研究所示,天竺葵素-3-O-葡糖苷被代谢为4-羟基苯甲酸。
六种主要花青素及其结肠代谢物


Liang A,et al.Crit Rev Food Sci Nutr.2023
★ 花青素的主要代谢物对人体健康有益
原儿茶酸
原儿茶酸是一种水溶性酚酸成分,并且是很多中药中的活性物质,其不仅具有抗血小板凝集、降低心肌耗氧量、提高心肌耐氧能力、减慢心率、抑菌、镇痛等药理活性,还具有抗氧化、抗肿瘤和神经保护作用。
没食子酸
没食子酸具有抗炎、抗突变、抗氧化、抗自由基等多种生物学活性;同时没食子酸具有抗肿瘤作用,可以抑制肥大细胞瘤的转移, 从而延长生存期;对肝脏具有保护作用。
丁香酸
丁香酸可以抑制炎症反应,减轻炎症症状;同时丁香酸具有抗菌作用,可以抑制多种细菌和真菌的生长;丁香酸还能够降血糖、降血脂。
✦肠道微生物在花青素的去酰化起重要作用
此外,人体肠道微生物组在花青素的去酰化过程中发挥重要作用,释放出具有更高生物利用度的酚酸。
花青素衍生的代谢物可能比母体花青素表现出更强的稳定性和生物活性,并可能调节人体肠道微生物组成。
肠道微生物群受年龄、体重、饮食模式、抗生素治疗和宿主遗传的影响,并且个体之间(以及个体内部)存在差异。这种变化可能会影响膳食花青素的生物利用度和代谢。
花青素及其结肠代谢物通过其生物活性直接改善健康,并通过重塑肠道微生物组的组成和操纵短链脂肪酸的产生间接改善健康。
在宿主的一生中,肠道微生物组的组成随着时间的推移而变化,以响应内部和外部刺激。因此,肠道微生物组成的动态平衡和多样性是正常肠道功能所必需的,包括维生素和短链脂肪酸的产生、脂质代谢、免疫防御和肠-脑轴相互作用等。
▼
花青素及其代谢物目前被认为是改变肠道微生物群的调节剂,主要是通过促进有益菌的增殖和抑制有害菌的生长,许多不同模型的研究都观察到这一点。
✦促进了有益菌的增殖
研究发现黑米中分离的矢车菊素-3-葡萄糖苷在体外发酵条件下对青春双歧杆菌(B. adolescentis)、婴儿双歧杆菌(B. infantis)、双歧双歧杆菌(B.bifidum)和嗜酸乳酸杆菌(L.acidophilus)的增殖具有促进作用。
培养48小时后还观察到生长培养基pH值的降低,这归因于由酚酸和短链脂肪酸组成的有机酸的产生。双歧杆菌和乳杆菌的数量增加。它们通过竞争底物和粘附位点以及降低结肠腔内pH值来对病原体产生抗菌作用。
研究发现,降低结肠内pH值可抑制肠杆菌科(Enterobacteriaceae)和梭状芽胞杆菌(Clostridia)等pH敏感有害菌群的过度增殖,并通过抑制前致癌物的形成来降低结直肠癌的风险。
✦抑制有害菌的生长
与上述发现一致,紫甘薯中提取的花青素增加了最知名的益生菌之一双歧杆菌(Bifidobacterium)和乳杆菌(Lactobacillus)的种群数量,但减少了溶组织梭状芽胞杆菌(C. histolyticum)和拟杆菌/普雷沃氏菌的种群数量。
溶组织梭状芽胞杆菌是与感染和炎症性肠病相关的最常见致病性物种之一。
▼
虽然许多研究表明花青素及其代谢产物促进有益菌群生长,抑制有害菌群生长,但对结肠细菌的促进作用存在差异。
对微生物群的不同影响可能是由于源自花青素的代谢物的差异。
花青素(单独和混合物)和没食子酸的孵育被证明可以增加双歧杆菌和乳酸杆菌的数量。而混合花青素和没食子酸显著诱导奇异菌属(Atopobium)的生长,并减少了潜在致病性溶组织梭菌。
没食子酸似乎是本研究中的关键代谢物,可抑制溶组织梭菌增殖。
在其他研究中,研究了没食子酸对梭菌、大肠杆菌和金黄色葡萄球菌等有害微生物的抗菌活性。
花青素对肠道菌群的调节作用



Liang A,et al.Crit Rev Food Sci Nutr.2023
▼
花青素的发酵有助于短链脂肪酸的产生,主要是乳酸、乙酸、丙酸和丁酸。短链脂肪酸通过调节细菌毒力基因表达和降低结肠中管腔pH值来抑制肠道病原体如沙门氏菌(Salmonella spp.)、大肠杆菌(E. coli)和李斯特菌(Listeria spp.)的入侵。
此外,短链脂肪酸在肠道生理事件中发挥着重要作用,如获取能量、调节pH、参与肠脑轴和保护肠道屏障功能。
花青素与肠道菌群作用的研究证据
花青素与肠道微生物的相互作用已经通过动物模型得到了广泛的研究。用黑甜樱桃对小鼠进行饮食干预发现,除了双歧杆菌和乳杆菌外,樱桃花青素的补充还促进了结肠中阿克曼氏菌(Akkermansia)的增殖。
阿克曼氏菌的丰富度被认为可以刺激粘液分泌,改善肠道屏障功能,从而降低炎症风险和免疫介导的疾病,如乳糜泻。
促进Coriobacteriaceae有助于健康
对小鼠进行为期六周的多种浆果饮食干预,结果发现放线菌(Actinobacteria)数量有所改善,这与补充蓝莓的研究结果一致。
放线菌门下的一些科,如双歧杆菌和Coriobacteriaceae,已被证明对健康有益。特别是,有人认为,在高脂肪饮食存在的情况下, Coriobacteriaceae在降低肥胖和肝脏相关疾病的风险方面发挥作用。
双歧杆菌和乳酸杆菌的丰度增加
与体内试验的结果一致,在参加为期六周的25克蓝莓能量饮料的健康男性中发现双歧杆菌和乳酸杆菌的丰度增加。
花青素、其代谢物和肠道微生物群间的相互作用
Liang A,et al.Crit Rev Food Sci Nutr.2023
小结
体外、动物和人体研究一致认为,花青素及其代谢物能够调节肠道微生物群。花青素会促进益生菌的生长,特别是双歧杆菌、乳杆菌和阿克曼氏菌,它们通过产生短链脂肪酸或通过竞争底物和定植位点来对抗有害和致病性菌株,从而有利于宿主健康。
然而,花青素对肠道微生物群的调节也可能依赖于其他相关的化学物质,如葡萄糖,因为与那些喂食高葡萄糖对照饮食的大鼠相比,在蓝莓补充后,在肠道中发现了较低水平的乳酸杆菌。
此外,不同的动物模型和志愿者群体在微生物组成方面存在较大差异,这是这些研究的另一个挑战。
因此,未来的临床研究重点应放在不同年龄和生理阶段的男性和女性不同亚类人群上,这可能会更深入地了解花青素在微生物群调节中的作用及其对特定人群的健康益处。
前面讲述了花青素对肠道菌群的调节作用,下面谷禾来具体讲讲花青素和肠道微生物群相互作用下对一些疾病的影响
肥胖和超重被定义为对健康构成威胁的脂肪组织的过度积累。脂肪组织中的代谢紊乱,如炎症、脂肪因子释放失调和脂肪生成增加,是肥胖和其他肥胖相关疾病的一些常见潜在特征。
有证据表明,与肥胖相关的疾病可能部分由肠道生态失调引起,包括微生物组成及其代谢物的变化。
最近,花青素与肠道微生物的相互作用被证明具有改善肥胖的作用。主要通过调节脂肪生成和脂肪分解,炎症反应的介导以及通过肠脑通讯控制食欲。
1
肠道微生物组影响脂质代谢,肠道菌群失调与血脂异常和肥胖等有关。
最近的一项体内研究显示,对高脂喂养的小鼠补充了200毫克/公斤体重的紫甘薯花青素(花青素和芍药苷酰基糖苷),改善了高脂饮食引起的体重增加和肝脏总脂肪积累。
√调节AMPK通路减少脂肪积累
他们认为,花青素抑制脂肪堆积的作用需要激活小鼠肝脏细胞AMPK通路。此外,在摄入花青素后,AMPK途径下游靶点乙酰辅酶a羧化酶、脂肪酸合成酶、甾醇调节元件结合蛋白也被下调,以减少小鼠肝细胞中的脂肪积累。
已知AMPK通路的上调在抑制脂肪生成中发挥重要作用,例如抑制脂蛋白脂肪酶 (LPL),这是一种可受肠道微生物群调节的酶。肠道菌群通过影响抑制脂蛋白脂肪酶,以相反的方式促进脂肪细胞中甘油三酯的储存。而活化的AMPK及其下游信号通路至少部分抵消了肠道微生物群促进的能量储存。
√操纵法尼醇X受体信号减轻代谢受损
此外,已知肠道菌群产生的次生胆汁酸通过胆汁酸受体法尼醇X受体(FXR)改变肝脏脂质代谢。胆汁酸-结肠微生物群相互作用的破坏可能导致肥胖易感性。
花青素被证明可以操纵肠道微生物群/法尼醇X受体信号,从而减轻高脂肪诱导的肝脏脂肪积累和脂质代谢受损。
黑米花青素(0.48g/kg)喂养12周使血清乳酸脱氢酶(LDH)、丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)含量正常化,这些指标是肝脏脂肪过度积累影响肝损伤的指标。
这些发现表明,膳食花青素可能通过改变肠道菌群来减轻高脂饮食引起的脂质代谢紊乱。
2
肠道微生物群参与调节炎症,在肥胖患者的脂肪组织中通常观察到系统性的低级别炎症并发症。
√经常摄入花青素的肥胖患者炎症标志物含量下降
在一项研究中,代谢综合征患者每天食用400克新鲜越桔,持续12周后,血清脂多糖、IL-6、IL-12和高敏C反应蛋白(hsCPR)浓度下降。
hsCPR是一种与肥胖相关的炎症标志物。
另一项动物研究显示,花青素的干预通过抑制21天大的小鼠白色脂肪组织中TLR4介导的NF-κB信号通路,降低了高脂肪诱导的促炎标志物IL-6和肿瘤坏死因子的表达。
此外,高脂肪喂养诱导下的粪便双歧杆菌减少,在妊娠期和哺乳期用花青素处理后恢复。
3
肠道微生物在调节涉及能量稳态的神经激素活动中发挥作用。由微生物群产生的花青素和短链脂肪酸会影响促食欲激素和厌食激素的释放。
√刺激肠促胰岛素激素分泌减少食物摄入量
飞燕草素3-芸香糖苷被证明可刺激释放胰高血糖素样肽-1,这是一种肠促胰岛素激素,可促进胰岛素分泌和饱腹感,从而减少食物摄入量。
√减轻肥胖引起的神经激素紊乱
肥胖会通过表观遗传修饰相关基因表达导致参与能量平衡的神经激素活动紊乱。食用花青素可能会恢复肥胖引起的这些不利影响。
在肥胖大鼠中,连续8周食用额外的樱桃和桑葚花青素可以减少体重增加,降低血清瘦素水平,增加脂联素。
与先前的研究一致,肥胖患者在食用富含花青素的水果6周后,发现瘦素受体表达增加,这表明补充花青素后瘦素敏感性有所改善。
此外,高脂饮食诱导的肥胖大鼠大脑皮层和海马体中的γ-氨基丁酸(GABA)水平下降。研究报道,与对照组相比,40天摄入黑大豆花青素减少了成年大鼠的体重增加。高剂量花青素可降低促氧神经肽Y (NPY)的表达,提高下丘脑GABA受体B (GABAB1R)的表达。
GABA是中枢神经系统中的一种抑制性神经递质,通过控制神经元的兴奋性、可塑性和额叶皮质的同步性,在摄食反应中起关键作用。
综上所述,花青素似乎通过多种方式与肠道微生物群相互作用,包括调节脂质代谢、炎症反应和参与能量平衡的神经激素活动,从而具有改善肥胖的作用。
注:关于健康和肥胖个体肠道中花青素代谢的差异,人们的理解有限。因此,未来的研究重点应放在花青素结肠代谢物及其对健康和肥胖受试者的健康影响上。
2型糖尿病是一种以高血糖为特征的代谢性疾病,由胰岛素抵抗逐渐发展而来。
许多研究已经报道了花青素及其代谢物的抗糖尿病潜力,这可能归因于以下单一或同时的作用,包括增强胰岛素敏感性,改善β细胞功能和延迟餐后血糖反应。
1
花青素可以通过自身或其微生物代谢物改善胰岛素敏感性。
脂肪组织能够分泌脂联素等脂肪细胞因子来调节葡萄糖稳态。
√花青素可以诱导脂肪细胞摄取葡萄糖
花青素及其微生物代谢物原儿茶酸已被证明可以通过上调葡萄糖转运蛋白4来增加人类脂肪细胞去除血浆葡萄糖的能力。
PPARγ的敲除消除了花青素的胰岛素增敏特性,这表明PPARγ可能在增加花青素诱导的脂肪细胞葡萄糖摄取中发挥作用。
PPARγ是一种参与葡萄糖处理和葡萄糖转运蛋白调节的核转录因子
√花青素还可以介导骨骼肌中的葡萄糖摄取
除了脂肪细胞外,骨骼肌中的葡萄糖摄取也可由花青素介导。
糖尿病小鼠口服紫玉米花青素提取物8周后,骨骼肌对葡萄糖的摄取增加,因为在肌肉细胞中发现葡萄糖转运蛋白4表达增加,并伴随AMPK通路的激活。增加AMPK活性是刺激葡萄糖转运蛋白4从细胞内囊泡转移到细胞膜的重要途径,从而促进葡萄糖流入细胞。
此外,在摄入原儿茶酸后大鼠肝脏中发现胰岛素受体底物1/磷脂酰肌醇3-激酶/蛋白激酶B-2 (IRS1/PI3K/AKT2) 信号通路的活性增加,表明肝脏胰岛素敏感性得到改善。
证据表明,花青素及其降解产物改善了脂肪细胞和肌肉细胞的胰岛素敏感性。
2
花青素还可以通过消除高血糖引起的氧化应激来保护胰腺β细胞的功能。
√改善高糖影响下的胰岛β细胞损伤
发现富含花青素的提取物可减轻高糖诱导的β细胞损伤,保护其分泌功能,并导致血清胰岛素水平升高。
一项体外研究(对与桑椹花青素孵育的高糖培养的β细胞)发现,花青素能够通过抑制β细胞中的凋亡相关蛋白,包括丝裂原活化蛋白激酶、细胞色素c和Bcl-2家族蛋白,消除高糖诱导的细胞内活性氧水平升高,并将β细胞活力恢复到84%。
除了完整的花青素外,丁香酸是花青素的主要微生物代谢产物之一,口服30天可改善四氧嘧啶诱导的糖尿病大鼠的胰岛素释放功能异常、血糖和糖蛋白水平升高。
丁香酸的抗糖尿病作用可能与保持β细胞的活力和功能有关。
3
在人体试验中也观察到了膳食花青素和微生物代谢物在调节餐前和餐后血糖中的作用,从而降低了患2型糖尿病的风险。
众所周知,血糖水平是动态的,全天都在变化。空腹和餐后血糖水平是诊断糖尿病的两个重要指标。空腹血糖值代表身体在一夜禁食后如何管理血浆葡萄糖,而餐后血糖则代表餐后的血糖反应。
√多摄入花青素表现出延迟的血糖反应
与未补充花青素的人相比,额外摄入150克混合浆果泥的参与者表现出延迟的血糖反应。
研究人员解释:餐后血糖降低至少部分是由于花青素对α-葡萄糖苷酶的抑制作用,α-葡萄糖苷酶是一种释放α-葡萄糖的酶。
该研究结果支持以下机制:花青素通过抑制胰腺α-淀粉酶和α-葡萄糖苷酶的活性,以及干扰葡萄糖转运蛋白(SGLT1和GLUT2),因为这些转运蛋白存在竞争关系,从而降低餐后血糖。
√降低了空腹血糖浓度
血清马尿酸是一种花青素的结肠代谢产物,在成年人食用越橘8周(200克/天)后显著增加。8周越桔 干预也降低了空腹血糖浓度。
然而,没有观察到血浆马尿酸与餐后血糖浓度之间存在任何相关性。
花青素可能通过抑制α-淀粉酶和α-葡萄糖苷酶活性以及与葡萄糖载体相互作用来调节餐后血糖,而花青素代谢产物马尿酸则由于微生物降解物的延迟出现而与改善空腹血糖控制有关。
小结
花青素及其代谢物的抗糖尿病作用已经在体外和体内研究中得到阐明。主要通过调节葡萄糖转运蛋白表达和易位来改善胰岛素抵抗,对胰岛β细胞及其分泌功能的保护作用,以及调节空腹和餐后血糖水平。
因此,由富含花青素的食物或补充剂组成的饮食干预可能是更好地控制患有2型糖尿病高风险个体和糖尿病患者血糖的替代途径。
心血管疾病是一类影响心脏和血管的疾病,最常见的形式包括动脉粥样硬化、冠心病、心律失常、心力衰竭和中风。
流行病学研究表明,高花青素摄入量与心血管疾病风险降低有关。花青素及其代谢物发挥保护作用,主要归因于抑制血小板过度活跃,缓解内皮功能障碍,改善脂质谱和逆转胆固醇转运。
1
花青素和原儿茶酸已被证明稳定血小板活性,从而防止血栓形成。
√摄入花青素抑制了血小板的过度聚集
一项研究发现,100μM和500μM没食子酸可以减少刺激物(二磷酸腺苷和血栓素A2激动剂U46619)诱导的血小板聚集、血小板-白细胞聚集和P-选择素表达。
P-选择素(一种参与细胞表面粘附的糖蛋白)的表达减少,表明血小板稳定性提高,血栓形成风险降低。
没食子酸抗血小板聚集的潜在机制是通过降低细胞内钙水平和下调蛋白激酶c-α(PKCα)/p38丝裂原活化蛋白激酶(p38MAPK)和Akt/糖原合成酶激酶3β (GSK3β)通路的活性。
另一项临床试验也支持了这种抗血栓作用,该试验发现,在健康志愿者中,200mL富含花青素和芸香苷的李子汁干预28天,可有效抑制人工刺激的血小板聚集,并降低P-选择素的表达。
此外,补充花青素28天后还观察到氧化应激生物标志物丙二醛水平降低,这表明血小板的抗机能亢进至少部分归因于花青素及其代谢物的抗氧化能力。
2
花青素及其代谢物具有血管内皮保护作用,内皮功能障碍被认为是动脉粥样硬化发展的早期指标。内皮功能受损可破坏血管收缩和血管舒张的止血作用,引发一系列生理事件,如促炎因子分泌、白细胞粘附等,从而引发动脉粥样硬化。
√减缓动脉粥样硬化
研究了花青素代谢物原儿茶酸对载脂蛋白e缺乏小鼠的内皮保护作用。原儿茶酸(0.03g/kg)喂养20周小鼠,动脉粥样硬化形成延迟,血管细胞粘附分子1 (VCAM-1)和细胞间粘附分子1(ICAM-1)表达显著降低。
这些粘附分子的减少可以减少单核细胞对血管内皮的附着,从而减缓动脉粥样硬化的早期发展。
√改善血管舒张情况
蓝莓花青素的血管保护特性已在临床试验中得到证实。健康志愿者在摄入蓝莓花青素(766-1791毫克)1至2小时和6小时后,内皮依赖性血管舒张得到改善。
3
许多研究也报道了富含花青素的饮食对血脂的有益影响。
√直接补充花青素缓解高脂血症
在高脂饮食诱导的肥胖小鼠中,每天补充150 mg/kg黑加仑花青素12周后,高脂血症得到缓解,相应的血清总胆固醇、甘油三酯和低密度脂蛋白水平降低。
另一项研究报告,50mg/kg原儿茶酸干预10周后,降低了先前由脂肪和果糖丰富的饮食引起的高脂血症雄性大鼠的血清甘油三酯、总胆固醇和低密度脂蛋白水平。
三项新指标,即血浆动脉粥样硬化指数(AIP)、动脉粥样硬化指数(AI)和冠状动脉危险指数(CRI),在50mg/kg原儿茶酸治疗后分别显著降低33%、52%和36%。
√通过调节菌群降低血脂
此外,花青素干预后观察到嗜黏蛋白阿克曼菌(Akkermansia muciniphila)和狄氏副拟杆菌(Parabacteroides distasonis)的富集,其与循环甘油三酯和低密度脂蛋白水平呈负相关。已知阿克曼菌可以积极调节肠道屏障完整性,防止脂多糖易位诱导炎症。
低密度脂蛋白(LDL)及其氧化修饰(oxLDL)通过刺激泡沫细胞的形成与动脉粥样硬化的发病机制有关。
最近发现狄氏副拟杆菌(Parabacteroides distasonis)通过产生琥珀酸和次生胆汁酸,如石胆酸和熊去氧胆酸,具有降血脂作用。
综上所述,花青素及其代谢物可能通过改善血脂来预防动脉粥样硬化和冠状动脉疾病。
小结
综上所述,花青素及其代谢物通过维持血小板稳定、保护血管内皮功能、改善血脂等发挥心血管保护作用。
然而,关于花青素心血管保护作用的人类和动物研究之间存在差距。因为动物中使用的浓度可能无法在人体中达到生理水平。
此外,临床研究的实验持续时间通常在4至12周之间,这可能无法捕捉到长期补充的影响。因此,未来可能需要进行长达一年的长期饮食干预研究。
帕金森病、阿尔茨海默病和肌萎缩侧索硬化症等神经退行性疾病是发生在神经系统中的疾病,导致日常活动协调困难、认知障碍和记忆丧失。
这些疾病的病因可能多种多样,但它们有一系列共同的潜在因素。这些因素包括但不限于长时间的氧化应激、中枢神经系统炎症、神经元钙信号失调和兴奋性毒性(即神经毒性)。
有证据表明,一些花青素代谢物,如原儿茶酸、香草酸、没食子酸和其他简单的酚酸,可以通过血脑屏障进入中枢神经系统,这表明这些物质可能直接在发生神经系统疾病的中枢神经系统中发挥作用。
1
花青素肠道代谢物与防止神经毒性和维持Ca2+体内平衡有关。
√没食子酸可以减轻谷氨酸诱导的神经毒性
谷氨酸是一种兴奋性神经递质,有助于大脑正常功能,而谷氨酸水平异常升高可引起谷氨酸兴奋性毒性。谷氨酸兴奋性毒性被认为是神经退行性疾病的主要原因之一。
没食子酸是能够穿透血脑屏障的代谢物之一。报道,25和50μg/ml 没食子酸预处理2小时可导致大鼠皮层神经元细胞中N-乙酰天冬氨酸(NAA)水平和微管相关蛋白2(MAP-2)表达增加,表明没食子酸处理减轻了谷氨酸诱导的大鼠神经元神经毒性。
在缺乏没食子酸的细胞中观察到的NAA和MAP-2的下调被认为是神经元损伤和丧失的直接指标。
此外,在没食子酸处理的细胞中也观察到钙结合蛋白(一种能够缓冲Ca2+内流的钙结合蛋白)的上调,表明没食子酸在保护神经元免受谷氨酸引发的钙失衡方面的作用。
√天竺葵素代谢物减轻神经兴奋性毒性
观察到4-羟基苯甲酸(HBA)是一种天竺葵素的代谢物,可在体外保护大鼠小脑颗粒神经元免受谷氨酸兴奋性毒性。当仅用谷氨酸处理的大鼠小脑颗粒神经元导致近50%的细胞损失时,4-羟基苯甲酸处理保留了细胞并且只有13%的细胞死亡得到证实,揭示了4-羟基苯甲酸在谷氨酸兴奋性毒性缓解中的作用。
注:原儿茶酸和4-羟基苯甲酸似乎发挥互补作用,表明它们的共同治疗可能比单一代谢物更有效。然而,本研究并未提供原儿茶酸和4-羟基苯甲酸的联合治疗,因此其最佳效果的混合比例值得进一步研究。
2
花青素及其代谢物的神经保护作用与它们在防止蛋白质聚集和促进自噬中的潜在作用有关。
蛋白质聚集被认为刺激神经元变性,与许多神经退行性疾病有关。例如,由聚集的淀粉样蛋白(Aβ)形成的斑块和由tau蛋白形成的神经原纤维缠结是阿尔茨海默病的标志。导致路易体形成的α-突触核蛋白(αS)的异常组装与帕金森病有关。
√原儿茶酸防止蛋白质异常聚集
48小时原儿茶酸处理(10至100 μM)对Aβ和αS原纤维聚集的抑制率分别为30–79%和70–80%。原儿茶酸治疗6天(100μM)也使预先形成的Aβ原纤维和αS原纤维不稳定65%和80%。
这些结果表明,原儿茶酸不仅能抑制Aβ和αS纤颤,还能逆转预先形成的纤颤,它们共同调节蛋白质相互作用,防止蛋白质异常聚集导致的细胞死亡
√香草酸的干预有助于治疗阿尔兹海默病
香草酸是黑芝麻色素释放的主要代谢物,它显示出对β-淀粉样蛋白的抑制活性。在用6μM香草酸处理24小时后发现一半(50%)的抑制,在50μM香草酸孵育时达到90%的抑制。
此外,较高浓度的香草酸(60μM)可使β-分泌酶活性降低60%。β-分泌酶是一种在神经元中催化淀粉样前体蛋白合成淀粉样肽的第一步酶,促进蛋白质聚集。抑制β-分泌酶活性被认为是治疗阿尔茨海默病的另一种方法。
3
花青素微生物降解产物的有益作用已通过调节神经元细胞凋亡信号通路被发现。诱导细胞死亡是神经退行性疾病的最终病理活动。
√花青素代谢物调控细胞凋亡信号
原儿茶酸在最近的动物研究中显示出抗凋亡能力。原儿茶酸通过上调大脑皮层中参与抗氧化活性的基因,如Sod2、Cat、Gpx1和Gsr,来阻止镉诱导的细胞凋亡。
原儿茶酸处理可以减轻镉引起的促炎生物标志物肿瘤坏死因子和IL-1β的表达增加,这表明原儿茶酸通过介导促凋亡蛋白和抗凋亡蛋白,增强抗氧化防御系统和减少炎症细胞因子的产生来保护皮质组织免受镉损伤。
总之,这些发现表明花青素代谢物不仅可以减轻导致神经元死亡的各种诱导剂,还可以调节凋亡信号,从而在多个层面上降低神经退行性病变的风险。
√花青素介导的肠道菌群变化减少了神经退行性疾病的风险
除了花青素及其代谢物有助于神经保护作用外,花青素介导的肠道微生物群变化间接减少了神经退行性疾病的发生。
研究表明,由于脂多糖诱导的神经炎症反应、血脑屏障渗漏增加和β-淀粉样蛋白错误折叠的发生率,肠道生态失调可能增加神经退行性疾病的易感性。
在高脂喂养大鼠中补充黑莓花青素(25mg/kg)17天可以抵消高脂饮食引起的部分生态失调,例如孢杆菌属(sporobacter)数量增加和瘤胃球菌(Rumminococcus)数量减少。
花青素相关的肠道菌群调节通过犬尿氨酸途径改变色氨酸代谢,从而与抗神经炎症活性相关。这种改变被证明可以增加犬尿氨酸的产生,犬尿酸是一种抗兴奋毒性分子,可以减轻神经退行性病变。
尽管花青素介导的色氨酸代谢对神经保护的证据有限,但肠道微生物群对色氨酸代谢的操纵很可能会影响肠-脑轴。
建议
花青素及其微生物代谢产物可能是治疗神经退行性疾病的有效分子。然而,由于大多数研究结果都是基于体外或动物模型,因此在未来的研究中需要进行大量的临床前和临床研究。
由于衰老是神经退行性变的主要危险因素,因此有必要以老年人为重点补充花青素,以探索其在认知改善中的作用和肠道微生物群。
▼
•花青素抑制了炎性细胞因子的产生
花青素可以通过调节微生物群来预防肠道疾病。在葡聚糖硫酸钠(DSS)诱导的结肠炎小鼠中,用枸杞中的花青素提取物(200 mg/kg/天)喂养持续至少一周,恢复了紧密连接蛋白的表达,抑制炎症细胞因子(如TNF-α,IL-6)的产生。
同样,食用富含花青素的马铃薯持续9周喂养结肠炎小鼠,缓解了结肠长度的缩短,降低了髓过氧化物酶(炎性粘膜标志物)水平和炎性细胞因子。
•微生物群是花青素调节炎症性肠病的介质
然而,这种作用在抗生素治疗的小鼠身上消失了,强烈表明微生物群作为花青素对炎症性肠病介质的作用。
▼
摄入花青素可通过多种潜在机制降低患非酒精性脂肪性肝病的风险,例如其固有的抗炎作用、脂质代谢和葡萄糖代谢的管理以及改变微生物群特性。
•改变了脂肪肝小鼠体内的微生物群
其他研究也证明了花青素改变微生物群的作用,但花青素来源的多样性可能导致不同的微生物种群发生改变。在高脂饮食诱导的非酒精性脂肪肝变性小鼠中,摄入桑树水提取物(0.2-0.6%)可减少促炎的Turicibacteres,并提高拟杆菌(Bacteroidales)与梭菌(Clostridiales)的比例。
总的来说,花青素的摄入可能会改变肠道微生物群的组成,从而改善肠道屏障功能和能量消耗,降低肥胖、炎症、胰岛素抵抗,并最终降低非酒精性脂肪性肝病及其代谢并发症的风险。
▼
先前的动物研究已经证明了花青素通过微生物群调节途径抑制肿瘤生长和癌症进展的潜力。
•花青素治疗后肿瘤计数显著降低
在结直肠癌小鼠模型中,用覆盆子花青素治疗可显著削弱结肠癌的发生,每只动物的肿瘤计数减少约90%,肿瘤发病率降低(从100%降至72%左右)。
肠道生态失调可能与结直肠癌的增加有关,而花青素似乎可以恢复这种平衡,并通过促进乳酸菌的生长、抑制肠球菌和脱硫弧菌来调节微生物群。
此外,口服越桔花青素可能通过微生物群加速免疫检查点抑制剂(即程序性死亡配体1,可以限制T免疫细胞反应激活的蛋白质)的肿瘤抑制特性。
研究人员提出,补充花青素可改善肠道物种多样性,诱导梭状芽孢杆菌、约氏乳杆菌和毛螺菌科的丰度增加。
▼
花青素有可能降低慢性肾脏疾病的风险。慢性肾脏疾病的特点是肠道生态失调和由此产生的尿毒症毒素。
在一项研究中,花青素显示出通过AMPK磷酸化减轻培养细胞中糖尿病肾病的能力,并在腺嘌呤诱导的慢性肾病小鼠模型中减轻症状。
▼
花青素和富含花青素的食品的抗炎作用也与减缓骨关节炎和骨修复的进展有关,主要是通过抑制MAPK信号通路和NF-kB信号通路。
认识了花青素对人体健康的重要性,那么我们在日常生活中应该如何去补充呢,谷禾在这里列出了一些建议。
水果:存在于葡萄、蓝莓、桑葚、血橙、草莓、樱桃、红心火龙果、山楂等水果中,与水果色泽有一定的关系,在外观上有所体现,水果是补充花青素的较好选择;
蔬菜:如紫甘蓝、紫薯、紫玉米、紫土豆、黑枸杞、茄子、紫苏、甜菜、萝卜、紫洋葱等蔬菜中,也含有较多的花青素;
谷物:大麦、高粱、黑米,以及豆类如绿豆、红豆、黑豆、黄豆、赤小豆等,其中也含有较多的花青素。
花青素易受热、光、氧等因素的影响而降解,因此建议选择新鲜的食物食用,以保证花青素的含量。
花青素在高温下易被破坏,因此建议采用轻微加热的烹饪方式,如蒸、煮、炖等,以尽可能保留花青素的含量。
花青素与其他营养素的搭配可以增强其吸收和利用效果。例如,与维生素C搭配可以增强花青素的抗氧化作用。
如果日常饮食中花青素的摄入量不足,可以考虑适当补充花青素保健品。但是,需要注意选择正规品牌和适量摄入。
虽然花青素对人体健康具有多种保护作用,但过量摄入也可能对健康造成负面影响。
因此,建议适量摄入花青素,不要过度依赖花青素保健品等补充剂。
总之,通过日常饮食摄入富含花青素的食物,可以有效补充花青素,发挥其保健作用。同时,需要注意花青素的摄入量和搭配方式,以充分发挥其保健作用。
总的来说,花青素的健康益处已被广泛研究,它们被认为可以有效减轻或预防一些疾病。
通过与肠道微生物相互作用了解花青素及其健康益处是很重要的。肠道菌群在花青素降解过程中发挥重要作用,并介导多种生理活动。
花青素也会改变肠道微生物组成,维持微生态平衡,操纵短链脂肪酸的产生、脂肪代谢、肠道上皮功能、与中枢神经系统的联系和免疫反应。
因此,花青素的潜在益处可能间接归因于其对肠道微生物群的调节作用及其随之而来的生理影响。由于这些原因,研究花青素和肠道微生物群的相互作用在慢性疾病预防和治疗中是很重要的。
主要参考文献
Liang A, Leonard W, Beasley JT, Fang Z, Zhang P, Ranadheera CS. Anthocyanins-gut microbiota-health axis: A review. Crit Rev Food Sci Nutr. 2023 Mar 17:1-26.
Akbari, G. 2020. Molecular mechanisms underlying gallic acid effects against cardiovascular diseases: An update review. Avicenna Journal of Phytomedicine 10 (1):11–23.
Agustí, A., M. P. García-Pardo, I. López-Almela, I. Campillo, M. Maes, M. Romaní-Pérez, and Y. Sanz. 2018. Interplay between the gut-brain axis, obesity and cognitive function. Frontiers in Neuroscience 12:155.
Cortés‐Martín, A., C. E. Iglesias‐Aguirre, A. Meoro, M. V. Selma, and J. C. Espín. 2021. Pharmacological therapy determines the gut microbiota modulation by a pomegranate extract nutraceutical in metabolic syndrome: A randomized clinical trial. Molecular Nutrition & Food Research 65 (6):2001048. 2001048.
Drago, L. 2019. Probiotics and colon cancer. Microorganisms 7 (3):66.
Foley, M. H., S. O’Flaherty, R. Barrangou, and C. M. Theriot. 2019. Bile salt hydrolases: Gatekeepers of bile acid metabolism and host-microbiome crosstalk in the gastrointestinal tract. PLOS Pathogens 15 (3):e1007581.
Hampel, H., R. Vassar, B. De Strooper, J. Hardy, M. Willem, N. Singh, … A. De Vos. 2020. The β-secretase BACE1 in Alzheimer’s disease. Biological Psychiatry 89 (8):745–756.