-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
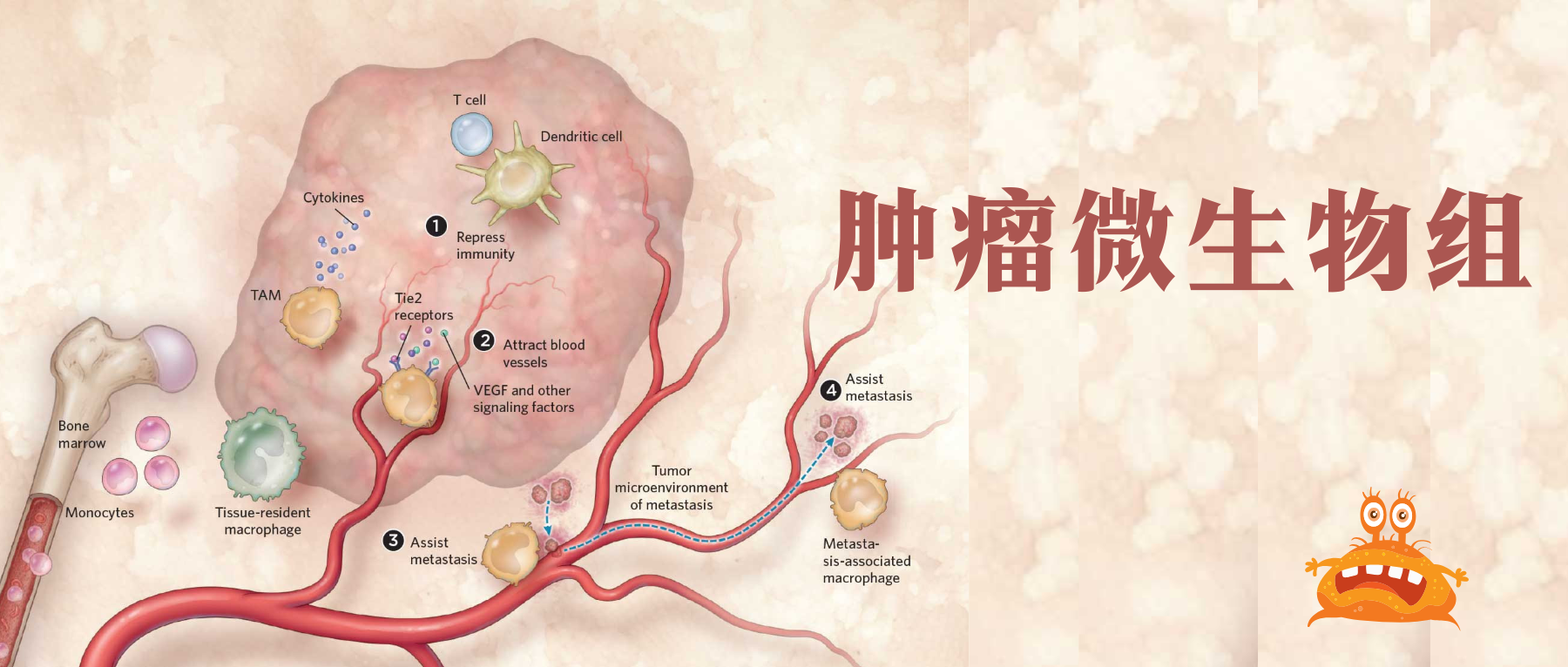
通常认为人类体内微生物群存在于与外部环境接触的体腔和器官中,例如胃肠道、皮肤、口腔、上呼吸道(尤其是鼻咽)和泌尿生殖道。然而在过去十年中,越来越多的研究确定了肿瘤内存在着低生物量而独特的微生物群落(瘤内微生物群)。
在肿瘤内,细菌、真菌、病毒和古菌等微生物形成了肿瘤微生物群,主要存在于肿瘤细胞、免疫细胞和细胞间基质中。这些微生物群落构成了肿瘤微环境(TME)的一部分,影响免疫调节、炎症和代谢控制等过程,这些过程与肿瘤的发生和进展密切相关。迄今为止报道的证据表明,肿瘤微生物组存在于33种主要癌症类型中。
大量证据表明,多达20%的癌症与微生物感染有着错综复杂的联系。最初在伯基特淋巴瘤中发现了EB 病毒(EBV)。从那时起,病毒感染就被认为是导致人类癌症的重要因素,包括确定人乳头瘤病毒(HPV)是导致宫颈癌的原因,乙型肝炎病毒(HBV)是导致肝癌的原因,以及人T细胞嗜淋巴细胞病毒是导致白血病和淋巴瘤的主要原因。
伯基特淋巴瘤(Burkitt淋巴瘤)是儿童恶性淋巴瘤中最常见的类型,起病急,进展快,侵袭强和恶性度高。1964年首先从非洲儿童Burkitt淋巴组织中分离出EB病毒。
1982年,就在胃中发现幽门螺杆菌(Helicobacter pylori)证实了其作为消化性溃疡和胃癌病原体的作用。2020年,对来自七种常见实体瘤(包括乳腺癌、肺癌、卵巢癌、胰腺癌、黑色素瘤、骨癌和脑肿瘤)的超过1526个样本进行了分析,发现大多数实体瘤含有细菌,其中许多是存活在癌细胞内的细胞内细菌。随后,在各种人类癌症标本中也发现了真菌,包括胰腺癌、肺腺癌和结直肠癌。
本文介绍了肿瘤微生物组的相关概念、来源和特征及检测方法。然后,我们描述了常见肿瘤中肿瘤微生物组的组成及其在塑造肿瘤微环境中的作用。肿瘤微生物组和免疫系统之间的相互作用可以调节宿主的抗肿瘤免疫,影响肿瘤治疗的疗效。理解肿瘤微生物组与肿瘤之间的相互关系,有助于为肿瘤的早期诊断和治疗带来新的突破。
▸ 肿瘤微生物的定义
“肿瘤微生物”,其定义为在肿瘤组织中发现的可影响癌症易感性和治疗反应的微生物。国际癌症登记协会(IARC)将11种微生物归类为人类致癌物。
其中包括7种病毒,即乙型肝炎病毒(HBV)、丙型肝炎病毒、人类嗜T细胞病毒、人乳头瘤病毒(HPV)、EB病毒、卡波西肉瘤相关疱疹病毒(KSHV)和默克尔细胞多瘤病毒(MCV);三种寄生虫,即华支睾吸虫、埃及血吸虫和Clonorchis mukusicus;和一种细菌,幽门螺杆菌(Helicobacter pylori)。
术语“瘤内微生物群 ”和 “瘤内微生物组 ”经常被人们混用。在本文中,我们将前者定义为肿瘤组织内所有微生物(包括细菌、病毒、真菌、原生动物和古细菌)的集合,而后者包括肿瘤组织内所有微生物的基因组和产物,包括所有分泌毒素(如来自脆弱拟杆菌和具核梭杆菌的毒素)、代谢物(如短链脂肪酸)和氧化还原活性小分子(活性氧、活性氮)。
并且在本文的术语中,“肿瘤”主要是指癌症(恶性肿瘤)。尽管良性肿瘤(如子宫肌瘤)也含有微生物群,但关于良性肿瘤的微生物群和微生物组的研究较少。此外,良性肿瘤不具有转移特性,限制了对微生物组在转移中作用的探索。
▸ 肿瘤微生物的来源
肿瘤微生物群的来源可分为两类。第一类是“常驻”生物,它们栖息在人类生态位中,在正常情况下通常不会引起疾病。然而,在微生物组的整体扰动导致生态失衡(生态失调)之后,共生微生物群的比例被破坏,导致共生微生物易位,从而诱导肿瘤形成。
第二类由“外来入侵者”组成,例如致癌微生物和其他病原微生物。入侵的肿瘤微生物群可以根据入侵途径进一步分为三种类型。
(一)微生物通过粘膜屏障侵入
微生物群落栖息在人体的各种粘膜表面,形成不同的微生物组生态位。在健康状态下,微生物群保持动态平衡,调节免疫系统以抵抗外部病原体的定植,并抑制内源性微生物的致病潜力。
然而,微生物组成的破坏或这些群落的位移会导致生态位间微生物串扰,从而可能影响癌症进展。在肿瘤发生过程中,粘膜屏障的损伤(无论是由细菌还是其他因素引起)可能使粘膜微生物有机会侵入肿瘤组织,从而导致结直肠癌、胰腺癌、肺癌和宫颈癌等癌症的发展。
(二)源自邻近健康组织的微生物
一些研究发现,肿瘤组织的微生物群组成与邻近正常组织的组成非常相似。胰腺癌患者肿瘤组织和十二指肠组织之间的细菌DNA谱相似性表明胰腺组织中的细菌可能起源于十二指肠。
起源于口腔的具核梭杆菌(Fusobacterium nucleatum)可进入肠道并在结直肠癌内增殖,从而在肿瘤微环境(TME)内诱导免疫细胞激活。小鼠模型显示,具核梭杆菌通过将其粘附素Fap2与结直肠癌细胞上表达的糖分子Gal-GalNAc结合来定植结直肠癌组织,而Fap2缺陷细菌在这些小鼠中的定植受损。
同样,发现口服荧光标记的粪肠球菌(Enterococcus faecalis)从肠道转移到肿瘤外围,改变了肿瘤微生物组的基因组特征并调节免疫功能。
此外,与正常组织相比,肿瘤微环境(TME)的特点是免疫抑制和缺氧,这些条件更有利于微生物定植,因此假设肿瘤微生物群可能起源于正常组织。
(三)微生物通过血液迁移到肿瘤
血液是肿瘤微生物组的另一个潜在来源。由于肿瘤组织的丰富血管化,它们为微生物的生存和传播提供了合适的环境。红细胞在细菌易位中起着至关重要的作用,有助于免疫逃避。使用 16S rDNA 定量聚合酶链反应测定和 MiSeq 测序(16S 靶向宏基因组测序)证实了健康人血液中存在细菌,并且在红细胞中检测到的细菌 DNA 浓度高于血浆。
活细菌,如肺炎链球菌和金黄色葡萄球菌,已被证明存在于红细胞中。
源自口腔、肠道、呼吸道和其他区域的微生物可以通过血流运输到肿瘤部位,通过受损的血管浸润肿瘤。坏死肿瘤细胞碎片的趋化梯度可能引导从身体不同部位进入血液的微生物迁移到肿瘤。
例如,金黄色葡萄球菌(Staphylococcus aureus) 的肺部感染已被证明会影响乳腺癌转移。结肠中的大肠杆菌(Escherichia coli)在结直肠癌期间破坏肠道血管屏障,进入血液,随后定植于肝脏,诱导转移前生态位的形成并促进肝转移。
★ 不同类型的癌症微生物群组成不同
许多研究已经确定了肿瘤组织内微生物组的存在,并强调了癌症微生物群的异质性。癌症微生物群是多种多样的,癌症微生物群的组成在不同类型的癌症之间,甚至在同一癌症的不同病理亚型之间也不同。
例如厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是结直肠癌中最丰富的物种,而变形菌门(Proteobacteria)在胰腺癌的微生物群中占主导地位。肝细胞癌富含变形菌门、拟杆菌门和Patescibacteria。
不同的癌症类型承载着不同的微环境,具有不同的氧分压、血管生成能力和周围组织的微生物群,这会影响肿瘤微生物群的组成并产生肿瘤类型的异质性。
不同肿瘤类型中微生物群的组成



Ma Y,et al.Microb Pathog.2024
★ 癌症不同阶段的微生物群也存在变化
除了类型异质性外,癌症微生物群还表现出位点异质性和分期异质性。前者是指肿瘤组织和非肿瘤组织之间微生物群组成的差异,主要包括特定个体微生物的存在或生态失调。肿瘤组织中的微生物群多样性通常低于非肿瘤组织,这可能与肿瘤微环境中特定微生物的选择性扩增有关。
后者是指癌症发展不同阶段肿瘤微生物群的变化。在口腔鳞状细胞癌的进化过程中,癌前阶段(癌前病变)显示链球菌(Streptococcus)和罗氏菌(Rothia)的高富集。而在晚期癌症中,Capnocytophaga在肿瘤组织中富集。
★ 癌症微生物组与宿主之间存在双向作用
肿瘤微生物组和宿主之间的相互作用是双向的。
这种影响主要体现在两个方面:
首先,细胞内和细胞外肿瘤环境之间的生化和生物差异与细胞内和细胞外肿瘤微生物组之间的功能变化有关。例如,某些细菌可以在癌细胞侵袭过程中调节RhoA-GTP酶-Rock-肌动蛋白细胞骨架重塑途径,从而促进携带细菌的癌细胞远处转移——这是细胞内肿瘤微生物组特有的作用。
其次,肿瘤微环境对肿瘤微生物组产生选择性影响。不同微环境中血管生成、氧水平、微生物来源、内吞作用和胞饮作用活性的变化导致肿瘤内的微生物组成不同。
让我们一起来看下不同癌症中的肿瘤微生物组与宿主之间可能存在的相互作用。
结直肠癌(CRC)是全球最常见的肿瘤之一,也是与肿瘤微生物组密切相关的肿瘤之一。
菌群失调可能是结直肠癌的诱因之一
动态平衡的微生物群对人类健康有益,但菌群失调可能导致结直肠炎症、炎症性肠病,甚至结直肠癌。
一项对423名I-IV期结直肠癌患者的肿瘤组织和正常粘膜进行 16S rRNA 测序的研究发现,与正常肠粘膜相比,结直肠癌组织的α多样性降低,β多样性增加。
变形菌门、梭菌门、弯曲杆菌门在肿瘤组织中的含量增加,而拟杆菌门、厚壁菌门、疣微菌门、放线菌门和古细菌减少。
有益菌和有害菌在结直肠癌环境中的作用
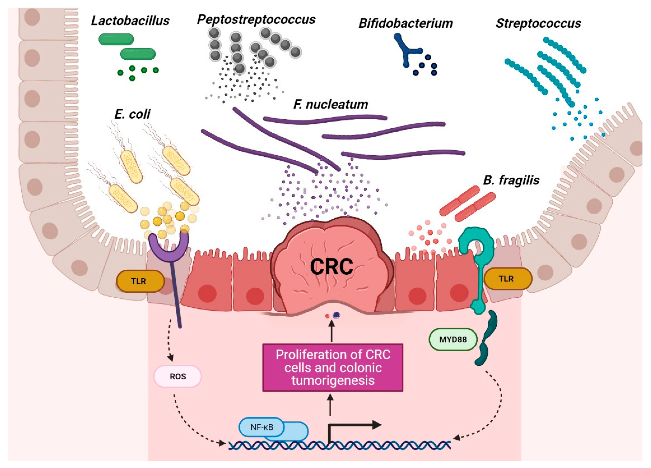
Torres-Maravilla,et al.Microorganisms.2021
产生毒素的特定细菌诱导肿瘤的进展
结直肠癌患者富含特定菌群,包括产生肠毒素的脆弱拟杆菌(B.fragilis)、肝螺杆菌(Helicobacter hepaticus)、败血梭菌(Clostridium septicum)、粪肠球菌(Enterococcus faecalis)、具核梭杆菌(F.nucleatum)、大肠杆菌、无乳链球菌和幽门螺杆菌。
这些细菌可通过释放破坏宿主细胞基因组的毒素,激活STAT3、NF-κB、Wnt和SREBP-2途径、诱导COX-2表达、与TRL2和TRL4相互作用、刺激促炎细胞因子(IL-1β、IL-6、IL-8、IL-17、TNF-α和IFN-γ)产生、调节NLRP3炎症体活性,通过氧化应激活性氧(ROS)和活性氮(RNS)DNA损伤来促进肿瘤中炎性微环境的形成并导致免疫逃逸来影响肿瘤的发展。
由于肿瘤粘膜微生态中的病原体网络与肿瘤突变和代谢特征相关,我们预计肿瘤微生物群组成的分析可以预测接受切除的结直肠癌患者的预后。
肺癌是常见的恶性肿瘤之一,肺癌的发生与下呼吸道以及口腔、鼻腔、胃肠道的微生物群密切相关。
肺癌患者中Gemmiger、Blautia等菌增加
普雷沃氏菌属(Prevotella)、链球菌属(Streptococcus)和韦荣氏球菌属(Veillonella)常见于口腔中,在肺癌中的含量增加。
并且与良性肺病患者相比,肺癌患者发现的菌群之间存在高度差异,Capnocytophaga、Sediminibacterium、吉米菌(Gemmiger)、Blautia和颤螺菌属(Oscillospira)这几个细菌相对丰富。
与肺癌可能相关的微生物
从全球角度来看,假单胞菌、链球菌、葡萄球菌、韦荣球菌属和莫拉克斯氏菌属经常被报道为与肺癌最相关的微生物群。

Liu NN,et al.NPJ Precis Oncol.2020
通过qPCR确定,二氧化碳嗜纤维菌(capnocytophaga)和韦荣氏球菌在肺癌患者的唾液样本中含量更高,而奈瑟菌属的丰度相对较低,它们有可能用作肺癌早期检测的生物标志物和微生物组治疗的靶标。
对30项相关研究的荟萃分析发现,肺部感染结核分枝杆菌、非结核分枝杆菌和其他病原体会增加患肺癌的风险。
胰腺癌是一种主要起源于胰腺导管上皮及腺泡细胞的恶性肿瘤,起病隐匿,早期诊断困难,进展迅速,生存时间短,是预后最差的恶性肿瘤之一,被称为“癌中之王”。
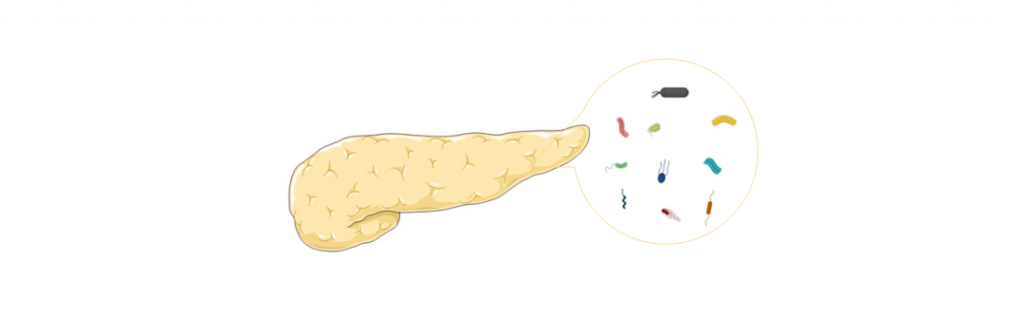
胰腺中存在细菌,胰腺癌患者细菌更多
胰腺以前被认为是一个完全无菌的器官。然而,在2017年,在人胰腺癌组织中发现了γ-变形杆菌。随后,其他研究通过 16S rRNA 测序、NGS 和免疫荧光鉴定了胰腺癌中的肠杆菌科、假单胞菌属和变形杆菌科等细菌。
用16S rRNA基因特异性PCR对胰腺囊肿标本进行分析,发现优势菌:氨基酸球菌属(Acidaminococcus),埃希氏菌属(Escherichia),拟杆菌属(Bacteroides),志贺氏菌(Shigella)。
最近,对胰腺癌样本进行的16S rRNA荧光探针和qPCR实验都证实,与正常人相比,胰腺癌患者中存在的细菌约为正常人的1000倍。
肿瘤微生物可引发炎症,促进胰腺癌变
此外,胰腺组织中的真菌组相比正常组织富集度增加了3000倍,主要成分为马拉色菌(Malassezia)。研究表明,马拉色菌属激活并结合甘露糖结合凝集素(MBL)蛋白,触发诱导胰腺癌的补体级联反应。
此外,肿瘤微生物组中的代谢物可以引发炎症和免疫抑制反应,并产生有利于肿瘤进展的免疫抑制微环境,促进胰腺癌变。
微生物组与胰腺癌发生的关系
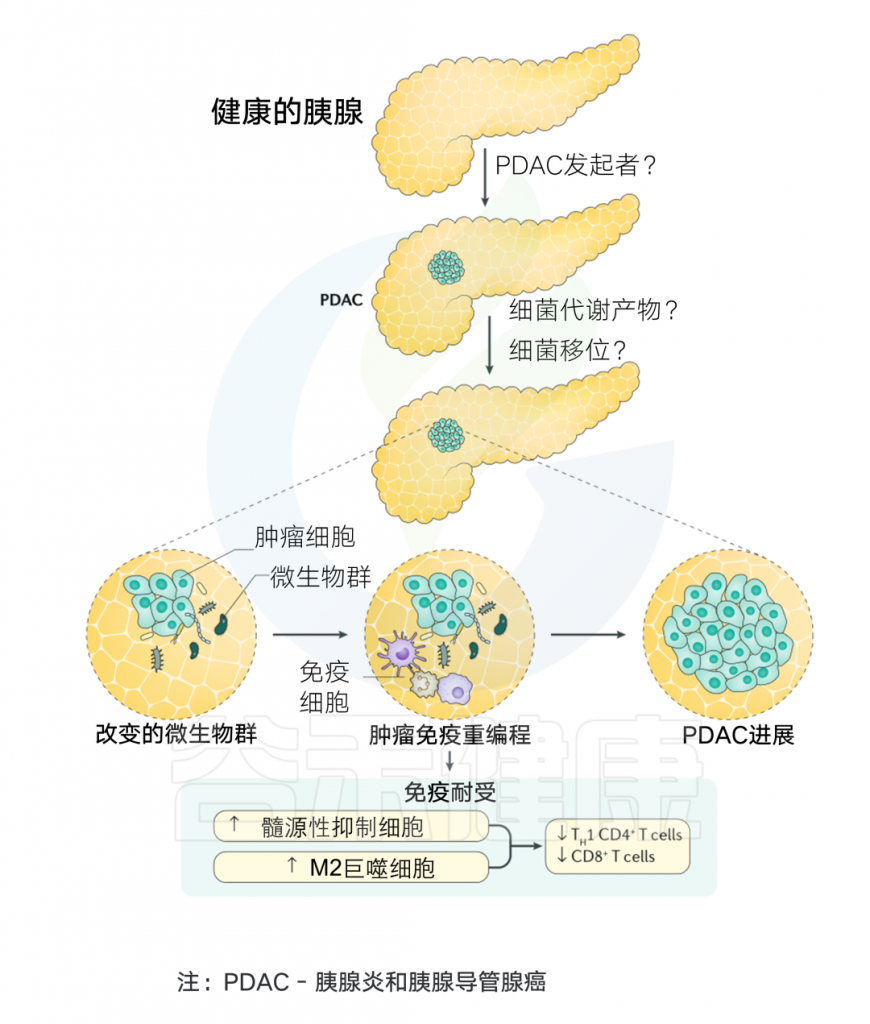
Thomas R M, et al.Nature Reviews Gastroenterology & Hepatology.2019
乳腺癌是常见的癌症之一,也是全球女性癌症相关死亡的主要原因。
乳腺癌组织中的微生物稳态受到破坏
与正常乳腺组织相比,乳腺癌组织中的细菌 DNA 总水平较低,并且这些水平随着癌症的进展而持续下降,这表明癌症可能会破坏微生物组稳态。此外,已经确定肠道微生物群中预先存在的干扰增加了乳腺癌细胞转移,但还需要更多的研究来确定这些发现在临床环境中的相关性。
进一步表征乳腺组织中的正常微生物群和乳腺癌组织中的群落结构变化,可能会确定乳腺癌预防和诊断的新靶点。
阴道微生物组影响卵巢癌、子宫内膜癌和宫颈癌的发生和进展。研究表明,阴道细菌多样性的增加和乳杆菌丰度的降低可能导致持续的HPV感染。
阴道微生物组与HPV感染、宫颈上皮内瘤变相关
评估了250名女性的阴道菌群,证明了阴道微生物组、HPV感染与宫颈上皮内瘤变之间存在联系。阴道微生物群以阴道加德纳菌为主,其次是 Lactobacillus iners、Lactobacillus crispatus、Lactobacillus taiwanensis。
与健康女性相比,子宫肌瘤(UF)患者的宫颈和阴道微生物群相互作用和相对微生物丰度发生了改变。Erysipelatoclostridium、Mucispirillum、Finegoldia相对丰富,而Finegoldia的丰度降低,这表明子宫肌瘤患者可能存在宫颈和阴道微生物群的生态失调。
促炎微生物群与前列腺癌有关
前列腺癌是男性人群中常见的癌症,前列腺癌和非前列腺癌患者的尿液测序显示,促炎微生物群与泌尿生殖系统感染和前列腺癌有关。
研究报告了前列腺癌中促炎拟杆菌和链球菌丰度的显著差异,叶酸和精氨酸途径显著改变。对前列腺肿瘤微环境的分析显示,与非肿瘤组织相比,肿瘤/肿瘤周围组织中的葡萄球菌(Staphylococcus)明显更多,而丙酸菌属(Propionibacterium)在所有测试的肿瘤/肿瘤周围和非肿瘤组织中最为丰富。
病例对照研究还发现,良性对照受试者和前列腺癌男性的肠道微生物组的组成有很大不同,这可能适应前列腺癌的发病机制和对其危险因素的进一步研究。特别是,与对照组相比,前列腺癌病例中Bacteroides massiliensis的相对丰度较高,而对照组中普氏栖粪杆菌(Faecalibacterium prausnitzii)和直肠真杆菌(Eubacterium rectalie)的相对丰度较高。
超过700种不同的微生物定植于人类口腔,健康人的口腔微生物群保持相对稳定。而口腔癌患者的口腔微生物群发生了变化。
口腔癌患者丰度和多样性比正常人群更高
对121例患者的分析显示,与健康个体相比,口腔癌患者的戴阿利斯特杆菌属(Dialister)含量显著增加,放线菌属、乳酸菌属和链球菌属丰度显著降低。牙龈卟啉单胞菌和核镰刀菌等主要牙周病原菌的慢性感染可增强IL-6-STAT3 轴信号传导并诱导口腔鳞状细胞癌。
使用16S rDNA测序来表征口腔鳞状细胞癌(OSCC)组织的微生物群,肿瘤部位细菌的丰度和多样性显著高于来自同一患者的正常组织样本。在OSCC样本中检测到梭杆菌属、卟啉单胞菌属、消化链球菌科、Flavobacteriaceae、Prevotellaceae和Campylobacteraceae,可能是诊断标志物和治疗靶点。
肿瘤微生物组与肿瘤发生、发展和转移密切相关,研究人员认为可以将多态性微生物组列为肿瘤的标志。接下来,我们将讲述肿瘤微生物组与肿瘤之间关系的代表性机制。
肿瘤微生物组与肿瘤密切相关
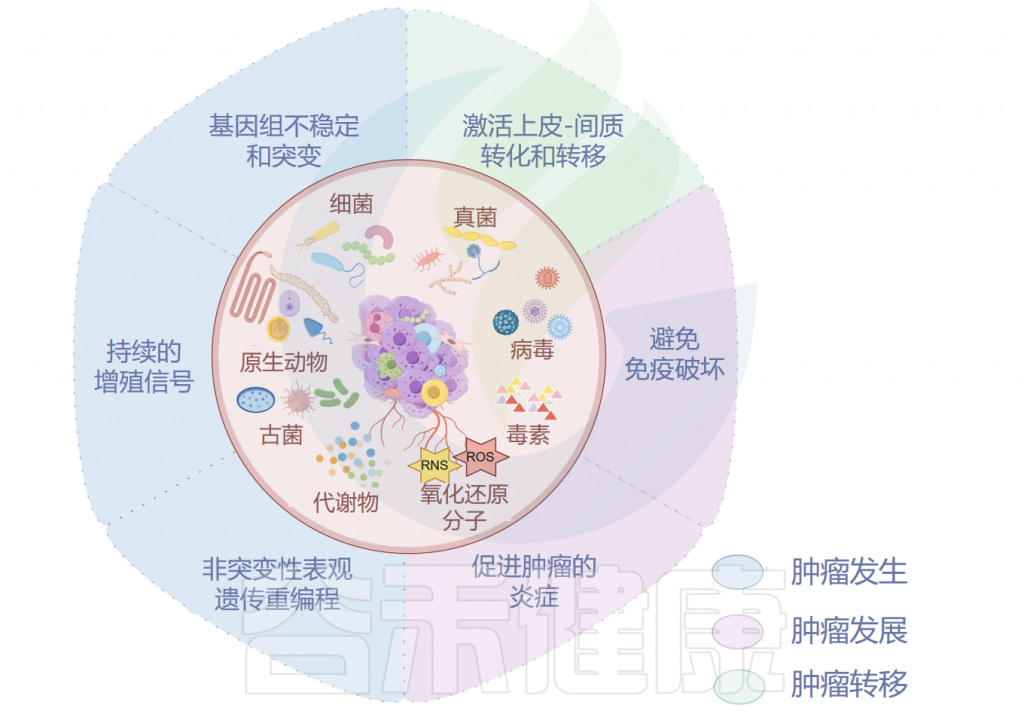
Ma Y,et al.Microb Pathog.2024
▸ 与肿瘤发生之间的关系
已被证明有助于肿瘤发生的肿瘤微生物组成分包括毒素、代谢物、酶和触发氧化应激的反应性小分子。这些物质可通过诱导基因组不稳定、表观遗传修饰和刺激宿主细胞的持续增殖而导致癌症。
细菌产生的毒素破坏基因稳定性并导致氧化应激
例如,由聚酮合酶阳性(pks+)大肠杆菌产生的大肠杆菌素和空肠弯曲菌分泌的细胞致死性膨胀毒素(Cdt)具有DNA酶活性,可以直接降解双链DNA,也可以导致DNA烷基化,从而在表观遗传水平上破坏基因组的稳定。
毒素介导的对DNA结构的间接损伤也可能是由反应性小分子的失衡引起的,例如脆弱拟杆菌毒素(BFT),它通过增加活性氧(ROS)的水平来诱导宿主细胞中的氧化应激。
此外,许多研究证实了肿瘤发生与癌微生物群产生的代谢物之间的联系。黄曲霉毒素B1(AFB1)是黄曲霉的代谢产物,可与DNA中的鸟嘌呤残基形成DNA加合物并诱导DNA损伤,最终致癌。在肝脏中,细胞色素P450酶参与AFB的代谢,它经历环氧化并转化为具有遗传毒性的8,9-环氧化物。8,9-环氧化物随后形成DNA加合物并促进突变,导致肝细胞癌的发展。
丁酸表达异常可能导致上皮细胞过度增殖
丁酸盐是一种短链脂肪酸,由结肠中的细菌发酵可溶性纤维衍生而来,是首选的宿主能量底物,可抑制结肠癌的发展。
丁酸抑制组蛋白脱乙酰酶(HDACs)和 DNA 修复蛋白的表达,在表观遗传水平上调节细胞增殖和凋亡,并减轻淋巴瘤。然而,在错配修复缺陷(dMMR)小鼠模型中,丁酸与结肠上皮细胞的过度增殖有关。
除了遗传起源外,表观遗传,包括由DNA甲基化、组蛋白甲基化和组蛋白乙酰化驱动的表观遗传,可以驱动宿主细胞恶性转化为癌细胞。
致癌微生物会驱动肿瘤的发生
EB病毒(EBV),也称为人类疱疹病毒4型(HHV-4),是一种致癌病毒,可诱导表观遗传变化以驱动肿瘤发生。溶原性EBV可诱导基因组不稳定并改变免疫逃逸,而潜伏的EBV有助于肿瘤细胞获得干性。
注:肿瘤干性被认为是肿瘤发展的关键组成部分
具核梭杆菌(F.nucleatum)通过钙黏附蛋白(E-cadherin)和粘附A蛋白(FadA)与癌细胞或免疫细胞结合,并激活β-catenin和Wnt信号通路以促进癌细胞增殖。
微生物组产生的炎症反应会增加对肿瘤的易感性
肿瘤微生物组产生炎症反应,以增加宿主对肿瘤的易感性。肿瘤微生物群的抗原表位被肿瘤微环境(TME)中的模式识别受体(如Toll样受体)识别,并导致活性氧、细胞因子和趋化因子等炎症介质的诱导,触发促进血管生成、癌细胞增殖以及肿瘤生长和进展的信号级联反应。
口腔牙龈卟啉单胞菌在癌症和胰腺导管腺癌中定植,促进CXCR2介导的中性粒细胞浸润,增强中性粒细胞弹性蛋白酶分泌,重塑肿瘤的炎症微环境,从而导致癌症进展。结直肠癌中,牙龈卟啉单胞菌激活造血NLRP3炎症小体,招募髓细胞,创造促炎微环境,与结直肠癌的发展和不良预后相关。
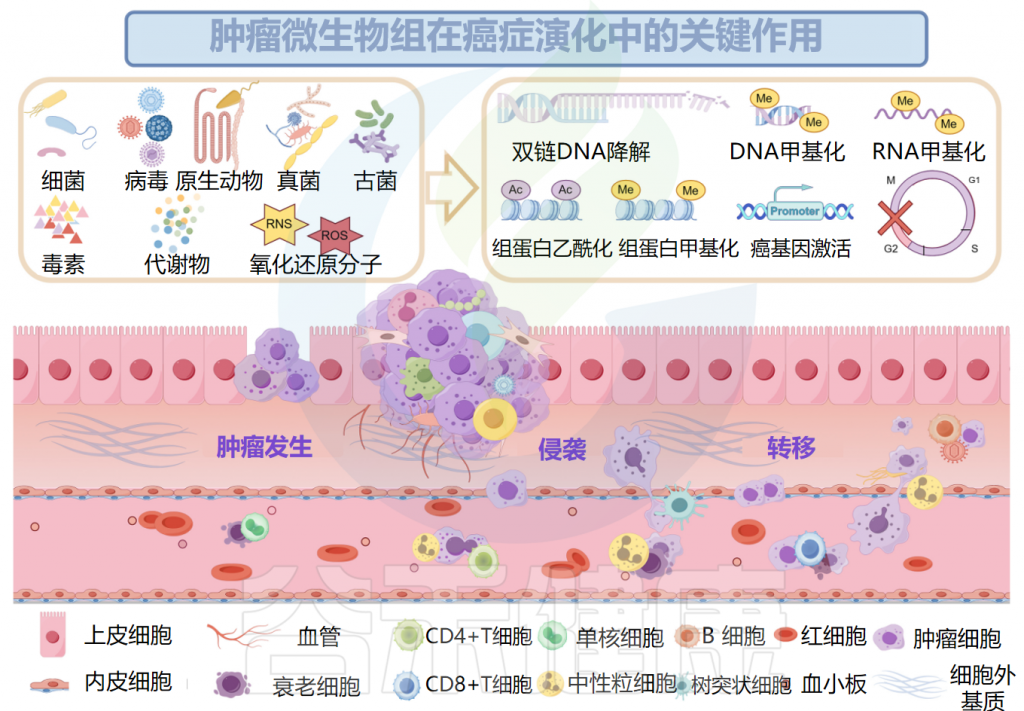
Ma Y,et al.Microb Pathog.2024
!
代谢物可能促癌也可能抑制癌症
重要的是要注意,代谢物的活性取决于肿瘤类型。色氨酸是变形杆菌和放线菌的能量来源,其代谢衍生物吲哚-3-醛激活肿瘤相关巨噬细胞中的芳烃受体(AHR),改变炎症基因的表达,随后可能诱发结直肠癌。
相反,在黑色素瘤中,罗伊氏乳杆菌代谢产生的吲哚-3-醛通过IFN-γ激活CD8+T 细胞中的AHR并增强免疫检查点抑制剂的疗效,从而促进肿瘤治疗。
▸ 与肿瘤发展之间的关系
肿瘤微生物群及其结构成分调节宿主代谢和免疫力,从而影响肿瘤的发展。
抑制自然杀伤细胞并促进肿瘤发展
除了激活长链非编码RNA ENO1-IT1的转录并影响组蛋白修饰外,具核梭杆菌(F.nucleatum)还调节结直肠癌细胞中的糖酵解途径,抑制自然杀伤细胞的活性并促进肿瘤发展。
肿瘤微生物的作用在不同肿瘤中可能有所不同,而不同生物体也可能在肿瘤中产生相同的生理效应。
例如,食管癌中的具核梭杆菌(F.nucleatum)以趋化因子(CCL20)依赖性方式促进Treg淋巴细胞浸润到肿瘤中,从而增强了肿瘤的侵袭性。在结直肠癌中,具核梭杆菌通过CCL20诱导巨噬细胞M2型极化参与肿瘤转移。
口腔鳞状细胞癌(OSCC)是一种起源于口腔粘膜复杂鳞状上皮的恶性肿瘤。具核梭杆菌激活自噬途径可促进体内癌细胞的迁移和侵袭。
同样,产气荚膜梭菌肠毒素诱导紧密连接蛋白Claudin 4(CLDN4)的核转位,增强OSCC细胞的增殖、迁移和侵袭,抑制YAP1磷酸化,促进YAP1表达以驱动肿瘤进展。
▸ 与肿瘤转移之间的关系
癌症转移是指肿瘤从原发部位迁移到远端器官的复杂过程,形成继发性肿瘤,是恶性肿瘤的一个重要标志。在发现癌微生物组作为肿瘤成分后,多项研究表征了癌微生物组在肿瘤转移中的作用。
调节上皮-间充质转化的激活
上皮-间充质转化(EMT)是将上皮细胞转化为间充质细胞的过程,其特征是细胞间极性和粘附丧失,运动和迁移增加。EMT的激活是肿瘤适应恶劣环境以促进侵袭和转移的关键策略,也可以由肿瘤微生物组调节。
在口腔癌小鼠模型中,具核梭杆菌(F.nucleatum)分泌的外膜囊泡调节EMT相关蛋白的表达,上调波形蛋白和神经钙网蛋白(N-cadherin)的表达,下调E-钙网蛋白(E-cadherin)的表达,从而促进口腔癌转移。
白色念珠菌是口腔癌菌群的主要组成部分,分泌蛋白酶诱导上皮细胞整合素的变化,增加E-钙粘蛋白表达,增强口腔癌的EMT表型,并促进侵袭和转移。
定植于乳腺导管腺癌的产肠毒素脆弱拟杆菌(ETBF)分泌的毒素可影响 Slug 和 Twist(EMT 标志物)的表达,并激活 β-catenin 和 Notch1 信号通路,促进肿瘤转移。
驱动细胞因子产生刺激癌细胞增殖和迁移
在胰腺癌中,具核梭杆菌(F.nucleatum)通过Fap-2依赖性途径靶向胰腺癌细胞紧密连接。这种相互作用驱动细胞因子的产生,这些细胞因子刺激癌细胞增殖并促进通过自分泌和旁分泌途径的迁移,最终驱动恶性肿瘤进展。
此外,紧密连接的破坏会激活YAP信号转导,从而抑制FOXD3的表达,从而降低m6A甲基转移酶甲基转移酶样3(METTL3)的表达。这随后降低了m6A甲基化,并促进了靶驱动蛋白家族成员26B的表达,从而驱动结直肠癌转移。
分泌细胞外囊泡,促进胰腺癌转移
最后,胰腺肿瘤微生物群可以分泌小的细胞外囊泡(sEVs),这些囊泡重塑细胞外基质,促进血管生成,并形成转移前生态位,促进胰腺癌转移。
与转移相关的肿瘤微生物群的研究

doi.org/10.1016/j.tcb.2022.11.007
对肿瘤微生物组及其异质性的研究发现了其在肿瘤诊断、预防和治疗方面的重要作用。
★ 有助于作为早期癌症的诊断标志物
迄今为止的研究表明,肿瘤微生物组可用作早期癌症诊断的标志物。幽门螺杆菌、梭杆菌、肠球菌属、沙门氏菌属、假单胞菌属和双歧杆菌属在特定的肿瘤部位富集,它们的检出可能用于诊断。
例如在原发性人类结肠癌和远处转移中检测到梭杆菌门(Fusobacteria),而使用甲硝唑抗生素治疗可以消除梭杆菌,并减缓肿瘤生长速度。
肝脏中Stenotrophomonas maltophilia丰度的增加诱导了肝星状细胞的细胞衰老相关的分泌表型(SASP),从而促进了肝癌发生。
微生物组对肿瘤细胞和免疫细胞的特异性机制
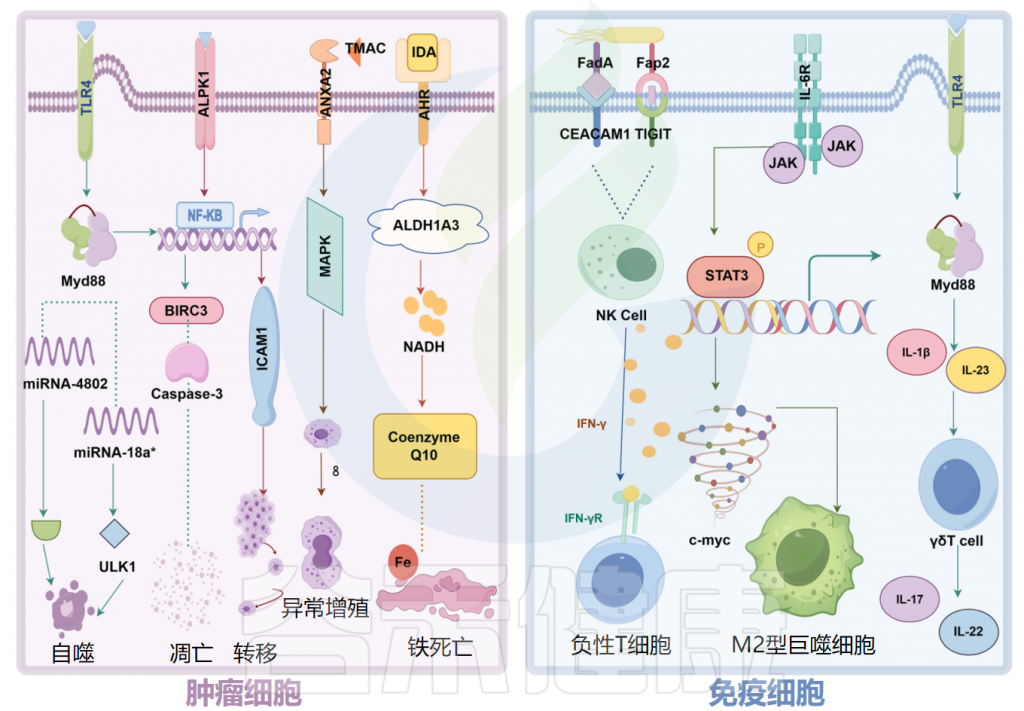
Ma Y,et al.Microb Pathog.2024
测序技术的广泛使用大大提高了我们研究肿瘤微生物组的能力。这些测序技术包括16S rRNA测序、DNA测序、下一代测序技术(NGS)、表观遗传学测序(例如染色质免疫沉淀测序和DNA/RNA甲基化测序)和三维(3D)基因组技术。
肿瘤内微生物的生物量相对较低,这导致了多路复用16S rRNA 测序方案的开发,以最大限度地减少污染并准确表征癌微生物组。
例如,利用qPCR和16S测序技术从肿瘤组织获取测序数据,并构建了一个表征肿瘤微生物组的数据库,实现了检测灵敏度103-104每克组织对应的细菌数。
宏基因组是一种针对样本中所有DNA的非靶向测序方法,包括微生物群落的全基因组序列,广泛应用于复杂微生物组的分析。宏基因组的分辨率更高,可以达到物种甚至菌株水平。此外,宏基因组学可以提供功能信息。最近的研究表明,宏基因组数据涵盖了更多类型的癌症,这可能促进肿瘤内微生物群领域的新进展。
代谢组学,特别是质谱法,可以检测和表征人类微生物群产生的小分子,并了解这些微生物代谢物的功能作用。这提高了我们研究肿瘤微生物群的能力,并可能开发出非侵入性的诊断性肿瘤生物标志物。
微生物产生的多种细胞毒性代谢物在肿瘤发生和发展中起着至关重要的作用。单一的实验技术可能不足以完全解释肿瘤和微生物之间的复杂相互作用,需要基因组学、转录组学、蛋白质组学和代谢组学的组合来了解各种代谢物在调节肿瘤发生和发展中的作用。
肿瘤微生物组检测技术

Ma Y,et al.Microb Pathog.2024
▸ 微生物组在癌症治疗中的作用
现有的癌症疗法很多,化疗、放疗等方式虽然有效,但副作用较多;免疫疗法有其局限性,有效率低且针对癌症类型有限。
靶向肿瘤微生物组的治疗方法可能通过增强宿主抗肿瘤免疫、诱导肿瘤细胞焦亡、促进CD8+ T 细胞活性以及避免干扰健康组织及其相关微生物群来改善肿瘤的治疗。
肿瘤微生物组在肿瘤治疗中的应用
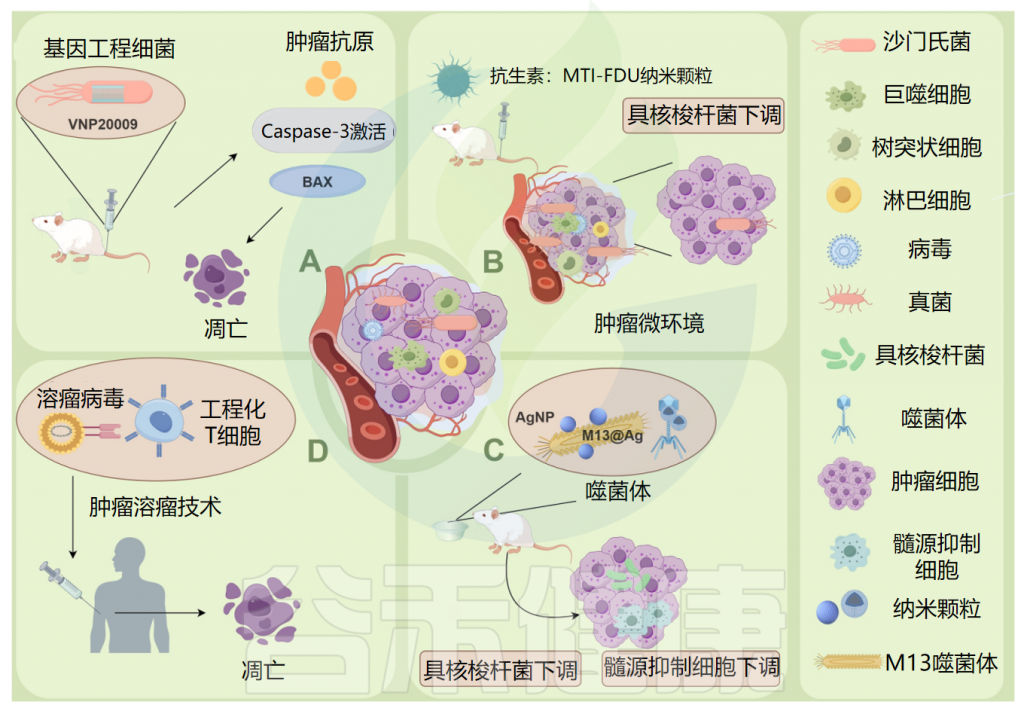
Ma Y,et al.Microb Pathog.2024
例如:(A)将基因工程减毒细菌菌株VNP20009直接递送到肿瘤发生部位,以及caspase-3凋亡酶活性的增加和促凋亡蛋白 Bax 的表达,显著诱导小鼠胰腺肿瘤细胞坏死,可作为杀死胰腺肿瘤的有效药物。
(B)甲硝唑-氟尿嘧啶利用增强的渗透性和保留作用,靶向肿瘤中的微生物群和肿瘤细胞,可以有效地从结直肠癌癌症组织中去除具核梭杆菌(F.nucleatum),具有低毒性和副作用。
(C)ONCOTECH(溶瘤病毒T细胞嵌合体)递送技术不仅增强了溶酶体病毒的靶向递送,而且改善了肿瘤微环境,能够在肿瘤中诱导长期免疫记忆。
(D)M13噬菌体特异性结合具核梭杆菌,在其表面外壳蛋白上静电组装银纳米粒子(AgNP)(M13@Ag),从肿瘤中去除具核梭杆菌,导致肿瘤部位髓系衍生抑制细胞(MDSC)减少。
除此之外,许多研究和谷禾的检测数据发现肠道微生物群可以调节癌症治疗,针对性地提高治疗效果并预防不良反应。
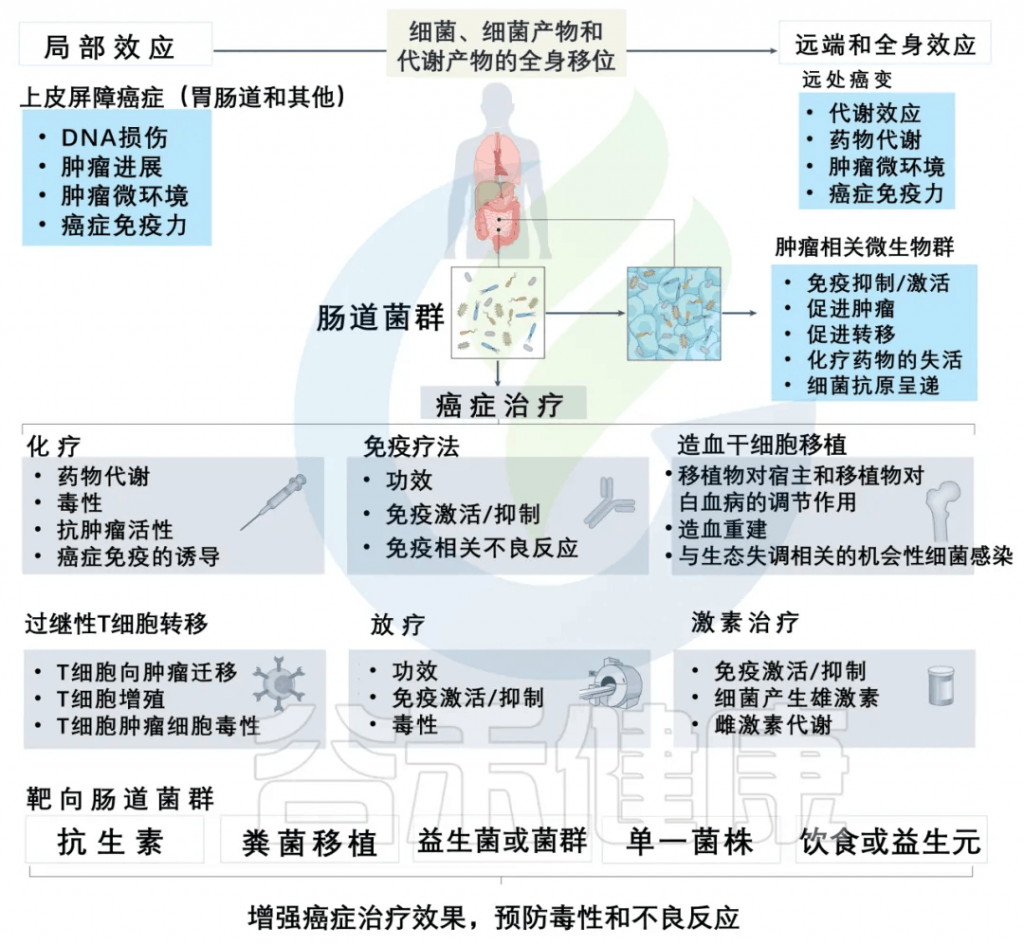
减轻化疗副作用,提高治疗效果
一些证据清楚地表明,调节肠道菌群可以减轻化疗药物的副作用,提高治疗效果。

减轻放疗毒性
在进行异基因造血干细胞移植预处理过程中,观察到患有白血病的患者的粪便样本中存在着毛螺菌科(Lachnospiraceae)和肠球菌科(Enterococcaceae)。这些患者在接受全身放疗治疗时出现的肠道毒性较轻。
几项研究表明,产生短链脂肪酸的益生菌,如乳酸杆菌和双歧杆菌,可以预防全身放疗治疗毒性。可能对癌症免疫和治疗毒性产生复杂影响,包括粘膜保护作用,部分由ANGPTL4、IL-18和IL-22的诱导介导,以及通过Treg细胞诱导和抑制树突状细胞功能介导的对立的免疫调节效应。
影响免疫疗法的效果
当前的癌症免疫疗法集中于利用特异性抗体来自我调节癌症免疫周期,这确保了应答的传播而没有生物中断。
微生态的改变会中断和削弱化学信号,导致致病状态,包括与炎症相关的疾病和癌症。
肠道微生物群对抗癌免疫反应的调节活性也与通过微生物群影响PD-L1和CTLA-4抑制剂的疗效有关。当与双歧杆菌的口服给药相结合时,PD-L1特异性抗体疗法的给药可以显著调节肿瘤的发展,在小鼠模型中肿瘤的生长几乎被消除。
我们预计肿瘤微生物组的研究将继续引起关注。然而,肿瘤微生物组在肿瘤预防和诊断中的应用,还存在着一些挑战。包括以下几点:
(一)人类微生物组在健康人群中的差异
同一个体在不同年龄的微生物组组成是可变的,更不用说不同个体中的微生物组成差异。部分原因是微生物组受饮食习惯、生活环境、药物暴露、生活方式和其他因素的影响。
因此,一个重大的挑战是根据微生物组的变化来确定个体的健康状况和癌症风险。未来,研究应探索肿瘤微生物组与环境、饮食和个人因素之间的相互作用。
(二)肿瘤微生物组的内容非常多样化
迄今为止已发表的大多数研究主要集中在细菌组上,而分析真菌组或病毒组的研究较少。此外,缺乏关于微生物组在非粘膜器官来源的肿瘤发展中的作用的数据。对肿瘤微生物组中微生物之间的关系也了解有限。例如,目前尚不清楚肿瘤微生物组中不同种类的细菌和真菌以及不同的病毒家族是相互独立的、协同的还是拮抗的。
(三)缺乏微生物代谢物等机制细节
尽管一些研究已经阐明了微生物改变肿瘤发生和发展的机制,但大多数仅具有相关性,缺乏与肿瘤发生因果关系的直接证据。特别是,其中许多研究无法确定微生物在肿瘤中定植的时间点。并且缺乏机制细节,主要集中在微生物种类的检测上,而忽略了分泌的毒素、代谢物和其他产物的功能。
未来的临床进展需要更精确地鉴定细菌分类单元对癌症早期诊断和治疗的因果关系,并了解其作用机制,因此需要进行更广泛的试验。改进的细菌可能作为抗癌药物,甚至可被改造成“微型机器人”用于药物传递。
总体而言,这一领域的发展为癌症患者提供了新的治疗选择和希望,但也需谨慎评估和监测以确保安全性和有效性。
微生物群在开发癌症诊断和抗癌策略中的重要性和潜力值得强调,将微生物调节疗法纳入癌症管理的整体方法很有必要。未来,我们有望实现更精准和个性化的菌群调节策略,为癌症治疗带来更大突破。
主要参考文献
Ma Y, Chen T, Sun T, Dilimulati D, Xiao Y. The oncomicrobiome: New insights into microorganisms in cancer. Microb Pathog. 2024 Oct 29;197:107091.
Azevedo MM, Pina-Vaz C, Baltazar F. Microbes and Cancer: Friends or Faux? Int J Mol Sci. 2020 Apr 28;21(9):3115.
Wong-Rolle A, Wei HK, Zhao C, Jin C. Unexpected guests in the tumor microenvironment: microbiome in cancer. Protein Cell. 2021 May;12(5):426-435.
Gagliani N, Hu B, Huber S, Elinav E, Flavell RA. The fire within: microbes inflame tumors. Cell. 2014 May 8;157(4):776-83.
Nejman D, Livyatan I, Fuks G, Gavert N, Zwang Y, Geller LT, Rotter-Maskowitz A, Weiser R, Mallel G, Gigi E, Meltser A, Douglas GM, Kamer I, Gopalakrishnan V, Dadosh T, Levin-Zaidman S, Avnet S, Atlan T, Cooper ZA, Arora R, Cogdill AP, Khan MAW, Ologun G, Bussi Y, Weinberger A, Lotan-Pompan M, Golani O, Perry G, Rokah M, Bahar-Shany K, Rozeman EA, Blank CU, Ronai A, Shaoul R, Amit A, Dorfman T, Kremer R, Cohen ZR, Harnof S, Siegal T, Yehuda-Shnaidman E, Gal-Yam EN, Shapira H, Baldini N, Langille MGI, Ben-Nun A, Kaufman B, Nissan A, Golan T, Dadiani M, Levanon K, Bar J, Yust-Katz S, Barshack I, Peeper DS, Raz DJ, Segal E, Wargo JA, Sandbank J, Shental N, Straussman R. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science. 2020 May 29;368(6494):973-980.
Poore GD, Kopylova E, Zhu Q, Carpenter C, Fraraccio S, Wandro S, Kosciolek T, Janssen S, Metcalf J, Song SJ, Kanbar J, Miller-Montgomery S, Heaton R, Mckay R, Patel SP, Swafford AD, Knight R. Microbiome analyses of blood and tissues suggest cancer diagnostic approach. Nature. 2020 Mar;579(7800):567-574.
Narunsky-Haziza L, Sepich-Poore GD, Livyatan I, Asraf O, Martino C, Nejman D, Gavert N, Stajich JE, Amit G, González A, Wandro S, Perry G, Ariel R, Meltser A, Shaffer JP, Zhu Q, Balint-Lahat N, Barshack I, Dadiani M, Gal-Yam EN, Patel SP, Bashan A, Swafford AD, Pilpel Y, Knight R, Straussman R. Pan-cancer analyses reveal cancer-type-specific fungal ecologies and bacteriome interactions. Cell. 2022 Sep 29;185(20):3789-3806.e17.
El Tekle G, Garrett WS. Bacteria in cancer initiation, promotion and progression. Nat Rev Cancer. 2023 Sep;23(9):600-618.
革兰氏阳性和阴性菌
在日常生活中,我们常常会看到药物或抗菌产品适应症会这样写到,对革兰氏阳性菌有效,对革兰氏阴性菌敏感,或者说对革兰氏阴性菌有效,对革兰氏阳性菌无效。可能很多人不是很清楚或搞不懂二者的区别。
本文主要介绍革兰氏阳性和阴性菌,它们的区别,代表性菌种以及针对用药等。
1884年,细菌学家Hans Christian Gram发明了革兰氏染色法来鉴别区分细菌。这种技术将细菌分成两大类,即革兰氏阳性菌(G+)和革兰氏阴性菌(G-)。区分主要是这两类细菌细胞壁成分不同,因而着色也不同所致。
这两类细菌的生理结构,疾病原因以及抗菌作用不一,因此,区分病原菌是革兰氏阳性菌,还是阴性菌,在临床确定感染和选择用药方面意义重大。
革兰氏阴性菌致病多由于患者有基础疾病或者体质比较差,肠道细菌感染引起的腹泻多是由肠道菌群中的革兰氏阴性菌所致,如大肠杆菌、沙门氏菌、志贺氏菌,布氏杆菌等,治疗这类细菌感染,一般使用三代头孢菌素以及喹诺酮类抗生素。注意大多数革兰氏阴性菌对青霉素耐药或不敏感。
大多数化脓性球菌都属于革兰氏阳性菌,它们能产生外毒素使人致病,常见的菌种有葡萄球菌、链球菌、肺炎双球菌、李斯特菌、炭疽杆菌、白喉杆菌、破伤风杆菌等。尤其在人体肠道内,革兰氏阳性致病菌致病几率更大。大多数由革兰氏阳性菌引起的感染可以用相当少量的抗生素治疗。青霉素、氯唑西林和红霉素足以覆盖 90% 的革兰氏阳性感染。
此外,某些广谱抗生素对革兰氏阳性菌和革兰氏阴性菌都有抗菌作用,如氨苄青霉素、庆大霉素、土霉素、磷霉素及环丙沙星等,但是作用效果可能不是最优。此外,磺胺类药物也属于广谱抑菌药物。
临床应用时,如果对细菌感染比较明确,尽量使用窄谱抗菌药物,如不太明确,可选用广谱抗菌药物。因此,临床治疗疾病时,首先要对药物的作用与用途要详细了解,然后再根据感染类型或诊断结果合理选择药物,这样才能取得最佳治疗效果。否则,药物选择不当,将会出现无效或越治越重的结果。
革兰氏阴性菌和革兰氏阳性菌之间的主要区别在于肽聚糖层的厚度和外部脂质膜的存在与否。
不同细菌的革兰氏染色
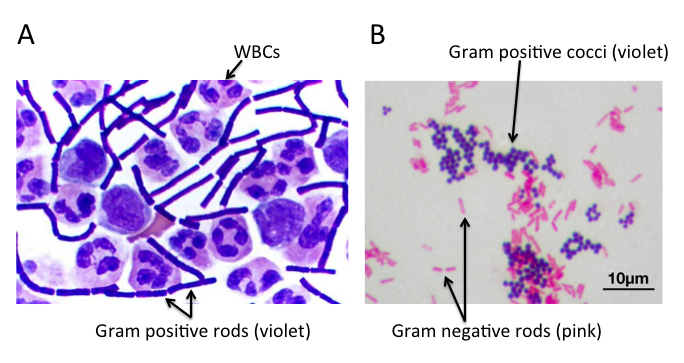
A) 脑脊液样本中的杆状革兰氏阳性炭疽杆菌(导致炭疽),也含有白细胞。B) 革兰氏阳性金黄色葡萄球菌(紫色或紫色)和革兰氏阴性杆菌大肠杆菌(粉红色)的革兰氏染色,它们是最常用的革兰氏染色参考细菌。参考来源:Wikipedia commons 和 tmedweb)
// 缺乏外膜,更容易受抗生素影响
革兰氏阳性菌的细胞壁含有肽聚糖、脂质、磷糖醛酸和磷壁酸。这种结构成分不同于由肽聚糖和外膜(由脂质、蛋白质和脂多糖组成)组成的革兰氏阴性细菌细胞壁。尽管革兰氏阳性菌具有较厚的肽聚糖层,但它们比革兰氏阴性菌更容易受到某些靶向细胞壁的抗生素的影响,因为它们缺乏外膜。
// 常见的致病菌
最常见的革兰氏阳性细菌包括葡萄球菌、链球菌、芽孢杆菌、梭状芽孢杆菌、李斯特菌、棒状杆菌等。这些革兰氏阳性菌的代表性物种是致病的,并可能引起多种疾病。
// 可用于治疗的抗生素
青霉素是影响革兰氏阳性菌的主要抗生素之一。
红霉素是另一种用于治疗革兰氏阳性细菌感染的强效抗生素。红霉素属于一类称为大环内酯类的抗生素,与阿奇霉素和克拉霉素同属一类。它通常用于对青霉素过敏的人。
甲氧苄啶/磺胺甲恶唑,克林霉素,克林霉素,强力霉素,万古霉素也可以用于特定的革兰氏阳性菌的感染。
// 层层抵抗更难杀死:细胞壁更硬,可改变外膜
革兰氏阴性菌有坚硬的保护外壳。它们的肽聚糖层比革兰氏阳性杆菌薄得多。
当它们的细胞壁受到干扰时,革兰氏阴性细菌会释放内毒素,症状更糟。同时,大多数抗生素为了接近它们的目标,必须通过外膜。例如,亲水性抗生素通过孔蛋白。革兰氏阴性菌可以通过改变它们的疏水特性或通过孔蛋白的突变来改变它们的外膜。这对这些细菌细胞产生了抵抗力。
// 暗藏玄机:比革兰氏阳性菌更危险
与革兰氏阳性菌相比,革兰氏阴性菌作为疾病生物体更危险,因为存在覆盖外膜的荚膜或粘液层。通过这种方式,微生物可以隐藏表面抗原,这个抗原可以触发人体免疫反应。
革兰氏阴性菌是一组臭名昭著的细菌,可导致多种疾病,包括肺炎、脑膜炎、淋病、细菌性痢疾、霍乱、胃炎等。在重症监护病房 (ICU)的患者,处于发病和死亡的高风险中,更容易遇见这类细菌,因此它们在医院具有重要的临床意义。
// 可用于治疗的抗生素
已经开发了许多不同种类的抗生素来杀死革兰氏阴性菌,例如头孢菌素、叶酸拮抗剂、哌拉西林-他唑巴坦、脲青霉素、内酰胺-β-内酰胺酶抑制剂、碳青霉烯类和喹诺酮类。它们是专门针对革兰氏阴性细菌而开发的,不过有时也对某些革兰氏阳性细菌有效。
革兰氏阳性菌与革兰氏阴性菌区别总结

参考来源:microbenotes
以上是革兰氏阳性菌和阴性菌的主要区别,接下来我们针对革兰氏阳/阴性菌,从细菌特征,形状表征,细胞结构等方面,进行更详细的介绍。
革兰氏阳性菌的定义是基于它们在革兰氏染色中用酒精短暂洗涤后保留结晶紫染料的能力。革兰氏阳性菌呈紫色。
这些细菌具有非常独特的特征,可以将其与其他类型的细菌区分开来。这些包括:
在革兰氏染色过程中,革兰氏阴性细菌在用酒精清洗后将失去结晶紫染料的颜色,并吸收反染物藏红花的粉红色/红色。
几乎在地球上的每个生活区域都可能发现革兰氏阴性细菌。
尽管大多数细菌是通过革兰氏染色染料进行区分的,但显微镜下的观察揭示了更多可用于定义和表征这些细菌的特征。
根据形状的定义,革兰氏阳性菌可分为两类:
革兰氏阳性细菌形成的其他特殊形状包括:
革兰氏阴性菌细胞的显微镜观察范围从杆状到芽孢杆菌,从球菌到螺旋状,螺旋状是最常见的形状。然而,有些表现出特殊的形状,如球杆菌、四分体、栅栏、毛状体等。例如:
革兰氏阳性菌的细胞壁含有肽聚糖、脂质、磷糖醛酸和磷壁酸。这种结构成分不同于由肽聚糖和外膜(由脂质、蛋白质和脂多糖组成)组成的革兰氏阴性细菌细胞壁。因此,革兰氏阳性菌的细胞壁很厚,并吸收了革兰氏染色的结晶紫染料。因此,显微镜下的革兰氏阳性菌呈紫色。
革兰氏阳性细菌细胞壁的结构特征
革兰氏阳性细菌具有由肽聚糖组成的厚的多层细胞壁(因为它含有肽和糖的混合物)。由于肽聚糖存在于大多数细菌中,但不存在于哺乳动物细胞中,因此它是抗菌药物的良好靶标(例如细胞壁合成抑制剂,包括青霉素、头孢菌素和万古霉素)。
这些抗生素会干扰转肽酶(也称为青霉素结合蛋白或PBP 的活性) 在细胞壁中催化相邻聚糖链之间的交联。
细胞壁还含有磷壁酸纤维,有助于细菌附着在宿主细胞膜(例如粘膜细胞)上,释放后会引起感染性休克,类似于革兰氏阴性菌释放的内毒素 (LPS) 产生的感染。
β-内酰胺酶(青霉素酶)是由细菌产生的酶家族,可水解 β-内酰胺抗生素(其中许多也是细菌来源)的四原子 β-内酯环,从而使其抗菌性能失活。
细菌细胞膜还可以包含ABC 外排泵这可能导致抗生素耐药性和对那些具有细胞内作用机制的药物(例如 DNA 促旋酶抑制剂或蛋白质合成抑制剂)的多药耐药性 (MDR)。
结晶紫染料附着在革兰氏阳性菌细胞壁的厚肽聚糖层上,在光学显微镜下观察时将它们染成紫色或紫色。
肽聚糖
它也被称为胞壁质(murein),占细菌细胞壁含量的 90%。
——维持形状,并保持细胞壁强度和弹性
它是一种优质聚合物,由两种相同的糖衍生物(N-乙酰氨基葡糖和 N-乙酰胞壁酸)以及 L-氨基酸链和蛋白质中很少发现的三种不同 D-氨基酸(即 D-谷氨酸、D-丙氨酸和内消旋二氨基庚二酸)组成,可保护细胞壁免受肽酶的攻击。
D-氨基酸和L-氨基酸连接到N-乙酰壁酸,L-氨基酸特别是赖氨酸可以取代中二氨基丙烯酸。
肽聚糖亚基的这种相互连接使肽聚糖具有很强的维持细菌形状和完整性的能力,并具有弹性和延展性。
肽聚糖也具有渗透性,允许分子进出细菌细胞。
——肽聚糖的生物合成
抑制细菌细胞壁肽聚糖层的合成是许多抗菌药物的分子靶点,包括 β-内酰胺类抗生素(青霉素、头孢菌素、碳青霉烯类和单环内酰胺类)和糖肽类抗生素(万古霉素和其他较新的类似物)。
这些药物的两个主要分子靶标是转肽酶,也称为青霉素结合蛋白 (PBP),因为它们与青霉素结合,而糖基转移酶 (GT) 可被万古霉素等糖肽抑制。
PBPs 有许多亚型,给定的细菌菌株可以表达多种 PBPs。这些 PBP 在其生理特性和与抗生素相互作用的敏感性方面可能有所不同。取决于 PBP 亚型,糖基转移酶可以作为单独的酶或作为与转肽酶相关的二聚体存在。
革兰氏阳性细胞壁生物合成
图片来源自(Wikipedia Commons 和 tmedweb)
细菌细胞壁由重复的 N-乙酰氨基葡萄糖 (NAG) 和 N-乙酰胞壁酸 (NAM) 亚基链组成。NAM 亚基附有短肽链。
肽链的组成因细菌而异,但近端的丙氨酸通常是 L-Ala,而远端的两个通常是 D-Ala。也与青霉素结合的细胞壁转肽酶(青霉素结合蛋白:PBPs)在肽侧链之间形成键,并从肽侧链之一排出末端 D-丙氨酸。
一旦形成交联,PBP 就会从壁上解离。用糖基转移酶 (GT)分离酶结构域NAM 和 NAG 残基之间的活性形成联系。一些高分子量 PBP(例如 PBP2)是含有转肽酶和糖基转移酶结构域的酶复合物。
磷壁酸纤维存在于革兰氏阳性菌的细胞壁中,由磷酸甘油或磷酸核糖醇的聚合物组成。它们参与细菌与黏膜细胞的附着,可诱发感染性休克,类似于革兰氏阴性菌释放的 LPS(内毒素)。
磷壁酸
这是由甘油共聚物组成的加固墙。
磷壁酸是水溶性的,占细菌细胞壁总干重的 50%。
它要么直接与肽聚糖共价连接,要么与细胞膜(脂磷壁酸)连接。通过 6-羟基 N-乙酰胞壁酸与肽聚糖直接相连。
带负电荷,延伸到肽聚糖表面,使细菌细胞壁带负电荷。
它还有助于维持细胞壁的结构。
它在革兰氏阴性菌中完全不存在。
脂质
它们在肽聚糖下方有一层薄薄的脂质,大约 2-5%,其作用是锚定细菌细胞壁。
细胞壁
——细胞壁非常复杂
结合细胞外膜的主要作用,加上一层肽聚糖,其功能特性复杂,这里是对细胞壁及其功能部分的描述。
革兰氏阴性细菌的细胞壁具有一层2-7nm的肽聚糖薄层和7-8nm厚的外膜。
——周质空间较大
显微镜下,细胞膜和细胞壁之间有一个空间,称为由周质组成的周质空间。在革兰氏阴性菌和革兰氏阳性菌中均能发现,但在革兰氏阴性菌中,周质空间较大。
革兰氏阴性细菌细胞壁
在结构上,革兰氏阴性细胞壁由细胞膜外部的两层组成:一层薄薄的肽聚糖(太薄而无法吸收大量甲基紫染色)和一层外膜(革兰氏阴性细菌独有),通常含有促进小(<700 Da)亲水分子(例如糖、氨基酸和维生素)扩散的孔蛋白。
许多抗生素(例如许多青霉素和头孢菌素)也可以通过孔蛋白扩散到达它们的作用部位。
然而,万古霉素 (1449 Da) 的质量太大,无法透过孔蛋白到达其作用部位,这使其对革兰氏阴性细菌无效。因此,外膜为革兰氏阴性菌提供了对某些抗生素的固有“内在抗性”,可以通过改变孔蛋白的表达水平或改变孔蛋白的孔特性以降低抗生素的渗透性来进一步修饰。
革兰氏阴性菌的外膜还含有脂多糖 (LPS)或内毒素,可被细菌排出,引起宿主强大的免疫反应。
周质空间
革兰氏阴性菌的周质空间由几种蛋白质组成,这些蛋白质有助于获取营养,例如攻击核酸和磷酸化分子的水解酶,以及积极协助将物质运输到细菌细胞中的结合蛋白。周质空间还具有合成肽聚糖和修饰可能对细胞造成伤害的有毒元素的酶。
肽聚糖
革兰氏阴性细菌细胞壁有一层薄的肽聚糖层,位于质膜上方,约占细胞干重的5%。厚度不超过4纳米,一些细菌如大肠杆菌只有2纳米厚的肽聚糖。
外膜和脂多糖
革兰氏阴性菌还有第二层脂质双层,位于肽聚糖层的外部。这种外膜通过布劳恩脂蛋白与肽聚糖相连。外膜和肽聚糖之间的紧密连接是维持外膜作为许多有毒分子和抗生素的不渗透屏障所必需的。
外膜上的粘附位点也加强了革兰氏阴性细胞壁,这些粘附位点在允许细胞接触和膜融合方面发挥作用。物质通过这些粘附位点进入细胞。
革兰氏阴性菌结构

图源:Jeff Dahl,wikipedia
外膜主要由脂多糖 (LPS)组成,脂多糖是由脂质和碳水化合物组成的大型复杂分子。脂多糖由3个单元组成:脂质A、核心多糖和O侧链。
脂质A由两种氨基葡萄糖糖衍生物组成,每个衍生物含有三种脂肪酸和焦磷酸盐,脂多糖的任何剩余部分都会伸出膜表面。
O侧链也称为O抗原,是从核心向外延伸的链。它由导致细菌菌株之间变异的糖组成。这些 O 抗原也负责细菌逃避抗体反应。
// 外膜及其脂多糖的作用
——脂多糖负责保护细胞壁免受外部攻击
LPS 带有负电荷,使电池表面带负电荷。因此,这稳定了膜结构。
脂质A是脂多糖的有毒成分,因此它起到内毒素的作用。
——防毒素进入,防成分丢失
外膜及其脂多糖有助于防止抗生素、胆汁盐和其他有毒元素进入并破坏细胞。
外膜由孔蛋白组成,使其具有渗透性,允许小分子(如葡萄糖)进入。维生素 B12 等较大的分子通过特定的载体运输穿过外膜。
外膜还有助于防止成分丢失,特别是来自周质空间。
下表描述了主要的革兰氏阳性致病菌,它们的基本形态特征以及它们在人类中引起的疾病。

已知革兰氏阴性菌是正常菌群,部分会导致严重的人类感染,从社区获得性感染到医院感染。
革兰氏阴性菌外膜的结构是其众多显着特征之一。脂多糖 (LPS) 存在于膜的外叶上,其脂质 A 部分用作内毒素。
// 革兰氏阴性菌感染:严重时可危及生命
如果由于某种原因,革兰氏阴性细菌能够到达动物的循环系统,脂多糖将激活免疫系统,并触发先天免疫反应,产生细胞因子和激素调节剂。这会引起炎症,并可能导致毒性反应,从而导致发烧、呼吸急促和低血压。这就是已知革兰氏阴性细菌会导致危及生命的休克的原因。
内毒素休克的一些症状:
发烧和发冷或体温下降、发炎、皮疹、呼吸急促、心率加快、低血压、多器官衰竭等。
下表给出了一些革兰氏阴性致病细菌的例子以及它们在人类宿主中引起疾病和感染时表现出的临床特征。

如上表所述,已知革兰氏阳性细菌会引起多种感染,如果不及时和适当地治疗和管理,可能对人类造成灾难性的影响。
革兰氏阳性杆菌感染用抗生素治疗。青霉素、氯唑西林和红霉素可治疗 90% 以上的革兰氏阳性菌。
常见的革兰氏阳性抗菌药物及作用机制

然而,抗生素耐药性正在成为革兰氏阳性感染的一个严重问题。研究人员正在开发新的药物来帮助解决这个问题。只有在绝对需要时才应使用抗生素。需要严格遵循感染控制标准,以防止抗生素耐药性感染的发展和传播。
由于它们的外膜,这些细菌对溶菌酶和青霉素具有抗性。这是因为存在保护内膜和细胞壁的外壁。
在周质空间(两个细胞膜之间的区域)中也发现了分解或改变抗生素的酶。用于治疗革兰氏阴性菌感染的治疗方法包括羧基、氨基和脲基青霉素。为了对抗可以消化这些药物的酶,有时将它们与β-内酰胺酶抑制剂结合使用。β-内酰胺酶是一种存在于周质中的酶。
针对细菌病原体的抗菌剂被称为抗生素。这些抗生素启动针对细菌细胞的阻断或抑制机制,以诱导细菌细胞增殖和复制。
用于对抗革兰氏阴性菌的抗生素示例

抗生素耐药性是现在世界上的一个主要临床问题。
耐多药细菌在人群中变得越来越普遍,如果不进行有效治疗,这种感染可能会导致肾功能衰竭、败血症,甚至死亡。
微生物以多种方式抑制临床治疗中使用的许多抗菌剂。这些包括改变药物结合位点的方法,改变药物构象的方法,改变膜通透性的方法,可以导致耐药机制失活。
例如革兰氏阴性菌中有两层膜,外膜和内膜。脂多糖被认为是一种非常强的免疫反应诱导剂,它具有三个重要成分:脂质 A、亲水性多糖、抗原 O 的疏水域。
疏水域在细胞膜的外部表达。它是疏水成分脂质a,它负责内毒素作用。LPS 在细菌中是可变的,并且由于遗传变异,一些细菌只产生一种不被 Toll 样受体识别的弱抗原。然而,有大量的革兰氏阴性菌团体可能会引起这样的反应。免疫系统也被一些 toll 样受体 4 (TLR4) 激活,这些受体存在于与免疫系统有关的众多细胞中,如巨噬细胞、单核细胞、中性粒细胞和树突状细胞。
由 LPS 和 TLR4 受体介导的先天免疫反应的激活导致反应增强,产生细胞因子、趋化因子和干扰素等。
免疫系统的反应取决于感染过程的严重程度以及侵袭性细菌中 LPS 的结构,这与菌的毒力有关。因此,虽然一些细菌(如大肠杆菌)可以诱导免疫系统,但其他细菌(如幽门螺杆菌)仅具有弱抗原性。
// 对付耐药性细菌新思路:根据电荷相互作用原理设计新药
2017 年,伊利诺伊大学化学教授和当前研究的合著者Paul Hergenrother(ACPP 负责人/MMG)在《自然》杂志上报告说 ,发现的一个关键是,如果向它们添加带正电荷的基团,例如胺,一些抗生素可以使用特定的膜孔穿透革兰氏阴性细菌的细胞膜。
这项工作表明,抗生素上带正电荷的胺基与细菌孔内的负电荷有良好的相互作用。这些吸引力使带有胺基的抗生素以一种更有利于能量的方式排列,因为它穿过收缩区的孔的最狭窄部分。不含胺的抗生素面临更高的能量屏障去通过孔隙。
这或许意味着未来可以设计新药(或修改旧药),以攻击和杀死对抗生素治疗具有耐药性的微生物。
问
革兰氏阳性细胞和革兰氏阴性细胞之间的三个区别是什么?
答
革兰氏阳性菌有一层厚的肽聚糖作为它们的细胞壁,而革兰氏阴性菌有一层薄薄的肽聚糖和外膜。
革兰氏阴性菌有脂多糖(LPS),而革兰氏阳性菌没有。
一些革兰氏阳性细菌含有霉菌酸,它会在细胞壁上形成一层蜡质层。
问
什么是革兰氏阳性感染?
答
由革兰氏阳性菌引起的感染,如耐甲氧西林金黄色葡萄球菌 (MRSA)、耐万古霉素肠球菌 (VRE) 和艰难梭菌是常见的多重耐药菌感染。
问
革兰氏阳性菌更容易治疗吗?
答
革兰氏阳性细菌,即那些具有肽聚糖外层的物种,更容易被杀死——它们的厚肽聚糖层很容易吸收抗生素和清洁产物。因此,某些容易杀死革兰氏阳性菌的洗涤剂不会破坏革兰氏阴性菌。
问
肠道内很多革兰氏阳性菌致病吗?
答
是的,人体肠胃道的大多数革兰氏阳性菌都是条件致病菌。包括微球菌、肠球菌、金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、肺炎链球菌、草绿色链球菌、酿脓链球菌、无乳链球菌、破伤风梭菌、肉毒杆菌、产气荚膜梭菌、产气荚膜梭菌、艰难梭菌, 单核细胞增生李斯特菌等。
问
革兰氏阳性菌在哪里发现?
答
根据革兰氏阳性菌种,它们可以在人类的土壤、水生沉积物、灰尘、皮肤、口腔、肠道或生殖道中找到。
问
革兰氏阳性球菌危险吗?
答
革兰氏阳性菌可能是球菌或杆菌。这些称为常驻菌群的细菌通常不会引起疾病。革兰氏阳性杆菌引起某些感染,包括:炭疽。
问
革兰氏阳性菌对抗生素的抵抗力更强吗?
答
不是。与革兰氏阳性菌相比,革兰氏阴性菌对多种抗生素的耐药性更强。由于它们的外膜,它们对抗生素的抵抗力更强。
革兰氏阳性细菌更容易被杀死,因为它们的厚肽聚糖层很容易吸收抗生素和清洁剂。另一方面,革兰氏阴性细菌具有薄的肽聚糖层,不会吸收周围的任何异物。
问
革兰氏阳性菌有内毒素吗?
答
不会。内毒素与革兰氏阳性菌无关。这些细菌没有内毒素,因为它们没有外膜。另一方面,革兰氏阴性细菌会产生内毒素。
这些内毒素是革兰氏阴性细菌细胞外膜的一部分,只有当细胞裂解或细菌死亡时才会释放出来。内毒素是形成革兰氏阴性菌细胞壁结构的热稳定性脂多糖-蛋白质复合物。
问
为什么革兰氏阳性菌对抗生素更敏感?
答
尽管革兰氏阳性菌具有较厚的肽聚糖层,但它们比革兰氏阴性菌更容易受到某些靶向抗生素的细胞壁的影响,因为它们缺乏外膜。
大多数抗生素为了接近它们的目标,必须通过外膜。例如,亲水性抗生素通过孔蛋白。因此,革兰氏阴性菌可以通过改变它们的疏水特性或通过孔蛋白的突变来改变它们的外膜。这对这些细菌细胞产生了抵抗力。革兰氏阳性菌缺乏这一因素,因此革兰氏阴性菌对抗生素的抵抗力比它们强。
问
革兰氏阳性菌是否致病?
答
是的,大多数革兰氏阳性菌都是致病菌。致病性革兰氏阳性菌的实例包括微球菌、肠球菌、金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、肺炎链球菌、草绿色链球菌、酿脓链球菌、无乳链球菌、破伤风梭菌、肉毒杆菌、产气荚膜梭菌、产气荚膜梭菌、艰难梭菌, 单核细胞增生李斯特菌等。
问
革兰氏阳性菌引起的常见感染有哪些?
答
炭疽、白喉、腹泻、脑膜炎、恶心、皮肤感染、尿路感染。
问
哪种抗生素对革兰氏阳性菌有效?
答
对革兰氏阳性菌有效的抗生素是青霉素、氯唑西林和红霉素,几乎覆盖了 90% 的革兰氏阳性菌感染。其他还有万古霉素、甲氧苄啶/磺胺甲恶唑,克林霉素,克林霉素等。
问
革兰氏阴性菌引起的人类常见疾病有哪些?
答
革兰氏阴性菌会在医疗机构中引起感染,包括肺炎、血流感染、伤口或手术部位感染以及脑膜炎。此外还有霍乱、鼠疫、伤寒、脑膜炎和尿路感染是人类常见的细菌性疾病。
问
为什么革兰氏阴性菌比革兰氏阳性菌更有害?
答
革兰氏阴性菌细胞壁坚硬,不易对抗生素敏感,在抗生素作用下会释放内毒素。
问
什么会杀死革兰氏阴性菌?
答
这些抗生素包括头孢菌素类(头孢曲松-头孢噻肟、头孢他啶等)、氟喹诺酮类药物(环丙沙星、左氧氟沙星)、氨基糖苷类(庆大霉素、阿米卡星)等
问
革兰氏阴性菌的分泌系统是什么?
答
革兰氏阴性菌具有广泛封闭的分泌系统,可以转移微小分子、DNA、氨基酸、蛋白质。
问
革兰氏阴性菌从哪来?
答
革兰氏阴性细菌随处可见,几乎遍布地球上所有支持生命的环境。革兰氏阴性菌包括模式生物大肠杆菌,以及许多致病菌,如铜绿假单胞菌、淋病奈瑟菌、沙眼衣原体和鼠疫耶尔森菌。
问
如何自然去除革兰氏阴性菌?
答
天然抗生素。一些天然抗生素是大蒜、蜂蜜、卷心菜、葡萄柚籽提取物、生苹果醋、特级初榨椰子油、发酵食品等。
免责声明:本公众号内容仅作交流参考,不作为诊断及医疗依据。主要参考文献:
Oliveira J, Reygaert WC. Gram Negative Bacteria. 2022 Mar 26. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan–. PMID: 30855801.
Carroll K.C., & Hobden J.A., & Miller S, & Morse S.A., & Mietzner T.A., & Detrick B, & Mitchell T.G., & McKerrow J.H., & Sakanari J.A.(Eds.), (2019). Jawetz, Melnick, & Adelberg’s Medical Microbiology, 27e. McGraw Hill.
Acheson DWK (2015): Patient information: Food poisoning (foodborne illness) (Beyond the Basics). In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Apicella M (2015): Treatment and prevention of meningococcal infection. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Baum SG (2016): Mycoplasma pneumoniae infection in adults. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Crowe SE (2016): Bacteriology and epidemiology of Helicobacter pylori infection. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16.
Crowe SE (2016b): Treatment regimens for Helicobacter pylori. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16.
File TM (2016): Treatment of community-acquired pneumonia in adults in the outpatient setting. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Ghanem KG (2016): Clinical manifestations and diagnosis of Neisseria gonorrhoeae infection in adults and adolescents. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Hicks CB, Clement M (2016): Syphilis: Treatment and monitoring. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Kanafani ZA, Kanj SS (2014): Acinetobacter infection: Epidemiology, microbiology, pathogenesis, clinical features, and diagnosis. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/10/16
Kanafani ZA, Kanj SS (2016): Acinetobacter infection: Treatment and prevention. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/10/16
Kelly CP, Lamont JT (2015): Clostridium difficile in adults: Treatment. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Koulenti D et al (2009): Spectrum of practice in the diagnosis of nosocomial pneumonia in patients requiring mechanical ventilation in European intensive care units. Critical Care Med 37(9):2360-2369. doi: 10.1097/CCM.0b013e3181a037ac
Lamont JT (2016): Clostridium difficile in adults: Epidemiology, microbiology, and pathophysiology. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Li X-Z, Nikaido H (2004): Efflux-mediated drug resistance in bacteria. Drugs. 64(2):159–204.
Lowy FD (2016): Methicillin-resistant Staphylococcus aureus (MRSA) in adults: Treatment of skin and soft tissue infections. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Pegram PS, Stone SM (2016): Botulism. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Riley LW (2015): Natural history, microbiology, and pathogenesis of tuberculosis. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Sauvage E et al (2008): The penicillin-binding proteins: structure and role in peptidoglycan biosynthesis. FEMS Microbiol Rev 32:234–258. DOI:10.1111/j.1574-6976.2008.00105.x
Southwick F (2008): Infectious Diseases. A Clinical Short Course. McGraw Hill/Lange.
Sterling TR (2016): Treatment of pulmonary tuberculosis in HIV-uninfected adults. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/2/16
Stevens DL, Bryant A (2015): Group A streptococcus: Virulence factors and pathogenic mechanisms. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Stevens DL (2016): Group A streptococcal (Streptococcus pyogenes) bacteremia in adults. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Swygard H et al (2016): Treatment of uncomplicated gonococcal infections. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Wanke CA (2015): Pathogenic Escherichia coli. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 7/28/16
Wanke CA (2015b): Travelers’ diarrhea: Clinical manifestations, diagnosis, and treatment. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Yeh S (2015): Microbiology, epidemiology and treatment of Haemophilus influenzae. In: UpToDate, Basow, DS (Ed), Waltham, MA. Cited 8/1/16
Sagar Aryal,Gram-Positive Vs Gram-Negative Bacteria- 31 Differences With Examples. Microbenotes.2022,January 9
Jawertz M., Alderbergs., Medical Microbiology 28th Edition.
Prescott M. L., Microbiology. 5th Edition
Lippincott Microbiology in review: 3rd edition
Faith Mokobi,Gram-Positive Bacteria- Cell Wall, Examples, Diseases, Antibiotics,2021, April 15
Faith Mokobi,Gram-Negative Bacteria- Cell Wall, Examples, Diseases, Antibiotics ,2021 ,April 15

谷禾健康
一般在肠道菌群健康检测报告中,会有主要菌属构成比例,类似下图:
图源:谷禾肠道菌群健康检测报告我们可以看到图中列举了拟杆菌门,厚壁菌门…等。很多小伙伴拿到报告之后,对于这些细菌门表示困惑。
这些细菌门都代表了什么意思?
某个细菌门比例高了会怎么样?
某个细菌门比例高,是好是坏?
是不是与某些疾病相关?
…….
实际上,这几大类门的丰度和构成比例变化与人类健康和疾病发生息息相关。
两个主要门类,拟杆菌门和厚壁菌门,构成人类肠道细菌的大部分。七岁以后,拟杆菌和厚壁菌之间的比例相对稳定,而它们比例紊乱可能会导致肥胖和糖尿病等代谢综合征。
本文,我们就给大家详细介绍一下这其中最常见的几大细菌门:
拟杆菌门、厚壁菌门、变形菌门、放线菌门。
为什么选这四大细菌门?
依据自然属性分类,人类肠道菌群已经鉴定出细菌的几十个门,包括:拟杆菌门、厚壁菌门、变形菌门、放线菌门、疣微球菌门、梭杆菌门、蓝藻菌门、螺旋体门等。 但是其中98%的肠道菌可以归属为前四类,拟杆菌门、厚壁菌门、变形菌门和放线菌门,大多数人这4个门的菌占据肠道细菌数量的99%。 了解这四大细菌门,可以说你对大部分人体内肠道菌群的有了一定的了解。
▲ 拟杆菌 :革兰氏阴性菌
不形成孢子 厌氧菌 杆菌 ▲
它们具有外膜、肽聚糖层和细胞质膜。它们无氧呼吸的主要副产物是乙酸、异戊酸和琥珀酸。
包括碳水化合物的发酵、含氮物质的利用以及胆汁酸和其他类固醇的生物转化。大多数肠道细菌是糖酵解的,这意味着它们通过碳水化合物分子的水解获得碳和能量。
据估计,只有约 2% 的单糖通过上消化道到达结肠。因此,单糖可能不是拟杆菌的主要能量来源。然而,来自植物纤维的多糖,如纤维素、木聚糖、阿拉伯半乳聚糖和果胶,以及植物淀粉,如直链淀粉和支链淀粉,在结肠中更为普遍。
多糖还被证明可以诱导来自拟杆菌的多种葡糖苷酶活性,包括负责海带多糖降解的 β-1,3-葡糖苷酶活性以及多种 α、β-1,4 和 α、β–1,6 木糖苷酶和葡糖苷酶活性。大部分拟杆菌成员蛋白质组包括水解这些多糖的蛋白质。
表现出相当大的营养灵活性和对宿主和肠道环境施加的压力做出反应的能力。很难说肠道拟杆菌是否对宿主产生负面或正面影响。拟杆菌能够通过预防可能定植和感染肠道的潜在病原体感染来使宿主受益。由但是,在短链脂肪酸存在下,弱酸性 pH 值会抑制生长。诸如脆弱拟杆菌之类的致病物种已经开发出逃避宿主免疫系统的策略。
作为多糖降解联盟的成员,它们有助于从膳食纤维和淀粉中释放能量,它们很可能是丙酸盐的主要来源;然而,它们也参与了蛋白质分解过程中有毒产物的释放,这个群体的成员有一些可能有助于抑制炎症的活动,但他们也有可能促进炎症,有些是已知的机会性病原体。
谷禾健康
微生物群失调与人体中的多种疾病有关。在个体中,每个微生物栖息地都表现出不同的微生物种群模式。迄今为止,关于微生物组相关疾病的研究集中在器官特异性微生物组上。然而,器官间微生物网络正在成为生理功能和病理过程中的重要调节剂。
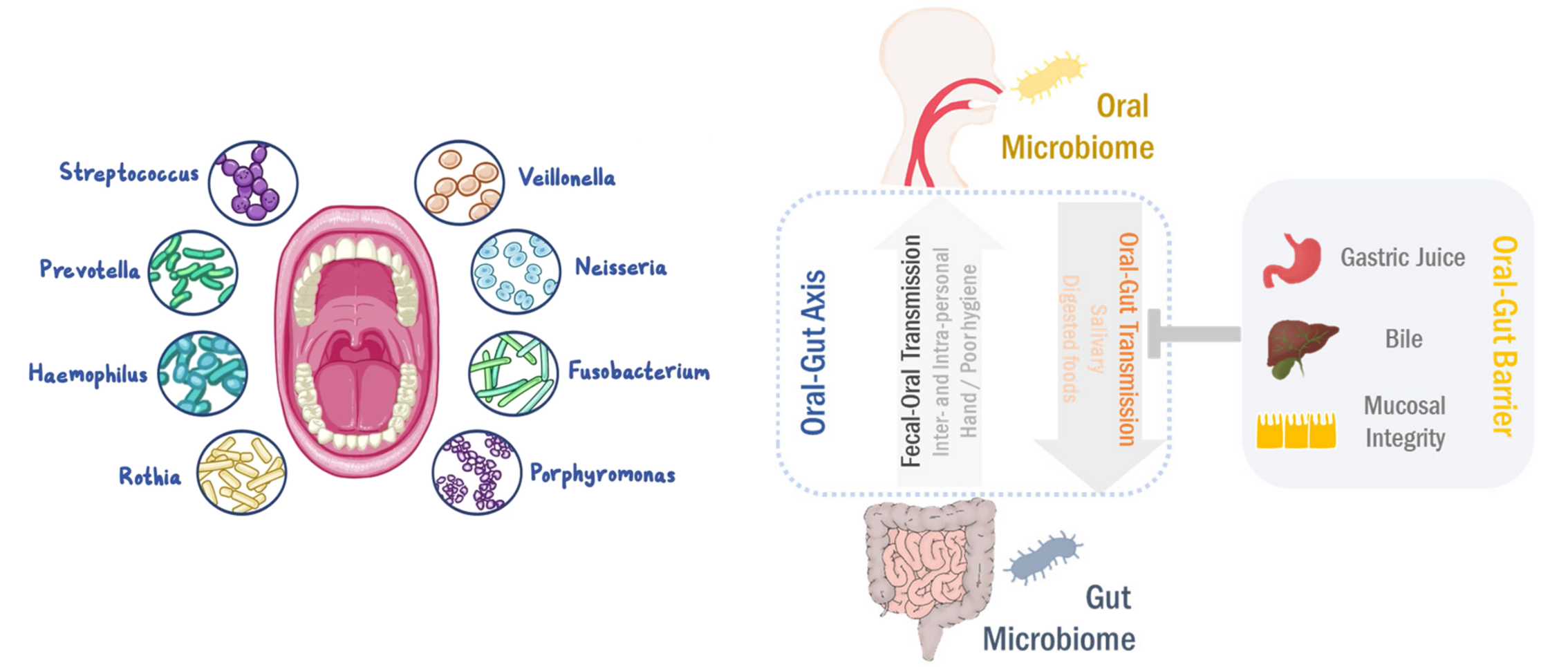
口-肠
口腔和肠道是两个最大的微生物栖息地,在微生物组相关疾病中起主要作用。即使口腔和肠道是通过胃肠道相连的连续区域,由于口腔-肠屏障的原因,口腔和肠道的微生物群分布很好的分离。
然而,在口腔-肠道屏障功能障碍的情况下,口腔微生物群可以转移到肠粘膜。相反,肠道至口腔的微生物传播也以人际和社区传播发生。
最近,有报道说口腔和肠道微生物组相互依赖地调节生理功能和病理过程。口腔到肠道和肠道到口腔的微生物传播可以塑造和/或重塑两个生境中的微生物生态系统,最终调节疾病的发病机理。
在这里,我们将讨论总结口腔-肠道微生物组轴在胃肠道疾病和癌症中的作用, 更好地了解肠道-肠道微生物组轴在发病机理中的作用将有利于精确的诊断/预后和有效的治疗。

人体消化系统由胃肠道和包括肝和胰腺在内的辅助消化器官组成。 胃肠道的粘膜排列整齐,从口腔开始,直到肠道(更准确地说是肛门)结束。 因此,口腔和肠道是通过胃肠道连接的解剖学连续区域。
此外,由于唾液和消化后的食物都通过胃肠道,因此这两个位置也是化学相连的。
通常,由于中空的运河结构,胃肠道被认为在人体外部。 口腔是消化道的通道,直接暴露于外部环境,例如微生物,营养物和其他外源性物质。 在这方面,口腔和肠道都为不同的微生物繁衍提供了适当的环境。
HMP(第一阶段人类微生物组计划)揭示了人体中一半以上的细菌位于胃肠道(29%)和口腔(26%)中。 除了这些丰富的生物外,口腔和肠道微生物群也高度多样化,并同时显示出与每个生境区分开的独特特征。
根据人类口腔微生物组数据库(HOMD),口腔中大约有700种微生物。口腔中的共生菌包括厚壁菌门、变形杆菌门、拟杆菌门、放线杆菌门、梭杆菌门、奈瑟菌门和TM7。口腔有几种不同的微生物环境,包括:颊粘膜、龈下菌斑、龈上菌斑、角化牙龈、硬腭、唾液、扁桃体、舌头和喉咙。口腔和腭粘膜的多样性低于其他口腔栖息地。
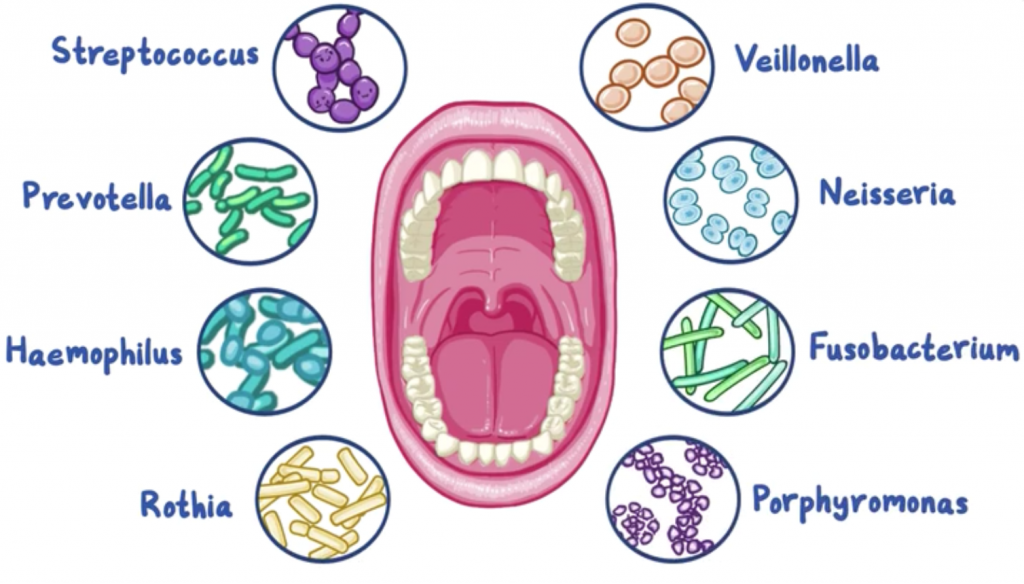

无论小生境的位置如何,健康受试者的所有口腔部位在属水平上的菌如下:
双歧杆菌 Gemella链球菌 Streptococcus
韦荣氏菌 Veillonella嗜血杆菌 Haemophilus
奈瑟菌 Neisseria卟啉单胞菌 Porphyromonas
放线菌 Actinomyces梭菌 Fusobacterium
普雷沃氏菌 Prevotella
除了这些常见的细菌进化枝外,每个小生境还具有分化良好的细菌组成。
根据微生物群落结构,口腔生态位可分为三组:
第一组:颊粘膜、角化牙龈和硬腭
第二组:唾液、舌头、扁桃体和喉咙
第三组:龈下和龈上菌斑
生态位对口腔微生物组的隔离可能归因于多种因素,例如pH,盐度,氧化还原电位,氧气和营养。 此外,牙齿卫生是影响口腔微生物组的另一个重要因素,因为口腔是直接向外界开放的。
肠道是人体内最大、最具特征的微生物生态系统,在50多个不同的门中有大约500到1000个物种。
由五个主要的拟杆菌门、厚壁菌门、放线菌门、变形菌门和疣状菌门组成,但以两个拟杆菌和厚壁菌门为主,占90%以上。
在属的水平上,拟杆菌是最丰富的。已知人类肠道微生物群在生命早期就已建立,然后可以随着年龄和环境(如饮食和营养)而改变,类似于人类口腔微生物群。因此,口腔和肠道微生物组直接反映了宿主的健康状况。
尽管肠道与口腔相连,但肠道微生物群的组成可与口腔微生物群的组成区分开来。在门的水平上,口腔主要由厚壁菌门控制,而粪便微生物群主要富含拟杆菌。这种分离可归因于胃中的胃酸和十二指肠中的胆汁酸。
据报道,长期使用质子泵抑制剂(PPI)会增加肠道感染的风险。值得注意的是,PPIs降低胃酸可以减少肠道微生物生态系统的多样性,改变肠道微生物组的组成。
此外,胆汁酸可引起肠细菌膜和/或DNA完整性的破坏,在口腔和肠道之间起有效的抗菌屏障作用。 因此,胃酸度和胆汁酸池负责肠道和口腔微生物组的独特模式。
人类肠道微生物组的概况可以根据健康状况,环境因素,遗传学甚至生活方式而改变。
宏基因组学分析表明,人类肠道菌群调节代谢途径,例如碳代谢和氨基酸合成。微生物显示出保守的分子基序,称为微生物相关的分子模式和病原体相关的分子模式(PAMP),宿主可通过模式识别受体(PRRs)识别这些基序,如toll样受体。
这种微生物与宿主的相互作用可以刺激人体的免疫系统和炎症反应。 这意味着肠道菌群可以调节人体的主要生物学功能,新陈代谢和免疫力,因此肠道菌群失调与多种人类疾病有关,从传染病到阿尔茨海默氏病。然而,要证明肠道微生物群是人类健康状况的原因还是后果是一个挑战。
另外,无菌(GF)动物为肠道微生物组的生理功能提供了深刻的线索。与无特定病原体(SPF)的小鼠相比,GF小鼠的肠重量减少,绒毛更短,小肠的总表面积减少,表明胃肠道发育存在缺陷。
与此相一致,GF小鼠显示出代谢异常,例如胆固醇代谢改变和肠道内短链脂肪酸的减少,短链脂肪酸是重要的能量来源之一。
因此,与SPF小鼠相比,GF小鼠显示出较低的体内脂肪含量和对高脂饮食诱导的体重增加的抵抗力。 但是,通过应用SPF小鼠的盲肠含量,通过GF小鼠的常规化可以恢复体内脂肪含量。
在免疫方面,GF小鼠在Peyer斑块和肠系膜淋巴结发育方面存在缺陷,CD4,CD8和Foxp3 T细胞数量减少,B细胞分泌的免疫球蛋白A产生减少。
通过与SPF小鼠共栖或口服SPF小鼠粪便中的成分,可以通过微生物群重建来恢复这些疾病。 两者合计,很明显,肠道菌群在维持生理稳态方面起着至关重要的作用,主要是代谢和免疫。
尽管口腔是人体第二大的微生物栖息地,但是累积的知识不足以完全了解口腔微生物组对人类健康的影响。 毫无疑问,口腔微生物组与牙齿健康直接相关。
口腔疾病中有许多已被确认的关键病原体,如龋齿的变形链球菌(Streptococcus mutans )和牙周炎的牙龈卟啉单胞菌(Porphyromonas gingivalis)。此外,与健康受试者相比,口腔鳞状细胞癌患者的口腔微生物组发生了改变。根据口腔微生物群分析,口腔鳞状细胞癌(OSCC)患者中的梭杆菌属(Fusobacterium)水平较高。
口腔微生物组会影响全身健康状况,而不仅限于牙齿健康(下图)。
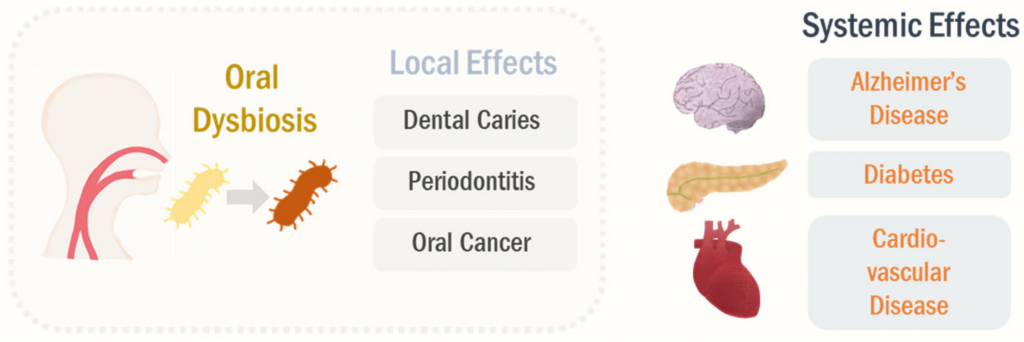

Park Se-Young, et al., Cancers (Basel),2021
流行病学和实验证据支持口腔菌群失调与全身性疾病密切相关,包括阿尔茨海默氏病,糖尿病和心血管疾病。 与此相符,阿尔茨海默氏病的口腔微生物群特征发生了显着变化,例如莫拉氏菌属(Moraxella),纤毛菌属(Leptotrichia)和鳞球菌属(Sphaerochaeta)的患病率。口腔不良反应的改变与阿尔茨海默氏病的进展有关。
I型糖尿病患者的放线菌门和厚壁菌门的丰度更高。此外,据报道,在有症状的动脉粥样硬化患者的口腔微生态环境中,厌氧菌属的富集已被报道。
在牙周炎(一种口腔失调疾病)的情况下,其标志性病原体牙龈卟啉单胞菌(P. gingivalis)感染可引起局部以及全身慢性炎症。
此外,口腔异位症可以诱导PAMP信号的产生,例如脂多糖(LPS),导致系统性刺激先天免疫应答和炎症转录因子,包括核因子κB。 这些全身性炎症和免疫反应被认为是主要机制之一,强调口腔微生物组调节远端器官的发病机理。
值得注意的是,口腔微生物群可以转移到其他器官,这被认为是口腔生物失调引起的全身性疾病的另一种机制。
在短期死后阿尔茨海默氏病患者的脑组织中已检测到口腔致病菌牙龈卟啉单胞菌(P. gingivalis)。 口腔病原体直接转移到大脑可以通过诱导神经炎症和神经变性而加剧阿尔茨海默氏病。
此外,在冠心病患者的动脉粥样硬化斑块中检测到许多口腔共生细菌,这进一步表明口腔细菌可能转移到远端器官。 由于物理和化学联系,口腔微生物向胃肠道系统的迁移可能更频繁。
在某些致病条件下,一些口腔细菌类群定居并富含胰腺和肠道,表明口腔和肠道菌群之间存在直接的串扰。
由于存在肠-肠屏障,物理距离以及化学障碍(例如胃酸和胆汁),因此口腔和肠道微生物组被很好地隔离了。 然而,口腔-肠道屏障的损伤会导致器官间的易位和交流。
一般来说,新生儿和老年人体内存在不成熟或功能性障碍较少。双歧杆菌是新生儿肠道中最丰富的细菌属。有趣的是,在新生儿的口液中发现了肠道内的双歧杆菌。
同样,与健康成年人相比,老年人肠道内口腔细菌的检出率也较高,如:
卟啉单胞菌(Porphyromonas)、梭杆菌(Fusobacterium) 和假分枝杆菌 (Pseudoramibacter)。
此外,低胃酸使肠道微生物群的组成向口腔微生物群转移。已在体外证明,通过分别引入人类粪便和唾液微生物群的GF小鼠组,口腔微生物群可以侵入肠道并重塑肠道微生物群。
综上所述,这些数据表明口腔微生物可以在某些情况下克服口腔与肠道之间的物理和/或化学障碍,并有可能转移到肠道中。
值得注意的是,在胃肠道的病理条件下已检测到典型的口腔驻留物种。 例如,炎症性肠病(IBD)患者的肠道粘膜中有大量嗜血杆菌和Veillonella富集,已知它们是口腔共生微生物。
在结肠癌患者中,他们的肠道微生物群包含几种口腔类群,包括梭菌。这意味着正常的人口腔微生物群可以在肠粘膜稳态中破坏并在肠道粘膜中定植,并成为条件致病菌。
而且,这种经口-粪便传播也可以在生理条件下发生,而不仅仅是在病理或屏障破坏的情况下。HMP联盟的数据被划分为每个身体部位的群落类型时,口腔和肠道微生物群类型显示出强烈的关联,尽管它们在分类上不同。
在唾液细菌中,普雷沃氏菌(Prevotella)大量存在于粪便样本中。与此相一致,从同一健康受试者的口腔和粪便样本中同时检测到几个属。通过分析470名个体口腔和粪便微生物群中的310种,唾液和粪便样本中普遍存在125种,包括链球菌(Streptococcus)、韦荣氏球菌属(Veillonella)、放线菌(Actinomyces)和嗜血杆菌(Haemophilus)菌株。
综上所述,很明显口腔微生物群可以比预期更广泛地进入肠道,即使在健康状态下,而不仅仅是在病理情况下。
肠道微生物可通过粪-口途径通过直接接触或通过受污染的液体和食物间接接触传播。人的手部微生物群与口腔和肠道微生物群模式高度重叠,表明人的手是粪便到口腔微生物传播的载体。因此,在发展中国家,由于卫生状况不佳,如缺乏清洁供水和公共卫生系统,微生物的粪-口途径经常被报道。
此外,免疫功能低下的个体也容易通过粪-口传播。在头颈部癌症患者中,放射治疗与革兰氏阴性杆菌的口腔定植高度相关,不良的口腔卫生状况会进一步加剧这种情况。因此,不良的卫生和/或免疫损害条件可能会促进同一个体的粪-口途径。
除了体内传播外,粪-口途径也被认为是病原体在人与人之间传播的重要机制。众所周知,甲型肝炎病毒(HAV)和戊型肝炎病毒(HEV)等肠道病毒通过粪-口途径传播,因此很容易通过人与人之间的接触传播,特别是在不卫生的条件下。
肠道病毒可以直接和间接地与肠道微生物群相互作用,对肠道微生物生态系统造成破坏性影响。据报道,戊型肝炎病毒感染会增加急性肝衰竭患者粪便样本中乳酸杆菌科(Lactobacillaceae)和伽马蛋白杆菌( Gammaproteobacteria)的丰度。
添加益生菌粪肠球菌NCIMB 10415(Enterococcus faecium NCIMB 10415) 可有效促进感染猪的HEV清除。
除了肠道病毒外,幽门螺杆菌(Helicobacter pylori)是严重胃十二指肠疾病的主要致病菌,也可以通过粪-口途径传播,显示出与甲型肝炎感染的相关性。
虽然需要进一步的研究来了解粪-口传播在口腔和肠道微生物群中的作用,但令人信服的是,口腔和肠道微生物群通过口-肠和粪-口途径紧密相连(下图)。
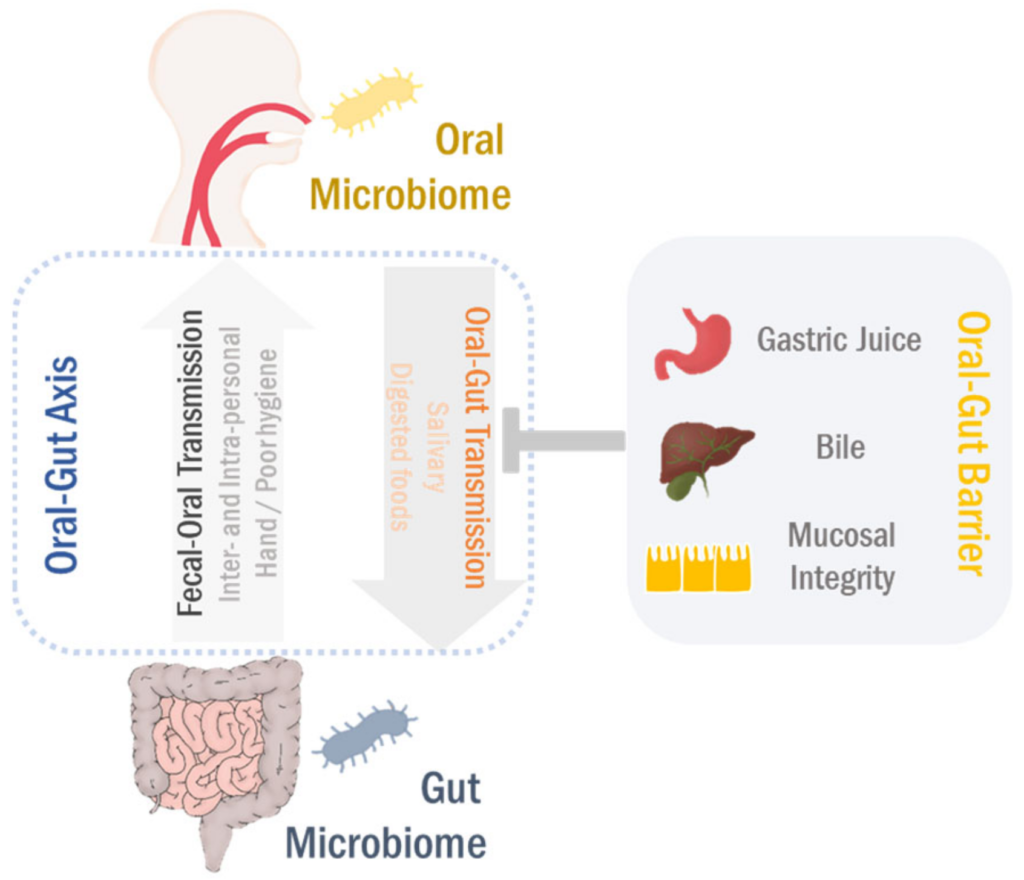
Park Se-Young, et al., Cancers (Basel),2021
这种双向相互作用可以相互塑造和/或重塑两个栖息地的微生物生态系统,最终调节胃肠系统的生理和病理过程。因此,口腔-肠道和粪便-口腔方向在以下中统称为“口腔-肠道微生物群轴”。

IBD代表结肠和小肠的慢性炎症性疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC)。因此,IBD与肠道微生物群失调密切相关。IBD患者的肠道微生物组显示出细菌组成的多样性降低和变化,包括厚壁菌门的丧失和变形菌门和拟杆菌门的丰度增加。在肠道粘膜组织活检中而不是在粪便中更深刻地观察到了这些不良生物事件。与健康受试者相比,在肠黏膜表面,IBD患者经常检测到细菌入侵和生物膜形成,表明肠屏障功能障碍与IBD发病有关。
在健康状态下,由于完整的粘膜屏障,肠道微生物群很少受到来自其他栖息地的微生物的入侵和定植。然而,IBD患者由于粘膜屏障受损而表现出肠上皮通透性增加。
值得注意的是,口腔内细菌菌株是从IBD患者的肠道微生物组中分离出来的,这可能是由于肠道渗漏造成的。具核梭杆菌( Fusobacterium nucleatum )通常存在于口腔中,但很少存在于健康人的肠道中。
有趣的是,IBD患者在肠道中出现了F. nucleatum,比其他F. nucleatum菌株更具侵袭性,表明IBD患者存在肠道-肠道微生物组轴。这一点已在体外通过将口腔微生物群移植到动物模型中得到证实。
在大鼠中,F.nucleatum的侵袭导致肠道微生物组发生转移并加重内脏超敏性。 此外,CD患者的唾液微生物群成功地定居在GF小鼠的肠道中。
克雷伯菌(Klebsiell)是最流行的定植菌,可促进肠道Th1细胞的诱导和炎症,这是IBD发病机理中的关键事件。 这些结果进一步支持了口腔微生物群,无论是共生的还是病原菌,都可以传播到肠道,通过肠道失调促进IBD的发病。
因此,口腔失调可以通过募集口腔-肠轴来直接调节IBD的发病机制。牙周炎是一种慢性炎性口腔疾病,与口腔微生物群的改变密切相关,特别是与其关键性病原体牙龈卟啉单胞菌的过度生长有关。
在C56BL/6小鼠中,口服牙龈卟啉单胞菌通过下调紧密连接蛋白来减弱肠道屏障功能,从而导致肠道微生物组发生重大变化,包括梭菌科的丰富。
此外,接种牙龈卟啉单胞菌的小鼠表现出肠道以及全身性炎症,这可以由牙龈卟啉单胞菌衍生的内毒素例如LPS介导。 与动物实验一致,荟萃分析表明牙周炎分别与IBD,CD和UC的两种主要形式密切相关。
两者合计,口腔病原体可以干扰肠屏障功能并侵入肠粘膜,从而引起肠道失调和慢性炎症,从而导致IBD发病。 值得注意的是,IBD患者以及结肠炎引起的小鼠唾液微生物群组成发生变化,这与炎症反应有关,表明口腔-肠道微生物相互作用可能是双向的。
大肠癌(CRC)是世界上最常见的癌症类型之一,也是导致癌症死亡的第二大原因。IBD是CRC发生和发展的最公认的危险因素。因此,IBD和CRC在发病机理中共享病因,包括肠道微生物组的明显变化。 与IBD相似,CRC与肠道失调密切相关。与健康个体相比,CRC患者在粪便和肠粘膜样品中均显示出不同的微生物组成模式。
一直以来,在结肠炎相关和化学诱导的大肠癌小鼠模型中都发现了肠道微生物群的深刻变化,支持肠道失调和大肠癌之间的关系。使用GF小鼠的研究进一步证明,肠道微生物群的改变可以直接促进炎症相关的结直肠癌的发展。
有趣的是,在大肠癌患者的肠道中发现了几种口腔分类群,包括细小单胞菌(Parvimonas)、消化链球菌(Peptostreptococcus)和梭形杆菌(Fusobacterium),表明大肠癌中存在口腔-肠道微生物群轴。
在这些口腔常驻细菌中,具核梭杆菌 (F.nucleatum)与健康人相比,结直肠癌患者的肿瘤组织和粪便中普遍存在细胞核,这与IBD一致。
在小鼠结肠炎模型中,口服具核梭杆菌(F.nucleatum) 细胞核引起的炎症以及小肠和大肠的肿瘤发生。具核梭杆菌 (F.nucleatum)细胞核似乎很容易附着在表达内皮钙粘蛋白的宿主CRC细胞上,然后刺激促炎症反应和细胞增殖。与IBD相似,结直肠肿瘤显示肠道屏障功能受损,这可能解释了口腔微生物群的肠道定植。
此外,据报道,具核梭杆菌 (F.nucleatum) 与口腔病原体牙龈卟啉单胞菌共聚并共感染。尽管体外方法存在局限性,但牙龈卟啉单胞菌仍侵袭CRC细胞并促进癌细胞增殖,这表明牙周病原体参与了结直肠肿瘤的发生。 与此相一致,牙龈卟啉单胞菌血清抗体水平与CRC患者的死亡率呈正相关。
此外,一项荟萃分析表明,牙周炎与CRC风险增加有关。 综上所述,这些研究可以证明口腔失调,口腔-肠道微生物组轴与CRC发病机理之间存在关联。
肝硬化是由慢性肝脏疾病引起的晚期肝病,例如非酒精性脂肪肝疾病(NAFLD)和非酒精性脂肪性肝炎(NASH)。 健康对照组相比,NAFLD、NASH或肝硬化患者粪便样本中的变形杆菌门显著增加,表明肠道微生物组与肝脏发病机制相关。在这方面,与SPF小鼠相比,GF小鼠免受高脂饮食诱导的脂质在肝脏中的蓄积。此外,定居于NAFLD易感肠道微生物的GF小鼠发生了严重的肝脂肪变性,进一步支持了肠道失调可能是慢性肝病的直接病因。
由于肠道和肝脏通过胆道和门静脉进行物理连接,如果粘膜屏障受损,肠道微生物可以转移到肝脏。胆汁酸具有抗菌活性,在肠道和肝脏之间循环循环,具有屏障和桥梁的双重功能。
慢性肝病通常与胆汁酸形成和/或分泌不良有关,会增加肠道通透性。 因此,胆道梗阻促进了细菌从肠道到肝脏的移位。 在胆结石患者中,与正常对照组(例如富集变形杆菌)相比,胆道和肠道中的微生物组成均发生了变化,这支持了慢性肝病中肠道-肝脏微生物组轴的存在。
通过与肠-肝微生物串扰的融合,口腔-肠道微生物组轴正在成为慢性肝病的重要调节剂。
值得注意的是,宏基因组学分析已证明肝硬化患者肠道内的口腔粘膜有侵袭和定植。另一项研究还显示,酒精依赖型肝硬化患者的肠道中口腔微生物的富集。 这些数据支持口腔微生物的肠道迁移与肝硬化有关。 但是,其潜在机制尚不清楚。如前所述,由于胃酸度低,PPI促进了从口腔到肠道的微生物转化。 同样,PPI治疗改变了肝硬化患者的肠道菌群组成,特别是肠道内口腔细菌的过度生长。 相同的研究小组已经证明了肝硬化患者唾液和粪便微生物组的伴随变化,进一步表明口腔-肠道微生物组轴调控肝脏的发病机制。
因此,口腔失调可能会通过改变肠道微生物组而加重慢性肝病。 确实,牙周炎与NASH,NAFLD和肝硬化显着相关。 在来自NAFLD和与病毒感染相关的肝硬化患者的口腔样本中已经检测到牙龈卟啉单胞菌,一种牙周基石病原体。
在高脂饮食喂养的小鼠中,牙龈卟啉单胞菌的牙源性感染通过脂质积累,纤维化和肝脏炎症促进了NAFLD和NASH的进展。 总体而言,口腔失调可能会通过调节肠道生态系统而加剧慢性肝病。 同时,口腔失调可能反映了由肝病驱动的肠道失调生态系统。
肝细胞癌(HCC)的发展经历了一个逐步的过程,从NAFLD/NASH到肝硬化,最后发展为HCC。在小鼠肝癌发生模型中,SPF小鼠比GF小鼠更易发生肝癌,类似于慢性肝病。
在生态型小鼠模型中,某些类型的肠道细菌,如大肠杆菌和粪链球菌,可显著增加肝肿瘤的发生,表明肠道微生物群直接参与了肝癌的发病机制。与这一观点一致,与健康对照组相比,HCC患者的丁酸产生菌属减少,如反刍球菌(Ruminococcus)、大肠杆菌(Oscillibacter)、粪杆菌(Faecalibacterium)、梭状芽孢杆菌IV(Clostridium IV)和粪球菌(Coprococcus),而LPS产生菌属增加,包括粪便样本中的克雷伯菌(Klebsiella)和嗜血杆菌(Haemophilus )。
此外,随着HCC的发展,肠道失调的水平趋于增加。 在患有肝硬化的HCC患者中,粪便微生物群的成分与没有HCC的肝硬化患者的粪便微生物群成分有所不同,例如大肠杆菌和Fusobacteriia的大量富集。 在化学诱导的HCC小鼠模型中,已在肿瘤内发现了一种肠道细菌肝幽门螺杆菌(Helicobacter hepaticus),它直接引起HCC的发展和进程,进一步支持肠道失调可以诱导HCC的发病机理。 然而,在人类HCC样品中未检测到肝炎性肝炎,而确诊存在其他幽门螺杆菌,例如幽门螺杆菌。因此,肝癌的发展与肠道失调密切相关。
有趣的是,据报道,与健康受试者相比,肝癌患者的口腔微生物群发生了变化。肝癌患者唾液微生物群中嗜血杆菌属、卟啉单胞菌属和Filifactor的丰度较高。在肝硬化的HCC患者中,根据舌苔的微生物组学特征,颤杆菌克属(Oribacterium)和梭形杆菌属(Fusobacterium)普遍存在。
此外,慢性牙周炎与晚期HCC相关,提示口腔失调与HCC相关。值得注意的是,肝硬化HCC患者的口腔和肠道微生物群中都富含梭杆菌,这表明口腔微生物可能通过口腔-肠道微生物群轴调节HCC发病机制,但需要进一步研究。
胰腺是消化系统的一部分,分泌分解脂类、蛋白质和碳水化合物的酶。主胰管与胆总管相结合,两者都与十二指肠相连。在正常健康条件下,胰腺被认为是一个无菌器官。
然而,胰腺导管腺癌(PDAC)患者的细菌数量增加,如肿瘤内的γ-变形菌纲(Gammaproteobacteria)和胰液和胰腺组织中的粪肠球菌(Enterococcus faecalis)。
此外,肿瘤内微生物组多样性与PDAC的预后相关。从更全面的角度来看,PDAC患者在胰腺组织、肿瘤以及粪便样本中表现出不同的微生物群模式,表明肠-胰腺微生物串扰参与了PDAC发病机制。特别是,PDAC患者的肠道和胰腺中同时富集了变形菌(Proteobacteria)。
在实验小鼠中,肠道通透性增加与肠道到胰腺的微生物易位有关,这可能加速PDAC的进展。在肠道菌群清除的小鼠中,用PDAC荷瘤小鼠的粪便菌群重新填充可显著促进胰腺肿瘤的发生,表明肠道菌群对PDAC进展的直接贡献。因此,肠道微生物组似乎与胰腺微生物生态系统密切相关,而胰腺生态系统在PDAC发病机理中起着至关重要的作用。
惊讶的是,口腔微生物组也与PDAC的发病机理有关。 根据元流行病学研究,牙周炎是一种主要的口腔菌群失调疾病,可以显着增加PDAC的风险和死亡率。
携带其关键病原体牙龈卟啉单胞菌与PDAC患者的较高风险和死亡率正相关。 在小鼠PDAC模型中,口服牙龈卟啉单胞菌可加速细胞增殖和上皮-间质转化,最终促进PDAC进程。
有趣的是,细胞内牙龈卟啉单胞菌直接促进人胰腺癌细胞系中肿瘤细胞的生长。 这些表明口腔菌群失调可能是直接的病因,也是诊断和预后PDAC发病机理的有用标志。
与健康受试者相比,PDAC患者的口腔微生物组有明显变化。 值得注意的是,尽管在人类PDAC组织中已发现了一种广为人知的口腔细菌群Fusobacterium,但其与PDAC预后的关系仍存在争议。
此外,PDAC患者的胰腺微生物组与肠道微生物组高度重叠。胰腺和肠道菌群均表现出口腔类群富集细菌和卟啉单胞菌的相对丰度。因此,某些类型的口腔微生物可能迁移到肠道,甚至进一步迁移到胰腺,这可能通过肠道和胰腺微生物群的协调调节促进PDAC的发病。
为了支持这一观点,在PDAC患者的口腔,肠道和胰腺微生物群之间发现了相关性,尤其是口腔起源的F. nucleatum subsp. vincentii亚种的丰度。
这些数据表明,口腔-肠道微生物组轴可以调节PDAC的发病机制,甚至进一步创造口腔-肠道-胰腺的微生物途径。

口腔和肠道是人体内最大的两个微生物栖息地。累积证据表明,口腔微生物群可以通过口腔细菌分泌体的直接易位和/或间接地改变整个肠道微生物生态系统。
肠道到口腔的微生物传播也可能发生,特别是在某些情况下,如卫生条件差和免疫功能低下。总之,口腔和肠道微生物群之间的双向串扰可以形成口腔-肠道微生物群轴,它在调节各种人类疾病的发病机制中起着关键作用,主要是在胃肠道系统(见下表)。
结肠疾病中的口腔-肠道微生物群轴

Park Se-Young, et al., Cancers (Basel),2021
肝脏疾病中的口腔-肠道微生物轴

Park Se-Young, et al., Cancers (Basel),2021
胰腺疾病的口腔-肠道微生物组轴
Park Se-Young, et al., Cancers (Basel),2021
值得注意的是,口腔-肠道微生物组轴改善了胃肠道系统的发病机理和预后的预测。荟萃分析表明,口腔微生物组的变化与胃肠道癌的风险有关,包括CRC,PDAC和HCC,这可能是早期发现的潜在指标。已经验证了PDAC特定的口腔微生物模式作为PDAC生物标志物。两种口腔细菌物种长奈瑟菌Neisseria elongata 和 轻型链球菌Streptococcus mitis
同时富集可以将PDAC患者与健康受试者区分开来。
口腔微生物分析的情况下,所述样品可从棉拭取,唾液和口腔冲洗获得。与肠道菌群的采样方法相比,无论健康状况如何,口腔菌群的收集实际上更为方便和可用,没有任何侵袭或卫生问题。因此,结合肠道微生物组,口腔微生物组还提供了作为诊断/预后工具以及治疗靶标的可行优点。
未来我们谷禾也将考虑口腔和肠道微生物组的相结合,结合口腔和肠道微生物组数据可以显着提高预测和检测息肉和/或肿瘤的敏感性。尽管揭示微生物组与疾病之间的因果关系具有挑战性。
参考文献:
Zhang, Z.; Yang, J.; Feng, Q.; Chen, B.; Li, M.; Liang, C.; Li, M.; Li, Z.; Xu, Q.; Zhang, L.; et al. Compositional and Functional Analysis of the Microbiome in Tissue and Saliva of Oral Squamous Cell Carcinoma. Front. Microbiol. 2019, 10, 1439
Wypych, T.P.; Wickramasinghe, L.C.; Marsland, B.J. The influence of the microbiome on respiratory health. Nat. Immunol. 2019, 20, 1279–1290
Park Se-Young,Hwang Byeong-Oh,Lim Mihwa et al. Oral-Gut Microbiome Axis in Gastrointestinal Disease and Cancer.[J] .Cancers (Basel), 2021, 13
Bathini, P.; Foucras, S.; Dupanloup, I.; Imeri, H.; Perna, A.; Berruex, J.L.; Doucey, M.A.; Annoni, J.M.; Auber Alberi, L. Classifying dementia progression using microbial profiling of saliva. Alzheimers Dement. 2020, 12, e12000.
Seedorf, H.; Griffin, N.W.; Ridaura, V.K.; Reyes, A.; Cheng, J.; Rey, F.E.; Smith, M.I.; Simon, G.M.; Scheffrahn, R.H.; Woebken, D.; et al. Bacteria from diverse habitats colonize and compete in the mouse gut. Cell 2014, 159, 253–266.
谷禾健康
韦荣氏球菌属(Veillonella)是革兰氏阴性厌氧性微小球菌,直径0.3~0.5μm,初期培植为革兰氏阳性,过夜转为阴性。光学显微镜下为双球状、片状和短链状,无荚膜,无鞭毛,无芽孢。最适生长温度37℃,最适pH6.5~8.0。
Veillonella该属的成员是非发酵的,它们无法使用碳水化合物或氨基酸,不发酵无法葡萄糖或任何其他碳水化合物(除了有一个种发酵果糖外)或氨基酸,但它们会积极发酵发酵丙酮酸、乳酸、苹果酸、富马酸和草酰乙酸。胰蛋白酶-葡萄糖-酵母提取物肉汤中的主要代谢终产物是乙酸和丙酸。能代谢乳酸产生丙酸、CO2和H2。一些物种产生一种缺乏卟啉的非典型过氧化氢酶。大多数菌株产生气体,如H2S。
在动物和人的自然腔道中大量存在,是分布于口腔、咽部、呼吸道、消化道的常见菌群。其粘附于表面或与其他细菌并形成生物膜的能力对于肠道和口腔微生物群组成和功能至关重要,尤其是在口咽和肠道中。 在一些严重的感染过程中,如菌血症、骨髓炎和心内膜炎,在各种混合感染中起作用。常从软组织脓肿及血液中检出。青霉素已被建议作为韦韦氏菌属病原体感染的治疗选择 。
Veillonella属最早于1898年被Veillon和Zuber分离。Prevot在1933年进一步描述了这些细菌,并提出了目前的分类法。
大多数Veillonella菌是从脓肿,吸入性肺炎,烧伤,叮咬和鼻窦中回收的。在95%例患者中感染是多菌种,但在5%例患者中,纯培养物中回收Veillonella。与该菌检出相关的诱因条件是先前的手术,恶性肿瘤,类固醇治疗,异物和免疫缺陷。。
已知的Veillonella属中已描述了超过10种。
人类样品分离出(齿状Veillonella denticariosi,Veillonella dispar,Veillonella montpellierensis,Veillonella rogosae 和 Veillonella tobetsuensis)
非人类动物样品分离出(Veillonella caviae,Veillonella criceti,Veillonella magna,Veillonella ratti和Veillonella rodentium)
Veillonella atenty 从人和其他动物来源分离出。
它们的表型特征,包括形态,主要代谢终产物,产气,硝酸盐还原和琥珀酸脱羧,这些菌株被鉴定为Veillonella属的成员。 多基因座序列分析和相应的系统发育基于16S rRNA,dnaK和rpoB基因,以及新近提出的gltA基因。
其中一个重要的菌种,小韦荣球菌(Veillonella parvula)在120年前,当Veillon和Zuber将其从阑尾炎脓肿中分离出来时被发现并被描述。六十年后,同样的微生物被用于第一次观察外膜(OM),从而证明了革兰氏阴性和革兰氏阳性细胞包膜结构之间的关键区别。目前在包括口腔、肺、胃肠道和阴道内的人体多个生态位中发现了Veillonella parvula菌。Veillonella parvula可能在许多环境中发挥重要作用,但其主要生态位是作为口腔中的第二殖民者。
与口腔疾病
Veillonella是牙周炎的重要病原体,是舌苔中的本土口腔细菌,而且Veillonella附着在舌头上的能力很高,已被确定为硫化氢(H2S)的主要生产者,H2S是口腔恶臭的主要成分之一。并且在1份报告中,它是慢性上颌窦炎中最常见的厌氧性病原体。
口腔生物膜是一个多物种的社区,敌对双方共存,以保持社区成员的生态平衡。 在早期的口腔生物膜形成的各个阶段中,Veillonella作为早期定居物种可以与许多细菌形成聚集,包括最初的定居者戈登链球菌和牙周病原体Fusobacter nucleatum。 除了为许多微生物提供结合位点外,Veillonella还能为牙周病原体的生存和生长提供营养。 这些发现表明,Veillonella在口腔生物膜的发育和人类口腔生态学中起着重要的“架桥”作用。
Veillonella和链球菌在生态系统(如口腔和结肠)中发生代谢相互作用并经常共生,共存可能部分取决于它们在代谢中的相互作用的潜力。链球菌属参与糖的发酵,产生乳酸作为其主要发酵终产物。反过来,Veillonella也以利用乳酸作为碳和能源的能力而闻名。
全世界龋齿的患病率仍然很高。 当牙齿暴露于产酸微生物通过碳水化合物代谢产生的酸(如乳酸)环境下时,就会引发龋齿。 Veillonella是主要的口腔微生物之一,由于它们具有将乳酸转化为弱酸并从NO3产生NO2的能力,而NO2可以抑制链球菌的生长和代谢。因此,Veillonella被认为对预防龋齿有好处。但是Veillonella代谢乳酸的能力受口腔环境因素(即pH和乳酸)的调节。
与免疫相关
肠道是肠道菌群与粘膜免疫系统相互作用的关键部位。近年来,人们发现Veillonella对人类微生物组,感染和免疫发育的重要影响。研究发现Veillonella parvula是细胞因子和TLR2 / 6信号转导的有效诱导。链球菌与韦永氏菌的组合似乎可以抵消IL-12p70的产生,同时增强IL-8,IL-6,IL-10和TNF-α的反应。
Veillonella的存在与疾病缓解或疾病稳定相关。这些特定的细菌属可能是免疫检查点抑制剂的生物标志物。在单抗治疗的患者中,或许它们可能成为晚期胃癌的特异性生物标志物。
一项研究指出对免疫治疗有响应的患者体内,富含屎肠球菌(Enterococcus faecium),产气柯林斯菌(Collinsella aerofaciens),青春双岐杆菌(Bifidobacterium adolescentis),肺炎克雷伯菌(Klebsiella pneumonia),小韦荣球菌(Veillonella parvula), Parabacteroides merdae, 乳酸杆菌(Lactobacillus species)和长双歧杆菌(B longum)8个菌种。
最近的数据表明,Veillonella parvula可能在儿童早期免疫系统发育中起到保护作用和帮助作用。对婴儿的流行病学研究表明,Veillonella parvula的存在与哮喘、毛细支气管炎负相关,在有哮喘风险的儿童中,肠道中相对丰富的细菌属Veillonella的相对丰度显著降低。
Prevotella 作为革兰氏阴性菌,产生 LPS 进而诱发炎症反应。与此同时,该菌代谢产生的丙酸盐可以发挥抗炎症的作用。产生相互矛盾的结论背后或许是由于肠道微环境以及菌群构成的不同所导致的。当在肠道中 Veillonella 与唾液链球菌菌株 1 共培养时可降低炎性细胞因子的产生,而与菌株 2 共培养时炎性细胞因子的产生比各自单独培养时显著增加。
链球菌 和Veillonella在肠道微生物群的高丰度和种内遗传多样性,可能是这些菌对由于食物摄入量变化引起的营养物利用率变化而引起的高种群动态的主要驱动因素。这些动态的种群可能会深刻影响当地宿主与微生物之间的相互作用,从而调节肠道的生理和免疫系统功能。
与运动耐力相关
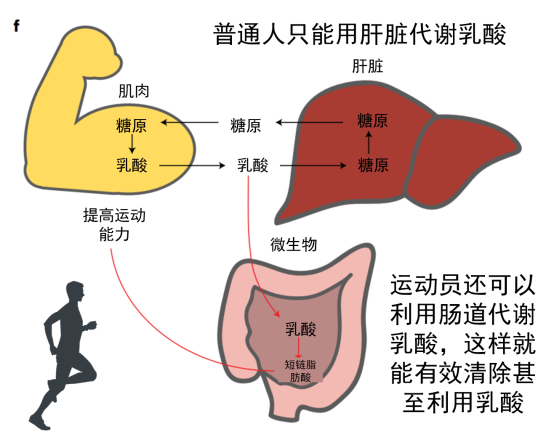
当我们跑步速度较慢时,糖和脂肪可以充分氧化分解成二氧化碳和水,并提供能量。但是,高强度运动后往往会出现肌肉酸痛现象,这是因为运动超过了有氧运动强度,导致葡萄糖通过无氧呼吸在体内代谢产生了乳酸,乳酸堆积会引起局部肌肉酸痛。
体内堆积的乳酸一部分继续分解成丙酮酸,再进一步被分解为二氧化碳和水,一部分则进入肝脏,乳酸可以再次合成糖原,这个过程称为糖异生。
Scheiman及其同事发表在《自然医学》(Nature Medicine)上文章研究了肠道微生物组对精英跑步者运动表现的影响,并确定了属于Veillonella属的一种能增强性能的微生物。比赛结束后,马拉松长跑运动员中富集了非典型的Veillonella atypica菌种。Veillonella 利用乳酸作为碳源, 分析发现乳酸到丙酸的代谢通路的运动后运动员中富集。
图片来源:慧跑
与其他厌氧菌不同,Veillonella atypica具有通过三羧酸循环的乳酸代谢的完整途径。Veillonella细菌可以将乳酸变成丙酮酸,而且体内产生的乳酸可以穿过上皮屏障进入肠腔,也就是说运动中体内积累的乳酸可以运输到肠道,肠道中的veillonella细菌就可以分解乳酸了。
在这个过程中,会产生丙酸,而丙酸可以提高小鼠心率和氧气利用率,丙酸还可以促进人体的新陈代谢。为了验证丙酸是否可以改善运动性能,研究人员给一些小鼠使用丙酸灌肠。与喂食Veillonella atypica 菌株的小鼠相同,这些使用丙酸灌肠的小鼠的运动时间也明显增加了。科学家们还给小鼠注射了可以追踪的乳酸,发现这些乳酸会进入到肠道。 而且乳酸有助于这种微生物的生长。
总的来说,葡萄糖因肌肉运动产生乳酸,一部分乳酸通过血液循环进入肝脏,在肝脏中通过糖异生作用重新合成葡萄糖;一部分乳酸通过血液循环进入肠道,肠道中的Veillonella属细菌迅速将乳酸分解成丙酸,从而降低乳酸浓度,改善运动表现。
哺乳动物肠道微生物组可能会通过肌肉衍生的乳酸代谢为丙酸酯来为其宿主提供额外的跑步耐力能力提升。 此外,由于在多个独立的人体研究中,相对于久坐的控制者,经常运动者中的Veillonella菌增加了,这增加了这些微生物通过利用独特的代谢环境(L-乳酸代谢)而在运动员的肠道中具有适应性优势的可能性。 这可能会导致积极的反馈循环,从而以较小的能力加强锻炼。 换句话说,由于预期重复运动会导致肠道L-乳酸浓度增加,L-乳酸代谢物的代谢位扩大,因此,这些L-乳酸代谢物反过来有望提高运动的耐力。
与其他疾病
自闭症
最新的发表在CELL和谷禾健康2019年发表在GUT上的队列都表明,未来发展为自闭症谱系障碍的儿童早期肠道内Veillonella菌富集,比对照儿童显著增加。
原发性硬化性胆管炎
原发性硬化性胆管炎(PSC)是一种罕见的、以肝内外胆管受损为主要特征的原发疾病,易导致胆管炎症和肝纤维化的发生而原发性硬化性胆管炎。
PSC患者肠道菌群某些菌群丰富度也会产生相应变化。特别是韦荣球菌(Veillonella)、肠球菌(Enterococcus)和链球菌(Streptococcus),其丰度显著升高。Veillonella可以通过肠道淋巴细胞进入肝脏。而肠球菌则是一种对万古霉素敏感的细菌,它可以通过分泌金属蛋白酶分解上皮钙黏蛋白破坏肠屏障。
肝病
在NAFLD和NASH中有几项研究确定,随着纤维化的进展,微生物群结构和功能恶化。晚期纤维化和NASH与碳水化合物和脂质代谢的变化有关,因为他们观察到相应功能的细菌含量增加。酒精性肝炎患者或肝脏疾病患者中Veillonella和Enterococcus丰度显著增加,而Veillonella parvula的丰度与白蛋白和血小板计数呈负相关。事实上,在所有3项肝硬化研究中,患者体内的几种Veillonella species的丰度都发生了改变。
肺癌
与对照组相比,肺癌患者的口腔菌群增加,特别是Streptococcus和Veillonella。口腔菌群的增加与PI3K和ERK上调有关。在体外实验中,气道上皮细胞暴露于Veillonella,Prevotella和Streptococcus也会导致ERK和PI3K通路上调(Tsay et al,2018)。PI3K通路被认为是肺癌发生的早期事件,因此共生微生物群失调会上调该通路促进肺癌发生。
胰腺癌
结果显示患有胰腺癌的病人组中三种口腔微生物Streptococcus,Treponema和Veillonella的组分显著低于其他组别。
其他
子痫前期患者会富集 Fusobacterium, Veillonella,Clostridum 等这些细菌。剖腹产的新生儿粪便微生物群富含Veillonella dispar/V这表明皮肤、口腔微生物以及出生过程中周围环境中的细菌是第一批在这些婴儿中定殖的细菌。
与对照组相比,后发展为T2D的研究对象Veillonella dispar的丰度较低,结果表明肠道菌群中的该物种可能与参与宿主血糖调节。
在肥胖的男性中观察到韦荣氏球菌属(Veillonella)和产甲烷短杆菌属(Methanobrevibacter)高于女性。 在吸烟人群中,Veillonella dispar的脂多糖生物合成通路相关的基因出现频率较高。
口腔,捏着呼吸道的脉搏,牙好胃口好,也不是句空话。Veillonella作为口腔和肠道的重要“居民”,它的定植,丰度以及与其他菌落共存的能力决定和影响着人体的口腔和消化道甚至肝肺胃疾病。
相关阅读:
主要参考文献:
Yu Sunakawa, et al. Genomic pathway of gut microbiome to predict efficacy of nivolumab in advanced gastric cancer: DELIVER trial (JACCRO GC-08). ASCO GI. Jan 15-17, 2021. ABSTRACT 161.
Jackson, M.A., Goodrich, J.K., Maxan, M.-E., Freedberg, D.E., Abrams, J.A., Poole, A.C., Sutter, J.L., Welter, D., Ley, R.E., Bell, J.T. et al. (2015) Proton pump inhibitors alter the composition of the gut microbiota. Gut, 65, 749-756.
Shi, Y.-C., Cai, S.-T., Tian, Y.-P., Zhao, H.-J., Zhang, Y.-B., Chen, J., Ren, R.-R., Luo, X., Peng, L.-H., Sun, G. et al. (2019) Effects of Proton Pump Inhibitors on the Gastrointestinal Microbiota in Gastroesophageal Reflux Disease. Genom Proteom Bioinform, 17, 52-63.
Bajaj, J.S., Acharya, C., Fagan, A., White, M.B., Gavis, E., Heuman, D.M., Hylemon, P.B., Fuchs, M., Puri, P., Schubert, M.L. et al. (2018) Proton Pump Inhibitor Initiation and Withdrawal affects Gut Microbiota and Readmission Risk in Cirrhosis. 113, 1177-1186.
Wang L, Yu X, Xu X, Ming J, Wang Z, Gao B, Xing Y, Zhou J, Fu J, Liu T, Liu X, Garstka MA, Wang X and Ji Q (2021) The Fecal Microbiota Is Already Altered in Normoglycemic Individuals Who Go on to Have Type 2 Diabetes. Front. Cell. Infect. Microbiol. 11:598672. doi: 10.3389/fcimb.2021.598672
Wong-Rolle A, Wei HK, Zhao C, Jin C. Unexpected guests in the tumor microenvironment: microbiome in cancer. Protein Cell. 2020 Dec 9. doi: 10.1007/s13238-020-00813-8. Epub ahead of print. PMID: 33296049.
Metagenomic analysis of bacterial species in tongue microbiome of current and never smokers 03-13, doi: 10.1038/s41522-020-0121-6
Scheiman J, Luber JM, Chavkin TA, MacDonald T, Tung A, Pham LD, Wibowo MC, Wurth RC, Punthambaker S, Tierney BT, Yang Z, Hattab MW, Avila-Pacheco J, Clish CB, Lessard S, Church GM, Kostic AD. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism. Nat Med. 2019 Jul;25(7):1104-1109. doi: 10.1038/s41591-019-0485-4. Epub 2019 Jun 24. PMID: 31235964; PMCID: PMC7368972.
Djais AA, Theodorea CF, Mashima I, Otomo M, Saitoh M, Nakazawa F. Identification and phylogenetic analysis of oral Veillonella species isolated from the saliva of Japanese children. F1000Res. 2019 May 3;8:616. doi: 10.12688/f1000research.18506.5. PMID: 31448103; PMCID: PMC6688723.
Mashima I, Theodorea CF, Djais AA, Kunihiro T, Kawamura Y, Otomo M, Saitoh M, Tamai R, Kiyoura Y. Veillonella nakazawae sp. nov., an anaerobic Gram-negative coccus isolated from the oral cavity of Japanese children. Int J Syst Evol Microbiol. 2021 Jan;71(1). doi: 10.1099/ijsem.0.004583. Epub 2020 Dec 2. PMID: 33263509.
Rovery C, Etienne A, Foucault C, Berger P, Brouqui P. Veillonella montpellierensis endocarditis. Emerg Infect Dis. 2005 Jul;11(7):1112-4. doi: 10.3201/eid1107.041361. PMID: 16022792; PMCID: PMC3371781.
Maqsood A. Bhatti, Michael O. Frank, Veillonella parvula Meningitis: Case Report and Review of Veillonella Infections, Clinical Infectious Diseases, Volume 31, Issue 3, September 2000, Pages 839–840, 0人