-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康

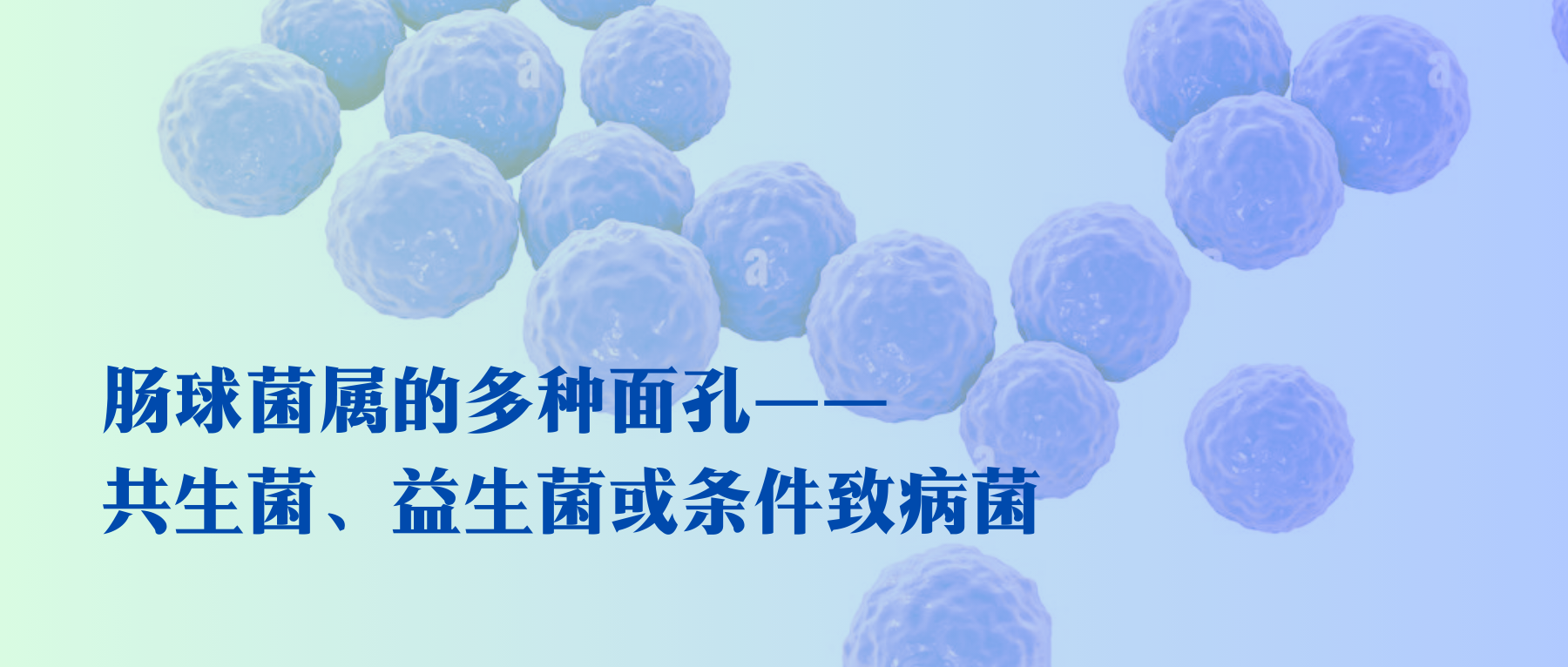
肠球菌属(Enterococcus)是厚壁菌门中一种革兰氏阳性球菌,常成对或短链出现,大部分物种无鞭毛,没有明显的荚膜。
其耐受性非常好,可在10至45°C的温度范围内生长,pH值范围4.6–9.9内生长,对胆汁盐也具有耐受性。目前,肠球菌属包含四十多种已知菌种,可以存在于各种环境中,包括人类、动物和昆虫的消化系统,食物、水源、土壤和一些植物中。
但在35-37°C下生长最佳,因此非常适合在人体肠道内定植。人体肠道中常见的肠球菌是粪肠球菌(E.faecalis)(90-95%)和屎肠球菌(E.faecium)(5-10%)。而粪肠球菌也是其模式菌种。
肠球菌可以发酵多种底物,包括葡萄糖、甘油、乳酸、苹果酸、柠檬酸、氨基酸和许多α-酮酸。能量产生的主要途径是葡萄糖通过糖酵解途径同质生成l-乳酸。粪肠球菌还可以通过降解粘蛋白来获取能量。
肠球菌具有“多种面孔”,其的健康益处可能是由于能够产生具有抑菌活性的“肠素”(细菌素),对李斯特菌、金黄色葡萄球菌等具有抑制作用。
进而可被用作天然的食品生物防腐剂。一些特殊的肠球菌株还被用作益生菌,具有不同有益特性:如刺激免疫力、抗炎活性、降胆固醇作用以及预防/治疗肠易激综合征和抗生素引起的腹泻,减少鼻窦炎患者的复发等。
然而,就像一枚硬币的两面,尽管它们具有促进健康的特性,但它们也具有有害特性。肠球菌也被视为机会性病原体,其表现出复杂的毒力机制,能够在各种宿主组织中定植,并对许多抗生素具有耐药性,包括四环素、β-内酰胺类药物、氟喹诺酮类药物、头孢菌素、磺胺甲噁唑/甲氧苄啶等,还可能导致耐药性的传播。
它们能够从胃肠道转移到各种组织和器官,进而造成感染或疾病。目前,肠球菌是革兰阳性菌中仅次于葡萄球菌属的重要医院感染病原菌,其感染最常见的为尿路感染,其次为腹部和盆腔等部位创伤和术后感染、败血症、心内膜炎和脑膜炎。此外由于其具有耐药性,所以感染治疗起来会更困难。同时,在心力衰竭、房颤、肥胖和炎症性肠病患者中发现了肠球菌属丰度的增加。
1
形态
肠球菌属(Enterococcus)是一种革兰氏阳性、不生芽孢的兼性厌氧菌,细胞呈球形或卵圆形,大小约在0.6~2.0μm×0.6~2.5μm,呈单个、成对或短链状排列。
大部分物种无鞭毛,但极少部分菌株可以通过稀少的鞭毛而运动。没有明显的荚膜。在35-37°C下生长最佳,因此非常适合在人体肠道内定植。
注:DNA G+C 含量(mol%):35.1–44.9
2
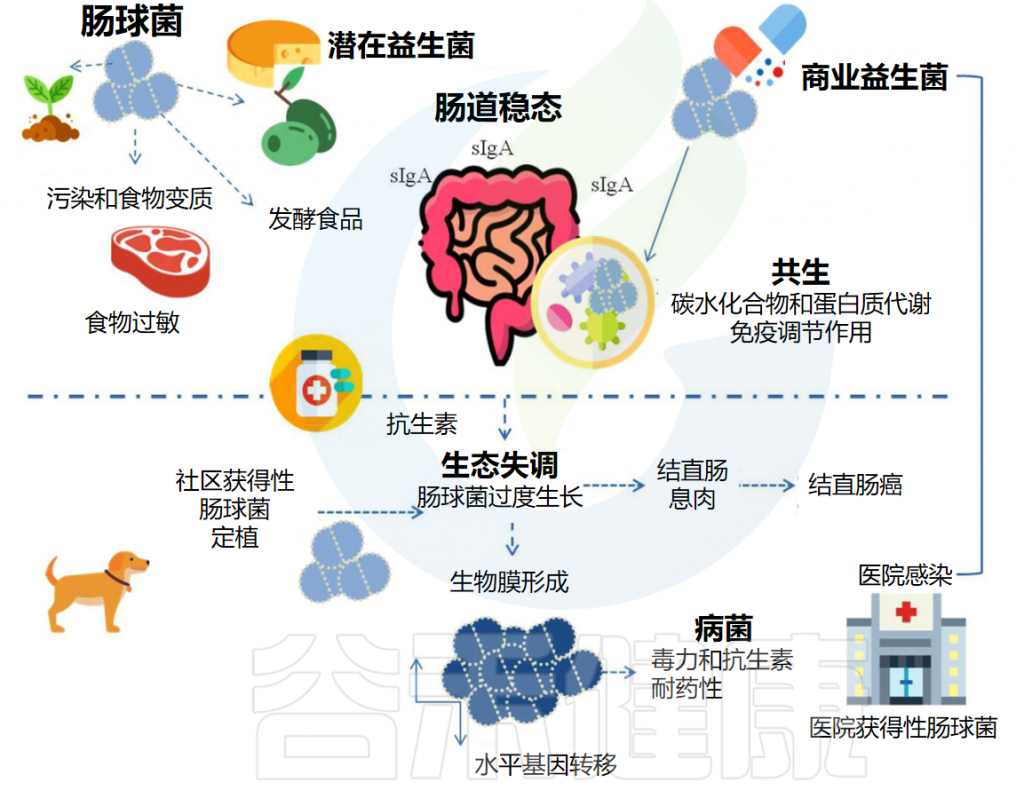
发现历史
“肠球菌”一词最早于1899年提出,用于描述具有致病能力的肠道共生菌。由于形态和生化上的相似性,肠球菌曾被归为链球菌属。
1970年,基于生化和培养特性分析,建议将其归为独立的肠球菌属。1984年,这一建议得到广泛接受,并在1986年版《伯杰氏系统细菌学手册》中出现。
2009年,基于16S rRNA基因相似性提出肠球菌科,包括肠球菌属(Enterococcus) 、迷走球菌 (Vagococcus)、Tetragenococcus和Melissococcus。迄今为止,肠球菌属已包含五十多个物种。
肠球菌的发现历史
doi: 10.1128/CMR.00058-18.
3
常见物种及分布
肠球菌(粪肠球菌和较少的屎肠球菌)在出生后7-10天内定植于大多数健康母乳喂养婴儿的消化系统中。这些微生物主要来自母亲生殖道的生理菌群,但肠球菌也会动态地定植于剖宫产新生儿的胃肠道。
这些菌种对胆汁盐表现出抵抗力,这使它们能够穿过人体消化系统并在大肠中定植。成年人也会从某些食物中获得各种肠球菌种,例如猪肉、家禽和凝乳酶奶酪。
▸ 粪肠球菌为模式菌种
粪肠球菌(Enterococcus faecalis)是肠球菌的模式菌种。人体肠道中主要存在以下两种肠球菌:粪肠球菌(E.faecalis)(90-95%)和屎肠球菌(E.faecium)(5-10%)。人体中较少见的菌群还有E.casseliflavus、E.gallinarum和E.raffinosus。肠球菌很少从阴道和口腔中分离出来,如果发现,极有可能是病原体感染。
粪肠球菌(Enterococcus faecalis)
粪肠球菌(Enterococcus faecalis)是一种革兰氏阳性菌,它不能形成孢子,但对恶劣的环境条件相当耐受,在肠道免疫中起重要作用
粪肠球菌是人类肠道的正常居民,存在于大约90-95%的人中。这种细菌通常是生命早期定植于人类胃肠道的首批微生物之一,在肠道免疫系统的发育中发挥着重要作用。
Enterococcus faecalis T-110:这种粪肠球菌菌株与枯草芽孢杆菌TO-A和丁酸梭菌TO-A结合使用作为益生菌(B10-THREE)。这三种菡株一起可以减少手术患者的术后感染并缩短急性腹泻患儿的住院时间。
Enterococcus faecais YM0831:一项交叉研究发现,对健康人类受试者单次施用该菌株可显著改善血糖对蔗糖耐量试验的反应。
▸ 肠球菌的常见种
临床上分离率最高的是粪肠球菌(E.faecalis),其次是屎肠球菌(E.faecium)。除此之外,还有以下的菌种:
向上滑动阅览
鸟肠球菌(E.avium)
酪黄肠球菌(E.casseliflavus)
坚忍肠球菌(E.durans)
鸡肠球菌(E.galinarum)
芒地肠球菌(E.mundii)
恶臭肠球菌(E.maladoratum)
希拉肠球菌(E.hirae)
孤立肠球菌(E.solitarius)
棉子糖肠球菌(E.raffinosus)
假鸟肠球菌(E.pseudoavium)
粪肠球变异株(E.faecalis var)
Enterococcus gallinarum
Enterococcus gilvus
Enterococcus haemoperoxidus
Enterococcus hawaiiensis
Enterococcus hermanniensis
Enterococcus hirae
Enterococcus inusitatus
Enterococcus italicus
Enterococcus lactis
Enterococcus lemanii
Enterococcus malodoratus
Enterococcus moraviensis
Enterococcus mundtii
Enterococcus olivae
Enterococcus pallens
Enterococcus pernyi
Enterococcus phoeniculicola
Enterococcus plantarum
Enterococcus pseudoavium
Enterococcus quebecensis
Enterococcus raffinosus
Enterococcus ratti
Enterococcus rattus
Enterococcus rivorum
Enterococcus rotai
Enterococcus saccharolyticus
Enterococcus silesiacus
Enterococcus sp.
Enterococcus sp. 2011_Ileo_MS_B2
Enterococcus sp. C6I11
Enterococcus sp. SI-4
Enterococcus sulfureus
Enterococcus termitis
Enterococcus thailandicus
Enterococcus ureasiticus
Enterococcus ureilyticus
Enterococcus viikkiensis
Enterococcus villorum
Enterococcus xiangfangensis
environmental samples
▸ 粪肠球菌和屎肠球菌是人体肠道中常见的肠球菌物种
肠球菌种的分布会因环境、人类和动物而异。粪肠球菌和屎肠球菌在人类胃肠道中最为常见,人类粪便中的粪肠球菌数量为每克105至107个,屎肠球菌的数量为每克104至105个。
▸ 其他动植物中的肠球菌
牲畜中分离出的屎肠球菌和粪肠球菌丰度低于从人类粪便中分离出的。家畜中常见的肠球菌有屎肠球菌(Enterococcus faecium)、盲肠球菌(Enterococcus cecorum)、粪肠球菌(Enterococcus faecalis)、Enterococcus hirae和耐久肠球菌(Enterococcus durans);相比之下,鹑鸡肠球菌(Enterococcus gallinarum)和鸟肠球菌(Enterococcus avium)是罕见的。
粪肠球菌(Enterococcus faecalis)是狗和猫的直肠和扁桃体中常见的一种。而鸽子肠中最常见的是柱状肠球菌(Enterococcus columbae),其次是盲肠球菌(Enterococcus cecorum)。
此外,在爬行动物、蜗牛、采蜜昆虫、白蚁中也发现了肠球菌。肠球菌还可以从食物、植物、土壤和水中分离出来。虽然这些细菌被认为只是植物菌群的临时组成部分,但在良好的条件下,它们可以在植物表面繁殖。从植物中分离出粪肠球菌、屎肠球菌、海氏肠球菌(Enterococcus hirae)、Enterococcus mundtii、Enterococcus casseliflavus和硫肠球菌)。
它们通常从花中分离出来,而不是从芽或叶中分离出来。这表明昆虫可能参与了肠球菌的传播。
▸ 一些食物中也存在肠球菌
肠球菌是许多食物中常见的一部分,尤其是那些动物来源的食物,如牛奶和奶制品、肉类和发酵香肠。它们通常被认为是食品的二级污染物,通常在其腐败中起作用,尽管某些菌株对成熟和香气有积极的影响。
然而,随着某些类型奶酪的开发。肠球菌甚至被用作某些产品中的益生菌培养物。
另一方面,已经证明在发酵剂和食物肠球菌菌株中存在毒力因子,以及毒力决定因素向发酵剂菌株的转移。
▸ 一些具有致病性的肠球菌
以下是临床中发现具有致病性的常见肠球菌物种:
Enterococcus avium
Enterococcus gallinarum
Enterococcus faecium
Enterococcus faecalis
Enterococcus raffinosus
Enterococcus durans
Enterococcus columbae
Enterococcus villorum
Enterococcus dispar
4
生存条件
▸ 肠球菌的耐受性非常好,但人体肠道温度最适宜生长
肠球菌可在10至45°C的温度范围内生长,但大多数物种在35-37°C下生长最佳。许多(但不是全部)品种能在42°C甚至45°C以及(缓慢地)在10°C下生长。
粪肠球菌和屎肠球菌均可在60°C的高温下存活 30 分钟。
▸ 肠球菌耐高盐、高碱、高胆汁、干燥
肠球菌可在pH值范围4.6–9.9内生长,最适pH值为 7.5。它们还可耐受40%(w/v)胆汁盐并在其中生长。粪肠球菌可在6.5% NaCl 中生长,并具有阳离子稳态,这被认为有助于其抵抗pH值、盐、金属和干燥。
5
代谢
肠球菌可以发酵多种底物,包括葡萄糖、甘油、乳酸、苹果酸、柠檬酸、氨基酸和许多α-酮酸。能量产生的主要途径是葡萄糖通过糖酵解途径同质生成l -乳酸。
由于肠球菌可以利用多种糖源,因此它可以在多种环境中生存。在肠道中,粪肠球菌的大部分能量来自未吸收糖的发酵。粪肠球菌还可以通过降解粘蛋白来获取能量,粘蛋白是一种由肠道杯状细胞产生的高度糖基化的碳水化合物。
注:能量也可以通过一些氨基酸的降解获得,如精氨酸、酪氨酸、丝氨酸、苯丙氨酸等。
▸ 在不同环境条件下,可代谢产生不同的物质
在有氧条件下,葡萄糖代谢为乙酸、乙酰和CO2。在pH 5.0-6.0时,丙酮酸被粪肠球菌转化为乳酸,但在中性或微碱性的pH下,丙酮酸以2:1:1的比例转化为甲酸盐、乙醇和醋酸盐。
在营养缺乏的情况下,丙酮酸转化为乙醇和醋酸盐。粪肠球菌通过诱导的特异性苹果酸酶代谢苹果酸。葡萄糖酸盐被磷酸化为6-磷酸葡萄糖酸盐,然后异化为乳酸盐和二氧化碳。
粪肠球菌能将甘油氧化为乙酸、二氧化碳和少量过氧化氢和微量乙酰甲基甲醇;将棘皮酸水解成甘氨酸和苯甲酸。
▸ 肠球菌还具有的代谢通路
卟啉和叶绿素代谢
丙酸代谢
蛋白质输出
嘌呤代谢
嘧啶代谢
丙酮酸代谢
RNA降解
核黄素代谢
次级胆酸生物合成
链霉素生物合成
苯乙烯降解
硫代谢
牛磺酸和亚牛磺酸代谢
硫胺素代谢
色氨酸代谢
缬氨酸、亮氨酸和异亮氨酸的生物合成
缬氨酸、亮氨酸和异亮氨酸降解
维生素B6代谢
β-丙氨酸代谢
2-氧代羧酸代谢
丙氨酸、天冬氨酸和谷氨酸代谢
氨基糖和核苷酸糖代谢
精氨酸和脯氨酸代谢
精氨酸生物合成
抗坏血酸和醛糖酸代谢
不饱和脂肪酸的生物合成
生物素代谢
丁酸代谢
C5-支链二元酸代谢
氯代烷和氯代烯烃降解
氯环己烷和氯苯降解
柠檬酸循环(TCA循环)
芳香族化合物的降解
果糖和甘露糖代谢
半乳糖代谢
谷胱甘肽代谢
甘油脂代谢
甘油磷脂代谢
甘氨酸、丝氨酸和苏氨酸代谢
糖酵解/糖异生
乙醛酸和二羧酸代谢
6
毒力
肠球菌作为一种条件性致病菌,与其致病性有关的特性包括毒力因子和抗生素耐药菌株的增加。
毒力因子是一种效应分子,这些因子有助于其在宿主体内定植和引起感染,会增强微生物致病能力。肠球菌的毒力因子在其致病性中起着重要作用。
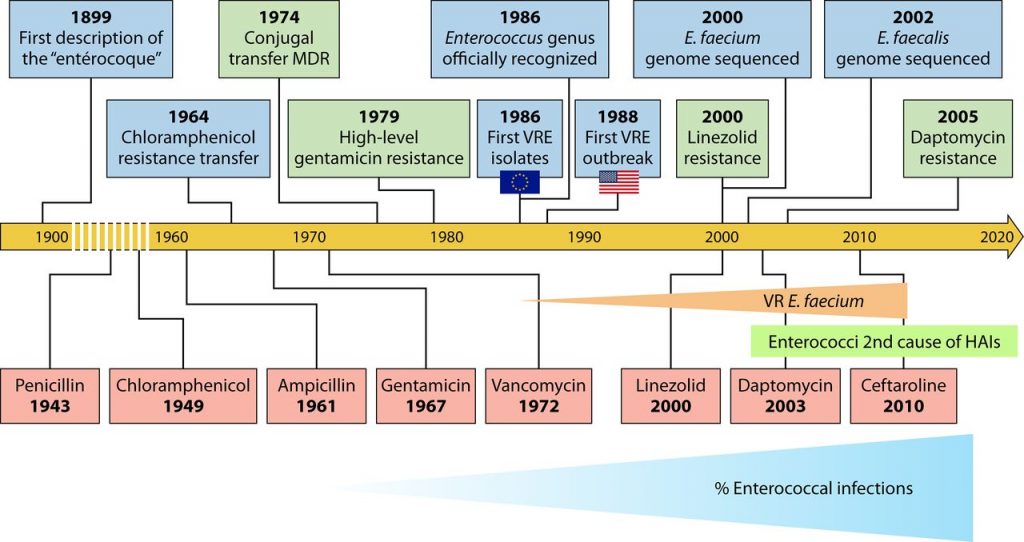
▸ 肠球菌能够产生的一些毒力因子
肠球菌中最常见且描述最详尽的毒力因子是聚集物质(agg、asa1)、溶细胞素(cyl)、明胶酶(gelE)、细胞外表面蛋白(esp)、粘附于胶原蛋白(ace、acm)和粘连样心内膜炎抗原(efaAfs和efaAfm)。
粪肠球菌和屎肠球菌主要毒力因子
Sangiorgio G,et al.Pathogens.2024
毒力因子的具体作用机制
聚集物质(agg和asa1)是诱导肠球菌菌株表面蛋白的毒力因子,可在细菌结合过程中促进聚集体的形成,并介导与上皮细胞的特异性结合以进行定植以及携带毒力特性和抗生素抗性基因的质粒的交换。
此外,聚集物质可以与细胞外基质蛋白结合,如I型胶原、纤连蛋白和血小板反应蛋白。agg基因增加肠球菌表面的疏水性,诱导胆固醇定位于吞噬体并延缓与溶酶体囊泡融合。不过迄今为止,agg决定簇仅存在于粪肠球菌菌株中。
溶细胞素(或β-溶血素)是一种具有双重功能的蛋白质细菌素/溶血素,是肠球菌中研究最多的毒力因子。它是一种肽类毒素,能够通过在细菌靶细胞的细胞质膜上形成孔隙来裂解细胞 。由产生溶细胞素的肠球菌感染引起的死亡频率比不产生溶细胞素的肠球菌感染引起的死亡频率高5倍。
明胶酶是一种胞外锌金属内切肽酶(EC 3.4.24.30),参与明胶、胶原蛋白、β-胰岛素、血红蛋白、酪蛋白和其他生物活性肽的水解。明胶酶能够裂解纤维蛋白并损伤宿主组织,从而使细菌迁移和扩散,这使得其与肠球菌特别是粪肠球菌的毒力有关。此外,这种蛋白酶在生物膜的形成中起着重要作用。
细胞外表面蛋白(esp)是一种与细胞间粘附(特别是粘附于真核细胞和逃避宿主的免疫反应)有关的致病基因决定簇。该基因可促进定植,位于肠球菌属内高度保守的染色体区域,在屎肠球菌中最常见。
efaA毒力基因与心内膜炎密切相关。最为人所知的是粪肠球菌的efaAfs和屎肠球菌的efaAfm。
总体而言,屎肠球菌菌株中这些毒力因子的发生率低于粪肠球菌菌株。毒力最高的肠球菌种是在临床中的分离株,其次是食品分离株,然后是发酵剂菌株。
许多因素会影响肠球菌种的毒力,例如:
(1)在胃肠道(正常的栖息地)定植的能力;
(2)粘附于多种细胞外基质蛋白的能力,包括血小板反应蛋白、乳铁蛋白和玻璃粘连蛋白;
(3)粘附于尿道上皮、口腔上皮和人胚肾细胞的能力。
大多数感染被认为是内源性的,细菌通过肠道上皮细胞易位,然后通过淋巴结引起感染,从而扩散到体内的其他细胞。
7
耐药性
肠球菌对常用抗生素的耐药性是另一个重要的毒力特性,这极大地增强了肠球菌的致病性,使其成为可能引起感染的条件性致病菌。
▸ 肠球菌对许多常用抗生素具有耐药性
肠球菌对许多β-内酰胺类药物、氟喹诺酮类药物、林可胺类药物、头孢菌素、磺胺甲噁唑/甲氧苄啶和低浓度氨基糖苷类药物具有天然耐药性。
肠球菌还可以通过质粒或转座因子从其他微生物获得耐药性,对氯霉素、红霉素、四环素、青霉素、氨苄西林、大环内酯类、氨基糖苷类(如庆大霉素、卡那霉素、链霉素)和糖肽类药物尤其是万古霉素表现出耐药性。
▸ 对万古霉素具有耐药性的肠球菌会造成严重的健康后果
万古霉素耐药菌株会带来严重的健康问题,一项报告了7066例由肠球菌引起的菌血症病例,所有病例中有28%是抗生素耐药性的。万古霉素耐药肠球菌(VRE)的死亡风险为75%,而感染敏感菌株的患者死亡风险为45%。
数据显示,在从血液中分离的肠球菌中,2%的粪肠球菌和60%的屎肠球菌分离菌对万古霉素具有耐药性。
万古霉素耐药肠球菌(VRE)对临床医生来说是一个挑战,因为这种抗生素传统上被认为是治疗肠球菌感染的“最后手段”,因为它经常被用来替代过敏患者的青霉素、氨苄西林和氨基糖苷类药物。
因此,人们开始评估新药作为万古霉素的替代候选药物,例如喹奴普丁和达福普汀、恶唑烷酮和达托霉素。
▸ 其他动物和环境中也存在耐药性肠球菌,并可能影响人体
在世界各地的食用动物和环境中都发现了其他抗生素耐药性肠球菌。事实上,从牛(80%)、鸡(62-64%)、猪(57%)、动物源性食品(如白肉和红肉) 、未煮熟的食物(如生菜)、污水中分离出的肠球菌(粪肠球菌、屎肠球菌和鸡肠球菌)中观察到了较高的庆大霉素、卡那霉素、链霉素、四环素和糖肽耐药性。
肠球菌抗生素耐药性的主要机制
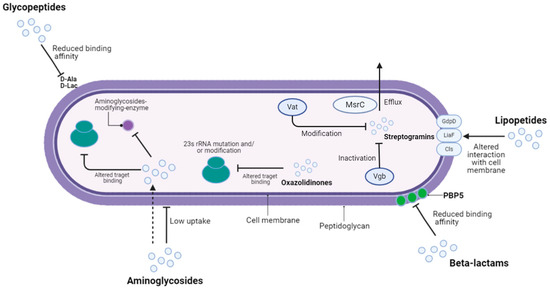
Sangiorgio G,et al.Pathogens.2024
总体而言,在所有这些不同的宿主和环境中都出现了高抗生素耐药性,表明耐药基因在菌株间存在传播。
8
细菌素
细菌素是核糖体合成的、细胞外释放的抗菌肽,对一些细菌物种有抑菌活性。
▸ 肠球菌能够产生具有抑菌活性的肠素
肠球菌产生的细菌素被称为“肠球菌素”,对其他肠球菌和菌群具有抑菌活性。肠球菌素分为四类:
(I类)羊毛硫抗生素肠素,如溶细胞素;
(II类)非羊毛硫抗生素肠素 ,有三个亚类,如肠素A(II-1类)、肠素Q(II-2类)和肠素B(II-3类);
(III类)其次是环状肠素,如肠素AS-48;
(IV类)高分子量肠素,如肠溶素A。
注:大多数已知的肠素属于II类。
肠球菌产生的细菌素
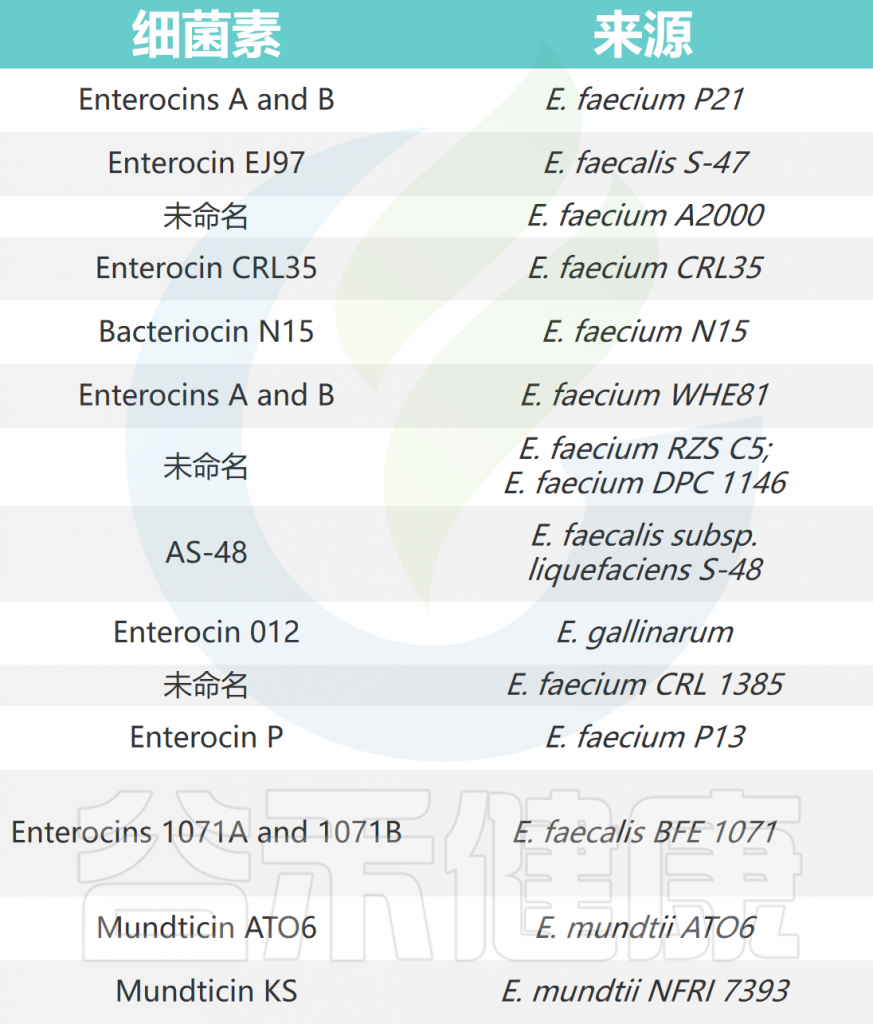
doi: 10.1099/mic.0.026385-0.
▸ 肠球菌素对李斯特菌、金黄色葡萄球菌等具有抑菌活性
已从乳制品、发酵肉以及蔬菜和植物中分离出产”肠球菌素”的肠球菌。它们对李斯特菌(Listeria)、梭菌(Clostridum)和金黄色葡萄球菌(Staphylococcus aureus)有抑菌活性。
E. faecium RZS C5 是一种天然奶酪分离物,具有抗李斯特菌特性。来自E. faecalis S-47的肠素 EJ97也表现出抗李斯特菌特性,浓度为20 AU ml−1时,6小时后细菌数量减少 ,24小时后完全抑制。
肠素 AS-48(由E. faecalis A-48-32 产生)可抑制罐装水果和蔬菜中冷藏和高温条件下凝结芽孢杆菌(Bacillus coagulans)细胞的生长。细菌素对抗革兰氏阴性菌的活性并不常见,但来自E. mundtii的细菌素 ST15已被证明可有效对抗一系列革兰氏阳性菌和革兰氏阴性菌,包括不动杆菌(Acinetobacter)、芽孢杆菌(Bacillus)、梭菌(Clostridium)、克雷伯氏菌(Klebsiella)、乳酸杆菌(Lactobacillus)和假单胞菌(Pseudomonas)。
▸ 肠球菌素如何发挥抑菌作用?
细菌素的杀菌作用被认为是由于细胞膜的通透性。细菌素的随机卷曲肽与细胞膜接触后形成螺旋结构,该结构融入并跨越膜,从而产生孔隙。这种作用方式已在肠素P中观察到。由此产生的孔隙导致K+离子泄漏、膜电位耗散和抑制氨基酸吸收。ATP 驱动的细胞吸收K+和细菌素介导的K+释放的循环会导致细胞死亡,从而抑制一些菌种的定值。
9
与其他菌的互作
肠球菌作为一类广泛存在于人类和动物肠道中的微生物,它们与肠道微生物群中的其他成员之间存在着复杂的相互作用。以下是谷禾通过查阅相关文献对肠球菌与其他肠道微生物群相互作用的总结:
▸ 屎肠球菌可以抑制李斯特菌、伤寒沙门氏菌等
屎肠球菌(Enterococcus faecium)是一种在人体中广泛存在的细菌,它能够产生一种名为肠球菌素的抗菌物质,这种物质具有广谱抗菌活性,可以抑制如植物乳杆菌(Lactobacillus plantarum)、单核细胞增生李斯特菌(Listeria monocytogenes)以及伤寒沙门氏菌(Salmonella paratyphi)等细菌的生长。
除此之外,一些研究表明肠球菌还可以抑制Peptoclostridium的生长与活性。
注:肠球菌因为这一特性可作为生物防腐剂,它们通过抑制病原菌和降解菌的生长,确保了产品的质量和安全。与传统的化学防腐剂相比,肠球菌素等具有更佳的生物相容性和环境友好性。
▸ 抑制肠球菌的细菌
Blautia producta 的共生菌株通过产生特定的抗菌化合物,可以抑制并排除粪肠球菌(E.faecium)。
此外,肠道中的枯草芽孢杆菌(Bacillus subtilis)释放一种抑制性化合物,可以阳止金黄色葡萄球菌的定植能力,或抑制肠球菌(Enterococcus faecalis)的毒力因子表达。
肠球菌(Enterococcus)是人类微生物群的天然组成部分。它们常定植于下消化道,口腔和生殖道中较少见。
★ 肠球菌是人体共生菌之一
人体肠道中约有106至107个肠球菌,结肠中发现的肠球菌高达1%,其中大多数是粪肠球菌(105-107 CFU/克粪便)或屎肠球菌(104 -105 CFU/克粪便)。
除了粪肠球菌(E. faecalis)和屎肠球菌(E. faecium)外,还经常分离出盲肠肠球菌(E. cecorum)和坚忍肠球菌(E. durans),偶尔也会检测到干酪肠球菌(E.caseliflavus)、海氏肠球菌(E. hirae)、鸡肠球菌 (E. gallinaroum)和鸟肠球菌(E. avium)。
参与营养物质代谢、激活免疫细胞
由于肠球菌在人体微生物群中存在大量,这表明它们可能在消化道中发挥重要作用。作为共生菌,它们参与营养物质(碳水化合物、脂质和蛋白质)的代谢,以及维持其生存环境的pH值,合成对正常功能很重要的维生素和其他代谢物,防止腐败细菌的定植和扩散,并对人体免疫系统(体液免疫和细胞免疫)产生影响。
研究发现,粪肠球菌(E.faecalis)可以起免疫调节作用,负责激活CD4、CD8(CD 分化簇)细胞和B淋巴细胞。
同时肠球菌还会影响肠道淋巴系统(肠道相关淋巴组织,是负责产生分泌性免疫球蛋白A(sIgA)的免疫器官)。sIgA 是肠道屏障的重要组成部分,它可以防止微生物粘附到上皮细胞上、中和细菌毒素、覆盖和凝集微生物,并具有抑菌作用。
作为一种益生菌
一些肠球菌菌株(如屎肠球菌M74和屎肠球菌SF-68)已被证明可作为一种安全有效的益生菌制剂。例如FortiFlora®和Cernivet®(含屎肠球菌SF68)和含粪肠球菌的Symbioflor®1。
• 缓解肠易激综合征和抗生素引起的腹泻

肠球菌益生菌可用于治疗或预防某些人类疾病,特别是在治疗腹泻方面。研究发现屎肠球菌(E.faecium strain SF68)可以缓解肠易激综合征症状和接受抗生素治疗的慢性肺结核患者的腹泻发病率,并预防了粘膜炎(可能是维生素缺乏的后果)。
使用屎肠球菌SF68 治疗腹泻被认为是抗生素治疗的替代方案。临床研究还显示,屎肠球菌对治疗儿童和成人肠炎有效, 对屎肠球菌SF68 治疗肠炎的“双盲”对照研究表明,腹泻持续时间和大便正常化时间显著减少。
• 减少鼻窦炎患者的复发

使用肠球菌还可以治疗慢性和复发性上呼吸道感染、鼻窦相关的慢性疾病(慢性鼻窦炎)。
一项双盲、安慰剂对照研究调查了157名患有慢性复发性鼻窦炎的患者在使用细菌免疫刺激剂(由人粪肠球菌细菌的细胞和自溶物组成)治疗期间急性复发的发生情况,并与使用安慰剂的患者进行了比较。结果表明,在使用粪肠球菌制成的免疫刺激剂后,复发的发生率(50次)约为安慰剂下观察到的复发次数(90次)的一半。
目前,粪肠球菌的益生菌制剂(有时富含大肠杆菌和乳杆菌)被推荐用于治疗鼻窦炎或支气管炎以及普通感冒等疾病。
注:在德国,粪肠球菌(DSM 16431) 以 Symbioflor 1的商品名作为药物出售,推荐用于治疗急性和复发性鼻窦炎或支气管炎。
• 一些菌种能产生丁酸,具有抗炎作用
已发现E. durans M4-5 能产生丁酸、短链脂肪酸 (SCFA),其可诱导显著的抗炎作用并有助于肠道上皮的完整性。
• 降低胆固醇水平

研究发现肠球菌(例如E.faecium M-74、E.durans KLDS)还具有降低胆固醇水平的特点。这些细菌产生一种水解酶,可催化胆汁酸解离过程,帮助胆固醇整合到细菌细胞壁中,或在酸性环境中帮助沉淀。
• 抗癌、免疫调节作用
此外,一些肠球菌还表现出抗诱变、抗致癌和免疫调节作用。
最近,菌株E. durans LAB18s还被推荐用作膳食硒补充剂的来源,而E.faecium LCW 44和E.durans 6HL 分别被证实对革兰氏阳性菌和革兰氏阴性菌具有很强的抑制作用。
益生菌E. faecium M-74 可用于治疗患有髓性白血病患者的胃肠道并发症。在小鼠模型中发表的另一份报告表明,海氏肠球菌(Enterococcus hirae)有助于形成抗癌免疫反应。
在食品中的益处
• 改善发酵乳制品的质地和口感
肠球菌存在于未经处理的牛奶、奶酪、肉类和植物产品(发酵蔬菜)等食品中。在食品工业中,精选的肠球菌菌株有助于改善发酵乳制品的香气、质地和口感。
肠球菌菌株可以将蛋白质降解为肽和氨基酸,分解柠檬酸盐,并产生具有脂解和蛋白水解特性的芳香物质。它们具有蛋白水解、脂解以及柠檬酸和丙酮酸代谢的能力,因此被用作乳制品的发酵剂。
• 一种天然的食品防腐剂
此外,肠杆菌通过产生肠素来抑制腐败微生物的增殖,这些细菌素可用作食品防腐剂。
由于它们对热处理(烹饪、巴氏灭菌或发酵)具有耐受性,因此它们也可用作食品生产中的天然防腐剂和卫生指标。
在养殖业中的作用
益生菌制剂也用于养殖业,以预防或治疗肠道疾病,或作为生长促进剂。
• 免疫调节作用、防止腹泻
例如,一些肠球菌益生菌被纳入饲料添加剂类别,用于稳定单胃动物和反刍动物消化道的微生物群落。屎肠球菌NCIMB 11181 和屎肠球菌DSM 7134 菌株已获批准作为牛和猪的饲料添加剂。益生菌屎肠球菌SF68®和粪肠球菌Symbioflor 1 也用于预防或治疗猪、家禽、牲畜和宠物的腹泻。屎肠球菌SF68对幼犬肠粘膜和消化系统发育具有免疫调节作用。
• 促进生长、提高代谢效率
此外,肠球菌对动物的生长和健康特征具有积极影响。用肠球菌益生菌属喂养猪,发现能减少肠道病原体。同样,给断奶后小猪口服屎肠球菌NHRD IHARA可提高血清和粪便中的IgA水平,改善小猪的生长。研究还表明,屎肠球菌能促进鸡的生长、肠道形态和盲肠微生物群的稳态。据报道,屎肠球菌还能提高肉鸡的代谢效率,降低炎症反应。
• 抑制水生病原体,改善鱼类生长
另一方面,许多研究表明肠球菌在水产养殖中具有有益作用。一些研究报道了屎肠球菌对水生病原体具有广泛的抑制作用,包括Yersinia ruckeri、哈维氏弧菌(Vibrio harveyi)、无乳链球菌(Streptococcus agalactiae)和维氏气单胞菌(Aeromonas veronii)。
此外,许多试验发现了将屎肠球菌添加到饲料中以改善鱼类生长和刺激免疫反应的功效。
肠球菌属(Enterococcus)普遍存在于人类及动物肠道内。正常情况下,肠球菌被认为是一种无害的共生菌,甚至被认为对许多胃肠道和全身疾病有积极作用。
然而,当与宿主的共生关系被破坏时,肠球菌可引起一些感染或疾病。目前,肠球菌是革兰阳性菌中仅次于葡萄球菌属的重要医院感染病原菌,其感染最常见的为尿路感染,其次为腹部和盆腔等部位创伤和术后感染、败血症、心内膜炎和脑膜炎。此外由于其具有耐药性,所致感染治疗困难。
注:目前几乎所有的院内肠球菌感染都是由粪肠球菌或屎肠球菌引起的。其中,粪肠球菌是致病性最强的菌种,但屎肠球菌的重要性日益增加,因为它通常对抗菌药物的耐药性更强。
肠球菌血流感染

肠球菌血流感染(BSI)与高死亡率相关。最近一项对加拿大医院的大型调查研究显示,住院患者肠球菌BSI发病率为每100000人 6.9 例,其中大多数病例由粪肠球菌引起(每100000人4.5例)。
• 肠球菌血流感染的死亡风险很高
在瑞士, 2008年至2014年间肠球菌血流感染发病率有所增加(每100000人9至14例),总体而言,院内肠球菌BSI的死亡率相当高,为25%至50%。
大多数肠球菌性血流感染病例被认为是肠球菌从肠道易位到血液所致。其他感染途径包括静脉注射、心内膜炎、尿路感染和脓肿。
肠球菌血流感染的死亡危险因素包括病情严重程度、患者年龄以及使用第三代头孢菌素或甲硝唑。
研究发现,感染溶血性、庆大霉素耐药粪肠球菌菌株的患者与感染非溶血性、庆大霉素敏感菌株的患者相比,三周内死亡风险增加5倍。
2
尿路感染
肠球菌是从尿路感染中分离出的最常见的革兰氏阳性菌,2011年至2014年期间,国家医疗保健安全网络报告了超过 20000 例病例。在这些病例中,超过50%是由粪肠球菌引起的,其次是“其他肠球菌种”(约30%)和屎肠球菌(约 20%)。
最令人担忧的是,约85%的屎肠球菌分离株对万古霉素具有耐药性,并且耐药分离株的比例每年都在增加。
3
心内膜炎
在肠球菌引起的感染中,感染性心内膜炎(IE)是治疗难度最大的感染之一。肠球菌占所有IE病例的10%至20%,其中大多数是由粪肠球菌引起的。
在感染性心内膜炎中,细菌在心内膜定植会导致组织内出现赘生物,并在细菌周围形成生物膜状基质,免疫系统或抗生素都难以穿透这些基质。
4
根管治疗失败
粪肠球菌(E. faecalis)是根管治疗失败的一个重要原因,部分原因是它对许多消毒剂和抗菌剂具有耐药性。
• 根管治疗常用的消毒剂无法完全杀灭粪肠球菌
在导致根管治疗失败的慢性和持续性根尖周围病变病例中尤其如此,24%~77%的病例中分离出粪肠球菌。氢氧化钙是根管治疗常用的消毒剂,已证实其本身无法完全杀死粪肠球菌,其他消毒剂如柠檬酸也是如此。
粪肠球菌能在根管内长时间耐受饥饿,并通过牙槽骨和牙周膜的血清复苏。获得充足食物后,粪肠球菌利用SprE和GelE蛋白酶及胶原结合蛋白Ace与牙本质结合并形成生物膜,进而影响根管治疗的效果。
注:一旦感染,最有效的治疗方法包括用次氯酸钠或洗必泰溶液长时间冲洗根管。在初始过程中使用洗必泰或次氯酸钠冲洗被认为是预防粪肠球菌感染根管和防止失败的最佳选择。
5
组织挫伤
肠球菌感染在宿主体内引发病理变化。这可能由宿主的炎症反应,或是粪肠球菌分泌的毒素、蛋白酶及有毒代谢副产物直接造成的组织损伤引起。
• 肠球菌脂磷壁酸具有炎症性
肠球菌脂磷壁酸(LTA)与多种生物过程有关,LTA的一些特性包括调节宿主的免疫反应和介导肠球菌粘附于宿主细胞。
研究发现肠球菌的LTA与革兰氏阴性菌的脂多糖一样具有炎症性。肠球菌结合物质(EBS)(至少部分源自 LTA)缺陷且蛋白质粘附素AS缺陷的粪肠球菌菌株在注射到兔子体内会诱发临床疾病症状。
• 肠球菌溶细胞素和蛋白酶对细胞具有一定毒性
肠球菌溶细胞素和两种蛋白酶(一种是锌金属蛋白酶(明胶酶)、一种是丝氨酸蛋白酶)是会导致疾病严重程度的分泌因子。溶细胞素的存在还被证实会促进粪肠球菌在血液中的出现。
这种毒素它既具有细菌素活性,又会对多种哺乳动物细胞类型有毒性。
使用兔眼内炎模型获得了由细胞溶素引起的病理损伤最直接和定量的证据。感染后24小时 β 波反应减弱和视网膜结构完全破坏明确证明了细胞溶素在组织病理学中的作用。
在无菌大鼠模型中,一种蛋白水解(Gel+)菌株表现出致龋活性,而三种非蛋白水解菌株几乎没有致龋性。
• 产生过量的过氧化氢造成细胞损伤

除了分泌蛋白外,粪肠球菌和屎肠球菌还被证明会产生有毒的氧代谢物,从而导致细胞或器官损伤。
一项研究表明,所检测的绝大多数(87/91)粪肠球菌菌株产生超氧化物(O2–),而屎肠球菌分离株产生超氧化物的频率较低。经研究推测,氧自由基的膜损伤作用可能会增强附近肠上皮细胞的细胞损伤。此外,细胞外超氧化物和过氧化氢的产生会损害结肠上皮细胞 DNA。
6
食源性肠球菌的危害
肠球菌的威胁不仅存在于临床感染。由于卫生条件差造成的污染导致食品中存在肠球菌也具有一定危害。粪肠球菌或屎肠球菌是造成手工和传统奶酪污染的最常见原因,但也发现了其他菌种(E.casseliflavus、E.durans、E.hirae和E.gallinarum)。
例如,从散装牛奶储罐中分离出E. casseliflavus和粪肠球菌。禽肉在加工过程中也可能被粪肠球菌和屎肠球菌污染,这种情况很常见。
• 对抗生素的耐药性会通过被肠球菌污染的食物传播
抗菌药物的广泛使用促进了耐药微生物的出现和传播。食物链是耐药性在环境和人类之间传播的关键因素。

人们发现临床材料和食物之间的细菌耐药性特征相似。最常见的是,这些细菌菌株对链霉素、红霉素、四环素和利福平表现出耐药性。
从即食食品中分离的肠球菌菌株中检测到氨基糖苷类、四环素类和大环内酯类药物的耐药基因水平转移。
研究显示,携带耐药基因的食源性肠球菌数量众多可能会显著降低抗生素治疗肠道感染的有效性。由于其高度适应能力,食物中的肠球菌会暂时或永久地定植于消化道,这增加了基因转移至肠道菌群的危险。
• 肠球菌会导致食物腐败
肠球菌也会导致食物腐败。它们会产生酪胺、组胺、苯乙丙氨酸、尸胺和腐胺等热稳定性胺,这些胺可引起过敏反应或中毒。
7
肠球菌在其他疾病中的丰度变化
通过查阅相关文献和谷禾的数据库,我们还发现肠球菌和以下疾病的联系:
• 移植物抗宿主病
一些细菌如肠球菌(Enterococcus spp.)与移植物抗宿主病(GVHD)高风险有关。
• 心力衰竭和房颤患者中丰度增加
与对照相比,心力衰竭患者肠道菌群中的肠球菌属(Enterococcus)丰度增加,在心脏病变患者中也观察到肠球菌属和肠球科的升高。
较多的基因和属种表明房颤患者体内可能存在多种有害细菌过度生长。瘤胃球菌(Ruminococcus)、链球菌(Streptococcus)、韦荣氏球菌(Veillonella)和肠球菌(Enterococcus)等在房颤患者中更为富集。
• 肥胖和炎症性肠病中肠球菌数量增加
肥胖是一种慢性代谢性疾病,引起肥胖的因素众多,如遗传因素、环境变化、生活和饮食习惯等,其中肠道微生物群的影响越来越受到人们的重视。
在属的水平上,分枝杆菌属、粪杆菌属、拟杆菌属、副拟杆菌属、粪杆菌属、毛螺菌属等显著减少,而梭菌属、芽孢杆菌属、布劳氏菌属、肠球菌属(Enterococcus)、萨特氏菌属、克雷伯氏菌属、柯林氏菌属、普雷沃氏菌属和乳酸杆菌属显著增加。
而在活跃期炎症性肠病与某些菌群的数量过多有关,如:
肠杆菌科(Enterobacteriaceae) ↑↑↑
梭杆菌属(Fusobacterium) ↑↑↑
咽峡炎链球菌(Streptococcus anginosus) ↑↑↑
肠球菌(Enterococcus) ↑↑↑
• 可能存在一定的致癌作用
肠道微生物群中的几种菌,这些细菌除了它们的致病性之外,还被可能对结肠直肠癌具有致癌作用,包括幽门螺杆菌、肝螺杆菌(Helicobacter hepaticus)、牛链球菌(Streptococcus bovis)、大肠杆菌、脆弱拟杆菌(B. fragiis)、败血梭菌(Clostnidium septicum)、粪肠球菌(Enterococcus faecalis)、具核梭杆菌(F.nucleatum)和牙龈卟啉单胞菌(Porphyromonas gingivalis),这些细菌都显示出潜在的致癌作用。
此外,肝外胆管癌患者体内也检测到大量肠球菌(Enterococcus)。
• 百岁老人肠球菌属含量较低
研究发现,与100岁以下人群相比,百岁老人体内肠道细菌(如拟杆菌属、脱硫弧菌属、瘤胃球菌科、乳杆菌、嗜粘蛋白阿克曼氏菌、发酵短杆菌属)含量较高,而Faecalibacter、普雷沃氏菌属、克雷伯氏菌属、链球菌属、肠杆菌属、肠球菌属含量较低。因此,我们推测肠球菌的丰度过高可能不利于健康。
肠球菌属(Enterococcus)是一种革兰氏阳性、兼性厌氧球菌,广泛存在于胃肠道中,在阴道或口腔中较少见。粪肠球菌(Enterococcus faecalis)和屎肠球菌(Enterococcus Faecium)是人类中最常见的菌种。作为共生菌,肠球菌定植于消化系统中并参与营养物质代谢及调节人类的免疫系统。
肠球菌还因其生物特性(酶和蛋白水解活性)而被用作食品发酵的发酵剂,或因其产生的抗菌细菌素(称为肠素)而被用作天然的食品生物防腐剂。一些特殊的肠球菌株还被用作益生菌,具有不同有益特性:如刺激免疫力、抗炎活性、降胆固醇作用以及预防/治疗肠易激综合征和抗生素引起的腹泻,减少鼻窦炎患者的复发等。
然而,就像一枚硬币的两面,尽管它们具有促进健康的特性,但它们可能具有有害特性。由于肠球菌菌株表现出复杂的毒力机制,使其能够在各种宿主组织中定植,并对许多抗生素具有耐药性,可能会导致耐药性的传播,肠球菌也被视为机会性病原体。
它们能够从胃肠道转移到各种组织和器官,进而造成感染或疾病。目前,肠球菌是革兰阳性菌中仅次于葡萄球菌属的重要医院感染病原菌,其感染最常见的为尿路感染,其次为腹部和盆腔等部位创伤和术后感染、败血症、心内膜炎和脑膜炎。此外由于其具有耐药性,所以感染治疗起来会更困难。同时,在心力衰竭、房颤、肥胖和炎症性肠病患者中发现了肠球菌属丰度的增加。

需要更深入地了解具体肠球菌种的健康益处、毒力特性,尤其是抗生素耐药性的增加,以便充分认识到肠球菌在改善健康和致病方面的复杂性。
通过深入理解肠球菌与宿主之间的微妙平衡,我们可以更好地利用这种微生物来促进人类健康,并开发新的治疗策略来对抗相关疾病。
主要参考文献
Krawczyk B, Wityk P, Gałęcka M, Michalik M. The Many Faces of Enterococcus spp.-Commensal, Probiotic and Opportunistic Pathogen. Microorganisms. 2021 Sep 7;9(9):1900.
Sangiorgio G, Calvo M, Migliorisi G, Campanile F, Stefani S. The Impact of Enterococcus spp. in the Immunocompromised Host: A Comprehensive Review. Pathogens. 2024 May 15;13(5):409.
García-Solache M, Rice LB. The Enterococcus: a Model of Adaptability to Its Environment. Clin Microbiol Rev. 2019 Jan 30;32(2):e00058-18.
Dubin K, Pamer EG. Enterococci and Their Interactions with the Intestinal Microbiome. Microbiol Spectr. 2014 Nov;5(6):10.1128/microbiolspec.BAD-0014-2016.
Kayser FH. Safety aspects of enterococci from the medical point of view. Int J Food Microbiol. 2003 Dec 1;88(2-3):255-62.
Byappanahalli MN, Nevers MB, Korajkic A, Staley ZR, Harwood VJ. 2012. Enterococci in the Environment. Microbiol Mol Biol Rev 76:.
Chajęcka-Wierzchowska W, Zadernowska A, Zarzecka U, Zakrzewski A, Gajewska J. Enterococci from ready-to-eat food – horizontal gene transfer of antibiotic resistance genes and genotypic characterization by PCR melting profile. J Sci Food Agric. 2019 Feb;99(3):1172-1179.
Fisher K, Phillips C. The ecology, epidemiology and virulence of Enterococcus. Microbiology (Reading). 2009 Jun;155(Pt 6):1749-1757.
Ramos S, Silva V, Dapkevicius MLE, Igrejas G, Poeta P. Enterococci, from Harmless Bacteria to a Pathogen. Microorganisms. 2020 Jul 25;8(8):1118.
Fiore E.Van Tyne D.Gilmore MS. 2019. Pathogenicity of Enterococci. Microbiol Spectr 7:10.1128/microbiolspec.gpp3-0053-2018.
Ben Braïek O, Smaoui S. Enterococci: Between Emerging Pathogens and Potential Probiotics. Biomed Res Int. 2019 May 23;2019:5938210.
谷禾健康
过敏性鼻炎是个全球性健康问题,易反复发作,困扰着全世界大约着4亿人。自20世纪60年代以来,过敏性鼻炎的患病率持续上升。近几年,我国主要大中城市过敏性鼻炎的平均患病率从11.1%升高到17.6%。
过敏性鼻炎主要临床表现包括发痒、打喷嚏、鼻塞等,这些症状不加以改善,严重的话会导致睡眠障碍、学习障碍和行为改变等,最终影响患者的生活质量。
过敏性鼻炎与普通感冒不一样,它不是由任何病毒引起的,因此不会传染。过敏性鼻炎主要由过敏原引起,常见过敏原包括花粉、灰尘、动物毛发、皮屑等。
目前过敏性鼻炎的治疗主要基于鼻用皮质类固醇以及鼻用和口服H1-抗组胺药等。但这些药物的有效性是有限的,并且还具有多种副作用,会产生药物依赖性,药效下降等问题。
目前越来越多的研究表明,过敏性鼻炎是一个较复杂的免疫炎症反应疾病,其中肠道微生物群在该病的发生发展过程中扮演了不可替代的角色,针对菌群的干预,无论在动物还是人类临床上均显示出了较大的改善,以及作为药物治疗的补充综合改善措施。
本文我们来详细了解关于过敏性鼻炎的症状,发生过程,风险因素,与肠道微生物群的关系,益生菌在该病中发挥的作用,其他过敏性鼻炎相关治疗干预措施包括饮食、生活方式、益生元、合生元等。
【全文概览】
01 关于过敏性鼻炎,你需要知道
发病率、症状、风险因素、易感人群
与普通鼻炎的区别;与感冒的区别
02 过敏性鼻炎是如何形成的?
发病机理、如何与肠道相关联
03 过敏性鼻炎与肠道菌群之间的关系
04 肠道菌群在过敏性鼻炎中的重要作用(机理)
肠道菌群 ⇄ Th1/Th2 平衡
肠道菌群影响ILC2:过敏中的重要作用
肠道菌群对血清炎症因子的影响
肠道菌群对Treg/Th17细胞平衡的影响
肠道菌群对耐受树突状细胞活性的影响
肠道菌群对Toll样受体的刺激
05 过敏性鼻炎的治疗
06 基于菌群的干预,对过敏性鼻炎的改善
益生菌
益生元
合生元
细菌裂解物
粪菌移植
饮食
07 关于改善过敏性鼻炎的其他自然疗法
草药或补充剂等
锻炼
生活方式
在了解过敏性鼻炎是如何形成之前,我们先了解一下,什么是过敏性鼻炎?

据不完全统计,我国过敏性鼻炎的发病率在5%-25%之间,各个地区发病率不太一样,城乡差异也十分显著,估计全国患病人数在1亿以上。
尘螨在南方的致敏率最高,艾蒿、豚草和蒲公英则是西北最常见的过敏原。
大约 80% 的过敏性鼻炎症状在 20 岁之前出现,并在 20-40 岁达到高峰,然后逐渐下降。据报道,出生后头 5 年儿童过敏性鼻炎的发病率为 17.2%,诊断时的高峰年龄为 24 ~ 29 个月 (2.5%) .
过敏性鼻炎是一个常见病、多发病,可分为季节性(间歇性)或常年性(慢性),大约 20% 的病例是季节性的,40% 是常年性的,40% 的病例同时具有这两种特征。
最初可能出现的症状包括:
可能还会遇到其他较多症状,包括:
当身体对大多数人无害的物质(如花粉)反应过度时,就会发生过敏性鼻炎。
通常在接触某些物质后会出现过敏性鼻炎,过敏原一般分为以下四大类:
我们稍作展开讨论:
➤ 来自屋尘过敏原
实际上,携带过敏原的并不是尘螨本身,而是一种化学物质,在尘螨的排泄物中发现,一般会以人类皮屑为生,常见于家中的以下位置:
地毯、床垫、枕头、床单、窗帘等
➤ 来自树、草等花粉过敏原
根据一年中的不同时间,会出现不同类型的过敏原,因为从春季到深秋,树木、草都会产生花粉
树木包括:
桦木(非常常见)、雪松、榛、扁柏、角树、七叶树、菩提树、橄榄、松树、白杨、柳树等
草包括:
黑麦草、蒂莫西、艾蒿、荨麻、芭蕉、豚草等
➤ 来自动物毛发的过敏原
注意过敏原携带在动物的毛发上。引起过敏原的不是真正的毛发,而是毛发上携带的动物死皮屑、唾液、尿液等。
研究表明,早年接触通常携带过敏原的动物会降低晚年患此类过敏性鼻炎的患病率。
这类动物包括:
猫、狗(这两种非常常见)
牛、马、兔子、啮齿动物等
➤ 来自工作中明确遇到的过敏原
某些特定物质会在一些人身上引起过敏性鼻炎,因此如果职业要求接触以下的一种或多种过敏原,那么患过敏性鼻炎的风险就会增加。
过敏性鼻炎是由遗传和环境因素相互作用引起的。
父母或家庭成员患有过敏性鼻炎,则患过敏性鼻炎的几率更大。
根据卫生假说,过敏性鼻炎发病率的增加与环境因素的变化有关,例如:
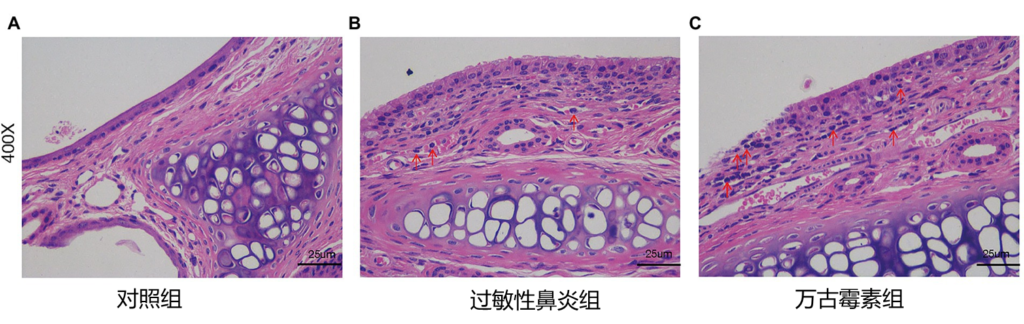
近期发表的在小鼠实验中,万古霉素诱导的肠道菌群失调,通过改变短链脂肪酸,加剧肠粘膜屏障的破坏,增加小鼠过敏性鼻炎的易感性和严重性。
鼻粘膜的 H&E 染色
Zhen et al., Front. Microbiol. 2022
万古霉素诱导的肠道菌群失调加重了过敏性鼻炎的严重程度,加重了鼻粘膜的炎症细胞浸润和粘液分泌。
关于过敏性鼻炎,这里有几个需要注意的点:
鼻炎是鼻粘膜的炎症,它是一种上呼吸道疾病。鼻炎的临床症状包括阵发性打喷嚏、鼻塞、流鼻涕、流眼泪等,没有明显病因。而过敏性鼻炎作为鼻炎的一种,症状是由过敏原引发的。
很多人刚开始打喷嚏的时候,还以为是感冒了,赶紧吃感冒药,却发现并没有好转…
实际上过敏性鼻炎的症状往往与早期感冒的症状很相似。
一般来说,可以通过以下几点来区分到底是感冒还是过敏性鼻炎:
1
感冒通常伴有全身症状,如无力、发热、全身酸痛等,而过敏性鼻炎只是单纯的鼻部问题,除了可能有头痛,没有其他全身性疼痛症状。
2
过敏性鼻炎有可能会持续数周至数月,而感冒通常会在1-2周内自愈。
3
大多数过敏性鼻炎具有非常明显的季节性,尤其是春秋两季,而感冒一年四季都可能发生。
4
通过验血,大多数过敏性鼻炎在血液分析中显示嗜酸性粒细胞和 IgE 值升高,而其他值通常正常。相反,感冒通常具有升高的淋巴细胞值。
5
过敏性鼻炎过敏原阳性几率高,感冒几率低。
一旦过敏原吸入鼻腔,就会引起免疫反应。过敏原会和IgE抗体结合,激活肥大细胞。
也许对于普通人来说这没什么,但是对于过敏性鼻炎患者来说,就会引起过度反应,也就是说,免疫系统把花粉,灰尘等莫名扣上“通缉犯”,对其进行打击。
肥大细胞通过释放“组胺”,通知其他细胞,包括嗜酸性粒细胞、嗜碱性粒细胞、嗜中性粒细胞和T细胞等,会导致炎症和鼻粘膜充血:
• 本来好好的通道变窄了,气体很难通过就是鼻塞;
• 炎症刺激到神经,就是鼻子痒;
• 鼻粘膜分泌过多的粘液,结果就是流鼻涕…
过度分泌的粘液会堵塞两个鼻子的重要开口:
鼻泪管的作用是将眼泪从眼睛排到鼻子,一旦因为过敏性鼻炎,粘膜肿胀就会导致鼻泪管堵塞,这时候看起来像是“泪汪汪”的。

咽鼓管引流中耳分泌物,一旦因为过敏性鼻炎被堵塞,就会让人感觉到耳朵被塞住。

最后鼻腔内的神经受到刺激会开始打喷嚏

甚至,过敏性鼻炎患者会感到呼吸困难…

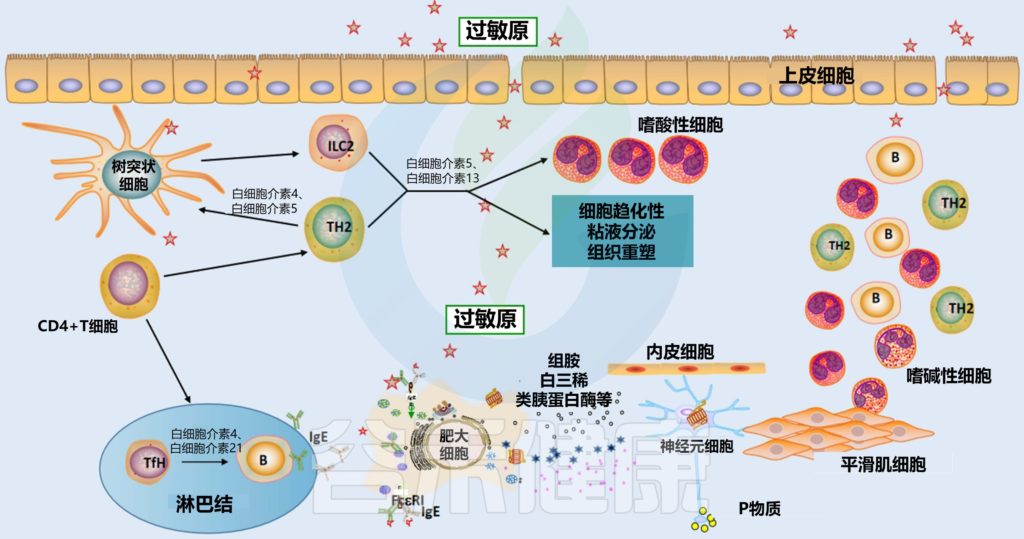
过敏性鼻炎的发病机理
鼻粘膜中的树突状细胞(DC)吸收过敏原 ➞ 引流淋巴结 ➞ 呈递给原始CD4+T细胞 ➞ 分化为过敏原特异性Th2细胞 ➞ 诱导B细胞活化产生浆细胞 ➞ 分化产生特异性IgE抗体 ➞ 在效应细胞(如肥大细胞和嗜碱性细胞)表面进行再循环和相互作用 ➞ 与IgE受体(FcεRI)结合 ➞ 炎症介质(如组胺、前列腺素、白三烯)释放 ➞ 介质与鼻感觉神经、血管系统和腺体相互作用,导致过敏性鼻炎症状
Liu P, et al., J Asthma Allergy. 2022
以上我们知道过敏性鼻炎涉及免疫反应,而人体内60%~70% 的免疫细胞集中在胃肠道中。肠道健康与过敏之间的联系始于免疫系统。
所有的免疫系统成分都直接或间接地受到微生物群的调节。
健康的微生物群会改变 Th1/Th2 细胞的比例,有利于 Th1 细胞,特应性疾病的特征在于对过敏原的 Th2 免疫反应。过敏性鼻炎以鼻腔黏膜Th2免疫反应为主的过敏性炎症反应,病变组织中存在大量Th2细胞因子浸润。
注:Th1细胞介导细胞免疫反应,直接攻击病原体或者促使其他细胞攻击病原体,就算病原体进入被感染的细胞,还会追进感染细胞里面去攻击;
Th2细胞介导体液免疫反应,它们会促使其他免疫细胞产生抗体,由这些抗体来攻击病原体。Th2细胞就不会进入被感染的细胞。
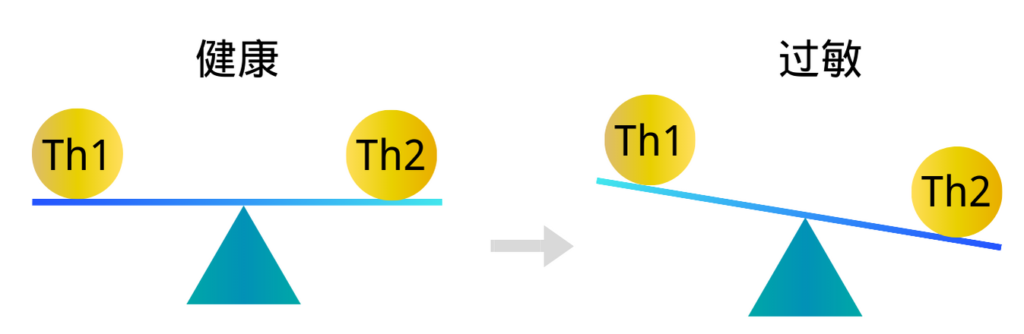
在免疫系统发育过程中,如果肠道失调通过将Th1/Th2细胞因子平衡向Th2反应转移,导致产生产生IgE的浆细胞,从而导致异常过敏反应。
越来越多的证据表明,平衡良好的肠道菌群对发育调节性T细胞(Tregs)至关重要,这对肠道耐受诱导至关重要。下一章节我们来讨论肠道菌群与过敏性鼻炎之间的关系。
注解:由于Th1细胞和Th2细胞都能分泌细胞因子促进自身的增殖并抑制对方的增殖,因此在正常情况下机体中 Th1细胞和Th2细胞处于相对平衡的状态。 但当机体发生功能异常时,常表现出平衡偏向其中一方,称为 “Th1/Th2漂移”。Th1细胞和Th2细胞之间的平衡状态被打破,会引起许多疾病的产生和发展。 包括肿瘤和一些自身免疫性疾病。
但是,不同的疾病表现出的Th1/Th2平衡漂移各不相同。如类风湿性关节炎、I型糖尿病、多发性硬化及慢性甲状腺炎等疾病中,Th1占优势状态;而在系统性红斑狼疮、硬皮病以及一些常见的变态反应性疾病比如过敏性鼻炎中,则Th2占优势状态。
我们知道,肠道菌群在人体中发挥着重要的生理作用,如影响维生素合成、免疫等,且与过敏性疾病的发生、发展相关。
肠道多样性的改变在过敏性疾病患者中较为常见。
目前已有的研究显示,与健康人相比,过敏性鼻炎患者的肠道菌群多样性显著较低(Chao1和Shannon多样性指数),其他菌群变化如下:
过敏性鼻炎患者肠道增加的菌群:
过敏性鼻炎患者肠道减少的菌群:
可见,健康个体和过敏性鼻炎患者的肠道菌群组成不同。
其中,普雷沃氏菌可能是影响免疫系统发育的重要微生物之一。
产丁酸盐的细菌,如梭状芽胞杆菌,可诱导调节性 T 细胞并通过预防肠道炎症来抑制过敏症状。
要解释肠道菌群是如何影响过敏性鼻炎的,我们要先从肠道菌群对免疫系统的塑造开始了解。
肠上皮细胞:将细菌和宿主的免疫系统连接起来
肠上皮细胞(IEC)翻译来自共生细菌的信号(细菌代谢物、细菌成分和细菌本身)并将它们发送到粘膜免疫细胞。可见,肠上皮细胞在肠道免疫中起关键作用。
微生物在肠道定植,并通过肠上皮细胞诱导血清淀粉样蛋白 A 的产生,从而改善 Th17 分化和 IL-22 的产生。
主要参与与定殖肠道细菌的串扰的免疫细胞主要见于固有层。其中,最常见的是树突状细胞(DCs)、Tregs、NK细胞和CD4+ T细胞。
树突状细胞:刺激 CD4+ T 细胞分化
树突状细胞在与先天性和适应性免疫反应的相互作用中起着至关重要的作用。它们迁移到次级淋巴组织并根据激活信号刺激 CD4+ T 细胞分化成亚型。
共生细菌衍生的代谢物影响树突状细胞的功能。例如,短链脂肪酸抑制 IL-12 并增加 IL-10 和 IL-23 的产生,降低 CCL3、CCL4、CCL5、CXCL9、CXCL10 和 CXCL11 的水平,间接调节 T 细胞功能。此外,它们通过树突状细胞的调制诱导 B 细胞IgA 类别转换和 IgA 产生,并调节其他适应性反应细胞功能。
巨噬细胞:摄取病原体
与肠上皮相关的巨噬细胞具有广泛的功能。它们可以摄取病原体,产生多种影响其他免疫细胞的细胞因子,并支持 Treg 的维持。
短链脂肪酸:促进巨噬细胞分泌抗炎 IL-10
微生物产生的短链脂肪酸促进巨噬细胞分泌抗炎 IL-10。此外,它们改变巨噬细胞的新陈代谢,降低 mTOR 激酶活性并增加抗菌肽的产生。
在正常情况下,微生物群和身体之间的相互作用是决定身体健康的基础,如果其中一个环节受损,可能会导致肠道菌群失衡。肠道微生物群的失调显著影响微生物群与宿主之间的代谢,并抑制宿主免疫系统。大多数过敏性疾病与肠道微生物群失衡有关,如过敏性鼻炎。
典型的过敏性鼻炎肠道菌群促进细胞因子的不利变化,从而促进过敏性鼻炎发展中涉及的 Th1/Th2 失衡。
过敏性鼻炎患者的肠道菌群失调及其对 Th1/Th2 平衡的影响
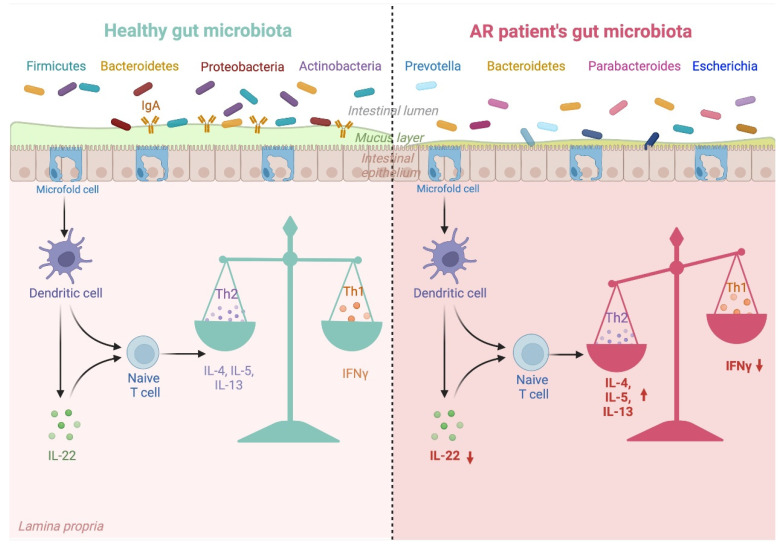
Kaczynska A, et al., Nutrients. 2022
肠道菌群的每一次紊乱都会对免疫系统产生负面影响,并破坏先天性和适应性反应。上图解释了改变的肠道微生物群组成与其对过敏性鼻炎患者免疫系统的影响之间的联系。
接下来章节,我们来详细了解,肠道菌群如何影响免疫系统从而引发过敏性鼻炎。
肠道菌群失调可能会破坏 Th1/Th2 细胞之间的稳态,这可能会对免疫耐受产生负面影响,破坏过敏原的正常清除,并增加过敏性鼻炎的风险。我们从以下六个方面详细展开讨论肠道微生物群在过敏性鼻炎中扮演的重要角色。
前面我们已经知道,过敏性鼻炎是一种I型过敏性疾病,与Th1/Th2平衡向Th2倾斜有关。
为什么生命早期肠道菌群多样性的变化会与过敏有关?
在生命早期,全身免疫反应偏向于Th2。研究表明,生命早期肠道菌群的多样性较低,会影响 IL-4 和 IFN-γ 的水平, IL-4 由Th2细胞产生的,IFN-γ由Th1产生,因此,这可能通过调节 Th1/Th2 平衡来影响气道炎症。
此外,在生命的前两年,较低的微生物多样性会延迟拟杆菌的定殖,并导致 Th1 型反应减少,从而导致Th1/Th2 平衡向Th2倾斜。
一些益生菌也能通过影响Th1/Th2 平衡,从而发挥作用。
植物乳杆菌(NR16)
从发酵韩国泡菜中提取的植物乳杆菌(NR16) 是一种强大的 Th1 诱导剂,当 NR16 与免疫细胞共培养时,它可以产生大量的 IFN-γ 和 IL-12,并且在同时口服 NR16 可降低小鼠气道高反应性和白细胞浸润。此外,口服 NR16 可以通过诱导 Th1 免疫反应来缓解过敏性鼻炎症状,这反过来又可以通过减少特定粘膜病变中 Th2 细胞因子的产生来重新平衡 Th1/Th2 比率。
植物乳杆菌可增加过敏性鼻炎小鼠模型中Th1型细胞因子(IFN-γ、特异性血清IgG2a)的产生,Th2型细胞因子(IL-4、IL-5、IL-13)减少并达到Th1/Th2的平衡。
泛福舒
一项随机对照研究表明,与对照组相比,泛福舒治疗后,泛福舒组鼻腔灌洗液中IL-4和IL-13的含量显著降低,而INF-γ的含量显著升高,导致IL-4/INF-γ的比值显著降低,泛福舒可以调节Th1/Th2细胞因子平衡,作为一种潜在的细胞信号机制,提高整体粘膜免疫。
短双歧杆菌
研究人员证实,口服短双歧杆菌可抑制 Th2 反应并诱导 CD4+CD25+Tregs 活性,但不引起 Th1 反应,但可调节 Th1/Th2 平衡并具有抗过敏作用。
其次,大剂量短双歧杆菌可显着减少打喷嚏的频率,同时降低血清IL-4和特异性IgE水平,增加脾脏中CD4+CD25+ Tregs的数量,显着降低鼻黏膜上皮的过敏反应,低剂量的短双歧杆菌只能轻微缓解过敏反应。
2型先天性淋巴细胞(ILC2)是一种先天性免疫细胞,缺乏表面标记物,因此难以识别。它们反映Th2型细胞,在过敏发展中发挥着重要作用。
我们知道,过敏性鼻炎是一种IgE介导的炎症,导致鼻粘膜中Th2细胞和II型细胞因子的数量增加。
研究人员发现鼻粘膜中ILC2的数量与过敏性鼻炎临床视觉模拟量表(VAS)评分呈正相关。
肠道微生物群失调如何影响过敏性鼻炎
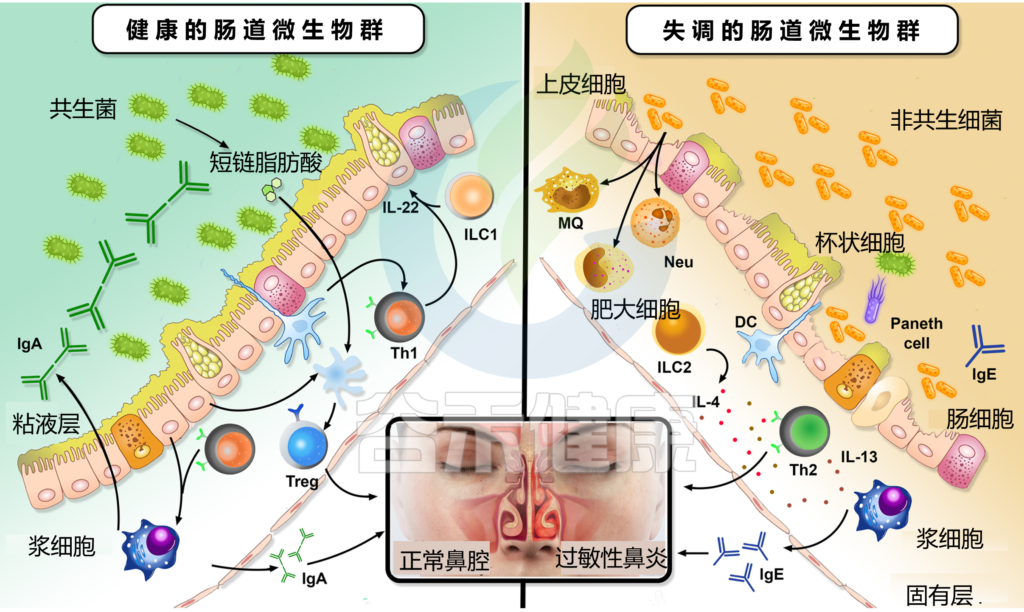
Li J, et al., Eur Arch Otorhinolaryngol. 2022
为什么ILC2在过敏性鼻炎的调节中起重要作用?
过敏性鼻炎患者中多种脂质受体上调,包括CysL1R(LTD4配体)和PGD2。尽管LTD4可激活ILC2中IL-4的产生,但过敏性鼻炎患者鼻分泌物中IL-4水平没有显著变化。
臭氧通过诱导ILC2释放IL-5和IL-13来加重过敏性鼻炎症状。
患有屋尘螨敏感的过敏性鼻炎的儿童外周血ILC2水平显著升高。所有这些发现表明ILC2在过敏性鼻炎的调节中起着重要作用。
肠道菌群对ILC2的影响
值得注意的是,肠道微生物群影响ILC2通过肠-肺轴从肠道向肺的迁移。例如,变形菌门显著促进了上述迁移,并促进了IL-33的产生。
此外,呼吸道过敏的发展与Ruminococcus gnavus的丰度增加有关联。
研究人员发现,肠道菌群失调刺激ILC2和树突状细胞产生2型细胞因子,并促进嗜酸性粒细胞和肥大细胞的肺浸润。
另一方面,肠道微生物群发酵膳食纤维产生的短链脂肪酸抑制ILC2的功能,防止肺部炎症。因此,研究表明ILC2s的活性受到肠道微生物群的调节,但其潜在机制尚未得到充分阐明。
益生菌可以通过抑制ILC2的激活来控制过敏性鼻炎的发生和发展
在一项木瓜蛋白酶诱导的BL6小鼠的研究中,益生菌大肠杆菌菌株Nisle 1917(ECN)的治疗导致IL-5的降低较小,IL-13,IL-33的水平显著降低。ECN处理的小鼠具有显著更低的CD3+CD4+IL5+和IL13+细胞频率。数据表明,ECN能够抑制Th2和ILC2的活化以及原型致敏IL-5和IL-13的产生。
然而目前的研究相对有限,需要更多的基础和临床研究来评估未来的长期治疗效果。
对于肠道菌群在人和动物过敏性鼻炎模型中的研究显示,在益生菌的作用下,大多数血清炎症因子都有不同程度的下降,如IL-4、IL-5、IL-13、IgE、特异性血清IgG1、嗜酸性粒细胞和嗜碱性粒细胞水平减少,但一些抗炎因子增加,如 IL-10、IFN-γ 和特异性血清 IgG2a 分泌增加。因此,益生菌可以通过提高血清中炎症因子的水平来缓解过敏性鼻炎患者的炎症反应,从而减轻他们的临床症状。
NVP-1703 益生菌混合物:IL-5↓ IL-13↓ IL-10↑
(长双歧杆菌IM55 和植物乳杆菌IM76)
一项关于多年过敏性鼻炎的成人研究评估了NVP-1703益生菌混合物(长双歧杆菌IM55和植物乳杆菌IM76)干预4周的疗效和安全性,IL-4血清中尘螨水平无明显变化,但尘螨特异性IgE水平显著降低。在第4周,与安慰剂组相比,NVP-1703组的血清IL-5和IL-13水平降低,而IL-10水平显著升高。
泛福舒:IL-4↓ IL-13↓ INF-γ↑
在早期研究中,60名过敏性鼻炎患者被随机分为泛福舒(BV)组和对照组。泛福舒治疗后,治疗组的药物评分明显低于对照组,且个体和总体鼻症状评分均显著低于对照组。
泛福舒组鼻腔灌洗液中的IL-4和IL-13水平显著降低,而干扰素γ(INF-γ)水平显著升高,这使得IL-4/INF-γ比值显著降低,嗜酸性粒细胞也显著减少,过敏性鼻炎患儿呼吸道病毒感染率/严重程度的增加可能由多种机制引起,但IFN-γ缺乏可能是其中之一,益生菌可以通过提高IFN-γ水平来改善呼吸道病毒感染。
植物乳杆菌:IL-4↓ IL-5↓ IL-13↓ IgE↓ IgG1↓ IFN-γ↑ IgG2↑
在过敏性鼻炎小鼠模型中,口服植物乳杆菌可减少过敏性鼻炎小鼠模型鼻腔和肺部浸润细胞数量,而支气管肺泡灌洗液和引流淋巴结标本显示免疫细胞计数减少,IL-4、IL-5、IL-13、血清IgE和特异性血清IgG1水平降低,IFN-γ和特异性血清IgG2a分泌增加,可改善过敏性鼻炎。
丁酸梭菌:IgE/G1↓ IL-10↑ 逆转Th1/Th2失衡
显着降低了肺阻力、肺气道炎症、肥大细胞脱粒、小鼠气道炎症重塑和 OVA 特异性 IgE/G1 表达。同时,它还逆转了Th1/Th2失衡,增加了抗炎血清因子IL-10.
益生菌发酵的红参:IL-4↓ IgE↓
益生菌发酵的红参(FRG)对卵白蛋白(OVA)诱导的小鼠过敏性鼻炎模型的影响是,FRG比红参更有效地降低支气管肺泡灌洗液、鼻液和血清中的IL-4和IgE水平,表明FRG比红参具有更好的免疫调节作用。 FRG 治疗可减少炎症。
瑞士乳杆菌SBT2171:IL-4↓ IL-13↓ IFN-γ↑ IL-10↑
瑞士乳杆菌SBT2171(LH2171)可在体外诱导抗原刺激的幼稚小鼠脾细胞产生细胞因子,从而抑制IL-4和IL-13的产生,并增加IFN-γ和IL-10的产生。
Treg作为免疫抑制性CD4+T细胞,而Th17作为炎性CD4+T细胞,两者之间的平衡是维持人体免疫系统稳定性的关键条件。 过敏性鼻炎患者Th1/Th2失衡。
益生菌可以通过调节Treg/Th17的平衡来改善过敏和免疫疾病的调节,并产生了一些具有相当效果的靶向治疗方法。
对变应性真菌性鼻窦炎患者的研究表明,血清中IL-1、IL-17、IL-21和TGF-β的分泌都有不同程度的增加,导致Th17/Treg平衡Th17方向的偏移。
研究数据证实,过敏性鼻炎患者外周血中炎性因子如IL-17、IL-35和Th17的分泌增加,炎性因子的增加导致Treg/Th17失衡,进而导致Th1/Th2失衡,导致一系列过敏性鼻炎典型临床症状和鼻粘膜纤毛破坏,鼻腺增生和炎性细胞浸润。
益生菌通过影响Treg / Th17的平衡调节自身免疫
梭菌孢子诱导CD4+FoxP3+Treg细胞可以抑制Th17细胞的促炎反应。
使用益生菌混合物VSL#3来诱导Treg细胞的增殖。
细胞实验表明,乳酸菌上清液可以减少CD4+T细胞、CD8+T细胞和粘膜相关恒定T细胞等的活化,乳酸菌的产物可以抑制这些细胞的增殖和脱颗粒。
其他研究表明,炎症引起的T细胞代谢变化会影响Treg细胞的免疫功能。例如,糖酵解过程中的烯醇化酶可以调节外显子中FoxP3的结合变体,以及应激状态引起的Treg代谢变化,这是触发自身免疫反应的重要部分。
使用干酪乳杆菌作为干预对照,结果表明,干预组脾脏中CD4+CD25+Foxp3+Treg的百分比增加,而CD4+IL-17A+Th17细胞的百分比降低,调节了Treg/Th17细胞比例的失衡。
另一项研究表明,鼠李糖乳杆菌GG(LGG)提取物可以通过Toll受体(TLR2)途径,降低IL-17+Th17的比率,增加CD25+Foxp3+Treg的比率,从而维持Treg/Th17的稳态。
树突状细胞(DC)是体内最有效的抗原呈递细胞(APC),通过调节对微生物抗原的耐受性和免疫性,可以有效诱导抗原特异性免疫应答。
益生菌可能通过调节树突状细胞成熟和免疫耐受性树突状细胞(TDC)产生,产生抗炎细胞因子,从而抑制炎症,影响免疫调节。
免疫耐受性树突状细胞在调节免疫耐受中发挥关键作用
其特征在于表达共刺激分子(CD80/CD86)的半成熟表型,其可通过TLR配体或通过暴露于特定细胞而激活,在因子环境中分化。
此外,它们还表达免疫调节分子并产生免疫抑制因子,半成熟的共刺激CD80/CD86信号通过CD28分子的作用影响T细胞上Treg的激活,进而诱导免疫耐受。
目前,一些临床试验正在进行,以探讨TDC作为免疫介导疾病的替代治疗方案的有效性。与抗炎分子相比,这些TDC具有半成熟表型,表现出低水平的T细胞共刺激特性,并且产生促炎细胞因子的能力降低,特别是通过调节性T细胞(Tregs)的扩增和/或诱导。
其他研究也表明,TDCs分泌抗炎细胞因子并调节T细胞,以促进小鼠和人类肠道中Foxp3+Treg的发育。在全球范围内,这些数据表明DC/Treg/B调节轴通过重新建立耐受性和调节Tregs在肠道中发挥中心作用。
菌群的免疫调节作用来自免疫细胞与肠道树突状细胞的相互作用
最近的证据表明,益生菌可能通过调节DC成熟和TDC产生,从而抑制炎症,从而影响体外和体内的免疫调节。益生菌的免疫调节作用来自免疫细胞与肠道DC的相互作用,从而调节先天和适应性免疫系统。
研究表明,益生菌能够与DC上的模式识别受体(PRR)反应,后者检测病原体上不同的进化保守结构(病原体相关分子模式,PAMP),或通过产生可溶性化合物,从而诱导TDCs。
不同种类和菌株的益生菌可能直接影响树突状细胞的成熟,益生菌可能调节抗炎细胞因子的水平,如转化生长因子β(TGF-β)、IL-10,并诱导Treg。
一项针对四种益生菌菌株(包括唾液乳杆菌、双歧杆菌、凝结芽孢杆菌和纳豆枯草杆菌)的研究,都诱导DC产生IL-10和TGF-β,双歧杆菌和凝结芽孢杆菌表现出更强的诱导IL-10和转化生长因子-β的能力。因此,益生菌诱导的树突状细胞活性产生抗炎细胞因子在免疫调节功能中起着关键作用。
总之,益生菌通过调节TDC活性是过敏性鼻炎治疗的潜在靶点。
Toll样受体(TLRs)是机体免疫的主要组成部分之一,是肠粘膜淋巴细胞和上皮细胞表面表达的识别受体,为入侵病原体和炎症反应提供防御屏障。
肠道共生菌群的一部分,可以通过与TLR相互作用,在控制免疫反应中发挥关键作用。
TLR位于细胞质膜和细胞内内体中,可检测细菌、病毒和真菌的一系列致病分子模式,树突状细胞中TLR的激活可影响适应性免疫反应。
许多微生物感染可以激活TLR4信号,而肠道共生微生物群的一部分,可以影响TLR4.
益生菌多糖胶囊可以通过调节Th1/Th2平衡、诱导T调节细胞分化和激活DC,进而通过TLR与肠道微生物群相互作用,在控制免疫反应中发挥关键作用。
在一项益生菌(鼠李糖乳杆菌GG)与舌下免疫疗法(SLIT)联合的研究中,组间分析表明,与SLIT维生素D组相比,SLIT益生菌组的CD4+CD25+Foxp3+诱导率显著增加,相比之下,TLR阳性细胞组的百分比降低更多。
研究表明,益生菌产生的瞬时蛋白可以诱导TLR的产生,这种蛋白可以缓解特定IgE引起的过敏反应。
此外,一些TLR可以刺激DC激活,进而导致Treg细胞产量增加。先前的研究指出,TLR可能是益生菌影响Treg细胞增殖和分化的潜在靶点。
菌群可以依赖TLR4/NF-κB途径调节过敏性炎症
在一项研究中,阐明了益生菌对TLR4/NF-kB通路在调节宿主对肺损伤和气道炎症的防御中的调节作用。过敏性婴儿哮喘和TLR有影响。
结果表明,β-乳蛋白刺激导致巨噬细胞TLR4/NF-κB信号通路的转导增加。
嗜酸乳杆菌KLDS 1.0738干预通过抑制TLR4通路显著减少过敏性炎症。此外,嗜酸乳杆菌KLDS 1.0738菌株可以显著降低TLR4转导和炎性细胞因子的产生,这与miR-146a水平的上调密切相关。
// 小结
总的来说,肠道菌群可以通过减少血清促炎因子、增加免疫细胞数量、调节Th1和Th2平衡、增加Treg数量和抑制Th17等方式来预防过敏性鼻炎的发生发展,此外,某些菌可以直接刺激TDC的形成或激活TLR通路以间接刺激DC,从而诱导Treg的形成。
通过增加有益细菌的水平可以调节肠道微生物群的稳定性,恢复肠道粘膜屏障,从而改善过敏性鼻炎。
可以根据疾病的具体严重程度、疾病类型和生活方式选择合适的治疗药物。
过敏性鼻炎的治疗选择

▸鼻用皮质类固醇
局部鼻用皮质类固醇起效迅速,尤其是缓解鼻塞。外用类固醇与特定的细胞质糖皮质激素受体 (GRs) 结合,激活抗炎基因转录并抑制促炎基因转录,外用类固醇的抗炎作用可减轻所有鼻部和眼部症状。
▸外用类固醇联合抗组胺药
MP Aze-Flu 是一种由盐酸氮卓斯汀和丙酸氟替卡松组成的鼻喷雾剂,在症状评分和生活质量方面比安慰剂或丙酸氟替卡松单独有效。
▸ 鼻塞减轻剂
由于鼻黏膜的反弹作用和习惯作用,连续使用最好不超过7天。大部分药物可使α肾上腺素受体起作用,引起血管舒张和收缩,可立即缓解鼻塞症状,主要包括伪麻黄碱、羟甲唑啉、三唑啉或去氧肾上腺素。
▸鼻用抗胆碱能药和色甘酸钠/肥大细胞稳定剂
主要影响鼻腔分泌物的鼻用色甘宁和抗胆碱能药有一些较早的研究,但没有足够的证据做出充分的推荐。
▸盐水冲洗
增加儿童的鼻腔冲洗是有益的,可以减少鼻嗜酸性粒细胞和中性粒细胞。
全身性糖皮质激素的所有机制均受 GR 的调节,GR 属于配体调节的核受体超家族,类固醇的抗炎作用可以通过三种广泛的分子机制来解释:促炎基因表达降低、抗炎炎症基因表达增加和非基因组机制。
▸口服抗组胺药
已在多种细胞上鉴定出四种组胺受体 H1 和 H2 受体,可刺激过敏反应的早期和晚期。第二代/第三代非镇静 H1 受体拮抗剂是过敏性鼻炎的首选抗组胺药。
许多研究表明西替利嗪是有效的,并且西替利嗪在症状缓解方面优于氯雷他定,并且具有良好的安全性。
▸白三烯受体拮抗剂(LTRA)
白三烯是炎症介质家族,包括LTA4、LTB4、LTC4、LTD4和LTE4,通过阻断半胱氨酸LT1(CysLT1)受体,LTRAs(如蒙特鲁甾醇)可以改善过敏性鼻炎和哮喘症状。目前,口服色甘酸作为肥大细胞稳定剂的研究不足。
迄今为止,过敏原免疫疗法是目前唯一可用于 IgE 介导的过敏性疾病患者的免疫调节和因果治疗。
过敏原免疫疗法的目的是对免疫系统进行重新编程以减少特异性IgE的产生,从而诱导对过敏原的耐受,可通过不同的给药途径分为皮下免疫和舌下免疫两种方式,通过不断增加过敏原剂量使患者脱敏。
同时,研究人员发现接种疫苗可以改善长期空气污染对过敏性呼吸道的负面影响。针对风疹、伤寒和天花的预防性免疫显示过敏性鼻炎的发生率较低,而麻疹疫苗的过敏性鼻炎发生率较高。
目前过敏性鼻炎的治疗仍然基于过敏原避免、症状缓解药物、抗炎治疗和过敏免疫治疗。现阶段过敏性鼻炎治疗药物不良反应多且无法治愈,症状易反复,免疫治疗疗程较长,依从性差,同时降低生活质量。
肠道微生物群正在成为早期治疗特应性疾病的新靶点,如过敏性鼻炎也是特应性疾病的一种。
益生菌可以用作宿主防御途径的免疫调节剂和激活剂,口服益生菌可以调节呼吸系统的免疫反应,并可以通过调节肠道微生物群和免疫反应的变化来预防和治疗上呼吸道疾病。
国际上对益生菌作为替代治疗方法的研究和应用正在增加,大多数研究表明益生菌可以显着改善过敏性鼻炎患者的症状。
接下来我们详细了解基于菌群干预的过敏性鼻炎疗法。
作为调节肠道菌群平衡的重要手段,益生菌包括多种细菌,其主要作用是维持免疫系统的平衡,改善菌群结构,恢复菌群平衡,同时,它可以减轻肠道局部黏膜炎症反应,恢复黏膜屏障,阻断外来病原体的入侵。
前面章节我们了解到,益生菌可以激活 Th1 或抑制 Th2,引起抗炎作用,还可以刺激免疫因子如IL-10的产生,其主要作用是抑制炎症反应。
因此益生菌治疗过敏性鼻炎的基础研究和临床应用越来越多。
➤ 关于益生菌改善过敏性鼻炎的研究
益生菌的使用可积极改善克雷伯菌与双歧杆菌的比例,并可预防过敏性疾病的发展。
对过敏性鼻炎大鼠的研究表明,婴儿双歧杆菌和长双歧杆菌的混合物LacB可以降低粘膜中H1受体和脱羧酶组氨酸的mRNA表达,从而减轻过敏性鼻炎表现。
在一项双盲安慰剂对照试验中,与安慰剂组相比,食用5个月的干酪乳杆菌(LcS)会导致IgG水平升高,IL-6、IL-5和干扰素γ(IFN-γ)水平显著降低。
研究人员还调查了嗜酸乳杆菌对患有实验性过敏性鼻炎的BALB/c小鼠的影响,并报告使用第二周后喷嚏明显减少,而对照干预措施在第四周减少了喷嚏。
在对1919名过敏性鼻炎患者的23篇论文进行的系统回顾和荟萃分析中,研究人员表明益生菌可能有效缓解过敏性鼻炎患者的症状和生活质量。
在另一项系统综述中,包括了11项关于使用益生菌治疗和预防过敏性鼻炎的随机对照试验。研究结果表明,益生菌的使用与过敏性鼻炎患者的生活质量和鼻腔症状的显著改善有关。
关于益生菌治疗过敏性鼻炎的研究


Liu P, et al., J Asthma Allergy. 2022
研究表明,添加益生菌可以通过恢复肠道菌群紊乱来调节过敏性鼻炎的免疫反应。
一项研究指出,用益生菌发酵乳治疗后,患者的血清特异性IgE显著降低,免疫功能显著改善,体内肠道菌群结构得到改善,肠道菌群平衡得到恢复,症状也显著缓解。
用从人类粪便和泡菜中分离的长双歧杆菌和植物乳杆菌的益生菌混合物(PM)进行过敏性鼻炎治疗,可以通过控制肠道菌群紊乱(显著抑制变形菌,增加拟杆菌和放线菌的组成)来缓解过敏性鼻炎。
也有结果表明,益生菌和L-谷氨酰胺可以有效调节过敏性鼻炎患儿治疗过程中胃肠肽的水平,恢复肠道菌群的平衡,并恢复肠黏膜的屏障功能,从而达到治疗目的。
基于上述研究结果,可以看出益生菌可以调节和恢复肠道微生物群紊乱以治疗过敏性鼻炎。
当然,也有研究中发现益生菌治疗后效果没有明显改善的,例如:
在一项关于益生菌治疗过敏性鼻炎疗效的研究中,患者的过敏症状没有明显缓解,但与治疗前相比,一些患者的鼻粘膜微环境有所改善。
17项纳入的研究发现,益生菌治疗至少在一个结果指标上比安慰剂有显著的治疗优势,而六项试验未发现效果。
目前,作为临床过敏性疾病研究的一个新方向,益生菌有望成为过敏性鼻炎控制和治疗的潜在新目标。益生菌治疗的可能机制如下图所示:
益生菌治疗过敏性鼻炎的简要机制

Liu P, et al., J Asthma Allergy. 2022
益生菌作为过敏性鼻炎的辅助疗法,不仅可以从深层次恢复肠道微生物群紊乱,缓解鼻过敏的典型症状,而且具有高性价比和低风险的优势。
然而需要注意的是,目前的关于益生菌的基础研究仍在进行中,益生菌的最佳菌株、剂量和持续时间还需要进一步探索,同时,在引入新的治疗方法的过程中,有必要注意其可能带来的副作用。
益生元是影响肠道微生物群组成和活性的特定膳食成分。常用的益生元是乳糖醇、乳果糖、菊粉、乳糖、低聚果糖、低聚半乳糖和大豆低聚糖等。
◣ 益生元对IgE水平高的过敏性鼻炎成人的影响
在52周内,患者接受乳糖,并测量其血清IgE水平。治疗一年后,血清IgE水平(尤其是花粉过敏原)显著降低,同时伴有过敏症状的缓解。
一项研究比较,干燥的Ma-al-Shaeer(一种富含纤维的传统伊朗药物,配方基于大麦)与非索非那定对成人过敏性鼻炎患者的影响。
受试者连续14天每天两次接受口头提及的制剂。两组过敏性鼻炎的临床病程均得到改善,而Ma al-Shaeer组的鼻塞、鼻后滴漏和头痛评分显著降低。
◣ 益生元被广泛用作婴儿配方奶粉的补充
一项研究评估了益生元寡糖对过敏的保护作用。
在这项随机对照试验中,具有特应性风险的健康婴儿在出生后的前六个月接受了补充益生元或补充安慰剂的配方奶粉喂养。随访期为五年。
补充益生元组的累计过敏表现发生率显著降低。该干预措施对预防过敏性鼻结膜炎和过敏性荨麻疹特别有益。
其他关于益生元预防/治疗哮喘或过敏性鼻炎的研究
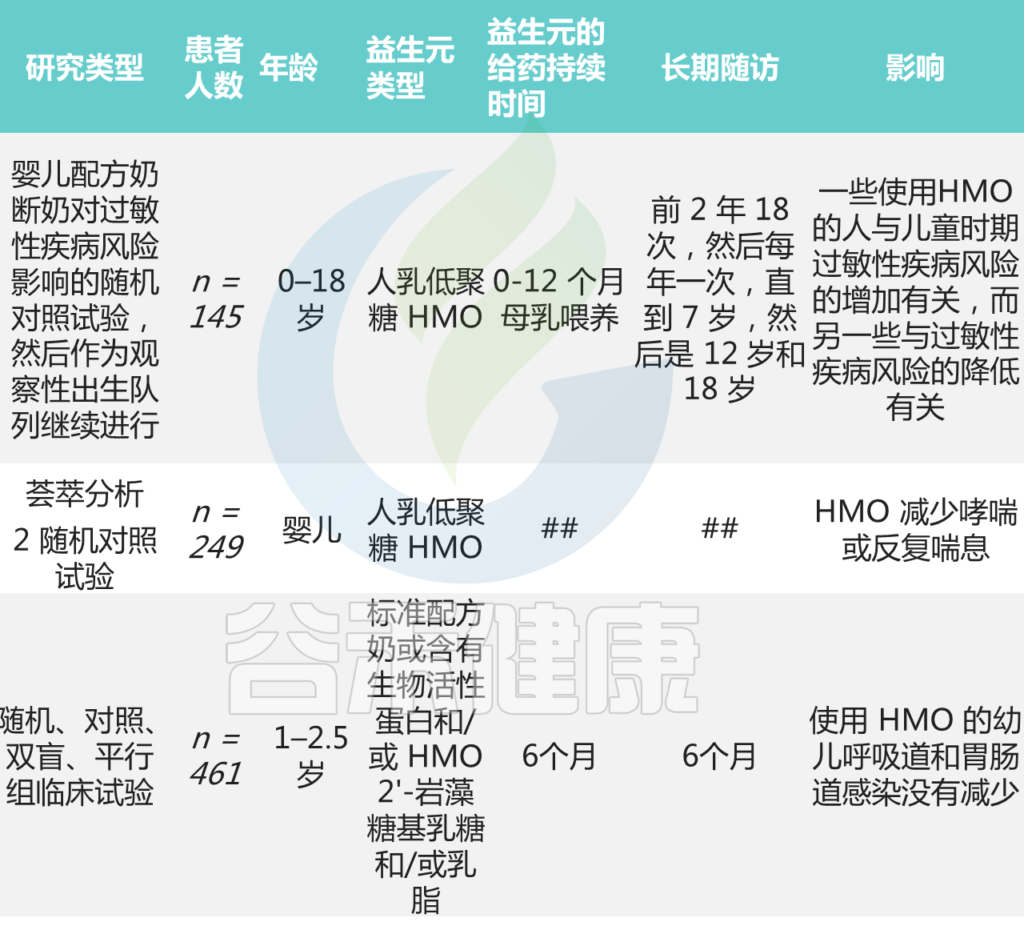
Meirlaen L, et al.,Nutrients. 2021
总之,关于益生元用于预防和治疗过敏性鼻炎的数据仍然不足。然而,它们调节细胞因子释放的能力,似乎是治疗过敏性疾病的一种新的、有前途的方法。
合生元治疗过敏性鼻炎的研究也很少,个别研究益生菌功效的试验实际上涉及合生元。
关于合生元预防/治疗过敏性鼻炎的研究
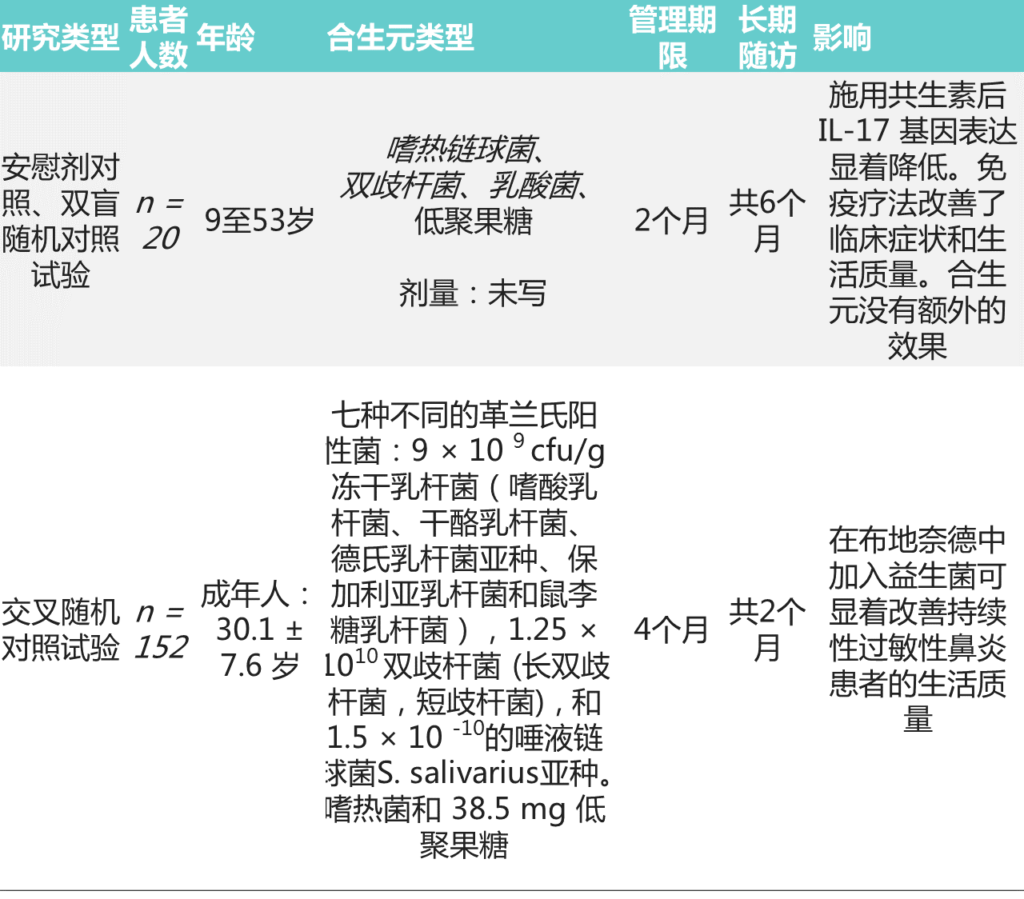
Meirlaen L, et al.,Nutrients. 2021
合生元对预防过敏性鼻炎的作用仍未得到解答,需要更多设计良好的研究,仅研究合生元对过敏预防和/或治疗的影响。
细菌裂解物是由源自呼吸道病原体的抗原组成的免疫调节制剂。最常见的是肺炎链球菌、流感嗜血杆菌、卡他莫拉菌、化脓性链球菌、绿色链球菌、金黄色葡萄球菌、肺炎克雷伯菌和奥扎纳克雷伯杆菌。
该制剂可通过化学或机械裂解获得。不同的生产方法可以产生不同的免疫效果。细菌裂解物可以口服、鼻内和舌下给药。这里讨论了口服给药对肠道环境的影响。
细菌裂解物的作用机制基于自然暴露于病原体抗原和随后的免疫反应。它们通过Toll样受体激活DC,促进抗病毒细胞因子释放、NK细胞活化和Th1/Th2平衡的恢复。
只有五项研究调查了细菌裂解物对过敏性鼻炎的影响。其中两个使用口服OM-85。
OM-85
一项开放标签的顺序研究,研究了在过敏性鼻炎、哮喘或慢性阻塞性肺疾病患者中使用OM-85对呼吸道感染率、原发病加重率和症状严重程度的影响。
减少过敏性鼻炎发作次数,严重程度减轻
患者分三个周期接受制剂,包括连续10天的摄入,然后休息20天。他们表明,与前一年相比,OM-85治疗减少了呼吸道感染和过敏性鼻炎发作的次数,并缓解了过敏症状的严重程度,而前一年患者只接受了标准的优化护理。
已证明血清和唾液IgA水平增加。为了进一步扩大这项研究,评估了60名常年过敏性鼻炎患者的临床效果。参与研究的参与者按照与前述研究相同的方案服用OM-85。治疗后,OM-85组的总鼻部症状评分、瘙痒评分、鼻溢评分、喷嚏评分和药物评分均显著下降。此外,观察到鼻IFN-γ增加,鼻IL-4和IL-13水平降低,鼻拭子中嗜酸性粒细胞数量减少。
细菌裂解物不会直接影响肠道细菌;然而,它们刺激的细胞因子可能会影响肠道环境。关于细菌裂解物对过敏性鼻炎的影响还需要更多的研究。
粪菌移植是将健康供体的粪便转化为粪便悬浮液,并将其施用于患者的肠道,以重建肠道微生物群的平衡的过程。目前,没有关于其在过敏性鼻炎治疗中的应用的研究;然而,这可能是恢复肠道细菌组成的一种有前途的方法。潜在地,它可能比益生菌更有效,因为其显著更丰富的注入微生物和永久定植肠道的能力。
一项研究证实了这一假设,他们研究了粪菌移植对成年特异性皮炎患者的影响。结果表明,粪菌移植后特应性皮炎评分显著降低。此外,在研究和随访期间,每周局部使用皮质类固醇的情况有所减少。
肠道微生物群的宏基因组分析显示,从供体到患者的细菌菌株传播显著。未观察到治疗的不良反应。
然而,关于其在过敏性疾病中的应用,仍然没有足够的数据;因此,需要更多的大样本研究。
高质量的饮食结构,如水果和蔬菜、高纤维食物、鱼、低脂食物、蛋白适量,可以增加肠道多样性,维持肠道菌群平衡,有助于平衡免疫反应。
研究表明饮食习惯和肠道微生物群与过敏性疾病有关。
一项研究招募了 186 名有过敏性鼻炎症状的参与者和 106 名没有过敏性鼻炎症状的对照受试者,该研究结果深入了解膳食营养素、肠道微生物组、肠道免疫系统和过敏性鼻炎发展之间的复杂相互作用。

维生素A
关联分析表明,视黄醇、维生素 A、隐黄素(维生素A原的一种)、铜与经年龄和性别调整后的过敏性鼻炎几率相关。
维生素A的主要膳食来源是动物性食物中的视黄醇,水果、蔬菜、蛋黄和黄油中的维生素A类胡萝卜素原。
在该研究人群中,维生素A和视黄醇的膳食摄入水平高度相关(R = 0.96).
维生素A对人体的多种功能至关重要,包括胚胎发育、良好视力、上皮分化和维持免疫功能,特别是在幼稚T细胞分化中。
如果没有维甲酸(注:维甲酸是维生素A的代谢产物),转化生长因子β(TGF-β)促进初始T细胞分化为Th17细胞,后者参与炎症、自身免疫和过敏性疾病。
在视黄酸的存在下,TGF-β帮助肠道树突状细胞介导幼稚T细胞分化为Treg细胞,从而抑制自身免疫反应。
在该研究中检测的类胡萝卜素中,只有隐黄素与过敏性鼻炎相关。
铜 和过敏性鼻炎之间:反向J形关系
铜是一种重要的微量金属,是许多氧化还原酶的辅因子,它参与铁代谢、抗氧化活性、神经肽合成和免疫功能。缺铜和过量铜都会对健康产生不利影响。
在该研究中,观察到铜和过敏性鼻炎之间的反向J形关系。这种反向J形曲线可能分别与铜在适当浓度和高浓度下的抗氧化和促氧化活性有关。
高膳食摄入视黄醇与类胡萝卜素与高丰度普雷沃氏菌的结合,可能对过敏性鼻炎的发展具有保护作用
该研究认为四种营养素(视黄醇、维生素A、隐黄质和铜)和两种肠道菌属(普雷沃氏菌属和大肠杆菌属)与过敏性鼻炎的年龄和性别调整几率相关。
此外,还观察到视黄醇和普雷沃氏菌的组合保护作用,与低视黄醇摄入量和低普雷沃氏菌丰度的受试者相比,高视黄醇摄入和高普雷沃氏菌丰度受试者的年龄和性别调整后的过敏性鼻炎几率低25倍。
绿叶蔬菜、时令水果,含有多种维生素和矿物质,有助于对抗过敏性鼻炎。
绿叶蔬菜包括菠菜、羽衣甘蓝、生菜、芝麻菜等,对于提高免疫系统非常重要。其他还包括黄瓜、大蒜、番茄、红椒、南瓜、红薯、西葫芦、西芹等,都是非常好的食物。水果包括香蕉、柠檬、橙子、蓝莓等。
当然并不是马上有效,这个饮食结构调整需要持续一定的时间。
生姜
生姜的抗炎特性有助于治疗花粉症引起的眼睛、鼻子和喉咙的瘙痒、刺激和炎症。
柑橘类水果
柑橘类水果有助于治疗过敏性鼻炎的症状以及由此引起的上呼吸道刺激。葡萄柚、柠檬、酸橙、橙子、浆果是维生素 C的丰富来源。
姜黄
姜黄抗炎和抗氧化特性,有助于治疗缓解过敏性鼻炎引起的症状。它有助于减少过敏引起的刺激和肿胀。 姜黄可以通过茶、药丸或酊剂服用,甚至可以添加到烹饪时食用的食物中。
西红柿
番茄红素是西红柿中的一种抗氧化化合物,有助于减少过敏引起的炎症。
洋葱
洋葱有抗炎和抗氧化特性,同时富含榭皮素,榭皮素是一种天然抗组胺剂,有助于减轻过敏性鼻炎的症状。
omega-3 脂肪酸
鱼(金枪鱼,三文鱼等)、杏仁、核桃、南瓜和亚麻籽富含的omega-3 脂肪酸的饮食,可以降低儿童和成人发生过敏的风险。
怀孕期间和产后早期摄入 omega-3 脂肪酸的母亲可能会调节免疫系统并降低孩子发生过敏症的风险。
其他饮食建议
易过敏体质尽可能从饮食中去除蛋,乳制品,麸质谷物等容易造成过敏的食品。尽可能减少摄入添加糖和加工食品。
研究发现,一些草药对过敏性鼻炎具有治疗作用,并显示出一些治疗前景。
Septilin
Septilin是一种阿育吠陀草药配方,含有苦皮草、堇叶天花粉、茜草、山茱萸、辣木和甘草,也显示出治疗过敏性鼻炎的巨大潜力。
在一项双盲研究中,190人接受了以上草药组合或标准抗组胺药(扑尔敏)治疗。结果表明,两种治疗方法同样有效。
在这项对32名健康人进行的双盲安慰剂对照试验中,使用Septilin 4周可显著减少皮下注射组胺引起的过敏反应。Septilin也被用作提高免疫力的治疗方法。
在一项针对40名持续性低度感染(如慢性咽痛或鼻窦感染)儿童的双盲安慰剂对照研究中,与安慰剂相比,服用Septilin1个月可显著改善病情。
异株荨麻
一项初步研究表明,异株荨麻 ( Urtica dioica ) 的冻干胶囊可减少患者的打喷嚏和瘙痒。推荐剂量为 600-900 mg TID。荨麻在植物医学中具有治疗咳嗽、肺结核和关节炎的历史用途。体外研究表明它还可能具有抗炎作用。
蓍草(Achillea millefolium)
蓍草是一种多年生草本植物,在欧洲和亚洲很常见。这种多用途草本植物具有抗氧化、健胃、解痉、收敛和透明的特性。传统上用于治疗感冒、流感和发烧,蓍草也可以是对抗过敏性鼻炎的有效药物。
它的抗菌和抗卡他性作用使其成为呼吸系统的理想草药,这种天然的治疗剂还治疗鼻窦炎和粉尘过敏。可以以茶的形式或作为酊剂服用。这是一种强效草本植物,不建议超过连续两周的限度。此外,如果对豚草过敏,应该避免这种草药。
蜂斗菜 ( Petasites hybridus )
在一项开放标签研究中,580名季节性过敏性鼻炎患者服用了50-75 mg BID的蜂斗菜提取物2周(每片含8 mg petasine)。
与基线相比,90%的患者在治疗后,改善了鼻漏、鼻塞、眼睛和鼻子发痒、眼睛发红和皮肤刺激等症状。
蜂斗菜也是一种温和的白三烯抑制剂,在一项研究中发现其与180 mg非索非那定一样有效。但蜂斗菜含有潜在的肝毒性吡咯里啶生物碱(PA),所以应谨慎使用,或者可以使用不含PA的提取物。它属于豚草科,因此对豚草过敏的人也应谨慎使用。
生蜂蜜
生蜂蜜含有很多种活性植物化学物质,有助于体内激素水平恢复正常,有助于构建强大的免疫系统,从而有助于预防过敏性鼻炎。一项随机对照试验表明,食用桦树花粉蜂蜜的过敏患者过敏症状减少了60%,在桦树花粉季节无症状天数增加了一倍。
维生素E
维生素E也可用于治疗过敏性鼻炎,因为它是一种温和的白三烯抑制剂。
一项研究发现,112名患有过敏性鼻炎的成年人在连续10周每天服用800IU维生素E后,鼻部症状明显改善。富含维生素E的饮食也被证明有助于预防过敏性鼻炎的症状,维生素的保护作用随着剂量的增加而增加。建议使用混合生育酚,而不是单独使用α.
注:生育酚,是维生素E的水解产物。天然的生育酚都是D-生育酚(右旋型),它有α、β、ϒ、δ等8种同分异构体,其中以α-生育酚的活性最强。作为抗氧化剂使用的生育酚混合浓缩物,是天然生育酚的各种同分异构体的混合物。
维生素 C
维生素 C具有抗组胺特性,有助于减轻过敏症状。此外,维生素C也有助于增强免疫系统。因此,它有助于预防感染,同时缩短过敏性鼻炎的持续时间。
因此,每天应多吃橙子、灯笼椒、西红柿、柠檬、草莓、豆芽、土豆、奇异果、西兰花、柚子等富含维生素C的食物。
金钗石斛
金钗石斛具有抗炎和免疫活性,近期的一项小鼠研究发现,石虎提取物的治疗抑制了PI3K/AKT/mTOR通路,在门和属水平上恢复了肠道菌群的平衡,并改善了调节T细胞分化,从而有效地扭转了过敏性鼻炎症状。
适度运动
定期锻炼有助于减少过敏反应,适度运动对有过敏症的人无害,过敏体质的人可以按照普通人群的运动建议进行。这包括每周至少 150 分钟的中等强度有氧运动或 75 分钟的高强度运动。
这些活动包括步行、跑步、骑自行车、跑步机锻炼、游泳等。
瑜伽
瑜伽可以通过很多种方式帮助缓解和治愈身体,甚至有助于缓解过敏性鼻炎的症状。瑜伽中的呼吸练习被称为调息,已被用作治疗哮喘的方法。它可能在减轻与过敏性鼻炎相关的症状方面发挥作用。
注意选择正规教师,一开始不要追求动作的完美,重要的是注意调息。
避免触发因素
一旦确定了过敏原,请尽量远离。例如:
洗鼻子
洗鼻液可以帮助清除鼻子中的过敏原。使用生理盐水喷雾有助于减少接触过敏原。
改善不良习惯
与其他过敏性疾病相比,肠道菌群在过敏性鼻炎发病机制中作用的证据仍然较少,但肠道菌群失调与 过敏性鼻炎之间的关系是显而易见的。
肠道微生物群的高度多样性有助于平衡免疫反应,其机制涉及增加代谢物(如短链脂肪酸)和减少炎症介质的产生。
肠道菌群结构异常与过敏性鼻炎的发生率密切相关,这为我们提供了一个新思路,即肠道菌群失调可能是过敏性疾病的重要预测因子。
目前很多研究已经发现益生菌在临床上治疗过敏性疾病的初步效果,可能会减少过敏症状的发生率和持续时间。然而也有一些研究发现,益生菌治疗并没有显着改善临床症状,这可能是因为临床试验包括许多变量,例如伴随疾病、年龄、性别和许多其他因素,还需进一步探索研究。同时,益生菌辅助联合疗法也是一个值得关注的领域。
总的来说,通过各种方式调节肠道微生物群,恢复肠道粘膜屏障,恢复免疫平衡,抑制炎症,有助于改善过敏性鼻炎,肠道菌群或将成为过敏性鼻炎早期干预的新靶点。
注:本账号内容仅作交流参考,不作为诊断及医疗依据。
主要参考文献:
Li J, Fang F, Mei M, Wu D. The gut microbiome and allergic rhinitis; refocusing on the role of probiotics as a treatment option. Eur Arch Otorhinolaryngol. 2022 Oct 14. doi: 10.1007/s00405-022-07694-z. Epub ahead of print. PMID: 36239785.
Zhou MS, Zhang B, Gao ZL, Zheng RP, Marcellin DFHM, Saro A, Pan J, Chu L, Wang TS, Huang JF. Altered diversity and composition of gut microbiota in patients with allergic rhinitis. Microb Pathog. 2021 Dec;161(Pt A):105272. doi: 10.1016/j.micpath.2021.105272. Epub 2021 Nov 2. PMID: 34740809.
Zhu L, Xu F, Wan W, Yu B, Tang L, Yang Y, Du Y, Chen Z, Xu H. Gut microbial characteristics of adult patients with allergy rhinitis. Microb Cell Fact. 2020 Sep 1;19(1):171. doi: 10.1186/s12934-020-01430-0. Erratum in: Microb Cell Fact. 2020 Oct 8;19(1):192. PMID: 32873292; PMCID: PMC7466420.
Kaczynska A, Klosinska M, Chmiel P, Janeczek K, Emeryk A. The Crosstalk between the Gut Microbiota Composition and the Clinical Course of Allergic Rhinitis: The Use of Probiotics, Prebiotics and Bacterial Lysates in the Treatment of Allergic Rhinitis. Nutrients. 2022 Oct 16;14(20):4328. doi: 10.3390/nu14204328. PMID: 36297012; PMCID: PMC9607052.
Liu P, Hu T, Kang C, Liu J, Zhang J, Ran H, Zeng X, Qiu S. Research Advances in the Treatment of Allergic Rhinitis by Probiotics. J Asthma Allergy. 2022 Oct 7;15:1413-1428. doi: 10.2147/JAA.S382978. PMID: 36238950; PMCID: PMC9552798.
Sahoyama Y, Hamazato F, Shiozawa M, Nakagawa T, Suda W, Ogata Y, Hachiya T, Kawakami E, Hattori M. Multiple nutritional and gut microbial factors associated with allergic rhinitis: the Hitachi Health Study. Sci Rep. 2022 Mar 1;12(1):3359. doi: 10.1038/s41598-022-07398-8. PMID: 35233003; PMCID: PMC8888718.
Huang J, Zhang J, Wang X, Jin Z, Zhang P, Su H, Sun X. Effect of Probiotics on Respiratory Tract Allergic Disease and Gut Microbiota. Front Nutr. 2022 Feb 22;9:821900. doi: 10.3389/fnut.2022.821900. PMID: 35295917; PMCID: PMC8920559.
Zoabi Y, Levi-Schaffer F, Eliashar R. Allergic Rhinitis: Pathophysiology and Treatment Focusing on Mast Cells. Biomedicines. 2022 Oct 5;10(10):2486. doi: 10.3390/biomedicines10102486. PMID: 36289748; PMCID: PMC9599528.
Meirlaen L, Levy EI, Vandenplas Y. Prevention and Management with Pro-, Pre and Synbiotics in Children with Asthma and Allergic Rhinitis: A Narrative Review. Nutrients. 2021 Mar 14;13(3):934. doi: 10.3390/nu13030934. PMID: 33799367; PMCID: PMC7999316.