-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
当我们坐在餐桌前,精心挑选着盘中的食物时,一个常常被忽略的事实是:我们并非独自在享用这顿美餐。在我们的身体内部,一个无比繁华、拥挤而又充满活力的微观世界——肠道菌群,正翘首以盼,等待着我们送去的“补给”。这个由数万亿个细菌、真菌、病毒和古菌组成的复杂生态系统,其细胞总数甚至超过了我们自身的人体细胞,基因数量更是人类基因组的百倍以上。因此,科学家们形象地将其称为人体的“第二基因组”或“隐形器官”。
那么,究竟是什么决定了这个“隐形器官”的构成与功能?虽然遗传、年龄、生活方式及药物等多种因素都有关联,但研究普遍指出,饮食是最关键的驱动力。我们的食物不仅为自身提供能量和营养,也直接影响肠道微生物的“口粮”,不同食物成分会选择性促进不同微生物的生长,正如施用不同肥料会催生出不同的花草组合一样。
在众多营养素中,碳水化合物(尤其是膳食纤维)和脂肪对肠道菌群的影响已有深入研究,而蛋白质这一生命基础营养素,其调节肠道菌群的作用却长期被忽视。
我们都知道蛋白质对构建肌肉、修复组织、维持生命活动至关重要,但我们摄入的蛋白质究竟如何与肠道菌群互动?更重要的是,不同来源的蛋白质——例如,一块牛排(动物蛋白)与一盘扁豆(植物蛋白),会对我们体内的微观生态系统产生截然不同的影响吗?
这正是我们今天要深入探讨的核心问题。本文是基于最近发表在bioRxiv平台、题为《膳食蛋白源塑造肠道微生物结构和预测功能:一项结合机器学习的Meta分析》的重磅研究,为我们揭开提供了迄今为止较为全面、系统化的线索。
该研究巧妙地运用了Meta分析,汇集了全球范围内多项独立研究的数据,并通过前沿的机器学习算法进行深度挖掘,以前所未有的广度和精度,描绘出动物蛋白与植物蛋白在肠道菌群世界里投下的不同“身影”。
接下来,我们将解读这项研究的核心发现,包括动物蛋白和植物蛋白如何影响菌群的多样性与结构,不同饮食下的代表菌种,以及这些变化如何通过代谢功能影响我们的长期健康。
这不仅是对前沿科学的探索,也为我们的饮食选择带来了全新的认知。
在深入探讨研究的具体发现之前,先了解一下此次研究使用的两大“工具”:Meta分析(Meta-Analysis)和机器学习(Machine Learning)。
理解了它们的工作原理,我们才能更深刻地体会到这项研究结论的科学分量与可靠性。
1
Meta分析:站在巨人肩膀上看得更远
关于“不同蛋白质对肠道菌群的影响”,全球许多研究团队曾独立开展实验,
例如:
A研究组可能招募了20名志愿者,让他们分别食用富含牛肉和富含豆类的饮食;
B研究组则可能在小鼠身上测试了乳清蛋白和豌豆蛋白的效果;
C研究组的研究对象则可能是另一群不同文化背景的人。
每一项研究由于其样本量、实验设计、测量方法和地域人群的差异,得出的结论可能不尽相同,甚至有时会相互矛盾。例如,A研究发现动物蛋白显著降低了某种细菌,而B研究可能发现没有显著变化。这会让公众和政策制定者感到困惑:我们到底该相信谁?
Meta分析正是为应对这种问题而设立的统计方法。它并非进行新实验,而是系统收集并整合同一主题下尽可能多的高质量独立研究,利用统计工具合并与再分析这些数据,从而得出更具代表性和可信度的综合结论。
◮ Meta分析有三大优势:
增大样本量:通过合并多个研究,原本几十、几百的样本量可以瞬间扩大到成千上千,极大地提高了统计功效,使得我们能够洞察到在单个小规模研究中难以发现的、更细微但真实存在的效应。
解决不一致性:它可以评估不同研究结果之间的差异程度(即“异质性”),并探究造成这种差异的原因(例如,可能是因为研究对象的年龄不同,或是干预时间长短不一)。
提高结论的普遍性:因为数据来自不同地区、不同人群、不同实验条件,所以Meta分析得出的结论往往比任何单一研究更具普遍适用性。
在本研究中,作者首先进行了大规模文献筛选,在数千篇论文中,依据严格标准最终选取了13项高质量的人类干预研究,构建了总计近600个样本的数据集。
2
机器学习:从海量数据中挖掘模式的智能算法
收集到了海量数据仅仅是第一步。肠道菌群的数据是出了名的高维度、高复杂度。每个人的肠道里都可能有成百上千种不同的细菌,它们的丰度(数量多少)各不相同。面对这样一个由无数变量构成的复杂矩阵,传统的统计方法有时会显得力不从心。
◮ 机器学习对于数据统计和处理更高效
这时,机器学习就是重要的工具了。作为人工智能的一个分支,机器学习算法尤其擅长在看似杂乱无章的海量数据中,自动学习并识别出隐藏的模式和规律。它不像传统统计学那样需要研究者预先设定严格的假设,而是能够以一种更加“开放”和“探索性”的方式,让数据自己“说话”,以上两种方法也是谷禾健康构建人群肠道菌群数据库和识别菌群与健康以及营养的重要工具。
本研究主要采用了“随机森林”模型。可以这样理解:
如果我们想训练医生仅凭肠道菌群组成判断病人偏好动物蛋白还是植物蛋白,可先搭建一棵决策树:医生依次提问,例如“普雷沃氏菌丰度是否超过X?”、“拟杆菌丰度是否低于Y?”,通过一系列“是”或“否”,最终给出饮食类型诊断。
但单棵决策树容易因偶然因素产生偏误,就像初学医生容易过拟合少数病例一样。
为了避免这个问题,“随机森林”模型同时构建了成百上千棵这样的决策树,形成一片茂密的“森林”。它的高明之处在于“随机”二字:
通过这两个“随机”过程,保证了森林里的每一棵树都是独一无二、各具特色的。当需要做出最终判断时,模型会让森林里的每一棵树都进行一次独立的投票,然后采纳“少数服从多数”的原则,得出最终的、最稳健的分类结果。这就像一个由数百位不同背景、不同专长的医生组成的专家委员会进行会诊,其诊断结果自然远比单个医生更加准确和可靠。
◮ 随机森林的特点
样本随机:在构建每一棵树时,都不是使用全部的样本数据,而是从总样本中随机抽取一部分(有放回抽样)。
特征随机:在每个决策节点上选择“提问”的菌种时,也不是从所有菌种里挑选,而是随机抽取一部分菌种作为候选。
更妙的是,随机森林模型在完成分类任务后,还能告诉我们,为了做出准确的判断,它最依赖哪些“线索”。也就是说,它能计算出每一种细菌(即“特征”)对于区分“动物蛋白”和“植物蛋白”饮食模式的重要性得分。得分越高的细菌,就越有可能是区分两种饮食模式的“生物标志物”(Biomarker)。
通过将Meta分析的宏观整合能力与机器学习的微观挖掘能力相结合,这项研究得以在坚实的数据基础上,可以更系统地回答了文章开头提出的核心问题。
现在,让我们正式进入研究的重要发现环节。
在评估一个生态系统的健康状况时,通常会关注两个核心指标:
一是物种的丰富度与均匀度,即生态系统内物种数量多不多,分布均不均匀(对应谷禾健康报告里的多样性分值);
二是物种的组成结构,即这个生态系统主要由哪些类型的物种构成。对于肠道这个微观生态系统而言,这两个指标分别对应着α-多样性(Alpha Diversity)和β-多样性(Beta Diversity)。
1
α-多样性:肠道菌群的“贫富”指数
α-多样性用于衡量单个样本内微生物多样性的“丰富”和“均衡”程度。较高的α-多样性通常代表更健康的肠道生态,意味着功能更稳定、韧性更强,更能抵御外部干扰,如饮食变化或抗生素影响。就像物种繁多的雨林比单一农田更能抵抗病虫害。
那么,动物蛋白和植物蛋白饮食,谁更能促进肠道菌群的“共同富裕”呢?以往,一些小规模的研究在这个问题上存在争议。但这次,通过Meta分析整合了13项研究的庞大数据后,答案变得清晰起来。
◮ 摄入动物蛋白与植物蛋白α多样性的差异不大
研究结果显示,与摄入动物蛋白(如乳清、牛肉、猪肉)相比,摄入植物蛋白(如大豆、豌豆、藜麦)的受试者,其肠道菌群的α-多样性没有发生显著变化,甚至在某些指标上呈现出增加的趋势。
这一发现非常重要。它有力地反驳了一些人担心的“植物蛋白饮食可能会导致肠道菌群变得单一”的观点。恰恰相反,富含植物蛋白的饮食模式,至少在维持甚至提升肠道菌群多样性方面,表现出了与动物蛋白饮食相当甚至更优的潜力。
这背后的原因我们将在后文深入探讨,但一个关键因素在于,植物蛋白往往与一位“黄金搭档”——膳食纤维——相伴相生。这些纤维是许多有益肠道细菌的“顶级美食”,能够有力地支撑起一个物种繁盛的菌群环境。
2
β-多样性:划分肠道菌群的“派系”
如果说α-多样性关注的是菌群的“丰富程度”,那么β-多样性则衡量不同样本间微生物群落结构的差异。如果两组样本(如动物蛋白组和植物蛋白组)β-多样性差异显著,说明各自肠道菌群已经形成了截然不同的“派系”。
◮ 动物蛋白饮食下的菌群与植物蛋白的截然不同
在这项研究中,这正是最显著的发现之一。分析结果明确无误地显示,动物蛋白饮食和植物蛋白饮食塑造出了两种显著不同的肠道菌群结构。这意味着,如果你长期以动物蛋白为主食,你的肠道菌群整体面貌,将会与一个长期以植物蛋白为主食的人,有着清晰可辨的巨大差异。
为直观展示这种差异,研究者使用主坐标分析(PCoA)作图,每个点代表一个人的肠道菌群,点间距离反映差异大小。结果显示,动物蛋白组和植物蛋白组的样本在图上分成两个清晰分离的“星团”。
这一发现具有里程碑式的意义。它证实了膳食蛋白的“来源”,而不仅仅是“数量”,是决定我们肠道菌群生态类型的关键变量。你的餐盘上放的是牛排还是豆腐,正在以一种超乎想象的深度,重塑着你体内那个庞大的微生物帝国。
但问题也随之而来:这两个不同的菌群“派系”,究竟是由哪些具体的细菌成员构成的?又是哪些“关键先生”造成了如此显著的差异?这就要依靠机器学习的强大威力来找出了。
随机森林模型不仅能准确区分两种饮食模式,还给出了区分动物蛋白与植物蛋白饮食最关键的细菌“标志物”名单,这些细菌对于理解不同蛋白来源如何影响肠道菌群至关重要。
研究筛选出多种在两种饮食下丰度明显不同的“核心细菌”,其中值得关注的有:
1
动物蛋白饮食的“拥护者”
在摄入动物蛋白后,一些偏爱在富含蛋白质和脂肪环境中生长的细菌丰度显著增加。这些细菌通常被认为是“蛋白质发酵型”或“腐生菌”,它们擅长分解蛋白质和氨基酸,但其代谢产物有时可能对宿主健康构成潜在风险。
◮ Alistipes和Bilophila——动物蛋白饮食富集
Alistipes(另枝菌属)和Bilophila(嗜胆菌属):这两种菌是动物蛋白饮食下典型的富集菌。Alistipes属的某些菌株与肠道炎症和一些情绪障碍有关联。Bilophila wadsworthia则更为糟糕,它能利用动物性饮食中常见的含硫氨基酸(如牛磺酸,在红肉和海鲜中富含)产生硫化氢(H₂S)。
低浓度的硫化氢对肠道粘膜有保护作用,但过量产生则会破坏肠道屏障,诱发炎症,被认为是炎症性肠病(IBD)的一个潜在触发因素。关于这两种菌详见:
肠道重要菌属——另枝菌属(Alistipes),调节炎症情绪等的潜力菌
肠道重要菌属——嗜胆菌属 (Bilophila)喜欢脂肪、耐胆汁的促炎菌
◮ 动物蛋白饮食还能提升拟杆菌丰度
Bacteroides(拟杆菌属):这是一个庞大且复杂的菌属,主要为革兰式阴性菌,在西方化饮食(高蛋白、高脂肪)人群的肠道中通常占据主导地位。它们是多面手,既能利用碳水化合物,也能分解蛋白质。
动物蛋白饮食能够显著提升它们的丰度。虽然Bacteroides的许多成员是中性甚至有益的共生菌,但它们的过度扩张,特别是当缺乏足够膳食纤维来“喂养”它们时,可能会导致它们转向分解宿主肠道粘液中的糖蛋白,从而削弱肠道的第一道物理防线。
两种饮食结构下,主要菌属的相对丰度
2
植物蛋白饮食的“爱好者”
与动物蛋白饮食形成鲜明对比的是,植物蛋白饮食极大地促进了一批被广泛认可的“有益菌”的生长。这些细菌大多是“糖类发酵型”,它们热衷于分解植物性食物中富含的各种复杂碳水化合物(膳食纤维、抗性淀粉等),并产生对宿主健康至关重要的代谢产物。
◮ 植物蛋白饮食显著提升了双歧杆菌属丰度
Bifidobacterium(双歧杆菌属)和Lactobacillus(乳杆菌属):这两个名字对大众来说可能并不陌生,它们是市面上益生菌酸奶和补充剂中的“常客”。研究发现,植物蛋白饮食显著提升了Bifidobacterium的丰度。双歧杆菌是著名的“健康基石”,尤其在婴幼儿肠道中占据主导地位。它们能够产生短链脂肪酸(SCFAs),抑制病原菌生长,调节免疫系统,增强肠道屏障功能。
◮ 富含纤维的食物还能促进普雷沃氏菌和粪杆菌生长
Prevotella(普雷沃氏菌属)和Roseburia(罗伊氏菌属):Prevotella属偏爱在富含纤维和碳水化合物的饮食环境中生长,在非西方化、以植物为主食的人群中丰度极高。它们是高效的纤维分解者。
而Roseburia则是肠道中产生丁酸盐(一种至关重要的SCFA)的主力军之一。丁酸盐是结肠上皮细胞的首选能源,能直接为肠道细胞“加油”,同时具有强大的抗炎作用。
Faecalibacterium(粪杆菌属):特别是Faecalibacterium prausnitzii(普拉梭菌),被誉为“抗炎明星”。它的丰度降低与多种炎症性疾病(如克罗恩病)直接相关。植物性饮食,通过提供丰富的可发酵底物,为这类有益菌创造了理想的生长环境。
肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
编者小结
通过这份“红黑榜”,我们可以清晰地看到,动物蛋白和植物蛋白饮食,在肠道菌群的“物种选择”上,展现出了强烈的偏好性。动物蛋白倾向于富集那些擅长蛋白质发酵、但部分代谢产物可能存在健康隐患的细菌;而植物蛋白则大力扶持了那些以分解纤维、产生有益代谢物而闻名的“健康卫士”。
这不仅仅是细菌名单的改变,更深层次的,是整个肠道微生态系统功能的转变。
肠道菌群结构的变化最终会影响其功能层面,而我们更关注这些细菌在肠道中的具体作用。为此,研究人员采用了PICRUSt2生物信息学工具,通过已知的16S rRNA基因序列,预测菌群的功能基因谱和可能激活或抑制的代谢通路。
分析结果显示,不同饮食模式下肠道内存在截然不同的“代谢模式”。
1
动物蛋白饮食的代谢特征:BCAA代谢亢进
分析发现,动物蛋白饮食组的菌群,其与支链氨基酸(BCAAs)代谢相关的通路被显著上调。BCAAs包括亮氨酸、异亮氨酸和缬氨酸,是人体必需氨基酸,对肌肉生长至关重要。动物蛋白(特别是乳清蛋白)正是BCAAs的极佳来源。
◮ 过量代谢BCAA的细菌可能导致代谢疾病风险
然而,近年来,越来越多的证据表明,循环血液中过高水平的BCAAs及其相关代谢物,与胰岛素抵抗和2型糖尿病的风险增加密切相关。
肠道菌群在BCAA的分解代谢中扮演了重要角色。动物蛋白饮食不仅直接带来了更多的BCAA,还富集了那些能更活跃地代谢BCAA的细菌,这可能导致一系列代谢副产物的产生,这些副产物被认为可能干扰宿主的胰岛素信号通路,从而埋下代谢疾病的隐患。
此外,动物蛋白饮食还与同型半胱氨酸(homocysteine)代谢的上调有关。高水平的同型半胱氨酸是心血管疾病的一个独立风险因子。
2
植物蛋白饮食的代谢特征:SCFA生产菌更丰富
与此相反,植物蛋白饮食组的菌群,展现出了另一幅欣欣向荣的代谢图景。最核心的变化,是与短链脂肪酸(SCFAs)生物合成相关的通路被显著激活。
SCFAs,主要包括乙酸盐、丙酸盐和丁酸盐,是肠道有益菌发酵膳食纤维产生的主要“宝藏”代谢物。它们的功能极其广泛且对健康至关重要:
能源供应:丁酸盐是结肠细胞的主要能量来源,能维持肠道屏障的完整性和健康。
抗炎作用:SCFAs能够抑制炎症反应,对预防和缓解肠道及全身性炎症至关重要。
代谢调节:它们可以通过作用于肠道和远端器官(如肝脏、脂肪组织)的受体,参与调节血糖和血脂代谢,改善胰岛素敏感性。
“肠-脑轴”通讯:SCFAs还能穿过血脑屏障,参与调节食欲、情绪和认知功能。
◮ 植物蛋白饮食促进微生物发酵并产生短链脂肪酸
植物蛋白饮食能够显著促进短链脂肪酸(SCFA)的生成,其主要机制在于植物性食物富含的特定营养素。植物蛋白来源的食物,如豆类、全谷物及坚果,普遍含有高密度的可发酵膳食纤维与抗性淀粉。这些碳水化合物是肠道中特定菌群,例如双歧杆菌属(Bifidobacterium)和罗氏菌属(Roseburia),合成SCFA所偏好的主要底物。
因此,采用植物蛋白为主的饮食模式,实质上是为这些有益微生物提供了一个理想的发酵基质,从而高效促进其代谢活动与增殖。
这一功能差异很可能构成关键的、基于肠道菌群的分子机制,用以解释为何长期坚持植物性饮食与较低的心血管疾病、2 型糖尿病及部分癌症风险相关。
读到这里,一个关键问题值得我们深思:造成上述所有差异的,真的仅仅是蛋白质分子本身的来源不同吗?是牛肉里的氨基酸和豆腐里的氨基酸有什么本质区别吗?
回答并非绝对。
该项荟萃分析的深刻之处,在于其揭示了一个更为宏观的视角:人类摄入的并非孤立的营养素,而是一个完整的“食物基质”(Food Matrix)。不同蛋白质来源之所以产生差异化的生理效应,很大程度上归因于与蛋白质共同摄入的“伴随营养素”所产生的协同作用。
1
动物源性蛋白质的营养基质特征
当摄入动物性食物,如红肉或加工肉制品时,机体获取的是一个复杂的生物活性化合物组合,而非仅仅是动物蛋白。此基质通常包含以下组分:
• 高含量的饱和脂肪与胆固醇:
这类脂质会刺激肝脏合成并分泌更多的初级胆汁酸进入肠道,以辅助脂肪的乳化与吸收。然而,肠道内的特定菌群(如前文提及的嗜胆菌属 Bilophila)能够将这些初级胆汁酸代谢为次级胆汁酸,而后者具有潜在的促炎与致癌特性。
• 丰富的含硫氨基酸(蛋氨酸、半胱氨酸)与牛磺酸:
动物蛋白富含此类化合物,它们为肠道中能够产生硫化氢(H₂S)的细菌提供了充足的反应底物。高浓度的硫化氢可能对肠道细胞产生毒性作用。
• 高浓度的左旋肉碱(L-carnitine)与胆碱:
红肉是这两种物质的重要膳食来源,可被特定肠道菌群代谢为三甲胺(TMA)。TMA被吸收后在肝脏经含黄素单加氧酶氧化为氧化三甲胺(TMAO)。循环中TMAO水平升高已被证实与动脉粥样硬化和心血管疾病风险增加存在因果关系。
• 血红素铁:
尽管红肉中的血红素铁生物利用度高,但过量摄入会作为一种促氧化剂,催化活性氧(ROS)的生成,可能对肠道上皮细胞造成氧化损伤。
• 膳食纤维的缺失:
此为关键区别点。纯动物性食物基质中几乎不含膳食纤维。这使得依赖碳水化合物为主要能量来源的有益菌(即短链脂肪酸生产者)缺乏发酵底物,导致其丰度下降。这种变化为那些进行蛋白质发酵并可能产生有害代谢物的菌群创造了增殖的生态位。
2
植物蛋白的“黄金搭档”
相比之下,植物蛋白的“食物基质”则显得友好得多。当你吃下一碗扁豆、鹰嘴豆或一块豆腐时,你同时摄入的还有:
• 丰富的膳食纤维:
这是植物蛋白最大的优势。各种可溶性和不溶性纤维,是肠道有益菌的“益生元大餐”,直接支撑了SCFA的生产体系,并促进了菌群的多样性。
• 多酚类物质:
植物中含有成千上万种多酚化合物(如黄酮、花青素),它们不仅自身具有强大的抗氧化和抗炎活性,还能被肠道菌群代谢为更具生物活性的小分子物质,同时它们也能反过来调节菌群的组成,抑制有害菌,促进有益菌。
不饱和脂肪酸:
许多植物性食物(如坚果、种子)富含有益心血管健康的单不饱和和多不饱和脂肪酸。
较低的氨基酸密度和不同的氨基酸谱:
植物蛋白的消化速度通常比动物蛋白慢,这使得更多的蛋白质和氨基酸有机会到达结肠,但由于有大量纤维的存在,发酵的模式会更偏向于有益方向。
因此,这场动物蛋白与植物蛋白在肠道中的“较量”,实际上是一场整体饮食模式的较量。
通过对这项结合了Meta分析与机器学习研究的深度解读,我们得以清晰地看到,餐盘中的蛋白质来源,是调控我们肠道微生物的一个强有力杠杆。
★核心结论可以概括为:
结构重塑:膳食蛋白的来源(动物vs.植物)是塑造肠道菌群结构的关键驱动力,能形成两种显著不同的菌群“派系”。
物种筛选:动物蛋白饮食倾向于富集Alistipes、Bilophila等可能与炎症和不良代谢产物相关的细菌;而植物蛋白饮食则大力促进了Bifidobacterium、Roseburia等公认的“有益菌”的繁荣。
功能转向:在功能层面,动物蛋白饮食与支链氨基酸(BCAA)代谢等可能关联胰岛素抵抗的通路被激活相关;而植物蛋白饮食则显著上调了短链脂肪酸(SCFA)的生物合成通路,后者对维持肠道和全身健康至关重要。
这些差异不仅源于蛋白质本身,更重要的是由蛋白质来源食物的整个“食物基质”——包括伴随的脂肪类型、纤维、多酚等共同决定的。
启示和指导
上述结论并非倡导彻底弃用动物蛋白或推行严格纯素,更非妖魔化动物蛋白。科学研究的价值在于提供循证依据,帮助个体做出更明智、均衡的饮食选择。
基于本研究,可提出以下可操作的饮食策略:
1.优化蛋白质来源结构,提升植物蛋白占比:
建议在日常膳食结构中有意识地提升源自植物性食物的蛋白质比例。
优质的植物蛋白来源包括:
豆类: 如小扁豆、鹰嘴豆、黑豆等;
豆制品: 如豆腐、豆豉;
全谷物与准谷物: 如藜麦;
坚果与种子。
可采取循序渐进的策略以实现这一目标,例如,每周设定若干“低动物蛋白日”,或在烹饪时,尝试使用植物蛋白部分或全部替代原有的动物蛋白成分,以逐步调整和优化个人的饮食习惯。
2.优先选择“优质”动物蛋白:
优先选择“优质”动物蛋白:如果选择动物蛋白,可以优先考虑鱼类(富含Omega-3脂肪酸)、禽肉和鸡蛋,适度摄入红肉,并尽量减少加工肉制品(如香肠、培根)的消费。
3.采用基于“食物基质”的整体性评估方法:
在进行膳食选择时,应超越对孤立营养素的关注,建立对食物整体营养构成的认知。评估蛋白质来源时,需系统性地考量其伴随的营养成分。
例如,分析该蛋白质是与有益健康的膳食纤维和植物多酚(如豆类)共同摄入,还是与可能增加代谢负担的饱和脂肪、胆固醇及加工助剂(如加工肉制品)一同进入体内。
4.保证充足膳食纤维摄入:
无论蛋白质来源如何,每日从全谷物、蔬菜、水果、豆类获取足量纤维,是维持肠道微生态的关键。充足的膳食纤维能够为有益菌提供发酵底物,支持其稳态与代谢。
个性化将是未来的大趋势。每个人的初始肠道菌群、遗传背景和生活方式都不同,对同一种蛋白质的反应也可能存在差异。未来的营养学,或许能够根据你的个人菌群特征,为你量身定制最适合你的蛋白质摄入方案。
但在此之前,研究所揭示的宏观规律,已经为我们指明了通往更健康肠道微生态的清晰方向。下一次,当你站在超市的货架前,或在餐厅的菜单上做出选择时,请记住,你的每一次选择,不仅是在喂饱自己,更是在为你体内那个数万亿的微小盟友,投票决定它们的未来,也间接地,决定你自己的健康未来。
参考文献:
Adejumo, Samson, et al. “Dietary Protein Source Shapes Gut Microbial Structure and Predicted Function: A Meta-Analysis with Machine Learning.” bioRxiv (2025): 2025-04.

谷禾健康

Alistipes是拟杆菌门的一种革兰氏阴性细菌,也是相对新的细菌属,主要从医学临床样本中分离出来。该菌的生态失调,可能是有益的也可能是有害的。
Alistipes可能对某些疾病有保护作用,包括肝纤维化、癌症免疫治疗和心血管疾病。相比之下,其他研究表明Alistipes在结直肠癌中具有致病性,并且与抑郁症有关。
该菌避开富含植物性食物的饮食,可以在高脂肪饮食中茁壮成长,并且在肥胖患者的肠道微生物群中生长得特别好,表明与肥胖相关。
Alistipes 是拟杆菌门中的一个属,革兰氏阴性,专性厌氧,是肠道共生的细菌,G+C 含量为55–58%,直径为 0.2–0.9 µm,长度为 0.5–4 µm 的直或略微弯曲的棒状,末端为圆形。不会形成孢子。细胞通常单独或成对出现,偶尔以较长的细丝出现。
不运动,可产生吲哚。不能还原硝酸盐,不水解精氨酸和尿素,葡萄糖代谢终产物是琥珀酸和少量的乙酸,丙酸。
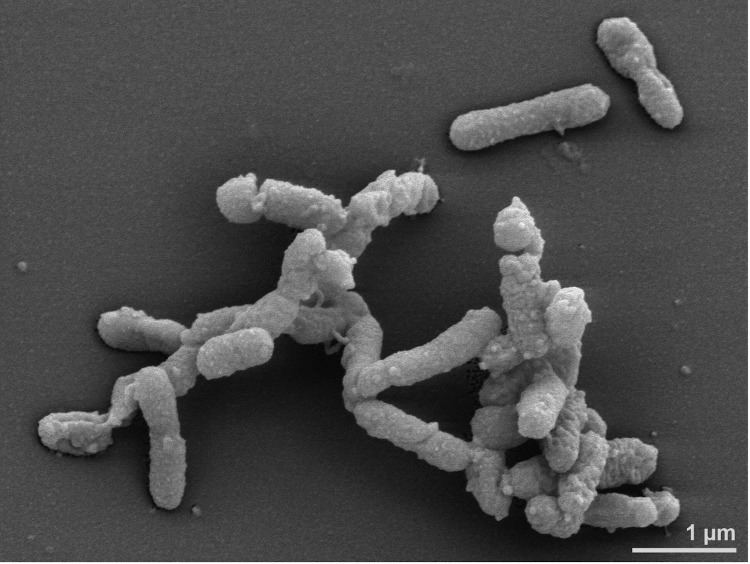
microbiomology
在分类学上,Alistipes 是在 2003 年在患有阑尾炎的儿童的组织样本中发现后描述的一个属。第一个被发现的Alistipes物种是Alistipes Finegoldii,它是以美国厌氧细菌学和传染病临床研究学家Sydney M. Finegold 的名字命名,极大地促进了我们对厌氧菌的理解。
根据NCBI分类数据库,目前Alistipes由13个物种组成:
2017 年从肠易激综合征患者的结肠中分离出来一种名为Tidjanibacter massiliensis Marseille-P3084 的新物种,与A. putredinis具有 92.1% 的序列同源性,不过该菌株尚未被官方认可或存放在公共菌株生物储存库中。
此外,三个较新的亚种:
从生态学角度来看,Alistipes主要存在于健康人的肠道中。然而,Alistipes也从其他液体中分离出来、如尿液、阑尾、腹部、直肠周围和脑脓肿中分离出来,突出了它们在人类疾病中潜在的机会致病作用。
A. putredinis(ATCC 29800 T型菌株)已从各种标本中分离出来,例如粪便、急性阑尾炎患者的阑尾组织、腹部和直肠脓肿、甚至农场土壤。该菌株对克林霉素、头孢西丁、氯霉素、红霉素和甲硝唑敏感,对四环素和强力霉素有中度耐药。
Alistipes finegoldii 已被认为是肉鸡的生长促进剂,并且已观察到在人类中,A. putredinis随着十字花科蔬菜摄入量的增加而增加,因此可以合理假设不同的Alistipes物种在营养和健康方面可能具有不同的作用。
A. onderdonkii和 A. shahii 分别从腹部脓肿和阑尾组织以及尿液中分离出来。它们具有圆形菌落。这两个种都对 20% 的胆汁具有抗性,并将色氨酸水解为吲哚。它们是过氧化氢酶、氮还原酶和脲酶阴性。琥珀酸是主要的代谢终产物,少量产生乙酸和丙酸。
其他两个种,A. senegalensis 和 A. timonensis 最初是从健康患者的粪便菌群中分离出来的。它们有圆形菌落并产生色素,可以将色氨酸水解为吲哚。A. senegalensis会发酵甘露糖,而A. timonensis 不会。这些细菌菌株对青霉素、阿莫西林加克拉维酸、亚胺培南和克林霉素敏感。此外,A. senegalensis菌株对甲硝唑耐药,A. timonensis 菌株对甲硝唑敏感。
Alistipes inops从人类粪便中分离出物种。它对吲哚产生呈阳性,对过氧化氢酶、硝酸还原酶和脲酶呈阴性。这种细菌是非发酵的,主要代谢终产物是琥珀酸和乙酸。
A. megaguti (Marseille-P5997 T型菌株)是从一名年轻健康女性的新鲜粪便样本中分离出来的。
A. megaguti是过氧化氢酶、脲酶和氧化酶阴性。
A. provencensis (Marseille-P2431 T型菌株) 分离自一名患有高血压和糖尿病的男性患者。该种属氧化酶和脲酶阴性,而过氧化氢酶阳性。
A.ihumii 已从患有神经性厌食症的患者的粪便中分离出来,而A.obesi则从患有病态肥胖症的患者中分离出来。
该菌属大部分耐胆汁,因此,有必要确定对胆汁酸的抗性是否确实决定了Alistipes胃肠道内的区域性富集,或临床上以胆汁改变为特征的疾病,其与Alistipes菌的关系。
肝病和短链脂肪酸中的 Alistipes
肝细胞癌 (HCC) 是全球第二大致命癌症。HCC 通常是由肝硬化、非酒精性脂肪肝病 (NAFLD) 或非酒精性脂肪性肝炎 (NASH) 引起的晚期肝纤维化发展而来的。这些肝脏疾病与“微生物-肝轴”有关,表明生态失调是潜在原因之一。
肝纤维化中Alistipes减少
在对微生物群组成和肝纤维化进行的研究中可以看出,在纤维化的整个进展过程中,Alistipes减少。
例如,在代偿性和失代偿性肝硬化 (LC) 患者中,来自健康志愿者和各种类型 LC 患者的新鲜粪便宏基因组序列表明,与健康对照组相比,A. shahii和A. putredinis菌减少。
针对 LC 患者粪便和活检的研究中,与 LC 患者相比,健康对照患者的Alistipes丰度增加。
代偿发展到失代偿,Alistipes减少
随着疾病从代偿发展到失代偿,观察到Alistipes indistinctus 的减少。一旦个体出现失代偿性肝硬化,患者就会开始产生多种严重并发症,例如肝性脑病。
另一项研究表明,在比较失代偿性肝硬化和急性肝性脑病患者的粪便微生物群时,Alistipes具有保护作用,其丰度的降低与肝性脑病复发的增加相关。因此,Alistipes的减少与肝硬化进展为失代偿状态有关。
NASH 和 NAFLD中 Alistipes 降低
在NASH 和 NAFLD 等其他纤维化疾病中可以看到肝纤维化患者的Alistipes丰度降低。有实质性纤维化的 NAFLD 患者粪便中乙酸盐和丙酸盐浓度降低,丁酸盐浓度无显着差异。当将健康对照与 NASH 患者进行比较时,A. finegoldii 显着减少,标准化计数平均值从 542 减少到 19。在具有显着纤维化的 NAFLD 患者中,观察到 A. onderdonkii 的显着减少从 285 到 31。
Alistipes生产短链脂肪酸
值得注意的是,这些晚期纤维化患者的粪便乙酸盐和丙酸盐水平降低。
Alistipes是一种丙酸生产者,表达甲基丙二酰辅酶A差向异构酶,其中该酶的基因位于具有乙酰辅酶A羧化酶基因的操纵子上。
此外,Alistipes是乙酸盐生产者,由于先前的研究表明短链脂肪酸具有抗炎机制,因此可以表明Alistipes 减少促使短链脂肪酸减少,可能加剧这些 NAFLD 患者中的晚期纤维化。
心血管疾病、高血压和上皮中的 Alistipes
心血管疾病 (CVD) 是发展中国家和发达国家死亡和发病的主要原因。随着全球人口老龄化,预计心血管疾病在未来会上升,因此对与肠道微生物群关系的评估进行了更广泛的研究。
Alistipes与高血压等心血管疾病风险因素以及心房颤动 (AF)、充血性心力衰竭 (CHF) 和动脉粥样硬化性心血管疾病 (ACVD) 等多种心血管疾病相关。
各种研究表明,Alistipes在心血管疾病中起保护作用。
心房颤动患者Alistipes减少
Alistipes与心房颤动 (AF) 等心血管疾病直接相关。心房颤动是最常见的心律失常,在高血压、心力衰竭和肥胖患者中普遍存在。
为了量化肠道微生物组和心房颤动之间的关系,对来自中国参与者的 100 个粪便样本全基因组鸟枪序列进行分析,显示在心房颤动患者肠道中Alistipes急剧减少。
Alistipes和链球菌的拮抗作用
然而,研究中提出在心房颤动期间急剧增加的细菌,如链球菌,可能是导致Alistipes下降的原因,这表明Alistipes和链球菌之间存在潜在的拮抗作用。这种趋势在其他心脏病中很常见,例如 ACVD和 CHF。
但是Alistipes在心血管疾病中证据是矛盾的,尚不清楚关联是保护性的、有益的还是致病的。因为大多数心血管疾病具有共同的病理生理特征,例如内皮功能障碍 ,Alistipes的作用可能取决于多个心血管疾病共享的疾病机制。因此,更多关于肠心轴的研究可能会导致未来对微生物组相关疾病和潜在疗法的理解。
高血压中Alistipes有助于炎症和上皮细胞的改变
宏基因组分析研究了 22 名高血压患者和 18 名对照患者的粪便样本。数据显示A. finegoldii和A. indistinctus的增加与收缩压呈正相关,表明该物种是高血压患者肠道屏障功能障碍和炎症的潜在驱动因素,但是该研究样本量较少,证据力度不大。
肠道炎症和结直肠癌中不一样的 Alistipes
由于胃肠道中微生物群的多样性,菌群失调与炎症性肠病(IBD)之间存在很强的相关性。
人群中最常见的炎症性肠病是克罗恩病 (CD) 和溃疡性结肠炎 (UC)。溃疡性结肠炎是一种主要针对结肠的慢性炎症性疾病。有人提出A. Finegoldii是一种针对结肠炎的保护性物种,因为A. Finegoldii在患有结肠炎的小鼠中减少。
基于这个事实,进行了一项研究,其中微生物群耗竭的小鼠用口服 DSS 治疗以诱发结肠炎。当用 A. finegoldii 灌胃时,结肠炎的严重程度与野生小鼠相似。当给患上结肠炎小鼠添加了A. finegoldii和 Bacteroides Eggerthii (一种结肠炎诱导细菌)时,与单独添加B. Eggerthii 或添加其他细菌(如Parabacteroides distasonis或Prevotella falsenii)的小鼠相比,结肠炎的严重程度显着降低,这进一步表明A. Finegoldii是一种减轻结肠炎的细菌。
具有对比临床意义的是,已从严重克罗恩病的肠壁海绵状瘘管 (CavFT) 微病变中分离出与其他拟杆菌有关的 A. finegoldii. 对自发性克罗恩病回肠炎小鼠模型粪便样本的宏基因组研究显示,与亲代 AKR/J 小鼠群体相比,Alistipes 富集。
8 周龄 NOD2 敲除小鼠富含Alistipes、抗炎细胞因子(TGF-β 和 IL-10)和 CD4 + LAP + FoxP3 –调节性 T 细胞。这些观察结果的一个可能联系来自对姜黄素的研究,姜黄素是一种已被证明可通过 IL-10增加 CD4 + LAP + FoxP3 -细胞来调节肠道炎症的香料。
有趣的是,有炎症的患者服用益生菌后,Alistipes增加了。迄今为止,尚不清楚该属与肠道中的其他微生物(包括食物和益生菌菌株)之间存在哪些相互作用机制。
诱发结直肠癌
已发现Alistipes作为潜在的病原体可能会诱发结直肠癌。A. Finegoldii 通过 IL-6/STAT 3 途径促进右侧结直肠癌。报告指出Alistipes能产生磺脂,已知磺脂类药物可作为血管性血友病因子受体的拮抗剂并抑制肿瘤坏死因子-α (TNF-a),这些物质与微炎症和血管内皮功能障碍有关。
Lipocalin 2 (LCN 2) 是一种与铁载体结合的抗微生物蛋白,最终会降低铁的利用率。
在 IBD 患者中,LCN 2 在黏膜和粪便样本中的浓度很高。从本质上讲,这可以减少Alistipes的繁殖,因为铁是A. finegoldii 生长的调节因子。
小鼠研究表明A. finegoldii在 WT、LCN 2 KO 和 IL-10 KO C57BL/6J 小鼠中口服给药 1 周后引起肠道炎症。因此,该论文得出结论,Alistipes在缺乏 LCN 2 并促进炎症和肿瘤形成的发炎环境中茁壮成长。此外,他们发现在盲肠中发现Alistipes finegoldii的丰度高于大肠内的其他位置。
癌症免疫疗法中的Alistipes
该属已被证明可以通过调节肿瘤微环境在癌症免疫治疗中发挥有益作用。癌症的主要标志之一是逃避免疫系统。因此,一种形式的抗癌治疗是操纵肿瘤微环境。
免疫疗法的一个例子是通过诱导肿瘤相关骨髓细胞产生肿瘤坏死因子 (TNF) 来操纵微环境,最终导致肿瘤根除。
一种方法是使用肿瘤内 CpG-寡脱氧核苷酸 (ODN) 的组合来激活 TLR9 和抑制性 IL-10R 抗体。这种免疫疗法通常会阻止肿瘤生长并通过肿瘤相关的骨髓细胞诱导肿瘤坏死因子依赖性出血性坏死,从而导致肿瘤抑制。
免疫疗法效果依赖微生物群的存在
由于 TNF 产生减少,抗生素导致肿瘤根除效率降低。然后,研究人员怀疑这是否取决于肠道中的细菌负荷。因此,具有 MC38 肿瘤的无菌 (GF) 小鼠接受了抗 IL-10R/CpG-ODN 治疗。与无特定病原体 (SPF) 小鼠相比,经处理的 GF 小鼠产生的 TNF 量显着降低。
这表明肿瘤相关的先天性骨髓细胞由微生物群引发,以响应抗 IL-10R/CpG-ODN 产生炎性细胞因子,并且抗生素治疗或无菌状态导致的细菌负荷减少会降低这种反应,并且TNF依赖的早期肿瘤坏死。
为了更好地了解抗生素的作用和肠道微生物群的作用,用 LPS 灌胃 MC38 荷瘤小鼠并重建 TNF 表达。Alistipes属和 TLR4 引发/TNF 产生的作用,两者之间存在正相关。
TNF 恢复是由于促炎性革兰氏阴性菌A. shahii与 TLR4 结合,启动 TNF 产生表达的作用。
为了进一步证明他们的假设,作者随后显示了抗生素治疗后A. shahii恢复的延迟,这也与抗生素给药后约 4 周的 TNF 恢复阶段平行。
此外,他们表明,当用抗生素预处理并用A. shahii灌胃的小鼠时,与肿瘤相关的骨髓细胞产生 TNF 的功能得到恢复。临床相关,该研究表明,当Alistipes减少,对癌症免疫疗法的最佳反应平行减少 。陆续其他人也确定了Alistipes在癌症免疫治疗中的作用。
精神健康中的 Alistipes
虽然Alistipes常见于肠道,但它已被证明对定位于肠道外的疾病有显着影响,例如抑郁症、焦虑症、慢性疲劳综合征、自闭症、肝硬化和衰老。肠道内的生态失调会影响肠脑轴,并用于解释肠道微生物群、抑郁症和其他情绪障碍(如焦虑)之间的关系。
抑郁患者中Alistipes增加
与健康对照组相比,重度抑郁症患者的粪便中肠杆菌科和Alistipes水平升高,粪杆菌水平降低。Alistipes属吲哚阳性,影响血清素前体色氨酸,而Faecalibacterium具有抗炎特性。
在一项对 BALB/c 小鼠进行的研究中,该小鼠置于压力环境中,Alistipes丰度显着增加。此外,还发现挪威患有慢性疲劳综合症的患者的Alistipes浓度增加了近 4 倍。这些发现与抑郁症患者Alistipes增加的证据相关,因为抑郁症患者通常与疲劳和压力作斗争 。
Aistipes丰度的增加可能与GABA增加有关
研究指出,Alistipes的增加扰乱了肠-脑轴,因为Alistipes是一种吲哚阳性生物体,因此会降低血清素的可用性。色氨酸是血清素的前体,血清素的减少与抑郁症有关。此外,Alistipes已被证明可表达谷氨酸脱羧酶,这是一种在鸡体内将谷氨酸代谢为 γ-氨基丁酸 (GABA) 的酶。因此Alistipes丰度的增加也可能与 GABA 的增加有关。然而,应该进行研究以证明 GABA 是否被分泌到肠腔中。
自闭症患者中Alistipes研究不一致
此外,自闭症谱系障碍患者的大脑和肠道之间存在关联。研究发现自闭症谱系障碍患者的Alistipes减少。然而,另一项针对不同形式的自闭症 PDD-NOS 的研究表明,儿童中存在大量Alistipes。据推测,这可能来自丙酸的产生,丙酸已被证明对大鼠具有神经生物学作用。需要对Alistipes进行更多研究及其对肠脑轴的影响,因为关于其在两个系统中的保护/致病作用存在矛盾的证据。
磺胺类和生化标志物
Alistipes是一种细菌,具有许多与上述疾病相关的免疫和生化途径。一个重要的意义是Alistipes通过 IL-6/STAT 3 途径促进结直肠癌。
因此,未来的研究可以考虑使用Alistipes物种作为结直肠癌的潜在生物标志物,利用我们基于微生物组 DNA 数据的理解以及对疾病发病机制的生化概念的整合。
实现这一目标的一种潜在方法是寻找磺基脂,这是一类独特的鞘脂,在鞘氨醇碱基中具有磺酸基团。
Alistipes产生磺基脂
研究表明,当 C57BL/6N 小鼠喂食含有红花油或猪油脂肪的高脂肪饮食 3 周时,与喂食正常食物的小鼠相比,磺胺脂以及体重都会增加。进行了宏基因组分析并筛选了这些小鼠盲肠中参与磺胺脂生物合成的细菌基因。发现除A. inops外的所有Alistipes物种都产生磺基脂(关于最新物种 A. megaguti、A.provencensis和磺基脂生产的信息仍然未知)。
为了进一步证明磺基脂是细菌的产物和Alistipes的标志物,科学家们对带有Alistipes的无菌 (GF) 小鼠进行了单定殖研究并检测到单定殖小鼠盲肠中明显出现了以前在无菌小鼠中不存在的磺基脂。
因此,由于结直肠癌的常见风险因素是高脂肪饮食、肥胖和年龄,除了这些结肠疾病中Alistipes的丰度增加外,还有一个有趣的提议是使用磺基脂类作为结直肠癌患者风险的标志物。此外,应进行研究以验证Alistipes丰度是否在息肉中增加,癌前与癌性,息肉是结直肠癌的另一个危险因素。
有害代谢产物与结直肠癌相关
此外,Alistipes在共生细菌中具有最多的腐败途径。腐败是肠道微生物群在胃肠道中发酵未消化的蛋白质,通常会导致细菌产生有害代谢物。据报道,这些产物有害并与结直肠癌相关。此类产品包括氨、H2S、甲酚、吲哚和苯酚。
在一项旨在确定肠道细菌使用的主要腐败途径的研究中,发现Alistipes有助于组氨酸降解/四氢呋喃产生、吲哚产生和苯酚产生。已发现组氨酸降解/THF 产生会释放过量的氨,当吸收时会损害结肠细胞。还发现氨会增加肠细胞增殖并有助于结直肠癌中癌细胞的生长。当患者有结直肠癌风险时,发现过量氨和其他Alistipes产生的腐败产物可能对临床医生有用。
Alistipes是一种从临床样本中分离出来的相对较新的细菌属,尽管与拟杆菌门中的其他细菌相比,其分离率较低。全基因组蛋白质系统发育分析表明,与拟杆菌门中的其他成员相比,该属可能具有独特的功能特性。
一般,超过一定量的Alistipes在临床和临床前研究中已被认为是导致疾病的原因。有趣的是,其他研究表明它们的存在与促进健康表型相关,例如Alistipes在结肠炎、自闭症谱系障碍以及各种肝脏和心血管纤维化疾病等疾病中的保护作用。
尽管Alistipes在健康表型中发挥作用,但与之形成鲜明对比的是,Alistipes在焦虑、肌痛性脑脊髓炎/慢性疲劳综合征、抑郁症、PDD-NOS 和 CRC 等疾病中具有致病作用。
根据相关研究的结论,该属可能在疾病的调节中起主导作用,或者可能只是具有辅助作用或共同诱导作用。将进一步需要动物研究来破译其复杂多模式疾病机制,以及亚型表型的有针对性研究。
使用无菌动物和模型将有助于了解该属在疾病和健康中的作用以及与宿主免疫防御耐受性的相互作用,例如应该有研究调查Alistipes及其生产的 SCFAs 的作用对各种肝病的影响和Alistipes对T细胞分化的直接作用。
主要参考文献
Parker BJ, Wearsch PA, Veloo ACM, Rodriguez-Palacios A. The Genus Alistipes: Gut Bacteria With Emerging Implications to Inflammation, Cancer, and Mental Health. Front Immunol. 2020 Jun 9;11:906. doi: 10.3389/fimmu.2020.00906. PMID: 32582143; PMCID: PMC7296073.
Sakamoto M, Ikeyama N, Ogata Y, Suda W, Iino T, Hattori M, et al. . Alistipes communis sp. nov., Alistipes dispar sp. nov. and Alistipes onderdonkii subsp. vulgaris subsp. nov., isolated from human faeces, and creation of Alistipes onderdonkii subsp. onderdonkii subsp. nov. Int J Syst Evol Microbiol. (2020) 70:473–80.
Rau M, Rehman A, Dittrich M, Groen AK, Hermanns HM, Seyfried F, et al. . Fecal SCFAs and SCFA-producing bacteria in gut microbiome of human NAFLD as a putative link to systemic T-cell activation and advanced disease. United Euro. Gastroenterol J. (2018) 6:1496–1507. 10.1177/2050640618804444
Song Y, Könönen E, Rautio M, Liu C, Bryk A, Eerola E, et al. . Alistipes onderdonkii sp. nov. and Alistipes shahii sp. nov., of human origin. Int J Syst Evol Microbiol. (2006) 56:1985–90. 10.1099/ijs.0.64318-0
Kim S, Goel R, Kumar A, Qi Y, Lobaton G, Hosaka K, et al. . Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure. Clin Sci. (2018) 132:701–18. 10.1042/CS20180087
Shen L, Liu L, Ji HF. Regulative effects of curcumin spice administration on gut microbiota and its pharmacological implications. Food Nutr Res. (2017) 61:1361780. 10.1080/16546628.2017.1361780
Merrill AH. Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics. Chem Rev. (2011) 111:6387–422. 10.1021/cr2002917
Parker BJ, Wearsch PA, Veloo ACM, Rodriguez-Palacios A. The Genus Alistipes: Gut Bacteria With Emerging Implications to Inflammation, Cancer, and Mental Health. Front Immunol. 2020 Jun 9;11:906. doi: 10.3389/fimmu.2020.00906. PMID: 32582143; PMCID: PMC7296073.
Sakamoto M, Ikeyama N, Ogata Y, Suda W, Iino T, Hattori M, et al. . Alistipes communis sp. nov., Alistipes dispar sp. nov. and Alistipes onderdonkii subsp. vulgaris subsp. nov., isolated from human faeces, and creation of Alistipes onderdonkii subsp. onderdonkii subsp. nov. Int J Syst Evol Microbiol. (2020) 70:473–80.
Rau M, Rehman A, Dittrich M, Groen AK, Hermanns HM, Seyfried F, et al. . Fecal SCFAs and SCFA-producing bacteria in gut microbiome of human NAFLD as a putative link to systemic T-cell activation and advanced disease. United Euro. Gastroenterol J. (2018) 6:1496–1507. 10.1177/2050640618804444
Song Y, Könönen E, Rautio M, Liu C, Bryk A, Eerola E, et al. . Alistipes onderdonkii sp. nov. and Alistipes shahii sp. nov., of human origin. Int J Syst Evol Microbiol. (2006) 56:1985–90. 10.1099/ijs.0.64318-0
Kim S, Goel R, Kumar A, Qi Y, Lobaton G, Hosaka K, et al. . Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure. Clin Sci. (2018) 132:701–18. 10.1042/CS20180087
Shen L, Liu L, Ji HF. Regulative effects of curcumin spice administration on gut microbiota and its pharmacological implications. Food Nutr Res. (2017) 61:1361780. 10.1080/16546628.2017.1361780
Merrill AH. Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics. Chem Rev. (2011) 111:6387–422. 10.1021/cr2002917