-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康
在追求健康与长寿的道路上,NAD+(烟酰胺腺嘌呤二核苷酸)近年来成为了科学研究和健康领域的热门话题。补充NAD⁺延缓衰老——仿佛补充了NAD+,就健康100岁更进一步。
烟酰胺腺嘌呤二核苷酸(NAD+),中文简称是氧化性辅酶Ⅰ,是人体内最重要且有趣的分子之一。它参与500多种酶促反应,并在几乎所有主要生物过程中发挥关键调节作用。
NAD+在我们体内的能量代谢、信号传递、DNA修复、免疫调节等多个重要生理过程中发挥着关键作用。除此之外,它还在胰岛素敏感性的提高、肌肉体能的提升、血流状态的促进、神经功能的调节及持肠道稳态等方面可能有益处。但最重要的是,它会影响细胞凋亡及人体衰老。
科学研究证实,一种名为「Sirtuins」的蛋白家族,或许能让人体寿命延长。Sirtuins的主要功能是去乙酰化蛋白质,这是一种重要的蛋白质修饰过程。通过去乙酰化,Sirtuins可以维持蛋白质的功能和稳定性,在细胞抗逆性、能量代谢、细胞凋亡和衰老过程中具有重要作用。而NAD+是Sirtuins发挥作用的唯一底物——就像只有特定形状的钥匙能打开保险箱,人体内没有任何其他物质可以替代NAD+激活 Sirtuins。NAD+水平降低与几种衰老相关疾病有关。
因此,越来越多的人开始选择通过摄入NAD+的前体物质,如酰胺单核苷酸(NMN)、烟酰胺核苷(NR)等,希望借此来补充体内的NAD+水平,以实现延缓衰老、提升健康的目标。然而,你有没有想过:你吃进去的NMN,真的被身体用上了吗?
就在前不久,权威期刊《Science Advances》发布了一项颠覆性研究:哈佛医学院团队发现,口服NMN和NR并不能直接转化为NAD⁺,它们必须经过肠道菌群的“加工”,先转化为烟酸类代谢物,再通过肠肝循环,最终在肝脏中生成NAD⁺。
因此,我们需要重新审视NAD+补充剂,如何确保补充效果,不再单纯关注前体物质的含量,而是采用综合方法,同时搭配科学的生活方式和精准的营养平衡,实现真正有效的健康老龄化。本文将带你详细认识烟酰胺腺嘌呤二核苷酸(NAD+)是什么、对身体的多重影响,以及究竟该如何正确地补充NAD+以延缓衰老并改善健康。
NAD+(Nicotinamide adenine dinucleotide)中文全称“烟酰胺腺嘌呤二核苷酸”,简称辅酶I。
烟酰胺腺嘌呤二核苷酸(NAD+)是体内最关键的分子之一,它是500多种酶促反应所必需的,并且在几乎所有主要生物过程的调节中起着关键作用。例如在糖酵解、糖异生、三羧酸循环及呼吸链中发挥着不可替代的作用。
▸ NAD+的历史
NAD于1906年首次被描述为增强酒精发酵的细胞成分。然后,在1936年,证明了氧化还原反应需要 NAD。并巩固了命名法:“NAD”是指与电荷无关的化学主链,“NAD+”和“NADH”分别是指氧化和还原形式。
1963 年,发现NAD+是聚ADP-核糖添加到蛋白质上的共底物,这一突破揭示了 PARP(多聚 ADP-核糖聚合酶)家族的功能。PARP涉及DNA修复和基因表达等多种细胞过程。
1990年,酵母研究发现 sirtuins 可延长寿命。SIR2 基因的上调能延长酵母的复制寿命,减少DNA损伤。Sir2 能调控基因沉默,随着细胞老化重新定位,防止 DNA 损伤积累。后来证实 Sir2 具有 NAD 依赖性的组蛋白去乙酰酶活性,哺乳动物的 sirtuins(SIRT1-7)也在衰老、长寿和应激反应中发挥重要作用。
注:Sirtuins被称为“长寿蛋白”,Sirtuins可以维持蛋白质的功能和稳定性,并参与多种细胞过程,如DNA修复、基因沉默、细胞周期调控和代谢调节等。
1999年发现哺乳动物 sirtuins 代谢 NAD+,并有研究证实,NAD+是Sirtuins发挥功能的唯一底物。2013年哈佛医学院大卫·辛克莱尔团队揭示了NAD+ 与衰老之间存在密切关联。
▸ NAD+的生理功能
NAD+(烟酰胺腺嘌呤二核苷酸)是细胞代谢的核心分子,具备以下主要功能:
NAD+的生理功能
Rajman L,et al.Cell Metab.2018
①能量代谢中的核心因子
NAD⁺在细胞能量生成中至关重要。它是细胞内最基本的氢受体与供体之一,在糖酵解、三羧酸循环和脂肪酸氧化等代谢通路中担任电子载体,催化底物的氧化还原反应,将能量储存在ATP分子中。
调节NAD+/NADH比率,这对维持线粒体功能和能量代谢至关重要。
②信号分子功能
NAD⁺不仅是代谢底物,更是许多关键酶类的必需共底物,主导细胞重要信号和修复通路:
去乙酰化酶(Sirtuins, SIRTs):NAD⁺依赖性去乙酰化酶,调控基因表达、代谢、细胞生长和寿命,参与衰老及抗逆境反应。
聚ADP核糖聚合酶(PARPs):NAD⁺为PARPs介导的DNA修复提供必需底物,维护基因组稳定。PARPs过度激活会消耗NAD⁺,诱发细胞凋亡。
CD38/CD157与钙信号:调节胞内钙信号,影响免疫细胞功能、代谢和衰老。
③细胞功能调节
NAD⁺具有广泛的细胞调节能力,包括:
-酶调节
-基因表达控制
-DNA修复
-细胞周期调节
-钙信号传导
-表观遗传重塑
NAD+代谢控制着广泛的生物过程
Navarro MN, et al.Br J Pharmacol.2022
④免疫系统调节
NAD⁺还能够调节免疫细胞功能
-控制T细胞存活、激活和分化
-调节巨噬细胞激活状态
-影响炎症反应的强度和持续时间
-参与免疫细胞的代谢重编程
具体机制
-通过ART2和P2X7受体调节T细胞凋亡
-通过SIRT1调节Treg/Th17平衡
-调节炎症因子产生(如TNF-α、IL-1β)
-影响免疫细胞的钙离子动员
⑤抗炎和抗衰老
NAD⁺通过调控PARPs、sirtuins和CD38等影响炎症因子的产生,对慢性炎症及炎症性衰老具有调节作用。
抗炎作用
-抑制NF-κB信号通路
-调节炎症小体组装
-减少促炎细胞因子分泌
抗衰老功能
-维持线粒体功能
-促进DNA修复
-调节细胞衰老过程
-对抗氧化应激
⑥影响细胞凋亡及人体衰老
NAD⁺作为DNA修复反应(如单链断裂修复和碱基切除修复)的必需辅因子,保障基因组稳定;NAD⁺枯竭则易导致基因损伤积累、细胞衰老乃至不同类型的细胞死亡(包括凋亡和坏死)。
并且随着年龄增长,NAD⁺水平普遍下降,被认为是组织功能衰退、代谢紊乱和多种年龄相关慢病(阿尔茨海默病、帕金森病、糖尿病、心血管病)发生的重要基础。
补充NAD+前体如NR和NMN可显著延缓衰老相关病理,改善线粒体功能、胰岛素敏感性和神经保护。并通过提升ATP生成、减少炎症及促进肌纤维类型转变来逆转与年龄相关的肌肉损害。
⑦调节代谢稳态和疾病防治
糖脂代谢:NAD⁺维持肝脏、脂肪组织和胰岛功能,对糖尿病和脂肪肝等代谢病防治至关重要。
心脑血管保护:NAD⁺通过抗炎、抗纤维化和抗氧化,减少内皮功能障碍、降低动脉僵硬度、保护心脏免受缺血性损伤。
Kane AE,et al.Circ Res.2018
神经保护:保护神经元免受退行性变化、改善认知功能、减轻神经退行性疾病症状、保护视网膜功能。
肿瘤治疗:NAD⁺代谢重编程调控癌细胞增殖和凋亡,是肿瘤治疗的重要潜在靶点。降低肿瘤组织的NAD+水平可削弱其DNA修复能力,提高对化疗药物的敏感性,目前已有多种PARP1和NAMPT抑制剂用于此目的并在临床测试。另一方面,提升NAD⁺水平可增强线粒体功能、下调糖酵解和抑制肿瘤生长。
⑧维护肠道稳态
NAD+代谢,特别是sirtuins和PARP-1等NAD+依赖性酶,以及与NAD+合成相关的酶如NAMPT,在维持肠道稳态、调控炎症反应和肠道上皮修复中发挥关键作用。
补充NAD+前体或激活sirtuins可改善肠道屏障功能,减轻结肠炎和相关炎症,但NAD+代谢的失衡,如NAMPT过度激活,也可能推动肠道炎症和肿瘤发生。因此,精准调控NAD+通路有望成为IBD及相关疾病的潜在治疗策略。
▸ 缺乏NAD的危害
NAD具有多种重要生理功能,那么其含量过低是否会有什么影响呢?糙皮病由缺乏烟酸导致NAD+和NADP+水平降低所致,表现为皮炎、腹泻和痴呆。近年来的研究还表明,低NAD+水平不仅与代谢和神经退行性疾病相关,还与啮齿动物和人类的衰老密切相关。
NAD⁺过低可能导致以下危害:
①加速衰老与寿命缩短
NAD⁺水平与生理健康、组织再生、干细胞功能密切相关。其稳步下降是衰老及相关功能障碍、寿命缩短的一个主因。
动物实验及部分临床证据显示,提升NAD⁺水平有望逆转部分衰老表型、延缓功能衰退。
②导致能量与代谢障碍
NAD⁺作为能量代谢(氧化磷酸化和糖酵解)核心辅因子,缺乏会导致ATP生成受损、细胞生长活性下降。坏死与细胞凋亡易发,组织损伤修复能力减弱。这可能是影响衰老的重要因素之一。
③基因组稳定性与DNA修复障碍
NAD⁺是PARP依赖性DNA修复所需底物,含量降低会削弱DNA修复能力,增加基因突变、癌变风险。
某些神经退行性疾病、衰老相关病变、肿瘤发生与此机制密切相关。
④炎症反应与免疫失调
NAD⁺不足可导致SIRT家族(NAD⁺依赖去乙酰酶)活性下降,削弱炎症抑制、细胞自噬、抗氧化等调控能力,促进慢性低度炎症和免疫失衡。
⑤肠道及其他器官功能障碍
NAD⁺对肠道上皮和干细胞修复、免疫屏障维持至关重要,缺乏时屏障功能显著下降,易导致肠道炎症(如IBD)、癌症风险上升。
NAD⁺缺乏影响神经元代谢和生存,促进神经退行性变化,如阿尔茨海默病、帕金森病和脑缺血等病理过程。
其他器官如肝脏、肾脏、心脏等NAD⁺相关信号异常,也会带来代谢紊乱、器官衰竭等问题。
NAD⁺含量降低,既是衰老及多种慢性疾病的重要机制,也是细胞功能紊乱、机体易感多种病理状态的根本驱动力。其危害涵盖能量代谢、基因组稳定、免疫炎症、神经健康及器官功能等多个层面。
▸ NAD⁺含量降低的原因
①衰老相关下降
随着年龄增长,所有物种(从酵母到人类)的NAD⁺水平都会自然稳步下降。原因包括:
-NAD⁺生物合成酶(如NAMPT、QPRT)的表达下调,NAD⁺新生途径能力减弱。
-消耗NAD⁺的酶如PARP-1、CD38等的活性升高,尤其是在DNA损伤积累和慢性炎症环境下。
②环境与代谢应激
-长期热量摄入过多、缺乏运动、代谢紊乱(如糖尿病、脂肪肝)等均可抑制NAD⁺合成或加速其分解。
-毒素、病原体、自由基等导致DNA损伤,促使PARP类酶大量消耗NAD⁺于DNA修复过程中。
–线粒体功能与能量代谢紊乱,导致NAD⁺循环效率下降,并诱发假缺氧状态;
–慢性炎症、免疫激活等病理状态也促进NAD⁺持续消耗。
③疾病和遗传因素
一些遗传代谢缺陷(如烟酸缺乏导致糙皮病)或酶功能异常影响NAD⁺合成/再生。
慢性免疫激活和自身免疫性疾病中,相关信号分子的上调可增加NAD⁺消耗。
随着人们对健康与长寿的关注不断提升,NAD+(烟酰胺腺嘌呤二核苷酸)逐渐成为科学研究和健康领域中的焦点,越来越多的研究人员和健康专家开始关注其在维持生命活力和促进健康方面的重要作用。
因此,深入了解NAD+的合成与代谢过程,对于我们科学把握其补充方式、提升健康水平以及实现延缓衰老的目标都极为重要。
▸ NAD+的合成
NAD+在哺乳动物中以四种主要方式合成:1.从头合成途径、2.挽救途径、3.烟酰胺核糖(NR)激酶途径和4.Preiss-Handler 途径。
▸ 从头合成途径
NAD+的从头合成以色氨酸为起点,主要在肝脏进行,过程受多种酶调控。喹啉酸磷酸核糖转移酶和吲哚胺2,3-双加氧酶或色氨酸2,3-双加氧酶催化关键反应。
吲哚胺 2,3-双加氧酶可被促炎介质(如干扰素、肿瘤坏死因子和脂多糖)激活,而色氨酸 2,3-双加氧酶可被压力荷尔蒙诱导,包括皮质醇、雌激素和催乳素。喹啉酸磷酸核糖转移酶催化喹啉酸从色氨酸转化为烟酸单核苷酸,随后转化为NAD+。
▸ 挽救途径
大多数组织通过挽救途径利用烟酰胺(NAM)合成NAD+。NAM 首先在关键限速酶烟酰胺磷酸核糖转移酶(NAMPT)的催化下转化为烟酰胺单核苷酸(NMN),然后NMN通过烟酰胺单核苷酸腺苷酸转移酶(NMNAT)转化为NAD+。
NAMPT存在于细胞内和细胞外亚型中,分别称为 iNAMPT和eNAMPT 。NMNAT有三种亚型:NMNAT1位于细胞核中,NMNAT2 位于高尔基体和神经元轴突中,NMNAT3位于线粒体中。
▸ 烟酰胺核糖(NR)途径
NAD+也可以通过烟酰胺核糖(NR)激酶途径从NR产生,以NMN为中间体。在细胞中,NR也可以通过嘌呤核苷磷酸化酶转化为烟酰胺,然后可以通过挽救途径转化为NAD+。
▸ Preiss-Handler途径
此外,烟酸(NA)(也称维生素B3)可通过Preiss-Handler途径生成NAD+,其中烟酸单核苷酸是关键中间体。相比之下,合成等量NAD+所需的色氨酸远多于NA,说明色氨酸合成NAD+效率较低。
▸ NAD+的代谢
▸ NAD+代谢可生成Ca2+动员信号分子
NAD+是多种代谢途径和细胞过程的关键代谢物和辅酶。CD38和CD157(BST1)是裂解NAD+生成NAM和腺苷二磷酸糖(ADPR)的糖水解酶,CD38还能将环状ADPR(cADPR)水解成ADPR。此外,这两种酶也作为ADP-核糖基环化酶,催化NAD+水解生成NAM和cADPR,而cADPR是许多细胞中活跃的Ca2+动员信号分子。
两种反应都会产生NAM,NAM可通过补救途径快速再生为NAD+。CD38广泛表达,CD157则主要分布于淋巴组织和肠道。这些酶与能量代谢、细胞粘附和免疫反应密切相关,并与帕金森病、卵巢癌和白血病等疾病有关。
▸ CD38是哺乳动物中NAD+的主要消耗酶
研究显示,缺乏CD38或用CD38抑制剂芹菜素处理的小鼠体内NAD+水平提高约50%,而衰老过程中多种组织的CD38蛋白水平升高,NAD+则下降。
32月龄野生型小鼠的NAD+仅为年轻小鼠的一半,而CD38敲除小鼠能维持NAD+水平,并抵抗高脂饮食引发的肝脂肪变性和葡萄糖耐受不良。相反,CD38过表达小鼠NAD+水平降低,线粒体功能受损,耗氧量下降,乳酸产生增加。
三大类NAD+消耗酶
doi: 10.1038/s41580-020-00313-x.
▸ NAD+在糖酵解和线粒体中发挥重要作用
在糖酵解中,NAD+被利用生成NADH,后者通过苹果酸/天冬氨酸和甘油醛3-磷酸穿梭转移到线粒体。线粒体内,苹果酸/天冬氨酸穿梭带来的NADH在电子传递链复合物I被氧化,甘油醛3-磷酸穿梭产生的FADH2则在复合物II被氧化。
线粒体中的NAD+被SIRT3-SIRT5消耗生成NAM。目前尚不明确NAM能否转化为NMN或在线粒体内再生为NAD+,或其他前体是否可跨膜促进NAD+合成。核内NAD+池可能通过核孔与胞质池平衡。
NAD+的生物合成及代谢
doi: 10.1038/s41580-020-00313-x.
a.烟酰胺腺嘌呤二核苷酸(NAD+)生物合成途径;b.不同亚细胞区室中的NAD+代谢。
▸ NAD+减少与神经元损伤相关
SARM1是一种新发现的NAD+切割酶,主要存在于神经元等细胞,是首个依赖TIR结构域活性的NAD+消耗酶。TIR结构域此前仅被认为是蛋白互作结构域,如今被证实具有酶活性。神经元损伤时,SARM1通过TIR结构域将胞质NAD+分解为ADPR、cADPR和NAM,启动细胞破坏,耗尽NAD+并引发轴突变性。
过表达NAMPT或NMNAT、补充NR可阻断这一过程。敲除SARM1能挽救NMNAT2缺陷小鼠的神经元异常和胚胎致死,说明SARM1在胚胎发育期也消耗NAD+。因此,SARM1是治疗急性神经损伤及神经退行性疾病的潜在靶点。
▸ 生活中常用的NAD+补充剂
NAD+水平会随着年龄的增长而逐步降低,或者在代谢失调和某些疾病的影响下出现明显下降。NAD+作为细胞内重要的辅酶,其含量减少会影响多项生理功能,甚至加速衰老进程。
这时就需要通过外部干预手段进行补充,当前,最常用和有效的方法是直接补充NAD+的前体物质。
▸ 常见NAD⁺前体有:
•烟酰胺单核苷酸(NMN):作为NAD⁺的直接前体,服用后可迅速在组织中提升NAD⁺水平(多项动物和人体初步实验得到支持)。
烟酰胺核糖(NR):作为新兴的NAD⁺前体,其生物利用度高,能显著提升多种组织中的NAD⁺浓度。
烟酸(NA):可通过饮食或口服补剂补充,也参与NAD⁺的合成,适合因烟酸缺乏导致的NAD⁺不足。
烟酰胺(NAM):是烟酸的酰胺化合物,通过补充可有效提高NAD⁺水平。
口服NAD+前体提高NAD+水平
Niño-Narvión J,et al.Nutrients.2023
然而,补充NAD+前体虽然是一种常见且有效的提升NAD+水平的方法,但在实际应用过程中依然面临许多问题。例如,不同的给药方式会对前体的吸收效率产生显著影响。此外,消化系统的状态以及肠道微生物群的组成,也会影响这些前体在体内的转运与利用。
因此,在考虑NAD+补充时,需要同时关注服用方法和个体肠道环境的差异。关于这些因素具体如何影响NAD+前体的吸收和代谢,我们将在下一章中进行更为详细的阐述与讨论。
人们通常通过口服给药补充NAD+前体,上文已经提到,烟酰胺单核苷酸(NMN)和烟酰胺核糖(NR)是最常用的补充剂。但需要注意的是,口服后,只有少量NMN和NR能直接被小肠吸收!
▸ 补充NAD+前体后的吸收过程
为了揭示口服NMN和NR的代谢途径,研究人员在单次口服NMN和NR后进行了时间过程NAD代谢组分析。
▸ 一部分NMN和NR可被小肠吸收,但数量有限
NMN管饲法在15分钟时显著增加小肠中的NMN水平。此外,口服NR灌胃NMN的升高远低于口服 NMN 的NMN增加(约 25 倍)。这些结果表明,在口服过程中,一定量的NMN被小肠直接吸收。此外,与 NR 给药相比,NMN 给药对 NR 水平的增加略有延迟。
口服灌胃NMN后小肠NR水平升高表明NMN迅速去磷酸化成为NR。还测量了脱酰胺的NAD代谢组,包括烟酸腺嘌呤二核苷酸(NAAD)和NAMN。我们发现 NAAD 和 NAMN 在较小的时间点 (180和360分钟)显著增加。小肠中的NAD水平分别在施用NMN和NR后15至30分钟达到峰值。这些结果表明,小肠中NAD的合成主要来自通过补救途径直接吸收的NMN和NR。
▸ 口服NMN和NR无法直接提升骨骼肌NAD水平
口服NAD前体经肝脏后分布到外周器官,其中骨骼肌是重要靶点,但其NAD合成主要依赖挽救途径。研究发现,NR和NMN给药后骨骼肌NAD提升有限,远低于肝脏,且大部分口服NR和NMN在到达肝脏前已转化为NAM和NA。
进一步的代谢组分析显示,NR和NMN给药后骨骼肌中NAD水平仅小幅上升,前体NMN和NR在60分钟内恢复基线,而NAM及相关脱酰胺代谢物则缓慢积累。骨骼肌中脱酰胺前体(如NAAD、NAMN和NA)水平较低,表明并非主要NAD来源。
(A)用 NMN 和 NR 管饲的小鼠肌肉 NAD+ 代谢组的时间过程分析;(B)口服 [m + 6] NR 后 3 小时的小鼠肌肉 NAD+ 代谢组;(C) 口服 [m + 8] NMN 后 3 小时小鼠的肌肉 NAD+ 代谢组。
▸ 肠道微生物群参与NAD+的合成代谢
补充NAD+前体物质时,这些物质首先需要经过肠道,而肠道中分布着种类繁多、数量庞大的微生物群。当烟酰胺单核苷酸(NMN)和烟酰胺核糖(NR)等NAD+前体进入体内,经过肠道时,必然会与这些丰富的微生物群发生接触与相互作用。在这一过程中,肠道微生物对NMN和NR等前体的吸收、分解及转化产生潜在影响。
▸ 肠道微生物群能积极转化和利用NAD+前体
大量研究表明,肠道微生物群不仅仅是被动的环境成分,而是在NAD+(烟酰胺腺嘌呤二核苷酸)的合成及代谢过程中发挥着积极的调控作用。正因为如此,对于NAD+前体物质的补充效果及其生物利用率,肠道微生物群的作用不可忽视。
注:微生物与哺乳动物在NAD+代谢上存在显著差异。例如,流感嗜血杆菌缺乏新生途径基因,而Cytophaga hutchinsonii则具备由色氨酸驱动的从头合成基因;部分真菌如光滑念珠菌也可能缺乏该途径。大肠杆菌和酿酒酵母则含有烟酰胺酶,可将NAM转化为NA参与Preiss-Handler途径。同时,一些细菌还能通过L-天冬氨酸合成NAD+。
肠道微生物群拥有独特的NAD代谢途径,有助于提升宿主补充NAD前体后的代谢能力。与肝脏不同,肠道菌群通过NaMNAT和NADS等关键酶,利用特定从头合成途径将NAD前体转化为NAD。梭杆菌属、厚壁菌门和变形杆菌均可通过此途径合成NAD,其中部分厚壁菌门还具备替代合成路径,能将喹啉酸转化为NaMN,并进一步生成NAD。
哺乳动物细胞和肠道微生物中的NAD+代谢途径
doi: 10.1016/j.aninu.2022.06.009.
此外,微生物对NAM、NA和NR等NAD前体的利用在NAD合成中也十分重要。只有放线菌门、厚壁菌门和变形杆菌能摄取NAM和NA,而NR的利用则限于厚壁菌门和变形菌门。
▸ 肠道微生物群合成了肝脏的大部分NAD+
研究表明,肠道微生物群广泛参与宿主NAD+代谢。大多数细菌具有将NAM转化为NA的NAM脱酰胺酶,而哺乳动物并无同源酶。肠道菌群将NAM转化为NA,对于口服NAD+前体转化为NAD+至关重要。
例如大肠杆菌和酿酒酵母中存在同源烟酰胺酶。烟酰胺脱酰胺酶(PncA)能将NAM转化为NA,从而激活Preiss-Handler通路。不同微生物和真核生物的NAM再生途径存在差异。
肠道微生物群利用PncA合成的NAD脱酰胺代谢物为肝脏NAD供应提供了主要来源。研究发现,肠道菌群与宿主的NA合成途径可以绕过肠道挽救途径,显示宿主与肠道菌群在NAD前体共享中的双向互动。
NAD的代谢及与肠道菌群和宿主的相互作用
Lu X,et al.iScience. 2024
肠道微生物还能提升宿主对NAMPT抑制剂的抵抗力,脱酰胺NAD前体可逆转NAMPT抑制导致的NAD和能量下降,突出Preiss-Handler途径在肝脏NAD合成中的重要性。此外,大肠杆菌中pncA基因的过表达会影响肝脏NAD代谢,优化后在哺乳动物体内表达可使NAD水平显著提升,甚至比正常饮食高约5倍。而常用的NAD前体NR和NMN由于肝细胞吸收有限,仅能使肝脏NAD水平增加1.5到2倍。
▸肠道菌群紊乱或多样性降低时,补充NAD前体效果有限
肠道菌群紊乱或多样性降低时,单独通过NR补充并不能显著提升肝脏NAD水平,这反映了肠道菌群在NR吸收和肝脏NAD提升中的重要作用。尤其是高烟酰胺脱酰胺酶(PncA)基因表达的肠道菌群能显著增加肝脏NAD水平。
▸ 连接NAD+和肠道微生物群的机制
• 代谢相互依赖
肠道微生物群通过利用宿主来源的烟酰胺合成NAD+,在这个过程中还会生成烟酸,烟酸随后又被宿主吸收并用于自身NAD+的生物合成。这样一来,宿主提供烟酰胺,微生物将其代谢为NAD+和烟酸,烟酸又返回到宿主体内被再次利用,形成了一个在宿主和微生物之间循环的NAD+前体交换系统。
这种循环不仅促进了双方的代谢活动,还体现了宿主与微生物之间密切的共生关系,是NAD+前体在二者间持续流动与利用的重要机制。
• 微生物酶
细菌酶如烟酰胺酶(PncA)能够将烟酰胺转化为烟酸,这一过程在微生物中起着关键作用。通过这一转化,微生物为宿主提供了烟酸,使宿主能够通过另一种替代的NAD+合成途径来补充NAD+。这种微生物介导的烟酰胺向烟酸的变化,为宿主拓宽了NAD+的代谢来源,还对宿主整体的代谢健康产生影响。
• 肠道微生物群的代谢物是NAD+的调节因子
研究发现,肠道微生物产生的二氢蝶酸、苯丙酮酸、吲哚-3-丙酸、苯乳酸、全反式维甲酸,以及多种脱氧、甲基和环核苷酸,是调节NAD+代谢的重要因子。进一步分析发现,共生埃希菌属、拟杆菌属、双歧杆菌属和乳酸杆菌属与NAD+产生等抗衰老代谢物相关。
• 微生物直接分泌
某些肠道细菌在宿主NAD+代谢中发挥着重要作用。例如,青春双歧杆菌能够产生代谢产物烟酸,这种烟酸在进入宿主机体后有助于恢复和提升肌肉中的NAD+水平。此外,还有一种名为ASTB Qing110的肠道细菌,可以直接分泌NAD+这一关键分子,为宿主补充NAD+。
NAD+与肠道菌群之间存在着密切的双向作用关系。一方面,肠道微生物群可以通过多种机制调节体内NAD+的生物利用度,对NAD+的代谢和供应起着调控作用。当肠道微生物群的结构或功能发生变化时,这种变化会进一步影响NAD+的生成与利用,可能导致体内NAD+的合成和使用减少,进而影响机体的代谢平衡。
另一方面,NAD+本身的含量和状态同样会反馈性地影响肠道微生物群的多样性和组成,甚至对整个肠道的健康状况产生一定的作用。这种相互影响表明,维持NAD+和肠道菌群之间的平衡对于机体健康和肠道环境的稳定具有重要意义。
NAD+主要通过以下方式影响肠道微生物:
▸ NAD+影响肠道微生物的代谢活动
▸ NAD+影响微生物的能量生成
NAD+作为微生物代谢所必需的酶辅因子、底物或氧化还原因子,可以直接影响肠道微生物的代谢,是微生物能量代谢的重要组成部分。NAD+作为如磷酸甘油醛脱氢酶、丙酮酸脱氢酶、3-羟酰基辅酶A脱氢酶、苹果酸脱氢酶、α-酮戊二酸脱氢酶和乳酸脱氢酶等能量代谢关键酶的辅因子,是细胞ATP产生的重要保障,因此提高NAD+有助于增强微生物能量生成。
▸ 影响长双歧杆菌等肠道微生物的繁殖
此外,以NAD+为底物的酶分子对于微生物的生存和繁殖至关重要。一些细菌具有NAD+依赖性DNA连接酶,它们在 DNA 复制、修复和重组中起关键作用。
在肠道中,长双歧杆菌和嗜酸乳杆菌可以通过使用 SIRT2(一种NAD+依赖性酶)催化蛋白质/组蛋白脱乙酰化,从而响应氧化应激。据报道,SIRT2 是酵母寿命的关键组成部分。此外,酿酒酵母中的多个硫胺素基因通过NAD+依赖性组蛋白脱乙酰酶Hst1和SIRT2受细胞内NAD+浓度的调节。
▸ NAD+影响肠道微生物群的组成
在高脂饮食诱导的大鼠中补充烟酰胺核糖(NAD前体)不仅改善了多项结果,还重塑了盲肠和结肠的微生物群结构。NR处理组在第4、8和12周均表现出α多样性提升,并通过促进丹毒菌科和瘤胃球菌科的持续增殖调节粪便菌群,同时Prevotellaceae在下消化道中的相对丰度也显著上升。
此外,NAD依赖性组蛋白脱乙酰酶SIRT1是调控肠道微生物群、上皮生物学和炎症的核心酶。肠道特异性SIRT1缺失小鼠表现出潘氏细胞和杯状细胞数量增加,并伴有肠道菌群重塑,这可能是NAD与肠道微生物群关联的关键环节。
▸ NAD+影响对病原菌的抵抗力
此外,提升NAD+水平可通过调节宿主免疫和代谢间接影响肠道菌群。
NAD+可以激活 SIRT1,SIRT1 介导对结核分枝杆菌感染的抵抗力。研究表明CD38缺陷小鼠更容易受到细菌感染。此外,补充NAM(NAD+的前体),已被证明可以增加宿主对金黄色葡萄球菌的抵抗,从而限制金黄色葡萄球菌的感染。因此,推测增强NAD+可以防止病原菌在肠道中的定植。
▸ 抑制有害菌增长
β-NAD是结肠的重要抑制性神经递质,能调节结肠运动,对肠道微生物发酵具有关键作用。此外,NAD+通过影响宿主胆汁酸的合成间接调节肠道微生物群。内质网合成胆固醇需NADH和NADPH作为电子供体,肝脏将胆固醇转化为胆汁酸,有助于脂肪和脂溶性营养素的吸收和代谢。
此外,分泌到肠道中的胆汁酸在破坏细菌细胞膜时也可以具有抗菌作用,从而抑制病原菌的增殖。相反,胆汁流动受阻会导致有害细菌在肠道中增殖。
▸ NAD+缺陷状态下的肠道炎症和菌群失调
NAD+缺乏状态可能导致包括肠道炎症和胃肠道功能受损(即IBD)的体征,并且出现有益共生菌与机会性病原体之间的不平衡。
▸ NAD缺乏对肠道屏障和炎症的影响
损害肠道屏障功能
NAD+在维持肠上皮细胞(IEC)能量代谢和屏障完整性中至关重要。NAD+缺乏导致上皮能量供应不足,使肠上皮通透性增加,易造成细菌和毒素穿透肠壁,引发局部和系统性炎症。
促发和加重肠道炎症
NAD+水平低下时,促炎信号(如NF-κB、IL-6、TNF-α等)激活,抗炎反应受阻,促使炎症细胞大量浸润肠道组织,加剧肠黏膜损伤和慢性炎症(如炎症性肠病)。
影响SIRT1等NAD+依赖酶活性
NAD+是SIRT1等一系列去乙酰化酶和PARP等修复酶的必需因子。NAD+缺乏导致这些关键酶活力下降,进一步削弱DNA修复、抗氧化和抗炎机制,使肠道对损伤和感染的易感性升高。
NAD+对宿主及肠道菌群的调节作用
doi: 10.1016/j.aninu.2022.06.009.
▸ NAD缺乏与肠道菌群失调
微生物群多样性下降
NAD+水平降低时,肠道内群落多样性和益生菌丰度减少,病原菌和条件致病菌增多。例如,乳酸杆菌等有益菌减少,肠杆菌科等致病菌升高,加剧肠道稳态失衡。
代谢产物的变化
肠道短链脂肪酸(SCFAs)、多酚代谢等微生物代谢产物减少,次级胆汁酸、氨等增加,削弱肠道抗炎能力,促进炎症环境。
加剧菌群紊乱-炎症正反馈
NAD+缺乏促进炎症,炎症又会进一步恶化菌群结构(如促进益生菌流失、促炎菌扩增),形成炎症-菌群失调的恶性循环,加重疾病进展。
▸ 实验与临床证据
动物实验
文献总结多项小鼠和大鼠模型的实验证据——饮食缺乏NAD+前体组出现更明显的肠道炎症、肠屏障破坏及致病菌增殖,补充NAD+前体可逆转上述现象。
人群研究
临床观察发现,炎症性肠病、慢性结肠炎等患者NAD+水平通常较低,且菌群多样性、功能均受损。
▸ 通过补充NAD+改善肠道健康
NAD+缺乏可能由营养不足、代谢异常、年龄相关疾病和免疫调节失衡引起,并与包括肠道在内的多系统不良结局有关。补充NAD+前体可提升组织NAD+水平,改善其缺乏引发的病理生理问题。
▸ 补充NAD+有助于缓解肠道炎症
鉴于NAD+增加方法在不同系统中具有良好的免疫调节和抗炎特性,通过增加NAD+前体的摄入量来提高NAD+的可用性可以被视为对抗肠道疾病的治疗策略。大多数研究表明,增加NAD+的疗法对肠道炎症有有益影响。
补充NAD+前体可直接或间接抑制肠道炎症的发展。其直接作用包括利用NA激活GPR109a或通过SIRT1抑制NFκB,均已被验证。同时,部分NAD+前体还能通过调节肠道菌群,间接发挥抗炎保护作用。
摄入的NAD+前体被细菌利用以合成NAD+,这是许多菌种(尤其是厚壁菌门和放线菌门)生长和代谢的关键。此外,NAD+前体可调节肠道菌群,影响次级胆汁酸和短链脂肪酸(SCFA)的合成,对宿主健康有积极作用。因此,提升NAD+水平有助于促进有益菌生长,并通过多种机制抵抗有害菌。
小结
不同NAD+前体可调节肠道生理并具有治疗肠道炎症的潜力。NAD+能够通过多种机制改善肠道炎症,增加NAD+成为潜在的治疗策略。数据显示,NAD+前体有助于通过调节肠道菌群部分恢复肠道功能。肠道菌群可将宿主的NAM转化为NA以合成NAD+,口服NR和NMN同样可经菌群转化为NA支持NAD+生成。然而,不同NAD+提升方法在各种免疫和代谢状态下的效果仍需进一步研究。
NAD+在能量代谢、细胞和免疫功能、抗炎抗衰老以及心血管和神经健康等方面都具有重要作用。但其水平会随着年龄的增长而逐渐下降,范围从10%到 65%,具体取决于不同的器官;或者在代谢失调和某些疾病的影响下出现明显下降。
因此,通过合理的方法使NAD+水平保持合理的范围,或是在其浓度过低时有效补充至关重要。上文中我们讲到NAD前体是最常用和有效补充NAD+的方法。除此之外,还有许多其他的方法,让我们一起来了解下。
▸ 调节NAD+生物合成
提升NAD+水平的另一途径是直接激活NAD+生物合成酶,尤其是调控从头合成和补救途径限速步骤的酶。
▸ 增强NAMPT和NMNATs活性促进NAD+合成
NAMPT激活剂和NMNATs被认为可有效促进NAD+的合成。神经保护剂P7C3能增强NAMPT活性并提高NAD+水平,显示出对衰老和神经退行性疾病的治疗潜力。
小分子SBI-797812被提出为高效的NAMPT激活剂,能提升体外和细胞中的NAD+水平,虽然在体内对肝脏的提升效果有限,仍具药理学发展前景。
此外,TES-991和TES-102524通过抑制ACMSD促进NAD+从头合成和SIRT1活性,从而提升肝脏、肾脏和大脑的线粒体功能。还有报道显示,绿茶成分EGCG可分别显著激活NMNAT2和NMNAT3,但相关数据尚需进一步验证。
▸ 调节NAD+/NADH平衡
除了调节NAD+含量外,还可通过外源性醌如β-lapachone调节NAD+/NADH平衡。作为NQO1的共底物,β-lapachone促进NADH转化为NAD+,有助于改善衰老小鼠的线粒体功能及运动、认知能力。注:然而,因NQO1在多种实体瘤中过度表达,β-lapachone可能引发氧化应激失衡,用药需谨慎。
▸ 抑制NAD+消耗
提升NAD+水平还可通过抑制其降解途径,如PARP或NADases(糖水解酶)。
▸ 槲皮素和芹菜素等类黄酮物质可抑制NAD降解
哺乳动物的主要NADase——CD38,可被低微摩尔浓度的类黄酮(如芹菜素、木犀草素、槲皮素等)抑制,这些分子在体内同样靶向CD38。芹菜素可提高多组织NAD+水平,降低蛋白质乙酰化,改善肥胖小鼠的葡萄糖和脂质稳态,作用机制可能与上调SIRT1、SIRT3有关。木犀草胺则有助于防止NAD+丢失,保护缺血后心脏功能。
SARM1是另一种NADase,参与神经损伤后NAD+的快速分解。XAV939是推定的SARM1抑制剂,同时也抑制PARP5a和PARP5b,不仅药代动力学良好,已进入神经疾病和轴突损伤的临床开发阶段。其在体内具体作用靶点仍待进一步明确。
总体而言,越来越多的证据表明,靶向相关的 NAD+消耗酶(如PARP)具有作为NAD+增强靶点的巨大潜力,以延长人类健康寿命。
除了补充NAD+前体;调节NAD+生物合成,以及抑制NAD+降解,NAD+水平可以通过生活方式和营养方法进行调节。
补充NAD+水平及其生理效应
Rajman L,et al.Cell Metab.2018
▸ 饮食会影响NAD+水平
均衡摄入宏量和微量营养素是健康的基础。热量限制(CR)被认为是有效、并有证据支持的延寿方式,在多种生物中,减少25-60%热量摄入可显著延长寿命。
▸ 热量限制有助于提高NAD+水平
热量限制与NAD+水平有何关系?研究发现,热量限制(CR)通过激活NAMPT,增强NAD+挽救途径,提高NAD+、降低NADH水平,从而激活sirtuins。NADH是Sir2等NAD+消耗酶的抑制剂,因此提升NAD+/NADH比值,尤其是降低NADH,对于提升NAD+水平至关重要。
▸ 饮食的时间种类也会影响NAD+的生物利用度
NAD+/sirtuin通路受饮食习惯等营养因素影响。我们在什么时间、吃什么食物和吃多少通过改变线粒体中的电子传递来影响细胞内的NAD+生物利用度。
高脂肪/高糖饮食会导致能量过剩,降低NAD+/NADH比率及NAD+水平,并因AMP/ATP比率下降、血糖和胰岛素升高,增加ROS生成和餐后氧化应激。高脂肪饮食和肥胖都会导致组织NAD+水平下降,肥胖人群的sirtuin和NAMPT表达降低,PARP活性上升;减重后这些指标均有所改善。而补充带有NAD+前体的物质可激活sirtuin和氧化代谢,改善高脂饮食诱导的肥胖和代谢紊乱。
烟酸等存在于多种动植物中,NMN和NR也见于黄瓜、卷心菜、生牛肉等。西兰花(每0.25克含1.88-100毫克NMN)、鳄梨和番茄(每100克含0.26-1.60毫克),生牛肉和虾、乳制品中NMN含量则较低。
▸ 运动有助于提高NAD+水平
运动如何影响NAD+水平?
▸ 运动可以促进NAD+挽救途径
研究发现有氧运动训练或任何类型的运动/体育活动都会增加NAD+的量,因为运动通过诱导骨骼肌中NAMPT的表达,促进NAD+挽救途径,从而提升NAD+水平,逆转NAD+随年龄下降的趋势。这一过程主要通过AMPK通路实现,有氧与阻力训练均能增加年轻人和老年人的NAMPT水平。在老年大鼠中,运动还提高了NAD+和SIRT1活性,加速L-色氨酸从头合成NAD+。
▸ 运动提高NAD+可利用水平
NAD+在细胞能量产生、线粒体生物发生和氧化还原反应中至关重要。运动增强ATP消耗,提高NAD+/NADH比值,激活去乙酰化酶、PARP和CD38等NAD+消耗酶,从而带来多方面健康益处。
高强度体育活动会增加对NADH的需求,促进NAD+再生,进一步提升NAD+/NADH比值。运动过程中能量需求增加激活AMPK,调节NAD+生物利用度。运动和热量限制均通过AMPK诱导NAMPT表达,提高sirtuins和PARP可利用的NAD+水平。
▸ 睡眠影响NAD+水平
睡眠障碍会增加肥胖、抑郁、糖尿病和多种代谢疾病的风险,这些病症与较高的死亡率和发病率密切相关。相反,规律的睡眠和清醒模式有助于健康和长寿。
▸ NAD+水平与昼夜节律之间存在双向作用
NAD+水平和sirtuin活性参与调节健康的睡眠和昼夜节律,且NAD+本身也受昼夜节律控制并参与其调节。NAD+水平呈24小时节律波动,受进食和睡眠时间影响。昼夜节律由下丘脑视交叉上核的生物钟协调,通过CLOCK和BMAL1激活因子及CRY与PER抑制因子的负反馈调节。CLOCK:BMAL1异二聚体调节NAMPT的昼夜表达,NAMPT影响NAD+合成,其活性受光照限制、黑暗增强。
注:CLOCK是一种组蛋白乙酰转移酶,其活性被NAD+依赖的去乙酰酶SIRT1拮抗。
随着年龄增长,NAMPT活性下降,NAD+利用度减少,导致昼夜节律变差。昼夜节律紊乱常见于多种疾病如心血管疾病、糖尿病、癌症及加速衰老。维持昼夜节律的正常同步有助于改善健康。
!
NAD+是否存在不利影响?
关于补充NAD+的效果与安全性,现有研究揭示了其复杂甚至矛盾的一面。
首先,补充NAD+前体对运动表现的影响因年龄而异,它虽能改善老年人的身体机能,却可能损害年轻个体的运动能力。同时,过量补充存在风险,不仅可能导致不良反应,高剂量的烟酰胺(NAM)和烟酰胺核苷(NR)还分别与肝毒性及代谢功能障碍有关。
此外,NAD+在疾病中的角色也具有两面性。在癌症中,它既能在早期发挥保护作用,也可能在后期助长肿瘤的生长和耐药性。同样,在败血症和某些炎症性疾病中,NAD+的作用也随疾病阶段而变,甚至可能加剧炎症反应。
综上所述,盲目补充NAD+并非总是有益,其应用需更加谨慎和精准。
NAD+作为细胞内重要的辅酶分子,在延缓衰老、人体的能量代谢、DNA修复等生理过程中发挥着至关重要的作用。但随着年龄增长,NAD+水平的下降被认为是衰老和多种慢性疾病发生的重要因素,这促使人们寻求通过补充NMN、NR等前体物质来提升NAD+水平。
但最近权威研究表明,口服的NMN和NR大部分不能直接转化为NAD+,而是需要经过肠道菌群的”预处理”,转化为烟酸类代谢物,再通过肠肝循环最终在肝脏中合成NAD+。这一发现颠覆了传统认知,表明肠道微生物群是影响NAD+补充效果的关键因素。
肠道微生物群与NAD+的相互作用表现在多个方面:肠道微生物拥有独特的NAD代谢途径,能够通过烟酰胺脱酰胺酶将NAM转化为NA,为宿主提供NAD+合成的原料;同时,肠道菌群的多样性和健康状况直接影响NAD+前体的转化效率。当肠道菌群紊乱或多样性降低时,单纯补充NAD+前体的效果将大大降低。
未来通过肠道微生物群有助于更好地补充NAD+,一个健康的肠道菌群,是确保补充效果的基石。这要求我们转变策略,不再单纯关注前体物质的含量,而是采用综合方法:将NAD+补充与肠道菌群维护相结合,同时搭配科学的生活方式和精准的营养补充,实现真正有效的健康老龄化。
主要参考文献
Yaku K, Palikhe S, Iqbal T, Hayat F, Watanabe Y, Fujisaka S, Izumi H, Yoshida T, Karim M, Uchida H, Nawaz A, Tobe K, Mori H, Migaud ME, Nakagawa T. Nicotinamide riboside and nicotinamide mononucleotide facilitate NAD+ synthesis via enterohepatic circulation. Sci Adv. 2025 Mar 21;11(12):eadr1538.
Rajman L, Chwalek K, Sinclair DA. Therapeutic Potential of NAD-Boosting Molecules: The In Vivo Evidence. Cell Metab. 2018 Mar 6;27(3):529-547.
Ren Z, Xu Y, Li T, Sun W, Tang Z, Wang Y, Zhou K, Li J, Ding Q, Liang K, Wu L, Yin Y, Sun Z. NAD+ and its possible role in gut microbiota: Insights on the mechanisms by which gut microbes influence host metabolism. Anim Nutr. 2022 Jun 22;10:360-371.
Lu X, Yang R, Chen Y, Chen D. NAD metabolic therapy in metabolic dysfunction-associated steatotic liver disease: Possible roles of gut microbiota. iScience. 2024 Feb 9;27(3):109174.
Covarrubias AJ, Perrone R, Grozio A, Verdin E. NAD+ metabolism and its roles in cellular processes during ageing. Nat Rev Mol Cell Biol. 2021 Feb;22(2):119-141.
Poljsak B, Kovač V, Milisav I. Healthy Lifestyle Recommendations: Do the Beneficial Effects Originate from NAD+ Amount at the Cellular Level? Oxid Med Cell Longev. 2020 Dec 12;2020:8819627.
Kane AE, Sinclair DA. Sirtuins and NAD+ in the Development and Treatment of Metabolic and Cardiovascular Diseases. Circ Res. 2018 Sep 14;123(7):868-885.
Bhasin S, Seals D, Migaud M, Musi N, Baur JA. Nicotinamide Adenine Dinucleotide in Aging Biology: Potential Applications and Many Unknowns. Endocr Rev. 2023 Nov 9;44(6):1047-1073.
Niño-Narvión J, Rojo-López MI, Martinez-Santos P, Rossell J, Ruiz-Alcaraz AJ, Alonso N, Ramos-Molina B, Mauricio D, Julve J. NAD+ Precursors and Intestinal Inflammation: Therapeutic Insights Involving Gut Microbiota. Nutrients. 2023 Jun 30;15(13):2992.
Navarro MN, Gómez de Las Heras MM, Mittelbrunn M. Nicotinamide adenine dinucleotide metabolism in the immune response, autoimmunity and inflammageing. Br J Pharmacol. 2022 May;179(9):1839-1856.
Devereaux J, Robinson AM, Stavely R, Davidson M, Dargahi N, Ephraim R, Kiatos D, Apostolopoulos V, Nurgali K. Alterations in tryptophan metabolism and de novo NAD+ biosynthesis within the microbiota-gut-brain axis in chronic intestinal inflammation. Front Med (Lausanne). 2024 Jul 2;11:1379335.
Chu X, Hou Y, Meng Q, Croteau DL, Wei Y, De S, Becker KG, Bohr VA. Nicotinamide adenine dinucleotide supplementation drives gut microbiota variation in Alzheimer’s mouse model. Front Aging Neurosci. 2022 Sep 15;14:993615.
Braidy N, Liu Y. NAD+ therapy in age-related degenerative disorders: A benefit/risk analysis. Exp Gerontol. 2020 Apr;132:110831.

谷禾健康

卵巢的衰老发生在其他器官系统的衰老之前,可以看作是多个器官衰老过程的“起搏器”。随着预期寿命的延长,预防卵巢衰老已成为促进女性延长生殖功能、改善与卵巢衰老相关的骨骼和泌尿生殖系统状况的重要目标。
卵巢衰老是指卵巢功能随着年龄的增长而逐渐衰退。其特点是卵母细胞数量和质量逐渐恶化,并伴有月经周期不规律、不孕,最后导致月经停止。
卵巢的寿命与其他器官不同。最近,多组学分析发现,女性在三十岁和五十岁左右的生物衰老显著加速,这与生育能力下降和更年期状态的时间点相一致。
随着全球预期寿命的延长,卵巢衰老将逐渐成为女性的主要健康问题。卵巢衰老是一个极其复杂的过程,包括,性激素的水平,促卵泡激素(FSH)、黄体生成素(LH)和抗缪勒管激素(AMH)等。此外,近年来越来越多的证据表明肠道微生物群与卵巢功能之间存在联系,肠道微生物群-卵巢轴有助于卵泡发育。肠道微生物群的组成和功能特征的改变对卵巢功能具有深远的影响。肠道微生物群和卵巢之间的相互作用是双向的。
本文带大家综合了解卵巢-微生物群串扰的不同方面,并提供有意义的结论。另外还尝试解释微生物群在一些抗衰老方法中的潜在作用。
在人类衰老以及与年龄相关的疾病中,优势微生物的特性、细菌多样性和功能特征发生了显著变化。最近的一项研究表明,体内存在多个“时钟”:器官/系统以不同的速度老化,并且特定器官或系统的老化速度与肠道微生物组的老化速度相关。因此,个体可能会表现出不同的健康或疾病状态。
肠道微生物特征可用于预测老年人的健康衰老或死亡率。有趣的是,小鼠实验表明,老年供体微生物群的移植会加速受体中与年龄相关的大脑退化的特定过程,相反,年轻供体微生物群的移植可以逆转这种情况。有人建议,肠道微生物群可以作为新的抗衰老干预措施的潜在治疗靶点。
更年期是卵巢自然衰老的标志事件。自然更年期多发生在49岁至52岁之间。随着卵巢卵泡的有限储备耗尽,剩余卵泡失去对促性腺激素的敏感性,卵泡停止发育和分泌卵巢激素雌激素和黄体酮。
雌二醇(E2)水平仅在围绝经期过渡过程相对较晚的情况下下降。然而,在最后一个月经周期期间,血浆E2水平急剧下降,绝经后卵巢停止合成E2。
√ 肠道微生物是循环雌激素的重要调节因子
肠道微生物 β-葡萄糖醛酸酶(gmGUS)可以将雌激素从失活形式转化为活性形式,并进一步影响宿主体内的雌激素水平。
肠道微生物群失调和微生物多样性降低会导致gmGUS减少和全身雌激素改变。反过来,肠道细菌也受到雌激素的影响。据报道,据报道,两个细菌类群的相对丰度,即γ-变形菌纲(Gammaproteobacteria)和Mixococcales目中的一个未知科,与雌二醇水平呈正相关,而普雷沃氏菌科(Prevotellaceae)的丰度与雌二醇水平呈负相关。
√ 雌激素也能发挥微生物调节作用
此外,雌激素或雌激素样化合物在患有代谢综合征的小鼠中发挥微生物组调节作用并维持肠道上皮屏障完整性。在绝经后妇女中,补充大豆异黄酮等类雌激素食物可增加双歧杆菌属(Bifidobacterium)和真杆菌属(Eubacterium )的丰度,同时抑制乳杆菌属 (Lactobacillus)和未分类的梭菌科细菌。
在某些病理条件下,肠道微生物群失调和gmGUS 活性升高可能通过参与内源性和外源性雌激素样化合物的循环或激活,导致雌激素驱动的疾病和更年期相关疾病的发生。
√ 更年期的变化影响女性肠道菌群及其代谢
众所周知,更年期状态会影响肠道微生物群。不同绝经状态的女性肠道微生物群的组成和功能特征的差异已经有报道,如下所述。
观察到绝经前(n=44)和绝经后(n=45)女性之间总共有90个差异丰富的分类群 ,与绝经后女性相比,绝经前女性与叶酸途径相关的嘧啶和碳库更加丰富。
罗氏菌属(Roseburia)被确定为区分绝经前群体(n=17)和绝经后群体(n=20)的显著的细菌分类群,并且观察到绝经前妇女的丙酸和丁酸代谢较高。
还有研究发现绝经后女性(n=24)的微生物组α多样性显著低于绝经前女性(n=24),厚壁菌门(Firmicutes)和罗氏菌属(Roseburia)丰度较低,而拟杆菌门(Bacteroidetes)和甲苯单胞菌属(Tolumonas)在绝经后妇女中被富集,绝经后妇女的同型半胱氨酸合成相关过程被激活。
在动物模型中,也描述了卵巢衰老引起的肠道微生物群的变化。4-乙烯基环己烯二环氧化物(VCD)是一种化学物质,可直接杀死卵巢的原始卵泡和初级卵泡,但对卵巢外组织没有毒性,可诱导卵巢衰老,类似于自然卵巢衰老。研究人员确定,VCD组和对照组小鼠在α多样性和β多样性上都存在显著差异。
VCD组占主导地位的微生物群中,包括幽门螺杆菌、Odoribacter和另枝菌属(Alistipes)水平较低,而梭菌XIVa群(Clostridium XIVa)、巴恩斯氏菌(Barnesiella)、拟杆菌属和Mucispirillum属的水平较高。
随着雌性的年龄增长,肠上皮恶化,导致微生物群负荷增高、屏障功能受损和寿命减短。
肠道微生物群在卵巢自然衰老过程中的生理演替
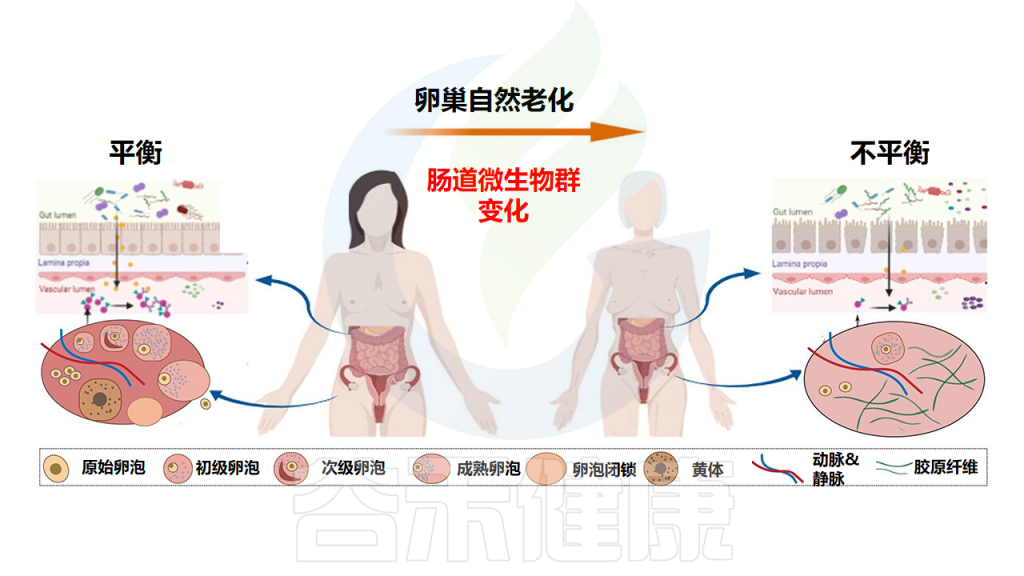
Huang F,et al.Gut Microbes.2024
为了进一步探讨肠道微生物群与卵巢自然衰老之间更复杂、更深入的因果关系,将粪便微生物群移植(FMT)应用于自然衰老的小鼠。使用来自年轻供体 (5周龄)FMT治疗的老年小鼠(42周龄)肠道微生物组呈现出“年轻动物样表型”,卵泡闭锁和细胞凋亡减少,从而提高了老年小鼠的生育能力。
这些卵巢衰老延迟效应可能是通过改善炎症状态和免疫微环境来解释的。老年斑马鱼的大量证据也证明了年轻微生物群对生殖调节的影响。从年轻供体到老年斑马鱼的FMT可以抵消随后接触有毒污染物的不利影响,有效降低膜结合孕激素受体转录物的水平,促进卵子发生的进展,并降低有毒污染物引起的畸形率,及其后代表现出更强的运动能力并且游得更快。
总体而言,在卵巢衰老过程中维持“年轻”的肠道微生物群可能会限制卵巢衰老并提供额外的好处。
人群中的一些女性并非卵巢自然衰老,而是卵巢功能过早衰退,即卵巢早衰(POI)。POI 是一种临床综合征,定义为40岁以下患者正常卵巢活动衰竭,表现为月经失调(闭经或月经稀发),促性腺激素水平升高和雌二醇水平低。
据估计,全球患病率高达3.7%,而30岁以下女性和20岁以下女性中分别有0.1%和0.01%患有该病。卵巢早衰因其对生育能力的不利影响以及随之而来的负面健康影响而引起公众关注,例如心血管疾病风险增加、认知障碍、情绪和性功能障碍、骨质疏松症和预期寿命缩短。
卵巢早衰是一种高度异质性的病症,70%至90%的卵巢早衰病例除了已知的遗传、自身免疫、感染和医源性因素外,病因不明,即特发性卵巢早衰。最近,越来越多的证据表明肠道微生物群失调与卵巢早衰相关。在本节中,我们回顾当前肠道菌群与卵巢早衰之间联系的研究,重点关注特发性卵巢早衰、医源性卵巢早衰和卵巢早衰驱动的疾病。
√ 卵巢早衰患者β多样性减少
研究注意到,卵巢早衰患者的β多样性有所减少。在门层级,观察到卵巢早衰患者中拟杆菌门(Bacteroides)的丰度较高,而厚壁菌门(Firmicutes)的丰度较低。
而在属(genus)层级,与健康女性(n=18)相比,卵巢早衰患者(n=35)中的丁酸弧菌(Butyricimonas)、Dorea、Lachnobacterium和萨特氏菌(Sutterella)的丰度较高,而Bulleidia和普拉梭菌(Faecalibacterium)的丰度较低。
此外,与对照组(n=10)相比,在卵巢早衰(POI)患者(n=10)中,观察到埃格氏菌属(Eggerthella)和葡萄球菌属(Staphylococcus)的丰度降低,而Comamonas和巴恩斯氏菌(Barnesiella)的丰度增加。
这些微生物变化与卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)和抗米勒管激素(AMH)的水平以及FSH/LH比值相关。
√ 健康的肠道微生物可能保护卵巢
激素替代疗法(HRT)是推荐用于卵巢早衰(POI)女性的治疗方法,既可用于症状管理也可用于疾病预防。与POI相关的β多样性变化、埃格特氏菌属(Eggerthella)相对丰度、血清代谢物以及雌二醇和孕酮激素水平,在实施HRT后显著逆转,这进一步验证了雌激素和肠道微生物之间的相互作用。
动物实验证实,E. lenta灌胃可诱导小鼠卵巢纤维化,而雌激素治疗可缓解卵巢纤维化。
综上所述,这些研究结果显示,肠道微生物群失调,如核心微生物群Lachnoclostridium和拟杆菌属扰动,短链脂肪酸产生菌Bacteroides和Faecalibacterium的减少,以及机会致病菌如埃格特氏菌属(Eggerthella)的增加,可能参与了原发性卵巢功能衰竭(POI)的病理生理过程。
肠道微生物群的逆转可能在一定程度上成为新的卵巢保护策略。尽管卵巢早衰与肠道微生物存在潜在关联,但这种关系的因果性仍需深入研究。
如上所述,大多数卵巢早衰病例是特发性的。但在少数已知原因的病例中,医源性因素占很大比例。许多医疗因素会损害肿瘤患者的卵巢功能,例如盆腔放疗、化疗和手术,这可能导致卵巢功能过早衰退甚至完全丧失。
√ 接受过卵巢手术的患者发生卵巢早衰概率较高
治疗剂量越高、照射面积越大、手术面积越大,对卵巢功能的影响就越大。接受过卵巢手术,尤其是腹腔镜手术的患者是医源性卵巢早衰的主要人群。由于医源性卵巢损伤,骨质流失和泌尿生殖系统萎缩是许多年轻癌症患者和术后妇女面临的两大挑战,严重影响了她们的整体生活质量。
一项研究对接受不同抗癌治疗的卵巢癌患者肠道微生物群的变化进行了分析,发现与手术后样本相比,拟杆菌门和厚壁菌门的丰度显著下降,变形菌门的丰度显著增加。然而,使用化疗呈现出了不一样的结果。与化疗前相比,化疗后的样本显示出拟杆菌门和厚壁菌门的丰度显著增加,变形杆菌门的丰度降低。
√ 肠道微生物群的变化与医源性卵巢早衰有关
根据卵巢切除(OVX)小鼠模型的许多研究显示,医源性绝经可能影响肠道微生物。在OVX组和假手术组的肠道微生物之间观察到β多样性和α多样性有显著差异。几项研究发现,OVX组在门水平上厚壁菌/拟杆菌比例更高,变形菌相对丰度更低。
双侧卵巢切除术是构建医源性更年期动物模型最成熟的方法,已广泛应用于更年期及绝经相关研究,如绝经期骨质疏松症、泌尿生殖系统萎缩等。
在属水平上,假手术组中优势属的丰度在OVX组中显著下降(87%VS29%)。相反,假手术组中丰度较低的属在OVX组中显著富集(<5%VS63%)。
在卵巢切除大鼠中确定了四个重要的关键属:Incertae Sedis、Anaerovorax、Anaerotruncus和Helicobacter。此外,卵巢切除组表现出明显的体重增加、肠屏障受损、骨丢失和阴道萎缩。
√ 补充益生菌有助于预防和治疗卵巢早衰
肠道微生物群对于卵巢切除诱导的破骨细胞分化是必不可少的。
厚壁菌门和拟杆菌门的比例对于破骨细胞分化至关重要,补充来自厚壁菌菌门的益生菌唾液乳杆菌(Lactobacillus salivarius LI01)可以预防卵巢切除诱导的骨质疏松症。
而来自卵巢完整小鼠的粪菌移植抑制了卵巢切除诱导的肠道微生物群变化和体重增加,抑制了促破骨细胞因子的释放,增加了粪便短链脂肪酸水平(主要是乙酸和丙酸),降低了肠道通透性,并最终防止了卵巢切除引导的骨丢失。
令人惊讶的是,来自卵巢完整的可育雌性的粪菌移植改变了卵巢切除小鼠的肠道微生物群,并显著缓解了阴道上皮萎缩。总的来说,粪菌移植可能是预防和治疗医源性卵巢早衰及相关后果的一个有前途的方案。
粪菌移植改变肠道微生物群并减缓卵巢衰老相关疾病
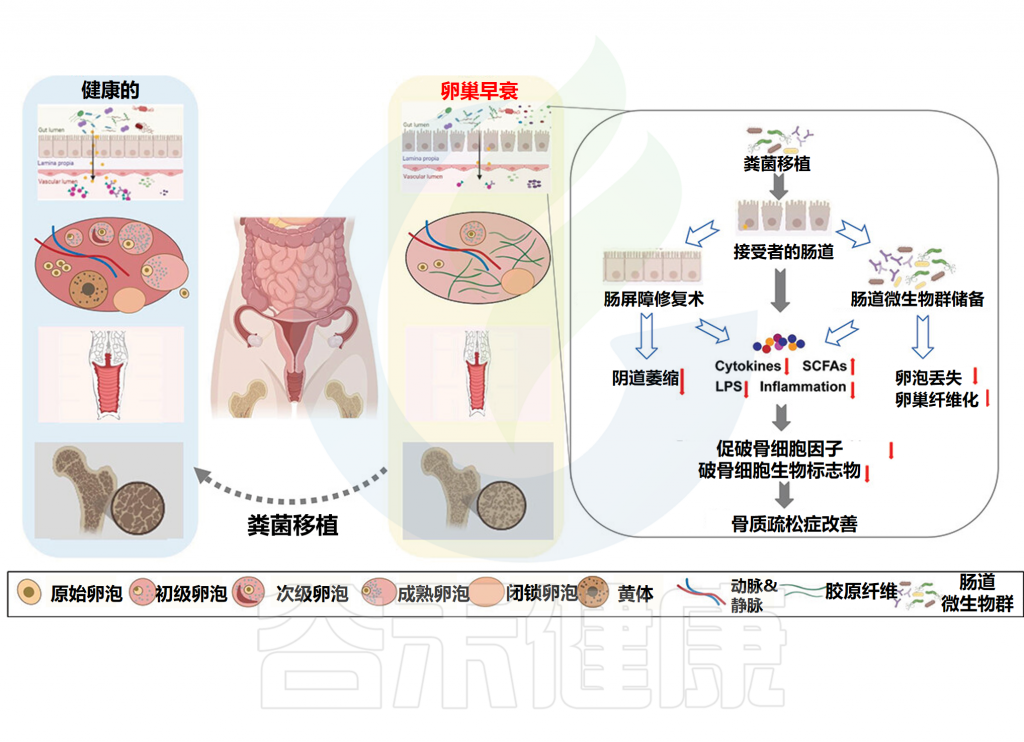
Huang F,et al.Gut Microbes.2024
迄今为止,还没有临床上可行的技术可以延迟或逆转与高龄相关的卵巢功能障碍。然而,过去几十年来,抗卵巢衰老领域取得了重要进展,出现了许多新兴的抗衰老药物,如辅酶Q10(CoQ10)、褪黑激素、烟酰胺单核苷酸(NMN)、白藜芦醇、雷帕霉素和N-乙酰基-L-半胱氨酸(NAC)已显示出延缓卵巢衰老的巨大潜力。
虽然没有研究直接探讨这些抗衰老药物、卵巢功能和肠道微生物群之间的关系,但一些间接证据表明这些药物的有益作用可能与肠道微生物有关。如图所示表格,这些药物可能通过肠道微生物发挥作用。

Huang F,et al.Gut Microbes.2024
1
辅酶Q10
辅酶Q10(CoQ10)是一种脂溶性的,类似维生素的苯醌化合物,在细胞能量生产中起关键作用,并且以还原形式起抗氧化剂的作用。
• 给予CoQ10改善卵巢反应
随着年龄的增加,CoQ10的合成似乎会下降,这与生育力和卵子质量下降的时间点一致。在生育治疗期间预先给予CoQ10可以改善卵巢储备减少的年轻患者的卵巢反应和胚胎质量。
在小鼠中,CoQ10治疗不仅保留了卵巢卵泡储备,还促进了能支持正常发育的配子的排卵。CoQ10的饮食补充对老年母鸡、高胎次妊娠母猪和红罗非鱼引用的生殖变量也有益效果。然而,在接受辅助生殖技术的不孕妇女中,CoQ10增加了临床妊娠率,但对活产率或流产率没有影响。
• CoQ10影响肠道微生物群组成,保护肠道屏障
CoQ10还影响肠道微生物及其产生的后续生物标志物。给予CoQ10 3周结果使瘤胃球菌(Ruminococcus)和Lachnospiraceae AC 2044群的相对丰度分别增加2.4倍和7.5倍,以及丁酸盐增加了1.26倍。
富含CoQ10的南瓜汁灌胃增加了小鼠肠道中乳酸菌和双歧杆菌的丰度,并通过减少变形菌门进一步保护了肠道屏障。
2
褪黑素
作为一种强大的抗氧化剂,褪黑素已被证明可以延缓雌性动物生育力的衰退。氧化应激被认为是卵巢老化的关键因素,它加速卵泡的损失和闭锁,同时也伴有显著的肠道微生物群失调。
• 褪黑素的抗氧化作用可以延缓卵巢老化
而褪黑素可以逆转氧化应激导致的表型,并改善肠道微生物群落。在小鼠身上,褪黑素治疗不仅显著增加了卵子的数量和质量,而且在体外受精后产生了更多的囊胚,产仔数也比对照组的更多。
褪黑素可能增加老年产蛋母鸡的雌二醇和黄体生成素水平,以及免疫球蛋白的水平和生长卵泡的数量。褪黑素预处理减少了厚壁菌门的丰度和厚壁菌门与拟杆菌门的比例,并在门的层面上增加了拟杆菌门的含量。
• 口服褪黑素可以逆转高脂饮食导致的菌群失调
此外,口服褪黑素补充剂显著逆转了高脂肪饮食诱导的肠道微生物群失调,包括肠道微生物群的α多样性降低,拟杆菌属和Alistipes属的相对丰度降低,以及乳杆菌目和乳杆菌属的相对丰富度增加。
褪黑素治疗小鼠粪菌移植后乙酸产生与拟杆菌属和Alistipes属的相对丰度之间的显著相关性表明,肠道微生物群重编程可能是褪黑素治疗的潜在机制。
扩展阅读:
3
烟酰胺单核苷酸
“NMN”是“烟酰胺单核苷酸”(Nicotinamide Mononucleotide)的缩写。它是细胞内 NAD+(烟酰胺腺嘌呤二核苷酸)的前体物质之一。
NAD+是一种重要的辅酶,存在于所有活细胞中,对于能量代谢、DNA修复、基因表达调控以及细胞信号传递等生命过程都至关重要。
随着年龄的增长,人体内NAD+的水平会逐渐下降,这与多种衰老相关的疾病有关。NMN作为一种补充剂,通过提高体内NAD+的水平,有望改善与衰老相关的各种生理功能下降,增强细胞的活力和代谢功能,因此被广泛研究作为抗衰老和提升健康寿命的潜在治疗方法。
• 延缓卵巢衰老,提高卵母细胞质量
NMN是另一种有前途的抗卵巢衰老药物。随着生殖衰老,卵母细胞质量的下降伴随着烟酰胺腺嘌呤二核苷酸(NAD+)水平的下降,作为NAD+生物合成的中间体,可以通过补充NMN来补偿,发挥延缓卵巢衰老的作用。
中年小鼠口服 NMN 20 周,改善发情周期状况,增加不同阶段卵泡数量以及黄体和血清FSH,与对照处理相比增强颗粒细胞(GCs)线粒体生物发生、自噬和蛋白酶活性。
在高脂饮食诱导的卵巢早衰小鼠中,给予 NMN 可以减少卵巢炎症和腹部脂肪组织的脂肪大小,并提高卵母细胞质量。NMN 处理增加了产生丁酸的细菌属的丰度,如Ruminococcae UCG-014, Prevotellaceae NK3B31 group 和 Akkermansia muciniphila,同时降低了几种有害细菌属的丰度,如Oscillibacter和嗜胆菌属(Bilophila)。NMN 还减少肠粘膜损伤并维持粘膜屏障完整性。
4
白藜芦醇
在谷禾菌群检测报告中,有很多菌的调节措施中给了白藜芦醇。白藜芦醇是一种天然多酚类化合物,可以延缓卵巢衰老并预防与年龄相关的不孕症,它还能够恢复微生物群的组成,并逆转肠道菌群失调。
• 白藜芦醇提高短链脂肪酸浓度并调节卵巢功能
一项研究揭示,白藜芦醇改善了氧化应激引起的产卵率下降和血清激素水平变化,以及肠道微生物群失调,并提高了产蛋母鸡体内主要短链脂肪酸的浓度。
这项研究直接证明了白藜芦醇通过肠道微生物调节卵巢功能。富集的微生物群,包括拟杆菌、Lachnospiraceae NK4A136群、Blautia、Lachnoclostridium,Parabacteroides和Ruminiclostridium 9(统称为白藜芦醇微生物群),显示出抗肥胖功能。
5
雷帕霉素
哺乳动物雷帕霉素靶蛋白 (mTOR) 信号通路在女性生殖细胞的卵泡发生中发挥着至关重要的作用。已有报告称,卵巢早衰患者激活了AKT/mTOR信号通路。
在高脂饮食诱导的卵巢早衰小鼠中抑制mTOR信号,逆转了卵泡丢失并延长了卵巢寿命。
• 雷帕霉素延长卵巢寿命,改善卵子质量
雷帕霉素是一种最初从细菌中分离出来的天然大环内酯化合物,作为TOR信号的抑制剂。雷帕霉素治疗增加了卵巢储备,并延长了卵巢寿命,特别是在老年小鼠中,改善了卵子质量。
在环磷酰胺诱导的卵巢早衰模型中,雷帕霉素防止了原始卵泡的损失,并保护了卵巢储备。在雷帕霉素处理的小鼠中观察到分段丝状细菌水平的显著增加。
然而,尽管雷帕霉素挽救了果蝇的肠道屏障功能障碍并增加了微生物负荷,但其抗衰老效果似乎与肠道微生物群无关。
6
乙酰氨基酚
乙酰氨基酚(NAC)有助于刺激谷胱甘肽的合成,发挥抗氧化作用。一项在小鼠身上进行的研究提出,NAC的给药可以改善植入前卵子的质量,并增加囊胚总细胞数和窝仔数,从而延缓生殖老化带来的生育能力下降。
NAC通过促进几种有益细菌的生长并影响肠道细菌的代谢途径,缓解了高脂饮食小鼠的肠道菌群失调。
总的来说,关于NAC治疗对生殖老化和肠道微生物群影响的证据是罕见的,需要进行与生育相关的研究来评估NAC给药的效果。
除了抗衰老药物之外,抗衰老饮食似乎是更受欢迎的选择,其中热量限制目前被认为是最可重复的策略。热量限制是指减少能量摄入,但不会导致营养不良或缺乏必需营养素。
作为抗衰老饮食的主导范式,其延长寿命的效果已被广泛认可。在过去的几十年里,人们关注了热量限制对生殖和肠道微生物群的影响(见下表)。
热量限制调节卵巢功能

Huang F,et al.Gut Microbes.2024
热量限制引起的肠道微生物群变化
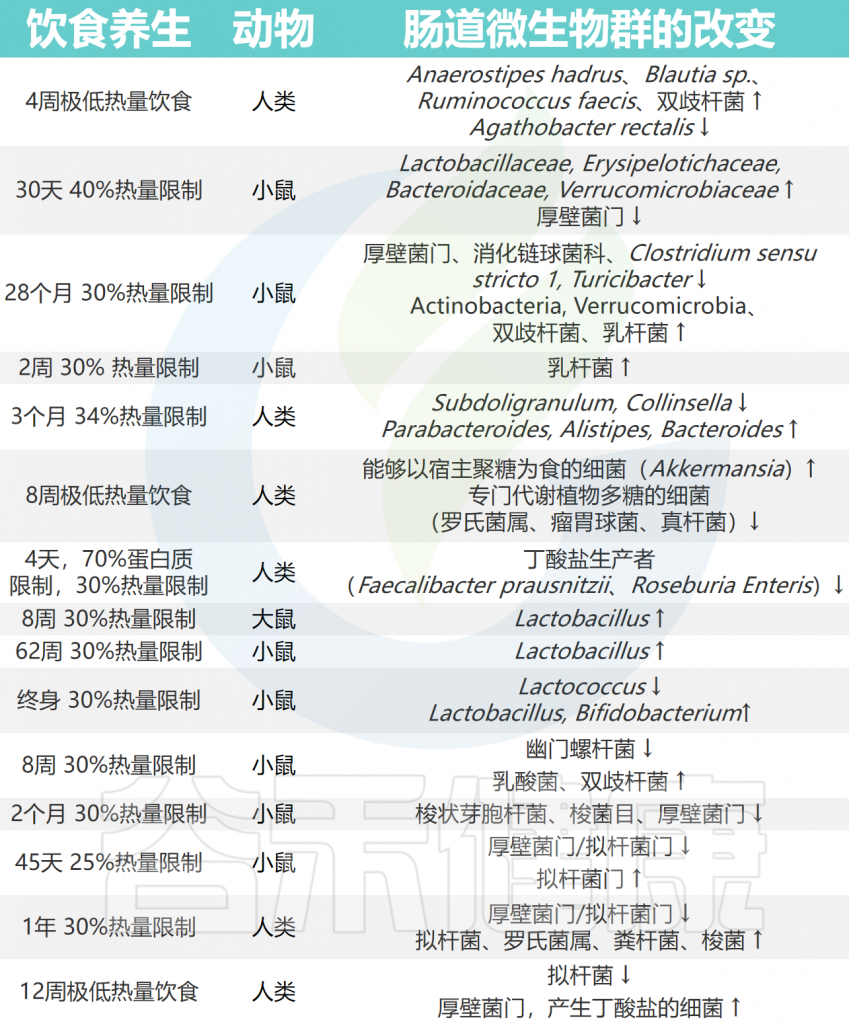
Huang F,et al.Gut Microbes.2024
• 抑制卵泡的丢失和保护卵泡库
肥胖、过多的体脂和胰岛素抵抗对卵巢卵泡的发育有不利影响,从而损害了雌性动物的生殖能力。
热量限制(CR)与体重减轻、腹部内脏脂肪积聚减少和胰岛素敏感性增加有关。因此,通过抑制卵泡丢失和保护卵泡库,实施了延缓卵巢老化的效果。
与对照组啮齿类动物不同,接受CR治疗的啮齿类动物显示出原始卵泡数量显著增加,并抑制了不同阶段卵泡的发育。
十周的热量限制喂食降低了血清黄体生成素、卵泡刺激素和雌激素水平。热量限制在高脂饮食诱导的卵巢早衰小鼠中产生了类似的效果。由CR引起的p53下调可能因其对细胞周期和凋亡的影响而抑制卵泡萎缩。
• 改善与年龄相关的菌群变化
热量限制还可以挽救老年雌性小鼠中观察到的与年龄相关的菌群变化。三个月34%的CR帮助实现了显著的体重减轻,并且腰围减小与五个细菌属(Subdoligranulum、Collinsella、Parabacteroides、Alistipes和Bacteroides)的变化相一致。
40%的热量限制喂食30天增加了 Lactobacillaceae, Erysipelotrichaceae,Bacteroidaceae 和 Verrucomicrobiaceae 丰度,并减少了厚壁菌门丰度。
• 改善葡萄糖代谢,降低脂多糖水平
热量限制还改善了葡萄糖代谢、脂肪棕化和耐寒能力,降低了脂多糖结合蛋白和循环脂多糖水平。
此外,严格的热量限制减少了体脂沉积,改善了葡萄糖耐受性。但富集了能够以宿主糖原为食的Akkermansia,并消耗了专门用于代谢植物多糖的Roseburia、Ruminococcus和Eubacterium,这些都是在人类肠道的核心菌。
• 热量限制可以减少炎症有助于防止卵巢衰老
慢性炎症是衰老以及卵巢衰老的另一种常见状况。炎症可能是导致生殖衰老的机制之一。卵巢内B细胞、CD4+ T细胞和巨噬细胞比例的增加与卵巢衰老的过程一致,并且在生殖衰老过程中观察到多种促炎细胞因子(包括IL-6、TNF-α和IL-1α/β)以及炎症小体基因NLRP3和ASC的年龄依赖性过表达。
抑制NLRP3炎症小体有助于防止卵巢衰老。肠道微生物群在调节炎症反应中起着至关重要的作用。热量限制可能通过塑造肠道微生物组来延迟免疫衰老。热量限制增加了受体的α多样性,并降低了梭状芽孢杆菌、Hungatella hathewayi和Alistipes obesi的丰度,这些CR相关的微生物群降低了肠道和肝脏效应记忆CD8+ T细胞、肠道记忆B细胞和肝脏效应记忆CD4+ T细胞的水平。
热量限制持续2周可显著减少肠道炎症,增加保护性肠道微生物群乳酸菌。终身热量限制诱导的双歧杆菌和乳酸菌增加与胆汁酸水平呈负相关,包括 ChDxCA 和次级胆汁酸(DxCA/TDxCA 和 ChDxCA 衍生物)。CR 促进的以乳杆菌群落降低了全身微生物抗原和炎症标志物的水平。
基于上述与热量限制相关的几种分子途径的发现,热量限制可能是改善炎症并可能促进肥胖相关不孕症和生殖寿命的一种可能策略。
!
不足之处
值得注意的是,上述这些抗衰老干预措施要么检查了对肠道微生物组或卵巢功能的影响,但很少有研究同时推测抗衰老药物、肠道微生物组和卵巢功能。
因此,目前涉及治疗机制影响卵巢功能的肠道微生物组的证据是支离破碎且分散的,这也是本综述的局限性。这些抗衰老干预措施在肠道微生物群和卵巢功能之间的相互作用方面仍然存在很大差距。因此,迫切需要更多的研究关注这些干预措施对肠道微生物组和卵巢功能的影响,以将这三个部分的相互作用联系起来。
肠道微生物群组成和功能的改变在生殖衰老的发病机制中发挥着重要作用。实验和临床研究揭示了肠道菌群失调与卵泡发育以及免疫反应紊乱之间的关系。粪菌移植研究结果为抗卵巢衰老提供了新的见解,即维持年轻的肠道菌群有助于保护卵巢功能并预防卵巢相关疾病。
基于微生物群的干预来延缓卵巢衰老是一种有吸引力的方法,并且可能为肠道微生物群调节提供新的治疗策略,以提高女性生育能力。
此外,抗衰老药物和限制热量等抗衰老干预措施的研究可能会改善肠道微生物失衡,促进更健康的肠道生态环境。然而,当前科学文献的证据无法提供有关这些措施的直接结论。大多数相关研究都是在动物模型中进行的,不能简单地适用于人类。因此,未来的研究应从简单的相关性分析转向大规模队列研究,重点关注潜在原因和潜在机制,以验证这些干预措施对卵巢衰老的有益作用。
鉴于肠道微生物群组成和功能在卵巢衰老过程中发生广泛变化,有人认为肠道微生物群可能适合破译女性预期和意外卵巢衰老的过程。肠道微生物群的失衡可能导致各种卵巢衰老相关疾病的进展。尽管卵巢衰老是不可避免的,但维持平衡的肠道微生物群是延缓卵巢衰老和随后不良后果的潜在方法。
特定菌株及其代谢物在卵泡发育中的作用和分子机制仍不确定,并且在很大程度上尚未得到探索。多项研究报告卵巢早衰样本中同时存在肠道和血清代谢紊乱,一些代谢物可能介导下丘脑-垂体-卵巢轴的功能。
发现短链脂肪酸与卵泡发育和卵泡液激素之间存在显著相关性。补充特定代谢物可能是调节卵巢功能的另一种选择。老年小鼠卵巢中多胺代谢物亚精胺水平降低,补充亚精胺可促进卵泡发育,恢复卵母细胞质量,提高老年小鼠的生育率。
发现支链氨基酸不足可能导致卵巢早衰,补充支链氨基酸可改善活性氧诱导的小鼠的卵巢功能障碍。
此外,卵泡闭锁是随着出生后GC细胞的凋亡而开始的。一项研究表明,肠道微生物群可能通过短链脂肪酸影响GC细胞凋亡来参与调节卵泡发育。其他某些代谢物对GC细胞凋亡的影响也值得探索。
大量研究还表明,使用三种略有不同的药物进行细菌疗法:益生菌、益生元和合生元,有望用于预防和治疗人类一般衰老和与年龄相关的疾病。
其中乳杆菌和双歧杆菌是最常用的,尽管不同研究的效果有所不同,具体取决于剂量、持续时间及其成分。研究表明,一些益生菌菌株对男性生殖功能障碍具有有益作用。补充乳酸菌和双歧杆菌可改善男性精子活力并降低DNA断裂率。然而,益生菌、益生元和合生元对卵巢衰老的影响尚不清楚,需要更多的研究来证明它们是否可以成为对抗卵巢衰老的有效策略。
尽管卵巢衰老是不可避免的,但维持平衡的肠道微生物群是延缓卵巢衰老和随后不良后果的潜在方法。
主要参考文献
Huang F, Cao Y, Liang J, Tang R, Wu S, Zhang P, Chen R. The influence of the gut microbiome on ovarian aging. Gut Microbes. 2024 Jan-Dec;16(1):2295394.
Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol. 2021 Jan;19(1):55-71.
Ling Z, Liu X, Cheng Y, Yan X, Wu S. Gut microbiota and aging. Crit Rev Food Sci Nutr. 2022;62(13):3509-3534.