-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com


谷禾健康


日常生活中,我们更多地认为心情是由思想控制的。这虽然是常识,但并非完全正确。
荷尔蒙也十分影响我们的情绪,同时我们的情绪也受到免疫系统和肠道微生物的影响。更复杂的是,在这个纠结的生物网络中,我们的生活承受着巨大的压力。
精神压力是身体对生活压力的反应。它设法使身体恢复平衡,正常发挥免疫力,激素和神经的作用。来自工作上的压力或生活的压力都可能会导致抑郁和焦虑。无论哪种情况,都可以从免疫系统开始。
抑郁症是全世界致残的主要原因之一。据估计,五分之一的人在一生中都会经历抑郁症。大约85%的人在经历第一次抑郁症发作后的10年内会复发。

今年,COVID-19大流行,更给全球人类造成了极大的焦虑和不安全感,持续的危机将导致很多心理和精神健康问题。
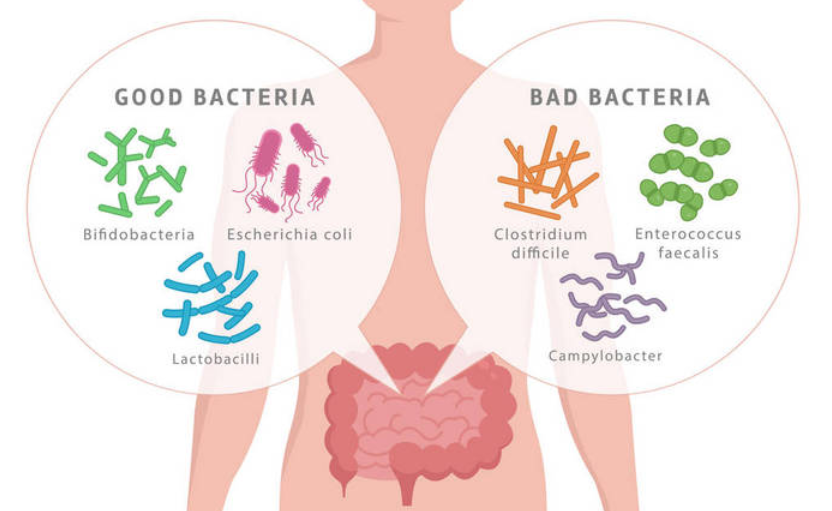
肠道是人体最大的器官,肠道中微生物包括细菌,病毒,真菌等。微生物的平衡对于身心健康至关重要。
而现代生活中的各个方面,例如压力大,加工食品饮食,抗生素,杀虫剂以及经过消毒的城市环境,都减少了健康肠道菌群的数量和丰富度,同时增加了有害菌群的数量。最新的抑郁理论表明,肠道菌群失衡可能在这种疾病中起主要作用。
一项2019年的研究将来自精神分裂症患者的粪便微生物移植物引入无菌小鼠中,发现这些小鼠随后表现出与精神分裂症有关的行为。
同样,另一项研究指出对患有抑郁样特征的啮齿动物施用益生菌可以减少这些特征,从而使啮齿动物恢复正常行为。所有这些表明,肠道菌群的外部操纵具有进行新的心理健康治疗的潜力。
抑郁症患者的肠道菌群与健康人不同。与健康个体相比,它们的肠道菌群多样性和丰富性较少。《自然》杂志上的一项新研究发现,肠道微生物对于消除小鼠的恐惧反应至关重要。
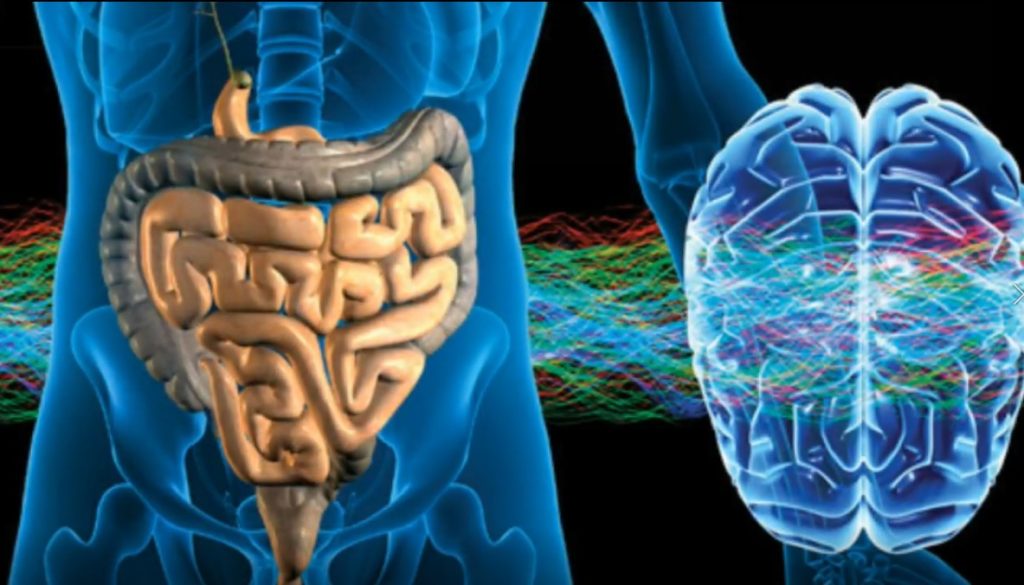
众多研究表明肠道微生物连接大脑至少有三种途径:免疫、神经系统,激素和代谢物。
病原体发作后,免疫系统就会立即按下紧急按钮。但是免疫系统也可以对心理压力做出反应,即所谓的“无菌压力”。与侵略者作斗争是一回事,但是让我们抵抗精神压力似乎是对免疫系统的一大要求。
有一种简单的方法来证明压力和免疫力之间的密切联系:每天将普通小鼠引入恶霸小鼠中几分钟。结果很神奇,受欺负的小鼠仅需一到两周即可产生炎症,这是通过其血液中的促炎化学物质测得的。其中,他们的淋巴细胞——白细胞发生了变化。
另外,有一种特别培育出来的淋巴细胞水平较低的老鼠比普通老鼠更焦虑,更不善于交际。但是,当您向这些害羞小鼠注入来自受欺负小鼠的淋巴细胞时,会发生一些有趣的事情:可能与你期望的相反,它们变得不那么焦虑,开始更多地社交。
在应激小鼠中,这些淋巴细胞正疯狂地试图减少恶霸引起的炎症。这是自然界最持久的回路之一:负反馈回路,可防止反应失控。威胁带来的心理压力会引发这些淋巴细胞抑制炎症。一旦转移,它们对宿主小鼠产生有益的“减轻压力”作用,导致促炎性化学物质减少并赋予其新宿主弹性。
这个有趣的实验表明,纯粹的心理压力可以改变免疫系统。这表明,通过简单地重新平衡免疫系统可以治疗抑郁症。
美国阿尔伯特·爱因斯坦医学院Paul S. Frenette小组发现,肠道微生物组可以调节心理压力引起的炎症。这一研究成果在线发表于2020年7月30日的 《免疫》。利用镰状细胞病的血管闭塞性发作(简称VOE)作为血管疾病模型,研究人员发现压力可通过引起糖皮质激素的激素反应增强VOE,这些激素反应可增强肠道壁的通透性,导致微生物依赖的IL-17A固有层辅助性T细胞17的分泌,随后引发VOE中性粒细胞循环池扩大。
我们已经看到反复的压力如何导致免疫反应,以及由此产生的炎症导致抑郁和恐惧。但是微生物扮演什么角色?
虽然认知疗法和增加5-羟色胺的抗抑郁药可以有效地治疗抑郁症,但这些治疗方法对超过三分之一的抑郁症患者无效。最近的抑郁理论表明,肠道微生物群的失衡和连接肠道和大脑的轴的功能障碍可能参与其中。
这个世界上布满了细菌,其中许多细菌都比吃我们的早餐更好。为了应对这种恶劣的现实,动物们很早就招募了自己的一组友好微生物来保护自己。这些有益细菌并没有真正站在我们这边,只是他们很乐意在温暖和潮湿的肠子中发酵,不断地吃自助餐。这些细菌被称为共生细菌,拉丁语是“共享餐桌”。
当病原体试图侵入这一长期建立的伙伴关系时,共生菌会手撕它们。从本质上讲,我们的微生物群是免疫的先锋。为了与人类宿主建立如此重要的关系,共栖者需要教会免疫系统容忍它们。这是在生命的早期,出生后一千天之内发生的,如果这个过程受到干扰,那么可能会终身受疾病困扰。
就像牧羊犬引导羊群一样,免疫细胞监视着共生菌,使它们在肠道内和血液循环外被包围。而细菌则分泌脂肪酸来安抚免疫细胞,保护它们免受攻击。通过这些分泌物,肠道细菌可以在远离肠道的地方发挥作用,甚至可以改变大脑的形状和功能。
这意味着微生物会改善情绪。
那些可以改善情绪的菌群,包括某些乳酸菌和双歧杆菌,甚至可以降低皮质醇水平。这些被称为精神药物,它们代表了另一种可能的抑郁症治疗方法。尽管这些都属于该领域的早期研究,但已证明它们可以减少负面想法,改善认知并降低IBS症状。
微生物可以影响你的海马体或杏仁核的大小,这些大脑中心与情绪、食欲和恐惧有关。海马体试图阻止下丘脑-垂体-肾上腺轴(HPA轴)偏离轨道,如果它的生长发育迟缓,就会影响应激反应。

如果说免疫细胞和微生物是生物乐队的主要参与者,那么HPA轴就是指挥。HPA轴是下丘脑-垂体-肾上腺的缩写,它协调着逐渐增加的激素释放与皮质醇的释放,皮质醇是战斗或逃避反应的药物。压力通路会通过交感神经系统(SNS)和/或下丘脑-垂体-肾上腺(HPA)轴从大脑传递信号。SNS的激活导致肾上腺素(从肾上腺髓质)和神经递质去甲肾上腺素(从各个器官的神经末梢)释放激素。
HPA轴激活最终导致肾上腺皮质分泌糖皮质激素。 糖皮质激素通常具有免疫抑制功能。 例如,在压力下升高的糖皮质激素浓度显示可通过B和T淋巴细胞的凋亡引起适应性免疫缺陷,并且糖皮质激素已在药理学上用作有效的抗炎药。 炎症被认为是导致与压力有关的疾病的常见途径。 考虑到糖皮质激素作为免疫抑制剂的作用,应激诱导炎症的机制仍然不清楚。
迷走神经是肠道和大脑之间的主要传输通路。
迷走神经也被称为“徘徊神经”,因为它是人体中最长的神经,并且有无数分支从脑干一直延伸到肠的最下部,并一路接触大部分主要器官。
迷走神经是副交感神经系统的主要组成部分,它调节“休息和消化”或“趋于友好”的反应。另一方面,为维持体内平衡,交感神经系统驱动“战斗或躲避”反应。
迷走神经通过引起所谓的“放松反应” 来抵消战斗或躲避中的应激反应。
迷走神经的早期解剖图
来源:Wellcome Library/Public Domain
炎症反应在许多疾病的发展和持续中起着核心作用,并可能导致慢性疼痛衰弱。在许多情况下,炎症是您身体对压力的反应。因此,减少神经系统中的“战斗或逃跑”反应并降低应激的生物标志物也可以减轻炎症。

瑜伽和冥想等日常习惯或可以对抗炎症
越来越多的证据表明,对抗炎症的另一种方法是通过接合迷走神经并改善“迷走神经张力”。这可以通过使用瑜伽和冥想等日常习惯来实现。
植入迷走神经刺激装置,改善类风湿关节炎
在更极端的炎症情况下,例如类风湿关节炎(RA),可以使用植入的迷走神经刺激装置(VNS)来实现。
最近,来自阿姆斯特丹和美国的国际研究人员团队进行了一项临床试验,该试验表明,使用小型植入装置刺激迷走神经可通过抑制细胞因子的产生显着减少炎症并改善类风湿关节炎患者的预后。
学会呼吸,缓解焦虑,辅助降压
健康的迷走神经表现为吸气时心率略有上升,呼气时心率略下降。
每次呼气时,迷走神经都会向心脏喷射一些乙酰胆碱。
横膈膜深呼吸(长时间缓慢呼气)是刺激迷走神经并减慢心率和血压的关键,特别是在表现焦虑时。
迷走神经张力指数与健康状况相关
较高的迷走神经张力指数与身心健康息息相关。相反,迷走神经张力指数低与发炎,抑郁,情绪低落,孤独,心脏病发作和中风有关。
2010年的一项研究发表在《心理学》杂志上:积极情绪如何建立身体健康:感知到的积极社会关系解释了积极情绪和迷走神经张力之间的螺旋上升。
在这项研究中,北卡罗来纳大学教堂山分校的Barbara Fredrickson和Bethany Kok研究了迷走神经,发现高迷走神经张力指数是积极情绪、身体健康和积极社会关系之间反馈回路的一部分。
慢性压力与胃溃疡有关
相信大家可能有过对公开演讲感到恐惧的经历,这种站在人前的演讲会导致消化不良。由于沿着肠脑轴的迷走神经通路是双向的,因此当人真正感到压力时,这些脑-肠连接创造了一条来回交流的高速公路,可能会失去控制。
脑岛接收来自肠道的压力信号,从而使大脑在胃部发出更多与压力有关的警钟。
注:脑岛为大脑的岛叶,控制很多感觉和情绪的产生。
Levinthal和Strick(2020)的最新研究表明,大脑会立即将压力信号从脑岛发送到肠道。随着时间的推移,慢性压力以一种可能导致胃溃疡的方式劫持了这些脑肠连接。
有趣的是,他们推测,促进“战斗或逃跑”反应的交感神经系统会沿着迷走神经通路发送大脑到肠道的信息,这些信息与大脑皮层的运动区域更紧密地联系在一起。
更好地理解脑-肠连接如何控制胃,将为肠胃科医生治疗肠道问题和胃肠道疾病带来新的更好的方法。
HPA轴通过几种不同的化学物质与微生物群和大脑进行通讯
细菌分泌物:代谢物如短链脂肪酸。
免疫化学物质:细胞因子,如干扰素,白介素和肿瘤坏死因子。
腺分泌物:肾上腺素和皮质醇等激素。
神经传递化学物质:神经递质,例如5-羟色胺,多巴胺和GABA。
更多关于肠道菌群与神经系统这部分内容详见之前的文章:肠道微生物(菌群)与脑神经(中枢神经)到底如何联系?
微生物代谢产物是细菌在进食和代谢食物时分泌的化学物质。
不同的细菌在不同的情况下会产生独特的代谢产物。其中一些代谢物是短链脂肪酸,例如丁酸,可以使其进入大脑,从而影响大脑的生长和功能。
从肠道内的微生物和细胞释放的化学物质可直接导致迷走神经和迷走神经支配的大脑区域的电活动变化。迷走神经的活动众所周知会影响人类行为。实际上,植入刺激该神经的电子设备(迷走神经刺激器)可以有效地治疗患有严重的,对治疗有抵抗力的抑郁症和癫痫症的患者。
越来越多的研究表明,与健康对照组相比,患有多种精神疾病的人倾向于具有不同的肠道菌群模式。例如,两项研究发现与健康对照组相比,精神分裂症患者的肠道菌群多样性要低得多。
其他研究表明,抑郁症患者和自闭症患者与健康对照组相比,肠道菌群的模式也不同。这与相关研究有关提示特定的肠道菌群在涉及精神疾病的神经递质和代谢产物的产生和调节中起重要作用。这包括5-羟色胺,多巴胺和γ-氨基丁酸(GABA)。
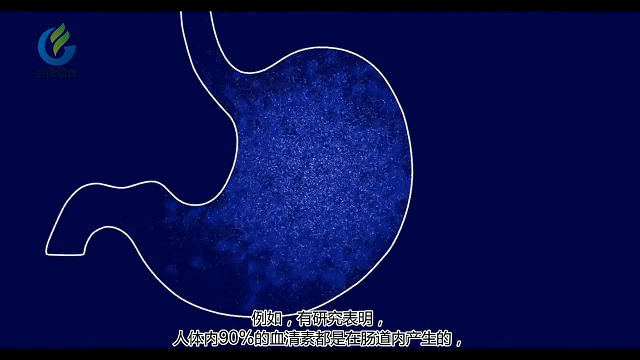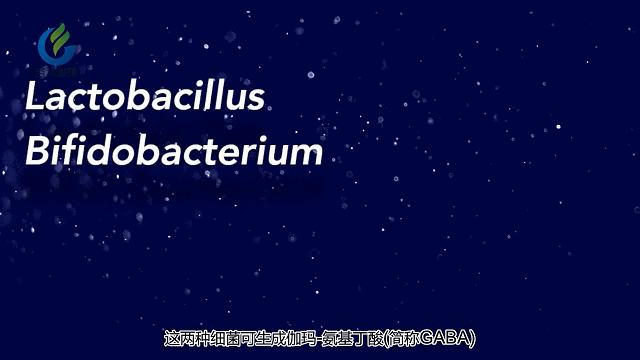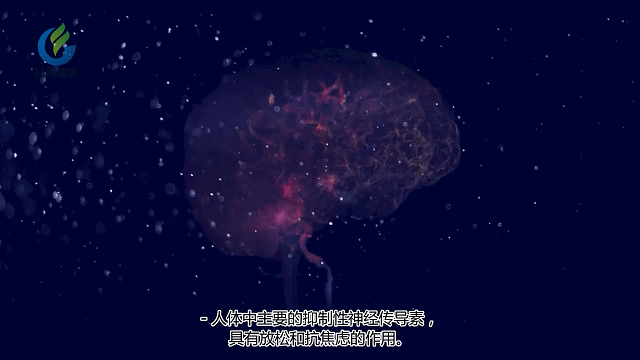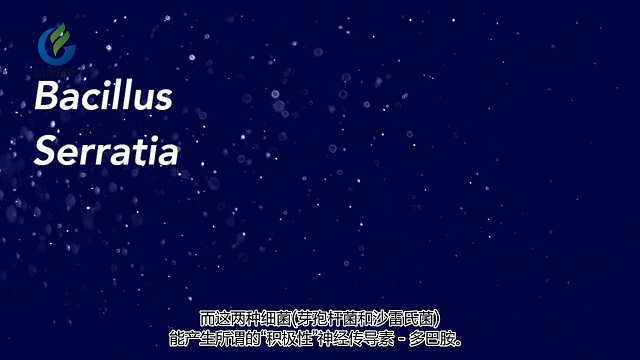
肠道微生物影响大脑和行为的其中一种方法是通过这些微生物或是受这些微生物影响的胃肠系统细胞释放化学物质。这些化学物质释放到血液中,然后穿过血脑屏障并影响神经细胞的生长,功能和连通性。
这些化学物质中的一部分也会影响大脑免疫系统的细胞。此外,人们早就知道,肠道中合成的某些化学物质也是由大脑细胞产生的(例如生长抑素和胆囊收缩素等),这些由大脑合成的肠道化学物质可有效调节大脑功能。
发现的第一种神经递质——乙酰胆碱
1921年,一位名叫奥托·洛维的德国生理学家发现,刺激迷走神经会触发释放Vagusstoff物质(德语为“ Vagus物质”),从而导致心率降低,“迷走神经物质”后来被识别为乙酰胆碱。并成为科学家发现的第一个神经递质。
乙酰胆碱就像一种镇静剂
Vagusstoff就像镇静剂一样,可以减缓心跳间隔并改善心率变异性(HRV)。稳健的迷走神经张力和更高的HRV齐头并进,是整体心理和身体健康的标志。
你可以通过做深呼吸并长时间呼气来简单地自我管理。有意识地利用迷走神经的力量可以在抑制炎症反射的同时建立一种内心平静的状态。
皮质醇
皮质醇是人体通过增加血压,心率和呼吸来增强压力反应的方式,以便逃脱或者逃离烦扰。 在此过程中,它还会降低免疫反应:首先,你逃脱烦扰,然后才处理流感或食物中毒。这是一个合理的回应方式,只是片刻的恐慌。 但是随着时间的流逝,防御能力下降可能导致肠漏,从而将心理压力转化为微生物压力。
5-羟色胺
在肠道中也发现了与抑郁和幸福有关的化学物质,例如血清素(5-羟色胺)。90%的5-羟色胺是在消化道而非大脑中产生的。许多抗抑郁药通过增加5-羟色胺发挥作用。
科学家发现肠道菌群会产生许多其他神经递质,例如多巴胺,去甲肾上腺素,GABA等,它们对情绪,焦虑,专注等至关重要。肠道微生物群会导致大脑反应方式发生变化。
我们知道,抑郁症不仅是精神疾病。抑郁症患者可能同时患有多种疾病,包括脑功能障碍,免疫系统失调和应激激素紊乱等。
研究表明,肠道菌群在免疫,激素平衡和神经系统功能中起着至关重要的作用。
新的理论和研究表明,肠道菌群失衡可能导致许多与抑郁症有关的疾病。前面我们知道,肠道菌群会影响HPA轴的发育,该轴调节压力反应并参与皮质醇的释放。在抑郁和长期处于压力下的人中,HPA轴可能失调,导致过量的皮质醇(一种压力激素)被循环。
肠道菌群也在免疫系统功能中发挥作用,并调节称为细胞因子的化学信使的产生。促炎性细胞因子的失衡可导致慢性炎症和自身免疫性疾病,通常与抑郁症同时发生。
肠道菌群也参与神经系统的功能。肠道菌群失衡可能会影响神经递质(例如血清素)的水平,已知这些物质与抑郁症有关。
其他研究将肠道菌群失衡与降低γ-氨基丁酸(GABA)的水平联系在一起,GABA是一种可以缓解焦虑的大脑化学物质。大脑和肠道可能通过迷走神经进行交流,迷走神经是一条遍及全身的大神经。
肠道微生物群和神经系统疾病详见之前的文章:最新研究速递 | 柳叶刀:肠道微生物群在神经系统疾病中的作用
2019年发表在《自然》杂志的一项新研究:肠道微生物对于消除小鼠的恐惧反应至关重要。该研究是对肠脑轴力学的不断探索中的最新成果。
他们发现了一组代谢产物,这些代谢产物影响大脑处理恐惧的方式。特别是,科学家们正在研究小鼠用了多长时间才能克服习得的恐惧反应。
在发出信号后,立即对这些小鼠进行小小的足部电击。学会了这种联想之后,每当听到信号时,他们都会陷入恐惧中。它们的大脑已经将听到信号的神经元与那些预期电击的神经元联系起来。这种硬连线的神经联系就是巩固大脑记忆的方式。
正常和无菌小鼠都能学会恐惧关联,但Artis和同事发现,无菌小鼠不能忘记恐惧。只要它们保持无菌,在听到信号时总是会冻僵。
如果研究人员再给无菌老鼠一些健康的微生物,他们就可以忘记这种关联,恐惧反应很快消失了。并且直到小鼠达到一定年龄才起作用。此后,即使肠道菌群好,他们也总是对这种音调做出反应。
研究人员排除了迷走神经和免疫系统的作用。相反,他们发现这种作用与四种特定的代谢产物密切相关。在正常生殖的小鼠中,这些代谢物从肠道到达大脑,并促进记忆形成和随后的遗忘。如果没有那些细菌来提供代谢产物,无菌小鼠似乎注定会永远对的音调做出反应。
研究人员已经知道,精神分裂症和肠道生物群系之间已有数年的联系。可惜他们一直无法完全理解两者之间为什么或如何相关。
一项新研究由多名中国研究人员与位于锡拉丘兹的纽约州立大学医学院研究团队共同发表的论文可能提供了一些答案。
该小组招募了63名严重程度不同的精神分裂症患者和69名健康对照者。两组的性别组成,平均年龄和平均体重指数相似。
然后,研究人员从这些组中收集了样本,并通过测序评估了每个受试者肠道微生物群。他们测试了两组之间的差异,以及可能将患者精神分裂症症状的严重程度与肠道生物群系内特定失衡联系起来的差异。
研究小组在2019年2月版的《科学进展》上撰文称,“发现两组动物肠道微生物组成存在明显差异”,两组细菌群落在门或类水平上存在差异。
此外,他们发现“全球微生物表型并没有受到性别或药物状况的很大影响。” 换句话说,与健康对照的肠道生物群系相比,精神分裂症受试者的肠道生物群具有一些特定菌群丰度增加,而其他特定菌群缺乏。
研究人员还发现,精神分裂症患者的肠道菌群失调与重度抑郁症患者不同,并且存在明显的微生物标志物,与症状严重程度密切相关。他们甚至可以非常准确地确定生物群样本是否来自精神分裂症受试者或对照受试者。
为了进一步证明肠道生物群对受试者的精神状态的影响,研究人员随后将精神分裂症受试者的肠道微生物样本转移到一组健康对照小鼠的肠道生物群中。然后,他们将这些先前健康的对照小鼠的行为与一组一直健康的对照小鼠的行为进行了比较。
令人惊讶的是,研究人员发现,将精神分裂症患者的肠道细菌移植到健康对照小鼠中会诱发某些鼠类精神分裂症的症状。这意味着研究人员仅使用精神分裂症受试者的肠道细菌就能将精神分裂症的症状转移至小鼠。
正如论文作者所写,这项研究提供了开创性的证据,表明精神分裂症与肠道菌群组成的变化有关,这种变化既与精神分裂症有关,又与其症状严重程度相关。
该研究不仅在精神分裂症和肠道生物群之间建立了明确的联系,还进一步证明了许多精神障碍是系统性问题,如果没有更全面的视野,就无法正确治疗。
压 力
一些研究表明慢性和暂时性压力均可影响肠道菌群的分布。同样,啮齿动物的研究表明子宫内的压力和母体分离会破坏肠道菌群的平衡,对心理健康产生连锁反应。
自然分娩和母乳喂养
其他研究表明暴露于母体微生物对后代健康多样的肠道发育很重要。这可以通过阴道分娩,皮肤接触和母乳喂养来实现。
漏 肠
有人提出,不健康饮食,酒精和其他因素引起的微生物群变化可使肠道内膜或上皮更易渗透。肠道上皮是一种壁或屏障,旨在防止有害菌产生的有害物质循环进入体内。当肠道变得“渗漏”时,由于炎症细胞因子的产生增加,可能会发生慢性炎症。在许多抑郁症患者中也发现了慢性炎症,这可能部分解释了抑郁症和心脏病之间的联系。
纤 维
为了使食物的口感更符合现代人的需求,很多食物在加工过程中被剥去了纤维,然而对人体有用的许多微生物都依赖纤维。
所谓垃圾食品的真正问题在于,它会使你体内的有益菌饥饿。纤维存在于洋葱,朝鲜蓟,芦笋和许多绿叶蔬菜中。地中海饮食强调这些食物,是值得效仿的典范。

抗 生 素
避免使用抗生素。这些虽然是挽救生命的药物,但是它们带来的副作用是杀死肠道微生物。请谨慎使用。
关于肠脑轴的新兴研究已经产生了关于精神疾病可能病因的新见解。而且,这一研究领域在诊断和治疗方面都具有很大的希望和潜力。如果炎症是与压力相关的抑郁症的核心,那么疗法如何起作用?
神奇的是,诸如认知行为疗法之类的治疗实际上可以降低促炎化学物质的水平。
抗抑郁药的发展引发了精神病学的巨大革命,它们是如何发挥作用呢?
最早的理论之一是它们“填补”了大脑中的神经递质。据认为,5-羟色胺在患有抑郁症的人中很少,因此任何可以增加其在大脑中水平的药物都是有益的。
选择性5-羟色胺再摄取抑制剂(SSRIs)可以使5-羟色胺在大脑中循环,因此可以做到这一点。但是,鉴于SSRI还可以减轻大脑炎症,因此可能需要对该机制进行一些重新解释。
免疫系统异常复杂,我们对此了解甚少,但最近的研究表明,它与抑郁症紧密相关,减轻炎症可以减轻抑郁症。
例如,益生菌可以提供健康的肠道细菌,而抗生素可以破坏有害的肠道细菌。同样,粪便微生物移植可用于将健康和多样的肠道细菌转移给缺乏的细菌。人们开始推测这些可以用于治疗精神疾病。
01
益 生 菌
益生菌已在动物研究中显示出减少炎症细胞因子的作用。发表在《英国营养杂志》上的一项研究描述了一项针对30名患有抑郁症志愿者的试验。
每天给这些沮丧的志愿者补充益生菌补充剂,其中包括乳酸杆菌和双歧杆菌细菌。在试验结束时,他们“显着”减轻了心理困扰的症状,包括抑郁和焦虑。
除补充剂外,酸奶和咸菜等发酵食品还含有益生菌。
02
Omega-3 补充剂
一些研究表明,omega-3补充剂可以有益地影响肠道菌群的组成并增加抗炎化合物(包括脂肪酸)的产生。
肠道微生物,脂肪酸和免疫力可以共同发挥作用,以维持肠道壁的完整性并减少肠道渗漏。
omega-3补充剂可以帮助某些类型的抑郁症。
Omega-3的天然来源包括鱼类,尤其是高脂肪鱼类,例如鲑鱼,沙丁鱼和鲭鱼。
03
益 生 元
如果饮食中不能摄取足够的纤维,那么益生元也会起到类似的作用。这些是人体无法消化的复杂糖,但是肠道微生物可以消化。
04
运 动
要知道久坐对肠和肠道微生物并不友好。如果运动是一种药物,那将价值数百万。目前尚不清楚具体作用机制,但是运动可以提高微生物群的质量。

05
规 律 饮 食
古人云:日出而作,日落而息。
这句话同样适用于你的微生物群,它也具有昼夜节律。如果这两个节奏相互同步,那么生活就是美好的事物。跟着大自然的昼夜节律,对于微生物而言也是非常舒适的节奏。
总而言之,沮丧可能源于悲伤,失落或糟糕的生活。但是它也可能是您的微生物群引起或加剧的,这意味着我们每个人都有机会摆脱困境。善待肠道微生物,你会发现自己的心情可以有所改善。
应当指出,关于精神疾病和肠脑轴的大多数研究都是在啮齿动物上进行的,加利福尼亚大学专家克莱尔·马丁及其同事正确地指出“因果关系的证据仍然很少”。
的确,缺乏双盲随机纵向研究来研究益生菌,抗生素或粪便微生物移植对精神疾病康复的影响。同样,反向因果关系的问题也没有得到充分解决。
例如,与精神疾病相关的生活方式因素和药物的副作用可能导致肠道菌群紊乱和失衡。换句话说,微生物群分布的变化可能是精神疾病的结果,不一定是原因。
但是不管是结果还是原因,精准的了解特定的肠道微生物及其特征与特定的精神疾病之间的关系可能有助于精神病患者的诊断和靶向治疗和个性化治疗有帮助。
相关阅读:
肠道微生物组如何影响运动能力,所谓的“精英肠道微生物组”真的存在吗?
参考文献
Brachman, Rebecca A., Michael L. Lehmann, Dragan Maric, and Miles Herkenham. “Lymphocytes from Chronically Stressed Mice Confer Antidepressant-Like Effects to Naive Mice.” The Journal of Neuroscience 35, no. 4 (January 28, 2015): 1530–38.
Pereira, Joana da Cruz, Kieran Rea, Yvonne M. Nolan, Olivia F. O’Leary, Timothy G. Dinan, and John F. Cryan. “Depression’s Unholy Trinity: Dysregulated Stress, Immunity, and the Microbiome.” Annual Review of Psychology 71, no. 1 (2020)
The Gut-Brain Axis: The Missing Link in Depression. Evrensel A, Ceylan ME.Clin Psychopharmacol Neurosci. 2015 Dec 31;13(3):239-44. doi: 10.9758/cpn.2015.13.3.239.
Fulling, C., Dinan, T.G., & Cryan, J.F. (2019 Mar 20). Gut microbe to brain signaling: what happens in vagus… Neuron. 101(6): 998-1002.
Scott C. Anderson, Stress, Inflammation, and Microbes: A Moody Trinity,2019, Nov, 30
Del Grande da Silva, Giovanna, Carolina David Wiener, Luana Porto Barbosa, Jaciana Marlova Gonçalves Araujo, Mariane Lopez Molina, Pedro San Martin, Jean Pierre Oses, Karen Jansen, Luciano Dias de Mattos Souza, and Ricardo Azevedo da Silva. “Pro-Inflammatory Cytokines and Psychotherapy in Depression: Results from a Randomized Clinical Trial.” Journal of Psychiatric Research 75 (April 2016): 57–64.
Martina Sgritta, Sean W. Dooling, Shelly A. Buffington, Eric N. Momin, Michael B. Francis, Robert A. Britton, Mauro Costa-Mattioli. “Mechanisms Underlying Microbial-Mediated Changes in Social Behavior in Mouse Models of Autism Spectrum Disorder.” Neuron (First published online: December 3, 2018) DOI: 10.1016/j.neuron.2018.11.018
Pan, Ying, Xu-Yang Chen, Qing-Yu Zhang, and Ling-Dong Kong. “Microglial NLRP3 Inflammasome Activation Mediates IL-1β-Related Inflammation in Prefrontal Cortex of Depressive Rats.” Brain, Behavior, and Immunity 41 (October 2014): 90–100.
Jacka, Felice N., Adrienne O’Neil, Rachelle Opie, Catherine Itsiopoulos, Sue Cotton, Mohammedreza Mohebbi, David Castle, et al. “A Randomised Controlled Trial of Dietary Improvement for Adults with Major Depression (the ‘SMILES’ Trial).” BMC Medicine 15, no. 1 (January 30, 2017): 23.
Melanie Greenberg. Feeling Depressed? Gut-Brain Dysfunction May Be to Blame, 2018, Dec 30,
Karen-Anne McVey Neufeld, John Bienenstock, Aadil Bharwani, Kevin Champagne-Jorgensen, YuKang Mao, Christine West, Yunpeng Liu, Michael G. Surette, Wolfgang Kunze & Paul Forsythe. “Oral Selective Serotonin Reuptake Inhibitors Activate Vagus Nerve Dependent Gut-Brain Signalling.” Scientific Reports (First published: October 3, 2019) DOI: 10.1038/s41598-019-50807-8
Christopher Bergland. The Vagus Nerve May Carry Serotonin Along the Gut-Brain Axis, 2019, Oct 06
Christopher Bergland. Vagus Nerve Stimulation Dramatically Reduces Inflammation. 2016, Jul 06,
Sudo, Nobuyuki, Yoichi Chida, Yuji Aiba, Junko Sonoda, Naomi Oyama, Xiao-Nian Yu, Chiharu Kubo, and Yasuhiro Koga. “Postnatal Microbial Colonization Programs the Hypothalamic-Pituitary-Adrenal System for Stress Response in Mice.” The Journal of Physiology 558, no. Pt 1 (July 1, 2004): 263–75.
Dinan, Timothy G., Catherine Stanton, and John F. Cryan. “Psychobiotics: A Novel Class of Psychotropic.” Biological Psychiatry 74, no. 10 (November 15, 2013): 720–26.
Bravo, Javier A., Paul Forsythe, Marianne V. Chew, Emily Escaravage, Hélène M. Savignac, Timothy G. Dinan, John Bienenstock, and John F. Cryan. “Ingestion of Lactobacillus Strain Regulates Emotional Behavior and Central GABA Receptor Expression in a Mouse via the Vagus Nerve.” Proceedings of the National Academy of Sciences 108, no. 38 (September 20, 2011): 16050–55.
Chu, Coco, Mitchell H. Murdock, Deqiang Jing, Tae Hyung Won, Hattie Chung, Adam M. Kressel, Tea Tsaava, et al. “The Microbiota Regulate Neuronal Function and Fear Extinction Learning.” Nature 574, no. 7779 (October 2019): 543–48.
Samoon Ahmad. Schizophrenia and the Gut. 2019, Mar 05,
Xu C, Lee SK, Zhang D, Frenette PS. The Gut Microbiome Regulates Psychological-Stress-Induced Inflammation [published online ahead of print, 2020 Jul 24]. Immunity. 2020;S1074-7613(20)30280-6. doi:10.1016/j.immuni.2020.06.025
VanElzakker, Michael B., M. Kathryn Dahlgren, F. Caroline Davis, Stacey Dubois, and Lisa M. Shin. “From Pavlov to PTSD: The Extinction of Conditioned Fear in Rodents, Humans, and Anxiety Disorders.” Neurobiology of Learning and Memory 113 (September 2014): 3–18.
Scott C. Anderson,Unending Fear and the Gut-Brain Axis,2019,Oct 24
欢迎关注: 谷禾健康
——让你和你的家人更健康