-

 CNAS L23010
CNAS L23010

 国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业
国家高新企业 | ISO9001认证 | 肠道健康精准检测高新技术研发中心 | 专精特新企业 二级病原微生物安全实验室
二级病原微生物安全实验室- 联系电话:+13336028502
- +400-161-1580
- service@guheinfo.com

谷禾健康
乳球菌属(Lactococcus)是一种革兰氏阳性、兼性厌氧、通常不产孢的乳酸菌,形态以球状或成对/短链出现,最早从乳制品与植物表面分离,现被广泛认为是乳制品发酵中的核心功能菌群之一。
其代表物种包括乳酸乳球菌(Lactococcus lactis)及干酪亚种 L.lactis subsp. cremoris 等,在食品工业与人类健康领域均具有重要价值。
乳球菌的代谢能力奠定了其功能基础与应用,其核心特征包括:
糖代谢与产酸能力:可快速降解乳糖、葡萄糖等糖类生成乳酸,降低pH,抑制腐败菌并塑造风味。
蛋白质与肽代谢:具外源蛋白酶与肽转运系统,能将酪蛋白等大分子蛋白分解为功能性肽,提升氨基酸供给,贡献鲜味与生理活性肽(如抗氧化、抗菌与免疫调节肽)。
胆固醇与脂代谢关联:部分菌株通过胆盐水解、吸附/同化胆固醇及调节短链脂肪酸产生,间接影响血脂与肝脂沉积,对代谢综合征相关表型(如葡萄糖耐受不良、胆固醇升高与脂肪堆积)具有干预潜力。
胞外多糖合成:合成与分泌多糖提高食品黏度与持水性,改善产品的口感与质构,同时作为可发酵底物参与肠道微生态与屏障功能调控。
在人体健康方面,乳球菌也可通过多重途径发挥作用:
一是在肠道与微生物群互作,提升黏液层与紧密连接蛋白,强化屏障;诱导抗菌肽与防御素分泌,抑制致病菌定植与增殖。
二是免疫调节,激活树突状细胞并促进 Treg 分化,上调抗炎因子(如 IL‑10、TGF‑β),抑制过度炎症。
三是在代谢健康和营养中的作用,通过糖发酵产生乳酸和短链脂肪酸,改善肠道代谢环境与能量底物利用。部分菌株还具胆盐水解/胆固醇同化能力,对胰岛素敏感性、脂肪堆积等代谢表型有改善趋势。
并有研究发现乳球菌属在多种代谢相关疾病患者体内(如肥胖、脂肪肝)以及炎症性肠病和肠道炎症患者中的丰度呈下降趋势。
综上所述,乳球菌属(Lactococcus)以其代谢能力和对人体健康的益处成为了贯通“食品发酵—肠道微生态—宿主免疫与代谢健康”的关键微生物。
1
细胞形态
乳球菌属(Lactococcus)为革兰氏阳性菌,细胞呈球形或卵圆形,大小约为0.5~1.2 μm × 0.5~1.5 μm,在显微镜下可观察到其典型形态。
在液体培养基中多呈单个、成对或短链排列;形成链状时,细胞常沿链方向伸长。
乳酸乳球菌亚种的扫描电子显微镜照片
doi.org/10.1002/9781118960608.gbm00610
乳球菌属无荚膜、亦不形成芽孢;同时缺乏鞭毛结构,因此不具备运动性。
2
研究历史
乳球菌属的研究历史甚至可以追溯到几百年前。
1780年:从酸牛奶中分离乳酸;
1857年:确认乳酸发酵的微生物本质;
1873年:获得首个纯培养并命名为Bacterium lactis;
1890年代:分离工业用菌株;
1909年:更名为Streptococcus lactis;
1933年:Lancefield血清学分类(N群);
1972年:发现质粒;
1985年:建立Lactococcus新属;
1990年代:浓缩深冻发酵剂技术逐渐成熟。
3
生长环境
温度范围:乳球菌是嗜温菌,适宜生长温度为10-40°C,部分菌株可在7°C下缓慢生长,大部分菌株无法在45°C下生长,但少数菌株可以耐受更高温度。
氧气需求:该属细菌具有兼性厌氧的特性,在有氧和无氧环境下都能生长,不过其代谢途径会因氧含量不同而有所差异。
盐耐受性:多数菌株可在4% NaCl中生长,但L.lactis subsp. cremoris仅耐受2% NaCl。
pH适应性:最适中性pH,生长下限约pH4.5。
主要栖息地:
⑴植物表面:这是许多乳球菌的天然栖息地与起源;
⑵农场动物:家畜乳腺、挤奶与牧场体系,参与乳源微生态交换;
⑶人与动物胃肠道:多为低丰度成员,短暂定植;摄入发酵食品/益生菌后检出率升高;
⑷鱼类与水产环境:部分物种可栖居于鱼类等水产环境,有时用于疾病研究背景;
⑸昆虫肠道:甚至有时可从白蚁、甲虫等分离,显示古老的生态关联。
4
代谢能力
乳球菌(Lactococcus)是一类重要的乳酸菌,具有多种代谢能力,在食品发酵和工业生产中发挥着关键作用。以下是乳球菌属细菌的主要代谢能力总结:
1.糖类代谢
最显著的特征是其高效的乳糖代谢能力。其发酵类型多为同型乳酸发酵,产酸能力较强,发酵效率可达80%-90%。
其可发酵乳糖生成L(+)-乳酸(同型发酵),据报道,在低pH值下生长时可以产生D-(-)-乳酸。
除乳糖外,Lactococcus还能代谢多种糖类,包括:
葡萄糖:通过糖酵解途径直接代谢;
半乳糖:通过Leloir途径代谢;
麦芽糖:部分菌株具有代谢能力;
注:为了最佳生长,乳球菌有时会需要生物素、吡哆醛、叶酸、核黄素、烟酰胺、硫胺素和泛酸。烟酸、泛酸和生物素是必需的。
乳酸乳球菌发酵的基础知识
Gaudu P,et al.Microbiol Spectr.2019
NADH/NAD+ 比率被列为乳酸乳球菌碳代谢选择的核心决定因素。(1)糖发酵产生ATP,用于氨基酸合成代谢。在厌氧条件和快速糖通量下,基本上所有糖都从丙酮酸(糖酵解)转化为乳酸(均乳酸发酵)。当糖通量较慢时,在存在葡萄糖或乳糖以外的糖或有氧生长时,可能会发生混合酸发酵。后一种条件的特点是 NADH/NAD+ 比率低于同乳酸发酵期间发现的比率。除了 NADH 之外,糖酵解还通过糖降解产生 ATP 和丙酮酸。
(2)丙酮酸脱氢酶 (Pdh) 在存在氧气时从丙酮酸中提供额外的 NADH。
(3)乳酸脱氢酶(Ldh)通过将丙酮酸转化为乳酸将NADH氧化为NAD+,从而在发酵过程中保持糖酵解活性。
(4)当氧气存在时,NADH可以被细胞质H2O形成NADH氧化酶(NoxE)氧化,生成NAD+。
(5)ATP酶以牺牲ATP为代价,以排出H+,以避免糖酵解引起的酸化。丙酮酸的积累导致乙酸盐或中性乙偶英和双乙酰的合成。
2.蛋白质代谢
乳球菌(Lactococcus)具有完整的蛋白水解系统,能够有效分解牛奶中的蛋白质:
•细胞壁相关蛋白酶(PrtP)能切割40%以上的肽键,产生100多种不同的寡肽;
•利用三种不同的转运系统摄取二肽、三肽和寡肽;
•细胞内肽酶将肽水解为生长所需的氨基酸;
•脂解酶(酯酶和脂肪酶)在奶酪成熟和风味发展中起有限作用
•多种氨基转移酶可将芳香族和支链氨基酸降解为挥发性芳香化合物。
3.产生细菌素
乳球菌属部分菌株可产生细菌素,这些细菌素具有抗菌活性能抑制一些有害菌生长,比如对李斯特菌有显著抑制效果。
•尼生素(Nisin):由Lactococcus. lactis subsp某些菌株产生的34个氨基酸的小肽。
•II类细菌素:含有高水平的小氨基酸(如甘氨酸),具有疏水结构域。
4.特殊代谢
部分菌株产胞外多糖(EPS),EPS有助于确定发酵乳制品的适当稠度,糖组分通常由半乳糖、葡萄糖和鼠李糖的重复单元组成。
有些乳球菌属菌株还能够利用柠檬酸作为碳源进行代谢,这一特性在发酵乳制品风味形成中发挥着重要作用。
在血红素存在时可进行呼吸代谢(通过细胞色素氧化酶bd)。
5
耐药性
乳球菌属(Lactococcus)细菌通常被认为是安全的微生物,但在某些情况下也可能表现出耐药性和特定的抗生素敏感性。以下是关于乳球菌属耐药性和抗生素敏感性的详细总结:
抗生素敏感性
乳球菌通常对以下抗生素敏感(基于实验室和临床观察):
•β-内酰胺类(如青霉素、氨苄西林)
•大环内酯类(如红霉素)
•林可酰胺类(如克林霉素)。
敏感原因:
缺乏常见的β-内酰胺酶基因(如blaZ)。
细胞壁合成途径对青霉素类敏感。
耐药性
已报道的耐药表型:
•四环素(tetS基因介导)
•氯霉素(cat基因介导乙酰化修饰)
•链霉素(str基因介导腺苷酸化)。
•其他潜在耐药:部分菌株可能通过mdtA外排泵对多种药物(如氟喹诺酮类)产生低水平耐药。
此外,这些基因可能通过水平基因转移从其他革兰氏阳性菌(如李斯特菌、葡萄球菌)获得,表明乳球菌在抗生素压力下可整合外源耐药元件。
噬菌体抗性
乳球菌通过质粒编码的机制抵抗噬菌体感染,包括:
•吸附抑制(阻断噬菌体结合受体);
•DNA注入阻断;
•限制-修饰系统(切割外来DNA);
•牺牲感染细胞以保护群体;
•工业中通过基因工程或筛选抗性菌株应对噬菌体污染。
6
遗传信息及主要菌种
截至2023年,已描述了22种乳球菌(Lactococcus),乳球菌的基因组相对较小,约2.3-2.8Mb,属于革兰氏阳性菌中较小的基因组。
乳球菌物种的系统发育分析
Mahony J,et al.Microb Biotechnol.2023
DNA G+C content (mol%): 34–43%,低于许多其他乳酸菌。
染色体结构:环状染色体,包含约2300-2800个基因,包含:
•糖酵解途径(如ldh基因编码乳酸脱氢酶)
•氨基酸合成(如支链氨基酸操纵子)
•质粒多样性:工业菌株常携带2–10个质粒(大小1–50 kb),功能包括:乳糖代谢(如lac操纵子)、噬菌体抗性(如abi基因簇)、抗生素耐药性(如pK214质粒)等。
▸ 乳酸乳球菌是模式菌种
乳酸乳球菌(Lactococcus lactis)是乳球菌属的模式菌种,包含两个重要亚种:L.lactis subsp. lactis(模式亚种)、L. lactis subsp. cremoris(常用于乳制品发酵)。
▸ 菌属下其他重要物种
Lactococcus garvieae
•常见于水生环境,是鱼类(如虹鳟鱼)的病原菌,引起乳球菌病。
•偶见人类感染案例(如心内膜炎、败血症)。
•耐药性:对青霉素敏感,但部分菌株携带多重耐药质粒(如pK214的同源基因)。
Lactococcus piscium
•分离自鱼类和冷冻海产品,与食品腐败相关。
•低温适应性强(可在4°C生长),是冷藏食品的潜在污染菌。
Lactococcus raffinolactis
•独特特征:可利用棉子糖作为碳源,区别于其他乳球菌。
•常见于植物表面和乳制品中,但工业应用较少。
乳球菌属(Lactococcus)不仅是乳制品发酵中的“重要参与菌”,也在临床前与部分临床证据中展现出多通路的健康促进潜力。
一方面,它们通过产生乳酸,帮助降低肠道局部 pH、抑制部分致病菌,并参与营养物质的初步分解与风味前体的形成;另一方面,部分菌株可产生细菌素、胞外多糖与功能性酶,可能影响黏膜屏障、微生态平衡与免疫应答。
综合多株研究发现,乳球菌通过重塑肠道微生态与代谢(提升短链脂肪酸、改善F/B比、富集 Muribaculaceae/Akkermansia 等有益菌),强化黏膜屏障与免疫稳态(上调 ZO‑1/Occludin/Claudin‑1、抑制 TLR4/NF‑κB、提升 sIgA/IFN 通路),并在代谢健康维度表现出抗肥胖、血脂优化、护肝与胰岛素敏感性改善等综合效应。
此外,特定菌株还涉及肠—脑轴调节(缓解内脏高敏、平衡 5‑HT 代谢)和脂质组学“去促炎化”(降低花生四烯酸相关氧脂素)。
1
调节肠道菌群
研究显示,乳球菌属(Lactococcus)可调节肠道微生群。其中,Lactococcus garvieae CF11通过“提升短链脂肪酸—重塑群落结构—增强代谢通路”多重机制改善肠道微生态。
▸ 提升物种丰富度与多样性,重塑群落结构
研究发现,补充 L.garvieae CF11 后,肠道 α 多样性显著提升:Observed_OTUs、PD_whole_tree、Shannon 指数均增加(p<0.05p<0.05)。
同时,β 多样性亦发生分离:加权 UniFrac 聚类显示实验组与对照组群落清晰区分,提示 CF11 重塑了整体群落结构。
同时还纠正年龄相关与炎症相关的F/B比异常(在老龄与老龄性结肠炎模型中均得到改善)。
▸ 富集产酸有益菌,抑制机会致病菌
属水平显著变化:Oscillospira、Coprococcus、Ruminococcus、Desulfovibrio、Dorea,以及科水平的 Lactobacillaceae、Streptococcaceae显著增加。
其中Oscillospira、Coprococcus、Ruminococcus 为重要的短链脂肪酸(乙酸/丙酸/丁酸)生产者。
门水平变化:Bacteroidetes 与 Proteobacteria比例上升,Firmicutes相对下降;同时家族层面 Ruminococcaceae 比例显著调整。
▸ 提高短链脂肪酸(SCFAs)产量
补充 L.garvieae CF11 后粪便短链脂肪酸显著升高:乙酸、丙酸显著增加,丁酸也上升。
功能推断:富集与丙酮酸发酵、乙酰辅酶A生成乙酸、琥珀酸/丙二醇生成丙酸相关的代谢通路,提示从碳水化合物与氨基酸发酵到乙酸/丙酸的转换被增强。
▸ 可能与健康相关作用
短链脂肪酸增加与产酸菌富集相互促进,推动代谢通路(糖酵解到丙酮酸、乙酰辅酶A、琥珀酸/丙二醇)活性提高,稳固健康型功能网络。
并且更高的乙酸/丙酸水平与能量代谢、抗氧化、免疫调节、屏障功能维护等相关。
2
增强肠道屏障
研究还表明,Lactococcus lactis HF08 具有肠道屏障保护作用,体现在:
▸ 强化紧密连接与上皮结构
上调紧密连接蛋白:在结肠中显著提高 Claudin‑1、Occludin‑1、ZO‑1 表达。
Lactococcus lactis HF08配合后生元能使紧密连接与桥粒清晰可见,单独Lactococcus lactis HF08也可使紧密连接蛋白变窄但连续,均优于未干预模型。
注:桥粒是角质形成细胞间连接的主要结构。
▸ 降低肠道通透性、修复屏障功能
血清FITC-葡聚糖与二胺氧化酶显著下降(老龄和老龄性结肠炎模型中均成立);在结肠炎模型中,Lactococcus lactis HF08配合后生元后降幅更大。
组织学改善:减少隐窝破坏、杯状细胞丢失与炎性浸润。
▸ 促进代谢支持屏障
Lactococcus lactis HF08还能够提升乙酸、丙酸、丁酸与总短链脂肪酸;短链脂肪酸与紧密连接蛋白呈正相关、与通透性和炎症指标呈负相关。
3
缓解肠易激综合征
在大鼠模型中发现,Lactococcus cremoris PS133对肠易激综合征(IBS)表现出多层面的改善作用,主要结论如下:
▸ 减轻症状与痛觉敏感
降低内脏高敏感性:经口补充14天后,PS133能显著阻断5-HTP诱发的结直肠胀气(CRD)致痛反应上升,提示对IBS核心表型(内脏高敏)有缓解作用。
▸ 保护肠黏膜屏障
保护并恢复黏液层:PS133可逆转5-HTP与CRD导致的结肠黏蛋白减少,黏液阳性面积显著增加。
提升紧密连接蛋白:PS133显著提高结肠上皮occludin与ZO-1水平与分布,提示降低通透性、强化屏障功能。
▸ 影响肠–脑轴与神经递质
脊髓疼痛相关神经肽:PS133显著降低Substance P(P物质)免疫反应强度,指向痛觉传导的下调。
脑内5-HT代谢:在前额叶与下丘脑,5-HTP使5-HT与其代谢产物5-HIAA升高及其比值改变;PS133有趋向性纠正(部分指标显著、部分为趋势),整体显示对5-HT/5-HIAA平衡具有调节潜力。
▸ 临床启示
在5-HTP诱导的肠易激综合征动物模型中,L.cremoris PS133可显著减轻内脏高敏,增强肠屏障,调节疼痛相关神经肽与5-HT代谢,并重塑特定肠菌群,显示其作为潜在益生干预的多通路作用前景。
4
调节免疫功能
乳球菌属(Lactococcus)具有菌株依赖的免疫调节活性,可通过先天免疫、黏膜免疫与体液/细胞免疫多层面协同,影响宿主免疫稳态。
▸ 先天免疫与树突状细胞激活
部分菌株(如 JCM5805)可被浆细胞样树突状细胞识别,经 TLR9 诱导 I/III 型干扰素,增强抗菌抗病毒防御(小鼠 mPIV 模型中存活率上升、肺部病理评分下降)。
同时促进巨噬细胞与 NK 细胞活性和吞噬功能,并上调 TNF‑α、IL‑6、IL‑12、IFN‑γ 等效应细胞因子(菌株依赖)。
▸ 黏膜免疫与屏障
在肠道等黏膜位点提升 sIgA/IgA,应增强 GALT 介导的局部免疫与病原阻断。
部分菌株还可抑制上皮炎性趋化因子(如 NCDO2118 抑制IL‑8),有助于缓解肠黏膜炎症。
▸ T细胞极化与过敏调节
倾向促进Th1相关细胞因子(IFN-γ、IL-12),同时下调IL-4/IgE通路,减轻IgE介导的过敏反应(如C59、G50、A17表现为升IgG2a/IFN-γ、抑制IgE)。
宿主与乳酸乳球菌之间的相互作用
Wu F,et al.World J Microbiol Biotechnol.2023
▸ 体液免疫与抗体谱
JCM5805还能提升特异性 IgA/IgG 水平;利用重组载体表达外源抗原,可在多个组织与黏膜部位诱导 IgA 与 IgG 的产生,同时动员并激活 CD4+ 与 CD8+ T 细胞,促进效应与记忆反应的建立与维持。通过这一策略,不仅增强体液免疫,还促进细胞免疫协同,形成更广泛且持久的免疫保护。
5
改善代谢健康
研究发现,在高脂高糖/西式饮食或高脂饮食模型中,Lactococcus(尤其是L.lactis subsp. cremoris ATCC 19257 与 L.lactis subsp. lactis LL‑1)可显著缓解体重增长、脂肪沉积、血脂异常与肝脏脂肪变;改善葡萄糖耐量和胰岛素敏感性;并通过调节肠道菌群与代谢产物,重塑宿主代谢网络,呈现抗肥胖、降脂与护肝效应。具体代谢改善如下:
▸ 减少体重与脂肪沉积
西式饮食下补充L.lactis subsp. cremoris ATCC 19257显著降低体重增长、BMI与内脏/系膜脂肪,且进食不增;呼吸交换率(RER)下降,提示底物利用向脂肪氧化倾斜。
▸ 降低血脂与胆固醇
L.cremoris有助于降低血清 TC、TG、LDL‑C,升高 HDL‑C(LL‑1);L.cremoris 将总胆固醇降至接近对照水平,且不改变粪便中中性甾醇,提示作用主要来自“吸收后”的宿主代谢重编程,而非肠腔吸收抑制。
Naudin CR,et al.Gastroenterology.2020
▸ 影响糖代谢与胰岛素敏感性
L.lactis可以改善葡萄糖耐量;纠正西式饮食诱导的 GIP 异常升高;降低胰岛素抵抗标志物 resistin。
注:抵抗素(Resistin)是一种富含半胱氨酸的来源于脂肪的肽激素,加速了动脉中低密度脂蛋白的积累。
▸ 改善肝脏与NAFLD相关指标
补充L.lactis可降低肝重并减少脂滴粒径,同时减轻肝脏炎症反应;此外,肝组织中炎性灶的面积与数量均下降,整体提示肝脏病理损伤得到缓解与改善。
同时整体表明对高脂饮食诱导的肝脏氧化应激与组织损伤具有保护作用,并有助于恢复肝功能指标至更趋正常的范围。
6
抗菌、抗高血压
乳球菌(Lactococcus)可作为“细胞工厂”,利用多种食源蛋白生产具免疫调节、抗菌与降压活性的生物活性物质。
▸ 降低动脉粥样硬化风险
其蛋白酶系统可生成 ACE 抑制剂,用于辅助控制高血压。作为辅助疗法,乳酸乳球菌可预防高胆固醇血症:在高胆固醇小鼠中显著降低动脉粥样硬化指数,提示具临床转化潜力。
▸ 抗炎、甚至有抗肿瘤作用
在健康肠道中,乳酸乳球菌(L.lactis)与宿主共生。表达胰腺炎相关蛋白(PAP,参与肠道稳态)的重组乳酸乳球菌 NZ9000 能预防小鼠黏膜炎;多株L.lactis还可抑制特定生态位病原定植,提示对黏膜炎具有潜在益处。
自然分离的 IBB109 与 IBB417 等菌株在细胞与小鼠肠道模型中表现出抗炎作用,可通过上调空肠 IL‑17、IL‑18、IL‑22,TLR2/5/6,以及 MyD88(MDPC88)调节肠道免疫。其通过重塑宿主微生物群调节免疫,降低肠易激综合征、腹泻与阴道感染风险。乳球菌亦被开发为多种药物,用于治疗人和动物的消化系统疾病;有研究显示其可用于癌症治疗并诱导 IL‑12 表达。
编者小结
乳球菌属(Lactococcus)对人体健康的主要益处体现在多个层面:
一是维持肠道微生物群平衡,促进有益菌群与短链脂肪酸(如乙酸、丙酸、丁酸)生成,滋养肠上皮、强化黏膜屏障并改善消化与代谢;
二是免疫调节,能下调促炎通路、增强抗菌肽与免疫细胞功能,从而降低炎症性肠病等肠道炎症风险并减轻相关症状;
三是代谢健康支持,包括帮助调节血脂与血糖、降低脂肪沉积与肝脂毒性、改善肝功能与胰岛素敏感性;
四是抗菌与安全替代潜力,部分菌株对致病菌有抑制作用,有助于减少抗生素依赖。
总体而言,乳球菌作为食品级益生菌,具有良好安全性与广泛应用前景,但具体效果依菌株与个体而异,仍需结合高质量临床证据与个体化使用。
1
胃癌患者中相对减少
证据强度:较高
在胃癌(GC)患者的肿瘤微环境与邻近非癌组织的配对比较中,乳球菌属(Lactococcus)在非癌组织中更为富集,而在癌组织中相对减少。
LEfSe分析显示:Lactococcus及其物种 Lactococcus lactis 为非癌组织的富集分类单元;相反,癌组织中富集的多为口源相关致病或条件致病菌(如 Streptococcus、Peptostreptococcus、Fusobacterium 等)。
2
结直肠癌患者手术后丰度增加
证据强度:较高
在未补充益生元的结直肠癌(CRC)患者中,手术后 Lactococcus(乳球菌属)相对丰度显著上升(术前约0.02%→术后约2.40%),与 Enterococcus、Streptococcus、Bacillus 等共生/机会致病菌同步上升,提示手术应激可推动部分兼性/共生菌群扩增与群落失衡。
在补充益生元的患者中,术后未观察到 Lactococcus 的显著上升,提示短期益生元干预对手术相关的 Lactococcus 扩增具有一定“缓冲/稳定”作用。
3
溃疡性结肠炎患者中丰度降低
证据强度:较高
在俄罗斯中欧地区的溃疡性结肠炎(UC)患者中,Lactococcus(乳球菌属)相对丰度显著降低(约降幅 5.9 倍),与健康对照相比呈一致性下行。
该下降与多种潜在有益/共栖菌的减少相伴(如 Butyricimonas、Fusicatenibacter等产丁酸菌),而与多种与炎症相关或条件致病菌的上升相对(如 Haemophilus、Prevotella、Peptostreptococcus 等)。
结合文献,Lactococcus具备潜在抗炎与免疫调节作用;其在UC中的降低或反映了黏膜屏障与免疫稳态受损的微生态特征。
4
肥胖患者中丰度降低
证据强度:较高
小鼠与人群的研究均显示,在肥胖及代谢紊乱个体中,乳球菌属(Lactococcus)的相对丰度普遍偏低;与此同时,补充乳酸乳球菌(Lactococcus lactis Subsp. lactis LL-1)以及并行使用的Lacticaseibacillus paracasei LP-16,能够通过调节肠道微生物群组成与相关代谢物谱,进而带来抗肥胖效果并降低血脂水平。
5
帕金森病中升高
证据强度:一般
在帕金森病(PD)小鼠模型中,肠道微生物群发生显著重塑:PD组乳杆菌科(Lactobacillaceae)、链球菌科(Streptococcaceae)等升高,而拟杆菌门下降、部分拟杆菌科与瘤胃球菌科类群减少。
就属水平看,PD 组中 Lactococcus(乳球菌属)相对丰度明显上升。而有氧运动训练(AET)可以使Lactobacillaceae 相对丰度下降。
6
缺铁性贫血患者口腔中丰度上升
证据强度:一般
在缺铁性贫血(IDA)患者的口腔微生物组中,Lactococcus(乳球菌属)相对丰度较健康对照发生改变。Lactococcus 在 IDA 组呈显著升高(作为差异丰度属被标注为在患者组富集/上调)。
Lactococcus在 IDA 患者中相对丰度显著升高,并具统计学意义;这一上升常与其他口腔兼性/发酵菌(如部分 Lactobacillus、Streptococcus)同步,反映铁缺乏环境下的生态位重排。
铁限制可选择性影响口腔菌群代谢策略与竞争格局。Lactococcus 作为兼性发酵菌,在低铁环境中可能具有一定适应优势,从而在 IDA 患者口腔中相对扩增。
乳球菌作为益生菌
乳酸乳球菌(Lactococcus lactis)作为益生菌应用前景广阔,已被广泛认可,列入“全球公认安全”(GRAS)与欧洲食品安全局的“合格安全推定”(QPS)清单。
▸ 具有改善代谢健康和降压等有益作用
乳酸乳球菌作为多功能细菌,部分亚种具有有益效应。L. lactis W19与 W58 可通过重塑肠道微生物群改善宿主代谢健康,涉及肥胖与心血管疾病。
此外,由野生型乳酸乳球菌 NRRL B-50,571 和 NRRL B-50,572 单独或共同发酵的牛奶在体外可抑制血管紧张素转化酶活性;这些发酵乳在自发性高血压大鼠中还表现出降压、降脂与降低心率的作用。
▸ 抑制肿瘤生长
经修饰表达肿瘤坏死因子相关凋亡诱导配体(TRAIL)的乳酸乳球菌(L. lactis hsTRAIL+)可诱导人结直肠癌细胞系 HCT116 与 SW480 凋亡,并在体外抑制 HCT116 肿瘤球生长。
▸ 增强免疫能力
乳酸乳球菌 RWP-3 与 RWP-7 能发酵多种碳水化合物并分泌多类胞外酶,且在摄入与胃肠道不利条件下仍保持活性。乳酸乳球菌 PTCC 1403 具备显著抗病能力。乳酸乳球菌 L19 可调节先天免疫、促进生长与食物消化,广泛用于乳制品发酵加工;其通过刺激肠黏膜、粘附定植并增强宿主免疫,提升生长性能、体液免疫并降低病原体负担。
乳球菌在食品中的应用
▸ 保护食品免受病原菌污染
研究显示,乳酸乳球菌产生的抗菌物质可作为天然屏障,有效防止病原体和腐败菌导致的食品变质。乳球菌在乳制品中应用时,通过下调葡萄球菌主要毒力调控器 AGR 系统抑制肠毒素生成,从而预防金黄色葡萄球菌食物中毒。它们亦可作为奶酪、酱料和罐头食品的天然防腐剂与抗肉毒毒素剂。
▸ 用于生产奶酪等乳制品
乳酸乳球菌对于乳清和奶酪等乳制品的制造至关重要。当乳酸乳球菌被添加到牛奶中时,细菌使用酶从乳糖中产生能量分子(ATP)。ATP能量产生的副产品是乳酸。细菌产生的乳酸使牛奶凝结,然后将其分离形成用于制作奶酪的凝乳。用于生产许多奶酪,包括布里干酪、卡门培尔奶酪、切达干酪、科尔比奶酪、格鲁耶尔干酪、帕尔马干酪和羊乳干酪。
▸ 改善质地和风味,产生发酵食品
据报道,部分乳球菌产生的胞外多糖可提高黏度与硬度、改善质地,使低脂产品更可口且更易吸收利用。此外,乳球菌还用于发酵腌制蔬菜、啤酒、葡萄酒、部分面包及其他食品。
乳球菌的其他应用
▸ 用于疫苗生产
乳酸乳球菌(L.lactis)因其作为蛋白载体的优势而备受关注。借助抗原递送系统,乳酸乳球菌 BFE920 可作为黏膜佐剂,诱导强烈的促炎免疫反应,从而在表达目标抗原时发挥显著疫苗效应。
作为活载体,乳酸乳球菌已用于递送多种抗原与蛋白,包括单核细胞增生李斯特菌的 LLO、SARS‑CoV 核壳蛋白、破伤风毒素 C 片段(TTFC)及幽门螺杆菌 Cag12 抗原。近期研究显示,表达戊型肝炎病毒(HEV)衣壳抗原的重组菌株可经口触发黏膜与系统免疫,提供宿主保护。
▸ 用于基因工程
除在疫苗中的重要作用外,乳酸乳球菌亦广泛用于基因工程。其基因组已完全测序、体积小(约2.3Mbp),并具成熟的克隆系统,因而成为理想的工作模型。
研究者已构建可产生并释放分枝杆菌 Hsp65 的转基因乳酸乳球菌。Hsp 为多种免疫细胞与共生菌表达的免疫显性热休克蛋白。口服给予该转基因菌释放的 Hsp65 可完全预防小鼠诱导性结肠炎,提示其有望为人类炎症性肠病的长期管理提供替代方案。
乳球菌可能存在的隐患
尽管乳球菌通常被视为安全,但仍可能存在一定的安全隐患。
▸ 一些菌株可能携带毒力基因
自1974年起即有乳酸乳球菌感染人类的报告,最初被误分类为人克雷伯菌,现已确认为乳球菌属成员。尽管其对健康人通常无害,但携带毒力基因的临床分离株可在有基础疾病者中致病。
其致病性与对人体组织与胃肠道的黏附相关,已发现与心内膜炎相关的毒力基因 efaA,以及编码参与生物膜形成的表面蛋白基因 esp;此外,一些菌株产生具 β 溶血作用的细胞溶素,进一步提高心内膜炎风险。
▸ 极少情况下可能引起脓肿或菌血症
个案报道包括:一名27岁男性出现右季肋痛逾10天,后确诊为由乳酸乳球菌引起的罕见肝脓肿,诊疗与其他脓肿相同。
另有两名婴幼儿首发感染表现为慢性腹泻:其一为5个月男婴(新生期肠扭转手术与回肠造口后)并发乳酸乳球菌相关慢性腹泻与菌血症;其二为6个月女婴导管相关血流感染后出现慢性腹泻。两例均经静脉万古霉素治愈。
此外,一名患唐氏综合征与Hirschsprung症(先天性巨结肠症)的1岁男童在消化道手术后发生导管相关乳酸乳球菌菌血症。
需注意,乳酸乳球菌在临床上可致显著感染,且与链球菌、肠球菌形态学相近,易被误判,可能导致早期分离株被误归类。
建议在特定人群(如免疫功能低下者、重症患者、装有植入式医疗器械者)中谨慎评估其使用风险,并加强菌株鉴定与质量控制。
主要参考文献
doi.org/10.1002/9781118960608.gbm00610
Liu X, Ma Y, Guan K, Liu R, Mao K, Xu X, Li Q, Wang R. Intestinal barrier, immunity and gut microbiota-based protective effects of Lactococcus lactis HF08 and its postbiotic derivative on aging and aging colitis mice. Food Res Int. 2024 Dec;197(Pt 1):115164.
Deng FS, Lin MH, Huang CL, Wu CC, Lu CL, Tsai YC. Effects of Lactococcus cremoris PS133 in 5-Hydroxytryptophan-Induced Irritable Bowel Syndrome Model Rats. Int J Mol Sci. 2025 Mar 10;26(6):2464.
Naudin CR, Maner-Smith K, Owens JA, Wynn GM, Robinson BS, Matthews JD, Reedy AR, Luo L, Wolfarth AA, Darby TM, Ortlund EA, Jones RM. Lactococcus lactis Subspecies cremoris Elicits Protection Against Metabolic Changes Induced by a Western-Style Diet. Gastroenterology. 2020 Aug;159(2):639-651.e5.
Gao P, Nie Y, Zhao L, Zhang J, Ge W. Lactococcus lactis Subsp. lactis LL-1 and Lacticaseibacillus paracasei LP-16 Influence the Gut Microbiota and Metabolites for Anti-Obesity and Hypolipidemic Effects in Mice. Antioxidants (Basel). 2025 May 1;14(5):547.
Mahony J, Bottacini F, van Sinderen D. Towards the diversification of lactococcal starter and non-starter species in mesophilic dairy culture systems. Microb Biotechnol. 2023 Sep;16(9):1745-1754.
Gaudu P, Yamamoto Y, Jensen PR, Hammer K, Lechardeur D, Gruss A. Genetics of Lactococci. Microbiol Spectr. 2019 Jul;7(4):10.1128/microbiolspec.gpp3-0035-2018.
Frelet-Barrand A. Lactococcus lactis, an Attractive Cell Factory for the Expression of Functional Membrane Proteins. Biomolecules. 2022 Jan 22;12(2):180.
Papadimitriou K, Alegría Á, Bron PA, de Angelis M, Gobbetti M, Kleerebezem M, Lemos JA, Linares DM, Ross P, Stanton C, Turroni F, van Sinderen D, Varmanen P, Ventura M, Zúñiga M, Tsakalidou E, Kok J. Stress Physiology of Lactic Acid Bacteria. Microbiol Mol Biol Rev. 2016 Jul 27;80(3):837-90.
Chen XH, Wang A, Chu AN, Gong YH, Yuan Y. Mucosa-Associated Microbiota in Gastric Cancer Tissues Compared With Non-cancer Tissues. Front Microbiol. 2019 Jun 5;10:1261.
Xie X, He Y, Li H, Yu D, Na L, Sun T, Zhang D, Shi X, Xia Y, Jiang T, Rong S, Yang S, Ma X, Xu G. Effects of prebiotics on immunologic indicators and intestinal microbiota structure in perioperative colorectal cancer patients. Nutrition. 2019 May;61:132-142.
Gryaznova MV, Solodskikh SA, Panevina AV, Syromyatnikov MY, Dvoretskaya YD, Sviridova TN, Popov ES, Popov VN. Study of microbiome changes in patients with ulcerative colitis in the Central European part of Russia. Heliyon. 2021 Mar 10;7(3):e06432.
Fan T, Li X, Zhang X, Zhang J, Sun L, Chen J, Fu C. Influence of aerobic exercise training on mice gut microbiota in Parkinson’s disease. Turk J Biol. 2022 Apr 25;46(4):288-297.

谷禾健康
当我们坐在餐桌前,精心挑选着盘中的食物时,一个常常被忽略的事实是:我们并非独自在享用这顿美餐。在我们的身体内部,一个无比繁华、拥挤而又充满活力的微观世界——肠道菌群,正翘首以盼,等待着我们送去的“补给”。这个由数万亿个细菌、真菌、病毒和古菌组成的复杂生态系统,其细胞总数甚至超过了我们自身的人体细胞,基因数量更是人类基因组的百倍以上。因此,科学家们形象地将其称为人体的“第二基因组”或“隐形器官”。
那么,究竟是什么决定了这个“隐形器官”的构成与功能?虽然遗传、年龄、生活方式及药物等多种因素都有关联,但研究普遍指出,饮食是最关键的驱动力。我们的食物不仅为自身提供能量和营养,也直接影响肠道微生物的“口粮”,不同食物成分会选择性促进不同微生物的生长,正如施用不同肥料会催生出不同的花草组合一样。
在众多营养素中,碳水化合物(尤其是膳食纤维)和脂肪对肠道菌群的影响已有深入研究,而蛋白质这一生命基础营养素,其调节肠道菌群的作用却长期被忽视。
我们都知道蛋白质对构建肌肉、修复组织、维持生命活动至关重要,但我们摄入的蛋白质究竟如何与肠道菌群互动?更重要的是,不同来源的蛋白质——例如,一块牛排(动物蛋白)与一盘扁豆(植物蛋白),会对我们体内的微观生态系统产生截然不同的影响吗?
这正是我们今天要深入探讨的核心问题。本文是基于最近发表在bioRxiv平台、题为《膳食蛋白源塑造肠道微生物结构和预测功能:一项结合机器学习的Meta分析》的重磅研究,为我们揭开提供了迄今为止较为全面、系统化的线索。
该研究巧妙地运用了Meta分析,汇集了全球范围内多项独立研究的数据,并通过前沿的机器学习算法进行深度挖掘,以前所未有的广度和精度,描绘出动物蛋白与植物蛋白在肠道菌群世界里投下的不同“身影”。
接下来,我们将解读这项研究的核心发现,包括动物蛋白和植物蛋白如何影响菌群的多样性与结构,不同饮食下的代表菌种,以及这些变化如何通过代谢功能影响我们的长期健康。
这不仅是对前沿科学的探索,也为我们的饮食选择带来了全新的认知。
在深入探讨研究的具体发现之前,先了解一下此次研究使用的两大“工具”:Meta分析(Meta-Analysis)和机器学习(Machine Learning)。
理解了它们的工作原理,我们才能更深刻地体会到这项研究结论的科学分量与可靠性。
1
Meta分析:站在巨人肩膀上看得更远
关于“不同蛋白质对肠道菌群的影响”,全球许多研究团队曾独立开展实验,
例如:
A研究组可能招募了20名志愿者,让他们分别食用富含牛肉和富含豆类的饮食;
B研究组则可能在小鼠身上测试了乳清蛋白和豌豆蛋白的效果;
C研究组的研究对象则可能是另一群不同文化背景的人。
每一项研究由于其样本量、实验设计、测量方法和地域人群的差异,得出的结论可能不尽相同,甚至有时会相互矛盾。例如,A研究发现动物蛋白显著降低了某种细菌,而B研究可能发现没有显著变化。这会让公众和政策制定者感到困惑:我们到底该相信谁?
Meta分析正是为应对这种问题而设立的统计方法。它并非进行新实验,而是系统收集并整合同一主题下尽可能多的高质量独立研究,利用统计工具合并与再分析这些数据,从而得出更具代表性和可信度的综合结论。
◮ Meta分析有三大优势:
增大样本量:通过合并多个研究,原本几十、几百的样本量可以瞬间扩大到成千上千,极大地提高了统计功效,使得我们能够洞察到在单个小规模研究中难以发现的、更细微但真实存在的效应。
解决不一致性:它可以评估不同研究结果之间的差异程度(即“异质性”),并探究造成这种差异的原因(例如,可能是因为研究对象的年龄不同,或是干预时间长短不一)。
提高结论的普遍性:因为数据来自不同地区、不同人群、不同实验条件,所以Meta分析得出的结论往往比任何单一研究更具普遍适用性。
在本研究中,作者首先进行了大规模文献筛选,在数千篇论文中,依据严格标准最终选取了13项高质量的人类干预研究,构建了总计近600个样本的数据集。
2
机器学习:从海量数据中挖掘模式的智能算法
收集到了海量数据仅仅是第一步。肠道菌群的数据是出了名的高维度、高复杂度。每个人的肠道里都可能有成百上千种不同的细菌,它们的丰度(数量多少)各不相同。面对这样一个由无数变量构成的复杂矩阵,传统的统计方法有时会显得力不从心。
◮ 机器学习对于数据统计和处理更高效
这时,机器学习就是重要的工具了。作为人工智能的一个分支,机器学习算法尤其擅长在看似杂乱无章的海量数据中,自动学习并识别出隐藏的模式和规律。它不像传统统计学那样需要研究者预先设定严格的假设,而是能够以一种更加“开放”和“探索性”的方式,让数据自己“说话”,以上两种方法也是谷禾健康构建人群肠道菌群数据库和识别菌群与健康以及营养的重要工具。
本研究主要采用了“随机森林”模型。可以这样理解:
如果我们想训练医生仅凭肠道菌群组成判断病人偏好动物蛋白还是植物蛋白,可先搭建一棵决策树:医生依次提问,例如“普雷沃氏菌丰度是否超过X?”、“拟杆菌丰度是否低于Y?”,通过一系列“是”或“否”,最终给出饮食类型诊断。
但单棵决策树容易因偶然因素产生偏误,就像初学医生容易过拟合少数病例一样。
为了避免这个问题,“随机森林”模型同时构建了成百上千棵这样的决策树,形成一片茂密的“森林”。它的高明之处在于“随机”二字:
通过这两个“随机”过程,保证了森林里的每一棵树都是独一无二、各具特色的。当需要做出最终判断时,模型会让森林里的每一棵树都进行一次独立的投票,然后采纳“少数服从多数”的原则,得出最终的、最稳健的分类结果。这就像一个由数百位不同背景、不同专长的医生组成的专家委员会进行会诊,其诊断结果自然远比单个医生更加准确和可靠。
◮ 随机森林的特点
样本随机:在构建每一棵树时,都不是使用全部的样本数据,而是从总样本中随机抽取一部分(有放回抽样)。
特征随机:在每个决策节点上选择“提问”的菌种时,也不是从所有菌种里挑选,而是随机抽取一部分菌种作为候选。
更妙的是,随机森林模型在完成分类任务后,还能告诉我们,为了做出准确的判断,它最依赖哪些“线索”。也就是说,它能计算出每一种细菌(即“特征”)对于区分“动物蛋白”和“植物蛋白”饮食模式的重要性得分。得分越高的细菌,就越有可能是区分两种饮食模式的“生物标志物”(Biomarker)。
通过将Meta分析的宏观整合能力与机器学习的微观挖掘能力相结合,这项研究得以在坚实的数据基础上,可以更系统地回答了文章开头提出的核心问题。
现在,让我们正式进入研究的重要发现环节。
在评估一个生态系统的健康状况时,通常会关注两个核心指标:
一是物种的丰富度与均匀度,即生态系统内物种数量多不多,分布均不均匀(对应谷禾健康报告里的多样性分值);
二是物种的组成结构,即这个生态系统主要由哪些类型的物种构成。对于肠道这个微观生态系统而言,这两个指标分别对应着α-多样性(Alpha Diversity)和β-多样性(Beta Diversity)。
1
α-多样性:肠道菌群的“贫富”指数
α-多样性用于衡量单个样本内微生物多样性的“丰富”和“均衡”程度。较高的α-多样性通常代表更健康的肠道生态,意味着功能更稳定、韧性更强,更能抵御外部干扰,如饮食变化或抗生素影响。就像物种繁多的雨林比单一农田更能抵抗病虫害。
那么,动物蛋白和植物蛋白饮食,谁更能促进肠道菌群的“共同富裕”呢?以往,一些小规模的研究在这个问题上存在争议。但这次,通过Meta分析整合了13项研究的庞大数据后,答案变得清晰起来。
◮ 摄入动物蛋白与植物蛋白α多样性的差异不大
研究结果显示,与摄入动物蛋白(如乳清、牛肉、猪肉)相比,摄入植物蛋白(如大豆、豌豆、藜麦)的受试者,其肠道菌群的α-多样性没有发生显著变化,甚至在某些指标上呈现出增加的趋势。
这一发现非常重要。它有力地反驳了一些人担心的“植物蛋白饮食可能会导致肠道菌群变得单一”的观点。恰恰相反,富含植物蛋白的饮食模式,至少在维持甚至提升肠道菌群多样性方面,表现出了与动物蛋白饮食相当甚至更优的潜力。
这背后的原因我们将在后文深入探讨,但一个关键因素在于,植物蛋白往往与一位“黄金搭档”——膳食纤维——相伴相生。这些纤维是许多有益肠道细菌的“顶级美食”,能够有力地支撑起一个物种繁盛的菌群环境。
2
β-多样性:划分肠道菌群的“派系”
如果说α-多样性关注的是菌群的“丰富程度”,那么β-多样性则衡量不同样本间微生物群落结构的差异。如果两组样本(如动物蛋白组和植物蛋白组)β-多样性差异显著,说明各自肠道菌群已经形成了截然不同的“派系”。
◮ 动物蛋白饮食下的菌群与植物蛋白的截然不同
在这项研究中,这正是最显著的发现之一。分析结果明确无误地显示,动物蛋白饮食和植物蛋白饮食塑造出了两种显著不同的肠道菌群结构。这意味着,如果你长期以动物蛋白为主食,你的肠道菌群整体面貌,将会与一个长期以植物蛋白为主食的人,有着清晰可辨的巨大差异。
为直观展示这种差异,研究者使用主坐标分析(PCoA)作图,每个点代表一个人的肠道菌群,点间距离反映差异大小。结果显示,动物蛋白组和植物蛋白组的样本在图上分成两个清晰分离的“星团”。
这一发现具有里程碑式的意义。它证实了膳食蛋白的“来源”,而不仅仅是“数量”,是决定我们肠道菌群生态类型的关键变量。你的餐盘上放的是牛排还是豆腐,正在以一种超乎想象的深度,重塑着你体内那个庞大的微生物帝国。
但问题也随之而来:这两个不同的菌群“派系”,究竟是由哪些具体的细菌成员构成的?又是哪些“关键先生”造成了如此显著的差异?这就要依靠机器学习的强大威力来找出了。
随机森林模型不仅能准确区分两种饮食模式,还给出了区分动物蛋白与植物蛋白饮食最关键的细菌“标志物”名单,这些细菌对于理解不同蛋白来源如何影响肠道菌群至关重要。
研究筛选出多种在两种饮食下丰度明显不同的“核心细菌”,其中值得关注的有:
1
动物蛋白饮食的“拥护者”
在摄入动物蛋白后,一些偏爱在富含蛋白质和脂肪环境中生长的细菌丰度显著增加。这些细菌通常被认为是“蛋白质发酵型”或“腐生菌”,它们擅长分解蛋白质和氨基酸,但其代谢产物有时可能对宿主健康构成潜在风险。
◮ Alistipes和Bilophila——动物蛋白饮食富集
Alistipes(另枝菌属)和Bilophila(嗜胆菌属):这两种菌是动物蛋白饮食下典型的富集菌。Alistipes属的某些菌株与肠道炎症和一些情绪障碍有关联。Bilophila wadsworthia则更为糟糕,它能利用动物性饮食中常见的含硫氨基酸(如牛磺酸,在红肉和海鲜中富含)产生硫化氢(H₂S)。
低浓度的硫化氢对肠道粘膜有保护作用,但过量产生则会破坏肠道屏障,诱发炎症,被认为是炎症性肠病(IBD)的一个潜在触发因素。关于这两种菌详见:
肠道重要菌属——另枝菌属(Alistipes),调节炎症情绪等的潜力菌
肠道重要菌属——嗜胆菌属 (Bilophila)喜欢脂肪、耐胆汁的促炎菌
◮ 动物蛋白饮食还能提升拟杆菌丰度
Bacteroides(拟杆菌属):这是一个庞大且复杂的菌属,主要为革兰式阴性菌,在西方化饮食(高蛋白、高脂肪)人群的肠道中通常占据主导地位。它们是多面手,既能利用碳水化合物,也能分解蛋白质。
动物蛋白饮食能够显著提升它们的丰度。虽然Bacteroides的许多成员是中性甚至有益的共生菌,但它们的过度扩张,特别是当缺乏足够膳食纤维来“喂养”它们时,可能会导致它们转向分解宿主肠道粘液中的糖蛋白,从而削弱肠道的第一道物理防线。
两种饮食结构下,主要菌属的相对丰度
2
植物蛋白饮食的“爱好者”
与动物蛋白饮食形成鲜明对比的是,植物蛋白饮食极大地促进了一批被广泛认可的“有益菌”的生长。这些细菌大多是“糖类发酵型”,它们热衷于分解植物性食物中富含的各种复杂碳水化合物(膳食纤维、抗性淀粉等),并产生对宿主健康至关重要的代谢产物。
◮ 植物蛋白饮食显著提升了双歧杆菌属丰度
Bifidobacterium(双歧杆菌属)和Lactobacillus(乳杆菌属):这两个名字对大众来说可能并不陌生,它们是市面上益生菌酸奶和补充剂中的“常客”。研究发现,植物蛋白饮食显著提升了Bifidobacterium的丰度。双歧杆菌是著名的“健康基石”,尤其在婴幼儿肠道中占据主导地位。它们能够产生短链脂肪酸(SCFAs),抑制病原菌生长,调节免疫系统,增强肠道屏障功能。
◮ 富含纤维的食物还能促进普雷沃氏菌和粪杆菌生长
Prevotella(普雷沃氏菌属)和Roseburia(罗伊氏菌属):Prevotella属偏爱在富含纤维和碳水化合物的饮食环境中生长,在非西方化、以植物为主食的人群中丰度极高。它们是高效的纤维分解者。
而Roseburia则是肠道中产生丁酸盐(一种至关重要的SCFA)的主力军之一。丁酸盐是结肠上皮细胞的首选能源,能直接为肠道细胞“加油”,同时具有强大的抗炎作用。
Faecalibacterium(粪杆菌属):特别是Faecalibacterium prausnitzii(普拉梭菌),被誉为“抗炎明星”。它的丰度降低与多种炎症性疾病(如克罗恩病)直接相关。植物性饮食,通过提供丰富的可发酵底物,为这类有益菌创造了理想的生长环境。
肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
编者小结
通过这份“红黑榜”,我们可以清晰地看到,动物蛋白和植物蛋白饮食,在肠道菌群的“物种选择”上,展现出了强烈的偏好性。动物蛋白倾向于富集那些擅长蛋白质发酵、但部分代谢产物可能存在健康隐患的细菌;而植物蛋白则大力扶持了那些以分解纤维、产生有益代谢物而闻名的“健康卫士”。
这不仅仅是细菌名单的改变,更深层次的,是整个肠道微生态系统功能的转变。
肠道菌群结构的变化最终会影响其功能层面,而我们更关注这些细菌在肠道中的具体作用。为此,研究人员采用了PICRUSt2生物信息学工具,通过已知的16S rRNA基因序列,预测菌群的功能基因谱和可能激活或抑制的代谢通路。
分析结果显示,不同饮食模式下肠道内存在截然不同的“代谢模式”。
1
动物蛋白饮食的代谢特征:BCAA代谢亢进
分析发现,动物蛋白饮食组的菌群,其与支链氨基酸(BCAAs)代谢相关的通路被显著上调。BCAAs包括亮氨酸、异亮氨酸和缬氨酸,是人体必需氨基酸,对肌肉生长至关重要。动物蛋白(特别是乳清蛋白)正是BCAAs的极佳来源。
◮ 过量代谢BCAA的细菌可能导致代谢疾病风险
然而,近年来,越来越多的证据表明,循环血液中过高水平的BCAAs及其相关代谢物,与胰岛素抵抗和2型糖尿病的风险增加密切相关。
肠道菌群在BCAA的分解代谢中扮演了重要角色。动物蛋白饮食不仅直接带来了更多的BCAA,还富集了那些能更活跃地代谢BCAA的细菌,这可能导致一系列代谢副产物的产生,这些副产物被认为可能干扰宿主的胰岛素信号通路,从而埋下代谢疾病的隐患。
此外,动物蛋白饮食还与同型半胱氨酸(homocysteine)代谢的上调有关。高水平的同型半胱氨酸是心血管疾病的一个独立风险因子。
2
植物蛋白饮食的代谢特征:SCFA生产菌更丰富
与此相反,植物蛋白饮食组的菌群,展现出了另一幅欣欣向荣的代谢图景。最核心的变化,是与短链脂肪酸(SCFAs)生物合成相关的通路被显著激活。
SCFAs,主要包括乙酸盐、丙酸盐和丁酸盐,是肠道有益菌发酵膳食纤维产生的主要“宝藏”代谢物。它们的功能极其广泛且对健康至关重要:
能源供应:丁酸盐是结肠细胞的主要能量来源,能维持肠道屏障的完整性和健康。
抗炎作用:SCFAs能够抑制炎症反应,对预防和缓解肠道及全身性炎症至关重要。
代谢调节:它们可以通过作用于肠道和远端器官(如肝脏、脂肪组织)的受体,参与调节血糖和血脂代谢,改善胰岛素敏感性。
“肠-脑轴”通讯:SCFAs还能穿过血脑屏障,参与调节食欲、情绪和认知功能。
◮ 植物蛋白饮食促进微生物发酵并产生短链脂肪酸
植物蛋白饮食能够显著促进短链脂肪酸(SCFA)的生成,其主要机制在于植物性食物富含的特定营养素。植物蛋白来源的食物,如豆类、全谷物及坚果,普遍含有高密度的可发酵膳食纤维与抗性淀粉。这些碳水化合物是肠道中特定菌群,例如双歧杆菌属(Bifidobacterium)和罗氏菌属(Roseburia),合成SCFA所偏好的主要底物。
因此,采用植物蛋白为主的饮食模式,实质上是为这些有益微生物提供了一个理想的发酵基质,从而高效促进其代谢活动与增殖。
这一功能差异很可能构成关键的、基于肠道菌群的分子机制,用以解释为何长期坚持植物性饮食与较低的心血管疾病、2 型糖尿病及部分癌症风险相关。
读到这里,一个关键问题值得我们深思:造成上述所有差异的,真的仅仅是蛋白质分子本身的来源不同吗?是牛肉里的氨基酸和豆腐里的氨基酸有什么本质区别吗?
回答并非绝对。
该项荟萃分析的深刻之处,在于其揭示了一个更为宏观的视角:人类摄入的并非孤立的营养素,而是一个完整的“食物基质”(Food Matrix)。不同蛋白质来源之所以产生差异化的生理效应,很大程度上归因于与蛋白质共同摄入的“伴随营养素”所产生的协同作用。
1
动物源性蛋白质的营养基质特征
当摄入动物性食物,如红肉或加工肉制品时,机体获取的是一个复杂的生物活性化合物组合,而非仅仅是动物蛋白。此基质通常包含以下组分:
• 高含量的饱和脂肪与胆固醇:
这类脂质会刺激肝脏合成并分泌更多的初级胆汁酸进入肠道,以辅助脂肪的乳化与吸收。然而,肠道内的特定菌群(如前文提及的嗜胆菌属 Bilophila)能够将这些初级胆汁酸代谢为次级胆汁酸,而后者具有潜在的促炎与致癌特性。
• 丰富的含硫氨基酸(蛋氨酸、半胱氨酸)与牛磺酸:
动物蛋白富含此类化合物,它们为肠道中能够产生硫化氢(H₂S)的细菌提供了充足的反应底物。高浓度的硫化氢可能对肠道细胞产生毒性作用。
• 高浓度的左旋肉碱(L-carnitine)与胆碱:
红肉是这两种物质的重要膳食来源,可被特定肠道菌群代谢为三甲胺(TMA)。TMA被吸收后在肝脏经含黄素单加氧酶氧化为氧化三甲胺(TMAO)。循环中TMAO水平升高已被证实与动脉粥样硬化和心血管疾病风险增加存在因果关系。
• 血红素铁:
尽管红肉中的血红素铁生物利用度高,但过量摄入会作为一种促氧化剂,催化活性氧(ROS)的生成,可能对肠道上皮细胞造成氧化损伤。
• 膳食纤维的缺失:
此为关键区别点。纯动物性食物基质中几乎不含膳食纤维。这使得依赖碳水化合物为主要能量来源的有益菌(即短链脂肪酸生产者)缺乏发酵底物,导致其丰度下降。这种变化为那些进行蛋白质发酵并可能产生有害代谢物的菌群创造了增殖的生态位。
2
植物蛋白的“黄金搭档”
相比之下,植物蛋白的“食物基质”则显得友好得多。当你吃下一碗扁豆、鹰嘴豆或一块豆腐时,你同时摄入的还有:
• 丰富的膳食纤维:
这是植物蛋白最大的优势。各种可溶性和不溶性纤维,是肠道有益菌的“益生元大餐”,直接支撑了SCFA的生产体系,并促进了菌群的多样性。
• 多酚类物质:
植物中含有成千上万种多酚化合物(如黄酮、花青素),它们不仅自身具有强大的抗氧化和抗炎活性,还能被肠道菌群代谢为更具生物活性的小分子物质,同时它们也能反过来调节菌群的组成,抑制有害菌,促进有益菌。
不饱和脂肪酸:
许多植物性食物(如坚果、种子)富含有益心血管健康的单不饱和和多不饱和脂肪酸。
较低的氨基酸密度和不同的氨基酸谱:
植物蛋白的消化速度通常比动物蛋白慢,这使得更多的蛋白质和氨基酸有机会到达结肠,但由于有大量纤维的存在,发酵的模式会更偏向于有益方向。
因此,这场动物蛋白与植物蛋白在肠道中的“较量”,实际上是一场整体饮食模式的较量。
通过对这项结合了Meta分析与机器学习研究的深度解读,我们得以清晰地看到,餐盘中的蛋白质来源,是调控我们肠道微生物的一个强有力杠杆。
★核心结论可以概括为:
结构重塑:膳食蛋白的来源(动物vs.植物)是塑造肠道菌群结构的关键驱动力,能形成两种显著不同的菌群“派系”。
物种筛选:动物蛋白饮食倾向于富集Alistipes、Bilophila等可能与炎症和不良代谢产物相关的细菌;而植物蛋白饮食则大力促进了Bifidobacterium、Roseburia等公认的“有益菌”的繁荣。
功能转向:在功能层面,动物蛋白饮食与支链氨基酸(BCAA)代谢等可能关联胰岛素抵抗的通路被激活相关;而植物蛋白饮食则显著上调了短链脂肪酸(SCFA)的生物合成通路,后者对维持肠道和全身健康至关重要。
这些差异不仅源于蛋白质本身,更重要的是由蛋白质来源食物的整个“食物基质”——包括伴随的脂肪类型、纤维、多酚等共同决定的。
启示和指导
上述结论并非倡导彻底弃用动物蛋白或推行严格纯素,更非妖魔化动物蛋白。科学研究的价值在于提供循证依据,帮助个体做出更明智、均衡的饮食选择。
基于本研究,可提出以下可操作的饮食策略:
1.优化蛋白质来源结构,提升植物蛋白占比:
建议在日常膳食结构中有意识地提升源自植物性食物的蛋白质比例。
优质的植物蛋白来源包括:
豆类: 如小扁豆、鹰嘴豆、黑豆等;
豆制品: 如豆腐、豆豉;
全谷物与准谷物: 如藜麦;
坚果与种子。
可采取循序渐进的策略以实现这一目标,例如,每周设定若干“低动物蛋白日”,或在烹饪时,尝试使用植物蛋白部分或全部替代原有的动物蛋白成分,以逐步调整和优化个人的饮食习惯。
2.优先选择“优质”动物蛋白:
优先选择“优质”动物蛋白:如果选择动物蛋白,可以优先考虑鱼类(富含Omega-3脂肪酸)、禽肉和鸡蛋,适度摄入红肉,并尽量减少加工肉制品(如香肠、培根)的消费。
3.采用基于“食物基质”的整体性评估方法:
在进行膳食选择时,应超越对孤立营养素的关注,建立对食物整体营养构成的认知。评估蛋白质来源时,需系统性地考量其伴随的营养成分。
例如,分析该蛋白质是与有益健康的膳食纤维和植物多酚(如豆类)共同摄入,还是与可能增加代谢负担的饱和脂肪、胆固醇及加工助剂(如加工肉制品)一同进入体内。
4.保证充足膳食纤维摄入:
无论蛋白质来源如何,每日从全谷物、蔬菜、水果、豆类获取足量纤维,是维持肠道微生态的关键。充足的膳食纤维能够为有益菌提供发酵底物,支持其稳态与代谢。
个性化将是未来的大趋势。每个人的初始肠道菌群、遗传背景和生活方式都不同,对同一种蛋白质的反应也可能存在差异。未来的营养学,或许能够根据你的个人菌群特征,为你量身定制最适合你的蛋白质摄入方案。
但在此之前,研究所揭示的宏观规律,已经为我们指明了通往更健康肠道微生态的清晰方向。下一次,当你站在超市的货架前,或在餐厅的菜单上做出选择时,请记住,你的每一次选择,不仅是在喂饱自己,更是在为你体内那个数万亿的微小盟友,投票决定它们的未来,也间接地,决定你自己的健康未来。
参考文献:
Adejumo, Samson, et al. “Dietary Protein Source Shapes Gut Microbial Structure and Predicted Function: A Meta-Analysis with Machine Learning.” bioRxiv (2025): 2025-04.

谷禾健康
孩子像有个停不下来的小马达,总是坐立不安、难以专注,对话像是没在听,还伴随着一些无法自控的小动作,比如频繁地挤眉弄眼、清嗓子或不自觉地耸动肩膀?…
这些常常被家长和老师贴上“不听话”、“坏习惯”标签的行为,背后可能隐藏着在儿童神经发育常见问题——注意缺陷多动障碍(ADHD,下文简称多动症)与抽动障碍(TD,下文简称抽动症)。
统计显示,全球学龄儿童中多动症的患病率约为3-7%,抽动障碍的患病率约为1-3%,且两者共病现象十分普遍。约50%-60%的抽动症患者同时患有多动症,男孩比女孩更常见。
注意力缺陷多动障碍(ADHD)和抽动障碍是儿童期常见的神经发育障碍,并不是很多家长以为的“学坏”或“故意捣乱”等行为问题。长期以来,医学界认为其病因主要与遗传、大脑结构发育及神经递质失衡有关。然而,近年来越来越多的研究发现,一个常被忽视的因素——肠道菌群。
例如,研究发现多动症儿童的肠道中,具有抗炎能力的普拉梭菌的丰度显著降低;而在抽动障碍的案例中,则观察到梭菌属和拟杆菌属等菌群的异常改变。
这些特定的菌群失衡,可以直接或间接地导致肠道通透性增加(即“肠漏”),引发低度炎症,甚至影响多巴胺等关键神经递质的合成与代谢。
肠道微生态的紊乱不仅影响消化吸收,更能通过神经、免疫及内分泌通路,远程影响大脑功能,从而可能加剧注意力缺陷、多动冲动以及不自主的抽动症状。
本文我们一起来深入了解一下多动症和抽动症,包括其症状、发病率、原因、共病现象等,重点探讨肠道菌群失调是如何影响这些神经发育障碍,并介绍肠道菌群检测在辅助诊断中的应用,以及如何通过调节肠道微生态进行相关干预,为管理这类神经发育障碍提供全新的视角与策略。
本文目录
一、认识多动症与抽动症
核心症状(多动症、抽动症症状、相似之处与不同之处)
患病率、共病现象
风险因素、原因
二、传统干预手段及其局限性
多动症的常用药物治疗
抽动障碍的常用药物治疗
传统药物治疗的共同困境
三、肠道菌群与抽动障碍和多动症的关联
多动症患者的肠道菌群特征
抽动障碍患者的肠道菌群特征
四、从菌群失调到神经炎症:发病机制新解
肠道屏障受损与全身性炎症
神经炎症与氧化应激
菌群代谢物的关键作用
菌群对神经递质的直接与间接调控
五、多动症与抽动症的诊断
多动症和抽动症的常规诊断流程
当前诊断的困境
整合肠道菌群检测:辅助诊断的新思路
肠道菌群检测如何为中西医结合提供桥梁
六、多动症与抽动症的干预新策略
饮食干预
– 地中海饮食、寡抗原饮食、人造食用色素去除
益生菌
– 双歧杆菌、植物乳杆菌PS128等
关键营养素补充
– Omega-3、维生素B6、B9、B12、D、锌、镁、铁等
粪菌移植(FMT)
中草药
– 健脾疏肝汤、菖麻熄风片、息风颗粒等
生活方式
– 运动、睡眠、行为干预等
核 心 症 状
▶ 注意缺陷多动障碍
注意缺陷多动障碍(ADHD,下文简称多动症)是一种复杂的神经发育障碍,其核心症状主要围绕三个方面:
😕 注意缺陷
– 难以持续集中注意力、容易分心、做事拖沓、经常丢失物品、在对话中似乎没有在听。
😖 多动
– 在座位上不停扭动、难以安静地坐着、话多、在不适当的场合跑来跑去或爬上爬下。
😡 冲动
– 难以等待、经常打断他人、不假思索地行动。
ADHD依据症状特点可分为三类:
患者常伴有执行功能缺陷、情绪失调和运动协调障碍等问题,这些都会严重影响其学习、社交能力和日常生活质量。
症状通常在 3~6 岁之间出现,平均诊断年龄为 7 岁。
成人多动症的多动表现可能不如儿童明显,更多体现在内心的躁动不安和精神层面的注意力不集中,体现在工作效率低下、人际关系处理困难、情绪波动大易发火、自我管理能力差等方面,而儿童则主要表现在学习障碍、行为问题上。
▶ 抽动障碍
抽动障碍(TD,下文简称抽动症)是一种神经发育障碍,以不自主、快速、重复、无节律的运动或发声为主要特征,即“抽动”。这些抽动在病程中的某个时间点出现,但不一定同时发生。
抽动障碍(TD)最严重的亚型是抽动秽语综合征(Tourette Syndrome, TS),其症状包括:
运动性抽动
– 简单的如眨眼、耸肩、摇头、皱眉等;
– 复杂的如模仿他人动作、做鬼脸、行走时的奇怪步态等。
发声性抽动
– 简单的如清嗓子、咳嗽、犬吠声;
– 复杂的如重复他人话语、说出不恰当的词语(秽语症,并非所有抽动患者都有)。
这些症状并非持续不变,其严重程度和频率会随时间波动,并受到压力、兴奋或疲劳等多种因素的影响。虽然大部分患者的症状在18岁前能够自行缓解,但仍有约三分之一的患者症状会持续到成年。
典型发病年龄在 6-7 岁左右,症状通常在 10-12 岁达到高峰。
▻ 两 者 相 似 之 处
▻ 不 同 之 处
抽动秽语综合征也会像多动症一样出现注意力不集中的情况,但这个注意力不集中可能是由抽动发生前令人分心的不适感(如压力、冲动感),以及抑制非自愿抽动本身所消耗的大量精力造成的。
流行病学与共病现象
► 多动症发病率
多动症是全球最普遍的儿童神经发育障碍之一,全球学龄儿童的患病率估计在3%~7%之间,男孩的诊断率是女孩的两倍以上。
18 岁以下患有多动症的儿童数量几乎是自闭症儿童的四倍。
儿童青少年多动症发病率主要统计数据
我国成人多动症的患病率约为4.4%,其中男性患病率高于女性。
柳叶刀的一项基于人群的研究显示:
疫情前,成人多动症的新增诊断平均为每月每10万人口8.8例。在疫情期间(2020年3月至2021年6月),这一数字上升至19.2例,每月增长率为4.9%(95%置信区间:[3.7, 6.2])。
疫情结束后,2021年7月的月度诊断率猛增107.3%[68.5, 155.0],此后每月继续以1.5%[0.4, 2.7]的速度增长,疫情后平均达到每10万人口34.8例。
► 抽动障碍发病率
《Pediatric Neurology》对 13 项儿童研究的荟萃分析显示,抽动秽语综合征的患病率为 0.77%(95%置信区间,0.39-1.51%)。男孩的患病率更高:1.06%的男孩受影响(95%置信区间,0.54-2.09%),而 0.25%的女孩受影响(95%置信区间,0.05-1.20%)。
全球抽动障碍流行病数据
► 多动和抽动共病现象
临床上一个巨大的挑战是这两种疾病的高度共病性。研究显示:
– 约50%-60%抽动症患者同时患有多动症
– 多动症往往在抽动症状出现之前就已存在
▻ 多动和抽动共病的影响
当两者共病时,多动症的症状通常在抽动症状出现之前出现。这就是为什么多年来抽动症状可能被错误地归因于兴奋剂药物的使用。
当孩子同时患有这两种疾病时,他们可能会消耗额外的精力和注意力,试图抑制抽动;这会加剧调节注意力和专注度的困难。
同时患有多动症和抽动症的儿童,往往比仅患有 多动症或仅患有抽动症的儿童面临更多的心理社会和行为问题,更容易受到欺凌,这些儿童还可能伴有认知和其他神经精神障碍。
▻ 共病强迫症
强迫症(OCD)也是常见的共病,约10%~35%的抽动症患者符合强迫症诊断标准。
注:多动症和抽动症儿童都容易患有焦虑症和强迫症。同时患有多动症和抽动症的儿童甚至比只患有其中一种疾病的儿童有更高的强迫症和广泛性焦虑症的发生率。更复杂的是,患有焦虑症的人还有额外的风险发展为抑郁症。因此,当孩子同时患有这两种疾病时,应常规监测情绪障碍和强迫症。
这种共病不仅使诊断复杂化,也严重影响患者的社会心理功能、自尊和生活质量,其背后可能隐藏着共同的病理生理机制。
风险因素
传统上,多动症和抽动症被认为是源于大脑的疾病,其病因复杂,涉及多种因素的相互作用。
► 遗 传 因 素
多动症和抽动障碍都具有明显的家族遗传性,家族史显著增加患病风险,遗传模式复杂,可能涉及多个基因的共同作用,相关基因如多巴胺受体基因(如DRD4)等可能参与其中。
► 产前 / 围产期因素
孕期吸烟、饮酒、接触有害物质等可能增加抽动和多动症的患病风险。
孕期感染也可能与神经发育障碍相关。
早产、低出生体重、缺氧等可能与抽动和多动症相关。
► 免 疫 因 素
免疫系统异常可能在抽动和多动症的发病中发挥作用。链球菌感染可能与部分抽动患者的发生有关。
► 营 养 因 素
铁、镁等微量元素缺乏可能与多动症的发生有关。
高糖、高脂肪饮食可能加重多动症症状。
► 早期生活环境
不良的家庭环境、虐待、忽视等可能增加抽动和多动症的患病风险。
► 屏幕时间
多动症患儿的屏幕使用时间(包括看电视、用平板/手机)显著高于正常儿童,并且过度的屏幕时间与多动症风险的升高有很强的统计学关联。
回归分析表明,屏幕时间增加与多动症风险升高相关(OR [95% CI] = 1.93 [1.28–4.27])。作者特别强调,由于研究是回顾性的病例对照设计,这个发现只能表明关联性,并不能证明是屏幕时间导致了多动症。
患有多动症或相关特质(如冲动、注意力不集中)的家长,可能更难为孩子设定和执行屏幕时间的规则,这本身就可能是一个混杂因素,同时也会影响他们报告的准确性。
什么原因引起的?
抽动和多动症的在遗传和神经学上存在相似的重叠,病因复杂,目前认为与神经递质失衡、脑结构和功能异常等因素有关,例如,涉及“去抑制”的相似神经回路。
这些因素可引发外周低度炎症(如细胞因子IL-6、TNF-α上调)和血脑屏障通透性增加,激活中枢小胶质细胞,干扰突触修剪和可塑性,最终导致额叶-纹状体/基底节环路的兴奋-抑制失衡,以及多巴胺、去甲肾上腺素和GABA等神经递质的调节异常,表现为注意缺陷、多动或抽动症状。这种机制并非单一,而是多通路交互的结果,后续章节将详述肠-脑轴的具体作用。
► 多动症
慢性低度神经炎症:风险因素(如早期营养/免疫失调)诱导外周炎症上行,激活小胶质细胞并干扰前额叶-纹状体环路的执行功能,导致注意缺陷和冲动控制问题。
多巴胺系统失调:遗传背景加剧多巴胺/去甲肾上腺素信号异常,与围产期因素交互,进一步放大行为症状。
代谢支持不足:营养相关失衡削弱神经保护,影响认知和情绪调节。
► 抽动症
感染触发与自身免疫:早期免疫因素(如链球菌感染)诱导异常自身免疫反应,错误靶向基底节,导致兴奋-抑制失衡和抽动发作。
基底节环路异常:遗传易感与环境应激放大多巴胺活性亢进和GABA抑制不足,阈值降低引发症状波动。
炎症-神经递质耦合:风险因素影响递质平衡,间接干扰运动控制。
根据美国儿科学会的最新指南,患有多动症的学龄前儿童(4~6岁)应首先接受家长培训的行为管理(PTBM)。若行为干预后功能障碍仍持续存在,可辅助使用哌甲酯治疗。
多动症的药物治疗:兴奋剂与非兴奋剂
▸中枢神经兴奋剂
这是最常用且被认为最有效的药物,代表药物是哌甲酯。这类药物通过抑制多巴胺和去甲肾上腺素的再摄取,提高突触间隙中这些关键神经递质的浓度,从而改善注意力和冲动控制。研究表明,治疗剂量的口服哌甲酯能显著增加人脑细胞外的多巴胺水平。
▸非兴奋剂
当患者对兴奋剂不耐受或效果不佳时,会考虑使用非兴奋剂。代表药物是托莫西汀,它是一种选择性去甲肾上腺素再摄取抑制剂,主要通过增加大脑中去甲肾上腺素的水平来发挥作用。
抽动障碍的药物治疗:多巴胺系统调节剂
对于抽动障碍,特别是症状严重影响生活的TS患者,药物治疗的目标是抑制多巴胺系统的过度活跃。根据美国神经病学学会(AAN)等权威指南,常用药物包括:
▸ α2-肾上腺素能激动剂
如可乐定和胍法辛,通常作为一线选择,尤其适用于伴有多动症的患者。它们副作用相对温和,但起效较慢。
▸ 抗精神病药(多巴胺受体拮抗剂)
典型抗精神病药:如氟哌啶醇和匹莫齐特,是FDA批准用于治疗抽动障碍的传统药物,效果显著但副作用风险较高。
非典型抗精神病药:如阿立哌唑和利培酮,因其对多巴胺和血清素系统的双重作用,被认为引发运动障碍的风险较低,已成为临床常用选择。此外,硫必利等药物也被广泛使用。
药物治疗的局限性
尽管上述药物在一定程度上有效,但其局限性同样显著,这也是驱动我们寻找新疗法的主要原因。
▸疗效的个体差异与不完全性
相当一部分患者对药物反应不佳或无效。即使有效,药物也通常只能控制症状,而不能根治疾病。对于许多患者来说,症状的改善是有限的,无法完全恢复正常功能。
▸可能带来副作用
ADHD药物:兴奋剂可能导致食欲不振、失眠、头痛、胃肠不适和情绪波动。长期使用还可能影响身高和体重发育。
抽动障碍药物:抗精神病药物的副作用尤为突出,包括镇静、头晕、嗜睡、体重增加和代谢综合征。更令人担忧的是,它们可能引发锥体外系症状,如肌肉震颤、僵硬和不自主运动(迟发性运动障碍),这些症状有时是不可逆的。
▸依从性挑战
由于副作用和疗效不确定性,患者(尤其是青少年)的治疗依从性往往较差。突然停药可能导致症状反弹或加重,给长期管理带来困难。
这种治疗上的困境促使科学界和医学界不得不将目光转向更深层次的病理生理学机制,以寻找新的干预靶点。在此背景下,“肠-脑轴”进入了研究者的视野。抽动障碍和多动症的神经系统功能紊乱,是否可能源于或受到肠道微生态失衡的影响?这为我们理解和治疗这些神经发育障碍开启了一个全新的视角,也正是我们下一章节将要探讨的内容。
肠-脑轴是指连接肠道和中枢神经系统(大脑)的一个复杂的双向通讯网络。它整合了神经、内分泌、免疫和代谢等多种信号通路,确保了大脑和肠道功能的协调。这个双向交流系统意味着,肠道的健康状况可以直接影响到我们的大脑,反之亦然。
既然肠-脑轴如此重要,那么我们来详细了解一下多动症和抽动障碍患者的肠道菌群。
多动症患者的肠道菌群
菌群多样性
β多样性(样本间物种组成的差异)分析通常能将多动症患者与健康对照区分开来,表明其菌群整体结构发生了改变。
特定菌群的变化
多项研究一致发现,多动症患者肠道中一些重要的有益菌丰度降低,特别是普拉梭菌(Faecalibacterium prausnitzii),这是一种主要的丁酸产生菌,具有强大的抗炎作用。此外,双歧杆菌属、粪球菌属(Coprococcus)和戴阿利斯特杆菌属(Dialister)的丰度也常被报道减少。
注:普拉梭菌在不同研究中结果矛盾。
一些研究观察到多动症患者肠道中拟杆菌属的某些种(如B. uniformis)、臭杆菌属(Odoribacter)、肠球菌属(Enterococcus)和链球菌属(Streptococcus)的某些种丰度增加。
与症状的关联
一项2025年的研究通过宏基因组和代谢组学分析发现,Lactobacillus sanfranciscensis的减少与多动症的三种核心症状注意缺陷、多动、冲动(p.adj = 1.04E–13; p.adj = 5.07E–07; p.adj = 2.61E–05)均显著相关。
多动症混合型菌群失调更严重
值得注意的是,多动症不同临床表现亚型(如ADHD-I和ADHD-C)可能对应着不同的菌群特征,这提示了疾病内部的异质性。例如,混合型(ADHD-C)患者的菌群失调程度通常比注意缺陷为主型(ADHD-I)更严重。
doi: 10.1080/19490976.2025.2537755
不同检测方法下儿童多动症的肠道菌群变化
doi: 10.3389/fpsyt.2025.1588135
抽动症患者的肠道菌群
针对抽动障碍(TD)和抽动秽语综合征(TS)的研究虽然起步较晚,但也揭示了相似的菌群失调模式。
门水平的变化
研究发现,与健康儿童相比,抽动障碍患儿粪便中厚壁菌门的相对丰度降低,而变形菌门和拟杆菌门的相对丰度升高。
属和种水平的特异性改变
一项研究发现,抽动障碍患儿肠道中普通拟杆菌(Bacteroides plebeius)、Ruminococcus lactaris的丰度显著高于健康儿童。这些细菌被认为与多种自身免疫性疾病有关。
另一项研究同样观察到TD患儿中双歧杆菌属和柯林斯菌属(Collinsella)丰度显著降低,而普雷沃氏菌属(Prevotella)和臭杆菌属(Odoribacter)丰度增加。
总的来说,多动症和抽动障碍患者的肠道菌群普遍呈现出促炎菌增多和有益菌减少的特征。这种失衡状态不仅是疾病的伴随现象,也可能是驱动疾病发展的关键因素之一。
肠道菌群的失调如何一步步影响到远端的大脑,并最终导致ADHD和抽动障碍的症状?科学家们提出了一个以“肠道菌群失调-神经炎症”为核心的通路。
肠道菌群失调如何通过炎症通路影响多动症
DOI: 10.1016/j.neuroscience.2025.01.031
1
肠道屏障受损与全身性炎症
肠道菌群失调被视为多动症和抽动症等神经发育障碍发病机制中的关键起点。
健康的肠道屏障能严格控制物质进入血液,但在菌群失调时,其通透性增加,即“肠漏”。
异常的肠道菌群组成可能激活肠道免疫系统,破坏屏障功能,也可能是有益菌群减少,对肠上皮细胞至关重要的“燃料”——短链脂肪酸生成不足,使得屏障细胞营养不良,细胞间的紧密连接蛋白松动,还有一些菌群降解肠道黏液层,削弱屏障保护。
屏障一旦受损,肠道内的细菌成分,如脂多糖(LPS)和有害代谢物便能渗入血液循环系统。这会触发强烈的免疫反应,因为免疫系统将这些物质识别为威胁。LPS会激活如TLR4(Toll样受体)等模式识别受体,刺激免疫细胞释放大量的促炎细胞因子,如IL-6(白细胞介素-6)、IL-1β(白细胞介素-1β)和TNF-α(肿瘤坏死因子-α)。
这些炎症因子在全身循环,形成了一种慢性的、低度的全身性炎症状态。这便是连接肠道与大脑问题的关键一步。
多动症和抽动症患者常常共患过敏性疾病(如哮喘、湿疹)和自身免疫性疾病,这从侧面印证了他们体内可能存在着异常的免疫激活状态。
肠道菌群通过肠-脑轴影响多动症的可能机制
doi: 10.3389/fpsyt.2025.1588135
2
神经炎症与氧化应激
上一节我们谈到,由肠道菌群失调引发的肠漏,引发了一场慢性的、低度的全身性炎症风暴,它的其中一个目标是突破人体的精密防线,也就是我们常说的血脑屏障。
一旦这道屏障因持续的炎症冲击而出现缝隙,炎症物质就直接去影响中枢神经系统,从而引发神经炎症与氧化应激,这是导致抽动症和多动症神经功能紊乱的核心病理环节。
一旦进入大脑,这些炎症物质会立即激活大脑内的免疫细胞——小胶质细胞和星形胶质细胞。这些细胞原本是大脑的管家,被激活的小胶质细胞会释放更多的炎症因子,将局部的火星煽动成燎原大火,形成一个恶性循环,导致持续的神经炎症。
神经炎症环境会产生大量的活性氧(ROS),引发氧化应激,损害神经元的线粒体功能、破坏细胞膜和DNA,最终导致神经元功能障碍甚至死亡,表现为多动症和抽动症的核心症状。
这一系列病理过程并非只是理论推测,在多动症患者身上已经找到了直接证据。多项研究发现:
从受孕到成年整个生命周期中,抽动和多动症接触免疫功能失调风险因素的时间、周围和中枢免疫炎症反应的变化、小胶质细胞激活的变化以及肠道菌群的改变如下图:
doi: 10.3389/fneur.2020.567407
这种由炎症和氧化应激共同驱动的神经毒性环境,会干扰正常的神经环路发育、突触可塑性和神经递质平衡,最终导致多动症的注意力不集中、多动冲动,以及抽动症的抽动、刻板行为等症状。
3
菌群代谢物(如短链脂肪酸)的关键作用
短链脂肪酸,主要包括丁酸、丙酸、乙酸,是肠道中的有益菌发酵膳食纤维后产生的重要代谢产物。
短链脂肪酸具有多重生理功能
Lactobacillus sanfranciscensis → 咪唑乙酸 → 注意力缺陷
在抽动和多动症中,短链脂肪酸的失调是一个核心环节。近日,一项针对多动症的队列研究明确指出,短链脂肪酸缺乏是其关键致病机制。
该研究发现,多动症患者体内普遍存在短链脂肪酸的缺乏,咪唑乙酸、4-氨基丁酸、4-胍基丁酸等多种SCFAs的水平显著降低。这种缺乏与我们前面提到的菌群失调有关,负责高效生产短链脂肪酸的有益菌减少。
研究通过因果中介分析发现,旧金山乳杆菌(Lactobacillus sanfranciscensis) 的减少,会引起肠道内咪唑乙酸水平的下降,而咪唑乙酸水平的下降,则直接导致了注意力不集中症状的加重。
注:Lactobacillus sanfranciscensis 对注意力不集中症状的总效应为−0.672,包括直接效应−0.535和中介效应−0.137,咪唑乙酸部分介导了这些效应,占总效应的 20.387%。
因此,这条病理链条变得清晰:
菌群失调 → 有益菌减少 → 短链脂肪酸产量不足 → 屏障失修,抗炎不力 → 肠道屏障和血脑屏障通透性增加→ 全身性炎症和神经炎症
总的来说,短链脂肪酸的缺乏,使得从肠道到大脑的整个防御体系变得脆弱。它为炎症的发展敞开了门,降低了身体抗炎能力,使神经系统遭受炎症和氧化损害,导致抽动症和多动症神经功能障碍。
4
菌群对神经递质的直接与间接调控
大脑的功能在很大程度上依赖于神经递质的精确平衡,它们是神经元之间传递信息的化学信使。
抽动症和多动症的核心病理之一,就是关键神经递质系统(尤其是多巴胺系统)的失衡。
菌群是神经递质及其前体的代谢工厂
如前所述,菌群可以合成GABA、5-HT等神经递质,或影响其前体物(如色氨酸、苯丙氨酸、酪氨酸)的代谢。
这里的关键在于,菌群的代谢活动能够直接决定这些原料的最终去向。
当多动症患者的肠道菌群异常地将大量色氨酸在外周(肠道内)就地转化为5-HT时,由于5-HT分子本身无法穿过血脑屏障,这实质上是一种“资源截留”。
这种外周的过度消耗,直接导致了能够进入大脑、用于合成中枢5-HT的色氨酸原料供给不足,最终引发中枢神经系统的5-HT缺乏。
菌群的功能缺陷会引发供应链中断
多巴胺和5-羟色胺等关键神经递质的合成,不仅需要前体原料,还需要维生素B6、叶酸等重要辅酶的参与才能顺利完成。
例如,多动症患者肠道菌群在维生素B6和叶酸代谢通路上的功能异常,可能影响到多巴胺、血清素等关键神经递质的合成,因为这些维生素是合成过程中的重要辅酶。肠道菌群是这些B族维生素的重要生产者,这在我们之前的文章可以详细了解,点击查看
当多动症患者的菌群失调时,相关维生素代谢异常,就像切断了神经递质合成的辅助工具供应,即使有足够原料,也会导致神经递质系统紊乱。
导致抽动秽语综合征的病理生理机制
doi: 10.2147/DDDT.S542423
多动症诊断
严格依据DSM-5或采用国际疾病分类第11版(ICD-11)作为诊断标准,强调症状需持续至少6个月,并在多个环境中可被观察到(如工作和家庭)都持续存在并造成影响。 必须有明确证据表明,这些症状已对社交、学业或职业功能造成实质性的负面影响。
确诊需通过临床访谈、评定量表等综合评估,并仔细排除焦虑、抑郁等其他可能引起相似症状的疾病。
为什么在儿童时期,诊断多动症的女孩少于男孩?
柳叶刀有一篇文章专门讲了这个问题:
症状表现不同:多动症的诊断标准更多基于男孩常见的、外显的多动-冲动行为。而女孩的症状更多是内化的、不易察觉,如健忘、分心、做事拖沓,这些安静的症状常被老师和家长忽视。
共病掩盖:女孩的多动症症状常被焦虑、抑郁等情绪问题所掩盖,导致她们被误诊为其他精神障碍。
社会因素与补偿行为:出于社会期望,女孩更倾向于通过加倍努力或发展补偿策略来伪装和隐藏自己的困难,这使得她们的内在挣扎更难被识别,从而错过了及时的诊断和干预。
抽动障碍诊断
由于该疾病的临床异质性、抽搐的可抑制性以及症状的时间可变性,抽动症的诊断和评估可能特别复杂。因此,在症状首次出现后,诊断可能会延迟 3~11 年,大约 73%患者会经历初次误诊。
目前,尚未发现任何早期诊断标志物,如影像学检查、血液检查或脑脊液生物标志物,可以在症状出现之前帮助诊断。
目前,关于多动症和抽动症的诊断在很大程度上依赖于“非客观性”的指标, 例如量表、临床晤谈与行为观察。
像康纳斯量表、SNAP-IV量表或耶鲁全球抽动严重程度量表(YGTSS)等工具,其本质并非客观检测,而是将主观的观察和感受进行结构化和量化的工具。
客观检查主要用于排除而非确诊: 医生可能会建议进行脑电图、头颅MRI、血液检查等医学检查。但这些检查的主要目的,是排除其他可能引起相似症状的神经系统疾病(如癫痫、脑损伤等)。
这也是为什么寻找可靠的方式,以实现更精准、客观的诊断,是该领域未来研究的重要方向。肠道菌群检测逐渐为多动症和抽动症的辅助诊断提供了新的思路和可能性。
整合肠道菌群检测
目前肠道菌群检测还不能作为诊断的独立标准,它是一种辅助性的、探索性的工具,旨在深化对个体病理状态的理解,从而指导更精准的个体化治疗。
► 肠道菌群检测结合病理生理机制
结合我们在前面提到的多动和抽动的多种病理生理机制,包括神经递质失衡(多巴胺、谷氨酸等)、神经炎症(小胶质细胞活化)和免疫功能障碍等,肠道菌群恰好在这些方面都扮演着关键角色。
肠道菌群能够合成或影响多种神经递质(如多巴胺、5-羟色胺、GABA)的代谢。谷禾肠道菌群检测通过构建基于大样本的数据库,能够评估关键神经递质指标,如多巴胺,血清素,GABA等。
通过分析特定菌群的丰度和代谢活性,谷禾肠道菌群检测能够推断个体神经递质的合成能力和代谢状态,例如,某些双歧杆菌和乳杆菌株能够产生GABA,对于多动症和抽动症患者而言,这些神经递质的失衡往往是核心病理机制之一。多巴胺系统异常与注意力缺陷和运动控制障碍密切相关,GABA不足则可能导致大脑过度兴奋和自控能力下降。
< 来源:谷禾肠道菌群检测数据库>
肠道菌群的代谢产物(如脂多糖LPS)是强烈的促炎物质,若肠道屏障受损(肠漏),LPS进入血液会引发全身性低度炎症,并可能通过血脑屏障影响大脑,激活小胶质细胞。
谷禾肠道菌群检测结果可以提示,患者是否存在由菌群失调导致的营养吸收障碍或炎症状态,例如肠道炎症水平、肠道屏障、脂多糖LPS等指标。
< 来源:谷禾肠道菌群检测数据库>
对于多动症和抽动症患者,这些炎症指标的异常往往提示存在”肠-脑轴“功能紊乱,慢性低度炎症可能正在影响大脑的神经发育和功能,导致注意力、情绪调节和运动控制等方面的问题加重。
► 肠道菌群检测结合中西医
中医诊断依赖于辨证论治,比如将患者分为“肝风内动”、“痰火扰心”、“脾虚肝亢”等不同证型。这种辨证主要依赖于医生的四诊(望、闻、问、切),缺乏现代生物学的客观指标。
菌群特征与中医“证”的关联
通过对不同证型的患者进行肠道菌群检测,可以探索特定菌群的构成模式是否与某种中医证型存在关联。例如我们可以去探索:
如果能建立这种关联,肠道菌群检测就能为中医的辨证提供客观的生物学证据,有了可以量化的数据支持。
如果肠道菌群检测发现患者有明显的菌群失调和炎症标志物升高,那么在常规治疗(如多巴胺受体拮抗剂)的基础上,结合具有抗炎作用的中药(如黄芩等),或者补充益生菌、调整饮食结构,可能效果更好。
医生还可以根据菌群偏好,推荐更具体的食疗方案(如富含多糖的山药、茯苓等药食同源的食物)。关于药食同源可详见谷禾之前的文章:
从药食同源到微生态健康:中华传统医学养生智慧在肠道菌群中的现代诠释
肠道菌群检测可以成为连接中医、西医理论和实践的桥梁。
饮 食 干 预
关于儿童注意力和饮食模式关系的研究强调,注意力问题的儿童零食和垃圾食品的摄入量更高,并且这些儿童可能表现出过度进食行为。此外,文献中有发现表明,有明显注意力缺陷特征的成年人由于比普通人更频繁地摄入零食和添加糖,因此肥胖的风险更高。
一项综述发现:
► 地中海饮食
对地中海饮食的更高依从性与短链脂肪酸产生菌种 Faecalibacterium prausnitzii、Eubacterium eligens、Bacteroides cellulosilyticus 的丰度增加以及纤维降解功能的增强相关,与Ruminococcus gnavus 和血液胆固醇水平的降低有关。
► 限制消除饮食(寡抗原饮食) 证据层级:强
食物过敏/超敏反应可能是导致部分儿童多动症症状的关键因素。寡抗原饮食通过在几周内只允许食用极少数低过敏性食物(如米、梨、多种蔬菜等),来完全移除可能引发症状的食物触发器。
Tips:这里可以记录饮食日记,以追踪饮食与症状严重程度之间的潜在关联,识别并消除潜在的食品诱因,考虑常见的诱因,比如咖啡因、人工添加剂、高糖食品、麸质、乳制品等。
以上效果堪比药物治疗,且无药物副作用。
► 人造食用色素去除 证据强度 中等
多项研究(包括著名的南安普顿研究)发现,去除饮食中的人造色素和防腐剂(如苯甲酸钠)可以小幅但显著地改善儿童的多动行为。然而,其效果远不如严格的寡抗原饮食。文章认为,单独去除人造食用色素可能只对一小部分儿童有效,或者改善程度有限,因为还可能存在其他未被识别的食物触发因素。
以上有益,但作用有限。
相关饮食的生理益处
doi: 10.3390/metabo15050335
益 生 菌
一项为期 12 周的随机双盲安慰剂对照试验,涉及 80 名 5-14 岁的儿童(39 名患有多动症,41 名患有自闭症)。益生菌补充剂显著改变了多动症和自闭症儿童的肠道菌群。多动症患者增加梭菌属 、瘤胃球菌科、毛螺菌科、Odoribacter等。
注:AB Biotics S.A.提供了安慰剂和益生菌。
► 多动症:双歧杆菌
一项针对75名儿童的研究使用了长双歧杆菌 (B. longum),但研究重点是评估其作为药物辅助治疗的可行性,而不是直接的治疗效果。在为期四周的研究中,研究人员观察到益生菌组的注意力不集中症状有所改善。但文章强调,这只是初步发现。
一项为期12周的随机双盲安慰剂对照试验显示,补充双歧杆菌Bf-688可显著改善多动症患者的注意力与反应速度。其机制在于,Bf-688能提高肠道厚壁菌门/拟杆菌门的比例,从而强化肠道屏障,改善神经递质(特别是多巴胺)的调节功能。同时,它还减轻了患者的胃痛、食欲不振等胃肠道问题。
儿童多动症益生菌治疗的临床研究
doi: 10.3389/fpsyt.2025.1588135
► 抽动症:植物乳杆菌PS128
一项研究发现,给抽动症模型大鼠喂食植物乳杆菌PS128后,大鼠的抽动行为得到显著改善。这可能与益生菌调节了肠道菌群(如增加了普氏菌科,降低了毛螺菌科),并增强了多巴胺系统的稳定性有关。
► 抽动症:益生菌+药物
一项涉及130名抽动症患儿的为期12周的随机对照试验显示,将益生菌与常规药物(泰必利)联合使用时,对改善抽动症状的效果最为显著。相比之下,单独使用益生菌的效果最不明显。
补充剂
一项研究发现,抽动秽语综合征儿童的钠摄入量显著更高,而维生素D和维生素K的摄入量显著更低。维生素 B3、维生素 B6 和维生素 C、微量元素磷和硒较少达到参考营养摄入量(这一趋势在自闭症儿童中也得到体现)。
► Omega-3 和 Omega-6 脂肪酸
理论基础是多动症患者体内可能存在这些脂肪酸水平较低的情况。这是研究最多的补充剂类型。
研究结果不一致。荟萃分析显示,补充Omega-3/6脂肪酸(特别是EPA和DHA的组合)后,在注意力、多动和冲动方面有微小但显著的改善。然而,许多其他研究未发现显著效果。效果可能受剂量、EPA/DHA比例以及个体差异的影响。
► 维生素D和镁
维生素 D 和镁补充剂在两项研究中显示出改善多动症症状的效果;然而,一项研究得出结论,维生素 D 补充剂仅在同时存在维生素 D 缺乏的多动症儿童中才有益。
在一项调查中,许多家长报告称,给孩子补充镁后,观察到抽动症状有所改善。镁是一种对身体的许多方面调节和功能起关键作用的矿物质,包括调节肌肉和神经功能、血压和血糖控制。
► 叶酸和维生素 B12
研究发现,多动症患者的叶酸和维生素 B12 水平较低,一项研究发现维生素 B12 水平与多动症症状呈负相关,而另一项研究则未发现这种关系。
► L-茶氨酸和维生素B6
一项初步研究表明,这两者联合使用能显著减轻抽动严重程度,并对缓解伴随的焦虑有积极作用。
► 锌
锌在神经递质多巴胺的代谢中起着关键作用,而多巴胺与多动症的核心症状密切相关。关于补充锌对多动症的治疗效果,目前的研究结论尚不一致。
► 铁
研究发现,多动症儿童体内的铁蛋白(ferritin)水平普遍较低,而铁蛋白是反映体内铁储存量的指标。补充铁剂已被证明可以改善多动症儿童的症状,其效果甚至可以与某些兴奋剂药物相媲美。但对于铁水平正常的儿童,效果不明确。
粪菌移植 (FMT)
粪菌移植(FMT)作为一种仍在探索中的疗法,已被尝试应用于多种伴有肠道菌群异常的难治性神经系统疾病,如自闭症等。
动物实验
动物实验发现,将健康小鼠的粪便移植给抽动模型小鼠后,小鼠的抽动症状得到缓解,同时其血清中的5-羟色胺水平升高。
儿童
2017 年报道了首例使用粪菌移植治疗的抽动症病例,9岁男孩服用中药和泰拉普丁2.5年后仍有症状。粪便来自14岁健康男孩,通过胃镜和肠镜送入患者肠道。治疗前YGTSS评分31,8周后降至5,抽搐行为几乎消失且注意力集中,表明FMT对抽动症有治疗效果。
随后用FMT治疗5名抽动症男童。4名儿童YGTSS评分降低超25%(7-35分),2名症状消失,1名评分增加4分。这表明FMT对部分抽动儿童有效,但其机制及适用性需进一步研究。
成人
2022年,一位 22 岁的女性因反复发作的艰难梭菌感染导致多次严重腹泻。接受 FMT 治疗后,共病 ADHD 和焦虑症状得到缓解,CGI–S 评分从治疗前的 5 分降至 2 分。
中 草 药
在抽动症的管理中,许多中药方剂被使用,包括天麻钩藤饮、柴胡疏肝散和六味地黄丸等。
抽动障碍治疗中 15 种高频中药的现代药理机制
doi: 10.2147/NDT.S543465
► 中医药联合治疗抽动秽语综合征的临床实践
▻ 健脾疏肝汤 + 盐酸泰必利
一项涉及98名抽动症儿童的随机对照试验,经过8周治疗,发现“健脾疏肝汤”与西药“盐酸泰必利”的联合使用疗效,在降低抽动严重程度、改善神经递质分泌方面效果显著,且复发率更低,安全性良好。
▻ 菖麻熄风片 + 氟哌啶醇片
一项随机对照试验(n=96),发现菖麻熄风片联合氟哌啶醇片治疗儿童抽动症,能有效改善抽动症患儿的临床症状、认知发育、脑电图结果和血清神经递质水平(多巴胺、去甲肾上腺素和血清素)。
▻ 息风颗粒 + 心理干预
一项随机对照试验(n=120)比较了“息风颗粒联合心理干预”与西药“硫必利”的疗效,息风颗粒与心理干预相结合,可显著改善抽动患儿的临床症状,有效缓解症状,安全性高。
▻ 针刺 + 安神颗粒
一项对118名“心肝火旺”型抽动症儿童的随机试验,比较了“针刺联合安神颗粒”与西药“盐酸替亚必利片”的疗效。结果表明,针刺与安神颗粒(Anshen Zhicheng Granule)的结合疗法在缓解抽动、改善神经递质和神经功能方面,效果优于单独使用西药,且不良反应更少。
▻ 耳穴贴压 + 益智宁神液
一项对90名抽动症儿童的随机对照试验,评估了“耳穴贴压”联合“益智宁神液”的疗效。结果显示,与单用药物相比,联合疗法的效果更优,且安全、无明显毒副作用。
▻ 小儿黄龙颗粒:改善多动症
中药复方“小儿黄龙颗粒”能有效改善多动症模型大鼠的多动、冲动和焦虑样行为。研究对比了胃溶、肠溶和结肠溶三种制剂,发现结肠靶向释放的治疗效果最为显著。
其作用机理涉及恢复肠道菌群稳态、减轻全身性炎症反应以及修复受损的肠道和血脑屏障。治疗后,多动症模型大鼠体内异常的氨基酸代谢、神经递质调控和短链脂肪酸生成得到纠正。
▻ 静安汤:改善多动症
静安汤是一种中药方剂,过去20年来,静安汤在临床、药理学和制药领域广泛研究。
注:静安汤是南京中医院研发的专有配方,已获江苏省医药产品管理局注册证书(苏药制字Z20100001)。
研究发现,静安汤能够增加肠道中产丁酸盐细菌(特别是毛螺菌科Lachnospiraceae NK4A136群)的丰度,从而提升结肠和纹状体中的丁酸盐水平。丁酸盐通过抑制TLR4/HDAC3/NF-κB信号通路,促进小胶质细胞向抗炎的M2型极化,进而减轻神经炎症,改善肠道屏障和血脑屏障的完整性,最终有效缓解抽动症相关的刻板行为、多动和认知障碍。
doi.org/10.1016/j.phymed.2025.157009
生 活 方 式
► 运动
运动可以帮助减轻压力、改善情绪,并可能减少抽搐的频率和严重程度。对于患有多动症的人来说,运动也有助于提高注意力并减少多动。
– 每天至少进行30分钟的中等强度运动
– 选择喜欢且可持续的活动
– 考虑参加团队运动或团体健身课程以进行社交互动
任何运动,包括骑自行车、跳舞、慢跑、滑冰、棒球、游泳等,都可能对抽动症孩子有所帮助。
▻ 运动的核心机制
▻ 不同运动类型的具体效果
急性有氧运动: 比如跑步、跳跃
– 改善执行功能,包括选择性注意、信息处理和任务规划。
慢性/长期有氧运动:
– 改善ADHD儿童普遍较弱的注意力和记忆能力。
开放性技能运动:如足球(环境多变,需要高度执行功能)
– 在改善执行功能,特别是抑制性控制方面,比封闭性技能运动更有效。长期参与有助于儿童形成定向行动模式,从而规范行为、减少冲动。
封闭性技能运动:比如跑步、骑行(环境稳定)
– 对改善工作记忆有显著效果,尤其是在长期训练后。
▻ 瑜伽的特殊作用:
一个例外研究显示,每周进行一次60分钟的瑜伽,持续20周后,儿童的多动和攻击性行为得到了改善。这表明对于以多动为主的ADHD个体,瑜伽可能是一种有重要意义的方法。
► 建立规律的睡眠习惯
充足的睡眠对于管理抽动秽语综合征和注意力缺陷多动障碍症状至关重要。睡眠不足会加剧抽动并增加注意力和冲动控制的难度。
– 设定固定的睡觉和起床时间
– 创建放松的睡前仪式
– 睡前限制屏幕使用时间
– 确保舒适的睡眠环境
► 解压练习
正念可以帮助个人更意识到他们的抽动冲动和注意力缺陷多动障碍症状,从而实现更好的管理。它还可以减轻整体压力和焦虑。研究显示,它对改善“注意力不集中”有中等效应。其最一致的积极效果是能显著减轻家长育儿压力、改善儿童情绪调节。
▻ 正念和冥想练习:
– 练习当下时刻的觉察
– 培养对思想和感觉的非评判性观察
– 在一天中穿插进行简短的正念练习
▻ 放松技巧和深呼吸练习:
– 练习膈式呼吸
– 尝试引导想象或视觉化练习
– 将渐进式肌肉放松融入日常生活
习惯逆转训练(HRT)已被证明在减少抽搐频率和严重程度方面具有显著效果。它使个人能够主动管理抽搐,而不是感到被抽搐所控制。
▻ 习惯逆转训练用于抽动管理:
– 增加对抽动欲望的意识
– 建立竞争性反应来替代抽动
– 练习放松技巧以减少整体紧张
以上这些技巧可以帮助减少整体紧张和焦虑,这可能导致抽动频率和严重程度的降低。它们还可以帮助患有注意力缺陷多动障碍的人平静快速的想法并提高注意力。
综上,我们了解到注意缺陷多动障碍与抽动障碍是与全身健康状态紧密相连的复杂病症。越来越多的科学证据揭示了肠道菌群通过“肠-脑轴”在其中的关键作用。从肠道通透性增加(“肠漏”)引发的低度炎症,到特定菌群失衡(如普拉梭菌或梭菌属)对神经递质代谢的直接影响,都为我们理解这两种疾病提供了全新的视角。
这一发现为我们开辟了全新的干预视角:从“头痛医头”的传统干预模式中跳脱出来,转向探寻并解决问题的根源。这种通过调理消化系统来改善大脑功能的思路,与中医“培土生金,调理脾胃以宁心神”的千年智慧不谋而合,也是中西医理论在更高维度上的融合与共鸣。
而要将这一整体观精准地应用于每个独特的个体,肠道菌群检测便扮演了关键的导航角色。当我们可以通过调整饮食、补充益生菌等方式来重塑肠道微生态时,就为改善这些多动症和抽动症等神经发育障碍提供了更加温和且可能更有效的干预手段。
主要参考文献
Martino D, Johnson I, Leckman JF. What Does Immunology Have to Do With Normal Brain Development and the Pathophysiology Underlying Tourette Syndrome and Related Neuropsychiatric Disorders? Front Neurol. 2020 Sep 16;11:567407.
Wang X, Wang N, Gao T, Zhang Y, Fu Z, Zhao Y, Huang Y, Zheng X, Gao X, Lu L, Yang L. Symptom-specific gut microbial and metabolic profiles in ADHD reveal SCFA deficiency as a Key pathogenic mechanism. Gut Microbes. 2025 Dec;17(1):2537755.
Wang Y, Xu H, Jing M, Hu X, Wang J, Hua Y. Gut Microbiome Composition Abnormalities Determined Using High-Throughput Sequencing in Children With Tic Disorder. Front Pediatr. 2022 May 4;10:831944.
You L, Peng H, Liu J, Sai N, Zhao W, Li X, Yang C, Guo P, Ni J. Xiaoer Huanglong pellets remodels the periphery microenvironment to improve attention deficit hyperactivity disorder based on the microbiota-gut-brain axis. Phytomedicine. 2025 Sep;145:157007.
Lewis N, Lagopoulos J, Villani A. Gut-Brain Inflammatory Pathways in Attention-Deficit/Hyperactivity Disorder: The Role and Therapeutic Potential of Diet. Metabolites. 2025 May 19;15(5):335.
Eder K, Schneider-Momm K, Puce TK, Tobergte M, Clement HW, Rauh R, Schulz E, Biscaldi M, Clement C, Fleischhaker C. The Acute and Long-Term Benefits of the Oligoantigenic Diet for Children and Adolescents on the Three Symptom Subdomains of ADHD: Inattention, Hyperactivity, and Impulsivity. Nutrients. 2025 Jun 3;17(11):1916.
Rizzo R, Prato A, Scerbo M, Saia F, Barone R, Curatolo P. Use of Nutritional Supplements Based on L-Theanine and Vitamin B6 in Children with Tourette Syndrome, with Anxiety Disorders: A Pilot Study. Nutrients. 2022 Feb 18;14(4):852.
Novau-Ferré N, Papandreou C, Rojo-Marticella M, Canals-Sans J, Bulló M. Gut microbiome differences in children with Attention Deficit Hyperactivity Disorder and Autism Spectrum Disorder and effects of probiotic supplementation: A randomized controlled trial. Res Dev Disabil. 2025 Jun;161:105003.
Smith BL, Vafeiadou K, Ludlow AK. Nutrient intake and food selectivity in children with Tourette syndrome. Nutr Neurosci. 2025 Jun;28(6):670-678.
Geng J, Liu C, Xu J, Wang X, Li X. Potential relationship between Tourette syndrome and gut microbiome. J Pediatr (Rio J). 2023 Jan-Feb;99(1):11-16.
Bai L, Jin M, Zhang Q, Sun S. Progress in research on nutrition, neuroinflammation and dopaminergic alterations in Tic disorders. Front Pediatr. 2025 May 20;13:1526117.
Teleanu RI, Moldoveanu ET, Niculescu AG, Predescu E, Roza E, Tincu IF, Grumezescu AM, Teleanu DM. Liposomal and Lipid-Based Drug Delivery Systems: Bridging Gut Microbiota and Pediatric Disorder Treatments. Pharmaceutics. 2025 May 28;17(6):707.
Li B, Zhu J, Zhang B, Ling Z, Zhao Y, Leng W, Zhang Q, Zhou X. Evidence Based Research on Medication Patterns in the Traditional Chinese Medicine Treatment of Tic Disorders: A Complete Review. Neuropsychiatr Dis Treat. 2025 Sep 10;21:2001-2016.
Yu X, Zhu M, Tang Q, An S, Tan H, Wang X, Zhang J, Tian J, Li J. Traditional Chinese Medicine in the Comprehensive Management of Tourette Syndrome: Insights from Genetics and Pathophysiology: A Review. Drug Des Devel Ther. 2025 Sep 11;19:8181-8194.
Navab F, Abbasi K, Heidari H, Ghiasvand R, Clark CCT, Bagherniya M, Hassanizadeh S, Rouhani MH. Associations between dietary inflammatory index (DII) scores and attention deficit hyperactivity disorder (ADHD) in children. Sci Rep. 2025 Aug 22;15(1):30884.
Kang X, Cheng E, Guo P, Xi L, Xiang C, Xu S, Zhang Y, Yang Y, Zhang J, Long H. Jing An decoction alleviates neuroinflammation in Tourette syndrome by regulating butyrate-mediated microbiota-gut-brain axis. Phytomedicine. 2025 Sep;145:157009.
Liu Y, Zhang P, Sun H. A narrative review of research advances in gut microbiota and microecological agents in children with attention deficit hyperactivity disorder (ADHD). Front Psychiatry. 2025 May 23;16:1588135.
Yu X, Zhu M, Tang Q, An S, Tan H, Wang X, Zhang J, Tian J, Li J. Traditional Chinese Medicine in the Comprehensive Management of Tourette Syndrome: Insights from Genetics and Pathophysiology: A Review. Drug Des Devel Ther. 2025 Sep 11;19:8181-8194.
Li B, Zhu J, Zhang B, Ling Z, Zhao Y, Leng W, Zhang Q, Zhou X. Evidence Based Research on Medication Patterns in the Traditional Chinese Medicine Treatment of Tic Disorders: A Complete Review. Neuropsychiatr Dis Treat. 2025 Sep 10;21:2001-2016.
Navab F, Abbasi K, Heidari H, Ghiasvand R, Clark CCT, Bagherniya M, Hassanizadeh S, Rouhani MH. Associations between dietary inflammatory index (DII) scores and attention deficit hyperactivity disorder (ADHD) in children. Sci Rep. 2025 Aug 22;15(1):30884.
Shah N, Nadella H, Williams S. Non-pharmacological Approaches to Managing Attention-Deficit Hyperactivity Disorder in Pediatric Populations: A Scoping Review. Cureus. 2025 Jul 13;17(7):e87810.
Di Salvo G, Filippo L, Perotti C, Pellegrini L, Rosso G, Maina G. Adult ADHD: associated medical conditions and related factors. Int J Psychiatry Clin Pract. 2025 Sep;29(3):125-129.
Chen L, Li Z, Fan Y. Neurodevelopmental disorders and gut-brain interactions: exploring the therapeutic potential of pycnogenol through microbial-metabolic-neural networks. Front Cell Infect Microbiol. 2025 Jun 11;15:1601888.
Wang N, Gao X, Zhang Z, Yang L. Composition of the Gut Microbiota in Attention Deficit Hyperactivity Disorder: A Systematic Review and Meta-Analysis. Front Endocrinol (Lausanne). 2022 Mar 18;13:838941.
Talat, A., Zuberi, A. & Khan, A.U. Unravelling the Gut–Microbiome–Brain Axis: Implications for Infant Neurodevelopment and Future Therapeutics. Curr Microbiol 82, 390 (2025).
Tas, E., Ulgen, K.O. Exploring the Integrated Gut-Brain Metabolic Model for ADHD. Biochem Genet (2025).
Sibley MH, Bruton AM, Zhao X, Johnstone JM, Mitchell J, Hatsu I, Arnold LE, Basu HH, Levy L, Vyas P, Macphee F, Gonzalez ES, Kelley M, Jusko ML, Bolden CR, Zulauf-McCurdy C, Manzano M, Torres G. Non-pharmacological interventions for attention-deficit hyperactivity disorder in children and adolescents. Lancet Child Adolesc Health. 2023 Jun;7(6):415-428.
Martin J. Why are females less likely to be diagnosed with ADHD in childhood than males? Lancet Psychiatry. 2024 Apr;11(4):303-310.
Trends of incident adult Attention-deficit/hyperactivity disorder diagnoses before, during and after the pandemic provincial state of emergency in British Columbia (2013–2023): a population-based study. Hu, Kevin et al.The Lancet Regional Health – Americas, Volume 0, Issue 0, 101223

谷禾健康
当我们刷牙、吃饭、吞咽时,可能很少意识到:口腔其实是全身健康尤其胃肠道健康的第一道防线。
随着研究不断深入,牙周炎——这类发生在牙齿周围、因免疫失衡而持续炎症的常见疾病——正从一个“口腔小问题”跃升为影响胃肠功能障碍甚至全身的重要信号来源。越来越多证据显示,牙周炎不仅关乎牙龈是否出血、牙齿是否松动,更可能通过微生物及其产物远距离“跨界”,扰乱肠道菌群,牵动代谢、免疫与多器官功能,进而影响肠道健康。
牙周炎的发生,源于牙齿表面微生物生物膜与宿主免疫的长期博弈。诸如牙龈卟啉单胞菌(Porphyromonas gingivalis)、幽门螺杆菌(Helicobacter. Pylori)、链球菌(Streptococcus)、 韦荣球菌(Veillonella)、微小单胞菌(Parvimonas micra)、具核梭杆菌(Fusobacterium nucleatum)、消化链球菌(Peptostreptococcus)等“问题角色”,在局部引燃炎症反应,促使牙龈与牙周组织释放促炎因子、活性氧与急性期蛋白,逐步破坏软组织与牙槽骨。同时,这一炎症火种并不止步于口腔:研究已将牙周炎与糖尿病、心血管疾病、类风湿关节炎乃至多种癌症联系起来。
其中,“口腔—肠道轴”是关键通道。部分牙周病原体及其分子产物会随唾液被持续吞咽,抵达肠道后成功生存与定植,进一步打破原有微生态平衡。以 P. gingivalis 和 F. nucleatum 为代表的口腔致病菌,凭借脂多糖、挥发性硫化物等毒力因子,削弱肠上皮紧密连接,提升肠黏膜通透性,形成所谓的“肠漏”。这不仅放大先天与适应性免疫反应,扰动 Treg/Th17 等免疫平衡,上调 IL-1β、IL-6、TNF-α 等促炎因子级联,还通过代谢与表观遗传层面的重编程,改写上皮与免疫细胞功能,推动全身性炎症与氧化应激的恶性循环。最终,一个由“菌群失调—屏障受损—免疫失衡”相互放大的炎症正反馈环路就此形成。
近年来,口腔细菌与炎症性肠病、脂肪肝与肝纤维化、肝细胞癌以及胰腺癌等多种胃肠道疾病的联系日益清晰。尽管牙周炎与这些疾病的相关性已被证实,但口腔菌群如何精确地改写肠道微生态与免疫网络,其复杂的分子机制仍有待全面阐明。
本文将以最新研究为证据,系统梳理牙周病原体如何通过“口腔—肠道轴”引发肠道菌群失调与功能障碍:从毒力因子破坏屏障、免疫失衡级联放大,到代谢与表观遗传层面的细胞重编程。通过这条贯穿口腔与肠道的隐秘通道,我们将看到:口腔健康不仅影响容貌与社交,更可能作为维系机体稳态的前线屏障,关系到全身系统的平衡稳态。
近年来,随着宏基因组测序与培养技术的进步,研究者在肠道生态系统中频繁检测到源自口腔的细菌群落。
★ 肠道中可检出多种常见的口腔相关菌
肠道微生物群以厌氧菌为主,主要隶属于:拟杆菌门、厚壁菌门、放线菌门、变形菌门和疣微菌门,其中不少为典型口腔常驻菌。
肠道中常见的口腔相关类群包括:小单胞菌(Parvimonas)、卟啉单胞菌(Porphyromonas)、消化链球菌(Klebsiella Peptostreptococcus)、克雷伯菌、链球菌、嗜血杆菌、梭杆菌及部分变形菌门成员。
检出的代表性口腔物种有:幽门螺杆菌、微小微单胞菌(Parvimonas micra)、P.gingivalis、T.forsythia、T.denticola、P.intermedia、具核梭杆菌、流感嗜血杆菌,以及大肠杆菌、克雷伯氏菌属、Filifactor alocis、弯曲杆菌和粪链球菌等。
★ 许多口腔细菌定植于患病个体肠道
多种口腔细菌被检测到定植于患病个体的肠道与相关组织,其中以幽门螺杆菌最为常见,常出现于慢性胃炎、消化性溃疡、炎症性肠病和胃癌患者。肝硬化、非酒精性脂肪性肝病、肝细胞癌、溃疡性结肠炎(UC)与克罗恩病(CD)患者的粪便中亦可检出牙周病原体。
幽门螺杆菌、具核梭杆菌与粪链球菌在胰腺癌、结肠癌、肝病及IBD患者的胰腺组织与导管、肝脏、肠道及结肠中均有发现。与单纯肝细胞癌相比,合并肝硬化的患者体内大肠杆菌和梭杆菌水平更高。
作为牙周关键病原体的牙龈卟啉单胞菌(porphyromonas gingivalis),还被证实与胰腺导管腺癌(PDAC)的发病风险和死亡率升高呈正相关。
具核梭杆菌(F.nucleatum)被认为是慢性肝病、肝硬化、IBD、胰腺癌、肝细胞癌和结直肠癌(CRC)的潜在标志物。在 CRC 来源的生物膜中其丰度升高,而健康结肠组织通常检测不到。所有分离的生物膜均为多菌种组成,且肿瘤与配对的健康组织的生物膜样本均含侵袭性细菌。由此可见,CRC 相关生物膜在结构和致病性上与口腔疾病相似,可能参与 CRC 的肿瘤发生。
★ 致病性牙周菌在肠道可能推动疾病发生
其他研究还表明,肠道生物膜除了含有致病性牙周细菌(如F.nucleatum、P.gingivalis)外,还含有口腔共生菌(Parvimonas、Peptostreptococcus、Prevotella),这可能导致结直肠癌的发展。
研究显示,健康与 CRC 组织中可共同检出口腔厌氧菌,如具核梭杆菌、弯曲杆菌和纤毛菌属;在肿瘤组织内,它们与牙龈卟啉单胞菌等共同构建协作性多菌群网络。弯曲杆菌还能与具核梭杆菌共聚集,后者作为桥接微生物,吸引其他相容口腔菌定植于肠黏膜。
肝硬化患者的口源性菌在粪便中亦明显增多。多项研究报道,牙周病患者的肠道菌群呈厚壁菌门/拟杆菌门比值上升,并富集 Euryarchaeota、Verrucomicrobia 和变形菌门。IBD 患者肠黏膜中嗜血杆菌与韦荣球菌属显著升高;类似地,结直肠肿瘤也促进口腔菌在肠道的定植。
口腔细菌可以通过多种机制诱导肠道变化。口腔细菌诱发肠道功能障碍的一些潜在致病机制如下:
• Toll样受体的激活和促炎细胞因子的释放
• 补体系统的调制
• 氧化应激的改变和活性氧的释放
• 炎症小体的激活
• 激活急性期反应和释放急性期蛋白
• microRNA的激活
• 挥发性硫化合物的释放
• 宿主细胞的坏死毒性
牙周病、口腔细菌和胃肠道功能障碍之间联系
Mukherjee S,et al.Crit Rev Microbiol.2025
牙周炎症(牙龈炎和牙周炎)的发作以促炎介质(如IL1、IL8、IL17 和 TNF)的大量释放为标志,以及各种信号通路和宿主受体的激活,如Toll样受体 (TLR)、补体系统、核因子κ-β (NF-Kb)。这些促炎介质通过血管或唾液进入体循环,并到达肝脏,在那里它们触发急性期反应和急性期蛋白(如 C 反应蛋白 (CRP) 的释放。这会增加全身炎症负担和氧化应激。炎症负荷的增加反过来又会影响肠道的各个部位并导致胃肠道功能障碍。
▸ 激活Toll 样受体
口腔细菌进入肠道后可附着并激活分布于肠上皮、固有层及免疫细胞(巨噬细胞、中性粒细胞、Kupffer 细胞)上的多种Toll样受体(TLRs)(如 TLR2/3/4/5)。
其中 TLR2/4 是牙周病中最常被激活的受体,并与胃肠功能障碍相关。TLR 作为“肠道传感器”,在维持稳态、调控免疫与塑造微生物群方面至关重要;其遗传变异与菌群结构改变相关。
TLR 功能异常及多态性/突变与肠道免疫反应、微生物特征和炎症直接相关。促炎介质外流与 TLR 过度激活会重塑微生物特征,驱动多种肠道与相关疾病,包括胃炎、非酒精性脂肪性肝病、炎症性肠病(CD、UC)、消化性溃疡、肝纤维化及多种肿瘤(肝癌、CRC、胰腺癌)。
✔ 口腔细菌与TLR相互作用激活炎症通路
口腔细菌与Toll样受体(TLRs)相互作用后,可激活肠道多条炎症通路(NF‑κB、JNK、PI3K、MAPK、AP‑1、p38),诱导促炎因子(TNF‑α、IL‑1β、IL‑6、IL‑12、IL‑18)与抗炎因子(IL‑10)释放。
其中 NF‑κB‑MyD88 是肠道炎症与肿瘤发生的核心通路,其激活依赖细菌黏附与脂多糖通过 TLR‑MyD88 传导。口腔菌源脂多糖结合 MD2/TLR4 复合体,触发先天免疫;脂多糖结合蛋白(LPS‑BP,60 kDa 血清糖蛋白)存在于肠道、肝脏和胃肠上皮中,并在口腔细菌入侵时被激活。
与牙周病原体和胃肠道功能障碍相关的研究
Mukherjee S,et al.Crit Rev Microbiol.2025
▸ 触发炎症通路、增加炎症
✔ 慢性炎症信号可推动肠道炎症及结直肠癌等疾病的发生发展
慢性 NF‑κB 信号是炎症性肠病(UC、CD)、肠道炎症及胰腺癌、结肠癌、胃癌发生的关键驱动。MAPK 通路在牙龈卟啉单胞菌入肠后显著上调;牙周炎期释放的 TNF 亦可激活 MAPK,增加 CD、UC 风险。
TNF 还能改变胰腺 TLR4 表达,诱发胰腺炎;TLR4 促使胰腺组织大量释放弹性蛋白酶与硫酸乙酰肝素,破坏实质并加剧炎症。研究还发现,牙龈卟啉单胞菌的含脂多糖微囊泡可如“微子弹”般穿透肠黏膜,放大肠道炎症。
牙龈卟啉单胞菌可与补体受体(C5aR)与 TLR2 串扰,上调 IL‑1、IL‑6、IL‑17 和 TNF 的分泌;并可激活补体受体(CR)与 NOD 受体,进一步提高肠道细胞因子水平。由 NF‑κB 与 TLR 诱导的细胞因子(如 IL‑1β、IL‑6、IL‑17)还能通过激活 STAT3 通路促使 CD4(+)T 细胞增殖,并增强癌细胞的增殖、易位与转移。STAT3 激活与胰腺癌、胃癌和结直肠癌相关。
✔ 口腔细菌进入肠道会影响通透性和炎症
口腔细菌还激活 TLR4,导致肠上皮中的 Cox-2 受体激活。这导致受伤肠道增殖,并在肠道中释放促炎介质,这些促炎细胞因子与微生物一起影响肠道中的紧密连接蛋白“zonula occludens-1”和“occludin”,并导致导致肠道炎症和通透性增加。
肠上皮通透性升高促进细菌穿透并周期性加剧炎症。P. gingivalis 诱导的炎症与菌群失衡还会改变肠道代谢物谱,增加钙化风险。口源性脂多糖与 CpG DNA 作用于 TLR4/TLR9,可能联结原发性胆汁性肝硬化与原发性硬化性胆管炎的硬化进程。
口腔细菌及其副产物如何损伤胃肠道功能
Mukherjee S,et al.Crit Rev Microbiol.2025
口腔细菌与肠道中的 Toll 样受体 (TLR) 相互作用并导致促炎细胞因子(白细胞介素 (IL1、IL8)、前列腺素 (PGE2)、肿瘤坏死因子 (TNF)。一些口腔细菌还会释放挥发性硫,如硫化氢、二甲硫、二甲基二硫化物和甲硫醇,导致上皮通透性可逆增加和屏障功能丧失。
硫化氢还被证明可以通过诱导肠粘膜中的 DNA 低甲基化来增加隐窝形成和溃疡。这些炎症介质还会影响细胞粘附分子,如小带闭塞和闭塞蛋白,并增加通透性。这有助于细菌轻松进一步侵入肠道组织,增加肠道和肠道炎症中微生物菌群失调的风险。
✔ 具核梭杆菌能与P. gingivalis一起增加肠道炎症负担
具核梭杆菌(F.nucleatum) 是另一种潜在的口腔细菌,可以损害肠道上皮完整性、激活 TLR 并增加肠道通透性。研究还指出,具核梭杆菌诱导的 TLR4 激活可导致肝窦内皮细胞通过 NF-κB 激活产生更多的 TNF-α 和活性氧 (ROS),从而导致肝功能障碍和肝细胞增殖。
当具核梭杆菌激活TLR4信号传导时,Nf-kB和miRNA21表达也会升高。一项研究发现,结直肠癌患者组织中的 miRNA21 和具核梭杆菌DNA 水平较高。这些标志物表明 CRC 患者的风险更大且预后不良。具核梭杆菌还可以与牙龈假单胞菌等口腔病原体共同聚集和感染,并增加肠道组织中的炎症负荷。
!
总结与要点:
1) 关键信号轴线与级联
NF-κB 为核心炎症驱动:慢性激活贯穿 IBD、黏膜炎症到消化道肿瘤发生。
MAPK 通路被放大:受P.gingivalis入侵与 TNF 上调共同促推,连接牙周炎与肠道炎症风险。
TLR4–胰腺炎通路:TNF 改变胰腺 TLR4 表达;TLR4 触发弹性蛋白酶与肝素硫酸盐释放,破坏实质组织,形成炎-损伤正反馈。
2) 口腔致病菌的多受体串扰
含脂多糖微囊泡穿透黏膜,提升局部脂多糖负荷与免疫识别。与C5aR–TLR2串扰,上调 IL-1/6/17 与 TNF。
激活补体受体与 NOD 样受体,进一步扩增炎症网络。
这说明口源菌不仅通过 TLR4–LPS,还通过补体与胞内模式识别受体共同塑造高炎症微环境。
3) 炎症—肿瘤耦合的信号枢纽:STAT3
NF-κB/TLR 诱导因子 → STAT3 激活:IL-6、IL-1β、IL-17 驱动 STAT3,促进 CD4(+) T 细胞增殖与肿瘤相关表型(增殖、侵袭、迁移)。
疾病谱系关联:STAT3 的持续活化与胰腺癌、胃癌、CRC 的进展密切相关。
▸ 激活补体系统与胃肠道功能障碍
补体系统是由30余种可溶性蛋白和膜结合蛋白组成的精密免疫反应系统,存在于血清和组织液中,通过经典、旁路和凝集素三条途径激活,具有清除病原体、调节免疫和介导炎症等功能。
✔ 牙周细菌诱导的炎症介质可激活补体受体
牙周细菌及牙周炎产生的炎症介质可激活补体受体(CR)。牙周菌黏附于受体后大量释放 C3a、C5a(强效趋化因子),招募肠道中性粒细胞、淋巴细胞与巨噬细胞,触发吞噬并启动免疫反应。C3a/C5a 与其受体 C3aR/C5aR 结合,进一步激活先天与适应性免疫通路。
正常情况下,C5aR 在肝脏 Kupffer 细胞和星状细胞中构成性表达,其水平可随 IL‑1、IL‑6、TNF 等炎症因子上调。补体系统还可调控肠道微生物,从而影响胃肠功能与肠道稳态。
✔ 补体系统的失衡与胃肠道疾病相关
补体系统的失衡与多种胃肠道疾病相关,包括结直肠癌、溃疡性结肠炎、克罗恩病、肝纤维化、病毒性肝炎、酒精性肝病及肝缺血/再灌注损伤。
多项研究在患者肠道组织中检测到补体成分:如 UC 患者固有层与上皮基底外侧膜的 C3、IgG 强阳性;腺癌与 CD 患者小肠隐窝及绒毛‑隐窝区可见 C3、C4 沉积。还发现黏膜 C3 mRNA 升高并与 IBD 患者的 IL‑17 水平相关;IL‑17(牙周炎中升高)与上皮下肌成纤维细胞产生 C3 呈正相关。
总体上,C3、C4 水平升高与溃疡性结肠炎、克罗恩病病情严重度相关。
✔ 口腔病原体可加剧肠道炎症与失衡
基于现有证据,补体经典通路在溃疡性结肠炎(UC)患者的上皮细胞中更为活跃,而替代通路在克罗恩病(CD)患者中更显著。CD 患者组织中可检测到 C4 mRNA;IBD 患者结肠黏膜 C3 mRNA 的升高与 IL‑17 mRNA 呈正相关。免疫组化显示,暴发性与急性肝炎患者坏死区周围存在 MAC 沉积,提示补体参与肝损伤发病机制。
牙周炎诱导的 IgG 可在 UC 上皮细胞触发经典通路,致 C3b 与 MAC 沉积。口腔病原体(如 P. gingivalis)可下调 CR3a/CR5a 以逃逸免疫,进而加剧肠道炎症与失衡;其还可通过赋予 C5 转化酶样活性并促凝血酶原激活,裂解 C5 生成 C5a。
通过 C5a 介导的途径,牙龈蛋白酶诱导 M1 巨噬细胞极化,促进P.gingivalis感染扩散。P.gingivalis 介导的 C5a‑C5aR 激活增强肠道 Gi 依赖的细胞内 Ca2+ 信号,协同放大其微弱的 cAMP 反应,提升 TLR2 激活与促炎因子产生;持续高 cAMP 还削弱 NO 杀菌效应,并激活 PKA 使 GSK‑3 失活。C5aR‑TLR2 串扰除抑制 TLR2 诱导的 IL‑12p70 外,还上调 IL‑1、IL‑6、IL‑17、TNF,推动胃肠黏膜炎症。
类似地,Interpain A(InpA)可激活血清 C1 复合物,使 C1q 沉积于菌体表面;中间普雷沃氏菌的半胱氨酸蛋白酶 Interpain A(InpA)可裂解 C3,释放过敏毒素 C3a,提升局部与全身炎症负荷。
牙周病原体,尤其是牙龈卟啉单胞菌(P.gingivalis),可上调共刺激分子 CD80/CD86,激活多种T细胞亚群。牙周炎触发的补体激活同时诱导Th1与Th2反应:前者促释 IL‑12、IL‑1、IFN、TNF、IL‑18,后者促释 IL‑4、IL‑5、IL‑13。
这些细胞因子激活多类免疫细胞,包括Th细胞、T 抑制细胞、Treg 及抗原呈递细胞(巨噬细胞、树突状细胞)。Th 细胞促进浆细胞分化,产生IgG、IgA、IgM;Th1 为 IFN‑γ 等介质的主要来源,有助于清除肠道内的细胞内病原体。Th 细胞还支持生发中心 B 细胞分化与高亲和力抗体(含肠道 IgA)生成。肠黏膜富含非常规 T 细胞(γδ T、NKT、MAIT),共同维持屏障功能与免疫稳态。
▸ Th17轴:连接牙周炎与肠黏膜炎症的关键
✔ 发炎的牙周组织会产生大量Th17影响炎症性肠病风险
Th17 细胞被视为肠道功能障碍的关键介质。发炎的牙周组织大量产生 Th17,提升其体循环水平。P.gingivalis 可经 TLR2/4 与 RORγt 促进 IL‑17、IL‑1β、IL‑6、IL‑23 分泌,增强 Th17 分化;Th17 通路激活进一步提升肠黏膜中IL‑1β、IL‑6、IL‑17、IL‑22、IL‑23,增加活动性UC与CD风险。
IL‑17 升高及 RORC2 mRNA 上调还促进血栓素样蛋白 TSP‑1 释放,关联 IBD/UC/CD 风险上升。P.gingivalis‑LPS 通过增强单核细胞 δ‑样配体 4 表达放大 Th17 反应,促炎并促肿瘤发生;其牙龈蛋白酶可直接诱导 T 细胞 CD69/CD25 表达并驱动 IL‑17 产生,还可通过激活缓激肽 B2 受体或蛋白酶激活受体 2 引发 IL‑17 反应。
相反,P.gingivalis 亦可经 TLR4 下调 Treg 转录因子(Foxp3、TGF‑β、IL‑10)。UC 与 CD 患者的炎症黏膜中 IL‑17 mRNA 明显升高。P. gingivalis 蛋白酶还能降解驱动 Th1/Th17 的细胞因子,以获取营养并助长其他肠道微生物。除P.gingivalis 外,肠杆菌与克雷伯菌等口腔菌在肠道异位定植同样与 Th17/Th1 积累相关;研究发现,肺炎克雷伯菌可通过口腔‑肠道迁移显著增强Th1反应。
▸ 口腔炎症跨黏膜迁移驱动肠道炎症
T细胞介导的细胞因子可加重黏膜炎症与胃肠通透性,改变胃动力、延迟胃排空,并在IBD、CD、UC 中引发结肠症状;同时提升胃癌与肝细胞癌(HCC)风险。免疫组化研究显示,IBD/UC/CD 患者的炎症黏膜中 CD68 阳性细胞、Th17 与 IL‑17 表达升高;IBD 患者黏膜中由Th17共产生的IFN‑γ约为健康者的5.5倍。
✔ 口腔炎症会通过T细胞影响肠道菌群及炎症
口腔病原体可激活Th17,局部产生的Th17经口腔引流淋巴结迁移至肠道;T细胞在肠系膜淋巴结(MLN)获得肠道归巢“印记”,依赖 MAdCAM‑1 与 CCL25 通过血循环进入肠道。由此,口腔炎症可产生口源性致病反应性 T 细胞,这些细胞迁移至肠道后激活肠道菌群并诱发炎症。
口腔致病菌通常不定植于健康个体胃肠道;其异位定植需要破坏常驻微生物群的定植抵抗。肠道炎症削弱这种抵抗力,使口腔菌有机会取代本地菌群;肠杆菌与克雷伯菌的定植与 Th17/Th1 积累增加相关。小鼠实验亦证实,口腔炎症期诱导的 Th17 细胞可迁移至肠道并触发肠炎。
▸ 口腔致病菌进入肠道激活肠道炎症
连接牙周病原体与肠道疾病的另一机制,是口腔致病菌迁移入肠并被激活,从而推动口腔 Th17 TEM 向产生 IFN‑γ 的 Th17/Th1(致病性 Th17)转化,进而放大肠道炎症并激活肠道内已定植的口源微生物群,加剧结肠炎与其他胃肠病。证据显示,牙周炎期间出现的口源致病性T细胞具致结肠性,可能是多种胃肠道疾病的诱因。
Mukherjee S,et al.Crit Rev Microbiol.2025
✔ SFB与牙周菌对肠道 Th17/Treg 轴的影响
发炎牙周组织促进口源致病性Th17的迁移,这些细胞在牙周炎过程中获得肠道归巢受体(如 α4β7 整合素、CCR9),易位至肠黏膜后被口源菌群再激活,恶化结肠炎等胃肠道疾病。口腔致病菌的异位定植既为这些口源T细胞在肠内扩增提供抗原刺激,也可能通过诱导 IL‑1β 促进其激活与扩张。口腔细菌还能激活炎症小体并诱导 IL‑1β,在结肠炎的发生中起核心作用。
近期发现,肠道共生的分节丝状细菌(SFB)是强效的 Th17 细胞刺激物。少数研究提示,肠道内 Th17 可发生致病性转化,形成产生 IFN‑γ 的 Th1 样 CD4 T 细胞;SFB 诱导的 ex‑Th17 同样具有致病性并引发重度肠炎。
牙周病原体如何激活各种免疫细胞并增加肠道炎症
Mukherjee S,et al.Crit Rev Microbiol.2025
牙周细菌还可通过激活TLR,促进 CD4⁺ LAP⁺ 细胞释放,增强肠道 T 细胞免疫。CD4⁺ LAP⁺ 细胞为新型 Treg 亚群,表达潜伏相关肽(LAP),在潜伏 TGF‑β 复合物中起作用,阻断 TGF‑β 与受体结合,从而维持稳态并抵御肠道细菌入侵。
Th17与Treg是肠黏膜最丰富的 CD4 T 细胞群之一。Th17 在 TGF‑β 与 IL‑6 共同作用下经 RORγt 诱导,关键在于防御肠道真菌与细菌,并通过分泌 IL‑17/IL‑22 维持稳态;其异常活化与多种肠道自身免疫病相关。CD25⁺Foxp3⁺ Treg 则依赖 IL‑10 与 TGF‑β 发挥不可替代的稳态维持作用。
牙周炎产生的促炎细胞因子(IL‑1、IL‑6、IL‑8、TNF)进入肝脏,诱导多种急性期蛋白(APP)生成与释放,包括C-反应蛋白(CRP)、纤维蛋白原、五联蛋白、α‑1 酸性糖蛋白、α‑1 蛋白酶抑制剂、α‑1 抗胰凝乳蛋白酶和结合珠蛋白。
▸ 急性期蛋白与炎症
APP入血与促炎细胞因子协同,增强全身氧化应激与炎症。牙周炎被视为 APP 升高的风险因素:与无牙周炎者相比,严重牙周炎或牙列缺失者CRP升高约三分之一;牙周炎患者 CRP为健康者约两倍。
✔ 克罗恩病、炎症性肠病患者中急性期蛋白升高
克罗恩病、炎症性肠病、胃炎及胰腺癌患者亦常见 CRP 升高;在克罗恩病中,重度病例的血清 CRP 高于轻中度,提示牙周炎相关 CRP 增加或提高 CD、UC 风险。CRP可结合白细胞Fcγ受体(FcγR)激活免疫细胞并促进 IgG 产生,连接先天与适应性免疫;在钙存在下与细菌多糖结合后可激活补体并促进吞噬。
升高的 APP,尤其C-反应蛋白,还可刺激肠上皮与实质组织中的中性粒细胞、淋巴细胞和巨噬细胞。在 C3a、C5a 参与下,CRP 与细菌多糖结合,增加中性粒细胞浸润并放大全噬作用,提升肠道损伤与炎症风险。CRP 还能识别某些革兰阳性口腔菌的病原相关组分与受损细胞壁,进一步加剧炎症与氧化应激。
除 CRP 外,纤维蛋白原亦在牙周炎时沉积于肠道;牙周炎上调肠组织促炎介质,促进富含纤维蛋白的微血栓形成。APP 与促炎介质还可促使肝细胞增殖并诱发纤维化进程。
▸ 牙周炎影响炎症介质的产生
✔ 牙周病原体增加促炎介质导致肠道炎症
研究发现,牙周病原体可增加促炎介质(如IL-1、IL-6、TNF-α)的释放,从而激活肝细胞释放 CRP 和纤维蛋白原。此外,还观察到“455G/A 基因多态性”与β-纤维蛋白原基因启动子中纤维蛋白原水平增加之间的关联。
纤维蛋白原作为多种细胞(如白细胞、内皮细胞、血小板、成纤维细胞和平滑肌细胞)表面受体(VE-钙粘蛋白、ICAM-1、αIIbβ3、α5β1、αVβ3、αMβ2 和 αXβ2)的配体,其激活促进了肠道局部炎症与组织损伤。
牙周炎诱导的细胞因子和内毒素(如 LPS 和外膜蛋白)共同激活重要的急性期蛋白Pentraxins的释放。Pentraxins 可通过多种细胞因子激活巨噬细胞、内皮细胞、髓系细胞和树突状细胞。PTX3 是一种 TNF 刺激基因,能够诱导细胞增殖、胃炎症和细胞损伤,并与树突状细胞和巨噬细胞上的补体 C1q 相互作用,激活补体系统经典途径。
PTX3 水平的增加与溃疡性结肠炎(UC)和克罗恩病(CD)的风险上升相关。活动性UC患者的 PTX3 水平高于健康个体和非活动性UC患者,表明 PTX3 存在于肠道隐窝脓肿中的中性粒细胞中。PTX3 的表达主要在 UC 患者的结肠黏膜中,伴随中性粒细胞招募。炎症反应高组织学分级中,表达 PTX3 的细胞及炎症中性粒细胞数量增加,表明 PTX3 的表达与结肠组织对炎症的反应相关。研究发现,PTX3 蛋白可能促进 UC 患者发炎结肠组织中的细胞介导的免疫反应,尤其在隐窝脓肿病变中。
✔ 牙周炎诱导炎性小体激活
炎症小体是先天免疫系统中的多聚体蛋白结构,能够调节细胞死亡并诱导炎症,以应对源自宿主蛋白的感染性微生物和分子。
注:炎症小体的传感器分子涵盖多个模式识别受体(PRR)家族,包括核苷酸结合结构域和富含亮氨酸的重复蛋白(NLR, 即 NOD 样受体)。多种炎症小体以其激活的传感器命名,包括 NLRP1、NLRP3、NLRP4、NLRP6、NLRP12、NLRC4、AIM2 和 RIG-I 样受体。这些炎症小体与多种肠道炎症性疾病相关。
炎症小体可由多种因素激发,如慢性感染(如牙周炎)、组织损伤或代谢失衡。牙周细菌(如牙龈卟啉单胞菌、A.actinomycetemcomitans和F.nucleatum)被认为是炎症小体的有效激活剂,这些细菌通过与宿主上皮细胞上的 PRR 相互作用,激活 NLRP 信号通路,从而导致炎症小体形成。其中 NLRP3 是肠道稳态的重要调节因子。
NLRP3 的激活促使半胱天冬酶1活化,从而引发白细胞介素1β(IL-1β)和 IL-18 的分泌。这两种细胞因子的升高与炎症性肠病和肠道肿瘤的风险增加相关,炎症小体介导的 IL-1β 分泌在共生致病性 IBD 的发病机制中具有核心作用。众多研究已确认 NLRP3 炎性小体与牙周炎的强相关性,进一步证明了牙周炎与胃肠道疾病之间的联系。
中枢神经系统(CNS)通过下丘脑-垂体轴(HPA)连接肠道。多种神经肽,如P物质、血管活性肠肽(VIP)、神经激肽A(NKA)、激肽原和速激肽,形成肠神经系统(ENS)、中枢神经系统和肠道之间的主要联系。
这些神经肽不仅作为细胞内信号分子,直接影响肠道中免疫球蛋白(IgA、IgG 和 IgM)的产生,还与其相应的受体(如 G 蛋白偶联受体、神经激肽(NK 1、2 和 3)受体)结合,增加细胞因子(如 IL-1β、IL-6、IL-8 和 TNF-α)的产生。与炎症介质共同激活后,神经肽可增强淋巴细胞的有丝分裂、趋化性、吞噬作用、中性粒细胞溶酶体释放、迁移及肠道免疫效应细胞的归巢模式。
牙周组织与中枢神经系统和肠道相连
Mukherjee S,et al.Crit Rev Microbiol.2025
中枢神经系统(CNS)通过下丘脑-垂体轴(HPA)与肠道相连。各种神经肽,如P物质、血管活性肠肽 (VIP)、降钙素基因相关肽、神经激肽 A (NKA)、激肽原和速激肽,是肠神经系统 (ENS)、中枢神经系统和肠道之间的主要纽带。
牙周细菌还会增加激肽原和P物质的释放。这些神经肽影响肠神经系统(迷走神经和肠系膜神经),并影响肠道活动度、胃酸分泌和炎症介质的释放。这些神经肽充当细胞内信号分子,直接影响免疫球蛋白的产生、淋巴细胞有丝分裂发生、趋化性、吞噬作用、中性粒细胞溶酶体释放和迁移以及肠道中免疫效应细胞的归巢模式。
▸ 肠道神经肽与微生物的相互作用
当神经肽在肠道神经末梢释放时,它们会扩散到周围的肌肉、上皮、内皮和免疫细胞,导致肠/结肠粘膜的炎症。研究发现,在肠道炎症和炎症性肠病患者中,结肠神经损伤以及粘膜神经支配和神经肽表达的变化显著。
UC 和 CD 患者的结肠组织和神经纤维中都观察到 P 物质的表达增加。IBD 还会影响肠道的运动,P 物质及神经激肽 1 受体(NK1)在这一过程中发挥作用。多项证据表明,P 物质、NKA、降钙素基因相关肽和 VIP 与肠道运动变化、肠道过敏反应、感染、创伤和压力相关。
✔ 肠道微生物群可以合成多巴胺、血清素等神经肽
此外,肠道中的一些微生物如肠球菌、念珠菌、大肠杆菌和链球菌能够合成神经肽,例如 5-羟色胺;酵母菌属、芽孢杆菌属和大肠杆菌属可产生多巴胺或去甲肾上腺素;乳酸杆菌属则合成乙酰胆碱,以及 γ-氨基丁酸(GABA),由乳酸杆菌属和双歧杆菌属产生。
微生物衍生的多巴胺会进入肠腔,影响结肠的吸收能力。此外,肠道中的乳酸杆菌、拟杆菌、幽门螺杆菌、大肠杆菌和念珠菌也分泌与食欲调节相关的蛋白质。同时,针对 NPY、瘦素、α-黑色素刺激激素、生长素释放肽、刺豚鼠相关蛋白(AgRP)及其他神经肽/肽的 IgG 和 IgA 自身抗体也参与了食欲控制。
✔ 牙周病原体会增加神经肽分泌导致肠道炎症
牙周病原体进入肠道也会增加各种神经肽的分泌,特别是 P 物质、激肽和 VIP。发炎的牙周组织是激肽(激肽原)的增加来源。牙周炎症期间释放的激肽原被降解形成缓激肽,从而加剧了局部和全身炎症过程。
缓激肽的释放导致血管舒张,进而导致血浆外渗和肠道中其他介质的释放,特别是 P 物质和降钙素基因相关肽。牙周炎期间释放的 P 物质进入系统循环,这可以上调缺氧诱导因子1α(HIF-1α)。HIF-1α调节细胞对低氧水平的适应,创造缺氧微环境,并改变肠道屏障的功能。
注:在慢性缺氧中,HIF-1α 及其一些靶基因产物(如 iNOS、COX-2、IL-6 和 IL-8)被激活,导致肠道炎症增加、免疫改变和细胞凋亡。
研究还发现,牙周炎患者中其他神经肽的水平升高,例如降钙素基因相关肽、VIP、神经激肽A、激肽原和速激肽。速激肽具有促炎细胞因子样特性,速激肽分泌增加与微血管通透性增加、GIT 中血浆蛋白外渗、水肿形成、运动功能改变和肠道收缩刺激有关。 香草素受体-1 是另一种神经肽受体,在牙周期间上调,可能是牙周炎和炎症性肠病之间的关键联系。
▸ 牙周炎诱导miRNA影响胃肠道功能障碍
牙周炎会改变全身 miRNA 水平,从而影响多种肠道功能。miRNA 是一类小的非编码 RNA,负向调节蛋白质表达,并与肠道的多种生理和病理机制有关。牙周炎被认为是促使这些 miRNA 增加及诱导肠道功能障碍的潜在因素。
✔ 一些肠道疾病患者中miRNA增加
在牙周炎发作期间,由多形核细胞和单核细胞中的 TLR4 激活的核因子 kappa B(NF-κB)诱导的 miRNA-9 会增加肠粘膜通透性,进而导致水肿形成。
研究发现,一些 miRNA 在肠道疾病患者中存在差异。例如,miRNA-155 在牙周病和肝病患者中均有增加,参与了巨噬细胞中的抗原呈递和TNF通路的激活。
✔ miRNA 的异常表达会导致多种疾病
miRNA 的异常表达会导致先天和适应性免疫反应中多个细胞过程的失调。这些 miRNA 不仅在合成它们的细胞中发挥作用,还可以在细胞外与脂质和蛋白质结合。它们能够在全身循环中传递信号,改变受体细胞的基因表达。发炎的牙周组织中产生的 miRNA 可以进入血液循环,导致多种全身性疾病。
注:与牙周炎相关的常见miRNA包括miRNA-9、miRNA-155、miRNA-203a、miRNA-147、miRNA-182、miRNA-183、miRNA-664a、miRNA-501和miRNA-21。
这些 miRNA 在与炎症性肠病、慢性肝炎、非酒精性脂肪肝以及肠道炎症和癌症的病理生理过程中都发挥着重要作用。miRNAs 是免疫反应的关键调节因子,能够干扰肠道中特定靶基因的转录后表达。肠道 miRNA 的失调会损害组织完整性,改变屏障功能,并增加肠道炎症。
✔ 肠道炎症、癌症患者中的miRNA与健康个体存在显著差异
多项研究发现炎症性肠病患者与健康个体之间在数百种 miRNA 的谱上存在显著差异,包括儿童和成人患者、发炎和非发炎粘膜,以及疾病活动度相关的 miRNA。
IBD 中研究最多的 miRNA 之一是 miR-21,该 miRNA 在血浆中全身过度表达,并在结肠组织中局部过度表达。与健康对照相比,IBD 患者的固有层、巨噬细胞和 T 细胞亚群中 miR-21 的水平也显著增加。miR-21 与溃疡性结肠炎(UC)相关,但与克罗恩病(CD)无关,并且与疾病活动和严重程度有联系。
注:与小儿UC患者相比,成人肠道病变中 miR-21 水平显著升高。因此,miR-21 被强烈推荐作为健康与 IBD、UC 和 CD、活动期与缓解期的生物标志物。
与对照组相比,IBD 患者及结肠炎小鼠发炎粘膜中的 miR-31 水平也升高。研究表明,miR-31 直接靶向 IL-25 的表达,IL-25 是 Th1/Th17 炎症反应中的关键反调节细胞因子。研究还显示,克罗恩病患者及小鼠模型中 IL-25 与 miR-31 之间存在负相关关系。
此外,miRNA 还在多种恶性肿瘤中显示出差异表达,包括结肠癌。宿主细胞与肠道微生物群之间通过 miRNA 实现双向相互作用,miRNA 在肠上皮细胞分泌后参与塑造肠道微生物群,并在粪便中累积。反过来,宿主的 miRNA 表达也可能受到微生物衍生代谢物的影响,这些代谢物可能影响宿主的生理功能。最近的研究表明,miRNA 功能的失调与炎症性肠病的发病机制有关。
最近观察到某些细菌物种诱导其他微生物和宿主细胞死亡以获取营养,这一过程被称为“坏死毒力”或“细菌坏死性”。被杀死的细菌释放的营养物质为幸存的细菌提供了生存所需的资源,尤其在营养匮乏时。
▸ 口腔细菌影响肠道内的毒力基因
死亡细菌的增多为口腔生态系统中存活的细菌提供了丰富的营养来源(如C、N、P和Fe),并促进了生物膜的形成。死细菌的存在刺激其他口腔病原体的生长,并诱导新表型,进而上调细菌的毒力基因,造成对宿主组织的细胞毒性。
研究发现,口腔中含有大量死细菌,这些细菌为活微生物提供了营养。日常使用的漱口水和抗菌牙膏等产品导致了口腔微生物的大规模死亡,幸存细菌附近则聚集了大量的死细菌,使得病原菌能够利用这些微生物残体作为生长营养。
✔ 牙龈卟啉单胞菌的毒力基因在死细菌的存在下显著增加
在不同种类的死口腔细菌存在下,牙周病原体展现出坏死性生长。死细菌的存在促进了多物种生物膜中一些牙周病原体的生长,特别是“P.intermedia”和“牙龈卟啉单胞菌”的毒力基因在死细菌存在的情况下显著增加。
口腔中的死细菌还通过吞咽唾液进入肠道,刺激肠道内的各种病原体,导致新表型和细菌毒力的上调。
✔ 毒力基因上调可能导致肠道生态失调
研究指出,当可用于一个活细胞的死细菌数量达到至少10个时,P.gingivalis和P.intermedia显示出显著的生长增加。同时,研究还发现,在死亡的P.intermedia存在的情况下,牙龈卟啉单胞菌的牙龈蛋白酶基因 rgpA、rgpB 和 kgp 被上调,其表达增加可能促进了肠道细菌的进入、存活,导致严重的炎症和生态失调。
▸ 硫化物的释放与胃肠道功能障碍
食物颗粒的微生物降解会产生挥发性硫化合物(VSC),其中与口臭最相关的包括甲硫醇(CH3SH)、硫化氢(H2S)、二甲基硫化物((CH3)2S)、吲哚、粪臭素以及多胺(如腐胺)。这些 VSC 能进入体循环,影响多种器官系统,从而引发微生物生态失调、组织和器官的代谢活动及全身性疾病。它们作为致癌物,在肿瘤发生和细胞功能中起着关键作用。
✔ 硫化氢会增加肠道通透性和炎症
硫化氢是一种遗传毒性和促炎物质,能够增加肠道上皮的通透性并导致屏障功能丧失。研究表明,硫化氢可通过诱导肠粘膜中的 DNA 低甲基化来促进隐窝形成。过量的硫化氢会导致其在肠道内清除减少,从而促成溶酶体定植,成为溃疡性结肠炎(UC)的病因。硫化氢破坏了肠上皮细胞的凋亡、增殖和分化之间的微妙平衡。
硫化氢的增加还会影响结肠中罗丹酶(RHOD)和硫醇甲基转移酶(TMT)的功能,这些酶在去除硫化氢中发挥重要作用,并与溃疡性结肠炎的发病密切相关。
此外,硫化氢刺激 IL-10 的产生,同时抑制促炎细胞因子(如 IL-1β、IL-6、IL-8、IL-18、TNF-α 和 IFN-γ)。多项研究表明,IL-10 与炎症性肠病(IBD)之间存在关系,且 IL-10 分泌不足会加重 IBD 的炎症。硫化氢通过血管舒张增加血流量,以保护肠道粘膜,减少因胆汁、酸和消化酶等刺激物引起的损伤,并促进损伤后的组织修复。
牙周炎绝非局限于口腔的“局部炎症”。通过口腔—肠道轴,它能够持续重塑微生态、扰动免疫网络,并深刻牵动全身稳态,尤其与多种胃肠道功能障碍密切相关。
实践上,建议形成“口腔端—肠道端”的协同策略:
口腔端:规范的牙周治疗与维护、个体化生物膜管理、温和而精准的抗菌与抗炎方案,以降低系统性炎症负荷。
肠道端:基于微生态的综合干预(定向益生元/益生菌/合生元、黏膜营养支持如丁酸盐、个体化低硫或低FODMAP饮食),促进屏障修复与免疫重建,减少复发与并发症。
警示:避免非选择性、强力抗菌导致的“生态反噬”,坚持精准与生态友好的干预原则。
当我们以微生态与免疫稳态为框架重塑诊疗范式时,牙周炎将不再只是口腔科的“老问题”,而有望成为预防与干预消化系统疾病以及多种慢性全身性疾病的关键突破口。
主要参考文献
Mukherjee S, Chopra A, Karmakar S, Bhat SG. Periodontitis increases the risk of gastrointestinal dysfunction: an update on the plausible pathogenic molecular mechanisms. Crit Rev Microbiol. 2025 Feb;51(1):187-217.
Alarcón P, González M, Castro É. Rol de la microbiota gastrointestinal en la regulación de la respuesta inmune [The role of gut microbiota in the regulation of the immune response]. Rev Med Chil. 2016 Jul;144(7):910-6. Spanish.
Albuquerque-Souza E, Sahingur SE. Periodontitis, chronic liver diseases, and the emerging oral-gut-liver axis. Periodontol 2000. 2022 Jun;89(1):125-141.
Altaf-Ul-Amin M, Karim MB, Hu P, Ono N, Kanaya S. Discovery of inflammatory bowel disease-associated miRNAs using a novel bipartite clustering approach. BMC Med Genomics. 2020 Feb 24;13(Suppl 3):10.
Ansari SA, Iqbal MUN, Khan TA, Kazmi SU. Association of oral Helicobacter pylori with gastric complications. Life Sci. 2018 Jul 15;205:125-130.
Atarashi K, Suda W, Luo C, Kawaguchi T, Motoo I, Narushima S, Kiguchi Y, Yasuma K, Watanabe E, Tanoue T, Thaiss CA, Sato M, Toyooka K, Said HS, Yamagami H, Rice SA, Gevers D, Johnson RC, Segre JA, Chen K, Kolls JK, Elinav E, Morita H, Xavier RJ, Hattori M, Honda K. Ectopic colonization of oral bacteria in the intestine drives TH1 cell induction and inflammation. Science. 2017 Oct 20;358(6361):359-365.
Berkovich L, Gerber M, Katzav A, Kidron D, Avital S. NF-kappa B expression in resected specimen of colonic cancer is higher compared to its expression in inflammatory bowel diseases and polyps. Sci Rep. 2022 Oct 5;12(1):16645.
Bunte K, Beikler T. Th17 Cells and the IL-23/IL-17 Axis in the Pathogenesis of Periodontitis and Immune-Mediated Inflammatory Diseases. Int J Mol Sci. 2019 Jul 10;20(14):3394.

谷禾健康
微生物市场
当今全球生物医药投资领域,资本的嗅觉正在追逐下一个能够颠覆行业的风口。微生物组疗法正凭借其在慢病治疗领域的巨大潜力,迅速成为最受瞩目的焦点,它为无数传统药物难以解决的健康难题提供了全新的解决方案。
随之而来的,便是对其上下游的巨大需求,一个全新的、千亿级的市场正在悄然形成。
最新数据显示,2025年,全球微生物组制造市场规模预计将达到315.9亿美元,并有望在2034年飙升至约1303.7亿美元(约合人民币9200亿元),预测期内(2025-2034年)的复合年增长率高达17.06%。
这预示着一个新兴的生物技术赛道正在从潜力股转变为绩优股。如此强劲的增长势头并非偶然,其背后是由基础研究的资金支持、创新疗法的监管批准、市场需求的激增、生产能力的全球扩张等多重核心因素共同驱动的结果。
本文,我们基于Precedence Research机构最近出的2025年~2034年微生物制造市场规模及预测报告及其他最新资讯,来了解一下这个充满活力的市场。从占据主导地位的益生菌到潜力无限的活生物治疗产品到微生物检测应用,其产业链的各个环节,并探讨人工智能等前沿技术如何赋能这一变革,以及在迈向千亿市场的征途中,行业必须克服的复杂工艺和高昂成本等挑战。旨在为广大投资者、科研人员和相关产业从业者提供一个全面的微生物制造市场前景分析。
微生物组制造市场涵盖了用于人类健康、营养和诊断的活体微生物疗法、益生菌和微生物群落的开发与规模化生产。
其核心是利用先进的发酵技术和生产系统,在严格受控的环境中培养复杂的微生物群落,以确保产品的效力、稳定性和治疗精度。
该领域的成熟度在监管层面得到了印证。美国食品药品监督管理局(FDA)在2022年和2023年相继批准了Rebyota和Vowst这两款用于治疗复发性艰难梭菌感染的微生物组产品。这两项里程碑式的批准,不仅为活体微生物产品的商业化铺平了道路,也确立了其科学和监管路径。与此同时,欧洲药品管理局(EMA)和加拿大卫生部等机构也纷纷出台支持性框架,标志着全球正在协同推动微生物组产品的应用。
■ 驱动力:慢病高发与个性化需求催生巨大市场
慢病和生活方式相关疾病的日益流行,是推动微生物组制造市场增长的核心引擎。胃肠道疾病、代谢综合征、自身免疫性疾病和肥胖等问题,为基于微生物组的疗法创造了巨大的应用场景。医疗保健正从“对症下药”转向“调节失衡”,即通过靶向调节微生物群来从根源上解决问题。
根据世界卫生组织(WHO)2024年的报告,2022年全球有25亿成年人超重,其中8.9亿人患有肥胖症。此外,美国疾病控制与预防中心(CDC)2024年的数据显示,约有240万~310万美国成年人患有炎症性肠病。这些庞大的患者群体,为微生物组产品的治疗靶点提供了坚实的市场基础。
“微生物组产业有哪些新的市场细分或应用正在打开?
除了肠道健康之外,四个新兴应用领域代表了超越传统肠道健康应用的显著扩张机会,每个领域都针对未满足的临床需求,并拥有不同的监管途径。
“下一代测序和生物信息学成本快速下降
全基因组测序价格从2020年的每样本1万美元下降到2024年低于1000美元,同时计算成本降低了60%,实现了内部分析和患者分层的大众化。鸟枪法宏基因组学的普及使中型生物技术公司能够快速迭代细菌群落,指导个性化剂量,并为预测宿主-微生物药效的机器学习模型提供数据。这些进步降低了试验成本,提高了微生物组治疗市场临床成功的可能性。
“加速风险投资资金和大型制药公司合作
2024 年风险投资承诺额达到 5 亿美元,同比增长 40%,投资者优先考虑具有多适应症潜力的平台。雀巢健康科学的收购 VOWST™权利凸显了大型制药公司的兴趣,并预示着主流市场的广泛接受。战略联盟经常捆绑临床资产和独家生产名额,反映了稀缺发酵产能的需求。
合作伙伴关系现在强调人工智能驱动的发现和菌株级别的知识产权组合,为微生物组治疗市场在 2030 年之前继续保持交易活动奠定了基础。
同时,消费者对肠道健康的认知不断提升,对根据个人需求量身定制的个性化营养解决方案兴趣浓厚,这进一步推动了市场的扩张。
■ 制约:高昂的制造复杂性构成挑战
尽管前景广阔,但微生物组制造的道路并非一帆风顺。其最大的挑战在于高度的制造复杂性。活体生物治疗产品通常需要培养多种微生物菌株,每一种都需要高度受控的生长条件。发酵过程中的微小偏差都可能导致批次间的差异,增加成品不合格的风险,从而对规模化生产构成挑战。此外,高昂的生产和运营成本也可能对盈利能力产生负面影响,制约着市场的发展。
■ 机遇:研发投入激增,加速制造需求
幸运的是,全球对微生物组研发的投资正在以前所未有的力度增长。数十亿美元的资金正涌入微生物基因组学、合成生物学平台和人体临床试验等领域。科技巨头、制药公司和国际组织纷纷资助专注于新型微生物疗法的生物技术初创公司。
例如,美国国立卫生研究院(NIH)在2024年宣布,其超过25%的微生物组相关资金将用于支持活体生物治疗药物的规模化生产和制造准备。欧盟的“地平线欧洲2024”计划也包含了对微生物组项目的专项资助。这些投资不仅推动了生物加工技术的创新,也为满足严格的监管要求提供了保障。
人工智能(AI)正在为微生物制造领域带来一场革命,它使整个价值链的流程变得更智能、更快速、更可靠。
AI的融入,正在显著提升微生物组制造的效率和成功率,为市场的指数级增长注入了强大动力。
■ 按产品类型:益生菌主导,活体生物疗法潜力巨大
2024年,益生菌细分市场占据了主导地位,市场份额高达40%。这得益于其在胶囊、粉剂、饮料等多种剂型中的稳定配方,以及在消化和免疫支持方面得到证实的健康声明。
合生元和后生元绕过了冷链障碍,使它们能够在缺乏强大物流的地区渗透。微生物群衍生的代谢物虽然处于早期阶段,但由于小分子熟悉和可扩展的化学性质,吸引了制药行业的兴趣。
然而,增长最快的将是活体生物治疗药物(Live Biotherapeutics)领域。随着监管先例的建立,针对特定疾病的临床项目预计将大幅增加,其利用AI菌株筛选和厌氧发酵控制等先进技术,有望提高GMP批次的效力和一致性。
■ 按制造工艺:发酵为王,制剂与包装成新增长点
在制造工艺方面,发酵在2024年贡献了最大的收入份额(50%)。通过在受控的生物反应器中培养高密度菌株,制造商能够确保临床和商业批次的一致性。
展望未来,制剂与包装环节预计将以最快的复合年增长率增长。随着行业对活体产品稳定性、保质期和靶向递送的日益重视,对冻干、微胶囊化和控释基质等技术的投资正在增加。
■ 按终端用户:药企领跑,CDMO服务需求激增
制药与生物技术公司是2024年最大的终端用户,占据了55%的市场份额。这些公司已将微生物组发现纳入其药物管线,并拥有结合宏基因组学分析、菌株工程和转化药理学的专业团队。
与此同时,合同开发生产组织(CDMOs)预计将成为增长最快的细分市场。
注:合同开发生产组织(CDMO)是指那些为制药、生物技术和其他行业提供药物开发和生产服务的公司。它们为客户提供从药物研发到商业化生产的全过程外包服务。
由于微生物制造的复杂性,越来越多的公司选择外包服务。像Lonza这样的大型CDMO正在投资建设专用的微生物生产套件和一次性发酵罐,以满足日益增长的GMP级别外包需求。
■ 按技术平台:厌氧发酵是基石,微流控技术是未来
厌氧发酵平台在2024年占据了约45%的最大收入份额,是生产严格厌氧菌和肠道共生菌的核心技术。而基于微流控的培养技术(Microfluidics-based Culturing)则被视为未来增长最快的领域。该技术能够实现高通量分离、单细胞培养和受控的共培养,极大地加速了发现和早期生产过程,特别是在开发个性化和精准微生物疗法方面展现出巨大潜力。
■ 按应用领域:肿瘤学从概念验证转变为流程优先
复发性艰难梭菌感染在2024年占据38.45%的市场份额,成为微生物组治疗市场的商业立足点。真实世界数据显示,30天再入院率从24%下降到不到8%,增强了医疗系统需求。
肿瘤学代表增长最快的应用领域,以36.33%的复合年增长率发展,因为联合组织与检查点抑制剂协同作用并减轻免疫相关不良反应。
黑色素瘤和结直肠癌的II期临床试验结果已促成多中心试验,制药合作伙伴将微生物组调节视为伴随诊断机会。
除了这些基础应用外,炎症性肠病试验利用特定菌株恢复黏膜稳态,而代谢紊乱项目则通过胆酸信号调节胰岛素敏感性。神经系统应用从肠-脑轴数据中获得支持,帕金森病和自闭症研究正进入I期试验。
■ 北美:全球市场规模较大
2024年,北美市场以40%的份额主导了全球市场,其市场规模超过107.9亿美元。美国市场尤为突出,预计将从2024年的75.5亿美元增长到2034年的372.2亿美元。这一领先地位得益于哈佛医学院、斯坦福大学等顶级学术中心的转化研究,以及NIH的大量资金支持。
此外,大型CDMO和设备供应商对厌氧发酵套件、无菌灌装生产线等基础设施的投资,也极大地提升了该地区的生产能力。
■ 亚太地区:增长最快的新兴力量
亚太地区预计将成为预测期内增长最快的市场。2024年,该地区各国政府和机构加大了研发投入、提高了监管透明度并扩大了生产能力。
中国的庞大患者群体加速了试验招募,而海南省的博鳌乐城试验区加速了早期准入计划。
日本药品和医疗器械管理局在2024年采用了以美国食品药品监督管理局为中心的定义,促使他们大型企业获得西方平台许可。
跨国赞助商与区域人才发展的战略联盟,也正在加速技术转让和商业推广,使亚太市场成为不容忽视的新兴力量。
欧洲在绝对收入方面落后,但拥有一个复杂的研究基础。德国和英国是制造中心,利用生物工艺专长和研发税收抵免。监管滞后限制了近期的产品推出,但预计到2027年,欧洲药品管理局的协调将释放被压抑的需求。
2025年1月
Biohm Technologies 宣布将其长寿肠道报告作为其肠道微生物组检测平台的一部分推出。该功能利用人工智能和先进的生物信息学,评估个人肠道微生物组组成如何影响衰老过程。通过分析超过 1000 万个数据点,并识别出与长寿相关的近 100 种关键细菌和真菌类群,该公司开发了一个由机器学习和深度学习技术支持的可预测模型。
2025年2月
肠道微生物组研究领域的新兴公司MicrobioTx推出了一系列新的益生菌,以满足不同的健康需求。在印度微生物组科学家Palok Aich博士的指导下开发的配方旨在满足印度人群独特的微生物组需求。旗舰产品线包括DigesTx、MoodTx、GlucoTx和LeanTx,分别针对消化健康、心理健康、葡萄糖代谢和体重管理。
2025年2月
华大智造(MGI)推出了微生物组代谢编码测序包(MMSP),该包建立在该公司的DNBSEQ-G99和DNBSEQ-E25测序平台上。该新软件包专为全球微生物组研究人员设计,可使用16S/ITS rDNA测序进行全面的群落分析,为微生物分类和功能探索提供了一种高效且经济高效的方法。该技术使科学家能够研究包括人类健康、环境、工业和农业在内的各个领域的微生物多样性、丰度和相互作用。
2025年4月
全球代谢组学领导者Metabolon, Inc.推出了一种先进的微生物组研究解决方案,该解决方案将宏基因组测序与新型微生物组代谢物小组相结合。该集成工具包不仅可以识别微生物种类和遗传潜力,还可以揭示它们的代谢活动和生物活性化合物的产生,从而更深入地了解与诊断、治疗和精准医学相关的宿主-微生物相互作用。
2025年6月
达能北美公司,全球最大的B类认证公司之一,宣布了2024-2025年度肠道微生物组、酸奶和益生菌奖学金计划的获得者。今年,范德比尔特大学的Owen Hale和莱斯大学的Ella Ramamurthy获得了25000美元的研究资助,用于支持旨在深化对酸奶、益生菌和肠道微生物组科学理解的创新项目。
随着科学进步与临床应用的突破,微生物治疗市场的竞争格局正在被重塑。如今,行业领导力取决于跨学科的整合能力、高效的战略合作以及对市场的敏锐洞察——唯此方能驾驭挑战,抓住未来机遇。
全球微生物组制造市场正站在一个历史性的拐点。从不断增长的市场规模,到AI等颠覆性技术的应用,再到日益明朗的监管路径,所有迹象都预示着这个千亿级的蓝海市场正从概念加速走向现实。
与制造端并驾齐驱的是精准检测技术的飞跃。从判别菌群失衡,到评估微生物疗法效果,制造与检测的协同发展,将共同构筑起一个从诊断、生产到治疗的完整产业生态,驱动个性化健康管理的实现。
未来,随着科学研究的不断深入和制造技术的持续革新,我们有理由相信,基于微生物组的创新疗法和健康产品将深刻改变慢性病治疗和大众健康的未来图景。对于身处其中的企业、研究者和投资者而言,这无疑是一个充满挑战与无限机遇的黄金时代。
在微生物组产业的拐点上
告别营销炒作
回归科学实证
创新决定未来
主要参考资料
precedenceresearch. Microbiome Manufacturing Market Driving Innovation in Probiotics and Live Biotherapeutics,Sep 04, 2025
mordorintelligence. Microbiome Therapeutics Market Size & Share Analysis – Growth Trends & Forecasts (2025 – 2030)
谷禾健康
过去十余年,新一代测序(NGS)极大推动了人类微生物组研究,我们开始能以前所未有的分辨率,观察人体各生态位的细菌、古菌、真菌、病毒等。
研究发现,微生物组与肥胖代谢问题、消化道疾病、精神健康问题、癌症治疗响应、肝胆问题等健康状况都存在关联,这些前沿发现催生了如肠道菌群检测等专业服务,也推动学界提议将微生物组作为疾病辅助诊断、预后评估、治疗反应预测和监测、指导个性化的饮食方案的新工具。
但现实中,从科研发现到临床应用的转化之路并非坦途。样本差异很大、流程细节多、污染隐蔽、统计学和机器学习容易踩坑、不同实验室做法不一,导致可重复性与可比性不足,临床效用难以确认。
这场“从科研到临床”的转化难,其根源并非微生物本身潜力的匮乏,而在于我们缺乏一套能够驾驭其复杂性的严格“交通规则”。
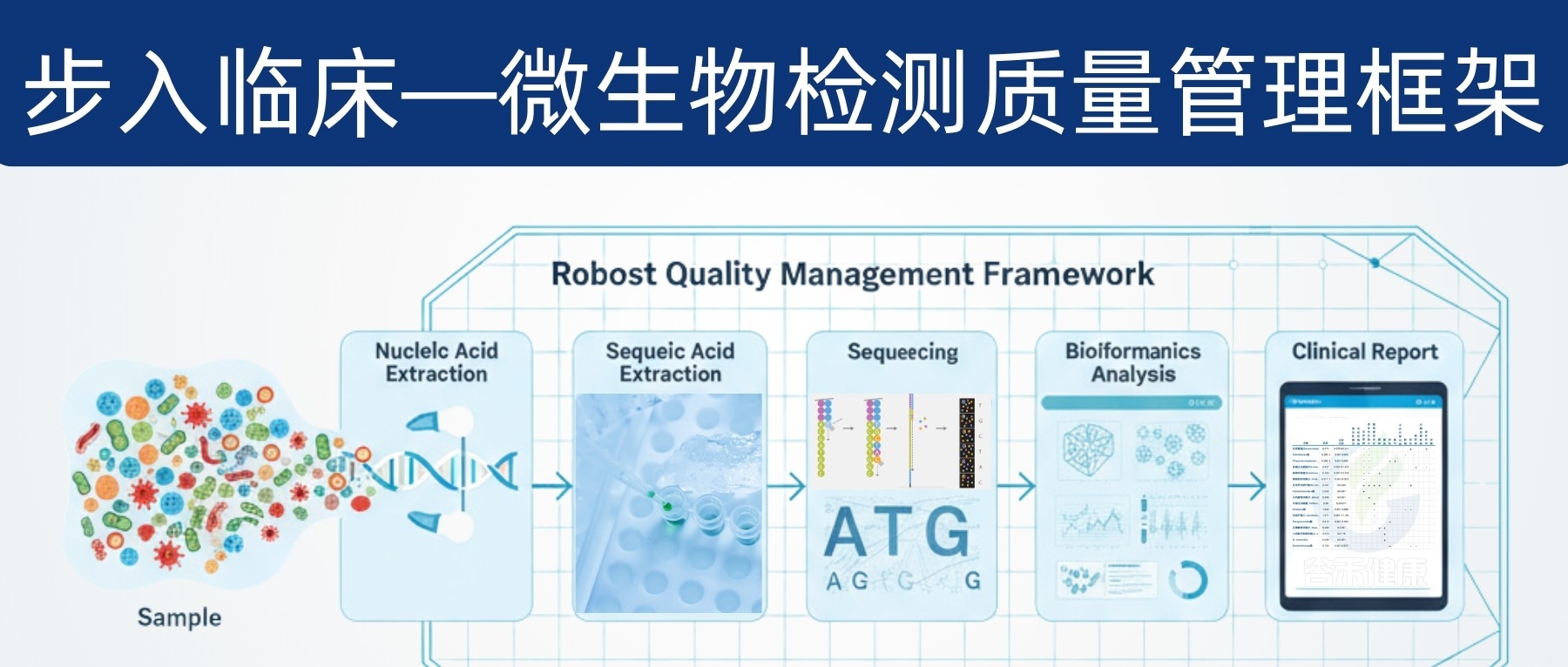
因此,微生物组要想真正服务临床,需要建立一套覆盖“分析前—分析中—分析后”的全流程质量管理,包含:标准操作程序(SOP)、质量控制(QC)、内部质量评估(IQA)、外部质量评估(EQA)与严格的分析/临床验证。
本文将为你揭示微生物组检测走向临床的关键挑战和解决方案,特别是质量管理框架的构建,为这一前沿领域的规范化发展提供路径。
从使用场景出发,理解“需要什么”远比“能做什么”更重要。微生物组数据可转化的临床用途,例如以下:
辅助筛查/诊断
识别疾病状态下的特征性菌群变化,例如肠道炎症、某些感染相关的菌群失衡。
指标示例:
特定物种丰度、菌群之间比值(如拟杆菌门/厚壁菌门)、功能通路、耐药/毒力基因等。
预后分层
用微生物组的“多样性与稳定性”预测疾病结局或加重风险,如囊性纤维化、消化系统或呼吸系统慢病的加重倾向。
比如说囊性纤维化患者:
菌群多样性下降 → 预测6个月内急性发作风险增加↑
指标示例:
α-多样性、β-多样性等。
微生物组分析指标作为生物标志物
预测治疗反应
典型案例:肿瘤免疫检查点抑制剂(ICIs)的疗效与基线肠道菌群结构相关;部分有益菌群富集与更好的应答有关。
具体来说,癌症治疗响应中,肠道菌群会通过调节免疫系统影响抗癌药物疗效。
指标示例:
响应者群体中特定属/种的富集模式、多样性高低、免疫调节相关功能基因与代谢产物等。
疗效监测/辅助治疗定制
动态随访微生物组,观察治疗(含饮食干预、FMT等)后的菌群变化轨迹;为供/受体匹配提供安全评估。
指标示例:
纵向β-多样性变化、特定功能通路恢复、致病菌负荷下降等。
注:这些指标不是金标准,可以认为是“窗口”,辅助筛查、分层或跟踪,但仍需在具体疾病与人群中完成临床验证与参考区间/阈值的建立。
正因如此,微生物群分析有望为疾病的早期诊断、个性化治疗以及健康管理提供全新的视角和方法,其作为生物标志物的潜力也备受关注。不过,微生物群分析的道路并非一帆风顺,诸多挑战横亘其中。
微生物组自身的善变与复杂性
微生物群本身具有高度的复杂性,它由数量庞大、种类繁多的微生物组成,包括细菌、真菌、病毒等,这些微生物之间以及它们与宿主之间存在着错综复杂的相互作用。
你的饮食、生活方式、服用的药物,都会引起肠道菌群的波动。这种看起来“牵一发而动全身”的特性,使得捕捉一个稳定且有代表性的快照变得困难。
数据分析的挑战
通过高通量测序(NGS)技术,我们能获得海量的微生物组数据。经过复杂的生物信息学处理,才能转化为可解读的分类、功能或多样性指标。
指标繁多:一个样本中可能包含成千上万种微生物或功能基因,为了简化,研究者会使用一些概括性指标,比如“α-多样性”(衡量菌群的丰富度和均匀度),但这可能会丢失关键信息。
统计陷阱:直接将成千上万个菌种与临床表型做关联分析,很容易因为数据本身的特点(高维度、稀疏性)而产生错误的、虚假的结论。
新工具的挑战:虽然机器学习等新工具很有前景,但它们也带来了新的复杂性,比如模型难以解释、验证困难等。
检测技术的细节
从样本离开人体到最终报告生成,整个流程遍布“雷区”,例如在样本储存条件、DNA 提取(方法、试剂盒品牌)、测序(引物的选择)等过程中,任何一个环节的细微差异,都可能对结果产生显著影响,从而导致研究结果的不一致性。
污染问题:尤其是在处理微生物含量低的样本时,实验中微量的污染物可能会导致错误的研究结论。
缺乏标准:目前没有统一的标准化实验流程。从样本处理到DNA提取,操作步骤的微小改动都会显著影响最终结果,导致不同研究之间的数据很难进行比较。
正是这些技术上的不统一和不可控,使得微生物组检测领域迫切需要一个标准化的质量管理体系,以确保未来临床检测的准确性和可靠性。
面对微生物群分析中的诸多挑战,建立一套完善的质量管理框架显得尤为重要。这个框架涵盖了从实验设计到结果解读的各个环节,旨在确保微生物群分析的准确性、可靠性和可重复性。它不仅为科研人员提供了标准化的操作流程,也为临床医生提供了更准确的诊断依据,有助于推动微生物群分析在精准医疗中的应用。
验 证:迈向精准医疗的基石
在微生物群分析中,新检测方法的引入如同打开一扇通往未知领域的门,但这扇门能否通向正确的方向,需要通过严格的验证来确保。
分析验证是对检测方法本身性能的评估,包括准确性、精密度、灵敏度、特异性等指标。
临床验证则是将检测方法应用于临床样本,验证其在实际临床环境中的有效性和可靠性。
临床效用评估是从临床实践的角度出发,评估检测方法对患者治疗决策和健康结果的影响。
临床效用——临床有效性,有用
微生物组检测必须同时满足两个条件:
这一验证阶段通常通过前瞻性临床试验进行,专门评估检测带来的实际改善。
虽然大型机构可能主导全面评估,但各临床实验室仍需验证自己的实施方案。
验证参考样本和数据的可用性对于充分评估任何新检测的实施至关重要。
目前微生物组分析还缺乏明确指导方针。现有的基因测序应用建议可作为基础,但验证过程必须根据特定方法和临床目的调整。尽管已提出许多潜在应用,但尚无一种完成正式临床验证。
标准操作程序:确保结果一致性的关键
严格标准流程的重要性
为整个微生物群分析工作流程定义严格的标准操作程序(SOPs)是确保结果一致性和可靠性的关键。
SOPs 好比一份详细的地图,为实验人员提供了清晰的操作指南,从样本采集到结果报告的每一个环节都有明确的规定和要求。
在湿实验室协议方面,任何细微的差异都可能对实验结果产生显著影响,因此需要严格控制实验条件,确保实验操作的一致性。
生物信息学工具的特殊需求
除了SOPs的基本要求(如书面文档和过程可追溯性)外,宏基因组学分析还特别需要生物信息学工具和参考数据库的稳定性。为了支持微生物组分析的各种应用,分析软件应具备可配置性和灵活性,同时保持易用、快速、稳定和可追溯的特点。
在宏基因组学分析的实际应用中,我们通过灵活组合构建定制化的数据分析脚本,满足不同分析需求的可配置性要求,确保分析工具既具备强大的统计分析能力,又保持了高效的数据处理性能。
谷禾所有生物信息学脚本的版本控制采用集中化管理策略,统一存储和备份于公司服务器中。对于分析所需的软件环境,本地统一部署管理,同时,建立了镜像作为备份方案,这种双重保障机制有效提升了分析环境的可靠性和可重现性。
这种基于官方资源的配置策略不仅保证了分析结果的标准化和可比较性,还为后续的方法验证和结果重现提供了坚实的技术基础。
质量控制:保障分析可靠性的支柱
质量控制(QCs)是质量管理的基石。它通过检查阴性和阳性对照样本,确保从采样到数据分析的全过程顺利完成。同时,设置“检查点”来监控关键步骤,只有满足标准才能继续。
核心原则
全流程把关:用阳性和阴性对照验证“采样→提取→建库→测序→分析”是否顺利完成。
检查点门槛:每个关键步骤设定接受标准,未达标则暂停或重做。
确保可重复与可比:严格执行标准,保证实验室内一致性和对外有效性。
内 部 质 量 控 制
阳性对照——验证能检出
最佳选择是标准化“细胞模拟”群落(已知组成),可覆盖提取到分析的全链条。
其他形式:DNA 模拟物、计算机模拟读段(不能覆盖湿实验室环节)。
平台特定补充,如 Illumina 常加 PhiX 作标定。
阴性对照——监测污染
污染物来源于实验室环境、试剂(“试剂盒”)或邻近样本(交叉污染),并在采样、DNA 提取、文库制备和测序(“索引跳跃”)过程中累积。
必备
提取空白、建库空白;必要时加“采样阴性”(例如清水、试剂空白)。
建议
所有阴性对照都进行测序,即便检测不到 DNA,也用于评估随机污染。
管理
建立污染物追踪库,长期记录与预警异常事件。
处理
策略
过滤阴性对照中出现的菌群(注意避免过度过滤导致假阴性)。
设阈值过滤或用专用工具(如 decontam、microDecon、Recentrifuge)识别并剔除污染;其中Recentrifuge能识别交叉污染。
注意
事项
低生物量样本(皮肤、下呼吸道)更易受污染影响;基于低丰度物种计数的指标更脆弱,像 α 多样性这类“更广义”的指标相对稳健。
关 键 检 查 点( 示 例 )
1
是否该做这个检测
核对临床指征、限制与必要咨询,避免无效或重复检测。
2
样本是否合适
采样部位要与临床问题匹配(肠道/皮肤/下呼吸道等生态位差异巨大)。
采样时机需控制(用药间隔、治疗/操作后多长时间、是否空腹/进食等),避免节律与饮食干扰。
采样质量判定(如直肠拭子是否有粪染、痰是否黏稠非唾液等)。
3
DNA 提取量与可用性
–工具:qPCR、荧光法(如 Qubit)、分光光度法(如 NanoDrop)。
–高生物量样本(粪便):若文库或测序读数异常偏低,提示提取/建库失败。
–低/中生物量样本(呼吸道、皮肤):常规前瞻性定量,关注污染风险。
–补充:靶向 qPCR(细菌 16S、真菌 ITS)可校正宿主 DNA 干扰,并将相对丰度换算为近似绝对量。
4
文库定量与标准化
–目的:测序前做等摩尔混合,也可侧面反映样本质量/微生物负荷。
–方法:荧光定量+片段长度分析。
5
测序质量
常用的测序数据指标:每样本读数、错误率、Q30 占比、读长等;
使用平台指标与 FastQC 辅助诊断问题。
6
生物信息学处理质量
流程:质控、过滤、修剪、聚类/ASV、组装、比对等;
检查各步骤的日志与评分,确认成功产出预期结果(分类、功能、耐药/毒力等)。
7
最终临床审核
由熟悉这方面的临床微生物学家把关,确认流程完整、报告恰当(必要时展示稀有但临床相关的菌群)。
早期需为临床医生提供解读支持;长期通过培训提升全科室对结果的理解与应用。
外部和内部质量评估:提升分析水平的助力
外部质量评估(EQA/能力验证)
核心做法是向多家实验室发放同一份参考材料,然后回收并比较各家的检测结果。可以理解为由权威第三方机构组织的 “全国统考”。
微生物组许多指标对流程细节非常敏感,因此需要定制化的 EQA 方案。
提出的两种解决方案:
结论导向 EQA:看不同实验室在临床结论上是否一致。
可能出现中间指标不一致(如多样性指数不同),但基于各自参考范围/阈值,最终临床判断一致(如粪菌移植失败风险高)。
举例:A、B两个实验室用了不同的方法,测出的多样性指数分别是3和5,数据不同。但他们根据各自的参考标准,可能都得出了“此患者粪菌移植失败风险高”的相同结论。这样就算通过。
局限:目前微生物组检测在临床上还没有太多公认的应用,所以这种考核很难开展。
方法导向 EQA:不讨论临床结论,只比对技术表现是否一致。看大家用同样的方法、同样的样本,能否得到同样的结果。
内 部 质 量 评 估(IQA)
简单来说,内部质量评估就是实验室内部的 “自我检查” 机制,用来确保自己的检测流程稳定可靠。
具体怎么做?
重复检测参考样本:定期把一个已知的、标准的参考样本拿出来重新检测一遍,看结果是不是和以前一样。这能保证实验流程长时间内没有发生偏移。
检测平行样本:把一份临床样本分成两份(或多份),当作两个独立的样本来检测。理论上,这两份得到的结果应该高度一致。这能检验操作的精密度和可重复性。
为什么要这么做?
因为目前针对微生物组分析的官方 “外部质量评估” (EQA)(也就是由权威机构组织的全国性或全球性大比对)还很缺乏。
解决方法:通过实验室内部的自我检查,以及组织几个本地或合作实验室之间搞 “比对测试”,可以很好地补充或弥补这个空缺,从而保证检测质量。
目前尚无充分验证的生物标志物可应用于常规实践,基于微生物组的生物标志物验证仍是一项持续而复杂的工作。下面的三个案例展示了常见挑战与可行做法。
案例一
Akkermansia muciniphila 预测免疫治疗反应
某些肠道菌与免疫检查点抑制剂疗效相关,Akkermansia muciniphila的存在被认为可能提示更好的应答。
► 分析验证(如何确保检测准确)
这个验证相对直接,因为目标很明确:只需要评估整个流程能否可靠地找到、识别并量化 A. muciniphila 这一种细菌。
具体做法是:
► 临床验证(这个指标在病人身上真的有用吗)
这需要通过设计良好的临床试验来证明。
可以这样做:
一个重要的提醒:
在做临床验证时,必须特别注意研究人群的构成。因为 种族、地理位置、饮食习惯 等因素都会显著影响肠道菌群。这些是混杂因素,如果不加考虑,可能会导致错误的结论。
案例二
用肠道菌群多样性指标,预测造血干细胞移植的预后
这个案例关注的是一个叫 “α-多样性”(Alpha-diversity) 的指标。简单来说,它衡量的是你肠道里微生物种类的“丰富程度”和“均匀程度”。就像一个生态系统,种类越多、分布越均匀,多样性就越高。
有研究发现,在接受造血干细胞移植前,如果患者肠道菌群的辛普森多样性指数的倒数(Inverse Simpson Diversity)越高,他们之后的总体生存率也越高。
► 分析验证(如何确保多样性算得准)
验证这类指标的难点在于,我们永远不知道样本里到底有多少种细菌(也就是说没有标准答案)。所以验证方法是直接看,我们测出的“多样性指数”和“病人的生存结果”之间有没有稳定的关联性。
► 临床应用与解读 (怎么用这个结果)
得到一个多样性指数后,怎么判断是高是低呢?
挑战:混杂因素
和上个案例一样,最大的挑战还是“混杂因素”。
人种、地区、饮食都极大地影响肠道菌群。
这个研究的优点是它的数据来自三大洲,说明结论可能具有普遍性。但反过来,这种大杂烩式的方法也可能掩盖了只针对某个特定人群的规律。
案例三
机器学习分析肠道菌群用于肝细胞癌筛查
这个案例探讨的是一个更前沿的方法:训练一个人工智能(AI)模型,让它通过分析一个人的肠道菌群数据,来判断他患上肝癌的风险。
核心思路
训练模型:先收集大量已知是“健康”或“肝癌患者”的肠道菌群数据。
让AI学习:把这些数据喂给AI模型,让它自己学习和总结出区分健康和患病人群的菌群模式。
预测:模型训练好后,当输入一个新人的菌群数据时,它就能根据学到的规律给出一个判断,这个人得肝癌的风险有多高。
如何验证这种AI模型?(这是最复杂的部分)
– 检查AI的学习方法
要确保AI不是过度训练得出的结论,比如,它可能学到了一些无关的线索或过度拟合部分线索,总的来说,AI需要比较大量的数据输入才可靠,此外对输入数据的准确性,描述等要求非常高。
– 严格的考试
绝对不能用训练过的数据来测试模型。这就像学生考试,不能用做过的练习题来当考卷。必须用一个全新的、独立的“验证数据集”来测试它的准确性。
– 在真实世界中检验
理想情况下,要把这个模型拿到一个更大、更多样化的人群中去检验,看它是否依然有效。
如何评价疾病预测模型的好坏?
评价一个疾病预测模型的精准性,远非一个“准确率”数字那么简单,其核心在于模型的性能是否与它的临床应用目的相匹配。我们必须综合评估一系列关键指标,并理解它们之间的内在权衡关系。
首先,要区分几个概念:
关键在于,这些指标的应用价值取决于场景:
对于疾病筛查(如早期癌症筛查):我们担心的是假阴性(把病人判为健康),这会延误宝贵的治疗时机。
因此,一个好的筛查模型必须追求灵敏度高,哪怕这会牺牲一部分特异度,导致一些假阳性(把健康人判为有病)。因为假阳性者可以通过后续更精确的检查(如CT、活检)来排除,只是虚惊一场,但漏诊的代价是巨大的。
对于疾病的确诊或指导重大治疗:此时,我们担心的是假阳性(误诊)。
给一个健康人施以不必要的、甚至有害的治疗是不可接受的。因此,一个用于确诊的模型必须拥有很高的特异度和阳性预测值(PPV),确保诊断的可靠性。
总的来说,一个模型的优劣是相对的。因此,最适合特定任务的模型,就是最佳模型。
评估微生物组的预测模型时,不能孤立地看某个指标,而应结合ROC曲线和AUC值来综合判断其区分能力,并根据其在临床路径中的具体角色(是用于大规模初筛,还是用于辅助诊断,辅助干预),来决定我们更看重哪个维度的性能。
关于这方面内容,详见谷禾之前的文章:
这套质量管理框架,为临床实验室未来如何开展微生物组检测指明了方向。
有些做法是现成的,比如必须使用“阴性对照”样本来监控污染。还有一些可以直接借鉴其他领域的经验,比如开展“内部质控”(IQA)和“外部质评”(EQA)。
因为如果科研人员在发表研究成果(比如发现一个新的生物标志物)时,就能提供详细的标准化操作流程(SOPs)和完整的质控数据,那么临床实验室就能更快、更容易地把这项新技术“接过去”并复现出来。
这将大大加快从基础研究成果,到病人能从中受益的诊断工具的转化过程。
编辑
目前,行业标准化已不再是纸上谈兵,本文所探讨的质量管理框架源自长期的实践与迭代。围绕实验室的人员、设备、环境、方法及管理流程等关键环节,谷禾进行了持续的系统化改进,建立并执行一套可追溯、可评估的质量管理体系,推动相关工作走向规范化。
在既有质量控制与验证基础上,谷禾将继续推进临床与微生物领域的转化应用,持续完善流程与方法,稳步提升落地能力与服务可用性。
主要参考文献
Scherz V, Greub G, Bertelli C. Building up a clinical microbiota profiling: a quality framework proposal. Crit Rev Microbiol. 2022 May;48(3):356-375.
Caminero A, Tropini C,et al., Credible inferences in microbiome research: ensuring rigour, reproducibility and relevance in the era of AI. Nat Rev Gastroenterol Hepatol. 2025 Jul 31.
Britton RA, Verdu EF, Di Rienzi SC, Reyes Muñoz A, Tarr PI, Preidis GA; Biotherapeutics Subcommittee of the AGA Center for Gut Microbiome Research and Education. Taking Microbiome Science to the Next Level: Recommendations to Advance the Emerging Field of Microbiome-Based Therapeutics and Diagnostics. Gastroenterology. 2024 Nov;167(6):1059-1064.

谷禾健康
当一只狗突然出现全身僵硬、四肢抽搐、口吐白沫,往往会令主人陷入恐慌 —— 这很可能是癫痫发作的典型症状。
作为犬类最常见的慢性神经系统疾病之一,癫痫发病率高达0.6-0.75%,相当于每200只狗中就有1-2只受其困扰。更令人揪心的是,传统抗癫痫药物虽然有效,但约三分之一的患病狗狗对传统抗癫痫药物(如苯巴比妥、左乙拉西坦)反应不佳,最终发展成“耐药性癫痫”。
频繁发作不仅损害狗狗的大脑功能,还会导致焦虑、认知障碍等行为共病,严重降低生活质量,且药物副作用(嗜睡、共济失调、肝损伤、多食等)常常让主人进退两难。因此,迫切需要更深入地了解狗癫痫的潜在机制,并寻求提高疗效和减少副作用的新型治疗方法。
近年来,“肠道菌群–肠–脑轴”(MGBA)逐渐成为研究热点。肠道菌群——被誉为身体 “第二大脑” 的微型生态系统,越来越多的研究表明,狗狗肠道里那些看不见的微生物,不仅主管消化功能,还可以通过复杂的菌群-肠-脑轴系统与大脑建立起深度互联。其中涉及代谢、神经、免疫和内分泌机制,深刻影响着包括癫痫在内的神经系统健康。相反,微生态的失衡会对生理学产生不利影响,并可能是导致癫痫发作背后的 “隐形推手”。
研究显示,癫痫犬的肠道菌群与健康犬显著不同,尤其是与抑制性神经递质GABA和抗炎短链脂肪酸(SCFAs)相关的菌群(如假单胞菌目、普雷沃菌科、瘤胃菌科、消化球菌科)丰度下降。失衡菌群可通过四条途径——代谢产物(如SCFAs)、神经信号(如GABA、血清素)、内分泌(HPA轴)与免疫炎症——提升脑兴奋性,诱发或加重癫痫发作。由此,面向菌群的非传统“靶向疗法”展现出应用潜力。包括:
一、生酮饮食/MCT饮食: 效果最显著。多项临床研究显示,添加中链甘油三酯(MCT)的饮食,能使9-14%的癫痫犬完全无发作,13-43%发作频率减少超50%,还可能改善行为共病(如多动、恐惧)。
二、特定益生菌: 动物与人类研究均显示一定潜力,例如可提升产GABA菌的丰度,其可能有助于调节神经兴奋性。然而,就犬癫痫而言,其临床疗效仍缺乏充分证据,仍需高质量、严格设计的研究加以验证与确认。
三、抗生素: 个别案例表现出显著性效果,但风险高(可能诱发癫痫耐药性),还会破坏肠道微生态,非常规推荐。
四、粪便菌群移植(FMT): 初步研究显示对改善癫痫相关的行为共病(焦虑、多动)效果显著,对发作控制效果不一,是极具前景的新方向。
本文将深入探讨肠道菌群是如何影响犬类癫痫,并结合近年来最新的研究文献,为宠物主和兽医提供全新思路和创新治疗与管理方案。
▸ 什么是犬类癫痫?
癫痫是犬类常见的慢性神经系统疾病。其由皮质神经元异常引起,涉及抑制性神经递质功能受损或兴奋性神经递质过度释放,导致突发性的短暂脑功能紊乱。
临床表现包括反复自发性发作、感觉异常、肢体抽动、意识丧失、行为改变和肌痉挛。正常时,神经元依靠精确的电信号传递信息;发作时,神经元出现异常同步放电,进而引发短暂的脑功能障碍。
▸ 狗的癫痫发作包括三个阶段:
•发作前期:狗狗可能会出现焦躁、不安、躲藏、或寻求关注的异常行为,可能伴随呜呜声或者颤抖。
•发作期:意识丧失、倒地、全身或者局部抽筋、四肢划动(强直-阵挛最常见)、口吐白沫、大小便失禁等。
•发作后期:可能陷入短暂昏迷或意识混乱,有意识但还没有功能。
在发作后阶段,大脑逐渐恢复正常功能。但持续时间可从片刻至数小时甚至数天。此时动物常迷失方向、行为异常(如重复发声、强迫性行走不避障),并出现疲劳、共济失调、饥饿或口渴增加。还可能急于排尿排便、极度疲惫并长时间睡眠,偶见发作后失明或攻击性。
癫痫与其合并症之间复杂关系的简化
Peek SI,et al.Vet J.2024
临床上,癫痫多表现为运动症状,如面部抽搐、反复点头和有节律的眨眼;常伴自主神经兴奋(瞳孔散大、流涎、呕吐)及行为改变(异常黏人)。
▸ 癫痫发作的原因
国际兽医癫痫工作组(IVETF)将癫痫发作的原因分为反应性癫痫(毒性或代谢紊乱所致)、结构性癫痫(颅内/脑部病变)和特发性癫痫。
•特发性癫痫是最常见的类型
特发性癫痫也叫作原发性癫痫,它指的是狗狗在没有明显的外部原因或脑部结构异常的情况下出现的癫痫发作,一般认为和遗传因素有关,而导致的大脑皮层及皮层下中枢对外界刺激敏感性增高,容易感受来自外界环境的刺激。特发性癫痫的患病率为53.8%,是犬癫痫最常见的病因。
影响癫痫及其合并症的机制
Peek SI,et al.Vet J.2024
原发性癫痫一般在6个月—6岁的狗中比较常见,而且会随着年龄的增长,发作的次数也会更加频繁,程度也会更加严重。某些品种的狗狗更容易患病,如比格犬、比利时牧羊犬、拉布拉多犬等。
!
传统治疗方法的困境
传统治疗的困境在于:常用抗癫痫药物主要作用是抑制异常放电,但约30%的狗狗对药物反应不佳,并逐渐出现耐药性,导致控制效果有限、复发风险增加。与此同时,长期用药常伴随一系列不良反应,包括明显的嗜睡、步态不稳(共济失调)、食欲显著增加以及潜在的肝毒性等,进一步削弱生活质量。
需要强调的是,癫痫带来的负担远不止“发作那一刻”的痛苦,它会以持续、深刻的方式影响患犬的日常功能、情绪状态和家庭照护压力。相较之下,肠道菌群相关研究正在提供新的视角,有助于更深入地理解癫痫的致病机制,并为制定更具针对性的个体化治疗策略开辟新的思路。
狗狗的肠道是一个庞大而复杂的微生态系统,该生态系统包括肠上皮细胞、粘液层、免疫系统和管腔环境。其中定植着数万亿微生物,包括细菌(占绝大多数 98% 以上)、真菌、病毒等,其中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)是健康犬的核心优势菌群。
这些微生物不仅参与营养物质消化吸收的基础功能,还在新陈代谢、免疫系统调节和防御病原体等多个过程中发挥重要作用,从而影响全身健康:
▸ 肠道微生物群的作用
•代谢工厂:合成B族维生素、发酵膳食纤维产生短链脂肪酸(SCFAs),如乙酸盐、丙酸盐和丁酸盐等。短链脂肪酸为其他组织提供能量,支持肠道细胞的生长和分化,并有助于肠道pH值恒定。此外,这些脂肪酸具有抗炎特性。
•免疫屏障:刺激肠道黏膜免疫细胞(如 T 细胞、巨噬细胞),抵御病原体入侵。
•神经信号传递:通过菌群-肠-脑轴与大脑进行交流,影响神经递质合成、炎症反应和应激激素分泌。
▸ 狗的攻击性或恐惧与肠道菌群存在联系
大脑与肠道之间的交流是一个复杂且双向的过程,涉及多个系统:包括中枢神经系统、肠道神经系统、内分泌系统和免疫系统。
这些系统通过神经信号、激素信号和免疫信号进行沟通。近年来的研究发现,肠道微生物群可能对“肠-脑轴”有着重要的影响。因此,近期的研究将这一轴系命名为为“微生物群-肠-脑轴”。肠道微生物群产生各种代谢物,这些代谢物会对大脑功能产生影响,并潜在地调控着健康的诸多方面。例如,在狗和小鼠中,分别发现了菌群失调与行为/攻击性和应激反应之间的相关性。
•攻击性强的狗中链状杆菌属和巨单胞菌属增加
最近的一项研究就发现,狗的攻击性或恐惧行为,与肠道菌群失调存在关联。他们在攻击性强的狗狗粪便样本中,发现了异常的细菌结构、高度的变异性,以及某些细菌尤其是链状杆菌属(Catenibacterium)和巨单胞菌属(Megamonas)数量的增加。
对于存在恐惧行为的狗,仅见乳酸菌(Lactobacillus)增多,整体菌群无显著变化。乳酸菌可影响抑制性神经递质 GABA 的生成。研究者推测,这些菌群变化可能导致神经活性代谢物异常,并通过与中枢神经系统互动影响行为。
注:需强调的是,该研究仅显示肠道菌群异常与行为相关,尚无因果证据,无法确认菌群异常直接引发攻击性增加。
•癫痫狗体内GABA产生菌和短链脂肪酸产生菌减少
多项研究对比了健康狗与癫痫犬之间的肠道菌群,并发现了其中的差异性:
与健康犬相比,癫痫犬粪便中乳酸菌数量无显著差异。但β多样性分析显示,无论是否接受抗癫痫药物,癫痫犬的肠道菌群结构均与健康犬不同,且差异主要来自低丰度的非优势菌群。具体而言,癫痫犬的假单胞菌目(Pseudomonadales)、普雷沃氏菌科(Prevotellaceae)、瘤胃球菌科(Ruminococcaceae)和消化球菌科(Peptococcaceae)显著减少。
假单胞菌可将谷氨酸转化为重要的抑制性神经递质 GABA。尽管 GABA 不能直接穿过血脑屏障,但研究推测其可经迷走神经通路间接影响中枢神经系统。因此,GABA 产生菌减少或干扰癫痫发作的频率与严重程度。
普雷沃氏菌科、瘤胃球菌科与消化球菌科为短链脂肪酸(SCFAs)生产者。SCFAs 不仅能穿越血脑屏障,还可在大脑中调节 GABA、谷氨酸与谷氨酰胺水平,并以多种方式维持脑内稳态。
这些发现表明,肠道菌群失衡——尤其是 GABA 与 SCFAs 产生菌的减少——可能通过影响神经递质水平与脑功能,参与犬特发性癫痫的发病。
此外,有研究团队发现,脑膜脑脊髓炎犬的普雷沃菌氏科(Prevotellaceae)亦低于健康犬,提示该菌群减少或为多种犬类神经系统疾病的共同特征或潜在风险因素。
然而,还有团队的更新研究得出不同结论:癫痫犬的乳酸菌反而多于健康犬;经过一个月生酮饮食后,这一差异明显缩小,提示饮食干预可通过调节特定菌群影响癫痫状况。
▸ 肠道与大脑之间的信息交流
微生物群-肠-脑轴是一个复杂且动态的系统,肠道与大脑之间通过代谢、神经、内分泌和免疫途径参与信息交流传递:
•代谢通路中SCFAs降低神经元过低兴奋
正如前文所说,肠道菌群与宿主之间存在着复杂且互利的关系。肠道细菌可分解进入结肠的未消化膳食纤维,生成短链脂肪酸(SCFAs),包括乙酸、丙酸和丁酸。SCFAs 是结肠细胞的主要能量来源,有助于维持肠道稳态与屏障功能;例如,体外研究显示丁酸可通过促进紧密连接蛋白组装强化屏障。
SCFAs还能跨越血脑屏障(BBB),通过多种机制直接作用于大脑,如增强 BBB、调节神经传递、影响小胶质细胞的成熟与功能。通过抑制肠道与神经炎症,SCFAs 亦可能降低神经元过度兴奋,进而减少癫痫发作的频率或严重程度。
•调节神经递质的水平影响情绪和行为
肠道微生物群通过调节神经递质的水平(包括血清素、多巴胺、去甲肾上腺素和γ-氨基丁酸(GABA)),在神经功能中扮演着关键角色。尽管肠道产生的神经递质直接穿过血脑屏障、作用于中枢神经系统的可能性不大,但它们可能间接影响中枢神经系统,进而作用于情绪、行为等生理过程。这种神经信号的传递很可能通过迷走神经或肠神经系统实现。
代谢物在大脑的兴奋/抑制平衡和癫痫发生的作用
Shah H,et al.Microorganisms.2024
γ-氨基丁酸(GABA)是一种重要的抑制性神经递质,存在于中枢和肠道神经系统中,可由多种乳酸菌产生,包括乳杆菌属(Lactobacillus)、肠球菌属(Enterococcus)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus)、丙酸杆菌属(Propionibacterium)与魏斯氏菌属(Weissella)。GABA能抑制杏仁核过度活跃,防止异常情绪与行为;其失衡常与压力和焦虑相关。由此引出问题:肠道乳酸菌产生的 GABA 能否进入杏仁核,或通过投射至杏仁核的神经元发挥作用?
为探究乳酸菌来源的 GABA 如何调控情绪,在小鼠中发现,长期补充特定乳杆菌可通过调节杏仁核及其他脑区的GABA受体表达,降低焦虑与抑郁样行为;但该效应依赖完整的迷走神经。除焦虑与抑郁外,GABA 失衡亦与癫痫、精神分裂症与自闭症谱系障碍等相关。
•血清素影响进食、睡眠、社交、情绪等
肠道产生的另一种重要的神经递质是血清素(5-HT)。人体超过90%的血清素是在肠道中产生的,仅不到10%由大脑产生。念珠菌属(Candida)、链球菌属(Streptococcus)、埃希氏菌属(Escherichia)和肠球菌属(Enterococcus)等肠道菌群都能合成血清素。
血清素会影响进食、睡眠、认知、社交互动、焦虑和情绪调节等功能。有研究表明,肠道中产生的血清素也可通过刺激迷走神经影响大脑,影响情绪和神经应激反应。
•影响HPA轴调控多种生理过程
除了调控前面提到的通路,肠道微生物群还通过调节肠–脑轴相关的内分泌系统发挥关键作用,尤以影响下丘脑–垂体–肾上腺轴(HPA 轴)为甚。HPA 轴是维持内分泌稳态的核心系统,可随压力变化调控多种生理过程。
当身体处于压力状态时,下丘脑会释放促肾上腺皮质激素释放激素(CRH)。这种激素会刺激垂体,使其向血液中分泌促肾上腺皮质激素(ACTH)。而 ACTH 会进一步促使肾上腺产生皮质醇——人体最主要的应激激素。皮质醇的作用广泛,会影响免疫反应、新陈代谢和大脑功能等多个方面。
肠道菌群能影响 HPA 轴的平衡状态:某些细菌可能会过度激活这一系统的活动,进而改变身体对压力的行为反应。反过来,压力事件及由此引发的 HPA 轴激活,也会导致肠道菌群的组成发生变化。这种菌群变化可能破坏肠道屏障的完整性,增加肠道通透性,使得内毒素和病原体进入血液,引发不受控制的炎症反应。而细胞因子等炎症介质能穿过血脑屏障(BBB),进一步激活 HPA 轴,形成恶性循环:压力、炎症和菌群失衡相互加剧,越演越烈。
•产生炎症介质影响神经元健康和行为
肠道微生物会影响肠道和大脑中免疫细胞的活性与功能。肠道菌群通过模式识别受体(PRRs)与免疫系统互动,是激活免疫细胞的关键。这些受体能识别微生物的特定成分,进而触发免疫反应,比如促使身体产生肿瘤坏死因子-α(TNF-α)等细胞因子。
这些炎症介质可以穿过血脑屏障,作用于中枢神经系统(CNS):它们会激活大脑中的常驻免疫细胞——小胶质细胞,引发神经炎症,进而影响神经元健康和行为。事实上,神经炎症是多种神经系统疾病的基础,比如帕金森病、阿尔茨海默病(老年痴呆)和癫痫等。
小结
总的来说,菌群—肠—脑轴是一个由神经系统、免疫系统和肠道菌群共同构成的复杂双向交流网络。这种密切的相互作用,在调节心理健康、行为表现以及维持整个机体的稳态中,都发挥着至关重要的作用。
尽管目前已开发出许多抗癫痫药物,但大约1/3的狗癫痫病例被归类为耐药性。这也意味着即使在服用两种或两种以上的抗癫痫药物后,癫痫发作管理仍然可能无效。此外,许多抗癫痫药物会促进不良反应,例如镇静(表现为精神萎靡、嗜睡)、共济失调(出现步态不稳、呆滞)、多食症、代谢异常和肝脏损伤等。
因此,迫切需要能够改善狗癫痫临床症状的新疗法。新兴研究表明,一些非常规干预手段可能带来新希望:例如生酮饮食、抗生素、益生菌和粪菌移植等,他们或能通过调节菌群-肠-脑轴来调控管理犬特发性癫痫。
近期多项研究评估了靶向肠道微生物群的干预对犬癫痫控制的效果,我们据此总结了通过菌群–肠–脑轴进行干预的治疗策略。
1
生酮饮食
动物模型研究表明,患有癫痫动物的大脑存在葡萄糖利用与代谢异常,导致能量生成不足并提高发作易感性。常见问题包括糖酵解障碍与丙酮酸脱氢酶活性下降。鉴于大脑高能耗特性,这些异常会破坏膜电位稳定与神经信号调控。
生酮饮食是以高脂肪、低碳水化合物和适量蛋白质为特征,是管理癫痫的一种方法。它能维持较低的血糖水平,促使肝脏利用脂肪酸和氨基酸产生酮体(如β-羟基丁酸),即进入“酮症”状态。这些酮体可以作为葡萄糖之外的辅助燃料供大脑使用。
•补充中链甘油三酯可作为大脑的另一种能量来源
在常规含碳水化合物的饮食中添加中链甘油三酯(MCTs),为大脑提供了另一种高效的能量来源。MCTs在胃肠道中迅速水解,生成的中链脂肪酸(MCFAs)可快速吸收并进入门静脉,输送至肝脏和肝外组织,在肝脏中转化为酮体。
与长链脂肪酸不同,MCFAs和酮体一样,无需依赖丙酮酸脱氢酶活性即可进入三羧酸循环(TCA循环),从而为大脑提供更稳定、高效的能量。因此,生酮饮食能以较为稳定的方式满足大脑能量需求,成为一种有益的辅助抗癫痫策略。
•生酮饮食影响GABA和谷氨酸水平从而抗癫痫
除直接供能外,生酮饮食的抗发作效应还可能源于对肠道菌群的调节。多项研究表明,该饮食可重塑人和动物的肠道微生物群,并与抑制性递质 GABA 与兴奋性递质谷氨酸水平升高相关,从而发挥抗癫痫作用。
在犬的研究中,与标准饮食相比,生酮饮食使拟杆菌科增加、放线菌门减少,且 Negativicutes 纲与 Selenomonadales 目相对丰度上升。需强调,这些发现仅为相关性,非因果证据。
综上,生酮饮食,尤其结合MCT补充,可能成为犬特发性癫痫的有前景辅助策略;但其机制与长期不良反应(如肾结石、骨矿物质流失)仍待进一步研究。
2
使用益生菌
益生菌是对肠道健康有益的微生物,主要包含乳酸菌、双歧杆菌和酵母菌等。如今,它在兽医神经学领域,尤其是犬特发性癫痫的研究中,正受到越来越多的关注。
•益生菌有助于减轻癫痫的严重程度
研究显示,益生菌可能有助于控制癫痫发作。在癫痫模型大鼠中发现,补充益生菌可显著减轻发作严重度并改善认知;其机制或与强化肠屏障、降低全身炎症、产生有益代谢物有关。另一项针对儿童难治性癫痫的研究也显示,益生菌能降低发作频率和严重程度,提升生活质量。
然而,目前尚无公开证据证实其对癫痫犬的直接益处;不同菌株、剂量与疗程可能影响效果,仍需更多研究验证其在犬中的疗效。
综上所述,虽然益生菌为犬癫痫管理提供了新思路,但实际应用需谨慎基于科学证据。未来通过深入探索,益生菌有望成为辅助治疗犬癫痫的有效工具,帮助患病动物获得更优质的生活。
3
抗生素
•抗生素可能对犬癫痫具有治疗效果
研究发现,抗生素可能对某些抗癫痫药耐药犬的发作频率产生意想不到的影响。该研究起源于一例临床个案:一只确诊为特发性癫痫且对抗惊厥药物耐药的犬只,却因疑似感染接受了为期一个月的抗生素(阿莫西林-克拉维酸)治疗。令人惊讶的是,在服药期间,原本平均每周发作2.5次的这只犬竟未出现任何癫痫发作。然而停药后,症状再次出现。
随后,研究人员对另外4只耐药性癫痫犬使用同种抗生素为期33天的治疗。结果呈现较大差异:2只完全停止发作,1只发作频率减少80%,但1只反而加重。不过,这只发作加重的犬在治疗期间更换了饮食,这可能干扰了结果——既往研究显示,饮食可能通过改变肠道菌群影响大脑功能,进而关联癫痫,这或许是其发作加重的原因。遗憾的是,该研究未进行粪便分析,无法明确治疗前后肠道菌群的变化是否与发作频率相关。加之样本量极小(仅4只犬)、缺乏对照组、存在多种混杂因素,因此目前所得结论仅属个案观察,尚未具备统计学支持。
总体而言,证实抗生素对癫痫犬有益的证据仍十分有限。盲目用药不仅可能无效,某些抗生素(如头孢类及部分 β‑内酰胺类)还可能因抑制 GABA 受体而诱发癫痫;广谱抗生素长期使用亦带来耐药等公共卫生风险,须谨慎对待。抗生素能否作为犬癫痫的辅助治疗仍待高质量研究验证;治疗决策应基于兽医专业评估,权衡风险与获益。
4
粪菌移植
粪菌移植(FMT)是将健康供体粪便移入受体体内,以重建肠道菌群、改善相关胃肠疾病的疗法,已在人体医学中应用并证实有效。
有观点认为 FMT 或可用于癫痫治疗,但证据仍有限。首次报道一例合并克罗恩病与癫痫的患者在接受 FMT 后发作完全停止,然仅为个案,需更大样本验证。
•粪菌移植有助于改善肠道菌群和神经递质水平
近期,有团队开展探索性研究,评估FMT对耐药性癫痫犬行为并发症(恐惧、焦虑样行为)的影响。结果显示,FMT 可改善冲动行为并提升患犬及主人的生活质量。该研究的供体为仅用苯巴比妥且停发超过一年的特发性癫痫犬。
移植后,行为改善伴随肠道菌群及 GABA、谷氨酸等神经递质水平变化,但发作频率与严重度仅部分个体获益。需注意样本量很小,统计效力不足。
总体而言,FMT 显示出作为人犬癫痫辅助治疗的潜力,但仍需更多双盲随机对照试验以严谨评估其安全性与有效性。
近年来,犬特发性癫痫与肠道菌群的关系逐渐受到重视,提示肠道健康与神经系统疾病密切相关,并为防治提供新方向。现有证据显示,菌群失衡可能是诱发癫痫的关键因素之一;通过饮食调整、益生菌、抗生素或粪菌移植等方式调节菌群,或可帮助降低发作频率。
尽管在实验室动物模型及人类癫痫研究中,调节肠道菌群已展现出降低发作频率的积极效果,但针对狗狗的研究仍需进一步深入:
机制与长期影响待明确:目前尚不清楚肠道菌群调节干预狗狗癫痫的具体作用机制,其长期使用效果也需更多研究验证;
需结合临床与粪便分析:通过治疗前后的粪便菌群检测,搭配全面的临床研究,才能更清晰揭示 “肠—脑轴” 的运作规律,以及它如何影响癫痫发作;
安全用药是核心:给癫痫狗狗使用菌群调节疗法时,必须警惕潜在副作用与药物相互作用。无论是选择抗生素、定制专属饮食,还是挑选益生菌,都需严格筛选,才能兼顾安全性与有效性。
总体而言,探索肠道菌群对犬特发性癫痫的影响,已成为兽医领域极具潜力的新方向。随着对 “肠—脑轴” 机制的深入了解,未来有望开发出更高效的癫痫治疗方案,帮助患病狗狗更好地控制发作,提升生活质量。
主要参考文献
Blanquet L, Serra D, Marrinhas C, Almeida A. Exploring Gut Microbiota-Targeted Therapies for Canine Idiopathic Epilepsy. Int J Mol Sci. 2025 Feb 18;26(4):1742.
Peek SI, Twele F, Meller S, Packer RMA, Volk HA. Epilepsy is more than a simple seizure disorder: Causal relationships between epilepsy and its comorbidities. Vet J. 2024 Feb;303:106061.
Ding M., Lang Y., Shu H., Shao J., Cui L. Microbiota–Gut–Brain Axis and Epilepsy: A Review on Mechanisms and Potential Therapeutics. Front. Immunol. 2021;12:742449.
Wernimont S.M., Radosevich J., Jackson M.I., Ephraim E., Badri D.V., MacLeay J.M., Jewell D.E., Suchodolski J.S. The Effects of Nutrition on the Gastrointestinal Microbiome of Cats and Dogs: Impact on Health and Disease. Front. Microbiol. 2020;11:1266.
Alessandri G., Argentini C., Milani C., Turroni F., Cristina Ossiprandi M., van Sinderen D., Ventura M. Catching a glimpse of the bacterial gut community of companion animals: A canine and feline perspective. Microb. Biotechnol. 2020;13:1708–1732.
Mondo E., Barone M., Soverini M., D’Amico F., Cocchi M., Petrulli C., Mattioli M., Marliani G., Candela M., Accorsi P.A. Gut microbiome structure and adrenocortical activity in dogs with aggressive and phobic behavioral disorders. Heliyon. 2020;6:e03311.
谷禾健康
在快节奏的现代生活中,我们面临着的食品安全挑战也在升级。全球化的食品供应链让美食跨越千山万水来到我们的餐桌,但也为病原菌的传播提供了更多机会。每一餐美食的背后,都可能潜藏着看不见的威胁。从夏日烧烤到家庭聚餐,食源性病原菌如同”隐形杀手”般悄然存在,威胁着我们的健康。
据世界卫生组织统计,全球每年有超过6亿人因食用被污染的食物而患病。在中国,食源性疾病同样影响着数百万人的健康。
有时候我们认为腹泻、呕吐只是”吃坏肚子”的小毛病,忍忍就过去了。然而这可能掩盖了严重的健康风险。食源性病原菌感染不仅会引起急性胃肠炎症状,还可能导致:
脱水和电解质紊乱:特别是对老人和儿童;
肠道菌群失调:破坏肠道微生态平衡;
免疫系统受损:降低机体抵抗力;
慢性健康问题:如肠易激综合征、炎症性肠病等后遗症。
产气荚膜梭菌、蜡样芽孢杆菌、肉毒杆菌、副溶血性弧菌、志贺氏菌等是最常见且危险的食源性病原菌。它们各具特色:有的耐高温,有的耐酸,有的产生致命毒素,有的传播力极强。
通过了解这些常见食源性病原菌的特性和传播规律,有助于我们识别和避免食用易受污染的食物,掌握正确的储存、烹饪和食用方式,同时监测肠道健康状况及时发现菌群异常变化。因为每个人的肠道菌群构成都是独特的,就像指纹一样。这意味着不同的人对同一种病原菌的易感性和抵抗力也不相同。有些人可能对某种病原菌特别敏感,而另一些人则相对耐受。
▶▷▶▷▶▷
▮ 产 气 荚 膜 梭 菌 ▮
产气荚膜梭菌(Clostridium perfringens)是一种革兰氏阳性杆状细菌,会引起食源性腹泻,是工业化国家常见的食源性致病菌之一,全年均有腹泻病例报道。它广泛存在于环境中,对人和动物均具致病性。
作为一种能够形成芽孢的厌氧细菌,产气荚膜梭菌在芽孢形成过程中会产生肠毒素(CPE),其A型到E型菌株与不同疾病相关。其中人类坏死性肠炎是一种致命的危及生命的疾病,会导致小肠溃疡。
该菌能在短期内快速繁殖、在相对较高的温度范围内生长、芽孢能抵抗恶劣环境条件、以及尽管是厌氧菌却具有耐氧能力,这些特性使得产气荚膜梭菌具有很强的环境适应性和致病潜力。
• 梭菌属中具有重要临床意义的致病菌种还有:
破伤风梭菌(Clostridium tetani)
肉毒梭菌(Clostridium botulinum)
巴氏梭菌(Clostridium baratii)
艰难梭菌(Clostridium difficile)
Clostridium argentinese
产气荚膜梭菌的常见栖息地是土壤、水、污泥、污水、食物(主要是生肉和冷冻肉)、受污染的设备等。产气荚膜杆菌也存在于人和动物的肠道中,尤其是老年人的粪便中。
产气荚膜梭菌需要多种氨基酸与维生素,最适生长温度为43–45°C。富含蛋白的肉类尤其适合其繁殖,特别是猪肉、牛肉和家禽产品;用酱料烹制的污染风险很高。
在加热和冷却过程中,如果食物在室温下没有足够的冷却温度,它会增殖并产生毒素。通常,学校食堂,医院,餐馆,监狱和集会是梭菌爆发的高风险场所。
产气荚膜梭菌在应激条件下孢子形成时产生肠毒素,已知可产生14种毒素与5类肠毒素(A–E型)。其还分泌4类细胞外毒素:α、β、ε、iota。
产气荚膜梭菌毒素和降解酶的作用
doi: 10.1080/21505594.2021.1886777.
A型:在人类中引起气性坏疽和腹泻相关的感染性腹泻,在动物中引起肠毒血症、坏死性肠炎和急性胃扩张。
C型:在人类中导致坏死性肠炎(空肠炎),在小猪、羔羊、小牛和鸟类中导致肠毒血症和坏死性肠炎。
B、D、E型:尚未证实致人类疾病;在动物可致肠炎与肠毒血症。
此外,该菌还能产生溶素O(θ毒素)与胶原酶(κ毒素),也需警惕。
与暴发有关的因素是大量准备食物、烹饪温度不够(食物的核心区域没有适当烹饪)、准备好的食物和食用期间受到污染。
集中爆发经常发生在提前准备大量食物的地方,如医院和学校食堂、监狱、聚会和研讨会。
案例调查显示,一道在室温下放置20小时且未再加热的羊肉菜是感染来源。产气荚膜杆菌还从羔羊肉、感染者粪便及尸检样本中被分离出。某校食堂因饮用制备后置于室温的受污染奶昔,导致77例腹泻。
产气荚膜梭菌只有在摄入含有约 10⁷-10⁹个营养细胞/克 的污染食物时才引起感染。
⑴第一阶段:胃肠道定植
-营养细胞抵抗胃酸
-在小肠内生长、增殖和产孢
⑵第二阶段:肠毒素作用机制
靶点结合:大量肠毒素与肠上皮细胞紧密连接处的 claudin蛋白 结合。
复合物形成:结合宿主膜蛋白,经构象变化形成 CPE复合物。
细胞损伤:
-细胞崩解和分离
-肠绒毛尖端损伤
-上皮细胞脱落
-绒毛缩短
膜损伤效应:
-膜上形成孔道
-电解质大量泄漏
-导致细胞溶解
-肠道吸收能力下降
-细胞骨架崩塌
⑶第三阶段:严重并发症
高浓度CPE (>10μg/ml):引起坏死(oncosis)
β-毒素作用:
-引起细胞毒性坏死性肠炎
-影响自主神经系统
-导致肠黏膜出血性坏死
-在真核细胞膜形成孔道
这种多重毒素协同作用使得产气荚膜梭菌食物中毒具有较强的致病性和复杂的临床表现。
主要症状多在食用重度污染食物后8–24小时出现。
常见症状包括腹部绞痛、水样腹泻、呕吐、恶心和发烧,大多数情况下通常在12至24小时内消退。致死率低于0.05%;但婴幼儿、老年人及慢性病患者风险较高;该菌可能侵入并导致严重溃疡,最终因急性脱水而死亡。
婴儿猝死综合征(SIDS)也是由产气荚膜梭菌与睡眠期间大脑的缺陷有关。
检测原理:产气荚膜梭菌食物中毒通过检测粪便样本中的肠毒素和营养细胞/芽孢数量来诊断。
⑴肠毒素检测
培养基法:熟肉培养基 → 巯基乙酸盐流体培养基(10ml) → Duncan-Strong产孢培养基
分子检测方法:通过PCR、多重PCR以及高通量测序手段检测样本中产气荚膜梭菌。例如谷禾健康依托高通量测序的tNGS技术可以特异性的识别粪便样本中的产气荚膜梭菌。
(来源:谷禾健康16S Plus版报告)
生物学方法
小鼠致死试验:评估毒素致死活性
Vero细胞毒性试验:检测细胞毒性效应
⑵免疫学检测
凝胶扩散法
对流免疫电泳
ELISA法
酶联免疫吸附试验进行CPE定量
注意事项:样本蛋白酶活性可降低IgG敏感性,需用1%血清白蛋白保护
⑶分子生物学方法
PCR技术:常规PCR、实时PCR
LAMP:环介导等温扩增
⑴治疗策略
一般治疗
抗生素使用原则
重症治疗
坏死性肠炎需要:
补液治疗
⑵预防控制措施
关键预防原则:烹调后立即食用
时间-温度控制
食品安全措施
▶▷▶▷▶▷
▮ 蜡 样 芽 孢 杆 菌 ▮
蜡样芽孢杆菌(Bacillus cereus)是一种致病性食源性微生物,广泛分布于自然界,如植物、土壤和昆虫及哺乳动物的胃肠道。
也常见于食品加工环境,其耐受性内生孢子可在恶劣条件下存活,污染原料与食品。
该菌可致两型食物中毒:腹泻型(在小肠产多种肠毒素)与呕吐型(摄入含耐热毒素的食物)。亦可引发机会性感染,如菌血症、败血症、肺炎、脑膜炎、胃炎、肝衰竭、肝坏死与脑水肿。
• 其他食源致病性芽孢杆菌:
B. subtilis(枯草芽孢杆菌):可致腹泻、呕吐;
B. licheniformis(地衣芽孢杆菌):常见食物中毒病因;
B. pumilus(短小芽孢杆菌):污染食品致胃肠炎。
• 其他特殊芽孢杆菌:
B. weihenstephanensis:强低温生长能力;
B. anthracis(炭疽芽孢杆菌):炭疽病原,极危;
B. mycoides(蕈状芽孢杆菌):形态特殊;
B. pseudomycoides(假蕈状芽孢杆菌):与蕈状近缘;
B. thuringiensis(苏云金芽孢杆菌):生物杀虫剂,偶可致病。
这些芽孢杆菌都具有形成芽孢的能力,使其在环境中具有很强的抵抗力和传播能力。
⑴基本特征
–革兰阳性菌
–产孢菌
–需氧至兼性厌氧
-有运动性
-杆状细菌
血培养的革兰氏染色蜡样芽孢杆菌
doi: 10.1128/CMR.00073-09.
⑵生长条件
生长温度范围:8-55°C
最适温度:25-37°C
pH范围:4.9-9.3
耐盐浓度达7.5%
内生孢子耐高温、辐射、干燥和消毒剂
⑶污染源
-从原料到包装储存的全程食品加工污染
-生物技术设备和机器污染
-土壤栖息,易传播至蔬菜和农作物
⑷常见污染食品
-大米、小麦、面食、面粉
-乳制品、肉制品、香料
-婴儿食品、鱼类、汤类
-蔬菜和水果
⑸流行病学特点
-全球性分布
-年度持续发生
-与饮食文化相关的地区差异
⑹易感人群
老年人、低胃酸患者
⑺防控挑战
其孢子高耐受性与污染源多样性要求从源头到终端的全程管控,尤其要严格温度控制并预防交叉污染。
蜡样芽孢杆菌产生蛋白质毒素,即肉毒毒素和催吐毒素。
⑴肉毒毒素(腹泻毒素)
当摄入的营养细胞在小肠增殖时产生腹泻毒素。该毒素对蛋白酶敏感,如链霉蛋白酶、胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶。
潜伏期通常为摄入后8–16小时,病程多持续24–48小时。症状以轻度水样腹泻和腹部痉挛为主;少数儿童或免疫低下者可出现血性腹泻与坏死性肠炎,进而致肝功能衰竭和脑水肿。
与肠道疾病相关的三种染色体编码肠毒素包括:
Hbl(溶血素BL):蜡样芽孢杆菌食物中毒的主要毒力因子,在小肠通过渗透溶解形成跨膜孔。
Nhe(非溶血性肠毒素):与 Hbl 同源,亦为三组分成孔毒素。
CytK(细胞毒素K):原型样β-桶成孔毒素,可致出血性腹泻与坏死性肠炎。
⑵呕吐毒素
呕吐型起病更急且更重,由小分子环状耐热肽引起,潜伏期为摄入受污染食物后约2–5小时。
其症状类似金黄色葡萄球菌食物中毒:恶心、呕吐、腹部痉挛,通常持续约24小时。催吐毒素作用机制尚不明,但高度耐热,可经受油炸、烘烤、煮沸和微波等烹调过程。
环境因素(温度、pH、大气成分、营养来源、食物稠度)亦影响毒素的产生。
⑴培养方法
实验室培养基如营养琼脂或血琼脂
⑵ELISA
ELISA技术在商业上被用于测定毒素,但它在评估蜡样芽孢杆菌的产毒活性方面不准确。它只检测一种毒素,溶血素BL或两种无毒蛋白质。
⑶反向被动乳胶凝集(RPLA)肠毒素试验
将样品煮沸以使其在生物学上稳定,从而产生阳性结果。该试验可识别溶血素B组分,但在存在高葡萄糖浓度的情况下,无法检测到毒素。
⑷PCR或高通量测序
通过检测蜡样芽孢杆菌DNA序列,来分析其丰度和毒力基因的存在。
蜡样芽孢杆菌食物中毒多为自限性,通常24–48小时内自行缓解。建议卧床休息并补充液体;重症时可在医生指导下使用抗生素,如克林霉素、万古霉素、庆大霉素或氯霉素。
蜡样芽孢杆菌耐热性强,常规烹调可杀灭营养细胞,但孢子仍可存活,故应在孢子萌发前切断污染。
食品应在储存前迅速冷却、食用前充分加热;芽孢杆菌属难以在高酸性环境存活。保持良好食品处理习惯与卫生。
▶▷▶▷▶▷
▮ 肉 毒 杆 菌 ▮
肉毒杆菌(Clostridium botulinum)是一种生长在缺氧环境下的细菌,在罐头食品及密封腌渍食物中具有极强的生存能力,是毒性最强的细菌之一。
肉毒杆菌中毒是由摄入肉毒毒素(BoNT)导致的致命性食源性麻痹性疾病,虽罕见但病死率高,微量毒素即可致命。
中毒来源包括食物中预先形成的BoNT或肠道内产生的BoNT。已知毒素分为A–G七型,可致人畜发病,其中A、B、E型与人类食源性肉毒中毒最相关。
肉毒杆菌为厌氧、产芽孢的革兰阳性菌,孢子广泛存在于土壤、污水、泥浆及湖海沉积物中,也见于陆生和水生动物肠道。
肉毒杆菌的孢子形成和发芽
doi: 10.1080/21505594.2023.2205251.
其孢子易污染食物并产生毒素。蜂蜜和糖浆曾被报道受其孢子污染,是婴儿肉毒中毒的主要来源。加工不当的罐头亦为重要来源,因孢子可耐受高温。其他高风险食物包括湖鱼、海鱼,以及烟熏、盐腌和发酵肉制品。
A型和B型毒素常见于土壤与生物肥料,故可能污染蔬果,尤其是加热不足的蔬菜制品。
症状通常在摄入后18–38小时出现,先累及胃肠道,常见腹痛、恶心、呕吐、腹泻,偶见便秘。随后出现神经系统表现:弛缓性麻痹、对称性下行无力、构音不清、吞咽困难、眩晕、视物模糊、口干及眼外肌无力。
婴儿肉毒中毒多见于1岁以下,因肠道菌群未成熟,毒素可在肠内产生。表现为哭声微弱嘶哑、上睑下垂、吮吸差、抬头困难与肌无力。
伤口型肉毒中毒为梭菌在伤口、脓肿等处定植,孢子发芽并产毒。其症状包括低血压、呼吸困难、眼肌麻痹、共济失调与瞳孔固定性散大,少见,通常在暴露后3–6天发病。
肉毒杆菌毒素曾在第二次世界大战期间被美国,日本军队用作生化武器。
1991年埃及因食用传统腌鱼 fesaikh 中的E型毒素发生大规模疫情,报告91例、死亡18例。
约90%的肉毒中毒病例见于美国,每年报告约9–10起暴发,常与家庭自制食品相关,尤以自制罐藏、瓶装及油浸食品为主。
口服或肠道内生成的肉毒毒素需先抵御胃酸,经肠道到达十二指肠与空肠。随后经内吞入血,分布至周围神经系统。
毒素进入神经元后作为锌依赖性蛋白酶,切割SNARE蛋白(可溶性N-乙基马来酰亚胺敏感因子附着受体)。其在神经肌肉接头终末结合并抑制乙酰胆碱释放,阻断神经传递,导致弛缓性麻痹。
肉毒毒素中毒的分子步骤
doi: 10.1038/srep23707.
⑴生物测定
小鼠生物测定是检测肉毒毒素最敏感、应用最广的方法:通过注射毒素评估其毒性,小鼠常在4小时内出现腹部颤动、蜂腰样腹部、四肢瘫
一个人表现出类似的肉毒中毒症状应立即置于重症监护与胃肠外营养供应。
如果怀疑有毒素,应在24小时内服用抗毒素,因为它能在到达神经肌肉接头之前中和血液中的所有游离毒素。
在伤口肉毒杆菌中毒的情况下,伤口应该用抗生素治疗,如青霉素。
以上都需要咨询医生确定。
食品应充分加热(≥121°C)并冷藏(≤4°C);加入柠檬酸等酸化剂可降低罐装食品中孢子形成的风险。
避免食用可疑的生或未充分加热食物,并避免其接触伤口。
▶▷▶▷▶▷
▮ 副 溶 血 性 弧 菌 ▮
副溶血性弧菌(Vibrio parahaemolyticus)是导致人类急性肠胃炎的主要病原体之一,通常发生在食用生的、未煮熟的和交叉污染的海鲜产品时。
该菌常见于热带海洋与沿海环境,可在滤食性贝类(牡蛎、蛤蜊、贻贝)肠道黏附并繁殖。除胃肠炎外,还可引起伤口与耳部感染,免疫低下者暴露海水时可发生败血症。
与之相关的人类致病弧菌还包括霍乱弧菌(Vibrio cholerae)与创伤弧菌(Vibrio vulnificus)。在日本及多国亚洲地区,副溶血性弧菌每年占食物中毒病例的约20%–30%。
其在全球范围内是胃肠炎的重要病因之一,亟需关注其流行情况、毒力因子及健康影响,并完善鉴定技术以降低风险。
–革兰氏阴性
-曲线杆状
-非孢子形成者的兼性厌氧菌
-轻度嗜盐,氧化酶阳性
-最佳温度30至35°C
-pH值范围为6.8至10.2。
副溶血性弧菌是海洋嗜盐菌,依靠单极鞭毛在水中游动,并可附着于鱼、蟹、虾、龙虾、浮游动物等水生动物表面。
当食用被副溶血性弧菌污染的生的和未煮熟的海鲜时,它会引起人类急性胃肠炎。当开放性伤口或伤口暴露于受污染的海水时,也会引起感染。
其他来源是副溶血性弧菌强毒株从海产品或设备到其他产品的交叉污染。
副溶血性弧菌按抗原性分为体细胞(O)和荚膜(K)抗原。其主要毒力因子包括粘附素、耐热直接溶血素(TDH)、TDH相关溶血素(TRH)及III型分泌系统(T3SS-1、T3SS-2)。
副溶血性弧菌的结构和毒力因子
doi: 10.3389/fmicb.2015.00437.
此外,它具有两类鞭毛用于运动,并可形成有助于在恶劣环境中生存的荚膜。感染多经粪-口途径,通过细菌表面粘附因子黏附宿主细胞。
TDH通过与红细胞膜结合并在其表面打孔致溶血;同时通过形成通道使细胞外Ca²⁺内流、细胞内Cl⁻分泌增加,导致渗透压升高、细胞形态与功能紊乱,最终细胞膨胀死亡。
TRH与TDH共同介导细胞毒性并诱发肠道感染;不耐热溶血素(TLH)主要用于种属鉴定,对红细胞溶血作用较弱。早期研究还显示,尿素酶是trh⁺菌株的重要辅助毒力因子,有助于在胃肠道定植与致病。
注:尿素酶指可以催化尿素,导致尿素分解成氨和二氧化碳的一种酶,在临床上明确幽门螺杆菌就是人体胃内能够产生大量尿素酶的细菌。
第三型分泌系统(T3SS 1)在组织细胞感染期间诱导自噬和细胞毒性。它连续引起自噬、细胞起泡、溶解最后导致死亡。
在我国东部沿海省份的部分暴发病例中,副溶血性弧菌感染相对较高。并且在亚洲、欧洲、非洲和美洲国家,类似病例的爆发已被频繁报道。
1950年,日本首次爆发副溶血性弧菌病,报告了272例急性胃肠炎,其中20人死亡。
1997年至1998年,美国报告了700多起食用受污染的生牡蛎的病例。
副溶血性弧菌食物中毒多发于夏季(6—10月),因温暖水域有利于其繁殖。
螃蟹、虾、龙虾、贝类、牡蛎、蛤蜊和金枪鱼是高风险的海产品,必须在食用前彻底煮熟。
副溶血性弧菌中毒典型的症状是水样腹泻、恶心、呕吐、腹部痉挛、发烧和发冷。进食受病原体污染的食物后,潜伏期约为12至24小时,并于5至7天内消退。
免疫功能低下的个体可能需要约10至15天的长时间才能恢复,因为疾病是自限性的,不需要药物治疗。
有些严重的患者可能会出现粘液或便血,血压下降,失去知觉,皮肤苍白、发紫,甚至死亡。此时应立即就医。
⑴菌株培养鉴定
使用含十二烷基硫酸钠(SDS)、烷基苯磺酸盐和胆汁盐的选择性增菌培养基可用于副溶血性弧菌的培养与分离。以碱性蛋白胨水为代表的增菌液具最佳pH和较高NaCl浓度,有利于弧菌生长。
⑵分子检测技术
副溶血性弧菌菌株的鉴定也可采用分子技术,如常规表型与生化试验、PCR及DNA检测。高通量宏基因组测序或靶向tNGS可用于分型与菌株区分。
该病多为自限性,但重症时需药物治疗。常用措施包括口服补液及应用四环素等抗生素;充足饮水以补充电解质、卧床休息亦有助于恢复。
副溶血性弧菌食物中毒的预防与控制:
–避免食用生或未熟透的贝类、牡蛎等海产品。
-处理海产品时注重个人卫生,生熟分开,防止交叉污染。
-皮肤有割伤或创口者应避免接触海水或微咸水,并尽量使用防水敷料。
▶▷▶▷▶▷
▮ 志 贺 氏 菌 ▮
志贺氏菌属(Shigella)是引起急性胃肠道感染的原因,这种感染会损害回肠和结肠上皮并引起细菌性痢疾。志贺氏菌感染多见于贫困、欠发达且缺乏卫生与医疗设施的国家和地区。
志贺氏菌病死亡率较高,尤以5岁以下营养不良儿童为甚。患者在腹泻期间因大量丢失电解质和血液而营养受损,可能致死。
• 志贺氏菌属分为四个血清群:
A群:痢疾志贺菌(S.dysenteriae)
B群:福氏志贺菌(S.flexneri)
C群:鲍氏志贺菌(S.boydii)
D群:宋内志贺菌(S.sonnei)
其中,S.dysenteriae 1型(志贺毒素产生菌)可引起严重的流行性痢疾,具有较高的致死率;而其他血清型通常引起相对较轻的痢疾症状。
–革兰阴性杆菌;无芽孢、无鞭毛(不运动)、无荚膜;兼性厌氧。
-最适生长温度为 37°C,生长范围约 10–40°C;可耐受一定盐度与酸性环境。
-低感染剂量:约 10–100 个菌体。
-对巴氏灭菌温度敏感(≥60°C 易被杀灭)。
-对紫外线和化学消毒剂敏感。
-能在不利的物理和化学条件下存活。
⑴病原菌储存宿主
–人类肠道是志贺菌的主要天然储存库;
-动物感染极为罕见,几乎不作为传染源。
⑵传播途径
–粪—口传播为主要途径
–人与人直接接触
–被污染的水和食物
-受污染的灌溉水可污染蔬果
⑶易感人群
–儿童和婴幼儿为高危人群
–免疫力低下者
–密切接触者(如家庭成员、托幼机构)
⑷流行特征
–发展中国家发病率较高
-与卫生设施不完善和个人卫生不良相关
-季节性:夏秋季高发
2003-2013年中国志贺氏菌的流行情况
doi: 10.3389/fcimb.2016.00045.
症状通常在摄入细菌后1–3天出现,视剂量可在12小时至7天内发病。
典型症状包括发热、食欲减退、腹痛、血性或水样腹泻、结肠炎、乏力与不适。大量水样便可致脱水,但较少见。伴随的厌食与营养不良需积极处理,是5岁以下儿童死亡的主要原因。少数患者可出现神经症状,如嗜睡、不自主运动和头痛。
这种疾病一般在5至7天内自行消退,但感染者可能会在很长一段时间内无症状地在粪便中排出细菌,并可能造成传播感染的威胁。
⑴侵入阶段
经口进入消化道
胃酸耐受:可抵抗低 pH
穿越小肠:因上皮更新快、液流迅速,难以定植
最终定植于大肠
⑵细胞侵袭机制
M细胞摄取:进入并被吞噬泡包裹
逃逸入胞:自吞噬泡逃出,进入细胞质
巨噬细胞:被吞噬后诱导其凋亡
⑶细胞内增殖与扩散
在大肠上皮内快速繁殖
经质膜包裹进行细胞间直接传播
继而感染邻近上皮细胞
⑴志贺毒素(主要由S.dysenteriae产生)
作用机制:经胞吞进入宿主细胞
毒性效应:抑制蛋白合成,致细胞死亡
临床表现:出血性腹泻
⑵脂多糖(LPS)
释放时机:细菌死亡破裂时释放
损伤效应:破坏肠道上皮组织
炎症反应:激发强烈的炎症应答
⑶炎症因子
IL-12释放:S. flexneri特别容易诱导IL-12产生
线粒体损伤:导致细胞坏死
组织破坏:引起肠道组织广泛炎症和溃疡
⑷病理损伤特点
组织破坏:主要由宿主免疫反应引起,而非病原菌直接作用
粘膜溃疡:免疫系统过度反应导致的继发损伤
炎症反应:局部组织出现严重炎症和水肿
⑴细菌培养方法
及时采样:出现痢疾症状后立即采集粪便标本
采集时机:感染初期阶段最佳,病原菌体外存活时间有限
样本处理:需要立即检测,避免病原菌死亡
⑵免疫学检测方法
酶免疫测定(EIA):成本低、操作简便。
⑶分子诊断技术
PCR/测序:基因检测快速、可靠,可区分不同志贺菌种。
⑷目标基因
ipaH基因:侵袭相关基因
virA基因:毒力基因
iral基因:调节基因
LPS基因:脂多糖合成基因
质粒DNA:毒力质粒
⑴抗菌治疗
首选:氟喹诺酮类(如环丙沙星)、大环内酯类(如阿奇霉素)
原则:尽早治疗,依据病情调整;监测耐药性
注意:具体用药请遵医嘱
⑵支持治疗
口服补液盐:轻中度脱水
静脉输液:重度脱水或电解质紊乱
营养支持:维持免疫功能
⑶环境与个人卫生
-完善卫生设施与排污系统
-安全处置粪便,防止污染
-保护水源,避免饮用水污染
-手卫生:勤洗手,使用肥皂或消毒剂
⑷食品安全
-生熟分开
-充分加热
-适当冷藏
-果蔬反复清洗
⑸重点人群
儿童与婴幼儿:加强护理与监测
食品从业人员:定期健康检查
集体生活人群:(学校、托幼机构等)
食源性病原菌虽“微小”,却以顽强的生存力、多样的毒力因子与隐匿的传播路径,对公众健康构成持续挑战。产气荚膜梭菌的耐受与产毒、蜡样芽孢杆菌的双型中毒与广泛污染、肉毒杆菌的致命神经毒素、以及志贺氏菌的低感染剂量与高传播力,共同勾勒出从农田到餐桌、从环境到个体的风险图谱。
守护肠道健康,关键在于两端同时用力:一端是系统性防控——完善卫生基础设施、保障饮水安全、规范食品加工与冷链管理、强化时间—温度控制与流程监测;另一端是个人与社区层面的良好习惯——勤洗手、生熟分开、充分加热、规范冷藏、创口防护与及时就医。面向重点人群(婴幼儿、老年人、免疫低下者及集体生活人群),还需更精准的健康教育与常态化监测。
科学认知让风险可见,规范行动让风险可控。以循证为底、以习惯为桥、以制度为盾,我们就能在快节奏与全球化的餐桌上,稳稳地守住每一个人的“肠道安全线”。
主要参考文献
Popoff, M. R.(2014). CLOSTRIDIUM | Detection of Enterotoxin of Clostridium perfringens. Encyclopedia of Food Microbiology, 474–480.
McLauchlin, J., & Grant, K. A. (n.d.). Clostridium botulinum and Clostridium perfringens. Foodborne Diseases, 41–78.
Miyamoto, K., & Nagahama, M. (2016). Clostridium: Food Poisoning by Clostridium perfringens. Encyclopedia of Food and Health, 149–154.
Chukwu, E. E., Nwaokorie, F. O., Coker, A. O., Avila-Campos, M. J., Solis, R. L., Llanco, L. A., & Ogunsola, F. T. (2016). Detection of toxigenic Clostridium perfringens and Clostridium botulinum from food sold in Lagos, Nigeria. Anaerobe, 42, 176–181.
Granum, P. E., & Lund, T. (2006). Bacillus cereus and its food poisoning toxins. FEMS Microbiology Letters, 157(2), 223–228.
Tewari, A., & Abdullah, S. (2014). Bacillus cereus food poisoning: international and Indian perspective. Journal of Food Science and Technology, 52(5), 2500–2511.
Parihar, H. S. (2014). Bacillus cereus. Encyclopedia of Toxicology, 353–354.
Batt, C. A. (2014). BACILLUS | Bacillus cereus. Encyclopedia of Food Microbiology, 124–128.
Carlin, F. (2016). Bacillus cereus and Other Bacillus sp. Causing Foodborne Poisonings, Detection of. Encyclopedia of Food and Health, 301–306.
Drobniewski, F. A. (1993). Bacillus cereus and related species. Clinical Microbiology Reviews, 6(4), 324–338.
Tewari, A., & Abdullah, S. (2014). Bacillus cereus food poisoning: international and Indian perspective. Journal of Food Science and Technology, 52(5), 2500–2511.
Marrollo, R. (2016). Bacillus cereus Food-Borne Disease. The Diverse Faces of Bacillus Cereus, 61–72.
Pavlik, B., Hruska, E., Van Cott, K. et al. Retargeting the Clostridium botulinum C2 toxin to the neuronal cytosol. Sci Rep 6, 23707 (2016).
Notermans, S. H. W., Stam, C. N., & Behar, A. E. (2014). CLOSTRIDIUM | Detection of Neurotoxins of Clostridium botulinum. Encyclopedia of Food Microbiology, 481–484.
Aureli, P. (2017). Botulism. International Encyclopedia of Public Health, 254–262.
McLauchlin, J., & Grant, K. A. (n.d.). Clostridium botulinum and Clostridium perfringens. Foodborne Diseases, 41–78.
Austin, J. W. (2016). Clostridium: Occurrence and Detection of Clostridium botulinum and Botulinum Neurotoxin. Encyclopedia of Food and Health, 155–159.
Lebeda, F. J., Dembek, Z. F., & Adler, M. (2018). Foodborne Botulism From a Systems Biology Perspective. Foodborne Diseases, 275–308.
Horowitz, B. Z. (2005). Botulinum Toxin. Critical Care Clinics, 21(4), 825–839.
Letchumanan, V., Chan, K.-G., & Lee, L.-H. (2014). Vibrio parahaemolyticus: a review on the pathogenesis, prevalence, and advance molecular identification techniques. Frontiers in Microbiology, 5.
Wang R, Zhong Y, Gu X, Yuan J, Saeed AF, Wang S. The pathogenesis, detection, and prevention of Vibrio parahaemolyticus. Front Microbiol. 2015 Mar 5;6:144.
Risk assessment tools for Vibrio parahaemolyticus and Vibrio vulnificus associated with seafood, Food and Agriculture Organization of the Unites Nations, ISSN 1726-5274.
Baker-Austin, C., Jenkins, C., Dadzie, J., Mestanza, O., Delgado, E., Powell, A., … Martinez-Urtaza, J. (2020). Genomic epidemiology of domestic and travel-associated Vibrio parahaemolyticus infections in the UK, 2008–2018. Food Control, 115, 107244.
Yaashikaa, P. R., Saravanan, A., & Kumar, P. S. (2016). Isolation and identification of Vibrio cholerae and Vibrio parahaemolyticus from prawn (Penaeus monodon) seafood: Preservation strategies. Microbial Pathogenesis, 99, 5–13.
Bolen, J. L., Zamiska, S. A., & Greenough, W. B. (1974). Clinical features in enteritis due to vibrio parahemolyticus. The American Journal of Medicine, 57(4), 638–641.
Mumy, K. L. (2014). Shigella. Encyclopedia of Toxicology, 254–255.
Ashkenazi, S. (2018). Shigella Species. Principles and Practice of Pediatric Infectious Diseases, 842–846.e2.